光導波路型バイオセンサーおよびそれを備えたバイオセンサーシステム
【課題】検出感度を高くできるバイオセンサーを提供する。
【解決手段】光導波路型バイオセンサー10は、基板1と、クラッド2と、コア3と、開口部4とを備える。クラッド2は、基板1上に形成される。コア3は、マッハツェンダー型のコアからなり、クラッド2中に形成される。そして、コア3の一部の領域321は、抗体を含む。開口部4は、コア3のうち、抗体がドープされた一部の領域321に接してクラッド2に設けられる。その結果、一部の領域意321は、開口部4を介して外部に露出される。
【解決手段】光導波路型バイオセンサー10は、基板1と、クラッド2と、コア3と、開口部4とを備える。クラッド2は、基板1上に形成される。コア3は、マッハツェンダー型のコアからなり、クラッド2中に形成される。そして、コア3の一部の領域321は、抗体を含む。開口部4は、コア3のうち、抗体がドープされた一部の領域321に接してクラッド2に設けられる。その結果、一部の領域意321は、開口部4を介して外部に露出される。
【発明の詳細な説明】
【技術分野】
【0001】
この発明は、マッハツェンダー型の光導波路型バイオセンサーおよびそれを備えたバイオセンサーシステムに関するものである。
【背景技術】
【0002】
センシング対象物を迅速、簡便に測定するシステムが求められており、例えば、医療・福祉分野においては、施設内の環境管理、ウィルス・細菌感染予防等の観点から、抗原抗体反応検査の迅速化、高精度化および多点化を狙いとしたシステムの実現が望まれている。
【0003】
一方、センシング対象物を検知する技術として、光導波路を用いた技術が検討されており、例えば、光ファイバーのクラッドの先端、光導波路コア、あるいは、光導波路クラッドの表面等に抗体を固定化し、それを検査対象に接触あるいは挿入して、取り扱いが容易であり生体物質間結合のモデルとして多用されるアジビン−ビオチン結合に基づく屈折率の変化から抗原の存在を検知する光バイオセンサーが知られている(非特許文献1)。この実験結果から抗原抗体反応に対する同様の検査方法が可能となる。
【先行技術文献】
【非特許文献】
【0004】
【非特許文献1】H. Tazawa et al, Applied Physics Letters, 91, 113901 (2007).
【発明の概要】
【発明が解決しようとする課題】
【0005】
しかし、従来の光バイオセンサーは、抗原抗体反応に起因して発生する光強度変化が小さく、十分な検出感度を得られないという問題がある。
【0006】
そこで、この発明は、かかる問題を解決するためになされたものであり、その目的は、検出感度を高くできるバイオセンサーを提供することである。
【0007】
また、この発明の別の目的は、検出感度を高くできる検出部を備えたバイオセンサーシステムを提供することである。
【課題を解決するための手段】
【0008】
この発明によれば、光導波路型バイオセンサーは、基板と、クラッドと、コアとを備える。クラッドは、基板上に形成され、ゾルゲルガラスからなる。コアは、クラッド中に形成され、ゾルゲルガラスからなる。コアは、第1から第4のコアからなる。第3のコアは、第1および第2のコアに接続される。第4のコアは、第1および第2のコアの軸に対して第3のコアと対称な形状を有するとともに、第1および第2のコアに接続され、抗体を含む。そして、第4のコアの抗体を含む領域は、クラッドに設けられた開口部を介して外部に露出している。
【0009】
好ましくは、光導波路型バイオセンサーは、流路をさらに備える。流路は、開口部に接してクラッド中に設けられ、水を流す。
【0010】
好ましくは、第4のコアに含まれる抗体は、検出対象物である抗原の種類に応じて決定されている。
【0011】
また、この発明によれば、バイオセンサーシステムは、複数の光導波路型バイオセンサーと、光ファイバーと、光パルス光源と、複数のファイバブラッググレーティングと、検出器とを備える。複数の光導波路型バイオセンサーの各々は、抗原を検出する。光ファイバーは、複数の光導波路型バイオセンサーを光学的に直列に接続する。光パルス光源は、光ファイバーの一方端に接続され、波長が相互に異なる複数のパルス光を出射する。複数のファイバブラッググレーティングは、複数の光導波路型バイオセンサーに対応して光ファイバー中に設けられ、各々が対応する光導波路型バイオセンサーにおける干渉光を反射する。検出器は、複数のファイバブラッググレーティングによって反射された複数の反射光を検出し、その検出結果に基づいて光導波路型バイオセンサーにおける抗原抗体反応の発生の有無を検出する。複数の光導波路型バイオセンサーの各々は、基板と、クラッドと、コアとを含む。クラッドは、基板上に形成され、ゾルゲルガラスからなる。コアは、クラッド中に形成され、ゾルゲルガラスからなる。コアは、第1から第4のコアからなる。第3のコアは、第1および第2のコアに接続される。第4のコアは、第1および第2のコアの軸に対して第3のコアと対称な形状を有するとともに、第1および第2のコアに接続され、抗体を含む。第4のコアの抗体を含む領域は、クラッドに設けられた開口部を介して外部に露出している。
【0012】
好ましくは、検出器は、光時間領域反射測定法によって複数の反射光の強度変化を検出する。
【0013】
好ましくは、検出器は、光パルスが光パルス光源から出射されてから、ファイバブラッググレーティングによって反射された光導波路型バイオセンサーにおける干渉後の光パルスが検出部に到達するまでの検出時間遅延を測定することによって、抗原抗体反応が発生した光導波路型バイオセンサーを特定して光導波路型バイオセンサーごとに光強度を検出する。
【0014】
好ましくは、光導波路型バイオセンサーの光導波路は、単一モードの光導波路であり、光ファイバーは、単一モードの光ファイバーである。
【発明の効果】
【0015】
この発明による光導波路型バイオセンサーにおいては、入射された光を第3のコアを伝搬する光と第4のコアを伝搬する光とに分岐し、第3のコアを伝搬した光と第4のコアを伝搬した光とが干渉するときの干渉条件を抗原の有無に応じて変えることによって抗原を検知する。そして、干渉条件は、抗原が抗体に付着することによる第4のコアの屈折率の変化によって変えられる。
【0016】
したがって、従来のバイオセンサーよりも高感度に抗原を検知できる。
【0017】
また、この発明によれば、センシング対象物を抗原とした抗原抗体反応によって変化する光強度を多数の観測点で同時に測定するとともに、センシング対象物を検出した光導波路型バイオセンサーを特定することができる。
【0018】
さらに、マルチモードよりも伝送損失が小さい単一モードの光ファイバーを用いるとともに、マッハツェンダー方式の光導波路型バイオセンサーの光導波路を単一モードの光導波路とし、光ファイバーと、マッハツェンダー方式の光導波路型バイオセンサーとを低結合損失で接続してセンサネットワークを構築しているので、長距離においても高感度な検出が可能になる。
【図面の簡単な説明】
【0019】
【図1】この発明の実施の形態によるバイオセンサーの斜視図である。
【図2】図1に示すA方向から見たコアの平面図である。
【図3】図1に示す線III−III間におけるバイオセンサーの断面図である。
【図4】図1に示す光導波路型バイオセンサーの製造方法を説明するための第1の工程図である。
【図5】図1に示す光導波路型バイオセンサーの製造方法を説明するための第2の工程図である。
【図6】図1に示す光導波路型バイオセンサーの製造方法を説明するための第3の工程図である。
【図7】図1に示す光導波路型バイオセンサーの製造方法を説明するための第4の工程図である。
【図8】光導波路型バイオセンサーにおける抗原の検知を説明するための模式図である。
【図9】この発明の実施の形態による他の光導波路型バイオセンサーの斜視図である。
【図10】図9に示す線X−X間における光導波路型バイオセンサーの断面図である。
【図11】図1に示す光導波路型バイオセンサーを備えたバイオセンサーシステムの構成図である。
【図12】検出されるパルス光の概念図である。
【発明を実施するための形態】
【0020】
本発明の実施の形態について図面を参照しながら詳細に説明する。なお、図中同一または相当部分には同一符号を付してその説明は繰返さない。
【0021】
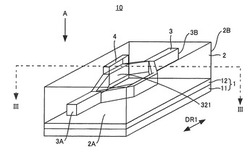
図1は、この発明の実施の形態によるバイオセンサーの斜視図である。図1を参照して、この発明の実施の形態による光導波路型バイオセンサー10は、基板1と、クラッド2と、コア3と、開口部4とを備える。光導波路型バイオセンサー10は、マッハツェンダー型のバイオセンサーである。
【0022】
光導波路型バイオセンサー10は、略長方形の平面形状を有する。基板1は、シリコン基板11と、酸化シリコン(SiO2)膜12とからなる。SiO2膜12は、6μmの厚みを有し、シリコン基板11の一主面に形成される。
【0023】
クラッド2は、たとえば、3−(トリメトキシシリル)プロピルメタクリレート(MAPTMS:Methacryloyloxy propyltrimethoxysilane)を主成分とするゾルゲルガラスからなり、基板1のSiO2膜12上に形成される。そして、クラッド2は、1550nmの波長に対して1.487の屈折率を有する。
【0024】
コア3は、たとえば、MAPTMSを主成分とするゾルゲルガラスからなり、光導波路型バイオセンサー10の長さ方向DR1に沿ってクラッド2中に配置される。そして、コア3は、6〜8μmの幅、3〜4μmの厚みおよび5mmの長さを有する。また、コア3は、1.5の屈折率を有する。さらに、コア3の端面3Aは、クラッド2の端面2Aに一致し、コア3の端面3Bは、クラッド2の端面2Bに一致する。なお、コア3は、単一モードの光導波路である。
【0025】
開口部4は、コア3の一部に接するようにクラッド2に設けられる。これによって、コア3の一部は、外部へ露出される。
【0026】
図2は、図1に示すA方向から見たコア3の平面図である。図2を参照して、コア3は、コア31〜34からなる。コア31,34の各々は、直線状の形状を有する。
【0027】
コア32は、一方端がコア31に接続され、他方端がコア34に接続される。そして、コア32の一部の領域321は、抗体がドープされている。この一部の領域321は、検出対象物である抗原が抗体に付着していない場合、コア32の他の領域と同じ屈折率を有し、抗原が抗体に付着すると、屈折率が変化する。
【0028】
なお、コア32の一部の領域321にドープされる抗体は、検出対象物である抗原の種類に応じて決定される。
【0029】
コア33は、コア31,34の軸AXに対してコア32と対称な形状を有する。そして、コア33は、一方端がコア31に接続され、他方端がコア34に接続される。また、コア33は、コア32と同じ長さを有する。
【0030】
このように、コア3は、2つのY型分岐を有するマッハツェンダー型のコアである。
【0031】
図3は、図1に示す線III−III間における光導波路型バイオセンサー10の断面図である。図3を参照して、コア3は、略四角形の断面形状を有する。そして、コア3は、一部の領域321を除いてクラッド2によって囲まれており、コア3の一部の領域321は、開口部4に接し、開口部4を介して外部に露出している。
【0032】
図4から図7は、それぞれ、図1に示す光導波路型バイオセンサー10の製造方法を説明するための第1から第4の工程図である。
【0033】
図4を参照して、光導波路型バイオセンサー10の製造が開始されると、酸素(O2)ガスを用いてシリコン基板11を1000℃の温度で酸化し、シリコン基板11の一主面にSiO2膜12を形成する。これによって、基板1が作製される(工程(a)参照)。
【0034】
その後、MAPTMSとZrPO(zirconium(IV)−n−propoxide)とのモル比MAPTMS/ZrPOを95%/5%に設定したゾルゲルシリカ溶液を作製し、その作製したゾルゲルシリカ溶液をスピンコートによって基板1上に塗布する。
【0035】
この場合、塗布したゾルゲルシリカ溶液の厚みは、図3においてSiO2膜12の表面からコア3の上面までの距離に相当する厚みである。
【0036】
そして、150℃の温度で1時間、ゾルゲルシリカ溶液をベーキングしてゾルゲルシリカ21を基板1上に形成する(工程(b)参照)。このゾルゲルシリカ21は、クラッド2の一部分である。
【0037】
引き続いて、ゾルゲルシリカ21のウェットエッチングは、UV光の照射と、試料をイソプロピルアルコール中に30秒〜1分の間、浸漬することによって行なわれる。水銀ランプのi線(波長=365nm)からなるUV光を照射した部分のみイソプロピルアルコールに溶解することなく残存させるために、ウェットエッチングを行なうゾルゲルシリカ溶液には、加水分解開始剤(例えば、CIBA製のIRGCURE184)を混入する。これにより、UV照射をフォトマスクにより遮断したゾルゲルシリカ部分に比べ、UV照射した部分の加水分解速度が増加し、UV照射部分のみが残る。
【0038】
従って、工程(b)の後、水銀ランプのi線(波長=365nm)からなるUV光をマスク22を介してゾルゲルシリカ21に照射する。この場合、UV光の照射強度は、11mW/cm2であり、照射時間は、10分間である。また、マスク22は、ガラス221と、金属膜222とからなる。金属膜222は、ガラス221の一主面221Aに形成される。そして、金属膜222は、i線(波長=365nm)からなるUV光を遮断する。これによって、ゾルゲルシリカ21のうちの一部分211以外の領域にUV光が照射される(工程(c)参照)。なお、ゾルゲルシリカ21の一部分21Aは、加水分解開始剤が含まれている。
【0039】
図5を参照して、工程(c)の後、ゾルゲルシリカ21のうちの一部分211をウェットエッチングによって除去し、コア3が形成される領域に穴23を形成する(工程(d)参照)。この場合、ウェットエッチングは、上述したように、試料をイソプロピルアルコール中に30秒〜1分の間、浸漬することによって行なわれる。
【0040】
その後、加水分解開始剤を混入したMAPTMSとZrPOとのモル比MAPTMS/ZrPOを85%/15%に設定したゾルゲルシリカ溶液を作製し、その作製したゾルゲルシリカ溶液をスピンコートによって穴23の中に塗布する。
【0041】
そして、その塗布したゾルゲルシリカ溶液を80℃の温度で10分、ベーキングする。これによって、ゾルゲルシリカ24がクラッド2の中に形成される(工程(e)参照)。
【0042】
引き続いて、水銀ランプのi線(波長=365nm)からなるUV光を、マスク25を介してゾルゲルシリカ24に照射する。この場合、UV光の照射強度は、11mW/cm2であり、照射時間は、10分間である。これによって、ゾルゲルシリカ24のうちの一部分241以外の部分にUV光が照射される(工程(f)参照)。なお、マスク25は、ガラス251と、金属膜252,253とからなる。金属膜252,253は、ガラス251の一主面251Aに形成される。
【0043】
図6を参照して、工程(f)の後、ゾルゲルシリカ24のうちの一部分241をウェットエッチングによって除去し、穴26を形成する(工程(g)参照)。この場合、ウェットエッチングは、試料をイソプロピルアルコール中に30秒〜1分の間、浸漬することによって行なわれる。
【0044】
その後、加水分解開始剤を混入したMAPTMSとZrPOとのモル比MAPTMS/ZrPOを95%/5%に設定したゾルゲルシリカ溶液を作製し、その作製したゾルゲルシリカ溶液をスピンコートによって試料の全面に塗布する。これによって、クラッド3の一部の領域321がゾルゲルシリカ溶液によって充填される。
【0045】
この場合、塗布したゾルゲルシリカ溶液の厚みは、図3においてコア3の上面からクラッド2の上面までの距離に相当する厚みである。
【0046】
そして、80℃の温度で10分、ゾルゲルシリカ溶液をベーキングしてゾルゲルシリカ27を基板1上に形成する(工程(h)参照)。このゾルゲルシリカ27は、クラッド2の一部分である。
【0047】
工程(h)の後、水銀ランプのi線(波長=365nm)からなるUV光を、マスク28を介してゾルゲルシリカ27に照射する。この場合、UV光の照射強度は、11mW/cm2であり、照射時間は、3分間である。また、マスク28は、ガラス281と、金属膜282とからなる。金属膜282は、ガラス281の一主面281Aに形成され、i線(波長=365nm)からなるUV光を遮断する。これによって、ゾルゲルシリカ27のうち、一部分271以外の領域にUV光が照射される(工程(i)参照)。
【0048】
図7を参照して、工程(i)の後、ゾルゲルシリカ27のうちの一部分271をウェットエッチングによって除去し、開口部4を形成し(工程(j)参照)、その後、150℃で1時間加熱する。この場合、ウェットエッチングは、試料をイソプロピルアルコール中に30秒〜1分の間、浸漬することによって行なわれる。また、このウェットエッチングによって、クラッド3の一部の領域321もエッチングされる。なお、ゾルゲルシリカ21,27は、クラッド2を構成する。
【0049】
その後、MAPTMSとZrPOとのモル比MAPTMS/ZrPOを85%/15%に設定したゾルゲルシリカ溶液を作製し、その作製したゾルゲルシリカ溶液に抗体(例えば、GFP)をドープし、その抗体をドープしたゾルゲルシリカ溶液をスピンコートによって開口部4に塗布する。これによって、クラッド3の一部の領域321にも、抗体をドープしたゾルゲルシリカ溶液が塗布される。その後、塗布したゾルゲルシリカ溶液(抗体を含む)にUV光を9分間照射する。
【0050】
これによって、抗体を一部の領域321に含むクラッド3がクラッド2の一部21の中に形成される(工程(k)参照)。そして、光導波路型バイオセンサー10が完成する。
【0051】
図8は、光導波路型バイオセンサー10における抗原の検知を説明するための模式図である。図8を参照して、検出対象物である抗原がコア3の一部の領域321に付着していない場合、コア3の端面3Aから入射した光は、コア31中を直進し、その後、コア32,33中へ分岐される。そして、光は、コア32,33中を進行し、コア32,33とコア34との接続部で強め合って合成される。その後、合成された光は、コア34中を進行し、光導波路型バイオセンサー10の外部へ放射される(図8の(a)参照)。
【0052】
一方、検出対象物である抗原20がコア3の一部の領域321に含まれる抗体に付着している場合、コア32の一部の領域321は、その屈折率が大きくなり、コア32中を進行した光と、コア33中を進行した光との間に位相差が発生し、その結果、コア32,33中を進行した2つの光は、コア32,33とコア34との接続部で弱め合って合成される。そして、合成された光は、コア34中を進行し、光導波路型バイオセンサー10の外部へ放射される(図8の(b)参照)。
【0053】
したがって、光導波路型バイオセンサー10から放射される光の強度を検出することにより、抗原20を検知できる。
【0054】
このように、光導波路型バイオセンサー10においては、マッハツェンダー型のコア3を用いて、入射された光を、コア32を伝搬する光とコア33を伝搬する光とに分岐し、コア32を伝搬する光とコア33を伝搬する光とが干渉するときの干渉光の強度変化を検出することによって領域321での抗原抗体反応の発生の有無、即ち、抗原の有無を高感度で検知できる。
【0055】
図9は、この発明の実施の形態による他のバイオセンサーの斜視図である。この発明の実施の形態によるバイオセンサーは、図9に示す光導波路型バイオセンサー10Aであってもよい。
【0056】
図9を参照して、光導波路型バイオセンサー10Aは、図1に示す光導波路型バイオセンサー10に流路5を追加したものであり、その他は、光導波路型バイオセンサー10と同じである。
【0057】
流路5は、流路51,52からなる。そして、流路51は、光導波路型バイオセンサー10Aの長さ方向DR1における開口部4の一方端側において開口部4に連通しており、流路52は、長さ方向DR1における開口部4の他方端側において開口部4に連通している。
【0058】
また、流路51の端面51Aは、幅方向DR2におけるクラッド2の端面2Cに一致しており、流露52の端面52Aは、幅方向DR2におけるクラッド2の端面2Cに一致している。
【0059】
この流路5は、水を流すための流路である。流路5に水を流すことにより、抗原が洗浄され、抗原が除去される。
【0060】
したがって、光導波路型バイオセンサー10Aは、使い捨てのセンサーではなく、抗原を洗浄除去することによって、複数回の使用が可能である。
【0061】
図10は、図9に示す線X−X間における光導波路型バイオセンサー10Aの断面図である。図10を参照して、流路5(51)は、開口部4に連通して配置されている。そして、流路5(51)の底面の高さは、開口部4の底面の高さと略同じである。
【0062】
光導波路型バイオセンサー10Aは、次の方法によって製造される。図7に示す工程(k)の後に、流路5(51,52)を形成する領域以外の領域にクラッド2の端面2CからUV光を照射し、UV光が照射されなかった領域を上述した条件でウェットエッチングする。これによって、光導波路型バイオセンサー10Aが完成する。最後にエッチングした流路51,52を基板(例えば、シリカガラス基板)等で蓋をして覆い、開口部4の部分は、外部と接触する構造とする(図10参照)。
【0063】
図11は、図1に示す光導波路型バイオセンサー10を備えたバイオセンサーシステムの構成図である。
【0064】
図11を参照して、バイオセンサーシステム100は、OTDR(Optical Time Domain Reflectometry)110と、カプラー120と、光ファイバー130と、光導波路型バイオセンサー131〜13n(nは2以上整数)と、ファイバブラックグレーティング141〜14nとを備える。
【0065】
光導波路型バイオセンサー131〜13nは、光ファイバー130によって光学的に直列に接続されている。そして、光ファイバー130は、単一モードの光ファイバーである。ファイバブラックグレーティング141〜14nは、それぞれ、光導波路型バイオセンサー131〜13nに対応して設けられる。
【0066】
OTDR110は、投光部111と、受光部112とを有する。投光部111は、光パルス光源(図示せず)を有し、受光部112は、光パルス検出部(図示せず)を有する。
【0067】
光パルス光源は、nsecオーダーの半値幅を有し、相互に異なる波長を有する複数の光パルスを出射する。この場合、複数の光パルスの波長は、ファイバブラックグレーティング141〜14nの反射周波数に一致している。
【0068】
OTDR110の投光部111および受光部112は、カプラー120によって光ファイバー130に接続されている。
【0069】
ファイバブラッググレーティング141〜14nは、例えば、光ファイバーに紫外のレーザ光を照射する等により光ファイバー中のコアの屈折率に周期的な強弱を持たせたものである。その結果、ファイバブラッググレーティング141〜14nは、光ファイバーの長手方向に周期的な屈折率変調が得られ、周期に合致した波長の光のみを反射し、他の波長の光を通過させる。他の波長の光は、この周期的な屈折率変動を感知しないからである。
【0070】
この発明の実施の形態では、ファイバブラッググレーティング141〜14nは、それぞれ、光導波路型バイオセンサー131〜13nごとに設定された所定波長の光のみを選択的に反射するように設定されている。
【0071】
OTDR110の光パルス検出部は、複数の光導波路型バイオセンサー131〜13nの後段に設置されたファイバブラッググレーティング141〜14nからの反射光を検出する。即ち、OTDR110の光パルス検出部は、光時間領域反射測定法によってファイバブラッググレーティング141〜14nからの反射光を検出する。OTDR110は、光ファイバー130中を伝搬している光パルスから光パワーの一部が入射側に戻ってくる現象を利用して光ファイバーの評価を行う方法であり(JIS C 6823:光ファイバー損失試験方法参照)、例えば、カプラー120を通じてフォトダイオード(PD:Photodiode)を接続し、A/D変換器によりデジタル信号に変換して制御装置によりパルス信号を解析する。具体的には、光パルス光源より光パルスを発した後、単一モードの光ファイバー130によって直列に接続された複数の光導波路型バイオセンサー141〜14nに対応して設置されたファイバブラッググレーティング141〜14nからの反射光が光パルス検出部に到達するまでの遅延時間を測定することにより、光導波路型バイオセンサー131〜13nまでの距離(即ち、光導波路型バイオセンサー131〜13nの位置)を特定して検出する。
【0072】
反射光が光パルス検出部に到達するまでの遅延時間は、ファイバーの長さに依存(dt=n dL/c,n:光ファイバーの屈折率)し、例えば、500m遠方の光導波路型バイオセンサー131〜13nを探知する時間遅延は、往復1kmで5μsとなる。 図12は、検出されるパルス光の概念図である。なお、図12において、縦軸は、信号強度であり、横軸は、時間である。
【0073】
抗原抗体反応が発生していない時は、(a)に示すような信号が検出され、例えば、2番目の光導波路型バイオセンサーに抗原抗体反応が発生すると、(b)のような信号になる。
【0074】
なお、本発明のバイオセンサネットワークは、ネットワーク中に設置されたファイバブラッググレーティング141〜14nからの反射光をOTDR110で検出し、その時間差から抗原抗体反応が発生したマッハツェンダー方式の光導波路型バイオセンサー131〜13nの位置を特定する方式である。
【0075】
従って、その位置を弁別して検出するためには、OTDR110の光パルス検出部の時間分解能Δt、光ファイバー130内での光伝送速度cを考慮して、マッハツェンダー方式の光導波路型バイオセンサー131〜13nの設置間隔Sを決定する必要がある。
【0076】
また、光ファイバー130内での減衰を0.16dB/km、OTDR110の光パルス検出部の最小検出感度を40dBとすると、本発明のバイオセンサネットワークシステム100の総延長距離Lは、125km程度(往復距離250km)となる。
【0077】
このように、本発明のマッハツェンダー型の光導波路型バイオセンサーとそれを用いたバイオセンサネットワークシステムによれば、複数の位置に設置されたセンシング対象物での抗原抗体反応の発生を、それが長距離であっても迅速、簡便に精度良く測定することができる。
【0078】
以上、実施の形態に基づき本発明を説明したが、本発明は、上記の実施の形態に何ら限定されるものではなく、その要旨を逸脱しない範囲内において各種の変更が可能である。
【0079】
例えば、投光部の光パルス光源は、市販の1台の波長可変型レーザを用い、各ファイバブラッググレーティングの反射波長に対応してレーザの波長を可変させる方法、あるいは、各ファイバブラッググレーティングの反射波長に対応する複数のレーザ光源からのパルスレーザ光をカプラーで結合して投光する方法等が考えられる。
【0080】
上記においては、バイオセンサーシステム100のn個のバイオセンサー131〜13nの各々は、図1に示す光導波路型バイオセンサー10からなると説明したが、この発明の実施の形態においては、これに限らず、n個のバイオセンサー131〜13nの各々は、図9に示す光導波路型バイオセンサー10Aからなっていてもよい。
【0081】
この場合、流路5に水を流すことによって抗体に付着した抗原を除去するので、バイオセンサーシステム100におけるn個のバイオセンサー131〜13nを用いて複数回の抗原の検知が可能である。
【0082】
なお、この発明の実施の形態においては、コア31は、「第1のコア」を構成し、コア34は、「第2のコア」を構成し、コア33は、「第3のコア」を構成し、コア32は、「第4のコア」を構成する。
【0083】
今回開示された実施の形態はすべての点で例示であって制限的なものではないと考えられるべきである。本発明の範囲は、上記した実施の形態の説明ではなくて特許請求の範囲によって示され、特許請求の範囲と均等の意味および範囲内でのすべての変更が含まれることが意図される。
【産業上の利用可能性】
【0084】
この発明によるマッハツェンダー方式の光導波路型バイオセンサー、およびそれを備えたネットワークシステムは、マッハツェンダー干渉系の原理を応用しており、抗原抗体反応に起因して発生する反射光強度の変化を高感度に検出することができ、また、光ファイバーを用いてセンサネットワークを構築しており、光ファイバーは、同軸ケーブルに比べて径が小さく、漏電の危険性がないことから、医療・福祉分野の施設内への敷設が容易となる。また、光ファイバーは、同軸ケーブルに比べて伝送損失が小さいため光増幅なしで100kmにわたる信号伝送が可能である。
【符号の説明】
【0085】
1 基板、2 クラッド、3 コア、4 開口部、10 光導波路型バイオセンサー、321 一部の領域。
【技術分野】
【0001】
この発明は、マッハツェンダー型の光導波路型バイオセンサーおよびそれを備えたバイオセンサーシステムに関するものである。
【背景技術】
【0002】
センシング対象物を迅速、簡便に測定するシステムが求められており、例えば、医療・福祉分野においては、施設内の環境管理、ウィルス・細菌感染予防等の観点から、抗原抗体反応検査の迅速化、高精度化および多点化を狙いとしたシステムの実現が望まれている。
【0003】
一方、センシング対象物を検知する技術として、光導波路を用いた技術が検討されており、例えば、光ファイバーのクラッドの先端、光導波路コア、あるいは、光導波路クラッドの表面等に抗体を固定化し、それを検査対象に接触あるいは挿入して、取り扱いが容易であり生体物質間結合のモデルとして多用されるアジビン−ビオチン結合に基づく屈折率の変化から抗原の存在を検知する光バイオセンサーが知られている(非特許文献1)。この実験結果から抗原抗体反応に対する同様の検査方法が可能となる。
【先行技術文献】
【非特許文献】
【0004】
【非特許文献1】H. Tazawa et al, Applied Physics Letters, 91, 113901 (2007).
【発明の概要】
【発明が解決しようとする課題】
【0005】
しかし、従来の光バイオセンサーは、抗原抗体反応に起因して発生する光強度変化が小さく、十分な検出感度を得られないという問題がある。
【0006】
そこで、この発明は、かかる問題を解決するためになされたものであり、その目的は、検出感度を高くできるバイオセンサーを提供することである。
【0007】
また、この発明の別の目的は、検出感度を高くできる検出部を備えたバイオセンサーシステムを提供することである。
【課題を解決するための手段】
【0008】
この発明によれば、光導波路型バイオセンサーは、基板と、クラッドと、コアとを備える。クラッドは、基板上に形成され、ゾルゲルガラスからなる。コアは、クラッド中に形成され、ゾルゲルガラスからなる。コアは、第1から第4のコアからなる。第3のコアは、第1および第2のコアに接続される。第4のコアは、第1および第2のコアの軸に対して第3のコアと対称な形状を有するとともに、第1および第2のコアに接続され、抗体を含む。そして、第4のコアの抗体を含む領域は、クラッドに設けられた開口部を介して外部に露出している。
【0009】
好ましくは、光導波路型バイオセンサーは、流路をさらに備える。流路は、開口部に接してクラッド中に設けられ、水を流す。
【0010】
好ましくは、第4のコアに含まれる抗体は、検出対象物である抗原の種類に応じて決定されている。
【0011】
また、この発明によれば、バイオセンサーシステムは、複数の光導波路型バイオセンサーと、光ファイバーと、光パルス光源と、複数のファイバブラッググレーティングと、検出器とを備える。複数の光導波路型バイオセンサーの各々は、抗原を検出する。光ファイバーは、複数の光導波路型バイオセンサーを光学的に直列に接続する。光パルス光源は、光ファイバーの一方端に接続され、波長が相互に異なる複数のパルス光を出射する。複数のファイバブラッググレーティングは、複数の光導波路型バイオセンサーに対応して光ファイバー中に設けられ、各々が対応する光導波路型バイオセンサーにおける干渉光を反射する。検出器は、複数のファイバブラッググレーティングによって反射された複数の反射光を検出し、その検出結果に基づいて光導波路型バイオセンサーにおける抗原抗体反応の発生の有無を検出する。複数の光導波路型バイオセンサーの各々は、基板と、クラッドと、コアとを含む。クラッドは、基板上に形成され、ゾルゲルガラスからなる。コアは、クラッド中に形成され、ゾルゲルガラスからなる。コアは、第1から第4のコアからなる。第3のコアは、第1および第2のコアに接続される。第4のコアは、第1および第2のコアの軸に対して第3のコアと対称な形状を有するとともに、第1および第2のコアに接続され、抗体を含む。第4のコアの抗体を含む領域は、クラッドに設けられた開口部を介して外部に露出している。
【0012】
好ましくは、検出器は、光時間領域反射測定法によって複数の反射光の強度変化を検出する。
【0013】
好ましくは、検出器は、光パルスが光パルス光源から出射されてから、ファイバブラッググレーティングによって反射された光導波路型バイオセンサーにおける干渉後の光パルスが検出部に到達するまでの検出時間遅延を測定することによって、抗原抗体反応が発生した光導波路型バイオセンサーを特定して光導波路型バイオセンサーごとに光強度を検出する。
【0014】
好ましくは、光導波路型バイオセンサーの光導波路は、単一モードの光導波路であり、光ファイバーは、単一モードの光ファイバーである。
【発明の効果】
【0015】
この発明による光導波路型バイオセンサーにおいては、入射された光を第3のコアを伝搬する光と第4のコアを伝搬する光とに分岐し、第3のコアを伝搬した光と第4のコアを伝搬した光とが干渉するときの干渉条件を抗原の有無に応じて変えることによって抗原を検知する。そして、干渉条件は、抗原が抗体に付着することによる第4のコアの屈折率の変化によって変えられる。
【0016】
したがって、従来のバイオセンサーよりも高感度に抗原を検知できる。
【0017】
また、この発明によれば、センシング対象物を抗原とした抗原抗体反応によって変化する光強度を多数の観測点で同時に測定するとともに、センシング対象物を検出した光導波路型バイオセンサーを特定することができる。
【0018】
さらに、マルチモードよりも伝送損失が小さい単一モードの光ファイバーを用いるとともに、マッハツェンダー方式の光導波路型バイオセンサーの光導波路を単一モードの光導波路とし、光ファイバーと、マッハツェンダー方式の光導波路型バイオセンサーとを低結合損失で接続してセンサネットワークを構築しているので、長距離においても高感度な検出が可能になる。
【図面の簡単な説明】
【0019】
【図1】この発明の実施の形態によるバイオセンサーの斜視図である。
【図2】図1に示すA方向から見たコアの平面図である。
【図3】図1に示す線III−III間におけるバイオセンサーの断面図である。
【図4】図1に示す光導波路型バイオセンサーの製造方法を説明するための第1の工程図である。
【図5】図1に示す光導波路型バイオセンサーの製造方法を説明するための第2の工程図である。
【図6】図1に示す光導波路型バイオセンサーの製造方法を説明するための第3の工程図である。
【図7】図1に示す光導波路型バイオセンサーの製造方法を説明するための第4の工程図である。
【図8】光導波路型バイオセンサーにおける抗原の検知を説明するための模式図である。
【図9】この発明の実施の形態による他の光導波路型バイオセンサーの斜視図である。
【図10】図9に示す線X−X間における光導波路型バイオセンサーの断面図である。
【図11】図1に示す光導波路型バイオセンサーを備えたバイオセンサーシステムの構成図である。
【図12】検出されるパルス光の概念図である。
【発明を実施するための形態】
【0020】
本発明の実施の形態について図面を参照しながら詳細に説明する。なお、図中同一または相当部分には同一符号を付してその説明は繰返さない。
【0021】
図1は、この発明の実施の形態によるバイオセンサーの斜視図である。図1を参照して、この発明の実施の形態による光導波路型バイオセンサー10は、基板1と、クラッド2と、コア3と、開口部4とを備える。光導波路型バイオセンサー10は、マッハツェンダー型のバイオセンサーである。
【0022】
光導波路型バイオセンサー10は、略長方形の平面形状を有する。基板1は、シリコン基板11と、酸化シリコン(SiO2)膜12とからなる。SiO2膜12は、6μmの厚みを有し、シリコン基板11の一主面に形成される。
【0023】
クラッド2は、たとえば、3−(トリメトキシシリル)プロピルメタクリレート(MAPTMS:Methacryloyloxy propyltrimethoxysilane)を主成分とするゾルゲルガラスからなり、基板1のSiO2膜12上に形成される。そして、クラッド2は、1550nmの波長に対して1.487の屈折率を有する。
【0024】
コア3は、たとえば、MAPTMSを主成分とするゾルゲルガラスからなり、光導波路型バイオセンサー10の長さ方向DR1に沿ってクラッド2中に配置される。そして、コア3は、6〜8μmの幅、3〜4μmの厚みおよび5mmの長さを有する。また、コア3は、1.5の屈折率を有する。さらに、コア3の端面3Aは、クラッド2の端面2Aに一致し、コア3の端面3Bは、クラッド2の端面2Bに一致する。なお、コア3は、単一モードの光導波路である。
【0025】
開口部4は、コア3の一部に接するようにクラッド2に設けられる。これによって、コア3の一部は、外部へ露出される。
【0026】
図2は、図1に示すA方向から見たコア3の平面図である。図2を参照して、コア3は、コア31〜34からなる。コア31,34の各々は、直線状の形状を有する。
【0027】
コア32は、一方端がコア31に接続され、他方端がコア34に接続される。そして、コア32の一部の領域321は、抗体がドープされている。この一部の領域321は、検出対象物である抗原が抗体に付着していない場合、コア32の他の領域と同じ屈折率を有し、抗原が抗体に付着すると、屈折率が変化する。
【0028】
なお、コア32の一部の領域321にドープされる抗体は、検出対象物である抗原の種類に応じて決定される。
【0029】
コア33は、コア31,34の軸AXに対してコア32と対称な形状を有する。そして、コア33は、一方端がコア31に接続され、他方端がコア34に接続される。また、コア33は、コア32と同じ長さを有する。
【0030】
このように、コア3は、2つのY型分岐を有するマッハツェンダー型のコアである。
【0031】
図3は、図1に示す線III−III間における光導波路型バイオセンサー10の断面図である。図3を参照して、コア3は、略四角形の断面形状を有する。そして、コア3は、一部の領域321を除いてクラッド2によって囲まれており、コア3の一部の領域321は、開口部4に接し、開口部4を介して外部に露出している。
【0032】
図4から図7は、それぞれ、図1に示す光導波路型バイオセンサー10の製造方法を説明するための第1から第4の工程図である。
【0033】
図4を参照して、光導波路型バイオセンサー10の製造が開始されると、酸素(O2)ガスを用いてシリコン基板11を1000℃の温度で酸化し、シリコン基板11の一主面にSiO2膜12を形成する。これによって、基板1が作製される(工程(a)参照)。
【0034】
その後、MAPTMSとZrPO(zirconium(IV)−n−propoxide)とのモル比MAPTMS/ZrPOを95%/5%に設定したゾルゲルシリカ溶液を作製し、その作製したゾルゲルシリカ溶液をスピンコートによって基板1上に塗布する。
【0035】
この場合、塗布したゾルゲルシリカ溶液の厚みは、図3においてSiO2膜12の表面からコア3の上面までの距離に相当する厚みである。
【0036】
そして、150℃の温度で1時間、ゾルゲルシリカ溶液をベーキングしてゾルゲルシリカ21を基板1上に形成する(工程(b)参照)。このゾルゲルシリカ21は、クラッド2の一部分である。
【0037】
引き続いて、ゾルゲルシリカ21のウェットエッチングは、UV光の照射と、試料をイソプロピルアルコール中に30秒〜1分の間、浸漬することによって行なわれる。水銀ランプのi線(波長=365nm)からなるUV光を照射した部分のみイソプロピルアルコールに溶解することなく残存させるために、ウェットエッチングを行なうゾルゲルシリカ溶液には、加水分解開始剤(例えば、CIBA製のIRGCURE184)を混入する。これにより、UV照射をフォトマスクにより遮断したゾルゲルシリカ部分に比べ、UV照射した部分の加水分解速度が増加し、UV照射部分のみが残る。
【0038】
従って、工程(b)の後、水銀ランプのi線(波長=365nm)からなるUV光をマスク22を介してゾルゲルシリカ21に照射する。この場合、UV光の照射強度は、11mW/cm2であり、照射時間は、10分間である。また、マスク22は、ガラス221と、金属膜222とからなる。金属膜222は、ガラス221の一主面221Aに形成される。そして、金属膜222は、i線(波長=365nm)からなるUV光を遮断する。これによって、ゾルゲルシリカ21のうちの一部分211以外の領域にUV光が照射される(工程(c)参照)。なお、ゾルゲルシリカ21の一部分21Aは、加水分解開始剤が含まれている。
【0039】
図5を参照して、工程(c)の後、ゾルゲルシリカ21のうちの一部分211をウェットエッチングによって除去し、コア3が形成される領域に穴23を形成する(工程(d)参照)。この場合、ウェットエッチングは、上述したように、試料をイソプロピルアルコール中に30秒〜1分の間、浸漬することによって行なわれる。
【0040】
その後、加水分解開始剤を混入したMAPTMSとZrPOとのモル比MAPTMS/ZrPOを85%/15%に設定したゾルゲルシリカ溶液を作製し、その作製したゾルゲルシリカ溶液をスピンコートによって穴23の中に塗布する。
【0041】
そして、その塗布したゾルゲルシリカ溶液を80℃の温度で10分、ベーキングする。これによって、ゾルゲルシリカ24がクラッド2の中に形成される(工程(e)参照)。
【0042】
引き続いて、水銀ランプのi線(波長=365nm)からなるUV光を、マスク25を介してゾルゲルシリカ24に照射する。この場合、UV光の照射強度は、11mW/cm2であり、照射時間は、10分間である。これによって、ゾルゲルシリカ24のうちの一部分241以外の部分にUV光が照射される(工程(f)参照)。なお、マスク25は、ガラス251と、金属膜252,253とからなる。金属膜252,253は、ガラス251の一主面251Aに形成される。
【0043】
図6を参照して、工程(f)の後、ゾルゲルシリカ24のうちの一部分241をウェットエッチングによって除去し、穴26を形成する(工程(g)参照)。この場合、ウェットエッチングは、試料をイソプロピルアルコール中に30秒〜1分の間、浸漬することによって行なわれる。
【0044】
その後、加水分解開始剤を混入したMAPTMSとZrPOとのモル比MAPTMS/ZrPOを95%/5%に設定したゾルゲルシリカ溶液を作製し、その作製したゾルゲルシリカ溶液をスピンコートによって試料の全面に塗布する。これによって、クラッド3の一部の領域321がゾルゲルシリカ溶液によって充填される。
【0045】
この場合、塗布したゾルゲルシリカ溶液の厚みは、図3においてコア3の上面からクラッド2の上面までの距離に相当する厚みである。
【0046】
そして、80℃の温度で10分、ゾルゲルシリカ溶液をベーキングしてゾルゲルシリカ27を基板1上に形成する(工程(h)参照)。このゾルゲルシリカ27は、クラッド2の一部分である。
【0047】
工程(h)の後、水銀ランプのi線(波長=365nm)からなるUV光を、マスク28を介してゾルゲルシリカ27に照射する。この場合、UV光の照射強度は、11mW/cm2であり、照射時間は、3分間である。また、マスク28は、ガラス281と、金属膜282とからなる。金属膜282は、ガラス281の一主面281Aに形成され、i線(波長=365nm)からなるUV光を遮断する。これによって、ゾルゲルシリカ27のうち、一部分271以外の領域にUV光が照射される(工程(i)参照)。
【0048】
図7を参照して、工程(i)の後、ゾルゲルシリカ27のうちの一部分271をウェットエッチングによって除去し、開口部4を形成し(工程(j)参照)、その後、150℃で1時間加熱する。この場合、ウェットエッチングは、試料をイソプロピルアルコール中に30秒〜1分の間、浸漬することによって行なわれる。また、このウェットエッチングによって、クラッド3の一部の領域321もエッチングされる。なお、ゾルゲルシリカ21,27は、クラッド2を構成する。
【0049】
その後、MAPTMSとZrPOとのモル比MAPTMS/ZrPOを85%/15%に設定したゾルゲルシリカ溶液を作製し、その作製したゾルゲルシリカ溶液に抗体(例えば、GFP)をドープし、その抗体をドープしたゾルゲルシリカ溶液をスピンコートによって開口部4に塗布する。これによって、クラッド3の一部の領域321にも、抗体をドープしたゾルゲルシリカ溶液が塗布される。その後、塗布したゾルゲルシリカ溶液(抗体を含む)にUV光を9分間照射する。
【0050】
これによって、抗体を一部の領域321に含むクラッド3がクラッド2の一部21の中に形成される(工程(k)参照)。そして、光導波路型バイオセンサー10が完成する。
【0051】
図8は、光導波路型バイオセンサー10における抗原の検知を説明するための模式図である。図8を参照して、検出対象物である抗原がコア3の一部の領域321に付着していない場合、コア3の端面3Aから入射した光は、コア31中を直進し、その後、コア32,33中へ分岐される。そして、光は、コア32,33中を進行し、コア32,33とコア34との接続部で強め合って合成される。その後、合成された光は、コア34中を進行し、光導波路型バイオセンサー10の外部へ放射される(図8の(a)参照)。
【0052】
一方、検出対象物である抗原20がコア3の一部の領域321に含まれる抗体に付着している場合、コア32の一部の領域321は、その屈折率が大きくなり、コア32中を進行した光と、コア33中を進行した光との間に位相差が発生し、その結果、コア32,33中を進行した2つの光は、コア32,33とコア34との接続部で弱め合って合成される。そして、合成された光は、コア34中を進行し、光導波路型バイオセンサー10の外部へ放射される(図8の(b)参照)。
【0053】
したがって、光導波路型バイオセンサー10から放射される光の強度を検出することにより、抗原20を検知できる。
【0054】
このように、光導波路型バイオセンサー10においては、マッハツェンダー型のコア3を用いて、入射された光を、コア32を伝搬する光とコア33を伝搬する光とに分岐し、コア32を伝搬する光とコア33を伝搬する光とが干渉するときの干渉光の強度変化を検出することによって領域321での抗原抗体反応の発生の有無、即ち、抗原の有無を高感度で検知できる。
【0055】
図9は、この発明の実施の形態による他のバイオセンサーの斜視図である。この発明の実施の形態によるバイオセンサーは、図9に示す光導波路型バイオセンサー10Aであってもよい。
【0056】
図9を参照して、光導波路型バイオセンサー10Aは、図1に示す光導波路型バイオセンサー10に流路5を追加したものであり、その他は、光導波路型バイオセンサー10と同じである。
【0057】
流路5は、流路51,52からなる。そして、流路51は、光導波路型バイオセンサー10Aの長さ方向DR1における開口部4の一方端側において開口部4に連通しており、流路52は、長さ方向DR1における開口部4の他方端側において開口部4に連通している。
【0058】
また、流路51の端面51Aは、幅方向DR2におけるクラッド2の端面2Cに一致しており、流露52の端面52Aは、幅方向DR2におけるクラッド2の端面2Cに一致している。
【0059】
この流路5は、水を流すための流路である。流路5に水を流すことにより、抗原が洗浄され、抗原が除去される。
【0060】
したがって、光導波路型バイオセンサー10Aは、使い捨てのセンサーではなく、抗原を洗浄除去することによって、複数回の使用が可能である。
【0061】
図10は、図9に示す線X−X間における光導波路型バイオセンサー10Aの断面図である。図10を参照して、流路5(51)は、開口部4に連通して配置されている。そして、流路5(51)の底面の高さは、開口部4の底面の高さと略同じである。
【0062】
光導波路型バイオセンサー10Aは、次の方法によって製造される。図7に示す工程(k)の後に、流路5(51,52)を形成する領域以外の領域にクラッド2の端面2CからUV光を照射し、UV光が照射されなかった領域を上述した条件でウェットエッチングする。これによって、光導波路型バイオセンサー10Aが完成する。最後にエッチングした流路51,52を基板(例えば、シリカガラス基板)等で蓋をして覆い、開口部4の部分は、外部と接触する構造とする(図10参照)。
【0063】
図11は、図1に示す光導波路型バイオセンサー10を備えたバイオセンサーシステムの構成図である。
【0064】
図11を参照して、バイオセンサーシステム100は、OTDR(Optical Time Domain Reflectometry)110と、カプラー120と、光ファイバー130と、光導波路型バイオセンサー131〜13n(nは2以上整数)と、ファイバブラックグレーティング141〜14nとを備える。
【0065】
光導波路型バイオセンサー131〜13nは、光ファイバー130によって光学的に直列に接続されている。そして、光ファイバー130は、単一モードの光ファイバーである。ファイバブラックグレーティング141〜14nは、それぞれ、光導波路型バイオセンサー131〜13nに対応して設けられる。
【0066】
OTDR110は、投光部111と、受光部112とを有する。投光部111は、光パルス光源(図示せず)を有し、受光部112は、光パルス検出部(図示せず)を有する。
【0067】
光パルス光源は、nsecオーダーの半値幅を有し、相互に異なる波長を有する複数の光パルスを出射する。この場合、複数の光パルスの波長は、ファイバブラックグレーティング141〜14nの反射周波数に一致している。
【0068】
OTDR110の投光部111および受光部112は、カプラー120によって光ファイバー130に接続されている。
【0069】
ファイバブラッググレーティング141〜14nは、例えば、光ファイバーに紫外のレーザ光を照射する等により光ファイバー中のコアの屈折率に周期的な強弱を持たせたものである。その結果、ファイバブラッググレーティング141〜14nは、光ファイバーの長手方向に周期的な屈折率変調が得られ、周期に合致した波長の光のみを反射し、他の波長の光を通過させる。他の波長の光は、この周期的な屈折率変動を感知しないからである。
【0070】
この発明の実施の形態では、ファイバブラッググレーティング141〜14nは、それぞれ、光導波路型バイオセンサー131〜13nごとに設定された所定波長の光のみを選択的に反射するように設定されている。
【0071】
OTDR110の光パルス検出部は、複数の光導波路型バイオセンサー131〜13nの後段に設置されたファイバブラッググレーティング141〜14nからの反射光を検出する。即ち、OTDR110の光パルス検出部は、光時間領域反射測定法によってファイバブラッググレーティング141〜14nからの反射光を検出する。OTDR110は、光ファイバー130中を伝搬している光パルスから光パワーの一部が入射側に戻ってくる現象を利用して光ファイバーの評価を行う方法であり(JIS C 6823:光ファイバー損失試験方法参照)、例えば、カプラー120を通じてフォトダイオード(PD:Photodiode)を接続し、A/D変換器によりデジタル信号に変換して制御装置によりパルス信号を解析する。具体的には、光パルス光源より光パルスを発した後、単一モードの光ファイバー130によって直列に接続された複数の光導波路型バイオセンサー141〜14nに対応して設置されたファイバブラッググレーティング141〜14nからの反射光が光パルス検出部に到達するまでの遅延時間を測定することにより、光導波路型バイオセンサー131〜13nまでの距離(即ち、光導波路型バイオセンサー131〜13nの位置)を特定して検出する。
【0072】
反射光が光パルス検出部に到達するまでの遅延時間は、ファイバーの長さに依存(dt=n dL/c,n:光ファイバーの屈折率)し、例えば、500m遠方の光導波路型バイオセンサー131〜13nを探知する時間遅延は、往復1kmで5μsとなる。 図12は、検出されるパルス光の概念図である。なお、図12において、縦軸は、信号強度であり、横軸は、時間である。
【0073】
抗原抗体反応が発生していない時は、(a)に示すような信号が検出され、例えば、2番目の光導波路型バイオセンサーに抗原抗体反応が発生すると、(b)のような信号になる。
【0074】
なお、本発明のバイオセンサネットワークは、ネットワーク中に設置されたファイバブラッググレーティング141〜14nからの反射光をOTDR110で検出し、その時間差から抗原抗体反応が発生したマッハツェンダー方式の光導波路型バイオセンサー131〜13nの位置を特定する方式である。
【0075】
従って、その位置を弁別して検出するためには、OTDR110の光パルス検出部の時間分解能Δt、光ファイバー130内での光伝送速度cを考慮して、マッハツェンダー方式の光導波路型バイオセンサー131〜13nの設置間隔Sを決定する必要がある。
【0076】
また、光ファイバー130内での減衰を0.16dB/km、OTDR110の光パルス検出部の最小検出感度を40dBとすると、本発明のバイオセンサネットワークシステム100の総延長距離Lは、125km程度(往復距離250km)となる。
【0077】
このように、本発明のマッハツェンダー型の光導波路型バイオセンサーとそれを用いたバイオセンサネットワークシステムによれば、複数の位置に設置されたセンシング対象物での抗原抗体反応の発生を、それが長距離であっても迅速、簡便に精度良く測定することができる。
【0078】
以上、実施の形態に基づき本発明を説明したが、本発明は、上記の実施の形態に何ら限定されるものではなく、その要旨を逸脱しない範囲内において各種の変更が可能である。
【0079】
例えば、投光部の光パルス光源は、市販の1台の波長可変型レーザを用い、各ファイバブラッググレーティングの反射波長に対応してレーザの波長を可変させる方法、あるいは、各ファイバブラッググレーティングの反射波長に対応する複数のレーザ光源からのパルスレーザ光をカプラーで結合して投光する方法等が考えられる。
【0080】
上記においては、バイオセンサーシステム100のn個のバイオセンサー131〜13nの各々は、図1に示す光導波路型バイオセンサー10からなると説明したが、この発明の実施の形態においては、これに限らず、n個のバイオセンサー131〜13nの各々は、図9に示す光導波路型バイオセンサー10Aからなっていてもよい。
【0081】
この場合、流路5に水を流すことによって抗体に付着した抗原を除去するので、バイオセンサーシステム100におけるn個のバイオセンサー131〜13nを用いて複数回の抗原の検知が可能である。
【0082】
なお、この発明の実施の形態においては、コア31は、「第1のコア」を構成し、コア34は、「第2のコア」を構成し、コア33は、「第3のコア」を構成し、コア32は、「第4のコア」を構成する。
【0083】
今回開示された実施の形態はすべての点で例示であって制限的なものではないと考えられるべきである。本発明の範囲は、上記した実施の形態の説明ではなくて特許請求の範囲によって示され、特許請求の範囲と均等の意味および範囲内でのすべての変更が含まれることが意図される。
【産業上の利用可能性】
【0084】
この発明によるマッハツェンダー方式の光導波路型バイオセンサー、およびそれを備えたネットワークシステムは、マッハツェンダー干渉系の原理を応用しており、抗原抗体反応に起因して発生する反射光強度の変化を高感度に検出することができ、また、光ファイバーを用いてセンサネットワークを構築しており、光ファイバーは、同軸ケーブルに比べて径が小さく、漏電の危険性がないことから、医療・福祉分野の施設内への敷設が容易となる。また、光ファイバーは、同軸ケーブルに比べて伝送損失が小さいため光増幅なしで100kmにわたる信号伝送が可能である。
【符号の説明】
【0085】
1 基板、2 クラッド、3 コア、4 開口部、10 光導波路型バイオセンサー、321 一部の領域。
【特許請求の範囲】
【請求項1】
基板と、
前記基板上に形成され、ゾルゲルガラスからなるクラッドと、
前記クラッド中に形成され、ゾルゲルガラスからなるコアとを備え、
前記コアは、
第1のコアと、
第2のコアと、
前記第1および第2のコアに接続された第3のコアと、
前記第1および第2のコアの軸に対して前記第3のコアと対称な形状を有するとともに、前記第1および第2のコアに接続され、抗体を含む第4のコアとを含み、
前記第4のコアの前記抗体を含む領域は、前記クラッドに設けられた開口部を介して外部に露出している、光導波路型バイオセンサー。
【請求項2】
前記開口部に接して前記クラッド中に設けられ、水を流すための流路をさらに備える、請求項1に記載の光導波路型バイオセンサー。
【請求項3】
前記第4のコアに含まれる抗体は、検出対象物である抗原の種類に応じて決定されている、請求項1または請求項2に記載の光導波路型バイオセンサー。
【請求項4】
各々が抗原を検出する複数の光導波路型バイオセンサーと、
前記複数の光導波路型バイオセンサーを光学的に直列に接続する光ファイバーと、
前記光ファイバーの一方端に接続され、波長が相互に異なる複数のパルス光を出射する光パルス光源と、
前記複数の光導波路型バイオセンサーに対応して前記光ファイバー中に設けられ、各々が対応する光導波路型バイオセンサーにおける干渉光を反射する複数のファイバブラッググレーティングと、
前記複数のファイバブラッググレーティングによって反射された複数の反射光を検出し、その検出結果に基づいて前記光導波路型バイオセンサーにおける抗原抗体反応の発生の有無を検出する検出器とを備え、
前記複数の光導波路型バイオセンサーの各々は、
基板と、
前記基板上に形成され、ゾルゲルガラスからなるクラッドと、
前記クラッド中に形成され、ゾルゲルガラスからなるコアとを含み、
前記コアは、
第1のコアと、
第2のコアと、
前記第1および第2のコアに接続された第3のコアと、
前記第1および第2のコアの軸に対して前記第3のコアと対称な形状を有するとともに、前記第1および第2のコアに接続され、抗体を含む第4のコアとを含み、
前記第4のコアの前記抗体を含む領域は、前記クラッドに設けられた開口部を介して外部に露出している、バイオセンサーシステム。
【請求項5】
前記検出器は、光時間領域反射測定法によって前記複数の反射光の強度変化を検出する、請求項4に記載のバイオセンサーシステム。
【請求項6】
前記検出器は、前記光パルスが光パルス光源から出射されてから、ファイバブラッググレーティングによって反射された前記光導波路型バイオセンサーにおける干渉後の光パルスが前記検出部に到達するまでの検出時間遅延を測定することによって、抗原抗体反応が発生した光導波路型バイオセンサーを特定して光導波路型バイオセンサーごとに光強度を検出する、請求項4に記載のバイオセンサーシステム。
【請求項7】
前記光導波路型バイオセンサーの光導波路は、単一モードの光導波路であり、
前記光ファイバーは、単一モードの光ファイバーである、請求項4から請求項6のいずれか1項に記載のバイオセンサーシステム。
【請求項1】
基板と、
前記基板上に形成され、ゾルゲルガラスからなるクラッドと、
前記クラッド中に形成され、ゾルゲルガラスからなるコアとを備え、
前記コアは、
第1のコアと、
第2のコアと、
前記第1および第2のコアに接続された第3のコアと、
前記第1および第2のコアの軸に対して前記第3のコアと対称な形状を有するとともに、前記第1および第2のコアに接続され、抗体を含む第4のコアとを含み、
前記第4のコアの前記抗体を含む領域は、前記クラッドに設けられた開口部を介して外部に露出している、光導波路型バイオセンサー。
【請求項2】
前記開口部に接して前記クラッド中に設けられ、水を流すための流路をさらに備える、請求項1に記載の光導波路型バイオセンサー。
【請求項3】
前記第4のコアに含まれる抗体は、検出対象物である抗原の種類に応じて決定されている、請求項1または請求項2に記載の光導波路型バイオセンサー。
【請求項4】
各々が抗原を検出する複数の光導波路型バイオセンサーと、
前記複数の光導波路型バイオセンサーを光学的に直列に接続する光ファイバーと、
前記光ファイバーの一方端に接続され、波長が相互に異なる複数のパルス光を出射する光パルス光源と、
前記複数の光導波路型バイオセンサーに対応して前記光ファイバー中に設けられ、各々が対応する光導波路型バイオセンサーにおける干渉光を反射する複数のファイバブラッググレーティングと、
前記複数のファイバブラッググレーティングによって反射された複数の反射光を検出し、その検出結果に基づいて前記光導波路型バイオセンサーにおける抗原抗体反応の発生の有無を検出する検出器とを備え、
前記複数の光導波路型バイオセンサーの各々は、
基板と、
前記基板上に形成され、ゾルゲルガラスからなるクラッドと、
前記クラッド中に形成され、ゾルゲルガラスからなるコアとを含み、
前記コアは、
第1のコアと、
第2のコアと、
前記第1および第2のコアに接続された第3のコアと、
前記第1および第2のコアの軸に対して前記第3のコアと対称な形状を有するとともに、前記第1および第2のコアに接続され、抗体を含む第4のコアとを含み、
前記第4のコアの前記抗体を含む領域は、前記クラッドに設けられた開口部を介して外部に露出している、バイオセンサーシステム。
【請求項5】
前記検出器は、光時間領域反射測定法によって前記複数の反射光の強度変化を検出する、請求項4に記載のバイオセンサーシステム。
【請求項6】
前記検出器は、前記光パルスが光パルス光源から出射されてから、ファイバブラッググレーティングによって反射された前記光導波路型バイオセンサーにおける干渉後の光パルスが前記検出部に到達するまでの検出時間遅延を測定することによって、抗原抗体反応が発生した光導波路型バイオセンサーを特定して光導波路型バイオセンサーごとに光強度を検出する、請求項4に記載のバイオセンサーシステム。
【請求項7】
前記光導波路型バイオセンサーの光導波路は、単一モードの光導波路であり、
前記光ファイバーは、単一モードの光ファイバーである、請求項4から請求項6のいずれか1項に記載のバイオセンサーシステム。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【公開番号】特開2011−107071(P2011−107071A)
【公開日】平成23年6月2日(2011.6.2)
【国際特許分類】
【出願番号】特願2009−264861(P2009−264861)
【出願日】平成21年11月20日(2009.11.20)
【出願人】(504136568)国立大学法人広島大学 (924)
【出願人】(504145320)国立大学法人福井大学 (287)
【Fターム(参考)】
【公開日】平成23年6月2日(2011.6.2)
【国際特許分類】
【出願日】平成21年11月20日(2009.11.20)
【出願人】(504136568)国立大学法人広島大学 (924)
【出願人】(504145320)国立大学法人福井大学 (287)
【Fターム(参考)】
[ Back to top ]

