光応答性リポソーム及び光応答性リポソームを利用した物質の運搬方法
【課題】リポソーム膜形状を可逆的に変化させることで、物質の封入と放出とを制御可能な光応答性リポソーム及びこれを利用した物質の運搬方法を提供する
【解決手段】光応答性リポソームは、アゾベンゼン脂質と、リン脂質と、をトリス塩酸緩衝液中で分散させて生成される。リン脂質は、リポソームの使用温度(例えば室温)より低いゲル−液晶相転移温度を有する。リポソームは、異種の光が別々のタイミングで照射されることにより、膜上に膜孔を可逆的に形成又は消滅することを特徴とする。アゾベンゼン脂質がKAONであることが好ましい。この膜孔を通して薬剤等の物質をリポソームの膜内に封入又は膜外へ放出させることができる。
【解決手段】光応答性リポソームは、アゾベンゼン脂質と、リン脂質と、をトリス塩酸緩衝液中で分散させて生成される。リン脂質は、リポソームの使用温度(例えば室温)より低いゲル−液晶相転移温度を有する。リポソームは、異種の光が別々のタイミングで照射されることにより、膜上に膜孔を可逆的に形成又は消滅することを特徴とする。アゾベンゼン脂質がKAONであることが好ましい。この膜孔を通して薬剤等の物質をリポソームの膜内に封入又は膜外へ放出させることができる。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、光応答性のリポソームに関し、特に異種の光を照射することにより膜孔の開閉を可逆的に制御できるリポソームに関するものである。
【背景技術】
【0002】
リポソームは、リン脂質等の脂質2分子膜によって形成され、数10nm〜数10μmの粒径を有する微小なカプセルであり、その内部に様々な分子を封入可能な水相を有する。このリポソームは、生体適合性や生分解性にも優れていることから、内部の水相に薬剤や生理活性物質を封入することで所望量の薬物を体内の標的部位に選択的に運搬するドラックキャリアになり得る製剤として注目を集めている。
【0003】
これまでに、例えば、温度の感受性やpHの感受性を利用したリポソームが提案されている(例えば、特許文献1参照)。ここで、温度感受性リポソームとは、ある特定の温度において中に閉じ込めた薬物を放出するリポソームのことである。通常、ゲル−液晶間の相転移温度が利用され、これより高温になった液晶状態のリポソームは、その膜透過性が高まり、内包していた薬物を放出する。また、pH感受性リポソームとはpHにより脂質分子の会合状態が変化するリポソームのことである。pH感受性リポソームは、通常、ジオレオイルエタノールアミンを含み、弱酸性環境下において膜透過性が高まり内包していた薬物を放出する。
【0004】
ところで、近年、アゾベンゼン脂質を含有したリポソームの光制御に関する研究が行われており(非特許文献1〜4を参照)、UV(紫外線)光照射によるアゾベンゼン脂質の分子構造の変化が、膜の透過性を上げ、物質を放出させることが明らかになっている。例えば、非特許文献1又は2では、アゾベンゼン脂質含有リポソームにUV光を照射させることで蛍光物質の漏れが促進されることが開示されている。また、非特許文献3では、アゾベンゼン脂質含有リポソームへのUV光の照射によって膜透過率が5倍程度上昇することが示されている。非特許文献4では、UV光の照射によってアゾベンゼン脂質含有リポソームが崩壊し、物質が放出されることが開示されている。
【0005】
しかしながら、従来のアゾベンゼン脂質含有リポソームをドラックキャリアとして用いる場合には、以下のような問題が指摘されている。
【0006】
(1)リポソームに内包された物質(薬物)を生体内に放出させるにはUV光の照射が要求されることになるが、UV光が生体に及ぼすダメージが懸念される。例えば、UV光はエネルギー密度が高く、細胞内のDNAを切断してしまう等の恐れがある。
【0007】
(2)また、リポソーム膜内部に存在する物質の移動は膜内外の濃度勾配に左右されるため、リポソーム膜外部の溶液中の物質濃度が高い場合には、当該物質を膜の内部から外部へ放出することができない。
【0008】
(3)リポソームからの物質放出時の制御についての報告例が多く、これらの報告例ではリポソームへの物質の封入ついてはリポソーム作製時に限定されている。これは、従来技術においては、膜透過率の制御のみが可能であるため、物質封入の制御が非常に困難であったことが推測される。
【0009】
(4)また、物質放出にあたってUV光を照射することによりリポソーム膜が破壊されてしまう報告例が多く、その膜を可逆的に復元できるものではない。
【先行技術文献】
【特許文献】
【0010】
【特許文献1】特開平6−227966号公報
【非特許文献】
【0011】
【非特許文献1】Bisby 他2名、FEBS Letters、463、pp.165−168、(1999)
【非特許文献2】Nano 他5名、Chemistry Letters、pp.421−424、(1980)
【非特許文献3】Lei 他1名、Langmuir、15、pp.3424−3429、(1999)
【非特許文献4】Sakai 他4名、J. Phys. Chem.、B 103、pp.10737−10740、(1999)
【非特許文献5】Nagasaki 他2名、Chemistry Letters、Vol.32,No,1、pp.88、(2003)
【非特許文献6】Hamada 他3名、Langmuir、21、pp.7626−7628、(2005)
【非特許文献7】Ishii 他5名、ChemBioChem、10、pp.251−256、(2009)
【発明の概要】
【発明が解決しようとする課題】
【0012】
本発明は、このような従来の実情に鑑みて提案されたものであり、従来の光応答性リポソームが有する欠点を排除したリポソームを提供することを目的とする。すなわち、リポソーム膜を可逆的に光反応させることで、リポソームへの物質の封入とリポソームからの物質の放出を制御可能な光応答性リポソーム及びこれを利用した物質の運搬方法を提供することを目的とする。
【0013】
また、本発明は、生体に害を及ぼすことなく生体内の標的部位に物質を放出可能な光応答性リポソーム及びこれを利用した物質の運搬方法を提供することを目的とする。
【0014】
さらに、本発明は、膜内外における物質の濃度勾配に依存せずに、物質の封入・放出が可能な光応答性リポソーム及びこれを利用した物質の運搬方法を提供することを目的とする。
【0015】
さらに、本発明は、リポソーム作製後のタイミングでも、膜内へ物質の封入が可能な光応答性リポソーム及びこれを利用した物質の運搬方法を提供することを目的とする。
【課題を解決するための手段】
【0016】
本願発明者らは、比較的低いゲル−液晶相転移温度を有したリン脂質(例えば、不飽和リン脂質)とアゾベンゼン脂質とを、所定の緩衝液中で混合した溶液中に小胞化したリポソームが形成されること、異種の光(例えば、UV光と緑光)の照射を制御することで膜孔が可逆的に生成・消滅されること、及び、さらに、この膜孔を介して、リポソームへの物質の封入とリポソームからの物質の放出とが可能になることを見出し、本発明を完成するに至った。
【0017】
すなわち、本発明は、アゾベンゼン脂質と、リン脂質と、をトリス塩酸緩衝液中で分散させて生成された光応答性リポソームであって、
前記リン脂質は前記リポソームの使用温度より低いゲル−液晶相転移温度を有し、
前記リポソームは、異種の光が別々のタイミングで照射されることにより、膜上に膜孔を可逆的に形成又は消滅することを特徴とするものである。
【0018】
ここで、「脂質」とは、疎水基と親水基を含む分子のことである。また、「アゾベンゼン脂質」とは、疎水基と親水基とがアゾベンゼンにより結合した脂質のことである。
【0019】
また、「リポソームの使用温度」とは、本発明のリポソームを生成若しくは光応答させる際のリポソーム温度、又はリポソームを利用して物質の運搬を行う際のリポソーム温度のことであり、通常、室温から体温程度の温度である。つまり、リン脂質は、リポソーム使用温度において液晶になるものが選択されている。
【0020】
また、光応答性リポソームを利用した物質の運搬方法も本発明として提供される。すなわち、
第1の光を前記リポソームに照射し、前記膜上に膜孔を消滅させて前記物質を前記膜内に封入する工程と、
前記リポソームを目標位置まで移動させる工程と、
前記第1の光とは異なる第2の光を前記リポソームに照射し、前記膜上に膜孔を形成させて前記物質を前記膜外へ放出する工程と、
を含み、かつ、
前記リポソームは、アゾベンゼン脂質と、前記リポソームの使用温度より低いゲル−液晶相転移温度を有したリン脂質と、をトリス塩酸緩衝液中で分散させて生成され、
前記膜孔の形成と消滅とが前記第1・第2の光の照射により可逆的に生じることを特徴徴とするものである。
【0021】
なお、本願発明者らによって現在までになされたアゾベンゼン脂質含有リポソームに関する研究成果として、非特許文献5〜7が挙げられるが、いずれもリポソーム形状の変化についての基礎的検討結果であり、物質の放出・封入、とりわけ、これを左右する膜孔の可逆的な開閉に関する知見を開示したものではない。
【発明の効果】
【0022】
本発明の光応答性リポソーム及びこれを利用した物質の運搬方法は、リポソーム膜上に膜孔を形成しこの膜孔を直接開閉できるため、膜内外の物質の濃度勾配に依らずに、物質(薬物)を放出することができる。
【0023】
また、本発明の光応答性リポソーム及びこれを利用した物質の運搬方法は、異種の光を照射することにより、膜孔の開閉を可逆的にコントロールできるので、リポソーム作製後においても物質を封入することができる。
【0024】
本発明のある態様に係る光応答性リポソーム及びこれを利用した物質の運搬方法及びこれを利用した物質の運搬方法は、生体内への標的部位に物質を放出させるためにリポソームに照射する光として緑光を使用するため、生体への害が無い。
【0025】
なお、リポソームを反応させるために光を利用するが、光は大変効率的な伝達媒体であり、非接触的かつ非浸食的にエネルギーをリポソームへ注入でき、即効性がある。
【図面の簡単な説明】
【0026】
【図1】アゾベンゼン脂質の例示であるKAON12の分子構造を示した図である。
【図2】緑光照射後のリポソーム膜の観察画像と膜形状の構成割合とを示した図である。
【図3】実施例及び比較例に係るリン脂質の分子構造を示した図である。
【図4】光応答性リポソームを用いて物質を封入・放出する様子を説明した図である
【図5】図5(a)はガラスプレートに付着した平板状のリポソーム膜を示した顕微鏡画像を示し、図5(b)は膜縁の揺らぎを定量的に分析するために用意したリポソーム膜の模式図を示し、図5(c)はリポソーム膜縁(外周)に沿って実測した膜の半径を示す。
【図6】図6(a)及び(b)は膜縁の揺らぎを構成する各波の大きさを示す図であり、図6(c)は、図6(b)の近似直線の勾配から求めたリポソーム膜面の張力を示した図である。
【発明を実施するための形態】
【0027】
以下、本発明を図面に示す実施の形態に基づき説明するが、本発明は、下記の具体的な実施形態に何等限定されるものではない。
【0028】
本発明の光応答性リポソームは、アゾベンゼン脂質と、リン脂質と、をトリス塩酸緩衝液(Tris−HCl)中で分散させて生成される。本発明のリポソームは、例えば、積層膜水和法によって生成することができる。具体的には、これらの脂質分子を溶解させたクロロホルム等の有機溶媒を乾燥させ、試験管の底に積層膜を作製しておき、トリス塩酸緩衝液を加え、積層していた2分子膜を分離・小胞化することで、本発明の光応答性リポソームが得られる。
【0029】
ここで、アゾベンゼン脂質とは、疎水基と親水基とがアゾベンゼンにより結合した脂質であり、例えば、KAON、RAON、AZTMA、Pazo PC、などが挙げられる。特に本発明のアゾベンゼン脂質は、光反応性の面からKAONであることが好ましい。
【0030】
なお、KAON(正式名称はN−[4−[4’−[N,N−ビス−[3−(N−リジルアミノ)プロピル]アミノカルボニル]フェニルアゾ]フェノキシアセチル]ジドデシルアミン)とは、本願発明者の一人である長崎によって初めて発見・作製されたアゾベンゼン脂質であり、疎水基の炭素数によってKAON8やKAON12と呼ばれている。本発明の作用効果を有利に奏するには、KAONは30%より大きく45%未満の濃度を有することがさらに好ましい。なお、以下の実施例では、KAON12をアゾベンゼン脂質として採用した。
【0031】
また、RAONも、KAONと同様に本願発明者の一人である長崎によって初めて発見・作製されたアゾベンゼン脂質であり、KAONと類似の分子構造を有する。また、AZTMAの正式名称は、4−Butylazobenzene−4’−(oxyethyl)trimethylammonium bromideであり、その脂質の詳細は非特許文献4に記載されている。また、Pazo PCの正式名称は、1−Hexadecanoyl−2−(4’−n−butylphenyl)azo−4’’(ganma−phenylbutyroyl))−glycero−3−phosphocholineであり、その脂質の詳細は非特許文献1に記載されている。
【0032】
また、リン脂質には、膜生成の観点から、そのゲル−液晶相転移温度(凝固温度とも呼ばれる)がリポソームの使用温度より低いものが選択されている。リン脂質は、好ましくは、少なくとも1つの疎水基が二重結合を有した不飽和脂質であり、例えば、ジオレオイルフォスフォコリン(DOPC、ゲル−液晶相転移温度−23℃)やステアロイルオレオイルフォスフォコリン(SOPC、ゲル−液晶相転移温度6℃)等が挙げられる。ここで、リポソームの使用温度とは、本発明のリポソームを生成若しくは光応答させ、又はこのリポソームを利用して物質の運搬を行う際のリポソーム温度のことであり、通常、室温から体温程度の温度である。つまり、リン脂質は、リポソーム使用温度において液晶になるものが選択されている。
【0033】
また、異種の光を別々のタイミングで光応答性リポソームに照射することにより、膜上に膜孔が可逆的に形成又は消滅することを特徴とする。例えば、アゾベンゼン脂質がKAONである場合、異種の光は緑光及び紫外光であることが好ましい。これにより、緑光をリポソームに照射することで膜上に膜孔を形成させたり、紫外光をリポソームに照射することでこの膜孔を消滅させたりすることができる。言い換えれば、上記光の照射によりKAONがcis体とtrans体とのいずれかの状態をとりつつ、KAONを含んだリポソームも変形し、膜上に膜孔が形成・消滅するのである。なお、紫外光は300nm〜400nmの波長を有する光であり、緑光は500nm〜600nmの波長を有する光である。
【0034】
また、リン脂質はその親水基が帯電(負に帯電)していないことが好ましい。親水基への帯電は膜構造全体を拘束させる力を生ずることがあり、光の照射によるリポソーム膜形状の変化が起きにくくなってしまう恐れがあるからである。
【実施例】
【0035】
本発明の実施例1として、リン脂質にDOPC、アゾベンゼン脂質にKAON12を用い、DOPCとKAON12とを4:3の割合で混合した脂質を濃度10mM(ミリモーラー)のTris−HCl(pH7.4)で分散させたリポソームを用意した。なお、DOPCとKAON12とを混合した全体の脂質の濃度は0.4mMに設定した。
【0036】
なお、図1はKAON12の分子構造および光照射による構造変化を示す。図1の左右に、KAON12のtrans構造とcis構造とを示し、紫外光(図中UV)と緑光(図中G)とを照射することにより、分子構造は可逆的に変化する。
【0037】
図2は、緑光照射後のリポソーム膜(実施例1)の観察画像と膜形状の構成割合とを示す。図2(a)〜(d)の上段に、緑光を照射した後に生成された様々な膜形状のリポソームの観察画像を示し、下段に観察画像に対応する模式図を示す。具体的には、球状(sphere、図2(a)参照)、膜面上にまず小さな膜孔が形成されたカップ状(cup1、図2(b)参照)、膜面上の膜孔部分がさらに増加したカップ状(cup2、図2(c)参照)、及び平板状(disc、図2(d)参照)のリポソームが確認された。なお、リポソーム膜中心Oから延びた膜孔の中心線と、膜中心Oから膜孔の外周円まで延びた線と、で画定される角度をθとした場合、上記cup1はθがπ/2未満になる膜孔を有する膜形状であるのに対し、上記cup2はθがπ/2以上になる膜孔を有する膜形状である。
【0038】
本発明の光応答性リポソームの好適な組成、濃度等のパラメータの影響を検討するために、以下の表1に示すような試験条件を設定し、リポソーム膜の形成及び光応答性の評価を行った。なお、表1には、評価結果も示している。
【0039】
【表1】

【0040】
(KAON濃度の検討)
次に、本発明の光応答現象に最適なKAON濃度を検討するために、20%(比較例1)、30%(比較例2)、35%(実施例1)、40%(実施例2)、及び45%(比較例3)のKAON濃度を有したリポソームを用意した。それぞれの場合におけるリポソームは500個以上のサンプルを用意した。
【0041】
図2(e)は緑光照射後の各サンプルにて観察された膜形状の構成割合を示したものである。KAON濃度が20%及び30%で作製されたリポソーム(比較例1及び2)は全て球状(sphere)である一方、KAON濃度が35%(実施例1)及び40%(実施例2)で作製されたリポソームでは、緑光照射によって、球状、カップ状及び平板状のリポソーム膜が確認された。なお、40%のKAON濃度の方がカップ状及び平板状のリポソーム膜が比較的多く生成されていることが確認された。また、KAON濃度が45%(比較例3)では、比較になるような小胞化したリポソームは生成されず、膜が不均一に繋がった巨大な塊になったため、図2(e)に示さなかった。
【0042】
(リン脂質の検討)
実施例1では本発明のリポソームを構成するリン脂質としてDOPCを用いたが、比較のため、DOPCに代えて、疎水基の一方に二重結合を有する飽和・不飽和脂質であるステアロイルオレオイルフォスフォコリン(SOPC、実施例3)、疎水基の両方に二重結合を有する飽和脂質であるジバルミトイルフォスフォコリン(DPPC、比較例4)、親水基がマイナスに帯電した不飽和脂質であるジオレオイルフォスフォグリセロール(DOPG、比較例5)を用いてリポソームの作製を試みた(図3参照)。そして、リポソームが無事作製された場合には緑光又はUV光の照射による光応答性を観察した。なお、表1に示すように、リン脂質以外の構成物質、混合比、その他のリポソーム作製条件は実施例1と同様である。
【0043】
この結果、SOPCを含んだ実施例3においても、DOPCを含んだ実施例1と同様、光照射によって膜形状が球状〜平板状の間を行ったり来たりする可逆的変化が確認された。しかしながら、DPPCを含んだ比較例4においてはリポソームが全く作製されなかった。また、DOPGを含んだ比較例5においてはリポソームが作製されたものの、これに光を照射しても膜形状を平板状に変化させることはできなかった。
【0044】
このような差異を生じた理由は、DOPCもSOPCも、そのゲル−液晶相転移温度がそれぞれ−23℃と−6℃と低温であるため、リポソーム使用温度である室温では液晶であり、リポソーム作製及び光照射の際に膜が形状変化し易い状況になっていることが推察される。
【0045】
一方、DPPCはそのゲル−液晶相転移温度が44℃であるため、室温ではゲルであり、リポソーム膜が形成されなかったと考えられる。また、DOPGはそのゲル−液晶相転移温度が−18℃であり、室温では液晶であるため、リポソームが作製され易い。しかしながら、親水基が負に帯電されているため、膜内に余分な力が生じ、膜形状の変化を制約していることが推察される。従って、KAONと組み合わせて本発明の光応答性リポソームを好適に作製するには、リン脂質がリポソーム使用温度(例えば、室温)で液晶であり、かつ、帯電していないことが要求されることが判明した。
【0046】
(緩衝液の検討)
次に、本発明の光応答現象に適した緩衝液を検討するために、実施例1で用いたTris−HCl(pH7.4)の他に、純水、Tris−HCl(pH8.5)、及び、HEPES(pH7.4)を用いてリポソームを作製した(表1の実施例4、比較例6及び7を参照)。その後、作製されたリポソームに光を照射して光応答性を観察した。
【0047】
表1に示すように、実施例4のTris−HCl(pH8.5)も、実施例1のTris−HCl(pH7.4)と同様の光応答性が確認されたものの、比較例6の純水又は比較例7のHEPES(pH7.4)では平板状への膜形状の変化や膜孔の形成等の光応答性は確認されなかった。従って、本発明のリポソームを得るにはTris−HCl緩衝液が必須であるが、そのpH濃度の範囲は特に限定されないことがわかった。
【0048】
(光応答性リポソームを利用した物質の運搬)
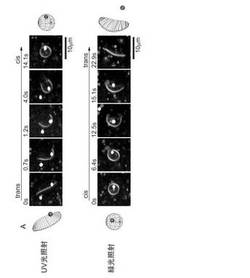
図4は、実施例1の光応答性リポソームを用いて物質を封入・放出する様子を説明した図である。封入・放出用の物質として、φ0.5μm程度の寸法の蛍光性ポリスチレンビーズ(Fluoresbrite mulutifluorescent microsphere, Polyscience社製)を用い、光応答のため照射するUV光の波長と緑光の波長とは、それぞれ、365nmと532nmとした。
【0049】
図4の上段では、平板状のリポソームに紫外光(UV光)を照射すると、リポソーム膜は次第にカップ状から完全な球状に変化すること、及び、この膜形状の変化とともに膜付近に存在していたポリスチレンビーズも膜内に封入できたことが確認された。特に、カップ状のリポソーム膜上に存在する膜孔に注目すれば、UV光の照射を継続することにより膜孔は徐々に減少し、ひいては消滅することになる。なお、UV光の照射により、KAONの分子構造はtrans構造からcis構造へと変化する。
【0050】
また、本発明のドラッグデリバリーへの適用を鑑みると、安全のため、UV光の光強度は小さい方が好ましい。現時点までの試験結果からは、3.7μW(マイクロワット)以上のUV光で照射すれば本発明の光応答現象を起こすことが確認されている。
【0051】
一方、図4の下段では、ポリスチレンビーズを膜内に封入した球状リポソームに緑光を照射していくと、先ず、膜上に小さな膜孔が形成され(上記cup1形状になり)、次いで膜孔が次第に拡大し(上記cup2形状になり)、最終的には膜が平板状になって、ポリスチレンビーズが放出される様子が確認された。なお、緑光の照射により、KAONの分子構造はtrans構造からcis構造へと変化する。
【0052】
(リポソーム膜の縁に生じる張力の試算)
図5(a)は、ガラスプレートに付着した平板状のリポソーム膜を示した顕微鏡画像である。左側の画像はリポソーム膜に含まれるKAON12がtrans状態にある画像であり、右側の画像はリポソーム膜に含まれるKAON12がcis状態にある画像である。左右の画像を比較すると、KAON12がtrans状態にある場合の方がリポソーム膜の縁が大きく揺らいでおり、膜縁の揺らぎに違いがあることが確認された。
【0053】
図5(b)は、膜縁の揺らぎを定量的に分析するために用意したリポソーム膜の模式図である。膜縁の状態は、膜の重心Oから膜縁までの距離つまり半径rが、膜縁を一周する間(つまり、角度φが0から2πまで変化する間)にどの程度変化したかを測定することで把握することが可能になる。
【0054】
図5(c)は、リポソーム膜縁(外周)に沿って実測した膜の半径rを示す。実線はKAON12がcis状態のときの測定結果であり、破線はtrans状態のときの測定結果である。この図より、cis状態では半径rが5.25〜5.8μmの狭い範囲内で振れているのに対し、tran状態では半径rが4.25〜6.25μmの広い範囲内で振れていることが確認された。つまり、tran状態ではcis状態よりも膜縁が3倍程度大きな振幅で揺らいでいることが確認された。
【0055】
図6(a)は、膜縁揺らぎを構成する各波の大きさを示す図であり、具体的には図5(c)にプロットされた各データ(φ,r)を次式に従ってフーリエ変換したグラフである。
【0056】
【数1】

【0057】
ここで、kは波数、つまり揺らぎ中の各波の成分であり、図6(a)のグラフ横軸のパラメータとして使用されている。また、ak,bkはそれぞれフーリエ係数であり、グラフ縦軸の(ak2+bk2)1/2は各波の大きさを示す。
【0058】
図6(b)は、図6(a)のグラフ軸をlogスケールに変換したグラフである。このグラフから、trans状態及びcis状態ともにプロットデータから直線的な近似線が描け、その近似直線の勾配が得られることが分かる。一方、キャピラリ・セオリーと呼ばれる次式により、波数kとフーリエ係数ak,bkとは以下の関係を有することが理論的に知られている。
【0059】
【数2】

【0060】
ここで、r0は膜の平均半径、Tは温度、kBはボルツマン係数である。この式の左辺と右辺の括弧部は、それぞれ、図6(b)の縦軸パラメータと横軸パラメータとに対応する。従って、図6(b)の近似直線の勾配からtrans状態又はcis状態における膜面の張力σ(つまり、膜を閉じる力)を求めることができる。
【0061】
上述の半径r及び張力σは、リポソーム膜の1サンプルにつき測定・導出が可能であり、図6(c)は30個のサンプルから導出された張力σを統計的に示した結果である。この図6(c)より、cis状態における張力σは、trans状態における張力σよりも比較的大きな値を持って分散していることが確認された。また、平均値を計算すると、cis状態の張力σavは1.2pN(pN=N×10−12)であるのに対し、trans状態の張力σavは0.18pNであった。以上の検討結果より、cis状態の膜の方がtrans状態の膜よりも膜を閉じる力が約10倍大きいことが推察される。
【0062】
以上の説明より、アゾベンゼン脂質と、リン脂質と、をトリス塩酸緩衝液中で分散させることで光応答性リポソームを生成することができる。リン脂質はリポソーム使用温度より低いゲル−液晶相転移温度を有するものを選択しておく。また、この光応答性リポソームに異種の光を別々のタイミングで照射することにより、膜形状が平板状から球状の間を可逆的変化させたり、その可逆的変化の際に膜上に膜孔が可逆的に形成又は消滅させたりすることが可能である。さらに、この独特な光応答性を利用すれば、ある地点でリポソーム内に薬物等の物質を包摂し、目標地点まで運搬し、リポソーム外へ放出することができる。
【0063】
また、本発明のある態様は、物質放出を誘引する光に人体に安全な緑光を採用するため、物質放出に人体に有害なUV光を提案していた従来技術に比して、大変好ましい。特に、本発明のリポソームをドラッグデリバリーのキャリアとして利用する場合、物質の放出は通常体内であるから、安全な光を使用できる本発明は大変有望である。
【0064】
なお、本発明のある態様においては、物質封入の誘引光にUV光を使用するが、本発明のリポソームを体内に注入する前に、つまり体外で、物質封入処理を行えば安全であり、安全面からも不都合は生じない。また、太陽光によるUV光照射量の強さを調節することで、リポソームの膜形状や膜孔の大きさ、物質の包摂・放出量を制御することも可能である。
【0065】
また、リポソーム膜作製時に膜内に物質を封入させておく必要はなく、必要に応じて、適宜、光を照射することで、物質を運搬に必要な数だけリポソーム膜内に封入させることができる。
【産業上の利用可能性】
【0066】
本発明の光応答性リポソームは、安全かつ効率的に薬物の封入・放出できるため、特にドラック・デリバリー・システム(DDS)の中核を成すドラックキャリアとして大変有望である。本発明の光応答性リポソームは、さらに化粧品としても利用できる等、産業上の利用可能性が高い。
【技術分野】
【0001】
本発明は、光応答性のリポソームに関し、特に異種の光を照射することにより膜孔の開閉を可逆的に制御できるリポソームに関するものである。
【背景技術】
【0002】
リポソームは、リン脂質等の脂質2分子膜によって形成され、数10nm〜数10μmの粒径を有する微小なカプセルであり、その内部に様々な分子を封入可能な水相を有する。このリポソームは、生体適合性や生分解性にも優れていることから、内部の水相に薬剤や生理活性物質を封入することで所望量の薬物を体内の標的部位に選択的に運搬するドラックキャリアになり得る製剤として注目を集めている。
【0003】
これまでに、例えば、温度の感受性やpHの感受性を利用したリポソームが提案されている(例えば、特許文献1参照)。ここで、温度感受性リポソームとは、ある特定の温度において中に閉じ込めた薬物を放出するリポソームのことである。通常、ゲル−液晶間の相転移温度が利用され、これより高温になった液晶状態のリポソームは、その膜透過性が高まり、内包していた薬物を放出する。また、pH感受性リポソームとはpHにより脂質分子の会合状態が変化するリポソームのことである。pH感受性リポソームは、通常、ジオレオイルエタノールアミンを含み、弱酸性環境下において膜透過性が高まり内包していた薬物を放出する。
【0004】
ところで、近年、アゾベンゼン脂質を含有したリポソームの光制御に関する研究が行われており(非特許文献1〜4を参照)、UV(紫外線)光照射によるアゾベンゼン脂質の分子構造の変化が、膜の透過性を上げ、物質を放出させることが明らかになっている。例えば、非特許文献1又は2では、アゾベンゼン脂質含有リポソームにUV光を照射させることで蛍光物質の漏れが促進されることが開示されている。また、非特許文献3では、アゾベンゼン脂質含有リポソームへのUV光の照射によって膜透過率が5倍程度上昇することが示されている。非特許文献4では、UV光の照射によってアゾベンゼン脂質含有リポソームが崩壊し、物質が放出されることが開示されている。
【0005】
しかしながら、従来のアゾベンゼン脂質含有リポソームをドラックキャリアとして用いる場合には、以下のような問題が指摘されている。
【0006】
(1)リポソームに内包された物質(薬物)を生体内に放出させるにはUV光の照射が要求されることになるが、UV光が生体に及ぼすダメージが懸念される。例えば、UV光はエネルギー密度が高く、細胞内のDNAを切断してしまう等の恐れがある。
【0007】
(2)また、リポソーム膜内部に存在する物質の移動は膜内外の濃度勾配に左右されるため、リポソーム膜外部の溶液中の物質濃度が高い場合には、当該物質を膜の内部から外部へ放出することができない。
【0008】
(3)リポソームからの物質放出時の制御についての報告例が多く、これらの報告例ではリポソームへの物質の封入ついてはリポソーム作製時に限定されている。これは、従来技術においては、膜透過率の制御のみが可能であるため、物質封入の制御が非常に困難であったことが推測される。
【0009】
(4)また、物質放出にあたってUV光を照射することによりリポソーム膜が破壊されてしまう報告例が多く、その膜を可逆的に復元できるものではない。
【先行技術文献】
【特許文献】
【0010】
【特許文献1】特開平6−227966号公報
【非特許文献】
【0011】
【非特許文献1】Bisby 他2名、FEBS Letters、463、pp.165−168、(1999)
【非特許文献2】Nano 他5名、Chemistry Letters、pp.421−424、(1980)
【非特許文献3】Lei 他1名、Langmuir、15、pp.3424−3429、(1999)
【非特許文献4】Sakai 他4名、J. Phys. Chem.、B 103、pp.10737−10740、(1999)
【非特許文献5】Nagasaki 他2名、Chemistry Letters、Vol.32,No,1、pp.88、(2003)
【非特許文献6】Hamada 他3名、Langmuir、21、pp.7626−7628、(2005)
【非特許文献7】Ishii 他5名、ChemBioChem、10、pp.251−256、(2009)
【発明の概要】
【発明が解決しようとする課題】
【0012】
本発明は、このような従来の実情に鑑みて提案されたものであり、従来の光応答性リポソームが有する欠点を排除したリポソームを提供することを目的とする。すなわち、リポソーム膜を可逆的に光反応させることで、リポソームへの物質の封入とリポソームからの物質の放出を制御可能な光応答性リポソーム及びこれを利用した物質の運搬方法を提供することを目的とする。
【0013】
また、本発明は、生体に害を及ぼすことなく生体内の標的部位に物質を放出可能な光応答性リポソーム及びこれを利用した物質の運搬方法を提供することを目的とする。
【0014】
さらに、本発明は、膜内外における物質の濃度勾配に依存せずに、物質の封入・放出が可能な光応答性リポソーム及びこれを利用した物質の運搬方法を提供することを目的とする。
【0015】
さらに、本発明は、リポソーム作製後のタイミングでも、膜内へ物質の封入が可能な光応答性リポソーム及びこれを利用した物質の運搬方法を提供することを目的とする。
【課題を解決するための手段】
【0016】
本願発明者らは、比較的低いゲル−液晶相転移温度を有したリン脂質(例えば、不飽和リン脂質)とアゾベンゼン脂質とを、所定の緩衝液中で混合した溶液中に小胞化したリポソームが形成されること、異種の光(例えば、UV光と緑光)の照射を制御することで膜孔が可逆的に生成・消滅されること、及び、さらに、この膜孔を介して、リポソームへの物質の封入とリポソームからの物質の放出とが可能になることを見出し、本発明を完成するに至った。
【0017】
すなわち、本発明は、アゾベンゼン脂質と、リン脂質と、をトリス塩酸緩衝液中で分散させて生成された光応答性リポソームであって、
前記リン脂質は前記リポソームの使用温度より低いゲル−液晶相転移温度を有し、
前記リポソームは、異種の光が別々のタイミングで照射されることにより、膜上に膜孔を可逆的に形成又は消滅することを特徴とするものである。
【0018】
ここで、「脂質」とは、疎水基と親水基を含む分子のことである。また、「アゾベンゼン脂質」とは、疎水基と親水基とがアゾベンゼンにより結合した脂質のことである。
【0019】
また、「リポソームの使用温度」とは、本発明のリポソームを生成若しくは光応答させる際のリポソーム温度、又はリポソームを利用して物質の運搬を行う際のリポソーム温度のことであり、通常、室温から体温程度の温度である。つまり、リン脂質は、リポソーム使用温度において液晶になるものが選択されている。
【0020】
また、光応答性リポソームを利用した物質の運搬方法も本発明として提供される。すなわち、
第1の光を前記リポソームに照射し、前記膜上に膜孔を消滅させて前記物質を前記膜内に封入する工程と、
前記リポソームを目標位置まで移動させる工程と、
前記第1の光とは異なる第2の光を前記リポソームに照射し、前記膜上に膜孔を形成させて前記物質を前記膜外へ放出する工程と、
を含み、かつ、
前記リポソームは、アゾベンゼン脂質と、前記リポソームの使用温度より低いゲル−液晶相転移温度を有したリン脂質と、をトリス塩酸緩衝液中で分散させて生成され、
前記膜孔の形成と消滅とが前記第1・第2の光の照射により可逆的に生じることを特徴徴とするものである。
【0021】
なお、本願発明者らによって現在までになされたアゾベンゼン脂質含有リポソームに関する研究成果として、非特許文献5〜7が挙げられるが、いずれもリポソーム形状の変化についての基礎的検討結果であり、物質の放出・封入、とりわけ、これを左右する膜孔の可逆的な開閉に関する知見を開示したものではない。
【発明の効果】
【0022】
本発明の光応答性リポソーム及びこれを利用した物質の運搬方法は、リポソーム膜上に膜孔を形成しこの膜孔を直接開閉できるため、膜内外の物質の濃度勾配に依らずに、物質(薬物)を放出することができる。
【0023】
また、本発明の光応答性リポソーム及びこれを利用した物質の運搬方法は、異種の光を照射することにより、膜孔の開閉を可逆的にコントロールできるので、リポソーム作製後においても物質を封入することができる。
【0024】
本発明のある態様に係る光応答性リポソーム及びこれを利用した物質の運搬方法及びこれを利用した物質の運搬方法は、生体内への標的部位に物質を放出させるためにリポソームに照射する光として緑光を使用するため、生体への害が無い。
【0025】
なお、リポソームを反応させるために光を利用するが、光は大変効率的な伝達媒体であり、非接触的かつ非浸食的にエネルギーをリポソームへ注入でき、即効性がある。
【図面の簡単な説明】
【0026】
【図1】アゾベンゼン脂質の例示であるKAON12の分子構造を示した図である。
【図2】緑光照射後のリポソーム膜の観察画像と膜形状の構成割合とを示した図である。
【図3】実施例及び比較例に係るリン脂質の分子構造を示した図である。
【図4】光応答性リポソームを用いて物質を封入・放出する様子を説明した図である
【図5】図5(a)はガラスプレートに付着した平板状のリポソーム膜を示した顕微鏡画像を示し、図5(b)は膜縁の揺らぎを定量的に分析するために用意したリポソーム膜の模式図を示し、図5(c)はリポソーム膜縁(外周)に沿って実測した膜の半径を示す。
【図6】図6(a)及び(b)は膜縁の揺らぎを構成する各波の大きさを示す図であり、図6(c)は、図6(b)の近似直線の勾配から求めたリポソーム膜面の張力を示した図である。
【発明を実施するための形態】
【0027】
以下、本発明を図面に示す実施の形態に基づき説明するが、本発明は、下記の具体的な実施形態に何等限定されるものではない。
【0028】
本発明の光応答性リポソームは、アゾベンゼン脂質と、リン脂質と、をトリス塩酸緩衝液(Tris−HCl)中で分散させて生成される。本発明のリポソームは、例えば、積層膜水和法によって生成することができる。具体的には、これらの脂質分子を溶解させたクロロホルム等の有機溶媒を乾燥させ、試験管の底に積層膜を作製しておき、トリス塩酸緩衝液を加え、積層していた2分子膜を分離・小胞化することで、本発明の光応答性リポソームが得られる。
【0029】
ここで、アゾベンゼン脂質とは、疎水基と親水基とがアゾベンゼンにより結合した脂質であり、例えば、KAON、RAON、AZTMA、Pazo PC、などが挙げられる。特に本発明のアゾベンゼン脂質は、光反応性の面からKAONであることが好ましい。
【0030】
なお、KAON(正式名称はN−[4−[4’−[N,N−ビス−[3−(N−リジルアミノ)プロピル]アミノカルボニル]フェニルアゾ]フェノキシアセチル]ジドデシルアミン)とは、本願発明者の一人である長崎によって初めて発見・作製されたアゾベンゼン脂質であり、疎水基の炭素数によってKAON8やKAON12と呼ばれている。本発明の作用効果を有利に奏するには、KAONは30%より大きく45%未満の濃度を有することがさらに好ましい。なお、以下の実施例では、KAON12をアゾベンゼン脂質として採用した。
【0031】
また、RAONも、KAONと同様に本願発明者の一人である長崎によって初めて発見・作製されたアゾベンゼン脂質であり、KAONと類似の分子構造を有する。また、AZTMAの正式名称は、4−Butylazobenzene−4’−(oxyethyl)trimethylammonium bromideであり、その脂質の詳細は非特許文献4に記載されている。また、Pazo PCの正式名称は、1−Hexadecanoyl−2−(4’−n−butylphenyl)azo−4’’(ganma−phenylbutyroyl))−glycero−3−phosphocholineであり、その脂質の詳細は非特許文献1に記載されている。
【0032】
また、リン脂質には、膜生成の観点から、そのゲル−液晶相転移温度(凝固温度とも呼ばれる)がリポソームの使用温度より低いものが選択されている。リン脂質は、好ましくは、少なくとも1つの疎水基が二重結合を有した不飽和脂質であり、例えば、ジオレオイルフォスフォコリン(DOPC、ゲル−液晶相転移温度−23℃)やステアロイルオレオイルフォスフォコリン(SOPC、ゲル−液晶相転移温度6℃)等が挙げられる。ここで、リポソームの使用温度とは、本発明のリポソームを生成若しくは光応答させ、又はこのリポソームを利用して物質の運搬を行う際のリポソーム温度のことであり、通常、室温から体温程度の温度である。つまり、リン脂質は、リポソーム使用温度において液晶になるものが選択されている。
【0033】
また、異種の光を別々のタイミングで光応答性リポソームに照射することにより、膜上に膜孔が可逆的に形成又は消滅することを特徴とする。例えば、アゾベンゼン脂質がKAONである場合、異種の光は緑光及び紫外光であることが好ましい。これにより、緑光をリポソームに照射することで膜上に膜孔を形成させたり、紫外光をリポソームに照射することでこの膜孔を消滅させたりすることができる。言い換えれば、上記光の照射によりKAONがcis体とtrans体とのいずれかの状態をとりつつ、KAONを含んだリポソームも変形し、膜上に膜孔が形成・消滅するのである。なお、紫外光は300nm〜400nmの波長を有する光であり、緑光は500nm〜600nmの波長を有する光である。
【0034】
また、リン脂質はその親水基が帯電(負に帯電)していないことが好ましい。親水基への帯電は膜構造全体を拘束させる力を生ずることがあり、光の照射によるリポソーム膜形状の変化が起きにくくなってしまう恐れがあるからである。
【実施例】
【0035】
本発明の実施例1として、リン脂質にDOPC、アゾベンゼン脂質にKAON12を用い、DOPCとKAON12とを4:3の割合で混合した脂質を濃度10mM(ミリモーラー)のTris−HCl(pH7.4)で分散させたリポソームを用意した。なお、DOPCとKAON12とを混合した全体の脂質の濃度は0.4mMに設定した。
【0036】
なお、図1はKAON12の分子構造および光照射による構造変化を示す。図1の左右に、KAON12のtrans構造とcis構造とを示し、紫外光(図中UV)と緑光(図中G)とを照射することにより、分子構造は可逆的に変化する。
【0037】
図2は、緑光照射後のリポソーム膜(実施例1)の観察画像と膜形状の構成割合とを示す。図2(a)〜(d)の上段に、緑光を照射した後に生成された様々な膜形状のリポソームの観察画像を示し、下段に観察画像に対応する模式図を示す。具体的には、球状(sphere、図2(a)参照)、膜面上にまず小さな膜孔が形成されたカップ状(cup1、図2(b)参照)、膜面上の膜孔部分がさらに増加したカップ状(cup2、図2(c)参照)、及び平板状(disc、図2(d)参照)のリポソームが確認された。なお、リポソーム膜中心Oから延びた膜孔の中心線と、膜中心Oから膜孔の外周円まで延びた線と、で画定される角度をθとした場合、上記cup1はθがπ/2未満になる膜孔を有する膜形状であるのに対し、上記cup2はθがπ/2以上になる膜孔を有する膜形状である。
【0038】
本発明の光応答性リポソームの好適な組成、濃度等のパラメータの影響を検討するために、以下の表1に示すような試験条件を設定し、リポソーム膜の形成及び光応答性の評価を行った。なお、表1には、評価結果も示している。
【0039】
【表1】

【0040】
(KAON濃度の検討)
次に、本発明の光応答現象に最適なKAON濃度を検討するために、20%(比較例1)、30%(比較例2)、35%(実施例1)、40%(実施例2)、及び45%(比較例3)のKAON濃度を有したリポソームを用意した。それぞれの場合におけるリポソームは500個以上のサンプルを用意した。
【0041】
図2(e)は緑光照射後の各サンプルにて観察された膜形状の構成割合を示したものである。KAON濃度が20%及び30%で作製されたリポソーム(比較例1及び2)は全て球状(sphere)である一方、KAON濃度が35%(実施例1)及び40%(実施例2)で作製されたリポソームでは、緑光照射によって、球状、カップ状及び平板状のリポソーム膜が確認された。なお、40%のKAON濃度の方がカップ状及び平板状のリポソーム膜が比較的多く生成されていることが確認された。また、KAON濃度が45%(比較例3)では、比較になるような小胞化したリポソームは生成されず、膜が不均一に繋がった巨大な塊になったため、図2(e)に示さなかった。
【0042】
(リン脂質の検討)
実施例1では本発明のリポソームを構成するリン脂質としてDOPCを用いたが、比較のため、DOPCに代えて、疎水基の一方に二重結合を有する飽和・不飽和脂質であるステアロイルオレオイルフォスフォコリン(SOPC、実施例3)、疎水基の両方に二重結合を有する飽和脂質であるジバルミトイルフォスフォコリン(DPPC、比較例4)、親水基がマイナスに帯電した不飽和脂質であるジオレオイルフォスフォグリセロール(DOPG、比較例5)を用いてリポソームの作製を試みた(図3参照)。そして、リポソームが無事作製された場合には緑光又はUV光の照射による光応答性を観察した。なお、表1に示すように、リン脂質以外の構成物質、混合比、その他のリポソーム作製条件は実施例1と同様である。
【0043】
この結果、SOPCを含んだ実施例3においても、DOPCを含んだ実施例1と同様、光照射によって膜形状が球状〜平板状の間を行ったり来たりする可逆的変化が確認された。しかしながら、DPPCを含んだ比較例4においてはリポソームが全く作製されなかった。また、DOPGを含んだ比較例5においてはリポソームが作製されたものの、これに光を照射しても膜形状を平板状に変化させることはできなかった。
【0044】
このような差異を生じた理由は、DOPCもSOPCも、そのゲル−液晶相転移温度がそれぞれ−23℃と−6℃と低温であるため、リポソーム使用温度である室温では液晶であり、リポソーム作製及び光照射の際に膜が形状変化し易い状況になっていることが推察される。
【0045】
一方、DPPCはそのゲル−液晶相転移温度が44℃であるため、室温ではゲルであり、リポソーム膜が形成されなかったと考えられる。また、DOPGはそのゲル−液晶相転移温度が−18℃であり、室温では液晶であるため、リポソームが作製され易い。しかしながら、親水基が負に帯電されているため、膜内に余分な力が生じ、膜形状の変化を制約していることが推察される。従って、KAONと組み合わせて本発明の光応答性リポソームを好適に作製するには、リン脂質がリポソーム使用温度(例えば、室温)で液晶であり、かつ、帯電していないことが要求されることが判明した。
【0046】
(緩衝液の検討)
次に、本発明の光応答現象に適した緩衝液を検討するために、実施例1で用いたTris−HCl(pH7.4)の他に、純水、Tris−HCl(pH8.5)、及び、HEPES(pH7.4)を用いてリポソームを作製した(表1の実施例4、比較例6及び7を参照)。その後、作製されたリポソームに光を照射して光応答性を観察した。
【0047】
表1に示すように、実施例4のTris−HCl(pH8.5)も、実施例1のTris−HCl(pH7.4)と同様の光応答性が確認されたものの、比較例6の純水又は比較例7のHEPES(pH7.4)では平板状への膜形状の変化や膜孔の形成等の光応答性は確認されなかった。従って、本発明のリポソームを得るにはTris−HCl緩衝液が必須であるが、そのpH濃度の範囲は特に限定されないことがわかった。
【0048】
(光応答性リポソームを利用した物質の運搬)
図4は、実施例1の光応答性リポソームを用いて物質を封入・放出する様子を説明した図である。封入・放出用の物質として、φ0.5μm程度の寸法の蛍光性ポリスチレンビーズ(Fluoresbrite mulutifluorescent microsphere, Polyscience社製)を用い、光応答のため照射するUV光の波長と緑光の波長とは、それぞれ、365nmと532nmとした。
【0049】
図4の上段では、平板状のリポソームに紫外光(UV光)を照射すると、リポソーム膜は次第にカップ状から完全な球状に変化すること、及び、この膜形状の変化とともに膜付近に存在していたポリスチレンビーズも膜内に封入できたことが確認された。特に、カップ状のリポソーム膜上に存在する膜孔に注目すれば、UV光の照射を継続することにより膜孔は徐々に減少し、ひいては消滅することになる。なお、UV光の照射により、KAONの分子構造はtrans構造からcis構造へと変化する。
【0050】
また、本発明のドラッグデリバリーへの適用を鑑みると、安全のため、UV光の光強度は小さい方が好ましい。現時点までの試験結果からは、3.7μW(マイクロワット)以上のUV光で照射すれば本発明の光応答現象を起こすことが確認されている。
【0051】
一方、図4の下段では、ポリスチレンビーズを膜内に封入した球状リポソームに緑光を照射していくと、先ず、膜上に小さな膜孔が形成され(上記cup1形状になり)、次いで膜孔が次第に拡大し(上記cup2形状になり)、最終的には膜が平板状になって、ポリスチレンビーズが放出される様子が確認された。なお、緑光の照射により、KAONの分子構造はtrans構造からcis構造へと変化する。
【0052】
(リポソーム膜の縁に生じる張力の試算)
図5(a)は、ガラスプレートに付着した平板状のリポソーム膜を示した顕微鏡画像である。左側の画像はリポソーム膜に含まれるKAON12がtrans状態にある画像であり、右側の画像はリポソーム膜に含まれるKAON12がcis状態にある画像である。左右の画像を比較すると、KAON12がtrans状態にある場合の方がリポソーム膜の縁が大きく揺らいでおり、膜縁の揺らぎに違いがあることが確認された。
【0053】
図5(b)は、膜縁の揺らぎを定量的に分析するために用意したリポソーム膜の模式図である。膜縁の状態は、膜の重心Oから膜縁までの距離つまり半径rが、膜縁を一周する間(つまり、角度φが0から2πまで変化する間)にどの程度変化したかを測定することで把握することが可能になる。
【0054】
図5(c)は、リポソーム膜縁(外周)に沿って実測した膜の半径rを示す。実線はKAON12がcis状態のときの測定結果であり、破線はtrans状態のときの測定結果である。この図より、cis状態では半径rが5.25〜5.8μmの狭い範囲内で振れているのに対し、tran状態では半径rが4.25〜6.25μmの広い範囲内で振れていることが確認された。つまり、tran状態ではcis状態よりも膜縁が3倍程度大きな振幅で揺らいでいることが確認された。
【0055】
図6(a)は、膜縁揺らぎを構成する各波の大きさを示す図であり、具体的には図5(c)にプロットされた各データ(φ,r)を次式に従ってフーリエ変換したグラフである。
【0056】
【数1】

【0057】
ここで、kは波数、つまり揺らぎ中の各波の成分であり、図6(a)のグラフ横軸のパラメータとして使用されている。また、ak,bkはそれぞれフーリエ係数であり、グラフ縦軸の(ak2+bk2)1/2は各波の大きさを示す。
【0058】
図6(b)は、図6(a)のグラフ軸をlogスケールに変換したグラフである。このグラフから、trans状態及びcis状態ともにプロットデータから直線的な近似線が描け、その近似直線の勾配が得られることが分かる。一方、キャピラリ・セオリーと呼ばれる次式により、波数kとフーリエ係数ak,bkとは以下の関係を有することが理論的に知られている。
【0059】
【数2】

【0060】
ここで、r0は膜の平均半径、Tは温度、kBはボルツマン係数である。この式の左辺と右辺の括弧部は、それぞれ、図6(b)の縦軸パラメータと横軸パラメータとに対応する。従って、図6(b)の近似直線の勾配からtrans状態又はcis状態における膜面の張力σ(つまり、膜を閉じる力)を求めることができる。
【0061】
上述の半径r及び張力σは、リポソーム膜の1サンプルにつき測定・導出が可能であり、図6(c)は30個のサンプルから導出された張力σを統計的に示した結果である。この図6(c)より、cis状態における張力σは、trans状態における張力σよりも比較的大きな値を持って分散していることが確認された。また、平均値を計算すると、cis状態の張力σavは1.2pN(pN=N×10−12)であるのに対し、trans状態の張力σavは0.18pNであった。以上の検討結果より、cis状態の膜の方がtrans状態の膜よりも膜を閉じる力が約10倍大きいことが推察される。
【0062】
以上の説明より、アゾベンゼン脂質と、リン脂質と、をトリス塩酸緩衝液中で分散させることで光応答性リポソームを生成することができる。リン脂質はリポソーム使用温度より低いゲル−液晶相転移温度を有するものを選択しておく。また、この光応答性リポソームに異種の光を別々のタイミングで照射することにより、膜形状が平板状から球状の間を可逆的変化させたり、その可逆的変化の際に膜上に膜孔が可逆的に形成又は消滅させたりすることが可能である。さらに、この独特な光応答性を利用すれば、ある地点でリポソーム内に薬物等の物質を包摂し、目標地点まで運搬し、リポソーム外へ放出することができる。
【0063】
また、本発明のある態様は、物質放出を誘引する光に人体に安全な緑光を採用するため、物質放出に人体に有害なUV光を提案していた従来技術に比して、大変好ましい。特に、本発明のリポソームをドラッグデリバリーのキャリアとして利用する場合、物質の放出は通常体内であるから、安全な光を使用できる本発明は大変有望である。
【0064】
なお、本発明のある態様においては、物質封入の誘引光にUV光を使用するが、本発明のリポソームを体内に注入する前に、つまり体外で、物質封入処理を行えば安全であり、安全面からも不都合は生じない。また、太陽光によるUV光照射量の強さを調節することで、リポソームの膜形状や膜孔の大きさ、物質の包摂・放出量を制御することも可能である。
【0065】
また、リポソーム膜作製時に膜内に物質を封入させておく必要はなく、必要に応じて、適宜、光を照射することで、物質を運搬に必要な数だけリポソーム膜内に封入させることができる。
【産業上の利用可能性】
【0066】
本発明の光応答性リポソームは、安全かつ効率的に薬物の封入・放出できるため、特にドラック・デリバリー・システム(DDS)の中核を成すドラックキャリアとして大変有望である。本発明の光応答性リポソームは、さらに化粧品としても利用できる等、産業上の利用可能性が高い。
【特許請求の範囲】
【請求項1】
アゾベンゼン脂質と、リン脂質と、をトリス塩酸緩衝液中で分散させて生成された光応答性リポソームであって、
前記リン脂質は前記リポソームの使用温度より低いゲル−液晶相転移温度を有し、
前記リポソームは、異種の光が別々のタイミングで照射されることにより、膜上に膜孔を可逆的に形成又は消滅することを特徴とする光応答性リポソーム。
【請求項2】
前記アゾベンゼン脂質がKAONであることを特徴とする請求項1に記載の光応答性リポソーム。
【請求項3】
前記KAONの濃度が30%より大きく45%未満であることを特徴とする請求項1又は2に記載の光応答性リポソーム。
【請求項4】
前記異種の光が緑光及び紫外光であることを特徴とする請求項2又は3に記載の光応答性リポソーム。
【請求項5】
前記リン脂質の少なくとも一つの疎水基が不飽和であることを特徴とする請求項1〜4のいずれか1項に記載の光応答性リポソーム。
【請求項6】
前記リン脂質の親水基が帯電していないことを特徴とする請求項1〜5のいずれか1項に記載の光応答性リポソーム。
【請求項7】
前記異種の光の照射により、前記リポソームの膜形状が、球状、前記膜孔が形成されたカップ状、又は平板状に変化することを特徴とする請求項1〜6のいずれか1項に記載の光応答性リポソーム。
【請求項8】
光応答性リポソームを利用した物質の運搬方法であって、
第1の光を前記リポソームに照射し、前記膜上に存在する膜孔を消滅させて前記物質を前記膜内に封入する工程と、
前記リポソームを目標位置まで移動させる工程と、
前記第1の光とは異なる第2の光を前記リポソームに照射し、前記膜上に膜孔を形成させて前記物質を前記膜外へ放出する工程と、
を含み、かつ、
前記リポソームは、アゾベンゼン脂質と、前記リポソームの使用温度より低いゲル−液晶相転移温度を有したリン脂質と、をトリス塩酸緩衝液中で分散させて生成され、
前記膜孔の形成と消滅とが前記第1・第2の光の照射により可逆的に生じることを特徴徴とする物質の運搬方法。
【請求項9】
前記アゾベンゼン脂質がKAONであることを特徴とする請求項8に記載の物質の運搬方法。
【請求項10】
前記KAONの濃度が30%より大きく45%未満であることを特徴とする請求項9又は10に記載の物質の運搬方法。
【請求項11】
前記第1の光が緑光であり、かつ、前記第2の光が紫外光であることを特徴とする請求項9又は10に記載の物質の運搬方法。
【請求項12】
前記リン脂質の少なくとも一つの疎水基が不飽和であることを特徴とする請求項8〜11のいずれか1項に記載の物質の運搬方法。
【請求項13】
前記リン脂質の親水基が帯電していないことを特徴とする請求項8〜12のいずれか1項に記載の物質の運搬方法。
【請求項14】
前記第1・第2の光の照射により、前記リポソームの膜形状が、球状、前記膜孔が設けられたカップ状、又は平板状に変化することを特徴とする請求項8〜13のいずれか1項に記載の物質の運搬方法。
【請求項15】
前記物質が薬剤であることを特徴とする請求項8〜14のいずれか1項に記載の物質の運搬方法。
【請求項1】
アゾベンゼン脂質と、リン脂質と、をトリス塩酸緩衝液中で分散させて生成された光応答性リポソームであって、
前記リン脂質は前記リポソームの使用温度より低いゲル−液晶相転移温度を有し、
前記リポソームは、異種の光が別々のタイミングで照射されることにより、膜上に膜孔を可逆的に形成又は消滅することを特徴とする光応答性リポソーム。
【請求項2】
前記アゾベンゼン脂質がKAONであることを特徴とする請求項1に記載の光応答性リポソーム。
【請求項3】
前記KAONの濃度が30%より大きく45%未満であることを特徴とする請求項1又は2に記載の光応答性リポソーム。
【請求項4】
前記異種の光が緑光及び紫外光であることを特徴とする請求項2又は3に記載の光応答性リポソーム。
【請求項5】
前記リン脂質の少なくとも一つの疎水基が不飽和であることを特徴とする請求項1〜4のいずれか1項に記載の光応答性リポソーム。
【請求項6】
前記リン脂質の親水基が帯電していないことを特徴とする請求項1〜5のいずれか1項に記載の光応答性リポソーム。
【請求項7】
前記異種の光の照射により、前記リポソームの膜形状が、球状、前記膜孔が形成されたカップ状、又は平板状に変化することを特徴とする請求項1〜6のいずれか1項に記載の光応答性リポソーム。
【請求項8】
光応答性リポソームを利用した物質の運搬方法であって、
第1の光を前記リポソームに照射し、前記膜上に存在する膜孔を消滅させて前記物質を前記膜内に封入する工程と、
前記リポソームを目標位置まで移動させる工程と、
前記第1の光とは異なる第2の光を前記リポソームに照射し、前記膜上に膜孔を形成させて前記物質を前記膜外へ放出する工程と、
を含み、かつ、
前記リポソームは、アゾベンゼン脂質と、前記リポソームの使用温度より低いゲル−液晶相転移温度を有したリン脂質と、をトリス塩酸緩衝液中で分散させて生成され、
前記膜孔の形成と消滅とが前記第1・第2の光の照射により可逆的に生じることを特徴徴とする物質の運搬方法。
【請求項9】
前記アゾベンゼン脂質がKAONであることを特徴とする請求項8に記載の物質の運搬方法。
【請求項10】
前記KAONの濃度が30%より大きく45%未満であることを特徴とする請求項9又は10に記載の物質の運搬方法。
【請求項11】
前記第1の光が緑光であり、かつ、前記第2の光が紫外光であることを特徴とする請求項9又は10に記載の物質の運搬方法。
【請求項12】
前記リン脂質の少なくとも一つの疎水基が不飽和であることを特徴とする請求項8〜11のいずれか1項に記載の物質の運搬方法。
【請求項13】
前記リン脂質の親水基が帯電していないことを特徴とする請求項8〜12のいずれか1項に記載の物質の運搬方法。
【請求項14】
前記第1・第2の光の照射により、前記リポソームの膜形状が、球状、前記膜孔が設けられたカップ状、又は平板状に変化することを特徴とする請求項8〜13のいずれか1項に記載の物質の運搬方法。
【請求項15】
前記物質が薬剤であることを特徴とする請求項8〜14のいずれか1項に記載の物質の運搬方法。
【図1】


【図3】


【図6】


【図2】


【図4】


【図5】




【図3】


【図6】


【図2】


【図4】


【図5】


【公開番号】特開2011−178689(P2011−178689A)
【公開日】平成23年9月15日(2011.9.15)
【国際特許分類】
【出願番号】特願2010−42688(P2010−42688)
【出願日】平成22年2月26日(2010.2.26)
【出願人】(304024430)国立大学法人北陸先端科学技術大学院大学 (169)
【Fターム(参考)】
【公開日】平成23年9月15日(2011.9.15)
【国際特許分類】
【出願日】平成22年2月26日(2010.2.26)
【出願人】(304024430)国立大学法人北陸先端科学技術大学院大学 (169)
【Fターム(参考)】
[ Back to top ]

