光触媒、水素製造方法、及び有機物分解方法
【課題】紫外光のみならず可視光に対する活性の高い光触媒、水素の生産効率が高い水素製造方法、及び分解活性の高い有機物分解方法を提供する。
【解決手段】dn(0<n<10)型の電子配置をとる金属イオンと、酸化物イオン(O2−)と、H、Li、Na、K、Rb、Cs、Mg、Ca、Sr、希土類元素、Ti、Zr、Hf、V、Nb、Ta、Mo、W、Cu、Ag、Au、Zn、Cd、Al、Ga、In、C、Si、Ge、Sn、N、P、Sb、S、Se、Te、F、Cl、Br、及びIからなる群から選ばれる少なくとも1つの元素Bのイオン(但し、元素Bが金属元素である場合には、この元素Bのイオンはdn(0<n<10)型以外の電子配置をとる。)と、を含む化合物Aを用いる。
【解決手段】dn(0<n<10)型の電子配置をとる金属イオンと、酸化物イオン(O2−)と、H、Li、Na、K、Rb、Cs、Mg、Ca、Sr、希土類元素、Ti、Zr、Hf、V、Nb、Ta、Mo、W、Cu、Ag、Au、Zn、Cd、Al、Ga、In、C、Si、Ge、Sn、N、P、Sb、S、Se、Te、F、Cl、Br、及びIからなる群から選ばれる少なくとも1つの元素Bのイオン(但し、元素Bが金属元素である場合には、この元素Bのイオンはdn(0<n<10)型以外の電子配置をとる。)と、を含む化合物Aを用いる。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、光触媒、この光触媒を用いた水素製造方法及び有機物分解方法に関する。
【背景技術】
【0002】
現在、環境問題及びエネルギー問題の解決のため、太陽光で水等を分解させて、クリーン燃料である水素を発生させることができる光触媒の開発が盛んに行われている。すでに、紫外線(<400nm)での水分解光触媒としてはTiO2が知られているが、紫外線は太陽光中にはわずかしか含まれていないために、太陽光の有効利用として未だ課題を有するものとなっている。
【0003】
このため、太陽光中の成分が多い可視光(400nm〜800nm)に活性な光触媒の開発が強く望まれている。これまで研究が進んでいるのは,d0又はd10型の電子配置をとる金属イオンを含む酸化物である(非特許文献1)。また、d0又はd10型の電子配置をとる金属イオンを含む化合物に可視光応答性を持たせるために、金属酸化物ではなくオキシ窒化物やオキシ硫化物の採用も試みられている(非特許文献2,3)。
【0004】
この他、紫外線又は可視光の照射下において、Pt(0.2wt%)/BaCr2O4粉末を用いてメタノール溶液から水素を生成させる研究(非特許文献4)や、弱い磁性を有するBiFeO3のナノ粒子によるメチルオレンジの分解特性を調べた研究(非特許文献5)もある。
【0005】
【非特許文献1】光触媒標準研究法 大谷文章著 東京図書株式会社発行 2005年1月25日発行 第376頁〜第380頁
【非特許文献2】Akio Ishikawa, Tsuyoshi Takata, Junko N. Kondo, Michikazu Hara, Hisayoshi Kobayashi, and Kazunari Domen,“Oxysulfide Sm2Ti2S2O5 as a Stable Photocatalyst for Water Oxidation and Reduction under Visible Light Irradiation (λ≦650nm)” J.Am.Chem.Soc.,124(2002),pp.13547−13553
【非特許文献3】Asako Kasahara, Kota Nukumizu, Go Hitoki, Tsuyoshi Takata, Junko N. Kondo, Michikazu Hara, Hisayoshi Kobayashi, and Kazunari Domen,“Photoreactions on LaTiO2N under Visible Light Irradiation”J.Phys.Chem.A,106(2002),pp.6750−6753
【非特許文献4】D.Wang,Z.Zou,and J.Ye,“A new spinel−type photocatalyst BaCr2O4 for H2 evolution under UV and visible light irradiation” Chem.Phys.lett.,373(2003),pp.191−196
【非特許文献5】F.Gao,X.Chen,K.Yin,S.Dong,Z.Ren,F.Yuan,T.Yu,Z.Zou,and J Liu,“Visible−Light Photocatalytic Properties of Weak Magnetic BiFeO3 Nanoparticles” Adv.Mater.,2007,19,pp.2889−2892
【発明の開示】
【発明が解決しようとする課題】
【0006】
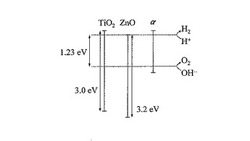
可視光に活性な光触媒を得るための条件として、少なくとも(イ)光触媒のバンドギャップが水素・酸素の酸化還元準位をまたぎ、かつ(ロ)可視光の吸収を持つようにすることが重要である。
【0007】
図1は、光触媒のバンド構造を示す模式図である。図1に示すように、可視光に活性を持たせるためには、水素の生成が可能となる1.23eV(=1008nm)のバンドギャップと重なるようなαのバンド構造を有する光触媒を得ることが好ましい。ところが、TiO2のバンドギャップは、水素・酸素の酸化還元準位をまたぐので上記(イ)の要件は満たすが、価電子帯が深すぎる位置に存在するため、バンドギャップが大きくて紫外光しか吸収できず上記(ロ)の要件を満たさない。バンドギャップについてより詳しく説明すると、これまで研究が進んでいるd0又はd10型の電子配置をとる金属イオンを含む酸化物については、d0型の電子配置をとるTiO2(Ti4+)やd10型の電子配置をとるZnO(Zn2+)は、図1に示すように3eV以上のバンドギャップを持つため、ほとんど紫外線しか吸収しないという課題がある。
【0008】
また、d0又はd10型の電子配置をとる金属イオンを含む化合物をオキシ窒化物やオキシ硫化物とすれば、化合物中の窒化物イオンや硫化物イオンが価電子バンドを引き上げてバンドギャップを小さくし、図1のαの様なバンド構造を得られる(上記(イ)、(ロ)の要件が満たされる)。このため、可視光に対して所定の活性を有する光触媒を得ることができる。このように、d0又はd10型の電子配置をとる金属イオンは有用な材料ではあるが、こうしたd0又はd10型の電子配置以外の電子配置をとる金属イオンにおいても光活性を有する光触媒の登場が望まれている。
【0009】
本発明は、上記課題を解決するためになされたものであって、その第1の目的は、紫外光のみならず可視光に対する活性の高い光触媒を提供することにある。
【0010】
本発明は、上記課題を解決するためになされたものであって、その第2の目的は、水素の生産効率が高い水素製造方法を提供することになる。
【0011】
本発明は、上記課題を解決するためになされたものであって、その第3の目的は、分解活性の高い有機物分解方法を提供することになる。
【課題を解決するための手段】
【0012】
上記目的の下、本発明者等が鋭意検討を行った結果、従来用いられてきたd0又はd10型の電子配置をとる金属イオンではなく、従来使用ができないと考えられていたdn(0<n<10)型の電子配置をとる金属イオンを用いた化合物においても、紫外光のみならず可視光に対する活性の高い光触媒を提供できることを見出し、本発明を完成させた。
【0013】
上記課題を解決するための本発明の光触媒は、dn(0<n<10)型の電子配置をとる金属イオンと、酸化物イオン(O2−)と、H、Li、Na、K、Rb、Cs、Mg、Ca、Sr、希土類元素、Ti、Zr、Hf、V、Nb、Ta、Mo、W、Cu、Ag、Au、Zn、Cd、Al、Ga、In、C、Si、Ge、Sn、N、P、Sb、S、Se、Te、F、Cl、Br、及びIからなる群から選ばれる少なくとも1つの元素Bのイオン(但し、元素Bが金属元素である場合には、前記元素Bのイオンはdn(0<n<10)型以外の電子配置をとる。)と、を含む化合物Aを用いることを特徴とする。
【0014】
この発明によれば、dn(0<n<10)型の電子配置をとる金属イオンと、酸化物イオン(O2−)と、H、Li、Na、K、Rb、Cs、Mg、Ca、Sr、希土類元素、Ti、Zr、Hf、V、Nb、Ta、Mo、W、Cu、Ag、Au、Zn、Cd、Al、Ga、In、C、Si、Ge、Sn、N、P、Sb、S、Se、Te、F、Cl、Br、及びIからなる群から選ばれる少なくとも1つの元素Bのイオン(但し、元素Bが金属元素である場合には、この元素Bのイオンはdn(0<n<10)型以外の電子配置をとる。)と、を含む化合物Aを用いるので、光触媒のバンドギャップが水素・酸素の酸化還元準位をまたぎ、かつ可視光の吸収を有するようになり、その結果、紫外光のみならず可視光に対する活性の高い光触媒を提供することができる。
【0015】
本発明の光触媒の好ましい態様においては、前記金属イオンのnが3又は5である。
【0016】
この発明によれば、金属イオンのnを3又は5として、d3型又はd5型の電子配置をとる金属イオンを用いるので、d−d遷移を制御しやすくなるか、スピン禁制とすることができるようになると推測され、その結果、紫外光のみならず可視光に対する活性がさらに高い光触媒を提供することができる。
【0017】
本発明の光触媒の好ましい態様においては、前記金属イオンがCr3+、Fe3+、又はMn2+である。
【0018】
この発明によれば、金属イオンがCr3+、Fe3+、又はMn2+であるので、d3型又はd5型の電子配置をとる金属イオンのうちでより好ましい金属イオンを用いることとなり、その結果、より活性の高い光触媒を得やすくなる。
【0019】
本発明の光触媒の好ましい態様においては、前記化合物Aが、複合金属酸化物、オキシ硫化物、及びオキシ窒化物のいずれかである。
【0020】
この発明によれば、化合物Aが、複合金属酸化物、オキシ硫化物、及びオキシ窒化物のいずれかであるので、化合物Aを光触媒に適した化合物とすることができ、その結果、紫外光のみならず可視光に対する活性がさらに高い光触媒を得やすくなる。
【0021】
本発明の光触媒の好ましい態様においては、前記化合物Aが、スピネル型結晶構造、ペロブスカイト型構造、層状ペロブスカイト型構造、又はNiWO4型構造のいずれかを有する。
【0022】
この発明によれば、化合物Aが、スピネル型結晶構造、ペロブスカイト型構造、層状ペロブスカイト型構造、又はNiWO4型構造のいずれかを有するので、結晶の対称性が良くなり、その結果、より活性の高い光触媒を得やすくなる。
【0023】
本発明の光触媒の好ましい態様においては、前記化合物Aが、MgFe2O4、ZnFe2O4、CdFe2O4、MnAl2O4、MnGa2O4、LaSrFeO4、LaFeO3、NbFeO4、LaCrO3、及びMgCr2O4の少なくともいずれかである。
【0024】
この発明によれば、化合物Aが、MgFe2O4、ZnFe2O4、CdFe2O4、MnAl2O4、MnGa2O4、LaSrFeO4、LaFeO3、NbFeO4、LaCrO3、及びMgCr2O4の少なくともいずれかであるので、工業的にも有用な材料を化合物Aに用いることになり、その結果、活性の高い光触媒を得やすくなる。
【0025】
本発明の光触媒の好ましい態様においては、前記光触媒が可視光応答型光触媒である。
【0026】
この発明によれば、光触媒が可視光応答型光触媒であるので、可視光に対する活性を確保することができ、その結果、実使用上非常に有用な光触媒となる。
【0027】
上記課題を解決するための本発明の水素製造方法は、本発明の光触媒と、水素含有化合物とを接触させるとともに、光を照射して水素を生成させる水素生成工程を有することを特徴とする。
【0028】
この発明によれば、本発明の光触媒と、水素含有化合物とを接触させるとともに、光を照射して水素を生成させる水素生成工程を有するので、紫外線のみならず可視光での活性が高くなって、その結果、水素の生産効率が高い水素製造方法を提供することができる。
【0029】
本発明の水素製造方法の好ましい態様においては、前記水素生成工程で照射する光が可視光である。
【0030】
この発明によれば、水素生成工程で照射する光が可視光であるので、可視光に対する活性を確保することができ、その結果、実使用上非常に有用な水素製造方法となる。
【0031】
上記課題を解決するための本発明の有機物分解方法は、本発明の光触媒に光を照射して、前記光触媒に接触した有機物を分解することを特徴とする。
【0032】
この発明によれば、本発明の光触媒に光を照射して、光触媒に接触した有機物を分解するので、紫外線のみならず可視光での活性が高くなって有機物の分解が促進されることになり、その結果、分解活性の高い有機物分解方法を提供することができる。
【0033】
本発明の有機物分解方法の好ましい態様においては、前記光が可視光である。
【0034】
この発明によれば、光が可視光であるので、可視光に対する活性を確保することができ、その結果、実使用上非常に有用な有機物分解方法となる。
【発明の効果】
【0035】
本発明によれば、紫外光のみならず可視光に対する活性の高い光触媒を提供することができる。
【0036】
本発明によれば、水素の生産効率が高い水素製造方法を提供することができる。
【0037】
本発明によれば、分解活性の高い有機物分解方法を提供することができる。
【発明を実施するための最良の形態】
【0038】
次に、本発明の実施の形態について詳細に説明するが、本発明は以下の実施の形態に限定されるものではなく、その要旨の範囲内で種々変形して実施することができる。
【0039】
(光触媒)
本発明の光触媒は、dn(0<n<10)型の電子配置をとる金属イオンと、酸化物イオン(O2−)と、H、Li、Na、K、Rb、Cs、Mg、Ca、Sr、希土類元素、Ti、Zr、Hf、V、Nb、Ta、Mo、W、Cu、Ag、Au、Zn、Cd、Al、Ga、In、C、Si、Ge、Sn、N、P、Sb、S、Se、Te、F、Cl、Br、及びIからなる群から選ばれる少なくとも1つの元素Bのイオン(但し、元素Bが金属元素である場合には、この元素Bのイオンはdn(0<n<10)型以外の電子配置をとる。)と、を含む化合物Aを用いる。これにより、光触媒のバンドギャップが水素・酸素の酸化還元準位をまたぎ、かつ可視光の吸収を有するようになり、その結果、紫外光のみならず可視光に対する活性の高い光触媒を提供することができる。
【0040】
上述したように、これまでは、d0又はd10型の電子配置をとる金属イオンを含む化合物を光触媒として採用することが試みられてきた。これは、d軌道内に不対電子が存在すると、照射された光が別の目的に使われてしまうために、効率が非常に悪くなると考えられていたからである。こうした技術背景があったため、光触媒を得ようとする場合には、d0又はd10型の電子配置をとる金属イオンを用いることは必須であるというのが通説的な見解となっている。
【0041】
これに対して、本発明者等は、実使用の観点から、未だ可視光に対する十分な活性を有する光触媒が開発されていない現状に鑑み、可視光に対する活性を高くするためには上記通説的見解とは別の新しい発想も必要であると考えた。そして、dn(0<n<10)型の電子配置を有する金属イオンを用いた化合物(例えば、dn遷移金属酸化物)は、d軌道を含むバンドがバンドギャップの下端を上げることができるので、図1に示すαの様な理想的なバンド構造をとることができることに注目し、こうした不対電子を含むdn遷移金属酸化物を光触媒として用いることができないかと考えた。
【0042】
ただ、dn遷移金属酸化物を用いる場合には、上述のとおり、d軌道間での遷移(d−d遷移)等の発生に注意しなければならず、本発明者等がさらに検討を加えた結果、dn(0<n<10)型の電子配置を有する金属イオンを用いる場合には、この金属イオンと組み合わせる元素の種類も重要になると考えた。例えば、非特許文献4では、新規スピネル型の材料としてBaCr2O4を採用しているが、同文献のFig.1からわかるように、BaCr2O4はスピネル単相の結晶構造にはなっていない。これは、dn(0<n<10)型の電子配置を有する金属イオンと組み合わせる元素としてBaを選んだために、結晶構造が変化したためと推測される。実際に、同文献のFig.3に示されるように、可視光を3時間照射した後の水素生成量は10μmol/h/gであり、可視光に対する活性が非常に低い。すなわち、Baの採用により結晶の対称性とバンド構造が変化した結果、可視光に対する活性が非常に低くなると推測される。このように、dn(0<n<10)遷移金属酸化物とはいっても、組み合わせる元素に留意しなければ良好な光触媒が得られないのである。
【0043】
より具体的には、dn型の電子配置を有する金属イオンを用いた化合物の場合には、d0型とd10型の電子配置をとる金属イオンを用いた化合物にはない、電子の遷移としてd−d遷移が発生するので、このd−d遷移のコントロールが重要になると考えられる。そして、こうしたd−d遷移のコントロールは、化学組成、結晶構造、d電子数をうまく組み合わせることである程度制御可能であると推測される。なお、d5の場合は特別でスピン禁制であるため,ほとんどd−d遷移は起きないと考えられる。
【0044】
以上の知見から本発明者等がさらに検討した結果、dn(0<n<10)型の電子配置をとる金属イオンと、酸化物イオン(O2−)と、H、Li、Na、K、Rb、Cs、Mg、Ca、Sr、希土類元素、Ti、Zr、Hf、V、Nb、Ta、Mo、W、Cu、Ag、Au、Zn、Cd、Al、Ga、In、C、Si、Ge、Sn、N、P、Sb、S、Se、Te、F、Cl、Br、及びIからなる群から選ばれる少なくとも1つの元素Bのイオン(但し、元素Bが金属元素である場合には、この元素Bのイオンはdn(0<n<10)型以外の電子配置をとる。)と、を含む化合物Aを用いることで、紫外光のみならず可視光に対する活性も高い光触媒が得られることを見出した。化合物Aは、好ましくは、上記金属イオンと、酸化物イオン(O2−)と、1以上の元素Bのイオンと、から構成される。また、化合物Aに用いる元素Bの数は、少なくとも1つ以上とするが、化合物Aに求められる特性に応じて、通常5個以下、好ましくは4個以下、より好ましくは3個以下とする。最も好ましくは、元素Bの数を1又は2個とする。これにより、所定の特性を有する化合物Aが得やすくなる。
【0045】
dn(0<n<10)型の電子配置をとる金属(第1の元素)イオンは、具体的には、dn(n=1〜9)型の電子配置をとる金属イオンを用いることを意味する。ここで、nは整数である。電子配置として、n=3,4,5,6,7,8,9のいずれかとすることが好ましく、n=3、5とすることがより好ましい。電子配置を上記のようにすることにより、d−d遷移が制御しやすくなると推測される。特に、金属イオンのnを3又は5として、d3型又はd5型の電子配置をとる金属イオンを用いると、d−d遷移を制御しやすくなるか、スピン禁制とすることができるようになると推測され、その結果、紫外光のみならず可視光に対する活性がさらに高い光触媒を提供することができる。そして、こうしたdn(0<n<10)型の電子配置をとる金属イオンを用いることにより、価電子帯の準位を上げながらも,理想的な電子配置であるd10電子配置に近い状態をとらせることができるので,可視光に対する活性の高い光触媒としやすくなるのである。
【0046】
dn(0<n<10)型の電子配置をとる金属イオンとしては、特に制限はなく、例えば、Ti3+、V3+、V4+、Cr3+、Cr4+、Cr5+、Mn2+、Mn3+、Mn4+、Fe2+、Fe3+、Fe4+、Co2+、Co3+、Co4+、Ni2+、Ni3+、及びCu2+を挙げることができる。こうした金属イオンのうち好ましいのは、Cr3+、Fe3+、Mn2+、又はCo4+である。より好ましいのは、Cr3+、Fe3+、又はMn2+である。これにより、d3型又はd5型の電子配置をとる金属イオンのうちでより好ましい金属イオンを用いることとなり、その結果、より活性の高い光触媒を得やすくなる。
【0047】
本発明の光触媒においては、dn(0<n<10)型の電子配置をとる金属イオンとともに酸素(第2の元素)を用いる。具体的には、酸化物イオン(O2−)を用いる。これにより、化合物Aを安定とすることができる。
【0048】
本発明の光触媒においては、dn(0<n<10)型の電子配置をとる金属イオンとともに、H、Li、Na、K、Rb、Cs、Mg、Ca、Sr、希土類元素、Ti、Zr、Hf、V、Nb、Ta、Mo、W、Cu、Ag、Au、Zn、Cd、Al、Ga、In、C、Si、Ge、Sn、N、P、Sb、S、Se、Te、F、Cl、Br、及びIからなる群から選ばれる少なくとも1つの元素B(第3の元素)のイオン(但し、元素Bが金属元素である場合には、この元素Bのイオンはdn(0<n<10)型以外の電子配置をとる。)を用いる。こうした元素Bをdn(0<n<10)型の電子配置をとる金属イオンと組み合わせることにより、高い光活性を得やすくなる。なお、元素Bのイオンは、金属(第1の元素)イオンと電子配置が同一にはならないという趣旨から、上述のとおり、金属元素を元素Bに用いる場合で当該金属元素がdn(0<n<10)型の電子配置をも採りうる元素である場合には、当該金属元素のイオンは、dn(0<n<10)型以外の電子配置をとる。こうした金属元素としては、例えば、Ti、Zr、Hf、V、Nb、Ta、Mo、W、Cu、Ag、Au、Zn、Cd、Ga、In、Ge、Sn、Sb、Se、及びTeを挙げることができる。そして、後述するように、Ti、Zr、Hf、V、Nb、Ta、Mo、及びWは、dn(0<n<10)型以外の電子配置として、d0型の電子配置をとる。また、Cu、Ag、Au、Zn、Cd、Ga、In、Ge、Sn、Sb、Se、及びTeは、dn(0<n<10)型以外の電子配置として、d10型の電子配置をとる。
【0049】
元素Bのうち、Li、Na、K、Rb、Cs、Mg、Ca、及びSrのアルカリ金属、アルカリ土類金属のイオンは、dn(0<n<10)型の電子配置をとる金属イオンとはイオン半径が異なる。このため、これら元素のイオンとdn(0<n<10)型の電子配置をとる金属イオンとを組み合わせて用いることにより、化合物Aが安定になりやすく、光活性も高くしやすくなる。一方、同じアルカリ土類金属であっても、Baは劇物である上、化合物Aの光触媒としての活性を確保しにくくする。Li、Na、K、Rb、Cs、Mg、Ca、及びSrのうち、安定性の観点から、好ましくはK、Rb、Cs、Ca、Sr、及びMgを用い、より好ましくはCa、Sr、及びMgを用い、最も好ましくはSr、Mgを用いる。
【0050】
元素Bのうち、希土類元素のイオンは、dn(0<n<10)型の電子配置をとる金属イオンとはイオン半径が異なる。このため、これら元素のイオンとdn(0<n<10)型の電子配置をとる金属イオンとを組み合わせて用いることにより、化合物Aが安定になりやすく、光活性も高くしやすくなる。希土類元素としては、Sc、Y、及びランタノイドの各元素を挙げることができるが、より具体的には、Sc、Y、La、Ce、Pr、Nd、Pm、Sm、Eu、Gd、Tb、Dy、Ho、Er、Tm、Yb、及びLuを挙げることができる。これら希土類元素のうち、安定性とコストの観点から、好ましくはY、La、Ce、Nd、Sm、Gd、Ho、及びYbを用い、より好ましくはY、La、及びCeを用い、最も好ましくはLaを用いる。
【0051】
元素Bのうち、Ti、Zr、Hf、V、Nb、Ta、Mo、及びWは、d0型の電子配置をとる。具体的には、Ti4+、Zr4+、Hf4+、V5+、Nb5+、Ta5+、Mo6+、W6+となることによりd0型の電子配置をとるので、酸化数が3前後の値をとる多くのdn(0<n<10)型の電子配置の金属イオンとは、価数及びイオン半径が適度に異なるので、良好な化合部Aを形成しやすくなる。また、これら元素は、d0型の電子配置をとるので、不対電子を取らずに存在することが可能であるので、d−d遷移制御の観点からも好ましい。こうした観点から、好ましくはTi、Zr、Hf、Nb、Ta、Mo、及びWを用い、より好ましくはTi、Zr、Hf、Nb、及びTaを用い、最も好ましくはNbを用いる。
【0052】
元素Bのうち、Cu、Ag、Au、Zn、Cd、Ga、In、Ge、Sn、Sb、Se、及びTeは、d10型の電子配置をとる。具体的には、Cu+、Ag+、Au+、Zn2+、Cd2+、Ga3+、In3+、Ge4+、Sn4+、Sb3+、Sb5+、Se4+、Se6+、Te4+、Te6+となることによりd10型の電子配置をとるので、酸化数が3前後の値をとる多くのdn(0<n<10)型の電子配置の金属イオンとは、価数及びイオン半径が適度に異なるので、良好な化合部Aを形成しやすくなる。また、これら元素は、Pブロックの元素で不対電子を持たないので、この点においても安定な化合物Aが得られやすくなる。こうした観点から、好ましくはZn、Cd、Ga、In、Ge、及びSnを用い、より好ましくはZn、Ga、In、及びSnを用い、最も好ましくはZn、Gaを用いる。
【0053】
元素Bのうち、Al、Siは、安定な元素でありかつ地球上での存在量も多いので、安定かつ低コストの化合物Aを得やすくなる。こうした観点から、好ましくはAlを用いる。
【0054】
元素Bのうち、C、N、P、S、F、Cl、Br、及びIは、陰イオンとなって、化合物Aをオキシ硫化物やオキシ窒化物等とできるために、高い光活性が得られやすくなる。こうした観点から、好ましくはN、P、S、及びClを用い、より好ましくはN、S、及びPを用いる。窒化物イオンや硫化物イオン等は、価電子帯を上げることができるので可視光活性を得やすくなるが、これに加えて、dn(0<n<10)型の電子配置をとる金属イオンも同様に価電子帯を上げることができる。その結果、全体として価電子帯を上げることができるので,紫外線より低エネルギーである可視光活性をより得やすくなる。
【0055】
また、上記説明した元素Bとして、原子量が184以下のものを用いることが好ましい。こうした特定の原子量を有する原子を併用することにより、より安定性の高い触媒を得やすくなる。
【0056】
本発明の光触媒は、化合物Aが、複合金属酸化物、オキシ硫化物、及びオキシ窒化物のいずれかであることが好ましい。これにより、化合物Aを光触媒に適した化合物とすることができ、その結果、紫外光のみならず可視光に対する活性がさらに高い光触媒を得やすくなる。これらのうち、好ましくは、化合物Aを複合金属酸化物とすることである。
【0057】
本発明の光触媒は、特定の結晶構造を有することが好ましい。こうした結晶構造としては、例えば、イルメナイト型結晶構造、スクッテルダイト型結晶構造、ホランダイト型結晶構造、スピネル型結晶構造、ペロブスカイト型結晶構造、層状ペロブスカイト型結晶構造、岩塩派生型結晶構造、パイロクロア型結晶構造、NiWO4型構造、及びジルコン型結晶構造を挙げることができる。こうした結晶構造のうち、化合物Aが、スピネル型結晶構造、ペロブスカイト型結晶構造、層状ペロブスカイト型結晶構造、岩塩派生型結晶構造、パイロクロア型結晶構造、NiWO4型構造、及びジルコン型結晶構造であることが好ましく、スピネル型結晶構造、ペロブスカイト型構造、層状ペロブスカイト型構造、又はNiWO4型構造のいずれかを有することがより好ましく、スピネル型結晶構造を有するようにすることがさらに好ましい。これにより、対称性が高い構造となり、その結果、より活性の高い光触媒を得やすくなる。特に、スピネル型結晶構造は以下の理由からも好ましい。すなわち、スピネル型結晶構造では、金属イオンに配位している酸化物イオンO2−が六配位または四配位し、酸化物イオンがそれぞれ八面体または四面体を形成するが、この多面体が正八面体や正四面体の時に,最も対称性が高くなり,その時に最もd−d遷移が制御しやすくなる、又はスピン禁制とできると考えられるからである。
【0058】
こうした化合物Aの具体例としては、特に制限はないが、MgFe2O4、ZnFe2O4、CdFe2O4、MnAl2O4、MnGa2O4、LaSrFeO4、LaFeO3、NbFeO4、LaCrO3、及びMgCr2O4の少なくともいずれかを用いることが好ましい。これにより、工業的にも有用な材料を化合物Aに用いることになり、その結果、活性の高い光触媒を得やすくなる。
【0059】
本発明の光触媒は、上記の材料を含む化合物Aを用いるが、その他の材料を併用したり、化合物Aに用いる元素以外の不純物を含むもの等であってもよい。こうした材料としては特に制限はなく、光触媒に所望される性能に応じて適切なものを適宜用いればよい。例えば、後述の水素製造方法に本発明の光触媒を用いる場合には、化合物Aに助触媒としての白金を担持することが行われる。
【0060】
本発明の光触媒の性状は、通常、常温(25±5℃)/常湿(50±10%RH)において粒状となる。この場合における光触媒の平均粒径は、通常100nm以上、好ましくは500nm以上、より好ましくは1μm以上、また、通常50μm以下、好ましくは20μm以下、より好ましくは10μm以下とする。この範囲とすれば、取り扱いもしやすく実使用に支障のない光触媒としやすくなる。なお、比表面積を大きくして活性をより高くする観点から、本発明の光触媒をナノ粒子としてもよいが、飛散しやすくなる等取り扱いが難しくなることがあるので、ナノ粒子とする場合には注意が必要である。
【0061】
本発明の光触媒は、上記の材料を含む化合物Aを用いるので、可視光応答型光触媒となる。これにより、可視光に対する活性を確保することができ、その結果、実使用上非常に有用な光触媒となる。より好ましくは、光触媒が、可視光応答型光触媒であるとともに、紫外線応答型光触媒でもあることである。これにより、太陽光を効率よく吸収してより活性の高い光触媒とすることができる。
【0062】
本発明の光触媒に用いる化合物Aは、従来公知の方法で製造することができる。こうした製造方法としては、例えば、所定の原料粉末を混合した後焼成する方法を挙げることができる。原料粉末の混合方法、混合比、焼成温度、焼成の際の雰囲気等の製造条件は、用いる原料粉末や得ようとする化合物Aの種類に応じて適宜選択・制御すればよい。
【0063】
(水素製造方法)
本発明の水素製造方法は、本発明の光触媒と、水素含有化合物とを接触させるとともに、光を照射して水素を生成させる水素生成工程を有する。これにより、紫外線のみならず可視光での活性が高くなって、その結果、水素の生産効率が高い水素製造方法を提供することができる。
【0064】
水素生成工程に用いる本発明の光触媒は、上述したとおりのものを用いればよいが、化合物Aに助触媒を担持した材料を光触媒として用いることが好ましい。助触媒としては、例えば、白金(Pt)、ニッケル(Ni)、ロジウム(Ph)、及び酸化クロム等を挙げることができる。
【0065】
助触媒を用いる意義は以下のとおりである。すなわち、図1に示すように、光によって励起された電子は上の準位で水素を生成するために使用され、下の順位に生成したホールは酸素の生成に使用される。こうした反応では、電子とホールとが別々のサイトで別々の反応を行うことが好ましい。そこで、助触媒を用いて励起された電子を集めることにより、一旦励起された電子が水素生成に使われずにホールと再結合し反応が進まないという現象を抑制することができる。こうした観点からは、助触媒に導電性材料を用いることが好ましい。例えば、助触媒として白金を用いると、白金は金属なので電子を集めやすく、励起された電子が白金側に移動してそこで水素の生成が起きやすくなると推測される。このように、助触媒を化合物Aに担持することにより、助触媒のサイトに電子を集めることができ,電子とホールの再結合を防ぎ,水素生成を促進させやすくなる。
【0066】
化合物Aに対する助触媒の含有量は、通常0.1wt%以上、好ましくは0.5wt%以上、また、通常5wt%以下、好ましくは3wt%以下とする。この範囲とすれば、光活性を高く維持しつつも助触媒の作用を発揮しやすくなる。
【0067】
水素生成工程に用いる水素含有化合物は、水素を含有する化合物であれば特に制限はなく、例えば、水;メタノール、エタノール、1−プロパノール、2−プロパノール、1−ブタノール、2−ブタノール等のアルコール;水とアルコールとの混合物等を用いることができる。これらのうち工業生産を視野に入れた場合には、水素含有化合物として汎用のものを用いることが好ましく、水、メタノール、エタノール、及び水とアルコールとの混合物を用いることが好ましい。
【0068】
水素含有化合物は、用いる製造方法に応じて固体、液体、気体として供給され、本発明の光触媒と接触させることになる。例えば、水素含有化合物を液体として用いる場合には、水素含有化合物中に本発明の光触媒を保持すれば、本発明の光触媒と、水素含有化合物とを接触させることができる。具体的には、液体状の水素含有化合物中に本発明の光触媒を分散させる、所定の基板上に本発明の光触媒を成膜又は担持し、これを液体状の水素含有化合物中に浸積する等の方法を用いればよい。また、例えば、水素含有化合物が気体として用いられる場合には、本発明の光触媒を保持したチャンバー内に気体状の水素含有化合物を供給して、本発明の光触媒と、水素含有化合物とを接触させればよい。
【0069】
水素生成工程において、本発明の光触媒や水素含有化合物の量は、製造する水素の量等に応じて適宜調整すればよい。
【0070】
水素生成工程においては、本発明の光触媒と、水素含有化合物とを接触させるとともに、光を照射して水素を生成させる。照射する光は、特に制限はないが、可視光であることが好ましい。これにより、可視光に対する活性を確保することができ、その結果、実使用上非常に有用な水素製造方法となる。
【0071】
水素生成工程における光の照射時間は、製造する水素の量に応じて適宜調整すればよいが、通常1分以上、好ましくは5分以上、また、通常100時間以下、好ましくは50時間以下、より好ましくは10時間以下、特に好ましくは5時間以下とする。
【0072】
本発明の水素製造方法は、水素生成工程を有するが、必要に応じてその他の工程も適宜行えばよい。例えば、水素生成工程に先立って、本発明の光触媒を準備する光触媒準備工程を行ってもよいし、水素生成工程の後に、生成した水素を単離する水素単離工程等を行ってもよい。こうした工程のうち、例えば、光触媒準備工程では、化合物Aに助触媒を担持して本発明の光触媒を準備すればよい。ここで、助触媒の担持方法については、従来公知の方法を適宜用いればよい。具体的には、助触媒として白金を用いる場合には、白金を含有する化合物の溶液を準備し、これに化合物Aを加えて攪拌しながら、光を照射して白金を化合物Aに担持するという方法を用いればよい。
【0073】
(有機物分解方法)
本発明の有機物分解方法は、本発明の光触媒に光を照射して、光触媒に接触した有機物を分解する。これにより、紫外線のみならず可視光での活性が高くなって有機物の分解が促進されることになり、その結果、分解活性の高い有機物分解方法を提供することができる。
【0074】
本発明の有機物分解方法は、例えば、大気浄化、抗菌、脱臭、浄水、防汚等の各用途に用いられる。光触媒と分解される有機物との接触方法は、こうした用途に応じて最適な手法を適宜用いればよい。例えば、大気浄化、抗菌、防汚の用途に用いる場合は、光触媒を塗料に分散させてこれを家の外壁等に塗布して塗膜を形成する等の手法を用いればよい。
【0075】
そして、光触媒に有機物等の汚れが付着しても、光を照射することにより、こうした有機物を分解して防汚効果を奏することができる。分解される有機物としては、例えば、アセトアルデヒド、ホルムアルデヒド、メチルメルカプタン、及びトリメチルアミン等を挙げることができる。また、照射する光につき特に制限はないが、光が可視光であることが好ましい。これにより、可視光に対する活性を確保することができ、その結果、実使用上非常に有用な防汚方法となる。
【実施例】
【0076】
次に、本発明を実施例により更に具体的に説明するが、本発明はその要旨を超えない限り、以下の実施例の記載に限定されるものではない。
【0077】
[実施例1〜10]
(複合金属酸化物(化合物A)の合成)
原料粉末を適量測りとり、これを乳鉢に投入し、乳鉢と乳棒を使用して30分程度混合した。その後、管状炉を使用して、上記原料粉末を所定の温度で焼成した。目的とする複合金属酸化物(目的物)、原料粉末、焼成温度、焼成時間を表−1に示す。なお、MnGa2O4、MnAl2O4はN2雰囲気で焼成を行った。
【0078】
【表1】

【0079】
(生成物の同定)
上記合成により所望の複合金属酸化物が得られているか否かを、粉末X線回折により確認した。測定には理学電機株式会社製RINT−2200粉末X線回折装置を利用し、X線源にはCu管球を用いた。
【0080】
図2,3,4は、それぞれ、合成された各生成物の一部のXRDパターンである。表−1に示す合成条件で、MgFe2O4,ZnFe2O4,CdFe2O4,MnGa2O4、MnAl2O4,LaSrFeO4,LaFeO3,NbFeO4、LaCrO3、MgCr2O4それぞれの単相が得られていることが確認された。
【0081】
(複合金属酸化物の反射率測定)
上記合成方法で得られた、MgFe2O4,ZnFe2O4,CdFe2O4,MnGa2O4、MnAl2O4,LaSrFeO4,LaFeO3,NbFeO4、LaCrO3、MgCr2O4の各複合金属酸化物の試料をそれぞれホルダーに詰め、装置にセットして各複合金属酸化物の反射率を特性した。測定は、バックグラウンド補正を行いながら、240〜800nmの範囲で反射率を測定することにより行った。反射率の測定には日本分光株式会社製V−570紫外・可視分光光度計を用いた。
【0082】
図5,6,7は、各複合金属酸化物の一部の反射率の測定結果である。全ての物質について400〜600nm付近で反射率の減少が見られることから、可視光の吸収が可能であることがわかる。また、全ての物質において、TiO2に比べて、400〜800nmの部分で大きな光の吸収があることがわかる。
【0083】
(光触媒準備工程)
各複合金属酸化物に白金を担持することにより、光触媒を製造した。具体的には、50%メタノール溶液中に、上記「(複合金属酸化物(化合物A)の合成)」で合成した複合金属酸化物の粉末と、塩化白金酸溶液と、を加えた(塩化白金酸溶液は、複合金属酸化物の粉末に対して白金が2wt%担持されるようにした)。この混合溶液をスターラーで攪拌しながら、PE300BUV 300W Xeランプで可視・紫外光を1時間照射して、白金を複合金属酸化物に担持した。この光触媒準備工程を、MgFe2O4,ZnFe2O4,CdFe2O4,MnGa2O4、MnAl2O4,LaSrFeO4,LaFeO3,NbFeO4、LaCrO3、MgCr2O4の各複合金属酸化物それぞれについて行った。
【0084】
(水素生成工程:気相反応系)
図8は、水素生成工程を気相反応系で行った場合の装置の模式的概念図である。同図に示す装置を用いて、水素生成工程を以下のようにして実施した。
【0085】
まず、上記光触媒準備工程で準備した光触媒0.2gをホルダーにセットして反応槽の内部に保持した。その後、反応槽内をロータリーポンプで真空状態にした。次いで、反応槽にメタノールガスと、標準ガスとしての少量のArと、を導入し、光触媒とメタノールガスとを接触させた。そして、反応漕を外部から放熱ファンで風冷しながら、光源として300W Xeランプを用い、全波長・可視光を50分間照射した。ここで、照射時の反応槽内のガスを測定室に微量導入した。なお、測定時の測定室内の気圧は、約3.0×10−7Paとなるように制御した。そして、PFEIFFER VACUUM Prisma QMS200型四重極質量分析計によりガス組成の分析を行い、その時間変化をコンピュータに記録した。
【0086】
図9は、複合金属酸化物をMgFe2O4とした場合の全波長(200〜1100nm)での水素発生量の時間変化を測定した測定結果である。また、図10は、図9を拡大して示したものである。図9からわかるように、光照射を始めた直後から、水素と一酸化炭素との急激な増加がみられた。また、図10からわかるように、水素と一酸化炭素との急激な増加と同時に、わずかながらホルムアルデヒドとメタノールの減少もみられた。これらの現象から、以下に示す反応が起こったものと考えられる。
【0087】
【化1】

【0088】
図11は、複合金属酸化物をMgFe2O4,CdFe2O4,MnGa2O4とそれぞれした場合における、全波長(200〜1100nm)での水素発生量の時間変化を測定した測定結果である。同図の結果から、鉄(Fe)を含む複合金属酸化物の方がマンガン(Mn)を含む複合金属酸化物よりも活性が高いことがわかる。
【0089】
図12は、複合金属酸化物をMgFe2O4,CdFe2O4,MnGa2O4とそれぞれした場合における、可視光(400〜800nm)での水素発生量の時間変化を測定した測定結果である。図11に示した全波長のときと比べて、ほとんど活性が変化していないことがわかる。このことから、これらの複合金属酸化物の活性がほぼ可視光によるものであることがわかる。
【0090】
(水素生成工程:液相反応系)
図13は、水素生成工程を液相反応系で行った場合の装置の模式的概念図である。同図に示す装置(総体積440ml)を用いて、水素生成工程を以下のようにして実施した。
【0091】
まず、上記光触媒準備工程で準備した光触媒0.15g、メタノール溶液20ml、及び磁気攪拌子を反応槽に入れて、光触媒とメタノール溶液とを接触させた。反応槽を装置に取り付けて密閉し、装置全体をArガスで置換した。次いで、スターラーで攪拌しながら、光源として300W Xeランプを用い、全波長・可視光を3時間照射した。なお、実験中は反応槽を扇風機で風冷した。その後、注射器を用いて反応槽内部のガスを2.5ml取り出した。取り出したガスにつき、島津ガスクロマトグラフGC−2014で分析を行った。水素標準ガスを用いて検量線を作成し、それによって発生した水素の体積を算出した。
【0092】
複合金属酸化物をMgFe2O4,ZnFe2O4,MnGa2O4、MnAl2O4、LaSrFeO4、LaFeO3、NbFeO4、LaCrO3、MgCr2O4とそれぞれした場合における水素発生速度を表−2に示す。表−2は、各複合金属酸化物の1gに対しての水素発生速度μmolh−1g−1の値である。
【0093】
【表2】

【図面の簡単な説明】
【0094】
【図1】光触媒のバンド構造を示す模式図である。
【図2】合成された各生成物の一部のXRDパターンである。
【図3】合成された各生成物の一部のXRDパターンである。
【図4】合成された各生成物の一部のXRDパターンである。
【図5】各複合金属酸化物の一部の反射率の測定結果である。
【図6】各複合金属酸化物の一部の反射率の測定結果である。
【図7】各複合金属酸化物の一部の反射率の測定結果である。
【図8】水素生成工程を気相反応系で行った場合の装置の模式的概念図である。
【図9】複合金属酸化物をMgFe2O4とした場合の全波長(200〜1100nm)での水素発生量の時間変化を測定した測定結果である。
【図10】図9を拡大して示したものである。
【図11】複合金属酸化物をMgFe2O4,CdFe2O4,MnGa2O4とそれぞれした場合における、全波長(200〜1100nm)での水素発生量の時間変化を測定した測定結果である。
【図12】複合金属酸化物をMgFe2O4,CdFe2O4,MnGa2O4とそれぞれした場合における、可視光(400〜800nm)での水素発生量の時間変化を測定した測定結果である。
【図13】水素生成工程を液相反応系で行った場合の装置の模式的概念図である。
【技術分野】
【0001】
本発明は、光触媒、この光触媒を用いた水素製造方法及び有機物分解方法に関する。
【背景技術】
【0002】
現在、環境問題及びエネルギー問題の解決のため、太陽光で水等を分解させて、クリーン燃料である水素を発生させることができる光触媒の開発が盛んに行われている。すでに、紫外線(<400nm)での水分解光触媒としてはTiO2が知られているが、紫外線は太陽光中にはわずかしか含まれていないために、太陽光の有効利用として未だ課題を有するものとなっている。
【0003】
このため、太陽光中の成分が多い可視光(400nm〜800nm)に活性な光触媒の開発が強く望まれている。これまで研究が進んでいるのは,d0又はd10型の電子配置をとる金属イオンを含む酸化物である(非特許文献1)。また、d0又はd10型の電子配置をとる金属イオンを含む化合物に可視光応答性を持たせるために、金属酸化物ではなくオキシ窒化物やオキシ硫化物の採用も試みられている(非特許文献2,3)。
【0004】
この他、紫外線又は可視光の照射下において、Pt(0.2wt%)/BaCr2O4粉末を用いてメタノール溶液から水素を生成させる研究(非特許文献4)や、弱い磁性を有するBiFeO3のナノ粒子によるメチルオレンジの分解特性を調べた研究(非特許文献5)もある。
【0005】
【非特許文献1】光触媒標準研究法 大谷文章著 東京図書株式会社発行 2005年1月25日発行 第376頁〜第380頁
【非特許文献2】Akio Ishikawa, Tsuyoshi Takata, Junko N. Kondo, Michikazu Hara, Hisayoshi Kobayashi, and Kazunari Domen,“Oxysulfide Sm2Ti2S2O5 as a Stable Photocatalyst for Water Oxidation and Reduction under Visible Light Irradiation (λ≦650nm)” J.Am.Chem.Soc.,124(2002),pp.13547−13553
【非特許文献3】Asako Kasahara, Kota Nukumizu, Go Hitoki, Tsuyoshi Takata, Junko N. Kondo, Michikazu Hara, Hisayoshi Kobayashi, and Kazunari Domen,“Photoreactions on LaTiO2N under Visible Light Irradiation”J.Phys.Chem.A,106(2002),pp.6750−6753
【非特許文献4】D.Wang,Z.Zou,and J.Ye,“A new spinel−type photocatalyst BaCr2O4 for H2 evolution under UV and visible light irradiation” Chem.Phys.lett.,373(2003),pp.191−196
【非特許文献5】F.Gao,X.Chen,K.Yin,S.Dong,Z.Ren,F.Yuan,T.Yu,Z.Zou,and J Liu,“Visible−Light Photocatalytic Properties of Weak Magnetic BiFeO3 Nanoparticles” Adv.Mater.,2007,19,pp.2889−2892
【発明の開示】
【発明が解決しようとする課題】
【0006】
可視光に活性な光触媒を得るための条件として、少なくとも(イ)光触媒のバンドギャップが水素・酸素の酸化還元準位をまたぎ、かつ(ロ)可視光の吸収を持つようにすることが重要である。
【0007】
図1は、光触媒のバンド構造を示す模式図である。図1に示すように、可視光に活性を持たせるためには、水素の生成が可能となる1.23eV(=1008nm)のバンドギャップと重なるようなαのバンド構造を有する光触媒を得ることが好ましい。ところが、TiO2のバンドギャップは、水素・酸素の酸化還元準位をまたぐので上記(イ)の要件は満たすが、価電子帯が深すぎる位置に存在するため、バンドギャップが大きくて紫外光しか吸収できず上記(ロ)の要件を満たさない。バンドギャップについてより詳しく説明すると、これまで研究が進んでいるd0又はd10型の電子配置をとる金属イオンを含む酸化物については、d0型の電子配置をとるTiO2(Ti4+)やd10型の電子配置をとるZnO(Zn2+)は、図1に示すように3eV以上のバンドギャップを持つため、ほとんど紫外線しか吸収しないという課題がある。
【0008】
また、d0又はd10型の電子配置をとる金属イオンを含む化合物をオキシ窒化物やオキシ硫化物とすれば、化合物中の窒化物イオンや硫化物イオンが価電子バンドを引き上げてバンドギャップを小さくし、図1のαの様なバンド構造を得られる(上記(イ)、(ロ)の要件が満たされる)。このため、可視光に対して所定の活性を有する光触媒を得ることができる。このように、d0又はd10型の電子配置をとる金属イオンは有用な材料ではあるが、こうしたd0又はd10型の電子配置以外の電子配置をとる金属イオンにおいても光活性を有する光触媒の登場が望まれている。
【0009】
本発明は、上記課題を解決するためになされたものであって、その第1の目的は、紫外光のみならず可視光に対する活性の高い光触媒を提供することにある。
【0010】
本発明は、上記課題を解決するためになされたものであって、その第2の目的は、水素の生産効率が高い水素製造方法を提供することになる。
【0011】
本発明は、上記課題を解決するためになされたものであって、その第3の目的は、分解活性の高い有機物分解方法を提供することになる。
【課題を解決するための手段】
【0012】
上記目的の下、本発明者等が鋭意検討を行った結果、従来用いられてきたd0又はd10型の電子配置をとる金属イオンではなく、従来使用ができないと考えられていたdn(0<n<10)型の電子配置をとる金属イオンを用いた化合物においても、紫外光のみならず可視光に対する活性の高い光触媒を提供できることを見出し、本発明を完成させた。
【0013】
上記課題を解決するための本発明の光触媒は、dn(0<n<10)型の電子配置をとる金属イオンと、酸化物イオン(O2−)と、H、Li、Na、K、Rb、Cs、Mg、Ca、Sr、希土類元素、Ti、Zr、Hf、V、Nb、Ta、Mo、W、Cu、Ag、Au、Zn、Cd、Al、Ga、In、C、Si、Ge、Sn、N、P、Sb、S、Se、Te、F、Cl、Br、及びIからなる群から選ばれる少なくとも1つの元素Bのイオン(但し、元素Bが金属元素である場合には、前記元素Bのイオンはdn(0<n<10)型以外の電子配置をとる。)と、を含む化合物Aを用いることを特徴とする。
【0014】
この発明によれば、dn(0<n<10)型の電子配置をとる金属イオンと、酸化物イオン(O2−)と、H、Li、Na、K、Rb、Cs、Mg、Ca、Sr、希土類元素、Ti、Zr、Hf、V、Nb、Ta、Mo、W、Cu、Ag、Au、Zn、Cd、Al、Ga、In、C、Si、Ge、Sn、N、P、Sb、S、Se、Te、F、Cl、Br、及びIからなる群から選ばれる少なくとも1つの元素Bのイオン(但し、元素Bが金属元素である場合には、この元素Bのイオンはdn(0<n<10)型以外の電子配置をとる。)と、を含む化合物Aを用いるので、光触媒のバンドギャップが水素・酸素の酸化還元準位をまたぎ、かつ可視光の吸収を有するようになり、その結果、紫外光のみならず可視光に対する活性の高い光触媒を提供することができる。
【0015】
本発明の光触媒の好ましい態様においては、前記金属イオンのnが3又は5である。
【0016】
この発明によれば、金属イオンのnを3又は5として、d3型又はd5型の電子配置をとる金属イオンを用いるので、d−d遷移を制御しやすくなるか、スピン禁制とすることができるようになると推測され、その結果、紫外光のみならず可視光に対する活性がさらに高い光触媒を提供することができる。
【0017】
本発明の光触媒の好ましい態様においては、前記金属イオンがCr3+、Fe3+、又はMn2+である。
【0018】
この発明によれば、金属イオンがCr3+、Fe3+、又はMn2+であるので、d3型又はd5型の電子配置をとる金属イオンのうちでより好ましい金属イオンを用いることとなり、その結果、より活性の高い光触媒を得やすくなる。
【0019】
本発明の光触媒の好ましい態様においては、前記化合物Aが、複合金属酸化物、オキシ硫化物、及びオキシ窒化物のいずれかである。
【0020】
この発明によれば、化合物Aが、複合金属酸化物、オキシ硫化物、及びオキシ窒化物のいずれかであるので、化合物Aを光触媒に適した化合物とすることができ、その結果、紫外光のみならず可視光に対する活性がさらに高い光触媒を得やすくなる。
【0021】
本発明の光触媒の好ましい態様においては、前記化合物Aが、スピネル型結晶構造、ペロブスカイト型構造、層状ペロブスカイト型構造、又はNiWO4型構造のいずれかを有する。
【0022】
この発明によれば、化合物Aが、スピネル型結晶構造、ペロブスカイト型構造、層状ペロブスカイト型構造、又はNiWO4型構造のいずれかを有するので、結晶の対称性が良くなり、その結果、より活性の高い光触媒を得やすくなる。
【0023】
本発明の光触媒の好ましい態様においては、前記化合物Aが、MgFe2O4、ZnFe2O4、CdFe2O4、MnAl2O4、MnGa2O4、LaSrFeO4、LaFeO3、NbFeO4、LaCrO3、及びMgCr2O4の少なくともいずれかである。
【0024】
この発明によれば、化合物Aが、MgFe2O4、ZnFe2O4、CdFe2O4、MnAl2O4、MnGa2O4、LaSrFeO4、LaFeO3、NbFeO4、LaCrO3、及びMgCr2O4の少なくともいずれかであるので、工業的にも有用な材料を化合物Aに用いることになり、その結果、活性の高い光触媒を得やすくなる。
【0025】
本発明の光触媒の好ましい態様においては、前記光触媒が可視光応答型光触媒である。
【0026】
この発明によれば、光触媒が可視光応答型光触媒であるので、可視光に対する活性を確保することができ、その結果、実使用上非常に有用な光触媒となる。
【0027】
上記課題を解決するための本発明の水素製造方法は、本発明の光触媒と、水素含有化合物とを接触させるとともに、光を照射して水素を生成させる水素生成工程を有することを特徴とする。
【0028】
この発明によれば、本発明の光触媒と、水素含有化合物とを接触させるとともに、光を照射して水素を生成させる水素生成工程を有するので、紫外線のみならず可視光での活性が高くなって、その結果、水素の生産効率が高い水素製造方法を提供することができる。
【0029】
本発明の水素製造方法の好ましい態様においては、前記水素生成工程で照射する光が可視光である。
【0030】
この発明によれば、水素生成工程で照射する光が可視光であるので、可視光に対する活性を確保することができ、その結果、実使用上非常に有用な水素製造方法となる。
【0031】
上記課題を解決するための本発明の有機物分解方法は、本発明の光触媒に光を照射して、前記光触媒に接触した有機物を分解することを特徴とする。
【0032】
この発明によれば、本発明の光触媒に光を照射して、光触媒に接触した有機物を分解するので、紫外線のみならず可視光での活性が高くなって有機物の分解が促進されることになり、その結果、分解活性の高い有機物分解方法を提供することができる。
【0033】
本発明の有機物分解方法の好ましい態様においては、前記光が可視光である。
【0034】
この発明によれば、光が可視光であるので、可視光に対する活性を確保することができ、その結果、実使用上非常に有用な有機物分解方法となる。
【発明の効果】
【0035】
本発明によれば、紫外光のみならず可視光に対する活性の高い光触媒を提供することができる。
【0036】
本発明によれば、水素の生産効率が高い水素製造方法を提供することができる。
【0037】
本発明によれば、分解活性の高い有機物分解方法を提供することができる。
【発明を実施するための最良の形態】
【0038】
次に、本発明の実施の形態について詳細に説明するが、本発明は以下の実施の形態に限定されるものではなく、その要旨の範囲内で種々変形して実施することができる。
【0039】
(光触媒)
本発明の光触媒は、dn(0<n<10)型の電子配置をとる金属イオンと、酸化物イオン(O2−)と、H、Li、Na、K、Rb、Cs、Mg、Ca、Sr、希土類元素、Ti、Zr、Hf、V、Nb、Ta、Mo、W、Cu、Ag、Au、Zn、Cd、Al、Ga、In、C、Si、Ge、Sn、N、P、Sb、S、Se、Te、F、Cl、Br、及びIからなる群から選ばれる少なくとも1つの元素Bのイオン(但し、元素Bが金属元素である場合には、この元素Bのイオンはdn(0<n<10)型以外の電子配置をとる。)と、を含む化合物Aを用いる。これにより、光触媒のバンドギャップが水素・酸素の酸化還元準位をまたぎ、かつ可視光の吸収を有するようになり、その結果、紫外光のみならず可視光に対する活性の高い光触媒を提供することができる。
【0040】
上述したように、これまでは、d0又はd10型の電子配置をとる金属イオンを含む化合物を光触媒として採用することが試みられてきた。これは、d軌道内に不対電子が存在すると、照射された光が別の目的に使われてしまうために、効率が非常に悪くなると考えられていたからである。こうした技術背景があったため、光触媒を得ようとする場合には、d0又はd10型の電子配置をとる金属イオンを用いることは必須であるというのが通説的な見解となっている。
【0041】
これに対して、本発明者等は、実使用の観点から、未だ可視光に対する十分な活性を有する光触媒が開発されていない現状に鑑み、可視光に対する活性を高くするためには上記通説的見解とは別の新しい発想も必要であると考えた。そして、dn(0<n<10)型の電子配置を有する金属イオンを用いた化合物(例えば、dn遷移金属酸化物)は、d軌道を含むバンドがバンドギャップの下端を上げることができるので、図1に示すαの様な理想的なバンド構造をとることができることに注目し、こうした不対電子を含むdn遷移金属酸化物を光触媒として用いることができないかと考えた。
【0042】
ただ、dn遷移金属酸化物を用いる場合には、上述のとおり、d軌道間での遷移(d−d遷移)等の発生に注意しなければならず、本発明者等がさらに検討を加えた結果、dn(0<n<10)型の電子配置を有する金属イオンを用いる場合には、この金属イオンと組み合わせる元素の種類も重要になると考えた。例えば、非特許文献4では、新規スピネル型の材料としてBaCr2O4を採用しているが、同文献のFig.1からわかるように、BaCr2O4はスピネル単相の結晶構造にはなっていない。これは、dn(0<n<10)型の電子配置を有する金属イオンと組み合わせる元素としてBaを選んだために、結晶構造が変化したためと推測される。実際に、同文献のFig.3に示されるように、可視光を3時間照射した後の水素生成量は10μmol/h/gであり、可視光に対する活性が非常に低い。すなわち、Baの採用により結晶の対称性とバンド構造が変化した結果、可視光に対する活性が非常に低くなると推測される。このように、dn(0<n<10)遷移金属酸化物とはいっても、組み合わせる元素に留意しなければ良好な光触媒が得られないのである。
【0043】
より具体的には、dn型の電子配置を有する金属イオンを用いた化合物の場合には、d0型とd10型の電子配置をとる金属イオンを用いた化合物にはない、電子の遷移としてd−d遷移が発生するので、このd−d遷移のコントロールが重要になると考えられる。そして、こうしたd−d遷移のコントロールは、化学組成、結晶構造、d電子数をうまく組み合わせることである程度制御可能であると推測される。なお、d5の場合は特別でスピン禁制であるため,ほとんどd−d遷移は起きないと考えられる。
【0044】
以上の知見から本発明者等がさらに検討した結果、dn(0<n<10)型の電子配置をとる金属イオンと、酸化物イオン(O2−)と、H、Li、Na、K、Rb、Cs、Mg、Ca、Sr、希土類元素、Ti、Zr、Hf、V、Nb、Ta、Mo、W、Cu、Ag、Au、Zn、Cd、Al、Ga、In、C、Si、Ge、Sn、N、P、Sb、S、Se、Te、F、Cl、Br、及びIからなる群から選ばれる少なくとも1つの元素Bのイオン(但し、元素Bが金属元素である場合には、この元素Bのイオンはdn(0<n<10)型以外の電子配置をとる。)と、を含む化合物Aを用いることで、紫外光のみならず可視光に対する活性も高い光触媒が得られることを見出した。化合物Aは、好ましくは、上記金属イオンと、酸化物イオン(O2−)と、1以上の元素Bのイオンと、から構成される。また、化合物Aに用いる元素Bの数は、少なくとも1つ以上とするが、化合物Aに求められる特性に応じて、通常5個以下、好ましくは4個以下、より好ましくは3個以下とする。最も好ましくは、元素Bの数を1又は2個とする。これにより、所定の特性を有する化合物Aが得やすくなる。
【0045】
dn(0<n<10)型の電子配置をとる金属(第1の元素)イオンは、具体的には、dn(n=1〜9)型の電子配置をとる金属イオンを用いることを意味する。ここで、nは整数である。電子配置として、n=3,4,5,6,7,8,9のいずれかとすることが好ましく、n=3、5とすることがより好ましい。電子配置を上記のようにすることにより、d−d遷移が制御しやすくなると推測される。特に、金属イオンのnを3又は5として、d3型又はd5型の電子配置をとる金属イオンを用いると、d−d遷移を制御しやすくなるか、スピン禁制とすることができるようになると推測され、その結果、紫外光のみならず可視光に対する活性がさらに高い光触媒を提供することができる。そして、こうしたdn(0<n<10)型の電子配置をとる金属イオンを用いることにより、価電子帯の準位を上げながらも,理想的な電子配置であるd10電子配置に近い状態をとらせることができるので,可視光に対する活性の高い光触媒としやすくなるのである。
【0046】
dn(0<n<10)型の電子配置をとる金属イオンとしては、特に制限はなく、例えば、Ti3+、V3+、V4+、Cr3+、Cr4+、Cr5+、Mn2+、Mn3+、Mn4+、Fe2+、Fe3+、Fe4+、Co2+、Co3+、Co4+、Ni2+、Ni3+、及びCu2+を挙げることができる。こうした金属イオンのうち好ましいのは、Cr3+、Fe3+、Mn2+、又はCo4+である。より好ましいのは、Cr3+、Fe3+、又はMn2+である。これにより、d3型又はd5型の電子配置をとる金属イオンのうちでより好ましい金属イオンを用いることとなり、その結果、より活性の高い光触媒を得やすくなる。
【0047】
本発明の光触媒においては、dn(0<n<10)型の電子配置をとる金属イオンとともに酸素(第2の元素)を用いる。具体的には、酸化物イオン(O2−)を用いる。これにより、化合物Aを安定とすることができる。
【0048】
本発明の光触媒においては、dn(0<n<10)型の電子配置をとる金属イオンとともに、H、Li、Na、K、Rb、Cs、Mg、Ca、Sr、希土類元素、Ti、Zr、Hf、V、Nb、Ta、Mo、W、Cu、Ag、Au、Zn、Cd、Al、Ga、In、C、Si、Ge、Sn、N、P、Sb、S、Se、Te、F、Cl、Br、及びIからなる群から選ばれる少なくとも1つの元素B(第3の元素)のイオン(但し、元素Bが金属元素である場合には、この元素Bのイオンはdn(0<n<10)型以外の電子配置をとる。)を用いる。こうした元素Bをdn(0<n<10)型の電子配置をとる金属イオンと組み合わせることにより、高い光活性を得やすくなる。なお、元素Bのイオンは、金属(第1の元素)イオンと電子配置が同一にはならないという趣旨から、上述のとおり、金属元素を元素Bに用いる場合で当該金属元素がdn(0<n<10)型の電子配置をも採りうる元素である場合には、当該金属元素のイオンは、dn(0<n<10)型以外の電子配置をとる。こうした金属元素としては、例えば、Ti、Zr、Hf、V、Nb、Ta、Mo、W、Cu、Ag、Au、Zn、Cd、Ga、In、Ge、Sn、Sb、Se、及びTeを挙げることができる。そして、後述するように、Ti、Zr、Hf、V、Nb、Ta、Mo、及びWは、dn(0<n<10)型以外の電子配置として、d0型の電子配置をとる。また、Cu、Ag、Au、Zn、Cd、Ga、In、Ge、Sn、Sb、Se、及びTeは、dn(0<n<10)型以外の電子配置として、d10型の電子配置をとる。
【0049】
元素Bのうち、Li、Na、K、Rb、Cs、Mg、Ca、及びSrのアルカリ金属、アルカリ土類金属のイオンは、dn(0<n<10)型の電子配置をとる金属イオンとはイオン半径が異なる。このため、これら元素のイオンとdn(0<n<10)型の電子配置をとる金属イオンとを組み合わせて用いることにより、化合物Aが安定になりやすく、光活性も高くしやすくなる。一方、同じアルカリ土類金属であっても、Baは劇物である上、化合物Aの光触媒としての活性を確保しにくくする。Li、Na、K、Rb、Cs、Mg、Ca、及びSrのうち、安定性の観点から、好ましくはK、Rb、Cs、Ca、Sr、及びMgを用い、より好ましくはCa、Sr、及びMgを用い、最も好ましくはSr、Mgを用いる。
【0050】
元素Bのうち、希土類元素のイオンは、dn(0<n<10)型の電子配置をとる金属イオンとはイオン半径が異なる。このため、これら元素のイオンとdn(0<n<10)型の電子配置をとる金属イオンとを組み合わせて用いることにより、化合物Aが安定になりやすく、光活性も高くしやすくなる。希土類元素としては、Sc、Y、及びランタノイドの各元素を挙げることができるが、より具体的には、Sc、Y、La、Ce、Pr、Nd、Pm、Sm、Eu、Gd、Tb、Dy、Ho、Er、Tm、Yb、及びLuを挙げることができる。これら希土類元素のうち、安定性とコストの観点から、好ましくはY、La、Ce、Nd、Sm、Gd、Ho、及びYbを用い、より好ましくはY、La、及びCeを用い、最も好ましくはLaを用いる。
【0051】
元素Bのうち、Ti、Zr、Hf、V、Nb、Ta、Mo、及びWは、d0型の電子配置をとる。具体的には、Ti4+、Zr4+、Hf4+、V5+、Nb5+、Ta5+、Mo6+、W6+となることによりd0型の電子配置をとるので、酸化数が3前後の値をとる多くのdn(0<n<10)型の電子配置の金属イオンとは、価数及びイオン半径が適度に異なるので、良好な化合部Aを形成しやすくなる。また、これら元素は、d0型の電子配置をとるので、不対電子を取らずに存在することが可能であるので、d−d遷移制御の観点からも好ましい。こうした観点から、好ましくはTi、Zr、Hf、Nb、Ta、Mo、及びWを用い、より好ましくはTi、Zr、Hf、Nb、及びTaを用い、最も好ましくはNbを用いる。
【0052】
元素Bのうち、Cu、Ag、Au、Zn、Cd、Ga、In、Ge、Sn、Sb、Se、及びTeは、d10型の電子配置をとる。具体的には、Cu+、Ag+、Au+、Zn2+、Cd2+、Ga3+、In3+、Ge4+、Sn4+、Sb3+、Sb5+、Se4+、Se6+、Te4+、Te6+となることによりd10型の電子配置をとるので、酸化数が3前後の値をとる多くのdn(0<n<10)型の電子配置の金属イオンとは、価数及びイオン半径が適度に異なるので、良好な化合部Aを形成しやすくなる。また、これら元素は、Pブロックの元素で不対電子を持たないので、この点においても安定な化合物Aが得られやすくなる。こうした観点から、好ましくはZn、Cd、Ga、In、Ge、及びSnを用い、より好ましくはZn、Ga、In、及びSnを用い、最も好ましくはZn、Gaを用いる。
【0053】
元素Bのうち、Al、Siは、安定な元素でありかつ地球上での存在量も多いので、安定かつ低コストの化合物Aを得やすくなる。こうした観点から、好ましくはAlを用いる。
【0054】
元素Bのうち、C、N、P、S、F、Cl、Br、及びIは、陰イオンとなって、化合物Aをオキシ硫化物やオキシ窒化物等とできるために、高い光活性が得られやすくなる。こうした観点から、好ましくはN、P、S、及びClを用い、より好ましくはN、S、及びPを用いる。窒化物イオンや硫化物イオン等は、価電子帯を上げることができるので可視光活性を得やすくなるが、これに加えて、dn(0<n<10)型の電子配置をとる金属イオンも同様に価電子帯を上げることができる。その結果、全体として価電子帯を上げることができるので,紫外線より低エネルギーである可視光活性をより得やすくなる。
【0055】
また、上記説明した元素Bとして、原子量が184以下のものを用いることが好ましい。こうした特定の原子量を有する原子を併用することにより、より安定性の高い触媒を得やすくなる。
【0056】
本発明の光触媒は、化合物Aが、複合金属酸化物、オキシ硫化物、及びオキシ窒化物のいずれかであることが好ましい。これにより、化合物Aを光触媒に適した化合物とすることができ、その結果、紫外光のみならず可視光に対する活性がさらに高い光触媒を得やすくなる。これらのうち、好ましくは、化合物Aを複合金属酸化物とすることである。
【0057】
本発明の光触媒は、特定の結晶構造を有することが好ましい。こうした結晶構造としては、例えば、イルメナイト型結晶構造、スクッテルダイト型結晶構造、ホランダイト型結晶構造、スピネル型結晶構造、ペロブスカイト型結晶構造、層状ペロブスカイト型結晶構造、岩塩派生型結晶構造、パイロクロア型結晶構造、NiWO4型構造、及びジルコン型結晶構造を挙げることができる。こうした結晶構造のうち、化合物Aが、スピネル型結晶構造、ペロブスカイト型結晶構造、層状ペロブスカイト型結晶構造、岩塩派生型結晶構造、パイロクロア型結晶構造、NiWO4型構造、及びジルコン型結晶構造であることが好ましく、スピネル型結晶構造、ペロブスカイト型構造、層状ペロブスカイト型構造、又はNiWO4型構造のいずれかを有することがより好ましく、スピネル型結晶構造を有するようにすることがさらに好ましい。これにより、対称性が高い構造となり、その結果、より活性の高い光触媒を得やすくなる。特に、スピネル型結晶構造は以下の理由からも好ましい。すなわち、スピネル型結晶構造では、金属イオンに配位している酸化物イオンO2−が六配位または四配位し、酸化物イオンがそれぞれ八面体または四面体を形成するが、この多面体が正八面体や正四面体の時に,最も対称性が高くなり,その時に最もd−d遷移が制御しやすくなる、又はスピン禁制とできると考えられるからである。
【0058】
こうした化合物Aの具体例としては、特に制限はないが、MgFe2O4、ZnFe2O4、CdFe2O4、MnAl2O4、MnGa2O4、LaSrFeO4、LaFeO3、NbFeO4、LaCrO3、及びMgCr2O4の少なくともいずれかを用いることが好ましい。これにより、工業的にも有用な材料を化合物Aに用いることになり、その結果、活性の高い光触媒を得やすくなる。
【0059】
本発明の光触媒は、上記の材料を含む化合物Aを用いるが、その他の材料を併用したり、化合物Aに用いる元素以外の不純物を含むもの等であってもよい。こうした材料としては特に制限はなく、光触媒に所望される性能に応じて適切なものを適宜用いればよい。例えば、後述の水素製造方法に本発明の光触媒を用いる場合には、化合物Aに助触媒としての白金を担持することが行われる。
【0060】
本発明の光触媒の性状は、通常、常温(25±5℃)/常湿(50±10%RH)において粒状となる。この場合における光触媒の平均粒径は、通常100nm以上、好ましくは500nm以上、より好ましくは1μm以上、また、通常50μm以下、好ましくは20μm以下、より好ましくは10μm以下とする。この範囲とすれば、取り扱いもしやすく実使用に支障のない光触媒としやすくなる。なお、比表面積を大きくして活性をより高くする観点から、本発明の光触媒をナノ粒子としてもよいが、飛散しやすくなる等取り扱いが難しくなることがあるので、ナノ粒子とする場合には注意が必要である。
【0061】
本発明の光触媒は、上記の材料を含む化合物Aを用いるので、可視光応答型光触媒となる。これにより、可視光に対する活性を確保することができ、その結果、実使用上非常に有用な光触媒となる。より好ましくは、光触媒が、可視光応答型光触媒であるとともに、紫外線応答型光触媒でもあることである。これにより、太陽光を効率よく吸収してより活性の高い光触媒とすることができる。
【0062】
本発明の光触媒に用いる化合物Aは、従来公知の方法で製造することができる。こうした製造方法としては、例えば、所定の原料粉末を混合した後焼成する方法を挙げることができる。原料粉末の混合方法、混合比、焼成温度、焼成の際の雰囲気等の製造条件は、用いる原料粉末や得ようとする化合物Aの種類に応じて適宜選択・制御すればよい。
【0063】
(水素製造方法)
本発明の水素製造方法は、本発明の光触媒と、水素含有化合物とを接触させるとともに、光を照射して水素を生成させる水素生成工程を有する。これにより、紫外線のみならず可視光での活性が高くなって、その結果、水素の生産効率が高い水素製造方法を提供することができる。
【0064】
水素生成工程に用いる本発明の光触媒は、上述したとおりのものを用いればよいが、化合物Aに助触媒を担持した材料を光触媒として用いることが好ましい。助触媒としては、例えば、白金(Pt)、ニッケル(Ni)、ロジウム(Ph)、及び酸化クロム等を挙げることができる。
【0065】
助触媒を用いる意義は以下のとおりである。すなわち、図1に示すように、光によって励起された電子は上の準位で水素を生成するために使用され、下の順位に生成したホールは酸素の生成に使用される。こうした反応では、電子とホールとが別々のサイトで別々の反応を行うことが好ましい。そこで、助触媒を用いて励起された電子を集めることにより、一旦励起された電子が水素生成に使われずにホールと再結合し反応が進まないという現象を抑制することができる。こうした観点からは、助触媒に導電性材料を用いることが好ましい。例えば、助触媒として白金を用いると、白金は金属なので電子を集めやすく、励起された電子が白金側に移動してそこで水素の生成が起きやすくなると推測される。このように、助触媒を化合物Aに担持することにより、助触媒のサイトに電子を集めることができ,電子とホールの再結合を防ぎ,水素生成を促進させやすくなる。
【0066】
化合物Aに対する助触媒の含有量は、通常0.1wt%以上、好ましくは0.5wt%以上、また、通常5wt%以下、好ましくは3wt%以下とする。この範囲とすれば、光活性を高く維持しつつも助触媒の作用を発揮しやすくなる。
【0067】
水素生成工程に用いる水素含有化合物は、水素を含有する化合物であれば特に制限はなく、例えば、水;メタノール、エタノール、1−プロパノール、2−プロパノール、1−ブタノール、2−ブタノール等のアルコール;水とアルコールとの混合物等を用いることができる。これらのうち工業生産を視野に入れた場合には、水素含有化合物として汎用のものを用いることが好ましく、水、メタノール、エタノール、及び水とアルコールとの混合物を用いることが好ましい。
【0068】
水素含有化合物は、用いる製造方法に応じて固体、液体、気体として供給され、本発明の光触媒と接触させることになる。例えば、水素含有化合物を液体として用いる場合には、水素含有化合物中に本発明の光触媒を保持すれば、本発明の光触媒と、水素含有化合物とを接触させることができる。具体的には、液体状の水素含有化合物中に本発明の光触媒を分散させる、所定の基板上に本発明の光触媒を成膜又は担持し、これを液体状の水素含有化合物中に浸積する等の方法を用いればよい。また、例えば、水素含有化合物が気体として用いられる場合には、本発明の光触媒を保持したチャンバー内に気体状の水素含有化合物を供給して、本発明の光触媒と、水素含有化合物とを接触させればよい。
【0069】
水素生成工程において、本発明の光触媒や水素含有化合物の量は、製造する水素の量等に応じて適宜調整すればよい。
【0070】
水素生成工程においては、本発明の光触媒と、水素含有化合物とを接触させるとともに、光を照射して水素を生成させる。照射する光は、特に制限はないが、可視光であることが好ましい。これにより、可視光に対する活性を確保することができ、その結果、実使用上非常に有用な水素製造方法となる。
【0071】
水素生成工程における光の照射時間は、製造する水素の量に応じて適宜調整すればよいが、通常1分以上、好ましくは5分以上、また、通常100時間以下、好ましくは50時間以下、より好ましくは10時間以下、特に好ましくは5時間以下とする。
【0072】
本発明の水素製造方法は、水素生成工程を有するが、必要に応じてその他の工程も適宜行えばよい。例えば、水素生成工程に先立って、本発明の光触媒を準備する光触媒準備工程を行ってもよいし、水素生成工程の後に、生成した水素を単離する水素単離工程等を行ってもよい。こうした工程のうち、例えば、光触媒準備工程では、化合物Aに助触媒を担持して本発明の光触媒を準備すればよい。ここで、助触媒の担持方法については、従来公知の方法を適宜用いればよい。具体的には、助触媒として白金を用いる場合には、白金を含有する化合物の溶液を準備し、これに化合物Aを加えて攪拌しながら、光を照射して白金を化合物Aに担持するという方法を用いればよい。
【0073】
(有機物分解方法)
本発明の有機物分解方法は、本発明の光触媒に光を照射して、光触媒に接触した有機物を分解する。これにより、紫外線のみならず可視光での活性が高くなって有機物の分解が促進されることになり、その結果、分解活性の高い有機物分解方法を提供することができる。
【0074】
本発明の有機物分解方法は、例えば、大気浄化、抗菌、脱臭、浄水、防汚等の各用途に用いられる。光触媒と分解される有機物との接触方法は、こうした用途に応じて最適な手法を適宜用いればよい。例えば、大気浄化、抗菌、防汚の用途に用いる場合は、光触媒を塗料に分散させてこれを家の外壁等に塗布して塗膜を形成する等の手法を用いればよい。
【0075】
そして、光触媒に有機物等の汚れが付着しても、光を照射することにより、こうした有機物を分解して防汚効果を奏することができる。分解される有機物としては、例えば、アセトアルデヒド、ホルムアルデヒド、メチルメルカプタン、及びトリメチルアミン等を挙げることができる。また、照射する光につき特に制限はないが、光が可視光であることが好ましい。これにより、可視光に対する活性を確保することができ、その結果、実使用上非常に有用な防汚方法となる。
【実施例】
【0076】
次に、本発明を実施例により更に具体的に説明するが、本発明はその要旨を超えない限り、以下の実施例の記載に限定されるものではない。
【0077】
[実施例1〜10]
(複合金属酸化物(化合物A)の合成)
原料粉末を適量測りとり、これを乳鉢に投入し、乳鉢と乳棒を使用して30分程度混合した。その後、管状炉を使用して、上記原料粉末を所定の温度で焼成した。目的とする複合金属酸化物(目的物)、原料粉末、焼成温度、焼成時間を表−1に示す。なお、MnGa2O4、MnAl2O4はN2雰囲気で焼成を行った。
【0078】
【表1】

【0079】
(生成物の同定)
上記合成により所望の複合金属酸化物が得られているか否かを、粉末X線回折により確認した。測定には理学電機株式会社製RINT−2200粉末X線回折装置を利用し、X線源にはCu管球を用いた。
【0080】
図2,3,4は、それぞれ、合成された各生成物の一部のXRDパターンである。表−1に示す合成条件で、MgFe2O4,ZnFe2O4,CdFe2O4,MnGa2O4、MnAl2O4,LaSrFeO4,LaFeO3,NbFeO4、LaCrO3、MgCr2O4それぞれの単相が得られていることが確認された。
【0081】
(複合金属酸化物の反射率測定)
上記合成方法で得られた、MgFe2O4,ZnFe2O4,CdFe2O4,MnGa2O4、MnAl2O4,LaSrFeO4,LaFeO3,NbFeO4、LaCrO3、MgCr2O4の各複合金属酸化物の試料をそれぞれホルダーに詰め、装置にセットして各複合金属酸化物の反射率を特性した。測定は、バックグラウンド補正を行いながら、240〜800nmの範囲で反射率を測定することにより行った。反射率の測定には日本分光株式会社製V−570紫外・可視分光光度計を用いた。
【0082】
図5,6,7は、各複合金属酸化物の一部の反射率の測定結果である。全ての物質について400〜600nm付近で反射率の減少が見られることから、可視光の吸収が可能であることがわかる。また、全ての物質において、TiO2に比べて、400〜800nmの部分で大きな光の吸収があることがわかる。
【0083】
(光触媒準備工程)
各複合金属酸化物に白金を担持することにより、光触媒を製造した。具体的には、50%メタノール溶液中に、上記「(複合金属酸化物(化合物A)の合成)」で合成した複合金属酸化物の粉末と、塩化白金酸溶液と、を加えた(塩化白金酸溶液は、複合金属酸化物の粉末に対して白金が2wt%担持されるようにした)。この混合溶液をスターラーで攪拌しながら、PE300BUV 300W Xeランプで可視・紫外光を1時間照射して、白金を複合金属酸化物に担持した。この光触媒準備工程を、MgFe2O4,ZnFe2O4,CdFe2O4,MnGa2O4、MnAl2O4,LaSrFeO4,LaFeO3,NbFeO4、LaCrO3、MgCr2O4の各複合金属酸化物それぞれについて行った。
【0084】
(水素生成工程:気相反応系)
図8は、水素生成工程を気相反応系で行った場合の装置の模式的概念図である。同図に示す装置を用いて、水素生成工程を以下のようにして実施した。
【0085】
まず、上記光触媒準備工程で準備した光触媒0.2gをホルダーにセットして反応槽の内部に保持した。その後、反応槽内をロータリーポンプで真空状態にした。次いで、反応槽にメタノールガスと、標準ガスとしての少量のArと、を導入し、光触媒とメタノールガスとを接触させた。そして、反応漕を外部から放熱ファンで風冷しながら、光源として300W Xeランプを用い、全波長・可視光を50分間照射した。ここで、照射時の反応槽内のガスを測定室に微量導入した。なお、測定時の測定室内の気圧は、約3.0×10−7Paとなるように制御した。そして、PFEIFFER VACUUM Prisma QMS200型四重極質量分析計によりガス組成の分析を行い、その時間変化をコンピュータに記録した。
【0086】
図9は、複合金属酸化物をMgFe2O4とした場合の全波長(200〜1100nm)での水素発生量の時間変化を測定した測定結果である。また、図10は、図9を拡大して示したものである。図9からわかるように、光照射を始めた直後から、水素と一酸化炭素との急激な増加がみられた。また、図10からわかるように、水素と一酸化炭素との急激な増加と同時に、わずかながらホルムアルデヒドとメタノールの減少もみられた。これらの現象から、以下に示す反応が起こったものと考えられる。
【0087】
【化1】

【0088】
図11は、複合金属酸化物をMgFe2O4,CdFe2O4,MnGa2O4とそれぞれした場合における、全波長(200〜1100nm)での水素発生量の時間変化を測定した測定結果である。同図の結果から、鉄(Fe)を含む複合金属酸化物の方がマンガン(Mn)を含む複合金属酸化物よりも活性が高いことがわかる。
【0089】
図12は、複合金属酸化物をMgFe2O4,CdFe2O4,MnGa2O4とそれぞれした場合における、可視光(400〜800nm)での水素発生量の時間変化を測定した測定結果である。図11に示した全波長のときと比べて、ほとんど活性が変化していないことがわかる。このことから、これらの複合金属酸化物の活性がほぼ可視光によるものであることがわかる。
【0090】
(水素生成工程:液相反応系)
図13は、水素生成工程を液相反応系で行った場合の装置の模式的概念図である。同図に示す装置(総体積440ml)を用いて、水素生成工程を以下のようにして実施した。
【0091】
まず、上記光触媒準備工程で準備した光触媒0.15g、メタノール溶液20ml、及び磁気攪拌子を反応槽に入れて、光触媒とメタノール溶液とを接触させた。反応槽を装置に取り付けて密閉し、装置全体をArガスで置換した。次いで、スターラーで攪拌しながら、光源として300W Xeランプを用い、全波長・可視光を3時間照射した。なお、実験中は反応槽を扇風機で風冷した。その後、注射器を用いて反応槽内部のガスを2.5ml取り出した。取り出したガスにつき、島津ガスクロマトグラフGC−2014で分析を行った。水素標準ガスを用いて検量線を作成し、それによって発生した水素の体積を算出した。
【0092】
複合金属酸化物をMgFe2O4,ZnFe2O4,MnGa2O4、MnAl2O4、LaSrFeO4、LaFeO3、NbFeO4、LaCrO3、MgCr2O4とそれぞれした場合における水素発生速度を表−2に示す。表−2は、各複合金属酸化物の1gに対しての水素発生速度μmolh−1g−1の値である。
【0093】
【表2】

【図面の簡単な説明】
【0094】
【図1】光触媒のバンド構造を示す模式図である。
【図2】合成された各生成物の一部のXRDパターンである。
【図3】合成された各生成物の一部のXRDパターンである。
【図4】合成された各生成物の一部のXRDパターンである。
【図5】各複合金属酸化物の一部の反射率の測定結果である。
【図6】各複合金属酸化物の一部の反射率の測定結果である。
【図7】各複合金属酸化物の一部の反射率の測定結果である。
【図8】水素生成工程を気相反応系で行った場合の装置の模式的概念図である。
【図9】複合金属酸化物をMgFe2O4とした場合の全波長(200〜1100nm)での水素発生量の時間変化を測定した測定結果である。
【図10】図9を拡大して示したものである。
【図11】複合金属酸化物をMgFe2O4,CdFe2O4,MnGa2O4とそれぞれした場合における、全波長(200〜1100nm)での水素発生量の時間変化を測定した測定結果である。
【図12】複合金属酸化物をMgFe2O4,CdFe2O4,MnGa2O4とそれぞれした場合における、可視光(400〜800nm)での水素発生量の時間変化を測定した測定結果である。
【図13】水素生成工程を液相反応系で行った場合の装置の模式的概念図である。
【特許請求の範囲】
【請求項1】
dn(0<n<10)型の電子配置をとる金属イオンと、
酸化物イオン(O2−)と、
H、Li、Na、K、Rb、Cs、Mg、Ca、Sr、希土類元素、Ti、Zr、Hf、V、Nb、Ta、Mo、W、Cu、Ag、Au、Zn、Cd、Al、Ga、In、C、Si、Ge、Sn、N、P、Sb、S、Se、Te、F、Cl、Br、及びIからなる群から選ばれる少なくとも1つの元素Bのイオン(但し、元素Bが金属元素である場合には、前記元素Bのイオンはdn(0<n<10)型以外の電子配置をとる。)と、
を含む化合物Aを用いることを特徴とする光触媒。
【請求項2】
前記金属イオンのnが3又は5である、請求項1に記載の光触媒。
【請求項3】
前記金属イオンがCr3+、Fe3+、又はMn2+である、請求項2に記載の光触媒。
【請求項4】
前記化合物Aが、複合金属酸化物、オキシ硫化物、及びオキシ窒化物のいずれかである、請求項1〜3のいずれか1項に記載の光触媒。
【請求項5】
前記化合物Aが、スピネル型結晶構造、ペロブスカイト型構造、層状ペロブスカイト型構造、又はNiWO4型構造のいずれかを有する、請求項1〜4のいずれか1項に記載の光触媒。
【請求項6】
前記化合物Aが、MgFe2O4、ZnFe2O4、CdFe2O4、MnAl2O4、MnGa2O4、LaSrFeO4、LaFeO3、NbFeO4、LaCrO3、及びMgCr2O4の少なくともいずれかである請求項1〜5のいずれか1項に記載の光触媒。
【請求項7】
前記光触媒が可視光応答型光触媒である、請求項1〜6のいずれか1項に記載の光触媒。
【請求項8】
請求項1〜7のいずれか1項に記載の光触媒と、水素含有化合物とを接触させるとともに、光を照射して水素を生成させる水素生成工程を有することを特徴とする水素製造方法。
【請求項9】
前記水素生成工程で照射する光が可視光である、請求項8に記載の水素製造方法。
【請求項10】
請求項1〜7のいずれか1項に記載の光触媒に光を照射して、前記光触媒に接触した有機物を分解することを特徴とする有機物分解方法。
【請求項11】
前記光が可視光である、請求項10に記載の有機物分解方法。
【請求項1】
dn(0<n<10)型の電子配置をとる金属イオンと、
酸化物イオン(O2−)と、
H、Li、Na、K、Rb、Cs、Mg、Ca、Sr、希土類元素、Ti、Zr、Hf、V、Nb、Ta、Mo、W、Cu、Ag、Au、Zn、Cd、Al、Ga、In、C、Si、Ge、Sn、N、P、Sb、S、Se、Te、F、Cl、Br、及びIからなる群から選ばれる少なくとも1つの元素Bのイオン(但し、元素Bが金属元素である場合には、前記元素Bのイオンはdn(0<n<10)型以外の電子配置をとる。)と、
を含む化合物Aを用いることを特徴とする光触媒。
【請求項2】
前記金属イオンのnが3又は5である、請求項1に記載の光触媒。
【請求項3】
前記金属イオンがCr3+、Fe3+、又はMn2+である、請求項2に記載の光触媒。
【請求項4】
前記化合物Aが、複合金属酸化物、オキシ硫化物、及びオキシ窒化物のいずれかである、請求項1〜3のいずれか1項に記載の光触媒。
【請求項5】
前記化合物Aが、スピネル型結晶構造、ペロブスカイト型構造、層状ペロブスカイト型構造、又はNiWO4型構造のいずれかを有する、請求項1〜4のいずれか1項に記載の光触媒。
【請求項6】
前記化合物Aが、MgFe2O4、ZnFe2O4、CdFe2O4、MnAl2O4、MnGa2O4、LaSrFeO4、LaFeO3、NbFeO4、LaCrO3、及びMgCr2O4の少なくともいずれかである請求項1〜5のいずれか1項に記載の光触媒。
【請求項7】
前記光触媒が可視光応答型光触媒である、請求項1〜6のいずれか1項に記載の光触媒。
【請求項8】
請求項1〜7のいずれか1項に記載の光触媒と、水素含有化合物とを接触させるとともに、光を照射して水素を生成させる水素生成工程を有することを特徴とする水素製造方法。
【請求項9】
前記水素生成工程で照射する光が可視光である、請求項8に記載の水素製造方法。
【請求項10】
請求項1〜7のいずれか1項に記載の光触媒に光を照射して、前記光触媒に接触した有機物を分解することを特徴とする有機物分解方法。
【請求項11】
前記光が可視光である、請求項10に記載の有機物分解方法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【公開番号】特開2010−46604(P2010−46604A)
【公開日】平成22年3月4日(2010.3.4)
【国際特許分類】
【出願番号】特願2008−213017(P2008−213017)
【出願日】平成20年8月21日(2008.8.21)
【出願人】(304036743)国立大学法人宇都宮大学 (209)
【Fターム(参考)】
【公開日】平成22年3月4日(2010.3.4)
【国際特許分類】
【出願日】平成20年8月21日(2008.8.21)
【出願人】(304036743)国立大学法人宇都宮大学 (209)
【Fターム(参考)】
[ Back to top ]

