光電変換素子用のスクアリリウム色素、これを使用する光電変換素子及び色素増感太陽電池
【課題】近赤外領域における吸収波長範囲が広く光電変換効率の向上可能な新規なスクアリリウム色素と、これを用いた光電変換素子及び色素増感太陽電池及び光電変換素子を提供する。
【解決手段】下記式(1)で表わされる光電変換素子用のスクアリリウム色素である。
式中、R1及びR2はそれぞれ独立にC1〜C30のアルキル基又はC1〜C30のハロゲン置換アルキル基である。環A1、A2及びA3は各々独立して、5又は6員環構造を有する環であり、環A1及びA3の環構造は含窒素複素環であり、A1、A2及びA3は縮合して縮合環を形成している。

【解決手段】下記式(1)で表わされる光電変換素子用のスクアリリウム色素である。
式中、R1及びR2はそれぞれ独立にC1〜C30のアルキル基又はC1〜C30のハロゲン置換アルキル基である。環A1、A2及びA3は各々独立して、5又は6員環構造を有する環であり、環A1及びA3の環構造は含窒素複素環であり、A1、A2及びA3は縮合して縮合環を形成している。

【発明の詳細な説明】
【技術分野】
【0001】
本発明は、光電変換素子用のスクアリリウム色素、この色素を用いる光電変換素子及び色素増感太陽電池に関する。
【背景技術】
【0002】
光電変換素子は、光センサー、太陽電池等の光発電装置に使用されている。色素によって増感された半導体微粒子を用いる光電変換素子が特許文献1等で知られている。
【0003】
太陽電池としては、単結晶、多結晶あるいはアモルファスのシリコン半導体を用いた太陽電池が、電卓などの電気製品や住宅用などに広く用いられている。しかしながら、このようなシリコン半導体を用いた太陽電池の製造には、プラズマCVDや高温結晶成長プロセスなどの高精度プロセスが用いられるため、多大のエネルギーを必要とすると共に、真空を必要とする高価な装置が必要なために製造コストが高くなっている。
【0004】
そこで、低コストで製造可能な太陽電池として、例えば、酸化チタンのような酸化物半導体にルテニウム金属錯体のような光増感色素を吸着させた材料を用いた色素増感太陽電池が提案されている。色素増感太陽電池は具体的には、例えばインジウム添加酸化スズのような透明導電層を設けた透明ガラス板あるいは透明樹脂板のような透明絶縁材料の透明導電層側に、例えばルテニウム錯体からなる色素を表面に吸着した酸化チタンなどを半導体層として形成した負極と、正極となる白金などの金属層あるいは導電層を設けた透明ガラス板あるいは透明樹脂板のような透明絶縁材料との間に電解質の液を封入したものがある。色素増感太陽電池に光が照射されると、負極では光を吸収した色素の電子が励起し、励起した電子が半導体層に移動し、更に透明電極へと導かれ、正極では導電層からくる電子により電解質を還元する。還元された電解質は色素に電子を伝えることで酸化され、このサイクルで色素増感太陽電池が発電すると考えられている。
【0005】
現在、色素増感太陽電池はシリコン太陽電池に比して照射光エネルギーに対する発電エネルギー効率が低く、その効率を上げることが実効的な色素増感太陽電池を製造する上での重要な課題となっている。色素増感太陽電池の効率は、それを構成する各要素の特性や、更にそれら要素の組み合わせによっても影響を受けると考えられており、さまざまな試みがなされている。中でも、光増感作用を持つ色素について、より高効率な増感色素の開発に注力されている。現在知られている高効率色素としてRu色素があるが、遷移金属であるRuは高価なため、安価で高効率の色素の開発が望まれている。また、これらの色素は可視光領域の光電変換効率は高いが、近赤外領域の光電変換効率が低く、近赤外領域近傍に吸収帯を有する色素の開発が望まれている。
【0006】
この近赤外領域近傍に吸収帯を有する光電変換素子用の有機色素については、特許文献1乃至4等でいくつかの化合物が知られている。また、スクアリリウム色素についても、これらの文献で知られている。
【先行技術文献】
【特許文献】
【0007】
【特許文献1】特開1999−214730公報
【特許文献2】特開2000−268892公報
【特許文献3】特開2000−294306公報
【特許文献4】WO2011/108481公報
【0008】
特許文献1では光電変換素子及び色素増感太陽電池を開示し、それに使用されるポリメチン色素を例示している。特許文献1において使用されるポリメチン色素は、一般式で表わされており、膨大な数の化合物が含まれるが、少なくとも2つの環が含窒素縮合環である3つの環で形成される縮合環を有するスクアリリウム色素は示されていない。ここで、スクアリリウム色素というときは、カルボキシインドレニン構造とN置換基を有するスクアリリウム色素の意味と解される。
【0009】
同様に、特許文献2及び特許文献3においても十分な光電変換効率及び吸収波長範囲を示すスクアリリウム色素は開示されていない。
【0010】
特許文献4では、ベンゾインドレニン構造を有するスクアリリウム色素を開示している。この色素は、特許文献1乃至3で開示されるインドレニン構造よりも電子的な共役が発達しており色素の吸収波長範囲が長波長領域まで及ぶ。その結果、より広い波長範囲の光を光電変換することで優れた光電変換効率を示した。さらに色素の電子的な共役を発達させることで、さらなる光電変換効率の向上が期待されるが、そのような色素は、光電変換効率、半導体層への吸着性、溶解性を兼ね備えることが困難なため、これまで検討されてこなかった。
【発明の概要】
【発明が解決しようとする課題】
【0011】
従来のスクアリリウム色素は、近赤外領域における吸収波長範囲が狭く、十分な光を吸収し、光電変換することができない。
【0012】
本発明は、上記の課題に鑑みてなされたものであり、近赤外領域における吸収波長範囲が広く光電変換効率の向上可能な新規な色素を提供し、これを用いた光電変換素子及び色素増感太陽電池及び光電変換素子を提供することを目的とする。
【課題を解決するための手段】
【0013】
本発明は下記式(1)で表わされる光電変換素子用のスクアリリウム色素である。
【化1】

式中、R1及びR2はそれぞれ独立にC1〜C30のアルキル基又はC1〜C30のハロゲン置換アルキル基である。環A1、A2及びA3は各々独立して、5又は6員環構造を有する環であり、環A1及びA3は含窒素複素環である。環A1、A2及びA3は縮合環を形成している。
【0014】
また、本発明は、色素を用いる光電変換素子において、色素が上記スクアリリウム色素であることを特徴とする光電変換素子である。また、本発明は、上記光電変換素子を用いて構成したことを特徴とする色素増感太陽電池である。
【発明の効果】
【0015】
本発明のスクアリリウム色素は、従来のスクアリリウム色素よりも吸収波長が長波長領域に達する。そのため、本発明のスクアリリウム色素を使用した光電変換素子又はこれから構成した色素増感太陽電池は、特に近赤外光領域における光電変換効率が高い。
【図面の簡単な説明】
【0016】
【図1】色素増感太陽電池の一例を示す断面図である。
【図2】本発明のスクアリリウム色素D−1のMSスペクトルである。
【発明を実施するための形態】
【0017】
本発明の光電変換素子又は色素増感太陽電池は、上記式(1)で表されるスクアリリウム色素を増感色素として含む。なお、色素増感太陽電池は光電変換素子を利用するものであるため、両者の説明の多くが共通するので、共通する説明は色素増感太陽電池で代表して説明する。
【0018】
式(1)において、環A1、A2及びA3は各々独立して、隣接環と縮合する5又は6員環であるが、これらの環は置換基を有してもよい。環A1、A2及びA3は隣接環と共有する2つ又は4つ(A2の場合)の炭素原子とともに5又は6員環を形成している。環A1、A2及びA3を説明するに当たり、隣接環と縮合する前の状態(共有する炭素を含む)であって、置換基を有しない状態の環構造からなる化合物で説明する。
【0019】
環A1及びA3は、含窒素複素環であり、環構成原子中に少なくとも1つの窒素原子を有し、他のヘテロ原子を有することができる。好ましくは、環構成原子中に少なくとも1つの窒素原子を有する5又は6員環化合物である。具体的には、ピロール、ピリジン、イミダゾール、ピラゾール、オキサゾール、チアゾール、イミドゾリン、ピラジン、及びチアジンから選択される化合物があり、好ましくは、ピロール又はピリジンである。
環A2は、環構成原子中に窒素原子を有しないが、他のヘテロ原子を有することができる。好ましくは、炭素5又は6員環化合物である。具体的には、ベンゼン、フラン、チオフェン、ピラン、及びチアピランから選択される化合物があり、好ましくはベンゼンである。
【0020】
また、上記環A1は隣接する環A2と、環A2は隣接するA1及びA3と、環A3は隣接する環A2と縮合して、縮合環を形成している。好ましくは、A2がベンゼンであり、さらに好ましくは、A1及びA3の一方がピロールであり、他方がピリジンである。
【0021】
環A1、A2及びA3から形成される縮合環はR2以外にも置換基を有することが好ましく、具体的には色素の溶解性の点からC1〜C6のアルキル基が望ましく、酸化チタン若しくは酸化スズへの吸着し易さの点からカルボキシル基が好ましい。これらの置換基は、1つ以上有することがよく、これらは環A1、A2及びA3のいずれか1つ以上に置換することができる。
【0022】
上記環A1、A2及びA3が縮合して生じる縮合環としては、以下の表1のF-1〜F-10に例示されるような縮合環が挙げられるが、これらの例に限らないことは言うまでもない。表1において、R2は式(1)と同じ意味を有し、R2を有する環が環A1である。
【0023】
【表1】

【0024】
式(1)において、R1及びR2はそれぞれ独立にC1〜C30のアルキル基又はC1〜C30のハロゲン置換アルキル基であり、好ましくは色素の溶解性の観点からC1〜C30のアルキル基である。
【0025】
式(1)において、R1及びR2がアルキル基の場合、アルキル基が長すぎる場合は、溶解性の低下により半導体電極への色素吸着が困難になる。この観点から上記アルキル基の炭素数は1〜16の範囲がより好ましい。アルキル基が短すぎる場合は、色素のエネルギー準位制御が不十分となり、色素の電子授受能力を最適化できないため、また、色素同士の会合により、効率が十分でなくなる。そのため、アルキル基の炭素数は2〜16の範囲がより好ましく、より好ましくはR1のアルキル基の炭素数は4〜12であり、R2のアルキル基の炭素数は2〜12である。
【0026】
正確な理由は定かではないが、R1及びR2はスクアリリウム色素の会合を防いで、色素間のエネルギー移動に起因する電荷分離損失を低減すると考えられる。また、3つの環で形成される縮合環骨格は、従来のインドレニン骨格に比べ共役が長いため、色素の吸収波長を長波長化させ、カルボン酸上の電子密度が大きくなり、電子注入効率が向上すると考えられる。
【0027】
式(1)において、R1及びR2の少なくとも一方がハロゲン置換アルキル基である場合、ハロゲンがフッ素であることが、特にエネルギー準位制御の効果が高く好ましい。また、R1及びR2の少なくとも一方がフッ素置換アルキル基である場合、CF3(CF2)m(CH2)nで表される基が好ましい。この場合、mとnが独立に0〜14の整数であり、且つmとnの合計が2〜14である範囲が好ましい。mとnの合計が15以上のような長いフッ素置換アルキル基においては、色素吸着速度が低下する傾向がある。好ましいm及びnは、mは0〜5の整数、より好ましくは1〜3の整数であり、nは0〜9の整数、より好ましくは1〜7の整数である。好ましいmとnの合計は、3〜10の整数である。
【0028】
次に、本発明の式(1)で表されるスクアリリウム色素の合成法について、説明する。
式(1)で表されるスクアリリウム色素における環A1、A2及びA3が縮合した縮合環部位は、下記の方法で合成することができる。一例として、環A1がピリジンであり、環A2がベンゼンであり、環A3がピロールである化合物18と、環A1がピロールであり、環A2がベンゼンであり、環A3がピリジンである化合物19の合成例を示す。化学式に付された番号は化合物番号である。
【0029】
【化2】

【0030】
N−アルキルピロロキノリン塩(化合物6)及び(化合物7)は、化合物1及び化合物2を出発物質として得られる化合物5とハロゲン化アルキルとの反応により合成することができる。アルキル基の炭素数を変化させたハロゲン化アルキルを使用することにより、炭素数の異なるN−アルキルピロロキノリン塩を合成することができる。本合成例の場合、N−アルキルピロロキノリン塩は、化合物6及び化合物7の混合物として得られる。
【0031】
化合物6及び化合物7とスクアリン酸エステル(化合物8)を用い、J.Am.Che.Soc., 2007, 129, p10320−10321を参考にして化合物9及び化合物10の混合物を合成することができる。更に化合物9及び化合物10の混合物を加水分解して、化合物11及び化合物12の混合物を合成することができる。
【0032】
【化3】

【0033】
また、化合物11及び化合物12をそれぞれ単体で得る場合は、化合物9及び化合物10の混合物を、例えばカラムクロマトグラフィーを使用して分離し、化合物11及び化合物12をそれぞれ個別に得ることができる。
【0034】
N−アルキルカルボキシインドレニン塩(化合物13)は、化合物14とハロゲン化アルキルとの反応により合成することができる。アルキル基の炭素数を変化させたハロゲン化アルキルを使用することにより、炭素数の異なるN−アルキルカルボキシインドレニン塩を合成することができる。
【0035】
【化4】

【0036】
具体的には、カルボキシインドレニン(化合物14)とn−オクチルアイオダイドを反応させN−n−オクチルカルボキシインドレニンアイオダイド(化合物15)を合成する。
【0037】
なお、カルボキシインドレニン(化合物14)は、Bioconjugate Chem.2003,Vol.14,1048−1051を参考に合成することができる。
【化5】

【0038】
式(1)で表されるスクアリリウム色素は、それぞれ単離した化合物11及び化合物12を化合物15を反応させ化合物16及び化合物17をそれぞれ合成し、更にそれぞれをアルカリで加水分解することでスクアリリウム色素(化合物18及び化合物19)を合成することができる。なお、化合物11及び化合物12を単離することなく化合物18及び化合物19を合成することも可能であり、この場合は化合物18及び化合物19の混合物としてスクアリリウム色素が得られる。混合物としてのスクアリリウム色素も本発明のスクアリリウム色素であり、本発明の光電変換素子、太陽電池の色素として好適に使用できる。
【0039】
【化6】

【0040】
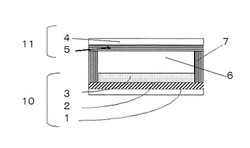
本発明の色素を用いた光電変換素子又は色素増感太陽電池の基本構成の一例を図1により説明する。図1は光電変換素子の一例を示す断面図であり、基板1上に、導電層2と半導体層に増感用の色素が吸着された色素吸着半導体層3が、積層された電極10と、基板4上に導電層5が設けられた対向電極11を有し、両電極間に電解質層6を配した構成となっている。色素吸着半導体層3は、電極の一部を構成するため半導体電極ともいう。色素吸着半導体層3はチタニアあるいは金属酸化物微粒子を用い1つの層として塗工・焼結されたもの、又は複数回の塗工・焼結により形成された層であり、色素が吸着された半導体層であり、酸化チタン粒子等の金属酸化物粒子とこの粒子の表面を覆うように存在する増感色素からなっている。なお、光は電極10側から入る。そして、本発明の色素増感太陽電池は、上記と同様な基本構成を有するが外部回路で仕事をさせるようにしたものである。そして、色素光電変換素子を色素増感太陽電池とする方法は上記特許文献1〜4等で公知であり、これら公知の方法でよい。
【0041】
基板1としては、透明な絶縁材料であれば特に限定されるものではなく、例えば通常のガラス板やプラスチック板などが挙げられ、更には屈曲性のあるものでも良く、例えばPET樹脂などが挙げられるが、好ましくは約500℃を上限にした酸化チタンを焼付ける工程に耐え得る耐熱材料であることであり、透明なガラス板が挙げられる。
【0042】
次に、この基板1の表面に基材の透明性を損なわないような導電層2を設けるが、導電層としてはいわゆる透明電極として知られているITO、FTO、ATOあるいはこれらを組み合わせたものでよく、更には透明性を損なわない厚みの金属層であってもよい。これらの導電層を設ける方法は特に限定されるものではなく、スパッタリング、蒸着(CVD及びPVDを含む)、スプレー、レーザアブレーションあるいはペースト化した各材料を用いるスピンコート、バーコート、スクリーン印刷の手法など既知の手法を用いることができる。中でも、スプレー法又は気相で行われるスパッタリング又は蒸着法が適する。
【0043】
この上に、色素吸着半導体層3を設ける。通常は半導体として金属酸化物の層を形成したのち、これに増感色素を吸着させる。金属酸化物としては、光電変換材料と知られているものが使用でき、酸化チタン、酸化亜鉛、酸化タングステン、酸化スズ等を挙げることができる、中でも酸化チタン及び酸化スズが好ましい。酸化チタンとしては、アナターゼ型、ルチル型、ブルッカイト型等の酸化チタンの他、水酸化チタン、含水酸化チタン類であってもよい。また、Nb、V又はTaの各元素の少なくとも1つを酸化チタンに対して30ppm〜5%の重量濃度(金属元素として)になるようドーピングしてもよい。このような金属酸化物であれば、本発明に用いることが可能であるが、平均粒子径が5〜500nm、好ましくは10〜200nmの範囲の微粒子であることがよい。
【0044】
金属酸化物の層を前記導電層2上に形成するが、その方法については、特に限定されるものではなく、例えばペースト化した金属酸化物をスピンコート、印刷、スプレーコートなどの各手法を用いても良い。また、製膜後に酸化チタン等の金属酸化物の焼結などを目的に焼成することも可能である。次に、金属酸化物に増感用の色素を吸着させて色素吸着金属酸化物として、色素吸着半導体層3とする。
【0045】
本発明では増感色素に特徴があり、その他の層又は材料は公知の構造又は材料とすることができ、図1に示す構造のものに限らない。
【0046】
色素吸着半導体層3を構成する材料は、半導体と色素であるが、通常、半導体は金属酸化物、好ましくは酸化チタン又は酸化スズであるので、半導体を金属酸化物又は酸化チタンで代表することがある。また、色素増感用の色素としては、上記式(1)で表わされるスクアリリウム色素を使用する。なお、必要により吸収波長領域を広げるためにこのスクアリリウム色素とは異なる範囲に最大吸収波長を有する他の色素を併用するなどしてもよい。
【0047】
色素はこれを溶解する溶媒に溶解してチタニア半導体層に吸着させる。吸着溶媒は色素が可能である溶媒であれば、使用することができる。具体的には、メタノール、エタノール、プロパノール、ノルマルブタノール等の脂肪族アルコール類、アセトニトリル、プロピオニトリル等のニトリル溶媒、アセトン、メチルエチルケトン等のケトン類、ジメチルカーボネート、ジエチルカーボネート等のカーボネート類、ラクトン類、カプロラクタム類を使用することができる。好ましくはメタノール、エタノール又はアセトニトリルである。
【0048】
色素溶液にデオキシコール酸、ケノデオキシコール酸(DCA)等の共吸着剤を溶解した色素溶液を用い、吸着してもよい。
【0049】
色素は超臨界流体、加圧流体に溶解して吸着させてもよい。具体的には、炭酸ガスや炭酸ガスにエントレーナーを加えた溶液により吸着させることが好ましい。
【0050】
色素の吸着した金属酸化物には、更にCO2超臨界流体中でカルボン酸を吸着させてもよい。カルボン酸を吸着させる効果は、非特許文献J. Photochem.and Photobio.A,Chem.164(2004)117により公知である。しかしながら、色素吸着やリンス処理と同様に、酸化チタン、酸化スズなどの金属酸化物の微細孔内部まで有効に吸着させることが重要である。色素の吸着した金属酸化物(色素の吸着した金属酸化物層を有する基板であってもよい)とカルボン酸を、圧力範囲5〜30Mpaであり、温度範囲が40〜60℃で形成されるCO2超臨界流体中又は加圧CO2中に置くことで、有効にカルボン酸を吸着できる。カルボン酸としては、好ましくは安息香酸、酢酸、アニス酸、ニコチン酸を挙げることができる。これらカルボン酸は、メタノール、エタノール、プロパノール、ブタノールのうちの少なくともいずれか1種類を含むアルコールに溶解した状態で使用することが好ましく、そのカルボン酸濃度が0.01〜10mol/Lの範囲であることが好ましい。さらに、色素の吸着は亜臨界状態の加圧下で吸着することが好ましく色素を溶媒に溶解させた溶液と炭酸ガスとの混合溶液中で吸着させたものであり、その炭酸ガスの圧力が1〜5MPa、温度が40℃〜60℃の範囲であることが好ましい。
【0051】
上記のように基板1、導電層2及び色素吸着半導体層3からなる電極10は負極として作用する。もう一方の正極として作用する電極(対向電極)11は図1に示すように、電極10と対向して配置する。正極となる電極は、導電性の金属などでよく、また、例えば通常のガラス板やプラスチック板などの基板4に金属膜や炭素膜等の導電層5を施したものでもよい。
【0052】
負極となる電極10と、正極となる対向電極11の間には、電解質層6を設ける。この電解質層6を構成する電解質の種類は、光励起され半導体への電子注入を果たした後の色素を還元するための酸化還元種を含んでいれば特に限定されず、液状の電解質であってもよく、これに公知のゲル化剤(高分子又は低分子のゲル化剤)やイオン液体と金属酸化物を混練した擬固体を添加して得られるゲル状の電解質であってもよい。
【0053】
例えば、溶液電解質に用いる電解質の例としては、ヨウ素とヨウ化物(LiI、NaI、KI、CsI、CaI2等の金属ヨウ化物、テトラアルキルアンモニウムヨーダイド、ピリジニウムヨーダイド、イミダゾリウムヨーダイド等の4級アンモニウム化合物ヨウ素塩等)の組み合わせ、臭素と臭化物(LiBr、NaBr、KBr、CsBr、CaBr2 等の金属臭化物、テトラアルキルアンモニウムブロマイド、ピリジニウムブロマイド等の4級アンモニウム化合物臭素塩等)の組み合わせ、ポリ硫化ナトリウム、アルキルチオール、アルキルジスルフィド等のイオウ化合物、ビオロゲン色素、ヒドロキノン、キノン等が挙げられる。電解質は混合して用いてもよい。
【0054】
また、電解質としては、高沸点を有する溶融塩電解質が好ましい。半導体電極が色素吸着酸化チタン層からなる場合は、溶融塩電解質と組み合わせることにより、特に優れた電池特性を発揮する。溶融塩電解質組成物は溶融塩を含む。溶融塩電解質組成物は常温で液体であるのが好ましい。主成分である溶融塩は室温において液状であるか又は低融点の電解質であり、その一般的な例としては「電気化学」、1997年、第65巻、第11号、p.923 等に記載のピリジニウム塩、イミダゾリウム塩、トリアゾリウム塩等が挙げられる。溶融塩は単独で使用しても2種以上混合して使用してもよい。また、LiI、NaI、KI、LiBF4、CF3COOLi、CF3COONa、LiSCN、NaSCN等のアルカリ金属塩を併用することもできる。通常、溶融塩電解質組成物はヨウ素を含有する。溶融塩電解質組成物の揮発性は低いことが好ましく、溶媒を含まないことが好ましい。溶融塩電解質組成物はゲル化して使用してもよい。
【0055】
電解液に溶媒を使用する場合は、粘度が低く高イオン移動度を示し、優れたイオン伝導性を発現できる化合物であることが望ましい。このような溶媒の例としては、エチレンカーボネート、プロピレンカーボネート等のカーボネート化合物、3-メチル-2-オキサゾリジノン等の複素環化合物、ジオキサン、ジエチルエーテル等のエーテル化合物、エチレングリコールジアルキルエーテル、プロピレングリコールジアルキルエーテル、ポリエチレングリコールジアルキルエーテル、ポリプロピレングリコールジアルキルエーテル等の鎖状エーテル類、メタノール、エタノール、エチレングリコールモノアルキルエーテル、プロピレングリコールモノアルキルエーテル、ポリエチレングリコールモノアルキルエーテル、ポリプロピレングリコールモノアルキルエーテル等のアルコール類、エチレングリコール、プロピレングリコール、ポリエチレングリコール、ポリプロピレングリコール、グリセリン等の多価アルコール類、アセトニトリル、グルタロジニトリル、メトキシアセトニトリル、プロピオニトリル、ベンゾニトリル等のニトリル化合物、ジメチルスルホキシド、スルフォラン等の非プロトン極性物質、水等が挙げられる。これらの溶媒は混合して用いることもできる。
【0056】
電解質層6を設ける方法は特に限定されるものではなく、例えば両電極の間にフィルム状のスペーサ7を配置して隙間を形成し、その隙間に電解質を注入する方法でも良く、また、負極内面に電解質を塗布などした後に正極を適当な間隔をおいて積載する方法でも良い。電解質が流出しないよう、両極とその周囲を封止することが望ましいが、封止の方法や封止材の材質については特に限定するものではない
【実施例】
【0057】
以下、実施例及び比較例に基づいて本発明について更に詳細に説明する。なお、合成例1は実施例であると理解される。
【0058】
合成例1
ピロロキノリン(化合物5)は2−メチル−6−ブロモキノリン(化合物1)をトルエン溶媒中で溶解させ、酢酸パラジウム1.0mol%、2,2’−ビス(ジフェニルホスフィノ)−1,1’−ビナフチル(BINAP)を1.0mmol%加え、その後にとベンゾフェノン−N−アリルヒドラゾン(化合物2)1.0mmol、ナトリウムブトキシドを1.4mmol加え80℃で終夜反応させた。さらにメチルイソプロピルケトン(化合物4)を2.0mmolとp−トルエンスルホン酸1水和物5mmolを加えエタノール溶媒中で還流させながら終夜反応させ、目的物である化合物5を30%の収率で得た。
【0059】
N−n−エチルピロロキノリン塩を合成するため、ピロロキノリン(化合物3)0. 1mmolと1−ヨウ化エタン0.11mmolを20mlのエタノールに溶かし、還流しながら7時間反応させた。固形分をろ過し、化合物6および化合物7の混合物としてN−アルキルピロロキノリンヨウ素塩混合物を55%の収率で得た。
【0060】
上記N−アルキルピロロキノリンヨウ素塩混合物を0.04molと3,4−ジエトキシ−3−シクロブテン−1,2−ジオン(化合物8)0.05molと2mlのトリエチルアミンを10mlのエタノールに溶解し、1時間還流した。溶媒を留去した後、粗製物をカラム精製し、スクアリリウム色素の中間体化合物である化合物9および化合物10をそれぞれ0.014mmolを得た。
【0061】
カラムクロマトグラフィーにより化合物10を分離精製し1.7mmolを使いエタノール20ml、40%NaOH水溶液2.0mlを加え、1時間還流させた。その後、エパポレーターで溶媒を蒸発させ、20%HCl水溶液1.5mlを加え化合物12を得た。
【0062】
N−n−オクチルカルボキシインドレニン塩を合成するため、カルボキシインドレニン(化合物14)0. 1mmolと1−ヨウ化オクタン0.11mmolを20mlのエタノールに溶かし、還流しながら7時間反応させた。固形分をろ過し、N−オクチルカルボキシインドレニンアイオダイド(化合物15)を55%の収率で得た。
【0063】
化合物12を0.2mmolと化合物15を0.2mmolを25mlのベンゼンと25mlのn−ブタノールの混合溶媒に溶解し反応させ目標とするスクアリリウム色素の前駆体化合物17を0.15mmol得た。
【0064】
次に、化合物17を加水分解するため、ナスフラスコに上記化合物17の混合物を(1. 7mmo1)とエタノール20ml、40%NaOH水溶液2.0mlを加え、1時間還流させた。その後、エパポレーターで溶媒を蒸発させ、20%HCl水溶液1.5mlを加えた。その残査をカラムクロマトで精製し、スクアリリウム色素D−1(化合物19)を250mg、32%の収率で得た。スクアリリウム色素D−1のMSスペクトルを図2に示す。
【0065】
合成例2
WO2010/104117を参考にして、下式(2)で表されるスクアリリウム色素D−2を合成した。
【化7】

【0066】
合成例3
2,3,3−トリメチル−5−カルボキシインドレニンと1−ヨウ化オクタンの代わりに2-メチルキノリンとヨウ化エタンを使用する以外は合成例1と同様の方法で、下式(4)で表されるスクアリリウム色素D−3を合成した。
【化8】

【0067】
合成例1〜3で得たスクアリリウム色素D−1、D−2及びD−3の最大吸収波長及び吸収端を表2に示す。
【0068】
【表2】

【0069】
実施例1
30mm×25mm×3mmの透明導電膜付ガラス基板として日本板ガラス製のFTO(フッ素ドープ酸化スズ)膜付ガラス基板(商品名:Low‐Eガラス)を使用した。
次に、導電性膜付き基板の導電性膜上に、酸化チタン膜を形成した。酸化チタンは、市販の酸化チタンペースト(ソラロニクス社製Dペースト)を使用した。これを、導電性膜付き基板の導電性膜上に、スキージ印刷の手法で5mm×5mmの範囲に塗工し、乾燥後450℃で焼成して厚み15μmの酸化チタン層を形成した積層板を得た。
【0070】
色素として色素D−1を使用した。これを3×10-4mol/L、DCAを3×10-3mol/Lとなるようにエタノールに溶解させた。色素の吸着は、容器に上記色素溶液を入れ、更に上記酸化チタン層を形成した積層板を配置し、2時間静置後、容器から色素の吸着した積層板を取り出した。
【0071】
この積層板の酸化チタンの膜を形成した5mm×5mmの外周4辺に厚み50μmのアイオノマー樹脂からなるシート状の熱可塑性接着剤(三井デュポンポリケミカル社商品名;ハイミランシート)を、電解液が注入できるよう、外周部の2箇所に約1mm程度の隙間を設けるようにして貼り付けた。この熱可塑性接着剤は、封止材であると同時に、両極間のスペーサの役割を果たす。次に、正極となる厚み10nmの白金膜をスパッタリングの手法で形成したガラス基板を、白金側が酸化チタン側と対向するように前記熱可塑性接着剤フィルムを介して貼り合わせた。この熱可塑性接着剤フィルムの隙間から、0.5MのLiI、0.5Mのt−ブチルピリジンと、0.05Mのヨウ素を主成分として含むアセトニトリル溶液を毛細管現象を利用して基材と正極の間に満たした。電解質を満たした後、直ちに前記隙間をエポキシ樹脂接着剤で封止して、光電変換素子を得た。
【0072】
比較例1
色素として色素D−2を用いた他は、実施例1と同様にして、光電変換素子を得た。
【0073】
比較例2
色素として色素D−3を用いた他は、実施例1と同様にして、光電変換素子を得た。
【0074】
実施例で作製した光電変換素子を色素増感太陽電池として、その電池特性は、ソーラーシミュレータを用いAM1.5、100mW/cm2の擬似太陽光を用い、I−Vカーブトレーサーを用いて特性評価した。変換効率(%)、短絡電流(Jsc: mA/cm2)、開放電圧(Voc: V), フィルファクター(ff:形状係数)の各特性を測定した結果を表3に示す。
【0075】
【表3】

【符号の説明】
【0076】
1:基板、2:導電層、3:色素吸着半導体層、4:基板、5:導電層、6:電解質層、7:スペーサ、10:電極、11:対向電極
【技術分野】
【0001】
本発明は、光電変換素子用のスクアリリウム色素、この色素を用いる光電変換素子及び色素増感太陽電池に関する。
【背景技術】
【0002】
光電変換素子は、光センサー、太陽電池等の光発電装置に使用されている。色素によって増感された半導体微粒子を用いる光電変換素子が特許文献1等で知られている。
【0003】
太陽電池としては、単結晶、多結晶あるいはアモルファスのシリコン半導体を用いた太陽電池が、電卓などの電気製品や住宅用などに広く用いられている。しかしながら、このようなシリコン半導体を用いた太陽電池の製造には、プラズマCVDや高温結晶成長プロセスなどの高精度プロセスが用いられるため、多大のエネルギーを必要とすると共に、真空を必要とする高価な装置が必要なために製造コストが高くなっている。
【0004】
そこで、低コストで製造可能な太陽電池として、例えば、酸化チタンのような酸化物半導体にルテニウム金属錯体のような光増感色素を吸着させた材料を用いた色素増感太陽電池が提案されている。色素増感太陽電池は具体的には、例えばインジウム添加酸化スズのような透明導電層を設けた透明ガラス板あるいは透明樹脂板のような透明絶縁材料の透明導電層側に、例えばルテニウム錯体からなる色素を表面に吸着した酸化チタンなどを半導体層として形成した負極と、正極となる白金などの金属層あるいは導電層を設けた透明ガラス板あるいは透明樹脂板のような透明絶縁材料との間に電解質の液を封入したものがある。色素増感太陽電池に光が照射されると、負極では光を吸収した色素の電子が励起し、励起した電子が半導体層に移動し、更に透明電極へと導かれ、正極では導電層からくる電子により電解質を還元する。還元された電解質は色素に電子を伝えることで酸化され、このサイクルで色素増感太陽電池が発電すると考えられている。
【0005】
現在、色素増感太陽電池はシリコン太陽電池に比して照射光エネルギーに対する発電エネルギー効率が低く、その効率を上げることが実効的な色素増感太陽電池を製造する上での重要な課題となっている。色素増感太陽電池の効率は、それを構成する各要素の特性や、更にそれら要素の組み合わせによっても影響を受けると考えられており、さまざまな試みがなされている。中でも、光増感作用を持つ色素について、より高効率な増感色素の開発に注力されている。現在知られている高効率色素としてRu色素があるが、遷移金属であるRuは高価なため、安価で高効率の色素の開発が望まれている。また、これらの色素は可視光領域の光電変換効率は高いが、近赤外領域の光電変換効率が低く、近赤外領域近傍に吸収帯を有する色素の開発が望まれている。
【0006】
この近赤外領域近傍に吸収帯を有する光電変換素子用の有機色素については、特許文献1乃至4等でいくつかの化合物が知られている。また、スクアリリウム色素についても、これらの文献で知られている。
【先行技術文献】
【特許文献】
【0007】
【特許文献1】特開1999−214730公報
【特許文献2】特開2000−268892公報
【特許文献3】特開2000−294306公報
【特許文献4】WO2011/108481公報
【0008】
特許文献1では光電変換素子及び色素増感太陽電池を開示し、それに使用されるポリメチン色素を例示している。特許文献1において使用されるポリメチン色素は、一般式で表わされており、膨大な数の化合物が含まれるが、少なくとも2つの環が含窒素縮合環である3つの環で形成される縮合環を有するスクアリリウム色素は示されていない。ここで、スクアリリウム色素というときは、カルボキシインドレニン構造とN置換基を有するスクアリリウム色素の意味と解される。
【0009】
同様に、特許文献2及び特許文献3においても十分な光電変換効率及び吸収波長範囲を示すスクアリリウム色素は開示されていない。
【0010】
特許文献4では、ベンゾインドレニン構造を有するスクアリリウム色素を開示している。この色素は、特許文献1乃至3で開示されるインドレニン構造よりも電子的な共役が発達しており色素の吸収波長範囲が長波長領域まで及ぶ。その結果、より広い波長範囲の光を光電変換することで優れた光電変換効率を示した。さらに色素の電子的な共役を発達させることで、さらなる光電変換効率の向上が期待されるが、そのような色素は、光電変換効率、半導体層への吸着性、溶解性を兼ね備えることが困難なため、これまで検討されてこなかった。
【発明の概要】
【発明が解決しようとする課題】
【0011】
従来のスクアリリウム色素は、近赤外領域における吸収波長範囲が狭く、十分な光を吸収し、光電変換することができない。
【0012】
本発明は、上記の課題に鑑みてなされたものであり、近赤外領域における吸収波長範囲が広く光電変換効率の向上可能な新規な色素を提供し、これを用いた光電変換素子及び色素増感太陽電池及び光電変換素子を提供することを目的とする。
【課題を解決するための手段】
【0013】
本発明は下記式(1)で表わされる光電変換素子用のスクアリリウム色素である。
【化1】

式中、R1及びR2はそれぞれ独立にC1〜C30のアルキル基又はC1〜C30のハロゲン置換アルキル基である。環A1、A2及びA3は各々独立して、5又は6員環構造を有する環であり、環A1及びA3は含窒素複素環である。環A1、A2及びA3は縮合環を形成している。
【0014】
また、本発明は、色素を用いる光電変換素子において、色素が上記スクアリリウム色素であることを特徴とする光電変換素子である。また、本発明は、上記光電変換素子を用いて構成したことを特徴とする色素増感太陽電池である。
【発明の効果】
【0015】
本発明のスクアリリウム色素は、従来のスクアリリウム色素よりも吸収波長が長波長領域に達する。そのため、本発明のスクアリリウム色素を使用した光電変換素子又はこれから構成した色素増感太陽電池は、特に近赤外光領域における光電変換効率が高い。
【図面の簡単な説明】
【0016】
【図1】色素増感太陽電池の一例を示す断面図である。
【図2】本発明のスクアリリウム色素D−1のMSスペクトルである。
【発明を実施するための形態】
【0017】
本発明の光電変換素子又は色素増感太陽電池は、上記式(1)で表されるスクアリリウム色素を増感色素として含む。なお、色素増感太陽電池は光電変換素子を利用するものであるため、両者の説明の多くが共通するので、共通する説明は色素増感太陽電池で代表して説明する。
【0018】
式(1)において、環A1、A2及びA3は各々独立して、隣接環と縮合する5又は6員環であるが、これらの環は置換基を有してもよい。環A1、A2及びA3は隣接環と共有する2つ又は4つ(A2の場合)の炭素原子とともに5又は6員環を形成している。環A1、A2及びA3を説明するに当たり、隣接環と縮合する前の状態(共有する炭素を含む)であって、置換基を有しない状態の環構造からなる化合物で説明する。
【0019】
環A1及びA3は、含窒素複素環であり、環構成原子中に少なくとも1つの窒素原子を有し、他のヘテロ原子を有することができる。好ましくは、環構成原子中に少なくとも1つの窒素原子を有する5又は6員環化合物である。具体的には、ピロール、ピリジン、イミダゾール、ピラゾール、オキサゾール、チアゾール、イミドゾリン、ピラジン、及びチアジンから選択される化合物があり、好ましくは、ピロール又はピリジンである。
環A2は、環構成原子中に窒素原子を有しないが、他のヘテロ原子を有することができる。好ましくは、炭素5又は6員環化合物である。具体的には、ベンゼン、フラン、チオフェン、ピラン、及びチアピランから選択される化合物があり、好ましくはベンゼンである。
【0020】
また、上記環A1は隣接する環A2と、環A2は隣接するA1及びA3と、環A3は隣接する環A2と縮合して、縮合環を形成している。好ましくは、A2がベンゼンであり、さらに好ましくは、A1及びA3の一方がピロールであり、他方がピリジンである。
【0021】
環A1、A2及びA3から形成される縮合環はR2以外にも置換基を有することが好ましく、具体的には色素の溶解性の点からC1〜C6のアルキル基が望ましく、酸化チタン若しくは酸化スズへの吸着し易さの点からカルボキシル基が好ましい。これらの置換基は、1つ以上有することがよく、これらは環A1、A2及びA3のいずれか1つ以上に置換することができる。
【0022】
上記環A1、A2及びA3が縮合して生じる縮合環としては、以下の表1のF-1〜F-10に例示されるような縮合環が挙げられるが、これらの例に限らないことは言うまでもない。表1において、R2は式(1)と同じ意味を有し、R2を有する環が環A1である。
【0023】
【表1】

【0024】
式(1)において、R1及びR2はそれぞれ独立にC1〜C30のアルキル基又はC1〜C30のハロゲン置換アルキル基であり、好ましくは色素の溶解性の観点からC1〜C30のアルキル基である。
【0025】
式(1)において、R1及びR2がアルキル基の場合、アルキル基が長すぎる場合は、溶解性の低下により半導体電極への色素吸着が困難になる。この観点から上記アルキル基の炭素数は1〜16の範囲がより好ましい。アルキル基が短すぎる場合は、色素のエネルギー準位制御が不十分となり、色素の電子授受能力を最適化できないため、また、色素同士の会合により、効率が十分でなくなる。そのため、アルキル基の炭素数は2〜16の範囲がより好ましく、より好ましくはR1のアルキル基の炭素数は4〜12であり、R2のアルキル基の炭素数は2〜12である。
【0026】
正確な理由は定かではないが、R1及びR2はスクアリリウム色素の会合を防いで、色素間のエネルギー移動に起因する電荷分離損失を低減すると考えられる。また、3つの環で形成される縮合環骨格は、従来のインドレニン骨格に比べ共役が長いため、色素の吸収波長を長波長化させ、カルボン酸上の電子密度が大きくなり、電子注入効率が向上すると考えられる。
【0027】
式(1)において、R1及びR2の少なくとも一方がハロゲン置換アルキル基である場合、ハロゲンがフッ素であることが、特にエネルギー準位制御の効果が高く好ましい。また、R1及びR2の少なくとも一方がフッ素置換アルキル基である場合、CF3(CF2)m(CH2)nで表される基が好ましい。この場合、mとnが独立に0〜14の整数であり、且つmとnの合計が2〜14である範囲が好ましい。mとnの合計が15以上のような長いフッ素置換アルキル基においては、色素吸着速度が低下する傾向がある。好ましいm及びnは、mは0〜5の整数、より好ましくは1〜3の整数であり、nは0〜9の整数、より好ましくは1〜7の整数である。好ましいmとnの合計は、3〜10の整数である。
【0028】
次に、本発明の式(1)で表されるスクアリリウム色素の合成法について、説明する。
式(1)で表されるスクアリリウム色素における環A1、A2及びA3が縮合した縮合環部位は、下記の方法で合成することができる。一例として、環A1がピリジンであり、環A2がベンゼンであり、環A3がピロールである化合物18と、環A1がピロールであり、環A2がベンゼンであり、環A3がピリジンである化合物19の合成例を示す。化学式に付された番号は化合物番号である。
【0029】
【化2】

【0030】
N−アルキルピロロキノリン塩(化合物6)及び(化合物7)は、化合物1及び化合物2を出発物質として得られる化合物5とハロゲン化アルキルとの反応により合成することができる。アルキル基の炭素数を変化させたハロゲン化アルキルを使用することにより、炭素数の異なるN−アルキルピロロキノリン塩を合成することができる。本合成例の場合、N−アルキルピロロキノリン塩は、化合物6及び化合物7の混合物として得られる。
【0031】
化合物6及び化合物7とスクアリン酸エステル(化合物8)を用い、J.Am.Che.Soc., 2007, 129, p10320−10321を参考にして化合物9及び化合物10の混合物を合成することができる。更に化合物9及び化合物10の混合物を加水分解して、化合物11及び化合物12の混合物を合成することができる。
【0032】
【化3】

【0033】
また、化合物11及び化合物12をそれぞれ単体で得る場合は、化合物9及び化合物10の混合物を、例えばカラムクロマトグラフィーを使用して分離し、化合物11及び化合物12をそれぞれ個別に得ることができる。
【0034】
N−アルキルカルボキシインドレニン塩(化合物13)は、化合物14とハロゲン化アルキルとの反応により合成することができる。アルキル基の炭素数を変化させたハロゲン化アルキルを使用することにより、炭素数の異なるN−アルキルカルボキシインドレニン塩を合成することができる。
【0035】
【化4】

【0036】
具体的には、カルボキシインドレニン(化合物14)とn−オクチルアイオダイドを反応させN−n−オクチルカルボキシインドレニンアイオダイド(化合物15)を合成する。
【0037】
なお、カルボキシインドレニン(化合物14)は、Bioconjugate Chem.2003,Vol.14,1048−1051を参考に合成することができる。
【化5】

【0038】
式(1)で表されるスクアリリウム色素は、それぞれ単離した化合物11及び化合物12を化合物15を反応させ化合物16及び化合物17をそれぞれ合成し、更にそれぞれをアルカリで加水分解することでスクアリリウム色素(化合物18及び化合物19)を合成することができる。なお、化合物11及び化合物12を単離することなく化合物18及び化合物19を合成することも可能であり、この場合は化合物18及び化合物19の混合物としてスクアリリウム色素が得られる。混合物としてのスクアリリウム色素も本発明のスクアリリウム色素であり、本発明の光電変換素子、太陽電池の色素として好適に使用できる。
【0039】
【化6】

【0040】
本発明の色素を用いた光電変換素子又は色素増感太陽電池の基本構成の一例を図1により説明する。図1は光電変換素子の一例を示す断面図であり、基板1上に、導電層2と半導体層に増感用の色素が吸着された色素吸着半導体層3が、積層された電極10と、基板4上に導電層5が設けられた対向電極11を有し、両電極間に電解質層6を配した構成となっている。色素吸着半導体層3は、電極の一部を構成するため半導体電極ともいう。色素吸着半導体層3はチタニアあるいは金属酸化物微粒子を用い1つの層として塗工・焼結されたもの、又は複数回の塗工・焼結により形成された層であり、色素が吸着された半導体層であり、酸化チタン粒子等の金属酸化物粒子とこの粒子の表面を覆うように存在する増感色素からなっている。なお、光は電極10側から入る。そして、本発明の色素増感太陽電池は、上記と同様な基本構成を有するが外部回路で仕事をさせるようにしたものである。そして、色素光電変換素子を色素増感太陽電池とする方法は上記特許文献1〜4等で公知であり、これら公知の方法でよい。
【0041】
基板1としては、透明な絶縁材料であれば特に限定されるものではなく、例えば通常のガラス板やプラスチック板などが挙げられ、更には屈曲性のあるものでも良く、例えばPET樹脂などが挙げられるが、好ましくは約500℃を上限にした酸化チタンを焼付ける工程に耐え得る耐熱材料であることであり、透明なガラス板が挙げられる。
【0042】
次に、この基板1の表面に基材の透明性を損なわないような導電層2を設けるが、導電層としてはいわゆる透明電極として知られているITO、FTO、ATOあるいはこれらを組み合わせたものでよく、更には透明性を損なわない厚みの金属層であってもよい。これらの導電層を設ける方法は特に限定されるものではなく、スパッタリング、蒸着(CVD及びPVDを含む)、スプレー、レーザアブレーションあるいはペースト化した各材料を用いるスピンコート、バーコート、スクリーン印刷の手法など既知の手法を用いることができる。中でも、スプレー法又は気相で行われるスパッタリング又は蒸着法が適する。
【0043】
この上に、色素吸着半導体層3を設ける。通常は半導体として金属酸化物の層を形成したのち、これに増感色素を吸着させる。金属酸化物としては、光電変換材料と知られているものが使用でき、酸化チタン、酸化亜鉛、酸化タングステン、酸化スズ等を挙げることができる、中でも酸化チタン及び酸化スズが好ましい。酸化チタンとしては、アナターゼ型、ルチル型、ブルッカイト型等の酸化チタンの他、水酸化チタン、含水酸化チタン類であってもよい。また、Nb、V又はTaの各元素の少なくとも1つを酸化チタンに対して30ppm〜5%の重量濃度(金属元素として)になるようドーピングしてもよい。このような金属酸化物であれば、本発明に用いることが可能であるが、平均粒子径が5〜500nm、好ましくは10〜200nmの範囲の微粒子であることがよい。
【0044】
金属酸化物の層を前記導電層2上に形成するが、その方法については、特に限定されるものではなく、例えばペースト化した金属酸化物をスピンコート、印刷、スプレーコートなどの各手法を用いても良い。また、製膜後に酸化チタン等の金属酸化物の焼結などを目的に焼成することも可能である。次に、金属酸化物に増感用の色素を吸着させて色素吸着金属酸化物として、色素吸着半導体層3とする。
【0045】
本発明では増感色素に特徴があり、その他の層又は材料は公知の構造又は材料とすることができ、図1に示す構造のものに限らない。
【0046】
色素吸着半導体層3を構成する材料は、半導体と色素であるが、通常、半導体は金属酸化物、好ましくは酸化チタン又は酸化スズであるので、半導体を金属酸化物又は酸化チタンで代表することがある。また、色素増感用の色素としては、上記式(1)で表わされるスクアリリウム色素を使用する。なお、必要により吸収波長領域を広げるためにこのスクアリリウム色素とは異なる範囲に最大吸収波長を有する他の色素を併用するなどしてもよい。
【0047】
色素はこれを溶解する溶媒に溶解してチタニア半導体層に吸着させる。吸着溶媒は色素が可能である溶媒であれば、使用することができる。具体的には、メタノール、エタノール、プロパノール、ノルマルブタノール等の脂肪族アルコール類、アセトニトリル、プロピオニトリル等のニトリル溶媒、アセトン、メチルエチルケトン等のケトン類、ジメチルカーボネート、ジエチルカーボネート等のカーボネート類、ラクトン類、カプロラクタム類を使用することができる。好ましくはメタノール、エタノール又はアセトニトリルである。
【0048】
色素溶液にデオキシコール酸、ケノデオキシコール酸(DCA)等の共吸着剤を溶解した色素溶液を用い、吸着してもよい。
【0049】
色素は超臨界流体、加圧流体に溶解して吸着させてもよい。具体的には、炭酸ガスや炭酸ガスにエントレーナーを加えた溶液により吸着させることが好ましい。
【0050】
色素の吸着した金属酸化物には、更にCO2超臨界流体中でカルボン酸を吸着させてもよい。カルボン酸を吸着させる効果は、非特許文献J. Photochem.and Photobio.A,Chem.164(2004)117により公知である。しかしながら、色素吸着やリンス処理と同様に、酸化チタン、酸化スズなどの金属酸化物の微細孔内部まで有効に吸着させることが重要である。色素の吸着した金属酸化物(色素の吸着した金属酸化物層を有する基板であってもよい)とカルボン酸を、圧力範囲5〜30Mpaであり、温度範囲が40〜60℃で形成されるCO2超臨界流体中又は加圧CO2中に置くことで、有効にカルボン酸を吸着できる。カルボン酸としては、好ましくは安息香酸、酢酸、アニス酸、ニコチン酸を挙げることができる。これらカルボン酸は、メタノール、エタノール、プロパノール、ブタノールのうちの少なくともいずれか1種類を含むアルコールに溶解した状態で使用することが好ましく、そのカルボン酸濃度が0.01〜10mol/Lの範囲であることが好ましい。さらに、色素の吸着は亜臨界状態の加圧下で吸着することが好ましく色素を溶媒に溶解させた溶液と炭酸ガスとの混合溶液中で吸着させたものであり、その炭酸ガスの圧力が1〜5MPa、温度が40℃〜60℃の範囲であることが好ましい。
【0051】
上記のように基板1、導電層2及び色素吸着半導体層3からなる電極10は負極として作用する。もう一方の正極として作用する電極(対向電極)11は図1に示すように、電極10と対向して配置する。正極となる電極は、導電性の金属などでよく、また、例えば通常のガラス板やプラスチック板などの基板4に金属膜や炭素膜等の導電層5を施したものでもよい。
【0052】
負極となる電極10と、正極となる対向電極11の間には、電解質層6を設ける。この電解質層6を構成する電解質の種類は、光励起され半導体への電子注入を果たした後の色素を還元するための酸化還元種を含んでいれば特に限定されず、液状の電解質であってもよく、これに公知のゲル化剤(高分子又は低分子のゲル化剤)やイオン液体と金属酸化物を混練した擬固体を添加して得られるゲル状の電解質であってもよい。
【0053】
例えば、溶液電解質に用いる電解質の例としては、ヨウ素とヨウ化物(LiI、NaI、KI、CsI、CaI2等の金属ヨウ化物、テトラアルキルアンモニウムヨーダイド、ピリジニウムヨーダイド、イミダゾリウムヨーダイド等の4級アンモニウム化合物ヨウ素塩等)の組み合わせ、臭素と臭化物(LiBr、NaBr、KBr、CsBr、CaBr2 等の金属臭化物、テトラアルキルアンモニウムブロマイド、ピリジニウムブロマイド等の4級アンモニウム化合物臭素塩等)の組み合わせ、ポリ硫化ナトリウム、アルキルチオール、アルキルジスルフィド等のイオウ化合物、ビオロゲン色素、ヒドロキノン、キノン等が挙げられる。電解質は混合して用いてもよい。
【0054】
また、電解質としては、高沸点を有する溶融塩電解質が好ましい。半導体電極が色素吸着酸化チタン層からなる場合は、溶融塩電解質と組み合わせることにより、特に優れた電池特性を発揮する。溶融塩電解質組成物は溶融塩を含む。溶融塩電解質組成物は常温で液体であるのが好ましい。主成分である溶融塩は室温において液状であるか又は低融点の電解質であり、その一般的な例としては「電気化学」、1997年、第65巻、第11号、p.923 等に記載のピリジニウム塩、イミダゾリウム塩、トリアゾリウム塩等が挙げられる。溶融塩は単独で使用しても2種以上混合して使用してもよい。また、LiI、NaI、KI、LiBF4、CF3COOLi、CF3COONa、LiSCN、NaSCN等のアルカリ金属塩を併用することもできる。通常、溶融塩電解質組成物はヨウ素を含有する。溶融塩電解質組成物の揮発性は低いことが好ましく、溶媒を含まないことが好ましい。溶融塩電解質組成物はゲル化して使用してもよい。
【0055】
電解液に溶媒を使用する場合は、粘度が低く高イオン移動度を示し、優れたイオン伝導性を発現できる化合物であることが望ましい。このような溶媒の例としては、エチレンカーボネート、プロピレンカーボネート等のカーボネート化合物、3-メチル-2-オキサゾリジノン等の複素環化合物、ジオキサン、ジエチルエーテル等のエーテル化合物、エチレングリコールジアルキルエーテル、プロピレングリコールジアルキルエーテル、ポリエチレングリコールジアルキルエーテル、ポリプロピレングリコールジアルキルエーテル等の鎖状エーテル類、メタノール、エタノール、エチレングリコールモノアルキルエーテル、プロピレングリコールモノアルキルエーテル、ポリエチレングリコールモノアルキルエーテル、ポリプロピレングリコールモノアルキルエーテル等のアルコール類、エチレングリコール、プロピレングリコール、ポリエチレングリコール、ポリプロピレングリコール、グリセリン等の多価アルコール類、アセトニトリル、グルタロジニトリル、メトキシアセトニトリル、プロピオニトリル、ベンゾニトリル等のニトリル化合物、ジメチルスルホキシド、スルフォラン等の非プロトン極性物質、水等が挙げられる。これらの溶媒は混合して用いることもできる。
【0056】
電解質層6を設ける方法は特に限定されるものではなく、例えば両電極の間にフィルム状のスペーサ7を配置して隙間を形成し、その隙間に電解質を注入する方法でも良く、また、負極内面に電解質を塗布などした後に正極を適当な間隔をおいて積載する方法でも良い。電解質が流出しないよう、両極とその周囲を封止することが望ましいが、封止の方法や封止材の材質については特に限定するものではない
【実施例】
【0057】
以下、実施例及び比較例に基づいて本発明について更に詳細に説明する。なお、合成例1は実施例であると理解される。
【0058】
合成例1
ピロロキノリン(化合物5)は2−メチル−6−ブロモキノリン(化合物1)をトルエン溶媒中で溶解させ、酢酸パラジウム1.0mol%、2,2’−ビス(ジフェニルホスフィノ)−1,1’−ビナフチル(BINAP)を1.0mmol%加え、その後にとベンゾフェノン−N−アリルヒドラゾン(化合物2)1.0mmol、ナトリウムブトキシドを1.4mmol加え80℃で終夜反応させた。さらにメチルイソプロピルケトン(化合物4)を2.0mmolとp−トルエンスルホン酸1水和物5mmolを加えエタノール溶媒中で還流させながら終夜反応させ、目的物である化合物5を30%の収率で得た。
【0059】
N−n−エチルピロロキノリン塩を合成するため、ピロロキノリン(化合物3)0. 1mmolと1−ヨウ化エタン0.11mmolを20mlのエタノールに溶かし、還流しながら7時間反応させた。固形分をろ過し、化合物6および化合物7の混合物としてN−アルキルピロロキノリンヨウ素塩混合物を55%の収率で得た。
【0060】
上記N−アルキルピロロキノリンヨウ素塩混合物を0.04molと3,4−ジエトキシ−3−シクロブテン−1,2−ジオン(化合物8)0.05molと2mlのトリエチルアミンを10mlのエタノールに溶解し、1時間還流した。溶媒を留去した後、粗製物をカラム精製し、スクアリリウム色素の中間体化合物である化合物9および化合物10をそれぞれ0.014mmolを得た。
【0061】
カラムクロマトグラフィーにより化合物10を分離精製し1.7mmolを使いエタノール20ml、40%NaOH水溶液2.0mlを加え、1時間還流させた。その後、エパポレーターで溶媒を蒸発させ、20%HCl水溶液1.5mlを加え化合物12を得た。
【0062】
N−n−オクチルカルボキシインドレニン塩を合成するため、カルボキシインドレニン(化合物14)0. 1mmolと1−ヨウ化オクタン0.11mmolを20mlのエタノールに溶かし、還流しながら7時間反応させた。固形分をろ過し、N−オクチルカルボキシインドレニンアイオダイド(化合物15)を55%の収率で得た。
【0063】
化合物12を0.2mmolと化合物15を0.2mmolを25mlのベンゼンと25mlのn−ブタノールの混合溶媒に溶解し反応させ目標とするスクアリリウム色素の前駆体化合物17を0.15mmol得た。
【0064】
次に、化合物17を加水分解するため、ナスフラスコに上記化合物17の混合物を(1. 7mmo1)とエタノール20ml、40%NaOH水溶液2.0mlを加え、1時間還流させた。その後、エパポレーターで溶媒を蒸発させ、20%HCl水溶液1.5mlを加えた。その残査をカラムクロマトで精製し、スクアリリウム色素D−1(化合物19)を250mg、32%の収率で得た。スクアリリウム色素D−1のMSスペクトルを図2に示す。
【0065】
合成例2
WO2010/104117を参考にして、下式(2)で表されるスクアリリウム色素D−2を合成した。
【化7】

【0066】
合成例3
2,3,3−トリメチル−5−カルボキシインドレニンと1−ヨウ化オクタンの代わりに2-メチルキノリンとヨウ化エタンを使用する以外は合成例1と同様の方法で、下式(4)で表されるスクアリリウム色素D−3を合成した。
【化8】

【0067】
合成例1〜3で得たスクアリリウム色素D−1、D−2及びD−3の最大吸収波長及び吸収端を表2に示す。
【0068】
【表2】

【0069】
実施例1
30mm×25mm×3mmの透明導電膜付ガラス基板として日本板ガラス製のFTO(フッ素ドープ酸化スズ)膜付ガラス基板(商品名:Low‐Eガラス)を使用した。
次に、導電性膜付き基板の導電性膜上に、酸化チタン膜を形成した。酸化チタンは、市販の酸化チタンペースト(ソラロニクス社製Dペースト)を使用した。これを、導電性膜付き基板の導電性膜上に、スキージ印刷の手法で5mm×5mmの範囲に塗工し、乾燥後450℃で焼成して厚み15μmの酸化チタン層を形成した積層板を得た。
【0070】
色素として色素D−1を使用した。これを3×10-4mol/L、DCAを3×10-3mol/Lとなるようにエタノールに溶解させた。色素の吸着は、容器に上記色素溶液を入れ、更に上記酸化チタン層を形成した積層板を配置し、2時間静置後、容器から色素の吸着した積層板を取り出した。
【0071】
この積層板の酸化チタンの膜を形成した5mm×5mmの外周4辺に厚み50μmのアイオノマー樹脂からなるシート状の熱可塑性接着剤(三井デュポンポリケミカル社商品名;ハイミランシート)を、電解液が注入できるよう、外周部の2箇所に約1mm程度の隙間を設けるようにして貼り付けた。この熱可塑性接着剤は、封止材であると同時に、両極間のスペーサの役割を果たす。次に、正極となる厚み10nmの白金膜をスパッタリングの手法で形成したガラス基板を、白金側が酸化チタン側と対向するように前記熱可塑性接着剤フィルムを介して貼り合わせた。この熱可塑性接着剤フィルムの隙間から、0.5MのLiI、0.5Mのt−ブチルピリジンと、0.05Mのヨウ素を主成分として含むアセトニトリル溶液を毛細管現象を利用して基材と正極の間に満たした。電解質を満たした後、直ちに前記隙間をエポキシ樹脂接着剤で封止して、光電変換素子を得た。
【0072】
比較例1
色素として色素D−2を用いた他は、実施例1と同様にして、光電変換素子を得た。
【0073】
比較例2
色素として色素D−3を用いた他は、実施例1と同様にして、光電変換素子を得た。
【0074】
実施例で作製した光電変換素子を色素増感太陽電池として、その電池特性は、ソーラーシミュレータを用いAM1.5、100mW/cm2の擬似太陽光を用い、I−Vカーブトレーサーを用いて特性評価した。変換効率(%)、短絡電流(Jsc: mA/cm2)、開放電圧(Voc: V), フィルファクター(ff:形状係数)の各特性を測定した結果を表3に示す。
【0075】
【表3】

【符号の説明】
【0076】
1:基板、2:導電層、3:色素吸着半導体層、4:基板、5:導電層、6:電解質層、7:スペーサ、10:電極、11:対向電極
【特許請求の範囲】
【請求項1】
下記式(1)で表わされる光電変換素子用のスクアリリウム色素。
【化1】

式中、R1及びR2はそれぞれ独立にC1〜C30のアルキル基又はC1〜C30のハロゲン置換アルキル基である。環A1、A2及びA3は各々独立して、5又は6員環構造を有する環であり、環A1及びA3の環構造は含窒素複素環であり、A1、A2及びA3は縮合して縮合環を形成している。
【請求項2】
色素を用いる光電変換素子において、色素として請求項1に記載のスクアリリウム色素を用いることを特徴とする光電変換素子。
【請求項3】
請求項2に記載の光電変換素子を用いて構成したことを特徴とする色素増感太陽電池。
【請求項1】
下記式(1)で表わされる光電変換素子用のスクアリリウム色素。
【化1】

式中、R1及びR2はそれぞれ独立にC1〜C30のアルキル基又はC1〜C30のハロゲン置換アルキル基である。環A1、A2及びA3は各々独立して、5又は6員環構造を有する環であり、環A1及びA3の環構造は含窒素複素環であり、A1、A2及びA3は縮合して縮合環を形成している。
【請求項2】
色素を用いる光電変換素子において、色素として請求項1に記載のスクアリリウム色素を用いることを特徴とする光電変換素子。
【請求項3】
請求項2に記載の光電変換素子を用いて構成したことを特徴とする色素増感太陽電池。
【図1】


【図2】




【図2】


【公開番号】特開2013−112702(P2013−112702A)
【公開日】平成25年6月10日(2013.6.10)
【国際特許分類】
【出願番号】特願2011−257863(P2011−257863)
【出願日】平成23年11月25日(2011.11.25)
【国等の委託研究の成果に係る記載事項】(出願人による申告)国等の委託研究の成果に係る特許出願(平成22年度独立行政法人新エネルギー・産業技術総合開発機構「新エネルギー技術開発/太陽光発電システム次世代高性能技術の開発/三層協調界面構築による高効率・低コスト・量産型色素増感太陽電池の研究開発」委託研究、産業技術力強化法第19条の適用を受ける特許出願)
【出願人】(000006644)新日鉄住金化学株式会社 (747)
【出願人】(504174135)国立大学法人九州工業大学 (489)
【Fターム(参考)】
【公開日】平成25年6月10日(2013.6.10)
【国際特許分類】
【出願日】平成23年11月25日(2011.11.25)
【国等の委託研究の成果に係る記載事項】(出願人による申告)国等の委託研究の成果に係る特許出願(平成22年度独立行政法人新エネルギー・産業技術総合開発機構「新エネルギー技術開発/太陽光発電システム次世代高性能技術の開発/三層協調界面構築による高効率・低コスト・量産型色素増感太陽電池の研究開発」委託研究、産業技術力強化法第19条の適用を受ける特許出願)
【出願人】(000006644)新日鉄住金化学株式会社 (747)
【出願人】(504174135)国立大学法人九州工業大学 (489)
【Fターム(参考)】
[ Back to top ]

