光電流を用いた被検物質の特異的検出方法、それに用いられる電極、測定用セル、および測定装置
【課題】 特異的結合性を有する被検物質を高感度で簡便かつ正確に検出および定量する方法の提供。
【解決手段】 増感色素の共存下、被検物質を含む試料液を、この被検物質と直接または間接的に特異的に結合可能なプローブ物質を表面に備えた作用電極に接触させて、プローブ物質に被検物質を直接または間接的に特異的に結合させ、この結合により増感色素を作用電極に固定させる。そして、作用電極と対電極とを電解質媒体に接触させ、そして、作用電極に光を照射して増感色素を光励起させ、この光励起された増感色素から作用電極への電子移動に起因して作用電極と対電極との間に流れる光電流を検出する。
【解決手段】 増感色素の共存下、被検物質を含む試料液を、この被検物質と直接または間接的に特異的に結合可能なプローブ物質を表面に備えた作用電極に接触させて、プローブ物質に被検物質を直接または間接的に特異的に結合させ、この結合により増感色素を作用電極に固定させる。そして、作用電極と対電極とを電解質媒体に接触させ、そして、作用電極に光を照射して増感色素を光励起させ、この光励起された増感色素から作用電極への電子移動に起因して作用電極と対電極との間に流れる光電流を検出する。
【発明の詳細な説明】
【発明の背景】
【0001】
発明の分野
本発明は、光電流を用いて、核酸、外因性内分泌攪乱物質、抗原等の特異的結合性を有する被検物質を特異的に検出する方法、それに用いられる電極、測定用セル、および測定装置に関する。
【0002】
背景技術
生体試料中のDNAを解析する遺伝子診断法が、各種病気の新たな予防および診断法として、有望視されている。このようなDNA解析を簡便かつ正確に行う技術として、以下のものが提案されている。
【0003】
被検体DNAを、これと相補的な塩基配列を有し、かつ蛍光物質を標識されたDNAプローブとハイブリダイズさせ、その際の蛍光シグナルを検出する、DNAの分析方法が知られている(例えば、特許文献1(特開平7−107999号公報)および特許文献2(特開平11−315095号公報)参照)。この方法にあっては、ハイブリダイゼーションによる二本鎖DNAの形成を色素の蛍光により検出する。
【0004】
また、一本鎖に変性された遺伝子サンプルを、これに相補性を有する一本鎖の核酸プローブとハイブリダイゼーションさせた後、インターカレータ等の二本鎖認識体を添加して電気化学的に検出する方法が知られている(例えば、特許文献3(特許公報第2573443号)および非特許文献1(表面科学Vol. 24, No. 11. Pp. 671-676, 2003)参照)。
【0005】
一方、近年、ダイオキシンを始めとする外因性内分泌撹乱物質(環境ホルモン)の生殖系および神経系等への障害が社会問題化している。現在、外因性内分泌撹乱毒性の検出は様々な方法によって行われているが、そのような物質はわずか10pptレベル程度の極めて低い濃度で毒性を示す。このため、そのような低濃度範囲における外因性内分泌撹乱物質の検出方法が望まれている。
【0006】
特に、外因性内分泌撹乱物質は、受容体等のタンパク質を介して標的DNAに結合し、それにより当該DNAの発現等に影響を与え、毒性を生じる。すなわち、外因性内分泌撹乱物質は、DNAに直接的に結合するのではなく、受容体等のタンパク質を介して間接的DNAに結合する。そのため、DNA結合性を用いたプレスクリーニング等の従来の方法にあっては、その結合の評価は容易ではない。
【0007】
ところで、増感色素を用いて光から電気エネルギーを発生させる太陽電池が知られている(例えば、特許文献4(特開平1−220380号公報)参照)。この太陽電池は、多結晶の金属酸化物半導体を有し、かつその表面積に広範囲にわたり増感色素の層が形成されてなるものである。しかしながら、このような電極を生物化学的な分析に応用しようとする試みは未だなされていない。
【特許文献1】特開平7−107999号公報
【特許文献2】特開平11−315095号公報
【特許文献3】特許公報第2573443号
【特許文献4】特開平1−220380号公報
【非特許文献1】表面科学Vol. 24, No. 11. Pp. 671-676, 2003
【発明の概要】
【0008】
本発明者らは、今般、被検物質とプローブ物質との直接または間接的な特異的結合を介して作用電極に増感色素を固定させ、この増感色素を光励起させて発生する光電流を検出することにより、被検物質を高感度で簡便かつ正確に検出および定量出来るとの知見を得た。また、一枚の作用電極上で、複数の試料を個別に測定したり、あるいは複数種類の被検物質の分析を同時に行えるとの知見も得た。
【0009】
したがって、本発明は、特異的結合性を有する被検物質を高感度で簡便かつ正確に検出および定量することを目的としている。
【0010】
そして、本発明の光電流を用いた被検物質の特異的検出方法は、
被検物質を含む試料液と、該被検物質と直接または間接的に特異的に結合可能なプローブ物質を表面に備えた作用電極と、対電極とを用意し、
増感色素の共存下、前記試料液を前記作用電極に接触させて、前記プローブ物質に前記被検物質を直接または間接的に特異的に結合させ、該結合により前記増感色素を前記作用電極に固定させ、
前記作用電極と前記対電極とを電解質媒体に接触させ、そして、
前記作用電極に光を照射して前記増感色素を光励起させ、該光励起された増感色素から前記作用電極への電子移動に起因して前記作用電極と前記対電極との間に流れる光電流を検出すること
を含んでなるものである。
【0011】
また、本発明の電極は、上記方法において作用電極として用いられる電極であって、
導電性基材と、
該導電性基材上に形成される、前記増感色素が光励起に応じて放出する電子を受容可能な電子受容物質を含んでなる電子受容層と、
を備えたものである。
【0012】
さらに、本発明の測定用セルは、上記方法に用いられる測定用セルであって、
上記作用電極と、
対電極と、
前記作用電極および前記対電極が接触される電解質媒体と
を備えたものである。
【0013】
また、本発明の測定装置は、上記方法に用いられる測定装置であって、
上記測定用セルと、
前記作用電極の表面に光を照射する光源と、
前記作用電極と前記対電極との間を流れる電流を測定する電流計と
を備えたものである。
【発明の具体的説明】
【0014】
光電流を用いた被検物質の特異的検出
本発明の方法にあっては、まず、被検物質を含む試料液と、作用電極と、対電極とを用意する。本発明に用いる作用電極は、被検物質と直接または間接的に特異的に結合可能なプローブ物質を表面に備えた電極である。すなわち、プローブ物質は、被検物質と直接、特異的に結合する物質のみならず、被検物質を受容体蛋白質分子等の媒介物質に特異的に結合させて得られる結合体と特異的に結合可能な物質であってよい。次いで、増感色素の共存下、試料液を作用電極に接触させて、プローブ物質に被検物質を直接または間接的に特異的に結合させ、この結合により増感色素を作用電極に固定させる。増感色素は、光励起に応じて作用電極に電子を放出可能な物質であり、被検物質あるいは媒介物質に予め標識させておくか、あるいは被検物質およびプローブ物質の結合体にインターカレーション可能な増感色素を用いる場合には試料液に単に添加すればよい。
【0015】
そして、作用電極と対電極とを電解質媒体に接触させた後、作用電極に光を照射して増感色素を光励起させると、光励起された増感色素から電子受容物質へ電子移動が起こる。この電子移動に起因して作用電極と対電極との間に流れる光電流を検出することにより、被検物質を高い感度で検出することができる。また、この検出電流は試料液中の被検試料濃度との高い相関関係を有しているので、測定された電流量または電気量に基づき被検試料の定量測定を行うことができる。
【0016】
被検物質およびプローブ物質
本発明の方法における被検物質としては、特異的な結合性を有する物質であれば限定されず、種々の物質であってよい。このような被検物質であれば、被検物質と直接または間接的に特異的に結合可能なプローブ物質を作用電極表面に担持させておくことにより、被検物質をプローブ物質に直接または間接的に特異的に結合させて検出することが可能となる。
【0017】
すなわち、本発明の方法にあっては、被検物質およびプローブ物質として互いに特異的に結合可能なものを選択することができる。すなわち、本発明の好ましい態様によれば、特異的な結合性を有する物質を被検物質とし、被検物質と特異的に結合する物質をプローブ物質として作用電極に担持させるのが好ましい。これにより、作用電極上に被検物質を直接、特異的に結合させて検出することができる。この態様における、被検物質およびプローブ物質の組合せの好ましい例としては、一本鎖の核酸および核酸に対して相補性を有する一本鎖の核酸の組合せ、ならびに抗原および抗体の組合せが挙げられる。
【0018】
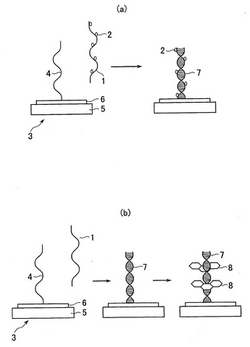
本発明のより好ましい態様によれば、被検物質を一本鎖の核酸とし、プローブ物質を核酸に対して相補性を有する一本鎖の核酸とするのが好ましい。この態様における被検物質の作用電極への特異的結合の工程を図1(a)および(b)に示す。これらの図に示されるように、被検物質としての一本鎖の核酸1は、作用電極3上に担持されたプローブ物質としての相補性を有する一本鎖の核酸4とハイブリダイズされて、二本鎖の核酸7を形成する。
【0019】
一本鎖の核酸を被検物質とする場合、プローブ物質である核酸と相補性部分を有していればよく、被検物質を構成する塩基対の長さは限定されないが、プローブ物質が核酸に対して15bp以上の相補性部分を有するのが好ましい。本発明の方法によれば、200bp、500bp、1000bpの塩基対を有する比較的鎖長の長い核酸であっても、高感度にプローブ物質と被検物質の核酸同士の特異的結合形成を光電流として検出することができる。
【0020】
被検物質としての一本鎖の核酸を含む試料液は、末梢静脈血のような血液、白血球、血清、尿、糞便、精液、唾液、培養細胞、各種臓器細胞のような組織細胞等の、核酸を含有する各種検体試料から、公知の方法により核酸を抽出して作製することができる。このとき、検体試料中の細胞の破壊は、例えば、振とう、超音波等の物理的作用を外部から加えて担体を振動させることにより行なうことができる。また、核酸抽出溶液を用いて、細胞から核酸を遊離させることもできる。核酸溶出溶液の例としては、SDS、Triton-X、Tween-20のような界面活性剤、サポニン、EDTA、プロテア−ゼ等を含む溶液が挙げられる。これらの溶液を用いて核酸を溶出する場合、37℃以上の温度でインキュベ−トすることにより反応を促進することができる。
【0021】
本発明のより好ましい態様によれば、被検物質とする遺伝子の含有量が微量である場合には、公知の方法により遺伝子を増幅した後検出を行なうのが好ましい。遺伝子を増幅する方法としては、ポリメラ−ゼチェインリアクション(PCR)等の酵素を用いる方法が代表的であろう。ここで、遺伝子増幅法に用いられる酵素の例としては、DNAポリメラ−ゼ、Taqポリメラ−ゼのようなDNA依存型DNAポリメラ−ゼ、RNAポリメラ−ゼIのようなDNA依存型RNAポリメラ−ゼ、Qβレプリカ−ゼのようなRNA依存型RNAポリメラ−ゼが挙げられ、好ましくは温度を調節するだけで連続して増幅を繰り返すことができる点で、Taqポリメラ−ゼを用いるPCR法である。
【0022】
本発明の好ましい態様によれば、上記増幅時に特異的に核酸を増感色素で標識することが出来る。一般的には、DNAにアミノアリル修飾dUTPを取り込ませることにより行うことができる。この分子は未修飾の dUTP と同じ効率で取り込まれる。次のカップリング段階において、N−ヒドロキシサクシンアミド(N-hydroxysuccinimide)により活性化された蛍光色素が修飾 dUTP と特異的に反応し、均一に増感色素で標識された被検物質が得られる。
【0023】
本発明の好ましい態様によれば、上記のようにして得られた核酸の粗抽出液あるいは精製した核酸溶液をまず90〜98℃、好ましくは95℃以上の温度で熱変性を施し、一本鎖核酸を調製することができる。
【0024】
本発明の方法にあっては、被検物質とプローブ物質が間接的に特異的に結合するものであってもよい。すなわち、本発明の別の好ましい態様によれば、特異的な結合性を有する物質を被検物質とし、この被検物質と特異的に結合する物質を媒介物質として共存させ、この媒介物質と特異的に結合可能な物質をプローブ物質として作用電極に担持させるのが好ましい。これにより、プローブ物質に特異的に結合できない物質であっても、媒介物質を介して作用電極上に間接的に特異的に結合させて検出することができる。この態様における、被検物質、媒介物質、およびプローブ物質の組合せの好ましい例としては、リガンド、このリガンドを受容可能な受容体蛋白質分子、およびこの受容体蛋白質分子と特異的に結合可能な二本鎖の核酸の組合せが挙げられる。リガンドの好ましい例としては、外因性内分泌攪乱物質(環境ホルモン)が挙げられる。外因性内分泌撹乱物質とは、受容体蛋白質分子を介してDNAに結合し、その遺伝子発現に影響して毒性を生じる物質であるが、本発明の方法によれば、被検物質によりもたらされる受容体等のタンパク質のDNAに対する結合性を簡便にモニタリングすることができる。この態様における被検物質の作用電極への特異的結合の工程を図2に示す。図2に示されるように、被検物質としてのリガンド10は、まず、媒介物質である受容体蛋白質分子11に特異的に結合する。そして、リガンドが結合された受容体蛋白質分子13が、プローブ物質としての二本鎖の核酸14に特異的に結合する。
【0025】
本発明の方法によれば、1つのプローブ物質に対し、異なる入手経路に由来する複数の同一被検物質を同時に反応させ、サンプルの由来による被検物質量の差異を判断することにより、目的とする入手経路に由来する被検物質を定量することも可能である。具体的な適用例としては、マイクロアレイ上での競合的ハイブリダイゼーションによる発現プロフィール解析が挙げられる。これは、細胞間での特定遺伝子の発現パターンの差異を解析するため、別々の蛍光色素で標識された被検物質を、同一プローブ物質に対して競合的にハイブリダイゼーションを行わせるものである。本発明においては、このような手法を用いることにより、細胞間での発現差異解析が電気化学的に行えるという、従来に無い利点が得られる。
【0026】
増感色素
本発明の方法にあっては、被検物質の存在を光電流で検出するために、増感色素の共存下、プローブ物質に被検物質を直接または間接的に特異的に結合させて、該結合により増感色素を作用電極に固定させる。そのために、本発明の方法にあっては、図1(a)および図2に示されるように被検物質1あるいは媒介物質11に予め増感色素2,12で標識しておくことができる。また、図1(b)に示されるように被検物質およびプローブ物質の結合体7(例えばハイブリダイゼーション後の二本鎖核酸)にインターカレーション可能な増感色素8を用いる場合には、試料液に増感色素を添加することにより、プローブ物質に増感色素を固定させることができる。
【0027】
本発明の好ましい態様によれば、被検物質が一本鎖の核酸の場合、被検物質1分子につき増感色素を一つ標識するのが好ましい。一本鎖の核酸における標識位置は、容易に被検物質とプローブ物質の特異的な結合を形成させる観点から、一本鎖の核酸の5’末端または3’末端のいずれかの位置とするのが好ましく、標識工程をさらに簡便にする観点から被検物質の5’末端とするのがさらに好ましい。
【0028】
また、本発明の別の好ましい態様によれば、被検物質1分子あたりの増感色素担持量を高める為、被検物質1分子につき2つ以上の増感色素を2つ以上標識するのが好ましい。これにより、電子受容物質の形成された作用電極における単位比表面積あたりの色素担持量をより多くすることができ、より高感度に光電流応答を観測することができる。
【0029】
本発明に用いる増感色素は、光励起に応じて作用電極に電子を放出可能な物質であり、光源の照射による光励起状態への遷移が可能であり、かつ励起状態から作用電極に電子注入できる電子状態を採りうるものであればよい。したがって、用いる増感色素は、作用電極、特に電子受容層との間において上記電子状態をとることができるものであればよいことから、多種の増感色素が使用可能であり、高価な色素を使用する必要がない。
【0030】
複数の被検物質の個別検出を行う態様にあっては、各々の被検物質に標識する増感色素は、それぞれ異なる波長の光で励起できるものであればよく、例えば、照射光の波長を選択することにより各被検物質を個別に励起できればよい。例えば、複数の被検物質に対応する複数の増感色素を用い、各増感色素毎に異なる励起波長の光を照射すると、複数のプローブが同一スポット上であっても個別に信号を検出することが可能となる。本発明の方法において、被検物質の数は限定されないが、光源から照射される光の波長と増感色素の吸収特性を考慮すると、1〜5種類が適当であろう。この態様において使用可能な増感色素は、照射光の波長領域内において光励起しさえすればよく、必ずしもその吸収極大が該波長領域にある必要はない。なお、特定波長における増感色素の光吸収反応の有無は、紫外可視スペクトロフォトメーター(例えば、島津製作所社製、UV−3150)を用いて測定することができる。
【0031】
増感色素の具体例としては、金属錯体や有機色素が挙げられる。金属錯体の好ましい例としては、銅フタロシアニン、チタニルフタロシアニン等の金属フタロシアニン;クロロフィルまたはその誘導体;ヘミン、特開平1−220380 号公報や特表平5−504023 号公報に記載のルテニウム、オスミウム、鉄及び亜鉛の錯体(例えばシス−ジシアネート−ビス(2、2 ’−ビピリジル−4、4 ’−ジカルボキシレート)ルテニウム(II))があげられる。有機色素の好ましい例としては、メタルフリーフタロシアニン、9−フェニルキサンテン系色素、シアニン系色素、メタロシアニン系色素、キサンテン系色素、トリフェニルメタン系色素、アクリジン系色素、オキサジン系色素、クマリン系色素、メロシアニン系色素、ロダシアニン系色素、ポリメチン系色素、インジゴ系色素等が挙げられる。また、増感色素の別の好ましい例としては、アマシャムバイオサイエンス社製のCy3、Cy3.5、Cy5、Cy5.5、Cy7、Cy7.5、Cy9;モルキュラープローブ社製のAlexaFluor355、AlexaFluor405、AlexaFluor430、AlexaFluor488、AlexaFluor532、AlexaFluor546、AlexaFluor555、AlexaFluor568、AlexaFluor594、AlexaFluor633、AlexaFluor647、AlexaFluor660、AlexaFluor680、AlexaFluor700、AlexaFluor750;Dyomics社製のDY−610、DY−615、DY−630、DY−631、DY−633、DY−635、DY−636、EVOblue10、EVOblue30、DY−647、DY−650、DY−651、DYQ−660、DYQ−661が挙げられる。
【0032】
二本鎖核酸にインターカレーション可能な増感色素の好ましい例としては、アクリジンオレンジ、エチジウムブロマイドが挙げられる。このような増感色素を用いる場合、核酸のハイブリダイゼーション後に試料液に添加するだけで増感色素で標識された二本鎖核酸が形成されるので、予め一本鎖の核酸を標識する必要が無い。
【0033】
作用電極およびその製造
本発明に用いる作用電極は、上記プローブ物質を表面に備えた電極であり、プローブ物質を介して固定された増感色素が光励起に応じて放出する電子を受容可能な電極である。したがって、作用電極の構成および材料は、使用される増感色素との間で上記電子移動が生じるものであれば限定されず、種々の構成および材料であってよい。
【0034】
本発明の好ましい態様によれば、作用電極が増感色素が光励起に応じて放出する電子を受容可能な電子受容物質を含んでなる電子受容層を有し、この電子受容層の表面にプローブ物質が備えられてなるのが好ましい。また、本発明のより好ましい態様によれば、作用電極が導電性基材をさらに含んでなり、この導電性基材上に電子受容層が形成されてなるのが好ましい。この態様の電極は図1および2に示される。図1および2に示される作用電極4は、導電性基材5と、この導電性基材上に形成され、電子受容物質を含んで成る電子受容層6とを備えてなる。そして、電子受容層6の表面にプローブ物質が担持される。
【0035】
本発明における電子受容層は、プローブ物質を介して固定された増感色素が光励起に応じて放出する電子を受容可能な電子受容物質を含んでなる。すなわち、電子受容物質は、光励起された標識色素からの電子注入が可能なエネルギー準位を取り得る物質であることができる。ここで、光励起された標識色素からの電子注入が可能なエネルギー準位(A)とは、例えば、電子受容性材料として半導体を用いる場合には、伝導体(コンダクションバンド:CB)を意味し、電子受容性材料として金属を用いる場合には、フェルミ準位を意味し、電子受容性材料として有機物もしくはC60等の分子状無機物を用いる場合には、最低非占有分子軌道(Lowest Unoccupied Molecular Orbital:LUMO)を意味する。すなわち、本発明に用いる電子受容物質は、このAの準位が、増感色素のLUMOのエネルギー準位よりも卑な準位、換言すれば、増感色素のLUMOのエネルギー準位よりも低いエネルギー準位を有するものであればよい。
【0036】
電子受容物質の好ましい例としては、シリコン、ゲルマニウムなどの単体半導体;チタン、スズ、亜鉛、鉄、タングステン、ジルコニウム、ハフニウム、ストロンチウム、インジウム、セリウム、イットリウム、ランタン、バナジウム、ニオブ、タンタル等の酸化物半導体;チタン酸ストロンチウム、チタン酸カルシウム、チタン酸ナトリウム、チタン酸バリウム、ニオブ酸カリウム等のペロブスカイト型半導体;カドミウム、亜鉛、鉛、銀、アンチモン、ビスマスの硫化物半導体;カドミウム、鉛のセレン化物半導体;カドミウムのテルル化物半導体;亜鉛、ガリウム、インジウム、カドミウム等のリン化物半導体;ガリウムヒ素、銅−インジウム−セレン化物、銅−インジウム−硫化物の化合物半導体;金、白金、銀、銅、アルミニウム、ロジウム、インジウム、ニッケル等の金属;ポリチオフェン、ポリアニリン、ポリアセチレン、ポリピロール等の有機物ポリマー;C60、C70等の分子状無機物が挙げられ、より好ましくは、シリコン、TiO2、SnO2、Fe2O3、WO3、ZnO、Nb2O5、Ta2O3、In2O3、チタン酸ストロンチウム、CdS、ZnS、PbS、Bi2S3、CdSe、CdTe、GaP、InP、GaAs、CuInS2、CuInSe、C60であり、さらに好ましくは、TiO2、ZnO、SnO2、Fe2O3、WO3、Nb2O5、Ta2O3、In2O3、チタン酸ストロンチウム、CdS、PbS、CdSe、InP、GaAs、CuInS2、CuInSe2であり、最も好ましくはTiO2である。なお、上記の列挙した半導体は、真性半導体および不純物半導体のいずれであってもよい。
【0037】
また、本発明の別の好ましい態様によれば、電子受容物質として、インジウム-スズ複合酸化物(ITO)またはフッ素がドープされた酸化スズ(FTO)を用いることができる。ITOおよびFTOは電子受容層のみならず導電性基材としても機能する性質を有するため、これらの材料を使用することにより導電性基材を用いることなく電子受容層のみで作用電極として機能させることができる。
【0038】
電子受容物質として半導体または金属を用いる場合、その半導体または金属は単結晶および多結晶のいずれであってもよいが、多結晶体が好ましく、さらに緻密なものよりも多孔性を有するものが好ましい。これにより、比表面積が大きくなり、被検物質および増感色素を多く吸着させて、より高い感度で被検物質を検出することができる。したがって、本発明の好ましい態様によれば、電子受容層が多孔性を有しており、各孔の径が3〜1000nmであるのが好ましく、より好ましくは、10〜100nmである。
【0039】
本発明の好ましい態様によれば、電子受容層を導電性基材上に形成した状態での表面積は、投影面積に対して10倍以上であることが好ましく、さらに100倍以上であることが好ましい。この表面積の上限には特に限定されないが、通常1000倍程度であろう。電子受容層を構成する電子受容物質の微粒子の粒径は、投影面積を円に換算したときの直径を用いた平均粒径で一次粒子として5〜200nmであることが好ましく、より好ましくは8〜100nmであり、さらに好ましくは20〜60nmである。また、分散物中の電子受容性物質の微粒子(二次粒子)の平均粒径としては0.01〜100μmであることが好ましい。また、入射光を散乱させて光捕獲率を向上させる目的で、粒子サイズの大きな、例えば300nm程度の電子受容物質の微粒子を併用して、電子受容層を形成してもよい。
【0040】
本発明の好ましい態様によれば、作用電極が導電性基材をさらに含んでなり、電子受容層が導電性基材上に形成されてなるのが好ましい。本発明に使用可能な導電性基材としては、チタン等の金属のように支持体そのものに導電性があるもののみならず、ガラスもしくはプラスチックの支持体の表面に導電材層を有するものであってよい。この導電材層を有する導電性基材を使用する場合、電子受容層はその導電材層上に形成される。導電材層を構成する導電材の例としては、白金、金、銀、銅、アルミニウム、ロジウム、インジウム等の金属;炭素、炭化物、窒化物等の導電性セラミックス;およびインジウム−スズ複合酸化物、酸化スズにフッ素をドープしたもの、酸化スズにアンチモンをドープしたもの、酸化亜鉛にガリウムをドープしたもの、または酸化亜鉛にアルミニウムをドープしたもの等の導電性の金属酸化物が挙げられ、より好ましくは、インジウム-スズ複合酸化物(ITO)、酸化スズにフッ素をドープした金属酸化物(FTO)である。ただし、前述した通り、電子受容層自体が導電性基材としても機能する場合にあっては導電性基材は省略可能である。また、本発明において、導電性基材は、導電性を確保できる材料であれば限定されず、それ自体では支持体としての強度を有しない薄膜状またはスポット状の導電材層も包含するものとする。
【0041】
本発明の好ましい態様によれば、導電性基材が実質的に透明、具体的には、光の透過率が10%以上であるのが好ましく、より好ましくは50%以上であり、さらに好ましくは70%以上である。これにより、作用電極の裏側(すなわち導電性基材)から光を照射させて、作用電極(すなわち導電性基材および電子受容層)を透過した光が増感色素を励起するようにセルを構成することができる。また、本発明の好ましい態様によれば、導電材層の厚みは、0.02〜10μm程度であるのが好ましい。さらに、本発明の好ましい態様によれば、導電性基材の表面抵抗が100Ω/cm2以下であり、さらに好ましくは40Ω/cm2以下であるのが好ましい。導電性基材の表面抵抗の下限は特に限定されないが、通常0.1Ω/cm2程度であろう。
【0042】
導電性基材上への電子受容層の好ましい形成方法の例としては、電子受容物質の分散液またはコロイド溶液を導電性支持体上に塗布する方法、半導体微粒子の前駆体を導電性支持体上に塗布し空気中の水分によって加水分解して微粒子膜を得る方法(ゾル−ゲル法)、スパッタリング法、CVD法、PVD法、蒸着法などが挙げられる。電子受容物質としての半導体微粒子の分散液を作成する方法としては、前述のゾル−ゲル法の他、乳鉢ですり潰す方法、ミルを使って粉砕しながら分散する方法、あるいは半導体を合成する際に溶媒中で微粒子として析出させそのまま使用する方法等が挙げられる。このときの分散媒としては水または各種の有機溶媒(例えばメタノール、エタノール、イソプロピルアルコール、ジクロロメタン、アセトン、アセトニトリル、酢酸エチル等)が挙げられる。分散の際、必要に応じてポリマー、界面活性剤、酸、もしくはキレート剤などを分散助剤として使用してもよい。
【0043】
電子受容物質の分散液またはコロイド溶液の塗布方法の好ましい例としては、アプリケーション系としてローラ法、ディップ法、メータリング系としてエアーナイフ法、ブレード法等、またアプリケーションとメータリングを同一部分でできるものとして、特公昭58−4589号公報に開示されているワイヤーバー法、米国特許2681294号、同2761419号、同2761791号等に記載のスライドホッパ法、エクストルージョン法、カーテン法、スピン法、スプレー法が挙げられる。
【0044】
本発明の好ましい態様によれば、電子受容層が半導体微粒子からなる場合、電子受容層の膜厚が0.1〜200μmであるのが好ましく、より好ましくは0.1〜100μmであり、さらに好ましくは1〜30μm、最も好ましくは2〜25μmである。これにより、単位投影面積当たりのプローブ物質および固定される増感色素量を増加して光電流量を多くするとともに、電荷再結合による生成した電子の損失をも低減することができる。また、導電性基材1m2当たりの半導体微粒子の塗布量は0.5〜400gであるのが好ましく、より好ましくは5〜100gである。
【0045】
本発明の好ましい態様によれば、電子受容物質がインジウム-スズ複合酸化物(ITO)または酸化スズにフッ素をドープした金属酸化物(FTO)を含んでなる場合、電子受容層の膜厚が1nm以上であるのが好ましく、より好ましくは10nm〜1μmである。
【0046】
本発明の好ましい態様によれば、半導体微粒子を導電性基材上に塗布した後に加熱処理を施すのが好ましい。これにより、粒子同士を電気的に接触させ、また、塗膜強度の向上や支持体との密着性を向上させることができる。好ましい加熱処理温度は、40〜700℃であり、より好ましくは100〜600℃である。また、好ましい加熱処理時間は10分〜10時間程度である。
【0047】
また、本発明の別の好ましい態様によれば、ポリマーフィルムなど融点や軟化点の低い導電性基材を用いる場合にあっては、熱による劣化を防止するため、高温処理を用いない方法により膜形成を行うのが好ましく、そのような膜形成方法の例として、プレス、低温加熱、電子線照射、マイクロ波照射、電気泳動、スパッタリング、CVD、PVD、蒸着等の方法が挙げられる。
【0048】
こうして得られた作用電極の電子受容層の表面にはプローブ物質が担持される。作用電極へのプローブ物質の担持は公知の方法に従い行うことができる。本発明の好ましい態様によれば、プローブ物質として一本鎖の核酸を用いる場合には、作用電極表面に酸化層を形成させておき、この酸化層を介して核酸プロ−ブと作用電極とを結合させることにより行うことができる。このとき、核酸プローブの作用電極への固定化は、核酸の末端に官能基を導入することにより行うことができる。これにより、官能基が導入された核酸プロ−ブはそのまま固定化反応により担体上に固定化されることができる。核酸末端への官能基の導入は、酵素反応もしくはDNA合成機を用いて行なうことができる。酵素反応において用いられる酵素としては、例えば、タ−ミナルデオキシヌクレオチジルトランスフェラ−ゼ、ポリAポリメラ−ゼ、ポリヌクレオチドカイネ−ス、DNAポリメラ−ゼ、ポリヌクレオチドアデニルトランスフェラ−ゼ、RNAリガ−ゼを挙げることができる。また、ポリメラ−ゼチェインリアクション(PCR法)、ニックトランスレ−ション、ランダムプライマ−法により官能基を導入することもできる。官能基は、核酸のどの部分に導入されてもよく、3'末端、5'末端もしくはランダムな位置に導入することができる。
【0049】
本発明の好ましい態様によれば、核酸プローブの作用電極への固定化のため官能基として、アミン、カルボン酸、スルホン酸、チオール、水酸基、リン酸等が好適に使用できる。また、本発明の好ましい態様によれば、核酸プローブを作用電極に強固に固定化するためには、作用電極と核酸プローブの間を架橋する材料を使用することも可能である。そのような架橋材料の好ましい例としては、シランカップリング剤、チタネートカップリング剤や、ポリチオフェン、ポリアセチレン、ポリピロール、ポリアニリン等の導電性ポリマーが挙げられる。
【0050】
本発明の好ましい態様によれば、核酸プロ−ブの固定化を物理吸着という、より簡単な操作で効率よく行うことも可能である。電極表面への核酸プロ−ブの物理吸着は、例えば、以下のように行なうことができる。まず、電極表面を、超音波洗浄器を用いて蒸留水およびアルコ−ルで洗浄する。その後、電極を核酸プロ−ブを含有する緩衝液に挿入して核酸プロ−ブを担体表面に吸着させる。
【0051】
また、核酸プローブの吸着後、ブロッキング剤を添加することにより、非特異的な吸着を抑制することができる。使用可能なブロッキング剤としては、核酸プローブが吸着していない電子受容層表面のサイトを埋めることができ、かつ電子受容物質に対して化学吸着あるいは物理吸着等により吸着可能な物質であれば限定されないが、好ましくは化学結合を介して吸着可能な官能基を有する物質である。例えば、酸化チタンを電子受容層として用いる場合における好ましいブロッキング剤の例としては、カルボン酸基、リン酸基、スルホン酸基、水酸基、アミノ基、ピリジル基、アミド等の酸化チタンに吸着可能な官能基を有する物質が挙げられる。
【0052】
本発明の好ましい態様によれば、作用電極上にプローブ物質が互いに分離された複数の領域毎に区分されて担持されてなり、光源による光照射が各領域に対して個別に行われるのが好ましい。これにより、複数の試料を一枚の作用電極上で測定することができるので、DNAチップの集積化等が可能となる。本発明のより好ましい態様によれば、作用電極上にプローブ物質が担持された、互いに分離された複数の領域がパターニングされており、光源から照射される光でスキャニングしながら、各領域の試料について被検物質の検出または定量を一度の操作で連続的に行うことが好ましい。
【0053】
本発明のより好ましい態様によれば、作用電極上の互いに分離された複数の領域の各領域に複数種類のプローブ物質を担持させることができる。これにより、領域の個数に、各領域毎のプローブ物質の種類数を乗じた数の、多数のサンプルの測定を同時に行うことができる。
【0054】
本発明のより好ましい態様によれば、作用電極上の互いに分離された複数の領域の各領域毎に異なるプローブ物質を担持させることができる。これにより、区分された領域の数に相当する種類数のプローブ物質を担持させることができるので、多種類の被検物質の測定を同時に行うことができる。この態様は、各領域毎に異なる被検物質の分析が可能なため、一塩基多型の解析(SNPs)の多項目解析に好ましく利用することができる。
【0055】
対電極
本発明に用いる対電極は、電解質媒体に接触させた場合に作用電極との間に電流が流れることができるものであれば特に限定されず、ガラス、プラスチック、セラミックス等の絶縁性の支持体に、金属もしくは導電性の酸化物を蒸着したものが使用可能である。また、対電極としての金属薄膜を5μm以下、好ましくは3nm〜3μmの範囲の膜厚になるように、蒸着やスパッタリングなどの方法により形成して作成することもできる。対電極に使用可能な材料の好ましい例としては、白金、金、パラジウム、ニッケル、カーボン、ポリチオフェン等の導電性ポリマー、酸化物、炭化物、窒化物等の導電性セラミックス等が挙げられ、より好ましくは、白金、カーボンであり、最も好ましくは白金である。これらの材料は電子受容層の形成方法と同様の方法により薄膜形成が可能である。
【0056】
測定方法および装置
本発明の方法にあっては、増感色素の共存下、試料液を作用電極に接触させて、プローブ物質に被検物質を直接または間接的に特異的に結合させ、この結合により増感色素を前記作用電極に固定させる。
【0057】
本発明の好ましい態様によれば、増感色素で予め標識された一本鎖の核酸を被検物質とする場合、プローブ物質である一本鎖核酸との間でハイブリダイゼーション反応を行なうことができる。ハイブリダイゼーション反応の好ましい温度は37〜72℃の範囲であるが、その最適温度は使用するプロ−ブの塩基配列や長さ等により異なる。
【0058】
本発明の別の好ましい態様によれば、被検物質およびプローブ物質の結合体(例えばハイブリダイゼーション後の二本鎖核酸)にインターカレーション可能な増感色素を用いる場合には、試料液に増感色素を添加することにより結合体を特異的に増感色素で標識することができる。
【0059】
本発明の方法にあっては、被検物質が増感色素と共に固定された作用電極を、対電極と共に電解質媒体に接触させ、作用電極に光を照射して増感色素を光励起させ、光励起された増感色素から作用電極への電子移動に起因して作用電極と対電極との間に流れる光電流を検出する。作用電極および対電極の相対的な位置関係は、互いに電気的に短絡することなく、なおかつ電解質媒体に接触しさえしていれば限定されるものではなく、互いに対向させて配置してもよいし、あるいは同一平面上に互いに離間させて配置してもよい。なお、作用電極および対電極が同一平面上に互いに離間させて配置される場合には、作用電極と対電極との間の電気的な短絡を防止するために絶縁基板上に両電極が設けられるのが望ましい。
【0060】
このような測定用セルの一例を図3に示す。図3に示される測定用セル21は、作用電極22と対電極23とにより挟まれて形成された空隙内に電解液24が充填されてなる。作用電極22は、導電性基材26と電子受容層27とを備えてなり、電子受容層27側を電解液24に接触させるように配置される。作用電極22と対電極23との間には絶縁スペーサ25が挿入されることにより、電解液24を収容する空間が確保されている。電極間の距離は酸化還元のサイクルを効率良く行わせるためには短い方が好ましく、工作的な精度との兼ね合いから数十μm であることが望ましい。また、いわゆるMEMS 的な製造方法を利用するのであれば、より近接した電極間距離とすることも可能である。
【0061】
本発明において用いる電解質媒体は、電解質、溶媒、および所望により添加物を含んでなるものであることができる。電解質の好ましい例としては、I2とヨウ化物の組み合わせ(ヨウ化物としてはLiI、NaI、KI、CsI、CaI2などの金属ヨウ化物、あるいはテトラアルキルアンモニウムヨーダイド、ピリジニウムヨーダイド、イミダゾリウムヨーダイドなど4級アンモニウム化合物のヨウ素塩など)、Br2と臭化物の組み合わせ(臭化物としてはLiBr、NaBr、KBr、CsBr、CaBr2などの金属臭化物、あるいはテトラアルキルアンモニウムブロマイド、ピリジニウムブロマイドなど4級アンモニウム化合物の臭素塩など)のほか、フェロシアン酸塩−フェリシアン酸塩やフェロセン−フェリシニウムイオンなどの金属錯体、ポリ硫化ナトリウム、アルキルチオール−アルキルジスルフィドなどのイオウ化合物、ビオロゲン色素、ヒドロキノン−キノン等が挙げられ、より好ましくは、I2とLiIやピリジニウムヨーダイド、イミダゾリウムヨーダイドなど4級アンモニウム化合物のヨウ素塩を組み合わせた電解質である。上述した電解質は混合して用いてもよい。本発明において特に好ましい電解質媒体はリチウムイオンを含んでなるものである。
【0062】
本発明の好ましい態様によれば、電解液の電解質濃度は0.1〜15Mであるのが好ましく、より好ましくは0.2〜10Mである。また、電解質にヨウ素を添加する場合における、好ましいヨウ素の添加濃度は0.01〜0.5Mである。
【0063】
好ましい溶媒の例としては、水、アルコール(メタノール、エタノール等)、非プロトン性の極性溶媒(例えばアセトニトリルなどのニトリル類、炭酸プロピレンや炭酸エチレンなどのカーボネート類、ジメチルホルムアミド、ジメチルスルホキシド、スルホラン、1,3−ジメチルイミダゾリノンや3−メチルオキサゾリジノン、ジアルキルイミダゾリウム塩などの複素環化合物、等)が挙げられる。
【0064】
本発明の好ましい態様によれば、水系の電解液が用いることができる。これにより、蛋白質等の生体分子を変性または失活させることなく適切に測定することが可能となる。また、電解液の流路等の劣化および電解液の揮発を防止できるとともに、廃液処理も容易に行えるとの利点もある。本発明の好ましい態様によれば、水系電解質は、支持電解質と、還元剤(電子供与体)と、溶媒としての水とを含んでなるのが好ましい。支持電解質としては、水に溶解した時にイオンに解離して伝導性を与え、かつ目的とする電極反応を阻害しないものであれば限定されず、好ましい例としては、NaCl、Na2SO4、KCl、K2SO4などが挙げられる。還元剤(電子供与体)の好ましい例としては、EDTA、トリエタノールアミン、シュウ酸、ヒドロキノンなどが挙げられる。
【0065】
本発明の好ましい態様によれば、電解質媒体はゲル化(固体化)させて使用することもできる。ゲル化の方法の例としては、ポリマー添加、オイルゲル化剤添加、多官能モノマー類を含む重合、ポリマーの架橋反応等の手法により行うことができる。ゲル電解質のマトリクスに使用されるポリマーの例としては、ポリアクリロニトリル、ポリビニリデンフルオリド等が挙げられる。
【0066】
図3に示されるように作用電極22の上方には光源28が光源カバー29を介して配置される。すなわち、作用電極22の裏側(すなわち導電性基材)から光を照射させて、作用電極(すなわち導電性基材および電子受容層)を透過した光が増感色素を励起するようにセルが構成されている。もっとも、対電極を透光性の材料で構成することにより光を対電極の裏側から照射してもよく、あるいは、作用電極および対電極に平行に光を照射してもよいのは言うまでもない。本発明に用いる光源としては、標識色素を光励起できる波長の光を照射できるものであれば限定されず、好ましい例としては、蛍光灯、ブラックライト、殺菌ランプ、白熱電球、低圧水銀ランプ、高圧水銀ランプ、キセノンランプ、水銀−キセノンランプ、ハロゲンランプ、メタルハライドランプ、LED(白色、青、緑、赤)、レーザー光、太陽光を用いることができ、より好ましくは、蛍光灯、白熱電球、キセノンランプ、ハロゲンランプ、メタルハライドランプ、LED(白色、青、緑、赤)、太陽光等を挙げることができる。また、必要に応じて、分光器やバンドパスフィルタを用いて特定波長領域の光のみを照射してもよい。
【0067】
本発明の好ましい態様によれば、互いに異なる光波長で励起可能な二種以上の増感色素を用いて複数種類の被検物質を個別に検出する場合、光源から波長選択手段を介して特定波長の光を照射することにより、複数の色素を個別に励起することが可能である。波長選択手段の例としては、分光器、色ガラスフィルタ、干渉フィルタ、バンドパスフィルタ等が挙げられる。また、増感色素の種類に応じて異なる波長の光を照射可能な複数の光源を用いてもよく、この場合の好ましい光源の例としては、特定波長の光が照射されるレーザー光やLEDを用いてもよい。また、作用極に光を効率よく照射するため、石英、ガラス、液体ライトガイドを用いて導光してもよい。
【0068】
本発明の好ましい態様によれば、光源から放射される光がもともと紫外線を実質的に含まないか、または光源からの光の照射が紫外線を除去する手段を介して行われるのが好ましい。これにより、照射光に400nm以下の波長の紫外線が含まれる場合に発生しうる電子受容物質自体の光励起によるバックグランド電流、すなわちノイズを効果的に抑制して、より精度の高い測定が可能となる。なお、増感色素は一般的に可視光の吸収により励起されることができるため、紫外線を除去したとしても可視光の照射により高い感度で光電流を検出することが可能である。
【0069】
紫外線を除去する手段の好ましい例としては、光学フィルタ、および分光器が挙げられる。光学フィルタまたは分光器を用いることにより、照射光の波長を制御することができ、作用電極自体の光励起を防止しつつ、増感色素のみを励起することが可能となる。好ましい光学フィルタの例としては、紫外線カットフィルタ等の色ガラスフィルタが挙げられる。好ましい分光器の例としては、厳密な波長制御が可能な点で、回折格子が内蔵された分光器が挙げられる。
【0070】
もともと紫外線を実質的に含まない光を放出する光源の好ましい例としては、レーザ、無機エレクトロルミネッセンス(EL)素子、有機エレクトロルミネッセンス(EL)素子、発光ダイオード(LED)が挙げられるが、最も好ましくは発光ダイオード(LED)である。LEDによれば、波長分布の狭い制御された光を照射することができ、小型、軽量、低消費電力、および長寿命といった利点も得られる。
【0071】
本発明のより好ましい態様によれば、使用する電子受容物質についての既知のバンドギャップを下記式に代入して算出される、表1に示されるカットオフ波長よりも短い波長の光を除去することが好ましい。これにより、電子受容物質の特性に応じて、バックグランド電流の発生を効果的に抑制できる。
バンドギャップ(eV) = hν = hc/λ = 1239.8/λ(mm)
(h:プランク定数、c:光速)
【0072】
表 1
電子受容物質 バンドギャップ 好適なカットオフ波長
(eV) (nm)
ルチル型酸化チタン 3.2 387
アナターゼ型酸化チタン 3.0 413
酸化亜鉛 3.1 400
チタン酸ストロンチウム 3.2 387
酸化スズ 3.5 354
酸化タングステン 2.8 443
酸化ニオブ 3.1 400
酸化鉄 2.2 564
【0073】
なお、電子受容物質には不純物準位を含む場合があるため、万全を期して、カットオフ波長を表1に示される波長よりも長波長側に設定しても構わない。また、作用電極が複数の電子受容物質で構成されている場合には、構成成分のうち最もバンドギャップが狭い成分のカットオフ波長よりも短い波長を除去するのが好ましい。
【0074】
図4に示されるように、作用電極21および対電極22間には電流計30が接続され、光照射により系内を流れる光電流が電流計により測定される。これにより、被検物質を検出することができる。その際の電流値は作用電極上にトラップされた増感色素の量を反映する。例えば、被検物質が核酸の場合、相補性のある核酸間で形成された二本鎖の量が、電流値となり反映される。したがって、得られた電流値から被検物質を定量することができる。したがって、本発明の好ましい態様によれば、電流計が、得られた電流量または電気量から試料液中の被検物質濃度を算出する手段をさらに備えてなるのが好ましい。
【0075】
本発明の好ましい態様によれば、光電流を検出する工程が、電流値を測定し、得られた電流値または電気量から試料液中の被検物質濃度を算出することができる。この被検物質濃度の算出は、予め作成された被検物質濃度と電流値または電気量との検量線と、得られた電流値または電気量とを対比することにより行うことができる。本発明の方法にあっては、電流値は作用電極上にトラップされた増感色素の量が反映されるので、被検物質濃度に対応した正確な電流値が得られるため、定量測定に適する。
【0076】
本発明の別の好ましい態様によれば、予め増感色素で標識された被検物質を競合物質として用いて、増感色素で標識されていない、プローブ物質に特異的に結合可能な第二の被検物質を定量することができる。第二の被検物質はプローブ物質に標識済被検物質よりも特異的に結合しやすい性質を有するのが好ましい。これら二種類の被検物質を競合させてプローブ物質に特異的に結合させると、検出される電流値と第二の被検物質の濃度との間に相関関係が得られる。つまり、色素標識されていない第二の被検物質の数が増加するにつれ、プローブ物質に特異的に結合する競合物質の数が減少するため、第二の被検物質濃度の増加につれて、検出電流値が減少する検量線を得ることができる。したがって、増感色素で標識されていない第二の被検物質の検出および定量が可能となる。
【0077】
本発明のより好ましい態様によれば、被検物質および第二の被検物質が抗原であり、プローブ物質が抗体であるのが好ましい。この態様における被検物質および第二の被検物質のプローブ物質への固定化工程を図5に示す。図5に示されるように、増感色素で標識された抗原41と、色素標識されていない抗原42とが競合して抗体43に特異的に結合する。したがって、色素標識されていない抗原42が増加するにつれ、抗体に特異的に結合する色素標識された抗原43が減少するため、第二の被検物質濃度の増加につれて、検出電流値が減少する検量線を得ることができる。
【0078】
フロー型測定用セルおよびパターニング電極を用いた測定方法および装置
本発明の方法および装置の好ましい実施態様の一例として、フロー型測定用セルおよびパターニング電極を用いた測定方法および装置について説明する。図6に、装置の全体構造を示す。図6に示される装置50は、フロー型測定用セル51と、光源52と、電解液タンク53と、洗浄液タンク54と、供給ポンプ55と、電流計56と、排出ポンプ57とを備えてなる。フロー型測定用セル51は、パターニングされた作用電極58と、作用電極に対向する対電極59とを備えてなり、作用電極58および対電極59の間に、電解液または洗浄液を収容しかつ流すことができる流路が形成される。すなわち、供給ポンプ55により測定用セル51内に供給された電解液または洗浄液は、作用電極58および対電極59に接触しながら流路を通過した後、排出ポンプ57により測定用セル51外に排出されるように構成されている。これら一連の動作の制御および光電流値の解析は図示しない制御解析装置により行われることができる。
【0079】
作用電極58は、電子受容層上にプローブ物質が担持された、互いに分離された複数の領域がパターニングされており、光源から照射される光でスキャニングしながら、各領域の試料について被検物質の検出または定量を一度の操作で連続的に行えるように構成されている。このようにパターニングされた作用電極の例を図7(a)〜(d)および図8(a)〜(c)に示す。
【0080】
図7(a)および(b)に示される作用電極58は、導電性基材58aの全面に形成された電子受容層58b上に、プローブ物質58cが担持された複数のスポット60が縦横方向にパターニングされたものである。そして、この作用電極58の導電性基材にリード線61が施され、このリード線61を介して作用電極58全体が電流計56に接続されている。この作用電極58によれば、各スポットに順次光照射を行うことにより、発生する光電流を各スポット毎に測定することができる。また、電極の構成が比較的簡単なため電極の作製が容易であり、従来のDNAチップの製造技術を利用できるとの利点もある。また、変形例として、図7(c)に示されるように電子受容層58b自体をスポット状に形成してその上にプローブ物質58cを担持させる、あるいは、図7(d)に示されるように導電性基材を省略して電子受容層58bのみでスポット状の作用電極58を構成してその上にプローブ物質58cを担持させ、かつ電子受容層58bにリード線61を施してもよく、特に後者にあっては、製造工程が簡略化されるとともに製造コストも低減できるとの利点がある。この作用電極に使用される光源52としては、図9に示されるように作用電極58上を縦横方向に移動する光源であるか、または図10に示されるように作用電極58の各スポットに対応して複数の光源が配列させておき、各光源を順に点灯および消灯させるものであってよい。
【0081】
図8(a)および(b)に示される作用電極58’は、絶縁基板58d’上に導電性基材58a’および電子受容層58b’からなる複数のスポット60’が縦横方向にパターニングされており、電子受容層58b’上にプローブ物質58c’が担持される。そして、各スポット60’の導電性基材には個別にリード線61’が施され、このリード線61’を介して各スポット60’が電流計56に接続されている。この作用電極58’によれば、作用電極の全面に光を同時に照射するだけで、各スポットに発生する光電流を同時にかつ個別に測定することができる。また、各スポットにおける光電流を個別に測定することができるので、他のスポットで発生した光電流をノイズとして拾うことが無いとの利点もある。また、変形例として、図8(c)に示されるように導電性基材を省略して電子受容層58b’のみでスポット状の作用電極58’を構成してその上にプローブ物質58c’を担持させ、かつ電子受容層58b’にリード線61’を施してもよく、製造工程が簡略化されるとともに製造コストも低減できるとの利点がある。この作用電極58’に使用される光源52は、図6の作用電極の場合と同様、作用電極58上を縦横方向に移動する光源であるか、または作用電極58の各スポットに対応して複数の光源が配列させておき、各光源を順に点灯および消灯させるものであってよい。
【0082】
この装置を使用した測定方法の一例について以下に説明する。
まず、増感色素の共存下、試料液を作用電極に接触させて、プローブ物質に被検物質を直接または間接的に特異的に結合させ、この結合により増感色素を作用電極58に固定させる。このとき、作用電極の電子受容層に図7に示されるスポットパターンのマスキングを施して、プローブ物質が担持された複数のスポット60が縦横方向にパターニングされた作用電極58を得る。こうして得られた作用電極58をフロー型測定用セル51に装着する。
【0083】
次いで、供給ポンプ55を作動させて電解液タンク53から電解液を測定用セル51内に送り込み、測定用セル内の流路を電解液で満たした後、送液を停止する。光源52から作用電極58に光を照射し、電流計56により作用電極58および対電極59間に発生する光電流を測定する。この光電流値の測定にあっては、光電流値が安定する、照射開始後数十秒後の値を採用するのが好ましい。そして、図示しない制御解析装置において、得られた電流値と、予め作成された被検物質濃度と電流値との検量線とを対比することにより被検物質濃度が算出される。光電流の測定終了後、供給ポンプ55を作動させて洗浄液タンク53から洗浄液を測定用セル51内に送り込むと同時に、測定用セル51内の電解液を排出ポンプ57を作動させて排出し、測定用セル内の流路内の電解液で洗浄液で置換した後、送液および排液を停止する。これにより、洗浄液で洗浄化された測定用セル51を用いて、次の測定を上記同様の手順で行うことができる。
【実施例】
【0084】
以下の実施例によって本発明をさらに詳細に説明する。なお、本発明はこれら実施例に限定されるものではない。
【0085】
例1:作用電極の作製
まず、以下の配合を有する原料を自動乳鉢を用いて充分に混合した後、150℃で6時間乾燥させて混合物を得た。
α−テルピネオール 60重量%
2−(2−ブトキシエトキシ)エタノール 15重量%
エチルセルロース 25重量%
【0086】
得られた混合物0.5gに粒状酸化チタン(日本エアロゾル社製P25、平均粒径20〜25nm)1gを添加して混合した後、先に得られた混合物0.5gをさらに添加して混合した。その後、α−テルピネオールを加えて再度混合して、ペーストを得た。これら一連の混合は自動乳鉢を用いて合計3時間行った。
【0087】
フッ素ドープされたSnO2膜が形成されたガラス基板(旭硝子製)の縁枠を幅約63μmのテープでマスキングし、上記ペーストをスキージ印刷した後、60℃で2時間乾燥させた。得られたガラス基板を焼成炉内に入れ、約17分間かけて500℃まで炉内温度を上昇させ、この温度で30分間保持した後、放冷した。炉内温度が100℃に達した時点でガラス基板をエタノールに浸漬した。こうして、酸化チタンを含んでなる電子受容層が形成された作用電極を得た。
【0088】
次いで、5’−NH2−AACGTCGTGACTGGGの塩基配列を有するNH2修飾DNAをバッファ(3X SSC)に溶解して、286μMのNH2修飾DNA溶液を調製した。この溶液を、予め95℃で3分間保持した後、氷上で冷却させることにより、変性させておいた。
【0089】
先に得られた作用電極の電子受容層上に、5mm×5mm角の大きさの開口部が形成された、厚さ700μmのシリコンシールを載置した。この開口部に286μMのNH2修飾DNA溶液35μl注入した。このとき、ピペットチップの先端を用いて、シリコンシールの開口部の四隅まで充分にDNA溶液が行き渡るようにした。続いて、DNA溶液中に気泡が極力入らないようにガラス板で真上から覆い、湿らせた紙等で蒸気圧が調整されたプラスチック容器に収容した。この容器中に60℃で2時間保持して、NH2修飾DNAをインキュベートした。その後、DNA溶液を除去し、流水で軽く電極表面を洗浄した後、空気を吹き付けて残水を飛散させた。こうして、プローブ物質が担持された作用電極を得た。
【0090】
例2:ローダミン修飾DNAの検出
5’−Rho−CCCAGTCACGACGTTの塩基配列を有するローダミン修飾DNAをバッファ(2X SSC、0.03% SDS)に溶解して、28.6μMおよび286μMの各濃度を有するローダミン修飾DNA溶液を作製した。
例1で使用したものと同様のシリコンシールを作用電極表面に載置し、各濃度のローダミン修飾DNA溶液を35μlずつ、開口部に注入した。溶液中に気泡が極力入らないようにガラス板で真上から覆い、湿らせた紙等で蒸気圧を調整したプラスチック容器に入れた。こうして、60℃で一晩(12時間)インキュベートさせて、ハイブリダイゼーションを行った。
【0091】
こうしてハイブリダイゼーションが施された作用電極を洗浄液に浸し、ゆっくりと揺らしながら洗浄した。洗浄液としては下記表2に示されるものを使用し、各洗浄液について下記表に示される洗浄時間、洗浄回数、および温度で洗浄を行った。なお、洗浄液を変更する毎に洗浄容器を交換した。
表 2
洗浄液 1回当たりの 洗浄回数 温度
洗浄時間
2X SSC、0.2% SDS 6分間 3回 室温
0.2X SSC、0.2% SDS 6分間 3回 室温
0.2X SSC、0.2% SDS 13分間 1回 60℃
0.2X SSC、0.2% SDS 6分間 2回 室温
0.2X SSC 6分間 1回 室温
注)2X SSC:0.3M塩化ナトリウムおよび0.03Mクエン酸ナトリウム含有水溶液(pH7.0)
SDS:硫酸ドデシルナトリウム
【0092】
さらに、作用電極をエタノールで軽く液中で上下させることにより、2回洗浄を行った。2回目の洗浄後は紙等で拭き取らずに、素早く空気を吹き付けて残水を飛散させた。
【0093】
こうして得られた作用電極と、対電極としての白金電極とを用いて、図3および図4に示されるような測定用セルを以下のようにして組み立てた。
まず、白金電極として、ガラス基板上に白金薄膜をスパッタリングにより形成したものを用意した。白金電極の白金膜上に、厚さ500μmのシリコンシートを載置した。このシリコンシートは作用電極と対電極との接触による短絡を防ぐためのスペーサーである。このとき、白金電極の白金で被膜された端部にリード線を接続して、電流を取り出し可能に構成した。作用電極もリード線を介して電流計と接続した。
電解液として、体積比が8:2のエチレンカーボネートとアセトニトリルの混合溶媒にヨウ素0.05Mとテトラプロピルアンモニウムヨーダイド0.5Mを溶解した混合液を用意した。この電解液を白金電極に5μL滴下した後、作用電極をその電子受容層が白金電極と対向するように、載置した。こうして、スペーサーおよび電解液を作用電極および対電極とで挟持されてなる、サンドイッチ型の測定用セルを得た。
【0094】
作用電極のリード線と対電極のリード線とを電流計(ALSモデル832A、ディアル電気化学アナライザー)に接続した。光源(林時計社製、LA−250XE)から液体ライトガイドを用いて導光し、紫外線カットフィルタ(Y-43、旭テクノグラス)を介して作用電極表面の1.5cm上方から白色光を30秒間作用電極表面に照射した。このとき、作用電極と対電極との間に流れる電流値を電流計により経時的に測定した。
【0095】
図6に28.6μMローダミン修飾DNA溶液を用いた場合の検出電流の経時変化を、図7に286μMローダミン修飾DNA溶液を用いた場合の検出電流の経時変化を示す。これらの図に示されるように、増感色素で標識づけられたDNAと、これと相補性を有するDNAとをハイブリダイゼーションさせると、光の照射により大きな電流が流れることが分かる。
【0096】
また、28.6μMおよび286μMの各ローダミン修飾DNA溶液を用いた場合について、電流値が定常状態になった時点における電流値を別途測定したところ、図8に示される通りの結果が得られた。また、参照のため、ローダミン修飾DNAの固定化を行わなかった場合についても同様にして測定を行った。その結果も図8に併せて示す。図8に示されるように、ローダミン修飾DNAの濃度に依存して電流値が変化した。したがって、本発明の方法によれば定量分析が可能なことが分かる。
【0097】
例3:プローブ物質を担持させない作用電極を使用した測定
また、比較のため、例1で作製された、NH2修飾DNAを担持させる前の、酸化チタンを含んでなる電子受容層のみが形成された作用電極を用いて測定用セルを構成して、例2と同様に測定を行った。図6に28.6μMローダミン修飾DNA溶液を用いた場合の検出電流の経時変化を、図7に286μMローダミン修飾DNA溶液を用いた場合の検出電流の経時変化を示す。これらの図に示されるように、紫外線カットフィルタで除去できなかった若干量の紫外線によって酸化チタン自身が励起され、光電流が観測されるものの、ローダミン修飾DNA溶液を用いた例2の場合と比べて、光電流は著しく低かった。
【0098】
例4:作用電極にブロッキングを施した場合の測定
例1と同様にして、プローブ物質が担持された作用電極を得た。この電極表面に例1で使用したものと同様のシリコンシールを再度載置して、開口部にブロッキング剤として10μMのジエタノールアミン35μlを注入した。ブロッキング剤中に気泡が極力入らないようにガラス板で真上から覆い、湿らせた紙等で蒸気圧を調整したプラスチック容器に入れた。そして、60℃で30分間保持して、ブロッキング剤をインキュベートした。電極表面を再度流水で軽く洗浄した後、空気を吹き付けて残水を飛散させた。
【0099】
こうしてプローブ物質がブロッキングされた作用電極を用いて、例2と同様にして、ローダミン修飾DNAのインキュベーションによるハイブリダイゼーション、および光電流測定を行った。その結果は図6および図7に示される通りであった。これらの図に示されるように、ブロッキングが施された作用電極を用いた場合には、それが施されない例2の場合と比べて、著しく電流値が低下した。
【0100】
例5:競合物質PNAとの共存下におけるローダミン修飾DNAの検出
5’−Rho−CCCAGTCACGACGTTの塩基配列を有するローダミン修飾DNAと、競合物質として5’−CCCAGTCACGACGTTTの塩基配列を有するPNAとをバッファ(2X SSC、0.03% SDS)に溶解して、28.6μMローダミン修飾および200μM PNA含有溶液と、286μMローダミン修飾および200μM PNA含有溶液とを作製した。
この試料溶液を用いたこと以外は、例2と同様にして、ローダミン修飾DNAのインキュベーションによるハイブリダイゼーション、および光電流測定を行った。その結果は図6および図7に示される通りであった。これらの図に示されるように、ハイブリダイゼーション時に競合すると考えられる塩基配列を有するPNAを共存させた場合、PNAが共存しない例2の場合と比べて、電流値が低下した。
【0101】
例6:検量線の作成
(1) 被検物質およびプローブ物質の準備
色素標識された被検物質(以下、被検DNAともいう)として、3’末端をローダミンBで標識された、以下の塩基配列を有する15塩基の核酸塩基(3’ローダミンDNA)を用意した。また、プローブ物質(以下、プローブDNAともいう)として上記被検DNAと相補鎖を有する15塩基の核酸塩基(5’末端をアミノ基で修飾したDNA(以下、5’−NH2−DNAという)を用意した。すなわち、このプローブDNAと被検DNAは、ハイブリダイゼーション反応により二本鎖DNAを形成することができる。
被検DNA(3’ローダミンDNA):
3’Rho−TTGCAGCACTGACCC 5’
プローブDNA(5’−NH2−DNA):
5’NH2−AACGTCGTGACTGGG 3’
【0102】
(2) 作用電極の作製およびプローブ物質の担持
まず、チタニア微粉末(昭和タイタニウム社製、F2、平均粒径60nm、アナターゼ:ルチル=4:6)1gと、以下の配合を有する有機ビヒクル1gとを自動乳鉢で混練しながら、徐々に溶媒(αテルピネオール:ブチルカルビトール=重量比60:40)1gを添加して、酸化チタンペーストを得た。これら一連の混合は合計5時間行われた。
α−テルピネオール 65重量%
ブチルカルビトール 15重量%
ポリビニルブチラール 20重量%
【0103】
フッ素ドープされた酸化スズ(F−SnO2:FTO)コートガラス(エイアイ特殊硝子社製、U膜、シート抵抗:15Ω/□)の導電面上の縁枠を金属メタルスクリーンマスクでマスキングし、上記ペーストを用いて厚さ120μm、大きさ5mm×5mmの膜を作製した。得られた膜を60℃で3時間乾燥させた後、500℃で30分間焼成を行い、酸化チタン多孔質膜を電子受容層として備えた作用電極を得た。こうして得られた作用電極にBLBランプで一晩紫外線照射を施し、汚れおよび残存有機物の除去を行った。
【0104】
次いで、プローブDNAとして5’−NH2−DNAを50mM HEPES(pH7.0)に溶解させて水溶液を調製した。この溶液を、予め95℃で3分間保持した後、氷上(2℃)で3分間以上冷却させることにより、熱変性させておいた。
【0105】
先に得られた作用電極の電子受容層上に、スペーサー用穴あきテープを貼り、ピンセットの先を用いてテープ接着面に残存する空気を除去した。このテープ上に、5mm×5mm角の大きさの開口部が形成されたシリコンシートを載置して密着させた。この開口部に先に調製した5’−NH2−DNA溶液(200μM)を25μl装填した。このとき、ピペットチップの先端を用いて、シリコンシールの開口部の四隅まで充分にDNA溶液が行き渡るようにした。続いて、DNA溶液中に気泡が極力入らないようにガラス板で真上から蓋をして、湿らせた紙等で蒸気圧が調整されたプラスチック容器に収容した。この容器中に60℃で6時間保持して、5’−NH2−DNAをインキュベートした。その後、DNA溶液を除去し、流水で軽く電極表面を2秒間洗浄した後、空気を吹き付けて残水を飛散させた。こうして、プローブDNAが担持された作用電極を得た。
【0106】
上記プローブ物質が担持された作用電極に新たなシリコンシールを載置し、開口部にブロッキング剤として1μMのジエタノールアミン25μlを装填した。ブロッキング剤中に気泡が極力入らないようにガラス板で真上から蓋をして、湿らせた紙等で蒸気圧を調整したプラスチック容器に入れた。そして、60℃で30分間保持して、ブロッキング剤をインキュベートした。電極表面を再度流水で軽く2秒間洗浄した後、空気を吹き付けて残水を飛散させた。こうしてブロッキングが施された作用電極を得た。
【0107】
(3)ハイブリダイゼーション
色素標識された被検DNAとしての3’ローダミンDNAをHEPES水溶液に溶解して、0、10、40、400、4000、15000、25000、30000、40000、80000nMの各濃度を有する3’ローダミンDNA溶液を作製した。
各濃度の3’ローダミンDNA溶液を25μl作用電極に装填した。溶液中に気泡が極力入らないようにガラス板で真上から蓋をして、湿らせた紙等で蒸気圧を調整したプラスチック容器に入れた。こうして、60℃で15時間インキュベートさせて、ハイブリダイゼーションを行った。
【0108】
こうしてハイブリダイゼーションが施された作用電極を洗浄液に浸し、ゆっくりと揺らしながら洗浄した。洗浄液としては下記表3に示されるものを使用し、各洗浄液について下記表に示される洗浄時間、洗浄回数、および温度で洗浄を行った。なお、洗浄液を変更する毎に洗浄容器を交換した。さらに、作用電極を水で5秒間洗い流し、素早く空気を吹き付けて残水を飛散させた。
表 3
洗浄液 1回当たりの 洗浄回数 温度
洗浄時間
HEPES、0.1%Tween20 6分間 6回 室温
HEPES、0.1%Tween20 13分間 1回 60℃
HEPES 6分間 2回 室温
超純水 15分間 1回 室温
注)HEPES:2−[4−(2−ヒドロキシエチル)−1−ピペラジニル]エタンスルホン酸(同仁化学研究所製)の50mM、pH7.0の溶液
0.1%Tween20:SERVA社製の界面活性剤を超純水に0.1vol%で希釈したもの
【0109】
(4)測定用セルの組み立て
こうして得られた作用電極と、対電極としての白金電極とを用いて、図3および図4に示されるような測定用セルを以下のようにして組み立てた。
まず、白金電極として、厚さ1mmのガラス基板上に、密着性確保のためのクロム層を介して、白金薄膜をスパッタリングにより形成したものを用意した。白金電極の白金膜上に、厚さ500μmのシリコンシートを載置した。このシリコンシートは作用電極と対電極との接触による短絡を防ぐためのスペーサーである。このとき、白金電極の白金で被膜された端部にリード線を接続して、電流を取り出し可能に構成した。作用電極もリード線を介して電流計と接続した。
電解液として、体積比が4:6のアセトニトリルと炭酸エチレンの混合溶媒にヨウ素0.06Mとテトラプロピルアンモニウムヨーダイド0.6Mを溶解した混合液を用意した。この電解液を白金電極に1滴(5μL)滴下した後、作用電極をその電子受容層が白金電極と対向するように、載置した。こうして、スペーサーおよび電解液を作用電極および対電極とで挟持されてなる、サンドイッチ型の測定用セルを得た。
【0110】
(5)光電流の測定
作用電極のリード線と対電極のリード線とをポテンシオスタット(北斗電工社製、HSV−100)に接続した。250Wキセノンランプ(林時計工業社製、LA−250Xe)から液体ライトガイドを用いて導光し、基材である酸化チタンによる光吸収および光電流発生を避けるため430nm以下の波長の光を除去できる紫外線カットフィルタ(旭テクノグラス社製、Y−43)を介して作用電極表面に光を作用電極表面に照射した。このとき、作用電極と対電極との間に流れる電流値を電流計により経時的に測定した。電流値の測定は60秒間行ったが、光の照射は電流の測定開始10秒後から30秒間のみ行った。
【0111】
(6)検量線の作成
被検DNAの濃度と、検出された光電流の値とから、図14および15に示される検量線が得られた。図14に示されるように、被検DNA濃度が0〜4000nMの低濃度域では、被検DNA濃度と電流値との間に比例関係が見られた。また、図15に示されるように、被検DNA濃度が1000〜100000nMの高濃度域では、被検DNA濃度の対数と電流値との間にリニアな関係が得られた。したがって、これらの検量線を用いることにより、未知の被検DNAの濃度を、測定された光電流値に基づいて正確に知ることができる。すなわち、本発明の方法によれば、DNAの定量が可能である。
【0112】
例7:リチウムイオンを含む電解質媒体を用いた例
電解液として以下の二種類の対カチオンを含有する電解液AおよびBを使用したこと、および被検DNA溶液(5’−NH2−DNA溶液)の濃度を200μMとしたこと以外は例6と同様にして試験を行った。
電解液A:40容量%炭酸エチレンおよび60容量%アセトニトリルの混合溶媒中、0.06M I2および0.6M TPA+I−が溶解された液(テトラプロピルアミンモニウムカチオン((n−C3H7)4N+;TPA+)を対カチオンとして有する電解液)
電解液B:アセトニトリル中、0.05M I2および0.5M Li+I−が溶解した液(リチウムイオンを対カチオンとする電解液)
【0113】
また、ブランクとして、プローブDNAおよび被検DNAのいずれも固定化されていない、作製されたままの作用電極についても光電流値を測定した。
【0114】
測定された光電流値(安定電流値)は表4に示される通りであった。
表 4
電解液 光電流値(mA)
本発明例 ブランク
A(TPA+) 1.4 0.3
B(Li+) 1.7 0.4
【0115】
表4から分かるように、電解液AおよびBのいずれもヨウ素とヨウ化物を含んでおり、そのいずれを用いた場合も、高感度に光電流を検出することができた。特に、リチウムイオンを対カチオンとして含有する電解液Bでは、リチウムイオンを含まない電解液Aと比べて、20〜35%も光電流が増加する傾向が見られた。つまり、リチウムイオンを対カチオンとして電解質媒体に使用することで、検出される光電流を増加させて、被検DNAを高感度に検出できることが分かる。
【0116】
例8:電子受容物質として酸化チタンまたはチタン酸ストロンチウムを用いた例
作用電極作製用ペーストを以下のように調製したこと、および被検DNA溶液の濃度を200μMとしたこと以外は例6と同様にして試験を行った。
【0117】
すなわち、作用電極作製用ペーストの作製は、以下に示される酸化物半導体0.5gと、例6で使用したものと同様の有機ビヒクル0.5gとを自動乳鉢で混練しながら、徐々に溶媒(αテルピネオール:ブチルカルビトール=重量比60:40)1gを添加することにより行った。これら一連の混合は合計5時間行われた。
TiO2:昭和タイタニウム社製、F−2、平均粒子径約60nm、アナターゼ:ルチル=2:8の混合相
ZnO:シーアイ化成社製、NanotekZnO、平均粒子径約30nm
Nb2O5:多木化学社製、酸化ニオブゾルを蒸発乾固した粉末、平均粒子径約10nm
WO3:和光純薬社製、平均粒子径約100nm
SrTiO3:2−エチルヘキサン酸ストロンチウムのトルエン溶液とチタンテトライソプロポキシドのイソプロピルアルコール溶液をモル比(Sr:Ti)で1:1の割合で混合し、100℃で蒸発乾固させた後、850℃で焼成する方法で自製した粉末、平均粒子径約200nm
In2O3:和光純薬社製、平均粒子径約100nm
【0118】
また、ブランクとして、プローブDNAおよび被検DNAのいずれも固定化されていない、作製されたままの作用電極についても光電流値を測定した。
【0119】
測定された光電流値(安定電流値)は表5に示される通りであった。なお、表4には、実測値のみならず、ブランクについて計測されたバックグランド電流値を差し引いた補正後の電流値も示す。
表 5
電子受容物質 平均粒子径 光電流値(mA)
(nm) 実測値 ブランク 補正後の電流値
TiO2 60 1.53 0.04 1.49
ZnO 30 0.59 0.03 0.56
WO3 100 0.24 0.10 0.14
Nb2O5 10 0.025 0.010 0.015
SrTiO3 200 0.045 0.0006 0.045
In2O3 100 0.30 0.07 0.23
【0120】
表5から分かるように、上記いずれの酸化物半導体を電子受容物質として使用した場合にも、光電流を検出することができた。特に、光電流の実測値および補正後の電流値と共に酸化チタンが最も高い値を示し、優れた電子受容物質であることが分かる。また、チタン酸ストロンチウムは、ブランクについて計測されたバックグランド電流値が極めて低いことからS/N比に優れており、高い精度で被検DNAに起因する応答電流を検出できることが分かる。
【0121】
例9:各種酸化物半導体におけるバックグランド電流の波長依存性
以下の5種類の酸化物半導体について、分光光度計(島津製作所社製、UV−3150)を使用して、拡散反射(DR)スペクトルを測定した。
SrTiO3:2−エチルヘキサン酸ストロンチウムのトルエン溶液とチタンテトライソプロポキシドのイソプロピルアルコール溶液をモル比(Sr:Ti)で1:1の割合で混合し、100℃で蒸発乾固させた後、850℃で焼成する方法で自製した粉末、平均粒子径約200nm
F3:昭和タイタニウム社製、平均粒子径約50nm、アナターゼ:ルチル=4:6の酸化チタン
P−25:日本アエロジル社製、平均粒子径約25nm、アナターゼ:ルチル=7:3の酸化チタン
ST−01:石原産業社製、平均粒子径約7nm、アナターゼ型酸化チタン
ZnO:シーアイ化成社製、NanotekZnO、平均粒子径30nm
【0122】
その結果は図16に示される通りであった。図16に示されるように、測定した全ての酸化物粉末は全て紫外領域の波長の光を吸収するが、410nm以上の波長の光をほとんど吸収しないことが分かる。このことは、照射光の波長をカットフィルタやバンドパスフィルタを用いて制御することにより、電子受容物質自体の光吸収に由来するバックグランド電流を極力抑制できることを意味する。特に、図16から分かるように、チタン酸ストロンチウムは400nm以上の波長の光をほとんど吸収しておらず、バックグランド電流が極めて低いという例8の結果と一致する。
【0123】
例10:被検DNAにおける色素標識位置による測定への影響
色素標識された被検DNAとして以下に示される3’ローダミンDNAおよび5’ローダミンDNAの二種類を使用したこと、および被検DNA溶液の濃度を200μMとしたこと以外は例6と同様にして試験を行った。
被検DNA(3’ローダミンDNA):
3’Rho−TTGCAGCACTGACCC 5’
被検DNA(5’ローダミンDNA):
3’ TTGCAGCACTGACCC−Rho5’
【0124】
なお、これらの被検DNAはいずれも、プローブDNAである5’−NH2−DNAとハイブリダイゼーション反応により二本鎖DNAを形成することができるものである。
【0125】
比較のため、被検DNAの代わりに、プローブDNAとの相補鎖を持たない、3’末端をローダミンBで標識された、以下の塩基配列を有する15塩基の核酸塩基(T−ローダミンDNA)を用いて、上記同様の試験を行った。
T−ローダミンDNA:
5’ TTTTTTTTTTTTTTT−Rho3’
【0126】
また、ブランクとして、プローブDNAおよび被検DNAのいずれも固定化されていない、作製されたままの作用電極についても光電流値を測定した。
【0127】
測定された光電流値(安定電流値)は表6に示される通りであった。
表 6
被検DNA 光電流値(mA)
3’ローダミンDNA 1.53
5’ローダミンDNA 1.28
T−ローダミンDNA(比較例) 0.29
ブランク(比較例) 0.04
【0128】
表6に示される通り、被検DNAの3‘末端を色素標識した場合と、被検DNAの5’末端を色素標識した場合の両方において、ほぼ同等の光電流が観測された。この結果から、被検DNAの3‘末端および5’末端のどちらに色素標識しても、高感度に被検DNAを検出できることが分かる。
一方、表6から分かるように、プローブDNAと相補鎖を持たないT−ローダミンDNAを使用した場合には、色素に由来する光電流がほとんど検出されなかった。すなわち、T−ローダミンDNAとプローブDNAとの間にハイブリダイゼーション反応が起こらなかったことが分かる。
また、ブランク試験の結果から、プローブDNAおよび被検DNAのいずれも固定化されていない、作製されたままの作用電極を使用した場合には、ほとんど光電流が検出されないことが分かる。
したがって、光電流の発生は基本的に被検DNAに標識された増感色素の光励起反応および電子受容物質への電子移動反応によって起こるものであり、その光電流値は電極上の二本鎖DNAの形成の割合に依存することが分かる。
【0129】
例11:光電流のアクションスペクトルの測定
被検DNA溶液の濃度を40μMとしたこと、光電流の測定の代わりに以下に述べる光電流のアクションスペクトルの測定を行ったこと以外は例6と同様にして試験を行った。
すなわち、光電流のアクションスペクトルの測定は、波長可変単色光源(分光計器製)を用いて行った。IPCE(Incident Photon to Current Efficiency:光電変換効率)をM. Gratzelらの報告(J. Am. Chem. Soc. 115, 6382, 1993)に基づき、下記式を用いて算出した。中心波長を各波長に設定し、半値幅を20nmとした。フォトンフラックス(Photon Flux)はスペクトルラディオメーター(ウシオ電機社製、USR−40D)を用いて測定した。
IPCE = 1250×光電流密度(μA/cm2)/[波長(nm)×フォトンフラックス(W/m2)]
【0130】
測定されたアクションスペクトル(IPCEの波長依存性)は図17に示される通りであった。図17には、使用した増感色素であるローダミンBの吸収スペクトルの併せて示してある。図17から分かるように、得られたアクションスペクトルは、増感色素(ローダミンB)の吸収スペクトルと同様のプロファイルを示した。これは、光電流が増感色素の励起に起因することを示唆する。すなわち、ローダミンBの吸収中心波長は520nmと見られるので、この波長域の光量を増加させることで、光電流値を増大できるものと考えられる。一方、420nm以下の波長領域では光電流が上昇する傾向が見られたが、この光電流は電子受容物質である酸化チタン自身の光励起に起因する光電流である。この電流は、被検DNAおよびプローブDNAのハイブリダイゼーションの有無にかかわらず発生し、いわゆるノイズとなる。したがって、センサの高精度化を実現させるためには、420nm以下の光を極力除去することが有効であることが分かる。
【0131】
例12:光源フィルタとバックグランド電流との関係
光学フィルタとして以下の6種類を使用したこと、およびハイブリダイゼーションを行わなかったこと以外は例6と同様にして試験を行った。
Y-43フィルタ:朝日テクノグラス社製、Y-43、紫外線カットフィルタ
550nm-40hwフィルタ:オプトライン社製、A06-8200843、中心波長550nm、半値幅40nm
20nm-220hwフィルタ:朝日分光社製、PB0620-220、中心波長620nm、半値幅220nm
600nm-260hwフィルタ:朝日分光社製、PB060-260、中心波長600nm、半値幅260nm
620nm-260hwフィルタ:朝日分光社製、PB0620-260、中心波長620nm、半値幅260nm
600nm-300hwフィルタ:朝日分光社製、PB0600-300、中心波長600nm、半値幅300nm
【0132】
また、色素の光吸収量を以下のようにして測定した。まず、酸化チタン電極上に吸着したDNAにラベルした色素を分光光度計(島津製作所社製、UV−3100)を用いて測定した。積分球を使用した拡散反射法に基づき、色素の反射率(R%)を算出した。このとき、反射率100%の参照物質として、硫酸バリウムの粉末を用いた。そして、式α(%)=100−R(%)に基づき、吸収率α(%)を算出した。
次いで、光吸収量を下記式に基づき、算出した。
【数1】

【0133】
測定されたバックグランド光電流値(安定電流値)および光吸収量は表7に示される通りであった。
表 7
フィルタ バックグランド光電流値 光吸収量
(μA) (mW/cm2)
Y-43フィルタ 46.6 4.3
550nm-40hwフィルタ 1.5 0.57
20nm-220hwフィルタ 11.8 1.6
600nm-260hwフィルタ 26.4 3.6
620nm-260hwフィルタ 16.4 2.7
600nm-300hwフィルタ 42.1 4.1
【0134】
ハイブリダイゼーション反応を行わない本例にあっては、増感色素の光励起が起こらないことから、電流値は本来ゼロとなることが望ましい。しかし、表7に示されるように、電子受容物質である酸化チタン自身の光励起による光電流がバックグランド電流として観測されてしまう。また、表7から分かるように、紫外線量の少ない550nm-40hwフィルタを使用した場合にはバックグランド電流を低減できるが、色素の光吸収量が他のフィルタよりも少なくなってしまう。したがって、バックグランドの低減には550nm-40hwフィルタの使用が好ましい一方、大きな光電流の値を得るためにはY-43フィルタの使用が有効であることが分かる。
【0135】
参考のため、上記6種類のフィルタを250Wのキセノンランプ光源(林時計工業社製、LA250Xe)に使用した場合の光源のスペクトル分布を、スペクトルラディオメーター(ウシオ電機、USR−40D)を用いて測定した。その結果は図18に示される通りであった。また、図18に示されるスペクトル分布図における350〜550nmの波長域を拡大した図を図19に示す。
【0136】
例13:光源フィルタとS/N比との関係
光学フィルタとして例11で用いたY-43フィルタおよび550nm-40hwフィルタを使用したこと、および被検DNA溶液の濃度を40μMとしたこと以外は例6と同様にして試験を行った。
【0137】
測定されたバックグランド光電流値の経時変化は図20に示される通りであった。図20に示されるように、Y-43フィルタの光電流の最大値は3.4mA、550nm-40hwフィルタの最大値は1.1mAとなった。すなわち、550nm-40hwフィルタを使用した場合の光電流の値はY-43フィルタを使用した場合の1/3程度と小さかった。これは、550nm-40hwフィルタは、例12の結果から分かるようにバックグランド電流を低減できるフィルタである一方、可視光の強度も弱くしてしまうため、増感色素の光吸収量が小さくなったためと考えられる。
【0138】
ここで、センサのシグナル/ノイズ比(S/N比)の指標として、光電流の最大値/バックグランド電流の比を考える。550nm-40hwフィルタを用いると、Y-43フィルタよりもバックグランド電流が1/30に低減される一方、光電流の最大値が1/3となる。したがって、550nm-40hwフィルタのS/N比はY-43フィルタに比較して、(1/3)/(1/30)=10倍向上することになる。他のフィルタに関しても同様な評価をおこなったところ、550nm-40hwフィルタのS/N比が最も優れていることが分かった。
【0139】
例14:照射光の強度依存性
被検DNA溶液の濃度を40μMとしたこと、および光源の強度を変化させたこと以外は例6と同様にして試験を行った。また、光強度をスペクトルラディオメーター(ウシオ電機社製、USR−40d)を用いて測定した。
【0140】
測定された光電流値(安定電流値)と、光強度との関係は図21に示される通りであった。図21に示されるように、光強度800mW/cm2の領域まで線形性が確認でき、光電流が反応速度は光強度の1乗に比例する光量律速であることが判明した。なお、一般的に、センサとして高精度でかつ安定に機能させるためには、反応速度が光強度の1/2乗に比例する拡散律速とはならない、光量律速下で評価することが望ましいとされている。
【0141】
例15:LED光源の検討
プローブDNAの担持を以下の通り行ったこと、ハイブリダイゼーションを行わなかったこと、および光源として以下のLEDを使用したこと以外は、例6と同様にして試験を行った。
赤色LED:オアシスRED、TOL-50aURsCEs
黄色LED:日亜化学、YELLOW NSPY-500S
白色LED:日亜化学、WHITE NSPW500BS
青色LED:豊田合成、BLUE E1L51-3B
緑色LED:豊田合成、GREEN E1L51-3G
なお、これらのLEDのスペクトル分布をスペクトルラディオメーター(ウシオ電機、USR−40D)を用いて測定したところ、図22に示される通りの結果が得られた。
【0142】
すなわち、プローブDNAの担持は以下の通り行った。まず、例6と同様にしてプローブDNAが担持される前の作用電極を作製した。こうして得られた作用電極にBLBランプで一晩紫外線照射を施し、汚れおよび残存有機物の除去を行った。次いで、プローブDNAとして以下に示される5’−NH2−3’ローダミンDNAを50mM HEPES(pH7.0)に溶解させて水溶液を調製した。この溶液を、予め95℃で3分間保持した後、氷上(2℃)で3分間以上冷却させることにより、熱変性させておいた。
プローブDNA(5’−NH2−3’ローダミンDNA):
5’ NH2−AACGTCGTGACTGGG 3’Rho
【0143】
先に得られた作用電極の電子受容層上に、プローブDNAと電子受容物質(酸化チタン)の結合力を向上させるために、シランカップリング剤による表面処理を行った。すなわち、イソプロパノール中にシランカップリング剤(信越化学社製、KBM−403)を0.5wt%溶解させた液を、75℃で5分間酸化チタンの表面に反応させた後、イソプロパノールで洗浄して乾燥した。こうして得られた作用電極表面にスペーサ用穴あきテープを貼り、ピンセットの先を用いてテープ接着面に残存する空気を除去した。このテープ上に、5mm×5mm角の大きさの開口部が形成されたシリコンシートを載置して密着させた。この開口部に先に調製した5’−NH2−3’ローダミンDNA溶液(40μM)を25μl装填した。このとき、ピペットチップの先端を用いて、シリコンシールの開口部の四隅まで充分にDNA溶液が行き渡るようにした。続いて、DNA溶液中に気泡が極力入らないようにガラス板で真上から蓋をして、湿らせた紙等で蒸気圧が調整されたプラスチック容器に収容した。この容器中に60℃で15時間保持して、5’アミン−3’ローダミンDNAをインキュベートした。その後、DNA溶液を除去し、流水で軽く電極表面を2秒間洗浄した後、空気を吹き付けて残水を飛散させた。こうして、プローブDNAが担持された作用電極を得た。
【0144】
こうしてプローブ物質が担持された作用電極に新たなシリコンシールを載置し、開口部にブロッキング剤として10μMのジエタノールアミン25μlを注入した。ブロッキング剤中に気泡が極力入らないようにガラス板で真上から蓋をして、湿らせた紙等で蒸気圧を調整したプラスチック容器に入れた。そして、60℃で30分間保持して、ブロッキング剤をインキュベートした。電極表面を再度流水で軽く2秒間洗浄した後、空気を吹き付けて残水を飛散させた。こうしてブロッキングが施された作用電極を得た。
【0145】
また、ブランクとして、作用電極に上記プローブDNAを固定化しないブランク電極についても光電流を測定した。プローブDNAを固定化した作用電極の光電流と、プランク電極の光電流との比をS/N比として評価した。
【0146】
測定された光電流、ブランク電流、光電流とブランク電流の差、およびS/N比を図23に示す。図23から分かるように、黄色および緑色のLEDにおいて、ブランク電流を低く抑えることができ、良好な結果が得られた。青色および白色のLEDは400nm以下の波長を若干含むため、ノイズとして検出される酸化チタン由来のバックグランド電流値が大きくなった。一方、赤色のLEDは最も光強度が強いにもかかわらず、色素として用いたローダミンの励起波長よりも長波長のため、光電流が検出されなかった。
【0147】
例16:LED光源を用いた被検DNAの検出
被検DNA溶液の濃度を10、20、および30μMとしたこと、プローブDNAの担持を以下の通り行ったこと、および光源として以下のLEDを使用したこと以外は、例6と同様にして光電流の測定を行った。
黄色LED:日亜化学、YELLOW NSPY-500S
緑色LED:豊田合成、GREEN E1L51-3G
【0148】
すなわち、プローブDNAの担持は以下の通り行った。まず、例6と同様にしてプローブ物質が担持される前の作用電極を作製した。こうして得られた作用電極にBLBランプで一晩紫外線照射を施し、汚れおよび残存有機物の除去を行った。
【0149】
次いで、プローブDNAとして例6で使用したものと同じ5’−NH2−DNAを50mM HEPES(pH7.0)に溶解させて水溶液を調製した。この溶液を、予め95℃で3分間保持した後、氷上(2℃)で3分間以上冷却させることにより、熱変性させておいた。
【0150】
先に得られた作用電極の電子受容層上に、プローブDNAと電子受容物質(酸化チタン)の結合力を向上させるために、シランカップリング剤による表面処理を行った。すなわち、イソプロパノール中にシランカップリング剤(信越化学、KBM−403)を0.5wt%溶解させた液を75℃で5分間電子受容層(酸化チタン)の表面に反応させた後、イソプロパノールで洗浄して乾燥した。こうして得られた作用電極表面にスペーサ用穴あきテープを貼り、ピンセットの先を用いてテープ接着面に残存する空気を除去した。このテープ上に、5mm×5mm角の大きさの開口部が形成されたシリコンシートを載置して密着させた。この開口部に先に調製した5’−NH2−DNA溶液(200μM)を25μl注入した。このとき、ピペットチップの先端を用いて、シリコンシールの開口部の四隅まで充分にDNA溶液が行き渡るようにした。続いて、DNA溶液中に気泡が極力入らないようにガラス板で真上から蓋をして、湿らせた紙等で蒸気圧が調整されたプラスチック容器に収容した。この容器中に60℃で6時間保持して、5’−NH2−DNAをインキュベートした。その後、DNA溶液を除去し、流水で軽く電極表面を2秒間洗浄した後、空気を吹き付けて残水を飛散させた。こうして、プローブDNAが担持された作用電極を得た。
【0151】
こうしてプローブ物質が担持された作用電極に新たなシリコンシールを載置し、開口部にブロッキング剤として10μMのジエタノールアミン25μlを注入した。ブロッキング剤中に気泡が極力入らないようにガラス板で真上から蓋をして、湿らせた紙等で蒸気圧を調整したプラスチック容器に入れた。そして、60℃で30分間保持して、ブロッキング剤をインキュベートした。電極表面を再度流水で軽く2秒間洗浄した後、空気を吹き付けて残水を飛散させた。こうしてブロッキングが施された作用電極を得た。
【0152】
測定された光電流と被検DNA濃度との関係は図24に示される通りであった。黄色および緑色LEDを光源として用いた場合、被検DNA濃度に依存した光電流が観測され、ハイブリダイゼーションを行わなかった濃度0μMのブランクよりも優位な光電流が観測された。これらの結果から、黄色および緑色LED光源は被検DNAの定量測定に適していることが分かる。
【0153】
例17:ルテニウム錯体スクシンイミジルエステルを用いた被検DNAの色素標識
被検DNAを標識するための増感色素として、アミノ基を持つ蛋白質を色素修飾するための色素として市販されている、下記式で表されるルテニウム錯体スクシンイミジルエステル(Ru−ONSu)を用意した。
【化1】

【0154】
この増感色素を用いたDNA末端アミンへの修飾を以下の通り行った。まず、上記増感色素を以下の条件で3’末端にアミノ基を持つ15merのssDNAと反応させた。
Ru−ONSu:200nmol/25μl
ssDNA:20nmol/25μl
緩衝液:50mM HEPES(pH7.0)
TAPS(pH8.0)
TAPS(pH9.0)
【0155】
各溶液を室温で15時間振盪させた後、ゲルろ過、続いてエタノール沈殿を行い、色素修飾DNAを精製した。Ru−ONSuの濃度を458nmの吸収スペクトルで測定した。また、ssDNAの濃度をMolecularProbes社の定量キットを用いて測定した。得られた測定結果を基に、ssDNAに対するRu−ONSuの修飾比(モル比)を算出した。得られた結果は表8に示される通りであった。
表 8
緩衝液 修飾比(Ru/DNA)
HEPES(pH7.0) 5.6
TAPS(pH8.0) 3.1
TAPS(pH9.0) 4.4
【0156】
表8に示される結果から、スクシンイミジルエステル誘導体をDNAの標識色素としても利用可能なことが分かる。表8の結果から分かるように、スクシンイミジルエステル誘導体は末端アミンのみならず核酸塩基中のアミンにも結合していると見られるため、この色素によれば1分子のDNAに対して複数個の標識色素を導入できることも分かる。
【0157】
例18:光電流のアクションスペクトルの測定
色素標識された被検DNAとして以下に示される3’AlexaFluor(R)647DNAを使用し、かつプローブDNAとして5’−NH2−DNA―2を使用したこと、および被検DNA溶液の濃度を40μMとしたこと以外は例11と同様にして光電流のアクションスペクトルの測定を行った。
被検DNA(3’AlexaFluora647DNA):
3’ AlexaFluora647−CCATGATGTCAGTTT 5’
プローブDNA(5’−NH2−DNA−2):
5’ NH2−GGTACTACAGTCAAA 3’
なお、これらの被検DNAとプローブDNAは、ハイブリダイゼーション反応により二本鎖DNAを形成することができるものである。
【0158】
測定されたアクションスペクトル(IPCEの波長依存性)は図25に示される通りであった。図25から分かるように、得られたアクションスペクトルは、増感色素であるAlexaFluor(R)647の吸収スペクトルと同様のプロファイルを示した。これは、光電流が増感色素の励起に起因することを示唆する。AlexaFluor(R)647の吸収中心波長は640nmと見られるので、前述したローダミンB色素の吸収中心波長(520nm)と分離して、それぞれの色素由来の光電流を観測できる。よって、複数の吸収波長の異なる色素を各々のDNAに標識し、それらの色素を別々に励起できる光を照射することで、同時に二本鎖DNAの形成を光電流として観測することが可能となる。
【0159】
例19: 酸化チタン多孔質膜を電子受容層として備えた作用電極の微細構造の評価
例6と同様にして、酸化チタン多孔質膜を電子受容層として備えた作用電極の作製を行った。得られた作用電極の断面および表面を走査型電子顕微鏡(S-4100型、日立製作所製)により観察した。作用電極の断面について得られたSEM画像を図26に、作用電極の酸化チタン多孔質膜表面について得られたSEM画像を図27に、それぞれ示す。図26に示される画像から、多孔質酸化チタン電極の膜厚は約20μmであり、表面が非常に平滑な均一な膜構造を有することが分かる。また、図27に示される画像から、得られた多孔質電極は、使用した酸化チタン粉末の一次粒子(粒径:約40〜50nm)に相当する粒子が良好に分散した、比較的大きなメソ細孔を有する良好な多孔質膜であることが分かった。従って、得られた多孔質膜にあっては、比較的分子サイズの大きいDNA分子であっても細孔内への拡散が容易に起こるものと考えられる。
【0160】
また、得られた酸化チタン多孔質膜の細孔分布を、細孔分布測定装置(日本ベル製、Belsorp28SA)を用いて測定した。このとき、測定サンプルとして、焼成後の作用電極から酸化チタン多孔質膜を剥離させたものを用いた。サンプルの表面積はBET式より、細孔径はDH式により算出した。その結果、BET比表面積は19.8m2/gと比較的高く、細孔分布は67.8nmにピークを持つ曲線が得られた。これらの結果から、得られた酸化チタン多孔質膜は、比較的大きな細孔が均一に開いた非常にポーラスな構造を有することが分かった。このような大きな細孔内にあっては、比較的嵩高いDNA分子(例えば一本鎖DNAの幅が約2nmのもの)の拡散が容易に起こるものと考えられる。
【0161】
例20:LED光源に対する酸化物半導体電極の最適化
(1)被検物質およびプローブ物質の準備
色素標識された被検物質(以下、被検DNAともいう)として、5’末端を蛍光色素Cy5で標識された、以下の塩基配列を有する25塩基の核酸塩基(5’Cy5DNA)を用意した。また、プローブ物質(以下、プローブDNAともいう)として上記被検DNAと相補鎖を有する5’末端にアミンを標識した25塩基の核酸塩基(5’−NH2−DNA)を用意した。すなわち、このプローブDNAと被検DNAは、ハイブリダイゼーション反応により二本鎖DNAを形成することができる。
被検DNA(5’Cy5DNA):
3’−TGGAAGTAGTTTTTGTAGTAGTAGG−Cy5−5’
プローブDNA(5’−NH2−DNA):
5’NH2−ACCTTCATCAAAAACATCATCATCC−3’
【0162】
(2)作用電極の作製およびプローブ物質の担持
プローブ物質として上記(1)に示したプローブDNAを使用したこと、チタニア微粉末またはその代わりとして以下に示される酸化物半導体微粉末を使用したこと、およびペーストを塗布する際の膜厚を60μmとしたこと以外は例6と同様にしてプローブDNAが担持された作用電極を得た。
TiO2:昭和タイタニウム社製、F-3、平均粒径50nm
ZnO:シーアイ化成社製、NanotekZnO)
Nb2O5:多木化学社製、酸化ニオブゾルを蒸発乾固した粉末
WO3:和光純薬社製
SrTiO3:Sr(NO3)2+Ti(OiPr)4を加水分解後焼成して得た粉末
In2O3:和光純薬社製
Ta2O5:シグマアルドリッチジャパン社製
【0163】
用いた各種酸化物半導体のバンドギャップ、平均粒径、およびバックグランド電流を表9に示す。なお、バックグランド電流とは、プローブDNAおよび被検DNAのどちらも吸着していない剥き出し(Bare)の電極の光電流である。
表 9
酸化物半導体 バンドギャップ(eV) 平均粒径(nm) バックグランド電流(nA)
酸化チタン(アナターゼ) 3.2 50 3
酸化亜鉛 3.1 30 25
酸化ニオブ 3.1 10 20
酸化タングステン 2.8 100 25
チタン酸ストロンチウム 3.2 200 0
酸化インジウム 3.8 100 15
酸化タンタル 3.9 500 0
【0164】
上記プローブ物質が担持された作用電極を、湿らせた紙等で蒸気圧が調整されたプラスチック容器に入れて、60℃で30分間、飽和水蒸気中に置いた。こうして蒸気に触れさせた電極に90℃で3分間加熱処理を行い、新たなシリコンシールを電極に載せた。
【0165】
(3)ハイブリダイゼーション
被検DNA溶液として10μMの5’Cy5DNA溶液を使用したこと、およびインキュベートの温度を50℃としたこと以外は例6と同様にしてハイブリダイゼーションを行った。
【0166】
(4)測定用セルの組み立て
例6と同様にしてサンドイッチ型の測定用セルを組み立てた。
【0167】
(5)光電流の測定
光源として赤色LED (CCS社製、HLV-27-NR-R)を用いたこと、および紫外線カットフィルタを使用しなかったこと以外は例6と同様にして光電流の測定を行った。
その結果は、図28に示される通りであった。図28に示されるように、赤色LED照射下でCy−5色素標識DNAを被検DNAとして用いた場合、酸化インジウム、酸化亜鉛、および酸化チタン電極において高い光電流値が得られることが判明した。また、その他の酸化物半導体電極、酸化タングステン、酸化ニオブ、チタン酸ストロンチウム、および酸化タンタルにおいてもバックグランド電流値以上の光電流値が得られているのでDNAセンサーとして有効であることが判明した。上記結果から、必ずしも酸化チタン電極だけが最適な電極であるとは限らず、光源、標識色素、およびDNA等の諸条件に応じて最適な電極も変化し得ることが分かる。
【0168】
例21:電子受容層のみで構成される作用電極を用いた例
(1) 色素標識プローブDNAの準備
色素標識されたプローブDNAとして、3’末端をCy5で標識された、以下の塩基配列を有する25塩基の核酸塩基(Cy5標識ssDNA)を用意した。
色素標識プローブDNA(Cy5標識ssDNA):
5’NH2−ACCTTCATCAAAAACATCATCATCC−Cy5−3’
【0169】
(2)作用電極の準備および色素標識DNAの担持
電子受容層のみで構成される作用電極として、フッ素をドープした酸化スズ(F−SnO2:FTO)コートガラス(エイアイ特殊硝子社製、U膜、シート抵抗:15Ω/□)およびスズをドープした酸化インジウム(Sn−InO2:ITO)コートガラス(東洋精密工業株式会社製、100Ω/□)を用意した。これらのガラスをアセトンと水で洗浄し、酸素雰囲気下で紫外線照射を30分間施して、汚れおよび残存有機物の除去を行った。洗浄されたガラスにスペーサ用穴あきテープを貼り、ピンセットの先を用いてテープ接着面に残存する空気を除去した。このテープ上に5mm×5mm角の大きさの開口部が形成されたシリコンシートを戴置して密着させた。
【0170】
続いて、0、1、10、50μMの各濃度に調製したCy5標識ssDNA溶液を95℃で5分間保持した後、直ちに氷上に移して10分間保持してDNAを変性させ、先に用意した電極上の開口部に25μlを装填した。この時ピペットチップの先端を用いて、シリコンシールの開口部の四隅まで充分にDNA溶液が行き渡るようにした。そして、DNA溶液中に気泡が入らないようにガラス板で真上から蓋をして、湿らせた紙等で蒸気圧が調製されたプラスチック容器に収容して、60℃で一晩インキュベートさせた。インキュベート後、DNA溶液を除去し、流水で軽く電極表面を約2秒間洗浄した後、空気を吹き付けて残水を飛散させた。その後、例6の表3に示した条件でDNAを吸着させた電極を洗浄し、最後に空気を吹き付けて残水を飛散させた。
【0171】
(3)測定用セルの組み立て
こうして得られた作用電極と、対電極としての白金電極とを用いて、図6に示されるようなフロー型測定セルを組み立てた。その際、作用電極を白金対電極と対向させて配置するとともに、その間には、両電極間の短絡を防止しかつ電解液を充填する空間を形成するための膜厚500μmのシリコンシートを挿入した。シリコンシートには5mm×5mm角よりも十分大きい穴が空いており、ここに送液された電解液が溜まり、作用電極上に固定化されたDNAが接触する構造になっている。作用電極は電気的に接しているスプリングプローブを介して、白金電極は端部に接続されたリード線を介してポテンシオスタット(ビー・エー・エス株式会社、ALS Modl832A)に接続した。
電解液として、体積比が4:6のアセトニトリルと炭酸エチレンの混合溶媒にヨウ素0.06Mとテトラプロピルアンモニウムヨーダイド0.6Mを溶解した混合液を用意した。この電解液を先に述べたフロー型測定セルに組み込まれた作用電極と白金対電極の間に充填させた。
【0172】
(4)光電流の測定
フロー型測定セルに固定したLED(CCS社製、HLV-27-NR-R)から生じた光を作用電極表面に照射し、作用電極と白金対電極との間に流れる電流を経時的に測定した。測定は180秒間行ったが、光の照射は電流の測定開始60秒後から60秒間のみ行った。観測した光電流について、120秒後の光電流値から180秒後の光電流値を差し引くことにより補正を行った。
各濃度のCy5標識ssDNAについて測定されたた光電流値は、図29に示される通りであった。図29に示されるように、FTOまたはITOを電子受容層として用いた場合、その下層に導電性基材を更に設けること無く、作用電極として十分に機能させることが出来る。すなわち、FTOおよびITOは電子受容層のみならず導電性基材としても機能することが確認された。
【0173】
例22:蛋白質の測定
(1)被検物質およびプローブ物質の準備
色素標識された被検物質として、ローダミンで標識したHSA(ヒト血清アルブミン)を用意した。また、プローブ物質として、抗HSA抗体(ウサギ抗HSA血清、日本バイオテスト研究所)を用意した。
【0174】
(2)作用電極の作製およびプローブ物質の担持
例6と同様にして作用電極の作製、および汚れおよび残存有機物の除去を行った。
得られた作用電極上に、スペーサ用穴あきテープを貼り、ピンセットの先を用いてテープ接着面に残存する空気を除去した。このテープ上に、5mm×5mm角の大きさの開口部が形成されたシリコンシートを戴置して密着させた。
次いで、プローブ物質として抗HSA抗体(ウサギ抗HSA血清、日本バイオテスト研究所)を50mM HEPES緩衝液(pH7.0)に7.68mg/mlになるように溶解させて水溶液を調製した。この溶液を、作用電極上のシリコンシールの開口部に25μl/電極ずつ装填して、ガラス板で覆い、4℃で一晩放置して固相化した。こうして得られた作用電極を50mM HEPES緩衝液(pH 7.0)で3回洗浄した。洗浄後、0.2%カゼインを含む50mM HEPES緩衝液(pH 7.0)をシリコンシールを作用電極表面に載置した開口部に25μl/電極ずつ装填して、ガラス板で覆い30℃で90分インキュベートし、ブロッキングを行った。
標識キットとしてFluoReporter Tetramethylrhodamine Protein Labeling kit(Molecular Probes社)を用いて、テトラメチルローダミンをHSAに標識した。製造元のプロトコルに従い、色素の標識反応、精製、および分離を行い、標識比1のローダミン標識HSA溶液を3.78mg/ml濃度で1.5ml得た。
【0175】
(3)被検物質の装填
次いで、ブロッキング後の作用電極を0.05% Tween20を含む50mM HEPES緩衝液(pH7.0)(以下T−HEPES)で3回洗浄した。ローダミン標識HSAをブロッキング液で段階希釈することにより、0.1、0.33、1.0、および3.3mg/mlの各濃度のローダミン標識HSA溶液を作製した。各濃度のローダミン標識HSA溶液を作用電極上のシリコンシールの開口部に25μl/電極ずつ装填して、ガラス板で覆い、30℃で90分間インキュベートした。その後、T−HEPESで3回洗浄し、超純水でリンスした。
【0176】
(4)測定用セルの組み立て
電解液として100mMエチレンジアミン四酢酸、100mM NaCl、および100mM Na2SO4からなる成分を溶解した水溶液を使用したこと以外は例21と同様にしてフロー型測定セルを組み立てた。
【0177】
(5)光電流の測定
フロー型測定セルに固定した緑色LED(CCS社製、HLV-24GR-NR-3W)と集光マイクロファイバヘッド(CCS社製、HFR-25-30)を用いて作用電極表面の3cm上方から光を照射し、作用電極と白金対電極の間に流れる電流を経時的に測定した。測定は180秒間行ったが、光の照射は電流の測定開始60秒後から60秒間のみ行った。観測した光電流は120秒後の光電流値から180秒後の光電流値を差し引くことで補正を行った。
各濃度のHSA溶液について測定された光電流値は、図30に示される通りであった。抗原濃度が0.1〜3.3mg/mlの範囲で相関係数の高い検量線を引くことができ、蛋白質の定量が可能であることが分かった。
【図面の簡単な説明】
【0178】
【図1】被検物質が一本鎖の核酸であり、プローブ物質が前記核酸に対して相補性を有する一本鎖の核酸である場合における、被検物質のプローブ物質への固定化工程を示す図であり、(a)は被検物質が予め増感色素で標識されてなる場合を、(b)は二本鎖の核酸にインターカレーション可能な増感色素を添加した場合をそれぞれ示す。
【図2】被検物質がリガンドであり、媒介物質が受容体蛋白質分子であり、プローブ物質が二本鎖の核酸である場合における、被検物質のプローブ物質への固定化工程を示す図である。
【図3】光源が配置された測定用セルを示す図であり、図中の点線で囲まれる部分21が測定用セルである。
【図4】図3に示される測定用セルの平面図である。
【図5】互いに競合する特異的結合性を有する被検物質および第二の被検物質が抗原であり、プローブ物質が抗体である場合の、被検物質のプローブ物質への固定化工程を示す図である。
【図6】フロー型測定用セルおよびパターニングされた作用電極を用いた装置の一例を示す図である。
【図7】パターニングされた作用電極の一例を示す図であり、(a)は作用電極の平面図を、(b)は作用電極の断面図を、(c)は別の態様の作用電極の断面図を、(d)はさらに別の態様の作用電極の断面図をそれぞれ示す。
【図8】パターニングされた作用電極の他の一例を示す図であり、(a)は作用電極の平面図を、(b)は作用電極の断面図を、(c)は別の態様の作用電極の断面図をそれぞれ示す。
【図9】パターニングされた作用電極に用いられる光源の一例を示す図である。
【図10】パターニングされた作用電極に用いられる光源の他の一例を示す図である。
【図11】例2〜5において得られた、28.6μMローダミン修飾DNA溶液を試料液とし手用いた場合の検出電流の経時変化を示す図である。
【図12】例2〜5において得られた、286μMローダミン修飾DNA溶液を試料液として用いた場合の検出電流の経時変化を示す。
【図13】例2において得られた、0nM、28.6μM、および286μMの各濃度のローダミン修飾DNA溶液を試料液として用いた場合の、定常状態にある検出電流を示す図である。
【図14】例6において被検物質DNAについて得られた、低濃度域における検量線を示す図である。
【図15】例6において被検物質DNAについて得られた、高濃度域における検量線を示す図である。
【図16】例9において得られた、拡散反射スペクトルによる各種酸化物半導体の光吸収測定の結果を示す図である。
【図17】例11において得られたアクションスペクトルを示す図である。
【図18】例12において使用した各種光学フィルタを介して照射した光のスペクトル分布を示す図である。
【図19】図18に示されるスペクトル分布図における350〜550nmの波長域を拡大した図である。
【図20】例13において得られた、各種光学フィルタを用いた場合におけるバックグランド光電流値の経時変化を示す図である。
【図21】例14において得られた、光電流値と、光強度との関係を示す図である。
【図22】例15において使用した各種LEDのスペクトル分布を示す図である。
【図23】例15において得られた、各種LEDを使用した場合における、光電流、ブランク電流、光電流とブランク電流の差、およびS/N比を示す図である。
【図24】例16において得られた、光電流と、被験DNA濃度との関係を示す図である。
【図25】例18において得られた、アクションスペクトルを示す図である。
【図26】例19において得られた、作用電極の断面について得られたSEM画像である。
【図27】例19において得られた、作用電極の酸化チタン多孔質膜表面について得られたSEM画像である。
【図28】例20において得られた、各種酸化物半導体電極について得られた光電流値を示す図である。
【図29】例21において得られた、光電流と、Cy5標識ssDNA濃度との関係を示す図である。
【図30】例22において得られた、光電流と、ローダミン標識HSA濃度との関係を示す図である。
【発明の背景】
【0001】
発明の分野
本発明は、光電流を用いて、核酸、外因性内分泌攪乱物質、抗原等の特異的結合性を有する被検物質を特異的に検出する方法、それに用いられる電極、測定用セル、および測定装置に関する。
【0002】
背景技術
生体試料中のDNAを解析する遺伝子診断法が、各種病気の新たな予防および診断法として、有望視されている。このようなDNA解析を簡便かつ正確に行う技術として、以下のものが提案されている。
【0003】
被検体DNAを、これと相補的な塩基配列を有し、かつ蛍光物質を標識されたDNAプローブとハイブリダイズさせ、その際の蛍光シグナルを検出する、DNAの分析方法が知られている(例えば、特許文献1(特開平7−107999号公報)および特許文献2(特開平11−315095号公報)参照)。この方法にあっては、ハイブリダイゼーションによる二本鎖DNAの形成を色素の蛍光により検出する。
【0004】
また、一本鎖に変性された遺伝子サンプルを、これに相補性を有する一本鎖の核酸プローブとハイブリダイゼーションさせた後、インターカレータ等の二本鎖認識体を添加して電気化学的に検出する方法が知られている(例えば、特許文献3(特許公報第2573443号)および非特許文献1(表面科学Vol. 24, No. 11. Pp. 671-676, 2003)参照)。
【0005】
一方、近年、ダイオキシンを始めとする外因性内分泌撹乱物質(環境ホルモン)の生殖系および神経系等への障害が社会問題化している。現在、外因性内分泌撹乱毒性の検出は様々な方法によって行われているが、そのような物質はわずか10pptレベル程度の極めて低い濃度で毒性を示す。このため、そのような低濃度範囲における外因性内分泌撹乱物質の検出方法が望まれている。
【0006】
特に、外因性内分泌撹乱物質は、受容体等のタンパク質を介して標的DNAに結合し、それにより当該DNAの発現等に影響を与え、毒性を生じる。すなわち、外因性内分泌撹乱物質は、DNAに直接的に結合するのではなく、受容体等のタンパク質を介して間接的DNAに結合する。そのため、DNA結合性を用いたプレスクリーニング等の従来の方法にあっては、その結合の評価は容易ではない。
【0007】
ところで、増感色素を用いて光から電気エネルギーを発生させる太陽電池が知られている(例えば、特許文献4(特開平1−220380号公報)参照)。この太陽電池は、多結晶の金属酸化物半導体を有し、かつその表面積に広範囲にわたり増感色素の層が形成されてなるものである。しかしながら、このような電極を生物化学的な分析に応用しようとする試みは未だなされていない。
【特許文献1】特開平7−107999号公報
【特許文献2】特開平11−315095号公報
【特許文献3】特許公報第2573443号
【特許文献4】特開平1−220380号公報
【非特許文献1】表面科学Vol. 24, No. 11. Pp. 671-676, 2003
【発明の概要】
【0008】
本発明者らは、今般、被検物質とプローブ物質との直接または間接的な特異的結合を介して作用電極に増感色素を固定させ、この増感色素を光励起させて発生する光電流を検出することにより、被検物質を高感度で簡便かつ正確に検出および定量出来るとの知見を得た。また、一枚の作用電極上で、複数の試料を個別に測定したり、あるいは複数種類の被検物質の分析を同時に行えるとの知見も得た。
【0009】
したがって、本発明は、特異的結合性を有する被検物質を高感度で簡便かつ正確に検出および定量することを目的としている。
【0010】
そして、本発明の光電流を用いた被検物質の特異的検出方法は、
被検物質を含む試料液と、該被検物質と直接または間接的に特異的に結合可能なプローブ物質を表面に備えた作用電極と、対電極とを用意し、
増感色素の共存下、前記試料液を前記作用電極に接触させて、前記プローブ物質に前記被検物質を直接または間接的に特異的に結合させ、該結合により前記増感色素を前記作用電極に固定させ、
前記作用電極と前記対電極とを電解質媒体に接触させ、そして、
前記作用電極に光を照射して前記増感色素を光励起させ、該光励起された増感色素から前記作用電極への電子移動に起因して前記作用電極と前記対電極との間に流れる光電流を検出すること
を含んでなるものである。
【0011】
また、本発明の電極は、上記方法において作用電極として用いられる電極であって、
導電性基材と、
該導電性基材上に形成される、前記増感色素が光励起に応じて放出する電子を受容可能な電子受容物質を含んでなる電子受容層と、
を備えたものである。
【0012】
さらに、本発明の測定用セルは、上記方法に用いられる測定用セルであって、
上記作用電極と、
対電極と、
前記作用電極および前記対電極が接触される電解質媒体と
を備えたものである。
【0013】
また、本発明の測定装置は、上記方法に用いられる測定装置であって、
上記測定用セルと、
前記作用電極の表面に光を照射する光源と、
前記作用電極と前記対電極との間を流れる電流を測定する電流計と
を備えたものである。
【発明の具体的説明】
【0014】
光電流を用いた被検物質の特異的検出
本発明の方法にあっては、まず、被検物質を含む試料液と、作用電極と、対電極とを用意する。本発明に用いる作用電極は、被検物質と直接または間接的に特異的に結合可能なプローブ物質を表面に備えた電極である。すなわち、プローブ物質は、被検物質と直接、特異的に結合する物質のみならず、被検物質を受容体蛋白質分子等の媒介物質に特異的に結合させて得られる結合体と特異的に結合可能な物質であってよい。次いで、増感色素の共存下、試料液を作用電極に接触させて、プローブ物質に被検物質を直接または間接的に特異的に結合させ、この結合により増感色素を作用電極に固定させる。増感色素は、光励起に応じて作用電極に電子を放出可能な物質であり、被検物質あるいは媒介物質に予め標識させておくか、あるいは被検物質およびプローブ物質の結合体にインターカレーション可能な増感色素を用いる場合には試料液に単に添加すればよい。
【0015】
そして、作用電極と対電極とを電解質媒体に接触させた後、作用電極に光を照射して増感色素を光励起させると、光励起された増感色素から電子受容物質へ電子移動が起こる。この電子移動に起因して作用電極と対電極との間に流れる光電流を検出することにより、被検物質を高い感度で検出することができる。また、この検出電流は試料液中の被検試料濃度との高い相関関係を有しているので、測定された電流量または電気量に基づき被検試料の定量測定を行うことができる。
【0016】
被検物質およびプローブ物質
本発明の方法における被検物質としては、特異的な結合性を有する物質であれば限定されず、種々の物質であってよい。このような被検物質であれば、被検物質と直接または間接的に特異的に結合可能なプローブ物質を作用電極表面に担持させておくことにより、被検物質をプローブ物質に直接または間接的に特異的に結合させて検出することが可能となる。
【0017】
すなわち、本発明の方法にあっては、被検物質およびプローブ物質として互いに特異的に結合可能なものを選択することができる。すなわち、本発明の好ましい態様によれば、特異的な結合性を有する物質を被検物質とし、被検物質と特異的に結合する物質をプローブ物質として作用電極に担持させるのが好ましい。これにより、作用電極上に被検物質を直接、特異的に結合させて検出することができる。この態様における、被検物質およびプローブ物質の組合せの好ましい例としては、一本鎖の核酸および核酸に対して相補性を有する一本鎖の核酸の組合せ、ならびに抗原および抗体の組合せが挙げられる。
【0018】
本発明のより好ましい態様によれば、被検物質を一本鎖の核酸とし、プローブ物質を核酸に対して相補性を有する一本鎖の核酸とするのが好ましい。この態様における被検物質の作用電極への特異的結合の工程を図1(a)および(b)に示す。これらの図に示されるように、被検物質としての一本鎖の核酸1は、作用電極3上に担持されたプローブ物質としての相補性を有する一本鎖の核酸4とハイブリダイズされて、二本鎖の核酸7を形成する。
【0019】
一本鎖の核酸を被検物質とする場合、プローブ物質である核酸と相補性部分を有していればよく、被検物質を構成する塩基対の長さは限定されないが、プローブ物質が核酸に対して15bp以上の相補性部分を有するのが好ましい。本発明の方法によれば、200bp、500bp、1000bpの塩基対を有する比較的鎖長の長い核酸であっても、高感度にプローブ物質と被検物質の核酸同士の特異的結合形成を光電流として検出することができる。
【0020】
被検物質としての一本鎖の核酸を含む試料液は、末梢静脈血のような血液、白血球、血清、尿、糞便、精液、唾液、培養細胞、各種臓器細胞のような組織細胞等の、核酸を含有する各種検体試料から、公知の方法により核酸を抽出して作製することができる。このとき、検体試料中の細胞の破壊は、例えば、振とう、超音波等の物理的作用を外部から加えて担体を振動させることにより行なうことができる。また、核酸抽出溶液を用いて、細胞から核酸を遊離させることもできる。核酸溶出溶液の例としては、SDS、Triton-X、Tween-20のような界面活性剤、サポニン、EDTA、プロテア−ゼ等を含む溶液が挙げられる。これらの溶液を用いて核酸を溶出する場合、37℃以上の温度でインキュベ−トすることにより反応を促進することができる。
【0021】
本発明のより好ましい態様によれば、被検物質とする遺伝子の含有量が微量である場合には、公知の方法により遺伝子を増幅した後検出を行なうのが好ましい。遺伝子を増幅する方法としては、ポリメラ−ゼチェインリアクション(PCR)等の酵素を用いる方法が代表的であろう。ここで、遺伝子増幅法に用いられる酵素の例としては、DNAポリメラ−ゼ、Taqポリメラ−ゼのようなDNA依存型DNAポリメラ−ゼ、RNAポリメラ−ゼIのようなDNA依存型RNAポリメラ−ゼ、Qβレプリカ−ゼのようなRNA依存型RNAポリメラ−ゼが挙げられ、好ましくは温度を調節するだけで連続して増幅を繰り返すことができる点で、Taqポリメラ−ゼを用いるPCR法である。
【0022】
本発明の好ましい態様によれば、上記増幅時に特異的に核酸を増感色素で標識することが出来る。一般的には、DNAにアミノアリル修飾dUTPを取り込ませることにより行うことができる。この分子は未修飾の dUTP と同じ効率で取り込まれる。次のカップリング段階において、N−ヒドロキシサクシンアミド(N-hydroxysuccinimide)により活性化された蛍光色素が修飾 dUTP と特異的に反応し、均一に増感色素で標識された被検物質が得られる。
【0023】
本発明の好ましい態様によれば、上記のようにして得られた核酸の粗抽出液あるいは精製した核酸溶液をまず90〜98℃、好ましくは95℃以上の温度で熱変性を施し、一本鎖核酸を調製することができる。
【0024】
本発明の方法にあっては、被検物質とプローブ物質が間接的に特異的に結合するものであってもよい。すなわち、本発明の別の好ましい態様によれば、特異的な結合性を有する物質を被検物質とし、この被検物質と特異的に結合する物質を媒介物質として共存させ、この媒介物質と特異的に結合可能な物質をプローブ物質として作用電極に担持させるのが好ましい。これにより、プローブ物質に特異的に結合できない物質であっても、媒介物質を介して作用電極上に間接的に特異的に結合させて検出することができる。この態様における、被検物質、媒介物質、およびプローブ物質の組合せの好ましい例としては、リガンド、このリガンドを受容可能な受容体蛋白質分子、およびこの受容体蛋白質分子と特異的に結合可能な二本鎖の核酸の組合せが挙げられる。リガンドの好ましい例としては、外因性内分泌攪乱物質(環境ホルモン)が挙げられる。外因性内分泌撹乱物質とは、受容体蛋白質分子を介してDNAに結合し、その遺伝子発現に影響して毒性を生じる物質であるが、本発明の方法によれば、被検物質によりもたらされる受容体等のタンパク質のDNAに対する結合性を簡便にモニタリングすることができる。この態様における被検物質の作用電極への特異的結合の工程を図2に示す。図2に示されるように、被検物質としてのリガンド10は、まず、媒介物質である受容体蛋白質分子11に特異的に結合する。そして、リガンドが結合された受容体蛋白質分子13が、プローブ物質としての二本鎖の核酸14に特異的に結合する。
【0025】
本発明の方法によれば、1つのプローブ物質に対し、異なる入手経路に由来する複数の同一被検物質を同時に反応させ、サンプルの由来による被検物質量の差異を判断することにより、目的とする入手経路に由来する被検物質を定量することも可能である。具体的な適用例としては、マイクロアレイ上での競合的ハイブリダイゼーションによる発現プロフィール解析が挙げられる。これは、細胞間での特定遺伝子の発現パターンの差異を解析するため、別々の蛍光色素で標識された被検物質を、同一プローブ物質に対して競合的にハイブリダイゼーションを行わせるものである。本発明においては、このような手法を用いることにより、細胞間での発現差異解析が電気化学的に行えるという、従来に無い利点が得られる。
【0026】
増感色素
本発明の方法にあっては、被検物質の存在を光電流で検出するために、増感色素の共存下、プローブ物質に被検物質を直接または間接的に特異的に結合させて、該結合により増感色素を作用電極に固定させる。そのために、本発明の方法にあっては、図1(a)および図2に示されるように被検物質1あるいは媒介物質11に予め増感色素2,12で標識しておくことができる。また、図1(b)に示されるように被検物質およびプローブ物質の結合体7(例えばハイブリダイゼーション後の二本鎖核酸)にインターカレーション可能な増感色素8を用いる場合には、試料液に増感色素を添加することにより、プローブ物質に増感色素を固定させることができる。
【0027】
本発明の好ましい態様によれば、被検物質が一本鎖の核酸の場合、被検物質1分子につき増感色素を一つ標識するのが好ましい。一本鎖の核酸における標識位置は、容易に被検物質とプローブ物質の特異的な結合を形成させる観点から、一本鎖の核酸の5’末端または3’末端のいずれかの位置とするのが好ましく、標識工程をさらに簡便にする観点から被検物質の5’末端とするのがさらに好ましい。
【0028】
また、本発明の別の好ましい態様によれば、被検物質1分子あたりの増感色素担持量を高める為、被検物質1分子につき2つ以上の増感色素を2つ以上標識するのが好ましい。これにより、電子受容物質の形成された作用電極における単位比表面積あたりの色素担持量をより多くすることができ、より高感度に光電流応答を観測することができる。
【0029】
本発明に用いる増感色素は、光励起に応じて作用電極に電子を放出可能な物質であり、光源の照射による光励起状態への遷移が可能であり、かつ励起状態から作用電極に電子注入できる電子状態を採りうるものであればよい。したがって、用いる増感色素は、作用電極、特に電子受容層との間において上記電子状態をとることができるものであればよいことから、多種の増感色素が使用可能であり、高価な色素を使用する必要がない。
【0030】
複数の被検物質の個別検出を行う態様にあっては、各々の被検物質に標識する増感色素は、それぞれ異なる波長の光で励起できるものであればよく、例えば、照射光の波長を選択することにより各被検物質を個別に励起できればよい。例えば、複数の被検物質に対応する複数の増感色素を用い、各増感色素毎に異なる励起波長の光を照射すると、複数のプローブが同一スポット上であっても個別に信号を検出することが可能となる。本発明の方法において、被検物質の数は限定されないが、光源から照射される光の波長と増感色素の吸収特性を考慮すると、1〜5種類が適当であろう。この態様において使用可能な増感色素は、照射光の波長領域内において光励起しさえすればよく、必ずしもその吸収極大が該波長領域にある必要はない。なお、特定波長における増感色素の光吸収反応の有無は、紫外可視スペクトロフォトメーター(例えば、島津製作所社製、UV−3150)を用いて測定することができる。
【0031】
増感色素の具体例としては、金属錯体や有機色素が挙げられる。金属錯体の好ましい例としては、銅フタロシアニン、チタニルフタロシアニン等の金属フタロシアニン;クロロフィルまたはその誘導体;ヘミン、特開平1−220380 号公報や特表平5−504023 号公報に記載のルテニウム、オスミウム、鉄及び亜鉛の錯体(例えばシス−ジシアネート−ビス(2、2 ’−ビピリジル−4、4 ’−ジカルボキシレート)ルテニウム(II))があげられる。有機色素の好ましい例としては、メタルフリーフタロシアニン、9−フェニルキサンテン系色素、シアニン系色素、メタロシアニン系色素、キサンテン系色素、トリフェニルメタン系色素、アクリジン系色素、オキサジン系色素、クマリン系色素、メロシアニン系色素、ロダシアニン系色素、ポリメチン系色素、インジゴ系色素等が挙げられる。また、増感色素の別の好ましい例としては、アマシャムバイオサイエンス社製のCy3、Cy3.5、Cy5、Cy5.5、Cy7、Cy7.5、Cy9;モルキュラープローブ社製のAlexaFluor355、AlexaFluor405、AlexaFluor430、AlexaFluor488、AlexaFluor532、AlexaFluor546、AlexaFluor555、AlexaFluor568、AlexaFluor594、AlexaFluor633、AlexaFluor647、AlexaFluor660、AlexaFluor680、AlexaFluor700、AlexaFluor750;Dyomics社製のDY−610、DY−615、DY−630、DY−631、DY−633、DY−635、DY−636、EVOblue10、EVOblue30、DY−647、DY−650、DY−651、DYQ−660、DYQ−661が挙げられる。
【0032】
二本鎖核酸にインターカレーション可能な増感色素の好ましい例としては、アクリジンオレンジ、エチジウムブロマイドが挙げられる。このような増感色素を用いる場合、核酸のハイブリダイゼーション後に試料液に添加するだけで増感色素で標識された二本鎖核酸が形成されるので、予め一本鎖の核酸を標識する必要が無い。
【0033】
作用電極およびその製造
本発明に用いる作用電極は、上記プローブ物質を表面に備えた電極であり、プローブ物質を介して固定された増感色素が光励起に応じて放出する電子を受容可能な電極である。したがって、作用電極の構成および材料は、使用される増感色素との間で上記電子移動が生じるものであれば限定されず、種々の構成および材料であってよい。
【0034】
本発明の好ましい態様によれば、作用電極が増感色素が光励起に応じて放出する電子を受容可能な電子受容物質を含んでなる電子受容層を有し、この電子受容層の表面にプローブ物質が備えられてなるのが好ましい。また、本発明のより好ましい態様によれば、作用電極が導電性基材をさらに含んでなり、この導電性基材上に電子受容層が形成されてなるのが好ましい。この態様の電極は図1および2に示される。図1および2に示される作用電極4は、導電性基材5と、この導電性基材上に形成され、電子受容物質を含んで成る電子受容層6とを備えてなる。そして、電子受容層6の表面にプローブ物質が担持される。
【0035】
本発明における電子受容層は、プローブ物質を介して固定された増感色素が光励起に応じて放出する電子を受容可能な電子受容物質を含んでなる。すなわち、電子受容物質は、光励起された標識色素からの電子注入が可能なエネルギー準位を取り得る物質であることができる。ここで、光励起された標識色素からの電子注入が可能なエネルギー準位(A)とは、例えば、電子受容性材料として半導体を用いる場合には、伝導体(コンダクションバンド:CB)を意味し、電子受容性材料として金属を用いる場合には、フェルミ準位を意味し、電子受容性材料として有機物もしくはC60等の分子状無機物を用いる場合には、最低非占有分子軌道(Lowest Unoccupied Molecular Orbital:LUMO)を意味する。すなわち、本発明に用いる電子受容物質は、このAの準位が、増感色素のLUMOのエネルギー準位よりも卑な準位、換言すれば、増感色素のLUMOのエネルギー準位よりも低いエネルギー準位を有するものであればよい。
【0036】
電子受容物質の好ましい例としては、シリコン、ゲルマニウムなどの単体半導体;チタン、スズ、亜鉛、鉄、タングステン、ジルコニウム、ハフニウム、ストロンチウム、インジウム、セリウム、イットリウム、ランタン、バナジウム、ニオブ、タンタル等の酸化物半導体;チタン酸ストロンチウム、チタン酸カルシウム、チタン酸ナトリウム、チタン酸バリウム、ニオブ酸カリウム等のペロブスカイト型半導体;カドミウム、亜鉛、鉛、銀、アンチモン、ビスマスの硫化物半導体;カドミウム、鉛のセレン化物半導体;カドミウムのテルル化物半導体;亜鉛、ガリウム、インジウム、カドミウム等のリン化物半導体;ガリウムヒ素、銅−インジウム−セレン化物、銅−インジウム−硫化物の化合物半導体;金、白金、銀、銅、アルミニウム、ロジウム、インジウム、ニッケル等の金属;ポリチオフェン、ポリアニリン、ポリアセチレン、ポリピロール等の有機物ポリマー;C60、C70等の分子状無機物が挙げられ、より好ましくは、シリコン、TiO2、SnO2、Fe2O3、WO3、ZnO、Nb2O5、Ta2O3、In2O3、チタン酸ストロンチウム、CdS、ZnS、PbS、Bi2S3、CdSe、CdTe、GaP、InP、GaAs、CuInS2、CuInSe、C60であり、さらに好ましくは、TiO2、ZnO、SnO2、Fe2O3、WO3、Nb2O5、Ta2O3、In2O3、チタン酸ストロンチウム、CdS、PbS、CdSe、InP、GaAs、CuInS2、CuInSe2であり、最も好ましくはTiO2である。なお、上記の列挙した半導体は、真性半導体および不純物半導体のいずれであってもよい。
【0037】
また、本発明の別の好ましい態様によれば、電子受容物質として、インジウム-スズ複合酸化物(ITO)またはフッ素がドープされた酸化スズ(FTO)を用いることができる。ITOおよびFTOは電子受容層のみならず導電性基材としても機能する性質を有するため、これらの材料を使用することにより導電性基材を用いることなく電子受容層のみで作用電極として機能させることができる。
【0038】
電子受容物質として半導体または金属を用いる場合、その半導体または金属は単結晶および多結晶のいずれであってもよいが、多結晶体が好ましく、さらに緻密なものよりも多孔性を有するものが好ましい。これにより、比表面積が大きくなり、被検物質および増感色素を多く吸着させて、より高い感度で被検物質を検出することができる。したがって、本発明の好ましい態様によれば、電子受容層が多孔性を有しており、各孔の径が3〜1000nmであるのが好ましく、より好ましくは、10〜100nmである。
【0039】
本発明の好ましい態様によれば、電子受容層を導電性基材上に形成した状態での表面積は、投影面積に対して10倍以上であることが好ましく、さらに100倍以上であることが好ましい。この表面積の上限には特に限定されないが、通常1000倍程度であろう。電子受容層を構成する電子受容物質の微粒子の粒径は、投影面積を円に換算したときの直径を用いた平均粒径で一次粒子として5〜200nmであることが好ましく、より好ましくは8〜100nmであり、さらに好ましくは20〜60nmである。また、分散物中の電子受容性物質の微粒子(二次粒子)の平均粒径としては0.01〜100μmであることが好ましい。また、入射光を散乱させて光捕獲率を向上させる目的で、粒子サイズの大きな、例えば300nm程度の電子受容物質の微粒子を併用して、電子受容層を形成してもよい。
【0040】
本発明の好ましい態様によれば、作用電極が導電性基材をさらに含んでなり、電子受容層が導電性基材上に形成されてなるのが好ましい。本発明に使用可能な導電性基材としては、チタン等の金属のように支持体そのものに導電性があるもののみならず、ガラスもしくはプラスチックの支持体の表面に導電材層を有するものであってよい。この導電材層を有する導電性基材を使用する場合、電子受容層はその導電材層上に形成される。導電材層を構成する導電材の例としては、白金、金、銀、銅、アルミニウム、ロジウム、インジウム等の金属;炭素、炭化物、窒化物等の導電性セラミックス;およびインジウム−スズ複合酸化物、酸化スズにフッ素をドープしたもの、酸化スズにアンチモンをドープしたもの、酸化亜鉛にガリウムをドープしたもの、または酸化亜鉛にアルミニウムをドープしたもの等の導電性の金属酸化物が挙げられ、より好ましくは、インジウム-スズ複合酸化物(ITO)、酸化スズにフッ素をドープした金属酸化物(FTO)である。ただし、前述した通り、電子受容層自体が導電性基材としても機能する場合にあっては導電性基材は省略可能である。また、本発明において、導電性基材は、導電性を確保できる材料であれば限定されず、それ自体では支持体としての強度を有しない薄膜状またはスポット状の導電材層も包含するものとする。
【0041】
本発明の好ましい態様によれば、導電性基材が実質的に透明、具体的には、光の透過率が10%以上であるのが好ましく、より好ましくは50%以上であり、さらに好ましくは70%以上である。これにより、作用電極の裏側(すなわち導電性基材)から光を照射させて、作用電極(すなわち導電性基材および電子受容層)を透過した光が増感色素を励起するようにセルを構成することができる。また、本発明の好ましい態様によれば、導電材層の厚みは、0.02〜10μm程度であるのが好ましい。さらに、本発明の好ましい態様によれば、導電性基材の表面抵抗が100Ω/cm2以下であり、さらに好ましくは40Ω/cm2以下であるのが好ましい。導電性基材の表面抵抗の下限は特に限定されないが、通常0.1Ω/cm2程度であろう。
【0042】
導電性基材上への電子受容層の好ましい形成方法の例としては、電子受容物質の分散液またはコロイド溶液を導電性支持体上に塗布する方法、半導体微粒子の前駆体を導電性支持体上に塗布し空気中の水分によって加水分解して微粒子膜を得る方法(ゾル−ゲル法)、スパッタリング法、CVD法、PVD法、蒸着法などが挙げられる。電子受容物質としての半導体微粒子の分散液を作成する方法としては、前述のゾル−ゲル法の他、乳鉢ですり潰す方法、ミルを使って粉砕しながら分散する方法、あるいは半導体を合成する際に溶媒中で微粒子として析出させそのまま使用する方法等が挙げられる。このときの分散媒としては水または各種の有機溶媒(例えばメタノール、エタノール、イソプロピルアルコール、ジクロロメタン、アセトン、アセトニトリル、酢酸エチル等)が挙げられる。分散の際、必要に応じてポリマー、界面活性剤、酸、もしくはキレート剤などを分散助剤として使用してもよい。
【0043】
電子受容物質の分散液またはコロイド溶液の塗布方法の好ましい例としては、アプリケーション系としてローラ法、ディップ法、メータリング系としてエアーナイフ法、ブレード法等、またアプリケーションとメータリングを同一部分でできるものとして、特公昭58−4589号公報に開示されているワイヤーバー法、米国特許2681294号、同2761419号、同2761791号等に記載のスライドホッパ法、エクストルージョン法、カーテン法、スピン法、スプレー法が挙げられる。
【0044】
本発明の好ましい態様によれば、電子受容層が半導体微粒子からなる場合、電子受容層の膜厚が0.1〜200μmであるのが好ましく、より好ましくは0.1〜100μmであり、さらに好ましくは1〜30μm、最も好ましくは2〜25μmである。これにより、単位投影面積当たりのプローブ物質および固定される増感色素量を増加して光電流量を多くするとともに、電荷再結合による生成した電子の損失をも低減することができる。また、導電性基材1m2当たりの半導体微粒子の塗布量は0.5〜400gであるのが好ましく、より好ましくは5〜100gである。
【0045】
本発明の好ましい態様によれば、電子受容物質がインジウム-スズ複合酸化物(ITO)または酸化スズにフッ素をドープした金属酸化物(FTO)を含んでなる場合、電子受容層の膜厚が1nm以上であるのが好ましく、より好ましくは10nm〜1μmである。
【0046】
本発明の好ましい態様によれば、半導体微粒子を導電性基材上に塗布した後に加熱処理を施すのが好ましい。これにより、粒子同士を電気的に接触させ、また、塗膜強度の向上や支持体との密着性を向上させることができる。好ましい加熱処理温度は、40〜700℃であり、より好ましくは100〜600℃である。また、好ましい加熱処理時間は10分〜10時間程度である。
【0047】
また、本発明の別の好ましい態様によれば、ポリマーフィルムなど融点や軟化点の低い導電性基材を用いる場合にあっては、熱による劣化を防止するため、高温処理を用いない方法により膜形成を行うのが好ましく、そのような膜形成方法の例として、プレス、低温加熱、電子線照射、マイクロ波照射、電気泳動、スパッタリング、CVD、PVD、蒸着等の方法が挙げられる。
【0048】
こうして得られた作用電極の電子受容層の表面にはプローブ物質が担持される。作用電極へのプローブ物質の担持は公知の方法に従い行うことができる。本発明の好ましい態様によれば、プローブ物質として一本鎖の核酸を用いる場合には、作用電極表面に酸化層を形成させておき、この酸化層を介して核酸プロ−ブと作用電極とを結合させることにより行うことができる。このとき、核酸プローブの作用電極への固定化は、核酸の末端に官能基を導入することにより行うことができる。これにより、官能基が導入された核酸プロ−ブはそのまま固定化反応により担体上に固定化されることができる。核酸末端への官能基の導入は、酵素反応もしくはDNA合成機を用いて行なうことができる。酵素反応において用いられる酵素としては、例えば、タ−ミナルデオキシヌクレオチジルトランスフェラ−ゼ、ポリAポリメラ−ゼ、ポリヌクレオチドカイネ−ス、DNAポリメラ−ゼ、ポリヌクレオチドアデニルトランスフェラ−ゼ、RNAリガ−ゼを挙げることができる。また、ポリメラ−ゼチェインリアクション(PCR法)、ニックトランスレ−ション、ランダムプライマ−法により官能基を導入することもできる。官能基は、核酸のどの部分に導入されてもよく、3'末端、5'末端もしくはランダムな位置に導入することができる。
【0049】
本発明の好ましい態様によれば、核酸プローブの作用電極への固定化のため官能基として、アミン、カルボン酸、スルホン酸、チオール、水酸基、リン酸等が好適に使用できる。また、本発明の好ましい態様によれば、核酸プローブを作用電極に強固に固定化するためには、作用電極と核酸プローブの間を架橋する材料を使用することも可能である。そのような架橋材料の好ましい例としては、シランカップリング剤、チタネートカップリング剤や、ポリチオフェン、ポリアセチレン、ポリピロール、ポリアニリン等の導電性ポリマーが挙げられる。
【0050】
本発明の好ましい態様によれば、核酸プロ−ブの固定化を物理吸着という、より簡単な操作で効率よく行うことも可能である。電極表面への核酸プロ−ブの物理吸着は、例えば、以下のように行なうことができる。まず、電極表面を、超音波洗浄器を用いて蒸留水およびアルコ−ルで洗浄する。その後、電極を核酸プロ−ブを含有する緩衝液に挿入して核酸プロ−ブを担体表面に吸着させる。
【0051】
また、核酸プローブの吸着後、ブロッキング剤を添加することにより、非特異的な吸着を抑制することができる。使用可能なブロッキング剤としては、核酸プローブが吸着していない電子受容層表面のサイトを埋めることができ、かつ電子受容物質に対して化学吸着あるいは物理吸着等により吸着可能な物質であれば限定されないが、好ましくは化学結合を介して吸着可能な官能基を有する物質である。例えば、酸化チタンを電子受容層として用いる場合における好ましいブロッキング剤の例としては、カルボン酸基、リン酸基、スルホン酸基、水酸基、アミノ基、ピリジル基、アミド等の酸化チタンに吸着可能な官能基を有する物質が挙げられる。
【0052】
本発明の好ましい態様によれば、作用電極上にプローブ物質が互いに分離された複数の領域毎に区分されて担持されてなり、光源による光照射が各領域に対して個別に行われるのが好ましい。これにより、複数の試料を一枚の作用電極上で測定することができるので、DNAチップの集積化等が可能となる。本発明のより好ましい態様によれば、作用電極上にプローブ物質が担持された、互いに分離された複数の領域がパターニングされており、光源から照射される光でスキャニングしながら、各領域の試料について被検物質の検出または定量を一度の操作で連続的に行うことが好ましい。
【0053】
本発明のより好ましい態様によれば、作用電極上の互いに分離された複数の領域の各領域に複数種類のプローブ物質を担持させることができる。これにより、領域の個数に、各領域毎のプローブ物質の種類数を乗じた数の、多数のサンプルの測定を同時に行うことができる。
【0054】
本発明のより好ましい態様によれば、作用電極上の互いに分離された複数の領域の各領域毎に異なるプローブ物質を担持させることができる。これにより、区分された領域の数に相当する種類数のプローブ物質を担持させることができるので、多種類の被検物質の測定を同時に行うことができる。この態様は、各領域毎に異なる被検物質の分析が可能なため、一塩基多型の解析(SNPs)の多項目解析に好ましく利用することができる。
【0055】
対電極
本発明に用いる対電極は、電解質媒体に接触させた場合に作用電極との間に電流が流れることができるものであれば特に限定されず、ガラス、プラスチック、セラミックス等の絶縁性の支持体に、金属もしくは導電性の酸化物を蒸着したものが使用可能である。また、対電極としての金属薄膜を5μm以下、好ましくは3nm〜3μmの範囲の膜厚になるように、蒸着やスパッタリングなどの方法により形成して作成することもできる。対電極に使用可能な材料の好ましい例としては、白金、金、パラジウム、ニッケル、カーボン、ポリチオフェン等の導電性ポリマー、酸化物、炭化物、窒化物等の導電性セラミックス等が挙げられ、より好ましくは、白金、カーボンであり、最も好ましくは白金である。これらの材料は電子受容層の形成方法と同様の方法により薄膜形成が可能である。
【0056】
測定方法および装置
本発明の方法にあっては、増感色素の共存下、試料液を作用電極に接触させて、プローブ物質に被検物質を直接または間接的に特異的に結合させ、この結合により増感色素を前記作用電極に固定させる。
【0057】
本発明の好ましい態様によれば、増感色素で予め標識された一本鎖の核酸を被検物質とする場合、プローブ物質である一本鎖核酸との間でハイブリダイゼーション反応を行なうことができる。ハイブリダイゼーション反応の好ましい温度は37〜72℃の範囲であるが、その最適温度は使用するプロ−ブの塩基配列や長さ等により異なる。
【0058】
本発明の別の好ましい態様によれば、被検物質およびプローブ物質の結合体(例えばハイブリダイゼーション後の二本鎖核酸)にインターカレーション可能な増感色素を用いる場合には、試料液に増感色素を添加することにより結合体を特異的に増感色素で標識することができる。
【0059】
本発明の方法にあっては、被検物質が増感色素と共に固定された作用電極を、対電極と共に電解質媒体に接触させ、作用電極に光を照射して増感色素を光励起させ、光励起された増感色素から作用電極への電子移動に起因して作用電極と対電極との間に流れる光電流を検出する。作用電極および対電極の相対的な位置関係は、互いに電気的に短絡することなく、なおかつ電解質媒体に接触しさえしていれば限定されるものではなく、互いに対向させて配置してもよいし、あるいは同一平面上に互いに離間させて配置してもよい。なお、作用電極および対電極が同一平面上に互いに離間させて配置される場合には、作用電極と対電極との間の電気的な短絡を防止するために絶縁基板上に両電極が設けられるのが望ましい。
【0060】
このような測定用セルの一例を図3に示す。図3に示される測定用セル21は、作用電極22と対電極23とにより挟まれて形成された空隙内に電解液24が充填されてなる。作用電極22は、導電性基材26と電子受容層27とを備えてなり、電子受容層27側を電解液24に接触させるように配置される。作用電極22と対電極23との間には絶縁スペーサ25が挿入されることにより、電解液24を収容する空間が確保されている。電極間の距離は酸化還元のサイクルを効率良く行わせるためには短い方が好ましく、工作的な精度との兼ね合いから数十μm であることが望ましい。また、いわゆるMEMS 的な製造方法を利用するのであれば、より近接した電極間距離とすることも可能である。
【0061】
本発明において用いる電解質媒体は、電解質、溶媒、および所望により添加物を含んでなるものであることができる。電解質の好ましい例としては、I2とヨウ化物の組み合わせ(ヨウ化物としてはLiI、NaI、KI、CsI、CaI2などの金属ヨウ化物、あるいはテトラアルキルアンモニウムヨーダイド、ピリジニウムヨーダイド、イミダゾリウムヨーダイドなど4級アンモニウム化合物のヨウ素塩など)、Br2と臭化物の組み合わせ(臭化物としてはLiBr、NaBr、KBr、CsBr、CaBr2などの金属臭化物、あるいはテトラアルキルアンモニウムブロマイド、ピリジニウムブロマイドなど4級アンモニウム化合物の臭素塩など)のほか、フェロシアン酸塩−フェリシアン酸塩やフェロセン−フェリシニウムイオンなどの金属錯体、ポリ硫化ナトリウム、アルキルチオール−アルキルジスルフィドなどのイオウ化合物、ビオロゲン色素、ヒドロキノン−キノン等が挙げられ、より好ましくは、I2とLiIやピリジニウムヨーダイド、イミダゾリウムヨーダイドなど4級アンモニウム化合物のヨウ素塩を組み合わせた電解質である。上述した電解質は混合して用いてもよい。本発明において特に好ましい電解質媒体はリチウムイオンを含んでなるものである。
【0062】
本発明の好ましい態様によれば、電解液の電解質濃度は0.1〜15Mであるのが好ましく、より好ましくは0.2〜10Mである。また、電解質にヨウ素を添加する場合における、好ましいヨウ素の添加濃度は0.01〜0.5Mである。
【0063】
好ましい溶媒の例としては、水、アルコール(メタノール、エタノール等)、非プロトン性の極性溶媒(例えばアセトニトリルなどのニトリル類、炭酸プロピレンや炭酸エチレンなどのカーボネート類、ジメチルホルムアミド、ジメチルスルホキシド、スルホラン、1,3−ジメチルイミダゾリノンや3−メチルオキサゾリジノン、ジアルキルイミダゾリウム塩などの複素環化合物、等)が挙げられる。
【0064】
本発明の好ましい態様によれば、水系の電解液が用いることができる。これにより、蛋白質等の生体分子を変性または失活させることなく適切に測定することが可能となる。また、電解液の流路等の劣化および電解液の揮発を防止できるとともに、廃液処理も容易に行えるとの利点もある。本発明の好ましい態様によれば、水系電解質は、支持電解質と、還元剤(電子供与体)と、溶媒としての水とを含んでなるのが好ましい。支持電解質としては、水に溶解した時にイオンに解離して伝導性を与え、かつ目的とする電極反応を阻害しないものであれば限定されず、好ましい例としては、NaCl、Na2SO4、KCl、K2SO4などが挙げられる。還元剤(電子供与体)の好ましい例としては、EDTA、トリエタノールアミン、シュウ酸、ヒドロキノンなどが挙げられる。
【0065】
本発明の好ましい態様によれば、電解質媒体はゲル化(固体化)させて使用することもできる。ゲル化の方法の例としては、ポリマー添加、オイルゲル化剤添加、多官能モノマー類を含む重合、ポリマーの架橋反応等の手法により行うことができる。ゲル電解質のマトリクスに使用されるポリマーの例としては、ポリアクリロニトリル、ポリビニリデンフルオリド等が挙げられる。
【0066】
図3に示されるように作用電極22の上方には光源28が光源カバー29を介して配置される。すなわち、作用電極22の裏側(すなわち導電性基材)から光を照射させて、作用電極(すなわち導電性基材および電子受容層)を透過した光が増感色素を励起するようにセルが構成されている。もっとも、対電極を透光性の材料で構成することにより光を対電極の裏側から照射してもよく、あるいは、作用電極および対電極に平行に光を照射してもよいのは言うまでもない。本発明に用いる光源としては、標識色素を光励起できる波長の光を照射できるものであれば限定されず、好ましい例としては、蛍光灯、ブラックライト、殺菌ランプ、白熱電球、低圧水銀ランプ、高圧水銀ランプ、キセノンランプ、水銀−キセノンランプ、ハロゲンランプ、メタルハライドランプ、LED(白色、青、緑、赤)、レーザー光、太陽光を用いることができ、より好ましくは、蛍光灯、白熱電球、キセノンランプ、ハロゲンランプ、メタルハライドランプ、LED(白色、青、緑、赤)、太陽光等を挙げることができる。また、必要に応じて、分光器やバンドパスフィルタを用いて特定波長領域の光のみを照射してもよい。
【0067】
本発明の好ましい態様によれば、互いに異なる光波長で励起可能な二種以上の増感色素を用いて複数種類の被検物質を個別に検出する場合、光源から波長選択手段を介して特定波長の光を照射することにより、複数の色素を個別に励起することが可能である。波長選択手段の例としては、分光器、色ガラスフィルタ、干渉フィルタ、バンドパスフィルタ等が挙げられる。また、増感色素の種類に応じて異なる波長の光を照射可能な複数の光源を用いてもよく、この場合の好ましい光源の例としては、特定波長の光が照射されるレーザー光やLEDを用いてもよい。また、作用極に光を効率よく照射するため、石英、ガラス、液体ライトガイドを用いて導光してもよい。
【0068】
本発明の好ましい態様によれば、光源から放射される光がもともと紫外線を実質的に含まないか、または光源からの光の照射が紫外線を除去する手段を介して行われるのが好ましい。これにより、照射光に400nm以下の波長の紫外線が含まれる場合に発生しうる電子受容物質自体の光励起によるバックグランド電流、すなわちノイズを効果的に抑制して、より精度の高い測定が可能となる。なお、増感色素は一般的に可視光の吸収により励起されることができるため、紫外線を除去したとしても可視光の照射により高い感度で光電流を検出することが可能である。
【0069】
紫外線を除去する手段の好ましい例としては、光学フィルタ、および分光器が挙げられる。光学フィルタまたは分光器を用いることにより、照射光の波長を制御することができ、作用電極自体の光励起を防止しつつ、増感色素のみを励起することが可能となる。好ましい光学フィルタの例としては、紫外線カットフィルタ等の色ガラスフィルタが挙げられる。好ましい分光器の例としては、厳密な波長制御が可能な点で、回折格子が内蔵された分光器が挙げられる。
【0070】
もともと紫外線を実質的に含まない光を放出する光源の好ましい例としては、レーザ、無機エレクトロルミネッセンス(EL)素子、有機エレクトロルミネッセンス(EL)素子、発光ダイオード(LED)が挙げられるが、最も好ましくは発光ダイオード(LED)である。LEDによれば、波長分布の狭い制御された光を照射することができ、小型、軽量、低消費電力、および長寿命といった利点も得られる。
【0071】
本発明のより好ましい態様によれば、使用する電子受容物質についての既知のバンドギャップを下記式に代入して算出される、表1に示されるカットオフ波長よりも短い波長の光を除去することが好ましい。これにより、電子受容物質の特性に応じて、バックグランド電流の発生を効果的に抑制できる。
バンドギャップ(eV) = hν = hc/λ = 1239.8/λ(mm)
(h:プランク定数、c:光速)
【0072】
表 1
電子受容物質 バンドギャップ 好適なカットオフ波長
(eV) (nm)
ルチル型酸化チタン 3.2 387
アナターゼ型酸化チタン 3.0 413
酸化亜鉛 3.1 400
チタン酸ストロンチウム 3.2 387
酸化スズ 3.5 354
酸化タングステン 2.8 443
酸化ニオブ 3.1 400
酸化鉄 2.2 564
【0073】
なお、電子受容物質には不純物準位を含む場合があるため、万全を期して、カットオフ波長を表1に示される波長よりも長波長側に設定しても構わない。また、作用電極が複数の電子受容物質で構成されている場合には、構成成分のうち最もバンドギャップが狭い成分のカットオフ波長よりも短い波長を除去するのが好ましい。
【0074】
図4に示されるように、作用電極21および対電極22間には電流計30が接続され、光照射により系内を流れる光電流が電流計により測定される。これにより、被検物質を検出することができる。その際の電流値は作用電極上にトラップされた増感色素の量を反映する。例えば、被検物質が核酸の場合、相補性のある核酸間で形成された二本鎖の量が、電流値となり反映される。したがって、得られた電流値から被検物質を定量することができる。したがって、本発明の好ましい態様によれば、電流計が、得られた電流量または電気量から試料液中の被検物質濃度を算出する手段をさらに備えてなるのが好ましい。
【0075】
本発明の好ましい態様によれば、光電流を検出する工程が、電流値を測定し、得られた電流値または電気量から試料液中の被検物質濃度を算出することができる。この被検物質濃度の算出は、予め作成された被検物質濃度と電流値または電気量との検量線と、得られた電流値または電気量とを対比することにより行うことができる。本発明の方法にあっては、電流値は作用電極上にトラップされた増感色素の量が反映されるので、被検物質濃度に対応した正確な電流値が得られるため、定量測定に適する。
【0076】
本発明の別の好ましい態様によれば、予め増感色素で標識された被検物質を競合物質として用いて、増感色素で標識されていない、プローブ物質に特異的に結合可能な第二の被検物質を定量することができる。第二の被検物質はプローブ物質に標識済被検物質よりも特異的に結合しやすい性質を有するのが好ましい。これら二種類の被検物質を競合させてプローブ物質に特異的に結合させると、検出される電流値と第二の被検物質の濃度との間に相関関係が得られる。つまり、色素標識されていない第二の被検物質の数が増加するにつれ、プローブ物質に特異的に結合する競合物質の数が減少するため、第二の被検物質濃度の増加につれて、検出電流値が減少する検量線を得ることができる。したがって、増感色素で標識されていない第二の被検物質の検出および定量が可能となる。
【0077】
本発明のより好ましい態様によれば、被検物質および第二の被検物質が抗原であり、プローブ物質が抗体であるのが好ましい。この態様における被検物質および第二の被検物質のプローブ物質への固定化工程を図5に示す。図5に示されるように、増感色素で標識された抗原41と、色素標識されていない抗原42とが競合して抗体43に特異的に結合する。したがって、色素標識されていない抗原42が増加するにつれ、抗体に特異的に結合する色素標識された抗原43が減少するため、第二の被検物質濃度の増加につれて、検出電流値が減少する検量線を得ることができる。
【0078】
フロー型測定用セルおよびパターニング電極を用いた測定方法および装置
本発明の方法および装置の好ましい実施態様の一例として、フロー型測定用セルおよびパターニング電極を用いた測定方法および装置について説明する。図6に、装置の全体構造を示す。図6に示される装置50は、フロー型測定用セル51と、光源52と、電解液タンク53と、洗浄液タンク54と、供給ポンプ55と、電流計56と、排出ポンプ57とを備えてなる。フロー型測定用セル51は、パターニングされた作用電極58と、作用電極に対向する対電極59とを備えてなり、作用電極58および対電極59の間に、電解液または洗浄液を収容しかつ流すことができる流路が形成される。すなわち、供給ポンプ55により測定用セル51内に供給された電解液または洗浄液は、作用電極58および対電極59に接触しながら流路を通過した後、排出ポンプ57により測定用セル51外に排出されるように構成されている。これら一連の動作の制御および光電流値の解析は図示しない制御解析装置により行われることができる。
【0079】
作用電極58は、電子受容層上にプローブ物質が担持された、互いに分離された複数の領域がパターニングされており、光源から照射される光でスキャニングしながら、各領域の試料について被検物質の検出または定量を一度の操作で連続的に行えるように構成されている。このようにパターニングされた作用電極の例を図7(a)〜(d)および図8(a)〜(c)に示す。
【0080】
図7(a)および(b)に示される作用電極58は、導電性基材58aの全面に形成された電子受容層58b上に、プローブ物質58cが担持された複数のスポット60が縦横方向にパターニングされたものである。そして、この作用電極58の導電性基材にリード線61が施され、このリード線61を介して作用電極58全体が電流計56に接続されている。この作用電極58によれば、各スポットに順次光照射を行うことにより、発生する光電流を各スポット毎に測定することができる。また、電極の構成が比較的簡単なため電極の作製が容易であり、従来のDNAチップの製造技術を利用できるとの利点もある。また、変形例として、図7(c)に示されるように電子受容層58b自体をスポット状に形成してその上にプローブ物質58cを担持させる、あるいは、図7(d)に示されるように導電性基材を省略して電子受容層58bのみでスポット状の作用電極58を構成してその上にプローブ物質58cを担持させ、かつ電子受容層58bにリード線61を施してもよく、特に後者にあっては、製造工程が簡略化されるとともに製造コストも低減できるとの利点がある。この作用電極に使用される光源52としては、図9に示されるように作用電極58上を縦横方向に移動する光源であるか、または図10に示されるように作用電極58の各スポットに対応して複数の光源が配列させておき、各光源を順に点灯および消灯させるものであってよい。
【0081】
図8(a)および(b)に示される作用電極58’は、絶縁基板58d’上に導電性基材58a’および電子受容層58b’からなる複数のスポット60’が縦横方向にパターニングされており、電子受容層58b’上にプローブ物質58c’が担持される。そして、各スポット60’の導電性基材には個別にリード線61’が施され、このリード線61’を介して各スポット60’が電流計56に接続されている。この作用電極58’によれば、作用電極の全面に光を同時に照射するだけで、各スポットに発生する光電流を同時にかつ個別に測定することができる。また、各スポットにおける光電流を個別に測定することができるので、他のスポットで発生した光電流をノイズとして拾うことが無いとの利点もある。また、変形例として、図8(c)に示されるように導電性基材を省略して電子受容層58b’のみでスポット状の作用電極58’を構成してその上にプローブ物質58c’を担持させ、かつ電子受容層58b’にリード線61’を施してもよく、製造工程が簡略化されるとともに製造コストも低減できるとの利点がある。この作用電極58’に使用される光源52は、図6の作用電極の場合と同様、作用電極58上を縦横方向に移動する光源であるか、または作用電極58の各スポットに対応して複数の光源が配列させておき、各光源を順に点灯および消灯させるものであってよい。
【0082】
この装置を使用した測定方法の一例について以下に説明する。
まず、増感色素の共存下、試料液を作用電極に接触させて、プローブ物質に被検物質を直接または間接的に特異的に結合させ、この結合により増感色素を作用電極58に固定させる。このとき、作用電極の電子受容層に図7に示されるスポットパターンのマスキングを施して、プローブ物質が担持された複数のスポット60が縦横方向にパターニングされた作用電極58を得る。こうして得られた作用電極58をフロー型測定用セル51に装着する。
【0083】
次いで、供給ポンプ55を作動させて電解液タンク53から電解液を測定用セル51内に送り込み、測定用セル内の流路を電解液で満たした後、送液を停止する。光源52から作用電極58に光を照射し、電流計56により作用電極58および対電極59間に発生する光電流を測定する。この光電流値の測定にあっては、光電流値が安定する、照射開始後数十秒後の値を採用するのが好ましい。そして、図示しない制御解析装置において、得られた電流値と、予め作成された被検物質濃度と電流値との検量線とを対比することにより被検物質濃度が算出される。光電流の測定終了後、供給ポンプ55を作動させて洗浄液タンク53から洗浄液を測定用セル51内に送り込むと同時に、測定用セル51内の電解液を排出ポンプ57を作動させて排出し、測定用セル内の流路内の電解液で洗浄液で置換した後、送液および排液を停止する。これにより、洗浄液で洗浄化された測定用セル51を用いて、次の測定を上記同様の手順で行うことができる。
【実施例】
【0084】
以下の実施例によって本発明をさらに詳細に説明する。なお、本発明はこれら実施例に限定されるものではない。
【0085】
例1:作用電極の作製
まず、以下の配合を有する原料を自動乳鉢を用いて充分に混合した後、150℃で6時間乾燥させて混合物を得た。
α−テルピネオール 60重量%
2−(2−ブトキシエトキシ)エタノール 15重量%
エチルセルロース 25重量%
【0086】
得られた混合物0.5gに粒状酸化チタン(日本エアロゾル社製P25、平均粒径20〜25nm)1gを添加して混合した後、先に得られた混合物0.5gをさらに添加して混合した。その後、α−テルピネオールを加えて再度混合して、ペーストを得た。これら一連の混合は自動乳鉢を用いて合計3時間行った。
【0087】
フッ素ドープされたSnO2膜が形成されたガラス基板(旭硝子製)の縁枠を幅約63μmのテープでマスキングし、上記ペーストをスキージ印刷した後、60℃で2時間乾燥させた。得られたガラス基板を焼成炉内に入れ、約17分間かけて500℃まで炉内温度を上昇させ、この温度で30分間保持した後、放冷した。炉内温度が100℃に達した時点でガラス基板をエタノールに浸漬した。こうして、酸化チタンを含んでなる電子受容層が形成された作用電極を得た。
【0088】
次いで、5’−NH2−AACGTCGTGACTGGGの塩基配列を有するNH2修飾DNAをバッファ(3X SSC)に溶解して、286μMのNH2修飾DNA溶液を調製した。この溶液を、予め95℃で3分間保持した後、氷上で冷却させることにより、変性させておいた。
【0089】
先に得られた作用電極の電子受容層上に、5mm×5mm角の大きさの開口部が形成された、厚さ700μmのシリコンシールを載置した。この開口部に286μMのNH2修飾DNA溶液35μl注入した。このとき、ピペットチップの先端を用いて、シリコンシールの開口部の四隅まで充分にDNA溶液が行き渡るようにした。続いて、DNA溶液中に気泡が極力入らないようにガラス板で真上から覆い、湿らせた紙等で蒸気圧が調整されたプラスチック容器に収容した。この容器中に60℃で2時間保持して、NH2修飾DNAをインキュベートした。その後、DNA溶液を除去し、流水で軽く電極表面を洗浄した後、空気を吹き付けて残水を飛散させた。こうして、プローブ物質が担持された作用電極を得た。
【0090】
例2:ローダミン修飾DNAの検出
5’−Rho−CCCAGTCACGACGTTの塩基配列を有するローダミン修飾DNAをバッファ(2X SSC、0.03% SDS)に溶解して、28.6μMおよび286μMの各濃度を有するローダミン修飾DNA溶液を作製した。
例1で使用したものと同様のシリコンシールを作用電極表面に載置し、各濃度のローダミン修飾DNA溶液を35μlずつ、開口部に注入した。溶液中に気泡が極力入らないようにガラス板で真上から覆い、湿らせた紙等で蒸気圧を調整したプラスチック容器に入れた。こうして、60℃で一晩(12時間)インキュベートさせて、ハイブリダイゼーションを行った。
【0091】
こうしてハイブリダイゼーションが施された作用電極を洗浄液に浸し、ゆっくりと揺らしながら洗浄した。洗浄液としては下記表2に示されるものを使用し、各洗浄液について下記表に示される洗浄時間、洗浄回数、および温度で洗浄を行った。なお、洗浄液を変更する毎に洗浄容器を交換した。
表 2
洗浄液 1回当たりの 洗浄回数 温度
洗浄時間
2X SSC、0.2% SDS 6分間 3回 室温
0.2X SSC、0.2% SDS 6分間 3回 室温
0.2X SSC、0.2% SDS 13分間 1回 60℃
0.2X SSC、0.2% SDS 6分間 2回 室温
0.2X SSC 6分間 1回 室温
注)2X SSC:0.3M塩化ナトリウムおよび0.03Mクエン酸ナトリウム含有水溶液(pH7.0)
SDS:硫酸ドデシルナトリウム
【0092】
さらに、作用電極をエタノールで軽く液中で上下させることにより、2回洗浄を行った。2回目の洗浄後は紙等で拭き取らずに、素早く空気を吹き付けて残水を飛散させた。
【0093】
こうして得られた作用電極と、対電極としての白金電極とを用いて、図3および図4に示されるような測定用セルを以下のようにして組み立てた。
まず、白金電極として、ガラス基板上に白金薄膜をスパッタリングにより形成したものを用意した。白金電極の白金膜上に、厚さ500μmのシリコンシートを載置した。このシリコンシートは作用電極と対電極との接触による短絡を防ぐためのスペーサーである。このとき、白金電極の白金で被膜された端部にリード線を接続して、電流を取り出し可能に構成した。作用電極もリード線を介して電流計と接続した。
電解液として、体積比が8:2のエチレンカーボネートとアセトニトリルの混合溶媒にヨウ素0.05Mとテトラプロピルアンモニウムヨーダイド0.5Mを溶解した混合液を用意した。この電解液を白金電極に5μL滴下した後、作用電極をその電子受容層が白金電極と対向するように、載置した。こうして、スペーサーおよび電解液を作用電極および対電極とで挟持されてなる、サンドイッチ型の測定用セルを得た。
【0094】
作用電極のリード線と対電極のリード線とを電流計(ALSモデル832A、ディアル電気化学アナライザー)に接続した。光源(林時計社製、LA−250XE)から液体ライトガイドを用いて導光し、紫外線カットフィルタ(Y-43、旭テクノグラス)を介して作用電極表面の1.5cm上方から白色光を30秒間作用電極表面に照射した。このとき、作用電極と対電極との間に流れる電流値を電流計により経時的に測定した。
【0095】
図6に28.6μMローダミン修飾DNA溶液を用いた場合の検出電流の経時変化を、図7に286μMローダミン修飾DNA溶液を用いた場合の検出電流の経時変化を示す。これらの図に示されるように、増感色素で標識づけられたDNAと、これと相補性を有するDNAとをハイブリダイゼーションさせると、光の照射により大きな電流が流れることが分かる。
【0096】
また、28.6μMおよび286μMの各ローダミン修飾DNA溶液を用いた場合について、電流値が定常状態になった時点における電流値を別途測定したところ、図8に示される通りの結果が得られた。また、参照のため、ローダミン修飾DNAの固定化を行わなかった場合についても同様にして測定を行った。その結果も図8に併せて示す。図8に示されるように、ローダミン修飾DNAの濃度に依存して電流値が変化した。したがって、本発明の方法によれば定量分析が可能なことが分かる。
【0097】
例3:プローブ物質を担持させない作用電極を使用した測定
また、比較のため、例1で作製された、NH2修飾DNAを担持させる前の、酸化チタンを含んでなる電子受容層のみが形成された作用電極を用いて測定用セルを構成して、例2と同様に測定を行った。図6に28.6μMローダミン修飾DNA溶液を用いた場合の検出電流の経時変化を、図7に286μMローダミン修飾DNA溶液を用いた場合の検出電流の経時変化を示す。これらの図に示されるように、紫外線カットフィルタで除去できなかった若干量の紫外線によって酸化チタン自身が励起され、光電流が観測されるものの、ローダミン修飾DNA溶液を用いた例2の場合と比べて、光電流は著しく低かった。
【0098】
例4:作用電極にブロッキングを施した場合の測定
例1と同様にして、プローブ物質が担持された作用電極を得た。この電極表面に例1で使用したものと同様のシリコンシールを再度載置して、開口部にブロッキング剤として10μMのジエタノールアミン35μlを注入した。ブロッキング剤中に気泡が極力入らないようにガラス板で真上から覆い、湿らせた紙等で蒸気圧を調整したプラスチック容器に入れた。そして、60℃で30分間保持して、ブロッキング剤をインキュベートした。電極表面を再度流水で軽く洗浄した後、空気を吹き付けて残水を飛散させた。
【0099】
こうしてプローブ物質がブロッキングされた作用電極を用いて、例2と同様にして、ローダミン修飾DNAのインキュベーションによるハイブリダイゼーション、および光電流測定を行った。その結果は図6および図7に示される通りであった。これらの図に示されるように、ブロッキングが施された作用電極を用いた場合には、それが施されない例2の場合と比べて、著しく電流値が低下した。
【0100】
例5:競合物質PNAとの共存下におけるローダミン修飾DNAの検出
5’−Rho−CCCAGTCACGACGTTの塩基配列を有するローダミン修飾DNAと、競合物質として5’−CCCAGTCACGACGTTTの塩基配列を有するPNAとをバッファ(2X SSC、0.03% SDS)に溶解して、28.6μMローダミン修飾および200μM PNA含有溶液と、286μMローダミン修飾および200μM PNA含有溶液とを作製した。
この試料溶液を用いたこと以外は、例2と同様にして、ローダミン修飾DNAのインキュベーションによるハイブリダイゼーション、および光電流測定を行った。その結果は図6および図7に示される通りであった。これらの図に示されるように、ハイブリダイゼーション時に競合すると考えられる塩基配列を有するPNAを共存させた場合、PNAが共存しない例2の場合と比べて、電流値が低下した。
【0101】
例6:検量線の作成
(1) 被検物質およびプローブ物質の準備
色素標識された被検物質(以下、被検DNAともいう)として、3’末端をローダミンBで標識された、以下の塩基配列を有する15塩基の核酸塩基(3’ローダミンDNA)を用意した。また、プローブ物質(以下、プローブDNAともいう)として上記被検DNAと相補鎖を有する15塩基の核酸塩基(5’末端をアミノ基で修飾したDNA(以下、5’−NH2−DNAという)を用意した。すなわち、このプローブDNAと被検DNAは、ハイブリダイゼーション反応により二本鎖DNAを形成することができる。
被検DNA(3’ローダミンDNA):
3’Rho−TTGCAGCACTGACCC 5’
プローブDNA(5’−NH2−DNA):
5’NH2−AACGTCGTGACTGGG 3’
【0102】
(2) 作用電極の作製およびプローブ物質の担持
まず、チタニア微粉末(昭和タイタニウム社製、F2、平均粒径60nm、アナターゼ:ルチル=4:6)1gと、以下の配合を有する有機ビヒクル1gとを自動乳鉢で混練しながら、徐々に溶媒(αテルピネオール:ブチルカルビトール=重量比60:40)1gを添加して、酸化チタンペーストを得た。これら一連の混合は合計5時間行われた。
α−テルピネオール 65重量%
ブチルカルビトール 15重量%
ポリビニルブチラール 20重量%
【0103】
フッ素ドープされた酸化スズ(F−SnO2:FTO)コートガラス(エイアイ特殊硝子社製、U膜、シート抵抗:15Ω/□)の導電面上の縁枠を金属メタルスクリーンマスクでマスキングし、上記ペーストを用いて厚さ120μm、大きさ5mm×5mmの膜を作製した。得られた膜を60℃で3時間乾燥させた後、500℃で30分間焼成を行い、酸化チタン多孔質膜を電子受容層として備えた作用電極を得た。こうして得られた作用電極にBLBランプで一晩紫外線照射を施し、汚れおよび残存有機物の除去を行った。
【0104】
次いで、プローブDNAとして5’−NH2−DNAを50mM HEPES(pH7.0)に溶解させて水溶液を調製した。この溶液を、予め95℃で3分間保持した後、氷上(2℃)で3分間以上冷却させることにより、熱変性させておいた。
【0105】
先に得られた作用電極の電子受容層上に、スペーサー用穴あきテープを貼り、ピンセットの先を用いてテープ接着面に残存する空気を除去した。このテープ上に、5mm×5mm角の大きさの開口部が形成されたシリコンシートを載置して密着させた。この開口部に先に調製した5’−NH2−DNA溶液(200μM)を25μl装填した。このとき、ピペットチップの先端を用いて、シリコンシールの開口部の四隅まで充分にDNA溶液が行き渡るようにした。続いて、DNA溶液中に気泡が極力入らないようにガラス板で真上から蓋をして、湿らせた紙等で蒸気圧が調整されたプラスチック容器に収容した。この容器中に60℃で6時間保持して、5’−NH2−DNAをインキュベートした。その後、DNA溶液を除去し、流水で軽く電極表面を2秒間洗浄した後、空気を吹き付けて残水を飛散させた。こうして、プローブDNAが担持された作用電極を得た。
【0106】
上記プローブ物質が担持された作用電極に新たなシリコンシールを載置し、開口部にブロッキング剤として1μMのジエタノールアミン25μlを装填した。ブロッキング剤中に気泡が極力入らないようにガラス板で真上から蓋をして、湿らせた紙等で蒸気圧を調整したプラスチック容器に入れた。そして、60℃で30分間保持して、ブロッキング剤をインキュベートした。電極表面を再度流水で軽く2秒間洗浄した後、空気を吹き付けて残水を飛散させた。こうしてブロッキングが施された作用電極を得た。
【0107】
(3)ハイブリダイゼーション
色素標識された被検DNAとしての3’ローダミンDNAをHEPES水溶液に溶解して、0、10、40、400、4000、15000、25000、30000、40000、80000nMの各濃度を有する3’ローダミンDNA溶液を作製した。
各濃度の3’ローダミンDNA溶液を25μl作用電極に装填した。溶液中に気泡が極力入らないようにガラス板で真上から蓋をして、湿らせた紙等で蒸気圧を調整したプラスチック容器に入れた。こうして、60℃で15時間インキュベートさせて、ハイブリダイゼーションを行った。
【0108】
こうしてハイブリダイゼーションが施された作用電極を洗浄液に浸し、ゆっくりと揺らしながら洗浄した。洗浄液としては下記表3に示されるものを使用し、各洗浄液について下記表に示される洗浄時間、洗浄回数、および温度で洗浄を行った。なお、洗浄液を変更する毎に洗浄容器を交換した。さらに、作用電極を水で5秒間洗い流し、素早く空気を吹き付けて残水を飛散させた。
表 3
洗浄液 1回当たりの 洗浄回数 温度
洗浄時間
HEPES、0.1%Tween20 6分間 6回 室温
HEPES、0.1%Tween20 13分間 1回 60℃
HEPES 6分間 2回 室温
超純水 15分間 1回 室温
注)HEPES:2−[4−(2−ヒドロキシエチル)−1−ピペラジニル]エタンスルホン酸(同仁化学研究所製)の50mM、pH7.0の溶液
0.1%Tween20:SERVA社製の界面活性剤を超純水に0.1vol%で希釈したもの
【0109】
(4)測定用セルの組み立て
こうして得られた作用電極と、対電極としての白金電極とを用いて、図3および図4に示されるような測定用セルを以下のようにして組み立てた。
まず、白金電極として、厚さ1mmのガラス基板上に、密着性確保のためのクロム層を介して、白金薄膜をスパッタリングにより形成したものを用意した。白金電極の白金膜上に、厚さ500μmのシリコンシートを載置した。このシリコンシートは作用電極と対電極との接触による短絡を防ぐためのスペーサーである。このとき、白金電極の白金で被膜された端部にリード線を接続して、電流を取り出し可能に構成した。作用電極もリード線を介して電流計と接続した。
電解液として、体積比が4:6のアセトニトリルと炭酸エチレンの混合溶媒にヨウ素0.06Mとテトラプロピルアンモニウムヨーダイド0.6Mを溶解した混合液を用意した。この電解液を白金電極に1滴(5μL)滴下した後、作用電極をその電子受容層が白金電極と対向するように、載置した。こうして、スペーサーおよび電解液を作用電極および対電極とで挟持されてなる、サンドイッチ型の測定用セルを得た。
【0110】
(5)光電流の測定
作用電極のリード線と対電極のリード線とをポテンシオスタット(北斗電工社製、HSV−100)に接続した。250Wキセノンランプ(林時計工業社製、LA−250Xe)から液体ライトガイドを用いて導光し、基材である酸化チタンによる光吸収および光電流発生を避けるため430nm以下の波長の光を除去できる紫外線カットフィルタ(旭テクノグラス社製、Y−43)を介して作用電極表面に光を作用電極表面に照射した。このとき、作用電極と対電極との間に流れる電流値を電流計により経時的に測定した。電流値の測定は60秒間行ったが、光の照射は電流の測定開始10秒後から30秒間のみ行った。
【0111】
(6)検量線の作成
被検DNAの濃度と、検出された光電流の値とから、図14および15に示される検量線が得られた。図14に示されるように、被検DNA濃度が0〜4000nMの低濃度域では、被検DNA濃度と電流値との間に比例関係が見られた。また、図15に示されるように、被検DNA濃度が1000〜100000nMの高濃度域では、被検DNA濃度の対数と電流値との間にリニアな関係が得られた。したがって、これらの検量線を用いることにより、未知の被検DNAの濃度を、測定された光電流値に基づいて正確に知ることができる。すなわち、本発明の方法によれば、DNAの定量が可能である。
【0112】
例7:リチウムイオンを含む電解質媒体を用いた例
電解液として以下の二種類の対カチオンを含有する電解液AおよびBを使用したこと、および被検DNA溶液(5’−NH2−DNA溶液)の濃度を200μMとしたこと以外は例6と同様にして試験を行った。
電解液A:40容量%炭酸エチレンおよび60容量%アセトニトリルの混合溶媒中、0.06M I2および0.6M TPA+I−が溶解された液(テトラプロピルアミンモニウムカチオン((n−C3H7)4N+;TPA+)を対カチオンとして有する電解液)
電解液B:アセトニトリル中、0.05M I2および0.5M Li+I−が溶解した液(リチウムイオンを対カチオンとする電解液)
【0113】
また、ブランクとして、プローブDNAおよび被検DNAのいずれも固定化されていない、作製されたままの作用電極についても光電流値を測定した。
【0114】
測定された光電流値(安定電流値)は表4に示される通りであった。
表 4
電解液 光電流値(mA)
本発明例 ブランク
A(TPA+) 1.4 0.3
B(Li+) 1.7 0.4
【0115】
表4から分かるように、電解液AおよびBのいずれもヨウ素とヨウ化物を含んでおり、そのいずれを用いた場合も、高感度に光電流を検出することができた。特に、リチウムイオンを対カチオンとして含有する電解液Bでは、リチウムイオンを含まない電解液Aと比べて、20〜35%も光電流が増加する傾向が見られた。つまり、リチウムイオンを対カチオンとして電解質媒体に使用することで、検出される光電流を増加させて、被検DNAを高感度に検出できることが分かる。
【0116】
例8:電子受容物質として酸化チタンまたはチタン酸ストロンチウムを用いた例
作用電極作製用ペーストを以下のように調製したこと、および被検DNA溶液の濃度を200μMとしたこと以外は例6と同様にして試験を行った。
【0117】
すなわち、作用電極作製用ペーストの作製は、以下に示される酸化物半導体0.5gと、例6で使用したものと同様の有機ビヒクル0.5gとを自動乳鉢で混練しながら、徐々に溶媒(αテルピネオール:ブチルカルビトール=重量比60:40)1gを添加することにより行った。これら一連の混合は合計5時間行われた。
TiO2:昭和タイタニウム社製、F−2、平均粒子径約60nm、アナターゼ:ルチル=2:8の混合相
ZnO:シーアイ化成社製、NanotekZnO、平均粒子径約30nm
Nb2O5:多木化学社製、酸化ニオブゾルを蒸発乾固した粉末、平均粒子径約10nm
WO3:和光純薬社製、平均粒子径約100nm
SrTiO3:2−エチルヘキサン酸ストロンチウムのトルエン溶液とチタンテトライソプロポキシドのイソプロピルアルコール溶液をモル比(Sr:Ti)で1:1の割合で混合し、100℃で蒸発乾固させた後、850℃で焼成する方法で自製した粉末、平均粒子径約200nm
In2O3:和光純薬社製、平均粒子径約100nm
【0118】
また、ブランクとして、プローブDNAおよび被検DNAのいずれも固定化されていない、作製されたままの作用電極についても光電流値を測定した。
【0119】
測定された光電流値(安定電流値)は表5に示される通りであった。なお、表4には、実測値のみならず、ブランクについて計測されたバックグランド電流値を差し引いた補正後の電流値も示す。
表 5
電子受容物質 平均粒子径 光電流値(mA)
(nm) 実測値 ブランク 補正後の電流値
TiO2 60 1.53 0.04 1.49
ZnO 30 0.59 0.03 0.56
WO3 100 0.24 0.10 0.14
Nb2O5 10 0.025 0.010 0.015
SrTiO3 200 0.045 0.0006 0.045
In2O3 100 0.30 0.07 0.23
【0120】
表5から分かるように、上記いずれの酸化物半導体を電子受容物質として使用した場合にも、光電流を検出することができた。特に、光電流の実測値および補正後の電流値と共に酸化チタンが最も高い値を示し、優れた電子受容物質であることが分かる。また、チタン酸ストロンチウムは、ブランクについて計測されたバックグランド電流値が極めて低いことからS/N比に優れており、高い精度で被検DNAに起因する応答電流を検出できることが分かる。
【0121】
例9:各種酸化物半導体におけるバックグランド電流の波長依存性
以下の5種類の酸化物半導体について、分光光度計(島津製作所社製、UV−3150)を使用して、拡散反射(DR)スペクトルを測定した。
SrTiO3:2−エチルヘキサン酸ストロンチウムのトルエン溶液とチタンテトライソプロポキシドのイソプロピルアルコール溶液をモル比(Sr:Ti)で1:1の割合で混合し、100℃で蒸発乾固させた後、850℃で焼成する方法で自製した粉末、平均粒子径約200nm
F3:昭和タイタニウム社製、平均粒子径約50nm、アナターゼ:ルチル=4:6の酸化チタン
P−25:日本アエロジル社製、平均粒子径約25nm、アナターゼ:ルチル=7:3の酸化チタン
ST−01:石原産業社製、平均粒子径約7nm、アナターゼ型酸化チタン
ZnO:シーアイ化成社製、NanotekZnO、平均粒子径30nm
【0122】
その結果は図16に示される通りであった。図16に示されるように、測定した全ての酸化物粉末は全て紫外領域の波長の光を吸収するが、410nm以上の波長の光をほとんど吸収しないことが分かる。このことは、照射光の波長をカットフィルタやバンドパスフィルタを用いて制御することにより、電子受容物質自体の光吸収に由来するバックグランド電流を極力抑制できることを意味する。特に、図16から分かるように、チタン酸ストロンチウムは400nm以上の波長の光をほとんど吸収しておらず、バックグランド電流が極めて低いという例8の結果と一致する。
【0123】
例10:被検DNAにおける色素標識位置による測定への影響
色素標識された被検DNAとして以下に示される3’ローダミンDNAおよび5’ローダミンDNAの二種類を使用したこと、および被検DNA溶液の濃度を200μMとしたこと以外は例6と同様にして試験を行った。
被検DNA(3’ローダミンDNA):
3’Rho−TTGCAGCACTGACCC 5’
被検DNA(5’ローダミンDNA):
3’ TTGCAGCACTGACCC−Rho5’
【0124】
なお、これらの被検DNAはいずれも、プローブDNAである5’−NH2−DNAとハイブリダイゼーション反応により二本鎖DNAを形成することができるものである。
【0125】
比較のため、被検DNAの代わりに、プローブDNAとの相補鎖を持たない、3’末端をローダミンBで標識された、以下の塩基配列を有する15塩基の核酸塩基(T−ローダミンDNA)を用いて、上記同様の試験を行った。
T−ローダミンDNA:
5’ TTTTTTTTTTTTTTT−Rho3’
【0126】
また、ブランクとして、プローブDNAおよび被検DNAのいずれも固定化されていない、作製されたままの作用電極についても光電流値を測定した。
【0127】
測定された光電流値(安定電流値)は表6に示される通りであった。
表 6
被検DNA 光電流値(mA)
3’ローダミンDNA 1.53
5’ローダミンDNA 1.28
T−ローダミンDNA(比較例) 0.29
ブランク(比較例) 0.04
【0128】
表6に示される通り、被検DNAの3‘末端を色素標識した場合と、被検DNAの5’末端を色素標識した場合の両方において、ほぼ同等の光電流が観測された。この結果から、被検DNAの3‘末端および5’末端のどちらに色素標識しても、高感度に被検DNAを検出できることが分かる。
一方、表6から分かるように、プローブDNAと相補鎖を持たないT−ローダミンDNAを使用した場合には、色素に由来する光電流がほとんど検出されなかった。すなわち、T−ローダミンDNAとプローブDNAとの間にハイブリダイゼーション反応が起こらなかったことが分かる。
また、ブランク試験の結果から、プローブDNAおよび被検DNAのいずれも固定化されていない、作製されたままの作用電極を使用した場合には、ほとんど光電流が検出されないことが分かる。
したがって、光電流の発生は基本的に被検DNAに標識された増感色素の光励起反応および電子受容物質への電子移動反応によって起こるものであり、その光電流値は電極上の二本鎖DNAの形成の割合に依存することが分かる。
【0129】
例11:光電流のアクションスペクトルの測定
被検DNA溶液の濃度を40μMとしたこと、光電流の測定の代わりに以下に述べる光電流のアクションスペクトルの測定を行ったこと以外は例6と同様にして試験を行った。
すなわち、光電流のアクションスペクトルの測定は、波長可変単色光源(分光計器製)を用いて行った。IPCE(Incident Photon to Current Efficiency:光電変換効率)をM. Gratzelらの報告(J. Am. Chem. Soc. 115, 6382, 1993)に基づき、下記式を用いて算出した。中心波長を各波長に設定し、半値幅を20nmとした。フォトンフラックス(Photon Flux)はスペクトルラディオメーター(ウシオ電機社製、USR−40D)を用いて測定した。
IPCE = 1250×光電流密度(μA/cm2)/[波長(nm)×フォトンフラックス(W/m2)]
【0130】
測定されたアクションスペクトル(IPCEの波長依存性)は図17に示される通りであった。図17には、使用した増感色素であるローダミンBの吸収スペクトルの併せて示してある。図17から分かるように、得られたアクションスペクトルは、増感色素(ローダミンB)の吸収スペクトルと同様のプロファイルを示した。これは、光電流が増感色素の励起に起因することを示唆する。すなわち、ローダミンBの吸収中心波長は520nmと見られるので、この波長域の光量を増加させることで、光電流値を増大できるものと考えられる。一方、420nm以下の波長領域では光電流が上昇する傾向が見られたが、この光電流は電子受容物質である酸化チタン自身の光励起に起因する光電流である。この電流は、被検DNAおよびプローブDNAのハイブリダイゼーションの有無にかかわらず発生し、いわゆるノイズとなる。したがって、センサの高精度化を実現させるためには、420nm以下の光を極力除去することが有効であることが分かる。
【0131】
例12:光源フィルタとバックグランド電流との関係
光学フィルタとして以下の6種類を使用したこと、およびハイブリダイゼーションを行わなかったこと以外は例6と同様にして試験を行った。
Y-43フィルタ:朝日テクノグラス社製、Y-43、紫外線カットフィルタ
550nm-40hwフィルタ:オプトライン社製、A06-8200843、中心波長550nm、半値幅40nm
20nm-220hwフィルタ:朝日分光社製、PB0620-220、中心波長620nm、半値幅220nm
600nm-260hwフィルタ:朝日分光社製、PB060-260、中心波長600nm、半値幅260nm
620nm-260hwフィルタ:朝日分光社製、PB0620-260、中心波長620nm、半値幅260nm
600nm-300hwフィルタ:朝日分光社製、PB0600-300、中心波長600nm、半値幅300nm
【0132】
また、色素の光吸収量を以下のようにして測定した。まず、酸化チタン電極上に吸着したDNAにラベルした色素を分光光度計(島津製作所社製、UV−3100)を用いて測定した。積分球を使用した拡散反射法に基づき、色素の反射率(R%)を算出した。このとき、反射率100%の参照物質として、硫酸バリウムの粉末を用いた。そして、式α(%)=100−R(%)に基づき、吸収率α(%)を算出した。
次いで、光吸収量を下記式に基づき、算出した。
【数1】

【0133】
測定されたバックグランド光電流値(安定電流値)および光吸収量は表7に示される通りであった。
表 7
フィルタ バックグランド光電流値 光吸収量
(μA) (mW/cm2)
Y-43フィルタ 46.6 4.3
550nm-40hwフィルタ 1.5 0.57
20nm-220hwフィルタ 11.8 1.6
600nm-260hwフィルタ 26.4 3.6
620nm-260hwフィルタ 16.4 2.7
600nm-300hwフィルタ 42.1 4.1
【0134】
ハイブリダイゼーション反応を行わない本例にあっては、増感色素の光励起が起こらないことから、電流値は本来ゼロとなることが望ましい。しかし、表7に示されるように、電子受容物質である酸化チタン自身の光励起による光電流がバックグランド電流として観測されてしまう。また、表7から分かるように、紫外線量の少ない550nm-40hwフィルタを使用した場合にはバックグランド電流を低減できるが、色素の光吸収量が他のフィルタよりも少なくなってしまう。したがって、バックグランドの低減には550nm-40hwフィルタの使用が好ましい一方、大きな光電流の値を得るためにはY-43フィルタの使用が有効であることが分かる。
【0135】
参考のため、上記6種類のフィルタを250Wのキセノンランプ光源(林時計工業社製、LA250Xe)に使用した場合の光源のスペクトル分布を、スペクトルラディオメーター(ウシオ電機、USR−40D)を用いて測定した。その結果は図18に示される通りであった。また、図18に示されるスペクトル分布図における350〜550nmの波長域を拡大した図を図19に示す。
【0136】
例13:光源フィルタとS/N比との関係
光学フィルタとして例11で用いたY-43フィルタおよび550nm-40hwフィルタを使用したこと、および被検DNA溶液の濃度を40μMとしたこと以外は例6と同様にして試験を行った。
【0137】
測定されたバックグランド光電流値の経時変化は図20に示される通りであった。図20に示されるように、Y-43フィルタの光電流の最大値は3.4mA、550nm-40hwフィルタの最大値は1.1mAとなった。すなわち、550nm-40hwフィルタを使用した場合の光電流の値はY-43フィルタを使用した場合の1/3程度と小さかった。これは、550nm-40hwフィルタは、例12の結果から分かるようにバックグランド電流を低減できるフィルタである一方、可視光の強度も弱くしてしまうため、増感色素の光吸収量が小さくなったためと考えられる。
【0138】
ここで、センサのシグナル/ノイズ比(S/N比)の指標として、光電流の最大値/バックグランド電流の比を考える。550nm-40hwフィルタを用いると、Y-43フィルタよりもバックグランド電流が1/30に低減される一方、光電流の最大値が1/3となる。したがって、550nm-40hwフィルタのS/N比はY-43フィルタに比較して、(1/3)/(1/30)=10倍向上することになる。他のフィルタに関しても同様な評価をおこなったところ、550nm-40hwフィルタのS/N比が最も優れていることが分かった。
【0139】
例14:照射光の強度依存性
被検DNA溶液の濃度を40μMとしたこと、および光源の強度を変化させたこと以外は例6と同様にして試験を行った。また、光強度をスペクトルラディオメーター(ウシオ電機社製、USR−40d)を用いて測定した。
【0140】
測定された光電流値(安定電流値)と、光強度との関係は図21に示される通りであった。図21に示されるように、光強度800mW/cm2の領域まで線形性が確認でき、光電流が反応速度は光強度の1乗に比例する光量律速であることが判明した。なお、一般的に、センサとして高精度でかつ安定に機能させるためには、反応速度が光強度の1/2乗に比例する拡散律速とはならない、光量律速下で評価することが望ましいとされている。
【0141】
例15:LED光源の検討
プローブDNAの担持を以下の通り行ったこと、ハイブリダイゼーションを行わなかったこと、および光源として以下のLEDを使用したこと以外は、例6と同様にして試験を行った。
赤色LED:オアシスRED、TOL-50aURsCEs
黄色LED:日亜化学、YELLOW NSPY-500S
白色LED:日亜化学、WHITE NSPW500BS
青色LED:豊田合成、BLUE E1L51-3B
緑色LED:豊田合成、GREEN E1L51-3G
なお、これらのLEDのスペクトル分布をスペクトルラディオメーター(ウシオ電機、USR−40D)を用いて測定したところ、図22に示される通りの結果が得られた。
【0142】
すなわち、プローブDNAの担持は以下の通り行った。まず、例6と同様にしてプローブDNAが担持される前の作用電極を作製した。こうして得られた作用電極にBLBランプで一晩紫外線照射を施し、汚れおよび残存有機物の除去を行った。次いで、プローブDNAとして以下に示される5’−NH2−3’ローダミンDNAを50mM HEPES(pH7.0)に溶解させて水溶液を調製した。この溶液を、予め95℃で3分間保持した後、氷上(2℃)で3分間以上冷却させることにより、熱変性させておいた。
プローブDNA(5’−NH2−3’ローダミンDNA):
5’ NH2−AACGTCGTGACTGGG 3’Rho
【0143】
先に得られた作用電極の電子受容層上に、プローブDNAと電子受容物質(酸化チタン)の結合力を向上させるために、シランカップリング剤による表面処理を行った。すなわち、イソプロパノール中にシランカップリング剤(信越化学社製、KBM−403)を0.5wt%溶解させた液を、75℃で5分間酸化チタンの表面に反応させた後、イソプロパノールで洗浄して乾燥した。こうして得られた作用電極表面にスペーサ用穴あきテープを貼り、ピンセットの先を用いてテープ接着面に残存する空気を除去した。このテープ上に、5mm×5mm角の大きさの開口部が形成されたシリコンシートを載置して密着させた。この開口部に先に調製した5’−NH2−3’ローダミンDNA溶液(40μM)を25μl装填した。このとき、ピペットチップの先端を用いて、シリコンシールの開口部の四隅まで充分にDNA溶液が行き渡るようにした。続いて、DNA溶液中に気泡が極力入らないようにガラス板で真上から蓋をして、湿らせた紙等で蒸気圧が調整されたプラスチック容器に収容した。この容器中に60℃で15時間保持して、5’アミン−3’ローダミンDNAをインキュベートした。その後、DNA溶液を除去し、流水で軽く電極表面を2秒間洗浄した後、空気を吹き付けて残水を飛散させた。こうして、プローブDNAが担持された作用電極を得た。
【0144】
こうしてプローブ物質が担持された作用電極に新たなシリコンシールを載置し、開口部にブロッキング剤として10μMのジエタノールアミン25μlを注入した。ブロッキング剤中に気泡が極力入らないようにガラス板で真上から蓋をして、湿らせた紙等で蒸気圧を調整したプラスチック容器に入れた。そして、60℃で30分間保持して、ブロッキング剤をインキュベートした。電極表面を再度流水で軽く2秒間洗浄した後、空気を吹き付けて残水を飛散させた。こうしてブロッキングが施された作用電極を得た。
【0145】
また、ブランクとして、作用電極に上記プローブDNAを固定化しないブランク電極についても光電流を測定した。プローブDNAを固定化した作用電極の光電流と、プランク電極の光電流との比をS/N比として評価した。
【0146】
測定された光電流、ブランク電流、光電流とブランク電流の差、およびS/N比を図23に示す。図23から分かるように、黄色および緑色のLEDにおいて、ブランク電流を低く抑えることができ、良好な結果が得られた。青色および白色のLEDは400nm以下の波長を若干含むため、ノイズとして検出される酸化チタン由来のバックグランド電流値が大きくなった。一方、赤色のLEDは最も光強度が強いにもかかわらず、色素として用いたローダミンの励起波長よりも長波長のため、光電流が検出されなかった。
【0147】
例16:LED光源を用いた被検DNAの検出
被検DNA溶液の濃度を10、20、および30μMとしたこと、プローブDNAの担持を以下の通り行ったこと、および光源として以下のLEDを使用したこと以外は、例6と同様にして光電流の測定を行った。
黄色LED:日亜化学、YELLOW NSPY-500S
緑色LED:豊田合成、GREEN E1L51-3G
【0148】
すなわち、プローブDNAの担持は以下の通り行った。まず、例6と同様にしてプローブ物質が担持される前の作用電極を作製した。こうして得られた作用電極にBLBランプで一晩紫外線照射を施し、汚れおよび残存有機物の除去を行った。
【0149】
次いで、プローブDNAとして例6で使用したものと同じ5’−NH2−DNAを50mM HEPES(pH7.0)に溶解させて水溶液を調製した。この溶液を、予め95℃で3分間保持した後、氷上(2℃)で3分間以上冷却させることにより、熱変性させておいた。
【0150】
先に得られた作用電極の電子受容層上に、プローブDNAと電子受容物質(酸化チタン)の結合力を向上させるために、シランカップリング剤による表面処理を行った。すなわち、イソプロパノール中にシランカップリング剤(信越化学、KBM−403)を0.5wt%溶解させた液を75℃で5分間電子受容層(酸化チタン)の表面に反応させた後、イソプロパノールで洗浄して乾燥した。こうして得られた作用電極表面にスペーサ用穴あきテープを貼り、ピンセットの先を用いてテープ接着面に残存する空気を除去した。このテープ上に、5mm×5mm角の大きさの開口部が形成されたシリコンシートを載置して密着させた。この開口部に先に調製した5’−NH2−DNA溶液(200μM)を25μl注入した。このとき、ピペットチップの先端を用いて、シリコンシールの開口部の四隅まで充分にDNA溶液が行き渡るようにした。続いて、DNA溶液中に気泡が極力入らないようにガラス板で真上から蓋をして、湿らせた紙等で蒸気圧が調整されたプラスチック容器に収容した。この容器中に60℃で6時間保持して、5’−NH2−DNAをインキュベートした。その後、DNA溶液を除去し、流水で軽く電極表面を2秒間洗浄した後、空気を吹き付けて残水を飛散させた。こうして、プローブDNAが担持された作用電極を得た。
【0151】
こうしてプローブ物質が担持された作用電極に新たなシリコンシールを載置し、開口部にブロッキング剤として10μMのジエタノールアミン25μlを注入した。ブロッキング剤中に気泡が極力入らないようにガラス板で真上から蓋をして、湿らせた紙等で蒸気圧を調整したプラスチック容器に入れた。そして、60℃で30分間保持して、ブロッキング剤をインキュベートした。電極表面を再度流水で軽く2秒間洗浄した後、空気を吹き付けて残水を飛散させた。こうしてブロッキングが施された作用電極を得た。
【0152】
測定された光電流と被検DNA濃度との関係は図24に示される通りであった。黄色および緑色LEDを光源として用いた場合、被検DNA濃度に依存した光電流が観測され、ハイブリダイゼーションを行わなかった濃度0μMのブランクよりも優位な光電流が観測された。これらの結果から、黄色および緑色LED光源は被検DNAの定量測定に適していることが分かる。
【0153】
例17:ルテニウム錯体スクシンイミジルエステルを用いた被検DNAの色素標識
被検DNAを標識するための増感色素として、アミノ基を持つ蛋白質を色素修飾するための色素として市販されている、下記式で表されるルテニウム錯体スクシンイミジルエステル(Ru−ONSu)を用意した。
【化1】

【0154】
この増感色素を用いたDNA末端アミンへの修飾を以下の通り行った。まず、上記増感色素を以下の条件で3’末端にアミノ基を持つ15merのssDNAと反応させた。
Ru−ONSu:200nmol/25μl
ssDNA:20nmol/25μl
緩衝液:50mM HEPES(pH7.0)
TAPS(pH8.0)
TAPS(pH9.0)
【0155】
各溶液を室温で15時間振盪させた後、ゲルろ過、続いてエタノール沈殿を行い、色素修飾DNAを精製した。Ru−ONSuの濃度を458nmの吸収スペクトルで測定した。また、ssDNAの濃度をMolecularProbes社の定量キットを用いて測定した。得られた測定結果を基に、ssDNAに対するRu−ONSuの修飾比(モル比)を算出した。得られた結果は表8に示される通りであった。
表 8
緩衝液 修飾比(Ru/DNA)
HEPES(pH7.0) 5.6
TAPS(pH8.0) 3.1
TAPS(pH9.0) 4.4
【0156】
表8に示される結果から、スクシンイミジルエステル誘導体をDNAの標識色素としても利用可能なことが分かる。表8の結果から分かるように、スクシンイミジルエステル誘導体は末端アミンのみならず核酸塩基中のアミンにも結合していると見られるため、この色素によれば1分子のDNAに対して複数個の標識色素を導入できることも分かる。
【0157】
例18:光電流のアクションスペクトルの測定
色素標識された被検DNAとして以下に示される3’AlexaFluor(R)647DNAを使用し、かつプローブDNAとして5’−NH2−DNA―2を使用したこと、および被検DNA溶液の濃度を40μMとしたこと以外は例11と同様にして光電流のアクションスペクトルの測定を行った。
被検DNA(3’AlexaFluora647DNA):
3’ AlexaFluora647−CCATGATGTCAGTTT 5’
プローブDNA(5’−NH2−DNA−2):
5’ NH2−GGTACTACAGTCAAA 3’
なお、これらの被検DNAとプローブDNAは、ハイブリダイゼーション反応により二本鎖DNAを形成することができるものである。
【0158】
測定されたアクションスペクトル(IPCEの波長依存性)は図25に示される通りであった。図25から分かるように、得られたアクションスペクトルは、増感色素であるAlexaFluor(R)647の吸収スペクトルと同様のプロファイルを示した。これは、光電流が増感色素の励起に起因することを示唆する。AlexaFluor(R)647の吸収中心波長は640nmと見られるので、前述したローダミンB色素の吸収中心波長(520nm)と分離して、それぞれの色素由来の光電流を観測できる。よって、複数の吸収波長の異なる色素を各々のDNAに標識し、それらの色素を別々に励起できる光を照射することで、同時に二本鎖DNAの形成を光電流として観測することが可能となる。
【0159】
例19: 酸化チタン多孔質膜を電子受容層として備えた作用電極の微細構造の評価
例6と同様にして、酸化チタン多孔質膜を電子受容層として備えた作用電極の作製を行った。得られた作用電極の断面および表面を走査型電子顕微鏡(S-4100型、日立製作所製)により観察した。作用電極の断面について得られたSEM画像を図26に、作用電極の酸化チタン多孔質膜表面について得られたSEM画像を図27に、それぞれ示す。図26に示される画像から、多孔質酸化チタン電極の膜厚は約20μmであり、表面が非常に平滑な均一な膜構造を有することが分かる。また、図27に示される画像から、得られた多孔質電極は、使用した酸化チタン粉末の一次粒子(粒径:約40〜50nm)に相当する粒子が良好に分散した、比較的大きなメソ細孔を有する良好な多孔質膜であることが分かった。従って、得られた多孔質膜にあっては、比較的分子サイズの大きいDNA分子であっても細孔内への拡散が容易に起こるものと考えられる。
【0160】
また、得られた酸化チタン多孔質膜の細孔分布を、細孔分布測定装置(日本ベル製、Belsorp28SA)を用いて測定した。このとき、測定サンプルとして、焼成後の作用電極から酸化チタン多孔質膜を剥離させたものを用いた。サンプルの表面積はBET式より、細孔径はDH式により算出した。その結果、BET比表面積は19.8m2/gと比較的高く、細孔分布は67.8nmにピークを持つ曲線が得られた。これらの結果から、得られた酸化チタン多孔質膜は、比較的大きな細孔が均一に開いた非常にポーラスな構造を有することが分かった。このような大きな細孔内にあっては、比較的嵩高いDNA分子(例えば一本鎖DNAの幅が約2nmのもの)の拡散が容易に起こるものと考えられる。
【0161】
例20:LED光源に対する酸化物半導体電極の最適化
(1)被検物質およびプローブ物質の準備
色素標識された被検物質(以下、被検DNAともいう)として、5’末端を蛍光色素Cy5で標識された、以下の塩基配列を有する25塩基の核酸塩基(5’Cy5DNA)を用意した。また、プローブ物質(以下、プローブDNAともいう)として上記被検DNAと相補鎖を有する5’末端にアミンを標識した25塩基の核酸塩基(5’−NH2−DNA)を用意した。すなわち、このプローブDNAと被検DNAは、ハイブリダイゼーション反応により二本鎖DNAを形成することができる。
被検DNA(5’Cy5DNA):
3’−TGGAAGTAGTTTTTGTAGTAGTAGG−Cy5−5’
プローブDNA(5’−NH2−DNA):
5’NH2−ACCTTCATCAAAAACATCATCATCC−3’
【0162】
(2)作用電極の作製およびプローブ物質の担持
プローブ物質として上記(1)に示したプローブDNAを使用したこと、チタニア微粉末またはその代わりとして以下に示される酸化物半導体微粉末を使用したこと、およびペーストを塗布する際の膜厚を60μmとしたこと以外は例6と同様にしてプローブDNAが担持された作用電極を得た。
TiO2:昭和タイタニウム社製、F-3、平均粒径50nm
ZnO:シーアイ化成社製、NanotekZnO)
Nb2O5:多木化学社製、酸化ニオブゾルを蒸発乾固した粉末
WO3:和光純薬社製
SrTiO3:Sr(NO3)2+Ti(OiPr)4を加水分解後焼成して得た粉末
In2O3:和光純薬社製
Ta2O5:シグマアルドリッチジャパン社製
【0163】
用いた各種酸化物半導体のバンドギャップ、平均粒径、およびバックグランド電流を表9に示す。なお、バックグランド電流とは、プローブDNAおよび被検DNAのどちらも吸着していない剥き出し(Bare)の電極の光電流である。
表 9
酸化物半導体 バンドギャップ(eV) 平均粒径(nm) バックグランド電流(nA)
酸化チタン(アナターゼ) 3.2 50 3
酸化亜鉛 3.1 30 25
酸化ニオブ 3.1 10 20
酸化タングステン 2.8 100 25
チタン酸ストロンチウム 3.2 200 0
酸化インジウム 3.8 100 15
酸化タンタル 3.9 500 0
【0164】
上記プローブ物質が担持された作用電極を、湿らせた紙等で蒸気圧が調整されたプラスチック容器に入れて、60℃で30分間、飽和水蒸気中に置いた。こうして蒸気に触れさせた電極に90℃で3分間加熱処理を行い、新たなシリコンシールを電極に載せた。
【0165】
(3)ハイブリダイゼーション
被検DNA溶液として10μMの5’Cy5DNA溶液を使用したこと、およびインキュベートの温度を50℃としたこと以外は例6と同様にしてハイブリダイゼーションを行った。
【0166】
(4)測定用セルの組み立て
例6と同様にしてサンドイッチ型の測定用セルを組み立てた。
【0167】
(5)光電流の測定
光源として赤色LED (CCS社製、HLV-27-NR-R)を用いたこと、および紫外線カットフィルタを使用しなかったこと以外は例6と同様にして光電流の測定を行った。
その結果は、図28に示される通りであった。図28に示されるように、赤色LED照射下でCy−5色素標識DNAを被検DNAとして用いた場合、酸化インジウム、酸化亜鉛、および酸化チタン電極において高い光電流値が得られることが判明した。また、その他の酸化物半導体電極、酸化タングステン、酸化ニオブ、チタン酸ストロンチウム、および酸化タンタルにおいてもバックグランド電流値以上の光電流値が得られているのでDNAセンサーとして有効であることが判明した。上記結果から、必ずしも酸化チタン電極だけが最適な電極であるとは限らず、光源、標識色素、およびDNA等の諸条件に応じて最適な電極も変化し得ることが分かる。
【0168】
例21:電子受容層のみで構成される作用電極を用いた例
(1) 色素標識プローブDNAの準備
色素標識されたプローブDNAとして、3’末端をCy5で標識された、以下の塩基配列を有する25塩基の核酸塩基(Cy5標識ssDNA)を用意した。
色素標識プローブDNA(Cy5標識ssDNA):
5’NH2−ACCTTCATCAAAAACATCATCATCC−Cy5−3’
【0169】
(2)作用電極の準備および色素標識DNAの担持
電子受容層のみで構成される作用電極として、フッ素をドープした酸化スズ(F−SnO2:FTO)コートガラス(エイアイ特殊硝子社製、U膜、シート抵抗:15Ω/□)およびスズをドープした酸化インジウム(Sn−InO2:ITO)コートガラス(東洋精密工業株式会社製、100Ω/□)を用意した。これらのガラスをアセトンと水で洗浄し、酸素雰囲気下で紫外線照射を30分間施して、汚れおよび残存有機物の除去を行った。洗浄されたガラスにスペーサ用穴あきテープを貼り、ピンセットの先を用いてテープ接着面に残存する空気を除去した。このテープ上に5mm×5mm角の大きさの開口部が形成されたシリコンシートを戴置して密着させた。
【0170】
続いて、0、1、10、50μMの各濃度に調製したCy5標識ssDNA溶液を95℃で5分間保持した後、直ちに氷上に移して10分間保持してDNAを変性させ、先に用意した電極上の開口部に25μlを装填した。この時ピペットチップの先端を用いて、シリコンシールの開口部の四隅まで充分にDNA溶液が行き渡るようにした。そして、DNA溶液中に気泡が入らないようにガラス板で真上から蓋をして、湿らせた紙等で蒸気圧が調製されたプラスチック容器に収容して、60℃で一晩インキュベートさせた。インキュベート後、DNA溶液を除去し、流水で軽く電極表面を約2秒間洗浄した後、空気を吹き付けて残水を飛散させた。その後、例6の表3に示した条件でDNAを吸着させた電極を洗浄し、最後に空気を吹き付けて残水を飛散させた。
【0171】
(3)測定用セルの組み立て
こうして得られた作用電極と、対電極としての白金電極とを用いて、図6に示されるようなフロー型測定セルを組み立てた。その際、作用電極を白金対電極と対向させて配置するとともに、その間には、両電極間の短絡を防止しかつ電解液を充填する空間を形成するための膜厚500μmのシリコンシートを挿入した。シリコンシートには5mm×5mm角よりも十分大きい穴が空いており、ここに送液された電解液が溜まり、作用電極上に固定化されたDNAが接触する構造になっている。作用電極は電気的に接しているスプリングプローブを介して、白金電極は端部に接続されたリード線を介してポテンシオスタット(ビー・エー・エス株式会社、ALS Modl832A)に接続した。
電解液として、体積比が4:6のアセトニトリルと炭酸エチレンの混合溶媒にヨウ素0.06Mとテトラプロピルアンモニウムヨーダイド0.6Mを溶解した混合液を用意した。この電解液を先に述べたフロー型測定セルに組み込まれた作用電極と白金対電極の間に充填させた。
【0172】
(4)光電流の測定
フロー型測定セルに固定したLED(CCS社製、HLV-27-NR-R)から生じた光を作用電極表面に照射し、作用電極と白金対電極との間に流れる電流を経時的に測定した。測定は180秒間行ったが、光の照射は電流の測定開始60秒後から60秒間のみ行った。観測した光電流について、120秒後の光電流値から180秒後の光電流値を差し引くことにより補正を行った。
各濃度のCy5標識ssDNAについて測定されたた光電流値は、図29に示される通りであった。図29に示されるように、FTOまたはITOを電子受容層として用いた場合、その下層に導電性基材を更に設けること無く、作用電極として十分に機能させることが出来る。すなわち、FTOおよびITOは電子受容層のみならず導電性基材としても機能することが確認された。
【0173】
例22:蛋白質の測定
(1)被検物質およびプローブ物質の準備
色素標識された被検物質として、ローダミンで標識したHSA(ヒト血清アルブミン)を用意した。また、プローブ物質として、抗HSA抗体(ウサギ抗HSA血清、日本バイオテスト研究所)を用意した。
【0174】
(2)作用電極の作製およびプローブ物質の担持
例6と同様にして作用電極の作製、および汚れおよび残存有機物の除去を行った。
得られた作用電極上に、スペーサ用穴あきテープを貼り、ピンセットの先を用いてテープ接着面に残存する空気を除去した。このテープ上に、5mm×5mm角の大きさの開口部が形成されたシリコンシートを戴置して密着させた。
次いで、プローブ物質として抗HSA抗体(ウサギ抗HSA血清、日本バイオテスト研究所)を50mM HEPES緩衝液(pH7.0)に7.68mg/mlになるように溶解させて水溶液を調製した。この溶液を、作用電極上のシリコンシールの開口部に25μl/電極ずつ装填して、ガラス板で覆い、4℃で一晩放置して固相化した。こうして得られた作用電極を50mM HEPES緩衝液(pH 7.0)で3回洗浄した。洗浄後、0.2%カゼインを含む50mM HEPES緩衝液(pH 7.0)をシリコンシールを作用電極表面に載置した開口部に25μl/電極ずつ装填して、ガラス板で覆い30℃で90分インキュベートし、ブロッキングを行った。
標識キットとしてFluoReporter Tetramethylrhodamine Protein Labeling kit(Molecular Probes社)を用いて、テトラメチルローダミンをHSAに標識した。製造元のプロトコルに従い、色素の標識反応、精製、および分離を行い、標識比1のローダミン標識HSA溶液を3.78mg/ml濃度で1.5ml得た。
【0175】
(3)被検物質の装填
次いで、ブロッキング後の作用電極を0.05% Tween20を含む50mM HEPES緩衝液(pH7.0)(以下T−HEPES)で3回洗浄した。ローダミン標識HSAをブロッキング液で段階希釈することにより、0.1、0.33、1.0、および3.3mg/mlの各濃度のローダミン標識HSA溶液を作製した。各濃度のローダミン標識HSA溶液を作用電極上のシリコンシールの開口部に25μl/電極ずつ装填して、ガラス板で覆い、30℃で90分間インキュベートした。その後、T−HEPESで3回洗浄し、超純水でリンスした。
【0176】
(4)測定用セルの組み立て
電解液として100mMエチレンジアミン四酢酸、100mM NaCl、および100mM Na2SO4からなる成分を溶解した水溶液を使用したこと以外は例21と同様にしてフロー型測定セルを組み立てた。
【0177】
(5)光電流の測定
フロー型測定セルに固定した緑色LED(CCS社製、HLV-24GR-NR-3W)と集光マイクロファイバヘッド(CCS社製、HFR-25-30)を用いて作用電極表面の3cm上方から光を照射し、作用電極と白金対電極の間に流れる電流を経時的に測定した。測定は180秒間行ったが、光の照射は電流の測定開始60秒後から60秒間のみ行った。観測した光電流は120秒後の光電流値から180秒後の光電流値を差し引くことで補正を行った。
各濃度のHSA溶液について測定された光電流値は、図30に示される通りであった。抗原濃度が0.1〜3.3mg/mlの範囲で相関係数の高い検量線を引くことができ、蛋白質の定量が可能であることが分かった。
【図面の簡単な説明】
【0178】
【図1】被検物質が一本鎖の核酸であり、プローブ物質が前記核酸に対して相補性を有する一本鎖の核酸である場合における、被検物質のプローブ物質への固定化工程を示す図であり、(a)は被検物質が予め増感色素で標識されてなる場合を、(b)は二本鎖の核酸にインターカレーション可能な増感色素を添加した場合をそれぞれ示す。
【図2】被検物質がリガンドであり、媒介物質が受容体蛋白質分子であり、プローブ物質が二本鎖の核酸である場合における、被検物質のプローブ物質への固定化工程を示す図である。
【図3】光源が配置された測定用セルを示す図であり、図中の点線で囲まれる部分21が測定用セルである。
【図4】図3に示される測定用セルの平面図である。
【図5】互いに競合する特異的結合性を有する被検物質および第二の被検物質が抗原であり、プローブ物質が抗体である場合の、被検物質のプローブ物質への固定化工程を示す図である。
【図6】フロー型測定用セルおよびパターニングされた作用電極を用いた装置の一例を示す図である。
【図7】パターニングされた作用電極の一例を示す図であり、(a)は作用電極の平面図を、(b)は作用電極の断面図を、(c)は別の態様の作用電極の断面図を、(d)はさらに別の態様の作用電極の断面図をそれぞれ示す。
【図8】パターニングされた作用電極の他の一例を示す図であり、(a)は作用電極の平面図を、(b)は作用電極の断面図を、(c)は別の態様の作用電極の断面図をそれぞれ示す。
【図9】パターニングされた作用電極に用いられる光源の一例を示す図である。
【図10】パターニングされた作用電極に用いられる光源の他の一例を示す図である。
【図11】例2〜5において得られた、28.6μMローダミン修飾DNA溶液を試料液とし手用いた場合の検出電流の経時変化を示す図である。
【図12】例2〜5において得られた、286μMローダミン修飾DNA溶液を試料液として用いた場合の検出電流の経時変化を示す。
【図13】例2において得られた、0nM、28.6μM、および286μMの各濃度のローダミン修飾DNA溶液を試料液として用いた場合の、定常状態にある検出電流を示す図である。
【図14】例6において被検物質DNAについて得られた、低濃度域における検量線を示す図である。
【図15】例6において被検物質DNAについて得られた、高濃度域における検量線を示す図である。
【図16】例9において得られた、拡散反射スペクトルによる各種酸化物半導体の光吸収測定の結果を示す図である。
【図17】例11において得られたアクションスペクトルを示す図である。
【図18】例12において使用した各種光学フィルタを介して照射した光のスペクトル分布を示す図である。
【図19】図18に示されるスペクトル分布図における350〜550nmの波長域を拡大した図である。
【図20】例13において得られた、各種光学フィルタを用いた場合におけるバックグランド光電流値の経時変化を示す図である。
【図21】例14において得られた、光電流値と、光強度との関係を示す図である。
【図22】例15において使用した各種LEDのスペクトル分布を示す図である。
【図23】例15において得られた、各種LEDを使用した場合における、光電流、ブランク電流、光電流とブランク電流の差、およびS/N比を示す図である。
【図24】例16において得られた、光電流と、被験DNA濃度との関係を示す図である。
【図25】例18において得られた、アクションスペクトルを示す図である。
【図26】例19において得られた、作用電極の断面について得られたSEM画像である。
【図27】例19において得られた、作用電極の酸化チタン多孔質膜表面について得られたSEM画像である。
【図28】例20において得られた、各種酸化物半導体電極について得られた光電流値を示す図である。
【図29】例21において得られた、光電流と、Cy5標識ssDNA濃度との関係を示す図である。
【図30】例22において得られた、光電流と、ローダミン標識HSA濃度との関係を示す図である。
【特許請求の範囲】
【請求項1】
光電流を用いた被検物質の特異的検出方法であって、
被検物質を含む試料液と、該被検物質と直接または間接的に特異的に結合可能なプローブ物質を表面に備えた作用電極と、対電極とを用意し、
増感色素の共存下、前記試料液を前記作用電極に接触させて、前記プローブ物質に前記被検物質を直接または間接的に特異的に結合させ、該結合により前記増感色素を前記作用電極に固定させ、
前記作用電極と前記対電極とを電解質媒体に接触させ、そして、
前記作用電極に光を照射して前記増感色素を光励起させ、該光励起された増感色素から前記作用電極への電子移動に起因して前記作用電極と前記対電極との間に流れる光電流を検出すること
を含んでなる、方法。
【請求項2】
光電流を用いた被検物質の特異的検出方法であって、
被検物質が直接または間接的に特異的に結合したプローブ物質を表面に備え、かつ該結合により増感色素が固定されてなる作用電極と、対電極とを電解質媒体に接触させ、
前記作用電極に光を照射して前記増感色素を光励起させ、該光励起された増感色素から前記作用電極への電子移動に起因して前記作用電極と前記対電極との間に流れる光電流を検出すること
を含んでなる、方法。
【請求項3】
前記被検物質が予め前記増感色素で標識されてなる、請求項1または2に記載の方法。
【請求項4】
前記増感色素が前記被検物質とプローブ物質との結合体にインターカレーション可能なものである、請求項1または2に記載の方法。
【請求項5】
前記被検物質が一本鎖の核酸であり、前記プローブ物質が前記核酸に対して相補性を有する一本鎖の核酸である、請求項1〜4のいずれか一項に記載の方法。
【請求項6】
前記相補性を有する核酸が、前記核酸に対して15bp以上の相補性部分を有する、請求項5に記載の方法。
【請求項7】
前記被検物質が予め前記増感色素で標識されてなる核酸であり、前記被検物質1分子につき前記増感色素が1つ標識されている、請求項5または6に記載の方法。
【請求項8】
前記被検物質が予め前記増感色素で標識されてなる核酸であり、前記被検物質1分子につき前記増感色素が2つ以上標識されている、請求項5または6に記載の方法。
【請求項9】
前記試料が、予め前記増感色素で標識されてなる、前記被検物質と特異的に結合可能な媒介物質をさらに含んでなり、該媒介物質と前記被検物質との結合物が前記プローブ物質に特異的に結合する、請求項1または2に記載の方法。
【請求項10】
前記被検物質がリガンドであり、前記媒介物質が受容体蛋白質分子であり、前記プローブ物質が二本鎖の核酸である、請求項9に記載の方法。
【請求項11】
前記被検物質が外因性内分泌攪乱物質である、請求項9または10に記載の方法。
【請求項12】
前記光電流を検出する工程が、電流値または電気量を測定し、得られた電流値または電気量から前記試料液中の被検物質濃度を算出することをさらに含んでなる、請求項1〜11のいずれか一項に記載の方法。
【請求項13】
得られた電流値または電気量から前記試料液中の被検物質濃度を算出する工程が、予め作成された被検物質濃度と電流値または電気量との検量線と、得られた電流値または電気量とを対比することにより行われる、請求項12に記載の方法。
【請求項14】
前記被検物質が予め前記増感色素で標識されてなり、
前記試料液が、前記増感色素で標識されていない、前記プローブ物質に特異的に結合可能な第二の被検物質をさらに含んでなり、それにより、前記被検物質および第二の被検物質を前記プローブ物質に競合させて特異的に結合させ、そして、
前記光電流を検出する工程が、電流値または電気量を測定し、得られた電流値または電気量から前記試料液中の第二の被検物質濃度を算出することをさらに含んでなる、請求項1または2に記載の方法。
【請求項15】
得られた電流値または電気量から前記試料液中の第二の被検物質濃度を算出する工程が、予め作成された第二の被検物質濃度と電流値または電気量との検量線と、得られた電流値または電気量とを対比することにより行われる、請求項14に記載の方法。
【請求項16】
前記被検物質および前記第二の被検物質が抗原であり、前記プローブ物質が抗体である、請求項14または15に記載の方法。
【請求項17】
前記第二の被検物質が、前記被検物質よりも前記プローブ物質に特異的に結合しやすい性質を有する、請求項14〜16のいずれか一項に記載の方法。
【請求項18】
前記作用電極が、前記増感色素が光励起に応じて放出する電子を受容可能な電子受容物質を含んでなる電子受容層を有し、該電子受容層の表面に前記プローブ物質が担持されてなる、請求項1〜17のいずれか一項に記載の方法。
【請求項19】
前記電子受容物質が、前記増感色素の最低非占有分子軌道(LUMO)のエネルギー準位よりも低いエネルギー準位を有する物質である、請求項18に記載の方法。
【請求項20】
前記電子受容物質が、酸化チタン、酸化亜鉛、酸化スズ、酸化ニオブ、酸化インジウム、酸化タングステン、酸化タンタル、およびチタン酸ストロンチウムからなる群から選択される少なくとも一種を含んでなる、請求項18または19に記載の方法。
【請求項21】
前記電子受容物質が酸化チタンまたはチタン酸ストロンチウムである、請求項18または19に記載の方法。
【請求項22】
前記電子受容物質がインジウム−スズ複合酸化物(ITO)またはフッ素がドープされた酸化スズ(FTO)である、請求項18または19に記載の方法。
【請求項23】
前記作用電極が導電性基材をさらに含んでなり、前記電子受容層が該導電性基材上に形成されてなる、請求項1〜22のいずれか一項に記載の方法。
【請求項24】
前記増感色素が金属錯体色素または有機色素である、請求項1〜23のいずれか一項に記載の方法。
【請求項25】
前記インターカレーション可能な増感色素が、アクリジンオレンジまたはエチジウムブロマイドである、請求項4〜24のいずれか一項に記載の方法。
【請求項26】
前記被検物質が二種以上存在し、前記各被検物質が互いに異なる波長の光で励起可能な異なる増感色素で標識され、
各増感色素毎に異なる波長の光を照射することにより、前記各被検物質を個別に検出する、請求項1〜25のいずれか一項に記載の方法。
【請求項27】
前記作用電極上に前記プローブ物質が互いに分離された複数の領域毎に区分されて担持されてなり、前記光照射が各領域に対して個別に行われる、請求項1〜26のいずれか一項に記載の方法。
【請求項28】
前記電子受容層が前記導電性基材の全面にわたって形成されてなり、前記導電性基材全体を流れる光電流を検出する、請求項27に記載の方法。
【請求項29】
前記作用電極が絶縁基板をさらに備えてなり、該絶縁基板上に、前記導電性基材および前記電子受容層からなるスポットが、互いに分離された複数の領域毎に区分されて形成されてなり、該各領域の導電性基材毎に流れる光電流を個別に検出する、請求項1〜27のいずれか一項に記載の方法。
【請求項30】
前記作用電極が絶縁基板をさらに備えてなり、該絶縁基板上に、前記電子受容層からなるスポットが、互いに分離された複数の領域毎に区分されて形成されてなり、該各領域の電子受容層毎に流れる光電流を個別に検出する、請求項1〜27のいずれか一項に記載の方法。
【請求項31】
前記作用電極上の互いに分離された複数の領域の各領域に複数種類のプローブ物質が担持させることにより、複数の試料液の測定を同時に行う、請求項27〜30のいずれか一項に記載の方法。
【請求項32】
前記作用電極上の互いに分離された複数の領域の各領域毎に異なるプローブ物質が担持させることにより、複数種類の被検物質の測定を同時に行う、請求項27〜30のいずれか一項に記載の方法。
【請求項33】
前記電解質媒体がリチウムイオンを含む、請求項1〜32のいずれか一項に記載の方法。
【請求項34】
前記光が紫外線を実質的に含まない、請求項1〜33のいずれか一項に記載の方法。
【請求項35】
前記光の照射が、紫外線を除去する手段を介して行われる、請求項1〜33のいずれか一項に記載の方法。
【請求項36】
前記紫外線を除去する手段が、光学フィルタまたは分光器である、請求項35に記載の方法。
【請求項37】
前記光が、レーザ、無機エレクトロルミネッセンス(EL)素子、および有機エレクトロルミネッセンス(EL)素子からなる群から選択される少なくとも一つの光源から放出された光である、請求項34〜36のいずれか一項に記載の方法。
【請求項38】
前記光が、発光ダイオード(LED)である光源から放出された光である、請求項34〜37のいずれか一項に記載の方法。
【請求項39】
請求項1〜38のいずれか一項に記載の方法において作用電極として用いられる電極であって、
導電性基材と、
該導電性基材上に形成される、前記増感色素が光励起に応じて放出する電子を受容可能な電子受容物質を含んでなる電子受容層と、
を備えた、電極。
【請求項40】
前記電子受容層上に担持される、前記被検物質と直接または間接的に特異的に結合可能なプローブ物質をさらに備えた、請求項39に記載の電極。
【請求項41】
前記電子受容物質が、前記増感色素の最低非占有分子軌道(LUMO)のエネルギー準位よりも低いエネルギー準位を有する物質である、請求項39または40に記載の電極。
【請求項42】
前記電子受容物質が、酸化チタン、酸化亜鉛、酸化スズ、酸化ニオブ、酸化インジウム、酸化タングステン、酸化タンタル、およびチタン酸ストロンチウムからなる群から選択される少なくとも一種を含んでなる、請求項39〜41のいずれか一項に記載の電極。
【請求項43】
前記電子受容物質が酸化チタンである、請求項39〜41のいずれか一項に記載の電極。
【請求項44】
前記電子受容物質がチタン酸ストロンチウムである、請求項39〜41のいずれか一項に記載の電極。
【請求項45】
前記電子受容層の膜厚が0.1〜200μmである、請求項39〜44のいずれか一項に記載の電極。
【請求項46】
前記電子受容層が多孔性を有する、請求項39〜45のいずれか一項に記載の電極。
【請求項47】
前記導電性基材が透明である、請求項39〜46のいずれか一項に記載の電極。
【請求項48】
前記プローブ物質が、前記電子受容層上の、互いに分離された複数の領域毎に区分されて担持されてなる、請求項39〜47のいずれか一項に記載の電極。
【請求項49】
前記電子受容層が前記導電性基材の全面にわたって形成されてなる、前記導電性基材にリード線が接続されてなる、請求項48に記載の電極。
【請求項50】
絶縁基板をさらに備えてなり、該絶縁基板上に、前記導電性基材および前記電子受容層からなるスポットが、互いに分離された複数の領域毎に区分されて形成されてなり、該各領域の導電性基材毎に個別にリード線が接続されてなる、請求項48に記載の電極。
【請求項51】
請求項1〜38のいずれか一項に記載の方法に用いられる測定用セルであって、
請求項39〜50のいずれか一項に記載の作用電極と、
対電極と、
前記作用電極および前記対電極が接触される電解質媒体と
を備えた、測定用セル。
【請求項52】
前記作用電極と前記対電極との間に挿入されるスペーサをさらに備えた、請求項51に記載の測定用セル。
【請求項53】
前記電解質媒体が前記作用電極と前記対電極との間に充填されてなる、請求項51または52に記載の測定用セル。
【請求項54】
前記電解質媒体がリチウムイオンを含む、請求項51〜54のいずれか一項に記載の測定用セル。
【請求項55】
請求項1〜38のいずれか一項に記載の方法に用いられる測定装置であって、
請求項51〜54のいずれか一項に記載される測定用セルと、
前記作用電極の表面に光を照射する光源と、
前記作用電極と前記対電極との間を流れる電流を測定する電流計と
を備えた、測定装置。
【請求項56】
前記光源が、増感色素の種類に応じて異なる波長の光を照射可能な複数の光源を備えた、請求項55に記載の装置。
【請求項57】
前記光源が、波長選択手段をさらに備えてなり、増感色素の種類に応じて異なる波長の光を照射可能とされてなる、請求項55に記載の装置。
【請求項58】
前記光源が、紫外線を実質的に含まない光を放出する光源である、請求項55〜57のいずれか一項に記載の装置。
【請求項59】
前記光源と前記作用電極との間に、紫外線を除去する手段をさらに備えた、請求項55〜57のいずれか一項に記載の装置。
【請求項60】
前記紫外線を除去する手段が、光学フィルタまたは分光器である、請求項59に記載の装置。
【請求項61】
前記光源が、レーザ、無機エレクトロルミネッセンス(EL)素子、および有機エレクトロルミネッセンス(EL)素子からなる群から選択される少なくとも一つである、請求項58〜60のいずれか一項に記載の装置。
【請求項62】
前記光源が、発光ダイオード(LED)である、請求項58〜60のいずれか一項に記載の装置。
【請求項63】
前記光源が、前記作用電極上を走査するための走査機構をさらに備えてなる、請求項55〜62のいずれか一項に記載の装置。
【請求項64】
前記電流計が、得られた電流量または電気量から試料液中の被検物質濃度を算出する手段をさらに備えてなる、請求項55〜63のいずれか一項に記載の装置。
【請求項1】
光電流を用いた被検物質の特異的検出方法であって、
被検物質を含む試料液と、該被検物質と直接または間接的に特異的に結合可能なプローブ物質を表面に備えた作用電極と、対電極とを用意し、
増感色素の共存下、前記試料液を前記作用電極に接触させて、前記プローブ物質に前記被検物質を直接または間接的に特異的に結合させ、該結合により前記増感色素を前記作用電極に固定させ、
前記作用電極と前記対電極とを電解質媒体に接触させ、そして、
前記作用電極に光を照射して前記増感色素を光励起させ、該光励起された増感色素から前記作用電極への電子移動に起因して前記作用電極と前記対電極との間に流れる光電流を検出すること
を含んでなる、方法。
【請求項2】
光電流を用いた被検物質の特異的検出方法であって、
被検物質が直接または間接的に特異的に結合したプローブ物質を表面に備え、かつ該結合により増感色素が固定されてなる作用電極と、対電極とを電解質媒体に接触させ、
前記作用電極に光を照射して前記増感色素を光励起させ、該光励起された増感色素から前記作用電極への電子移動に起因して前記作用電極と前記対電極との間に流れる光電流を検出すること
を含んでなる、方法。
【請求項3】
前記被検物質が予め前記増感色素で標識されてなる、請求項1または2に記載の方法。
【請求項4】
前記増感色素が前記被検物質とプローブ物質との結合体にインターカレーション可能なものである、請求項1または2に記載の方法。
【請求項5】
前記被検物質が一本鎖の核酸であり、前記プローブ物質が前記核酸に対して相補性を有する一本鎖の核酸である、請求項1〜4のいずれか一項に記載の方法。
【請求項6】
前記相補性を有する核酸が、前記核酸に対して15bp以上の相補性部分を有する、請求項5に記載の方法。
【請求項7】
前記被検物質が予め前記増感色素で標識されてなる核酸であり、前記被検物質1分子につき前記増感色素が1つ標識されている、請求項5または6に記載の方法。
【請求項8】
前記被検物質が予め前記増感色素で標識されてなる核酸であり、前記被検物質1分子につき前記増感色素が2つ以上標識されている、請求項5または6に記載の方法。
【請求項9】
前記試料が、予め前記増感色素で標識されてなる、前記被検物質と特異的に結合可能な媒介物質をさらに含んでなり、該媒介物質と前記被検物質との結合物が前記プローブ物質に特異的に結合する、請求項1または2に記載の方法。
【請求項10】
前記被検物質がリガンドであり、前記媒介物質が受容体蛋白質分子であり、前記プローブ物質が二本鎖の核酸である、請求項9に記載の方法。
【請求項11】
前記被検物質が外因性内分泌攪乱物質である、請求項9または10に記載の方法。
【請求項12】
前記光電流を検出する工程が、電流値または電気量を測定し、得られた電流値または電気量から前記試料液中の被検物質濃度を算出することをさらに含んでなる、請求項1〜11のいずれか一項に記載の方法。
【請求項13】
得られた電流値または電気量から前記試料液中の被検物質濃度を算出する工程が、予め作成された被検物質濃度と電流値または電気量との検量線と、得られた電流値または電気量とを対比することにより行われる、請求項12に記載の方法。
【請求項14】
前記被検物質が予め前記増感色素で標識されてなり、
前記試料液が、前記増感色素で標識されていない、前記プローブ物質に特異的に結合可能な第二の被検物質をさらに含んでなり、それにより、前記被検物質および第二の被検物質を前記プローブ物質に競合させて特異的に結合させ、そして、
前記光電流を検出する工程が、電流値または電気量を測定し、得られた電流値または電気量から前記試料液中の第二の被検物質濃度を算出することをさらに含んでなる、請求項1または2に記載の方法。
【請求項15】
得られた電流値または電気量から前記試料液中の第二の被検物質濃度を算出する工程が、予め作成された第二の被検物質濃度と電流値または電気量との検量線と、得られた電流値または電気量とを対比することにより行われる、請求項14に記載の方法。
【請求項16】
前記被検物質および前記第二の被検物質が抗原であり、前記プローブ物質が抗体である、請求項14または15に記載の方法。
【請求項17】
前記第二の被検物質が、前記被検物質よりも前記プローブ物質に特異的に結合しやすい性質を有する、請求項14〜16のいずれか一項に記載の方法。
【請求項18】
前記作用電極が、前記増感色素が光励起に応じて放出する電子を受容可能な電子受容物質を含んでなる電子受容層を有し、該電子受容層の表面に前記プローブ物質が担持されてなる、請求項1〜17のいずれか一項に記載の方法。
【請求項19】
前記電子受容物質が、前記増感色素の最低非占有分子軌道(LUMO)のエネルギー準位よりも低いエネルギー準位を有する物質である、請求項18に記載の方法。
【請求項20】
前記電子受容物質が、酸化チタン、酸化亜鉛、酸化スズ、酸化ニオブ、酸化インジウム、酸化タングステン、酸化タンタル、およびチタン酸ストロンチウムからなる群から選択される少なくとも一種を含んでなる、請求項18または19に記載の方法。
【請求項21】
前記電子受容物質が酸化チタンまたはチタン酸ストロンチウムである、請求項18または19に記載の方法。
【請求項22】
前記電子受容物質がインジウム−スズ複合酸化物(ITO)またはフッ素がドープされた酸化スズ(FTO)である、請求項18または19に記載の方法。
【請求項23】
前記作用電極が導電性基材をさらに含んでなり、前記電子受容層が該導電性基材上に形成されてなる、請求項1〜22のいずれか一項に記載の方法。
【請求項24】
前記増感色素が金属錯体色素または有機色素である、請求項1〜23のいずれか一項に記載の方法。
【請求項25】
前記インターカレーション可能な増感色素が、アクリジンオレンジまたはエチジウムブロマイドである、請求項4〜24のいずれか一項に記載の方法。
【請求項26】
前記被検物質が二種以上存在し、前記各被検物質が互いに異なる波長の光で励起可能な異なる増感色素で標識され、
各増感色素毎に異なる波長の光を照射することにより、前記各被検物質を個別に検出する、請求項1〜25のいずれか一項に記載の方法。
【請求項27】
前記作用電極上に前記プローブ物質が互いに分離された複数の領域毎に区分されて担持されてなり、前記光照射が各領域に対して個別に行われる、請求項1〜26のいずれか一項に記載の方法。
【請求項28】
前記電子受容層が前記導電性基材の全面にわたって形成されてなり、前記導電性基材全体を流れる光電流を検出する、請求項27に記載の方法。
【請求項29】
前記作用電極が絶縁基板をさらに備えてなり、該絶縁基板上に、前記導電性基材および前記電子受容層からなるスポットが、互いに分離された複数の領域毎に区分されて形成されてなり、該各領域の導電性基材毎に流れる光電流を個別に検出する、請求項1〜27のいずれか一項に記載の方法。
【請求項30】
前記作用電極が絶縁基板をさらに備えてなり、該絶縁基板上に、前記電子受容層からなるスポットが、互いに分離された複数の領域毎に区分されて形成されてなり、該各領域の電子受容層毎に流れる光電流を個別に検出する、請求項1〜27のいずれか一項に記載の方法。
【請求項31】
前記作用電極上の互いに分離された複数の領域の各領域に複数種類のプローブ物質が担持させることにより、複数の試料液の測定を同時に行う、請求項27〜30のいずれか一項に記載の方法。
【請求項32】
前記作用電極上の互いに分離された複数の領域の各領域毎に異なるプローブ物質が担持させることにより、複数種類の被検物質の測定を同時に行う、請求項27〜30のいずれか一項に記載の方法。
【請求項33】
前記電解質媒体がリチウムイオンを含む、請求項1〜32のいずれか一項に記載の方法。
【請求項34】
前記光が紫外線を実質的に含まない、請求項1〜33のいずれか一項に記載の方法。
【請求項35】
前記光の照射が、紫外線を除去する手段を介して行われる、請求項1〜33のいずれか一項に記載の方法。
【請求項36】
前記紫外線を除去する手段が、光学フィルタまたは分光器である、請求項35に記載の方法。
【請求項37】
前記光が、レーザ、無機エレクトロルミネッセンス(EL)素子、および有機エレクトロルミネッセンス(EL)素子からなる群から選択される少なくとも一つの光源から放出された光である、請求項34〜36のいずれか一項に記載の方法。
【請求項38】
前記光が、発光ダイオード(LED)である光源から放出された光である、請求項34〜37のいずれか一項に記載の方法。
【請求項39】
請求項1〜38のいずれか一項に記載の方法において作用電極として用いられる電極であって、
導電性基材と、
該導電性基材上に形成される、前記増感色素が光励起に応じて放出する電子を受容可能な電子受容物質を含んでなる電子受容層と、
を備えた、電極。
【請求項40】
前記電子受容層上に担持される、前記被検物質と直接または間接的に特異的に結合可能なプローブ物質をさらに備えた、請求項39に記載の電極。
【請求項41】
前記電子受容物質が、前記増感色素の最低非占有分子軌道(LUMO)のエネルギー準位よりも低いエネルギー準位を有する物質である、請求項39または40に記載の電極。
【請求項42】
前記電子受容物質が、酸化チタン、酸化亜鉛、酸化スズ、酸化ニオブ、酸化インジウム、酸化タングステン、酸化タンタル、およびチタン酸ストロンチウムからなる群から選択される少なくとも一種を含んでなる、請求項39〜41のいずれか一項に記載の電極。
【請求項43】
前記電子受容物質が酸化チタンである、請求項39〜41のいずれか一項に記載の電極。
【請求項44】
前記電子受容物質がチタン酸ストロンチウムである、請求項39〜41のいずれか一項に記載の電極。
【請求項45】
前記電子受容層の膜厚が0.1〜200μmである、請求項39〜44のいずれか一項に記載の電極。
【請求項46】
前記電子受容層が多孔性を有する、請求項39〜45のいずれか一項に記載の電極。
【請求項47】
前記導電性基材が透明である、請求項39〜46のいずれか一項に記載の電極。
【請求項48】
前記プローブ物質が、前記電子受容層上の、互いに分離された複数の領域毎に区分されて担持されてなる、請求項39〜47のいずれか一項に記載の電極。
【請求項49】
前記電子受容層が前記導電性基材の全面にわたって形成されてなる、前記導電性基材にリード線が接続されてなる、請求項48に記載の電極。
【請求項50】
絶縁基板をさらに備えてなり、該絶縁基板上に、前記導電性基材および前記電子受容層からなるスポットが、互いに分離された複数の領域毎に区分されて形成されてなり、該各領域の導電性基材毎に個別にリード線が接続されてなる、請求項48に記載の電極。
【請求項51】
請求項1〜38のいずれか一項に記載の方法に用いられる測定用セルであって、
請求項39〜50のいずれか一項に記載の作用電極と、
対電極と、
前記作用電極および前記対電極が接触される電解質媒体と
を備えた、測定用セル。
【請求項52】
前記作用電極と前記対電極との間に挿入されるスペーサをさらに備えた、請求項51に記載の測定用セル。
【請求項53】
前記電解質媒体が前記作用電極と前記対電極との間に充填されてなる、請求項51または52に記載の測定用セル。
【請求項54】
前記電解質媒体がリチウムイオンを含む、請求項51〜54のいずれか一項に記載の測定用セル。
【請求項55】
請求項1〜38のいずれか一項に記載の方法に用いられる測定装置であって、
請求項51〜54のいずれか一項に記載される測定用セルと、
前記作用電極の表面に光を照射する光源と、
前記作用電極と前記対電極との間を流れる電流を測定する電流計と
を備えた、測定装置。
【請求項56】
前記光源が、増感色素の種類に応じて異なる波長の光を照射可能な複数の光源を備えた、請求項55に記載の装置。
【請求項57】
前記光源が、波長選択手段をさらに備えてなり、増感色素の種類に応じて異なる波長の光を照射可能とされてなる、請求項55に記載の装置。
【請求項58】
前記光源が、紫外線を実質的に含まない光を放出する光源である、請求項55〜57のいずれか一項に記載の装置。
【請求項59】
前記光源と前記作用電極との間に、紫外線を除去する手段をさらに備えた、請求項55〜57のいずれか一項に記載の装置。
【請求項60】
前記紫外線を除去する手段が、光学フィルタまたは分光器である、請求項59に記載の装置。
【請求項61】
前記光源が、レーザ、無機エレクトロルミネッセンス(EL)素子、および有機エレクトロルミネッセンス(EL)素子からなる群から選択される少なくとも一つである、請求項58〜60のいずれか一項に記載の装置。
【請求項62】
前記光源が、発光ダイオード(LED)である、請求項58〜60のいずれか一項に記載の装置。
【請求項63】
前記光源が、前記作用電極上を走査するための走査機構をさらに備えてなる、請求項55〜62のいずれか一項に記載の装置。
【請求項64】
前記電流計が、得られた電流量または電気量から試料液中の被検物質濃度を算出する手段をさらに備えてなる、請求項55〜63のいずれか一項に記載の装置。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【図17】


【図18】


【図19】


【図20】


【図21】


【図22】


【図23】


【図24】


【図25】


【図28】


【図29】


【図30】


【図26】


【図27】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【図17】


【図18】


【図19】


【図20】


【図21】


【図22】


【図23】


【図24】


【図25】


【図28】


【図29】


【図30】


【図26】


【図27】


【公開番号】特開2006−119111(P2006−119111A)
【公開日】平成18年5月11日(2006.5.11)
【国際特許分類】
【出願番号】特願2005−91884(P2005−91884)
【出願日】平成17年3月28日(2005.3.28)
【出願人】(000010087)東陶機器株式会社 (3,889)
【Fターム(参考)】
【公開日】平成18年5月11日(2006.5.11)
【国際特許分類】
【出願日】平成17年3月28日(2005.3.28)
【出願人】(000010087)東陶機器株式会社 (3,889)
【Fターム(参考)】
[ Back to top ]

