免疫エフェクター活性を有するエンドシアリン細胞に内部移行する抗体
【課題】エンドシアリンを発現する細胞に特異的に結合し、選択的にこの細胞に内部移行し、抗体依存性細胞傷害作用などの免疫エフェクター活性を誘発する能力を有するモノクローナルおよびポリクローナル抗体、および、その利用の提供。
【解決手段】薬物をエンドシアリン発現細胞に特異的に送達し、特に腫瘍細胞および新生血管細胞および前駆体で免疫エフェクター活性を誘発する際に有用である抗エンドシアリン抗体、および、本発明の抗体をコード化したヌクレオチド、さらに前記抗体を発現する細胞、癌および新生血管細胞を検出する方法、および前記抗体、その誘導体、およびそのフラグメントを用いて癌および血管新生疾患を治療する方法。
【解決手段】薬物をエンドシアリン発現細胞に特異的に送達し、特に腫瘍細胞および新生血管細胞および前駆体で免疫エフェクター活性を誘発する際に有用である抗エンドシアリン抗体、および、本発明の抗体をコード化したヌクレオチド、さらに前記抗体を発現する細胞、癌および新生血管細胞を検出する方法、および前記抗体、その誘導体、およびそのフラグメントを用いて癌および血管新生疾患を治療する方法。
【発明の詳細な説明】
【技術分野】
【0001】
本願は2005年4月22日付け出願の米国特許仮出願第60/674,185号に対して優先権を主張するものであり、その開示はこの参照によって本明細書に完全に組み込まれる。
【0002】
本発明は、エンドシアリンを発現または提示する細胞(「エンドシアリン陽性細胞」)に特異的に結合し、前記細胞に選択的に内部移行し、または抗体依存性細胞傷害作用などの免疫エフェクター活性を誘導する、モノクローナル抗体およびポリクローナル抗体の使用に関する。前記抗体は、薬物をエンドシアリン陽性細胞に特異的に送達し、これらに限らないが、特に血管新生細胞、内皮前駆細胞、腫瘍、間質腫瘍、及び異型細胞などを含むエンドシアリン陽性細胞で免疫エフェクター活性を誘発させる際に有用である。本発明は、前記モノクローナル抗体、ポリクローナル抗体、キメラおよびヒト化モノクローナル抗体などの抗体誘導体、抗体フラグメントを発現した細胞、エンドシアリン陽性細胞の検出法、および本発明の抗体を用いた癌および血管新生疾患の治療法にも関連する。
【背景技術】
【0003】
血管新生は新しい血管形成が関与した調整された工程である。血管新生は正常な成長、胚の発育、創傷治癒、および生理学的工程において重要な役割を果たしている。 (Yancopoulos et al.(2000) Nature 407(6801):242−8).更に、新血管新生は癌を含む幾つかの病状が関与しており、新しい「胚の様な」血管(本願明細書においては新血管形成と称する)は、構造及び機能に関しては正常な血管系とは異なるように思われる (Hanahan and Weinberg (2000) Cell 100(1):57−70)。多くのインビボおよびインビトロ研究において、血管新生疾患を治療するために胚型および腫瘍が関連した内皮型の血管形成を選択的に阻害する新規抗血管新生化合物を開発可能な様々な血管新生のモデル系を使用した場合、正常な血管系と疾患が関与した血管系とは生物学的に異なることが示されているこのような治療の機会の観点から見ると、具体的に腫瘍及び他の血管新生疾患に関連した内皮細胞の成長を阻害する可能な標的に対する熱心な探索が行われている。そのような標的を同定する試みにおいて、腫瘍間質の細胞表面抗原を同定、および新生血管内皮細胞において発現されるタンパク質またはRNAを単離する戦略が設計されている (Rettig et al.(1992) Proc Natl.Acad Sci USA 89(22):10832−6; St. Croix et al.(2000) Science 289:1197−1202)。このような戦略によって、エンドシアリン(または腫瘍内皮マーカー1、tumor endothelial marker1:TEM1)と呼ばれる特に血管新生内皮細胞において発現される細胞表面タンパク質が特定されている。悪性組織の免疫組織化学的研究に抗体を用いることによって、悪性組織内の多くの血管新生内皮細胞、腫瘍間質細胞、及び推定内皮白血球中においてエンドシアリンの良好な発現を見出した[(Brady et al.(2004) ヒトエンドシアリン(腫瘍内皮マーカー1)は、非常に悪性であり且つ侵襲性の脳腫瘍において多量に発現される(Human endosialin (tumor endothelial marker 1) is abundantly expressed in highly malignant and invasive brain tumors.)J Neuropathol Exp Neurol.63:1274−83; Rettig et al.(1992); Conejo−Garcia et.al. (2005) 血管白血球は腫瘍脈管系に寄与する(Vascular leukocytes contribute to tumor vascularization).Blood 105:679−81)] 、一方、これらに限らないが、HUVEC (Human Umbilical Vein Endothelial Cells) or HMVEC−(Neonatal Dermal Microvascular Endothelial Cells)などの胚様内皮培養物から誘導される細胞株における発現は限られているが(Cambrex社からオンラインで入手可能)。エンドシアリンに結合可能な抗体の分析によって、内皮細胞培養物中、この抗原を発現する一連の細胞、および正常な患者組織における樹状様細胞のサブセットが特定された近年、腫瘍の血管中で内皮細胞を形成可能な細胞が白血球に含まれていることが示され、治療のためにこのようなエンドシアリン陽性細胞型を標的とした抗体の使用が支持されている(Peters et al.(2005)骨髄由来内皮細胞のヒト腫瘍血管系への寄与(Contribution of bone marrow−derived endothelial cells to human tumor vasculature.)Nat. Med.11:261−262)。
【0004】
血管新生は多くの病状に関連している。癌では、血管新生が腫瘍に血液を供給する上で重要であると考えられている。網膜症、および黄斑変性症などの非腫瘍疾患では、無制限な血管新生により失明を招く(Wilkinson−Berka(2004)Curr Pharm Des.10(27):3331−48;Das and McGuire (2003) Prog Retin Eye Res.22(6):721−48)。さらに、一部の報告によると、炎症疾患における血管新生の役割が報告されている(Paleolog and Miotla(1998)Angiogenesis2(4):295−307)。これらの病状に関連した胚性内皮細胞および前駆細胞をより良く定義する方法により、これらの疾患を治療する新規薬物の開発を導くことになるであろう。または血管新生疾患(加齢による黄班変性症、網膜症、炎症など)に関連した内皮細胞を特に標的とすることが可能な抗体の開発によって、これらの疾患の治療能力が提示される。
【0005】
有効な抗血管新生およびプロ血管新生治療における困難な問題は、薬学的化合物を介して特にこれらの細胞を標的として死滅或いは抑制することが不可能なことである。An より特異的に癌または血管新生疾患を治療するアプローチは、癌、新内皮細胞、または前駆体において発現するが正常細胞では発現しないか低レベルで発現する特異的抗原を標的とすることが可能な抗体を使用することである。前記抗原の生物活性を阻害し、補体依存性細胞傷害作用(CDC)および/または抗体依存性細胞傷害作用(ADCC)による免疫エフェクター機能を誘発することにより、または抗原提示細胞に送達されたときに前記標的細胞を特異的に死滅させる免疫複合体または放射性複合体(radio−conjugate)を送達することにより、抗原提示細胞を死滅させる抗体を利用にこれらの抗体を用いることが可能となる。例えば炎症、加齢黄班変性症、および網膜症などの腫瘍形成および血管新生関連疾患に関与した抗原提示細胞に特異的に結合して効率的に死滅させることが可能な抗体を見つけることは、多くの生物学的化合物に対して困難であることが証明されている(Dhanabal (2005)、癌治療ダイアグラムとしての抗抗原治療(Anti−angiogenic therapy as a cancer treatment paradigm)、Curr Med Chem Anti−Canc Agents 5:115−30)。このことは、免疫エフェクター機能の欠如、または免疫毒素を運ぶ抗体が効率的に内部移行しないため、確実に死滅させることができないことが部分的にその原因となっている。
【0006】
1992年、Rettigらは、種々の癌の血管において抗原を認識するモノクローナル抗体について記載している。 (Rettig et al.(1992) Proc Natl.Acad Sci USA 89(22):10832−6)。これらのうちの1つに、このFB5は神経芽細胞腫細胞株LA1−5sの表面上で1〜100kDaタンパク質を認識するFB5が指定されている。FB5は、エンドシアリンに結合するマウスIgG1抗体であり、様々な異なる癌種と関連する内皮細胞を認識する。一部の評価によると、エンドセリンは、5つの球状細胞外ドメイン(C−タイプレクチンドメイン、Sushi/ccp/scrパターンと3つのEGF反復とに対する類似性を有する1つのドメインを含む)から構成されるC−タイプレクチン様タンパク質として分類される。このタンパク質はまた、ムチン様領域、膜貫通セグメント、短い細胞質尾部を含む。前記タンパク質は糖タンパク質のようでもある。炭水化物分析によると、エンドシアリン・コアタンパク質には、シアロムチン様分子に対する類似性を有するシアリル化されたO−結合オリゴ糖が多数含まれていることを示している。その後の研究によると、マウスFB5の相補性決定領域(complementarity determining regions:CDR)をヒトIgG1骨格に連結させて、悪性組織およびHMVEC培養物中の細胞サブセットで血管に結合することが可能なヒト化抗体を作製した。
【0007】
エンドシアリンは癌および血管新生疾患を特異的に標的とした機会を提供するものである本願明細書において、選択的にエンドシアリン陽性細胞(例えば毒素複合体)内に内在化し、さらに免疫エフェクター活性を介して細胞毒性を誘発するインアウト(インアウト)抗体が提供される。本発明の抗体は、癌治療、これらに限らないが例えば黄班変性症(加齢黄班変性症)、網膜症、および炎症など血管新生に関連した疾患、およびエンドシアリンが関連する他の疾患などに有効な抗体を提供するものである。
【発明の開示】
【課題を解決するための手段】
【0008】
本発明は、選択的に、強力な免疫エフェクター機能を誘発し、さらにエンドセリン陽性細胞に内部移行するエンドシアリン特異的抗体が提供され、これを本明細書ではインアウト坑エンドシアリン抗体と称する。本明細書に用いられる「インアウト抗体」(「インアウト Abs」)は、選択的に、免疫エフェクター活性を誘発し、標的抗原に結合して抗原提示細胞に内部移行することが可能な抗体を指す。特定の理論に縛られることなく、インアウト抗体は、抗原−抗体提示細胞に補充される免疫エフェクター細胞または生化学物質によって結合されない限り、坑原提示細胞の細胞表面に結合し、一定期間後内部移行すると考えられている。ADCCまたはCDCなどの免疫エフェクター作用を誘発し、内部移行する抗体は以前に報告されているが(Wolff et al.,Monoclonal antibody homodimers: enhanced antitumor activity in nude mice.Cancer Res.1993 Jun 1;53:2560−5)、任意の抗原またはエピトープに対してインアウト抗体を発展させることができるかは明らかではない(Kusano et al.、 Immunocytochemical study on internalization of anti−carbohydrate monoclonal antibodies.Anticancer Res.,1993 Nov−Dec;13(6A):2207−12)。エンドシアリンを標的とするインアウト抗体についてはこれまでに報告されていない。エンドシアリン特異的抗体は以前に報告されているが、そのような抗体がエンドシアリン提示細胞上で内在化して免疫エフェクター機能を誘発することは知られていない(Rettig et al.1992;Brady et al.2004)。細胞表面の抗原を標的にすることができる抗体は、前記細胞表面の抗原に結合したときに、必ずしも免疫エフェクター機能を誘発するものではない(Niwa et al.,Defucosylated chimeric anti−CC chemokine receptor 4 IgG1 with enhanced antibody−dependent cellular cytotoxicity shows potent therapeutic activity to T−cell leukemia and lymphoma.Cancer Res.64:2127−33,2004;Kikuchi et al.,Apoptosis inducing bivalent single−chain antibody fragments against CD47 showed antitumor potency for multiple myeloma.Leuk Res.29:445−50, 2005; Scott et al.Immunological effects of chimeric anti−GD3 monoclonal antibody KM871 in patients with metastatic melanoma.Cancer Immun.Feb 22;5:3, 2005)。本明細書において、前記細胞表面の抗原エンドシアリンに結合し、選択的に(例えばADCCまたはCDCなどの)免疫エフェクター活性を誘発し、抗原陽性細胞に内部移行する抗体が提供される。これらの抗体およびその誘導体は、癌および血管新生疾患の治療に有用である。
【0009】
本発明において、エンドシアリンに特異的に結合するインアウト(in−out)抗体が提供される。一部の実施形態において、前記抗体はFB5よりも親和性および/または結合活性が高い抗原に結合する。一部の実施形態において、本発明のインアウト抗体は、例えば立体構造エピトープなど、FB5によって結合するエピトープと同じエピトープに結合する。一部の実施形態において、本発明のインアウト抗体はFB5によって結合するエピトープとは異なるエピトープに結合する
本発明の抗体は、ヒト−マウスキメラ抗体を含む(これに限定されるものではないが)キメラ抗体であっても良い。本発明の抗体はヒト化されていても良い。本発明の抗体は完全にヒト化されていても良い。本発明において、本発明の抗体を発現したハイブリドーマ細胞、本発明の抗体をコードしたポリヌクレオチド、前記本発明の抗体をコードしたポリヌクレオチドを有するベクター、およびトランスフェクトーマと呼ばれる、本発明のポリヌクレオチドを有する発現細胞もまた提供される。
【0010】
本発明はまた、エンドシアリンに特異的に結合するインアウト抗体を産生する方法も提供する。一部の方法には、本発明の抗体を発現したトランスフェクトーマまたはハイブリドーマを培養する工程が含まれる。本発明の抗体産生細胞は、細菌、酵母、昆虫細胞、および動物細胞であり、好ましくは哺乳類細胞である。
【0011】
本発明はさらに、エンドシアリン陽性細胞の成長を阻害する方法を提供する。>一部の実施形態において、そのような方法は、エンドシアリン陽性細胞を有する患者に、エンドシアリンに特異的に結合するインアウト抗体を含む組成物を投与する工程を有する。前記方法は、例えば、炎症性疾患、他の血管新生疾患、加齢黄班変性症および網膜症を含む眼疾患、これらに限定されないが例えば卵巣癌、乳癌、結腸直腸癌、腎臓癌、および肺癌など、様々な異形成疾患の治療に用いることが可能である。好ましい実施形態において、前記患者はヒトである。一部の実施形態において、前記抗体は、これらに限定されるものではないが、放射性核種、毒素、および細胞傷害性薬および細胞増殖抑制物質など、1若しくはそれ以上の化学療法剤と結合する。他の実施形態において、前記抗体は、1若しくはそれ以上の化学療法剤と併用される。インアウト抗体は、複合型または非複合型抗体として単独で、または前記複合型または非複合型形態物または別の治療薬と併用して投与することが可能である。
【0012】
エンドシアリンに特異的に結合するインアウト抗体の開発については今まで報告されていない。本明細書において、我々は、エンドシアリン陽性で内在化し、内在化しない場合には免疫エフェクター活性を介して細胞毒性を誘発するインアウト抗体の開発について説明する。
【0013】
本発明の他の特徴および利点は、以下の詳細な説明および実施例から明らかとなる。
【図面の簡単な説明】
【0014】
【図1】図1は、インアウト抗体ES−1によるエンドシアリン特異的結合を免疫組織化学的に示した図である。抗体はウエスタンブロット、精製された抗原、未精製抗原、膜画分、又は細胞全体を使用したELISA、および免疫染色によって検出可能である。エンドシアリン抗原に特異的に結合する抗体を特定する免疫染色を示した。免疫染色は、精製または半精製した膜調製物、またはエンドシアリンを発現する全細胞を用いて形式を整える。ここでは全細胞を示す。上部パネルは位相差顕微鏡の元での細胞の全体の分析を示したものである。下部パネルは、ES−1又はアイソタイプ抗体で染色した細胞の蛍光標識二次抗体を用いた細胞の同じ部分を示したものである。
【図2A】図2は、ES−1の抗体のADCC免疫エフェクター活性を誘発する能力を示した図である。ES−1は強いADCC活性を誘発する。図2Aは、ヌル黒色腫細胞が陰性であるのに対して、HMVEC細胞においてはES−1抗体がエンドシアリンに結合する能力を提示した非変性ウエスタンブロットを示した図である。
【図2B】図2は、ES−1の抗体のADCC免疫エフェクター活性を誘発する能力を示した図である。ES−1は強いADCC活性を誘発する。図2Bの下部パネルは、ヒト抹消血リンパ球(peripheral blood lymphocytes:PBLs)単独(0レーン)、又は増量させたES−1と共に(右の棒グラフ)又は対照Igと共に(正常IgGは左の棒グラフ)インキュベートした標的HMVEC細胞(標的細胞と称す)を示した。細胞溶解時に発生する乳酸脱水素酵素(lactate dehydrogenase:LDH)の放出をモニターすることにより、細胞培養物の死滅について分析した。示したように、ES−1はエンドセリン発現細胞においてADCC活性を有していた。図2Bの上部パネルは、エンドシアリンに対して発現しないヒト黒色腫細胞をヒトPBLs単独(0レーン)、又はES−1(右の棒グラフ)又は対照Ig(正常IgGは左の棒グラフ)と共にインキュベートした結果を示した図である。細胞溶解時に発生する乳酸脱水素酵素(lactate dehydrogenase:LDH)の放出をモニターすることにより、細胞培養物の死滅について分析した。
【図3】図3は、エンドシアリン提示細胞においてES−1の内在化能力を示した図である。ES−1はエンドシアリン発現細胞において内在化した。図3は、アイソタイプ対照抗体は複合毒素形態中(四角)で細胞を死滅させないのに対して、サポリンに結合したES−1(ダイアモンド)が細胞を死滅させる能力を有することをES−1抗体単独(図示せず)と比較して、示した図である。対照として、エンドシアリンを発現しない細胞を用いて示し、ES−1は複合又は非複合形態(図示せず)において毒性を有さなかった。These これらのデータはES−1がエンドシアリン提示細胞で内在化することを支持するものである。
【発明を実施するための最良の形態】
【0015】
本明細書において引用したGenBankデータベースの配列の受入番号を含む、参照研究、特許、特許出願書類、および科学文献は、当業者の知識を確立するものであり、各資料が具体的かつ個別に参照によって組み込まれるように、これらの資料は、この参照によってその全体が本明細書に完全に組み込まれるものである。本明細書に引用された参照と本明細書の特定の教義の間に不一致があった場合、本明細書の特定の教義を優先して解決されるものとする。同様に、当業者に理解される単語または表現の定義と、本明細書で具体的に教示されている単語または表現の定義との間に不一致があった場合、本明細書の単語または表現を優先して解決されるものとする。
【0016】
当業者に周知の組み換えDNA技術に関する一般的原理を示した標準的な参照研究には、Ausubel et al.CURRENT PROTOCOLS IN MOLECULAR BIOLOGY,John Wiley & Sons,New York(1998);Sambrook et al.MOLECULAR CLONING: A LABORATORY MANUAL,2D ED.,Cold Spring Harbor Laboratory Press,Plainview,New York(1989);Kaufman et al.,Eds.,HANDBOOK OF MOLECULAR AND CELLULAR METHODS IN BIOLOGY AND MEDICINE, CRC Press,Boca Raton(1995);McPherson,Ed.,DIRECTED MUTAGENESIS: A PRACTICAL APPROACH,IRL Press,Oxford(1991)が含まれる。
【0017】
本発明は特定の方法、試薬、化合物、組成物、または生物系に制限されることはなく、当然ながら変更されることは理解されるものとする。また、本明細書で使用される専門用語は、特定の実施形態のみを説明する目的で使用されるものであり、限定する意図はないこともまた理解される。本明細書および添付の請求項に用いられる、単数形の「a」、「an」、および「the」は、その内容が明らかに別のことを示していない限り、複数の言及を含む。従って、例えば「a cell(細胞)」の言及は2若しくはそれ以上の細胞の組み合わせなどを含む。
【0018】
本明細書に列挙した各範囲は、本明細書に含まれる特定の数字だけでなく、範囲内のすべての組み合わせおよびサブコンビネーションを含む。
【0019】
本明細書に用いるとおり、「約」という用語は、量、一時的な期間など、測定可能な値を指す場合、特定の値からの±20%または±10%、より好ましくは±5%、さらに好ましくは±1%、まださらに好ましくは±0.1%のばらつきを含むことを意味し、そのようなばらつきは開示された方法を実施する上で適応する。
【0020】
本発明は、エンドシアリン、好ましくは哺乳類エンドシアリン、より好ましくはヒトエンドシアリン(配列ID番号1(ヌクレオチド)および2(アミノ酸))に特異的に結合するインアウト抗体を用いてエンドシアリン陽性細胞の成長を阻害する方法を提供するものである。本発明の方法は、エンドシアリン陽性細胞の成長を調節し、ヒトを含む哺乳類における癌、炎症、および/または血管新生疾患の進行を治療する。前述の阻害された細胞とは、正常ヒト組織に関して増強されたエンドシアリンの発現を有し、さらに血管新生において関与するエンドシアリンを発現する白血球を有する全細胞を含む。
【0021】
特定の操作理論にしばられることなく、癌組織において細胞においてエンドシアリンのの発現が増強されると、前記腫瘍の内皮細胞表面における膜結合型の細胞表面発現が亢進する。従って、癌組織では、正常組織と比較して、エンドシアリン発現血管および間質細胞の発現が増強している。このため、エンドシアリン陽性細胞は、癌の抗体治療における理想的な標的となっている。同様に、血管新生疾患において増強されたエンドシアリン発現は、前記細胞表面におけるタンパク質の膜結合型の細胞表面発現が増強されると考えられている。従って、エンドシアリン陽性細胞は、血管新生疾患における抗体治療においてもまた理想的な標的となっている。
【0022】
本明細書に用いられる「エピトープ」という用語は、抗体が特異的に結合する抗原の一部を指す。
【0023】
本明細書に用いられる「立体構造エピトープ」という用語は、連続したアミノ酸以外の抗原のアミノ酸同士の空間関係によって形成される不連続エピトープを指す。
【0024】
本明細書に用いられる「免疫エフェクター活性」、「免疫エフェクター作用」、および「免疫エフェクター機能」という用語は、抗体依存性細胞傷害作用(antibody−dependent cellular cytotoxicity:ADCC)または補体依存性細胞傷害作用(complement−dependent cytotoxicity:CDC)による抗体の殺細胞力を指す。
【0025】
本明細書に用いられる「インアウト抗体」という用語は、抗原提示細胞に内部移行し、内部移行しない場合は免疫エフェクター活性を誘発することができる抗体を指す。
【0026】
本明細書に用いられる「選択的」という表現は、内部移行または免疫エフェクター活性を誘発する抗体の能力を指す場合、前記抗体が内部移行能力と免疫エフェクター活性誘発能力の両方を有するが、同時に両方を行うことはできないことを意味する。
【0027】
本明細書に用いられる「インビトロでの異型細胞の成長抑制」という用語は、例えば異型細胞または新生血管細胞などにおいて、細胞数が約5%、好ましくは約10%、より好ましくは約20%、より好ましくは約30%、より好ましくは約40%、より好ましくは約50%、より好ましくは約60%、より好ましくは約70%、より好ましくは約80%、より好ましくは約90%、最も好ましくは約100%減少することを意味する。インビトロでの腫瘍細胞の成長抑制は、当該分野で既知のアッセイにより測定される。
【0028】
本明細書において用いられる「インビボでの異型細胞の成長抑制」という用語は、例えば異型細胞または新生血管細胞において細胞数が約5%、好ましくは約10%、より好ましくは約20%、より好ましくは約30%、より好ましくは約40%、より好ましくは約50%、より好ましくは約60%、より好ましくは約70%、より好ましくは約80%、より好ましくは約90%、最も好ましくは約100%減少することを意味する。インビボでの細胞成長の調節は、当該分野で既知のアッセイにより測定することができる。
【0029】
本明細書に用いられる「異型細胞」は異常な成長を示す細胞を指す。異常な成長特性の例には、これに限定されるものではないが、軟寒天中での増殖、接触阻害の欠如、無血清状態で細胞周期停止の拒否、および免疫力低下マウスに注入したときにの腫瘍形成などが含まれる。異型細胞には、これに限定されるものではないが、腫瘍、過形成などが含まれる。
【0030】
本願明細書で用いられる「新生血管細胞」の用語は、腫瘍間質、腫瘍血管、炎症血管、および眼疾患を含む血管新生疾患の血管に関連した細胞を称する。
「予防する」という用語は、微生物が感染するか、異形成または新生血管疾患などの異常な状態を発生させる可能性を低下させることを指す。
【0031】
「治療する」という用語は、治療効果を有し、生物体における異型性または血管新生疾患などの異常状態を少なくとも部分的に軽減または抑止することを指す。治療とは、例えば抑制された腫瘍成長の維持、寛解の誘発、改善された視界、失明の遅延化、および視覚障害への遅延化を含む。
【0032】
「治療的有効量」は、疾患、状態、または障害を治療するために対象者に投与する場合、その疾患に対する治療効果をもたらすのに十分な量を指す。「有効量」は、所望の作用を生じるために必要な量を指す。「治療的有効量」は、疾患、状態、または障害を治療するために対象に投与する場合、その疾患に対する治療効果をもたらすのに十分な量を指す。治療効果は、前記異常な状態の1若しくはそれ以上の症状をある程度軽減する。前記異常な状態の治療に関して、治療効果は、(a)細胞の増殖、成長、および/または分化の増加または減少、(b)インビボにおける腫瘍細胞の成長の阻害(つまり遅延化または停止)、(c)細胞死の促進、(d)変性の抑制、(e)前記異常な状態に関連した1若しくはそれ以上の症状のある程度の軽減、(f)細胞集団の機能強化、(g)マトリックスまたはリガンドへの細胞結合の阻害、(h)細胞遊走の変化、(i)治療に対する細胞反応の変化の1若しくはそれ以上を指す可能性がある。本明細書に説明した抗体およびその誘導体は、単独、または本発明の組成物の複合体または更なる組成物と併用して前記治療効果を達成する。
【0033】
本明細書において用いられる「癌または腫瘍性疾患の進行の阻害」という用語は、未治療癌細胞が末期疾患に向かうのを調節することと関連し、腫瘍性疾患の末期癌へ向かうのを調節して遅らせる治療活動を指す。
【0034】
本明細書において用いられる「血管新生疾患の阻害」という用語は、新生血管組織内の疾患を遅延または逆転させる治療活動を指す。
【0035】
本明細書において用いられる「新生血管組織」という用語は、炎症、眼疾患、および癌によって侵襲された組織を含む内皮細胞および/または内皮細胞前駆体を標的とした治療に応答する疾患組織を指す。
【0036】
本明細書に用いられる「腫瘍性疾患」という用語は、癌などの組織細胞の異常な増殖によって特徴付けられる状態を指す。
【0037】
本明細書に用いられる「生体分子」という用語は、複合体を形成し、同時投与され、本発明の抗体投与前後に投与され、またはそれ以外で本発明の抗体と関連して使用することができるすべての分子を指す。生体分子には、これらに限定されるものではないが酵素、タンパク質、ペプチド、アミノ酸、核酸、脂質、炭水化物、およびフラグメント、相同体、類似体、または誘導体、およびその組み合わせを含む。生体分子の例には、これらに限定されるものではないが、インターロイキン−2、インターフェロンα、インターフェロンβ、インターフェロンγ、リツキサン、ゼバリン、ハーセプチン、エルビタックス、およびアバスチンを含む。前記生体分子は、天然型、組み換え型、または合成とすることができ、例えばグリコシル化、アセチル化、リン酸化、ミリスチル化などにより、その天然型から修飾することもできる。本明細書に用いられる生体分子という用語は、天然型の分子に限定されず、生物由来ではない合成分子を含む。
【0038】
本明細書に用いられる「細胞傷害性」または「細胞増殖抑制」物質という用語は、細胞の生存率または増殖する可能性を低下させる物質を指す。細胞傷害性薬または細胞増殖抑制物質は、例えば、これに限定されるものではないがDNAの障害を誘導、細胞周期停止を誘導、DNA合成を阻害、転写を阻害、翻訳またはタンパク質合成を阻害、細胞分裂を阻害、またはアポトーシスを誘導することにより、細胞の生存可能性または増殖を抑制する様々な方法で作用することができる。本明細書に用いられる「化学治療物質」という用語は、腫瘍細胞を選択的に死滅、その成長を抑制、またはその転移を抑制するか、急速に増殖する細胞の細胞周期を混乱させる細胞傷害性物質、細胞増殖抑制物質、および抗腫瘍性物質を指す。化学治療物質の具体的な例には、これらに限定されるものではないが、放射性核種、ヤマゴボウ抗ウイルス性タンパク質、アブリン、リシン、およびそのA鎖、アルトレタミン、アクチノマイシンD、プリカマイシン、プロマイシン、グラミシジンD、ドキソルビシン、コルヒチン、サイトカラシンB、シクロホスファミド、エメチン、マイタンシン、アムサクリン、シスプラチン、エトポシド、エトポシドオルトキノン、テニポシド、ダウノルビシン、ゲムシタビン、ドキソルビシン、ミトキサントロン(mitoxantraone)、ビサントレン、ブレオマイシン、メトトレキセート、ビンデシン、アドリアマイシン、ビンクリスチン、ビンブラスチン、BCNU、タキソール、タルセバ、アバスチン、マイトマイシン、修飾シュードモナスエンテロトキシンA、カリチェアミシン、5−フルオロウラシル、シクロホスファミド、およびTNF−αおよびTNF−βなどの特定サイトカインが含まれる。
【0039】
「保存的修飾変異体」はアミノ酸および核酸配列の両方に当てはまる。特定の核酸配列に関して、保存的修飾変異体とは、同一或いは基本的に同一であるアミノ酸配列をコードする核酸を指し、または前記核酸がアミノ酸配列をコードしない場合は、基本的に同一の配列を指す。遺伝暗号の縮重のため、多数の機能的に同一な核酸が特定タンパク質をコードする。例えば、コドンGCA、GCC、GCG、およびGCUはすべてアミノ酸のアラニンをコードする。従って、アラニンがコドンで特定されるすべての位置で、コードされるポリペプチドを変化させることなく、前記コドンを前述の対応するコドンのいずれかと変更することができる。そのような核酸変異は「サイレント変異」であり、保存的修飾変異体の一種である。ポリヌクレオチドをコードする本明細書のすべての核酸配列は、前記核酸の考えられるすべてのサイレント変異も描写する。当業者であれば、核酸の各コドン(通常メチオニンの唯一のコドンであるAUGと、通常トリプトファンの唯一のコドンであるTGGを除く)を修飾し、機能的に同一な分子を生じることができることが理解される。従って、ポリヌクレオチドをコードする核酸の各サイレント変異は、発現生成物について描写された各配列で絶対的であるが、実際のプローブ配列については絶対的ではない。
【0040】
例えば、細胞、核酸、タンパク質、またはベクターに関連して用いられる場合、「組み換え型」は、前記細胞、核酸、タンパク質、またはベクターが異種核酸またはタンパク質の導入、または天然型核酸またはタンパク質の変更により修飾されたか、前記細胞がそのように修飾された細胞に由来することを示す。従って、例えば、組み換え型細胞は前記細胞の天然型(非組み換え型)には見られない遺伝子を発現しているか、そうでなければ異常に発現されるか、発現が少ないか、全く発現されていない天然型遺伝子を発現している。
【0041】
「核酸」または「ポリヌクレオチド配列」という用語は、5'から3'末端に向かって読み取ったデオキシリボヌクレオチドまたはリボヌクレオチド塩基の一本鎖または二本鎖重合体を指す。核酸には、ポリメラーゼにより読み取りを補正することができ、例えば保存的修飾変異体を含む核酸でコードされるポリペプチドの発現を変化させない、修飾ヌクレオチドも含むことができる。
【0042】
「ポリペプチド」、「ペプチド」、および「タンパク質」は本明細書で同義的に使用され、アミノ酸残基の重合体を指す。前記用語は、1若しくはそれ以上のアミノ酸残基が対応する天然型アミノ酸の人工化学的ミメティックであるアミノ酸重合体、および天然型アミノ酸重合体および非天然型アミノ酸重合体にも当てはまる。本発明の抗体を含む本発明のポリペプチドには、保存的修飾変異体を含む。当業者であれば、コード化配列中の単一アミノ酸または少ない割合のアミノ酸を変更、付加、または欠失させる核酸、ペプチド、ポリペプチド、またはタンパク質配列の置換、欠失、または付加は「保存的修飾変異体」であり、前記変化により、アミノ酸が化学的に類似のアミノ酸と置換されることが認識される。機能的に類似したアミノ酸を提供する保存的置換表は当該分野で周知である。そのような保存的修飾変異体は、本発明の多型変異体、種間相同体、および対立遺伝子に追加され、これらを除外しない。以下の8群はそれぞれ互いに保存的置換のあるアミノ酸を含み、それは1)アラニン(A)、グリシン(G);2)アスパラギン酸(D)、グルタミン酸(E);3)アスパラギン(N)、グルタミン(Q);4)アルギニン(R)、リジン(K);5)イソロイシン(I)、ロイシン(L)、メチオニン(M)、バリン(V);6)フェニルアラニン(F)、チロシン(Y)、トリプトファン(W);7)セリン(S)、トレオニン(T);および8)システイン(C)、メチオニン(M)である(33)。「保存的置換」という用語は、非置換親アミノ酸に代わり置換アミノ酸を使用することも含むが、ただしそのようなポリペプチドは必須の結合活性も示す。
【0043】
「アミノ酸」は、天然型および合成アミノ酸、および前記天然型アミノ酸と同様に機能するアミノ酸類似体およびアミノ酸ミメティックを指す。天然型アミノ酸は、遺伝暗号でコードされたアミノ酸、および後で修飾されたアミノ酸、例えば、ヒドロキシプロリン、γ−カルボキシグルタメート、およびO−ホスホセリンである。「アミノ酸類似体」は、天然型アミノ酸と同じ基本的化学構造、つまり、水素、カルボキシル基、アミノ基、およびR群、例えばホモセリン、ノルロイシン、メチオニンスルホキシド、メチオニンメチルスルホニウムに結合するα炭素を有する化合物を指す。そのような類似体は、修飾されたR群(例えばノルロイシン)または修飾されたペプチド骨格を有するが、天然型アミノ酸と同じ基本的化学構造を保持している。「アミノ酸ミメティック」は、アミノ酸の一般的化学構造とは異なる構造を有するが、天然型アミノ酸と同様に機能する化学化合物を指す。
【0044】
本明細書において、アミノ酸は一般的に知られる3文字記号またはIUPAC−IUB Biochemical Nomenclature Commissionが推奨する1文字記号で称することができる(以下の表1を参照)。同様に、ヌクレオチドは一般的に受け入れられている1文字コードによって称される。
【0045】
【表1】

【0046】
本明細書において、すべてのアミノ酸配列は、左から右の方向が従来のアミノ末端からカルボキシ末端の方向である式で表されていることに留意すべきである。
【0047】
本明細書に用いられる「インビトロ」または「生体外(ex vivo)」という用語は、人工環境、およびこれらに限定されるものではないが、例えば試験管および細胞培養などの人工的な環境で発生する工程または反応を指す。前記「インビボ」という用語は、自然環境(例えば、動物または細胞)および自然環境で発生する工程または反応を指す。
【0048】
「薬学的に許容される」、「生理学的に忍容性の」、およびその文法的変形形態は、組成、担体、希釈剤、試薬を指す場合は同義的に用いられ、前記組成の投与を阻害する程度の好ましくない生理学的効果を発生させずに、前記物質を人に投与できることを示す。
【0049】
「薬学的に許容される担体」という用語は、適切な医学的判断の範囲内で、妥当な利益/リスク比と釣り合い、過剰な毒性、刺激、アレルギー反応、または他の合併症を生じずに、ヒトおよび動物の組織と接触させて使用するのに適した、試薬、添加物、細胞、成分、物質、組成物、および/または投与形態を指す。本明細書でさらに詳細に説明するとおり、本発明での使用に適した薬学的に許容される担体には、気体、液体、および半固体および固体物質が含まれる。
【0050】
特別な記載がない限り、「対象」または「患者」は同義的に用いられ、ヒト患者およびヒト以外の霊長類などの哺乳類、ウサギ、イヌ、ネコ、ラット、マウス、およびその他の動物などの実験動物を指す。従って、本明細書に用いられる「対象」または「患者」は、本発明の組成物を投与することが可能なすべての哺乳類患者または被験者を意味する。本発明の一部の実施形態において、前記患者は感染症または炎症性疾患に罹患する。本発明の一部の実施形態において、前記患者は癌と診断される。本発明の典型的な実施形態において、本発明に沿った治療の候補患者を特定するため、一般に認められたスクリーニング方法を採用し、被験者の既存の疾患または状態の状況、または標的となるか疑わしい疾患または状態と関連したリスクファクターを決定する。これらのスクリーニング方法には、例えば、被験者が感染症、炎症性疾患、または癌に罹患しているか否かを決定する検査を含む。このようなルーティンな方法により、臨床医は治療が必要な被験者を選択することができる。
【0051】
本明細書に用いられる「治療用化合物」は癌などの疾患または状態の予防または治療に有用な化合物を指す。
【0052】
本明細書に用いられる「併用投与」、「同時投与」、または「併用」には、同時にまたは併用して、一緒に、または互いに前後して活性薬物(例えば、MAbs、化学治療物質、生体分子)を投与することを含む。前記複数の薬物は、すべての薬物が作用部位で十分有効濃度を達成することができる方法で投与される限り、同じ経路または異なる経路で、同時にまたは順次投与することができる。当業者であれば、特定の薬物と本発明の組成を投与する適切なタイミング、順序、および用量を決定することは困難なことではない。
【0053】
「免疫グロブリン」または「抗体」は広義に用いられ、抗体分子と様々な抗体由来分子の両方を指し、前記免疫系の主要成分である、高等哺乳動物で生成する一連の糖タンパク質の一員を含む。前記「抗体」という用語は広義の意味で用いられ、望みの生物活性を示す限り、具体的にはモノクローナル抗体、多エピトープ特異性を持つ抗体組成、二重特異性抗体、ダイアボディ(diabodies)、および単鎖分子、また抗体フラグメント(例えば、Fab、F(ab')2、およびFv)を網羅する。免疫グロブリン分子には抗原結合ドメインを含み、それぞれが軽鎖と、重鎖の末端タンパク質、および補体との結合など様々な機能に必要なFc領域を含む。免疫グロブリンには5種類のクラスがあり、前記Fc領域の重鎖の主要構造が前記免疫グロブリンのクラスを決める。具体的には、α、δ、ε、γ、およびμ鎖がそれぞれIgA、IgD、IgE、IgG、およびIgMに対応する。本明細書に用いるとおり、「免疫グロブリン」または「抗体」にはα、δ、ε、γ、およびμのすべてのサブクラスを含み、4鎖の免疫グロブリン構造の天然(例えば、IgAおよびIgM)または合成多量体も指す。抗体は、非共有結合的に、特異的に、および可逆的に抗原と結合する。本明細書に用いるとおり、前記「モノクローナル抗体」という用語は、かなり均質な抗体集団から得られる抗体を指し、つまり、少量で存在することができ、自然に発生した可能性のある変異を除き、前記集団を有する個々の抗体は同一である。例えば、モノクローナル抗体は抗体産生細胞の単一クローンにより作製することができる。ポリクローナル抗体と異なり、モノクローナル抗体は単一特異的である(例えば、単一抗原の単一エピトープに対して特異的である)。前記「モノクローナル」という修飾語は、かなり均質な抗体集団から得られる抗体の特徴を示し、いかなる特定の方法でも前記抗体の作製が必要であるとは解釈されない。例えば、本発明に従って使用される前記モノクローナル抗体は、Kohler et al.,Nature,256:495,1975で最初に報告されたハイブリドーマ法により作製することができるか、組み換えDNA法により作製することができる。前記「モノクローナル抗体」は、例えば、Marks et al.,J.Mol.Biol.,222:581−597,1991に報告されている技術を利用し、ファージ抗体ライブラリから単離することもできる。
抗体由来分子は、抗原結合特異性を保持し、例えば、少なくとも1つの可変領域(重鎖または軽鎖可変領域)を有する完全な抗体の一部を有する。抗体由来分子には、例えば、Fabフラグメント、Fab'フラグメント、F(ab')2フラグメント、Fdフラグメント、F(v)フラグメント、Fabcフラグメント、Fdフラグメント、Fabcフラグメント、Sc抗体(単鎖抗体)、ダイアボディ、個々の抗体軽鎖、個々の抗体重鎖、抗体鎖と他の分子とのキメラ融合、重鎖単量体または二量体、軽鎖単量体または二量体、重鎖1つと軽鎖1つから成る二量体などの分子を含む。すべてのクラスの免疫グロブリン(例えば、IgA、IgD、IgE、IgG、およびIgM)とそのサブクラスが含まれる。
【0054】
抗体は毒性または非毒性部分で標識するか、これと結合することができる。毒性部分には、例えば、細菌毒素、ウイルス毒素、放射性同位元素などを含む。抗体は、前記抗体の検出を助けるため、生物学的アッセイ(例えば、放射標識、蛍光標識)で使用するために標識することができる。抗体は、診断または治療の目的で、例えば、放射免疫治療(Garmestani et al.,Nucl.Med.Biol.,28:409,2001)、画像法および放射免疫誘導手術などの望みの適用部位に直接放射線を照射する放射性同位元素、または特定の抗体/抗原複合体のインビボでの画像化または検出を可能とする標識により、標識/結合することもできる。抗体は、免疫毒素を提供する毒素と結合することもできる(Kreitman,R.J.Adv.Drug Del.Rev.,31:53,1998を参照)。
【0055】
抗体について、前記「免疫学的に特異的な」という用語は、対象タンパク質の1若しくはそれ以上のエピトープに結合する抗体を指すが、抗原性生体分子の混合集団を含むサンプル中の他の分子を十分認識し、結合することはない。
【0056】
「キメラ」または「キメラ化」抗体(免疫グロブリン)は、望みの生物活性を示す限り、前記重鎖および/または軽鎖の一部が特定の種に由来するか、特定の抗体クラスまたはサブクラスに属する抗体の対応する配列と同一または相同的であるが、前記鎖の残りの部分が別の種に由来するか、別の抗体クラスまたはサブクラスに属する抗体、またそのような抗体のフラグメントの対応する配列と同一または相同的である抗体を指す(Morrison et al.,Proc.Natl.Acad..Sci.U.S.A.,81:6851−6855,1984)。
【0057】
非ヒト(例えば、マウス)抗体の「ヒト化」型は、非ヒト免疫グロブリン由来の最小限の配列を含む、キメラ免疫グロブリン、免疫グロブリン鎖、またはそのフラグメント(Fv、Fab、Fab'、F(ab')2、または抗体の他の抗原結合配列など)である。ヒト化抗体は大部分がヒト免疫グロブリン(受容抗体)であり、前記受容抗体の相補性決定領域(CDR)の残基が、望みの特異性、親和性、および能力を有する、マウス、ラット、またはウサギなどの非ヒト種のCDR残基(供与抗体)によって置換される。場合によっては、前記ヒト免疫グロブリンのFvフレームワーク領域(FR)の残基が、対応する非ヒト残基によって置換される。さらに、ヒト化抗体は、前記供与抗体、または移入されたCDRまたはフレームワーク配列にはない残基を有することができる。これらの修飾を行い、抗体性能をさらに洗練し、最適化する。一般に、前記ヒト化抗体は少なくとも1つ、典型的には2つの可変ドメインの実質的にすべてを有し、前記CDR領域のすべてまたは実質的にすべてが非ヒト免疫グロブリンのCDR領域と一致し、前記FR領域のすべてまたは実質的にすべてがヒト免疫グロブリン配列のFR領域と一致する。前記ヒト化抗体は、選択的に免疫グロブリン定常領域(Fc)の少なくとも一部、典型的にはヒト免疫グロブリンの一部も有する。さらなる詳細については、Jones et al.,Nature,321:522−525,1986;Reichmann et al.,Nature,332:323−329,1988;Presta,Curr.Op.Struct.Biol.,2:593−596,1992を参照。
【0058】
「完全ヒト」とは、抗体などの免疫グロブリンを指し、前記分子全体がヒト由来であるか、前記抗体のヒト型と同一のアミノ酸配列から成る。
【0059】
「ハイブリドーマ」は、培養した腫瘍化リンパ球と、親細胞の特異的免疫力を発現し初回抗原刺激を受けたBまたはTリンパ球との細胞融合生成物を指す。
【0060】
他に定義のない限り、本明細書で用いたすべての技術および科学用語は、本発明に関連する当業者に一般的に理解されるものと同じ意味を有する。本明細書で説明されたものと同一または同等のいかなる方法および材料も、本発明の検証実施に用いることができるが、好ましい材料および方法が本明細書において説明される。本発明を説明および請求項において、以下の用語が使用される。
【0061】
様々な特許および他の文献が本明細書に引用されており、それぞれの全開示内容は参照によって本明細書中に組み込まれる。
【0062】
抗体
本発明の抗体は特異的に、例えば立体構造エピトープなどのエンドシアリンのエピトープに結合し、インアウト活性(つまり、選択的に免疫エフェクター活性を誘導し、エンドシアリン陽性細胞に内部移行する能力)を示す。本発明の抗体が結合するエンドシアリンは好ましくは哺乳類であり、さらに好ましくはヒトである。ヒトエンドシアリンは配列ID番号1でコードされ、配列ID番号2のアミノ酸配列を有する。
【0063】
【表2】

【0064】
【表3】

【0065】
一部の実施形態において、前記抗体はFB5として同じエピトープに結合する。別の実施形態において、前記抗体は、FB5によって結合するもの以外のエピトープに結合する。
【0066】
好ましい抗体、および本発明の方法で使用するのに適した抗体には、例えば、完全ヒト抗体、ヒト単鎖抗体、抗体相同体、ヒト化抗体相同体、キメラ抗体、キメラ抗体相同体、および抗体重鎖または軽鎖またはその混合物の単量体または二量体を含む。
本発明の抗体には、タイプIgA、IgG、IgE、IgD、IgM(およびそのサブタイプ)を含む、すべてのアイソタイプの完全な免疫グロブリンを含むことができる。前記免疫グロブリンの軽鎖はκまたはλである。
【0067】
本発明の抗体には、抗原結合特異性を保持する完全な抗体の一部、例えば、Fabフラグメント、Fab'フラグメント、F(ab')2フラグメント、F(v)フラグメント、重鎖単量体または二量体、軽鎖単量体または二量体、重鎖1つおよび軽鎖1つから成る二量体などを含む。従って、抗原結合フラグメント、および前述の抗体由来の、完全な長さの二量体または三量体ポリペプチドは、それ自体がインアウト活性を生じるために有用である。
【0068】
齧歯類モノクローナル抗体をヒトの治療薬として直接使用すると、ヒト抗齧歯類抗体(「HARA(human anti−rodent antibody)」)反応が生じ、この反応は前記齧歯類由来抗体を投与した有意に多数の患者において発生することが分かった(Khazaeli,et al.(1994)Immunother.15:42−52)。齧歯類のアミノ酸配列がより少ないキメラ抗体は、ヒトで免疫反応を誘発するという問題が回避できると考えられた。
【0069】
キメラ抗体は組み換えDNA技術によって作製することができ、この技術では、免疫グロブリン軽鎖、重鎖、またはその両方のヒンジおよび定常領域のすべてまたは一部が、別の動物の免疫グロブリン軽鎖または重鎖の対応領域と置換されてきた。この方法では、前記親モノクローナル抗体の抗原結合部分が、別の種の抗体の骨格に移植(グラフト)される。Winterらの欧州特許第EP 0239400号明細書に報告された1つのアプローチでは、ヒト重鎖および軽鎖免疫グロブリン可変領域のCDRsをマウス可変領域ドメインのCDRsと置換するなど、1つの種の相補性決定領域(CDRs)と別の種のCDRsとの置換について報告している。これらの変化させた抗体は、その後ヒト免疫グロブリン定常領域と組み合わせることにより、置換された前記抗原に特異的なマウスCDRsを除いてはヒトである抗体を形成する。抗体のCDR領域を移植(graft)する方法は、例えば、Riechmann et al.(1988)Nature 332:323−327およびVerhoeyen et al.(1988)Science 239:1534−1536において見出される。
【0070】
限定されない例として、CDRグラフトの実行方法は、前記標的抗原(例えば、エンドシアリン)に結合する目的とする抗体の重鎖および軽鎖のマウスでの配列を決定し、前記CDR DNA配列の遺伝子を操作し、部位特異的突然変異によりこれらのアミノ酸配列を対応するヒトV領域に与えることにより実行することができる。所望のアイソタイプのヒト定常領域の遺伝子セグメントを追加し、前記キメラ重鎖および軽鎖遺伝子を哺乳類細胞に同時発現させ、可溶性抗体を作製する。典型的な発現細胞は、チャイニーズハムスター卵巣由来(CHO)細胞である。他の発現細胞には、HEK293および骨髄腫細胞を含む。前記キメラ抗体を作製するのに適した方法は、例えばJones et al.(1986)Nature 321:522−525;Riechmann(1988)Nature 332:323−327;Queen et al.(1989)Proc.Nat.Acad.Sci.USA 86:10029;およびOrlandi et al.(1989)Proc.Natl.Acad.Sci.USA 86:3833において見出される。
【0071】
HARA反応の問題を回避するため、さらに抗体を改良すると、「ヒト化抗体」の開発につながる。ヒト化抗体は組み換えDNA技術により作製され、この技術では、抗原の結合に不必要なヒト免疫グロブリン軽鎖または重鎖のアミノ酸の少なくとも1つが、対応する非ヒト哺乳類免疫グロブリン軽鎖または重鎖のアミノ酸と置換されている。例えば、前記免疫グロブリンがマウスモノクローナル抗体の場合、抗原の結合に必要のない少なくとも1つのアミノ酸が、対応するヒト抗体のその部位にあるアミノ酸を用いて置換されている。いかなる特定の操作理論に縛られることなく、前記モノクローナル抗体の「ヒト化」は外来性免疫グロブリン分子に対するヒトの免疫反応を抑制すると考えられている。
【0072】
Queen et al.(1989)Proc.Nat.Acad.Sci.USA 86:10029−10033および国際公開第WO 90/07861号パンフレットでは、ヒト化抗体の調製について報告している。ヒトおよびマウスの可変フレームワーク領域は、タンパク質配列の相同性が最適となるように選択される。前記マウス可変領域の三次構造はコンピューターによりモデル化され、相同的なヒトのフレームワークに重ね合わせることにより、アミノ酸残基と前記マウスCDRsとの最適な相互作用が示された。これにより、抗原に対する結合親和性(CDRを移植したキメラ抗体を作製する際は通常低下する)が向上した抗体が開発された。ヒト化抗体を作製する代替アプローチは当該分野で周知であり、例えばTempest(1991)Biotechnology 9:266−271において報告されている。
【0073】
本発明の抗体には、例えば、あらゆるタイプの分子と前記抗体との共有結合により、共有結合が前記抗体のエピトープへの結合を阻害しないように修飾された誘導体を含む。適切な誘導体の例には、これに限定されるものではないが、グリコシル化抗体およびフラグメント、アセチル化抗体およびフラグメント、ポリエチレングリコール化抗体およびフラグメント、リン酸化抗体およびフラグメント、およびアミド化抗体およびフラグメントが含まれる。本発明の抗体とその誘導体は、それ自体、既知の保護基/封鎖基、タンパク質分解的切断、細胞のリガンドまたは他のタンパク質との結合などにより誘導体化されていても良い。さらに、本発明の抗体とその誘導体は、1若しくはそれ以上の非古典的アミノ酸を含んでいても良い。
【0074】
本発明の抗体には、単一または複数のアミノ酸置換、欠失、付加、または交換され、本発明の抗体の生物学的特性(例えば、内部移行、結合親和性または結合活性、または免疫エフェクター活性)を保持した変異体が含まれる。当業者であれば、単一または複数のアミノ酸が置換、欠失、付加、または交換された変異体を作製することができる。これらの変異体には、とりわけ、(a)1若しくはそれ以上のアミノ酸残基が保存的または非保存的アミノ酸と置換された変異体、(b)1若しくはそれ以上のアミノ酸がポリペプチドに追加されるか、ポリペプチドから欠失した変異体、(c)1若しくはそれ以上のアミノ酸が置換基を含む変異体、および(d)例えば、抗体エピトープ、ポリヒスチジン配列、ビオチン部分など、前記ポリペプチドに有用な特性を与えることができる、融合パートナー、タンパク質標識、または他の化学部分など、別のペプチドまたはポリペプチドと、前記ポリペプチドが融合した変異体を含む。本発明の抗体は、保存的または非保存的な位置で、1種のアミノ酸残基が別の種の対応する残基と置換された変異体を含む。別の実施形態において、非保存的な位置のアミノ酸残基は保存的または非保存的残基と置換される。遺伝的(抑制、欠失、変異など)、化学的、および酵素的技術を含む、これらの変異体を得る技術は、当業者に周知である。本発明の抗体には抗体フラグメントが含まれる。「フラグメント」とはポリペプチド配列を指し、好ましくは少なくとも約40、より好ましくは少なくとも約50、より好ましくは約60、より好ましくは少なくとも約70、より好ましくは少なくとも約80、より好ましくは少なくとも約90、より好ましくは少なくとも約100アミノ酸長であり、例えば、エンドシアリン結合親和性または結合活性、内部移行能力、免疫エフェクター活性など、前記完全な長さの配列の生物活性または免疫活性を一部保持する。
【0075】
本発明には、エンドシアリン関連癌患者の末梢血単核細胞に由来する抗体など、完全ヒト抗体も含む。そのような細胞は骨髄腫細胞と融合し、例えば完全ヒト抗エンドシアリン抗体を産生するハイブリドーマ細胞を形成することができる。
本発明の抗体とその誘導体は、解離定数(Kd)が1×10−2未満である結合親和性を有する。一部の実施形態によると、前記Kdは1×10−3未満である。他の実施形態によると、前記Kdは1×10−4未満である。一部の実施形態によると、前記Kdは1×10−5未満である。さらに他の実施形態によると、前記Kdは1×10−6未満である。他の実施形態によると、前記Kdは1×10−7未満である。他の実施形態によると、前記Kdは1×10−8未満である。他の実施形態によると、前記Kdは1×10−9未満である。他の実施形態によると、前記Kdは1×10−10未満である。さらに他の実施形態によると、前記Kdは1×10−11未満である。一部の実施形態によると、前記Kdは1×10−12未満である。他の実施形態によると、前記Kdは1×10−13未満である。他の実施形態によると、前記Kdは1×10−14未満である。さらに他の実施形態によると、前記Kdは1×10−15未満である。
【0076】
いかなる特定の操作理論にも縛られることなく、本発明の抗体は、前記抗体の両方の「アーム(arm)」(Fabフラグメント)の増加された親和力により、エンドシアリン分子を分離するため、特にエンドシアリンの結合に有用であると考えられている。このため前記抗体の解離定数(Kd)が低下し、前記観察された親和性(KD)が全体的に上昇する。さらに、本発明の抗体は、前記抗体−抗原複合体の内部移行を可能にするエピトープに結合する必要がある。本発明の抗体は正常組織よりも腫瘍組織または新生血管組織に強固に結合し、細胞傷害性を有する免疫細胞を引き寄せ、結合薬物を送達し治療効果を追加するために内部移行することができるため、これらの特徴は腫瘍および新生血管組織の標的化に特に適している。
【0077】
本発明の抗体は、単独、または細胞傷害性物質または細胞増殖抑制物質などの生体分子または化学治療物質と共に(併用または混合して)使用することが可能である。一部の実施形態では、前記化学治療物質が、鉛−212、ビスマス−212、アスタチン−211、ヨウ素−131、スカンジウム−47、レニウム−186、レニウム−188、イットリウム−90、ヨウ素−123、ヨウ素−125、臭素−77、インジウム−111、およびホウ素−10またはアクチニドなどの核分裂性核種を含む(これに限定されるものではないが)放射性同位元素である。他の実施形態では、前記化学治療物質がリシン、修飾シュードモナスエンテロトキシンA、カリケアマイシン、アドリアマイシン、5−フルオロウラシルなどを含む(これに限定されるものではないが)毒素または細胞傷害性薬である。そのような薬物への抗体および抗体フラグメントの結合方法は、文献に知られている。
【0078】
本発明には、本発明のインアウト抗体を産生する細胞も含まれる。本発明の抗体産生細胞は細菌、酵母、昆虫、動物細胞であり、好ましくは哺乳類細胞である。例えば、本発明の抗体産生細胞には、例えばSpodoptera frugiperda細胞などの昆虫細胞、例えば酵母(Saccharomyces cerevisiaeおよびSchizosaccharomyces pombe)細胞などの酵母細胞、例えばチャイニーズハムスター卵巣由来細胞、胎仔ハムスター腎細胞、ヒト胎児腎臓株293、正常イヌ腎臓細胞株、正常ネコ腎臓細胞株、サル腎細胞、アフリカミドリザル腎細胞、COS細胞、および非腫瘍化マウス筋芽細胞G8細胞、線維芽細胞株、骨髄腫細胞株、マウスNIH/3T3細胞、LMTK細胞、マウスsertoli細胞、ヒト子宮頸癌細胞、バッファローラット肝細胞、ヒト肺細胞、ヒト肝細胞、マウス乳癌細胞、TRI細胞、MRC 5細胞、およびFS4細胞などの哺乳類細胞を含む。抗体産生細胞は2006年4月24日にAmer.Type Cult.Coll.(10801 University Blvd.,Manassas,Virginia 20110−2209)に掲載され、受入番号_______を割り当てられた。本発明のインアウト抗体の例は、そのような細胞によって産生された抗体である。
【0079】
核酸
本発明には、本発明の抗FRA抗体の重鎖および/または軽鎖をコードする核酸も含まれる。本明細書において用いられる「核酸」または「核酸分子」は、一本鎖または二本鎖のすべてのDNAまたはRNA分子を指し、一本鎖の場合は直鎖または環状型の相補的配列の分子を指す。核酸分子について考察する場合、5'から3'方向の配列を提供する通常の慣習に従い、特定の核酸分子の配列または構造について本明細書に説明することがある。本発明の一部の実施形態では、核酸分子は「単離」されている。この用語は、核酸分子に用いられる場合、由来する生物体の天然型ゲノムに隣接する配列から分離された核酸分子を指す。例えば、「単離核酸」は、プラスミドまたはウイルスベクターなどのベクターに挿入されるか、原核または真核細胞または宿主微生物のゲノムDNAに組み込まれたDNA分子を有する。RNAに用いる場合、前記「単離核酸」という用語は、主に、上記に定義した単離DNA分子によってコードされるRNA分子を指す。あるいは、前記用語は、天然の状態(つまり、細胞または組織中)で関連すると考えられる他の核酸から十分分離されたRNA分子を指す。単離核酸(DNAまたはRNA)は、さらに生物学的方法または合成法によって直接作製されたか、その作製中に存在する他の成分から分離された分子を示す。
【0080】
本発明の核酸には、本発明の核酸と少なくとも80%、より好ましくは少なくとも約90%、より好ましくは少なくとも約95%、最も好ましくは少なくとも約98%の相同性を有する核酸を含む。特定の配列を指す場合の「%類似性」、「%同一性」および「%相同性」という用語は、ウィスコンシン大学GCGソフトウェアプログラムに定義されるように使用する。本発明の核酸には相補的核酸も含まれる。一部の例では、前記配列を並べた場合に、完全に相補的となる(ミスマッチなし)。他の例によると、前記配列に最高約20%のミスマッチがある。
【0081】
本発明の核酸には、本発明の核酸のフラグメントも含まれる。「フラグメント」は、好ましくは少なくとも約10核酸長、より好ましくは約40核酸、最も好ましくは約100核酸長の核酸配列を指す。「フラグメント」は、1若しくはそれ以上の欠失、挿入、または置換を含む、少なくとも約100連続ヌクレオチド長を意味することもできる。「フラグメント」は、遺伝子の全コード化配列を意味し、5'および3'非翻訳領域を含む場合がある。
【0082】
本発明の核酸はベクターにクローン化することもできる。「ベクター」はプラスミド、コスミド、バクミド、ファージ、人工染色体(BAC、YAC)またはウイルスなどのレプリコンであり、これに別の遺伝子配列または遺伝要素(DNAまたはRNA)を挿入し、結合した配列または要素の複製を作ることができる。「レプリコン」は例えば、プラスミド、コスミド、バクミド、ファージ、人工染色体(BAC、YAC)またはウイルスなどの遺伝的要素であり、大部分は独自の制御で複製することができる。レプリコンはRNAまたはDNAとすることができ、一本鎖または二本鎖とすることができる。いくつかの実施形態では、前記発現ベクターに構成的に活性なプロモーターセグメント(これに限定されるものではないが、CMV、SV40、伸長因子、またはLTR配列)またはステロイド誘導pINDベクター(Invitrogen)などの誘導プロモーター配列を含み、前記核酸の発現を制御することができる。本発明の発現ベクターは、さらに例えば内部リボソーム侵入部位などの制御配列を有することもある。前記発現ベクターは、例えばトランスフェクションにより細胞に導入することができる。
【0083】
本発明の抗体をコードする核酸は、組み換えにより発現させることができる。本発明の発現細胞には、例えばSpodoptera frugiperda細胞など、既知の昆虫発現細胞株を含む。前記発現細胞株は、例えばSaccharomyces cerevisiaeおよびSchizosaccharomyces pombe細胞などの酵母細胞株とすることもできる。前記発現細胞は、例えば、チャイニーズハムスター卵巣由来細胞、胎仔ハムスター腎細胞、ヒト胎児腎臓株293、正常イヌ腎臓細胞株、正常ネコ腎臓細胞株、サル腎細胞、アフリカミドリザル腎細胞、COS細胞、および非腫瘍化マウス筋芽細胞G8細胞、線維芽細胞株、骨髄腫細胞株、マウスNIH/3T3細胞、LMTK細胞、マウスsertoli細胞、ヒト子宮頸癌細胞、バッファローラット肝細胞、ヒト肺細胞、ヒト肝細胞、マウス乳房腫瘍細胞、TRI細胞、MRC5細胞、およびFS4細胞などの哺乳類細胞とすることもできる。本発明の核酸は、例えばトランスフェクションにより細胞に導入することができる。組み換えにより発現された抗体は、例えば細胞の成長培地から回収することができる。
【0084】
エンドシアリンに対するインアウト抗体の作製法
免疫化動物
本発明では、エンドシアリンに特異的に結合するインアウトモノクローナル抗体を作製する方法も提供する。エンドシアリンは、タンパク質を単離および精製するための様々な既知の技術を利用し、細胞または組み換え系から精製することができる。例えば、これに限定されるものではないが、FRAは前記タンパク質の見かけ上の分子量に基づき、前記タンパク質をSDS−PAGEゲルに流し、前記タンパク質を膜にブロットすることで単離することができる。その後、エンドシアリンに対応する適切なサイズのバンドを膜から切り取り、直接動物で免疫原として利用するか、まず前記タンパク質を前記膜から抽出または溶出してから利用することができる。代わりの例として、前記タンパク質はサイズ排除クロマトグラフィーのみ、または他の単離および精製法との併用で単離することができる。他の精製法は、Zola,MONOCLONAL ANTIBODIES:PREPARATION AND USE OF MONOCLONAL ANTIBODIES AND ENGINEERED ANTIBODY DERIVATIVES (BASICS: FROM BACKGROUND TO BENCH) Springer−Verlag Ltd.,New York,2000;BASIC METHODS IN ANTIBODY PRODUCTION AND CHARACTERIZATION,Chapter 11,"Antibody Purification Methods,"Howard and Bethell,Eds.,CRC Press,2000;ANTIBODY ENGINEERING(SPRINGER LAB MANUAL.),Kontermann and Dubel,Eds.,Springer−Verlag,2001などの標準的な参考書籍で参照可能である。
【0085】
エンドシアリンに対するインアウト抗体を作製する1つの戦略には、エンドシアリン発現細胞を持つ動物を免疫化することを含む。そのように免疫化した動物は、前記タンパク質に対する抗体を産生する。ハイブリドーマ法(Kohler&Milstein,(1975)Nature 256:495−497を参照)、トリオーマ法、ヒトB細胞ハイブリドーマ法(Kozbor et al.(1983)Immunol.Today 4:72を参照)、およびヒトモノクローナル抗体を作製するEBVハイブリドーマ法(Cole,et al.MONOCLONAL ANTIBODIES AND CANCER THERAPY,Alan R.Liss,Inc.,1985,pp.77−96を参照)を含む(これに限定されるものではないが)、モノクローナル抗体を作製する標準的な方法が知られている。
【0086】
本発明の抗体は、インビボまたはインビトロで作製することができる。インビボでの抗体作製においては、一般的に動物がエンドシアリンの免疫原性部分で免疫化される。前記抗原または抗原陽性細胞は、一般的に免疫原性を促進するアジュバントと併用される。アジュバントは免疫化に使用する種によって異なる。アジュバントの例には、(これに限定されるものではないが)フロイント完全アジュバント(「FCA(Freund's complete adjuvant)」)、フロイント不完全アジュバント(「FIA(Freund's incomplete adjuvant」)、無機質ゲル(例えば、水酸化アルミニウム)、界面活性物質(例えば、リゾレシチン、プルロニックポリオール、ポリアニオン)、ペプチド、油性乳剤、キーホールリンペットヘモシアニン(「KLH(keyhole limpet hemocyanin)」)、ジニトロフェノール(「DNP(dinitrophenol)」)、およびカルメット・ゲラン桿菌(「BCG(Bacille Calmette−Guerin」)およびcorynebacterium parvumなどの潜在的に有用なヒトアジュバントを含む。そのようなアジュバントは当該分野で周知である。
【0087】
免疫化は周知の方法により達成することができる。用量と免疫化法は、免疫化される哺乳類の種、その免疫状態、体重、および/または表面積の計算値などに依存する。典型的には、免疫化する哺乳類から血清を採取し、例えば、以下に説明する適切なスクリーニング法により抗エンドシアリン抗体を分析する。
【0088】
免疫化動物の脾細胞は、(前記抗体産生B細胞を含む)前記脾細胞と骨髄腫株などの不死化細胞株を融合することで不死化することができる。典型的には、骨髄腫細胞株は前記脾細胞ドナーと同じ種のものとする。1実施形態では、前記不死化細胞株がヒポキサンチン、アミノプテリン、およびチミジンを含む培地(「HAT培地」)に感受性を示す。一部の実施形態では、前記骨髄腫細胞がエプスタインバーウイルス(EBV)感染陰性である。好適な実施形態では、前記骨髄腫細胞がHAT感受性、EBV陰性、およびIg発現陰性である。すべての適切な骨髄腫を使用することができる。マウスハイブリドーマは、マウス骨髄腫細胞株(例えば、P3−NS1/1−Ag4−1、P3−x63−Ag8.653、またはSp2/O−Ag14骨髄腫株)により作製することができる。これらのマウス骨髄腫株はATCCから入手できる。これらの骨髄腫細胞は、前記ドナー脾細胞のポリエチレングリコール(「PEG」)、好ましくは1500分子量のポリエチレングリコール(「PEG1500」)に融合する。前記融合で得られるハイブリドーマ細胞は、未融合の骨髄腫細胞と非生産的に融合された骨髄腫細胞を死滅させるHAT培地で選択される。未融合の脾細胞は培養時に短期間で死滅する。いくつかの実施形態では、前記骨髄腫細胞が免疫グロブリン遺伝子を発現しない。
【0089】
以下に説明するようなスクリーニング方法で検出される、望みの抗体を産生するハイブリドーマは、培養または動物で抗体を作製するために使用することができる。例えば、前記ハイブリドーマ細胞は、前記ハイブリドーマ細胞が前記培地に前記モノクローナル抗体を十分分泌できる条件および時間で、培養液中で培養することができる。これらの技術と培地は、当業者に周知である。或いは、前記ハイブリドーマ細胞を非免疫化動物の腹膜に注入することができる。前記細胞は腹腔で増殖し、前記抗体を分泌し、これが腹水として蓄積する。前記腹水は、前記モノクローナル抗体が豊富な供給源として、腹腔からシリンジで抜くことができる。
【0090】
ヒト抗体を作製するための別の限定されない方法は、米国特許第5,789,650号明細書に報告されており、この明細書では、自らの内因性免疫グロブリン遺伝子が不活性化され、別の種(例えば、ヒト)の抗体を産生するトランスジェニック哺乳類について説明している。前記異種抗体の遺伝子は、ヒト免疫グロブリン遺伝子によってコードされている。再配列されていない免疫グロブリンのコード領域を含む導入遺伝子は、非ヒト動物に導入される。得られたトランスジェニック動物は、前記トランスジェニック免疫グロブリン配列を機能的に再配列し、ヒト免疫グロブリン遺伝子でコードされた様々なアイソタイプの抗体レパートリーを産生することができる。前記トランスジェニック動物のB細胞は、その後、不死化細胞株(例えば、骨髄腫細胞)と融合させるなど、様々な方法のいずれかによって不死化される。
【0091】
エンドシアリンに対するインアウト抗体は、当該分野で既知の様々な技術によりインビトロで調整することができる。例えば、(これに限定されるものではないが)エンドシアリンに対する完全ヒトモノクローナル抗体は、インビトロで初回抗原刺激したヒト碑細胞を用いて調整することができる(Boerner et al.(1991)J.Immunol.147:86−95)。
【0092】
或いは、例えば、本発明の抗体を「レパートリークローニング」により調整することができる(Persson et al.(1991)Proc.Nat.Acad.Sci.USA 88:2432−2436;およびHuang and Stollar(1991)J.Immunol.Methods 141:227−236)。さらに、米国特許第5,798,230号明細書では、エプスタインバーウイルス核抗原2(EBNA2)を発現したエプスタインバーウイルスに感染させることで不死化した、ヒトB抗体産生B細胞のヒトモノクローナル抗体の調整について報告している。その後不死化に必要なEBNA2を不活化し、抗体力価を上昇させる。
【0093】
別の実施形態では、エンドシアリンに対するインアウト抗体が末梢血単核細胞(「PBMCs」)のインビトロでの免疫化によって形成される。これは、例えば文献に報告された方法を用いるなど、当該分野で既知の方法により達成することができる(Zafiropoulos et al.(1997)J.Immunological Methods 200:181−190)。
【0094】
エンドシアリンに対するインアウト抗体を作製する別の戦略では、エンドシアリンの膜結合型の領域に対応するペプチドを持つ動物を免疫化する工程を含み、これにより確実な免疫エフェクター活性を保持する抗体を内部移行させる。そのように免疫化した動物は、前記タンパク質に対する抗体を産生する。ハイブリドーマ法(Kohler & Milstein,(1975)Nature 256:495−497を参照)、トリオーマ法、ヒトB細胞ハイブリドーマ法(Kozbor et al.(1983)Immunol.Today 4:72を参照)、およびヒトモノクローナル抗体を作製するEBVハイブリドーマ法(Cole,et al.MONOCLONAL ANTIBODIES AND CANCER THERAPY,Alan R.Liss,Inc.,1985,pp.77−96を参照)を含む(これに限定されるものではないが)モノクローナル抗体を作製する標準的な方法が知られている。
【0095】
本発明の1実施形態では、インビトロでの免疫化法がハイブリドーマ細胞の定向進化により補完され、PMS1、PMS2、PMS2−134、PMSR2、PMSR3、MLH1、MLH2、MLH3、MLH4、MLH5、MLH6、PMSL9、MSH1、およびMSH2などのミスマッチ修復遺伝子のドミナントネガティブ対立遺伝子が、前記碑細胞の融合後に前記ハイブリドーマ細胞に導入されるか、融合前に前記骨髄腫細胞に導入される。前記ドミナントネガティブ突然変異を含む細胞は超変異となり、形質移入していない対照細胞よりも高い割合で変異を蓄積する。前記突然変異細胞のプールから、高親和性抗体を産生するか、高力価抗体を産生するか、単純に特定の条件でより早く、良好に増殖するクローンをスクリーニングすることができる。ミスマッチ修復遺伝子のドミナントネガティブ対立遺伝子を用いて超変異細胞を作製する方法は、2000年11月4日発行の米国特許第6,146,894号明細書に報告されている。代わりに、Nicolaidesらが2002年7月18日公開のWO 02/054856「Chemical Inhibitors of Mismatch Repair」に報告した、ミスマッチ修復の化学的阻害剤を用いて、ミスマッチ修復を阻害することもできる。ミスマッチ修復遺伝子のドミナントネガティブ対立遺伝子またはミスマッチ修復の化学的阻害剤を用いて抗体を強化する方法は、クローン化免疫グロブリン遺伝子も発現した哺乳類の発現細胞に適用されることもある。前記ドミナントネガティブ対立遺伝子をオフとし、誘導できる場合は前記細胞から排除することで、前記細胞をもう一度遺伝的に安定させ、異常に高い割合で突然変異が蓄積しないようにできるという点において、前記ドミナントネガティブ対立遺伝子を発現する細胞は「矯正」することができる。
【0096】
インアウト抗体のスクリーニング
エンドシアリンに特異的に結合するインアウト抗体のスクリーニングは、酵素免疫吸着測定法(ELISA)を利用し、免疫エフェクター活性を持つ抗体をスクリーニングする、および/または内部移行をアッセイすることで達成することができる。免疫エフェクター活性を示す抗体は、抗体依存性細胞傷害作用(ADCC)または補体依存性細胞傷害作用(CDC)をモニターする標準的な免疫エフェクター法を利用することで同定することができる。内部移行可能な抗体は、前記抗体を蛍光色素またはプロドラッグなどの検出可能な標識と結合させ、可視化した内部移行能力または毒性をモニターすることで、同定可能である。1若しくはそれ以上のこれらのアッセイ(ELISA、免疫エフェクター法、および内部移行法)は、本発明のインアウト抗体を同定する任意の順序で実行することができる。
【0097】
例えば、前記ELISAは、抗原(タンパク質全体またはペプチド)を免疫化したコーティングマイクロタイタープレートを有することもある。陽性反応を示したクローンの抗体は、エンドシアリンに対するELISAを基本としたアッセイで反応性をスクリーニングすることができる。葉酸受容体α型に特異的な抗体は、1若しくはそれ以上の他の葉酸受容体アイソタイプを利用し、ELISAで同定することができる。エンドシアリンに対して反応性を示す抗体を産生するクローンは、さらなる発展と開発のために選択される。インアウト活性を示すエンドシアリン反応性抗体は、例えば、抗体依存性細胞傷害作用(ADCC)または補体依存性細胞傷害作用(CDC)をモニターする標準的な免疫エフェクター法を用いて確認することができる。免疫エフェクター活性を示すエンドシアリン特異的抗体については、次に蛍光色素またはプロドラッグと結合し、可視化した内部移行能力、またはプロドラッグが内部移行し、前記抗体が遊離することで前記毒素が生じる際に発生する毒性をモニターすることができる。
【0098】
抗体の薬学的組成物
本発明の別の観点では、本発明の抗エンドシアリン抗体の薬学的組成物を特徴としている。前記薬学的組成物を使用し、患者のエンドシアリン陽性細胞の成長を抑制または軽減することができる。特定の実施形態では、前記薬学的組成物が製剤化され、注射または注入により投与される。
【0099】
本発明の薬学的組成物は、さらに1若しくはそれ以上の生体分子または化学治療物質を有する。一部の実施形態において、前記抗体は前記生体分子、抗葉酸化合物、または化学治療物質に結合する。適切な化学治療物質には、(これに限定されるものではないが)鉛−212、ビスマス−212、アスタチン−211、ヨウ素−131、スカンジウム−47、レニウム−186、レニウム−188、イットリウム−90、ヨウ素−123、ヨウ素−125、臭素−77、インジウム−111、およびホウ素−10またはアクチニドなどの核分裂性核種を含む放射性同位元素を含む。他の実施形態では、前記化学治療物質がリシン、修飾シュードモナスエンテロトキシンA、カリケアマイシン、アドリアマイシン、5−フルオロウラシルなどを含む(これに限定されるものではないが)、毒素または細胞傷害性薬である。
【0100】
本発明の薬学的組成物は、薬学的に許容される担体または媒体とともに製剤化されることもある。適切な薬学的に許容される担体には、水、PBS、食塩水(リンガー溶液など)、アルコール、オイル、ゼラチン、およびラクトース、アミロール、またはデンプンなどの炭水化物、脂肪酸エステル、ヒドロキシメチルセルロース、およびポリビニル・ピロリジンを含む。そのような製剤は滅菌し、望ましい場合は、潤滑剤、保存料、安定剤、湿潤剤、乳化剤、浸透圧に影響する塩、緩衝液、および着色剤などの助剤と混合することができる。本発明での使用に適した薬学的担体は当該分野で既知であり、例えばPharmaceutical Sciences(第17版、Mack Pub.Co.、ペンシルバニア州イーストン)に説明されている。
【0101】
キット
本発明のさらに別の観点では、インビトロまたはインビボでエンドシアリン陽性細胞の成長を阻害または抑制するキットが提供される。また、インビトロまたはインビボでエンドシアリン陽性細胞の有無を確認するキットも提供される。
【0102】
本発明のキットは、本発明の抗体または抗体組成、およびエンドシアリン陽性細胞、好ましくは異型細胞の成長をインビトロまたはインビボで阻害または抑制する方法、例えば生物サンプル中のエンドシアリン陽性細胞、好ましくは異型細胞の有無を同定する方法において、前記キットを使用するための使用説明書を有する。前記キットは少なくとも1つの生体分子、抗葉酸化合物、または化学治療物質を有することができる。前記キットは、少なくとも1つの診断試薬を有することができる。診断試薬の例は、例えば放射性、蛍光性、または発色試薬(例えば、111In−DOTA)などの(これに限定されるものではないが)検出可能な標識である。前記検出可能な標識は酵素を有することもある。前記キットは、前記抗体または抗体組成を、例えば注射または注入により投与するための使用説明書および/または手段を有することもある。
【0103】
エンドシアリン陽性細胞の検出法
本発明の方法には、卵巣癌、膵癌、前立腺癌、または肺癌細胞を含む(これに限定されるものではないが)、表面にエンドシアリンを提示する、異型細胞または新生血管細胞などの細胞を検出する方法を含む。前記方法は、生物サンプルに対してインビトロで、またはインビボで実行することができる。本発明のエンドシアリン陽性細胞の検出方法は、本発明の抗エンドシアリン抗体を生物サンプルと接触させる工程または本発明の抗エンドシアリン抗体を患者に投与する工程(前記抗体は例えば放射性、蛍光性、または発色試薬(例えば、111In−DOTA)などの(これに限定されるものではないが)検出可能な標識で標識される)、および前記抗体の細胞への結合を決定する工程を有する。前記検出可能な標識は酵素とすることもある。
【0104】
エンドシアリン陽性細胞の成長を抑制する方法
本発明のインアウト抗エンドシアリン抗体は、インビトロまたはインビボにおいてエンドシアリン陽性細胞の成長を抑制するための使用に適している。本発明の方法は、エンドシアリンを発現する細胞を含む組織、好ましくは増強されたエンドシアリンの発現を示す細胞に関連した腫瘍疾患または血管新生疾患を有すると同定された非ヒト動物での使用に適している。本発明の利益を受ける非ヒト動物には、ペット、外来性(例えば、動物園の動物)および国産家畜を含む。好ましくは、前記非ヒト動物は哺乳類である。
【0105】
本発明は、正常組織に関連し、腫瘍または新生血管組織において増強されたエンドシアリンの発現により特徴付けられる、形成異常症または血管新生疾患を有すると同定されたヒトまたは動物患者での使用に適している。そのような患者がそのような状態を治療する必要があると同定されると、前記状態の治療を達成するため、本発明の方法が適応されることがある。治療可能な異型組織または新生血管組織には、(これに限定されるものではないが)卵巣、乳、結腸、肝臓、脳、肺、膵臓、骨間接、骨、眼、および前立腺を含む。
【0106】
本発明で使用される抗体とその誘導体は、カプセル、錠剤、水性懸濁液、溶液など、許容される剤形であれば経口投与することができる。前記抗体とその誘導体は、非経口投与することもできる。その場合、皮下、静脈内、筋肉内、関節内、滑膜内、胸骨内、鼻腔内、局所、くも膜下腔内、肝内、病巣内、および頭蓋内注射または注入法の投与経路とする。一般に前記抗体と誘導体は、筋肉内または静脈内注射として提供される。
【0107】
本発明の抗体と誘導体は、単独、または許容されるアジュバント、賦形剤、および添加物を含む、薬学的に許容される担体との併用で投与することができる。
【0108】
本発明の抗体と誘導体は、1若しくはそれ以上の抗葉酸化合物を併用して投与することもできる。前記抗葉酸化合物には、(これに限定されるものではないが)5−フルオロ−2'−デオキシ−ウリジン−5'−一リン酸(FdUMP)、5−フルオロウラシル(5−FU)、L−5−ホルミルテトラヒドロ葉酸(「ロイコボリン」)、N−[5−(N−(3,4−ジヒドロ−2−メチル−4−オキソキナゾリン−6−イル−メチル)−アミノ)−2−テニル)]−L−グルタミン酸(「ZD1649」、「トムデックス」としても知られる)(Jackman et al.(1991)Cancer Res.51:5579−5586)、N−(4−(2−(2−アミノ−4,7−ジヒドロ−4−オキソ−3H−ピロロ[2,3−D]ピリミジン−5−イル)−エチル)−ベンゾイル]−L−グルタミン酸(「マルチターゲット葉酸」(multi−targeted antifolate:MTA)、「LY231514」、「ALIMTA」、および「ペメトレキセド」としても知られる)(Taylor et al.(1992)J.Med.Chem.35:4450−4454;Shih et al.(1997)Cancer Res.57:1116−1123)、(S)−2−(5)−(((1,2−ジヒドロ−3−メチル−1−オキソベンゾ(f)キナゾリン−9−イル)−メチル)−アミノ)−オキソ−2−イソインドリニル)−グルタル酸(「GW1843U89」)(Hanlon and Ferone(1996)Cancer Res.56:3301−3306)、(2S)−2−{O−フルオロ−p−[N−(2,7−ジメチル−4−オキソ−3,4−ジヒドロ−キナゾリン−6−イル−メチル)−N−プロパ−2−イニル)アミノ]ベンズアミド}−4−(テトラゾール−5−イル)−酪酸(「ZD9331」)(Jackman et al.(1997)Clin.Cancer Res.3:911−921);3,4−ジヒドロ−アミノ−6−メチル−4−オキソ−5−(4−ピリジルチオ)−キナゾリン(「AG337」、「チミタック(Thymitaq)」としても知られる)(Webber et al.(1996)Cancer Chemother.Pharmacol.37:509−517;Rafi et al.(1998)J.Clin.Oncol.16:1331−1341)、およびNα−(4−アミノ−4−デオキシプテロイル)−Nδ−(ヘミフタロイル−L−オルニチン)(「PT523」)(Rhee et al.(1994)Mol.Pharmacol.45:783−791、Rowowsky(1999)Curr.Med.Chem.6:329−352)を含む。前記抗葉酸化合物は、本発明の抗FR−α抗体の前後、または同時に投与することができる。投与される抗葉酸化合物の量は現在使用されている用量とするか、増減することができ、これは前記患者に対して有害作用を生じずに、腫瘍の成長抑制または腫瘍の除去を達成することを基本に、医師が容易に決定することができる。
【0109】
本発明の抗体は、別の治療薬または診断薬の前後、または同時に投与することができる。例えば、本発明のインアウト抗体は単独、またはアドリアマイシン、ドキソルビシン、ゲムシタビン、または5−フルオロウラシルなど(これに限定されるものではないが)細胞傷害性薬と併用して投与することができる。本発明のインアウト抗体は単独、またはタルセバおよびアバスチンなど(これに限定されるものではないが)細胞増殖抑制物質と併用して投与することができる。本発明のインアウト抗体と誘導体は単独、またはワクチン剤と併用して投与することができる。本発明のインアウト抗体および誘導体は単独、またはインターロイキン−2、インターフェロンα、インターフェロンβ、インターフェロンγ、リツキサン、ゼバリン、ハーセプチン、エルビタックス、アバスチンなど(これに限定されるものではないが)別の生体分子と併用して投与することができる。
【0110】
本発明のインアウト抗体および誘導体は、非複合型または複合型抗体の均一混合物として、または非複合型または複合型インアウト抗体の不均一混合物として投与することができる。
【0111】
有効量は様々な因子によって決まり、これは体重、治療目標、最高耐量、使用される特定の製剤、投与経路などの様々なパラメーターによって、特定患者の用量を調整する熟練医師の権限の範囲内である。一般に、前記抗体またはその誘導体の用量レベルは、1日約0.001および約100mg/kg体重の範囲が適切である。いくつかの実施形態では、前記抗体またはその誘導体の用量が1日約0.1〜約50mg/kg体重である。他の実施形態では、前記用量が約0.1mg/kg体重/日〜約20mg/kg体重/日である。さらに他の実施形態では、前記用量が約0.1mg/kg体重/日〜約10mg/kg体重/日である。投与はボーラスまたは注入とすることができる。投与は、1日1回または1日複数回とすることができる。さらに、投与は一定期間に複数回とすることができる。いくつかの実施形態では、前記用量を1〜14日おきに投与する。いくつかの実施形態では、前記抗体またはその誘導体が腹腔内に約3〜1mg/kgの用量で投与される。他の実施形態では、前記抗体またはその誘導体は静脈内に約5〜12.5mg/kgで提供される。さらに他の実施形態では、前記抗体またはその誘導体が、血漿レベルを少なくとも約1ug/mlに維持するように提供される。
【0112】
治療の有効性ついては、様々な方法で評価することができる。一実施形態によると、腫瘍成長の進行の遅延、または血管新生疾患組織において症状が軽減されることにより、治療が有効であると判断される。他の実施形態によると、前記腫瘍の縮小(つまり、前記腫瘍サイズの減少)、または新生血管組織における正常機能の回復によって治療が有効であると決定される。他の実施形態では、前記腫瘍の転移の抑制、または新生血管組織の改善された正常機能によって治療が有効であると決定される。さらに他の実施形態において、治療の有効性は、体重増加、体力回復、疼痛軽減、視界の回復、成長、および健康回復および疾患の抑制に関する前記患者からの主観的指標などの徴候を含む、前記患者の満足感(well−being)向上により決定される。
【0113】
以下の実施例は、本発明を図示するために提供されるものであり、本発明を限定するものとして解釈されるべきではない。
【実施例1】
【0114】
エンドシアリンに結合可能なインアウト抗体
モノクローナル抗体ES−1はエンドシアリンに特異的なヒト化抗体である、前記抗体はエンドシアリンタンパク質、エンドシアリンを発現した癌細胞、ヒト胚内皮細胞、および白血球に対する特異的な結合を示す。エンドシアリンに特異的な結合性を立証するために、当業者によって用いられる方法に従って、96型ウェル中、エンドシアリン発現細胞を用いて全細胞ELISAを行った。ELISAによって反応が見出された抗体はさらに、製造プロトコールに従って、FACS分析を用いたエンドシアリン結合分析を行った。インアウト抗体は、免疫組織化学(immunohistochemistry:IHC)を用いてスクリーニングすることにより同定した。IHCを用いることによって、エンドシアリンを発現している内皮細胞(endothelial cells:ECs)の免疫組織化学による前記細胞表面上で発現したエンドシアリンに結合可能な抗体が検出された。前記抗エンドシアリンまたは正常IgG抗体は、ECs濃度(0.5ug/mLおよび2.5μg/mL)に対して適用された。Phosphate−リン酸緩衝食塩水[PBS(0.15M NaCl,pH7.2)]+1%ウシ血清アルブミンを第1抗体に対する希釈液として使用した。Cells細胞はスライドに播種して培養し、Tissue−Tek(商標)OCT培地中で固定した。スライドを−70℃以下で染色するまで保存した。染色直前、スライドを10%中性緩衝ホルマリン中に10秒間固定した。
【0115】
Slidesスライドをリン酸緩衝食塩水中 (PBS[0.15M NaCl,pH7.2])で2回洗浄した。Endogenous peroxidaseDako EnVision(登録商標)Kitによって提供されるペルオキシダーゼ溶液と共に前記スライドを5分間インキュベートして内因性ペルオキシダーゼを阻害した後、PBS(0.15M NaCl,pH7.2)中で2回洗浄した。次に、非特異的結合を抑制するために設計されたタンパク質阻害剤を用いて前記スライド20分間処理した。前記タンパク質阻害剤は以下のように調製した。PBS(0.15M NaCl, pH7.2)、0.5%カゼイン、1%ウシ血清アルブミン(bovine serum albumin:BSA)、および1.5%正常ヤギ血清。Following the タンパク質阻害剤に従って、第1抗体(被験物質、陰性コントロール抗体、またはなし(分析対照として緩衝液単独))を室温で1時間適用させた。次に、前記スライドをPBS(0.15M NaCl, pH7.2)を用いて2回洗浄し、Dako EnVision(登録商標)Kitから提供されるペルオキシダーゼ標識したヤギ抗IgGポリマーで30分間処理し、PBS(0.15M NaCl, pH7.2)で2回洗浄し、Dako EnVision(登録商標)Kitから提供される基質発色(substrate−chromogen:DAB)溶液で8分間処理した。Allすべてのスライドは水で洗浄し、ヘマトキシリンで対比染色し、脱水し、判読のためにカバースリップを載せた。図1は、ヌル細胞に対して、エンドシアリン発現細胞がES−1結合に対して陽性となったIHC分析データを示している。
【実施例2】
【0116】
ES−1の免疫エフェクター活性
免疫エフェクター活性は、エンドシアリン発現Lu細胞株にて標準的な抗体依存性細胞傷害(antibody−dependent cellular cytotoxicity:ADCC)分析により評価した。簡潔に述べると、OVCAR−3標的細胞を完全成長培地(10% FBS、2mM L−グルタミン含有RPMI−1640)中、平底96ウェルマイクロプレートに播種した。翌日、前記完全培地を100ulのCHO−CD無血清培地(Sigma)と交換し、抗体含有ならし培地50ulを標的細胞に追加し、37℃で20分間インキュベートした。その後、2×105のエフェクター細胞を含む100ulの無血清培地を加え、5%CO2、37℃で5〜6時間インキュベートした。エフェクター細胞はヒト末梢血単核球(peripheral blood mononuclear cells:PBMCs)から誘導し、健常ドナーから単離した(Interstate Blood Bankより購入)。ADCCにて使用する前に、PBMCsを約10ng/mlのヒト組み換え型インターロイキン2(R&D Systems)を含む完全RPMI中に2.5×106/mlで播種し、37℃、5% CO2にて3日間、PBMCsを活性化した。次に、活性化PBMCsをエフェクター細胞:標的細胞比を5:1としてOVCAR−3細胞に追加し、この培地を37℃、5%CO2にて5〜6時間インキュベートした。各ウェルから上清を回収し、ELISAプレートに移し、以下のとおりADCCを分析行った。ADCCは乳酸脱水素酵素(lactase dehydrogenase:LDH)、標準分析においてADCCの測定に使用される内因性酵素の放出によってモニターした。LDHは、100μlのLDH基質(Roche)を上清に添加し、周囲温度で10分間インキュベートすることによってモニターし、LDHによって変換された化学物質は分光光度法でOD490にて検出可能であった。LDH活性は、溶解標的細胞から放出される前記LDH酵素の量と比例する。490nmの吸光度(OD490)は分光光度法で得られる。2%トリトンXを「最大値(max)」の陽性対照としてエフェクター細胞単独に追加し、抗体は加えてないがPBMCを伴った標的細胞は「自然値(spontaneous)」としての陰性対照とした。LDH値を取得し、以下の式により細胞傷害性の割合を決定した。(サンプル値−自然値)/(最大値−自然値)×100%(式中、「自然値」=エフェクター細胞不在下での標的細胞の溶解、「最大値」=2%トリトン混在下での標的細胞の溶解)。100ng/mlの正常ヒトIgG1抗体を用い、非特異的細胞傷害性をモニターする。前記%細胞傷害性を各ウェル/クローンの抗体濃度で割って得られた比(つまり、比=50(%)/100(ng/ml)=0.5)を、エフェクター機能が高いと考えられるリードクローンを選択する基準として設定する。
【0117】
ES−1の分析によると、対照Igと共に、または抗体なしでインキュベートした細胞のADCC活性上昇力(p=0.018)を示している(図2)。図2は、ヌル黒色腫細胞は陰性であったのに対して、ES−1抗体のエンドシアリンに結合する能力を示すHMVEC細胞の非変性ウエスタンブロットを示していた。図2Bの下部パネルは、ヒトPBLs単独(0レーン)と共に、または増量されたES−1(棒グラフ右)と共に、または対照Ig(正常IgG−棒グラフ左)と共にインキュベートした標的HMVEC細胞(標的と称する)を示している。細胞溶解時に発生する乳酸脱水素酵素(LDH)の放出をモニターすることにより、細胞培養液の殺細胞を分析した。示したように、ES−1はエンドセリン発現細胞上においてADCC活性を有していた。図2Bの上部パネルは、ヒトPBLs単独で(0レーン)、または増量されたES−1(棒グラフ右)と共に、または対照Ig(正常IgG−棒グラフ左)と共にインキュベートしたエンドシアリンに対してヌルであるヒト黒色腫細胞を示している。細胞溶解時に発生する乳酸脱水素酵素(LDH)の放出をモニターすることにより、細胞培養液の殺細胞を分析した。示したように、ES−1はエンドシアリンヌル細胞上において、ADCC活性を有していなかった。これらのデータは、ML−1が免疫エフェクター機能を介して細胞傷害作用を有するという所見を支持するものである。
【実施例3】
【0118】
ES−1抗体の内在化
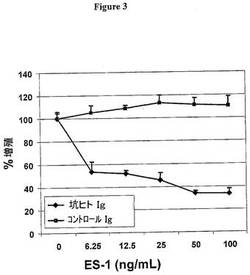
ES−1はエンドシアリン発現細胞に結合すると内部移行する。この所見は、Hum−ZAP分析を用いた図3に示した。第2の免疫毒素は、2次抗体とリボソーム不活化タンパク質サポリンの複合体である。試験している1次抗体が内部移行すると、前記サポリンは前記2次抗体と結合して前記細胞に運ばれる内部移行したサポリンがそのIgG複合体から一旦分離すると、タンパク質合成が阻害され、最終的に細胞死が引き起こされる。Hum−ZAP(Advanced Targeting Systems、cat# IT−22)は、ヒトモノクローナル抗体を認識するアフィニティー精製したヤギ抗ヒトIgG(分子量210kDa)の2次化学的複合体である。対照分子のヤギIgG−SAP(Advanced Targeting Systems cat#IT−19)は、正常なヤギIgGとサポリンの複合体である。簡潔に述べると、10%FCS、2.0mMグルタミン、1.0mMピルビン酸ナトリウム、および0.1mM MEM非必須アミノ酸を含む80ulのRPMI 1640中の平底96ウェル組織培養プレートに、2500/ウェルで細胞を播種した。24時間後、10μlの1次抗体ES−1またはMORAb−A92を10μlのHum−ZAPまたはヤギIgG−SAPとともに添加し、総量を100ulにした。実験では抗体の滴定を行い、1次抗体および2次抗体を対照として含ませた。4日後、分光光度法により生存細胞数を読み取るPromega CellTiter(登録商標)細胞傷害性アッセイ(cat#G3581)を用いて、細胞の生存率を評価した。すべての検査は3回ずつ行った。データは処理および未処理ウェルを比較することにより評価し、結果は対照のパーセントとして表した。図3に示したように、サポリンに結合したES−1はエンドシアリンを過剰発現したLu細胞を死滅させたが、ES−1抗体単独と比較して(図示せず)、アイソタイプ対照抗体MORAb−A92は複合体毒素形態において細胞を死滅させたかった(四角)。対照としてエンドシアリンを発現しない細胞を使用し、ES−1は複合または非複合形態において毒性効果を有していないことが示された(図示せず)。これらのデータは、ES−1がエンドシアリン提示細胞に内部移行するという知見を支持するものである。
【技術分野】
【0001】
本願は2005年4月22日付け出願の米国特許仮出願第60/674,185号に対して優先権を主張するものであり、その開示はこの参照によって本明細書に完全に組み込まれる。
【0002】
本発明は、エンドシアリンを発現または提示する細胞(「エンドシアリン陽性細胞」)に特異的に結合し、前記細胞に選択的に内部移行し、または抗体依存性細胞傷害作用などの免疫エフェクター活性を誘導する、モノクローナル抗体およびポリクローナル抗体の使用に関する。前記抗体は、薬物をエンドシアリン陽性細胞に特異的に送達し、これらに限らないが、特に血管新生細胞、内皮前駆細胞、腫瘍、間質腫瘍、及び異型細胞などを含むエンドシアリン陽性細胞で免疫エフェクター活性を誘発させる際に有用である。本発明は、前記モノクローナル抗体、ポリクローナル抗体、キメラおよびヒト化モノクローナル抗体などの抗体誘導体、抗体フラグメントを発現した細胞、エンドシアリン陽性細胞の検出法、および本発明の抗体を用いた癌および血管新生疾患の治療法にも関連する。
【背景技術】
【0003】
血管新生は新しい血管形成が関与した調整された工程である。血管新生は正常な成長、胚の発育、創傷治癒、および生理学的工程において重要な役割を果たしている。 (Yancopoulos et al.(2000) Nature 407(6801):242−8).更に、新血管新生は癌を含む幾つかの病状が関与しており、新しい「胚の様な」血管(本願明細書においては新血管形成と称する)は、構造及び機能に関しては正常な血管系とは異なるように思われる (Hanahan and Weinberg (2000) Cell 100(1):57−70)。多くのインビボおよびインビトロ研究において、血管新生疾患を治療するために胚型および腫瘍が関連した内皮型の血管形成を選択的に阻害する新規抗血管新生化合物を開発可能な様々な血管新生のモデル系を使用した場合、正常な血管系と疾患が関与した血管系とは生物学的に異なることが示されているこのような治療の機会の観点から見ると、具体的に腫瘍及び他の血管新生疾患に関連した内皮細胞の成長を阻害する可能な標的に対する熱心な探索が行われている。そのような標的を同定する試みにおいて、腫瘍間質の細胞表面抗原を同定、および新生血管内皮細胞において発現されるタンパク質またはRNAを単離する戦略が設計されている (Rettig et al.(1992) Proc Natl.Acad Sci USA 89(22):10832−6; St. Croix et al.(2000) Science 289:1197−1202)。このような戦略によって、エンドシアリン(または腫瘍内皮マーカー1、tumor endothelial marker1:TEM1)と呼ばれる特に血管新生内皮細胞において発現される細胞表面タンパク質が特定されている。悪性組織の免疫組織化学的研究に抗体を用いることによって、悪性組織内の多くの血管新生内皮細胞、腫瘍間質細胞、及び推定内皮白血球中においてエンドシアリンの良好な発現を見出した[(Brady et al.(2004) ヒトエンドシアリン(腫瘍内皮マーカー1)は、非常に悪性であり且つ侵襲性の脳腫瘍において多量に発現される(Human endosialin (tumor endothelial marker 1) is abundantly expressed in highly malignant and invasive brain tumors.)J Neuropathol Exp Neurol.63:1274−83; Rettig et al.(1992); Conejo−Garcia et.al. (2005) 血管白血球は腫瘍脈管系に寄与する(Vascular leukocytes contribute to tumor vascularization).Blood 105:679−81)] 、一方、これらに限らないが、HUVEC (Human Umbilical Vein Endothelial Cells) or HMVEC−(Neonatal Dermal Microvascular Endothelial Cells)などの胚様内皮培養物から誘導される細胞株における発現は限られているが(Cambrex社からオンラインで入手可能)。エンドシアリンに結合可能な抗体の分析によって、内皮細胞培養物中、この抗原を発現する一連の細胞、および正常な患者組織における樹状様細胞のサブセットが特定された近年、腫瘍の血管中で内皮細胞を形成可能な細胞が白血球に含まれていることが示され、治療のためにこのようなエンドシアリン陽性細胞型を標的とした抗体の使用が支持されている(Peters et al.(2005)骨髄由来内皮細胞のヒト腫瘍血管系への寄与(Contribution of bone marrow−derived endothelial cells to human tumor vasculature.)Nat. Med.11:261−262)。
【0004】
血管新生は多くの病状に関連している。癌では、血管新生が腫瘍に血液を供給する上で重要であると考えられている。網膜症、および黄斑変性症などの非腫瘍疾患では、無制限な血管新生により失明を招く(Wilkinson−Berka(2004)Curr Pharm Des.10(27):3331−48;Das and McGuire (2003) Prog Retin Eye Res.22(6):721−48)。さらに、一部の報告によると、炎症疾患における血管新生の役割が報告されている(Paleolog and Miotla(1998)Angiogenesis2(4):295−307)。これらの病状に関連した胚性内皮細胞および前駆細胞をより良く定義する方法により、これらの疾患を治療する新規薬物の開発を導くことになるであろう。または血管新生疾患(加齢による黄班変性症、網膜症、炎症など)に関連した内皮細胞を特に標的とすることが可能な抗体の開発によって、これらの疾患の治療能力が提示される。
【0005】
有効な抗血管新生およびプロ血管新生治療における困難な問題は、薬学的化合物を介して特にこれらの細胞を標的として死滅或いは抑制することが不可能なことである。An より特異的に癌または血管新生疾患を治療するアプローチは、癌、新内皮細胞、または前駆体において発現するが正常細胞では発現しないか低レベルで発現する特異的抗原を標的とすることが可能な抗体を使用することである。前記抗原の生物活性を阻害し、補体依存性細胞傷害作用(CDC)および/または抗体依存性細胞傷害作用(ADCC)による免疫エフェクター機能を誘発することにより、または抗原提示細胞に送達されたときに前記標的細胞を特異的に死滅させる免疫複合体または放射性複合体(radio−conjugate)を送達することにより、抗原提示細胞を死滅させる抗体を利用にこれらの抗体を用いることが可能となる。例えば炎症、加齢黄班変性症、および網膜症などの腫瘍形成および血管新生関連疾患に関与した抗原提示細胞に特異的に結合して効率的に死滅させることが可能な抗体を見つけることは、多くの生物学的化合物に対して困難であることが証明されている(Dhanabal (2005)、癌治療ダイアグラムとしての抗抗原治療(Anti−angiogenic therapy as a cancer treatment paradigm)、Curr Med Chem Anti−Canc Agents 5:115−30)。このことは、免疫エフェクター機能の欠如、または免疫毒素を運ぶ抗体が効率的に内部移行しないため、確実に死滅させることができないことが部分的にその原因となっている。
【0006】
1992年、Rettigらは、種々の癌の血管において抗原を認識するモノクローナル抗体について記載している。 (Rettig et al.(1992) Proc Natl.Acad Sci USA 89(22):10832−6)。これらのうちの1つに、このFB5は神経芽細胞腫細胞株LA1−5sの表面上で1〜100kDaタンパク質を認識するFB5が指定されている。FB5は、エンドシアリンに結合するマウスIgG1抗体であり、様々な異なる癌種と関連する内皮細胞を認識する。一部の評価によると、エンドセリンは、5つの球状細胞外ドメイン(C−タイプレクチンドメイン、Sushi/ccp/scrパターンと3つのEGF反復とに対する類似性を有する1つのドメインを含む)から構成されるC−タイプレクチン様タンパク質として分類される。このタンパク質はまた、ムチン様領域、膜貫通セグメント、短い細胞質尾部を含む。前記タンパク質は糖タンパク質のようでもある。炭水化物分析によると、エンドシアリン・コアタンパク質には、シアロムチン様分子に対する類似性を有するシアリル化されたO−結合オリゴ糖が多数含まれていることを示している。その後の研究によると、マウスFB5の相補性決定領域(complementarity determining regions:CDR)をヒトIgG1骨格に連結させて、悪性組織およびHMVEC培養物中の細胞サブセットで血管に結合することが可能なヒト化抗体を作製した。
【0007】
エンドシアリンは癌および血管新生疾患を特異的に標的とした機会を提供するものである本願明細書において、選択的にエンドシアリン陽性細胞(例えば毒素複合体)内に内在化し、さらに免疫エフェクター活性を介して細胞毒性を誘発するインアウト(インアウト)抗体が提供される。本発明の抗体は、癌治療、これらに限らないが例えば黄班変性症(加齢黄班変性症)、網膜症、および炎症など血管新生に関連した疾患、およびエンドシアリンが関連する他の疾患などに有効な抗体を提供するものである。
【発明の開示】
【課題を解決するための手段】
【0008】
本発明は、選択的に、強力な免疫エフェクター機能を誘発し、さらにエンドセリン陽性細胞に内部移行するエンドシアリン特異的抗体が提供され、これを本明細書ではインアウト坑エンドシアリン抗体と称する。本明細書に用いられる「インアウト抗体」(「インアウト Abs」)は、選択的に、免疫エフェクター活性を誘発し、標的抗原に結合して抗原提示細胞に内部移行することが可能な抗体を指す。特定の理論に縛られることなく、インアウト抗体は、抗原−抗体提示細胞に補充される免疫エフェクター細胞または生化学物質によって結合されない限り、坑原提示細胞の細胞表面に結合し、一定期間後内部移行すると考えられている。ADCCまたはCDCなどの免疫エフェクター作用を誘発し、内部移行する抗体は以前に報告されているが(Wolff et al.,Monoclonal antibody homodimers: enhanced antitumor activity in nude mice.Cancer Res.1993 Jun 1;53:2560−5)、任意の抗原またはエピトープに対してインアウト抗体を発展させることができるかは明らかではない(Kusano et al.、 Immunocytochemical study on internalization of anti−carbohydrate monoclonal antibodies.Anticancer Res.,1993 Nov−Dec;13(6A):2207−12)。エンドシアリンを標的とするインアウト抗体についてはこれまでに報告されていない。エンドシアリン特異的抗体は以前に報告されているが、そのような抗体がエンドシアリン提示細胞上で内在化して免疫エフェクター機能を誘発することは知られていない(Rettig et al.1992;Brady et al.2004)。細胞表面の抗原を標的にすることができる抗体は、前記細胞表面の抗原に結合したときに、必ずしも免疫エフェクター機能を誘発するものではない(Niwa et al.,Defucosylated chimeric anti−CC chemokine receptor 4 IgG1 with enhanced antibody−dependent cellular cytotoxicity shows potent therapeutic activity to T−cell leukemia and lymphoma.Cancer Res.64:2127−33,2004;Kikuchi et al.,Apoptosis inducing bivalent single−chain antibody fragments against CD47 showed antitumor potency for multiple myeloma.Leuk Res.29:445−50, 2005; Scott et al.Immunological effects of chimeric anti−GD3 monoclonal antibody KM871 in patients with metastatic melanoma.Cancer Immun.Feb 22;5:3, 2005)。本明細書において、前記細胞表面の抗原エンドシアリンに結合し、選択的に(例えばADCCまたはCDCなどの)免疫エフェクター活性を誘発し、抗原陽性細胞に内部移行する抗体が提供される。これらの抗体およびその誘導体は、癌および血管新生疾患の治療に有用である。
【0009】
本発明において、エンドシアリンに特異的に結合するインアウト(in−out)抗体が提供される。一部の実施形態において、前記抗体はFB5よりも親和性および/または結合活性が高い抗原に結合する。一部の実施形態において、本発明のインアウト抗体は、例えば立体構造エピトープなど、FB5によって結合するエピトープと同じエピトープに結合する。一部の実施形態において、本発明のインアウト抗体はFB5によって結合するエピトープとは異なるエピトープに結合する
本発明の抗体は、ヒト−マウスキメラ抗体を含む(これに限定されるものではないが)キメラ抗体であっても良い。本発明の抗体はヒト化されていても良い。本発明の抗体は完全にヒト化されていても良い。本発明において、本発明の抗体を発現したハイブリドーマ細胞、本発明の抗体をコードしたポリヌクレオチド、前記本発明の抗体をコードしたポリヌクレオチドを有するベクター、およびトランスフェクトーマと呼ばれる、本発明のポリヌクレオチドを有する発現細胞もまた提供される。
【0010】
本発明はまた、エンドシアリンに特異的に結合するインアウト抗体を産生する方法も提供する。一部の方法には、本発明の抗体を発現したトランスフェクトーマまたはハイブリドーマを培養する工程が含まれる。本発明の抗体産生細胞は、細菌、酵母、昆虫細胞、および動物細胞であり、好ましくは哺乳類細胞である。
【0011】
本発明はさらに、エンドシアリン陽性細胞の成長を阻害する方法を提供する。>一部の実施形態において、そのような方法は、エンドシアリン陽性細胞を有する患者に、エンドシアリンに特異的に結合するインアウト抗体を含む組成物を投与する工程を有する。前記方法は、例えば、炎症性疾患、他の血管新生疾患、加齢黄班変性症および網膜症を含む眼疾患、これらに限定されないが例えば卵巣癌、乳癌、結腸直腸癌、腎臓癌、および肺癌など、様々な異形成疾患の治療に用いることが可能である。好ましい実施形態において、前記患者はヒトである。一部の実施形態において、前記抗体は、これらに限定されるものではないが、放射性核種、毒素、および細胞傷害性薬および細胞増殖抑制物質など、1若しくはそれ以上の化学療法剤と結合する。他の実施形態において、前記抗体は、1若しくはそれ以上の化学療法剤と併用される。インアウト抗体は、複合型または非複合型抗体として単独で、または前記複合型または非複合型形態物または別の治療薬と併用して投与することが可能である。
【0012】
エンドシアリンに特異的に結合するインアウト抗体の開発については今まで報告されていない。本明細書において、我々は、エンドシアリン陽性で内在化し、内在化しない場合には免疫エフェクター活性を介して細胞毒性を誘発するインアウト抗体の開発について説明する。
【0013】
本発明の他の特徴および利点は、以下の詳細な説明および実施例から明らかとなる。
【図面の簡単な説明】
【0014】
【図1】図1は、インアウト抗体ES−1によるエンドシアリン特異的結合を免疫組織化学的に示した図である。抗体はウエスタンブロット、精製された抗原、未精製抗原、膜画分、又は細胞全体を使用したELISA、および免疫染色によって検出可能である。エンドシアリン抗原に特異的に結合する抗体を特定する免疫染色を示した。免疫染色は、精製または半精製した膜調製物、またはエンドシアリンを発現する全細胞を用いて形式を整える。ここでは全細胞を示す。上部パネルは位相差顕微鏡の元での細胞の全体の分析を示したものである。下部パネルは、ES−1又はアイソタイプ抗体で染色した細胞の蛍光標識二次抗体を用いた細胞の同じ部分を示したものである。
【図2A】図2は、ES−1の抗体のADCC免疫エフェクター活性を誘発する能力を示した図である。ES−1は強いADCC活性を誘発する。図2Aは、ヌル黒色腫細胞が陰性であるのに対して、HMVEC細胞においてはES−1抗体がエンドシアリンに結合する能力を提示した非変性ウエスタンブロットを示した図である。
【図2B】図2は、ES−1の抗体のADCC免疫エフェクター活性を誘発する能力を示した図である。ES−1は強いADCC活性を誘発する。図2Bの下部パネルは、ヒト抹消血リンパ球(peripheral blood lymphocytes:PBLs)単独(0レーン)、又は増量させたES−1と共に(右の棒グラフ)又は対照Igと共に(正常IgGは左の棒グラフ)インキュベートした標的HMVEC細胞(標的細胞と称す)を示した。細胞溶解時に発生する乳酸脱水素酵素(lactate dehydrogenase:LDH)の放出をモニターすることにより、細胞培養物の死滅について分析した。示したように、ES−1はエンドセリン発現細胞においてADCC活性を有していた。図2Bの上部パネルは、エンドシアリンに対して発現しないヒト黒色腫細胞をヒトPBLs単独(0レーン)、又はES−1(右の棒グラフ)又は対照Ig(正常IgGは左の棒グラフ)と共にインキュベートした結果を示した図である。細胞溶解時に発生する乳酸脱水素酵素(lactate dehydrogenase:LDH)の放出をモニターすることにより、細胞培養物の死滅について分析した。
【図3】図3は、エンドシアリン提示細胞においてES−1の内在化能力を示した図である。ES−1はエンドシアリン発現細胞において内在化した。図3は、アイソタイプ対照抗体は複合毒素形態中(四角)で細胞を死滅させないのに対して、サポリンに結合したES−1(ダイアモンド)が細胞を死滅させる能力を有することをES−1抗体単独(図示せず)と比較して、示した図である。対照として、エンドシアリンを発現しない細胞を用いて示し、ES−1は複合又は非複合形態(図示せず)において毒性を有さなかった。These これらのデータはES−1がエンドシアリン提示細胞で内在化することを支持するものである。
【発明を実施するための最良の形態】
【0015】
本明細書において引用したGenBankデータベースの配列の受入番号を含む、参照研究、特許、特許出願書類、および科学文献は、当業者の知識を確立するものであり、各資料が具体的かつ個別に参照によって組み込まれるように、これらの資料は、この参照によってその全体が本明細書に完全に組み込まれるものである。本明細書に引用された参照と本明細書の特定の教義の間に不一致があった場合、本明細書の特定の教義を優先して解決されるものとする。同様に、当業者に理解される単語または表現の定義と、本明細書で具体的に教示されている単語または表現の定義との間に不一致があった場合、本明細書の単語または表現を優先して解決されるものとする。
【0016】
当業者に周知の組み換えDNA技術に関する一般的原理を示した標準的な参照研究には、Ausubel et al.CURRENT PROTOCOLS IN MOLECULAR BIOLOGY,John Wiley & Sons,New York(1998);Sambrook et al.MOLECULAR CLONING: A LABORATORY MANUAL,2D ED.,Cold Spring Harbor Laboratory Press,Plainview,New York(1989);Kaufman et al.,Eds.,HANDBOOK OF MOLECULAR AND CELLULAR METHODS IN BIOLOGY AND MEDICINE, CRC Press,Boca Raton(1995);McPherson,Ed.,DIRECTED MUTAGENESIS: A PRACTICAL APPROACH,IRL Press,Oxford(1991)が含まれる。
【0017】
本発明は特定の方法、試薬、化合物、組成物、または生物系に制限されることはなく、当然ながら変更されることは理解されるものとする。また、本明細書で使用される専門用語は、特定の実施形態のみを説明する目的で使用されるものであり、限定する意図はないこともまた理解される。本明細書および添付の請求項に用いられる、単数形の「a」、「an」、および「the」は、その内容が明らかに別のことを示していない限り、複数の言及を含む。従って、例えば「a cell(細胞)」の言及は2若しくはそれ以上の細胞の組み合わせなどを含む。
【0018】
本明細書に列挙した各範囲は、本明細書に含まれる特定の数字だけでなく、範囲内のすべての組み合わせおよびサブコンビネーションを含む。
【0019】
本明細書に用いるとおり、「約」という用語は、量、一時的な期間など、測定可能な値を指す場合、特定の値からの±20%または±10%、より好ましくは±5%、さらに好ましくは±1%、まださらに好ましくは±0.1%のばらつきを含むことを意味し、そのようなばらつきは開示された方法を実施する上で適応する。
【0020】
本発明は、エンドシアリン、好ましくは哺乳類エンドシアリン、より好ましくはヒトエンドシアリン(配列ID番号1(ヌクレオチド)および2(アミノ酸))に特異的に結合するインアウト抗体を用いてエンドシアリン陽性細胞の成長を阻害する方法を提供するものである。本発明の方法は、エンドシアリン陽性細胞の成長を調節し、ヒトを含む哺乳類における癌、炎症、および/または血管新生疾患の進行を治療する。前述の阻害された細胞とは、正常ヒト組織に関して増強されたエンドシアリンの発現を有し、さらに血管新生において関与するエンドシアリンを発現する白血球を有する全細胞を含む。
【0021】
特定の操作理論にしばられることなく、癌組織において細胞においてエンドシアリンのの発現が増強されると、前記腫瘍の内皮細胞表面における膜結合型の細胞表面発現が亢進する。従って、癌組織では、正常組織と比較して、エンドシアリン発現血管および間質細胞の発現が増強している。このため、エンドシアリン陽性細胞は、癌の抗体治療における理想的な標的となっている。同様に、血管新生疾患において増強されたエンドシアリン発現は、前記細胞表面におけるタンパク質の膜結合型の細胞表面発現が増強されると考えられている。従って、エンドシアリン陽性細胞は、血管新生疾患における抗体治療においてもまた理想的な標的となっている。
【0022】
本明細書に用いられる「エピトープ」という用語は、抗体が特異的に結合する抗原の一部を指す。
【0023】
本明細書に用いられる「立体構造エピトープ」という用語は、連続したアミノ酸以外の抗原のアミノ酸同士の空間関係によって形成される不連続エピトープを指す。
【0024】
本明細書に用いられる「免疫エフェクター活性」、「免疫エフェクター作用」、および「免疫エフェクター機能」という用語は、抗体依存性細胞傷害作用(antibody−dependent cellular cytotoxicity:ADCC)または補体依存性細胞傷害作用(complement−dependent cytotoxicity:CDC)による抗体の殺細胞力を指す。
【0025】
本明細書に用いられる「インアウト抗体」という用語は、抗原提示細胞に内部移行し、内部移行しない場合は免疫エフェクター活性を誘発することができる抗体を指す。
【0026】
本明細書に用いられる「選択的」という表現は、内部移行または免疫エフェクター活性を誘発する抗体の能力を指す場合、前記抗体が内部移行能力と免疫エフェクター活性誘発能力の両方を有するが、同時に両方を行うことはできないことを意味する。
【0027】
本明細書に用いられる「インビトロでの異型細胞の成長抑制」という用語は、例えば異型細胞または新生血管細胞などにおいて、細胞数が約5%、好ましくは約10%、より好ましくは約20%、より好ましくは約30%、より好ましくは約40%、より好ましくは約50%、より好ましくは約60%、より好ましくは約70%、より好ましくは約80%、より好ましくは約90%、最も好ましくは約100%減少することを意味する。インビトロでの腫瘍細胞の成長抑制は、当該分野で既知のアッセイにより測定される。
【0028】
本明細書において用いられる「インビボでの異型細胞の成長抑制」という用語は、例えば異型細胞または新生血管細胞において細胞数が約5%、好ましくは約10%、より好ましくは約20%、より好ましくは約30%、より好ましくは約40%、より好ましくは約50%、より好ましくは約60%、より好ましくは約70%、より好ましくは約80%、より好ましくは約90%、最も好ましくは約100%減少することを意味する。インビボでの細胞成長の調節は、当該分野で既知のアッセイにより測定することができる。
【0029】
本明細書に用いられる「異型細胞」は異常な成長を示す細胞を指す。異常な成長特性の例には、これに限定されるものではないが、軟寒天中での増殖、接触阻害の欠如、無血清状態で細胞周期停止の拒否、および免疫力低下マウスに注入したときにの腫瘍形成などが含まれる。異型細胞には、これに限定されるものではないが、腫瘍、過形成などが含まれる。
【0030】
本願明細書で用いられる「新生血管細胞」の用語は、腫瘍間質、腫瘍血管、炎症血管、および眼疾患を含む血管新生疾患の血管に関連した細胞を称する。
「予防する」という用語は、微生物が感染するか、異形成または新生血管疾患などの異常な状態を発生させる可能性を低下させることを指す。
【0031】
「治療する」という用語は、治療効果を有し、生物体における異型性または血管新生疾患などの異常状態を少なくとも部分的に軽減または抑止することを指す。治療とは、例えば抑制された腫瘍成長の維持、寛解の誘発、改善された視界、失明の遅延化、および視覚障害への遅延化を含む。
【0032】
「治療的有効量」は、疾患、状態、または障害を治療するために対象者に投与する場合、その疾患に対する治療効果をもたらすのに十分な量を指す。「有効量」は、所望の作用を生じるために必要な量を指す。「治療的有効量」は、疾患、状態、または障害を治療するために対象に投与する場合、その疾患に対する治療効果をもたらすのに十分な量を指す。治療効果は、前記異常な状態の1若しくはそれ以上の症状をある程度軽減する。前記異常な状態の治療に関して、治療効果は、(a)細胞の増殖、成長、および/または分化の増加または減少、(b)インビボにおける腫瘍細胞の成長の阻害(つまり遅延化または停止)、(c)細胞死の促進、(d)変性の抑制、(e)前記異常な状態に関連した1若しくはそれ以上の症状のある程度の軽減、(f)細胞集団の機能強化、(g)マトリックスまたはリガンドへの細胞結合の阻害、(h)細胞遊走の変化、(i)治療に対する細胞反応の変化の1若しくはそれ以上を指す可能性がある。本明細書に説明した抗体およびその誘導体は、単独、または本発明の組成物の複合体または更なる組成物と併用して前記治療効果を達成する。
【0033】
本明細書において用いられる「癌または腫瘍性疾患の進行の阻害」という用語は、未治療癌細胞が末期疾患に向かうのを調節することと関連し、腫瘍性疾患の末期癌へ向かうのを調節して遅らせる治療活動を指す。
【0034】
本明細書において用いられる「血管新生疾患の阻害」という用語は、新生血管組織内の疾患を遅延または逆転させる治療活動を指す。
【0035】
本明細書において用いられる「新生血管組織」という用語は、炎症、眼疾患、および癌によって侵襲された組織を含む内皮細胞および/または内皮細胞前駆体を標的とした治療に応答する疾患組織を指す。
【0036】
本明細書に用いられる「腫瘍性疾患」という用語は、癌などの組織細胞の異常な増殖によって特徴付けられる状態を指す。
【0037】
本明細書に用いられる「生体分子」という用語は、複合体を形成し、同時投与され、本発明の抗体投与前後に投与され、またはそれ以外で本発明の抗体と関連して使用することができるすべての分子を指す。生体分子には、これらに限定されるものではないが酵素、タンパク質、ペプチド、アミノ酸、核酸、脂質、炭水化物、およびフラグメント、相同体、類似体、または誘導体、およびその組み合わせを含む。生体分子の例には、これらに限定されるものではないが、インターロイキン−2、インターフェロンα、インターフェロンβ、インターフェロンγ、リツキサン、ゼバリン、ハーセプチン、エルビタックス、およびアバスチンを含む。前記生体分子は、天然型、組み換え型、または合成とすることができ、例えばグリコシル化、アセチル化、リン酸化、ミリスチル化などにより、その天然型から修飾することもできる。本明細書に用いられる生体分子という用語は、天然型の分子に限定されず、生物由来ではない合成分子を含む。
【0038】
本明細書に用いられる「細胞傷害性」または「細胞増殖抑制」物質という用語は、細胞の生存率または増殖する可能性を低下させる物質を指す。細胞傷害性薬または細胞増殖抑制物質は、例えば、これに限定されるものではないがDNAの障害を誘導、細胞周期停止を誘導、DNA合成を阻害、転写を阻害、翻訳またはタンパク質合成を阻害、細胞分裂を阻害、またはアポトーシスを誘導することにより、細胞の生存可能性または増殖を抑制する様々な方法で作用することができる。本明細書に用いられる「化学治療物質」という用語は、腫瘍細胞を選択的に死滅、その成長を抑制、またはその転移を抑制するか、急速に増殖する細胞の細胞周期を混乱させる細胞傷害性物質、細胞増殖抑制物質、および抗腫瘍性物質を指す。化学治療物質の具体的な例には、これらに限定されるものではないが、放射性核種、ヤマゴボウ抗ウイルス性タンパク質、アブリン、リシン、およびそのA鎖、アルトレタミン、アクチノマイシンD、プリカマイシン、プロマイシン、グラミシジンD、ドキソルビシン、コルヒチン、サイトカラシンB、シクロホスファミド、エメチン、マイタンシン、アムサクリン、シスプラチン、エトポシド、エトポシドオルトキノン、テニポシド、ダウノルビシン、ゲムシタビン、ドキソルビシン、ミトキサントロン(mitoxantraone)、ビサントレン、ブレオマイシン、メトトレキセート、ビンデシン、アドリアマイシン、ビンクリスチン、ビンブラスチン、BCNU、タキソール、タルセバ、アバスチン、マイトマイシン、修飾シュードモナスエンテロトキシンA、カリチェアミシン、5−フルオロウラシル、シクロホスファミド、およびTNF−αおよびTNF−βなどの特定サイトカインが含まれる。
【0039】
「保存的修飾変異体」はアミノ酸および核酸配列の両方に当てはまる。特定の核酸配列に関して、保存的修飾変異体とは、同一或いは基本的に同一であるアミノ酸配列をコードする核酸を指し、または前記核酸がアミノ酸配列をコードしない場合は、基本的に同一の配列を指す。遺伝暗号の縮重のため、多数の機能的に同一な核酸が特定タンパク質をコードする。例えば、コドンGCA、GCC、GCG、およびGCUはすべてアミノ酸のアラニンをコードする。従って、アラニンがコドンで特定されるすべての位置で、コードされるポリペプチドを変化させることなく、前記コドンを前述の対応するコドンのいずれかと変更することができる。そのような核酸変異は「サイレント変異」であり、保存的修飾変異体の一種である。ポリヌクレオチドをコードする本明細書のすべての核酸配列は、前記核酸の考えられるすべてのサイレント変異も描写する。当業者であれば、核酸の各コドン(通常メチオニンの唯一のコドンであるAUGと、通常トリプトファンの唯一のコドンであるTGGを除く)を修飾し、機能的に同一な分子を生じることができることが理解される。従って、ポリヌクレオチドをコードする核酸の各サイレント変異は、発現生成物について描写された各配列で絶対的であるが、実際のプローブ配列については絶対的ではない。
【0040】
例えば、細胞、核酸、タンパク質、またはベクターに関連して用いられる場合、「組み換え型」は、前記細胞、核酸、タンパク質、またはベクターが異種核酸またはタンパク質の導入、または天然型核酸またはタンパク質の変更により修飾されたか、前記細胞がそのように修飾された細胞に由来することを示す。従って、例えば、組み換え型細胞は前記細胞の天然型(非組み換え型)には見られない遺伝子を発現しているか、そうでなければ異常に発現されるか、発現が少ないか、全く発現されていない天然型遺伝子を発現している。
【0041】
「核酸」または「ポリヌクレオチド配列」という用語は、5'から3'末端に向かって読み取ったデオキシリボヌクレオチドまたはリボヌクレオチド塩基の一本鎖または二本鎖重合体を指す。核酸には、ポリメラーゼにより読み取りを補正することができ、例えば保存的修飾変異体を含む核酸でコードされるポリペプチドの発現を変化させない、修飾ヌクレオチドも含むことができる。
【0042】
「ポリペプチド」、「ペプチド」、および「タンパク質」は本明細書で同義的に使用され、アミノ酸残基の重合体を指す。前記用語は、1若しくはそれ以上のアミノ酸残基が対応する天然型アミノ酸の人工化学的ミメティックであるアミノ酸重合体、および天然型アミノ酸重合体および非天然型アミノ酸重合体にも当てはまる。本発明の抗体を含む本発明のポリペプチドには、保存的修飾変異体を含む。当業者であれば、コード化配列中の単一アミノ酸または少ない割合のアミノ酸を変更、付加、または欠失させる核酸、ペプチド、ポリペプチド、またはタンパク質配列の置換、欠失、または付加は「保存的修飾変異体」であり、前記変化により、アミノ酸が化学的に類似のアミノ酸と置換されることが認識される。機能的に類似したアミノ酸を提供する保存的置換表は当該分野で周知である。そのような保存的修飾変異体は、本発明の多型変異体、種間相同体、および対立遺伝子に追加され、これらを除外しない。以下の8群はそれぞれ互いに保存的置換のあるアミノ酸を含み、それは1)アラニン(A)、グリシン(G);2)アスパラギン酸(D)、グルタミン酸(E);3)アスパラギン(N)、グルタミン(Q);4)アルギニン(R)、リジン(K);5)イソロイシン(I)、ロイシン(L)、メチオニン(M)、バリン(V);6)フェニルアラニン(F)、チロシン(Y)、トリプトファン(W);7)セリン(S)、トレオニン(T);および8)システイン(C)、メチオニン(M)である(33)。「保存的置換」という用語は、非置換親アミノ酸に代わり置換アミノ酸を使用することも含むが、ただしそのようなポリペプチドは必須の結合活性も示す。
【0043】
「アミノ酸」は、天然型および合成アミノ酸、および前記天然型アミノ酸と同様に機能するアミノ酸類似体およびアミノ酸ミメティックを指す。天然型アミノ酸は、遺伝暗号でコードされたアミノ酸、および後で修飾されたアミノ酸、例えば、ヒドロキシプロリン、γ−カルボキシグルタメート、およびO−ホスホセリンである。「アミノ酸類似体」は、天然型アミノ酸と同じ基本的化学構造、つまり、水素、カルボキシル基、アミノ基、およびR群、例えばホモセリン、ノルロイシン、メチオニンスルホキシド、メチオニンメチルスルホニウムに結合するα炭素を有する化合物を指す。そのような類似体は、修飾されたR群(例えばノルロイシン)または修飾されたペプチド骨格を有するが、天然型アミノ酸と同じ基本的化学構造を保持している。「アミノ酸ミメティック」は、アミノ酸の一般的化学構造とは異なる構造を有するが、天然型アミノ酸と同様に機能する化学化合物を指す。
【0044】
本明細書において、アミノ酸は一般的に知られる3文字記号またはIUPAC−IUB Biochemical Nomenclature Commissionが推奨する1文字記号で称することができる(以下の表1を参照)。同様に、ヌクレオチドは一般的に受け入れられている1文字コードによって称される。
【0045】
【表1】

【0046】
本明細書において、すべてのアミノ酸配列は、左から右の方向が従来のアミノ末端からカルボキシ末端の方向である式で表されていることに留意すべきである。
【0047】
本明細書に用いられる「インビトロ」または「生体外(ex vivo)」という用語は、人工環境、およびこれらに限定されるものではないが、例えば試験管および細胞培養などの人工的な環境で発生する工程または反応を指す。前記「インビボ」という用語は、自然環境(例えば、動物または細胞)および自然環境で発生する工程または反応を指す。
【0048】
「薬学的に許容される」、「生理学的に忍容性の」、およびその文法的変形形態は、組成、担体、希釈剤、試薬を指す場合は同義的に用いられ、前記組成の投与を阻害する程度の好ましくない生理学的効果を発生させずに、前記物質を人に投与できることを示す。
【0049】
「薬学的に許容される担体」という用語は、適切な医学的判断の範囲内で、妥当な利益/リスク比と釣り合い、過剰な毒性、刺激、アレルギー反応、または他の合併症を生じずに、ヒトおよび動物の組織と接触させて使用するのに適した、試薬、添加物、細胞、成分、物質、組成物、および/または投与形態を指す。本明細書でさらに詳細に説明するとおり、本発明での使用に適した薬学的に許容される担体には、気体、液体、および半固体および固体物質が含まれる。
【0050】
特別な記載がない限り、「対象」または「患者」は同義的に用いられ、ヒト患者およびヒト以外の霊長類などの哺乳類、ウサギ、イヌ、ネコ、ラット、マウス、およびその他の動物などの実験動物を指す。従って、本明細書に用いられる「対象」または「患者」は、本発明の組成物を投与することが可能なすべての哺乳類患者または被験者を意味する。本発明の一部の実施形態において、前記患者は感染症または炎症性疾患に罹患する。本発明の一部の実施形態において、前記患者は癌と診断される。本発明の典型的な実施形態において、本発明に沿った治療の候補患者を特定するため、一般に認められたスクリーニング方法を採用し、被験者の既存の疾患または状態の状況、または標的となるか疑わしい疾患または状態と関連したリスクファクターを決定する。これらのスクリーニング方法には、例えば、被験者が感染症、炎症性疾患、または癌に罹患しているか否かを決定する検査を含む。このようなルーティンな方法により、臨床医は治療が必要な被験者を選択することができる。
【0051】
本明細書に用いられる「治療用化合物」は癌などの疾患または状態の予防または治療に有用な化合物を指す。
【0052】
本明細書に用いられる「併用投与」、「同時投与」、または「併用」には、同時にまたは併用して、一緒に、または互いに前後して活性薬物(例えば、MAbs、化学治療物質、生体分子)を投与することを含む。前記複数の薬物は、すべての薬物が作用部位で十分有効濃度を達成することができる方法で投与される限り、同じ経路または異なる経路で、同時にまたは順次投与することができる。当業者であれば、特定の薬物と本発明の組成を投与する適切なタイミング、順序、および用量を決定することは困難なことではない。
【0053】
「免疫グロブリン」または「抗体」は広義に用いられ、抗体分子と様々な抗体由来分子の両方を指し、前記免疫系の主要成分である、高等哺乳動物で生成する一連の糖タンパク質の一員を含む。前記「抗体」という用語は広義の意味で用いられ、望みの生物活性を示す限り、具体的にはモノクローナル抗体、多エピトープ特異性を持つ抗体組成、二重特異性抗体、ダイアボディ(diabodies)、および単鎖分子、また抗体フラグメント(例えば、Fab、F(ab')2、およびFv)を網羅する。免疫グロブリン分子には抗原結合ドメインを含み、それぞれが軽鎖と、重鎖の末端タンパク質、および補体との結合など様々な機能に必要なFc領域を含む。免疫グロブリンには5種類のクラスがあり、前記Fc領域の重鎖の主要構造が前記免疫グロブリンのクラスを決める。具体的には、α、δ、ε、γ、およびμ鎖がそれぞれIgA、IgD、IgE、IgG、およびIgMに対応する。本明細書に用いるとおり、「免疫グロブリン」または「抗体」にはα、δ、ε、γ、およびμのすべてのサブクラスを含み、4鎖の免疫グロブリン構造の天然(例えば、IgAおよびIgM)または合成多量体も指す。抗体は、非共有結合的に、特異的に、および可逆的に抗原と結合する。本明細書に用いるとおり、前記「モノクローナル抗体」という用語は、かなり均質な抗体集団から得られる抗体を指し、つまり、少量で存在することができ、自然に発生した可能性のある変異を除き、前記集団を有する個々の抗体は同一である。例えば、モノクローナル抗体は抗体産生細胞の単一クローンにより作製することができる。ポリクローナル抗体と異なり、モノクローナル抗体は単一特異的である(例えば、単一抗原の単一エピトープに対して特異的である)。前記「モノクローナル」という修飾語は、かなり均質な抗体集団から得られる抗体の特徴を示し、いかなる特定の方法でも前記抗体の作製が必要であるとは解釈されない。例えば、本発明に従って使用される前記モノクローナル抗体は、Kohler et al.,Nature,256:495,1975で最初に報告されたハイブリドーマ法により作製することができるか、組み換えDNA法により作製することができる。前記「モノクローナル抗体」は、例えば、Marks et al.,J.Mol.Biol.,222:581−597,1991に報告されている技術を利用し、ファージ抗体ライブラリから単離することもできる。
抗体由来分子は、抗原結合特異性を保持し、例えば、少なくとも1つの可変領域(重鎖または軽鎖可変領域)を有する完全な抗体の一部を有する。抗体由来分子には、例えば、Fabフラグメント、Fab'フラグメント、F(ab')2フラグメント、Fdフラグメント、F(v)フラグメント、Fabcフラグメント、Fdフラグメント、Fabcフラグメント、Sc抗体(単鎖抗体)、ダイアボディ、個々の抗体軽鎖、個々の抗体重鎖、抗体鎖と他の分子とのキメラ融合、重鎖単量体または二量体、軽鎖単量体または二量体、重鎖1つと軽鎖1つから成る二量体などの分子を含む。すべてのクラスの免疫グロブリン(例えば、IgA、IgD、IgE、IgG、およびIgM)とそのサブクラスが含まれる。
【0054】
抗体は毒性または非毒性部分で標識するか、これと結合することができる。毒性部分には、例えば、細菌毒素、ウイルス毒素、放射性同位元素などを含む。抗体は、前記抗体の検出を助けるため、生物学的アッセイ(例えば、放射標識、蛍光標識)で使用するために標識することができる。抗体は、診断または治療の目的で、例えば、放射免疫治療(Garmestani et al.,Nucl.Med.Biol.,28:409,2001)、画像法および放射免疫誘導手術などの望みの適用部位に直接放射線を照射する放射性同位元素、または特定の抗体/抗原複合体のインビボでの画像化または検出を可能とする標識により、標識/結合することもできる。抗体は、免疫毒素を提供する毒素と結合することもできる(Kreitman,R.J.Adv.Drug Del.Rev.,31:53,1998を参照)。
【0055】
抗体について、前記「免疫学的に特異的な」という用語は、対象タンパク質の1若しくはそれ以上のエピトープに結合する抗体を指すが、抗原性生体分子の混合集団を含むサンプル中の他の分子を十分認識し、結合することはない。
【0056】
「キメラ」または「キメラ化」抗体(免疫グロブリン)は、望みの生物活性を示す限り、前記重鎖および/または軽鎖の一部が特定の種に由来するか、特定の抗体クラスまたはサブクラスに属する抗体の対応する配列と同一または相同的であるが、前記鎖の残りの部分が別の種に由来するか、別の抗体クラスまたはサブクラスに属する抗体、またそのような抗体のフラグメントの対応する配列と同一または相同的である抗体を指す(Morrison et al.,Proc.Natl.Acad..Sci.U.S.A.,81:6851−6855,1984)。
【0057】
非ヒト(例えば、マウス)抗体の「ヒト化」型は、非ヒト免疫グロブリン由来の最小限の配列を含む、キメラ免疫グロブリン、免疫グロブリン鎖、またはそのフラグメント(Fv、Fab、Fab'、F(ab')2、または抗体の他の抗原結合配列など)である。ヒト化抗体は大部分がヒト免疫グロブリン(受容抗体)であり、前記受容抗体の相補性決定領域(CDR)の残基が、望みの特異性、親和性、および能力を有する、マウス、ラット、またはウサギなどの非ヒト種のCDR残基(供与抗体)によって置換される。場合によっては、前記ヒト免疫グロブリンのFvフレームワーク領域(FR)の残基が、対応する非ヒト残基によって置換される。さらに、ヒト化抗体は、前記供与抗体、または移入されたCDRまたはフレームワーク配列にはない残基を有することができる。これらの修飾を行い、抗体性能をさらに洗練し、最適化する。一般に、前記ヒト化抗体は少なくとも1つ、典型的には2つの可変ドメインの実質的にすべてを有し、前記CDR領域のすべてまたは実質的にすべてが非ヒト免疫グロブリンのCDR領域と一致し、前記FR領域のすべてまたは実質的にすべてがヒト免疫グロブリン配列のFR領域と一致する。前記ヒト化抗体は、選択的に免疫グロブリン定常領域(Fc)の少なくとも一部、典型的にはヒト免疫グロブリンの一部も有する。さらなる詳細については、Jones et al.,Nature,321:522−525,1986;Reichmann et al.,Nature,332:323−329,1988;Presta,Curr.Op.Struct.Biol.,2:593−596,1992を参照。
【0058】
「完全ヒト」とは、抗体などの免疫グロブリンを指し、前記分子全体がヒト由来であるか、前記抗体のヒト型と同一のアミノ酸配列から成る。
【0059】
「ハイブリドーマ」は、培養した腫瘍化リンパ球と、親細胞の特異的免疫力を発現し初回抗原刺激を受けたBまたはTリンパ球との細胞融合生成物を指す。
【0060】
他に定義のない限り、本明細書で用いたすべての技術および科学用語は、本発明に関連する当業者に一般的に理解されるものと同じ意味を有する。本明細書で説明されたものと同一または同等のいかなる方法および材料も、本発明の検証実施に用いることができるが、好ましい材料および方法が本明細書において説明される。本発明を説明および請求項において、以下の用語が使用される。
【0061】
様々な特許および他の文献が本明細書に引用されており、それぞれの全開示内容は参照によって本明細書中に組み込まれる。
【0062】
抗体
本発明の抗体は特異的に、例えば立体構造エピトープなどのエンドシアリンのエピトープに結合し、インアウト活性(つまり、選択的に免疫エフェクター活性を誘導し、エンドシアリン陽性細胞に内部移行する能力)を示す。本発明の抗体が結合するエンドシアリンは好ましくは哺乳類であり、さらに好ましくはヒトである。ヒトエンドシアリンは配列ID番号1でコードされ、配列ID番号2のアミノ酸配列を有する。
【0063】
【表2】

【0064】
【表3】

【0065】
一部の実施形態において、前記抗体はFB5として同じエピトープに結合する。別の実施形態において、前記抗体は、FB5によって結合するもの以外のエピトープに結合する。
【0066】
好ましい抗体、および本発明の方法で使用するのに適した抗体には、例えば、完全ヒト抗体、ヒト単鎖抗体、抗体相同体、ヒト化抗体相同体、キメラ抗体、キメラ抗体相同体、および抗体重鎖または軽鎖またはその混合物の単量体または二量体を含む。
本発明の抗体には、タイプIgA、IgG、IgE、IgD、IgM(およびそのサブタイプ)を含む、すべてのアイソタイプの完全な免疫グロブリンを含むことができる。前記免疫グロブリンの軽鎖はκまたはλである。
【0067】
本発明の抗体には、抗原結合特異性を保持する完全な抗体の一部、例えば、Fabフラグメント、Fab'フラグメント、F(ab')2フラグメント、F(v)フラグメント、重鎖単量体または二量体、軽鎖単量体または二量体、重鎖1つおよび軽鎖1つから成る二量体などを含む。従って、抗原結合フラグメント、および前述の抗体由来の、完全な長さの二量体または三量体ポリペプチドは、それ自体がインアウト活性を生じるために有用である。
【0068】
齧歯類モノクローナル抗体をヒトの治療薬として直接使用すると、ヒト抗齧歯類抗体(「HARA(human anti−rodent antibody)」)反応が生じ、この反応は前記齧歯類由来抗体を投与した有意に多数の患者において発生することが分かった(Khazaeli,et al.(1994)Immunother.15:42−52)。齧歯類のアミノ酸配列がより少ないキメラ抗体は、ヒトで免疫反応を誘発するという問題が回避できると考えられた。
【0069】
キメラ抗体は組み換えDNA技術によって作製することができ、この技術では、免疫グロブリン軽鎖、重鎖、またはその両方のヒンジおよび定常領域のすべてまたは一部が、別の動物の免疫グロブリン軽鎖または重鎖の対応領域と置換されてきた。この方法では、前記親モノクローナル抗体の抗原結合部分が、別の種の抗体の骨格に移植(グラフト)される。Winterらの欧州特許第EP 0239400号明細書に報告された1つのアプローチでは、ヒト重鎖および軽鎖免疫グロブリン可変領域のCDRsをマウス可変領域ドメインのCDRsと置換するなど、1つの種の相補性決定領域(CDRs)と別の種のCDRsとの置換について報告している。これらの変化させた抗体は、その後ヒト免疫グロブリン定常領域と組み合わせることにより、置換された前記抗原に特異的なマウスCDRsを除いてはヒトである抗体を形成する。抗体のCDR領域を移植(graft)する方法は、例えば、Riechmann et al.(1988)Nature 332:323−327およびVerhoeyen et al.(1988)Science 239:1534−1536において見出される。
【0070】
限定されない例として、CDRグラフトの実行方法は、前記標的抗原(例えば、エンドシアリン)に結合する目的とする抗体の重鎖および軽鎖のマウスでの配列を決定し、前記CDR DNA配列の遺伝子を操作し、部位特異的突然変異によりこれらのアミノ酸配列を対応するヒトV領域に与えることにより実行することができる。所望のアイソタイプのヒト定常領域の遺伝子セグメントを追加し、前記キメラ重鎖および軽鎖遺伝子を哺乳類細胞に同時発現させ、可溶性抗体を作製する。典型的な発現細胞は、チャイニーズハムスター卵巣由来(CHO)細胞である。他の発現細胞には、HEK293および骨髄腫細胞を含む。前記キメラ抗体を作製するのに適した方法は、例えばJones et al.(1986)Nature 321:522−525;Riechmann(1988)Nature 332:323−327;Queen et al.(1989)Proc.Nat.Acad.Sci.USA 86:10029;およびOrlandi et al.(1989)Proc.Natl.Acad.Sci.USA 86:3833において見出される。
【0071】
HARA反応の問題を回避するため、さらに抗体を改良すると、「ヒト化抗体」の開発につながる。ヒト化抗体は組み換えDNA技術により作製され、この技術では、抗原の結合に不必要なヒト免疫グロブリン軽鎖または重鎖のアミノ酸の少なくとも1つが、対応する非ヒト哺乳類免疫グロブリン軽鎖または重鎖のアミノ酸と置換されている。例えば、前記免疫グロブリンがマウスモノクローナル抗体の場合、抗原の結合に必要のない少なくとも1つのアミノ酸が、対応するヒト抗体のその部位にあるアミノ酸を用いて置換されている。いかなる特定の操作理論に縛られることなく、前記モノクローナル抗体の「ヒト化」は外来性免疫グロブリン分子に対するヒトの免疫反応を抑制すると考えられている。
【0072】
Queen et al.(1989)Proc.Nat.Acad.Sci.USA 86:10029−10033および国際公開第WO 90/07861号パンフレットでは、ヒト化抗体の調製について報告している。ヒトおよびマウスの可変フレームワーク領域は、タンパク質配列の相同性が最適となるように選択される。前記マウス可変領域の三次構造はコンピューターによりモデル化され、相同的なヒトのフレームワークに重ね合わせることにより、アミノ酸残基と前記マウスCDRsとの最適な相互作用が示された。これにより、抗原に対する結合親和性(CDRを移植したキメラ抗体を作製する際は通常低下する)が向上した抗体が開発された。ヒト化抗体を作製する代替アプローチは当該分野で周知であり、例えばTempest(1991)Biotechnology 9:266−271において報告されている。
【0073】
本発明の抗体には、例えば、あらゆるタイプの分子と前記抗体との共有結合により、共有結合が前記抗体のエピトープへの結合を阻害しないように修飾された誘導体を含む。適切な誘導体の例には、これに限定されるものではないが、グリコシル化抗体およびフラグメント、アセチル化抗体およびフラグメント、ポリエチレングリコール化抗体およびフラグメント、リン酸化抗体およびフラグメント、およびアミド化抗体およびフラグメントが含まれる。本発明の抗体とその誘導体は、それ自体、既知の保護基/封鎖基、タンパク質分解的切断、細胞のリガンドまたは他のタンパク質との結合などにより誘導体化されていても良い。さらに、本発明の抗体とその誘導体は、1若しくはそれ以上の非古典的アミノ酸を含んでいても良い。
【0074】
本発明の抗体には、単一または複数のアミノ酸置換、欠失、付加、または交換され、本発明の抗体の生物学的特性(例えば、内部移行、結合親和性または結合活性、または免疫エフェクター活性)を保持した変異体が含まれる。当業者であれば、単一または複数のアミノ酸が置換、欠失、付加、または交換された変異体を作製することができる。これらの変異体には、とりわけ、(a)1若しくはそれ以上のアミノ酸残基が保存的または非保存的アミノ酸と置換された変異体、(b)1若しくはそれ以上のアミノ酸がポリペプチドに追加されるか、ポリペプチドから欠失した変異体、(c)1若しくはそれ以上のアミノ酸が置換基を含む変異体、および(d)例えば、抗体エピトープ、ポリヒスチジン配列、ビオチン部分など、前記ポリペプチドに有用な特性を与えることができる、融合パートナー、タンパク質標識、または他の化学部分など、別のペプチドまたはポリペプチドと、前記ポリペプチドが融合した変異体を含む。本発明の抗体は、保存的または非保存的な位置で、1種のアミノ酸残基が別の種の対応する残基と置換された変異体を含む。別の実施形態において、非保存的な位置のアミノ酸残基は保存的または非保存的残基と置換される。遺伝的(抑制、欠失、変異など)、化学的、および酵素的技術を含む、これらの変異体を得る技術は、当業者に周知である。本発明の抗体には抗体フラグメントが含まれる。「フラグメント」とはポリペプチド配列を指し、好ましくは少なくとも約40、より好ましくは少なくとも約50、より好ましくは約60、より好ましくは少なくとも約70、より好ましくは少なくとも約80、より好ましくは少なくとも約90、より好ましくは少なくとも約100アミノ酸長であり、例えば、エンドシアリン結合親和性または結合活性、内部移行能力、免疫エフェクター活性など、前記完全な長さの配列の生物活性または免疫活性を一部保持する。
【0075】
本発明には、エンドシアリン関連癌患者の末梢血単核細胞に由来する抗体など、完全ヒト抗体も含む。そのような細胞は骨髄腫細胞と融合し、例えば完全ヒト抗エンドシアリン抗体を産生するハイブリドーマ細胞を形成することができる。
本発明の抗体とその誘導体は、解離定数(Kd)が1×10−2未満である結合親和性を有する。一部の実施形態によると、前記Kdは1×10−3未満である。他の実施形態によると、前記Kdは1×10−4未満である。一部の実施形態によると、前記Kdは1×10−5未満である。さらに他の実施形態によると、前記Kdは1×10−6未満である。他の実施形態によると、前記Kdは1×10−7未満である。他の実施形態によると、前記Kdは1×10−8未満である。他の実施形態によると、前記Kdは1×10−9未満である。他の実施形態によると、前記Kdは1×10−10未満である。さらに他の実施形態によると、前記Kdは1×10−11未満である。一部の実施形態によると、前記Kdは1×10−12未満である。他の実施形態によると、前記Kdは1×10−13未満である。他の実施形態によると、前記Kdは1×10−14未満である。さらに他の実施形態によると、前記Kdは1×10−15未満である。
【0076】
いかなる特定の操作理論にも縛られることなく、本発明の抗体は、前記抗体の両方の「アーム(arm)」(Fabフラグメント)の増加された親和力により、エンドシアリン分子を分離するため、特にエンドシアリンの結合に有用であると考えられている。このため前記抗体の解離定数(Kd)が低下し、前記観察された親和性(KD)が全体的に上昇する。さらに、本発明の抗体は、前記抗体−抗原複合体の内部移行を可能にするエピトープに結合する必要がある。本発明の抗体は正常組織よりも腫瘍組織または新生血管組織に強固に結合し、細胞傷害性を有する免疫細胞を引き寄せ、結合薬物を送達し治療効果を追加するために内部移行することができるため、これらの特徴は腫瘍および新生血管組織の標的化に特に適している。
【0077】
本発明の抗体は、単独、または細胞傷害性物質または細胞増殖抑制物質などの生体分子または化学治療物質と共に(併用または混合して)使用することが可能である。一部の実施形態では、前記化学治療物質が、鉛−212、ビスマス−212、アスタチン−211、ヨウ素−131、スカンジウム−47、レニウム−186、レニウム−188、イットリウム−90、ヨウ素−123、ヨウ素−125、臭素−77、インジウム−111、およびホウ素−10またはアクチニドなどの核分裂性核種を含む(これに限定されるものではないが)放射性同位元素である。他の実施形態では、前記化学治療物質がリシン、修飾シュードモナスエンテロトキシンA、カリケアマイシン、アドリアマイシン、5−フルオロウラシルなどを含む(これに限定されるものではないが)毒素または細胞傷害性薬である。そのような薬物への抗体および抗体フラグメントの結合方法は、文献に知られている。
【0078】
本発明には、本発明のインアウト抗体を産生する細胞も含まれる。本発明の抗体産生細胞は細菌、酵母、昆虫、動物細胞であり、好ましくは哺乳類細胞である。例えば、本発明の抗体産生細胞には、例えばSpodoptera frugiperda細胞などの昆虫細胞、例えば酵母(Saccharomyces cerevisiaeおよびSchizosaccharomyces pombe)細胞などの酵母細胞、例えばチャイニーズハムスター卵巣由来細胞、胎仔ハムスター腎細胞、ヒト胎児腎臓株293、正常イヌ腎臓細胞株、正常ネコ腎臓細胞株、サル腎細胞、アフリカミドリザル腎細胞、COS細胞、および非腫瘍化マウス筋芽細胞G8細胞、線維芽細胞株、骨髄腫細胞株、マウスNIH/3T3細胞、LMTK細胞、マウスsertoli細胞、ヒト子宮頸癌細胞、バッファローラット肝細胞、ヒト肺細胞、ヒト肝細胞、マウス乳癌細胞、TRI細胞、MRC 5細胞、およびFS4細胞などの哺乳類細胞を含む。抗体産生細胞は2006年4月24日にAmer.Type Cult.Coll.(10801 University Blvd.,Manassas,Virginia 20110−2209)に掲載され、受入番号_______を割り当てられた。本発明のインアウト抗体の例は、そのような細胞によって産生された抗体である。
【0079】
核酸
本発明には、本発明の抗FRA抗体の重鎖および/または軽鎖をコードする核酸も含まれる。本明細書において用いられる「核酸」または「核酸分子」は、一本鎖または二本鎖のすべてのDNAまたはRNA分子を指し、一本鎖の場合は直鎖または環状型の相補的配列の分子を指す。核酸分子について考察する場合、5'から3'方向の配列を提供する通常の慣習に従い、特定の核酸分子の配列または構造について本明細書に説明することがある。本発明の一部の実施形態では、核酸分子は「単離」されている。この用語は、核酸分子に用いられる場合、由来する生物体の天然型ゲノムに隣接する配列から分離された核酸分子を指す。例えば、「単離核酸」は、プラスミドまたはウイルスベクターなどのベクターに挿入されるか、原核または真核細胞または宿主微生物のゲノムDNAに組み込まれたDNA分子を有する。RNAに用いる場合、前記「単離核酸」という用語は、主に、上記に定義した単離DNA分子によってコードされるRNA分子を指す。あるいは、前記用語は、天然の状態(つまり、細胞または組織中)で関連すると考えられる他の核酸から十分分離されたRNA分子を指す。単離核酸(DNAまたはRNA)は、さらに生物学的方法または合成法によって直接作製されたか、その作製中に存在する他の成分から分離された分子を示す。
【0080】
本発明の核酸には、本発明の核酸と少なくとも80%、より好ましくは少なくとも約90%、より好ましくは少なくとも約95%、最も好ましくは少なくとも約98%の相同性を有する核酸を含む。特定の配列を指す場合の「%類似性」、「%同一性」および「%相同性」という用語は、ウィスコンシン大学GCGソフトウェアプログラムに定義されるように使用する。本発明の核酸には相補的核酸も含まれる。一部の例では、前記配列を並べた場合に、完全に相補的となる(ミスマッチなし)。他の例によると、前記配列に最高約20%のミスマッチがある。
【0081】
本発明の核酸には、本発明の核酸のフラグメントも含まれる。「フラグメント」は、好ましくは少なくとも約10核酸長、より好ましくは約40核酸、最も好ましくは約100核酸長の核酸配列を指す。「フラグメント」は、1若しくはそれ以上の欠失、挿入、または置換を含む、少なくとも約100連続ヌクレオチド長を意味することもできる。「フラグメント」は、遺伝子の全コード化配列を意味し、5'および3'非翻訳領域を含む場合がある。
【0082】
本発明の核酸はベクターにクローン化することもできる。「ベクター」はプラスミド、コスミド、バクミド、ファージ、人工染色体(BAC、YAC)またはウイルスなどのレプリコンであり、これに別の遺伝子配列または遺伝要素(DNAまたはRNA)を挿入し、結合した配列または要素の複製を作ることができる。「レプリコン」は例えば、プラスミド、コスミド、バクミド、ファージ、人工染色体(BAC、YAC)またはウイルスなどの遺伝的要素であり、大部分は独自の制御で複製することができる。レプリコンはRNAまたはDNAとすることができ、一本鎖または二本鎖とすることができる。いくつかの実施形態では、前記発現ベクターに構成的に活性なプロモーターセグメント(これに限定されるものではないが、CMV、SV40、伸長因子、またはLTR配列)またはステロイド誘導pINDベクター(Invitrogen)などの誘導プロモーター配列を含み、前記核酸の発現を制御することができる。本発明の発現ベクターは、さらに例えば内部リボソーム侵入部位などの制御配列を有することもある。前記発現ベクターは、例えばトランスフェクションにより細胞に導入することができる。
【0083】
本発明の抗体をコードする核酸は、組み換えにより発現させることができる。本発明の発現細胞には、例えばSpodoptera frugiperda細胞など、既知の昆虫発現細胞株を含む。前記発現細胞株は、例えばSaccharomyces cerevisiaeおよびSchizosaccharomyces pombe細胞などの酵母細胞株とすることもできる。前記発現細胞は、例えば、チャイニーズハムスター卵巣由来細胞、胎仔ハムスター腎細胞、ヒト胎児腎臓株293、正常イヌ腎臓細胞株、正常ネコ腎臓細胞株、サル腎細胞、アフリカミドリザル腎細胞、COS細胞、および非腫瘍化マウス筋芽細胞G8細胞、線維芽細胞株、骨髄腫細胞株、マウスNIH/3T3細胞、LMTK細胞、マウスsertoli細胞、ヒト子宮頸癌細胞、バッファローラット肝細胞、ヒト肺細胞、ヒト肝細胞、マウス乳房腫瘍細胞、TRI細胞、MRC5細胞、およびFS4細胞などの哺乳類細胞とすることもできる。本発明の核酸は、例えばトランスフェクションにより細胞に導入することができる。組み換えにより発現された抗体は、例えば細胞の成長培地から回収することができる。
【0084】
エンドシアリンに対するインアウト抗体の作製法
免疫化動物
本発明では、エンドシアリンに特異的に結合するインアウトモノクローナル抗体を作製する方法も提供する。エンドシアリンは、タンパク質を単離および精製するための様々な既知の技術を利用し、細胞または組み換え系から精製することができる。例えば、これに限定されるものではないが、FRAは前記タンパク質の見かけ上の分子量に基づき、前記タンパク質をSDS−PAGEゲルに流し、前記タンパク質を膜にブロットすることで単離することができる。その後、エンドシアリンに対応する適切なサイズのバンドを膜から切り取り、直接動物で免疫原として利用するか、まず前記タンパク質を前記膜から抽出または溶出してから利用することができる。代わりの例として、前記タンパク質はサイズ排除クロマトグラフィーのみ、または他の単離および精製法との併用で単離することができる。他の精製法は、Zola,MONOCLONAL ANTIBODIES:PREPARATION AND USE OF MONOCLONAL ANTIBODIES AND ENGINEERED ANTIBODY DERIVATIVES (BASICS: FROM BACKGROUND TO BENCH) Springer−Verlag Ltd.,New York,2000;BASIC METHODS IN ANTIBODY PRODUCTION AND CHARACTERIZATION,Chapter 11,"Antibody Purification Methods,"Howard and Bethell,Eds.,CRC Press,2000;ANTIBODY ENGINEERING(SPRINGER LAB MANUAL.),Kontermann and Dubel,Eds.,Springer−Verlag,2001などの標準的な参考書籍で参照可能である。
【0085】
エンドシアリンに対するインアウト抗体を作製する1つの戦略には、エンドシアリン発現細胞を持つ動物を免疫化することを含む。そのように免疫化した動物は、前記タンパク質に対する抗体を産生する。ハイブリドーマ法(Kohler&Milstein,(1975)Nature 256:495−497を参照)、トリオーマ法、ヒトB細胞ハイブリドーマ法(Kozbor et al.(1983)Immunol.Today 4:72を参照)、およびヒトモノクローナル抗体を作製するEBVハイブリドーマ法(Cole,et al.MONOCLONAL ANTIBODIES AND CANCER THERAPY,Alan R.Liss,Inc.,1985,pp.77−96を参照)を含む(これに限定されるものではないが)、モノクローナル抗体を作製する標準的な方法が知られている。
【0086】
本発明の抗体は、インビボまたはインビトロで作製することができる。インビボでの抗体作製においては、一般的に動物がエンドシアリンの免疫原性部分で免疫化される。前記抗原または抗原陽性細胞は、一般的に免疫原性を促進するアジュバントと併用される。アジュバントは免疫化に使用する種によって異なる。アジュバントの例には、(これに限定されるものではないが)フロイント完全アジュバント(「FCA(Freund's complete adjuvant)」)、フロイント不完全アジュバント(「FIA(Freund's incomplete adjuvant」)、無機質ゲル(例えば、水酸化アルミニウム)、界面活性物質(例えば、リゾレシチン、プルロニックポリオール、ポリアニオン)、ペプチド、油性乳剤、キーホールリンペットヘモシアニン(「KLH(keyhole limpet hemocyanin)」)、ジニトロフェノール(「DNP(dinitrophenol)」)、およびカルメット・ゲラン桿菌(「BCG(Bacille Calmette−Guerin」)およびcorynebacterium parvumなどの潜在的に有用なヒトアジュバントを含む。そのようなアジュバントは当該分野で周知である。
【0087】
免疫化は周知の方法により達成することができる。用量と免疫化法は、免疫化される哺乳類の種、その免疫状態、体重、および/または表面積の計算値などに依存する。典型的には、免疫化する哺乳類から血清を採取し、例えば、以下に説明する適切なスクリーニング法により抗エンドシアリン抗体を分析する。
【0088】
免疫化動物の脾細胞は、(前記抗体産生B細胞を含む)前記脾細胞と骨髄腫株などの不死化細胞株を融合することで不死化することができる。典型的には、骨髄腫細胞株は前記脾細胞ドナーと同じ種のものとする。1実施形態では、前記不死化細胞株がヒポキサンチン、アミノプテリン、およびチミジンを含む培地(「HAT培地」)に感受性を示す。一部の実施形態では、前記骨髄腫細胞がエプスタインバーウイルス(EBV)感染陰性である。好適な実施形態では、前記骨髄腫細胞がHAT感受性、EBV陰性、およびIg発現陰性である。すべての適切な骨髄腫を使用することができる。マウスハイブリドーマは、マウス骨髄腫細胞株(例えば、P3−NS1/1−Ag4−1、P3−x63−Ag8.653、またはSp2/O−Ag14骨髄腫株)により作製することができる。これらのマウス骨髄腫株はATCCから入手できる。これらの骨髄腫細胞は、前記ドナー脾細胞のポリエチレングリコール(「PEG」)、好ましくは1500分子量のポリエチレングリコール(「PEG1500」)に融合する。前記融合で得られるハイブリドーマ細胞は、未融合の骨髄腫細胞と非生産的に融合された骨髄腫細胞を死滅させるHAT培地で選択される。未融合の脾細胞は培養時に短期間で死滅する。いくつかの実施形態では、前記骨髄腫細胞が免疫グロブリン遺伝子を発現しない。
【0089】
以下に説明するようなスクリーニング方法で検出される、望みの抗体を産生するハイブリドーマは、培養または動物で抗体を作製するために使用することができる。例えば、前記ハイブリドーマ細胞は、前記ハイブリドーマ細胞が前記培地に前記モノクローナル抗体を十分分泌できる条件および時間で、培養液中で培養することができる。これらの技術と培地は、当業者に周知である。或いは、前記ハイブリドーマ細胞を非免疫化動物の腹膜に注入することができる。前記細胞は腹腔で増殖し、前記抗体を分泌し、これが腹水として蓄積する。前記腹水は、前記モノクローナル抗体が豊富な供給源として、腹腔からシリンジで抜くことができる。
【0090】
ヒト抗体を作製するための別の限定されない方法は、米国特許第5,789,650号明細書に報告されており、この明細書では、自らの内因性免疫グロブリン遺伝子が不活性化され、別の種(例えば、ヒト)の抗体を産生するトランスジェニック哺乳類について説明している。前記異種抗体の遺伝子は、ヒト免疫グロブリン遺伝子によってコードされている。再配列されていない免疫グロブリンのコード領域を含む導入遺伝子は、非ヒト動物に導入される。得られたトランスジェニック動物は、前記トランスジェニック免疫グロブリン配列を機能的に再配列し、ヒト免疫グロブリン遺伝子でコードされた様々なアイソタイプの抗体レパートリーを産生することができる。前記トランスジェニック動物のB細胞は、その後、不死化細胞株(例えば、骨髄腫細胞)と融合させるなど、様々な方法のいずれかによって不死化される。
【0091】
エンドシアリンに対するインアウト抗体は、当該分野で既知の様々な技術によりインビトロで調整することができる。例えば、(これに限定されるものではないが)エンドシアリンに対する完全ヒトモノクローナル抗体は、インビトロで初回抗原刺激したヒト碑細胞を用いて調整することができる(Boerner et al.(1991)J.Immunol.147:86−95)。
【0092】
或いは、例えば、本発明の抗体を「レパートリークローニング」により調整することができる(Persson et al.(1991)Proc.Nat.Acad.Sci.USA 88:2432−2436;およびHuang and Stollar(1991)J.Immunol.Methods 141:227−236)。さらに、米国特許第5,798,230号明細書では、エプスタインバーウイルス核抗原2(EBNA2)を発現したエプスタインバーウイルスに感染させることで不死化した、ヒトB抗体産生B細胞のヒトモノクローナル抗体の調整について報告している。その後不死化に必要なEBNA2を不活化し、抗体力価を上昇させる。
【0093】
別の実施形態では、エンドシアリンに対するインアウト抗体が末梢血単核細胞(「PBMCs」)のインビトロでの免疫化によって形成される。これは、例えば文献に報告された方法を用いるなど、当該分野で既知の方法により達成することができる(Zafiropoulos et al.(1997)J.Immunological Methods 200:181−190)。
【0094】
エンドシアリンに対するインアウト抗体を作製する別の戦略では、エンドシアリンの膜結合型の領域に対応するペプチドを持つ動物を免疫化する工程を含み、これにより確実な免疫エフェクター活性を保持する抗体を内部移行させる。そのように免疫化した動物は、前記タンパク質に対する抗体を産生する。ハイブリドーマ法(Kohler & Milstein,(1975)Nature 256:495−497を参照)、トリオーマ法、ヒトB細胞ハイブリドーマ法(Kozbor et al.(1983)Immunol.Today 4:72を参照)、およびヒトモノクローナル抗体を作製するEBVハイブリドーマ法(Cole,et al.MONOCLONAL ANTIBODIES AND CANCER THERAPY,Alan R.Liss,Inc.,1985,pp.77−96を参照)を含む(これに限定されるものではないが)モノクローナル抗体を作製する標準的な方法が知られている。
【0095】
本発明の1実施形態では、インビトロでの免疫化法がハイブリドーマ細胞の定向進化により補完され、PMS1、PMS2、PMS2−134、PMSR2、PMSR3、MLH1、MLH2、MLH3、MLH4、MLH5、MLH6、PMSL9、MSH1、およびMSH2などのミスマッチ修復遺伝子のドミナントネガティブ対立遺伝子が、前記碑細胞の融合後に前記ハイブリドーマ細胞に導入されるか、融合前に前記骨髄腫細胞に導入される。前記ドミナントネガティブ突然変異を含む細胞は超変異となり、形質移入していない対照細胞よりも高い割合で変異を蓄積する。前記突然変異細胞のプールから、高親和性抗体を産生するか、高力価抗体を産生するか、単純に特定の条件でより早く、良好に増殖するクローンをスクリーニングすることができる。ミスマッチ修復遺伝子のドミナントネガティブ対立遺伝子を用いて超変異細胞を作製する方法は、2000年11月4日発行の米国特許第6,146,894号明細書に報告されている。代わりに、Nicolaidesらが2002年7月18日公開のWO 02/054856「Chemical Inhibitors of Mismatch Repair」に報告した、ミスマッチ修復の化学的阻害剤を用いて、ミスマッチ修復を阻害することもできる。ミスマッチ修復遺伝子のドミナントネガティブ対立遺伝子またはミスマッチ修復の化学的阻害剤を用いて抗体を強化する方法は、クローン化免疫グロブリン遺伝子も発現した哺乳類の発現細胞に適用されることもある。前記ドミナントネガティブ対立遺伝子をオフとし、誘導できる場合は前記細胞から排除することで、前記細胞をもう一度遺伝的に安定させ、異常に高い割合で突然変異が蓄積しないようにできるという点において、前記ドミナントネガティブ対立遺伝子を発現する細胞は「矯正」することができる。
【0096】
インアウト抗体のスクリーニング
エンドシアリンに特異的に結合するインアウト抗体のスクリーニングは、酵素免疫吸着測定法(ELISA)を利用し、免疫エフェクター活性を持つ抗体をスクリーニングする、および/または内部移行をアッセイすることで達成することができる。免疫エフェクター活性を示す抗体は、抗体依存性細胞傷害作用(ADCC)または補体依存性細胞傷害作用(CDC)をモニターする標準的な免疫エフェクター法を利用することで同定することができる。内部移行可能な抗体は、前記抗体を蛍光色素またはプロドラッグなどの検出可能な標識と結合させ、可視化した内部移行能力または毒性をモニターすることで、同定可能である。1若しくはそれ以上のこれらのアッセイ(ELISA、免疫エフェクター法、および内部移行法)は、本発明のインアウト抗体を同定する任意の順序で実行することができる。
【0097】
例えば、前記ELISAは、抗原(タンパク質全体またはペプチド)を免疫化したコーティングマイクロタイタープレートを有することもある。陽性反応を示したクローンの抗体は、エンドシアリンに対するELISAを基本としたアッセイで反応性をスクリーニングすることができる。葉酸受容体α型に特異的な抗体は、1若しくはそれ以上の他の葉酸受容体アイソタイプを利用し、ELISAで同定することができる。エンドシアリンに対して反応性を示す抗体を産生するクローンは、さらなる発展と開発のために選択される。インアウト活性を示すエンドシアリン反応性抗体は、例えば、抗体依存性細胞傷害作用(ADCC)または補体依存性細胞傷害作用(CDC)をモニターする標準的な免疫エフェクター法を用いて確認することができる。免疫エフェクター活性を示すエンドシアリン特異的抗体については、次に蛍光色素またはプロドラッグと結合し、可視化した内部移行能力、またはプロドラッグが内部移行し、前記抗体が遊離することで前記毒素が生じる際に発生する毒性をモニターすることができる。
【0098】
抗体の薬学的組成物
本発明の別の観点では、本発明の抗エンドシアリン抗体の薬学的組成物を特徴としている。前記薬学的組成物を使用し、患者のエンドシアリン陽性細胞の成長を抑制または軽減することができる。特定の実施形態では、前記薬学的組成物が製剤化され、注射または注入により投与される。
【0099】
本発明の薬学的組成物は、さらに1若しくはそれ以上の生体分子または化学治療物質を有する。一部の実施形態において、前記抗体は前記生体分子、抗葉酸化合物、または化学治療物質に結合する。適切な化学治療物質には、(これに限定されるものではないが)鉛−212、ビスマス−212、アスタチン−211、ヨウ素−131、スカンジウム−47、レニウム−186、レニウム−188、イットリウム−90、ヨウ素−123、ヨウ素−125、臭素−77、インジウム−111、およびホウ素−10またはアクチニドなどの核分裂性核種を含む放射性同位元素を含む。他の実施形態では、前記化学治療物質がリシン、修飾シュードモナスエンテロトキシンA、カリケアマイシン、アドリアマイシン、5−フルオロウラシルなどを含む(これに限定されるものではないが)、毒素または細胞傷害性薬である。
【0100】
本発明の薬学的組成物は、薬学的に許容される担体または媒体とともに製剤化されることもある。適切な薬学的に許容される担体には、水、PBS、食塩水(リンガー溶液など)、アルコール、オイル、ゼラチン、およびラクトース、アミロール、またはデンプンなどの炭水化物、脂肪酸エステル、ヒドロキシメチルセルロース、およびポリビニル・ピロリジンを含む。そのような製剤は滅菌し、望ましい場合は、潤滑剤、保存料、安定剤、湿潤剤、乳化剤、浸透圧に影響する塩、緩衝液、および着色剤などの助剤と混合することができる。本発明での使用に適した薬学的担体は当該分野で既知であり、例えばPharmaceutical Sciences(第17版、Mack Pub.Co.、ペンシルバニア州イーストン)に説明されている。
【0101】
キット
本発明のさらに別の観点では、インビトロまたはインビボでエンドシアリン陽性細胞の成長を阻害または抑制するキットが提供される。また、インビトロまたはインビボでエンドシアリン陽性細胞の有無を確認するキットも提供される。
【0102】
本発明のキットは、本発明の抗体または抗体組成、およびエンドシアリン陽性細胞、好ましくは異型細胞の成長をインビトロまたはインビボで阻害または抑制する方法、例えば生物サンプル中のエンドシアリン陽性細胞、好ましくは異型細胞の有無を同定する方法において、前記キットを使用するための使用説明書を有する。前記キットは少なくとも1つの生体分子、抗葉酸化合物、または化学治療物質を有することができる。前記キットは、少なくとも1つの診断試薬を有することができる。診断試薬の例は、例えば放射性、蛍光性、または発色試薬(例えば、111In−DOTA)などの(これに限定されるものではないが)検出可能な標識である。前記検出可能な標識は酵素を有することもある。前記キットは、前記抗体または抗体組成を、例えば注射または注入により投与するための使用説明書および/または手段を有することもある。
【0103】
エンドシアリン陽性細胞の検出法
本発明の方法には、卵巣癌、膵癌、前立腺癌、または肺癌細胞を含む(これに限定されるものではないが)、表面にエンドシアリンを提示する、異型細胞または新生血管細胞などの細胞を検出する方法を含む。前記方法は、生物サンプルに対してインビトロで、またはインビボで実行することができる。本発明のエンドシアリン陽性細胞の検出方法は、本発明の抗エンドシアリン抗体を生物サンプルと接触させる工程または本発明の抗エンドシアリン抗体を患者に投与する工程(前記抗体は例えば放射性、蛍光性、または発色試薬(例えば、111In−DOTA)などの(これに限定されるものではないが)検出可能な標識で標識される)、および前記抗体の細胞への結合を決定する工程を有する。前記検出可能な標識は酵素とすることもある。
【0104】
エンドシアリン陽性細胞の成長を抑制する方法
本発明のインアウト抗エンドシアリン抗体は、インビトロまたはインビボにおいてエンドシアリン陽性細胞の成長を抑制するための使用に適している。本発明の方法は、エンドシアリンを発現する細胞を含む組織、好ましくは増強されたエンドシアリンの発現を示す細胞に関連した腫瘍疾患または血管新生疾患を有すると同定された非ヒト動物での使用に適している。本発明の利益を受ける非ヒト動物には、ペット、外来性(例えば、動物園の動物)および国産家畜を含む。好ましくは、前記非ヒト動物は哺乳類である。
【0105】
本発明は、正常組織に関連し、腫瘍または新生血管組織において増強されたエンドシアリンの発現により特徴付けられる、形成異常症または血管新生疾患を有すると同定されたヒトまたは動物患者での使用に適している。そのような患者がそのような状態を治療する必要があると同定されると、前記状態の治療を達成するため、本発明の方法が適応されることがある。治療可能な異型組織または新生血管組織には、(これに限定されるものではないが)卵巣、乳、結腸、肝臓、脳、肺、膵臓、骨間接、骨、眼、および前立腺を含む。
【0106】
本発明で使用される抗体とその誘導体は、カプセル、錠剤、水性懸濁液、溶液など、許容される剤形であれば経口投与することができる。前記抗体とその誘導体は、非経口投与することもできる。その場合、皮下、静脈内、筋肉内、関節内、滑膜内、胸骨内、鼻腔内、局所、くも膜下腔内、肝内、病巣内、および頭蓋内注射または注入法の投与経路とする。一般に前記抗体と誘導体は、筋肉内または静脈内注射として提供される。
【0107】
本発明の抗体と誘導体は、単独、または許容されるアジュバント、賦形剤、および添加物を含む、薬学的に許容される担体との併用で投与することができる。
【0108】
本発明の抗体と誘導体は、1若しくはそれ以上の抗葉酸化合物を併用して投与することもできる。前記抗葉酸化合物には、(これに限定されるものではないが)5−フルオロ−2'−デオキシ−ウリジン−5'−一リン酸(FdUMP)、5−フルオロウラシル(5−FU)、L−5−ホルミルテトラヒドロ葉酸(「ロイコボリン」)、N−[5−(N−(3,4−ジヒドロ−2−メチル−4−オキソキナゾリン−6−イル−メチル)−アミノ)−2−テニル)]−L−グルタミン酸(「ZD1649」、「トムデックス」としても知られる)(Jackman et al.(1991)Cancer Res.51:5579−5586)、N−(4−(2−(2−アミノ−4,7−ジヒドロ−4−オキソ−3H−ピロロ[2,3−D]ピリミジン−5−イル)−エチル)−ベンゾイル]−L−グルタミン酸(「マルチターゲット葉酸」(multi−targeted antifolate:MTA)、「LY231514」、「ALIMTA」、および「ペメトレキセド」としても知られる)(Taylor et al.(1992)J.Med.Chem.35:4450−4454;Shih et al.(1997)Cancer Res.57:1116−1123)、(S)−2−(5)−(((1,2−ジヒドロ−3−メチル−1−オキソベンゾ(f)キナゾリン−9−イル)−メチル)−アミノ)−オキソ−2−イソインドリニル)−グルタル酸(「GW1843U89」)(Hanlon and Ferone(1996)Cancer Res.56:3301−3306)、(2S)−2−{O−フルオロ−p−[N−(2,7−ジメチル−4−オキソ−3,4−ジヒドロ−キナゾリン−6−イル−メチル)−N−プロパ−2−イニル)アミノ]ベンズアミド}−4−(テトラゾール−5−イル)−酪酸(「ZD9331」)(Jackman et al.(1997)Clin.Cancer Res.3:911−921);3,4−ジヒドロ−アミノ−6−メチル−4−オキソ−5−(4−ピリジルチオ)−キナゾリン(「AG337」、「チミタック(Thymitaq)」としても知られる)(Webber et al.(1996)Cancer Chemother.Pharmacol.37:509−517;Rafi et al.(1998)J.Clin.Oncol.16:1331−1341)、およびNα−(4−アミノ−4−デオキシプテロイル)−Nδ−(ヘミフタロイル−L−オルニチン)(「PT523」)(Rhee et al.(1994)Mol.Pharmacol.45:783−791、Rowowsky(1999)Curr.Med.Chem.6:329−352)を含む。前記抗葉酸化合物は、本発明の抗FR−α抗体の前後、または同時に投与することができる。投与される抗葉酸化合物の量は現在使用されている用量とするか、増減することができ、これは前記患者に対して有害作用を生じずに、腫瘍の成長抑制または腫瘍の除去を達成することを基本に、医師が容易に決定することができる。
【0109】
本発明の抗体は、別の治療薬または診断薬の前後、または同時に投与することができる。例えば、本発明のインアウト抗体は単独、またはアドリアマイシン、ドキソルビシン、ゲムシタビン、または5−フルオロウラシルなど(これに限定されるものではないが)細胞傷害性薬と併用して投与することができる。本発明のインアウト抗体は単独、またはタルセバおよびアバスチンなど(これに限定されるものではないが)細胞増殖抑制物質と併用して投与することができる。本発明のインアウト抗体と誘導体は単独、またはワクチン剤と併用して投与することができる。本発明のインアウト抗体および誘導体は単独、またはインターロイキン−2、インターフェロンα、インターフェロンβ、インターフェロンγ、リツキサン、ゼバリン、ハーセプチン、エルビタックス、アバスチンなど(これに限定されるものではないが)別の生体分子と併用して投与することができる。
【0110】
本発明のインアウト抗体および誘導体は、非複合型または複合型抗体の均一混合物として、または非複合型または複合型インアウト抗体の不均一混合物として投与することができる。
【0111】
有効量は様々な因子によって決まり、これは体重、治療目標、最高耐量、使用される特定の製剤、投与経路などの様々なパラメーターによって、特定患者の用量を調整する熟練医師の権限の範囲内である。一般に、前記抗体またはその誘導体の用量レベルは、1日約0.001および約100mg/kg体重の範囲が適切である。いくつかの実施形態では、前記抗体またはその誘導体の用量が1日約0.1〜約50mg/kg体重である。他の実施形態では、前記用量が約0.1mg/kg体重/日〜約20mg/kg体重/日である。さらに他の実施形態では、前記用量が約0.1mg/kg体重/日〜約10mg/kg体重/日である。投与はボーラスまたは注入とすることができる。投与は、1日1回または1日複数回とすることができる。さらに、投与は一定期間に複数回とすることができる。いくつかの実施形態では、前記用量を1〜14日おきに投与する。いくつかの実施形態では、前記抗体またはその誘導体が腹腔内に約3〜1mg/kgの用量で投与される。他の実施形態では、前記抗体またはその誘導体は静脈内に約5〜12.5mg/kgで提供される。さらに他の実施形態では、前記抗体またはその誘導体が、血漿レベルを少なくとも約1ug/mlに維持するように提供される。
【0112】
治療の有効性ついては、様々な方法で評価することができる。一実施形態によると、腫瘍成長の進行の遅延、または血管新生疾患組織において症状が軽減されることにより、治療が有効であると判断される。他の実施形態によると、前記腫瘍の縮小(つまり、前記腫瘍サイズの減少)、または新生血管組織における正常機能の回復によって治療が有効であると決定される。他の実施形態では、前記腫瘍の転移の抑制、または新生血管組織の改善された正常機能によって治療が有効であると決定される。さらに他の実施形態において、治療の有効性は、体重増加、体力回復、疼痛軽減、視界の回復、成長、および健康回復および疾患の抑制に関する前記患者からの主観的指標などの徴候を含む、前記患者の満足感(well−being)向上により決定される。
【0113】
以下の実施例は、本発明を図示するために提供されるものであり、本発明を限定するものとして解釈されるべきではない。
【実施例1】
【0114】
エンドシアリンに結合可能なインアウト抗体
モノクローナル抗体ES−1はエンドシアリンに特異的なヒト化抗体である、前記抗体はエンドシアリンタンパク質、エンドシアリンを発現した癌細胞、ヒト胚内皮細胞、および白血球に対する特異的な結合を示す。エンドシアリンに特異的な結合性を立証するために、当業者によって用いられる方法に従って、96型ウェル中、エンドシアリン発現細胞を用いて全細胞ELISAを行った。ELISAによって反応が見出された抗体はさらに、製造プロトコールに従って、FACS分析を用いたエンドシアリン結合分析を行った。インアウト抗体は、免疫組織化学(immunohistochemistry:IHC)を用いてスクリーニングすることにより同定した。IHCを用いることによって、エンドシアリンを発現している内皮細胞(endothelial cells:ECs)の免疫組織化学による前記細胞表面上で発現したエンドシアリンに結合可能な抗体が検出された。前記抗エンドシアリンまたは正常IgG抗体は、ECs濃度(0.5ug/mLおよび2.5μg/mL)に対して適用された。Phosphate−リン酸緩衝食塩水[PBS(0.15M NaCl,pH7.2)]+1%ウシ血清アルブミンを第1抗体に対する希釈液として使用した。Cells細胞はスライドに播種して培養し、Tissue−Tek(商標)OCT培地中で固定した。スライドを−70℃以下で染色するまで保存した。染色直前、スライドを10%中性緩衝ホルマリン中に10秒間固定した。
【0115】
Slidesスライドをリン酸緩衝食塩水中 (PBS[0.15M NaCl,pH7.2])で2回洗浄した。Endogenous peroxidaseDako EnVision(登録商標)Kitによって提供されるペルオキシダーゼ溶液と共に前記スライドを5分間インキュベートして内因性ペルオキシダーゼを阻害した後、PBS(0.15M NaCl,pH7.2)中で2回洗浄した。次に、非特異的結合を抑制するために設計されたタンパク質阻害剤を用いて前記スライド20分間処理した。前記タンパク質阻害剤は以下のように調製した。PBS(0.15M NaCl, pH7.2)、0.5%カゼイン、1%ウシ血清アルブミン(bovine serum albumin:BSA)、および1.5%正常ヤギ血清。Following the タンパク質阻害剤に従って、第1抗体(被験物質、陰性コントロール抗体、またはなし(分析対照として緩衝液単独))を室温で1時間適用させた。次に、前記スライドをPBS(0.15M NaCl, pH7.2)を用いて2回洗浄し、Dako EnVision(登録商標)Kitから提供されるペルオキシダーゼ標識したヤギ抗IgGポリマーで30分間処理し、PBS(0.15M NaCl, pH7.2)で2回洗浄し、Dako EnVision(登録商標)Kitから提供される基質発色(substrate−chromogen:DAB)溶液で8分間処理した。Allすべてのスライドは水で洗浄し、ヘマトキシリンで対比染色し、脱水し、判読のためにカバースリップを載せた。図1は、ヌル細胞に対して、エンドシアリン発現細胞がES−1結合に対して陽性となったIHC分析データを示している。
【実施例2】
【0116】
ES−1の免疫エフェクター活性
免疫エフェクター活性は、エンドシアリン発現Lu細胞株にて標準的な抗体依存性細胞傷害(antibody−dependent cellular cytotoxicity:ADCC)分析により評価した。簡潔に述べると、OVCAR−3標的細胞を完全成長培地(10% FBS、2mM L−グルタミン含有RPMI−1640)中、平底96ウェルマイクロプレートに播種した。翌日、前記完全培地を100ulのCHO−CD無血清培地(Sigma)と交換し、抗体含有ならし培地50ulを標的細胞に追加し、37℃で20分間インキュベートした。その後、2×105のエフェクター細胞を含む100ulの無血清培地を加え、5%CO2、37℃で5〜6時間インキュベートした。エフェクター細胞はヒト末梢血単核球(peripheral blood mononuclear cells:PBMCs)から誘導し、健常ドナーから単離した(Interstate Blood Bankより購入)。ADCCにて使用する前に、PBMCsを約10ng/mlのヒト組み換え型インターロイキン2(R&D Systems)を含む完全RPMI中に2.5×106/mlで播種し、37℃、5% CO2にて3日間、PBMCsを活性化した。次に、活性化PBMCsをエフェクター細胞:標的細胞比を5:1としてOVCAR−3細胞に追加し、この培地を37℃、5%CO2にて5〜6時間インキュベートした。各ウェルから上清を回収し、ELISAプレートに移し、以下のとおりADCCを分析行った。ADCCは乳酸脱水素酵素(lactase dehydrogenase:LDH)、標準分析においてADCCの測定に使用される内因性酵素の放出によってモニターした。LDHは、100μlのLDH基質(Roche)を上清に添加し、周囲温度で10分間インキュベートすることによってモニターし、LDHによって変換された化学物質は分光光度法でOD490にて検出可能であった。LDH活性は、溶解標的細胞から放出される前記LDH酵素の量と比例する。490nmの吸光度(OD490)は分光光度法で得られる。2%トリトンXを「最大値(max)」の陽性対照としてエフェクター細胞単独に追加し、抗体は加えてないがPBMCを伴った標的細胞は「自然値(spontaneous)」としての陰性対照とした。LDH値を取得し、以下の式により細胞傷害性の割合を決定した。(サンプル値−自然値)/(最大値−自然値)×100%(式中、「自然値」=エフェクター細胞不在下での標的細胞の溶解、「最大値」=2%トリトン混在下での標的細胞の溶解)。100ng/mlの正常ヒトIgG1抗体を用い、非特異的細胞傷害性をモニターする。前記%細胞傷害性を各ウェル/クローンの抗体濃度で割って得られた比(つまり、比=50(%)/100(ng/ml)=0.5)を、エフェクター機能が高いと考えられるリードクローンを選択する基準として設定する。
【0117】
ES−1の分析によると、対照Igと共に、または抗体なしでインキュベートした細胞のADCC活性上昇力(p=0.018)を示している(図2)。図2は、ヌル黒色腫細胞は陰性であったのに対して、ES−1抗体のエンドシアリンに結合する能力を示すHMVEC細胞の非変性ウエスタンブロットを示していた。図2Bの下部パネルは、ヒトPBLs単独(0レーン)と共に、または増量されたES−1(棒グラフ右)と共に、または対照Ig(正常IgG−棒グラフ左)と共にインキュベートした標的HMVEC細胞(標的と称する)を示している。細胞溶解時に発生する乳酸脱水素酵素(LDH)の放出をモニターすることにより、細胞培養液の殺細胞を分析した。示したように、ES−1はエンドセリン発現細胞上においてADCC活性を有していた。図2Bの上部パネルは、ヒトPBLs単独で(0レーン)、または増量されたES−1(棒グラフ右)と共に、または対照Ig(正常IgG−棒グラフ左)と共にインキュベートしたエンドシアリンに対してヌルであるヒト黒色腫細胞を示している。細胞溶解時に発生する乳酸脱水素酵素(LDH)の放出をモニターすることにより、細胞培養液の殺細胞を分析した。示したように、ES−1はエンドシアリンヌル細胞上において、ADCC活性を有していなかった。これらのデータは、ML−1が免疫エフェクター機能を介して細胞傷害作用を有するという所見を支持するものである。
【実施例3】
【0118】
ES−1抗体の内在化
ES−1はエンドシアリン発現細胞に結合すると内部移行する。この所見は、Hum−ZAP分析を用いた図3に示した。第2の免疫毒素は、2次抗体とリボソーム不活化タンパク質サポリンの複合体である。試験している1次抗体が内部移行すると、前記サポリンは前記2次抗体と結合して前記細胞に運ばれる内部移行したサポリンがそのIgG複合体から一旦分離すると、タンパク質合成が阻害され、最終的に細胞死が引き起こされる。Hum−ZAP(Advanced Targeting Systems、cat# IT−22)は、ヒトモノクローナル抗体を認識するアフィニティー精製したヤギ抗ヒトIgG(分子量210kDa)の2次化学的複合体である。対照分子のヤギIgG−SAP(Advanced Targeting Systems cat#IT−19)は、正常なヤギIgGとサポリンの複合体である。簡潔に述べると、10%FCS、2.0mMグルタミン、1.0mMピルビン酸ナトリウム、および0.1mM MEM非必須アミノ酸を含む80ulのRPMI 1640中の平底96ウェル組織培養プレートに、2500/ウェルで細胞を播種した。24時間後、10μlの1次抗体ES−1またはMORAb−A92を10μlのHum−ZAPまたはヤギIgG−SAPとともに添加し、総量を100ulにした。実験では抗体の滴定を行い、1次抗体および2次抗体を対照として含ませた。4日後、分光光度法により生存細胞数を読み取るPromega CellTiter(登録商標)細胞傷害性アッセイ(cat#G3581)を用いて、細胞の生存率を評価した。すべての検査は3回ずつ行った。データは処理および未処理ウェルを比較することにより評価し、結果は対照のパーセントとして表した。図3に示したように、サポリンに結合したES−1はエンドシアリンを過剰発現したLu細胞を死滅させたが、ES−1抗体単独と比較して(図示せず)、アイソタイプ対照抗体MORAb−A92は複合体毒素形態において細胞を死滅させたかった(四角)。対照としてエンドシアリンを発現しない細胞を使用し、ES−1は複合または非複合形態において毒性効果を有していないことが示された(図示せず)。これらのデータは、ES−1がエンドシアリン提示細胞に内部移行するという知見を支持するものである。
【特許請求の範囲】
【請求項1】
(a)エンドシアリンに特異的に結合し、さらに(b)選択的に免疫エフェクター活性を誘発するか、或いはエンドシアリン提示細胞に内部移行する抗体。
【請求項2】
請求項1記載の抗体において、前記抗体は少なくとも約1×10−7Mの親和性でエンドシアリンに結合する。
【請求項3】
請求項1記載の抗体において、前記抗体は少なくとも約1×10−8Mの親和性でエンドシアリンに結合する。
【請求項4】
請求項1記載の抗体において、前記抗体は少なくとも約1×10−9Mの親和性でエンドシアリンに結合する。
【請求項5】
請求項1記載の抗体において、前記抗体は少なくとも約1×10−10Mの親和性でエンドシアリンに結合する。
【請求項6】
請求項1記載の抗体において、前記抗体はキメラ抗体である。
【請求項7】
請求項6記載の抗体において、前記キメラ抗体はヒト−マウスキメラ抗体である。
【請求項8】
請求項1記載の抗体において、前記抗体はヒト化抗体である。
【請求項9】
請求項1記載の抗体において、前記抗体は完全ヒト抗体である。
【請求項10】
請求項1記載の抗体において、抗体は化学治療物質に結合するものである。
【請求項11】
請求項10記載の抗体において、前記化学治療物質は放射性核種である。
【請求項12】
請求項1記載の抗体において、エンドシアリンは配列ID番号2のアミノ酸配列を有するものである。
【請求項13】
請求項1記載の抗体において、エンドシアリンは配列ID番号1のヌクレオチド配列によってコードされるものである。
【請求項14】
請求項1記載の抗体において、前記免疫エフェクター活性は抗体依存性細胞傷害作用である。
【請求項15】
請求項1記載の抗体の重鎖をコードするポリヌクレオチド。
【請求項16】
請求項1記載の抗体の軽鎖をコードするポリヌクレオチド。
【請求項17】
請求項1記載の抗体の重鎖および軽鎖をコードするポリヌクレオチド。
【請求項18】
請求項1記載の抗体を有する薬学的組成物。
【請求項19】
請求項18記載の薬学的組成物において、前記抗体は化学治療物質に結合するものである。
【請求項20】
請求項19記載の薬学的組成物において、前記化学治療物質は放射性核種である。
【請求項21】
請求項1記載の抗体の重鎖をコードするポリヌクレオチドを有するベクター。
【請求項22】
請求項1記載の抗体の軽鎖をコードするポリヌクレオチドを有するベクター。
【請求項23】
請求項1記載の抗体の重鎖と請求項1記載の抗体の軽鎖とをコードするポリヌクレオチドを有するベクター。
【請求項24】
請求項1記載の抗体の重鎖をコードするポリヌクレオチドと、請求項1記載の抗体の軽鎖をコードするポリヌクレオチドとを有する発現細胞。
【請求項25】
請求項23記載のベクターを有する発現細胞。
【請求項26】
請求項25記載の発現細胞において、前記細胞は哺乳類細胞である。
【請求項27】
請求項24記載の発現細胞において、前記細胞は哺乳類細胞である。
【請求項28】
請求項1記載の抗体を産生する細胞。
【請求項29】
請求項28記載の細胞において、前記細胞はハイブリドーマである。
【請求項30】
エンドシアリンに特異的に結合するインアウト抗体を作製する方法であって、
請求項28記載の細胞を培養する工程と、
成長培地から前記抗体を回収する工程と
を有する方法。
【請求項31】
エンドシアリン陽性細胞の成長を阻害する方法であって、
前記細胞を有する対象にインアウト抗エンドシアリン抗体を投与する工程を有する、方法。
【請求項32】
請求項31記載の方法において、前記インアウト抗FRA抗体は生体分子に結合されるものである。
【請求項33】
請求項31記載の方法において、前記エンドシアリン陽性細胞は異型細胞である。
【請求項34】
請求項31記載の方法において、エンドシアニリン陽性細胞は血管神経細胞である。
【請求項35】
請求項31記載の方法において、前記対象はヒトである。
【請求項36】
請求項31記載の方法において、前記抗体は化学治療物質と結合されるものである。
【請求項37】
請求項36記載の方法において、前記化学治療物質は放射性核種である。
【請求項38】
請求項31記載の方法において、この方法は、さらに、
細胞傷害性物質を前記対象に投与する工程を有するものである。
【請求項39】
請求項31記載の方法において、この方法は、さらに、
細胞増殖抑制物質を前記対象に投与する工程を有するものである。
【請求項40】
請求項31記載の方法において、この方法は、さらに、
化学治療物質を前記対象に投与する工程を有するものである。
【請求項41】
請求項31記載の方法において、前記抗体は非複合型抗体として投与されるものである。
【請求項42】
請求項31記載の方法において、前記抗体は非複合型抗体と化学治療物質に結合した抗体との混合物として投与されるものである。
【請求項43】
キットであって、インアウト抗エンドシアリン抗体と、対象においてエンドシアリン陽性細胞の増殖を阻害する方法において前記キットを使用するための使用説明書とを有する、キット。
【請求項44】
請求項43記載のキットであって、このキットは、さらに、
少なくとも1つの化学治療物質を有するものである。
【請求項45】
請求項43記載のキットにおいて、このキットは、さらに、
少なくとも1つの診断薬を有するものである。
【請求項46】
請求項43記載のキットにおいて、このキットは、さらに、
前記抗体を前記対象に投与する方法と使用説明書を有するものである。
【請求項47】
キットであって、インアウトエンドシアリン抗体と、インビトロまたはインビボでエンドシアリン提示細胞の有無を特定する方法において、前記キットを使用するための使用説明書とを有するキット。
【請求項48】
請求項47のキットにおいて、このキットは、さらに、
少なくとも1つの診断薬を有するものである。
【請求項1】
(a)エンドシアリンに特異的に結合し、さらに(b)選択的に免疫エフェクター活性を誘発するか、或いはエンドシアリン提示細胞に内部移行する抗体。
【請求項2】
請求項1記載の抗体において、前記抗体は少なくとも約1×10−7Mの親和性でエンドシアリンに結合する。
【請求項3】
請求項1記載の抗体において、前記抗体は少なくとも約1×10−8Mの親和性でエンドシアリンに結合する。
【請求項4】
請求項1記載の抗体において、前記抗体は少なくとも約1×10−9Mの親和性でエンドシアリンに結合する。
【請求項5】
請求項1記載の抗体において、前記抗体は少なくとも約1×10−10Mの親和性でエンドシアリンに結合する。
【請求項6】
請求項1記載の抗体において、前記抗体はキメラ抗体である。
【請求項7】
請求項6記載の抗体において、前記キメラ抗体はヒト−マウスキメラ抗体である。
【請求項8】
請求項1記載の抗体において、前記抗体はヒト化抗体である。
【請求項9】
請求項1記載の抗体において、前記抗体は完全ヒト抗体である。
【請求項10】
請求項1記載の抗体において、抗体は化学治療物質に結合するものである。
【請求項11】
請求項10記載の抗体において、前記化学治療物質は放射性核種である。
【請求項12】
請求項1記載の抗体において、エンドシアリンは配列ID番号2のアミノ酸配列を有するものである。
【請求項13】
請求項1記載の抗体において、エンドシアリンは配列ID番号1のヌクレオチド配列によってコードされるものである。
【請求項14】
請求項1記載の抗体において、前記免疫エフェクター活性は抗体依存性細胞傷害作用である。
【請求項15】
請求項1記載の抗体の重鎖をコードするポリヌクレオチド。
【請求項16】
請求項1記載の抗体の軽鎖をコードするポリヌクレオチド。
【請求項17】
請求項1記載の抗体の重鎖および軽鎖をコードするポリヌクレオチド。
【請求項18】
請求項1記載の抗体を有する薬学的組成物。
【請求項19】
請求項18記載の薬学的組成物において、前記抗体は化学治療物質に結合するものである。
【請求項20】
請求項19記載の薬学的組成物において、前記化学治療物質は放射性核種である。
【請求項21】
請求項1記載の抗体の重鎖をコードするポリヌクレオチドを有するベクター。
【請求項22】
請求項1記載の抗体の軽鎖をコードするポリヌクレオチドを有するベクター。
【請求項23】
請求項1記載の抗体の重鎖と請求項1記載の抗体の軽鎖とをコードするポリヌクレオチドを有するベクター。
【請求項24】
請求項1記載の抗体の重鎖をコードするポリヌクレオチドと、請求項1記載の抗体の軽鎖をコードするポリヌクレオチドとを有する発現細胞。
【請求項25】
請求項23記載のベクターを有する発現細胞。
【請求項26】
請求項25記載の発現細胞において、前記細胞は哺乳類細胞である。
【請求項27】
請求項24記載の発現細胞において、前記細胞は哺乳類細胞である。
【請求項28】
請求項1記載の抗体を産生する細胞。
【請求項29】
請求項28記載の細胞において、前記細胞はハイブリドーマである。
【請求項30】
エンドシアリンに特異的に結合するインアウト抗体を作製する方法であって、
請求項28記載の細胞を培養する工程と、
成長培地から前記抗体を回収する工程と
を有する方法。
【請求項31】
エンドシアリン陽性細胞の成長を阻害する方法であって、
前記細胞を有する対象にインアウト抗エンドシアリン抗体を投与する工程を有する、方法。
【請求項32】
請求項31記載の方法において、前記インアウト抗FRA抗体は生体分子に結合されるものである。
【請求項33】
請求項31記載の方法において、前記エンドシアリン陽性細胞は異型細胞である。
【請求項34】
請求項31記載の方法において、エンドシアニリン陽性細胞は血管神経細胞である。
【請求項35】
請求項31記載の方法において、前記対象はヒトである。
【請求項36】
請求項31記載の方法において、前記抗体は化学治療物質と結合されるものである。
【請求項37】
請求項36記載の方法において、前記化学治療物質は放射性核種である。
【請求項38】
請求項31記載の方法において、この方法は、さらに、
細胞傷害性物質を前記対象に投与する工程を有するものである。
【請求項39】
請求項31記載の方法において、この方法は、さらに、
細胞増殖抑制物質を前記対象に投与する工程を有するものである。
【請求項40】
請求項31記載の方法において、この方法は、さらに、
化学治療物質を前記対象に投与する工程を有するものである。
【請求項41】
請求項31記載の方法において、前記抗体は非複合型抗体として投与されるものである。
【請求項42】
請求項31記載の方法において、前記抗体は非複合型抗体と化学治療物質に結合した抗体との混合物として投与されるものである。
【請求項43】
キットであって、インアウト抗エンドシアリン抗体と、対象においてエンドシアリン陽性細胞の増殖を阻害する方法において前記キットを使用するための使用説明書とを有する、キット。
【請求項44】
請求項43記載のキットであって、このキットは、さらに、
少なくとも1つの化学治療物質を有するものである。
【請求項45】
請求項43記載のキットにおいて、このキットは、さらに、
少なくとも1つの診断薬を有するものである。
【請求項46】
請求項43記載のキットにおいて、このキットは、さらに、
前記抗体を前記対象に投与する方法と使用説明書を有するものである。
【請求項47】
キットであって、インアウトエンドシアリン抗体と、インビトロまたはインビボでエンドシアリン提示細胞の有無を特定する方法において、前記キットを使用するための使用説明書とを有するキット。
【請求項48】
請求項47のキットにおいて、このキットは、さらに、
少なくとも1つの診断薬を有するものである。
【図1】


【図2A】


【図2B】


【図3】




【図2A】


【図2B】


【図3】


【公開番号】特開2012−100676(P2012−100676A)
【公開日】平成24年5月31日(2012.5.31)
【国際特許分類】
【外国語出願】
【出願番号】特願2011−290448(P2011−290448)
【出願日】平成23年12月29日(2011.12.29)
【分割の表示】特願2008−508001(P2008−508001)の分割
【原出願日】平成18年4月24日(2006.4.24)
【出願人】(506031948)モルフォテック、インク. (16)
【Fターム(参考)】
【公開日】平成24年5月31日(2012.5.31)
【国際特許分類】
【出願番号】特願2011−290448(P2011−290448)
【出願日】平成23年12月29日(2011.12.29)
【分割の表示】特願2008−508001(P2008−508001)の分割
【原出願日】平成18年4月24日(2006.4.24)
【出願人】(506031948)モルフォテック、インク. (16)
【Fターム(参考)】
[ Back to top ]

