免疫促進剤およびその製造方法
【課題】 免疫促進活性を有する天然物由来の新たな免疫促進剤およびその製造方法の提供を目的とする。
【解決手段】 本発明の免疫促進剤は、動物の心臓またはその抽出物を含むことを特徴とする。前記抽出物は、例えば、加熱処理した前記心臓の抽出物であることが好ましく、特に水溶性画分を含む抽出物であることが好ましい。本発明の免疫促進剤によれば、免疫活性を促進できる。また、本発明の免疫促進剤は、天然物由来であることから、例えば、安全性にも優れ、水産バイオマス等の利用ならびに水産廃棄物および畜産廃棄物等のゼロエミッション化にも有効である。
【解決手段】 本発明の免疫促進剤は、動物の心臓またはその抽出物を含むことを特徴とする。前記抽出物は、例えば、加熱処理した前記心臓の抽出物であることが好ましく、特に水溶性画分を含む抽出物であることが好ましい。本発明の免疫促進剤によれば、免疫活性を促進できる。また、本発明の免疫促進剤は、天然物由来であることから、例えば、安全性にも優れ、水産バイオマス等の利用ならびに水産廃棄物および畜産廃棄物等のゼロエミッション化にも有効である。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、免疫促進剤およびその製造方法に関する。
【背景技術】
【0002】
近年、環境問題の深刻化から、水産バイオマスの有効利用および水産廃棄物のゼロエミッション化が、大きく注目されている。中でも、ハマチ等は、養殖魚であることから、その廃棄物の有効利用は、非常に重要である。
【0003】
他方、種々の疾患の治療において、免疫力の強化が抵抗力の向上につながることが知られている。このため、様々な免疫活性促進剤の開発が進められている。しかしながら、化学合成された薬剤等は、免疫活性を促進する一方、副作用を生じるおそれもある。このため、安全性に優れる天然物由来の免疫活性促進剤の開発が望まれている。
【発明の概要】
【発明が解決しようとする課題】
【0004】
そこで、本発明は、免疫促進活性を有する天然物由来の新たな免疫促進剤およびその製造方法の提供を目的とする。
【課題を解決するための手段】
【0005】
本発明の免疫促進剤は、動物の心臓またはその抽出物を含むことを特徴とする。
【0006】
本発明の免疫促進剤の製造方法は、免疫促進剤の製造方法であって、動物の心臓を使用することを特徴とする。
【発明の効果】
【0007】
前記目的を達成するために、本発明者らは一連の研究を重ねた結果、例えば、Seriola quinqueradiata等の動物の心臓に、免疫促進活性があることを見出し、本発明に到達した。本発明の免疫促進剤によれば、免疫活性を促進できる。また、本発明の免疫促進剤は、原料として前記心臓を使用する。このため、例えば、廃棄される心臓を有効利用でき、水産廃棄物および畜産廃棄物等のゼロエミッション化も可能である。
【図面の簡単な説明】
【0008】
【図1】図1は、実施例1におけるハマチ心臓の抽出物に含まれるタンパク質の、SDS−PAGEの解析結果を示す写真である。
【図2】図2は、実施例4におけるハマチ心臓の抽出物の陰イオン交換クロマトグラフィーによる溶出結果のクロマトグラムを示すグラフである。
【図3】図3は、実施例4における陰イオンクロマトグラフィーにより得られた各フラクションの、SDS−PAGEの解析結果を示す写真である。
【図4】図4は、実施例4のハマチ心臓の抽出物およびブタ由来トロポミオシンにおける、IgM産生量の測定結果を示すグラフである。
【発明を実施するための形態】
【0009】
<免疫促進剤>
本発明の免疫促進剤は、前述のように、動物の心臓またはその抽出物を含むことを特徴とする。本発明の免疫促進剤は、このように天然物由来であることから、例えば、安全性にも優れ、水産バイオマス等の利用ならびに水産廃棄物および畜産廃棄物等のゼロエミッション化にも有効である。
【0010】
前記動物は、特に制限されず、例えば、哺乳類、鳥類、魚類等があげられる。前記哺乳類は、特に制限されず、例えば、ブタ、ウシ、シカ、イノシシ、ウマ等のヒトを除く非ヒト哺乳類があげられる。前記鳥類は、例えば、ニワトリ、キジ、カモ、アヒル等があげられる。前記魚類は、特に制限されず、例えば、Seriola quinqueradiata(以下、S.quinqueradiataという)、カツオ、マグロ、マダイ、マアジ、サケ、ニジマス、サメ、エイ、ハタ、クエ等があげられる。本発明の免疫促進剤の製造にあたり、例えば、入手の容易性から、前記魚類は、養殖魚が好ましく、S.quinqueradiataが特に好ましい。
【0011】
S.quinqueradiataは、あじ科の海魚である。S.quinqueradiataは、例えば、成長過程において、ハマチ(例えば、体長 40〜60cm)、ブリ等と呼ばれるが、本発明で使用するS.quinqueradiataは、いずれでもよく、成長過程は問わない。
【0012】
本発明の免疫促進剤は、前述のように、前記心臓および前記心臓の抽出物のいずれを含んでもよく、両方を含んでもよい。前記心臓および前記心臓の抽出物の形態は、特に制限されない。
【0013】
前記心臓の形状は、特に制限されず、例えば、前記動物から取り出した心臓そのものの形状でもよいし、前記心臓を破砕処理した破砕物でもよい。また、前記心臓は、例えば、取り出した前記心臓そのもの、すなわち未処理物でもよいし、種々の処理を施した処理物でもよい。前記処理は、特に制限されず、例えば、加熱処理、凍結処理および乾燥処理等があげられ、いずれか1種類の処理を施した処理物でもよいし、2種類以上の処理を施した処理物でもよい。具体例として、前記処理物は、例えば、加熱処理を施した心臓(以下、加熱物という)でもよいし、加熱処理を施していない心臓(以下、非加熱物という)でもよい。前記処理物は、例えば、乾燥処理を施した心臓(以下、乾燥物という)でもよいし、乾燥処理を施していない心臓(以下、非乾燥物という)でもよい。前記処理物は、例えば、凍結処理を施した心臓(以下、凍結物という)でもよいし、凍結処理を施していない心臓(以下、非凍結物という)でもよい。以下、「心臓」とは、特に示さない限り、これらの列記した心臓の意味を含む。前記破砕処理、前記加熱処理、前記乾燥処理、前記凍結処理については、後述する。
【0014】
前記抽出物は、前記心臓の抽出物であればよく、前記心臓は、例えば、前述の列挙したいずれの心臓であってもよい。前記抽出物は、例えば、前記心臓から溶媒を使用して抽出できる。抽出に使用する前記心臓の形状は、例えば、抽出効率に優れることから、前記破砕物が好ましい。前記心臓の抽出物は、例えば、前記加熱物の抽出物でもよいし、前記非加熱物の抽出物でもよく、好ましくは、前記加熱物の抽出物である。前記抽出方法は、後述する。
【0015】
前記溶媒は、特に制限されず、例えば、水性溶媒、非水性溶媒、これらの混合溶媒があげられ、中でも、前記水性溶媒が好ましい。前記水性溶媒は、例えば、水、緩衝液、生理食塩水等があげられる。前記緩衝液は、特に制限されず、例えば、リン酸ナトリウム緩衝液、リン酸緩衝生理食塩水、クエン酸緩衝液、炭酸ナトリウム緩衝液、トリス緩衝液、酢酸緩衝液等があげられる。前記水性溶媒のpHは、特に制限されず、例えば、3〜10、好ましくは、5〜8、より好ましくは、6.5〜7.5である。前記水性溶媒は、例えば、さらに添加剤を含んでもよく、前記添加剤は、例えば、界面活性剤、塩化ナトリウム、変性剤等があげられる。前記非水性溶媒は、例えば、有機溶媒である。具体的には、例えば、メタノール、エタノール、酢酸エチル、ヘキサン、アセトン、クロロホルム、ジメチルスルホキシド、2−プロパノール、ジエチルエーテル等があげられる。
【0016】
前記抽出物は、例えば、前記水性溶媒により抽出した、前記心臓の水溶性画分を含むことが好ましく、より好ましくは、前記加熱物の水溶性画分を含む。
【0017】
本発明者らは、前記心臓の抽出物が、免疫促進活性を示すことを見出し、さらに、前記抽出物に含まれる免疫促進物質の1つが、配列番号1で表わされるアミノ酸配列からなるゼブラフィッシュ由来トロポミオシン4 Isoform 1等のトロポミオシンと同様の機能を奏するタンパク質(以下、「トロポミオシン様タンパク質」という)であることを突き止めた。そこで、前記抽出物は、例えば、前記トロポミオシンまたは前記トロポミオシン様タンパク質を含むことが好ましい。前記トロポミオシンまたは前記トロポミオシン様タンパク質は、例えば、水溶性画分に含まれることから、前記抽出物は、前記水溶性画分を含むことが好ましく、より好ましくは、前記加熱物の水溶性画分を含む。
【0018】
前記心臓由来のトロポミオシン様タンパク質は、例えば、下記(t1)、(t2)、(t3)のタンパク質である。配列番号1で表わされるアミノ酸配列は、ゼブラフィッシュのトロポミオシン4 アイソフォーム1の配列である(Proc. Natl. Acad. Sci. U.S.A. 99 (26), 16899−16903 (2002))。
(t1)配列番号1で表わされるアミノ酸配列を含むタンパク質
(t2)配列番号1で表わされるアミノ酸配列において、1個または数個のアミノ酸が欠失、置換、挿入および/または付加されたアミノ酸配列を含み、且つ、前記(t1)のタンパク質と同一の機能を有するタンパク質
(t3)配列番号1で表わされるアミノ酸配列と70%以上の同一性を有するアミノ酸配列を含み、且つ、前記(t1)のタンパク質と同一の機能を有するタンパク質
【0019】
前記心臓由来のトロポミオシン様タンパク質は、例えば、前記(t1)、(t2)または(t3)のアミノ酸配列からなるタンパク質でもよいし、前記アミノ酸配列を含むタンパク質でもよい。前記(t3)において、相同性は、例えば、80%以上、85%以上、90%以上、95%以上、98%以上が好ましい。相同性は、例えば、BLAST等の公知のアルゴリズムに基づき、デフォルトのパラメータで算出できる。
【0020】
前記抽出物の形態は、特に制限されず、液体でも、固体でもよい。前記抽出物が液体の場合、例えば、前記抽出処理により得られた前記抽出液そのものでもよいし、前記抽出液をさらに処理した処理液でもよい。前記処理は、例えば、希釈処理、濃縮処理、精製処理等があげられ、前記処理液は、例えば、前記抽出液の希釈液、前記抽出液の濃縮液、前記抽出液の精製液等があげられる。前記精製処理は、例えば、不純物の除去処理があげられ、具体例は、ろ過処理、クロマトグラフィー処理、塩析処理、透析処理等があげられる。前記精製処理は、例えば、不純物として、分子量14,000未満の物質を除去する処理が好ましい。前記抽出物が固体の場合、例えば、前記抽出液または前記処理液から溶媒を除去したものがあげられ、ペレット、乾燥物等が例示できる。前記乾燥物は、例えば、凍結乾燥物があげられる。前記溶媒の除去処理は、例えば、自然乾燥処理、加熱乾燥処理、凍結乾燥処理等があげられる。
【0021】
本発明の免疫促進剤は、例えば、その機能を損なわない範囲で、前記心臓または前記抽出物の他に、薬学的または食品安全上許容される、その他の添加剤を含んでもよい。前記添加剤は、例えば、ビタミン、ミネラル、着色料、保存料等があげられる。
【0022】
本発明の免疫促進剤の製造方法は、特に制限されず、例えば、本発明の製造方法によって製造できる。以下に、本発明の製造方法を示すが、これには制限されない。
【0023】
<免疫促進剤の製造方法>
本発明の免疫促進剤の製造方法は、前述のように、原料として、動物の心臓を使用することを特徴とする。本発明の製造方法において、前記原料となる前記心臓は、本発明の免疫促進剤の説明において、述べた通りである。
【0024】
本発明の免疫促進剤が前記心臓を含む場合、本発明の製造方法は、例えば、以下のように行うことができる。本発明の製造方法は、例えば、前記動物から取り出した心臓そのものを、本発明の免疫促進剤とすることができる。また、本発明の製造方法は、さらに、前記取り出した心臓を処理する処理工程を含んでもよい。前記処理工程は、特に制限されず、例えば、破砕処理、加熱処理、凍結処理および乾燥処理があげられる。本発明の製造方法において、前記処理工程は、例えば、いずれか1種類の処理を行ってもよいし、2種類以上の処理を行ってもよい。
【0025】
本発明の免疫促進剤が前記心臓の抽出物を含む場合、本発明の製造方法は、例えば、以下のように行うことができる。
【0026】
本発明の製造方法は、さらに、溶媒を用いて、前記心臓を抽出処理する抽出工程を含むことが好ましい。前記溶媒は、特に制限されず、前述の通りである。特に、前記抽出工程は、例えば、前記水性溶媒を使用することが好ましく、前記水性溶媒による抽出によって、前記心臓の水溶性画分を回収することが好ましい。
【0027】
前記抽出工程は、例えば、前記溶媒による抽出によって、前記トロポミオシン様タンパク質を含む画分を回収することが好ましい。前記トロポミオシン様タンパク質は、例えば、水溶性画分に含まれることから、前記抽出工程は、前述のように、前記水性溶媒による抽出によって、前記心臓の水溶性画分を回収することが好ましい。
【0028】
前記抽出工程において、前記心臓として前記破砕物を使用する場合、本発明の製造方法は、例えば、さらに、前記心臓を破砕する破砕処理工程を含んでもよい。
【0029】
前記抽出工程において、前記心臓は、前述のように、例えば、前記加熱物でもよいし、前記非加熱物でもよい。前者の場合、本発明の製造方法は、例えば、さらに、前記心臓を加熱する加熱処理工程を含んでもよい。本発明の製造方法が、前記破砕処理工程と前記加熱処理工程とを含む場合、前記両工程のいずれを先に行ってもよく、前記両工程を同時に行ってもよい。
【0030】
本発明の製造方法は、さらに、前記抽出物を処理する処理工程を含んでもよい。前記処理を、以下、後処理ともいう。前記後処理は、例えば、希釈処理、溶媒除去処理、精製処理等があげられる。前記溶媒除去処理は、例えば、濃縮処理、乾燥処理等があげられる。前記処理工程は、例えば、いずれか1種類の処理を行ってもよいし、2種類以上の処理を行ってもよい。
【0031】
前記希釈処理は、特に制限されず、前記抽出物をさらに溶媒で希釈することにより行える。前記溶媒は、特に制限されず、前述したような水性溶媒、有機溶媒、これらの混合溶媒があげられる。
【0032】
前記溶媒除去処理は、例えば、濃縮処理、乾燥処理があげられる。前記濃縮処理は、特に制限されず、例えば、エバポレータ等を用いた減圧処理、限外ろ過膜を用いたろ過処理等があげられる。前記乾燥処理は、例えば、自然乾燥処理、加熱乾燥処理、凍結乾燥処理等があげられる。
【0033】
前記精製処理は、例えば、不純物の除去処理があげられる。このように、さらに不純物の除去を行うことによって、例えば、不純物の影響を低減し、免疫促進活性をさらに向上できる。前記精製処理は、例えば、ろ過処理、クロマトグラフィー処理、塩析処理、透析処理等があげられる。前記クロマトグラフフィー処理は、例えば、陰イオンカラムクロマトグラフィーを使用できる。前記精製処理は、例えば、不純物として、分子量7,000未満の物質を除去する処理が好ましく、より好ましくは、分子量10,000未満、さらに好ましくは14,000未満の物質である。
【0034】
以下に、本発明の免疫促進剤の製造方法について、前記抽出物を含む免疫促進剤の製造方法を一例にあげて説明する。この例では、S.quinqueradiataの心臓について説明するが、本発明は、この例には限定されない。他の動物由来の心臓を用いた場合も、例えば、同様に製造できる。
【0035】
(1)原料の準備
まず、S.quinqueradiataから取り出した心臓を準備する。前記心臓は、例えば、取出したものをそのまま生の状態で使用してもよいし、取出した後に、凍結保存されたもの解凍して使用してもよい。
【0036】
(2)破砕処理
つぎに、前記心臓を破砕処理して、前記破砕物を調製する。破砕方法は、特に制限されず、ミキサー等が使用できる。破砕処理は、例えば、溶媒の存在下または非存在下のいずれで行ってもよいが、前記溶媒の存在下で行うことが好ましい。また、前記心臓を、例えば、溶媒の存在下または非存在下で破砕した後、さらに、前記溶媒を添加してもよい。前記溶媒は、特に制限されず、前述のような各種溶媒が使用でき、中でも水性溶媒が好ましい。前記溶媒は、前述と同様に、例えば、さらに前記添加剤を含んでもよい。
【0037】
(3)加熱処理
前記破砕物に加熱処理を施す。前記加熱処理は、例えば、前記溶媒の存在下で行うことが好ましい。前記溶媒は、例えば、前記心臓の破砕時に添加された溶媒でもよいし、前記破砕後に添加された溶媒でもよい。加熱処理の条件は、特に制限されない。前記加熱処理により、例えば、免疫促進活性を亢進できる。加熱温度は、例えば、60〜140℃、好ましくは、80〜130℃、より好ましくは、100〜125℃である。加熱時間は、例えば、0を越え60分以内、好ましくは、10〜30分、より好ましくは、15〜25分である。中でも、例えば、加熱温度100〜125℃、加熱時間15〜25分の処理を行うことによって、さらに、免疫促進活性を亢進でき、特に、約120℃、20分の加熱処理が好ましい。
【0038】
前記加熱処理は、特に制限されず、例えば、従来公知の機器を使用して行うことができる。前記機器は、例えば、オートクレーブ、圧力鍋等があげられる。
【0039】
(4)抽出処理
つぎに、加熱後の前記破砕物に、溶媒を用いて抽出処理を行う。前記抽出処理は、例えば、加熱後の前記破砕物に溶媒を添加することで行ってもよいし、前記加熱処理を、前記溶媒の存在下で行うことによって、前記加熱処理と同時に行ってもよく、後者が好ましい。
【0040】
抽出処理は、さらに、前記溶媒と前記破砕物とを含む混合物を遠心分離して、溶媒画分を回収することが好ましい。前述のように、前記溶媒は、前記水性溶媒が好ましく、前記水性溶媒を使用した場合、回収する前記溶媒画分は、水性溶媒画分であり、水溶性物質が含まれることから、水溶性画分ということができる。前述のように、前記心臓に含まれる免疫促進物質の1つが、前記トロポミオシン様タンパク質であり、前記トロポミオシン様タンパク質は、水性溶媒に溶解可能であることから、前記溶媒画分は、前記水溶性画分であることが好ましい。前記遠心分離の条件は、特に制限されない。具体例として、遠心加速度は、例えば、1,960,000〜2,744,000m/s2であり、遠心時間は、例えば、20〜40分であり、温度は、例えば、4〜25℃である。
【0041】
このようにして、前記抽出物が得られる。前記抽出物は、例えば、そのまま本発明の免疫促進剤としてもよいし、さらに処理を施して、本発明の免疫促進剤としてもよい。前記処理は、前述のように、例えば、希釈処理、溶媒除去処理、精製処理等があげられる。これらの処理は、例えば、公知の方法に従って行える。
【0042】
本発明の製造方法は、前記(1)〜(4)の工程には限られず、例えば、未加熱の心臓に対して、前述と同様にして、抽出処理を行ってもよい。
【0043】
<用途>
本発明の免疫促進剤は、前述のように、免疫促進活性を有し、具体的には、例えば、in vivoおよびin vitroにかかわらず、抗体産生を亢進し、産生される抗体量を増加できる。このため、本発明の免疫促進剤は、例えば、抗体産生促進剤ということもできる。前記抗体は、例えば、IgM、IgA、IgG、IgD、IgE等があげられる。
【0044】
本発明の免疫促進剤によれば、このように免疫の促進が可能であることから、例えば、種々の疾患の予防、改善、治療等に有用である。前記疾患は、特に制限されず、例えば、癌、感染症等があげられる。前記癌は、特に制限されず、例えば、肺癌、肝臓癌、胃腸の癌、腎臓癌、膵臓癌、甲状腺癌、前立腺癌、卵巣癌、子宮癌、骨癌等があげられる。前記感染症は、特に制限されず、例えば、肝炎ウイルス、インフルエンザウイルス、ヒト免疫不全ウイルス等の各種ウイルスの感染症、MRSA、溶連菌、マイコプラズマ等の感染症等があげられる。
【0045】
本発明の免疫促進剤は、例えば、in vivoおよびin vitroのいずれで使用することもできる。in vitroの場合、例えば、前記免疫促進剤の存在下、対象を培養することが好ましい。前記対象は、特に制限されず、例えば、細胞、組織等があげられ、それらの由来は、特に制限されず、ヒト、ヒトを除く非ヒト哺乳類、鳥類等があげられる。
【0046】
in vivoの場合、例えば、前記免疫促進剤を、対象に投与することが好ましい。前記対象は、特に制限されず、ヒト、サル、ウシ、ブタ、イヌ、ネコ等の非ヒト哺乳類、ニワトリ等の鳥類、魚介類等があげられる。投与方法は、特に制限されず、例えば、経口投与でもよいし、非経口投与でもよい。前記非経口投与は、例えば、静脈注射、筋肉注射、皮下投与、直腸投与、経皮投与、腹腔内投与、局所投与等があげられる。前記免疫促進剤の投与量は、特に制限されず、例えば、動物種、年齢等に応じて適宜設定できる。前記免疫促進剤をヒト成人に投与する場合、1日あたりの投与量は、前記免疫促進剤に含まれるタンパク質量として、例えば、0.5〜100mg/kg、好ましくは、1.0〜50mg/kg、より好ましくは、1.5〜10mg/kgである。
【0047】
前記免疫促進剤は、例えば、家畜および水産魚等の飼料添加剤として使用することもできる。この場合、一般的な飼料に、前記免疫促進剤を添加剤として配合し、前記家畜等に投与することができる。
【0048】
本発明の免疫促進剤の剤型は、特に制限されず、例えば、用途に応じて適宜決定できる。前記免疫促進剤を非経口投与する場合、前記剤型は、例えば、注射用製剤、点滴製剤等の非経口製剤があげられる。前記免疫促進剤を経口投与する場合、前記剤型は、例えば、固体状または液体状の経口製剤があげられ、具体的には、錠剤、被覆錠剤、カプセル剤、丸剤、散剤、細粒剤、顆粒剤、カプセル剤、トローチ剤、液剤等があげられる。前記免疫促進剤は、例えば、賦形剤、結合剤、滑沢剤、崩壊剤、吸収促進剤、乳化剤、安定化剤、防腐剤等の各種添加剤を含んでもよく、従来公知の製剤化技術等により製剤化可能である。
【0049】
本発明の免疫促進剤は、免疫を促進させる治療において使用するための免疫促進剤である。また、本発明の免疫促進方法は、患者に、前記本発明の免疫促進剤を投与する工程を含むことを特徴とする。
【0050】
本発明の免疫促進剤は、トロポミオシンまたはトロポミオシンと同様の機能を奏するタンパク質(前記トロポミオシン様タンパク質)を含むことを特徴とする。前記トロポミオシンおよび前記トロポミオシン様タンパク質の由来は、特に制限されず、天然由来でも、化学的または遺伝子工学的に合成したタンパク質でもよい。前記トロポミオシンは、例えば、前記トロポミオシン4等があげられ、前記トロポミオシン様タンパク質は、例えば、前記トロポミオシン4様タンパク質等があげられる。前記トロポミオシンおよび前記トロポミオシン様タンパク質のアミノ酸配列は、例えば、前述の通りである。また、本発明の免疫促進剤は、前述と同様にして使用できる。
【実施例】
【0051】
つぎに、本発明の実施例について説明する。本発明は、以下の実施例により制限されない。
【0052】
[実施例1]
本例では、ハマチ心臓の抽出物を調製して、培養細胞を用いた生理活性(免疫促進活性)を評価した。
【0053】
(1)抽出物の調製
凍結保存したハマチ心臓を解凍し、10mmol/L リン酸ナトリウム緩衝液(pH7.4)を適量加えて、ミキサーにより破砕した。前記破砕物を、オートクレーブにより、120℃で所定時間(0、10、20、30分間)加熱した。加熱後の前記破砕物を、2,646,000m/s2、4℃、20分の条件で遠心分離し、上清を回収した。前記上清を、ハマチ心臓の抽出物とし、下記の試験に用いた。
【0054】
(2)培養細胞を用いた免疫促進活性の評価
前記4種類の抽出物の免疫促進活性を、動物培養細胞を用いて評価した。前記動物培養細胞は、ヒトハイブリドーマ細胞株HB4C5を使用した。まず、前記HB4C5を、ERDF培地0.2mLを用いて、前記抽出物を添加し、37℃、6時間培養した。前記抽出物は、予めタンパク質濃度を測定し、前記培養液におけるタンパク質濃度が、約1000μg/mLとなるように、前記培養液に添加した。前記培養後、前記培養液の上清を回収し、前記上清中に分泌されたIgM量を酵素抗体法で測定した(n=3)。コントロールは、前記抽出物に代えて、蒸留水を添加し、同様にしてIgM量を測定した(n=6)。
【0055】
下記表1に、IgM産生量の測定結果を示す。下記表1において、加熱0分(非加熱)、加熱10分、加熱20分および加熱30分の各抽出物のIgM産生量は、コントロールのIgM産生量(5.7±1.0ng/mL)を1とする相対値で示した。
【0056】
【表1】

【0057】
前記表1に示すように、前記各抽出物は、前記コントロールと比較して、IgM産生量が高かった。特に、20分間加熱した抽出物は、高いIgM産生量を示した。以上の結果から、前記ハマチ心臓の抽出物は、免疫促進活性を示すことが分かった。また、前記心臓を加熱した場合でも、前記抽出物は、前記免疫促進活性を示すことから、例えば、加熱調理したハマチ心臓を、免疫促進剤として有効利用することが可能といえる。
【0058】
(3)SDS−PAGE
前記4種類の抽出物に含まれるタンパク質を、SDS−PAGE(Sodium dodecyl sulfate Poly−Acrylamide Gel Electrophoresis)法およびクマシーブリリアントブルーゲル染色により解析した。図1の写真に、前記解析の結果を示す。図1において、レーン1は、分子量マーカーであり、レーン2は、加熱0分の非加熱抽出物、レーン3は、加熱10分の抽出物、レーン4は、加熱20分の抽出物、レーン5は、加熱30分の抽出物の結果を示す。図1のレーン3〜5に示すように、加熱抽出物のいずれにおいても、約33kDa程度の同じ分子量のタンパク質が存在することが確認された。前記加熱抽出物は免疫促進活性を示すことから、このタンパク質が前記活性に関与していると考えられる。
【0059】
(4)透析による影響
前記(3)の結果から、加熱後に存在が確認された前記タンパク質は、免疫促進活性に関与する免疫促進物質であることが示唆された。そこで、前記(1)と同様にして、120℃で20分間加熱した抽出物を調製し、分画分子量14,000の透析膜(セルロース透析膜、和光純薬社製)を用いて透析した。透析液は、10mmol/L リン酸ナトリウム緩衝液(pH7.4)を使用した。そして、未透析の前記抽出物と、透析後の前記抽出物とについて、前記(2)と同様にして、IgM産生量を測定し(n=3)、平均値を求めた。コントロールは、前記抽出物に代えて、10mmol/L リン酸ナトリウム緩衝液(pH7.4)を添加し、同様にしてIgM量を測定した(n=6)。
【0060】
下記表2に、IgM産生量の測定結果を示す。下記表2において、透析後の抽出物(透析あり)および未透析の抽出物(透析なし)のIgM産生量は、コントロールのIgM産生量(9.3±1.1ng/mL)を1とする相対値で示した。下記表2に示すように、前記透析によって、IgM産生量は低下しなかった。以上の結果から、前記免疫促進物質は、分子量が14,000以上の物質であることが分かった。
【0061】
【表2】

【0062】
また、前記培養液に添加する前記抽出物由来のタンパク質濃度を、3556.0μg/mLにまで増加させ、前述と同様にして、未透析の抽出物と透析後の抽出物とについて、IgM産生量を測定した。前記未透析の抽出物は、IgM産生量25.6±0.1ng/mL(n=3)であったのに対し、前記透析後の抽出物は、IgM産生量71.9±18.2ng/mL(n=3)であり、活性の向上が確認された。このように、分子量14,000未満の物質を除去することで、さらに、免疫促進活性を向上できることがわかった。
【0063】
[実施例2]
(1)マウス脾臓リンパ球を用いた免疫促進活性の評価
本例では、生体内に近い状態で前記免疫促進活性を評価するため、前記抽出物の免疫促進活性を、マウス脾臓リンパ球の初代細胞培養系を用いて、in vitroで評価した。前記抽出物は、前記実施例1の(1)で調製した、120℃で20分加熱して得た抽出物を使用した(以下、同様)。前記マウス脾臓リンパ球は、6週齢メスBALB/cマウスより摘出した脾臓から調製した。まず、5%ウシ胎児血清(FBS)を含有するRPMI1640培地に、前記抽出物を添加した。前記抽出物は、予めタンパク質濃度を測定し、前記培地におけるタンパク質濃度が約1000μg/mLとなるように、前記培地に添加した。この培地に、前記マウス脾臓リンパ球を1×106細胞/mLで接種し、さらに、37℃で24時間培養した。前記培養後、培養液の上清を回収し、前記上清に分泌された抗体量を酵素抗体法で測定した(n=3)。抗体は、IgM、IgA、IgGについて、それぞれ測定した。コントロールは、前記抽出物に代えて、10mmol/L リン酸ナトリウム緩衝液(pH7.4)を添加し、同様にして抗体産生量を測定した(n=3)。
【0064】
下記表3に、IgM、IgAおよびIgGの各抗体産生量の測定結果を示す。下記表3において、前記抽出物の各抗体産生量は、下記表3のかっこ内に示すコントロールの各抗体産生量を1とする相対値で示している。下記表3に示すように、前記抽出物は、前記コントロールと比較して、高いIgM産生量、IgA産生量およびIgG産生量を示した。この結果から、前記抽出物は、特定の培養細胞だけでなく、抗体産生細胞全般に対して免疫促進活性を示すことが示唆された。
【0065】
【表3】

【0066】
[実施例3]
(1)生体内における免疫促進活性の評価
本例では、生体内(in vivo)での前記抽出物の免疫促進活性を、マウスを用いた動物実験で評価した。前記抽出物は、前記実施例2の加熱抽出物を使用した。前記マウスは、6週齢メスBALB/cマウスを使用した。前記マウスを、投与群およびコントロール群の2群(n=5)に分けた。そして、前記抽出物を、各マウスに20日間経口投与した。前記投与群の投与条件は、タンパク質1.5mg/kg/dayとした。前記コントロール群には、前記抽出物に代えて、10mmol/L リン酸ナトリウム緩衝液を投与した。投与開始から21日目に採血し、血中の抗体濃度を酵素抗体法で測定した。
【0067】
下記表4に、血中IgM、IgAおよびIgG濃度の測定結果を示す。下記表4において、前記投与群の各血中抗体濃度は、下記表4のかっこ内に示すコントロール群の各血中抗体濃度を1とする相対値で示している。下記表4に示すように、前記投与群は、前記コントロール群と比較して、IgM、IgAおよびIgGの血中濃度が高かった。なお、IgMおよびIgAの血中濃度が有意(p<0.05)に高かった。以上の結果から、前記ハマチ心臓の抽出物が、生体内の免疫細胞の抗体産生を促進し、血中の抗体濃度を上昇させたと推察された。
【0068】
【表4】

【0069】
[実施例4]
本例では、前記ハマチ心臓の抽出物に含まれる免疫促進物質の精製および同定を行った。
【0070】
(1)免疫促進物質の精製
前記ハマチ心臓の抽出物から、液体クロマトグラフ法を用いて免疫促進物質を精製した。前記抽出物は、前記実施例2における前記加熱抽出物を使用した。前記液体クロマトグラフ法は、下記条件の陰イオン交換クロマトグラフィーにより、得られた溶出液の280nmの吸光度(シグナル強度)を測定した。
カラム:TOYOPEARL(登録商標) SuperQ−650M(東ソー社製)
カラムサイズ:1.6×13cm
アプライする抽出物量:タンパク質 200mg
溶出液:10mmol/Lリン酸ナトリウム緩衝液(pH 7.4)
NaCl濃度0〜1000mMの濃度勾配
【0071】
図2のグラフに、陰イオンカラムクロマトグラフィーのクロマトグラムを示す。図2において、横軸は、溶出時間を示し、左側の縦軸は、シグナル強度を示し、右側の縦軸は、溶出液のNaCl濃度を示す。図2に示すように、非吸着部分を含む6つのフラクション(F1〜F6)に分画した。
【0072】
前記各フラクションの免疫促進活性を、前記実施例1の(2)と同様にして、前記HB4C5細胞を用いて評価した(n=3)。また、未精製の前記抽出物についても、同様に評価した(n=3)。コントロールは、前記抽出物に代えて、10mmol/Lリン酸ナトリウム緩衝液を添加し、同様にして評価した(n=3)。この結果、前記フラクションF5およびF6が、前記コントロールと比較して、高い比活性を示した。
【0073】
(2)免疫促進物質の同定
前記(1)で得られた各フラクションについて、タンパク質の同定を行った。まず、前記各フラクション(F1〜F6)について、前記実施例1の(3)と同様にして、SDS−PAGEを行い、タンパク質を解析した。併せて、非加熱の抽出物および未精製の抽出物についても、同様にタンパク質を解析した。
【0074】
図3の写真に、前記解析の結果を示す。図3において、レーン1は、分子量マーカーであり、レーン2は、加熱0分の非加熱抽出物、レーン3は、未精製の抽出物、レーン4は、F1、レーン5は、F2、レーン6は、F3、レーン7は、F4、レーン8は、F5、レーン9は、F6の結果を示す。図3に示すように、優れたIgM産生量を示した前記フラクションF5およびF6に共通して、分子量約33kDaのタンパク質が検出された(図中の矢印)。特に、前記フラクションF6では、単一のバンドとして、前記33kDaの精製タンパク質が検出された。一方、前記フラクションF1からF4には、前記33kDaのタンパク質は検出されなかった。以上の結果から、前記33kDaのタンパク質が、前記免疫促進物質である可能性が非常に高いと推察された。
【0075】
さらに、前記33kDaのタンパク質を、LC−MS/MS法により解析し、タンパク質同定システム(マトリックスサイエンス(株)製の商品名MASCOT Server Version 2.2)を用いて同定を行った。
【0076】
以下に、解析結果を示す。前記解析におけるマスコットスコア(Score)は、545であった。また、前記解析によって、前記33kDaのタンパク質における7つの領域の配列について、ゼブラフィッシュ(Brachydanio rerio、Zebrafish、Danio rerio)由来のトロポミオシン4と共通していることがわかった。この7つの領域のトータルアミノ酸数(73アミノ酸残基)は、ゼブラフィッシュ由来のトロポミオシン4の全アミノ酸配列(284アミノ酸残基)の25.7%(Sequence Coverage)に相当した。これらの結果から、前記33kDaのタンパク質は、ゼブラフィッシュ由来のトロポミオシン4と極めて高い相同性であることが確認できた。
Tropomyosin 4, isoform 1 - Brachydanio rerio (Zebrafish) (Danio rerio)
Score: 545
Taxonomy: Danio rerio
Nominal mass (Mr): 32704
Calculated pI value: 4.66
Cleavage by Trypsin: cuts C-term side of KR unless next residue is P
Sequence Coverage: 26%
【0077】
また、以下に、ゼブラフィッシュ(Brachydanio rerio、Zebrafish、Danio rerio)由来のトロポミオシン4(Tropomyosin 4, isoform 1.)のアミノ酸配列(配列番号1)を示す。下記アミノ酸配列において、下線部は、前記33kDaのタンパク質の7つの領域と共通しているアミノ酸配列である。
(アミノ酸配列:配列番号1)
1 MEAIKKKMQM LKLDKENAID RAEQAETEQK AAEDKCKQLD DELVGLQKKL
51 RQTEDELDKY SEALKDAQEK LELSEKKAAD AEGDVAALNR RIQLVEEELD
101 RAQERLGTAL QKLEEAEKAA DESERGMKVI ENRAMKDEEK MEIQEMQLKE
151 AKHIAEEADR KYEEVARKLV ILEGELERAE ERAEVAECKA SDLEEELKNV
201 TNNLKSLEAQ AEKYSEKEDK YEEEIKVLSD KLKEAETRAE FAERTVAKLE
251 KSIDDLEDEL YAQKLKYKAI SEELDHALND TTSL
【0078】
前記33kDaのタンパク質は、ゼブラフィッシュ(Brachydanio rerio;Zebrafish;Danio rerio)由来のトロポミオシン4(Tropomyosin 4, isoform 1.)と非常に高い相同性を示した。また、前記33kDaのタンパク質は、ゼブラフィッシュ由来のトロポミオシン4の他、下記のトロポミオシンと非常に高い相同性を示した。
・Tropomyosin 4-1; Fugu rubripes (Japanese pufferfish、Takifugu rubripes)由来
・Tropomyosin 4 isoform 2; Brachydanio rerio (Zebrafish、Danio rerio)由来
・TPM4 alpha tropomyosin; Ambystoma mexicanum (Axolotl)由来
・Tropomyosin beta chain, platelet; Horse由来
・Tm-4 protein; Xenopus laevis (African clawed frog)由来
・Chromosome 1 SCAF14995; Tetraodon nigroviridis由来
・Tropomyosin beta chain, skeletal muscle [validated]; Rabbit由来
・Chromosome 15 SCAF14981; Tetraodon nigroviridis由来
・Tropomyosin 2 Skeletal muscle alpha splice form CTm7; Chicken由来
・Tropomyosin 1 Smooth muscle alpha splice form; Chicken由来
・Tropomyosin 3; Fugu rubripes (Japanese pufferfish、Takifugu rubripes)由来
【0079】
トロポミオシンは、骨格筋に存在するタンパク質であり、トロポニンとともに、骨格筋の収縮・弛緩を調節する作用がある。前記トロポミオシンの分子構造は、ほとんどがα−ヘリックスの細い棒状の分子である。脊椎動物のトロポミオシンは、アレルゲン性がないことが知られている。このことからも、トロポミオシン4様タンパク質が免疫促進を示すことは、本発明者らが初めて見出した知見といえる。
【0080】
(3)トロポミオシンの免疫促進活性
トロポミオシンの免疫促進活性を、前記実施例1の(2)と同様にして、前記HB4C5細胞を用いて評価した(n=3)。前記トロポミオシンは、市販のブタ由来トロポミオシン(トロポミオシン4、シグマ社製、配列番号2)を使用した。前記トロポミオシンは、培養液におけるタンパク質濃度が、0.6、3.1、15.6、78.0、389.9μg/mLとなるように、培養液に添加した。他方、前記実施例2で調製したハマチ心臓の前記加熱抽出物についても、同様に評価した(n=3)。前記ハマチ心臓の抽出物は、前記培養液におけるタンパク質濃度が、5.3、26.3、131.3、656.7、3283.3μg/mLとなるように、前記培養液に添加した。コントロールは、前記抽出物に代えて、10mmol/Lリン酸ナトリウム緩衝液を添加し、同様にして評価した(n=6)。
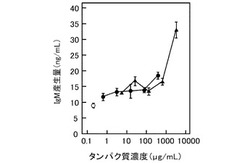
【0081】
図4のグラフに、IgM産生量の測定結果を示す。図4において、横軸は、前記培養液に添加した前記トロポミオシンおよび前記ハマチ心臓の抽出物由来のタンパク質濃度を示し、縦軸は、前記IgM産生量(IgM濃度)を示す。図4において、黒丸は、トロポミオシン、黒三角は、ハマチ心臓の抽出物、白丸は、コントロールの結果を示す。図4に示すように、前記トロポミオシンおよび前記抽出物は、いずれも、前記コントロールと比較して、高いIgM産生量を示した。この結果から、ブタ由来トロポミオシンおよびハマチ心臓の抽出物は、免疫促進活性を有していることが分かった。このことから、前記ハマチ心臓の抽出物に含まれる免疫促進物質は、トロポミオシン様タンパク質であることが確認された。このように、ブタ由来トロポミオシンおよびハマチ心臓由来トロポミオシンが免疫促進活性を有することが、新たに見出された。
【産業上の利用可能性】
【0082】
本発明の免疫促進剤によれば、免疫活性を促進できる。また、本発明の免疫促進剤は、原料として前記心臓を使用する。このため、例えば、廃棄される心臓を有効利用でき、水産廃棄物および畜産廃棄物等のゼロエミッション化も可能である。
【技術分野】
【0001】
本発明は、免疫促進剤およびその製造方法に関する。
【背景技術】
【0002】
近年、環境問題の深刻化から、水産バイオマスの有効利用および水産廃棄物のゼロエミッション化が、大きく注目されている。中でも、ハマチ等は、養殖魚であることから、その廃棄物の有効利用は、非常に重要である。
【0003】
他方、種々の疾患の治療において、免疫力の強化が抵抗力の向上につながることが知られている。このため、様々な免疫活性促進剤の開発が進められている。しかしながら、化学合成された薬剤等は、免疫活性を促進する一方、副作用を生じるおそれもある。このため、安全性に優れる天然物由来の免疫活性促進剤の開発が望まれている。
【発明の概要】
【発明が解決しようとする課題】
【0004】
そこで、本発明は、免疫促進活性を有する天然物由来の新たな免疫促進剤およびその製造方法の提供を目的とする。
【課題を解決するための手段】
【0005】
本発明の免疫促進剤は、動物の心臓またはその抽出物を含むことを特徴とする。
【0006】
本発明の免疫促進剤の製造方法は、免疫促進剤の製造方法であって、動物の心臓を使用することを特徴とする。
【発明の効果】
【0007】
前記目的を達成するために、本発明者らは一連の研究を重ねた結果、例えば、Seriola quinqueradiata等の動物の心臓に、免疫促進活性があることを見出し、本発明に到達した。本発明の免疫促進剤によれば、免疫活性を促進できる。また、本発明の免疫促進剤は、原料として前記心臓を使用する。このため、例えば、廃棄される心臓を有効利用でき、水産廃棄物および畜産廃棄物等のゼロエミッション化も可能である。
【図面の簡単な説明】
【0008】
【図1】図1は、実施例1におけるハマチ心臓の抽出物に含まれるタンパク質の、SDS−PAGEの解析結果を示す写真である。
【図2】図2は、実施例4におけるハマチ心臓の抽出物の陰イオン交換クロマトグラフィーによる溶出結果のクロマトグラムを示すグラフである。
【図3】図3は、実施例4における陰イオンクロマトグラフィーにより得られた各フラクションの、SDS−PAGEの解析結果を示す写真である。
【図4】図4は、実施例4のハマチ心臓の抽出物およびブタ由来トロポミオシンにおける、IgM産生量の測定結果を示すグラフである。
【発明を実施するための形態】
【0009】
<免疫促進剤>
本発明の免疫促進剤は、前述のように、動物の心臓またはその抽出物を含むことを特徴とする。本発明の免疫促進剤は、このように天然物由来であることから、例えば、安全性にも優れ、水産バイオマス等の利用ならびに水産廃棄物および畜産廃棄物等のゼロエミッション化にも有効である。
【0010】
前記動物は、特に制限されず、例えば、哺乳類、鳥類、魚類等があげられる。前記哺乳類は、特に制限されず、例えば、ブタ、ウシ、シカ、イノシシ、ウマ等のヒトを除く非ヒト哺乳類があげられる。前記鳥類は、例えば、ニワトリ、キジ、カモ、アヒル等があげられる。前記魚類は、特に制限されず、例えば、Seriola quinqueradiata(以下、S.quinqueradiataという)、カツオ、マグロ、マダイ、マアジ、サケ、ニジマス、サメ、エイ、ハタ、クエ等があげられる。本発明の免疫促進剤の製造にあたり、例えば、入手の容易性から、前記魚類は、養殖魚が好ましく、S.quinqueradiataが特に好ましい。
【0011】
S.quinqueradiataは、あじ科の海魚である。S.quinqueradiataは、例えば、成長過程において、ハマチ(例えば、体長 40〜60cm)、ブリ等と呼ばれるが、本発明で使用するS.quinqueradiataは、いずれでもよく、成長過程は問わない。
【0012】
本発明の免疫促進剤は、前述のように、前記心臓および前記心臓の抽出物のいずれを含んでもよく、両方を含んでもよい。前記心臓および前記心臓の抽出物の形態は、特に制限されない。
【0013】
前記心臓の形状は、特に制限されず、例えば、前記動物から取り出した心臓そのものの形状でもよいし、前記心臓を破砕処理した破砕物でもよい。また、前記心臓は、例えば、取り出した前記心臓そのもの、すなわち未処理物でもよいし、種々の処理を施した処理物でもよい。前記処理は、特に制限されず、例えば、加熱処理、凍結処理および乾燥処理等があげられ、いずれか1種類の処理を施した処理物でもよいし、2種類以上の処理を施した処理物でもよい。具体例として、前記処理物は、例えば、加熱処理を施した心臓(以下、加熱物という)でもよいし、加熱処理を施していない心臓(以下、非加熱物という)でもよい。前記処理物は、例えば、乾燥処理を施した心臓(以下、乾燥物という)でもよいし、乾燥処理を施していない心臓(以下、非乾燥物という)でもよい。前記処理物は、例えば、凍結処理を施した心臓(以下、凍結物という)でもよいし、凍結処理を施していない心臓(以下、非凍結物という)でもよい。以下、「心臓」とは、特に示さない限り、これらの列記した心臓の意味を含む。前記破砕処理、前記加熱処理、前記乾燥処理、前記凍結処理については、後述する。
【0014】
前記抽出物は、前記心臓の抽出物であればよく、前記心臓は、例えば、前述の列挙したいずれの心臓であってもよい。前記抽出物は、例えば、前記心臓から溶媒を使用して抽出できる。抽出に使用する前記心臓の形状は、例えば、抽出効率に優れることから、前記破砕物が好ましい。前記心臓の抽出物は、例えば、前記加熱物の抽出物でもよいし、前記非加熱物の抽出物でもよく、好ましくは、前記加熱物の抽出物である。前記抽出方法は、後述する。
【0015】
前記溶媒は、特に制限されず、例えば、水性溶媒、非水性溶媒、これらの混合溶媒があげられ、中でも、前記水性溶媒が好ましい。前記水性溶媒は、例えば、水、緩衝液、生理食塩水等があげられる。前記緩衝液は、特に制限されず、例えば、リン酸ナトリウム緩衝液、リン酸緩衝生理食塩水、クエン酸緩衝液、炭酸ナトリウム緩衝液、トリス緩衝液、酢酸緩衝液等があげられる。前記水性溶媒のpHは、特に制限されず、例えば、3〜10、好ましくは、5〜8、より好ましくは、6.5〜7.5である。前記水性溶媒は、例えば、さらに添加剤を含んでもよく、前記添加剤は、例えば、界面活性剤、塩化ナトリウム、変性剤等があげられる。前記非水性溶媒は、例えば、有機溶媒である。具体的には、例えば、メタノール、エタノール、酢酸エチル、ヘキサン、アセトン、クロロホルム、ジメチルスルホキシド、2−プロパノール、ジエチルエーテル等があげられる。
【0016】
前記抽出物は、例えば、前記水性溶媒により抽出した、前記心臓の水溶性画分を含むことが好ましく、より好ましくは、前記加熱物の水溶性画分を含む。
【0017】
本発明者らは、前記心臓の抽出物が、免疫促進活性を示すことを見出し、さらに、前記抽出物に含まれる免疫促進物質の1つが、配列番号1で表わされるアミノ酸配列からなるゼブラフィッシュ由来トロポミオシン4 Isoform 1等のトロポミオシンと同様の機能を奏するタンパク質(以下、「トロポミオシン様タンパク質」という)であることを突き止めた。そこで、前記抽出物は、例えば、前記トロポミオシンまたは前記トロポミオシン様タンパク質を含むことが好ましい。前記トロポミオシンまたは前記トロポミオシン様タンパク質は、例えば、水溶性画分に含まれることから、前記抽出物は、前記水溶性画分を含むことが好ましく、より好ましくは、前記加熱物の水溶性画分を含む。
【0018】
前記心臓由来のトロポミオシン様タンパク質は、例えば、下記(t1)、(t2)、(t3)のタンパク質である。配列番号1で表わされるアミノ酸配列は、ゼブラフィッシュのトロポミオシン4 アイソフォーム1の配列である(Proc. Natl. Acad. Sci. U.S.A. 99 (26), 16899−16903 (2002))。
(t1)配列番号1で表わされるアミノ酸配列を含むタンパク質
(t2)配列番号1で表わされるアミノ酸配列において、1個または数個のアミノ酸が欠失、置換、挿入および/または付加されたアミノ酸配列を含み、且つ、前記(t1)のタンパク質と同一の機能を有するタンパク質
(t3)配列番号1で表わされるアミノ酸配列と70%以上の同一性を有するアミノ酸配列を含み、且つ、前記(t1)のタンパク質と同一の機能を有するタンパク質
【0019】
前記心臓由来のトロポミオシン様タンパク質は、例えば、前記(t1)、(t2)または(t3)のアミノ酸配列からなるタンパク質でもよいし、前記アミノ酸配列を含むタンパク質でもよい。前記(t3)において、相同性は、例えば、80%以上、85%以上、90%以上、95%以上、98%以上が好ましい。相同性は、例えば、BLAST等の公知のアルゴリズムに基づき、デフォルトのパラメータで算出できる。
【0020】
前記抽出物の形態は、特に制限されず、液体でも、固体でもよい。前記抽出物が液体の場合、例えば、前記抽出処理により得られた前記抽出液そのものでもよいし、前記抽出液をさらに処理した処理液でもよい。前記処理は、例えば、希釈処理、濃縮処理、精製処理等があげられ、前記処理液は、例えば、前記抽出液の希釈液、前記抽出液の濃縮液、前記抽出液の精製液等があげられる。前記精製処理は、例えば、不純物の除去処理があげられ、具体例は、ろ過処理、クロマトグラフィー処理、塩析処理、透析処理等があげられる。前記精製処理は、例えば、不純物として、分子量14,000未満の物質を除去する処理が好ましい。前記抽出物が固体の場合、例えば、前記抽出液または前記処理液から溶媒を除去したものがあげられ、ペレット、乾燥物等が例示できる。前記乾燥物は、例えば、凍結乾燥物があげられる。前記溶媒の除去処理は、例えば、自然乾燥処理、加熱乾燥処理、凍結乾燥処理等があげられる。
【0021】
本発明の免疫促進剤は、例えば、その機能を損なわない範囲で、前記心臓または前記抽出物の他に、薬学的または食品安全上許容される、その他の添加剤を含んでもよい。前記添加剤は、例えば、ビタミン、ミネラル、着色料、保存料等があげられる。
【0022】
本発明の免疫促進剤の製造方法は、特に制限されず、例えば、本発明の製造方法によって製造できる。以下に、本発明の製造方法を示すが、これには制限されない。
【0023】
<免疫促進剤の製造方法>
本発明の免疫促進剤の製造方法は、前述のように、原料として、動物の心臓を使用することを特徴とする。本発明の製造方法において、前記原料となる前記心臓は、本発明の免疫促進剤の説明において、述べた通りである。
【0024】
本発明の免疫促進剤が前記心臓を含む場合、本発明の製造方法は、例えば、以下のように行うことができる。本発明の製造方法は、例えば、前記動物から取り出した心臓そのものを、本発明の免疫促進剤とすることができる。また、本発明の製造方法は、さらに、前記取り出した心臓を処理する処理工程を含んでもよい。前記処理工程は、特に制限されず、例えば、破砕処理、加熱処理、凍結処理および乾燥処理があげられる。本発明の製造方法において、前記処理工程は、例えば、いずれか1種類の処理を行ってもよいし、2種類以上の処理を行ってもよい。
【0025】
本発明の免疫促進剤が前記心臓の抽出物を含む場合、本発明の製造方法は、例えば、以下のように行うことができる。
【0026】
本発明の製造方法は、さらに、溶媒を用いて、前記心臓を抽出処理する抽出工程を含むことが好ましい。前記溶媒は、特に制限されず、前述の通りである。特に、前記抽出工程は、例えば、前記水性溶媒を使用することが好ましく、前記水性溶媒による抽出によって、前記心臓の水溶性画分を回収することが好ましい。
【0027】
前記抽出工程は、例えば、前記溶媒による抽出によって、前記トロポミオシン様タンパク質を含む画分を回収することが好ましい。前記トロポミオシン様タンパク質は、例えば、水溶性画分に含まれることから、前記抽出工程は、前述のように、前記水性溶媒による抽出によって、前記心臓の水溶性画分を回収することが好ましい。
【0028】
前記抽出工程において、前記心臓として前記破砕物を使用する場合、本発明の製造方法は、例えば、さらに、前記心臓を破砕する破砕処理工程を含んでもよい。
【0029】
前記抽出工程において、前記心臓は、前述のように、例えば、前記加熱物でもよいし、前記非加熱物でもよい。前者の場合、本発明の製造方法は、例えば、さらに、前記心臓を加熱する加熱処理工程を含んでもよい。本発明の製造方法が、前記破砕処理工程と前記加熱処理工程とを含む場合、前記両工程のいずれを先に行ってもよく、前記両工程を同時に行ってもよい。
【0030】
本発明の製造方法は、さらに、前記抽出物を処理する処理工程を含んでもよい。前記処理を、以下、後処理ともいう。前記後処理は、例えば、希釈処理、溶媒除去処理、精製処理等があげられる。前記溶媒除去処理は、例えば、濃縮処理、乾燥処理等があげられる。前記処理工程は、例えば、いずれか1種類の処理を行ってもよいし、2種類以上の処理を行ってもよい。
【0031】
前記希釈処理は、特に制限されず、前記抽出物をさらに溶媒で希釈することにより行える。前記溶媒は、特に制限されず、前述したような水性溶媒、有機溶媒、これらの混合溶媒があげられる。
【0032】
前記溶媒除去処理は、例えば、濃縮処理、乾燥処理があげられる。前記濃縮処理は、特に制限されず、例えば、エバポレータ等を用いた減圧処理、限外ろ過膜を用いたろ過処理等があげられる。前記乾燥処理は、例えば、自然乾燥処理、加熱乾燥処理、凍結乾燥処理等があげられる。
【0033】
前記精製処理は、例えば、不純物の除去処理があげられる。このように、さらに不純物の除去を行うことによって、例えば、不純物の影響を低減し、免疫促進活性をさらに向上できる。前記精製処理は、例えば、ろ過処理、クロマトグラフィー処理、塩析処理、透析処理等があげられる。前記クロマトグラフフィー処理は、例えば、陰イオンカラムクロマトグラフィーを使用できる。前記精製処理は、例えば、不純物として、分子量7,000未満の物質を除去する処理が好ましく、より好ましくは、分子量10,000未満、さらに好ましくは14,000未満の物質である。
【0034】
以下に、本発明の免疫促進剤の製造方法について、前記抽出物を含む免疫促進剤の製造方法を一例にあげて説明する。この例では、S.quinqueradiataの心臓について説明するが、本発明は、この例には限定されない。他の動物由来の心臓を用いた場合も、例えば、同様に製造できる。
【0035】
(1)原料の準備
まず、S.quinqueradiataから取り出した心臓を準備する。前記心臓は、例えば、取出したものをそのまま生の状態で使用してもよいし、取出した後に、凍結保存されたもの解凍して使用してもよい。
【0036】
(2)破砕処理
つぎに、前記心臓を破砕処理して、前記破砕物を調製する。破砕方法は、特に制限されず、ミキサー等が使用できる。破砕処理は、例えば、溶媒の存在下または非存在下のいずれで行ってもよいが、前記溶媒の存在下で行うことが好ましい。また、前記心臓を、例えば、溶媒の存在下または非存在下で破砕した後、さらに、前記溶媒を添加してもよい。前記溶媒は、特に制限されず、前述のような各種溶媒が使用でき、中でも水性溶媒が好ましい。前記溶媒は、前述と同様に、例えば、さらに前記添加剤を含んでもよい。
【0037】
(3)加熱処理
前記破砕物に加熱処理を施す。前記加熱処理は、例えば、前記溶媒の存在下で行うことが好ましい。前記溶媒は、例えば、前記心臓の破砕時に添加された溶媒でもよいし、前記破砕後に添加された溶媒でもよい。加熱処理の条件は、特に制限されない。前記加熱処理により、例えば、免疫促進活性を亢進できる。加熱温度は、例えば、60〜140℃、好ましくは、80〜130℃、より好ましくは、100〜125℃である。加熱時間は、例えば、0を越え60分以内、好ましくは、10〜30分、より好ましくは、15〜25分である。中でも、例えば、加熱温度100〜125℃、加熱時間15〜25分の処理を行うことによって、さらに、免疫促進活性を亢進でき、特に、約120℃、20分の加熱処理が好ましい。
【0038】
前記加熱処理は、特に制限されず、例えば、従来公知の機器を使用して行うことができる。前記機器は、例えば、オートクレーブ、圧力鍋等があげられる。
【0039】
(4)抽出処理
つぎに、加熱後の前記破砕物に、溶媒を用いて抽出処理を行う。前記抽出処理は、例えば、加熱後の前記破砕物に溶媒を添加することで行ってもよいし、前記加熱処理を、前記溶媒の存在下で行うことによって、前記加熱処理と同時に行ってもよく、後者が好ましい。
【0040】
抽出処理は、さらに、前記溶媒と前記破砕物とを含む混合物を遠心分離して、溶媒画分を回収することが好ましい。前述のように、前記溶媒は、前記水性溶媒が好ましく、前記水性溶媒を使用した場合、回収する前記溶媒画分は、水性溶媒画分であり、水溶性物質が含まれることから、水溶性画分ということができる。前述のように、前記心臓に含まれる免疫促進物質の1つが、前記トロポミオシン様タンパク質であり、前記トロポミオシン様タンパク質は、水性溶媒に溶解可能であることから、前記溶媒画分は、前記水溶性画分であることが好ましい。前記遠心分離の条件は、特に制限されない。具体例として、遠心加速度は、例えば、1,960,000〜2,744,000m/s2であり、遠心時間は、例えば、20〜40分であり、温度は、例えば、4〜25℃である。
【0041】
このようにして、前記抽出物が得られる。前記抽出物は、例えば、そのまま本発明の免疫促進剤としてもよいし、さらに処理を施して、本発明の免疫促進剤としてもよい。前記処理は、前述のように、例えば、希釈処理、溶媒除去処理、精製処理等があげられる。これらの処理は、例えば、公知の方法に従って行える。
【0042】
本発明の製造方法は、前記(1)〜(4)の工程には限られず、例えば、未加熱の心臓に対して、前述と同様にして、抽出処理を行ってもよい。
【0043】
<用途>
本発明の免疫促進剤は、前述のように、免疫促進活性を有し、具体的には、例えば、in vivoおよびin vitroにかかわらず、抗体産生を亢進し、産生される抗体量を増加できる。このため、本発明の免疫促進剤は、例えば、抗体産生促進剤ということもできる。前記抗体は、例えば、IgM、IgA、IgG、IgD、IgE等があげられる。
【0044】
本発明の免疫促進剤によれば、このように免疫の促進が可能であることから、例えば、種々の疾患の予防、改善、治療等に有用である。前記疾患は、特に制限されず、例えば、癌、感染症等があげられる。前記癌は、特に制限されず、例えば、肺癌、肝臓癌、胃腸の癌、腎臓癌、膵臓癌、甲状腺癌、前立腺癌、卵巣癌、子宮癌、骨癌等があげられる。前記感染症は、特に制限されず、例えば、肝炎ウイルス、インフルエンザウイルス、ヒト免疫不全ウイルス等の各種ウイルスの感染症、MRSA、溶連菌、マイコプラズマ等の感染症等があげられる。
【0045】
本発明の免疫促進剤は、例えば、in vivoおよびin vitroのいずれで使用することもできる。in vitroの場合、例えば、前記免疫促進剤の存在下、対象を培養することが好ましい。前記対象は、特に制限されず、例えば、細胞、組織等があげられ、それらの由来は、特に制限されず、ヒト、ヒトを除く非ヒト哺乳類、鳥類等があげられる。
【0046】
in vivoの場合、例えば、前記免疫促進剤を、対象に投与することが好ましい。前記対象は、特に制限されず、ヒト、サル、ウシ、ブタ、イヌ、ネコ等の非ヒト哺乳類、ニワトリ等の鳥類、魚介類等があげられる。投与方法は、特に制限されず、例えば、経口投与でもよいし、非経口投与でもよい。前記非経口投与は、例えば、静脈注射、筋肉注射、皮下投与、直腸投与、経皮投与、腹腔内投与、局所投与等があげられる。前記免疫促進剤の投与量は、特に制限されず、例えば、動物種、年齢等に応じて適宜設定できる。前記免疫促進剤をヒト成人に投与する場合、1日あたりの投与量は、前記免疫促進剤に含まれるタンパク質量として、例えば、0.5〜100mg/kg、好ましくは、1.0〜50mg/kg、より好ましくは、1.5〜10mg/kgである。
【0047】
前記免疫促進剤は、例えば、家畜および水産魚等の飼料添加剤として使用することもできる。この場合、一般的な飼料に、前記免疫促進剤を添加剤として配合し、前記家畜等に投与することができる。
【0048】
本発明の免疫促進剤の剤型は、特に制限されず、例えば、用途に応じて適宜決定できる。前記免疫促進剤を非経口投与する場合、前記剤型は、例えば、注射用製剤、点滴製剤等の非経口製剤があげられる。前記免疫促進剤を経口投与する場合、前記剤型は、例えば、固体状または液体状の経口製剤があげられ、具体的には、錠剤、被覆錠剤、カプセル剤、丸剤、散剤、細粒剤、顆粒剤、カプセル剤、トローチ剤、液剤等があげられる。前記免疫促進剤は、例えば、賦形剤、結合剤、滑沢剤、崩壊剤、吸収促進剤、乳化剤、安定化剤、防腐剤等の各種添加剤を含んでもよく、従来公知の製剤化技術等により製剤化可能である。
【0049】
本発明の免疫促進剤は、免疫を促進させる治療において使用するための免疫促進剤である。また、本発明の免疫促進方法は、患者に、前記本発明の免疫促進剤を投与する工程を含むことを特徴とする。
【0050】
本発明の免疫促進剤は、トロポミオシンまたはトロポミオシンと同様の機能を奏するタンパク質(前記トロポミオシン様タンパク質)を含むことを特徴とする。前記トロポミオシンおよび前記トロポミオシン様タンパク質の由来は、特に制限されず、天然由来でも、化学的または遺伝子工学的に合成したタンパク質でもよい。前記トロポミオシンは、例えば、前記トロポミオシン4等があげられ、前記トロポミオシン様タンパク質は、例えば、前記トロポミオシン4様タンパク質等があげられる。前記トロポミオシンおよび前記トロポミオシン様タンパク質のアミノ酸配列は、例えば、前述の通りである。また、本発明の免疫促進剤は、前述と同様にして使用できる。
【実施例】
【0051】
つぎに、本発明の実施例について説明する。本発明は、以下の実施例により制限されない。
【0052】
[実施例1]
本例では、ハマチ心臓の抽出物を調製して、培養細胞を用いた生理活性(免疫促進活性)を評価した。
【0053】
(1)抽出物の調製
凍結保存したハマチ心臓を解凍し、10mmol/L リン酸ナトリウム緩衝液(pH7.4)を適量加えて、ミキサーにより破砕した。前記破砕物を、オートクレーブにより、120℃で所定時間(0、10、20、30分間)加熱した。加熱後の前記破砕物を、2,646,000m/s2、4℃、20分の条件で遠心分離し、上清を回収した。前記上清を、ハマチ心臓の抽出物とし、下記の試験に用いた。
【0054】
(2)培養細胞を用いた免疫促進活性の評価
前記4種類の抽出物の免疫促進活性を、動物培養細胞を用いて評価した。前記動物培養細胞は、ヒトハイブリドーマ細胞株HB4C5を使用した。まず、前記HB4C5を、ERDF培地0.2mLを用いて、前記抽出物を添加し、37℃、6時間培養した。前記抽出物は、予めタンパク質濃度を測定し、前記培養液におけるタンパク質濃度が、約1000μg/mLとなるように、前記培養液に添加した。前記培養後、前記培養液の上清を回収し、前記上清中に分泌されたIgM量を酵素抗体法で測定した(n=3)。コントロールは、前記抽出物に代えて、蒸留水を添加し、同様にしてIgM量を測定した(n=6)。
【0055】
下記表1に、IgM産生量の測定結果を示す。下記表1において、加熱0分(非加熱)、加熱10分、加熱20分および加熱30分の各抽出物のIgM産生量は、コントロールのIgM産生量(5.7±1.0ng/mL)を1とする相対値で示した。
【0056】
【表1】

【0057】
前記表1に示すように、前記各抽出物は、前記コントロールと比較して、IgM産生量が高かった。特に、20分間加熱した抽出物は、高いIgM産生量を示した。以上の結果から、前記ハマチ心臓の抽出物は、免疫促進活性を示すことが分かった。また、前記心臓を加熱した場合でも、前記抽出物は、前記免疫促進活性を示すことから、例えば、加熱調理したハマチ心臓を、免疫促進剤として有効利用することが可能といえる。
【0058】
(3)SDS−PAGE
前記4種類の抽出物に含まれるタンパク質を、SDS−PAGE(Sodium dodecyl sulfate Poly−Acrylamide Gel Electrophoresis)法およびクマシーブリリアントブルーゲル染色により解析した。図1の写真に、前記解析の結果を示す。図1において、レーン1は、分子量マーカーであり、レーン2は、加熱0分の非加熱抽出物、レーン3は、加熱10分の抽出物、レーン4は、加熱20分の抽出物、レーン5は、加熱30分の抽出物の結果を示す。図1のレーン3〜5に示すように、加熱抽出物のいずれにおいても、約33kDa程度の同じ分子量のタンパク質が存在することが確認された。前記加熱抽出物は免疫促進活性を示すことから、このタンパク質が前記活性に関与していると考えられる。
【0059】
(4)透析による影響
前記(3)の結果から、加熱後に存在が確認された前記タンパク質は、免疫促進活性に関与する免疫促進物質であることが示唆された。そこで、前記(1)と同様にして、120℃で20分間加熱した抽出物を調製し、分画分子量14,000の透析膜(セルロース透析膜、和光純薬社製)を用いて透析した。透析液は、10mmol/L リン酸ナトリウム緩衝液(pH7.4)を使用した。そして、未透析の前記抽出物と、透析後の前記抽出物とについて、前記(2)と同様にして、IgM産生量を測定し(n=3)、平均値を求めた。コントロールは、前記抽出物に代えて、10mmol/L リン酸ナトリウム緩衝液(pH7.4)を添加し、同様にしてIgM量を測定した(n=6)。
【0060】
下記表2に、IgM産生量の測定結果を示す。下記表2において、透析後の抽出物(透析あり)および未透析の抽出物(透析なし)のIgM産生量は、コントロールのIgM産生量(9.3±1.1ng/mL)を1とする相対値で示した。下記表2に示すように、前記透析によって、IgM産生量は低下しなかった。以上の結果から、前記免疫促進物質は、分子量が14,000以上の物質であることが分かった。
【0061】
【表2】

【0062】
また、前記培養液に添加する前記抽出物由来のタンパク質濃度を、3556.0μg/mLにまで増加させ、前述と同様にして、未透析の抽出物と透析後の抽出物とについて、IgM産生量を測定した。前記未透析の抽出物は、IgM産生量25.6±0.1ng/mL(n=3)であったのに対し、前記透析後の抽出物は、IgM産生量71.9±18.2ng/mL(n=3)であり、活性の向上が確認された。このように、分子量14,000未満の物質を除去することで、さらに、免疫促進活性を向上できることがわかった。
【0063】
[実施例2]
(1)マウス脾臓リンパ球を用いた免疫促進活性の評価
本例では、生体内に近い状態で前記免疫促進活性を評価するため、前記抽出物の免疫促進活性を、マウス脾臓リンパ球の初代細胞培養系を用いて、in vitroで評価した。前記抽出物は、前記実施例1の(1)で調製した、120℃で20分加熱して得た抽出物を使用した(以下、同様)。前記マウス脾臓リンパ球は、6週齢メスBALB/cマウスより摘出した脾臓から調製した。まず、5%ウシ胎児血清(FBS)を含有するRPMI1640培地に、前記抽出物を添加した。前記抽出物は、予めタンパク質濃度を測定し、前記培地におけるタンパク質濃度が約1000μg/mLとなるように、前記培地に添加した。この培地に、前記マウス脾臓リンパ球を1×106細胞/mLで接種し、さらに、37℃で24時間培養した。前記培養後、培養液の上清を回収し、前記上清に分泌された抗体量を酵素抗体法で測定した(n=3)。抗体は、IgM、IgA、IgGについて、それぞれ測定した。コントロールは、前記抽出物に代えて、10mmol/L リン酸ナトリウム緩衝液(pH7.4)を添加し、同様にして抗体産生量を測定した(n=3)。
【0064】
下記表3に、IgM、IgAおよびIgGの各抗体産生量の測定結果を示す。下記表3において、前記抽出物の各抗体産生量は、下記表3のかっこ内に示すコントロールの各抗体産生量を1とする相対値で示している。下記表3に示すように、前記抽出物は、前記コントロールと比較して、高いIgM産生量、IgA産生量およびIgG産生量を示した。この結果から、前記抽出物は、特定の培養細胞だけでなく、抗体産生細胞全般に対して免疫促進活性を示すことが示唆された。
【0065】
【表3】

【0066】
[実施例3]
(1)生体内における免疫促進活性の評価
本例では、生体内(in vivo)での前記抽出物の免疫促進活性を、マウスを用いた動物実験で評価した。前記抽出物は、前記実施例2の加熱抽出物を使用した。前記マウスは、6週齢メスBALB/cマウスを使用した。前記マウスを、投与群およびコントロール群の2群(n=5)に分けた。そして、前記抽出物を、各マウスに20日間経口投与した。前記投与群の投与条件は、タンパク質1.5mg/kg/dayとした。前記コントロール群には、前記抽出物に代えて、10mmol/L リン酸ナトリウム緩衝液を投与した。投与開始から21日目に採血し、血中の抗体濃度を酵素抗体法で測定した。
【0067】
下記表4に、血中IgM、IgAおよびIgG濃度の測定結果を示す。下記表4において、前記投与群の各血中抗体濃度は、下記表4のかっこ内に示すコントロール群の各血中抗体濃度を1とする相対値で示している。下記表4に示すように、前記投与群は、前記コントロール群と比較して、IgM、IgAおよびIgGの血中濃度が高かった。なお、IgMおよびIgAの血中濃度が有意(p<0.05)に高かった。以上の結果から、前記ハマチ心臓の抽出物が、生体内の免疫細胞の抗体産生を促進し、血中の抗体濃度を上昇させたと推察された。
【0068】
【表4】

【0069】
[実施例4]
本例では、前記ハマチ心臓の抽出物に含まれる免疫促進物質の精製および同定を行った。
【0070】
(1)免疫促進物質の精製
前記ハマチ心臓の抽出物から、液体クロマトグラフ法を用いて免疫促進物質を精製した。前記抽出物は、前記実施例2における前記加熱抽出物を使用した。前記液体クロマトグラフ法は、下記条件の陰イオン交換クロマトグラフィーにより、得られた溶出液の280nmの吸光度(シグナル強度)を測定した。
カラム:TOYOPEARL(登録商標) SuperQ−650M(東ソー社製)
カラムサイズ:1.6×13cm
アプライする抽出物量:タンパク質 200mg
溶出液:10mmol/Lリン酸ナトリウム緩衝液(pH 7.4)
NaCl濃度0〜1000mMの濃度勾配
【0071】
図2のグラフに、陰イオンカラムクロマトグラフィーのクロマトグラムを示す。図2において、横軸は、溶出時間を示し、左側の縦軸は、シグナル強度を示し、右側の縦軸は、溶出液のNaCl濃度を示す。図2に示すように、非吸着部分を含む6つのフラクション(F1〜F6)に分画した。
【0072】
前記各フラクションの免疫促進活性を、前記実施例1の(2)と同様にして、前記HB4C5細胞を用いて評価した(n=3)。また、未精製の前記抽出物についても、同様に評価した(n=3)。コントロールは、前記抽出物に代えて、10mmol/Lリン酸ナトリウム緩衝液を添加し、同様にして評価した(n=3)。この結果、前記フラクションF5およびF6が、前記コントロールと比較して、高い比活性を示した。
【0073】
(2)免疫促進物質の同定
前記(1)で得られた各フラクションについて、タンパク質の同定を行った。まず、前記各フラクション(F1〜F6)について、前記実施例1の(3)と同様にして、SDS−PAGEを行い、タンパク質を解析した。併せて、非加熱の抽出物および未精製の抽出物についても、同様にタンパク質を解析した。
【0074】
図3の写真に、前記解析の結果を示す。図3において、レーン1は、分子量マーカーであり、レーン2は、加熱0分の非加熱抽出物、レーン3は、未精製の抽出物、レーン4は、F1、レーン5は、F2、レーン6は、F3、レーン7は、F4、レーン8は、F5、レーン9は、F6の結果を示す。図3に示すように、優れたIgM産生量を示した前記フラクションF5およびF6に共通して、分子量約33kDaのタンパク質が検出された(図中の矢印)。特に、前記フラクションF6では、単一のバンドとして、前記33kDaの精製タンパク質が検出された。一方、前記フラクションF1からF4には、前記33kDaのタンパク質は検出されなかった。以上の結果から、前記33kDaのタンパク質が、前記免疫促進物質である可能性が非常に高いと推察された。
【0075】
さらに、前記33kDaのタンパク質を、LC−MS/MS法により解析し、タンパク質同定システム(マトリックスサイエンス(株)製の商品名MASCOT Server Version 2.2)を用いて同定を行った。
【0076】
以下に、解析結果を示す。前記解析におけるマスコットスコア(Score)は、545であった。また、前記解析によって、前記33kDaのタンパク質における7つの領域の配列について、ゼブラフィッシュ(Brachydanio rerio、Zebrafish、Danio rerio)由来のトロポミオシン4と共通していることがわかった。この7つの領域のトータルアミノ酸数(73アミノ酸残基)は、ゼブラフィッシュ由来のトロポミオシン4の全アミノ酸配列(284アミノ酸残基)の25.7%(Sequence Coverage)に相当した。これらの結果から、前記33kDaのタンパク質は、ゼブラフィッシュ由来のトロポミオシン4と極めて高い相同性であることが確認できた。
Tropomyosin 4, isoform 1 - Brachydanio rerio (Zebrafish) (Danio rerio)
Score: 545
Taxonomy: Danio rerio
Nominal mass (Mr): 32704
Calculated pI value: 4.66
Cleavage by Trypsin: cuts C-term side of KR unless next residue is P
Sequence Coverage: 26%
【0077】
また、以下に、ゼブラフィッシュ(Brachydanio rerio、Zebrafish、Danio rerio)由来のトロポミオシン4(Tropomyosin 4, isoform 1.)のアミノ酸配列(配列番号1)を示す。下記アミノ酸配列において、下線部は、前記33kDaのタンパク質の7つの領域と共通しているアミノ酸配列である。
(アミノ酸配列:配列番号1)
1 MEAIKKKMQM LKLDKENAID RAEQAETEQK AAEDKCKQLD DELVGLQKKL
51 RQTEDELDKY SEALKDAQEK LELSEKKAAD AEGDVAALNR RIQLVEEELD
101 RAQERLGTAL QKLEEAEKAA DESERGMKVI ENRAMKDEEK MEIQEMQLKE
151 AKHIAEEADR KYEEVARKLV ILEGELERAE ERAEVAECKA SDLEEELKNV
201 TNNLKSLEAQ AEKYSEKEDK YEEEIKVLSD KLKEAETRAE FAERTVAKLE
251 KSIDDLEDEL YAQKLKYKAI SEELDHALND TTSL
【0078】
前記33kDaのタンパク質は、ゼブラフィッシュ(Brachydanio rerio;Zebrafish;Danio rerio)由来のトロポミオシン4(Tropomyosin 4, isoform 1.)と非常に高い相同性を示した。また、前記33kDaのタンパク質は、ゼブラフィッシュ由来のトロポミオシン4の他、下記のトロポミオシンと非常に高い相同性を示した。
・Tropomyosin 4-1; Fugu rubripes (Japanese pufferfish、Takifugu rubripes)由来
・Tropomyosin 4 isoform 2; Brachydanio rerio (Zebrafish、Danio rerio)由来
・TPM4 alpha tropomyosin; Ambystoma mexicanum (Axolotl)由来
・Tropomyosin beta chain, platelet; Horse由来
・Tm-4 protein; Xenopus laevis (African clawed frog)由来
・Chromosome 1 SCAF14995; Tetraodon nigroviridis由来
・Tropomyosin beta chain, skeletal muscle [validated]; Rabbit由来
・Chromosome 15 SCAF14981; Tetraodon nigroviridis由来
・Tropomyosin 2 Skeletal muscle alpha splice form CTm7; Chicken由来
・Tropomyosin 1 Smooth muscle alpha splice form; Chicken由来
・Tropomyosin 3; Fugu rubripes (Japanese pufferfish、Takifugu rubripes)由来
【0079】
トロポミオシンは、骨格筋に存在するタンパク質であり、トロポニンとともに、骨格筋の収縮・弛緩を調節する作用がある。前記トロポミオシンの分子構造は、ほとんどがα−ヘリックスの細い棒状の分子である。脊椎動物のトロポミオシンは、アレルゲン性がないことが知られている。このことからも、トロポミオシン4様タンパク質が免疫促進を示すことは、本発明者らが初めて見出した知見といえる。
【0080】
(3)トロポミオシンの免疫促進活性
トロポミオシンの免疫促進活性を、前記実施例1の(2)と同様にして、前記HB4C5細胞を用いて評価した(n=3)。前記トロポミオシンは、市販のブタ由来トロポミオシン(トロポミオシン4、シグマ社製、配列番号2)を使用した。前記トロポミオシンは、培養液におけるタンパク質濃度が、0.6、3.1、15.6、78.0、389.9μg/mLとなるように、培養液に添加した。他方、前記実施例2で調製したハマチ心臓の前記加熱抽出物についても、同様に評価した(n=3)。前記ハマチ心臓の抽出物は、前記培養液におけるタンパク質濃度が、5.3、26.3、131.3、656.7、3283.3μg/mLとなるように、前記培養液に添加した。コントロールは、前記抽出物に代えて、10mmol/Lリン酸ナトリウム緩衝液を添加し、同様にして評価した(n=6)。
【0081】
図4のグラフに、IgM産生量の測定結果を示す。図4において、横軸は、前記培養液に添加した前記トロポミオシンおよび前記ハマチ心臓の抽出物由来のタンパク質濃度を示し、縦軸は、前記IgM産生量(IgM濃度)を示す。図4において、黒丸は、トロポミオシン、黒三角は、ハマチ心臓の抽出物、白丸は、コントロールの結果を示す。図4に示すように、前記トロポミオシンおよび前記抽出物は、いずれも、前記コントロールと比較して、高いIgM産生量を示した。この結果から、ブタ由来トロポミオシンおよびハマチ心臓の抽出物は、免疫促進活性を有していることが分かった。このことから、前記ハマチ心臓の抽出物に含まれる免疫促進物質は、トロポミオシン様タンパク質であることが確認された。このように、ブタ由来トロポミオシンおよびハマチ心臓由来トロポミオシンが免疫促進活性を有することが、新たに見出された。
【産業上の利用可能性】
【0082】
本発明の免疫促進剤によれば、免疫活性を促進できる。また、本発明の免疫促進剤は、原料として前記心臓を使用する。このため、例えば、廃棄される心臓を有効利用でき、水産廃棄物および畜産廃棄物等のゼロエミッション化も可能である。
【特許請求の範囲】
【請求項1】
動物の心臓またはその抽出物を含むことを特徴とする免疫促進剤。
【請求項2】
前記動物が、魚類である、請求項1記載の免疫促進剤。
【請求項3】
前記魚類が、Seriola quinqueradiataである、請求項2記載の免疫促進剤。
【請求項4】
前記抽出物が、加熱処理した前記心臓の抽出物である、請求項1から3のいずれか一項に記載の免疫促進剤。
【請求項5】
前記抽出物が、前記心臓の水溶性画分を含む抽出物である、請求項1から4のいずれか一項に記載の免疫促進剤。
【請求項6】
前記水溶性画分が、トロポミオシンまたはトロポミオシン様タンパク質を含む画分である、請求項5記載の免疫促進剤。
【請求項7】
前記トロポミオシンが、トロポミオシン4であり、トロポミオシン様タンパク質が、トロポミオシン4様タンパク質である、請求項6記載の免疫促進剤。
【請求項8】
免疫促進剤の製造方法であって、
動物の心臓を使用することを特徴とする免疫促進剤の製造方法。
【請求項9】
前記動物が、魚類である、請求項8記載の免疫促進剤の製造方法。
【請求項10】
前記魚類が、Seriola quinqueradiataである、請求項9記載の免疫促進剤の製造方法。
【請求項11】
前記心臓を加熱処理する加熱工程を含む、請求項8から10のいずれか一項に記載の免疫促進剤の製造方法。
【請求項12】
前記加熱工程において、加熱温度が、60〜140℃の範囲である、請求項11記載の免疫促進剤の製造方法。
【請求項13】
前記加熱工程において、加熱時間が、0を超え60分以内である、請求項11または12記載の免疫促進剤の製造方法。
【請求項14】
溶媒を用いて、前記心臓を抽出処理する抽出工程を含む、請求項8から13のいずれか一項に記載の免疫促進剤の製造方法。
【請求項15】
前記溶媒が、水性溶媒である、請求項14記載の免疫促進剤の製造方法。
【請求項16】
前記抽出工程において、水溶性画分を回収する、請求項14または15記載の免疫促進剤の製造方法。
【請求項1】
動物の心臓またはその抽出物を含むことを特徴とする免疫促進剤。
【請求項2】
前記動物が、魚類である、請求項1記載の免疫促進剤。
【請求項3】
前記魚類が、Seriola quinqueradiataである、請求項2記載の免疫促進剤。
【請求項4】
前記抽出物が、加熱処理した前記心臓の抽出物である、請求項1から3のいずれか一項に記載の免疫促進剤。
【請求項5】
前記抽出物が、前記心臓の水溶性画分を含む抽出物である、請求項1から4のいずれか一項に記載の免疫促進剤。
【請求項6】
前記水溶性画分が、トロポミオシンまたはトロポミオシン様タンパク質を含む画分である、請求項5記載の免疫促進剤。
【請求項7】
前記トロポミオシンが、トロポミオシン4であり、トロポミオシン様タンパク質が、トロポミオシン4様タンパク質である、請求項6記載の免疫促進剤。
【請求項8】
免疫促進剤の製造方法であって、
動物の心臓を使用することを特徴とする免疫促進剤の製造方法。
【請求項9】
前記動物が、魚類である、請求項8記載の免疫促進剤の製造方法。
【請求項10】
前記魚類が、Seriola quinqueradiataである、請求項9記載の免疫促進剤の製造方法。
【請求項11】
前記心臓を加熱処理する加熱工程を含む、請求項8から10のいずれか一項に記載の免疫促進剤の製造方法。
【請求項12】
前記加熱工程において、加熱温度が、60〜140℃の範囲である、請求項11記載の免疫促進剤の製造方法。
【請求項13】
前記加熱工程において、加熱時間が、0を超え60分以内である、請求項11または12記載の免疫促進剤の製造方法。
【請求項14】
溶媒を用いて、前記心臓を抽出処理する抽出工程を含む、請求項8から13のいずれか一項に記載の免疫促進剤の製造方法。
【請求項15】
前記溶媒が、水性溶媒である、請求項14記載の免疫促進剤の製造方法。
【請求項16】
前記抽出工程において、水溶性画分を回収する、請求項14または15記載の免疫促進剤の製造方法。
【図4】


【図1】


【図2】


【図3】




【図1】


【図2】


【図3】


【公開番号】特開2012−111698(P2012−111698A)
【公開日】平成24年6月14日(2012.6.14)
【国際特許分類】
【出願番号】特願2010−260076(P2010−260076)
【出願日】平成22年11月22日(2010.11.22)
【出願人】(504147254)国立大学法人愛媛大学 (214)
【出願人】(592134583)愛媛県 (53)
【Fターム(参考)】
【公開日】平成24年6月14日(2012.6.14)
【国際特許分類】
【出願日】平成22年11月22日(2010.11.22)
【出願人】(504147254)国立大学法人愛媛大学 (214)
【出願人】(592134583)愛媛県 (53)
【Fターム(参考)】
[ Back to top ]

