免疫増幅
【課題】血液などの臨床関連試料のための高度に感度のよい、ハイスループット免疫増幅アッセイを提供する。
【解決手段】このアッセイは、オリゴヌクレオチドに複合体形成している分析物特異的結合成分を含む2つの近接構成要素の使用を含む。分析物を結合させることにより、近接構成要素のオリゴヌクレオチド部はアンプリコンを形成するのに十分に近くなる。次いで、アンプリコンの増幅および増幅した核酸の検出により、分析物の存在を検出する。本発明のアッセイの感度は、分析物と複合体化しない近接構成要素により誤ったまたは非特異的アンプリコンの形成を妨げることによって向上している。一実施形態では、互いにハイブリッド形成しないオリゴヌクレオチド部に結合するハイブリッド形成ブロッカーオリゴヌクレオチドを使用することにより、標的非依存性アンプリコンの形成を妨げる。捕捉された複合体が放出されるまでアンプリコンの形成を妨げる固相捕捉オリゴヌクレオチドを提供することにより、バックグラウンドはさらに減少している。
【解決手段】このアッセイは、オリゴヌクレオチドに複合体形成している分析物特異的結合成分を含む2つの近接構成要素の使用を含む。分析物を結合させることにより、近接構成要素のオリゴヌクレオチド部はアンプリコンを形成するのに十分に近くなる。次いで、アンプリコンの増幅および増幅した核酸の検出により、分析物の存在を検出する。本発明のアッセイの感度は、分析物と複合体化しない近接構成要素により誤ったまたは非特異的アンプリコンの形成を妨げることによって向上している。一実施形態では、互いにハイブリッド形成しないオリゴヌクレオチド部に結合するハイブリッド形成ブロッカーオリゴヌクレオチドを使用することにより、標的非依存性アンプリコンの形成を妨げる。捕捉された複合体が放出されるまでアンプリコンの形成を妨げる固相捕捉オリゴヌクレオチドを提供することにより、バックグラウンドはさらに減少している。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、溶液中の分析物を検出および定量する超高感度、ハイスループットアッセイを提供するための、分析物特異的結合成分および核酸増幅の新規な適用に関する。
【背景技術】
【0002】
興味のある分析物を検出および定量する研究分野における主要目的は、血液、血清、血漿、尿またはその他の体液などの複雑な環境にあるごく少量の分析物を検出することが可能な、高度に特異的かつ感度のよいアッセイシステムを開発することである。診断上重要な分子は、体液のその他の成分と比較して極めて微量で構成または存在し得るので、許容できるアッセイ形態は、試料中の総生体材料の割合のごく少量に相当するであろう分析物を識別しなければならない。従来の手順では分析物特異的抗体を使用して必要な識別をしていたが、抗体はその他の非標的分析物との交差反応性により限定される。高い特異性を有する抗体であっても、低い親和性で抗体に結合する分析物が豊富な環境にその抗体がごく少量で存在すれば、わずかな交差反応性により、克服できない問題が引き起こされることがある。
【0003】
免疫増幅は、免疫アッセイの感度を増大させる手段として使用されてきた。この手順では、増幅することができるDNAマーカー分子に複合体形成している抗体と抗原を接触させる。検出可能に標識された抗−抗体で抗体−抗原複合体を標識するなどの従来の手順で抗体の存在を検出する代わりに、ポリメラーゼ連鎖反応(「PCR」)によるDNAマーカーの増幅を介して、抗原−抗体−マーカー複合体を間接的に検出する。さらに、増幅したDNAは、二本鎖DNAに挿入すると蛍光を発する染料の使用などの従来の方法で検出してもよい。「免疫PCR」として知られるこの方法は、検出に抗−抗体を使用する従来のアッセイと比較して、免疫アッセイの理論感度を10000倍超増大させるのに使用されてきた。しかし、実際には抗体−核酸複合体の他の分析物への非特異的結合、または反応場所を提供するために使用している支持体表面への非特異的結合によって、免疫PCRの感度は制限されている。さらに、試料は、前回の反応の残りの増幅された標識(「アンプリコン」)によって汚染されることがある。これは、臨床的に許容されるハイスループットアッセイにこの技術を適用するには問題である。
【0004】
これらの問題を解決する努力がいくつかなされてきた。例えば、研究者らは固定化された抗体を使用して抗体−核酸−抗原複合体を固体支持体に捕捉した。これはDNA増幅の前に、複合体化していない抗原および結合していない抗体−核酸複合体の除去を促進する。別の場合では、抗原の異なる決定基に特異的な2つの抗体は、抗原を結合させることによって近接させることができる。各抗体は、隣接する抗体−オリゴヌクレオチド複合体のオリゴヌクレオチドとハイブリッド形成することができる一本鎖オリゴヌクレオチド部で修飾して二本鎖領域を形成する。オリゴヌクレオチド部のハイブリッド形成は、同じ抗原に結合したときに2つの抗体が近接することによって促進される。次いで、DNAの二本鎖領域は、抗原の存在を示す検出可能なシグナルを生じさせる増幅の対象となる。この技術は、いずれかの抗体のみの非特異的結合ではアンプリコンを形成できるには不十分なため、検出の感度を高めるのに有利である。しかし、この方法の感度は、とりわけ、誤った抗原非依存性アンプリコンの形成につながる抗体部同士の非特異的相互作用によって限定される可能性がある。
【0005】
したがって、本技術分野では、さらにより感度のよい分析物の検出方法および定量方法を提供することが引き続き必要とされている。臨床環境で有用な方法は、所望の分析物に対して極めて選択的であり、ハイスループットスクリーニング法に容易に適合することが好ましい。
【先行技術文献】
【特許文献】
【0006】
【特許文献1】米国特許第4683195号明細書
【特許文献2】米国特許第4683202号明細書
【特許文献3】米国特許第4800159号明細書
【特許文献4】米国特許第4965188号明細書
【特許文献5】米国特許第5270184号明細書
【特許文献6】米国特許第5648211号明細書
【特許文献7】米国特許第5744311号明細書
【特許文献8】米国特許第5130238号明細書
【特許文献9】米国特許第5427930号明細書
【特許文献10】米国特許第5849878号明細書
【特許文献11】米国特許第5665539号明細書
【特許文献12】米国特許第6511809号明細書
【特許文献13】米国特許出願公開第2002/006779号明細書
【特許文献14】米国特許第5928869号明細書
【特許文献15】米国特許第5919630号明細書
【特許文献16】米国特許第5935791号明細書
【特許文献17】米国特許第6316200号明細書
【特許文献18】米国特許第6379888号明細書
【特許文献19】米国特許第5840487号明細書
【特許文献20】米国特許第5919630号明細書
【特許文献21】米国特許第5846726号明細書
【特許文献22】米国特許第6054729号明細書
【特許文献23】米国特許第5863736号明細書
【特許文献24】米国特許第6066458号明細書
【非特許文献】
【0007】
【非特許文献1】Walker et al., Proc. Nat'l Acad. Sci. USA 89: 392 (1992)
【非特許文献2】Walker et al., Nucl. Acids Res. 20: 1691 (1992)
【非特許文献3】Guatelli et al., Proc. Nat'l Acad. Sci. USA 87: 1874-78 (1990)
【非特許文献4】Lizardi et al., Bio Technology 6: 1197 (1988)
【非特許文献5】Hirose et al., Clin. Chem. 44: 2446-2452 (1998)
【非特許文献6】Kwoh et al., Proc. Nat'l Acad. Sci. USA 86: 1173-77 (1989)
【非特許文献7】Sambrook et al., Molecular Cloning, A Laboratory Manual (3rd ed., 2001)
【非特許文献8】Nadeau et al., "Real-time Sequence-specific Detection of Nucleic Acids during Strand Displacement Amplification," Anal. Biochem. 276: 177-187 (1999)
【非特許文献9】http://www.bioinfo.rpi.edu/application/mfold
【非特許文献10】Zuker, Nucl. Acids. Res. 31: 3406-15 (2003)
【発明の概要】
【課題を解決するための手段】
【0008】
本発明は、ハイスループットアッセイに適した合理化された作業の流れを与える高感度、低バックグラウンドのアッセイを提供することによって、これらの要求を達成する。本発明のアッセイは、2つの「分析物特異的結合単位」、例えば抗体(「近接対」)の同じ分析物の異なるエピトープまたは近接している分析物のエピトープとの相互作用により分析物特異的アンプリコンを形成することによって分析物を検出および定量する。近接対の各構成要素(「近接構成要素」)は、一本鎖核酸、好ましくはDNA(「オリゴヌクレオチド部」または「プローブ」)に複合体形成している分析物特異的結合単位を含む。オリゴヌクレオチド部は、標的または分析物(本明細書を通じて「標的」と「分析物」は同義的に使用する)との相互作用により近接構成要素が密接に接触したときに、アンプリコンを直接的または間接的に形成する。近接構成要素と分析物との相互作用により、オリゴヌクレオチド部は密接に近接し、分析物と結合していない近接構成要素のオリゴヌクレオチド部の濃度に比べ、その有効な局所濃度を高める。この濃度効果は、結合していない近接構成要素のオリゴヌクレオチド部に比べ、アンプリコンを形成する2つのオリゴヌクレオチド部の相互作用を大いに促進させる。次いで、近接対−分析物複合体を、当技術分野でよく知られているDNA増幅技術を使用してアンプリコンを増幅することにより検出する。したがって、他のオリゴヌクレオチド部と相互作用していないオリゴヌクレオチド部は増幅することが不可能であり、アンプリコンの形成は近接対−分析物複合体のオリゴヌクレオチド部の局所的濃度の増大によって大いに促進されるため、アンプリコンの形成は標的の存在に対して高感度である。
【0009】
本発明のアッセイの感度は、分析物と複合体化していない溶液中の近接構成要素同士の誤った不要なアンプリコンの形成を妨げることにより向上するのに有利である。本発明は、1つには、近接構成要素のオリゴヌクレオチド部の一方または両方とハイブリッド形成する1つまたは複数のハイブリッド形成ブロッカーオリゴヌクレオチド(または「ハイブリッド形成ブロッカー」)を提供することによって、この目的を達成する。ハイブリッド形成ブロッカーは、分析物と複合体化していない近接構成要素同士の溶液内でのアンプリコン形成を妨げるのに有利である。ハイブリッド形成ブロッカーを使用する方法は、少なくとも1つの近接構成要素のオリゴヌクレオチド部がハイブリッド形成ブロッカーとハイブリッド形成する反応混合物中の、第1および第2の近接構成要素と分析物を接触させることを含む。混合物を加温するか、イオン強度を低下させて十分にハイブリッド形成ブロッカーを解離させ、そして混合物を冷却するか、混合物のイオン強度を増大させて、分析物に結合した近接構成要素間にアンプリコンを形成させる。一実施形態では、分析物に結合した近接構成要素の大部分は、加温ステップの間、分析物に結合したままである。別の実施形態では、ハイブリッド形成ブロッカーを近接構成要素のオリゴヌクレオチド部にモル過剰で加える。さらに別の実施形態では、ハイブリッド形成ブロッカーは「スプリントオリゴヌクレオチド」とハイブリッド形成して、スプリントオリゴヌクレオチドが近接構成要素のオリゴヌクレオチド部とハイブリッド形成できないようにする。さらなる実施形態では、「デブロッカーオリゴヌクレオチド」(または「デブロッカー」)とも呼ばれる相補配列とハイブリッド形成させることによってハイブリッド形成ブロッカーを近接構成要素のオリゴヌクレオチド部から除去する。すなわち、デブロッカーは過剰に加えた場合、ハイブリッド形成ブロッカーがオリゴヌクレオチド部またはスプリントオリゴヌクレオチドとハイブリッド形成できないように、ハイブリッド形成ブロッカーを二重鎖にして隔絶する。したがって、デブロッカーは、ハイブリッド形成ブロッカーオリゴヌクレオチドとその相補配列との間のハイブリッドの存在を減少させる。
【0010】
ハイブリッド形成ブロッカーは、その末端の一方にヘアピンループを含んでいてもよく、このヘアピン構造はDNAポリメラーゼの二本鎖「プライマー」として働く。本発明の便宜上、「プライマー」は、鋳型核酸の一本鎖とハイブリッド形成できるヌクレオチド、典型的にはDNAの短い一続きと定義する。プライマーとその相補配列との間の二重鎖ハイブリッドは、DNAポリメラーゼまたは逆転写酵素によるプライマーの伸長のための、あるいはRNAポリメラーゼによるRNA分子の合成のための開始部位を提供する。DNAポリメラーゼによる伸長がハイブリッド形成ブロッカーをオリゴヌクレオチド部から鎖置換によって除去するように、ハイブリッド形成ブロッカーはヘアピン構造の下流領域でオリゴヌクレオチド部とハイブリッド形成してもよい。この実施形態は、オリゴヌクレオチド部またはスプリントオリゴヌクレオチドから反応混合物を加温する必要なくハイブリッド形成ブロッカーを除去するのに有利であり、それにより分析物との近接構成要素の解離を回避または低減する。別の実施形態では、ハイブリッド形成ブロッカーは、近接対−分析物複合体の形成後および近接対のオリゴヌクレオチド部が互いにハイブリッド形成した後に加えられる。ハイブリッド形成ブロッカーは、まだ溶液中にある少なくとも1つの近接構成要素のオリゴヌクレオチド部とハイブリッド形成し、それにより分析物と結合していない近接対によるアンプリコンの分析物非依存的な形成を妨げる。この実施形態でも、バックグラウンドシグナルを減少させるための反応混合物の加熱は必要ではない。ヘアピン構造を他の場所でも使用してもよい。例えば、近接構成要素のオリゴヌクレオチド部の一方または両方は、アンプリコンの形成をブロックするヘアピン構造を含んでいてもよい。ヘアピンのループ内またはヘアピンに隣接する不対塩基によるオリゴヌクレオチド部のハイブリッド形成(あるいは穏やかな加熱)は、ヘアピン構造を分裂させ、それによりアンプリコンを形成および増幅させる。
【0011】
バックグラウンドシグナルは、特異的な放出オリゴヌクレオチドが提供されるまでアンプリコンの形成を妨げるか、近接対/分析物複合体を捕捉して結合していない成分を除去する固相捕捉オリゴヌクレオチドを提供することによって、好都合にさらに減少させることができる。
【0012】
さらなる利点は、抗体が結合できる任意の分析物を検出するのに利用できる一般的な試薬を使用することによって提供される。例えば、オリゴヌクレオチド部は抗Fc抗体またはプロテインAもしくはGとカップリングすることができ、これは抗体−分析物複合体の免疫グロブリン定常領域と反応する。一部の実施形態では、一方または両方の抗体は、アプタマー、受容体分析物に特異的なリガンド、またはリガンド分析物に特異的な受容体などの任意の適切な特異的検出物−標的単位と置き替えられる。一方または両方の抗体部分のこの置き換えにより、それがなければ抗体部分同士の非特異的相互作用から生じるかもしれない誤ったアンプリコンの形成が減少する。その他の適切な特異的分析物−標的単位としては、Fc、Fv、Fab’またはF(ab’)2断片などの抗体の機能的断片、がある。抗原の結合と関係していない抗体構造のサイズが小さくなると、抗原又は分析物との特異的相互作用を減少させることなく、抗体同士の非特異的相互作用が減少すると考えられている。
【0013】
本発明によって提供される利点により、血液およびその他の体液などの臨床関連試料中の分析物を検出および定量するのに使用することができるハイスルーアウトかつ極めて感度のよいアッセイが可能になる。本発明の方法によって検出および定量できる分析物は、複雑な混合物(例えば、体液)にかつてないほどごく少量で存在してもよい。一実施形態では、本発明を使用して、サイトカインなどの分析物約80fg/mlを検出している。これは、そのような低モル重量の分析物の少なくとも約10fMのモル濃度を検出する能力に換算される。
【0014】
したがって、本発明は、標的分析物ばかりでなく本発明の方法を実施するのに有用な組成物を検出および/または定量する種々の方法を提供する。例えば、任意の適切な増幅方法を本発明の方法で使用してもよい。そのような方法には、これらだけに限定するものではないが、PCR(特許文献1、特許文献2、特許文献3および特許文献4に記載)、鎖置換増幅(「SDA」;非特許文献1;非特許文献2;およびその開示の全体が本明細書に組み込まれる特許文献5参照)、好熱性鎖置換増幅(「tSDA」;その開示の全体が本明細書に組み込まれる特許文献6および特許文献7参照)、自己保持配列複製(「3SR」;非特許文献3参照)、核酸配列に基づく増幅(「NASBA」;特許文献8参照)、Qβレプリカーゼシステム(非特許文献4参照)、リガーゼ連鎖反応(「LCR」;特許文献9参照)、転写介在増幅(「TMA」;非特許文献5);および転写に基づく増幅(非特許文献6参照)がある。好ましい増幅方法はSDAである。
【0015】
アンプリコン自体は、近接対の隣接するオリゴヌクレオチド部のハイブリッド形成を含む多くの方法で形成してもよい。例えば、隣接するオリゴヌクレオチド部はそれらの長さの全体または一部分にわたってハイブリッド形成してよい。隣接するオリゴヌクレオチドが各末端部分でハイブリッド形成する場合、得られた二重鎖はDNAポリメラーゼを使用して伸長し得る。増幅反応がSDA反応を含む場合、制限エンドヌクレアーゼ認識部位は、近接構成要素のオリゴヌクレオチド部またはそれらの伸長産物の一方または両方に組み込まれてもよい。
【0016】
また、アンプリコンは、近接対のオリゴヌクレオチド部を、オリゴヌクレオチド部の各末端とハイブリッド形成するオリゴヌクレオチド「スプリント」と接触させることによって形成してもよい。オリゴヌクレオチドスプリントは、制限エンドヌクレアーゼ認識部位と、第1のオリゴヌクレオチドプローブと相補的な第1の配列をさらに含んでもよい。さらに、第1の近接構成要素のオリゴヌクレオチド部は、第2のオリゴヌクレオチドプローブと相補的な第2の配列を含んでもよい。スプリントは、第1および第2のプローブを加えるステップと、オリゴヌクレオチド部と相補的な配列をDNAポリメラーゼで伸長するステップとを含む方法で使用してもよい。第2の近接構成要素のオリゴヌクレオチド部は置換され、第1の近接構成要素のオリゴヌクレオチド部との複合体形成を介して第1の近接構成要素に付いたアンプリコンが残る。本発明の便宜上、増幅されていない置換されたオリゴヌクレオチド部を「テザー(tether)オリゴヌクレオチド」と呼ぶ。本発明の便宜上、「置換」は、鎖の置換、又は3’−5’エキソヌクレアーゼ活性を有するポリメラーゼにより触媒作用を受けた置換された鎖の加水分解などの方法により達成されてもよい。さらに、この方法は、SDAなどの任意のよく知られた増幅方法でアンプリコンを増幅するステップを含んでもよい。
【0017】
別の実施形態では、アンプリコンは近接対と分析物との複合体から放出されるのに有利であり、これにより、アッセイ支持体表面に吸着された抗体−オリゴヌクレオチド複合体からシグナルを除去することによりバックグラウンドを減少させる。この実施形態では、2つのオリゴヌクレオチドスプリントを使用してアンプリコンを形成し、近接構成要素の両方のオリゴヌクレオチド部はテザーオリゴヌクレオチドである。第1の橋かけプローブは第1の近接構成要素のオリゴヌクレオチド部の5’末端とハイブリッド形成し、第2の橋かけプローブは第2の近接構成要素のオリゴヌクレオチド部の5’末端とハイブリッド形成する。第1および第2の橋かけプローブは、それぞれの各3’末端で互いにハイブリッド形成する。ポリメラーゼで伸長すると、第1および第2の近接構成要素のオリゴヌクレオチド部は置換され、近接対−分析物複合体の残りの成分からアンプリコンが放出される。次いで、任意のよく知られた増幅方法によってこのアンプリコンを増幅する。
【0018】
別の実施形態では、近接対−分析物複合体を固体支持体に固定する。アンプリコンを上記の方法を使用して複合体から溶液へ放出し、一方、近接対−分析物の残りの成分は固体支持体に結合したままである。この実施形態では、アンプリコンを含む溶液は、増幅の前に複合体の残りの成分から完全に除去することができ、これによりバックグラウンドをさらに減少させる。
【0019】
上記に従い2つのスプリントオリゴヌクレオチドを使用することによって、標的を介在したプローブサイクル方法が可能になる。この方法は、近接対を第1および第2のスプリントオリゴヌクレオチドと接触させるステップと、オリゴヌクレオチド部の相補体をDNAポリメラーゼで伸長して、アンプリコンを近接対から置換するステップと、アンプリコンを増幅するステップと、近接対を追加の第1および第2のスプリントオリゴヌクレオチドと接触させるステップとを含む。スプリントオリゴヌクレオチドは、第1の近接構成要素のオリゴヌクレオチド部の3’末端および第2の近接構成要素のオリゴヌクレオチド部の5’末端と任意選択的にハイブリッド形成してもよい。スプリントオリゴヌクレオチドは、第1の近接構成要素のオリゴヌクレオチド部の3’末端および第2の近接構成要素のオリゴヌクレオチド部の3’末端と場合によってハイブリッド形成することができる。この両方のスプリントオリゴヌクレオチドは、第1と第2のスプリントオリゴヌクレオチドの間に架橋を形成する第3のスプリントオリゴヌクレオチドの相補配列と任意選択的にハイブリッド形成してもよい。
【0020】
さらなる実施形態では、オリゴヌクレオチドスプリントは、オリゴヌクレオチド部とハイブリッド形成せず、且つ第1のオリゴヌクレオチドプローブと相補的な第1の配列の上流である、すなわち5’方向に位置するプローブの領域に、RNAポリメラーゼプロモーターをコードする配列を含んでもよい。さらに、第1の近接構成要素のオリゴヌクレオチド部は、第2のオリゴヌクレオチドプローブと相補的な第2の配列を含んでもよい。スプリントは、第1および第2のプローブを加えるステップと、オリゴヌクレオチド部と相補的な配列をDNAポリメラーゼで伸長するステップとを含む方法で使用してもよい。第2の近接構成要素のオリゴヌクレオチド部は伸長した鎖で置換されて、これまでのところ無傷の二本鎖RNAポリメラーゼ結合性部位を含み、第1の近接構成要素に付いたアンプリコンを残す。さらに、この方法は、RNAポリメラーゼ結合性部位をRNAポリメラーゼと接触させることによって一本鎖RNAを転写するステップを含む。RNAは、標識プローブとのハイブリッド形成を含む当技術分野でよく知られた手段により検出してもよい。鎖置換に加えて、第2の近接構成要素のオリゴヌクレオチド部を、Taq DNAポリメラーゼなどの5’−3’エキソヌクレアーゼ活性を有するDNAポリメラーゼを使用して除去してもよい。
【0021】
あるいは、一本鎖RNA転写物を、RNAとその3’領域でハイブリッド形成するプライマーと接触させて、DNA−RNAハイブリッドを生成する逆転写酵素によりRNAを転写することができる。このDNA−RNAハイブリッドをRNアーゼHで消化すると、相補DNA鎖が得られる。このDNA鎖を、RNAポリメラーゼ結合性部位に対する相補体を含むプライマーと接触させると、無傷の二本鎖RNAポリメラーゼ結合性部位が再生する。DNA鎖を、一本鎖RNA転写物の合成を触媒するRNAポリメラーゼと接触させる。転写物をプライマーと接触させるステップ、プライマー−転写物ハイブリッドを逆転写酵素と接触させるステップ、DNA−RNAハイブリッドを消化するステップ、および得られる一本鎖DNAを、RNAポリメラーゼ結合性部位を再構成するプライマーと接触させるステップを繰り返して、アンプリコンを指数関数的に増幅することができる。
【0022】
本発明の増幅方法は、「均一な形態」の溶液で行ってもよく、または「不均一な形態」中で反応の成分を固体支持体に固定することを含んでもよい。不均一な形態を使用する増幅の方法では、近接構成要素、分析物、または近接構成要素もしくは近接対と分析物との複合体は、粒子または反応容器の表面などの固体支持体に固定される。この目的のため、近接構成要素または分析物は、支持体に複合体形成しているオリゴヌクレオチド(「捕捉オリゴヌクレオチド」)と相補的なオリゴヌクレオチド部を含む。近接構成要素または分析物のオリゴヌクレオチド部と捕捉オリゴヌクレオチドとの間に形成されたハイブリッドは、制限エンドヌクレアーゼ認識部位を含んでもよい。捕捉された近接構成要素または分析物は、適切な制限エンドヌクレアーゼと認識部位を接触させるステップを含む方法で固体支持体から放出される。あるいは、結合した近接構成要素または分析物を放出する方法は、温度を上昇させるか、イオン強度を低下させるか、反応混合物のpHを変更するか、ハイブリッドの変性を促進するキレート剤を加えるような手段によって、捕捉オリゴヌクレオチドと近接構成要素または分析物のオリゴヌクレオチド部とのハイブリッドを変性するステップを含む。さらに別の実施形態では、捕捉オリゴヌクレオチドは、例えば物理的、酵素的、化学的または光化学的手段による開裂を特に受け易い、切れ易い連結を含む。さらなる実施形態では、捕捉オリゴヌクレオチドまたは近接構成要素のオリゴヌクレオチド部または分析物は、プライマーと相補的な配列を含む。プライマーは、捕捉オリゴヌクレオチドと近接構成要素のオリゴヌクレオチド部または分析物との間に形成したハイブリッドとハイブリッド形成できる。次いで、近接構成要素のオリゴヌクレオチド部または分析物は、ポリメラーゼ連鎖伸長および鎖置換によってハイブリッドから置換されてもよい。関連の実施形態では、捕捉オリゴヌクレオチドはポリメラーゼ伸長の鋳型を形成するヘアピン構造を形成でき、捕捉された近接構成要素または分析物を鎖置換により放出させる。
【0023】
捕捉オリゴヌクレオチドと近接構成要素のオリゴヌクレオチド部または分析物との間のハイブリッドは、任意選択的にRNA配列を含んでもよい。近接構成要素または分析物は、ハイブリッドをRNアーゼHなどのRNアーゼと接触させることにより表面から放出される。一実施形態では、捕捉オリゴヌクレオチドとハイブリッド形成する近接構成要素のオリゴヌクレオチド部は、アンプリコンの形成に関与するオリゴヌクレオチド部である。このオリゴヌクレオチド部は捕捉オリゴヌクレオチドとハイブリッド形成している限りアンプリコンを形成できないが、例えば鎖置換によりハイブリッドからオリゴヌクレオチド部が放出されるとアンプリコンを形成できる。
【0024】
不均一な形態を使用する増幅は、分析物を反応混合物中の第1の近接構成要素と接触させるステップと、固体支持体に固定された、又はアンプリコンを含む近接対−分析物複合体を形成するのに十分な条件下で固体支持体に固定されうる第2の近接構成要素を加えるステップと、結合した近接対−分析物複合体を洗浄して固体支持体に固定されていない近接構成要素を除去するステップと、アンプリコンを増幅するステップと、増幅産物を検出するステップとを含んでもよい。第2の近接構成要素を、第1の近接構成要素を加える前、後またはそれと同時に加えてもよい。第2の近接構成要素は、任意選択的に、洗浄後だが増幅前に開裂する切れ易い連結によって固体支持体に固定してもよい。上記の近接構成要素を固体支持体に固定し、近接構成要素を上記の固体支持体から開裂する方法を使用してもよい。さらに、スプリントオリゴヌクレオチドを加えるステップを含む方法など、上記のアンプリコンを形成する方法のいずれかを不均一な形態で使用することができる。
【0025】
本発明は、上記の増幅方法のいずれでも使用できる一般的な成分を提供するのに有利である。好ましい実施形態では、分析物を、第1のエピトープと結合する第1の抗体および第2のエピトープと結合する第2の抗体と接触させる。ここで、第1および第2のエピトープおよび抗体は同じでも異なってもよい。第1および第2の抗体はそれぞれ、異なるハプテン部(例えば、ビオチン、フルオレセイン、ジゴキシゲニン、トリニトロフェノール、ジニトロフェノールなど)で任意選択的に標識されてもよい。抗体は、第1および/または第2の抗体と特異的に結合してアンプリコンを含む近接対を形成する1つまたは複数の近接構成要素を含む一般的な成分と接触させる。一般的な成分は、例えばオリゴヌクレオチド部に複合体形成したプロテインAまたはプロテインGでもよい。あるいは、一般的な成分は、オリゴヌクレオチドに複合体形成している抗免疫グロブリン定常領域の抗体であってもよい。第1および第2の抗体がハプテン部で標識されていれば、一般的な成分は特定のハプテン標識に特異的な抗体(またはストレプトアビジンなどのその他の作用物質)でもよい。一般的な成分を使用することは、各分析物に特異的な分析物結合単位をオリゴヌクレオチド部で修飾する必要性をなくすのに有利である。
【0026】
近接構成要素は、2つの異なるオリゴヌクレオチド部に複合体形成している抗原でもよい。この実施形態の分析物は、IgGまたは任意のその他のタイプの抗体でもよい抗原特異的抗体である。結合した抗原−オリゴヌクレオチド複合体が異なるオリゴヌクレオチド部を含む場合、抗体による抗原−オリゴヌクレオチド複合体の結合により、アンプリコンを含み得る近接対が形成される。したがって、この方法を使用して、特定の抗体の存在を高感度で検出することができる。
【0027】
また、本発明は、緩衝液、化学試薬、酵素、オリゴヌクレオチド、近接構成要素などの本発明の方法を実施するのに有用な個々のまたは組み合わせた成分および試薬、ならびにこれらの成分または試薬を使用するための指示書を含むことができるキットを提供する。例えば、このキットは本明細書に記載の増幅方法および検出方法を実施するのに適切なオリゴヌクレオチド増幅プライマーを含んでいてもよい。さらにキットは、放射標識、酵素基質、抗体などの増幅した核酸を検出するための試薬および溶液を含んでもよい。適切な溶液および試薬はよく知られており、例えば非特許文献7に記載されている。キットの構成品は、一般的な容器に一緒にパッケージされており、通常、本明細書で開示の方法の実施形態を実施するための指示書を含む。
【図面の簡単な説明】
【0028】
【図1A】抗原とオリゴヌクレオチドに複合体形成している抗体との混合を示す図である。
【図1B】隣接するプローブのハイブリッド形成を示す図である。
【図1C】ポリメラーゼ伸長および制限酵素ニック形成を示す図である。
【図1D】伸長、置換および線形増幅を示す図である。
【図1E】ハイブリッド形成、ポリメラーゼ伸長、ニック形成および指数関数的増幅を示す図である。
【図1F】抗原とオリゴヌクレオチドに複合体形成している抗体との混合を示す図である。
【図1G】隣接するプローブのハイブリッド形成を示す図である。
【図1H】プローブのポリメラーゼによる伸長を示す図である。
【図1I】プローブ伸長二重鎖の変性およびSDAプライマーの結合を示す図である。
【図1J】反対の配列方向のハイブリッド形成したプローブからのアンプリコン形成を示す図である。
【図2A】スプリントオリゴヌクレオチドのハイブリッド形成を示す図である。
【図2B】隣接するプローブの連結を示す図である。
【図2C】DNAポリメラーゼ伸長および置換を示す図である。
【図2D】第3のプローブを連結するための2つのハイブリッド形成した近接プローブの使用を示す図である。
【図2E】第3のプローブを連結するための反対の配列方向の2つのハイブリッド形成した近接プローブの使用を示す図である。
【図3A】一本鎖テザープローブを示す図である。
【図3B】一本鎖テザープローブの伸長および置換を示す図である。
【図3C】ニック形成、伸長、置換および捕捉を示す図である。
【図3D】ニック形成、伸長、置換および捕捉を示す図である。
【図3E】3’/3’構造を有するスプリントオリゴヌクレオチドを示す図である。
【図3F】スプリントオリゴヌクレオチドの伸長/置換を示す図である。
【図3G】標的介在プローブサイクルを示す図である。
【図3H】5’/3’構造を有するスプリントオリゴヌクレオチドを示す図である。
【図3I】5’/5’構造を有するスプリントオリゴヌクレオチドを示す図である。
【図3J】3’/3’構造を有するスプリントオリゴヌクレオチドを示す図である。
【図3K】3’/3’構造を有するスプリントオリゴヌクレオチドを示す図である。
【図3L】スプリントオリゴヌクレオチドの捕捉された複合体からの置換を示す図である。
【図4A】単純な競合的ハイブリッド形成ブロッカーを示す図である。
【図4B】陥入型競合的ハイブリッド形成ブロッカーを示す図である。
【図4C】無能力化ハイブリッド形成ブロッカーを示す図である。
【図4D】置換可能なハイブリッド形成ブロッカーを示す図である。
【図4E】自己置換型ハイブリッド形成ブロッカーを示す図である。
【図4EE】プローブ−ブロッカー二重鎖を安定化するための3’プローブ末端の使用を示す図である。
【図4F】二元免疫SDA反応での競合的ハイブリッド形成ブロッカーを示す図である。
【図4G】二元免疫SDA反応での無能力化ハイブリッド形成ブロッカーを示す図である。
【図4H】二元免疫SDA反応での段階的ブロッキングを示す図である。
【図4I】二元免疫SDA反応でのハイブリッド形成ブロッカーの結合後の添加を示す図である。
【図5A】スプリントオリゴヌクレオチドのハイブリッド形成を示す図である。
【図5B】伸長および置換を示す図である。
【図5C】RNAポリメラーゼ活性、ハイブリッド形成および伸長を示す図である。
【図5D】RNアーゼH活性、ハイブリッド形成および伸長を示す図である。
【図6A】付着した複合体の制限エンドヌクレアーゼ介在型放出を示す図である。
【図6B】付着した複合体の制限エンドヌクレアーゼ介在型放出を示す図である。
【図6C】付着した複合体の制限エンドヌクレアーゼ介在型放出を示す図である。
【図6D】ポリメラーゼおよび制限エンドヌクレアーゼ介在型放出を示す図である。
【図6E】ポリメラーゼおよび制限エンドヌクレアーゼ介在型放出を示す図である。
【図6F】物理的放出を示す図である。
【図6G】切れやすい連結および化学的開裂を示す図である。
【図6GG】切れやすい連結および化学的開裂を示す図である。
【図6H】オリゴヌクレオチド置換を示す図である。
【図6I】オリゴヌクレオチド伸長を示す図である。
【図6J】オリゴヌクレオチド伸長を示す図である。
【図6K】RNアーゼH放出を示す図である。
【図6L】RNアーゼH放出を示す図である。
【図6M】自己プライミング捕捉/置換オリゴヌクレオチドを示す図である。
【図6N】置換されたプローブ部のアンプリコン形成への関与を示す図である。
【図7A】第1の近接構成要素のオリゴヌクレオチド部の捕捉オリゴヌクレオチドとのハイブリッド形成による第1の近接構成要素の固定化を示す図である。
【図7B】固定化された第1の近接構成要素への標的分析物の結合を示す図である。
【図7C】標的分析物と第1の近接構成要素との間の固定化複合体への第2の近接構成要素の結合による固定化された2部位の「サンドイッチ」の形成を示す図である。
【図7D】標的非依存性アンプリコンが形成するメカニズムを示す図である。
【図7E】標的非依存性アンプリコンの形成につながるプローブ−プローブ相互作用を抑制するためのハイブリッド形成ブロッカーオリゴヌクレオチドの使用を示す図である。
【図7F】標的非依存性アンプリコンの形成につながるプローブ−プローブ相互作用を抑制するためのハイブリッド形成ブロッカーオリゴヌクレオチドの使用を示す図である。
【図7G】標的非依存性アンプリコンの形成につながるプローブ−プローブ相互作用を抑制するためのハイブリッド形成ブロッカーオリゴヌクレオチドの使用を示す図である。
【図7H】標的非依存性アンプリコンの形成につながるプローブ−プローブ相互作用を抑制するためのハイブリッド形成ブロッカーオリゴヌクレオチドの使用を示す図である。
【図7I】低イオン強度を使用する、標的分析物と2つの近接構成要素との間の固定化された複合体の放出を示す図である。
【図7J】捕捉オリゴヌクレオチドの使用および不均一なアッセイ形態への放出を示す図である。
【図8A】不均一な免疫増幅を示す図である。
【図8B】不均一な免疫増幅を示す図である。
【図8C】不均一な免疫増幅を示す図である。
【図8D】切れやすい連結による不均一な免疫増幅を示す図である。
【図9】スプリントオリゴヌクレオチドによる不均一な免疫増幅を示す図である。
【図10】一般的な免疫増幅システムを示す図である。
【図11A】ヘアピン放出プローブを示す図である。
【図11B】ヘアピンハイブリッド形成ブロッカープローブを示す図である。
【図11C】ヘアピンハイブリッド形成ブロッカープローブの置換を示す図である。
【図12】抗原特異的免疫グロブリンの検出を示す図である。
【図13】二元免疫SDA用の代表的なプローブ、プライマーおよびテザーオリゴヌクレオチドの地図を表す図である。
【図14A】第1の近接構成要素および第2の近接構成要素に付着したが、ただし、両方の近接構成要素に同時には付着していないアンプリコンを形成するための3’キャップされたオリゴヌクレオチド部の使用を示す図である。
【図14B】第1の近接構成要素および第2の近接構成要素に付着したが、ただし、両方の近接構成要素に同時には付着していないアンプリコンを形成するための3’キャップされたオリゴヌクレオチド部の使用を示す図である。
【図14C】第1の近接構成要素および第2の近接構成要素に付着した、ただし、両方の近接構成要素に同時には付着していないアンプリコンを形成するための3’キャップされたオリゴヌクレオチド部の使用を示す図である。
【図14D】第1の近接構成要素および第2の近接構成要素に付着した、ただし、両方の近接構成要素に同時には付着していないアンプリコンを形成するための3’キャップされたオリゴヌクレオチド部の使用を示す図である。
【図14E】第1の近接構成要素および第2の近接構成要素に付着した、ただし、両方の近接構成要素に同時には付着していないアンプリコンを形成するための3’キャップされたオリゴヌクレオチド部の使用を示す図である。
【図15A】IL−8の免疫SDA検出のための2色のリアルタイム蛍光プロファイルを示す図である。
【図15B】IL−8の定量のための検量線を示す図である。
【発明を実施するための形態】
【0029】
本発明により、ごく少量の分析物を高い感度で検出することができる。本発明は、アンプリコンを形成できるオリゴヌクレオチド部に複合体形成した、抗体などの分析物特異的結合因子の複合体を提供する。抗体とオリゴヌクレオチドを有するその他のタンパク質との間の複合体形成は、当技術分野で知られており、例えば参照によりその全体が本明細書に組み込まれる特許文献10および特許文献11で教示されている。分析物特異的結合因子が核酸、例えばアプタマーである場合、分析物特異的結合因子及びオリゴヌクレオチド部またはプローブ部は、1つの隣接した鎖内において、当技術分野で知られた化学合成方法を使用して合成され得る。さらに、用語「複合体形成(conjugate)」は、そのようなアプタマー−プローブ単位にも適用される。抗体にそれぞれ複合体形成しているオリゴヌクレオチドを結びつけることによりアンプリコンを構築する条件も知られており、例えば特許文献12で教示されている。アンプリコンを増幅するための、およびそれらの存在を検出するための条件および方法論も、その全体が参照により本明細書に組み込まれる特許文献12および特許文献13で教示されているように当技術分野で知られている。また、増幅産物を検出するために標識プローブを使用することも、例えば特許文献14、特許文献15、特許文献16、特許文献17および特許文献18で教示されており、それらすべての全体は参照により本明細書に組み込まれる。特許文献19は、恒温核酸増幅反応での内部対照の使用を教示しており、その全体は参照により本明細書に組み込まれる。
【0030】
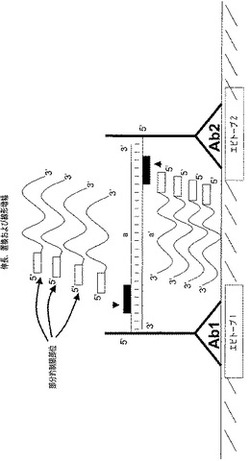
本発明によれば、SDAによる好ましい増幅方法は図1で詳述する。Ab1およびAb2はそれぞれ、隣接するエピトープ1および2を認識し、オリゴヌクレオチドプローブP1およびP2に複合体形成している抗体である(図1A)。抗体は、この例に限定するわけではないが、本発明で有用な分析物特異的結合成分の代表的なものである。例えば、当技術分野で知られている有用な分析物特異的結合成分には、Fc、Fv、Fab’およびF(ab’)2断片などの抗体の機能的断片が含まれる。分析物特的結合成分のその他の例は、アプタマー、受容体分析物に特異的なリガンド、またはリガンド分析物に特異的な受容体を含む。さらに、種々の異なるタイプの分析物特異的結合成分を組み合わせて使用してもよいことを当業者は理解するであろう。「オリゴヌクレオチドプローブ」および「オリゴヌクレオチド部」は本発明の便宜上、同義的に使用する。用語「オリゴヌクレオチド」は、本発明の便宜上、核酸部のサイズの上限を設けるものと理解するべきではない。したがって、本明細書の使用では「オリゴヌクレオチド」は「ポリヌクレオチド」と同義である。本発明の便宜上、オリゴヌクレオチドは、全体的または部分的にDNA、RNAまたはそれらの類似体もしくは誘導体で構成されていてもよい。この実施形態では、P1およびP2は、相補的な3’末端配列および上流のSDAニック部位を含む。SDAのためのニック部位の使用および一般的なSDAの条件は、特許文献15、特許文献20および特許文献21に記載されており、それらの全体は参照により本明細書に組み込まれる。P1とP2の3’末端は、連結されている2つの抗体がそれらの各エピトープに結合することにより近くに近接して保持されている場合に、互いにハイブリッド形成する(図1B)。核酸のハイブリッド形成した部分の塩基対またはミスマッチの数ならびにハイブリッド形成が生じる緩衝液の温度およびイオン強度を含む、核酸ハイブリッド形成につながる条件は、当技術分野でよく知られており、例えば非特許文献7で概説されている。Ab1およびAb2のバルク溶液濃度は、P1とP2の抗原非依存性ハイブリッド形成が最少になるように、抗原の表面の濃度と比較して相対的に低い。次いで、DNAポリメラーゼを使用してP1:P2ハイブリッドの陥入した3’末端を平滑化する(図1C)。これは、SDAニック形成酵素が認識する二本鎖制限部位の生成に役立つ。ニック形成酵素は二本鎖DNA鋳型の一本鎖のみの開裂を触媒する。ニック形成およびニックの部位からのポリメラーゼ伸長は下流のDNA鎖を溶液に置換し、ニック部位を再生する(図1D)。ニック形成および伸長/置換ステップの繰返しサイクルを使用して、置換された鎖の多数のコピーを産生することができる。置換された鎖は相補的なSDAプライマーによって捕捉される(図1E)。捕捉した鎖およびハイブリッド形成したSDAプライマーの3’末端からの伸長により、一連の中間体を経て指数関数的に増幅できる二本鎖DNA分子を産生される。代替的な実施形態では、オリゴヌクレオチドプローブP1およびP2の一方のみがSDAニック部位を含む。
【0031】
別の実施形態(図1F〜I)では、プローブP1およびP2はSDAニック部位を欠くが、代わりに配列cおよびd’を含み、これはそれぞれSDAプライマーSP2およびSP1にも存在する(図1I参照)。P1およびP2の3’末端を伸長することにより、P1の伸長産物に相補配列dとP2の伸長産物に相補配列c’とを含有する二重鎖を作製する(図1H参照)。次いで、例えば加熱により二重鎖伸長産物の鎖を分けると、SDAプライマーSP1およびSP2は、伸長したプローブの新たに合成された配列dおよびc’の相補体とハイブリッド形成する。伸長したプローブは、伸長したP1の配列eおよび伸長したP2の配列b’として示した、SDAプライマーの結合性部位の3’側に位置する配列を任意選択的に含んでもよい。これらの配列はバンパープライマーSB1およびSB2とハイブリッド形成する(図1I参照)。SDAの間、SDAプライマーSP1およびSP2はポリメラーゼによって伸長される(図示せず)。もし存在するならば、バンパープライマーの伸長によりSDAプライマー伸長産物をプローブ鎖から置換され、次いで置換された鎖は、特許文献5、特許文献15、特許文献20および特許文献21で記載されたように、SDAで増幅される。もし伸長したプローブがSP1およびSP2結合性部位に対して配列3’を含有しない場合(図示せず)は、SDAプライマーとハイブリッド形成するプローブの3’末端はポリメラーゼによって伸長されて、その後のニック形成および上記のSDAによる鎖置換を可能にするニック形成可能な制限部位を作製する。
【0032】
前述の実施形態では、オリゴヌクレオチド部(P1およびP2)は、それらの5’末端または5’末端の近くに位置する連結を介してそれらの各分析物結合単位(Ab1およびAb2)に複合体形成していた。図1Jで説明した代替的な実施形態では、複合体形成Ab1−P1はP1の3’末端または3’末端の近くに位置する連結を介して形成され、一方、複合体形成Ab2−P2はP2の5’末端または5’末端の近くに位置する連結を介して形成される。P1は配列(abcdef)(5’側から3’側に読む)を含み、P2は配列(j’i’h’g’f’e’)(5’側から3’側に読む)を含む。さらに、Ab2−P2は、伸長可能な3’末端(すなわち3’末端ヒドロキシル基)を含む。示した通り、P2の配列(f’e’)とハイブリッド形成することが可能なP1の配列(ef)は、P1がAb1に複合体形成する部位の5’に位置し、一方、(f’e’)はP2がAb2に複合体形成する部位の3’に位置する。したがって、プローブP1およびP2は、反対の配列方向のそれらの各分析物結合単位(Ab1またはAb2)と連結するといえる。P1とP2が、例えばそれらの各近接構成要素の同じ標的分析物分子への結合を介して、近くに近接している場合、P1の配列(ef)は、図1Jの左側で示した通り、P2の(f’e’)とハイブリッド形成する。次いでポリメラーゼを使用してP2の3’末端を伸長して、示した通り、新たな配列を含有する伸長産物(すなわち、アンプリコン)P2−extを作製することができる。次いで、当技術分野で知られた方法により新たな配列(d’c’b’a’)の全体または部分を使用してP2−extを検出して、P2−extを変換されていないP2と区別することができる。例えば、P2−extは、上記の核酸増幅法で増幅してもよい。溶液を加熱することによってP2−extをP1から分離することができ、プライマーはP2−extの3’末端で新たな配列とハイブリッド形成し、伸長してP2−estの相補体を作製することができる。増幅の次の期間は、P2−extからの相補体の分離およびP2の5’末端の近くに位置する配列から構成される異なるプライマーを相補体にハイブリッド形成することを含む。好ましい実施形態では、配列bは、SDA適合性制限酵素の認識配列の一本鎖成分を含有する。次いで、P2−extを形成することにより、制限酵素により切断される二本鎖認識配列を作製する。ニックからの伸長により、P2−extと相補的な新たな鎖を作製し、ニック形成可能な認識配列を再生する。この産物を、前述したSDA法により増幅し、検出してもよい。任意選択的に、P2の配列i’はまた、SDAのための認識配列の一本鎖成分を含んでもよく、そうであるならば、P2−extとその完全長相補鎖との間に形成した二重鎖は、2つのニック形成可能な制限酵素認識配列を含有する。別の実施形態では、配列bはRNAポリメラーゼプロモーター部位の一本鎖成分であってもよい。次いでP2−extを形成することにより、二本鎖RNAポリメラーゼプロモーターを作製し、これを使用してRNAポリメラーゼの活性を、P2−extの配列(j’i’h’g’f’e’d’c’)と相補的なRNA分子を合成するように方向づける。これらのRNA分子は直接検出してもよく、あるいは3SR、NASBA、TMAまたは転写に基づく増幅などの方法でさらに増幅してもよい。任意選択的に、P2の配列i’はRNAポリメラーゼプロモーターの一本鎖成分を含んでもよい。この場合、P2−extの3’末端とハイブリッド形成したプライマーを伸長することにより、RNAポリメラーゼの活性を、直接検出することができ、または上記の方法を使用して増幅することができる配列(h’g’f’e’d’c’b’a’)を含むRNA分子を合成するように方向づけるのに使用できる二本鎖プロモーター部位を作製する。P2−extの検出または増幅の方法にかかわらず、図1Jで示した実施形態は、反対の配列方向のそれらの各分析物結合要素Ab1またはAb2と連結するプローブ部P1およびP2を含み、この2つのプローブは標的介在プロセスで互いにハイブリッド形成して、後で伸長してアンプリコンを作製する伸長可能な3’末端を有する二重鎖を作製する。標的分析物が存在しない場合、P1とP2は近くに近接せず、以下で言及する誤った(すなわち、標的非依存性の)相互作用による以外は、P2−extは形成しない。この誤った相互作用は、これも以下で記載するハイブリッド形成ブロッキングオリゴヌクレオチドによって抑制することができる。したがって、P2−extは標的分析物の存在の結果として、かつ存在する標的分析物の量に比例して産生される。したがって、産生したP2−extの量の判定を使用することによって、試料に存在する標的分析物の量を定量することができる。
【0033】
図2A〜Cは、スプリントオリゴヌクレオチドの代表的な使用を詳述する。Ab1およびAb2は隣接するエピトープ1および2を認識する抗体であり、それぞれオリゴヌクレオチドプローブP1およびP2に複合体形成している(図2A)。P1はAb1にその5’末端または5’末端の近くに位置する連結を介して複合体形成しており、3’末端ヒドロキシル基および上流のSDAニック部位を含む。プローブP2はAb1にその3’末端で複合体形成しており、SDAプライマー結合性部位および5’末端ホスフェート基を含む。スプリントオリゴヌクレオチドSの配列は、抗体がそれらの各エピトープに結合することにより近くに近接している場合に、オリゴヌクレオチドP1およびP2がスプリントSと二本鎖ハイブリッドを形成するように、プローブP1の3’末端およびプローブP2の5’末端と相補的である。スプリントオリゴヌクレオチドSとハイブリッド形成した場合、P1の3’−OHとP2の5’−PO4は隣接し、DNAリガーゼを使用してP1とP2の配列を連結するリン酸ジエステル結合の形成を触媒する(図2B)。SDAプライマーSP1はスプリントオリゴヌクレオチドSの上流のプローブP2とハイブリッド形成する。鎖置換型DNAポリメラーゼは、プライマーSP1の3’末端およびスプリントオリゴヌクレオチドSの3’末端から伸長する。プライマーSP1の伸長はスプリントオリゴヌクレオチドSの伸長産物を置換し(図2C)、SDA制限酵素ニック部位をいずれかの末端に有する二本鎖DNA分子を作製する。この分子は図1Cで示したものと類似している。ニック形成、ニックからのポリメラーゼ伸長および下流の鎖の置換は、指数関数的増幅につながる(図1D〜E)。一実施形態では、プローブP1はSDAニック部位を含まない。別の実施形態では、スプリントオリゴヌクレオチドSは、スプリントSの3’伸長を妨げる3’キャップを含む。
【0034】
図2Dおよび2Eは、近接構成要素の対を使用する、標的介在性で且つリガーゼで触媒されたアンプリコン形成の代替的な実施形態を説明する。プローブP1およびP2はそれらの各抗体(またはその他の分析物結合単位)Ab1およびAb2に連結されるか、複合体形成される。複合体形成は、図2Dで示した通り、両方のプローブの5’末端または5’末端の近くの連結を介して生じてもよく、あるいは2つのプローブ(P1)の一方は、プローブの3’末端または3’末端の近くに位置する連結を介して複合体形成してもよい。P1は配列(abcdef)(5’側から3’側に読む)を含み、P2は配列(j’i’h’g’f’e’)を含む(5’側から3’側に読む)。複合体Ab2−P2は3’末端ヒドロキシル基をさらに含む。図2Dまたは2Eのいずれかで示された構造では、P1の配列(ef)およびP2の(f’e’)は互いにハイブリッド形成することが可能である。第3のプローブP3は配列(d’c’b’x’y’)を含み、さらに5’末端ホスフェート基を含む。P3はプローブP1の配列(bcd)(P1の配列(ef)に隣接)とハイブリッド形成することが可能である。標的分析物の存在下では、P1とP2は近くに近接し、配列(ef)と(f’e’)とのハイブリッド形成により二重鎖を形成する。示した通り、プローブP3は、P1とP2とのハイブリッド形成の前または後のいずれかに、P1とハイブリッド形成してもよい。いずれの場合も、P3の5’ヌクレオチドはP2の3’ヌクレオチドに隣接して位置し、この構造では、P2とP3はDNAリガーゼ(またはその他の連結メカニズム)で共有結合して、示した通り、アンプリコンP2:P3を形成することができる。次いで、P2:P3は、図1Jで示した実施形態について上記したものなどの増幅を含む種々の方法によって検出することができる。しかし、この場合、配列x’および/またはy’は、プライマーハイブリッド形成のための部位として使用することとなる。標的分析物が不在の場合、P1とP2は近くに近接せず、以下で言及するP1とP2との間の誤った(すなわち、標的非依存性の)相互作用による以外は、P2:P3は形成しない。この誤った相互作用は、これも以下で記載するハイブリッド形成ブロッキングオリゴヌクレオチドによって抑制することができる。したがって、P2:P3は標的分析物の存在の結果として、かつ存在する標的分析物の量に比例して産生される。したがって、産生されたP2:P3の量の定量を使用して、試料に存在する標的分析物の量を定量することができる。近接構成要素のオリゴヌクレオチド部を連結することによって形成されたアンプリコンの増幅中、ハイブリッド形成ブロッカーは不要である。なぜなら、連結によってつなぐことができるプローブは通常互いにハイブリッドを形成せず、したがって、オリゴヌクレオチドの3’伸長を含む増幅中、誤ったプローブ変換をする可能性がないからである。
【0035】
図3は、近接構成要素の2つのオリゴヌクレオチド部間のギャップを架橋するように設計されたスプリントオリゴヌクレオチドを含む本発明の代表的な実施形態を示す。一実施形態(図3A)では、近接抗体Ab1の1つはテザーオリゴヌクレオチドの3’末端または3’末端の近くの連結を介して複合体形成している。今後、「テザーオリゴヌクレオチド」は、アンプリコンから置換されるが、分析物特異的結合性部に複合体形成したままであるオリゴヌクレオチド部を指す。テザーオリゴヌクレオチドTOは、スプリントオリゴヌクレオチドP1のセグメント(好ましくは5’末端または5’末端の近くにある)と相補的である。さらに、スプリントオリゴヌクレオチドP1は、変換されたプローブの増幅を促進するプライマー配列および変換されたプローブの検出を促進する検出領域を含んでもよい。また、P1は、SDAによる増幅を促進する制限認識配列を含んでもよい。さらに、スプリントオリゴヌクレオチドの3’配列は、その5’末端を介して抗体Ab2に複合体形成しているプローブP2の3’末端と相補的である。図3Aで示した通り、P1の5’末端は、Ab1に付いたテザーオリゴヌクレオチドTOと相補的である。任意選択的に、テザーオリゴヌクレオチドはP1の5’末端上ではない配列と相補的であってもよい。抗体Ab1およびAb2がそれらの各エピトープに結合している場合、スプリントオリゴヌクレオチドP1はTOおよびP2の両方とハイブリッド形成することができる(図3A)。プローブP2およびスプリントオリゴヌクレオチドの3’末端からの伸長はテザーオリゴヌクレオチドTOを置換し、抗体Ab2と連結した二本鎖DNA分子を作製する(図3B)。この二本鎖産物をニック形成し、ポリメラーゼで伸長し、下流の鎖を置換することにより、相補的なSDAプライマーとハイブリッドを形成し得る一本鎖オリゴヌクレオチドが生じる(図3C)。これは、一連の中間ニック形成、伸長、置換およびプライミング事象を介する指数関数的増幅につながる(図3D)。
【0036】
図3Eは抗体間のギャップを架橋する第2の実施形態を示す。この構造では、各抗体(Ab1およびAb2)は、異なるテザーオリゴヌクレオチド、Ab1はa’、Ab2はjに複合体形成している。通常、抗体Ab1のテザーオリゴヌクレオチドは第2の抗体Ab2のテザーオリゴヌクレオチドとは異なる。この場合、a’およびjは配列において等価ではない。スプリントオリゴヌクレオチドP1およびP2はそれぞれ、オリゴヌクレオチド配列a’およびjと相補的な配列(場合により5’末端の近く)を含有する。例えば、P1は配列aを含有し、P2は配列j’を含有する。プローブP1の配列aはAb1の配列a’とハイブリッド形成し、Ab2の配列jはP2の配列j’とハイブリッド形成する。この実施形態では、P1およびP2はそれぞれ、他方のプローブと相補的な短い3’配列を含有し、したがってP1の配列(ef)はP2の(f’e’)と相補的である。P1およびP2のこれらの相補的な3’配列の明らかなハイブリッド形成は、プローブP1とP2が、近接したエピトープに結合した抗体のテザーオリゴヌクレオチド(a’およびj)とハイブリッド形成した結果、空間的に近接した場合のみに高い効率で生じる。P1とP2の3’末端のハイブリッド形成により、陥入した3’末端を有する短い二重鎖が生じ、次いでこれをポリメラーゼで伸長することができる。一実施形態では、3’末端の伸長はスプリントオリゴヌクレオチドP1およびP2をテザーオリゴヌクレオチド(および抗体)から置換するように働き、一方同時に、両方のプローブの伸長産物(P1−extおよびP2−ext)で構成された二重鎖を作製する(図3F)。次いで、P1およびP2伸長産物を、PCR、SDA、リガーゼ連鎖反応、3SR、Qβレプリカーゼに基づく増幅、固相増幅およびNASBAを含む、当技術分野で知られた種々の増幅方法で検出することができる。P1の配列(b、c、d、e、f)およびP2の(e’、f’、g’、h’、i’、j’)などのプローブが含有する配列、またはプローブ伸長産物を使用して、プローブの増幅および検出を促進してもよい。増幅を促進するのに使用できる特別な配列には、プライマー結合性部位、制限エンドヌクレアーゼ部位、ハイブリッド形成ブロッカーオリゴヌクレオチドとハイブリッド形成することが可能な配列、RNAプロモーター部位などがある。増幅した産物は、当技術分野でよく知られた不均一法または均一法で検出することができる。あるいは、図3Fの二重鎖IIを、当技術分野でよく知られた方法で増幅することなく直接検出してもよい。方法が、5’−3’エキソヌクレアーゼ活性を有するDNAポリメラーゼ、例えばTaqDNAポリメラーゼを用いる場合、テザーオリゴヌクレオチド(a’またはj)は伸長プロセス中に分解することがあり、この分解産物は標的抗原の存在を示すものとして検出することができる。
【0037】
図3Eおよび3Fは、テザーオリゴヌクレオチドの3’末端に複合体形成している抗体を示し、図3Hは、近接対の両方の抗体がテザーオリゴヌクレオチドの5’末端に複合体形成している別の構造を示す。同様に、図3Iは、1つのテザーオリゴヌクレオチドが抗体に5’連結を介して複合体形成し、他のオリゴヌクレオチドが3’連結を介して複合体形成している実施形態を示す。これらの後者の2つの構造のそれぞれにおいて、プローブ配列P1およびP2を3’伸長することにより、結果としてプローブをテザーオリゴヌクレオチドから置換し、図3Fで示したものと同一の二本鎖の二重鎖を作製することになる。
【0038】
テザーオリゴヌクレオチドが置換プロセス中に分解しない場合には、プローブ分子P1およびP2の第2の組は、標的に結合した近接構成要素の空いたテザーオリゴヌクレオチドとハイブリッド形成することができる(図3G)。前記のとおり、P1とP2の3’末端はアニールし、再び伸長することによって、結果としてプローブを置換し、P1−extおよびP2−extで構成された二重鎖を作製することになる。存在する場合ならば、空いたテザーオリゴヌクレオチドは再び、伸長していないプローブ(P1およびP2)の新たな対とアニールし、Ab1およびAb2が近接エピトープに結合し且つP1およびP2の供給が存在する限り、伸長していないプローブの3’ハイブリッド形成、伸長、置換およびそれに続く結合のサイクルは続く。このサイクルプロセスの結果として、検出可能なプローブ伸長二重鎖の多数のコピーが、存在する各標的から形成される。
【0039】
図3A〜3Lで示した例のすべてにおいて、プローブのテザーオリゴヌクレオチドへの最初のハイブリッド形成は、使用した実験プロトコル次第で、抗体が標的分子に結合する前または後のいずれでも生じる。一実施形態では、抗体Ab1およびAb2の少なくとも一方は、常磁性粒子(図9)またはその他の固体表面(図3L)、例えばマイクロウェルの内壁に共有結合的または非共有結合的に連結しているか、連結し得る。少なくとも1つの抗体がビーズ、固体表面またはその他の固体マトリックスと連結し、プローブP1およびP2の両方(図3L)がテザーオリゴヌクレオチドとのハイブリッド形成によって抗体に間接的に付いている構造では、プローブを伸長することにより抗体−標的複合体から置換された二重鎖が作製され、一方、複合体自体はビーズ、固体表面またはその他の固体マトリックスに付いたままである。所望により次いで、マトリックス表面に非特異的に結合した複合体および任意の物質は残して、置換された二重鎖を含有する溶液を取り出し、別のウェルまたは区画で分析または増幅してもよい。
【0040】
本発明の別の実施形態では、連結スプリントオリゴヌクレオチドは、例えば図3Jで示したスプリントオリゴヌクレオチドP1およびP2の両方の部分と相補的であってもよい。連結スプリントオリゴヌクレオチドとハイブリッド形成した場合、プローブP1とP2はP1の3’末端がP2の5’末端と共有結合するように図2で記載の通りに連結されてもよい(図3J)。次いでこれらを図2で記載の通りに増幅してもよい。
【0041】
別の実施形態では、スプリントオリゴヌクレオチドは、図3Kで例示した通りにテザーオリゴヌクレオチド(j’)および1つのプローブ分子P2とハイブリッド形成する。次いで、スプリント結合したP2の3’末端は空間的に近接したP1の相補的な3’末端とハイブリッド形成することができる。このプローブの3’を伸長すると、プローブはスプリントおよびテザーオリゴヌクレオチドから置換され、図3で示した前述の例で産生したものと類似の完全長の増幅可能な二重鎖が形成する。
【0042】
図4は、近接したエピトープに結合していない抗体に連結したプローブ分子同士のハイブリッド形成の拡がりを減少させるように設計されたハイブリッド形成ブロッカーオリゴヌクレオチドを示す。そのような標的非依存性ハイブリッド形成は、真正な標的結合事象で産生したものと区別できないプローブ伸長産物となるため、バックグラウンドシグナルの原因であり、バックグラウンドシグナルは検出方法の全体的な感度を減少させる。本発明は、バックグラウンドシグナルにつながる誤った標的非依存性プローブの相互作用を低減するハイブリッド形成ブロッカーオリゴヌクレオチド(または「ハイブリッド形成ブロッカー」)の使用を含む。図4Aは、ハイブリッド形成ブロッカーの近接に基づく増幅方法での使用の基礎となる基本原理を示す。相互相補性の短い配列(ef及びf’e’)(5’側から3’側に読む)は、P1およびP2の3’末端を含む。これらの配列は互いにハイブリッド形成して、示した通り、5’側が突出した二重鎖を形成し得る。二重鎖状態に対する一本鎖状態にあるプローブ分子の数は、総プローブ濃度および二重鎖の本質的な安定性により決まり、これは二重鎖の長さおよび組成に関係する。P1とP2との間の相互作用を、プローブに対して好ましくはモル過剰の、P1とハイブリッド形成すると、2つのプローブ間の相互作用を競合的にブロックするハイブリッド形成ブロッカーオリゴヌクレオチドを加えることによって減少させるか、反対にすることができる。このブロッカーは、P2と相互作用する部分配列全体にわたってP1と相補的である必要はない。この部位との部分的な相補性でも、P1のP2に対するハイブリッド形成を減少させる。
【0043】
一実施形態では、ハイブリッド形成ブロッカーオリゴヌクレオチドは、P1と相補的なP2の部分(部分配列ef)の一部または全体と同一の第1の部分配列(e’またはf’e’)を含む。第2の実施形態(図4B)では、ハイブリッド形成ブロッカーオリゴヌクレオチドは、上記定義の第1の部分配列と、P1のセグメントと相補的であるがP2の部分配列とは同一でない第2の部分配列(図4Bのd’)とを含む。ハイブリッド形成ブロッカーの第2の部分配列は、P1−P2の相互作用と比較してブロッカー−P1相互作用を安定化させることによって、ブロッキング効果を向上させる。第2の部分配列はまた、P2分子がP1と既にハイブリッド形成している場合に、P1−ブロッカー二重鎖の核形成部位としても働くことができる。次いで核形成に続いて、完全なP1−ブロッカー二重鎖の形成は、P2をP1から置換する。この実施形態のP1の部分配列dは、図4Bで示した通り、プローブの部分配列eと直接隣接していてもよく、あるいは部分配列eから数ヌクレオチド離れて位置していてもよい(図示せず)。後者の場合、ハイブリッド形成ブロッカー部分配列d’は、追加のヌクレオチドおよび/またはテトラエチレングリコール(TEG)部などの非ヌクレオチドリンカーを含むスペーサーを介してハイブリッド形成ブロッカー部分配列e’と間接的に連結していてもよい。
【0044】
第3の実施形態(図4C)では、ハイブリッド形成ブロッカーオリゴヌクレオチドは、第1の部分配列(上記定義)、任意選択的に第2の部分配列(上記定義)、および第1の配列の5’に位置し、P1の3’伸長の鋳型として働くことができる第3の部分配列(図4Cのt’s’)を含んでいてもよい。第3の部分配列は、当技術分野でよく知られた、適切な非ヌクレオチド部m’(すなわち、「5’キャップ」)を任意選択的に含有し、非鋳型ヌクレオチドがP1の3’伸長産物に付加するのを妨げ、かつポリメラーゼがP1の伸長によって形成した平滑末端の二重鎖に結合するのを抑えることができる(図4C参照)。ブロッカー−鋳型でのP1の3’伸長により、P2の配列と相補的でないその3’末端に新たな配列(st)を含有するP1−伸長産物を得るのが好ましい。したがって、3’配列(st)の付加は、P2の鋳型でDNA合成のための機能的プライマーとしてのP1の使用を不可能にするように働く。また、配列(st)の付加は、2つの分子間の相補的塩基対の数を増加させることによって、ブロッカー−P1の相互作用を安定化するように働く。任意選択的に、この実施形態で産生された新たな3’配列(st)は、伸長されたP1とハイブリッド形成ブロッカーが解離した場合、伸長されたP1がステムループ(ヘアピン)構造に折り畳まれて、P2との任意の相互作用が減少するように、P1のセグメントと全体的または部分的に相補的である。この場合、P1のヘアピンの3’末端はヘアピンのステムを伸ばすように場合によって伸長されてもよく、この伸長はニック形成可能または開裂可能な制限エンドヌクレアーゼ部位をP1分子内に任意選択的に作製することができる。
【0045】
第4の実施形態では、プロセスのある段階の間、P1とP2との間の相互作用を可逆的にブロックすることが望ましい場合がある。図4Dは、可逆的なブロックを可能にするハイブリッド形成ブロッカーの設計を示す。この実施形態では、ハイブリッド形成ブロッカーは、ブロックされるプローブ(図4DのP1)と相補的な部分配列(e’d’)およびプローブと相補的でない1つまたは複数のテール配列(t’および/またはk’)を含む。ハイブリッド形成ブロッカーのP1とのハイブリッド形成は、P1−P2の相互作用を妨げる。所望の時点で、脱ブロック化(デブロッキング)オリゴヌクレオチドを加えてハイブリッド形成ブロッカーオリゴヌクレオチドをP1から置換して、P1をP2と自由に相互作用できるようにすることができる。デブロッキングオリゴヌクレオチドは、ハイブリッド形成ブロッカーのテール配列と相補的な1つまたは複数のテール配列(tおよび/またはk)を含む。このテール配列は、ブロッカー−デブロッカーハイブリッド形成の核形成の部位として働く。相補的テール配列のハイブリッド形成が核形成されると、ブロッカーがP1から置換されるまで、ハイブリッド形成ブロッカーとデブロッカーとの間に追加的塩基対が形成する。ブロッカーのプローブからの置換を確実にするために、ブロッカー−デブロッカー複合体の全体的な熱力学的安定性は、プローブ−ブロッカー複合体よりも高くなければならない。デブロッキングオリゴヌクレオチドは、ブロッカー−デブロッカー二重鎖の熱力学的安定性がプローブ−ブロッカー二重鎖の安定性よりも高いならば、ハイブリッド形成ブロッカーオリゴヌクレオチドと完璧に相補的である必要はない。例えば、デブロッカーは、得られるブロッカー−デブロッカー二重鎖がプローブ−ブロッカー二重鎖よりも安定であるならば、ハイブリッド形成ブロッカーオリゴヌクレオチドとミスマッチを形成する1つまたは複数のヌクレオチドを含有していることが望ましいことがある。特に、デブロッカーの配列eが、ブロッカーの配列e’と1つまたは複数のミスマッチを形成する1つまたは複数のヌクレオチドを含有することが好ましい場合がある。デブロッカーのこれらのミスマッチヌクレオチドの主要な機能は、デブロッカーの配列eとP2の配列e’との間の潜在的な相互作用を不安定化することである。この実施形態のひとつの変形において、ハイブリッド形成ブロッカーは、図4Eで示した通り、配列kのポリメラーゼで触媒した伸長によって置換されてもよい。この場合、デブロッキング配列は、ブロッキング配列で直接合成され、分離させるデブロッカーオリゴヌクレオチドを加える必要はない。さらに別の実施形態では、プローブは、プローブ分子間の相互作用をブロックするように働くその3’末端または3’末端の近くに3’ステム−ループ構造を含んでもよい(図11A〜C参照)。
【0046】
ブロッカーのポリメラーゼによる3’伸長を妨げるために、図4Eで示したヘアピン構造を有するハイブリッド形成ブロッカーを除いて、上記のハイブリッド形成ブロッカーオリゴヌクレオチドはすべて、3’末端のヌクレオチドにキャップを含んでもよい。3’キャップを有するハイブリッド形成ブロッカーオリゴヌクレオチドは、「キャップされたオリゴヌクレオチド」と呼ぶ。そのような3’キャップは当技術分野でよく知られており、逆位ヌクレオチド、2’−3’ジデオキシリボヌクレオチドおよび3’デオキシリボヌクレオチドを含む。ハイブリッド形成ブロッカーオリゴヌクレオチドは、ハイブリッド形成ブロッカーがプローブと二重鎖を形成する場合に、プローブヌクレオチドと相補的な塩基対を形成しない3’テール配列を含んでもよい。また、非塩基対形成3’テールは、ハイブリッド形成ブロッカーがプローブと二重鎖を形成している場合、ブロッカーの3’伸長を妨げるように働き、したがって「3’キャップ」としても働く。
【0047】
図4EEは、P1ブロッカー二重鎖の安定性を促進するための、プローブ1(P1)での3’テールの使用を説明する。P1の3’テールは配列xyで構成され、プローブ2(P2)の配列(f’e’)とハイブリッド形成することが可能な配列(ef)の3’側に位置する。P1の3’テールは、P2とハイブリッド形成しない。ハイブリッド形成ブロッカーは、配列(y’x’f’)および任意選択的にe’を含む。したがって、ハイブリッド形成ブロッカーは、P1とハイブリッド形成して、P1の3’テールならびにP1の配列efのすべてまたは一部を転換させる二重鎖を形成することが可能である。ブロッカー:P1二重鎖の形成は、上記の通り、P1:P2ハイブリッドの拡がりを減少させる。P1の(xy)とハイブリッド形成ブロッカーの(y’x’)との間の塩基対形成は、ブロッカー:P1二重鎖を安定化するように働く。ハイブリッド形成ブロッカーは、配列(y’x’)の5’に位置する配列z’を任意選択的に含む。配列z’は、上記の方法においてデブロッカーオリゴヌクレオチドのハイブリッド形成を開始するための部位として働くことができる。
【0048】
図4Fは、二元免疫増幅反応におけるハイブリッド形成ブロッカーオリゴヌクレオチドの使用を説明する。P1およびP2はそれぞれ、抗体Ab1およびAb2に直接複合体形成している。プローブが抗体にテザーオリゴヌクレオチドとのハイブリッド形成を介して間接的に結合している場合、または分析物特異的結合成分がアプタマーまたは抗体以外のその他の分析物特異的結合分子である場合も関係なく、同じ原理が当てはまる。示した通り、ハイブリッド形成ブロッカーオリゴヌクレオチドはP1の3’末端とハイブリッド形成して、P2とのその相互作用を妨げる。ハイブリッド形成ブロッカーのハイブリッド形成は、抗体が標的分析物に結合するのを妨げず、当初ハイブリッド形成ブロッカーは、Ab1が分析物と複合体形成しているか、溶液中で自由であるかにかかわらずP1鎖とハイブリッド形成する(状態I)。通常、自由なAb1およびAb2(および複合体形成しているプローブ)のバルク溶液中の濃度は、1fMと10nMとの間である。通常ハイブリッド形成ブロッカーの濃度はプローブ濃度よりも10〜100000倍高いため、ブロッカー−P1の相互作用は、標的に結合していない抗体に複合体形成しているプローブについてP1−P2の相互作用を上回る。しかし、標的分子のエピトープ1および2がそれぞれAb1およびAb2と結合する場合、三元標的−抗体複合体でのP2に比べたP1の有効局所濃度は、バルク溶液中のプローブおよびハイブリッド形成ブロッカーの濃度よりもはるかに高く(通常1〜100μM)なる。その結果、標的に結合した抗体と連結しているプローブでは、P1:P2二重鎖がP1:ブロッカー二重鎖よりも優勢である(状態II)。したがって、P1:2ハイブリッドの3’末端をポリメラーゼ触媒伸長させることにより、標的−Ab1−Ab2複合体上での増幅可能な二重鎖が生じ(状態III)、一方、標的複合体と連結していないプローブは、ブロックされ、伸長されず、増幅不可能なままである。図4Fは、プローブの1つのみとハイブリッド形成する単一のハイブリッド形成ブロッカーの使用を示すが、その他のプローブとハイブリッド形成する第2のハイブリッド形成ブロッカーを第1のブロッカーと連結して使用してもよい。
【0049】
図4Gは、伸長の鋳型として機能することにより、P1分子を「無能力」にすることが可能なハイブリッド形成ブロッカーを用いる同様の反応スキームを示す(上記図4C参照)。上記の理由により、バルク溶液中のプローブではブロッカー:P1二重鎖がP1:P2二重鎖よりも優勢であり、一方、三元標的−抗体複合体ではP1:P2二重鎖が優勢である。ブロッカー:P1二重鎖をポリメラーゼ触媒伸長させることにより、「無能力化された」P1伸長産物が生じ(図4C参照)、一方、P1:P2二重鎖の伸長により、図4Fの通り、増幅可能な二重鎖が生じる。
【0050】
図4Hは、置換可能なハイブリッド形成ブロッカーAがP2とハイブリッド形成してブロッカーA:P2二重鎖を形成する段階的ブロッキングプロセスを示す。任意選択的に、このスキームのハイブリッド形成ブロッカーAは、バルク溶液中および三元標的−Ab1−Ab2複合体上の両方において、ブロッカーA:P2二重鎖をP1:P2二重鎖よりも安定にするのに十分な長さまたは濃度を有することができる。P1のセグメントと相補的な第2のハイブリッド形成ブロッカーBおよび置換可能なハイブリッド形成ブロッカーAと相補的なデブロッカーDを溶液に加えることにより、AをP2から置換させ、バルク溶液中でのP1:ブロッカーB二重鎖を形成し、そして三元標的−抗体複合体でのP1:P2二重鎖を形成する。任意選択的に、ハイブリッド形成ブロッカーBは、上記の通りP1を無能力化させる「無能力化」配列を含んでもよい(図4Cおよび4F参照)。前述の通り、プローブ−プローブハイブリッドをポリメラーゼ触媒伸長させることにより増幅可能な二重鎖が生じ、一方、P1:ブロッカーB二重鎖を場合によって伸長することにより、「無能力化された」P1伸長産物が生じる。
【0051】
図4Iは、P1:P2二重鎖がバルク溶液中および三元標的−抗体複合体上の両方において形成することができる反応スキームを示す。次いで、バルク溶液と三元複合体とは有効プローブ濃度が異なるので、ハイブリッド形成ブロッカーを加えることにより、三元標的複合体上のものよりもバルク溶液中のP1:P2二重鎖を優先的に分裂させる(図4F参照)。
【0052】
一実施形態では、ハイブリッド形成ブロッカーオリゴヌクレオチドを、常磁性粒子またはその他の固体表面と共有結合的または非共有結合的に連結してもよく、さらに近接構成要素を表面に可逆的に結合するために使用してもよい(図6参照)。本発明の別の実施形態では、抗体Ab1およびAb2の少なくとも1つは、常磁性粒子(図9参照)またはその他の固体表面と共有結合的または非共有結合的に連結しているか、連結することができる。
【0053】
図5で示した本発明の実施形態は、2つの近接構成要素間のギャップを架橋するように設計されたスプリントオリゴヌクレオチドを含む。一実施形態では、スプリントオリゴヌクレオチドSは、RNAポリメラーゼプロモーター配列、下流のプライマー結合配列および検出領域を含む(図5A)。スプリントSの5’配列は、抗体Ab1にその3’末端で複合体形成するP1の5’末端と相補的である。さらに、スプリントSの3’配列は、抗体Ab2にその5’末端で複合体形成するプローブP2の3’末端と相補的である。抗体Ab1およびAb2がそれらの各エピトープと結合する場合、スプリントオリゴヌクレオチドSはP1およびP2の両方とハイブリッド形成することができる(図5A)。プローブP2およびスプリントSの3’末端からの伸長により、プローブP1は置換され、抗体Ab2と連結した機能的RNAポリメラーゼプロモーターを有する二本鎖分子を作製する(図5B)。RNAポリメラーゼは、この二本鎖プロモーター配列を使用して一本鎖RNAを産生する。一実施形態(図示せず)では、一本鎖オリゴヌクレオチドを、当技術分野で知られた任意の適切な方法で直接検出する。第2の実施形態では、一本鎖RNA分子は、伸長してDNA:RNAハイブリッドを生じる相補的プライマーとハイブリッド形成する(図5C)。これらのハイブリッドのRNA鎖をRNアーゼで分離することにより、RNAポリメラーゼプロモーターを含有するプライマーがハイブリッド形成できる一本鎖DNA分子を産生する(図5D)。ハイブリッド形成したプライマーおよびそれらの標的鎖の3’末端から伸長することにより、二本鎖RNAポリメラーゼプロモーター配列が生じ、指数関数的増幅となる。
【0054】
図6で説明した本発明の別の態様は、固体表面、ポリマー、ヒドロゲルまたはその他の表面であってもよい支持体に直接付着した捕捉オリゴヌクレオチドへのオリゴヌクレオチドハイブリッド形成によって、抗体、抗原または抗原−抗体複合体を固体表面に付着するための異なる方法を含む。本発明に適切な、粒子またはマイクロタイターウェル表面などの支持体は、当技術分野でよく知られている。オリゴヌクレオチドを種々の支持体に安定に複合体形成させる方法は、当技術分野でよく知られている。捕捉オリゴヌクレオチドは、ハイブリッド形成によってオリゴヌクレオチド部と相互作用することができ、あるいは近接構成要素の分析物結合性部に複合体形成している別のオリゴヌクレオチドと相互作用することができる。さらに、本発明は、捕捉した分子を表面から種々の化学的、物理的または酵素的手段で選択的に放出する方法を含む。
【0055】
図6Aで示した通り、抗体、抗原または抗体−抗原複合体Cは、P1にその5’末端を介して複合体形成してもよい。複合体形成したオリゴヌクレオチドは、制限酵素認識配列および任意選択のフランキング配列を含み、その5’末端で固体表面に付着している相補的オリゴヌクレオチドP2とハイブリッド形成する。固相からの複合体Cの放出は、P1とP2のハイブリッド形成で形成した二重鎖認識配列を開裂する制限酵素の特異的活性を介して生じる。図6のすべてのパネルのP1は近接構成要素の増幅可能なオリゴヌクレオチド部であってよく(図6N参照)、あるいは分析物特異的結合性部に複合体形成している別のオリゴヌクレオチドであってもよい。
【0056】
図6Bで示した通り、抗体、抗原または抗体−抗原複合体Cは、P1にその5’末端を介して複合体形成してもよい。複合体形成したオリゴヌクレオチドは、制限酵素認識配列および任意選択のフランキング配列を含み、その5’末端で固体表面に付いた相補的オリゴヌクレオチドP2とハイブリッド形成する。P2は、オリゴヌクレオチドP1の相補体および3’非相補的テールを含む。複合体Cの固相からの放出は、オリゴヌクレオチドP1とP2のハイブリッド形成で形成した二重鎖認識配列を開裂する制限酵素の特異的活性を介して生じる。開裂したP1オリゴヌクレオチドは、置換オリゴヌクレオチドDのハイブリッド形成を介して一本鎖にされる。
【0057】
図6Cで示した通り、抗体、抗原または抗体−抗原複合体Cは、P1にその3’末端を介して複合体形成してもよい。複合体形成したオリゴヌクレオチドは、制限酵素認識配列および任意選択のフランキング配列を含み、その3’末端で固体表面に付いた相補的オリゴヌクレオチドP2とハイブリッド形成する。複合体Cの固相からの放出は、P1とP2のハイブリッド形成で形成した二重鎖認識配列を開裂する制限酵素の特異的活性を介して生じる。
【0058】
図6Dで示した通り、抗体、抗原または抗体−抗原複合体Cは、P1にその5’末端を介して複合体形成している。複合体形成したオリゴヌクレオチドは、その5’末端で固体表面に付いたオリゴヌクレオチドP2の3’末端と相補的な配列を含む。P2は、制限酵素認識配列および任意選択のフランキング配列を含む。P1の3’末端からのDNAポリメラーゼ伸長により、P2の相補体が合成され、そして選択的に開裂して複合体Cを放出することができる二本鎖制限酵素認識配列が形成される。さらなる実施形態では、オリゴヌクレオチドP2の3’末端はキャップされて伸長を妨げる。
【0059】
図6Eで示した通り、抗体、抗原または抗体−抗原複合体Cは、オリゴヌクレオチドP1にその5’末端を介して複合体形成している。複合体形成したオリゴヌクレオチドは、制限酵素認識配列を、任意選択のフランキングDNA、およびその5’末端で固体表面に付いているオリゴヌクレオチドP2の3’末端と相補的な配列と共に含む。P2の3’末端からのDNAポリメラーゼ伸長により、オリゴヌクレオチドP1の相補体が合成され、そして選択的に開裂して複合体Cを放出することができる二本鎖制限酵素認識配列が形成される。さらなる実施形態では、オリゴヌクレオチドP1の3’末端はキャップされて伸長を妨げる。
【0060】
図6Fで示した通り、抗体、抗原または抗体−抗原複合体Cは、オリゴヌクレオチドP1にその5’末端を介して複合体形成している。複合体形成したオリゴヌクレオチドは、その5’末端で固体表面に付いている別のオリゴヌクレオチドP2と相補的な配列を含む。複合体Cの固相からの放出は、イオン強度の低下、キレート剤の添加、pHの変更または温度の上昇、あるいはこれらの因子の組合せなどの物理的な環境の変化によって生じる。適切な条件下では、複合体Cの物理的放出は可逆的である。
【0061】
図6Gで示した通り、抗体、抗原または抗体−抗原複合体Cは、オリゴヌクレオチドP1にその5’末端を介して複合体形成している。複合体形成したオリゴヌクレオチドは、その5’末端で固体表面に付いている別のオリゴヌクレオチドP2と相補的な配列を含む。P2の配列は、P1の少なくとも部分的な相補体と、物理的、化学的または光化学的手段で開裂して複合体Cを溶液中に放出することができる切れやすい連結とを含む。切れやすい連結の具体例は、これらだけに限定するものではないが、ジスルフィド結合(例えば、DTTにより開裂)およびcis−ヒドロキシル基(過ヨウ素酸塩により開裂)を含む。図6GGでは、抗体、抗原または抗体−抗原複合体を担持するプローブP1は、切れやすい連結、例えばジスルフィド、cis−グリコールなどを介して固体表面に付着している。この連結の物理的、酵素的、化学的または光化学的開裂を使用して、P1−担持複合体を表面から遊離させることができる。
【0062】
図6Hで示した通り、抗体、抗原または抗体−抗原複合体Cは、オリゴヌクレオチドP1にその5’末端を介して複合体形成している。複合体形成したオリゴヌクレオチドは、任意選択の5’配列および3’配列a’を含む。オリゴヌクレオチドP2は、その5’末端を介して固体支持体に付着されており、配列aおよび上流の配列bを含む。aとa’とのハイブリッド形成により、複合体Cは支持体に付着される。複合体Cの選択的放出は、配列a’およびb’を含む置換オリゴヌクレオチドDの添加によって達成される。P2の配列aおよびbへのDのハイブリッド形成は、配列aおよびa’のみのハイブリッド形成よりも熱力学的に好ましく、P1を置換させ、複合体Cを溶液中への放出させることとなる。第2の実施形態では、置換プローブはP1のすべてまたは一部と相補的であることができる。第3の実施形態では、抗体または抗体−抗原複合体は、表面に結合されたオリゴヌクレオチドおよびP1の両方に相補的な配列を含むスプリントオリゴヌクレオチドを介して間接的に表面に結合されたオリゴヌクレオチドP2と連結することができる(図示せず)。この後者の場合、置換は、オリゴヌクレオチドDのP1、P2のいずれか、またはスプリントオリゴヌクレオチドとのハイブリッド形成によって生じることができる。
【0063】
図6Iで示した通り、抗体、抗原または抗体−抗原複合体Cは、オリゴヌクレオチドP1にその5’末端を介して複合体形成している。複合体形成したオリゴヌクレオチドは、任意選択の3’配列a’を含む。オリゴヌクレオチドP2は、その5’末端を介して固体支持体に付着し、P2は、配列aおよび下流の配列bを含む。オリゴヌクレオチドP2の配列aとオリゴヌクレオチドP1の配列a’とのハイブリッド形成により、複合体Cは表面に付着する。複合体Cの選択的放出は、配列b’を含む置換オリゴヌクレオチドDのP2の配列bとのハイブリッド形成および鎖置換型DNAポリメラーゼを使用するオリゴヌクレオチドDのその3’末端からの伸長によって達成される。さらなる実施形態では、伸長反応に使用するポリメラーゼは、P1の配列a’を分解して、ハイブリッド形成したP2オリゴヌクレオチドを放出する5’−3’エキソヌクレアーゼ活性を有していてもよい。別の実施形態では、P2は3’ヘアピン構造を含み(図6M)、ヘアピンの3’末端からのポリメラーゼによる伸長により、P1が置換される。この実施形態では、置換オリゴヌクレオチドDは不要である。任意選択的に、スプリントオリゴヌクレオチドを図6Iおよび6Mで示した実施形態で使用してもよい。
【0064】
図6Jで示した通り、抗体、抗原または抗体−抗原複合体Cは、オリゴヌクレオチドP1にその3’末端を介して複合体形成している。複合体形成したオリゴヌクレオチドは、3’配列bおよび5’配列aを含む。オリゴヌクレオチドP2は、その3’末端を介して固体支持体に付着しており、配列a’および任意選択の下流の配列を含む。オリゴヌクレオチドP1のaとオリゴヌクレオチドP2のa’とのハイブリッド形成により、複合体Cは表面に付着する。複合体Cの選択的放出は、置換オリゴヌクレオチドDのP1の配列bとのハイブリッド形成および鎖置換型DNAポリメラーゼを使用する3’末端からの伸長によって達成される。さらなる実施形態では、伸長反応に使用するポリメラーゼは、P2の配列a’を分解して、ハイブリッド形成したP1オリゴヌクレオチドを放出する5’−3’エキソヌクレアーゼ活性を有していてもよい。
【0065】
図6Kで示した通り、抗体、抗原または抗体−抗原複合体Cは、オリゴヌクレオチドP1にその5’末端を介して複合体形成している。複合体形成したオリゴヌクレオチドは、任意選択の5’配列bおよび3’配列aを含む。オリゴヌクレオチドP2は、RNAでできており、その5’末端を介して固体支持体に付着しており、配列a’を含む。オリゴヌクレオチドP1の配列aとオリゴヌクレオチドP2の配列a’とのハイブリッド形成により、複合体Cは表面に付着する。複合体Cの放出は、DNA:RNAハイブリッドのRNA鎖を選択的に分解するRNアーゼHなどのRNアーゼの添加によって達成される。別の実施形態では、Ab1へのP1の複合体形成およびP2の固体支持体への付着は、各オリゴヌクレオチドの3’末端を介して生じる。
【0066】
図6Lで示した通り、抗体、抗原または抗体−抗原複合体Cは、オリゴヌクレオチドP1にその5’末端を介して複合体形成している。複合体形成したオリゴヌクレオチドは、RNAでできており、任意選択の5’配列bおよび3’配列aを含む。オリゴヌクレオチドP2は、その5’末端を介して固体支持体に付着ており、配列a’を含む。オリゴヌクレオチドP1の配列aとオリゴヌクレオチドP2の配列a’とのハイブリッド形成により、複合体Cは表面に付着する。複合体Cの放出は、DNA:RNAハイブリッドのRNA鎖を選択的に分解するRNアーゼHなどのRNアーゼの添加によって達成される。別の実施形態では、Ab1へのP1の複合体形成およびP2の固体支持体への付着は、各オリゴヌクレオチドの3’末端を介して生じる。
【0067】
図6Nで説明した実施形態では、固定化された近接構成要素は、制限エンドヌクレアーゼによる開裂によって放出される。Ab1は、配列(abc)を含むオリゴヌクレオチドP1に複合体形成している。抗体Ab2は、配列(a’b’c’d’e’)を含むオリゴヌクレオチドP2に複合体形成しており、ここで、領域dは制限エンドヌクレアーゼ認識部位に相当する。抗体Ab2はその特異的エピトープに結合しており、抗体−抗原複合体は、オリゴヌクレオチドP2の相補的捕捉オリゴヌクレオチドC(表面に付着している)とのハイブリッド形成によって固体支持体に捕捉されている。任意選択的に、支持体は洗浄され、結合していない抗原および試料のその他の成分を除去する。次いで抗体Ab1を加えると、その結果、それはエピトープ1を結合する。オリゴヌクレオチドP2と捕捉プローブCとの間の相補性の程度は、P2とオリゴヌクレオチドP1との間のものよりも大きく、したがって、P1と捕捉プローブCとの間のハイブリッド形成は、オリゴヌクレオチドP1とP2とのハイブリッド形成よりも熱力学的に好ましい。抗原−抗体複合体は、制限エンドヌクレアーゼ認識部位dが開裂すると放出される。抗体Ab2に付着したオリゴヌクレオチドP2の残りの断片は、配列(a’b’c’)を含み、抗体Ab1上のプローブP1と相補的である。(a’b’c’)のその相補体とのハイブリッド形成は、熱力学的に好ましく、伸長可能な3’末端を有するオリゴヌクレオチドハイブリッドを介する抗体Ab1とAb2とを連結させる。この複合体は、図1で示したような適切な増幅反応で使用することができる。
【0068】
図7Aは、オリゴヌクレオチド部の捕捉オリゴヌクレオチドとの相互作用を介する近接構成要素の固定化を示す。ここで、オリゴヌクレオチド部は、オリゴヌクレオチド部が捕捉オリゴヌクレオチドから放出された場合にアンプリコンを形成することが可能である。領域b、cおよびyを含む捕捉オリゴヌクレオチドは固体支持体にその5’末端で複合体形成されているように示されているが、その3’末端で付着していてもよい。領域bおよびcは、オリゴヌクレオチド部P1のそれぞれ領域b’およびc’とのハイブリッド形成により相互作用している。領域yは、図6A〜6Nで示したものを含む上記の方法のいずれかによって放出を促進する部位を表す。Ab2は、分析物Agに結合する前または後に固体支持体に固定化することができる。図7Bは、Ab2が分析物Agと結合する前にAb2が固定化されている実施形態を示す。一実施形態では、結合された近接構成要素−分析物複合体を増幅の前に洗浄して、結合していない分子を除去することによってバックグラウンドシグナルを減少させる。Ab2、Ab1および標的分析物間の完全な複合体を図7Cで示す。
【0069】
図7Dは、2つの近接構成要素間の非特異的相互作用によって生じる標的非依存性増幅の原因と考えられるものを説明する。非特異的相互作用のその他の原因も考えられるが、示した通り、Ab1とAb2との間でこの非特異的相互作用が起きる。Ab1とAb2との間の相互作用は、アンプリコンの形成に使用される、この場合それぞれ領域(de)および(d’e’)の相補的な領域を介して、P1とP2の相互作用を促進する。P1:P2の相互作用の形成は同様に、Ab1とAb2との間の継続した連関を促進することができ、したがって、P1:P2の相互作用の不安定化により、標的非依存性シグナルを全体的に低減し得る。これは、P1の領域(de)と相互作用するハイブリッド形成ブロッカーオリゴヌクレオチドを提供することにより、例えば、この領域とP2のその相補体(d’e’)との相互作用を防ぐことによって達成できる。
【0070】
増幅により分析物を検出する方法におけるハイブリッド形成ブロッカーオリゴヌクレオチドの使用を図7E〜7Hで説明する。反応混合物にAb1を加える前またはAb1を加えるのと同時にAb2は分析物のエピトープ2と結合し、Ab2は、捕捉オリゴヌクレオチドとの相互作用によって表面に固定化される。この実施形態の捕捉オリゴヌクレオチドは、P2の領域(b’c’)とハイブリッド形成する。任意選択的に、結合した複合体をAb2と分析物との間の複合体の形成前または後に洗浄して、結合していない分子を除去する。P1の領域(de)とハイブリッド形成している領域(d’e’)を含むハイブリッド形成ブロッカーオリゴヌクレオチドの存在下でAb1を加えて、上記の通りAb1とAb2との相互作用を抑制する。結合していないAb1は、Ab1が分析物のエピトープ1と複合体を形成した後に、反応容器から洗浄してもよい。図7E〜7Hで示した通り、ハイブリッド形成ブロッカーオリゴヌクレオチドは、標的特異的複合体の形成を妨害しない。捕捉オリゴヌクレオチドからのP2の放出により、P2の領域(d’e’)はP1の(de)の領域と相互作用して、増幅のための二本鎖開始部位を形成することができる。P2は、上記の任意の手段により、捕捉オリゴヌクレオチドから放出されてもよい。例えば、図7Iで示した通り、P2は緩衝液のイオン強度を変更することによって放出される(捕捉オリゴヌクレオチドからの物理的放出を示す図6F参照)。図7Iで示した通り、P2が放出されると、それはP1と自由に相互作用して、増幅することができる二本鎖配列を形成する。あるいは、図7Jで示した経路に従って、置換オリゴヌクレオチドを使用してP2を捕捉オリゴヌクレオチドから解離してもよい(図6Hも参照)。
【0071】
図7Iは、イオン強度の変更をどのように使用して選択的にP2を放出し、それに続くP1とP2の相互作用を促進するかを説明する。図7Iでは、Ab1−P1、Ab2−P2および標的分析物間の複合体の形成が、三元複合体の形成に最適なイオン強度を有し得る緩衝液で達成される。結合していないか非特異的に結合したAb1−P1は、非特異的相互作用は弱めるが、P2の配列(b’c’)と捕捉オリゴヌクレオチドとの間で形成した二重鎖ならびにAb1、Ab2および標的分析物間で形成した複合体は、維持する高イオン強度の緩衝液中で洗い流してもよい。緩衝液のイオン強度を低イオン強度に変更することは、P2と捕捉オリゴヌクレオチドとの間の二重鎖を溶かす効果がある。イオン強度を低下させることによる核酸二重鎖の不安定化の程度は、ヌクレオチドの任意の配列について、例えば非特許文献7に挙げられた方法を使用して計算することができる。複合体が捕捉オリゴヌクレオチドから解離した後にイオン強度を高イオン強度に戻すことにより、P1とP2はハイブリッド形成して増幅可能な配列を形成することができる。
【0072】
図8Aでは、抗体Ab1およびAb2は、隣接する抗原性エピトープを認識し、5’末端の連結を介してそれぞれオリゴヌクレオチドP1およびP2に複合体形成している。P1およびP2の3’末端は相補的であり、抗体Ab2は共有結合的または非共有結合的のいずれかで常磁性粒子にも連結する。抗体Ab1は、Ab2で被覆された常磁性粒子を加える前に、その特異的エピトープに結合させることができる。Ab2がAb1に隣接して結合することにより、オリゴヌクレオチドP1とP2の3’末端はハイブリッド形成することができる。P1とP2の抗原非依存性のハイブリッド形成を最小化させるように、Ab1およびAb2の溶液中の濃度は、抗原の表面に結合したものと比較して低い。抗体−抗原複合体を磁場を適用することによって捕捉し、結合していないAb1抗体を洗浄によって除去する。次いで、P1:P2ハイブリッドを、図1で示したものなどの適切な増幅反応に使用してもよい。
【0073】
図8Bでは、抗体Ab1およびAb2は、隣接する抗原性エピトープを認識し、5’末端の連結を介してそれぞれオリゴヌクレオチドP1およびP2に複合体形成している。P1とP2の3’末端は相補的であり、抗体Ab1は共有結合的または非共有結合的のいずれかで常磁性粒子にも連結する。抗体Ab1は、抗体Ab2を加える前に、その特異的エピトープに結合させることができる。Ab2がAb1に隣接して結合することにより、オリゴヌクレオチドP1とP2の3’末端はハイブリッド形成することができる。P1とP2の抗原非依存性のハイブリッド形成は最小化するように、Ab1およびAb2の溶液中の濃度は、抗原の表面に結合したものと比較して低い。抗体−抗原複合体を磁場を適用することによって捕捉し、結合していないAb2抗体を洗浄によって除去する。次いで、P1:P2ハイブリッドを増幅反応に使用してもよい。
【0074】
図8Cでは、抗体Ab1およびAb2は、隣接する抗原性エピトープを認識し、5’末端の連結を介してそれぞれオリゴヌクレオチドP1およびP2に複合体形成している。P1とP2の3’末端は相補的であり、抗体Ab1は共有結合的または非共有結合的のいずれかで常磁性粒子にも連結する。抗体Ab1およびAb2は、それらの特異的エピトープに同時に結合させることができる。Ab2がAb1に隣接して結合することにより、オリゴヌクレオチドP1とP2の3’末端はハイブリッド形成することができる。P1とP2の抗原非依存性のハイブリッド形成は最小化するように、Ab1およびAb2の溶液中の濃度は、抗原の表面に結合したものと比較して低い。抗体−抗原複合体を磁場を適用することによって捕捉し、結合していないAb2抗体を洗浄によって除去する。次いで、P1:P2ハイブリッドを増幅反応で使用してもよい。
【0075】
図8Dでは、プローブP2を担持する抗体Ab2は、表面、例えばビーズまたはマイクロウェルの壁に、切れやすい連結を介して付着しているか、付着できる(図6GG参照)。P1を担持する抗体Ab1は、標的抗原のエピトープ1に結合しており、この複合体は、表面に連結したAb1とエピトープ2を結合することにより固定化されている。結合していないAb1は洗い流し、次いで切れやすい連結を開裂し、三元複合体は表面から遊離される。次いで、分離された三元複合体を含有する溶液相を増幅用の第2の反応ウェルに移し、最初の表面に非特異的に結合したAb1を残す。
【0076】
本発明の別の態様を図9で説明する。抗体Ab1およびAb2は、隣接する抗原性エピトープを認識する。オリゴヌクレオチドP1は、その3’末端で抗体Ab1に複合体形成している。オリゴヌクレオチドP2は、その5’末端で抗体Ab2に複合体形成している。抗体Ab1は共有結合的または非共有結合的のいずれかで常磁性粒子と連結している。この2つの抗体を抗原と混合し、それらの各エピトープに結合させる。得られる抗体−抗原複合体を磁場を適用することによって捕捉し、結合していないAb2抗体および試料マトリックスのその他の成分を洗浄によって除去する。次いで、プローブP1の5’末端およびプローブP2の3’末端と相補的なスプリントオリゴヌクレオチドSを加える。スプリントオリゴヌクレオチドSとプローブP1の5’末端およびプローブ2の3’末端との間のハイブリッド形成により、2つの抗体間のギャップが架橋される。次いで、P1:L:P2ハイブリッドを図3で示したように増幅反応で使用してもよい。図3で示したその他のリンカー構造も使用してよい。さらに、Ab1は、図6A〜6Lで記載の通りの開裂可能な連結を介して常磁性またはその他の粒子に付着してもよい。
【0077】
本発明のさらに別の態様を図10に挙げる。標識していないAb1およびAb2は、標的抗原の近接エピトープに結合している。第2の抗体Sec1およびSec2、例えば抗Fc1および抗Fc2をそれぞれ、互いに相補的な3’末端を含むオリゴヌクレオチドプローブP1およびP2で標識する。次いで、第2の抗体は標識していない最初の抗体Ab1およびAb2と結合し、オリゴヌクレオチドプローブを近くに近接させて、3’末端のハイブリッド形成および伸長によりプローブを増幅可能な鎖に変換する。任意選択的に、Ab1およびAb2はハプテン部(例えば、ビオチン、フルオレセイン、ジゴキシゲニン、トリニトロフェノール、ジニトロフェノールなど)で標識されていてもよい。この場合、プローブで標識した第2の抗体Sec1およびSec2は、Ab1およびAb2の各ハプテン標識に対して結合特異性を有する。
【0078】
さらなる実施形態では、第2の抗体は、連結スプリントオリゴヌクレオチドと互いに塩基対形成した場合に連結できるプローブで標識されている(図2)。第2の抗体の対が、近接エピトープに結合している標識していない抗体の対に結合している場合、プローブは連結スプリントオリゴヌクレオチドと互いに塩基対形成し、連結が生じる。
【0079】
第3の実施形態では、標識した第2の抗体は、抗原とインキュベーションする前またはインキュベーションしている間に最初の抗体と結合する(または結合することができる)。第4の実施形態では、第2の抗体の少なくとも1つは固体表面、例えばマイクロウェル壁または電磁ビーズに連結している。第5の実施形態では、第2の抗体は固体表面に可逆的に連結している(図6A〜6L、7A〜7D、および8A〜8D)。第6の実施形態では、表面に連結された抗体が固体表面から放出され、放出された抗体が増幅反応にかけられる。第7の実施形態では、Ab1および/またはAb2は、アプタマー、受容体またはその他のエピトープ結合単位であってもよく、Sec1およびSec2はAb1およびAb2に結合しているプローブで標識された認識分子である。第8の実施形態では、Sec1および/またはSec2は、Fab’断片、アプタマー、抗体に対する抗体、またはAb1もしくはAb2を特異的に認識する任意の分子であってもよい。
【0080】
プロテインGまたはプロテインAを、図10で説明した通り、任意選択的にSec1およびSec2の代わりにすることができる。プロテインGおよびプロテインAは、1つのプロテインGまたはプロテインAがIgG分子ごとに結合して、ほとんどのIgG分子およびFc領域に結合する。特に、プロテインGまたはプロテインAは、「一般的なオリゴヌクレオチド」プローブで修飾されることができる(図10の標識されたP1およびP2)。例えば、修飾されたプロテインG分子は、エピトープ1およびエピトープ2を認識する抗体に先に結合していることができる。この場合、P1で修飾されたプロテインGまたはプロテインAはAb1に先に結合しているであろう。同様に、P2で修飾されたプロテインGまたはプロテインAは、Ab2に先に結合しているであろう。あるいは、プローブで修飾されたプロテインGまたはプロテインA分子は、一緒に混合して、図10で示した通りに使用することができる。
【0081】
このアプローチには確かな利点がある。第1に、修飾する必要があるのは、ただ1つの試薬、すなわちプロテインGまたはプロテインAである。第2に、ほとんどの任意の一次検出抗体を、例えばラット、マウスまたはウサギ抗体に対する抗原に結合するのに使用することができる。第3に、主要な抗体に先に結合する修飾されたプロテインGまたはプロテインAは、特に、任意のAb1またはAb2での一般的な使用で使用可能な印の付いた試薬である。得られるアッセイ成分の標準化は、定量および再現性を向上させると期待される。
【0082】
ある場合には、プロテインAまたはプロテインGの代わりにプロテインA/プロテインGの融合産物を使用することが有利である。また、「プロテインA」または「プロテインG」は、天然の細菌産物、または例えばプロテインGのアルブミン結合能力を排除することによってIgG分子に最適に結合するように設計された遺伝子操作されたバージョンもしくは組換えバージョンを指すことができることも理解されよう。
【0083】
本発明の別の態様を図11A〜Cで示す。ここでは、本発明は、ヘアピン構造を取り入れることにより非特異的プライマー−プライマー相互作用に関与できないようにされた免疫増幅反応で使用するための、オリゴヌクレオチドで標識された抗体を含む。抗体Ab1は、SDA制限酵素ニック形成部位および下流の配列(aba’c)を含むオリゴヌクレオチドP1に複合体形成しており、ここで、aとa’はハイブリッド形成してヘアピン構造を形成する相補配列である。ヘアピンのTmは十分に低いので、オリゴヌクレオチド標識の一部は、増幅反応の条件下で、開いて弛緩した形態で存在する。核酸二重鎖のTmは、温度とイオン強度の所与の組合せの下で、例えば非特許文献7で記載の方法の1つを使用して、ヌクレオチドの任意の配列に関して当技術分野でよく知られた方法で計算されることができる。3’末端配列cは、ヘアピン構造の一部を形成せず、DNAポリメラーゼ伸長の自己プライミングを妨げるように設計されている。抗体Ab2は、SDA制限酵素ニック形成部位および下流の配列(ab’)を含むオリゴヌクレオチドP2に複合体形成している。抗体Ab1およびAb2がそれらの各エピトープに結合する場合、プローブP1のヘアピンの揺らぎ(breathing)によって、2つのオリゴヌクレオチド標識間で塩基対形成が生じる。配列(ba’)と(ab’)の対形成で形成したP1:P2ハイブリッドのTmは、P1ヘアピンのものよりも大きい。したがって、P1とP2とのハイブリッド形成は熱力学的に好ましい。次いで、DNAポリメラーゼはP2の3’末端を伸長して、ニック形成可能な二本鎖制限部位を生じる。ニック形成、伸長および鎖置換により、ニック形成可能な制限部位をいずれかの末端に有する二本鎖DNA分子が形成される。この構造物は、指数関数的SDA反応で使用してもよい。
【0084】
別の実施形態では、抗体Ab1は、SDA制限酵素ニック形成部位および下流の配列(b’aba’c)を含むオリゴヌクレオチドP1に複合体形成していてもよく、ここで、aとa’はハイブリッド形成してヘアピン構造を形成する相補配列である。配列bとb’も相補的だが、aとa’のハイブリッド形成で形成したものよりも不安定な構造を形成する。したがって、a:a’ヘアピンの形成が好ましい。3’末端配列cはヘアピン構造の一部を形成せず、DNAポリメラーゼ伸長の自己プライミングを妨げるように設計されている。抗体Ab2は、配列(b’a’b)を含むオリゴヌクレオチドP2に複合体形成しており、ここで、bとb’は相補的で、且つヘアピン構造を形成する。プローブP2はSDAニック形成部位を欠く。したがって、DNAポリメラーゼ伸長が3’末端から生じると、線形増幅をすることができないデッドエンド産物が生じる。a:a’およびb:b’ヘアピンのTmは十分に低いので、各オリゴヌクレオチドの一部は、反応の条件下で、開いて弛緩した形態で存在する。抗体Ab1およびAb2がそれらの各エピトープに結合する場合、プローブP1およびP2のヘアピンの揺らぎによって、2つのオリゴヌクレオチド標識間で塩基対形成が生じる。配列(b’ab)と(ba’b’)との対形成で形成したP1:P2ハイブリッドのTmは、いずれのヘアピン構造のものよりも大きい。したがって、P1とP2のハイブリッド形成は熱力学的に好ましい。次いで、DNAポリメラーゼはP2の3’末端を伸長して、ニック形成可能な二本鎖制限部位を生じる。ニック形成、伸長および鎖置換により、指数関数的SDA反応で用いることができる二本鎖DNA分子が形成される。
【0085】
さらなる実施形態を図11Cで示す。プローブP1は、ヘアピン配列b、d、b’、ヘアピン配列の5’である配列a、およびヘアピン配列の3’であり、伸長不可能な3’キャップを任意選択的に含有する配列cを含む。配列bとb’は相補的であり、ハイブリッド形成してヘアピン構造のステムを形成する。配列dはヘアピンのループを形成する。任意選択的に、配列dの一部はそれ自体と塩基対形成して、bおよびb’と共にステム構造の一部を形成してもよい。プローブP2は、P1の配列dと相補的な配列d’を含む。ヘアピン構造の存在により、dとd’とのハイブリッド形成が妨げられる。置換オリゴヌクレオチドDを加えると、最初にP1の配列aとハイブリッド形成し、次いでステムのb’アームを置換することによってヘアピンを開く。次いで、P2の配列d’はP1の折り畳まれていない配列dとハイブリッド形成し、P2はポリメラーゼで伸長されて、オリゴヌクレオチドDを置換し、ニック形成可能な二本鎖制限部位をP1上に作製する。次いで、増幅は、図11Bで示した実施形態と類似の方法に従う。
【0086】
図12は、試験試料中の抗原特異的免疫グロブリン抗体の存在を検出する方法を示す。プローブP1およびP2は、各Ag分子がP1またはP2のいずれか(ただし、両方ではない)によって標識されるように、抗原分子Agに複合体形成している。標識された抗原は、試験試料と混合され、示したようにAg特異的免疫グロブリンに結合する。P1とP2の両方を含有する複合体は、増幅可能であり、検出可能であり、Ag特異的免疫グロブリンの存在を示す。Ag特異的免疫グロブリンの不在下では、検出可能な複合体は形成しない。同様のアプローチを使用して、2つ以上の同一のリガンド結合性部位または2つ以上の異なるリガンドの結合性部位のいずれかを含む任意のリガンド−受容体の相互作用を検出することができる。後者の場合、各リガンドは異なるプローブ配列で標識されている。例えば、IgGのFc領域に結合するプロテインGはP1で標識してもよく、AgはP2で標識してもよい。標識したAgおよびプロテインGを同じIgG分子に結合することにより、本発明の方法により増幅可能で、且つ検出可能な複合体が生じるであろう。
【0087】
図13は、二元免疫SDAで有用な、代表的なプローブ、プライマー、アダプター、レポーターおよびテザーオリゴヌクレオチドを示す。これらのオリゴヌクレオチドの構造およびそれらの使用は、以下の実施例で挙げる。以下の実施例には、一切、本発明の範囲を限定する意図はない。
【実施例1】
【0088】
(二元免疫SDAに有用なプローブ、プライマー、アダプター、レポーターの代表的な配列)
以下に示したプローブ、プライマー、アダプターおよびレポーターのいくつかの配列は、図13で挙げられている。
【0089】
(プローブ(P1、P2))
RHP−1(右側のプローブ;太字の配列は下記のプライマーSRH−1と共通である):
【0090】

【0091】
RHP−3(右側のプローブ;太字の配列は下記のプライマーSRH−1と共通である):
【0092】

【0093】
RBD−3v3(右側のプローブ;X=ビオチン標識dT;太字の配列は下記のプライマーSRH−1と共通である):
【0094】

【0095】
LHP−1(左側のプローブ;下線の塩基はRHP−1の3’末端と相補的である):
5’ ATT CAC GCT TCC ATT CCA TGT CTC GGG TTT ACT TCA TCT GCA ACT GTA C
【0096】
LHP−2(左側のプローブ;下線の塩基はRHP−1の3’末端と相補的である):
5’ ATT CAC GCT TCC ATT CCA TGT CTC GGG TTT ACT TCA TCT GCA ACT GTA CAT
【0097】
LHP−3(左側のプローブ;下線の塩基はRHP−1の3’末端と相補的である):
5’ ATT CAC GCT TCC ATT CCA TGT CTC GGG TTT ACT TCA TCT GCA ACT GTA CAT CTG T
【0098】
LHP−4(左側のプローブ;下線の塩基はRHP−1の3’末端と相補的である):
5’ ATT CAC GCT TCC ATT CCA TGT CTC GGG TTT ACT TCA TCT GCA ACT GTA CAT CTG TCT
【0099】
LHP−5(左側のプローブ;下線の塩基はRHP−1の3’末端と相補的である):
5’ ATT CAC GCT TCC ATT CCA TGT CTC GGG TTT ACT TCA TCT GCA ACT GTA CAT CT
【0100】
(プライマー)
SRH−1(右側のプライマー;太字の配列はRHP−1と共通である):
【0101】

【0102】
SLH−2(左側のプライマー;太字の配列はLHP−1、2、3、4および5と共通であり;下線の塩基はRHP−1の3’末端と相補的である):
【0103】

【0104】
(アダプター)
ADR−2(下線の塩基はTBD10.2[D/R]の3’末端と同一である):
5’ ACG TTA GCC ACC ATA CGG ATA GTG ACG TGA TGA GCT AGA C
【0105】
ADR−5(下線の塩基はTBD10.2[D/R]の3’末端と同一である):
5’ ACG TTA GCC ACC ATA CGG ATG ATG AGC TAG AC
【0106】
ADR−8(下線の塩基はTBD10.2[D/R]の3’末端と同一である):
5’ ACG TTA GCC ACC ATA CGG ATG TGA CGT GAT GAG C
【0107】
ADIQS−1(IQSアダプター):
5’ ACG TTA GCC ACC ATA CGG ATG ATG AGC ATC TG
【0108】
ADQS−2(IQS−2のアダプター;下線の塩基はaltD6.9(F/D)の3’末端と同一である):
5’ AGC TAT CCG CCA TAA GCC AT AC TCA
GAG TGA TCA AGT
【0109】
(レポーター)
TBD10.2(D/R)(下線の塩基はADR−2およびADR−5の5’末端と同一である):
5’(dabcyl)−TAG CGC CCG AGC GCT ACG TT(rox)A GCC ACC ATA CGG AT
【0110】
altD6.9(F/D):
5’(fam)−AGT TGC CCC GAG GCA ACT(dabcyl)AGC TAT CCG CCA TAA GCC AT
【0111】
(テザーオリゴヌクレオチド)
RCP−1(テザーオリゴヌクレオチド;大文字の塩基はRHP−1の5’末端と相補的である):
5’ CCG AGA ACA GAC AAG ACA AGA CTG Gat at
【0112】
LCP−2(テザーオリゴヌクレオチド;大文字の塩基はLHP1−5の5’末端と相補的である):
5’ CGA GAC ATG GAA TGG AAG CGT GAA Ttt tt
【0113】
LCP−4(テザーオリゴヌクレオチド;大文字の塩基はLHP1−5の5’末端と相補的である):
5’t tta ttt tat CGA GAC ATG GAA TGG AAG CGT GAA T
【0114】
(捕捉および置換オリゴ)
RCP−13v1(捕捉オリゴヌクレオチド;大文字の塩基はRHP−3の5’末端近くの配列と相補的であり;下線の塩基はDO−13v1と相補的であり;X=テトラ−エチレングリコール;Z=ヘキサ−エチレングリコール;XはZにリン酸ジエステル部を介して連結しており;Zはオリゴヌクレオチドの5’末端にリン酸ジエステル部を介して連結している):
【0115】
5’ビオチン−X−Z−cct ggt acg agt ttc tat cct AA TGC ATC aCG AGA ACA GAC AAG ACA AG t
【0116】
DO−13v1(置換オリゴヌクレオチド[キャップ]=3’デオキシルイジン):
5’ CTT GTC TTG TCT GTT CTC GTG ATG CAT TAG GAT AGA AAC TCG TAC CAG G−[キャップ]3’
【0117】
RCP−9v2.2(捕捉オリゴヌクレオチド;大文字の塩基はRHP−3の5’末端近くの塩基と相補的であり;下線の塩基は置換オリゴCMPR−9v2と相補的であり;X=テトラ−エチレングリコール;Z=ヘキサ−エチレングリコール;XはZにリン酸ジエステル部を介して連結しており;Zはオリゴヌクレオチドの5’末端にリン酸ジエステル部を介して連結している):
5’ビオチン−X−Z−t tta CAC TGA ATG CAT tCC
tAG AAC AGA CAA GAC AAG ACT ccg tgg cAg
cgt
【0118】
CMPR−9v2(捕捉オリゴヌクレオチド;大文字の塩基はRHP−3の5’末端と相補的であり;[キャップ]=3’デオキシウリジン):
5’ ACG CTG CCA CGG AGT CTT GTC TTG TCT GTT CTt GGA ATG CAT TCA GT−[キャップ]3’
(ブロッキングオリゴヌクレオチド([キャップ]=2’,3’ジデオキシシチジン))
【0119】
LBK−1(大文字の塩基はLHP−3の3’末端と相補的である):
5’ ACA GAT GTA CAG Taa ttt−[キャップ]3’
【0120】
RDB−3p5(大文字の塩基はRHP−1の3’末端と相補的であり;下線の塩基はRHP−3の3’末端と相補的である):
5’ cag ttc agc acA CTG TAC ATC TGT CTA GC aa−[キャップ]3’
【0121】
RDB−3p8(大文字の塩基はRHP−1の3’末端と相補的であり;下線の塩基はRHP−3の3’末端と相補的である):
5’ cag ttc agc acA CTG TAC ATC TGT CTA GCT CA aa−[キャップ]3’
【0122】
RDB−3p10(大文字の塩基はRHP−1の3’末端と相補的であり;下線の塩基はRHP−3の3’末端と相補的である):
5’ cag ttc agc acA CTG TAC ATC TG T CTA GCT CAT Cta−[キャップ]3’
【0123】
RDB−3z8(大文字の塩基はRHP−3の3’末端と相補的である):
5’ cag ttc agc ac aa GTA CAT CTG TCT
AGC TCA aac−[キャップ]3’
【0124】
RDB−3z0(大文字の塩基はRHP−3の3’末端と相補的である):
5’ cag ttc agc ac aa GTA CAT CTG T aac−[キャップ]3’
【0125】
(定量化標準および品質管理(「QC」)ヌクレオチド)
LTAR−1(Epoch Biosciences(ワシントン州Bothell)製のQCオリゴヌクレオチド;下線の塩基はIQS−1とは異なる):
5’ TTT TAC TTC ATC TGC AAC TGT ACA TCT GTC TAG CTC ATC ACG TCA CTG AAT GCA T
【0126】
IQS−1(定量化内部標準;下線の塩基はLTAR−1とは異なる):
5’ TT TAC TTC ATC TGC AAC ACA TGA TCT
CAG ATG CTC ATC ACG TCA CTG AAT GCA TC
【0127】
IQS−2(定量化内部標準;下記の場合の塩基は標的誘導アンプリコンとは異なる):
5’ TTA CTT CAT CTG CAA C at ctg tca ctt gat cac tct ga G TCA CTG AAT GCA TC
【実施例2】
【0128】
(均一な免疫SDAの実験的証明)
以下の一連の実験では、近接構成要素の分析物特異的結合性部はビオチン部であり、選択した試験分析物はストレプトアビジン(「SA」)であった。ビオチンは、オリゴヌクレオチド部P1(RHP−1)およびP2(LHP−1またはLHP−3)の5’末端に連結させた。(実施例1参照、上記)。P1およびP2はそれぞれ濃度1μMであり、10mMのTris−EDTA緩衝液およびウシ血清アルブミン(BSA)および任意選択的に0.25μMのSAと混合した。室温で10分後、最終的なプローブ濃度がpMの範囲になるように混合物を連続的に希釈した。次いで、希釈した混合物をSDAプライマー(SRH1、SLH2)、アダプター(ADR−5)およびレポータープローブ(TBD10.2)と混合し、混合物を72℃に10分間加熱した。試料を52℃に冷却し、dNTPを含むSDA成分の乾燥カクテルを含有する「増幅ウェル」に加えた。最終的なプローブ濃度は1fMまたは10fMのいずれかであり、最終的なSA濃度はゼロまたは各プローブ濃度の2分の1であった。次いで、BsoBI制限エンドヌクレアーゼおよびBstDNAポリメラーゼ(BD Diagnostic Systems、メリーランド州Baltimore)を混合物に加え、等温増幅を52℃で1時間実施した。特許文献17で記載の通りに、フルオレセイン標識レポータープローブ、TBD10.2の変換に伴う蛍光の増加を観察することによって増幅を監視した。
【0129】
MOTA値(1時間の反応の過程にわたって統合した蛍光強度の測定値)を表1で報告する。P2が、P1(RHP−1)とハイブリッド形成した場合に13塩基対の二重鎖を形成するLHP−3である場合、分析物SAを含有する試料では、SAを含有しなかった対照よりもMOTA値が100〜1000倍高く、fM未満の濃度でSAタンパク質を検出するこのSDAに基づく二元プローブシステムの能力を証明している。
【0130】
【表1】

【実施例3】
【0131】
(不均一な免疫SDAの実験的証明)
この実験では、5’ビオチンを担持するか、またはビオチンを担持せず5’アミノリンカーを担持するかの、いずれかのRHP−1はP1として働き、5’ビオチンを担持するか、またはビオチンを担持せず5’アミノリンカーを担持するかの、いずれかのLHP−1はP2として働いた。100nMのプローブをSAで被覆したビーズ(Promega、ウィスコンシン州Madison)と混合し、時々撹拌しながら室温で45分間インキュベートした。次いで、ビーズを管の脇に集め、溶液を除去した。ビーズを0.1mg/mLのBSAに再懸濁し、それらを管の脇に集め、溶液相を廃棄した。これらの洗浄ステップを4回繰り返し、最後にビーズをSDA反応緩衝液に再懸濁した。得られる懸濁液を、SDAプライマー(SLH−2、SRH−1)、アダプター(ADR−5)およびレポーター(TBD.10.2)を含有する混合物に加えた。これらの混合物中のビーズに結合したSAの最終濃度は40または400fMであった。次いで、上記の実施例2の記載の通りにSDAを実施した。
【0132】
結果を表2に示す。期待した通り、ビオチン化プローブおよびSAを40または400fMのいずれかで含有する反応において、強いMOTA値が観察され、SAに結合したプローブが増幅可能な伸長産物に変換したことを示した。対照的に、SAと、ビオチンの代わりに5’アミノ連結基で標識したプローブとを含有する対照反応では、MOTA値は非常に低かった。これらの対照反応について期待した通り、ビオチンを欠くプローブはビーズに連結したSAに結合することはできず、その結果、洗浄ステップ中に排除され、したがって増幅可能な伸長産物には変換されなかった。対照反応に現れた低いシグナルは、アミノに連結したプローブのビーズ表面への非特異的結合の結果の可能性がある。
【0133】
【表2】

【実施例4】
【0134】
(単一のテザーオリゴヌクレオチドによる免疫SDAの実験的証明)
この実験では、非ビオチン化RHP−1(上記参照)はP1として、LHP−3(5’ビオチンを担持している)はP2として、RCP−1(3’ビオチンを担持している)はテザーオリゴ、TOとして働いた。プローブP1およびP2ならびにテザーオリゴTOを等モル比で混合し、SAを含有しているか欠いているかのいずれかの管に加えた。この管を短時間室温でインキュベートし、次いで管の内容物を連続的に希釈して、プローブの濃度をpM範囲にした。次いで、希釈した混合物を、SDAプライマー(SRH1、SLH2)、アダプター(ADR−5)およびレポータープローブ(TBB10.2)と混合して、SAの最終濃度を0または0.25fMのいずれかに、P1、P2およびTOのそれぞれの濃度を1fMとした。次いで、混合物を「熱スパイク」(72℃で10分間)にかけるか、52℃で10分間インキュベートした(「熱スパイクなし」)。推定Tm64℃を有するP1:TO二重鎖は52℃では安定で、72℃のインキュベーションで分裂すると予想される。分裂すると、P1:TO二重鎖は、極めて非常にゆっくりと(t1/2>100時間)、希釈した(1fM)プローブ濃度で再形成することとなる。BsoBI制限エンドヌクレアーゼ、BstDNAポリメラーゼおよびdNTPの乾燥カクテルを加えることによって試料をSDAにかけ、次いで52℃においてProbeTec(商標)ET装置でインキュベートした。プローブP1およびP2がそれぞれTOまたはビオチンを介して共通のSA分子に結合すると、それらの相補的な3’末端はハイブリッド形成し伸長して、SDAプライマー(SLH−2およびSRH−1)およびアダプターADR−5のためのハイブリッド形成部位を作製する。これにより、伸長したP1およびP2分子の同時の増幅および検出が可能になる。フルオレセイン標識レポータープローブ、TBD10.2の変換に伴うアダプターが介在する蛍光の増加を観察することによって増幅を観測した(アダプター介在型レポータープローブ変換の詳細については特許文献17参照)。
【0135】
結果を表3に示す。分析物0.25fMのSAおよび1fMのプローブを含む「熱スパイクなし」試料は、蛍光の強い増加(平均MOTA=166000)を示したが、SAを欠くが1fMのプローブを含有する対照試料は、ちょうど3000の平均MOTA値を示した。これはP1:TO二重鎖がSDAの前に72℃の熱スパイクで分裂された試料から得られた値と同程度である。SAを欠く試料では、MOTA値は低いままであり、これはP1−P2二重鎖の形成が1fMのプローブ濃度では測定可能な効率で生じないからである。
【0136】
【表3】

【実施例5】
【0137】
(二元免疫SDAによる分析物定量)
試料中の標的分析物のレベルは、標的介在型プローブ伸長産物と共増幅された内部標準(例えば、実施例1のIQS−1)を入れることによって定量的に測定してもよい。内部標準および標的依存性プローブ伸長産物は、SDAプライマーの共通の対によって増幅されるが、それぞれの識別可能に標識されたレポータープローブ(例えば、実施例1のTBD10.2およびAltD6.9)により検出される。2つのレポータープローブの相対的なシグナルを比較することにより、内部標準の既知の量と相対的なプローブ特異的伸長産物の濃度を推定することができる。分析物の絶対濃度の測定では、バックグラウンド修正済み標的/対照シグナル対標的分析物シグナルの比の「標準曲線」を作製することが有利な場合がある。次いで、試験試料について観察したシグナル比を標準曲線と比較して、絶対分析物濃度を作製する。核酸標的レベルを定量する同様の方法が当技術分野で知られている(例えば、非特許文献8参照)。
【実施例6】
【0138】
(2つのテザーオリゴヌクレオチドを用いる免疫SDAの実験的証明)
この実験では、非ビオチン化RHP−1(上記参照)はP1として、非ビオチン化LHP−3はP2として、一方、RCP−1(3’ビオチンを担持している)およびLCP−4(5’ビオチンを担持している)はテザーオリゴヌクレオチドとして働いた。P1、P2およびテザーオリゴヌクレオチド間の相互作用を図3Hに図示する。プローブP1およびP2ならびにテザーオリゴヌクレオチドを等モル比(ここで、モル濃度は近接構成要素のテザーオリゴヌクレオチド部のみに関して測定された)で混合し、SAを含有しているか又は欠いているかのいずれかの管に加えた。72℃の「熱スパイク」実験を実施しなかった以外は、実施例4で記載の通りに反応を実施した。結果を表4に示す。SAを含有する試料は、強い蛍光の増加(平均MOTA値=136000)を示したが、SAを欠く試料は、ごくわずかな増加を示した(MOTA=533)。
【0139】
【表4】

【実施例7】
【0140】
(分析物としてIL−8を用いる均一な免疫SDAの実験的証明)
ヒトIL−8を対象としたMAb G265−8(Ab1;BD Bioscience Pharmingen)をSAと共有結合させて、IgG当たり1つのSA1を含有する抗−IL−8 IgG−SA複合体(Ab1−SA)を得た。MAb G265−8とSAは当技術分野でよく知られた方法を使用して複合体形成させた。20nMの5’ビオチン標識プローブRHP−3(P1)、10nMのAb1−SA複合体、10nMのTris−EDTA緩衝液および0.1mg/mlのBSAを含有する混合物を調製し、一夜4℃でインキュベートしてビオチン化オリゴヌクレオチドをAb1−SA複合体に結合させて、Ab1−SA−P1を形成した。
【0141】
MAb G265−8のものとは異なるIL−8エピトープに結合するMAb G265−5(Ab2;BD Bioscience Pharmingen)を、プローブLHP−3(P2)のアミノ修飾された形態と直接、共有結合的にカップリングさせて、Ab2を1個当たり平均して2.5個のP2部を有するAb2−P2複合体を産生した。LHP−3は5’末端に連結した第1脂肪族アミン基を含んでおり、MAb G265−5とLHP−3は本質的に特許文献12で記載の通りに複合体形成させた。
【0142】
それぞれ1nMのAb−プローブ複合体濃度を有するAb1−SA−P1およびAb2−P2を、10mMのTris−EDTA緩衝液およびBSAおよび任意選択的に0.01〜1nMのIL−8と混合した。室温で30分後、Ab−プローブ複合体の最終濃度がfMの範囲になるように、混合物を連続的に希釈した。次いで、希釈した混合物をSDAプライマーSRH−1およびSLH−2、アダプターADR−5、ならびにレポータープローブTBD10.2と混合した。混合物を37℃に10分間加温した後、各試料の一部を増幅ウェルに52℃で実施例2に記載の通りに加えた。ここで、各増幅反応はBsoBI制限酵素およびBst DNA ポリメラーゼを含有していた。Ab−プローブ複合体の最終濃度は1fMであり、IL−8の最終濃度は0、0.01、0.1または1fMであった。その他の成分の濃度は実施例2で記載の通りであった。試料を直ちにProbeTec(商標)ET装置に移し、そこで等温増幅を52℃で1時間実施した。実施例2で記載の通りに蛍光の増加を観察することによって増幅を観測した。
【0143】
平均MOTA値を表5に報告する。IL−8を欠く試料では低いMOTA値が得られたが、一方、より高いレベルのIL−8によりMOTA値は増加され、均一な免疫SDA法によるIL−8の検出を立証した。この実験では、ハイブリッド形成ブロッカーオリゴヌクレオチドは用いなかったが、近接対−IL−8複合体の形成後に試料を約100万倍に希釈して、標的非依存性プローブの増幅の発生を低減させた。
【0144】
【表5】

【実施例8】
【0145】
(ハイブリッド形成ブロッカーオリゴヌクレオチドの使用によるバックグラウンド抑制の実験的証明)
この実験は、標的分析物を伴わないP1とP2分子との塩基対形成から生じる標的非依存性増幅を抑制するためのハイブリッド形成ブロッカーオリゴヌクレオチドの使用を説明する。この実験では、プローブP1は5’ビオチン化RHP−3であり、プローブP2は5’ビオチン化LHP−3である(上記参照)。P1およびP2の3’末端を含む10ヌクレオチド配列は、互いに相補的である。実施例2と同様に、標的分析物はSAであり、これは、その四量体に4つのビオチン結合性部位を含有する。ハイブリッド形成ブロッカーオリゴヌクレオチドは、RHP−3の3’末端と相補的な18ヌクレオチド配列を含むRDB−3p8(実施例1)である。したがって、P1とハイブリッド形成ブロッカーRDB−3p8との間に形成された二重鎖は、P2と相補的なP1の3’末端での10ヌクレオチド、ならびにP2と相補的ではないP1のさらなる8ヌクレオチドを含む。さらに、RDB−3p8は、14ヌクレオチドの5’テール配列を含み(実施例1のRDP−3p8の下線の塩基の塩基5’)、これは、その上でRHP−3の3’末端が伸長することができる無能力化鋳型として働く(図4Cで示した)。本発明のハイブリッド形成ブロッカーの特徴は、近接構成要素のオリゴヌクレオチド部に共有結合的に付着しない、または連結しないということである。オリゴヌクレオチド部の3’末端の伸長に依拠して分析物特異的アンプリコンを産生する本発明の方法では、ハイブリッド形成ブロッカー−プローブ二本鎖が、3’末端の伸長を必要とし、二重鎖が不安定化する高温で一般に生じるポリメラーゼ触媒増幅方法(例えば、SDAおよびPCR)中で安定性を維持する必要がある。一般に、ポリメラーゼベースの増幅方法(例えば、PCRおよびSDA)で使用する高温は、プローブ−ブロッカーハイブリッドの拡がりを、誤ったプローブ変換の抑制の効力がなくなる点まで減少させることができる。本発明では、プローブ間で形成するハイブリッドよりも安定なプローブ−ブロッカーハイブリッドを形成することが可能なハイブリッド形成ブロッカーを選択することにより、かつ高温でプローブ−ブロッカー鋳型を安定化する無能力化鋳型を使用することにより、この困難を克服している。
【0146】
免疫SDAによるSA含有溶液の分析は、以下の通りに実施した。それぞれ20pMの5’ビオチン標識プローブRHP−3(P1)および5’ビオチン標識LHP−3(P2)、50nMのRDB−3p8ハイブリッド形成ブロッカーオリゴヌクレオチド、10mMのTris−EDTA緩衝液および0.1mg/mlのBSAを含有する溶液を調製した。また、各溶液は、SAを0、0.1、1、10または100fMで含有していた。この溶液を2時間37℃でインキュベートし、混合物を免疫SDA緩衝液中で10倍に希釈した。次いで、希釈した試料100μLを、SRH−1SDAプライマー1.5μM、SLH−2SDAプライマー3.75μM、ADR−8アダプター2.25μM、TBD10.2レポータープローブ3.75μMおよびRDB−3p8ハイブリッド形成ブロッカーオリゴヌクレオチド0.375μMを含有するプライミング溶液20μLと混合した。得られた混合物を37℃で10分間インキュベートした。オリゴヌクレオチドすべての配列は、実施例1に見出すことができる。免疫SDA反応を開始するために、52℃で予備平衡され、Bst DNAポリメラーゼ、BsoBI制限酵素、ならびにリン酸カリウム、BSAおよびdNTPを含むその他のSDA成分で構成されたSDA酵素溶液20μLを含有する増幅マイクロウェルに、各混合物80μLを移した。次いで、マイクロウェルを直ちに密封し、ProbeTec(商標)ET装置内に置き、各マイクロウェルの蛍光を観測しながら、52℃で1時間維持した。RDB−3p8ハイブリッド形成ブロッカーオリゴヌクレオチドを含有しない一連の対照反応物を上記のものと一緒に調製し、ProbeTec(商標)ET装置内で同時に観測した。
【0147】
最初の結合性混合物の希釈度を考慮した結果、各免疫SDA混合物は、1.3pMのP1およびP2と、0、0.6、6、66、666または6666aMのいずれかの濃度のSAとを含有していた。また、免疫SDA反応物は、30mMのリン酸カリウム(pH7.6)、75mMのビシン、50mMの水酸化カリウム、3.5%のジメチルスルホキシド(DMSO)、5mMの酢酸マグネシウム、50μg/mlのBSA、500nMのSLH−2、200nMのSRH−1、50nMのRDB−3p8、300nMのADR−8、500nMのTBD10.2、0.1mMのdATP、0.1mMのdGTP、0.1mMのdTTP、0.5mMの2’−デオキシシチジン5’−O−(1−チオトリホスフェート)S異性体(dCTPαS)、約8単位のBst DNAポリメラーゼおよび18単位のBsoBI制限酵素を含有していた。P1とP2との相互のハイブリッド形成および伸長から生じた産物の増幅は(図1参照)、特許文献17で記載のアダプター介在型プロセスによるTBD10.2レポーターオリゴヌクレオチドの増幅に伴うROX蛍光の増加を観測することによって検出した。各ウェルについて、反応の過程の間1分間に1回ROXを読み取った。各試料のROX蛍光の読取り値を60分間にわたってプロットした。
【0148】
MOTA値を表6に報告する。ハイブリッド形成ブロッカーオリゴヌクレオチドを用いない標的を含まない反応(すなわち、0aM SA)では、相対的に高い平均MOTA値49382が得られた。このバックグラウンドシグナルは、免疫増幅の感度をかなり制限し、標的分析物の不在下でさえプローブを増幅可能な産物に変換するP1とP2の標的非依存性のハイブリッド形成およびそれに続くそれらの3’末端の伸長から生じると考えられる。しかし、ハイブリッド形成ブロッカーオリゴヌクレオチドが反応混合物に含まれるる場合、RDB−3p8を用いる標的を含まない混合物から得られた低い平均MOTA値376により明らかになったように、バックグラウンドシグナルは劇的に減少した。これらの反応では、ハイブリッド形成ブロッカーオリゴヌクレオチドはP1の3’末端に競合的に結合し、これによりP2がP1とハイブリッド形成するのを妨げ、プローブの増幅可能な産物への標的非依存性の変換を本質的に排除する。
【0149】
標的分析物SAおよびRDB−3p8ハイブリッド形成ブロッカーオリゴヌクレオチドの両方を含有する反応混合物は高いMOTA値を示し、これはハイブリッド形成ブロッカーオリゴヌクレオチドの存在下であっても標的結合プローブが効率的に増幅されることを示す。本発明者らは、プローブP1とP2が同じSA分子に同時に結合することにより、バルク溶液中の結合していないプローブと比較して、2つのプローブの局所濃度が1000万倍超高められると推定する。SA分子上のこの2つのプローブの推定有効局所濃度は10μMを超え、これはバルク溶液中のハイブリッド形成ブロッカーオリゴヌクレオチドの濃度50nMを大きく上回る。競合的ハイブリッド形成ブロッカーオリゴヌクレオチドの存在にもかかわらず、標的に結合したP1およびP2の高い局所濃度により、プローブ同士のハイブリッド形成およびプローブの増幅可能な産物への変換は促進される。対照的に、標的に結合していないプローブP1およびP2は、バルク溶液内の濃度が1.3pMであり、これらの結合していないプローブ同士のハイブリッド形成は、ハイブリッド形成ブロッカーオリゴヌクレオチドとP1との競合的ハイブリッド形成によって効果的に抑制されている。ブロッカーを用いない666aM SAでの反応と比較して、ハイブリッド形成ブロッカーを含有する666aM SAでのSDA反応においてMOTAスコアが減少していることが示す通り、標的結合プローブの変換がある程度抑制されていると思われるが、標的シグナル/バックグラウンドシグナルの比は、ハイブリッド形成ブロッカーを含有する反応に関して200倍近く大きい。
【0150】
【表6】

【0151】
一般的に、より高い濃度の結合していないプローブP1およびP2を含有する反応混合物は、より低いプローブ濃度を含有する試料と同程度のバックグラウンド抑制を提供するために、ハイブリッド形成ブロッカーオリゴヌクレオチドの濃度をより増大することが必要となる。ハイブリッド形成ブロッカーオリゴヌクレオチドの濃度を経験的に調整して、適切な程度のバックグラウンド抑制を提供するのに必要な濃度を特定することができる。また、高濃度のハイブリッド形成ブロッカーオリゴヌクレオチドは標的結合プローブの増幅をある程度抑制する可能性があるので、適切なバックグラウンド抑制を与えることが見出されたハイブリッド形成ブロッカーオリゴヌクレオチドの最低濃度が一般的に最適である。
【0152】
RDB−3p8のRHP−3とのハイブリッド形成が18塩基対の二重鎖および各オリゴヌクレオチドの5’末端上の対形成していない一本鎖のテールを作製するように、この実施例で用いたハイブリッド形成ブロッカーオリゴヌクレオチド、RDB−3p8は、プローブP1、RHP−3の3’末端と相補的な18ヌクレオチドの配列を含有する。RDB−3pよりも長いか短いいずれかの相補的配列(例えば、それぞれRDB−3p10またはRDB−3p5)を有するハイブリッド形成ブロッカーオリゴヌクレオチドも用いてよい。一般的に、所与の濃度では、プローブの相補性がより短いセグメントを有するハイブリッド形成ブロッカーオリゴヌクレオチドは、プローブの相補性がより長いセグメントを有するものよりも安定性がより低い(より低いTm)P1との二重鎖を形成する。一般的に、所与のプローブと安定性のより低い二重鎖を形成するハイブリッド形成ブロッカーオリゴヌクレオチドは、プローブとより安定な二重鎖を形成するハイブリッド形成ブロッカーオリゴヌクレオチドと同程度のバックグラウンド抑制を提供するためには、より高い濃度で用いられる必要がある。また、P1:P2二重鎖の安定性により、所与のハイブリッド形成ブロッカーオリゴヌクレオチドの効率に影響が及ぼされることとなる。一般的に、P1:P2二重鎖が安定であればあるほど、適切なレベルのバックグラウンド抑制を与えるのに用いなければならない所与のハイブリッド形成ブロッカーオリゴヌクレオチドの濃度は高くなる。同様に、P1:P2二重鎖が安定であればあるほど、固定濃度のハイブリッド形成ブロッカーオリゴヌクレオチドに対して同程度のバックグラウンド抑制を与えるのにプローブ−ブロッカー二重鎖はより安定でなければならない。ハイブリッド形成ブロッカーオリゴヌクレオチドとプローブとの間に形成した二重鎖の安定性は、プローブと相補的なハイブリッド形成ブロッカーオリゴヌクレオチド配列の長さまたは配列組成を変えることによって調節されることができる。オリゴヌクレオチド配列および濃度などのパラメータから二重鎖の安定性を推定するためのソフトウェアは、OLIGO(登録商標)(英国Cambio)およびMfold(著作権、1996、Dr.M.Zuker)など、当技術分野でよく知られている(参照により本明細書に組み込まれる非特許文献9参照、非特許文献10に記載)。
【0153】
各プローブに特異的な2種のハイブリッド形成ブロッカーオリゴヌクレオチドを同時に用いてバックグラウンドシグナルを抑制してもよい。一般的に、単一のハイブリッド形成ブロッカーオリゴヌクレオチドで得たものと同程度のバックグラウンド抑制を与えるのに必要とされる各ハイブリッド形成ブロッカーオリゴヌクレオチドの濃度はより低くなる。
【実施例9】
【0154】
(免疫SDAによるピコモル未満のIL−8濃度の均一検出)
抗体−プローブ複合体Ab1−SA−P1およびAb2−P2は、実施例7で記載の通りであった。10mMのTris−EDTA緩衝液、20pMのAb1−SA−P1、100pMのAb2−P2、1mg/mLのBSA、0.1mg/mLのマウスγグロブリン、50nMのハイブリッド形成ブロッカーオリゴヌクレオチドRDB−3z8および0、0.005、0.010または0.025pMのIL−8を含有する試料50μLを調製した。室温で3時間インキュベートした後、各試料の分量5μLを1:10(v/v)に希釈して、0.1mg/mLのBSAを含有するTris−EDTA緩衝液とし、次いでさらに1:10(v/v)に希釈して、SDAプライマーSRH−1(100nM)およびSLH−2(500nM)、300nMのアダプタープライマーADR−8、500nMのレポータープローブTBD10.2(D/R)ならびに50nMのハイブリッド形成ブロッカーRDB−3z8を含有する溶液100μLとした。そのように希釈した4つの混合物は、最初の試料のそれぞれから調製された。次いで、希釈した混合物を37℃で約10分間インキュベートし、52℃に予め加温したSDA酵素溶液20μLを含有する別個のマイクロウェルに各混合物の分量80μLを移した。このマイクロウェルを密封し、ProbeTec(商標)ET装置内に置き、52℃で1時間インキュベートした。参照により本明細書中に組み込まれる特許文献17で記載の通りに、フルオレセイン標識レポータープローブ、TBD10.2の変換に伴う蛍光の増加を観察することによって増幅を観測した。得られるMOTA値を表7に報告する。0.005pMと低いIL−8濃度を含有する結合性混合物の平均MOTA値は、IL−8ゼロの試料から得られる対応値よりも著しく高く、これは本発明の均一法が、未結合の抗体から結合抗体を分離せずに、低フェムトモル範囲の分析物濃度を検出できることを立証している。
【0155】
IL−8ゼロの試料のMOTAスコアで表されたバックグラウンドシグナルは、標的に結合していない抗体同士の弱い相互作用から生じる誤ったアンプリコン形成による結果と考えられる(実施例16参照)。この実施例のSDA反応での抗体濃度は、前述の実施例よりも少なくとも200倍高いため、この実施例におけるバックグラウンドレベルは実施例7よりも高い。
【0156】
【表7】

【実施例10】
【0157】
(テザーオリゴヌクレオチドおよび架橋プローブを用いてIL−8を検出する免疫SDAの実験的証明)
実施例9のAb1−SA複合体10nMを、0.1mg/mLのBSAを含有する0.1MのTris−EDTA緩衝液中で20nMの3’−ビオチン標識RCP−1テザーオリゴヌクレオチド(TO)と混合した。この混合物を一晩4℃でインキュベートして、ビオチン化オリゴヌクレオチドをAb1−SA複合体に結合させてAb1−SA−TOを形成した。
【0158】
1nMのAb1−SA−TO、ビオチン標識を有さない1nMのRHP−3(P1)、1nMのAb2−P2(実施例8参照)、10mMのTris−EDTA緩衝液、0.1mg/mLのBSAおよび0、10または100pMのIL−8を含有する混合物を調製した。30分間室温でインキュベートした後、Ab−プローブ複合体の最終濃度がfMの範囲になるように、混合物を連続的に希釈した。次いで、希釈した混合物をSDAプライマーSRH−1およびSLH−2、アダプターADR−5、ならびにレポータープローブTBD10.2と混合し、この混合物を37℃に10分間加温した。希釈した試料それぞれの部分を、BsoBI制限酵素およびBstDNAポリメラーゼをも含有する乾燥した増幅ウェルに52℃で実施例2に記載の通りに加えた。得られるSDA混合物中のAb−プローブ複合体の濃度は1fMであり、IL−8の濃度は0、0.01または0.1fMのいずれかであった。試料を直ちにProbeTec(商標)ET装置に移し、そこで等温増幅を52℃で1時間実施した。上記の実施例2で記載の通りに蛍光の増加を観察することによって増幅を観測した。
【0159】
MOTA値を表8に報告する。IL−8を欠く試料では低いMOTA値が得られたが、一方、より高いレベルのIL−8によりMOTA値は増加され、図3Aで示す通り、テザーオリゴヌクレオチドTOとのハイブリッド形成を介して分析物結合性部Ab1と間接的に連結したスプリントオリゴヌクレオチドとしてP1を用いる免疫SDA法によるIL−8の検出を立証した。この実験では、ハイブリッド形成ブロッカーオリゴヌクレオチドは用いなかったが、近接対−IL−8複合体の形成後に試料を約100万倍に希釈して、標的非依存性プローブの増幅の発生を減少させた。
【0160】
【表8】

【実施例11】
【0161】
(IL−8の検出において検出物結合性部としてFab’断片を用いる免疫SDAの実験的証明)
MAb G265−8(実施例9参照)をペプシンで消化して、F(ab’)2断片およびFc領域の断片を得た。F(ab’)2を精製し、ジチオスレイトール(DTT)でさらに処理して、Fab’断片を連結しているジスルフィド架橋を減少させた。得られるFab’断片(Ab1)を2つのRHP−3オリゴヌクレオチド(P1)とカップリングさせて、Ab1−P1複合体を形成した。
【0162】
0.1nMのAb1−P1、0.1nMのAb2−P2(実施例8参照)、10mMのTris−EDTA緩衝液、0.1mg/mLのBSA、10nMのハイブリッド形成ブロッカーオリゴヌクレオチドRDB−3p8(実施例1参照)および0、0.1または1pMのIL−8を含有する混合物を調製した。37℃で3時間インキュベートした後、Ab−プローブ複合体の得られる濃度がfMの範囲になるように、混合物を連続的に希釈した。次いで、希釈した混合物をSDAプライマーSRH−1およびSLH−2、アダプターADR−5、最終濃度を10nMにするまでの追加のハイブリッド形成ブロッカーRDB−3p8、ならびにレポータープローブTBD10.2と混合した。得られる混合物を37℃で10分間維持した。次いで、各試料の部分を、BsoBI制限酵素およびBstDNAポリメラーゼをも含有する乾燥した増幅ウェルに52℃で実施例2に記載の通りに加えた。得られるSDA混合物において、Ab−プローブ複合体の濃度は100fMであり、IL−8の濃度は0、0.1または1fMのいずれかであった(表9)。試料を直ちにProbeTec(商標)ET装置に移し、そこで等温増幅を52℃で1時間実施した。実施例2で記載の通りに蛍光の増加を観察することによって増幅を観測した。
【0163】
【表9】

【0164】
反復試験4回の平均MOTA値を表9に報告する。IL−8を欠く試料では低いMOTA値が得られたが、一方、より高いレベルのIL−8により、MOTA値は増加され、Fab’をAb1−P1の分析物結合性部として用いる免疫SDA法によるIL−8の検出を立証した。
【実施例12】
【0165】
(ハイブリッド形成ブロッカーオリゴヌクレオチドを使用するバックグラウンド抑制と組み合わせた、可逆的に固定化されたた近接構成要素を使用する標的介在型アンプリコン形成)
この実施例で使用した緩衝液は以下の通りである:
・ TBS:25mMのTris(pH7.6)、150mMのNaCl;
・ 希釈液A:希釈液Bプラス0.01%Tween−20、800μMのD−ビオチンおよび5mMのEDTA;
・ 希釈液B:TBS、0.5%スキムミルクパウダー(Oxoid Ltd.、英国)、0.1mg/mLの分子生物学等級のDNA(Roche Molecular Systems、カリフォルニア州Pleasanton);
・ ブロッキング溶液:TBS、4.5%スキムミルクパウダー、1mg/mLの分子生物学等級のDNA、2mg/mLのアジ化ナトリウム、5mMのEDTA
・ 洗浄緩衝液:TBS、5mMのEDTA、0.05%Tween−20;
・ SDA反応緩衝液(濃縮):90mMのビシン、60mMのKOH、12mMのリン酸カリウム、6.57%グリセロール、4.23%DMSO;
・ SDAプライマー混合物:7.5μMのSRH−1、37.5μMのSLH−2、300μMのADR−5、37.5μMのTBD10.2(水中);ならびに
・ SDA酵素混合物:75mMのビシン中18単位のBsoBI制限エンドヌクレアーゼおよび8単位のBstポリメラーゼ(BD Diagnostic Systems)、50mMの水酸化カリウム、10mMのリン酸カリウム(pH7.6)
選択した標的分析物はIL−8であり、MAb G265−5およびMab G265−8が分析物結合性部である。MAb G265−5はプローブLHP−3に複合体形成して、Ab1−P1を産生した。MAb G265−8はSAに複合体形成し、この複合体をAb分子1個当たりの2種のプローブの割合で5’ビオチン化プローブRHP−3と混合して、Ab2−P2を産生した。
【0166】
以下の手順に従って、捕捉ヌクレオチドを固体支持体に固定した。SAで被覆された96マイクロウェルプレート(Pierceカタログ番号15121)をTBS中で3回すすぎ、ブロッキング溶液中で一晩インキュベートし、次に洗浄緩衝液で4回洗浄した。80nMの5’ビオチン化RCP−9v2.2捕捉オリゴヌクレオチドを含有する溶液100μLを各ウェルに加え、室温で1時間インキュベートした。次いで、800μMのD−ビオチンを含有する洗浄緩衝液でプレートを4回洗浄した。
【0167】
Ab2−P2複合体の固定化された捕捉オリゴヌクレオチドとのハイブリッド形成を以下の通りに実施した:希釈液A中に0.1nMのAb2−P2を100μLずつ各マイクロウェルに加え、室温で1時間インキュベートした。次いで、マイクロウェルを洗浄緩衝液で4回洗浄した。希釈液B中の0または50pMのいずれかのIL−8を含有する試料溶液100μLを各マイクロウェルに加え、室温で1時間インキュベートした。次いで、マイクロウェルを洗浄緩衝液で4回洗浄した。このステップの結果、IL−8と固定化したAb2−P2との間に複合体が形成された。
【0168】
IL−8と固定化されたAb2−P2との間の複合体へのAb1−P1の結合を、以下の通り実施した:1μMのLBK−1ハイブリッド形成ブロッカーオリゴヌクレオチドを含有するかハイブリッド形成ブロッカーオリゴヌクレオチドを含有しない、希釈液A中の0.1nMのAb1−P1複合体の溶液100μLを、IL−8とAb2−P2との間の複合体を含有するマイクロウェルに加え、室温で1時間インキュベートした。次に、LBK−1ハイブリッド形成ブロッカーオリゴヌクレオチドを含有するマイクロウェルを、1μMのLBK−1を含有する洗浄緩衝液で5回、次いでLBK−1のない洗浄緩衝液で2回洗浄した。ハイブリッド形成ブロッカーオリゴヌクレオチドに曝露しなかったマイクロウェルを洗浄緩衝液で7回洗浄した。両方の組のウェルに対して、TBSで最後に2回洗浄した。
【0169】
上記の通りに調製した捕捉された複合体を、SDA反応緩衝液(濃縮)120μLを加えることによって支持体から溶離し、室温で20分間インキュベートした。溶離した複合体を含有する体積100μLを各マイクロウェルから、SDAプライマーミックス20μLを含有する新たなマイクロウェルに移した。これらのマイクロウェルを20分間室温でインキュベートし、次いで37℃のヒートブロック上に10分間置いた。SDAによる増幅を開始するために、37℃の各マイクロウェルから80μLを取り出し、52℃に予め加熱しておいたSDA酵素混合物20μLを含有する別のマイクロウェルに移した。次いで、マイクロウェルを素早くBD ProbeTec(商標)ET装置内に置き、52℃で1時間維持して、増幅の過程の間、蛍光強度を観測した。各増幅反応のMOTA値を、反応の過程の間に得た動的蛍光プロファイルから測定した。
【0170】
図7Dで示した通り、抗体−プローブ複合体Ab1−P1およびAb2−P2のプローブ部P1とP2との間の塩基対形成により、この2つの抗体−プローブ複合体間の標的を含まない二元複合体の形成が促進される。ハイブリッド形成ブロッカーオリゴヌクレオチドLBK−1を結合性混合物に含めることは、P1とP2との間の塩基対形成を妨げることによって、標的を含まない複合体の形成を抑制する。IL−8もLBK−1ハイブリッド形成ブロッカーオリゴヌクレオチドも含まない結合性混合物に対する高い平均MOTA値により表10に示された通り、ハイブリッド形成ブロッカーオリゴヌクレオチドの不在下における標的非含有二元複合体の存在によって、免疫増幅反応中の高レベルのバックグラウンドシグナルが生じた。対照的に、1μMのLBK−1ハイブリッド形成ブロッカーオリゴヌクレオチドの存在は、「IL−8なし」の結合性混合物の平均MOTA値を20分の1に減少させ、標的を含まない複合体の形成のかなりの減少を示している。ハイブリッド形成ブロッカーオリゴヌクレオチドの存在は、IL−8特異的シグナルの強度をわずかに減少させる(LBK−1ありおよびなしの50pMのIL−8混合物のMOTA値を比較);しかし、特異的シグナル対バックグラウンドシグナルの比は、ハイブリッド形成ブロッカーオリゴヌクレオチドを含有する結合性混合物に関する方がそれを含まないものに関するものよりも12倍高い。
【0171】
さらに、この結果は、図7A〜7Gで示す通り、標的抗原(IL−8)を捕捉または固定し、かつ標的抗原および近接対(Ab1−P1およびAb2−P2)の両方の構成要素を含む固定化した三元複合体を形成するための固定化した近接構成要素(Ab2−P2)の使用を証明している。また、この実施例は、固定化するハイブリッド(捕捉オリゴヌクレオチドとプローブ部P2との間に形成した二重鎖)の推定半減期が20分間の溶離時間よりもはるかに長いにもかかわらず、検出可能な数の固定化された三元複合体が、濃縮したSDA緩衝液添加後の20分間の室温での溶離時間中に固相から離れることを示す。
【0172】
【表10】

【実施例13】
【0173】
(可逆的に固定化した近接構成要素を使用する標的介在型アンプリコン形成:低イオン強度溶液の適用による固定化された複合体の放出)
この実施例で使用したMAb、分析物および緩衝液は実施例12で記載のものと同じである。ビオチン化RCP−9v2.2捕捉オリゴヌクレオチドは、実施例12で記載されたものと同じ方法で支持体に固定化された。Ab2−P2複合体の固定化された捕捉オリゴヌクレオチドとのハイブリッド形成は、実施例12で記載の通りに実施された。次いで、0または10pMのいずれかのIL−8を含有する100μLの希釈液Bを各マイクロウェルに加え、これを室温で1時間インキュベートした。次に、マイクロウェルを洗浄緩衝液で4回洗浄した。次に、0.1nMのAb1−P1複合体および1μMのLBK−1ハイブリッド形成ブロッカーオリゴヌクレオチドを含有する希釈液Aを各マイクロウェルに加え、そのマイクロウェルを室温で1時間インキュベートした。次いで、最後の2回の洗浄ステップがTBSではなく10mMのNaClを含有していたことを除き、実施例12で記載の通りにマイクロウェルを洗浄した。
【0174】
IL−8と、Ab1−P1の複合体と、Ab2−P2の複合体との間で得られる固定化された複合体を放出するために、各マイクロウェルを75μLの水または濃縮していないSDA緩衝液で処理した。20分間室温でインキュベートした後、この溶液70μLを取り出し、実施例12で記載の通りにSDAで分析した。
【0175】
この実施例は、低イオン強度溶液を使用して、近接対Ab1−P1およびAb2−P2に同時に結合したIL−8分子で構成された固定化した三元複合体を無傷で放出することを証明している。この実施例の結果は表11に示す。水(低イオン強度)で溶離した10pMのIL−8を含有する試料について得られた平均MOTA値は、SDA緩衝液(中程度のイオン強度)で溶離した試料の平均MOTA値よりも10倍近く高く、図7Iで示した通り、低イオン強度溶液の適用による三元複合体の放出を立証している。
【0176】
【表11】

【実施例14】
【0177】
(可逆的に固定化した近接構成要素を使用する標的介在型アンプリコン形成:置換オリゴヌクレオチドの適用による固定化された複合体の放出)
MAb、分析物および緩衝液は実施例12に記載のものと同じである。ビオチン化RCP−9v2.2捕捉オリゴヌクレオチドは、実施例12に記載されたものと同じ方法で支持体に固定化された。Ab2−P2複合体の固定化された捕捉オリゴヌクレオチドとのハイブリッド形成は、実施例12に記載の通りに実施された。次いで、0または10pMのいずれかのIL−8を含有する希釈液B100μLを各マイクロウェルに加え、これを室温で1時間インキュベートした。次に、マイクロウェルを洗浄緩衝液で4回洗浄した。次に、0.1nMのAb1−P1複合体および1μMのLBK−1ハイブリッド形成ブロッカーオリゴヌクレオチドを含有する希釈液Aを各マイクロウェルに加え、そのマイクロウェルを室温で1時間インキュベートした。次いで、実施例12に記載の通りにマイクロウェルを洗浄した。
【0178】
IL−8と、Ab1−P1の複合体と、Ab2−P2の複合体との間で得られる固定化された複合体を放出するために、各マイクロウェルを0.1μMのCMPR−9v2置換オリゴヌクレオチドを含有するか、または置換オリゴヌクレオチドを含有しない、120μLのSDA緩衝液(濃縮)で処理した。20分間室温でインキュベートした後、この溶液を実施例12に記載の通りにSDAで分析した。
【0179】
この実施例は、置換オリゴヌクレオチドを使用して、近接対Ab1−P1およびAb2−P2に同時に結合したIL−8分子で構成された固定化された三元複合体を無傷で放出することを証明している。この実施例の結果を表12に示す。10pMのIL−8を含有し、置換オリゴヌクレオチドで処理した試料に対して得られた平均MOTA値は、置換オリゴヌクレオチドで処理しなかった10pMのIL−8試料のMOTA値よりも10倍高く、図7Jで示した放出メカニズムを立証している。
【0180】
【表12】

【実施例15】
【0181】
(3’キャップされた近接プローブを使用する免疫SDAの実験的証明)
この実施例は、図14で示したプロセス、すなわち免疫増幅によって検出物を検出するための3’キャップした伸長不可能な近接プローブの使用の実験的証明を提供する。この実施例の標的分析物はSAである。3’キャップした近接プローブP1はLHP−3[キャップ]である(実施例1で示した)。LHP−3[キャップ]は、LHP−3[キャップ]が相補的な鋳型鎖P2とハイブリッド形成した場合にプローブの伸長を妨げる3’デオキシウリジン部を含む。この実施例では、分析物結合性部は、LHP−3[キャップ]の5’末端に付着したビオチン部である。近接対の第2のプローブ、P2は、5’ビオチン部および伸長可能な3’末端を含むRHP−3(実施例1で示した)である。キャップしていない対照プローブ、LHP−3は、5’ビオチン部および伸長可能な3’末端を含む。増幅プライマー、アダプターオリゴヌクレオチド、レポータープローブ、ハイブリッド形成ブロッカーオリゴヌクレオチドおよびその他の反応成分は実施例8と同じである。
【0182】
20pMの5’ビオチンRHP−3、20pMの5’ビオチンLHP−3[キャップ]、10mMのTris−EDTA緩衝液、5μg/mLのBSAおよび0または10fMのいずれかのSAを含有する溶液を調製した。結合性混合物は、100nMのRDB−3p5ハイブリッド形成ブロッカーオリゴヌクレオチドを任意選択的に含有した(表13参照)。この結合性混合物を37℃で2時間インキュベートし、次いで10倍に希釈し、実施例8に記載の通りにSDAにかけた。LHP−3[キャップ]がキャップしていないLHP−3に置き換えられた対照混合物も調製し、上記の通りSDAにかけた。種々のSDA反応からの平均MOTA値を表13に示す。
【0183】
【表13】

【0184】
SAなしの試料のMOTA値により示された通り、近接プローブP1が3’伸長キャップを含有する反応(「LHP−3[キャップ])は、キャップされていないプローブを含有する反応(LHP−3)よりも著しく低いバックグラウンドシグナルを示した。キャップされたプローブおよびキャップされていないプローブの両方に対して、ハイブリッド形成ブロッカーオリゴヌクレオチドの存在は、ハイブリッド形成ブロッカーオリゴヌクレオチドのない同じ反応混合物と比較して約12倍バックグラウンドシグナルを抑制した。キャップされたプローブではバックグラウンドシグナルが低かったが、10fMのSAの存在下のシグナルは、キャップされていないプローブに対してキャップされたプローブではわずかに高く、標的分析物の存在下におけるキャップされたP1プローブおよびキャップされていないP2プローブの増幅可能な産物への効率的な変換を示す。さらに、この実施例は、プローブ−プローブハイブリッドで形成された重なり合った3’末端の一方のみが3’OH基を含む場合に、分析物特異的アンプリコンの形成が生じ得ることを証明している。
【実施例16】
【0185】
(標的非依存性アンプリコン形成の原因としての抗体−抗体の相互作用を明らかにする実験)
この実施例は、近接構成要素のAb部同士の間の相互作用が標的非依存性増幅の一因となることを証明する。実施例9で記載の通り、以下に挙げた成分を10mMのTris−EDTA緩衝液および0.1mg/mLのBSAの溶液中に含有する4つの試験溶液を調製した。
・ 試験溶液1:1nMのAb1−P1および1nMのAb2−SA−P2;
・ 試験溶液2:1nMのAb1−P1、1nMの複合体形成していないAb2および2nMの複合体形成していないP2;
・ 試験溶液3:1nMの複合体形成していないAb1、2nMの複合体形成していないP1および1nMのAb2−P2;ならびに
・ 試験溶液4:2nMの複合体形成していないP1、2nMの複合体形成していないP2。
【0186】
試験溶液を30分間37℃でインキュベートし、次いで、抗体、プローブおよびコンジュゲートの得られる濃度がpMの範囲になるように、連続的に希釈した。次いで、希釈した混合物をSDAプライマーおよび酵素と混合し、SDA反応混合物が50nMのRDB−3p8ハイブリッド形成ブロッカーオリゴヌクレオチドを任意選択的に含む以外は、実施例9で記載の通りにSDAにかけた。さらに、複合体形成していないプローブを抗体−プローブ複合体のモル比の2倍で使用して、複合体中2:1の既知のプローブ:抗体比を反映させた。標的分析物は反応に存在しなかったので、生成したMOTA値は標的非依存性プローブの変換のみに起因する。
【0187】
種々の試験溶液からの平均MOTA値を表14に報告する。ハイブリッド形成ブロッカーオリゴヌクレオチドなしの反応混合物では、すべての試験溶液について平均MOTA値は100000を上回った。50nMのRDB−3p8ハイブリッド形成ブロッカーオリゴヌクレオチドを含有する試験溶液4では、平均MOTA値は20000未満に減少しており、5倍を超えるバックグラウンドシグナルの抑制を示している。対照的に、試験溶液1のMOTA値は、そのハイブリッド形成ブロッカーオリゴヌクレオチドの存在によってわずか約2分の1に減少して約59000になり、RDB−3p8によりもたらされるブロッキング効率は、複合体形成していないプローブP1およびP2の存在中よりも、2つの無傷の抗体プローブ複合体の存在中のほうが低いことを示している。試験溶液1のMOTA値が試験溶液4のMOTA値よりも高いことは、試験溶液1で抗体介在型アンプリコンの形成が生じていることを暗示し、さらにAb1とAb2が互いに標的非依存性付着することにより、付着したプローブ部が十分に近く近接されて誤ったアンプリコン形成を促進することを示唆する。明らかに、互いに付着した抗体対の局所プローブ濃度はバルク溶液のプローブ濃度全体よりもかなり高いので、ハイブリッド形成ブロッカーオリゴヌクレオチドは試験溶液1の標的非依存性プローブ変換を、付着した抗体対が形成できない試験溶液4ほど効率的に抑制することはできない。これは、試験溶液4のMOTA値と匹敵するMOTA値を示す試験溶液2および3の結果と一致しており、これは、試験溶液1で見られた抗体介在型プローブ変換の一因となる高いMOTA値を生じるために、近接対の両方のプローブ部は抗体に複合体形成していなければならないことを示している。
【0188】
【表14】

【実施例17】
【0189】
(反転した反対の配列方向を有するプローブを用いる免疫SDAによるIL−8の検出)
この実施例は、図1Jで示した概念の実験的証明を与える。抗体複合体Ab1−SAおよびAb2−P2は、実施例7に記載した通りである。Ab1−SAを、プローブRBD−3v3とプローブ:抗体比2:1で、4℃で一晩インキュベートしてAb1−SA−P1を形成した。実施例1で言及した通り、RBD−3v3はビオチン部をその3’末端の近くに含有している。10mMのTris−EDTA緩衝液、20pMのAb1−SA−P1、100pMのAb2−P2、1mg/mLのBSA、50nMのハイブリッド形成ブロッカーオリゴヌクレオチドRDB−3z8ならびに0、0.1、0.25、0.5および1.0pMのIL−8を含有する試料を調製した。室温で3時間インキュベートした後、各標準試料の分量を、BSA0.1mg/mLを含有するTris−EDTA緩衝液に1:10(v/v)に希釈し、さらに、SDAプライマー(SRH−1およびSLH−2)、アダプタープライマー(adr−8)、レポータープローブ(TBD10.2(D/R))およびハイブリッド形成ブロッカー(RDB−3z8)50nMを含有する溶液中に1:10(v/v)に希釈した。SDA反応では、プライマー、アダプターおよびレポーターの濃度は実施例18で記載の通りであり、ハイブリッド形成ブロッカーRDB−3z8の濃度は50nMであった。これらの希釈混合物の反復試験試料4点を、それぞれの最初の試料から調製した。次いで、希釈混合物を37℃で約10分間インキュベートし、52℃に予め加温したSDA酵素溶液20μLを含有する別個のマイクロウェルに各混合物の分量80μLを移した。このマイクロウェルを密封し、ProbeTec(商標)ET装置内に置き、52℃で1時間インキュベートした。実施例9に記載の通りに蛍光の増加を観察することによって増幅を観測した。
【0190】
平均MOTA値を表15に報告する。IL−8を欠く試料では低いMOTA値が得られたが、一方、IL−8のレベルが増大することにより、徐々により高いMOTA値になり、図1Jで記載の通り、プローブの1つが抗体とその3’末端の近くの連結を介してつながれている免疫SDA法によるIL−8の検出を立証している。さらに、この結果は、伸長可能な3’OH基を1つだけ含むプローブ−プローブ(P1−P2)二重鎖が分析物特異的アンプリコンを産生できることを立証している。
【0191】
【表15】

【実施例18】
【0192】
(内部の核酸対照および近接対を用いる免疫SDAによるIL−8の定量)
この実施例は、核酸対照およびそれぞれ分析物に結合した近接構成要素から産生された標的アンプリコンの共増幅から得られる2つの蛍光シグナルの比を使用する試験試料中の標的分析物(この場合、IL−8)の絶対定量を説明する。本発明によれば、複数の標準試料および少なくとも1つの試験試料が最初に形成される。複数の標準試料はそれぞれ、既知の開始量の核酸対照配列、既知の開始量の標的分析物およびある量の本発明の近接対を含有する。通常、複数の標準試料の異なる構成要素は、既知の量の標的分析物を有することとなる。試験試料は、既知の開始量の核酸対照配列、未知の量の非核酸標的分析物およびある量の近接対を含有する。絶対定量法で測定されるのは、この未知の量の標的分析物である。
【0193】
標準試料および試験試料では、同じ標的分析物分子に同時に結合している近接構成要素のオリゴヌクレオチド部は、上記の本発明方法のいずれかによってアンプリコンに変換される。次いで、各標準試料および試験試料で得られるアンプリコンおよび核酸対照配列を共増幅する。各試料中、同じ試料中のアンプリコンおよび対照核酸の増幅が、増幅の過程の間、異なる蛍光放出波長で独立して観測することができるように、アンプリコンおよび対照配列の増幅により、検出可能な蛍光の放出を別個に発生させることができる。
【0194】
増幅の間に得られた蛍光値は、「リアルタイム蛍光プロファイル」と呼ばれ、測定時点を横座標に割り当て、蛍光値を縦座標に割り当てた二次元のグラフとして表示することができる。図15Aは、下記の実験における標的と対照アンプリコンとの共増幅から得られる試料の2色のリアルタイム蛍光プロファイルの実施例を示す。この実施例で使用した検出波長は、それぞれ標的アンプリコンおよび対照核酸に特異的なレポーターオリゴヌクレオチドの標識に使用した蛍光色素ローダミンおよびフルオレセインに特徴的なものであった。
【0195】
標準試料および試験試料のそれぞれについて、蛍光強度を2つの独立した検出波長で、増幅間隔を含む複数nの時点にわたって測定した。所与の試料iに対し、各時点(tp)は一方は増幅した標的アンプリコン(FT(tp)i)に対応し、他方は増幅した対照核酸(FC(tp)i)に対応した2つの関連した蛍光値を有する。同じ試料から同じ時間間隔で集められたこれらの2つの読取り値は、蛍光値の「マッチした対」と呼ばれる。
【0196】
分析の便宜上、2種以上の異なる試料のリアルタイム蛍光プロファイルは同期していると考えられる。すなわち、2種以上の異なる試料からの同じ時点は、各試料での増幅開始後の同じ尺度の経過時間に対応している。異なる試料からのこれらの等価な時点を「同時」という。異なる試料の未加工の蛍光プロファイルが同期していない場合、当技術分野で知られた方法を用いて、未加工データから同期した「正規化した」プロファイルを構築することができる(例えば、それらの開示の全体は参照により本明細書内に組み込まれる特許文献22および特許文献23参照)。
【0197】
所与の試料iのリアルタイム蛍光プロファイル内の各時点(tp)について、蛍光値の各マッチした対を使用して、関係(式1)に従ってシグナル比、SR(tp)iを算出することができる。
【0198】
SR(tp)i=[FT(tp)i-FT(base)i]/[FC(tp)i-FC(base)i] 式1
【0199】
式中、基準蛍光測定値、FT(base)iおよびFC(base)iは、標的と対照アンプリコンの検出可能な増幅前の各蛍光強度に対応している。基準蛍光のその他の近似を用いてもよいが、実際には、FT(base)iは、試料iの増幅中の最初のいくつかの時点にわたって測定した標的アンプリコンの蛍光の平均値とし、FC(base)iは、それらの同じ時点にわたって測定した平均核酸対照蛍光とする。
【0200】
したがって、増幅した試料から得られる、標的および対照のリアルタイム蛍光プロファイルの各対は、nをプロファイル中の時点の数とすると、n個のシグナル比を生じることとなる。同様に、複数のk個の試料にわたって同時である各時点は、それに伴って、各シグナル比が一致した時点tpにおいて試料iに対応しているk個の「同時」シグナル比、SR(tp)iを有している。
【0201】
試料によって生じたシグナル比と試料が含有する分析物(IL−8)の量とを相関させるために、種々の既知の量のIL−8を含有する複数のk個の標準試料について測定したシグナル比を以下の通りに分析した。同時シグナル比の各組(すなわち、k個すべての標準試料にわたって同じ時点、tpから導出したシグナル比)をまず式2に従って既知の分析物濃度に対する線形回帰にかける。式2は、量log(SR(tp)i)およびlog([IL−8]i)を関連付け、回帰手順で決定した勾配m(tp)および切片b(tp)の値を有する「検量」線を定義する。
【0202】
log(SR(tp)i)={m(tp)xlog([IL-8]i)}+b(tp) 式2
【0203】
この操作をn組の同時シグナル比のそれぞれについて繰り返して、各対は複数の標準試料k個にわたる個々の同時時点に対応しながら、n対の勾配と切片の値で定義したn個の検量線を作製する。この分析から得られたn個の検量線の1つ(tp=8分)を図15Bで示す。
【0204】
次いで、勾配と切片の値の「最高の」対に対応する「最高の」測定時点(tpbest)を適合度基準に基づいて選択し、試験試料についてのシグナル比を式1に従って、選択した「最高の」時点と同時の時点で得られた蛍光測定値から算出する。次に、試験試料j中の分析物IL−8の量を、最高の測定時点の試験試料のシグナル比、SR(tpbest)j、および勾配、m(tpbest)と切片、b(tpbest)「最高の」対の値から式3によって計算することができる。
【0205】
log([IL-8]j)={log(SR(tpbest))-b(tpbest)}/m((tpbest) 式3
【0206】
種々の統計的基準を用いて「最高の」検量線または対応する「最高の」測定時間、tpbestを決定することができる。多くのこれらの統計的基準は、特許文献22および特許文献23に記載されている。最高の時間を選択するその他の統計的方法も用いることができる。
【0207】
実験手順を以下の通りに実施した。抗体−プローブ複合体Ab1−SA−P1およびAb2−P2は、実施例7に記載した通りである。10mMのTris−EDTA緩衝液、20pMのAb1−SA−P1、100pMのAb2−P2、1mg/mLのBSA、25nMのハイブリッド形成ブロッカーオリゴヌクレオチドRDB−3p8および0.01、0.1、1.0、10.0および100pMのIL−8を含有する標準試料を調製した。室温で3時間インキュベートした後、各標準試料の分量を、BSA0.1mg/mLを含有するTris−EDTA緩衝液中に1:10(v/v)に希釈し、次いでさらに、SDAプライマー(SRH−1およびSLH−2)、アダプタープライマー(adr−8およびadqs−2)、レポータープローブ(TBD10.2(D/R)およびALTD6.9(F/D))、50nMのハイブリッド形成ブロッカー(RDB−3p8)ならびに対照核酸(IQS−2)100000コピーを含有する溶液中に1:100(v/v)に希釈した。2つのそのように希釈された混合物は、最初の標準試料のそれぞれから調製された。次いで、希釈された標準混合物を37℃で約10分間インキュベートし、52℃に予め加温したSDA酵素溶液20μLを含有する別個のマイクロウェルに各混合物の分量80μLを移した。次に、このマイクロウェルを密封し、ProbeTec(商標)ET装置内に置き、52℃で1時間インキュベートした。この1時間のインキュベーションの間、各マイクロウェルの蛍光を、一方はローダミン蛍光に特異的であり、他方はフルオレセイン蛍光に特異的である2つの光学的チャネルを介して記録した。1対の蛍光読取り値(1つのフルオレセインと1つのローダミン)をそれぞれ1分間隔で1時間の反応過程の間記録し、各SDA反応について60対の蛍光読取り値が得られた。
【0208】
濃度0.01、0.1、1.0、10.0および100.0pMのIL−8を含有する1組の試験試料を調製し、標準試料に対して上記した通り、競合的な2色のSDAにかけた。対照オリゴヌクレオチド(IQS−2)の量は標準試料のものと同等であった。
【0209】
この実施例では、5つのIL−8標準試料それぞれの合計10個の複製SDA反応からの2色の蛍光データを使用して、以下の検量線式を構築した。10個の増幅した標準試料(i)のそれぞれについて、シグナル比、SR(tp)iを式1に従って60個の時点(tp)それぞれに対して計算した。標準試料からの同時シグナル比の各組を、上記の式2に記載の通りに既知のIL−8濃度に対する線形回帰にかけると、60個の時点のそれぞれについて、異なる「検量」線に対応する勾配(m(tp))および切片(b(tp))値が得られた。適合度基準を検量線に適用して、この複数の標準試料の最高の測定時間はtp=8分であると決定した。log(SR(tp=8分))対log([IL−8])のプロットおよび対応する検量線を図15Bに示す。これは、分析物濃度の10000倍の範囲にわたるシグナル比とIL−8濃度との間の線形関係を表す。
【0210】
上記の種々の試験試料の蛍光データ(tp=8分)からシグナル比を算出した。次いで、標準曲線から導出したtp=8分の検量線に対応する最高の勾配および切片値を使用し、式3を使用して、試験試料のIL−8濃度を計算した。
【0211】
表16に示した結果は、計算したIL−8濃度と実際のIL−8濃度との間でほぼ一致しており、本発明の方法による標的分析物の正確な定量を立証している。
【0212】
【表16】

【0213】
これまで特定の代表的な実施形態および詳細を参照して本発明を完全に記載してきたが、本明細書に記載された本発明の精神および範囲から逸脱することなく変更および修正を加えられることができることは当業者には明らかであろう。本明細書に記載された方法および手順のすべては、当業者が容易に実施できるものである。
【技術分野】
【0001】
本発明は、溶液中の分析物を検出および定量する超高感度、ハイスループットアッセイを提供するための、分析物特異的結合成分および核酸増幅の新規な適用に関する。
【背景技術】
【0002】
興味のある分析物を検出および定量する研究分野における主要目的は、血液、血清、血漿、尿またはその他の体液などの複雑な環境にあるごく少量の分析物を検出することが可能な、高度に特異的かつ感度のよいアッセイシステムを開発することである。診断上重要な分子は、体液のその他の成分と比較して極めて微量で構成または存在し得るので、許容できるアッセイ形態は、試料中の総生体材料の割合のごく少量に相当するであろう分析物を識別しなければならない。従来の手順では分析物特異的抗体を使用して必要な識別をしていたが、抗体はその他の非標的分析物との交差反応性により限定される。高い特異性を有する抗体であっても、低い親和性で抗体に結合する分析物が豊富な環境にその抗体がごく少量で存在すれば、わずかな交差反応性により、克服できない問題が引き起こされることがある。
【0003】
免疫増幅は、免疫アッセイの感度を増大させる手段として使用されてきた。この手順では、増幅することができるDNAマーカー分子に複合体形成している抗体と抗原を接触させる。検出可能に標識された抗−抗体で抗体−抗原複合体を標識するなどの従来の手順で抗体の存在を検出する代わりに、ポリメラーゼ連鎖反応(「PCR」)によるDNAマーカーの増幅を介して、抗原−抗体−マーカー複合体を間接的に検出する。さらに、増幅したDNAは、二本鎖DNAに挿入すると蛍光を発する染料の使用などの従来の方法で検出してもよい。「免疫PCR」として知られるこの方法は、検出に抗−抗体を使用する従来のアッセイと比較して、免疫アッセイの理論感度を10000倍超増大させるのに使用されてきた。しかし、実際には抗体−核酸複合体の他の分析物への非特異的結合、または反応場所を提供するために使用している支持体表面への非特異的結合によって、免疫PCRの感度は制限されている。さらに、試料は、前回の反応の残りの増幅された標識(「アンプリコン」)によって汚染されることがある。これは、臨床的に許容されるハイスループットアッセイにこの技術を適用するには問題である。
【0004】
これらの問題を解決する努力がいくつかなされてきた。例えば、研究者らは固定化された抗体を使用して抗体−核酸−抗原複合体を固体支持体に捕捉した。これはDNA増幅の前に、複合体化していない抗原および結合していない抗体−核酸複合体の除去を促進する。別の場合では、抗原の異なる決定基に特異的な2つの抗体は、抗原を結合させることによって近接させることができる。各抗体は、隣接する抗体−オリゴヌクレオチド複合体のオリゴヌクレオチドとハイブリッド形成することができる一本鎖オリゴヌクレオチド部で修飾して二本鎖領域を形成する。オリゴヌクレオチド部のハイブリッド形成は、同じ抗原に結合したときに2つの抗体が近接することによって促進される。次いで、DNAの二本鎖領域は、抗原の存在を示す検出可能なシグナルを生じさせる増幅の対象となる。この技術は、いずれかの抗体のみの非特異的結合ではアンプリコンを形成できるには不十分なため、検出の感度を高めるのに有利である。しかし、この方法の感度は、とりわけ、誤った抗原非依存性アンプリコンの形成につながる抗体部同士の非特異的相互作用によって限定される可能性がある。
【0005】
したがって、本技術分野では、さらにより感度のよい分析物の検出方法および定量方法を提供することが引き続き必要とされている。臨床環境で有用な方法は、所望の分析物に対して極めて選択的であり、ハイスループットスクリーニング法に容易に適合することが好ましい。
【先行技術文献】
【特許文献】
【0006】
【特許文献1】米国特許第4683195号明細書
【特許文献2】米国特許第4683202号明細書
【特許文献3】米国特許第4800159号明細書
【特許文献4】米国特許第4965188号明細書
【特許文献5】米国特許第5270184号明細書
【特許文献6】米国特許第5648211号明細書
【特許文献7】米国特許第5744311号明細書
【特許文献8】米国特許第5130238号明細書
【特許文献9】米国特許第5427930号明細書
【特許文献10】米国特許第5849878号明細書
【特許文献11】米国特許第5665539号明細書
【特許文献12】米国特許第6511809号明細書
【特許文献13】米国特許出願公開第2002/006779号明細書
【特許文献14】米国特許第5928869号明細書
【特許文献15】米国特許第5919630号明細書
【特許文献16】米国特許第5935791号明細書
【特許文献17】米国特許第6316200号明細書
【特許文献18】米国特許第6379888号明細書
【特許文献19】米国特許第5840487号明細書
【特許文献20】米国特許第5919630号明細書
【特許文献21】米国特許第5846726号明細書
【特許文献22】米国特許第6054729号明細書
【特許文献23】米国特許第5863736号明細書
【特許文献24】米国特許第6066458号明細書
【非特許文献】
【0007】
【非特許文献1】Walker et al., Proc. Nat'l Acad. Sci. USA 89: 392 (1992)
【非特許文献2】Walker et al., Nucl. Acids Res. 20: 1691 (1992)
【非特許文献3】Guatelli et al., Proc. Nat'l Acad. Sci. USA 87: 1874-78 (1990)
【非特許文献4】Lizardi et al., Bio Technology 6: 1197 (1988)
【非特許文献5】Hirose et al., Clin. Chem. 44: 2446-2452 (1998)
【非特許文献6】Kwoh et al., Proc. Nat'l Acad. Sci. USA 86: 1173-77 (1989)
【非特許文献7】Sambrook et al., Molecular Cloning, A Laboratory Manual (3rd ed., 2001)
【非特許文献8】Nadeau et al., "Real-time Sequence-specific Detection of Nucleic Acids during Strand Displacement Amplification," Anal. Biochem. 276: 177-187 (1999)
【非特許文献9】http://www.bioinfo.rpi.edu/application/mfold
【非特許文献10】Zuker, Nucl. Acids. Res. 31: 3406-15 (2003)
【発明の概要】
【課題を解決するための手段】
【0008】
本発明は、ハイスループットアッセイに適した合理化された作業の流れを与える高感度、低バックグラウンドのアッセイを提供することによって、これらの要求を達成する。本発明のアッセイは、2つの「分析物特異的結合単位」、例えば抗体(「近接対」)の同じ分析物の異なるエピトープまたは近接している分析物のエピトープとの相互作用により分析物特異的アンプリコンを形成することによって分析物を検出および定量する。近接対の各構成要素(「近接構成要素」)は、一本鎖核酸、好ましくはDNA(「オリゴヌクレオチド部」または「プローブ」)に複合体形成している分析物特異的結合単位を含む。オリゴヌクレオチド部は、標的または分析物(本明細書を通じて「標的」と「分析物」は同義的に使用する)との相互作用により近接構成要素が密接に接触したときに、アンプリコンを直接的または間接的に形成する。近接構成要素と分析物との相互作用により、オリゴヌクレオチド部は密接に近接し、分析物と結合していない近接構成要素のオリゴヌクレオチド部の濃度に比べ、その有効な局所濃度を高める。この濃度効果は、結合していない近接構成要素のオリゴヌクレオチド部に比べ、アンプリコンを形成する2つのオリゴヌクレオチド部の相互作用を大いに促進させる。次いで、近接対−分析物複合体を、当技術分野でよく知られているDNA増幅技術を使用してアンプリコンを増幅することにより検出する。したがって、他のオリゴヌクレオチド部と相互作用していないオリゴヌクレオチド部は増幅することが不可能であり、アンプリコンの形成は近接対−分析物複合体のオリゴヌクレオチド部の局所的濃度の増大によって大いに促進されるため、アンプリコンの形成は標的の存在に対して高感度である。
【0009】
本発明のアッセイの感度は、分析物と複合体化していない溶液中の近接構成要素同士の誤った不要なアンプリコンの形成を妨げることにより向上するのに有利である。本発明は、1つには、近接構成要素のオリゴヌクレオチド部の一方または両方とハイブリッド形成する1つまたは複数のハイブリッド形成ブロッカーオリゴヌクレオチド(または「ハイブリッド形成ブロッカー」)を提供することによって、この目的を達成する。ハイブリッド形成ブロッカーは、分析物と複合体化していない近接構成要素同士の溶液内でのアンプリコン形成を妨げるのに有利である。ハイブリッド形成ブロッカーを使用する方法は、少なくとも1つの近接構成要素のオリゴヌクレオチド部がハイブリッド形成ブロッカーとハイブリッド形成する反応混合物中の、第1および第2の近接構成要素と分析物を接触させることを含む。混合物を加温するか、イオン強度を低下させて十分にハイブリッド形成ブロッカーを解離させ、そして混合物を冷却するか、混合物のイオン強度を増大させて、分析物に結合した近接構成要素間にアンプリコンを形成させる。一実施形態では、分析物に結合した近接構成要素の大部分は、加温ステップの間、分析物に結合したままである。別の実施形態では、ハイブリッド形成ブロッカーを近接構成要素のオリゴヌクレオチド部にモル過剰で加える。さらに別の実施形態では、ハイブリッド形成ブロッカーは「スプリントオリゴヌクレオチド」とハイブリッド形成して、スプリントオリゴヌクレオチドが近接構成要素のオリゴヌクレオチド部とハイブリッド形成できないようにする。さらなる実施形態では、「デブロッカーオリゴヌクレオチド」(または「デブロッカー」)とも呼ばれる相補配列とハイブリッド形成させることによってハイブリッド形成ブロッカーを近接構成要素のオリゴヌクレオチド部から除去する。すなわち、デブロッカーは過剰に加えた場合、ハイブリッド形成ブロッカーがオリゴヌクレオチド部またはスプリントオリゴヌクレオチドとハイブリッド形成できないように、ハイブリッド形成ブロッカーを二重鎖にして隔絶する。したがって、デブロッカーは、ハイブリッド形成ブロッカーオリゴヌクレオチドとその相補配列との間のハイブリッドの存在を減少させる。
【0010】
ハイブリッド形成ブロッカーは、その末端の一方にヘアピンループを含んでいてもよく、このヘアピン構造はDNAポリメラーゼの二本鎖「プライマー」として働く。本発明の便宜上、「プライマー」は、鋳型核酸の一本鎖とハイブリッド形成できるヌクレオチド、典型的にはDNAの短い一続きと定義する。プライマーとその相補配列との間の二重鎖ハイブリッドは、DNAポリメラーゼまたは逆転写酵素によるプライマーの伸長のための、あるいはRNAポリメラーゼによるRNA分子の合成のための開始部位を提供する。DNAポリメラーゼによる伸長がハイブリッド形成ブロッカーをオリゴヌクレオチド部から鎖置換によって除去するように、ハイブリッド形成ブロッカーはヘアピン構造の下流領域でオリゴヌクレオチド部とハイブリッド形成してもよい。この実施形態は、オリゴヌクレオチド部またはスプリントオリゴヌクレオチドから反応混合物を加温する必要なくハイブリッド形成ブロッカーを除去するのに有利であり、それにより分析物との近接構成要素の解離を回避または低減する。別の実施形態では、ハイブリッド形成ブロッカーは、近接対−分析物複合体の形成後および近接対のオリゴヌクレオチド部が互いにハイブリッド形成した後に加えられる。ハイブリッド形成ブロッカーは、まだ溶液中にある少なくとも1つの近接構成要素のオリゴヌクレオチド部とハイブリッド形成し、それにより分析物と結合していない近接対によるアンプリコンの分析物非依存的な形成を妨げる。この実施形態でも、バックグラウンドシグナルを減少させるための反応混合物の加熱は必要ではない。ヘアピン構造を他の場所でも使用してもよい。例えば、近接構成要素のオリゴヌクレオチド部の一方または両方は、アンプリコンの形成をブロックするヘアピン構造を含んでいてもよい。ヘアピンのループ内またはヘアピンに隣接する不対塩基によるオリゴヌクレオチド部のハイブリッド形成(あるいは穏やかな加熱)は、ヘアピン構造を分裂させ、それによりアンプリコンを形成および増幅させる。
【0011】
バックグラウンドシグナルは、特異的な放出オリゴヌクレオチドが提供されるまでアンプリコンの形成を妨げるか、近接対/分析物複合体を捕捉して結合していない成分を除去する固相捕捉オリゴヌクレオチドを提供することによって、好都合にさらに減少させることができる。
【0012】
さらなる利点は、抗体が結合できる任意の分析物を検出するのに利用できる一般的な試薬を使用することによって提供される。例えば、オリゴヌクレオチド部は抗Fc抗体またはプロテインAもしくはGとカップリングすることができ、これは抗体−分析物複合体の免疫グロブリン定常領域と反応する。一部の実施形態では、一方または両方の抗体は、アプタマー、受容体分析物に特異的なリガンド、またはリガンド分析物に特異的な受容体などの任意の適切な特異的検出物−標的単位と置き替えられる。一方または両方の抗体部分のこの置き換えにより、それがなければ抗体部分同士の非特異的相互作用から生じるかもしれない誤ったアンプリコンの形成が減少する。その他の適切な特異的分析物−標的単位としては、Fc、Fv、Fab’またはF(ab’)2断片などの抗体の機能的断片、がある。抗原の結合と関係していない抗体構造のサイズが小さくなると、抗原又は分析物との特異的相互作用を減少させることなく、抗体同士の非特異的相互作用が減少すると考えられている。
【0013】
本発明によって提供される利点により、血液およびその他の体液などの臨床関連試料中の分析物を検出および定量するのに使用することができるハイスルーアウトかつ極めて感度のよいアッセイが可能になる。本発明の方法によって検出および定量できる分析物は、複雑な混合物(例えば、体液)にかつてないほどごく少量で存在してもよい。一実施形態では、本発明を使用して、サイトカインなどの分析物約80fg/mlを検出している。これは、そのような低モル重量の分析物の少なくとも約10fMのモル濃度を検出する能力に換算される。
【0014】
したがって、本発明は、標的分析物ばかりでなく本発明の方法を実施するのに有用な組成物を検出および/または定量する種々の方法を提供する。例えば、任意の適切な増幅方法を本発明の方法で使用してもよい。そのような方法には、これらだけに限定するものではないが、PCR(特許文献1、特許文献2、特許文献3および特許文献4に記載)、鎖置換増幅(「SDA」;非特許文献1;非特許文献2;およびその開示の全体が本明細書に組み込まれる特許文献5参照)、好熱性鎖置換増幅(「tSDA」;その開示の全体が本明細書に組み込まれる特許文献6および特許文献7参照)、自己保持配列複製(「3SR」;非特許文献3参照)、核酸配列に基づく増幅(「NASBA」;特許文献8参照)、Qβレプリカーゼシステム(非特許文献4参照)、リガーゼ連鎖反応(「LCR」;特許文献9参照)、転写介在増幅(「TMA」;非特許文献5);および転写に基づく増幅(非特許文献6参照)がある。好ましい増幅方法はSDAである。
【0015】
アンプリコン自体は、近接対の隣接するオリゴヌクレオチド部のハイブリッド形成を含む多くの方法で形成してもよい。例えば、隣接するオリゴヌクレオチド部はそれらの長さの全体または一部分にわたってハイブリッド形成してよい。隣接するオリゴヌクレオチドが各末端部分でハイブリッド形成する場合、得られた二重鎖はDNAポリメラーゼを使用して伸長し得る。増幅反応がSDA反応を含む場合、制限エンドヌクレアーゼ認識部位は、近接構成要素のオリゴヌクレオチド部またはそれらの伸長産物の一方または両方に組み込まれてもよい。
【0016】
また、アンプリコンは、近接対のオリゴヌクレオチド部を、オリゴヌクレオチド部の各末端とハイブリッド形成するオリゴヌクレオチド「スプリント」と接触させることによって形成してもよい。オリゴヌクレオチドスプリントは、制限エンドヌクレアーゼ認識部位と、第1のオリゴヌクレオチドプローブと相補的な第1の配列をさらに含んでもよい。さらに、第1の近接構成要素のオリゴヌクレオチド部は、第2のオリゴヌクレオチドプローブと相補的な第2の配列を含んでもよい。スプリントは、第1および第2のプローブを加えるステップと、オリゴヌクレオチド部と相補的な配列をDNAポリメラーゼで伸長するステップとを含む方法で使用してもよい。第2の近接構成要素のオリゴヌクレオチド部は置換され、第1の近接構成要素のオリゴヌクレオチド部との複合体形成を介して第1の近接構成要素に付いたアンプリコンが残る。本発明の便宜上、増幅されていない置換されたオリゴヌクレオチド部を「テザー(tether)オリゴヌクレオチド」と呼ぶ。本発明の便宜上、「置換」は、鎖の置換、又は3’−5’エキソヌクレアーゼ活性を有するポリメラーゼにより触媒作用を受けた置換された鎖の加水分解などの方法により達成されてもよい。さらに、この方法は、SDAなどの任意のよく知られた増幅方法でアンプリコンを増幅するステップを含んでもよい。
【0017】
別の実施形態では、アンプリコンは近接対と分析物との複合体から放出されるのに有利であり、これにより、アッセイ支持体表面に吸着された抗体−オリゴヌクレオチド複合体からシグナルを除去することによりバックグラウンドを減少させる。この実施形態では、2つのオリゴヌクレオチドスプリントを使用してアンプリコンを形成し、近接構成要素の両方のオリゴヌクレオチド部はテザーオリゴヌクレオチドである。第1の橋かけプローブは第1の近接構成要素のオリゴヌクレオチド部の5’末端とハイブリッド形成し、第2の橋かけプローブは第2の近接構成要素のオリゴヌクレオチド部の5’末端とハイブリッド形成する。第1および第2の橋かけプローブは、それぞれの各3’末端で互いにハイブリッド形成する。ポリメラーゼで伸長すると、第1および第2の近接構成要素のオリゴヌクレオチド部は置換され、近接対−分析物複合体の残りの成分からアンプリコンが放出される。次いで、任意のよく知られた増幅方法によってこのアンプリコンを増幅する。
【0018】
別の実施形態では、近接対−分析物複合体を固体支持体に固定する。アンプリコンを上記の方法を使用して複合体から溶液へ放出し、一方、近接対−分析物の残りの成分は固体支持体に結合したままである。この実施形態では、アンプリコンを含む溶液は、増幅の前に複合体の残りの成分から完全に除去することができ、これによりバックグラウンドをさらに減少させる。
【0019】
上記に従い2つのスプリントオリゴヌクレオチドを使用することによって、標的を介在したプローブサイクル方法が可能になる。この方法は、近接対を第1および第2のスプリントオリゴヌクレオチドと接触させるステップと、オリゴヌクレオチド部の相補体をDNAポリメラーゼで伸長して、アンプリコンを近接対から置換するステップと、アンプリコンを増幅するステップと、近接対を追加の第1および第2のスプリントオリゴヌクレオチドと接触させるステップとを含む。スプリントオリゴヌクレオチドは、第1の近接構成要素のオリゴヌクレオチド部の3’末端および第2の近接構成要素のオリゴヌクレオチド部の5’末端と任意選択的にハイブリッド形成してもよい。スプリントオリゴヌクレオチドは、第1の近接構成要素のオリゴヌクレオチド部の3’末端および第2の近接構成要素のオリゴヌクレオチド部の3’末端と場合によってハイブリッド形成することができる。この両方のスプリントオリゴヌクレオチドは、第1と第2のスプリントオリゴヌクレオチドの間に架橋を形成する第3のスプリントオリゴヌクレオチドの相補配列と任意選択的にハイブリッド形成してもよい。
【0020】
さらなる実施形態では、オリゴヌクレオチドスプリントは、オリゴヌクレオチド部とハイブリッド形成せず、且つ第1のオリゴヌクレオチドプローブと相補的な第1の配列の上流である、すなわち5’方向に位置するプローブの領域に、RNAポリメラーゼプロモーターをコードする配列を含んでもよい。さらに、第1の近接構成要素のオリゴヌクレオチド部は、第2のオリゴヌクレオチドプローブと相補的な第2の配列を含んでもよい。スプリントは、第1および第2のプローブを加えるステップと、オリゴヌクレオチド部と相補的な配列をDNAポリメラーゼで伸長するステップとを含む方法で使用してもよい。第2の近接構成要素のオリゴヌクレオチド部は伸長した鎖で置換されて、これまでのところ無傷の二本鎖RNAポリメラーゼ結合性部位を含み、第1の近接構成要素に付いたアンプリコンを残す。さらに、この方法は、RNAポリメラーゼ結合性部位をRNAポリメラーゼと接触させることによって一本鎖RNAを転写するステップを含む。RNAは、標識プローブとのハイブリッド形成を含む当技術分野でよく知られた手段により検出してもよい。鎖置換に加えて、第2の近接構成要素のオリゴヌクレオチド部を、Taq DNAポリメラーゼなどの5’−3’エキソヌクレアーゼ活性を有するDNAポリメラーゼを使用して除去してもよい。
【0021】
あるいは、一本鎖RNA転写物を、RNAとその3’領域でハイブリッド形成するプライマーと接触させて、DNA−RNAハイブリッドを生成する逆転写酵素によりRNAを転写することができる。このDNA−RNAハイブリッドをRNアーゼHで消化すると、相補DNA鎖が得られる。このDNA鎖を、RNAポリメラーゼ結合性部位に対する相補体を含むプライマーと接触させると、無傷の二本鎖RNAポリメラーゼ結合性部位が再生する。DNA鎖を、一本鎖RNA転写物の合成を触媒するRNAポリメラーゼと接触させる。転写物をプライマーと接触させるステップ、プライマー−転写物ハイブリッドを逆転写酵素と接触させるステップ、DNA−RNAハイブリッドを消化するステップ、および得られる一本鎖DNAを、RNAポリメラーゼ結合性部位を再構成するプライマーと接触させるステップを繰り返して、アンプリコンを指数関数的に増幅することができる。
【0022】
本発明の増幅方法は、「均一な形態」の溶液で行ってもよく、または「不均一な形態」中で反応の成分を固体支持体に固定することを含んでもよい。不均一な形態を使用する増幅の方法では、近接構成要素、分析物、または近接構成要素もしくは近接対と分析物との複合体は、粒子または反応容器の表面などの固体支持体に固定される。この目的のため、近接構成要素または分析物は、支持体に複合体形成しているオリゴヌクレオチド(「捕捉オリゴヌクレオチド」)と相補的なオリゴヌクレオチド部を含む。近接構成要素または分析物のオリゴヌクレオチド部と捕捉オリゴヌクレオチドとの間に形成されたハイブリッドは、制限エンドヌクレアーゼ認識部位を含んでもよい。捕捉された近接構成要素または分析物は、適切な制限エンドヌクレアーゼと認識部位を接触させるステップを含む方法で固体支持体から放出される。あるいは、結合した近接構成要素または分析物を放出する方法は、温度を上昇させるか、イオン強度を低下させるか、反応混合物のpHを変更するか、ハイブリッドの変性を促進するキレート剤を加えるような手段によって、捕捉オリゴヌクレオチドと近接構成要素または分析物のオリゴヌクレオチド部とのハイブリッドを変性するステップを含む。さらに別の実施形態では、捕捉オリゴヌクレオチドは、例えば物理的、酵素的、化学的または光化学的手段による開裂を特に受け易い、切れ易い連結を含む。さらなる実施形態では、捕捉オリゴヌクレオチドまたは近接構成要素のオリゴヌクレオチド部または分析物は、プライマーと相補的な配列を含む。プライマーは、捕捉オリゴヌクレオチドと近接構成要素のオリゴヌクレオチド部または分析物との間に形成したハイブリッドとハイブリッド形成できる。次いで、近接構成要素のオリゴヌクレオチド部または分析物は、ポリメラーゼ連鎖伸長および鎖置換によってハイブリッドから置換されてもよい。関連の実施形態では、捕捉オリゴヌクレオチドはポリメラーゼ伸長の鋳型を形成するヘアピン構造を形成でき、捕捉された近接構成要素または分析物を鎖置換により放出させる。
【0023】
捕捉オリゴヌクレオチドと近接構成要素のオリゴヌクレオチド部または分析物との間のハイブリッドは、任意選択的にRNA配列を含んでもよい。近接構成要素または分析物は、ハイブリッドをRNアーゼHなどのRNアーゼと接触させることにより表面から放出される。一実施形態では、捕捉オリゴヌクレオチドとハイブリッド形成する近接構成要素のオリゴヌクレオチド部は、アンプリコンの形成に関与するオリゴヌクレオチド部である。このオリゴヌクレオチド部は捕捉オリゴヌクレオチドとハイブリッド形成している限りアンプリコンを形成できないが、例えば鎖置換によりハイブリッドからオリゴヌクレオチド部が放出されるとアンプリコンを形成できる。
【0024】
不均一な形態を使用する増幅は、分析物を反応混合物中の第1の近接構成要素と接触させるステップと、固体支持体に固定された、又はアンプリコンを含む近接対−分析物複合体を形成するのに十分な条件下で固体支持体に固定されうる第2の近接構成要素を加えるステップと、結合した近接対−分析物複合体を洗浄して固体支持体に固定されていない近接構成要素を除去するステップと、アンプリコンを増幅するステップと、増幅産物を検出するステップとを含んでもよい。第2の近接構成要素を、第1の近接構成要素を加える前、後またはそれと同時に加えてもよい。第2の近接構成要素は、任意選択的に、洗浄後だが増幅前に開裂する切れ易い連結によって固体支持体に固定してもよい。上記の近接構成要素を固体支持体に固定し、近接構成要素を上記の固体支持体から開裂する方法を使用してもよい。さらに、スプリントオリゴヌクレオチドを加えるステップを含む方法など、上記のアンプリコンを形成する方法のいずれかを不均一な形態で使用することができる。
【0025】
本発明は、上記の増幅方法のいずれでも使用できる一般的な成分を提供するのに有利である。好ましい実施形態では、分析物を、第1のエピトープと結合する第1の抗体および第2のエピトープと結合する第2の抗体と接触させる。ここで、第1および第2のエピトープおよび抗体は同じでも異なってもよい。第1および第2の抗体はそれぞれ、異なるハプテン部(例えば、ビオチン、フルオレセイン、ジゴキシゲニン、トリニトロフェノール、ジニトロフェノールなど)で任意選択的に標識されてもよい。抗体は、第1および/または第2の抗体と特異的に結合してアンプリコンを含む近接対を形成する1つまたは複数の近接構成要素を含む一般的な成分と接触させる。一般的な成分は、例えばオリゴヌクレオチド部に複合体形成したプロテインAまたはプロテインGでもよい。あるいは、一般的な成分は、オリゴヌクレオチドに複合体形成している抗免疫グロブリン定常領域の抗体であってもよい。第1および第2の抗体がハプテン部で標識されていれば、一般的な成分は特定のハプテン標識に特異的な抗体(またはストレプトアビジンなどのその他の作用物質)でもよい。一般的な成分を使用することは、各分析物に特異的な分析物結合単位をオリゴヌクレオチド部で修飾する必要性をなくすのに有利である。
【0026】
近接構成要素は、2つの異なるオリゴヌクレオチド部に複合体形成している抗原でもよい。この実施形態の分析物は、IgGまたは任意のその他のタイプの抗体でもよい抗原特異的抗体である。結合した抗原−オリゴヌクレオチド複合体が異なるオリゴヌクレオチド部を含む場合、抗体による抗原−オリゴヌクレオチド複合体の結合により、アンプリコンを含み得る近接対が形成される。したがって、この方法を使用して、特定の抗体の存在を高感度で検出することができる。
【0027】
また、本発明は、緩衝液、化学試薬、酵素、オリゴヌクレオチド、近接構成要素などの本発明の方法を実施するのに有用な個々のまたは組み合わせた成分および試薬、ならびにこれらの成分または試薬を使用するための指示書を含むことができるキットを提供する。例えば、このキットは本明細書に記載の増幅方法および検出方法を実施するのに適切なオリゴヌクレオチド増幅プライマーを含んでいてもよい。さらにキットは、放射標識、酵素基質、抗体などの増幅した核酸を検出するための試薬および溶液を含んでもよい。適切な溶液および試薬はよく知られており、例えば非特許文献7に記載されている。キットの構成品は、一般的な容器に一緒にパッケージされており、通常、本明細書で開示の方法の実施形態を実施するための指示書を含む。
【図面の簡単な説明】
【0028】
【図1A】抗原とオリゴヌクレオチドに複合体形成している抗体との混合を示す図である。
【図1B】隣接するプローブのハイブリッド形成を示す図である。
【図1C】ポリメラーゼ伸長および制限酵素ニック形成を示す図である。
【図1D】伸長、置換および線形増幅を示す図である。
【図1E】ハイブリッド形成、ポリメラーゼ伸長、ニック形成および指数関数的増幅を示す図である。
【図1F】抗原とオリゴヌクレオチドに複合体形成している抗体との混合を示す図である。
【図1G】隣接するプローブのハイブリッド形成を示す図である。
【図1H】プローブのポリメラーゼによる伸長を示す図である。
【図1I】プローブ伸長二重鎖の変性およびSDAプライマーの結合を示す図である。
【図1J】反対の配列方向のハイブリッド形成したプローブからのアンプリコン形成を示す図である。
【図2A】スプリントオリゴヌクレオチドのハイブリッド形成を示す図である。
【図2B】隣接するプローブの連結を示す図である。
【図2C】DNAポリメラーゼ伸長および置換を示す図である。
【図2D】第3のプローブを連結するための2つのハイブリッド形成した近接プローブの使用を示す図である。
【図2E】第3のプローブを連結するための反対の配列方向の2つのハイブリッド形成した近接プローブの使用を示す図である。
【図3A】一本鎖テザープローブを示す図である。
【図3B】一本鎖テザープローブの伸長および置換を示す図である。
【図3C】ニック形成、伸長、置換および捕捉を示す図である。
【図3D】ニック形成、伸長、置換および捕捉を示す図である。
【図3E】3’/3’構造を有するスプリントオリゴヌクレオチドを示す図である。
【図3F】スプリントオリゴヌクレオチドの伸長/置換を示す図である。
【図3G】標的介在プローブサイクルを示す図である。
【図3H】5’/3’構造を有するスプリントオリゴヌクレオチドを示す図である。
【図3I】5’/5’構造を有するスプリントオリゴヌクレオチドを示す図である。
【図3J】3’/3’構造を有するスプリントオリゴヌクレオチドを示す図である。
【図3K】3’/3’構造を有するスプリントオリゴヌクレオチドを示す図である。
【図3L】スプリントオリゴヌクレオチドの捕捉された複合体からの置換を示す図である。
【図4A】単純な競合的ハイブリッド形成ブロッカーを示す図である。
【図4B】陥入型競合的ハイブリッド形成ブロッカーを示す図である。
【図4C】無能力化ハイブリッド形成ブロッカーを示す図である。
【図4D】置換可能なハイブリッド形成ブロッカーを示す図である。
【図4E】自己置換型ハイブリッド形成ブロッカーを示す図である。
【図4EE】プローブ−ブロッカー二重鎖を安定化するための3’プローブ末端の使用を示す図である。
【図4F】二元免疫SDA反応での競合的ハイブリッド形成ブロッカーを示す図である。
【図4G】二元免疫SDA反応での無能力化ハイブリッド形成ブロッカーを示す図である。
【図4H】二元免疫SDA反応での段階的ブロッキングを示す図である。
【図4I】二元免疫SDA反応でのハイブリッド形成ブロッカーの結合後の添加を示す図である。
【図5A】スプリントオリゴヌクレオチドのハイブリッド形成を示す図である。
【図5B】伸長および置換を示す図である。
【図5C】RNAポリメラーゼ活性、ハイブリッド形成および伸長を示す図である。
【図5D】RNアーゼH活性、ハイブリッド形成および伸長を示す図である。
【図6A】付着した複合体の制限エンドヌクレアーゼ介在型放出を示す図である。
【図6B】付着した複合体の制限エンドヌクレアーゼ介在型放出を示す図である。
【図6C】付着した複合体の制限エンドヌクレアーゼ介在型放出を示す図である。
【図6D】ポリメラーゼおよび制限エンドヌクレアーゼ介在型放出を示す図である。
【図6E】ポリメラーゼおよび制限エンドヌクレアーゼ介在型放出を示す図である。
【図6F】物理的放出を示す図である。
【図6G】切れやすい連結および化学的開裂を示す図である。
【図6GG】切れやすい連結および化学的開裂を示す図である。
【図6H】オリゴヌクレオチド置換を示す図である。
【図6I】オリゴヌクレオチド伸長を示す図である。
【図6J】オリゴヌクレオチド伸長を示す図である。
【図6K】RNアーゼH放出を示す図である。
【図6L】RNアーゼH放出を示す図である。
【図6M】自己プライミング捕捉/置換オリゴヌクレオチドを示す図である。
【図6N】置換されたプローブ部のアンプリコン形成への関与を示す図である。
【図7A】第1の近接構成要素のオリゴヌクレオチド部の捕捉オリゴヌクレオチドとのハイブリッド形成による第1の近接構成要素の固定化を示す図である。
【図7B】固定化された第1の近接構成要素への標的分析物の結合を示す図である。
【図7C】標的分析物と第1の近接構成要素との間の固定化複合体への第2の近接構成要素の結合による固定化された2部位の「サンドイッチ」の形成を示す図である。
【図7D】標的非依存性アンプリコンが形成するメカニズムを示す図である。
【図7E】標的非依存性アンプリコンの形成につながるプローブ−プローブ相互作用を抑制するためのハイブリッド形成ブロッカーオリゴヌクレオチドの使用を示す図である。
【図7F】標的非依存性アンプリコンの形成につながるプローブ−プローブ相互作用を抑制するためのハイブリッド形成ブロッカーオリゴヌクレオチドの使用を示す図である。
【図7G】標的非依存性アンプリコンの形成につながるプローブ−プローブ相互作用を抑制するためのハイブリッド形成ブロッカーオリゴヌクレオチドの使用を示す図である。
【図7H】標的非依存性アンプリコンの形成につながるプローブ−プローブ相互作用を抑制するためのハイブリッド形成ブロッカーオリゴヌクレオチドの使用を示す図である。
【図7I】低イオン強度を使用する、標的分析物と2つの近接構成要素との間の固定化された複合体の放出を示す図である。
【図7J】捕捉オリゴヌクレオチドの使用および不均一なアッセイ形態への放出を示す図である。
【図8A】不均一な免疫増幅を示す図である。
【図8B】不均一な免疫増幅を示す図である。
【図8C】不均一な免疫増幅を示す図である。
【図8D】切れやすい連結による不均一な免疫増幅を示す図である。
【図9】スプリントオリゴヌクレオチドによる不均一な免疫増幅を示す図である。
【図10】一般的な免疫増幅システムを示す図である。
【図11A】ヘアピン放出プローブを示す図である。
【図11B】ヘアピンハイブリッド形成ブロッカープローブを示す図である。
【図11C】ヘアピンハイブリッド形成ブロッカープローブの置換を示す図である。
【図12】抗原特異的免疫グロブリンの検出を示す図である。
【図13】二元免疫SDA用の代表的なプローブ、プライマーおよびテザーオリゴヌクレオチドの地図を表す図である。
【図14A】第1の近接構成要素および第2の近接構成要素に付着したが、ただし、両方の近接構成要素に同時には付着していないアンプリコンを形成するための3’キャップされたオリゴヌクレオチド部の使用を示す図である。
【図14B】第1の近接構成要素および第2の近接構成要素に付着したが、ただし、両方の近接構成要素に同時には付着していないアンプリコンを形成するための3’キャップされたオリゴヌクレオチド部の使用を示す図である。
【図14C】第1の近接構成要素および第2の近接構成要素に付着した、ただし、両方の近接構成要素に同時には付着していないアンプリコンを形成するための3’キャップされたオリゴヌクレオチド部の使用を示す図である。
【図14D】第1の近接構成要素および第2の近接構成要素に付着した、ただし、両方の近接構成要素に同時には付着していないアンプリコンを形成するための3’キャップされたオリゴヌクレオチド部の使用を示す図である。
【図14E】第1の近接構成要素および第2の近接構成要素に付着した、ただし、両方の近接構成要素に同時には付着していないアンプリコンを形成するための3’キャップされたオリゴヌクレオチド部の使用を示す図である。
【図15A】IL−8の免疫SDA検出のための2色のリアルタイム蛍光プロファイルを示す図である。
【図15B】IL−8の定量のための検量線を示す図である。
【発明を実施するための形態】
【0029】
本発明により、ごく少量の分析物を高い感度で検出することができる。本発明は、アンプリコンを形成できるオリゴヌクレオチド部に複合体形成した、抗体などの分析物特異的結合因子の複合体を提供する。抗体とオリゴヌクレオチドを有するその他のタンパク質との間の複合体形成は、当技術分野で知られており、例えば参照によりその全体が本明細書に組み込まれる特許文献10および特許文献11で教示されている。分析物特異的結合因子が核酸、例えばアプタマーである場合、分析物特異的結合因子及びオリゴヌクレオチド部またはプローブ部は、1つの隣接した鎖内において、当技術分野で知られた化学合成方法を使用して合成され得る。さらに、用語「複合体形成(conjugate)」は、そのようなアプタマー−プローブ単位にも適用される。抗体にそれぞれ複合体形成しているオリゴヌクレオチドを結びつけることによりアンプリコンを構築する条件も知られており、例えば特許文献12で教示されている。アンプリコンを増幅するための、およびそれらの存在を検出するための条件および方法論も、その全体が参照により本明細書に組み込まれる特許文献12および特許文献13で教示されているように当技術分野で知られている。また、増幅産物を検出するために標識プローブを使用することも、例えば特許文献14、特許文献15、特許文献16、特許文献17および特許文献18で教示されており、それらすべての全体は参照により本明細書に組み込まれる。特許文献19は、恒温核酸増幅反応での内部対照の使用を教示しており、その全体は参照により本明細書に組み込まれる。
【0030】
本発明によれば、SDAによる好ましい増幅方法は図1で詳述する。Ab1およびAb2はそれぞれ、隣接するエピトープ1および2を認識し、オリゴヌクレオチドプローブP1およびP2に複合体形成している抗体である(図1A)。抗体は、この例に限定するわけではないが、本発明で有用な分析物特異的結合成分の代表的なものである。例えば、当技術分野で知られている有用な分析物特異的結合成分には、Fc、Fv、Fab’およびF(ab’)2断片などの抗体の機能的断片が含まれる。分析物特的結合成分のその他の例は、アプタマー、受容体分析物に特異的なリガンド、またはリガンド分析物に特異的な受容体を含む。さらに、種々の異なるタイプの分析物特異的結合成分を組み合わせて使用してもよいことを当業者は理解するであろう。「オリゴヌクレオチドプローブ」および「オリゴヌクレオチド部」は本発明の便宜上、同義的に使用する。用語「オリゴヌクレオチド」は、本発明の便宜上、核酸部のサイズの上限を設けるものと理解するべきではない。したがって、本明細書の使用では「オリゴヌクレオチド」は「ポリヌクレオチド」と同義である。本発明の便宜上、オリゴヌクレオチドは、全体的または部分的にDNA、RNAまたはそれらの類似体もしくは誘導体で構成されていてもよい。この実施形態では、P1およびP2は、相補的な3’末端配列および上流のSDAニック部位を含む。SDAのためのニック部位の使用および一般的なSDAの条件は、特許文献15、特許文献20および特許文献21に記載されており、それらの全体は参照により本明細書に組み込まれる。P1とP2の3’末端は、連結されている2つの抗体がそれらの各エピトープに結合することにより近くに近接して保持されている場合に、互いにハイブリッド形成する(図1B)。核酸のハイブリッド形成した部分の塩基対またはミスマッチの数ならびにハイブリッド形成が生じる緩衝液の温度およびイオン強度を含む、核酸ハイブリッド形成につながる条件は、当技術分野でよく知られており、例えば非特許文献7で概説されている。Ab1およびAb2のバルク溶液濃度は、P1とP2の抗原非依存性ハイブリッド形成が最少になるように、抗原の表面の濃度と比較して相対的に低い。次いで、DNAポリメラーゼを使用してP1:P2ハイブリッドの陥入した3’末端を平滑化する(図1C)。これは、SDAニック形成酵素が認識する二本鎖制限部位の生成に役立つ。ニック形成酵素は二本鎖DNA鋳型の一本鎖のみの開裂を触媒する。ニック形成およびニックの部位からのポリメラーゼ伸長は下流のDNA鎖を溶液に置換し、ニック部位を再生する(図1D)。ニック形成および伸長/置換ステップの繰返しサイクルを使用して、置換された鎖の多数のコピーを産生することができる。置換された鎖は相補的なSDAプライマーによって捕捉される(図1E)。捕捉した鎖およびハイブリッド形成したSDAプライマーの3’末端からの伸長により、一連の中間体を経て指数関数的に増幅できる二本鎖DNA分子を産生される。代替的な実施形態では、オリゴヌクレオチドプローブP1およびP2の一方のみがSDAニック部位を含む。
【0031】
別の実施形態(図1F〜I)では、プローブP1およびP2はSDAニック部位を欠くが、代わりに配列cおよびd’を含み、これはそれぞれSDAプライマーSP2およびSP1にも存在する(図1I参照)。P1およびP2の3’末端を伸長することにより、P1の伸長産物に相補配列dとP2の伸長産物に相補配列c’とを含有する二重鎖を作製する(図1H参照)。次いで、例えば加熱により二重鎖伸長産物の鎖を分けると、SDAプライマーSP1およびSP2は、伸長したプローブの新たに合成された配列dおよびc’の相補体とハイブリッド形成する。伸長したプローブは、伸長したP1の配列eおよび伸長したP2の配列b’として示した、SDAプライマーの結合性部位の3’側に位置する配列を任意選択的に含んでもよい。これらの配列はバンパープライマーSB1およびSB2とハイブリッド形成する(図1I参照)。SDAの間、SDAプライマーSP1およびSP2はポリメラーゼによって伸長される(図示せず)。もし存在するならば、バンパープライマーの伸長によりSDAプライマー伸長産物をプローブ鎖から置換され、次いで置換された鎖は、特許文献5、特許文献15、特許文献20および特許文献21で記載されたように、SDAで増幅される。もし伸長したプローブがSP1およびSP2結合性部位に対して配列3’を含有しない場合(図示せず)は、SDAプライマーとハイブリッド形成するプローブの3’末端はポリメラーゼによって伸長されて、その後のニック形成および上記のSDAによる鎖置換を可能にするニック形成可能な制限部位を作製する。
【0032】
前述の実施形態では、オリゴヌクレオチド部(P1およびP2)は、それらの5’末端または5’末端の近くに位置する連結を介してそれらの各分析物結合単位(Ab1およびAb2)に複合体形成していた。図1Jで説明した代替的な実施形態では、複合体形成Ab1−P1はP1の3’末端または3’末端の近くに位置する連結を介して形成され、一方、複合体形成Ab2−P2はP2の5’末端または5’末端の近くに位置する連結を介して形成される。P1は配列(abcdef)(5’側から3’側に読む)を含み、P2は配列(j’i’h’g’f’e’)(5’側から3’側に読む)を含む。さらに、Ab2−P2は、伸長可能な3’末端(すなわち3’末端ヒドロキシル基)を含む。示した通り、P2の配列(f’e’)とハイブリッド形成することが可能なP1の配列(ef)は、P1がAb1に複合体形成する部位の5’に位置し、一方、(f’e’)はP2がAb2に複合体形成する部位の3’に位置する。したがって、プローブP1およびP2は、反対の配列方向のそれらの各分析物結合単位(Ab1またはAb2)と連結するといえる。P1とP2が、例えばそれらの各近接構成要素の同じ標的分析物分子への結合を介して、近くに近接している場合、P1の配列(ef)は、図1Jの左側で示した通り、P2の(f’e’)とハイブリッド形成する。次いでポリメラーゼを使用してP2の3’末端を伸長して、示した通り、新たな配列を含有する伸長産物(すなわち、アンプリコン)P2−extを作製することができる。次いで、当技術分野で知られた方法により新たな配列(d’c’b’a’)の全体または部分を使用してP2−extを検出して、P2−extを変換されていないP2と区別することができる。例えば、P2−extは、上記の核酸増幅法で増幅してもよい。溶液を加熱することによってP2−extをP1から分離することができ、プライマーはP2−extの3’末端で新たな配列とハイブリッド形成し、伸長してP2−estの相補体を作製することができる。増幅の次の期間は、P2−extからの相補体の分離およびP2の5’末端の近くに位置する配列から構成される異なるプライマーを相補体にハイブリッド形成することを含む。好ましい実施形態では、配列bは、SDA適合性制限酵素の認識配列の一本鎖成分を含有する。次いで、P2−extを形成することにより、制限酵素により切断される二本鎖認識配列を作製する。ニックからの伸長により、P2−extと相補的な新たな鎖を作製し、ニック形成可能な認識配列を再生する。この産物を、前述したSDA法により増幅し、検出してもよい。任意選択的に、P2の配列i’はまた、SDAのための認識配列の一本鎖成分を含んでもよく、そうであるならば、P2−extとその完全長相補鎖との間に形成した二重鎖は、2つのニック形成可能な制限酵素認識配列を含有する。別の実施形態では、配列bはRNAポリメラーゼプロモーター部位の一本鎖成分であってもよい。次いでP2−extを形成することにより、二本鎖RNAポリメラーゼプロモーターを作製し、これを使用してRNAポリメラーゼの活性を、P2−extの配列(j’i’h’g’f’e’d’c’)と相補的なRNA分子を合成するように方向づける。これらのRNA分子は直接検出してもよく、あるいは3SR、NASBA、TMAまたは転写に基づく増幅などの方法でさらに増幅してもよい。任意選択的に、P2の配列i’はRNAポリメラーゼプロモーターの一本鎖成分を含んでもよい。この場合、P2−extの3’末端とハイブリッド形成したプライマーを伸長することにより、RNAポリメラーゼの活性を、直接検出することができ、または上記の方法を使用して増幅することができる配列(h’g’f’e’d’c’b’a’)を含むRNA分子を合成するように方向づけるのに使用できる二本鎖プロモーター部位を作製する。P2−extの検出または増幅の方法にかかわらず、図1Jで示した実施形態は、反対の配列方向のそれらの各分析物結合要素Ab1またはAb2と連結するプローブ部P1およびP2を含み、この2つのプローブは標的介在プロセスで互いにハイブリッド形成して、後で伸長してアンプリコンを作製する伸長可能な3’末端を有する二重鎖を作製する。標的分析物が存在しない場合、P1とP2は近くに近接せず、以下で言及する誤った(すなわち、標的非依存性の)相互作用による以外は、P2−extは形成しない。この誤った相互作用は、これも以下で記載するハイブリッド形成ブロッキングオリゴヌクレオチドによって抑制することができる。したがって、P2−extは標的分析物の存在の結果として、かつ存在する標的分析物の量に比例して産生される。したがって、産生したP2−extの量の判定を使用することによって、試料に存在する標的分析物の量を定量することができる。
【0033】
図2A〜Cは、スプリントオリゴヌクレオチドの代表的な使用を詳述する。Ab1およびAb2は隣接するエピトープ1および2を認識する抗体であり、それぞれオリゴヌクレオチドプローブP1およびP2に複合体形成している(図2A)。P1はAb1にその5’末端または5’末端の近くに位置する連結を介して複合体形成しており、3’末端ヒドロキシル基および上流のSDAニック部位を含む。プローブP2はAb1にその3’末端で複合体形成しており、SDAプライマー結合性部位および5’末端ホスフェート基を含む。スプリントオリゴヌクレオチドSの配列は、抗体がそれらの各エピトープに結合することにより近くに近接している場合に、オリゴヌクレオチドP1およびP2がスプリントSと二本鎖ハイブリッドを形成するように、プローブP1の3’末端およびプローブP2の5’末端と相補的である。スプリントオリゴヌクレオチドSとハイブリッド形成した場合、P1の3’−OHとP2の5’−PO4は隣接し、DNAリガーゼを使用してP1とP2の配列を連結するリン酸ジエステル結合の形成を触媒する(図2B)。SDAプライマーSP1はスプリントオリゴヌクレオチドSの上流のプローブP2とハイブリッド形成する。鎖置換型DNAポリメラーゼは、プライマーSP1の3’末端およびスプリントオリゴヌクレオチドSの3’末端から伸長する。プライマーSP1の伸長はスプリントオリゴヌクレオチドSの伸長産物を置換し(図2C)、SDA制限酵素ニック部位をいずれかの末端に有する二本鎖DNA分子を作製する。この分子は図1Cで示したものと類似している。ニック形成、ニックからのポリメラーゼ伸長および下流の鎖の置換は、指数関数的増幅につながる(図1D〜E)。一実施形態では、プローブP1はSDAニック部位を含まない。別の実施形態では、スプリントオリゴヌクレオチドSは、スプリントSの3’伸長を妨げる3’キャップを含む。
【0034】
図2Dおよび2Eは、近接構成要素の対を使用する、標的介在性で且つリガーゼで触媒されたアンプリコン形成の代替的な実施形態を説明する。プローブP1およびP2はそれらの各抗体(またはその他の分析物結合単位)Ab1およびAb2に連結されるか、複合体形成される。複合体形成は、図2Dで示した通り、両方のプローブの5’末端または5’末端の近くの連結を介して生じてもよく、あるいは2つのプローブ(P1)の一方は、プローブの3’末端または3’末端の近くに位置する連結を介して複合体形成してもよい。P1は配列(abcdef)(5’側から3’側に読む)を含み、P2は配列(j’i’h’g’f’e’)を含む(5’側から3’側に読む)。複合体Ab2−P2は3’末端ヒドロキシル基をさらに含む。図2Dまたは2Eのいずれかで示された構造では、P1の配列(ef)およびP2の(f’e’)は互いにハイブリッド形成することが可能である。第3のプローブP3は配列(d’c’b’x’y’)を含み、さらに5’末端ホスフェート基を含む。P3はプローブP1の配列(bcd)(P1の配列(ef)に隣接)とハイブリッド形成することが可能である。標的分析物の存在下では、P1とP2は近くに近接し、配列(ef)と(f’e’)とのハイブリッド形成により二重鎖を形成する。示した通り、プローブP3は、P1とP2とのハイブリッド形成の前または後のいずれかに、P1とハイブリッド形成してもよい。いずれの場合も、P3の5’ヌクレオチドはP2の3’ヌクレオチドに隣接して位置し、この構造では、P2とP3はDNAリガーゼ(またはその他の連結メカニズム)で共有結合して、示した通り、アンプリコンP2:P3を形成することができる。次いで、P2:P3は、図1Jで示した実施形態について上記したものなどの増幅を含む種々の方法によって検出することができる。しかし、この場合、配列x’および/またはy’は、プライマーハイブリッド形成のための部位として使用することとなる。標的分析物が不在の場合、P1とP2は近くに近接せず、以下で言及するP1とP2との間の誤った(すなわち、標的非依存性の)相互作用による以外は、P2:P3は形成しない。この誤った相互作用は、これも以下で記載するハイブリッド形成ブロッキングオリゴヌクレオチドによって抑制することができる。したがって、P2:P3は標的分析物の存在の結果として、かつ存在する標的分析物の量に比例して産生される。したがって、産生されたP2:P3の量の定量を使用して、試料に存在する標的分析物の量を定量することができる。近接構成要素のオリゴヌクレオチド部を連結することによって形成されたアンプリコンの増幅中、ハイブリッド形成ブロッカーは不要である。なぜなら、連結によってつなぐことができるプローブは通常互いにハイブリッドを形成せず、したがって、オリゴヌクレオチドの3’伸長を含む増幅中、誤ったプローブ変換をする可能性がないからである。
【0035】
図3は、近接構成要素の2つのオリゴヌクレオチド部間のギャップを架橋するように設計されたスプリントオリゴヌクレオチドを含む本発明の代表的な実施形態を示す。一実施形態(図3A)では、近接抗体Ab1の1つはテザーオリゴヌクレオチドの3’末端または3’末端の近くの連結を介して複合体形成している。今後、「テザーオリゴヌクレオチド」は、アンプリコンから置換されるが、分析物特異的結合性部に複合体形成したままであるオリゴヌクレオチド部を指す。テザーオリゴヌクレオチドTOは、スプリントオリゴヌクレオチドP1のセグメント(好ましくは5’末端または5’末端の近くにある)と相補的である。さらに、スプリントオリゴヌクレオチドP1は、変換されたプローブの増幅を促進するプライマー配列および変換されたプローブの検出を促進する検出領域を含んでもよい。また、P1は、SDAによる増幅を促進する制限認識配列を含んでもよい。さらに、スプリントオリゴヌクレオチドの3’配列は、その5’末端を介して抗体Ab2に複合体形成しているプローブP2の3’末端と相補的である。図3Aで示した通り、P1の5’末端は、Ab1に付いたテザーオリゴヌクレオチドTOと相補的である。任意選択的に、テザーオリゴヌクレオチドはP1の5’末端上ではない配列と相補的であってもよい。抗体Ab1およびAb2がそれらの各エピトープに結合している場合、スプリントオリゴヌクレオチドP1はTOおよびP2の両方とハイブリッド形成することができる(図3A)。プローブP2およびスプリントオリゴヌクレオチドの3’末端からの伸長はテザーオリゴヌクレオチドTOを置換し、抗体Ab2と連結した二本鎖DNA分子を作製する(図3B)。この二本鎖産物をニック形成し、ポリメラーゼで伸長し、下流の鎖を置換することにより、相補的なSDAプライマーとハイブリッドを形成し得る一本鎖オリゴヌクレオチドが生じる(図3C)。これは、一連の中間ニック形成、伸長、置換およびプライミング事象を介する指数関数的増幅につながる(図3D)。
【0036】
図3Eは抗体間のギャップを架橋する第2の実施形態を示す。この構造では、各抗体(Ab1およびAb2)は、異なるテザーオリゴヌクレオチド、Ab1はa’、Ab2はjに複合体形成している。通常、抗体Ab1のテザーオリゴヌクレオチドは第2の抗体Ab2のテザーオリゴヌクレオチドとは異なる。この場合、a’およびjは配列において等価ではない。スプリントオリゴヌクレオチドP1およびP2はそれぞれ、オリゴヌクレオチド配列a’およびjと相補的な配列(場合により5’末端の近く)を含有する。例えば、P1は配列aを含有し、P2は配列j’を含有する。プローブP1の配列aはAb1の配列a’とハイブリッド形成し、Ab2の配列jはP2の配列j’とハイブリッド形成する。この実施形態では、P1およびP2はそれぞれ、他方のプローブと相補的な短い3’配列を含有し、したがってP1の配列(ef)はP2の(f’e’)と相補的である。P1およびP2のこれらの相補的な3’配列の明らかなハイブリッド形成は、プローブP1とP2が、近接したエピトープに結合した抗体のテザーオリゴヌクレオチド(a’およびj)とハイブリッド形成した結果、空間的に近接した場合のみに高い効率で生じる。P1とP2の3’末端のハイブリッド形成により、陥入した3’末端を有する短い二重鎖が生じ、次いでこれをポリメラーゼで伸長することができる。一実施形態では、3’末端の伸長はスプリントオリゴヌクレオチドP1およびP2をテザーオリゴヌクレオチド(および抗体)から置換するように働き、一方同時に、両方のプローブの伸長産物(P1−extおよびP2−ext)で構成された二重鎖を作製する(図3F)。次いで、P1およびP2伸長産物を、PCR、SDA、リガーゼ連鎖反応、3SR、Qβレプリカーゼに基づく増幅、固相増幅およびNASBAを含む、当技術分野で知られた種々の増幅方法で検出することができる。P1の配列(b、c、d、e、f)およびP2の(e’、f’、g’、h’、i’、j’)などのプローブが含有する配列、またはプローブ伸長産物を使用して、プローブの増幅および検出を促進してもよい。増幅を促進するのに使用できる特別な配列には、プライマー結合性部位、制限エンドヌクレアーゼ部位、ハイブリッド形成ブロッカーオリゴヌクレオチドとハイブリッド形成することが可能な配列、RNAプロモーター部位などがある。増幅した産物は、当技術分野でよく知られた不均一法または均一法で検出することができる。あるいは、図3Fの二重鎖IIを、当技術分野でよく知られた方法で増幅することなく直接検出してもよい。方法が、5’−3’エキソヌクレアーゼ活性を有するDNAポリメラーゼ、例えばTaqDNAポリメラーゼを用いる場合、テザーオリゴヌクレオチド(a’またはj)は伸長プロセス中に分解することがあり、この分解産物は標的抗原の存在を示すものとして検出することができる。
【0037】
図3Eおよび3Fは、テザーオリゴヌクレオチドの3’末端に複合体形成している抗体を示し、図3Hは、近接対の両方の抗体がテザーオリゴヌクレオチドの5’末端に複合体形成している別の構造を示す。同様に、図3Iは、1つのテザーオリゴヌクレオチドが抗体に5’連結を介して複合体形成し、他のオリゴヌクレオチドが3’連結を介して複合体形成している実施形態を示す。これらの後者の2つの構造のそれぞれにおいて、プローブ配列P1およびP2を3’伸長することにより、結果としてプローブをテザーオリゴヌクレオチドから置換し、図3Fで示したものと同一の二本鎖の二重鎖を作製することになる。
【0038】
テザーオリゴヌクレオチドが置換プロセス中に分解しない場合には、プローブ分子P1およびP2の第2の組は、標的に結合した近接構成要素の空いたテザーオリゴヌクレオチドとハイブリッド形成することができる(図3G)。前記のとおり、P1とP2の3’末端はアニールし、再び伸長することによって、結果としてプローブを置換し、P1−extおよびP2−extで構成された二重鎖を作製することになる。存在する場合ならば、空いたテザーオリゴヌクレオチドは再び、伸長していないプローブ(P1およびP2)の新たな対とアニールし、Ab1およびAb2が近接エピトープに結合し且つP1およびP2の供給が存在する限り、伸長していないプローブの3’ハイブリッド形成、伸長、置換およびそれに続く結合のサイクルは続く。このサイクルプロセスの結果として、検出可能なプローブ伸長二重鎖の多数のコピーが、存在する各標的から形成される。
【0039】
図3A〜3Lで示した例のすべてにおいて、プローブのテザーオリゴヌクレオチドへの最初のハイブリッド形成は、使用した実験プロトコル次第で、抗体が標的分子に結合する前または後のいずれでも生じる。一実施形態では、抗体Ab1およびAb2の少なくとも一方は、常磁性粒子(図9)またはその他の固体表面(図3L)、例えばマイクロウェルの内壁に共有結合的または非共有結合的に連結しているか、連結し得る。少なくとも1つの抗体がビーズ、固体表面またはその他の固体マトリックスと連結し、プローブP1およびP2の両方(図3L)がテザーオリゴヌクレオチドとのハイブリッド形成によって抗体に間接的に付いている構造では、プローブを伸長することにより抗体−標的複合体から置換された二重鎖が作製され、一方、複合体自体はビーズ、固体表面またはその他の固体マトリックスに付いたままである。所望により次いで、マトリックス表面に非特異的に結合した複合体および任意の物質は残して、置換された二重鎖を含有する溶液を取り出し、別のウェルまたは区画で分析または増幅してもよい。
【0040】
本発明の別の実施形態では、連結スプリントオリゴヌクレオチドは、例えば図3Jで示したスプリントオリゴヌクレオチドP1およびP2の両方の部分と相補的であってもよい。連結スプリントオリゴヌクレオチドとハイブリッド形成した場合、プローブP1とP2はP1の3’末端がP2の5’末端と共有結合するように図2で記載の通りに連結されてもよい(図3J)。次いでこれらを図2で記載の通りに増幅してもよい。
【0041】
別の実施形態では、スプリントオリゴヌクレオチドは、図3Kで例示した通りにテザーオリゴヌクレオチド(j’)および1つのプローブ分子P2とハイブリッド形成する。次いで、スプリント結合したP2の3’末端は空間的に近接したP1の相補的な3’末端とハイブリッド形成することができる。このプローブの3’を伸長すると、プローブはスプリントおよびテザーオリゴヌクレオチドから置換され、図3で示した前述の例で産生したものと類似の完全長の増幅可能な二重鎖が形成する。
【0042】
図4は、近接したエピトープに結合していない抗体に連結したプローブ分子同士のハイブリッド形成の拡がりを減少させるように設計されたハイブリッド形成ブロッカーオリゴヌクレオチドを示す。そのような標的非依存性ハイブリッド形成は、真正な標的結合事象で産生したものと区別できないプローブ伸長産物となるため、バックグラウンドシグナルの原因であり、バックグラウンドシグナルは検出方法の全体的な感度を減少させる。本発明は、バックグラウンドシグナルにつながる誤った標的非依存性プローブの相互作用を低減するハイブリッド形成ブロッカーオリゴヌクレオチド(または「ハイブリッド形成ブロッカー」)の使用を含む。図4Aは、ハイブリッド形成ブロッカーの近接に基づく増幅方法での使用の基礎となる基本原理を示す。相互相補性の短い配列(ef及びf’e’)(5’側から3’側に読む)は、P1およびP2の3’末端を含む。これらの配列は互いにハイブリッド形成して、示した通り、5’側が突出した二重鎖を形成し得る。二重鎖状態に対する一本鎖状態にあるプローブ分子の数は、総プローブ濃度および二重鎖の本質的な安定性により決まり、これは二重鎖の長さおよび組成に関係する。P1とP2との間の相互作用を、プローブに対して好ましくはモル過剰の、P1とハイブリッド形成すると、2つのプローブ間の相互作用を競合的にブロックするハイブリッド形成ブロッカーオリゴヌクレオチドを加えることによって減少させるか、反対にすることができる。このブロッカーは、P2と相互作用する部分配列全体にわたってP1と相補的である必要はない。この部位との部分的な相補性でも、P1のP2に対するハイブリッド形成を減少させる。
【0043】
一実施形態では、ハイブリッド形成ブロッカーオリゴヌクレオチドは、P1と相補的なP2の部分(部分配列ef)の一部または全体と同一の第1の部分配列(e’またはf’e’)を含む。第2の実施形態(図4B)では、ハイブリッド形成ブロッカーオリゴヌクレオチドは、上記定義の第1の部分配列と、P1のセグメントと相補的であるがP2の部分配列とは同一でない第2の部分配列(図4Bのd’)とを含む。ハイブリッド形成ブロッカーの第2の部分配列は、P1−P2の相互作用と比較してブロッカー−P1相互作用を安定化させることによって、ブロッキング効果を向上させる。第2の部分配列はまた、P2分子がP1と既にハイブリッド形成している場合に、P1−ブロッカー二重鎖の核形成部位としても働くことができる。次いで核形成に続いて、完全なP1−ブロッカー二重鎖の形成は、P2をP1から置換する。この実施形態のP1の部分配列dは、図4Bで示した通り、プローブの部分配列eと直接隣接していてもよく、あるいは部分配列eから数ヌクレオチド離れて位置していてもよい(図示せず)。後者の場合、ハイブリッド形成ブロッカー部分配列d’は、追加のヌクレオチドおよび/またはテトラエチレングリコール(TEG)部などの非ヌクレオチドリンカーを含むスペーサーを介してハイブリッド形成ブロッカー部分配列e’と間接的に連結していてもよい。
【0044】
第3の実施形態(図4C)では、ハイブリッド形成ブロッカーオリゴヌクレオチドは、第1の部分配列(上記定義)、任意選択的に第2の部分配列(上記定義)、および第1の配列の5’に位置し、P1の3’伸長の鋳型として働くことができる第3の部分配列(図4Cのt’s’)を含んでいてもよい。第3の部分配列は、当技術分野でよく知られた、適切な非ヌクレオチド部m’(すなわち、「5’キャップ」)を任意選択的に含有し、非鋳型ヌクレオチドがP1の3’伸長産物に付加するのを妨げ、かつポリメラーゼがP1の伸長によって形成した平滑末端の二重鎖に結合するのを抑えることができる(図4C参照)。ブロッカー−鋳型でのP1の3’伸長により、P2の配列と相補的でないその3’末端に新たな配列(st)を含有するP1−伸長産物を得るのが好ましい。したがって、3’配列(st)の付加は、P2の鋳型でDNA合成のための機能的プライマーとしてのP1の使用を不可能にするように働く。また、配列(st)の付加は、2つの分子間の相補的塩基対の数を増加させることによって、ブロッカー−P1の相互作用を安定化するように働く。任意選択的に、この実施形態で産生された新たな3’配列(st)は、伸長されたP1とハイブリッド形成ブロッカーが解離した場合、伸長されたP1がステムループ(ヘアピン)構造に折り畳まれて、P2との任意の相互作用が減少するように、P1のセグメントと全体的または部分的に相補的である。この場合、P1のヘアピンの3’末端はヘアピンのステムを伸ばすように場合によって伸長されてもよく、この伸長はニック形成可能または開裂可能な制限エンドヌクレアーゼ部位をP1分子内に任意選択的に作製することができる。
【0045】
第4の実施形態では、プロセスのある段階の間、P1とP2との間の相互作用を可逆的にブロックすることが望ましい場合がある。図4Dは、可逆的なブロックを可能にするハイブリッド形成ブロッカーの設計を示す。この実施形態では、ハイブリッド形成ブロッカーは、ブロックされるプローブ(図4DのP1)と相補的な部分配列(e’d’)およびプローブと相補的でない1つまたは複数のテール配列(t’および/またはk’)を含む。ハイブリッド形成ブロッカーのP1とのハイブリッド形成は、P1−P2の相互作用を妨げる。所望の時点で、脱ブロック化(デブロッキング)オリゴヌクレオチドを加えてハイブリッド形成ブロッカーオリゴヌクレオチドをP1から置換して、P1をP2と自由に相互作用できるようにすることができる。デブロッキングオリゴヌクレオチドは、ハイブリッド形成ブロッカーのテール配列と相補的な1つまたは複数のテール配列(tおよび/またはk)を含む。このテール配列は、ブロッカー−デブロッカーハイブリッド形成の核形成の部位として働く。相補的テール配列のハイブリッド形成が核形成されると、ブロッカーがP1から置換されるまで、ハイブリッド形成ブロッカーとデブロッカーとの間に追加的塩基対が形成する。ブロッカーのプローブからの置換を確実にするために、ブロッカー−デブロッカー複合体の全体的な熱力学的安定性は、プローブ−ブロッカー複合体よりも高くなければならない。デブロッキングオリゴヌクレオチドは、ブロッカー−デブロッカー二重鎖の熱力学的安定性がプローブ−ブロッカー二重鎖の安定性よりも高いならば、ハイブリッド形成ブロッカーオリゴヌクレオチドと完璧に相補的である必要はない。例えば、デブロッカーは、得られるブロッカー−デブロッカー二重鎖がプローブ−ブロッカー二重鎖よりも安定であるならば、ハイブリッド形成ブロッカーオリゴヌクレオチドとミスマッチを形成する1つまたは複数のヌクレオチドを含有していることが望ましいことがある。特に、デブロッカーの配列eが、ブロッカーの配列e’と1つまたは複数のミスマッチを形成する1つまたは複数のヌクレオチドを含有することが好ましい場合がある。デブロッカーのこれらのミスマッチヌクレオチドの主要な機能は、デブロッカーの配列eとP2の配列e’との間の潜在的な相互作用を不安定化することである。この実施形態のひとつの変形において、ハイブリッド形成ブロッカーは、図4Eで示した通り、配列kのポリメラーゼで触媒した伸長によって置換されてもよい。この場合、デブロッキング配列は、ブロッキング配列で直接合成され、分離させるデブロッカーオリゴヌクレオチドを加える必要はない。さらに別の実施形態では、プローブは、プローブ分子間の相互作用をブロックするように働くその3’末端または3’末端の近くに3’ステム−ループ構造を含んでもよい(図11A〜C参照)。
【0046】
ブロッカーのポリメラーゼによる3’伸長を妨げるために、図4Eで示したヘアピン構造を有するハイブリッド形成ブロッカーを除いて、上記のハイブリッド形成ブロッカーオリゴヌクレオチドはすべて、3’末端のヌクレオチドにキャップを含んでもよい。3’キャップを有するハイブリッド形成ブロッカーオリゴヌクレオチドは、「キャップされたオリゴヌクレオチド」と呼ぶ。そのような3’キャップは当技術分野でよく知られており、逆位ヌクレオチド、2’−3’ジデオキシリボヌクレオチドおよび3’デオキシリボヌクレオチドを含む。ハイブリッド形成ブロッカーオリゴヌクレオチドは、ハイブリッド形成ブロッカーがプローブと二重鎖を形成する場合に、プローブヌクレオチドと相補的な塩基対を形成しない3’テール配列を含んでもよい。また、非塩基対形成3’テールは、ハイブリッド形成ブロッカーがプローブと二重鎖を形成している場合、ブロッカーの3’伸長を妨げるように働き、したがって「3’キャップ」としても働く。
【0047】
図4EEは、P1ブロッカー二重鎖の安定性を促進するための、プローブ1(P1)での3’テールの使用を説明する。P1の3’テールは配列xyで構成され、プローブ2(P2)の配列(f’e’)とハイブリッド形成することが可能な配列(ef)の3’側に位置する。P1の3’テールは、P2とハイブリッド形成しない。ハイブリッド形成ブロッカーは、配列(y’x’f’)および任意選択的にe’を含む。したがって、ハイブリッド形成ブロッカーは、P1とハイブリッド形成して、P1の3’テールならびにP1の配列efのすべてまたは一部を転換させる二重鎖を形成することが可能である。ブロッカー:P1二重鎖の形成は、上記の通り、P1:P2ハイブリッドの拡がりを減少させる。P1の(xy)とハイブリッド形成ブロッカーの(y’x’)との間の塩基対形成は、ブロッカー:P1二重鎖を安定化するように働く。ハイブリッド形成ブロッカーは、配列(y’x’)の5’に位置する配列z’を任意選択的に含む。配列z’は、上記の方法においてデブロッカーオリゴヌクレオチドのハイブリッド形成を開始するための部位として働くことができる。
【0048】
図4Fは、二元免疫増幅反応におけるハイブリッド形成ブロッカーオリゴヌクレオチドの使用を説明する。P1およびP2はそれぞれ、抗体Ab1およびAb2に直接複合体形成している。プローブが抗体にテザーオリゴヌクレオチドとのハイブリッド形成を介して間接的に結合している場合、または分析物特異的結合成分がアプタマーまたは抗体以外のその他の分析物特異的結合分子である場合も関係なく、同じ原理が当てはまる。示した通り、ハイブリッド形成ブロッカーオリゴヌクレオチドはP1の3’末端とハイブリッド形成して、P2とのその相互作用を妨げる。ハイブリッド形成ブロッカーのハイブリッド形成は、抗体が標的分析物に結合するのを妨げず、当初ハイブリッド形成ブロッカーは、Ab1が分析物と複合体形成しているか、溶液中で自由であるかにかかわらずP1鎖とハイブリッド形成する(状態I)。通常、自由なAb1およびAb2(および複合体形成しているプローブ)のバルク溶液中の濃度は、1fMと10nMとの間である。通常ハイブリッド形成ブロッカーの濃度はプローブ濃度よりも10〜100000倍高いため、ブロッカー−P1の相互作用は、標的に結合していない抗体に複合体形成しているプローブについてP1−P2の相互作用を上回る。しかし、標的分子のエピトープ1および2がそれぞれAb1およびAb2と結合する場合、三元標的−抗体複合体でのP2に比べたP1の有効局所濃度は、バルク溶液中のプローブおよびハイブリッド形成ブロッカーの濃度よりもはるかに高く(通常1〜100μM)なる。その結果、標的に結合した抗体と連結しているプローブでは、P1:P2二重鎖がP1:ブロッカー二重鎖よりも優勢である(状態II)。したがって、P1:2ハイブリッドの3’末端をポリメラーゼ触媒伸長させることにより、標的−Ab1−Ab2複合体上での増幅可能な二重鎖が生じ(状態III)、一方、標的複合体と連結していないプローブは、ブロックされ、伸長されず、増幅不可能なままである。図4Fは、プローブの1つのみとハイブリッド形成する単一のハイブリッド形成ブロッカーの使用を示すが、その他のプローブとハイブリッド形成する第2のハイブリッド形成ブロッカーを第1のブロッカーと連結して使用してもよい。
【0049】
図4Gは、伸長の鋳型として機能することにより、P1分子を「無能力」にすることが可能なハイブリッド形成ブロッカーを用いる同様の反応スキームを示す(上記図4C参照)。上記の理由により、バルク溶液中のプローブではブロッカー:P1二重鎖がP1:P2二重鎖よりも優勢であり、一方、三元標的−抗体複合体ではP1:P2二重鎖が優勢である。ブロッカー:P1二重鎖をポリメラーゼ触媒伸長させることにより、「無能力化された」P1伸長産物が生じ(図4C参照)、一方、P1:P2二重鎖の伸長により、図4Fの通り、増幅可能な二重鎖が生じる。
【0050】
図4Hは、置換可能なハイブリッド形成ブロッカーAがP2とハイブリッド形成してブロッカーA:P2二重鎖を形成する段階的ブロッキングプロセスを示す。任意選択的に、このスキームのハイブリッド形成ブロッカーAは、バルク溶液中および三元標的−Ab1−Ab2複合体上の両方において、ブロッカーA:P2二重鎖をP1:P2二重鎖よりも安定にするのに十分な長さまたは濃度を有することができる。P1のセグメントと相補的な第2のハイブリッド形成ブロッカーBおよび置換可能なハイブリッド形成ブロッカーAと相補的なデブロッカーDを溶液に加えることにより、AをP2から置換させ、バルク溶液中でのP1:ブロッカーB二重鎖を形成し、そして三元標的−抗体複合体でのP1:P2二重鎖を形成する。任意選択的に、ハイブリッド形成ブロッカーBは、上記の通りP1を無能力化させる「無能力化」配列を含んでもよい(図4Cおよび4F参照)。前述の通り、プローブ−プローブハイブリッドをポリメラーゼ触媒伸長させることにより増幅可能な二重鎖が生じ、一方、P1:ブロッカーB二重鎖を場合によって伸長することにより、「無能力化された」P1伸長産物が生じる。
【0051】
図4Iは、P1:P2二重鎖がバルク溶液中および三元標的−抗体複合体上の両方において形成することができる反応スキームを示す。次いで、バルク溶液と三元複合体とは有効プローブ濃度が異なるので、ハイブリッド形成ブロッカーを加えることにより、三元標的複合体上のものよりもバルク溶液中のP1:P2二重鎖を優先的に分裂させる(図4F参照)。
【0052】
一実施形態では、ハイブリッド形成ブロッカーオリゴヌクレオチドを、常磁性粒子またはその他の固体表面と共有結合的または非共有結合的に連結してもよく、さらに近接構成要素を表面に可逆的に結合するために使用してもよい(図6参照)。本発明の別の実施形態では、抗体Ab1およびAb2の少なくとも1つは、常磁性粒子(図9参照)またはその他の固体表面と共有結合的または非共有結合的に連結しているか、連結することができる。
【0053】
図5で示した本発明の実施形態は、2つの近接構成要素間のギャップを架橋するように設計されたスプリントオリゴヌクレオチドを含む。一実施形態では、スプリントオリゴヌクレオチドSは、RNAポリメラーゼプロモーター配列、下流のプライマー結合配列および検出領域を含む(図5A)。スプリントSの5’配列は、抗体Ab1にその3’末端で複合体形成するP1の5’末端と相補的である。さらに、スプリントSの3’配列は、抗体Ab2にその5’末端で複合体形成するプローブP2の3’末端と相補的である。抗体Ab1およびAb2がそれらの各エピトープと結合する場合、スプリントオリゴヌクレオチドSはP1およびP2の両方とハイブリッド形成することができる(図5A)。プローブP2およびスプリントSの3’末端からの伸長により、プローブP1は置換され、抗体Ab2と連結した機能的RNAポリメラーゼプロモーターを有する二本鎖分子を作製する(図5B)。RNAポリメラーゼは、この二本鎖プロモーター配列を使用して一本鎖RNAを産生する。一実施形態(図示せず)では、一本鎖オリゴヌクレオチドを、当技術分野で知られた任意の適切な方法で直接検出する。第2の実施形態では、一本鎖RNA分子は、伸長してDNA:RNAハイブリッドを生じる相補的プライマーとハイブリッド形成する(図5C)。これらのハイブリッドのRNA鎖をRNアーゼで分離することにより、RNAポリメラーゼプロモーターを含有するプライマーがハイブリッド形成できる一本鎖DNA分子を産生する(図5D)。ハイブリッド形成したプライマーおよびそれらの標的鎖の3’末端から伸長することにより、二本鎖RNAポリメラーゼプロモーター配列が生じ、指数関数的増幅となる。
【0054】
図6で説明した本発明の別の態様は、固体表面、ポリマー、ヒドロゲルまたはその他の表面であってもよい支持体に直接付着した捕捉オリゴヌクレオチドへのオリゴヌクレオチドハイブリッド形成によって、抗体、抗原または抗原−抗体複合体を固体表面に付着するための異なる方法を含む。本発明に適切な、粒子またはマイクロタイターウェル表面などの支持体は、当技術分野でよく知られている。オリゴヌクレオチドを種々の支持体に安定に複合体形成させる方法は、当技術分野でよく知られている。捕捉オリゴヌクレオチドは、ハイブリッド形成によってオリゴヌクレオチド部と相互作用することができ、あるいは近接構成要素の分析物結合性部に複合体形成している別のオリゴヌクレオチドと相互作用することができる。さらに、本発明は、捕捉した分子を表面から種々の化学的、物理的または酵素的手段で選択的に放出する方法を含む。
【0055】
図6Aで示した通り、抗体、抗原または抗体−抗原複合体Cは、P1にその5’末端を介して複合体形成してもよい。複合体形成したオリゴヌクレオチドは、制限酵素認識配列および任意選択のフランキング配列を含み、その5’末端で固体表面に付着している相補的オリゴヌクレオチドP2とハイブリッド形成する。固相からの複合体Cの放出は、P1とP2のハイブリッド形成で形成した二重鎖認識配列を開裂する制限酵素の特異的活性を介して生じる。図6のすべてのパネルのP1は近接構成要素の増幅可能なオリゴヌクレオチド部であってよく(図6N参照)、あるいは分析物特異的結合性部に複合体形成している別のオリゴヌクレオチドであってもよい。
【0056】
図6Bで示した通り、抗体、抗原または抗体−抗原複合体Cは、P1にその5’末端を介して複合体形成してもよい。複合体形成したオリゴヌクレオチドは、制限酵素認識配列および任意選択のフランキング配列を含み、その5’末端で固体表面に付いた相補的オリゴヌクレオチドP2とハイブリッド形成する。P2は、オリゴヌクレオチドP1の相補体および3’非相補的テールを含む。複合体Cの固相からの放出は、オリゴヌクレオチドP1とP2のハイブリッド形成で形成した二重鎖認識配列を開裂する制限酵素の特異的活性を介して生じる。開裂したP1オリゴヌクレオチドは、置換オリゴヌクレオチドDのハイブリッド形成を介して一本鎖にされる。
【0057】
図6Cで示した通り、抗体、抗原または抗体−抗原複合体Cは、P1にその3’末端を介して複合体形成してもよい。複合体形成したオリゴヌクレオチドは、制限酵素認識配列および任意選択のフランキング配列を含み、その3’末端で固体表面に付いた相補的オリゴヌクレオチドP2とハイブリッド形成する。複合体Cの固相からの放出は、P1とP2のハイブリッド形成で形成した二重鎖認識配列を開裂する制限酵素の特異的活性を介して生じる。
【0058】
図6Dで示した通り、抗体、抗原または抗体−抗原複合体Cは、P1にその5’末端を介して複合体形成している。複合体形成したオリゴヌクレオチドは、その5’末端で固体表面に付いたオリゴヌクレオチドP2の3’末端と相補的な配列を含む。P2は、制限酵素認識配列および任意選択のフランキング配列を含む。P1の3’末端からのDNAポリメラーゼ伸長により、P2の相補体が合成され、そして選択的に開裂して複合体Cを放出することができる二本鎖制限酵素認識配列が形成される。さらなる実施形態では、オリゴヌクレオチドP2の3’末端はキャップされて伸長を妨げる。
【0059】
図6Eで示した通り、抗体、抗原または抗体−抗原複合体Cは、オリゴヌクレオチドP1にその5’末端を介して複合体形成している。複合体形成したオリゴヌクレオチドは、制限酵素認識配列を、任意選択のフランキングDNA、およびその5’末端で固体表面に付いているオリゴヌクレオチドP2の3’末端と相補的な配列と共に含む。P2の3’末端からのDNAポリメラーゼ伸長により、オリゴヌクレオチドP1の相補体が合成され、そして選択的に開裂して複合体Cを放出することができる二本鎖制限酵素認識配列が形成される。さらなる実施形態では、オリゴヌクレオチドP1の3’末端はキャップされて伸長を妨げる。
【0060】
図6Fで示した通り、抗体、抗原または抗体−抗原複合体Cは、オリゴヌクレオチドP1にその5’末端を介して複合体形成している。複合体形成したオリゴヌクレオチドは、その5’末端で固体表面に付いている別のオリゴヌクレオチドP2と相補的な配列を含む。複合体Cの固相からの放出は、イオン強度の低下、キレート剤の添加、pHの変更または温度の上昇、あるいはこれらの因子の組合せなどの物理的な環境の変化によって生じる。適切な条件下では、複合体Cの物理的放出は可逆的である。
【0061】
図6Gで示した通り、抗体、抗原または抗体−抗原複合体Cは、オリゴヌクレオチドP1にその5’末端を介して複合体形成している。複合体形成したオリゴヌクレオチドは、その5’末端で固体表面に付いている別のオリゴヌクレオチドP2と相補的な配列を含む。P2の配列は、P1の少なくとも部分的な相補体と、物理的、化学的または光化学的手段で開裂して複合体Cを溶液中に放出することができる切れやすい連結とを含む。切れやすい連結の具体例は、これらだけに限定するものではないが、ジスルフィド結合(例えば、DTTにより開裂)およびcis−ヒドロキシル基(過ヨウ素酸塩により開裂)を含む。図6GGでは、抗体、抗原または抗体−抗原複合体を担持するプローブP1は、切れやすい連結、例えばジスルフィド、cis−グリコールなどを介して固体表面に付着している。この連結の物理的、酵素的、化学的または光化学的開裂を使用して、P1−担持複合体を表面から遊離させることができる。
【0062】
図6Hで示した通り、抗体、抗原または抗体−抗原複合体Cは、オリゴヌクレオチドP1にその5’末端を介して複合体形成している。複合体形成したオリゴヌクレオチドは、任意選択の5’配列および3’配列a’を含む。オリゴヌクレオチドP2は、その5’末端を介して固体支持体に付着されており、配列aおよび上流の配列bを含む。aとa’とのハイブリッド形成により、複合体Cは支持体に付着される。複合体Cの選択的放出は、配列a’およびb’を含む置換オリゴヌクレオチドDの添加によって達成される。P2の配列aおよびbへのDのハイブリッド形成は、配列aおよびa’のみのハイブリッド形成よりも熱力学的に好ましく、P1を置換させ、複合体Cを溶液中への放出させることとなる。第2の実施形態では、置換プローブはP1のすべてまたは一部と相補的であることができる。第3の実施形態では、抗体または抗体−抗原複合体は、表面に結合されたオリゴヌクレオチドおよびP1の両方に相補的な配列を含むスプリントオリゴヌクレオチドを介して間接的に表面に結合されたオリゴヌクレオチドP2と連結することができる(図示せず)。この後者の場合、置換は、オリゴヌクレオチドDのP1、P2のいずれか、またはスプリントオリゴヌクレオチドとのハイブリッド形成によって生じることができる。
【0063】
図6Iで示した通り、抗体、抗原または抗体−抗原複合体Cは、オリゴヌクレオチドP1にその5’末端を介して複合体形成している。複合体形成したオリゴヌクレオチドは、任意選択の3’配列a’を含む。オリゴヌクレオチドP2は、その5’末端を介して固体支持体に付着し、P2は、配列aおよび下流の配列bを含む。オリゴヌクレオチドP2の配列aとオリゴヌクレオチドP1の配列a’とのハイブリッド形成により、複合体Cは表面に付着する。複合体Cの選択的放出は、配列b’を含む置換オリゴヌクレオチドDのP2の配列bとのハイブリッド形成および鎖置換型DNAポリメラーゼを使用するオリゴヌクレオチドDのその3’末端からの伸長によって達成される。さらなる実施形態では、伸長反応に使用するポリメラーゼは、P1の配列a’を分解して、ハイブリッド形成したP2オリゴヌクレオチドを放出する5’−3’エキソヌクレアーゼ活性を有していてもよい。別の実施形態では、P2は3’ヘアピン構造を含み(図6M)、ヘアピンの3’末端からのポリメラーゼによる伸長により、P1が置換される。この実施形態では、置換オリゴヌクレオチドDは不要である。任意選択的に、スプリントオリゴヌクレオチドを図6Iおよび6Mで示した実施形態で使用してもよい。
【0064】
図6Jで示した通り、抗体、抗原または抗体−抗原複合体Cは、オリゴヌクレオチドP1にその3’末端を介して複合体形成している。複合体形成したオリゴヌクレオチドは、3’配列bおよび5’配列aを含む。オリゴヌクレオチドP2は、その3’末端を介して固体支持体に付着しており、配列a’および任意選択の下流の配列を含む。オリゴヌクレオチドP1のaとオリゴヌクレオチドP2のa’とのハイブリッド形成により、複合体Cは表面に付着する。複合体Cの選択的放出は、置換オリゴヌクレオチドDのP1の配列bとのハイブリッド形成および鎖置換型DNAポリメラーゼを使用する3’末端からの伸長によって達成される。さらなる実施形態では、伸長反応に使用するポリメラーゼは、P2の配列a’を分解して、ハイブリッド形成したP1オリゴヌクレオチドを放出する5’−3’エキソヌクレアーゼ活性を有していてもよい。
【0065】
図6Kで示した通り、抗体、抗原または抗体−抗原複合体Cは、オリゴヌクレオチドP1にその5’末端を介して複合体形成している。複合体形成したオリゴヌクレオチドは、任意選択の5’配列bおよび3’配列aを含む。オリゴヌクレオチドP2は、RNAでできており、その5’末端を介して固体支持体に付着しており、配列a’を含む。オリゴヌクレオチドP1の配列aとオリゴヌクレオチドP2の配列a’とのハイブリッド形成により、複合体Cは表面に付着する。複合体Cの放出は、DNA:RNAハイブリッドのRNA鎖を選択的に分解するRNアーゼHなどのRNアーゼの添加によって達成される。別の実施形態では、Ab1へのP1の複合体形成およびP2の固体支持体への付着は、各オリゴヌクレオチドの3’末端を介して生じる。
【0066】
図6Lで示した通り、抗体、抗原または抗体−抗原複合体Cは、オリゴヌクレオチドP1にその5’末端を介して複合体形成している。複合体形成したオリゴヌクレオチドは、RNAでできており、任意選択の5’配列bおよび3’配列aを含む。オリゴヌクレオチドP2は、その5’末端を介して固体支持体に付着ており、配列a’を含む。オリゴヌクレオチドP1の配列aとオリゴヌクレオチドP2の配列a’とのハイブリッド形成により、複合体Cは表面に付着する。複合体Cの放出は、DNA:RNAハイブリッドのRNA鎖を選択的に分解するRNアーゼHなどのRNアーゼの添加によって達成される。別の実施形態では、Ab1へのP1の複合体形成およびP2の固体支持体への付着は、各オリゴヌクレオチドの3’末端を介して生じる。
【0067】
図6Nで説明した実施形態では、固定化された近接構成要素は、制限エンドヌクレアーゼによる開裂によって放出される。Ab1は、配列(abc)を含むオリゴヌクレオチドP1に複合体形成している。抗体Ab2は、配列(a’b’c’d’e’)を含むオリゴヌクレオチドP2に複合体形成しており、ここで、領域dは制限エンドヌクレアーゼ認識部位に相当する。抗体Ab2はその特異的エピトープに結合しており、抗体−抗原複合体は、オリゴヌクレオチドP2の相補的捕捉オリゴヌクレオチドC(表面に付着している)とのハイブリッド形成によって固体支持体に捕捉されている。任意選択的に、支持体は洗浄され、結合していない抗原および試料のその他の成分を除去する。次いで抗体Ab1を加えると、その結果、それはエピトープ1を結合する。オリゴヌクレオチドP2と捕捉プローブCとの間の相補性の程度は、P2とオリゴヌクレオチドP1との間のものよりも大きく、したがって、P1と捕捉プローブCとの間のハイブリッド形成は、オリゴヌクレオチドP1とP2とのハイブリッド形成よりも熱力学的に好ましい。抗原−抗体複合体は、制限エンドヌクレアーゼ認識部位dが開裂すると放出される。抗体Ab2に付着したオリゴヌクレオチドP2の残りの断片は、配列(a’b’c’)を含み、抗体Ab1上のプローブP1と相補的である。(a’b’c’)のその相補体とのハイブリッド形成は、熱力学的に好ましく、伸長可能な3’末端を有するオリゴヌクレオチドハイブリッドを介する抗体Ab1とAb2とを連結させる。この複合体は、図1で示したような適切な増幅反応で使用することができる。
【0068】
図7Aは、オリゴヌクレオチド部の捕捉オリゴヌクレオチドとの相互作用を介する近接構成要素の固定化を示す。ここで、オリゴヌクレオチド部は、オリゴヌクレオチド部が捕捉オリゴヌクレオチドから放出された場合にアンプリコンを形成することが可能である。領域b、cおよびyを含む捕捉オリゴヌクレオチドは固体支持体にその5’末端で複合体形成されているように示されているが、その3’末端で付着していてもよい。領域bおよびcは、オリゴヌクレオチド部P1のそれぞれ領域b’およびc’とのハイブリッド形成により相互作用している。領域yは、図6A〜6Nで示したものを含む上記の方法のいずれかによって放出を促進する部位を表す。Ab2は、分析物Agに結合する前または後に固体支持体に固定化することができる。図7Bは、Ab2が分析物Agと結合する前にAb2が固定化されている実施形態を示す。一実施形態では、結合された近接構成要素−分析物複合体を増幅の前に洗浄して、結合していない分子を除去することによってバックグラウンドシグナルを減少させる。Ab2、Ab1および標的分析物間の完全な複合体を図7Cで示す。
【0069】
図7Dは、2つの近接構成要素間の非特異的相互作用によって生じる標的非依存性増幅の原因と考えられるものを説明する。非特異的相互作用のその他の原因も考えられるが、示した通り、Ab1とAb2との間でこの非特異的相互作用が起きる。Ab1とAb2との間の相互作用は、アンプリコンの形成に使用される、この場合それぞれ領域(de)および(d’e’)の相補的な領域を介して、P1とP2の相互作用を促進する。P1:P2の相互作用の形成は同様に、Ab1とAb2との間の継続した連関を促進することができ、したがって、P1:P2の相互作用の不安定化により、標的非依存性シグナルを全体的に低減し得る。これは、P1の領域(de)と相互作用するハイブリッド形成ブロッカーオリゴヌクレオチドを提供することにより、例えば、この領域とP2のその相補体(d’e’)との相互作用を防ぐことによって達成できる。
【0070】
増幅により分析物を検出する方法におけるハイブリッド形成ブロッカーオリゴヌクレオチドの使用を図7E〜7Hで説明する。反応混合物にAb1を加える前またはAb1を加えるのと同時にAb2は分析物のエピトープ2と結合し、Ab2は、捕捉オリゴヌクレオチドとの相互作用によって表面に固定化される。この実施形態の捕捉オリゴヌクレオチドは、P2の領域(b’c’)とハイブリッド形成する。任意選択的に、結合した複合体をAb2と分析物との間の複合体の形成前または後に洗浄して、結合していない分子を除去する。P1の領域(de)とハイブリッド形成している領域(d’e’)を含むハイブリッド形成ブロッカーオリゴヌクレオチドの存在下でAb1を加えて、上記の通りAb1とAb2との相互作用を抑制する。結合していないAb1は、Ab1が分析物のエピトープ1と複合体を形成した後に、反応容器から洗浄してもよい。図7E〜7Hで示した通り、ハイブリッド形成ブロッカーオリゴヌクレオチドは、標的特異的複合体の形成を妨害しない。捕捉オリゴヌクレオチドからのP2の放出により、P2の領域(d’e’)はP1の(de)の領域と相互作用して、増幅のための二本鎖開始部位を形成することができる。P2は、上記の任意の手段により、捕捉オリゴヌクレオチドから放出されてもよい。例えば、図7Iで示した通り、P2は緩衝液のイオン強度を変更することによって放出される(捕捉オリゴヌクレオチドからの物理的放出を示す図6F参照)。図7Iで示した通り、P2が放出されると、それはP1と自由に相互作用して、増幅することができる二本鎖配列を形成する。あるいは、図7Jで示した経路に従って、置換オリゴヌクレオチドを使用してP2を捕捉オリゴヌクレオチドから解離してもよい(図6Hも参照)。
【0071】
図7Iは、イオン強度の変更をどのように使用して選択的にP2を放出し、それに続くP1とP2の相互作用を促進するかを説明する。図7Iでは、Ab1−P1、Ab2−P2および標的分析物間の複合体の形成が、三元複合体の形成に最適なイオン強度を有し得る緩衝液で達成される。結合していないか非特異的に結合したAb1−P1は、非特異的相互作用は弱めるが、P2の配列(b’c’)と捕捉オリゴヌクレオチドとの間で形成した二重鎖ならびにAb1、Ab2および標的分析物間で形成した複合体は、維持する高イオン強度の緩衝液中で洗い流してもよい。緩衝液のイオン強度を低イオン強度に変更することは、P2と捕捉オリゴヌクレオチドとの間の二重鎖を溶かす効果がある。イオン強度を低下させることによる核酸二重鎖の不安定化の程度は、ヌクレオチドの任意の配列について、例えば非特許文献7に挙げられた方法を使用して計算することができる。複合体が捕捉オリゴヌクレオチドから解離した後にイオン強度を高イオン強度に戻すことにより、P1とP2はハイブリッド形成して増幅可能な配列を形成することができる。
【0072】
図8Aでは、抗体Ab1およびAb2は、隣接する抗原性エピトープを認識し、5’末端の連結を介してそれぞれオリゴヌクレオチドP1およびP2に複合体形成している。P1およびP2の3’末端は相補的であり、抗体Ab2は共有結合的または非共有結合的のいずれかで常磁性粒子にも連結する。抗体Ab1は、Ab2で被覆された常磁性粒子を加える前に、その特異的エピトープに結合させることができる。Ab2がAb1に隣接して結合することにより、オリゴヌクレオチドP1とP2の3’末端はハイブリッド形成することができる。P1とP2の抗原非依存性のハイブリッド形成を最小化させるように、Ab1およびAb2の溶液中の濃度は、抗原の表面に結合したものと比較して低い。抗体−抗原複合体を磁場を適用することによって捕捉し、結合していないAb1抗体を洗浄によって除去する。次いで、P1:P2ハイブリッドを、図1で示したものなどの適切な増幅反応に使用してもよい。
【0073】
図8Bでは、抗体Ab1およびAb2は、隣接する抗原性エピトープを認識し、5’末端の連結を介してそれぞれオリゴヌクレオチドP1およびP2に複合体形成している。P1とP2の3’末端は相補的であり、抗体Ab1は共有結合的または非共有結合的のいずれかで常磁性粒子にも連結する。抗体Ab1は、抗体Ab2を加える前に、その特異的エピトープに結合させることができる。Ab2がAb1に隣接して結合することにより、オリゴヌクレオチドP1とP2の3’末端はハイブリッド形成することができる。P1とP2の抗原非依存性のハイブリッド形成は最小化するように、Ab1およびAb2の溶液中の濃度は、抗原の表面に結合したものと比較して低い。抗体−抗原複合体を磁場を適用することによって捕捉し、結合していないAb2抗体を洗浄によって除去する。次いで、P1:P2ハイブリッドを増幅反応に使用してもよい。
【0074】
図8Cでは、抗体Ab1およびAb2は、隣接する抗原性エピトープを認識し、5’末端の連結を介してそれぞれオリゴヌクレオチドP1およびP2に複合体形成している。P1とP2の3’末端は相補的であり、抗体Ab1は共有結合的または非共有結合的のいずれかで常磁性粒子にも連結する。抗体Ab1およびAb2は、それらの特異的エピトープに同時に結合させることができる。Ab2がAb1に隣接して結合することにより、オリゴヌクレオチドP1とP2の3’末端はハイブリッド形成することができる。P1とP2の抗原非依存性のハイブリッド形成は最小化するように、Ab1およびAb2の溶液中の濃度は、抗原の表面に結合したものと比較して低い。抗体−抗原複合体を磁場を適用することによって捕捉し、結合していないAb2抗体を洗浄によって除去する。次いで、P1:P2ハイブリッドを増幅反応で使用してもよい。
【0075】
図8Dでは、プローブP2を担持する抗体Ab2は、表面、例えばビーズまたはマイクロウェルの壁に、切れやすい連結を介して付着しているか、付着できる(図6GG参照)。P1を担持する抗体Ab1は、標的抗原のエピトープ1に結合しており、この複合体は、表面に連結したAb1とエピトープ2を結合することにより固定化されている。結合していないAb1は洗い流し、次いで切れやすい連結を開裂し、三元複合体は表面から遊離される。次いで、分離された三元複合体を含有する溶液相を増幅用の第2の反応ウェルに移し、最初の表面に非特異的に結合したAb1を残す。
【0076】
本発明の別の態様を図9で説明する。抗体Ab1およびAb2は、隣接する抗原性エピトープを認識する。オリゴヌクレオチドP1は、その3’末端で抗体Ab1に複合体形成している。オリゴヌクレオチドP2は、その5’末端で抗体Ab2に複合体形成している。抗体Ab1は共有結合的または非共有結合的のいずれかで常磁性粒子と連結している。この2つの抗体を抗原と混合し、それらの各エピトープに結合させる。得られる抗体−抗原複合体を磁場を適用することによって捕捉し、結合していないAb2抗体および試料マトリックスのその他の成分を洗浄によって除去する。次いで、プローブP1の5’末端およびプローブP2の3’末端と相補的なスプリントオリゴヌクレオチドSを加える。スプリントオリゴヌクレオチドSとプローブP1の5’末端およびプローブ2の3’末端との間のハイブリッド形成により、2つの抗体間のギャップが架橋される。次いで、P1:L:P2ハイブリッドを図3で示したように増幅反応で使用してもよい。図3で示したその他のリンカー構造も使用してよい。さらに、Ab1は、図6A〜6Lで記載の通りの開裂可能な連結を介して常磁性またはその他の粒子に付着してもよい。
【0077】
本発明のさらに別の態様を図10に挙げる。標識していないAb1およびAb2は、標的抗原の近接エピトープに結合している。第2の抗体Sec1およびSec2、例えば抗Fc1および抗Fc2をそれぞれ、互いに相補的な3’末端を含むオリゴヌクレオチドプローブP1およびP2で標識する。次いで、第2の抗体は標識していない最初の抗体Ab1およびAb2と結合し、オリゴヌクレオチドプローブを近くに近接させて、3’末端のハイブリッド形成および伸長によりプローブを増幅可能な鎖に変換する。任意選択的に、Ab1およびAb2はハプテン部(例えば、ビオチン、フルオレセイン、ジゴキシゲニン、トリニトロフェノール、ジニトロフェノールなど)で標識されていてもよい。この場合、プローブで標識した第2の抗体Sec1およびSec2は、Ab1およびAb2の各ハプテン標識に対して結合特異性を有する。
【0078】
さらなる実施形態では、第2の抗体は、連結スプリントオリゴヌクレオチドと互いに塩基対形成した場合に連結できるプローブで標識されている(図2)。第2の抗体の対が、近接エピトープに結合している標識していない抗体の対に結合している場合、プローブは連結スプリントオリゴヌクレオチドと互いに塩基対形成し、連結が生じる。
【0079】
第3の実施形態では、標識した第2の抗体は、抗原とインキュベーションする前またはインキュベーションしている間に最初の抗体と結合する(または結合することができる)。第4の実施形態では、第2の抗体の少なくとも1つは固体表面、例えばマイクロウェル壁または電磁ビーズに連結している。第5の実施形態では、第2の抗体は固体表面に可逆的に連結している(図6A〜6L、7A〜7D、および8A〜8D)。第6の実施形態では、表面に連結された抗体が固体表面から放出され、放出された抗体が増幅反応にかけられる。第7の実施形態では、Ab1および/またはAb2は、アプタマー、受容体またはその他のエピトープ結合単位であってもよく、Sec1およびSec2はAb1およびAb2に結合しているプローブで標識された認識分子である。第8の実施形態では、Sec1および/またはSec2は、Fab’断片、アプタマー、抗体に対する抗体、またはAb1もしくはAb2を特異的に認識する任意の分子であってもよい。
【0080】
プロテインGまたはプロテインAを、図10で説明した通り、任意選択的にSec1およびSec2の代わりにすることができる。プロテインGおよびプロテインAは、1つのプロテインGまたはプロテインAがIgG分子ごとに結合して、ほとんどのIgG分子およびFc領域に結合する。特に、プロテインGまたはプロテインAは、「一般的なオリゴヌクレオチド」プローブで修飾されることができる(図10の標識されたP1およびP2)。例えば、修飾されたプロテインG分子は、エピトープ1およびエピトープ2を認識する抗体に先に結合していることができる。この場合、P1で修飾されたプロテインGまたはプロテインAはAb1に先に結合しているであろう。同様に、P2で修飾されたプロテインGまたはプロテインAは、Ab2に先に結合しているであろう。あるいは、プローブで修飾されたプロテインGまたはプロテインA分子は、一緒に混合して、図10で示した通りに使用することができる。
【0081】
このアプローチには確かな利点がある。第1に、修飾する必要があるのは、ただ1つの試薬、すなわちプロテインGまたはプロテインAである。第2に、ほとんどの任意の一次検出抗体を、例えばラット、マウスまたはウサギ抗体に対する抗原に結合するのに使用することができる。第3に、主要な抗体に先に結合する修飾されたプロテインGまたはプロテインAは、特に、任意のAb1またはAb2での一般的な使用で使用可能な印の付いた試薬である。得られるアッセイ成分の標準化は、定量および再現性を向上させると期待される。
【0082】
ある場合には、プロテインAまたはプロテインGの代わりにプロテインA/プロテインGの融合産物を使用することが有利である。また、「プロテインA」または「プロテインG」は、天然の細菌産物、または例えばプロテインGのアルブミン結合能力を排除することによってIgG分子に最適に結合するように設計された遺伝子操作されたバージョンもしくは組換えバージョンを指すことができることも理解されよう。
【0083】
本発明の別の態様を図11A〜Cで示す。ここでは、本発明は、ヘアピン構造を取り入れることにより非特異的プライマー−プライマー相互作用に関与できないようにされた免疫増幅反応で使用するための、オリゴヌクレオチドで標識された抗体を含む。抗体Ab1は、SDA制限酵素ニック形成部位および下流の配列(aba’c)を含むオリゴヌクレオチドP1に複合体形成しており、ここで、aとa’はハイブリッド形成してヘアピン構造を形成する相補配列である。ヘアピンのTmは十分に低いので、オリゴヌクレオチド標識の一部は、増幅反応の条件下で、開いて弛緩した形態で存在する。核酸二重鎖のTmは、温度とイオン強度の所与の組合せの下で、例えば非特許文献7で記載の方法の1つを使用して、ヌクレオチドの任意の配列に関して当技術分野でよく知られた方法で計算されることができる。3’末端配列cは、ヘアピン構造の一部を形成せず、DNAポリメラーゼ伸長の自己プライミングを妨げるように設計されている。抗体Ab2は、SDA制限酵素ニック形成部位および下流の配列(ab’)を含むオリゴヌクレオチドP2に複合体形成している。抗体Ab1およびAb2がそれらの各エピトープに結合する場合、プローブP1のヘアピンの揺らぎ(breathing)によって、2つのオリゴヌクレオチド標識間で塩基対形成が生じる。配列(ba’)と(ab’)の対形成で形成したP1:P2ハイブリッドのTmは、P1ヘアピンのものよりも大きい。したがって、P1とP2とのハイブリッド形成は熱力学的に好ましい。次いで、DNAポリメラーゼはP2の3’末端を伸長して、ニック形成可能な二本鎖制限部位を生じる。ニック形成、伸長および鎖置換により、ニック形成可能な制限部位をいずれかの末端に有する二本鎖DNA分子が形成される。この構造物は、指数関数的SDA反応で使用してもよい。
【0084】
別の実施形態では、抗体Ab1は、SDA制限酵素ニック形成部位および下流の配列(b’aba’c)を含むオリゴヌクレオチドP1に複合体形成していてもよく、ここで、aとa’はハイブリッド形成してヘアピン構造を形成する相補配列である。配列bとb’も相補的だが、aとa’のハイブリッド形成で形成したものよりも不安定な構造を形成する。したがって、a:a’ヘアピンの形成が好ましい。3’末端配列cはヘアピン構造の一部を形成せず、DNAポリメラーゼ伸長の自己プライミングを妨げるように設計されている。抗体Ab2は、配列(b’a’b)を含むオリゴヌクレオチドP2に複合体形成しており、ここで、bとb’は相補的で、且つヘアピン構造を形成する。プローブP2はSDAニック形成部位を欠く。したがって、DNAポリメラーゼ伸長が3’末端から生じると、線形増幅をすることができないデッドエンド産物が生じる。a:a’およびb:b’ヘアピンのTmは十分に低いので、各オリゴヌクレオチドの一部は、反応の条件下で、開いて弛緩した形態で存在する。抗体Ab1およびAb2がそれらの各エピトープに結合する場合、プローブP1およびP2のヘアピンの揺らぎによって、2つのオリゴヌクレオチド標識間で塩基対形成が生じる。配列(b’ab)と(ba’b’)との対形成で形成したP1:P2ハイブリッドのTmは、いずれのヘアピン構造のものよりも大きい。したがって、P1とP2のハイブリッド形成は熱力学的に好ましい。次いで、DNAポリメラーゼはP2の3’末端を伸長して、ニック形成可能な二本鎖制限部位を生じる。ニック形成、伸長および鎖置換により、指数関数的SDA反応で用いることができる二本鎖DNA分子が形成される。
【0085】
さらなる実施形態を図11Cで示す。プローブP1は、ヘアピン配列b、d、b’、ヘアピン配列の5’である配列a、およびヘアピン配列の3’であり、伸長不可能な3’キャップを任意選択的に含有する配列cを含む。配列bとb’は相補的であり、ハイブリッド形成してヘアピン構造のステムを形成する。配列dはヘアピンのループを形成する。任意選択的に、配列dの一部はそれ自体と塩基対形成して、bおよびb’と共にステム構造の一部を形成してもよい。プローブP2は、P1の配列dと相補的な配列d’を含む。ヘアピン構造の存在により、dとd’とのハイブリッド形成が妨げられる。置換オリゴヌクレオチドDを加えると、最初にP1の配列aとハイブリッド形成し、次いでステムのb’アームを置換することによってヘアピンを開く。次いで、P2の配列d’はP1の折り畳まれていない配列dとハイブリッド形成し、P2はポリメラーゼで伸長されて、オリゴヌクレオチドDを置換し、ニック形成可能な二本鎖制限部位をP1上に作製する。次いで、増幅は、図11Bで示した実施形態と類似の方法に従う。
【0086】
図12は、試験試料中の抗原特異的免疫グロブリン抗体の存在を検出する方法を示す。プローブP1およびP2は、各Ag分子がP1またはP2のいずれか(ただし、両方ではない)によって標識されるように、抗原分子Agに複合体形成している。標識された抗原は、試験試料と混合され、示したようにAg特異的免疫グロブリンに結合する。P1とP2の両方を含有する複合体は、増幅可能であり、検出可能であり、Ag特異的免疫グロブリンの存在を示す。Ag特異的免疫グロブリンの不在下では、検出可能な複合体は形成しない。同様のアプローチを使用して、2つ以上の同一のリガンド結合性部位または2つ以上の異なるリガンドの結合性部位のいずれかを含む任意のリガンド−受容体の相互作用を検出することができる。後者の場合、各リガンドは異なるプローブ配列で標識されている。例えば、IgGのFc領域に結合するプロテインGはP1で標識してもよく、AgはP2で標識してもよい。標識したAgおよびプロテインGを同じIgG分子に結合することにより、本発明の方法により増幅可能で、且つ検出可能な複合体が生じるであろう。
【0087】
図13は、二元免疫SDAで有用な、代表的なプローブ、プライマー、アダプター、レポーターおよびテザーオリゴヌクレオチドを示す。これらのオリゴヌクレオチドの構造およびそれらの使用は、以下の実施例で挙げる。以下の実施例には、一切、本発明の範囲を限定する意図はない。
【実施例1】
【0088】
(二元免疫SDAに有用なプローブ、プライマー、アダプター、レポーターの代表的な配列)
以下に示したプローブ、プライマー、アダプターおよびレポーターのいくつかの配列は、図13で挙げられている。
【0089】
(プローブ(P1、P2))
RHP−1(右側のプローブ;太字の配列は下記のプライマーSRH−1と共通である):
【0090】

【0091】
RHP−3(右側のプローブ;太字の配列は下記のプライマーSRH−1と共通である):
【0092】

【0093】
RBD−3v3(右側のプローブ;X=ビオチン標識dT;太字の配列は下記のプライマーSRH−1と共通である):
【0094】

【0095】
LHP−1(左側のプローブ;下線の塩基はRHP−1の3’末端と相補的である):
5’ ATT CAC GCT TCC ATT CCA TGT CTC GGG TTT ACT TCA TCT GCA ACT GTA C
【0096】
LHP−2(左側のプローブ;下線の塩基はRHP−1の3’末端と相補的である):
5’ ATT CAC GCT TCC ATT CCA TGT CTC GGG TTT ACT TCA TCT GCA ACT GTA CAT
【0097】
LHP−3(左側のプローブ;下線の塩基はRHP−1の3’末端と相補的である):
5’ ATT CAC GCT TCC ATT CCA TGT CTC GGG TTT ACT TCA TCT GCA ACT GTA CAT CTG T
【0098】
LHP−4(左側のプローブ;下線の塩基はRHP−1の3’末端と相補的である):
5’ ATT CAC GCT TCC ATT CCA TGT CTC GGG TTT ACT TCA TCT GCA ACT GTA CAT CTG TCT
【0099】
LHP−5(左側のプローブ;下線の塩基はRHP−1の3’末端と相補的である):
5’ ATT CAC GCT TCC ATT CCA TGT CTC GGG TTT ACT TCA TCT GCA ACT GTA CAT CT
【0100】
(プライマー)
SRH−1(右側のプライマー;太字の配列はRHP−1と共通である):
【0101】

【0102】
SLH−2(左側のプライマー;太字の配列はLHP−1、2、3、4および5と共通であり;下線の塩基はRHP−1の3’末端と相補的である):
【0103】

【0104】
(アダプター)
ADR−2(下線の塩基はTBD10.2[D/R]の3’末端と同一である):
5’ ACG TTA GCC ACC ATA CGG ATA GTG ACG TGA TGA GCT AGA C
【0105】
ADR−5(下線の塩基はTBD10.2[D/R]の3’末端と同一である):
5’ ACG TTA GCC ACC ATA CGG ATG ATG AGC TAG AC
【0106】
ADR−8(下線の塩基はTBD10.2[D/R]の3’末端と同一である):
5’ ACG TTA GCC ACC ATA CGG ATG TGA CGT GAT GAG C
【0107】
ADIQS−1(IQSアダプター):
5’ ACG TTA GCC ACC ATA CGG ATG ATG AGC ATC TG
【0108】
ADQS−2(IQS−2のアダプター;下線の塩基はaltD6.9(F/D)の3’末端と同一である):
5’ AGC TAT CCG CCA TAA GCC AT AC TCA
GAG TGA TCA AGT
【0109】
(レポーター)
TBD10.2(D/R)(下線の塩基はADR−2およびADR−5の5’末端と同一である):
5’(dabcyl)−TAG CGC CCG AGC GCT ACG TT(rox)A GCC ACC ATA CGG AT
【0110】
altD6.9(F/D):
5’(fam)−AGT TGC CCC GAG GCA ACT(dabcyl)AGC TAT CCG CCA TAA GCC AT
【0111】
(テザーオリゴヌクレオチド)
RCP−1(テザーオリゴヌクレオチド;大文字の塩基はRHP−1の5’末端と相補的である):
5’ CCG AGA ACA GAC AAG ACA AGA CTG Gat at
【0112】
LCP−2(テザーオリゴヌクレオチド;大文字の塩基はLHP1−5の5’末端と相補的である):
5’ CGA GAC ATG GAA TGG AAG CGT GAA Ttt tt
【0113】
LCP−4(テザーオリゴヌクレオチド;大文字の塩基はLHP1−5の5’末端と相補的である):
5’t tta ttt tat CGA GAC ATG GAA TGG AAG CGT GAA T
【0114】
(捕捉および置換オリゴ)
RCP−13v1(捕捉オリゴヌクレオチド;大文字の塩基はRHP−3の5’末端近くの配列と相補的であり;下線の塩基はDO−13v1と相補的であり;X=テトラ−エチレングリコール;Z=ヘキサ−エチレングリコール;XはZにリン酸ジエステル部を介して連結しており;Zはオリゴヌクレオチドの5’末端にリン酸ジエステル部を介して連結している):
【0115】
5’ビオチン−X−Z−cct ggt acg agt ttc tat cct AA TGC ATC aCG AGA ACA GAC AAG ACA AG t
【0116】
DO−13v1(置換オリゴヌクレオチド[キャップ]=3’デオキシルイジン):
5’ CTT GTC TTG TCT GTT CTC GTG ATG CAT TAG GAT AGA AAC TCG TAC CAG G−[キャップ]3’
【0117】
RCP−9v2.2(捕捉オリゴヌクレオチド;大文字の塩基はRHP−3の5’末端近くの塩基と相補的であり;下線の塩基は置換オリゴCMPR−9v2と相補的であり;X=テトラ−エチレングリコール;Z=ヘキサ−エチレングリコール;XはZにリン酸ジエステル部を介して連結しており;Zはオリゴヌクレオチドの5’末端にリン酸ジエステル部を介して連結している):
5’ビオチン−X−Z−t tta CAC TGA ATG CAT tCC
tAG AAC AGA CAA GAC AAG ACT ccg tgg cAg
cgt
【0118】
CMPR−9v2(捕捉オリゴヌクレオチド;大文字の塩基はRHP−3の5’末端と相補的であり;[キャップ]=3’デオキシウリジン):
5’ ACG CTG CCA CGG AGT CTT GTC TTG TCT GTT CTt GGA ATG CAT TCA GT−[キャップ]3’
(ブロッキングオリゴヌクレオチド([キャップ]=2’,3’ジデオキシシチジン))
【0119】
LBK−1(大文字の塩基はLHP−3の3’末端と相補的である):
5’ ACA GAT GTA CAG Taa ttt−[キャップ]3’
【0120】
RDB−3p5(大文字の塩基はRHP−1の3’末端と相補的であり;下線の塩基はRHP−3の3’末端と相補的である):
5’ cag ttc agc acA CTG TAC ATC TGT CTA GC aa−[キャップ]3’
【0121】
RDB−3p8(大文字の塩基はRHP−1の3’末端と相補的であり;下線の塩基はRHP−3の3’末端と相補的である):
5’ cag ttc agc acA CTG TAC ATC TGT CTA GCT CA aa−[キャップ]3’
【0122】
RDB−3p10(大文字の塩基はRHP−1の3’末端と相補的であり;下線の塩基はRHP−3の3’末端と相補的である):
5’ cag ttc agc acA CTG TAC ATC TG T CTA GCT CAT Cta−[キャップ]3’
【0123】
RDB−3z8(大文字の塩基はRHP−3の3’末端と相補的である):
5’ cag ttc agc ac aa GTA CAT CTG TCT
AGC TCA aac−[キャップ]3’
【0124】
RDB−3z0(大文字の塩基はRHP−3の3’末端と相補的である):
5’ cag ttc agc ac aa GTA CAT CTG T aac−[キャップ]3’
【0125】
(定量化標準および品質管理(「QC」)ヌクレオチド)
LTAR−1(Epoch Biosciences(ワシントン州Bothell)製のQCオリゴヌクレオチド;下線の塩基はIQS−1とは異なる):
5’ TTT TAC TTC ATC TGC AAC TGT ACA TCT GTC TAG CTC ATC ACG TCA CTG AAT GCA T
【0126】
IQS−1(定量化内部標準;下線の塩基はLTAR−1とは異なる):
5’ TT TAC TTC ATC TGC AAC ACA TGA TCT
CAG ATG CTC ATC ACG TCA CTG AAT GCA TC
【0127】
IQS−2(定量化内部標準;下記の場合の塩基は標的誘導アンプリコンとは異なる):
5’ TTA CTT CAT CTG CAA C at ctg tca ctt gat cac tct ga G TCA CTG AAT GCA TC
【実施例2】
【0128】
(均一な免疫SDAの実験的証明)
以下の一連の実験では、近接構成要素の分析物特異的結合性部はビオチン部であり、選択した試験分析物はストレプトアビジン(「SA」)であった。ビオチンは、オリゴヌクレオチド部P1(RHP−1)およびP2(LHP−1またはLHP−3)の5’末端に連結させた。(実施例1参照、上記)。P1およびP2はそれぞれ濃度1μMであり、10mMのTris−EDTA緩衝液およびウシ血清アルブミン(BSA)および任意選択的に0.25μMのSAと混合した。室温で10分後、最終的なプローブ濃度がpMの範囲になるように混合物を連続的に希釈した。次いで、希釈した混合物をSDAプライマー(SRH1、SLH2)、アダプター(ADR−5)およびレポータープローブ(TBD10.2)と混合し、混合物を72℃に10分間加熱した。試料を52℃に冷却し、dNTPを含むSDA成分の乾燥カクテルを含有する「増幅ウェル」に加えた。最終的なプローブ濃度は1fMまたは10fMのいずれかであり、最終的なSA濃度はゼロまたは各プローブ濃度の2分の1であった。次いで、BsoBI制限エンドヌクレアーゼおよびBstDNAポリメラーゼ(BD Diagnostic Systems、メリーランド州Baltimore)を混合物に加え、等温増幅を52℃で1時間実施した。特許文献17で記載の通りに、フルオレセイン標識レポータープローブ、TBD10.2の変換に伴う蛍光の増加を観察することによって増幅を監視した。
【0129】
MOTA値(1時間の反応の過程にわたって統合した蛍光強度の測定値)を表1で報告する。P2が、P1(RHP−1)とハイブリッド形成した場合に13塩基対の二重鎖を形成するLHP−3である場合、分析物SAを含有する試料では、SAを含有しなかった対照よりもMOTA値が100〜1000倍高く、fM未満の濃度でSAタンパク質を検出するこのSDAに基づく二元プローブシステムの能力を証明している。
【0130】
【表1】

【実施例3】
【0131】
(不均一な免疫SDAの実験的証明)
この実験では、5’ビオチンを担持するか、またはビオチンを担持せず5’アミノリンカーを担持するかの、いずれかのRHP−1はP1として働き、5’ビオチンを担持するか、またはビオチンを担持せず5’アミノリンカーを担持するかの、いずれかのLHP−1はP2として働いた。100nMのプローブをSAで被覆したビーズ(Promega、ウィスコンシン州Madison)と混合し、時々撹拌しながら室温で45分間インキュベートした。次いで、ビーズを管の脇に集め、溶液を除去した。ビーズを0.1mg/mLのBSAに再懸濁し、それらを管の脇に集め、溶液相を廃棄した。これらの洗浄ステップを4回繰り返し、最後にビーズをSDA反応緩衝液に再懸濁した。得られる懸濁液を、SDAプライマー(SLH−2、SRH−1)、アダプター(ADR−5)およびレポーター(TBD.10.2)を含有する混合物に加えた。これらの混合物中のビーズに結合したSAの最終濃度は40または400fMであった。次いで、上記の実施例2の記載の通りにSDAを実施した。
【0132】
結果を表2に示す。期待した通り、ビオチン化プローブおよびSAを40または400fMのいずれかで含有する反応において、強いMOTA値が観察され、SAに結合したプローブが増幅可能な伸長産物に変換したことを示した。対照的に、SAと、ビオチンの代わりに5’アミノ連結基で標識したプローブとを含有する対照反応では、MOTA値は非常に低かった。これらの対照反応について期待した通り、ビオチンを欠くプローブはビーズに連結したSAに結合することはできず、その結果、洗浄ステップ中に排除され、したがって増幅可能な伸長産物には変換されなかった。対照反応に現れた低いシグナルは、アミノに連結したプローブのビーズ表面への非特異的結合の結果の可能性がある。
【0133】
【表2】

【実施例4】
【0134】
(単一のテザーオリゴヌクレオチドによる免疫SDAの実験的証明)
この実験では、非ビオチン化RHP−1(上記参照)はP1として、LHP−3(5’ビオチンを担持している)はP2として、RCP−1(3’ビオチンを担持している)はテザーオリゴ、TOとして働いた。プローブP1およびP2ならびにテザーオリゴTOを等モル比で混合し、SAを含有しているか欠いているかのいずれかの管に加えた。この管を短時間室温でインキュベートし、次いで管の内容物を連続的に希釈して、プローブの濃度をpM範囲にした。次いで、希釈した混合物を、SDAプライマー(SRH1、SLH2)、アダプター(ADR−5)およびレポータープローブ(TBB10.2)と混合して、SAの最終濃度を0または0.25fMのいずれかに、P1、P2およびTOのそれぞれの濃度を1fMとした。次いで、混合物を「熱スパイク」(72℃で10分間)にかけるか、52℃で10分間インキュベートした(「熱スパイクなし」)。推定Tm64℃を有するP1:TO二重鎖は52℃では安定で、72℃のインキュベーションで分裂すると予想される。分裂すると、P1:TO二重鎖は、極めて非常にゆっくりと(t1/2>100時間)、希釈した(1fM)プローブ濃度で再形成することとなる。BsoBI制限エンドヌクレアーゼ、BstDNAポリメラーゼおよびdNTPの乾燥カクテルを加えることによって試料をSDAにかけ、次いで52℃においてProbeTec(商標)ET装置でインキュベートした。プローブP1およびP2がそれぞれTOまたはビオチンを介して共通のSA分子に結合すると、それらの相補的な3’末端はハイブリッド形成し伸長して、SDAプライマー(SLH−2およびSRH−1)およびアダプターADR−5のためのハイブリッド形成部位を作製する。これにより、伸長したP1およびP2分子の同時の増幅および検出が可能になる。フルオレセイン標識レポータープローブ、TBD10.2の変換に伴うアダプターが介在する蛍光の増加を観察することによって増幅を観測した(アダプター介在型レポータープローブ変換の詳細については特許文献17参照)。
【0135】
結果を表3に示す。分析物0.25fMのSAおよび1fMのプローブを含む「熱スパイクなし」試料は、蛍光の強い増加(平均MOTA=166000)を示したが、SAを欠くが1fMのプローブを含有する対照試料は、ちょうど3000の平均MOTA値を示した。これはP1:TO二重鎖がSDAの前に72℃の熱スパイクで分裂された試料から得られた値と同程度である。SAを欠く試料では、MOTA値は低いままであり、これはP1−P2二重鎖の形成が1fMのプローブ濃度では測定可能な効率で生じないからである。
【0136】
【表3】

【実施例5】
【0137】
(二元免疫SDAによる分析物定量)
試料中の標的分析物のレベルは、標的介在型プローブ伸長産物と共増幅された内部標準(例えば、実施例1のIQS−1)を入れることによって定量的に測定してもよい。内部標準および標的依存性プローブ伸長産物は、SDAプライマーの共通の対によって増幅されるが、それぞれの識別可能に標識されたレポータープローブ(例えば、実施例1のTBD10.2およびAltD6.9)により検出される。2つのレポータープローブの相対的なシグナルを比較することにより、内部標準の既知の量と相対的なプローブ特異的伸長産物の濃度を推定することができる。分析物の絶対濃度の測定では、バックグラウンド修正済み標的/対照シグナル対標的分析物シグナルの比の「標準曲線」を作製することが有利な場合がある。次いで、試験試料について観察したシグナル比を標準曲線と比較して、絶対分析物濃度を作製する。核酸標的レベルを定量する同様の方法が当技術分野で知られている(例えば、非特許文献8参照)。
【実施例6】
【0138】
(2つのテザーオリゴヌクレオチドを用いる免疫SDAの実験的証明)
この実験では、非ビオチン化RHP−1(上記参照)はP1として、非ビオチン化LHP−3はP2として、一方、RCP−1(3’ビオチンを担持している)およびLCP−4(5’ビオチンを担持している)はテザーオリゴヌクレオチドとして働いた。P1、P2およびテザーオリゴヌクレオチド間の相互作用を図3Hに図示する。プローブP1およびP2ならびにテザーオリゴヌクレオチドを等モル比(ここで、モル濃度は近接構成要素のテザーオリゴヌクレオチド部のみに関して測定された)で混合し、SAを含有しているか又は欠いているかのいずれかの管に加えた。72℃の「熱スパイク」実験を実施しなかった以外は、実施例4で記載の通りに反応を実施した。結果を表4に示す。SAを含有する試料は、強い蛍光の増加(平均MOTA値=136000)を示したが、SAを欠く試料は、ごくわずかな増加を示した(MOTA=533)。
【0139】
【表4】

【実施例7】
【0140】
(分析物としてIL−8を用いる均一な免疫SDAの実験的証明)
ヒトIL−8を対象としたMAb G265−8(Ab1;BD Bioscience Pharmingen)をSAと共有結合させて、IgG当たり1つのSA1を含有する抗−IL−8 IgG−SA複合体(Ab1−SA)を得た。MAb G265−8とSAは当技術分野でよく知られた方法を使用して複合体形成させた。20nMの5’ビオチン標識プローブRHP−3(P1)、10nMのAb1−SA複合体、10nMのTris−EDTA緩衝液および0.1mg/mlのBSAを含有する混合物を調製し、一夜4℃でインキュベートしてビオチン化オリゴヌクレオチドをAb1−SA複合体に結合させて、Ab1−SA−P1を形成した。
【0141】
MAb G265−8のものとは異なるIL−8エピトープに結合するMAb G265−5(Ab2;BD Bioscience Pharmingen)を、プローブLHP−3(P2)のアミノ修飾された形態と直接、共有結合的にカップリングさせて、Ab2を1個当たり平均して2.5個のP2部を有するAb2−P2複合体を産生した。LHP−3は5’末端に連結した第1脂肪族アミン基を含んでおり、MAb G265−5とLHP−3は本質的に特許文献12で記載の通りに複合体形成させた。
【0142】
それぞれ1nMのAb−プローブ複合体濃度を有するAb1−SA−P1およびAb2−P2を、10mMのTris−EDTA緩衝液およびBSAおよび任意選択的に0.01〜1nMのIL−8と混合した。室温で30分後、Ab−プローブ複合体の最終濃度がfMの範囲になるように、混合物を連続的に希釈した。次いで、希釈した混合物をSDAプライマーSRH−1およびSLH−2、アダプターADR−5、ならびにレポータープローブTBD10.2と混合した。混合物を37℃に10分間加温した後、各試料の一部を増幅ウェルに52℃で実施例2に記載の通りに加えた。ここで、各増幅反応はBsoBI制限酵素およびBst DNA ポリメラーゼを含有していた。Ab−プローブ複合体の最終濃度は1fMであり、IL−8の最終濃度は0、0.01、0.1または1fMであった。その他の成分の濃度は実施例2で記載の通りであった。試料を直ちにProbeTec(商標)ET装置に移し、そこで等温増幅を52℃で1時間実施した。実施例2で記載の通りに蛍光の増加を観察することによって増幅を観測した。
【0143】
平均MOTA値を表5に報告する。IL−8を欠く試料では低いMOTA値が得られたが、一方、より高いレベルのIL−8によりMOTA値は増加され、均一な免疫SDA法によるIL−8の検出を立証した。この実験では、ハイブリッド形成ブロッカーオリゴヌクレオチドは用いなかったが、近接対−IL−8複合体の形成後に試料を約100万倍に希釈して、標的非依存性プローブの増幅の発生を低減させた。
【0144】
【表5】

【実施例8】
【0145】
(ハイブリッド形成ブロッカーオリゴヌクレオチドの使用によるバックグラウンド抑制の実験的証明)
この実験は、標的分析物を伴わないP1とP2分子との塩基対形成から生じる標的非依存性増幅を抑制するためのハイブリッド形成ブロッカーオリゴヌクレオチドの使用を説明する。この実験では、プローブP1は5’ビオチン化RHP−3であり、プローブP2は5’ビオチン化LHP−3である(上記参照)。P1およびP2の3’末端を含む10ヌクレオチド配列は、互いに相補的である。実施例2と同様に、標的分析物はSAであり、これは、その四量体に4つのビオチン結合性部位を含有する。ハイブリッド形成ブロッカーオリゴヌクレオチドは、RHP−3の3’末端と相補的な18ヌクレオチド配列を含むRDB−3p8(実施例1)である。したがって、P1とハイブリッド形成ブロッカーRDB−3p8との間に形成された二重鎖は、P2と相補的なP1の3’末端での10ヌクレオチド、ならびにP2と相補的ではないP1のさらなる8ヌクレオチドを含む。さらに、RDB−3p8は、14ヌクレオチドの5’テール配列を含み(実施例1のRDP−3p8の下線の塩基の塩基5’)、これは、その上でRHP−3の3’末端が伸長することができる無能力化鋳型として働く(図4Cで示した)。本発明のハイブリッド形成ブロッカーの特徴は、近接構成要素のオリゴヌクレオチド部に共有結合的に付着しない、または連結しないということである。オリゴヌクレオチド部の3’末端の伸長に依拠して分析物特異的アンプリコンを産生する本発明の方法では、ハイブリッド形成ブロッカー−プローブ二本鎖が、3’末端の伸長を必要とし、二重鎖が不安定化する高温で一般に生じるポリメラーゼ触媒増幅方法(例えば、SDAおよびPCR)中で安定性を維持する必要がある。一般に、ポリメラーゼベースの増幅方法(例えば、PCRおよびSDA)で使用する高温は、プローブ−ブロッカーハイブリッドの拡がりを、誤ったプローブ変換の抑制の効力がなくなる点まで減少させることができる。本発明では、プローブ間で形成するハイブリッドよりも安定なプローブ−ブロッカーハイブリッドを形成することが可能なハイブリッド形成ブロッカーを選択することにより、かつ高温でプローブ−ブロッカー鋳型を安定化する無能力化鋳型を使用することにより、この困難を克服している。
【0146】
免疫SDAによるSA含有溶液の分析は、以下の通りに実施した。それぞれ20pMの5’ビオチン標識プローブRHP−3(P1)および5’ビオチン標識LHP−3(P2)、50nMのRDB−3p8ハイブリッド形成ブロッカーオリゴヌクレオチド、10mMのTris−EDTA緩衝液および0.1mg/mlのBSAを含有する溶液を調製した。また、各溶液は、SAを0、0.1、1、10または100fMで含有していた。この溶液を2時間37℃でインキュベートし、混合物を免疫SDA緩衝液中で10倍に希釈した。次いで、希釈した試料100μLを、SRH−1SDAプライマー1.5μM、SLH−2SDAプライマー3.75μM、ADR−8アダプター2.25μM、TBD10.2レポータープローブ3.75μMおよびRDB−3p8ハイブリッド形成ブロッカーオリゴヌクレオチド0.375μMを含有するプライミング溶液20μLと混合した。得られた混合物を37℃で10分間インキュベートした。オリゴヌクレオチドすべての配列は、実施例1に見出すことができる。免疫SDA反応を開始するために、52℃で予備平衡され、Bst DNAポリメラーゼ、BsoBI制限酵素、ならびにリン酸カリウム、BSAおよびdNTPを含むその他のSDA成分で構成されたSDA酵素溶液20μLを含有する増幅マイクロウェルに、各混合物80μLを移した。次いで、マイクロウェルを直ちに密封し、ProbeTec(商標)ET装置内に置き、各マイクロウェルの蛍光を観測しながら、52℃で1時間維持した。RDB−3p8ハイブリッド形成ブロッカーオリゴヌクレオチドを含有しない一連の対照反応物を上記のものと一緒に調製し、ProbeTec(商標)ET装置内で同時に観測した。
【0147】
最初の結合性混合物の希釈度を考慮した結果、各免疫SDA混合物は、1.3pMのP1およびP2と、0、0.6、6、66、666または6666aMのいずれかの濃度のSAとを含有していた。また、免疫SDA反応物は、30mMのリン酸カリウム(pH7.6)、75mMのビシン、50mMの水酸化カリウム、3.5%のジメチルスルホキシド(DMSO)、5mMの酢酸マグネシウム、50μg/mlのBSA、500nMのSLH−2、200nMのSRH−1、50nMのRDB−3p8、300nMのADR−8、500nMのTBD10.2、0.1mMのdATP、0.1mMのdGTP、0.1mMのdTTP、0.5mMの2’−デオキシシチジン5’−O−(1−チオトリホスフェート)S異性体(dCTPαS)、約8単位のBst DNAポリメラーゼおよび18単位のBsoBI制限酵素を含有していた。P1とP2との相互のハイブリッド形成および伸長から生じた産物の増幅は(図1参照)、特許文献17で記載のアダプター介在型プロセスによるTBD10.2レポーターオリゴヌクレオチドの増幅に伴うROX蛍光の増加を観測することによって検出した。各ウェルについて、反応の過程の間1分間に1回ROXを読み取った。各試料のROX蛍光の読取り値を60分間にわたってプロットした。
【0148】
MOTA値を表6に報告する。ハイブリッド形成ブロッカーオリゴヌクレオチドを用いない標的を含まない反応(すなわち、0aM SA)では、相対的に高い平均MOTA値49382が得られた。このバックグラウンドシグナルは、免疫増幅の感度をかなり制限し、標的分析物の不在下でさえプローブを増幅可能な産物に変換するP1とP2の標的非依存性のハイブリッド形成およびそれに続くそれらの3’末端の伸長から生じると考えられる。しかし、ハイブリッド形成ブロッカーオリゴヌクレオチドが反応混合物に含まれるる場合、RDB−3p8を用いる標的を含まない混合物から得られた低い平均MOTA値376により明らかになったように、バックグラウンドシグナルは劇的に減少した。これらの反応では、ハイブリッド形成ブロッカーオリゴヌクレオチドはP1の3’末端に競合的に結合し、これによりP2がP1とハイブリッド形成するのを妨げ、プローブの増幅可能な産物への標的非依存性の変換を本質的に排除する。
【0149】
標的分析物SAおよびRDB−3p8ハイブリッド形成ブロッカーオリゴヌクレオチドの両方を含有する反応混合物は高いMOTA値を示し、これはハイブリッド形成ブロッカーオリゴヌクレオチドの存在下であっても標的結合プローブが効率的に増幅されることを示す。本発明者らは、プローブP1とP2が同じSA分子に同時に結合することにより、バルク溶液中の結合していないプローブと比較して、2つのプローブの局所濃度が1000万倍超高められると推定する。SA分子上のこの2つのプローブの推定有効局所濃度は10μMを超え、これはバルク溶液中のハイブリッド形成ブロッカーオリゴヌクレオチドの濃度50nMを大きく上回る。競合的ハイブリッド形成ブロッカーオリゴヌクレオチドの存在にもかかわらず、標的に結合したP1およびP2の高い局所濃度により、プローブ同士のハイブリッド形成およびプローブの増幅可能な産物への変換は促進される。対照的に、標的に結合していないプローブP1およびP2は、バルク溶液内の濃度が1.3pMであり、これらの結合していないプローブ同士のハイブリッド形成は、ハイブリッド形成ブロッカーオリゴヌクレオチドとP1との競合的ハイブリッド形成によって効果的に抑制されている。ブロッカーを用いない666aM SAでの反応と比較して、ハイブリッド形成ブロッカーを含有する666aM SAでのSDA反応においてMOTAスコアが減少していることが示す通り、標的結合プローブの変換がある程度抑制されていると思われるが、標的シグナル/バックグラウンドシグナルの比は、ハイブリッド形成ブロッカーを含有する反応に関して200倍近く大きい。
【0150】
【表6】

【0151】
一般的に、より高い濃度の結合していないプローブP1およびP2を含有する反応混合物は、より低いプローブ濃度を含有する試料と同程度のバックグラウンド抑制を提供するために、ハイブリッド形成ブロッカーオリゴヌクレオチドの濃度をより増大することが必要となる。ハイブリッド形成ブロッカーオリゴヌクレオチドの濃度を経験的に調整して、適切な程度のバックグラウンド抑制を提供するのに必要な濃度を特定することができる。また、高濃度のハイブリッド形成ブロッカーオリゴヌクレオチドは標的結合プローブの増幅をある程度抑制する可能性があるので、適切なバックグラウンド抑制を与えることが見出されたハイブリッド形成ブロッカーオリゴヌクレオチドの最低濃度が一般的に最適である。
【0152】
RDB−3p8のRHP−3とのハイブリッド形成が18塩基対の二重鎖および各オリゴヌクレオチドの5’末端上の対形成していない一本鎖のテールを作製するように、この実施例で用いたハイブリッド形成ブロッカーオリゴヌクレオチド、RDB−3p8は、プローブP1、RHP−3の3’末端と相補的な18ヌクレオチドの配列を含有する。RDB−3pよりも長いか短いいずれかの相補的配列(例えば、それぞれRDB−3p10またはRDB−3p5)を有するハイブリッド形成ブロッカーオリゴヌクレオチドも用いてよい。一般的に、所与の濃度では、プローブの相補性がより短いセグメントを有するハイブリッド形成ブロッカーオリゴヌクレオチドは、プローブの相補性がより長いセグメントを有するものよりも安定性がより低い(より低いTm)P1との二重鎖を形成する。一般的に、所与のプローブと安定性のより低い二重鎖を形成するハイブリッド形成ブロッカーオリゴヌクレオチドは、プローブとより安定な二重鎖を形成するハイブリッド形成ブロッカーオリゴヌクレオチドと同程度のバックグラウンド抑制を提供するためには、より高い濃度で用いられる必要がある。また、P1:P2二重鎖の安定性により、所与のハイブリッド形成ブロッカーオリゴヌクレオチドの効率に影響が及ぼされることとなる。一般的に、P1:P2二重鎖が安定であればあるほど、適切なレベルのバックグラウンド抑制を与えるのに用いなければならない所与のハイブリッド形成ブロッカーオリゴヌクレオチドの濃度は高くなる。同様に、P1:P2二重鎖が安定であればあるほど、固定濃度のハイブリッド形成ブロッカーオリゴヌクレオチドに対して同程度のバックグラウンド抑制を与えるのにプローブ−ブロッカー二重鎖はより安定でなければならない。ハイブリッド形成ブロッカーオリゴヌクレオチドとプローブとの間に形成した二重鎖の安定性は、プローブと相補的なハイブリッド形成ブロッカーオリゴヌクレオチド配列の長さまたは配列組成を変えることによって調節されることができる。オリゴヌクレオチド配列および濃度などのパラメータから二重鎖の安定性を推定するためのソフトウェアは、OLIGO(登録商標)(英国Cambio)およびMfold(著作権、1996、Dr.M.Zuker)など、当技術分野でよく知られている(参照により本明細書に組み込まれる非特許文献9参照、非特許文献10に記載)。
【0153】
各プローブに特異的な2種のハイブリッド形成ブロッカーオリゴヌクレオチドを同時に用いてバックグラウンドシグナルを抑制してもよい。一般的に、単一のハイブリッド形成ブロッカーオリゴヌクレオチドで得たものと同程度のバックグラウンド抑制を与えるのに必要とされる各ハイブリッド形成ブロッカーオリゴヌクレオチドの濃度はより低くなる。
【実施例9】
【0154】
(免疫SDAによるピコモル未満のIL−8濃度の均一検出)
抗体−プローブ複合体Ab1−SA−P1およびAb2−P2は、実施例7で記載の通りであった。10mMのTris−EDTA緩衝液、20pMのAb1−SA−P1、100pMのAb2−P2、1mg/mLのBSA、0.1mg/mLのマウスγグロブリン、50nMのハイブリッド形成ブロッカーオリゴヌクレオチドRDB−3z8および0、0.005、0.010または0.025pMのIL−8を含有する試料50μLを調製した。室温で3時間インキュベートした後、各試料の分量5μLを1:10(v/v)に希釈して、0.1mg/mLのBSAを含有するTris−EDTA緩衝液とし、次いでさらに1:10(v/v)に希釈して、SDAプライマーSRH−1(100nM)およびSLH−2(500nM)、300nMのアダプタープライマーADR−8、500nMのレポータープローブTBD10.2(D/R)ならびに50nMのハイブリッド形成ブロッカーRDB−3z8を含有する溶液100μLとした。そのように希釈した4つの混合物は、最初の試料のそれぞれから調製された。次いで、希釈した混合物を37℃で約10分間インキュベートし、52℃に予め加温したSDA酵素溶液20μLを含有する別個のマイクロウェルに各混合物の分量80μLを移した。このマイクロウェルを密封し、ProbeTec(商標)ET装置内に置き、52℃で1時間インキュベートした。参照により本明細書中に組み込まれる特許文献17で記載の通りに、フルオレセイン標識レポータープローブ、TBD10.2の変換に伴う蛍光の増加を観察することによって増幅を観測した。得られるMOTA値を表7に報告する。0.005pMと低いIL−8濃度を含有する結合性混合物の平均MOTA値は、IL−8ゼロの試料から得られる対応値よりも著しく高く、これは本発明の均一法が、未結合の抗体から結合抗体を分離せずに、低フェムトモル範囲の分析物濃度を検出できることを立証している。
【0155】
IL−8ゼロの試料のMOTAスコアで表されたバックグラウンドシグナルは、標的に結合していない抗体同士の弱い相互作用から生じる誤ったアンプリコン形成による結果と考えられる(実施例16参照)。この実施例のSDA反応での抗体濃度は、前述の実施例よりも少なくとも200倍高いため、この実施例におけるバックグラウンドレベルは実施例7よりも高い。
【0156】
【表7】

【実施例10】
【0157】
(テザーオリゴヌクレオチドおよび架橋プローブを用いてIL−8を検出する免疫SDAの実験的証明)
実施例9のAb1−SA複合体10nMを、0.1mg/mLのBSAを含有する0.1MのTris−EDTA緩衝液中で20nMの3’−ビオチン標識RCP−1テザーオリゴヌクレオチド(TO)と混合した。この混合物を一晩4℃でインキュベートして、ビオチン化オリゴヌクレオチドをAb1−SA複合体に結合させてAb1−SA−TOを形成した。
【0158】
1nMのAb1−SA−TO、ビオチン標識を有さない1nMのRHP−3(P1)、1nMのAb2−P2(実施例8参照)、10mMのTris−EDTA緩衝液、0.1mg/mLのBSAおよび0、10または100pMのIL−8を含有する混合物を調製した。30分間室温でインキュベートした後、Ab−プローブ複合体の最終濃度がfMの範囲になるように、混合物を連続的に希釈した。次いで、希釈した混合物をSDAプライマーSRH−1およびSLH−2、アダプターADR−5、ならびにレポータープローブTBD10.2と混合し、この混合物を37℃に10分間加温した。希釈した試料それぞれの部分を、BsoBI制限酵素およびBstDNAポリメラーゼをも含有する乾燥した増幅ウェルに52℃で実施例2に記載の通りに加えた。得られるSDA混合物中のAb−プローブ複合体の濃度は1fMであり、IL−8の濃度は0、0.01または0.1fMのいずれかであった。試料を直ちにProbeTec(商標)ET装置に移し、そこで等温増幅を52℃で1時間実施した。上記の実施例2で記載の通りに蛍光の増加を観察することによって増幅を観測した。
【0159】
MOTA値を表8に報告する。IL−8を欠く試料では低いMOTA値が得られたが、一方、より高いレベルのIL−8によりMOTA値は増加され、図3Aで示す通り、テザーオリゴヌクレオチドTOとのハイブリッド形成を介して分析物結合性部Ab1と間接的に連結したスプリントオリゴヌクレオチドとしてP1を用いる免疫SDA法によるIL−8の検出を立証した。この実験では、ハイブリッド形成ブロッカーオリゴヌクレオチドは用いなかったが、近接対−IL−8複合体の形成後に試料を約100万倍に希釈して、標的非依存性プローブの増幅の発生を減少させた。
【0160】
【表8】

【実施例11】
【0161】
(IL−8の検出において検出物結合性部としてFab’断片を用いる免疫SDAの実験的証明)
MAb G265−8(実施例9参照)をペプシンで消化して、F(ab’)2断片およびFc領域の断片を得た。F(ab’)2を精製し、ジチオスレイトール(DTT)でさらに処理して、Fab’断片を連結しているジスルフィド架橋を減少させた。得られるFab’断片(Ab1)を2つのRHP−3オリゴヌクレオチド(P1)とカップリングさせて、Ab1−P1複合体を形成した。
【0162】
0.1nMのAb1−P1、0.1nMのAb2−P2(実施例8参照)、10mMのTris−EDTA緩衝液、0.1mg/mLのBSA、10nMのハイブリッド形成ブロッカーオリゴヌクレオチドRDB−3p8(実施例1参照)および0、0.1または1pMのIL−8を含有する混合物を調製した。37℃で3時間インキュベートした後、Ab−プローブ複合体の得られる濃度がfMの範囲になるように、混合物を連続的に希釈した。次いで、希釈した混合物をSDAプライマーSRH−1およびSLH−2、アダプターADR−5、最終濃度を10nMにするまでの追加のハイブリッド形成ブロッカーRDB−3p8、ならびにレポータープローブTBD10.2と混合した。得られる混合物を37℃で10分間維持した。次いで、各試料の部分を、BsoBI制限酵素およびBstDNAポリメラーゼをも含有する乾燥した増幅ウェルに52℃で実施例2に記載の通りに加えた。得られるSDA混合物において、Ab−プローブ複合体の濃度は100fMであり、IL−8の濃度は0、0.1または1fMのいずれかであった(表9)。試料を直ちにProbeTec(商標)ET装置に移し、そこで等温増幅を52℃で1時間実施した。実施例2で記載の通りに蛍光の増加を観察することによって増幅を観測した。
【0163】
【表9】

【0164】
反復試験4回の平均MOTA値を表9に報告する。IL−8を欠く試料では低いMOTA値が得られたが、一方、より高いレベルのIL−8により、MOTA値は増加され、Fab’をAb1−P1の分析物結合性部として用いる免疫SDA法によるIL−8の検出を立証した。
【実施例12】
【0165】
(ハイブリッド形成ブロッカーオリゴヌクレオチドを使用するバックグラウンド抑制と組み合わせた、可逆的に固定化されたた近接構成要素を使用する標的介在型アンプリコン形成)
この実施例で使用した緩衝液は以下の通りである:
・ TBS:25mMのTris(pH7.6)、150mMのNaCl;
・ 希釈液A:希釈液Bプラス0.01%Tween−20、800μMのD−ビオチンおよび5mMのEDTA;
・ 希釈液B:TBS、0.5%スキムミルクパウダー(Oxoid Ltd.、英国)、0.1mg/mLの分子生物学等級のDNA(Roche Molecular Systems、カリフォルニア州Pleasanton);
・ ブロッキング溶液:TBS、4.5%スキムミルクパウダー、1mg/mLの分子生物学等級のDNA、2mg/mLのアジ化ナトリウム、5mMのEDTA
・ 洗浄緩衝液:TBS、5mMのEDTA、0.05%Tween−20;
・ SDA反応緩衝液(濃縮):90mMのビシン、60mMのKOH、12mMのリン酸カリウム、6.57%グリセロール、4.23%DMSO;
・ SDAプライマー混合物:7.5μMのSRH−1、37.5μMのSLH−2、300μMのADR−5、37.5μMのTBD10.2(水中);ならびに
・ SDA酵素混合物:75mMのビシン中18単位のBsoBI制限エンドヌクレアーゼおよび8単位のBstポリメラーゼ(BD Diagnostic Systems)、50mMの水酸化カリウム、10mMのリン酸カリウム(pH7.6)
選択した標的分析物はIL−8であり、MAb G265−5およびMab G265−8が分析物結合性部である。MAb G265−5はプローブLHP−3に複合体形成して、Ab1−P1を産生した。MAb G265−8はSAに複合体形成し、この複合体をAb分子1個当たりの2種のプローブの割合で5’ビオチン化プローブRHP−3と混合して、Ab2−P2を産生した。
【0166】
以下の手順に従って、捕捉ヌクレオチドを固体支持体に固定した。SAで被覆された96マイクロウェルプレート(Pierceカタログ番号15121)をTBS中で3回すすぎ、ブロッキング溶液中で一晩インキュベートし、次に洗浄緩衝液で4回洗浄した。80nMの5’ビオチン化RCP−9v2.2捕捉オリゴヌクレオチドを含有する溶液100μLを各ウェルに加え、室温で1時間インキュベートした。次いで、800μMのD−ビオチンを含有する洗浄緩衝液でプレートを4回洗浄した。
【0167】
Ab2−P2複合体の固定化された捕捉オリゴヌクレオチドとのハイブリッド形成を以下の通りに実施した:希釈液A中に0.1nMのAb2−P2を100μLずつ各マイクロウェルに加え、室温で1時間インキュベートした。次いで、マイクロウェルを洗浄緩衝液で4回洗浄した。希釈液B中の0または50pMのいずれかのIL−8を含有する試料溶液100μLを各マイクロウェルに加え、室温で1時間インキュベートした。次いで、マイクロウェルを洗浄緩衝液で4回洗浄した。このステップの結果、IL−8と固定化したAb2−P2との間に複合体が形成された。
【0168】
IL−8と固定化されたAb2−P2との間の複合体へのAb1−P1の結合を、以下の通り実施した:1μMのLBK−1ハイブリッド形成ブロッカーオリゴヌクレオチドを含有するかハイブリッド形成ブロッカーオリゴヌクレオチドを含有しない、希釈液A中の0.1nMのAb1−P1複合体の溶液100μLを、IL−8とAb2−P2との間の複合体を含有するマイクロウェルに加え、室温で1時間インキュベートした。次に、LBK−1ハイブリッド形成ブロッカーオリゴヌクレオチドを含有するマイクロウェルを、1μMのLBK−1を含有する洗浄緩衝液で5回、次いでLBK−1のない洗浄緩衝液で2回洗浄した。ハイブリッド形成ブロッカーオリゴヌクレオチドに曝露しなかったマイクロウェルを洗浄緩衝液で7回洗浄した。両方の組のウェルに対して、TBSで最後に2回洗浄した。
【0169】
上記の通りに調製した捕捉された複合体を、SDA反応緩衝液(濃縮)120μLを加えることによって支持体から溶離し、室温で20分間インキュベートした。溶離した複合体を含有する体積100μLを各マイクロウェルから、SDAプライマーミックス20μLを含有する新たなマイクロウェルに移した。これらのマイクロウェルを20分間室温でインキュベートし、次いで37℃のヒートブロック上に10分間置いた。SDAによる増幅を開始するために、37℃の各マイクロウェルから80μLを取り出し、52℃に予め加熱しておいたSDA酵素混合物20μLを含有する別のマイクロウェルに移した。次いで、マイクロウェルを素早くBD ProbeTec(商標)ET装置内に置き、52℃で1時間維持して、増幅の過程の間、蛍光強度を観測した。各増幅反応のMOTA値を、反応の過程の間に得た動的蛍光プロファイルから測定した。
【0170】
図7Dで示した通り、抗体−プローブ複合体Ab1−P1およびAb2−P2のプローブ部P1とP2との間の塩基対形成により、この2つの抗体−プローブ複合体間の標的を含まない二元複合体の形成が促進される。ハイブリッド形成ブロッカーオリゴヌクレオチドLBK−1を結合性混合物に含めることは、P1とP2との間の塩基対形成を妨げることによって、標的を含まない複合体の形成を抑制する。IL−8もLBK−1ハイブリッド形成ブロッカーオリゴヌクレオチドも含まない結合性混合物に対する高い平均MOTA値により表10に示された通り、ハイブリッド形成ブロッカーオリゴヌクレオチドの不在下における標的非含有二元複合体の存在によって、免疫増幅反応中の高レベルのバックグラウンドシグナルが生じた。対照的に、1μMのLBK−1ハイブリッド形成ブロッカーオリゴヌクレオチドの存在は、「IL−8なし」の結合性混合物の平均MOTA値を20分の1に減少させ、標的を含まない複合体の形成のかなりの減少を示している。ハイブリッド形成ブロッカーオリゴヌクレオチドの存在は、IL−8特異的シグナルの強度をわずかに減少させる(LBK−1ありおよびなしの50pMのIL−8混合物のMOTA値を比較);しかし、特異的シグナル対バックグラウンドシグナルの比は、ハイブリッド形成ブロッカーオリゴヌクレオチドを含有する結合性混合物に関する方がそれを含まないものに関するものよりも12倍高い。
【0171】
さらに、この結果は、図7A〜7Gで示す通り、標的抗原(IL−8)を捕捉または固定し、かつ標的抗原および近接対(Ab1−P1およびAb2−P2)の両方の構成要素を含む固定化した三元複合体を形成するための固定化した近接構成要素(Ab2−P2)の使用を証明している。また、この実施例は、固定化するハイブリッド(捕捉オリゴヌクレオチドとプローブ部P2との間に形成した二重鎖)の推定半減期が20分間の溶離時間よりもはるかに長いにもかかわらず、検出可能な数の固定化された三元複合体が、濃縮したSDA緩衝液添加後の20分間の室温での溶離時間中に固相から離れることを示す。
【0172】
【表10】

【実施例13】
【0173】
(可逆的に固定化した近接構成要素を使用する標的介在型アンプリコン形成:低イオン強度溶液の適用による固定化された複合体の放出)
この実施例で使用したMAb、分析物および緩衝液は実施例12で記載のものと同じである。ビオチン化RCP−9v2.2捕捉オリゴヌクレオチドは、実施例12で記載されたものと同じ方法で支持体に固定化された。Ab2−P2複合体の固定化された捕捉オリゴヌクレオチドとのハイブリッド形成は、実施例12で記載の通りに実施された。次いで、0または10pMのいずれかのIL−8を含有する100μLの希釈液Bを各マイクロウェルに加え、これを室温で1時間インキュベートした。次に、マイクロウェルを洗浄緩衝液で4回洗浄した。次に、0.1nMのAb1−P1複合体および1μMのLBK−1ハイブリッド形成ブロッカーオリゴヌクレオチドを含有する希釈液Aを各マイクロウェルに加え、そのマイクロウェルを室温で1時間インキュベートした。次いで、最後の2回の洗浄ステップがTBSではなく10mMのNaClを含有していたことを除き、実施例12で記載の通りにマイクロウェルを洗浄した。
【0174】
IL−8と、Ab1−P1の複合体と、Ab2−P2の複合体との間で得られる固定化された複合体を放出するために、各マイクロウェルを75μLの水または濃縮していないSDA緩衝液で処理した。20分間室温でインキュベートした後、この溶液70μLを取り出し、実施例12で記載の通りにSDAで分析した。
【0175】
この実施例は、低イオン強度溶液を使用して、近接対Ab1−P1およびAb2−P2に同時に結合したIL−8分子で構成された固定化した三元複合体を無傷で放出することを証明している。この実施例の結果は表11に示す。水(低イオン強度)で溶離した10pMのIL−8を含有する試料について得られた平均MOTA値は、SDA緩衝液(中程度のイオン強度)で溶離した試料の平均MOTA値よりも10倍近く高く、図7Iで示した通り、低イオン強度溶液の適用による三元複合体の放出を立証している。
【0176】
【表11】

【実施例14】
【0177】
(可逆的に固定化した近接構成要素を使用する標的介在型アンプリコン形成:置換オリゴヌクレオチドの適用による固定化された複合体の放出)
MAb、分析物および緩衝液は実施例12に記載のものと同じである。ビオチン化RCP−9v2.2捕捉オリゴヌクレオチドは、実施例12に記載されたものと同じ方法で支持体に固定化された。Ab2−P2複合体の固定化された捕捉オリゴヌクレオチドとのハイブリッド形成は、実施例12に記載の通りに実施された。次いで、0または10pMのいずれかのIL−8を含有する希釈液B100μLを各マイクロウェルに加え、これを室温で1時間インキュベートした。次に、マイクロウェルを洗浄緩衝液で4回洗浄した。次に、0.1nMのAb1−P1複合体および1μMのLBK−1ハイブリッド形成ブロッカーオリゴヌクレオチドを含有する希釈液Aを各マイクロウェルに加え、そのマイクロウェルを室温で1時間インキュベートした。次いで、実施例12に記載の通りにマイクロウェルを洗浄した。
【0178】
IL−8と、Ab1−P1の複合体と、Ab2−P2の複合体との間で得られる固定化された複合体を放出するために、各マイクロウェルを0.1μMのCMPR−9v2置換オリゴヌクレオチドを含有するか、または置換オリゴヌクレオチドを含有しない、120μLのSDA緩衝液(濃縮)で処理した。20分間室温でインキュベートした後、この溶液を実施例12に記載の通りにSDAで分析した。
【0179】
この実施例は、置換オリゴヌクレオチドを使用して、近接対Ab1−P1およびAb2−P2に同時に結合したIL−8分子で構成された固定化された三元複合体を無傷で放出することを証明している。この実施例の結果を表12に示す。10pMのIL−8を含有し、置換オリゴヌクレオチドで処理した試料に対して得られた平均MOTA値は、置換オリゴヌクレオチドで処理しなかった10pMのIL−8試料のMOTA値よりも10倍高く、図7Jで示した放出メカニズムを立証している。
【0180】
【表12】

【実施例15】
【0181】
(3’キャップされた近接プローブを使用する免疫SDAの実験的証明)
この実施例は、図14で示したプロセス、すなわち免疫増幅によって検出物を検出するための3’キャップした伸長不可能な近接プローブの使用の実験的証明を提供する。この実施例の標的分析物はSAである。3’キャップした近接プローブP1はLHP−3[キャップ]である(実施例1で示した)。LHP−3[キャップ]は、LHP−3[キャップ]が相補的な鋳型鎖P2とハイブリッド形成した場合にプローブの伸長を妨げる3’デオキシウリジン部を含む。この実施例では、分析物結合性部は、LHP−3[キャップ]の5’末端に付着したビオチン部である。近接対の第2のプローブ、P2は、5’ビオチン部および伸長可能な3’末端を含むRHP−3(実施例1で示した)である。キャップしていない対照プローブ、LHP−3は、5’ビオチン部および伸長可能な3’末端を含む。増幅プライマー、アダプターオリゴヌクレオチド、レポータープローブ、ハイブリッド形成ブロッカーオリゴヌクレオチドおよびその他の反応成分は実施例8と同じである。
【0182】
20pMの5’ビオチンRHP−3、20pMの5’ビオチンLHP−3[キャップ]、10mMのTris−EDTA緩衝液、5μg/mLのBSAおよび0または10fMのいずれかのSAを含有する溶液を調製した。結合性混合物は、100nMのRDB−3p5ハイブリッド形成ブロッカーオリゴヌクレオチドを任意選択的に含有した(表13参照)。この結合性混合物を37℃で2時間インキュベートし、次いで10倍に希釈し、実施例8に記載の通りにSDAにかけた。LHP−3[キャップ]がキャップしていないLHP−3に置き換えられた対照混合物も調製し、上記の通りSDAにかけた。種々のSDA反応からの平均MOTA値を表13に示す。
【0183】
【表13】

【0184】
SAなしの試料のMOTA値により示された通り、近接プローブP1が3’伸長キャップを含有する反応(「LHP−3[キャップ])は、キャップされていないプローブを含有する反応(LHP−3)よりも著しく低いバックグラウンドシグナルを示した。キャップされたプローブおよびキャップされていないプローブの両方に対して、ハイブリッド形成ブロッカーオリゴヌクレオチドの存在は、ハイブリッド形成ブロッカーオリゴヌクレオチドのない同じ反応混合物と比較して約12倍バックグラウンドシグナルを抑制した。キャップされたプローブではバックグラウンドシグナルが低かったが、10fMのSAの存在下のシグナルは、キャップされていないプローブに対してキャップされたプローブではわずかに高く、標的分析物の存在下におけるキャップされたP1プローブおよびキャップされていないP2プローブの増幅可能な産物への効率的な変換を示す。さらに、この実施例は、プローブ−プローブハイブリッドで形成された重なり合った3’末端の一方のみが3’OH基を含む場合に、分析物特異的アンプリコンの形成が生じ得ることを証明している。
【実施例16】
【0185】
(標的非依存性アンプリコン形成の原因としての抗体−抗体の相互作用を明らかにする実験)
この実施例は、近接構成要素のAb部同士の間の相互作用が標的非依存性増幅の一因となることを証明する。実施例9で記載の通り、以下に挙げた成分を10mMのTris−EDTA緩衝液および0.1mg/mLのBSAの溶液中に含有する4つの試験溶液を調製した。
・ 試験溶液1:1nMのAb1−P1および1nMのAb2−SA−P2;
・ 試験溶液2:1nMのAb1−P1、1nMの複合体形成していないAb2および2nMの複合体形成していないP2;
・ 試験溶液3:1nMの複合体形成していないAb1、2nMの複合体形成していないP1および1nMのAb2−P2;ならびに
・ 試験溶液4:2nMの複合体形成していないP1、2nMの複合体形成していないP2。
【0186】
試験溶液を30分間37℃でインキュベートし、次いで、抗体、プローブおよびコンジュゲートの得られる濃度がpMの範囲になるように、連続的に希釈した。次いで、希釈した混合物をSDAプライマーおよび酵素と混合し、SDA反応混合物が50nMのRDB−3p8ハイブリッド形成ブロッカーオリゴヌクレオチドを任意選択的に含む以外は、実施例9で記載の通りにSDAにかけた。さらに、複合体形成していないプローブを抗体−プローブ複合体のモル比の2倍で使用して、複合体中2:1の既知のプローブ:抗体比を反映させた。標的分析物は反応に存在しなかったので、生成したMOTA値は標的非依存性プローブの変換のみに起因する。
【0187】
種々の試験溶液からの平均MOTA値を表14に報告する。ハイブリッド形成ブロッカーオリゴヌクレオチドなしの反応混合物では、すべての試験溶液について平均MOTA値は100000を上回った。50nMのRDB−3p8ハイブリッド形成ブロッカーオリゴヌクレオチドを含有する試験溶液4では、平均MOTA値は20000未満に減少しており、5倍を超えるバックグラウンドシグナルの抑制を示している。対照的に、試験溶液1のMOTA値は、そのハイブリッド形成ブロッカーオリゴヌクレオチドの存在によってわずか約2分の1に減少して約59000になり、RDB−3p8によりもたらされるブロッキング効率は、複合体形成していないプローブP1およびP2の存在中よりも、2つの無傷の抗体プローブ複合体の存在中のほうが低いことを示している。試験溶液1のMOTA値が試験溶液4のMOTA値よりも高いことは、試験溶液1で抗体介在型アンプリコンの形成が生じていることを暗示し、さらにAb1とAb2が互いに標的非依存性付着することにより、付着したプローブ部が十分に近く近接されて誤ったアンプリコン形成を促進することを示唆する。明らかに、互いに付着した抗体対の局所プローブ濃度はバルク溶液のプローブ濃度全体よりもかなり高いので、ハイブリッド形成ブロッカーオリゴヌクレオチドは試験溶液1の標的非依存性プローブ変換を、付着した抗体対が形成できない試験溶液4ほど効率的に抑制することはできない。これは、試験溶液4のMOTA値と匹敵するMOTA値を示す試験溶液2および3の結果と一致しており、これは、試験溶液1で見られた抗体介在型プローブ変換の一因となる高いMOTA値を生じるために、近接対の両方のプローブ部は抗体に複合体形成していなければならないことを示している。
【0188】
【表14】

【実施例17】
【0189】
(反転した反対の配列方向を有するプローブを用いる免疫SDAによるIL−8の検出)
この実施例は、図1Jで示した概念の実験的証明を与える。抗体複合体Ab1−SAおよびAb2−P2は、実施例7に記載した通りである。Ab1−SAを、プローブRBD−3v3とプローブ:抗体比2:1で、4℃で一晩インキュベートしてAb1−SA−P1を形成した。実施例1で言及した通り、RBD−3v3はビオチン部をその3’末端の近くに含有している。10mMのTris−EDTA緩衝液、20pMのAb1−SA−P1、100pMのAb2−P2、1mg/mLのBSA、50nMのハイブリッド形成ブロッカーオリゴヌクレオチドRDB−3z8ならびに0、0.1、0.25、0.5および1.0pMのIL−8を含有する試料を調製した。室温で3時間インキュベートした後、各標準試料の分量を、BSA0.1mg/mLを含有するTris−EDTA緩衝液に1:10(v/v)に希釈し、さらに、SDAプライマー(SRH−1およびSLH−2)、アダプタープライマー(adr−8)、レポータープローブ(TBD10.2(D/R))およびハイブリッド形成ブロッカー(RDB−3z8)50nMを含有する溶液中に1:10(v/v)に希釈した。SDA反応では、プライマー、アダプターおよびレポーターの濃度は実施例18で記載の通りであり、ハイブリッド形成ブロッカーRDB−3z8の濃度は50nMであった。これらの希釈混合物の反復試験試料4点を、それぞれの最初の試料から調製した。次いで、希釈混合物を37℃で約10分間インキュベートし、52℃に予め加温したSDA酵素溶液20μLを含有する別個のマイクロウェルに各混合物の分量80μLを移した。このマイクロウェルを密封し、ProbeTec(商標)ET装置内に置き、52℃で1時間インキュベートした。実施例9に記載の通りに蛍光の増加を観察することによって増幅を観測した。
【0190】
平均MOTA値を表15に報告する。IL−8を欠く試料では低いMOTA値が得られたが、一方、IL−8のレベルが増大することにより、徐々により高いMOTA値になり、図1Jで記載の通り、プローブの1つが抗体とその3’末端の近くの連結を介してつながれている免疫SDA法によるIL−8の検出を立証している。さらに、この結果は、伸長可能な3’OH基を1つだけ含むプローブ−プローブ(P1−P2)二重鎖が分析物特異的アンプリコンを産生できることを立証している。
【0191】
【表15】

【実施例18】
【0192】
(内部の核酸対照および近接対を用いる免疫SDAによるIL−8の定量)
この実施例は、核酸対照およびそれぞれ分析物に結合した近接構成要素から産生された標的アンプリコンの共増幅から得られる2つの蛍光シグナルの比を使用する試験試料中の標的分析物(この場合、IL−8)の絶対定量を説明する。本発明によれば、複数の標準試料および少なくとも1つの試験試料が最初に形成される。複数の標準試料はそれぞれ、既知の開始量の核酸対照配列、既知の開始量の標的分析物およびある量の本発明の近接対を含有する。通常、複数の標準試料の異なる構成要素は、既知の量の標的分析物を有することとなる。試験試料は、既知の開始量の核酸対照配列、未知の量の非核酸標的分析物およびある量の近接対を含有する。絶対定量法で測定されるのは、この未知の量の標的分析物である。
【0193】
標準試料および試験試料では、同じ標的分析物分子に同時に結合している近接構成要素のオリゴヌクレオチド部は、上記の本発明方法のいずれかによってアンプリコンに変換される。次いで、各標準試料および試験試料で得られるアンプリコンおよび核酸対照配列を共増幅する。各試料中、同じ試料中のアンプリコンおよび対照核酸の増幅が、増幅の過程の間、異なる蛍光放出波長で独立して観測することができるように、アンプリコンおよび対照配列の増幅により、検出可能な蛍光の放出を別個に発生させることができる。
【0194】
増幅の間に得られた蛍光値は、「リアルタイム蛍光プロファイル」と呼ばれ、測定時点を横座標に割り当て、蛍光値を縦座標に割り当てた二次元のグラフとして表示することができる。図15Aは、下記の実験における標的と対照アンプリコンとの共増幅から得られる試料の2色のリアルタイム蛍光プロファイルの実施例を示す。この実施例で使用した検出波長は、それぞれ標的アンプリコンおよび対照核酸に特異的なレポーターオリゴヌクレオチドの標識に使用した蛍光色素ローダミンおよびフルオレセインに特徴的なものであった。
【0195】
標準試料および試験試料のそれぞれについて、蛍光強度を2つの独立した検出波長で、増幅間隔を含む複数nの時点にわたって測定した。所与の試料iに対し、各時点(tp)は一方は増幅した標的アンプリコン(FT(tp)i)に対応し、他方は増幅した対照核酸(FC(tp)i)に対応した2つの関連した蛍光値を有する。同じ試料から同じ時間間隔で集められたこれらの2つの読取り値は、蛍光値の「マッチした対」と呼ばれる。
【0196】
分析の便宜上、2種以上の異なる試料のリアルタイム蛍光プロファイルは同期していると考えられる。すなわち、2種以上の異なる試料からの同じ時点は、各試料での増幅開始後の同じ尺度の経過時間に対応している。異なる試料からのこれらの等価な時点を「同時」という。異なる試料の未加工の蛍光プロファイルが同期していない場合、当技術分野で知られた方法を用いて、未加工データから同期した「正規化した」プロファイルを構築することができる(例えば、それらの開示の全体は参照により本明細書内に組み込まれる特許文献22および特許文献23参照)。
【0197】
所与の試料iのリアルタイム蛍光プロファイル内の各時点(tp)について、蛍光値の各マッチした対を使用して、関係(式1)に従ってシグナル比、SR(tp)iを算出することができる。
【0198】
SR(tp)i=[FT(tp)i-FT(base)i]/[FC(tp)i-FC(base)i] 式1
【0199】
式中、基準蛍光測定値、FT(base)iおよびFC(base)iは、標的と対照アンプリコンの検出可能な増幅前の各蛍光強度に対応している。基準蛍光のその他の近似を用いてもよいが、実際には、FT(base)iは、試料iの増幅中の最初のいくつかの時点にわたって測定した標的アンプリコンの蛍光の平均値とし、FC(base)iは、それらの同じ時点にわたって測定した平均核酸対照蛍光とする。
【0200】
したがって、増幅した試料から得られる、標的および対照のリアルタイム蛍光プロファイルの各対は、nをプロファイル中の時点の数とすると、n個のシグナル比を生じることとなる。同様に、複数のk個の試料にわたって同時である各時点は、それに伴って、各シグナル比が一致した時点tpにおいて試料iに対応しているk個の「同時」シグナル比、SR(tp)iを有している。
【0201】
試料によって生じたシグナル比と試料が含有する分析物(IL−8)の量とを相関させるために、種々の既知の量のIL−8を含有する複数のk個の標準試料について測定したシグナル比を以下の通りに分析した。同時シグナル比の各組(すなわち、k個すべての標準試料にわたって同じ時点、tpから導出したシグナル比)をまず式2に従って既知の分析物濃度に対する線形回帰にかける。式2は、量log(SR(tp)i)およびlog([IL−8]i)を関連付け、回帰手順で決定した勾配m(tp)および切片b(tp)の値を有する「検量」線を定義する。
【0202】
log(SR(tp)i)={m(tp)xlog([IL-8]i)}+b(tp) 式2
【0203】
この操作をn組の同時シグナル比のそれぞれについて繰り返して、各対は複数の標準試料k個にわたる個々の同時時点に対応しながら、n対の勾配と切片の値で定義したn個の検量線を作製する。この分析から得られたn個の検量線の1つ(tp=8分)を図15Bで示す。
【0204】
次いで、勾配と切片の値の「最高の」対に対応する「最高の」測定時点(tpbest)を適合度基準に基づいて選択し、試験試料についてのシグナル比を式1に従って、選択した「最高の」時点と同時の時点で得られた蛍光測定値から算出する。次に、試験試料j中の分析物IL−8の量を、最高の測定時点の試験試料のシグナル比、SR(tpbest)j、および勾配、m(tpbest)と切片、b(tpbest)「最高の」対の値から式3によって計算することができる。
【0205】
log([IL-8]j)={log(SR(tpbest))-b(tpbest)}/m((tpbest) 式3
【0206】
種々の統計的基準を用いて「最高の」検量線または対応する「最高の」測定時間、tpbestを決定することができる。多くのこれらの統計的基準は、特許文献22および特許文献23に記載されている。最高の時間を選択するその他の統計的方法も用いることができる。
【0207】
実験手順を以下の通りに実施した。抗体−プローブ複合体Ab1−SA−P1およびAb2−P2は、実施例7に記載した通りである。10mMのTris−EDTA緩衝液、20pMのAb1−SA−P1、100pMのAb2−P2、1mg/mLのBSA、25nMのハイブリッド形成ブロッカーオリゴヌクレオチドRDB−3p8および0.01、0.1、1.0、10.0および100pMのIL−8を含有する標準試料を調製した。室温で3時間インキュベートした後、各標準試料の分量を、BSA0.1mg/mLを含有するTris−EDTA緩衝液中に1:10(v/v)に希釈し、次いでさらに、SDAプライマー(SRH−1およびSLH−2)、アダプタープライマー(adr−8およびadqs−2)、レポータープローブ(TBD10.2(D/R)およびALTD6.9(F/D))、50nMのハイブリッド形成ブロッカー(RDB−3p8)ならびに対照核酸(IQS−2)100000コピーを含有する溶液中に1:100(v/v)に希釈した。2つのそのように希釈された混合物は、最初の標準試料のそれぞれから調製された。次いで、希釈された標準混合物を37℃で約10分間インキュベートし、52℃に予め加温したSDA酵素溶液20μLを含有する別個のマイクロウェルに各混合物の分量80μLを移した。次に、このマイクロウェルを密封し、ProbeTec(商標)ET装置内に置き、52℃で1時間インキュベートした。この1時間のインキュベーションの間、各マイクロウェルの蛍光を、一方はローダミン蛍光に特異的であり、他方はフルオレセイン蛍光に特異的である2つの光学的チャネルを介して記録した。1対の蛍光読取り値(1つのフルオレセインと1つのローダミン)をそれぞれ1分間隔で1時間の反応過程の間記録し、各SDA反応について60対の蛍光読取り値が得られた。
【0208】
濃度0.01、0.1、1.0、10.0および100.0pMのIL−8を含有する1組の試験試料を調製し、標準試料に対して上記した通り、競合的な2色のSDAにかけた。対照オリゴヌクレオチド(IQS−2)の量は標準試料のものと同等であった。
【0209】
この実施例では、5つのIL−8標準試料それぞれの合計10個の複製SDA反応からの2色の蛍光データを使用して、以下の検量線式を構築した。10個の増幅した標準試料(i)のそれぞれについて、シグナル比、SR(tp)iを式1に従って60個の時点(tp)それぞれに対して計算した。標準試料からの同時シグナル比の各組を、上記の式2に記載の通りに既知のIL−8濃度に対する線形回帰にかけると、60個の時点のそれぞれについて、異なる「検量」線に対応する勾配(m(tp))および切片(b(tp))値が得られた。適合度基準を検量線に適用して、この複数の標準試料の最高の測定時間はtp=8分であると決定した。log(SR(tp=8分))対log([IL−8])のプロットおよび対応する検量線を図15Bに示す。これは、分析物濃度の10000倍の範囲にわたるシグナル比とIL−8濃度との間の線形関係を表す。
【0210】
上記の種々の試験試料の蛍光データ(tp=8分)からシグナル比を算出した。次いで、標準曲線から導出したtp=8分の検量線に対応する最高の勾配および切片値を使用し、式3を使用して、試験試料のIL−8濃度を計算した。
【0211】
表16に示した結果は、計算したIL−8濃度と実際のIL−8濃度との間でほぼ一致しており、本発明の方法による標的分析物の正確な定量を立証している。
【0212】
【表16】

【0213】
これまで特定の代表的な実施形態および詳細を参照して本発明を完全に記載してきたが、本明細書に記載された本発明の精神および範囲から逸脱することなく変更および修正を加えられることができることは当業者には明らかであろう。本明細書に記載された方法および手順のすべては、当業者が容易に実施できるものである。
【特許請求の範囲】
【請求項1】
増幅産物を検出することにより分析物を検出できる分析物の検出方法であって、
(i)(a)分析物と;
(b)分析物と複合体を形成することができて、且つ第1の部分および第2の部分を含む第1のオリゴヌクレオチド部に複合体形成している第1の分析物特異的結合単位を含む第1の近接構成要素と;
(c)分析物と複合体を形成することができて、且つ第2のオリゴヌクレオチド部に複合体形成している第2の分析物特異的結合単位を含む第2の近接構成要素であって、第2のオリゴヌクレオチド部は第1のオリゴヌクレオチドの第1の部分とハイブリッド形成できる部分を含む第2の近接構成要素と;
(d)第1のオリゴヌクレオチド部の第2の部分とハイブリッド形成できる捕捉オリゴヌクレオチドを含む支持体と;
を組み合わせるステップ;
(ii)第1のオリゴヌクレオチド部の第1の部分と第2のオリゴヌクレオチド部の部分とを含むハイブリッドを形成するステップ;
(iii)3’末端を伸長してアンプリコンを産生するステップ;
(iv)アンプリコンを増幅して増幅産物を産生するステップ;および
(v)増幅産物を検出するステップ;
を含むことを特徴とする分析物の検出方法。
【請求項2】
第1のオリゴヌクレオチドの第1および第2の部分はオーバーラップする塩基を含まないことを特徴とする請求項1に記載の方法。
【請求項3】
第1のオリゴヌクレオチドの第1および第2の部分は共に隣接した塩基を含むことを特徴とする請求項1に記載の方法。
【請求項4】
第1のオリゴヌクレオチドの第1および第2の部分は同じ塩基配列であることを特徴とする請求項1に記載の方法。
【請求項5】
ハイブリッドは第1または第2のオリゴヌクレオチド部の3’末端を含み、前記アンプリコンを産生するステップは3’末端を伸長することを含むことを特徴とする請求項1に記載の方法。
【請求項6】
前記アンプリコンを産生するステップは、連結ステップを含むことを特徴とする請求項1に記載の方法。
【請求項7】
前記組み合わせるステップの後に、捕捉オリゴヌクレオチドと第1のオリゴヌクレオチド部との間にハイブリッドを形成するステップを含むことを特徴とする請求項1に記載の方法。
【請求項8】
前記捕捉オリゴヌクレオチドと第1のオリゴヌクレオチド部との間にハイブリッドを形成するステップの後に、支持体を洗浄するステップをさらに含むことを特徴とする請求項7に記載の方法。
【請求項9】
前記支持体を洗浄するステップの後に、支持体から第1の近接構成要素を放出するステップをさらに含むことを特徴とする請求項8に記載の方法。
【請求項10】
捕捉オリゴヌクレオチドと第1のオリゴヌクレオチド部との間のハイブリッドは制限エンドヌクレアーゼ認識部位を含み、且つ前記放出するステップは同源の制限エンドヌクレアーゼでその部位を開裂することを含むことを特徴とする請求項9に記載の方法。
【請求項11】
捕捉オリゴヌクレオチドと第1のオリゴヌクレオチド部との間のハイブリッドをポリメラーゼ触媒伸長して制限エンドヌクレアーゼ認識部位を形成するステップをさらに含み、前記放出するステップは同源の制限エンドヌクレアーゼでその部位を開裂することを含むことを特徴とする請求項9に記載の方法。
【請求項12】
放出するステップは、捕捉オリゴヌクレオチドと第1のオリゴヌクレオチド部との間のハイブリッドの物理的解離によるものであることを特徴とする請求項9に記載の方法。
【請求項13】
放出するステップは、物理的、化学的または酵素的開裂であることを特徴とする請求項9に記載の方法。
【請求項14】
放出するステップは、捕捉オリゴヌクレオチドの二本鎖部分を伸長して、捕捉オリゴヌクレオチドと第1のオリゴヌクレオチド部との間のハイブリッドから第1のオリゴヌクレオチド部を置換することを含むことを特徴とする請求項9に記載の方法。
【請求項15】
捕捉オリゴヌクレオチドの二本鎖部分はヘアピンループを含むことを特徴とする請求項14に記載の方法。
【請求項16】
放出するステップは、第1のオリゴヌクレオチド部の二本鎖部分を伸長して、捕捉オリゴヌクレオチドと第1のオリゴヌクレオチド部との間のハイブリッドから捕捉オリゴヌクレオチドを置換することを含むことを特徴とする請求項9に記載の方法。
【請求項17】
二本鎖部分はヘアピンループを含むことを特徴とする請求項16に記載の方法。
【請求項18】
捕捉オリゴヌクレオチドと第1のオリゴヌクレオチド部との間のハイブリッドの一本鎖または二本鎖はRNAを含み、且つ放出するステップは前記一本鎖または二本鎖をRNアーゼで分解することを含むことを特徴とする請求項9に記載の方法。
【請求項19】
前記増幅するステップは、ポリメラーゼ連鎖反応、鎖置換増幅、好熱性鎖置換増幅、自己保持配列複製、核酸配列に基づく増幅、Qβレプリカーゼシステム、リガーゼ連鎖反応および転写介在増幅からなる群から選択される方法によるものであることを特徴とする請求項1に記載の方法。
【請求項20】
検出は定量的であることを特徴とする請求項1に記載の方法。
【請求項21】
増幅産物を検出することにより分析物を検出できる分析物の検出方法であって、
(i)(a)分析物と;
(b)分析物と複合体を形成することができて、且つ第1の部分および第2の部分を含むテザーオリゴヌクレオチド部に複合体形成している第1の分析物特異的結合単位を含む第1の近接構成要素と;
(c)分析物と複合体を形成することができて、且つ第1の部分を含むオリゴヌクレオチド部に複合体形成している第2の分析物特異的結合単位を含む第2の近接構成要素と;
(d)(i)オリゴヌクレオチド部の第1の部分とハイブリッド形成できる第1の部分および(ii)テザーオリゴヌクレオチド部の第1の部分とハイブリッド形成できる第2の部分を含むスプリントオリゴヌクレオチドと;
を組み合わせるステップ;
(ii)(a)オリゴヌクレオチド部の第1の部分、スプリントオリゴヌクレオチドの第1の部分、および、オリゴヌクレオチド部またはスプリントオリゴヌクレオチドのいずれかの伸長可能な末端を含む第1のハイブリッドと;および
(b)テザーオリゴヌクレオチドの第1の部分およびテザーオリゴヌクレオチドの第2の部分を含む第2のハイブリッドと;
を形成するステップ;
(iii)伸長可能な末端を伸長することによってアンプリコンを産生するステップ;
(iv)アンプリコンを増幅して増幅産物を産生するステップ;
(v)増幅産物を検出するステップ;
を含むことを特徴とする分析物の検出方法。
【請求項22】
オリゴヌクレオチド部が伸長可能な末端を含むことを特徴とする請求項21に記載の方法。
【請求項23】
スプリントオリゴヌクレオチドが伸長可能な末端を含むことを特徴とする請求項21に記載の方法。
【請求項24】
前記伸長可能な末端を伸長するステップは、テザーオリゴヌクレオチドを第2のハイブリッドから置換することを特徴とする請求項21に記載の方法。
【請求項25】
テザーオリゴヌクレオチドは、鎖置換により置換されることを特徴とする請求項24に記載の方法。
【請求項26】
テザーオリゴヌクレオチドは、3’−5’エキソヌクレアーゼ活性を有するポリメラーゼで触媒された加水分解で置換されることを特徴とする請求項24に記載の方法。
【請求項27】
前記増幅するステップは、ポリメラーゼ連鎖反応、鎖置換増幅、好熱性鎖置換増幅、自己保持配列複製、核酸配列に基づく増幅、Qβレプリカーゼシステム、リガーゼ連鎖反応および転写介在増幅からなる群から選択される方法によるものであることを特徴とする請求項21に記載の方法。
【請求項28】
スプリントオリゴヌクレオチドは、第2の部分の3’に位置する制限エンドヌクレアーゼ認識部位ならびに制限エンドヌクレアーゼ認識部位の3’および第1の部分の5’に位置する第1のプライマー結合性部位をさらに含み、オリゴヌクレオチド部はオリゴヌクレオチド部の第1の部分の5’に位置する第2のプライマー結合性部位を含むことを特徴とする請求項21に記載の方法。
【請求項29】
前記増幅するステップは、それぞれ第1および第2のプライマー結合性部位とハイブリッド形成する第1および第2のプライマーならびにその同源の認識部位にニック形成する制限エンドヌクレアーゼを使用することを含む鎖置換増幅によるものであることを特徴とする請求項28に記載の方法。
【請求項30】
検出は定量的であることを特徴とする請求項21に記載の方法。
【請求項31】
前記アンプリコンを産生するステップは、連結ステップを含むことを特徴とする請求項21に記載の方法。
【請求項32】
増幅産物を検出することにより分析物を検出できる分析物の検出方法であって、
(i)(a)分析物と;
(b)分析物と複合体を形成することができて、且つ第1の部分を含む第1のテザーオリゴヌクレオチド部に複合体形成している第1の分析物特異的結合単位を含む第1の近接構成要素と;
(c)分析物と複合体を形成することができて、且つ第1の部分を含む第2のテザーオリゴヌクレオチド部に複合体形成している第2の分析物特異的結合単位を含む第2の近接構成要素と;
(d)(i)第1のテザーオリゴヌクレオチド部の第1の部分とハイブリッド形成できる第1の部分および(ii)第2のスプリントオリゴヌクレオチドの第2の部分とハイブリッド形成できる第2の部分を含む第1のスプリントオリゴヌクレオチドと;
(e)(i)第2のテザーオリゴヌクレオチド部の第1の部分とハイブリッド形成できる第1の部分および(ii)第1のスプリントオリゴヌクレオチドの第2の部分とハイブリッド形成できる第2の部分を含む第2のスプリントオリゴヌクレオチドと;
を組み合わせるステップ;
(ii)(a)第1のテザーオリゴヌクレオチド部の第1の部分および第1のスプリントオリゴヌクレオチドの第1の部分を含む第1のハイブリッドと;
(b)第2のテザーオリゴヌクレオチドの第1の部分および第2のスプリントオリゴヌクレオチドの第1の部分を含む第2のハイブリッドと;
(c)第1および第2のスプリントオリゴヌクレオチドの第2の部分、第1のスプリントオリゴヌクレオチドの3’末端、ならびに第2のスプリントオリゴヌクレオチドの3’末端を含む第3のハイブリッドと;
を形成するステップ;
(iii)第3のハイブリッドの3’末端を伸長することによってアンプリコンを産生するステップ;
(iv)アンプリコンを増幅して増幅産物を産生するステップ;および
(v)増幅産物を検出するステップ;
を含むことを特徴とする分析物の検出方法。
【請求項33】
第1のテザーオリゴヌクレオチドの3’末端または5’末端は第1の分析物特異的結合単位に複合体形成し、第2のテザーオリゴヌクレオチドの3’末端は第2の分析物特異的結合単位に複合体形成することを特徴とする請求項32に記載の方法。
【請求項34】
前記アンプリコンを産生するステップは、第1および第2のテザーオリゴヌクレオチドを第1および第2のハイブリッドから置換することを特徴とする請求項32に記載の方法。
【請求項35】
第1および第2のテザーオリゴヌクレオチドは、鎖置換により置換されることを特徴とする請求項32に記載の方法。
【請求項36】
第1および第2のテザーオリゴヌクレオチドは、3’−5’エキソヌクレアーゼ活性を有するポリメラーゼで触媒された加水分解で置換されることを特徴とする請求項32に記載の方法。
【請求項37】
前記伸長するステップの後で且つ前記増幅するステップの前に、第1および第2の近接構成要素からアンプリコンを実質的に除去する洗浄ステップをさらに含むことを特徴とする請求項32に記載の方法。
【請求項38】
検出は定量的であることを特徴とする請求項32に記載の方法。
【請求項39】
前記アンプリコンを産生するステップは、連結ステップを含むことを特徴とする請求項32に記載の方法。
【請求項40】
増幅産物を検出することにより分析物を検出できる分析物の検出方法であって、
(i)(a)分析物と;
(b)分析物と複合体を形成することができて、且つ第1のオリゴヌクレオチド部に複合体形成している第1の分析物特異的結合単位を含む第1の近接構成要素であって、第1のオリゴヌクレオチド部は制限エンドヌクレアーゼ認識部位、DNAポリメラーゼによる第1のオリゴヌクレオチド部の3’伸長を妨げる3’キャップ、および制限エンドヌクレアーゼ認識部位の3’である第1の部分を含む第1の近接構成要素と;
(c)分析物と複合体を形成することができて、且つ第2のオリゴヌクレオチド部に複合体形成している第2の分析物特異的結合単位を含む第2の近接構成要素であって、第2のオリゴヌクレオチド部は第1のオリゴヌクレオチド部の第1の部分とハイブリッドを形成できる第1の部分を含む第2の近接構成要素と;
を組み合わせるステップ;
(ii)第1および第2のオリゴヌクレオチド部の第1の部分ならびに第2のオリゴヌクレオチドの3’末端を含むハイブリッドを形成するステップ;
(iii)第2のオリゴヌクレオチド部の3’末端を伸長することによって、二本鎖の第1のオリゴヌクレオチド部の制限エンドヌクレアーゼ認識部位を作製するステップ;
(iv)第1のオリゴヌクレオチド部の制限エンドヌクレアーゼ認識部位にニック形成するステップ;
(v)ニックから第1のオリゴヌクレオチド部を伸長して、第1のオリゴヌクレオチド部の下流部分を置換するステップ;
(vi)制限エンドヌクレアーゼ認識部位から鎖置換増幅して増幅産物を産生するステップ;および
(vii)増幅産物を検出するステップ;
を含むことを特徴とする分析物の検出方法。
【請求項41】
第2のオリゴヌクレオチド部は制限エンドヌクレアーゼ認識部位を含み、鎖置換増幅は第1および第2のオリゴヌクレオチド部の制限エンドヌクレアーゼ認識部位からのものであることを特徴とする請求項40に記載の方法。
【請求項42】
検出は定量的であることを特徴とする請求項40に記載の方法。
【請求項43】
第1のオリゴヌクレオチド部の5’末端は第1の分析物特異的結合単位に複合体形成しており、第2のオリゴヌクレオチド部の5’末端は第2の分析物特異的結合単位に複合体形成していることを特徴とする請求項40に記載の方法。
【請求項44】
増幅産物を検出することにより分析物を検出できる分析物の検出方法であって、
(i)(a)分析物と;
(b)分析物と複合体を形成することができて、且つ第1の部分を含む第1のオリゴヌクレオチド部に複合体形成している第1の分析物特異的結合単位を含む第1の近接構成要素と;
(c)分析物と複合体を形成することができて、且つ第1の部分を含む第2のオリゴヌクレオチド部に複合体形成している第2の分析物特異的結合単位を含む第2の近接構成要素と;
を組み合わせるステップ;
(ii)第1のオリゴヌクレオチド部の第1の部分および第2のオリゴヌクレオチド部の第1の部分を含む少なくとも1つのハイブリッドを形成するステップであって、その少なくとも一つのハイブリッドは、伸長されて5’末端を含む第1のオリゴヌクレオチド部の第2の部分の相補体を形成することができる3’末端を含むステップ;
(iii)アンプリコンを産生するステップ;
(iv)アンプリコンを増幅して増幅産物を産生するステップ;および
(v)増幅産物を検出するステップ;
を含むことを特徴とする分析物の検出方法。
【請求項45】
少なくとも1つのハイブリッドは、第1および第2のオリゴヌクレオチドの第1の部分を含むことを特徴とする請求項44に記載の方法。
【請求項46】
第1のハイブリッドは第1のオリゴヌクレオチド部の第1の部分およびスプリントオリゴヌクレオチドの第1の部分を含み、且つ第2のハイブリッドは第2のオリゴヌクレオチド部の第1の部分およびスプリントオリゴヌクレオチドの第2の部分を含む2つのハイブリッドが形成されることを特徴とする請求項44に記載の方法。
【請求項47】
前記アンプリコンを産生するステップは、3’末端を伸長することを含むことを特徴とする請求項44に記載の方法。
【請求項48】
前記アンプリコンを産生するステップは、(i)第1のオリゴヌクレオチド部の第2の部分と第3のオリゴヌクレオチドとの間にハイブリッドを形成すること、および(ii)少なくとも1つのハイブリッドの3’末端を第3のオリゴヌクレオチドの5’末端に連結することを含むことを特徴とする請求項44に記載の方法。
【請求項49】
増幅産物を検出することにより分析物を検出できる分析物の検出方法であって、
(i)(a)少なくとも2つの抗原特異的結合性部位を含む分析物と;
(b)第1の部分を含む第1のオリゴヌクレオチド部に複合体形成している第1の抗原を含む第1の近接構成要素であって、第1の抗原は分析物の抗原結合性部位の1つと複合体を形成することができる第1の近接構成要素と;
(c)第1の部分を含む第2のオリゴヌクレオチド部に複合体形成している第2の抗原を含む第2の近接構成要素であって、第2の抗原は分析物の別の抗原結合性部位と複合体を形成することができる第2の近接構成要素と;
を組み合わせるステップ;
(ii)第1および第2のオリゴヌクレオチド部の第1の部分を含むハイブリッドを形成してアンプリコンを産生するステップ;
(iii)アンプリコンを増幅して増幅産物を産生するステップ;および
(iv)増幅産物を検出するステップ;
を含むことを特徴とする分析物の検出方法。
【請求項50】
検出は定量的であることを特徴とする請求項49に記載の方法。
【請求項51】
検出物は抗原特異的免疫グロブリンであることを特徴とする請求項49に記載の方法。
【請求項52】
ハイブリッドは第1または第2のオリゴヌクレオチド部の3’末端を含むことを特徴とする請求項49に記載の方法。
【請求項53】
キットであって、
(a)分析物と複合体を形成することができて、且つ第1の部分および第2の部分を含む第1のオリゴヌクレオチド部に複合体形成している第1の分析物特異的結合単位を含む第1の近接構成要素と;
(b)分析物と複合体を形成することができて、第2のオリゴヌクレオチド部に複合体形成している第2の分析物特異的結合単位を含む第2の近接構成要素であって、第2のオリゴヌクレオチド部は第1のオリゴヌクレオチドの第1の部分とハイブリッド形成できる部分を含む第2の近接構成要素と;
(c)第1のオリゴヌクレオチド部の第2の部分とハイブリッド形成できる捕捉オリゴヌクレオチドを含む支持体と;
を含むことを特徴とするキット。
【請求項54】
第1のオリゴヌクレオチドの第1および第2の部分はオーバーラップする塩基を含まないことを特徴とする請求項53に記載のキット。
【請求項55】
第1のオリゴヌクレオチドの第1および第2の部分は隣接した塩基を共に含むことを特徴とする請求項53に記載のキット。
【請求項56】
第1のオリゴヌクレオチドの第1および第2の部分は同じ塩基配列であることを特徴とする請求項53に記載のキット。
【請求項57】
捕捉オリゴヌクレオチドまたは第1のオリゴヌクレオチド部は、制限エンドヌクレアーゼ認識部位の1つの鎖を含むことを特徴とする請求項53に記載のキット。
【請求項58】
捕捉オリゴヌクレオチドは二本鎖部分を含むことを特徴とする請求項54に記載のキット。
【請求項59】
捕捉オリゴヌクレオチドの二本鎖部分はヘアピンループを含むことを特徴とする請求項58に記載のキット。
【請求項60】
捕捉オリゴヌクレオチドは、第1のオリゴヌクレオチド部とハイブリッドを形成できるRNA部分を含むことを特徴とする請求項53に記載のキット。
【請求項61】
第1のオリゴヌクレオチド部は、捕捉オリゴヌクレオチドとハイブリッドを形成できるRNA部分を含むことを特徴とする請求項53に記載のキット。
【請求項62】
キットであって、
(a)分析物と複合体を形成することができて、且つ第1の部分を含むテザーオリゴヌクレオチド部に複合体形成している第1の分析物特異的結合単位を含む第1の近接構成要素と;
(b)分析物と複合体を形成することができて、且つ第1の部分を含むオリゴヌクレオチド部に複合体形成している第2の分析物特異的結合単位を含む第2の近接構成要素と;
(c)(i)オリゴヌクレオチド部の第1の部分とハイブリッド形成できる第1の部分および(ii)テザーオリゴヌクレオチド部の第1の部分とハイブリッド形成できる第2の部分を含むスプリントオリゴヌクレオチドと;
を含むことを特徴とするキット。
【請求項63】
テザーオリゴヌクレオチドの3’末端は第1の分析物特異的結合単位に複合体形成しており、オリゴヌクレオチド部の5’末端は第2の分析物特異的結合単位に複合体形成していることを特徴とする請求項62に記載のキット。
【請求項64】
スプリントオリゴヌクレオチドは、第2の部分の3’に位置する制限エンドヌクレアーゼ認識部位ならびに制限エンドヌクレアーゼ認識部位の3’および第1の部分の5’に位置する第1のプライマー結合性部位をさらに含み、オリゴヌクレオチド部は、オリゴヌクレオチド部の第1の部分の5’に位置する第2のプライマー結合性部位を含むことを特徴とする請求項62に記載のキット。
【請求項65】
キットであって、
(a)分析物と複合体を形成することができて、且つ第1の部分を含む第1のテザーオリゴヌクレオチド部に複合体形成している第1の分析物特異的結合単位を含む第1の近接構成要素と;
(b)分析物と複合体を形成することができて、且つ第1の部分を含む第2のテザーオリゴヌクレオチド部に複合体形成している第2の分析物特異的結合単位を含む第2の近接構成要素と;
(c)(i)第1のテザーオリゴヌクレオチド部の第1の部分とハイブリッド形成できる第1の部分および(ii)第2のスプリントオリゴヌクレオチドの第2の部分とハイブリッド形成できる第2の部分を含む第1のスプリントオリゴヌクレオチドと;
(d)(i)第2のテザーオリゴヌクレオチド部の第1の部分とハイブリッド形成できる第1の部分および(ii)第1のスプリントオリゴヌクレオチドの第2の部分とハイブリッド形成できる第2の部分を含む第2のスプリントオリゴヌクレオチドと;
を含むことを特徴とするキット。
【請求項66】
第1のテザーオリゴヌクレオチドの3’または5’末端は第1の分析物特異的結合単位に複合体形成しており、第2のテザーオリゴヌクレオチドの3’末端は第2の分析物特異的結合単位に複合体形成していることを特徴とする請求項65に記載のキット。
【請求項67】
キットであって、
(a)分析物と複合体を形成することができて、且つ第1のオリゴヌクレオチド部に複合体形成している第1の分析物特異的結合単位を含む第1の近接構成要素であって、第1のオリゴヌクレオチド部は制限エンドヌクレアーゼ認識部位、DNAポリメラーゼによる第1のオリゴヌクレオチド部の3’伸長を妨げる3’キャップ、および制限エンドヌクレアーゼ認識部位の3’である第1の部分を含む第1の近接構成要素と;
(b)分析物と複合体を形成することができて、且つ第2のオリゴヌクレオチド部に複合体形成している第2の分析物特異的結合単位を含む第2の近接構成要素であって、第2のオリゴヌクレオチド部は第1のオリゴヌクレオチド部の第1の部分とハイブリッドを形成することができる第1の部分を含む第2の近接構成要素と;
を含むことを特徴とするキット。
【請求項68】
第2のオリゴヌクレオチド部は、第1の部分の5’である制限エンドヌクレアーゼ認識部位を含むことを特徴とする請求項67に記載のキット。
【請求項69】
第1のオリゴヌクレオチド部の5’末端は第1の分析物特異的結合単位に複合体形成しており、第2のオリゴヌクレオチド部の5’末端は第2の分析物特異的結合単位に複合体形成していることを特徴とする請求項67に記載のキット。
【請求項70】
キットであって、
(a)第1の部分を含む第1のオリゴヌクレオチド部に複合体形成している第1の抗原を含む第1の近接構成要素であって、第1の抗原は少なくとも2つの抗原特異的結合性部位を含む分析物の抗原結合性部位と複合体を形成することができる第1の近接構成要素と;
(b)第1の部分を含む第2のオリゴヌクレオチド部に複合体形成している第2の抗原を含む第2の近接構成要素であって、第2の抗原は分析物の別の抗原結合性部位と複合体を形成することができる第2の近接構成要素と;
を含むことを特徴とするキット。
【請求項71】
非核酸分析物の定量方法であって、
(i)(a)オリゴヌクレオチド部に複合体形成している分析物特異的結合単位をそれぞれ含む第1および第2の近接構成要素と、
(b)既知の出発量の核酸対照と、
(c)既知の量の非核酸分析物と、
を含む複数の標準試料を形成することにより、第1および第2のオリゴヌクレオチド部の部分を含むアンプリコンを形成するステップ;
(ii)(a)オリゴヌクレオチド部に複合体形成している分析物特異的結合単位をそれぞれ含む第1および第2の近接構成要素と、
(b)同じ既知の出発量の核酸対照と、
(c)未知の量の非核酸分析物と、
を含む少なくとも1つの試験試料を形成することにより、第1および第2のオリゴヌクレオチド部の部分を含むアンプリコンを形成するステップ;
(iii)アンプリコンおよび核酸対照を増幅するステップ;
(iv)増幅したアンプリコンおよび核酸対照を測定して表示測定値を決定するステップ;
(v)複数の標準試料の表示測定値から検量曲線を決定するステップ;ならびに
(vi)少なくとも1つの試験試料の表示測定値を検量曲線と比較して試験試料中の非核酸分析物の量を決定するステップ;
を含むことを特徴とする非核酸分析物の定量方法。
【請求項1】
増幅産物を検出することにより分析物を検出できる分析物の検出方法であって、
(i)(a)分析物と;
(b)分析物と複合体を形成することができて、且つ第1の部分および第2の部分を含む第1のオリゴヌクレオチド部に複合体形成している第1の分析物特異的結合単位を含む第1の近接構成要素と;
(c)分析物と複合体を形成することができて、且つ第2のオリゴヌクレオチド部に複合体形成している第2の分析物特異的結合単位を含む第2の近接構成要素であって、第2のオリゴヌクレオチド部は第1のオリゴヌクレオチドの第1の部分とハイブリッド形成できる部分を含む第2の近接構成要素と;
(d)第1のオリゴヌクレオチド部の第2の部分とハイブリッド形成できる捕捉オリゴヌクレオチドを含む支持体と;
を組み合わせるステップ;
(ii)第1のオリゴヌクレオチド部の第1の部分と第2のオリゴヌクレオチド部の部分とを含むハイブリッドを形成するステップ;
(iii)3’末端を伸長してアンプリコンを産生するステップ;
(iv)アンプリコンを増幅して増幅産物を産生するステップ;および
(v)増幅産物を検出するステップ;
を含むことを特徴とする分析物の検出方法。
【請求項2】
第1のオリゴヌクレオチドの第1および第2の部分はオーバーラップする塩基を含まないことを特徴とする請求項1に記載の方法。
【請求項3】
第1のオリゴヌクレオチドの第1および第2の部分は共に隣接した塩基を含むことを特徴とする請求項1に記載の方法。
【請求項4】
第1のオリゴヌクレオチドの第1および第2の部分は同じ塩基配列であることを特徴とする請求項1に記載の方法。
【請求項5】
ハイブリッドは第1または第2のオリゴヌクレオチド部の3’末端を含み、前記アンプリコンを産生するステップは3’末端を伸長することを含むことを特徴とする請求項1に記載の方法。
【請求項6】
前記アンプリコンを産生するステップは、連結ステップを含むことを特徴とする請求項1に記載の方法。
【請求項7】
前記組み合わせるステップの後に、捕捉オリゴヌクレオチドと第1のオリゴヌクレオチド部との間にハイブリッドを形成するステップを含むことを特徴とする請求項1に記載の方法。
【請求項8】
前記捕捉オリゴヌクレオチドと第1のオリゴヌクレオチド部との間にハイブリッドを形成するステップの後に、支持体を洗浄するステップをさらに含むことを特徴とする請求項7に記載の方法。
【請求項9】
前記支持体を洗浄するステップの後に、支持体から第1の近接構成要素を放出するステップをさらに含むことを特徴とする請求項8に記載の方法。
【請求項10】
捕捉オリゴヌクレオチドと第1のオリゴヌクレオチド部との間のハイブリッドは制限エンドヌクレアーゼ認識部位を含み、且つ前記放出するステップは同源の制限エンドヌクレアーゼでその部位を開裂することを含むことを特徴とする請求項9に記載の方法。
【請求項11】
捕捉オリゴヌクレオチドと第1のオリゴヌクレオチド部との間のハイブリッドをポリメラーゼ触媒伸長して制限エンドヌクレアーゼ認識部位を形成するステップをさらに含み、前記放出するステップは同源の制限エンドヌクレアーゼでその部位を開裂することを含むことを特徴とする請求項9に記載の方法。
【請求項12】
放出するステップは、捕捉オリゴヌクレオチドと第1のオリゴヌクレオチド部との間のハイブリッドの物理的解離によるものであることを特徴とする請求項9に記載の方法。
【請求項13】
放出するステップは、物理的、化学的または酵素的開裂であることを特徴とする請求項9に記載の方法。
【請求項14】
放出するステップは、捕捉オリゴヌクレオチドの二本鎖部分を伸長して、捕捉オリゴヌクレオチドと第1のオリゴヌクレオチド部との間のハイブリッドから第1のオリゴヌクレオチド部を置換することを含むことを特徴とする請求項9に記載の方法。
【請求項15】
捕捉オリゴヌクレオチドの二本鎖部分はヘアピンループを含むことを特徴とする請求項14に記載の方法。
【請求項16】
放出するステップは、第1のオリゴヌクレオチド部の二本鎖部分を伸長して、捕捉オリゴヌクレオチドと第1のオリゴヌクレオチド部との間のハイブリッドから捕捉オリゴヌクレオチドを置換することを含むことを特徴とする請求項9に記載の方法。
【請求項17】
二本鎖部分はヘアピンループを含むことを特徴とする請求項16に記載の方法。
【請求項18】
捕捉オリゴヌクレオチドと第1のオリゴヌクレオチド部との間のハイブリッドの一本鎖または二本鎖はRNAを含み、且つ放出するステップは前記一本鎖または二本鎖をRNアーゼで分解することを含むことを特徴とする請求項9に記載の方法。
【請求項19】
前記増幅するステップは、ポリメラーゼ連鎖反応、鎖置換増幅、好熱性鎖置換増幅、自己保持配列複製、核酸配列に基づく増幅、Qβレプリカーゼシステム、リガーゼ連鎖反応および転写介在増幅からなる群から選択される方法によるものであることを特徴とする請求項1に記載の方法。
【請求項20】
検出は定量的であることを特徴とする請求項1に記載の方法。
【請求項21】
増幅産物を検出することにより分析物を検出できる分析物の検出方法であって、
(i)(a)分析物と;
(b)分析物と複合体を形成することができて、且つ第1の部分および第2の部分を含むテザーオリゴヌクレオチド部に複合体形成している第1の分析物特異的結合単位を含む第1の近接構成要素と;
(c)分析物と複合体を形成することができて、且つ第1の部分を含むオリゴヌクレオチド部に複合体形成している第2の分析物特異的結合単位を含む第2の近接構成要素と;
(d)(i)オリゴヌクレオチド部の第1の部分とハイブリッド形成できる第1の部分および(ii)テザーオリゴヌクレオチド部の第1の部分とハイブリッド形成できる第2の部分を含むスプリントオリゴヌクレオチドと;
を組み合わせるステップ;
(ii)(a)オリゴヌクレオチド部の第1の部分、スプリントオリゴヌクレオチドの第1の部分、および、オリゴヌクレオチド部またはスプリントオリゴヌクレオチドのいずれかの伸長可能な末端を含む第1のハイブリッドと;および
(b)テザーオリゴヌクレオチドの第1の部分およびテザーオリゴヌクレオチドの第2の部分を含む第2のハイブリッドと;
を形成するステップ;
(iii)伸長可能な末端を伸長することによってアンプリコンを産生するステップ;
(iv)アンプリコンを増幅して増幅産物を産生するステップ;
(v)増幅産物を検出するステップ;
を含むことを特徴とする分析物の検出方法。
【請求項22】
オリゴヌクレオチド部が伸長可能な末端を含むことを特徴とする請求項21に記載の方法。
【請求項23】
スプリントオリゴヌクレオチドが伸長可能な末端を含むことを特徴とする請求項21に記載の方法。
【請求項24】
前記伸長可能な末端を伸長するステップは、テザーオリゴヌクレオチドを第2のハイブリッドから置換することを特徴とする請求項21に記載の方法。
【請求項25】
テザーオリゴヌクレオチドは、鎖置換により置換されることを特徴とする請求項24に記載の方法。
【請求項26】
テザーオリゴヌクレオチドは、3’−5’エキソヌクレアーゼ活性を有するポリメラーゼで触媒された加水分解で置換されることを特徴とする請求項24に記載の方法。
【請求項27】
前記増幅するステップは、ポリメラーゼ連鎖反応、鎖置換増幅、好熱性鎖置換増幅、自己保持配列複製、核酸配列に基づく増幅、Qβレプリカーゼシステム、リガーゼ連鎖反応および転写介在増幅からなる群から選択される方法によるものであることを特徴とする請求項21に記載の方法。
【請求項28】
スプリントオリゴヌクレオチドは、第2の部分の3’に位置する制限エンドヌクレアーゼ認識部位ならびに制限エンドヌクレアーゼ認識部位の3’および第1の部分の5’に位置する第1のプライマー結合性部位をさらに含み、オリゴヌクレオチド部はオリゴヌクレオチド部の第1の部分の5’に位置する第2のプライマー結合性部位を含むことを特徴とする請求項21に記載の方法。
【請求項29】
前記増幅するステップは、それぞれ第1および第2のプライマー結合性部位とハイブリッド形成する第1および第2のプライマーならびにその同源の認識部位にニック形成する制限エンドヌクレアーゼを使用することを含む鎖置換増幅によるものであることを特徴とする請求項28に記載の方法。
【請求項30】
検出は定量的であることを特徴とする請求項21に記載の方法。
【請求項31】
前記アンプリコンを産生するステップは、連結ステップを含むことを特徴とする請求項21に記載の方法。
【請求項32】
増幅産物を検出することにより分析物を検出できる分析物の検出方法であって、
(i)(a)分析物と;
(b)分析物と複合体を形成することができて、且つ第1の部分を含む第1のテザーオリゴヌクレオチド部に複合体形成している第1の分析物特異的結合単位を含む第1の近接構成要素と;
(c)分析物と複合体を形成することができて、且つ第1の部分を含む第2のテザーオリゴヌクレオチド部に複合体形成している第2の分析物特異的結合単位を含む第2の近接構成要素と;
(d)(i)第1のテザーオリゴヌクレオチド部の第1の部分とハイブリッド形成できる第1の部分および(ii)第2のスプリントオリゴヌクレオチドの第2の部分とハイブリッド形成できる第2の部分を含む第1のスプリントオリゴヌクレオチドと;
(e)(i)第2のテザーオリゴヌクレオチド部の第1の部分とハイブリッド形成できる第1の部分および(ii)第1のスプリントオリゴヌクレオチドの第2の部分とハイブリッド形成できる第2の部分を含む第2のスプリントオリゴヌクレオチドと;
を組み合わせるステップ;
(ii)(a)第1のテザーオリゴヌクレオチド部の第1の部分および第1のスプリントオリゴヌクレオチドの第1の部分を含む第1のハイブリッドと;
(b)第2のテザーオリゴヌクレオチドの第1の部分および第2のスプリントオリゴヌクレオチドの第1の部分を含む第2のハイブリッドと;
(c)第1および第2のスプリントオリゴヌクレオチドの第2の部分、第1のスプリントオリゴヌクレオチドの3’末端、ならびに第2のスプリントオリゴヌクレオチドの3’末端を含む第3のハイブリッドと;
を形成するステップ;
(iii)第3のハイブリッドの3’末端を伸長することによってアンプリコンを産生するステップ;
(iv)アンプリコンを増幅して増幅産物を産生するステップ;および
(v)増幅産物を検出するステップ;
を含むことを特徴とする分析物の検出方法。
【請求項33】
第1のテザーオリゴヌクレオチドの3’末端または5’末端は第1の分析物特異的結合単位に複合体形成し、第2のテザーオリゴヌクレオチドの3’末端は第2の分析物特異的結合単位に複合体形成することを特徴とする請求項32に記載の方法。
【請求項34】
前記アンプリコンを産生するステップは、第1および第2のテザーオリゴヌクレオチドを第1および第2のハイブリッドから置換することを特徴とする請求項32に記載の方法。
【請求項35】
第1および第2のテザーオリゴヌクレオチドは、鎖置換により置換されることを特徴とする請求項32に記載の方法。
【請求項36】
第1および第2のテザーオリゴヌクレオチドは、3’−5’エキソヌクレアーゼ活性を有するポリメラーゼで触媒された加水分解で置換されることを特徴とする請求項32に記載の方法。
【請求項37】
前記伸長するステップの後で且つ前記増幅するステップの前に、第1および第2の近接構成要素からアンプリコンを実質的に除去する洗浄ステップをさらに含むことを特徴とする請求項32に記載の方法。
【請求項38】
検出は定量的であることを特徴とする請求項32に記載の方法。
【請求項39】
前記アンプリコンを産生するステップは、連結ステップを含むことを特徴とする請求項32に記載の方法。
【請求項40】
増幅産物を検出することにより分析物を検出できる分析物の検出方法であって、
(i)(a)分析物と;
(b)分析物と複合体を形成することができて、且つ第1のオリゴヌクレオチド部に複合体形成している第1の分析物特異的結合単位を含む第1の近接構成要素であって、第1のオリゴヌクレオチド部は制限エンドヌクレアーゼ認識部位、DNAポリメラーゼによる第1のオリゴヌクレオチド部の3’伸長を妨げる3’キャップ、および制限エンドヌクレアーゼ認識部位の3’である第1の部分を含む第1の近接構成要素と;
(c)分析物と複合体を形成することができて、且つ第2のオリゴヌクレオチド部に複合体形成している第2の分析物特異的結合単位を含む第2の近接構成要素であって、第2のオリゴヌクレオチド部は第1のオリゴヌクレオチド部の第1の部分とハイブリッドを形成できる第1の部分を含む第2の近接構成要素と;
を組み合わせるステップ;
(ii)第1および第2のオリゴヌクレオチド部の第1の部分ならびに第2のオリゴヌクレオチドの3’末端を含むハイブリッドを形成するステップ;
(iii)第2のオリゴヌクレオチド部の3’末端を伸長することによって、二本鎖の第1のオリゴヌクレオチド部の制限エンドヌクレアーゼ認識部位を作製するステップ;
(iv)第1のオリゴヌクレオチド部の制限エンドヌクレアーゼ認識部位にニック形成するステップ;
(v)ニックから第1のオリゴヌクレオチド部を伸長して、第1のオリゴヌクレオチド部の下流部分を置換するステップ;
(vi)制限エンドヌクレアーゼ認識部位から鎖置換増幅して増幅産物を産生するステップ;および
(vii)増幅産物を検出するステップ;
を含むことを特徴とする分析物の検出方法。
【請求項41】
第2のオリゴヌクレオチド部は制限エンドヌクレアーゼ認識部位を含み、鎖置換増幅は第1および第2のオリゴヌクレオチド部の制限エンドヌクレアーゼ認識部位からのものであることを特徴とする請求項40に記載の方法。
【請求項42】
検出は定量的であることを特徴とする請求項40に記載の方法。
【請求項43】
第1のオリゴヌクレオチド部の5’末端は第1の分析物特異的結合単位に複合体形成しており、第2のオリゴヌクレオチド部の5’末端は第2の分析物特異的結合単位に複合体形成していることを特徴とする請求項40に記載の方法。
【請求項44】
増幅産物を検出することにより分析物を検出できる分析物の検出方法であって、
(i)(a)分析物と;
(b)分析物と複合体を形成することができて、且つ第1の部分を含む第1のオリゴヌクレオチド部に複合体形成している第1の分析物特異的結合単位を含む第1の近接構成要素と;
(c)分析物と複合体を形成することができて、且つ第1の部分を含む第2のオリゴヌクレオチド部に複合体形成している第2の分析物特異的結合単位を含む第2の近接構成要素と;
を組み合わせるステップ;
(ii)第1のオリゴヌクレオチド部の第1の部分および第2のオリゴヌクレオチド部の第1の部分を含む少なくとも1つのハイブリッドを形成するステップであって、その少なくとも一つのハイブリッドは、伸長されて5’末端を含む第1のオリゴヌクレオチド部の第2の部分の相補体を形成することができる3’末端を含むステップ;
(iii)アンプリコンを産生するステップ;
(iv)アンプリコンを増幅して増幅産物を産生するステップ;および
(v)増幅産物を検出するステップ;
を含むことを特徴とする分析物の検出方法。
【請求項45】
少なくとも1つのハイブリッドは、第1および第2のオリゴヌクレオチドの第1の部分を含むことを特徴とする請求項44に記載の方法。
【請求項46】
第1のハイブリッドは第1のオリゴヌクレオチド部の第1の部分およびスプリントオリゴヌクレオチドの第1の部分を含み、且つ第2のハイブリッドは第2のオリゴヌクレオチド部の第1の部分およびスプリントオリゴヌクレオチドの第2の部分を含む2つのハイブリッドが形成されることを特徴とする請求項44に記載の方法。
【請求項47】
前記アンプリコンを産生するステップは、3’末端を伸長することを含むことを特徴とする請求項44に記載の方法。
【請求項48】
前記アンプリコンを産生するステップは、(i)第1のオリゴヌクレオチド部の第2の部分と第3のオリゴヌクレオチドとの間にハイブリッドを形成すること、および(ii)少なくとも1つのハイブリッドの3’末端を第3のオリゴヌクレオチドの5’末端に連結することを含むことを特徴とする請求項44に記載の方法。
【請求項49】
増幅産物を検出することにより分析物を検出できる分析物の検出方法であって、
(i)(a)少なくとも2つの抗原特異的結合性部位を含む分析物と;
(b)第1の部分を含む第1のオリゴヌクレオチド部に複合体形成している第1の抗原を含む第1の近接構成要素であって、第1の抗原は分析物の抗原結合性部位の1つと複合体を形成することができる第1の近接構成要素と;
(c)第1の部分を含む第2のオリゴヌクレオチド部に複合体形成している第2の抗原を含む第2の近接構成要素であって、第2の抗原は分析物の別の抗原結合性部位と複合体を形成することができる第2の近接構成要素と;
を組み合わせるステップ;
(ii)第1および第2のオリゴヌクレオチド部の第1の部分を含むハイブリッドを形成してアンプリコンを産生するステップ;
(iii)アンプリコンを増幅して増幅産物を産生するステップ;および
(iv)増幅産物を検出するステップ;
を含むことを特徴とする分析物の検出方法。
【請求項50】
検出は定量的であることを特徴とする請求項49に記載の方法。
【請求項51】
検出物は抗原特異的免疫グロブリンであることを特徴とする請求項49に記載の方法。
【請求項52】
ハイブリッドは第1または第2のオリゴヌクレオチド部の3’末端を含むことを特徴とする請求項49に記載の方法。
【請求項53】
キットであって、
(a)分析物と複合体を形成することができて、且つ第1の部分および第2の部分を含む第1のオリゴヌクレオチド部に複合体形成している第1の分析物特異的結合単位を含む第1の近接構成要素と;
(b)分析物と複合体を形成することができて、第2のオリゴヌクレオチド部に複合体形成している第2の分析物特異的結合単位を含む第2の近接構成要素であって、第2のオリゴヌクレオチド部は第1のオリゴヌクレオチドの第1の部分とハイブリッド形成できる部分を含む第2の近接構成要素と;
(c)第1のオリゴヌクレオチド部の第2の部分とハイブリッド形成できる捕捉オリゴヌクレオチドを含む支持体と;
を含むことを特徴とするキット。
【請求項54】
第1のオリゴヌクレオチドの第1および第2の部分はオーバーラップする塩基を含まないことを特徴とする請求項53に記載のキット。
【請求項55】
第1のオリゴヌクレオチドの第1および第2の部分は隣接した塩基を共に含むことを特徴とする請求項53に記載のキット。
【請求項56】
第1のオリゴヌクレオチドの第1および第2の部分は同じ塩基配列であることを特徴とする請求項53に記載のキット。
【請求項57】
捕捉オリゴヌクレオチドまたは第1のオリゴヌクレオチド部は、制限エンドヌクレアーゼ認識部位の1つの鎖を含むことを特徴とする請求項53に記載のキット。
【請求項58】
捕捉オリゴヌクレオチドは二本鎖部分を含むことを特徴とする請求項54に記載のキット。
【請求項59】
捕捉オリゴヌクレオチドの二本鎖部分はヘアピンループを含むことを特徴とする請求項58に記載のキット。
【請求項60】
捕捉オリゴヌクレオチドは、第1のオリゴヌクレオチド部とハイブリッドを形成できるRNA部分を含むことを特徴とする請求項53に記載のキット。
【請求項61】
第1のオリゴヌクレオチド部は、捕捉オリゴヌクレオチドとハイブリッドを形成できるRNA部分を含むことを特徴とする請求項53に記載のキット。
【請求項62】
キットであって、
(a)分析物と複合体を形成することができて、且つ第1の部分を含むテザーオリゴヌクレオチド部に複合体形成している第1の分析物特異的結合単位を含む第1の近接構成要素と;
(b)分析物と複合体を形成することができて、且つ第1の部分を含むオリゴヌクレオチド部に複合体形成している第2の分析物特異的結合単位を含む第2の近接構成要素と;
(c)(i)オリゴヌクレオチド部の第1の部分とハイブリッド形成できる第1の部分および(ii)テザーオリゴヌクレオチド部の第1の部分とハイブリッド形成できる第2の部分を含むスプリントオリゴヌクレオチドと;
を含むことを特徴とするキット。
【請求項63】
テザーオリゴヌクレオチドの3’末端は第1の分析物特異的結合単位に複合体形成しており、オリゴヌクレオチド部の5’末端は第2の分析物特異的結合単位に複合体形成していることを特徴とする請求項62に記載のキット。
【請求項64】
スプリントオリゴヌクレオチドは、第2の部分の3’に位置する制限エンドヌクレアーゼ認識部位ならびに制限エンドヌクレアーゼ認識部位の3’および第1の部分の5’に位置する第1のプライマー結合性部位をさらに含み、オリゴヌクレオチド部は、オリゴヌクレオチド部の第1の部分の5’に位置する第2のプライマー結合性部位を含むことを特徴とする請求項62に記載のキット。
【請求項65】
キットであって、
(a)分析物と複合体を形成することができて、且つ第1の部分を含む第1のテザーオリゴヌクレオチド部に複合体形成している第1の分析物特異的結合単位を含む第1の近接構成要素と;
(b)分析物と複合体を形成することができて、且つ第1の部分を含む第2のテザーオリゴヌクレオチド部に複合体形成している第2の分析物特異的結合単位を含む第2の近接構成要素と;
(c)(i)第1のテザーオリゴヌクレオチド部の第1の部分とハイブリッド形成できる第1の部分および(ii)第2のスプリントオリゴヌクレオチドの第2の部分とハイブリッド形成できる第2の部分を含む第1のスプリントオリゴヌクレオチドと;
(d)(i)第2のテザーオリゴヌクレオチド部の第1の部分とハイブリッド形成できる第1の部分および(ii)第1のスプリントオリゴヌクレオチドの第2の部分とハイブリッド形成できる第2の部分を含む第2のスプリントオリゴヌクレオチドと;
を含むことを特徴とするキット。
【請求項66】
第1のテザーオリゴヌクレオチドの3’または5’末端は第1の分析物特異的結合単位に複合体形成しており、第2のテザーオリゴヌクレオチドの3’末端は第2の分析物特異的結合単位に複合体形成していることを特徴とする請求項65に記載のキット。
【請求項67】
キットであって、
(a)分析物と複合体を形成することができて、且つ第1のオリゴヌクレオチド部に複合体形成している第1の分析物特異的結合単位を含む第1の近接構成要素であって、第1のオリゴヌクレオチド部は制限エンドヌクレアーゼ認識部位、DNAポリメラーゼによる第1のオリゴヌクレオチド部の3’伸長を妨げる3’キャップ、および制限エンドヌクレアーゼ認識部位の3’である第1の部分を含む第1の近接構成要素と;
(b)分析物と複合体を形成することができて、且つ第2のオリゴヌクレオチド部に複合体形成している第2の分析物特異的結合単位を含む第2の近接構成要素であって、第2のオリゴヌクレオチド部は第1のオリゴヌクレオチド部の第1の部分とハイブリッドを形成することができる第1の部分を含む第2の近接構成要素と;
を含むことを特徴とするキット。
【請求項68】
第2のオリゴヌクレオチド部は、第1の部分の5’である制限エンドヌクレアーゼ認識部位を含むことを特徴とする請求項67に記載のキット。
【請求項69】
第1のオリゴヌクレオチド部の5’末端は第1の分析物特異的結合単位に複合体形成しており、第2のオリゴヌクレオチド部の5’末端は第2の分析物特異的結合単位に複合体形成していることを特徴とする請求項67に記載のキット。
【請求項70】
キットであって、
(a)第1の部分を含む第1のオリゴヌクレオチド部に複合体形成している第1の抗原を含む第1の近接構成要素であって、第1の抗原は少なくとも2つの抗原特異的結合性部位を含む分析物の抗原結合性部位と複合体を形成することができる第1の近接構成要素と;
(b)第1の部分を含む第2のオリゴヌクレオチド部に複合体形成している第2の抗原を含む第2の近接構成要素であって、第2の抗原は分析物の別の抗原結合性部位と複合体を形成することができる第2の近接構成要素と;
を含むことを特徴とするキット。
【請求項71】
非核酸分析物の定量方法であって、
(i)(a)オリゴヌクレオチド部に複合体形成している分析物特異的結合単位をそれぞれ含む第1および第2の近接構成要素と、
(b)既知の出発量の核酸対照と、
(c)既知の量の非核酸分析物と、
を含む複数の標準試料を形成することにより、第1および第2のオリゴヌクレオチド部の部分を含むアンプリコンを形成するステップ;
(ii)(a)オリゴヌクレオチド部に複合体形成している分析物特異的結合単位をそれぞれ含む第1および第2の近接構成要素と、
(b)同じ既知の出発量の核酸対照と、
(c)未知の量の非核酸分析物と、
を含む少なくとも1つの試験試料を形成することにより、第1および第2のオリゴヌクレオチド部の部分を含むアンプリコンを形成するステップ;
(iii)アンプリコンおよび核酸対照を増幅するステップ;
(iv)増幅したアンプリコンおよび核酸対照を測定して表示測定値を決定するステップ;
(v)複数の標準試料の表示測定値から検量曲線を決定するステップ;ならびに
(vi)少なくとも1つの試験試料の表示測定値を検量曲線と比較して試験試料中の非核酸分析物の量を決定するステップ;
を含むことを特徴とする非核酸分析物の定量方法。
【図1A】


【図1B】


【図1C】


【図1D】


【図1E】


【図1F】


【図1G】


【図1H】


【図1I】


【図1J】


【図2A】


【図2B】


【図2C】


【図2D】


【図2E】


【図3A】


【図3B】


【図3C】


【図3D】


【図3E】


【図3F】


【図3G】


【図3H】


【図3I】


【図3J】


【図3K】


【図3L】


【図4A】


【図4B】


【図4C】


【図4D】


【図4E】


【図4EE】


【図4F】


【図4G】


【図4H】


【図4I】


【図5A】


【図5B】


【図5C】


【図5D】


【図6A】


【図6B】


【図6C】


【図6D】


【図6E】


【図6F】


【図6G】


【図6GG】


【図6H】


【図6I】


【図6J】


【図6K】


【図6L】


【図6M】


【図6N】


【図7A】


【図7B】


【図7C】


【図7D】


【図7E】


【図7F】


【図7G】


【図7H】


【図7I】


【図7J】


【図8A】


【図8B】


【図8C】


【図8D】


【図9】


【図10】


【図11A】


【図11B】


【図11C】


【図12】


【図13】


【図14A】


【図14B】


【図14C】


【図14D】


【図14E】


【図15A】


【図15B】




【図1B】


【図1C】


【図1D】


【図1E】


【図1F】


【図1G】


【図1H】


【図1I】


【図1J】


【図2A】


【図2B】


【図2C】


【図2D】


【図2E】


【図3A】


【図3B】


【図3C】


【図3D】


【図3E】


【図3F】


【図3G】


【図3H】


【図3I】


【図3J】


【図3K】


【図3L】


【図4A】


【図4B】


【図4C】


【図4D】


【図4E】


【図4EE】


【図4F】


【図4G】


【図4H】


【図4I】


【図5A】


【図5B】


【図5C】


【図5D】


【図6A】


【図6B】


【図6C】


【図6D】


【図6E】


【図6F】


【図6G】


【図6GG】


【図6H】


【図6I】


【図6J】


【図6K】


【図6L】


【図6M】


【図6N】


【図7A】


【図7B】


【図7C】


【図7D】


【図7E】


【図7F】


【図7G】


【図7H】


【図7I】


【図7J】


【図8A】


【図8B】


【図8C】


【図8D】


【図9】


【図10】


【図11A】


【図11B】


【図11C】


【図12】


【図13】


【図14A】


【図14B】


【図14C】


【図14D】


【図14E】


【図15A】


【図15B】


【公開番号】特開2012−125250(P2012−125250A)
【公開日】平成24年7月5日(2012.7.5)
【国際特許分類】
【外国語出願】
【出願番号】特願2012−37475(P2012−37475)
【出願日】平成24年2月23日(2012.2.23)
【分割の表示】特願2006−513098(P2006−513098)の分割
【原出願日】平成16年4月19日(2004.4.19)
【出願人】(595117091)ベクトン・ディキンソン・アンド・カンパニー (539)
【氏名又は名称原語表記】BECTON, DICKINSON AND COMPANY
【住所又は居所原語表記】1 BECTON DRIVE, FRANKLIN LAKES, NEW JERSEY 07417−1880, UNITED STATES OF AMERICA
【Fターム(参考)】
【公開日】平成24年7月5日(2012.7.5)
【国際特許分類】
【出願番号】特願2012−37475(P2012−37475)
【出願日】平成24年2月23日(2012.2.23)
【分割の表示】特願2006−513098(P2006−513098)の分割
【原出願日】平成16年4月19日(2004.4.19)
【出願人】(595117091)ベクトン・ディキンソン・アンド・カンパニー (539)
【氏名又は名称原語表記】BECTON, DICKINSON AND COMPANY
【住所又は居所原語表記】1 BECTON DRIVE, FRANKLIN LAKES, NEW JERSEY 07417−1880, UNITED STATES OF AMERICA
【Fターム(参考)】
[ Back to top ]

