免疫応答調節剤の製造におけるTGF−β1インヒビターペプチドの使用
【課題】新規免疫応答調節剤の提供。
【解決手段】配列番号1に対応する配列を有するペプチドp144、配列番号2に対応する配列を有するペプチドp17、上記ペプチドと少なくとも90%の相同性を有するペプチド、またはその断片から選択されるTGF-β1を阻害するペプチドを含有する。配列番号3の配列で定義される断片p17(1-11)、配列番号4に対応する断片p17(1-11)am、および配列番号5の配列で定義される断片Acp17(1-11)amから選択される、TGF-β1を阻害するペプチド断片を含んでなる、免疫応答調節剤。
【解決手段】配列番号1に対応する配列を有するペプチドp144、配列番号2に対応する配列を有するペプチドp17、上記ペプチドと少なくとも90%の相同性を有するペプチド、またはその断片から選択されるTGF-β1を阻害するペプチドを含有する。配列番号3の配列で定義される断片p17(1-11)、配列番号4に対応する断片p17(1-11)am、および配列番号5の配列で定義される断片Acp17(1-11)amから選択される、TGF-β1を阻害するペプチド断片を含んでなる、免疫応答調節剤。
【発明の詳細な説明】
【発明の背景】
【0001】
発明の分野
本発明は、免疫応答調節剤の製造の分野に包含される。
【0002】
背景技術
TGF-β1(トランスフォーミング増殖因子β1)は、様々な効果を生じる免疫応答の総ての時期に存在する強力な免疫調節剤である。これは、リンパ球、マクロファージおよび樹状細胞などの強力な免疫系細胞調節薬として一般に知られている(Letterio, J.J., 1998)。
【0003】
TGF-β1の生物活性は、細胞分化のタイプおよび状態並びに他のサイトカインの存在によって大きく変化し、サイトカインの集まりのバランスが変化するとTGF-β1にも影響し、さらには免疫系の機能不全に関連した病変の発生の一因となる可能性もあることを示唆している。TGF-β1は、複雑な状況に依存した方法で免疫応答を調節しており、これは、様々な疾患の実験モデルを用いることによって並びにTGF-β1発現、その受容体または調節タンパク質に関する遺伝子組換えマウスの評価において明らかにされておいる。TGF-β1は、体液性、細胞傷害性および免疫寛容応答の発生および多数の感染性および自己免疫疾患の病理学的起源における免疫系細胞の機能および相互作用を調節する。
【0004】
Tリンパ球は、その発生の総ての時期においてTGF-β1によって明らかに調節される(Fontana A. et al., 1992)。TGF-β1の作用は、リンパ球の分化の状態およびそれが受け取る活性化シグナルの種類に従って変化する。ヒトリンパ球におけるTGF-β1の作用についての最初の研究において、IL-2依存性増殖および細胞溶解機能のインヒビターとしてTGF-β1を産生し、分泌するその能力が明らかにされた(Pardoux C. et al., 1997)。
【0005】
樹状細胞は、Tリンパ球応答の活性化における抗原提示細胞としてのその機能によって明確に分化されている白血球個体群である。それらは高度に特殊化した細胞個体群であり、表皮ランゲルハンス細胞およびリンパ節由来の小胞性樹状細胞が挙げられ、TGF-β1はそれらの分化およびそれらの活性の両方を調節する(Strobl H, Knapp W, 1999)。
【0006】
TGF-β1が、他のサイトカイン(TNF-α、SCFおよびGM-CSF)の存在によって誘導されるCD34+前駆体からイン・ビトロでの樹状細胞の機能的分化を高めることが確認されている。TGF-β1はまた、培養されている樹状細胞の生育力を増加させることによっても作用する。一方、この種類の細胞におけるTGF-β1の役割も、低特異性応答を阻害して自己免疫過程を回避する調節機構に関係していると思われる。
【0007】
B細胞Ig (免疫グロブリン)の分化、増殖および産生において、TGF-β1は、プレ-Bリンパ球および成熟B細胞の両方における主要組織適合性複合体II型(MHC-II)などある種の表面分子のレベルの阻害を介する調節機能を有する。一方、TGF-β1は一般にIg分泌を阻害するが、明らかにIgAの産生を誘導し、このために粘膜に関連した免疫応答において重要な役割を果たしている。総ての型のIgの産生のインヒビターとしてのTGF-β1の作用に対するほとんどの研究は、イン・ビトロで行われてきた。しかしながら、IgGおよびIgEを効果的に産生するには、オートクラインレベル(autocrine level)で作用するリンパ球培養物中に所定のレベルのTGF-β1が必要であることも、報告されている。従って、抗体の誘導におけるTGF-β1の機能は、多くの他の過程におけるのと同様に免疫応答の文脈に従えば、二元的(dual)および対立するものである(Lebman D.A., Edmiston J.S., 1999)。
【0008】
マクロファージの場合には、組織レベルでのTGF-β1の効果は一般に抑制的であり、炎症性応答を完結させるのに寄与する。
【0009】
あるいは、マクロファージの不活性化に対するTGF-β1の最も関連性のある効果は、IFN-γまたはLPSで活性化された細胞による、酸素反応性種と窒素の代謝中間体の産生を制限するその能力によるものである。活性化したマクロファージによるNO(一酸化窒素)の産生に関与する酵素は、誘導型の一酸化窒素シンターゼ(iNOS)酵素である。TGF-β1などの異なるサイトカインによりこの酵素の活性を調節することによって、一般的には微生物に対するマクロファージの応答、詳細には微生物および腫瘍細胞に対するマクロファージの応答を調節することができる。TGF-β1は、転写レベル、mRNAレベルの引き下げ、およびタンパク質活性の抑制においてiNOS酵素を阻害する。TGF-β1はまた、マクロファージの不活性化および末梢血単球の制御により、中間酸素反応種の産生および酸化的細胞毒性を阻害する(Ashcroft G.S., 1999)。
【0010】
更に、TGF-β1の活性化または産生並びにそのシグナル経路の変更は、Leishmania、Trypanosoma cruzi、ヒト免疫不全ウイルス、C型肝炎ウイルスなど様々な微生物の感染によって引き起こされる多くの疾患で報告されている。
【0011】
本発明に近接している当該技術分野の文献としては、特許ES2146552号明細書および特許出願ES200302020号明細書がある。最初の文献は、生物体のTGF-β1受容体へのTGF-β1結合のアンタゴニストペプチドの使用であって、TGF-β1および/またはその受容体に類似のまたは同一のアミノ酸の部分配列を有することを特徴とする使用、並びに肝臓疾患、特に肝繊維症において用いられる組成物の製造におけるその使用に関する。この文献では、ペプチドp144(配列番号1)並びにその上記使用が保護されるが、本発明の目的を構成している免疫応答調節剤の製造におけるその使用については記載されていない。
【0012】
特許出願ES200302020号明細書では、ファージのライブラリーから産生されたTGF-β1の生物活性を阻害するペプチドと、TGF-β1の制御逸脱発現を進める疾患、特に繊維症変化の治療におけるそれらの使用とが保護される。この文献では、p17(配列番号2)と開示された使用とが保護されるが、この文献も免疫調節剤の製造におけるその使用に関するものではない。
【0013】
この免疫系調節作用は、必要に準じて様々な態様の免疫応答を刺激しまたは阻害することができるので、極めて重要であり、またこれはワクチン接種アジュバントとして応用されることもある。
【0014】
もう一つの関連文献は、特許出願WO 2005/059133A2号明細書であり、これは少なくとも1種類の免疫細胞機能の刺激薬と細胞増殖を阻害しおよび/または細胞死を誘発する少なくとも1種類の物質とを含んでなる医薬組成物に関する。TGF-β1のアンタゴニストは免疫系機能の刺激薬として用いられ、TGF-β1をコードするmRNAもしくはDNAとハイブリダイズするオリゴヌクレオチド、分子量が100 kDaより小さいTGF-β1を阻害するTGF-β1阻害タンパク質およびペプチドから選択される。更に、この文献は、新生物の治療における上記医薬組成物の使用にも関する。それにも拘わらず、この文献では、1種類のオリゴヌクレオチドを除き、ペプチドはTGF-β1阻害剤として全く用いられていないが、これらの特徴のペプチドは原則として同様な効果を有すると推定することができる。これは、相当な実験なしには確認することができない。
【0015】
本願明細書に引用した引用文献のリストを、以下に示す。
Ashcroft GS. (1999).「TGF-βによるマクロファージ機能の二方向調節」Microbes Infect. Dec; 1(15): 1275-82.
Fontana A, Constam DB, Frei K, Mlipiero U, Pfister HW.「トランスフォーミング増殖因子βによる免疫応答の調節」(1992) Int Arch Allergy Immunol.; 99(1): 1-7.
Lai, M.Z., Ross, D.T., Guillet, J.G., Brinter, T.G., Gefter, M.L., Smith, J.A. (1987) 「バクテリオファージλリプレッサーcIタンパク質に対するTリンパ球応答。異なるハプロタイプのIa分子による存在する同一ペプチドの認識」J. Immunol 139, 3973-80.
Letterio, J.J., Roberts, A.B. (1998)「TGF-βによる免疫応答の調節」Annu Rev Immunol 16, 137-761.
Lebman DA, Edmiston JS. (1999)「Bリンパ球の増殖、分化および成熟におけるTGF-βの役割」Microbes Infect. Dec; 1(15): 1297-304.
Pardoux, C., Ma, X., Gobert, S., Pellegrini, S., Mayeux, P., Gay, F., Trinchieri, G., Chouaib, S. (1999)「トランスフォーミング増殖因子-βによるヒトT細胞におけるインターロイキン-12(IL-12)のダウンレギュレーション: IL-12シグナリングとの関係」Blood 93, 1448-55.
Schini, V.B., Durante, W., Elizondo, E., Scott-Burden, T., Junquero, D.C., Schafer, A.I., Vanhouette, P.M. (1992)「脈管平滑筋細胞における一酸化窒素シンターゼ活性の誘発はTGF-β 1、PDGFABおよびPDGFBBによって阻害される」Eur J Pharmacol 216, 379-83.
Strobl H, Knapp W. (1999)「樹状細胞のTGF-β1調節」Microbes Infect. Dec; 1(15): 1283-90.
Teicher B.A. (2000)「悪性細胞、悪性過程のディレクター: トランスフォーミングの役割: トランスフォーミング増殖因子-βの役割」Cancer and Metastasis Reviews 20, 133-143.
【発明の具体的説明】
【0016】
本明細書の理解を容易にするため、「ペプチドp144」という用語は、TGF-β1を阻害するペプチドであって、そのアミノ酸配列が配列番号1で定義されている配列に対応することを特徴とするペプチドを表すことが示されている。同様に、「p17」という用語は、TGF-β1活性を阻害するペプチドであって、そのアミノ酸配列が配列番号2で定義されている配列に対応することを特徴とするペプチドを表す。
【0017】
「フロイントの不完全アジュバント」とは、当業者に周知であって、油中水エマルションから構成されることを特徴とし、抗原放出を遅らせるアジュバントとして作用する組成物を表す。
【0018】
本発明は、配列番号1に対応する配列を有するペプチドp144、配列番号2に対応する配列を有するペプチドp17、それらと少なくとも90%の相同性を有するペプチド、または上記ペプチドの断片から選択される、TGF-β1を阻害するペプチドを含んでなる、免疫応答調節剤に関する。本発明の特定の態様によれば、TGF-β1を阻害するペプチドの上記断片は、配列番号3の配列で定義される断片p17(1-11)、配列番号4に対応する断片p17(1-11)、および配列番号5の配列によって定義される断片Acp17(1-11)amから選択される。
【0019】
一方、本発明はまた、体液性もしくは細胞性免疫応答または両方の調節における、上記調節剤の使用に関する。好ましい態様によれば、本発明は、ワクチン接種アジュバントとしての調節剤の使用に関する。本発明の特定の態様によれば、免疫応答調節剤は、フロイントの不完全アジュバントを更に含んでなることを特徴とする。
【0020】
好ましい態様によれば、本発明は、TGF-β1によって介在される免疫抑制を誘発する微生物と関連した病変および癌から選択される病変の治療用の医薬組成物の製造における、上記調節剤の使用に関する。好ましくは、上記微生物は、Leishmania、Trypanosoma cruzi、ヒト免疫不全ウイルス、インフルエンザウイルス、単純ヘルペスウイルスから選択される。同様に、本発明の特定の態様によれば、上記組成物は、乳癌、前立腺癌、結腸癌、膵臓癌、皮膚癌、肝細胞癌、多発性骨髄腫、および胃癌から選択される癌の治療用である。
【0021】
本発明は、免疫応答調節剤の製造における、配列番号1に対応する配列を有するペプチドp144、配列番号2に対応する配列を有するペプチドp17、それらと少なくとも90%の相同性を有するペプチド、または上記ペプチドの断片から選択される、TGF-β1を阻害するペプチドの使用に関する。
【0022】
更に、本発明は、配列番号1に対応する配列を有するペプチドp144、配列番号2に対応する配列を有するペプチドp17、それらと少なくとも90%の相同性を有するペプチド、または上記ペプチドの断片から選択される、TGF-β1を阻害するペプチドを用い、免疫応答調節剤を製造する方法に関する。
【0023】
更に、本発明は、配列番号3の配列で定義される断片p17(1-11)、配列番号4に対応する断片p17(1-11)am、および配列番号5の配列によって定義される断片Acp17(1-11)amから選択されるペプチドp17から得られるTGF-β1を阻害するペプチド断片の使用に関する。本明細書の理解を容易にするために、ペプチドp17(1-11)amはペプチドp17のアミノ酸1-11に対応する断片に対応し、11位のアミノ酸(トリプトファン)はアミド化されており、Acp17(1-11)amは、更に1位のアミノ酸(リシン)がアセチル化されている上記断片に対応することが示されている。
【0024】
本発明はまた、上記ペプチドと少なくとも70%の相同性を有し、好ましくは上記ペプチドと少なくとも80%の相同性を有し、TGF-β1の生物活性を阻害する能力を保持するペプチドに関する。TGF-β1の生物活性を阻害する能力を保持する上記ペプチドの断片も同様である。
【0025】
好ましい態様によれば、本発明は、上記調節剤が体液性もしくは細胞性免疫応答、または両方を調節することを特徴とする、TGF-β1を阻害する上記ペプチドの使用に関する。本発明の特定の態様によれば、上記調節剤は、好ましくはワクチン接種アジュバントとして免疫応答に対する刺激効果を有する。
【0026】
一方、本発明の好ましい態様によれば、上記調節剤が免疫応答に対する阻害効果を有することを特徴とする。
更に、本発明は、配列番号1に対応する配列を有するペプチドp144、配列番号2に対応する配列を有するペプチドp17、それらと少なくとも90%の相同性を有するペプチド、または上記ペプチドの断片から選択される、TGF-β1を阻害するペプチドをコードするDNA配列を用いる免疫応答調節剤の製造に関する。本発明は、更にペプチドp144、ペプチドp17、それらと少なくとも90%の相同性を有するペプチド、または上記ペプチドの断片をコードする組換え発現系を用いる免疫応答調節剤の製造に関する。本発明の好ましい態様によれば、上記免疫応答調節剤は、免疫応答刺激剤および阻害剤から選択される効果を有する。
【0027】
一方、本発明は、TGF-β1によって介在される免疫抑制を誘発する微生物と関連した病変および癌から選択される病変の治療用の組成物の製造における、配列番号1に対応する配列を有するTGF-β1を阻害するペプチド、それらと少なくとも90%の相同性を有するペプチド、または上記の一つのペプチドの使用に関する。本発明の特定の態様によれば、上記微生物はLeishmania、Trypanosoma cruzi、ヒト免疫不全ウイルス、インフルエンザウイルス、単純ヘルペスウイルスから選択される。
【0028】
本発明の特定の態様によれば、上記組成物が、定着した腫瘍に対する免疫応答の誘発の効果を有し、様々な種類の腫瘍(Teicher B.A., 2001)、すなわち乳癌、前立腺癌、結腸癌、膵臓癌、皮膚癌、肝細胞癌、多発性骨髄腫、および胃癌におけるTGF-β1の産生および/または活性化に関連した免疫抑制効果を阻害することを特徴とする。
【0029】
本発明の目的である調節剤を、齧歯類および霊長類など総ての種類の哺乳類に用いることができる。また、好ましい態様によれば、ヒトに用いることができる。
【0030】
発明の態様
本発明の機能の幾つかの例を例証的に示すが、これらは決して発明の範囲を制限するものではない。
【実施例】
【0031】
実施例1
この実施例では、外来TGF-β1が脾臓細胞の個体群の樹状細胞への分化のインデューサーとして用いられる系におけるペプチドp144の効果を検討する。
【0032】
樹状細胞の単離および培養
8週齢の雄C57マウスを屠殺した後、その脾臓を無菌条件下で取りだし、清浄な培地を用いてプレート上でホモジナイズして細胞懸濁物を得た。細胞を1000rpmで5分間遠心分離し、得られた細胞沈殿物をACKリーシス溶液(0.15 M NH4Cl、1 mM KHCO3、0.1 M EDTAナトリウム塩溶液、pH 7.2-7.4) 1 ml/脾臓で37℃にて1分間再懸濁した。次いで、細胞を遠心分離し、冷R10培地(RPMI-1640、10% FBS、グルタミン、2x10-5 M 2-メルカプトエタノール) 10 mlで洗浄し、再度遠心分離および洗浄を繰り返した。最後に、細胞をR10培地50 mlに再懸濁した。6ウェルプレート(Costar #3471)を準備し、それらをウェル当たりR10培地1 mlで処理し、樹状細胞からの脾臓細胞を室温で15分間分化させた[R10 + マウスGM-CSF (Peprotec, EC LTD, ロンドン, 英国)10 ng/ml + TGF-β1(RD Systems, ミネアポリス, 米国)1 ng/ml]。次いで、細胞懸濁液2 mlをそれぞれのウェルに加え、それらを37℃および5% CO2でインキュベーションした。最初の週は、上清1 mlを除き、樹状細胞用の新鮮な培地(R10 + GM-CSF + TGF-β1)1 mlを加えることによって培地を2回交換した。これらの2週間後に、培地を分離した。無酵素BPS (GIBCO BRL)中解離培地(dissociation medium)1 ml/ウェルをプレートに加え、培地を37℃でインキュベーションした後、これを取りだし、微温培地(tepid medium)(R10 + GM-CSF + TGF-β1)2 mlを加えた。次に、細胞を慎重にピペット採取し、採取した細胞を1000 rpmで遠心分離し、新鮮な培地(R10 + GM-CSF + TGF-β1)に再懸濁した。このようにして得られた細胞は、プレート上に播種し、初期工程を繰り返すことによって再増幅することができる。
【0033】
樹状細胞の処理
脾臓細胞由来の樹状細胞の18日間培養したものに、下記の処理を72時間行った。
対照群: 0.25% DMSOを含む樹状細胞用培地(R10 + GM-CSF + TGF-β1)で処理した細胞。
抗TGF-β1抗体: 0.25% DMSOを含む樹状細胞用培地(R10 + GM-CSF + TGF-β1)で処理し、抗(TGF-β1)中和抗体(Pharmingen)を20 μg/mlの濃度で加えた細胞。
ペプチドp144: 樹状細胞用培地(R10 + GM-CSF + TGF-β1)で処理した細胞であって、これにp144 をDMSOに溶解したものを加え、25%DMSOでの最終ペプチド溶液が50μg/mlとなるようにしたもの。
【0034】
48時間後に、それぞれの処理対応する培地を新しいものに取り換え、処理の終了時点に、細胞を解離培地(dissociation medium)(GIBCO BRL)で処理した後にピペットにて回収した。
【0035】
フローサイトメトリーによる表面マーカーの分析
様々な処理により培養した脾臓細胞からの表面マーカーを、フローサイトメトリー(FACScalibur, Becton-Dickinson, サンホゼ, カリフォルニア, 米国)を用いて測定した。細胞を食塩溶液2 ml/ウェルで洗浄した後、無酵素BPS (GIBCO BRL)中解離培地(dissociation medium)1 ml/ウェルを加え、37℃で10分間インキュベーションした。次に、培地を除き、PBS 2 mlを加えた。細胞を慎重にピペット採取し、採取した細胞をPBS中2 x 106個/mlの濃度で1000 rpmで遠心分離した。得られた細胞懸濁液100μl/ウェルを、96ウェルプレート中でFITC(1 mg/ml)で標識したマウス抗CD80、抗-CD11cおよび抗-MHC Iモノクローナル抗体(Becton-Dickinson, Pharmingen)のバイアル1μlと共に、4℃暗所にて30分間インキュベーションした。次いで、プレートを1500 rpmで遠心分離することによって(Centrifuge 5810R, Eppendorf)細胞をPBSで3回洗浄し、上清を除去し、細胞をPBS 100μlに再懸濁した。ネガティブコントロールとして、非反応性モノクローナル抗体をFITC(1 mg/ml)で標識したものを用いた。
【0036】
イン・ビトロでの脾臓細胞の成熟中に、培地にある種の因子およびサイトカインが存在することにより、細胞を様々な白血球の表現型に分化させることができる。この場合には、TGF-β1は、イン・ビトロである種の細胞が表面上で樹状細胞に関連したマーカーを発現するのに必要な因子として記載されている。p144の存在下における72時間の樹状細胞のインキュベーションのこれらのマーカーに対する効果の検討では、p144はMHC I、CD11cおよびCD80の発現に対して負の効果を有することが観察された。この効果は、細胞を抗(TGF-β1)抗体の存在下でインキュベーションするときに得られるのと同じ意味および同様な重要性を有する。実際に、図1で観察することができるように、それぞれのマーカーと関連した蛍光レベルは、p144または抗(TGF-β1)抗体で処理することによって同様に減少する。この結果は樹状細胞の成熟におけるTGF-β1の重要性を示しており、免疫プロトコルにおけるこのサイトカインのインヒビターを用いることによって、体液性および細胞応答の両方の誘導に重要な効果を生じることを示唆している。
【0037】
実施例2
マウスIL-12に対する組換えアデノウイルスのイン・ビボ活性
この実施例では、TGF-β1がこのモデルで誘導されるサイトカインの想定上のアンタゴニストとして作用するイン・ビボ系におけるペプチドp144の効果を検討する。組換えアデノウイルスに含まれるトランスジーンの発現によるマウスIL-12の産生により、IFN-γおよび一酸化窒素などの因子のカスケードの誘発により炎症状態が誘発される。TGF-β1は、IL-12、IFN-γおよびNOの産生および生物学的作用の阻害剤として記載されている(Pardoux C. et al., 1999: Schini V.B. et al., 1992)。このモデルでは、マウスRAd IL-12 1x108 pfuを食塩血清500μlに溶解したものを4-8週齢の3匹のBALB/cマウスの群に腹腔内投与し、動物を下記の群に分類した。
- Rad IL-12: これらの動物には、0日目にマウスRAd IL-12 1x108 pfuを投与した。
- Rad IL-12 + p144: これらの動物には、上記の群と同一処理を行ったが、アデノウイルスの投与後5日間、0.66%DMSOを含むPS 100μgの1日用量でペプチドを投与した。
【0038】
血液試料を、免疫の6および9日後に両群から採取した後、血清中のIFN-γおよびNOレベルを定量した。
【0039】
IFN-γレベルの測定
IFN-γの量は、市販のELISA (Mouse IFN-γ Duoset ELISA Development System, Genzyme, ケンブリッジ、およびOPTEIA Mouse IFN-γSer, Pharmingen, サンディエゴ, 米国)により製造業者の使用説明書に従って測定した。結果は、IFN-γのpg/ml数として、既知量のIFN-γの標準曲線を用いて表した。
【0040】
一酸化窒素レベルの測定
NO生成レベルは、血清中の亜硝酸塩および硝酸塩レベルの間接的測定として採用されている。測定は、Sievers NOA 280一酸化窒素検出装置を用いる化学発光分析法により製造業者(Sievers Instruments Inc. 1996)が推奨する方法に従って行った。
【0041】
用いた手法により、使用したNO還元工程によって硝酸塩または硝酸塩+亜硝酸塩を測定することができる。試料中の亜硝酸塩は、下記の反応に従って氷酢酸中でNaI 350 mMとインキュベーションすることによってNOに還元された。
I- + NO2- + 2H+ -------→ NO+1/2 I2 + H2O
【0042】
亜硝酸塩と硝酸塩の測定では、それらを下記の反応に従って1N HCl中VCl3 50 mMと90℃でインキュベーションすることによって還元した。
2NO3- + 3V+3 + 2H2O -------→ 2NO + 3VO2+ 4H+
【0043】
NOへの還元は、検出装置タンクで起こる。上記2反応のいずれの生成NOも、真空ポンプによって検出装置に輸送される。検出装置では、化学発光反応がNOとオゾンとの間に生じる。
NO + O3 -------→ O2 + NO2* -------→ NO2 + h・
【0044】
NO2*は、光線スペクトルの赤色および赤外領域において放出され、赤色感光性光電子増倍管によって検出される。このシグナルを定量し、得られたデーターを集めて、コンピューター処理を行う。
【0045】
マウスIL-12を発現する組換えアデノウイルス(RAd)をマウスに投与することによって、応答のカスケードが生じるが、それらの中でもIFN-γとNOの血清レベルにおける重要な増加が突出している。IFN-γおよびNO誘導工程はTGF-β1レベルによって影響を受けるので(Schini V.B. et al., 1992)、上記レベルに対するp144の投与の効果も検討した。図2および図3は、それぞれ、p144の存在下または非存在下におけるマウスIL-12 (RAd-IL 12)に対する組換えアデノウイルスを1 x 108 pfuの用量で投与したマウスの血清におけるIFN-γおよびNOのレベルを示している。図2は、ペプチドp144をRAd IL-12と共に投与することにより、RAd IL-12だけを投与した後に到達したものに関して誘導されたIFN-γのレベルが増加することを示している。
【0046】
図3は、p144の存在下または非存在下でのRAd IL-12の投与のNO血清レベルに対する効果を示している。RAd IL-12とp144を合わせて投与すると、RAd IL-12の投与のみで生じたものと比較して6日目には一層高いNOレベルを生じる。
【0047】
炎症誘発性サイトカインのこの誘導モデルに対するp144の効果は、TGF-β1がIL-12の調節、発現および活性に対して発揮する作用およびこのサイトカインが活性化する工程に基づいて説明することができる。実際に、TGF-β1は、IL-12およびIFN-γの発現および活性に対して拮抗作用を示すことが報告されている。従って、p144がTGF-β1を中和すると、このサイトカインのIL-12およびIFN-γの発現および活性に対する拮抗作用を除去し、従って、TGF-β1の血清レベルを増加する(図2)。要するに、このモデルでは、TGF-β1はIL-12の発現および(付随的に)TGF-β1の発現の両方をチェックすることによって作用する。結果として、p144によるTGF-β1の阻害はIFN-γ発現を増加する効果を有する。
【0048】
p144がNOの増加に対して有する効果に関しては、p144によるTGF-β1の阻害に基づいて説明することもできると考える。実際に、TGF-β1はNO生成に関与するiNOS酵素の発現および活性化を阻害するので、サイトカインを除去するとNOレベルは6日目に図3に見られるように増加傾向があると結論することは当然である。
【0049】
TGF-β1はiNOSの発現および活性を誘発するので、図2および3の結果は、6日目にp144の投与はそれぞれIFN-γおよびNOレベルの増加に寄与することが観察されるように明瞭である。
【0050】
実施例3
抗体誘導
体液性応答に対するペプチドp144の免疫調節作用を分析するため、6-8週齢の雌BALB/cマウス(Harlan, Barcelona)を用いた。特異抗体を誘導するため、100℃の槽で10分間不活性化した組換えアデノウイルス(RAd-LacZ)を接種した。
【0051】
動物の群および処理
不活性化RAd-LacZアデノウイルス1 x 108 pfu、生理学的血清(PS)またはペプチドp144 50μgを表M4に示されるようにいずれも1:1の容積比でフロイントの完全アジュバント(FCA)に乳化されているものを含む混合物200μlを、群当たり3匹のマウスに、腹腔内投与によって免疫した。最初の免疫から30日後に、動物を同じ混合物でフロイントの不完全アジュバント(FIA)に乳化したもので再免疫した。血液試料を後眼窩静脈叢から15および45日目に採取して、それぞれの動物に生じた抗アデノウイルス抗体を定量した。
【0052】
p144を投与したマウスにおける1回目の投与の50日後に抗原寛容の誘導の可能性を検討するため、活性LacZアデノウイルスを静脈内投与しただけの新たな群のマウス(ivを含む)を含むマウスに活性RAd-LacZ 4x108 pfuをRPMI-1640 100μlに混合したものを静脈内接種した。血液試料を、総ての群で7日後に採取した。次いで、動物を屠殺して、肝臓試料をOCT(登録商標)(Tissue-Teck(登録商標), SAKURA, オランダ)に入れ、後で肝臓におけるLacZ発現を評価した。
【0053】
【表1】

【0054】
血清中の抗RAd-LacZ抗体の定量
血清中のRAd-LacZに対する抗体の検出は、2,2'-アジノ-ビス-3-エチルベンズチアゾリン-6-スルホン酸(ABTS)を顕色剤として用いるストレプトアビジン-ビオチン系に基づくMaxisorp(登録商標)平底96穴プレート(Nunc, ロスキレ, デンマーク)を用いてELISA分析法によって行った。1010 pfu/mlのRAd-LacZ 75μlを0.1 M Na2CO3 10 mlに溶解したもの(pH = 10.5)50μl/ウェルのプレートを、4℃で一晩インキュベーションした。次に、PBST洗浄緩衝液(0.1% Tween 20を含むpH = 6のリン酸緩衝食塩液)200μl/ウェルで、洗浄を3回行った。非特異結合は、1%粉乳を含むPBST 400μl/ウェルを用いてプレートを室温にて1時間インキュベーションすることによってブロックした。プレート内容物を空けて、PBSTで3回洗浄した。血清4μlをPLT 100μlに加え、8個の二倍連続希釈溶液(double serial solutions)を作製し、プレートを37℃の温室で1時間インキュベーションした。これをPBSTで3回洗浄し、ヤギから得たビオチン化マウス抗IgG抗体(Amersham)をPBSTで1/1000倍に希釈したもの50μl/ウェルを用いて37℃で1時間インキュベーションした。これをPBSTで3回洗浄し、ストレプトアビジン-ペルオキシダーゼ(Amersham)の1/500倍希釈溶液を50μl/ウェルを加えた。1時間インキュベーションした後、PBSTで3回洗浄し、プレートを顕色させた。ABTSを顕色反応の基質として用い、過酸化水素とペルオキシダーゼ酵素の存在下で緑色を示す。0.6%酢酸(pH = 4.6) 10 ml、33% H2O2 (v/v)7.5μl、および40 mM ABTS 100μlを用いて、溶液を調製した。100μl/ウェルを加え、1時間後にプレートをMultiskan Plus MKIIリーダー(Labsystem, ヘルシンキ, フィンランド)で405 nmで測定した。
【0055】
トランスジーン発現のイン・シテュー染色(X-gal染色)
最適切断温度化合物(OCT)用の化合物に包含された肝臓試料の標品からのクリオスタット切片(6μm)を室温で乾燥した。次いで、それらを0.5%グルタルデヒドを標品当たり200μl加えて10分間固定した。次にPBSで3回洗浄した後、染料混合物(30 mM K3Fe(CN)6, 30 mM K4Fe(CN)6, 20 ng/ml X-GalおよびMgCl2/PBS) 200μlを加えた。標品を37℃で12時間インキュベーションした後、PBSで3回洗浄して、乾燥した後、標品を取り付けた。
【0056】
遺伝子療法の手段としてのある種の組換えウイルスの使用は、ウイルスに対する抗体が誘導されるため僅かの回数しか用いることができないという欠点を有する。実際に、ウイルスを2回以上投与すると、その効果は、一回目の投与で誘導された抗体がその後の治療で投与したウイルスを中和することができるという事実により、顕著に(または完全に)減少する。この理由により、組換えウイルスに対する抗体の誘導の過程におけるp144の役割を検討することにした。この実験の基礎となる考え方は、p144によるTGF-β1の中和が抗体誘導を阻害することがあるかまたはないか、または更に連続投与におけるアデノウイルスに対する免疫寛容を誘導することがあるかまたはないかを検討することであった。従って、最初の実験では、マウスを、Lac Zに対して熱不活性化した組換えアデノウイルス(RAd LacZinact)で免疫した。この免疫は、p144の存在下または非存在下で行った。図4に示されるように、最初の免疫では、抗-RAd Lac Z産生についてELISAによる定量可能な効果は得られなかった。
【0057】
しかしながら、2回目の免疫の後には極めて様々な効果が見られた(図5)。従って、p144の存在下で不活性化したRAd LacZによる2回目の免疫では、RAd LacZに対する高力価の抗体が誘導された。しかしながら、p144は免疫混合物に含まれるので、RAd LacZに対する抗体力価は不活性化したRAd LacZのみで得られたものより明らかに低かった。
【0058】
これらの結果の後、p144で処理したマウスが不活性化アデノウイルスの形態で示される抗原に対してある程度の寛容を生じることができたかどうかを検討することとした。これを行うために、上記マウス群にペプチドp144の非存在下で活性LacZアデノウイルス(RAd LacZact)を(2回目の免疫の)20日後に静脈内経路で接種した。7日後、トランスジーンの発現がイン・ビボで見られ、血清中の抗体の存在および肝臓におけるLacZの発現を両方とも定量した。図6に見られるように、抗体力価は2群のマウスでほぼ等しく、寛容が生成せずかつp144は抗原、本発明の場合には熱不活性化アデノウイルスとの免疫混合物に含まれているときにのみ体液性応答を阻害することができることを示していた。
【0059】
図6のマウス肝臓の7日目の組織学的分析では、RAd LacZactを静脈内投与された対照群のみがLacZ染色に対して正であることを示し、これは、他の郡では血清中に抗アデノウイルス抗体が含まれていることでRAd LacZactウイルスの投与を中和するのに十分であり、肝臓における感染とその後のLacZ遺伝子の発現が妨げられることを示唆した(図7)。
【0060】
実施例4
この実施例では、免疫混合物中におけるp144がTヘルパー決定基として作用するペプチド(FIS)と共に含まれることの効果を検討する。このペプチドは、様々な抗原に対する抗体の産生を促進するサイトカインプロフィールを誘導する。
【0061】
Tヘルパー応答の誘導
FISペプチドは、マッコウクジラミオグロビン由来のTヘルパー決定基、アミノ酸(106-118)を特徴とする。このペプチドは、ハプテンペプチドに対する抗体の誘導に広く用いられてきた。とりわけ、IFN-γおよびIL-12の増加を特徴とするサイトカインプロフィールの誘導に対するペプチドp144の効果を分析しようとした。このモデルでは、下記のものを、4-8週齢の3匹のBALB/cマウスの群に静脈内経路によって投与し、下記の処理で動物を分類した。
- FIS: FIS 50μgを含むフロイントの不完全アジュバントと食塩血清の1:1エマルションを静脈内経路で投与したマウス。
- FIS + p144: FIS 50μgとp144 50μgを含むフロイントの不完全アジュバントと食塩血清の1:1エマルションを静脈内経路で投与したマウス。
【0062】
免疫の10日後に、動物を屠殺し、膝窩、鼠蹊および大動脈周囲リンパ節を摘出した。これらのリンパ節を注射器でホモジナイズし、洗浄培地(清浄なRPMI 1640培地)を用いて4℃で3回洗浄した。次に、細胞を、完全培地(10% FBS、2 mM グルタミン、100 U/mlペニシリン、100μg/mlストレプトマイシン、5x10-5 M β-メルカプトエタノール、25 mM Hepesおよびピルビン酸ナトリウムを含むRPMI 1640)に5.3 x 106個/mlの濃度で再懸濁し、平底96穴プレートのそれぞれのウェルに150μl加えた。様々なペプチド濃度(6および10μM)を3個ずつ100μM/ウェルの容積で加えた。細胞を、37℃および5% CO2の温室で2日間培養した。24時間後に、上清50μlを96穴プレートに集め、細胞で産生されたIL-2を測定し、48時間後に、上清50μlを集めて、IFN-γを測定した。これらの上清を、サイトカイン濃度の定量まで-20℃で凍結した。
【0063】
IFN-γレベルの測定
IFN-γの量を、市販のELISA (Mouse IFN-γ Duoset ELISA Development System, Genzyme, ケンブリッジ、およびOPTEIA Mouse IFN-γSer, Pharmingen, サンディエゴ, 米国)により製造業者の使用説明書に従って測定した。結果は、IFN-γのpg/ml数として、既知量のIFN-γの標準曲線を用いて表した。
【0064】
それぞれの上清のIL-2の量は、増殖がIL-2依存性であるCTL.L.細胞系の増殖を検討することによって測定した(Lai M. et al., 1987)。この系を、10 U/mlの濃度のIL-2を補足した完全培地で培養した。
【0065】
分析を行うため、上清を3000-5000 CTL.L.個の細胞/ウェルで培養し、100μlの最終容積に希釈した。24時間培養した後、ウェル当たり0.5μCi (25 Ci/ミリモル)のトリチウム標識チミジン(Amersham)を加え、細胞を20時間後にハーベスター(Fitermate 196 Harvester, Packard)を用いてフィルター(Unifilter-96 GF/C(登録商標), Perkin Elmer)付プレート上に集めた。25μl/ウェルのシンチレーション液(MICROSCINT(登録商標), Packard, Bioscience Company)を加えた後、放射能をシンチレーションカウンター(Top Count, Microplate Scintillation Counter, Packard)で定量した。カウントの結果をIL-2のmU/mlとして表し、それぞれのウェルのカウント数を標準曲線で補間した。
【0066】
FISペプチドは、マッコウクジラミオグロビンの配列残基106-118を含むTヘルパー決定基である。BALB/cマウスをFISで免疫すると、ペプチドに応答してIFN-γおよびIL-2産生Tリンパ球の活性化が誘導される。TGF-β1は免疫応答の誘導において作用するので、FISでマウスを免疫した後のp144のサイトメトリー産生に対する効果をp144の存在下および非存在下において検討した。これを行うため、BALB/cマウスをFIS 50μgのみまたはp144 50μgの存在下にてFIS 50μgで免疫した。
【0067】
図8に見られるように、免疫混合物にペプチドp144が含まれると、FISと比較してIL-2およびIFN-γの産生が減少した。p144に対してイン・ビトロで再刺激すると、IL-2の産生およびIFN-γの幾らかの産生も見られるので、p144は恐らくDThとしてのBALB/cマウスからのクラスII MHC分子によっても提示されることを指摘することは重要である。これらの結果は、免疫混合物にp144が包含されると、DThヘルパー能に対して負の効果を有し、これは免疫応答の誘導の時点に必要なTGF-β1の中和によると思われることが示唆されている。
【0068】
実施例5
A.腫瘍抗原のDTc(AH1)およびDTh(LQV)を含む免疫混合物に対するペプチドp144の効果
DTcは、提示細胞の表面のMHC-IIによって提示されるペプチドであり、かつDTcは、提示細胞の表面上および腫瘍細胞中のMHC-Iによって提示されるペプチドである。DTc(AH1ペプチド)およびDTh(LVQペプチド)であって、CT26細胞によって発現される腫瘍抗原のgp70タンパク質に由来するこれらのペプチドの合同免疫によって、500,000個のCT26腫瘍細胞の皮下増殖を防止することができることが知られている。TGF-β1は免疫応答誘導過程において重要であるので、CT26細胞の増殖の防止に関与する応答の誘導に対するペプチドp144の効果を検討することにした。表1に示されるように、BALB/cマウスの3群を下記のフロイントの不完全アジュバントと(i) AH1 LVQ、(ii) AH1 + LVQ + p144との混合物、および(iii) フロイントの不完全アジュバントのみで免疫した。AH1 + LVQによる免疫だけがマウスを保護することができ、従って、免疫混合物にp144を取り込んだものはCT26細胞の増殖の防止に負の効果を有することが観察された。
【0069】
【表2】

【0070】
ペプチドp144はTGF-β1活性をブロックすることができるので、得られた結果は、サイトカインが有効な抗腫瘍応答の誘導に決定的役割を果たしておりかつこの段階でのそのブロッキングは防御的抗腫瘍応答の誘導に対して負の効果を有することを示唆していた。この結果は、p144をDTh FISと共に投与すると、FISに対するTh応答の活性化がどのようにブロックされるかを示しているもう一つの結果(図8)と一致している。
【0071】
B. 肺転移モデルにおけるDTc (AH1)で免疫した後のペプチドp144の効果
免疫応答が一旦誘導されてしまうと、TGF-β1の中和はその進化に対して有益な効果を有することが推測される。この概念を証明するため、5x105個のCT26細胞を静脈内経路によって投与することによって誘導した肺転移モデルにおけるマウスの生存に対するp144の投与の効果を、様々な時間および様々な免疫プロトコルで検討した。
【0072】
DTc AH1のみで免疫すると、CT26細胞の静脈内投与後の腫瘍の出現がある程度遅れることが以前の経験から分かっている。この理由により、生存実験では、p144の包含をAH1で免疫後の様々な時間で比較した。例えば、群(i)の動物はCT26細胞のみを投与され、動物群(ii)、(iii)および(iv)には、0日目にAH1 50μg/FIA(フロイントの不完全アジュバント)を用いて皮下経路で免疫した後、10日目に5x105個のCT26細胞を静脈内経路によって投与した。群(iii)には、更にp144 50μg/PS (生理学的血清)500μlを4-20日の間に1日置きに腹腔内経路によって投与した。群(iv)には、群(iii)と同様に、p144 50μg/PS 500μlを10-20日の間だけ1日置きに腹腔内経路によって投与した。図9に示されるように、AH1による免疫(ii)では、免疫しなかった対照群(i)と比較して死亡率が若干遅れているだけである。AH1で免疫した動物では、p144の投与により生存効果が特にp144を10-20日の間に投与した群(iv)で増強されている。
【0073】
C. 皮下腫瘍モデルにおけるDTc (AH1)による免疫後のp144ペプチドの効果
次に、p144の効果を、CT26の投与より侵襲性の低い腫瘍進行モデルについて検討した。この新たなモデルでは、0日目にAH1 50μgでマウスを免疫し、10日後に5x105個のCT26細胞を皮下経路によって投与した。更に、CT26腫瘍細胞からの保護に対するブロッキングTGF-β1の効果を試験する目的で、他の2群のマウス(群2および3)にp144 50μgを10-30日の間1日置きに腹腔内経路によって投与した。
【0074】
【表3】

【0075】
表3に示されるように、AH1で免疫してから10日後のTGF-β1のブロッキングは、腫瘍細胞の皮下投与の50日後に測定した腫瘍増殖を防止する。この防御は、動物の40%に達した。
【0076】
TGF-β1の中和による腫瘍細胞の増殖を防止する有効性の増加を考慮すれば、これは非常に興味深いことであり、一層良好な抗腫瘍応答を得るために採用すべき戦略とすることができる。
【0077】
実施例6
NK細胞の調節
材料および方法
NK細胞培養物
それらは、TおよびBリンパ球の非存在下でRAG1-/-マウスの脾臓細胞から実行した。幾つかの場合には、総脾臓細胞を、10% SBF、L-グルタミン、抗生物質、非必須アミノ酸、β-メルカプトエタノール、およびヒト組換えインターロイキン-2 (Chiron) 600 IU/mlを強化したRPMI培地1ml当たり4x106個で6穴プレート上で培養した。ウェルの半分には、ペプチドp17を150μg/mlの濃度で加えた。48時間後に、培地を除き、ウェルをRPMI培地で洗浄し、非付着細胞を廃棄した。次いで、新鮮な培地を、ペプチドの存在下または非存在下で加えた。+5日目に、培地を再度交換し、今回は対応する培養物における総ての細胞とペプチドp17を取り換えた。トリパンブルーによる細胞計数は、この培養の+5日および+6日目に行った。他の場合には、マウスの脾臓細胞由来のNK細胞を、MiniMACS装置、抗-DX5ビーズ、およびMSカラム(Miltenyi Biotech)を用いる免疫磁気選択によって製造業者の使用説明書に従って精製した。このようにして得られた細胞を、48穴プレート上でペプチドp17 150μg/mlの存在下または非存在下で上記培地中1.5x106個/mlで培養した。48時間後に、新たなペプチドをp17を有する細胞に加え、計数を+2および+4日目に行った。
【0078】
フローサイトメトリー
下記のPE標識したラット抗マウスモノクローナル抗体を用いた: 抗-CD25、抗-CD69および同位体制御抗体、いずれもPharmingen (BD)製。試料の取得および分析は、FACScaliburおよびCellQuestプログラムを用いて行った。
【0079】
トリチウム標識チミジンを用いる増殖分析
この分析のため、DX5+細胞を培養の2および4日目に用いた。簡単に言えば、3つの10000個/ウェルをペプチドの存在下および非存在下で培養し、6000 IU/mlのIL-2を含む典型的培地におけるトリチウム標識チミジンの取込をチミジンの添加の6時間後に測定した。
【0080】
クロム放出分析
NK細胞の細胞傷害性を、標準物4.5h 51Cr放出分析法によって確かめた。簡単に言えば、ターゲットを51Cr 50μCiと2時間インキュベーションし、洗浄(3回)し、次に、エフェクター細胞を様々な比率で加え、最大比は40:1 (エフェクター:ターゲット)とした。最後に、NK細胞によるリーシスによる51Crの放出を、TopCount Scintillation カウンター(Perkin Elmer)で4.5時間後に測定した。細胞傷害性は、細胞による総獲得数に対する放出されたCrの比率として測定した。
【0081】
細胞系
下記の腫瘍系、C57BL/6およびCT26マウス(大腸癌)由来のMC38(大腸癌)およびLLC(肺癌)、およびBALB/cマウス由来のRENCA(腎癌)を、NK細胞による細胞傷害性分析のターゲットとして用いた。LLCおよびRENCAは、ウシ胎児血清、抗生物質およびL-グルタミンを補足したRPMIで培養し、MC38およびRENCAは同様に補足したDMEMで培養した。
【0082】
結果
ペプチドp17は、直接細胞計数またはDNA合成(トリチウム標識チミジンの取込)による増殖定量分析においてRAGI-/-マウスから得てイン・ビトロで培養したNK細胞の個体群に対して明らかな抗増殖効果を発揮する(図10)。様々なマーカーの細胞表面での発現に対するp17の効果を分析したところ、p17は平均蛍光強度として測定したCD25およびCD69のレベルを減少させた(図11)。CD25およびCD69マーカーは免疫抑制を媒介し、いずれもTGF-β1によって誘導される。従って、ペプチドp17は、この免疫系の細胞個体群ではこれらのマーカー(CD25およびCD69)の誘導に対するTGF-β1の効果をブロックすることによって作用する。一方、細胞傷害性分析は様々なマウス腫瘍系に対するこの細胞個体群を阻害し(図12)、ペプチドp17が存在すると、ナチュラルキラー細胞のこの個体群の細胞傷害活性は多少向上する。総ての実験モデルにおいて、ペプチドp17はNK細胞の増殖、分化およびエフェクター期において明らかな生物活性を示すと結論される。
【0083】
実施例7
樹状細胞の調節
材料および方法
マウス骨髄由来の樹状細胞(DC)の入手
最初に、下肢を分離して、氷上の10%RPMI FBSを含むプレート上に置いた。骨髄を得るには、大腿骨頭部を切断し、骨の内側に培地を流して骨髄を10%RPMI FBSを含む皿に引き出す必要がある。次に、骨髄を注射器で粉砕し、内容物をFalconチューブに集めて、2000 rpmで5分間遠心分離し、遠心分離の後、上清を取りだし、赤血球をリーシスし、これはACKリーシス緩衝液で行った。細胞をリーシスした後、目的以外の細胞個体群を涸渇させ、これを行うため、市販の抗体とウサギ補体と結合した腹水から産生される抗体を用いた。涸渇は、下記の混合物を加えた2x107個の細胞濃度で行った。
- 100μg/mlの抗CD4腹水、
- 100μg/mlの抗CD8腹水、
- B220上清の1/20倍希釈液(B抗リンパ球)、
- GR1 10μg/ml(抗顆粒球)、
- 補体の1/20倍希釈液。
【0084】
この混合物を、37℃でほぼ15-20分毎に攪拌しながら50分間インキュベーションした。その後、清浄なRPMI培地で洗浄し、得られる細胞の下図を定量刷る。最後に、細胞を106/mlの最終濃度、およびIL-4およびGM-CSFサイトカイン 20μg/mlで12ウェルプレートに播種した(3 ml/ウェル)。播種から3および5日目に、2mlをそれぞれの細胞から取りだし、これをその容積に対応するサイトカイン濃度と共に新鮮な培地に取り換えた。
【0085】
6日目に、CDを集め、定量して、106/ml(3 ml/ウェル)の濃度、およびIL-4およびGM-CSF 20μg/mlで12ウェルプレートに置き、下記の処理を行った。
刺激なし p17なし
p17 (150μg/ml)
LPS (10μg/ml) p17なし
p17 (150μg/ml)
Poly (I:C) (100μg/ml) p17なし
p17 (150μg/ml)
1668 (1μM) p17なし
p17 (150μg/ml)
3TC-CG40L p17なし
p17 (150μg/ml)
LPS: リポ多糖類
Poly (I:C): 合成二本鎖RNA(ポリイノシン酸-ポリシチジル酸)
1668: オリゴデオキシヌクレオチド(ODN)
3TC-CD40L: CD40リガンドを産生する細胞系。
【0086】
細胞を、様々な刺激の存在下にて48時間放置した後、細胞を集めて定量し、測定株に属するマウスの非付着性脾臓細胞を別の異なるマウスの株の樹状細胞に対抗させる同種免疫反応からなる混合白血球応答を行った。この分析は、異なるマウスの株に属しているので他のマウスのリンパ球によって認識されそれらを増殖させる異なるHLA制限を示すCDの提示能を検討することを目的とする。増殖の程度は、トリチウム標識チミジンの取込によって測定される。このパラメーターは、CDが抗原を提示するのに有効であることを示唆している。この場合には、非付着細胞はBALB/cマウスから得て、樹状細胞はC57マウスに由来した。
【0087】
更に、細胞に様々な刺激を加えながらインキュベーションして、これに関するp17の効果を検討した。
【0088】
結果
ペプチドp17は、細胞が抗原を提示する有効性が増加する結果として、混合リンパ球応答分析(MLR)においてリンパ球増殖を増加させることができる。ペプチドp17のこの効果は、未刺激またはLPSまたはpICで刺激した樹状細胞により生じる(図13)。しかしながら、他の刺激(1668および3T-CD40L)では、ペプチドp17が抗原提示の有効性、従って増殖性リンパ球応答における差に影響を与えることはできない。これらの結果は、抗原提示細胞(CD)の刺激におけるTGF-β1を阻害するペプチドの能力および抗原提示の有効性を示している。
【0089】
実施例8
調節Tリンパ球の調節
材料および方法
1. 総脾臓細胞の取得
6週齢の雌Balb-cマウスから脾臓細胞を得るため、4匹の動物を屠殺し、脾臓を摘出した後、清浄な培地に移して結晶を有する分散液を得て、ホモジェネートを濾過し(70ミクロンフィルター)、50mlチューブに移した後、洗浄し、遠心分離した。得られた細胞をリーシス緩衝液中で1分間インキュベーションして、赤血球を除去した後、清浄な培地で洗浄した。最後に、得られた細胞をAUTOMACS培地1mlに再懸濁し、計数した。
【0090】
2. CD25+リンパ球の精製
CD25+リンパ球の精製は、CD25PEを標識した磁気カラムを用いて行い、インキュベーションの後、抗-PE磁気微小球(Phycoerythrin)を加えた。インキュベーション、洗浄および濾過(30ミクロンフィルター)の後、試料を磁気カラム中を通過させ、CD25-個体群を含む溶出液を重力によって得た。カラムを磁場から外した後、加圧洗浄し、CD25+細胞を得た。
【0091】
3. 抑制活性分析
CD25+個体群の調節性を明らかにするため、200μl/ウェルの容積のU底96穴プレート上にウェル当たり総数が100,000の脾臓細胞をおよび抗-CD3抗体(0.5μl/ウェル)を単独でまたはCD25+またはCD25-に対抗して播種し、25,000個/ウェル(CD25+)または50,000個/ウェル(CD25-)を入れ、これらの細胞の濃度の二倍希釈を行った。
【0092】
4. ペプチドによる抑制作用の阻害の分析
200μl/ウェルの容積のU底96穴プレートに、ウェル当たり100,000個の脾臓細胞、および抗-CD3抗体(0.5μl/ウェル)とウェル当たり25,000個のCD25+リンパ球を播種した。ペプチドをこれらの混合物に加えた(3本カラム/ペプチド、第1列には50 MicroM、および以下の3列には二倍希釈液)。3種類のペプチドを分析した: P17(1-11) 配列番号3、P17(1-11)am 配列番号4、およびAcP17(1-11)am 配列番号5。この分析および抑制活性の分析法では、いずれも37℃で48時間インキュベーションし、トリチウム標識チミジンを0.5μCi/ウェルで加え、8時間後に集めた後、それぞれのウェルから細胞によって放射されるCPMを計数した。
【0093】
5. Tregの効果的分離の証明
蛍光性抗CD4および抗CD25抗体を用いる標識、およびフローサイトメトリーによる分析(磁気分離した個体群の89%はDC4+CD25+)
結果
選択されたCD25+は調節活性を有するTリンパ球である:
図14は、適当な刺激(抗CD3)の存在下およびレギュレーター細胞の非存在下において脾臓細胞の個体群が増殖することを示す。CG25+リンパ球の存在は、総脾臓細胞の増殖を完全に阻害する。
【0094】
TGFBの阻害ペプチドは、調節Tリンパ球(CD25+)の抑制活性をブロックすることができる:
図14に設定されたモデルに基づいて、ペプチドp17由来のペプチドはCD25+リンパ球個体群の抗増殖効果を用量依存的にブロックすることができる。50μMの濃度では、ペプチドAcP17(1-11)AmおよびP17(1-1)amは調節Tリンパ球の効果を完全に阻害することができる(図15)。
【0095】
実施例8
腫瘍増殖に対する効果
材料および方法
群: 7匹の6週齢の雌balb-cマウスの4群。
AH1 + FIA s.c.
AH1 + FIA s.c. + p144 (50μg ip/用量/マウス)
AH1 + FIA s.c. + p17(1-11)(50μg ip/用量/マウス)
デザイン: AH1 + FIA: 10日目; ペプチド: -6日目から1日置きに10日目まで。
腫瘍モデル容積: 10日目から41日目までそれぞれ3日間。0日目にCT26 (500000個/マウスs.c.、脾腹)を免疫。
【0096】
結果
ペプチド投与群による平均腫瘍容積の減少:
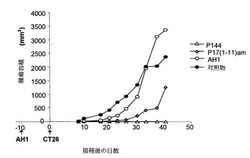
ペプチドp144およびp17(1-11)Amの効果を、腫瘍進行モデルで検討した。このモデルでは、マウスをAH1 50μgで免疫した10日後に5x105個のCT26細胞を投与した。CT腫瘍細胞への保護におけるTGF-β1をブロックする効果を明らかにするため、別の2群のマウスにペプチドp144およびp17(1-11)Amを6-10日の間1日置きに腹腔内経路によって投与した。これらのペプチドは、腫瘍細胞の皮下投与から42日後に腫瘍増殖からの防護を生じることができる。この防護は、p144の場合には動物の100%に達した(図16)。
【0097】
TGF-β1の中和により腫瘍細胞の増殖に対する防護の有効性が増加している。よって、抗腫瘍療法を改良する目的で採用されるストラテジーにおいて、これらのペプチドに大きな関心が寄せられ、発展の可能性が特に示される。
【図面の簡単な説明】
【0098】
【図1】p144(黒塗り棒線)またはTGF-β1を中和する抗体(白抜き棒線)とインキュベーションした後の樹状細胞成熟の際の様々なマーカーの阻害。細胞表面マーカー発現は、フローサイトメトリーによって測定した。
【図2】p144および/またはRAd-IL12のBALB/cマウスへの投与の0、3および6日目のTGF-β1の血清レベルに対する効果。108 pfuのマウスRAd-IL12(白抜き棒線)またはRAdIL-12およびp144(黒塗り棒線)は腹腔内投与した。
【図3】マウスRAd-IL-12 108 pfuをp144と共に(黒塗り棒線)またはp144uなしで(白抜き棒線)腹腔内経路によって投与後0日および6日目の血清中のNOレベル(μM)。
【図4】p144の存在下または非存在下でRAd LacZinactで皮下免疫(FIA中)後のBALB/cマウスで15日目に誘発されたRAd LacZに対する体液性応答。
【図5】p144の存在下または非存在下でRAd LacZinactで2回目の皮下免疫(FIA中)後のBALB/cマウスで15日目に誘発されたRAd LacZに対する体液性応答。
【図6】RAd LacZact 4x 108 pfuにより静脈内経路による感染後7日目の図5のマウスに誘発された体液性応答。対照群は、RAd LacZact 4x108 pfuを1回だけ静脈内投与したマウスに対応する。
【図7】RAd LacZact 4x108 pfuを静脈内投与して7日後の図6のマウス由来の肝臓試料の組織切片のX-gal染色。
【図8】FISまたはFIS+p144のみで免疫したマウスから得たリンパ節由来のリンパ球培養物の上清における、IL-2 (A)およびIFN-γ(B)のレベルに対するFISによる免疫混合物中のp144封入体の効果。サイトカインの産生は、6μM(白抜き棒線)または30μM(黒塗り棒線)のFISまたはp144で培養物を再刺激した後にイン・ビトロで測定した。
【図9】5x105個の CT26細胞を静脈内経路で投与しかつ様々な治療(i)-(iv)を受けたBALB/cマウスの生存率。5x105個の CT26細胞のみを10日目に投与された対照群を除き、残りの3群は0日目に、AH1 50μgをFIAに混合したもので皮下経路によって更に免疫した。群(iii)および(iv)には、更にそれぞれ4-20および10-20日の間に1日置きにp144 50μgを腹腔内経路によって投与した。
【図10】TGF-β1ブロッキングペプチドをマウスNK細胞培地に添加することによって、高IL-2濃度に応答してそれらの増殖が阻害される。すべての場合について、ペプチドp17の存在下および非存在下で正確に同一の方法で設定した「ナチュラルキラー」リンパ球を比較した。A) RAG-/-マウスの総脾臓細胞からの、指示された時間における細胞数。示された値は、絶対数でのそれぞれの場合における2x3.5 cm直径のウェルの計数の平均に対応する。B) RAG-/-マウスの脾臓細胞から磁気精製し、TおよびBリンパ球を欠き、それぞれの場合に2x0.4 cm直径のウェルの計数の平均として表された、DX5+細胞培養物の、指示された時間における計数。C) Bに示されたのと同様のミクロ培養細胞の、6時間アッセイでトリチウム標識チミジンの取込として測定された増殖。
【図11】ペプチドp17は、マウスNK細胞における活性化マーカーCD25およびCD69の膜における発現レベルを減少させる。これらのヒトスグラムは、ペプチドの存在下および非存在下で培養しかつIL-2で活性化したこれらのマーカーのフローサイトメトリーによる発現レベルを示している。それぞれのマーカーの平均蛍光単位は、それぞれのヒトスグラムの内側に示してある。
【図12】ペプチドp17は、様々な腫瘍系に対するIL-2で活性化したマウスNK細胞の細胞傷害性を増加する。これらのグラフは、NKによる細胞傷害性に対して異なる感受性を有する細胞系のリーシス率を示している。エフェクター細胞は、エフェクターリンパ球とターゲット細胞との間の対応する比率で示されたターゲット細胞に対して、培養およびクロム放出アッセイ時の6日間、ペプチドの存在下または非存在下で保持した。
【図13】これらのグラフは、様々な前刺激の非存在下または存在下、およびペプチドp17(150μg/ml)の存在下または非存在下で、ウェル当たりに存在する樹状細胞の量に準じてトリチウム標識チミジンの取込としての細胞増殖測定量を示す。ペプチドp17は、LPSまたはpICで刺激しないまたは刺激したDCを用いる混合リンパ球応答(MLR)アッセイにおいて、リンパ球の増殖を増加させる。
【図14】CD25個体群は、抗CD-3抗体(0.5μl/ウェル)によって活性化した脾臓細胞の増殖に抑制効果を示し(菱形)、CD25-(四角形)細胞はこの効果の生成できず、増殖性刺激の非存在下での脾臓細胞の基本増殖(三角)と比較して細胞増殖を行うことができる。
【図15】調節T細胞と活性化マウス脾臓細胞の同時培養物中で(p17から切り詰めて改質した)TGF-βを阻害するペプチドは、調節Tリンパ球によって発揮される細胞増殖の抑制作用を阻害する。調節Tリンパ球の阻害作用に対するペプチドp17(1-11)amおよびAcp17(1-11)amの用量依存的効果を観察することができる。発揮される阻害作用は用量依存的であり、50μMの濃度ではp17(1-11)は抑制効果を20%だけ阻害することができ、25μMの濃度ではp17(1-11)amは128%だけおよびAcp17(1-11)amは148%だけ阻害することができる。
【図16】6日から10日の間に腹腔内経路によって投与したTGF-βを阻害するペプチド、p144およびp17(1-11)am(50μg/マウス/48時間)は、AH1で10日前に免疫した動物における、0日目での50,000個のCT26細胞の皮下接種による腫瘍増殖を遅延させる。
【発明の背景】
【0001】
発明の分野
本発明は、免疫応答調節剤の製造の分野に包含される。
【0002】
背景技術
TGF-β1(トランスフォーミング増殖因子β1)は、様々な効果を生じる免疫応答の総ての時期に存在する強力な免疫調節剤である。これは、リンパ球、マクロファージおよび樹状細胞などの強力な免疫系細胞調節薬として一般に知られている(Letterio, J.J., 1998)。
【0003】
TGF-β1の生物活性は、細胞分化のタイプおよび状態並びに他のサイトカインの存在によって大きく変化し、サイトカインの集まりのバランスが変化するとTGF-β1にも影響し、さらには免疫系の機能不全に関連した病変の発生の一因となる可能性もあることを示唆している。TGF-β1は、複雑な状況に依存した方法で免疫応答を調節しており、これは、様々な疾患の実験モデルを用いることによって並びにTGF-β1発現、その受容体または調節タンパク質に関する遺伝子組換えマウスの評価において明らかにされておいる。TGF-β1は、体液性、細胞傷害性および免疫寛容応答の発生および多数の感染性および自己免疫疾患の病理学的起源における免疫系細胞の機能および相互作用を調節する。
【0004】
Tリンパ球は、その発生の総ての時期においてTGF-β1によって明らかに調節される(Fontana A. et al., 1992)。TGF-β1の作用は、リンパ球の分化の状態およびそれが受け取る活性化シグナルの種類に従って変化する。ヒトリンパ球におけるTGF-β1の作用についての最初の研究において、IL-2依存性増殖および細胞溶解機能のインヒビターとしてTGF-β1を産生し、分泌するその能力が明らかにされた(Pardoux C. et al., 1997)。
【0005】
樹状細胞は、Tリンパ球応答の活性化における抗原提示細胞としてのその機能によって明確に分化されている白血球個体群である。それらは高度に特殊化した細胞個体群であり、表皮ランゲルハンス細胞およびリンパ節由来の小胞性樹状細胞が挙げられ、TGF-β1はそれらの分化およびそれらの活性の両方を調節する(Strobl H, Knapp W, 1999)。
【0006】
TGF-β1が、他のサイトカイン(TNF-α、SCFおよびGM-CSF)の存在によって誘導されるCD34+前駆体からイン・ビトロでの樹状細胞の機能的分化を高めることが確認されている。TGF-β1はまた、培養されている樹状細胞の生育力を増加させることによっても作用する。一方、この種類の細胞におけるTGF-β1の役割も、低特異性応答を阻害して自己免疫過程を回避する調節機構に関係していると思われる。
【0007】
B細胞Ig (免疫グロブリン)の分化、増殖および産生において、TGF-β1は、プレ-Bリンパ球および成熟B細胞の両方における主要組織適合性複合体II型(MHC-II)などある種の表面分子のレベルの阻害を介する調節機能を有する。一方、TGF-β1は一般にIg分泌を阻害するが、明らかにIgAの産生を誘導し、このために粘膜に関連した免疫応答において重要な役割を果たしている。総ての型のIgの産生のインヒビターとしてのTGF-β1の作用に対するほとんどの研究は、イン・ビトロで行われてきた。しかしながら、IgGおよびIgEを効果的に産生するには、オートクラインレベル(autocrine level)で作用するリンパ球培養物中に所定のレベルのTGF-β1が必要であることも、報告されている。従って、抗体の誘導におけるTGF-β1の機能は、多くの他の過程におけるのと同様に免疫応答の文脈に従えば、二元的(dual)および対立するものである(Lebman D.A., Edmiston J.S., 1999)。
【0008】
マクロファージの場合には、組織レベルでのTGF-β1の効果は一般に抑制的であり、炎症性応答を完結させるのに寄与する。
【0009】
あるいは、マクロファージの不活性化に対するTGF-β1の最も関連性のある効果は、IFN-γまたはLPSで活性化された細胞による、酸素反応性種と窒素の代謝中間体の産生を制限するその能力によるものである。活性化したマクロファージによるNO(一酸化窒素)の産生に関与する酵素は、誘導型の一酸化窒素シンターゼ(iNOS)酵素である。TGF-β1などの異なるサイトカインによりこの酵素の活性を調節することによって、一般的には微生物に対するマクロファージの応答、詳細には微生物および腫瘍細胞に対するマクロファージの応答を調節することができる。TGF-β1は、転写レベル、mRNAレベルの引き下げ、およびタンパク質活性の抑制においてiNOS酵素を阻害する。TGF-β1はまた、マクロファージの不活性化および末梢血単球の制御により、中間酸素反応種の産生および酸化的細胞毒性を阻害する(Ashcroft G.S., 1999)。
【0010】
更に、TGF-β1の活性化または産生並びにそのシグナル経路の変更は、Leishmania、Trypanosoma cruzi、ヒト免疫不全ウイルス、C型肝炎ウイルスなど様々な微生物の感染によって引き起こされる多くの疾患で報告されている。
【0011】
本発明に近接している当該技術分野の文献としては、特許ES2146552号明細書および特許出願ES200302020号明細書がある。最初の文献は、生物体のTGF-β1受容体へのTGF-β1結合のアンタゴニストペプチドの使用であって、TGF-β1および/またはその受容体に類似のまたは同一のアミノ酸の部分配列を有することを特徴とする使用、並びに肝臓疾患、特に肝繊維症において用いられる組成物の製造におけるその使用に関する。この文献では、ペプチドp144(配列番号1)並びにその上記使用が保護されるが、本発明の目的を構成している免疫応答調節剤の製造におけるその使用については記載されていない。
【0012】
特許出願ES200302020号明細書では、ファージのライブラリーから産生されたTGF-β1の生物活性を阻害するペプチドと、TGF-β1の制御逸脱発現を進める疾患、特に繊維症変化の治療におけるそれらの使用とが保護される。この文献では、p17(配列番号2)と開示された使用とが保護されるが、この文献も免疫調節剤の製造におけるその使用に関するものではない。
【0013】
この免疫系調節作用は、必要に準じて様々な態様の免疫応答を刺激しまたは阻害することができるので、極めて重要であり、またこれはワクチン接種アジュバントとして応用されることもある。
【0014】
もう一つの関連文献は、特許出願WO 2005/059133A2号明細書であり、これは少なくとも1種類の免疫細胞機能の刺激薬と細胞増殖を阻害しおよび/または細胞死を誘発する少なくとも1種類の物質とを含んでなる医薬組成物に関する。TGF-β1のアンタゴニストは免疫系機能の刺激薬として用いられ、TGF-β1をコードするmRNAもしくはDNAとハイブリダイズするオリゴヌクレオチド、分子量が100 kDaより小さいTGF-β1を阻害するTGF-β1阻害タンパク質およびペプチドから選択される。更に、この文献は、新生物の治療における上記医薬組成物の使用にも関する。それにも拘わらず、この文献では、1種類のオリゴヌクレオチドを除き、ペプチドはTGF-β1阻害剤として全く用いられていないが、これらの特徴のペプチドは原則として同様な効果を有すると推定することができる。これは、相当な実験なしには確認することができない。
【0015】
本願明細書に引用した引用文献のリストを、以下に示す。
Ashcroft GS. (1999).「TGF-βによるマクロファージ機能の二方向調節」Microbes Infect. Dec; 1(15): 1275-82.
Fontana A, Constam DB, Frei K, Mlipiero U, Pfister HW.「トランスフォーミング増殖因子βによる免疫応答の調節」(1992) Int Arch Allergy Immunol.; 99(1): 1-7.
Lai, M.Z., Ross, D.T., Guillet, J.G., Brinter, T.G., Gefter, M.L., Smith, J.A. (1987) 「バクテリオファージλリプレッサーcIタンパク質に対するTリンパ球応答。異なるハプロタイプのIa分子による存在する同一ペプチドの認識」J. Immunol 139, 3973-80.
Letterio, J.J., Roberts, A.B. (1998)「TGF-βによる免疫応答の調節」Annu Rev Immunol 16, 137-761.
Lebman DA, Edmiston JS. (1999)「Bリンパ球の増殖、分化および成熟におけるTGF-βの役割」Microbes Infect. Dec; 1(15): 1297-304.
Pardoux, C., Ma, X., Gobert, S., Pellegrini, S., Mayeux, P., Gay, F., Trinchieri, G., Chouaib, S. (1999)「トランスフォーミング増殖因子-βによるヒトT細胞におけるインターロイキン-12(IL-12)のダウンレギュレーション: IL-12シグナリングとの関係」Blood 93, 1448-55.
Schini, V.B., Durante, W., Elizondo, E., Scott-Burden, T., Junquero, D.C., Schafer, A.I., Vanhouette, P.M. (1992)「脈管平滑筋細胞における一酸化窒素シンターゼ活性の誘発はTGF-β 1、PDGFABおよびPDGFBBによって阻害される」Eur J Pharmacol 216, 379-83.
Strobl H, Knapp W. (1999)「樹状細胞のTGF-β1調節」Microbes Infect. Dec; 1(15): 1283-90.
Teicher B.A. (2000)「悪性細胞、悪性過程のディレクター: トランスフォーミングの役割: トランスフォーミング増殖因子-βの役割」Cancer and Metastasis Reviews 20, 133-143.
【発明の具体的説明】
【0016】
本明細書の理解を容易にするため、「ペプチドp144」という用語は、TGF-β1を阻害するペプチドであって、そのアミノ酸配列が配列番号1で定義されている配列に対応することを特徴とするペプチドを表すことが示されている。同様に、「p17」という用語は、TGF-β1活性を阻害するペプチドであって、そのアミノ酸配列が配列番号2で定義されている配列に対応することを特徴とするペプチドを表す。
【0017】
「フロイントの不完全アジュバント」とは、当業者に周知であって、油中水エマルションから構成されることを特徴とし、抗原放出を遅らせるアジュバントとして作用する組成物を表す。
【0018】
本発明は、配列番号1に対応する配列を有するペプチドp144、配列番号2に対応する配列を有するペプチドp17、それらと少なくとも90%の相同性を有するペプチド、または上記ペプチドの断片から選択される、TGF-β1を阻害するペプチドを含んでなる、免疫応答調節剤に関する。本発明の特定の態様によれば、TGF-β1を阻害するペプチドの上記断片は、配列番号3の配列で定義される断片p17(1-11)、配列番号4に対応する断片p17(1-11)、および配列番号5の配列によって定義される断片Acp17(1-11)amから選択される。
【0019】
一方、本発明はまた、体液性もしくは細胞性免疫応答または両方の調節における、上記調節剤の使用に関する。好ましい態様によれば、本発明は、ワクチン接種アジュバントとしての調節剤の使用に関する。本発明の特定の態様によれば、免疫応答調節剤は、フロイントの不完全アジュバントを更に含んでなることを特徴とする。
【0020】
好ましい態様によれば、本発明は、TGF-β1によって介在される免疫抑制を誘発する微生物と関連した病変および癌から選択される病変の治療用の医薬組成物の製造における、上記調節剤の使用に関する。好ましくは、上記微生物は、Leishmania、Trypanosoma cruzi、ヒト免疫不全ウイルス、インフルエンザウイルス、単純ヘルペスウイルスから選択される。同様に、本発明の特定の態様によれば、上記組成物は、乳癌、前立腺癌、結腸癌、膵臓癌、皮膚癌、肝細胞癌、多発性骨髄腫、および胃癌から選択される癌の治療用である。
【0021】
本発明は、免疫応答調節剤の製造における、配列番号1に対応する配列を有するペプチドp144、配列番号2に対応する配列を有するペプチドp17、それらと少なくとも90%の相同性を有するペプチド、または上記ペプチドの断片から選択される、TGF-β1を阻害するペプチドの使用に関する。
【0022】
更に、本発明は、配列番号1に対応する配列を有するペプチドp144、配列番号2に対応する配列を有するペプチドp17、それらと少なくとも90%の相同性を有するペプチド、または上記ペプチドの断片から選択される、TGF-β1を阻害するペプチドを用い、免疫応答調節剤を製造する方法に関する。
【0023】
更に、本発明は、配列番号3の配列で定義される断片p17(1-11)、配列番号4に対応する断片p17(1-11)am、および配列番号5の配列によって定義される断片Acp17(1-11)amから選択されるペプチドp17から得られるTGF-β1を阻害するペプチド断片の使用に関する。本明細書の理解を容易にするために、ペプチドp17(1-11)amはペプチドp17のアミノ酸1-11に対応する断片に対応し、11位のアミノ酸(トリプトファン)はアミド化されており、Acp17(1-11)amは、更に1位のアミノ酸(リシン)がアセチル化されている上記断片に対応することが示されている。
【0024】
本発明はまた、上記ペプチドと少なくとも70%の相同性を有し、好ましくは上記ペプチドと少なくとも80%の相同性を有し、TGF-β1の生物活性を阻害する能力を保持するペプチドに関する。TGF-β1の生物活性を阻害する能力を保持する上記ペプチドの断片も同様である。
【0025】
好ましい態様によれば、本発明は、上記調節剤が体液性もしくは細胞性免疫応答、または両方を調節することを特徴とする、TGF-β1を阻害する上記ペプチドの使用に関する。本発明の特定の態様によれば、上記調節剤は、好ましくはワクチン接種アジュバントとして免疫応答に対する刺激効果を有する。
【0026】
一方、本発明の好ましい態様によれば、上記調節剤が免疫応答に対する阻害効果を有することを特徴とする。
更に、本発明は、配列番号1に対応する配列を有するペプチドp144、配列番号2に対応する配列を有するペプチドp17、それらと少なくとも90%の相同性を有するペプチド、または上記ペプチドの断片から選択される、TGF-β1を阻害するペプチドをコードするDNA配列を用いる免疫応答調節剤の製造に関する。本発明は、更にペプチドp144、ペプチドp17、それらと少なくとも90%の相同性を有するペプチド、または上記ペプチドの断片をコードする組換え発現系を用いる免疫応答調節剤の製造に関する。本発明の好ましい態様によれば、上記免疫応答調節剤は、免疫応答刺激剤および阻害剤から選択される効果を有する。
【0027】
一方、本発明は、TGF-β1によって介在される免疫抑制を誘発する微生物と関連した病変および癌から選択される病変の治療用の組成物の製造における、配列番号1に対応する配列を有するTGF-β1を阻害するペプチド、それらと少なくとも90%の相同性を有するペプチド、または上記の一つのペプチドの使用に関する。本発明の特定の態様によれば、上記微生物はLeishmania、Trypanosoma cruzi、ヒト免疫不全ウイルス、インフルエンザウイルス、単純ヘルペスウイルスから選択される。
【0028】
本発明の特定の態様によれば、上記組成物が、定着した腫瘍に対する免疫応答の誘発の効果を有し、様々な種類の腫瘍(Teicher B.A., 2001)、すなわち乳癌、前立腺癌、結腸癌、膵臓癌、皮膚癌、肝細胞癌、多発性骨髄腫、および胃癌におけるTGF-β1の産生および/または活性化に関連した免疫抑制効果を阻害することを特徴とする。
【0029】
本発明の目的である調節剤を、齧歯類および霊長類など総ての種類の哺乳類に用いることができる。また、好ましい態様によれば、ヒトに用いることができる。
【0030】
発明の態様
本発明の機能の幾つかの例を例証的に示すが、これらは決して発明の範囲を制限するものではない。
【実施例】
【0031】
実施例1
この実施例では、外来TGF-β1が脾臓細胞の個体群の樹状細胞への分化のインデューサーとして用いられる系におけるペプチドp144の効果を検討する。
【0032】
樹状細胞の単離および培養
8週齢の雄C57マウスを屠殺した後、その脾臓を無菌条件下で取りだし、清浄な培地を用いてプレート上でホモジナイズして細胞懸濁物を得た。細胞を1000rpmで5分間遠心分離し、得られた細胞沈殿物をACKリーシス溶液(0.15 M NH4Cl、1 mM KHCO3、0.1 M EDTAナトリウム塩溶液、pH 7.2-7.4) 1 ml/脾臓で37℃にて1分間再懸濁した。次いで、細胞を遠心分離し、冷R10培地(RPMI-1640、10% FBS、グルタミン、2x10-5 M 2-メルカプトエタノール) 10 mlで洗浄し、再度遠心分離および洗浄を繰り返した。最後に、細胞をR10培地50 mlに再懸濁した。6ウェルプレート(Costar #3471)を準備し、それらをウェル当たりR10培地1 mlで処理し、樹状細胞からの脾臓細胞を室温で15分間分化させた[R10 + マウスGM-CSF (Peprotec, EC LTD, ロンドン, 英国)10 ng/ml + TGF-β1(RD Systems, ミネアポリス, 米国)1 ng/ml]。次いで、細胞懸濁液2 mlをそれぞれのウェルに加え、それらを37℃および5% CO2でインキュベーションした。最初の週は、上清1 mlを除き、樹状細胞用の新鮮な培地(R10 + GM-CSF + TGF-β1)1 mlを加えることによって培地を2回交換した。これらの2週間後に、培地を分離した。無酵素BPS (GIBCO BRL)中解離培地(dissociation medium)1 ml/ウェルをプレートに加え、培地を37℃でインキュベーションした後、これを取りだし、微温培地(tepid medium)(R10 + GM-CSF + TGF-β1)2 mlを加えた。次に、細胞を慎重にピペット採取し、採取した細胞を1000 rpmで遠心分離し、新鮮な培地(R10 + GM-CSF + TGF-β1)に再懸濁した。このようにして得られた細胞は、プレート上に播種し、初期工程を繰り返すことによって再増幅することができる。
【0033】
樹状細胞の処理
脾臓細胞由来の樹状細胞の18日間培養したものに、下記の処理を72時間行った。
対照群: 0.25% DMSOを含む樹状細胞用培地(R10 + GM-CSF + TGF-β1)で処理した細胞。
抗TGF-β1抗体: 0.25% DMSOを含む樹状細胞用培地(R10 + GM-CSF + TGF-β1)で処理し、抗(TGF-β1)中和抗体(Pharmingen)を20 μg/mlの濃度で加えた細胞。
ペプチドp144: 樹状細胞用培地(R10 + GM-CSF + TGF-β1)で処理した細胞であって、これにp144 をDMSOに溶解したものを加え、25%DMSOでの最終ペプチド溶液が50μg/mlとなるようにしたもの。
【0034】
48時間後に、それぞれの処理対応する培地を新しいものに取り換え、処理の終了時点に、細胞を解離培地(dissociation medium)(GIBCO BRL)で処理した後にピペットにて回収した。
【0035】
フローサイトメトリーによる表面マーカーの分析
様々な処理により培養した脾臓細胞からの表面マーカーを、フローサイトメトリー(FACScalibur, Becton-Dickinson, サンホゼ, カリフォルニア, 米国)を用いて測定した。細胞を食塩溶液2 ml/ウェルで洗浄した後、無酵素BPS (GIBCO BRL)中解離培地(dissociation medium)1 ml/ウェルを加え、37℃で10分間インキュベーションした。次に、培地を除き、PBS 2 mlを加えた。細胞を慎重にピペット採取し、採取した細胞をPBS中2 x 106個/mlの濃度で1000 rpmで遠心分離した。得られた細胞懸濁液100μl/ウェルを、96ウェルプレート中でFITC(1 mg/ml)で標識したマウス抗CD80、抗-CD11cおよび抗-MHC Iモノクローナル抗体(Becton-Dickinson, Pharmingen)のバイアル1μlと共に、4℃暗所にて30分間インキュベーションした。次いで、プレートを1500 rpmで遠心分離することによって(Centrifuge 5810R, Eppendorf)細胞をPBSで3回洗浄し、上清を除去し、細胞をPBS 100μlに再懸濁した。ネガティブコントロールとして、非反応性モノクローナル抗体をFITC(1 mg/ml)で標識したものを用いた。
【0036】
イン・ビトロでの脾臓細胞の成熟中に、培地にある種の因子およびサイトカインが存在することにより、細胞を様々な白血球の表現型に分化させることができる。この場合には、TGF-β1は、イン・ビトロである種の細胞が表面上で樹状細胞に関連したマーカーを発現するのに必要な因子として記載されている。p144の存在下における72時間の樹状細胞のインキュベーションのこれらのマーカーに対する効果の検討では、p144はMHC I、CD11cおよびCD80の発現に対して負の効果を有することが観察された。この効果は、細胞を抗(TGF-β1)抗体の存在下でインキュベーションするときに得られるのと同じ意味および同様な重要性を有する。実際に、図1で観察することができるように、それぞれのマーカーと関連した蛍光レベルは、p144または抗(TGF-β1)抗体で処理することによって同様に減少する。この結果は樹状細胞の成熟におけるTGF-β1の重要性を示しており、免疫プロトコルにおけるこのサイトカインのインヒビターを用いることによって、体液性および細胞応答の両方の誘導に重要な効果を生じることを示唆している。
【0037】
実施例2
マウスIL-12に対する組換えアデノウイルスのイン・ビボ活性
この実施例では、TGF-β1がこのモデルで誘導されるサイトカインの想定上のアンタゴニストとして作用するイン・ビボ系におけるペプチドp144の効果を検討する。組換えアデノウイルスに含まれるトランスジーンの発現によるマウスIL-12の産生により、IFN-γおよび一酸化窒素などの因子のカスケードの誘発により炎症状態が誘発される。TGF-β1は、IL-12、IFN-γおよびNOの産生および生物学的作用の阻害剤として記載されている(Pardoux C. et al., 1999: Schini V.B. et al., 1992)。このモデルでは、マウスRAd IL-12 1x108 pfuを食塩血清500μlに溶解したものを4-8週齢の3匹のBALB/cマウスの群に腹腔内投与し、動物を下記の群に分類した。
- Rad IL-12: これらの動物には、0日目にマウスRAd IL-12 1x108 pfuを投与した。
- Rad IL-12 + p144: これらの動物には、上記の群と同一処理を行ったが、アデノウイルスの投与後5日間、0.66%DMSOを含むPS 100μgの1日用量でペプチドを投与した。
【0038】
血液試料を、免疫の6および9日後に両群から採取した後、血清中のIFN-γおよびNOレベルを定量した。
【0039】
IFN-γレベルの測定
IFN-γの量は、市販のELISA (Mouse IFN-γ Duoset ELISA Development System, Genzyme, ケンブリッジ、およびOPTEIA Mouse IFN-γSer, Pharmingen, サンディエゴ, 米国)により製造業者の使用説明書に従って測定した。結果は、IFN-γのpg/ml数として、既知量のIFN-γの標準曲線を用いて表した。
【0040】
一酸化窒素レベルの測定
NO生成レベルは、血清中の亜硝酸塩および硝酸塩レベルの間接的測定として採用されている。測定は、Sievers NOA 280一酸化窒素検出装置を用いる化学発光分析法により製造業者(Sievers Instruments Inc. 1996)が推奨する方法に従って行った。
【0041】
用いた手法により、使用したNO還元工程によって硝酸塩または硝酸塩+亜硝酸塩を測定することができる。試料中の亜硝酸塩は、下記の反応に従って氷酢酸中でNaI 350 mMとインキュベーションすることによってNOに還元された。
I- + NO2- + 2H+ -------→ NO+1/2 I2 + H2O
【0042】
亜硝酸塩と硝酸塩の測定では、それらを下記の反応に従って1N HCl中VCl3 50 mMと90℃でインキュベーションすることによって還元した。
2NO3- + 3V+3 + 2H2O -------→ 2NO + 3VO2+ 4H+
【0043】
NOへの還元は、検出装置タンクで起こる。上記2反応のいずれの生成NOも、真空ポンプによって検出装置に輸送される。検出装置では、化学発光反応がNOとオゾンとの間に生じる。
NO + O3 -------→ O2 + NO2* -------→ NO2 + h・
【0044】
NO2*は、光線スペクトルの赤色および赤外領域において放出され、赤色感光性光電子増倍管によって検出される。このシグナルを定量し、得られたデーターを集めて、コンピューター処理を行う。
【0045】
マウスIL-12を発現する組換えアデノウイルス(RAd)をマウスに投与することによって、応答のカスケードが生じるが、それらの中でもIFN-γとNOの血清レベルにおける重要な増加が突出している。IFN-γおよびNO誘導工程はTGF-β1レベルによって影響を受けるので(Schini V.B. et al., 1992)、上記レベルに対するp144の投与の効果も検討した。図2および図3は、それぞれ、p144の存在下または非存在下におけるマウスIL-12 (RAd-IL 12)に対する組換えアデノウイルスを1 x 108 pfuの用量で投与したマウスの血清におけるIFN-γおよびNOのレベルを示している。図2は、ペプチドp144をRAd IL-12と共に投与することにより、RAd IL-12だけを投与した後に到達したものに関して誘導されたIFN-γのレベルが増加することを示している。
【0046】
図3は、p144の存在下または非存在下でのRAd IL-12の投与のNO血清レベルに対する効果を示している。RAd IL-12とp144を合わせて投与すると、RAd IL-12の投与のみで生じたものと比較して6日目には一層高いNOレベルを生じる。
【0047】
炎症誘発性サイトカインのこの誘導モデルに対するp144の効果は、TGF-β1がIL-12の調節、発現および活性に対して発揮する作用およびこのサイトカインが活性化する工程に基づいて説明することができる。実際に、TGF-β1は、IL-12およびIFN-γの発現および活性に対して拮抗作用を示すことが報告されている。従って、p144がTGF-β1を中和すると、このサイトカインのIL-12およびIFN-γの発現および活性に対する拮抗作用を除去し、従って、TGF-β1の血清レベルを増加する(図2)。要するに、このモデルでは、TGF-β1はIL-12の発現および(付随的に)TGF-β1の発現の両方をチェックすることによって作用する。結果として、p144によるTGF-β1の阻害はIFN-γ発現を増加する効果を有する。
【0048】
p144がNOの増加に対して有する効果に関しては、p144によるTGF-β1の阻害に基づいて説明することもできると考える。実際に、TGF-β1はNO生成に関与するiNOS酵素の発現および活性化を阻害するので、サイトカインを除去するとNOレベルは6日目に図3に見られるように増加傾向があると結論することは当然である。
【0049】
TGF-β1はiNOSの発現および活性を誘発するので、図2および3の結果は、6日目にp144の投与はそれぞれIFN-γおよびNOレベルの増加に寄与することが観察されるように明瞭である。
【0050】
実施例3
抗体誘導
体液性応答に対するペプチドp144の免疫調節作用を分析するため、6-8週齢の雌BALB/cマウス(Harlan, Barcelona)を用いた。特異抗体を誘導するため、100℃の槽で10分間不活性化した組換えアデノウイルス(RAd-LacZ)を接種した。
【0051】
動物の群および処理
不活性化RAd-LacZアデノウイルス1 x 108 pfu、生理学的血清(PS)またはペプチドp144 50μgを表M4に示されるようにいずれも1:1の容積比でフロイントの完全アジュバント(FCA)に乳化されているものを含む混合物200μlを、群当たり3匹のマウスに、腹腔内投与によって免疫した。最初の免疫から30日後に、動物を同じ混合物でフロイントの不完全アジュバント(FIA)に乳化したもので再免疫した。血液試料を後眼窩静脈叢から15および45日目に採取して、それぞれの動物に生じた抗アデノウイルス抗体を定量した。
【0052】
p144を投与したマウスにおける1回目の投与の50日後に抗原寛容の誘導の可能性を検討するため、活性LacZアデノウイルスを静脈内投与しただけの新たな群のマウス(ivを含む)を含むマウスに活性RAd-LacZ 4x108 pfuをRPMI-1640 100μlに混合したものを静脈内接種した。血液試料を、総ての群で7日後に採取した。次いで、動物を屠殺して、肝臓試料をOCT(登録商標)(Tissue-Teck(登録商標), SAKURA, オランダ)に入れ、後で肝臓におけるLacZ発現を評価した。
【0053】
【表1】

【0054】
血清中の抗RAd-LacZ抗体の定量
血清中のRAd-LacZに対する抗体の検出は、2,2'-アジノ-ビス-3-エチルベンズチアゾリン-6-スルホン酸(ABTS)を顕色剤として用いるストレプトアビジン-ビオチン系に基づくMaxisorp(登録商標)平底96穴プレート(Nunc, ロスキレ, デンマーク)を用いてELISA分析法によって行った。1010 pfu/mlのRAd-LacZ 75μlを0.1 M Na2CO3 10 mlに溶解したもの(pH = 10.5)50μl/ウェルのプレートを、4℃で一晩インキュベーションした。次に、PBST洗浄緩衝液(0.1% Tween 20を含むpH = 6のリン酸緩衝食塩液)200μl/ウェルで、洗浄を3回行った。非特異結合は、1%粉乳を含むPBST 400μl/ウェルを用いてプレートを室温にて1時間インキュベーションすることによってブロックした。プレート内容物を空けて、PBSTで3回洗浄した。血清4μlをPLT 100μlに加え、8個の二倍連続希釈溶液(double serial solutions)を作製し、プレートを37℃の温室で1時間インキュベーションした。これをPBSTで3回洗浄し、ヤギから得たビオチン化マウス抗IgG抗体(Amersham)をPBSTで1/1000倍に希釈したもの50μl/ウェルを用いて37℃で1時間インキュベーションした。これをPBSTで3回洗浄し、ストレプトアビジン-ペルオキシダーゼ(Amersham)の1/500倍希釈溶液を50μl/ウェルを加えた。1時間インキュベーションした後、PBSTで3回洗浄し、プレートを顕色させた。ABTSを顕色反応の基質として用い、過酸化水素とペルオキシダーゼ酵素の存在下で緑色を示す。0.6%酢酸(pH = 4.6) 10 ml、33% H2O2 (v/v)7.5μl、および40 mM ABTS 100μlを用いて、溶液を調製した。100μl/ウェルを加え、1時間後にプレートをMultiskan Plus MKIIリーダー(Labsystem, ヘルシンキ, フィンランド)で405 nmで測定した。
【0055】
トランスジーン発現のイン・シテュー染色(X-gal染色)
最適切断温度化合物(OCT)用の化合物に包含された肝臓試料の標品からのクリオスタット切片(6μm)を室温で乾燥した。次いで、それらを0.5%グルタルデヒドを標品当たり200μl加えて10分間固定した。次にPBSで3回洗浄した後、染料混合物(30 mM K3Fe(CN)6, 30 mM K4Fe(CN)6, 20 ng/ml X-GalおよびMgCl2/PBS) 200μlを加えた。標品を37℃で12時間インキュベーションした後、PBSで3回洗浄して、乾燥した後、標品を取り付けた。
【0056】
遺伝子療法の手段としてのある種の組換えウイルスの使用は、ウイルスに対する抗体が誘導されるため僅かの回数しか用いることができないという欠点を有する。実際に、ウイルスを2回以上投与すると、その効果は、一回目の投与で誘導された抗体がその後の治療で投与したウイルスを中和することができるという事実により、顕著に(または完全に)減少する。この理由により、組換えウイルスに対する抗体の誘導の過程におけるp144の役割を検討することにした。この実験の基礎となる考え方は、p144によるTGF-β1の中和が抗体誘導を阻害することがあるかまたはないか、または更に連続投与におけるアデノウイルスに対する免疫寛容を誘導することがあるかまたはないかを検討することであった。従って、最初の実験では、マウスを、Lac Zに対して熱不活性化した組換えアデノウイルス(RAd LacZinact)で免疫した。この免疫は、p144の存在下または非存在下で行った。図4に示されるように、最初の免疫では、抗-RAd Lac Z産生についてELISAによる定量可能な効果は得られなかった。
【0057】
しかしながら、2回目の免疫の後には極めて様々な効果が見られた(図5)。従って、p144の存在下で不活性化したRAd LacZによる2回目の免疫では、RAd LacZに対する高力価の抗体が誘導された。しかしながら、p144は免疫混合物に含まれるので、RAd LacZに対する抗体力価は不活性化したRAd LacZのみで得られたものより明らかに低かった。
【0058】
これらの結果の後、p144で処理したマウスが不活性化アデノウイルスの形態で示される抗原に対してある程度の寛容を生じることができたかどうかを検討することとした。これを行うために、上記マウス群にペプチドp144の非存在下で活性LacZアデノウイルス(RAd LacZact)を(2回目の免疫の)20日後に静脈内経路で接種した。7日後、トランスジーンの発現がイン・ビボで見られ、血清中の抗体の存在および肝臓におけるLacZの発現を両方とも定量した。図6に見られるように、抗体力価は2群のマウスでほぼ等しく、寛容が生成せずかつp144は抗原、本発明の場合には熱不活性化アデノウイルスとの免疫混合物に含まれているときにのみ体液性応答を阻害することができることを示していた。
【0059】
図6のマウス肝臓の7日目の組織学的分析では、RAd LacZactを静脈内投与された対照群のみがLacZ染色に対して正であることを示し、これは、他の郡では血清中に抗アデノウイルス抗体が含まれていることでRAd LacZactウイルスの投与を中和するのに十分であり、肝臓における感染とその後のLacZ遺伝子の発現が妨げられることを示唆した(図7)。
【0060】
実施例4
この実施例では、免疫混合物中におけるp144がTヘルパー決定基として作用するペプチド(FIS)と共に含まれることの効果を検討する。このペプチドは、様々な抗原に対する抗体の産生を促進するサイトカインプロフィールを誘導する。
【0061】
Tヘルパー応答の誘導
FISペプチドは、マッコウクジラミオグロビン由来のTヘルパー決定基、アミノ酸(106-118)を特徴とする。このペプチドは、ハプテンペプチドに対する抗体の誘導に広く用いられてきた。とりわけ、IFN-γおよびIL-12の増加を特徴とするサイトカインプロフィールの誘導に対するペプチドp144の効果を分析しようとした。このモデルでは、下記のものを、4-8週齢の3匹のBALB/cマウスの群に静脈内経路によって投与し、下記の処理で動物を分類した。
- FIS: FIS 50μgを含むフロイントの不完全アジュバントと食塩血清の1:1エマルションを静脈内経路で投与したマウス。
- FIS + p144: FIS 50μgとp144 50μgを含むフロイントの不完全アジュバントと食塩血清の1:1エマルションを静脈内経路で投与したマウス。
【0062】
免疫の10日後に、動物を屠殺し、膝窩、鼠蹊および大動脈周囲リンパ節を摘出した。これらのリンパ節を注射器でホモジナイズし、洗浄培地(清浄なRPMI 1640培地)を用いて4℃で3回洗浄した。次に、細胞を、完全培地(10% FBS、2 mM グルタミン、100 U/mlペニシリン、100μg/mlストレプトマイシン、5x10-5 M β-メルカプトエタノール、25 mM Hepesおよびピルビン酸ナトリウムを含むRPMI 1640)に5.3 x 106個/mlの濃度で再懸濁し、平底96穴プレートのそれぞれのウェルに150μl加えた。様々なペプチド濃度(6および10μM)を3個ずつ100μM/ウェルの容積で加えた。細胞を、37℃および5% CO2の温室で2日間培養した。24時間後に、上清50μlを96穴プレートに集め、細胞で産生されたIL-2を測定し、48時間後に、上清50μlを集めて、IFN-γを測定した。これらの上清を、サイトカイン濃度の定量まで-20℃で凍結した。
【0063】
IFN-γレベルの測定
IFN-γの量を、市販のELISA (Mouse IFN-γ Duoset ELISA Development System, Genzyme, ケンブリッジ、およびOPTEIA Mouse IFN-γSer, Pharmingen, サンディエゴ, 米国)により製造業者の使用説明書に従って測定した。結果は、IFN-γのpg/ml数として、既知量のIFN-γの標準曲線を用いて表した。
【0064】
それぞれの上清のIL-2の量は、増殖がIL-2依存性であるCTL.L.細胞系の増殖を検討することによって測定した(Lai M. et al., 1987)。この系を、10 U/mlの濃度のIL-2を補足した完全培地で培養した。
【0065】
分析を行うため、上清を3000-5000 CTL.L.個の細胞/ウェルで培養し、100μlの最終容積に希釈した。24時間培養した後、ウェル当たり0.5μCi (25 Ci/ミリモル)のトリチウム標識チミジン(Amersham)を加え、細胞を20時間後にハーベスター(Fitermate 196 Harvester, Packard)を用いてフィルター(Unifilter-96 GF/C(登録商標), Perkin Elmer)付プレート上に集めた。25μl/ウェルのシンチレーション液(MICROSCINT(登録商標), Packard, Bioscience Company)を加えた後、放射能をシンチレーションカウンター(Top Count, Microplate Scintillation Counter, Packard)で定量した。カウントの結果をIL-2のmU/mlとして表し、それぞれのウェルのカウント数を標準曲線で補間した。
【0066】
FISペプチドは、マッコウクジラミオグロビンの配列残基106-118を含むTヘルパー決定基である。BALB/cマウスをFISで免疫すると、ペプチドに応答してIFN-γおよびIL-2産生Tリンパ球の活性化が誘導される。TGF-β1は免疫応答の誘導において作用するので、FISでマウスを免疫した後のp144のサイトメトリー産生に対する効果をp144の存在下および非存在下において検討した。これを行うため、BALB/cマウスをFIS 50μgのみまたはp144 50μgの存在下にてFIS 50μgで免疫した。
【0067】
図8に見られるように、免疫混合物にペプチドp144が含まれると、FISと比較してIL-2およびIFN-γの産生が減少した。p144に対してイン・ビトロで再刺激すると、IL-2の産生およびIFN-γの幾らかの産生も見られるので、p144は恐らくDThとしてのBALB/cマウスからのクラスII MHC分子によっても提示されることを指摘することは重要である。これらの結果は、免疫混合物にp144が包含されると、DThヘルパー能に対して負の効果を有し、これは免疫応答の誘導の時点に必要なTGF-β1の中和によると思われることが示唆されている。
【0068】
実施例5
A.腫瘍抗原のDTc(AH1)およびDTh(LQV)を含む免疫混合物に対するペプチドp144の効果
DTcは、提示細胞の表面のMHC-IIによって提示されるペプチドであり、かつDTcは、提示細胞の表面上および腫瘍細胞中のMHC-Iによって提示されるペプチドである。DTc(AH1ペプチド)およびDTh(LVQペプチド)であって、CT26細胞によって発現される腫瘍抗原のgp70タンパク質に由来するこれらのペプチドの合同免疫によって、500,000個のCT26腫瘍細胞の皮下増殖を防止することができることが知られている。TGF-β1は免疫応答誘導過程において重要であるので、CT26細胞の増殖の防止に関与する応答の誘導に対するペプチドp144の効果を検討することにした。表1に示されるように、BALB/cマウスの3群を下記のフロイントの不完全アジュバントと(i) AH1 LVQ、(ii) AH1 + LVQ + p144との混合物、および(iii) フロイントの不完全アジュバントのみで免疫した。AH1 + LVQによる免疫だけがマウスを保護することができ、従って、免疫混合物にp144を取り込んだものはCT26細胞の増殖の防止に負の効果を有することが観察された。
【0069】
【表2】

【0070】
ペプチドp144はTGF-β1活性をブロックすることができるので、得られた結果は、サイトカインが有効な抗腫瘍応答の誘導に決定的役割を果たしておりかつこの段階でのそのブロッキングは防御的抗腫瘍応答の誘導に対して負の効果を有することを示唆していた。この結果は、p144をDTh FISと共に投与すると、FISに対するTh応答の活性化がどのようにブロックされるかを示しているもう一つの結果(図8)と一致している。
【0071】
B. 肺転移モデルにおけるDTc (AH1)で免疫した後のペプチドp144の効果
免疫応答が一旦誘導されてしまうと、TGF-β1の中和はその進化に対して有益な効果を有することが推測される。この概念を証明するため、5x105個のCT26細胞を静脈内経路によって投与することによって誘導した肺転移モデルにおけるマウスの生存に対するp144の投与の効果を、様々な時間および様々な免疫プロトコルで検討した。
【0072】
DTc AH1のみで免疫すると、CT26細胞の静脈内投与後の腫瘍の出現がある程度遅れることが以前の経験から分かっている。この理由により、生存実験では、p144の包含をAH1で免疫後の様々な時間で比較した。例えば、群(i)の動物はCT26細胞のみを投与され、動物群(ii)、(iii)および(iv)には、0日目にAH1 50μg/FIA(フロイントの不完全アジュバント)を用いて皮下経路で免疫した後、10日目に5x105個のCT26細胞を静脈内経路によって投与した。群(iii)には、更にp144 50μg/PS (生理学的血清)500μlを4-20日の間に1日置きに腹腔内経路によって投与した。群(iv)には、群(iii)と同様に、p144 50μg/PS 500μlを10-20日の間だけ1日置きに腹腔内経路によって投与した。図9に示されるように、AH1による免疫(ii)では、免疫しなかった対照群(i)と比較して死亡率が若干遅れているだけである。AH1で免疫した動物では、p144の投与により生存効果が特にp144を10-20日の間に投与した群(iv)で増強されている。
【0073】
C. 皮下腫瘍モデルにおけるDTc (AH1)による免疫後のp144ペプチドの効果
次に、p144の効果を、CT26の投与より侵襲性の低い腫瘍進行モデルについて検討した。この新たなモデルでは、0日目にAH1 50μgでマウスを免疫し、10日後に5x105個のCT26細胞を皮下経路によって投与した。更に、CT26腫瘍細胞からの保護に対するブロッキングTGF-β1の効果を試験する目的で、他の2群のマウス(群2および3)にp144 50μgを10-30日の間1日置きに腹腔内経路によって投与した。
【0074】
【表3】

【0075】
表3に示されるように、AH1で免疫してから10日後のTGF-β1のブロッキングは、腫瘍細胞の皮下投与の50日後に測定した腫瘍増殖を防止する。この防御は、動物の40%に達した。
【0076】
TGF-β1の中和による腫瘍細胞の増殖を防止する有効性の増加を考慮すれば、これは非常に興味深いことであり、一層良好な抗腫瘍応答を得るために採用すべき戦略とすることができる。
【0077】
実施例6
NK細胞の調節
材料および方法
NK細胞培養物
それらは、TおよびBリンパ球の非存在下でRAG1-/-マウスの脾臓細胞から実行した。幾つかの場合には、総脾臓細胞を、10% SBF、L-グルタミン、抗生物質、非必須アミノ酸、β-メルカプトエタノール、およびヒト組換えインターロイキン-2 (Chiron) 600 IU/mlを強化したRPMI培地1ml当たり4x106個で6穴プレート上で培養した。ウェルの半分には、ペプチドp17を150μg/mlの濃度で加えた。48時間後に、培地を除き、ウェルをRPMI培地で洗浄し、非付着細胞を廃棄した。次いで、新鮮な培地を、ペプチドの存在下または非存在下で加えた。+5日目に、培地を再度交換し、今回は対応する培養物における総ての細胞とペプチドp17を取り換えた。トリパンブルーによる細胞計数は、この培養の+5日および+6日目に行った。他の場合には、マウスの脾臓細胞由来のNK細胞を、MiniMACS装置、抗-DX5ビーズ、およびMSカラム(Miltenyi Biotech)を用いる免疫磁気選択によって製造業者の使用説明書に従って精製した。このようにして得られた細胞を、48穴プレート上でペプチドp17 150μg/mlの存在下または非存在下で上記培地中1.5x106個/mlで培養した。48時間後に、新たなペプチドをp17を有する細胞に加え、計数を+2および+4日目に行った。
【0078】
フローサイトメトリー
下記のPE標識したラット抗マウスモノクローナル抗体を用いた: 抗-CD25、抗-CD69および同位体制御抗体、いずれもPharmingen (BD)製。試料の取得および分析は、FACScaliburおよびCellQuestプログラムを用いて行った。
【0079】
トリチウム標識チミジンを用いる増殖分析
この分析のため、DX5+細胞を培養の2および4日目に用いた。簡単に言えば、3つの10000個/ウェルをペプチドの存在下および非存在下で培養し、6000 IU/mlのIL-2を含む典型的培地におけるトリチウム標識チミジンの取込をチミジンの添加の6時間後に測定した。
【0080】
クロム放出分析
NK細胞の細胞傷害性を、標準物4.5h 51Cr放出分析法によって確かめた。簡単に言えば、ターゲットを51Cr 50μCiと2時間インキュベーションし、洗浄(3回)し、次に、エフェクター細胞を様々な比率で加え、最大比は40:1 (エフェクター:ターゲット)とした。最後に、NK細胞によるリーシスによる51Crの放出を、TopCount Scintillation カウンター(Perkin Elmer)で4.5時間後に測定した。細胞傷害性は、細胞による総獲得数に対する放出されたCrの比率として測定した。
【0081】
細胞系
下記の腫瘍系、C57BL/6およびCT26マウス(大腸癌)由来のMC38(大腸癌)およびLLC(肺癌)、およびBALB/cマウス由来のRENCA(腎癌)を、NK細胞による細胞傷害性分析のターゲットとして用いた。LLCおよびRENCAは、ウシ胎児血清、抗生物質およびL-グルタミンを補足したRPMIで培養し、MC38およびRENCAは同様に補足したDMEMで培養した。
【0082】
結果
ペプチドp17は、直接細胞計数またはDNA合成(トリチウム標識チミジンの取込)による増殖定量分析においてRAGI-/-マウスから得てイン・ビトロで培養したNK細胞の個体群に対して明らかな抗増殖効果を発揮する(図10)。様々なマーカーの細胞表面での発現に対するp17の効果を分析したところ、p17は平均蛍光強度として測定したCD25およびCD69のレベルを減少させた(図11)。CD25およびCD69マーカーは免疫抑制を媒介し、いずれもTGF-β1によって誘導される。従って、ペプチドp17は、この免疫系の細胞個体群ではこれらのマーカー(CD25およびCD69)の誘導に対するTGF-β1の効果をブロックすることによって作用する。一方、細胞傷害性分析は様々なマウス腫瘍系に対するこの細胞個体群を阻害し(図12)、ペプチドp17が存在すると、ナチュラルキラー細胞のこの個体群の細胞傷害活性は多少向上する。総ての実験モデルにおいて、ペプチドp17はNK細胞の増殖、分化およびエフェクター期において明らかな生物活性を示すと結論される。
【0083】
実施例7
樹状細胞の調節
材料および方法
マウス骨髄由来の樹状細胞(DC)の入手
最初に、下肢を分離して、氷上の10%RPMI FBSを含むプレート上に置いた。骨髄を得るには、大腿骨頭部を切断し、骨の内側に培地を流して骨髄を10%RPMI FBSを含む皿に引き出す必要がある。次に、骨髄を注射器で粉砕し、内容物をFalconチューブに集めて、2000 rpmで5分間遠心分離し、遠心分離の後、上清を取りだし、赤血球をリーシスし、これはACKリーシス緩衝液で行った。細胞をリーシスした後、目的以外の細胞個体群を涸渇させ、これを行うため、市販の抗体とウサギ補体と結合した腹水から産生される抗体を用いた。涸渇は、下記の混合物を加えた2x107個の細胞濃度で行った。
- 100μg/mlの抗CD4腹水、
- 100μg/mlの抗CD8腹水、
- B220上清の1/20倍希釈液(B抗リンパ球)、
- GR1 10μg/ml(抗顆粒球)、
- 補体の1/20倍希釈液。
【0084】
この混合物を、37℃でほぼ15-20分毎に攪拌しながら50分間インキュベーションした。その後、清浄なRPMI培地で洗浄し、得られる細胞の下図を定量刷る。最後に、細胞を106/mlの最終濃度、およびIL-4およびGM-CSFサイトカイン 20μg/mlで12ウェルプレートに播種した(3 ml/ウェル)。播種から3および5日目に、2mlをそれぞれの細胞から取りだし、これをその容積に対応するサイトカイン濃度と共に新鮮な培地に取り換えた。
【0085】
6日目に、CDを集め、定量して、106/ml(3 ml/ウェル)の濃度、およびIL-4およびGM-CSF 20μg/mlで12ウェルプレートに置き、下記の処理を行った。
刺激なし p17なし
p17 (150μg/ml)
LPS (10μg/ml) p17なし
p17 (150μg/ml)
Poly (I:C) (100μg/ml) p17なし
p17 (150μg/ml)
1668 (1μM) p17なし
p17 (150μg/ml)
3TC-CG40L p17なし
p17 (150μg/ml)
LPS: リポ多糖類
Poly (I:C): 合成二本鎖RNA(ポリイノシン酸-ポリシチジル酸)
1668: オリゴデオキシヌクレオチド(ODN)
3TC-CD40L: CD40リガンドを産生する細胞系。
【0086】
細胞を、様々な刺激の存在下にて48時間放置した後、細胞を集めて定量し、測定株に属するマウスの非付着性脾臓細胞を別の異なるマウスの株の樹状細胞に対抗させる同種免疫反応からなる混合白血球応答を行った。この分析は、異なるマウスの株に属しているので他のマウスのリンパ球によって認識されそれらを増殖させる異なるHLA制限を示すCDの提示能を検討することを目的とする。増殖の程度は、トリチウム標識チミジンの取込によって測定される。このパラメーターは、CDが抗原を提示するのに有効であることを示唆している。この場合には、非付着細胞はBALB/cマウスから得て、樹状細胞はC57マウスに由来した。
【0087】
更に、細胞に様々な刺激を加えながらインキュベーションして、これに関するp17の効果を検討した。
【0088】
結果
ペプチドp17は、細胞が抗原を提示する有効性が増加する結果として、混合リンパ球応答分析(MLR)においてリンパ球増殖を増加させることができる。ペプチドp17のこの効果は、未刺激またはLPSまたはpICで刺激した樹状細胞により生じる(図13)。しかしながら、他の刺激(1668および3T-CD40L)では、ペプチドp17が抗原提示の有効性、従って増殖性リンパ球応答における差に影響を与えることはできない。これらの結果は、抗原提示細胞(CD)の刺激におけるTGF-β1を阻害するペプチドの能力および抗原提示の有効性を示している。
【0089】
実施例8
調節Tリンパ球の調節
材料および方法
1. 総脾臓細胞の取得
6週齢の雌Balb-cマウスから脾臓細胞を得るため、4匹の動物を屠殺し、脾臓を摘出した後、清浄な培地に移して結晶を有する分散液を得て、ホモジェネートを濾過し(70ミクロンフィルター)、50mlチューブに移した後、洗浄し、遠心分離した。得られた細胞をリーシス緩衝液中で1分間インキュベーションして、赤血球を除去した後、清浄な培地で洗浄した。最後に、得られた細胞をAUTOMACS培地1mlに再懸濁し、計数した。
【0090】
2. CD25+リンパ球の精製
CD25+リンパ球の精製は、CD25PEを標識した磁気カラムを用いて行い、インキュベーションの後、抗-PE磁気微小球(Phycoerythrin)を加えた。インキュベーション、洗浄および濾過(30ミクロンフィルター)の後、試料を磁気カラム中を通過させ、CD25-個体群を含む溶出液を重力によって得た。カラムを磁場から外した後、加圧洗浄し、CD25+細胞を得た。
【0091】
3. 抑制活性分析
CD25+個体群の調節性を明らかにするため、200μl/ウェルの容積のU底96穴プレート上にウェル当たり総数が100,000の脾臓細胞をおよび抗-CD3抗体(0.5μl/ウェル)を単独でまたはCD25+またはCD25-に対抗して播種し、25,000個/ウェル(CD25+)または50,000個/ウェル(CD25-)を入れ、これらの細胞の濃度の二倍希釈を行った。
【0092】
4. ペプチドによる抑制作用の阻害の分析
200μl/ウェルの容積のU底96穴プレートに、ウェル当たり100,000個の脾臓細胞、および抗-CD3抗体(0.5μl/ウェル)とウェル当たり25,000個のCD25+リンパ球を播種した。ペプチドをこれらの混合物に加えた(3本カラム/ペプチド、第1列には50 MicroM、および以下の3列には二倍希釈液)。3種類のペプチドを分析した: P17(1-11) 配列番号3、P17(1-11)am 配列番号4、およびAcP17(1-11)am 配列番号5。この分析および抑制活性の分析法では、いずれも37℃で48時間インキュベーションし、トリチウム標識チミジンを0.5μCi/ウェルで加え、8時間後に集めた後、それぞれのウェルから細胞によって放射されるCPMを計数した。
【0093】
5. Tregの効果的分離の証明
蛍光性抗CD4および抗CD25抗体を用いる標識、およびフローサイトメトリーによる分析(磁気分離した個体群の89%はDC4+CD25+)
結果
選択されたCD25+は調節活性を有するTリンパ球である:
図14は、適当な刺激(抗CD3)の存在下およびレギュレーター細胞の非存在下において脾臓細胞の個体群が増殖することを示す。CG25+リンパ球の存在は、総脾臓細胞の増殖を完全に阻害する。
【0094】
TGFBの阻害ペプチドは、調節Tリンパ球(CD25+)の抑制活性をブロックすることができる:
図14に設定されたモデルに基づいて、ペプチドp17由来のペプチドはCD25+リンパ球個体群の抗増殖効果を用量依存的にブロックすることができる。50μMの濃度では、ペプチドAcP17(1-11)AmおよびP17(1-1)amは調節Tリンパ球の効果を完全に阻害することができる(図15)。
【0095】
実施例8
腫瘍増殖に対する効果
材料および方法
群: 7匹の6週齢の雌balb-cマウスの4群。
AH1 + FIA s.c.
AH1 + FIA s.c. + p144 (50μg ip/用量/マウス)
AH1 + FIA s.c. + p17(1-11)(50μg ip/用量/マウス)
デザイン: AH1 + FIA: 10日目; ペプチド: -6日目から1日置きに10日目まで。
腫瘍モデル容積: 10日目から41日目までそれぞれ3日間。0日目にCT26 (500000個/マウスs.c.、脾腹)を免疫。
【0096】
結果
ペプチド投与群による平均腫瘍容積の減少:
ペプチドp144およびp17(1-11)Amの効果を、腫瘍進行モデルで検討した。このモデルでは、マウスをAH1 50μgで免疫した10日後に5x105個のCT26細胞を投与した。CT腫瘍細胞への保護におけるTGF-β1をブロックする効果を明らかにするため、別の2群のマウスにペプチドp144およびp17(1-11)Amを6-10日の間1日置きに腹腔内経路によって投与した。これらのペプチドは、腫瘍細胞の皮下投与から42日後に腫瘍増殖からの防護を生じることができる。この防護は、p144の場合には動物の100%に達した(図16)。
【0097】
TGF-β1の中和により腫瘍細胞の増殖に対する防護の有効性が増加している。よって、抗腫瘍療法を改良する目的で採用されるストラテジーにおいて、これらのペプチドに大きな関心が寄せられ、発展の可能性が特に示される。
【図面の簡単な説明】
【0098】
【図1】p144(黒塗り棒線)またはTGF-β1を中和する抗体(白抜き棒線)とインキュベーションした後の樹状細胞成熟の際の様々なマーカーの阻害。細胞表面マーカー発現は、フローサイトメトリーによって測定した。
【図2】p144および/またはRAd-IL12のBALB/cマウスへの投与の0、3および6日目のTGF-β1の血清レベルに対する効果。108 pfuのマウスRAd-IL12(白抜き棒線)またはRAdIL-12およびp144(黒塗り棒線)は腹腔内投与した。
【図3】マウスRAd-IL-12 108 pfuをp144と共に(黒塗り棒線)またはp144uなしで(白抜き棒線)腹腔内経路によって投与後0日および6日目の血清中のNOレベル(μM)。
【図4】p144の存在下または非存在下でRAd LacZinactで皮下免疫(FIA中)後のBALB/cマウスで15日目に誘発されたRAd LacZに対する体液性応答。
【図5】p144の存在下または非存在下でRAd LacZinactで2回目の皮下免疫(FIA中)後のBALB/cマウスで15日目に誘発されたRAd LacZに対する体液性応答。
【図6】RAd LacZact 4x 108 pfuにより静脈内経路による感染後7日目の図5のマウスに誘発された体液性応答。対照群は、RAd LacZact 4x108 pfuを1回だけ静脈内投与したマウスに対応する。
【図7】RAd LacZact 4x108 pfuを静脈内投与して7日後の図6のマウス由来の肝臓試料の組織切片のX-gal染色。
【図8】FISまたはFIS+p144のみで免疫したマウスから得たリンパ節由来のリンパ球培養物の上清における、IL-2 (A)およびIFN-γ(B)のレベルに対するFISによる免疫混合物中のp144封入体の効果。サイトカインの産生は、6μM(白抜き棒線)または30μM(黒塗り棒線)のFISまたはp144で培養物を再刺激した後にイン・ビトロで測定した。
【図9】5x105個の CT26細胞を静脈内経路で投与しかつ様々な治療(i)-(iv)を受けたBALB/cマウスの生存率。5x105個の CT26細胞のみを10日目に投与された対照群を除き、残りの3群は0日目に、AH1 50μgをFIAに混合したもので皮下経路によって更に免疫した。群(iii)および(iv)には、更にそれぞれ4-20および10-20日の間に1日置きにp144 50μgを腹腔内経路によって投与した。
【図10】TGF-β1ブロッキングペプチドをマウスNK細胞培地に添加することによって、高IL-2濃度に応答してそれらの増殖が阻害される。すべての場合について、ペプチドp17の存在下および非存在下で正確に同一の方法で設定した「ナチュラルキラー」リンパ球を比較した。A) RAG-/-マウスの総脾臓細胞からの、指示された時間における細胞数。示された値は、絶対数でのそれぞれの場合における2x3.5 cm直径のウェルの計数の平均に対応する。B) RAG-/-マウスの脾臓細胞から磁気精製し、TおよびBリンパ球を欠き、それぞれの場合に2x0.4 cm直径のウェルの計数の平均として表された、DX5+細胞培養物の、指示された時間における計数。C) Bに示されたのと同様のミクロ培養細胞の、6時間アッセイでトリチウム標識チミジンの取込として測定された増殖。
【図11】ペプチドp17は、マウスNK細胞における活性化マーカーCD25およびCD69の膜における発現レベルを減少させる。これらのヒトスグラムは、ペプチドの存在下および非存在下で培養しかつIL-2で活性化したこれらのマーカーのフローサイトメトリーによる発現レベルを示している。それぞれのマーカーの平均蛍光単位は、それぞれのヒトスグラムの内側に示してある。
【図12】ペプチドp17は、様々な腫瘍系に対するIL-2で活性化したマウスNK細胞の細胞傷害性を増加する。これらのグラフは、NKによる細胞傷害性に対して異なる感受性を有する細胞系のリーシス率を示している。エフェクター細胞は、エフェクターリンパ球とターゲット細胞との間の対応する比率で示されたターゲット細胞に対して、培養およびクロム放出アッセイ時の6日間、ペプチドの存在下または非存在下で保持した。
【図13】これらのグラフは、様々な前刺激の非存在下または存在下、およびペプチドp17(150μg/ml)の存在下または非存在下で、ウェル当たりに存在する樹状細胞の量に準じてトリチウム標識チミジンの取込としての細胞増殖測定量を示す。ペプチドp17は、LPSまたはpICで刺激しないまたは刺激したDCを用いる混合リンパ球応答(MLR)アッセイにおいて、リンパ球の増殖を増加させる。
【図14】CD25個体群は、抗CD-3抗体(0.5μl/ウェル)によって活性化した脾臓細胞の増殖に抑制効果を示し(菱形)、CD25-(四角形)細胞はこの効果の生成できず、増殖性刺激の非存在下での脾臓細胞の基本増殖(三角)と比較して細胞増殖を行うことができる。
【図15】調節T細胞と活性化マウス脾臓細胞の同時培養物中で(p17から切り詰めて改質した)TGF-βを阻害するペプチドは、調節Tリンパ球によって発揮される細胞増殖の抑制作用を阻害する。調節Tリンパ球の阻害作用に対するペプチドp17(1-11)amおよびAcp17(1-11)amの用量依存的効果を観察することができる。発揮される阻害作用は用量依存的であり、50μMの濃度ではp17(1-11)は抑制効果を20%だけ阻害することができ、25μMの濃度ではp17(1-11)amは128%だけおよびAcp17(1-11)amは148%だけ阻害することができる。
【図16】6日から10日の間に腹腔内経路によって投与したTGF-βを阻害するペプチド、p144およびp17(1-11)am(50μg/マウス/48時間)は、AH1で10日前に免疫した動物における、0日目での50,000個のCT26細胞の皮下接種による腫瘍増殖を遅延させる。
【特許請求の範囲】
【請求項1】
配列番号1に対応する配列を有するペプチドp144、配列番号2に対応する配列を有するペプチドp17、それらと少なくとも90%の相同性を有するペプチド、または上記ペプチドの断片から選択される、TGF-β1を阻害するペプチドを含んでなる、免疫応答調節剤。
【請求項2】
配列番号3の配列で定義される断片p17(1-11)、配列番号4に対応する断片p17(1-11) am、および配列番号5の配列で定義される断片Acp17(1-11)amから選択される、TGF-β1を阻害するペプチド断片を含んでなる、請求項1に記載の免疫応答調節剤。
【請求項3】
体液性もしくは細胞性免疫応答または両方の調節における、請求項1または2に記載の調節剤の使用。
【請求項4】
ワクチン接種アジュバントとしての、請求項3に記載の調節剤の使用。
【請求項5】
TGF-β1によって介在される免疫抑制を誘発する微生物と関連した病変および癌から選択される病変の治療用の医薬組成物の製造における、請求項3に記載の調節剤の使用。
【請求項6】
前記微生物が、Leishmania、Trypanosoma cruzi、ヒト免疫不全ウイルス、インフルエンザウイルス、および単純ヘルペスウイルスから選択される、請求項5に記載の免疫応答調節剤の使用。
【請求項7】
前記組成物が、乳癌、前立腺癌、結腸癌、膵臓癌、皮膚癌、肝細胞癌、多発性骨髄腫、および胃癌から選択される癌の治療用である、請求項5に記載の調節剤の使用。
【請求項8】
免疫応答調節剤の製造における、配列番号1に対応する配列を有するペプチドp144、配列番号2に対応する配列を有するペプチドp17、それらと少なくとも90%の相同性を有するペプチド、または上記ペプチドの断片から選択されるTGF-β1を阻害するペプチドの使用。
【請求項9】
配列番号3の配列で定義される断片p17(1-11)、配列番号4に対応する断片p17(1-11)、および配列番号5の配列によって定義される断片Acp17(1-11)amから選択されるTGF-β1を阻害するペプチドの断片から選択される、請求項8に記載のTGF-β1を阻害するペプチドの断片の使用。
【請求項10】
前記調節剤が体液性もしくは細胞性応答または両方を調節する、請求項8または9に記載のTGF-β1を阻害するペプチドの使用。
【請求項11】
前記調節剤が免疫応答に対する刺激作用を有する、請求項8〜10のいずれか一項に記載のTGF-β1を阻害するペプチドの使用。
【請求項12】
請求項8〜11のいずれか一項に記載のTGF-β1を阻害するペプチドの、ワクチン接種アジュバントとしての使用。
【請求項13】
前記調節剤が免疫応答に対する阻害作用を有する、請求項8〜10のいずれか一項に記載のTGF-β1を阻害するペプチドの使用。
【請求項14】
免疫応答調節剤の製造における、配列番号1に対応する配列を有するペプチドp144、配列番号2に対応する配列を有するペプチドp17、それらと少なくとも90%の相同性を有するペプチド、または上記ペプチドの断片から選択される、TGF-β1を阻害するペプチドをコードするDNA配列の使用。
【請求項15】
免疫応答調節剤を製造するための、配列番号1に対応する配列を有するペプチドp144、配列番号2に対応する配列を有するペプチドp17、それらと少なくとも90%の相同性を有するペプチド、または上記ペプチドの断片から選択される、TGF-β1を阻害するペプチドをコードする組換え発現系のシステムの使用。
【請求項16】
前記免疫応答調節剤が、免疫応答の刺激剤および阻害剤から選択される作用を有する、請求項14に記載のDNA配列または請求項15に記載の組換え発現系の使用。
【請求項17】
TGF-β1によって介在される免疫抑制を誘発する微生物と関連した病変および癌から選択される病変の治療用の組成物の製造における、配列番号1、配列番号2に対応する配列を有するTGF-β1を阻害するペプチド、それらと少なくとも90%の相同性を有するペプチド、または上記の一つのペプチドの断片の使用。
【請求項18】
前記微生物が、Leishmania、Trypanosoma cruzi、ヒト免疫不全ウイルス、インフルエンザウイルス、単純ヘルペスウイルスから選択される、請求項17に記載のTGF-β1を阻害するペプチドの使用。
【請求項19】
前記組成物が、乳癌、前立腺癌、結腸癌、膵臓癌、皮膚癌、肝細胞癌、多発性骨髄腫、および胃癌から選択される癌の治療用である、請求項17に記載のTGF-β1を阻害するペプチドの使用。
【請求項1】
配列番号1に対応する配列を有するペプチドp144、配列番号2に対応する配列を有するペプチドp17、それらと少なくとも90%の相同性を有するペプチド、または上記ペプチドの断片から選択される、TGF-β1を阻害するペプチドを含んでなる、免疫応答調節剤。
【請求項2】
配列番号3の配列で定義される断片p17(1-11)、配列番号4に対応する断片p17(1-11) am、および配列番号5の配列で定義される断片Acp17(1-11)amから選択される、TGF-β1を阻害するペプチド断片を含んでなる、請求項1に記載の免疫応答調節剤。
【請求項3】
体液性もしくは細胞性免疫応答または両方の調節における、請求項1または2に記載の調節剤の使用。
【請求項4】
ワクチン接種アジュバントとしての、請求項3に記載の調節剤の使用。
【請求項5】
TGF-β1によって介在される免疫抑制を誘発する微生物と関連した病変および癌から選択される病変の治療用の医薬組成物の製造における、請求項3に記載の調節剤の使用。
【請求項6】
前記微生物が、Leishmania、Trypanosoma cruzi、ヒト免疫不全ウイルス、インフルエンザウイルス、および単純ヘルペスウイルスから選択される、請求項5に記載の免疫応答調節剤の使用。
【請求項7】
前記組成物が、乳癌、前立腺癌、結腸癌、膵臓癌、皮膚癌、肝細胞癌、多発性骨髄腫、および胃癌から選択される癌の治療用である、請求項5に記載の調節剤の使用。
【請求項8】
免疫応答調節剤の製造における、配列番号1に対応する配列を有するペプチドp144、配列番号2に対応する配列を有するペプチドp17、それらと少なくとも90%の相同性を有するペプチド、または上記ペプチドの断片から選択されるTGF-β1を阻害するペプチドの使用。
【請求項9】
配列番号3の配列で定義される断片p17(1-11)、配列番号4に対応する断片p17(1-11)、および配列番号5の配列によって定義される断片Acp17(1-11)amから選択されるTGF-β1を阻害するペプチドの断片から選択される、請求項8に記載のTGF-β1を阻害するペプチドの断片の使用。
【請求項10】
前記調節剤が体液性もしくは細胞性応答または両方を調節する、請求項8または9に記載のTGF-β1を阻害するペプチドの使用。
【請求項11】
前記調節剤が免疫応答に対する刺激作用を有する、請求項8〜10のいずれか一項に記載のTGF-β1を阻害するペプチドの使用。
【請求項12】
請求項8〜11のいずれか一項に記載のTGF-β1を阻害するペプチドの、ワクチン接種アジュバントとしての使用。
【請求項13】
前記調節剤が免疫応答に対する阻害作用を有する、請求項8〜10のいずれか一項に記載のTGF-β1を阻害するペプチドの使用。
【請求項14】
免疫応答調節剤の製造における、配列番号1に対応する配列を有するペプチドp144、配列番号2に対応する配列を有するペプチドp17、それらと少なくとも90%の相同性を有するペプチド、または上記ペプチドの断片から選択される、TGF-β1を阻害するペプチドをコードするDNA配列の使用。
【請求項15】
免疫応答調節剤を製造するための、配列番号1に対応する配列を有するペプチドp144、配列番号2に対応する配列を有するペプチドp17、それらと少なくとも90%の相同性を有するペプチド、または上記ペプチドの断片から選択される、TGF-β1を阻害するペプチドをコードする組換え発現系のシステムの使用。
【請求項16】
前記免疫応答調節剤が、免疫応答の刺激剤および阻害剤から選択される作用を有する、請求項14に記載のDNA配列または請求項15に記載の組換え発現系の使用。
【請求項17】
TGF-β1によって介在される免疫抑制を誘発する微生物と関連した病変および癌から選択される病変の治療用の組成物の製造における、配列番号1、配列番号2に対応する配列を有するTGF-β1を阻害するペプチド、それらと少なくとも90%の相同性を有するペプチド、または上記の一つのペプチドの断片の使用。
【請求項18】
前記微生物が、Leishmania、Trypanosoma cruzi、ヒト免疫不全ウイルス、インフルエンザウイルス、単純ヘルペスウイルスから選択される、請求項17に記載のTGF-β1を阻害するペプチドの使用。
【請求項19】
前記組成物が、乳癌、前立腺癌、結腸癌、膵臓癌、皮膚癌、肝細胞癌、多発性骨髄腫、および胃癌から選択される癌の治療用である、請求項17に記載のTGF-β1を阻害するペプチドの使用。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【公開番号】特開2012−214489(P2012−214489A)
【公開日】平成24年11月8日(2012.11.8)
【国際特許分類】
【出願番号】特願2012−142344(P2012−142344)
【出願日】平成24年6月25日(2012.6.25)
【分割の表示】特願2008−537124(P2008−537124)の分割
【原出願日】平成17年10月24日(2005.10.24)
【出願人】(506061716)プロイェクト、デ、ビオメディシナ、シーマ、ソシエダッド、リミターダ (34)
【氏名又は名称原語表記】PROYECTO DE BIOMEDICINA CIMA, S.L.
【Fターム(参考)】
【公開日】平成24年11月8日(2012.11.8)
【国際特許分類】
【出願日】平成24年6月25日(2012.6.25)
【分割の表示】特願2008−537124(P2008−537124)の分割
【原出願日】平成17年10月24日(2005.10.24)
【出願人】(506061716)プロイェクト、デ、ビオメディシナ、シーマ、ソシエダッド、リミターダ (34)
【氏名又は名称原語表記】PROYECTO DE BIOMEDICINA CIMA, S.L.
【Fターム(参考)】
[ Back to top ]

