免疫性流産を低減するためのIL−27アゴニストの使用
【課題】寛容および子宮内膜への胚の着床を調節する方法の提供。
【解決手段】サイトカインと、IL−27アゴニストを用いて胎児に対する母体の寛容を調節する方法とが提供される。さらに、子宮内膜への胚の着床を調節する方法および診断方法も提供される。一実施形態では、被検体はヒトであり、IL−27アゴニストを、a)妊娠第1三半期;b)妊娠第2三半期;c)妊娠第3三半期;またはd)妊娠第1、妊娠第2および妊娠第3三半期中に投与する。上記IL−27アゴニストは、IL−27タンパク質であってもよく、このタンパク質はヒトIL−27であってもよい。
【解決手段】サイトカインと、IL−27アゴニストを用いて胎児に対する母体の寛容を調節する方法とが提供される。さらに、子宮内膜への胚の着床を調節する方法および診断方法も提供される。一実施形態では、被検体はヒトであり、IL−27アゴニストを、a)妊娠第1三半期;b)妊娠第2三半期;c)妊娠第3三半期;またはd)妊娠第1、妊娠第2および妊娠第3三半期中に投与する。上記IL−27アゴニストは、IL−27タンパク質であってもよく、このタンパク質はヒトIL−27であってもよい。
【発明の詳細な説明】
【技術分野】
【0001】
(発明の分野)
本発明は、寛容および子宮内膜への胚の着床を調節する方法を提供する。
【背景技術】
【0002】
(発明の背景)
哺乳動物の免疫反応は、「免疫ネットワーク」と呼ばれる一連の複雑な細胞間相互作用に基づいている。最近の研究から、このネットワークの内部の仕組みに対する新たな洞察が得られてきた。その反応の大部分が実際に、リンパ球、マクロファージ、顆粒球およびこれ以外の細胞のネットワーク様相互作用を中心に展開するのは以前から明らかであるが、一方、現在の免疫学者は一般に、サイトカインとして知られる可溶性タンパク質がこうした細胞間相互作用の制御に極めて重要な役割を果たしているという見解を持っている。したがって、細胞調節因子の単離、特徴付けおよび作用機序に対して大きな関心が集まっており、それを理解すれば、たとえば、免疫系障害など多くの医学的異常の診断および治療の大きな進歩につながるであろう。これらの因子の一部として、たとえば、幹細胞因子(SCF:stem cell factor)またはIL−12などの造血成長および/または造血分化因子がある(たとえば、Mire−Sluis and Thorpe(1998)Cytokines,Academic Press,San Diego,CA;Thomson(ed.)(1998)The Cytokine Handbook(3d ed.)Academic Press,San Diego,CA;Metcalf and Nicola(1995)The Hematopoietic
Colony Stimulating Factors,Cambridge Univ.Press,Cambridge,UK;and Aggarwal and Gutterman(1991)Human Cytokines,Blackwell,Malden,MAを参照)。
【0003】
サイトカインは、様々な形で細胞活性に関与している。多能性造血幹細胞が、複雑な免疫系を構成する多様な細胞系統からなる数々の前駆細胞へと増殖、成長および分化するのをサイトカインが支持することが明らかになっている。健康な免疫反応には細胞成分間の適切かつバランスのとれた相互作用が必要である。サイトカインが他の因子と併用投与されると、異なる細胞系統が、別の形で反応することが多い。
【0004】
免疫反応に特に重要な細胞の系統として、免疫グロブリン(異物の除去を行うための異物に対する認識能および結合能を持つタンパク質)を産生および分泌できるB細胞、サイトカインを分泌し、かつB細胞および免疫ネットワークを構成する他の様々な細胞(他のT細胞など)を誘発または抑制する種々のサブセットのT細胞、感染性病原体および腫瘍細胞に反応してサイトカインの産生に関与するNK(natural killer)細胞ならびに樹状細胞および他のミエロイド由来の細胞などの抗原提示細胞が挙げられる。
【0005】
本発明は、IL−12に関係するサイトカインであるIL−27の使用方法を提供する。IL−12は、p35とp40の2つのサブユニットからなるヘテロ二量体サイトカインであり、細胞性免疫に極めて重要な役割を果たしている。その活性は、2つのサブユニットIL−12Rβ1およびIL−12Rβ2を含む高親和性の受容体複合体により惹起される。IL−12のp35サブユニットは、EBI3と呼ばれる第2の可溶性タンパク質に結合することができ、p35およびEBI3が分泌ヘテロ二量体を形成すると考えられた(ただし、このヘテロ二量体の機能は不明である)。また、EBI3は、別のタンパク質p28にも結合し、現在IL−27と呼ばれる、p28およびEBI3を含む可溶性ヘテロ二量体を形成する。p28サブユニットは、IL−80またはIL−D80とも呼ばれる。ヒトおよびマウスのp35サブユニットをコードするcDNAは、どちらも参照によって援用する特許文献1および特許文献2に記載されている(たとえば、Devergne,et al.(1997)Proc.Natl.Acad.Sci USA 94:12041−12046;Chua,et al.(1995)J.Immunol.155:4286:4294;Presky,et al.(1998)J.Immunol.160:2174−2179;Gately,et al.(1998)Ann.Rev.Immunol.16:495−521;Presky,et al.(1996)Proc.Natl.Acad.Sci USA 93:14002−14007;Trinchieri(1998)Adv.Immunol.70:83−243;Trinchieri(1998)Immunol.Res.17:269−278;Trinchieri(1995)Annu.Rev.Immunol.13:251−276を参照)。
【0006】
インビトロ研究では、IL−27の主要な供給源として活性化単球および単球由来樹状細胞が同定されている。これらの研究ではさらに、EBI3遺伝子およびp28遺伝子の発現が必ずしも協調的に起きるとは限らないことが明らかにされた。p28遺伝子は通常、EBI3遺伝子よりも低レベルで発現し、極めて一過性であり、細胞型のスペクトルがより限定的である(たとえば、Pflanz et al.(2002)Immunity 16:779−790を参照)。おそらくこうした低レベルかつ一過性の遺伝子発現が原因で、p28タンパク質のin situ発現を証明することが難しくなっている。ヒトリンパ球組織を用いたEBI3およびp28発現の免疫組織化学的研究によれば、EBI3発現は、多くの場合、検出可能なp28の発現とは関連しておらず、EBI3とp28の共発現が主に検出されたのは、マクロファージ系統の細胞および反応組織の内皮細胞においてであった(たとえば、Larousserie et al.(2004)J
Pathol. 202:164−171;Larousserie et al.(2005)Am J Pathol 166:1217−1228;and Larousserie(2006)J Pathol 209:360−368を参照)。
【0007】
EBI3は、EBI3がp28と会合してIL−27を形成することが明らかになる前に、ヒトの胎児と母体の界面において非常に高レベルで発現することが示されていた(たとえば、Devergne et al.(1996)J Virol 70:1143−1153;Devergne et al.(1997)Proc Natl Acad Sci USA 94:12041−12046;and Devergne et
al.(2001)Am J Pathol 159:1763−1776を参照)。EBI3は、妊娠期間を通じて母胎の免疫系に直接接触している胎児由来の2つの細胞型、合胞体栄養細胞層(母体血と相互作用する)および絨毛外栄養膜(母体の子宮内膜(uterine mucosa)と相互作用する)のみに発現する。浸潤性の絨毛外栄養膜は、一部はサイトカインおよびケモカインの産生を介して母体の寛容および血管リモデリングに中心的な役割を果たしている(たとえば、Moffett and Loke(2006)Nat Rev Immunol 6:584−594を参照)。これらの細胞に、非古典的MHCクラスI分子のHLA−Gが特異的に発現する。HLA−Gは、異なる表面分子に結合することで、脱落膜NK細胞、CD4+およびCD8+T細胞など複数の細胞型で免疫調節機能を示し(たとえば、Le Bouteiller et al.(2003)Placenta 24:Suppl A.S10−5.を参照)、新脈管形成を制御する(たとえば、Fons et al.(2006)Blood 108:2608−2615.を参照)。興味深いことに、膜結合または可溶性HLA−Gにより提示されたペプチドを精製すると、EBI3の九量体ペプチドがペプチドとして最も多く含まれており、回収したすべてのリガンドの最大15%を占めることが明らかになった(たとえば、Ishitani(2003)J Immunol 171:1376−1384を参照)。
【先行技術文献】
【特許文献】
【0008】
【特許文献1】米国特許出願公開第2002/0164609号明細書
【特許文献2】国際公開第02/068596号パンフレット
【発明の概要】
【発明が解決しようとする課題】
【0009】
上述から、サイトカインおよびサイトカイン受容体、たとえば、IL−27およびその受容体複合体に関係する新しい機能および方法の発見が、妊娠異常の新たな治療に貢献する可能性があるは明らかである。特に、既知のサイトカインの有益な活性を促進または増強するサイトカインが発見および開発されれば、極めて好都合であろう。本発明は、IL−27により寛容および胚の着床を調節する方法を提供する。
【課題を解決するための手段】
【0010】
(発明の要旨)
本発明は、母体と胎児の界面部位におけるIL−27の発現および産生の発見に基づく。
【0011】
本発明は、胎児性抗原に対する母体の寛容を誘導する方法であって、免疫性流産(immune mrdiated abortion)のリスクがあるか、それに罹患している被検体に有効量のIL−27アゴニストを投与することを含む、方法を提供する。一実施形態では、被検体はヒトであり、IL−27アゴニストを、a)妊娠第1三半期;b)妊娠第2三半期;c)妊娠第3三半期;またはd)妊娠第1、妊娠第2および妊娠第3三半期中に投与する。IL−27アゴニストは、IL−27タンパク質であってもよく、このタンパク質はヒトIL−27であってもよい。ある実施形態では、IL−27アゴニストは、IL−27受容体(IL−27R)複合体の少なくとも1つのサブユニットに結合するアゴニスト抗体である。IL−27R複合体は、ヒトIL−27R複合体である。アゴニスト抗体は、IL−27R複合体のシグナル伝達を誘導する。
【0012】
本発明はまた、少なくとも1個の胚の子宮内膜への着床を促進する方法であって、有効量のIL−27アゴニストを被検体に投与することを含む、方法も提供する。IL−27アゴニストについては、a)妊娠第1三半期;b)妊娠第2三半期;c)妊娠第3三半期;またはd)妊娠第1、妊娠第2および妊娠第3三半期中に投与してもよい。IL−27アゴニストは、IL−27タンパク質であることを意図している。さらなる実施形態では、IL−27タンパク質はヒトIL−27である。さらに、IL−27アゴニストは、IL−27R複合体の少なくとも1つのサブユニットに結合するアゴニスト抗体であることも想定している。IL−27複合体はヒトIL−27複合体であり、アゴニスト抗体は、IL−27R複合体のシグナル伝達を誘導する。
【0013】
さらに、被検体が免疫性流産であるかどうかを判定する診断方法であって、被検体から採取した生物学的サンプル中のIL−27またはIL−27Rの存在あるいはレベルを検出することと、被検体が自然流産であるかどうかを判定することとを含む、診断方法も提供する。生物学的サンプルについては、組織サンプル、細胞サンプルまたは血清サンプルからなる群から選択してもよい。さらなる実施形態では、組織サンプルは、絨毛膜絨毛サンプルおよび胎盤サンプルからなる群から選択される。
【0014】
本発明は、被検体が免疫性流産を起こすリスクがあるかどうかを判定する予後診断方法であって、被検体から採取した生物学的サンプルまたはサンプルの単離物におけるIL−27またはIL−27RのmRNAまたはポリペプチドの存在またはレベルを検出し、それにより被検体が自然流産を起こすリスクがあるかどうかを判定することを含む、予後診断方法を包含する。生物学的サンプルは、絨毛膜絨毛サンプルおよび胎盤サンプルなどの組織サンプル、細胞サンプルまたは血清サンプルからなる群から選択される。
【0015】
さらに、免疫性流産のリスクがあるか、それに罹患している被検体に対するIL−27アゴニストによる処置をモニターする方法であって、被検体由来の生物学的サンプルまたはサンプルの単離物におけるTh1またはTh2サイトカインのmRNAまたはポリペプチドのレベルを測定し、それにより被検体が免疫性流産のリスクがあるか、それに罹患しているかどうかを判定することを含む、方法も意図している。Th1サイトカインは、TNF−α、IFN−γ、IL−2、IL−1、IL−6、IL−12およびRANTESからなる群から選択される。Th2サイトカインは、CSF−1、GM−CSF、IL−10、IL−4、IL−11、TGFおよびIL−3からなる群から選択される。
例えば、本願発明は以下の項目を提供する。
(項目1)
胎児性抗原に対する母体の寛容を誘導する方法であって、免疫性流産のリスクがあるか、免疫性流産に罹患している被検体に有効量のIL−27アゴニストを投与する工程を含む、方法。
(項目2)
前記被検体はヒトであり、前記IL−27アゴニストは、
a)妊娠第1三半期;
b)妊娠第2三半期;
c)妊娠第3三半期;または
d)妊娠第1、妊娠第2および妊娠第3三半期
の間に投与される、項目1に記載の方法。
(項目3)
前記IL−27アゴニストはIL−27タンパク質である、項目1に記載の方法。
(項目4)
前記IL−27タンパク質はヒトIL−27タンパク質である、項目3に記載の方法。
(項目5)
前記IL−27アゴニストは、IL−27受容体(IL−27R)複合体の少なくとも1つのサブユニットに結合するアゴニスト抗体である、項目1に記載の方法。
(項目6)
前記IL−27R複合体はヒトIL−27R複合体である、項目5に記載の方法。
(項目7)
前記アゴニスト抗体は前記IL−27R複合体のシグナル伝達を誘導する、項目5に記載の方法。
(項目8)
少なくとも1個の胚の子宮内膜への着床を促進する方法であって、有効量のIL−27アゴニストを被検体に投与する工程を含む、方法。
(項目9)
前記被検体はヒトであり、IL−27アゴニストは、
a)妊娠第1三半期;
b)妊娠第2三半期;
c)妊娠第3三半期;または
d)妊娠第1、妊娠第2および妊娠第3三半期
の間に投与される、項目8に記載の方法。
(項目10)
前記IL−27アゴニストはIL−27タンパク質である、項目8に記載の方法。
(項目11)
前記IL−27タンパク質はヒトIL−27タンパク質である、項目10に記載の方法。
(項目12)
前記IL−27アゴニストは、IL−27R複合体の少なくとも1つのサブユニットに結合するアゴニスト抗体である、項目8に記載の方法。
(項目13)
前記IL−27複合体はヒトIL−27複合体である、項目12に記載の方法。
(項目14)
前記アゴニスト抗体は前記IL−27R複合体のシグナル伝達を誘導する、項目12に記載の方法。
(項目15)
被検体が免疫性流産であるかどうかを判定する診断方法であって、該被検体から得られた生物学的サンプル中のIL−27またはIL−27Rの存在またはレベルを検出する工程と、該被検体が自然流産を有しているかどうかを判定する工程とを含む、診断方法。
(項目16)
前記生物学的サンプルは組織サンプル、細胞サンプルまたは血清サンプルからなる群から選択される、項目15に記載の方法。
(項目17)
前記組織サンプルは絨毛膜絨毛サンプルおよび胎盤サンプルからなる群から選択される、項目16に記載の方法。
(項目18)
被検体が免疫性流産を起こすリスクがあるかどうかを判定する予後診断方法であって、該被検体から得られた生物学的サンプルまたは該サンプルの単離物中のIL−27またはIL−27RのmRNAまたはポリペプチドの存在またはレベルを検出する工程を含み、それにより該被検体が自然流産を起こすリスクがあるかどうかを判定する、予後診断方法。
(項目19)
前記生物学的サンプルは組織サンプル、細胞サンプルまたは血清サンプルからなる群から選択される、項目18に記載の方法。
(項目20)
前記組織サンプルは絨毛膜絨毛サンプルおよび胎盤サンプルからなる群から選択される、項目19に記載の方法。
(項目21)
免疫性流産のリスクがあるか、免疫性流産に罹患している被検体に対するIL−27アゴニストによる処置をモニターする方法であって、該被検体からの生物学的サンプルまたは該サンプルの単離物中のTh1またはTh2サイトカインのmRNAまたはポリペプチドのレベルを測定する工程を含み、それにより該被検体が免疫性流産のリスクがあるか、免疫性流産に罹患しているどうかを判定する、方法。
(項目22)
前記Th1サイトカインはTNF−α、IFN−γ、IL−2、IL−1、IL−6、IL−12およびRANTESからなる群から選択される、項目21に記載の方法。
(項目23)
前記Th2サイトカインはCSF−1、GM−CSF、IL−10、IL−4、IL−11、TGFおよびIL−3からなる群から選択される、項目21に記載の方法。
【図面の簡単な説明】
【0016】
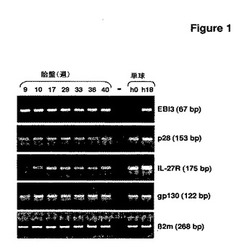
【図1】図1は、半定量RT−PCRにより解析した、様々な妊娠時期に採取した7個の胎盤のEBI3、p28、IL−27Rおよびgp130の遺伝子発現を示す。LPS(100ng/ml)による刺激の前あるいはそれで一晩刺激した後に磁気精製したヒト単球を陽性対照として用いた。<<−>>のレーンは、PCR反応でcDNAを加えていない陰性対照である。B2−ミクログロブリン(B2m)を、各条件で同じ材料の内部対照として用いた。
【図2】図2Aは、p28によるEBI3の免疫共沈降を示す。妊娠17および28週目に採取した2個の胎盤のNP40抽出物を、ウサギポリクローナル抗EBI3Ab、ウサギポリクローナル抗p28Abあるいはウサギ対照Ab(IP当たり10μg)による免疫沈降(IP)に供した。IPの前に得た細胞ライセートの画分(レーン2および5)および免疫沈降物(レーン1、3、4、6、7)を12%ゲルによるSDS−PAGEで解析し、マウスモノクローナル抗EBI3Abまたはウサギポリクローナル抗p28Abを用いたウエスタンブロット解析に供した。EBI3およびp28の位置を示してある。左の数字は、標準分子量のタンパク質(1000の位で示す)の位置を示す。p28ブロットのp28のバンドの上にあるバンドは、ウサギIg鎖に相当する可能性が非常に高い。妊娠9週目、33週目、36週目および40週目の胎盤のライセートにより、類似の免疫共沈降データを取得した。図2Bは、胎盤外植片の培養上清におけるIL−27の検出を示す。グラフの下の時間で示した様々な培養時間に採取した、満期胎盤14個の外植片の培養上清をIL−27のELISAで検査した。平均値(±SD)を示す。
【図3】図3は、各図の上端に示すように対照ウサギAb(a)、ウサギポリクローナル抗p28Ab(b、c)およびマウスモノクローナル抗EBI3Ab(d)を用いた免疫組織化学的検査で解析した第1三半期胎盤の切片を示す。(c)は、(b)において枠で区切った部分の拡大図を示す。合胞体栄養細胞層細胞(syncytiotrophoblast cell)はEBI3とp28とに対して強い陽性を示すのに対し、栄養膜細胞層細胞(cytotrophoblast cell)は陰性のままである点に留意されたい。絨毛癌成分を含む精巣混合型胚細胞腫瘍(testicular mixed germ cell tumor)例の切片をウサギ対照Ab(e)、ウサギポリクローナル抗p28Ab(f)またはマウスモノノクローナル抗EBI3Ab(g)で染色した。EBI3およびp28に対して共に陽性の合胞体栄養細胞層細胞を示す。(f)の挿入図は、合胞体栄養細胞層細胞がp28陽性であるのに対し、形態学的に栄養膜細胞層細胞(矢印)と一致する細胞は陰性であることを示す。対物レンズ:(a)および(b)で10倍;(c〜g)で20倍。ccは栄養膜細胞層細胞;syは合胞体栄養細胞層細胞。
【図4】図4は、対照ウサギAb(a)、ウサギ抗p28Ab(b)またはマウス抗EBI3Ab(c)を用いて免疫組織化学的検査で解析した第1三半期胎盤の連続切片を示す。間質性栄養膜細胞は、EBI3とp28とに対して陽性である。対物レンズ:a〜cで×20。saは螺旋動脈;evtは絨毛外栄養膜細胞(extravillous trophoblast cell)。
【発明を実施するための形態】
【0017】
(好ましい実施形態の詳細な説明)
本明細書に引用する参考文献についてはすべて、参照によって援用すべく1つ1つの刊行物または特許出願を具体的に個々に示す場合と同程度に参照によって本明細書に援用する。
【0018】
本明細書で使用する場合、添付の特許請求の範囲を含め、単語「a」、「an」および「the」などの単数形は、文脈上明らかに他の意味に解すべき場合を除き、それに対応する複数の言及を含む。
【0019】
I.定義
未変性IL−27タンパク質に対して形成された抗体により認識され得る分子、あるいは、未変性IL−27タンパク質の刺激活性、阻害活性または結合活性のいずれかを持つ分子は、少なくとも1つの「IL−27生物活性」または「IL−27アゴニスト活性」を有する。たとえば、その分子は、免疫細胞を強化してIFNγを産生させてもよいし、IL−27受容体に結合してもよい。その分子は、好ましくはWSX−1/TCCRに結合し、一層好ましくはIFNγの産生を増強することができる。
【0020】
「投与」および「処置」とは、ヒト、家畜、動物、実験被検体、細胞、組織、器官または生物学的液体に用いる場合、外因性の医薬剤、治療薬、診断剤または医薬組成物、治療組成物、診断用組成物を動物、ヒト、被検体、細胞、組織、器官または生物学的液体に接触させることをいう。「投与」および「処置」は、たとえば、治療方法、薬物動態学的方法、診断方法、調査方法および実験方法を指してもよい。細胞の処置は、試薬と細胞の接触ばかりでなく、体液が細胞と接触している場合の試薬と体液の接触を包含する。細胞の処置は、ヒトまたは動物において試薬が生物学的液体に接触するが、試薬と細胞の接触が明らかにされていない状態を含む。さらに、処置は、投与された試薬または細胞が代謝、分解または貯蔵条件により改変される状態も包含する。
【0021】
生物活性、機能、健康または有機体の状態の「増進」という語は、増加、補強、強化または改善のプロセスをいう。
【0022】
「作動可能に連結された」という語は、この語を用いた各成分が好適な条件下で固有の機能を発揮できる関係にあることを意味する。たとえば、タンパク質コード配列に「作動可能に連結された」制御配列は、制御配列の転写活性に適合した条件下でタンパク質コード配列の発現を達成するようにそこに連結される。
【0023】
「制御配列」という語は、それが連結されるコード配列の発現およびプロセシングを行うことができる、被検体のポリヌクレオチド配列を意味する。そうした制御配列の性質は、宿主生物によって異なる場合がある。特定の実施形態では、原核生物の制御配列はプロモーター、リボソーム結合部位および転写終結配列を含むことがある。他の特定の実施形態では、真核生物の制御配列は、転写因子の1つまたは複数の認識部位を含むプロモーター、転写エンハンサー配列および転写終結配列を含んでもよい。ある実施形態では、「制御配列」はリーダー配列および/または融合パートナー配列を含み得る。
【0024】
「ポリヌクレオチド」という語は、少なくとも長さ10塩基の一本鎖または二本鎖核酸ポリマーを意味する。ある実施形態では、ポリヌクレオチドを含むヌクレオチドは、リボヌクレオチドまたはデオキシリボヌクレオチドまたはどちらかのタイプのヌクレオチドの改変形であり得る。該改変体は、ブロモウリジンおよびイノシン誘導体などの塩基の改変体、2’,3’−ジデオキシリボースなどのリボース改変体ならびにホスホロチオアート、ホスホロジチオアート、ホスホロセレノアート、ホスホロジセレノアート、ホスホロアニロチオアート、ホスホラニラダートおよびホスホロアミダートなどのヌクレオチド間の連結改変体を含む。ポリヌクレオチドという語は、一本鎖形態および二本鎖形態のDNAを含む。
【0025】
「オリゴヌクレオチド」という語は、200塩基以下の長さを持つポリヌクレオチドを意味する。好ましい実施形態では、オリゴヌクレオチドは長さ10〜60塩基である。より好ましい実施形態では、オリゴヌクレオチドは長さ12、13、14、15、16、17、18、19または20〜40塩基である。たとえば、突然変異遺伝子の構築に用いる場合、オリゴヌクレオチドは一本鎖でも二本鎖でも構わない。本発明のオリゴヌクレオチドは、センスオリゴヌクレオチドであっても、アンチセンスオリゴヌクレオチドであってもよい。
【0026】
「天然に存在するヌクレオチド」という語は、デオキシリボヌクレオチドおよびリボヌクレオチドを含む。「改変ヌクレオチド」という語は、改変または置換された糖基あるいは改変または置換された塩基を持つヌクレオチドを含む。「オリゴヌクレオチド連結」という語は、ホスホロチオアート、ホスホロジチオアート、ホスホロセレノアート、ホスホロジセレノアート、ホスホロアニロチオアート、ホスホラニラダート、ホスホロアミダートなどの連結を含む。たとえば、目的に応じてその開示内容を参照によって本明細書に援用するLaPlanche et al.(1986),Nucl.Acids Res.14:9081;Stec et al.(1984),J.Am.Chem.Soc.106:6077;Stein et al.(1988),Nucl.Acids Res.16:3209;Zon et al.(1991),Anti−Cancer
Drug Design 6:539;Zon et al.(1991),Oligonucleotides and Analogues:A Practical Approach,pp.87−108(F.Eckstein,ed.),Oxford
University Press,Oxford England;Stec et
al.,米国特許第5,151,510号;Uhlmann and Peyman(1990),Chemical Reviews 90:543を参照されたい。本発明のオリゴヌクレオチドは、検出アッセイ用の放射標識、蛍光標識、ハプテンまたは抗原標識などの標識を含んでもよい。
【0027】
「ベクター」という語は、宿主細胞へのコーディング情報の伝達に使用する任意の分子(核酸、プラスミドまたはウイルスなど)を意味する。
【0028】
「発現ベクター」または「発現コンストラクト」という語は、宿主細胞の形質転換に好適なベクターをいい、それに作動的に連結された1つまたは複数の異種コード領域の発現を(宿主細胞と共同して)誘導および/または制御する核酸配列を含む。発現コンストラクトは、以下に限定されるものではないが、転写と、翻訳と、イントロンが存在する場合、それに作動可能に連結されたコード領域のRNAスプライシングとに作用または制御する配列を含んでもよい。
【0029】
「宿主細胞」という語は、核酸配列により形質転換されているか、形質転換され得て、それにより選択した目的の遺伝子を発現する細胞を意味する。選択した遺伝子が存在する限り、子孫の形態または遺伝子構成が最初の親細胞と同一かどうかに関係なく、宿主細胞は親細胞の子孫を含む。
【0030】
「形質導入」という語は、通常、ファージによりある細菌の遺伝子が別の細菌に導入されることを意味する。また、「形質導入」は、真核細胞配列のレトロウイルスによる獲得および伝達のこともいう。
【0031】
「トランスフェクション」という語は、細胞による外来または外因性DNAの取り込みを意味し、外因性DNAが細胞膜内に導入されているとき、細胞は「トランスフェクトされている」。当該技術分野において多くのトランスフェクション技術が周知であり、本明細書に開示する。たとえば、Graham et al.,1973,Virology
52:456;Sambrook et al.,2001,Molecular Cloning:A Laboratory Manual,Id;Davis et al.,1986,Basic Methods in Molecular Biology,Elsevier;and Chu et al.,1981,Gene 13:197を参照されたい。こうした技術を用いて1つまたは複数の外因性DNA部分を好適な宿主細胞に導入することができる。
【0032】
「形質転換」という語は、細胞の遺伝的特徴の変化をいい、細胞は、新しいDNAを含むように改変されているとき、形質転換されている。たとえば、細胞は、トランスフェクション、形質導入または他の技術により未変性状態から遺伝子改変される場合、形質転換される。トランスフェクション後または形質導入後の形質転換DNAについては、細胞の染色体に物理的に組み込んで細胞のDNAと組換えてもよいし、複製されない一過性のエピソーム要素のままでもよいし、プラスミドとして独立に複製させてもよい。細胞は、細胞分裂により形質転換DNAが複製されるとき、「安定に形質転換された」と考察される。
【0033】
IL−27のポリペプチドおよび核酸の保存的に改変された改変体、誘導体およびムテインの使用方法を提供する。「保存的に改変された改変体」は、アミノ酸配列および核酸配列の両方に用いられる。特定の核酸配列に関する保存的に改変された改変体とは、同一または本質的に同一のアミノ酸配列をコードする核酸をいい、あるいは、核酸がアミノ酸配列をコードしない場合、本質的に同一の核酸配列をいう。遺伝コードの縮重により、機能的に同一の核酸の多くが任意の特定のタンパク質をコードすることがある。
【0034】
アミノ酸配列については、コード化配列の1つのアミノ酸またはごく一部のアミノ酸を保存アミノ酸で置換する、核酸配列、ペプチド配列、ポリペプチド配列またはタンパク質配列の個々の置換が、「保存的に改変された改変体」であることを当業者は認識する。機能的に類似したアミノ酸を与える保存的置換の表は、当該技術分野において周知である。たとえば、保存的置換の例は、以下の群の1つのアミノ酸と、同一群における別のアミノ酸との交換である(Lee,らに付与された米国特許第5,767,063号;Kyte
and Doolittle(1982)J.Mol. Biol.157:105−132):
(1)疎水性:ノルロイシン、Ile、Val、Leu、Phe、CysまたはMet;(2)中性親水性:Cys、Ser、Thr;
(3)酸性:Asp、Glu;
(4)塩基性:Asn、Gln、His、Lys、Arg;
(5)鎖の配向に影響を与える残基:Gly、Pro;
(6)芳香族:Trp、Tyr、Phe;
(7)小アミノ酸:Gly、Ala、Ser。
【0035】
「ポリペプチド」または「タンパク質」という語は、未変性タンパク質の配列、すなわち、天然に存在し明確な非組換え細胞、あるいは遺伝子操作または組換え細胞から産生されるタンパク質の配列を持つ分子を意味し、未変性タンパク質のアミノ酸配列を持つ分子または未変性の配列中の1つまたは複数のアミノ酸に欠失、付加および/または置換がある分子を含む。具体的には、「ポリペプチド」および「タンパク質」という語は、抗体、あるいは、そうした抗体の1つまたは複数のアミノ酸に欠失、付加および/または置換がある配列を包含する。「ポリペプチドフラグメント」という語は、アミノ末端欠失、カルボキシル末端欠失および/または内部欠失を持つポリペプチドをいう。ある実施形態では、フラグメントは少なくとも5〜約500アミノ酸長である。ある実施形態では、フラグメントは少なくとも5、6、8、10、14、20、50、70、100、110、150、200、250、300、350、400または450アミノ酸長であることが理解される。特に有用なポリペプチドフラグメントとして、結合ドメインなどの機能ドメインが挙げられる。抗体の場合の有用なフラグメントとして、CDR領域、重鎖または軽鎖の可変ドメイン、抗体鎖または2つのCDRをちょうど含む可変領域の一部などを含むが、これに限定されるものではない。
【0036】
「天然に存在する」および「未変性の」という語は、この語を用いる生物材料(分子、配列、タンパク質複合体、細胞など)が自然界に見出され、ヒトにより操作されていないことを意味する。たとえば、有機体(ウイルスなど)に存在するポリペプチドまたはポリヌクレオチド配列が自然界の供給源から単離することができ、かつヒトにより意図的に改変されていない場合、それは天然に存在するものである。同様に、「非天然の」または「外来の(non−native)」という語は、自然界に見られないか、あるいは、ヒトにより構造改変されたまたは合成された材料をいう。
【0037】
医薬品業界では、鋳型ペプチドと類似の特性を持つ非ペプチド薬物としてペプチドアナログが一般に用いられる。このタイプの非ペプチド化合物は、「ペプチド模倣体(peptide mimetic)」または「ペプチド模倣物(peptidemimetic)」と呼ばれる。参照によって本明細書に援用するFauchere(1986),Adv.Drug Res.15:29;Veber & Freidinger,1985,TINS p.392;and Evans et al.(1987),J.Med.Chem.30:1229を参照されたい。そうした化合物は、コンピューター分子モデリングを用いて開発されることが多い。治療上有用なペプチドと構造的に類似したペプチド模倣体を用いると、類似の治療または予防効果が得られることがある。通常、ペプチド模倣物は、ヒト抗体などのパラダイムペプチドまたはポリペプチド(すなわち、生化学的特性または薬理学的活性を持つペプチドまたはポリペプチド)と構造的に類似しているが、当該技術分野において周知の方法で−−CH2−−NH−−、−−CH2−−S−−、−−CH2−−CH2−−、−−CH=CH−−(シスおよびトランス)、−−COCH2−−、−−CH(OH)CH2−−および−−CH2SO−−から選択される結合により必要に応じて置き換えられる1つまたは複数のペプチド結合を持つ。ある実施形態では、コンセンサス配列の1つまたは複数のアミノ酸を同じタイプのD−アミノ酸による系統的置換(L−リジンをD−リジンで置換など)を用いてより安定なペプチドを生成することができる。さらに、当該技術分野において公知の方法(任意の目的に応じて参照によって本明細書に援用するRizo & Gierasch,1992,Ann.Rev.Biochem.61:387)により、たとえば、ペプチドを環化する分子内ジスルフィド架橋を形成できる内部システイン残基を付加して、コンセンサス配列または実質的に同一のコンセンサス配列改変を含む、束縛されたペプチドを生成してもよい。
【0038】
「半減期延長剤」という語は、治療用タンパク質の分解を防止する、および/または半減期を延長させる、毒性を低下させる、免疫原性を低下させる、あるいは生物活性を増加させる分子をいう。例示的ビヒクルとして、Fcドメイン(好ましい)および線状ポリマー(たとえば、ポリエチレングリコール(PEG)、ポリリシン、デキストランなど);分枝鎖ポリマー(たとえば、1981年9月15日に発行したDenkenwalterらに付与された米国特許第4,289,872号;1993年7月20日に発行したTamに付与された米国特許第5,229,490号;1993年10月28日に公開されたFrechetらによる国際公開第93/21259号を参照);脂質;コレステロール群(ステロイドなど);炭水化物またはオリゴ糖(デキストランなど);サルベージ受容体に結合する任意の天然または合成タンパク質、ポリペプチドまたはペプチド;ヒト血清アルブミン(HSA)などのアルブミン、ロイシンジッパードメインならびに他のそうしたタンパク質およびタンパク質フラグメントが挙げられる。
【0039】
「未変性Fc」という語は、単量体または多量体を問わず、全抗体の消化から得られる非抗原結合フラグメントの配列を含む分子または配列をいう。未変性Fcの最初の免疫グロブリン源は、好ましくはヒト由来であり、IgG1およびIgG2が好ましいが、免疫グロブリンのいずれであってもよい。未変性Fcは、共有結合(すなわち、ジスルフィド結合)および非共有結合により二量体または多量体に結合できる、単量体ポリペプチドからなる。未変性Fc分子の単量体サブユニット間の分子間ジスルフィド結合の数は、クラス(IgG、IgA、IgEなど)またはサブクラス(IgG1、IgG2、IgG3、IgA1、IgGA2など)に応じて1〜4である。未変性Fcの一例として、IgGのパパイン消化から得られるジスルフィド結合二量体がある(Ellison et al.(1982),Nucleic Acids Res.10:4071−9を参照)。本明細書で使用する場合、「未変性Fc」という語は、単量体、二量体および多量体の総称である。
【0040】
「選択的結合剤」という語は、目的のタンパク質に優先的に結合する分子をいう。選択的結合剤は、タンパク質、ペプチド、核酸、炭水化物、脂質または低分子量化合物を含んでもよい。本発明の主題の選択的結合剤であるタンパク質の例として、可溶性受容体(すなわち、天然に存在する膜結合タンパク質の細胞外ドメインの全部または一部を持つが、膜貫通ドメインまたは細胞内ドメインを持たないタンパク質);抗体およびそのフラグメント;抗体および可溶性受容体の改変体、誘導体および融合タンパク質;ペプチド模倣物化合物;および有機模倣体化合物が挙げられる。好ましい実施形態では、選択的結合剤は、以下に限定されるものではないが、酵素的切断、ペプチド合成または組換え技術などの既知の技術により得られるポリクローナル抗体、モノクローナル抗体(mAb)、キメラ抗体、CDR移植抗体、可溶形または結合形で標識できる抗体に対する抗イディオタイプ(抗Id)抗体およびこれらのフラグメント、領域または誘導体などの抗体である。
【0041】
「抗原」という語は、抗体などの選択的結合剤が結合することができ、しかもその抗原のエピトープに結合できる抗体を産生する動物において使用可能な分子または分子の一部をいう。抗原が持つエピトープは1つでも複数でもよい。
【0042】
「エピトープ」という語は、任意の決定基、好ましくは免疫グロブリンまたはT細胞受容体に特異的に結合できるポリペプチド決定基を含む。ある実施形態では、エピトープ決定基は、アミノ酸、糖側鎖、ホスホリルまたはスルホニルなどの分子の化学的に活性な表面基を含み、ある実施形態では、特異的な三次元構造特性および/または特異的な電荷特性を持ってもよい。エピトープは、抗体が結合する抗原領域である。ある実施形態では、抗体は、タンパク質および/または高分子の複雑な混合物において標的抗原を優先的に認識するとき、抗原に特異的に結合するとされる。好ましい実施形態では、抗体は、解離定数が約10nM以下、一層好ましくは解離定数が約100pM以下、最も好ましくは解離定数が約10pM以下のとき、抗原に特異的に結合するとされる。「抗体」または「抗体ペプチド(単数または複数)」とは、インタクトな抗体または特異的結合に際してインタクトな抗体と競合するその結合フラグメントをいい、キメラ抗体、ヒト化抗体、完全ヒト抗体および二重特異性抗体を含む。ある実施形態では、結合フラグメントを組換えDNA技術により作製する。さらなる実施形態では、インタクトな抗体の酵素的切断または化学的切断により結合フラグメントを作製する。結合フラグメントには、Fab、Fab’、F(ab’)2、Fv、免疫学的に機能的な免疫グロブリンフラグメント、重鎖抗体、軽鎖抗体および一本鎖抗体があるが、これに限定されるものではない。
【0043】
「重鎖」という語は、全長重鎖および結合特異性を与えるのに十分な可変領域配列を持つそのフラグメントを含む。全長重鎖は、可変領域ドメインのVHならびに3つの定常領域ドメインCH1、CH2およびCH3を含む。VHドメインは、ポリペプチドのアミノ末端にあり、CH3ドメインはカルボキシル末端にある。
【0044】
「軽鎖」という語は、全長軽鎖、および結合特異性を与えるのに十分な可変領域配列を持つそのフラグメントを含む。全長軽鎖は、可変領域ドメインのVLおよび定常領域ドメインのCLを含む。軽鎖の可変領域ドメインは重鎖と同様にポリペプチドのアミノ末端にある。
【0045】
「Fabフラグメント」は、1本の軽鎖と1本の重鎖のCH1および可変領域を含む。Fab分子の重鎖は、別の重鎖分子とジスルフィド結合を形成できない。
【0046】
「Fab’フラグメント」は、1本の軽鎖と、CH1ドメインとCH2ドメインの間までの一層多くの定常領域を含む1本の重鎖とを含み、2本の重鎖の間に鎖間ジスルフィド結合が形成されてF(ab’)2分子になることができる。
【0047】
「F(ab’)2フラグメント」は、2本の軽鎖と、CH1ドメインとCH2ドメインの間の定常領域の部分を含む2本の重鎖とを含み、2本の重鎖の間に鎖間ジスルフィド結合が形成されている。
【0048】
「Fv領域」は、重鎖および軽鎖両方の可変領域を含むが、定常領域を欠いている。
【0049】
「一本鎖抗体」は、重鎖および軽鎖可変領域がフレキシブルリンカーにより連結されて単一のポリペプチド鎖を形成し、これが抗原結合領域になっているFv分子である。一本鎖抗体については、任意の目的に応じてその開示内容を参照によって援用する国際特許出願公開第88/01649号および米国特許第4,946,778号および同第5,260,203号に詳細に考察されている。
【0050】
ある実施形態では、「多重特異性(multispecific)」または「多機能性」抗体以外の「二価抗体」は、抗原特異性が同一の結合部位を含むと理解される。
【0051】
「二重特異性」または「二機能性」抗体は、2つの異なる重鎖/軽鎖対および2つの異なる結合部位を持つハイブリッド抗体である。二重特異性抗体については、以下に限定されるものではないが、ハイブリドーマの融合またはFab’フラグメントの連結など種々の方法により作製することができる。たとえば、Songsivilai & Lachmann(1990),Clin.Exp.Immunol.79:315−321;Kostelny et al.(1992),J.Immunol.148:1547−1553を参照されたい。
【0052】
「有効量」とは、使用目的を達成するのに十分な治療薬物の量である。たとえば、母体の寛容を促進する組成物の有効量は、胎児、胚または受精卵の免疫拒絶を予防するのに十分な量である。同様に、組成物の有効量は、受精卵または胚の子宮内膜への着床または付着を促す。障害、疾患または医学的状態を処置または軽減する有効量は、障害、疾患または医学的状態の症状を緩和または完全に除去するのに十分な量である。所定の治療薬物の有効量は、薬物の性質、投与経路、治療薬物を投与される動物の大きさおよび種ならびに投与目的などの要因によって異なる。個々の例の有効量については、当該技術分野において確立された方法に従い当業者が経験的に判定してもよい。
【0053】
細胞を物質に「曝露する」とは、直接的または間接的に物質を細胞に与えることをいう。物質に関しては、たとえば、その物質へと変化することが知られているその物質の前駆体を与えることで、間接的に与えてもよい。たとえば、IL−27への標的細胞の曝露は、IL−27タンパク質を含む組成物を標的細胞に与えることにより、あるいは、IL−27をコードする遺伝子(単数または複数)を標的細胞に導入することにより実施してもよい。あるいは、このことを、IL−27をコードする遺伝子(単数または複数)を第2の細胞に導入し、標的細胞をその第2の細胞と混合することにより実施しても構わない。
【0054】
「発現」は、たとえば、mRNAのような核酸またはポリペプチドの生合成と、たとえば、核からサイトゾルへの移動、形質膜への挿入、脱顆粒または分泌などによる高分子の区分化における変化とを包含する。細胞による高分子の発現または産生には、細胞に認められる量、たとえば、ある特定の時点での細胞ホモジネート中に認められる量しか含めなくてもよい。通常、この規定は、非分泌性分子の発現に適用される。あるいは、細胞による高分子の発現または産生は、細胞に認められる量に加えて、たとえば、細胞培地または生体のコンパートメントにおいて分泌および蓄積した量を含める。通常、この規定は、分泌または脱顆粒されたタンパク質、たとえば、サイトカインに適用される。「レベル」とは、たとえば、所定容積の血漿、血清、血液、間質液、脳脊髄液または尿における濃度、臓器全体または臓器のフラグメントにおける濃度、たとえば、赤脾髄、白脾髄または膵島のような臓器内のコンパートメントにおける濃度、あるいは、たとえば、マクロファージのような特定の細胞または細胞群における濃度など、生体コンパートメントのようなコンパートメントにおける濃度をいう。
【0055】
「ハイパーカイン」とは、サイトカインの少なくとも2つのサイトカインポリペプチドサブユニットが相互に共有結合している、操作されたヘテロ二量体、ホモ二量体または多量体のサイトカインである(Pflanz,et al.(2002)Immunity
16:779−790)。IL−27の場合は、p28とEBI3が共有結合(covelent association)したハイパーカインである。
【0056】
「免疫細胞」とは、B細胞、T細胞、NK細胞、単球、マクロファージ、マスト細胞、好酸球または抗原提示細胞(APC)もしくは樹状細胞などの免疫系の細胞である。免疫細胞は、文脈に応じて、免疫のメディエーターを発現する任意の細胞でも、サイトカインを発現する上皮細胞でもよい。
【0057】
障害、疾患または医学的状態「の疑いがある」ヒトまたは動物の被検体とは、まだ障害、疾患または医学的状態があると診断されていないものの、障害の1つまたは複数の症状を示すか、障害の遺伝的素因があるか、再発を起こしやすい障害の処置を以前に受けたことがある被検体である。
【0058】
「核酸」は、一本鎖核酸と、一本鎖核酸鎖およびその相補鎖の複合体からなる二本鎖核酸とを包含する。本発明は、たとえば、IL−27ヘテロ二量体サイトカインの各サブユニットをコードする少なくとも1つの核酸を含む少なくとも1つの発現ベクター内に存在する少なくとも1つの核酸の使用方法を包含する。
【0059】
本発明は、たとえば、上記の核酸が1つのベクターによってコードされる場合;1つの核酸が第1のベクターによってコードされ、残りの核酸が第2のベクターによってコードされる場合;および各核酸がそれぞれ別々のベクターによってコードされる場合の方法ならびにこれらの様々な組み合わせを意図している。さらに、上記のサイトカインを提供する方法であって、1種または複数種のサイトカインをベクターで提供する方法、および、たとえば、ベクターおよびポリペプチドを含む組成物による処置など、1種または複数種のサイトカインをサイトカインポリペプチドにより提供する方法も意図している。意図した方法のベクターは、たとえば、第1の核酸と作動可能に連結された第1のプロモーター;第2の核酸と作動可能に連結された第2のプロモーター;第3の核酸と作動可能に連結された第3のプロモーターなど、ならびに第1および第2の核酸と作動可能に連結された第1のプロモーター、第1、第2および第3の核酸と作動可能に連結された第1のプロモーターなどを含む。
【0060】
「処置または軽減」とは、障害、疾患または医学的状態の症状の緩和または完全な除去を意味する。
【0061】
本明細書で使用する場合、「生物学的サンプル」という語は、被検体、好ましくはヒト被験者から単離された、あるいは、被検体、好ましくはヒト被験者内に存在する生物材料のサンプルをいう。「生物材料」は、たとえば、組織、組織サンプル、腫瘍、腫瘍サンプル、細胞、生物学的液体および精製されたおよび/または部分的に精製された生体分子を含んでもよい。本明細書で使用する「単離された」という語は、生物学的サンプルの文脈で用いる場合、生物学的サンプルが被検体から除去されていることを示すものである。)。母体の血清または血液中のIL−27またはIL−27Rのレベルを測定する。別のさらなる実施形態では、IL−27またはIL−27Rのレベルを胎盤、羊水または絨毛膜絨毛サンプル中で測定してもよい。
【0062】
本明細書で使用する場合、「免疫性流産」という語は、たとえば、流産(miscarriage)のような自然妊娠中絶を含む。本明細書に定義する免疫性流産は、受精胚が被検体の子宮壁に正しく着床できないこと、あるいは、胚がいったん着床して被検体の子宮から脱落することまたは被検体による胚が再吸収されることを含む。免疫性流産は、たとえば、胚性もしくは胎児性抗原または胚もしくは胎児に発現する、あるいは、胚もしくは胎児から放出される父系抗原などの抗原に対する被検体の免疫反応に起因する。
【0063】
本明細書で使用する場合、「着床」という語は、自然受精プロセス後の、あるいは、生殖補助技術を用いた、子宮内膜への受精卵の付着を含む。本明細書で使用する場合、「生殖補助技術」とは、たとえば、排卵誘発、体外受精、胚芽移植など、生殖を技術的に補助する任意の方法をいう。ヒトの自然生殖プロセスにおいて、着床が起こるのは、通常、排卵から5〜7日後である。
【0064】
本明細書で使用する場合、「胚」という語は、接合体が受精する時期から、その接合体から発生する生体が自由生活をするようになる時点までの多細胞生体の発生における段階を含む。
【0065】
「寛容」は、たとえば、癌もしくは腫瘍または移植アロ抗原などのアロ抗原、外来抗原分子、外来分子複合体、または外来有機体もしくはウイルス由来の抗原に対して無反応である免疫寛容を包含する。寛容はまた、妊娠中の胎児性抗原に対する免疫無反応または免疫無反応の拡大も包含する。さらに、「寛容」は、自然寛容(naturally occurring tolerance)および人為的または薬理学的に誘導した寛容も包含する。さらに、寛容は、分子類似性により認識される自己抗原に対する免疫無反応にも関する(たとえば、Liu(1997)J.Exp.Med.186:625−629;Waldman and Cobbold(1998)Annul Rev.Immunol.16:619−644;Xiao and Link(1997)Clin.Immunol.Immunopathol.85:119−128;Steinman,et al.(2003)Annu.Rev.Immunol.21:685−711;Olson,et al.(2002)J.Immunol.169:2719−2726;Toussirot(2002)Curr.Drugs Targets Inflamm.Allergy 1:45−52;Takahashi and Sakaguchi(2003)Int Rev CytoL 225:1−32;Burt,et al.(2002)Int.J.Hematol.76(Suppl l):226−47;Gery and Egwuagu(2002)Int.Rev.Immunol.21(2−3):89−100;Weiner(2001)Microbes Infect.3:947−54を参照)。本発明における「母体の寛容」とは、胎児または胚に発現するか、胎児または胚により放出される胎児性抗原または父系抗原に対する寛容をいう。
【0066】
II.一般的事項
本発明は、胎児に対する母体の寛容を調節する方法を提供する。さらに、子宮内膜への胚の着床を調節する方法も提供する。
【0067】
妊娠9〜40週の範囲の7個の正常なヒト胎盤を用いてEBI3遺伝子およびp28遺伝子の発現を調査した。無刺激あるいはLPSで18時間刺激した精製単球を陽性対照として用いた。LPS刺激単球およびすべての胎盤の例では、EBI13およびp28のシグナルが検出され、様々な在胎齢でIL−27の2つのサブユニットが胎盤に発現することが示された。同様に、IL−27受容体の2つの成分IL−27Rおよびgp130の遺伝子発現もすべての胎盤で検出された(図1)。したがって、IL−27およびIL−27R複合体をコードする遺伝子は、様々な妊娠期で胎盤に発現する。
【0068】
次に、ヒト胎盤におけるタンパク質レベルのIL−27ヘテロ二量体を調べた。このため、0.5%NP40抽出物を様々な妊娠期で胎盤から調製し、免疫共沈降実験に供した(図2A)。ウサギ抗p28Abまたは対照ウサギIgGでp28を免疫沈降し、結合したEBI3の量をEBI3のウエスタンブロットにより評価した。陽性対照として、ライセートをウサギ抗EBI3Abで免疫沈降に供した。予想通り、EBI3のイムノブロットにより、免疫沈降前の胎盤ライセート中(図2A、上パネル、レーン2および5)および抗EBI3の免疫沈降物中(図2A、上パネル、レーン1)で33kDaのタンパク質が同定された。より重要なのは、抗p28の免疫沈降物中でもEBI3が検出された(図2A、上パネル、レーン4および7)が、対照の免疫沈降物(レーン3および6)中ではほとんど検出できなかったことであり、これによりEBI3がp28に特異的に結合することが示唆された。p28については、抗p28Abで免疫沈降しない限り、胎盤のライセートを用いたウエスタンブロットにより検出できなかった、(図2、下パネル)。また、p28のバンドは、抗EBI3の免疫沈降物を用いたウエスタンブロットでも観察されなかった(図2A、下パネル、レーン1)。その理由は、EBI3/p28ヘテロ二量体に対して遊離EBI3が過剰であること(以下を参照)およびp28のブロットが低感度であることにある可能性が非常に高い。
【0069】
胎盤細胞がIL−27を産生することを確かめるため、様々な培養時間に回収した満期胎盤外植片の培養上清に存在するIL−27の量をELISAにより測定した。図2Bに示すように、IL−27は約1〜4ng/mlの範囲の濃度で検出され、胎盤細胞がIL−27を産生することが確認された。これらの上清については、ELISAにより以前にEBI3を検査し、10〜33ng/mlのEBI3を含んでいた(たとえば、Devergne,et al.(2001)Am J Pathol 159:1763−1776を参照)。したがって、遊離EBI3はすべての例でIL−27ヘテロ二量体よりも過多に(平均で約10倍過剰)存在した。類似の知見が、本実験で観察された範囲の量でEBI3およびIL−27を含む、活性化ヒト単球由来の樹状細胞の培養上清でも観察された(たとえば、Nagai et al.(2003)J Immunol 17:5233−5243を参照)。こうしたEBI3の過剰な産生は、ヒト胎盤におけるIL−27発現に関する以前の研究と整合している(たとえば、Pflanz,et al.(2002)を参照 上掲)。
【0070】
妊婦の血清中に増加したレベルのEBI3が存在することは既に明らかにされている。EBI3の血清レベルは妊娠から2ヶ月後に既に上方制御され、在胎齢と共に徐々に上昇し、妊娠末期には最大400ng/mlの濃度に達する(たとえば、Devergne,et al.(2001)を参照 上掲)。しかしながら、妊婦7名の血清についてELISAによりIL−27を検査したところ、期間を問わず、顕著なレベルのIL−27は検出されなかった。このようにそれらの血清中でIL−27が検出されないのは、インビボでのIL−27の半減期が短いことが原因であり得る。実際、サブユニットが共有結合するIL−12およびIL−23など他のヘテロ二量体サイトカインと異なり、EBI3とp28の結合は、共有結合でない点に留意すべきである。結果として、このヘテロ二量体はインビボで解離しやすく、それにより血清中での検出を低めている可能性がある。
【0071】
胎盤の自由絨毛は、内層の栄養膜細胞層および外層の合胞体栄養細胞層からなる。本発明者らは以前に、免疫組織化学的検査により自由絨毛におけるEBI3の発現が合胞体栄養細胞層に限定されることを示した。これらの細胞は妊娠期間を通じてEBI3陽性であるのに対し、絨毛性栄養膜細胞層、Hofbauer細胞(胎盤のマクロファージ)および胎児内皮細胞はEBI3陰性であった(Devergne et al.(2001)Am J Pathol 159:1763−1776)。合胞体栄養細胞層にIL−27の第2のサブユニットが発現するかどうかを検討するため、第1、第2および第3三半期の胎盤19個を対象としてウサギポリクローナルまたはラットモノクローナル抗p28Abを用いて免疫組織化学的検査によりp28の発現を解析した。これらの胎盤については、免疫組織化学的検査によりEBI3を以前検査してあったか(たとえば、Devergne et al.(2001)を参照 上掲)、あるいはそうでない場合、EBI3およびp28を平行して検査した。図3a〜図3cに示すように、合胞体栄養細胞層では著しいp28染色性が見られた一方、栄養膜細胞層ではp28シグナルが観察されなかったか、非常に低かった。合胞体栄養細胞層のp28染色性は、通常、第1三半期の胎盤で最も強かったが、第2および第3三半期の胎盤でも観察された。
【0072】
妊娠以外に、ある種の胚細胞腫瘍において栄養膜性細胞(trophoblastic
cell)が観察されることがある。したがって、栄養膜細胞(trophoblast cell)がIL−27の2つのサブユニットを共発現する能力をさらに解析するため、絨毛癌など7例の精巣胚細胞腫瘍について、免疫組織化学的検査によりEBI3およびp28の発現を解析した。これらの腫瘍では、胎盤の栄養膜細胞と同様に、合胞体栄養細胞層細胞にはEBI3およびp28が共発現するが、栄養膜細胞層細胞には共発現しなかった(図3e〜図3g)。
【0073】
胎盤の付着絨毛の栄養膜細胞層は子宮に浸潤し、絨毛外栄養膜(extravillous trophoblast)に分化する。これらの浸潤性の絨毛外栄養膜は、間質性栄養膜(interstitial trophoblast)、多核巨細胞および血管内栄養膜(endovascular trophoblast)と呼ばれる、母体の子宮螺旋動脈に浸潤し、これを形質転換させる栄養膜の不均一な集団からなる。EBI3は、間質性栄養膜、多核巨細胞および螺旋動脈壁に浸潤する栄養膜に発現するが、これらの細胞が血管内栄養膜に分化したならば、下方制御されることは既に明らかにされた。EBI3陽性絨毛外栄養膜は、妊娠期間を通じて観察され、脱落膜におけるEBI3の主な供給源をなしていた。その理由は、脱落膜細胞および浸潤性リンパ球など、この部位に存在する他の細胞型はEBI3陰性であるためであった(たとえば、Devergne et
al.(2001)を参照 上掲)。上述の19個の胎盤におけるp28発現の免疫組織化学的研究から、期間に関係なく絨毛外栄養膜(間質性栄養膜および多核巨細胞)にp28が発現することが示された(図4)。したがって、絨毛外栄養膜には合胞体栄養細胞層のようにIL−27の2つのサブユニットが共発現し得る。
【0074】
この研究は、胎児と母体の界面でのEBI3の発現に関するこれまでの観察結果を発展させるものである。本研究から、この部位の合胞体栄養細胞層および絨毛外栄養膜にEBI3ばかりでなくIL−27も発現することが明らかになる。従来のin situ解析では、樹状細胞またはリンパ腫の腫瘍性細胞など、EBI3を強力に発現する細胞においてp28の発現が検出されなかった。そのため、栄養膜細胞(trophoblast cell)を用いたIL−27の2つのサブユニットのin situ検出に関しては、あまり期待されていなかった(Larousserie,et al.(2004)上掲;Larousserie et al.(2005)上掲;and Larousserie et al.(2006)上掲.)。また、胎児と母体の界面でのIL−27の発現も、この新しいサイトカインの最初に記載された機能に照らして、予測されていなかった。実際に最初の研究では、ナイーブCD4+T細胞への反応性(responsiveness)をIL−12に与える能力、およびナイーブCD4+T細胞および単球においてそれぞれIFN−γおよびプロ炎症性サイトカインの発現を増加させる能力などを理由に、IL−27をpro−Th1およびプロ炎症性サイトカインとして同定した(たとえば、Pflanz et al.(2002)上掲;and Pflanz et al.(2004)を参照 上掲)。
【0075】
これらの知見は、妊娠が成立するのはTh2優位の状況である一方、Th1サイトカインは妊娠に有害(deletorious)であるとした、過去10年を通じて普及していた考え方と対照的である(Wegmann et al.(1993)Immunol
Today 14:353−356)。しかしながら、この仮説は後に、IFN−γ、IL−12およびIL−18などの古典的なTh1サイトカインが正常な子宮に発現することが明らかになり、適量で発現する場合、妊娠において正の制御に関与していることが示唆されたため、疑問視された(Chaouat et al.(2004)Immunol Lett 92:207−214)。LIFおよびIL−11などのプロ炎症性サイトカインは、着床プロセスにおいて、特に栄養膜および脱落膜細胞に接着分子を誘導することで、決定的に重要な役割を果たしていることが明らかになった(Chaouat,et al.(2004)上掲)。これらの知見により、Th1/Th2パラダイムおよび妊娠におけるTh1およびプロ炎症性サイトカインの積極的な役割に関する見解が再考された。さらに、最近の研究からは、IL−27の生物活性がそのpro−Th1活性をはるかに超えて拡張したことが示され、マウスの研究に基づき、過剰なT細胞活性および炎症反応の抑制におけるIL−27の役割が提案された(Trinchieri,et al.(2003)上掲)。近年、主要なプロ炎症性Th細胞サブセットであるTh17細胞の発生をIL−27が阻害することが証明され、IL−27の抗炎症の役割が一部解明された(Batten et al.(2006)Nat Immunol 7:929−936;and Stumhofer et al.(2006)Nat Immunol 7:937−945)。
【0076】
以上をまとめると、これらの観察結果から、IL−27が、本前後関係およびサイトカイン環境に応じて、Th反応および炎症反応の制御において明らかに正反対の役割を果たすモデルが導かれた。多くのマウスモデルでは、IL−27の免疫抑制機能がそのpro−Th1活性に比べて優位であることが示唆された(たとえば、Batten et al.(2006)上掲;Stumhofer et al.(2006)上掲;Villarino et al.(2003)Immunity 19:645−655;Hamano et al.(2003)Immunity 19:657−667;and
Wirtz et al.(2006)J Exp Med 203:1875−1881を参照)。
【0077】
RT−PCR解析により、IL−27受容体鎖をコードする遺伝子が様々な在胎齢で胎盤に発現することが明らかになった。免疫組織化学的検査に好適なIL−27R抗体がないため、IL−27受容体をin situ発現している細胞の正確な性質は、確認できなかった。しかしながら、従来の研究から、この受容体が多くの細胞型に発現し、NK細胞、NKT細胞、CD8+T細胞およびCD4+CD25+制御性T細胞など(Villarino(2005)J Immunol 174:7684−7691)の多くは、胎児と母体の界面に存在することが明らかになっている(Boyson et al.(2002)Proc Natl Acad Sci USA 99:13741−13746;Shao et al.(2005)J Immunol 174:7539−7547;Sasaki et al.(2004)Mol Hum Reprod 10:347−353;Somerset et al.(2004)Immunology
112:38−43;Tilburgs et al.(2006)Placenta
27 Suppl A:S47−53;and Zenclussen(2006)Springer Semin Immun 28:31−39)。これらの中で、脱落膜NK細胞は、白血球集団の50%超を占める場合、妊娠の第1および第2三半期に脱落膜に特に浸潤する、最も多く含まれるリンパ球集団である。脱落膜NK細胞および浸潤性の栄養膜は、1つにサイトカイン産生を通して直接相互合作用し、その機能を相互に制御する(Moffett−King(2002)Nat Rev Immunol 2:656−663;Parham(2004)J Exp Med 200:951−955;Tabiasco et al.(2006)Placenta 27 Suppl A:S34−9;and Le Bouteiller and Tabiasco(2006)Nat Med 12:991−992)。これらの2つの細胞型の間で制御される相互作用は、血管を拡張し発育中の胎児胎盤ユニットに十分な血液供給を行うのに必要な重要な事象である、母体の子宮動脈の血管の形質転換に決定的に重要な役割を担うことが特に明らかになっている。子宮KN細胞は、VEGFなどの血管新生促進因子の産生により血管新生促進活性を示す(Hanna,et al.(2006)Nat Med 12:1065−1074)。興味深いことに、この細胞はさらに、高用量では流産の作用があるにもかかわらず、正常なマウスの妊娠の過程で脱落膜および子宮血管の修飾が適切に進展するのに必要なIFN−γも産生する(Ashkar et al.(2000)J Exp Med 192:259−269)。IL−27は、末梢NK細胞によるIFN−γ産生に関与し(Pflanz,et al.(2002)上掲)、脱落膜KN細胞によるIFN−γ、さらには他の可溶性因子の産生を制御し得ることが明らかにされている。同様に、IL−27は、以前のマウス研究から示唆されるように、脱落膜NKT細胞によるサイトカインの産生を調節し得る(Yamanaka et al.(2004)J Immunol 172:3590−3596)。
【0078】
IFN−γ以外にIL−12およびIL−18も、妊娠中の新脈管形成に関与していることが示唆されている。したがって、体外受精後に着床不全が繰り返される女性では、血管の変質に伴い子宮内膜で調節不全のIL−12およびIL−18発現プロファイル(欠損または過剰)が観察された(Ledee−Bataille et al.(2004)Fertil Steril 81:59−65)。IL−27は最近、内皮細胞に直接作用し、抗新脈管形成性(antiangiogenic)ケモカインIP−10およびMIGの産生を誘導することで新脈管形成を阻害することが明らかになっている(Shimizu,et al.(2006)上掲)。それ故、絨毛外栄養膜によるIL−27の産生により、過剰な新脈管形成促進活性を防ぐネガティブフィードバック機構が働く可能性がある。実際に絨毛外栄養膜は、Fas/FasL相互作用を介して(Ashton,et al.(2005)Arterioscler Thromb Vasc Biol 25:102−108)、または可溶性HLA−G1の分泌を介して(Fons,et al.(2006)上掲)内皮細胞のアポトーシスの誘導により抗新脈管形成性活性を示すことが既に知られている。
【0079】
IL−27は、新脈管形成における役割ばかりでなく、正常または病的状態においてT細胞応答の抑制または炎症反応の制御に局所的に関与し得る。ヒトおよびマウスでは、脱落膜においてIL−17の産生が認められているが(Ostojic et al.(2003)Am J Reprod Immunol 49:101−112)、ヒト脱落膜にTh17細胞が存在するかどうかについては、今後の検討が待たれる。
【0080】
最後に、IL−27の産生は胎盤で検出されたが、その産生量はEBI3に比べて非常に少ない点に留意すべきである。まだ明らかにされていないが、EBI3は、p28との結合とは別に、おそらくIL−27アンタゴニストとしての役割を果たし得ることが示唆されている。その場合、そうした過剰な遊離EBI3がIL−27の機能を制御し得る。
【0081】
III.IL−27アゴニスト
IL−27の活性のアゴニズムを実現できるのは、たとえば、IL−27ポリペプチドまたはそのミュータント、リガンドIL−27に対して形成されたアゴニスト抗体またはそのフラグメント、リガンドのサブユニットに対するアゴニスト抗体(たとえば、抗p28抗体または抗EBI3抗体)、受容体複合体とリガンドの相互作用を高めることができる、p28およびEBI3の両方に結合する抗体のようなIL−27アゴニストによってである。この抗体はまた、IL−27受容体複合体(WSX−1/TCCR、gp130)に対するアゴニスト抗体であってもよい。このアゴニスト抗体は、受容体に対するリガンドの結合を模倣して、受容体複合体のシグナル伝達を誘導する。
【0082】
あるいは、特定されたリガンド受容体対形成により媒介された相互作用またはシグナル伝達を模倣したり、増強したりできる化合物について小分子ライブラリーをスクリーニングしてもよい。
【0083】
本発明は、特定のサイトカインリガンド、好ましくは、たとえば、霊長類、ヒト、ネコ、イヌ、ラットまたはマウスのような哺乳動物のサイトカインリガンドに特異的に結合する、抗体または結合組成物の使用を提供する。抗体については、天然に存在する(全長)形または組換え形を問わず、個別の改変体、多型改変体、対立遺伝子改変体、系統改変体または種改変体およびこれらのフラグメントなど、種々のサイトカインタンパク質に対して形成してもよい。さらに、抗体に関しては、未変性(または活性)形または、不活性形(たとえば変性形)を問わず、受容体タンパク質に対して形成しても構わない。抗イディオタイプ抗体を用いてもよい。
【0084】
リガンドまたは受容体タンパク質と特異的に反応する抗体の作製には、多くの免疫原を選択することができる。組換えタンパク質は、モノクローナルまたはポリクローナル抗体の作製に好ましい免疫原である。また、たとえば、霊長類、齧歯類などの適切な供給源からの天然に存在するタンパク質を純粋な形あるいは不純な形で用いてもよい。さらに、適切なタンパク質配列を用いて作製した合成ペプチドを抗体作製の免疫原として用いてもよい。組換えタンパク質については、たとえば、Coligan,et al.(eds.)(1995 and periodic supplements)Current Protocols in Protein Science,John Wiley & Sons,New York,NY;and Ausubel,et al(eds.)(1987 and periodic supplements)Current
Protocols in Molecular Biology,Greene/Wiley,New York,NYに記載のように、真核細胞または原核細胞に発現させ精製してもよい。抗体の作製には、必要に応じて、自然に折りたたまれた材料を用いても変性材料を用いてもよい。たとえば、モノクローナルあるいはポリクローナル抗体を作製して、タンパク質を測定するイムノアッセイでその後使用してもよいし、免疫精製法を行ってもよい。
【0085】
ポリクローナル抗体の作製方法は、当業者によく知られている。代表的には、免疫原、好ましくは精製されたタンパク質をアジュバントと混合し、この混合物で動物を免疫する。免疫原調製物に対する動物の免疫反応については、試験採血を行い目的のタンパク質に対する反応力価を測定することでモニターする。たとえば、通常、免疫を繰り返した後に、免疫原に対して適度に高い抗体力価が得られたときは、動物から血液を採取し、抗血清を調製する。さらに必要に応じて、タンパク質に反応する抗体を富化するため抗血清の分画を行ってもよい。たとえば、HarlowおよびLane;またはColiganを参照されたい。また、たとえば、DNAベクターによる免疫化など他の方法により免疫を行っても構わない。たとえば、Wang,et al.(1997)Virology 228:278−284を参照されたい。
【0086】
モノクローナル抗体については、当該技術分野の研究者によく知られた様々な技術により得ることができる。代表的には、所望の抗原で免疫した動物の脾臓細胞を、通常、骨髄腫細胞と融合して不死化する。Kohler and Milstein(1976)Eur.J.Immunol.6:511−519を参照されたい。不死化の別の方法として、エプスタインバーウイルス、オンコジーンまたはレトロウイルスによる形質転換または当該技術分野において公知の他の方法が挙げられる。たとえば、Doyle,et al.(eds.)(1994 and periodic supplements)Cell and Tissue Culture:Laboratory Procedures,John Wiley and Sons,New York,NYを参照されたい。抗原に対する所望の特異性および親和性を持つ抗体の産生について、単一の不死化細胞から生じるコロニーをスクリーニングして、そうした細胞から産生されるモノクローナル抗体の収量を、脊椎動物宿主の腹膜腔に注射するなど様々な技術により高めてもよい。あるいは、たとえば、Huse,et al.(1989)Science 246:1275−1281に概説された一般的なプロトコルに従って、ヒトB細胞のDNAライブラリーをスクリーニングしてモノクローナル抗体またはその結合フラグメントをコードするDNA配列を単離しても構わない。
【0087】
リガンドまたは受容体タンパク質の所定のフラグメントに対する抗体または結合組成物(結合フラグメントおよび一本鎖バージョンなど)については、フラグメントとキャリアタンパク質のコンジュゲートで動物を免疫することにより形成できる。所望の抗体を分泌している細胞から、モノクローナル抗体を調製する。これらの抗体について、正常タンパク質または不完全なタンパク質に対する結合をスクリーニングすればよい。抗体または結合組成物は、通常はKDが少なくとも約10−3M、より通常には少なくとも10−6M、典型的には少なくとも10−7M、より典型的には少なくとも10−8M、好ましくは少なくとも約10−9M、一層好ましくは少なくとも10−10M、最も好ましくは少なくとも10−11Mで結合する(たとえば、Presta,et al.(2001)Thromb.Haemost.85:379−389;Yang,et al.(2001)Crit.Rev.Oncol.Hematol.38:17−23;Carnahan,et al.(2003)Clin.Cancer Res.(Suppl.)9:3982s−3990sを参照)。
【0088】
場合によっては、マウス、齧歯類、霊長類、ヒトなどの様々な哺乳動物宿主からモノクローナル抗体(mAb)を調製することが望ましい。そうしたモノクローナル抗体の調製技術に関する記載は、たとえば、Stites,et al.(eds.)Basic and Clinical Immunology(4th ed.)Lange Medical Publications,Los Altos,CAおよびその中に引用された参考文献;Harlow and Lane(1988)Antibodies:A Laboratory Manual,CSH Press;Goding(1986)Monoclonal Antibodies:Principles and Practice(2d ed.)Academic Press,New York,NY;および特に、モノクローナル抗体の作製の一方法を考察するKohler and Milstein(1975)Nature 256:495−497で確認することができる。簡単にまとめると、この方法では、動物に免疫原の注射を行うことを含む。次いでこの動物を屠殺し、その脾臓から細胞を採取し、次いでこの細胞を骨髄腫細胞と融合する。得られたものは、ハイブリッド細胞、すなわち、インビトロで再産生が可能な「ハイブリドーマ」である。その後ハイブリド−マの集団をスクリーニングし、それぞれが免疫原に対して単一の抗体種を分泌する個々のクローンを単離する。こうして、得られた各抗体種は、免疫原性物質上に認められる特異的な部位に反応して生成された免疫動物由来の不死化およびクローン化された単一B細胞の産物である。
【0089】
本発明のポリペプチドおよび抗体については、キメラまたはヒト化抗体を含め改変して用いても、改変せずに用いてもよい。ポリペプチドおよび抗体に関しては、多くの場合、検出可能なシグナルを発する物質に共有結合または非共有結合で連結して標識する。種々の標識およびコンジュゲーション技術が知られており、科学文献にも特許文献にも広く報告されている。好適な標識として、放射性核種、酵素、基質、補助因子、阻害剤、蛍光部分、化学発光部分、磁気粒子などが挙げられる。そうした標識の使用を教示する特許として、米国特許第3,817,837号;同第3,850,752号;同第3,939,350号;同第3,996,345号;同第4,277,437号;同第4,275,149号;および同第4,366,241号がある。また、組換え免疫グロブリンを作製してもよく、Cabilly,米国特許第4,816,567号または下記;およびQueen,et al(1989)Proc.Natl Acad.Sci USA 86:10029−10033を参照されたい。あるいは、組換え免疫グロブリンを、トランスジェニックマウスを用いて作製してもよく、Mendez,et al.(1997)Nature Genetics 15:146−156と、さらにAbgenixおよびMedarexの技術も参照されたい。
【0090】
モノクローナル抗体は通常、ヒト供給源からではなく非ヒト供給源から得られる(Harlow and Lane(1988)Antibodies A Laboratory Manual,Cold Spring Harbor Laboratory,Cold Spring Harbor,NY,pp.139−243)。非ヒト供給源を用いると、モノクローナル抗体の治療効率が制限される場合がある。マウスまたは他の非ヒト供給源から得られた抗体は、免疫反応を誘発する、エフェクター機能があまり増強されない、血流からの急速なクリアランスという好ましくない特性を持つことがある(Baca,et al.(1997)J.Biol.Chem.272:10678−10684)。これらの理由から、治療抗体を、ヒト化により調製することが望ましい場合がある。
【0091】
「ヒト化抗体」とは、たとえば、齧歯類のような非ヒト起源の抗原結合領域と、たとえば、ヒトフレームワーク領域、ヒト定常領域またはその一部のようなヒト起源の免疫グロブリンの少なくとも一部とを含む抗体を意味する(たとえば、米国特許第6,352,832号を参照)。
【0092】
ヒト化抗体は、親マウス抗体の6つの相補性決定領域(CDR)に由来するアミノ酸配列を含み、これがヒト抗体のフレームワークに移植される。ヒト化抗体における非ヒト配列の量は、低い方が好ましく、言い換えれば、約5%である(Baca,et al.(1997)J.Biol.Chem.272:10678−10684)。最適な結合を実現するには、通常、CDRの立体構造の支持に関与するある種のフレームワークアミノ酸を、親マウス抗体に見られる対応するアミノ酸に戻すことで、ヒト化抗体を微調節する必要があるかもしれない。普通親に戻すフレームワークアミノ酸は、CDRループの立体構造の支持に関与するフレームワークアミノ酸である(Chothia,et al.(1989)Nature 342:877−883;Foote and Winter(1992)J.Mol.Biol.224:487−499)。抗原結合に最も多く影響するフレームワーク残基は、比較的小さく、11残基のように小さい場合がある(Baca,et al.(1997)J.Biol.Chem.272:10678−10684)。
【0093】
ヒト化抗体は、IgM、IgG、IgD、IgAおよびIgEならびに任意のアイソタイプ(IgG1、IgG2、IgG3およびIgG4を含む)を含む、定常領域のすべてのタイプを持つ抗体を含む。ヒト化抗体が細胞傷害活性を示すことが望ましい場合、定常ドメインは、通常、補体結合定常ドメインであり、クラスは代表的にはIgG1である。そうした細胞傷害活性が望ましくない場合、定常ドメインは、IgG2クラスのそれであってもよい。ヒト化抗体は、複数のクラスまたはアイソタイプ由来の配列を含んでもよい(Vasquez,et al.に付与された米国特許第6,329,511号)。結合親和性が高い抗体のスクリーニングおよび選択には、ファージディスプレイ技術を用いてもよい(Hoogenboom and Chames(2000)Immunol.Today 21:371−377;Barbas,et al.(2001)Phage
Display:A Laboratory Manual,Cold Spring
Harbor Laboratory,Cold Spring Harbor,New York;Kay,et al.(1996)Phage Display of Peptides and Proteins:A Laboratory Manual,Academic Press,San Diego,CA)。
【0094】
また、ファージディスプレイ法またはトランスジェニックマウスに含まれるヒト抗体ライブラリーを用いて、抗体を調製または設計してもよい(たとえば、de Bruin,et al.(1999)Nature Biotechnology 17:397−399;Vaughan,et al.(1996)Nature Biotechnology 14:309−314;Barbas(1995)Nature Medicine 1:837−839;Mendez,et al.(1997)Nature Genetics 15:146−156;Huse,et al.(1989)Science 246:1275−1281;Ward,et al.(1989)Nature 341:544−546を参照)。
【0095】
抗体は、特異的な結合組成物の一形態に過ぎない。用途が似ていることが多い他の結合組成物として、たとえば、結合パートナー−結合パートナー様式で、抗体−抗原相互作用で、または生理的に関連する天然のタンパク質−タンパク質相互作用(たとえば、所望のタンパク質に特異的に結合する、共有結合あるいは非共有結合タンパク質)でリガンドまたは受容体に特異的に結合する分子が挙げられる。分子は、ポリマーでも化学試薬であってもよい。機能的アナログについては、構造的に改変したタンパク質であってもよいし、たとえば、適切な結合決定基と相互作用する分子形状を持つ構造的に無関係の分子であっても構わない。
【0096】
IV.IL−27ポリペプチドアゴニスト
本発明のIL−27アゴニストポリペプチドは、様々な細胞株に発現することができる。これらの実施形態では、IL−27ヘテロ二量体またはその単一のサブユニット(たとえばEBI−3またはp28)をコードする配列を用いて、好適な哺乳動物宿主細胞を形質転換してもよい。これらの実施形態によれば、たとえば、ポリヌクレオチドをウイルス(またはウイルスベクター)にパッケージングし、このウイルス(またはベクター)を宿主細胞へ形質導入するなど、ポリヌクレオチドを宿主細胞に導入する任意の既知の方法、あるいは、当該技術分野において公知のトランスフェクション手順により、形質転換を行うことができる。そうした手順については、米国特許第4,399,216号、同第4,912,040号、同第4,740,461号および同第4,959,455号(任意の目的に応じて、これらすべてを参照によって本明細書に援用する)に例示されている。通常、使用する形質転換の手順は、形質転換される宿主に依存し得る。異種ポリヌクレオチドを哺乳動物細胞に導入する方法は、当該技術分野において周知であり、以下に限定されるものではないが、デキストランを介したトランスフェクション、リン酸カルシウム沈殿、ポリブレンを介したトランスフェクション、プロトプラスト融合、エレクトロポレーション、ポリヌクレオチド(単数または複数)のリポソーム封入および核へのDNAの直接マイクロインジェクションが挙げられる。
【0097】
本発明の方法のある実施形態では、標準的なライゲーション技術を用いて、IL−27ヘテロ二量体またはその個々のサブユニットをコードする核酸分子を適切な発現ベクターに挿入する。ベクターは代表的には、使用する特定の宿主細胞において機能する(すなわち、ベクターが宿主細胞機構に適合して遺伝子の増幅および/または遺伝子の発現が起こり得る)ように選択する。発現ベクターの概説については、Goeddel(ed.),1990,Meth.Enzymol.Vol.185,Academic Press.N.Yを参照されたい。
【0098】
代表的には、宿主細胞のいずれかに用いる発現ベクターは、プラスミドの維持と、外因性ヌクレオチド配列のクローンニングおよび発現のための配列を含む。そうした配列は、「フランキング配列」と総称され、ある実施形態では、代表的には、プロモーター、1つまたは複数のエンハンサー配列、複製開始点、転写終結配列、ドナーおよびアクセプタースプライス部位を含む完全なイントロン配列、ポリペプチド分泌のためのリーダー配列をコードする配列、リボソーム結合部位、ポリアデニル化配列、発現するポリペプチドをコードする核酸を挿入するためのポリリンカー領域、および選択可能なマーカー要素など、ヌクレオチド配列の1つまたは複数を含む。これらの配列はそれぞれ以下で考察する。
【0099】
必要に応じて、ベクターは、「タグ」コード配列、すなわち、ポリペプチドコード配列の5’または3’末端に位置するオリゴヌクレオチド分子を含んでもよく、このオリゴヌクレオチド配列は、ポリHis(ヘキサHisなど)、あるいは、市販されている抗体が存在するFLAG、HA(インフルエンザウイルスの赤血球凝集素(hemaglutinin))またはmycなどの他の「タグ」をコードする。このタグは代表的には、ポリペプチドの発現時にポリペプチドに融合され、宿主細胞からの抗体のアフィニティー精製または検出の手段としての機能を果たすことができる。アフィニティー精製については、たとえば、親和性マトリックスとしてのタグに対する抗体を用いてカラムクロマトグラフィーにより実施してもよい。その後必要に応じて、切断用のある種のペプチダーゼを用いるなど様々な手段により、精製されたポリペプチドからタグを除去してもよい。
【0100】
フランキング配列は、同種(すなわち、宿主細胞と同じ種および/または系統)でも、異種(すなわち、宿主細胞種または系統以外の種)でも、ハイブリッド(すなわち、複数の供給源のフランキング配列の組み合わせ)でも、合成でも、未変性でもよい。このため、フランキング配列の供給源は、どのような原核生物または真核生物でも、どのような脊椎動物または無脊椎動物でも、どのような植物でもよく、ただし、フランキング配列は、宿主細胞機構において機能的であり、宿主細胞機構により活性化され得る。
【0101】
本発明のベクターに有用なフランキング配列に関しては、当該技術分野において周知の複数の方法のいずれかで得ることができる。代表的には、マッピングおよび/または制限エンドヌクレアーゼ消化により、本明細書に有用なフランキング配列を前もって特定しておいて、適当な制限エンドヌクレアーゼを用いて適切な組織供給源からこれを単離することができる。場合によっては、フランキング配列の全ヌクレオチド配列が既知であることもある。この場合、核酸合成またはクローンニングのため本明細書に記載した方法を用いて、フランキング配列を合成してもよい。
【0102】
フランキング配列は、その全部または一部だけが既知の場合、ポリメラーゼ連鎖反応(PCR)により、および/または、同種もしくは他の種のオリゴヌクレオチドおよび/またはフランキング配列フラグメントなどの好適なプローブでゲノムライブラリーをスクリーニングすることにより得てもよい。フランキング配列が分からない場合は、たとえば、コード配列、さらには他の遺伝子(単数または複数)を含み得るより大きなDNA部分から、フランキング配列を含むDNAのフラグメントを単離すればよい。単離を行うには、制限エンドヌクレアーゼ消化により適切なDNAフラグメントを作製し、続いてアガロースゲル精製、Qiagen(登録商標)カラムクロマトグラフィー(Chatsworth,Calif.)または当業者に公知の他の方法を用いて単離してもよい。この目的を達成するのに好適な酵素に何を選択するかについては、当業者に容易に明らかになるであろう。
【0103】
複製開始点は、代表的には、市販されている原核生物発現ベクターの一部になっており、この開始点は宿主細胞においてベクターの増幅に役立つ。選択したベクターが複製開始点部位を含まない場合、既知の配列に基づき化学的に合成し、ベクターに連結してもよい。たとえば、プラスミドpBR322の複製開始点(New England Biolabs,Beverly,Mass.)は、大部分のグラム陰性菌に好適であり、種々のウイルス性の開始点(SV40、ポリオーマ、アデノウイルス、水疱性口内炎ウイルス(vesicular stomatitus virus)(VSV)またはHPVもしくはBPVなどのパピローマウイルス)は、哺乳動物細胞のクローニングベクターに有用である。通常、哺乳動物の発現ベクターは、複製開始点成分を必要としない(たとえば、SV40開始点は、ウイルス初期プロモーターも含む場合に限り使用されることが多い)。
【0104】
転写終結配列は代表的には、ポリペプチドコード領域末端の3’側に位置し、転写を終結させる働きをする。通常、原核生物細胞の転写終結配列は、G−Cリッチなフラグメントに続きポリ−T配列がある。この配列については、ライブラリーから簡単にクローニングが可能であり、ベクターの一部として市販されてもいるが、本明細書に記載の方法のような核酸合成を用いて簡単に合成することもできる。
【0105】
選択可能なマーカー遺伝子は、選択培地で増殖する宿主細胞の生存および増殖に必要なタンパク質をコードする。典型的な選択マーカー遺伝子は、(a)抗生物質または他のトキシン、たとえば、アンピシリン、テトラサイクリンまたはカナマイシンに対する耐性を原核生物宿主細胞に与えるタンパク質;(b)細胞の栄養要求性の欠損を補うタンパク質;または(c)複合培地または規定の培地から得られない重要な栄養素を供給するタンパク質をコードする。好ましい選択可能なマーカーは、カナマイシン耐性遺伝子、アンピシリン耐性遺伝子およびテトラサイクリン耐性遺伝子である。また、ネオマイシン耐性遺伝子については、原核生物宿主細胞でも真核生物宿主細胞でも選択用に用いてよい。
【0106】
他の選択可能な遺伝子を用いて、発現する遺伝子を増幅させてもよい。増幅とは、増殖または細胞の生存に重要なタンパク質を産生する上で必要性がより高い遺伝子が、組換え細胞の染色体内で継代的に通常タンデムに反復されるプロセスである。哺乳動物細胞に好適な選択可能なマーカーの例として、ジヒドロ葉酸還元酵素(DHFR)およびプロモーターを持たないチミジンキナーゼが挙げられる。哺乳動物細胞の形質転換体については、ベクターに存在する選択可能な遺伝子により形質転換体のみが独自に生存に適合する淘汰圧下に置く。淘汰圧を加えるには、培地中の選択剤濃度を連続的に高め、それにより選択可能な遺伝子と別の遺伝子をコードするDNAとの両方を増幅する条件下で形質転換細胞を培養する。その結果、増幅したDNAから多量のポリペプチドを合成することができる。
【0107】
リボソーム結合部位は通常、mRNAの翻訳開始に必要であり、シャイン―ダルガーノ配列(原核生物)またはコザック配列(真核生物)を特徴とする。この要素は通常、プロモーターの3’側および発現するポリペプチドのコード配列の5’側に位置する。
【0108】
真核生物宿主細胞の発現系においてグリコシル化が望まれるような場合においては、様々なプレまたはプロ配列を操作してグリコシル化または収量を改善し得る。たとえば、特定のシグナルペプチドのペプチダーゼ切断部位を変更してもよいし、グリコシル化にも作用する場合があるプロ配列を付加してもよい。最終のタンパク質産物は、完全には除去され得なかった、発現に伴う1つまたは複数の付加アミノ酸を(成熟タンパク質の最初のアミノ酸に対して)その1位に含んでもよい。たとえば、最終のタンパク質産物は、アミノ末端に結合したペプチダーゼ切断部位に認められる1つまたは2つのアミノ酸残基を含んでもよい。また、複数の酵素切断部位を用いると、成熟ポリペプチド内のそうした領域で酵素切断が行われる場合に、所望のポリペプチドの形がやや切り取られ得る。
【0109】
本発明の発現ベクターおよびクローニングベクターは代表的には、宿主生物により認識され、かつ抗体をコードする分子に作動可能に連結されたプロモーターを含む。プロモーターは、構造遺伝子の開始コドンの上流(すなわち、5’側)(通常約100〜1000bp以内)に位置し、構造遺伝子の転写を制御する非転写配列である。プロモーターは慣習的に、誘導プロモーターおよび構成的プロモーターという2つのクラスの1つに分類される。誘導プロモーターは、栄養素の有無または温度変化などの培養条件の何らかの変化に応じて、プロモーターの制御下でDNAの高レベルの転写を開始する。一方、構成的プロモーターは、連続的な遺伝子産物の産生を開始する。すなわち、遺伝子発現に対する制御をほとんど行わないか、まったく行わない。有望な種々の宿主細胞により認識される多くのプロモーターがよく知られている。好適なプロモーターは、制限酵素消化で供給源のDNAからプロモーターを除去し、所望のプロモーター配列をベクターに挿入することで、本発明の抗体を構成する重鎖または軽鎖をコードするDNAに作動可能に連結される。
【0110】
また、酵母宿主に用いるのに好適なプロモーターも当該技術分野において周知である。酵母エンハンサーは、酵母プロモーターと一緒に用いると都合がよい。哺乳動物宿主細胞に用いるのに好適なプロモーターは、よく知られており、ポリオーマウイルス、鶏痘ウイルス、アデノウイルス(アデノウイルス2など)、ウシパピローマウイルス、トリ肉腫ウイルス、サイトメガロウイルス、レトロウイルス、B型肝炎ウイルスおよび最も好ましくはシミアンウイルス40(SV40)などのウイルスのゲノムから得られるプロモーターがあるが、これに限定されるものではない。他の好適な哺乳動物プロモーターとして、たとえば、熱ショックプロモーターおよびアクチンプロモーターのような異種哺乳動物のプロモーターが挙げられる。
【0111】
関心の対象になり得るさらなるプロモーターとして、SV40初期プロモーター領域(Bernoist and Chambon,1981,Nature 290:304−10);CMVプロモーター;ラウス肉腫ウイルスの3’長末端反復配列に含まれるプロモーター(Yamamoto et al.,1980,Cell 22:787−97);ヘルペスチミジンキナーゼプロモーター(Wagner et al.,1981,Proc.Natl.Acad.Sci USA 78:1444−45);メタロチオニン遺伝子の制御配列(Brinster et al.,1982,Nature 296:39−42);βラクタマーゼプロモーターなどの原核生物発現ベクター(Villa−Kamaroff et al.,1978,Proc.Natl.Acad.Sci USA 75:3727−31);またはtacプロモーター(DeBoer et al.,1983,Proc.Natl.Acad.Sci USA 80:21−25)があるが、これに限定されるものではない。さらに、組織特異性を示しトランスジェニックアニマルに用いられてきた動物転写制御領域として、膵腺房細胞で活性なエラスターゼI遺伝子制御領域(Swift et al.,1984,Cell 38:639−46;Ornitz et al.,1986,Cold Spring Harbor Symp.Quant.Biol.50:399−409(1986);MacDonald,1987,Hepatology 7:425−515);膵β細胞で活性なインスリン遺伝子制御領域(Hanahan,1985,Nature 315:115−22);リンパ系細胞で活性な免疫グロブリン遺伝子制御領域(Grosschedl et al.,1984,Cell 38:647−58;Adames et al.,1985,Nature 318:533−38;Alexander et al.,1987,Mol.Cell.Biol.7:1436−44);精巣細胞、乳腺細胞、リンパ系細胞およびマスト細胞で活性なマウス乳腺癌ウイルス制御領域(Leder et al.,1986,Cell 45:485−95);肝臓で活性なアルブミン遺伝子制御領域(Pinkert et al.,1987,Genes and Devel.1:268−76);肝臓で活性なαフェトプロテイン遺伝子制御領域(Krumlauf et al.,1985,Mol.Cell.Biol.5:1639−48;Hammer et al.,1987,Science 235:53−58);肝臓で活性なα1アンチトリプシン遺伝子制御領域(Kelsey et al.,1987,Genes and Devel.1:161−71);骨髄系細胞で活性なβグロビン遺伝子制御領域(Mogram et al.,1985,Nature 315:338−40;Kollias et al.,1986,Cell 46:89−94);脳のオリゴデンドロサイト細胞で活性なミエリン塩基性タンパク質遺伝子制御領域(Readhead et al.,1987,Cell 48:703−12);骨格筋で活性なミオシン軽鎖−2遺伝子制御領域(Sani,1985,Nature 314:283−86);および視床下部で活性な性腺刺激ホルモン放出ホルモン遺伝子制御領域(Mason et al.,1986,Science 234:1372−78)が注目される。
【0112】
エンハンサー配列については、高等真核生物で、ベクターに挿入して本発明の抗体を構成する軽鎖または重鎖をコードするDNAの転写を増加させてもよい。エンハンサーは、DNAのシス作用エレメント(通常、長さ約10〜300bp)であり、プロモーターに作用し転写を増加させる。エンハンサーは、配向および位置とはあまり関係がなく、転写ユニットの5’および3’で確認されている。哺乳動物の遺伝子から入手できる複数のエンハンサー配列(グロビン、エラスターゼ、アルブミン、αフェトプロテインおよびインスリンなど)が知られている。しかしながら、ウイルス由来のエンハンサーを用いるのが典型的である。真核生物プロモーターの活性化を増強する例示的な要素として、当該技術分野において公知のSV40エンハンサー、サイトメガロウイルス初期プロモーターエンハンサー、ポリオーマエンハンサーおよびアデノウイルスエンハンサーが挙げられる。エンハンサーをベクターに接合するのは核酸分子の5’位でも3’位でもよいが、代表的にはプロモーターの5’部位に置く。
【0113】
本発明の発現ベクターについては、市販されているベクターのような出発ベクターから構築してもよい。そうしたベクターは、所望のフランキング配列をすべて含む場合もあるが、そうでない場合もある。本明細書に記載の1つまたは複数のフランキング配列がまだベクターに存在していない場合、フランキング配列を個別に得てベクターに連結してもよい。各フランキング配列を得る方法は、当業者によく知られている。
【0114】
ベクターを構築し、軽鎖もしくは重鎖または軽鎖および重鎖をコードする核酸分子をベクターの適切な部位に挿入した後、増幅および/またはポリペプチド発現のため完成したベクターを好適な宿主細胞に挿入してもよい。選択した宿主細胞に抗体の発現ベクターを形質転換するには、トランスフェクション、感染、リン酸カルシウム共沈殿、エレクトロポレーション、マイクロインジェクション、リポフェクション、DEAE−デキストランによるトランスフェクションまたは他の既知の技術など、よく知られた方法を行えばよい。選択する方法は、使用する宿主細胞のタイプによってある程度決まる。これらの方法および他の好適な方法は、当業者によく知られており、たとえば、上掲のSambrookらに記載されている。
【0115】
宿主細胞は、適切な条件下で培養されると、抗体を合成するが、抗体はその後培地から回収してもよいし(宿主細胞が抗体を培地に分泌する場合)、抗体を産生する宿主細胞から直接回収してもよい(抗体が分泌されない場合)。どの宿主細胞を選択するのが適切かは、所望の発現レベル、活性に望ましいまたは必要なポリペプチド改変(グリコシル化またはリン酸化など)および生物活性分子への折りたたまれやすさなど様々な要因によって異なる。
【0116】
発現用の宿主として入手可能な哺乳動物細胞株は、当該技術分野において周知であり、以下に限定されるものではないが、チャイニーズハムスターの卵巣(CHO)細胞、HeLa細胞、ベビーハムスター腎(BHK)細胞、サル腎細胞(COS)、ヒト肝細胞癌細胞(HepG2など)およびこれ以外の多くの細胞株などアメリカンタイプカルチャーコレクション(A.T.C.C)から入手可能な多くの不死化細胞株があるが、これに限定されるものではない。
【0117】
V.治療用組成物
本発明は、たとえば、再発性流産、胚着床の不良、子癇前症などの生殖障害を処置するIL−27のアゴニストの使用方法を提供する。
【0118】
本発明のアンタゴニストおよび/またはアゴニストに関しては、単独で投与しても、同一または付随する経路の他のアゴニストあるいは症状の処置に用いる他の化合物と組み合わせて投与してもよい。診断方法は、予後の予測;特定の治療コースに反応するあるいはしない患者のサブセットの判定;生殖関連障害またはこの障害のサブタイプの診断;または治療に対する反応の評価などの側面を含む。
【0119】
処置、治療または診断については、アゴニストまたはアンタゴニストの直接投与により行ってもよいし、アゴニストまたはアンタゴニストをコードする核酸の投与により行ってもよい。アゴニストは、抗体から得られた結合組成物、IL−27またはIL−27Rに特異的に結合する抗体または抗体フラグメント、IL−27ポリペプチドもしくは改変体、またはアゴニストをコードする核酸を発現するベクターを包含する(たとえば、Arenz and Schepers(2003)Naturwissenschaften
90:345−359;Sazani and Kole(2003)J.Clin.Invest.112:481−486;Pirollo,et al.(2003)Pharmacol.Therapeutics 99:55−77;Wang,et al.(2003)Antisense Nucl.Acid Drug Devel.13:169−189を参照)。
【0120】
ポリペプチドもしくはアゴニスト抗体、その結合組成物または小分子アゴニストなど、医薬組成物または無菌組成物を調製するには、その物質を、好ましくは不活性な薬学的に許容されるキャリアまたは賦形剤と混合する。そうした医薬組成物の調製に関しては、当該技術分野において公知であり、たとえば、Remington’s Pharmaceutical Sciences and U.S.Pharmacopeia:National Formulary,Mack Publishing Company,Easton,PA(1984)を参照されたい。
【0121】
抗体、結合組成物またはサイトカインについては、非経口的に、好ましくは静脈内に通常投与する。そうしたタンパク質またはペプチドは、免疫原性を持つ場合があるため、たとえば、Tomasi,et al,米国特許第4,732,863号により教示されているように通常のIV投与セットあるいは皮下デポーにより、ゆっくりと投与するのが好ましい。免疫学的反応を最小限にとどめる方法を用いても構わない。小分子物質は、経口投与で効果を発揮してもよい。
【0122】
また、膣内投与に好適な組成物として、当該技術分野において適切であることが公知のキャリアを含むペッサリー、タンポン、クリーム、ゲル、ペースト、気泡、薄膜または噴霧組成物が挙げられる。用いられるキャリアは、膣内投与に適合しているべきである。組み合わせは、注水液(douche)、気泡、薄膜、軟膏(ointment)、クリーム、バルム、ゲル、軟膏(salve)、ペースト、スラリー、経膣坐剤または潤滑ゼリー(sexual lubricant)など、たとえば、固形、半固形および液体剤形であってもよい。
【0123】
活性化合物については、インプラントおよびマイクロカプセル化送達系のような放出制御調合物など、化合物の体からの急速な消失を防止するキャリアを用いて調製する。エチレン酢酸ビニル、ポリ酸無水物、ポリグリコール酸、コラーゲン、ポリオルトエステルおよびポリ乳酸など、生分解性、生体適合性ポリマーを用いてもよい。そうした調合物の調製方法は、当業者には明らかである。また、これらの材料は、たとえば、Alza CorporationおよびNova Pharmaceuticals,Inc.から市販されている。さらに、リポソーム懸濁液(ウイルス抗原に対するモノクローナル抗体により感染細胞を標的にしたリポソームなど)を薬学的に許容されるキャリアとして用いてもよい。これらは、たとえば、米国特許第4,522,811号に記載されているように当業者に公知の方法により調製できる。
【0124】
生物製剤については、非経口的に投与する場合、薬学的に許容される非経口ビヒクルと共に注射可能な単位剤形(溶液、懸濁液、エマルジョン)として製剤化する。そうしたビヒクルは、本質的に無毒で治療効果がないのが一般的である。この治療剤に関しては、様々な添加剤および/または希釈剤を使用してあるいは使用せずに、水、生理食塩水または緩衝ビヒクルなどの水性ビヒクルに加えて投与してもよい。あるいは、本ペプチドを含ませるため、亜鉛懸濁液などの懸濁液を調製してもよい。そうした懸濁液は、皮下(SQ)または筋肉内(IM)注射に有用であり得る。生物製剤および添加剤の比率は、両剤が有効量で存在する限り、広範囲に異なってもよい。本抗体は、凝集体、他のタンパク質、エンドトキシンなどを実質的に含まず、約5〜30mg/ml、好ましくは10〜20mg/mlの濃度で精製された形で製剤化されるのが好ましい。好ましくは、エンドトキシンのレベルは、2.5EU/ml未満である。たとえば、Avis,et al.(eds.)(1993)Pharmaceutical Dosage Forms:Parenteral Medications,2d ed.,Dekker,NY;Lieberman,et al.(eds.)(1990)Pharmaceutical Dosage Forms:Tablets,2d ed.,Dekker,NY;Lieberman,et al.(eds.)(1990)Pharmaceutical Dosage Forms:Disperse Systems,Dekker,NY;Fodor,et al.(1991)Science 251:767−773,Coligan(ed.)Current Protocols in Immunology;Hood,et al.(1984)Immunology,Pearson,Upper Saddle River,NY;Paul(ed.)(1999)Fundamental Immunology,4th ed.,Lippincott Williams & Wilkins Publishers,Phila.,PA;Parce,et al.(1989)Science 246:243−247;Owicki,et al.(1990)Proc.Natl.Acad.Sci USA 87:4007−4011;and Blundell and Johnson(1976)Protein Crystallography,Academic Press,New Yorkを参照されたい。
【0125】
治療剤のためにどの投与レジメンを選択するかは、その物質の血清または組織代謝回転速度、症状のレベル、その物質の免疫原性および標的細胞の到達性、投与のタイミングなど複数の要因に左右される。好ましくは、投与レジメンは、許容可能な副作用のレベルと整合し、患者に送達される治療剤の量を最大にする。したがって、生物製剤の送達量は、個々の物質および処置される症候の重症度にある程度依存する。適切な抗体用量を選択する際のガイダンスは、たとえば、Bach,et al.,chapter 22,in
Ferrone,et al.(eds.)(1985)Handbook of Monoclonal Antibodies,Noges Publications,Park Ridge,NJ;and Haber,et al.(eds.)(1977)Antibodies in Human Diagnosis and Therapy,Raven Press,New York,NY(Russell,pgs.303−357,and Smith,et al.,pgs.365−389)で確認できる。あるいは、標準的な方法論を用いてサイトカインまたは小分子の用量を測定する。
【0126】
適切な用量については、たとえば、当該技術分野において処置に作用することが知られていたり、そのように思われていたり、予想されていたりするパラメータまたは因子により、臨床家が決定する。通常、用量は、至適用量よりもやや少ない量から始め、その後、任意の負の副作用に対して望ましい効果または至適効果が得られるまで少しずつ増量する。重要な診断尺度として、たとえば、発生した炎症または炎症性サイトカインのレベルのような症状の尺度が挙げられる。好ましくは、使用する生物製剤は、処置対象の動物と同じ種由来であり、それにより試薬に対する液性免疫反応を最小限にとどめる。
【0127】
リガンドまたは受容体に特異的に結合する抗体またはそのフラグメントの1週間の総用量の範囲は通常、体重1キログラム当たり約10μg以上、より一般的には約100μg以上、典型的には約500μg以上、より典型的には約1000μg以上、好ましくは約5mg以上、一層好ましくは約10mg以上である。通常、この範囲は、体重1キログラム当たり100mg未満、好ましくは約50mg未満、一層好ましくは約25mg未満である。ポリペプチドまたは小分子治療剤は、類似のモル濃度で用いてもよい。
【0128】
サイトカイン受容体によるシグナル伝達のアンタゴニスト(たとえば、抗体または結合フラグメント)の1週間の用量範囲は、体重1キログラム当たり約1μg以上、好ましくは少なくとも約5μg以上、一層好ましくは少なくとも約10μg以上である。通常、この範囲は、体重1キログラム当たり約1000μg未満、好ましくは約500μg未満、一層好ましくは約100μg未満である。投与量は、所望の処置を達成するスケジュールに基づき、スケジュールは定期的に期間を短くしたり長くしたりしてもよい。一般的な範囲は、体重1キログラム当たり少なくとも約10μg〜約50mg、好ましくは約100μg〜約10mgである。サイトカインアゴニストまたは小分子治療剤については代表的には、類似のモル量で用いるが、それらは恐らく分子量がより小さいので、体重用量が少なくなる。
【0129】
本発明は、たとえば、炎症に関連した症状を緩和するエストロゲンまたはプロゲストロンなどのホルモンまたは抗生物質もしくは抗感染症剤など、既知の治療物と組み合わせた生物製剤の投与も提供する。糖質コルチコイドの1日の投与量は、1日当たり少なくとも約1mg以上、通常少なくとも約2mg、好ましくは少なくとも約5mgである。通常、その投与量は、1日当たり約100mg未満、代表的には約50mg未満、好ましくは約20mg未満、一層好ましくは少なくとも約10mgである。一般に、この範囲は、1日当たり少なくとも約1mg〜約100mg、好ましくは約2mg〜50mgである。「有効量」という語は、医学的状態の症状または徴候を緩和するのに十分な量を意味する。代表的な哺乳動物宿主には、マウス、ラット、ネコ、イヌおよびヒトを含む霊長類がある。個々の患者に対する有効量は、処置対象の症候、患者の健康全般、投与の方法経路および用量ならびにサイドアフェクト(side affect)の重症度などの因子によって異なり得る。併用する場合の有効量は、成分の組み合わせ比率となり、その作用は個々の成分単独の作用に限定されるものではない。
【0130】
治療剤の有効量は、典型的には少なくとも約10%;通常、少なくとも約20%;好ましくは少なくとも約30%;一層好ましくは少なくとも約50%症状を緩和する。本発明は、本明細書の別の箇所(たとえば、上述の適応症に関連する障害の処置の概要についての一般的な記載)に記載されているような治療用途に用いられる試薬を提供する。Berkow(ed.)The Merck Manual of Diagnosis and Therapy,Merck & Co.,Rahway,N.J.;Brauwald,et al.(eds.)(2001)Harrison’s Principles of Internal Medicine,15th ed.,McGraw−Hill,NY;Gilman,et al.(eds.)(1990)Goodman
and Gilman’s:The Pharmacological Bases of Therapeutics,8th Ed.,Pergamon Press;Remington’s Pharmaceutical Sciences,17th ed.(1990),Mack Publishing Co.,Easton,Penn;Langer(1990)Science 249:1527−1533;Merck Index,Merck & Co.,Rahway,New Jersey;and Physician’s Desk Reference(PDR);Cotran,et al.(eds.),上掲;and Dale and Federman(eds.)(2000)Scientific American Medicine,Healtheon/WebMD,New York,NYを参照されたい。
【0131】
VI.診断方法
本発明は、生物学的サンプル中のIL−27またはIL−27Rの存在を検出する方法を提供する。この方法は、タンパク質または核酸分子(mRNAなど)を検出できる薬物と生物学的サンプルを接触させ、生物学的サンプル中のこれらの遺伝子の1つまたは両方の存在を検出することを含む。mRNAを検出する薬物の1つは、特定の遺伝子のmRNAに特異的にハイブリダイズできる標識核酸プローブである。核酸プローブは、たとえば、全長cDNAでも、長さが少なくとも15、30、50、100、250または500ヌクレオチドのオリゴヌクレオチドなど、その一部でもよいが、ストリンジェントな条件下で特定のmRNAに特異的にハイブリダイズするのに十分に相補的である。プローブについては、GenBankから公に入手可能な配列(ヒトEBI−3のNM_005755;ヒトp28のNM_145659;ヒトWSX1/TCCRのNM_004843;およびヒトgp130のNM_175767など)を用いて設計してもよい。所望の遺伝子名および所望の有機体名を用いてGenBankを検索して、ヒト以外の種に由来する前述の遺伝子のいずれかの配列を取得してもよい。
【0132】
サンプル中のmRNAについては、Perkin Elmer Taqman EZ RT−PCRキット(Perkin Elmer)を用いて測定する。遺伝子特異的プライマーおよびプローブに関しては、Primer Expressソフトウェア(Perkin Elmer)および受託番号により上述の遺伝子配列を用いて設計してもよい。
【0133】
特定のタンパク質(接着分子、炎症性サイトカインまたは免疫細胞表面抗原など)を検出する薬物は、特定のタンパク質に結合できる標識抗体または標識可能な抗体である。抗体は、ポリクローナル抗体でも、一層好ましくはモノクローナル抗体でもよい。インタクトな抗体またはそのフラグメント(FabまたはF(ab’)2など)を用いてもよい。プローブまたは抗体に対する「標識または標識可能な」という語は、検出可能な物質(125Iなど)をプローブまたは抗体にカップリング(すなわち、物理的結合)してプローブまたは抗体を直接標識すること、さらに直接標識された他の試薬と反応させてプローブまたは抗体を間接標識することとを包含することを意図している。間接標識の例として、蛍光標識二次抗体を用いた一次抗体の検出および蛍光標識ストレプトアビジンで検出できるようにしたビオチンによるDNAプローブの末端標識が挙げられる。
【0134】
生物学的サンプルは、被検体から単離されたサンプルを含み、単離後さらに処理または操作を加えずに本発明の方法に供される。別の実施形態では、単離後および本発明の方法に供する前に、生物学的サンプルを処理または操作してもよい。たとえば、サンプルを冷蔵(4℃で保管など)、凍結(−20℃で保管、−135℃で保管、液体窒素による凍結または当該技術分野において公知の多くの標準的な低温保存技術のいずれか1つを用いた凍結保存など)してもよい。さらに、被検体からの単離後および本発明の方法に供する前に、サンプルを精製してもよい。本明細書で使用する場合、「精製」という語は、生物学的サンプルの文脈で用いる場合、単離された生物学的サンプルの少なくとも1つの成分が生物学的サンプルから除去されて、精製後に成分が減少し、したがってより純粋な成分が残ることを示すことを意図している。たとえば、血清サンプルを当該技術分野において公知の遠心分離技術より1つまたは複数の成分に分離して、部分精製サンプル調製物を得てもよい。さらに、生物学的サンプルを、実質的に1つの成分だけが残るように精製することもできる。たとえば、生物学的サンプルのタンパク質またはmRNA成分だけが実質的に残るように、組織または腫瘍サンプルを精製することができる。
【0135】
成分を検出しやすいように、生物学的サンプルの成分を増幅することが望ましい場合がある。たとえば、mRNAを検出しやすいように、(RT−PCRなどにより)生物学的サンプルのmRNA成分を増幅してもよい。本明細書で使用する場合、「RT−PCR」(「逆転写酵素−ポリメラーゼ連鎖反応」)という語は、mRNAを逆転写酵素と反応させ、mRNAの塩基配列と相補的なDNAを産生することを含む。次いで選択したcDNAを、その増幅作用から耐熱性DNAポリメラーゼ(poly erase)の作用を利用するポリメラーゼ連鎖反応により大量に作製し得る。別の増幅方法として、以下に限定されるものではないが、自己支持配列複製(Guatelli,J.C.et al.,1990,Proc.Natl.Acad.Sci.USA 87:1874−1878)、転写増幅系(Kwoh,D.Y.et al.,1989,Proc.Natl.Acad.Sci.USA 86:1173−1177)、Qβレプリカーゼ(Lizardi,P.M.et all,1988,Bio/Technology 6:1197)または任意の他の核酸増幅法があり、その後、増幅された分子を当業者によく知られた技術により検出する。核酸分子数が非常に少ない場合、こうした検出スキームは、そうした分子の検出に特に有用である。
【0136】
本発明の検出方法については、生物学的サンプル中のタンパク質または核酸分子のインビトロおよびインビボでの検出に用いてもよい。たとえば、インビトロでのmRNAの検出技術として、ノーザンハイブリダイゼーションおよびin situハイブリダイゼーションが挙げられる。インビトロでのタンパク質の検出技術として、酵素結合免疫吸着測定(ELISA)、ウエスタンブロット、免疫沈降および免疫蛍光法が挙げられる。
【0137】
被験者の生物学的サンプル中のIL−27またはIL−27Rのレベルが異常かどうかを判定するには、被験者のIL−27またはIL−27Rのレベルを、たとえば、妊娠が正常だった女性から測定したこれらの分子の平均レベルと比較する。被験者において測定したこれらの分子のレベルの方が正常な妊娠の場合のレベルよりも低ければ(すなわち、統計学的に有意に低い)、被験者は、免疫性(inmune−mediated)自然流産が発生するリスクがあると診断される。
【0138】
たとえば、IL−27またはIL−27Rのレベルが10〜20%低い被検体は、リスクがあると診断される。なお別の実施形態では、たとえば、好適または適切な対照と比較したときに、レベルが20〜30%、30〜40%、40〜50%、50〜100%、100〜200%、200〜400%(2倍〜4倍など)、4倍〜10倍、10倍〜100倍、100倍またはそれを超えて低い被検体は、免疫性自然流産のリスクがあると診断される。
【0139】
本発明はまた、生物学的サンプル中のIL−27またはIL−27Rの存在を検出するキットを含む。たとえば、そのキットは、生物学的サンプル中のIL−27ヘテロ二量体またはIL−27R複合体の少なくとも1つのサブユニットのmRNAまたはポリペプチドを検出できる標識薬物または標識可能な薬物および生物学的サンプル中のIL−27またはIL−27RのmRNAまたはポリペプチドの量を測定する手段を含んでもよい。この薬物は、好適な容器に包装されていてもよい。さらに、そのキットは、サンプル中のIL−27またはIL−27Rの量を標準物質(IL−27またはIL−27Rレベルの正常範囲および異常範囲を示すチャートあるいは好適または適切な対照サンプルなど)と比較する手段をさらに含んでもよく、および/または、IL−27ヘテロ二量体またはIL−27R複合体の少なくとも1つのサブユニットのmRNAまたはポリペプチドを検出するキットの使用説明書をさらに含んでもよい。
【0140】
胚に対する母体の免疫寛容に関する現在のモデルは、サイトカインおよびホルモンの間接的なシグナル伝達の活用と母体のリンパ球の能動的な免疫抑制という2つの相補的な機構が中心になっている。多くの既知の免疫調節性サイトカインについて、最近、胚に対する母体の寛容に作用することが明らかになっているとの記載がなされた。TNF−α、IFN−γ、IL−2、IL−1、IL−6、IL−12およびRANTESなど、(細胞内の寄生虫感染などの過程で)細胞傷害性を促進するTh1サイトカインは、流産を起こしやすいマウスで自然流産率を上昇させることが明らかになっているのに対し、液性免疫を促進するCSF−1、GM−CSF、IL−10、IL−4、IL−11、TGFおよびIL−3などのTh2サイトカインの存在は、流産率の低下と相関することが示されている(Chaouat et al.,1990,J Reprod Fertil 89,447−58;Gafter et al.,1997,J Clin Immunol 17,408−19)。また、胚供給源に由来する因子の研究では、能動的な免疫抑制についても記述されている。未同定のタンパク質および抗父系遮断抗原の中には、胚に対して若干の免疫抑制を与えるものがあることがこれまでに報告されている(Herrera−Gonzalez and Dresser,1993,Dev Comp Immunol 17,1−18)。実施例7〜11は、異常妊娠(pathologic
pregnancy)中のマウスにおいては、多くのサイトカインと共に接着分子および細胞表面抗原の発現レベルが変化するが、CTLA4Igによる処置で多くが正常化し得ることを示している。このため、これらの遺伝子の発現レベルの変化は、被検体が免疫性自然流産のリスクがあるかどうか、それを発生しているかどうか、あるいは、それに罹患しているかどうかを判定する診断基準として用い得る。
【0141】
また、上記のような本発明の方法を用いて、被検体の処置の進展をモニターすることも望み得る。たとえば、ある被検体(ヒトなど)が、本明細書に記載の処置方法のいずれか1つにより、免疫性自然流産の処置を受け得る。上述の診断方法を用いて、IL−27またはIL−27Rのレベルが正常レベルに戻ったかどうかを判定することができる。その後、結果に応じて被検体の処置を変更(たとえば、増減)してもよい。
【0142】
本発明の広範な範囲は、以下の実施例を参照すると最もよく理解される。実施例は、本発明を個々の実施形態に限定することを意図するものではない。
【実施例】
【0143】
I.一般的な方法
以下の標準的な方法の多くは、たとえば、Maniatis,et al.(1982)Molecular Cloning,A Laboratory Manual,Cold Spring Harbor Laboratory,Cold Spring
Harbor Press,NY;Sambrook,et al.(1989)Molecular Cloning:A Laboratory Manual(2d ed.)Vols.1−3,CSH Press,NY;Ausubel,et al.,Biology,Greene Publishing Associates,Brooklyn,NY;or Ausubel,et al.(1987 and Supplements)Current Protocols in Molecular Biology,Wiley/Greene,NY;Innis,et al.(eds.)(1990)PCR Protocols:A Guide to Methods and Applications,Academic Press,NYに記載または参照されている。タンパク質の精製方法には、硫酸アンモニウム沈殿、カラムクロマトグラフィー、電気泳動、遠心分離、結晶化などのような方法がある。たとえば、Ausubel,et al.(1987 and periodic supplements);Deutscher(1990)「Guide to Protein Purification,」Methods in Enzymology,vol.182およびこのシリーズの他の巻;Coligan,et al.(1995 and supplements)Current Protocols in Protein Science,John Wiley and Sons,New York,NY;P.Matsudaira(ed.)(1993)A Practical Guide to Protein and Peptide Purification for Microsequencing,Academic Press,San Diego,CA;およびタンパク質精製産物の使用に関する製造者の文献、たとえば、Pharmacia,Piscataway,NJまたはBio−Rad Laboratories,Hercules,CA.を参照されたい。組換え技術と組み合わせれば、たとえば、プロテアーゼの除去が可能な配列により、FLAG配列などの適切なセグメント(エピトープタグ)または融合が可能な等価物に融合できる。たとえば、Hochuli(1989)Chemische Industrie 12:69−70;Hochuli(1990)「Purification of Recombinant Proteins with Metal Chelate Absorbent」in Setlow(ed.)Genetic Engineering,Principle and Methods 12:87−98,Plenum Press,NY;and Crowe,et al.(1992)QIAexpress:The High Level Expression & Protein Purification System,QIAGEN,Inc.,Chatsworth,CAを参照されたい。
【0144】
標準的な免疫学的技術は、たとえば、Hertzenberg,et al.(eds.)(1996)Weir’s Handbook of Experimental Immunology vols.1−4,Blackwell,Malden,MA;Coligan(1991)Current Protocols in Immunology Wiley/Greene,NY;and Methods in Enzymology vols.70,73,74,84,92,93,108,116,121,132,150,162,and 163に記載されている。サイトカインアッセイについては、たとえば、Thomson(ed.)(1998)The Cytokine Handbook(3d ed.)Academic Press,San Diego;Mire−Sluis and Thorpe(1998)Cytokines,Academic Press,San Diego,CA;Metcalf and Nicola(1995)The Hematopoietic Colony Stimulating Factors,Cambridge Univ.Press,Cambridge,UK;and Aggarwal and Gutterman(1991)Human Cytokines,Blackwell,Malden,MAに記載されている。
【0145】
血管の生物活性アッセイは、当該技術分野において周知である。こうしたアッセイは、たとえば、動脈平滑筋の増殖(たとえば、Koyoma,et al.(1996)Cell 87:1069−1078を参照)、血管上皮への単球接着(たとえば、McEvoy,et al.(1997)J.Exp.Med.185:2069−2077;Ross(1993)Nature 362:801−809;Rekhter and Gordon(1995)Am.J.Pathol.147:668−677;Thyberg,et al.(1990)Atherosclerosis 10:966−990;Gumbiner(1996)Cell 84:345−357を参照などの腫瘍または他の組織における新脈管形成活性および抗新脈管形成性活性をカバーする。
【0146】
神経細胞の生物活性アッセイについては、たとえば、Wouterlood(ed.1995)Neuroscience Protocols modules 10,Elsevier;Methods in Neurosciences,Academic
Press;and Neuromethods Humana Press,Totowa,NJ.に記載されている。発生系の方法論は、たとえば、Meisami(ed.)Handbook of Human Growth and Developmental Biology,CRC Press;and Chrispeels(ed.)Molecular Techniques and Approaches in
Developmental Biology,Interscienceに記載されている。
【0147】
FACS分析については、Melamed,et al.(1990)Flow Cytometry and Sorting,Wiley−Liss,Inc.,New York,NY;Shapiro(1988)Practical Flow Cytometry,Liss,New York,NY;and Robinson,et al.(1993)Handbook of Flow Cytometry Methods,Wiley−Liss,New York,NYに記載されている。
【0148】
II.ヒト組織
妊娠9〜40週にある8個の胎盤の凍結組織サンプルをRT−PCRおよび/または免疫共沈降実験により解析した。さらに、妊娠第1三半期(4〜10週、n=11)、第2三半期(17〜27週、n=4)および第3三半期(33〜39週、n=4)の胎盤19個のホルマリン固定パラフィン包埋組織サンプルを免疫組織化学的検査により解析した。胎盤については、堕胎(第1三半期の胎盤)、治療的中絶、流産、帝王切開または自然分娩(第2および第3三半期の胎盤)から採取した。肉眼的検査および組織学的検査で異常がなかったためこれらの胎盤を選択した。子癇前症を示す病変および感染症は観察されなかった。さらに、精巣胚細胞腫瘍7例のパラフィン包埋組織サンプル(絨毛癌成分を含む混合型胚細胞腫瘍5例および合胞体栄養細胞層細胞を含むセミノーマ2例)も解析した。
【0149】
フランスの倫理ガイドラインに従って、患者の同意を得てから採取した凍結組織と、組織学的検査および診断目的(purposis)のために収集した固定組織とを調査した。
【0150】
III.RNAの抽出およびRT−PCR解析
TRIzol抽出により凍結組織または細胞からRNAを単離し、続いてM−MLV逆転写酵素およびoligo(dT)プライマー(試薬はすべてInvitrogen,Cergy−Pontoise,France製)を用いてDNaseI消化および逆転写を行った。PCR解析では、以下のプライマーを用いた:
【0151】
【化1】

熱サイクルプロファイルは、以下のとおりであった:94℃で1分、55℃で30秒および72℃で20秒、30サイクル(EBI3)、32サイクル(p28)、35サイクル(IL−27R)および30サイクル(gp130およびβ2−ミクログロブリン)。
【0152】
IV.免疫共沈降およびウエスタンブロット解析
凍結胎盤の組織を粉砕し、プロテアーゼ阻害剤(1mMのPMSF、1μg/mlのペプスタチン、10μg/mlのロイペプチン)を含む溶解緩衝液(0.5%ノニデットP−40、50mMのトリス(pH7.4)、150mMのNaCl、3%グリセロール、1.5mMのEDTA)中でインキュベートして氷上で1時間溶解した。細胞ライセートを13,000×gで15分間遠心した。次いで、この上清を、プロテインAセファロース(Amersham Biosciences,Saclay,France)により4℃で2時間プレクリアし、ウサギポリクローナル抗EBI3もしくは抗p28抗体(Ab)または対照ウサギIgG Ab(Sigma,St−Quentin−Fallavier,France)と4℃で2時間インキュベートした。ウサギポリクローナル抗EBI3または抗p28Abをそれぞれ、細菌性6His−EBI3融合タンパク質(たとえば、Devergne et al.(2001)Am J Pathol 159:1763−1776を参照)またはp28のN末端にマッピングされたペプチド(たとえば、Larousserie et al.(2004)J Pathol 202:164−171を参照)で免疫されたウサギの血清から精製した。免疫複合体を、4℃で1時間プロテインAセファロースとインキュベートして回収した。次いでビーズを、1mlの0.5%NP−40溶解緩衝液で5回洗浄し、結合タンパク質を、SDSサンプル緩衝液中で煮沸して回収した。イムノブロッティングのため、溶出したタンパク質をSDS−PAGEで分離し、ニトロセルロース膜にトランスファーした。EBI3を、マウス2G4H6mAbを用いて検出し(Devergne et al.(2001)上掲)、p28を、p28のC末端を認識するアフィニテイ精製ウサギ抗p28Ab(Schering−Plough Biopharma,Palo Alto,CA)を用いて検出した。マウスAbまたはウサギAbの結合をそれぞれ、西洋わさびペルオキシダーゼ結合体化抗マウスAbまたは西洋わさびペルオキシダーゼ結合体化プロテインAで検出した(Amersham Biosciences)。ペルオキシダーゼ反応を化学発光試薬により展開させた(Pierce,Rockford,Il,USA)。
【0153】
V.ELISA
正常な満期胎盤14個の胎盤外植片の培養上清(以前に記載されているように調製(Devergne,et al.(2001)上掲))および正常な妊娠の女性7名の血清(妊娠中の様々な時期(妊娠9〜40週)由来)についてELISAによりIL−27を検査した。これらはすべて、ELISAによりEBI3について既に検査がなされていた(Devergneら(2001)上掲)。EBI3/p28ヘテロ二量体を認識するが、遊離EBI3を認識しないIL−27のELISAについては、既に記載されている(たとえば、Pflanz,et al.(2002)を参照 上掲)。
【0154】
VI.免疫組織化学的検査
記載のように間接的なアビジン−ビオチンペルオキシダーゼ技術により、ホルマリン固定パラフィン包埋組織について免疫組織化学的検査を行った(Larousserie,et al.(2004)上掲;Larousserie,et al.(2005)上掲;Larousserie,et al.(2006)上掲;and Devergne,et al.(2001)上掲)。ペルオキシダーゼ反応を3’−ジアミノベンジジンで展開させ、切片をハリスヘマトキシリンで対比染色した。EBI3を、2μg/mlの2G4H6マウスmAb(IgG2a)と平行してアイソタイプ対応対照mAb(RPC5,IgG2a,Cappel Durham,NC,USA)を用いて検出した。p28を、1〜2μg/mlでアフィニテイ精製ウサギポリクローナル抗p28抗体(Schering−Plough Biopharma)を用いて検出し、正常なウサギIgG(Sigma)を陰性対照として用いた。場合によっては、正常なラットIgGと平行してラット抗p28モノクローナルAb(10μg/ml)(Schering−Plough Biopharma)を用い、記載のように(Larousserie,et al.(2004)上掲)ビオチン化ウサギ抗ラットポリクローナルIgG(Vector laboratories)で検出した。
【0155】
VII.免疫性流産の動物モデル
流産を起こしやすいDBA×CBAマウスモデルは、免疫性自然流産に関する研究の標準的なモデルである(Toder et al.,1989 ,J Reprod Fertil Suppl 37,79−84)。CBA妊娠雌マウスでは、DBA:CBAハイブリッドの吸収胚率は、21〜30%であるのに対し、対照Balb C:CBAの吸収胚率は8%である。このモデル系の場合、胚に対する母体の免疫学的拒絶反応が妊娠6日目、着床後2日目に始まる(Duclos et al.,1995,Am J Reprod Immunol 33,354−66)。胚に対する母体の拒絶を抑制するIL−27アゴニストの潜在力を評価するため、IL−27アゴニストを、自然流産率が高いマウス、自然流産率が高いあるいは低い妊娠マウスに投与する。着床時期(4日目)および胚に対する免疫学的反応が最初に検出される日(6日目)に対応する妊娠4日目および6日目など様々な時点で投与を行う。吸収された胚の定量を妊娠12日目に行う。高率で流産が起こるCBA×DBA交配マウス(n=14)の吸収胚率を、対照Balb/C×DBA交配マウスのそれと比較する。
【0156】
本明細書に引用するすべての参考文献については、すべての目的ために参照によってその全体を援用すべく、1つ1つの刊行物、特許または特許出願を具体的に個々に示しているのと同じ程度に参照によって本明細書に援用する。
【0157】
当業者には明らかなように、本発明の精神および範囲から逸脱することなく、その多くの変形例および変更例が可能である。本明細書に記載の具体的な実施形態は、例示のみを目的として提供されるものであり、本発明は、添付の特許請求の範囲の用語およびその特許請求の範囲が権利を有する等価物の全範囲によってのみ限定される。
【技術分野】
【0001】
(発明の分野)
本発明は、寛容および子宮内膜への胚の着床を調節する方法を提供する。
【背景技術】
【0002】
(発明の背景)
哺乳動物の免疫反応は、「免疫ネットワーク」と呼ばれる一連の複雑な細胞間相互作用に基づいている。最近の研究から、このネットワークの内部の仕組みに対する新たな洞察が得られてきた。その反応の大部分が実際に、リンパ球、マクロファージ、顆粒球およびこれ以外の細胞のネットワーク様相互作用を中心に展開するのは以前から明らかであるが、一方、現在の免疫学者は一般に、サイトカインとして知られる可溶性タンパク質がこうした細胞間相互作用の制御に極めて重要な役割を果たしているという見解を持っている。したがって、細胞調節因子の単離、特徴付けおよび作用機序に対して大きな関心が集まっており、それを理解すれば、たとえば、免疫系障害など多くの医学的異常の診断および治療の大きな進歩につながるであろう。これらの因子の一部として、たとえば、幹細胞因子(SCF:stem cell factor)またはIL−12などの造血成長および/または造血分化因子がある(たとえば、Mire−Sluis and Thorpe(1998)Cytokines,Academic Press,San Diego,CA;Thomson(ed.)(1998)The Cytokine Handbook(3d ed.)Academic Press,San Diego,CA;Metcalf and Nicola(1995)The Hematopoietic
Colony Stimulating Factors,Cambridge Univ.Press,Cambridge,UK;and Aggarwal and Gutterman(1991)Human Cytokines,Blackwell,Malden,MAを参照)。
【0003】
サイトカインは、様々な形で細胞活性に関与している。多能性造血幹細胞が、複雑な免疫系を構成する多様な細胞系統からなる数々の前駆細胞へと増殖、成長および分化するのをサイトカインが支持することが明らかになっている。健康な免疫反応には細胞成分間の適切かつバランスのとれた相互作用が必要である。サイトカインが他の因子と併用投与されると、異なる細胞系統が、別の形で反応することが多い。
【0004】
免疫反応に特に重要な細胞の系統として、免疫グロブリン(異物の除去を行うための異物に対する認識能および結合能を持つタンパク質)を産生および分泌できるB細胞、サイトカインを分泌し、かつB細胞および免疫ネットワークを構成する他の様々な細胞(他のT細胞など)を誘発または抑制する種々のサブセットのT細胞、感染性病原体および腫瘍細胞に反応してサイトカインの産生に関与するNK(natural killer)細胞ならびに樹状細胞および他のミエロイド由来の細胞などの抗原提示細胞が挙げられる。
【0005】
本発明は、IL−12に関係するサイトカインであるIL−27の使用方法を提供する。IL−12は、p35とp40の2つのサブユニットからなるヘテロ二量体サイトカインであり、細胞性免疫に極めて重要な役割を果たしている。その活性は、2つのサブユニットIL−12Rβ1およびIL−12Rβ2を含む高親和性の受容体複合体により惹起される。IL−12のp35サブユニットは、EBI3と呼ばれる第2の可溶性タンパク質に結合することができ、p35およびEBI3が分泌ヘテロ二量体を形成すると考えられた(ただし、このヘテロ二量体の機能は不明である)。また、EBI3は、別のタンパク質p28にも結合し、現在IL−27と呼ばれる、p28およびEBI3を含む可溶性ヘテロ二量体を形成する。p28サブユニットは、IL−80またはIL−D80とも呼ばれる。ヒトおよびマウスのp35サブユニットをコードするcDNAは、どちらも参照によって援用する特許文献1および特許文献2に記載されている(たとえば、Devergne,et al.(1997)Proc.Natl.Acad.Sci USA 94:12041−12046;Chua,et al.(1995)J.Immunol.155:4286:4294;Presky,et al.(1998)J.Immunol.160:2174−2179;Gately,et al.(1998)Ann.Rev.Immunol.16:495−521;Presky,et al.(1996)Proc.Natl.Acad.Sci USA 93:14002−14007;Trinchieri(1998)Adv.Immunol.70:83−243;Trinchieri(1998)Immunol.Res.17:269−278;Trinchieri(1995)Annu.Rev.Immunol.13:251−276を参照)。
【0006】
インビトロ研究では、IL−27の主要な供給源として活性化単球および単球由来樹状細胞が同定されている。これらの研究ではさらに、EBI3遺伝子およびp28遺伝子の発現が必ずしも協調的に起きるとは限らないことが明らかにされた。p28遺伝子は通常、EBI3遺伝子よりも低レベルで発現し、極めて一過性であり、細胞型のスペクトルがより限定的である(たとえば、Pflanz et al.(2002)Immunity 16:779−790を参照)。おそらくこうした低レベルかつ一過性の遺伝子発現が原因で、p28タンパク質のin situ発現を証明することが難しくなっている。ヒトリンパ球組織を用いたEBI3およびp28発現の免疫組織化学的研究によれば、EBI3発現は、多くの場合、検出可能なp28の発現とは関連しておらず、EBI3とp28の共発現が主に検出されたのは、マクロファージ系統の細胞および反応組織の内皮細胞においてであった(たとえば、Larousserie et al.(2004)J
Pathol. 202:164−171;Larousserie et al.(2005)Am J Pathol 166:1217−1228;and Larousserie(2006)J Pathol 209:360−368を参照)。
【0007】
EBI3は、EBI3がp28と会合してIL−27を形成することが明らかになる前に、ヒトの胎児と母体の界面において非常に高レベルで発現することが示されていた(たとえば、Devergne et al.(1996)J Virol 70:1143−1153;Devergne et al.(1997)Proc Natl Acad Sci USA 94:12041−12046;and Devergne et
al.(2001)Am J Pathol 159:1763−1776を参照)。EBI3は、妊娠期間を通じて母胎の免疫系に直接接触している胎児由来の2つの細胞型、合胞体栄養細胞層(母体血と相互作用する)および絨毛外栄養膜(母体の子宮内膜(uterine mucosa)と相互作用する)のみに発現する。浸潤性の絨毛外栄養膜は、一部はサイトカインおよびケモカインの産生を介して母体の寛容および血管リモデリングに中心的な役割を果たしている(たとえば、Moffett and Loke(2006)Nat Rev Immunol 6:584−594を参照)。これらの細胞に、非古典的MHCクラスI分子のHLA−Gが特異的に発現する。HLA−Gは、異なる表面分子に結合することで、脱落膜NK細胞、CD4+およびCD8+T細胞など複数の細胞型で免疫調節機能を示し(たとえば、Le Bouteiller et al.(2003)Placenta 24:Suppl A.S10−5.を参照)、新脈管形成を制御する(たとえば、Fons et al.(2006)Blood 108:2608−2615.を参照)。興味深いことに、膜結合または可溶性HLA−Gにより提示されたペプチドを精製すると、EBI3の九量体ペプチドがペプチドとして最も多く含まれており、回収したすべてのリガンドの最大15%を占めることが明らかになった(たとえば、Ishitani(2003)J Immunol 171:1376−1384を参照)。
【先行技術文献】
【特許文献】
【0008】
【特許文献1】米国特許出願公開第2002/0164609号明細書
【特許文献2】国際公開第02/068596号パンフレット
【発明の概要】
【発明が解決しようとする課題】
【0009】
上述から、サイトカインおよびサイトカイン受容体、たとえば、IL−27およびその受容体複合体に関係する新しい機能および方法の発見が、妊娠異常の新たな治療に貢献する可能性があるは明らかである。特に、既知のサイトカインの有益な活性を促進または増強するサイトカインが発見および開発されれば、極めて好都合であろう。本発明は、IL−27により寛容および胚の着床を調節する方法を提供する。
【課題を解決するための手段】
【0010】
(発明の要旨)
本発明は、母体と胎児の界面部位におけるIL−27の発現および産生の発見に基づく。
【0011】
本発明は、胎児性抗原に対する母体の寛容を誘導する方法であって、免疫性流産(immune mrdiated abortion)のリスクがあるか、それに罹患している被検体に有効量のIL−27アゴニストを投与することを含む、方法を提供する。一実施形態では、被検体はヒトであり、IL−27アゴニストを、a)妊娠第1三半期;b)妊娠第2三半期;c)妊娠第3三半期;またはd)妊娠第1、妊娠第2および妊娠第3三半期中に投与する。IL−27アゴニストは、IL−27タンパク質であってもよく、このタンパク質はヒトIL−27であってもよい。ある実施形態では、IL−27アゴニストは、IL−27受容体(IL−27R)複合体の少なくとも1つのサブユニットに結合するアゴニスト抗体である。IL−27R複合体は、ヒトIL−27R複合体である。アゴニスト抗体は、IL−27R複合体のシグナル伝達を誘導する。
【0012】
本発明はまた、少なくとも1個の胚の子宮内膜への着床を促進する方法であって、有効量のIL−27アゴニストを被検体に投与することを含む、方法も提供する。IL−27アゴニストについては、a)妊娠第1三半期;b)妊娠第2三半期;c)妊娠第3三半期;またはd)妊娠第1、妊娠第2および妊娠第3三半期中に投与してもよい。IL−27アゴニストは、IL−27タンパク質であることを意図している。さらなる実施形態では、IL−27タンパク質はヒトIL−27である。さらに、IL−27アゴニストは、IL−27R複合体の少なくとも1つのサブユニットに結合するアゴニスト抗体であることも想定している。IL−27複合体はヒトIL−27複合体であり、アゴニスト抗体は、IL−27R複合体のシグナル伝達を誘導する。
【0013】
さらに、被検体が免疫性流産であるかどうかを判定する診断方法であって、被検体から採取した生物学的サンプル中のIL−27またはIL−27Rの存在あるいはレベルを検出することと、被検体が自然流産であるかどうかを判定することとを含む、診断方法も提供する。生物学的サンプルについては、組織サンプル、細胞サンプルまたは血清サンプルからなる群から選択してもよい。さらなる実施形態では、組織サンプルは、絨毛膜絨毛サンプルおよび胎盤サンプルからなる群から選択される。
【0014】
本発明は、被検体が免疫性流産を起こすリスクがあるかどうかを判定する予後診断方法であって、被検体から採取した生物学的サンプルまたはサンプルの単離物におけるIL−27またはIL−27RのmRNAまたはポリペプチドの存在またはレベルを検出し、それにより被検体が自然流産を起こすリスクがあるかどうかを判定することを含む、予後診断方法を包含する。生物学的サンプルは、絨毛膜絨毛サンプルおよび胎盤サンプルなどの組織サンプル、細胞サンプルまたは血清サンプルからなる群から選択される。
【0015】
さらに、免疫性流産のリスクがあるか、それに罹患している被検体に対するIL−27アゴニストによる処置をモニターする方法であって、被検体由来の生物学的サンプルまたはサンプルの単離物におけるTh1またはTh2サイトカインのmRNAまたはポリペプチドのレベルを測定し、それにより被検体が免疫性流産のリスクがあるか、それに罹患しているかどうかを判定することを含む、方法も意図している。Th1サイトカインは、TNF−α、IFN−γ、IL−2、IL−1、IL−6、IL−12およびRANTESからなる群から選択される。Th2サイトカインは、CSF−1、GM−CSF、IL−10、IL−4、IL−11、TGFおよびIL−3からなる群から選択される。
例えば、本願発明は以下の項目を提供する。
(項目1)
胎児性抗原に対する母体の寛容を誘導する方法であって、免疫性流産のリスクがあるか、免疫性流産に罹患している被検体に有効量のIL−27アゴニストを投与する工程を含む、方法。
(項目2)
前記被検体はヒトであり、前記IL−27アゴニストは、
a)妊娠第1三半期;
b)妊娠第2三半期;
c)妊娠第3三半期;または
d)妊娠第1、妊娠第2および妊娠第3三半期
の間に投与される、項目1に記載の方法。
(項目3)
前記IL−27アゴニストはIL−27タンパク質である、項目1に記載の方法。
(項目4)
前記IL−27タンパク質はヒトIL−27タンパク質である、項目3に記載の方法。
(項目5)
前記IL−27アゴニストは、IL−27受容体(IL−27R)複合体の少なくとも1つのサブユニットに結合するアゴニスト抗体である、項目1に記載の方法。
(項目6)
前記IL−27R複合体はヒトIL−27R複合体である、項目5に記載の方法。
(項目7)
前記アゴニスト抗体は前記IL−27R複合体のシグナル伝達を誘導する、項目5に記載の方法。
(項目8)
少なくとも1個の胚の子宮内膜への着床を促進する方法であって、有効量のIL−27アゴニストを被検体に投与する工程を含む、方法。
(項目9)
前記被検体はヒトであり、IL−27アゴニストは、
a)妊娠第1三半期;
b)妊娠第2三半期;
c)妊娠第3三半期;または
d)妊娠第1、妊娠第2および妊娠第3三半期
の間に投与される、項目8に記載の方法。
(項目10)
前記IL−27アゴニストはIL−27タンパク質である、項目8に記載の方法。
(項目11)
前記IL−27タンパク質はヒトIL−27タンパク質である、項目10に記載の方法。
(項目12)
前記IL−27アゴニストは、IL−27R複合体の少なくとも1つのサブユニットに結合するアゴニスト抗体である、項目8に記載の方法。
(項目13)
前記IL−27複合体はヒトIL−27複合体である、項目12に記載の方法。
(項目14)
前記アゴニスト抗体は前記IL−27R複合体のシグナル伝達を誘導する、項目12に記載の方法。
(項目15)
被検体が免疫性流産であるかどうかを判定する診断方法であって、該被検体から得られた生物学的サンプル中のIL−27またはIL−27Rの存在またはレベルを検出する工程と、該被検体が自然流産を有しているかどうかを判定する工程とを含む、診断方法。
(項目16)
前記生物学的サンプルは組織サンプル、細胞サンプルまたは血清サンプルからなる群から選択される、項目15に記載の方法。
(項目17)
前記組織サンプルは絨毛膜絨毛サンプルおよび胎盤サンプルからなる群から選択される、項目16に記載の方法。
(項目18)
被検体が免疫性流産を起こすリスクがあるかどうかを判定する予後診断方法であって、該被検体から得られた生物学的サンプルまたは該サンプルの単離物中のIL−27またはIL−27RのmRNAまたはポリペプチドの存在またはレベルを検出する工程を含み、それにより該被検体が自然流産を起こすリスクがあるかどうかを判定する、予後診断方法。
(項目19)
前記生物学的サンプルは組織サンプル、細胞サンプルまたは血清サンプルからなる群から選択される、項目18に記載の方法。
(項目20)
前記組織サンプルは絨毛膜絨毛サンプルおよび胎盤サンプルからなる群から選択される、項目19に記載の方法。
(項目21)
免疫性流産のリスクがあるか、免疫性流産に罹患している被検体に対するIL−27アゴニストによる処置をモニターする方法であって、該被検体からの生物学的サンプルまたは該サンプルの単離物中のTh1またはTh2サイトカインのmRNAまたはポリペプチドのレベルを測定する工程を含み、それにより該被検体が免疫性流産のリスクがあるか、免疫性流産に罹患しているどうかを判定する、方法。
(項目22)
前記Th1サイトカインはTNF−α、IFN−γ、IL−2、IL−1、IL−6、IL−12およびRANTESからなる群から選択される、項目21に記載の方法。
(項目23)
前記Th2サイトカインはCSF−1、GM−CSF、IL−10、IL−4、IL−11、TGFおよびIL−3からなる群から選択される、項目21に記載の方法。
【図面の簡単な説明】
【0016】
【図1】図1は、半定量RT−PCRにより解析した、様々な妊娠時期に採取した7個の胎盤のEBI3、p28、IL−27Rおよびgp130の遺伝子発現を示す。LPS(100ng/ml)による刺激の前あるいはそれで一晩刺激した後に磁気精製したヒト単球を陽性対照として用いた。<<−>>のレーンは、PCR反応でcDNAを加えていない陰性対照である。B2−ミクログロブリン(B2m)を、各条件で同じ材料の内部対照として用いた。
【図2】図2Aは、p28によるEBI3の免疫共沈降を示す。妊娠17および28週目に採取した2個の胎盤のNP40抽出物を、ウサギポリクローナル抗EBI3Ab、ウサギポリクローナル抗p28Abあるいはウサギ対照Ab(IP当たり10μg)による免疫沈降(IP)に供した。IPの前に得た細胞ライセートの画分(レーン2および5)および免疫沈降物(レーン1、3、4、6、7)を12%ゲルによるSDS−PAGEで解析し、マウスモノクローナル抗EBI3Abまたはウサギポリクローナル抗p28Abを用いたウエスタンブロット解析に供した。EBI3およびp28の位置を示してある。左の数字は、標準分子量のタンパク質(1000の位で示す)の位置を示す。p28ブロットのp28のバンドの上にあるバンドは、ウサギIg鎖に相当する可能性が非常に高い。妊娠9週目、33週目、36週目および40週目の胎盤のライセートにより、類似の免疫共沈降データを取得した。図2Bは、胎盤外植片の培養上清におけるIL−27の検出を示す。グラフの下の時間で示した様々な培養時間に採取した、満期胎盤14個の外植片の培養上清をIL−27のELISAで検査した。平均値(±SD)を示す。
【図3】図3は、各図の上端に示すように対照ウサギAb(a)、ウサギポリクローナル抗p28Ab(b、c)およびマウスモノクローナル抗EBI3Ab(d)を用いた免疫組織化学的検査で解析した第1三半期胎盤の切片を示す。(c)は、(b)において枠で区切った部分の拡大図を示す。合胞体栄養細胞層細胞(syncytiotrophoblast cell)はEBI3とp28とに対して強い陽性を示すのに対し、栄養膜細胞層細胞(cytotrophoblast cell)は陰性のままである点に留意されたい。絨毛癌成分を含む精巣混合型胚細胞腫瘍(testicular mixed germ cell tumor)例の切片をウサギ対照Ab(e)、ウサギポリクローナル抗p28Ab(f)またはマウスモノノクローナル抗EBI3Ab(g)で染色した。EBI3およびp28に対して共に陽性の合胞体栄養細胞層細胞を示す。(f)の挿入図は、合胞体栄養細胞層細胞がp28陽性であるのに対し、形態学的に栄養膜細胞層細胞(矢印)と一致する細胞は陰性であることを示す。対物レンズ:(a)および(b)で10倍;(c〜g)で20倍。ccは栄養膜細胞層細胞;syは合胞体栄養細胞層細胞。
【図4】図4は、対照ウサギAb(a)、ウサギ抗p28Ab(b)またはマウス抗EBI3Ab(c)を用いて免疫組織化学的検査で解析した第1三半期胎盤の連続切片を示す。間質性栄養膜細胞は、EBI3とp28とに対して陽性である。対物レンズ:a〜cで×20。saは螺旋動脈;evtは絨毛外栄養膜細胞(extravillous trophoblast cell)。
【発明を実施するための形態】
【0017】
(好ましい実施形態の詳細な説明)
本明細書に引用する参考文献についてはすべて、参照によって援用すべく1つ1つの刊行物または特許出願を具体的に個々に示す場合と同程度に参照によって本明細書に援用する。
【0018】
本明細書で使用する場合、添付の特許請求の範囲を含め、単語「a」、「an」および「the」などの単数形は、文脈上明らかに他の意味に解すべき場合を除き、それに対応する複数の言及を含む。
【0019】
I.定義
未変性IL−27タンパク質に対して形成された抗体により認識され得る分子、あるいは、未変性IL−27タンパク質の刺激活性、阻害活性または結合活性のいずれかを持つ分子は、少なくとも1つの「IL−27生物活性」または「IL−27アゴニスト活性」を有する。たとえば、その分子は、免疫細胞を強化してIFNγを産生させてもよいし、IL−27受容体に結合してもよい。その分子は、好ましくはWSX−1/TCCRに結合し、一層好ましくはIFNγの産生を増強することができる。
【0020】
「投与」および「処置」とは、ヒト、家畜、動物、実験被検体、細胞、組織、器官または生物学的液体に用いる場合、外因性の医薬剤、治療薬、診断剤または医薬組成物、治療組成物、診断用組成物を動物、ヒト、被検体、細胞、組織、器官または生物学的液体に接触させることをいう。「投与」および「処置」は、たとえば、治療方法、薬物動態学的方法、診断方法、調査方法および実験方法を指してもよい。細胞の処置は、試薬と細胞の接触ばかりでなく、体液が細胞と接触している場合の試薬と体液の接触を包含する。細胞の処置は、ヒトまたは動物において試薬が生物学的液体に接触するが、試薬と細胞の接触が明らかにされていない状態を含む。さらに、処置は、投与された試薬または細胞が代謝、分解または貯蔵条件により改変される状態も包含する。
【0021】
生物活性、機能、健康または有機体の状態の「増進」という語は、増加、補強、強化または改善のプロセスをいう。
【0022】
「作動可能に連結された」という語は、この語を用いた各成分が好適な条件下で固有の機能を発揮できる関係にあることを意味する。たとえば、タンパク質コード配列に「作動可能に連結された」制御配列は、制御配列の転写活性に適合した条件下でタンパク質コード配列の発現を達成するようにそこに連結される。
【0023】
「制御配列」という語は、それが連結されるコード配列の発現およびプロセシングを行うことができる、被検体のポリヌクレオチド配列を意味する。そうした制御配列の性質は、宿主生物によって異なる場合がある。特定の実施形態では、原核生物の制御配列はプロモーター、リボソーム結合部位および転写終結配列を含むことがある。他の特定の実施形態では、真核生物の制御配列は、転写因子の1つまたは複数の認識部位を含むプロモーター、転写エンハンサー配列および転写終結配列を含んでもよい。ある実施形態では、「制御配列」はリーダー配列および/または融合パートナー配列を含み得る。
【0024】
「ポリヌクレオチド」という語は、少なくとも長さ10塩基の一本鎖または二本鎖核酸ポリマーを意味する。ある実施形態では、ポリヌクレオチドを含むヌクレオチドは、リボヌクレオチドまたはデオキシリボヌクレオチドまたはどちらかのタイプのヌクレオチドの改変形であり得る。該改変体は、ブロモウリジンおよびイノシン誘導体などの塩基の改変体、2’,3’−ジデオキシリボースなどのリボース改変体ならびにホスホロチオアート、ホスホロジチオアート、ホスホロセレノアート、ホスホロジセレノアート、ホスホロアニロチオアート、ホスホラニラダートおよびホスホロアミダートなどのヌクレオチド間の連結改変体を含む。ポリヌクレオチドという語は、一本鎖形態および二本鎖形態のDNAを含む。
【0025】
「オリゴヌクレオチド」という語は、200塩基以下の長さを持つポリヌクレオチドを意味する。好ましい実施形態では、オリゴヌクレオチドは長さ10〜60塩基である。より好ましい実施形態では、オリゴヌクレオチドは長さ12、13、14、15、16、17、18、19または20〜40塩基である。たとえば、突然変異遺伝子の構築に用いる場合、オリゴヌクレオチドは一本鎖でも二本鎖でも構わない。本発明のオリゴヌクレオチドは、センスオリゴヌクレオチドであっても、アンチセンスオリゴヌクレオチドであってもよい。
【0026】
「天然に存在するヌクレオチド」という語は、デオキシリボヌクレオチドおよびリボヌクレオチドを含む。「改変ヌクレオチド」という語は、改変または置換された糖基あるいは改変または置換された塩基を持つヌクレオチドを含む。「オリゴヌクレオチド連結」という語は、ホスホロチオアート、ホスホロジチオアート、ホスホロセレノアート、ホスホロジセレノアート、ホスホロアニロチオアート、ホスホラニラダート、ホスホロアミダートなどの連結を含む。たとえば、目的に応じてその開示内容を参照によって本明細書に援用するLaPlanche et al.(1986),Nucl.Acids Res.14:9081;Stec et al.(1984),J.Am.Chem.Soc.106:6077;Stein et al.(1988),Nucl.Acids Res.16:3209;Zon et al.(1991),Anti−Cancer
Drug Design 6:539;Zon et al.(1991),Oligonucleotides and Analogues:A Practical Approach,pp.87−108(F.Eckstein,ed.),Oxford
University Press,Oxford England;Stec et
al.,米国特許第5,151,510号;Uhlmann and Peyman(1990),Chemical Reviews 90:543を参照されたい。本発明のオリゴヌクレオチドは、検出アッセイ用の放射標識、蛍光標識、ハプテンまたは抗原標識などの標識を含んでもよい。
【0027】
「ベクター」という語は、宿主細胞へのコーディング情報の伝達に使用する任意の分子(核酸、プラスミドまたはウイルスなど)を意味する。
【0028】
「発現ベクター」または「発現コンストラクト」という語は、宿主細胞の形質転換に好適なベクターをいい、それに作動的に連結された1つまたは複数の異種コード領域の発現を(宿主細胞と共同して)誘導および/または制御する核酸配列を含む。発現コンストラクトは、以下に限定されるものではないが、転写と、翻訳と、イントロンが存在する場合、それに作動可能に連結されたコード領域のRNAスプライシングとに作用または制御する配列を含んでもよい。
【0029】
「宿主細胞」という語は、核酸配列により形質転換されているか、形質転換され得て、それにより選択した目的の遺伝子を発現する細胞を意味する。選択した遺伝子が存在する限り、子孫の形態または遺伝子構成が最初の親細胞と同一かどうかに関係なく、宿主細胞は親細胞の子孫を含む。
【0030】
「形質導入」という語は、通常、ファージによりある細菌の遺伝子が別の細菌に導入されることを意味する。また、「形質導入」は、真核細胞配列のレトロウイルスによる獲得および伝達のこともいう。
【0031】
「トランスフェクション」という語は、細胞による外来または外因性DNAの取り込みを意味し、外因性DNAが細胞膜内に導入されているとき、細胞は「トランスフェクトされている」。当該技術分野において多くのトランスフェクション技術が周知であり、本明細書に開示する。たとえば、Graham et al.,1973,Virology
52:456;Sambrook et al.,2001,Molecular Cloning:A Laboratory Manual,Id;Davis et al.,1986,Basic Methods in Molecular Biology,Elsevier;and Chu et al.,1981,Gene 13:197を参照されたい。こうした技術を用いて1つまたは複数の外因性DNA部分を好適な宿主細胞に導入することができる。
【0032】
「形質転換」という語は、細胞の遺伝的特徴の変化をいい、細胞は、新しいDNAを含むように改変されているとき、形質転換されている。たとえば、細胞は、トランスフェクション、形質導入または他の技術により未変性状態から遺伝子改変される場合、形質転換される。トランスフェクション後または形質導入後の形質転換DNAについては、細胞の染色体に物理的に組み込んで細胞のDNAと組換えてもよいし、複製されない一過性のエピソーム要素のままでもよいし、プラスミドとして独立に複製させてもよい。細胞は、細胞分裂により形質転換DNAが複製されるとき、「安定に形質転換された」と考察される。
【0033】
IL−27のポリペプチドおよび核酸の保存的に改変された改変体、誘導体およびムテインの使用方法を提供する。「保存的に改変された改変体」は、アミノ酸配列および核酸配列の両方に用いられる。特定の核酸配列に関する保存的に改変された改変体とは、同一または本質的に同一のアミノ酸配列をコードする核酸をいい、あるいは、核酸がアミノ酸配列をコードしない場合、本質的に同一の核酸配列をいう。遺伝コードの縮重により、機能的に同一の核酸の多くが任意の特定のタンパク質をコードすることがある。
【0034】
アミノ酸配列については、コード化配列の1つのアミノ酸またはごく一部のアミノ酸を保存アミノ酸で置換する、核酸配列、ペプチド配列、ポリペプチド配列またはタンパク質配列の個々の置換が、「保存的に改変された改変体」であることを当業者は認識する。機能的に類似したアミノ酸を与える保存的置換の表は、当該技術分野において周知である。たとえば、保存的置換の例は、以下の群の1つのアミノ酸と、同一群における別のアミノ酸との交換である(Lee,らに付与された米国特許第5,767,063号;Kyte
and Doolittle(1982)J.Mol. Biol.157:105−132):
(1)疎水性:ノルロイシン、Ile、Val、Leu、Phe、CysまたはMet;(2)中性親水性:Cys、Ser、Thr;
(3)酸性:Asp、Glu;
(4)塩基性:Asn、Gln、His、Lys、Arg;
(5)鎖の配向に影響を与える残基:Gly、Pro;
(6)芳香族:Trp、Tyr、Phe;
(7)小アミノ酸:Gly、Ala、Ser。
【0035】
「ポリペプチド」または「タンパク質」という語は、未変性タンパク質の配列、すなわち、天然に存在し明確な非組換え細胞、あるいは遺伝子操作または組換え細胞から産生されるタンパク質の配列を持つ分子を意味し、未変性タンパク質のアミノ酸配列を持つ分子または未変性の配列中の1つまたは複数のアミノ酸に欠失、付加および/または置換がある分子を含む。具体的には、「ポリペプチド」および「タンパク質」という語は、抗体、あるいは、そうした抗体の1つまたは複数のアミノ酸に欠失、付加および/または置換がある配列を包含する。「ポリペプチドフラグメント」という語は、アミノ末端欠失、カルボキシル末端欠失および/または内部欠失を持つポリペプチドをいう。ある実施形態では、フラグメントは少なくとも5〜約500アミノ酸長である。ある実施形態では、フラグメントは少なくとも5、6、8、10、14、20、50、70、100、110、150、200、250、300、350、400または450アミノ酸長であることが理解される。特に有用なポリペプチドフラグメントとして、結合ドメインなどの機能ドメインが挙げられる。抗体の場合の有用なフラグメントとして、CDR領域、重鎖または軽鎖の可変ドメイン、抗体鎖または2つのCDRをちょうど含む可変領域の一部などを含むが、これに限定されるものではない。
【0036】
「天然に存在する」および「未変性の」という語は、この語を用いる生物材料(分子、配列、タンパク質複合体、細胞など)が自然界に見出され、ヒトにより操作されていないことを意味する。たとえば、有機体(ウイルスなど)に存在するポリペプチドまたはポリヌクレオチド配列が自然界の供給源から単離することができ、かつヒトにより意図的に改変されていない場合、それは天然に存在するものである。同様に、「非天然の」または「外来の(non−native)」という語は、自然界に見られないか、あるいは、ヒトにより構造改変されたまたは合成された材料をいう。
【0037】
医薬品業界では、鋳型ペプチドと類似の特性を持つ非ペプチド薬物としてペプチドアナログが一般に用いられる。このタイプの非ペプチド化合物は、「ペプチド模倣体(peptide mimetic)」または「ペプチド模倣物(peptidemimetic)」と呼ばれる。参照によって本明細書に援用するFauchere(1986),Adv.Drug Res.15:29;Veber & Freidinger,1985,TINS p.392;and Evans et al.(1987),J.Med.Chem.30:1229を参照されたい。そうした化合物は、コンピューター分子モデリングを用いて開発されることが多い。治療上有用なペプチドと構造的に類似したペプチド模倣体を用いると、類似の治療または予防効果が得られることがある。通常、ペプチド模倣物は、ヒト抗体などのパラダイムペプチドまたはポリペプチド(すなわち、生化学的特性または薬理学的活性を持つペプチドまたはポリペプチド)と構造的に類似しているが、当該技術分野において周知の方法で−−CH2−−NH−−、−−CH2−−S−−、−−CH2−−CH2−−、−−CH=CH−−(シスおよびトランス)、−−COCH2−−、−−CH(OH)CH2−−および−−CH2SO−−から選択される結合により必要に応じて置き換えられる1つまたは複数のペプチド結合を持つ。ある実施形態では、コンセンサス配列の1つまたは複数のアミノ酸を同じタイプのD−アミノ酸による系統的置換(L−リジンをD−リジンで置換など)を用いてより安定なペプチドを生成することができる。さらに、当該技術分野において公知の方法(任意の目的に応じて参照によって本明細書に援用するRizo & Gierasch,1992,Ann.Rev.Biochem.61:387)により、たとえば、ペプチドを環化する分子内ジスルフィド架橋を形成できる内部システイン残基を付加して、コンセンサス配列または実質的に同一のコンセンサス配列改変を含む、束縛されたペプチドを生成してもよい。
【0038】
「半減期延長剤」という語は、治療用タンパク質の分解を防止する、および/または半減期を延長させる、毒性を低下させる、免疫原性を低下させる、あるいは生物活性を増加させる分子をいう。例示的ビヒクルとして、Fcドメイン(好ましい)および線状ポリマー(たとえば、ポリエチレングリコール(PEG)、ポリリシン、デキストランなど);分枝鎖ポリマー(たとえば、1981年9月15日に発行したDenkenwalterらに付与された米国特許第4,289,872号;1993年7月20日に発行したTamに付与された米国特許第5,229,490号;1993年10月28日に公開されたFrechetらによる国際公開第93/21259号を参照);脂質;コレステロール群(ステロイドなど);炭水化物またはオリゴ糖(デキストランなど);サルベージ受容体に結合する任意の天然または合成タンパク質、ポリペプチドまたはペプチド;ヒト血清アルブミン(HSA)などのアルブミン、ロイシンジッパードメインならびに他のそうしたタンパク質およびタンパク質フラグメントが挙げられる。
【0039】
「未変性Fc」という語は、単量体または多量体を問わず、全抗体の消化から得られる非抗原結合フラグメントの配列を含む分子または配列をいう。未変性Fcの最初の免疫グロブリン源は、好ましくはヒト由来であり、IgG1およびIgG2が好ましいが、免疫グロブリンのいずれであってもよい。未変性Fcは、共有結合(すなわち、ジスルフィド結合)および非共有結合により二量体または多量体に結合できる、単量体ポリペプチドからなる。未変性Fc分子の単量体サブユニット間の分子間ジスルフィド結合の数は、クラス(IgG、IgA、IgEなど)またはサブクラス(IgG1、IgG2、IgG3、IgA1、IgGA2など)に応じて1〜4である。未変性Fcの一例として、IgGのパパイン消化から得られるジスルフィド結合二量体がある(Ellison et al.(1982),Nucleic Acids Res.10:4071−9を参照)。本明細書で使用する場合、「未変性Fc」という語は、単量体、二量体および多量体の総称である。
【0040】
「選択的結合剤」という語は、目的のタンパク質に優先的に結合する分子をいう。選択的結合剤は、タンパク質、ペプチド、核酸、炭水化物、脂質または低分子量化合物を含んでもよい。本発明の主題の選択的結合剤であるタンパク質の例として、可溶性受容体(すなわち、天然に存在する膜結合タンパク質の細胞外ドメインの全部または一部を持つが、膜貫通ドメインまたは細胞内ドメインを持たないタンパク質);抗体およびそのフラグメント;抗体および可溶性受容体の改変体、誘導体および融合タンパク質;ペプチド模倣物化合物;および有機模倣体化合物が挙げられる。好ましい実施形態では、選択的結合剤は、以下に限定されるものではないが、酵素的切断、ペプチド合成または組換え技術などの既知の技術により得られるポリクローナル抗体、モノクローナル抗体(mAb)、キメラ抗体、CDR移植抗体、可溶形または結合形で標識できる抗体に対する抗イディオタイプ(抗Id)抗体およびこれらのフラグメント、領域または誘導体などの抗体である。
【0041】
「抗原」という語は、抗体などの選択的結合剤が結合することができ、しかもその抗原のエピトープに結合できる抗体を産生する動物において使用可能な分子または分子の一部をいう。抗原が持つエピトープは1つでも複数でもよい。
【0042】
「エピトープ」という語は、任意の決定基、好ましくは免疫グロブリンまたはT細胞受容体に特異的に結合できるポリペプチド決定基を含む。ある実施形態では、エピトープ決定基は、アミノ酸、糖側鎖、ホスホリルまたはスルホニルなどの分子の化学的に活性な表面基を含み、ある実施形態では、特異的な三次元構造特性および/または特異的な電荷特性を持ってもよい。エピトープは、抗体が結合する抗原領域である。ある実施形態では、抗体は、タンパク質および/または高分子の複雑な混合物において標的抗原を優先的に認識するとき、抗原に特異的に結合するとされる。好ましい実施形態では、抗体は、解離定数が約10nM以下、一層好ましくは解離定数が約100pM以下、最も好ましくは解離定数が約10pM以下のとき、抗原に特異的に結合するとされる。「抗体」または「抗体ペプチド(単数または複数)」とは、インタクトな抗体または特異的結合に際してインタクトな抗体と競合するその結合フラグメントをいい、キメラ抗体、ヒト化抗体、完全ヒト抗体および二重特異性抗体を含む。ある実施形態では、結合フラグメントを組換えDNA技術により作製する。さらなる実施形態では、インタクトな抗体の酵素的切断または化学的切断により結合フラグメントを作製する。結合フラグメントには、Fab、Fab’、F(ab’)2、Fv、免疫学的に機能的な免疫グロブリンフラグメント、重鎖抗体、軽鎖抗体および一本鎖抗体があるが、これに限定されるものではない。
【0043】
「重鎖」という語は、全長重鎖および結合特異性を与えるのに十分な可変領域配列を持つそのフラグメントを含む。全長重鎖は、可変領域ドメインのVHならびに3つの定常領域ドメインCH1、CH2およびCH3を含む。VHドメインは、ポリペプチドのアミノ末端にあり、CH3ドメインはカルボキシル末端にある。
【0044】
「軽鎖」という語は、全長軽鎖、および結合特異性を与えるのに十分な可変領域配列を持つそのフラグメントを含む。全長軽鎖は、可変領域ドメインのVLおよび定常領域ドメインのCLを含む。軽鎖の可変領域ドメインは重鎖と同様にポリペプチドのアミノ末端にある。
【0045】
「Fabフラグメント」は、1本の軽鎖と1本の重鎖のCH1および可変領域を含む。Fab分子の重鎖は、別の重鎖分子とジスルフィド結合を形成できない。
【0046】
「Fab’フラグメント」は、1本の軽鎖と、CH1ドメインとCH2ドメインの間までの一層多くの定常領域を含む1本の重鎖とを含み、2本の重鎖の間に鎖間ジスルフィド結合が形成されてF(ab’)2分子になることができる。
【0047】
「F(ab’)2フラグメント」は、2本の軽鎖と、CH1ドメインとCH2ドメインの間の定常領域の部分を含む2本の重鎖とを含み、2本の重鎖の間に鎖間ジスルフィド結合が形成されている。
【0048】
「Fv領域」は、重鎖および軽鎖両方の可変領域を含むが、定常領域を欠いている。
【0049】
「一本鎖抗体」は、重鎖および軽鎖可変領域がフレキシブルリンカーにより連結されて単一のポリペプチド鎖を形成し、これが抗原結合領域になっているFv分子である。一本鎖抗体については、任意の目的に応じてその開示内容を参照によって援用する国際特許出願公開第88/01649号および米国特許第4,946,778号および同第5,260,203号に詳細に考察されている。
【0050】
ある実施形態では、「多重特異性(multispecific)」または「多機能性」抗体以外の「二価抗体」は、抗原特異性が同一の結合部位を含むと理解される。
【0051】
「二重特異性」または「二機能性」抗体は、2つの異なる重鎖/軽鎖対および2つの異なる結合部位を持つハイブリッド抗体である。二重特異性抗体については、以下に限定されるものではないが、ハイブリドーマの融合またはFab’フラグメントの連結など種々の方法により作製することができる。たとえば、Songsivilai & Lachmann(1990),Clin.Exp.Immunol.79:315−321;Kostelny et al.(1992),J.Immunol.148:1547−1553を参照されたい。
【0052】
「有効量」とは、使用目的を達成するのに十分な治療薬物の量である。たとえば、母体の寛容を促進する組成物の有効量は、胎児、胚または受精卵の免疫拒絶を予防するのに十分な量である。同様に、組成物の有効量は、受精卵または胚の子宮内膜への着床または付着を促す。障害、疾患または医学的状態を処置または軽減する有効量は、障害、疾患または医学的状態の症状を緩和または完全に除去するのに十分な量である。所定の治療薬物の有効量は、薬物の性質、投与経路、治療薬物を投与される動物の大きさおよび種ならびに投与目的などの要因によって異なる。個々の例の有効量については、当該技術分野において確立された方法に従い当業者が経験的に判定してもよい。
【0053】
細胞を物質に「曝露する」とは、直接的または間接的に物質を細胞に与えることをいう。物質に関しては、たとえば、その物質へと変化することが知られているその物質の前駆体を与えることで、間接的に与えてもよい。たとえば、IL−27への標的細胞の曝露は、IL−27タンパク質を含む組成物を標的細胞に与えることにより、あるいは、IL−27をコードする遺伝子(単数または複数)を標的細胞に導入することにより実施してもよい。あるいは、このことを、IL−27をコードする遺伝子(単数または複数)を第2の細胞に導入し、標的細胞をその第2の細胞と混合することにより実施しても構わない。
【0054】
「発現」は、たとえば、mRNAのような核酸またはポリペプチドの生合成と、たとえば、核からサイトゾルへの移動、形質膜への挿入、脱顆粒または分泌などによる高分子の区分化における変化とを包含する。細胞による高分子の発現または産生には、細胞に認められる量、たとえば、ある特定の時点での細胞ホモジネート中に認められる量しか含めなくてもよい。通常、この規定は、非分泌性分子の発現に適用される。あるいは、細胞による高分子の発現または産生は、細胞に認められる量に加えて、たとえば、細胞培地または生体のコンパートメントにおいて分泌および蓄積した量を含める。通常、この規定は、分泌または脱顆粒されたタンパク質、たとえば、サイトカインに適用される。「レベル」とは、たとえば、所定容積の血漿、血清、血液、間質液、脳脊髄液または尿における濃度、臓器全体または臓器のフラグメントにおける濃度、たとえば、赤脾髄、白脾髄または膵島のような臓器内のコンパートメントにおける濃度、あるいは、たとえば、マクロファージのような特定の細胞または細胞群における濃度など、生体コンパートメントのようなコンパートメントにおける濃度をいう。
【0055】
「ハイパーカイン」とは、サイトカインの少なくとも2つのサイトカインポリペプチドサブユニットが相互に共有結合している、操作されたヘテロ二量体、ホモ二量体または多量体のサイトカインである(Pflanz,et al.(2002)Immunity
16:779−790)。IL−27の場合は、p28とEBI3が共有結合(covelent association)したハイパーカインである。
【0056】
「免疫細胞」とは、B細胞、T細胞、NK細胞、単球、マクロファージ、マスト細胞、好酸球または抗原提示細胞(APC)もしくは樹状細胞などの免疫系の細胞である。免疫細胞は、文脈に応じて、免疫のメディエーターを発現する任意の細胞でも、サイトカインを発現する上皮細胞でもよい。
【0057】
障害、疾患または医学的状態「の疑いがある」ヒトまたは動物の被検体とは、まだ障害、疾患または医学的状態があると診断されていないものの、障害の1つまたは複数の症状を示すか、障害の遺伝的素因があるか、再発を起こしやすい障害の処置を以前に受けたことがある被検体である。
【0058】
「核酸」は、一本鎖核酸と、一本鎖核酸鎖およびその相補鎖の複合体からなる二本鎖核酸とを包含する。本発明は、たとえば、IL−27ヘテロ二量体サイトカインの各サブユニットをコードする少なくとも1つの核酸を含む少なくとも1つの発現ベクター内に存在する少なくとも1つの核酸の使用方法を包含する。
【0059】
本発明は、たとえば、上記の核酸が1つのベクターによってコードされる場合;1つの核酸が第1のベクターによってコードされ、残りの核酸が第2のベクターによってコードされる場合;および各核酸がそれぞれ別々のベクターによってコードされる場合の方法ならびにこれらの様々な組み合わせを意図している。さらに、上記のサイトカインを提供する方法であって、1種または複数種のサイトカインをベクターで提供する方法、および、たとえば、ベクターおよびポリペプチドを含む組成物による処置など、1種または複数種のサイトカインをサイトカインポリペプチドにより提供する方法も意図している。意図した方法のベクターは、たとえば、第1の核酸と作動可能に連結された第1のプロモーター;第2の核酸と作動可能に連結された第2のプロモーター;第3の核酸と作動可能に連結された第3のプロモーターなど、ならびに第1および第2の核酸と作動可能に連結された第1のプロモーター、第1、第2および第3の核酸と作動可能に連結された第1のプロモーターなどを含む。
【0060】
「処置または軽減」とは、障害、疾患または医学的状態の症状の緩和または完全な除去を意味する。
【0061】
本明細書で使用する場合、「生物学的サンプル」という語は、被検体、好ましくはヒト被験者から単離された、あるいは、被検体、好ましくはヒト被験者内に存在する生物材料のサンプルをいう。「生物材料」は、たとえば、組織、組織サンプル、腫瘍、腫瘍サンプル、細胞、生物学的液体および精製されたおよび/または部分的に精製された生体分子を含んでもよい。本明細書で使用する「単離された」という語は、生物学的サンプルの文脈で用いる場合、生物学的サンプルが被検体から除去されていることを示すものである。)。母体の血清または血液中のIL−27またはIL−27Rのレベルを測定する。別のさらなる実施形態では、IL−27またはIL−27Rのレベルを胎盤、羊水または絨毛膜絨毛サンプル中で測定してもよい。
【0062】
本明細書で使用する場合、「免疫性流産」という語は、たとえば、流産(miscarriage)のような自然妊娠中絶を含む。本明細書に定義する免疫性流産は、受精胚が被検体の子宮壁に正しく着床できないこと、あるいは、胚がいったん着床して被検体の子宮から脱落することまたは被検体による胚が再吸収されることを含む。免疫性流産は、たとえば、胚性もしくは胎児性抗原または胚もしくは胎児に発現する、あるいは、胚もしくは胎児から放出される父系抗原などの抗原に対する被検体の免疫反応に起因する。
【0063】
本明細書で使用する場合、「着床」という語は、自然受精プロセス後の、あるいは、生殖補助技術を用いた、子宮内膜への受精卵の付着を含む。本明細書で使用する場合、「生殖補助技術」とは、たとえば、排卵誘発、体外受精、胚芽移植など、生殖を技術的に補助する任意の方法をいう。ヒトの自然生殖プロセスにおいて、着床が起こるのは、通常、排卵から5〜7日後である。
【0064】
本明細書で使用する場合、「胚」という語は、接合体が受精する時期から、その接合体から発生する生体が自由生活をするようになる時点までの多細胞生体の発生における段階を含む。
【0065】
「寛容」は、たとえば、癌もしくは腫瘍または移植アロ抗原などのアロ抗原、外来抗原分子、外来分子複合体、または外来有機体もしくはウイルス由来の抗原に対して無反応である免疫寛容を包含する。寛容はまた、妊娠中の胎児性抗原に対する免疫無反応または免疫無反応の拡大も包含する。さらに、「寛容」は、自然寛容(naturally occurring tolerance)および人為的または薬理学的に誘導した寛容も包含する。さらに、寛容は、分子類似性により認識される自己抗原に対する免疫無反応にも関する(たとえば、Liu(1997)J.Exp.Med.186:625−629;Waldman and Cobbold(1998)Annul Rev.Immunol.16:619−644;Xiao and Link(1997)Clin.Immunol.Immunopathol.85:119−128;Steinman,et al.(2003)Annu.Rev.Immunol.21:685−711;Olson,et al.(2002)J.Immunol.169:2719−2726;Toussirot(2002)Curr.Drugs Targets Inflamm.Allergy 1:45−52;Takahashi and Sakaguchi(2003)Int Rev CytoL 225:1−32;Burt,et al.(2002)Int.J.Hematol.76(Suppl l):226−47;Gery and Egwuagu(2002)Int.Rev.Immunol.21(2−3):89−100;Weiner(2001)Microbes Infect.3:947−54を参照)。本発明における「母体の寛容」とは、胎児または胚に発現するか、胎児または胚により放出される胎児性抗原または父系抗原に対する寛容をいう。
【0066】
II.一般的事項
本発明は、胎児に対する母体の寛容を調節する方法を提供する。さらに、子宮内膜への胚の着床を調節する方法も提供する。
【0067】
妊娠9〜40週の範囲の7個の正常なヒト胎盤を用いてEBI3遺伝子およびp28遺伝子の発現を調査した。無刺激あるいはLPSで18時間刺激した精製単球を陽性対照として用いた。LPS刺激単球およびすべての胎盤の例では、EBI13およびp28のシグナルが検出され、様々な在胎齢でIL−27の2つのサブユニットが胎盤に発現することが示された。同様に、IL−27受容体の2つの成分IL−27Rおよびgp130の遺伝子発現もすべての胎盤で検出された(図1)。したがって、IL−27およびIL−27R複合体をコードする遺伝子は、様々な妊娠期で胎盤に発現する。
【0068】
次に、ヒト胎盤におけるタンパク質レベルのIL−27ヘテロ二量体を調べた。このため、0.5%NP40抽出物を様々な妊娠期で胎盤から調製し、免疫共沈降実験に供した(図2A)。ウサギ抗p28Abまたは対照ウサギIgGでp28を免疫沈降し、結合したEBI3の量をEBI3のウエスタンブロットにより評価した。陽性対照として、ライセートをウサギ抗EBI3Abで免疫沈降に供した。予想通り、EBI3のイムノブロットにより、免疫沈降前の胎盤ライセート中(図2A、上パネル、レーン2および5)および抗EBI3の免疫沈降物中(図2A、上パネル、レーン1)で33kDaのタンパク質が同定された。より重要なのは、抗p28の免疫沈降物中でもEBI3が検出された(図2A、上パネル、レーン4および7)が、対照の免疫沈降物(レーン3および6)中ではほとんど検出できなかったことであり、これによりEBI3がp28に特異的に結合することが示唆された。p28については、抗p28Abで免疫沈降しない限り、胎盤のライセートを用いたウエスタンブロットにより検出できなかった、(図2、下パネル)。また、p28のバンドは、抗EBI3の免疫沈降物を用いたウエスタンブロットでも観察されなかった(図2A、下パネル、レーン1)。その理由は、EBI3/p28ヘテロ二量体に対して遊離EBI3が過剰であること(以下を参照)およびp28のブロットが低感度であることにある可能性が非常に高い。
【0069】
胎盤細胞がIL−27を産生することを確かめるため、様々な培養時間に回収した満期胎盤外植片の培養上清に存在するIL−27の量をELISAにより測定した。図2Bに示すように、IL−27は約1〜4ng/mlの範囲の濃度で検出され、胎盤細胞がIL−27を産生することが確認された。これらの上清については、ELISAにより以前にEBI3を検査し、10〜33ng/mlのEBI3を含んでいた(たとえば、Devergne,et al.(2001)Am J Pathol 159:1763−1776を参照)。したがって、遊離EBI3はすべての例でIL−27ヘテロ二量体よりも過多に(平均で約10倍過剰)存在した。類似の知見が、本実験で観察された範囲の量でEBI3およびIL−27を含む、活性化ヒト単球由来の樹状細胞の培養上清でも観察された(たとえば、Nagai et al.(2003)J Immunol 17:5233−5243を参照)。こうしたEBI3の過剰な産生は、ヒト胎盤におけるIL−27発現に関する以前の研究と整合している(たとえば、Pflanz,et al.(2002)を参照 上掲)。
【0070】
妊婦の血清中に増加したレベルのEBI3が存在することは既に明らかにされている。EBI3の血清レベルは妊娠から2ヶ月後に既に上方制御され、在胎齢と共に徐々に上昇し、妊娠末期には最大400ng/mlの濃度に達する(たとえば、Devergne,et al.(2001)を参照 上掲)。しかしながら、妊婦7名の血清についてELISAによりIL−27を検査したところ、期間を問わず、顕著なレベルのIL−27は検出されなかった。このようにそれらの血清中でIL−27が検出されないのは、インビボでのIL−27の半減期が短いことが原因であり得る。実際、サブユニットが共有結合するIL−12およびIL−23など他のヘテロ二量体サイトカインと異なり、EBI3とp28の結合は、共有結合でない点に留意すべきである。結果として、このヘテロ二量体はインビボで解離しやすく、それにより血清中での検出を低めている可能性がある。
【0071】
胎盤の自由絨毛は、内層の栄養膜細胞層および外層の合胞体栄養細胞層からなる。本発明者らは以前に、免疫組織化学的検査により自由絨毛におけるEBI3の発現が合胞体栄養細胞層に限定されることを示した。これらの細胞は妊娠期間を通じてEBI3陽性であるのに対し、絨毛性栄養膜細胞層、Hofbauer細胞(胎盤のマクロファージ)および胎児内皮細胞はEBI3陰性であった(Devergne et al.(2001)Am J Pathol 159:1763−1776)。合胞体栄養細胞層にIL−27の第2のサブユニットが発現するかどうかを検討するため、第1、第2および第3三半期の胎盤19個を対象としてウサギポリクローナルまたはラットモノクローナル抗p28Abを用いて免疫組織化学的検査によりp28の発現を解析した。これらの胎盤については、免疫組織化学的検査によりEBI3を以前検査してあったか(たとえば、Devergne et al.(2001)を参照 上掲)、あるいはそうでない場合、EBI3およびp28を平行して検査した。図3a〜図3cに示すように、合胞体栄養細胞層では著しいp28染色性が見られた一方、栄養膜細胞層ではp28シグナルが観察されなかったか、非常に低かった。合胞体栄養細胞層のp28染色性は、通常、第1三半期の胎盤で最も強かったが、第2および第3三半期の胎盤でも観察された。
【0072】
妊娠以外に、ある種の胚細胞腫瘍において栄養膜性細胞(trophoblastic
cell)が観察されることがある。したがって、栄養膜細胞(trophoblast cell)がIL−27の2つのサブユニットを共発現する能力をさらに解析するため、絨毛癌など7例の精巣胚細胞腫瘍について、免疫組織化学的検査によりEBI3およびp28の発現を解析した。これらの腫瘍では、胎盤の栄養膜細胞と同様に、合胞体栄養細胞層細胞にはEBI3およびp28が共発現するが、栄養膜細胞層細胞には共発現しなかった(図3e〜図3g)。
【0073】
胎盤の付着絨毛の栄養膜細胞層は子宮に浸潤し、絨毛外栄養膜(extravillous trophoblast)に分化する。これらの浸潤性の絨毛外栄養膜は、間質性栄養膜(interstitial trophoblast)、多核巨細胞および血管内栄養膜(endovascular trophoblast)と呼ばれる、母体の子宮螺旋動脈に浸潤し、これを形質転換させる栄養膜の不均一な集団からなる。EBI3は、間質性栄養膜、多核巨細胞および螺旋動脈壁に浸潤する栄養膜に発現するが、これらの細胞が血管内栄養膜に分化したならば、下方制御されることは既に明らかにされた。EBI3陽性絨毛外栄養膜は、妊娠期間を通じて観察され、脱落膜におけるEBI3の主な供給源をなしていた。その理由は、脱落膜細胞および浸潤性リンパ球など、この部位に存在する他の細胞型はEBI3陰性であるためであった(たとえば、Devergne et
al.(2001)を参照 上掲)。上述の19個の胎盤におけるp28発現の免疫組織化学的研究から、期間に関係なく絨毛外栄養膜(間質性栄養膜および多核巨細胞)にp28が発現することが示された(図4)。したがって、絨毛外栄養膜には合胞体栄養細胞層のようにIL−27の2つのサブユニットが共発現し得る。
【0074】
この研究は、胎児と母体の界面でのEBI3の発現に関するこれまでの観察結果を発展させるものである。本研究から、この部位の合胞体栄養細胞層および絨毛外栄養膜にEBI3ばかりでなくIL−27も発現することが明らかになる。従来のin situ解析では、樹状細胞またはリンパ腫の腫瘍性細胞など、EBI3を強力に発現する細胞においてp28の発現が検出されなかった。そのため、栄養膜細胞(trophoblast cell)を用いたIL−27の2つのサブユニットのin situ検出に関しては、あまり期待されていなかった(Larousserie,et al.(2004)上掲;Larousserie et al.(2005)上掲;and Larousserie et al.(2006)上掲.)。また、胎児と母体の界面でのIL−27の発現も、この新しいサイトカインの最初に記載された機能に照らして、予測されていなかった。実際に最初の研究では、ナイーブCD4+T細胞への反応性(responsiveness)をIL−12に与える能力、およびナイーブCD4+T細胞および単球においてそれぞれIFN−γおよびプロ炎症性サイトカインの発現を増加させる能力などを理由に、IL−27をpro−Th1およびプロ炎症性サイトカインとして同定した(たとえば、Pflanz et al.(2002)上掲;and Pflanz et al.(2004)を参照 上掲)。
【0075】
これらの知見は、妊娠が成立するのはTh2優位の状況である一方、Th1サイトカインは妊娠に有害(deletorious)であるとした、過去10年を通じて普及していた考え方と対照的である(Wegmann et al.(1993)Immunol
Today 14:353−356)。しかしながら、この仮説は後に、IFN−γ、IL−12およびIL−18などの古典的なTh1サイトカインが正常な子宮に発現することが明らかになり、適量で発現する場合、妊娠において正の制御に関与していることが示唆されたため、疑問視された(Chaouat et al.(2004)Immunol Lett 92:207−214)。LIFおよびIL−11などのプロ炎症性サイトカインは、着床プロセスにおいて、特に栄養膜および脱落膜細胞に接着分子を誘導することで、決定的に重要な役割を果たしていることが明らかになった(Chaouat,et al.(2004)上掲)。これらの知見により、Th1/Th2パラダイムおよび妊娠におけるTh1およびプロ炎症性サイトカインの積極的な役割に関する見解が再考された。さらに、最近の研究からは、IL−27の生物活性がそのpro−Th1活性をはるかに超えて拡張したことが示され、マウスの研究に基づき、過剰なT細胞活性および炎症反応の抑制におけるIL−27の役割が提案された(Trinchieri,et al.(2003)上掲)。近年、主要なプロ炎症性Th細胞サブセットであるTh17細胞の発生をIL−27が阻害することが証明され、IL−27の抗炎症の役割が一部解明された(Batten et al.(2006)Nat Immunol 7:929−936;and Stumhofer et al.(2006)Nat Immunol 7:937−945)。
【0076】
以上をまとめると、これらの観察結果から、IL−27が、本前後関係およびサイトカイン環境に応じて、Th反応および炎症反応の制御において明らかに正反対の役割を果たすモデルが導かれた。多くのマウスモデルでは、IL−27の免疫抑制機能がそのpro−Th1活性に比べて優位であることが示唆された(たとえば、Batten et al.(2006)上掲;Stumhofer et al.(2006)上掲;Villarino et al.(2003)Immunity 19:645−655;Hamano et al.(2003)Immunity 19:657−667;and
Wirtz et al.(2006)J Exp Med 203:1875−1881を参照)。
【0077】
RT−PCR解析により、IL−27受容体鎖をコードする遺伝子が様々な在胎齢で胎盤に発現することが明らかになった。免疫組織化学的検査に好適なIL−27R抗体がないため、IL−27受容体をin situ発現している細胞の正確な性質は、確認できなかった。しかしながら、従来の研究から、この受容体が多くの細胞型に発現し、NK細胞、NKT細胞、CD8+T細胞およびCD4+CD25+制御性T細胞など(Villarino(2005)J Immunol 174:7684−7691)の多くは、胎児と母体の界面に存在することが明らかになっている(Boyson et al.(2002)Proc Natl Acad Sci USA 99:13741−13746;Shao et al.(2005)J Immunol 174:7539−7547;Sasaki et al.(2004)Mol Hum Reprod 10:347−353;Somerset et al.(2004)Immunology
112:38−43;Tilburgs et al.(2006)Placenta
27 Suppl A:S47−53;and Zenclussen(2006)Springer Semin Immun 28:31−39)。これらの中で、脱落膜NK細胞は、白血球集団の50%超を占める場合、妊娠の第1および第2三半期に脱落膜に特に浸潤する、最も多く含まれるリンパ球集団である。脱落膜NK細胞および浸潤性の栄養膜は、1つにサイトカイン産生を通して直接相互合作用し、その機能を相互に制御する(Moffett−King(2002)Nat Rev Immunol 2:656−663;Parham(2004)J Exp Med 200:951−955;Tabiasco et al.(2006)Placenta 27 Suppl A:S34−9;and Le Bouteiller and Tabiasco(2006)Nat Med 12:991−992)。これらの2つの細胞型の間で制御される相互作用は、血管を拡張し発育中の胎児胎盤ユニットに十分な血液供給を行うのに必要な重要な事象である、母体の子宮動脈の血管の形質転換に決定的に重要な役割を担うことが特に明らかになっている。子宮KN細胞は、VEGFなどの血管新生促進因子の産生により血管新生促進活性を示す(Hanna,et al.(2006)Nat Med 12:1065−1074)。興味深いことに、この細胞はさらに、高用量では流産の作用があるにもかかわらず、正常なマウスの妊娠の過程で脱落膜および子宮血管の修飾が適切に進展するのに必要なIFN−γも産生する(Ashkar et al.(2000)J Exp Med 192:259−269)。IL−27は、末梢NK細胞によるIFN−γ産生に関与し(Pflanz,et al.(2002)上掲)、脱落膜KN細胞によるIFN−γ、さらには他の可溶性因子の産生を制御し得ることが明らかにされている。同様に、IL−27は、以前のマウス研究から示唆されるように、脱落膜NKT細胞によるサイトカインの産生を調節し得る(Yamanaka et al.(2004)J Immunol 172:3590−3596)。
【0078】
IFN−γ以外にIL−12およびIL−18も、妊娠中の新脈管形成に関与していることが示唆されている。したがって、体外受精後に着床不全が繰り返される女性では、血管の変質に伴い子宮内膜で調節不全のIL−12およびIL−18発現プロファイル(欠損または過剰)が観察された(Ledee−Bataille et al.(2004)Fertil Steril 81:59−65)。IL−27は最近、内皮細胞に直接作用し、抗新脈管形成性(antiangiogenic)ケモカインIP−10およびMIGの産生を誘導することで新脈管形成を阻害することが明らかになっている(Shimizu,et al.(2006)上掲)。それ故、絨毛外栄養膜によるIL−27の産生により、過剰な新脈管形成促進活性を防ぐネガティブフィードバック機構が働く可能性がある。実際に絨毛外栄養膜は、Fas/FasL相互作用を介して(Ashton,et al.(2005)Arterioscler Thromb Vasc Biol 25:102−108)、または可溶性HLA−G1の分泌を介して(Fons,et al.(2006)上掲)内皮細胞のアポトーシスの誘導により抗新脈管形成性活性を示すことが既に知られている。
【0079】
IL−27は、新脈管形成における役割ばかりでなく、正常または病的状態においてT細胞応答の抑制または炎症反応の制御に局所的に関与し得る。ヒトおよびマウスでは、脱落膜においてIL−17の産生が認められているが(Ostojic et al.(2003)Am J Reprod Immunol 49:101−112)、ヒト脱落膜にTh17細胞が存在するかどうかについては、今後の検討が待たれる。
【0080】
最後に、IL−27の産生は胎盤で検出されたが、その産生量はEBI3に比べて非常に少ない点に留意すべきである。まだ明らかにされていないが、EBI3は、p28との結合とは別に、おそらくIL−27アンタゴニストとしての役割を果たし得ることが示唆されている。その場合、そうした過剰な遊離EBI3がIL−27の機能を制御し得る。
【0081】
III.IL−27アゴニスト
IL−27の活性のアゴニズムを実現できるのは、たとえば、IL−27ポリペプチドまたはそのミュータント、リガンドIL−27に対して形成されたアゴニスト抗体またはそのフラグメント、リガンドのサブユニットに対するアゴニスト抗体(たとえば、抗p28抗体または抗EBI3抗体)、受容体複合体とリガンドの相互作用を高めることができる、p28およびEBI3の両方に結合する抗体のようなIL−27アゴニストによってである。この抗体はまた、IL−27受容体複合体(WSX−1/TCCR、gp130)に対するアゴニスト抗体であってもよい。このアゴニスト抗体は、受容体に対するリガンドの結合を模倣して、受容体複合体のシグナル伝達を誘導する。
【0082】
あるいは、特定されたリガンド受容体対形成により媒介された相互作用またはシグナル伝達を模倣したり、増強したりできる化合物について小分子ライブラリーをスクリーニングしてもよい。
【0083】
本発明は、特定のサイトカインリガンド、好ましくは、たとえば、霊長類、ヒト、ネコ、イヌ、ラットまたはマウスのような哺乳動物のサイトカインリガンドに特異的に結合する、抗体または結合組成物の使用を提供する。抗体については、天然に存在する(全長)形または組換え形を問わず、個別の改変体、多型改変体、対立遺伝子改変体、系統改変体または種改変体およびこれらのフラグメントなど、種々のサイトカインタンパク質に対して形成してもよい。さらに、抗体に関しては、未変性(または活性)形または、不活性形(たとえば変性形)を問わず、受容体タンパク質に対して形成しても構わない。抗イディオタイプ抗体を用いてもよい。
【0084】
リガンドまたは受容体タンパク質と特異的に反応する抗体の作製には、多くの免疫原を選択することができる。組換えタンパク質は、モノクローナルまたはポリクローナル抗体の作製に好ましい免疫原である。また、たとえば、霊長類、齧歯類などの適切な供給源からの天然に存在するタンパク質を純粋な形あるいは不純な形で用いてもよい。さらに、適切なタンパク質配列を用いて作製した合成ペプチドを抗体作製の免疫原として用いてもよい。組換えタンパク質については、たとえば、Coligan,et al.(eds.)(1995 and periodic supplements)Current Protocols in Protein Science,John Wiley & Sons,New York,NY;and Ausubel,et al(eds.)(1987 and periodic supplements)Current
Protocols in Molecular Biology,Greene/Wiley,New York,NYに記載のように、真核細胞または原核細胞に発現させ精製してもよい。抗体の作製には、必要に応じて、自然に折りたたまれた材料を用いても変性材料を用いてもよい。たとえば、モノクローナルあるいはポリクローナル抗体を作製して、タンパク質を測定するイムノアッセイでその後使用してもよいし、免疫精製法を行ってもよい。
【0085】
ポリクローナル抗体の作製方法は、当業者によく知られている。代表的には、免疫原、好ましくは精製されたタンパク質をアジュバントと混合し、この混合物で動物を免疫する。免疫原調製物に対する動物の免疫反応については、試験採血を行い目的のタンパク質に対する反応力価を測定することでモニターする。たとえば、通常、免疫を繰り返した後に、免疫原に対して適度に高い抗体力価が得られたときは、動物から血液を採取し、抗血清を調製する。さらに必要に応じて、タンパク質に反応する抗体を富化するため抗血清の分画を行ってもよい。たとえば、HarlowおよびLane;またはColiganを参照されたい。また、たとえば、DNAベクターによる免疫化など他の方法により免疫を行っても構わない。たとえば、Wang,et al.(1997)Virology 228:278−284を参照されたい。
【0086】
モノクローナル抗体については、当該技術分野の研究者によく知られた様々な技術により得ることができる。代表的には、所望の抗原で免疫した動物の脾臓細胞を、通常、骨髄腫細胞と融合して不死化する。Kohler and Milstein(1976)Eur.J.Immunol.6:511−519を参照されたい。不死化の別の方法として、エプスタインバーウイルス、オンコジーンまたはレトロウイルスによる形質転換または当該技術分野において公知の他の方法が挙げられる。たとえば、Doyle,et al.(eds.)(1994 and periodic supplements)Cell and Tissue Culture:Laboratory Procedures,John Wiley and Sons,New York,NYを参照されたい。抗原に対する所望の特異性および親和性を持つ抗体の産生について、単一の不死化細胞から生じるコロニーをスクリーニングして、そうした細胞から産生されるモノクローナル抗体の収量を、脊椎動物宿主の腹膜腔に注射するなど様々な技術により高めてもよい。あるいは、たとえば、Huse,et al.(1989)Science 246:1275−1281に概説された一般的なプロトコルに従って、ヒトB細胞のDNAライブラリーをスクリーニングしてモノクローナル抗体またはその結合フラグメントをコードするDNA配列を単離しても構わない。
【0087】
リガンドまたは受容体タンパク質の所定のフラグメントに対する抗体または結合組成物(結合フラグメントおよび一本鎖バージョンなど)については、フラグメントとキャリアタンパク質のコンジュゲートで動物を免疫することにより形成できる。所望の抗体を分泌している細胞から、モノクローナル抗体を調製する。これらの抗体について、正常タンパク質または不完全なタンパク質に対する結合をスクリーニングすればよい。抗体または結合組成物は、通常はKDが少なくとも約10−3M、より通常には少なくとも10−6M、典型的には少なくとも10−7M、より典型的には少なくとも10−8M、好ましくは少なくとも約10−9M、一層好ましくは少なくとも10−10M、最も好ましくは少なくとも10−11Mで結合する(たとえば、Presta,et al.(2001)Thromb.Haemost.85:379−389;Yang,et al.(2001)Crit.Rev.Oncol.Hematol.38:17−23;Carnahan,et al.(2003)Clin.Cancer Res.(Suppl.)9:3982s−3990sを参照)。
【0088】
場合によっては、マウス、齧歯類、霊長類、ヒトなどの様々な哺乳動物宿主からモノクローナル抗体(mAb)を調製することが望ましい。そうしたモノクローナル抗体の調製技術に関する記載は、たとえば、Stites,et al.(eds.)Basic and Clinical Immunology(4th ed.)Lange Medical Publications,Los Altos,CAおよびその中に引用された参考文献;Harlow and Lane(1988)Antibodies:A Laboratory Manual,CSH Press;Goding(1986)Monoclonal Antibodies:Principles and Practice(2d ed.)Academic Press,New York,NY;および特に、モノクローナル抗体の作製の一方法を考察するKohler and Milstein(1975)Nature 256:495−497で確認することができる。簡単にまとめると、この方法では、動物に免疫原の注射を行うことを含む。次いでこの動物を屠殺し、その脾臓から細胞を採取し、次いでこの細胞を骨髄腫細胞と融合する。得られたものは、ハイブリッド細胞、すなわち、インビトロで再産生が可能な「ハイブリドーマ」である。その後ハイブリド−マの集団をスクリーニングし、それぞれが免疫原に対して単一の抗体種を分泌する個々のクローンを単離する。こうして、得られた各抗体種は、免疫原性物質上に認められる特異的な部位に反応して生成された免疫動物由来の不死化およびクローン化された単一B細胞の産物である。
【0089】
本発明のポリペプチドおよび抗体については、キメラまたはヒト化抗体を含め改変して用いても、改変せずに用いてもよい。ポリペプチドおよび抗体に関しては、多くの場合、検出可能なシグナルを発する物質に共有結合または非共有結合で連結して標識する。種々の標識およびコンジュゲーション技術が知られており、科学文献にも特許文献にも広く報告されている。好適な標識として、放射性核種、酵素、基質、補助因子、阻害剤、蛍光部分、化学発光部分、磁気粒子などが挙げられる。そうした標識の使用を教示する特許として、米国特許第3,817,837号;同第3,850,752号;同第3,939,350号;同第3,996,345号;同第4,277,437号;同第4,275,149号;および同第4,366,241号がある。また、組換え免疫グロブリンを作製してもよく、Cabilly,米国特許第4,816,567号または下記;およびQueen,et al(1989)Proc.Natl Acad.Sci USA 86:10029−10033を参照されたい。あるいは、組換え免疫グロブリンを、トランスジェニックマウスを用いて作製してもよく、Mendez,et al.(1997)Nature Genetics 15:146−156と、さらにAbgenixおよびMedarexの技術も参照されたい。
【0090】
モノクローナル抗体は通常、ヒト供給源からではなく非ヒト供給源から得られる(Harlow and Lane(1988)Antibodies A Laboratory Manual,Cold Spring Harbor Laboratory,Cold Spring Harbor,NY,pp.139−243)。非ヒト供給源を用いると、モノクローナル抗体の治療効率が制限される場合がある。マウスまたは他の非ヒト供給源から得られた抗体は、免疫反応を誘発する、エフェクター機能があまり増強されない、血流からの急速なクリアランスという好ましくない特性を持つことがある(Baca,et al.(1997)J.Biol.Chem.272:10678−10684)。これらの理由から、治療抗体を、ヒト化により調製することが望ましい場合がある。
【0091】
「ヒト化抗体」とは、たとえば、齧歯類のような非ヒト起源の抗原結合領域と、たとえば、ヒトフレームワーク領域、ヒト定常領域またはその一部のようなヒト起源の免疫グロブリンの少なくとも一部とを含む抗体を意味する(たとえば、米国特許第6,352,832号を参照)。
【0092】
ヒト化抗体は、親マウス抗体の6つの相補性決定領域(CDR)に由来するアミノ酸配列を含み、これがヒト抗体のフレームワークに移植される。ヒト化抗体における非ヒト配列の量は、低い方が好ましく、言い換えれば、約5%である(Baca,et al.(1997)J.Biol.Chem.272:10678−10684)。最適な結合を実現するには、通常、CDRの立体構造の支持に関与するある種のフレームワークアミノ酸を、親マウス抗体に見られる対応するアミノ酸に戻すことで、ヒト化抗体を微調節する必要があるかもしれない。普通親に戻すフレームワークアミノ酸は、CDRループの立体構造の支持に関与するフレームワークアミノ酸である(Chothia,et al.(1989)Nature 342:877−883;Foote and Winter(1992)J.Mol.Biol.224:487−499)。抗原結合に最も多く影響するフレームワーク残基は、比較的小さく、11残基のように小さい場合がある(Baca,et al.(1997)J.Biol.Chem.272:10678−10684)。
【0093】
ヒト化抗体は、IgM、IgG、IgD、IgAおよびIgEならびに任意のアイソタイプ(IgG1、IgG2、IgG3およびIgG4を含む)を含む、定常領域のすべてのタイプを持つ抗体を含む。ヒト化抗体が細胞傷害活性を示すことが望ましい場合、定常ドメインは、通常、補体結合定常ドメインであり、クラスは代表的にはIgG1である。そうした細胞傷害活性が望ましくない場合、定常ドメインは、IgG2クラスのそれであってもよい。ヒト化抗体は、複数のクラスまたはアイソタイプ由来の配列を含んでもよい(Vasquez,et al.に付与された米国特許第6,329,511号)。結合親和性が高い抗体のスクリーニングおよび選択には、ファージディスプレイ技術を用いてもよい(Hoogenboom and Chames(2000)Immunol.Today 21:371−377;Barbas,et al.(2001)Phage
Display:A Laboratory Manual,Cold Spring
Harbor Laboratory,Cold Spring Harbor,New York;Kay,et al.(1996)Phage Display of Peptides and Proteins:A Laboratory Manual,Academic Press,San Diego,CA)。
【0094】
また、ファージディスプレイ法またはトランスジェニックマウスに含まれるヒト抗体ライブラリーを用いて、抗体を調製または設計してもよい(たとえば、de Bruin,et al.(1999)Nature Biotechnology 17:397−399;Vaughan,et al.(1996)Nature Biotechnology 14:309−314;Barbas(1995)Nature Medicine 1:837−839;Mendez,et al.(1997)Nature Genetics 15:146−156;Huse,et al.(1989)Science 246:1275−1281;Ward,et al.(1989)Nature 341:544−546を参照)。
【0095】
抗体は、特異的な結合組成物の一形態に過ぎない。用途が似ていることが多い他の結合組成物として、たとえば、結合パートナー−結合パートナー様式で、抗体−抗原相互作用で、または生理的に関連する天然のタンパク質−タンパク質相互作用(たとえば、所望のタンパク質に特異的に結合する、共有結合あるいは非共有結合タンパク質)でリガンドまたは受容体に特異的に結合する分子が挙げられる。分子は、ポリマーでも化学試薬であってもよい。機能的アナログについては、構造的に改変したタンパク質であってもよいし、たとえば、適切な結合決定基と相互作用する分子形状を持つ構造的に無関係の分子であっても構わない。
【0096】
IV.IL−27ポリペプチドアゴニスト
本発明のIL−27アゴニストポリペプチドは、様々な細胞株に発現することができる。これらの実施形態では、IL−27ヘテロ二量体またはその単一のサブユニット(たとえばEBI−3またはp28)をコードする配列を用いて、好適な哺乳動物宿主細胞を形質転換してもよい。これらの実施形態によれば、たとえば、ポリヌクレオチドをウイルス(またはウイルスベクター)にパッケージングし、このウイルス(またはベクター)を宿主細胞へ形質導入するなど、ポリヌクレオチドを宿主細胞に導入する任意の既知の方法、あるいは、当該技術分野において公知のトランスフェクション手順により、形質転換を行うことができる。そうした手順については、米国特許第4,399,216号、同第4,912,040号、同第4,740,461号および同第4,959,455号(任意の目的に応じて、これらすべてを参照によって本明細書に援用する)に例示されている。通常、使用する形質転換の手順は、形質転換される宿主に依存し得る。異種ポリヌクレオチドを哺乳動物細胞に導入する方法は、当該技術分野において周知であり、以下に限定されるものではないが、デキストランを介したトランスフェクション、リン酸カルシウム沈殿、ポリブレンを介したトランスフェクション、プロトプラスト融合、エレクトロポレーション、ポリヌクレオチド(単数または複数)のリポソーム封入および核へのDNAの直接マイクロインジェクションが挙げられる。
【0097】
本発明の方法のある実施形態では、標準的なライゲーション技術を用いて、IL−27ヘテロ二量体またはその個々のサブユニットをコードする核酸分子を適切な発現ベクターに挿入する。ベクターは代表的には、使用する特定の宿主細胞において機能する(すなわち、ベクターが宿主細胞機構に適合して遺伝子の増幅および/または遺伝子の発現が起こり得る)ように選択する。発現ベクターの概説については、Goeddel(ed.),1990,Meth.Enzymol.Vol.185,Academic Press.N.Yを参照されたい。
【0098】
代表的には、宿主細胞のいずれかに用いる発現ベクターは、プラスミドの維持と、外因性ヌクレオチド配列のクローンニングおよび発現のための配列を含む。そうした配列は、「フランキング配列」と総称され、ある実施形態では、代表的には、プロモーター、1つまたは複数のエンハンサー配列、複製開始点、転写終結配列、ドナーおよびアクセプタースプライス部位を含む完全なイントロン配列、ポリペプチド分泌のためのリーダー配列をコードする配列、リボソーム結合部位、ポリアデニル化配列、発現するポリペプチドをコードする核酸を挿入するためのポリリンカー領域、および選択可能なマーカー要素など、ヌクレオチド配列の1つまたは複数を含む。これらの配列はそれぞれ以下で考察する。
【0099】
必要に応じて、ベクターは、「タグ」コード配列、すなわち、ポリペプチドコード配列の5’または3’末端に位置するオリゴヌクレオチド分子を含んでもよく、このオリゴヌクレオチド配列は、ポリHis(ヘキサHisなど)、あるいは、市販されている抗体が存在するFLAG、HA(インフルエンザウイルスの赤血球凝集素(hemaglutinin))またはmycなどの他の「タグ」をコードする。このタグは代表的には、ポリペプチドの発現時にポリペプチドに融合され、宿主細胞からの抗体のアフィニティー精製または検出の手段としての機能を果たすことができる。アフィニティー精製については、たとえば、親和性マトリックスとしてのタグに対する抗体を用いてカラムクロマトグラフィーにより実施してもよい。その後必要に応じて、切断用のある種のペプチダーゼを用いるなど様々な手段により、精製されたポリペプチドからタグを除去してもよい。
【0100】
フランキング配列は、同種(すなわち、宿主細胞と同じ種および/または系統)でも、異種(すなわち、宿主細胞種または系統以外の種)でも、ハイブリッド(すなわち、複数の供給源のフランキング配列の組み合わせ)でも、合成でも、未変性でもよい。このため、フランキング配列の供給源は、どのような原核生物または真核生物でも、どのような脊椎動物または無脊椎動物でも、どのような植物でもよく、ただし、フランキング配列は、宿主細胞機構において機能的であり、宿主細胞機構により活性化され得る。
【0101】
本発明のベクターに有用なフランキング配列に関しては、当該技術分野において周知の複数の方法のいずれかで得ることができる。代表的には、マッピングおよび/または制限エンドヌクレアーゼ消化により、本明細書に有用なフランキング配列を前もって特定しておいて、適当な制限エンドヌクレアーゼを用いて適切な組織供給源からこれを単離することができる。場合によっては、フランキング配列の全ヌクレオチド配列が既知であることもある。この場合、核酸合成またはクローンニングのため本明細書に記載した方法を用いて、フランキング配列を合成してもよい。
【0102】
フランキング配列は、その全部または一部だけが既知の場合、ポリメラーゼ連鎖反応(PCR)により、および/または、同種もしくは他の種のオリゴヌクレオチドおよび/またはフランキング配列フラグメントなどの好適なプローブでゲノムライブラリーをスクリーニングすることにより得てもよい。フランキング配列が分からない場合は、たとえば、コード配列、さらには他の遺伝子(単数または複数)を含み得るより大きなDNA部分から、フランキング配列を含むDNAのフラグメントを単離すればよい。単離を行うには、制限エンドヌクレアーゼ消化により適切なDNAフラグメントを作製し、続いてアガロースゲル精製、Qiagen(登録商標)カラムクロマトグラフィー(Chatsworth,Calif.)または当業者に公知の他の方法を用いて単離してもよい。この目的を達成するのに好適な酵素に何を選択するかについては、当業者に容易に明らかになるであろう。
【0103】
複製開始点は、代表的には、市販されている原核生物発現ベクターの一部になっており、この開始点は宿主細胞においてベクターの増幅に役立つ。選択したベクターが複製開始点部位を含まない場合、既知の配列に基づき化学的に合成し、ベクターに連結してもよい。たとえば、プラスミドpBR322の複製開始点(New England Biolabs,Beverly,Mass.)は、大部分のグラム陰性菌に好適であり、種々のウイルス性の開始点(SV40、ポリオーマ、アデノウイルス、水疱性口内炎ウイルス(vesicular stomatitus virus)(VSV)またはHPVもしくはBPVなどのパピローマウイルス)は、哺乳動物細胞のクローニングベクターに有用である。通常、哺乳動物の発現ベクターは、複製開始点成分を必要としない(たとえば、SV40開始点は、ウイルス初期プロモーターも含む場合に限り使用されることが多い)。
【0104】
転写終結配列は代表的には、ポリペプチドコード領域末端の3’側に位置し、転写を終結させる働きをする。通常、原核生物細胞の転写終結配列は、G−Cリッチなフラグメントに続きポリ−T配列がある。この配列については、ライブラリーから簡単にクローニングが可能であり、ベクターの一部として市販されてもいるが、本明細書に記載の方法のような核酸合成を用いて簡単に合成することもできる。
【0105】
選択可能なマーカー遺伝子は、選択培地で増殖する宿主細胞の生存および増殖に必要なタンパク質をコードする。典型的な選択マーカー遺伝子は、(a)抗生物質または他のトキシン、たとえば、アンピシリン、テトラサイクリンまたはカナマイシンに対する耐性を原核生物宿主細胞に与えるタンパク質;(b)細胞の栄養要求性の欠損を補うタンパク質;または(c)複合培地または規定の培地から得られない重要な栄養素を供給するタンパク質をコードする。好ましい選択可能なマーカーは、カナマイシン耐性遺伝子、アンピシリン耐性遺伝子およびテトラサイクリン耐性遺伝子である。また、ネオマイシン耐性遺伝子については、原核生物宿主細胞でも真核生物宿主細胞でも選択用に用いてよい。
【0106】
他の選択可能な遺伝子を用いて、発現する遺伝子を増幅させてもよい。増幅とは、増殖または細胞の生存に重要なタンパク質を産生する上で必要性がより高い遺伝子が、組換え細胞の染色体内で継代的に通常タンデムに反復されるプロセスである。哺乳動物細胞に好適な選択可能なマーカーの例として、ジヒドロ葉酸還元酵素(DHFR)およびプロモーターを持たないチミジンキナーゼが挙げられる。哺乳動物細胞の形質転換体については、ベクターに存在する選択可能な遺伝子により形質転換体のみが独自に生存に適合する淘汰圧下に置く。淘汰圧を加えるには、培地中の選択剤濃度を連続的に高め、それにより選択可能な遺伝子と別の遺伝子をコードするDNAとの両方を増幅する条件下で形質転換細胞を培養する。その結果、増幅したDNAから多量のポリペプチドを合成することができる。
【0107】
リボソーム結合部位は通常、mRNAの翻訳開始に必要であり、シャイン―ダルガーノ配列(原核生物)またはコザック配列(真核生物)を特徴とする。この要素は通常、プロモーターの3’側および発現するポリペプチドのコード配列の5’側に位置する。
【0108】
真核生物宿主細胞の発現系においてグリコシル化が望まれるような場合においては、様々なプレまたはプロ配列を操作してグリコシル化または収量を改善し得る。たとえば、特定のシグナルペプチドのペプチダーゼ切断部位を変更してもよいし、グリコシル化にも作用する場合があるプロ配列を付加してもよい。最終のタンパク質産物は、完全には除去され得なかった、発現に伴う1つまたは複数の付加アミノ酸を(成熟タンパク質の最初のアミノ酸に対して)その1位に含んでもよい。たとえば、最終のタンパク質産物は、アミノ末端に結合したペプチダーゼ切断部位に認められる1つまたは2つのアミノ酸残基を含んでもよい。また、複数の酵素切断部位を用いると、成熟ポリペプチド内のそうした領域で酵素切断が行われる場合に、所望のポリペプチドの形がやや切り取られ得る。
【0109】
本発明の発現ベクターおよびクローニングベクターは代表的には、宿主生物により認識され、かつ抗体をコードする分子に作動可能に連結されたプロモーターを含む。プロモーターは、構造遺伝子の開始コドンの上流(すなわち、5’側)(通常約100〜1000bp以内)に位置し、構造遺伝子の転写を制御する非転写配列である。プロモーターは慣習的に、誘導プロモーターおよび構成的プロモーターという2つのクラスの1つに分類される。誘導プロモーターは、栄養素の有無または温度変化などの培養条件の何らかの変化に応じて、プロモーターの制御下でDNAの高レベルの転写を開始する。一方、構成的プロモーターは、連続的な遺伝子産物の産生を開始する。すなわち、遺伝子発現に対する制御をほとんど行わないか、まったく行わない。有望な種々の宿主細胞により認識される多くのプロモーターがよく知られている。好適なプロモーターは、制限酵素消化で供給源のDNAからプロモーターを除去し、所望のプロモーター配列をベクターに挿入することで、本発明の抗体を構成する重鎖または軽鎖をコードするDNAに作動可能に連結される。
【0110】
また、酵母宿主に用いるのに好適なプロモーターも当該技術分野において周知である。酵母エンハンサーは、酵母プロモーターと一緒に用いると都合がよい。哺乳動物宿主細胞に用いるのに好適なプロモーターは、よく知られており、ポリオーマウイルス、鶏痘ウイルス、アデノウイルス(アデノウイルス2など)、ウシパピローマウイルス、トリ肉腫ウイルス、サイトメガロウイルス、レトロウイルス、B型肝炎ウイルスおよび最も好ましくはシミアンウイルス40(SV40)などのウイルスのゲノムから得られるプロモーターがあるが、これに限定されるものではない。他の好適な哺乳動物プロモーターとして、たとえば、熱ショックプロモーターおよびアクチンプロモーターのような異種哺乳動物のプロモーターが挙げられる。
【0111】
関心の対象になり得るさらなるプロモーターとして、SV40初期プロモーター領域(Bernoist and Chambon,1981,Nature 290:304−10);CMVプロモーター;ラウス肉腫ウイルスの3’長末端反復配列に含まれるプロモーター(Yamamoto et al.,1980,Cell 22:787−97);ヘルペスチミジンキナーゼプロモーター(Wagner et al.,1981,Proc.Natl.Acad.Sci USA 78:1444−45);メタロチオニン遺伝子の制御配列(Brinster et al.,1982,Nature 296:39−42);βラクタマーゼプロモーターなどの原核生物発現ベクター(Villa−Kamaroff et al.,1978,Proc.Natl.Acad.Sci USA 75:3727−31);またはtacプロモーター(DeBoer et al.,1983,Proc.Natl.Acad.Sci USA 80:21−25)があるが、これに限定されるものではない。さらに、組織特異性を示しトランスジェニックアニマルに用いられてきた動物転写制御領域として、膵腺房細胞で活性なエラスターゼI遺伝子制御領域(Swift et al.,1984,Cell 38:639−46;Ornitz et al.,1986,Cold Spring Harbor Symp.Quant.Biol.50:399−409(1986);MacDonald,1987,Hepatology 7:425−515);膵β細胞で活性なインスリン遺伝子制御領域(Hanahan,1985,Nature 315:115−22);リンパ系細胞で活性な免疫グロブリン遺伝子制御領域(Grosschedl et al.,1984,Cell 38:647−58;Adames et al.,1985,Nature 318:533−38;Alexander et al.,1987,Mol.Cell.Biol.7:1436−44);精巣細胞、乳腺細胞、リンパ系細胞およびマスト細胞で活性なマウス乳腺癌ウイルス制御領域(Leder et al.,1986,Cell 45:485−95);肝臓で活性なアルブミン遺伝子制御領域(Pinkert et al.,1987,Genes and Devel.1:268−76);肝臓で活性なαフェトプロテイン遺伝子制御領域(Krumlauf et al.,1985,Mol.Cell.Biol.5:1639−48;Hammer et al.,1987,Science 235:53−58);肝臓で活性なα1アンチトリプシン遺伝子制御領域(Kelsey et al.,1987,Genes and Devel.1:161−71);骨髄系細胞で活性なβグロビン遺伝子制御領域(Mogram et al.,1985,Nature 315:338−40;Kollias et al.,1986,Cell 46:89−94);脳のオリゴデンドロサイト細胞で活性なミエリン塩基性タンパク質遺伝子制御領域(Readhead et al.,1987,Cell 48:703−12);骨格筋で活性なミオシン軽鎖−2遺伝子制御領域(Sani,1985,Nature 314:283−86);および視床下部で活性な性腺刺激ホルモン放出ホルモン遺伝子制御領域(Mason et al.,1986,Science 234:1372−78)が注目される。
【0112】
エンハンサー配列については、高等真核生物で、ベクターに挿入して本発明の抗体を構成する軽鎖または重鎖をコードするDNAの転写を増加させてもよい。エンハンサーは、DNAのシス作用エレメント(通常、長さ約10〜300bp)であり、プロモーターに作用し転写を増加させる。エンハンサーは、配向および位置とはあまり関係がなく、転写ユニットの5’および3’で確認されている。哺乳動物の遺伝子から入手できる複数のエンハンサー配列(グロビン、エラスターゼ、アルブミン、αフェトプロテインおよびインスリンなど)が知られている。しかしながら、ウイルス由来のエンハンサーを用いるのが典型的である。真核生物プロモーターの活性化を増強する例示的な要素として、当該技術分野において公知のSV40エンハンサー、サイトメガロウイルス初期プロモーターエンハンサー、ポリオーマエンハンサーおよびアデノウイルスエンハンサーが挙げられる。エンハンサーをベクターに接合するのは核酸分子の5’位でも3’位でもよいが、代表的にはプロモーターの5’部位に置く。
【0113】
本発明の発現ベクターについては、市販されているベクターのような出発ベクターから構築してもよい。そうしたベクターは、所望のフランキング配列をすべて含む場合もあるが、そうでない場合もある。本明細書に記載の1つまたは複数のフランキング配列がまだベクターに存在していない場合、フランキング配列を個別に得てベクターに連結してもよい。各フランキング配列を得る方法は、当業者によく知られている。
【0114】
ベクターを構築し、軽鎖もしくは重鎖または軽鎖および重鎖をコードする核酸分子をベクターの適切な部位に挿入した後、増幅および/またはポリペプチド発現のため完成したベクターを好適な宿主細胞に挿入してもよい。選択した宿主細胞に抗体の発現ベクターを形質転換するには、トランスフェクション、感染、リン酸カルシウム共沈殿、エレクトロポレーション、マイクロインジェクション、リポフェクション、DEAE−デキストランによるトランスフェクションまたは他の既知の技術など、よく知られた方法を行えばよい。選択する方法は、使用する宿主細胞のタイプによってある程度決まる。これらの方法および他の好適な方法は、当業者によく知られており、たとえば、上掲のSambrookらに記載されている。
【0115】
宿主細胞は、適切な条件下で培養されると、抗体を合成するが、抗体はその後培地から回収してもよいし(宿主細胞が抗体を培地に分泌する場合)、抗体を産生する宿主細胞から直接回収してもよい(抗体が分泌されない場合)。どの宿主細胞を選択するのが適切かは、所望の発現レベル、活性に望ましいまたは必要なポリペプチド改変(グリコシル化またはリン酸化など)および生物活性分子への折りたたまれやすさなど様々な要因によって異なる。
【0116】
発現用の宿主として入手可能な哺乳動物細胞株は、当該技術分野において周知であり、以下に限定されるものではないが、チャイニーズハムスターの卵巣(CHO)細胞、HeLa細胞、ベビーハムスター腎(BHK)細胞、サル腎細胞(COS)、ヒト肝細胞癌細胞(HepG2など)およびこれ以外の多くの細胞株などアメリカンタイプカルチャーコレクション(A.T.C.C)から入手可能な多くの不死化細胞株があるが、これに限定されるものではない。
【0117】
V.治療用組成物
本発明は、たとえば、再発性流産、胚着床の不良、子癇前症などの生殖障害を処置するIL−27のアゴニストの使用方法を提供する。
【0118】
本発明のアンタゴニストおよび/またはアゴニストに関しては、単独で投与しても、同一または付随する経路の他のアゴニストあるいは症状の処置に用いる他の化合物と組み合わせて投与してもよい。診断方法は、予後の予測;特定の治療コースに反応するあるいはしない患者のサブセットの判定;生殖関連障害またはこの障害のサブタイプの診断;または治療に対する反応の評価などの側面を含む。
【0119】
処置、治療または診断については、アゴニストまたはアンタゴニストの直接投与により行ってもよいし、アゴニストまたはアンタゴニストをコードする核酸の投与により行ってもよい。アゴニストは、抗体から得られた結合組成物、IL−27またはIL−27Rに特異的に結合する抗体または抗体フラグメント、IL−27ポリペプチドもしくは改変体、またはアゴニストをコードする核酸を発現するベクターを包含する(たとえば、Arenz and Schepers(2003)Naturwissenschaften
90:345−359;Sazani and Kole(2003)J.Clin.Invest.112:481−486;Pirollo,et al.(2003)Pharmacol.Therapeutics 99:55−77;Wang,et al.(2003)Antisense Nucl.Acid Drug Devel.13:169−189を参照)。
【0120】
ポリペプチドもしくはアゴニスト抗体、その結合組成物または小分子アゴニストなど、医薬組成物または無菌組成物を調製するには、その物質を、好ましくは不活性な薬学的に許容されるキャリアまたは賦形剤と混合する。そうした医薬組成物の調製に関しては、当該技術分野において公知であり、たとえば、Remington’s Pharmaceutical Sciences and U.S.Pharmacopeia:National Formulary,Mack Publishing Company,Easton,PA(1984)を参照されたい。
【0121】
抗体、結合組成物またはサイトカインについては、非経口的に、好ましくは静脈内に通常投与する。そうしたタンパク質またはペプチドは、免疫原性を持つ場合があるため、たとえば、Tomasi,et al,米国特許第4,732,863号により教示されているように通常のIV投与セットあるいは皮下デポーにより、ゆっくりと投与するのが好ましい。免疫学的反応を最小限にとどめる方法を用いても構わない。小分子物質は、経口投与で効果を発揮してもよい。
【0122】
また、膣内投与に好適な組成物として、当該技術分野において適切であることが公知のキャリアを含むペッサリー、タンポン、クリーム、ゲル、ペースト、気泡、薄膜または噴霧組成物が挙げられる。用いられるキャリアは、膣内投与に適合しているべきである。組み合わせは、注水液(douche)、気泡、薄膜、軟膏(ointment)、クリーム、バルム、ゲル、軟膏(salve)、ペースト、スラリー、経膣坐剤または潤滑ゼリー(sexual lubricant)など、たとえば、固形、半固形および液体剤形であってもよい。
【0123】
活性化合物については、インプラントおよびマイクロカプセル化送達系のような放出制御調合物など、化合物の体からの急速な消失を防止するキャリアを用いて調製する。エチレン酢酸ビニル、ポリ酸無水物、ポリグリコール酸、コラーゲン、ポリオルトエステルおよびポリ乳酸など、生分解性、生体適合性ポリマーを用いてもよい。そうした調合物の調製方法は、当業者には明らかである。また、これらの材料は、たとえば、Alza CorporationおよびNova Pharmaceuticals,Inc.から市販されている。さらに、リポソーム懸濁液(ウイルス抗原に対するモノクローナル抗体により感染細胞を標的にしたリポソームなど)を薬学的に許容されるキャリアとして用いてもよい。これらは、たとえば、米国特許第4,522,811号に記載されているように当業者に公知の方法により調製できる。
【0124】
生物製剤については、非経口的に投与する場合、薬学的に許容される非経口ビヒクルと共に注射可能な単位剤形(溶液、懸濁液、エマルジョン)として製剤化する。そうしたビヒクルは、本質的に無毒で治療効果がないのが一般的である。この治療剤に関しては、様々な添加剤および/または希釈剤を使用してあるいは使用せずに、水、生理食塩水または緩衝ビヒクルなどの水性ビヒクルに加えて投与してもよい。あるいは、本ペプチドを含ませるため、亜鉛懸濁液などの懸濁液を調製してもよい。そうした懸濁液は、皮下(SQ)または筋肉内(IM)注射に有用であり得る。生物製剤および添加剤の比率は、両剤が有効量で存在する限り、広範囲に異なってもよい。本抗体は、凝集体、他のタンパク質、エンドトキシンなどを実質的に含まず、約5〜30mg/ml、好ましくは10〜20mg/mlの濃度で精製された形で製剤化されるのが好ましい。好ましくは、エンドトキシンのレベルは、2.5EU/ml未満である。たとえば、Avis,et al.(eds.)(1993)Pharmaceutical Dosage Forms:Parenteral Medications,2d ed.,Dekker,NY;Lieberman,et al.(eds.)(1990)Pharmaceutical Dosage Forms:Tablets,2d ed.,Dekker,NY;Lieberman,et al.(eds.)(1990)Pharmaceutical Dosage Forms:Disperse Systems,Dekker,NY;Fodor,et al.(1991)Science 251:767−773,Coligan(ed.)Current Protocols in Immunology;Hood,et al.(1984)Immunology,Pearson,Upper Saddle River,NY;Paul(ed.)(1999)Fundamental Immunology,4th ed.,Lippincott Williams & Wilkins Publishers,Phila.,PA;Parce,et al.(1989)Science 246:243−247;Owicki,et al.(1990)Proc.Natl.Acad.Sci USA 87:4007−4011;and Blundell and Johnson(1976)Protein Crystallography,Academic Press,New Yorkを参照されたい。
【0125】
治療剤のためにどの投与レジメンを選択するかは、その物質の血清または組織代謝回転速度、症状のレベル、その物質の免疫原性および標的細胞の到達性、投与のタイミングなど複数の要因に左右される。好ましくは、投与レジメンは、許容可能な副作用のレベルと整合し、患者に送達される治療剤の量を最大にする。したがって、生物製剤の送達量は、個々の物質および処置される症候の重症度にある程度依存する。適切な抗体用量を選択する際のガイダンスは、たとえば、Bach,et al.,chapter 22,in
Ferrone,et al.(eds.)(1985)Handbook of Monoclonal Antibodies,Noges Publications,Park Ridge,NJ;and Haber,et al.(eds.)(1977)Antibodies in Human Diagnosis and Therapy,Raven Press,New York,NY(Russell,pgs.303−357,and Smith,et al.,pgs.365−389)で確認できる。あるいは、標準的な方法論を用いてサイトカインまたは小分子の用量を測定する。
【0126】
適切な用量については、たとえば、当該技術分野において処置に作用することが知られていたり、そのように思われていたり、予想されていたりするパラメータまたは因子により、臨床家が決定する。通常、用量は、至適用量よりもやや少ない量から始め、その後、任意の負の副作用に対して望ましい効果または至適効果が得られるまで少しずつ増量する。重要な診断尺度として、たとえば、発生した炎症または炎症性サイトカインのレベルのような症状の尺度が挙げられる。好ましくは、使用する生物製剤は、処置対象の動物と同じ種由来であり、それにより試薬に対する液性免疫反応を最小限にとどめる。
【0127】
リガンドまたは受容体に特異的に結合する抗体またはそのフラグメントの1週間の総用量の範囲は通常、体重1キログラム当たり約10μg以上、より一般的には約100μg以上、典型的には約500μg以上、より典型的には約1000μg以上、好ましくは約5mg以上、一層好ましくは約10mg以上である。通常、この範囲は、体重1キログラム当たり100mg未満、好ましくは約50mg未満、一層好ましくは約25mg未満である。ポリペプチドまたは小分子治療剤は、類似のモル濃度で用いてもよい。
【0128】
サイトカイン受容体によるシグナル伝達のアンタゴニスト(たとえば、抗体または結合フラグメント)の1週間の用量範囲は、体重1キログラム当たり約1μg以上、好ましくは少なくとも約5μg以上、一層好ましくは少なくとも約10μg以上である。通常、この範囲は、体重1キログラム当たり約1000μg未満、好ましくは約500μg未満、一層好ましくは約100μg未満である。投与量は、所望の処置を達成するスケジュールに基づき、スケジュールは定期的に期間を短くしたり長くしたりしてもよい。一般的な範囲は、体重1キログラム当たり少なくとも約10μg〜約50mg、好ましくは約100μg〜約10mgである。サイトカインアゴニストまたは小分子治療剤については代表的には、類似のモル量で用いるが、それらは恐らく分子量がより小さいので、体重用量が少なくなる。
【0129】
本発明は、たとえば、炎症に関連した症状を緩和するエストロゲンまたはプロゲストロンなどのホルモンまたは抗生物質もしくは抗感染症剤など、既知の治療物と組み合わせた生物製剤の投与も提供する。糖質コルチコイドの1日の投与量は、1日当たり少なくとも約1mg以上、通常少なくとも約2mg、好ましくは少なくとも約5mgである。通常、その投与量は、1日当たり約100mg未満、代表的には約50mg未満、好ましくは約20mg未満、一層好ましくは少なくとも約10mgである。一般に、この範囲は、1日当たり少なくとも約1mg〜約100mg、好ましくは約2mg〜50mgである。「有効量」という語は、医学的状態の症状または徴候を緩和するのに十分な量を意味する。代表的な哺乳動物宿主には、マウス、ラット、ネコ、イヌおよびヒトを含む霊長類がある。個々の患者に対する有効量は、処置対象の症候、患者の健康全般、投与の方法経路および用量ならびにサイドアフェクト(side affect)の重症度などの因子によって異なり得る。併用する場合の有効量は、成分の組み合わせ比率となり、その作用は個々の成分単独の作用に限定されるものではない。
【0130】
治療剤の有効量は、典型的には少なくとも約10%;通常、少なくとも約20%;好ましくは少なくとも約30%;一層好ましくは少なくとも約50%症状を緩和する。本発明は、本明細書の別の箇所(たとえば、上述の適応症に関連する障害の処置の概要についての一般的な記載)に記載されているような治療用途に用いられる試薬を提供する。Berkow(ed.)The Merck Manual of Diagnosis and Therapy,Merck & Co.,Rahway,N.J.;Brauwald,et al.(eds.)(2001)Harrison’s Principles of Internal Medicine,15th ed.,McGraw−Hill,NY;Gilman,et al.(eds.)(1990)Goodman
and Gilman’s:The Pharmacological Bases of Therapeutics,8th Ed.,Pergamon Press;Remington’s Pharmaceutical Sciences,17th ed.(1990),Mack Publishing Co.,Easton,Penn;Langer(1990)Science 249:1527−1533;Merck Index,Merck & Co.,Rahway,New Jersey;and Physician’s Desk Reference(PDR);Cotran,et al.(eds.),上掲;and Dale and Federman(eds.)(2000)Scientific American Medicine,Healtheon/WebMD,New York,NYを参照されたい。
【0131】
VI.診断方法
本発明は、生物学的サンプル中のIL−27またはIL−27Rの存在を検出する方法を提供する。この方法は、タンパク質または核酸分子(mRNAなど)を検出できる薬物と生物学的サンプルを接触させ、生物学的サンプル中のこれらの遺伝子の1つまたは両方の存在を検出することを含む。mRNAを検出する薬物の1つは、特定の遺伝子のmRNAに特異的にハイブリダイズできる標識核酸プローブである。核酸プローブは、たとえば、全長cDNAでも、長さが少なくとも15、30、50、100、250または500ヌクレオチドのオリゴヌクレオチドなど、その一部でもよいが、ストリンジェントな条件下で特定のmRNAに特異的にハイブリダイズするのに十分に相補的である。プローブについては、GenBankから公に入手可能な配列(ヒトEBI−3のNM_005755;ヒトp28のNM_145659;ヒトWSX1/TCCRのNM_004843;およびヒトgp130のNM_175767など)を用いて設計してもよい。所望の遺伝子名および所望の有機体名を用いてGenBankを検索して、ヒト以外の種に由来する前述の遺伝子のいずれかの配列を取得してもよい。
【0132】
サンプル中のmRNAについては、Perkin Elmer Taqman EZ RT−PCRキット(Perkin Elmer)を用いて測定する。遺伝子特異的プライマーおよびプローブに関しては、Primer Expressソフトウェア(Perkin Elmer)および受託番号により上述の遺伝子配列を用いて設計してもよい。
【0133】
特定のタンパク質(接着分子、炎症性サイトカインまたは免疫細胞表面抗原など)を検出する薬物は、特定のタンパク質に結合できる標識抗体または標識可能な抗体である。抗体は、ポリクローナル抗体でも、一層好ましくはモノクローナル抗体でもよい。インタクトな抗体またはそのフラグメント(FabまたはF(ab’)2など)を用いてもよい。プローブまたは抗体に対する「標識または標識可能な」という語は、検出可能な物質(125Iなど)をプローブまたは抗体にカップリング(すなわち、物理的結合)してプローブまたは抗体を直接標識すること、さらに直接標識された他の試薬と反応させてプローブまたは抗体を間接標識することとを包含することを意図している。間接標識の例として、蛍光標識二次抗体を用いた一次抗体の検出および蛍光標識ストレプトアビジンで検出できるようにしたビオチンによるDNAプローブの末端標識が挙げられる。
【0134】
生物学的サンプルは、被検体から単離されたサンプルを含み、単離後さらに処理または操作を加えずに本発明の方法に供される。別の実施形態では、単離後および本発明の方法に供する前に、生物学的サンプルを処理または操作してもよい。たとえば、サンプルを冷蔵(4℃で保管など)、凍結(−20℃で保管、−135℃で保管、液体窒素による凍結または当該技術分野において公知の多くの標準的な低温保存技術のいずれか1つを用いた凍結保存など)してもよい。さらに、被検体からの単離後および本発明の方法に供する前に、サンプルを精製してもよい。本明細書で使用する場合、「精製」という語は、生物学的サンプルの文脈で用いる場合、単離された生物学的サンプルの少なくとも1つの成分が生物学的サンプルから除去されて、精製後に成分が減少し、したがってより純粋な成分が残ることを示すことを意図している。たとえば、血清サンプルを当該技術分野において公知の遠心分離技術より1つまたは複数の成分に分離して、部分精製サンプル調製物を得てもよい。さらに、生物学的サンプルを、実質的に1つの成分だけが残るように精製することもできる。たとえば、生物学的サンプルのタンパク質またはmRNA成分だけが実質的に残るように、組織または腫瘍サンプルを精製することができる。
【0135】
成分を検出しやすいように、生物学的サンプルの成分を増幅することが望ましい場合がある。たとえば、mRNAを検出しやすいように、(RT−PCRなどにより)生物学的サンプルのmRNA成分を増幅してもよい。本明細書で使用する場合、「RT−PCR」(「逆転写酵素−ポリメラーゼ連鎖反応」)という語は、mRNAを逆転写酵素と反応させ、mRNAの塩基配列と相補的なDNAを産生することを含む。次いで選択したcDNAを、その増幅作用から耐熱性DNAポリメラーゼ(poly erase)の作用を利用するポリメラーゼ連鎖反応により大量に作製し得る。別の増幅方法として、以下に限定されるものではないが、自己支持配列複製(Guatelli,J.C.et al.,1990,Proc.Natl.Acad.Sci.USA 87:1874−1878)、転写増幅系(Kwoh,D.Y.et al.,1989,Proc.Natl.Acad.Sci.USA 86:1173−1177)、Qβレプリカーゼ(Lizardi,P.M.et all,1988,Bio/Technology 6:1197)または任意の他の核酸増幅法があり、その後、増幅された分子を当業者によく知られた技術により検出する。核酸分子数が非常に少ない場合、こうした検出スキームは、そうした分子の検出に特に有用である。
【0136】
本発明の検出方法については、生物学的サンプル中のタンパク質または核酸分子のインビトロおよびインビボでの検出に用いてもよい。たとえば、インビトロでのmRNAの検出技術として、ノーザンハイブリダイゼーションおよびin situハイブリダイゼーションが挙げられる。インビトロでのタンパク質の検出技術として、酵素結合免疫吸着測定(ELISA)、ウエスタンブロット、免疫沈降および免疫蛍光法が挙げられる。
【0137】
被験者の生物学的サンプル中のIL−27またはIL−27Rのレベルが異常かどうかを判定するには、被験者のIL−27またはIL−27Rのレベルを、たとえば、妊娠が正常だった女性から測定したこれらの分子の平均レベルと比較する。被験者において測定したこれらの分子のレベルの方が正常な妊娠の場合のレベルよりも低ければ(すなわち、統計学的に有意に低い)、被験者は、免疫性(inmune−mediated)自然流産が発生するリスクがあると診断される。
【0138】
たとえば、IL−27またはIL−27Rのレベルが10〜20%低い被検体は、リスクがあると診断される。なお別の実施形態では、たとえば、好適または適切な対照と比較したときに、レベルが20〜30%、30〜40%、40〜50%、50〜100%、100〜200%、200〜400%(2倍〜4倍など)、4倍〜10倍、10倍〜100倍、100倍またはそれを超えて低い被検体は、免疫性自然流産のリスクがあると診断される。
【0139】
本発明はまた、生物学的サンプル中のIL−27またはIL−27Rの存在を検出するキットを含む。たとえば、そのキットは、生物学的サンプル中のIL−27ヘテロ二量体またはIL−27R複合体の少なくとも1つのサブユニットのmRNAまたはポリペプチドを検出できる標識薬物または標識可能な薬物および生物学的サンプル中のIL−27またはIL−27RのmRNAまたはポリペプチドの量を測定する手段を含んでもよい。この薬物は、好適な容器に包装されていてもよい。さらに、そのキットは、サンプル中のIL−27またはIL−27Rの量を標準物質(IL−27またはIL−27Rレベルの正常範囲および異常範囲を示すチャートあるいは好適または適切な対照サンプルなど)と比較する手段をさらに含んでもよく、および/または、IL−27ヘテロ二量体またはIL−27R複合体の少なくとも1つのサブユニットのmRNAまたはポリペプチドを検出するキットの使用説明書をさらに含んでもよい。
【0140】
胚に対する母体の免疫寛容に関する現在のモデルは、サイトカインおよびホルモンの間接的なシグナル伝達の活用と母体のリンパ球の能動的な免疫抑制という2つの相補的な機構が中心になっている。多くの既知の免疫調節性サイトカインについて、最近、胚に対する母体の寛容に作用することが明らかになっているとの記載がなされた。TNF−α、IFN−γ、IL−2、IL−1、IL−6、IL−12およびRANTESなど、(細胞内の寄生虫感染などの過程で)細胞傷害性を促進するTh1サイトカインは、流産を起こしやすいマウスで自然流産率を上昇させることが明らかになっているのに対し、液性免疫を促進するCSF−1、GM−CSF、IL−10、IL−4、IL−11、TGFおよびIL−3などのTh2サイトカインの存在は、流産率の低下と相関することが示されている(Chaouat et al.,1990,J Reprod Fertil 89,447−58;Gafter et al.,1997,J Clin Immunol 17,408−19)。また、胚供給源に由来する因子の研究では、能動的な免疫抑制についても記述されている。未同定のタンパク質および抗父系遮断抗原の中には、胚に対して若干の免疫抑制を与えるものがあることがこれまでに報告されている(Herrera−Gonzalez and Dresser,1993,Dev Comp Immunol 17,1−18)。実施例7〜11は、異常妊娠(pathologic
pregnancy)中のマウスにおいては、多くのサイトカインと共に接着分子および細胞表面抗原の発現レベルが変化するが、CTLA4Igによる処置で多くが正常化し得ることを示している。このため、これらの遺伝子の発現レベルの変化は、被検体が免疫性自然流産のリスクがあるかどうか、それを発生しているかどうか、あるいは、それに罹患しているかどうかを判定する診断基準として用い得る。
【0141】
また、上記のような本発明の方法を用いて、被検体の処置の進展をモニターすることも望み得る。たとえば、ある被検体(ヒトなど)が、本明細書に記載の処置方法のいずれか1つにより、免疫性自然流産の処置を受け得る。上述の診断方法を用いて、IL−27またはIL−27Rのレベルが正常レベルに戻ったかどうかを判定することができる。その後、結果に応じて被検体の処置を変更(たとえば、増減)してもよい。
【0142】
本発明の広範な範囲は、以下の実施例を参照すると最もよく理解される。実施例は、本発明を個々の実施形態に限定することを意図するものではない。
【実施例】
【0143】
I.一般的な方法
以下の標準的な方法の多くは、たとえば、Maniatis,et al.(1982)Molecular Cloning,A Laboratory Manual,Cold Spring Harbor Laboratory,Cold Spring
Harbor Press,NY;Sambrook,et al.(1989)Molecular Cloning:A Laboratory Manual(2d ed.)Vols.1−3,CSH Press,NY;Ausubel,et al.,Biology,Greene Publishing Associates,Brooklyn,NY;or Ausubel,et al.(1987 and Supplements)Current Protocols in Molecular Biology,Wiley/Greene,NY;Innis,et al.(eds.)(1990)PCR Protocols:A Guide to Methods and Applications,Academic Press,NYに記載または参照されている。タンパク質の精製方法には、硫酸アンモニウム沈殿、カラムクロマトグラフィー、電気泳動、遠心分離、結晶化などのような方法がある。たとえば、Ausubel,et al.(1987 and periodic supplements);Deutscher(1990)「Guide to Protein Purification,」Methods in Enzymology,vol.182およびこのシリーズの他の巻;Coligan,et al.(1995 and supplements)Current Protocols in Protein Science,John Wiley and Sons,New York,NY;P.Matsudaira(ed.)(1993)A Practical Guide to Protein and Peptide Purification for Microsequencing,Academic Press,San Diego,CA;およびタンパク質精製産物の使用に関する製造者の文献、たとえば、Pharmacia,Piscataway,NJまたはBio−Rad Laboratories,Hercules,CA.を参照されたい。組換え技術と組み合わせれば、たとえば、プロテアーゼの除去が可能な配列により、FLAG配列などの適切なセグメント(エピトープタグ)または融合が可能な等価物に融合できる。たとえば、Hochuli(1989)Chemische Industrie 12:69−70;Hochuli(1990)「Purification of Recombinant Proteins with Metal Chelate Absorbent」in Setlow(ed.)Genetic Engineering,Principle and Methods 12:87−98,Plenum Press,NY;and Crowe,et al.(1992)QIAexpress:The High Level Expression & Protein Purification System,QIAGEN,Inc.,Chatsworth,CAを参照されたい。
【0144】
標準的な免疫学的技術は、たとえば、Hertzenberg,et al.(eds.)(1996)Weir’s Handbook of Experimental Immunology vols.1−4,Blackwell,Malden,MA;Coligan(1991)Current Protocols in Immunology Wiley/Greene,NY;and Methods in Enzymology vols.70,73,74,84,92,93,108,116,121,132,150,162,and 163に記載されている。サイトカインアッセイについては、たとえば、Thomson(ed.)(1998)The Cytokine Handbook(3d ed.)Academic Press,San Diego;Mire−Sluis and Thorpe(1998)Cytokines,Academic Press,San Diego,CA;Metcalf and Nicola(1995)The Hematopoietic Colony Stimulating Factors,Cambridge Univ.Press,Cambridge,UK;and Aggarwal and Gutterman(1991)Human Cytokines,Blackwell,Malden,MAに記載されている。
【0145】
血管の生物活性アッセイは、当該技術分野において周知である。こうしたアッセイは、たとえば、動脈平滑筋の増殖(たとえば、Koyoma,et al.(1996)Cell 87:1069−1078を参照)、血管上皮への単球接着(たとえば、McEvoy,et al.(1997)J.Exp.Med.185:2069−2077;Ross(1993)Nature 362:801−809;Rekhter and Gordon(1995)Am.J.Pathol.147:668−677;Thyberg,et al.(1990)Atherosclerosis 10:966−990;Gumbiner(1996)Cell 84:345−357を参照などの腫瘍または他の組織における新脈管形成活性および抗新脈管形成性活性をカバーする。
【0146】
神経細胞の生物活性アッセイについては、たとえば、Wouterlood(ed.1995)Neuroscience Protocols modules 10,Elsevier;Methods in Neurosciences,Academic
Press;and Neuromethods Humana Press,Totowa,NJ.に記載されている。発生系の方法論は、たとえば、Meisami(ed.)Handbook of Human Growth and Developmental Biology,CRC Press;and Chrispeels(ed.)Molecular Techniques and Approaches in
Developmental Biology,Interscienceに記載されている。
【0147】
FACS分析については、Melamed,et al.(1990)Flow Cytometry and Sorting,Wiley−Liss,Inc.,New York,NY;Shapiro(1988)Practical Flow Cytometry,Liss,New York,NY;and Robinson,et al.(1993)Handbook of Flow Cytometry Methods,Wiley−Liss,New York,NYに記載されている。
【0148】
II.ヒト組織
妊娠9〜40週にある8個の胎盤の凍結組織サンプルをRT−PCRおよび/または免疫共沈降実験により解析した。さらに、妊娠第1三半期(4〜10週、n=11)、第2三半期(17〜27週、n=4)および第3三半期(33〜39週、n=4)の胎盤19個のホルマリン固定パラフィン包埋組織サンプルを免疫組織化学的検査により解析した。胎盤については、堕胎(第1三半期の胎盤)、治療的中絶、流産、帝王切開または自然分娩(第2および第3三半期の胎盤)から採取した。肉眼的検査および組織学的検査で異常がなかったためこれらの胎盤を選択した。子癇前症を示す病変および感染症は観察されなかった。さらに、精巣胚細胞腫瘍7例のパラフィン包埋組織サンプル(絨毛癌成分を含む混合型胚細胞腫瘍5例および合胞体栄養細胞層細胞を含むセミノーマ2例)も解析した。
【0149】
フランスの倫理ガイドラインに従って、患者の同意を得てから採取した凍結組織と、組織学的検査および診断目的(purposis)のために収集した固定組織とを調査した。
【0150】
III.RNAの抽出およびRT−PCR解析
TRIzol抽出により凍結組織または細胞からRNAを単離し、続いてM−MLV逆転写酵素およびoligo(dT)プライマー(試薬はすべてInvitrogen,Cergy−Pontoise,France製)を用いてDNaseI消化および逆転写を行った。PCR解析では、以下のプライマーを用いた:
【0151】
【化1】

熱サイクルプロファイルは、以下のとおりであった:94℃で1分、55℃で30秒および72℃で20秒、30サイクル(EBI3)、32サイクル(p28)、35サイクル(IL−27R)および30サイクル(gp130およびβ2−ミクログロブリン)。
【0152】
IV.免疫共沈降およびウエスタンブロット解析
凍結胎盤の組織を粉砕し、プロテアーゼ阻害剤(1mMのPMSF、1μg/mlのペプスタチン、10μg/mlのロイペプチン)を含む溶解緩衝液(0.5%ノニデットP−40、50mMのトリス(pH7.4)、150mMのNaCl、3%グリセロール、1.5mMのEDTA)中でインキュベートして氷上で1時間溶解した。細胞ライセートを13,000×gで15分間遠心した。次いで、この上清を、プロテインAセファロース(Amersham Biosciences,Saclay,France)により4℃で2時間プレクリアし、ウサギポリクローナル抗EBI3もしくは抗p28抗体(Ab)または対照ウサギIgG Ab(Sigma,St−Quentin−Fallavier,France)と4℃で2時間インキュベートした。ウサギポリクローナル抗EBI3または抗p28Abをそれぞれ、細菌性6His−EBI3融合タンパク質(たとえば、Devergne et al.(2001)Am J Pathol 159:1763−1776を参照)またはp28のN末端にマッピングされたペプチド(たとえば、Larousserie et al.(2004)J Pathol 202:164−171を参照)で免疫されたウサギの血清から精製した。免疫複合体を、4℃で1時間プロテインAセファロースとインキュベートして回収した。次いでビーズを、1mlの0.5%NP−40溶解緩衝液で5回洗浄し、結合タンパク質を、SDSサンプル緩衝液中で煮沸して回収した。イムノブロッティングのため、溶出したタンパク質をSDS−PAGEで分離し、ニトロセルロース膜にトランスファーした。EBI3を、マウス2G4H6mAbを用いて検出し(Devergne et al.(2001)上掲)、p28を、p28のC末端を認識するアフィニテイ精製ウサギ抗p28Ab(Schering−Plough Biopharma,Palo Alto,CA)を用いて検出した。マウスAbまたはウサギAbの結合をそれぞれ、西洋わさびペルオキシダーゼ結合体化抗マウスAbまたは西洋わさびペルオキシダーゼ結合体化プロテインAで検出した(Amersham Biosciences)。ペルオキシダーゼ反応を化学発光試薬により展開させた(Pierce,Rockford,Il,USA)。
【0153】
V.ELISA
正常な満期胎盤14個の胎盤外植片の培養上清(以前に記載されているように調製(Devergne,et al.(2001)上掲))および正常な妊娠の女性7名の血清(妊娠中の様々な時期(妊娠9〜40週)由来)についてELISAによりIL−27を検査した。これらはすべて、ELISAによりEBI3について既に検査がなされていた(Devergneら(2001)上掲)。EBI3/p28ヘテロ二量体を認識するが、遊離EBI3を認識しないIL−27のELISAについては、既に記載されている(たとえば、Pflanz,et al.(2002)を参照 上掲)。
【0154】
VI.免疫組織化学的検査
記載のように間接的なアビジン−ビオチンペルオキシダーゼ技術により、ホルマリン固定パラフィン包埋組織について免疫組織化学的検査を行った(Larousserie,et al.(2004)上掲;Larousserie,et al.(2005)上掲;Larousserie,et al.(2006)上掲;and Devergne,et al.(2001)上掲)。ペルオキシダーゼ反応を3’−ジアミノベンジジンで展開させ、切片をハリスヘマトキシリンで対比染色した。EBI3を、2μg/mlの2G4H6マウスmAb(IgG2a)と平行してアイソタイプ対応対照mAb(RPC5,IgG2a,Cappel Durham,NC,USA)を用いて検出した。p28を、1〜2μg/mlでアフィニテイ精製ウサギポリクローナル抗p28抗体(Schering−Plough Biopharma)を用いて検出し、正常なウサギIgG(Sigma)を陰性対照として用いた。場合によっては、正常なラットIgGと平行してラット抗p28モノクローナルAb(10μg/ml)(Schering−Plough Biopharma)を用い、記載のように(Larousserie,et al.(2004)上掲)ビオチン化ウサギ抗ラットポリクローナルIgG(Vector laboratories)で検出した。
【0155】
VII.免疫性流産の動物モデル
流産を起こしやすいDBA×CBAマウスモデルは、免疫性自然流産に関する研究の標準的なモデルである(Toder et al.,1989 ,J Reprod Fertil Suppl 37,79−84)。CBA妊娠雌マウスでは、DBA:CBAハイブリッドの吸収胚率は、21〜30%であるのに対し、対照Balb C:CBAの吸収胚率は8%である。このモデル系の場合、胚に対する母体の免疫学的拒絶反応が妊娠6日目、着床後2日目に始まる(Duclos et al.,1995,Am J Reprod Immunol 33,354−66)。胚に対する母体の拒絶を抑制するIL−27アゴニストの潜在力を評価するため、IL−27アゴニストを、自然流産率が高いマウス、自然流産率が高いあるいは低い妊娠マウスに投与する。着床時期(4日目)および胚に対する免疫学的反応が最初に検出される日(6日目)に対応する妊娠4日目および6日目など様々な時点で投与を行う。吸収された胚の定量を妊娠12日目に行う。高率で流産が起こるCBA×DBA交配マウス(n=14)の吸収胚率を、対照Balb/C×DBA交配マウスのそれと比較する。
【0156】
本明細書に引用するすべての参考文献については、すべての目的ために参照によってその全体を援用すべく、1つ1つの刊行物、特許または特許出願を具体的に個々に示しているのと同じ程度に参照によって本明細書に援用する。
【0157】
当業者には明らかなように、本発明の精神および範囲から逸脱することなく、その多くの変形例および変更例が可能である。本明細書に記載の具体的な実施形態は、例示のみを目的として提供されるものであり、本発明は、添付の特許請求の範囲の用語およびその特許請求の範囲が権利を有する等価物の全範囲によってのみ限定される。
【特許請求の範囲】
【請求項1】
本願明細書に記載された発明。
【請求項1】
本願明細書に記載された発明。
【図1】


【図2】


【図3】


【図4】




【図2】


【図3】


【図4】


【公開番号】特開2013−18794(P2013−18794A)
【公開日】平成25年1月31日(2013.1.31)
【国際特許分類】
【外国語出願】
【出願番号】特願2012−236373(P2012−236373)
【出願日】平成24年10月26日(2012.10.26)
【分割の表示】特願2009−540269(P2009−540269)の分割
【原出願日】平成19年12月5日(2007.12.5)
【出願人】(596129215)メルク・シャープ・アンド・ドーム・コーポレーション (785)
【氏名又は名称原語表記】Merck Sharp & Dohme Corp.
【住所又は居所原語表記】One Merck Drive,Whitehouse Station,New Jersey 08889,U.S.A.
【Fターム(参考)】
【公開日】平成25年1月31日(2013.1.31)
【国際特許分類】
【出願番号】特願2012−236373(P2012−236373)
【出願日】平成24年10月26日(2012.10.26)
【分割の表示】特願2009−540269(P2009−540269)の分割
【原出願日】平成19年12月5日(2007.12.5)
【出願人】(596129215)メルク・シャープ・アンド・ドーム・コーポレーション (785)
【氏名又は名称原語表記】Merck Sharp & Dohme Corp.
【住所又は居所原語表記】One Merck Drive,Whitehouse Station,New Jersey 08889,U.S.A.
【Fターム(参考)】
[ Back to top ]

