免疫抱合体
【課題】生物活性を有するリガンドを特異的標的細胞または組織に到達させるための、例えば腫瘍治療に用い得る新たな融合タンパク質の免疫抱合体を提供する。
【解決手段】本発明にかかる融合タンパク質は、腫瘍関連標的エレメント、好ましくは、ヒト上皮増殖因子受容体(EGFR)などのヒト腫瘍細胞上で優先的に表現される分子を認識するモノクローナル抗体またはそのフラグメント、および増殖および/または分化因子などの生物活性を有するリガンドからなる。
【解決手段】本発明にかかる融合タンパク質は、腫瘍関連標的エレメント、好ましくは、ヒト上皮増殖因子受容体(EGFR)などのヒト腫瘍細胞上で優先的に表現される分子を認識するモノクローナル抗体またはそのフラグメント、および増殖および/または分化因子などの生物活性を有するリガンドからなる。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、腫瘍関連標的エレメント、最も好ましくは、ヒト上皮増殖因子受容体(EGFR)などのヒト腫瘍細胞上で優先的に発現される分子を優先的に認識するモノクローナル抗体またはそのフラグメントおよび成長および/または分化因子のような生物活性を有するリガンドからなる新規融合タンパク質に関する。得られる融合タンパク質は、特異的標的細胞または組織に生物活性を有するリガンドを運ぶために用いることができる。新規の免疫抱合体は腫瘍の治療に使用することができる。
【背景技術】
【0002】
多様な治療概念が癌患者の治療のために用いられてきた。過去数年、悪性細胞上で発現される細胞表面分子を特異的にまたは選択的に認識するモノクローナル抗体を用いて臨床試験が行われてきた。このアプローチのねらいは、癌細胞を排除するために抗体依存性細胞性細胞毒性(ADCC)または補体媒介細胞毒性(CDC)を誘導することである。第二のアプローチは、免疫応答のサイトカイン媒介活性化である。サイトカイン誘導抗腫瘍活性は次のようなもので媒介され得る。すなわち、1)腫瘍増殖に対するサイトカインの直接的細胞毒性/細胞制圧効果2)LAK活性または単球/マクロファージ媒介細胞毒性などの腫瘍−抗原−非特異的メカニズム3)CD4およびCD8陽性T細胞によって媒介される腫瘍−抗原−特異的免疫応答。この場合、腫瘍に対する全身性免疫が動物モデルにおいて観察された。あいにく、IL−2またはTNFαなどのサイトカインの全身性適用はそれらの毒性によって妨げられている(Rubin、Cancer Invest.、11、460−472、1990;Balkwill、Nature、361、206−207、1993)。
【0003】
腫瘍部位における充分なサイトカイン濃度を確実にするためにはかなり多量の投与が必要であるが、最大許容量は有効用量以下である。したがって、サイトカインのマイナス効果は主に全身的適用の結果もたらされるが、腫瘍治療におけるそれらの臨床的効果は疑いの余地がない。動物モデルにおいて、腫瘍内注射またはトランスフェクトさせた腫瘍細胞の分泌のいずれかによってサイトカインを腫瘍部位に存在させることによって腫瘍を退行させ得ることが示された(Hockら、PNAS、90、2774−2778、1993;Colomboら、Cancer Res.、52、4853−4857、1992;McBrideら、Cancer Res.、52,3931−3937、1992;Tepperら、Science、257、548−551、1992;Mullenら、Cancer Res.、52、6020−6024、1992;Blankensteinら、J.Exp.Med.、173、1047−1052、1991;Gansbacherら、J.Exp.Med.、172、1217−1224、1990)。これらのシステムでは、サイトカインは腫瘍の増殖は障害しないが、迅速で有効な抗腫瘍反応を活性化することができる。したがって、エフェクター分子と標的エレメントとの物理的組み合わせは、周辺部の存在を減らして生物活性を有するリガンドの腫瘍内での利用を促進する。さらに、単一腫瘍細胞またはミクロ転移もまた、これらの分子の標的となり得る。
【0004】
抗体特異性標的のための生物活性を有するリガンドは、直接的にまたは標的細胞に対する致死的環境をつくり出すことによって標的細胞の破壊を誘導しなければならない。生物活性を有するリガンドとしては、IL−1、IL−2、IL−4、IL−6、IL−7、IL−10、IL−13、IFN、TNFαまたはCSFなどのサイトカインがある。これらのサイトカインは、抗腫瘍効果を直接的にあるいは宿主の防護機構を活性化するかのいずれかによって発揮することが示された(Mire−Sluis、TIBTECH、11、74−77、1993;Columboら、Cancer Res.、52、4853−4857、1992;ThomasおよびBalkwill、Pharmac.Ther.、52、307−330、1991)。
【0005】
例えば、IL−2は免疫応答の中心メディエーターと考えられている。IL−2は、T細胞およびNK細胞の増殖を刺激することおよびリンホカイン活性化キラー細胞(LAK)を誘導することが示されている。腫瘍浸潤Tリンパ球はIL−2に応答して増殖する。さらに、IL−2はT細胞および単球の細胞毒性を増強する。加えて、IL−2は、免疫応答をさらに増強するT細胞、NK細胞および単球によって分泌されるサイトカインカスケードを誘導する。
【0006】
TNFαは、主にある種の腫瘍細胞に対するその直接的な細胞毒性および腫瘍の出血性退行の誘導のために腫瘍治療における広範な適用が見出だされている。加えて、TNFαは免疫応答を増強する。すなわち、これはT細胞増殖に対して共刺激作用を有し、MHCクラスIおよびクラスII抗原の発現およびマクロファージによるTNFα、IFNおよびIL−1の分泌を誘導する。IL−4は、最初はB細胞増殖因子として記述された。さらなる研究で、IL−4は抗原特異性細胞毒性T細胞を刺激することおよびNK細胞様LAKよりもむしろT細胞様LAK細胞に特異的に作用することが示された。IL−4は、ヒトメラノーマ細胞の成長を阻害して、それらのMHCクラスIおよびIIの発現を促進する。IL−4によるマクロファージ媒介抗腫瘍効果の誘導についてはまだ議論の余地がある。
【0007】
IL−7は、preB細胞およびヒト末梢CD4およびCD8陽性T細胞の増殖因子である。IL−7は、CD8陽性T細胞亜集団の細胞毒性を増強する。加えて、IL−7は、末梢単球によるIL−1、IL−6およびTNFαの産生を誘導する。インビトロにおいて、単球/マクロファージの腫瘍殺傷活性はIL−7によって刺激され、これはおそらくTNFαなどのサイトカインによって媒介される。
【0008】
上皮増殖因子(EGF)は、表皮および上皮細胞のミトゲンであるポリペプチドホルモンである。EGFが感受性細胞と相互作用するときには、これは膜受容体(EGFR)に結合する。EGFRは、約170kDの貫膜糖タンパク質であって、cerb−B プロトオンコジーン(癌原遺伝子)の遺伝子産物である。
【0009】
ネズミモノクローナル抗体MAb425はヒトA431癌腫細胞系(ATCCC RL1555)に対してつくられたもので、EGFRの外側ドメイン上のポリペプチドエピトープに結合することが見出だされた。これはEGFの結合を阻害し、インビトロで腫瘍細胞毒性を媒介し、インビトロで上皮および結腸直腸癌腫由来の細胞系の腫瘍細胞増殖を抑制することが見出だされた(Rodeckら、Cancer Res.、47、3692、1987)。MAb425のヒト化されたキメラは、WO92/15683から公知である。
【0010】
活性タンパク質の指向的送達のための多様な組み合わせの抗体−サイトカイン免疫抱合体については、既に記述がある。IL−2は、ヒト癌腫特異性抗体L6(Fellら、J.Immunol.、146、2446−2452、1991、EP−OS−0439095)と、または抗ガングリオシドGD2抗体(Gilliesら、PNAS、89、1428−1432、1992、WO92/08495)と組み合わされた。抗ダンシル抗体およびIGF1からなる免疫抱合体はホルモンの指向的送達のためにつくられた(ShinおよびMorrison、PNAS、87、5322−5326、1990、WO91/14438)。
【特許文献1】WO 92/15683
【特許文献2】EP−OS−0439095
【特許文献3】WO 92/08495
【特許文献4】WO 91/14437
【非特許文献1】Rubin, Cnacer Invest. 11:460−472, 1990
【非特許文献2】Balkwill, Nature 361:206−207, 1993
【非特許文献3】Hock et al. PNAS 90:2774−2778, 1993
【非特許文献4】Colombo et al. Cancer Res. 52:4853−4857, 1992
【非特許文献5】McBride et al. Cancer Res. 52:3931−3937, 1992
【非特許文献6】Tepper et al. Science 257:548−551, 1992
【非特許文献7】Mullen et al. Cancer Res. 52:6020−6024, 1992
【非特許文献8】Blankenstein et al. J. Exp.Med.173:1047−1052, 1991
【非特許文献9】Gansbacher et al. J. Exp.Med.172:1217−1224, 1990
【非特許文献10】Mire−Sluis, TIBTECH 11:74−77, 1993
【非特許文献11】Thomas & Balkwill, Pharmac. Ther. 52:307−330, 1991
【非特許文献12】Rpdeck et al. Cancer Res. 47:3692, 1987
【非特許文献13】Fell et al. J. Immunol.146:2446−2452, 1991
【非特許文献14】Gillies et al. PNAS 89:1428−1432, 1992
【非特許文献15】Shin & Morrison, PNAS 87:5322−5326, 1990
【発明の開示】
【発明が解決しようとする課題】
【0011】
このように、本発明の目的は、(1)腫瘍細胞表面のEGFR抗原特異性エピトープおよび(2)細胞毒性の誘導にきわめて有力な生物活性を有するリガンドからなり、したがってその場での抗腫瘍効果を増強する抗体またはそのフラグメントをつくり出すことであった。
【課題を解決するための手段】
【0012】
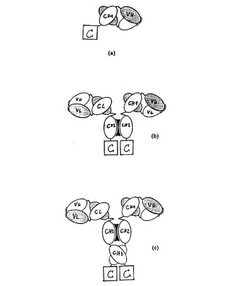
本発明は、モノクローナル抗体の部分、少なくとも抗原認識部位または完全なモノクローナル抗体を、生物活性を有するリガンドと組み合わせる免疫抱合体に関する。これらの免疫抱合体をコードする構築物は、組み換えDNA技術によって作出される。免疫抱合体は、抗体重鎖の可変部ならびに定常部のCH1ドメイン(抗体−CH1抱合体)、または定常部のCH1およびCH2ドメイン(抗体−CH2抱合体)、または定常部のCH1、CH2およびCH3ドメイン(抗体−CH3抱合体)を、生物活性を有するリガンドに融合して含む。適合する軽鎖を加えることによって、抗原保有細胞を標的にして、活性リガンドを生体の特定の部位に送達するような免疫抱合体を作出することができる(図1 a〜c)。
【発明の効果】
【0013】
本発明の免疫抱合体を用いることによって、メラノーマ、神経膠腫および癌腫などの腫瘍を検出して治療することができる。
【発明を実施するための最良の形態】
【0014】
このように、本発明の目的は、(1)上皮増殖因子受容体(EGFR)の抗原エピトープを保有する腫瘍細胞に特異性のモノクローナル抗体またはそのフラグメント、および(2)該抗体または抗体フラグメントに融合し、腫瘍細胞をとくにその場で溶解する細胞毒性を有するかまたは腫瘍特異性免疫応答を誘導するような生物活性を有するリガンド、好ましくはサイトカインからなる免疫抱合体を提供することである。
【0015】
本発明による好ましい実施態様においては、サイトカインは、TNFα、IL−2、IL−4およびIL−7からなる群から選択される。
【0016】
本発明の他の好ましい実施態様においては、抗体または抗体フラグメントは、ネズミ、ヒト化またはキメラMAb425に由来する。
【0017】
本発明のさらなる好ましい実施態様においては、免疫抱合体は、MAb425−CH1−TNFα、MAb425−CH2−TNFα、MAb425−CH3−TNFα、MAb425−CH1−IL−2、MAb425−CH2−IL−2およびMAb425−CH3−IL−2、MAb425−CH1−IL−7、MAb425−CH2−IL−7およびMAb425−CH3−IL−7からなる群から選択される。
【0018】
さらに、本発明の目的は上記および請求の範囲に定義した免疫抱合体の製造法を提供することであって、これは、宿主生物を用いて、抗体または抗体フラグメントおよび生物活性を有するリガンドをコードするDNA配列を互いに融合させて、得られる構築物を発現ベクターに導入して、これで該宿主生物を形質転換させて、この宿主細胞を栄養溶液中で培養して、融合タンパク質を発現させることによって行われる。
【0019】
本発明による好ましい実施態様においては、抗体または抗体フラグメントおよび生物活性を有するリガンドをコードするDNA配列を所望の融合DNA配列に相補的なオリゴヌクレオチドを用いて一本鎖DNA上に融合させるという手法が用いられる。
さらに、本発明の目的は、少なくとも上記および請求の範囲に定義した免疫抱合体および生物学的に容認し得る担体からなる薬剤組成物を提供することにある。
【0020】
最後に、本発明の目的は、上記および請求の範囲に定義した免疫抱合体の腫瘍に向けた薬物の調製のための使用である。
【0021】
とくに、例えば、MAb425−CH2−TNFαおよびMAb425−CH3−TNFαなどの抗体−CH2および抗体−CH3抱合体の場合、細胞性細胞毒性の誘導は、カップリングさせないTNFαよりも優れていた。これは、おそらく、結合的性質ならびに、モノクローナル抗体の定常部およびサイトカイン活性によるADCCの誘導に関する組み合わせによるものと考えられる。
【0022】
本発明による抗体−CH1抱合体は、小分子であること、および原核細胞における発現が可能であるという点で有利である。さらに、サイズが小さいことによって(腫瘍)組織への進入が促進される。
【0023】
本発明の免疫抱合体はさらに、好ましくはMAb425またはそのフラグメントなどのモノクローナル抗体と比較して、良好な結合および増殖特性を示す。
【0024】
材料および方法
モノクローナル抗体
MAb425は、ヒトA431癌腫細胞系(ATCC CRL1555)に対するIgG1ネズミモノクローナル抗体である。MAb425は、ヒトEGF受容体の外側ドメインのポリペプチドエピトープと結合し、EGFの結合と競合する。MAb425は、インビボで腫瘍細胞毒性を媒介することおよびインビトロで類表皮腫および結腸直腸癌腫由来細胞系の腫瘍細胞増殖を抑制することが見出だされた(Rodeckら、Cancer Res、47、3692、1987)。ヒト化およびキメラ型MAb425はWO92/15683に開示されている。
【0025】
サイトカイン
サイトカインをコードするcDNAは、British Biotechnology Limited(Herrmann Biermann GMBH、Bad Nauheim FRG;ヒトIL−2 BBG30、ヒトIL−4 BBG15、ヒトIL−7 BBG43、ヒトTNFα BBG18)から購入した。市販のcDNAは、タンパク質分泌に必要なシグナル配列を欠いている。サイトカインをコードするcDNAは、サイトカイン産生細胞から分離されるmRNAから作出することができる。
【0026】
ベクター
pUC19は一連の多重コピー数大腸菌プラスミドクローニングベクターの一部であって、pBR322およびM13mp19の部分を含む。pUC19は、誘導性細菌性lacプロモーター−オペレーターおよびそれに続く多クローニング部位を含む(Yanisch−Perronら、Gene、33、103−109、1985)。pUCベクターは、市販されている(例えばNew England Biolabsなど)。pBluescript KS/SK+およびKS/SK−ファージミド・ベクターはpUC19に由来する。これらベクターは市販されている(Stratagene)。
【0027】
真核細胞発現ベクターpHCMV(Gilliesら、Cell、33、717、1983)は、シミアン(アカゲザル)ウイルス40(SV40)の複製開始点およびヒトサイトメガロウイルスのプロモーターおよびエンハンサー領域を含む。プロモーター/エンハンサー領域の後には、発現されるべき遺伝子導入のための多クローニング部位(mcs)が続く。このベクターにおいて、MAb425重鎖可変部のキメラ型およびΔSacII cγ1領域とそれにCH1、CH2またはCH3ドメインの末端でそれぞれ融合したエフェクター分子とを組み合わせて、MAb425重鎖融合タンパク質がつくり出された。この融合Ig鎖を、適合する軽鎖と組み合わせることによって、一価の抗原結合領域を形成して、これを免疫抱合体に組み立てることができ、これを会合させて標的抗原に特異的な二価の免疫抱合体を産生するができる(図1)。重鎖および軽鎖構築物は、同一のまたは別々のベクターに導入することができる。
【0028】
原核細胞発現ベクターは、pSW1ベクター(Wardら、Nature、341、544−546、1989)に基づき、これはpUC19ベクターに由来する。pSW1は、Erwinia carotovoraからの細菌性pelB遺伝子のリーダーペプチドをコードする配列を含む(Leiら、J.Bact.、169、4379−4383、1987)。外来性DNAをpelBリーダー配列の後に、読み枠を揃えて導入して、ペリプラズム中へのタンパク質発現を行わせることができる。
【0029】
[図面および表の簡単な説明]
[表1] MAb425−サイトカイン融合タンパク質の作出のために用いたPCRプライマー(真核細胞発現)
* StratageneのpBluescriptベクターSK+/−およびKS+/−とハイブリダイズするリバース・プライマー(市販品)
** このプライマーは、単一のSacII部位を含むCg1定常部とハイブリダイズする。
【0030】
*** M13由来のベクターとハイブリダイズするリバース・プライマー(市販品)
[表2] MAb425−サイトカイン融合タンパク質の作出のために用いたPCRプライマー(原核細胞発現)
[図1] 抗体−サイトカイン免疫抱合体のモデル図
C=サイトカイン;VH=重鎖可変部;VL=軽鎖可変部;CH=重鎖定常部;CL=軽鎖定常部。
【0031】
(a)抗体−CH1抱合体、(b)抗体−CH2抱合体、(c)抗体−CH3抱合体。
【0032】
[図2] EGR−R特異性ELISAにおける免疫抱合体のEGF−Rへの結合
過渡的にトランスフェクトさせたCOS−7細胞の上清の免疫抱合体含量を調べた。
【0033】
縦軸:490nmでの%吸収、横軸:上清希釈(log2)。
【0034】
黒丸:MAb425CH1−TNFα、黒四角:MAb425CH2−TNFα、黒三角:MAb425CH3−TNFα、黒菱:MAb425−対照、黒逆三角:MAb425FAb−対照、黒六角:再成形したMAb425F(ab’)2(精製タンパク質)。
【0035】
[図3A] COS−7細胞において発現されたMAb425−CH1−IL−2免疫抱合体のIL−2活性
CTLL−2細胞をインジケーター細胞系として用いた。MAb425−CH1−IL−2を含む連続希釈したCOS上清の増殖活性を左図に示す(黒丸)。MAb425Fab−対照を含むCOS上清を対照として用いた(白丸)。組み換え市販IL−2タンパク質を伴うあるいはIL−2を伴わない(KO)活性化時のCTLL−2細胞の増殖応答を右図に示した。
【0036】
[図3B] 大腸菌において発現されたMAb425−CH1−IL−2免疫抱合体のIL−2活性
CTLL−2細胞をインジケーター細胞系として用いた。大腸菌中で発現させて抗MAb425イディオタイプカラム上でアフィニティークロマト精製したMAb425−CH1−IL−2の連続希釈物の増殖活性を左図に示す(黒三角)。MAb425−CH1−IL−を含むCOS上清を対照として用いた(黒丸)。透析緩衝液(黒四角)。緩衝液がIL−活性に影響しなかったことを確認するために、透析緩衝液を一定濃度のIL−2(1U/ml)の存在下で滴定した(逆黒三角)。組み換え市販IL−2タンパク質を伴うあるいはIL−2を伴わない(KO)活性化時のCTLL−2細胞の増殖応答を右図に示した。
【0037】
[図3C] MAb425−CH1−IL−2免疫抱合体によるTIL増殖の誘導
メラノーマ腫瘍浸潤リンパ球を、MAb425−CH1−IL−2免疫抱合体を含む連続希釈したCOS上清の存在下または非存在(KO)下で培養した(左図)。組み換え市販IL−2を用いた活性化時のTILの増殖応答を右図に示す。
【0038】
[図4] MAb425−IL−4免疫抱合体によるHPBL増殖の誘導
PHA活性化HPBLを、MAb425−CH2−IL−4(黒丸)、MAb435−CH3−IL−4(黒三角)融合タンパク質を含む連続希釈したCOS上清の存在下で培養した。MAb425(黒四角)、IL−4(黒菱)およびベクター対照(黒逆三角)を含む上清を対照として用いた。組み換え市販IL−4を伴うおよび成長因子と伴わない(KO)活性化時のHPBLの増殖応答を右図(上)に示す。
【0039】
[図5] WEHI164細胞に対するMAb425−TNFα免疫抱合体細胞毒性
TNFα感受性ネズミ線維肉腫細胞系WEHI164を、MAb425−CH1−TNFα免疫抱合体(黒四角)、またはMAb425−CH2−TNFα免疫抱合体(黒三角)、またはMAb425Fab−対照(黒丸)を含む連続希釈したCOS上清の存在下で48時間培養した(左図:上)。市販の組み換えヒトTNFαによって誘導されるインジケーター細胞の増殖阻害を右図(下)に示す。
【0040】
[図6] PBMCによるMAb425−TNFα免疫抱合体媒介腫瘍細胞溶解
非活性化ヒト末梢血リンパ球(PBMC)をエフェクター細胞として用いて、異質遺伝子的EGF−R陽性の51Cr標識C8161標的細胞とともに、エフェクター/標的細胞比30:1の割合で共培養した。特異的溶解(%)をMAb425−CH3−TNFα免疫抱合体を含む連続希釈したCOS培養上清の非存在または存在下で18時間培養した後に調べる(ハッチングを施したバー)。組み換えTNFα(Genzyme)は36kDダイマーとして大腸菌中で発現させた(ドットを施したバー)。
【実施例】
【0041】
一般:
本出願に記載の他の微生物、細胞系、プラスミド、プロモーター、耐性マーカー、複製開始点、制限部位またはベクターの他のフラグメントは、市販されているかまたは他の手段でふつうに入手が可能である。とくに記載がない限り、これらは例として使用されているもので、本発明に必須ではなく、他の適当な手段および生物学的材料で置き換えることができる。
【0042】
本発明に必須の方法技術を、以下に詳細に記述する。詳細な記述のない他の方法技術は、当業者に公知の標準法であるかまたは引用参考文献および特許出願または標準的文献(例えば、「Antibodies、A LaboratoryManual」、Harlow、Lane、Cold Spring Harbor、1988)により詳細に記述されている。
【0043】
融合タンパク質の真核細胞における発現
Fab425−サイトカイン融合タンパク質発現のための真核細胞発現ベクターの構築
MAb425およびサイトカインのループ・アウト手法による融合:
TNFα構築物の作出:
ΔSacII cγ1クローンのSacII/XbaIフラグメントを、TNFαcDNAなどのサイトカインをコードする配列を含むBluescriptSK+に挿入した。TNFα cDNAをSmaI部位とEcoRI部位との間に導入した。得られる構築物を適当なヘルパーファージを加えることによって一本鎖DNAに調製した。CH2またはCH3ドメインをTNFαコード配列の5’末端と読み枠を合わせて融合させた。下記のオリゴヌクレオチド、すなわち
【0044】
【化1】

【0045】
は、それぞれCH2ドメインおよびCH3ドメインの3’末端、およびTNFαコード配列と一致する。一本鎖DNA配列をオリゴヌクレオチドによって一体にして、間の不要な配列を構築物から除去する。上方の鎖が一本鎖DNAとして作出されたので、オリゴヌクレオチドは逆配向を有している。
DNAを配列合成酵素(シクエナーゼ・ポリメラーゼ)によって二本鎖型に形成した。この酵素は、AmplitaqDNAポリメラーゼのようにエラーを生じる傾向にはないので、単離されたクローンの接合部のDNA配列のみを決定した。正しい配列を有するこれらクローンを、完全なMAb425融合タンパク質を作出するために必要な配列と組み合わせて、真核細胞での発現のためにpHCMVベクターにクローニングした。
【0046】
IL−4構築物の作出:
これらの構築のために、完全なΔSacIIcγ1クローンをKpnI/SalIフラグメントとしてBluescriptKS+に挿入した。IL−4をHindIII/EcoRIフラグメントとして同じベクターにクローニングした。融合を上記のTNFα構築物と同様にして下記のそれぞれCH2およびCH3ドメインの融合のためのオリゴヌクレオチド、すなわち
【0047】
【化2】

【0048】
を用いて行った。
【0049】
正しい配列を有するこれらクローンを完全なMAb425融合タンパク質を作出するために必要な配列と組み合わせて、真核細胞での発現のためにpHCMVベクターにクローニングした。
【0050】
PCR手法によるMAb425とサイトカインとの融合
AmplitaqDNAポリメラーゼはエラーを生じがちであるので、エラーがなかったことを確認するためにPCR手法によって増幅されたこれら配列を決定した。これらの実験に用いたプライマーを、表1に纏めて示す。
【0051】
CH1融合タンパク質の作出
pUH5プラスミドは原核細胞発現のための重鎖FAb425フラグメントのてめの配列、それにErwinia carotovoraに由来するタンパク質分泌を確実にするN末端pelBリーダー配列(Leiら、J.Bact.、169、4379−4383、1987)を含む。HindIII/NotIフラグメントをBluescriptKS+ベクターに再クローニングした。サイトカインIL−4およびIL−7をPCR手法によって増幅して、5’NcoIおよび3’BamHI制限部位をそれぞれ導入した。IL−2およびTNFαは5’NcoIおよび3’BamHI制限部位を既に含んでいる。すべてのサイトカインをNcoI/BamHIフラグメントとしてCH1ドメインの後にクローニングした。これらの構築物において、サイトカイン配列は読み枠は揃っていなかった。したがって、アダプター(5’ TCGACAAGAAAG 3’)をSalIとNcoI制限部位間に導入した。その結果、得られる構築物においては重鎖およびサイトカインはアダプター配列によって導入された一つのアミノ酸(Ala)の追加された融合タンパク質として発現される。DraIII/BamHIフラグメントを、完全MAb425重鎖cDNAクローンを含むpHCMV発現ベクターにクローニングした。この構築物において、pelBリーダー配列はMAb425重鎖cDNAのリーダー配列に置き換えられた。
【0052】
CH2およびCH3融合タンパク質の作出
ΔSacII cγ1DNAの増幅をPCR手法によって、IL−2およびIL−7などの対応するサイトカインの5’末端と、読み枠を揃えてオーバーラップするCH2−3’末端プライマーを用いる二つの別々の反応で行った。IL−2およびIL−7cDNAクローンもまた、PCRによって増幅した。SK+ベクターおよび続いてのpHCMV発現ベクターへのサブクローニングを促進するために、3’末端において、唯一のNotIおよびSalI部位をIL−2構築物に、唯一のXbaI部位をIL−7構築物にそれぞれ導入した。IL−2およびIL−7PCR産生物の完全ΔSacII cγ1領域との融合をPCR組み換えによって行った。得られるBamHI/NotI ΔSacII cγ1 CH2−IL−2フラグメントを、MAb425重鎖可変部を含むSK+にサブクローニングした。SacII/XbaI ΔSacII cγ1 CH2−IL−7フラグメントを、MAb425重鎖可変部およびSacII部位までのΔSacII cγ1領域を含むSK+ベクターにサブクローニングした。この工程によって完全MAb425−CH2−IL−2およびIL−7融合遺伝子がそれぞれ作出された。完全MAb425−CH3−IL−2も同様にして作出されるが、この場合はΔSacII cγ1を5’末端として唯一SacII部位から増幅した。CH2−IL−2融合物を含むSK+中のMAb425−CH2−IL−2のSacII/PstIフラグメントを、次いでCH3−IL−2融合物を含むSacII/PstIフラグメントに置き換えた。完全なMAb425融合遺伝子を次いで真核細胞中における発現のためにpHCMVベクターにクローニングした。
【0053】
免疫抱合体の発現
CH1ドメインのみを含む一価の免疫抱合体またはCH2およびCH2プラスCH3ドメインを含む二価の免疫抱合体の発現のためのベクター構築物の宿主細胞への導入は、電気穿孔法、DEAEデキストラン、リン酸カルシウム、リポフェクチンまたはプロトプラスト融合によって行うことができる。免疫抱合体および適当な軽鎖をコードする組み換えDNA配列がその細胞において正しくmRNAに転写される限り、いかなる宿主細胞型を用いてもよい。宿主細胞としては、免疫グロブリンを産生しないマウスミエローマ細胞、例えばSp2/0−AG14(ATCC DRL1581)、P3X63Ag8.653(ATCC CRL1580)またはハムスター細胞、例えばCHO−K1(ATCC CCL61)、またはCHO/dhFr−(ATCC CRL9096)、またはBHK−21(ATCC CCL10)が用いられる。過渡的発現には、COS−1(ATCC CRL1650)またはCOS−7(ATCC CRL1651)が用いられる。
【0054】
免疫抱合体の過渡的発現
発現ベクターpHCMVは、アカゲザルウイルス40(SV40)の複製開始点を含む。細胞系COS−7は、開始点欠失SV40ウイルスで形質転換されたアカゲザル細胞系CV−1から誘導されたものである。したがって、SV40複製開始点を含むプラスミドは増幅されて、免疫抱合体の産生が向上すると考えられる。上清を72時間後に集めて、EGF−受容体結合およびサイトカイン濃度について調べた。
【0055】
免疫抱合体の定常的発現
免疫抱合体の発現のための組み換え構築物を含むベクターを、適当な宿主細胞に導入する。重鎖および軽鎖構築物を同一または別々のベクターに入れることができる。後者の場合は、両ベクターはネオマイシン耐性またはdhFrなどの同一の選択マーカーまたは二つの異なる選択マーカーを両ベクターの選択検出のために含ませればよい。dhFrマーカーの選択は、CHO/dhFr−などのdhFr陰性細胞系においてのみ可能である。クローンを免疫抱合体の発現についてEGF−受容体特異性ELISAを用いて分析する。選択されたクローンを、次いで、限定希釈クローニングによってさらに精製する。
【0056】
MAb425−CH1−サイトカイン融合タンパク質発現のための原核細胞発現ベクターの構築
MAb425軽鎖および重鎖のFdフラグメントをコードするDNA配列を、pSW1ベクターの多クローニング部位に導入した。成熟軽鎖コード配列および成熟重鎖コード配列は、細菌性pelB遺伝子のリーダーペプチドの先に位置する。重鎖コード配列は、3’NcoI部位を含む。サイトカインをコードするcDNAをPCRによって修飾して、NcoI(5’末端)およびNotI(3’末端)制限部位を導入した。サイトカイン遺伝子を枠内で重鎖のCH1ドメインに直接に融合させた。これらの実験に用いたプライマーを表2に纏めて示す。
【0057】
【表1】

【0058】
【表2】

【0059】
これらのベクターによって、機能的Fab−サイトカイン融合タンパク質の大腸菌における効率的な発現が可能になる。軽鎖および重鎖サイトカイン融合タンパク質は、誘導性lacプロモーターのコントロール下にあるジシストロン・メッセンジャーRNA(SkerraおよびPlueckthun、Science、242、1038−104、1988)上に位置される。したがって、Fab−融合タンパク質の発現は、培養条件の要求に従って誘導することができる。両タンパク質のジシストロン・メッセンジャーRNAからの翻訳は等量のFd−IL−2融合タンパク質および軽鎖の合成に好都合であるので、その結果、機能性Fab−融合タンパク質への正しい組立のチャンスが高まる。二つのポリペプチドは大腸菌のペリプラズム中に分泌され、ここで、折り畳み、ジスルフィド結合の形成および機能性FAb425−CH1融合タンパク質への組立がなされる。細菌培養の延長下で、タンパク質は培養培地中に分泌される。
【0060】
MAb425−CH1−IL−2融合タンパク質の大腸菌における発現、および精製
タンパク質発現に適する大腸菌株を、発現プラスミドによって形質転換させた。細胞をOD5800.5になるまで増殖させて、IPTG(1mM)で誘導した。細胞を一晩増殖させて、上清および細胞を回収した。上清を抗MAb425抗イディオタイプカラムに載せる。カラムを0.5M NaCl−リン酸緩衝溶液で洗浄して、結合したタンパク質を100mMグリシン−0.5M NaCl(pH2.5)で溶出した。溶出された液を、2.5M トリス(pH8)で直ちに中和した。MAb425−CH1−IL−2を含むフラクションをプールし、濃縮して、PBSに対して透析した。
【0061】
MAb425免疫抱合体の結合特性
MAb425免疫抱合体の結合特性を、EGF受容体特異性ELISAによって決定した。すなわち、マイクロタイタープレートを、精製EGF受容体を用いて4℃で一晩被覆して、未結合タンパク質を洗浄除去した。プレートを、融合タンパク質を含む上清または非抱合MAbまたはFabフラグメントを含む上清または精製したかたちのタンパク質とともにインキュベートした。プレートを洗浄して、ペルオキシダーゼと抱合したヤギ抗ヒトIgGおよびIgM(重鎖および軽鎖)とともにインキュベートした。基質を加えて、結合したEGF受容体特異性タンパク質の量を450nmで測定して決定した(図2)。サイトカイン濃度は、それぞれのサイトカインに特異的な市販のELISAを用いて、製造元の指示に従って決定した(データ表示せず)。
【0062】
白血球の増殖
腫瘍特異性エフェクター細胞
末梢血単核白血球およびメラノーマ患者から分離された腫瘍浸潤リンパ球(TIL)を、照射(30Gy)した同原性腫瘍細胞と培地(RPMI1640、1%ペニシリン/ストレプトマイシン、1%グルタミン、20mMHepes、50mM β−メルカプトエタノール、10%胎児ウシ血清、20U/mlのIL−2、20U/mlのIL−4)中で共培養した。応答細胞を同原性腫瘍細胞で毎週刺激した。
【0063】
増殖の測定
サイトカイン媒介増殖は次のような細胞を用いて測定することができる。すなわち、
a)適当なインジケーター細胞系。
【0064】
IL−2の場合、IL−2依存性マウス細胞系CTLL−2(ATCC TIB241)(図3 A)、または他のIL−2依存性細胞系を用いることができる。
【0065】
b)インビトロ 培養 腫瘍浸潤リンパ球(図3 B)
c)PHA−M(シグマ)によって前処理した、新たに分離した血液単球細胞。この場合、実験は、MAb425−IL−4融合タンパク質を用いて行った(図4)。
【0066】
健康な供血者またはメラノーマ患者から調製した、新鮮なヒト末梢血白血球、またはメラノーマ患者から分離したTILを、インビトロで増殖させた(上記を参照されたい)。融合タンパク質を分析するために、白血球を96ウェル平底マイクロタイタープレート中で1×105細胞/ウェルの密度で最終容量200μlにして培養した。細胞を、融合タンパク質を含む上清または非抱合MAbを含む上清または非抱合サイトカインを含む上清または精製タンパク質とともにインキュベートした。72時間後、細胞を0.5μCi 3H−チミジンで処理した。放射能の取り込みを、一晩インキュベートした後に、液体シンチレーションβプレートカウンターを用いて測定した。結果を平均cpmで表す。
【0067】
MAb425−TNFα免疫抱合体の細胞毒性の測定
TNFα媒介細胞毒性の測定
TNFαは種々の腫瘍細胞を含むある種の細胞には直接的に細胞毒性を示すことが報告された。TNFαの直接的細胞毒性は、L929ネズミ線維芽細胞(ATCC CCL1)またはWEHI164(ATCC CRL1751)、または他のTNFα感受性細胞系を用いて、決定することができる(FlickおよびGifford、J.Immunol.Meth.、68、167、1984)。図4において、MAb425−CH1−TNFαおよびMAb425−CH2−TNFαの細胞毒性は、WEHI164細胞をインジケーター細胞系として示されている。
【0068】
TNFα誘導細胞毒性の測定
高浸潤性で自然転移性のEGF受容体陽性細胞系C8161(Welchら、Int.J.Cancer、47、227、1991およびその引用文献)などのEGF受容体陽性細胞系を、同原性腫瘍浸潤リンパ球、またはメラノーマ患者または健康な供血者から分離された、新鮮なヒト末梢血リンパ球による、細胞溶解の標的細胞として使用することができる。腫瘍細胞およびTILの培養条件は、既に記載されている(Shimizuら、Cancer Res.、51、6153、1991)。
【0069】
インビトロ細胞毒性アッセイを、51Cr−標識腫瘍標的細胞を用いて行った。標的細胞を51Cr(100μCi/107細胞)で1時間標識して、次いで3回洗浄して過剰の51Crを除去した。2x103標識細胞/ウェルを、融合タンパク質を含む上清または非抱合MAbを含む上清または非抱合サイトカインを含む上清(対照)または精製タンパク質の存在下でエフェクター細胞と96ウェルマイクロタイタープレート中で共インキュベートした。上清または精製タンパク質を培養培地で連続希釈して、アッセイは三重に行った。プレートを、37℃、4時間、10%CO2雰囲気下でインキュベートした。次いで、細胞を遠心分離によって除去して、上清中の放射能を、γカウンターを用いて測定した。次の計算式によって特異的51Cr放出(%)を算出した。
【0070】
特異的51Cr放出(%)=100×(実験的放出−自然放出)/(最大放出−自然放出)
【0071】
免疫抱合体の治療的使用
本発明の免疫抱合体は、治療のためにヒト患者に投与することができる。したがって、本発明の目的は、上記および請求の範囲に記載の少なくとも一つの融合タンパク質を活性組成分として、一つまたはそれ以上の薬剤学的に容認し得る担体、賦形剤または希釈剤とともに含んでなる薬物調製物を提供することにある。
【0072】
通常、本発明の免疫抱合体は静脈注射によってまたは非経口的に投与される。一般に、免疫抱合体の投与量は、所望の腫瘍抑制および腫瘍溶解効果が得られる範囲の量である。投与量は、患者の年齢、状態、性別、病気の程度によって異なり、0.1mg/kg〜200mg/kg、好ましくは0.1mg/kg〜100mg/kg/用量の範囲で、1日1回またはそれ以上を1日または数日間投与することができる。
【0073】
非経口的投与のための調製物には、滅菌水溶液または非水溶液、懸濁液および乳濁液が含まれる。非水性溶媒の例としては、プロピレングリコール、ポリエチレングリコール、オリーブ油などの植物油、オレイン酸エチルなどの注射可能な有機エステルおよびこれらの目的に適した当業者に公知の他の溶媒があげられる。本発明の免疫抱合体は、生理学的に容認し得る担体からなる組成物において使用することができる。それら適当な担体の例としては、生理食塩水、PBS、リンゲル溶液または乳酸リンゲル溶液があげられる。保存剤および他の添加剤、例えば抗生物質、抗酸化剤およびキレート剤などを薬剤調製物に加えることも可能である。
【0074】
本発明の薬剤調製物は、メラノーマ、神経膠腫および癌腫、さらに血液腫瘍および固形腫瘍を含むあらゆる種類の腫瘍の治療に適している。
【産業上の利用可能性】
【0075】
本発明は、腫瘍関連標的エレメント、最も好ましくは、ヒト上皮増殖因子受容体(EGFR)などのヒト腫瘍細胞上で優先的に発現される分子を優先的に認識するモノクローナル抗体またはそのフラグメントおよび成長および/または分化因子のような生物活性を有するリガンドからなる新規融合タンパク質に関する。得られる融合タンパク質は、特異的標的細胞または組織に生物活性を有するリガンドを運ぶために用いることができる。新規の免疫抱合体は腫瘍の治療に使用することができる。
【図面の簡単な説明】
【0076】
【図1】抗体−サイトカイン免疫抱合体のモデル図;(a)抗体−CH1抱合体、(b)抗体−CH2抱合体、(c)抗体−CH3抱合体。
【図2】EGR−R特異性ELISAにおける免疫抱合体のEGF−Rへの結合。
【図3】図3中、Aは、COS−7細胞において発現されたMAb425−CH1−IL−2免疫抱合体のIL−2活性、Bは、大腸菌において発現されたMAb425−CH1−IL−2免疫抱合体のIL−2活性、Cは、MAb425−CH1−IL−2免疫抱合体によるTIL増殖の誘導。
【図4】MAb425−IL−4免疫抱合体によるHPBL増殖の誘導。
【図5】WEHI164細胞に対するMAb425−TNFα免疫抱合体細胞毒性。
【図6】PBMCによるMAb425−TNFα免疫抱合体媒介腫瘍細胞溶解
【符号の説明】
【0077】
C=サイトカイン
VH=重鎖可変部
VL=軽鎖可変部
CH=重鎖定常部
CL=軽鎖定常部
【技術分野】
【0001】
本発明は、腫瘍関連標的エレメント、最も好ましくは、ヒト上皮増殖因子受容体(EGFR)などのヒト腫瘍細胞上で優先的に発現される分子を優先的に認識するモノクローナル抗体またはそのフラグメントおよび成長および/または分化因子のような生物活性を有するリガンドからなる新規融合タンパク質に関する。得られる融合タンパク質は、特異的標的細胞または組織に生物活性を有するリガンドを運ぶために用いることができる。新規の免疫抱合体は腫瘍の治療に使用することができる。
【背景技術】
【0002】
多様な治療概念が癌患者の治療のために用いられてきた。過去数年、悪性細胞上で発現される細胞表面分子を特異的にまたは選択的に認識するモノクローナル抗体を用いて臨床試験が行われてきた。このアプローチのねらいは、癌細胞を排除するために抗体依存性細胞性細胞毒性(ADCC)または補体媒介細胞毒性(CDC)を誘導することである。第二のアプローチは、免疫応答のサイトカイン媒介活性化である。サイトカイン誘導抗腫瘍活性は次のようなもので媒介され得る。すなわち、1)腫瘍増殖に対するサイトカインの直接的細胞毒性/細胞制圧効果2)LAK活性または単球/マクロファージ媒介細胞毒性などの腫瘍−抗原−非特異的メカニズム3)CD4およびCD8陽性T細胞によって媒介される腫瘍−抗原−特異的免疫応答。この場合、腫瘍に対する全身性免疫が動物モデルにおいて観察された。あいにく、IL−2またはTNFαなどのサイトカインの全身性適用はそれらの毒性によって妨げられている(Rubin、Cancer Invest.、11、460−472、1990;Balkwill、Nature、361、206−207、1993)。
【0003】
腫瘍部位における充分なサイトカイン濃度を確実にするためにはかなり多量の投与が必要であるが、最大許容量は有効用量以下である。したがって、サイトカインのマイナス効果は主に全身的適用の結果もたらされるが、腫瘍治療におけるそれらの臨床的効果は疑いの余地がない。動物モデルにおいて、腫瘍内注射またはトランスフェクトさせた腫瘍細胞の分泌のいずれかによってサイトカインを腫瘍部位に存在させることによって腫瘍を退行させ得ることが示された(Hockら、PNAS、90、2774−2778、1993;Colomboら、Cancer Res.、52、4853−4857、1992;McBrideら、Cancer Res.、52,3931−3937、1992;Tepperら、Science、257、548−551、1992;Mullenら、Cancer Res.、52、6020−6024、1992;Blankensteinら、J.Exp.Med.、173、1047−1052、1991;Gansbacherら、J.Exp.Med.、172、1217−1224、1990)。これらのシステムでは、サイトカインは腫瘍の増殖は障害しないが、迅速で有効な抗腫瘍反応を活性化することができる。したがって、エフェクター分子と標的エレメントとの物理的組み合わせは、周辺部の存在を減らして生物活性を有するリガンドの腫瘍内での利用を促進する。さらに、単一腫瘍細胞またはミクロ転移もまた、これらの分子の標的となり得る。
【0004】
抗体特異性標的のための生物活性を有するリガンドは、直接的にまたは標的細胞に対する致死的環境をつくり出すことによって標的細胞の破壊を誘導しなければならない。生物活性を有するリガンドとしては、IL−1、IL−2、IL−4、IL−6、IL−7、IL−10、IL−13、IFN、TNFαまたはCSFなどのサイトカインがある。これらのサイトカインは、抗腫瘍効果を直接的にあるいは宿主の防護機構を活性化するかのいずれかによって発揮することが示された(Mire−Sluis、TIBTECH、11、74−77、1993;Columboら、Cancer Res.、52、4853−4857、1992;ThomasおよびBalkwill、Pharmac.Ther.、52、307−330、1991)。
【0005】
例えば、IL−2は免疫応答の中心メディエーターと考えられている。IL−2は、T細胞およびNK細胞の増殖を刺激することおよびリンホカイン活性化キラー細胞(LAK)を誘導することが示されている。腫瘍浸潤Tリンパ球はIL−2に応答して増殖する。さらに、IL−2はT細胞および単球の細胞毒性を増強する。加えて、IL−2は、免疫応答をさらに増強するT細胞、NK細胞および単球によって分泌されるサイトカインカスケードを誘導する。
【0006】
TNFαは、主にある種の腫瘍細胞に対するその直接的な細胞毒性および腫瘍の出血性退行の誘導のために腫瘍治療における広範な適用が見出だされている。加えて、TNFαは免疫応答を増強する。すなわち、これはT細胞増殖に対して共刺激作用を有し、MHCクラスIおよびクラスII抗原の発現およびマクロファージによるTNFα、IFNおよびIL−1の分泌を誘導する。IL−4は、最初はB細胞増殖因子として記述された。さらなる研究で、IL−4は抗原特異性細胞毒性T細胞を刺激することおよびNK細胞様LAKよりもむしろT細胞様LAK細胞に特異的に作用することが示された。IL−4は、ヒトメラノーマ細胞の成長を阻害して、それらのMHCクラスIおよびIIの発現を促進する。IL−4によるマクロファージ媒介抗腫瘍効果の誘導についてはまだ議論の余地がある。
【0007】
IL−7は、preB細胞およびヒト末梢CD4およびCD8陽性T細胞の増殖因子である。IL−7は、CD8陽性T細胞亜集団の細胞毒性を増強する。加えて、IL−7は、末梢単球によるIL−1、IL−6およびTNFαの産生を誘導する。インビトロにおいて、単球/マクロファージの腫瘍殺傷活性はIL−7によって刺激され、これはおそらくTNFαなどのサイトカインによって媒介される。
【0008】
上皮増殖因子(EGF)は、表皮および上皮細胞のミトゲンであるポリペプチドホルモンである。EGFが感受性細胞と相互作用するときには、これは膜受容体(EGFR)に結合する。EGFRは、約170kDの貫膜糖タンパク質であって、cerb−B プロトオンコジーン(癌原遺伝子)の遺伝子産物である。
【0009】
ネズミモノクローナル抗体MAb425はヒトA431癌腫細胞系(ATCCC RL1555)に対してつくられたもので、EGFRの外側ドメイン上のポリペプチドエピトープに結合することが見出だされた。これはEGFの結合を阻害し、インビトロで腫瘍細胞毒性を媒介し、インビトロで上皮および結腸直腸癌腫由来の細胞系の腫瘍細胞増殖を抑制することが見出だされた(Rodeckら、Cancer Res.、47、3692、1987)。MAb425のヒト化されたキメラは、WO92/15683から公知である。
【0010】
活性タンパク質の指向的送達のための多様な組み合わせの抗体−サイトカイン免疫抱合体については、既に記述がある。IL−2は、ヒト癌腫特異性抗体L6(Fellら、J.Immunol.、146、2446−2452、1991、EP−OS−0439095)と、または抗ガングリオシドGD2抗体(Gilliesら、PNAS、89、1428−1432、1992、WO92/08495)と組み合わされた。抗ダンシル抗体およびIGF1からなる免疫抱合体はホルモンの指向的送達のためにつくられた(ShinおよびMorrison、PNAS、87、5322−5326、1990、WO91/14438)。
【特許文献1】WO 92/15683
【特許文献2】EP−OS−0439095
【特許文献3】WO 92/08495
【特許文献4】WO 91/14437
【非特許文献1】Rubin, Cnacer Invest. 11:460−472, 1990
【非特許文献2】Balkwill, Nature 361:206−207, 1993
【非特許文献3】Hock et al. PNAS 90:2774−2778, 1993
【非特許文献4】Colombo et al. Cancer Res. 52:4853−4857, 1992
【非特許文献5】McBride et al. Cancer Res. 52:3931−3937, 1992
【非特許文献6】Tepper et al. Science 257:548−551, 1992
【非特許文献7】Mullen et al. Cancer Res. 52:6020−6024, 1992
【非特許文献8】Blankenstein et al. J. Exp.Med.173:1047−1052, 1991
【非特許文献9】Gansbacher et al. J. Exp.Med.172:1217−1224, 1990
【非特許文献10】Mire−Sluis, TIBTECH 11:74−77, 1993
【非特許文献11】Thomas & Balkwill, Pharmac. Ther. 52:307−330, 1991
【非特許文献12】Rpdeck et al. Cancer Res. 47:3692, 1987
【非特許文献13】Fell et al. J. Immunol.146:2446−2452, 1991
【非特許文献14】Gillies et al. PNAS 89:1428−1432, 1992
【非特許文献15】Shin & Morrison, PNAS 87:5322−5326, 1990
【発明の開示】
【発明が解決しようとする課題】
【0011】
このように、本発明の目的は、(1)腫瘍細胞表面のEGFR抗原特異性エピトープおよび(2)細胞毒性の誘導にきわめて有力な生物活性を有するリガンドからなり、したがってその場での抗腫瘍効果を増強する抗体またはそのフラグメントをつくり出すことであった。
【課題を解決するための手段】
【0012】
本発明は、モノクローナル抗体の部分、少なくとも抗原認識部位または完全なモノクローナル抗体を、生物活性を有するリガンドと組み合わせる免疫抱合体に関する。これらの免疫抱合体をコードする構築物は、組み換えDNA技術によって作出される。免疫抱合体は、抗体重鎖の可変部ならびに定常部のCH1ドメイン(抗体−CH1抱合体)、または定常部のCH1およびCH2ドメイン(抗体−CH2抱合体)、または定常部のCH1、CH2およびCH3ドメイン(抗体−CH3抱合体)を、生物活性を有するリガンドに融合して含む。適合する軽鎖を加えることによって、抗原保有細胞を標的にして、活性リガンドを生体の特定の部位に送達するような免疫抱合体を作出することができる(図1 a〜c)。
【発明の効果】
【0013】
本発明の免疫抱合体を用いることによって、メラノーマ、神経膠腫および癌腫などの腫瘍を検出して治療することができる。
【発明を実施するための最良の形態】
【0014】
このように、本発明の目的は、(1)上皮増殖因子受容体(EGFR)の抗原エピトープを保有する腫瘍細胞に特異性のモノクローナル抗体またはそのフラグメント、および(2)該抗体または抗体フラグメントに融合し、腫瘍細胞をとくにその場で溶解する細胞毒性を有するかまたは腫瘍特異性免疫応答を誘導するような生物活性を有するリガンド、好ましくはサイトカインからなる免疫抱合体を提供することである。
【0015】
本発明による好ましい実施態様においては、サイトカインは、TNFα、IL−2、IL−4およびIL−7からなる群から選択される。
【0016】
本発明の他の好ましい実施態様においては、抗体または抗体フラグメントは、ネズミ、ヒト化またはキメラMAb425に由来する。
【0017】
本発明のさらなる好ましい実施態様においては、免疫抱合体は、MAb425−CH1−TNFα、MAb425−CH2−TNFα、MAb425−CH3−TNFα、MAb425−CH1−IL−2、MAb425−CH2−IL−2およびMAb425−CH3−IL−2、MAb425−CH1−IL−7、MAb425−CH2−IL−7およびMAb425−CH3−IL−7からなる群から選択される。
【0018】
さらに、本発明の目的は上記および請求の範囲に定義した免疫抱合体の製造法を提供することであって、これは、宿主生物を用いて、抗体または抗体フラグメントおよび生物活性を有するリガンドをコードするDNA配列を互いに融合させて、得られる構築物を発現ベクターに導入して、これで該宿主生物を形質転換させて、この宿主細胞を栄養溶液中で培養して、融合タンパク質を発現させることによって行われる。
【0019】
本発明による好ましい実施態様においては、抗体または抗体フラグメントおよび生物活性を有するリガンドをコードするDNA配列を所望の融合DNA配列に相補的なオリゴヌクレオチドを用いて一本鎖DNA上に融合させるという手法が用いられる。
さらに、本発明の目的は、少なくとも上記および請求の範囲に定義した免疫抱合体および生物学的に容認し得る担体からなる薬剤組成物を提供することにある。
【0020】
最後に、本発明の目的は、上記および請求の範囲に定義した免疫抱合体の腫瘍に向けた薬物の調製のための使用である。
【0021】
とくに、例えば、MAb425−CH2−TNFαおよびMAb425−CH3−TNFαなどの抗体−CH2および抗体−CH3抱合体の場合、細胞性細胞毒性の誘導は、カップリングさせないTNFαよりも優れていた。これは、おそらく、結合的性質ならびに、モノクローナル抗体の定常部およびサイトカイン活性によるADCCの誘導に関する組み合わせによるものと考えられる。
【0022】
本発明による抗体−CH1抱合体は、小分子であること、および原核細胞における発現が可能であるという点で有利である。さらに、サイズが小さいことによって(腫瘍)組織への進入が促進される。
【0023】
本発明の免疫抱合体はさらに、好ましくはMAb425またはそのフラグメントなどのモノクローナル抗体と比較して、良好な結合および増殖特性を示す。
【0024】
材料および方法
モノクローナル抗体
MAb425は、ヒトA431癌腫細胞系(ATCC CRL1555)に対するIgG1ネズミモノクローナル抗体である。MAb425は、ヒトEGF受容体の外側ドメインのポリペプチドエピトープと結合し、EGFの結合と競合する。MAb425は、インビボで腫瘍細胞毒性を媒介することおよびインビトロで類表皮腫および結腸直腸癌腫由来細胞系の腫瘍細胞増殖を抑制することが見出だされた(Rodeckら、Cancer Res、47、3692、1987)。ヒト化およびキメラ型MAb425はWO92/15683に開示されている。
【0025】
サイトカイン
サイトカインをコードするcDNAは、British Biotechnology Limited(Herrmann Biermann GMBH、Bad Nauheim FRG;ヒトIL−2 BBG30、ヒトIL−4 BBG15、ヒトIL−7 BBG43、ヒトTNFα BBG18)から購入した。市販のcDNAは、タンパク質分泌に必要なシグナル配列を欠いている。サイトカインをコードするcDNAは、サイトカイン産生細胞から分離されるmRNAから作出することができる。
【0026】
ベクター
pUC19は一連の多重コピー数大腸菌プラスミドクローニングベクターの一部であって、pBR322およびM13mp19の部分を含む。pUC19は、誘導性細菌性lacプロモーター−オペレーターおよびそれに続く多クローニング部位を含む(Yanisch−Perronら、Gene、33、103−109、1985)。pUCベクターは、市販されている(例えばNew England Biolabsなど)。pBluescript KS/SK+およびKS/SK−ファージミド・ベクターはpUC19に由来する。これらベクターは市販されている(Stratagene)。
【0027】
真核細胞発現ベクターpHCMV(Gilliesら、Cell、33、717、1983)は、シミアン(アカゲザル)ウイルス40(SV40)の複製開始点およびヒトサイトメガロウイルスのプロモーターおよびエンハンサー領域を含む。プロモーター/エンハンサー領域の後には、発現されるべき遺伝子導入のための多クローニング部位(mcs)が続く。このベクターにおいて、MAb425重鎖可変部のキメラ型およびΔSacII cγ1領域とそれにCH1、CH2またはCH3ドメインの末端でそれぞれ融合したエフェクター分子とを組み合わせて、MAb425重鎖融合タンパク質がつくり出された。この融合Ig鎖を、適合する軽鎖と組み合わせることによって、一価の抗原結合領域を形成して、これを免疫抱合体に組み立てることができ、これを会合させて標的抗原に特異的な二価の免疫抱合体を産生するができる(図1)。重鎖および軽鎖構築物は、同一のまたは別々のベクターに導入することができる。
【0028】
原核細胞発現ベクターは、pSW1ベクター(Wardら、Nature、341、544−546、1989)に基づき、これはpUC19ベクターに由来する。pSW1は、Erwinia carotovoraからの細菌性pelB遺伝子のリーダーペプチドをコードする配列を含む(Leiら、J.Bact.、169、4379−4383、1987)。外来性DNAをpelBリーダー配列の後に、読み枠を揃えて導入して、ペリプラズム中へのタンパク質発現を行わせることができる。
【0029】
[図面および表の簡単な説明]
[表1] MAb425−サイトカイン融合タンパク質の作出のために用いたPCRプライマー(真核細胞発現)
* StratageneのpBluescriptベクターSK+/−およびKS+/−とハイブリダイズするリバース・プライマー(市販品)
** このプライマーは、単一のSacII部位を含むCg1定常部とハイブリダイズする。
【0030】
*** M13由来のベクターとハイブリダイズするリバース・プライマー(市販品)
[表2] MAb425−サイトカイン融合タンパク質の作出のために用いたPCRプライマー(原核細胞発現)
[図1] 抗体−サイトカイン免疫抱合体のモデル図
C=サイトカイン;VH=重鎖可変部;VL=軽鎖可変部;CH=重鎖定常部;CL=軽鎖定常部。
【0031】
(a)抗体−CH1抱合体、(b)抗体−CH2抱合体、(c)抗体−CH3抱合体。
【0032】
[図2] EGR−R特異性ELISAにおける免疫抱合体のEGF−Rへの結合
過渡的にトランスフェクトさせたCOS−7細胞の上清の免疫抱合体含量を調べた。
【0033】
縦軸:490nmでの%吸収、横軸:上清希釈(log2)。
【0034】
黒丸:MAb425CH1−TNFα、黒四角:MAb425CH2−TNFα、黒三角:MAb425CH3−TNFα、黒菱:MAb425−対照、黒逆三角:MAb425FAb−対照、黒六角:再成形したMAb425F(ab’)2(精製タンパク質)。
【0035】
[図3A] COS−7細胞において発現されたMAb425−CH1−IL−2免疫抱合体のIL−2活性
CTLL−2細胞をインジケーター細胞系として用いた。MAb425−CH1−IL−2を含む連続希釈したCOS上清の増殖活性を左図に示す(黒丸)。MAb425Fab−対照を含むCOS上清を対照として用いた(白丸)。組み換え市販IL−2タンパク質を伴うあるいはIL−2を伴わない(KO)活性化時のCTLL−2細胞の増殖応答を右図に示した。
【0036】
[図3B] 大腸菌において発現されたMAb425−CH1−IL−2免疫抱合体のIL−2活性
CTLL−2細胞をインジケーター細胞系として用いた。大腸菌中で発現させて抗MAb425イディオタイプカラム上でアフィニティークロマト精製したMAb425−CH1−IL−2の連続希釈物の増殖活性を左図に示す(黒三角)。MAb425−CH1−IL−を含むCOS上清を対照として用いた(黒丸)。透析緩衝液(黒四角)。緩衝液がIL−活性に影響しなかったことを確認するために、透析緩衝液を一定濃度のIL−2(1U/ml)の存在下で滴定した(逆黒三角)。組み換え市販IL−2タンパク質を伴うあるいはIL−2を伴わない(KO)活性化時のCTLL−2細胞の増殖応答を右図に示した。
【0037】
[図3C] MAb425−CH1−IL−2免疫抱合体によるTIL増殖の誘導
メラノーマ腫瘍浸潤リンパ球を、MAb425−CH1−IL−2免疫抱合体を含む連続希釈したCOS上清の存在下または非存在(KO)下で培養した(左図)。組み換え市販IL−2を用いた活性化時のTILの増殖応答を右図に示す。
【0038】
[図4] MAb425−IL−4免疫抱合体によるHPBL増殖の誘導
PHA活性化HPBLを、MAb425−CH2−IL−4(黒丸)、MAb435−CH3−IL−4(黒三角)融合タンパク質を含む連続希釈したCOS上清の存在下で培養した。MAb425(黒四角)、IL−4(黒菱)およびベクター対照(黒逆三角)を含む上清を対照として用いた。組み換え市販IL−4を伴うおよび成長因子と伴わない(KO)活性化時のHPBLの増殖応答を右図(上)に示す。
【0039】
[図5] WEHI164細胞に対するMAb425−TNFα免疫抱合体細胞毒性
TNFα感受性ネズミ線維肉腫細胞系WEHI164を、MAb425−CH1−TNFα免疫抱合体(黒四角)、またはMAb425−CH2−TNFα免疫抱合体(黒三角)、またはMAb425Fab−対照(黒丸)を含む連続希釈したCOS上清の存在下で48時間培養した(左図:上)。市販の組み換えヒトTNFαによって誘導されるインジケーター細胞の増殖阻害を右図(下)に示す。
【0040】
[図6] PBMCによるMAb425−TNFα免疫抱合体媒介腫瘍細胞溶解
非活性化ヒト末梢血リンパ球(PBMC)をエフェクター細胞として用いて、異質遺伝子的EGF−R陽性の51Cr標識C8161標的細胞とともに、エフェクター/標的細胞比30:1の割合で共培養した。特異的溶解(%)をMAb425−CH3−TNFα免疫抱合体を含む連続希釈したCOS培養上清の非存在または存在下で18時間培養した後に調べる(ハッチングを施したバー)。組み換えTNFα(Genzyme)は36kDダイマーとして大腸菌中で発現させた(ドットを施したバー)。
【実施例】
【0041】
一般:
本出願に記載の他の微生物、細胞系、プラスミド、プロモーター、耐性マーカー、複製開始点、制限部位またはベクターの他のフラグメントは、市販されているかまたは他の手段でふつうに入手が可能である。とくに記載がない限り、これらは例として使用されているもので、本発明に必須ではなく、他の適当な手段および生物学的材料で置き換えることができる。
【0042】
本発明に必須の方法技術を、以下に詳細に記述する。詳細な記述のない他の方法技術は、当業者に公知の標準法であるかまたは引用参考文献および特許出願または標準的文献(例えば、「Antibodies、A LaboratoryManual」、Harlow、Lane、Cold Spring Harbor、1988)により詳細に記述されている。
【0043】
融合タンパク質の真核細胞における発現
Fab425−サイトカイン融合タンパク質発現のための真核細胞発現ベクターの構築
MAb425およびサイトカインのループ・アウト手法による融合:
TNFα構築物の作出:
ΔSacII cγ1クローンのSacII/XbaIフラグメントを、TNFαcDNAなどのサイトカインをコードする配列を含むBluescriptSK+に挿入した。TNFα cDNAをSmaI部位とEcoRI部位との間に導入した。得られる構築物を適当なヘルパーファージを加えることによって一本鎖DNAに調製した。CH2またはCH3ドメインをTNFαコード配列の5’末端と読み枠を合わせて融合させた。下記のオリゴヌクレオチド、すなわち
【0044】
【化1】

【0045】
は、それぞれCH2ドメインおよびCH3ドメインの3’末端、およびTNFαコード配列と一致する。一本鎖DNA配列をオリゴヌクレオチドによって一体にして、間の不要な配列を構築物から除去する。上方の鎖が一本鎖DNAとして作出されたので、オリゴヌクレオチドは逆配向を有している。
DNAを配列合成酵素(シクエナーゼ・ポリメラーゼ)によって二本鎖型に形成した。この酵素は、AmplitaqDNAポリメラーゼのようにエラーを生じる傾向にはないので、単離されたクローンの接合部のDNA配列のみを決定した。正しい配列を有するこれらクローンを、完全なMAb425融合タンパク質を作出するために必要な配列と組み合わせて、真核細胞での発現のためにpHCMVベクターにクローニングした。
【0046】
IL−4構築物の作出:
これらの構築のために、完全なΔSacIIcγ1クローンをKpnI/SalIフラグメントとしてBluescriptKS+に挿入した。IL−4をHindIII/EcoRIフラグメントとして同じベクターにクローニングした。融合を上記のTNFα構築物と同様にして下記のそれぞれCH2およびCH3ドメインの融合のためのオリゴヌクレオチド、すなわち
【0047】
【化2】

【0048】
を用いて行った。
【0049】
正しい配列を有するこれらクローンを完全なMAb425融合タンパク質を作出するために必要な配列と組み合わせて、真核細胞での発現のためにpHCMVベクターにクローニングした。
【0050】
PCR手法によるMAb425とサイトカインとの融合
AmplitaqDNAポリメラーゼはエラーを生じがちであるので、エラーがなかったことを確認するためにPCR手法によって増幅されたこれら配列を決定した。これらの実験に用いたプライマーを、表1に纏めて示す。
【0051】
CH1融合タンパク質の作出
pUH5プラスミドは原核細胞発現のための重鎖FAb425フラグメントのてめの配列、それにErwinia carotovoraに由来するタンパク質分泌を確実にするN末端pelBリーダー配列(Leiら、J.Bact.、169、4379−4383、1987)を含む。HindIII/NotIフラグメントをBluescriptKS+ベクターに再クローニングした。サイトカインIL−4およびIL−7をPCR手法によって増幅して、5’NcoIおよび3’BamHI制限部位をそれぞれ導入した。IL−2およびTNFαは5’NcoIおよび3’BamHI制限部位を既に含んでいる。すべてのサイトカインをNcoI/BamHIフラグメントとしてCH1ドメインの後にクローニングした。これらの構築物において、サイトカイン配列は読み枠は揃っていなかった。したがって、アダプター(5’ TCGACAAGAAAG 3’)をSalIとNcoI制限部位間に導入した。その結果、得られる構築物においては重鎖およびサイトカインはアダプター配列によって導入された一つのアミノ酸(Ala)の追加された融合タンパク質として発現される。DraIII/BamHIフラグメントを、完全MAb425重鎖cDNAクローンを含むpHCMV発現ベクターにクローニングした。この構築物において、pelBリーダー配列はMAb425重鎖cDNAのリーダー配列に置き換えられた。
【0052】
CH2およびCH3融合タンパク質の作出
ΔSacII cγ1DNAの増幅をPCR手法によって、IL−2およびIL−7などの対応するサイトカインの5’末端と、読み枠を揃えてオーバーラップするCH2−3’末端プライマーを用いる二つの別々の反応で行った。IL−2およびIL−7cDNAクローンもまた、PCRによって増幅した。SK+ベクターおよび続いてのpHCMV発現ベクターへのサブクローニングを促進するために、3’末端において、唯一のNotIおよびSalI部位をIL−2構築物に、唯一のXbaI部位をIL−7構築物にそれぞれ導入した。IL−2およびIL−7PCR産生物の完全ΔSacII cγ1領域との融合をPCR組み換えによって行った。得られるBamHI/NotI ΔSacII cγ1 CH2−IL−2フラグメントを、MAb425重鎖可変部を含むSK+にサブクローニングした。SacII/XbaI ΔSacII cγ1 CH2−IL−7フラグメントを、MAb425重鎖可変部およびSacII部位までのΔSacII cγ1領域を含むSK+ベクターにサブクローニングした。この工程によって完全MAb425−CH2−IL−2およびIL−7融合遺伝子がそれぞれ作出された。完全MAb425−CH3−IL−2も同様にして作出されるが、この場合はΔSacII cγ1を5’末端として唯一SacII部位から増幅した。CH2−IL−2融合物を含むSK+中のMAb425−CH2−IL−2のSacII/PstIフラグメントを、次いでCH3−IL−2融合物を含むSacII/PstIフラグメントに置き換えた。完全なMAb425融合遺伝子を次いで真核細胞中における発現のためにpHCMVベクターにクローニングした。
【0053】
免疫抱合体の発現
CH1ドメインのみを含む一価の免疫抱合体またはCH2およびCH2プラスCH3ドメインを含む二価の免疫抱合体の発現のためのベクター構築物の宿主細胞への導入は、電気穿孔法、DEAEデキストラン、リン酸カルシウム、リポフェクチンまたはプロトプラスト融合によって行うことができる。免疫抱合体および適当な軽鎖をコードする組み換えDNA配列がその細胞において正しくmRNAに転写される限り、いかなる宿主細胞型を用いてもよい。宿主細胞としては、免疫グロブリンを産生しないマウスミエローマ細胞、例えばSp2/0−AG14(ATCC DRL1581)、P3X63Ag8.653(ATCC CRL1580)またはハムスター細胞、例えばCHO−K1(ATCC CCL61)、またはCHO/dhFr−(ATCC CRL9096)、またはBHK−21(ATCC CCL10)が用いられる。過渡的発現には、COS−1(ATCC CRL1650)またはCOS−7(ATCC CRL1651)が用いられる。
【0054】
免疫抱合体の過渡的発現
発現ベクターpHCMVは、アカゲザルウイルス40(SV40)の複製開始点を含む。細胞系COS−7は、開始点欠失SV40ウイルスで形質転換されたアカゲザル細胞系CV−1から誘導されたものである。したがって、SV40複製開始点を含むプラスミドは増幅されて、免疫抱合体の産生が向上すると考えられる。上清を72時間後に集めて、EGF−受容体結合およびサイトカイン濃度について調べた。
【0055】
免疫抱合体の定常的発現
免疫抱合体の発現のための組み換え構築物を含むベクターを、適当な宿主細胞に導入する。重鎖および軽鎖構築物を同一または別々のベクターに入れることができる。後者の場合は、両ベクターはネオマイシン耐性またはdhFrなどの同一の選択マーカーまたは二つの異なる選択マーカーを両ベクターの選択検出のために含ませればよい。dhFrマーカーの選択は、CHO/dhFr−などのdhFr陰性細胞系においてのみ可能である。クローンを免疫抱合体の発現についてEGF−受容体特異性ELISAを用いて分析する。選択されたクローンを、次いで、限定希釈クローニングによってさらに精製する。
【0056】
MAb425−CH1−サイトカイン融合タンパク質発現のための原核細胞発現ベクターの構築
MAb425軽鎖および重鎖のFdフラグメントをコードするDNA配列を、pSW1ベクターの多クローニング部位に導入した。成熟軽鎖コード配列および成熟重鎖コード配列は、細菌性pelB遺伝子のリーダーペプチドの先に位置する。重鎖コード配列は、3’NcoI部位を含む。サイトカインをコードするcDNAをPCRによって修飾して、NcoI(5’末端)およびNotI(3’末端)制限部位を導入した。サイトカイン遺伝子を枠内で重鎖のCH1ドメインに直接に融合させた。これらの実験に用いたプライマーを表2に纏めて示す。
【0057】
【表1】

【0058】
【表2】

【0059】
これらのベクターによって、機能的Fab−サイトカイン融合タンパク質の大腸菌における効率的な発現が可能になる。軽鎖および重鎖サイトカイン融合タンパク質は、誘導性lacプロモーターのコントロール下にあるジシストロン・メッセンジャーRNA(SkerraおよびPlueckthun、Science、242、1038−104、1988)上に位置される。したがって、Fab−融合タンパク質の発現は、培養条件の要求に従って誘導することができる。両タンパク質のジシストロン・メッセンジャーRNAからの翻訳は等量のFd−IL−2融合タンパク質および軽鎖の合成に好都合であるので、その結果、機能性Fab−融合タンパク質への正しい組立のチャンスが高まる。二つのポリペプチドは大腸菌のペリプラズム中に分泌され、ここで、折り畳み、ジスルフィド結合の形成および機能性FAb425−CH1融合タンパク質への組立がなされる。細菌培養の延長下で、タンパク質は培養培地中に分泌される。
【0060】
MAb425−CH1−IL−2融合タンパク質の大腸菌における発現、および精製
タンパク質発現に適する大腸菌株を、発現プラスミドによって形質転換させた。細胞をOD5800.5になるまで増殖させて、IPTG(1mM)で誘導した。細胞を一晩増殖させて、上清および細胞を回収した。上清を抗MAb425抗イディオタイプカラムに載せる。カラムを0.5M NaCl−リン酸緩衝溶液で洗浄して、結合したタンパク質を100mMグリシン−0.5M NaCl(pH2.5)で溶出した。溶出された液を、2.5M トリス(pH8)で直ちに中和した。MAb425−CH1−IL−2を含むフラクションをプールし、濃縮して、PBSに対して透析した。
【0061】
MAb425免疫抱合体の結合特性
MAb425免疫抱合体の結合特性を、EGF受容体特異性ELISAによって決定した。すなわち、マイクロタイタープレートを、精製EGF受容体を用いて4℃で一晩被覆して、未結合タンパク質を洗浄除去した。プレートを、融合タンパク質を含む上清または非抱合MAbまたはFabフラグメントを含む上清または精製したかたちのタンパク質とともにインキュベートした。プレートを洗浄して、ペルオキシダーゼと抱合したヤギ抗ヒトIgGおよびIgM(重鎖および軽鎖)とともにインキュベートした。基質を加えて、結合したEGF受容体特異性タンパク質の量を450nmで測定して決定した(図2)。サイトカイン濃度は、それぞれのサイトカインに特異的な市販のELISAを用いて、製造元の指示に従って決定した(データ表示せず)。
【0062】
白血球の増殖
腫瘍特異性エフェクター細胞
末梢血単核白血球およびメラノーマ患者から分離された腫瘍浸潤リンパ球(TIL)を、照射(30Gy)した同原性腫瘍細胞と培地(RPMI1640、1%ペニシリン/ストレプトマイシン、1%グルタミン、20mMHepes、50mM β−メルカプトエタノール、10%胎児ウシ血清、20U/mlのIL−2、20U/mlのIL−4)中で共培養した。応答細胞を同原性腫瘍細胞で毎週刺激した。
【0063】
増殖の測定
サイトカイン媒介増殖は次のような細胞を用いて測定することができる。すなわち、
a)適当なインジケーター細胞系。
【0064】
IL−2の場合、IL−2依存性マウス細胞系CTLL−2(ATCC TIB241)(図3 A)、または他のIL−2依存性細胞系を用いることができる。
【0065】
b)インビトロ 培養 腫瘍浸潤リンパ球(図3 B)
c)PHA−M(シグマ)によって前処理した、新たに分離した血液単球細胞。この場合、実験は、MAb425−IL−4融合タンパク質を用いて行った(図4)。
【0066】
健康な供血者またはメラノーマ患者から調製した、新鮮なヒト末梢血白血球、またはメラノーマ患者から分離したTILを、インビトロで増殖させた(上記を参照されたい)。融合タンパク質を分析するために、白血球を96ウェル平底マイクロタイタープレート中で1×105細胞/ウェルの密度で最終容量200μlにして培養した。細胞を、融合タンパク質を含む上清または非抱合MAbを含む上清または非抱合サイトカインを含む上清または精製タンパク質とともにインキュベートした。72時間後、細胞を0.5μCi 3H−チミジンで処理した。放射能の取り込みを、一晩インキュベートした後に、液体シンチレーションβプレートカウンターを用いて測定した。結果を平均cpmで表す。
【0067】
MAb425−TNFα免疫抱合体の細胞毒性の測定
TNFα媒介細胞毒性の測定
TNFαは種々の腫瘍細胞を含むある種の細胞には直接的に細胞毒性を示すことが報告された。TNFαの直接的細胞毒性は、L929ネズミ線維芽細胞(ATCC CCL1)またはWEHI164(ATCC CRL1751)、または他のTNFα感受性細胞系を用いて、決定することができる(FlickおよびGifford、J.Immunol.Meth.、68、167、1984)。図4において、MAb425−CH1−TNFαおよびMAb425−CH2−TNFαの細胞毒性は、WEHI164細胞をインジケーター細胞系として示されている。
【0068】
TNFα誘導細胞毒性の測定
高浸潤性で自然転移性のEGF受容体陽性細胞系C8161(Welchら、Int.J.Cancer、47、227、1991およびその引用文献)などのEGF受容体陽性細胞系を、同原性腫瘍浸潤リンパ球、またはメラノーマ患者または健康な供血者から分離された、新鮮なヒト末梢血リンパ球による、細胞溶解の標的細胞として使用することができる。腫瘍細胞およびTILの培養条件は、既に記載されている(Shimizuら、Cancer Res.、51、6153、1991)。
【0069】
インビトロ細胞毒性アッセイを、51Cr−標識腫瘍標的細胞を用いて行った。標的細胞を51Cr(100μCi/107細胞)で1時間標識して、次いで3回洗浄して過剰の51Crを除去した。2x103標識細胞/ウェルを、融合タンパク質を含む上清または非抱合MAbを含む上清または非抱合サイトカインを含む上清(対照)または精製タンパク質の存在下でエフェクター細胞と96ウェルマイクロタイタープレート中で共インキュベートした。上清または精製タンパク質を培養培地で連続希釈して、アッセイは三重に行った。プレートを、37℃、4時間、10%CO2雰囲気下でインキュベートした。次いで、細胞を遠心分離によって除去して、上清中の放射能を、γカウンターを用いて測定した。次の計算式によって特異的51Cr放出(%)を算出した。
【0070】
特異的51Cr放出(%)=100×(実験的放出−自然放出)/(最大放出−自然放出)
【0071】
免疫抱合体の治療的使用
本発明の免疫抱合体は、治療のためにヒト患者に投与することができる。したがって、本発明の目的は、上記および請求の範囲に記載の少なくとも一つの融合タンパク質を活性組成分として、一つまたはそれ以上の薬剤学的に容認し得る担体、賦形剤または希釈剤とともに含んでなる薬物調製物を提供することにある。
【0072】
通常、本発明の免疫抱合体は静脈注射によってまたは非経口的に投与される。一般に、免疫抱合体の投与量は、所望の腫瘍抑制および腫瘍溶解効果が得られる範囲の量である。投与量は、患者の年齢、状態、性別、病気の程度によって異なり、0.1mg/kg〜200mg/kg、好ましくは0.1mg/kg〜100mg/kg/用量の範囲で、1日1回またはそれ以上を1日または数日間投与することができる。
【0073】
非経口的投与のための調製物には、滅菌水溶液または非水溶液、懸濁液および乳濁液が含まれる。非水性溶媒の例としては、プロピレングリコール、ポリエチレングリコール、オリーブ油などの植物油、オレイン酸エチルなどの注射可能な有機エステルおよびこれらの目的に適した当業者に公知の他の溶媒があげられる。本発明の免疫抱合体は、生理学的に容認し得る担体からなる組成物において使用することができる。それら適当な担体の例としては、生理食塩水、PBS、リンゲル溶液または乳酸リンゲル溶液があげられる。保存剤および他の添加剤、例えば抗生物質、抗酸化剤およびキレート剤などを薬剤調製物に加えることも可能である。
【0074】
本発明の薬剤調製物は、メラノーマ、神経膠腫および癌腫、さらに血液腫瘍および固形腫瘍を含むあらゆる種類の腫瘍の治療に適している。
【産業上の利用可能性】
【0075】
本発明は、腫瘍関連標的エレメント、最も好ましくは、ヒト上皮増殖因子受容体(EGFR)などのヒト腫瘍細胞上で優先的に発現される分子を優先的に認識するモノクローナル抗体またはそのフラグメントおよび成長および/または分化因子のような生物活性を有するリガンドからなる新規融合タンパク質に関する。得られる融合タンパク質は、特異的標的細胞または組織に生物活性を有するリガンドを運ぶために用いることができる。新規の免疫抱合体は腫瘍の治療に使用することができる。
【図面の簡単な説明】
【0076】
【図1】抗体−サイトカイン免疫抱合体のモデル図;(a)抗体−CH1抱合体、(b)抗体−CH2抱合体、(c)抗体−CH3抱合体。
【図2】EGR−R特異性ELISAにおける免疫抱合体のEGF−Rへの結合。
【図3】図3中、Aは、COS−7細胞において発現されたMAb425−CH1−IL−2免疫抱合体のIL−2活性、Bは、大腸菌において発現されたMAb425−CH1−IL−2免疫抱合体のIL−2活性、Cは、MAb425−CH1−IL−2免疫抱合体によるTIL増殖の誘導。
【図4】MAb425−IL−4免疫抱合体によるHPBL増殖の誘導。
【図5】WEHI164細胞に対するMAb425−TNFα免疫抱合体細胞毒性。
【図6】PBMCによるMAb425−TNFα免疫抱合体媒介腫瘍細胞溶解
【符号の説明】
【0077】
C=サイトカイン
VH=重鎖可変部
VL=軽鎖可変部
CH=重鎖定常部
CL=軽鎖定常部
【特許請求の範囲】
【請求項1】
(1)上皮増殖因子受容体(EGFR)の抗原エピトープを有する腫瘍細胞に対するモノクローナル抗体またはそのフラグメントおよび(2)該抗体または抗体フラグメントと融合し、腫瘍細胞をその場で特異的に溶解する細胞毒性を有するか腫瘍特異性免疫応答を誘導する生物活性を有するリガンドからなる免疫抱合体。
【請求項2】
生物活性を有するリガンドがサイトカインである
請求項1に記載の免疫抱合体。
【請求項3】
サイトカインがTNFα、IL−2、IL−4またはIL−7からなる群から選択される
請求項2に記載の免疫抱合体。
【請求項4】
該抗体が、抗体重鎖の可変部、定常部のCH1ドメインおよび適当な軽鎖から本質的になるFabフラグメントまたはF(ab’)2フラグメントである(抗体−CH1抱合体)
請求項1、2または3に記載の免疫抱合体。
【請求項5】
該抗体が、抗体重鎖の可変部、定常部のCH1およびCH2ドメインおよび適当な軽鎖から本質的になる抗体フラグメントである(抗体−CH2抱合体)
請求項1、2または3に記載の免疫抱合体。
【請求項6】
該抗体が、抗体重鎖の可変部、定常部のCH1、CH2およびCH3ドメインおよび適当な軽鎖から本質的になる(抗体−CH3抱合体)
請求項1、2または3に記載の免疫抱合体。
【請求項7】
該抗体または抗体フラグメントが、ネズミ、ヒト化またはキメラMAb425に由来する
請求項1〜5のいずれか一項に記載の免疫抱合体。
【請求項8】
MAb425−CH1−TNFα、MAb425−CH2−TNFα、MAb425−CH3−TNFα、MAb425−CH2−IL2、MAb425−CH2−IL2およびMAb425−CH3−IL2からなる群から選択される免疫抱合体。
【請求項9】
請求項1〜8のいずれか1項に記載の免疫抱合体の調製法であって、
抗体または抗体フラグメントおよび生物活性を有するリガンドをコードするDNA配列をともに融合して、
得られる構築物を発現ベクターに導入してそれで宿主細胞を形質転換して、
その宿主細胞を栄養溶液中で培養して、融合タンパク質を発現する
ことからなる調製法。
【請求項10】
抗体または抗体フラグメントおよび生物活性を有するリガンドをコードするDNA配列を、所望の融合DNA配列に相補的なオリゴヌクレオチドを用いて一本鎖DNA上に融合させる
ことを特徴とする請求項9に記載の調製法。
【請求項11】
大腸菌宿主における抗体−CH1抱合体の発現のための
請求項9または10に記載の調製法。
【請求項12】
真核細胞宿主における抗体−CH2または抗体−CH3抱合体の発現のための
請求項9または10に記載の調製法。
【請求項13】
請求項1〜8に記載の少なくとも一つの免疫抱合体および生物学的に容認し得る担体からなる薬剤組成物。
【請求項14】
腫瘍に向けた薬物の調製のための請求項1〜8項のいずれか1項に記載の免疫抱合体の使用。
【特許請求の範囲】
【請求項1】
(1)上皮増殖因子受容体(EGFR)の抗原エピトープを有する腫瘍細胞に対するモノクローナル抗体またはその抗体フラグメント、および(2)該抗体またはその抗体フラグメントのC末端に融合されている、系内において腫瘍細胞を特異的に溶解する細胞毒性を有するか、腫瘍特異的な免疫応答を誘導する、生物活性を有するリガンドからなる免疫抱合体であり、その際、
該生物活性を有するリガンドは、TNFαであり、
該抗体またはその抗体フラグメントのC末端に、該生物活性を有するリガンドのN末端が融合されており、
該抗体またはその抗体フラグメントは、
本質的に、抗体重鎖の可変部、定常部のCH1ドメイン、CH2ドメインおよびCH3ドメインおよび、対応する全抗体分子に由来する軽鎖とからなる抗体; または、本質的に、抗体重鎖の可変部、定常部のCH1ドメインおよびCH2ドメインおよび、対応する全抗体分子に由来する軽鎖とからなる抗体フラグメントであり、
該抗体またはその抗体フラグメントは、ネズミ、ヒト化またはキメラMAb425に由来する
ことを特徴とする免疫抱合体。
【請求項2】
MAb425−CH2−TNFα、MAb425−CH3−TNFαからなる群から選択される、請求項1に記載の免疫抱合体。
【請求項3】
請求項1または2に記載の免疫抱合体の調製法であって、
該抗体または抗体フラグメントおよび該生物活性を有するTNFαをコードするDNA配列を、オリゴ核酸を利用して、所望の融合DNA配列に対して相補的である一本鎖DNA上において、相互に融合する工程;
得られる構築物を発現ベクターに導入して、それで宿主細胞を形質転換する工程;
ならびに、
その宿主細胞を栄養溶液中で培養して、融合タンパク質を発現する工程とを含んでなる
ことを特徴とする調製法。
【請求項4】
発現される融合タンパク質は、請求項1に記載の抗体−CH3抱合体である
ことを特徴とする請求項3に記載の調製法。
【請求項5】
大腸菌宿主中において、抗体−CH2または抗体−CH3抱合体を発現するための請求項3に記載の調製法。
【請求項6】
真核細胞宿主中において、抗体−CH2または抗体−CH3抱合体を発現するための請求項3に記載の調製法。
【請求項7】
請求項1または2に記載される免疫抱合体の少なくとも一つ、および生物学的に容認し得る担体を含んでなる、腫瘍の治療に利用可能な薬剤組成物。
【請求項8】
腫瘍を対象とする治療に利用可能な医薬の調製において、その活性成分として、請求項1または2に記載の免疫抱合体を使用する方法。
【請求項1】
(1)上皮増殖因子受容体(EGFR)の抗原エピトープを有する腫瘍細胞に対するモノクローナル抗体またはそのフラグメントおよび(2)該抗体または抗体フラグメントと融合し、腫瘍細胞をその場で特異的に溶解する細胞毒性を有するか腫瘍特異性免疫応答を誘導する生物活性を有するリガンドからなる免疫抱合体。
【請求項2】
生物活性を有するリガンドがサイトカインである
請求項1に記載の免疫抱合体。
【請求項3】
サイトカインがTNFα、IL−2、IL−4またはIL−7からなる群から選択される
請求項2に記載の免疫抱合体。
【請求項4】
該抗体が、抗体重鎖の可変部、定常部のCH1ドメインおよび適当な軽鎖から本質的になるFabフラグメントまたはF(ab’)2フラグメントである(抗体−CH1抱合体)
請求項1、2または3に記載の免疫抱合体。
【請求項5】
該抗体が、抗体重鎖の可変部、定常部のCH1およびCH2ドメインおよび適当な軽鎖から本質的になる抗体フラグメントである(抗体−CH2抱合体)
請求項1、2または3に記載の免疫抱合体。
【請求項6】
該抗体が、抗体重鎖の可変部、定常部のCH1、CH2およびCH3ドメインおよび適当な軽鎖から本質的になる(抗体−CH3抱合体)
請求項1、2または3に記載の免疫抱合体。
【請求項7】
該抗体または抗体フラグメントが、ネズミ、ヒト化またはキメラMAb425に由来する
請求項1〜5のいずれか一項に記載の免疫抱合体。
【請求項8】
MAb425−CH1−TNFα、MAb425−CH2−TNFα、MAb425−CH3−TNFα、MAb425−CH2−IL2、MAb425−CH2−IL2およびMAb425−CH3−IL2からなる群から選択される免疫抱合体。
【請求項9】
請求項1〜8のいずれか1項に記載の免疫抱合体の調製法であって、
抗体または抗体フラグメントおよび生物活性を有するリガンドをコードするDNA配列をともに融合して、
得られる構築物を発現ベクターに導入してそれで宿主細胞を形質転換して、
その宿主細胞を栄養溶液中で培養して、融合タンパク質を発現する
ことからなる調製法。
【請求項10】
抗体または抗体フラグメントおよび生物活性を有するリガンドをコードするDNA配列を、所望の融合DNA配列に相補的なオリゴヌクレオチドを用いて一本鎖DNA上に融合させる
ことを特徴とする請求項9に記載の調製法。
【請求項11】
大腸菌宿主における抗体−CH1抱合体の発現のための
請求項9または10に記載の調製法。
【請求項12】
真核細胞宿主における抗体−CH2または抗体−CH3抱合体の発現のための
請求項9または10に記載の調製法。
【請求項13】
請求項1〜8に記載の少なくとも一つの免疫抱合体および生物学的に容認し得る担体からなる薬剤組成物。
【請求項14】
腫瘍に向けた薬物の調製のための請求項1〜8項のいずれか1項に記載の免疫抱合体の使用。
【特許請求の範囲】
【請求項1】
(1)上皮増殖因子受容体(EGFR)の抗原エピトープを有する腫瘍細胞に対するモノクローナル抗体またはその抗体フラグメント、および(2)該抗体またはその抗体フラグメントのC末端に融合されている、系内において腫瘍細胞を特異的に溶解する細胞毒性を有するか、腫瘍特異的な免疫応答を誘導する、生物活性を有するリガンドからなる免疫抱合体であり、その際、
該生物活性を有するリガンドは、TNFαであり、
該抗体またはその抗体フラグメントのC末端に、該生物活性を有するリガンドのN末端が融合されており、
該抗体またはその抗体フラグメントは、
本質的に、抗体重鎖の可変部、定常部のCH1ドメイン、CH2ドメインおよびCH3ドメインおよび、対応する全抗体分子に由来する軽鎖とからなる抗体; または、本質的に、抗体重鎖の可変部、定常部のCH1ドメインおよびCH2ドメインおよび、対応する全抗体分子に由来する軽鎖とからなる抗体フラグメントであり、
該抗体またはその抗体フラグメントは、ネズミ、ヒト化またはキメラMAb425に由来する
ことを特徴とする免疫抱合体。
【請求項2】
MAb425−CH2−TNFα、MAb425−CH3−TNFαからなる群から選択される、請求項1に記載の免疫抱合体。
【請求項3】
請求項1または2に記載の免疫抱合体の調製法であって、
該抗体または抗体フラグメントおよび該生物活性を有するTNFαをコードするDNA配列を、オリゴ核酸を利用して、所望の融合DNA配列に対して相補的である一本鎖DNA上において、相互に融合する工程;
得られる構築物を発現ベクターに導入して、それで宿主細胞を形質転換する工程;
ならびに、
その宿主細胞を栄養溶液中で培養して、融合タンパク質を発現する工程とを含んでなる
ことを特徴とする調製法。
【請求項4】
発現される融合タンパク質は、請求項1に記載の抗体−CH3抱合体である
ことを特徴とする請求項3に記載の調製法。
【請求項5】
大腸菌宿主中において、抗体−CH2または抗体−CH3抱合体を発現するための請求項3に記載の調製法。
【請求項6】
真核細胞宿主中において、抗体−CH2または抗体−CH3抱合体を発現するための請求項3に記載の調製法。
【請求項7】
請求項1または2に記載される免疫抱合体の少なくとも一つ、および生物学的に容認し得る担体を含んでなる、腫瘍の治療に利用可能な薬剤組成物。
【請求項8】
腫瘍を対象とする治療に利用可能な医薬の調製において、その活性成分として、請求項1または2に記載の免疫抱合体を使用する方法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】




【図2】


【図3】


【図4】


【図5】


【図6】


【公開番号】特開2006−298936(P2006−298936A)
【公開日】平成18年11月2日(2006.11.2)
【国際特許分類】
【出願番号】特願2006−178409(P2006−178409)
【出願日】平成18年6月28日(2006.6.28)
【分割の表示】特願平6−320978の分割
【原出願日】平成6年12月22日(1994.12.22)
【出願人】(591032596)メルク パテント ゲゼルシャフト ミット ベシュレンクテル ハフトング (1,043)
【氏名又は名称原語表記】Merck Patent Gesellschaft mit beschraenkter Haftung
【住所又は居所原語表記】Frankfurter Str. 250,D−64293 Darmstadt,Federal Republic of Germany
【Fターム(参考)】
【公開日】平成18年11月2日(2006.11.2)
【国際特許分類】
【出願日】平成18年6月28日(2006.6.28)
【分割の表示】特願平6−320978の分割
【原出願日】平成6年12月22日(1994.12.22)
【出願人】(591032596)メルク パテント ゲゼルシャフト ミット ベシュレンクテル ハフトング (1,043)
【氏名又は名称原語表記】Merck Patent Gesellschaft mit beschraenkter Haftung
【住所又は居所原語表記】Frankfurter Str. 250,D−64293 Darmstadt,Federal Republic of Germany
【Fターム(参考)】
[ Back to top ]

