免疫測定装置、免疫測定法、免疫測定プログラム
【課題】B/F分離処理を含む免疫測定技術において、B/F分離に用いるノズルが不溶物により詰まるという問題を解決する。
【解決手段】反応容器内の抗体結合担体又は抗原結合担体に反応した抗原又は抗体と未反応な遊離抗原又は遊離抗体を洗浄し前記未反応な遊離抗原又は遊離抗体を吸引部(ノズル)により吸引することで分離するB/F分離部を備えた免疫測定装置であって、前記B/F分離部の前段に、前記反応容器に光照射を行う発光部と、反応容器の透過光を測定する受光部と、を備えた測光部と、前記受光部における受光強度に基づいて、前記吸引部の詰まりの原因となる不溶物の有無を判定する不溶物判定部と、を有することを特徴とする免疫測定装置。
【解決手段】反応容器内の抗体結合担体又は抗原結合担体に反応した抗原又は抗体と未反応な遊離抗原又は遊離抗体を洗浄し前記未反応な遊離抗原又は遊離抗体を吸引部(ノズル)により吸引することで分離するB/F分離部を備えた免疫測定装置であって、前記B/F分離部の前段に、前記反応容器に光照射を行う発光部と、反応容器の透過光を測定する受光部と、を備えた測光部と、前記受光部における受光強度に基づいて、前記吸引部の詰まりの原因となる不溶物の有無を判定する不溶物判定部と、を有することを特徴とする免疫測定装置。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、B/F分離を含む免疫測定技術に関し、特に、B/F分離の不溶物判定技術に関する。
【背景技術】
【0002】
図1は、B/F(Bound/Free)分離を必要とするヘテロジニアスな免疫測定法の流れの概要の一例を示す図である。抗原(Antigen)または抗体(Antibody)などの免疫測定法として、競合法あるいはサンドイッチ法等が知られている。これは、反応液3で満たされた反応容器(セル等)1内で抗原抗体反応(免疫反応)を行わせ、この磁性粒子やポリスチレン粒子、プレートなどに固相化された抗原・抗体と複合体を形成するコンジュゲートに予め標識されている酵素を結合させることにより抗原・抗体を検出する方法である。この方法では、固相化抗原・抗体に反応した抗体・抗原と複合体を形成したコンジュゲートのみを反応容器1内に残し、反応しなかった抗原・抗体と複合体を形成していないコンジュゲートは反応容器1内から除去する。
【0003】
ヘテロジニアスな免疫測定法では、この除去操作が必要であり、一般にB/F分離という。通常はこのB/F分離のために、抗原抗体反応を行う抗原103あるいは抗体101を反応容器1内の担体に予め固定しておく(図1(a)、この場合には、抗原103の量を測定する。)。担体として例えば磁性粒子105を用いる場合、抗体101を表面に固定した磁性粒子105に、測定対象となる特定の抗原103を含む溶液を添加し、1次免疫反応を反応容器1内で行わせた後に(図1(b)、磁性粒子105に固定された抗体101に抗原103を結合させる。)、反応容器1に磁石5を接触あるいは接近させることで、反応容器1内の内側壁に抗体101と抗原103とが結合された磁性粒子105が捕捉される(図1(c))。
【0004】
図1(c)に示す状態で、反応容器1の内側壁に捕捉されなかった不純物を含む非磁性成分(図では未反応の抗原103a等)を、吸引ノズル7で吸引除去するとともに洗浄液を吐出部11から吐出する。磁石5を反応容器1から十分に離して洗浄液を洗浄液吐出部11から分注すると、反応生成物は反応容器1内側壁から離れ、磁性粒子105全体に洗浄液が行き渡り、前記の吸引のみでは除去しきれなかった不純物(freeの抗原・抗体等)を剥離することができる。図1(d)に示すように、酵素標識抗体107(抗体109に酵素111が結合したもの)を添加して2次免疫反応をさせると、結合磁性粒子105に固定された抗体101に抗原103を結合させた複合体に、酵素標識抗体107が結合する(複合体Xが形成される)。ここで、未反応の酵素標識抗体107aを除去するために、図1(e)に示すように、再び磁石5を反応容器1に接触あるいは接近させると、反応容器1内側壁に反応生成物(複合体X)が捕捉され、さらに前記と同様に吸引ノズル7によって不純物等(未反応の酵素標識抗体107aを含む)を含んだ洗浄液を吸引ノズル7で吸引除去する洗浄液を吐出部11から吐出する。
【0005】
この操作を繰り返すことで反応生成物の洗浄効果が高まり、予め酵素を標識しているコンジュゲートと抗原抗体とからなる複合体Xのみを残すことができる。従って、高精度な分析結果(抗原103の濃度、量等を求めるための分析結果)を得ることができる。尚、洗浄液を分注した後に攪拌作業を実施すれば、さらなる洗浄効果の向上が期待できる。次いで、図1(f)に示すように、発光基質113を反応液に添加する。すると、発光基質113が酵素標識抗体107により消費され、その際にシグナルを発する。このようにして、複合体Xのシグナルを分析することができる。例えば抗原103の数が多いほど、消費される基質数が多くなるため、図1(f)の状態でシグナルを測定することで、シグナル量に依存する抗原又は抗体の量(濃度)を測定することができ、検体中の対象物質の濃度を知ることができる。
【0006】
ここで、このB/F分離を確実に行うことにより、免疫測定法におけるシグナルのバックグラウンドは小さくなり、測定の感度と精度を高めることができる。
【0007】
従来、B/F分離の確実性を増すために洗浄回数を増加させることは、測定の高速化や高スループット化を妨げるという問題があった。このため、最短の動作で最大の分離効率を得るための種々の発明がなされてきた。その一例としては、B/F分離に用いる洗浄液の組成の改良や、洗浄液残りの低減などが挙げられる。
【0008】
下記特許文献1は、担体表面に固定された分子と溶液中の分子を結合させる抗原抗体反応において、洗浄液の吐出と排出の繰返しによって未結合の分子を除去するB/F分離を行う際の洗浄を、1回目は所定の濃度の洗浄液となるような吐出とその後の排出を行い、2回目以降は前の回よりも濃くない洗浄液になるような吐出とその後の排出を行い、最終回は、初回の濃度より薄い洗浄液になるような吐出とその後の排出とを行うものである。これにより、全体としては洗浄液量を減らして効率よく洗浄を行い、かつ、洗浄液残存の影響を低減することができる。
【0009】
また、下記特許文献2に記載の乳び・溶血検体検出装置においては、検体を分析する分析処理の前に前記検体の画像情報を検出する撮像部と、検出した前記画像情報に基づき、前記検体の色から前記検体の乳び状態または溶血状態を検出する乳び・溶血検体検出部と、を備えるものである。検体の画像情報を利用して検体の色から前記検体の乳び状態または溶血状態を検出することで、高い精度で、かつ、効率良く、検体の状態を検出することができる。例えば、検体の色が黄色の場合を正常状態として設定し、ティーチングにより判定処理を行う。例えば検体の色が赤色、桃色、橙色など、正常状態よりも赤みがかっている場合には溶血状態と判定する。一方、検体の色が桃色や乳白色など、正常状態よりも白濁している場合には乳び状態と判定することができる。
【先行技術文献】
【特許文献】
【0010】
【特許文献1】特開2009−162733号公報
【特許文献2】特開2010−281604号公報
【発明の概要】
【発明が解決しようとする課題】
【0011】
しかしながら、特許文献1に記載の技術を用いた場合に、B/F分離後の吸引工程において、ノズルが不溶物により詰まるという問題が生じていた。また、特許文献2に記載の技術では、検体の画像情報に基づいて白濁の度合いを検査しているが、目視の場合と同様に、検出精度があまり良くないという問題もある。
【0012】
また、B/F分離工程における問題点として、例えば、HCV(C型肝炎ウイルス)コア抗原などの測定系においては、ウイルス内のコア抗原を表出させるために、界面活性剤を含む酸やアルカリによる変性前処理が必要となる。この前処理を、高タンパク血症の検体で行うと、不可逆的なタンパク変性が生じ多様な不溶物が発生するという問題がある。
【0013】
かかる処理により生じた変性物や血漿(または血清)のフィブリン塊、尿・便中の不純物などの不溶物がB/F分離の際に用いる吸引ノズル7を詰まらせるという現象が生じ、B/F分離処理部を含む装置の不良・トラブルが発生するという問題がある。
【0014】
また、B/F分離処理が不完全になることで、測定結果が偽陽性になったり、偽陰性になったりすることにより、医療過誤の要因となるという問題もあった。
【0015】
本発明は、B/F分離処理を含む免疫測定技術において、B/F分離に用いるノズルが不溶物により詰まるという問題を解決することを目的とする。また、不溶物の検出精度を向上させることを目的とする。
【課題を解決するための手段】
【0016】
上記目的を達成するために、本発明のB/F分離を含む免疫測定装置においては、B/F分離部の前段に、不溶物検出部とその測光結果に基づいて不溶物の有無を判定する不溶物判定部とを設け、当該不溶物判定部において、前記B/F分離部において反応容器の内側壁に捕捉されなかった不純物を含む非磁性成分(不溶物)により、ノズルで吸引する際のノズルの詰まりが生じうるか否かを光の透過率に基づいて予め判定し、ノズル詰まりが生じない程度の透過率が得られなかった場合には、そのサンプルは、不溶物によりノズルを詰まらす可能性が高いと判定することを特徴とする。
【0017】
B/F分離部によるノズル吸引より前に、不溶物の有無を判定することで、不溶物に起因するノズル詰まりを防止し、また、不溶物に起因するB/F分離処理が不完全になることを抑制して、抗原濃度などの測定結果が偽陽性になったり、偽陰性になったりすることによる、医療過誤の要因を少なくすることができる。
【0018】
例えば、B/F分離における免疫測定装置のトラブルまたは、医療過誤を回避するために、B/F分離工程前で反応容器に光等を照射し、対向側に配置された受光素子(フォトダイオードなど)により、吸光度変化(またはフォトダイオードの電庄変化)に基づいて、反応容器内の不溶物の有無の判定を行う。この不溶物の判定には、吸光度(または電圧)の積算値やピーク値などを使用することができる。そして、不溶物が有と判定された場合は、B/F分離工程に入る前にその試料を排出または廃棄する。尚、光源としてLEDを用いる場合には、赤(波長635nm付近)、緑(波長525nm付近)、青(波長470nm付近)の全て又はいずれかを使用することができる。光源としては、可視光域を含む波長帯を有する光を用いることができる。
【0019】
本発明の一観点によれば、反応容器内の抗体結合磁性粒子又は抗原結合磁性粒子に反応した抗原又は抗体と未反応な遊離抗原又は遊離抗体を洗浄し、前記未反応な遊離抗原又は遊離抗体を吸引部(ノズル)により吸引することで分離するB/F分離部を備えた免疫測定装置であって、前記B/F分離部の前段に、前記反応容器に光照射を行う発光部と、反応容器の透過光を測定する受光部と、を備えた測光部と、前記受光部における受光強度に基づいて、前記吸引部の詰まりの原因となる不溶物の有無を判定する不溶物判定部と、を有することを特徴とする免疫測定装置が提供される。
【0020】
さらに、不溶物の有無を判定するしきい値を格納するしきい値格納部を設け、前記不溶物判定部は、前記受光部の受光強度と、前記しきい値との大小関係に基づいて、不溶物の有無を判定することを特徴とすることが好ましい。しきい値として、吸光度(または電圧)の積算値を用いることが好ましい。前記発光部の光源として、LEDを用いることが好ましい。前記LEDとして、赤色LEDを用いることが好ましい。共存物質が混入している場合でも、赤色LEDであれば、しきい値を超えない試料を、不溶物の入っている試料と判定しない。
【0021】
前記受光部は、赤色を検出波長帯に含む第1の受光素子と、赤色を検出波長帯に含む第2の受光素子であって、赤色以外をフィルタリングするフィルタ部を受光面側に設け第2の受光素子との受光強度の差異に基づいて、前記不溶物判定部が不溶物の判定を行うことが好ましい。第1受光素子で不溶物とされても、第2受光素子で赤色とされた場合には、ヘモグロビンの共存物質として、不溶物と判定しない。
【0022】
前記しきい値は、モデル検体として、前記吸引部の開口径に近似した粒径を有する沈殿物を入れた反応容器における第1の受光強度と、沈殿物を入れていない反応容器における第2の受光強度との間の値として決められることが好ましい。
【0023】
前記吸引部の詰まりの原因となる不溶物の有無を判定する不溶物判定部は、前記受光部における受光強度に依存するパラメータの積算値に基づいて、不溶物の有無を判定することが好ましい。
【0024】
前記測光部は、前記発光部と前記受光部とが対向する位置に配置され、前記反応容器を鉛直方向にスキャンさせる操作部を有していることが好ましい。これにより積算値を求めることができる。
【0025】
前記測光部の近傍に、前記不溶物判定部が不溶物有りと判定した前記反応容器を排出または廃棄する廃棄部を備えることが好ましい。
【0026】
本発明の他の観点によれば、反応容器内の抗体又は抗原結合磁性粒子に反応した抗原又は抗体と未反応な遊離抗原又は抗体を洗浄し吸引部(ノズル)により吸引することで分離するB/F分離処理を含む免疫測定法であって、前記B/F分離ステップの前ステップとして、前記反応容器に光照射を行う発光部と、反応容器の透過光を測定する受光部と、を備えた測光ステップと、前記受光部における受光強度に基づいて、前記吸引部の詰まりの原因となる不溶物の有無を判定する不溶物判定ステップと、を有することを特徴とする免疫測定法が提供される。
【0027】
また、本発明は、上記に記載の免疫測定法をコンピュータに実行させるためのプログラム、当該プログラムを記録するコンピュータ読み取り可能な記録媒体であっても良い。
【発明の効果】
【0028】
本発明によれば、B/F分離を含む免疫測定装置において、B/F分離処理における不溶物に起因するノズル詰まりを防止することができる。
【0029】
また、不溶物に起因するB/F分離処理が不完全になることを抑制して、対象物質の濃度などの測定結果が偽陽性になったり、偽陰性になったりすることによる、医療過誤の要因を少なくすることができる。
【図面の簡単な説明】
【0030】
【図1】本発明の一実施の形態によるB/F分離を含む免疫測定法の流れを示す概要図である。
【図2A】本発明の一実施の形態による免疫測定装置の概略構成を示す斜視図である。
【図2B】本発明の一実施の形態による免疫測定装置の概略構成を示す分解斜視図である。
【図3】本発明の一実施の形態による免疫測定装置の概略構成を示す平面図である。
【図4】本発明の一実施の形態による免疫測定装置の要部の概略構成を示す図である。
【図5】本発明の一実施の形態による免疫測定装置のうち、不溶物測定部の概略構成を示す図である。
【図6】本発明の一実施の形態による免疫測定装置の概略構成例を示す機能ブロック図である。
【図7】実施例1の標準モデル検体を用いた測光結果を示す図であり、(a)は赤色LEDを、(b)は緑色LEDを、(c)は青色LEDを用いた場合の、受光部(フォトダイオード)の受光強度に依存する電圧と、反応容器のz方向へのスキャンタイミングとの関係を示す図である。
【図8】実施例1の標準モデル検体を用いた測光結果を示す図であり、(a)は赤色LEDを、(b)は緑色LEDを、(c)は青色LEDを用いた場合の、受光部(フォトダイオード)の受光強度に依存する吸光度と、反応容器のz方向へのスキャンタイミングとの関係を示す図である。
【図9】実施例2のモデル検体を用いた免疫測定に用いられる反応容器群の一例を示す図である。
【図10】実施例2のモデル検体を用いた測光結果を示す図であり、(a)は赤色LEDを、(b)は緑色LEDを、(c)は青色LEDを用いた場合の、受光部(フォトダイオード)の受光強度に依存する電圧と、反応容器のz方向へのスキャンタイミングとの関係を示す図である。
【図11】実施例2のモデル検体を用いた測光結果を示す図であり、(a)は赤色LEDを、(b)は緑色LEDを、(c)は青色LEDを用いた場合の、受光部(フォトダイオード)の受光強度に依存する吸光度と反応容器のz方向へのスキャンタイミングとの関係を示す図である。
【図12】実施例3の実検体を用いた免疫測定に用いられる反応容器群の一例を示す図である。
【図13】実施例3の実検体を用いた測光結果を示す図であり、(a)は赤色LEDを、(b)は緑色LEDを、(c)は青色LEDを用いた場合の、受光部(フォトダイオード)の受光強度に依存する電圧と、反応容器のz方向へのスキャンタイミングとの関係を示す図である。
【図14】実施例3の実検体を用いた測光結果を示す図であり、(a)は赤色LEDを、(b)は緑色LEDを、(c)は青色LEDを用いた場合の、受光部(フォトダイオード)の受光強度に依存する吸光度と反応容器のz方向へのスキャンタイミングとの関係を示す図である。
【図15】実施例4の共存物質を含む検体の測光結果を示す図であり、(a)は赤色LEDを、(b)は緑色LEDを、(c)は青色LEDを用いた場合の、受光部(フォトダイオード)の受光強度に依存する電圧と、反応容器のz方向へのスキャンタイミングとの関係を示す図である。
【図16】実施例4の共存物質を含む検体の測光結果を用いた測光結果を示す図であり、(a)は赤色LEDを、(b)は緑色LEDを、(c)は青色LEDを用いた場合の、吸光度と反応容器のz方向へのスキャンタイミングとの関係を示す図である。
【図17】実施例5の免疫測定装置を用いた場合の測光結果を示す図であり、赤色LEDを用い、(a)はBGG依存性、(b)は沈殿物の量依存性、(c)は検体依存性の、受光部(フォトダイオード)の受光強度に依存する電圧と、反応容器のz方向へのスキャンタイミングとの関係を示す図である。
【図18】実施例5の免疫測定装置を用いた場合の測光結果を示す図であり、赤色LEDを用い、(a)はBGG依存性、(b)は沈殿物の量依存性、(c)は検体依存性の、吸光度と反応容器のz方向へのスキャンタイミングとの関係を示す図である。
【図19】実施例6の免疫測定装置を用いた共存の物質のモデル検体として血漿/血清の実検体を用いた場合の測光結果を示す図であり、赤色LEDを用い、(a)は共存物質のモデル検体、(b)は乳び血漿、(c)はHb血漿の、受光部(フォトダイオード)の受光強度に依存する電圧と、反応容器のz方向へのスキャンタイミングとの関係を示す図である。
【図20】実施例6の免疫測定装置を用いた共存の物質のモデル検体として血漿/血清の実検体を用いた場合の測光結果を示す図であり、赤色LEDを用い、(a)は共存物質のモデル検体、(b)は乳び血漿、(c)はHb血漿の、受光部(フォトダイオード)の吸光度と、反応容器のz方向へのスキャンタイミングとの関係を示す図である。
【図21】1ステップ法による免疫測定法の流れを示すフローチャート図である。
【図22】ディレイド1ステップ法による免疫測定法の流れを示すフローチャート図である。
【図23】2ステップ法(1)による免疫測定法の流れを示すフローチャート図である。
【図24】2ステップ法(2)による免疫測定法の流れを示すフローチャート図である。
【図25】前処理付き2ステップ法による免疫測定法の流れを示すフローチャート図である。
【図26】前希釈付き2ステップ法による免疫測定法の流れを示すフローチャート図である。
【発明を実施するための形態】
【0031】
以下、本発明の実施の形態による不溶物判定技術について図面を参照しながら説明を行う。
B/F分離を必要とするヘテロジニアスアッセイ系において、B/F分離とは抗体(または抗原)結合磁性粒子に反応した抗原(または抗体)と未反応な遊離抗原(または抗体)を
洗浄分離する方法である。
【0032】
まず、本発明の一実施の形態によるB/F分離部と測光部とを有する免疫測定装置について説明する。図1は、本発明の一実施の形態によるB/F分離を含む免疫測定の流れを示す概要図である。図1については前述したため、説明を省略する。
【0033】
図2Aは、本発明の一実施の形態による免疫測定装置の概略構成を示す斜視図である。図2Bは、本発明の一実施の形態による免疫測定装置の概略構成を示す分解斜視図である。
【0034】
また、本実施の形態による免疫測定装置Aには、反応容器1を1本ずつ自動的に装置に供給するオートセルフィーダー37と、インキュベーションを行うためのインキュベーションテーブル39と、B/F分離処理を行うためのB/F分離機構41と、不溶物の検出を行う検出ユニット(不溶物検出部)45と、を有する。
【0035】
図3は、本発明の一実施の形態による免疫測定装置の概略構成例を示す平面図である。図3に示すように、本発明の一実施の形態による免疫測定装置Aを上面からみると、例えば、反応容器1内に検体を分注するサンプル分注部20と試薬を分注する試薬分注部(1)50または(2)23、検体・試薬が分注された反応容器1内の1次または2次免疫反応液を攪拌する反応容器攪拌部47または55aと、1次または2次免疫反応を行うインキュベーションテーブル(1)43及び(2)44と、試薬を保冷する試薬保冷部51と、反応容器を搬送する反応容器搬送部57と、試薬ノズル洗浄槽61と、不溶物の検出を行う不溶物検出部(測光部)63と、測光部63で不溶物が検出され排出または廃棄すべき検体を反応容器1毎排出または廃棄する廃棄部64と、測光部63で不溶物が検出されずに排出または廃棄しないでB/F分離をすべき検体のB/F分離処理を行うB/F分離部65と、B/F分離処理における洗浄液1、2を吐出するB/F分注部(1)67、(2)69と、B/F洗浄部65aと、試薬ノズルを洗浄する試薬ノズル洗浄槽70と、シグナルを検出する検出部97と、シグナル検出後の反応容器1毎を廃棄する廃棄部64と、を有している。尚、上記構成のうちのいずれかを他の構成で置換したり、一部の構成を他の装置に持たせたりすることが可能である。
【0036】
装置の動作について説明する。
図4は、本発明の一実施の形態による免疫測定装置の要部の概略構成を示す図である。図4(a)に示すように、反応容器搬送部57により、反応容器1が測光部63内に挿入され、Z軸方向に移動させながらLED発光の透過光を受光素子により測定して、不溶物量に依存する受光素子の電圧又は吸光度を求める。求めた電圧又は吸光度に基づいて、あるしきい値を超える反応容器は、透明であり不溶物なしとして、検体として利用することができる。あるしきい値を超えない反応容器は、不溶物ありと判断して、検体として利用できないため、廃棄部64に排出または廃棄する。
【0037】
図5は、本発明の一実施の形態による免疫測定装置のうち、不溶物検出部(測光部)63の詳細な構成例を示す図である。反応容器搬送部57は、反応容器1を把持し、上下(Z軸)方向に移動させることができる。不溶物検出部63は、空洞63aを有しており、空洞63aの内壁の反応容器1を挟んで対向する位置に、発光部(LED)81と、受光部(フォトダイオード、PD)85と、を配置している。そして、LED(発光部)81からの発光は、反応容器1の中心部を透過してPD(受光部)85に照射される。照射された光は、PD85において、受光する光量に依存する電圧に変換され、吸光度を求めることができる。電圧が高いほど、検体中の不溶物が少ない、すなわち吸光度が低い。従って、受光素子の電圧又は吸光度により、検体中の不溶物量を推定することができる。
【0038】
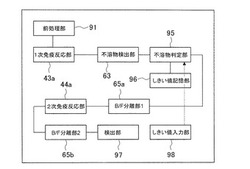
図6は、本発明の一実施の形態による免疫測定装置の概略構成例を示す機能ブロック図である。まず、反応容器1内の検体は、前処理部91において前処理が行われ、次いで、1次免疫反応後、不溶物検出部63で測光される。次いで、不溶物検出部63における測光結果に基づいて、不溶物判定部95でノズルの詰まりが生じるような不溶物の有無を判定し、そのような不溶物がない場合には、B/F分離部65でB/F(1)分離を行う。次いで、2次免疫反応後、B/F分離部65でB/F(2)分離を行い、検出部97でシグナル量の分析を行い、抗原、抗体の定量及び定性分析を行う。ここで、不溶物判定部95は、しきい値記憶部96に予め記憶していたしきい値又はしきい値入力部98から入力されたしきい値等との比較結果に基づいてノズル詰まりの可能性を判定する。
【0039】
次に、不溶物判定の具体的な処理内容について説明する。
ノズル径が0.6〜0.8mmであるため、それよりも少し大きい径を持つ沈殿物を入れた標準モデル検体を、ノズルを詰まらせる不溶物の標準試料として用いることができる。
【0040】
[実施例1]
図7は、反応容器1のz軸に沿ったスキャンのタイミングと赤LED、緑LED、青LEDのそれぞれにおけるPDの出力電圧(LED光の透過率に対応)の関係を、沈殿物無し、少量から多量のそれぞれについて測定した図である。図7より沈殿物の程度におけるスキャン期間中の電圧の和(電圧積算値)を求めることができる。同様に、LED(緑)、LED(青)についてもスキャン期間中の電圧の和(電圧積算値)を求めると表1のようになる。0.5msにて、例えば288ポイントを測光している。実装置のデータでLEDの切替えをする際は、288ポイントを測光するLEDの数で割った分、つまり赤と緑の2つであれば144ポイントずつになる。測光部のみの簡易装置では、各波長において288ポイントを測光することが可能である。
【0041】
【表1】

【0042】
【表2】

【0043】
表1では、LED(赤)、LED(緑)、LED(青)のいずれの場合でも、スキャン中の電圧の和(電圧積算値)は、沈殿物の量とともに減少することがわかる。ここで、沈殿物無しと少量との間にノズル詰まりに関する電圧積算値のしきい値があることから、表2に示すように、各色のLEDにおけるノズル詰まりに関する電圧積算値のしきい値は、それぞれ、35000、25000、20000と求めることができる。これらのしきい値以下であると、ノズル詰まりが生じることになる。
【0044】
このしきい値が、以下に説明する同様の検体における、ノズルを詰まらせるか否かの判定の基準値となる。この基準値を、しきい値記憶部96に記憶しておく。或いは、しきい値入力部98から入力しておく。
【0045】
図8は、標準モデル検体を用いた測光結果を示す図であり、図7に対応する図である。図8(a)は赤色LEDを、(b)は緑色LEDを、(c)は青色LEDを用いた場合の、受光部(フォトダイオード)の受光強度に依存する吸光度と、反応容器のz方向へのスキャンタイミングとの関係を示す図である。図8より沈殿物の量におけるスキャン中の吸光度の積算値を求めることができる。同様に、LED(緑)、LED(青)についてもスキャン中の吸光度の和(積算値)を求めると表3のようになる。沈殿物の有無における積算値のしきい値が求まる。同様に、LED(緑)、LED(青)についても求めると以下のようになる。
【0046】
【表3】

【0047】
【表4】

【0048】
吸光度を基準にする場合には、LED(赤)、LED(緑)、LED(青)のしきい値は、表4に示すように150000、160000、350000であることがわかる。これらのしきい値以上であると、ノズル詰まりが生じることになる。
【0049】
このしきい値も、以下に説明する同様の検体における、ノズルを詰まらせるか否かの判定の基準値となる。この基準値を、しきい値記憶部96に記憶しておく。或いは、しきい値入力部98から入力しておく。
【0050】
[実施例2]
図9は、モデル検体を用いた免疫反応に用いられる反応容器群の一例を示す図である。
【0051】
モデル検体1として、ヒト正常血清(NHS)にBovine γG(BGG)を添加し、疑似的高タンパク血清を作製し、前処理を実施したものを用いた。図9の左側の反応容器から順番に、NHS、+0.5%BGG、+1%BGG、+2%BGG、+4%BGG、+6%BGG、+8%BGG、+10%BGGの酸・アルカリ前処理後の様子を示す図であり、ある反応容器には不溶物の白濁が発生していることがわかる。不溶物の検出は、LED光を反応容器の底部から上部に向けて走査照射し受光素子により受光させて、反応容器を透過する透過光量に依存する受光素子の電圧の値を積算する。
【0052】
【表5】

【0053】
【表6】

【0054】
表5は、LED(赤)、LED(緑)、LED(青)に関する、NHS、+0.5%BGG、+1%BGG、+2%BGG、+4%BGG、+6%BGG、+8%BGG、+10%BGGのスキャン中の電圧の和(電圧積算値)を示す表である。表6より、LED(赤)、LED(緑)、LED(青)に関するしきい値として、35000、25000、20000がしきい値記憶部96に記憶されている(表2と同じ値)。このしきい値を参照して、実際に図10で求めた値から、それぞれ、しきい値以上の電圧積算値は、LED(赤)で+1%BGG、LED(緑)で+0.5%BGG、LED(青)でも+0.5%BGGとなり、これらの結果より、+1%BGGから+0.5%BGGの検体は、ノズルを詰まらせない可能性が高い検体であると判断することができる。この測光結果より、安全を見込めば+0.5%BGGの検体までをB/F分離処理に用い、それ以上の高濃度のBGG検体は排出または破棄することになる。
【0055】
図11は、モデル検体を用いた測光結果を示す図であり、(a)は赤色LEDを、(b)は緑色LEDを、(c)は青色LEDを用いた場合の、吸光度と反応容器のz方向へのスキャンタイミングとの関係を示す図である。
【0056】
【表7】

【0057】
【表8】

【0058】
表7は、LED(赤)、LED(緑)、LED(青)に関する、NHS、+0.5%BGG、+1%BGG、+2%BGG、+4%BGG、+6%BGG、+8%BGG、+10%BGGのスキャン中の吸光度積算値を示す表である。表8よりLED(赤)、LED(緑)、LED(青)に関するしきい値として、150000、160000、350000がしきい値記憶部96に記憶されている(表4と同じ値)。このしきい値を参照して、実際に図11で求めた値から、それぞれ、しきい値以下の吸光度積算値は、LED(赤)で+1%BGG、LED(緑)で+0.5%BGG、LED(青)でも+0.5%BGGとなり、これらの結果より、+1%BGGから+0.5%BGGの検体は、ノズルを詰まらせない可能性が高い検体であると判断することができる。この測光結果より、安全を見込めば+0.5%BGGの検体までをB/F分離処理に用い、それ以上の高濃度のBGG検体は排出または廃棄することになる。電圧積算値でも吸光度の積算値でも同様の結果が得られている。
【0059】
このようにして、NHS、+0.5%BGGの各検体について、実際にB/F分離でノズルを詰まらせることなく処理を行うことができることがわかる。すなわち、これらの検体は、ノズル詰まりを生じさせないものであり、B/F分離を行っても良い検体であると言える。
【0060】
[実施例3]
図12は、実検体を用いた免疫反応に用いられる反応容器群の一例を示す図である。
【0061】
実検体として、高タンパク血漿検体を用いている。図12の左側の反応容器から順番に、ヒト正常血清、残り6反応容器が、酸・アルカリ前処理後、多様な不溶物が発生した様子を示しており(左から#4、#6、#39、#43、#72、#82である)、不溶物の白濁が発生していることがわかる。不溶物の検出はLED光を反応容器に走査照射し受光させて、光量に依存する受光素子の電圧の値を積算する。
【0062】
図13は、実検体を用いた測光結果を示す図であり、(a)は赤色LEDを、(b)は緑色LEDを、(c)は青色LEDを用いた場合の、受光部(フォトダイオード)の受光強度に依存する電圧と、反応容器のz方向へのスキャンタイミングとの関係を示す図である。
【0063】
図13より、各種検体におけるスキャン中の電圧の和(電圧積算値)を求めることができる(表9)。
【0064】
【表9】

【0065】
【表10】

【0066】
また、表10は、表2に対応する表である。表9と表10より、この検体では、NHS以外の検体では、しきい値以下の電圧積算を有しており、これらの検体は不溶物を含みノズルを詰まらせる可能性がある検体であることがわかる。
【0067】
図14は、実検体を用いた測光結果を示す図であり、(a)は赤色LEDを、(b)は緑色LEDを、(c)は青色LEDを用いた場合の、吸光度と反応容器のz方向へのスキャンタイミングとの関係を示す図である。図14より、各種検体におけるスキャン中の吸光度の積算値を求めることができる(表11)。
【0068】
【表11】

【0069】
【表12】

【0070】
また、表12は、表4に対応する表である。表11と表12より、この検体では、NHS以外の検体では、しきい値以上の吸光度積算値を有しており、これらの検体は不溶物を含みノズルを詰まらせる可能性がある検体であることがわかる。この結果は、図13の結果と同様である。
【0071】
以上のように、ノズル径よりも少しだけ大きい径を有する沈殿物に関する、積算電圧、又は、吸光度積算値に基づいて求めたしきい値を記憶しておき、このしきい値に基づいて、実際の検体のB/F分離処理前の測光処理においてその検体の積算値が上記しきい値よりも大きいか否かに基づいて、ノズルを詰まらせるような検体であるか否かを測光部において判定することができる。
【0072】
従って、B/F分離処理前に、非破壊的に検体内の不溶物の有無を調べることができ、B/F分離処理におけるノズル詰まりを未然に防止することができる。
【0073】
このように、B/F分離を含む免疫測定装置において、B/F分離処理における不溶物に起因するノズル詰まりを防止し、また、不溶物に起因するB/F分離処理が不完全になることを抑制して、対象物質の濃度などの測定結果が偽陽性になったり、偽陰性になったりすることによる、医療過誤の要因を少なくすることができる。
【0074】
次に、共存物質の影響について説明する。検体には、直接型ビリルビン(Bil−F)、抱合型ビリルビン(Bil−C)、乳び、溶血(Hb)の共存物質が混入している場合が多く、これらが不溶物検出処理に影響を与える可能性がある。以下に、共存物質の影響を考慮した免疫測定技術の例について説明する。
【0075】
[実施例4]
図15は、共存物質を含む検体の測光結果を示す図であり、(a)は赤色LEDを、(b)は緑色LEDを、(c)は青色LEDを用いた場合の、受光部(フォトダイオード)の受光強度に依存する電圧と、反応容器のz方向へのスキャンタイミングとの関係を示す図である。共存物質としては、NHS、Bil−F・L(約4mg/dL)、Bil−F・H(約20mg/dL)、Bil−C・L(約4mg/dL)、Bil−C・H(約20mg/dL)、乳び・L(約280濁度)、乳び・H(約1400濁度)、Hb・L(約95mg/dL)、Hb・H(約480mg/dL)を例として測定している。
【0076】
【表13】

【0077】
【表14】

【0078】
表13は測定結果を示すものであり、表14は表2に対応し、電圧変換の場合のしきい値を示す。
表13は、電圧積算の結果を示す図である。この表13を見るとわかるように、LED(緑)、LED(青)では、しきい値を超えないものが多く、実際には共存物質は検体中に含まれてB/F分離処理が行われるべきであるにもかかわらず、共存物質が含まれることでしきい値以下の積算値とされて排出または廃棄対象となってしまうという問題がある。
【0079】
そこで、光源のLEDとしては、LED(赤)を用いることが好ましい。さらに、LED(赤)を用いても、Hb・L、Hb・Hは、しきい値で、共存物質であるか否かを判定できない。そこで、測光部63の第1のPD85(可視光用)に加えて、同様の第2のPDに赤色のみを透過するフィルタを付けることで赤色であることを検出し(或いは目視により検出し)、2つの第1及び第2のPDの測定結果から、第1のPDでしきい値以下であるが、第2のPDで赤色であることを検出すると、これを、Hb・L、Hb・Hの共存物質と判定するようにすると良い。このようにすれば、共存物質を含む検体を不溶物として除去することを防止することができる。目視で判定することもできる。
【0080】
図16は、共存物質を含む検体の測光結果を示す図であり、(a)は赤色LEDを、(b)は緑色LEDを、(c)は青色LEDを用いた場合の、吸光度と反応容器のz方向へのスキャンタイミングとの関係を示す図である。
【0081】
【表15】

【0082】
【表16】

【0083】
表15は測定結果を示すものであり、表16は表4に対応し、吸光度の場合のしきい値を示す。
LED(緑)、LED(青)では、しきい値を超えるものが多く、実際には共存物質は検体中に含まれてB/F分離処理が行われるべきであるにもかかわらず、共存物質が含まれることでしきい値以上の吸光度積算値とされて排出または廃棄対象となってしまうという問題がある。そこで、上記の場合と同様に、LEDとしては、LED(赤)を用いることが好ましい。さらに、LED(赤)を用いても、Hb・L、Hb・Hは、しきい値で、共存物質であるか否かを判定できない。そこで、測光部63の第1のPD85(可視光用)に加えて、同様の第2のPDに赤色のみを透過するフィルタを付けることで赤色であることを検出し(或いは目視により検出し)、2つの第1及び第2のPDの測定結果から、第1のPDでしきい値以下であるが、第2のPDで赤色であることを検出すると、これを、Hb・L、Hb・Hの共存物質と判定するようにしても良い。このようにすれば、吸光度測定の場合でも、共存物質を含む検体を不溶物として除去することを防止することができる。
【0084】
[実施例5]
図17は、免疫測定装置(実装置)を用いた測光結果の図であり、赤色LEDを用いた場合における、(a)はNHS、+0.5%BGG、+1%BGG、+2%BGG、+4%BGG、+6%BGG、+8%BGG、+10%BGGのスキャン中の電圧の和(電圧積算値)を示す表である。(b)は、沈殿物なし、少から多の場合の測定結果を示す図であり、(c)は、NHSと、種々の検体の測定結果を示す図である。
【0085】
【表17】

【0086】
【表18】

【0087】
表18は、沈殿物0(NHS)と少の場合の間の20000にしきい値を設定する。そして、表17に示す測定結果より、+1%BGGの場合が、ノズルの詰まらせない限界であると判定することができる。さらに、#4から#82までの表示されている全ての検体がしきい値を超えておらず、不溶物によるノズル詰まりを生じさせる可能性がある検体であることがわかる。
【0088】
図18は、免疫測定装置を用いた測光結果の図であり、(a)はNHS、+0.5%BGG、+1%BGG、+2%BGG、+4%BGG、+6%BGG、+8%BGG、+10%BGGのスキャン中の吸光度の和(吸光度積算値)を示す表である。(b)は、沈殿物なし、少から多の場合の測定結果を示す図であり、(c)は、NHSと、種々の検体の測定結果を示す図である。
【0089】
【表19】

【0090】
【表20】

【0091】
同様に沈殿物0と少との間の吸光度のしきい値として400000が求められる(表20)。この値を元に、表19に示すように、+1%BGGの場合が、ノズルの詰まらせない限界であると判定することができる。さらに、#4から#82までの表示されている全ての検体がしきい値を超えており、不溶物によるノズル詰まりを生じさせる検体であることがわかる。
【0092】
[実施例6]
図19は、免疫測定装置を用いた共存物質のモデル検体として血漿/血清の実検体を用いた場合の測光結果を示す図であり、(a)共存物質のモデル検体、(b)は乳び血漿、(c)はHb血漿の、受光部(フォトダイオード)の電圧と、反応容器のz方向へのスキャンタイミングとの関係を示す図である。
【0093】
【表21】

【0094】
【表22】

【0095】
上記で求めた表18の、沈殿物0(NHS)と1個の場合の間の20000をしきい値とすると、表21のうち、Hb・H以外は全て、不溶物でないと判断される。尚、Hb・Hは、本来は共存物質であるが、上記と同様に、LED(赤)を用いても、Hb・L、Hb・Hは、しきい値で、共存物質であるか否かを判定できない。そこで、測光部63の第1のPD85(可視光用)に加えて、同様の第2のPDに赤色のみを透過するフィルタを付けることで赤色であることを検出し(或いは目視により検出し)、2つの第1及び第2のPDの測定結果から、第1のPDでしきい値以下であるが、第2のPDで赤色であることを検出すると、これを、Hb・L、Hb・Hの共存物質と判定するようにしても良い。
【0096】
また、図20は、免疫測定装置を用いた共存物質のモデル検体として血漿/血清の実検体を用いた場合の測光結果を示す図であり、赤色LEDを用い、(a)共存物質のモデル検体、(b)は乳び血漿、(c)はHb血漿の、受光部(フォトダイオード)の吸光度と、反応容器のz方向へのスキャンタイミングとの関係を示す図である。
【0097】
【表23】

【0098】
【表24】

【0099】
この場合には、表24に示す400000のしきい値(表20に対応)を利用して、全ての血清・血漿、等の共存物質を、ノズル詰まりのない物質として判定することができる。
【0100】
[実施例7]
次に、実際の装置を用いて検体を測定するための処理の流れについて、いくつかの例について、より具体的に説明する。
【0101】
図21は、1ステップ法による免疫測定法の流れを示すフローチャート図である。
この1ステップ法では、酵素標識物、サンプル(検体)、磁性粒子を分注し(ステップS1)、攪拌/インキュベーション(37℃)を行い(ステップS2)、次いで、不溶物測光(LED):する・しないの選択を行い(ステップS3)、不溶物測光をする場合で測光結果が不溶物無しであれば、B/F分離洗浄操作(集磁、反応液吸引/洗浄液分注、攪拌)を行う(ステップS4)。次いで、発光試薬1を入れて攪拌を行い(ステップS5)、発光試薬2(基質)を入れ(ステップS6)、発光量の測定を行う(ステップS7)。これにより、B/F分離処理前にノズル詰まりの可能性を判定し、ノズル詰まりを未然に防ぐことが出来る。
【0102】
[実施例8]
図22は、ディレイド1ステップ法による免疫測定法の流れを示すフローチャート図である。すなわち、免疫反応溶液、サンプル(検体)、磁性粒子を分注する(ステップS11)。次いで、攪拌/インキュベーション(37℃)を行い(ステップS12)、酵素標識物を添加し(ステップS13)、攪拌/インキュベーション(37℃)を行う(ステップS14)。次いで、不溶物の測光処理(LED)をする・しないの選択を行い(ステップS15)、不溶物測光をする場合で測光結果が不溶物無しであれば、B/F分離洗浄操作(集磁、反応液吸引/洗浄液分注、攪拌)を行う(ステップS16)。さらに、発光試薬1を添加して攪拌し(ステップS17)、発光試薬2(基質)を入れて(ステップS18)、発光量の測定を行う(ステップS19)。これにより、B/F分離処理前にノズル詰まりの可能性を判定し、ノズル詰まりを未然に防ぐことが出来る。
【0103】
[実施例9]
図23は、2ステップ法(1)による免疫測定法の流れを示すフローチャート図である。免疫反応溶液、サンプル(検体)、磁性粒子を分注し(ステップS21)、攪拌/インキュベーション(37℃)を行う(ステップS22)。次いで、不溶物の測光処理(LED)をする・しないの選択を行い(ステップS23)、不溶物測光をする場合で測光結果が不溶物無しであれば、B/F分離洗浄操作(集磁、反応液吸引/洗浄液分注、攪拌)を行う(ステップS24)。酵素標識希釈液と酵素標識物を添加する(ステップS25)。さらに、攪拌/インキュベーション(37℃)を行い(ステップS26)、B/F分離洗浄操作(集磁、反応液吸引/洗浄液分注、攪拌)を行う(ステップS27)。次いで、発光試薬1を入れ攪拌し(ステップS28)、発光試薬2(基質)を用いて(ステップS29)、発光量の測定を行う(ステップS30)。これにより、B/F分離処理前にノズル詰まりの可能性を判定し、ノズル詰まりを未然に防ぐことが出来る。
【0104】
[実施例10]
図24は、2ステップ法(2)による免疫測定法の流れを示すフローチャート図である。まず、免疫反応溶液1、免疫反応溶液2を分注し(ステップS31)、攪拌した後、サンプル(検体)、磁性粒子を混ぜる(ステップS32)。次いで、攪拌/インキュベーション(37℃)を行う(ステップS33)。次いで、不溶物の測光処理(LED)をする・しないの選択を行い(ステップS34)、不溶物測光をする場合で測光結果が不溶物無しであれば、B/F分離洗浄操作(集磁、反応液吸引/洗浄液分注、攪拌)を行う(ステップS35)。次いで酵素標識希釈液、酵素標識物を混ぜて(ステップS36)、攪拌/インキュベーション(37℃)を行う(ステップS37)。次いで、B/F分離洗浄操作(集磁、反応液吸引/洗浄液分注、攪拌)を行い(ステップS38)、発光試薬1を加えて攪拌する(ステップS39)。そして、発光試薬2(基質)を用いて(ステップS40)、発光量の測定を行う(ステップS41)。これにより、B/F分離処理前にノズル詰まりの可能性を判定し、ノズル詰まりを未然に防ぐことが出来る。
【0105】
[実施例11]
図25は、前処理付き2ステップ法による免疫測定法の流れを示すフローチャート図である。この方法は、前処理の自動化を含む2ステップ法である。
【0106】
まず、前処理液と、サンプル(検体)とを用い(ステップS51)攪拌/インキュベーション(37℃)を行う(ステップS52)。次いで、免疫反応溶液を混ぜて(ステップS53)、攪拌し、磁性粒子を混ぜて(ステップS54)、攪拌/インキュベーション(37℃)を行う(ステップS55)。次いで、不溶物の測光処理(LED)をする・しないの選択を行い(ステップS56)、不溶物測光をする場合で測光結果が不溶物無しであれば、B/F分離洗浄操作(集磁、反応液吸引/洗浄液分注、攪拌)を行う(ステップS57)。次いで、酵素標識希釈液、酵素標識物を用い(ステップS58)、攪拌/インキュベーション(37℃)を行う(ステップS59)。次いで、B/F分離洗浄操作(集磁、反応液吸引/洗浄液分注、攪拌)を行う(ステップS60)。さらに、発光試薬1を混ぜて(ステップS61)攪拌し、発光試薬2(基質)を用いて(ステップS62)、発光量の測定を行う(ステップS63)。これにより、B/F分離処理前にノズル詰まりの可能性を判定し、ノズル詰まりを未然に防ぐことが出来る。
【0107】
[実施例12]
図26は、前希釈付き2ステップ法による免疫測定法の流れを示すフローチャート図である。
【0108】
まず、検体希釈液とサンプル(検体)を分注し(ステップS71)、攪拌した後、免疫反応液、希釈済み検体を混ぜて(ステップS72)攪拌する。次いで、磁性粒子を加え(ステップS73)、攪拌/インキュベーション(37℃)を行う(ステップS74)。次いで、不溶物の測光処理(LED)をする・しないの選択を行い(ステップS75)、不溶物測光をする場合で測光結果が不溶物無しであれば、B/F分離洗浄操作(集磁、反応液吸引/洗浄液分注、攪拌)を行う(ステップS76)。次いで、酵素標識希釈液、酵素標識物を混ぜ(ステップS77)、攪拌/インキュベーション(37℃)を行う(ステップS78)。さらに、B/F分離洗浄操作(集磁、反応液吸引/洗浄液分注、攪拌)を行い(ステップS79)、発光試薬1を混ぜて攪拌する(ステップS80)。発光試薬2(基質)を用いて(ステップS81)、発光量の測定を行う(ステップS82)。これにより、B/F分離処理前にノズル詰まりの可能性を判定し、ノズル詰まりを未然に防ぐことが出来る。
【0109】
以上に説明したように、本実施の形態による免疫測定装置によれば、前処理の有無、項目試薬数、などに依存せずに、種々の方法において、非破壊的に、不溶物の検出を行った後に、B/F処理を行うため、B/F分離を含む免疫測定装置において、B/F分離処理における不溶物に起因するノズル詰まりを防止し、また、不溶物に起因するB/F分離処理が不完全になることを抑制して、対象物質の濃度などの測定結果が偽陽性になったり、偽陰性になったりすることによる、医療過誤の要因を少なくすることができる。
【0110】
上記の実施の形態において、添付図面に図示されている構成等については、これらに限定されるものではなく、本発明の効果を発揮する範囲内で適宜変更することが可能である。その他、本発明の目的の範囲を逸脱しない限りにおいて適宜変更して実施することが可能である。
【産業上の利用可能性】
【0111】
本発明は、免疫測定技術に用いることができる。
【符号の説明】
【0112】
1…反応容器、3…反応液、5…磁石、7…吸引ノズル、11…吐出部、21…項目試薬保冷庫、23…サンプル分注機構、25…検体搬送部、27…アルカリ・B/F洗浄液、
31…基質保冷庫、33…廃棄容器、35…メイン扉、37…オートセルフィーダー、39…インキュベーションテーブル、41…B/F分離機構、45…検出ユニット、57…反応容器搬送部、61…試薬ノズル洗浄槽、63…不溶物検出部(測光部)、63a…空洞、64…廃棄部、65…B/F分離部、81…LED、85…PD、91…前処理部、95…不溶物判定部、96…しきい値記憶部、97…検出部、98…しきい値入力部。
【技術分野】
【0001】
本発明は、B/F分離を含む免疫測定技術に関し、特に、B/F分離の不溶物判定技術に関する。
【背景技術】
【0002】
図1は、B/F(Bound/Free)分離を必要とするヘテロジニアスな免疫測定法の流れの概要の一例を示す図である。抗原(Antigen)または抗体(Antibody)などの免疫測定法として、競合法あるいはサンドイッチ法等が知られている。これは、反応液3で満たされた反応容器(セル等)1内で抗原抗体反応(免疫反応)を行わせ、この磁性粒子やポリスチレン粒子、プレートなどに固相化された抗原・抗体と複合体を形成するコンジュゲートに予め標識されている酵素を結合させることにより抗原・抗体を検出する方法である。この方法では、固相化抗原・抗体に反応した抗体・抗原と複合体を形成したコンジュゲートのみを反応容器1内に残し、反応しなかった抗原・抗体と複合体を形成していないコンジュゲートは反応容器1内から除去する。
【0003】
ヘテロジニアスな免疫測定法では、この除去操作が必要であり、一般にB/F分離という。通常はこのB/F分離のために、抗原抗体反応を行う抗原103あるいは抗体101を反応容器1内の担体に予め固定しておく(図1(a)、この場合には、抗原103の量を測定する。)。担体として例えば磁性粒子105を用いる場合、抗体101を表面に固定した磁性粒子105に、測定対象となる特定の抗原103を含む溶液を添加し、1次免疫反応を反応容器1内で行わせた後に(図1(b)、磁性粒子105に固定された抗体101に抗原103を結合させる。)、反応容器1に磁石5を接触あるいは接近させることで、反応容器1内の内側壁に抗体101と抗原103とが結合された磁性粒子105が捕捉される(図1(c))。
【0004】
図1(c)に示す状態で、反応容器1の内側壁に捕捉されなかった不純物を含む非磁性成分(図では未反応の抗原103a等)を、吸引ノズル7で吸引除去するとともに洗浄液を吐出部11から吐出する。磁石5を反応容器1から十分に離して洗浄液を洗浄液吐出部11から分注すると、反応生成物は反応容器1内側壁から離れ、磁性粒子105全体に洗浄液が行き渡り、前記の吸引のみでは除去しきれなかった不純物(freeの抗原・抗体等)を剥離することができる。図1(d)に示すように、酵素標識抗体107(抗体109に酵素111が結合したもの)を添加して2次免疫反応をさせると、結合磁性粒子105に固定された抗体101に抗原103を結合させた複合体に、酵素標識抗体107が結合する(複合体Xが形成される)。ここで、未反応の酵素標識抗体107aを除去するために、図1(e)に示すように、再び磁石5を反応容器1に接触あるいは接近させると、反応容器1内側壁に反応生成物(複合体X)が捕捉され、さらに前記と同様に吸引ノズル7によって不純物等(未反応の酵素標識抗体107aを含む)を含んだ洗浄液を吸引ノズル7で吸引除去する洗浄液を吐出部11から吐出する。
【0005】
この操作を繰り返すことで反応生成物の洗浄効果が高まり、予め酵素を標識しているコンジュゲートと抗原抗体とからなる複合体Xのみを残すことができる。従って、高精度な分析結果(抗原103の濃度、量等を求めるための分析結果)を得ることができる。尚、洗浄液を分注した後に攪拌作業を実施すれば、さらなる洗浄効果の向上が期待できる。次いで、図1(f)に示すように、発光基質113を反応液に添加する。すると、発光基質113が酵素標識抗体107により消費され、その際にシグナルを発する。このようにして、複合体Xのシグナルを分析することができる。例えば抗原103の数が多いほど、消費される基質数が多くなるため、図1(f)の状態でシグナルを測定することで、シグナル量に依存する抗原又は抗体の量(濃度)を測定することができ、検体中の対象物質の濃度を知ることができる。
【0006】
ここで、このB/F分離を確実に行うことにより、免疫測定法におけるシグナルのバックグラウンドは小さくなり、測定の感度と精度を高めることができる。
【0007】
従来、B/F分離の確実性を増すために洗浄回数を増加させることは、測定の高速化や高スループット化を妨げるという問題があった。このため、最短の動作で最大の分離効率を得るための種々の発明がなされてきた。その一例としては、B/F分離に用いる洗浄液の組成の改良や、洗浄液残りの低減などが挙げられる。
【0008】
下記特許文献1は、担体表面に固定された分子と溶液中の分子を結合させる抗原抗体反応において、洗浄液の吐出と排出の繰返しによって未結合の分子を除去するB/F分離を行う際の洗浄を、1回目は所定の濃度の洗浄液となるような吐出とその後の排出を行い、2回目以降は前の回よりも濃くない洗浄液になるような吐出とその後の排出を行い、最終回は、初回の濃度より薄い洗浄液になるような吐出とその後の排出とを行うものである。これにより、全体としては洗浄液量を減らして効率よく洗浄を行い、かつ、洗浄液残存の影響を低減することができる。
【0009】
また、下記特許文献2に記載の乳び・溶血検体検出装置においては、検体を分析する分析処理の前に前記検体の画像情報を検出する撮像部と、検出した前記画像情報に基づき、前記検体の色から前記検体の乳び状態または溶血状態を検出する乳び・溶血検体検出部と、を備えるものである。検体の画像情報を利用して検体の色から前記検体の乳び状態または溶血状態を検出することで、高い精度で、かつ、効率良く、検体の状態を検出することができる。例えば、検体の色が黄色の場合を正常状態として設定し、ティーチングにより判定処理を行う。例えば検体の色が赤色、桃色、橙色など、正常状態よりも赤みがかっている場合には溶血状態と判定する。一方、検体の色が桃色や乳白色など、正常状態よりも白濁している場合には乳び状態と判定することができる。
【先行技術文献】
【特許文献】
【0010】
【特許文献1】特開2009−162733号公報
【特許文献2】特開2010−281604号公報
【発明の概要】
【発明が解決しようとする課題】
【0011】
しかしながら、特許文献1に記載の技術を用いた場合に、B/F分離後の吸引工程において、ノズルが不溶物により詰まるという問題が生じていた。また、特許文献2に記載の技術では、検体の画像情報に基づいて白濁の度合いを検査しているが、目視の場合と同様に、検出精度があまり良くないという問題もある。
【0012】
また、B/F分離工程における問題点として、例えば、HCV(C型肝炎ウイルス)コア抗原などの測定系においては、ウイルス内のコア抗原を表出させるために、界面活性剤を含む酸やアルカリによる変性前処理が必要となる。この前処理を、高タンパク血症の検体で行うと、不可逆的なタンパク変性が生じ多様な不溶物が発生するという問題がある。
【0013】
かかる処理により生じた変性物や血漿(または血清)のフィブリン塊、尿・便中の不純物などの不溶物がB/F分離の際に用いる吸引ノズル7を詰まらせるという現象が生じ、B/F分離処理部を含む装置の不良・トラブルが発生するという問題がある。
【0014】
また、B/F分離処理が不完全になることで、測定結果が偽陽性になったり、偽陰性になったりすることにより、医療過誤の要因となるという問題もあった。
【0015】
本発明は、B/F分離処理を含む免疫測定技術において、B/F分離に用いるノズルが不溶物により詰まるという問題を解決することを目的とする。また、不溶物の検出精度を向上させることを目的とする。
【課題を解決するための手段】
【0016】
上記目的を達成するために、本発明のB/F分離を含む免疫測定装置においては、B/F分離部の前段に、不溶物検出部とその測光結果に基づいて不溶物の有無を判定する不溶物判定部とを設け、当該不溶物判定部において、前記B/F分離部において反応容器の内側壁に捕捉されなかった不純物を含む非磁性成分(不溶物)により、ノズルで吸引する際のノズルの詰まりが生じうるか否かを光の透過率に基づいて予め判定し、ノズル詰まりが生じない程度の透過率が得られなかった場合には、そのサンプルは、不溶物によりノズルを詰まらす可能性が高いと判定することを特徴とする。
【0017】
B/F分離部によるノズル吸引より前に、不溶物の有無を判定することで、不溶物に起因するノズル詰まりを防止し、また、不溶物に起因するB/F分離処理が不完全になることを抑制して、抗原濃度などの測定結果が偽陽性になったり、偽陰性になったりすることによる、医療過誤の要因を少なくすることができる。
【0018】
例えば、B/F分離における免疫測定装置のトラブルまたは、医療過誤を回避するために、B/F分離工程前で反応容器に光等を照射し、対向側に配置された受光素子(フォトダイオードなど)により、吸光度変化(またはフォトダイオードの電庄変化)に基づいて、反応容器内の不溶物の有無の判定を行う。この不溶物の判定には、吸光度(または電圧)の積算値やピーク値などを使用することができる。そして、不溶物が有と判定された場合は、B/F分離工程に入る前にその試料を排出または廃棄する。尚、光源としてLEDを用いる場合には、赤(波長635nm付近)、緑(波長525nm付近)、青(波長470nm付近)の全て又はいずれかを使用することができる。光源としては、可視光域を含む波長帯を有する光を用いることができる。
【0019】
本発明の一観点によれば、反応容器内の抗体結合磁性粒子又は抗原結合磁性粒子に反応した抗原又は抗体と未反応な遊離抗原又は遊離抗体を洗浄し、前記未反応な遊離抗原又は遊離抗体を吸引部(ノズル)により吸引することで分離するB/F分離部を備えた免疫測定装置であって、前記B/F分離部の前段に、前記反応容器に光照射を行う発光部と、反応容器の透過光を測定する受光部と、を備えた測光部と、前記受光部における受光強度に基づいて、前記吸引部の詰まりの原因となる不溶物の有無を判定する不溶物判定部と、を有することを特徴とする免疫測定装置が提供される。
【0020】
さらに、不溶物の有無を判定するしきい値を格納するしきい値格納部を設け、前記不溶物判定部は、前記受光部の受光強度と、前記しきい値との大小関係に基づいて、不溶物の有無を判定することを特徴とすることが好ましい。しきい値として、吸光度(または電圧)の積算値を用いることが好ましい。前記発光部の光源として、LEDを用いることが好ましい。前記LEDとして、赤色LEDを用いることが好ましい。共存物質が混入している場合でも、赤色LEDであれば、しきい値を超えない試料を、不溶物の入っている試料と判定しない。
【0021】
前記受光部は、赤色を検出波長帯に含む第1の受光素子と、赤色を検出波長帯に含む第2の受光素子であって、赤色以外をフィルタリングするフィルタ部を受光面側に設け第2の受光素子との受光強度の差異に基づいて、前記不溶物判定部が不溶物の判定を行うことが好ましい。第1受光素子で不溶物とされても、第2受光素子で赤色とされた場合には、ヘモグロビンの共存物質として、不溶物と判定しない。
【0022】
前記しきい値は、モデル検体として、前記吸引部の開口径に近似した粒径を有する沈殿物を入れた反応容器における第1の受光強度と、沈殿物を入れていない反応容器における第2の受光強度との間の値として決められることが好ましい。
【0023】
前記吸引部の詰まりの原因となる不溶物の有無を判定する不溶物判定部は、前記受光部における受光強度に依存するパラメータの積算値に基づいて、不溶物の有無を判定することが好ましい。
【0024】
前記測光部は、前記発光部と前記受光部とが対向する位置に配置され、前記反応容器を鉛直方向にスキャンさせる操作部を有していることが好ましい。これにより積算値を求めることができる。
【0025】
前記測光部の近傍に、前記不溶物判定部が不溶物有りと判定した前記反応容器を排出または廃棄する廃棄部を備えることが好ましい。
【0026】
本発明の他の観点によれば、反応容器内の抗体又は抗原結合磁性粒子に反応した抗原又は抗体と未反応な遊離抗原又は抗体を洗浄し吸引部(ノズル)により吸引することで分離するB/F分離処理を含む免疫測定法であって、前記B/F分離ステップの前ステップとして、前記反応容器に光照射を行う発光部と、反応容器の透過光を測定する受光部と、を備えた測光ステップと、前記受光部における受光強度に基づいて、前記吸引部の詰まりの原因となる不溶物の有無を判定する不溶物判定ステップと、を有することを特徴とする免疫測定法が提供される。
【0027】
また、本発明は、上記に記載の免疫測定法をコンピュータに実行させるためのプログラム、当該プログラムを記録するコンピュータ読み取り可能な記録媒体であっても良い。
【発明の効果】
【0028】
本発明によれば、B/F分離を含む免疫測定装置において、B/F分離処理における不溶物に起因するノズル詰まりを防止することができる。
【0029】
また、不溶物に起因するB/F分離処理が不完全になることを抑制して、対象物質の濃度などの測定結果が偽陽性になったり、偽陰性になったりすることによる、医療過誤の要因を少なくすることができる。
【図面の簡単な説明】
【0030】
【図1】本発明の一実施の形態によるB/F分離を含む免疫測定法の流れを示す概要図である。
【図2A】本発明の一実施の形態による免疫測定装置の概略構成を示す斜視図である。
【図2B】本発明の一実施の形態による免疫測定装置の概略構成を示す分解斜視図である。
【図3】本発明の一実施の形態による免疫測定装置の概略構成を示す平面図である。
【図4】本発明の一実施の形態による免疫測定装置の要部の概略構成を示す図である。
【図5】本発明の一実施の形態による免疫測定装置のうち、不溶物測定部の概略構成を示す図である。
【図6】本発明の一実施の形態による免疫測定装置の概略構成例を示す機能ブロック図である。
【図7】実施例1の標準モデル検体を用いた測光結果を示す図であり、(a)は赤色LEDを、(b)は緑色LEDを、(c)は青色LEDを用いた場合の、受光部(フォトダイオード)の受光強度に依存する電圧と、反応容器のz方向へのスキャンタイミングとの関係を示す図である。
【図8】実施例1の標準モデル検体を用いた測光結果を示す図であり、(a)は赤色LEDを、(b)は緑色LEDを、(c)は青色LEDを用いた場合の、受光部(フォトダイオード)の受光強度に依存する吸光度と、反応容器のz方向へのスキャンタイミングとの関係を示す図である。
【図9】実施例2のモデル検体を用いた免疫測定に用いられる反応容器群の一例を示す図である。
【図10】実施例2のモデル検体を用いた測光結果を示す図であり、(a)は赤色LEDを、(b)は緑色LEDを、(c)は青色LEDを用いた場合の、受光部(フォトダイオード)の受光強度に依存する電圧と、反応容器のz方向へのスキャンタイミングとの関係を示す図である。
【図11】実施例2のモデル検体を用いた測光結果を示す図であり、(a)は赤色LEDを、(b)は緑色LEDを、(c)は青色LEDを用いた場合の、受光部(フォトダイオード)の受光強度に依存する吸光度と反応容器のz方向へのスキャンタイミングとの関係を示す図である。
【図12】実施例3の実検体を用いた免疫測定に用いられる反応容器群の一例を示す図である。
【図13】実施例3の実検体を用いた測光結果を示す図であり、(a)は赤色LEDを、(b)は緑色LEDを、(c)は青色LEDを用いた場合の、受光部(フォトダイオード)の受光強度に依存する電圧と、反応容器のz方向へのスキャンタイミングとの関係を示す図である。
【図14】実施例3の実検体を用いた測光結果を示す図であり、(a)は赤色LEDを、(b)は緑色LEDを、(c)は青色LEDを用いた場合の、受光部(フォトダイオード)の受光強度に依存する吸光度と反応容器のz方向へのスキャンタイミングとの関係を示す図である。
【図15】実施例4の共存物質を含む検体の測光結果を示す図であり、(a)は赤色LEDを、(b)は緑色LEDを、(c)は青色LEDを用いた場合の、受光部(フォトダイオード)の受光強度に依存する電圧と、反応容器のz方向へのスキャンタイミングとの関係を示す図である。
【図16】実施例4の共存物質を含む検体の測光結果を用いた測光結果を示す図であり、(a)は赤色LEDを、(b)は緑色LEDを、(c)は青色LEDを用いた場合の、吸光度と反応容器のz方向へのスキャンタイミングとの関係を示す図である。
【図17】実施例5の免疫測定装置を用いた場合の測光結果を示す図であり、赤色LEDを用い、(a)はBGG依存性、(b)は沈殿物の量依存性、(c)は検体依存性の、受光部(フォトダイオード)の受光強度に依存する電圧と、反応容器のz方向へのスキャンタイミングとの関係を示す図である。
【図18】実施例5の免疫測定装置を用いた場合の測光結果を示す図であり、赤色LEDを用い、(a)はBGG依存性、(b)は沈殿物の量依存性、(c)は検体依存性の、吸光度と反応容器のz方向へのスキャンタイミングとの関係を示す図である。
【図19】実施例6の免疫測定装置を用いた共存の物質のモデル検体として血漿/血清の実検体を用いた場合の測光結果を示す図であり、赤色LEDを用い、(a)は共存物質のモデル検体、(b)は乳び血漿、(c)はHb血漿の、受光部(フォトダイオード)の受光強度に依存する電圧と、反応容器のz方向へのスキャンタイミングとの関係を示す図である。
【図20】実施例6の免疫測定装置を用いた共存の物質のモデル検体として血漿/血清の実検体を用いた場合の測光結果を示す図であり、赤色LEDを用い、(a)は共存物質のモデル検体、(b)は乳び血漿、(c)はHb血漿の、受光部(フォトダイオード)の吸光度と、反応容器のz方向へのスキャンタイミングとの関係を示す図である。
【図21】1ステップ法による免疫測定法の流れを示すフローチャート図である。
【図22】ディレイド1ステップ法による免疫測定法の流れを示すフローチャート図である。
【図23】2ステップ法(1)による免疫測定法の流れを示すフローチャート図である。
【図24】2ステップ法(2)による免疫測定法の流れを示すフローチャート図である。
【図25】前処理付き2ステップ法による免疫測定法の流れを示すフローチャート図である。
【図26】前希釈付き2ステップ法による免疫測定法の流れを示すフローチャート図である。
【発明を実施するための形態】
【0031】
以下、本発明の実施の形態による不溶物判定技術について図面を参照しながら説明を行う。
B/F分離を必要とするヘテロジニアスアッセイ系において、B/F分離とは抗体(または抗原)結合磁性粒子に反応した抗原(または抗体)と未反応な遊離抗原(または抗体)を
洗浄分離する方法である。
【0032】
まず、本発明の一実施の形態によるB/F分離部と測光部とを有する免疫測定装置について説明する。図1は、本発明の一実施の形態によるB/F分離を含む免疫測定の流れを示す概要図である。図1については前述したため、説明を省略する。
【0033】
図2Aは、本発明の一実施の形態による免疫測定装置の概略構成を示す斜視図である。図2Bは、本発明の一実施の形態による免疫測定装置の概略構成を示す分解斜視図である。
【0034】
また、本実施の形態による免疫測定装置Aには、反応容器1を1本ずつ自動的に装置に供給するオートセルフィーダー37と、インキュベーションを行うためのインキュベーションテーブル39と、B/F分離処理を行うためのB/F分離機構41と、不溶物の検出を行う検出ユニット(不溶物検出部)45と、を有する。
【0035】
図3は、本発明の一実施の形態による免疫測定装置の概略構成例を示す平面図である。図3に示すように、本発明の一実施の形態による免疫測定装置Aを上面からみると、例えば、反応容器1内に検体を分注するサンプル分注部20と試薬を分注する試薬分注部(1)50または(2)23、検体・試薬が分注された反応容器1内の1次または2次免疫反応液を攪拌する反応容器攪拌部47または55aと、1次または2次免疫反応を行うインキュベーションテーブル(1)43及び(2)44と、試薬を保冷する試薬保冷部51と、反応容器を搬送する反応容器搬送部57と、試薬ノズル洗浄槽61と、不溶物の検出を行う不溶物検出部(測光部)63と、測光部63で不溶物が検出され排出または廃棄すべき検体を反応容器1毎排出または廃棄する廃棄部64と、測光部63で不溶物が検出されずに排出または廃棄しないでB/F分離をすべき検体のB/F分離処理を行うB/F分離部65と、B/F分離処理における洗浄液1、2を吐出するB/F分注部(1)67、(2)69と、B/F洗浄部65aと、試薬ノズルを洗浄する試薬ノズル洗浄槽70と、シグナルを検出する検出部97と、シグナル検出後の反応容器1毎を廃棄する廃棄部64と、を有している。尚、上記構成のうちのいずれかを他の構成で置換したり、一部の構成を他の装置に持たせたりすることが可能である。
【0036】
装置の動作について説明する。
図4は、本発明の一実施の形態による免疫測定装置の要部の概略構成を示す図である。図4(a)に示すように、反応容器搬送部57により、反応容器1が測光部63内に挿入され、Z軸方向に移動させながらLED発光の透過光を受光素子により測定して、不溶物量に依存する受光素子の電圧又は吸光度を求める。求めた電圧又は吸光度に基づいて、あるしきい値を超える反応容器は、透明であり不溶物なしとして、検体として利用することができる。あるしきい値を超えない反応容器は、不溶物ありと判断して、検体として利用できないため、廃棄部64に排出または廃棄する。
【0037】
図5は、本発明の一実施の形態による免疫測定装置のうち、不溶物検出部(測光部)63の詳細な構成例を示す図である。反応容器搬送部57は、反応容器1を把持し、上下(Z軸)方向に移動させることができる。不溶物検出部63は、空洞63aを有しており、空洞63aの内壁の反応容器1を挟んで対向する位置に、発光部(LED)81と、受光部(フォトダイオード、PD)85と、を配置している。そして、LED(発光部)81からの発光は、反応容器1の中心部を透過してPD(受光部)85に照射される。照射された光は、PD85において、受光する光量に依存する電圧に変換され、吸光度を求めることができる。電圧が高いほど、検体中の不溶物が少ない、すなわち吸光度が低い。従って、受光素子の電圧又は吸光度により、検体中の不溶物量を推定することができる。
【0038】
図6は、本発明の一実施の形態による免疫測定装置の概略構成例を示す機能ブロック図である。まず、反応容器1内の検体は、前処理部91において前処理が行われ、次いで、1次免疫反応後、不溶物検出部63で測光される。次いで、不溶物検出部63における測光結果に基づいて、不溶物判定部95でノズルの詰まりが生じるような不溶物の有無を判定し、そのような不溶物がない場合には、B/F分離部65でB/F(1)分離を行う。次いで、2次免疫反応後、B/F分離部65でB/F(2)分離を行い、検出部97でシグナル量の分析を行い、抗原、抗体の定量及び定性分析を行う。ここで、不溶物判定部95は、しきい値記憶部96に予め記憶していたしきい値又はしきい値入力部98から入力されたしきい値等との比較結果に基づいてノズル詰まりの可能性を判定する。
【0039】
次に、不溶物判定の具体的な処理内容について説明する。
ノズル径が0.6〜0.8mmであるため、それよりも少し大きい径を持つ沈殿物を入れた標準モデル検体を、ノズルを詰まらせる不溶物の標準試料として用いることができる。
【0040】
[実施例1]
図7は、反応容器1のz軸に沿ったスキャンのタイミングと赤LED、緑LED、青LEDのそれぞれにおけるPDの出力電圧(LED光の透過率に対応)の関係を、沈殿物無し、少量から多量のそれぞれについて測定した図である。図7より沈殿物の程度におけるスキャン期間中の電圧の和(電圧積算値)を求めることができる。同様に、LED(緑)、LED(青)についてもスキャン期間中の電圧の和(電圧積算値)を求めると表1のようになる。0.5msにて、例えば288ポイントを測光している。実装置のデータでLEDの切替えをする際は、288ポイントを測光するLEDの数で割った分、つまり赤と緑の2つであれば144ポイントずつになる。測光部のみの簡易装置では、各波長において288ポイントを測光することが可能である。
【0041】
【表1】

【0042】
【表2】

【0043】
表1では、LED(赤)、LED(緑)、LED(青)のいずれの場合でも、スキャン中の電圧の和(電圧積算値)は、沈殿物の量とともに減少することがわかる。ここで、沈殿物無しと少量との間にノズル詰まりに関する電圧積算値のしきい値があることから、表2に示すように、各色のLEDにおけるノズル詰まりに関する電圧積算値のしきい値は、それぞれ、35000、25000、20000と求めることができる。これらのしきい値以下であると、ノズル詰まりが生じることになる。
【0044】
このしきい値が、以下に説明する同様の検体における、ノズルを詰まらせるか否かの判定の基準値となる。この基準値を、しきい値記憶部96に記憶しておく。或いは、しきい値入力部98から入力しておく。
【0045】
図8は、標準モデル検体を用いた測光結果を示す図であり、図7に対応する図である。図8(a)は赤色LEDを、(b)は緑色LEDを、(c)は青色LEDを用いた場合の、受光部(フォトダイオード)の受光強度に依存する吸光度と、反応容器のz方向へのスキャンタイミングとの関係を示す図である。図8より沈殿物の量におけるスキャン中の吸光度の積算値を求めることができる。同様に、LED(緑)、LED(青)についてもスキャン中の吸光度の和(積算値)を求めると表3のようになる。沈殿物の有無における積算値のしきい値が求まる。同様に、LED(緑)、LED(青)についても求めると以下のようになる。
【0046】
【表3】

【0047】
【表4】

【0048】
吸光度を基準にする場合には、LED(赤)、LED(緑)、LED(青)のしきい値は、表4に示すように150000、160000、350000であることがわかる。これらのしきい値以上であると、ノズル詰まりが生じることになる。
【0049】
このしきい値も、以下に説明する同様の検体における、ノズルを詰まらせるか否かの判定の基準値となる。この基準値を、しきい値記憶部96に記憶しておく。或いは、しきい値入力部98から入力しておく。
【0050】
[実施例2]
図9は、モデル検体を用いた免疫反応に用いられる反応容器群の一例を示す図である。
【0051】
モデル検体1として、ヒト正常血清(NHS)にBovine γG(BGG)を添加し、疑似的高タンパク血清を作製し、前処理を実施したものを用いた。図9の左側の反応容器から順番に、NHS、+0.5%BGG、+1%BGG、+2%BGG、+4%BGG、+6%BGG、+8%BGG、+10%BGGの酸・アルカリ前処理後の様子を示す図であり、ある反応容器には不溶物の白濁が発生していることがわかる。不溶物の検出は、LED光を反応容器の底部から上部に向けて走査照射し受光素子により受光させて、反応容器を透過する透過光量に依存する受光素子の電圧の値を積算する。
【0052】
【表5】

【0053】
【表6】

【0054】
表5は、LED(赤)、LED(緑)、LED(青)に関する、NHS、+0.5%BGG、+1%BGG、+2%BGG、+4%BGG、+6%BGG、+8%BGG、+10%BGGのスキャン中の電圧の和(電圧積算値)を示す表である。表6より、LED(赤)、LED(緑)、LED(青)に関するしきい値として、35000、25000、20000がしきい値記憶部96に記憶されている(表2と同じ値)。このしきい値を参照して、実際に図10で求めた値から、それぞれ、しきい値以上の電圧積算値は、LED(赤)で+1%BGG、LED(緑)で+0.5%BGG、LED(青)でも+0.5%BGGとなり、これらの結果より、+1%BGGから+0.5%BGGの検体は、ノズルを詰まらせない可能性が高い検体であると判断することができる。この測光結果より、安全を見込めば+0.5%BGGの検体までをB/F分離処理に用い、それ以上の高濃度のBGG検体は排出または破棄することになる。
【0055】
図11は、モデル検体を用いた測光結果を示す図であり、(a)は赤色LEDを、(b)は緑色LEDを、(c)は青色LEDを用いた場合の、吸光度と反応容器のz方向へのスキャンタイミングとの関係を示す図である。
【0056】
【表7】

【0057】
【表8】

【0058】
表7は、LED(赤)、LED(緑)、LED(青)に関する、NHS、+0.5%BGG、+1%BGG、+2%BGG、+4%BGG、+6%BGG、+8%BGG、+10%BGGのスキャン中の吸光度積算値を示す表である。表8よりLED(赤)、LED(緑)、LED(青)に関するしきい値として、150000、160000、350000がしきい値記憶部96に記憶されている(表4と同じ値)。このしきい値を参照して、実際に図11で求めた値から、それぞれ、しきい値以下の吸光度積算値は、LED(赤)で+1%BGG、LED(緑)で+0.5%BGG、LED(青)でも+0.5%BGGとなり、これらの結果より、+1%BGGから+0.5%BGGの検体は、ノズルを詰まらせない可能性が高い検体であると判断することができる。この測光結果より、安全を見込めば+0.5%BGGの検体までをB/F分離処理に用い、それ以上の高濃度のBGG検体は排出または廃棄することになる。電圧積算値でも吸光度の積算値でも同様の結果が得られている。
【0059】
このようにして、NHS、+0.5%BGGの各検体について、実際にB/F分離でノズルを詰まらせることなく処理を行うことができることがわかる。すなわち、これらの検体は、ノズル詰まりを生じさせないものであり、B/F分離を行っても良い検体であると言える。
【0060】
[実施例3]
図12は、実検体を用いた免疫反応に用いられる反応容器群の一例を示す図である。
【0061】
実検体として、高タンパク血漿検体を用いている。図12の左側の反応容器から順番に、ヒト正常血清、残り6反応容器が、酸・アルカリ前処理後、多様な不溶物が発生した様子を示しており(左から#4、#6、#39、#43、#72、#82である)、不溶物の白濁が発生していることがわかる。不溶物の検出はLED光を反応容器に走査照射し受光させて、光量に依存する受光素子の電圧の値を積算する。
【0062】
図13は、実検体を用いた測光結果を示す図であり、(a)は赤色LEDを、(b)は緑色LEDを、(c)は青色LEDを用いた場合の、受光部(フォトダイオード)の受光強度に依存する電圧と、反応容器のz方向へのスキャンタイミングとの関係を示す図である。
【0063】
図13より、各種検体におけるスキャン中の電圧の和(電圧積算値)を求めることができる(表9)。
【0064】
【表9】

【0065】
【表10】

【0066】
また、表10は、表2に対応する表である。表9と表10より、この検体では、NHS以外の検体では、しきい値以下の電圧積算を有しており、これらの検体は不溶物を含みノズルを詰まらせる可能性がある検体であることがわかる。
【0067】
図14は、実検体を用いた測光結果を示す図であり、(a)は赤色LEDを、(b)は緑色LEDを、(c)は青色LEDを用いた場合の、吸光度と反応容器のz方向へのスキャンタイミングとの関係を示す図である。図14より、各種検体におけるスキャン中の吸光度の積算値を求めることができる(表11)。
【0068】
【表11】

【0069】
【表12】

【0070】
また、表12は、表4に対応する表である。表11と表12より、この検体では、NHS以外の検体では、しきい値以上の吸光度積算値を有しており、これらの検体は不溶物を含みノズルを詰まらせる可能性がある検体であることがわかる。この結果は、図13の結果と同様である。
【0071】
以上のように、ノズル径よりも少しだけ大きい径を有する沈殿物に関する、積算電圧、又は、吸光度積算値に基づいて求めたしきい値を記憶しておき、このしきい値に基づいて、実際の検体のB/F分離処理前の測光処理においてその検体の積算値が上記しきい値よりも大きいか否かに基づいて、ノズルを詰まらせるような検体であるか否かを測光部において判定することができる。
【0072】
従って、B/F分離処理前に、非破壊的に検体内の不溶物の有無を調べることができ、B/F分離処理におけるノズル詰まりを未然に防止することができる。
【0073】
このように、B/F分離を含む免疫測定装置において、B/F分離処理における不溶物に起因するノズル詰まりを防止し、また、不溶物に起因するB/F分離処理が不完全になることを抑制して、対象物質の濃度などの測定結果が偽陽性になったり、偽陰性になったりすることによる、医療過誤の要因を少なくすることができる。
【0074】
次に、共存物質の影響について説明する。検体には、直接型ビリルビン(Bil−F)、抱合型ビリルビン(Bil−C)、乳び、溶血(Hb)の共存物質が混入している場合が多く、これらが不溶物検出処理に影響を与える可能性がある。以下に、共存物質の影響を考慮した免疫測定技術の例について説明する。
【0075】
[実施例4]
図15は、共存物質を含む検体の測光結果を示す図であり、(a)は赤色LEDを、(b)は緑色LEDを、(c)は青色LEDを用いた場合の、受光部(フォトダイオード)の受光強度に依存する電圧と、反応容器のz方向へのスキャンタイミングとの関係を示す図である。共存物質としては、NHS、Bil−F・L(約4mg/dL)、Bil−F・H(約20mg/dL)、Bil−C・L(約4mg/dL)、Bil−C・H(約20mg/dL)、乳び・L(約280濁度)、乳び・H(約1400濁度)、Hb・L(約95mg/dL)、Hb・H(約480mg/dL)を例として測定している。
【0076】
【表13】

【0077】
【表14】

【0078】
表13は測定結果を示すものであり、表14は表2に対応し、電圧変換の場合のしきい値を示す。
表13は、電圧積算の結果を示す図である。この表13を見るとわかるように、LED(緑)、LED(青)では、しきい値を超えないものが多く、実際には共存物質は検体中に含まれてB/F分離処理が行われるべきであるにもかかわらず、共存物質が含まれることでしきい値以下の積算値とされて排出または廃棄対象となってしまうという問題がある。
【0079】
そこで、光源のLEDとしては、LED(赤)を用いることが好ましい。さらに、LED(赤)を用いても、Hb・L、Hb・Hは、しきい値で、共存物質であるか否かを判定できない。そこで、測光部63の第1のPD85(可視光用)に加えて、同様の第2のPDに赤色のみを透過するフィルタを付けることで赤色であることを検出し(或いは目視により検出し)、2つの第1及び第2のPDの測定結果から、第1のPDでしきい値以下であるが、第2のPDで赤色であることを検出すると、これを、Hb・L、Hb・Hの共存物質と判定するようにすると良い。このようにすれば、共存物質を含む検体を不溶物として除去することを防止することができる。目視で判定することもできる。
【0080】
図16は、共存物質を含む検体の測光結果を示す図であり、(a)は赤色LEDを、(b)は緑色LEDを、(c)は青色LEDを用いた場合の、吸光度と反応容器のz方向へのスキャンタイミングとの関係を示す図である。
【0081】
【表15】

【0082】
【表16】

【0083】
表15は測定結果を示すものであり、表16は表4に対応し、吸光度の場合のしきい値を示す。
LED(緑)、LED(青)では、しきい値を超えるものが多く、実際には共存物質は検体中に含まれてB/F分離処理が行われるべきであるにもかかわらず、共存物質が含まれることでしきい値以上の吸光度積算値とされて排出または廃棄対象となってしまうという問題がある。そこで、上記の場合と同様に、LEDとしては、LED(赤)を用いることが好ましい。さらに、LED(赤)を用いても、Hb・L、Hb・Hは、しきい値で、共存物質であるか否かを判定できない。そこで、測光部63の第1のPD85(可視光用)に加えて、同様の第2のPDに赤色のみを透過するフィルタを付けることで赤色であることを検出し(或いは目視により検出し)、2つの第1及び第2のPDの測定結果から、第1のPDでしきい値以下であるが、第2のPDで赤色であることを検出すると、これを、Hb・L、Hb・Hの共存物質と判定するようにしても良い。このようにすれば、吸光度測定の場合でも、共存物質を含む検体を不溶物として除去することを防止することができる。
【0084】
[実施例5]
図17は、免疫測定装置(実装置)を用いた測光結果の図であり、赤色LEDを用いた場合における、(a)はNHS、+0.5%BGG、+1%BGG、+2%BGG、+4%BGG、+6%BGG、+8%BGG、+10%BGGのスキャン中の電圧の和(電圧積算値)を示す表である。(b)は、沈殿物なし、少から多の場合の測定結果を示す図であり、(c)は、NHSと、種々の検体の測定結果を示す図である。
【0085】
【表17】

【0086】
【表18】

【0087】
表18は、沈殿物0(NHS)と少の場合の間の20000にしきい値を設定する。そして、表17に示す測定結果より、+1%BGGの場合が、ノズルの詰まらせない限界であると判定することができる。さらに、#4から#82までの表示されている全ての検体がしきい値を超えておらず、不溶物によるノズル詰まりを生じさせる可能性がある検体であることがわかる。
【0088】
図18は、免疫測定装置を用いた測光結果の図であり、(a)はNHS、+0.5%BGG、+1%BGG、+2%BGG、+4%BGG、+6%BGG、+8%BGG、+10%BGGのスキャン中の吸光度の和(吸光度積算値)を示す表である。(b)は、沈殿物なし、少から多の場合の測定結果を示す図であり、(c)は、NHSと、種々の検体の測定結果を示す図である。
【0089】
【表19】

【0090】
【表20】

【0091】
同様に沈殿物0と少との間の吸光度のしきい値として400000が求められる(表20)。この値を元に、表19に示すように、+1%BGGの場合が、ノズルの詰まらせない限界であると判定することができる。さらに、#4から#82までの表示されている全ての検体がしきい値を超えており、不溶物によるノズル詰まりを生じさせる検体であることがわかる。
【0092】
[実施例6]
図19は、免疫測定装置を用いた共存物質のモデル検体として血漿/血清の実検体を用いた場合の測光結果を示す図であり、(a)共存物質のモデル検体、(b)は乳び血漿、(c)はHb血漿の、受光部(フォトダイオード)の電圧と、反応容器のz方向へのスキャンタイミングとの関係を示す図である。
【0093】
【表21】

【0094】
【表22】

【0095】
上記で求めた表18の、沈殿物0(NHS)と1個の場合の間の20000をしきい値とすると、表21のうち、Hb・H以外は全て、不溶物でないと判断される。尚、Hb・Hは、本来は共存物質であるが、上記と同様に、LED(赤)を用いても、Hb・L、Hb・Hは、しきい値で、共存物質であるか否かを判定できない。そこで、測光部63の第1のPD85(可視光用)に加えて、同様の第2のPDに赤色のみを透過するフィルタを付けることで赤色であることを検出し(或いは目視により検出し)、2つの第1及び第2のPDの測定結果から、第1のPDでしきい値以下であるが、第2のPDで赤色であることを検出すると、これを、Hb・L、Hb・Hの共存物質と判定するようにしても良い。
【0096】
また、図20は、免疫測定装置を用いた共存物質のモデル検体として血漿/血清の実検体を用いた場合の測光結果を示す図であり、赤色LEDを用い、(a)共存物質のモデル検体、(b)は乳び血漿、(c)はHb血漿の、受光部(フォトダイオード)の吸光度と、反応容器のz方向へのスキャンタイミングとの関係を示す図である。
【0097】
【表23】

【0098】
【表24】

【0099】
この場合には、表24に示す400000のしきい値(表20に対応)を利用して、全ての血清・血漿、等の共存物質を、ノズル詰まりのない物質として判定することができる。
【0100】
[実施例7]
次に、実際の装置を用いて検体を測定するための処理の流れについて、いくつかの例について、より具体的に説明する。
【0101】
図21は、1ステップ法による免疫測定法の流れを示すフローチャート図である。
この1ステップ法では、酵素標識物、サンプル(検体)、磁性粒子を分注し(ステップS1)、攪拌/インキュベーション(37℃)を行い(ステップS2)、次いで、不溶物測光(LED):する・しないの選択を行い(ステップS3)、不溶物測光をする場合で測光結果が不溶物無しであれば、B/F分離洗浄操作(集磁、反応液吸引/洗浄液分注、攪拌)を行う(ステップS4)。次いで、発光試薬1を入れて攪拌を行い(ステップS5)、発光試薬2(基質)を入れ(ステップS6)、発光量の測定を行う(ステップS7)。これにより、B/F分離処理前にノズル詰まりの可能性を判定し、ノズル詰まりを未然に防ぐことが出来る。
【0102】
[実施例8]
図22は、ディレイド1ステップ法による免疫測定法の流れを示すフローチャート図である。すなわち、免疫反応溶液、サンプル(検体)、磁性粒子を分注する(ステップS11)。次いで、攪拌/インキュベーション(37℃)を行い(ステップS12)、酵素標識物を添加し(ステップS13)、攪拌/インキュベーション(37℃)を行う(ステップS14)。次いで、不溶物の測光処理(LED)をする・しないの選択を行い(ステップS15)、不溶物測光をする場合で測光結果が不溶物無しであれば、B/F分離洗浄操作(集磁、反応液吸引/洗浄液分注、攪拌)を行う(ステップS16)。さらに、発光試薬1を添加して攪拌し(ステップS17)、発光試薬2(基質)を入れて(ステップS18)、発光量の測定を行う(ステップS19)。これにより、B/F分離処理前にノズル詰まりの可能性を判定し、ノズル詰まりを未然に防ぐことが出来る。
【0103】
[実施例9]
図23は、2ステップ法(1)による免疫測定法の流れを示すフローチャート図である。免疫反応溶液、サンプル(検体)、磁性粒子を分注し(ステップS21)、攪拌/インキュベーション(37℃)を行う(ステップS22)。次いで、不溶物の測光処理(LED)をする・しないの選択を行い(ステップS23)、不溶物測光をする場合で測光結果が不溶物無しであれば、B/F分離洗浄操作(集磁、反応液吸引/洗浄液分注、攪拌)を行う(ステップS24)。酵素標識希釈液と酵素標識物を添加する(ステップS25)。さらに、攪拌/インキュベーション(37℃)を行い(ステップS26)、B/F分離洗浄操作(集磁、反応液吸引/洗浄液分注、攪拌)を行う(ステップS27)。次いで、発光試薬1を入れ攪拌し(ステップS28)、発光試薬2(基質)を用いて(ステップS29)、発光量の測定を行う(ステップS30)。これにより、B/F分離処理前にノズル詰まりの可能性を判定し、ノズル詰まりを未然に防ぐことが出来る。
【0104】
[実施例10]
図24は、2ステップ法(2)による免疫測定法の流れを示すフローチャート図である。まず、免疫反応溶液1、免疫反応溶液2を分注し(ステップS31)、攪拌した後、サンプル(検体)、磁性粒子を混ぜる(ステップS32)。次いで、攪拌/インキュベーション(37℃)を行う(ステップS33)。次いで、不溶物の測光処理(LED)をする・しないの選択を行い(ステップS34)、不溶物測光をする場合で測光結果が不溶物無しであれば、B/F分離洗浄操作(集磁、反応液吸引/洗浄液分注、攪拌)を行う(ステップS35)。次いで酵素標識希釈液、酵素標識物を混ぜて(ステップS36)、攪拌/インキュベーション(37℃)を行う(ステップS37)。次いで、B/F分離洗浄操作(集磁、反応液吸引/洗浄液分注、攪拌)を行い(ステップS38)、発光試薬1を加えて攪拌する(ステップS39)。そして、発光試薬2(基質)を用いて(ステップS40)、発光量の測定を行う(ステップS41)。これにより、B/F分離処理前にノズル詰まりの可能性を判定し、ノズル詰まりを未然に防ぐことが出来る。
【0105】
[実施例11]
図25は、前処理付き2ステップ法による免疫測定法の流れを示すフローチャート図である。この方法は、前処理の自動化を含む2ステップ法である。
【0106】
まず、前処理液と、サンプル(検体)とを用い(ステップS51)攪拌/インキュベーション(37℃)を行う(ステップS52)。次いで、免疫反応溶液を混ぜて(ステップS53)、攪拌し、磁性粒子を混ぜて(ステップS54)、攪拌/インキュベーション(37℃)を行う(ステップS55)。次いで、不溶物の測光処理(LED)をする・しないの選択を行い(ステップS56)、不溶物測光をする場合で測光結果が不溶物無しであれば、B/F分離洗浄操作(集磁、反応液吸引/洗浄液分注、攪拌)を行う(ステップS57)。次いで、酵素標識希釈液、酵素標識物を用い(ステップS58)、攪拌/インキュベーション(37℃)を行う(ステップS59)。次いで、B/F分離洗浄操作(集磁、反応液吸引/洗浄液分注、攪拌)を行う(ステップS60)。さらに、発光試薬1を混ぜて(ステップS61)攪拌し、発光試薬2(基質)を用いて(ステップS62)、発光量の測定を行う(ステップS63)。これにより、B/F分離処理前にノズル詰まりの可能性を判定し、ノズル詰まりを未然に防ぐことが出来る。
【0107】
[実施例12]
図26は、前希釈付き2ステップ法による免疫測定法の流れを示すフローチャート図である。
【0108】
まず、検体希釈液とサンプル(検体)を分注し(ステップS71)、攪拌した後、免疫反応液、希釈済み検体を混ぜて(ステップS72)攪拌する。次いで、磁性粒子を加え(ステップS73)、攪拌/インキュベーション(37℃)を行う(ステップS74)。次いで、不溶物の測光処理(LED)をする・しないの選択を行い(ステップS75)、不溶物測光をする場合で測光結果が不溶物無しであれば、B/F分離洗浄操作(集磁、反応液吸引/洗浄液分注、攪拌)を行う(ステップS76)。次いで、酵素標識希釈液、酵素標識物を混ぜ(ステップS77)、攪拌/インキュベーション(37℃)を行う(ステップS78)。さらに、B/F分離洗浄操作(集磁、反応液吸引/洗浄液分注、攪拌)を行い(ステップS79)、発光試薬1を混ぜて攪拌する(ステップS80)。発光試薬2(基質)を用いて(ステップS81)、発光量の測定を行う(ステップS82)。これにより、B/F分離処理前にノズル詰まりの可能性を判定し、ノズル詰まりを未然に防ぐことが出来る。
【0109】
以上に説明したように、本実施の形態による免疫測定装置によれば、前処理の有無、項目試薬数、などに依存せずに、種々の方法において、非破壊的に、不溶物の検出を行った後に、B/F処理を行うため、B/F分離を含む免疫測定装置において、B/F分離処理における不溶物に起因するノズル詰まりを防止し、また、不溶物に起因するB/F分離処理が不完全になることを抑制して、対象物質の濃度などの測定結果が偽陽性になったり、偽陰性になったりすることによる、医療過誤の要因を少なくすることができる。
【0110】
上記の実施の形態において、添付図面に図示されている構成等については、これらに限定されるものではなく、本発明の効果を発揮する範囲内で適宜変更することが可能である。その他、本発明の目的の範囲を逸脱しない限りにおいて適宜変更して実施することが可能である。
【産業上の利用可能性】
【0111】
本発明は、免疫測定技術に用いることができる。
【符号の説明】
【0112】
1…反応容器、3…反応液、5…磁石、7…吸引ノズル、11…吐出部、21…項目試薬保冷庫、23…サンプル分注機構、25…検体搬送部、27…アルカリ・B/F洗浄液、
31…基質保冷庫、33…廃棄容器、35…メイン扉、37…オートセルフィーダー、39…インキュベーションテーブル、41…B/F分離機構、45…検出ユニット、57…反応容器搬送部、61…試薬ノズル洗浄槽、63…不溶物検出部(測光部)、63a…空洞、64…廃棄部、65…B/F分離部、81…LED、85…PD、91…前処理部、95…不溶物判定部、96…しきい値記憶部、97…検出部、98…しきい値入力部。
【特許請求の範囲】
【請求項1】
反応液内の抗体結合担体又は抗原結合担体に反応した抗原又は抗体と未反応な遊離抗原又は遊離抗体を洗浄し前記未反応な遊離抗原又は遊離抗体を吸引部(ノズル)により吸引することで分離するB/F分離部を備えた免疫測定装置であって、
前記B/F分離部の前段に、前記反応容器に光照射を行う発光部と、反応容器の透過光を測定する受光部と、を備えた測光部と、
前記受光部における受光強度に基づいて、前記吸引部の詰まりの原因となる不溶物の有無を判定する不溶物判定部と、
を有することを特徴とする免疫測定装置。
【請求項2】
さらに、不溶物の有無を判定するしきい値を格納するしきい値格納部を設け、
前記不溶物判定部は、前記受光部の受光強度と、前記しきい値との大小関係に基づいて、不溶物の有無を判定することを特徴とする請求項1に記載の免疫測定装置。
【請求項3】
前記担体は、磁性粒子であることを特徴とする請求項1又は2に記載の免疫測定装置。
【請求項4】
前記発光部の光源として、LEDを用いることを特徴とする請求項1から3までのいずれか1項に記載の免疫測定装置。
【請求項5】
前記LEDとして、赤色LEDを用いることを特徴とする請求項4に記載の免疫測定装置。
【請求項6】
前記受光部は、赤色を検出波長帯に含む第1の受光素子と、赤色を検出波長帯に含む第2の受光素子であって、赤色以外をフィルタリングするフィルタ部を受光面側に設け第2の受光素子との受光強度の差異に基づいて、前記不溶物判定部が不溶物の判定を行うことを特徴とする請求項5に記載の免疫測定装置。
【請求項7】
前記しきい値は、モデル検体として、前記吸引部の開口径に近似した沈殿物を有するモデル検体を入れた反応容器における第1の受光強度と、モデル検体を入れていない反応容器における第2の受光強度との間の値として決められることを特徴とする請求項1から6までのいずれか1項に記載の免疫測定装置。
【請求項8】
前記吸引部の詰まりの原因となる不溶物の有無を判定する不溶物判定部は、前記受光部における受光強度に依存するパラメータの積算値に基づいて、不溶物の有無を判定することを特徴とする請求項1から7までのいずれか1項に記載の免疫測定装置。
【請求項9】
前記測光部は、前記発光部と前記受光部とが対向する位置に配置され、前記反応容器を鉛直方向にスキャンさせる操作部を有していることを特徴とする請求項1から8までのいずれか1項に記載の免疫測定装置。
【請求項10】
前記測光部の近傍に、前記不溶物判定部が不溶部有りと判定した前記反応容器を排出または廃棄する廃棄部を備えることを特徴とする請求項9に記載の免疫測定装置。
【請求項11】
反応容器内の抗体又は抗原結合担体に反応した抗原又は抗体と未反応な遊離抗原又は抗体を洗浄し吸引部(ノズル)により吸引することで分離するB/F分離処理を含む免疫測定法であって、
前記B/F分離ステップの前ステップとして、前記反応容器に光照射を行う発光部と、反応容器の透過光を測定する受光部と、を備えた測光ステップと、
前記受光部における受光強度に基づいて、前記吸引部の詰まりの原因となる不溶物の有無を判定する不溶物判定ステップと、
を有することを特徴とする免疫測定法。
【請求項12】
請求項11に記載の免疫測定法をコンピュータに実行させるためのプログラム。
【請求項1】
反応液内の抗体結合担体又は抗原結合担体に反応した抗原又は抗体と未反応な遊離抗原又は遊離抗体を洗浄し前記未反応な遊離抗原又は遊離抗体を吸引部(ノズル)により吸引することで分離するB/F分離部を備えた免疫測定装置であって、
前記B/F分離部の前段に、前記反応容器に光照射を行う発光部と、反応容器の透過光を測定する受光部と、を備えた測光部と、
前記受光部における受光強度に基づいて、前記吸引部の詰まりの原因となる不溶物の有無を判定する不溶物判定部と、
を有することを特徴とする免疫測定装置。
【請求項2】
さらに、不溶物の有無を判定するしきい値を格納するしきい値格納部を設け、
前記不溶物判定部は、前記受光部の受光強度と、前記しきい値との大小関係に基づいて、不溶物の有無を判定することを特徴とする請求項1に記載の免疫測定装置。
【請求項3】
前記担体は、磁性粒子であることを特徴とする請求項1又は2に記載の免疫測定装置。
【請求項4】
前記発光部の光源として、LEDを用いることを特徴とする請求項1から3までのいずれか1項に記載の免疫測定装置。
【請求項5】
前記LEDとして、赤色LEDを用いることを特徴とする請求項4に記載の免疫測定装置。
【請求項6】
前記受光部は、赤色を検出波長帯に含む第1の受光素子と、赤色を検出波長帯に含む第2の受光素子であって、赤色以外をフィルタリングするフィルタ部を受光面側に設け第2の受光素子との受光強度の差異に基づいて、前記不溶物判定部が不溶物の判定を行うことを特徴とする請求項5に記載の免疫測定装置。
【請求項7】
前記しきい値は、モデル検体として、前記吸引部の開口径に近似した沈殿物を有するモデル検体を入れた反応容器における第1の受光強度と、モデル検体を入れていない反応容器における第2の受光強度との間の値として決められることを特徴とする請求項1から6までのいずれか1項に記載の免疫測定装置。
【請求項8】
前記吸引部の詰まりの原因となる不溶物の有無を判定する不溶物判定部は、前記受光部における受光強度に依存するパラメータの積算値に基づいて、不溶物の有無を判定することを特徴とする請求項1から7までのいずれか1項に記載の免疫測定装置。
【請求項9】
前記測光部は、前記発光部と前記受光部とが対向する位置に配置され、前記反応容器を鉛直方向にスキャンさせる操作部を有していることを特徴とする請求項1から8までのいずれか1項に記載の免疫測定装置。
【請求項10】
前記測光部の近傍に、前記不溶物判定部が不溶部有りと判定した前記反応容器を排出または廃棄する廃棄部を備えることを特徴とする請求項9に記載の免疫測定装置。
【請求項11】
反応容器内の抗体又は抗原結合担体に反応した抗原又は抗体と未反応な遊離抗原又は抗体を洗浄し吸引部(ノズル)により吸引することで分離するB/F分離処理を含む免疫測定法であって、
前記B/F分離ステップの前ステップとして、前記反応容器に光照射を行う発光部と、反応容器の透過光を測定する受光部と、を備えた測光ステップと、
前記受光部における受光強度に基づいて、前記吸引部の詰まりの原因となる不溶物の有無を判定する不溶物判定ステップと、
を有することを特徴とする免疫測定法。
【請求項12】
請求項11に記載の免疫測定法をコンピュータに実行させるためのプログラム。
【図1】


【図2A】


【図2B】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【図17】


【図18】


【図19】


【図20】


【図21】


【図22】


【図23】


【図24】


【図25】


【図26】




【図2A】


【図2B】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【図17】


【図18】


【図19】


【図20】


【図21】


【図22】


【図23】


【図24】


【図25】


【図26】


【公開番号】特開2013−32992(P2013−32992A)
【公開日】平成25年2月14日(2013.2.14)
【国際特許分類】
【出願番号】特願2011−169589(P2011−169589)
【出願日】平成23年8月2日(2011.8.2)
【出願人】(000120456)栄研化学株式会社 (67)
【Fターム(参考)】
【公開日】平成25年2月14日(2013.2.14)
【国際特許分類】
【出願日】平成23年8月2日(2011.8.2)
【出願人】(000120456)栄研化学株式会社 (67)
【Fターム(参考)】
[ Back to top ]

