免疫細胞のインターフェロン産生を誘導し、Toll様受容体を活性化する漢方生薬エキス
【課題】免疫細胞のインターフェロン産生を誘導し、Toll様受容体を活性化する漢方生薬エキスならびにその作製方法を提供する。
【解決手段】本発明に係る漢方生薬エキスは、有効量の甘草、柴胡、黄岑、五味子および赤芍を含む。甘草と柴胡と黄岑と五味子と赤芍の重量比は1〜5:1〜5:1〜5:1〜3:1〜3とする。
【解決手段】本発明に係る漢方生薬エキスは、有効量の甘草、柴胡、黄岑、五味子および赤芍を含む。甘草と柴胡と黄岑と五味子と赤芍の重量比は1〜5:1〜5:1〜5:1〜3:1〜3とする。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は漢方生薬エキスに関し、特に免疫細胞のインターフェロン産生を誘導し、かつToll様受容体を活性化できる漢方生薬エキスおよびその作製方法に関するものである。
【0002】
関連出願の相互参照
本出願は、参照することによってその全体が組み込まれる2008年5月8日出願の台湾特許出願第97116973号の優先権を主張するものである。
【背景技術】
【0003】
インターフェロン(interferon, IFN)は最初に発見されたサイトカインであり、そのウィルスの複製を“干渉”する能力によってそのように命名された。インターフェロンは1957年にイギリスにおいて2名の研究者、エリック・アイザックス(Alick Isaacs)とジーンリンデンマン(Jean Lindenmann)によって発見された。細胞はウィルスに感染すると、直ちにインターフェロンを作り出してウィルスに抵抗すると同時に、周囲の正常な細胞に警報を発し、警戒を高めることによってウィルスの進入を防ぐ。インターフェロンは大きくTypeIおよびTypeIIに分けられる。TypeIのインターフェロンにはインターフェロン−α、インターフェロン−β、インターフェロン−ω、インターフェロン−τがあり、インターフェロン−αおよびインターフェロン−βは大部分の細胞に発現する。またTypeIIのインターフェロンにはインターフェロン−γがあり、これは一部の免疫細胞、例えばナチュラルキラー細胞(natural killer cell, NK cell)、CD4+Tヘルパー1(TH1)リンパ球およびCD8+細胞障害性(cytotoxic)Tリンパ球においてのみ発現する。
【0004】
ウィルスに感染すると、TypeIのインターフェロンの産生が速やかに誘導され、引き続いてそれが標的細胞上のTypeIインターフェロン受容体と結合し、Jak−STATシグナル経路を作動して、インターフェロン誘導遺伝子(IFN-stimulated genes, ISGs)の発現を誘導する。インターフェロン誘導遺伝子のタンパク質生成物は、インターフェロンがウィルスに対抗する際の最主要戦略となるもので、現時点で500種を超えるインターフェロン誘導遺伝子タンパク質が同定されているが、これら分子の関与する範囲は非常に幅広く、抗ウィルス(anti-virus)から、アポトーシス(apoptosis)、タンパク質分解(protein degradation)、炎症性細胞応答(inflammatory cell response)、脂質代謝(lipid metabolism)に至るまで多様な機能をカバーする。最もよく知られているインターフェロン誘導遺伝子タンパク質としては、プロテインキナーゼR(PKR)、RNAに作用するアデノシンデアミナーゼ(adenosine deaminase acting on RNA, ADAR)、2’,5’−オリゴアデニル酸シンセターゼ(2’,5’-oligo adenylate synthetase, OAS)、RNase LおよびMxタンパクがある。PKRは真核生物開始因子22(eukaryotic initiation factor 2, eIF2)を抑制することによりウィルスタンパクの合成を阻害し、ADARはウィルスのRNA編集(RNA editing)を抑制し、OASおよびRNase LはウィルスRNAを分解し、Mxタンパクはウィルス複製を抑制することができる。
【0005】
TypeIのインターフェロンは、ウィルスに直接対抗できるのみならず、免疫調節(immunomodulatory)にも関与し、自然および獲得免疫反応において重要な役割を担う。例えば、IL−15を産生してナチュラルキラー細胞の生存および増殖を促す他、MHC、CD80、CD86およびCD40分子の発現を刺激して、樹状細胞(dendritic cell)の成熟化を促進することもできる。さらにTypeIのインターフェロンは、形質細胞様樹状細胞(plasmacytoid dendritic cell, pDC)の分化を誘導して成熟した抗原提示細胞(antigen presenting cell)とさせることもできる。獲得免疫に関しては、TypeIのインターフェロンは、CD8+細胞障害性Tリンパ球の活性化、CD4+Tヘルパー1(TH1)リンパ球およびD8+細胞障害性Tリンパ球の生存、Bリンパ球の分化と増殖において重要な役割を果たす。
【0006】
このようにTypeIのインターフェロンは抗ウィルス、細胞増殖の調節(regulators of cell growth)および免疫調節の能力を備えることから、すでに臨床治療に応用されている。米、英、日、独などをはじめとする先進国にて認可されているその適応症には、(1)ウィルスにより引き起こされる疾病、例えば慢性B型肝炎、慢性C型肝炎、尖圭コンジローマ、エイズ患者に発症の多いカポジ肉腫(Kaposi's sarcoma)など、(2)血液疾患、例えば有毛細胞白血病、慢性骨髄性白血病、多発性骨髄腫、低悪性度非ホジキンリンパ腫など、(3)その他の腫瘍、例えばメラノーマ(Melanoma)、腎細胞癌、基底細胞癌などがある。
【0007】
インターフェロンの産生は免疫系の伝達係であるToll様受容体(Toll-like receptor, TLR)の活性化によって誘導されることが、現在すでに研究により分かっている。Tollは1988年頃にショウジョウバエの体内で発見され、後に哺乳動物においてもTollに極めて類似する受容体が発見された。これがToll様受容体と称されるものである。外来の異物が侵入してくると、Toll様受容体は、病原体の病原体関連分子パターン(pathogen-associated molecular patterns, PAMPs)を識別することにより、シグナル伝達経路を介してサイトカイン(TypeIインターフェロン、IL−1、IL−12、インターフェロン−α)、化学走化性物質、MHCおよび共刺激分子(co-stimulatory molecules)を含む下流の遺伝子の発現を起こさせる。また誘導型一酸化窒素合成酵素(inducible nitric oxide synthase, iNOS)および抗菌性ペプチド(antimicrobial peptides)の発現を誘導して、外来の病原体を直接破壊することもできる。Toll様受容体は、自然免疫という防御の第一線を発動するだけでなく、抗原提示細胞(例えば樹状細胞(dendritic cell))の成熟化を誘導することを通して獲得免疫反応を活性化しもする。微生物が体内に侵入したとき、樹状細胞自身のToll様受容体が病原菌を識別し、MHC分子が抗原を表面に提示することにより、ナイーブTリンパ球が活性化される。そして、Toll様受容体に誘導されて産生したIL−12が、活性化されたTリンパ球をさらにTh1リンパ球に分化し、獲得免疫反応が発動される。このようにして慢性ウィルス感染への抵抗に協力し、最終目的であるウィルス排除が達成されることとなり、防御メカニズムにより強力かつ特異的な保護が提供される。
【0008】
現在までに確認されているToll様受容体は、Toll様受容体1からToll様受容体10まで10種あり、これらは細菌、ウィルス、真菌および原生動物など各種の外来の異物を認識することができる。Toll様受容体は構造上2つの部分、(1)外来の異物の認識を担う細胞外のロイシンリッチリピート(leucine-rich repeat, LRR)ドメインと、(2)例えばMyD88(myeloid differentiation factor-88 )、TIRAP/MAL(TIR-associated protein)、TRIF/TICAM−1(Toll/IL-1 receptor domain-containing adaptor inducing IFN-β)およびTRAM/TIRP/TICAM−2(Toll-receptor-associated molecule)などの下流のアダプタータンパクと作用して、細胞外シグナル調節キナーゼ(Extracellular Signal-regulated Kin, ERK)、p38、c−Jun N末端キナーゼ(c-Jun N-terminal kinase)およびNF−kBを活性化し、炎症性サイトカイン(pro-inflammatory cytokine)であるIL−1、IL−6、インターフェロン−αおよびTypeIのインターフェロンの産生を誘導する細胞内のToll−インターロイキン−1受容体(Toll-interleukin-1 receptor, TIR)ドメインを有している。
【0009】
哺乳動物において最初に発見されたのはToll様受容体4であり、これはBリンパ球、樹状細胞、単球(monocytes)、マクロファージ(macrophages)、顆粒球(granulocytes)およびTリンパ球といった多くの免疫細胞に発現するもので、呼吸器合胞体ウイルス(respiratory syncytial virus, RSV)、C型肝炎ウィルス(hepatitis C virus, HCV)およびマウス乳癌ウイルス(mouse mammary tumor virus, MMTV)など多数の外来ウィルスを認識できると共に、MyD88とTIRAPとの作用を介して大量のインターフェロンの産生を誘導する。
【0010】
すべてのToll様受容体のうち、Toll様受容体2が最も多くのPAMPsを認識でき、それらPAMPsは主に細菌由来のものであって、リポアラビノマンナン(lipoarabinomannan, LAM)、リポポリサッカリド(lipopolysaccharide, LPS)、リポタイコ酸(lipoteichoic acid, LTA)、ペプチドグリカン(peptidoglycan, PGN)およびその他のリポタンパク(lipoprotein)、糖脂質(glycolipid)、糖タンパク(glycoprotein)などである。またToll様受容体2は、麻疹ウィルス(measles virus, MV)、ヒトサイトメガロウィルス(human cytomegalovirus, HCMV)、C型肝炎ウィルスなどのウィルスの侵入をも認識でき、防御メカニズムにおいて重要な役割を担っている。
【0011】
Toll様受容体7は、単球、Bリンパ球および樹状細胞などの免疫細胞に高度に発現し、外来の物質の侵入を認識したときに極めて大量のTypeIインターフェロン、特にインターフェロン−αを産生することができ、自然免疫において重要な役割を果たす。Toll様受容体7は主にヒト免疫不全ウイルス(human immunodeficiency virus, HIV)およびVSVなどウィルス由来のG/UリッチssRNA(G/U-rich ssRNA)を感知することができ、ウィルス排除に無視することのできない影響力を持つ。
【0012】
医薬面での発展に目を向けると、Toll様受容体9拮抗剤が現在すでに臨床試験の段階に入っている。この拮抗剤は、樹状細胞を刺激してIL−12および極めて大量のインターフェロン−αを産出させると共に、Bリンパ球の増殖と抗体分泌を誘導することができ、インターフェロン−αでの治療に失敗したHCV患者に優れた効果をあげている。また、Toll様受容体7拮抗剤は幅広い抗ウィルス応答(antiviral response)を誘導し、多種のサイトカイン、特にインターフェロン−αを放出させることができるため、各種HCV遺伝子型の患者において高いウィルス排除率が得られている。
【0013】
近年ではすでに多くの抗ウィルス薬が研究・開発されており、臨床治療に広く利用されている。例として、呼吸器合胞体ウイルス、インフルエンザウィルス(influenza virus)、アデノウィルス(adenovirus)、HIVおよびHCVなど多種のウィルスの増殖を抑制することが実験により確認されたヌクレオシドアナログ(nucleside analog)の一種であるリバビリン、A型インフルエンザウィルスのM2膜タンパクを抑制するよう作用して、A型インフルエンザウィルスの脱穀を阻害し、後続の複製を行えなくするアマンタジン、HIVの逆転写酵素(reverse transcriptase)を抑制し、ウィルスのRNAがDNAへ逆転写できなくなるようにすることで、DNAの合成を中断させるジドブジン(AZT)、ジダノシン(ddI)、ザルシタビン(ddc)、スタブジン(d4T)およびラミブジン(3TC)などが挙げられる。
【0014】
多数の抗ウィルス薬が次々と臨床に用いられ効果をあげてはいるが、ここ数年で多くの薬剤に耐性ウィルスが発生してきている。耐性が生じるのはウィルスの遺伝子が突然変異することによって抗ウィルス薬がその作用の標的を失ってしまうことに主な原因があり、例えば次のような例を挙げることができる。HSVのチミジンキナーゼ(thymidine kinase)遺伝子が突然変異することでアシクロビル(acyclovir)およびガンシクロビル(ganciclovir)などが細胞内で有効な成分に転換し得ずこれら薬物に対して耐性が生じる。A型インフルエンザウィルスのM2タンパク遺伝子の突然変異によりアマンタジン(amantadine)またはリマンタジン(rimantadine)に対する耐性が生じる。HIV逆転写酵素またはプロテアーゼ(protease)遺伝子の突然変異もまた耐性を招来する原因となる。HCVの非構造(non-structural)5Aおよびエンベロープ遺伝子(envelope gene)2−糖タンパクの遺伝子の突然変異は、HCVにインターフェロンに対する耐性を生じさせる。
【0015】
昨今ではますます多くの薬剤が免疫調節の方向で発展しており、宿主の自然および獲得免疫反応を刺激することにより外来の微生物を排除する目的を達成している。免疫調節は漢方薬治療の得意とするところである。漢方生薬には双方向調節(または免疫調節)作用があり、かかる作用は、正常な有機体に対してはあまり影響はないが、免疫が失調を起こした有機体に対しては有効に作用して有機体の免疫の不足または過剰状態を修正し、回復させて免疫の安定を維持するといった形で表れ、これによれば正常な有機体の免疫能力が増強され、かつ病原因子が取り除かれる。
【0016】
漢方生薬は天然のままの構造と活性を保ったものであって、数千年にわたる選別・篩い分けの結果、残った確実に治療効果のある薬物である。
【0017】
ウィルス性疾患の種類は多岐にわたっており、例えばB型肝炎、C型肝炎、インフルエンザ、流行性耳下腺炎、流行性髄膜炎、ウィルス性肺炎、エンテロウィルス、AIDSウィルスなど実に多く、その病原性、潜伏期間および感染ルートは疾患の種類によりそれぞれ異なっている。臨床実験により、数多くの漢方生薬がウィルス性疾患の治療に顕著な効果を示すことが証明されている。
【0018】
例えば特許文献1は、金銀花、連翹から超臨界抽出および水抽出ならびに黄岑から水抽出したエキスが、抗インフルエンザウィルス作用を有することを開示している。特許文献2は、白花蛇舌草(Hedyotis diffuse)など14種の薬材から作製される注射剤とカプセル剤について、延べ人数で5人に対し臨床試験を行った結果、これらに抗AIDSウィルス作用が認められたと開示している。特許文献3は、金銀花、甘草、竜葵などを含んでなる複合漢方薬HHT888−4が、in vitro実験において、人体のリンパ球中の98%以上のAIDSウィルス活性を抑制したと開示している。特許文献4は、薑黄、黄耆、桑寄生、虎杖の漢方生薬エキスについて、臨床試験でC型肝炎の治療に顕著な効果が確認されたと開示している。
【0019】
上述以外にも、漢方薬は、現代医学による薬物治療と併用しての補助療法にも応用されている。例えば、特許文献5は、大棗などより組成されるPHY906を化学療法における薬物およびウィルス性疾患治療に併用すると、治療効果を高め、クオリティ・オブ・ライフを向上すると共に、毒性と副作用を低減することができ、米国ではすでに第II相臨床試験に入っていると開示する。特許文献6は、冬虫夏草および?耆から組成され、C型肝炎の併用療法(インターフェロンおよびリバビリン)と組み合わせてC型肝炎を治療するC型肝炎補助治療薬を開示しており、臨床試験において持続的なウィルス排除率が70%以上に達し、治療効果を高めるのみならず、治療後の再発率を低減することもできるとしている。
【0020】
さらに免疫系の観点から見ると、ウィルス性肝炎の治療において、インターフェロン産生の誘発は極めて指標的な意義を持つ。特許文献7は、夾竹桃および甘草エキスについて、マウス脳心筋炎ウイルス(encephalo-myocarditis virus, EMCV)に感染したヒト扁平上皮癌細胞(HEp−2 cell)に対する抗ウィルス試験を行ったところ、ウィルスを有効に低減することを確認し、In Vitro実験においてもインターフェロン−γの産生を誘導するという結果が出たと示している。
【0021】
人体の免疫系においてすでに10種のToll様受容体(Toll-like receptors, TLR)が確認されており、人体が体内外の病原体(ウィルス、細菌または真菌)から脅威をうけたとき、これらTLRは、個別に対応する免疫反応をそれぞれ識別して作動させる。由来のそれぞれ異なる病原分子が特定のTLRと結合することによって一連の反応が誘発され、病原体の侵襲から細胞が保護されることになる。TLRによる治療法は、TLRの免疫反応への対応に高度の特異性があるという原理を利用し、治療がなされる特定の病症に対し刺激剤(アゴニスト)または遮断剤(アンタゴニスト)を与えて免疫調節を行うことを通し病症の治療効果を達成するというものである。他の免疫系を利用した治療方法とは異なり、TLR治療法は、疾病の治療に高度な特異性があるので、病原体を有効かつ持続的に抑制できるだけでなく、自然免疫系が非特異的に活性化されることに伴う副作用またははその他の症状を低減させることもできる。
【0022】
最近、コリー・ファーマシューティカル・グループ社(Coley Pharmaceutical Group)が、合成の短鎖オリゴデオキシヌクレオチド(ODNs)によりTLR−9を制御するTLR治療薬アクチロン(Actilon)を開発した。このODNsはDNAのような配列を有する短鎖化合物であり、病原体の侵入時にTLR−9が認識する病原体のCpGモチーフを模倣したものである。TLR−9は、発現された後、免疫系における一連のシグナル伝達を作動させ、インターフェロンの産生を誘発する。上記治療薬はこうした機序によってC型肝炎などウィルス性疾患の治療を行うものであり、現在、第Ib相臨床試験の段階に入っている。また、アナディス・ファーマシューティカル社(Anadys Pharmaceutical)が開発したのは、TLR−7を発現させるANA245およびANA975 (経口薬)であり、それぞれすでに第Ibおよび第Ia相臨床試験段階に入っている。
【0023】
上記以外に、TLR治療法の研究において、天然エキスを使った試験も行われている。特許文献8は、エキナセアなどのハーブから抽出したメラニン(Melanin)エキスについて、In vitro/Monocyte試験系(NF-kappa B/luciferase)で試験を行ったところ、TLR−2およびTLR−4の発現を誘発できたと示している。
【0024】
【特許文献1】米国特許第6787165号明細書
【特許文献2】米国特許第6696094号明細書
【特許文献3】米国特許第6214350号明細書
【特許文献4】米国特許第6426098号明細書
【特許文献5】米国特許出願公開第2003/0211180号明細書
【特許文献6】台湾特許第I258373号明細書
【特許文献7】国際公開番号WO02102395号公報
【特許文献8】国際公開番号WO04093518号公報
【発明の開示】
【発明が解決しようとする課題】
【0025】
ウィルス耐性の問題を解決するため、本発明は多種の漢方生薬を組み合わせなるて複合漢方生薬を提供する。その原理は、同じ標的ウィルスに作用する多種の異なる薬物またはウィルスの異なる部位に作用する多種の薬物を同時に用いて治療を行うことによって、相加効果が生じるだけでなく、ウィルスがある薬物に耐性を持っていても他にも有効な薬物が含まれているために治療の成功率も高まる、というものである。さらに漢方生薬は天然の構造と活性を保ったものであって、数千年にわたって選別・篩い分けがなされてきた結果残った確実に治療効果のある薬物である。そこで本発明は、漢方薬の多面的効果、双方向調節作用、温和・無毒および顕著な免疫増強作用などの長所に基づいて、ウィルス疾患に対し治療効果を有する漢方生薬エキスを提供するものである。
【課題を解決するための手段】
【0026】
1実施形態において本発明は、免疫細胞のインターフェロン産生を誘導し、Toll様受容体(Toll-like receptor)を活性化する漢方生薬エキスであって、有効量の甘草(GLYCYRRHIZAE RADIX)、柴胡(BUPLEURI RADIX)および黄岑(SCUTELLARIAE RADIX)を含む原料を抽出してなり、甘草と柴胡と黄岑の重量比が1〜5:1〜5:1〜5または1〜2:1〜2:1〜2である漢方生薬エキスを提供する。
【0027】
甘草(GLYCYRRHIZAE RADIX)にはウラル甘草(Glycyrrhiza uralensis)またはスペイン甘草(Glycyrrhiza glabra)が含まれる。柴胡(BUPLEURI RADIX)には北柴胡(Bupleurum chinense)または狭葉柴胡(Bupleurum scorzonerifolium)が含まれる。黄岑(SCUTELLARIAE RADIX)には黄金花(Scutellaria baicalensis)が含まれる。
【0028】
本発明に係る漢方生薬エキスの原料は、五味子(SCHISANDRAE FRUCTUS)および赤芍(PAEONIAE RUBRA RADIX)をさらに含む。甘草と柴胡と黄岑と五味子と赤芍の重量比は1〜5:1〜5:1〜5:1〜3:1〜3または1〜2:1〜2:1〜2:1〜2:1〜2である。五味子(SCHISANDRAE FRUCTUS)には朝鮮五味子(Schisandra chinensis)または南五味子(Schisandra sphenanthera)が含まれる。赤芍(PAEONIAE RUBRA RADIX)にはエビスグスリ(Paeonia lactiflora)または川赤芍(Paeonia veitchii)が含まれる。
【0029】
本発明に係る漢方生薬エキスは、Toll様受容体2、Toll様受容体4またはToll様受容体7を含む複数のToll様受容体を活性化する。
【0030】
本発明に係る漢方生薬エキスは、免疫調節機能を強化でき、ウィルス感染性疾患の治療の用いることができる。
【0031】
別の実施形態において本発明は、免疫細胞のインターフェロン産生を誘導し、Toll様受容体(Toll-like receptor)を活性化する漢方生薬エキスの作製方法であって、有効量の甘草(GLYCYRRHIZAE RADIX)、柴胡(BUPLEURI RADIX)および黄岑(SCUTELLARIAE RADIX)を含み、甘草と柴胡と黄岑の重量比が1〜5:1〜5:1〜5または1〜2:1〜2:1〜2である漢方生薬組成物を準備する工程と、漢方生薬組成物を溶剤で抽出して抽出液を得る工程と、抽出液を濃縮して濃縮生成物を得る工程と、濃縮生成物を乾燥させる工程と、賦形剤を加えて所定の剤型に調製する工程と、を含む漢方生薬エキスの作製方法を提供する。
【0032】
甘草(GLYCYRRHIZAE RADIX)にはウラル甘草(Glycyrrhiza uralensis)またはスペイン甘草(Glycyrrhiza glabra)が含まれる。柴胡(BUPLEURI RADIX)には北柴胡(Bupleurum chinense)または狭葉柴胡(Bupleurum scorzonerifolium)が含まれる。黄岑(SCUTELLARIAE RADIX)には黄金花(Scutellaria baicalensis)が含まれる。
【0033】
漢方生薬組成物は、有効量の五味子(SCHISANDRAE FRUCTUS)および赤芍(PAEONIAE RUBRA RADIX)をさらに含む。甘草と柴胡と黄岑と五味子と赤芍の重量比は1〜5:1〜5:1〜5:1〜3:1〜3または1〜2:1〜2:1〜2:1〜2:1〜2である。五味子(SCHISANDRAE FRUCTUS)には朝鮮五味子(Schisandra chinensis)または南五味子(Schisandra sphenanthera)が含まれる。赤芍(PAEONIAE RUBRA RADIX)にはエビスグスリ(Paeonia lactiflora)または川赤芍(Paeonia veitchii)が含まれる。
【0034】
溶剤には水または濃度0.1〜95%のエタノールが含まれ、かつ溶剤と漢方生薬組成物の重量比は6:1〜10:1である。濃縮生成物の固形分は10〜30%である。本発明で用いる乾燥方法には真空乾燥、凍結乾燥、噴霧乾燥または流動床乾燥が含まれる。賦形剤にはデンプン、麦芽糖、乳糖、ショ糖、マンニトール、ステアリン酸マグネシウム、二酸化ケイ素、微結晶セルロース、カルボキシメチルセルロースまたはタルクが含まれる。形成される所定の剤型にはカプセル剤、錠剤、散剤または液剤が含まれる。
【0035】
本発明(1)は、有効量の甘草(GLYCYRRHIZAE RADIX)、柴胡(BUPLEURI RADIX)および黄岑(SCUTELLARIAE RADIX)を含む原料を抽出してなり、甘草と柴胡と黄岑の重量比が1〜5:1〜5:1〜5である、免疫細胞のインターフェロン産生を誘導する漢方生薬エキスである。
本発明(2)は、甘草と柴胡と黄岑の重量比が1〜2:1〜2:1〜2である、本発明(1)の免疫細胞のインターフェロン産生を誘導する漢方生薬エキスである。
本発明(3)は、原料に有効量の五味子(SCHISANDRAE FRUCTUS)および赤芍(PAEONIAE RUBRA RADIX)がさらに含まれる、本発明(1)の免疫細胞のインターフェロン産生を誘導する漢方生薬エキスである。
本発明(4)は、甘草と柴胡と黄岑と五味子と赤芍の重量比が1〜5:1〜5:1〜5:1〜3:1〜3である、本発明(3)の免疫細胞のインターフェロン産生を誘導する漢方生薬エキスである。
本発明(5)は、甘草と柴胡と黄岑と五味子と赤芍の重量比が1〜2:1〜2:1〜2:1〜2:1〜2である、本発明(4)の免疫細胞のインターフェロン産生を誘導する漢方生薬エキスである。
本発明(6)は、免疫細胞のインターフェロン産生を誘導する漢方生薬エキスの作製方法であって、
有効量の甘草、柴胡および黄岑を含み、甘草と柴胡と黄岑の重量比が1〜5:1〜5:1〜5である漢方生薬組成物を準備する工程、
前記漢方生薬組成物を溶剤で抽出して抽出液を得る工程、
前記抽出液を濃縮して濃縮生成物を得る工程、
前記濃縮生成物を乾燥させる工程、ならびに、
賦形剤を加えて所定の剤型に調製する工程、
を含む作製方法である。
本発明(7)は、前記漢方生薬組成物が有効量の五味子および赤芍をさらに含む、本発明(6)の免疫細胞のインターフェロン産生を誘導する漢方生薬エキスの作製方法である。
本発明(8)は、甘草と柴胡と黄岑と五味子と赤芍の重量比が1〜5:1〜5:1〜5:1〜3:1〜3である、本発明(7)の免疫細胞のインターフェロン産生を誘導する漢方生薬エキスの作製方法である。
本発明(9)は、甘草と柴胡と黄岑と五味子と赤芍の重量比が1〜2:1〜2:1〜2:1〜2:1〜2である、本発明(8)の免疫細胞のインターフェロン産生を誘導する漢方生薬エキスの作製方法である。
本発明(10)は、前記溶剤には水または濃度0.1〜95%のエタノールが含まれる、本発明(6)の免疫細胞のインターフェロン産生を誘導する漢方生薬エキスの作製方法である。
本発明(11)は、前記溶剤と前記漢方生薬組成物の重量比が6:1〜10:1である、本発明(6)の免疫細胞のインターフェロン産生を誘導する漢方生薬エキスの作製方法である。
本発明(12)は、前記濃縮生成物の固形分が10〜30%である、本発明(6)の免疫細胞のインターフェロン産生を誘導する漢方生薬エキスの作製方法である。
本発明(13)は、前記濃縮生成物を真空乾燥、凍結乾燥、噴霧乾燥または流動床乾燥により乾燥させる、本発明(6)の免疫細胞のインターフェロン産生を誘導する漢方生薬エキスの作製方法である。
本発明(14)は、前記賦形剤にデンプン、麦芽糖、乳糖、ショ糖、マンニトール、ステアリン酸マグネシウム、二酸化ケイ素、微結晶セルロース、カルボキシメチルセルロースまたはタルクが含まれる、本発明(6)の免疫細胞のインターフェロン産生を誘導する漢方生薬エキスの作製方法である。
本発明(15)は、前記所定の剤型にはカプセル剤、錠剤、散剤または液剤が含まれる、本発明(6)の免疫細胞のインターフェロン産生を誘導する漢方生薬エキスの作製方法である。
本発明(16)は、有効量の甘草、柴胡および黄岑を含む原料を抽出してなり、甘草と柴胡と黄岑の重量比が1〜5:1〜5:1〜5である、Toll様受容体を活性化する漢方生薬エキスである。
本発明(17)は、Toll様受容体2、Toll様受容体4およびToll様受容体7を活性化する、本発明(16)のToll様受容体を活性化する漢方生薬エキスである。
本発明(18)は、甘草と柴胡と黄岑の重量比が1〜2:1〜2:1〜2である、本発明(16)のToll様受容体を活性化する漢方生薬エキスである。
本発明(19)は、原料に有効量の五味子および赤芍がさらに含まれる、本発明(16)のToll様受容体を活性化する漢方生薬エキスである。
本発明(20)は、甘草と柴胡と黄岑と五味子と赤芍の重量比が1〜5:1〜5:1〜5:1〜3:1〜3である、本発明(19)のToll様受容体を活性化する漢方生薬エキスである。
本発明(21)は、甘草と柴胡と黄岑と五味子と赤芍の重量比が1〜2:1〜2:1〜2:1〜2:1〜2である、本発明(20)のToll様受容体を活性化する漢方生薬エキスである。
本発明(22)は、Toll様受容体を活性化する漢方生薬エキスの作製方法であって、
有効量の甘草、柴胡および黄岑を含み、甘草と柴胡と黄岑の重量比が1〜5:1〜5:1〜5である漢方生薬組成物を準備する工程、
前記漢方生薬組成物を溶剤で抽出して抽出液を得る工程、
前記抽出液を濃縮して濃縮生成物を得る工程、
前記濃縮生成物を乾燥させる工程、ならびに、
賦形剤を加えて所定の剤型に調製する工程、
を含む作製方法である。
本発明(23)は、前記漢方生薬組成物が有効量の五味子および赤芍をさらに含む、本発明(22)のToll様受容体を活性化する漢方生薬エキスの作製方法である。
本発明(24)は、甘草と柴胡と黄岑と五味子と赤芍の重量比が1〜5:1〜5:1〜5:1〜3:1〜3である、本発明(23)のToll様受容体を活性化する漢方生薬エキスの作製方法である。
本発明(25)は、甘草と柴胡と黄岑と五味子と赤芍の重量比が1〜2:1〜2:1〜2:1〜2:1〜2である、本発明(24)のToll様受容体を活性化する漢方生薬エキスの作製方法である。
本発明(26)は、前記溶剤には水または濃度0.1〜95%のエタノールが含まれる、本発明(22)のToll様受容体を活性化する漢方生薬エキスの作製方法である。
本発明(27)は、前記溶剤と前記漢方生薬組成物の重量比が6:1〜10:1である、本発明(22)のToll様受容体を活性化する漢方生薬エキスの作製方法である。
本発明(28)は、前記濃縮生成物の固形分が10〜30%である、本発明(22)のToll様受容体を活性化する漢方生薬エキスの作製方法である。
本発明(29)は、前記濃縮生成物を真空乾燥、凍結乾燥、噴霧乾燥または流動床乾燥により乾燥させる、本発明(22)のToll様受容体を活性化する漢方生薬エキスの作製方法である。
本発明(30)は、前記賦形剤にはデンプン、麦芽糖、乳糖、ショ糖、マンニトール、ステアリン酸マグネシウム、二酸化ケイ素、微結晶セルロース、カルボキシメチルセルロースまたはタルクが含まれる、本発明(22)のToll様受容体を活性化する漢方生薬エキスの作製方法である。
本発明(31)は、前記所定の剤型にはカプセル剤、錠剤、散剤または液剤が含まれる、本発明(22)のToll様受容体を活性化する漢方生薬エキスの作製方法である。
【発明の効果】
【0036】
本発明に係る漢方生薬エキスは甘草、柴胡および黄岑などから抽出されてなり、免疫細胞のインターフェロン産生を誘導し、かつToll様受容体を活性化することができる。本発明に係る漢方生薬エキスは多種の漢方生薬を組み合わせてなる複合漢方生薬であるため、相加効果が得られるのみでなく、ウィルス性疾患の治療に際し、ウィルスが当該漢方生薬エキス中の薬物に耐性を持っていたとしても他にも有効な薬物が含まれていることより治療の成功率が高まる。また、本発明は、多面的効果、双方向調節作用、温和・無毒および顕著な免疫増強作用などといった漢方薬の長所も備えている。
【発明を実施するための最良の形態】
【0037】
上述した本発明の目的、特徴および長所がより明りょうとなるよう、以下に添付の図面を参照にしながら、実施例を挙げて詳細に説明する。
【0038】
1実施形態において本発明は、免疫細胞のインターフェロン産生を誘導し、Toll様受容体(Toll-like receptor)を活性化する漢方生薬エキスであって、有効量の甘草(GLYCYRRHIZAE RADIX)、柴胡(BUPLEURI RADIX)および黄岑(SCUTELLARIAE RADIX)を含む原料を抽出してなる漢方生薬エキスを提供する。
【0039】
漢方生薬エキスの原料において、甘草と柴胡と黄岑の重量比は約1〜5:1〜5:1〜5または1〜2:1〜2:1〜2である。
【0040】
甘草(GLYCYRRHIZAE RADIX)としてはウラル甘草(Glycyrrhiza uralensis)またはスペイン甘草(Glycyrrhiza glabra)を挙げることができる。柴胡(BUPLEURI RADIX)としては北柴胡(Bupleurum chinense)または狭葉柴胡(Bupleurum scorzonerifolium)を挙げることができる。黄岑(SCUTELLARIAE RADIX)としては黄金花(Scutellaria baicalensis)を挙げることができる。
【0041】
上記漢方生薬エキスの原料は、有効量の五味子(SCHISANDRAE FRUCTUS)および赤芍(PAEONIAE RUBRA RADIX)をさらに含んでいてもよい。甘草と柴胡と黄岑と五味子と赤芍の重量比は約1〜5:1〜5:1〜5:1〜3:1〜3または1〜2:1〜2:1〜2:1〜2:1〜2である。五味子(SCHISANDRAE FRUCTUS)としては朝鮮五味子(Schisandra chinensis)または南五味子(Schisandra sphenanthera)を挙げることができる。赤芍(PAEONIAE RUBRA RADIX)としてはエビスグスリ(Paeonia lactiflora)または川赤芍(Paeonia veitchii)を挙げることができる。
【0042】
上記漢方生薬エキスは、例えばToll様受容体2、Toll様受容体4およびToll様受容体7といった複数のToll様受容体を活性化することができる。
【0043】
別の実施形態において本発明は、免疫細胞のインターフェロン産生を誘導し、Toll様受容体(Toll-like receptor)を活性化する漢方生薬エキスの作製方法を提供する。該作製方法は次の工程を含む。先ず、有効量の甘草(GLYCYRRHIZAE RADIX)、柴胡(BUPLEURI RADIX)および黄岑(SCUTELLARIAE RADIX)を含む漢方生薬組成物を準備する。甘草と柴胡と黄岑の重量比は約1〜5:1〜5:1〜5または1〜2:1〜2:1〜2である。次に、漢方生薬組成物を溶剤で抽出して抽出液を得る。用いる溶剤は水または濃度0.1〜95%のエタノールとすることができ、溶剤と漢方生薬組成物の重量比は約6:1〜10:1である。続いて、抽出液を濃縮して濃縮生成物を得る。濃縮生成物の固形分は約10〜30%である。次いで、濃縮生成物を乾燥させる。濃縮生成物を乾燥させる方法は真空乾燥、凍結乾燥、噴霧乾燥または流動床乾燥とすることができる。さらに、賦形剤を加えて所定の剤形に調製する。賦形剤はデンプン、麦芽糖、乳糖、ショ糖、マンニトール、ステアリン酸マグネシウム、二酸化ケイ素、微結晶セルロース、カルボキシメチルセルロースまたはタルクとすることができる。また、所定の剤形は、錠剤、散剤または液剤などであってよい。
【0044】
甘草(GLYCYRRHIZAE RADIX)としてはウラル甘草(Glycyrrhiza uralensis)またはスペイン甘草(Glycyrrhiza glabra)を挙げることができる。柴胡(BUPLEURI RADIX)としては北柴胡(Bupleurum chinense)または狭葉柴胡(Bupleurum scorzonerifolium)を挙げることができる。黄岑(SCUTELLARIAE RADIX)としては黄金花(Scutellaria baicalensis)を挙げることができる。
【0045】
上記漢方生薬エキスの原料は、有効量の五味子(SCHISANDRAE FRUCTUS)および赤芍(PAEONIAE RUBRA RADIX)をさらに含んでいてもよい。甘草と柴胡と黄岑と五味子と赤芍の重量比は約1〜5:1〜5:1〜5:1〜3:1〜3または1〜2:1〜2:1〜2:1〜2:1〜2である。五味子(SCHISANDRAE FRUCTUS)としては朝鮮五味子(Schisandra chinensis)または南五味子(Schisandra sphenanthera)を挙げることができる。赤芍(PAEONIAE RUBRA RADIX)としてはエビスグスリ(Paeonia lactiflora)または川赤芍(Paeonia veitchii)を挙げることができる。
【0046】
所定重量%の甘草、柴胡、黄岑、五味子および赤芍を取ってこれを原料とし、重量比で6から10倍の0.1〜95%エタノールで1回または複数回抽出する。次いで、濃縮終点の固形分が10〜30%となるように濃縮を行う。次に、賦形剤を添加してから、含水量が2〜10%となるように濃縮混合液を凍結乾燥し、さらにその乾燥物を、粒度が35メッシュ未満の粉末になるように粉砕する。最後に、得られた乾燥漢方生薬エキス粉末をハードカプセル中に充填する。各カプセル剤には、約1.35±0.09gの漢方生薬エキス製剤に相当する量が充填される。漢方生薬エキスの濃縮比は2〜3倍である。
【0047】
本発明では、好中球(neutrophil)、Tリンパ球およびナチュラルキラー細胞を試験の主体として、インターフェロンの産生とToll様受容体2、Toll様受容体4、Toll様受容体7の発現を観察し、これを薬剤のスクリーニングの基準とした。
【実施例】
【0048】
本発明に係る漢方生薬エキスの作製
実施例1
黄金花(Scutellaria baicalensis)4kg、北柴胡(Bupleurum chinense)4kg、ウラル甘草(Glycyrrhiza uralensis)4kg、エビスグスリ(Paeonia lactiflora)4kg、朝鮮五味子(Schisandra chinensis)4kg(薬材の重量比1:1:1:1:1)、および30%エタノール溶液200kgをそれぞれ取り、1時間還流させて加熱抽出した。2回抽出した後、得られた抽出液を100メッシュのフィルターでろ過し、濃縮終点の固形分が15%になるように減圧濃縮した。続いて、マルトデキストリン2kgを添加し、凍結乾燥を行った。その乾燥物を粉砕して35メッシュ未満の粉末にし、さらに二酸化ケイ素120gおよびステアリン酸マグネシウム60gを混入した。最後に、乾燥漢方生薬エキス粉末を0号のハードカプセルに充填した。各カプセル剤の充填量は565±40mgであり、漢方生薬エキス製剤は約1.35±0.09gとなった。
【0049】
実施例2
黄金花(Scutellaria baicalensis)2.5g、北柴胡(Bupleurum chinense)2.5g、ウラル甘草(Glycyrrhiza uralensis)2.5g、エビスグスリ(Paeonia lactiflora)7.5g、朝鮮五味子(Schisandra chinensis)7.5g(薬材の重量比1:1:1:3:3)、および30%エタノール溶液250gをそれぞれ取り、1時間還流させて加熱抽出した。2回抽出した後、得られた抽出液を100メッシュのフィルターでろ過してから、減圧濃縮および凍結乾燥を行い、その乾燥物を粉砕して粉末を得た。
【0050】
実施例3
黄金花(Scutellaria baicalensis)12.5g、北柴胡(Bupleurum chinense)6.25g、ウラル甘草(Glycyrrhiza uralensis)6.25g(薬材の重量比2:1:1)、および30%エタノール溶液250gをそれぞれ取り、1時間還流させて加熱抽出した。2回抽出した後、得られた抽出液を100メッシュのフィルターでろ過してから、減圧濃縮および凍結乾燥を行い、その乾燥物を粉砕して粉末を得た。
【0051】
実施例4
黄金花(Scutellaria baicalensis)6.25g、北柴胡(Bupleurum chinense)12.5g、ウラル甘草(Glycyrrhiza uralensis)6.25g(薬材の重量比1:2:1)、および30%エタノール溶液250gをそれぞれ取り、1時間還流させて加熱抽出した。2回抽出した後、得られた抽出液を100メッシュのフィルターでろ過してから、減圧濃縮および凍結乾燥を行い、その乾燥物を粉砕して粉末を得た。
【0052】
実施例5
黄金花(Scutellaria baicalensis)6.25g、北柴胡(Bupleurum chinense)6.25g、ウラル甘草(Glycyrrhiza uralensis)12.5g(薬材の重量比1:1:2)、および30%エタノール溶液250gをそれぞれ取り、1時間還流させて加熱抽出した。2回抽出した後、得られた抽出液を100メッシュのフィルターでろ過してから、減圧濃縮および凍結乾燥を行い、その乾燥物を粉砕して粉末を得た。
【0053】
実施例6
黄金花(Scutellaria baicalensis)5g、北柴胡(Bupleurum chinense)5g、ウラル甘草(Glycyrrhiza uralensis)5g、エビスグスリ(Paeonia lactiflora)5g、朝鮮五味子(Schisandra chinensis)5g(薬材の重量比1:1:1:1:1)、および純水250gをそれぞれ取り、1時間還流させて加熱抽出した。2回抽出した後、得られた抽出液を100メッシュのフィルターでろ過してから、減圧濃縮および凍結乾燥を行い、その乾燥物を粉砕して粉末を得た。
【0054】
実施例7
黄金花(Scutellaria baicalensis)5g、北柴胡(Bupleurum chinense)5g、ウラル甘草(Glycyrrhiza uralensis)5g、エビスグスリ(Paeonia lactiflora)5g、朝鮮五味子(Schisandra chinensis)5g(薬材の重量比1:1:1:1:1)、および50%エタノール溶液250gをそれぞれ取り、1時間還流させて加熱抽出した。2回抽出した後、得られた抽出液を100メッシュのフィルターでろ過してから、減圧濃縮および凍結乾燥を行い、その乾燥物を粉砕して粉末を得た。
【0055】
実施例8
黄金花(Scutellaria baicalensis)5g、北柴胡(Bupleurum chinense)5g、ウラル甘草(Glycyrrhiza uralensis)5g、エビスグスリ(Paeonia lactiflora)5g、朝鮮五味子(Schisandra chinensis)5g(薬材の重量比1:1:1:1:1)、および95%エタノール溶液250gをそれぞれ取り、1時間還流させて加熱抽出した。2回抽出した後、得られた抽出液を100メッシュのフィルターでろ過してから、減圧濃縮および凍結乾燥を行い、その乾燥物を粉砕して粉末を得た。
【0056】
本発明に係る漢方生薬エキスの好中球およびTリンパ球に対する細胞毒性
実施例9
先ず、96ウェルプレートに細胞を播種した。次いで、本発明に係る漢方生薬エキス(実施例1で作製したもの)を加え、さらにアラマーブルー色素(Alamarblue dye)10μlを加えて37℃のインキュベーターで16時間培養し、570nmおよび600nmにおける吸光値を測定した。結果は図1Aと1Bに示すとおりであり、該漢方生薬エキスには、好中球およびTリンパ球に対し明らかな細胞毒性がないことが確認された。
【0057】
本発明に係る漢方生薬エキスの免疫細胞表面インターフェロン産生誘導試験
実施例10
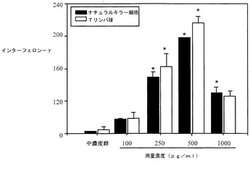
先ず、抹消血液から分離したTリンパ球およびナチュラルキラー細胞の細胞株(NK92)を用意し、それに本発明に係る漢方生薬エキス(実施例1で作製したもの)を加え、24時間経過後、上層液を取り、ELISAでインターフェロンの含量を測定した。その結果、図2Aに示すように、漢方生薬エキスの濃度の増加に伴ってインターフェロン−γの発現量も増加しており、用量反応が表れた。かかる現象は、Tリンパ球およびナチュラルキラー細胞株(NK92)のいずれにおいても似たような傾向を示した。さらに、PC−IL−12を陽性対照とし、同様の方式でインターフェロン−αの含量を測定したところ、図2Bおよび2Cに示すように、漢方生薬エキスは100μg/mlでナチュラルキラー細胞株(NK92)のインターフェロン−α産生を誘導できることが確認され、また、抹消血液から分離したTリンパ球を系とした誘導試験では、250〜1000μg/mlにおいて顕著なインターフェロン−α産生誘導が認められた。
【0058】
実施例11
本発明に係る漢方生薬エキス(実施例3で作製したもの)を取りインターフェロン−γの誘導活性試験を行った。結果、試料濃度500μg/mlで免疫細胞からインターフェロン−γ産生を誘導できることが確認され、その値は94.3±15.7pg/mlに達した(陽性対照に用いたIL−12では、40ng/mlの濃度で、免疫細胞から50±2.04pg/mlのインターフェロン-γが産生された)。
【0059】
実施例12
本発明に係る漢方生薬エキス(実施例5で作製したもの)を取りインターフェロン−γの誘導活性試験を行った。結果、試料濃度500μg/mlで免疫細胞のインターフェロン−γ産生を誘導できることが確認され、その値は129.1±8.5pg/mlに達した(陽性対照に用いたIL−12では、40ng/mlの濃度で、免疫細胞から50±2.04pg/mlのインターフェロン-γが産生された)。
【0060】
実施例13
本発明に係る漢方生薬エキス(実施例6で作製したもの)を取りインターフェロン−γの誘導活性試験を行った。結果、試料濃度1000μg/mlで免疫細胞のインターフェロン−γ産生を誘導できることが確認され、その値は95.2±15.7pg/mlに達した(陽性対照に用いたIL−12では、40ng/mlの濃度で、免疫細胞から50±2.04pg/mlのインターフェロン-γが産生された)。
【0061】
実施例14
本発明に係る漢方生薬エキス(実施例7で作製したもの)を取りインターフェロン−γの誘導活性試験を行った。結果、試料濃度1000μg/mlで免疫細胞のインターフェロン−γ産生を誘導できることが確認され、その値は1563.6±44.9pg/mlに達した(陽性対照に用いたIL−12では、40ng/mlの濃度で、免疫細胞から50±2.04pg/mlのインターフェロン-γが産生された)。
【0062】
実施例15
乾燥物(実施例8で作製したもの)を適量取り、インターフェロン−γの誘導活性試験を行った。結果、試料濃度500ug/mlで免疫細胞のインターフェロン−γ産生を誘導できることが確認され、その値は80.2±24.6pg/mlに達した(陽性対照に用いたIL−12では、40ng/mlの濃度で、免疫細胞から50±2.04pg/mlのインターフェロン-γが産生された)。
【0063】
本発明に係る漢方生薬エキスのラットインターフェロン産生誘導試験
実施例16
本発明に係る漢方生薬エキス(実施例1で作製したもの)を適量取り、in vivoインターフェロン−γ誘導活性試験を行った。Wistarラットを対照群、中濃度群および高濃度群に分け、対照群には水、中濃度群には漢方生薬エキス5g/kg、高濃度群には漢方生薬エキス10g/kgをそれぞれ28日間連続して与え、29日目に採血して血中のIFNγ産生を測定した。その結果図3に示すように、本発明に係る漢方生薬エキスが動物体内のIFNγの産生を顕著に誘導できることが認められ、雌ラットでは特に優れた効果が見られた。
【0064】
本発明に係る漢方生薬エキスのPBMC/T細胞のToll様受容体(TLR)発現に対する影響
実施例17
本発明に係る漢方生薬エキス(実施例1で作製したもの)を適量取り、TLR2、TLR4およびTLR7の活性試験を行った。TLR2、TLR4およびTLR7の抗体を用いて細胞表面マーカー染色を行った後、フローサイトメトリー(FACS)で直接分析した。その結果、低用量(250ug/ml)で、TLR2、TLR4またはTLR7のいずれについても75%以上の発現を誘導できることがわかった。図4A〜4Iを参照されたい。
【0065】
実施例18
本発明に係る漢方生薬エキス(実施例2で作製したもの)を取りTLR2、TLR4およびTLR7の活性試験を行った。その結果は図5A〜5Iに示すとおりである。試験濃度が500ug/mlのときに65%以上のTLRsの発現を誘導できることが確認された。
【0066】
実施例19
本発明に係る漢方生薬エキス(実施例3で作製したもの)を取りTLR2、TLR4およびTLR7の活性試験を行った。その結果は図6A〜6Iに示すとおりである。試験濃度が低用量(250ug/ml)でも60%以上のTLRsの発現を誘導できることが確認された。
【0067】
実施例20
本発明に係る漢方生薬エキス(実施例4で作製したもの)を取りTLR2、TLR4およびTLR7の活性試験を行った。その結果は図7A〜7Iに示すとおりである。試験濃度が低用量(250ug/ml)のときでも85%以上のTLRsの発現を誘導できることが確認された。
【0068】
実施例21
本発明に係る漢方生薬エキス(実施例5で作製したもの)を取りTLR2、TLR4およびTLR7の活性試験を行った。その結果は図8A〜8Iに示すとおりである。試験濃度が低用量(250ug/ml)のときでも80%以上のTLRsの発現を誘導できることが確認された。
【0069】
実施例22
本発明の漢方生薬エキス(実施例6で作製したもの)を取りTLR2、TLR4およびTLR7の活性試験を行った。その結果は図9A〜9Iに示すとおりである。試験濃度が低用量(250ug/ml)のときでも85%以上のTLRsの発現を誘導できることが確認された。
【0070】
実施例23
本発明の漢方生薬エキス(実施例7で作製したもの)を取りTLR2、TLR4およびTLR7の活性試験を行った。その結果は図10A〜10Iに示すとおりである。試験濃度が低用量(250ug/ml)のときでも94%以上のTLRsの発現を誘導できることが確認された。
【0071】
実施例24
本発明の漢方生薬エキス(実施例8で作製したもの)を取りTLR2、TLR4およびTLR7の活性試験を行った。その結果は図11A〜11Iに示すとおりである。試験濃度が低用量(250ug/ml)のときでも75%以上のTLRsの高度な発現を誘導できることが確認された。
【0072】
以上、好適な実施形態を挙げて本発明を説明したが、本発明はこれら実施形態に限定はされないと解されるべきであり、つまり本発明は、(当業者であれば明らかであるように)添付の特許請求の範囲は、かかる各種変更および均等なアレンジがすべて包含されるように、最も広い意味に解釈されるべきである。
【図面の簡単な説明】
【0073】
【図1A】本発明に係る漢方生薬エキスの好中球に対する細胞毒性を示した図である。
【図1B】本発明に係る漢方生薬エキスのTリンパ球に対する細胞毒性を示した図である。
【図2A】本発明に係る漢方生薬エキスがナチュラルキラー細胞およびTリンパ球のIFN−γ発現を促進できることを示す図である。データは3回の独立した実験の平均値±標準差を示し、*は中濃度群と比較したときのp<0.05を示す。
【図2B】本発明に係る漢方生薬エキスがナチュラルキラー細胞のIFN−α発現を促進できることを示す図である。データは3回の独立した実験の平均値±標準差を示し、*は中濃度群と比較したときのp<0.05を示す。
【図2C】本発明に係る漢方生薬エキスがTリンパ球のIFN−α発現を促進できることを示す図である。データは3回の独立した実験の平均値±標準差を示し、*は中濃度群と比較したときのp<0.05を示す。
【図3】本発明に係る漢方生薬エキスが動物(in vivo)のIFN−γ発現を促進できることを示す図である。*は対照群と比較したときのp<0.05を示す。
【図4】図4A〜図4Iは、本発明に係る漢方生薬エキスのPBMC/T細胞のToll様受容体(TLR)発現に対する影響を示す図である。
【図5】図5A〜図5Iは、本発明に係る漢方生薬エキスのPBMC/T細胞のToll様受容体(TLR)発現に対する影響を示す図である。
【図6】図6A〜図6Iは、本発明に係る漢方生薬エキスのPBMC/T細胞のToll様受容体(TLR)発現に対する影響を示す図である。
【図7】図7A〜図7Iは、本発明に係る漢方生薬エキスのPBMC/T細胞のToll様受容体(TLR)発現に対する影響を示す図である。
【図8】図8A〜図8Iは、本発明に係る漢方生薬エキスのPBMC/T細胞のToll様受容体(TLR)発現に対する影響を示す図である。
【図9】図9A〜図9Iは、本発明に係る漢方生薬エキスのPBMC/T細胞のToll様受容体(TLR)発現に対する影響を示す図である。
【図10】図10A〜図10Iは、本発明に係る漢方生薬エキスのPBMC/T細胞のToll様受容体(TLR)発現に対する影響を示す図である。
【図11】図11A〜図11Iは、本発明に係る漢方生薬エキスのPBMC/T細胞のToll様受容体(TLR)発現に対する影響を示す図である。
【技術分野】
【0001】
本発明は漢方生薬エキスに関し、特に免疫細胞のインターフェロン産生を誘導し、かつToll様受容体を活性化できる漢方生薬エキスおよびその作製方法に関するものである。
【0002】
関連出願の相互参照
本出願は、参照することによってその全体が組み込まれる2008年5月8日出願の台湾特許出願第97116973号の優先権を主張するものである。
【背景技術】
【0003】
インターフェロン(interferon, IFN)は最初に発見されたサイトカインであり、そのウィルスの複製を“干渉”する能力によってそのように命名された。インターフェロンは1957年にイギリスにおいて2名の研究者、エリック・アイザックス(Alick Isaacs)とジーンリンデンマン(Jean Lindenmann)によって発見された。細胞はウィルスに感染すると、直ちにインターフェロンを作り出してウィルスに抵抗すると同時に、周囲の正常な細胞に警報を発し、警戒を高めることによってウィルスの進入を防ぐ。インターフェロンは大きくTypeIおよびTypeIIに分けられる。TypeIのインターフェロンにはインターフェロン−α、インターフェロン−β、インターフェロン−ω、インターフェロン−τがあり、インターフェロン−αおよびインターフェロン−βは大部分の細胞に発現する。またTypeIIのインターフェロンにはインターフェロン−γがあり、これは一部の免疫細胞、例えばナチュラルキラー細胞(natural killer cell, NK cell)、CD4+Tヘルパー1(TH1)リンパ球およびCD8+細胞障害性(cytotoxic)Tリンパ球においてのみ発現する。
【0004】
ウィルスに感染すると、TypeIのインターフェロンの産生が速やかに誘導され、引き続いてそれが標的細胞上のTypeIインターフェロン受容体と結合し、Jak−STATシグナル経路を作動して、インターフェロン誘導遺伝子(IFN-stimulated genes, ISGs)の発現を誘導する。インターフェロン誘導遺伝子のタンパク質生成物は、インターフェロンがウィルスに対抗する際の最主要戦略となるもので、現時点で500種を超えるインターフェロン誘導遺伝子タンパク質が同定されているが、これら分子の関与する範囲は非常に幅広く、抗ウィルス(anti-virus)から、アポトーシス(apoptosis)、タンパク質分解(protein degradation)、炎症性細胞応答(inflammatory cell response)、脂質代謝(lipid metabolism)に至るまで多様な機能をカバーする。最もよく知られているインターフェロン誘導遺伝子タンパク質としては、プロテインキナーゼR(PKR)、RNAに作用するアデノシンデアミナーゼ(adenosine deaminase acting on RNA, ADAR)、2’,5’−オリゴアデニル酸シンセターゼ(2’,5’-oligo adenylate synthetase, OAS)、RNase LおよびMxタンパクがある。PKRは真核生物開始因子22(eukaryotic initiation factor 2, eIF2)を抑制することによりウィルスタンパクの合成を阻害し、ADARはウィルスのRNA編集(RNA editing)を抑制し、OASおよびRNase LはウィルスRNAを分解し、Mxタンパクはウィルス複製を抑制することができる。
【0005】
TypeIのインターフェロンは、ウィルスに直接対抗できるのみならず、免疫調節(immunomodulatory)にも関与し、自然および獲得免疫反応において重要な役割を担う。例えば、IL−15を産生してナチュラルキラー細胞の生存および増殖を促す他、MHC、CD80、CD86およびCD40分子の発現を刺激して、樹状細胞(dendritic cell)の成熟化を促進することもできる。さらにTypeIのインターフェロンは、形質細胞様樹状細胞(plasmacytoid dendritic cell, pDC)の分化を誘導して成熟した抗原提示細胞(antigen presenting cell)とさせることもできる。獲得免疫に関しては、TypeIのインターフェロンは、CD8+細胞障害性Tリンパ球の活性化、CD4+Tヘルパー1(TH1)リンパ球およびD8+細胞障害性Tリンパ球の生存、Bリンパ球の分化と増殖において重要な役割を果たす。
【0006】
このようにTypeIのインターフェロンは抗ウィルス、細胞増殖の調節(regulators of cell growth)および免疫調節の能力を備えることから、すでに臨床治療に応用されている。米、英、日、独などをはじめとする先進国にて認可されているその適応症には、(1)ウィルスにより引き起こされる疾病、例えば慢性B型肝炎、慢性C型肝炎、尖圭コンジローマ、エイズ患者に発症の多いカポジ肉腫(Kaposi's sarcoma)など、(2)血液疾患、例えば有毛細胞白血病、慢性骨髄性白血病、多発性骨髄腫、低悪性度非ホジキンリンパ腫など、(3)その他の腫瘍、例えばメラノーマ(Melanoma)、腎細胞癌、基底細胞癌などがある。
【0007】
インターフェロンの産生は免疫系の伝達係であるToll様受容体(Toll-like receptor, TLR)の活性化によって誘導されることが、現在すでに研究により分かっている。Tollは1988年頃にショウジョウバエの体内で発見され、後に哺乳動物においてもTollに極めて類似する受容体が発見された。これがToll様受容体と称されるものである。外来の異物が侵入してくると、Toll様受容体は、病原体の病原体関連分子パターン(pathogen-associated molecular patterns, PAMPs)を識別することにより、シグナル伝達経路を介してサイトカイン(TypeIインターフェロン、IL−1、IL−12、インターフェロン−α)、化学走化性物質、MHCおよび共刺激分子(co-stimulatory molecules)を含む下流の遺伝子の発現を起こさせる。また誘導型一酸化窒素合成酵素(inducible nitric oxide synthase, iNOS)および抗菌性ペプチド(antimicrobial peptides)の発現を誘導して、外来の病原体を直接破壊することもできる。Toll様受容体は、自然免疫という防御の第一線を発動するだけでなく、抗原提示細胞(例えば樹状細胞(dendritic cell))の成熟化を誘導することを通して獲得免疫反応を活性化しもする。微生物が体内に侵入したとき、樹状細胞自身のToll様受容体が病原菌を識別し、MHC分子が抗原を表面に提示することにより、ナイーブTリンパ球が活性化される。そして、Toll様受容体に誘導されて産生したIL−12が、活性化されたTリンパ球をさらにTh1リンパ球に分化し、獲得免疫反応が発動される。このようにして慢性ウィルス感染への抵抗に協力し、最終目的であるウィルス排除が達成されることとなり、防御メカニズムにより強力かつ特異的な保護が提供される。
【0008】
現在までに確認されているToll様受容体は、Toll様受容体1からToll様受容体10まで10種あり、これらは細菌、ウィルス、真菌および原生動物など各種の外来の異物を認識することができる。Toll様受容体は構造上2つの部分、(1)外来の異物の認識を担う細胞外のロイシンリッチリピート(leucine-rich repeat, LRR)ドメインと、(2)例えばMyD88(myeloid differentiation factor-88 )、TIRAP/MAL(TIR-associated protein)、TRIF/TICAM−1(Toll/IL-1 receptor domain-containing adaptor inducing IFN-β)およびTRAM/TIRP/TICAM−2(Toll-receptor-associated molecule)などの下流のアダプタータンパクと作用して、細胞外シグナル調節キナーゼ(Extracellular Signal-regulated Kin, ERK)、p38、c−Jun N末端キナーゼ(c-Jun N-terminal kinase)およびNF−kBを活性化し、炎症性サイトカイン(pro-inflammatory cytokine)であるIL−1、IL−6、インターフェロン−αおよびTypeIのインターフェロンの産生を誘導する細胞内のToll−インターロイキン−1受容体(Toll-interleukin-1 receptor, TIR)ドメインを有している。
【0009】
哺乳動物において最初に発見されたのはToll様受容体4であり、これはBリンパ球、樹状細胞、単球(monocytes)、マクロファージ(macrophages)、顆粒球(granulocytes)およびTリンパ球といった多くの免疫細胞に発現するもので、呼吸器合胞体ウイルス(respiratory syncytial virus, RSV)、C型肝炎ウィルス(hepatitis C virus, HCV)およびマウス乳癌ウイルス(mouse mammary tumor virus, MMTV)など多数の外来ウィルスを認識できると共に、MyD88とTIRAPとの作用を介して大量のインターフェロンの産生を誘導する。
【0010】
すべてのToll様受容体のうち、Toll様受容体2が最も多くのPAMPsを認識でき、それらPAMPsは主に細菌由来のものであって、リポアラビノマンナン(lipoarabinomannan, LAM)、リポポリサッカリド(lipopolysaccharide, LPS)、リポタイコ酸(lipoteichoic acid, LTA)、ペプチドグリカン(peptidoglycan, PGN)およびその他のリポタンパク(lipoprotein)、糖脂質(glycolipid)、糖タンパク(glycoprotein)などである。またToll様受容体2は、麻疹ウィルス(measles virus, MV)、ヒトサイトメガロウィルス(human cytomegalovirus, HCMV)、C型肝炎ウィルスなどのウィルスの侵入をも認識でき、防御メカニズムにおいて重要な役割を担っている。
【0011】
Toll様受容体7は、単球、Bリンパ球および樹状細胞などの免疫細胞に高度に発現し、外来の物質の侵入を認識したときに極めて大量のTypeIインターフェロン、特にインターフェロン−αを産生することができ、自然免疫において重要な役割を果たす。Toll様受容体7は主にヒト免疫不全ウイルス(human immunodeficiency virus, HIV)およびVSVなどウィルス由来のG/UリッチssRNA(G/U-rich ssRNA)を感知することができ、ウィルス排除に無視することのできない影響力を持つ。
【0012】
医薬面での発展に目を向けると、Toll様受容体9拮抗剤が現在すでに臨床試験の段階に入っている。この拮抗剤は、樹状細胞を刺激してIL−12および極めて大量のインターフェロン−αを産出させると共に、Bリンパ球の増殖と抗体分泌を誘導することができ、インターフェロン−αでの治療に失敗したHCV患者に優れた効果をあげている。また、Toll様受容体7拮抗剤は幅広い抗ウィルス応答(antiviral response)を誘導し、多種のサイトカイン、特にインターフェロン−αを放出させることができるため、各種HCV遺伝子型の患者において高いウィルス排除率が得られている。
【0013】
近年ではすでに多くの抗ウィルス薬が研究・開発されており、臨床治療に広く利用されている。例として、呼吸器合胞体ウイルス、インフルエンザウィルス(influenza virus)、アデノウィルス(adenovirus)、HIVおよびHCVなど多種のウィルスの増殖を抑制することが実験により確認されたヌクレオシドアナログ(nucleside analog)の一種であるリバビリン、A型インフルエンザウィルスのM2膜タンパクを抑制するよう作用して、A型インフルエンザウィルスの脱穀を阻害し、後続の複製を行えなくするアマンタジン、HIVの逆転写酵素(reverse transcriptase)を抑制し、ウィルスのRNAがDNAへ逆転写できなくなるようにすることで、DNAの合成を中断させるジドブジン(AZT)、ジダノシン(ddI)、ザルシタビン(ddc)、スタブジン(d4T)およびラミブジン(3TC)などが挙げられる。
【0014】
多数の抗ウィルス薬が次々と臨床に用いられ効果をあげてはいるが、ここ数年で多くの薬剤に耐性ウィルスが発生してきている。耐性が生じるのはウィルスの遺伝子が突然変異することによって抗ウィルス薬がその作用の標的を失ってしまうことに主な原因があり、例えば次のような例を挙げることができる。HSVのチミジンキナーゼ(thymidine kinase)遺伝子が突然変異することでアシクロビル(acyclovir)およびガンシクロビル(ganciclovir)などが細胞内で有効な成分に転換し得ずこれら薬物に対して耐性が生じる。A型インフルエンザウィルスのM2タンパク遺伝子の突然変異によりアマンタジン(amantadine)またはリマンタジン(rimantadine)に対する耐性が生じる。HIV逆転写酵素またはプロテアーゼ(protease)遺伝子の突然変異もまた耐性を招来する原因となる。HCVの非構造(non-structural)5Aおよびエンベロープ遺伝子(envelope gene)2−糖タンパクの遺伝子の突然変異は、HCVにインターフェロンに対する耐性を生じさせる。
【0015】
昨今ではますます多くの薬剤が免疫調節の方向で発展しており、宿主の自然および獲得免疫反応を刺激することにより外来の微生物を排除する目的を達成している。免疫調節は漢方薬治療の得意とするところである。漢方生薬には双方向調節(または免疫調節)作用があり、かかる作用は、正常な有機体に対してはあまり影響はないが、免疫が失調を起こした有機体に対しては有効に作用して有機体の免疫の不足または過剰状態を修正し、回復させて免疫の安定を維持するといった形で表れ、これによれば正常な有機体の免疫能力が増強され、かつ病原因子が取り除かれる。
【0016】
漢方生薬は天然のままの構造と活性を保ったものであって、数千年にわたる選別・篩い分けの結果、残った確実に治療効果のある薬物である。
【0017】
ウィルス性疾患の種類は多岐にわたっており、例えばB型肝炎、C型肝炎、インフルエンザ、流行性耳下腺炎、流行性髄膜炎、ウィルス性肺炎、エンテロウィルス、AIDSウィルスなど実に多く、その病原性、潜伏期間および感染ルートは疾患の種類によりそれぞれ異なっている。臨床実験により、数多くの漢方生薬がウィルス性疾患の治療に顕著な効果を示すことが証明されている。
【0018】
例えば特許文献1は、金銀花、連翹から超臨界抽出および水抽出ならびに黄岑から水抽出したエキスが、抗インフルエンザウィルス作用を有することを開示している。特許文献2は、白花蛇舌草(Hedyotis diffuse)など14種の薬材から作製される注射剤とカプセル剤について、延べ人数で5人に対し臨床試験を行った結果、これらに抗AIDSウィルス作用が認められたと開示している。特許文献3は、金銀花、甘草、竜葵などを含んでなる複合漢方薬HHT888−4が、in vitro実験において、人体のリンパ球中の98%以上のAIDSウィルス活性を抑制したと開示している。特許文献4は、薑黄、黄耆、桑寄生、虎杖の漢方生薬エキスについて、臨床試験でC型肝炎の治療に顕著な効果が確認されたと開示している。
【0019】
上述以外にも、漢方薬は、現代医学による薬物治療と併用しての補助療法にも応用されている。例えば、特許文献5は、大棗などより組成されるPHY906を化学療法における薬物およびウィルス性疾患治療に併用すると、治療効果を高め、クオリティ・オブ・ライフを向上すると共に、毒性と副作用を低減することができ、米国ではすでに第II相臨床試験に入っていると開示する。特許文献6は、冬虫夏草および?耆から組成され、C型肝炎の併用療法(インターフェロンおよびリバビリン)と組み合わせてC型肝炎を治療するC型肝炎補助治療薬を開示しており、臨床試験において持続的なウィルス排除率が70%以上に達し、治療効果を高めるのみならず、治療後の再発率を低減することもできるとしている。
【0020】
さらに免疫系の観点から見ると、ウィルス性肝炎の治療において、インターフェロン産生の誘発は極めて指標的な意義を持つ。特許文献7は、夾竹桃および甘草エキスについて、マウス脳心筋炎ウイルス(encephalo-myocarditis virus, EMCV)に感染したヒト扁平上皮癌細胞(HEp−2 cell)に対する抗ウィルス試験を行ったところ、ウィルスを有効に低減することを確認し、In Vitro実験においてもインターフェロン−γの産生を誘導するという結果が出たと示している。
【0021】
人体の免疫系においてすでに10種のToll様受容体(Toll-like receptors, TLR)が確認されており、人体が体内外の病原体(ウィルス、細菌または真菌)から脅威をうけたとき、これらTLRは、個別に対応する免疫反応をそれぞれ識別して作動させる。由来のそれぞれ異なる病原分子が特定のTLRと結合することによって一連の反応が誘発され、病原体の侵襲から細胞が保護されることになる。TLRによる治療法は、TLRの免疫反応への対応に高度の特異性があるという原理を利用し、治療がなされる特定の病症に対し刺激剤(アゴニスト)または遮断剤(アンタゴニスト)を与えて免疫調節を行うことを通し病症の治療効果を達成するというものである。他の免疫系を利用した治療方法とは異なり、TLR治療法は、疾病の治療に高度な特異性があるので、病原体を有効かつ持続的に抑制できるだけでなく、自然免疫系が非特異的に活性化されることに伴う副作用またははその他の症状を低減させることもできる。
【0022】
最近、コリー・ファーマシューティカル・グループ社(Coley Pharmaceutical Group)が、合成の短鎖オリゴデオキシヌクレオチド(ODNs)によりTLR−9を制御するTLR治療薬アクチロン(Actilon)を開発した。このODNsはDNAのような配列を有する短鎖化合物であり、病原体の侵入時にTLR−9が認識する病原体のCpGモチーフを模倣したものである。TLR−9は、発現された後、免疫系における一連のシグナル伝達を作動させ、インターフェロンの産生を誘発する。上記治療薬はこうした機序によってC型肝炎などウィルス性疾患の治療を行うものであり、現在、第Ib相臨床試験の段階に入っている。また、アナディス・ファーマシューティカル社(Anadys Pharmaceutical)が開発したのは、TLR−7を発現させるANA245およびANA975 (経口薬)であり、それぞれすでに第Ibおよび第Ia相臨床試験段階に入っている。
【0023】
上記以外に、TLR治療法の研究において、天然エキスを使った試験も行われている。特許文献8は、エキナセアなどのハーブから抽出したメラニン(Melanin)エキスについて、In vitro/Monocyte試験系(NF-kappa B/luciferase)で試験を行ったところ、TLR−2およびTLR−4の発現を誘発できたと示している。
【0024】
【特許文献1】米国特許第6787165号明細書
【特許文献2】米国特許第6696094号明細書
【特許文献3】米国特許第6214350号明細書
【特許文献4】米国特許第6426098号明細書
【特許文献5】米国特許出願公開第2003/0211180号明細書
【特許文献6】台湾特許第I258373号明細書
【特許文献7】国際公開番号WO02102395号公報
【特許文献8】国際公開番号WO04093518号公報
【発明の開示】
【発明が解決しようとする課題】
【0025】
ウィルス耐性の問題を解決するため、本発明は多種の漢方生薬を組み合わせなるて複合漢方生薬を提供する。その原理は、同じ標的ウィルスに作用する多種の異なる薬物またはウィルスの異なる部位に作用する多種の薬物を同時に用いて治療を行うことによって、相加効果が生じるだけでなく、ウィルスがある薬物に耐性を持っていても他にも有効な薬物が含まれているために治療の成功率も高まる、というものである。さらに漢方生薬は天然の構造と活性を保ったものであって、数千年にわたって選別・篩い分けがなされてきた結果残った確実に治療効果のある薬物である。そこで本発明は、漢方薬の多面的効果、双方向調節作用、温和・無毒および顕著な免疫増強作用などの長所に基づいて、ウィルス疾患に対し治療効果を有する漢方生薬エキスを提供するものである。
【課題を解決するための手段】
【0026】
1実施形態において本発明は、免疫細胞のインターフェロン産生を誘導し、Toll様受容体(Toll-like receptor)を活性化する漢方生薬エキスであって、有効量の甘草(GLYCYRRHIZAE RADIX)、柴胡(BUPLEURI RADIX)および黄岑(SCUTELLARIAE RADIX)を含む原料を抽出してなり、甘草と柴胡と黄岑の重量比が1〜5:1〜5:1〜5または1〜2:1〜2:1〜2である漢方生薬エキスを提供する。
【0027】
甘草(GLYCYRRHIZAE RADIX)にはウラル甘草(Glycyrrhiza uralensis)またはスペイン甘草(Glycyrrhiza glabra)が含まれる。柴胡(BUPLEURI RADIX)には北柴胡(Bupleurum chinense)または狭葉柴胡(Bupleurum scorzonerifolium)が含まれる。黄岑(SCUTELLARIAE RADIX)には黄金花(Scutellaria baicalensis)が含まれる。
【0028】
本発明に係る漢方生薬エキスの原料は、五味子(SCHISANDRAE FRUCTUS)および赤芍(PAEONIAE RUBRA RADIX)をさらに含む。甘草と柴胡と黄岑と五味子と赤芍の重量比は1〜5:1〜5:1〜5:1〜3:1〜3または1〜2:1〜2:1〜2:1〜2:1〜2である。五味子(SCHISANDRAE FRUCTUS)には朝鮮五味子(Schisandra chinensis)または南五味子(Schisandra sphenanthera)が含まれる。赤芍(PAEONIAE RUBRA RADIX)にはエビスグスリ(Paeonia lactiflora)または川赤芍(Paeonia veitchii)が含まれる。
【0029】
本発明に係る漢方生薬エキスは、Toll様受容体2、Toll様受容体4またはToll様受容体7を含む複数のToll様受容体を活性化する。
【0030】
本発明に係る漢方生薬エキスは、免疫調節機能を強化でき、ウィルス感染性疾患の治療の用いることができる。
【0031】
別の実施形態において本発明は、免疫細胞のインターフェロン産生を誘導し、Toll様受容体(Toll-like receptor)を活性化する漢方生薬エキスの作製方法であって、有効量の甘草(GLYCYRRHIZAE RADIX)、柴胡(BUPLEURI RADIX)および黄岑(SCUTELLARIAE RADIX)を含み、甘草と柴胡と黄岑の重量比が1〜5:1〜5:1〜5または1〜2:1〜2:1〜2である漢方生薬組成物を準備する工程と、漢方生薬組成物を溶剤で抽出して抽出液を得る工程と、抽出液を濃縮して濃縮生成物を得る工程と、濃縮生成物を乾燥させる工程と、賦形剤を加えて所定の剤型に調製する工程と、を含む漢方生薬エキスの作製方法を提供する。
【0032】
甘草(GLYCYRRHIZAE RADIX)にはウラル甘草(Glycyrrhiza uralensis)またはスペイン甘草(Glycyrrhiza glabra)が含まれる。柴胡(BUPLEURI RADIX)には北柴胡(Bupleurum chinense)または狭葉柴胡(Bupleurum scorzonerifolium)が含まれる。黄岑(SCUTELLARIAE RADIX)には黄金花(Scutellaria baicalensis)が含まれる。
【0033】
漢方生薬組成物は、有効量の五味子(SCHISANDRAE FRUCTUS)および赤芍(PAEONIAE RUBRA RADIX)をさらに含む。甘草と柴胡と黄岑と五味子と赤芍の重量比は1〜5:1〜5:1〜5:1〜3:1〜3または1〜2:1〜2:1〜2:1〜2:1〜2である。五味子(SCHISANDRAE FRUCTUS)には朝鮮五味子(Schisandra chinensis)または南五味子(Schisandra sphenanthera)が含まれる。赤芍(PAEONIAE RUBRA RADIX)にはエビスグスリ(Paeonia lactiflora)または川赤芍(Paeonia veitchii)が含まれる。
【0034】
溶剤には水または濃度0.1〜95%のエタノールが含まれ、かつ溶剤と漢方生薬組成物の重量比は6:1〜10:1である。濃縮生成物の固形分は10〜30%である。本発明で用いる乾燥方法には真空乾燥、凍結乾燥、噴霧乾燥または流動床乾燥が含まれる。賦形剤にはデンプン、麦芽糖、乳糖、ショ糖、マンニトール、ステアリン酸マグネシウム、二酸化ケイ素、微結晶セルロース、カルボキシメチルセルロースまたはタルクが含まれる。形成される所定の剤型にはカプセル剤、錠剤、散剤または液剤が含まれる。
【0035】
本発明(1)は、有効量の甘草(GLYCYRRHIZAE RADIX)、柴胡(BUPLEURI RADIX)および黄岑(SCUTELLARIAE RADIX)を含む原料を抽出してなり、甘草と柴胡と黄岑の重量比が1〜5:1〜5:1〜5である、免疫細胞のインターフェロン産生を誘導する漢方生薬エキスである。
本発明(2)は、甘草と柴胡と黄岑の重量比が1〜2:1〜2:1〜2である、本発明(1)の免疫細胞のインターフェロン産生を誘導する漢方生薬エキスである。
本発明(3)は、原料に有効量の五味子(SCHISANDRAE FRUCTUS)および赤芍(PAEONIAE RUBRA RADIX)がさらに含まれる、本発明(1)の免疫細胞のインターフェロン産生を誘導する漢方生薬エキスである。
本発明(4)は、甘草と柴胡と黄岑と五味子と赤芍の重量比が1〜5:1〜5:1〜5:1〜3:1〜3である、本発明(3)の免疫細胞のインターフェロン産生を誘導する漢方生薬エキスである。
本発明(5)は、甘草と柴胡と黄岑と五味子と赤芍の重量比が1〜2:1〜2:1〜2:1〜2:1〜2である、本発明(4)の免疫細胞のインターフェロン産生を誘導する漢方生薬エキスである。
本発明(6)は、免疫細胞のインターフェロン産生を誘導する漢方生薬エキスの作製方法であって、
有効量の甘草、柴胡および黄岑を含み、甘草と柴胡と黄岑の重量比が1〜5:1〜5:1〜5である漢方生薬組成物を準備する工程、
前記漢方生薬組成物を溶剤で抽出して抽出液を得る工程、
前記抽出液を濃縮して濃縮生成物を得る工程、
前記濃縮生成物を乾燥させる工程、ならびに、
賦形剤を加えて所定の剤型に調製する工程、
を含む作製方法である。
本発明(7)は、前記漢方生薬組成物が有効量の五味子および赤芍をさらに含む、本発明(6)の免疫細胞のインターフェロン産生を誘導する漢方生薬エキスの作製方法である。
本発明(8)は、甘草と柴胡と黄岑と五味子と赤芍の重量比が1〜5:1〜5:1〜5:1〜3:1〜3である、本発明(7)の免疫細胞のインターフェロン産生を誘導する漢方生薬エキスの作製方法である。
本発明(9)は、甘草と柴胡と黄岑と五味子と赤芍の重量比が1〜2:1〜2:1〜2:1〜2:1〜2である、本発明(8)の免疫細胞のインターフェロン産生を誘導する漢方生薬エキスの作製方法である。
本発明(10)は、前記溶剤には水または濃度0.1〜95%のエタノールが含まれる、本発明(6)の免疫細胞のインターフェロン産生を誘導する漢方生薬エキスの作製方法である。
本発明(11)は、前記溶剤と前記漢方生薬組成物の重量比が6:1〜10:1である、本発明(6)の免疫細胞のインターフェロン産生を誘導する漢方生薬エキスの作製方法である。
本発明(12)は、前記濃縮生成物の固形分が10〜30%である、本発明(6)の免疫細胞のインターフェロン産生を誘導する漢方生薬エキスの作製方法である。
本発明(13)は、前記濃縮生成物を真空乾燥、凍結乾燥、噴霧乾燥または流動床乾燥により乾燥させる、本発明(6)の免疫細胞のインターフェロン産生を誘導する漢方生薬エキスの作製方法である。
本発明(14)は、前記賦形剤にデンプン、麦芽糖、乳糖、ショ糖、マンニトール、ステアリン酸マグネシウム、二酸化ケイ素、微結晶セルロース、カルボキシメチルセルロースまたはタルクが含まれる、本発明(6)の免疫細胞のインターフェロン産生を誘導する漢方生薬エキスの作製方法である。
本発明(15)は、前記所定の剤型にはカプセル剤、錠剤、散剤または液剤が含まれる、本発明(6)の免疫細胞のインターフェロン産生を誘導する漢方生薬エキスの作製方法である。
本発明(16)は、有効量の甘草、柴胡および黄岑を含む原料を抽出してなり、甘草と柴胡と黄岑の重量比が1〜5:1〜5:1〜5である、Toll様受容体を活性化する漢方生薬エキスである。
本発明(17)は、Toll様受容体2、Toll様受容体4およびToll様受容体7を活性化する、本発明(16)のToll様受容体を活性化する漢方生薬エキスである。
本発明(18)は、甘草と柴胡と黄岑の重量比が1〜2:1〜2:1〜2である、本発明(16)のToll様受容体を活性化する漢方生薬エキスである。
本発明(19)は、原料に有効量の五味子および赤芍がさらに含まれる、本発明(16)のToll様受容体を活性化する漢方生薬エキスである。
本発明(20)は、甘草と柴胡と黄岑と五味子と赤芍の重量比が1〜5:1〜5:1〜5:1〜3:1〜3である、本発明(19)のToll様受容体を活性化する漢方生薬エキスである。
本発明(21)は、甘草と柴胡と黄岑と五味子と赤芍の重量比が1〜2:1〜2:1〜2:1〜2:1〜2である、本発明(20)のToll様受容体を活性化する漢方生薬エキスである。
本発明(22)は、Toll様受容体を活性化する漢方生薬エキスの作製方法であって、
有効量の甘草、柴胡および黄岑を含み、甘草と柴胡と黄岑の重量比が1〜5:1〜5:1〜5である漢方生薬組成物を準備する工程、
前記漢方生薬組成物を溶剤で抽出して抽出液を得る工程、
前記抽出液を濃縮して濃縮生成物を得る工程、
前記濃縮生成物を乾燥させる工程、ならびに、
賦形剤を加えて所定の剤型に調製する工程、
を含む作製方法である。
本発明(23)は、前記漢方生薬組成物が有効量の五味子および赤芍をさらに含む、本発明(22)のToll様受容体を活性化する漢方生薬エキスの作製方法である。
本発明(24)は、甘草と柴胡と黄岑と五味子と赤芍の重量比が1〜5:1〜5:1〜5:1〜3:1〜3である、本発明(23)のToll様受容体を活性化する漢方生薬エキスの作製方法である。
本発明(25)は、甘草と柴胡と黄岑と五味子と赤芍の重量比が1〜2:1〜2:1〜2:1〜2:1〜2である、本発明(24)のToll様受容体を活性化する漢方生薬エキスの作製方法である。
本発明(26)は、前記溶剤には水または濃度0.1〜95%のエタノールが含まれる、本発明(22)のToll様受容体を活性化する漢方生薬エキスの作製方法である。
本発明(27)は、前記溶剤と前記漢方生薬組成物の重量比が6:1〜10:1である、本発明(22)のToll様受容体を活性化する漢方生薬エキスの作製方法である。
本発明(28)は、前記濃縮生成物の固形分が10〜30%である、本発明(22)のToll様受容体を活性化する漢方生薬エキスの作製方法である。
本発明(29)は、前記濃縮生成物を真空乾燥、凍結乾燥、噴霧乾燥または流動床乾燥により乾燥させる、本発明(22)のToll様受容体を活性化する漢方生薬エキスの作製方法である。
本発明(30)は、前記賦形剤にはデンプン、麦芽糖、乳糖、ショ糖、マンニトール、ステアリン酸マグネシウム、二酸化ケイ素、微結晶セルロース、カルボキシメチルセルロースまたはタルクが含まれる、本発明(22)のToll様受容体を活性化する漢方生薬エキスの作製方法である。
本発明(31)は、前記所定の剤型にはカプセル剤、錠剤、散剤または液剤が含まれる、本発明(22)のToll様受容体を活性化する漢方生薬エキスの作製方法である。
【発明の効果】
【0036】
本発明に係る漢方生薬エキスは甘草、柴胡および黄岑などから抽出されてなり、免疫細胞のインターフェロン産生を誘導し、かつToll様受容体を活性化することができる。本発明に係る漢方生薬エキスは多種の漢方生薬を組み合わせてなる複合漢方生薬であるため、相加効果が得られるのみでなく、ウィルス性疾患の治療に際し、ウィルスが当該漢方生薬エキス中の薬物に耐性を持っていたとしても他にも有効な薬物が含まれていることより治療の成功率が高まる。また、本発明は、多面的効果、双方向調節作用、温和・無毒および顕著な免疫増強作用などといった漢方薬の長所も備えている。
【発明を実施するための最良の形態】
【0037】
上述した本発明の目的、特徴および長所がより明りょうとなるよう、以下に添付の図面を参照にしながら、実施例を挙げて詳細に説明する。
【0038】
1実施形態において本発明は、免疫細胞のインターフェロン産生を誘導し、Toll様受容体(Toll-like receptor)を活性化する漢方生薬エキスであって、有効量の甘草(GLYCYRRHIZAE RADIX)、柴胡(BUPLEURI RADIX)および黄岑(SCUTELLARIAE RADIX)を含む原料を抽出してなる漢方生薬エキスを提供する。
【0039】
漢方生薬エキスの原料において、甘草と柴胡と黄岑の重量比は約1〜5:1〜5:1〜5または1〜2:1〜2:1〜2である。
【0040】
甘草(GLYCYRRHIZAE RADIX)としてはウラル甘草(Glycyrrhiza uralensis)またはスペイン甘草(Glycyrrhiza glabra)を挙げることができる。柴胡(BUPLEURI RADIX)としては北柴胡(Bupleurum chinense)または狭葉柴胡(Bupleurum scorzonerifolium)を挙げることができる。黄岑(SCUTELLARIAE RADIX)としては黄金花(Scutellaria baicalensis)を挙げることができる。
【0041】
上記漢方生薬エキスの原料は、有効量の五味子(SCHISANDRAE FRUCTUS)および赤芍(PAEONIAE RUBRA RADIX)をさらに含んでいてもよい。甘草と柴胡と黄岑と五味子と赤芍の重量比は約1〜5:1〜5:1〜5:1〜3:1〜3または1〜2:1〜2:1〜2:1〜2:1〜2である。五味子(SCHISANDRAE FRUCTUS)としては朝鮮五味子(Schisandra chinensis)または南五味子(Schisandra sphenanthera)を挙げることができる。赤芍(PAEONIAE RUBRA RADIX)としてはエビスグスリ(Paeonia lactiflora)または川赤芍(Paeonia veitchii)を挙げることができる。
【0042】
上記漢方生薬エキスは、例えばToll様受容体2、Toll様受容体4およびToll様受容体7といった複数のToll様受容体を活性化することができる。
【0043】
別の実施形態において本発明は、免疫細胞のインターフェロン産生を誘導し、Toll様受容体(Toll-like receptor)を活性化する漢方生薬エキスの作製方法を提供する。該作製方法は次の工程を含む。先ず、有効量の甘草(GLYCYRRHIZAE RADIX)、柴胡(BUPLEURI RADIX)および黄岑(SCUTELLARIAE RADIX)を含む漢方生薬組成物を準備する。甘草と柴胡と黄岑の重量比は約1〜5:1〜5:1〜5または1〜2:1〜2:1〜2である。次に、漢方生薬組成物を溶剤で抽出して抽出液を得る。用いる溶剤は水または濃度0.1〜95%のエタノールとすることができ、溶剤と漢方生薬組成物の重量比は約6:1〜10:1である。続いて、抽出液を濃縮して濃縮生成物を得る。濃縮生成物の固形分は約10〜30%である。次いで、濃縮生成物を乾燥させる。濃縮生成物を乾燥させる方法は真空乾燥、凍結乾燥、噴霧乾燥または流動床乾燥とすることができる。さらに、賦形剤を加えて所定の剤形に調製する。賦形剤はデンプン、麦芽糖、乳糖、ショ糖、マンニトール、ステアリン酸マグネシウム、二酸化ケイ素、微結晶セルロース、カルボキシメチルセルロースまたはタルクとすることができる。また、所定の剤形は、錠剤、散剤または液剤などであってよい。
【0044】
甘草(GLYCYRRHIZAE RADIX)としてはウラル甘草(Glycyrrhiza uralensis)またはスペイン甘草(Glycyrrhiza glabra)を挙げることができる。柴胡(BUPLEURI RADIX)としては北柴胡(Bupleurum chinense)または狭葉柴胡(Bupleurum scorzonerifolium)を挙げることができる。黄岑(SCUTELLARIAE RADIX)としては黄金花(Scutellaria baicalensis)を挙げることができる。
【0045】
上記漢方生薬エキスの原料は、有効量の五味子(SCHISANDRAE FRUCTUS)および赤芍(PAEONIAE RUBRA RADIX)をさらに含んでいてもよい。甘草と柴胡と黄岑と五味子と赤芍の重量比は約1〜5:1〜5:1〜5:1〜3:1〜3または1〜2:1〜2:1〜2:1〜2:1〜2である。五味子(SCHISANDRAE FRUCTUS)としては朝鮮五味子(Schisandra chinensis)または南五味子(Schisandra sphenanthera)を挙げることができる。赤芍(PAEONIAE RUBRA RADIX)としてはエビスグスリ(Paeonia lactiflora)または川赤芍(Paeonia veitchii)を挙げることができる。
【0046】
所定重量%の甘草、柴胡、黄岑、五味子および赤芍を取ってこれを原料とし、重量比で6から10倍の0.1〜95%エタノールで1回または複数回抽出する。次いで、濃縮終点の固形分が10〜30%となるように濃縮を行う。次に、賦形剤を添加してから、含水量が2〜10%となるように濃縮混合液を凍結乾燥し、さらにその乾燥物を、粒度が35メッシュ未満の粉末になるように粉砕する。最後に、得られた乾燥漢方生薬エキス粉末をハードカプセル中に充填する。各カプセル剤には、約1.35±0.09gの漢方生薬エキス製剤に相当する量が充填される。漢方生薬エキスの濃縮比は2〜3倍である。
【0047】
本発明では、好中球(neutrophil)、Tリンパ球およびナチュラルキラー細胞を試験の主体として、インターフェロンの産生とToll様受容体2、Toll様受容体4、Toll様受容体7の発現を観察し、これを薬剤のスクリーニングの基準とした。
【実施例】
【0048】
本発明に係る漢方生薬エキスの作製
実施例1
黄金花(Scutellaria baicalensis)4kg、北柴胡(Bupleurum chinense)4kg、ウラル甘草(Glycyrrhiza uralensis)4kg、エビスグスリ(Paeonia lactiflora)4kg、朝鮮五味子(Schisandra chinensis)4kg(薬材の重量比1:1:1:1:1)、および30%エタノール溶液200kgをそれぞれ取り、1時間還流させて加熱抽出した。2回抽出した後、得られた抽出液を100メッシュのフィルターでろ過し、濃縮終点の固形分が15%になるように減圧濃縮した。続いて、マルトデキストリン2kgを添加し、凍結乾燥を行った。その乾燥物を粉砕して35メッシュ未満の粉末にし、さらに二酸化ケイ素120gおよびステアリン酸マグネシウム60gを混入した。最後に、乾燥漢方生薬エキス粉末を0号のハードカプセルに充填した。各カプセル剤の充填量は565±40mgであり、漢方生薬エキス製剤は約1.35±0.09gとなった。
【0049】
実施例2
黄金花(Scutellaria baicalensis)2.5g、北柴胡(Bupleurum chinense)2.5g、ウラル甘草(Glycyrrhiza uralensis)2.5g、エビスグスリ(Paeonia lactiflora)7.5g、朝鮮五味子(Schisandra chinensis)7.5g(薬材の重量比1:1:1:3:3)、および30%エタノール溶液250gをそれぞれ取り、1時間還流させて加熱抽出した。2回抽出した後、得られた抽出液を100メッシュのフィルターでろ過してから、減圧濃縮および凍結乾燥を行い、その乾燥物を粉砕して粉末を得た。
【0050】
実施例3
黄金花(Scutellaria baicalensis)12.5g、北柴胡(Bupleurum chinense)6.25g、ウラル甘草(Glycyrrhiza uralensis)6.25g(薬材の重量比2:1:1)、および30%エタノール溶液250gをそれぞれ取り、1時間還流させて加熱抽出した。2回抽出した後、得られた抽出液を100メッシュのフィルターでろ過してから、減圧濃縮および凍結乾燥を行い、その乾燥物を粉砕して粉末を得た。
【0051】
実施例4
黄金花(Scutellaria baicalensis)6.25g、北柴胡(Bupleurum chinense)12.5g、ウラル甘草(Glycyrrhiza uralensis)6.25g(薬材の重量比1:2:1)、および30%エタノール溶液250gをそれぞれ取り、1時間還流させて加熱抽出した。2回抽出した後、得られた抽出液を100メッシュのフィルターでろ過してから、減圧濃縮および凍結乾燥を行い、その乾燥物を粉砕して粉末を得た。
【0052】
実施例5
黄金花(Scutellaria baicalensis)6.25g、北柴胡(Bupleurum chinense)6.25g、ウラル甘草(Glycyrrhiza uralensis)12.5g(薬材の重量比1:1:2)、および30%エタノール溶液250gをそれぞれ取り、1時間還流させて加熱抽出した。2回抽出した後、得られた抽出液を100メッシュのフィルターでろ過してから、減圧濃縮および凍結乾燥を行い、その乾燥物を粉砕して粉末を得た。
【0053】
実施例6
黄金花(Scutellaria baicalensis)5g、北柴胡(Bupleurum chinense)5g、ウラル甘草(Glycyrrhiza uralensis)5g、エビスグスリ(Paeonia lactiflora)5g、朝鮮五味子(Schisandra chinensis)5g(薬材の重量比1:1:1:1:1)、および純水250gをそれぞれ取り、1時間還流させて加熱抽出した。2回抽出した後、得られた抽出液を100メッシュのフィルターでろ過してから、減圧濃縮および凍結乾燥を行い、その乾燥物を粉砕して粉末を得た。
【0054】
実施例7
黄金花(Scutellaria baicalensis)5g、北柴胡(Bupleurum chinense)5g、ウラル甘草(Glycyrrhiza uralensis)5g、エビスグスリ(Paeonia lactiflora)5g、朝鮮五味子(Schisandra chinensis)5g(薬材の重量比1:1:1:1:1)、および50%エタノール溶液250gをそれぞれ取り、1時間還流させて加熱抽出した。2回抽出した後、得られた抽出液を100メッシュのフィルターでろ過してから、減圧濃縮および凍結乾燥を行い、その乾燥物を粉砕して粉末を得た。
【0055】
実施例8
黄金花(Scutellaria baicalensis)5g、北柴胡(Bupleurum chinense)5g、ウラル甘草(Glycyrrhiza uralensis)5g、エビスグスリ(Paeonia lactiflora)5g、朝鮮五味子(Schisandra chinensis)5g(薬材の重量比1:1:1:1:1)、および95%エタノール溶液250gをそれぞれ取り、1時間還流させて加熱抽出した。2回抽出した後、得られた抽出液を100メッシュのフィルターでろ過してから、減圧濃縮および凍結乾燥を行い、その乾燥物を粉砕して粉末を得た。
【0056】
本発明に係る漢方生薬エキスの好中球およびTリンパ球に対する細胞毒性
実施例9
先ず、96ウェルプレートに細胞を播種した。次いで、本発明に係る漢方生薬エキス(実施例1で作製したもの)を加え、さらにアラマーブルー色素(Alamarblue dye)10μlを加えて37℃のインキュベーターで16時間培養し、570nmおよび600nmにおける吸光値を測定した。結果は図1Aと1Bに示すとおりであり、該漢方生薬エキスには、好中球およびTリンパ球に対し明らかな細胞毒性がないことが確認された。
【0057】
本発明に係る漢方生薬エキスの免疫細胞表面インターフェロン産生誘導試験
実施例10
先ず、抹消血液から分離したTリンパ球およびナチュラルキラー細胞の細胞株(NK92)を用意し、それに本発明に係る漢方生薬エキス(実施例1で作製したもの)を加え、24時間経過後、上層液を取り、ELISAでインターフェロンの含量を測定した。その結果、図2Aに示すように、漢方生薬エキスの濃度の増加に伴ってインターフェロン−γの発現量も増加しており、用量反応が表れた。かかる現象は、Tリンパ球およびナチュラルキラー細胞株(NK92)のいずれにおいても似たような傾向を示した。さらに、PC−IL−12を陽性対照とし、同様の方式でインターフェロン−αの含量を測定したところ、図2Bおよび2Cに示すように、漢方生薬エキスは100μg/mlでナチュラルキラー細胞株(NK92)のインターフェロン−α産生を誘導できることが確認され、また、抹消血液から分離したTリンパ球を系とした誘導試験では、250〜1000μg/mlにおいて顕著なインターフェロン−α産生誘導が認められた。
【0058】
実施例11
本発明に係る漢方生薬エキス(実施例3で作製したもの)を取りインターフェロン−γの誘導活性試験を行った。結果、試料濃度500μg/mlで免疫細胞からインターフェロン−γ産生を誘導できることが確認され、その値は94.3±15.7pg/mlに達した(陽性対照に用いたIL−12では、40ng/mlの濃度で、免疫細胞から50±2.04pg/mlのインターフェロン-γが産生された)。
【0059】
実施例12
本発明に係る漢方生薬エキス(実施例5で作製したもの)を取りインターフェロン−γの誘導活性試験を行った。結果、試料濃度500μg/mlで免疫細胞のインターフェロン−γ産生を誘導できることが確認され、その値は129.1±8.5pg/mlに達した(陽性対照に用いたIL−12では、40ng/mlの濃度で、免疫細胞から50±2.04pg/mlのインターフェロン-γが産生された)。
【0060】
実施例13
本発明に係る漢方生薬エキス(実施例6で作製したもの)を取りインターフェロン−γの誘導活性試験を行った。結果、試料濃度1000μg/mlで免疫細胞のインターフェロン−γ産生を誘導できることが確認され、その値は95.2±15.7pg/mlに達した(陽性対照に用いたIL−12では、40ng/mlの濃度で、免疫細胞から50±2.04pg/mlのインターフェロン-γが産生された)。
【0061】
実施例14
本発明に係る漢方生薬エキス(実施例7で作製したもの)を取りインターフェロン−γの誘導活性試験を行った。結果、試料濃度1000μg/mlで免疫細胞のインターフェロン−γ産生を誘導できることが確認され、その値は1563.6±44.9pg/mlに達した(陽性対照に用いたIL−12では、40ng/mlの濃度で、免疫細胞から50±2.04pg/mlのインターフェロン-γが産生された)。
【0062】
実施例15
乾燥物(実施例8で作製したもの)を適量取り、インターフェロン−γの誘導活性試験を行った。結果、試料濃度500ug/mlで免疫細胞のインターフェロン−γ産生を誘導できることが確認され、その値は80.2±24.6pg/mlに達した(陽性対照に用いたIL−12では、40ng/mlの濃度で、免疫細胞から50±2.04pg/mlのインターフェロン-γが産生された)。
【0063】
本発明に係る漢方生薬エキスのラットインターフェロン産生誘導試験
実施例16
本発明に係る漢方生薬エキス(実施例1で作製したもの)を適量取り、in vivoインターフェロン−γ誘導活性試験を行った。Wistarラットを対照群、中濃度群および高濃度群に分け、対照群には水、中濃度群には漢方生薬エキス5g/kg、高濃度群には漢方生薬エキス10g/kgをそれぞれ28日間連続して与え、29日目に採血して血中のIFNγ産生を測定した。その結果図3に示すように、本発明に係る漢方生薬エキスが動物体内のIFNγの産生を顕著に誘導できることが認められ、雌ラットでは特に優れた効果が見られた。
【0064】
本発明に係る漢方生薬エキスのPBMC/T細胞のToll様受容体(TLR)発現に対する影響
実施例17
本発明に係る漢方生薬エキス(実施例1で作製したもの)を適量取り、TLR2、TLR4およびTLR7の活性試験を行った。TLR2、TLR4およびTLR7の抗体を用いて細胞表面マーカー染色を行った後、フローサイトメトリー(FACS)で直接分析した。その結果、低用量(250ug/ml)で、TLR2、TLR4またはTLR7のいずれについても75%以上の発現を誘導できることがわかった。図4A〜4Iを参照されたい。
【0065】
実施例18
本発明に係る漢方生薬エキス(実施例2で作製したもの)を取りTLR2、TLR4およびTLR7の活性試験を行った。その結果は図5A〜5Iに示すとおりである。試験濃度が500ug/mlのときに65%以上のTLRsの発現を誘導できることが確認された。
【0066】
実施例19
本発明に係る漢方生薬エキス(実施例3で作製したもの)を取りTLR2、TLR4およびTLR7の活性試験を行った。その結果は図6A〜6Iに示すとおりである。試験濃度が低用量(250ug/ml)でも60%以上のTLRsの発現を誘導できることが確認された。
【0067】
実施例20
本発明に係る漢方生薬エキス(実施例4で作製したもの)を取りTLR2、TLR4およびTLR7の活性試験を行った。その結果は図7A〜7Iに示すとおりである。試験濃度が低用量(250ug/ml)のときでも85%以上のTLRsの発現を誘導できることが確認された。
【0068】
実施例21
本発明に係る漢方生薬エキス(実施例5で作製したもの)を取りTLR2、TLR4およびTLR7の活性試験を行った。その結果は図8A〜8Iに示すとおりである。試験濃度が低用量(250ug/ml)のときでも80%以上のTLRsの発現を誘導できることが確認された。
【0069】
実施例22
本発明の漢方生薬エキス(実施例6で作製したもの)を取りTLR2、TLR4およびTLR7の活性試験を行った。その結果は図9A〜9Iに示すとおりである。試験濃度が低用量(250ug/ml)のときでも85%以上のTLRsの発現を誘導できることが確認された。
【0070】
実施例23
本発明の漢方生薬エキス(実施例7で作製したもの)を取りTLR2、TLR4およびTLR7の活性試験を行った。その結果は図10A〜10Iに示すとおりである。試験濃度が低用量(250ug/ml)のときでも94%以上のTLRsの発現を誘導できることが確認された。
【0071】
実施例24
本発明の漢方生薬エキス(実施例8で作製したもの)を取りTLR2、TLR4およびTLR7の活性試験を行った。その結果は図11A〜11Iに示すとおりである。試験濃度が低用量(250ug/ml)のときでも75%以上のTLRsの高度な発現を誘導できることが確認された。
【0072】
以上、好適な実施形態を挙げて本発明を説明したが、本発明はこれら実施形態に限定はされないと解されるべきであり、つまり本発明は、(当業者であれば明らかであるように)添付の特許請求の範囲は、かかる各種変更および均等なアレンジがすべて包含されるように、最も広い意味に解釈されるべきである。
【図面の簡単な説明】
【0073】
【図1A】本発明に係る漢方生薬エキスの好中球に対する細胞毒性を示した図である。
【図1B】本発明に係る漢方生薬エキスのTリンパ球に対する細胞毒性を示した図である。
【図2A】本発明に係る漢方生薬エキスがナチュラルキラー細胞およびTリンパ球のIFN−γ発現を促進できることを示す図である。データは3回の独立した実験の平均値±標準差を示し、*は中濃度群と比較したときのp<0.05を示す。
【図2B】本発明に係る漢方生薬エキスがナチュラルキラー細胞のIFN−α発現を促進できることを示す図である。データは3回の独立した実験の平均値±標準差を示し、*は中濃度群と比較したときのp<0.05を示す。
【図2C】本発明に係る漢方生薬エキスがTリンパ球のIFN−α発現を促進できることを示す図である。データは3回の独立した実験の平均値±標準差を示し、*は中濃度群と比較したときのp<0.05を示す。
【図3】本発明に係る漢方生薬エキスが動物(in vivo)のIFN−γ発現を促進できることを示す図である。*は対照群と比較したときのp<0.05を示す。
【図4】図4A〜図4Iは、本発明に係る漢方生薬エキスのPBMC/T細胞のToll様受容体(TLR)発現に対する影響を示す図である。
【図5】図5A〜図5Iは、本発明に係る漢方生薬エキスのPBMC/T細胞のToll様受容体(TLR)発現に対する影響を示す図である。
【図6】図6A〜図6Iは、本発明に係る漢方生薬エキスのPBMC/T細胞のToll様受容体(TLR)発現に対する影響を示す図である。
【図7】図7A〜図7Iは、本発明に係る漢方生薬エキスのPBMC/T細胞のToll様受容体(TLR)発現に対する影響を示す図である。
【図8】図8A〜図8Iは、本発明に係る漢方生薬エキスのPBMC/T細胞のToll様受容体(TLR)発現に対する影響を示す図である。
【図9】図9A〜図9Iは、本発明に係る漢方生薬エキスのPBMC/T細胞のToll様受容体(TLR)発現に対する影響を示す図である。
【図10】図10A〜図10Iは、本発明に係る漢方生薬エキスのPBMC/T細胞のToll様受容体(TLR)発現に対する影響を示す図である。
【図11】図11A〜図11Iは、本発明に係る漢方生薬エキスのPBMC/T細胞のToll様受容体(TLR)発現に対する影響を示す図である。
【特許請求の範囲】
【請求項1】
有効量の甘草(GLYCYRRHIZAE RADIX)、柴胡(BUPLEURI RADIX)および黄岑(SCUTELLARIAE RADIX)を含む原料を抽出してなり、甘草と柴胡と黄岑の重量比が1〜5:1〜5:1〜5である、免疫細胞のインターフェロン産生を誘導する漢方生薬エキス。
【請求項2】
甘草と柴胡と黄岑の重量比が1〜2:1〜2:1〜2である、請求項1記載の免疫細胞のインターフェロン産生を誘導する漢方生薬エキス。
【請求項3】
原料に有効量の五味子(SCHISANDRAE FRUCTUS)および赤芍(PAEONIAE RUBRA RADIX)がさらに含まれる、請求項1記載の免疫細胞のインターフェロン産生を誘導する漢方生薬エキス。
【請求項4】
甘草と柴胡と黄岑と五味子と赤芍の重量比が1〜5:1〜5:1〜5:1〜3:1〜3である、請求項3記載の免疫細胞のインターフェロン産生を誘導する漢方生薬エキス。
【請求項5】
甘草と柴胡と黄岑と五味子と赤芍の重量比が1〜2:1〜2:1〜2:1〜2:1〜2である、請求項4記載の免疫細胞のインターフェロン産生を誘導する漢方生薬エキス。
【請求項6】
免疫細胞のインターフェロン産生を誘導する漢方生薬エキスの作製方法であって、
有効量の甘草、柴胡および黄岑を含み、甘草と柴胡と黄岑の重量比が1〜5:1〜5:1〜5である漢方生薬組成物を準備する工程、
前記漢方生薬組成物を溶剤で抽出して抽出液を得る工程、
前記抽出液を濃縮して濃縮生成物を得る工程、
前記濃縮生成物を乾燥させる工程、ならびに、
賦形剤を加えて所定の剤型に調製する工程、
を含む作製方法。
【請求項7】
前記漢方生薬組成物が有効量の五味子および赤芍をさらに含む、請求項6記載の免疫細胞のインターフェロン産生を誘導する漢方生薬エキスの作製方法。
【請求項8】
甘草と柴胡と黄岑と五味子と赤芍の重量比が1〜5:1〜5:1〜5:1〜3:1〜3である、請求項7記載の免疫細胞のインターフェロン産生を誘導する漢方生薬エキスの作製方法。
【請求項9】
甘草と柴胡と黄岑と五味子と赤芍の重量比が1〜2:1〜2:1〜2:1〜2:1〜2である、請求項8記載の免疫細胞のインターフェロン産生を誘導する漢方生薬エキスの作製方法。
【請求項10】
前記溶剤には水または濃度0.1〜95%のエタノールが含まれる、請求項6記載の免疫細胞のインターフェロン産生を誘導する漢方生薬エキスの作製方法。
【請求項11】
前記溶剤と前記漢方生薬組成物の重量比が6:1〜10:1である、請求項6記載の免疫細胞のインターフェロン産生を誘導する漢方生薬エキスの作製方法。
【請求項12】
前記濃縮生成物の固形分が10〜30%である、請求項6記載の免疫細胞のインターフェロン産生を誘導する漢方生薬エキスの作製方法。
【請求項13】
前記濃縮生成物を真空乾燥、凍結乾燥、噴霧乾燥または流動床乾燥により乾燥させる、請求項6記載の免疫細胞のインターフェロン産生を誘導する漢方生薬エキスの作製方法。
【請求項14】
前記賦形剤にはデンプン、麦芽糖、乳糖、ショ糖、マンニトール、ステアリン酸マグネシウム、二酸化ケイ素、微結晶セルロース、カルボキシメチルセルロースまたはタルクが含まれる、請求項6記載の免疫細胞のインターフェロン産生を誘導する漢方生薬エキスの作製方法。
【請求項15】
前記所定の剤型にはカプセル剤、錠剤、散剤または液剤が含まれる、請求項6記載の免疫細胞のインターフェロン産生を誘導する漢方生薬エキスの作製方法。
【請求項16】
有効量の甘草、柴胡および黄岑を含む原料を抽出してなり、甘草と柴胡と黄岑の重量比が1〜5:1〜5:1〜5である、Toll様受容体を活性化する漢方生薬エキス。
【請求項17】
Toll様受容体2、Toll様受容体4およびToll様受容体7を活性化する、請求項16記載のToll様受容体を活性化する漢方生薬エキス。
【請求項18】
甘草と柴胡と黄岑の重量比が1〜2:1〜2:1〜2である、請求項16記載のToll様受容体を活性化する漢方生薬エキス。
【請求項19】
原料に有効量の五味子および赤芍がさらに含まれる、請求項16記載のToll様受容体を活性化する漢方生薬エキス。
【請求項20】
甘草と柴胡と黄岑と五味子と赤芍の重量比が1〜5:1〜5:1〜5:1〜3:1〜3である、請求項19記載のToll様受容体を活性化する漢方生薬エキス。
【請求項21】
甘草と柴胡と黄岑と五味子と赤芍の重量比が1〜2:1〜2:1〜2:1〜2:1〜2である、請求項20記載のToll様受容体を活性化する漢方生薬エキス。
【請求項22】
Toll様受容体を活性化する漢方生薬エキスの作製方法であって、
有効量の甘草、柴胡および黄岑を含み、甘草と柴胡と黄岑の重量比が1〜5:1〜5:1〜5である漢方生薬組成物を準備する工程、
前記漢方生薬組成物を溶剤で抽出して抽出液を得る工程、
前記抽出液を濃縮して濃縮生成物を得る工程、
前記濃縮生成物を乾燥させる工程、ならびに、
賦形剤を加えて所定の剤型に調製する工程、
を含む作製方法。
【請求項23】
前記漢方生薬組成物が有効量の五味子および赤芍をさらに含む、請求項22記載のToll様受容体を活性化する漢方生薬エキスの作製方法。
【請求項24】
甘草と柴胡と黄岑と五味子と赤芍の重量比が1〜5:1〜5:1〜5:1〜3:1〜3である、請求項23記載のToll様受容体を活性化する漢方生薬エキスの作製方法。
【請求項25】
甘草と柴胡と黄岑と五味子と赤芍の重量比が1〜2:1〜2:1〜2:1〜2:1〜2である、請求項24記載のToll様受容体を活性化する漢方生薬エキスの作製方法。
【請求項26】
前記溶剤には水または濃度0.1〜95%のエタノールが含まれる、請求項22記載のToll様受容体を活性化する漢方生薬エキスの作製方法。
【請求項27】
前記溶剤と前記漢方生薬組成物の重量比が6:1〜10:1である、請求項22記載のToll様受容体を活性化する漢方生薬エキスの作製方法。
【請求項28】
前記濃縮生成物の固形分が10〜30%である、請求項22記載のToll様受容体を活性化する漢方生薬エキスの作製方法。
【請求項29】
前記濃縮生成物を真空乾燥、凍結乾燥、噴霧乾燥または流動床乾燥により乾燥させる、請求項22記載のToll様受容体を活性化する漢方生薬エキスの作製方法。
【請求項30】
前記賦形剤にはデンプン、麦芽糖、乳糖、ショ糖、マンニトール、ステアリン酸マグネシウム、二酸化ケイ素、微結晶セルロース、カルボキシメチルセルロースまたはタルクが含まれる、請求項22記載のToll様受容体を活性化する漢方生薬エキスの作製方法。
【請求項31】
前記所定の剤型にはカプセル剤、錠剤、散剤または液剤が含まれる、請求項22記載のToll様受容体を活性化する漢方生薬エキスの作製方法。
【請求項1】
有効量の甘草(GLYCYRRHIZAE RADIX)、柴胡(BUPLEURI RADIX)および黄岑(SCUTELLARIAE RADIX)を含む原料を抽出してなり、甘草と柴胡と黄岑の重量比が1〜5:1〜5:1〜5である、免疫細胞のインターフェロン産生を誘導する漢方生薬エキス。
【請求項2】
甘草と柴胡と黄岑の重量比が1〜2:1〜2:1〜2である、請求項1記載の免疫細胞のインターフェロン産生を誘導する漢方生薬エキス。
【請求項3】
原料に有効量の五味子(SCHISANDRAE FRUCTUS)および赤芍(PAEONIAE RUBRA RADIX)がさらに含まれる、請求項1記載の免疫細胞のインターフェロン産生を誘導する漢方生薬エキス。
【請求項4】
甘草と柴胡と黄岑と五味子と赤芍の重量比が1〜5:1〜5:1〜5:1〜3:1〜3である、請求項3記載の免疫細胞のインターフェロン産生を誘導する漢方生薬エキス。
【請求項5】
甘草と柴胡と黄岑と五味子と赤芍の重量比が1〜2:1〜2:1〜2:1〜2:1〜2である、請求項4記載の免疫細胞のインターフェロン産生を誘導する漢方生薬エキス。
【請求項6】
免疫細胞のインターフェロン産生を誘導する漢方生薬エキスの作製方法であって、
有効量の甘草、柴胡および黄岑を含み、甘草と柴胡と黄岑の重量比が1〜5:1〜5:1〜5である漢方生薬組成物を準備する工程、
前記漢方生薬組成物を溶剤で抽出して抽出液を得る工程、
前記抽出液を濃縮して濃縮生成物を得る工程、
前記濃縮生成物を乾燥させる工程、ならびに、
賦形剤を加えて所定の剤型に調製する工程、
を含む作製方法。
【請求項7】
前記漢方生薬組成物が有効量の五味子および赤芍をさらに含む、請求項6記載の免疫細胞のインターフェロン産生を誘導する漢方生薬エキスの作製方法。
【請求項8】
甘草と柴胡と黄岑と五味子と赤芍の重量比が1〜5:1〜5:1〜5:1〜3:1〜3である、請求項7記載の免疫細胞のインターフェロン産生を誘導する漢方生薬エキスの作製方法。
【請求項9】
甘草と柴胡と黄岑と五味子と赤芍の重量比が1〜2:1〜2:1〜2:1〜2:1〜2である、請求項8記載の免疫細胞のインターフェロン産生を誘導する漢方生薬エキスの作製方法。
【請求項10】
前記溶剤には水または濃度0.1〜95%のエタノールが含まれる、請求項6記載の免疫細胞のインターフェロン産生を誘導する漢方生薬エキスの作製方法。
【請求項11】
前記溶剤と前記漢方生薬組成物の重量比が6:1〜10:1である、請求項6記載の免疫細胞のインターフェロン産生を誘導する漢方生薬エキスの作製方法。
【請求項12】
前記濃縮生成物の固形分が10〜30%である、請求項6記載の免疫細胞のインターフェロン産生を誘導する漢方生薬エキスの作製方法。
【請求項13】
前記濃縮生成物を真空乾燥、凍結乾燥、噴霧乾燥または流動床乾燥により乾燥させる、請求項6記載の免疫細胞のインターフェロン産生を誘導する漢方生薬エキスの作製方法。
【請求項14】
前記賦形剤にはデンプン、麦芽糖、乳糖、ショ糖、マンニトール、ステアリン酸マグネシウム、二酸化ケイ素、微結晶セルロース、カルボキシメチルセルロースまたはタルクが含まれる、請求項6記載の免疫細胞のインターフェロン産生を誘導する漢方生薬エキスの作製方法。
【請求項15】
前記所定の剤型にはカプセル剤、錠剤、散剤または液剤が含まれる、請求項6記載の免疫細胞のインターフェロン産生を誘導する漢方生薬エキスの作製方法。
【請求項16】
有効量の甘草、柴胡および黄岑を含む原料を抽出してなり、甘草と柴胡と黄岑の重量比が1〜5:1〜5:1〜5である、Toll様受容体を活性化する漢方生薬エキス。
【請求項17】
Toll様受容体2、Toll様受容体4およびToll様受容体7を活性化する、請求項16記載のToll様受容体を活性化する漢方生薬エキス。
【請求項18】
甘草と柴胡と黄岑の重量比が1〜2:1〜2:1〜2である、請求項16記載のToll様受容体を活性化する漢方生薬エキス。
【請求項19】
原料に有効量の五味子および赤芍がさらに含まれる、請求項16記載のToll様受容体を活性化する漢方生薬エキス。
【請求項20】
甘草と柴胡と黄岑と五味子と赤芍の重量比が1〜5:1〜5:1〜5:1〜3:1〜3である、請求項19記載のToll様受容体を活性化する漢方生薬エキス。
【請求項21】
甘草と柴胡と黄岑と五味子と赤芍の重量比が1〜2:1〜2:1〜2:1〜2:1〜2である、請求項20記載のToll様受容体を活性化する漢方生薬エキス。
【請求項22】
Toll様受容体を活性化する漢方生薬エキスの作製方法であって、
有効量の甘草、柴胡および黄岑を含み、甘草と柴胡と黄岑の重量比が1〜5:1〜5:1〜5である漢方生薬組成物を準備する工程、
前記漢方生薬組成物を溶剤で抽出して抽出液を得る工程、
前記抽出液を濃縮して濃縮生成物を得る工程、
前記濃縮生成物を乾燥させる工程、ならびに、
賦形剤を加えて所定の剤型に調製する工程、
を含む作製方法。
【請求項23】
前記漢方生薬組成物が有効量の五味子および赤芍をさらに含む、請求項22記載のToll様受容体を活性化する漢方生薬エキスの作製方法。
【請求項24】
甘草と柴胡と黄岑と五味子と赤芍の重量比が1〜5:1〜5:1〜5:1〜3:1〜3である、請求項23記載のToll様受容体を活性化する漢方生薬エキスの作製方法。
【請求項25】
甘草と柴胡と黄岑と五味子と赤芍の重量比が1〜2:1〜2:1〜2:1〜2:1〜2である、請求項24記載のToll様受容体を活性化する漢方生薬エキスの作製方法。
【請求項26】
前記溶剤には水または濃度0.1〜95%のエタノールが含まれる、請求項22記載のToll様受容体を活性化する漢方生薬エキスの作製方法。
【請求項27】
前記溶剤と前記漢方生薬組成物の重量比が6:1〜10:1である、請求項22記載のToll様受容体を活性化する漢方生薬エキスの作製方法。
【請求項28】
前記濃縮生成物の固形分が10〜30%である、請求項22記載のToll様受容体を活性化する漢方生薬エキスの作製方法。
【請求項29】
前記濃縮生成物を真空乾燥、凍結乾燥、噴霧乾燥または流動床乾燥により乾燥させる、請求項22記載のToll様受容体を活性化する漢方生薬エキスの作製方法。
【請求項30】
前記賦形剤にはデンプン、麦芽糖、乳糖、ショ糖、マンニトール、ステアリン酸マグネシウム、二酸化ケイ素、微結晶セルロース、カルボキシメチルセルロースまたはタルクが含まれる、請求項22記載のToll様受容体を活性化する漢方生薬エキスの作製方法。
【請求項31】
前記所定の剤型にはカプセル剤、錠剤、散剤または液剤が含まれる、請求項22記載のToll様受容体を活性化する漢方生薬エキスの作製方法。
【図1A】


【図1B】


【図2A】


【図2B】


【図2C】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】




【図1B】


【図2A】


【図2B】


【図2C】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【公開番号】特開2009−269902(P2009−269902A)
【公開日】平成21年11月19日(2009.11.19)
【国際特許分類】
【出願番号】特願2008−171397(P2008−171397)
【出願日】平成20年6月30日(2008.6.30)
【出願人】(390023582)財団法人工業技術研究院 (524)
【氏名又は名称原語表記】INDUSTRIAL TECHNOLOGY RESEARCH INSTITUTE
【住所又は居所原語表記】195 Chung Hsing Rd.,Sec.4,Chutung,Hsin−Chu,Taiwan R.O.C
【Fターム(参考)】
【公開日】平成21年11月19日(2009.11.19)
【国際特許分類】
【出願日】平成20年6月30日(2008.6.30)
【出願人】(390023582)財団法人工業技術研究院 (524)
【氏名又は名称原語表記】INDUSTRIAL TECHNOLOGY RESEARCH INSTITUTE
【住所又は居所原語表記】195 Chung Hsing Rd.,Sec.4,Chutung,Hsin−Chu,Taiwan R.O.C
【Fターム(参考)】
[ Back to top ]

