免疫誘導剤及びその用途
【課題】癌の治療及び/又は予防剤として有用なペプチドを見出し、該ペプチドの免疫誘導剤としての用途を提供すること。
【解決手段】カルモジュリン2がヒトの腫瘍組織において、正常組織と比較して有意に高発現していることが見出された。カルモジュリン2タンパク中の部分ペプチドが、抗原提示細胞により提示されて、該ペプチドに特異的な細胞障害性T細胞を活性化及び増殖させる能力(免疫誘導活性)を有し、このため、該ペプチドが癌の治療及び/又は予防に有用であり、また、該ペプチドと接触した抗原提示細胞や、該抗原提示細胞と接触したT細胞が癌の治療及び/又は予防に有用である。
【解決手段】カルモジュリン2がヒトの腫瘍組織において、正常組織と比較して有意に高発現していることが見出された。カルモジュリン2タンパク中の部分ペプチドが、抗原提示細胞により提示されて、該ペプチドに特異的な細胞障害性T細胞を活性化及び増殖させる能力(免疫誘導活性)を有し、このため、該ペプチドが癌の治療及び/又は予防に有用であり、また、該ペプチドと接触した抗原提示細胞や、該抗原提示細胞と接触したT細胞が癌の治療及び/又は予防に有用である。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、ヒトの癌に特異的なタンパク質又はその部分ペプチドを含む免疫誘導剤に関する。さらに本発明は、上記ペプチドによって刺激され誘導された活性化T細胞、該ペプチドとHLA分子の複合体を含む抗原提示細胞、上記活性化T細胞又は上記抗原提示細胞を有効成分として含む医薬、前記タンパク質の遺伝子発現量を指標とした癌の検出方法、及び該タンパク質に対する抗体を含む癌の診断剤に関する。
【背景技術】
【0002】
癌は全死亡原因の第一位を占める疾患であり、現在行われている治療は手術療法を主体に放射線療法と化学療法を組み合わせたものである。近年の新しい手術法の開発や新たな抗癌剤の発見にも関わらず、一部の癌を除いて、癌の治療成績はあまり向上していないのが現状である。
【0003】
近年、分子生物学や癌免疫学の進歩で癌に反応する細胞障害性T細胞により認識される癌抗原や癌抗原をコードする遺伝子が同定されてき、抗原特異性免疫療法への期待が高まっている(非特許文献1を参照)。1991年、ベルギーLudwig研究所のBoonらは自己癌細胞株と癌反応性T細胞を用いたcDNA発現クローニング法によりCD8陽性T細胞が認識するヒトメラノーマ抗原MAGE1を単離した(非特許文献2を参照)。Boonの報告後CD8陽性T細胞の認識する抗原としてtyrosinase(非特許文献3を参照)、MART1/MelanA(非特許文献4を参照)、gp100(非特許文献5を参照)などの単離が行われた。
【0004】
免疫療法においては、副作用を軽減するため、その抗原として認識されるタンパク質は、正常細胞には少なく、癌細胞に過剰に存在していることが望ましい。
【先行技術文献】
【非特許文献】
【0005】
【非特許文献1】秋吉毅,「癌と化学療法」、1997年、第24巻、p551−519
【非特許文献2】Bruggen P. et al., Science, 254:1643-1647(1991)
【非特許文献3】Robbins P.F. et al., Cancer Res., 54:3124-3126(1994)
【非特許文献4】Kawakami Y. et al., Proc. Natl. Acad. Sci. USA, 91(9):3515-3519(1994)
【非特許文献5】Kawakami Y. et al., Proc. Natl. Acad. Sci. USA, 91:6458-6462(1994)
【発明の概要】
【発明が解決しようとする課題】
【0006】
本発明の目的は、癌の治療及び/又は予防剤として有用なペプチドを見出し、該ペプチドの免疫誘導剤としての用途を提供することである。また、本発明の目的は、該ペプチドとHLA分子の複合体を含む、単離抗原提示細胞、及びペプチドとHLA分子の複合体を選択的に結合する単離T細胞並びにそれらの癌の治療及び/又は予防剤の用途を提供することである。さらに、本発明の目的は、前記ペプチドの発現量を指標とした癌の検出方法を提供することである。さらに、本発明の目的は、前記ペプチドに対する抗体又はその抗原結合性断片の、癌の診断剤としての用途を提供することである。
【課題を解決するための手段】
【0007】
本願発明者らは、鋭意研究の結果、カルモジュリン2(以下CALM2と略記することがある)がヒトの腫瘍組織において、正常組織と比較して有意に高発現していることを見出した(実施例1を参照)。そして、配列番号2で示されるアミノ酸配列を有する上記CALM2タンパク中の部分ペプチドが、抗原提示細胞により提示されて、該ペプチドに特異的な細胞障害性T細胞を活性化及び増殖させる能力(免疫誘導活性)を有すること、このため、該ペプチドが癌の治療及び/又は予防に有用であり、また、該ペプチドと接触した抗原提示細胞や、該抗原提示細胞と接触したT細胞が癌の治療及び/又は予防に有用であることを見出し、本発明を完成した。
【0008】
すなわち、本発明は、配列番号2で表されるアミノ酸配列を有するカルモジュリン2タンパク若しくは免疫誘導活性を有し、連続する7個以上のアミノ酸から成るその断片、又は前記カルモジュリン2タンパク若しくはその前記断片と80%以上の相同性を有し、免疫誘導活性を有するペプチド、又は前記カルモジュリン2タンパク、その前記断片若しくは前記ペプチドを部分配列として含み、免疫誘導活性を有するペプチドを有効成分として含有する免疫誘導剤を提供する。また、本発明は、上記ペプチドとHLA分子の複合体を含む、単離抗原提示細胞を提供する。さらに、本発明は、上記ペプチドとHLA分子の複合体を選択的に結合する、単離T細胞を提供する。さらに、本発明は、上記本発明の単離抗原提示細胞又は上記本発明の単離T細胞を有効成分として含有する医薬を提供する。さらに、本発明は、上記本発明の単離抗原提示細胞又は上記本発明の単離T細胞を有効成分として含有する癌の治療及び/又は予防剤を提供する。さらに、本発明は、癌であるか否かを検出すべき患者から得た試料における、配列番号1に示す塩基配列を有するコード領域を有するカルモジュリン2遺伝子の発現を調べ、健常者由来の試料中の該遺伝子の発現量と比較することを含む、癌の検出方法を提供する。さらに、本発明は、配列番号2で表されるアミノ酸配列を有するカルモジュリン2タンパクと抗原抗体反応する抗体又はその抗原結合性断片を含む癌の診断剤を提供する。
【発明の効果】
【0009】
本発明により、癌の治療及び/又は予防や、そのための抗原提示細胞やT細胞の誘導に有用なペプチドが新規に同定され、医学分野における該ペプチドの各種用途が提供された。下記実施例において具体的に示されるように、前記ペプチドにより活性化されたCD8陽性T細胞は、CALM2を発現する癌細胞に対して優れた細胞障害活性を示す。従って、本発明で用いられるペプチドは、これをヒトに投与することにより、又はこれを用いてインビトロで活性化T細胞をヒトに投与することにより、癌の治療及び/又は予防に有効である。
【図面の簡単な説明】
【0010】
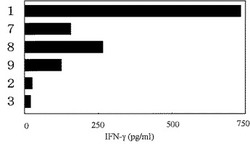
【図1】ペプチド特異的CD8陽性T細胞が該ペプチドとHLA−A0201との複合体を認識してIFN−γを産生することを示す図である。参照番号1;配列番号3のペプチドについての結果、参照番号7;配列番号5のペプチドについての結果、参照番号8;配列番号6のペプチドについての結果、参照番号9;配列番号7のペプチドについての結果、参照番号2;配列番号4のペプチドについての結果、参照番号3;ペプチドを添加せずに処理を行なった場合についての結果である。
【図2】ペプチド特異的CD8陽性T細胞の癌細胞に対する障害活性を示した図である。
【図3】ペプチド特異的CD8陽性T細胞の癌細胞に対する障害活性を示した図である。参照番号4;配列番号3のペプチドについての結果、参照番号10;配列番号5のペプチドについての結果、参照番号11;配列番号6のペプチドについての結果、参照番号12;配列番号7のペプチドについての結果、参照番号5;配列番号4のペプチドについての結果、参照番号6;ペプチドを添加せずに処理を行なった場合についての結果である。
【図4】ペプチド特異的CD8陽性T細胞の癌細胞に対する障害活性を示した図である。参照番号13;配列番号5のペプチドについての結果、参照番号14;配列番号6のペプチドについての結果、参照番号15;配列番号7のペプチドについての結果、参照番号16;配列番号4のペプチドについての結果、参照番号17;ペプチドを添加せずに処理を行なった場合についての結果である。
【発明を実施するための形態】
【0011】
本発明の免疫誘導剤に有効成分として含まれるペプチドとしては、以下のものが挙げられる。なお、「ペプチド」とは、複数のアミノ酸がペプチド結合することによって形成される分子をいい、構成するアミノ酸数が少ない低分子量の分子(オリゴペプチド)のみならず、アミノ酸数が多いポリペプチドやタンパク質も包含され、本発明ではカルモジュリン2の全長タンパク質も包含される。
(a) 配列番号2で表されるアミノ酸配列を有するカルモジュリン2タンパク(以下CALM2タンパクと略記することがある)。
(b) (a)の断片であって、連続する7個以上のアミノ酸配列からなり、免疫誘導活性を有する断片(以下、便宜的に「免疫誘導性断片」と言うことがある)。
(c) (a)のカルモジュリン2タンパク又は(b)の断片と、80%以上の相同性を有し、免疫誘導活性を有するペプチド(以下、便宜的に「免疫誘導性修飾ペプチド」と言うことがある)。
(d) (a)のカルモジュリン2タンパク、(b)の断片または(c)のペプチドを部分配列として含み、免疫誘導活性を有するペプチド(以下、便宜的に「免疫誘導性付加ペプチド」と言うことがある)。
【0012】
なお、本発明において、「アミノ酸配列を有する」とは、アミノ酸残基がそのような順序で配列しているという意味である。従って、例えば、「配列番号3で示されるアミノ酸配列を有するペプチド」とは、Thr Ile Asp Phe Pro Glu Phe Leu Thr Metのアミノ酸配列を持つ10アミノ酸残基のサイズのペプチドを意味する。また、例えば、「配列番号3で示されるアミノ酸配列を有するペプチド」を「配列番号3のペプチド」と略記することがある。「塩基配列を有する」という表現についても同様である。
【0013】
ここで、「免疫誘導活性」は、CALM2を発現する癌細胞に反応するT細胞を活性化および増殖させる能力を意味し、具体的には、下記実施例に詳述する方法により測定される、ペプチドで刺激されたT細胞のIFN-γ産生能力及び/又はCALM2発現癌細胞に対する細胞障害活性が、ペプチドで刺激していない対照のT細胞よりも高く、かつ、ペプチドで刺激されたT細胞が、ペプチドで刺激していない対照のT細胞よりもよく増殖することを意味する。増殖は、目視観察、フローサイトメトリー、培地中のトリチウムチミジンの細胞内への取り込み量等により確認することができる。なお、下記実施例で採用したIFN-γ産生能力の測定は、例えばJ.Immunol.,154,p2257,1995に記載されており、また、細胞障害活性の測定は、Int.J.Cancer,58:p317,1994に記載された51Crリリースアッセイと呼ばれる公知の方法に準拠している。
【0014】
上記(a)のカルモジュリン2タンパクをコードするCALM2遺伝子は、本願発明者らが、DNAマイクロアレイ解析により、ヒトの腫瘍組織において、正常組織と比較して有意に高発現していることを初めて見出したものである(実施例1を参照)。
【0015】
上記(b)の免疫誘導性断片は、配列番号2で表されるアミノ酸配列を有するカルモジュリン2タンパクの断片であって、免疫誘導活性を有するものである。該断片は、配列番号2のアミノ酸配列中の連続する7個以上のアミノ酸からなり、好ましくは連続する9個以上のアミノ酸からなる。
【0016】
上記(c)の免疫誘導性修飾ペプチドは、前記(a)のカルモジュリン2タンパク又は前記(b)の免疫誘導性断片のうちの少数のアミノ酸残基が置換し、欠失し及び/又は挿入され、元の配列と80%以上、好ましくは90%以上、より好ましくは95%以上、さらに好ましくは98%以上の同一性を有し、かつ、免疫誘導活性を有するペプチドである。ここで、アミノ酸配列の「同一性」とは、両者のアミノ酸配列残基ができるだけ多く一致するように(必要ならばギャップを挿入する)両アミノ酸配列を整列させ、一致したアミノ酸残基数を、全アミノ酸残基数(両者の配列で全アミノ酸残基数が異なる場合には短い方の配列の全アミノ酸残基数)で除したものを百分率で表したものであり、BLASTのような周知のソフトを用いて容易に算出することができる。また、該免疫誘導性修飾ペプチドは、前記(a)のカルモジュリン2タンパク又は前記(b)の免疫誘導性断片のうちの1ないし数個のアミノ酸残基が置換し、欠失し及び/又は挿入されたペプチドであることも好ましい。なお、天然のタンパク質を構成する20種類のアミノ酸は、低極性側鎖を有する中性アミノ酸(Gly, Ile, Val, Leu, Ala, Met, Pro)、親水性側鎖を有する中性アミノ酸(Asn, Gln, Thr, Ser, Tyr Cys)、酸性アミノ酸(Asp, Glu)、塩基性アミノ酸(Arg, Lys, His)、芳香族アミノ酸(Phe, Tyr, Trp)のように類似の性質を有するものにグループ分けでき、これらの間での置換であればペプチドの性質が変化しないことが多いことが知られている。従って、上記本発明の免疫誘導性部分ペプチド中のアミノ酸残基を置換する場合には、これらの各グループの間で置換することにより、免疫誘導活性を維持できる可能性が高くなる。
【0017】
上記(d)の免疫誘導性付加ペプチドは、前記(a)のカルモジュリン2タンパク、前記(b)の免疫誘導性断片又は前記(c)の免疫誘導性修飾ペプチドを部分配列として含み、免疫誘導活性を有するペプチドである。すなわち、(a)のタンパク質、(b)の断片又は(c)のペプチドの一端又は両端に他のペプチドが付加されたものであって、免疫誘導活性を有するペプチドである。これらのペプチドも、本発明の免疫誘導剤等の調製に用いることができる。
【0018】
本発明で用いられる上記ペプチドの好ましい例として、配列番号2中の(1)aa9〜17の9アミノ酸の領域、(2)aa63〜72の10アミノ酸の領域、(3)aa65〜73の9アミノ酸の領域又は(4)aa121〜129の9アミノ酸の領域を含む、9アミノ酸以上のペプチドを挙げることができる。なお、(1)ないし(4)の領域のアミノ酸配列は、配列表中にそれぞれ配列番号5、配列番号3、配列番号7、配列番号6として示されている。
【0019】
本発明で用いられる上記ペプチドは、例えば市販のペプチド合成機を用いて常法により容易に調製することができる。また、公知の遺伝子工学的手法を用いて容易に調製することができる。例えば、カルモジュリン2遺伝子を発現している組織から抽出したRNAから、カルモジュリン2遺伝子のcDNAをRT−PCRにより調製し、該cDNAの全長又は所望の一部を発現ベクターに組み込んで、宿主細胞中に導入し、目的とするペプチドを得ることができる。RNAの抽出、RT−PCR、ベクターへのcDNAの組み込み、ベクターの宿主細胞への導入は周知の方法により行なうことができる。また、用いるベクターや宿主細胞も周知であり、種々のものが市販されている。
【0020】
下記実施例に具体的に記載されるように、上記ペプチドは、免疫誘導活性を示す。すなわち、該ペプチドで刺激したT細胞は、CALM2を発現する癌細胞に対して細胞障害活性を示し、増殖する。従って、該ペプチドを有効成分として含む免疫誘導剤を生体に投与することにより、癌を治療及び/又は予防することができる。従って、本発明の免疫誘導剤は、癌の治療及び/又は予防剤として用いることができる。なお、下記実施例では、免疫誘導活性が高い領域を選択して用いているが、例えばカルモジュリン2タンパクの全長を用いた場合であっても、生体内で分解され、結果として免疫誘導活性の高い領域を含む断片を生じることになるので、本発明では該タンパク質全長や、アミノ酸数が30を超えるその断片、特に全長の半分以上のサイズを有する大きな断片を用いることもできる。
【0021】
本発明の免疫誘導剤を癌の治療及び/又は予防剤として用いる場合、対象となる癌としては、CALM2を発現している癌を挙げることができ、脳腫瘍、頭、首、肺、子宮又は食道の扁平上皮癌、メラノーマ、肺または子宮の腺癌、腎癌等を挙げることができる。また、投与対象は、哺乳動物であり、特にヒトが好ましい。
【0022】
本発明の免疫誘導剤の生体への投与経路は、経口投与でも非経口投与でもよいが、筋肉内投与、皮下投与、静脈内投与、動脈内投与等の非経口投与が好ましい。また、投与量は、免疫誘導するのに有効な量、すなわち、CALM2を発現する癌細胞に反応するT細胞を活性化および増殖させるのに有効な量であればよく、例えば癌の治療及び/又は予防に用いるのであれば、癌の治療及び/又は予防に有効な量であればよい。投与量は、症状、使用目的等に応じて適宜選択されるが、通常、0.0001μg〜1000μg、好ましくは0.001μg〜1000μgであり、これを数日ないし数月に1回投与するのが好ましい。
【0023】
本発明の免疫誘導剤は、ペプチドのみから成っていてもよいし、各投与形態に適した、薬理学的に許容される担体及び/又は希釈剤を用いて製剤することができる。製剤方法及びそのための各種担体は、医薬製剤の分野において周知である。薬理学的に許容される担体又は希釈剤は、例えば、生理緩衝液のような緩衝液や、賦形剤(砂糖、乳糖、コーンスターチ、リン酸カルシウム、ソルビトール、グリシン等)であってよく、結合剤(シロップ、ゼラチン、アラビアゴム、ソルビトール、ポリビニルクロリド、トラガント等)、滑沢剤(ステアリン酸マグネシウム、ポリエチレングリコール、タルク、シリカ等)等が適宜混合されていてもよい。投与形態としては、錠剤、カプセル剤、顆粒剤、散剤、シロップ剤などによる経口剤、吸入剤、注射剤、座剤、液剤などによる非経口剤などを挙げることができる。これらの製剤は一般的に知られている製法によって作ることができる。
【0024】
また、上記ペプチドを生体内に投与することにより、該ペプチドを生体内で抗原として認識させ、生体にあらかじめ該ペプチドに対する免疫を誘導することができる。従って、上記ペプチドを有効成分として含有する本発明の免疫誘導剤は、ワクチンとして用いることができる。この場合には、免疫誘導剤は、有効成分として含む上記ペプチドに加えてアジュバントを含むことが好ましい。アジュバントは、抗原の貯蔵所(細胞外またはマクロファージ内)を提供し、マクロファージを活性化し、かつ特定組のリンパ球を刺激することにより、免疫学的応答を強化し得る。多数の種類のアジュバントが、当業界で周知である。具体例としては、MPL(SmithKline Beecham)、サルモネラ属のSalmonella minnesota Re 595リポ多糖類の精製および酸加水分解後に得られる同類物;QS21(SmithKline Beecham)、Quillja saponaria抽出物から精製される純QA−21サポニン;PCT出願WO96/33739(SmithKline Beecham)に記載されたDQS21;QS−7、QS−17、QS−18およびQS−L1(ソ(So)、外10名、「モレキュルズ・アンド・セル(Molecules and cells)」、1997年、第7巻、p.178−186);フロイントの不完全アジュバント;フロイントの完全アジュバント;ビタミンE;モンタニド;ミョウバン;CpGオリゴヌクレオチド(例えば、クレイグ(Kreig)、外7名、「ネイチャー(Nature)」、第374巻、p.546−549)を参照);ポリIC;ポリICLC;ならびにスクアレンおよび/またはトコフェロールのような生分解性油から調製される種々の油中水エマルションが挙げられる。
【0025】
ワクチンとして免疫誘導剤を用いる場合、有効成分として含有されるペプチドは、好ましくはDQS21/MPLの組合せと混合されて投与される。DQS21対MPLの比は、典型的には約1:10〜10:1,好ましくは約1:5〜5:1、さらに好ましくは約1:1である。典型的には、ヒト投与に関しては、DQS21およびMPLは、約1μg〜約100μgの範囲でワクチン処方物中に存在する。その他のアジュバントが当業界で既知であり、本発明に用いられ得る(例えば、ゴッディング(Goding)著,「モノクローナル・アンチボディーズ:プリンシプル・アンド・プラクティス(Monoclonal Antibodies:Principles and Practice)」、第2版、1986年を参照)。ペプチドおよびアジュバントの混合物またはエマルションの調製方法は、予防接種の当業者には周知である。
【0026】
対象の免疫応答を刺激するその他の因子も、対象に投与され得る。例えばその他のサイトカインも、リンパ球刺激特性の結果として、予防接種プロトコルに有用である。このような目的のために有用な多数のサイトカインは当業者に既知であり、その例としては、ワクチンの防御作用を強化することが示されているインターフェロン、インターロイキン−12(IL−12)、GM−CSF、IL−18およびFlt3リガンドが挙げられる。投与される場合、本発明の治療用組成物は、製薬上許容可能な調製物中で投与される。このような調製物は、製薬上許容可能な濃度の塩、緩衝剤、防腐剤、相溶性担体、補助免疫増強剤、例えばアジュバントおよびサイトカイン、ならびに任意にその他の療法的作用物質をルーチンに含有し得る。
【0027】
下記実施例において具体的に記載されるように、本発明で用いられる上記ペプチドと、抗原提示細胞をインビトロで接触させることにより、該ペプチドを抗原提示細胞に提示させることができる。すなわち、本発明の免疫誘導剤は、抗原提示細胞の処理剤として用いることができる。ここで、抗原提示細胞としては、HLAクラスI分子を保有する樹状細胞又はB細胞を好ましく用いることができる。種々のHLAクラスI分子が同定されており、周知である。HLAクラスI分子としては、HLA-A、HLA-B、HLA-Cを挙げることができ、より具体的には、HLA-A1, HLA-A0201, HLA-A0204, HLA-A0205, HLA-A0206, HLA-A0207, HLA-A11, HLA-A24, HLA-A31, HLA-A6801, HLA-B7, HLA-B8, HLA-B2705, HLA-B37, HLA-Cw0401, HLA-Cw0602などを挙げることができる。
【0028】
HLAクラスI分子を保有する樹状細胞又はB細胞は、周知の方法により末梢血から調製することができる。例えば、骨髄、臍帯血あるいは患者末梢血から、顆粒球マクロファージコロニー刺激因子(GM-CSF)とIL-3(あるいはIL-4)を用いて樹状細胞を誘導し、その培養系に腫瘍関連ペプチドを加えることにより、腫瘍特異的な樹状細胞を誘導することができる。この樹状細胞を有効量投与することで、癌の治療に望ましい応答を誘導できる。用いる細胞は、健康人から提供された骨髄や臍帯血、患者本人の骨髄や末梢血等を用いることができるが、患者本来の自家細胞を使う場合は、安全性が高く、重篤な副作用を回避することも期待できる。末梢血または骨髄は新鮮試料、低温保存試料及び凍結保存試料のいずれでもよい。末梢血は、全血を培養してもよいし、白血球成分だけを分離して培養してもよいが、後者の方が効率的で好ましい。さらに白血球成分の中でも単核球を分離してもよい。また、骨髄や臍帯血を起源とする場合には、骨髄を構成する細胞全体を培養してもよいし、これから単核球を分離して培養してもよい。末梢血やその白血球成分、骨髄細胞には、樹状細胞の起源となる単核球、造血幹細胞又は未成熟樹状細胞やCD4陽性細胞等が含まれている。用いられるサイトカインは、安全性と生理活性が確認された特性のものであれば、天然型、あるいは遺伝子組み換え型等、その生産手法については問わないが、好ましくは医療用に用いられる品質が確保された標品が必要最低量で用いられる。添加するサイトカインの濃度は、樹状細胞が誘導される濃度であれば特に限定されず、通常サイトカインの合計濃度で10〜1000ng/mL程度が好ましく、さらに好ましくは20〜500ng/mL程度である。培養は、白血球の培養に通常用いられている周知の培地を用いて行うことができる。培養温度は白血球の増殖が可能であれば特に限定されないが、ヒトの体温である37℃程度が最も好ましい。また、培養中の気体環境は白血球の増殖が可能であれば特に限定されないが、5%CO2を通気することが好ましい。さらに培養期間は、必要数の細胞が誘導される期間であれば特に限定されないが、通常3日〜2週間の間で行われる。細胞の分離や培養に供される機器は、適宜適当なものを用いることができるが、医療用に安全性が確認され、かつ操作が安定して簡便であることが好ましい。特に細胞培養装置については、シャーレ、フラスコ、ボトル等の一般的容器に拘わらず、積層型容器や多段式容器、ローラーボトル、スピナー式ボトル、バッグ式培養器、中空糸カラム等も用いることができる。
【0029】
本発明で用いられる上記ペプチドと抗原提示細胞をインビトロで接触させる方法自体は周知の方法により行なうことができ、下記実施例にも具体的に記載されている。すなわち、抗原提示細胞を、上記ペプチドを含む培養液中で培養することにより行なうことができる。培地中のペプチド濃度は、特に限定されないが、通常、1μg/mlないし100μg/ml程度、好ましくは5μg/mlないし20μg/ml程度である。培養時の細胞密度は特に限定されないが、通常、103細胞/mlから107細胞/ml程度、好ましくは5x104細胞/mlから5x106細胞/ml程度である。培養は、常法に従い、37℃、5%CO2雰囲気中で行なうことが好ましい。なお、抗原提示細胞が表面上に提示できるペプチドの長さは、通常、最大で30アミノ酸残基程度である。従って、特に限定されないが、抗原提示細胞とペプチドをインビトロで接触させる場合、該ペプチドをおよそ30アミノ酸残基以下の長さに調製してもよい。
【0030】
上記したペプチドの共存下において抗原提示細胞を培養することにより、ペプチドが抗原提示細胞のHLA分子に取り込まれ、抗原提示細胞の表面に提示される。本発明は、このような、上記ペプチドとHLA分子の複合体を含む、単離抗原提示細胞をも提供する。このような抗原提示細胞は、生体内又はインビトロにおいて、T細胞に対して該ペプチドを提示し、該ペプチドに特異的な細胞障害性T細胞を誘導し、増殖させる。
【0031】
上記のようにして調製される、上記ペプチドとHLA分子の複合体とを含む抗原提示細胞を、T細胞とインビトロで接触させることにより、該ペプチドに特異的な細胞障害性T細胞を誘導し、増殖させることができる。これは、上記抗原提示細胞とT細胞とを液体培地中で共存培養することにより行なうことができる。例えば、抗原提示細胞を液体培地に懸濁して、マイクロプレートのウェル等の容器に入れ、これにT細胞を添加して培養することにより行なうことができる。共存培養時の抗原提示細胞とT細胞の混合比率は、特に限定されないが、通常、細胞数の比率で1:1〜1:100程度、好ましくは1:5〜1:20程度である。また、液体培地中に懸濁する抗原提示細胞の密度は、特に限定されないが、通常、100〜1000万細胞/ml程度、好ましくは10000〜100万細胞/ml程度である。共存培養は、常法に従い、37℃、5%CO2雰囲気中で行なうことが好ましい。培養時間は、特に限定されないが、通常、2日〜3週間、好ましくは4日〜2週間程度である。また、共存培養は、IL-2、IL-6、IL-7及びIL-12のようなインターロイキンの1種又は複数の存在下で行なうことが好ましい。この場合、IL-2及びIL-7の濃度は、通常、5U/mlから20U/ml程度、IL-6の濃度は通常、500U/mlから2000U/ml程度、IL-12の濃度は通常、5ng/mlから20ng/ml程度であるが、これらに限定されるものではない。上記の共存培養は、新鮮な抗原提示細胞を追加して1回ないし数回繰り返してもよい。例えば、共存培養後の培養上清を捨て、新鮮な抗原提示細胞の懸濁液を添加してさらに共存培養を行なうという操作を、1回ないし数回繰り返してもよい。各共存培養の条件は、上記と同様でよい。なお、本明細書において、上記のように、ペプチドを抗原提示細胞の表面に提示させるためにペプチドを抗原提示細胞の培養液に加えることを、「ペプチドで細胞をパルスする」と呼ぶことがある。また、上記ペプチドを提示する抗原提示細胞とT細胞を接触させることを、「ペプチドでT細胞を刺激する」と呼ぶことがある。
【0032】
上記の共存培養により、該ペプチドに特異的な細胞障害性T細胞が誘導され、増殖される。本発明は、このような、上記ペプチドとHLA分子の複合体を選択的に結合する、単離T細胞をも提供する。
【0033】
上記ペプチドを提示する上記抗原提示細胞は、生体内においても該ペプチドに特異的な細胞障害性T細胞を誘導し、増殖させることができるので、これを生体に投与することにより癌の治療及び/又は予防を行なうことができる。また、上記ペプチドとHLA分子の複合体を選択的に結合する、T細胞は、CALM2を発現する癌細胞に対して細胞障害活性を示すので、該T細胞を生体に投与することによっても癌の治療及び/又は予防を行なうことができる。従って、本発明は、上記本発明の抗原提示細胞を有効成分として含有する医薬、並びに癌の治療及び/又は予防剤、並びに上記本発明のT細胞を有効成分として含有する医薬、並びに癌の治療及び/又は予防剤をも提供する。治療対象となる癌の例としては、当然ながら、上記ペプチドを有効成分として含有する癌の治療及び/又は予防剤の対象として上記した癌を挙げることができる。
【0034】
生体に投与する抗原提示細胞又はT細胞は、これらの細胞を異物として攻撃する生体内での免疫応答を回避するために、治療を受ける患者から採取した抗原提示細胞又はT細胞を、上記のように本発明で用いられる上記ペプチドを用いて調製したものであることが好ましい。
【0035】
抗原提示細胞又はT細胞を有効成分として含む癌の治療及び/又は予防剤の投与経路は、静脈内投与や動脈内投与のような非経口投与が好ましい。また、投与量は、症状や投与目的等に応じて適宜選択されるが、通常1個〜10兆個、好ましくは100万個〜10億個であり、これを数日ないし数月に1回投与するのが好ましい。製剤は、例えば、細胞を生理緩衝食塩水に懸濁したもの等であってよく、他の抗癌剤やサイトカイン等と併用することもできる。また、製剤分野において周知の1又は2以上の添加剤を添加することもできる。
【0036】
本発明が開示する、癌の治療及び/又は予防に用いることができるCALM2タンパクのアミノ酸配列自体は、配列番号2に示すとおり公知であり、CALM2遺伝子のコード領域の塩基配列も配列番号1に示すとおり公知である。従って、CALM2タンパクをコードするポリヌクレオチドを含み、哺乳動物細胞中で該ポリヌクレオチドを発現することができる組換えベクターを調製することができ、該組換えベクターを癌の治療及び/又は予防のための遺伝子ワクチンとして利用することができる。
【0037】
ベクターに挿入するポリヌクレオチドとしては、配列番号1に示される塩基配列を有するポリヌクレオチドであってもよく、また、上記した免疫誘導性断片をコードする領域の塩基配列を有するものであってもよい。あるいは、その保存的置換塩基配列(コードするアミノ酸配列が同じで塩基配列が異なるもの)を用いることができる。なお、各アミノ酸をコードするコドンは公知であるから、特定のアミノ酸配列をコードするポリヌクレオチドの塩基配列は容易に特定することができる。従って、上記した免疫誘導性修飾ペプチド及び免疫誘導性付加ペプチドをコードするポリヌクレオチドの塩基配列も容易に特定することができる。これらのポリヌクレオチドは、市販の核酸合成機を用いて常法により合成することができる。これらのポリヌクレオチドをベクターに挿入してもよい。また、ポリヌクレオチドはDNAでもRNAでもよい。
【0038】
哺乳動物細胞に遺伝子導入するためのベクターとしては、プラスミドベクターでもウイルスベクターでもよく、これら自体は周知であり、種々のものが市販されているので、市販のベクターを利用することができる。市販のベクターのマルチクローニング部位に上記したポリヌクレオチドを挿入することにより、前記組換えベクターを得ることができる。
【0039】
遺伝子ワクチンの投与経路は、好ましくは筋肉内投与、皮下投与、静脈内投与、動脈内投与等の非経口投与経路であり、投与量は、抗原の種類等に応じて適宜選択することができるが、通常、体重1kg当たり、遺伝子ワクチンの重量で0.1μg〜100mg程度、好ましくは1μg〜10mg程度である。
【0040】
ウイルスベクターによる方法としては、例えばレトロウイルス、アデノウイルス、アデノ関連ウイルス、ヘルペスウイルス、ワクシニアウイルス、ポックスウイルス、ポリオウイルス、シンドビスウイルス等のRNA ウイルスまたはDNA ウイルスに本発明のDNA を組み込んで導入する方法が挙げられる。この中で、レトロウイルス、アデノウイルス、アデノ関連ウイルス、ワクシニアウイルス等を用いた方法が特に好ましい。
【0041】
その他の方法としては、発現プラスミドを直接筋肉内に投与する方法(DNAワクチン法)、リポソーム法、リポフェクチン法、マイクロインジェクション法、リン酸カルシウム法、エレクトロポレーション法等が挙げられ、特にDNAワクチン法、リポソーム法が好ましい。
【0042】
本発明で用いられる上記ペプチドをコードする遺伝子を実際に医薬として作用させるには、遺伝子を直接体内に導入するin vivo方法、およびヒトからある種の細胞を採取し体外で遺伝子を該細胞に導入しその細胞を体内に戻すex vivo方法がある(日経サイエンス,1994年4月,p20−45、月刊薬事,1994年,第36巻,第1号,p.23−48、実験医学増刊,1994年,第12巻,第15号、およびこれらの引用文献等)。in vivo方法がより好ましい。
【0043】
in vivo方法により投与する場合は、治療目的の疾患、症状等に応じた適当な投与経路により投与され得る。例えば、静脈、動脈、皮下、筋肉内などに投与することが出来る。in vivo方法により投与する場合は、例えば、液剤等の製剤形態をとりうるが、一般的には、有効成分である本発明で用いられる上記ペプチドをコードするDNAを含有する注射剤等とされ、必要に応じて、慣用の担体を加えてもよい。また、該DNAを含有するリポソームまたは膜融合リポソーム(センダイウイルス(HVJ)−リポソーム等)においては、懸濁剤、凍結剤、遠心分離濃縮凍結剤等のリポソーム製剤の形態とすることができる。
【0044】
一方、大腸菌や酵母菌などの微生物用のベクターも周知であり、種々のものが市販されている。微生物用のベクターに上記ポリヌクレオチドを組み込んだ組換えベクターは、本発明で用いられる上記ペプチドを遺伝子工学的に大量生産するために用いることができる。微生物への組換えベクターの組み込みは周知の方法により行なうことができる。
【0045】
下記実施例1に記載される通り、カルモジュリン2遺伝子(そのコード領域の塩基配列を配列番号1に示す)は、癌組織において正常組織よりも有意に高発現している。従って、癌の疑いのある患者から得た試料における、該カルモジュリン2遺伝子の発現量を、健常者から得た試料における発現量と比較することにより、該患者が癌であるか否かを調べることができる。発現量の比較は、例えば以下のようにして行うことができる。先ず、癌を罹患していることが分かっている複数の患者と、複数の健常者とから試料を得て、カルモジュリン2遺伝子の発現量を調べ、癌患者集団と健常者集団それぞれについてカルモジュリン2遺伝子発現量の基準値を定める。そして、癌であるか否かを診断すべき患者から試料を得て、該試料中のカルモジュリン2遺伝子発現量を調べ、前記基準値と比較する。発現量が健常者基準値よりも有意に高く、癌患者基準値に近ければ、その患者は癌である可能性が高いと考えられる。健常者基準値との比較のみでも癌の検出は可能であるが、癌患者基準値とも比較することにより、さらに検出精度を高めることができる。なお、前記基準値は、例えば、各試料における発現量を数値化し、その平均値を算出することによって定めることができる。なお、遺伝子の発現量は、該遺伝子から生産されるmRNA又はタンパク質の量を測定することにより調べることができる。試料としては、例えばヒト由来の体組織等を用いることができる。mRNA又はタンパク質の量は常法により測定することができる。例えば、カルモジュリン2のmRNAは、該mRNAを鋳型とするリアルタイム検出RT-PCRのような常法により定量することができ、常法であるノーザンブロットにおける染色強度等によっても概ね定量することができる。また、タンパク質の量は、常法である免疫測定により定量することができる。
【0046】
カルモジュリン2タンパクと抗原抗体反応する抗体又はその抗原結合性断片を作製し、これを用いて免疫測定を行うことにより、試料中のカルモジュリン2タンパクの検出又は定量を行うことができる。癌組織中では正常組織よりも有意にカルモジュリン2遺伝子の発現量が高いので、該遺伝子にコードされるカルモジュリン2タンパクの蓄積量も有意に高いと考えられる。従って、そのような抗体又はその抗原結合性断片を用いることによっても、上記の通り癌の検出を行うことができる。すなわち、本発明は、カルモジュリン2タンパクと抗原抗体反応する抗体又はその抗原結合性断片を含む癌の診断剤をも提供する。本発明の癌の診断剤を用いた癌の検出は、上記したカルモジュリン2遺伝子の発現量を指標とする癌の検出方法と同様に、癌の疑いのある患者由来の試料と健常者由来の試料との間でのタンパク質蓄積量の比較に基づいて行うことができる。
【0047】
ここで、抗原結合性断片とは、抗体分子中に含まれるFab断片やF(ab')2断片のような、抗原との結合能を有する抗体断片を意味する。抗体はポリクローナル抗体でもモノクローナル抗体でもよいが、免疫測定等のためには、再現性の高いモノクローナル抗体が好ましい。ペプチドを免疫原とするポリクローナル抗体及びモノクローナル抗体の調製方法は周知であり、常法により容易に行なうことができる。例えば、ペプチドをキーホールリンペットヘモシアニン(KLH)やカゼイン等のキャリアタンパク質に結合させたものを免疫原とし、アジュバントと共に動物に免疫することにより該ペプチドに対する抗体を誘起することができる。免疫した動物から採取した脾細胞やリンパ球のような抗体産生細胞をミエローマ細胞と融合させてハイブリドーマを調製し、本発明のペプチドと結合する抗体を産生するハイブリドーマを選択し、これを増殖させて培養上清から本発明のペプチドを対応抗原とするモノクローナル抗体を得ることができる。なお、上記の方法は周知の常法である。
【0048】
免疫測定自体はこの分野において周知であり、反応様式で分類すると、サンドイッチ法、競合法、凝集法、ウェスタンブロット法等があり、フローサイトメトリーも免疫測定の1種と考えることができる。また、標識で分類すると、放射免疫測定、蛍光免疫測定、酵素免疫測定、ビオチン免疫測定等があり、上記抗体又はその抗原結合性断片はこれらのいずれにも用いることができる。癌の診断剤として用いる場合は、操作が簡便で大掛かりな装置等を必要としないサンドイッチELISAや凝集法を適用することが好ましい。なお、本発明で用いられる上記ペプチドは、該ペプチドを発現する細胞を競合法で検出又は測定する場合の免疫測定用試薬として用いることもできる。
【0049】
以下、本発明を実施例に基づきより具体的に説明する。
【実施例】
【0050】
実施例1:癌組織のDNAマイクロアレイ解析
(1)実験者の臨床病理学的所見
インフォームドコンセントを得た119名の食道ガン患者から、食道ガン摘出手術時又は食道生検実施時に食道の摘出組織を得た。摘出された組織片について肉眼的及び/又は病理組織学的に食道ガン組織を判断し、食道ガン病変部と正常組織部を分けてただちに凍結し、液体窒素中で保存した。
【0051】
(2)全RNA抽出とcDNAの調製
試料として食道ガン患者の食道組織における食道ガン病変部の組織、及び同一食道組織における非ガン組織(正常組織)を用いた。おのおのの組織から、Trizol reagent(Invitrogen社)を用いて、同社推奨のプロトコールにより全RNAを調製した。
【0052】
上述の方法で得られた全RNA 1μgについて、oligo(dT)プライマー及びランダムノナマーを併用し、CyScribe First-Strand CDNA Labeling Kit(GEヘルスケア社)を用いてメーカー推奨のプロトコールで逆転写反応を行った。正常組織由来又は食道ガン組織由来の全RNAにはCy3-dUTP(GEヘルスケア社)を、リファレンス全RNA(Stratagene社)にはCy5-dUTP(GEヘルスケア社)を添加して、メーカー推奨のプロトコールで逆転写反応時にcDNAの標識を行った。標識されたcDNAはQIA quick PCR purification Kit(QIAGEN社)で精製してからハイブリダイズに用いた。
【0053】
(3)オリゴDNAマイクロアレイの作製
オリゴDNAマイクロアレイとしてはAffymetrix社GeneChip(登録商標)(Human Genome U133 A)及び本明細書中で述べる方法に従って作製したDNAチップを使用した。
【0054】
DNAチップの作製方法を以下に示す。最初に搭載するオリゴDNAの種類を決定するために、Affymetrix社GeneChip(登録商標)を用いて遺伝子の絞込みを行った。GeneChip(登録商標)の操作については、Complete GeneChip(登録商標) Instrument System及び添付の指示書に基づいて実施した。Complete GeneChip(登録商標)を用いた解析の結果、食道ガンによって発現変動が起こる可能性がある遺伝子及び実験対照となりうる遺伝子を計8961種抽出した。
【0055】
抽出した8961種の遺伝子について、配列の重複をおこさないように配列特異性が高い部位の配列60−70merをそれぞれ選択して合成した。4倍に希釈したSolution I(タカラバイオ社)に30μMとなるように溶解した、8961種の60又は70merからなる合成オリゴDNAを、MATSUNAMI DNAマイクロアレイ用コートグラスDMSO対応TypeIアミノ修飾オリゴDNA固定コート(松浪硝子工業株式会社)上にスポッター(GMS417arrayer,Affymetrix社)を用いて湿度環境50−60%でスポットした。
【0056】
(4)ハイブリダイゼーション
標識したcDNA 1μgをアンチセンスオリゴカクテル(QIAGEN)に溶解し、Gapカバーグラス(松浪硝子工業)を載せたDNAチップにアプライし、42℃で16時間ハイブリダイズを行った。ハイブリダイズ終了後、DNAチップを2xSSC/0.1%SDS、1xSSC、0.2xSSCで順次洗浄した。
【0057】
(5)遺伝子発現量の測定
上述の方法によりハイブリダイゼーションを行ったDNAチップをAgilentマイクロアレイスキャナー(Agilent社)を用いてスキャンし、画像を取得して蛍光強度を数値化した。統計学的処理はSpeed T.著「Statistical analysis of gene expression microarray data」Chapman & Hall/CRC,及びCauston H.C.ら著「A beginner's guide Microarray gene expression data analysis」Blackwell publishingを参考にして行った。すなわちハイブリダイズ後の画像解析から得られたデータについて、それぞれの対数値をとり、global normalizationとLOWESS(locally weighted scatterplot smoother)による平滑化を行い、MADによるスケーリング処理によってノーマライゼーション補正を行った。その結果、食道ガン病変部における発現量が、非ガン組織部よりも多い遺伝子として、CALM2を見出すことができた。
【0058】
実施例2:CALM2由来ペプチドエピトープ反応性CD8陽性T細胞の誘導
(1)ヒトCALM2タンパク質のアミノ酸配列の情報をGenBankから得た。HLA-A0201結合モチーフ予測のため、公知のBIMASソフト(http://bimas.dcrt.nih.gov/molbio/hla_bind/で利用可能)を用いたコンピューター予測プログラムを用いてヒトCALM2タンパク質のアミノ酸配列を解析し、HLAクラスI分子に結合可能と予想されるペプチド24種類を選択した。
【0059】
(2)HLA-A0201陽性の健常人から末梢血を分離し、Lymphocyte separation medium(OrganonpTeknika, Durham, NC)に重層して1,500rpmで室温で20分間遠心分離した。PBMCを含有する画分を回収し、冷リン酸塩緩衝液中で3回(またはそれ以上)洗浄し、末梢血単核球(PBMC)を得た。得られたPBMCをAIM−V培地(Life Technololgies, Inc., 米国ニューヨーク州Grand Island)20mlに懸濁し、培養フラスコ(Falcon)中に37℃、5%CO2の条件下で2時間付着させた。非付着細胞はT細胞調製に用い、付着細胞は樹状細胞を調製するために用いた。
【0060】
一方、付着細胞をAIM−V培地中でIL−4(1000U/ml)およびGM−CSF(1000U/ml)の存在下で培養した。6日後にIL−4(1000U/ml)、GM−CSF(1000U/ml)、IL−6(1000U/ml、Genzyme, Cambridge, MA)、IL−1β(10ng/ml、Genzyme, Cambridge, MA)およびTNF−α(10ng/ml、Genzyme, Cambridge, MA)を添加したAIM−V培地に交換してさらに2日間培養した後得られた非付着細胞集団を樹状細胞として用いた。
【0061】
(3)調製した樹状細胞をAIM−V培地中に1×106細胞/mlの細胞密度で懸濁し、選択したペプチドを10μg/mlの濃度で添加し、96穴プレートを用いて37℃、5%CO2の条件下で4時間培養した。培養後、X線照射(3000rad)し、AIM−V培地で洗浄し、10%ヒトAB血清(Nabi, Miami, FL)、IL−6(1000U/ml)およびIL−12(10ng/ml、Genzyme, Cambridge, MA)を含有するAIM−V培地で懸濁し、24穴プレート1穴当りにそれぞれ1×105細胞づつ添加した。さらに調製したT細胞集団を1穴当りそれぞれ1×106細胞添加し、37℃、5%CO2の条件下で培養した。7日後、それぞれの培養上清を捨て、上記と同様にして得た各ペプチドで処理後X線照射した樹状細胞を10%ヒトAB血清(Nabi, Miami, FL)、IL−7(10U/ml、Genzyme, Cambridge, MA)およびIL−2(10U/ml、Genzyme, Cambridge, MA)を含有するAIM−V培地で懸濁し(細胞密度:1×105細胞/ml)、24穴プレート1穴当りにそれぞれ1×105細胞づつ添加し、さらに培養した。同様の操作を7日間おきに4〜6回繰返した後刺激されたT細胞を回収し,フローサイトメトリーによりCD8陽性T細胞の誘導を確認した。
【0062】
実施例3:HLA-A0201陽性CD8陽性T細胞を刺激するCALM2由来細胞障害性T細胞抗原エピトープの決定
(1)上記で誘導した各穴のT細胞の内、配列番号3、5、6又は7に示すアミノ酸配列を有するペプチドで刺激されたT細胞が増殖していることが顕微鏡下における細胞数計測により確認された。増殖が見られたT細胞それぞれについて、パルスに用いた各ペプチドに対する特異性を調べるために、ペプチドでパルスされた、HLA-A0201分子を発現するT2細胞(Salter RD et al.,Immunogenetics, 21:235-246(1985)、ATCCより購入)(10μg/mlの濃度でAIM−V培地中各ペプチドを添加し、37℃、5%CO2の条件下で4時間培養)5×104個に対して、5×103個のT細胞を添加し、10%ヒトAB血清を含むAIM−V培地中で96穴プレートにて24時間培養した。培養後の上清を取って、IFN−γの産生量をELISA法により測定した。その結果、ペプチドをパルスしていないT2細胞を用いた穴の培養上清に比べて、配列番号3、5、6又は7のペプチドをパルスしたT2細胞を用いた穴の培養上清において、IFN−γ産生が確認された(図1)。中でも、配列番号3のペプチドでパルスした場合におけるIFN−γ産生量が顕著に高かった。従って、配列番号3、5、6及び7のペプチドは特異的にHLA-A0201陽性CD8陽性T細胞を増殖刺激させ、IFN−γ産生を誘導する能力を有するT細胞エピトープペプチドであることが判明した。
【0063】
なお、図1中、縦軸の参照番号1は、配列番号3で示されるアミノ酸配列を有するペプチドについての結果を示す。参照番号7、8及び9はそれぞれ配列番号5、6及び7のペプチドについての結果を示す。参照番号2はCALM2由来ペプチドの1つであるが本発明の範囲外のペプチドAELRHVMTNL(配列番号4)についての結果を示す(比較例1)。参照番号3はペプチドを添加せずに上記処理を行なった場合についての結果を示す(比較例2)。
【0064】
(2)次に、本発明で用いられるペプチドの1つである配列番号3のペプチドが、HLA-A0201陽性でCALM2を発現する腫瘍細胞上のHLA-A0201分子上に提示されるものであるか、また本ペプチドで刺激されたCD8陽性T細胞がHLA-A0201陽性でCALM2を発現する腫瘍細胞を障害することができるかを検討した。CALM2の発現が確認されている悪性脳腫瘍細胞株、T98G(Stein GH et al.,J. Cell Physiol., 99:43-54(1979)、ATCCより購入)を105個50ml容の遠心チューブに集め、100μCiのクロミウム51を加え37℃で2時間インキュベートした。その後10%ヒトAB血清を含むAIM−V培地で3回洗浄し、96穴V底プレート1穴あたり103個づつ添加し、さらにこれに後10%ヒトAB血清を含むAIM−V培地で懸濁された105、5x104、2.5x104および1.25x104個の配列番号3のペプチドで刺激されたHLA-A0201陽性のCD8陽性T細胞をそれぞれ添加して、37℃、5%CO2の条件下で4時間培養した。培養後、障害を受けた腫瘍細胞から放出される培養上清中のクロミウム51の量を測定することによって、配列番号3のペプチドで刺激されたCD8陽性T細胞細胞の細胞障害活性を算出した。その結果、本ペプチドで刺激されたHLA-A0201陽性のCD8陽性T細胞がT98Gに対する細胞障害活性を有することが判明した(図2)。従って、本発明で用いられるペプチドの1つである配列番号3のペプチドは、HLA-A0201陽性でCALM2を発現する腫瘍細胞上のHLA-A0201分子上に提示されるものであり、さらに本ペプチドは、このような腫瘍細胞を障害することができるCD8陽性細胞障害性T細胞を誘導する能力があることが明らかになった。
【0065】
同様にして、配列番号5,6及び7のペプチドで刺激されたHLA-A0201陽性のCD8陽性T細胞は、T98Gに対して細胞障害活性を示した(図4)。なお、図4中、横軸の参照番号13、14および15は、それぞれ配列番号5,6および7のペプチドについての結果を示す。さらに、横軸の参照番号16はCALM2由来ペプチドの1つであるが本発明の範囲外のペプチドである配列番号4のペプチドについての結果(比較例5)、横軸の参照番号17はペプチドを添加せずに上記処理を行なった場合についての結果を示す(比較例6)。
【0066】
さらに、配列番号3,5,6及び7のペプチドで刺激されたHLA-A0201陽性のCD8陽性T細胞は、CALM2の発現が確認されている別の悪性脳腫瘍細胞株、U87 MG(Beckman G et al.,Hum.Hered., 21:238-241(1971)、ATCCより購入)に対して細胞障害活性を示した(図3)。
【0067】
なお、細胞障害活性は、上記のように、本発明で用いられる各ペプチドで刺激誘導されたCD8陽性T細胞105個とクロミウム51を取り込ませた103個の悪性脳腫瘍細胞株T98GおよびU87 MGとを混合して4時間培養し、培養後培地に放出されたクロミウム51の量を測定して、以下計算式*により算出したCD8陽性T細胞のT98GおよびU87 MGに対する細胞障害活性を示した結果である。*式:細胞障害活性(%)=CD8陽性T細胞を加えた際のT98GおよびU87 MGからのクロミウム51遊離量÷1N塩酸を加えた標的細胞からのクロミウム51遊離量×100
【0068】
なお、図3中、横軸の参照番号4、10,11および12は、それぞれ配列番号3、5,6および7のペプチドについての結果を示す。さらに、横軸の参照番号5はCALM2由来ペプチドの1つであるが本発明の範囲外のペプチドである配列番号4のペプチドについての結果(比較例3)、横軸の参照番号6はペプチドを添加せずに上記処理を行なった場合についての結果を示す(比較例4)。
【産業上の利用可能性】
【0069】
本発明で用いられるペプチドは、免疫誘導剤、特に癌の治療及び/又は予防剤の有効成分として有用であり、また、癌の治療及び/又は予防剤として利用できる抗原提示細胞やT細胞の誘導に有用である。
【技術分野】
【0001】
本発明は、ヒトの癌に特異的なタンパク質又はその部分ペプチドを含む免疫誘導剤に関する。さらに本発明は、上記ペプチドによって刺激され誘導された活性化T細胞、該ペプチドとHLA分子の複合体を含む抗原提示細胞、上記活性化T細胞又は上記抗原提示細胞を有効成分として含む医薬、前記タンパク質の遺伝子発現量を指標とした癌の検出方法、及び該タンパク質に対する抗体を含む癌の診断剤に関する。
【背景技術】
【0002】
癌は全死亡原因の第一位を占める疾患であり、現在行われている治療は手術療法を主体に放射線療法と化学療法を組み合わせたものである。近年の新しい手術法の開発や新たな抗癌剤の発見にも関わらず、一部の癌を除いて、癌の治療成績はあまり向上していないのが現状である。
【0003】
近年、分子生物学や癌免疫学の進歩で癌に反応する細胞障害性T細胞により認識される癌抗原や癌抗原をコードする遺伝子が同定されてき、抗原特異性免疫療法への期待が高まっている(非特許文献1を参照)。1991年、ベルギーLudwig研究所のBoonらは自己癌細胞株と癌反応性T細胞を用いたcDNA発現クローニング法によりCD8陽性T細胞が認識するヒトメラノーマ抗原MAGE1を単離した(非特許文献2を参照)。Boonの報告後CD8陽性T細胞の認識する抗原としてtyrosinase(非特許文献3を参照)、MART1/MelanA(非特許文献4を参照)、gp100(非特許文献5を参照)などの単離が行われた。
【0004】
免疫療法においては、副作用を軽減するため、その抗原として認識されるタンパク質は、正常細胞には少なく、癌細胞に過剰に存在していることが望ましい。
【先行技術文献】
【非特許文献】
【0005】
【非特許文献1】秋吉毅,「癌と化学療法」、1997年、第24巻、p551−519
【非特許文献2】Bruggen P. et al., Science, 254:1643-1647(1991)
【非特許文献3】Robbins P.F. et al., Cancer Res., 54:3124-3126(1994)
【非特許文献4】Kawakami Y. et al., Proc. Natl. Acad. Sci. USA, 91(9):3515-3519(1994)
【非特許文献5】Kawakami Y. et al., Proc. Natl. Acad. Sci. USA, 91:6458-6462(1994)
【発明の概要】
【発明が解決しようとする課題】
【0006】
本発明の目的は、癌の治療及び/又は予防剤として有用なペプチドを見出し、該ペプチドの免疫誘導剤としての用途を提供することである。また、本発明の目的は、該ペプチドとHLA分子の複合体を含む、単離抗原提示細胞、及びペプチドとHLA分子の複合体を選択的に結合する単離T細胞並びにそれらの癌の治療及び/又は予防剤の用途を提供することである。さらに、本発明の目的は、前記ペプチドの発現量を指標とした癌の検出方法を提供することである。さらに、本発明の目的は、前記ペプチドに対する抗体又はその抗原結合性断片の、癌の診断剤としての用途を提供することである。
【課題を解決するための手段】
【0007】
本願発明者らは、鋭意研究の結果、カルモジュリン2(以下CALM2と略記することがある)がヒトの腫瘍組織において、正常組織と比較して有意に高発現していることを見出した(実施例1を参照)。そして、配列番号2で示されるアミノ酸配列を有する上記CALM2タンパク中の部分ペプチドが、抗原提示細胞により提示されて、該ペプチドに特異的な細胞障害性T細胞を活性化及び増殖させる能力(免疫誘導活性)を有すること、このため、該ペプチドが癌の治療及び/又は予防に有用であり、また、該ペプチドと接触した抗原提示細胞や、該抗原提示細胞と接触したT細胞が癌の治療及び/又は予防に有用であることを見出し、本発明を完成した。
【0008】
すなわち、本発明は、配列番号2で表されるアミノ酸配列を有するカルモジュリン2タンパク若しくは免疫誘導活性を有し、連続する7個以上のアミノ酸から成るその断片、又は前記カルモジュリン2タンパク若しくはその前記断片と80%以上の相同性を有し、免疫誘導活性を有するペプチド、又は前記カルモジュリン2タンパク、その前記断片若しくは前記ペプチドを部分配列として含み、免疫誘導活性を有するペプチドを有効成分として含有する免疫誘導剤を提供する。また、本発明は、上記ペプチドとHLA分子の複合体を含む、単離抗原提示細胞を提供する。さらに、本発明は、上記ペプチドとHLA分子の複合体を選択的に結合する、単離T細胞を提供する。さらに、本発明は、上記本発明の単離抗原提示細胞又は上記本発明の単離T細胞を有効成分として含有する医薬を提供する。さらに、本発明は、上記本発明の単離抗原提示細胞又は上記本発明の単離T細胞を有効成分として含有する癌の治療及び/又は予防剤を提供する。さらに、本発明は、癌であるか否かを検出すべき患者から得た試料における、配列番号1に示す塩基配列を有するコード領域を有するカルモジュリン2遺伝子の発現を調べ、健常者由来の試料中の該遺伝子の発現量と比較することを含む、癌の検出方法を提供する。さらに、本発明は、配列番号2で表されるアミノ酸配列を有するカルモジュリン2タンパクと抗原抗体反応する抗体又はその抗原結合性断片を含む癌の診断剤を提供する。
【発明の効果】
【0009】
本発明により、癌の治療及び/又は予防や、そのための抗原提示細胞やT細胞の誘導に有用なペプチドが新規に同定され、医学分野における該ペプチドの各種用途が提供された。下記実施例において具体的に示されるように、前記ペプチドにより活性化されたCD8陽性T細胞は、CALM2を発現する癌細胞に対して優れた細胞障害活性を示す。従って、本発明で用いられるペプチドは、これをヒトに投与することにより、又はこれを用いてインビトロで活性化T細胞をヒトに投与することにより、癌の治療及び/又は予防に有効である。
【図面の簡単な説明】
【0010】
【図1】ペプチド特異的CD8陽性T細胞が該ペプチドとHLA−A0201との複合体を認識してIFN−γを産生することを示す図である。参照番号1;配列番号3のペプチドについての結果、参照番号7;配列番号5のペプチドについての結果、参照番号8;配列番号6のペプチドについての結果、参照番号9;配列番号7のペプチドについての結果、参照番号2;配列番号4のペプチドについての結果、参照番号3;ペプチドを添加せずに処理を行なった場合についての結果である。
【図2】ペプチド特異的CD8陽性T細胞の癌細胞に対する障害活性を示した図である。
【図3】ペプチド特異的CD8陽性T細胞の癌細胞に対する障害活性を示した図である。参照番号4;配列番号3のペプチドについての結果、参照番号10;配列番号5のペプチドについての結果、参照番号11;配列番号6のペプチドについての結果、参照番号12;配列番号7のペプチドについての結果、参照番号5;配列番号4のペプチドについての結果、参照番号6;ペプチドを添加せずに処理を行なった場合についての結果である。
【図4】ペプチド特異的CD8陽性T細胞の癌細胞に対する障害活性を示した図である。参照番号13;配列番号5のペプチドについての結果、参照番号14;配列番号6のペプチドについての結果、参照番号15;配列番号7のペプチドについての結果、参照番号16;配列番号4のペプチドについての結果、参照番号17;ペプチドを添加せずに処理を行なった場合についての結果である。
【発明を実施するための形態】
【0011】
本発明の免疫誘導剤に有効成分として含まれるペプチドとしては、以下のものが挙げられる。なお、「ペプチド」とは、複数のアミノ酸がペプチド結合することによって形成される分子をいい、構成するアミノ酸数が少ない低分子量の分子(オリゴペプチド)のみならず、アミノ酸数が多いポリペプチドやタンパク質も包含され、本発明ではカルモジュリン2の全長タンパク質も包含される。
(a) 配列番号2で表されるアミノ酸配列を有するカルモジュリン2タンパク(以下CALM2タンパクと略記することがある)。
(b) (a)の断片であって、連続する7個以上のアミノ酸配列からなり、免疫誘導活性を有する断片(以下、便宜的に「免疫誘導性断片」と言うことがある)。
(c) (a)のカルモジュリン2タンパク又は(b)の断片と、80%以上の相同性を有し、免疫誘導活性を有するペプチド(以下、便宜的に「免疫誘導性修飾ペプチド」と言うことがある)。
(d) (a)のカルモジュリン2タンパク、(b)の断片または(c)のペプチドを部分配列として含み、免疫誘導活性を有するペプチド(以下、便宜的に「免疫誘導性付加ペプチド」と言うことがある)。
【0012】
なお、本発明において、「アミノ酸配列を有する」とは、アミノ酸残基がそのような順序で配列しているという意味である。従って、例えば、「配列番号3で示されるアミノ酸配列を有するペプチド」とは、Thr Ile Asp Phe Pro Glu Phe Leu Thr Metのアミノ酸配列を持つ10アミノ酸残基のサイズのペプチドを意味する。また、例えば、「配列番号3で示されるアミノ酸配列を有するペプチド」を「配列番号3のペプチド」と略記することがある。「塩基配列を有する」という表現についても同様である。
【0013】
ここで、「免疫誘導活性」は、CALM2を発現する癌細胞に反応するT細胞を活性化および増殖させる能力を意味し、具体的には、下記実施例に詳述する方法により測定される、ペプチドで刺激されたT細胞のIFN-γ産生能力及び/又はCALM2発現癌細胞に対する細胞障害活性が、ペプチドで刺激していない対照のT細胞よりも高く、かつ、ペプチドで刺激されたT細胞が、ペプチドで刺激していない対照のT細胞よりもよく増殖することを意味する。増殖は、目視観察、フローサイトメトリー、培地中のトリチウムチミジンの細胞内への取り込み量等により確認することができる。なお、下記実施例で採用したIFN-γ産生能力の測定は、例えばJ.Immunol.,154,p2257,1995に記載されており、また、細胞障害活性の測定は、Int.J.Cancer,58:p317,1994に記載された51Crリリースアッセイと呼ばれる公知の方法に準拠している。
【0014】
上記(a)のカルモジュリン2タンパクをコードするCALM2遺伝子は、本願発明者らが、DNAマイクロアレイ解析により、ヒトの腫瘍組織において、正常組織と比較して有意に高発現していることを初めて見出したものである(実施例1を参照)。
【0015】
上記(b)の免疫誘導性断片は、配列番号2で表されるアミノ酸配列を有するカルモジュリン2タンパクの断片であって、免疫誘導活性を有するものである。該断片は、配列番号2のアミノ酸配列中の連続する7個以上のアミノ酸からなり、好ましくは連続する9個以上のアミノ酸からなる。
【0016】
上記(c)の免疫誘導性修飾ペプチドは、前記(a)のカルモジュリン2タンパク又は前記(b)の免疫誘導性断片のうちの少数のアミノ酸残基が置換し、欠失し及び/又は挿入され、元の配列と80%以上、好ましくは90%以上、より好ましくは95%以上、さらに好ましくは98%以上の同一性を有し、かつ、免疫誘導活性を有するペプチドである。ここで、アミノ酸配列の「同一性」とは、両者のアミノ酸配列残基ができるだけ多く一致するように(必要ならばギャップを挿入する)両アミノ酸配列を整列させ、一致したアミノ酸残基数を、全アミノ酸残基数(両者の配列で全アミノ酸残基数が異なる場合には短い方の配列の全アミノ酸残基数)で除したものを百分率で表したものであり、BLASTのような周知のソフトを用いて容易に算出することができる。また、該免疫誘導性修飾ペプチドは、前記(a)のカルモジュリン2タンパク又は前記(b)の免疫誘導性断片のうちの1ないし数個のアミノ酸残基が置換し、欠失し及び/又は挿入されたペプチドであることも好ましい。なお、天然のタンパク質を構成する20種類のアミノ酸は、低極性側鎖を有する中性アミノ酸(Gly, Ile, Val, Leu, Ala, Met, Pro)、親水性側鎖を有する中性アミノ酸(Asn, Gln, Thr, Ser, Tyr Cys)、酸性アミノ酸(Asp, Glu)、塩基性アミノ酸(Arg, Lys, His)、芳香族アミノ酸(Phe, Tyr, Trp)のように類似の性質を有するものにグループ分けでき、これらの間での置換であればペプチドの性質が変化しないことが多いことが知られている。従って、上記本発明の免疫誘導性部分ペプチド中のアミノ酸残基を置換する場合には、これらの各グループの間で置換することにより、免疫誘導活性を維持できる可能性が高くなる。
【0017】
上記(d)の免疫誘導性付加ペプチドは、前記(a)のカルモジュリン2タンパク、前記(b)の免疫誘導性断片又は前記(c)の免疫誘導性修飾ペプチドを部分配列として含み、免疫誘導活性を有するペプチドである。すなわち、(a)のタンパク質、(b)の断片又は(c)のペプチドの一端又は両端に他のペプチドが付加されたものであって、免疫誘導活性を有するペプチドである。これらのペプチドも、本発明の免疫誘導剤等の調製に用いることができる。
【0018】
本発明で用いられる上記ペプチドの好ましい例として、配列番号2中の(1)aa9〜17の9アミノ酸の領域、(2)aa63〜72の10アミノ酸の領域、(3)aa65〜73の9アミノ酸の領域又は(4)aa121〜129の9アミノ酸の領域を含む、9アミノ酸以上のペプチドを挙げることができる。なお、(1)ないし(4)の領域のアミノ酸配列は、配列表中にそれぞれ配列番号5、配列番号3、配列番号7、配列番号6として示されている。
【0019】
本発明で用いられる上記ペプチドは、例えば市販のペプチド合成機を用いて常法により容易に調製することができる。また、公知の遺伝子工学的手法を用いて容易に調製することができる。例えば、カルモジュリン2遺伝子を発現している組織から抽出したRNAから、カルモジュリン2遺伝子のcDNAをRT−PCRにより調製し、該cDNAの全長又は所望の一部を発現ベクターに組み込んで、宿主細胞中に導入し、目的とするペプチドを得ることができる。RNAの抽出、RT−PCR、ベクターへのcDNAの組み込み、ベクターの宿主細胞への導入は周知の方法により行なうことができる。また、用いるベクターや宿主細胞も周知であり、種々のものが市販されている。
【0020】
下記実施例に具体的に記載されるように、上記ペプチドは、免疫誘導活性を示す。すなわち、該ペプチドで刺激したT細胞は、CALM2を発現する癌細胞に対して細胞障害活性を示し、増殖する。従って、該ペプチドを有効成分として含む免疫誘導剤を生体に投与することにより、癌を治療及び/又は予防することができる。従って、本発明の免疫誘導剤は、癌の治療及び/又は予防剤として用いることができる。なお、下記実施例では、免疫誘導活性が高い領域を選択して用いているが、例えばカルモジュリン2タンパクの全長を用いた場合であっても、生体内で分解され、結果として免疫誘導活性の高い領域を含む断片を生じることになるので、本発明では該タンパク質全長や、アミノ酸数が30を超えるその断片、特に全長の半分以上のサイズを有する大きな断片を用いることもできる。
【0021】
本発明の免疫誘導剤を癌の治療及び/又は予防剤として用いる場合、対象となる癌としては、CALM2を発現している癌を挙げることができ、脳腫瘍、頭、首、肺、子宮又は食道の扁平上皮癌、メラノーマ、肺または子宮の腺癌、腎癌等を挙げることができる。また、投与対象は、哺乳動物であり、特にヒトが好ましい。
【0022】
本発明の免疫誘導剤の生体への投与経路は、経口投与でも非経口投与でもよいが、筋肉内投与、皮下投与、静脈内投与、動脈内投与等の非経口投与が好ましい。また、投与量は、免疫誘導するのに有効な量、すなわち、CALM2を発現する癌細胞に反応するT細胞を活性化および増殖させるのに有効な量であればよく、例えば癌の治療及び/又は予防に用いるのであれば、癌の治療及び/又は予防に有効な量であればよい。投与量は、症状、使用目的等に応じて適宜選択されるが、通常、0.0001μg〜1000μg、好ましくは0.001μg〜1000μgであり、これを数日ないし数月に1回投与するのが好ましい。
【0023】
本発明の免疫誘導剤は、ペプチドのみから成っていてもよいし、各投与形態に適した、薬理学的に許容される担体及び/又は希釈剤を用いて製剤することができる。製剤方法及びそのための各種担体は、医薬製剤の分野において周知である。薬理学的に許容される担体又は希釈剤は、例えば、生理緩衝液のような緩衝液や、賦形剤(砂糖、乳糖、コーンスターチ、リン酸カルシウム、ソルビトール、グリシン等)であってよく、結合剤(シロップ、ゼラチン、アラビアゴム、ソルビトール、ポリビニルクロリド、トラガント等)、滑沢剤(ステアリン酸マグネシウム、ポリエチレングリコール、タルク、シリカ等)等が適宜混合されていてもよい。投与形態としては、錠剤、カプセル剤、顆粒剤、散剤、シロップ剤などによる経口剤、吸入剤、注射剤、座剤、液剤などによる非経口剤などを挙げることができる。これらの製剤は一般的に知られている製法によって作ることができる。
【0024】
また、上記ペプチドを生体内に投与することにより、該ペプチドを生体内で抗原として認識させ、生体にあらかじめ該ペプチドに対する免疫を誘導することができる。従って、上記ペプチドを有効成分として含有する本発明の免疫誘導剤は、ワクチンとして用いることができる。この場合には、免疫誘導剤は、有効成分として含む上記ペプチドに加えてアジュバントを含むことが好ましい。アジュバントは、抗原の貯蔵所(細胞外またはマクロファージ内)を提供し、マクロファージを活性化し、かつ特定組のリンパ球を刺激することにより、免疫学的応答を強化し得る。多数の種類のアジュバントが、当業界で周知である。具体例としては、MPL(SmithKline Beecham)、サルモネラ属のSalmonella minnesota Re 595リポ多糖類の精製および酸加水分解後に得られる同類物;QS21(SmithKline Beecham)、Quillja saponaria抽出物から精製される純QA−21サポニン;PCT出願WO96/33739(SmithKline Beecham)に記載されたDQS21;QS−7、QS−17、QS−18およびQS−L1(ソ(So)、外10名、「モレキュルズ・アンド・セル(Molecules and cells)」、1997年、第7巻、p.178−186);フロイントの不完全アジュバント;フロイントの完全アジュバント;ビタミンE;モンタニド;ミョウバン;CpGオリゴヌクレオチド(例えば、クレイグ(Kreig)、外7名、「ネイチャー(Nature)」、第374巻、p.546−549)を参照);ポリIC;ポリICLC;ならびにスクアレンおよび/またはトコフェロールのような生分解性油から調製される種々の油中水エマルションが挙げられる。
【0025】
ワクチンとして免疫誘導剤を用いる場合、有効成分として含有されるペプチドは、好ましくはDQS21/MPLの組合せと混合されて投与される。DQS21対MPLの比は、典型的には約1:10〜10:1,好ましくは約1:5〜5:1、さらに好ましくは約1:1である。典型的には、ヒト投与に関しては、DQS21およびMPLは、約1μg〜約100μgの範囲でワクチン処方物中に存在する。その他のアジュバントが当業界で既知であり、本発明に用いられ得る(例えば、ゴッディング(Goding)著,「モノクローナル・アンチボディーズ:プリンシプル・アンド・プラクティス(Monoclonal Antibodies:Principles and Practice)」、第2版、1986年を参照)。ペプチドおよびアジュバントの混合物またはエマルションの調製方法は、予防接種の当業者には周知である。
【0026】
対象の免疫応答を刺激するその他の因子も、対象に投与され得る。例えばその他のサイトカインも、リンパ球刺激特性の結果として、予防接種プロトコルに有用である。このような目的のために有用な多数のサイトカインは当業者に既知であり、その例としては、ワクチンの防御作用を強化することが示されているインターフェロン、インターロイキン−12(IL−12)、GM−CSF、IL−18およびFlt3リガンドが挙げられる。投与される場合、本発明の治療用組成物は、製薬上許容可能な調製物中で投与される。このような調製物は、製薬上許容可能な濃度の塩、緩衝剤、防腐剤、相溶性担体、補助免疫増強剤、例えばアジュバントおよびサイトカイン、ならびに任意にその他の療法的作用物質をルーチンに含有し得る。
【0027】
下記実施例において具体的に記載されるように、本発明で用いられる上記ペプチドと、抗原提示細胞をインビトロで接触させることにより、該ペプチドを抗原提示細胞に提示させることができる。すなわち、本発明の免疫誘導剤は、抗原提示細胞の処理剤として用いることができる。ここで、抗原提示細胞としては、HLAクラスI分子を保有する樹状細胞又はB細胞を好ましく用いることができる。種々のHLAクラスI分子が同定されており、周知である。HLAクラスI分子としては、HLA-A、HLA-B、HLA-Cを挙げることができ、より具体的には、HLA-A1, HLA-A0201, HLA-A0204, HLA-A0205, HLA-A0206, HLA-A0207, HLA-A11, HLA-A24, HLA-A31, HLA-A6801, HLA-B7, HLA-B8, HLA-B2705, HLA-B37, HLA-Cw0401, HLA-Cw0602などを挙げることができる。
【0028】
HLAクラスI分子を保有する樹状細胞又はB細胞は、周知の方法により末梢血から調製することができる。例えば、骨髄、臍帯血あるいは患者末梢血から、顆粒球マクロファージコロニー刺激因子(GM-CSF)とIL-3(あるいはIL-4)を用いて樹状細胞を誘導し、その培養系に腫瘍関連ペプチドを加えることにより、腫瘍特異的な樹状細胞を誘導することができる。この樹状細胞を有効量投与することで、癌の治療に望ましい応答を誘導できる。用いる細胞は、健康人から提供された骨髄や臍帯血、患者本人の骨髄や末梢血等を用いることができるが、患者本来の自家細胞を使う場合は、安全性が高く、重篤な副作用を回避することも期待できる。末梢血または骨髄は新鮮試料、低温保存試料及び凍結保存試料のいずれでもよい。末梢血は、全血を培養してもよいし、白血球成分だけを分離して培養してもよいが、後者の方が効率的で好ましい。さらに白血球成分の中でも単核球を分離してもよい。また、骨髄や臍帯血を起源とする場合には、骨髄を構成する細胞全体を培養してもよいし、これから単核球を分離して培養してもよい。末梢血やその白血球成分、骨髄細胞には、樹状細胞の起源となる単核球、造血幹細胞又は未成熟樹状細胞やCD4陽性細胞等が含まれている。用いられるサイトカインは、安全性と生理活性が確認された特性のものであれば、天然型、あるいは遺伝子組み換え型等、その生産手法については問わないが、好ましくは医療用に用いられる品質が確保された標品が必要最低量で用いられる。添加するサイトカインの濃度は、樹状細胞が誘導される濃度であれば特に限定されず、通常サイトカインの合計濃度で10〜1000ng/mL程度が好ましく、さらに好ましくは20〜500ng/mL程度である。培養は、白血球の培養に通常用いられている周知の培地を用いて行うことができる。培養温度は白血球の増殖が可能であれば特に限定されないが、ヒトの体温である37℃程度が最も好ましい。また、培養中の気体環境は白血球の増殖が可能であれば特に限定されないが、5%CO2を通気することが好ましい。さらに培養期間は、必要数の細胞が誘導される期間であれば特に限定されないが、通常3日〜2週間の間で行われる。細胞の分離や培養に供される機器は、適宜適当なものを用いることができるが、医療用に安全性が確認され、かつ操作が安定して簡便であることが好ましい。特に細胞培養装置については、シャーレ、フラスコ、ボトル等の一般的容器に拘わらず、積層型容器や多段式容器、ローラーボトル、スピナー式ボトル、バッグ式培養器、中空糸カラム等も用いることができる。
【0029】
本発明で用いられる上記ペプチドと抗原提示細胞をインビトロで接触させる方法自体は周知の方法により行なうことができ、下記実施例にも具体的に記載されている。すなわち、抗原提示細胞を、上記ペプチドを含む培養液中で培養することにより行なうことができる。培地中のペプチド濃度は、特に限定されないが、通常、1μg/mlないし100μg/ml程度、好ましくは5μg/mlないし20μg/ml程度である。培養時の細胞密度は特に限定されないが、通常、103細胞/mlから107細胞/ml程度、好ましくは5x104細胞/mlから5x106細胞/ml程度である。培養は、常法に従い、37℃、5%CO2雰囲気中で行なうことが好ましい。なお、抗原提示細胞が表面上に提示できるペプチドの長さは、通常、最大で30アミノ酸残基程度である。従って、特に限定されないが、抗原提示細胞とペプチドをインビトロで接触させる場合、該ペプチドをおよそ30アミノ酸残基以下の長さに調製してもよい。
【0030】
上記したペプチドの共存下において抗原提示細胞を培養することにより、ペプチドが抗原提示細胞のHLA分子に取り込まれ、抗原提示細胞の表面に提示される。本発明は、このような、上記ペプチドとHLA分子の複合体を含む、単離抗原提示細胞をも提供する。このような抗原提示細胞は、生体内又はインビトロにおいて、T細胞に対して該ペプチドを提示し、該ペプチドに特異的な細胞障害性T細胞を誘導し、増殖させる。
【0031】
上記のようにして調製される、上記ペプチドとHLA分子の複合体とを含む抗原提示細胞を、T細胞とインビトロで接触させることにより、該ペプチドに特異的な細胞障害性T細胞を誘導し、増殖させることができる。これは、上記抗原提示細胞とT細胞とを液体培地中で共存培養することにより行なうことができる。例えば、抗原提示細胞を液体培地に懸濁して、マイクロプレートのウェル等の容器に入れ、これにT細胞を添加して培養することにより行なうことができる。共存培養時の抗原提示細胞とT細胞の混合比率は、特に限定されないが、通常、細胞数の比率で1:1〜1:100程度、好ましくは1:5〜1:20程度である。また、液体培地中に懸濁する抗原提示細胞の密度は、特に限定されないが、通常、100〜1000万細胞/ml程度、好ましくは10000〜100万細胞/ml程度である。共存培養は、常法に従い、37℃、5%CO2雰囲気中で行なうことが好ましい。培養時間は、特に限定されないが、通常、2日〜3週間、好ましくは4日〜2週間程度である。また、共存培養は、IL-2、IL-6、IL-7及びIL-12のようなインターロイキンの1種又は複数の存在下で行なうことが好ましい。この場合、IL-2及びIL-7の濃度は、通常、5U/mlから20U/ml程度、IL-6の濃度は通常、500U/mlから2000U/ml程度、IL-12の濃度は通常、5ng/mlから20ng/ml程度であるが、これらに限定されるものではない。上記の共存培養は、新鮮な抗原提示細胞を追加して1回ないし数回繰り返してもよい。例えば、共存培養後の培養上清を捨て、新鮮な抗原提示細胞の懸濁液を添加してさらに共存培養を行なうという操作を、1回ないし数回繰り返してもよい。各共存培養の条件は、上記と同様でよい。なお、本明細書において、上記のように、ペプチドを抗原提示細胞の表面に提示させるためにペプチドを抗原提示細胞の培養液に加えることを、「ペプチドで細胞をパルスする」と呼ぶことがある。また、上記ペプチドを提示する抗原提示細胞とT細胞を接触させることを、「ペプチドでT細胞を刺激する」と呼ぶことがある。
【0032】
上記の共存培養により、該ペプチドに特異的な細胞障害性T細胞が誘導され、増殖される。本発明は、このような、上記ペプチドとHLA分子の複合体を選択的に結合する、単離T細胞をも提供する。
【0033】
上記ペプチドを提示する上記抗原提示細胞は、生体内においても該ペプチドに特異的な細胞障害性T細胞を誘導し、増殖させることができるので、これを生体に投与することにより癌の治療及び/又は予防を行なうことができる。また、上記ペプチドとHLA分子の複合体を選択的に結合する、T細胞は、CALM2を発現する癌細胞に対して細胞障害活性を示すので、該T細胞を生体に投与することによっても癌の治療及び/又は予防を行なうことができる。従って、本発明は、上記本発明の抗原提示細胞を有効成分として含有する医薬、並びに癌の治療及び/又は予防剤、並びに上記本発明のT細胞を有効成分として含有する医薬、並びに癌の治療及び/又は予防剤をも提供する。治療対象となる癌の例としては、当然ながら、上記ペプチドを有効成分として含有する癌の治療及び/又は予防剤の対象として上記した癌を挙げることができる。
【0034】
生体に投与する抗原提示細胞又はT細胞は、これらの細胞を異物として攻撃する生体内での免疫応答を回避するために、治療を受ける患者から採取した抗原提示細胞又はT細胞を、上記のように本発明で用いられる上記ペプチドを用いて調製したものであることが好ましい。
【0035】
抗原提示細胞又はT細胞を有効成分として含む癌の治療及び/又は予防剤の投与経路は、静脈内投与や動脈内投与のような非経口投与が好ましい。また、投与量は、症状や投与目的等に応じて適宜選択されるが、通常1個〜10兆個、好ましくは100万個〜10億個であり、これを数日ないし数月に1回投与するのが好ましい。製剤は、例えば、細胞を生理緩衝食塩水に懸濁したもの等であってよく、他の抗癌剤やサイトカイン等と併用することもできる。また、製剤分野において周知の1又は2以上の添加剤を添加することもできる。
【0036】
本発明が開示する、癌の治療及び/又は予防に用いることができるCALM2タンパクのアミノ酸配列自体は、配列番号2に示すとおり公知であり、CALM2遺伝子のコード領域の塩基配列も配列番号1に示すとおり公知である。従って、CALM2タンパクをコードするポリヌクレオチドを含み、哺乳動物細胞中で該ポリヌクレオチドを発現することができる組換えベクターを調製することができ、該組換えベクターを癌の治療及び/又は予防のための遺伝子ワクチンとして利用することができる。
【0037】
ベクターに挿入するポリヌクレオチドとしては、配列番号1に示される塩基配列を有するポリヌクレオチドであってもよく、また、上記した免疫誘導性断片をコードする領域の塩基配列を有するものであってもよい。あるいは、その保存的置換塩基配列(コードするアミノ酸配列が同じで塩基配列が異なるもの)を用いることができる。なお、各アミノ酸をコードするコドンは公知であるから、特定のアミノ酸配列をコードするポリヌクレオチドの塩基配列は容易に特定することができる。従って、上記した免疫誘導性修飾ペプチド及び免疫誘導性付加ペプチドをコードするポリヌクレオチドの塩基配列も容易に特定することができる。これらのポリヌクレオチドは、市販の核酸合成機を用いて常法により合成することができる。これらのポリヌクレオチドをベクターに挿入してもよい。また、ポリヌクレオチドはDNAでもRNAでもよい。
【0038】
哺乳動物細胞に遺伝子導入するためのベクターとしては、プラスミドベクターでもウイルスベクターでもよく、これら自体は周知であり、種々のものが市販されているので、市販のベクターを利用することができる。市販のベクターのマルチクローニング部位に上記したポリヌクレオチドを挿入することにより、前記組換えベクターを得ることができる。
【0039】
遺伝子ワクチンの投与経路は、好ましくは筋肉内投与、皮下投与、静脈内投与、動脈内投与等の非経口投与経路であり、投与量は、抗原の種類等に応じて適宜選択することができるが、通常、体重1kg当たり、遺伝子ワクチンの重量で0.1μg〜100mg程度、好ましくは1μg〜10mg程度である。
【0040】
ウイルスベクターによる方法としては、例えばレトロウイルス、アデノウイルス、アデノ関連ウイルス、ヘルペスウイルス、ワクシニアウイルス、ポックスウイルス、ポリオウイルス、シンドビスウイルス等のRNA ウイルスまたはDNA ウイルスに本発明のDNA を組み込んで導入する方法が挙げられる。この中で、レトロウイルス、アデノウイルス、アデノ関連ウイルス、ワクシニアウイルス等を用いた方法が特に好ましい。
【0041】
その他の方法としては、発現プラスミドを直接筋肉内に投与する方法(DNAワクチン法)、リポソーム法、リポフェクチン法、マイクロインジェクション法、リン酸カルシウム法、エレクトロポレーション法等が挙げられ、特にDNAワクチン法、リポソーム法が好ましい。
【0042】
本発明で用いられる上記ペプチドをコードする遺伝子を実際に医薬として作用させるには、遺伝子を直接体内に導入するin vivo方法、およびヒトからある種の細胞を採取し体外で遺伝子を該細胞に導入しその細胞を体内に戻すex vivo方法がある(日経サイエンス,1994年4月,p20−45、月刊薬事,1994年,第36巻,第1号,p.23−48、実験医学増刊,1994年,第12巻,第15号、およびこれらの引用文献等)。in vivo方法がより好ましい。
【0043】
in vivo方法により投与する場合は、治療目的の疾患、症状等に応じた適当な投与経路により投与され得る。例えば、静脈、動脈、皮下、筋肉内などに投与することが出来る。in vivo方法により投与する場合は、例えば、液剤等の製剤形態をとりうるが、一般的には、有効成分である本発明で用いられる上記ペプチドをコードするDNAを含有する注射剤等とされ、必要に応じて、慣用の担体を加えてもよい。また、該DNAを含有するリポソームまたは膜融合リポソーム(センダイウイルス(HVJ)−リポソーム等)においては、懸濁剤、凍結剤、遠心分離濃縮凍結剤等のリポソーム製剤の形態とすることができる。
【0044】
一方、大腸菌や酵母菌などの微生物用のベクターも周知であり、種々のものが市販されている。微生物用のベクターに上記ポリヌクレオチドを組み込んだ組換えベクターは、本発明で用いられる上記ペプチドを遺伝子工学的に大量生産するために用いることができる。微生物への組換えベクターの組み込みは周知の方法により行なうことができる。
【0045】
下記実施例1に記載される通り、カルモジュリン2遺伝子(そのコード領域の塩基配列を配列番号1に示す)は、癌組織において正常組織よりも有意に高発現している。従って、癌の疑いのある患者から得た試料における、該カルモジュリン2遺伝子の発現量を、健常者から得た試料における発現量と比較することにより、該患者が癌であるか否かを調べることができる。発現量の比較は、例えば以下のようにして行うことができる。先ず、癌を罹患していることが分かっている複数の患者と、複数の健常者とから試料を得て、カルモジュリン2遺伝子の発現量を調べ、癌患者集団と健常者集団それぞれについてカルモジュリン2遺伝子発現量の基準値を定める。そして、癌であるか否かを診断すべき患者から試料を得て、該試料中のカルモジュリン2遺伝子発現量を調べ、前記基準値と比較する。発現量が健常者基準値よりも有意に高く、癌患者基準値に近ければ、その患者は癌である可能性が高いと考えられる。健常者基準値との比較のみでも癌の検出は可能であるが、癌患者基準値とも比較することにより、さらに検出精度を高めることができる。なお、前記基準値は、例えば、各試料における発現量を数値化し、その平均値を算出することによって定めることができる。なお、遺伝子の発現量は、該遺伝子から生産されるmRNA又はタンパク質の量を測定することにより調べることができる。試料としては、例えばヒト由来の体組織等を用いることができる。mRNA又はタンパク質の量は常法により測定することができる。例えば、カルモジュリン2のmRNAは、該mRNAを鋳型とするリアルタイム検出RT-PCRのような常法により定量することができ、常法であるノーザンブロットにおける染色強度等によっても概ね定量することができる。また、タンパク質の量は、常法である免疫測定により定量することができる。
【0046】
カルモジュリン2タンパクと抗原抗体反応する抗体又はその抗原結合性断片を作製し、これを用いて免疫測定を行うことにより、試料中のカルモジュリン2タンパクの検出又は定量を行うことができる。癌組織中では正常組織よりも有意にカルモジュリン2遺伝子の発現量が高いので、該遺伝子にコードされるカルモジュリン2タンパクの蓄積量も有意に高いと考えられる。従って、そのような抗体又はその抗原結合性断片を用いることによっても、上記の通り癌の検出を行うことができる。すなわち、本発明は、カルモジュリン2タンパクと抗原抗体反応する抗体又はその抗原結合性断片を含む癌の診断剤をも提供する。本発明の癌の診断剤を用いた癌の検出は、上記したカルモジュリン2遺伝子の発現量を指標とする癌の検出方法と同様に、癌の疑いのある患者由来の試料と健常者由来の試料との間でのタンパク質蓄積量の比較に基づいて行うことができる。
【0047】
ここで、抗原結合性断片とは、抗体分子中に含まれるFab断片やF(ab')2断片のような、抗原との結合能を有する抗体断片を意味する。抗体はポリクローナル抗体でもモノクローナル抗体でもよいが、免疫測定等のためには、再現性の高いモノクローナル抗体が好ましい。ペプチドを免疫原とするポリクローナル抗体及びモノクローナル抗体の調製方法は周知であり、常法により容易に行なうことができる。例えば、ペプチドをキーホールリンペットヘモシアニン(KLH)やカゼイン等のキャリアタンパク質に結合させたものを免疫原とし、アジュバントと共に動物に免疫することにより該ペプチドに対する抗体を誘起することができる。免疫した動物から採取した脾細胞やリンパ球のような抗体産生細胞をミエローマ細胞と融合させてハイブリドーマを調製し、本発明のペプチドと結合する抗体を産生するハイブリドーマを選択し、これを増殖させて培養上清から本発明のペプチドを対応抗原とするモノクローナル抗体を得ることができる。なお、上記の方法は周知の常法である。
【0048】
免疫測定自体はこの分野において周知であり、反応様式で分類すると、サンドイッチ法、競合法、凝集法、ウェスタンブロット法等があり、フローサイトメトリーも免疫測定の1種と考えることができる。また、標識で分類すると、放射免疫測定、蛍光免疫測定、酵素免疫測定、ビオチン免疫測定等があり、上記抗体又はその抗原結合性断片はこれらのいずれにも用いることができる。癌の診断剤として用いる場合は、操作が簡便で大掛かりな装置等を必要としないサンドイッチELISAや凝集法を適用することが好ましい。なお、本発明で用いられる上記ペプチドは、該ペプチドを発現する細胞を競合法で検出又は測定する場合の免疫測定用試薬として用いることもできる。
【0049】
以下、本発明を実施例に基づきより具体的に説明する。
【実施例】
【0050】
実施例1:癌組織のDNAマイクロアレイ解析
(1)実験者の臨床病理学的所見
インフォームドコンセントを得た119名の食道ガン患者から、食道ガン摘出手術時又は食道生検実施時に食道の摘出組織を得た。摘出された組織片について肉眼的及び/又は病理組織学的に食道ガン組織を判断し、食道ガン病変部と正常組織部を分けてただちに凍結し、液体窒素中で保存した。
【0051】
(2)全RNA抽出とcDNAの調製
試料として食道ガン患者の食道組織における食道ガン病変部の組織、及び同一食道組織における非ガン組織(正常組織)を用いた。おのおのの組織から、Trizol reagent(Invitrogen社)を用いて、同社推奨のプロトコールにより全RNAを調製した。
【0052】
上述の方法で得られた全RNA 1μgについて、oligo(dT)プライマー及びランダムノナマーを併用し、CyScribe First-Strand CDNA Labeling Kit(GEヘルスケア社)を用いてメーカー推奨のプロトコールで逆転写反応を行った。正常組織由来又は食道ガン組織由来の全RNAにはCy3-dUTP(GEヘルスケア社)を、リファレンス全RNA(Stratagene社)にはCy5-dUTP(GEヘルスケア社)を添加して、メーカー推奨のプロトコールで逆転写反応時にcDNAの標識を行った。標識されたcDNAはQIA quick PCR purification Kit(QIAGEN社)で精製してからハイブリダイズに用いた。
【0053】
(3)オリゴDNAマイクロアレイの作製
オリゴDNAマイクロアレイとしてはAffymetrix社GeneChip(登録商標)(Human Genome U133 A)及び本明細書中で述べる方法に従って作製したDNAチップを使用した。
【0054】
DNAチップの作製方法を以下に示す。最初に搭載するオリゴDNAの種類を決定するために、Affymetrix社GeneChip(登録商標)を用いて遺伝子の絞込みを行った。GeneChip(登録商標)の操作については、Complete GeneChip(登録商標) Instrument System及び添付の指示書に基づいて実施した。Complete GeneChip(登録商標)を用いた解析の結果、食道ガンによって発現変動が起こる可能性がある遺伝子及び実験対照となりうる遺伝子を計8961種抽出した。
【0055】
抽出した8961種の遺伝子について、配列の重複をおこさないように配列特異性が高い部位の配列60−70merをそれぞれ選択して合成した。4倍に希釈したSolution I(タカラバイオ社)に30μMとなるように溶解した、8961種の60又は70merからなる合成オリゴDNAを、MATSUNAMI DNAマイクロアレイ用コートグラスDMSO対応TypeIアミノ修飾オリゴDNA固定コート(松浪硝子工業株式会社)上にスポッター(GMS417arrayer,Affymetrix社)を用いて湿度環境50−60%でスポットした。
【0056】
(4)ハイブリダイゼーション
標識したcDNA 1μgをアンチセンスオリゴカクテル(QIAGEN)に溶解し、Gapカバーグラス(松浪硝子工業)を載せたDNAチップにアプライし、42℃で16時間ハイブリダイズを行った。ハイブリダイズ終了後、DNAチップを2xSSC/0.1%SDS、1xSSC、0.2xSSCで順次洗浄した。
【0057】
(5)遺伝子発現量の測定
上述の方法によりハイブリダイゼーションを行ったDNAチップをAgilentマイクロアレイスキャナー(Agilent社)を用いてスキャンし、画像を取得して蛍光強度を数値化した。統計学的処理はSpeed T.著「Statistical analysis of gene expression microarray data」Chapman & Hall/CRC,及びCauston H.C.ら著「A beginner's guide Microarray gene expression data analysis」Blackwell publishingを参考にして行った。すなわちハイブリダイズ後の画像解析から得られたデータについて、それぞれの対数値をとり、global normalizationとLOWESS(locally weighted scatterplot smoother)による平滑化を行い、MADによるスケーリング処理によってノーマライゼーション補正を行った。その結果、食道ガン病変部における発現量が、非ガン組織部よりも多い遺伝子として、CALM2を見出すことができた。
【0058】
実施例2:CALM2由来ペプチドエピトープ反応性CD8陽性T細胞の誘導
(1)ヒトCALM2タンパク質のアミノ酸配列の情報をGenBankから得た。HLA-A0201結合モチーフ予測のため、公知のBIMASソフト(http://bimas.dcrt.nih.gov/molbio/hla_bind/で利用可能)を用いたコンピューター予測プログラムを用いてヒトCALM2タンパク質のアミノ酸配列を解析し、HLAクラスI分子に結合可能と予想されるペプチド24種類を選択した。
【0059】
(2)HLA-A0201陽性の健常人から末梢血を分離し、Lymphocyte separation medium(OrganonpTeknika, Durham, NC)に重層して1,500rpmで室温で20分間遠心分離した。PBMCを含有する画分を回収し、冷リン酸塩緩衝液中で3回(またはそれ以上)洗浄し、末梢血単核球(PBMC)を得た。得られたPBMCをAIM−V培地(Life Technololgies, Inc., 米国ニューヨーク州Grand Island)20mlに懸濁し、培養フラスコ(Falcon)中に37℃、5%CO2の条件下で2時間付着させた。非付着細胞はT細胞調製に用い、付着細胞は樹状細胞を調製するために用いた。
【0060】
一方、付着細胞をAIM−V培地中でIL−4(1000U/ml)およびGM−CSF(1000U/ml)の存在下で培養した。6日後にIL−4(1000U/ml)、GM−CSF(1000U/ml)、IL−6(1000U/ml、Genzyme, Cambridge, MA)、IL−1β(10ng/ml、Genzyme, Cambridge, MA)およびTNF−α(10ng/ml、Genzyme, Cambridge, MA)を添加したAIM−V培地に交換してさらに2日間培養した後得られた非付着細胞集団を樹状細胞として用いた。
【0061】
(3)調製した樹状細胞をAIM−V培地中に1×106細胞/mlの細胞密度で懸濁し、選択したペプチドを10μg/mlの濃度で添加し、96穴プレートを用いて37℃、5%CO2の条件下で4時間培養した。培養後、X線照射(3000rad)し、AIM−V培地で洗浄し、10%ヒトAB血清(Nabi, Miami, FL)、IL−6(1000U/ml)およびIL−12(10ng/ml、Genzyme, Cambridge, MA)を含有するAIM−V培地で懸濁し、24穴プレート1穴当りにそれぞれ1×105細胞づつ添加した。さらに調製したT細胞集団を1穴当りそれぞれ1×106細胞添加し、37℃、5%CO2の条件下で培養した。7日後、それぞれの培養上清を捨て、上記と同様にして得た各ペプチドで処理後X線照射した樹状細胞を10%ヒトAB血清(Nabi, Miami, FL)、IL−7(10U/ml、Genzyme, Cambridge, MA)およびIL−2(10U/ml、Genzyme, Cambridge, MA)を含有するAIM−V培地で懸濁し(細胞密度:1×105細胞/ml)、24穴プレート1穴当りにそれぞれ1×105細胞づつ添加し、さらに培養した。同様の操作を7日間おきに4〜6回繰返した後刺激されたT細胞を回収し,フローサイトメトリーによりCD8陽性T細胞の誘導を確認した。
【0062】
実施例3:HLA-A0201陽性CD8陽性T細胞を刺激するCALM2由来細胞障害性T細胞抗原エピトープの決定
(1)上記で誘導した各穴のT細胞の内、配列番号3、5、6又は7に示すアミノ酸配列を有するペプチドで刺激されたT細胞が増殖していることが顕微鏡下における細胞数計測により確認された。増殖が見られたT細胞それぞれについて、パルスに用いた各ペプチドに対する特異性を調べるために、ペプチドでパルスされた、HLA-A0201分子を発現するT2細胞(Salter RD et al.,Immunogenetics, 21:235-246(1985)、ATCCより購入)(10μg/mlの濃度でAIM−V培地中各ペプチドを添加し、37℃、5%CO2の条件下で4時間培養)5×104個に対して、5×103個のT細胞を添加し、10%ヒトAB血清を含むAIM−V培地中で96穴プレートにて24時間培養した。培養後の上清を取って、IFN−γの産生量をELISA法により測定した。その結果、ペプチドをパルスしていないT2細胞を用いた穴の培養上清に比べて、配列番号3、5、6又は7のペプチドをパルスしたT2細胞を用いた穴の培養上清において、IFN−γ産生が確認された(図1)。中でも、配列番号3のペプチドでパルスした場合におけるIFN−γ産生量が顕著に高かった。従って、配列番号3、5、6及び7のペプチドは特異的にHLA-A0201陽性CD8陽性T細胞を増殖刺激させ、IFN−γ産生を誘導する能力を有するT細胞エピトープペプチドであることが判明した。
【0063】
なお、図1中、縦軸の参照番号1は、配列番号3で示されるアミノ酸配列を有するペプチドについての結果を示す。参照番号7、8及び9はそれぞれ配列番号5、6及び7のペプチドについての結果を示す。参照番号2はCALM2由来ペプチドの1つであるが本発明の範囲外のペプチドAELRHVMTNL(配列番号4)についての結果を示す(比較例1)。参照番号3はペプチドを添加せずに上記処理を行なった場合についての結果を示す(比較例2)。
【0064】
(2)次に、本発明で用いられるペプチドの1つである配列番号3のペプチドが、HLA-A0201陽性でCALM2を発現する腫瘍細胞上のHLA-A0201分子上に提示されるものであるか、また本ペプチドで刺激されたCD8陽性T細胞がHLA-A0201陽性でCALM2を発現する腫瘍細胞を障害することができるかを検討した。CALM2の発現が確認されている悪性脳腫瘍細胞株、T98G(Stein GH et al.,J. Cell Physiol., 99:43-54(1979)、ATCCより購入)を105個50ml容の遠心チューブに集め、100μCiのクロミウム51を加え37℃で2時間インキュベートした。その後10%ヒトAB血清を含むAIM−V培地で3回洗浄し、96穴V底プレート1穴あたり103個づつ添加し、さらにこれに後10%ヒトAB血清を含むAIM−V培地で懸濁された105、5x104、2.5x104および1.25x104個の配列番号3のペプチドで刺激されたHLA-A0201陽性のCD8陽性T細胞をそれぞれ添加して、37℃、5%CO2の条件下で4時間培養した。培養後、障害を受けた腫瘍細胞から放出される培養上清中のクロミウム51の量を測定することによって、配列番号3のペプチドで刺激されたCD8陽性T細胞細胞の細胞障害活性を算出した。その結果、本ペプチドで刺激されたHLA-A0201陽性のCD8陽性T細胞がT98Gに対する細胞障害活性を有することが判明した(図2)。従って、本発明で用いられるペプチドの1つである配列番号3のペプチドは、HLA-A0201陽性でCALM2を発現する腫瘍細胞上のHLA-A0201分子上に提示されるものであり、さらに本ペプチドは、このような腫瘍細胞を障害することができるCD8陽性細胞障害性T細胞を誘導する能力があることが明らかになった。
【0065】
同様にして、配列番号5,6及び7のペプチドで刺激されたHLA-A0201陽性のCD8陽性T細胞は、T98Gに対して細胞障害活性を示した(図4)。なお、図4中、横軸の参照番号13、14および15は、それぞれ配列番号5,6および7のペプチドについての結果を示す。さらに、横軸の参照番号16はCALM2由来ペプチドの1つであるが本発明の範囲外のペプチドである配列番号4のペプチドについての結果(比較例5)、横軸の参照番号17はペプチドを添加せずに上記処理を行なった場合についての結果を示す(比較例6)。
【0066】
さらに、配列番号3,5,6及び7のペプチドで刺激されたHLA-A0201陽性のCD8陽性T細胞は、CALM2の発現が確認されている別の悪性脳腫瘍細胞株、U87 MG(Beckman G et al.,Hum.Hered., 21:238-241(1971)、ATCCより購入)に対して細胞障害活性を示した(図3)。
【0067】
なお、細胞障害活性は、上記のように、本発明で用いられる各ペプチドで刺激誘導されたCD8陽性T細胞105個とクロミウム51を取り込ませた103個の悪性脳腫瘍細胞株T98GおよびU87 MGとを混合して4時間培養し、培養後培地に放出されたクロミウム51の量を測定して、以下計算式*により算出したCD8陽性T細胞のT98GおよびU87 MGに対する細胞障害活性を示した結果である。*式:細胞障害活性(%)=CD8陽性T細胞を加えた際のT98GおよびU87 MGからのクロミウム51遊離量÷1N塩酸を加えた標的細胞からのクロミウム51遊離量×100
【0068】
なお、図3中、横軸の参照番号4、10,11および12は、それぞれ配列番号3、5,6および7のペプチドについての結果を示す。さらに、横軸の参照番号5はCALM2由来ペプチドの1つであるが本発明の範囲外のペプチドである配列番号4のペプチドについての結果(比較例3)、横軸の参照番号6はペプチドを添加せずに上記処理を行なった場合についての結果を示す(比較例4)。
【産業上の利用可能性】
【0069】
本発明で用いられるペプチドは、免疫誘導剤、特に癌の治療及び/又は予防剤の有効成分として有用であり、また、癌の治療及び/又は予防剤として利用できる抗原提示細胞やT細胞の誘導に有用である。
【特許請求の範囲】
【請求項1】
配列番号2で表されるアミノ酸配列を有するカルモジュリン2タンパク若しくは免疫誘導活性を有し、連続する7個以上のアミノ酸から成るその断片、又は前記カルモジュリン2タンパク若しくはその前記断片と80%以上の同一性を有し、免疫誘導活性を有するペプチド、又は前記カルモジュリン2タンパク、その前記断片若しくは前記ペプチドを部分配列として含み、免疫誘導活性を有するペプチドを有効成分として含有する免疫誘導剤。
【請求項2】
前記カルモジュリン2タンパク又は免疫誘導活性を有する連続する7個以上のアミノ酸から成るその断片を有効成分として含有する請求項1記載の免疫誘導剤。
【請求項3】
前記断片は、配列番号2中の(1)aa9〜17の9アミノ酸の領域、(2)aa63〜72の10アミノ酸の領域、(3)aa65〜73の9アミノ酸の領域又は(4)aa121〜129の9アミノ酸の領域を含む、9アミノ酸以上のペプチドである請求項1又は2記載の免疫誘導剤。
【請求項4】
癌の治療及び/又は予防剤である請求項1ないし3のいずれか1項に記載の免疫誘導剤。
【請求項5】
ワクチン又は抗原提示細胞の処理剤である請求項1ないし4のいずれか1項に記載の免疫誘導剤。
【請求項6】
有効成分であるペプチドのアミノ酸数が7〜30であり、抗原提示細胞の処理剤である請求項5記載の免疫誘導剤。
【請求項7】
請求項6記載のペプチドとHLA分子の複合体を含む、単離抗原提示細胞。
【請求項8】
請求項6記載のペプチドとHLA分子の複合体を選択的に結合する、単離T細胞。
【請求項9】
請求項7記載の単離抗原提示細胞又は請求項8記載の単離T細胞を有効成分として含有する医薬。
【請求項10】
請求項7記載の単離抗原提示細胞又は請求項8記載の単離T細胞を有効成分として含有する癌の治療及び/又は予防剤。
【請求項11】
癌であるか否かを検出すべき患者から得た試料における、配列番号1に示す塩基配列を有するコード領域を有するカルモジュリン2遺伝子の発現を調べ、健常者由来の試料中の該遺伝子の発現量と比較することを含む、癌の検出方法。
【請求項12】
配列番号2で表されるアミノ酸配列を有するカルモジュリン2タンパクと抗原抗体反応する抗体又はその抗原結合性断片を含む癌の診断剤。
【請求項1】
配列番号2で表されるアミノ酸配列を有するカルモジュリン2タンパク若しくは免疫誘導活性を有し、連続する7個以上のアミノ酸から成るその断片、又は前記カルモジュリン2タンパク若しくはその前記断片と80%以上の同一性を有し、免疫誘導活性を有するペプチド、又は前記カルモジュリン2タンパク、その前記断片若しくは前記ペプチドを部分配列として含み、免疫誘導活性を有するペプチドを有効成分として含有する免疫誘導剤。
【請求項2】
前記カルモジュリン2タンパク又は免疫誘導活性を有する連続する7個以上のアミノ酸から成るその断片を有効成分として含有する請求項1記載の免疫誘導剤。
【請求項3】
前記断片は、配列番号2中の(1)aa9〜17の9アミノ酸の領域、(2)aa63〜72の10アミノ酸の領域、(3)aa65〜73の9アミノ酸の領域又は(4)aa121〜129の9アミノ酸の領域を含む、9アミノ酸以上のペプチドである請求項1又は2記載の免疫誘導剤。
【請求項4】
癌の治療及び/又は予防剤である請求項1ないし3のいずれか1項に記載の免疫誘導剤。
【請求項5】
ワクチン又は抗原提示細胞の処理剤である請求項1ないし4のいずれか1項に記載の免疫誘導剤。
【請求項6】
有効成分であるペプチドのアミノ酸数が7〜30であり、抗原提示細胞の処理剤である請求項5記載の免疫誘導剤。
【請求項7】
請求項6記載のペプチドとHLA分子の複合体を含む、単離抗原提示細胞。
【請求項8】
請求項6記載のペプチドとHLA分子の複合体を選択的に結合する、単離T細胞。
【請求項9】
請求項7記載の単離抗原提示細胞又は請求項8記載の単離T細胞を有効成分として含有する医薬。
【請求項10】
請求項7記載の単離抗原提示細胞又は請求項8記載の単離T細胞を有効成分として含有する癌の治療及び/又は予防剤。
【請求項11】
癌であるか否かを検出すべき患者から得た試料における、配列番号1に示す塩基配列を有するコード領域を有するカルモジュリン2遺伝子の発現を調べ、健常者由来の試料中の該遺伝子の発現量と比較することを含む、癌の検出方法。
【請求項12】
配列番号2で表されるアミノ酸配列を有するカルモジュリン2タンパクと抗原抗体反応する抗体又はその抗原結合性断片を含む癌の診断剤。
【図1】


【図2】


【図3】


【図4】




【図2】


【図3】


【図4】


【公開番号】特開2013−28639(P2013−28639A)
【公開日】平成25年2月7日(2013.2.7)
【国際特許分類】
【出願番号】特願2012−224180(P2012−224180)
【出願日】平成24年10月9日(2012.10.9)
【分割の表示】特願2007−247031(P2007−247031)の分割
【原出願日】平成19年9月25日(2007.9.25)
【出願人】(000003159)東レ株式会社 (7,677)
【Fターム(参考)】
【公開日】平成25年2月7日(2013.2.7)
【国際特許分類】
【出願日】平成24年10月9日(2012.10.9)
【分割の表示】特願2007−247031(P2007−247031)の分割
【原出願日】平成19年9月25日(2007.9.25)
【出願人】(000003159)東レ株式会社 (7,677)
【Fターム(参考)】
[ Back to top ]

