免疫調節薬としてのピリジン−3−イル誘導体
本発明は、Gタンパク質結合受容体S1P1/EDG1のアゴニストであり、かつ循環および浸潤するTおよびBリンパ球の数を減少させることによりこれらの成熟、記憶または増殖に影響を及ぼさずに達成される強力かつ持続性の免疫抑制効果を有する式(I)の新規化合物を提供する。S1P1/EDG1アゴニズムの結果としての循環T/Bリンパ球の減少により、おそらくS1P1/EDG1活性化と関連した内皮細胞層機能の改善が観察されることと合わせて、このような化合物が、抑制されていない炎症性疾患を治療するために、および血管機能性を改善するために有用となる。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、式(I)のS1P1/EDG1受容体アゴニストおよび医薬組成物の製造における活性成分としてのこれらの使用に関する。また、本発明は、化合物の製造のための方法、式(I)の化合物を含む医薬組成物、並びに血管機能を改善する化合物としての、および免疫調節薬としての、単独またはその他の活性化合物もしくは療法と組み合わせたこれらの使用を含む関連した側面に関する。本発明のさらなる側面は、式(I)の化合物を製造するための中間体となる式(II)の新規化合物に関する。
【背景技術】
【0002】
ヒト免疫系は、感染または疾患を生じさせる外来微生物および物質から体を守るようにデザインされている。複雑な調節機構が、免疫応答が侵入する物質または生物体を標的とし、宿主を標的としないことを保証する。場合によっては、これらの制御メカニズムが制御されず、自己免疫応答を発症し得る。炎症反応が制御されない結果として、重篤な器官、細胞、組織または関節の損傷が生じる。また、現在の治療では、通常、全免疫系が抑制されて、体が感染に応答する能力が大きく損なわれてしまう。この種の典型的な薬物には、アザチオプリン、クロランブシル、シクロホスファミド、シクロスポリンまたはメトトレキセートを含む。炎症を減少させて、免疫応答を抑制する副腎皮質ステロイドは、長期治療に使用されると、副作用の原因となることがある。非ステロイド性抗炎症薬(NSAID)は、疼痛および炎症を減少させることができるが、しかし、これらは、かなりの副作用を示す。代わりの治療には、サイトカインシグナリングを活性化し、または遮断する薬剤を含む。
【0003】
免疫調節特性をもち、免疫応答を損なうことなく、そして副作用が減少された、経口で有効な化合物は、制御されない炎症性疾患の現在の治療を大幅に向上させるであろう。
【0004】
臓器移植の分野では、器官拒絶反応を防止するために宿主免疫応答を抑制しなければならない。臓器移植レシピエントは、彼らが免疫抑制剤を服用するときでも、いくらか拒絶反応を受けることがある。拒絶反応は、移植後の最初の数週に最も頻繁に生じるが、拒絶反応の発症は、移植の何月もまたは何年後でさえも生じ得る。副作用を最小にすると共に、拒絶反応から最大限保護するために、3つまたは4つまでの薬物療法の組み合わせが一般に使用されている。移植臓器の拒絶反応を治療するために使用される現在の標準薬は、T型またはB型白血球の活性化における別々の細胞内経路を妨げる。このような薬物の例には、サイトカイン放出またはシグナリングを妨げるシクロスポリン、ダクリズマブ、バシリキシマブ、エベロリムスもしくはFK506;ヌクレオチド合成を阻害するアザチオプリンもしくはレフルノミド;または白血球分化の阻害剤である15-デオキシスペルグアリンがある。
【0005】
広範な免疫抑制療法による有益な効果は、これらの効果に関連するが;しかし、これらの薬物により生じる全身的免疫抑制は、感染および悪性腫瘍に対する免疫系の防御を減弱させる。さらにまた、標準的な免疫抑制剤は、高投薬量で使用されることが多く、器官損傷を引き起こし、または促進し得る。
【発明の開示】
【0006】
本発明は、Gタンパク質結合受容体S1P1/EDG1のアゴニストであり、かつ循環および浸潤するTおよびBリンパ球の数を減少させることによりこれらの成熟、記憶または増殖に影響を及ぼさずに達成される強力かつ持続性の免疫抑制効果を有する式(I)の新規化合物を提供する。S1P1/EDG1アゴニズムの結果としての循環T/Bリンパ球の減少により、おそらくS1P1/EDG1活性化と関連した内皮細胞層機能の改善が観察されることと合わせて、このような化合物が、抑制されていない炎症性疾患を治療するために、および血管機能性を改善するために有用となる。
【0007】
本発明の化合物は、単独で、またはT細胞活性化を阻害する標準薬と組み合わせて、標準的な免疫抑制療法と比較したときに感染の性向が減少した新たな免疫抑制療法を提供するために利用することができる。さらにまた、本発明の化合物は、投薬量を減少した従来の免疫抑制性療法と組み合わせて、一方では有効な免疫抑制活性を、一方では高用量の標準的な免疫抑制剤に付随した末端器官損傷の減少を提供するために使用することができる。S1P1/EDG1活性化と関連した内皮細胞層機能の改善の観察は、血管機能を改善するための化合物のさらなる利点をもたらす。
【0008】
ヒトS1P1/EDG1受容体のためのヌクレオチド配列およびアミノ酸配列は、当技術分野において公知であり、たとえばHla, T., and Maciag, T. J. Biol Chem. 265(1990), 9308-9313;1991年10月17日に公開された国際公開公報第91/15583号;1999年9月16日に公開された国際公開公報第99/46277号に発表されている(特許文献1、2、非特許文献1)。式(I)の化合物の能力および有効性は、EC50値を決定するためのGTPγSアッセイ法を使用して、および経口投与後のラットにおける循環リンパ球を測定することによって、それぞれ評価される(実施例を参照されたい)。
【先行技術文献】
【特許文献】
【0009】
【特許文献1】国際公開公報第91/15583号
【特許文献2】国際公開公報第99/46277号
【非特許文献】
【0010】
【非特許文献1】Hla, T., and Maciag, T. J. Biol Chem. 265(1990) 上記及び下記において使用される一般的用語は、本開示の範囲内において、特に示さない限り、好ましくは以下の意味を有する。
【0011】
化合物、塩、医薬組成物、疾病等について複数形が使用される場合は、単数の化合物、塩等をも意味することが意図されている。
【0012】
式(I)の化合物に対する上記又は下記のいずれの言及も、適切かつ好都合なように、式(I)の化合物の塩、特に薬学的に許容される塩をも指すものと理解されるべきである。
【0013】
C1-5アルキルという用語は、単独で、またはその他の基と組み合わせて、1から5の炭素原子をもつ飽和した、分枝または直鎖状基を意味する。C1-5アルキル基の例は、メチル、エチル、n-プロピル、イソ-プロピル、n-ブチル、イソ-ブチル、n-ペンチルおよびイソ-ペンチルである。
【0014】
同様に、C1-4アルキルという用語は、単独で、またはその他の基と組み合わせて、1から4の炭素原子をもつ飽和した、分枝または直鎖状基を意味する。C1-4アルキル基の例は、メチル、エチル、n-プロピル、イソ-プロピル、n-ブチルおよびイソ-ブチルである。
【0015】
同様に、C1-3アルキルという用語は、単独で、またはその他の基と組み合わせて、1から3の炭素原子をもつ飽和した、分枝または直鎖状基を意味し、メチル、エチル、n-プロピルまたはイソ-プロピル基を表す;好ましくはメチルおよびエチルである。
【0016】
同様に、C2-5アルキルという用語は、単独で、またはその他の基と組み合わせて、2から5の炭素原子をもつ飽和した、分枝または直鎖状基を意味する。
【0017】
同様に、C2-4アルキルという用語は、単独で、またはその他の基と組み合わせて、2から4の炭素原子をもつ飽和した、分枝または直鎖状基を意味する。C2-4アルキル基の例は、エチル、n-プロピル、イソ-プロピル、n-ブチルおよびイソ-ブチルである。
【0018】
C1-4アルコキシという用語は、単独で、またはその他の基と組み合わせて、RがC1-4アルキルであるR-O基を意味する。C1-4アルコキシ基の例は、メトキシ、エトキシ、プロポキシ、イソ-プロポキシおよびイソ-ブトキシ、好ましくはメトキシ、エトキシ、プロポキシおよびイソ-プロポキシである。
【0019】
C2-5アルコキシという用語は、単独で、またはその他の基と組み合わせて、RがC2-5アルキルであるR-O基を意味する。C2-5アルコキシ基の例は、エトキシ、プロポキシ、イソ-プロポキシ、イソ-ブトキシおよびイソ-ペントキシである。
【0020】
ハロゲンという用語は、フルオロ、クロロ、ブロモまたはヨード、好ましくはフルオロまたはクロロを、最も好ましくはクロロを意味する。
塩は、好ましくは式(I)の化合物の薬学的に許容される塩である。
【0021】
薬学的に許容される塩という用語は、無毒性の無機もしくは有機酸および/または塩基付加塩を意味する、文献: 例えば"Salt selection for basic drugs", Int. J. Pharm. (1986), 33, 201-217。
【0022】
式(I)の化合物は、1または2以上の不斉炭素原子などの、1または2以上のキラルまたは不斉中心を含んでいてもよい。二重結合または環の置換基は、特に明記しない限り、cis-(=Z-)またはtrans(=E-)形態で存在してもよい。従って、式(I)の化合物は、立体異性体の混合物として、または好ましくは純粋な立体異性体として存在してもよい。立体異性体の混合物は当業者に知られた方法で分離してもよい。
【0023】
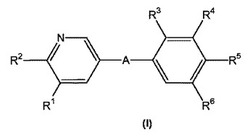
i)本発明は、式(I)のピリジン−3−イル誘導体に関する:
【0024】
【化1】

【0025】
式中
Aは*-CONH-CH2-、*-CO-CH=CH-、*-CO-CH2CH2-、
【0026】
【化2】

【0027】
(アスタリスクは式(I)のピリジン基に結合される結合を表す。)を表し;
R1は水素、C1-4アルキルまたはクロロを表し;
R2は、C1-5アルキルまたはC1-4アルコキシを表し;
R3は、水素、C1-4アルキル、C1-4アルコキシまたはハロゲンを表し;
R4は、水素、C1-4アルキル、C1-4アルコキシ、ハロゲン、トリフルオロメチルまたはトリフルオロメトキシを表し;
R5は、2,3-ジヒドロキシプロピル、ジ-(ヒドロキシ-C1-4アルキル)-C1-4アルキル、-CH2-(CH2)k-NHSO2R53、-(CH2)nCH(OH)-CH2-NHSO2R53、-CH2-(CH2)k-NHCOR54、-(CH2)nCH(OH)-CH2-NHCOR54、-CH2-(CH2)n-CONR51R52、-CONHR51、1-(3-カルボキシ-アゼチジニル)-2-アセチル、1-(2-カルボキシ-ピロリジニル)-2-アセチル、1-(3-カルボキシ-ピロリジニル)-2-アセチル、1-(3-カルボキシ-アゼチジニル)-3-プロピオニル、1-(2-カルボキシ-ピロリジニル)-3-プロピオニル、1-(3-カルボキシ-ピロリジニル)-3-プロピオニル、-(CH2)nCH(OH)-CH2-NR51R52、ヒドロキシ、ヒドロキシ-C2-5アルコキシ、ジ-(ヒドロキシ-C1-4アルキル)-C1-4アルコキシ、2,3-ジヒドロキシプロポキシ、2-ヒドロキシ-3-メトキシ-プロポキシ、-OCH2-(CH2)m-NR51R52、2-[(アゼチジン-3-カルボン酸)-1-イル]-エトキシ、2-[(アゼチジン-3-カルボン酸C1-5-アルキルエステル)-1-イル]-エトキシ、2-[(ピロリジン-3-カルボン酸)-1-イル]-エトキシ、2-[(ピロリジン-3-カルボン酸 C1-5-アルキルエステル)-1-イル]-エトキシ、-OCH2-CH(OH)-CH2-NR51R52、3-[(アゼチジン-3-カルボン酸)-1-イル]-2-ヒドロキシプロポキシ、3-[(アゼチジン-3-カルボン酸 C1-5-アルキルエステル)-1-イル]-2-ヒドロキシプロポキシ、2-ヒドロキシ-3-[(ピロリジン-3-カルボン酸)-1-イル]-プロポキシ、2-ヒドロキシ-3-[(ピロリジン-3-カルボン酸 C1-5-アルキルエステル)-1-イル]-プロポキシ、2-ヒドロキシ-3-[(ピロリジン-2-カルボン酸)-1-イル]-プロポキシ、2-ヒドロキシ-3-[(ピロリジン-2-カルボン酸 C1-5-アルキルエステル)-1-イル]-プロポキシ、-OCH2-(CH2)m-NHSO2R53、-OCH2-CH(OH)-CH2-NHSO2R53、-OCH2-(CH2)m-NHCOR54、-OCH2-CH(OH)-CH2-NHCOR54を表し;
R51は、水素、C1-3アルキル、2-ヒドロキシエチル、2-ヒドロキシ-1-ヒドロキシメチル-エチル、2,3-ジヒドロキシプロピル、カルボキシメチル、1-(C1-5-アルキルカルボキシ)メチル、2-カルボキシエチルまたは2-(C1-5-アルキルカルボキシ)エチルを表し;
R52は、水素、メチルまたはエチルを表し;
R53は、C1-3-アルキル、メチルアミノ、エチルアミノまたはジメチルアミノを表し;
R54は、ヒドロキシメチル、ヒドロキシエチル、アミノメチル、メチルアミノメチル、ジメチルアミノメチル、アミノエチル、2-メチルアミノ-エチルまたは2-ジメチルアミノ-エチルを表し;
kは、1、2または3の整数を表し;
mは、1または2の整数を表し;
nは、0、1または2を表し;そして
R6は、水素、C1-4アルキルまたはハロゲンを表す。
【0028】
ii)本発明のもう一つの態様は、Aが、
【0029】
【化3】

【0030】
(アスタリスクは式(I)のピリジン基に結合される結合を表す。)を表す、態様i)に記載のピリジン−3−イル誘導体に関する。
【0031】
iii)本発明のもう一つの態様は、Aが、
【0032】
【化4】

【0033】
(アスタリスクは式(I)のピリジン基に結合される結合を表す。)を表す、態様i)に記載のピリジン−3−イル誘導体に関する。
【0034】
iv)本発明のもう一つの態様は、Aが、
【0035】
【化5】

【0036】
(特にAが
【0037】
【化6】

【0038】
を表す)
(アスタリスクは式(I)のピリジン基に結合される結合を表す。)を表す、態様i)に記載のピリジン−3−イル誘導体に関する。
【0039】
v)本発明のもう一つの態様は、Aが、
【0040】
【化7】

【0041】
(アスタリスクは式(I)のピリジン基に結合される結合を表す。)を表す、態様i)に記載のピリジン−3−イル誘導体に関する。
【0042】
vi)本発明のもう一つの態様は、Aが、
【0043】
【化8】

【0044】
(アスタリスクは式(I)のピリジン基に結合される結合を表す。)を表す、態様i)に記載のピリジン−3−イル誘導体に関する。
【0045】
vii)本発明のもう一つの態様は、Aが、
【0046】
【化9】

【0047】
を表す、態様i)に記載のピリジン−3−イル誘導体に関する。
【0048】
viii)本発明のもう一つの態様は、R1がC1-4アルキルまたはクロロを表す、態様i)からvii)のいずれかに記載のピリジン−3−イル誘導体に関する。
【0049】
ix)本発明のもう一つの態様は、R1がC1-4アルキルを表す、態様i)からvii)のいずれかに記載のピリジン−3−イル誘導体に関する。
【0050】
x)本発明のもう一つの態様は、R1がメチルまたはエチルを表す、態様i)からvi)のいずれかに記載のピリジン−3−イル誘導体に関する。
【0051】
xi)本発明のもう一つの態様は、R1がメチルを表す、態様i)からvi)のいずれかに記載のピリジン−3−イル誘導体に関する。
【0052】
xii)本発明のもう一つの態様は、R2がC1-5アルキルを表す、態様i)からxi)のいずれかに記載のピリジン−3−イル誘導体に関する。
【0053】
xiii)本発明のもう一つの態様は、R2がC2-4アルキルを表す、態様i)からxi)のいずれかに記載のピリジン−3−イル誘導体に関する。
【0054】
xiv)本発明のもう一つの態様は、R2がエチル、n-プロピル、イソプロピルまたはイソブチルを表す、態様i)からxi)のいずれかに記載のピリジン−3−イル誘導体に関する。
【0055】
xv)本発明のもう一つの態様は、R2がn-プロピルまたはイソブチルを表す、態様i)からxi)のいずれかに記載のピリジン−3−イル誘導体に関する。
【0056】
xvi)本発明のもう一つの態様は、R2がC1-4アルコキシを表す、態様i)からxi)のいずれかに記載のピリジン−3−イル誘導体に関する。
【0057】
xvii)本発明のもう一つの態様は、R3、R4およびR6の少なくとも一つが水素以外の基を表す、態様i)からxvi)のいずれかに記載のピリジン−3−イル誘導体に関する。
【0058】
xviii)本発明のもう一つの態様は、R3がメチルまたはメトキシ(特にメトキシ)を表し、R4およびR6が水素を表す、態様i)からxvi)のいずれかに記載のピリジン−3−イル誘導体に関する。
【0059】
xix)本発明のもう一つの態様は、R3が水素を表す、態様i)からxvi)のいずれかに記載のピリジン−3−イル誘導体に関する。
【0060】
xx)本発明のもう一つの態様は、R3が水素を表し、R4がC1-4アルキルまたはC1-4アルコキシを表し、R6がC1-4アルキルまたはハロゲンを表す、態様i)からxvi)のいずれかに記載のピリジン−3−イル誘導体に関する。
【0061】
xxi)本発明のもう一つの態様は、R3が水素を表し、R4がC1-3アルキルまたはメトキシ(特にメチル、エチルまたはメトキシ)を表し、R6がメチル、エチルまたはハロゲン(特にクロロ)を表す、態様i)からxvi)のいずれかに記載のピリジン−3−イル誘導体に関する。
【0062】
xxii)本発明のもう一つの態様は、R3が水素を表し、R4およびR6がメチル基を表す、態様i)からxvi)のいずれかに記載のピリジン−3−イル誘導体に関する。
【0063】
xxiii)本発明のもう一つの態様は、R3が水素を表し、R4がメチル基を表し、R6がエチル基を表す、態様i)からxvi)のいずれかに記載のピリジン−3−イル誘導体に関する。
【0064】
xxiv)本発明のもう一つの態様は、R3が水素を表し、R4がメトキシ基を表し、R6がクロロを表す、態様i)からxvi)のいずれかに記載のピリジン−3−イル誘導体に関する。
【0065】
xxv)本発明のもう一つの態様は、R3が水素を表し、R4がメチル基を表し、R6がクロロを表す、態様i)からxvi)のいずれかに記載のピリジン−3−イル誘導体に関する。
【0066】
xxvi)本発明のもう一つの態様は、R5が、2,3-ジヒドロキシプロピル、ジ-(ヒドロキシ-C1-4アルキル)-C1-4アルキル、-CH2-(CH2)k-NHSO2R53、-(CH2)nCH(OH)-CH2-NHSO2R53、-CH2-(CH2)k-NHCOR54、-(CH2)nCH(OH)-CH2-NHCOR54、-CH2-(CH2)n-CONR51R52、-CONHR51、-(CH2)nCH(OH)-CH2-NR51R52、ヒドロキシ、ヒドロキシ-C2-5アルコキシ、ジ-(ヒドロキシ-C1-4アルキル)-C1-4アルコキシ、2,3-ジヒドロキシプロポキシ、2-ヒドロキシ-3-メトキシ-プロポキシ、-OCH2-(CH2)m-NR51R52、-OCH2-CH(OH)-CH2-NR51R52、-OCH2-(CH2)m-NHSO2R53、-OCH2-CH(OH)-CH2-NHSO2R53、-OCH2-(CH2)m-NHCOR54または-OCH2-CH(OH)-CH2-NHCOR54を表す、態様i)からxxv)のいずれかに記載のピリジン−3−イル誘導体に関する。
【0067】
xxvii)本発明のもう一つの態様は、R5が、2,3-ジヒドロキシプロピル、-CH2-(CH2)k-NR51R52、-CH2-(CH2)k-NHCOR54、-(CH2)nCH(OH)-CH2-NHCOR54、-CH2-(CH2)n-CONR51R52、-CONHR51、-(CH2)nCH(OH)-CH2-NR51R52、ヒドロキシ-C2-5アルコキシ、ジ-(ヒドロキシ-C1-4アルキル)-C1-4アルコキシ、2,3-ジヒドロキシプロポキシ、2-ヒドロキシ-3-メトキシ-プロポキシ、-OCH2-(CH2)m-NR51R52、-OCH2-CH(OH)-CH2-NR51R52、-OCH2-(CH2)m-NHCOR54または-OCH2-CH(OH)-CH2-NHCOR54を表す(特に、R5が、2,3-ジヒドロキシプロピル、-CH2-(CH2)k-NR51R52、-CH2-(CH2)k-NHCOR54、-(CH2)nCH(OH)-CH2-NHCOR54、-CH2-(CH2)n-CONR51R52、-(CH2)nCH(OH)-CH2-NR51R52、ヒドロキシ-C2-5アルコキシ、ジ-(ヒドロキシ-C1-4アルキル)-C1-4アルコキシ、2,3-ジヒドロキシプロポキシ、2-ヒドロキシ-3-メトキシ-プロポキシ、-OCH2-(CH2)m-NR51R52、-OCH2-CH(OH)-CH2-NR51R52、-OCH2-(CH2)m-NHCOR54または-OCH2-CH(OH)-CH2-NHCOR54を表す)、態様i)からxxv)のいずれかに記載のピリジン−3−イル誘導体に関する。
【0068】
xxviii)本発明のもう一つの態様は、R5が、ヒドロキシ-C2-5アルコキシ、ジ-(ヒドロキシ-C1-4アルキル)-C1-4アルコキシ、2,3-ジヒドロキシプロポキシ、-OCH2-(CH2)m-NR51R52、-OCH2-CH(OH)-CH2-NR51R52、-OCH2-(CH2)m-NHCOR54または-OCH2-CH(OH)-CH2-NHCOR54を表す、態様i)からxxv)のいずれかに記載のピリジン−3−イル誘導体に関する。
【0069】
xxix)本発明のもう一つの態様は、R5が、3-ヒドロキシ-2-ヒドロキシメチル-プロポキシ、2,3-ジヒドロキシプロポキシまたは-OCH2-CH(OH)-CH2-NHCOR54を表す(特に、R5が、2,3-ジヒドロキシプロポキシまたは-OCH2-CH(OH)-CH2-NHCOR54を表し、上記式中R54がヒドロキシメチルを表す)、態様i)からxxv)のいずれかに記載のピリジン−3−イル誘導体に関する。
【0070】
xxx)本発明のもう一つの態様は、R5が、-OCH2-CH(OH)-CH2-NHCOR54を表し、上記式中、R54がヒドロキシメチルを表す、態様i)からxxv)のいずれかに記載のピリジン−3−イル誘導体に関する。
【0071】
xxxi)本発明のもう一つの態様は、R5が、2,3-ジヒドロキシプロポキシを表す、態様i)からxxv)のいずれかに記載のピリジン−3−イル誘導体に関する。
【0072】
xxxii)本発明のもう一つの態様は、
Aが
【0073】
【化10】

【0074】
(特にAが
【0075】
【化11】

【0076】
を表し)(アスタリスクは式(I)のピリジン基に結合される結合を表す。);
R1が、メチル、エチルまたはクロロ(特にメチルまたはエチル)を表し;
R2が、n-プロピル、イソブチルまたはイソプロポキシ(特にn-プロピルまたはイソブチル)を表し;
R3が、水素、メチルまたはメトキシ(特に水素またはメトキシ)を表し;
R4が、水素、メチル、エチルまたはメトキシを表し;
R5が、ヒドロキシ-C2-5アルコキシ、ジ-(ヒドロキシ-C1-4アルキル)-C1-4アルコキシ、2,3-ジヒドロキシプロポキシ、-OCH2-CH(OH)-CH2-NR51R52または-OCH2-CH(OH)-CH2-NHCOR54を表し(特にR5が、2,3-ジヒドロキシプロポキシまたは-OCH2-CH(OH)-CH2-NHCOR54を表し);
R54が、ヒドロキシメチル、メチルアミノメチルまたは2-メチルアミノ-エチルを表し;そして
R6が、水素、メチル、エチルまたはクロロを表し;
本態様において、1または2以上の置換基または基の意味は、態様v)からvii)、x)、xi)、xv)、xvii)からxix)、xxii)からxxv)、およびxxix)からxxxi)のいずれかにおける当該置換基または基に対して与えられた意味によって置き換えられてもよい、態様i)に記載のピリジン−3−イル誘導体に関する。
【0077】
xxxiii)本発明のもう一つの態様は、
Aが
【0078】
【化12】

【0079】
を表し(特にAが
【0080】
【化13】

【0081】
を表し)(アスタリスクは式(I)のピリジン基に結合される結合を表す。);
R1が、水素、C1-4アルキルまたはクロロを表し;
R2が、C1-5アルキルまたはC1-4アルコキシを表し;
R3が、水素を表し;
R4が、C1-4アルキルまたはC1-4アルコキシを表し;
R5が、ヒドロキシ、ヒドロキシ-C2-5アルコキシ、ジ-(ヒドロキシ-C1-4アルキル)-C1-4アルコキシ、2,3-ジヒドロキシプロポキシ、-OCH2-CH(OH)-CH2-NR51R52または-OCH2-CH(OH)-CH2-NHCOR54を表し;
R51が、水素、2-ヒドロキシエチルまたは2-ヒドロキシ-1-ヒドロキシメチル-エチル(特に水素)を表し;
R52が、水素を表し;
R54が、ヒドロキシメチルを表し;
R6が、C1-4アルキルまたはハロゲンを表し;
本態様において、1または2以上の置換基または基の意味は、態様vi)からxvi)、xxi)からxxv)およびxxix)からxxxi)のいずれかにおける当該置換基または基に対して与えられた意味によって置き換えられてもよい、態様i)に記載のピリジン−3−イル誘導体に関する。
【0082】
xxxiv)式(I)のピリジン−3−イル誘導体の例は:
3-{4-[5-(5-クロロ-6-イソプロポキシ-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-2,6-ジメチル-フェノキシ}-プロパン-1,2-ジオール、
N-(3-{4-[5-(5-クロロ-6-イソプロポキシ-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-2,6-ジメチル-フェノキシ}-2-ヒドロキシ-プロピル)-2-ヒドロキシ-アセタミド、
3-{4-[5-(6-イソブチル-5-メチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-2,6-ジメチル-フェノキシ}-プロパン-1,2-ジオール、
2-ヒドロキシ-N-(2-ヒドロキシ-3-{4-[5-(6-イソブチル-5-メチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-2,6-ジメチル-フェノキシ}-プロピル)-アセタミド、
N-(3-{2-エチル-4-[5-(6-イソブチル-5-メチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-6-メチル-フェノキシ}-2-ヒドロキシ-プロピル)-2-ヒドロキシ-アセタミド、
3-{4-[5-(5,6-ジイソブチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-2,6-ジメチル-フェノキシ}-プロパン-1,2-ジオール、
N-(3-{4-[5-(5,6-ジエチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-2-エチル-6-メチル-フェノキシ}-2-ヒドロキシ-プロピル)-2-ヒドロキシ-アセタミド、
2-ヒドロキシ-N-(2-ヒドロキシ-3-{4-[5-(6-イソブチル-5-メチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-3-メチル-フェノキシ}-プロピル)-アセタミド、
N-(3-{2-クロロ-4-[5-(6-イソブチル-5-メチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-6-メチル-フェノキシ}-2-ヒドロキシ-プロピル)-2-ヒドロキシ-アセタミド、
N-(3-{2-クロロ-4-[5-(6-イソブチル-5-メチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-6-メトキシ-フェノキシ}-2-ヒドロキシ-プロピル)-2-ヒドロキシ-アセタミド、
N-((R)-3-{2-エチル-4-[5-(6-イソブチル-5-メチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-6-メチル-フェノキシ}-2-ヒドロキシ-プロピル)-2-ヒドロキシ-アセタミド、
N-((S)-3-{2-エチル-4-[3-(6-イソブチル-5-メチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-5-イル]-6-メチル-フェノキシ}-2-ヒドロキシ-プロピル)-2-ヒドロキシ-アセタミド、
N-((S)-3-{2-エチル-4-[5-(6-イソブチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-6-メチル-フェノキシ}-2-ヒドロキシ-プロピル)-2-ヒドロキシ-アセタミド、
(S)-3-{2-エチル-4-[5-(5-エチル-6-イソブチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-6-メチル-フェノキシ}-プロパン-1,2-ジオール、
N-(3-{2-エチル-4-[5-(5-エチル-6-イソブチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-6-メチル-フェノキシ}-2-ヒドロキシ-プロピル)-2-ヒドロキシ-アセタミド、
(R)-3-{2-エチル-4-[5-(6-イソプロポキシ-5-メチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-6-メチル-フェノキシ}-プロパン-1,2-ジオール、
(S)-3-{2-エチル-4-[5-(6-イソプロポキシ-5-メチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-6-メチル-フェノキシ}-プロパン-1,2-ジオール、
N-((R)-3-{2-エチル-4-[5-(6-イソプロポキシ-5-メチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-6-メチル-フェノキシ}-2-ヒドロキシ-プロピル)-2-ヒドロキシ-アセタミド、
N-((S)-3-{2-エチル-4-[5-(6-イソプロポキシ-5-メチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-6-メチル-フェノキシ}-2-ヒドロキシ-プロピル)-2-ヒドロキシ-アセタミド、
3-{2-エチル-4-[5-(6-イソプロポキシ-5-メチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-6-メチル-フェニル}-N-(2-ヒドロキシ-エチル)-プロピオンアミド、
(R)-3-{2-エチル-4-[3-(6-イソプロポキシ-5-メチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-5-イル]-6-メチル-フェノキシ}-プロパン-1,2-ジオール、
(S)-3-{2-エチル-4-[3-(6-イソプロポキシ-5-メチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-5-イル]-6-メチル-フェノキシ}-プロパン-1,2-ジオールおよび
3-{2-エチル-4-[5-(6-イソプロポキシ-5-メチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-6-メチル-フェニル}-プロピオン酸
から選択される。
【0083】
xxxv) 式(I)のピリジン−3−イル誘導体の別の態様例は:
(R)-3-{4-[5-(5-クロロ-6-イソプロポキシ-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-2,6-ジメチル-フェノキシ}-プロパン-1,2-ジオール、
(S)-3-{4-[5-(5-クロロ-6-イソプロポキシ-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-2,6-ジメチル-フェノキシ}-プロパン-1,2-ジオール、
N-((R)-3-{4-[5-(5-クロロ-6-イソプロポキシ-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-2,6-ジメチル-フェノキシ}-2-ヒドロキシ-プロピル)-2-ヒドロキシ-アセタミド、
N-((S)-3-{4-[5-(5-クロロ-6-イソプロポキシ-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-2,6-ジメチル-フェノキシ}-2-ヒドロキシ-プロピル)-2-ヒドロキシ-アセタミド、
(R)-3-{4-[5-(6-イソブチル-5-メチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-2,6-ジメチル-フェノキシ}-プロパン-1,2-ジオール、
(S)-3-{4-[5-(6-イソブチル-5-メチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-2,6-ジメチル-フェノキシ}-プロパン-1,2-ジオール、
2-ヒドロキシ-N-((R)-2-ヒドロキシ-3-{4-[5-(6-イソブチル-5-メチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-2,6-ジメチル-フェノキシ}-プロピル)-アセタミド、
2-ヒドロキシ-N-((S)-2-ヒドロキシ-3-{4-[5-(6-イソブチル-5-メチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-2,6-ジメチル-フェノキシ}-プロピル)-アセタミド、
N-((R)-3-{2-エチル-4-[5-(6-イソブチル-5-メチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-6-メチル-フェノキシ}-2-ヒドロキシ-プロピル)-2-ヒドロキシ-アセタミド、
N-((S)-3-{2-エチル-4-[5-(6-イソブチル-5-メチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-6-メチル-フェノキシ}-2-ヒドロキシ-プロピル)-2-ヒドロキシ-アセタミド、
(R)-3-{4-[5-(5,6-ジイソブチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-2,6-ジメチル-フェノキシ}-プロパン-1,2-ジオール、
(S)-3-{4-[5-(5,6-ジイソブチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-2,6-ジメチル-フェノキシ}-プロパン-1,2-ジオール、
N-((R)-3-{4-[5-(5,6-ジエチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-2-エチル-6-メチル-フェノキシ}-2-ヒドロキシ-プロピル)-2-ヒドロキシ-アセタミド、
N-((S)-3-{4-[5-(5,6-ジエチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-2-エチル-6-メチル-フェノキシ}-2-ヒドロキシ-プロピル)-2-ヒドロキシ-アセタミド、
2-ヒドロキシ-N-((R)-2-ヒドロキシ-3-{4-[5-(6-イソブチル-5-メチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-3-メチル-フェノキシ}-プロピル)-アセタミド、
2-ヒドロキシ-N-((S)-2-ヒドロキシ-3-{4-[5-(6-イソブチル-5-メチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-3-メチル-フェノキシ}-プロピル)-アセタミド、
N-((R)-3-{2-クロロ-4-[5-(6-イソブチル-5-メチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-6-メチル-フェノキシ}-2-ヒドロキシ-プロピル)-2-ヒドロキシ-アセタミド、
N-((S)-3-{2-クロロ-4-[5-(6-イソブチル-5-メチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-6-メチル-フェノキシ}-2-ヒドロキシ-プロピル)-2-ヒドロキシ-アセタミド、
N-((R)-3-{2-クロロ-4-[5-(6-イソブチル-5-メチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-6-メトキシ-フェノキシ}-2-ヒドロキシ-プロピル)-2-ヒドロキシ-アセタミド、
N-((S)-3-{2-クロロ-4-[5-(6-イソブチル-5-メチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-6-メトキシ-フェノキシ}-2-ヒドロキシ-プロピル)-2-ヒドロキシ-アセタミド、
N-((R)-3-{2-エチル-4-[5-(6-イソブチル-5-メチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-6-メチル-フェノキシ}-2-ヒドロキシ-プロピル)-2-ヒドロキシ-アセタミド、
N-((S)-3-{2-エチル-4-[3-(6-イソブチル-5-メチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-5-イル]-6-メチル-フェノキシ}-2-ヒドロキシ-プロピル)-2-ヒドロキシ-アセタミド、
N-((S)-3-{2-エチル-4-[5-(6-イソブチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-6-メチル-フェノキシ}-2-ヒドロキシ-プロピル)-2-ヒドロキシ-アセタミド、
(S)-3-{2-エチル-4-[5-(5-エチル-6-イソブチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-6-メチル-フェノキシ}-プロパン-1,2-ジオール、
N-((R)-3-{2-エチル-4-[5-(5-エチル-6-イソブチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-6-メチル-フェノキシ}-2-ヒドロキシ-プロピル)-2-ヒドロキシ-アセタミド、
N-((S)-3-{2-エチル-4-[5-(5-エチル-6-イソブチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-6-メチル-フェノキシ}-2-ヒドロキシ-プロピル)-2-ヒドロキシ-アセタミド、
(R)-3-{2-エチル-4-[5-(6-イソプロポキシ-5-メチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-6-メチル-フェノキシ}-プロパン-1,2-ジオール、
(S)-3-{2-エチル-4-[5-(6-イソプロポキシ-5-メチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-6-メチル-フェノキシ}-プロパン-1,2-ジオール、
N-((R)-3-{2-エチル-4-[5-(6-イソプロポキシ-5-メチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-6-メチル-フェノキシ}-2-ヒドロキシ-プロピル)-2-ヒドロキシ-アセタミド、
N-((S)-3-{2-エチル-4-[5-(6-イソプロポキシ-5-メチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-6-メチル-フェノキシ}-2-ヒドロキシ-プロピル)-2-ヒドロキシ-アセタミド、
3-{2-エチル-4-[5-(6-イソプロポキシ-5-メチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-6-メチル-フェニル}-N-(2-ヒドロキシ-エチル)-プロピオンアミド、
(R)-3-{2-エチル-4-[3-(6-イソプロポキシ-5-メチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-5-イル]-6-メチル-フェノキシ}-プロパン-1,2-ジオール、
(S)-3-{2-エチル-4-[3-(6-イソプロポキシ-5-メチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-5-イル]-6-メチル-フェノキシ}-プロパン-1,2-ジオールおよび
3-{2-エチル-4-[5-(6-イソプロポキシ-5-メチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-6-メチル-フェニル}-プロピオン酸
から選択される。
【0084】
xxxvi) 本発明のさらなる側面は、新規な式(II)のピリジン−3−イル誘導体に関する:
【0085】
【化14】

【0086】
式中、A、R1、R2及びnは、請求項1に定義された意味を有する;R3は、水素を表す;R4は、C1-4-アルキルまたはC1-4-アルコキシを表す;そしてR6は、C1-4-アルキルまたはハロゲンを表す。
【0087】
式(I)の化合物およびこれらの薬学的に許容される塩は、医薬として、たとえば経腸または非経口投与のための医薬組成物の形態で使用することができる。
【0088】
医薬組成物の製造は、いずれの当業者によく知られた様式で(たとえばMark Gibson, Editor, Pharmaceutical Preformulation and Formulation, IHS Health Group, Englewood, CO, USA, 2001; Remington, The Science and Practice of Pharmacy, 20th Edition, Philadelphia College of Pharmacy and Scienceを参照されたい)、記述された式(I)の化合物またはこれらの薬学的に許容される塩を、任意に、ガレノスの投与形態中に、適切な無毒の不活性な薬学的に許容される固体または液体の担体材料および必要に応じて、通常の薬学的アジュバントと共に、その他の治療的に有益な物質と組み合わせることによって遂行することができる。
【0089】
式(I)の化合物を含む医薬組成物は、活性化された免疫系と関連する疾患もしくは障害の予防および/または治療のために有用である。
【0090】
かかる疾患または障害は、移植された臓器、組織または細胞に対する拒絶反応;移植によってもたらされる移植片対宿主病;関節リウマチを含む自己免疫性症候群;全身性エリテマトーデス;抗リン脂質抗体症候群;橋本甲状腺炎;リンパ球性甲状腺炎;多発性硬化症;重症筋無力症;I型糖尿病;ブドウ膜炎;上強膜炎;強膜炎;川崎病、ブドウ膜網膜炎;後部ブドウ膜炎;ベーチェット病関連ブドウ膜炎;ブドウ膜髄膜炎症候群;アレルギー性脳脊髄炎;慢性アレルギー性血管症;リウマチ熱、感染後糸球体腎炎を含む感染後自己免疫疾患;炎症性および過増殖性皮膚疾患;乾癬;乾癬性関節炎;アトピー性皮膚炎;ミオパシー;筋炎;骨髄炎;接触皮膚炎;湿疹性皮膚炎;脂漏性皮膚炎;扁平苔癬;天疱瘡;水疱性類天疱瘡;表皮水疱症;蕁麻疹;血管性浮腫;脈管炎;紅斑;皮膚好酸球増加;アクネ(瘡);強皮症;円形脱毛症;角結膜炎;春季カタル性結膜炎;角膜炎;ヘルペス性角膜炎;角膜上皮性ジストロフィー;角膜白斑;眼部天疱瘡;モーレン潰瘍;潰瘍性角膜炎;強膜炎;グレーブス眼症;フォークト・小柳・原田症候群;類肉腫症;花粉アレルギー;可逆性閉塞性気道疾患;気管支喘息;アレルギー喘息;内因性喘息;外因性喘息;塵埃喘息;慢性または難治性喘息;遅発性喘息および気道過敏症;細気管支炎;気管支炎;子宮内膜症;睾丸炎;胃潰瘍;虚血性腸疾患;炎症性腸疾患;壊死性腸炎;熱傷関連腸病変;セリアック病;直腸炎;好酸球性胃腸炎;肥満細胞症;クローン病;潰瘍性大腸炎;虚血性疾患および血栓症により惹起された血管損傷;アテローム性動脈硬化症;脂肪心;心筋炎;心筋梗塞;大動脈症候群;ウイルス性疾患による悪液質;血管血栓症;偏頭痛;鼻炎;湿疹;間質性腎炎;IgA誘発腎障害;グッドパスチャー症候群;溶血性尿毒症症候群;糖尿病性腎障害;糸球体硬化;糸球体腎炎;尿細管間質性腎炎;間質性膀胱炎;多発筋炎;ギラン・バレ症候群;メニエール病;多発神経炎;多発性神経炎;脊髄炎;単神経炎;神経根障害;甲状腺機能亢進症;バセドウ病;甲状腺中毒症;真性赤血球系無形成症;再生不良性貧血;低形成貧血;特発性血小板減少性紫斑病;自己免疫性溶血性貧血;自己免疫性血小板減少症;顆粒球減少;悪性貧血;巨赤芽球性貧血;赤血球形成不全;骨粗しょう症;肺線維症;特発性間質性肺炎;皮膚筋炎;尋常性白斑;尋常性魚鱗癬;光線過敏症;皮膚T細胞リンパ腫;結節性多発性動脈炎;ハンチントン舞踏病;シデナム舞踏病;心筋症;心筋炎;強皮症;ウェーゲナー肉芽腫;シェーグレン症候群;脂肪過多;好酸球性筋膜炎;歯肉、歯周靱帯、歯槽骨、セメント質の損傷・病変;若はげまたは老年性脱毛;筋ジストロフィー;膿皮症;セザリー症候群;下垂体炎;慢性副腎機能不全;アジソン病;保存時に起る臓器の虚血・再灌流損傷;エンドトキシンショック;偽膜性結腸炎;薬物または放射線による結腸炎;虚血性急性腎不全;慢性腎不全;肺癌;リンパ起源の悪性腫瘍;急性または慢性リンパ球性白血病;リンパ腫;肺気腫;白内障;鉄沈着症;網膜色素変性;老年性黄斑変性;硝子体瘢痕化;角膜アルカリ熱傷;紅斑性皮膚炎;水疱性皮膚炎;セメント皮膚炎;歯肉炎;歯周炎;敗血症;膵炎;抹消動脈疾患;発癌;固形癌腫瘍;癌転移;高山病;自己免疫肝炎;原発性胆汁性肝硬変;硬化性胆道炎;部分肝切除;急性肝壊死;肝硬変;アルコール肝硬変;肝不全;劇症肝不全;遅発性肝不全;「慢性期急性」肝不全からなる群から選ばれるものである。
【0091】
式(I)の化合物により治療および/または予防されるべき、好ましい疾患または障害は、腎臓、肝臓、心臓、肺、膵臓、角膜および皮膚等の移植された臓器に対する拒絶反応;幹細胞移植によりもたらされる移植片対宿主病;関節リウマチ、多発性硬化症、クローン病および潰瘍性大腸炎等の炎症性腸疾患、乾癬、乾癬性関節炎、橋本甲状腺炎等の甲状腺炎、ブドウ膜網膜炎を含む自己免疫症候群;鼻炎、結膜炎、皮膚炎等のアトピー性疾患;喘息;I型糖尿病;リウマチ熱、感染後糸球体腎炎を含む感染後自己免疫疾患;固形癌および腫瘍転移からなる群から選ばれるものである。
【0092】
式(I)の化合物により治療および/または予防されるべき、特に好ましい疾患または障害は、腎臓、肝臓、心臓および肺から選択される移植された臓器に対する拒絶反応;幹細胞移植によりもたらされる移植片対宿主病;関節リウマチ、多発性硬化症、乾癬、乾癬性関節炎、クローン病および橋本甲状腺炎から選択される自己免疫症候群;およびアトピー性皮膚炎からなる群から選ばれるものである。
【0093】
本発明はまた、式(I)の化合物の薬学的に活性な量を患者に投与することを含む、本明細書において言及した疾患もしくは障害の予防または治療のための方法にも関する。
さらにまた、式(I)の化合物は、1つまたはいくつかの免疫調節薬と組み合わせて、本明細書において言及した疾患および障害の予防および/または治療のために有用である。本発明の好ましい態様によれば、前記薬剤は、免疫抑制薬、副腎皮質ステロイド、NSAID、細胞毒、接着分子阻害剤、サイトカイン、サイトカイン阻害剤、サイトカイン受容体アンタゴニストおよび組換えサイトカイン受容体からなる群より選択される。
【0094】
また、本発明は、任意に1つまたはいくつかの免疫調節薬と組み合わせて使用するための、本明細書において言及した疾患および障害の予防または治療のための医薬組成物の製造のための、式(I)の化合物の使用に関する。
【0095】
式(I)の化合物は、以下の方法によって、実施例に示された方法によって、または類似の方法によって製造することができる。最適反応条件は、使用する具体的反応物または溶媒によって変更してもよいが、このような条件は、当業者により、ルーチンの最適化手順によって決定することができる。
【0096】
本発明の式(I)の化合物は、下記に概説した反応の一般的順序に従って製造することができる。式(I)の化合物を生じる合成の可能性のうちの少数のみを記述してある。
【0097】
【化15】

【0098】
Aが-CO-CH=CH-を表す場合には、式(I)の化合物は、構造1の化合物を、塩基または酸の存在下で、構造2の化合物と反応させることにより調製してもよい。残基R3〜R6に存在する官能基は、一時的に保護を必要としてもよく、または縮合反応に続くさらなる工程においてさらに導入してもよい。Aが-CO-CH2CH2-を表す式(I)の化合物は、Aが-CO-CH=CH-を表す式(I)の化合物を、EtOH、MeOH、THFなど、またはそれらの混合物などの溶媒中で、Pd/C、Pt/C、PtO2などの触媒の存在下で、水素と反応させることによって調製してもよい。
【0099】
【化16】

【0100】
構造1の化合物は、構造3の化合物をメチルグリニャール試薬と反応させることにより、または構造4の化合物を、エーテル、THF等の溶媒中で、−20と50℃の間の温度で、2当量のメチルリチウムで処理することにより調製してもよい。構造3のWeinrebアミド化合物は、EDC、DCCなどのカップリング試薬の存在下において、構造4の化合物を塩酸N,O-ジメチルヒドロキシルアミンで処理することによって製造される。(M. Mentzel, H. M. R. Hoffmann, N-Methoxy N-methyl amides (Weinreb amides) in modern organic synthesis, Journal fuer Praktische Chemie/Chemiker-Zeitung 339 (1997), 517-524; J. Singh, N. Satyamurthi, I. S. Aidhen, The growing synthetic utility of Weinreb's amide, Journal fuer Praktische Chemie(Weinheim, Germany) 342 (2000) 340-347; V. K. Khlestkin, D. G. Mazhukin, Recent advances in the application of N,O-dialkyl hydroxylamines in organic chemistry, Current Organic Chemistry 7(2003), 967-993)。
【0101】
【化17】

【0102】
Aが-CO-NH-CH2-を表す式(I)の化合物は、EDC、DCC、TBTU、PyBOPなどのカップリング試薬を用いて、構造5の化合物を構造4の化合物とカップリングすることによって、または構造5の化合物を、構造4の化合物の対応する酸クロリドまたはブロミドとカップリングすることによって、製造してもよい。
【0103】
5-ピリジン-3-イル-[1,2,4]オキサジアゾール誘導体を表す式(I)の化合物は、ジオキサン、THF、DME、キシレン、トルエン、ベンゼン、ピリジン、DMF、DCM、酢酸、TFAなどの溶媒中で、室温または高温にて、酸(たとえば、TFA、酢酸、HCl、その他)、塩基(たとえば、NaH、NaOAc、Na2CO3、K2CO3、NEt3、その他)、テトラアルキルアンモニウム塩または水除去剤(たとえば、塩化オキサリル、カルボン酸無水物、POCl3、PCl5、P4O10、モレキュラーシーブ、Burgess試薬、その他)等の添加剤の存在下または非存在下において、構造6の化合物を反応させることによって製造される(文献: たとえば、A. R. Gangloff, J. Litvak, E. J. Shelton, D. Sperandio, V. R. Wang, K. D. Rice, Tetrahedron Lett.42 (2001), 1441-1443; T. Suzuki, K. Iwaoka, N. Imanishi, Y. Nagakura, K. Miyta, H. Nakahara, M. Ohta, T. Mase, Chem. Pharm. Bull. 47 (1999), 120-122; R. F. Poulain, A. L. Tartar, B. P. Deprez, Tetrahedron Lett. 42 (2001), 1495-1498; R. M. Srivastava, F. J. S. Oliveira, D. S. Machado, R. M. Souto-Maior, Synthetic Commun. 29 (1999), 1437-1450; E. O. John, J. M. Shreeve, Inorganic Chemistry27 (1988), 3100-3104; B. Kaboudin,K. Navaee, Heterocycles60 (2003), 2287-2292)。
【0104】
【化18】

【0105】
構造6の化合物は、DMF、THF、DCMなどの溶媒中で、TBTU、DCC、EDC、HBTU、HOBT、CDIなどの1つまたは複数のカップリング試薬の存在下または非存在下において、およびNEt3、DIPEA、NaH、K2CO3などの塩基の存在下または非存在下において、構造4の化合物を構造7の化合物と反応させることによって製造してもよい(文献: たとえば、A. Hamze, J.-F. Hernandez, P. Fulcrand, J. Martinez, J. Org. Chem. 68 (2003) 7316-7321;および前述の文献)。
【0106】
【化19】

【0107】
3-ピリジン-3-イル-[1,2,4]オキサジアゾール誘導体を表す式(I)の化合物は、構造8の化合物を構造9の化合物と反応させ、続いて対応するヒドロキシアミジンエステル中間体の環化を行うことにより、同様の方法にて製造される。(文献: たとえば、C. T. Brain, J. M. Paul, Y. Loong, P. J. Oakley, Tetrahedron Lett. 40 (1999) 3275-3278)。
【0108】
【化20】

【0109】
構造7および8の化合物は、MeOH、EtOH、ピリジンなどの溶媒中で、Na2CO3、K2CO3、NEt3、KOtBuなどの塩基の存在下または非存在下において、それぞれ構造10および11の化合物をヒドロキシルアミンまたはその塩の1つと反応させることによって製造してもよい(文献: たとえば、T. Suzuki, K. Iwaoka, N. Imanishi, Y. Nagakura, K. Miyta, H. Nakahara, M. Ohta, T. Mase, Chem. Pharm. Bull. 47(1999), 120-122; J. Cui, D. Crich, D. Wink, M. Lam, A. L. Rheingold, D. A. Case, W. T. Fu, Y. Zhou, M. Rao, A. J. Olson, M. E. Johnson, Bioorg. Med. Chem. 11 (2003), 3379-3392; R. Miller, F. Lang, Z. J. Song, D. Zewge, 国際公開公報第 2004/035538号 (Merck & Co., Inc., USA); B. Kaboudin, K. Navaee, Heterocycles 60(2003), 2287-2292)。
【0110】
【化21】

【0111】
構造2、5、6、7、9および10の残基R3〜R6に存在する官能基の性質に応じて、これらの官能基には、一時的な保護が必要であってもよい。適切な保護基は、当業者に公知であり、たとえばアルコールを保護するためのベンジルまたはトリアルキルシリル基、ジオールを保護するためのケタールなどを含む。これらの保護基は、標準的な方法論に従って採用してもよい(たとえば、T. W. Greene, P. G. M. Wuts, Protective Groups in Organic Synthesis, 3rdEdition, Wiley New York, 1991; P. J. Kocienski, Protecting Groups, Thieme Stuttgart, 1994)。あるいは、所望の残基R3〜R6、特にR5は、それぞれ構造2、5、7、9または10の化合物の適切な前駆体を用いることにより、構造1、4、8または11のピリジン化合物の、構造2、5、7、9または10のフェニル誘導体とのカップリングに続く後半の工程で導入してもよい。構造2、5、7、9および10のフェニル化合物またはこれらの前駆体は、商業的に入手可能であるか、または当業者に公知の手順に従って製造される。
【0112】
【化22】

【0113】
2-ピリジン-3-イル-[1,3,4]オキサジアゾールまたは2-ピリジン-3-イル-[1,3,4]チアジアゾール誘導体を表す式(I)の化合物は、構造4の化合物を(TBTU、DCC、EDC、HBTU、PyBOP、HOBt、CDIなどのカップリング試薬を用いて)ヒドラジンと反応させ、構造12の化合物を生成させることにより、同様に製造される。構造12の化合物は、構造9の化合物とカップリングされ、構造13の化合物を与える。構造13の化合物は、逆の反応順序に従うことにより、すなわち、最初に構造9の化合物をヒドラジンとカップリングさせ、続いて対応するヒドラジド中間体を構造4の化合物と反応させることにより製造することもできる。所望の2-ピリジン-3-イル-[1,3,4]オキサジアゾール誘導体を生成させるための構造13の化合物の脱水反応は、トルエン、MeCN、ジオキサン、THF、CHCl3等の溶媒中で、マイクロ波照射の存在下または非存在下、20と120℃の間の温度で、構造13の化合物を、PPh3、P2O5、Burgess試薬等と組み合わせてPOCl3、CCl4またはCBr4等の試薬で処理することにより行われる。(文献: たとえば、 M. A. Garcia, S. Martin-Santamaria, M. Cacho, F. Moreno de la Llave, M. Julian, A. Martinez, B. De Pascual-Teresa, A. Ramos, J. Med. Chem. 48(2005) 4068-4075; C. T. Brain, J. M. Paul, Y. Loong, P. J. Oakley, Tetrahedron Lett. 40 (1999) 3275-3278)。同様に、2-ピリジン-3-イル-[1,3,4]チアジアゾール誘導体は、構造13の化合物を、ピリジン、トルエン、THF、MeCN等の溶媒の存在下または非存在下、マイクロ波照射下または非照射下で、任意にP2S5と組み合わせて、Lawesson試薬にて高温で環化することにより得られる(文献: たとえば、 A. A. Kiryanov, P. Sampson, A. J. Seed, J. Org. Chem. 66 (2001) 7925-7929)。
【0114】
【化23】

【0115】
5-ピリジン-3-イル-オキサゾールまたは5-ピリジン-3-イル-チアゾール誘導体を表す式(I)の化合物は、構造14の化合物を、トルエン、ベンゼン、ジオキサン、THF等の溶媒中、20と120℃の間の温度で、PPh3およびNEt3、トリフルオロ酢酸無水物、Burgess試薬等と組み合わせてPOCl3、PCl5、I2で処理するか、または上述のようにピリジン、トルエン、THF、MeCN等の溶媒の存在下または非存在下、マイクロ波照射下または非照射下で、任意にP2S5と組み合わせて、Lawesson試薬にて高温で処理することにより製造される(文献: たとえば、 N. Sato, T. Shibata, M. Jitsuoka, T. Ohno, T. Takahashi, T. Hirohashi, T. Kanno, H. Iwaasa, A. Kanatani, T. Fukami, Takehiro, Bioorg. & Med. Chem. Lett. 14(2004) 1761-1764)。構造14の化合物は、構造15の化合物を構造9の化合物と反応させることにより製造される。構造15のアミノケトンは、構造1の化合物から、文献(たとえば. J. L. LaMattina, J. Heterocyclic Chem. 20(1983) 533-538; M. Pesson, M. Antoine, P. Girard, J. L. Benichon, S. Chabassier, P. De Lajudie, S. Patte, F. Roquet, G. Montay, Eur. J. Med. Chem. 15 (1980) 263-268)に記載された手順により製造することができる。2-ピリジン-3-イル-オキサゾールまたは2-ピリジン-3-イル-チアゾール誘導体を表す式(I)の化合物は、構造16の化合物および構造4の化合物から同様の方法で製造される。
【0116】
【化24】

【0117】
また、ピリジンまたはフェニル環と中央の5員芳香族複素環との間の結合は、パラジウムで触媒されたクロスカップリング反応を適用することによっても形成することができる。
構造4の化合物を構造11の化合物に変換する方法、またはその逆を行う方法は、当業者に知られている。
構造4の化合物は、5,6-ジクロロニコチン酸エステルを、Fe(acac)3 の存在下、THF、ジオキサン、DMF、NMPなど、またはこれらを組み合わせた溶媒中で、-78から25℃の範囲の温度にて、アルキルグリニャール試薬と反応させることにより製造してもよい(Fuerstnerの条件、文献: たとえば、A. Fuerstner, A. Leitner, M. Mendez, H. Krause J. Am. Chem. Soc. 124(2002) 13856-13863; A. Fuerstner, A. Leitner Angew. Chem. 114(2002) 632-635)。反応条件は、5-クロロ-6-アルキル-ニコチン酸エステルまたは5,6-ジアルキル-ニコチン酸エステルが主生成物として得られるように選択することができる。5,6-ジクロロ-ニコチン酸エステル中の2つの塩素原子は、5,6-ジクロロ-ニコチン酸エステルを、当業者に知られているSuzukiのカップリング条件下で、適宜なアルケニルホウ素誘導体にて処理することにより、段階的にまたは1回の工程で、同一または異なっていてもよい、2つの1-アルケニル基によって置換されてもよい。得られる5,6-ジアルケニル-ニコチン酸エステルは、水素化により、対応する5,6-ジアルキル-ニコチン酸エステルとなる。加えて、FuerstnerとSuzukiの条件を連続的に採用する手順が想定できる。対応する5-クロロ-6-アルコキシ-ニコチン酸エステルを供給するために、5,6-ジクロロニコチン酸エステルは、アルコールまたはアルコラートによって高温で処理されてもよい。最後に、エステル官能基の開裂により、構造4の化合物が得られる。
【0118】
また、R1がメチル基を表す構造4の化合物は、構造17の化合物から、当業者によく知られた方法を用いる対応する6-クロロ-5-メチル-ニコチン酸エステルの形成、それに続く上記のFuerstnerとSuzukiの条件を用いる誘導体化およびその後のエステル基の開裂を介して製造され得る。構造17の化合物は、既知の6-クロロ-3-ホルミル-5-メチル-ピリジン(文献、例えば欧州公開公報第0702003号)から、トルエン、THF、MeCN、アセトン等の溶媒の存在下または非存在下、0と120℃の間の温度で、ギ酸中のH2O2水溶液、KMnO4などの当業者によく知られた酸化剤を用いるホルミル基のカルボン酸への酸化により製造され得る。R1がメチル基を表す構造11の化合物は、上記のように、R1がメチル基を表す構造4の化合物からも;または文献(文献:例えば、J.B.Paine III, J. Heterocyclic Chem. 1987, 351-355)の方法に従っても製造され得る。
【0119】
【化25】

【0120】
式(I)の化合物がエナンチオマーの混合物の形態で得られる場合には常に、エナンチオマーは、当業者に知られた方法、例えばジアステレオマー塩の形成及び分離、またはRegis Whelk-O1(R,R) (10 μm) カラム、 Daicel ChiralCel OD-H (5-10 μm) カラム、またはDaicel ChiralPak IA (10 μm) もしくはAD-H (5 μm) カラム等のキラル固定相上のHPLC、を用いて分離することができる。キラルHPLCの典型的な条件は、0.8から150 mL/分の流速における、溶出液A(EtOH。NEt3、ジエチルアミン等のアミンの存在下または非存在下で)および溶出液B(ヘキサン)の無勾配混合物である。
【実施例】
【0121】
試験の部
I)化学
以下の実施例は、本発明を例証するが、これらの範囲を全く限定しない。
すべての温度は、摂氏度で述べてある。化合物は、1H-NMR(300MHz)または13C-NMR(75MHz)によって(Varian Oxford;化学シフトは、使用する溶媒と関連して、ppmで示してある;多重度:s =一重項、d =二重項、t =三重項;p =四重項、hex= 五重項、hept= 六重項、m =多重項、br =広域、結合定数は、Hzで示してある);LC-MSによって(HP 1100 Binary PumpおよびDADを備えたFinnigan Navigator、カラム:4.6×50 mm、Zorbax SB-AQ、5μm、120Å、勾配:5〜95%のMeCNの水溶液、1分、0.04%のTFAを含む、流速: 4.5 mL/分)、tRは、分で示してある(* またはLC-MS*を付した保持時間は、基本条件、(すなわち13 mMの水酸化アンモニウムを含む水中のMeCNの勾配で溶出し、他は同一条件である。)にて行ったLCを意味する。);TLCによって(MerckからのTLC-プレート、Silica gel 60 F254);または融点によって特徴付けてある。化合物は、調製用HPLCによって(カラム:X-terra RP18、50×19 mm、5μm、勾配:0.5%のギ酸を含む10〜95%のMeCNの水溶液)またはMPLCによって(Labomatic MD-80-100ポンプ、Linear UVIS-201検出器、カラム:350×18 mm、Labogel-RP-18-5s-100、勾配:10%のMeOH水溶液〜100%のMeOH)精製される。ラセミ体は、調製HPLC(カラム:ChiralPaK AD 20x250mm、5μm、ヘキサン中15%EtOH)によってそのエナンチオマーに分離され得る。
【0122】
略語(本明細書で使用したもの)
aq. 水溶液
atm 雰囲気
BSA ウシ血清アルブミン
Burgess試薬 メトキシカルボニルスルファモイルトリエチルアンモニウムヒドロキ シド
CC カラムクロマトグラフィー
CDI カルボニルジイミダゾール
DCC ジシクロヘキシルカルボジイミド
DCM ジクロロメタン
DEAD ジエチル-ジアゾジカルボン酸
DIPEA Huening塩基、ジエチルイソプロピルアミン
DME 1,2-ジメトキシエタン
DMF ジメチルホルムアミド
DMSO ジメチルスルホキシド
dppf 1,1'-ビス(ジフェニルホスフィノ)フェロセン
EA 酢酸エチル
EDC N-(3-ジメチルアミノプロピル)-N'-エチル-カルボジイミド
エーテル ジエチルエーテル
EtOH エタノール
Fe(acac)3 鉄(III)アセチルアセトン -錯体
h 時間
HBTU O-(ベンゾトリアゾール-1-イル)-N,N,N',N'-テトラメチルウロニウム
ヘキサフルオロホスフェート
HOBt 1-ヒドロキシベンゾトリアゾール
HPLC 高速液体クロマトグラフィー
HV 高真空状態
Lawesson試薬 2,4-ビス(4-メトキシフェニル)-1,3,2,4-ジチアジホスフェタン-2,4-
ジスルフィド
LC-MS 液体クロマトグラフィー−質量分析
MeCN アセトニトリル
MeOH メタノール
min 分
MPLC 中圧液体クロマトグラフィー
NaOAc 酢酸ナトリウム
NEt3 トリエチルアミン
NMO N-メチル-モルホリン-N-オキシド
NMP 1-メチル-2-ピロリドン
OAc 酢酸
org. 有機
Ph フェニル
PPh3 トリフェニルホスフィン
PyBOP ベンゾトリアゾール-1-イル-オキシ-トリス-ピロリジノ-ホスホニウ
ム-ヘキサフルオロ-ホスファート
prep. 調製用
rac ラセミ
rt 室温
sat. 飽和
S1P スフィンゴシン1-リン酸
TBME tert.-ブチルメチルエーテル
TBTU 2-(1H-ベンゾトリアゾール-1-イル)-1,2,3,3-テトラメチルウロニウ
ムテトラフルオロホウ酸塩
tert. 第三級
TFA トリフルオロ酢酸
THF テトラヒドロフラン
TLC 薄層クロマトグラフィー
tR 保持時間
中間体の製造
ニコチン酸 1
【0123】
【化26】

【0124】
5,6-ジクロロニコチン酸(1.95 g、10 mmol)を、KOtBu(2.28 g、20 mmol)のイソプロパノール(20 mL)溶液に添加する。混合物を15時間で80℃に加熱する。混合物を水(60 mL)で希釈し、1M HCl水溶液で酸性化する。水溶液をエーテル(5x50 mL)で抽出し、合わせた有機抽出物を乾燥し(Na2SO4)、ろ過し、蒸発させ、5-クロロ-6-イソプロポキシ-ニコチン酸を得る;1H NMR (d6-DMSO) δ-1.38 (d, J = 6.2 Hz, 7 H), 5.44 (hept, J = 6.2 Hz, 1 H), 8.18 (d, J = 2.1 Hz, 1 H), 8.65 (d, J = 2.1 Hz, 1 H)。
ニコチン酸 2
【0125】
【化27】

【0126】
a) 5,6-ジクロロニコチン酸(5.25 g、27.3 mmol)のトルエン(200 mL)懸濁液を80℃に加熱し、その後、ゆっくりとN,N-ジメチルホルムアミド ジ-tert.ブチルアセタール(20.0 g、98.0 mmol)で処理する。混合物はわずかに黄色を帯び、そして澄んでくる。加熱と撹拌を3時間継続した後、溶液を室温に冷却し、エーテルで希釈し、飽和Na2CO3水溶液で洗浄する。有機抽出物をMgSO4上で乾燥し、ろ過し、溶媒を蒸発させる。残渣をMPLC (SiO2)により精製し、5,6-ジクロロニコチン酸 tert.-ブチルエステル(5.13 g)を得る。1H NMR (CDCl3): δ1.62 (s, 9 H), 8.30 (d, J = 2.0 Hz, 1 H), 8.83 (d, J = 2.0 Hz, 1 H)。
【0127】
b) 5,6-ジクロロニコチン酸 tert.-ブチルエステル(3.37 g、13.6 mmol)、Fe(acac)3 (719 mg、2.04 mmol)およびNMP(1.95 g、20 mmol)のTHF(300 mL)溶液に、塩化マグネシウムメチルのTHF溶液(3M、5.4 mL、16.3 mmol)を、-78℃にて、ゆっくりと添加する。茶色の溶液は、懸濁し、黒色になる。撹拌を−75℃で1時間継続した後、0℃に温める。反応は不完全であり、混合物を再び−70℃に冷却する。THF中の臭化マグネシウムメチルのさらなるバッチ(3M、5.4 mL、16.3 mmol)を、−70°Cにてゆっくりと添加する。暗緑色の混合物をゆっくりと−20℃に温め、0.7N HCl(150 mL)水溶液で注意深くクェンチする。混合物をエーテル(5x60mL)で抽出する。合わせた有機抽出物をNa2SO4上で乾燥し、ろ過し、蒸発させ、粗製5-クロロ-6-メチル-ニコチン酸 tert.-ブチルエステルを、黄色の油状物質(4.66 g)として得る;LC-MS: tR = 1.03 min, [M+1]+ = 228.22。
【0128】
c) 5-クロロ-6-メチル-ニコチン酸 tert.-ブチルエステル(3.09 g、13.5 mmol)、Fe(acac)3(719 mg、2.04 mmol)およびNMP(1.95 mL、20 mmol)をTHF(3M, 500 mL)中に溶解し、-78℃に冷却する。臭化マグネシウムイソブチルのTHF溶液(2M、13.6 mmol)を、−75℃にてゆっくりと添加する。茶色の溶液は、懸濁し、黄色になる。撹拌を−75℃で1時間継続した後、ゆっくりと室温に温める。反応は不完全であり、さらなるFe(acac)3(719 mg、2.04 mmol)を添加し、混合物を再び−70℃に冷却する。さらなるTHF中臭化マグネシウムメチル(2M、13.6 mmol)を、−70°Cにてゆっくりと添加する。暗緑色の混合物をゆっくりと室温に温め、15時間撹拌する。混合物を、0.7N HCl(150 mL)水溶液で注意深くクェンチする。混合物をEA(6x60mL)で抽出する。合わせた有機抽出物をNa2SO4上で乾燥し、ろ過し、蒸発させる。残渣を逆相MPLCにより精製し、6-メチル-5-イソブチル-ニコチン酸 tert.-ブチルエステルを、黒色の油状物質(0.50 g)として得る; LC-MS: tR = 0.84 min, [M+1]+ = 250.14。
【0129】
d) 6-メチル-5-イソブチル-ニコチン酸 tert.-ブチルエステル(0.50 g、2 mmol)の溶液をジオキサン(20 mL)に溶解し、4N HClのジオキサン中溶液(30 mL)を添加する。混合物を3時間撹拌する。溶媒を蒸発させ、6-メチル-5-イソブチル-ニコチン酸 塩酸塩(0.52 g)を得る;LC-MS: tR = 0.54 min; [M+1]+ =194.29; 1H NMR (d6-DMSO) δ0.91 (d, J = 6.5 Hz, 6 H), 1.91 (hept, J = 6.5 Hz), 2.68 (d, J = 7.3 Hz, 2 H), 2.73 (s, 3 H), 8.47 (d, J = 1.8 Hz, 1 H), 8.90 (d, J = 2.0 Hz, 1 H)。
ニコチン酸3
【0130】
【化28】

【0131】
a) 5,6-ジクロロニコチン酸 tert.-ブチルエステル(5.00 g、20.0 mmol)および2,4,6-トリビニルシクロトリボロキサン ピリジン錯体(9.700 mg、40 mmol)のジオキサン(30 mL)溶液に、2M K2CO3水溶液(6 mL)、続いてPd(PPh3)4(620 mg、0.38 mmol)およびPPh3(620 mg、3.8 mmol)を添加する。混合物を100℃で2時間撹拌し、室温に冷却し、そしてエーテル(200 mL)で希釈する。混合物を1M NaOH水溶液(2x50 mL)および塩水(50 mL)で抽出する。有機相を乾燥し(Na2SO4)、ろ過し、蒸発させる。残渣をFC (SiO2、EA-ヘプタン)で精製し、5-クロロ-6-ビニル-ニコチン酸 tert.-ブチルエステル(4.0 g)を、黄色の油状物質として得る; LC-MS: tR = 1.05 min, [M+1+CH3CN]+= 281.36。
【0132】
b) 5-クロロ-6-ビニル-ニコチン酸 tert.-ブチルエステル(2.0 g)、Cs2CO3 (3.4 g)、トリ(tert.-ブチル)ホスフィン(0.04当量)、トリス(ジベンジリデンアセトン)ジパラジウム(0.02 当量)および2,4,6-トリビニルシクロトリボロキサン ピリジン錯体(2.0 g)のジオキサン(30 mL)中混合物を脱気し、15時間で100℃に加熱する。混合物を室温に冷却し、エーテル(200 mL)で抽出する。混合物を、1M NaOH水溶液(2x50 mL)および塩水(50 mL)で抽出する。有機相を乾燥し(Na2SO4)、ろ過し、蒸発させる。残渣をFC (SiO2、EA-ヘプタン)で精製し、5,6-ジビニル-ニコチン酸 tert.-ブチルエステル(0.89 g)を、油状物質として得る LC-MS: tR = 1.01 min, [M+1]+ = 232.04。
【0133】
c) いくらかのMeOHを含む5,6-ジビニル-ニコチン酸 tert-ブチルエステル(890 mg、3.8 mmol)のTHF溶液(20 mL)に、Pd/C (100 mg、10% Pd)を添加し、混合物を1atmのH2下、室温で3時間撹拌する。触媒をろ過除去し、ろ液を蒸発させる。残った残渣をFC (SiO2、EA-ヘプタン)で精製し、5,6-ジエチル-ニコチン酸 tert-ブチルエステル(860 mg)を油状物質として得る; LC-MS: tR = 0.79 min, [M+1]+ = 236.14。
【0134】
d) 5,6-ジエチル-ニコチン酸 tert-ブチルエステル(860 mg、3.65 mmol)の6N HCl水溶液(15 mL)を、65℃で3時間撹拌した後、溶媒を蒸発させる。残渣をHV下で乾燥し、5,6-ジエチル-ニコチン酸 塩酸塩(923 mg)を油状物質として得る; LC-MS: tR = 0.50 min, [M+1]+= 180.05。
ニコチン酸4
【0135】
【化29】

【0136】
5-クロロ-6-ビニル-ニコチン酸 tert.-ブチルエステルおよび、F. Kerins, D. F. O'Shea J. Org. Chem. 67(2002) 4968-4971)に記載された手順と同様に製造される、2,4,6-トリ-(2-メチル-プロペニル)-シクロボロキサン ピリジン錯体から、ニコチン酸3と同様に、6-エチル-5-イソブチル-ニコチン酸を製造する; LC-MS: tR = 0.64 min, [M+1]+ =207.98。
ニコチン酸5
【0137】
【化30】

【0138】
a) 5,6-ジクロロニコチン酸(5.0 g、26 mmol)の乾燥EtOH(300 mL)およびクロロトリメチルシラン(33 mL、10当量)中の溶液を、室温で16時間撹拌する。溶媒を蒸発させ、残渣をエーテル(200 mL)に溶解させ、飽和Na2CO3水溶液(75 mL)および塩水(50 mL)で洗浄する。有機相をNa2SO4上で乾燥し、ろ過し、蒸発させ、5,6-ジクロロニコチン酸 エチルエステル(5.8 g)を固体として得る; LC-MS: tR = 0.96 min, [M+1]+= 219.93。
【0139】
b) 5,6-ジクロロニコチン酸 エチルエステル(0.8 g、3.6 mmol)および2,4,6-トリ-(2-メチル-プロペニル)-シクロボロキサン ピリジン 錯体(1.78 g、5.49 mmol)のDME(20 mL)溶液に、2M K2CO3水溶液(5 mL)、続いてPd(PPh3)4(50 mg、0.068 mmol)およびPPh3(110 mg、0.68 mmol)を添加する。混合物を100℃で2日撹拌した後、室温に冷却し、エーテル(100 mL)で希釈する。相を分離し、水相をエーテル(50 mL)で再抽出する。合わせた有機抽出物を、1M NaOH水溶液(2x40 mL)および塩水(40 mL)で洗浄し、乾燥し(Na2SO4)、ろ過し、蒸発させる。粗生成物をFC (SiO2、EA-ヘプタン)で精製し、5,6-ジ(2-メチル-プロペニル)-ニコチン酸 エチルエステル(52 mg)を無色の油状物質として得る; LC-MS: tR =1.11 min, [M+1]+ = 260.24。
【0140】
c) 5,6-ジ(2-メチル-プロペニル)-ニコチン酸 エチルエステル(52 mg、0.3 mmol)をTHF(10 mL)に溶解し、Pd/C (20 mg、10% Pd)を添加し、混合物を1atmのH2下、室温で15時間撹拌する。触媒をろ過除去し、ろ液を蒸発させ、5,6-ジイソブチル-ニコチン酸 エチルエステル(52 mg)を油状物質として得る; LC-MS: tR = 1.12 min, [M+1]+ = 264.19。
【0141】
d) 5,6-ジイソブチル-ニコチン酸 エチルエステル(52 mg、0.2 mmol)の6N HCl水溶液(2 mL)を、65℃で15時間撹拌した後、室温に冷却し、エーテル(2x10 mL)で抽出する。水相を蒸発させ、残渣をHV下で乾燥し、5,6-ジイソブチル-ニコチン酸 塩酸塩(0.12 g)を無色の油状物質として得る; LC-MS: tR = 0.73 min; [M+1]+= 236.40。
ニコチン酸6
【0142】
【化31】

【0143】
a) ホスホロキシ塩化物(183 mL、2 mol)を90℃で加熱し、商業的に入手可能な2-メチル-2-ブテンニトリル(73 g、0.9 mol)およびDMF(154 mL、2 mol)の混合物を、温度を100から110℃に保ちながら、ゆっくりと添加する。混合物を110℃で15時間撹拌し、室温に冷却し、DCM(500 mL)で希釈する。混合物を0℃で冷却し、水(500 mL)で注意深くクェンチする。相を分離し、水相をDCM (合わせて800 mL)で抽出する。合わせた有機抽出物を乾燥し(Na2SO4)、ろ過し、蒸発させる。残渣をシクロヘキサンから結晶化させ、6-クロロ-3-ホルミル-5-メチル-ピリジン(28.3 g)を、薄黄色の結晶として得る; LC-MS: tR = 0.76 min, [M+1]+ = 156.14。
【0144】
b) 6-クロロ-3-ホルミル-5-メチル-ピリジン(10 g、64 mmol)のギ酸溶液(200 mL)を0℃に冷却し、50重量%のH2O2水溶液(9.6 mL, 360 mmol)を、この温度で添加する。混合物を0℃で15時間撹拌し、水(200 mL)で注意深く希釈し、DCM(8x100 mL)で抽出する。合わせた有機抽出物を1M HCl水溶液(100 mL)で洗浄し(残留過酸化物をチェックし)、乾燥し(MgSO4)、ろ過し、蒸発させる。残渣を乾燥し、6-クロロ-5-メチル-ニコチン酸(9.56 g)を得る; LC-MS: tR = 0.72 min, [M+1]+ = 172.0。
【0145】
c) 数滴の濃硫酸を含む、6-クロロ-5-メチル-ニコチン酸(13.85 g、80.75 mmol)の乾燥EtOH(200 mL)溶液を、還流下、2日間撹拌する。溶液を室温に冷却し、溶媒を蒸発させ、残渣をEA(200 mL)に溶解し、飽和Na2CO3水溶液(2x80 mL)、1M KHSO4水溶液(2x80 mL)および塩水(50 mL)で洗浄する。有機相をMgSO4上で乾燥し、ろ過し、蒸発させ、6-クロロ-5-メチル-ニコチン酸 エチルエステル(12.65 g)を固体として得る; LC-MS: tR= 0.92 min; [M+1]+ = 200.10; 1H NMR (CDCl3) δ1.43 (t, J = 7.0 Hz, 3 H), 2.46 (s, 3 H), 4.43 (q, J = 7.3 Hz, 2 H), 8.16 (m, 1 H), 8.84 (d, J = 2.0 Hz, 1 H)。
【0146】
d) 6-クロロ-5-メチル-ニコチン酸 エチルエステル(4.98 g、24.9 mmol)、2,4,6-トリ-(2-メチル-プロペニル)-シクロボロキサン ピリジン 錯体(5.74 g、17.7 mmol、F. Kerins, D. F. O'Shea J. Org. Chem. 67(2002) 4968-4971に記載された手順と同様に製造する)およびPPh3(1.15 g、4.4 mmol)のDME(60 mL)溶液に、2M K2CO3水溶液(20 mL)を添加する。混合物を脱気し、N2でフラッシュした後、Pd(PPh3)4(460 mg、0.4 mmol)を添加する。混合物を90℃で20時間撹拌した後、室温に冷却し、EA(150 mL)で希釈し、飽和NaHCO3水溶液(2x50 mL)で洗浄する。有機抽出物をMgSO4上で乾燥し、ろ過し、蒸発させる。粗生成物をFC (SiO2, ヘプタン-EA)で精製し、5-メチル-6-(2-メチル-プロペニル)-ニコチン酸 エチルエステル(3.98 g)をオレンジ色の油状物質として得る; LC-MS: tR = 0.72 min, [M+1]+ = 220.15。
【0147】
e) 5-メチル-6-(2-メチル-プロペニル)-ニコチン酸 エチルエステル(3.98 g、18.2 mmol)をTHF(100 mL)およびMeOH(100 mL)中に溶解し、Pd/C(500 mg、10% Pd)を添加し、混合物を1atmのH2下、室温で15時間撹拌する。触媒をろ過除去し、ろ液を蒸発させ、6-イソブチル-5-メチル-ニコチン酸 エチルエステル(3.76 g)を、無色の油状物質として得る; LC-MS: tR = 0.75 min; [M+1]+ = 222.15; 1H NMR (CDCl3) δ0.97 (d, J = 6.8 Hz, 6 H), 1.42 (t, J = 7.3 Hz, 3 H), 2.20 (hept, J = 6.8 Hz, 1H), 2.38 (s, 3 H), 2.75 (d, J = 7.0 Hz, 2 H), 4.41 (q, J = 7.3 Hz, 2 H), 8.03 (d, J = 1.8 Hz, 1 H), 9.00 (d, J = 2.0 Hz, 1 H)。
【0148】
f) 6-イソブチル-5-メチル-ニコチン酸 エチルエステル(3.75 g、16.95 mmol)の12.5% HCl水溶液(50 mL)中の溶液を、65℃で24時間撹拌した後、溶媒を蒸発させる。残渣をHV下で乾燥し、6-イソブチル-5-メチル-ニコチン酸 塩酸塩(3.55 g)を白色粉末として得る; LC-MS: tR = 0.57 min, [M+1]+ = 194.25。
ニコチン酸7
【0149】
【化32】

【0150】
5-メチル-6-プロピル-ニコチン酸(塩酸塩として1.85g)を、6-クロロ-5-メチル-ニコチン酸 エチルエステル(2.0 g)および、商業的に入手可能な、trans-1-プロペン-1-イルボロン酸(1.3 g)から、ニコチン酸6と同様に製造する;1H NMR (d6-DMSO) δ0.96 (t, J = 7.3 Hz, 3 H), 1.72 (m, 2 H), 3.05 (t, J = 7.5 Hz, 2 H), 8.66 (m, 1 H), 8.86 (d, J = 1.5 Hz, 1 H)。
ニコチン酸8
【0151】
【化33】

【0152】
6-イソブチル-ニコチン酸を、商業的に入手可能な6-クロロニコチン酸 エチルエステルおよび塩化マグネシウムイソブチルから、ニコチン酸2と同様に製造する; LC-MS: tR = 0.52 min, [M+1]+ = 180.30。
ニコチン酸9
【0153】
【化34】

【0154】
a) 5,6-ジクロロニコチン酸 エチルエステル(2.40 g、10.9 mmol)および2,4,6-トリス-(2-メチル-プロペニル)-シクロトリボロキサン ピリジン 錯体(2.02 g、6.22 mmol、F. Kerins, D. F. O'Shea J. Org. Chem. 67 (2002) 4968-4971に記載の手順と同様に製造する。)のジオキサン(40 mL)および2M K2CO3水溶液(10 mL)中の溶液に、PPh3(114 mg、0.436 mmol)を添加する。混合物を脱気し、N2下に置いた後、Pd(PPh3)4(160 mg、0.218 mmol)を添加する。混合物を100℃で1.5時間撹拌後、別量の2,4,6-トリス-(2-メチル-プロペニル)-シクロトリボロキサン ピリジン 錯体(1.01 g、3.11 mmol)を添加する。撹拌を100℃で3時間継続した後、混合物を室温に冷却し、エーテルで希釈し、1N NaOH水溶液、続いて水で洗浄し、MgSO4上で洗浄し、ろ過し、濃縮する。粗生成物を、ヘプタン:EA 9:1で溶出するシリカゲル上のCCで精製し、5-クロロ-6-(2-メチル-プロペニル)-ニコチン酸 エチルエステル(2.4 g)を、油状物質として得る; LC-MS: tR = 1.05 min, [M+1]+ = 240.02。この物質のジオキサン(40 mL)溶液に、2,4,6-トリビニルシクロトリボロキサン ピリジン 錯体(1.84 g、7.63 mmol)、Cs2CO3(4.62 g、14.2 mmol)、続いてトリ-tert-ブチルホスフィン(88 mg、0.436 mmol)を添加する。混合物を脱気し、N2下に置いた後、Pd2(dba)3(200 mg、0.218 mmol)を添加する。混合物を100℃で16時間撹拌した後、別量の2,4,6-トリビニルシクロトリボロキサン ピリジン 錯体(1.84 g、7.63 mmol)およびPd2(dba)3(200 mg、0.218 mmol)を添加する。撹拌を100℃で24時間継続した後、混合物をEAで希釈し、1N NaOH水溶液で洗浄し、MgSO4上で乾燥し、ろ過し、濃縮する。粗生成物を、ヘプタン:EA 10:1で溶出するシリカゲル上のCCで精製し、最初の分量の6-(2-メチル-プロペニル)-5-ビニル-ニコチン酸 エチルエステルを得る。加えて、未反応の5-クロロ-6-(2-メチル-プロペニル)-ニコチン酸 エチルエステルを分離する。この物質を再び、上記のように、2,4,6-トリビニルシクロトリボロキサン ピリジン 錯体で処理した後、ワークアップ、精製を行い、二つの分量を合わせて、6-(2-メチル-プロペニル)-5-ビニル-ニコチン酸 エチルエステル(1.37 g)を油状物質として得る; LC-MS: tR= 0.87 min, [M+1]+ = 232.13。
【0155】
b) 6-(2-メチル-プロペニル)-5-ビニル-ニコチン酸 エチルエステル(1.37 g、6.74 mmol)のTHF(20 mL)溶液に、Pd/C (100 mg、10% Pd)、続いてEtOH(20 mL)を添加する。混合物を、1atmのH2下、室温で24時間撹拌する。触媒をろ過除去し、ろ液を濃縮する。粗生成物を、ヘプタン:EA 4:1で溶出するシリカゲル上のCCで精製し、5-エチル-6-イソブチル-ニコチン酸 エチルエステル(970 mg)を、無色の油状物質として得る, LC-MS: tR = 0.79 min, [M+1]+ = 236.20; 1H NMR (CDCl3): δ0.97 (d, J = 6.8 Hz, 6 H), 1.27 (t, J = 7.5 Hz, 3 H), 1.42 (t, J = 7.0 Hz, 3 H), 2.17-2.28 (m, 1 H), 2.69-2.78 (m, 4 H), 4.42 (q, J= 7.0 Hz, 2 H), 8.07 (s, 1 H), 9.00 (s, 1 H)。
【0156】
c) 5-エチル-6-イソブチル-ニコチン酸 エチルエステル(970 mg、4.12 mmol)の25% HCl水溶液中の溶液を、95℃で8時間撹拌する。溶媒を蒸発させ、残渣を高真空下で乾燥し、5-エチル-6-イソブチル-ニコチン酸 塩酸塩(1.15 g、おそらく水和物として)を、無色の樹脂として得る LC-MS: tR = 0.62 min, [M+1]+ = 208.35。
ニコチン酸10
【0157】
【化35】

【0158】
6-(3-メチル-ブチル)-ニコチン酸を、6-クロロ-ニコチン酸 tert-ブチルエステルを、臭化マグネシウム3-メチル-ブチルと、ニコチン酸2について記載したように、Fuerstnerの条件で反応させることにより製造する; LC-MS: tR = 0.58 min, [M+1]+ = 194.30。
ニコチン酸11
【0159】
【化36】

【0160】
a) tert.ブチル酸カリウム塩(1.26 g、11.3 mmol)のイソプロパノール(30 mL)溶液に、2,5-ジブロモ-3-ピコリン(2.89 g、11.3 mmol)を添加する。混合物を80℃で15時間撹拌した後、別量のtert.-ブチル酸カリウム塩(2.53 g、27.5 mmol)を添加する。撹拌を80℃で24時間継続した後、混合物を飽和NaHCO3水溶液で希釈する。混合物をエーテルで抽出し、有機抽出物をMgSO4上で乾燥し、ろ過し、濃縮する。粗生成物を、ヘプタン:EA 9:1で溶出するシリカゲル上のCCで精製し、5-ブロモ-2-イソプロポキシ-3-メチル-ピリジン(1.24 g)を、無色の油状物質として得る; LC-MS: tR = 1.06 min; [M+1]+ = 230.00; 1H NMR (CDCl3): δ1.35 (d, J = 6.3 Hz, 6 H), 2.16 (s, 3 H), 5.27 (hept, J = 6.3 Hz, 1H), 7.48 (d, J = 1.5 Hz, 1 H), 8.02 (d, J = 2.0 Hz, 1 H)。
【0161】
b) 5-ブロモ-2-イソプロポキシ-3-メチル-ピリジン(1.24 g、5.39 mmol)および2,4,6-トリビニルシクロトリボロキサン ピリジン 錯体(1.27 g、5.26 mmol)のDME(12 mL)および2M K2CO3(5 mL)水溶液中の溶液を脱気し、アルゴン下に置いた後、Pd(PPh3)4(112 mg、0.097 mmol)を添加する。混合物を80℃で15時間撹拌した後、室温に冷却し、エーテル(50 mL)で希釈し、飽和NaHCO3水溶液(2x30 mL)で洗浄し、MgSO4上で乾燥し、ろ過し、濃縮する。粗生成物を、ヘプタン:EA 9:1で溶出するシリカゲル上のCCで精製し、2-イソプロポキシ-3-メチル-5-ビニル-ピリジン(703 mg)を、薄黄色の油状物質として得る; LC-MS: tR = 1.01 min; [M+1]+ = 178.11。
【0162】
c) 2-イソプロポキシ-3-メチル-5-ビニル-ピリジン(703 mg、3.97 mmol)のアセトン(80 mL)溶液に、KMnO4(1.60 g、10.1 mmol)を添加し、混合物を室温で18時間撹拌する。暗茶色の懸濁液をろ過し、澄んだ無色のろ液を乾燥するまで蒸発させ、6-イソプロポキシ-5-メチル-ニコチン酸(1.06 g、カリウム塩として)を、薄灰色の固体として得る; LC-MS: tR = 0.86 min; [M+1]+ = 196.09; 1H NMR (D2O): δ1.31 (d, J = 6.3 Hz, 6 H), 2.14 (s, 3 H), 5.15 (hept, J = 7.0 Hz, 1H), 7.91 (s, 1 H), 8.34 (s, 1 H)。
N-ヒドロキシ-6-イソブチル-5-メチル-ニコチンアミジン
【0163】
【化37】

【0164】
a) 6-イソブチル-5-メチル-ニコチン酸 エチルエステル(2.86 g、12.9 mmol)の7N NH3、MeOH(80 mL)溶液中の溶液を、60℃で20時間撹拌後、溶媒を真空除去する。残渣を乾燥し、6-イソブチル-5-メチル-ニコチンアミド(1.89 g)を、黄色の油状物質として得る; LC-MS: tR = 0.66 min, [M+1]+ = 193.29; 1H NMR (D6-DMSO): δ0.91 (d, J = 6.5 Hz, 6 H), 2.08-2.20 (m, 1 H), 2.32 (s, 3 H), 2.65 (d, J = 7.3 Hz, 2 H), 7.43 (s, 1 H), 7.95 (s, 1 H), 8.01 (m, 1 H), 8.78 (s, 1 H).
b) 6-イソブチル-5-メチル-ニコチンアミド(1.89 g、9.85 mmol)のDCM(40 mL)およびピリジン(2.83 g、39.4 mmol)中の溶液に、TFA 無水物(5.17 g、24.6 mmol)を、0℃にて少しづつ添加する。混合物を室温で24時間撹拌し、DCMで希釈し、水、4% クエン酸水溶液、続いて飽和NaHCO3水溶液で洗浄する。有機抽出物をMgSO4上で乾燥し、ろ過し、濃縮する。粗生成物を、ヘプタン:EA 9:1で溶出するシリカゲル上のCCで精製し、6-イソブチル-5-メチル-ニコチノニトリル(1.35 g)を、白色の固体として得る; LC-MS: tR = 0.89 min, [M+1]+ = 175.11。
【0165】
c) tert-ブチル酸カリウム塩(3.04 g、27.1 mmol)のMeOH(60 mL)溶液に、ヒドロキシルアミン 塩酸塩(1.62 g、23.2 mmol)を、0℃にて添加する。この懸濁液に、6-イソブチル-5-メチル-ニコチノニトリル(1.35 g、7.75 mmol)を添加する。混合物を3時間還流し、室温に冷却し、ろ過し、そしてろ液を乾燥するまで蒸発させる。残渣を少量の水に懸濁し、EAで抽出する。有機抽出物を濃縮し、高真空下で乾燥し、N-ヒドロキシ-6-イソブチル-5-メチル-ニコチンアミジン(1.53 g)を、薄黄色の油状物質として得る; LC-MS: tR = 0.68 min, [M+1]+= 208.22; 1H NMR (D6-DMSO): δ0.91 (d, J = 6.8 Hz, 6 H), 2.06-2.17 (m, 1 H), 2.29 (s, 3 H), 2.61 (d, J = 7.0 Hz, 2 H), 5.85 (s br, 2 H), 7.76 (s, 1 H), 8.60 (s, 1 H), 9.68 (s, 1 H)。
N-ヒドロキシ-6-イソプロポキシ-5-メチル-ニコチンアミジン
【0166】
【化38】

【0167】
表題化合物を、ニコチン酸11から、N-ヒドロキシ-6-イソブチル-5-メチル-ニコチンアミジンと同様に製造する; LC-MS: tR = 0.64 min, [M+1]+ = 210.08。
4-アリルオキシ-N-ヒドロキシ-ベンズアミジン
【0168】
【化39】

【0169】
表題化合物を、商業的に入手可能な4-ヒドロキシ-ベンゾニトリルをアリル化し、続いてニトリルをヒドロキシアミジンに変換することにより、4-アリルオキシ-N-ヒドロキシ-3,5-ジメチル-ベンズアミジンと同様に製造する; LC-MS: tR = 0.59 min, [M+1]+ = 193.58。
4-アリルオキシ-N-ヒドロキシ-2-メチル-ベンズアミジン
【0170】
【化40】

【0171】
表題化合物を、商業的に入手可能な4-ヒドロキシ-2-メチル-ベンズアルデヒドから、4-アリルオキシ-3-エチル-N-ヒドロキシ-5-メチル-ベンズアミジンと同様に製造する; LC-MS: tR = 0.62 min, [M+1]+ = 207.10; 13C NMR (CDCl3): δ20.72, 68.91, 104.72, 112.75, 116.45, 118.32, 118.53, 132.25, 134.19, 144.09, 161.71。
4-アリルオキシ-N-ヒドロキシ-2-メトキシ-ベンズアミジン
【0172】
【化41】

【0173】
表題化合物を、商業的に入手可能な4-ヒドロキシ-2-メトキシ-ベンズアルデヒドから、文献の手順(3-エチル-4,N-ジヒドロキシ-5-メチル-ベンズアミジンについて引用された参考文献)に従って製造する; LC-MS: tR = 0.64 min; [M+1]+ = 223.24; 1H NMR (D6-DMSO): δ9.33 (s br, 1H), 7.30 (d, J =8.2 Hz, 1H), 6.60 (d, J = 2.3 Hz, 1H), 6.50 (dd, J = 2.3, 8.2 Hz, 1H), 6.10-5.94 (m, 1H), 5.50 (s, 2H), 5.40 (d, J = 17.0 Hz, 1H), 5.24 (d, J = 10.6 Hz, 1H), 4.57 (d, J = 4.7 Hz, 2H), 3.76 (s, 3H)。
4-アリルオキシ-N-ヒドロキシ-3-メトキシ-ベンズアミジン
【0174】
【化42】

【0175】
表題化合物を、商業的に入手可能な4-ヒドロキシ-3-メトキシ-ベンゾニトリルをアリル化し、続いてニトリルをヒドロキシアミジンに変換することにより、4-アリルオキシ-N-ヒドロキシ-3,5-ジメチル-ベンズアミジンと同様に製造する; LC-MS: tR = 0.59 min, [M+1]+ = 223.18。
4-アリルオキシ-3-ブロモ-N-ヒドロキシ-ベンズアミジン
【0176】
【化43】

【0177】
表題化合物を、商業的に入手可能な3-ブロモ-4-ヒドロキシ-ベンゾニトリルをアリル化し、続いてニトリルをヒドロキシアミジンに変換することにより、4-アリルオキシ-N-ヒドロキシ-3,5-ジメチル-ベンズアミジンと同様に製造する; LC-MS: tR = 0.68 min, [M+1]+ = 270.96。
4-アリルオキシ-3-クロロ-N-ヒドロキシ-5-メチル-ベンズアミジン
【0178】
【化44】

【0179】
表題化合物を、商業的に入手可能な3-クロロ-4-ヒドロキシ-5-メチル-ベンズアルデヒドから、4-アリルオキシ-3-エチル-N-ヒドロキシ-5-メチル-ベンズアミジンと同様に製造する; LC-MS: tR = 0.69 min, [M+1]+ = 241.10。
4-アリルオキシ-N-ヒドロキシ-3,5-ジメチル-ベンズアミジン
【0180】
【化45】

【0181】
表題化合物を、商業的に入手可能な4-ヒドロキシ-3,5-ジメチル-ベンゾニトリルを、室温にて、イソプロパノール中NaOHの存在下、臭化アリルでアリル化することにより製造する。ニトリルは、文献の手順に従ってヒドロキシアミジンに変換される。(例えば、E. Meyer, A. C. Joussef, H. Gallardo, Synthesis 2003, 899-905); 1H NMR (CD3OD): δ7.27 (s, 2 H), 6.10 (m, 1 H), 5.42 (m, 1 H), 5.26 (m, 1 H), 4.31 (dt, J = 5.6, 1.5 Hz, 2 H), 2.29 (s, 6 H)。
4-アリルオキシ-3-エチル-N-ヒドロキシ-5-メチル-ベンズアミジン
【0182】
【化46】

【0183】
表題化合物を、文献の手順(3-エチル-4,N-ジヒドロキシ-5-メチル-ベンズアミジンを見よ。)に従って2-エチル-6-メチル-フェノールから製造される3-エチル-4-ヒドロキシ-5-メチル-ベンズアルデヒドをアリル化することにより製造する。アルデヒドは、文献の手順(3-エチル-4,N-ジヒドロキシ-5-メチル-ベンズアミジンを見よ。)に従って、対応するヒドロキシアミジンに変換される; LC-MS: tR = 0.72 min; [M+1]+ = 235.09; 1H NMR(CD3OD):δ 7.31 (s, 1 H), 7.29 (s, 1 H), 6.10 (m, 1 H), 5.43 (dd, J = 17.0, 1.5 Hz, 1 H), 5.27 (dd, J = 10.3, 1.2 Hz, 1 H), 4.81 (s br, 3H), 4.31 (d, J = 5.6 Hz, 2 H), 2.67 (q, J = 7.6 Hz, 2 H), 2.30 (s, 3 H), 1.23 (t, J = 7.6 Hz, 4 H)。
4-アリルオキシ-3-クロロ-N-ヒドロキシ-5-メトキシ-ベンズアミジン
【0184】
【化47】

【0185】
表題化合物を、商業的に入手可能な3-クロロ-4-ヒドロキシ-5-メトキシベンズアルデヒド(4-アリルオキシ-3-エチル-N-ヒドロキシ-5-メチル-ベンズアミジンを見よ。)をアリル化することにより製造する。アルデヒドは、文献の手順(3-エチル-4,N-ジヒドロキシ-5-メチル-ベンズアミジンを見よ。)に従って、対応するヒドロキシアミジンに変換される; LC-MS: tR = 0.69 min; [M+1]+ = 257.26。
4,N-ジヒドロキシ-3,5-ジメチル-ベンズアミジン
【0186】
【化48】

【0187】
表題化合物を、商業的に入手可能な4-ヒドロキシ-3,5-ジメチル-ベンゾニトリルから、文献の手順(例えばE. Meyer, A. C. Joussef, H. Gallardo, Synthesis2003, 899-905)に従って製造する; 1H NMR (CD3OD):δ 7.20 (s, 2H), 2.20 (s, 6H)。
3-エチル-4,N-ジヒドロキシ-5-メチル-ベンズアミジン
【0188】
【化49】

【0189】
表題化合物を、商業的に入手可能な2-エチル-6-メチル-フェノールから、文献の手順(G. Trapani, A. Latrofa, M. Franco, C. Altomare, E. Sanna, M. Usala, G. Biggio, G. Liso, J. Med. Chem. 41 (1998) 1846-1854; A. K. Chakraborti, G. Kaur, Tetrahedron55 (1999) 13265-13268; E. Meyer, A. C. Joussef, H. Gallardo, Synthesis 2003, 899-905)に従って製造する; LC-MS: tR = 0.55 min; 1H NMR (d6-DMSO):δ 9.25 (s br, 1H), 7.21 (s, 2H), 5.56 (s, 2H), 2.55 (q, J = 7.6 Hz, 2H), 2.15 (s, 3H), 1.10 (t, J = 7.6 Hz, 3H)。
3,5-ジエチル-4,N-ジヒドロキシ-ベンズアミジン
【0190】
【化50】

【0191】
表題化合物を、商業的に入手可能な2,6-ジエチルアニリンから、分嫌の手順(G. G. Ecke, J. P. Napolitano, A. H. Filbey, A. J. Kolka, J. Org. Chem. 22 (1957) 639-642;および3-エチル-4,N-ジヒドロキシ-5-メチル-ベンズアミジンについて引用された文献)に従って製造する; LC-MS: tR = 60 min; [M+1]+= 209.46。
3-クロロ-4,N-ジヒドロキシ-5-メトキシ-ベンズアミジン
【0192】
【化51】

【0193】
表題化合物を、商業的に入手可能な3-クロロ-4-ヒドロキシ-5-メトキシ-ベンズアルデヒドから、3-エチル-4,N-ジヒドロキシ-5-メチル-ベンズアミジンについて引用された文献と同様に製造する; LC-MS: tR = 0.49 min; [M+1]+= 216.96; 1H NMR (D6-DMSO):δ 3.84 (s, 3 H), 5.79 (s, 2 H), 7.22 (d, J = 1.5 Hz, 1 H), 7.27 (d, J = 1.8 Hz, 1 H), 9.52 (s, 1 H), 9.58 (s br, 1 H)。
[4-(N-ヒドロキシカルバミミドイル)-フェニル]-酢酸
【0194】
【化52】

【0195】
a) メチル (4-シアノフェニル)アセテート(4.00 g、27.8 mmol)のMeOH (20 mL)溶液に、ヒドロキシアミン 塩酸塩(3.17 g、45.7 mmol)およびNaHCO3 (3.84 g、45.7 mmol)を添加する。懸濁液を60℃で18時間撹拌した後、ろ過し、ろ液を濃縮する。残渣をDCMに溶解し、水、続いて塩水で洗浄し、MgSO4上で乾燥し、ろ過し、濃縮し、乾燥して、メチル [4-(N-ヒドロキシカルバミミドイル)-フェニル]-アセテート(3.67 g)を、無色の油状物質として得る;LC-MS: tR= 0.50 min, [M+1]+ = 209.05。
【0196】
b) メチル[4-(N-ヒドロキシカルバミミドイル)-フェニル]-アセテート(3.67 g、17.6 mmol)の25% HCl (15 mL)水溶液中の溶液を65℃で4時間撹拌する。溶媒を真空除去し、残渣を高真空下で乾燥し、[4-(N-ヒドロキシカルバミミドイル)-フェニル]-酢酸(3.80 g、おそらく塩酸塩として)を黄色の固体として得る; LC-MS: tR= 0.34 min, [M+1]+ = 195.05。
{4-[5-(6-イソブチル-5-メチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-フェニル}-酢酸
【0197】
【化53】

【0198】
ニコチン酸 6および[4-(N-ヒドロキシカルバミミドイル)-フェニル]-酢酸から、実施例13と同様に、表題化合物を製造する; LC-MS: tR = 0.96 min, [M+1]+ = 352.39。
3-[2-エチル-4-(N-ヒドロキシカルバミミドイル)-6-メチル-フェニル]-プロピオン酸 tert-ブチル エステル
【0199】
【化54】

【0200】
a) 3-エチル-4-ヒドロキシ-5-メチル-安息香酸(80.3 g、0.446 mol)のDMF(500 mL)溶液に、KHCO3(53.5 g、0.535 mol)、続いて臭化ベンジル(114.3 g、0.668 mol)を添加する。混合物を50℃で18時間撹拌した後、室温に冷却し、水(250 mL)で希釈し、TBME(2x250 mL)で抽出する。有機抽出物を水で洗浄し、そして濃縮する。粗生成物を、ヘプタン:EA 19:1から9:1で溶出するシリカゲル上のCCで精製し、3-エチル-4-ヒドロキシ-5-メチル-安息香酸ベンジルエステル(108.5 g)を、ベージュ色の固体として得る ; 1H NMR (CDCl3):δ 1.28 (t, J = 7.5 Hz, 3 H), 2.30 (s, 3 H), 2.68 (q, J = 7.8 Hz, 2 H), 5.24 (s, 1 H), 5.37 (s, 2 H), 7.33-7.45 (m, 3 H), 7.45-7.50 (m, 2 H), 7.77 (s, 1 H), 7.79 (s, 1 H)。
【0201】
b) 3-エチル-4-ヒドロキシ-5-メチル-安息香酸ベンジルエステル(97.5 g、0.361 mol)およびピリジン(57.1 g、0.721 mol)のDCM(1000 mL)溶液に、トリフルオロメタンスルホン酸 無水物(122.1 g、0.433 mol)のDCM(100 mL)溶液を、0℃で滴下する。添加完了後、混合物を室温で2時間撹拌し、その後、2N HCl(500 mL)水溶液続いて水(500 mL)で洗浄する。有機抽出物を濃縮し、乾燥し、3-エチル-5-メチル-4-トリフルオロメタンスルフォニルオキシ-安息香酸(140.5 g)を、オレンジ色の油状物質として得る; 1H NMR δ1.30 (t, J = 7.5 Hz, 3 H), 2.46 (s, 3 H), 2.83 (q, J = 7.5 Hz, 2 H), 5.39 (s, 2 H), 7.35-7.50 (m, 5 H), 7.87 (s, 1 H), 7.91 (s, 1 H)。
【0202】
c) 3-エチル-5-メチル-4-トリフルオロメタンスルフォニルオキシ-安息香酸(10.0 g、25 mmol)、アクリル酸tert.-ブチル(6.37 g、50 mmol)、NEt3(5.03 g、50 mmol)およびDPPP(0.82 g、2 mmol)のDMF(100 mL)溶液に、Pd(OAc)2(0.45 g、2 mmol)を、窒素雰囲気下で添加する。混合物を115℃で3時間撹拌した後、室温に冷却し、セライトパッド上でろ過する。パッドをTBME(250 mL)で洗浄し、水(500 mL)をろ液に添加する。相を分離し、有機相を水(2x500 mL)で2回洗浄し、MgSO4上で乾燥し、乾燥するまで蒸発させる。粗生成物にEtOH(100 mL)を添加する。濃厚な懸濁液が生成する。固形物を集め、氷冷EtOH(10 mL)で洗浄し、4-(2-tert-ブトキシカルボニル-ビニル)-3-エチル-5-メチル-安息香酸ベンジルエステル(3.8 g)を、薄灰色の固体として得る。
【0203】
d) 4-(2-tert-ブトキシカルボニル-ビニル)-3-エチル-5-メチル-安息香酸 ベンジルエステル(10.0 g、26 mmol)のTHF(100 mL)溶液に、Pd/C(0.5 g、20% Pd)を、窒素下、添加する。混合物を、室温で48時間、1barのH2下で撹拌する。触媒を、セライトパッド上でろ過除去し、ろ液を、乾燥するまで蒸発させ、4-(2-tert-ブトキシカルボニル-エチル)-3-エチル-5-メチル-安息香酸(7.64 g)を、白色の固体として得る; 1H NMR δ 1.29 (t, J = 7.5 Hz, 3 H), 1.49 (s, 9 H), 2.36-2.41 (m, 2 H), 2.74 (q, J= 7.5 Hz, 2 H), 2.99-3.05 (m, 2 H), 7.77 (s, 1 H), 7.80 (s, 1 H)。
【0204】
e) 4-(2-tert-ブトキシカルボニル-エチル)-3-エチル-5-メチル-安息香酸(36.0 g、123 mmol)のイソプロパノール(400 mL)溶液に、HOBT(18.3 g、135 mmol)、続いてEDC HCl(27.1 g、142 mmol)を添加する。混合物を室温で1時間撹拌した後、アンモニア水溶液(25%溶液を69 mL)を添加する。撹拌を1時間継続した後、混合物をDCM(500 mL)で希釈し、半飽和NaHCO3水溶液(3x400 mL)、続いて水(400 mL)で洗浄する。有機抽出物を、MgSO4上で乾燥し、ろ過し、濃縮する。粗生成物をTBME 8250 mL)で粉砕(trituate)する。固形物を集め、さらなるTBME(50 mL)で洗浄し、高真空下で乾燥し、3-(4-カルバモイル-2-エチル-6-メチル-フェニル)-プロピオン酸 tert-ブチルエステル(31.91 g)を、白色固体として得る。
【0205】
f) 3-(4-カルバモイル-2-エチル-6-メチル-フェニル)-プロピオン酸 tert-ブチルエステル(30.0 g、103 mmol)およびNEt3(31.3 g、309 mmol)のDCM(300 mL)溶液に、トリフルオロ酢酸無水物(23.8 g、113 mmol)をゆっくりと添加する。発熱反応を冷却により、5℃未満に保つ。添加完了後、混合物を室温で1時間撹拌する。混合物を水(2x300 mL)で2回洗浄し、有機抽出物を乾燥するまで蒸発させ、3-(4-シアノ-2-エチル-6-メチル-フェニル)-プロピオン酸 tert-ブチルエステル(28.4 g)を、薄黄色の油状物質として得る; 1H NMR δ 1.25 (t, J = 7.5 Hz, 3 H), 1.48 (s, 9 H), 2.32-2.37 (m, 2 H), 2.38 (s, 3 H), 2.70 (q, J = 7.5 Hz, 2 H), 2.95-3.02 (m, 2 H), 7.30 (s, 1 H), 7.34 (s, 1 H)。
【0206】
g) 3-(4-シアノ-2-エチル-6-メチル-フェニル)-プロピオン酸 tert-ブチルエステル(37.0 g、135 mmol)、ヒドロキシアミン塩酸塩(14.1 g、203 mmol)およびNEt3(27.4 g、271 mmol)のMeOH(400 mL)溶液を、7時間加熱還流した後、室温に冷却する。溶媒を蒸発させ、残渣をイソプロピルアセテート(500 mL)中に溶解し、水(500 mL)で2回洗浄する。有機抽出物をMgSO4上で乾燥し、ろ過し、蒸発乾燥し、3-[2-エチル-4-(N-ヒドロキシカルバミミドイル)-6-メチル-フェニル]-プロピオン酸 tert-ブチルエステル(40.8 g)を、薄黄色の固体として得る; 1H NMR δ1.26 (t, J= 7.5 Hz, 3 H), 1.49 (s, 9 H), 2.33-2.41 (m, 5 H), 2.66-2.74 (m, 2 H), 2.93-3.01 (m, 2 H), 4.85 (s, 1 H), 7.28 (s, 2 H)。
3-[2-エチル-4-(N-ヒドロキシカルバミミドイル)-6-メチル-フェニル]-プロピオン酸
【0207】
【化55】

【0208】
a) 3-(4-シアノ-2-エチル-6-メチル-フェニル)-プロピオン酸 エチルエステルは、3-(4-シアノ-2-エチル-6-メチル-フェニル)-プロピオン酸 tert-ブチルエステルと同様に製造される; 1H NMR (CDCl3):δ 1.21-1.31 (m, 6 H), 2.37 (s, 3 H), 2.41-2.47 (m, 2 H), 2.69 (q, J = 7.5 Hz, 2 H), 2.99-3.05 (m, 2 H), 4.18 (q, J= 7.0 Hz, 2 H), 7.30 (s, 1 H), 7.33 (s, 1 H)。
【0209】
b) 3-(4-シアノ-2-エチル-6-メチル-フェニル)-プロピオン酸 エチルエステル(55.0 g、224 mmol)のTHF(220 mL)および1N NaOH水溶液(220 mL)中の溶液を、室温で2撹拌した後、水(200 mL)で希釈し、DCM(2x200 mL)で抽出する。水相を、32% HCl水溶液(50 mL)に、15-30℃にて添加する。沈殿が生じる。固形物を集め、水で洗浄し、高真空下で乾燥し、3-(4-シアノ-2-エチル-6-メチル-フェニル)-プロピオン酸(40.87 g)を、薄茶色の結晶として得る; 1H NMR (D6-DMSO):δ 1.17 (t, J = 7.5 Hz, 3 H), 2.30-2.39 (m, 5 H), 2.67 (q, J = 7.3 Hz, 2 H), 2.87-2.94 (m, 2 H), 7.47 (s, 2 H), 12.30 (s, 1 H)。
【0210】
c) 3-(4-シアノ-2-エチル-6-メチル-フェニル)-プロピオン酸(10.0 g、46.0 mmol)のEtOH(80 mL)溶液に、NEt3(13.97 g、138.1 mmol)、続いてヒドロキシルアミン 塩酸塩(6.40 g、92.1 mmol)を添加する。混合物を7時間還流した後、室温に冷却する。溶媒を真空除去する。残渣を2N HCl水溶液に溶解し、32% NaOH水溶液を添加することにより、pHを5に調整する。生じた沈殿物を集め、水で洗浄し、高真空下、40℃で18時間乾燥し、3-[2-エチル-4-(N-ヒドロキシカルバミミドイル)-6-メチル-フェニル]-プロピオン酸(11.7 g)を、ベージュ色の結晶粉末として得る; LC-MS: tR = 0.60 min, [M+1]+ = 251.09。
3-{2-エチル-4-[5-(6-イソプロポキシ-5-メチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-6-メチル-フェニル}-プロピオン酸
【0211】
【化56】

【0212】
ニコチン酸11および3-[2-エチル-4-(N-ヒドロキシカルバミミドイル)-6-メチル-フェニル]-プロピオン酸から、実施例13と同様に、表題化合物を製造する; LC-MS: tR = 1.15 min, [M+1]+ = 410.10。
3-エチル-4-ヒドロキシ-5-メチル-安息香酸
【0213】
【化57】

【0214】
a) H2SO4(150 mL)の氷冷水溶液(250 mL)に、2-エチル-6-メチルアニリン(15.0 g、111 mmol)を添加する。溶液を氷(150 g)で処理した後、NaNO2(10.7 g、155 mmol)水溶液(150 mL)および氷(50 g)を滴下する。混合物を0℃で1時間撹拌する。50% H2SO4(200 mL)水溶液を添加し、撹拌を室温で18時間継続する。混合物をDCMで抽出し、有機抽出物をMgSO4上で乾燥し、蒸発させる。粗生成物を、ヘプタン:EA 9:1で溶出するシリカゲル上のCCで精製し、2-エチル-6-メチル-フェノール(8.6 g)を、暗赤色の油状物質として得る; LC-MS: tR = 0.89 min; 1H NMR (CDCl3):δ7.03-6.95 (m, 2H), 6.80 (t, J =7.6 Hz, 1H), 4.60 (s, 1H), 2.64 (q, J = 7.6 Hz, 2H), 2.25 (s, 3H), 1.24 (t, J = 7.6 Hz, 3H)。
【0215】
b) 2-エチル-6-メチル-フェノール(8.40 g、61.7 mmol)およびヘキサメチレンテトラアミン(12.97 g、92.5 mmol)の酢酸(60 mL)溶液および水(14 mL)を、115℃に加熱する。水を117℃で溜去し、Dean-Stark 装置で集める。次に水分散機を還流コンデンサー替え、混合物を3時間還流する。混合物を室温に冷却し、水(100 mL)で希釈し、EAで抽出する。有機抽出物を、飽和NaHCO3水溶液で洗浄し、MgSO4上で乾燥し、蒸発させる。残った固体をEAに溶解し、ヘプタンで処理して、結晶化を始める。固形物を集め、乾燥し、3-エチル-4-ヒドロキシ-5-メチル-ベンズアルデヒド(3.13 g)を、無色の結晶粉末として得る、 1H NMR (CDCl3):δ 9.83 (s, 1H), 7.58-7.53 (m, 2H), 5.30 (s br, 1H), 2.69 (q, J = 7.6 Hz, 2H), 2.32 (s, 3H), 1.28 (t, J = 7.6 Hz, 3H)。
【0216】
c) 3-エチル-4-ヒドロキシ-5-メチル-ベンズアルデヒド(78.8 g、0.48 mol)のDMSO(585 mL)溶液に、NaH2PO4二水和物(17.3 g、0.144 mol)の水溶液(160 mL)を、13分かけて添加する。混合物を室温で撹拌し、混合物を氷浴で冷やしながら、NaClO2(65.17 g、0.577 mol)の水溶液(160 mL)を添加する。混合物を1時間撹拌した後、温度を氷浴で25と40℃の間に保ちながら、NaClO2(43.44 g、0.480 mol)水溶液(100 mL)の2回目の添加を行う。黄色の懸濁液を室温で24時間撹拌した後、32% HCl水溶液でpH 2-3に酸性化する。混合物をTBME(250 mL)で抽出し、有機抽出物を水で洗浄し、洗浄液をTBMEで抽出する。合わせた有機抽出物の溶媒を蒸発させ、粗製3-エチル-4-ヒドロキシ-5-メチル-安息香酸(80.3 g)を、黄色の固体として得る。
4-アリルオキシ-3,5-ジメチル-安息香酸ヒドラジド
【0217】
【化58】

【0218】
4-アリルオキシ-3,5-ジメチル-安息香酸(文献:US 3,262,946を見よ。)(5.26 g、25.5 mmol)のCHCl3(75 mL)溶液にチオニルクロリド(7.5 mL)を添加し、混合物を2時間、還流加熱する。混合物を蒸発させ、DCM(50 mL)に溶解した残渣を、冷却した(0℃)1M hydrazineのTHF(75 mL)中、DCM(250 mL)中溶液に添加する。混合物を15時間でゆっくりと室温に温め、エーテル(150 mL)で希釈し、1M HCl(5x50 mL)水溶液で洗浄する。水性抽出物をエーテル(50 mL)で洗浄し、有機相を廃棄する。水性抽出物を33% KOH水溶液で塩基性化し、DCM(5x50 mL)で抽出する。有機抽出物を乾燥し(Na2SO4)、ろ過し、蒸発させ、表題化合物(5.39 g)を白色の固体として得る; LC-MS: tR = 0.71 min; [M+1]+= 221.20。
メタンスルホン酸 2,2-ジメチル-[1,3]ジオキサン-5-イル メチル エステル
【0219】
【化59】

【0220】
表題化合物を、B. Xu, A. Stephens, G. Kirschenheuter, A. F. Greslin, X. Cheng, J. Sennelo, M. Cattaneo, M. L. Zighetti, A. Chen, S.-A. Kim, H. S. Kim, N. Bischofberger, G. Cook, K. A. Jacobson, J. Med. Chem. 45 (2002) 5694-5709に記載された手順に従って製造する。
実施例の製造
実施例1
【0221】
【化60】

【0222】
a) 5-クロロ-6-イソプロポキシ-ニコチン酸(202.9 mg、0.94 mmol)、TBTU(332 mg、1.04 mmol)、Huenigの塩基(607 mg、4.70 mmol)および4-アリルオキシ-N-ヒドロキシ-3,5-ジメチル-ベンズアミジン(230 mg、1.04 mmol)のDCM(7 mL)溶液を、室温で24時間撹拌する。混合物をエーテル(150 mL)で希釈し、1N HCl水溶液(2x20 mL)、1N KHSO4水溶液(20 mL)および塩水(20 mL)で洗浄し、Na2SO4上で乾燥し、ろ過し、濃縮する。粗生成物を、ヘプタン中のEAの勾配で溶出するシリカゲル上のMPLCで精製し、5-クロロ-6-イソプロポキシ-ニコチン酸(4-アリルオキシ-N-ヒドロキシ-3,5-ジメチル-ベンズアミジン)エステル(258 mg)を白色粉末として得る; LC-MS: tR = 1.12 min, [M+1]+ = 418.07。
【0223】
b) 5-クロロ-6-イソプロポキシ-ニコチン酸 (4-アリルオキシ-N-ヒドロキシ-3,5-ジメチル-ベンズアミジン)エステル(200 mg、0.48 mmol)のジオキサン(6 mL)溶液を、90℃で2日間撹拌する。溶媒を蒸発させ、粗製3-[3-(4-アリルオキシ-3,5-ジメチル-フェニル)-[1,2,4]オキサジアゾール-5-イル]-5-クロロ-6-イソプロポキシ-ピリジン(279 mg)を得る; LC-MS: tR = 1.27 min。
【0224】
c) 3-[3-(4-アリルオキシ-3,5-ジメチル-フェニル)-[1,2,4]オキサジアゾール-5-イル]-5-クロロ-6-イソプロポキシ-ピリジン(191 mg、0.48 mmol)のアセトン(10 mL)および水(1 mL)中の溶液に、NMO(97 mg、0.72 mmol)、続いてOsO4(12 mg、0.048 mmol)を添加する。混合物を45℃で16時間撹拌した後、1N KHSO4水溶液で希釈し、エーテル(3x50 mL)で抽出する。合わせた有機抽出物をNa2SO4上で乾燥し、濃縮する。粗生成物(299 mg)のサンプル(15 mg)を、調製用TLCプレート上のクロマトグラフィーにより、ヘプタン:EA 1:2で精製し、(RS)-3-{4-[5-(5-クロロ-6-イソプロポキシ-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-2,6-ジメチル-フェノキシ}-プロパン-1,2-ジオール(10.6 mg)を得る; LC-MS: tR = 1.06 min, [M+1]+ = 434.06。
実施例2
【0225】
【化61】

【0226】
粗製(RS)-3-{4-[5-(5-クロロ-6-イソプロポキシ-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-2,6-ジメチル-フェノキシ}-プロパン-1,2-ジオール(265 mg、0.61 mmol)のTHF(5 mL)溶液に、Huenigの塩基(158 mg、1.22 mmol)、続いて塩化メタンスルホニル(77 mg、0.67 mmol)を0℃にて添加する。混合物を室温で16時間撹拌した後、MeOH(2 mL)中7M NH3を添加する。混合物を65℃で16時間撹拌した後、溶媒を真空除去し、粗製(RS)-1-アミノ-3-{4-[5-(5-クロロ-6-イソプロポキシ-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-2,6-ジメチル-フェノキシ}-プロパン-2-オールを得る; LC-MS: tR = 0.92 min, [M+1+CH3CN]+ = 474.44。
実施例3
【0227】
【化62】

【0228】
(RS)-1-アミノ-3-{4-[5-(5-クロロ-6-イソプロポキシ-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-2,6-ジメチル-フェノキシ}-プロパン-2-オール(313 mg、0.6 mmol)のDCM(10 mL)溶液に、グリコール酸(95 mg、1.25 mmol)およびHuenigの塩基(233 mg、1.8 mmol)を添加する。混合物を0℃に冷却し、TBTU(236 mg、0.74 mmol)を添加する。混合物を0℃で1時間、続いて室温で16時間撹拌した後、EA(250 mL)で希釈し、1N NaOH水溶液(3x25 mL)、1N KHSO4水溶液(25 mL)および塩水(25 mL)で洗浄し、Na2SO4上で乾燥し、ろ過し、濃縮する。粗生成物を調製用HPLCで精製し、N-((RS)-3-{4-[5-(5-クロロ-6-イソプロポキシ-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-2,6-ジメチル-フェノキシ}-2-ヒドロキシ-プロピル)-2-ヒドロキシ-アセタミド(42 mg)を、白色粉末として得る; LC-MS: tR = 1.06 min; [M+1]+ = 491.48; 1H NMR (CD3OD)δ 1.45 (d, J = 6.3 Hz, 6 H), 2.38 (s, 6 H), 3.47 (dd, J = 13.6, 7.3 Hz, 1 H), 3.66 (dd, J = 13.6, 4.5 Hz, 1 H), 3.87 (m, 2 H), 4.04 (s, 2 H), 4.14 (m, 1 H), 5.52 (m, 1 H), 7.78 (s, 2 H), 8.43 (s, 1 H), 8.85 (s, 1 H)。
実施例4
【0229】
【化63】

【0230】
(RS)-3-{4-[5-(6-イソブチル-5-メチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-2,6-ジメチル-フェノキシ}-プロパン-1,2-ジオールを、実施例1と同様に製造する; LC-MS: tR = 0.92 min, [M+1]+ = 412.21。
実施例5
【0231】
【化64】

【0232】
2-ヒドロキシ-N-((RS)-2-ヒドロキシ-3-{4-[5-(6-イソブチル-5-メチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-2,6-ジメチル-フェノキシ}-プロピル)-アセタミドを、実施例2および3と同様に製造する; LC-MS: tR = 0.89 min, [M+1]+ = 469.57。
実施例6
【0233】
【化65】

【0234】
(RS)-3-{2-エチル-4-[5-(6-イソブチル-5-メチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-6-メチル-フェノキシ}-プロパン-1,2-ジオールを、実施例1と同様に製造する; LC-MS: tR = 0.95 min, [M+1]+ = 426.14。
実施例7
【0235】
【化66】

【0236】
(RS)-1-アミノ-3-{2-エチル-4-[5-(6-イソブチル-5-メチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-6-メチル-フェノキシ}-プロパン-2-オールを、実施例2と同様に製造する; LC-MS: tR = 0.82 min, [M+1]+ = 425.17。
実施例8
【0237】
【化67】

【0238】
N-((RS)-3-{2-エチル-4-[5-(6-イソブチル-5-メチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-6-メチル-フェノキシ}-2-ヒドロキシ-プロピル)-2-ヒドロキシ-アセタミドを、実施例3と同様に製造する; LC-MS: tR = 0.91 min, [M+1]+ = 483.21。
実施例9
【0239】
【化68】

【0240】
(RS)-3-{2-エチル-4-[5-(5-イソブチル-6-メチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-6-メチル-フェノキシ}-プロパン-1,2-ジオールを、実施例1と同様に製造する; LC-MS: tR = 0.96 min, [M+1]+ = 426.12。
実施例10
【0241】
【化69】

【0242】
(RS)-3-{2,6-ジメチル-4-[5-(5-メチル-6-プロピル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-フェノキシ}-プロパン-1,2-ジオールを、実施例1と同様に製造する; LC-MS: tR = 0.87 min, [M+1]+ = 398.54。
実施例11
【0243】
【化70】

【0244】
(RS)-3-{2-エチル-6-メチル-4-[5-(5-メチル-6-プロピル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-フェノキシ}-プロパン-1,2-ジオールを、実施例1と同様に製造する; LC-MS: tR = 0.91 min, [M+1]+ = 412.56。
実施例12
【0245】
【化71】

【0246】
(RS)-3-{4-[5-(5,6-ジイソブチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-2,6-ジメチル-フェノキシ}-プロパン-1,2-ジオールを、実施例1と同様に製造する; LC-MS: tR = 1.01 min; [M+1]+ = 454.56。
実施例13
【0247】
【化72】

【0248】
5,6-ジエチル-ニコチン酸 塩酸塩(920 mg、4.3 mmol)およびHuenigの塩基(2.76 g、21 mmol)のDCM(50 mL)溶液にTBTU(1.785 g、5.55 mmol)を添加し、混合物を室温で5分撹拌する。3-エチル-4,N-ジヒドロキシ-5-メチル-ベンズアミジン(1.14 g、4.7 mmol)を添加し、混合物を0.5時間撹拌する。混合物をDCMで希釈し、飽和NaHCO3水溶液で洗浄し、MgSO4上で乾燥し、ろ過し、濃縮する。粗製5,6-ジエチル-ニコチン酸 (3-エチル-4,N-ジヒドロキシ-5-メチル-ベンズアミジン)エステル(LC-MS: tR = 0.79 min)をジオキサン(50 mL)に溶解し、18時間で100℃に過熱する。溶媒を蒸発させ、粗生成物を、EA 10:1で溶出するシリカゲル上のFCで精製し、4-[5-(5,6-ジエチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-2-エチル-6-メチル-フェノール(0.42 g)を固体として得る; LC-MS: tR = 1.03 min, [M+1]+ =338.09。
実施例14
【0249】
【化73】

【0250】
4-[5-(5,6-ジエチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-2-エチル-6-メチル-フェノール(100 mg、0.296 mmol)のイソプロパノール(10 mL)および3N NaOH水溶液(3 mL)中の溶液に、(S)-3-クロロ-1,2-プロパンジオール(98 mg、0.89 mmol)を添加する。混合物を60℃で24時間撹拌した後、別量の(S)-3-クロロ-1,2-プロパンジオール(98 mg、0.89 mmol)を添加する。撹拌を60℃で2日継続する。混合物をEAで希釈し、飽和NaHCO3水溶液で洗浄する。有機抽出物をMgSO4上で乾燥し、ろ過し、蒸発させる。粗生成物を調製用TLCプレート上のクロマトグラフィーにより、EA-ヘプタンで精製し、(S)-3-{4-[5-(5,6-ジエチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-2-エチル-6-メチル-フェノキシ}-プロパン-1,2-ジオール(14 mg)を、赤色の油状物質として得る; LC-MS: tR = 0.93 min, [M+1]+= 412.16。
実施例15
【0251】
【化74】

【0252】
2-{4-[5-(5,6-ジエチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-2-エチル-6-メチル-フェノキシメチル}-プロパン-1,3-ジオールを、実施例14と同様に、メタンスルホン酸 2,2-ジメチル-[1,3]ジオキサン-5-イルメチル エステルをアルキル化剤として用いて、2段階で製造する。得られた、保護されたジオール(32 mg)をTHF(5 mL)に溶解し水(0.5 mL)およびTFA(0.25 mL)を添加する。混合物を室温で1時間撹拌し、EAで希釈し、飽和NaHCO3水溶液で洗浄する。有機相を蒸発させ、残渣を、調製用TLCプレート上のクロマトグラフィーにより、DCM-MeOHで精製し、2-{4-[5-(5,6-ジエチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-2-エチル-6-メチル-フェノキシメチル}-プロパン-1,3-ジオールを得る; LC-MS: tR = 0.95 min, [M+1]+ = 426.09。
実施例16
【0253】
【化75】

【0254】
2-{4-[5-(5,6-ジエチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-2-エチル-6-メチル-フェノキシ}-エタノールを、ブロモエタノールをアルキル化剤として用いて、実施例14と同様に製造する; LC-MS: tR = 1.01 min; [M+1]+ = 382.17; 1H NMR (CDCl3)δ 1.22-1.45 (m, 9 H), 2.42 (s, 3 H), 2.72-2.87 (m, 4 H), 2.96 (q, J = 7.5 Hz, 2 H), 4.00 (m, 5 H), 7.89 (s, 1 H), 7.90 (s, 1 H), 8.24 (s, 1 H), 9.21 (s, 1 H)。
実施例17
【0255】
【化76】

【0256】
a) 4-[5-(5,6-ジエチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-2-エチル-6-メチル-フェノール(150 mg、0.445 mmol)のイソプロパノール(10 mL)および3N NaOH水溶液(3 mL)の溶液に、エピクロロヒドリン(164 mg、1.78 mmol)を添加する。混合物を室温で20時間撹拌する。混合物をEAで希釈し、飽和NaHCO3水溶液で洗浄する。有機抽出物をMgSO4上で乾燥し、ろ過し、蒸発させる。粗生成物を、調製用TLCプレート上のクロマトグラフィーにより、EA-ヘプタンで精製し、(RS)-2,3-ジエチル-5-[3-(3-エチル-5-メチル-4-オキシラニルメトキシ-フェニル)-[1,2,4]オキサジアゾール-5-イル]-ピリジン (92 mg)を、油状物質として得る。
【0257】
b) (RS)-2,3-ジエチル-5-[3-(3-エチル-5-メチル-4-オキシラニルメトキシ-フェニル)-[1,2,4]オキサジアゾール-5-イル]-ピリジン(92 mg)をMeOH中7N NH3(20 mL)に溶解し、スクリュー・キャップ・ボトル中で60℃にて15時間加熱する。混合物を蒸発させ、粗製(RS)-1-アミノ-3-{4-[5-(5,6-ジエチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-2-エチル-6-メチル-フェノキシ}-プロパン-2-オール(99 mg)を得る; LC-MS: tR = 0.80 min, [M+1]+ = 411.09。
実施例18
【0258】
【化77】

【0259】
(RS)-1-アミノ-3-{4-[5-(5,6-ジエチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-2-エチル-6-メチル-フェノキシ}-プロパン-2-オール(99 mg、0.24 mmol)、グリコール酸(18.5 mg、0.244 mmol)およびHuenigの塩基(78 mg、0.61 mmol)のDCM(5 mL)溶液に、PyBOP(126.7 mg、0.24 mmol)を添加し、混合物を室温で30分撹拌する。混合物をEAで希釈し、飽和NaHCO3水溶液で洗浄し、MgSO4上で乾燥し、ろ過し、濃縮する。粗生成物を、DCM:MeOH 10:1で溶出する調製用TLCプレート上のクロマトグラフィーにより精製し、N-((RS)-3-{4-[5-(5,6-ジエチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-2-エチル-6-メチル-フェノキシ}-2-ヒドロキシ-プロピル)-2-ヒドロキシ-アセタミド (90 mg)を、油状物質として得る; LC-MS: tR = 0.88 min, [M+1]+=469.25。
実施例19
【0260】
【化78】

【0261】
2-エチル-4-[5-(6-エチル-5-イソブチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-6-メチル-フェノールを、実施例13と同様に製造する; LC-MS: tR = 1.09 min, [M+1]+ = 366.19。
実施例20
【0262】
【化79】

【0263】
(S)-3-{2-エチル-4-[5-(6-エチル-5-イソブチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-6-メチル-フェノキシ}-プロパン-1,2-ジオールを、実施例14と同様に製造する; LC-MS: tR = 1.00 min, [M+1]+ = 440.20.
実施例21
【0264】
【化80】

【0265】
(S)-2-{2-エチル-4-[5-(6-エチル-5-イソブチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-6-メチル-フェノキシ}-エタノールを、実施例16と同様に製造する; LC-MS: tR = 1.08 min, [M+1]+ = 410.15.
実施例22
【0266】
【化81】

【0267】
(RS)-1-アミノ-3-{2-エチル-4-[5-(6-エチル-5-イソブチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-6-メチル-フェノキシ}-プロパン-2-オールを、実施例17と同様に製造する; LC-MS: tR = 0.85 min, [M+1]+ = 439.17。
実施例23
【0268】
【化82】

【0269】
N-((RS)-3-{2-エチル-4-[5-(6-エチル-5-イソブチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-6-メチル-フェノキシ}-2-ヒドロキシ-プロピル)-2-ヒドロキシ-アセタミドを、実施例18と同様に製造する; LC-MS: tR = 0.95 min, [M+1]+ = 497.17。
実施例24
【0270】
【化83】

【0271】
4-[5-(6-イソブチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-2,6-ジメチル-フェノールを、実施例13と同様に製造する; LC-MS: tR = 1.04 min, [M+1]+ = 324.36。
実施例25
【0272】
【化84】

【0273】
(RS)-1-アミノ-3-{4-[5-(6-イソブチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-2,6-ジメチル-フェノキシ}-プロパン-2-オールを、実施例17と同様に製造する; LC-MS: tR = 0.8 min。
実施例26
【0274】
【化85】

【0275】
2-ヒドロキシ-N-((RS)-2-ヒドロキシ-3-{4-[5-(6-イソブチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-2,6-ジメチル-フェノキシ}-プロピル)-アセタミドを、実施例18と同様に製造する; LC-MS: tR = 0.89 min, [M+1]+ = 455.48。
実施例27
【0276】
【化86】

【0277】
(RS)-3-{2-クロロ-4-[5-(6-イソブチル-5-メチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-6-メトキシ-フェノキシ}-プロパン-1,2-ジオールを、実施例1と同様に製造する; LC-MS: tR = 0.94 min, [M+1]+ = 448.21。
実施例28
【0278】
【化87】

【0279】
a) 6-イソブチル-5-メチル-ニコチン酸 塩酸塩(50 mg、0.22 mmol)、DIPEA(0.12 mL、0.7 mmol)およびTBTU(97 mg、0.30 mmol)のDCM(5 mL)溶液に、0℃にて、4-アリルオキシ-3,5-ジメチル-安息香酸 ヒドラジド(50.6 mg、0.23 mmol)を添加し、混合物を0℃で4時間撹拌する。混合物をEA(15 mL)で希釈し、1M NaH2PO4水溶液(5 mL)、1M NaOH水溶液(5 mL)および水(5 mL)で洗浄する。有機相を乾燥し(MgSO4)、ろ過し、蒸発させ、6-イソブチル-5-メチル-ニコチン酸 N'-(4-アリルオキシ-3,5-ジメチル-ベンゾイル)-ヒドラジド (85 mg)を得る; LC-MS: tR = 0.81 min, [M+1]+ = 396.20。
【0280】
b) 6-イソブチル-5-メチル-ニコチン酸 N'-(4-アリルオキシ-3,5-ジメチル-ベンゾイル)-ヒドラジド(89 mg、0.224 mmol)およびBurgess試薬(162 mg、0.68 mmol)のTHF(4 mL)溶液を、マイクロ波オーヴンで、110℃にて6分加熱する。混合物をEA(15 mL)で希釈し、1M NaH2PO4水溶液(5 mL)、1M NaOH水溶液(5 mL)および水(5 mL)で洗浄する。有機相を乾燥し(MgSO4)、ろ過し、蒸発させ、粗製5-[5-(4-アリルオキシ-3,5-ジメチル-フェニル)-[1,3,4]オキサジアゾール-2-イル]-2-イソブチル-3-メチル-ピリジン (80 mg)を得る; LC-MS: tR = 1.07 min, [M+1]+ = 378.3。
【0281】
c) (RS)-3-{4-[5-(6-イソブチル-5-メチル-ピリジン-3-イル)-[1,3,4]オキサジアゾール-2-イル]-2,6-ジメチル-フェノキシ}-プロパン-1,2-ジオールを、5-[5-(4-アリルオキシ-3,5-ジメチル-フェニル)-[1,3,4]オキサジアゾール-2-イル]-2-イソブチル-3-メチル-ピリジンから、実施例1と同様に製造する; LC-MS: tR = 0.83 min; [M+1]+ = 412.23; 1H NMR (D6-DMSO) δ0.94 (d, J = 6.5 Hz, 6 H), 2.19 (hept, J = 6.5 Hz, 1 H), 2.36 (s, 6 H), 2.42 (s, 3 H), 2.73 (d, J= 7.3 Hz, 2 H), 3.50 (t, J = 5.5 Hz, 2 H), 3.76 (m, 1 H), 3.84 (m, 1 H), 3.89 (m, 1 H), 4.65 (t, J = 5.5 Hz, 1 H), 4.97 (d, J = 5.0 Hz, 1 H), 7.84 (s, 2 H), 8.24 (d, J = 1.0 Hz, 1 H), 9.05 (d, J = 1.5 Hz, 1 H)。
実施例29
【0282】
【化88】

【0283】
ニコチン酸2から、(RS)-3-{4-[5-(5-イソブチル-6-メチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-2,6-ジメチル-フェノキシ}-プロパン-1,2-ジオールを、実施例1と同様に製造する; LC-MS: tR = 0.93 min; [M+1]+ = 412.18。
実施例30から34
【0284】
【化89】

【0285】
ニコチン酸6から、下記の実施例を、実施例1と同様に製造する。
【0286】
【表1】

【0287】
実施例34
1H NMR (CDCl3):δ 1.01 (d, J= 6.8 Hz, 6 H), 2.18-2.31 (m, 1 H), 2.45 (s, 3 H), 2.46 (s, 3 H), 2.80 (d, J = 7.3 Hz, 2 H), 3.82-3.96 (m, 2 H), 4.06-4.13 (m, 2 H), 4.15-4.23 (m, 1 H), 7.95 (d, J = 0.8 Hz, 1 H), 8.09 (d, J = 1.5 Hz, 1 H), 8.21 (s, 1 H), 9.19 (s, 1 H).
実施例35から39
【0288】
【化90】

【0289】
上記実施例から、下記の実施例を、実施例2と同様に製造する。
【0290】
【表2】

【0291】
実施例40から43
【0292】
【化91】

【0293】
上記実施例から、下記の実施例を、実施例3と同様に製造する。
【0294】
【表3】

【0295】
実施例40
1H NMR (CDCl3):δ 1.01 (d, J= 6.5 Hz, 6 H), 2.17-2.30 (m, 1 H), 2.46 (s, 3 H), 2.68 (s, 3 H), 2.80 (d, J = 7.3 Hz, 2 H), 3.13-3.19 (m, 1 H), 3.47-3.56 (m, 1 H), 3.72-3.80 (m, 1 H), 3.99-4.08 (m, 2 H), 4.17-4.24 (m, 3 H), 6.85-6.90 (m, 2 H), 7.08 (t br, J = 5.5 Hz, 1 H), 8.06 (d, J = 8.3 Hz, 1 H), 8.21 (s, 1 H), 9.20 (s, 1 H)。
実施例44
【0296】
【化92】

【0297】
(RS)-1-{2-クロロ-4-[5-(6-イソブチル-5-メチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-6-メトキシ-フェノキシ}-3-(2-ヒドロキシ-エチルアミノ)-プロパン-2-オールを、実施例27から、メタンスルホン化された中間体をエタノールアミンと反応させることにより、実施例2と同様に製造する;LC-MS: tR = 0.82 min, [M+1]+ = 491.06; 1H NMR (CDCl3):δ 1.00 (d, J= 6.5 Hz, 6 H), 2.18-2.29 (m, 1 H), 2.46 (s, 3 H), 2.79 (d, J = 7.3 Hz, 2 H), 2.83-2.92 (m, 4 H), 3.68-3.73 (m, 2 H), 4.01 (s, 3 H), 4.04-4.16 (m, 2 H), 4.24-4.31 (m, 1 H), 7.64 (s, 1 H), 7.87 (s, 1 H), 8.21 (s, 1 H), 9.18 (s, 1 H)。
実施例45および46
【0298】
【化93】

【0299】
実施例8のラセミ化合物は、キラル固定相(ChiralPak ADH 4.6x250 mm、5μm、ヘプタン中0.1%のジエチルアミンを含む20% EtOH、40 min、流速:0.8 mL/min)上の調製用HPLCにより、純粋なエナンチオマーに分離される。
【0300】
【表4】

【0301】
実施例47
【0302】
【化94】

【0303】
2-エチル-4-[3-(6-イソブチル-5-メチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-5-イル]-6-メチル-フェノールを、N-ヒドロキシ-6-イソブチル-5-メチル-ニコチンアミジンおよび3-エチル-4-ヒドロキシ-5-メチル-安息香酸から、実施例13と同様に製造する, LC-MS: tR = 1.02 min, [M+1]+ = 352.09。
実施例48から53
【0304】
【化95】

【0305】
実施例47から、下記の実施例を、上記実施例と同様に製造する。
【0306】
【表5】

【0307】
実施例49
1H NMR (CDCl3):δ 1.00 (d, J= 6.3 Hz, 6 H), 1.33 (t, J = 7.3 Hz, 3 H), 2.17-2.27 (m, 2 H), 2.43 (s, 6 H), 2.79 (m, 4 H), 2.90 (s br, 1 H), 3.82-4.01 (m, 4 H), 4.15-4.24 (m, 1 H), 7.93 (s, 1 H), 7.94 (s, 1 H), 8.18 (s, 1 H), 9.15 (s, 1 H)。
実施例53
1H NMR (CDCl3):δ 1.01 (d, J= 6.5 Hz, 6 H), 1.33 (t, J = 7.3 Hz, 3 H), 2.16-2.28 (m, 1 H), 2.41 (s, 3 H), 2.44 (s, 3 H), 2.74-2.82 (m, 4 H), 3.39 (s br, 1 H), 3.49-3.58 (m, 1 H), 3.77-3.95 (m, 3 H), 4.20-4.27 (m, 3 H), 7.01 (s br, 1 H), 7.93 (s, 1 H), 7.94 (s, 1 H), 8.19 (s, 1 H), 9.15 (s, 1 H).
実施例54
【0308】
【化96】

【0309】
a) ニコチン酸6(50 mg、0.218 mmol)のDCM(5 mL)溶液に、TBTUの溶液(97 mg、0.301 mmol)、続いてDCM(5 mL)中DIPEA(90 mg、0.696 mmol)を添加する。混合物を撹拌し、0℃に冷却した後、4-アリルオキシ-3,5-ジメチル-安息香酸 ヒドラジド(51 mg、0.232 mmol)を添加する。混合物を0℃で16時間撹拌した後、EA(15 mL)で希釈し、飽和NaHCO3水溶液(5 mL)および1M NaOH水溶液(5 mL)で洗浄し、MgSO4上で乾燥し、ろ過し、濃縮し、真空下で乾燥し、ヒドラジド中間体を得る; LC-MS: tR = 0.81 min, [M+1]+ = 396.37。この化合物のTHF(3 mL)溶液にLawessonの試薬(129 mg、0.318 mmol)を添加し、混合物を、マイクロ波中、110℃で5分加熱する。混合物をEA(30 mL)で希釈し、飽和Na2CO3水溶液で洗浄し、Na2SO4上で乾燥し、ろ過し、濃縮する。粗生成物を、調製用TLCプレート上、MeOH中7N NH3を10%含むDCMで精製し、5-[5-(4-アリルオキシ-3,5-ジメチル-フェニル)-[1,3,4]チアジアゾール-2-イル]-2-イソブチル-3-メチル-ピリジン(67 mg)を、黄色の固体として得る LC-MS: tR = 1.04 min, [M+1]+ = 394.10。
【0310】
b) 5-[5-(4-アリルオキシ-3,5-ジメチル-フェニル)-[1,3,4]チアジアゾール-2-イル]-2-イソブチル-3-メチル-ピリジンを、実施例1の工程c)に記載されたように、OsO4で処理し、(RS)-3-{4-[5-(6-イソブチル-5-メチル-ピリジン-3-イル)-[1,3,4]チアジアゾール-2-イル]-2,6-ジメチル-フェノキシ}-プロパン-1,2-ジオールを得る; LC-MS: tR = 0.78 min, [M+1]+ = 428.50; 1H NMR (CDCl3):δ 1.01 (d, J= 6.5 Hz, 6 H), 2.17-2.28 (m, 1 H), 2.39 (s, 6 H), 2.43 (s, 3 H), 2.76 (d, J = 7.3 Hz, 2 H), 3.82-3.99 (m, 4 H), 4.14-4.21 (m, 1 H), 7.70 (s, 2 H), 8.13 (s, 1 H), 8.90 (s, 1 H)。
実施例55
【0311】
【化97】

【0312】
{4-[5-(6-イソブチル-5-メチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-フェニル}-酢酸(50 mg、142 μmol)のDMF(3 mL)溶液に、EDC HCl(33 mg、171 μmol)、HOBt(23 mg、171μmol)およびDIPEA(28 mg、213 μmol)を添加する。混合物を室温で5分撹拌した後、エタノールアミン(10 mg、157μmol)を添加する。撹拌を室温で72時間継続する。混合物をEAで希釈し、水で洗浄し、濃縮する。粗生成物を、調製用TLCプレート上、MeOHを10%含むDCMで精製し、N-(2-ヒドロキシ-エチル)-2-{4-[5-(6-イソブチル-5-メチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-フェニル}-アセタミド(26 mg)を、白色の固体として得る; LC-MS: tR = 0.82 min, [M+1]+ = 395.15; 1H NMR (CDCl3):δ 1.01 (d, J = 6.5 Hz, 6 H), 2.19-2.29 (m, 1 H), 2.46 (s, 3 H), 2.53 (s br, 1 H), 2.80 (d, J = 7.3 Hz, 2 H), 3.44 (q, J = 4.8 Hz, 2 H) , 3.69 (s, 2 H), 3.71-3.75 (m, 2 H), 5.96 (s br, 1 H), 7.46 (d, J = 7.5 Hz, 2 H), 8.18 (d, J = 7.8 Hz, 2 H), 8.17 (s), 8.19 (s), 8.22 (s, 1 H), 9.20 (s, 1 H)。
実施例56
【0313】
【化98】

【0314】
N-(2-ヒドロキシ-1-ヒドロキシメチル-エチル)-2-{4-[5-(6-イソブチル-5-メチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-フェニル}-アセタミドを、2-アミノ-プロパン-1,3-ジオールを用いて、実施例55と同様に製造する; tR = 0.78 min, [M+1]+ = 425.19。
実施例57
【0315】
【化99】

【0316】
1-(2-{4-[5-(6-イソブチル-5-メチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-フェニル}-アセチル)-アゼチジン-3-カルボン酸を、{4-[5-(6-イソブチル-5-メチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-フェニル}-酢酸およびアゼチジン-3-カルボン酸 メチルエステルから、実施例55と同様に製造する;この化合物を、3N NaOH/ジオキサン水溶液中で、室温にて20時間撹拌し、所望の化合物を得る; LC-MS: tR = 0.60, [M+1]+ = 434.96。
実施例58
【0317】
【化100】

【0318】
(RS)-3-{4-[5-(6-イソブチル-ピリジン-3-イル)-[1,3,4]オキサジアゾール-2-イル]-2,6-ジメチル-フェノキシ}-プロパン-1,2-ジオールを、ニコチン酸8から、実施例28と同様に製造する; LC-MS: tR = 0.85, [M+1]+ = 398.36。
実施例59
【0319】
【化101】

【0320】
(RS)-1-アミノ-3-{4-[5-(6-イソブチル-ピリジン-3-イル)-[1,3,4]オキサジアゾール-2-イル]-2,6-ジメチル-フェノキシ}-プロパン-2-オールを、実施例58から、実施例2と同様に製造する; LC-MS: tR = 0.75, [M+1]+ = 397.29。
実施例60
【0321】
【化102】

【0322】
(RS)-2-ヒドロキシ-N-(2-ヒドロキシ-3-{4-[5-(6-イソブチル-ピリジン-3-イル)-[1,3,4]オキサジアゾール-2-イル]-2,6-ジメチル-フェノキシ}-プロピル)-アセタミドを、実施例59から、実施例3と同様に製造する; LC-MS: tR = 0.80, [M+1]+ = 455.19; 1H NMR (CD3OD):δ 0.97 (d, J= 6.7 Hz, 6 H), 2.06-2.20 (m, 1 H), 2.38 (s, 6 H), 2.76 (d, J = 7.0 Hz, 2 H), 3.38-3.57 (m, 1 H), 3.59-3.73 (m, 1 H), 3.78-3.94 (m, 2 H), 4.01 (s, 2 H), 4.05-4.16 (m, 1 H), 7.50 (d, J = 7.9 Hz, 1 H), 7.81 (s, 2 H), 8.41 (dd, J = 8.2, 2.1 Hz, 1 H), 9.16 (d, J = 2.1 Hz, 1 H)。
実施例61から70
【0323】
【化103】

【0324】
ニコチン酸8から、下記の実施例を、上記実施例と同様に製造する。
【0325】
【表6】

【0326】
実施例66
1H NMR (CDCl3):δ 0.99 (d, J= 6.5 Hz, 6 H), 1.33 (t, J = 7.5 Hz, 3 H), 2.15-2.26 (m, 1 H), 2.40 (s, 3 H), 2.72-2.83 (m, 4 H), 3.49-3.58 (m, 1 H), 3.78-3.94 (m, 3 H), 4.17-4.26 (m, 3 H), 6.98 (s br, 1 H), 7.34 (d, J = 8.3 Hz, 1 H), 7.88 (s, 1 H), 7.89 (s, 1 H), 8.39 (dd, J = 8.0, 2.0 Hz, 1 H), 9.37 (d, J = 1.3 Hz, 1 H).
実施例71から77
【0327】
【化104】

【0328】
ニコチン酸9および3-エチル-4,N-ジヒドロキシ-5-メチル-ベンズアミジンから、下記の実施例を、上記実施例と同様に製造する。
【0329】
【表7】

【0330】
実施例75
1H NMR (CDCl3):δ 1.01 (d, J= 6.8 Hz, 6 H), 1.33 (m, 6 H), 2.15 (s br, 1 H), 2.22-2.34 (m, 2 H) , 2.42 (s, 3 H), 2.73-2.85 (m, 4 H), 3.51 (s, 1 H), 3.96-4.09 (m, 5H), 7.89 (s, 1 H), 7.92 (s, 1 H), 8.25 (d, J = 1.8 Hz, 1 H), 9.21 (d, J = 2.0 Hz, 1 H)。
実施例78から81
【0331】
【化105】

【0332】
ニコチン酸10および3-エチル-4,N-ジヒドロキシ-5-メチル-ベンズアミジンから、下記の実施例を、上記実施例と同様に製造する。
【0333】
【表8】

【0334】
実施例81
1H NMR (CDCl3):δ 1.01 (d, J = 6.0 Hz, 6 H), 1.33 (t, J = 7.8 Hz, 3 H), 1.67-1.77 (m, 2 H), 2.14 (s br, 1 H), 2.27-2.35 (m, 1 H), 2.42 (s, 3 H), 2.77 (q, J = 7.5 Hz, 2 H), 2.93-2.99 (m, 2 H), 3.99-4.09 (m, 5 H), 7.86-7.91 (m, 3 H), 7.94 (s, 1 H), 8.79 (d, J = 5.0 Hz, 1 H)。
実施例82から88
【0335】
【化106】

【0336】
ニコチン酸11および3-エチル-4,N-ジヒドロキシ-5-メチル-ベンズアミジンから、下記の実施例を、上記実施例と同様に製造する。
【0337】
【表9】

【0338】
実施例88
1H NMR (CDCl3):δ 1.32 (t, J= 7.5 Hz, 3 H), 1.42 (d, J = 6.0 Hz, 6 H), 2.28 (s, 3 H), 2.39 (s, 3 H), 2.75 (q, J = 7.5 Hz, 2 H), 3.41 (m, 1 H), 3.48-3.58 (m, 1 H), 3.76-3.93 (m, 3 H), 4.17-4.25 (m, 3 H), 5.43-5.52 (m, 1 H), 7.03 (t br, J = 4.3 Hz, 1 H), 7.85 (s, 1 H), 7.87 (s, 1 H), 8.14 (s, 1 H), 8.84 (s, 1 H)。
実施例89
【0339】
【化107】

【0340】
3-{2-エチル-4-[5-(6-イソプロポキシ-5-メチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-6-メチル-フェニル}-N-(2-ヒドロキシ-エチル)-プロピオンアミドを、3-{2-エチル-4-[5-(6-イソプロポキシ-5-メチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-6-メチル-フェニル}-プロピオン酸から、実施例55と同様に製造する; LC-MS: tR = 1.07, [M+1]+ = 453.23; 1H NMR (CDCl3):δ 1.31 (t, J= 7.3 Hz, 3 H), 1.42 (d, J = 5.5 Hz, 6 H), 2.28 (s, 3 H), 2.38-2.48 (m, 5 H), 2.53 (s br, 1 H), 2.77 (q, J = 7.3 Hz, 2 H), 3.06-3.14 (m, 2 H), 3.42-3.50 (m, 2 H), 3.71-3.79 (m, 2 H), 5.42-5.52 (m, 1 H), 5.89 (s br, 1 H), 7.82 (s, 1 H), 7.85 (s, 1 H), 8.15 (s, 1 H), 8.85 (s, 1 H)。
実施例90から92
【0341】
【化108】

【0342】
3-エチル-4-ヒドロキシ-5-メチル-安息香酸およびN-ヒドロキシ-6-イソプロポキシ-5-メチル-ニコチンアミジンから、下記の実施例を、実施例13と同様に製造する。
【0343】
【表10】

【0344】
実施例92
1H NMR (CDCl3):δ 1.34 (t, J= 7.5 Hz, 3 H), 1.41 (d, J = 6.0 Hz, 6 H), 2.03 (t, J = 6.0 Hz, 1 H), 2.27 (s, 3 H), 2.43 (s, 3 H), 2.70 (d, J = 5.0 Hz, 1 H), 2.79 (q, J = 7.3 Hz, 2 H), 3.82-3.99 (m, 4 H), 4.15-4.21 (m, 1 H), 5.41-5.49 (m, 1 H), 7.92 (s, 1 H), 7.96 (s, 1 H), 8.11 (s, 1 H), 8.79 (s, 1 H)。
II) 生物学
i)実施例43:EC50値を決定するためのGTPγS結合アッセイ法
GTPγS結合アッセイ法は、96ウェルマイクロタイタープレート(Nunc, 442587)で、組換えヒトS1P1受容体を発現するCHO細胞の膜標品を用いて200μlの最終体積で行った。アッセイ条件は、20mM Hepes(Fluka, 54461)、100mM NaCl(Fluka, 71378)、5mM MgCl2(Fluka, 63064)、0.1%のBSA(Calbiochem, 126609)、1μM GDP(Sigma, G-7127)、2.5%のDMSO(Fluka, 41644)、50pMの35S-GTPγS(Amersham Biosciences, SJ1320)である。pHは、7.4である。試験化合物を溶解して、100%のDMSOに希釈し、35S-GTPγSの非存在下で150μlの上記アッセイ緩衝液中で室温にて30分間プレインキュベートする。50μlの、35S-GTPγSの添加後、アッセイを室温にて1時間インキュベートする。アッセイをPackard Biosciencesからのセル‐ハーベスターを使用して反応混合物をMultiscreenプレート(Millipore, MAHFC1H60)に移すことによって終結させて、プレートを氷冷10mM Na2HPO4/NaH2PO4(70%/30%)で洗浄して、乾燥させ、底面を封着して、25μlのMicroScint20(Packard Biosciences, order no. 6013621)を添加後に、上部を封着する。膜結合型の35S-GTPγSをPackard BiosciencesからのTopCountで測定する。
EC50は、最大の特異的35S-GTPγS結合の50%を誘導するアゴニストの濃度である。特異的結合は、非特異的結合を最大結合から減算することによって決定する。最大結合は、10μMのS1Pの存在下においてMultiscreenプレートに結合したcpmの量である。非特異的結合は、アッセイにおけるアゴニストの非存在下での結合の量である。
92実施例化合物のうち、62化合物のアゴニスト活性(EC50値)を測定した。測定されたEC50値は、0.1〜9410nMの範囲内であり、平均は492nMである。選択された化合物のアゴニスト活性を表1に示す。
表1:
【0345】
【表11】

【0346】
ii)インビボでの有効性の評価
式(I)の化合物の有効性は、正常圧の雄ウィスターラットに対する3〜30mg/kgの式(I)の化合物の経口投与後に、循環リンパ球を測定することによって評価する。動物は、12時間-光/暗闇サイクルで気候制御条件に収容して、通常のラット固形飼料および飲料水の自由な摂取をさせた。血液は、薬物投与前、並びに後の3、6および24時間に収集する。全血をAdvia Hematologyシステム(Bayer Diagnostics, Zurich, Switzerland)を使用する血液検査に供する。
【0347】
すべてのデータは、平均±SEMとして示してある。統計分析は、多重比較のためにStatistica(StatSoft)およびStudent-Newman-Keuls法を使用して分散分析(分散分析)によって行う。帰無仮説は、p<0.05のときに拒絶する。
一例として、表2には、媒体だけで処理した一群の動物と比較して、正常圧の雄ウィスターラットに対する本発明の化合物の10mg/kgの経口投与の6時間後におけるリンパ球カウントに対する効果を示す。経口投与の6時間後におけるリンパ球カウントは6実施例化合物について測定され、−77 % to −61 % の範囲内であり、平均は−68 %である。
表2:
【0348】
【表12】

【技術分野】
【0001】
本発明は、式(I)のS1P1/EDG1受容体アゴニストおよび医薬組成物の製造における活性成分としてのこれらの使用に関する。また、本発明は、化合物の製造のための方法、式(I)の化合物を含む医薬組成物、並びに血管機能を改善する化合物としての、および免疫調節薬としての、単独またはその他の活性化合物もしくは療法と組み合わせたこれらの使用を含む関連した側面に関する。本発明のさらなる側面は、式(I)の化合物を製造するための中間体となる式(II)の新規化合物に関する。
【背景技術】
【0002】
ヒト免疫系は、感染または疾患を生じさせる外来微生物および物質から体を守るようにデザインされている。複雑な調節機構が、免疫応答が侵入する物質または生物体を標的とし、宿主を標的としないことを保証する。場合によっては、これらの制御メカニズムが制御されず、自己免疫応答を発症し得る。炎症反応が制御されない結果として、重篤な器官、細胞、組織または関節の損傷が生じる。また、現在の治療では、通常、全免疫系が抑制されて、体が感染に応答する能力が大きく損なわれてしまう。この種の典型的な薬物には、アザチオプリン、クロランブシル、シクロホスファミド、シクロスポリンまたはメトトレキセートを含む。炎症を減少させて、免疫応答を抑制する副腎皮質ステロイドは、長期治療に使用されると、副作用の原因となることがある。非ステロイド性抗炎症薬(NSAID)は、疼痛および炎症を減少させることができるが、しかし、これらは、かなりの副作用を示す。代わりの治療には、サイトカインシグナリングを活性化し、または遮断する薬剤を含む。
【0003】
免疫調節特性をもち、免疫応答を損なうことなく、そして副作用が減少された、経口で有効な化合物は、制御されない炎症性疾患の現在の治療を大幅に向上させるであろう。
【0004】
臓器移植の分野では、器官拒絶反応を防止するために宿主免疫応答を抑制しなければならない。臓器移植レシピエントは、彼らが免疫抑制剤を服用するときでも、いくらか拒絶反応を受けることがある。拒絶反応は、移植後の最初の数週に最も頻繁に生じるが、拒絶反応の発症は、移植の何月もまたは何年後でさえも生じ得る。副作用を最小にすると共に、拒絶反応から最大限保護するために、3つまたは4つまでの薬物療法の組み合わせが一般に使用されている。移植臓器の拒絶反応を治療するために使用される現在の標準薬は、T型またはB型白血球の活性化における別々の細胞内経路を妨げる。このような薬物の例には、サイトカイン放出またはシグナリングを妨げるシクロスポリン、ダクリズマブ、バシリキシマブ、エベロリムスもしくはFK506;ヌクレオチド合成を阻害するアザチオプリンもしくはレフルノミド;または白血球分化の阻害剤である15-デオキシスペルグアリンがある。
【0005】
広範な免疫抑制療法による有益な効果は、これらの効果に関連するが;しかし、これらの薬物により生じる全身的免疫抑制は、感染および悪性腫瘍に対する免疫系の防御を減弱させる。さらにまた、標準的な免疫抑制剤は、高投薬量で使用されることが多く、器官損傷を引き起こし、または促進し得る。
【発明の開示】
【0006】
本発明は、Gタンパク質結合受容体S1P1/EDG1のアゴニストであり、かつ循環および浸潤するTおよびBリンパ球の数を減少させることによりこれらの成熟、記憶または増殖に影響を及ぼさずに達成される強力かつ持続性の免疫抑制効果を有する式(I)の新規化合物を提供する。S1P1/EDG1アゴニズムの結果としての循環T/Bリンパ球の減少により、おそらくS1P1/EDG1活性化と関連した内皮細胞層機能の改善が観察されることと合わせて、このような化合物が、抑制されていない炎症性疾患を治療するために、および血管機能性を改善するために有用となる。
【0007】
本発明の化合物は、単独で、またはT細胞活性化を阻害する標準薬と組み合わせて、標準的な免疫抑制療法と比較したときに感染の性向が減少した新たな免疫抑制療法を提供するために利用することができる。さらにまた、本発明の化合物は、投薬量を減少した従来の免疫抑制性療法と組み合わせて、一方では有効な免疫抑制活性を、一方では高用量の標準的な免疫抑制剤に付随した末端器官損傷の減少を提供するために使用することができる。S1P1/EDG1活性化と関連した内皮細胞層機能の改善の観察は、血管機能を改善するための化合物のさらなる利点をもたらす。
【0008】
ヒトS1P1/EDG1受容体のためのヌクレオチド配列およびアミノ酸配列は、当技術分野において公知であり、たとえばHla, T., and Maciag, T. J. Biol Chem. 265(1990), 9308-9313;1991年10月17日に公開された国際公開公報第91/15583号;1999年9月16日に公開された国際公開公報第99/46277号に発表されている(特許文献1、2、非特許文献1)。式(I)の化合物の能力および有効性は、EC50値を決定するためのGTPγSアッセイ法を使用して、および経口投与後のラットにおける循環リンパ球を測定することによって、それぞれ評価される(実施例を参照されたい)。
【先行技術文献】
【特許文献】
【0009】
【特許文献1】国際公開公報第91/15583号
【特許文献2】国際公開公報第99/46277号
【非特許文献】
【0010】
【非特許文献1】Hla, T., and Maciag, T. J. Biol Chem. 265(1990) 上記及び下記において使用される一般的用語は、本開示の範囲内において、特に示さない限り、好ましくは以下の意味を有する。
【0011】
化合物、塩、医薬組成物、疾病等について複数形が使用される場合は、単数の化合物、塩等をも意味することが意図されている。
【0012】
式(I)の化合物に対する上記又は下記のいずれの言及も、適切かつ好都合なように、式(I)の化合物の塩、特に薬学的に許容される塩をも指すものと理解されるべきである。
【0013】
C1-5アルキルという用語は、単独で、またはその他の基と組み合わせて、1から5の炭素原子をもつ飽和した、分枝または直鎖状基を意味する。C1-5アルキル基の例は、メチル、エチル、n-プロピル、イソ-プロピル、n-ブチル、イソ-ブチル、n-ペンチルおよびイソ-ペンチルである。
【0014】
同様に、C1-4アルキルという用語は、単独で、またはその他の基と組み合わせて、1から4の炭素原子をもつ飽和した、分枝または直鎖状基を意味する。C1-4アルキル基の例は、メチル、エチル、n-プロピル、イソ-プロピル、n-ブチルおよびイソ-ブチルである。
【0015】
同様に、C1-3アルキルという用語は、単独で、またはその他の基と組み合わせて、1から3の炭素原子をもつ飽和した、分枝または直鎖状基を意味し、メチル、エチル、n-プロピルまたはイソ-プロピル基を表す;好ましくはメチルおよびエチルである。
【0016】
同様に、C2-5アルキルという用語は、単独で、またはその他の基と組み合わせて、2から5の炭素原子をもつ飽和した、分枝または直鎖状基を意味する。
【0017】
同様に、C2-4アルキルという用語は、単独で、またはその他の基と組み合わせて、2から4の炭素原子をもつ飽和した、分枝または直鎖状基を意味する。C2-4アルキル基の例は、エチル、n-プロピル、イソ-プロピル、n-ブチルおよびイソ-ブチルである。
【0018】
C1-4アルコキシという用語は、単独で、またはその他の基と組み合わせて、RがC1-4アルキルであるR-O基を意味する。C1-4アルコキシ基の例は、メトキシ、エトキシ、プロポキシ、イソ-プロポキシおよびイソ-ブトキシ、好ましくはメトキシ、エトキシ、プロポキシおよびイソ-プロポキシである。
【0019】
C2-5アルコキシという用語は、単独で、またはその他の基と組み合わせて、RがC2-5アルキルであるR-O基を意味する。C2-5アルコキシ基の例は、エトキシ、プロポキシ、イソ-プロポキシ、イソ-ブトキシおよびイソ-ペントキシである。
【0020】
ハロゲンという用語は、フルオロ、クロロ、ブロモまたはヨード、好ましくはフルオロまたはクロロを、最も好ましくはクロロを意味する。
塩は、好ましくは式(I)の化合物の薬学的に許容される塩である。
【0021】
薬学的に許容される塩という用語は、無毒性の無機もしくは有機酸および/または塩基付加塩を意味する、文献: 例えば"Salt selection for basic drugs", Int. J. Pharm. (1986), 33, 201-217。
【0022】
式(I)の化合物は、1または2以上の不斉炭素原子などの、1または2以上のキラルまたは不斉中心を含んでいてもよい。二重結合または環の置換基は、特に明記しない限り、cis-(=Z-)またはtrans(=E-)形態で存在してもよい。従って、式(I)の化合物は、立体異性体の混合物として、または好ましくは純粋な立体異性体として存在してもよい。立体異性体の混合物は当業者に知られた方法で分離してもよい。
【0023】
i)本発明は、式(I)のピリジン−3−イル誘導体に関する:
【0024】
【化1】

【0025】
式中
Aは*-CONH-CH2-、*-CO-CH=CH-、*-CO-CH2CH2-、
【0026】
【化2】

【0027】
(アスタリスクは式(I)のピリジン基に結合される結合を表す。)を表し;
R1は水素、C1-4アルキルまたはクロロを表し;
R2は、C1-5アルキルまたはC1-4アルコキシを表し;
R3は、水素、C1-4アルキル、C1-4アルコキシまたはハロゲンを表し;
R4は、水素、C1-4アルキル、C1-4アルコキシ、ハロゲン、トリフルオロメチルまたはトリフルオロメトキシを表し;
R5は、2,3-ジヒドロキシプロピル、ジ-(ヒドロキシ-C1-4アルキル)-C1-4アルキル、-CH2-(CH2)k-NHSO2R53、-(CH2)nCH(OH)-CH2-NHSO2R53、-CH2-(CH2)k-NHCOR54、-(CH2)nCH(OH)-CH2-NHCOR54、-CH2-(CH2)n-CONR51R52、-CONHR51、1-(3-カルボキシ-アゼチジニル)-2-アセチル、1-(2-カルボキシ-ピロリジニル)-2-アセチル、1-(3-カルボキシ-ピロリジニル)-2-アセチル、1-(3-カルボキシ-アゼチジニル)-3-プロピオニル、1-(2-カルボキシ-ピロリジニル)-3-プロピオニル、1-(3-カルボキシ-ピロリジニル)-3-プロピオニル、-(CH2)nCH(OH)-CH2-NR51R52、ヒドロキシ、ヒドロキシ-C2-5アルコキシ、ジ-(ヒドロキシ-C1-4アルキル)-C1-4アルコキシ、2,3-ジヒドロキシプロポキシ、2-ヒドロキシ-3-メトキシ-プロポキシ、-OCH2-(CH2)m-NR51R52、2-[(アゼチジン-3-カルボン酸)-1-イル]-エトキシ、2-[(アゼチジン-3-カルボン酸C1-5-アルキルエステル)-1-イル]-エトキシ、2-[(ピロリジン-3-カルボン酸)-1-イル]-エトキシ、2-[(ピロリジン-3-カルボン酸 C1-5-アルキルエステル)-1-イル]-エトキシ、-OCH2-CH(OH)-CH2-NR51R52、3-[(アゼチジン-3-カルボン酸)-1-イル]-2-ヒドロキシプロポキシ、3-[(アゼチジン-3-カルボン酸 C1-5-アルキルエステル)-1-イル]-2-ヒドロキシプロポキシ、2-ヒドロキシ-3-[(ピロリジン-3-カルボン酸)-1-イル]-プロポキシ、2-ヒドロキシ-3-[(ピロリジン-3-カルボン酸 C1-5-アルキルエステル)-1-イル]-プロポキシ、2-ヒドロキシ-3-[(ピロリジン-2-カルボン酸)-1-イル]-プロポキシ、2-ヒドロキシ-3-[(ピロリジン-2-カルボン酸 C1-5-アルキルエステル)-1-イル]-プロポキシ、-OCH2-(CH2)m-NHSO2R53、-OCH2-CH(OH)-CH2-NHSO2R53、-OCH2-(CH2)m-NHCOR54、-OCH2-CH(OH)-CH2-NHCOR54を表し;
R51は、水素、C1-3アルキル、2-ヒドロキシエチル、2-ヒドロキシ-1-ヒドロキシメチル-エチル、2,3-ジヒドロキシプロピル、カルボキシメチル、1-(C1-5-アルキルカルボキシ)メチル、2-カルボキシエチルまたは2-(C1-5-アルキルカルボキシ)エチルを表し;
R52は、水素、メチルまたはエチルを表し;
R53は、C1-3-アルキル、メチルアミノ、エチルアミノまたはジメチルアミノを表し;
R54は、ヒドロキシメチル、ヒドロキシエチル、アミノメチル、メチルアミノメチル、ジメチルアミノメチル、アミノエチル、2-メチルアミノ-エチルまたは2-ジメチルアミノ-エチルを表し;
kは、1、2または3の整数を表し;
mは、1または2の整数を表し;
nは、0、1または2を表し;そして
R6は、水素、C1-4アルキルまたはハロゲンを表す。
【0028】
ii)本発明のもう一つの態様は、Aが、
【0029】
【化3】

【0030】
(アスタリスクは式(I)のピリジン基に結合される結合を表す。)を表す、態様i)に記載のピリジン−3−イル誘導体に関する。
【0031】
iii)本発明のもう一つの態様は、Aが、
【0032】
【化4】

【0033】
(アスタリスクは式(I)のピリジン基に結合される結合を表す。)を表す、態様i)に記載のピリジン−3−イル誘導体に関する。
【0034】
iv)本発明のもう一つの態様は、Aが、
【0035】
【化5】

【0036】
(特にAが
【0037】
【化6】

【0038】
を表す)
(アスタリスクは式(I)のピリジン基に結合される結合を表す。)を表す、態様i)に記載のピリジン−3−イル誘導体に関する。
【0039】
v)本発明のもう一つの態様は、Aが、
【0040】
【化7】

【0041】
(アスタリスクは式(I)のピリジン基に結合される結合を表す。)を表す、態様i)に記載のピリジン−3−イル誘導体に関する。
【0042】
vi)本発明のもう一つの態様は、Aが、
【0043】
【化8】

【0044】
(アスタリスクは式(I)のピリジン基に結合される結合を表す。)を表す、態様i)に記載のピリジン−3−イル誘導体に関する。
【0045】
vii)本発明のもう一つの態様は、Aが、
【0046】
【化9】

【0047】
を表す、態様i)に記載のピリジン−3−イル誘導体に関する。
【0048】
viii)本発明のもう一つの態様は、R1がC1-4アルキルまたはクロロを表す、態様i)からvii)のいずれかに記載のピリジン−3−イル誘導体に関する。
【0049】
ix)本発明のもう一つの態様は、R1がC1-4アルキルを表す、態様i)からvii)のいずれかに記載のピリジン−3−イル誘導体に関する。
【0050】
x)本発明のもう一つの態様は、R1がメチルまたはエチルを表す、態様i)からvi)のいずれかに記載のピリジン−3−イル誘導体に関する。
【0051】
xi)本発明のもう一つの態様は、R1がメチルを表す、態様i)からvi)のいずれかに記載のピリジン−3−イル誘導体に関する。
【0052】
xii)本発明のもう一つの態様は、R2がC1-5アルキルを表す、態様i)からxi)のいずれかに記載のピリジン−3−イル誘導体に関する。
【0053】
xiii)本発明のもう一つの態様は、R2がC2-4アルキルを表す、態様i)からxi)のいずれかに記載のピリジン−3−イル誘導体に関する。
【0054】
xiv)本発明のもう一つの態様は、R2がエチル、n-プロピル、イソプロピルまたはイソブチルを表す、態様i)からxi)のいずれかに記載のピリジン−3−イル誘導体に関する。
【0055】
xv)本発明のもう一つの態様は、R2がn-プロピルまたはイソブチルを表す、態様i)からxi)のいずれかに記載のピリジン−3−イル誘導体に関する。
【0056】
xvi)本発明のもう一つの態様は、R2がC1-4アルコキシを表す、態様i)からxi)のいずれかに記載のピリジン−3−イル誘導体に関する。
【0057】
xvii)本発明のもう一つの態様は、R3、R4およびR6の少なくとも一つが水素以外の基を表す、態様i)からxvi)のいずれかに記載のピリジン−3−イル誘導体に関する。
【0058】
xviii)本発明のもう一つの態様は、R3がメチルまたはメトキシ(特にメトキシ)を表し、R4およびR6が水素を表す、態様i)からxvi)のいずれかに記載のピリジン−3−イル誘導体に関する。
【0059】
xix)本発明のもう一つの態様は、R3が水素を表す、態様i)からxvi)のいずれかに記載のピリジン−3−イル誘導体に関する。
【0060】
xx)本発明のもう一つの態様は、R3が水素を表し、R4がC1-4アルキルまたはC1-4アルコキシを表し、R6がC1-4アルキルまたはハロゲンを表す、態様i)からxvi)のいずれかに記載のピリジン−3−イル誘導体に関する。
【0061】
xxi)本発明のもう一つの態様は、R3が水素を表し、R4がC1-3アルキルまたはメトキシ(特にメチル、エチルまたはメトキシ)を表し、R6がメチル、エチルまたはハロゲン(特にクロロ)を表す、態様i)からxvi)のいずれかに記載のピリジン−3−イル誘導体に関する。
【0062】
xxii)本発明のもう一つの態様は、R3が水素を表し、R4およびR6がメチル基を表す、態様i)からxvi)のいずれかに記載のピリジン−3−イル誘導体に関する。
【0063】
xxiii)本発明のもう一つの態様は、R3が水素を表し、R4がメチル基を表し、R6がエチル基を表す、態様i)からxvi)のいずれかに記載のピリジン−3−イル誘導体に関する。
【0064】
xxiv)本発明のもう一つの態様は、R3が水素を表し、R4がメトキシ基を表し、R6がクロロを表す、態様i)からxvi)のいずれかに記載のピリジン−3−イル誘導体に関する。
【0065】
xxv)本発明のもう一つの態様は、R3が水素を表し、R4がメチル基を表し、R6がクロロを表す、態様i)からxvi)のいずれかに記載のピリジン−3−イル誘導体に関する。
【0066】
xxvi)本発明のもう一つの態様は、R5が、2,3-ジヒドロキシプロピル、ジ-(ヒドロキシ-C1-4アルキル)-C1-4アルキル、-CH2-(CH2)k-NHSO2R53、-(CH2)nCH(OH)-CH2-NHSO2R53、-CH2-(CH2)k-NHCOR54、-(CH2)nCH(OH)-CH2-NHCOR54、-CH2-(CH2)n-CONR51R52、-CONHR51、-(CH2)nCH(OH)-CH2-NR51R52、ヒドロキシ、ヒドロキシ-C2-5アルコキシ、ジ-(ヒドロキシ-C1-4アルキル)-C1-4アルコキシ、2,3-ジヒドロキシプロポキシ、2-ヒドロキシ-3-メトキシ-プロポキシ、-OCH2-(CH2)m-NR51R52、-OCH2-CH(OH)-CH2-NR51R52、-OCH2-(CH2)m-NHSO2R53、-OCH2-CH(OH)-CH2-NHSO2R53、-OCH2-(CH2)m-NHCOR54または-OCH2-CH(OH)-CH2-NHCOR54を表す、態様i)からxxv)のいずれかに記載のピリジン−3−イル誘導体に関する。
【0067】
xxvii)本発明のもう一つの態様は、R5が、2,3-ジヒドロキシプロピル、-CH2-(CH2)k-NR51R52、-CH2-(CH2)k-NHCOR54、-(CH2)nCH(OH)-CH2-NHCOR54、-CH2-(CH2)n-CONR51R52、-CONHR51、-(CH2)nCH(OH)-CH2-NR51R52、ヒドロキシ-C2-5アルコキシ、ジ-(ヒドロキシ-C1-4アルキル)-C1-4アルコキシ、2,3-ジヒドロキシプロポキシ、2-ヒドロキシ-3-メトキシ-プロポキシ、-OCH2-(CH2)m-NR51R52、-OCH2-CH(OH)-CH2-NR51R52、-OCH2-(CH2)m-NHCOR54または-OCH2-CH(OH)-CH2-NHCOR54を表す(特に、R5が、2,3-ジヒドロキシプロピル、-CH2-(CH2)k-NR51R52、-CH2-(CH2)k-NHCOR54、-(CH2)nCH(OH)-CH2-NHCOR54、-CH2-(CH2)n-CONR51R52、-(CH2)nCH(OH)-CH2-NR51R52、ヒドロキシ-C2-5アルコキシ、ジ-(ヒドロキシ-C1-4アルキル)-C1-4アルコキシ、2,3-ジヒドロキシプロポキシ、2-ヒドロキシ-3-メトキシ-プロポキシ、-OCH2-(CH2)m-NR51R52、-OCH2-CH(OH)-CH2-NR51R52、-OCH2-(CH2)m-NHCOR54または-OCH2-CH(OH)-CH2-NHCOR54を表す)、態様i)からxxv)のいずれかに記載のピリジン−3−イル誘導体に関する。
【0068】
xxviii)本発明のもう一つの態様は、R5が、ヒドロキシ-C2-5アルコキシ、ジ-(ヒドロキシ-C1-4アルキル)-C1-4アルコキシ、2,3-ジヒドロキシプロポキシ、-OCH2-(CH2)m-NR51R52、-OCH2-CH(OH)-CH2-NR51R52、-OCH2-(CH2)m-NHCOR54または-OCH2-CH(OH)-CH2-NHCOR54を表す、態様i)からxxv)のいずれかに記載のピリジン−3−イル誘導体に関する。
【0069】
xxix)本発明のもう一つの態様は、R5が、3-ヒドロキシ-2-ヒドロキシメチル-プロポキシ、2,3-ジヒドロキシプロポキシまたは-OCH2-CH(OH)-CH2-NHCOR54を表す(特に、R5が、2,3-ジヒドロキシプロポキシまたは-OCH2-CH(OH)-CH2-NHCOR54を表し、上記式中R54がヒドロキシメチルを表す)、態様i)からxxv)のいずれかに記載のピリジン−3−イル誘導体に関する。
【0070】
xxx)本発明のもう一つの態様は、R5が、-OCH2-CH(OH)-CH2-NHCOR54を表し、上記式中、R54がヒドロキシメチルを表す、態様i)からxxv)のいずれかに記載のピリジン−3−イル誘導体に関する。
【0071】
xxxi)本発明のもう一つの態様は、R5が、2,3-ジヒドロキシプロポキシを表す、態様i)からxxv)のいずれかに記載のピリジン−3−イル誘導体に関する。
【0072】
xxxii)本発明のもう一つの態様は、
Aが
【0073】
【化10】

【0074】
(特にAが
【0075】
【化11】

【0076】
を表し)(アスタリスクは式(I)のピリジン基に結合される結合を表す。);
R1が、メチル、エチルまたはクロロ(特にメチルまたはエチル)を表し;
R2が、n-プロピル、イソブチルまたはイソプロポキシ(特にn-プロピルまたはイソブチル)を表し;
R3が、水素、メチルまたはメトキシ(特に水素またはメトキシ)を表し;
R4が、水素、メチル、エチルまたはメトキシを表し;
R5が、ヒドロキシ-C2-5アルコキシ、ジ-(ヒドロキシ-C1-4アルキル)-C1-4アルコキシ、2,3-ジヒドロキシプロポキシ、-OCH2-CH(OH)-CH2-NR51R52または-OCH2-CH(OH)-CH2-NHCOR54を表し(特にR5が、2,3-ジヒドロキシプロポキシまたは-OCH2-CH(OH)-CH2-NHCOR54を表し);
R54が、ヒドロキシメチル、メチルアミノメチルまたは2-メチルアミノ-エチルを表し;そして
R6が、水素、メチル、エチルまたはクロロを表し;
本態様において、1または2以上の置換基または基の意味は、態様v)からvii)、x)、xi)、xv)、xvii)からxix)、xxii)からxxv)、およびxxix)からxxxi)のいずれかにおける当該置換基または基に対して与えられた意味によって置き換えられてもよい、態様i)に記載のピリジン−3−イル誘導体に関する。
【0077】
xxxiii)本発明のもう一つの態様は、
Aが
【0078】
【化12】

【0079】
を表し(特にAが
【0080】
【化13】

【0081】
を表し)(アスタリスクは式(I)のピリジン基に結合される結合を表す。);
R1が、水素、C1-4アルキルまたはクロロを表し;
R2が、C1-5アルキルまたはC1-4アルコキシを表し;
R3が、水素を表し;
R4が、C1-4アルキルまたはC1-4アルコキシを表し;
R5が、ヒドロキシ、ヒドロキシ-C2-5アルコキシ、ジ-(ヒドロキシ-C1-4アルキル)-C1-4アルコキシ、2,3-ジヒドロキシプロポキシ、-OCH2-CH(OH)-CH2-NR51R52または-OCH2-CH(OH)-CH2-NHCOR54を表し;
R51が、水素、2-ヒドロキシエチルまたは2-ヒドロキシ-1-ヒドロキシメチル-エチル(特に水素)を表し;
R52が、水素を表し;
R54が、ヒドロキシメチルを表し;
R6が、C1-4アルキルまたはハロゲンを表し;
本態様において、1または2以上の置換基または基の意味は、態様vi)からxvi)、xxi)からxxv)およびxxix)からxxxi)のいずれかにおける当該置換基または基に対して与えられた意味によって置き換えられてもよい、態様i)に記載のピリジン−3−イル誘導体に関する。
【0082】
xxxiv)式(I)のピリジン−3−イル誘導体の例は:
3-{4-[5-(5-クロロ-6-イソプロポキシ-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-2,6-ジメチル-フェノキシ}-プロパン-1,2-ジオール、
N-(3-{4-[5-(5-クロロ-6-イソプロポキシ-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-2,6-ジメチル-フェノキシ}-2-ヒドロキシ-プロピル)-2-ヒドロキシ-アセタミド、
3-{4-[5-(6-イソブチル-5-メチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-2,6-ジメチル-フェノキシ}-プロパン-1,2-ジオール、
2-ヒドロキシ-N-(2-ヒドロキシ-3-{4-[5-(6-イソブチル-5-メチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-2,6-ジメチル-フェノキシ}-プロピル)-アセタミド、
N-(3-{2-エチル-4-[5-(6-イソブチル-5-メチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-6-メチル-フェノキシ}-2-ヒドロキシ-プロピル)-2-ヒドロキシ-アセタミド、
3-{4-[5-(5,6-ジイソブチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-2,6-ジメチル-フェノキシ}-プロパン-1,2-ジオール、
N-(3-{4-[5-(5,6-ジエチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-2-エチル-6-メチル-フェノキシ}-2-ヒドロキシ-プロピル)-2-ヒドロキシ-アセタミド、
2-ヒドロキシ-N-(2-ヒドロキシ-3-{4-[5-(6-イソブチル-5-メチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-3-メチル-フェノキシ}-プロピル)-アセタミド、
N-(3-{2-クロロ-4-[5-(6-イソブチル-5-メチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-6-メチル-フェノキシ}-2-ヒドロキシ-プロピル)-2-ヒドロキシ-アセタミド、
N-(3-{2-クロロ-4-[5-(6-イソブチル-5-メチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-6-メトキシ-フェノキシ}-2-ヒドロキシ-プロピル)-2-ヒドロキシ-アセタミド、
N-((R)-3-{2-エチル-4-[5-(6-イソブチル-5-メチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-6-メチル-フェノキシ}-2-ヒドロキシ-プロピル)-2-ヒドロキシ-アセタミド、
N-((S)-3-{2-エチル-4-[3-(6-イソブチル-5-メチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-5-イル]-6-メチル-フェノキシ}-2-ヒドロキシ-プロピル)-2-ヒドロキシ-アセタミド、
N-((S)-3-{2-エチル-4-[5-(6-イソブチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-6-メチル-フェノキシ}-2-ヒドロキシ-プロピル)-2-ヒドロキシ-アセタミド、
(S)-3-{2-エチル-4-[5-(5-エチル-6-イソブチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-6-メチル-フェノキシ}-プロパン-1,2-ジオール、
N-(3-{2-エチル-4-[5-(5-エチル-6-イソブチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-6-メチル-フェノキシ}-2-ヒドロキシ-プロピル)-2-ヒドロキシ-アセタミド、
(R)-3-{2-エチル-4-[5-(6-イソプロポキシ-5-メチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-6-メチル-フェノキシ}-プロパン-1,2-ジオール、
(S)-3-{2-エチル-4-[5-(6-イソプロポキシ-5-メチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-6-メチル-フェノキシ}-プロパン-1,2-ジオール、
N-((R)-3-{2-エチル-4-[5-(6-イソプロポキシ-5-メチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-6-メチル-フェノキシ}-2-ヒドロキシ-プロピル)-2-ヒドロキシ-アセタミド、
N-((S)-3-{2-エチル-4-[5-(6-イソプロポキシ-5-メチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-6-メチル-フェノキシ}-2-ヒドロキシ-プロピル)-2-ヒドロキシ-アセタミド、
3-{2-エチル-4-[5-(6-イソプロポキシ-5-メチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-6-メチル-フェニル}-N-(2-ヒドロキシ-エチル)-プロピオンアミド、
(R)-3-{2-エチル-4-[3-(6-イソプロポキシ-5-メチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-5-イル]-6-メチル-フェノキシ}-プロパン-1,2-ジオール、
(S)-3-{2-エチル-4-[3-(6-イソプロポキシ-5-メチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-5-イル]-6-メチル-フェノキシ}-プロパン-1,2-ジオールおよび
3-{2-エチル-4-[5-(6-イソプロポキシ-5-メチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-6-メチル-フェニル}-プロピオン酸
から選択される。
【0083】
xxxv) 式(I)のピリジン−3−イル誘導体の別の態様例は:
(R)-3-{4-[5-(5-クロロ-6-イソプロポキシ-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-2,6-ジメチル-フェノキシ}-プロパン-1,2-ジオール、
(S)-3-{4-[5-(5-クロロ-6-イソプロポキシ-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-2,6-ジメチル-フェノキシ}-プロパン-1,2-ジオール、
N-((R)-3-{4-[5-(5-クロロ-6-イソプロポキシ-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-2,6-ジメチル-フェノキシ}-2-ヒドロキシ-プロピル)-2-ヒドロキシ-アセタミド、
N-((S)-3-{4-[5-(5-クロロ-6-イソプロポキシ-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-2,6-ジメチル-フェノキシ}-2-ヒドロキシ-プロピル)-2-ヒドロキシ-アセタミド、
(R)-3-{4-[5-(6-イソブチル-5-メチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-2,6-ジメチル-フェノキシ}-プロパン-1,2-ジオール、
(S)-3-{4-[5-(6-イソブチル-5-メチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-2,6-ジメチル-フェノキシ}-プロパン-1,2-ジオール、
2-ヒドロキシ-N-((R)-2-ヒドロキシ-3-{4-[5-(6-イソブチル-5-メチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-2,6-ジメチル-フェノキシ}-プロピル)-アセタミド、
2-ヒドロキシ-N-((S)-2-ヒドロキシ-3-{4-[5-(6-イソブチル-5-メチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-2,6-ジメチル-フェノキシ}-プロピル)-アセタミド、
N-((R)-3-{2-エチル-4-[5-(6-イソブチル-5-メチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-6-メチル-フェノキシ}-2-ヒドロキシ-プロピル)-2-ヒドロキシ-アセタミド、
N-((S)-3-{2-エチル-4-[5-(6-イソブチル-5-メチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-6-メチル-フェノキシ}-2-ヒドロキシ-プロピル)-2-ヒドロキシ-アセタミド、
(R)-3-{4-[5-(5,6-ジイソブチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-2,6-ジメチル-フェノキシ}-プロパン-1,2-ジオール、
(S)-3-{4-[5-(5,6-ジイソブチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-2,6-ジメチル-フェノキシ}-プロパン-1,2-ジオール、
N-((R)-3-{4-[5-(5,6-ジエチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-2-エチル-6-メチル-フェノキシ}-2-ヒドロキシ-プロピル)-2-ヒドロキシ-アセタミド、
N-((S)-3-{4-[5-(5,6-ジエチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-2-エチル-6-メチル-フェノキシ}-2-ヒドロキシ-プロピル)-2-ヒドロキシ-アセタミド、
2-ヒドロキシ-N-((R)-2-ヒドロキシ-3-{4-[5-(6-イソブチル-5-メチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-3-メチル-フェノキシ}-プロピル)-アセタミド、
2-ヒドロキシ-N-((S)-2-ヒドロキシ-3-{4-[5-(6-イソブチル-5-メチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-3-メチル-フェノキシ}-プロピル)-アセタミド、
N-((R)-3-{2-クロロ-4-[5-(6-イソブチル-5-メチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-6-メチル-フェノキシ}-2-ヒドロキシ-プロピル)-2-ヒドロキシ-アセタミド、
N-((S)-3-{2-クロロ-4-[5-(6-イソブチル-5-メチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-6-メチル-フェノキシ}-2-ヒドロキシ-プロピル)-2-ヒドロキシ-アセタミド、
N-((R)-3-{2-クロロ-4-[5-(6-イソブチル-5-メチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-6-メトキシ-フェノキシ}-2-ヒドロキシ-プロピル)-2-ヒドロキシ-アセタミド、
N-((S)-3-{2-クロロ-4-[5-(6-イソブチル-5-メチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-6-メトキシ-フェノキシ}-2-ヒドロキシ-プロピル)-2-ヒドロキシ-アセタミド、
N-((R)-3-{2-エチル-4-[5-(6-イソブチル-5-メチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-6-メチル-フェノキシ}-2-ヒドロキシ-プロピル)-2-ヒドロキシ-アセタミド、
N-((S)-3-{2-エチル-4-[3-(6-イソブチル-5-メチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-5-イル]-6-メチル-フェノキシ}-2-ヒドロキシ-プロピル)-2-ヒドロキシ-アセタミド、
N-((S)-3-{2-エチル-4-[5-(6-イソブチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-6-メチル-フェノキシ}-2-ヒドロキシ-プロピル)-2-ヒドロキシ-アセタミド、
(S)-3-{2-エチル-4-[5-(5-エチル-6-イソブチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-6-メチル-フェノキシ}-プロパン-1,2-ジオール、
N-((R)-3-{2-エチル-4-[5-(5-エチル-6-イソブチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-6-メチル-フェノキシ}-2-ヒドロキシ-プロピル)-2-ヒドロキシ-アセタミド、
N-((S)-3-{2-エチル-4-[5-(5-エチル-6-イソブチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-6-メチル-フェノキシ}-2-ヒドロキシ-プロピル)-2-ヒドロキシ-アセタミド、
(R)-3-{2-エチル-4-[5-(6-イソプロポキシ-5-メチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-6-メチル-フェノキシ}-プロパン-1,2-ジオール、
(S)-3-{2-エチル-4-[5-(6-イソプロポキシ-5-メチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-6-メチル-フェノキシ}-プロパン-1,2-ジオール、
N-((R)-3-{2-エチル-4-[5-(6-イソプロポキシ-5-メチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-6-メチル-フェノキシ}-2-ヒドロキシ-プロピル)-2-ヒドロキシ-アセタミド、
N-((S)-3-{2-エチル-4-[5-(6-イソプロポキシ-5-メチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-6-メチル-フェノキシ}-2-ヒドロキシ-プロピル)-2-ヒドロキシ-アセタミド、
3-{2-エチル-4-[5-(6-イソプロポキシ-5-メチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-6-メチル-フェニル}-N-(2-ヒドロキシ-エチル)-プロピオンアミド、
(R)-3-{2-エチル-4-[3-(6-イソプロポキシ-5-メチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-5-イル]-6-メチル-フェノキシ}-プロパン-1,2-ジオール、
(S)-3-{2-エチル-4-[3-(6-イソプロポキシ-5-メチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-5-イル]-6-メチル-フェノキシ}-プロパン-1,2-ジオールおよび
3-{2-エチル-4-[5-(6-イソプロポキシ-5-メチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-6-メチル-フェニル}-プロピオン酸
から選択される。
【0084】
xxxvi) 本発明のさらなる側面は、新規な式(II)のピリジン−3−イル誘導体に関する:
【0085】
【化14】

【0086】
式中、A、R1、R2及びnは、請求項1に定義された意味を有する;R3は、水素を表す;R4は、C1-4-アルキルまたはC1-4-アルコキシを表す;そしてR6は、C1-4-アルキルまたはハロゲンを表す。
【0087】
式(I)の化合物およびこれらの薬学的に許容される塩は、医薬として、たとえば経腸または非経口投与のための医薬組成物の形態で使用することができる。
【0088】
医薬組成物の製造は、いずれの当業者によく知られた様式で(たとえばMark Gibson, Editor, Pharmaceutical Preformulation and Formulation, IHS Health Group, Englewood, CO, USA, 2001; Remington, The Science and Practice of Pharmacy, 20th Edition, Philadelphia College of Pharmacy and Scienceを参照されたい)、記述された式(I)の化合物またはこれらの薬学的に許容される塩を、任意に、ガレノスの投与形態中に、適切な無毒の不活性な薬学的に許容される固体または液体の担体材料および必要に応じて、通常の薬学的アジュバントと共に、その他の治療的に有益な物質と組み合わせることによって遂行することができる。
【0089】
式(I)の化合物を含む医薬組成物は、活性化された免疫系と関連する疾患もしくは障害の予防および/または治療のために有用である。
【0090】
かかる疾患または障害は、移植された臓器、組織または細胞に対する拒絶反応;移植によってもたらされる移植片対宿主病;関節リウマチを含む自己免疫性症候群;全身性エリテマトーデス;抗リン脂質抗体症候群;橋本甲状腺炎;リンパ球性甲状腺炎;多発性硬化症;重症筋無力症;I型糖尿病;ブドウ膜炎;上強膜炎;強膜炎;川崎病、ブドウ膜網膜炎;後部ブドウ膜炎;ベーチェット病関連ブドウ膜炎;ブドウ膜髄膜炎症候群;アレルギー性脳脊髄炎;慢性アレルギー性血管症;リウマチ熱、感染後糸球体腎炎を含む感染後自己免疫疾患;炎症性および過増殖性皮膚疾患;乾癬;乾癬性関節炎;アトピー性皮膚炎;ミオパシー;筋炎;骨髄炎;接触皮膚炎;湿疹性皮膚炎;脂漏性皮膚炎;扁平苔癬;天疱瘡;水疱性類天疱瘡;表皮水疱症;蕁麻疹;血管性浮腫;脈管炎;紅斑;皮膚好酸球増加;アクネ(瘡);強皮症;円形脱毛症;角結膜炎;春季カタル性結膜炎;角膜炎;ヘルペス性角膜炎;角膜上皮性ジストロフィー;角膜白斑;眼部天疱瘡;モーレン潰瘍;潰瘍性角膜炎;強膜炎;グレーブス眼症;フォークト・小柳・原田症候群;類肉腫症;花粉アレルギー;可逆性閉塞性気道疾患;気管支喘息;アレルギー喘息;内因性喘息;外因性喘息;塵埃喘息;慢性または難治性喘息;遅発性喘息および気道過敏症;細気管支炎;気管支炎;子宮内膜症;睾丸炎;胃潰瘍;虚血性腸疾患;炎症性腸疾患;壊死性腸炎;熱傷関連腸病変;セリアック病;直腸炎;好酸球性胃腸炎;肥満細胞症;クローン病;潰瘍性大腸炎;虚血性疾患および血栓症により惹起された血管損傷;アテローム性動脈硬化症;脂肪心;心筋炎;心筋梗塞;大動脈症候群;ウイルス性疾患による悪液質;血管血栓症;偏頭痛;鼻炎;湿疹;間質性腎炎;IgA誘発腎障害;グッドパスチャー症候群;溶血性尿毒症症候群;糖尿病性腎障害;糸球体硬化;糸球体腎炎;尿細管間質性腎炎;間質性膀胱炎;多発筋炎;ギラン・バレ症候群;メニエール病;多発神経炎;多発性神経炎;脊髄炎;単神経炎;神経根障害;甲状腺機能亢進症;バセドウ病;甲状腺中毒症;真性赤血球系無形成症;再生不良性貧血;低形成貧血;特発性血小板減少性紫斑病;自己免疫性溶血性貧血;自己免疫性血小板減少症;顆粒球減少;悪性貧血;巨赤芽球性貧血;赤血球形成不全;骨粗しょう症;肺線維症;特発性間質性肺炎;皮膚筋炎;尋常性白斑;尋常性魚鱗癬;光線過敏症;皮膚T細胞リンパ腫;結節性多発性動脈炎;ハンチントン舞踏病;シデナム舞踏病;心筋症;心筋炎;強皮症;ウェーゲナー肉芽腫;シェーグレン症候群;脂肪過多;好酸球性筋膜炎;歯肉、歯周靱帯、歯槽骨、セメント質の損傷・病変;若はげまたは老年性脱毛;筋ジストロフィー;膿皮症;セザリー症候群;下垂体炎;慢性副腎機能不全;アジソン病;保存時に起る臓器の虚血・再灌流損傷;エンドトキシンショック;偽膜性結腸炎;薬物または放射線による結腸炎;虚血性急性腎不全;慢性腎不全;肺癌;リンパ起源の悪性腫瘍;急性または慢性リンパ球性白血病;リンパ腫;肺気腫;白内障;鉄沈着症;網膜色素変性;老年性黄斑変性;硝子体瘢痕化;角膜アルカリ熱傷;紅斑性皮膚炎;水疱性皮膚炎;セメント皮膚炎;歯肉炎;歯周炎;敗血症;膵炎;抹消動脈疾患;発癌;固形癌腫瘍;癌転移;高山病;自己免疫肝炎;原発性胆汁性肝硬変;硬化性胆道炎;部分肝切除;急性肝壊死;肝硬変;アルコール肝硬変;肝不全;劇症肝不全;遅発性肝不全;「慢性期急性」肝不全からなる群から選ばれるものである。
【0091】
式(I)の化合物により治療および/または予防されるべき、好ましい疾患または障害は、腎臓、肝臓、心臓、肺、膵臓、角膜および皮膚等の移植された臓器に対する拒絶反応;幹細胞移植によりもたらされる移植片対宿主病;関節リウマチ、多発性硬化症、クローン病および潰瘍性大腸炎等の炎症性腸疾患、乾癬、乾癬性関節炎、橋本甲状腺炎等の甲状腺炎、ブドウ膜網膜炎を含む自己免疫症候群;鼻炎、結膜炎、皮膚炎等のアトピー性疾患;喘息;I型糖尿病;リウマチ熱、感染後糸球体腎炎を含む感染後自己免疫疾患;固形癌および腫瘍転移からなる群から選ばれるものである。
【0092】
式(I)の化合物により治療および/または予防されるべき、特に好ましい疾患または障害は、腎臓、肝臓、心臓および肺から選択される移植された臓器に対する拒絶反応;幹細胞移植によりもたらされる移植片対宿主病;関節リウマチ、多発性硬化症、乾癬、乾癬性関節炎、クローン病および橋本甲状腺炎から選択される自己免疫症候群;およびアトピー性皮膚炎からなる群から選ばれるものである。
【0093】
本発明はまた、式(I)の化合物の薬学的に活性な量を患者に投与することを含む、本明細書において言及した疾患もしくは障害の予防または治療のための方法にも関する。
さらにまた、式(I)の化合物は、1つまたはいくつかの免疫調節薬と組み合わせて、本明細書において言及した疾患および障害の予防および/または治療のために有用である。本発明の好ましい態様によれば、前記薬剤は、免疫抑制薬、副腎皮質ステロイド、NSAID、細胞毒、接着分子阻害剤、サイトカイン、サイトカイン阻害剤、サイトカイン受容体アンタゴニストおよび組換えサイトカイン受容体からなる群より選択される。
【0094】
また、本発明は、任意に1つまたはいくつかの免疫調節薬と組み合わせて使用するための、本明細書において言及した疾患および障害の予防または治療のための医薬組成物の製造のための、式(I)の化合物の使用に関する。
【0095】
式(I)の化合物は、以下の方法によって、実施例に示された方法によって、または類似の方法によって製造することができる。最適反応条件は、使用する具体的反応物または溶媒によって変更してもよいが、このような条件は、当業者により、ルーチンの最適化手順によって決定することができる。
【0096】
本発明の式(I)の化合物は、下記に概説した反応の一般的順序に従って製造することができる。式(I)の化合物を生じる合成の可能性のうちの少数のみを記述してある。
【0097】
【化15】

【0098】
Aが-CO-CH=CH-を表す場合には、式(I)の化合物は、構造1の化合物を、塩基または酸の存在下で、構造2の化合物と反応させることにより調製してもよい。残基R3〜R6に存在する官能基は、一時的に保護を必要としてもよく、または縮合反応に続くさらなる工程においてさらに導入してもよい。Aが-CO-CH2CH2-を表す式(I)の化合物は、Aが-CO-CH=CH-を表す式(I)の化合物を、EtOH、MeOH、THFなど、またはそれらの混合物などの溶媒中で、Pd/C、Pt/C、PtO2などの触媒の存在下で、水素と反応させることによって調製してもよい。
【0099】
【化16】

【0100】
構造1の化合物は、構造3の化合物をメチルグリニャール試薬と反応させることにより、または構造4の化合物を、エーテル、THF等の溶媒中で、−20と50℃の間の温度で、2当量のメチルリチウムで処理することにより調製してもよい。構造3のWeinrebアミド化合物は、EDC、DCCなどのカップリング試薬の存在下において、構造4の化合物を塩酸N,O-ジメチルヒドロキシルアミンで処理することによって製造される。(M. Mentzel, H. M. R. Hoffmann, N-Methoxy N-methyl amides (Weinreb amides) in modern organic synthesis, Journal fuer Praktische Chemie/Chemiker-Zeitung 339 (1997), 517-524; J. Singh, N. Satyamurthi, I. S. Aidhen, The growing synthetic utility of Weinreb's amide, Journal fuer Praktische Chemie(Weinheim, Germany) 342 (2000) 340-347; V. K. Khlestkin, D. G. Mazhukin, Recent advances in the application of N,O-dialkyl hydroxylamines in organic chemistry, Current Organic Chemistry 7(2003), 967-993)。
【0101】
【化17】

【0102】
Aが-CO-NH-CH2-を表す式(I)の化合物は、EDC、DCC、TBTU、PyBOPなどのカップリング試薬を用いて、構造5の化合物を構造4の化合物とカップリングすることによって、または構造5の化合物を、構造4の化合物の対応する酸クロリドまたはブロミドとカップリングすることによって、製造してもよい。
【0103】
5-ピリジン-3-イル-[1,2,4]オキサジアゾール誘導体を表す式(I)の化合物は、ジオキサン、THF、DME、キシレン、トルエン、ベンゼン、ピリジン、DMF、DCM、酢酸、TFAなどの溶媒中で、室温または高温にて、酸(たとえば、TFA、酢酸、HCl、その他)、塩基(たとえば、NaH、NaOAc、Na2CO3、K2CO3、NEt3、その他)、テトラアルキルアンモニウム塩または水除去剤(たとえば、塩化オキサリル、カルボン酸無水物、POCl3、PCl5、P4O10、モレキュラーシーブ、Burgess試薬、その他)等の添加剤の存在下または非存在下において、構造6の化合物を反応させることによって製造される(文献: たとえば、A. R. Gangloff, J. Litvak, E. J. Shelton, D. Sperandio, V. R. Wang, K. D. Rice, Tetrahedron Lett.42 (2001), 1441-1443; T. Suzuki, K. Iwaoka, N. Imanishi, Y. Nagakura, K. Miyta, H. Nakahara, M. Ohta, T. Mase, Chem. Pharm. Bull. 47 (1999), 120-122; R. F. Poulain, A. L. Tartar, B. P. Deprez, Tetrahedron Lett. 42 (2001), 1495-1498; R. M. Srivastava, F. J. S. Oliveira, D. S. Machado, R. M. Souto-Maior, Synthetic Commun. 29 (1999), 1437-1450; E. O. John, J. M. Shreeve, Inorganic Chemistry27 (1988), 3100-3104; B. Kaboudin,K. Navaee, Heterocycles60 (2003), 2287-2292)。
【0104】
【化18】

【0105】
構造6の化合物は、DMF、THF、DCMなどの溶媒中で、TBTU、DCC、EDC、HBTU、HOBT、CDIなどの1つまたは複数のカップリング試薬の存在下または非存在下において、およびNEt3、DIPEA、NaH、K2CO3などの塩基の存在下または非存在下において、構造4の化合物を構造7の化合物と反応させることによって製造してもよい(文献: たとえば、A. Hamze, J.-F. Hernandez, P. Fulcrand, J. Martinez, J. Org. Chem. 68 (2003) 7316-7321;および前述の文献)。
【0106】
【化19】

【0107】
3-ピリジン-3-イル-[1,2,4]オキサジアゾール誘導体を表す式(I)の化合物は、構造8の化合物を構造9の化合物と反応させ、続いて対応するヒドロキシアミジンエステル中間体の環化を行うことにより、同様の方法にて製造される。(文献: たとえば、C. T. Brain, J. M. Paul, Y. Loong, P. J. Oakley, Tetrahedron Lett. 40 (1999) 3275-3278)。
【0108】
【化20】

【0109】
構造7および8の化合物は、MeOH、EtOH、ピリジンなどの溶媒中で、Na2CO3、K2CO3、NEt3、KOtBuなどの塩基の存在下または非存在下において、それぞれ構造10および11の化合物をヒドロキシルアミンまたはその塩の1つと反応させることによって製造してもよい(文献: たとえば、T. Suzuki, K. Iwaoka, N. Imanishi, Y. Nagakura, K. Miyta, H. Nakahara, M. Ohta, T. Mase, Chem. Pharm. Bull. 47(1999), 120-122; J. Cui, D. Crich, D. Wink, M. Lam, A. L. Rheingold, D. A. Case, W. T. Fu, Y. Zhou, M. Rao, A. J. Olson, M. E. Johnson, Bioorg. Med. Chem. 11 (2003), 3379-3392; R. Miller, F. Lang, Z. J. Song, D. Zewge, 国際公開公報第 2004/035538号 (Merck & Co., Inc., USA); B. Kaboudin, K. Navaee, Heterocycles 60(2003), 2287-2292)。
【0110】
【化21】

【0111】
構造2、5、6、7、9および10の残基R3〜R6に存在する官能基の性質に応じて、これらの官能基には、一時的な保護が必要であってもよい。適切な保護基は、当業者に公知であり、たとえばアルコールを保護するためのベンジルまたはトリアルキルシリル基、ジオールを保護するためのケタールなどを含む。これらの保護基は、標準的な方法論に従って採用してもよい(たとえば、T. W. Greene, P. G. M. Wuts, Protective Groups in Organic Synthesis, 3rdEdition, Wiley New York, 1991; P. J. Kocienski, Protecting Groups, Thieme Stuttgart, 1994)。あるいは、所望の残基R3〜R6、特にR5は、それぞれ構造2、5、7、9または10の化合物の適切な前駆体を用いることにより、構造1、4、8または11のピリジン化合物の、構造2、5、7、9または10のフェニル誘導体とのカップリングに続く後半の工程で導入してもよい。構造2、5、7、9および10のフェニル化合物またはこれらの前駆体は、商業的に入手可能であるか、または当業者に公知の手順に従って製造される。
【0112】
【化22】

【0113】
2-ピリジン-3-イル-[1,3,4]オキサジアゾールまたは2-ピリジン-3-イル-[1,3,4]チアジアゾール誘導体を表す式(I)の化合物は、構造4の化合物を(TBTU、DCC、EDC、HBTU、PyBOP、HOBt、CDIなどのカップリング試薬を用いて)ヒドラジンと反応させ、構造12の化合物を生成させることにより、同様に製造される。構造12の化合物は、構造9の化合物とカップリングされ、構造13の化合物を与える。構造13の化合物は、逆の反応順序に従うことにより、すなわち、最初に構造9の化合物をヒドラジンとカップリングさせ、続いて対応するヒドラジド中間体を構造4の化合物と反応させることにより製造することもできる。所望の2-ピリジン-3-イル-[1,3,4]オキサジアゾール誘導体を生成させるための構造13の化合物の脱水反応は、トルエン、MeCN、ジオキサン、THF、CHCl3等の溶媒中で、マイクロ波照射の存在下または非存在下、20と120℃の間の温度で、構造13の化合物を、PPh3、P2O5、Burgess試薬等と組み合わせてPOCl3、CCl4またはCBr4等の試薬で処理することにより行われる。(文献: たとえば、 M. A. Garcia, S. Martin-Santamaria, M. Cacho, F. Moreno de la Llave, M. Julian, A. Martinez, B. De Pascual-Teresa, A. Ramos, J. Med. Chem. 48(2005) 4068-4075; C. T. Brain, J. M. Paul, Y. Loong, P. J. Oakley, Tetrahedron Lett. 40 (1999) 3275-3278)。同様に、2-ピリジン-3-イル-[1,3,4]チアジアゾール誘導体は、構造13の化合物を、ピリジン、トルエン、THF、MeCN等の溶媒の存在下または非存在下、マイクロ波照射下または非照射下で、任意にP2S5と組み合わせて、Lawesson試薬にて高温で環化することにより得られる(文献: たとえば、 A. A. Kiryanov, P. Sampson, A. J. Seed, J. Org. Chem. 66 (2001) 7925-7929)。
【0114】
【化23】

【0115】
5-ピリジン-3-イル-オキサゾールまたは5-ピリジン-3-イル-チアゾール誘導体を表す式(I)の化合物は、構造14の化合物を、トルエン、ベンゼン、ジオキサン、THF等の溶媒中、20と120℃の間の温度で、PPh3およびNEt3、トリフルオロ酢酸無水物、Burgess試薬等と組み合わせてPOCl3、PCl5、I2で処理するか、または上述のようにピリジン、トルエン、THF、MeCN等の溶媒の存在下または非存在下、マイクロ波照射下または非照射下で、任意にP2S5と組み合わせて、Lawesson試薬にて高温で処理することにより製造される(文献: たとえば、 N. Sato, T. Shibata, M. Jitsuoka, T. Ohno, T. Takahashi, T. Hirohashi, T. Kanno, H. Iwaasa, A. Kanatani, T. Fukami, Takehiro, Bioorg. & Med. Chem. Lett. 14(2004) 1761-1764)。構造14の化合物は、構造15の化合物を構造9の化合物と反応させることにより製造される。構造15のアミノケトンは、構造1の化合物から、文献(たとえば. J. L. LaMattina, J. Heterocyclic Chem. 20(1983) 533-538; M. Pesson, M. Antoine, P. Girard, J. L. Benichon, S. Chabassier, P. De Lajudie, S. Patte, F. Roquet, G. Montay, Eur. J. Med. Chem. 15 (1980) 263-268)に記載された手順により製造することができる。2-ピリジン-3-イル-オキサゾールまたは2-ピリジン-3-イル-チアゾール誘導体を表す式(I)の化合物は、構造16の化合物および構造4の化合物から同様の方法で製造される。
【0116】
【化24】

【0117】
また、ピリジンまたはフェニル環と中央の5員芳香族複素環との間の結合は、パラジウムで触媒されたクロスカップリング反応を適用することによっても形成することができる。
構造4の化合物を構造11の化合物に変換する方法、またはその逆を行う方法は、当業者に知られている。
構造4の化合物は、5,6-ジクロロニコチン酸エステルを、Fe(acac)3 の存在下、THF、ジオキサン、DMF、NMPなど、またはこれらを組み合わせた溶媒中で、-78から25℃の範囲の温度にて、アルキルグリニャール試薬と反応させることにより製造してもよい(Fuerstnerの条件、文献: たとえば、A. Fuerstner, A. Leitner, M. Mendez, H. Krause J. Am. Chem. Soc. 124(2002) 13856-13863; A. Fuerstner, A. Leitner Angew. Chem. 114(2002) 632-635)。反応条件は、5-クロロ-6-アルキル-ニコチン酸エステルまたは5,6-ジアルキル-ニコチン酸エステルが主生成物として得られるように選択することができる。5,6-ジクロロ-ニコチン酸エステル中の2つの塩素原子は、5,6-ジクロロ-ニコチン酸エステルを、当業者に知られているSuzukiのカップリング条件下で、適宜なアルケニルホウ素誘導体にて処理することにより、段階的にまたは1回の工程で、同一または異なっていてもよい、2つの1-アルケニル基によって置換されてもよい。得られる5,6-ジアルケニル-ニコチン酸エステルは、水素化により、対応する5,6-ジアルキル-ニコチン酸エステルとなる。加えて、FuerstnerとSuzukiの条件を連続的に採用する手順が想定できる。対応する5-クロロ-6-アルコキシ-ニコチン酸エステルを供給するために、5,6-ジクロロニコチン酸エステルは、アルコールまたはアルコラートによって高温で処理されてもよい。最後に、エステル官能基の開裂により、構造4の化合物が得られる。
【0118】
また、R1がメチル基を表す構造4の化合物は、構造17の化合物から、当業者によく知られた方法を用いる対応する6-クロロ-5-メチル-ニコチン酸エステルの形成、それに続く上記のFuerstnerとSuzukiの条件を用いる誘導体化およびその後のエステル基の開裂を介して製造され得る。構造17の化合物は、既知の6-クロロ-3-ホルミル-5-メチル-ピリジン(文献、例えば欧州公開公報第0702003号)から、トルエン、THF、MeCN、アセトン等の溶媒の存在下または非存在下、0と120℃の間の温度で、ギ酸中のH2O2水溶液、KMnO4などの当業者によく知られた酸化剤を用いるホルミル基のカルボン酸への酸化により製造され得る。R1がメチル基を表す構造11の化合物は、上記のように、R1がメチル基を表す構造4の化合物からも;または文献(文献:例えば、J.B.Paine III, J. Heterocyclic Chem. 1987, 351-355)の方法に従っても製造され得る。
【0119】
【化25】

【0120】
式(I)の化合物がエナンチオマーの混合物の形態で得られる場合には常に、エナンチオマーは、当業者に知られた方法、例えばジアステレオマー塩の形成及び分離、またはRegis Whelk-O1(R,R) (10 μm) カラム、 Daicel ChiralCel OD-H (5-10 μm) カラム、またはDaicel ChiralPak IA (10 μm) もしくはAD-H (5 μm) カラム等のキラル固定相上のHPLC、を用いて分離することができる。キラルHPLCの典型的な条件は、0.8から150 mL/分の流速における、溶出液A(EtOH。NEt3、ジエチルアミン等のアミンの存在下または非存在下で)および溶出液B(ヘキサン)の無勾配混合物である。
【実施例】
【0121】
試験の部
I)化学
以下の実施例は、本発明を例証するが、これらの範囲を全く限定しない。
すべての温度は、摂氏度で述べてある。化合物は、1H-NMR(300MHz)または13C-NMR(75MHz)によって(Varian Oxford;化学シフトは、使用する溶媒と関連して、ppmで示してある;多重度:s =一重項、d =二重項、t =三重項;p =四重項、hex= 五重項、hept= 六重項、m =多重項、br =広域、結合定数は、Hzで示してある);LC-MSによって(HP 1100 Binary PumpおよびDADを備えたFinnigan Navigator、カラム:4.6×50 mm、Zorbax SB-AQ、5μm、120Å、勾配:5〜95%のMeCNの水溶液、1分、0.04%のTFAを含む、流速: 4.5 mL/分)、tRは、分で示してある(* またはLC-MS*を付した保持時間は、基本条件、(すなわち13 mMの水酸化アンモニウムを含む水中のMeCNの勾配で溶出し、他は同一条件である。)にて行ったLCを意味する。);TLCによって(MerckからのTLC-プレート、Silica gel 60 F254);または融点によって特徴付けてある。化合物は、調製用HPLCによって(カラム:X-terra RP18、50×19 mm、5μm、勾配:0.5%のギ酸を含む10〜95%のMeCNの水溶液)またはMPLCによって(Labomatic MD-80-100ポンプ、Linear UVIS-201検出器、カラム:350×18 mm、Labogel-RP-18-5s-100、勾配:10%のMeOH水溶液〜100%のMeOH)精製される。ラセミ体は、調製HPLC(カラム:ChiralPaK AD 20x250mm、5μm、ヘキサン中15%EtOH)によってそのエナンチオマーに分離され得る。
【0122】
略語(本明細書で使用したもの)
aq. 水溶液
atm 雰囲気
BSA ウシ血清アルブミン
Burgess試薬 メトキシカルボニルスルファモイルトリエチルアンモニウムヒドロキ シド
CC カラムクロマトグラフィー
CDI カルボニルジイミダゾール
DCC ジシクロヘキシルカルボジイミド
DCM ジクロロメタン
DEAD ジエチル-ジアゾジカルボン酸
DIPEA Huening塩基、ジエチルイソプロピルアミン
DME 1,2-ジメトキシエタン
DMF ジメチルホルムアミド
DMSO ジメチルスルホキシド
dppf 1,1'-ビス(ジフェニルホスフィノ)フェロセン
EA 酢酸エチル
EDC N-(3-ジメチルアミノプロピル)-N'-エチル-カルボジイミド
エーテル ジエチルエーテル
EtOH エタノール
Fe(acac)3 鉄(III)アセチルアセトン -錯体
h 時間
HBTU O-(ベンゾトリアゾール-1-イル)-N,N,N',N'-テトラメチルウロニウム
ヘキサフルオロホスフェート
HOBt 1-ヒドロキシベンゾトリアゾール
HPLC 高速液体クロマトグラフィー
HV 高真空状態
Lawesson試薬 2,4-ビス(4-メトキシフェニル)-1,3,2,4-ジチアジホスフェタン-2,4-
ジスルフィド
LC-MS 液体クロマトグラフィー−質量分析
MeCN アセトニトリル
MeOH メタノール
min 分
MPLC 中圧液体クロマトグラフィー
NaOAc 酢酸ナトリウム
NEt3 トリエチルアミン
NMO N-メチル-モルホリン-N-オキシド
NMP 1-メチル-2-ピロリドン
OAc 酢酸
org. 有機
Ph フェニル
PPh3 トリフェニルホスフィン
PyBOP ベンゾトリアゾール-1-イル-オキシ-トリス-ピロリジノ-ホスホニウ
ム-ヘキサフルオロ-ホスファート
prep. 調製用
rac ラセミ
rt 室温
sat. 飽和
S1P スフィンゴシン1-リン酸
TBME tert.-ブチルメチルエーテル
TBTU 2-(1H-ベンゾトリアゾール-1-イル)-1,2,3,3-テトラメチルウロニウ
ムテトラフルオロホウ酸塩
tert. 第三級
TFA トリフルオロ酢酸
THF テトラヒドロフラン
TLC 薄層クロマトグラフィー
tR 保持時間
中間体の製造
ニコチン酸 1
【0123】
【化26】

【0124】
5,6-ジクロロニコチン酸(1.95 g、10 mmol)を、KOtBu(2.28 g、20 mmol)のイソプロパノール(20 mL)溶液に添加する。混合物を15時間で80℃に加熱する。混合物を水(60 mL)で希釈し、1M HCl水溶液で酸性化する。水溶液をエーテル(5x50 mL)で抽出し、合わせた有機抽出物を乾燥し(Na2SO4)、ろ過し、蒸発させ、5-クロロ-6-イソプロポキシ-ニコチン酸を得る;1H NMR (d6-DMSO) δ-1.38 (d, J = 6.2 Hz, 7 H), 5.44 (hept, J = 6.2 Hz, 1 H), 8.18 (d, J = 2.1 Hz, 1 H), 8.65 (d, J = 2.1 Hz, 1 H)。
ニコチン酸 2
【0125】
【化27】

【0126】
a) 5,6-ジクロロニコチン酸(5.25 g、27.3 mmol)のトルエン(200 mL)懸濁液を80℃に加熱し、その後、ゆっくりとN,N-ジメチルホルムアミド ジ-tert.ブチルアセタール(20.0 g、98.0 mmol)で処理する。混合物はわずかに黄色を帯び、そして澄んでくる。加熱と撹拌を3時間継続した後、溶液を室温に冷却し、エーテルで希釈し、飽和Na2CO3水溶液で洗浄する。有機抽出物をMgSO4上で乾燥し、ろ過し、溶媒を蒸発させる。残渣をMPLC (SiO2)により精製し、5,6-ジクロロニコチン酸 tert.-ブチルエステル(5.13 g)を得る。1H NMR (CDCl3): δ1.62 (s, 9 H), 8.30 (d, J = 2.0 Hz, 1 H), 8.83 (d, J = 2.0 Hz, 1 H)。
【0127】
b) 5,6-ジクロロニコチン酸 tert.-ブチルエステル(3.37 g、13.6 mmol)、Fe(acac)3 (719 mg、2.04 mmol)およびNMP(1.95 g、20 mmol)のTHF(300 mL)溶液に、塩化マグネシウムメチルのTHF溶液(3M、5.4 mL、16.3 mmol)を、-78℃にて、ゆっくりと添加する。茶色の溶液は、懸濁し、黒色になる。撹拌を−75℃で1時間継続した後、0℃に温める。反応は不完全であり、混合物を再び−70℃に冷却する。THF中の臭化マグネシウムメチルのさらなるバッチ(3M、5.4 mL、16.3 mmol)を、−70°Cにてゆっくりと添加する。暗緑色の混合物をゆっくりと−20℃に温め、0.7N HCl(150 mL)水溶液で注意深くクェンチする。混合物をエーテル(5x60mL)で抽出する。合わせた有機抽出物をNa2SO4上で乾燥し、ろ過し、蒸発させ、粗製5-クロロ-6-メチル-ニコチン酸 tert.-ブチルエステルを、黄色の油状物質(4.66 g)として得る;LC-MS: tR = 1.03 min, [M+1]+ = 228.22。
【0128】
c) 5-クロロ-6-メチル-ニコチン酸 tert.-ブチルエステル(3.09 g、13.5 mmol)、Fe(acac)3(719 mg、2.04 mmol)およびNMP(1.95 mL、20 mmol)をTHF(3M, 500 mL)中に溶解し、-78℃に冷却する。臭化マグネシウムイソブチルのTHF溶液(2M、13.6 mmol)を、−75℃にてゆっくりと添加する。茶色の溶液は、懸濁し、黄色になる。撹拌を−75℃で1時間継続した後、ゆっくりと室温に温める。反応は不完全であり、さらなるFe(acac)3(719 mg、2.04 mmol)を添加し、混合物を再び−70℃に冷却する。さらなるTHF中臭化マグネシウムメチル(2M、13.6 mmol)を、−70°Cにてゆっくりと添加する。暗緑色の混合物をゆっくりと室温に温め、15時間撹拌する。混合物を、0.7N HCl(150 mL)水溶液で注意深くクェンチする。混合物をEA(6x60mL)で抽出する。合わせた有機抽出物をNa2SO4上で乾燥し、ろ過し、蒸発させる。残渣を逆相MPLCにより精製し、6-メチル-5-イソブチル-ニコチン酸 tert.-ブチルエステルを、黒色の油状物質(0.50 g)として得る; LC-MS: tR = 0.84 min, [M+1]+ = 250.14。
【0129】
d) 6-メチル-5-イソブチル-ニコチン酸 tert.-ブチルエステル(0.50 g、2 mmol)の溶液をジオキサン(20 mL)に溶解し、4N HClのジオキサン中溶液(30 mL)を添加する。混合物を3時間撹拌する。溶媒を蒸発させ、6-メチル-5-イソブチル-ニコチン酸 塩酸塩(0.52 g)を得る;LC-MS: tR = 0.54 min; [M+1]+ =194.29; 1H NMR (d6-DMSO) δ0.91 (d, J = 6.5 Hz, 6 H), 1.91 (hept, J = 6.5 Hz), 2.68 (d, J = 7.3 Hz, 2 H), 2.73 (s, 3 H), 8.47 (d, J = 1.8 Hz, 1 H), 8.90 (d, J = 2.0 Hz, 1 H)。
ニコチン酸3
【0130】
【化28】

【0131】
a) 5,6-ジクロロニコチン酸 tert.-ブチルエステル(5.00 g、20.0 mmol)および2,4,6-トリビニルシクロトリボロキサン ピリジン錯体(9.700 mg、40 mmol)のジオキサン(30 mL)溶液に、2M K2CO3水溶液(6 mL)、続いてPd(PPh3)4(620 mg、0.38 mmol)およびPPh3(620 mg、3.8 mmol)を添加する。混合物を100℃で2時間撹拌し、室温に冷却し、そしてエーテル(200 mL)で希釈する。混合物を1M NaOH水溶液(2x50 mL)および塩水(50 mL)で抽出する。有機相を乾燥し(Na2SO4)、ろ過し、蒸発させる。残渣をFC (SiO2、EA-ヘプタン)で精製し、5-クロロ-6-ビニル-ニコチン酸 tert.-ブチルエステル(4.0 g)を、黄色の油状物質として得る; LC-MS: tR = 1.05 min, [M+1+CH3CN]+= 281.36。
【0132】
b) 5-クロロ-6-ビニル-ニコチン酸 tert.-ブチルエステル(2.0 g)、Cs2CO3 (3.4 g)、トリ(tert.-ブチル)ホスフィン(0.04当量)、トリス(ジベンジリデンアセトン)ジパラジウム(0.02 当量)および2,4,6-トリビニルシクロトリボロキサン ピリジン錯体(2.0 g)のジオキサン(30 mL)中混合物を脱気し、15時間で100℃に加熱する。混合物を室温に冷却し、エーテル(200 mL)で抽出する。混合物を、1M NaOH水溶液(2x50 mL)および塩水(50 mL)で抽出する。有機相を乾燥し(Na2SO4)、ろ過し、蒸発させる。残渣をFC (SiO2、EA-ヘプタン)で精製し、5,6-ジビニル-ニコチン酸 tert.-ブチルエステル(0.89 g)を、油状物質として得る LC-MS: tR = 1.01 min, [M+1]+ = 232.04。
【0133】
c) いくらかのMeOHを含む5,6-ジビニル-ニコチン酸 tert-ブチルエステル(890 mg、3.8 mmol)のTHF溶液(20 mL)に、Pd/C (100 mg、10% Pd)を添加し、混合物を1atmのH2下、室温で3時間撹拌する。触媒をろ過除去し、ろ液を蒸発させる。残った残渣をFC (SiO2、EA-ヘプタン)で精製し、5,6-ジエチル-ニコチン酸 tert-ブチルエステル(860 mg)を油状物質として得る; LC-MS: tR = 0.79 min, [M+1]+ = 236.14。
【0134】
d) 5,6-ジエチル-ニコチン酸 tert-ブチルエステル(860 mg、3.65 mmol)の6N HCl水溶液(15 mL)を、65℃で3時間撹拌した後、溶媒を蒸発させる。残渣をHV下で乾燥し、5,6-ジエチル-ニコチン酸 塩酸塩(923 mg)を油状物質として得る; LC-MS: tR = 0.50 min, [M+1]+= 180.05。
ニコチン酸4
【0135】
【化29】

【0136】
5-クロロ-6-ビニル-ニコチン酸 tert.-ブチルエステルおよび、F. Kerins, D. F. O'Shea J. Org. Chem. 67(2002) 4968-4971)に記載された手順と同様に製造される、2,4,6-トリ-(2-メチル-プロペニル)-シクロボロキサン ピリジン錯体から、ニコチン酸3と同様に、6-エチル-5-イソブチル-ニコチン酸を製造する; LC-MS: tR = 0.64 min, [M+1]+ =207.98。
ニコチン酸5
【0137】
【化30】

【0138】
a) 5,6-ジクロロニコチン酸(5.0 g、26 mmol)の乾燥EtOH(300 mL)およびクロロトリメチルシラン(33 mL、10当量)中の溶液を、室温で16時間撹拌する。溶媒を蒸発させ、残渣をエーテル(200 mL)に溶解させ、飽和Na2CO3水溶液(75 mL)および塩水(50 mL)で洗浄する。有機相をNa2SO4上で乾燥し、ろ過し、蒸発させ、5,6-ジクロロニコチン酸 エチルエステル(5.8 g)を固体として得る; LC-MS: tR = 0.96 min, [M+1]+= 219.93。
【0139】
b) 5,6-ジクロロニコチン酸 エチルエステル(0.8 g、3.6 mmol)および2,4,6-トリ-(2-メチル-プロペニル)-シクロボロキサン ピリジン 錯体(1.78 g、5.49 mmol)のDME(20 mL)溶液に、2M K2CO3水溶液(5 mL)、続いてPd(PPh3)4(50 mg、0.068 mmol)およびPPh3(110 mg、0.68 mmol)を添加する。混合物を100℃で2日撹拌した後、室温に冷却し、エーテル(100 mL)で希釈する。相を分離し、水相をエーテル(50 mL)で再抽出する。合わせた有機抽出物を、1M NaOH水溶液(2x40 mL)および塩水(40 mL)で洗浄し、乾燥し(Na2SO4)、ろ過し、蒸発させる。粗生成物をFC (SiO2、EA-ヘプタン)で精製し、5,6-ジ(2-メチル-プロペニル)-ニコチン酸 エチルエステル(52 mg)を無色の油状物質として得る; LC-MS: tR =1.11 min, [M+1]+ = 260.24。
【0140】
c) 5,6-ジ(2-メチル-プロペニル)-ニコチン酸 エチルエステル(52 mg、0.3 mmol)をTHF(10 mL)に溶解し、Pd/C (20 mg、10% Pd)を添加し、混合物を1atmのH2下、室温で15時間撹拌する。触媒をろ過除去し、ろ液を蒸発させ、5,6-ジイソブチル-ニコチン酸 エチルエステル(52 mg)を油状物質として得る; LC-MS: tR = 1.12 min, [M+1]+ = 264.19。
【0141】
d) 5,6-ジイソブチル-ニコチン酸 エチルエステル(52 mg、0.2 mmol)の6N HCl水溶液(2 mL)を、65℃で15時間撹拌した後、室温に冷却し、エーテル(2x10 mL)で抽出する。水相を蒸発させ、残渣をHV下で乾燥し、5,6-ジイソブチル-ニコチン酸 塩酸塩(0.12 g)を無色の油状物質として得る; LC-MS: tR = 0.73 min; [M+1]+= 236.40。
ニコチン酸6
【0142】
【化31】

【0143】
a) ホスホロキシ塩化物(183 mL、2 mol)を90℃で加熱し、商業的に入手可能な2-メチル-2-ブテンニトリル(73 g、0.9 mol)およびDMF(154 mL、2 mol)の混合物を、温度を100から110℃に保ちながら、ゆっくりと添加する。混合物を110℃で15時間撹拌し、室温に冷却し、DCM(500 mL)で希釈する。混合物を0℃で冷却し、水(500 mL)で注意深くクェンチする。相を分離し、水相をDCM (合わせて800 mL)で抽出する。合わせた有機抽出物を乾燥し(Na2SO4)、ろ過し、蒸発させる。残渣をシクロヘキサンから結晶化させ、6-クロロ-3-ホルミル-5-メチル-ピリジン(28.3 g)を、薄黄色の結晶として得る; LC-MS: tR = 0.76 min, [M+1]+ = 156.14。
【0144】
b) 6-クロロ-3-ホルミル-5-メチル-ピリジン(10 g、64 mmol)のギ酸溶液(200 mL)を0℃に冷却し、50重量%のH2O2水溶液(9.6 mL, 360 mmol)を、この温度で添加する。混合物を0℃で15時間撹拌し、水(200 mL)で注意深く希釈し、DCM(8x100 mL)で抽出する。合わせた有機抽出物を1M HCl水溶液(100 mL)で洗浄し(残留過酸化物をチェックし)、乾燥し(MgSO4)、ろ過し、蒸発させる。残渣を乾燥し、6-クロロ-5-メチル-ニコチン酸(9.56 g)を得る; LC-MS: tR = 0.72 min, [M+1]+ = 172.0。
【0145】
c) 数滴の濃硫酸を含む、6-クロロ-5-メチル-ニコチン酸(13.85 g、80.75 mmol)の乾燥EtOH(200 mL)溶液を、還流下、2日間撹拌する。溶液を室温に冷却し、溶媒を蒸発させ、残渣をEA(200 mL)に溶解し、飽和Na2CO3水溶液(2x80 mL)、1M KHSO4水溶液(2x80 mL)および塩水(50 mL)で洗浄する。有機相をMgSO4上で乾燥し、ろ過し、蒸発させ、6-クロロ-5-メチル-ニコチン酸 エチルエステル(12.65 g)を固体として得る; LC-MS: tR= 0.92 min; [M+1]+ = 200.10; 1H NMR (CDCl3) δ1.43 (t, J = 7.0 Hz, 3 H), 2.46 (s, 3 H), 4.43 (q, J = 7.3 Hz, 2 H), 8.16 (m, 1 H), 8.84 (d, J = 2.0 Hz, 1 H)。
【0146】
d) 6-クロロ-5-メチル-ニコチン酸 エチルエステル(4.98 g、24.9 mmol)、2,4,6-トリ-(2-メチル-プロペニル)-シクロボロキサン ピリジン 錯体(5.74 g、17.7 mmol、F. Kerins, D. F. O'Shea J. Org. Chem. 67(2002) 4968-4971に記載された手順と同様に製造する)およびPPh3(1.15 g、4.4 mmol)のDME(60 mL)溶液に、2M K2CO3水溶液(20 mL)を添加する。混合物を脱気し、N2でフラッシュした後、Pd(PPh3)4(460 mg、0.4 mmol)を添加する。混合物を90℃で20時間撹拌した後、室温に冷却し、EA(150 mL)で希釈し、飽和NaHCO3水溶液(2x50 mL)で洗浄する。有機抽出物をMgSO4上で乾燥し、ろ過し、蒸発させる。粗生成物をFC (SiO2, ヘプタン-EA)で精製し、5-メチル-6-(2-メチル-プロペニル)-ニコチン酸 エチルエステル(3.98 g)をオレンジ色の油状物質として得る; LC-MS: tR = 0.72 min, [M+1]+ = 220.15。
【0147】
e) 5-メチル-6-(2-メチル-プロペニル)-ニコチン酸 エチルエステル(3.98 g、18.2 mmol)をTHF(100 mL)およびMeOH(100 mL)中に溶解し、Pd/C(500 mg、10% Pd)を添加し、混合物を1atmのH2下、室温で15時間撹拌する。触媒をろ過除去し、ろ液を蒸発させ、6-イソブチル-5-メチル-ニコチン酸 エチルエステル(3.76 g)を、無色の油状物質として得る; LC-MS: tR = 0.75 min; [M+1]+ = 222.15; 1H NMR (CDCl3) δ0.97 (d, J = 6.8 Hz, 6 H), 1.42 (t, J = 7.3 Hz, 3 H), 2.20 (hept, J = 6.8 Hz, 1H), 2.38 (s, 3 H), 2.75 (d, J = 7.0 Hz, 2 H), 4.41 (q, J = 7.3 Hz, 2 H), 8.03 (d, J = 1.8 Hz, 1 H), 9.00 (d, J = 2.0 Hz, 1 H)。
【0148】
f) 6-イソブチル-5-メチル-ニコチン酸 エチルエステル(3.75 g、16.95 mmol)の12.5% HCl水溶液(50 mL)中の溶液を、65℃で24時間撹拌した後、溶媒を蒸発させる。残渣をHV下で乾燥し、6-イソブチル-5-メチル-ニコチン酸 塩酸塩(3.55 g)を白色粉末として得る; LC-MS: tR = 0.57 min, [M+1]+ = 194.25。
ニコチン酸7
【0149】
【化32】

【0150】
5-メチル-6-プロピル-ニコチン酸(塩酸塩として1.85g)を、6-クロロ-5-メチル-ニコチン酸 エチルエステル(2.0 g)および、商業的に入手可能な、trans-1-プロペン-1-イルボロン酸(1.3 g)から、ニコチン酸6と同様に製造する;1H NMR (d6-DMSO) δ0.96 (t, J = 7.3 Hz, 3 H), 1.72 (m, 2 H), 3.05 (t, J = 7.5 Hz, 2 H), 8.66 (m, 1 H), 8.86 (d, J = 1.5 Hz, 1 H)。
ニコチン酸8
【0151】
【化33】

【0152】
6-イソブチル-ニコチン酸を、商業的に入手可能な6-クロロニコチン酸 エチルエステルおよび塩化マグネシウムイソブチルから、ニコチン酸2と同様に製造する; LC-MS: tR = 0.52 min, [M+1]+ = 180.30。
ニコチン酸9
【0153】
【化34】

【0154】
a) 5,6-ジクロロニコチン酸 エチルエステル(2.40 g、10.9 mmol)および2,4,6-トリス-(2-メチル-プロペニル)-シクロトリボロキサン ピリジン 錯体(2.02 g、6.22 mmol、F. Kerins, D. F. O'Shea J. Org. Chem. 67 (2002) 4968-4971に記載の手順と同様に製造する。)のジオキサン(40 mL)および2M K2CO3水溶液(10 mL)中の溶液に、PPh3(114 mg、0.436 mmol)を添加する。混合物を脱気し、N2下に置いた後、Pd(PPh3)4(160 mg、0.218 mmol)を添加する。混合物を100℃で1.5時間撹拌後、別量の2,4,6-トリス-(2-メチル-プロペニル)-シクロトリボロキサン ピリジン 錯体(1.01 g、3.11 mmol)を添加する。撹拌を100℃で3時間継続した後、混合物を室温に冷却し、エーテルで希釈し、1N NaOH水溶液、続いて水で洗浄し、MgSO4上で洗浄し、ろ過し、濃縮する。粗生成物を、ヘプタン:EA 9:1で溶出するシリカゲル上のCCで精製し、5-クロロ-6-(2-メチル-プロペニル)-ニコチン酸 エチルエステル(2.4 g)を、油状物質として得る; LC-MS: tR = 1.05 min, [M+1]+ = 240.02。この物質のジオキサン(40 mL)溶液に、2,4,6-トリビニルシクロトリボロキサン ピリジン 錯体(1.84 g、7.63 mmol)、Cs2CO3(4.62 g、14.2 mmol)、続いてトリ-tert-ブチルホスフィン(88 mg、0.436 mmol)を添加する。混合物を脱気し、N2下に置いた後、Pd2(dba)3(200 mg、0.218 mmol)を添加する。混合物を100℃で16時間撹拌した後、別量の2,4,6-トリビニルシクロトリボロキサン ピリジン 錯体(1.84 g、7.63 mmol)およびPd2(dba)3(200 mg、0.218 mmol)を添加する。撹拌を100℃で24時間継続した後、混合物をEAで希釈し、1N NaOH水溶液で洗浄し、MgSO4上で乾燥し、ろ過し、濃縮する。粗生成物を、ヘプタン:EA 10:1で溶出するシリカゲル上のCCで精製し、最初の分量の6-(2-メチル-プロペニル)-5-ビニル-ニコチン酸 エチルエステルを得る。加えて、未反応の5-クロロ-6-(2-メチル-プロペニル)-ニコチン酸 エチルエステルを分離する。この物質を再び、上記のように、2,4,6-トリビニルシクロトリボロキサン ピリジン 錯体で処理した後、ワークアップ、精製を行い、二つの分量を合わせて、6-(2-メチル-プロペニル)-5-ビニル-ニコチン酸 エチルエステル(1.37 g)を油状物質として得る; LC-MS: tR= 0.87 min, [M+1]+ = 232.13。
【0155】
b) 6-(2-メチル-プロペニル)-5-ビニル-ニコチン酸 エチルエステル(1.37 g、6.74 mmol)のTHF(20 mL)溶液に、Pd/C (100 mg、10% Pd)、続いてEtOH(20 mL)を添加する。混合物を、1atmのH2下、室温で24時間撹拌する。触媒をろ過除去し、ろ液を濃縮する。粗生成物を、ヘプタン:EA 4:1で溶出するシリカゲル上のCCで精製し、5-エチル-6-イソブチル-ニコチン酸 エチルエステル(970 mg)を、無色の油状物質として得る, LC-MS: tR = 0.79 min, [M+1]+ = 236.20; 1H NMR (CDCl3): δ0.97 (d, J = 6.8 Hz, 6 H), 1.27 (t, J = 7.5 Hz, 3 H), 1.42 (t, J = 7.0 Hz, 3 H), 2.17-2.28 (m, 1 H), 2.69-2.78 (m, 4 H), 4.42 (q, J= 7.0 Hz, 2 H), 8.07 (s, 1 H), 9.00 (s, 1 H)。
【0156】
c) 5-エチル-6-イソブチル-ニコチン酸 エチルエステル(970 mg、4.12 mmol)の25% HCl水溶液中の溶液を、95℃で8時間撹拌する。溶媒を蒸発させ、残渣を高真空下で乾燥し、5-エチル-6-イソブチル-ニコチン酸 塩酸塩(1.15 g、おそらく水和物として)を、無色の樹脂として得る LC-MS: tR = 0.62 min, [M+1]+ = 208.35。
ニコチン酸10
【0157】
【化35】

【0158】
6-(3-メチル-ブチル)-ニコチン酸を、6-クロロ-ニコチン酸 tert-ブチルエステルを、臭化マグネシウム3-メチル-ブチルと、ニコチン酸2について記載したように、Fuerstnerの条件で反応させることにより製造する; LC-MS: tR = 0.58 min, [M+1]+ = 194.30。
ニコチン酸11
【0159】
【化36】

【0160】
a) tert.ブチル酸カリウム塩(1.26 g、11.3 mmol)のイソプロパノール(30 mL)溶液に、2,5-ジブロモ-3-ピコリン(2.89 g、11.3 mmol)を添加する。混合物を80℃で15時間撹拌した後、別量のtert.-ブチル酸カリウム塩(2.53 g、27.5 mmol)を添加する。撹拌を80℃で24時間継続した後、混合物を飽和NaHCO3水溶液で希釈する。混合物をエーテルで抽出し、有機抽出物をMgSO4上で乾燥し、ろ過し、濃縮する。粗生成物を、ヘプタン:EA 9:1で溶出するシリカゲル上のCCで精製し、5-ブロモ-2-イソプロポキシ-3-メチル-ピリジン(1.24 g)を、無色の油状物質として得る; LC-MS: tR = 1.06 min; [M+1]+ = 230.00; 1H NMR (CDCl3): δ1.35 (d, J = 6.3 Hz, 6 H), 2.16 (s, 3 H), 5.27 (hept, J = 6.3 Hz, 1H), 7.48 (d, J = 1.5 Hz, 1 H), 8.02 (d, J = 2.0 Hz, 1 H)。
【0161】
b) 5-ブロモ-2-イソプロポキシ-3-メチル-ピリジン(1.24 g、5.39 mmol)および2,4,6-トリビニルシクロトリボロキサン ピリジン 錯体(1.27 g、5.26 mmol)のDME(12 mL)および2M K2CO3(5 mL)水溶液中の溶液を脱気し、アルゴン下に置いた後、Pd(PPh3)4(112 mg、0.097 mmol)を添加する。混合物を80℃で15時間撹拌した後、室温に冷却し、エーテル(50 mL)で希釈し、飽和NaHCO3水溶液(2x30 mL)で洗浄し、MgSO4上で乾燥し、ろ過し、濃縮する。粗生成物を、ヘプタン:EA 9:1で溶出するシリカゲル上のCCで精製し、2-イソプロポキシ-3-メチル-5-ビニル-ピリジン(703 mg)を、薄黄色の油状物質として得る; LC-MS: tR = 1.01 min; [M+1]+ = 178.11。
【0162】
c) 2-イソプロポキシ-3-メチル-5-ビニル-ピリジン(703 mg、3.97 mmol)のアセトン(80 mL)溶液に、KMnO4(1.60 g、10.1 mmol)を添加し、混合物を室温で18時間撹拌する。暗茶色の懸濁液をろ過し、澄んだ無色のろ液を乾燥するまで蒸発させ、6-イソプロポキシ-5-メチル-ニコチン酸(1.06 g、カリウム塩として)を、薄灰色の固体として得る; LC-MS: tR = 0.86 min; [M+1]+ = 196.09; 1H NMR (D2O): δ1.31 (d, J = 6.3 Hz, 6 H), 2.14 (s, 3 H), 5.15 (hept, J = 7.0 Hz, 1H), 7.91 (s, 1 H), 8.34 (s, 1 H)。
N-ヒドロキシ-6-イソブチル-5-メチル-ニコチンアミジン
【0163】
【化37】

【0164】
a) 6-イソブチル-5-メチル-ニコチン酸 エチルエステル(2.86 g、12.9 mmol)の7N NH3、MeOH(80 mL)溶液中の溶液を、60℃で20時間撹拌後、溶媒を真空除去する。残渣を乾燥し、6-イソブチル-5-メチル-ニコチンアミド(1.89 g)を、黄色の油状物質として得る; LC-MS: tR = 0.66 min, [M+1]+ = 193.29; 1H NMR (D6-DMSO): δ0.91 (d, J = 6.5 Hz, 6 H), 2.08-2.20 (m, 1 H), 2.32 (s, 3 H), 2.65 (d, J = 7.3 Hz, 2 H), 7.43 (s, 1 H), 7.95 (s, 1 H), 8.01 (m, 1 H), 8.78 (s, 1 H).
b) 6-イソブチル-5-メチル-ニコチンアミド(1.89 g、9.85 mmol)のDCM(40 mL)およびピリジン(2.83 g、39.4 mmol)中の溶液に、TFA 無水物(5.17 g、24.6 mmol)を、0℃にて少しづつ添加する。混合物を室温で24時間撹拌し、DCMで希釈し、水、4% クエン酸水溶液、続いて飽和NaHCO3水溶液で洗浄する。有機抽出物をMgSO4上で乾燥し、ろ過し、濃縮する。粗生成物を、ヘプタン:EA 9:1で溶出するシリカゲル上のCCで精製し、6-イソブチル-5-メチル-ニコチノニトリル(1.35 g)を、白色の固体として得る; LC-MS: tR = 0.89 min, [M+1]+ = 175.11。
【0165】
c) tert-ブチル酸カリウム塩(3.04 g、27.1 mmol)のMeOH(60 mL)溶液に、ヒドロキシルアミン 塩酸塩(1.62 g、23.2 mmol)を、0℃にて添加する。この懸濁液に、6-イソブチル-5-メチル-ニコチノニトリル(1.35 g、7.75 mmol)を添加する。混合物を3時間還流し、室温に冷却し、ろ過し、そしてろ液を乾燥するまで蒸発させる。残渣を少量の水に懸濁し、EAで抽出する。有機抽出物を濃縮し、高真空下で乾燥し、N-ヒドロキシ-6-イソブチル-5-メチル-ニコチンアミジン(1.53 g)を、薄黄色の油状物質として得る; LC-MS: tR = 0.68 min, [M+1]+= 208.22; 1H NMR (D6-DMSO): δ0.91 (d, J = 6.8 Hz, 6 H), 2.06-2.17 (m, 1 H), 2.29 (s, 3 H), 2.61 (d, J = 7.0 Hz, 2 H), 5.85 (s br, 2 H), 7.76 (s, 1 H), 8.60 (s, 1 H), 9.68 (s, 1 H)。
N-ヒドロキシ-6-イソプロポキシ-5-メチル-ニコチンアミジン
【0166】
【化38】

【0167】
表題化合物を、ニコチン酸11から、N-ヒドロキシ-6-イソブチル-5-メチル-ニコチンアミジンと同様に製造する; LC-MS: tR = 0.64 min, [M+1]+ = 210.08。
4-アリルオキシ-N-ヒドロキシ-ベンズアミジン
【0168】
【化39】

【0169】
表題化合物を、商業的に入手可能な4-ヒドロキシ-ベンゾニトリルをアリル化し、続いてニトリルをヒドロキシアミジンに変換することにより、4-アリルオキシ-N-ヒドロキシ-3,5-ジメチル-ベンズアミジンと同様に製造する; LC-MS: tR = 0.59 min, [M+1]+ = 193.58。
4-アリルオキシ-N-ヒドロキシ-2-メチル-ベンズアミジン
【0170】
【化40】

【0171】
表題化合物を、商業的に入手可能な4-ヒドロキシ-2-メチル-ベンズアルデヒドから、4-アリルオキシ-3-エチル-N-ヒドロキシ-5-メチル-ベンズアミジンと同様に製造する; LC-MS: tR = 0.62 min, [M+1]+ = 207.10; 13C NMR (CDCl3): δ20.72, 68.91, 104.72, 112.75, 116.45, 118.32, 118.53, 132.25, 134.19, 144.09, 161.71。
4-アリルオキシ-N-ヒドロキシ-2-メトキシ-ベンズアミジン
【0172】
【化41】

【0173】
表題化合物を、商業的に入手可能な4-ヒドロキシ-2-メトキシ-ベンズアルデヒドから、文献の手順(3-エチル-4,N-ジヒドロキシ-5-メチル-ベンズアミジンについて引用された参考文献)に従って製造する; LC-MS: tR = 0.64 min; [M+1]+ = 223.24; 1H NMR (D6-DMSO): δ9.33 (s br, 1H), 7.30 (d, J =8.2 Hz, 1H), 6.60 (d, J = 2.3 Hz, 1H), 6.50 (dd, J = 2.3, 8.2 Hz, 1H), 6.10-5.94 (m, 1H), 5.50 (s, 2H), 5.40 (d, J = 17.0 Hz, 1H), 5.24 (d, J = 10.6 Hz, 1H), 4.57 (d, J = 4.7 Hz, 2H), 3.76 (s, 3H)。
4-アリルオキシ-N-ヒドロキシ-3-メトキシ-ベンズアミジン
【0174】
【化42】

【0175】
表題化合物を、商業的に入手可能な4-ヒドロキシ-3-メトキシ-ベンゾニトリルをアリル化し、続いてニトリルをヒドロキシアミジンに変換することにより、4-アリルオキシ-N-ヒドロキシ-3,5-ジメチル-ベンズアミジンと同様に製造する; LC-MS: tR = 0.59 min, [M+1]+ = 223.18。
4-アリルオキシ-3-ブロモ-N-ヒドロキシ-ベンズアミジン
【0176】
【化43】

【0177】
表題化合物を、商業的に入手可能な3-ブロモ-4-ヒドロキシ-ベンゾニトリルをアリル化し、続いてニトリルをヒドロキシアミジンに変換することにより、4-アリルオキシ-N-ヒドロキシ-3,5-ジメチル-ベンズアミジンと同様に製造する; LC-MS: tR = 0.68 min, [M+1]+ = 270.96。
4-アリルオキシ-3-クロロ-N-ヒドロキシ-5-メチル-ベンズアミジン
【0178】
【化44】

【0179】
表題化合物を、商業的に入手可能な3-クロロ-4-ヒドロキシ-5-メチル-ベンズアルデヒドから、4-アリルオキシ-3-エチル-N-ヒドロキシ-5-メチル-ベンズアミジンと同様に製造する; LC-MS: tR = 0.69 min, [M+1]+ = 241.10。
4-アリルオキシ-N-ヒドロキシ-3,5-ジメチル-ベンズアミジン
【0180】
【化45】

【0181】
表題化合物を、商業的に入手可能な4-ヒドロキシ-3,5-ジメチル-ベンゾニトリルを、室温にて、イソプロパノール中NaOHの存在下、臭化アリルでアリル化することにより製造する。ニトリルは、文献の手順に従ってヒドロキシアミジンに変換される。(例えば、E. Meyer, A. C. Joussef, H. Gallardo, Synthesis 2003, 899-905); 1H NMR (CD3OD): δ7.27 (s, 2 H), 6.10 (m, 1 H), 5.42 (m, 1 H), 5.26 (m, 1 H), 4.31 (dt, J = 5.6, 1.5 Hz, 2 H), 2.29 (s, 6 H)。
4-アリルオキシ-3-エチル-N-ヒドロキシ-5-メチル-ベンズアミジン
【0182】
【化46】

【0183】
表題化合物を、文献の手順(3-エチル-4,N-ジヒドロキシ-5-メチル-ベンズアミジンを見よ。)に従って2-エチル-6-メチル-フェノールから製造される3-エチル-4-ヒドロキシ-5-メチル-ベンズアルデヒドをアリル化することにより製造する。アルデヒドは、文献の手順(3-エチル-4,N-ジヒドロキシ-5-メチル-ベンズアミジンを見よ。)に従って、対応するヒドロキシアミジンに変換される; LC-MS: tR = 0.72 min; [M+1]+ = 235.09; 1H NMR(CD3OD):δ 7.31 (s, 1 H), 7.29 (s, 1 H), 6.10 (m, 1 H), 5.43 (dd, J = 17.0, 1.5 Hz, 1 H), 5.27 (dd, J = 10.3, 1.2 Hz, 1 H), 4.81 (s br, 3H), 4.31 (d, J = 5.6 Hz, 2 H), 2.67 (q, J = 7.6 Hz, 2 H), 2.30 (s, 3 H), 1.23 (t, J = 7.6 Hz, 4 H)。
4-アリルオキシ-3-クロロ-N-ヒドロキシ-5-メトキシ-ベンズアミジン
【0184】
【化47】

【0185】
表題化合物を、商業的に入手可能な3-クロロ-4-ヒドロキシ-5-メトキシベンズアルデヒド(4-アリルオキシ-3-エチル-N-ヒドロキシ-5-メチル-ベンズアミジンを見よ。)をアリル化することにより製造する。アルデヒドは、文献の手順(3-エチル-4,N-ジヒドロキシ-5-メチル-ベンズアミジンを見よ。)に従って、対応するヒドロキシアミジンに変換される; LC-MS: tR = 0.69 min; [M+1]+ = 257.26。
4,N-ジヒドロキシ-3,5-ジメチル-ベンズアミジン
【0186】
【化48】

【0187】
表題化合物を、商業的に入手可能な4-ヒドロキシ-3,5-ジメチル-ベンゾニトリルから、文献の手順(例えばE. Meyer, A. C. Joussef, H. Gallardo, Synthesis2003, 899-905)に従って製造する; 1H NMR (CD3OD):δ 7.20 (s, 2H), 2.20 (s, 6H)。
3-エチル-4,N-ジヒドロキシ-5-メチル-ベンズアミジン
【0188】
【化49】

【0189】
表題化合物を、商業的に入手可能な2-エチル-6-メチル-フェノールから、文献の手順(G. Trapani, A. Latrofa, M. Franco, C. Altomare, E. Sanna, M. Usala, G. Biggio, G. Liso, J. Med. Chem. 41 (1998) 1846-1854; A. K. Chakraborti, G. Kaur, Tetrahedron55 (1999) 13265-13268; E. Meyer, A. C. Joussef, H. Gallardo, Synthesis 2003, 899-905)に従って製造する; LC-MS: tR = 0.55 min; 1H NMR (d6-DMSO):δ 9.25 (s br, 1H), 7.21 (s, 2H), 5.56 (s, 2H), 2.55 (q, J = 7.6 Hz, 2H), 2.15 (s, 3H), 1.10 (t, J = 7.6 Hz, 3H)。
3,5-ジエチル-4,N-ジヒドロキシ-ベンズアミジン
【0190】
【化50】

【0191】
表題化合物を、商業的に入手可能な2,6-ジエチルアニリンから、分嫌の手順(G. G. Ecke, J. P. Napolitano, A. H. Filbey, A. J. Kolka, J. Org. Chem. 22 (1957) 639-642;および3-エチル-4,N-ジヒドロキシ-5-メチル-ベンズアミジンについて引用された文献)に従って製造する; LC-MS: tR = 60 min; [M+1]+= 209.46。
3-クロロ-4,N-ジヒドロキシ-5-メトキシ-ベンズアミジン
【0192】
【化51】

【0193】
表題化合物を、商業的に入手可能な3-クロロ-4-ヒドロキシ-5-メトキシ-ベンズアルデヒドから、3-エチル-4,N-ジヒドロキシ-5-メチル-ベンズアミジンについて引用された文献と同様に製造する; LC-MS: tR = 0.49 min; [M+1]+= 216.96; 1H NMR (D6-DMSO):δ 3.84 (s, 3 H), 5.79 (s, 2 H), 7.22 (d, J = 1.5 Hz, 1 H), 7.27 (d, J = 1.8 Hz, 1 H), 9.52 (s, 1 H), 9.58 (s br, 1 H)。
[4-(N-ヒドロキシカルバミミドイル)-フェニル]-酢酸
【0194】
【化52】

【0195】
a) メチル (4-シアノフェニル)アセテート(4.00 g、27.8 mmol)のMeOH (20 mL)溶液に、ヒドロキシアミン 塩酸塩(3.17 g、45.7 mmol)およびNaHCO3 (3.84 g、45.7 mmol)を添加する。懸濁液を60℃で18時間撹拌した後、ろ過し、ろ液を濃縮する。残渣をDCMに溶解し、水、続いて塩水で洗浄し、MgSO4上で乾燥し、ろ過し、濃縮し、乾燥して、メチル [4-(N-ヒドロキシカルバミミドイル)-フェニル]-アセテート(3.67 g)を、無色の油状物質として得る;LC-MS: tR= 0.50 min, [M+1]+ = 209.05。
【0196】
b) メチル[4-(N-ヒドロキシカルバミミドイル)-フェニル]-アセテート(3.67 g、17.6 mmol)の25% HCl (15 mL)水溶液中の溶液を65℃で4時間撹拌する。溶媒を真空除去し、残渣を高真空下で乾燥し、[4-(N-ヒドロキシカルバミミドイル)-フェニル]-酢酸(3.80 g、おそらく塩酸塩として)を黄色の固体として得る; LC-MS: tR= 0.34 min, [M+1]+ = 195.05。
{4-[5-(6-イソブチル-5-メチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-フェニル}-酢酸
【0197】
【化53】

【0198】
ニコチン酸 6および[4-(N-ヒドロキシカルバミミドイル)-フェニル]-酢酸から、実施例13と同様に、表題化合物を製造する; LC-MS: tR = 0.96 min, [M+1]+ = 352.39。
3-[2-エチル-4-(N-ヒドロキシカルバミミドイル)-6-メチル-フェニル]-プロピオン酸 tert-ブチル エステル
【0199】
【化54】

【0200】
a) 3-エチル-4-ヒドロキシ-5-メチル-安息香酸(80.3 g、0.446 mol)のDMF(500 mL)溶液に、KHCO3(53.5 g、0.535 mol)、続いて臭化ベンジル(114.3 g、0.668 mol)を添加する。混合物を50℃で18時間撹拌した後、室温に冷却し、水(250 mL)で希釈し、TBME(2x250 mL)で抽出する。有機抽出物を水で洗浄し、そして濃縮する。粗生成物を、ヘプタン:EA 19:1から9:1で溶出するシリカゲル上のCCで精製し、3-エチル-4-ヒドロキシ-5-メチル-安息香酸ベンジルエステル(108.5 g)を、ベージュ色の固体として得る ; 1H NMR (CDCl3):δ 1.28 (t, J = 7.5 Hz, 3 H), 2.30 (s, 3 H), 2.68 (q, J = 7.8 Hz, 2 H), 5.24 (s, 1 H), 5.37 (s, 2 H), 7.33-7.45 (m, 3 H), 7.45-7.50 (m, 2 H), 7.77 (s, 1 H), 7.79 (s, 1 H)。
【0201】
b) 3-エチル-4-ヒドロキシ-5-メチル-安息香酸ベンジルエステル(97.5 g、0.361 mol)およびピリジン(57.1 g、0.721 mol)のDCM(1000 mL)溶液に、トリフルオロメタンスルホン酸 無水物(122.1 g、0.433 mol)のDCM(100 mL)溶液を、0℃で滴下する。添加完了後、混合物を室温で2時間撹拌し、その後、2N HCl(500 mL)水溶液続いて水(500 mL)で洗浄する。有機抽出物を濃縮し、乾燥し、3-エチル-5-メチル-4-トリフルオロメタンスルフォニルオキシ-安息香酸(140.5 g)を、オレンジ色の油状物質として得る; 1H NMR δ1.30 (t, J = 7.5 Hz, 3 H), 2.46 (s, 3 H), 2.83 (q, J = 7.5 Hz, 2 H), 5.39 (s, 2 H), 7.35-7.50 (m, 5 H), 7.87 (s, 1 H), 7.91 (s, 1 H)。
【0202】
c) 3-エチル-5-メチル-4-トリフルオロメタンスルフォニルオキシ-安息香酸(10.0 g、25 mmol)、アクリル酸tert.-ブチル(6.37 g、50 mmol)、NEt3(5.03 g、50 mmol)およびDPPP(0.82 g、2 mmol)のDMF(100 mL)溶液に、Pd(OAc)2(0.45 g、2 mmol)を、窒素雰囲気下で添加する。混合物を115℃で3時間撹拌した後、室温に冷却し、セライトパッド上でろ過する。パッドをTBME(250 mL)で洗浄し、水(500 mL)をろ液に添加する。相を分離し、有機相を水(2x500 mL)で2回洗浄し、MgSO4上で乾燥し、乾燥するまで蒸発させる。粗生成物にEtOH(100 mL)を添加する。濃厚な懸濁液が生成する。固形物を集め、氷冷EtOH(10 mL)で洗浄し、4-(2-tert-ブトキシカルボニル-ビニル)-3-エチル-5-メチル-安息香酸ベンジルエステル(3.8 g)を、薄灰色の固体として得る。
【0203】
d) 4-(2-tert-ブトキシカルボニル-ビニル)-3-エチル-5-メチル-安息香酸 ベンジルエステル(10.0 g、26 mmol)のTHF(100 mL)溶液に、Pd/C(0.5 g、20% Pd)を、窒素下、添加する。混合物を、室温で48時間、1barのH2下で撹拌する。触媒を、セライトパッド上でろ過除去し、ろ液を、乾燥するまで蒸発させ、4-(2-tert-ブトキシカルボニル-エチル)-3-エチル-5-メチル-安息香酸(7.64 g)を、白色の固体として得る; 1H NMR δ 1.29 (t, J = 7.5 Hz, 3 H), 1.49 (s, 9 H), 2.36-2.41 (m, 2 H), 2.74 (q, J= 7.5 Hz, 2 H), 2.99-3.05 (m, 2 H), 7.77 (s, 1 H), 7.80 (s, 1 H)。
【0204】
e) 4-(2-tert-ブトキシカルボニル-エチル)-3-エチル-5-メチル-安息香酸(36.0 g、123 mmol)のイソプロパノール(400 mL)溶液に、HOBT(18.3 g、135 mmol)、続いてEDC HCl(27.1 g、142 mmol)を添加する。混合物を室温で1時間撹拌した後、アンモニア水溶液(25%溶液を69 mL)を添加する。撹拌を1時間継続した後、混合物をDCM(500 mL)で希釈し、半飽和NaHCO3水溶液(3x400 mL)、続いて水(400 mL)で洗浄する。有機抽出物を、MgSO4上で乾燥し、ろ過し、濃縮する。粗生成物をTBME 8250 mL)で粉砕(trituate)する。固形物を集め、さらなるTBME(50 mL)で洗浄し、高真空下で乾燥し、3-(4-カルバモイル-2-エチル-6-メチル-フェニル)-プロピオン酸 tert-ブチルエステル(31.91 g)を、白色固体として得る。
【0205】
f) 3-(4-カルバモイル-2-エチル-6-メチル-フェニル)-プロピオン酸 tert-ブチルエステル(30.0 g、103 mmol)およびNEt3(31.3 g、309 mmol)のDCM(300 mL)溶液に、トリフルオロ酢酸無水物(23.8 g、113 mmol)をゆっくりと添加する。発熱反応を冷却により、5℃未満に保つ。添加完了後、混合物を室温で1時間撹拌する。混合物を水(2x300 mL)で2回洗浄し、有機抽出物を乾燥するまで蒸発させ、3-(4-シアノ-2-エチル-6-メチル-フェニル)-プロピオン酸 tert-ブチルエステル(28.4 g)を、薄黄色の油状物質として得る; 1H NMR δ 1.25 (t, J = 7.5 Hz, 3 H), 1.48 (s, 9 H), 2.32-2.37 (m, 2 H), 2.38 (s, 3 H), 2.70 (q, J = 7.5 Hz, 2 H), 2.95-3.02 (m, 2 H), 7.30 (s, 1 H), 7.34 (s, 1 H)。
【0206】
g) 3-(4-シアノ-2-エチル-6-メチル-フェニル)-プロピオン酸 tert-ブチルエステル(37.0 g、135 mmol)、ヒドロキシアミン塩酸塩(14.1 g、203 mmol)およびNEt3(27.4 g、271 mmol)のMeOH(400 mL)溶液を、7時間加熱還流した後、室温に冷却する。溶媒を蒸発させ、残渣をイソプロピルアセテート(500 mL)中に溶解し、水(500 mL)で2回洗浄する。有機抽出物をMgSO4上で乾燥し、ろ過し、蒸発乾燥し、3-[2-エチル-4-(N-ヒドロキシカルバミミドイル)-6-メチル-フェニル]-プロピオン酸 tert-ブチルエステル(40.8 g)を、薄黄色の固体として得る; 1H NMR δ1.26 (t, J= 7.5 Hz, 3 H), 1.49 (s, 9 H), 2.33-2.41 (m, 5 H), 2.66-2.74 (m, 2 H), 2.93-3.01 (m, 2 H), 4.85 (s, 1 H), 7.28 (s, 2 H)。
3-[2-エチル-4-(N-ヒドロキシカルバミミドイル)-6-メチル-フェニル]-プロピオン酸
【0207】
【化55】

【0208】
a) 3-(4-シアノ-2-エチル-6-メチル-フェニル)-プロピオン酸 エチルエステルは、3-(4-シアノ-2-エチル-6-メチル-フェニル)-プロピオン酸 tert-ブチルエステルと同様に製造される; 1H NMR (CDCl3):δ 1.21-1.31 (m, 6 H), 2.37 (s, 3 H), 2.41-2.47 (m, 2 H), 2.69 (q, J = 7.5 Hz, 2 H), 2.99-3.05 (m, 2 H), 4.18 (q, J= 7.0 Hz, 2 H), 7.30 (s, 1 H), 7.33 (s, 1 H)。
【0209】
b) 3-(4-シアノ-2-エチル-6-メチル-フェニル)-プロピオン酸 エチルエステル(55.0 g、224 mmol)のTHF(220 mL)および1N NaOH水溶液(220 mL)中の溶液を、室温で2撹拌した後、水(200 mL)で希釈し、DCM(2x200 mL)で抽出する。水相を、32% HCl水溶液(50 mL)に、15-30℃にて添加する。沈殿が生じる。固形物を集め、水で洗浄し、高真空下で乾燥し、3-(4-シアノ-2-エチル-6-メチル-フェニル)-プロピオン酸(40.87 g)を、薄茶色の結晶として得る; 1H NMR (D6-DMSO):δ 1.17 (t, J = 7.5 Hz, 3 H), 2.30-2.39 (m, 5 H), 2.67 (q, J = 7.3 Hz, 2 H), 2.87-2.94 (m, 2 H), 7.47 (s, 2 H), 12.30 (s, 1 H)。
【0210】
c) 3-(4-シアノ-2-エチル-6-メチル-フェニル)-プロピオン酸(10.0 g、46.0 mmol)のEtOH(80 mL)溶液に、NEt3(13.97 g、138.1 mmol)、続いてヒドロキシルアミン 塩酸塩(6.40 g、92.1 mmol)を添加する。混合物を7時間還流した後、室温に冷却する。溶媒を真空除去する。残渣を2N HCl水溶液に溶解し、32% NaOH水溶液を添加することにより、pHを5に調整する。生じた沈殿物を集め、水で洗浄し、高真空下、40℃で18時間乾燥し、3-[2-エチル-4-(N-ヒドロキシカルバミミドイル)-6-メチル-フェニル]-プロピオン酸(11.7 g)を、ベージュ色の結晶粉末として得る; LC-MS: tR = 0.60 min, [M+1]+ = 251.09。
3-{2-エチル-4-[5-(6-イソプロポキシ-5-メチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-6-メチル-フェニル}-プロピオン酸
【0211】
【化56】

【0212】
ニコチン酸11および3-[2-エチル-4-(N-ヒドロキシカルバミミドイル)-6-メチル-フェニル]-プロピオン酸から、実施例13と同様に、表題化合物を製造する; LC-MS: tR = 1.15 min, [M+1]+ = 410.10。
3-エチル-4-ヒドロキシ-5-メチル-安息香酸
【0213】
【化57】

【0214】
a) H2SO4(150 mL)の氷冷水溶液(250 mL)に、2-エチル-6-メチルアニリン(15.0 g、111 mmol)を添加する。溶液を氷(150 g)で処理した後、NaNO2(10.7 g、155 mmol)水溶液(150 mL)および氷(50 g)を滴下する。混合物を0℃で1時間撹拌する。50% H2SO4(200 mL)水溶液を添加し、撹拌を室温で18時間継続する。混合物をDCMで抽出し、有機抽出物をMgSO4上で乾燥し、蒸発させる。粗生成物を、ヘプタン:EA 9:1で溶出するシリカゲル上のCCで精製し、2-エチル-6-メチル-フェノール(8.6 g)を、暗赤色の油状物質として得る; LC-MS: tR = 0.89 min; 1H NMR (CDCl3):δ7.03-6.95 (m, 2H), 6.80 (t, J =7.6 Hz, 1H), 4.60 (s, 1H), 2.64 (q, J = 7.6 Hz, 2H), 2.25 (s, 3H), 1.24 (t, J = 7.6 Hz, 3H)。
【0215】
b) 2-エチル-6-メチル-フェノール(8.40 g、61.7 mmol)およびヘキサメチレンテトラアミン(12.97 g、92.5 mmol)の酢酸(60 mL)溶液および水(14 mL)を、115℃に加熱する。水を117℃で溜去し、Dean-Stark 装置で集める。次に水分散機を還流コンデンサー替え、混合物を3時間還流する。混合物を室温に冷却し、水(100 mL)で希釈し、EAで抽出する。有機抽出物を、飽和NaHCO3水溶液で洗浄し、MgSO4上で乾燥し、蒸発させる。残った固体をEAに溶解し、ヘプタンで処理して、結晶化を始める。固形物を集め、乾燥し、3-エチル-4-ヒドロキシ-5-メチル-ベンズアルデヒド(3.13 g)を、無色の結晶粉末として得る、 1H NMR (CDCl3):δ 9.83 (s, 1H), 7.58-7.53 (m, 2H), 5.30 (s br, 1H), 2.69 (q, J = 7.6 Hz, 2H), 2.32 (s, 3H), 1.28 (t, J = 7.6 Hz, 3H)。
【0216】
c) 3-エチル-4-ヒドロキシ-5-メチル-ベンズアルデヒド(78.8 g、0.48 mol)のDMSO(585 mL)溶液に、NaH2PO4二水和物(17.3 g、0.144 mol)の水溶液(160 mL)を、13分かけて添加する。混合物を室温で撹拌し、混合物を氷浴で冷やしながら、NaClO2(65.17 g、0.577 mol)の水溶液(160 mL)を添加する。混合物を1時間撹拌した後、温度を氷浴で25と40℃の間に保ちながら、NaClO2(43.44 g、0.480 mol)水溶液(100 mL)の2回目の添加を行う。黄色の懸濁液を室温で24時間撹拌した後、32% HCl水溶液でpH 2-3に酸性化する。混合物をTBME(250 mL)で抽出し、有機抽出物を水で洗浄し、洗浄液をTBMEで抽出する。合わせた有機抽出物の溶媒を蒸発させ、粗製3-エチル-4-ヒドロキシ-5-メチル-安息香酸(80.3 g)を、黄色の固体として得る。
4-アリルオキシ-3,5-ジメチル-安息香酸ヒドラジド
【0217】
【化58】

【0218】
4-アリルオキシ-3,5-ジメチル-安息香酸(文献:US 3,262,946を見よ。)(5.26 g、25.5 mmol)のCHCl3(75 mL)溶液にチオニルクロリド(7.5 mL)を添加し、混合物を2時間、還流加熱する。混合物を蒸発させ、DCM(50 mL)に溶解した残渣を、冷却した(0℃)1M hydrazineのTHF(75 mL)中、DCM(250 mL)中溶液に添加する。混合物を15時間でゆっくりと室温に温め、エーテル(150 mL)で希釈し、1M HCl(5x50 mL)水溶液で洗浄する。水性抽出物をエーテル(50 mL)で洗浄し、有機相を廃棄する。水性抽出物を33% KOH水溶液で塩基性化し、DCM(5x50 mL)で抽出する。有機抽出物を乾燥し(Na2SO4)、ろ過し、蒸発させ、表題化合物(5.39 g)を白色の固体として得る; LC-MS: tR = 0.71 min; [M+1]+= 221.20。
メタンスルホン酸 2,2-ジメチル-[1,3]ジオキサン-5-イル メチル エステル
【0219】
【化59】

【0220】
表題化合物を、B. Xu, A. Stephens, G. Kirschenheuter, A. F. Greslin, X. Cheng, J. Sennelo, M. Cattaneo, M. L. Zighetti, A. Chen, S.-A. Kim, H. S. Kim, N. Bischofberger, G. Cook, K. A. Jacobson, J. Med. Chem. 45 (2002) 5694-5709に記載された手順に従って製造する。
実施例の製造
実施例1
【0221】
【化60】

【0222】
a) 5-クロロ-6-イソプロポキシ-ニコチン酸(202.9 mg、0.94 mmol)、TBTU(332 mg、1.04 mmol)、Huenigの塩基(607 mg、4.70 mmol)および4-アリルオキシ-N-ヒドロキシ-3,5-ジメチル-ベンズアミジン(230 mg、1.04 mmol)のDCM(7 mL)溶液を、室温で24時間撹拌する。混合物をエーテル(150 mL)で希釈し、1N HCl水溶液(2x20 mL)、1N KHSO4水溶液(20 mL)および塩水(20 mL)で洗浄し、Na2SO4上で乾燥し、ろ過し、濃縮する。粗生成物を、ヘプタン中のEAの勾配で溶出するシリカゲル上のMPLCで精製し、5-クロロ-6-イソプロポキシ-ニコチン酸(4-アリルオキシ-N-ヒドロキシ-3,5-ジメチル-ベンズアミジン)エステル(258 mg)を白色粉末として得る; LC-MS: tR = 1.12 min, [M+1]+ = 418.07。
【0223】
b) 5-クロロ-6-イソプロポキシ-ニコチン酸 (4-アリルオキシ-N-ヒドロキシ-3,5-ジメチル-ベンズアミジン)エステル(200 mg、0.48 mmol)のジオキサン(6 mL)溶液を、90℃で2日間撹拌する。溶媒を蒸発させ、粗製3-[3-(4-アリルオキシ-3,5-ジメチル-フェニル)-[1,2,4]オキサジアゾール-5-イル]-5-クロロ-6-イソプロポキシ-ピリジン(279 mg)を得る; LC-MS: tR = 1.27 min。
【0224】
c) 3-[3-(4-アリルオキシ-3,5-ジメチル-フェニル)-[1,2,4]オキサジアゾール-5-イル]-5-クロロ-6-イソプロポキシ-ピリジン(191 mg、0.48 mmol)のアセトン(10 mL)および水(1 mL)中の溶液に、NMO(97 mg、0.72 mmol)、続いてOsO4(12 mg、0.048 mmol)を添加する。混合物を45℃で16時間撹拌した後、1N KHSO4水溶液で希釈し、エーテル(3x50 mL)で抽出する。合わせた有機抽出物をNa2SO4上で乾燥し、濃縮する。粗生成物(299 mg)のサンプル(15 mg)を、調製用TLCプレート上のクロマトグラフィーにより、ヘプタン:EA 1:2で精製し、(RS)-3-{4-[5-(5-クロロ-6-イソプロポキシ-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-2,6-ジメチル-フェノキシ}-プロパン-1,2-ジオール(10.6 mg)を得る; LC-MS: tR = 1.06 min, [M+1]+ = 434.06。
実施例2
【0225】
【化61】

【0226】
粗製(RS)-3-{4-[5-(5-クロロ-6-イソプロポキシ-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-2,6-ジメチル-フェノキシ}-プロパン-1,2-ジオール(265 mg、0.61 mmol)のTHF(5 mL)溶液に、Huenigの塩基(158 mg、1.22 mmol)、続いて塩化メタンスルホニル(77 mg、0.67 mmol)を0℃にて添加する。混合物を室温で16時間撹拌した後、MeOH(2 mL)中7M NH3を添加する。混合物を65℃で16時間撹拌した後、溶媒を真空除去し、粗製(RS)-1-アミノ-3-{4-[5-(5-クロロ-6-イソプロポキシ-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-2,6-ジメチル-フェノキシ}-プロパン-2-オールを得る; LC-MS: tR = 0.92 min, [M+1+CH3CN]+ = 474.44。
実施例3
【0227】
【化62】

【0228】
(RS)-1-アミノ-3-{4-[5-(5-クロロ-6-イソプロポキシ-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-2,6-ジメチル-フェノキシ}-プロパン-2-オール(313 mg、0.6 mmol)のDCM(10 mL)溶液に、グリコール酸(95 mg、1.25 mmol)およびHuenigの塩基(233 mg、1.8 mmol)を添加する。混合物を0℃に冷却し、TBTU(236 mg、0.74 mmol)を添加する。混合物を0℃で1時間、続いて室温で16時間撹拌した後、EA(250 mL)で希釈し、1N NaOH水溶液(3x25 mL)、1N KHSO4水溶液(25 mL)および塩水(25 mL)で洗浄し、Na2SO4上で乾燥し、ろ過し、濃縮する。粗生成物を調製用HPLCで精製し、N-((RS)-3-{4-[5-(5-クロロ-6-イソプロポキシ-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-2,6-ジメチル-フェノキシ}-2-ヒドロキシ-プロピル)-2-ヒドロキシ-アセタミド(42 mg)を、白色粉末として得る; LC-MS: tR = 1.06 min; [M+1]+ = 491.48; 1H NMR (CD3OD)δ 1.45 (d, J = 6.3 Hz, 6 H), 2.38 (s, 6 H), 3.47 (dd, J = 13.6, 7.3 Hz, 1 H), 3.66 (dd, J = 13.6, 4.5 Hz, 1 H), 3.87 (m, 2 H), 4.04 (s, 2 H), 4.14 (m, 1 H), 5.52 (m, 1 H), 7.78 (s, 2 H), 8.43 (s, 1 H), 8.85 (s, 1 H)。
実施例4
【0229】
【化63】

【0230】
(RS)-3-{4-[5-(6-イソブチル-5-メチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-2,6-ジメチル-フェノキシ}-プロパン-1,2-ジオールを、実施例1と同様に製造する; LC-MS: tR = 0.92 min, [M+1]+ = 412.21。
実施例5
【0231】
【化64】

【0232】
2-ヒドロキシ-N-((RS)-2-ヒドロキシ-3-{4-[5-(6-イソブチル-5-メチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-2,6-ジメチル-フェノキシ}-プロピル)-アセタミドを、実施例2および3と同様に製造する; LC-MS: tR = 0.89 min, [M+1]+ = 469.57。
実施例6
【0233】
【化65】

【0234】
(RS)-3-{2-エチル-4-[5-(6-イソブチル-5-メチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-6-メチル-フェノキシ}-プロパン-1,2-ジオールを、実施例1と同様に製造する; LC-MS: tR = 0.95 min, [M+1]+ = 426.14。
実施例7
【0235】
【化66】

【0236】
(RS)-1-アミノ-3-{2-エチル-4-[5-(6-イソブチル-5-メチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-6-メチル-フェノキシ}-プロパン-2-オールを、実施例2と同様に製造する; LC-MS: tR = 0.82 min, [M+1]+ = 425.17。
実施例8
【0237】
【化67】

【0238】
N-((RS)-3-{2-エチル-4-[5-(6-イソブチル-5-メチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-6-メチル-フェノキシ}-2-ヒドロキシ-プロピル)-2-ヒドロキシ-アセタミドを、実施例3と同様に製造する; LC-MS: tR = 0.91 min, [M+1]+ = 483.21。
実施例9
【0239】
【化68】

【0240】
(RS)-3-{2-エチル-4-[5-(5-イソブチル-6-メチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-6-メチル-フェノキシ}-プロパン-1,2-ジオールを、実施例1と同様に製造する; LC-MS: tR = 0.96 min, [M+1]+ = 426.12。
実施例10
【0241】
【化69】

【0242】
(RS)-3-{2,6-ジメチル-4-[5-(5-メチル-6-プロピル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-フェノキシ}-プロパン-1,2-ジオールを、実施例1と同様に製造する; LC-MS: tR = 0.87 min, [M+1]+ = 398.54。
実施例11
【0243】
【化70】

【0244】
(RS)-3-{2-エチル-6-メチル-4-[5-(5-メチル-6-プロピル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-フェノキシ}-プロパン-1,2-ジオールを、実施例1と同様に製造する; LC-MS: tR = 0.91 min, [M+1]+ = 412.56。
実施例12
【0245】
【化71】

【0246】
(RS)-3-{4-[5-(5,6-ジイソブチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-2,6-ジメチル-フェノキシ}-プロパン-1,2-ジオールを、実施例1と同様に製造する; LC-MS: tR = 1.01 min; [M+1]+ = 454.56。
実施例13
【0247】
【化72】

【0248】
5,6-ジエチル-ニコチン酸 塩酸塩(920 mg、4.3 mmol)およびHuenigの塩基(2.76 g、21 mmol)のDCM(50 mL)溶液にTBTU(1.785 g、5.55 mmol)を添加し、混合物を室温で5分撹拌する。3-エチル-4,N-ジヒドロキシ-5-メチル-ベンズアミジン(1.14 g、4.7 mmol)を添加し、混合物を0.5時間撹拌する。混合物をDCMで希釈し、飽和NaHCO3水溶液で洗浄し、MgSO4上で乾燥し、ろ過し、濃縮する。粗製5,6-ジエチル-ニコチン酸 (3-エチル-4,N-ジヒドロキシ-5-メチル-ベンズアミジン)エステル(LC-MS: tR = 0.79 min)をジオキサン(50 mL)に溶解し、18時間で100℃に過熱する。溶媒を蒸発させ、粗生成物を、EA 10:1で溶出するシリカゲル上のFCで精製し、4-[5-(5,6-ジエチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-2-エチル-6-メチル-フェノール(0.42 g)を固体として得る; LC-MS: tR = 1.03 min, [M+1]+ =338.09。
実施例14
【0249】
【化73】

【0250】
4-[5-(5,6-ジエチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-2-エチル-6-メチル-フェノール(100 mg、0.296 mmol)のイソプロパノール(10 mL)および3N NaOH水溶液(3 mL)中の溶液に、(S)-3-クロロ-1,2-プロパンジオール(98 mg、0.89 mmol)を添加する。混合物を60℃で24時間撹拌した後、別量の(S)-3-クロロ-1,2-プロパンジオール(98 mg、0.89 mmol)を添加する。撹拌を60℃で2日継続する。混合物をEAで希釈し、飽和NaHCO3水溶液で洗浄する。有機抽出物をMgSO4上で乾燥し、ろ過し、蒸発させる。粗生成物を調製用TLCプレート上のクロマトグラフィーにより、EA-ヘプタンで精製し、(S)-3-{4-[5-(5,6-ジエチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-2-エチル-6-メチル-フェノキシ}-プロパン-1,2-ジオール(14 mg)を、赤色の油状物質として得る; LC-MS: tR = 0.93 min, [M+1]+= 412.16。
実施例15
【0251】
【化74】

【0252】
2-{4-[5-(5,6-ジエチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-2-エチル-6-メチル-フェノキシメチル}-プロパン-1,3-ジオールを、実施例14と同様に、メタンスルホン酸 2,2-ジメチル-[1,3]ジオキサン-5-イルメチル エステルをアルキル化剤として用いて、2段階で製造する。得られた、保護されたジオール(32 mg)をTHF(5 mL)に溶解し水(0.5 mL)およびTFA(0.25 mL)を添加する。混合物を室温で1時間撹拌し、EAで希釈し、飽和NaHCO3水溶液で洗浄する。有機相を蒸発させ、残渣を、調製用TLCプレート上のクロマトグラフィーにより、DCM-MeOHで精製し、2-{4-[5-(5,6-ジエチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-2-エチル-6-メチル-フェノキシメチル}-プロパン-1,3-ジオールを得る; LC-MS: tR = 0.95 min, [M+1]+ = 426.09。
実施例16
【0253】
【化75】

【0254】
2-{4-[5-(5,6-ジエチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-2-エチル-6-メチル-フェノキシ}-エタノールを、ブロモエタノールをアルキル化剤として用いて、実施例14と同様に製造する; LC-MS: tR = 1.01 min; [M+1]+ = 382.17; 1H NMR (CDCl3)δ 1.22-1.45 (m, 9 H), 2.42 (s, 3 H), 2.72-2.87 (m, 4 H), 2.96 (q, J = 7.5 Hz, 2 H), 4.00 (m, 5 H), 7.89 (s, 1 H), 7.90 (s, 1 H), 8.24 (s, 1 H), 9.21 (s, 1 H)。
実施例17
【0255】
【化76】

【0256】
a) 4-[5-(5,6-ジエチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-2-エチル-6-メチル-フェノール(150 mg、0.445 mmol)のイソプロパノール(10 mL)および3N NaOH水溶液(3 mL)の溶液に、エピクロロヒドリン(164 mg、1.78 mmol)を添加する。混合物を室温で20時間撹拌する。混合物をEAで希釈し、飽和NaHCO3水溶液で洗浄する。有機抽出物をMgSO4上で乾燥し、ろ過し、蒸発させる。粗生成物を、調製用TLCプレート上のクロマトグラフィーにより、EA-ヘプタンで精製し、(RS)-2,3-ジエチル-5-[3-(3-エチル-5-メチル-4-オキシラニルメトキシ-フェニル)-[1,2,4]オキサジアゾール-5-イル]-ピリジン (92 mg)を、油状物質として得る。
【0257】
b) (RS)-2,3-ジエチル-5-[3-(3-エチル-5-メチル-4-オキシラニルメトキシ-フェニル)-[1,2,4]オキサジアゾール-5-イル]-ピリジン(92 mg)をMeOH中7N NH3(20 mL)に溶解し、スクリュー・キャップ・ボトル中で60℃にて15時間加熱する。混合物を蒸発させ、粗製(RS)-1-アミノ-3-{4-[5-(5,6-ジエチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-2-エチル-6-メチル-フェノキシ}-プロパン-2-オール(99 mg)を得る; LC-MS: tR = 0.80 min, [M+1]+ = 411.09。
実施例18
【0258】
【化77】

【0259】
(RS)-1-アミノ-3-{4-[5-(5,6-ジエチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-2-エチル-6-メチル-フェノキシ}-プロパン-2-オール(99 mg、0.24 mmol)、グリコール酸(18.5 mg、0.244 mmol)およびHuenigの塩基(78 mg、0.61 mmol)のDCM(5 mL)溶液に、PyBOP(126.7 mg、0.24 mmol)を添加し、混合物を室温で30分撹拌する。混合物をEAで希釈し、飽和NaHCO3水溶液で洗浄し、MgSO4上で乾燥し、ろ過し、濃縮する。粗生成物を、DCM:MeOH 10:1で溶出する調製用TLCプレート上のクロマトグラフィーにより精製し、N-((RS)-3-{4-[5-(5,6-ジエチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-2-エチル-6-メチル-フェノキシ}-2-ヒドロキシ-プロピル)-2-ヒドロキシ-アセタミド (90 mg)を、油状物質として得る; LC-MS: tR = 0.88 min, [M+1]+=469.25。
実施例19
【0260】
【化78】

【0261】
2-エチル-4-[5-(6-エチル-5-イソブチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-6-メチル-フェノールを、実施例13と同様に製造する; LC-MS: tR = 1.09 min, [M+1]+ = 366.19。
実施例20
【0262】
【化79】

【0263】
(S)-3-{2-エチル-4-[5-(6-エチル-5-イソブチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-6-メチル-フェノキシ}-プロパン-1,2-ジオールを、実施例14と同様に製造する; LC-MS: tR = 1.00 min, [M+1]+ = 440.20.
実施例21
【0264】
【化80】

【0265】
(S)-2-{2-エチル-4-[5-(6-エチル-5-イソブチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-6-メチル-フェノキシ}-エタノールを、実施例16と同様に製造する; LC-MS: tR = 1.08 min, [M+1]+ = 410.15.
実施例22
【0266】
【化81】

【0267】
(RS)-1-アミノ-3-{2-エチル-4-[5-(6-エチル-5-イソブチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-6-メチル-フェノキシ}-プロパン-2-オールを、実施例17と同様に製造する; LC-MS: tR = 0.85 min, [M+1]+ = 439.17。
実施例23
【0268】
【化82】

【0269】
N-((RS)-3-{2-エチル-4-[5-(6-エチル-5-イソブチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-6-メチル-フェノキシ}-2-ヒドロキシ-プロピル)-2-ヒドロキシ-アセタミドを、実施例18と同様に製造する; LC-MS: tR = 0.95 min, [M+1]+ = 497.17。
実施例24
【0270】
【化83】

【0271】
4-[5-(6-イソブチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-2,6-ジメチル-フェノールを、実施例13と同様に製造する; LC-MS: tR = 1.04 min, [M+1]+ = 324.36。
実施例25
【0272】
【化84】

【0273】
(RS)-1-アミノ-3-{4-[5-(6-イソブチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-2,6-ジメチル-フェノキシ}-プロパン-2-オールを、実施例17と同様に製造する; LC-MS: tR = 0.8 min。
実施例26
【0274】
【化85】

【0275】
2-ヒドロキシ-N-((RS)-2-ヒドロキシ-3-{4-[5-(6-イソブチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-2,6-ジメチル-フェノキシ}-プロピル)-アセタミドを、実施例18と同様に製造する; LC-MS: tR = 0.89 min, [M+1]+ = 455.48。
実施例27
【0276】
【化86】

【0277】
(RS)-3-{2-クロロ-4-[5-(6-イソブチル-5-メチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-6-メトキシ-フェノキシ}-プロパン-1,2-ジオールを、実施例1と同様に製造する; LC-MS: tR = 0.94 min, [M+1]+ = 448.21。
実施例28
【0278】
【化87】

【0279】
a) 6-イソブチル-5-メチル-ニコチン酸 塩酸塩(50 mg、0.22 mmol)、DIPEA(0.12 mL、0.7 mmol)およびTBTU(97 mg、0.30 mmol)のDCM(5 mL)溶液に、0℃にて、4-アリルオキシ-3,5-ジメチル-安息香酸 ヒドラジド(50.6 mg、0.23 mmol)を添加し、混合物を0℃で4時間撹拌する。混合物をEA(15 mL)で希釈し、1M NaH2PO4水溶液(5 mL)、1M NaOH水溶液(5 mL)および水(5 mL)で洗浄する。有機相を乾燥し(MgSO4)、ろ過し、蒸発させ、6-イソブチル-5-メチル-ニコチン酸 N'-(4-アリルオキシ-3,5-ジメチル-ベンゾイル)-ヒドラジド (85 mg)を得る; LC-MS: tR = 0.81 min, [M+1]+ = 396.20。
【0280】
b) 6-イソブチル-5-メチル-ニコチン酸 N'-(4-アリルオキシ-3,5-ジメチル-ベンゾイル)-ヒドラジド(89 mg、0.224 mmol)およびBurgess試薬(162 mg、0.68 mmol)のTHF(4 mL)溶液を、マイクロ波オーヴンで、110℃にて6分加熱する。混合物をEA(15 mL)で希釈し、1M NaH2PO4水溶液(5 mL)、1M NaOH水溶液(5 mL)および水(5 mL)で洗浄する。有機相を乾燥し(MgSO4)、ろ過し、蒸発させ、粗製5-[5-(4-アリルオキシ-3,5-ジメチル-フェニル)-[1,3,4]オキサジアゾール-2-イル]-2-イソブチル-3-メチル-ピリジン (80 mg)を得る; LC-MS: tR = 1.07 min, [M+1]+ = 378.3。
【0281】
c) (RS)-3-{4-[5-(6-イソブチル-5-メチル-ピリジン-3-イル)-[1,3,4]オキサジアゾール-2-イル]-2,6-ジメチル-フェノキシ}-プロパン-1,2-ジオールを、5-[5-(4-アリルオキシ-3,5-ジメチル-フェニル)-[1,3,4]オキサジアゾール-2-イル]-2-イソブチル-3-メチル-ピリジンから、実施例1と同様に製造する; LC-MS: tR = 0.83 min; [M+1]+ = 412.23; 1H NMR (D6-DMSO) δ0.94 (d, J = 6.5 Hz, 6 H), 2.19 (hept, J = 6.5 Hz, 1 H), 2.36 (s, 6 H), 2.42 (s, 3 H), 2.73 (d, J= 7.3 Hz, 2 H), 3.50 (t, J = 5.5 Hz, 2 H), 3.76 (m, 1 H), 3.84 (m, 1 H), 3.89 (m, 1 H), 4.65 (t, J = 5.5 Hz, 1 H), 4.97 (d, J = 5.0 Hz, 1 H), 7.84 (s, 2 H), 8.24 (d, J = 1.0 Hz, 1 H), 9.05 (d, J = 1.5 Hz, 1 H)。
実施例29
【0282】
【化88】

【0283】
ニコチン酸2から、(RS)-3-{4-[5-(5-イソブチル-6-メチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-2,6-ジメチル-フェノキシ}-プロパン-1,2-ジオールを、実施例1と同様に製造する; LC-MS: tR = 0.93 min; [M+1]+ = 412.18。
実施例30から34
【0284】
【化89】

【0285】
ニコチン酸6から、下記の実施例を、実施例1と同様に製造する。
【0286】
【表1】

【0287】
実施例34
1H NMR (CDCl3):δ 1.01 (d, J= 6.8 Hz, 6 H), 2.18-2.31 (m, 1 H), 2.45 (s, 3 H), 2.46 (s, 3 H), 2.80 (d, J = 7.3 Hz, 2 H), 3.82-3.96 (m, 2 H), 4.06-4.13 (m, 2 H), 4.15-4.23 (m, 1 H), 7.95 (d, J = 0.8 Hz, 1 H), 8.09 (d, J = 1.5 Hz, 1 H), 8.21 (s, 1 H), 9.19 (s, 1 H).
実施例35から39
【0288】
【化90】

【0289】
上記実施例から、下記の実施例を、実施例2と同様に製造する。
【0290】
【表2】

【0291】
実施例40から43
【0292】
【化91】

【0293】
上記実施例から、下記の実施例を、実施例3と同様に製造する。
【0294】
【表3】

【0295】
実施例40
1H NMR (CDCl3):δ 1.01 (d, J= 6.5 Hz, 6 H), 2.17-2.30 (m, 1 H), 2.46 (s, 3 H), 2.68 (s, 3 H), 2.80 (d, J = 7.3 Hz, 2 H), 3.13-3.19 (m, 1 H), 3.47-3.56 (m, 1 H), 3.72-3.80 (m, 1 H), 3.99-4.08 (m, 2 H), 4.17-4.24 (m, 3 H), 6.85-6.90 (m, 2 H), 7.08 (t br, J = 5.5 Hz, 1 H), 8.06 (d, J = 8.3 Hz, 1 H), 8.21 (s, 1 H), 9.20 (s, 1 H)。
実施例44
【0296】
【化92】

【0297】
(RS)-1-{2-クロロ-4-[5-(6-イソブチル-5-メチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-6-メトキシ-フェノキシ}-3-(2-ヒドロキシ-エチルアミノ)-プロパン-2-オールを、実施例27から、メタンスルホン化された中間体をエタノールアミンと反応させることにより、実施例2と同様に製造する;LC-MS: tR = 0.82 min, [M+1]+ = 491.06; 1H NMR (CDCl3):δ 1.00 (d, J= 6.5 Hz, 6 H), 2.18-2.29 (m, 1 H), 2.46 (s, 3 H), 2.79 (d, J = 7.3 Hz, 2 H), 2.83-2.92 (m, 4 H), 3.68-3.73 (m, 2 H), 4.01 (s, 3 H), 4.04-4.16 (m, 2 H), 4.24-4.31 (m, 1 H), 7.64 (s, 1 H), 7.87 (s, 1 H), 8.21 (s, 1 H), 9.18 (s, 1 H)。
実施例45および46
【0298】
【化93】

【0299】
実施例8のラセミ化合物は、キラル固定相(ChiralPak ADH 4.6x250 mm、5μm、ヘプタン中0.1%のジエチルアミンを含む20% EtOH、40 min、流速:0.8 mL/min)上の調製用HPLCにより、純粋なエナンチオマーに分離される。
【0300】
【表4】

【0301】
実施例47
【0302】
【化94】

【0303】
2-エチル-4-[3-(6-イソブチル-5-メチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-5-イル]-6-メチル-フェノールを、N-ヒドロキシ-6-イソブチル-5-メチル-ニコチンアミジンおよび3-エチル-4-ヒドロキシ-5-メチル-安息香酸から、実施例13と同様に製造する, LC-MS: tR = 1.02 min, [M+1]+ = 352.09。
実施例48から53
【0304】
【化95】

【0305】
実施例47から、下記の実施例を、上記実施例と同様に製造する。
【0306】
【表5】

【0307】
実施例49
1H NMR (CDCl3):δ 1.00 (d, J= 6.3 Hz, 6 H), 1.33 (t, J = 7.3 Hz, 3 H), 2.17-2.27 (m, 2 H), 2.43 (s, 6 H), 2.79 (m, 4 H), 2.90 (s br, 1 H), 3.82-4.01 (m, 4 H), 4.15-4.24 (m, 1 H), 7.93 (s, 1 H), 7.94 (s, 1 H), 8.18 (s, 1 H), 9.15 (s, 1 H)。
実施例53
1H NMR (CDCl3):δ 1.01 (d, J= 6.5 Hz, 6 H), 1.33 (t, J = 7.3 Hz, 3 H), 2.16-2.28 (m, 1 H), 2.41 (s, 3 H), 2.44 (s, 3 H), 2.74-2.82 (m, 4 H), 3.39 (s br, 1 H), 3.49-3.58 (m, 1 H), 3.77-3.95 (m, 3 H), 4.20-4.27 (m, 3 H), 7.01 (s br, 1 H), 7.93 (s, 1 H), 7.94 (s, 1 H), 8.19 (s, 1 H), 9.15 (s, 1 H).
実施例54
【0308】
【化96】

【0309】
a) ニコチン酸6(50 mg、0.218 mmol)のDCM(5 mL)溶液に、TBTUの溶液(97 mg、0.301 mmol)、続いてDCM(5 mL)中DIPEA(90 mg、0.696 mmol)を添加する。混合物を撹拌し、0℃に冷却した後、4-アリルオキシ-3,5-ジメチル-安息香酸 ヒドラジド(51 mg、0.232 mmol)を添加する。混合物を0℃で16時間撹拌した後、EA(15 mL)で希釈し、飽和NaHCO3水溶液(5 mL)および1M NaOH水溶液(5 mL)で洗浄し、MgSO4上で乾燥し、ろ過し、濃縮し、真空下で乾燥し、ヒドラジド中間体を得る; LC-MS: tR = 0.81 min, [M+1]+ = 396.37。この化合物のTHF(3 mL)溶液にLawessonの試薬(129 mg、0.318 mmol)を添加し、混合物を、マイクロ波中、110℃で5分加熱する。混合物をEA(30 mL)で希釈し、飽和Na2CO3水溶液で洗浄し、Na2SO4上で乾燥し、ろ過し、濃縮する。粗生成物を、調製用TLCプレート上、MeOH中7N NH3を10%含むDCMで精製し、5-[5-(4-アリルオキシ-3,5-ジメチル-フェニル)-[1,3,4]チアジアゾール-2-イル]-2-イソブチル-3-メチル-ピリジン(67 mg)を、黄色の固体として得る LC-MS: tR = 1.04 min, [M+1]+ = 394.10。
【0310】
b) 5-[5-(4-アリルオキシ-3,5-ジメチル-フェニル)-[1,3,4]チアジアゾール-2-イル]-2-イソブチル-3-メチル-ピリジンを、実施例1の工程c)に記載されたように、OsO4で処理し、(RS)-3-{4-[5-(6-イソブチル-5-メチル-ピリジン-3-イル)-[1,3,4]チアジアゾール-2-イル]-2,6-ジメチル-フェノキシ}-プロパン-1,2-ジオールを得る; LC-MS: tR = 0.78 min, [M+1]+ = 428.50; 1H NMR (CDCl3):δ 1.01 (d, J= 6.5 Hz, 6 H), 2.17-2.28 (m, 1 H), 2.39 (s, 6 H), 2.43 (s, 3 H), 2.76 (d, J = 7.3 Hz, 2 H), 3.82-3.99 (m, 4 H), 4.14-4.21 (m, 1 H), 7.70 (s, 2 H), 8.13 (s, 1 H), 8.90 (s, 1 H)。
実施例55
【0311】
【化97】

【0312】
{4-[5-(6-イソブチル-5-メチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-フェニル}-酢酸(50 mg、142 μmol)のDMF(3 mL)溶液に、EDC HCl(33 mg、171 μmol)、HOBt(23 mg、171μmol)およびDIPEA(28 mg、213 μmol)を添加する。混合物を室温で5分撹拌した後、エタノールアミン(10 mg、157μmol)を添加する。撹拌を室温で72時間継続する。混合物をEAで希釈し、水で洗浄し、濃縮する。粗生成物を、調製用TLCプレート上、MeOHを10%含むDCMで精製し、N-(2-ヒドロキシ-エチル)-2-{4-[5-(6-イソブチル-5-メチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-フェニル}-アセタミド(26 mg)を、白色の固体として得る; LC-MS: tR = 0.82 min, [M+1]+ = 395.15; 1H NMR (CDCl3):δ 1.01 (d, J = 6.5 Hz, 6 H), 2.19-2.29 (m, 1 H), 2.46 (s, 3 H), 2.53 (s br, 1 H), 2.80 (d, J = 7.3 Hz, 2 H), 3.44 (q, J = 4.8 Hz, 2 H) , 3.69 (s, 2 H), 3.71-3.75 (m, 2 H), 5.96 (s br, 1 H), 7.46 (d, J = 7.5 Hz, 2 H), 8.18 (d, J = 7.8 Hz, 2 H), 8.17 (s), 8.19 (s), 8.22 (s, 1 H), 9.20 (s, 1 H)。
実施例56
【0313】
【化98】

【0314】
N-(2-ヒドロキシ-1-ヒドロキシメチル-エチル)-2-{4-[5-(6-イソブチル-5-メチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-フェニル}-アセタミドを、2-アミノ-プロパン-1,3-ジオールを用いて、実施例55と同様に製造する; tR = 0.78 min, [M+1]+ = 425.19。
実施例57
【0315】
【化99】

【0316】
1-(2-{4-[5-(6-イソブチル-5-メチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-フェニル}-アセチル)-アゼチジン-3-カルボン酸を、{4-[5-(6-イソブチル-5-メチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-フェニル}-酢酸およびアゼチジン-3-カルボン酸 メチルエステルから、実施例55と同様に製造する;この化合物を、3N NaOH/ジオキサン水溶液中で、室温にて20時間撹拌し、所望の化合物を得る; LC-MS: tR = 0.60, [M+1]+ = 434.96。
実施例58
【0317】
【化100】

【0318】
(RS)-3-{4-[5-(6-イソブチル-ピリジン-3-イル)-[1,3,4]オキサジアゾール-2-イル]-2,6-ジメチル-フェノキシ}-プロパン-1,2-ジオールを、ニコチン酸8から、実施例28と同様に製造する; LC-MS: tR = 0.85, [M+1]+ = 398.36。
実施例59
【0319】
【化101】

【0320】
(RS)-1-アミノ-3-{4-[5-(6-イソブチル-ピリジン-3-イル)-[1,3,4]オキサジアゾール-2-イル]-2,6-ジメチル-フェノキシ}-プロパン-2-オールを、実施例58から、実施例2と同様に製造する; LC-MS: tR = 0.75, [M+1]+ = 397.29。
実施例60
【0321】
【化102】

【0322】
(RS)-2-ヒドロキシ-N-(2-ヒドロキシ-3-{4-[5-(6-イソブチル-ピリジン-3-イル)-[1,3,4]オキサジアゾール-2-イル]-2,6-ジメチル-フェノキシ}-プロピル)-アセタミドを、実施例59から、実施例3と同様に製造する; LC-MS: tR = 0.80, [M+1]+ = 455.19; 1H NMR (CD3OD):δ 0.97 (d, J= 6.7 Hz, 6 H), 2.06-2.20 (m, 1 H), 2.38 (s, 6 H), 2.76 (d, J = 7.0 Hz, 2 H), 3.38-3.57 (m, 1 H), 3.59-3.73 (m, 1 H), 3.78-3.94 (m, 2 H), 4.01 (s, 2 H), 4.05-4.16 (m, 1 H), 7.50 (d, J = 7.9 Hz, 1 H), 7.81 (s, 2 H), 8.41 (dd, J = 8.2, 2.1 Hz, 1 H), 9.16 (d, J = 2.1 Hz, 1 H)。
実施例61から70
【0323】
【化103】

【0324】
ニコチン酸8から、下記の実施例を、上記実施例と同様に製造する。
【0325】
【表6】

【0326】
実施例66
1H NMR (CDCl3):δ 0.99 (d, J= 6.5 Hz, 6 H), 1.33 (t, J = 7.5 Hz, 3 H), 2.15-2.26 (m, 1 H), 2.40 (s, 3 H), 2.72-2.83 (m, 4 H), 3.49-3.58 (m, 1 H), 3.78-3.94 (m, 3 H), 4.17-4.26 (m, 3 H), 6.98 (s br, 1 H), 7.34 (d, J = 8.3 Hz, 1 H), 7.88 (s, 1 H), 7.89 (s, 1 H), 8.39 (dd, J = 8.0, 2.0 Hz, 1 H), 9.37 (d, J = 1.3 Hz, 1 H).
実施例71から77
【0327】
【化104】

【0328】
ニコチン酸9および3-エチル-4,N-ジヒドロキシ-5-メチル-ベンズアミジンから、下記の実施例を、上記実施例と同様に製造する。
【0329】
【表7】

【0330】
実施例75
1H NMR (CDCl3):δ 1.01 (d, J= 6.8 Hz, 6 H), 1.33 (m, 6 H), 2.15 (s br, 1 H), 2.22-2.34 (m, 2 H) , 2.42 (s, 3 H), 2.73-2.85 (m, 4 H), 3.51 (s, 1 H), 3.96-4.09 (m, 5H), 7.89 (s, 1 H), 7.92 (s, 1 H), 8.25 (d, J = 1.8 Hz, 1 H), 9.21 (d, J = 2.0 Hz, 1 H)。
実施例78から81
【0331】
【化105】

【0332】
ニコチン酸10および3-エチル-4,N-ジヒドロキシ-5-メチル-ベンズアミジンから、下記の実施例を、上記実施例と同様に製造する。
【0333】
【表8】

【0334】
実施例81
1H NMR (CDCl3):δ 1.01 (d, J = 6.0 Hz, 6 H), 1.33 (t, J = 7.8 Hz, 3 H), 1.67-1.77 (m, 2 H), 2.14 (s br, 1 H), 2.27-2.35 (m, 1 H), 2.42 (s, 3 H), 2.77 (q, J = 7.5 Hz, 2 H), 2.93-2.99 (m, 2 H), 3.99-4.09 (m, 5 H), 7.86-7.91 (m, 3 H), 7.94 (s, 1 H), 8.79 (d, J = 5.0 Hz, 1 H)。
実施例82から88
【0335】
【化106】

【0336】
ニコチン酸11および3-エチル-4,N-ジヒドロキシ-5-メチル-ベンズアミジンから、下記の実施例を、上記実施例と同様に製造する。
【0337】
【表9】

【0338】
実施例88
1H NMR (CDCl3):δ 1.32 (t, J= 7.5 Hz, 3 H), 1.42 (d, J = 6.0 Hz, 6 H), 2.28 (s, 3 H), 2.39 (s, 3 H), 2.75 (q, J = 7.5 Hz, 2 H), 3.41 (m, 1 H), 3.48-3.58 (m, 1 H), 3.76-3.93 (m, 3 H), 4.17-4.25 (m, 3 H), 5.43-5.52 (m, 1 H), 7.03 (t br, J = 4.3 Hz, 1 H), 7.85 (s, 1 H), 7.87 (s, 1 H), 8.14 (s, 1 H), 8.84 (s, 1 H)。
実施例89
【0339】
【化107】

【0340】
3-{2-エチル-4-[5-(6-イソプロポキシ-5-メチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-6-メチル-フェニル}-N-(2-ヒドロキシ-エチル)-プロピオンアミドを、3-{2-エチル-4-[5-(6-イソプロポキシ-5-メチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-6-メチル-フェニル}-プロピオン酸から、実施例55と同様に製造する; LC-MS: tR = 1.07, [M+1]+ = 453.23; 1H NMR (CDCl3):δ 1.31 (t, J= 7.3 Hz, 3 H), 1.42 (d, J = 5.5 Hz, 6 H), 2.28 (s, 3 H), 2.38-2.48 (m, 5 H), 2.53 (s br, 1 H), 2.77 (q, J = 7.3 Hz, 2 H), 3.06-3.14 (m, 2 H), 3.42-3.50 (m, 2 H), 3.71-3.79 (m, 2 H), 5.42-5.52 (m, 1 H), 5.89 (s br, 1 H), 7.82 (s, 1 H), 7.85 (s, 1 H), 8.15 (s, 1 H), 8.85 (s, 1 H)。
実施例90から92
【0341】
【化108】

【0342】
3-エチル-4-ヒドロキシ-5-メチル-安息香酸およびN-ヒドロキシ-6-イソプロポキシ-5-メチル-ニコチンアミジンから、下記の実施例を、実施例13と同様に製造する。
【0343】
【表10】

【0344】
実施例92
1H NMR (CDCl3):δ 1.34 (t, J= 7.5 Hz, 3 H), 1.41 (d, J = 6.0 Hz, 6 H), 2.03 (t, J = 6.0 Hz, 1 H), 2.27 (s, 3 H), 2.43 (s, 3 H), 2.70 (d, J = 5.0 Hz, 1 H), 2.79 (q, J = 7.3 Hz, 2 H), 3.82-3.99 (m, 4 H), 4.15-4.21 (m, 1 H), 5.41-5.49 (m, 1 H), 7.92 (s, 1 H), 7.96 (s, 1 H), 8.11 (s, 1 H), 8.79 (s, 1 H)。
II) 生物学
i)実施例43:EC50値を決定するためのGTPγS結合アッセイ法
GTPγS結合アッセイ法は、96ウェルマイクロタイタープレート(Nunc, 442587)で、組換えヒトS1P1受容体を発現するCHO細胞の膜標品を用いて200μlの最終体積で行った。アッセイ条件は、20mM Hepes(Fluka, 54461)、100mM NaCl(Fluka, 71378)、5mM MgCl2(Fluka, 63064)、0.1%のBSA(Calbiochem, 126609)、1μM GDP(Sigma, G-7127)、2.5%のDMSO(Fluka, 41644)、50pMの35S-GTPγS(Amersham Biosciences, SJ1320)である。pHは、7.4である。試験化合物を溶解して、100%のDMSOに希釈し、35S-GTPγSの非存在下で150μlの上記アッセイ緩衝液中で室温にて30分間プレインキュベートする。50μlの、35S-GTPγSの添加後、アッセイを室温にて1時間インキュベートする。アッセイをPackard Biosciencesからのセル‐ハーベスターを使用して反応混合物をMultiscreenプレート(Millipore, MAHFC1H60)に移すことによって終結させて、プレートを氷冷10mM Na2HPO4/NaH2PO4(70%/30%)で洗浄して、乾燥させ、底面を封着して、25μlのMicroScint20(Packard Biosciences, order no. 6013621)を添加後に、上部を封着する。膜結合型の35S-GTPγSをPackard BiosciencesからのTopCountで測定する。
EC50は、最大の特異的35S-GTPγS結合の50%を誘導するアゴニストの濃度である。特異的結合は、非特異的結合を最大結合から減算することによって決定する。最大結合は、10μMのS1Pの存在下においてMultiscreenプレートに結合したcpmの量である。非特異的結合は、アッセイにおけるアゴニストの非存在下での結合の量である。
92実施例化合物のうち、62化合物のアゴニスト活性(EC50値)を測定した。測定されたEC50値は、0.1〜9410nMの範囲内であり、平均は492nMである。選択された化合物のアゴニスト活性を表1に示す。
表1:
【0345】
【表11】

【0346】
ii)インビボでの有効性の評価
式(I)の化合物の有効性は、正常圧の雄ウィスターラットに対する3〜30mg/kgの式(I)の化合物の経口投与後に、循環リンパ球を測定することによって評価する。動物は、12時間-光/暗闇サイクルで気候制御条件に収容して、通常のラット固形飼料および飲料水の自由な摂取をさせた。血液は、薬物投与前、並びに後の3、6および24時間に収集する。全血をAdvia Hematologyシステム(Bayer Diagnostics, Zurich, Switzerland)を使用する血液検査に供する。
【0347】
すべてのデータは、平均±SEMとして示してある。統計分析は、多重比較のためにStatistica(StatSoft)およびStudent-Newman-Keuls法を使用して分散分析(分散分析)によって行う。帰無仮説は、p<0.05のときに拒絶する。
一例として、表2には、媒体だけで処理した一群の動物と比較して、正常圧の雄ウィスターラットに対する本発明の化合物の10mg/kgの経口投与の6時間後におけるリンパ球カウントに対する効果を示す。経口投与の6時間後におけるリンパ球カウントは6実施例化合物について測定され、−77 % to −61 % の範囲内であり、平均は−68 %である。
表2:
【0348】
【表12】

【特許請求の範囲】
【請求項1】
式(I)の化合物、およびこのような化合物の塩:
【化1】

式中
Aは*-CONH-CH2-、*-CO-CH=CH-、*-CO-CH2CH2-、
【化2】

(アスタリスクは式(I)のピリジン基に結合される結合を表す。)を表し;
R1は水素、C1-4アルキルまたはクロロを表し;
R2は、C1-5アルキルまたはC1-4アルコキシを表し;
R3は、水素、C1-4アルキル、C1-4アルコキシまたはハロゲンを表し;
R4は、水素、C1-4アルキル、C1-4アルコキシ、ハロゲン、トリフルオロメチルまたはトリフルオロメトキシを表し;
R5は、2,3-ジヒドロキシプロピル、ジ-(ヒドロキシ-C1-4アルキル)-C1-4アルキル、-CH2-(CH2)k-NHSO2R53、-(CH2)nCH(OH)-CH2-NHSO2R53、-CH2-(CH2)k-NHCOR54、-(CH2)nCH(OH)-CH2-NHCOR54、-CH2-(CH2)n-CONR51R52、-CONHR51、1-(3-カルボキシ-アゼチジニル)-2-アセチル、1-(2-カルボキシ-ピロリジニル)-2-アセチル、1-(3-カルボキシ-ピロリジニル)-2-アセチル、1-(3-カルボキシ-アゼチジニル)-3-プロピオニル、1-(2-カルボキシ-ピロリジニル)-3-プロピオニル、1-(3-カルボキシ-ピロリジニル)-3-プロピオニル、-(CH2)nCH(OH)-CH2-NR51R52、ヒドロキシ、ヒドロキシ-C2-5アルコキシ、ジ-(ヒドロキシ-C1-4アルキル)-C1-4アルコキシ、2,3-ジヒドロキシプロポキシ、2-ヒドロキシ-3-メトキシ-プロポキシ、-OCH2-(CH2)m-NR51R52、2-[(アゼチジン-3-カルボン酸)-1-イル]-エトキシ、2-[(アゼチジン-3-カルボン酸C1-5-アルキルエステル)-1-イル]-エトキシ、2-[(ピロリジン-3-カルボン酸)-1-イル]-エトキシ、2-[(ピロリジン-3-カルボン酸 C1-5-アルキルエステル)-1-イル]-エトキシ、-OCH2-CH(OH)-CH2-NR51R52、3-[(アゼチジン-3-カルボン酸)-1-イル]-2-ヒドロキシプロポキシ、3-[(アゼチジン-3-カルボン酸 C1-5-アルキルエステル)-1-イル]-2-ヒドロキシプロポキシ、2-ヒドロキシ-3-[(ピロリジン-3-カルボン酸)-1-イル]-プロポキシ、2-ヒドロキシ-3-[(ピロリジン-3-カルボン酸 C1-5-アルキルエステル)-1-イル]-プロポキシ、2-ヒドロキシ-3-[(ピロリジン-2-カルボン酸)-1-イル]-プロポキシ、2-ヒドロキシ-3-[(ピロリジン-2-カルボン酸 C1-5-アルキルエステル)-1-イル]-プロポキシ、-OCH2-(CH2)m-NHSO2R53、-OCH2-CH(OH)-CH2-NHSO2R53、-OCH2-(CH2)m-NHCOR54、-OCH2-CH(OH)-CH2-NHCOR54を表し;
R51は、水素、C1-3アルキル、2-ヒドロキシエチル、2-ヒドロキシ-1-ヒドロキシメチル-エチル、2,3-ジヒドロキシプロピル、カルボキシメチル、1-(C1-5-アルキルカルボキシ)メチル、2-カルボキシエチルまたは2-(C1-5-アルキルカルボキシ)エチルを表し;
R52は、水素、メチルまたはエチルを表し;
R53は、C1-3-アルキル、メチルアミノ、エチルアミノまたはジメチルアミノを表し;
R54は、ヒドロキシメチル、ヒドロキシエチル、アミノメチル、メチルアミノメチル、ジメチルアミノメチル、アミノエチル、2-メチルアミノ-エチルまたは2-ジメチルアミノ-エチルを表し;
kは、1、2または3の整数を表し;
mは、1または2の整数を表し;
nは、0、1または2を表し;そして
R6は、水素、C1-4アルキルまたはハロゲンを表す。
【請求項2】
Aが、
【化3】

(アスタリスクは式(I)のピリジン基に結合される結合を表す。)を表す、請求項1に記載の化合物、およびこのような化合物の塩。
【請求項3】
Aが、
【化4】

(アスタリスクは式(I)のピリジン基に結合される結合を表す。)を表す、請求項1に記載の化合物、およびこのような化合物の塩。
【請求項4】
Aが、
【化5】

を表す、請求項1に記載の化合物、およびこのような化合物の塩。
【請求項5】
R1がC1-4アルキルまたはクロロを表す、請求項1〜4のいずれか1項に記載の化合物、およびこのような化合物の塩。
【請求項6】
R1がC1-4アルキルを表す、請求項1〜4のいずれか1項に記載の化合物、およびこのような化合物の塩。
【請求項7】
R2がC1-5アルキルを表す、請求項1〜6のいずれか1項に記載の化合物、およびこのような化合物の塩。
【請求項8】
R2がn-プロピルまたはイソ−ブチルを表す、請求項1〜6のいずれか1項に記載の化合物、およびこのような化合物の塩。
【請求項9】
R2がC1-4アルコキシを表す、請求項1〜6のいずれか1項に記載の化合物、およびこのような化合物の塩。
【請求項10】
R3が水素を表す、請求項1〜9のいずれか1項に記載の化合物、およびこのような化合物の塩。
【請求項11】
R3が水素を表し、R4がC1-4アルキルまたはC1-4アルコキシを表し、R6がC1-4アルキルまたはハロゲンを表す、請求項1〜9のいずれか1項に記載の化合物、およびこのような化合物の塩。
【請求項12】
R3が水素を表し、R4がC1-3アルキルまたはメトキシを表し、R6がメチル、エチルまたはハロゲンを表す、請求項1〜9のいずれか1項に記載の化合物、およびこのような化合物の塩。
【請求項13】
R5が、2,3-ジヒドロキシプロピル、ジ-(ヒドロキシ-C1-4アルキル)-C1-4アルキル、-CH2-(CH2)k-NHSO2R53、-(CH2)nCH(OH)-CH2-NHSO2R53、-CH2-(CH2)k-NHCOR54、-(CH2)nCH(OH)-CH2-NHCOR54、-CH2-(CH2)n-CONR51R52、-CONHR51、-(CH2)nCH(OH)-CH2-NR51R52、ヒドロキシ、ヒドロキシ-C2-5アルコキシ、ジ-(ヒドロキシ-C1-4アルキル)-C1-4アルコキシ、2,3-ジヒドロキシプロポキシ、2-ヒドロキシ-3-メトキシ-プロポキシ、-OCH2-(CH2)m-NR51R52、-OCH2-CH(OH)-CH2-NR51R52、-OCH2-(CH2)m-NHSO2R53、-OCH2-CH(OH)-CH2-NHSO2R53、-OCH2-(CH2)m-NHCOR54または-OCH2-CH(OH)-CH2-NHCOR54を表す、請求項1〜12のいずれか1項に記載の化合物、およびこのような化合物の塩。
【請求項14】
R5が、2,3-ジヒドロキシプロピル、-CH2-(CH2)k-NR51R52、-CH2-(CH2)k-NHCOR54、-(CH2)nCH(OH)-CH2-NHCOR54、-CH2-(CH2)n-CONR51R52、-CONHR51、-(CH2)nCH(OH)-CH2-NR51R52、ヒドロキシ-C2-5アルコキシ、ジ-(ヒドロキシ-C1-4アルキル)-C1-4アルコキシ、2,3-ジヒドロキシプロポキシ、2-ヒドロキシ-3-メトキシ-プロポキシ、-OCH2-(CH2)m-NR51R52、-OCH2-CH(OH)-CH2-NR51R52、-OCH2-(CH2)m-NHCOR54または-OCH2-CH(OH)-CH2-NHCOR54を表す、請求項1〜12のいずれか1項に記載の化合物、およびこのような化合物の塩。
【請求項15】
R5が、ヒドロキシ-C2-5アルコキシ、ジ-(ヒドロキシ-C1-4アルキル)-C1-4アルコキシ、2,3-ジヒドロキシプロポキシ、-OCH2-(CH2)m-NR51R52、-OCH2-CH(OH)-CH2-NR51R52、-OCH2-(CH2)m-NHCOR54または-OCH2-CH(OH)-CH2-NHCOR54を表す、請求項1〜12のいずれか1項に記載の化合物、およびこのような化合物の塩。
【請求項16】
R5が、3-ヒドロキシ-2-ヒドロキシメチル-プロポキシ、2,3-ジヒドロキシプロポキシまたは-OCH2-CH(OH)-CH2-NHCOR54を表す、請求項1〜12のいずれか1項に記載の化合物、およびこのような化合物の塩。
【請求項17】
以下からなる群より選択される請求項1に記載の化合物:
3-{4-[5-(5-クロロ-6-イソプロポキシ-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-2,6-ジメチル-フェノキシ}-プロパン-1,2-ジオール、
N-(3-{4-[5-(5-クロロ-6-イソプロポキシ-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-2,6-ジメチル-フェノキシ}-2-ヒドロキシ-プロピル)-2-ヒドロキシ-アセタミド、
3-{4-[5-(6-イソブチル-5-メチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-2,6-ジメチル-フェノキシ}-プロパン-1,2-ジオール、
2-ヒドロキシ-N-(2-ヒドロキシ-3-{4-[5-(6-イソブチル-5-メチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-2,6-ジメチル-フェノキシ}-プロピル)-アセタミド、
N-(3-{2-エチル-4-[5-(6-イソブチル-5-メチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-6-メチル-フェノキシ}-2-ヒドロキシ-プロピル)-2-ヒドロキシ-アセタミド、
3-{4-[5-(5,6-ジイソブチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-2,6-ジメチル-フェノキシ}-プロパン-1,2-ジオール、
N-(3-{4-[5-(5,6-ジエチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-2-エチル-6-メチル-フェノキシ}-2-ヒドロキシ-プロピル)-2-ヒドロキシ-アセタミド、
2-ヒドロキシ-N-(2-ヒドロキシ-3-{4-[5-(6-イソブチル-5-メチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-3-メチル-フェノキシ}-プロピル)-アセタミド、
N-(3-{2-クロロ-4-[5-(6-イソブチル-5-メチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-6-メチル-フェノキシ}-2-ヒドロキシ-プロピル)-2-ヒドロキシ-アセタミド、
N-(3-{2-クロロ-4-[5-(6-イソブチル-5-メチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-6-メトキシ-フェノキシ}-2-ヒドロキシ-プロピル)-2-ヒドロキシ-アセタミド、
N-((R)-3-{2-エチル-4-[5-(6-イソブチル-5-メチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-6-メチル-フェノキシ}-2-ヒドロキシ-プロピル)-2-ヒドロキシ-アセタミド、
N-((S)-3-{2-エチル-4-[3-(6-イソブチル-5-メチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-5-イル]-6-メチル-フェノキシ}-2-ヒドロキシ-プロピル)-2-ヒドロキシ-アセタミド、
N-((S)-3-{2-エチル-4-[5-(6-イソブチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-6-メチル-フェノキシ}-2-ヒドロキシ-プロピル)-2-ヒドロキシ-アセタミド、
(S)-3-{2-エチル-4-[5-(5-エチル-6-イソブチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-6-メチル-フェノキシ}-プロパン-1,2-ジオール、
N-(3-{2-エチル-4-[5-(5-エチル-6-イソブチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-6-メチル-フェノキシ}-2-ヒドロキシ-プロピル)-2-ヒドロキシ-アセタミド、
(R)-3-{2-エチル-4-[5-(6-イソプロポキシ-5-メチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-6-メチル-フェノキシ}-プロパン-1,2-ジオール、
(S)-3-{2-エチル-4-[5-(6-イソプロポキシ-5-メチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-6-メチル-フェノキシ}-プロパン-1,2-ジオール、
N-((R)-3-{2-エチル-4-[5-(6-イソプロポキシ-5-メチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-6-メチル-フェノキシ}-2-ヒドロキシ-プロピル)-2-ヒドロキシ-アセタミド、
N-((S)-3-{2-エチル-4-[5-(6-イソプロポキシ-5-メチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-6-メチル-フェノキシ}-2-ヒドロキシ-プロピル)-2-ヒドロキシ-アセタミド、
3-{2-エチル-4-[5-(6-イソプロポキシ-5-メチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-6-メチル-フェニル}-N-(2-ヒドロキシ-エチル)-プロピオンアミド、
(R)-3-{2-エチル-4-[3-(6-イソプロポキシ-5-メチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-5-イル]-6-メチル-フェノキシ}-プロパン-1,2-ジオール、
(S)-3-{2-エチル-4-[3-(6-イソプロポキシ-5-メチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-5-イル]-6-メチル-フェノキシ}-プロパン-1,2-ジオールおよび
3-{2-エチル-4-[5-(6-イソプロポキシ-5-メチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-6-メチル-フェニル}-プロピオン酸、
並びにこれらの化合物の塩。
【請求項18】
式(II)の化合物、およびこのような化合物の塩:
【化6】

式中、A、R1、R2及びnは、請求項1に定義された意味を有する;R3は、水素を表す;R4は、C1-4-アルキルまたはC1-4-アルコキシを表す;そしてR6は、C1-4-アルキルまたはハロゲンを表す。
【請求項19】
請求項1〜17のいずれか1項に記載の化合物またはこのような化合物の薬学的に許容される塩、および薬学的に許容される担体とを含む医薬組成物。
【請求項20】
医薬として使用するための、請求項1〜17のいずれか1項に記載の化合物、若しくはこのような化合物の薬学的に許容される塩、または請求項19に記載の医薬組成物。
【請求項21】
活性化された免疫系と関連する疾患もしくは障害の予防または治療のための医薬組成物の製造のための、請求項1〜17のいずれか1項に記載の化合物、またはこのような化合物の薬学的に許容される塩の使用。
【請求項22】
腎臓、肝臓、心臓、肺、膵臓、角膜および皮膚等の移植された臓器に対する拒絶反応;幹細胞移植によりもたらされる移植片対宿主病;関節リウマチ、多発性硬化症、クローン病および潰瘍性大腸炎等の炎症性腸疾患、乾癬、乾癬性関節炎、橋本甲状腺炎等の甲状腺炎、ブドウ膜網膜炎を含む自己免疫症候群;鼻炎、結膜炎、皮膚炎等のアトピー性疾患;喘息;I型糖尿病;リウマチ熱、感染後糸球体腎炎を含む感染後自己免疫疾患;固形癌および腫瘍転移からなる群より選択される疾患もしくは障害の予防または治療のための、請求項21に記載の使用。
【請求項23】
活性化された免疫系と関連する疾患もしくは障害の予防または治療のための、免疫抑制薬、副腎皮質ステロイド、NSAID、細胞障害性の薬剤、接着分子阻害剤、サイトカイン、サイトカイン阻害剤、サイトカイン受容体アンタゴニストおよび組換えサイトカイン受容体からなる群より選択される1つまたはいくつかの薬剤と組み合わせて使用するための医薬組成物の製造のための請求項1〜17のいずれか1項に記載の化合物、またはこのような化合物の薬学的に許容される塩の使用。
【請求項1】
式(I)の化合物、およびこのような化合物の塩:
【化1】

式中
Aは*-CONH-CH2-、*-CO-CH=CH-、*-CO-CH2CH2-、
【化2】

(アスタリスクは式(I)のピリジン基に結合される結合を表す。)を表し;
R1は水素、C1-4アルキルまたはクロロを表し;
R2は、C1-5アルキルまたはC1-4アルコキシを表し;
R3は、水素、C1-4アルキル、C1-4アルコキシまたはハロゲンを表し;
R4は、水素、C1-4アルキル、C1-4アルコキシ、ハロゲン、トリフルオロメチルまたはトリフルオロメトキシを表し;
R5は、2,3-ジヒドロキシプロピル、ジ-(ヒドロキシ-C1-4アルキル)-C1-4アルキル、-CH2-(CH2)k-NHSO2R53、-(CH2)nCH(OH)-CH2-NHSO2R53、-CH2-(CH2)k-NHCOR54、-(CH2)nCH(OH)-CH2-NHCOR54、-CH2-(CH2)n-CONR51R52、-CONHR51、1-(3-カルボキシ-アゼチジニル)-2-アセチル、1-(2-カルボキシ-ピロリジニル)-2-アセチル、1-(3-カルボキシ-ピロリジニル)-2-アセチル、1-(3-カルボキシ-アゼチジニル)-3-プロピオニル、1-(2-カルボキシ-ピロリジニル)-3-プロピオニル、1-(3-カルボキシ-ピロリジニル)-3-プロピオニル、-(CH2)nCH(OH)-CH2-NR51R52、ヒドロキシ、ヒドロキシ-C2-5アルコキシ、ジ-(ヒドロキシ-C1-4アルキル)-C1-4アルコキシ、2,3-ジヒドロキシプロポキシ、2-ヒドロキシ-3-メトキシ-プロポキシ、-OCH2-(CH2)m-NR51R52、2-[(アゼチジン-3-カルボン酸)-1-イル]-エトキシ、2-[(アゼチジン-3-カルボン酸C1-5-アルキルエステル)-1-イル]-エトキシ、2-[(ピロリジン-3-カルボン酸)-1-イル]-エトキシ、2-[(ピロリジン-3-カルボン酸 C1-5-アルキルエステル)-1-イル]-エトキシ、-OCH2-CH(OH)-CH2-NR51R52、3-[(アゼチジン-3-カルボン酸)-1-イル]-2-ヒドロキシプロポキシ、3-[(アゼチジン-3-カルボン酸 C1-5-アルキルエステル)-1-イル]-2-ヒドロキシプロポキシ、2-ヒドロキシ-3-[(ピロリジン-3-カルボン酸)-1-イル]-プロポキシ、2-ヒドロキシ-3-[(ピロリジン-3-カルボン酸 C1-5-アルキルエステル)-1-イル]-プロポキシ、2-ヒドロキシ-3-[(ピロリジン-2-カルボン酸)-1-イル]-プロポキシ、2-ヒドロキシ-3-[(ピロリジン-2-カルボン酸 C1-5-アルキルエステル)-1-イル]-プロポキシ、-OCH2-(CH2)m-NHSO2R53、-OCH2-CH(OH)-CH2-NHSO2R53、-OCH2-(CH2)m-NHCOR54、-OCH2-CH(OH)-CH2-NHCOR54を表し;
R51は、水素、C1-3アルキル、2-ヒドロキシエチル、2-ヒドロキシ-1-ヒドロキシメチル-エチル、2,3-ジヒドロキシプロピル、カルボキシメチル、1-(C1-5-アルキルカルボキシ)メチル、2-カルボキシエチルまたは2-(C1-5-アルキルカルボキシ)エチルを表し;
R52は、水素、メチルまたはエチルを表し;
R53は、C1-3-アルキル、メチルアミノ、エチルアミノまたはジメチルアミノを表し;
R54は、ヒドロキシメチル、ヒドロキシエチル、アミノメチル、メチルアミノメチル、ジメチルアミノメチル、アミノエチル、2-メチルアミノ-エチルまたは2-ジメチルアミノ-エチルを表し;
kは、1、2または3の整数を表し;
mは、1または2の整数を表し;
nは、0、1または2を表し;そして
R6は、水素、C1-4アルキルまたはハロゲンを表す。
【請求項2】
Aが、
【化3】

(アスタリスクは式(I)のピリジン基に結合される結合を表す。)を表す、請求項1に記載の化合物、およびこのような化合物の塩。
【請求項3】
Aが、
【化4】

(アスタリスクは式(I)のピリジン基に結合される結合を表す。)を表す、請求項1に記載の化合物、およびこのような化合物の塩。
【請求項4】
Aが、
【化5】

を表す、請求項1に記載の化合物、およびこのような化合物の塩。
【請求項5】
R1がC1-4アルキルまたはクロロを表す、請求項1〜4のいずれか1項に記載の化合物、およびこのような化合物の塩。
【請求項6】
R1がC1-4アルキルを表す、請求項1〜4のいずれか1項に記載の化合物、およびこのような化合物の塩。
【請求項7】
R2がC1-5アルキルを表す、請求項1〜6のいずれか1項に記載の化合物、およびこのような化合物の塩。
【請求項8】
R2がn-プロピルまたはイソ−ブチルを表す、請求項1〜6のいずれか1項に記載の化合物、およびこのような化合物の塩。
【請求項9】
R2がC1-4アルコキシを表す、請求項1〜6のいずれか1項に記載の化合物、およびこのような化合物の塩。
【請求項10】
R3が水素を表す、請求項1〜9のいずれか1項に記載の化合物、およびこのような化合物の塩。
【請求項11】
R3が水素を表し、R4がC1-4アルキルまたはC1-4アルコキシを表し、R6がC1-4アルキルまたはハロゲンを表す、請求項1〜9のいずれか1項に記載の化合物、およびこのような化合物の塩。
【請求項12】
R3が水素を表し、R4がC1-3アルキルまたはメトキシを表し、R6がメチル、エチルまたはハロゲンを表す、請求項1〜9のいずれか1項に記載の化合物、およびこのような化合物の塩。
【請求項13】
R5が、2,3-ジヒドロキシプロピル、ジ-(ヒドロキシ-C1-4アルキル)-C1-4アルキル、-CH2-(CH2)k-NHSO2R53、-(CH2)nCH(OH)-CH2-NHSO2R53、-CH2-(CH2)k-NHCOR54、-(CH2)nCH(OH)-CH2-NHCOR54、-CH2-(CH2)n-CONR51R52、-CONHR51、-(CH2)nCH(OH)-CH2-NR51R52、ヒドロキシ、ヒドロキシ-C2-5アルコキシ、ジ-(ヒドロキシ-C1-4アルキル)-C1-4アルコキシ、2,3-ジヒドロキシプロポキシ、2-ヒドロキシ-3-メトキシ-プロポキシ、-OCH2-(CH2)m-NR51R52、-OCH2-CH(OH)-CH2-NR51R52、-OCH2-(CH2)m-NHSO2R53、-OCH2-CH(OH)-CH2-NHSO2R53、-OCH2-(CH2)m-NHCOR54または-OCH2-CH(OH)-CH2-NHCOR54を表す、請求項1〜12のいずれか1項に記載の化合物、およびこのような化合物の塩。
【請求項14】
R5が、2,3-ジヒドロキシプロピル、-CH2-(CH2)k-NR51R52、-CH2-(CH2)k-NHCOR54、-(CH2)nCH(OH)-CH2-NHCOR54、-CH2-(CH2)n-CONR51R52、-CONHR51、-(CH2)nCH(OH)-CH2-NR51R52、ヒドロキシ-C2-5アルコキシ、ジ-(ヒドロキシ-C1-4アルキル)-C1-4アルコキシ、2,3-ジヒドロキシプロポキシ、2-ヒドロキシ-3-メトキシ-プロポキシ、-OCH2-(CH2)m-NR51R52、-OCH2-CH(OH)-CH2-NR51R52、-OCH2-(CH2)m-NHCOR54または-OCH2-CH(OH)-CH2-NHCOR54を表す、請求項1〜12のいずれか1項に記載の化合物、およびこのような化合物の塩。
【請求項15】
R5が、ヒドロキシ-C2-5アルコキシ、ジ-(ヒドロキシ-C1-4アルキル)-C1-4アルコキシ、2,3-ジヒドロキシプロポキシ、-OCH2-(CH2)m-NR51R52、-OCH2-CH(OH)-CH2-NR51R52、-OCH2-(CH2)m-NHCOR54または-OCH2-CH(OH)-CH2-NHCOR54を表す、請求項1〜12のいずれか1項に記載の化合物、およびこのような化合物の塩。
【請求項16】
R5が、3-ヒドロキシ-2-ヒドロキシメチル-プロポキシ、2,3-ジヒドロキシプロポキシまたは-OCH2-CH(OH)-CH2-NHCOR54を表す、請求項1〜12のいずれか1項に記載の化合物、およびこのような化合物の塩。
【請求項17】
以下からなる群より選択される請求項1に記載の化合物:
3-{4-[5-(5-クロロ-6-イソプロポキシ-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-2,6-ジメチル-フェノキシ}-プロパン-1,2-ジオール、
N-(3-{4-[5-(5-クロロ-6-イソプロポキシ-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-2,6-ジメチル-フェノキシ}-2-ヒドロキシ-プロピル)-2-ヒドロキシ-アセタミド、
3-{4-[5-(6-イソブチル-5-メチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-2,6-ジメチル-フェノキシ}-プロパン-1,2-ジオール、
2-ヒドロキシ-N-(2-ヒドロキシ-3-{4-[5-(6-イソブチル-5-メチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-2,6-ジメチル-フェノキシ}-プロピル)-アセタミド、
N-(3-{2-エチル-4-[5-(6-イソブチル-5-メチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-6-メチル-フェノキシ}-2-ヒドロキシ-プロピル)-2-ヒドロキシ-アセタミド、
3-{4-[5-(5,6-ジイソブチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-2,6-ジメチル-フェノキシ}-プロパン-1,2-ジオール、
N-(3-{4-[5-(5,6-ジエチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-2-エチル-6-メチル-フェノキシ}-2-ヒドロキシ-プロピル)-2-ヒドロキシ-アセタミド、
2-ヒドロキシ-N-(2-ヒドロキシ-3-{4-[5-(6-イソブチル-5-メチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-3-メチル-フェノキシ}-プロピル)-アセタミド、
N-(3-{2-クロロ-4-[5-(6-イソブチル-5-メチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-6-メチル-フェノキシ}-2-ヒドロキシ-プロピル)-2-ヒドロキシ-アセタミド、
N-(3-{2-クロロ-4-[5-(6-イソブチル-5-メチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-6-メトキシ-フェノキシ}-2-ヒドロキシ-プロピル)-2-ヒドロキシ-アセタミド、
N-((R)-3-{2-エチル-4-[5-(6-イソブチル-5-メチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-6-メチル-フェノキシ}-2-ヒドロキシ-プロピル)-2-ヒドロキシ-アセタミド、
N-((S)-3-{2-エチル-4-[3-(6-イソブチル-5-メチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-5-イル]-6-メチル-フェノキシ}-2-ヒドロキシ-プロピル)-2-ヒドロキシ-アセタミド、
N-((S)-3-{2-エチル-4-[5-(6-イソブチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-6-メチル-フェノキシ}-2-ヒドロキシ-プロピル)-2-ヒドロキシ-アセタミド、
(S)-3-{2-エチル-4-[5-(5-エチル-6-イソブチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-6-メチル-フェノキシ}-プロパン-1,2-ジオール、
N-(3-{2-エチル-4-[5-(5-エチル-6-イソブチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-6-メチル-フェノキシ}-2-ヒドロキシ-プロピル)-2-ヒドロキシ-アセタミド、
(R)-3-{2-エチル-4-[5-(6-イソプロポキシ-5-メチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-6-メチル-フェノキシ}-プロパン-1,2-ジオール、
(S)-3-{2-エチル-4-[5-(6-イソプロポキシ-5-メチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-6-メチル-フェノキシ}-プロパン-1,2-ジオール、
N-((R)-3-{2-エチル-4-[5-(6-イソプロポキシ-5-メチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-6-メチル-フェノキシ}-2-ヒドロキシ-プロピル)-2-ヒドロキシ-アセタミド、
N-((S)-3-{2-エチル-4-[5-(6-イソプロポキシ-5-メチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-6-メチル-フェノキシ}-2-ヒドロキシ-プロピル)-2-ヒドロキシ-アセタミド、
3-{2-エチル-4-[5-(6-イソプロポキシ-5-メチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-6-メチル-フェニル}-N-(2-ヒドロキシ-エチル)-プロピオンアミド、
(R)-3-{2-エチル-4-[3-(6-イソプロポキシ-5-メチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-5-イル]-6-メチル-フェノキシ}-プロパン-1,2-ジオール、
(S)-3-{2-エチル-4-[3-(6-イソプロポキシ-5-メチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-5-イル]-6-メチル-フェノキシ}-プロパン-1,2-ジオールおよび
3-{2-エチル-4-[5-(6-イソプロポキシ-5-メチル-ピリジン-3-イル)-[1,2,4]オキサジアゾール-3-イル]-6-メチル-フェニル}-プロピオン酸、
並びにこれらの化合物の塩。
【請求項18】
式(II)の化合物、およびこのような化合物の塩:
【化6】

式中、A、R1、R2及びnは、請求項1に定義された意味を有する;R3は、水素を表す;R4は、C1-4-アルキルまたはC1-4-アルコキシを表す;そしてR6は、C1-4-アルキルまたはハロゲンを表す。
【請求項19】
請求項1〜17のいずれか1項に記載の化合物またはこのような化合物の薬学的に許容される塩、および薬学的に許容される担体とを含む医薬組成物。
【請求項20】
医薬として使用するための、請求項1〜17のいずれか1項に記載の化合物、若しくはこのような化合物の薬学的に許容される塩、または請求項19に記載の医薬組成物。
【請求項21】
活性化された免疫系と関連する疾患もしくは障害の予防または治療のための医薬組成物の製造のための、請求項1〜17のいずれか1項に記載の化合物、またはこのような化合物の薬学的に許容される塩の使用。
【請求項22】
腎臓、肝臓、心臓、肺、膵臓、角膜および皮膚等の移植された臓器に対する拒絶反応;幹細胞移植によりもたらされる移植片対宿主病;関節リウマチ、多発性硬化症、クローン病および潰瘍性大腸炎等の炎症性腸疾患、乾癬、乾癬性関節炎、橋本甲状腺炎等の甲状腺炎、ブドウ膜網膜炎を含む自己免疫症候群;鼻炎、結膜炎、皮膚炎等のアトピー性疾患;喘息;I型糖尿病;リウマチ熱、感染後糸球体腎炎を含む感染後自己免疫疾患;固形癌および腫瘍転移からなる群より選択される疾患もしくは障害の予防または治療のための、請求項21に記載の使用。
【請求項23】
活性化された免疫系と関連する疾患もしくは障害の予防または治療のための、免疫抑制薬、副腎皮質ステロイド、NSAID、細胞障害性の薬剤、接着分子阻害剤、サイトカイン、サイトカイン阻害剤、サイトカイン受容体アンタゴニストおよび組換えサイトカイン受容体からなる群より選択される1つまたはいくつかの薬剤と組み合わせて使用するための医薬組成物の製造のための請求項1〜17のいずれか1項に記載の化合物、またはこのような化合物の薬学的に許容される塩の使用。
【公表番号】特表2010−502694(P2010−502694A)
【公表日】平成22年1月28日(2010.1.28)
【国際特許分類】
【出願番号】特願2009−527263(P2009−527263)
【出願日】平成19年9月6日(2007.9.6)
【国際出願番号】PCT/IB2007/053593
【国際公開番号】WO2008/029370
【国際公開日】平成20年3月13日(2008.3.13)
【出願人】(500226786)アクテリオン ファーマシューティカルズ リミテッド (151)
【氏名又は名称原語表記】Actelion Pharmaceuticals Ltd
【住所又は居所原語表記】Gewerbestrass 16,CH−4123 Allschwil,Switzerland
【Fターム(参考)】
【公表日】平成22年1月28日(2010.1.28)
【国際特許分類】
【出願日】平成19年9月6日(2007.9.6)
【国際出願番号】PCT/IB2007/053593
【国際公開番号】WO2008/029370
【国際公開日】平成20年3月13日(2008.3.13)
【出願人】(500226786)アクテリオン ファーマシューティカルズ リミテッド (151)
【氏名又は名称原語表記】Actelion Pharmaceuticals Ltd
【住所又は居所原語表記】Gewerbestrass 16,CH−4123 Allschwil,Switzerland
【Fターム(参考)】
[ Back to top ]

