免疫賦活剤、当該免疫賦活剤の製造方法及び茶抽出物の免疫賦活力を増進する方法
【課題】茶由来の成分を含み、優れた免疫賦活作用を有する免疫賦活剤、当該免疫賦活剤の製造方法、及び茶抽出物の免疫賦活力を増進する方法を提供すること。
【解決手段】エピガロカテキンとエピガロカテキンガレートとを含有させ、質量比(エピガロカテキン/エピガロカテキンガレート)が2以上になるように調整する。好ましくは、質量比を2以上3以下に調整する。さらに好ましくは、エピガロカテキン及びエピガロカテキンガレートの少なくとも一部が核酸と複合体の状態で存在するように調整する。
【解決手段】エピガロカテキンとエピガロカテキンガレートとを含有させ、質量比(エピガロカテキン/エピガロカテキンガレート)が2以上になるように調整する。好ましくは、質量比を2以上3以下に調整する。さらに好ましくは、エピガロカテキン及びエピガロカテキンガレートの少なくとも一部が核酸と複合体の状態で存在するように調整する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、免疫賦活剤、当該免疫賦活剤の製造方法及び茶抽出物の免疫賦活力を増進する方法に関する。
【背景技術】
【0002】
病気予防に関する予防医学という概念が知られており、最近の予防医学において、免疫機能が特に注目されている。免疫機能は生体の恒常性維持に役立っており、この免疫機能を向上させて病気を予防しようという提案がなされている。例えば基礎免疫機能を向上させることにより種々の感染症にかからないようにしたり、非特異的な免疫機能を向上させることにより癌や種々の抗原・微生物・ウイルス等を排除するようにしたり、初期免疫機能を向上させることで、免疫機能全体の改善や、免疫機能の調節、さらに特異的免疫機能のバランスを改善したり、異常な免疫作用によって引き起こされる種々の病態、例えば花粉症、アトピー、自己免疫疾患等を予防又は治療しようとする試みが行われている。
【0003】
病気予防のための免疫機能の向上には、免疫賦活作用を有する免疫賦活剤が使用される。免疫賦活剤としては、天然由来のものが望まれている。日常的に摂取することが可能であり、副作用の心配が少ないという点で、天然由来のものが望まれている。
【0004】
免疫賦活作用を有する天然由来の物質として、茶由来成分が知られている。例えば、特許文献1には、ヒト末梢血単核球のIgA産生増強作用をもつ分子量1万以上の茶葉多糖類が開示されている。特許文献2には、IgA産生増強、IgG産生増強作用をもつ茶葉カテキン類が開示されている。特許文献3には、ケール加工物と茶を複合したマクロファージ増強剤が開示されている。特許文献4には、大麦若葉と茶を複合したマクロファージ増強剤が開示されている。
【先行技術文献】
【特許文献】
【0005】
【特許文献1】特開2005−239571号公報
【特許文献2】特開2005−232115号公報
【特許文献3】特開2002−209552号公報
【特許文献4】特開2002−065206号公報
【特許文献5】特開2002−255811号公報
【特許文献6】特開2004−075666号公報
【発明の概要】
【発明が解決しようとする課題】
【0006】
しかし、茶に含まれるカテキン類は免疫抑制作用を有する場合もあることが知られている(例えば、特許文献5、6)。このように茶由来成分の機能としては、免疫賦活作用及び免疫抑制作用が知られているが、いかなる場合にいずれの機能を奏するかは不明である。
【0007】
本発明は、以上の課題を解決するためになされたものであり、その目的は、茶由来の成分を含み、優れた免疫賦活作用を有する免疫賦活剤、当該免疫賦活剤の製造方法、及び茶抽出物の免疫賦活力を増進する方法を提供することにある。
【課題を解決するための手段】
【0008】
本発明者らは、エピガロカテキンとエピガロカテキンガレートとの質量比が免疫賦活活性と高い相関を有することを見出し、本発明を完成するに至った。より具体的には、本発明は以下のものを提供する。
【0009】
(1) エピガロカテキンとエピガロカテキンガレートとを含み、質量比(エピガロカテキン/エピガロカテキンガレート)が2以上である免疫賦活剤。
【0010】
(2) 前記質量比は2以上3以下である(1)に記載の免疫賦活剤。
【0011】
(3) 前記エピガロカテキン及び前記エピガロカテキンガレートの少なくとも一部が核酸と複合体の状態で存在する(1)又は(2)に記載の免疫賦活剤。
【0012】
(4) 前記核酸がRNAである(3)に記載の免疫賦活剤。
【0013】
(5) さらに、高分子茶多糖類を含み、前記茶多糖類が核酸と複合体の状態で存在する(1)から(4)のいずれかに記載の免疫賦活剤。
【0014】
(6) さらに、茶抽出成分を含有する(1)から(5)のいずれかに記載の免疫賦活剤。
【0015】
(7) 貪食能増進剤、IgA産生促進剤の群から選ばれる少なくとも一種である(1)から(6)のいずれかに記載の免疫賦活剤。
【0016】
(8) 免疫賦活剤を製造する方法であって、Camellia sinensisに属する茶葉、Camellia taliensisに属する茶葉及びCamellia irrawadiensisに属する茶葉から選択される少なくとも一種の茶葉から−4℃以上30℃以下の抽出溶媒で茶抽出物を得る茶抽出物製造工程と、前記茶抽出物から免疫賦活剤を製造する免疫賦活剤製造工程と、を有する免疫賦活剤の製造方法。
【0017】
(9) 前記抽出溶媒が20℃以下の水である(8)に記載の免疫賦活剤の製造方法。
【0018】
(10) 前記茶抽出物製造工程において、抽出時間が1時間以上24時間以下である(8)又は(9)に記載の免疫賦活剤の製造方法。
【0019】
(11) 前記茶葉は、幼葉である(8)から(10)のいずれかに記載の免疫賦活剤の製造方法。
【0020】
(12) 茶抽出物中のエピガロカテキンとエピガロカテキンガレートとの、質量比を調整することにより茶抽出物の免疫賦活力を増進する方法。
【0021】
(13) さらに、前記エピガロカテキン及び前記エピガロカテキンガレートの少なくとも一部を核酸と複合体の状態で存在させる(12)に記載の茶抽出物の免疫賦活力を増進する方法。
【発明の効果】
【0022】
本発明の免疫賦活剤は、天然由来成分である特定のカテキンを含み、その特定のカテキンの組み合わせにより優れた免疫賦活作用を有する。このため、本発明の免疫賦活剤によれば、体内の免疫機能を充分に高めることができ、副作用の問題が少なく、効果的に病気にかかることを予防することができる。
【0023】
本発明の免疫賦活剤の製造方法は、茶葉から特定の種類のカテキンを特定の質量比で抽出できる。その結果、本発明の免疫賦活剤の製造方法によれば、優れた免疫賦活作用を有する免疫賦活剤を容易に製造できる。
【0024】
本発明の茶抽出物の免疫賦活力を増進する方法は、茶抽出物中のエピガロカテキンとエピガロカテキンガレートとの、質量比を調整することで、茶抽出物の免疫賦活力を容易に高めることができる。
【図面の簡単な説明】
【0025】
【図1】評価Aのマクロファージの貪食作用活性化評価結果を示す図である。
【図2】評価BのIgA産生促進評価結果を示す図である。
【図3】評価Cのマクロファージの貪食作用活性化評価結果を示す図である。
【図4】評価Cの分子量分画カラムを用いたHPLC分析結果を示す図である。
【図5】評価Cの核酸量の測定結果、核酸の種類の確認結果を示す図である。
【図6】評価Dのマクロファージの貪食作用活性化評価結果を示す図である。
【図7】評価Eのカテキンの種類の分析結果を示す図である。
【図8】評価EのIgA産生促進評価結果を示す図である。
【図9】評価Fの分泌型IgA含量の変化を示す図である。
【発明を実施するための形態】
【0026】
以下、本発明の実施形態について詳細に説明するが、本発明は、以下の実施形態に何ら限定されるものではなく、本発明の目的の範囲内において、適宜変更を加えて実施することができる。なお、説明が重複する箇所については、適宜説明を省略する場合があるが、発明の要旨を限定するものではない。
【0027】
以下、本発明について、免疫賦活剤、免疫賦活剤の製造方法、茶抽出物の免疫賦活力を増進する方法の順で説明する。
【0028】
<免疫賦活剤>
本発明の免疫賦活剤は、エピガロカテキン(EGC)とエピガロカテキンガレート(EGCG)とを含み、これらのカテキンの質量比(EGC/EGCG)が2以上である。これにより、本発明の免疫賦活剤は、マクロファージの貪食作用を活性化でき、マクロファージによるウイルス等の異物を取り込む効果を促進できる。そして、質量比(EGC/EGCG)が1の場合にはこれらのカテキンが核酸と複合体を形成してもマクロファージの貪食作用を充分には活性化しない。
【0029】
EGC、EGCGは、従来公知の茶等の天然物質に含まれる成分である。このため、本発明の免疫賦活剤は、副作用の問題が少なく、日常的に摂取することができる。
【0030】
EGC、EGCGとしては、茶等の天然物質から抽出したものを用いてもよいし、合成したものを用いてもよい。茶等の天然物質から抽出した場合には、EGC、EGCG以外の成分も含まれる可能性が高いが、EGCとEGCGの質量比が上記の範囲内であれば、本発明の効果を奏する。なお、本発明の免疫賦活剤においては、茶葉から抽出して得られたものを用いることが好ましい。茶葉にはEGC、EGCGの両者が含まれ、茶葉から所定の抽出条件で茶抽出物を得ることで、容易に所望のEGC、EGCGの混合物が得られるからであり、また、茶葉に含まれるRNAは、後述する通り、EGC及びEGCGと複合体を形成して、免疫賦活力の増進に寄与するからである。茶葉としては、例えば、Camellia sinensisに属する茶葉、Camellia taliensisに属する茶葉及びCamellia irrawadiensisに属する茶葉が挙げられる。
【0031】
上記質量比(EGC/EGCG)は、IgAの産生も促進できる点で3以下であることが好ましい。IgAは、強力な病原性をもつ微生物の腸管粘膜への結合を阻害する作用、細菌毒素と特異的に結合してその作用を不活化する作用、アレルゲンとして作用する食餌性の抗原と結合し消化管壁を通過することを防止してアレルギ−反応を抑制する作用等を有することが知られている。ただし、マクロファージの貪食作用を活性化する用途に着目すると、上記質量比は3以上であることが好ましい。
【0032】
本発明の免疫賦活剤に含まれるEGC及びEGCGは、EGC及びEGCGの少なくとも一部が核酸と複合体の状態で存在することが好ましい。これにより、マクロファージの貪食作用がさらに活性化できるため、本発明の免疫賦活剤はさらに優れる。
【0033】
免疫賦活剤に含まれるEGCとEGCGとの質量比(EGC/EGCG)と、複合体を形成するEGCとEGCGとの質量比(複合体の状態で存在するEGCの質量/複合体の状態で存在するEGCGの質量)とは、ほぼ等しいと推測される。
【0034】
ここで、複合体とは、EGC、EGCGと核酸とが化学的、電気的等の相互作用を介して挙動を共にする集合体を指し、必ずしも結合体である必要は無い。
【0035】
EGC、EGCGと複合化する核酸は、特に限定されないが、例えばRNA、DNAが挙げられる。これらの中でもRNAが好ましく、複合体の形成によるマクロファージの貪食作用活性化の効果がさらに高まる点で高分子茶多糖類に含まれるssRNAが最も好ましい。なお、核酸はEGC、EGCG等のカテキン類とともに茶葉から抽出してもよいし、EGC、EGCGを所定の質量比で含む混合物に核酸を外部から添加してもよい。なお、分子量分画カラムに通す条件は実施例に記載の条件とする。
【0036】
本発明の免疫賦活剤は、高分子茶多糖類をさらに含み、その高分子の茶多糖類が核酸と複合体を形成した状態で存在していることが好ましい。これにより、マクロファージの貪食作用を活性化する効果が高まる。核酸の種類、好ましい核酸は上記のものと同様である。なお、高分子の茶多糖類と核酸の複合体の存在は、茶多糖類を分子量分画カラムに通したときに検出されるピークの中で、最も大きなピークと同じ位置に核酸のピークが検出されることで確認できる。
【0037】
本発明では、上記成分の含有量は特に限定されないが、本発明の効果を充分に得るためには、EGCは40mg以上(より好ましくは60mg以上)含み、ssRNAを10質量%以上(より好ましくは15質量%以上)含む茶多糖類を5mg以上(より好ましくは15mg以上)含む組成物が好ましい。
【0038】
本発明の免疫賦活剤は、さらに茶抽出成分を含むことが好ましい。これにより、上記マクロファージの貪食作用を活性化する作用、IgAの産生を促進する作用が向上する。茶抽出成分としては、茶に含まれるEGC、EGCG以外のカテキン類、茶に含まれるアミノ酸、たんぱく質等が挙げられる。
【0039】
本発明の免疫賦活剤は、本発明の効果を害さない範囲であれば、上記以外の成分を含有してもよい。上記以外の成分としては、例えば、L−アスコルビン酸やアスコルビン酸ナトリウムのような酸化防止剤、香料、各種エステル類、有機酸類、有機酸塩類、無機酸類、無機酸塩類、無機塩類、色素類、乳化剤、保存料、調味料、甘味料、酸味料、果汁エキス類、野菜エキス類、花蜜エキス類、pH調整剤、品質安定剤等の添加剤が挙げられ、これらを単独、あるいは併用してもよい。
【0040】
本発明の免疫賦活剤の製造方法としては、特に限定されず、従来公知の方法で茶等の天然物質からEGC、EGCG等の各成分を単離してもよいし、各成分の一部又は全部を合成してもよいし、全ての所望成分を含む天然物質から成分を抽出することにより製造してもよい。全ての所望成分を含む天然物質から抽出する方法は、本発明の免疫賦活剤を容易に製造することができるため好ましい。その一例について、以下説明する。
【0041】
<免疫賦活剤の製造方法>
免疫賦活剤の製造方法は、茶抽出物製造工程と免疫賦活剤製造工程とを有する。以下、茶抽出物製造工程、免疫賦活剤製造工程の順で説明する。
【0042】
茶抽出物製造工程では、Camellia sinensisに属する茶葉、Camellia taliensisに属する茶葉及びCamellia irrawadiensisに属する茶葉から選択される少なくとも一種の茶葉から−4℃以上30℃以下の水で茶抽出物を得る。
【0043】
使用する茶葉は幼葉、成熟葉のいずれであってもよいが、カテキンや茶多糖類と複合体を形成する活性の高いRNA(例えば、ssRNA)を多く含み、免疫賦活剤の貪食作用をさらに高める点で、幼葉であることが好ましい。ここで言う幼葉とは、芽(心)から三葉までを指す。
【0044】
上記の茶葉について、種苗法に基づいて登録されている茶品種を例示すると、星野緑、おくゆたか、司みどり、たかねわせ、さとう早生、おくひかり、めいりょく、ふくみどり、いなぐち、寺川早生、みねかおり、みなみかおり、しゅんめい、さえみどり、茶中間母本農1号、ふうしゅん、みなみさやか、さわみずか、べにふうき、ほくめい、みねゆたか、松寿、摩利子、三重緑萌1号、あさのか、藤かおり、山の息吹、茶中間母本農2号、さがらひかり、さがらみどり、香駿、さがらかおり、さがらわせ、さきみどり、りょうふう、みどりの星、むさしかおり、りょくふう、茶中間母本農3号、成里乃、奥の山、はるみどり、つゆひかり、みえうえじま、そうふう、さいのみどり、みやまかおり、はるもえぎ、きら香、鳳春、展みょう、さやまかおり、さやまみどり、おくみどり、やまとみどり等が挙げられる。
【0045】
また、茶葉は、生葉であっても、萎凋処理等の前処理したものであってもよい。前処理は、不発酵、半発酵等の、いずれの方法によるものでもよい。半発酵茶までは単量体カテキンが残存しているという理由から不発酵茶、半発酵茶のいずれも使用できる。不発酵茶としては緑茶(煎茶、玉露、かぶせ茶、番茶、玉緑茶、碾茶、抹茶、ほうじ茶等)、半発酵茶としてはウーロン茶、包種茶等が挙げられる。本発明においては、単量体カテキンが生葉とほとんど変わらず保持されているという理由で緑茶、包種茶が好ましい。
【0046】
上記茶葉を、−4℃以上30℃以下の水を用いて抽出する。これにより、上記の茶葉からEGCを充分に抽出させつつ、EGCGの抽出を抑えることができる。その結果、茶抽出物に含まれる質量比(EGC/EGCG)は2以上になり、マクロファージの貪食作用が活性化され、茶抽出物は優れた免疫賦活剤になる。
【0047】
また、上記温度範囲の水を用いることで、茶抽出物に含まれるEGC、EGCGの質量比(EGC/EGCG)は、2以上3以下になりやすい。上記質量比が2以上3以下の範囲にあれば、IgAの産生も促進されるため、茶抽出物は優れた免疫賦活剤になる。特に、−4℃以上20℃以下の水で上記茶葉を抽出することで、上記質量比(EGC/EGCG)を3に近づけることができ、IgAの産生を促進する作用がさらに高まるため、さらに優れた免疫賦活剤が得られる。なお、0℃以上10℃以下の温度範囲の水を用いることが、より効果の高い免疫賦活剤を得る観点から最も好ましい。
【0048】
また、−4℃以上30℃以下の温度範囲の水を用いることで、茶葉から抽出されるRNAは活性が高くなる。活性の高いRNAは、単独では茶抽出物中で不安定であり、カテキンと複合化しやすい傾向にあるため、茶抽出物中に質量比(EGC/EGCG)が2以上の状態で存在するEGC及びEGCGと複合体を形成すると推測される。そして、この複合体がマクロファージの貪食作用を活性化させるため、優れた免疫賦活剤が得られる。特に、4℃以上20℃以下、好ましくは4℃以上10℃以下、より好ましくは約4℃の水を用いることで、茶多糖類と活性の高いRNAとの複合体により奏されるマクロファージの貪食作用活性の効果が高まる。
【0049】
本工程において、茶葉から茶抽出物を抽出する時間(抽出時間)は特に限定されないが、1時間以上24時間以内であることが好ましい。抽出時間が1時間以上であれば、EGC、EGCGを充分な量抽出しやすく、EGC/EGCGを3以下に抑えやすいため好ましい。抽出時間が4時間以内であればEGCに遅延してEGCGが抽出されることを防ぎやすいため好ましい。
【0050】
抽出溶媒としては、有効物質が水溶性の点で水を単独で使用することが好ましいが、本発明の効果を害さない範囲で、抽出溶媒である水に水以外の溶媒を含有させて用いることができる。水以外の溶媒としては、例えば、メタノール、エタノール、プロパノール等の極性有機溶媒が挙げられる。また、酸化重合等によるカテキン類の減少を防ぐ為にアスコルビン酸等の抗酸化性物質を添加してもよい。
【0051】
抽出に用いる抽出溶媒の量は、特に限定されず、使用する茶葉の種類、茶葉の量等によって、適宜好ましい量に設定できるが、茶葉(質量)の10倍量以上40倍量以下の抽出溶媒を用いることが、充分な溶出率を得られるという理由で好ましい。
【0052】
なお、茶葉から茶抽出物を得る具体的な抽出手順は特に限定されず、静置抽出、振とう抽出、抽出機を用いた抽出等従来公知の方法に従ってよい。
【0053】
次いで、免疫賦活剤製造工程について説明する。免疫賦活剤製造工程では、上記の茶抽出物製造工程で得られた茶抽出物から免疫賦活剤を製造する。
【0054】
本工程で得る免疫賦活剤の剤型としては、液剤、散剤、顆粒、錠剤、糖衣錠、カプセル、トローチ剤、シロップ剤等が挙げられる。目的となる剤型に応じて、茶抽出物を従来公知の方法で加工することにより、所望の剤型の免疫賦活剤を得ることができる。
【0055】
また、本工程では、茶抽出物又は茶抽出物を粉末化等させたものを、飲食品、医薬品、医薬部外品、動物用飼料に含有させてもよい。茶抽出物等の飲食品等への添加は、特に限定されず従来公知の方法で行うことができる。
【0056】
<免疫賦活力を増進する方法>
本発明の免疫賦活力を増進する方法は、EGC、EGCGの質量比を調整することで茶抽出物の免疫賦活力を増進する。従来からカテキン類の中には免疫賦活作用を有するもの、免疫抑制作用を有するものが知られているが、特定のカテキン、特定のカテキンの組み合わせが免疫賦活作用、免疫抑制作用を有することが知られているのみである。どのカテキンをどのような組み合わせで使用すれば、免疫賦活力が増進するかについて知られていなかったため、免疫賦活力を増進させるためには無数の組み合わせを検討する必要があり、多大な時間と手間がかかっていた。本発明者は、EGCとEGCGの質量比を調整することで、マクロファージ貪食作用を活性化できること、IgAの産生を促進できることを見出した。本発明によれば、EGCとEGCGの質量比を調整するという容易な工程で、茶抽出物の免疫賦活力を増進することができる。
【0057】
EGCとEGCGの質量比を調整する方法は、特に限定されないが、例えば、使用する茶葉、茶抽出物の抽出条件(抽出温度、抽出時間等)を調整すればよい。また、例えば、質量比(EGC/EGCG)が1の茶抽出物にEGCを添加する方法、質量比(EGC/EGCG)が1.5の茶抽出物にEGCを添加する方法、質量比(EGC/EGCG)が2の茶抽出物にEGCを添加する方法、質量比(EGC/EGCG)が3の茶抽出物にEGCを添加する方法、質量比(EGC/EGCG)が4の茶抽出物にEGCGを添加する方法、質量比(EGC/EGCG)が3の茶抽出物にEGCGを添加する方法等、茶抽出物にEGC、EGCG等のカテキンを添加する方法でも調整可能である。
【0058】
茶抽出物中のEGCの質量をEGCGの質量に対して増加させることで、茶抽出物の免疫賦活力は増進される。免疫賦活力が増進されるEGCとEGCGの好ましい質量比等は、上記の免疫賦活剤の発明で説明したものと同様であるため、説明を省略する。
【0059】
本発明の方法においては、EGC及びEGCGの少なくとも一部を核酸と複合体の状態で存在させることにより、茶抽出物の免疫賦活力をさらに増進することができる。本発明者は、質量比(EGC/EGCG)が2以上で茶抽出物中に含まれるEGCと核酸、EGCGと核酸が複合体を形成することで、マクロファージの貪食作用が活性化される点を見出した。本発明の方法によれば、EGCと核酸、EGCGと核酸とが複合体の状態で茶抽出物中に存在することで、容易に茶抽出物の免疫賦活力を増進することができる。
【0060】
EGCと核酸とを複合体の状態にする方法、EGCGと核酸とを複合体の状態にする方法は、特に限定されない。通常、茶葉から抽出された核酸は、茶抽出物中で不安定であり、カテキンと核酸とは複合化しやすいため、特別な操作を行わなくても、カテキンと核酸とが混合した状態にあれば、カテキンと核酸とは複合化すると推測される。
【0061】
核酸、複合体等については、本発明の免疫賦活剤で説明したものと同様であるため説明を省略する。
【実施例】
【0062】
以下、本発明の実施例について説明するが、この実施例は現時点で最良と考えられるデータ等を挙げたものである。したがって、本発明はこの実施例に限定されるものではない。
【0063】
<評価A>
[実施例1A〜3A、比較例1A]
評価Aで使用したEGC、EGCGは、茶から分離して得られたカテキンであり、茶に含まれる活性の高いssRNAは含まない。評価Aでは培養液中のEGCとEGCGの合計が100μg/mLになるように、実施例1A〜3A、比較例1Aを表1に示すように調製した。
【表1】

【0064】
[貪食作用活性化の評価]
実施例1A〜3A、比較例1Aの免疫賦活剤について、マクロファージの貪食作用の活性化評価を行った。具体的には以下の方法で行った。
10%FBS及び120nmolカルシトリオールを含有させたRPMI1640培地でHL−60細胞を7日以上培養し、48wellプレートに2.5×105cells/well/250μLになるよう分取した。分取した細胞を37℃に加温し、濃度調整したYG蛍光ビーズを25μLずつ加え、さらに実施例1A〜3A及び比較例1A〜4Aの免疫賦活剤を25μL(培養液中で必要な濃度の12倍量濃度。例えばEGCを培養液中で50μg/mLにしたい場合は600μg/mL濃度のEGCを25μL添加する。)添加し、シェイカー(1100rpm、30秒)で混和した。37℃、5%CO2の環境下で16時間培養し、培養終了後、2%ホルムアルデヒドを用いて細胞を固定し、フローサイトメーター(FCM(FL1);BeckmanCoulter製)にて蛍光ビーズから貪食した細胞を測定した。結果は、総細胞数に対する蛍光ビーズ貪食細胞数の比を、対照品を100%として相対値で表し、対照品より高い値を示すものを活性ありとし、対照品との有意差検定にはPaired−t−teatを用いた。評価結果を図1に示した。なお、対照品には滅菌水(DW)を用いた。
【0065】
図1の結果から明らかなように、EGCとEGCGの質量比(EGC/EGCG)が2以上であれば、マクロファージの貪食作用が活性化されることが確認された。
【0066】
<評価B>
[実施例1B〜3B、比較例1B〜6B]
評価Bでは、EGC、EGCGの質量比(EGC/EGCG)を、以下の表2に記載される通り調製した。使用したEGC、EGCGは評価Aで使用したものと同様である。
【0067】
【表2】

【0068】
実施例1B〜3B及び比較例1B〜6Bについて、IgAの産生促進効果の評価を行った。具体的には以下の方法で行った。
使用動物は、BALB/cマウス雌7週齢で、24℃、60%湿度のコンベンショナル環境下で飼育した。明期は7:00−19:00、暗期は19:00−7:00までとし、飼料と水はマウスに自由に摂取させた。マウスには、2週間連続で、1日1回1mL(EGC、EGCGの総量1mg相当)の実施例及び比較例の免疫賦活剤、対照品のDWを経口投与した。屠殺後、小腸からパイエル板を分離し、注射器用プランジャーの底を利用して潰し、パイエル板細胞を得た。パイエル板細胞をナイロンメッシュでろ過後、2回洗浄し、10%非働化FBS含有のRPMI1640培養液に浮遊させ、96ウエルプレートに5×105cells/200μLとなるように播種し、37℃、5%CO2インキュベータ内で5日間培養した。5日後、細胞上清中のIgA含量をELISA法で測定した。(capture抗体:goat anti−mouse IgA (Zymed)、1000倍希釈, blocking:1%BSA,detect抗体:goat anti−mouse IgA horseradish peroxidase conjugates (Zymed)、2000倍希釈、ABTS溶液で発色、1.5%シュウ酸で反応停止)。IgAは免疫賦活の指標として使用した。評価結果は図2に示した。なお、効果はDWの効果を100%としたときの、それぞれの効果を%で表した。
【0069】
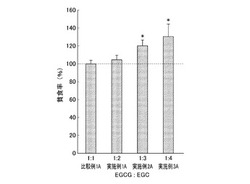
図2から明らかなように、EGCとEGCGの質量比(EGC/EGCG)が2以上3以下の範囲にあれば、IgAの産生が促進されることが確認された。
評価A、Bの結果から明らかなように、EGCとEGCGの質量比(EGC/EGCG)が2以上3以下であれば、マクロファージの貪食作用を活性化するとともにIgAの産生も促進する。したがって、EGCとEGCGの質量比(EGC/EGCG)が2以上3以下の免疫賦活剤であれば、さらに優れた免疫賦活剤になる。
【0070】
<評価C>
[実施例1C]
幼葉から茶抽出物を抽出した。抽出条件は以下の通りである。
幼葉としてはやぶきた緑茶の芽(心)から三葉を用い、抽出溶媒としては4℃の水を茶葉の質量に対して10倍量用い、抽出時間は60分とした。
上記の方法で得られた茶抽出物から茶多糖類をエタノール沈殿法で抽出した。得られた茶多糖類を実施例1Cとした。なお、後述する通り、茶多糖類には、ssRNAが含まれている。
【0071】
[実施例2C]
成熟葉から茶抽出物を抽出した。抽出条件は幼葉の代わりに成熟葉(四〜五葉)を用いた以外は、実施例1Cと同様である。また、実施例1Cと同様にして茶抽出物から茶多糖類を抽出した。
【0072】
[比較例1C]
緑茶の茎から茶抽出物を抽出した。抽出条件は幼葉の代わりに緑茶の茎を用いた以外は、実施例1Cと同様である。また、実施例1Cと同様にして緑茶の茎の抽出物から茶多糖類を抽出した。なお、緑茶の茎は実施例1C、2Cで使用したものと同じ品種の茶の茎である。
【0073】
実施例1C、2C、比較例1Cについて、マクロファージの貪食作用の活性化評価を行った。具体的には評価Aと同様の方法で行った。
【0074】
実施例1C、2C、比較例1Cについて、分子量分画カラムを用いたHPLC分析を行った。茶多糖類の分析結果を図4(a)に示し、RNAの分析結果は図4(b)に示した。なお、分析条件は以下の通りである。
装置 :Shimadzu LC−10 system (LC solution)
カラム :Shodex OHpak SB−806 M HQ column
溶離液 :DW
検出器 :茶多糖類については示差屈折率検出器(商品名「RID−10A」、島津製作所社製)
RNAについてはUV検出器(商品名「SPD−M10Avp」、島津製作所社製)
流速 :1mL/min
カラム温度:25℃
注入量 :10μL
【0075】
実施例1C、2C、比較例1Cについて、エチジウムブロマイド染色による核酸量の測定を行った。測定結果を図5(a)に示した。なお、多糖の濃度が10mg/mLの水溶液を用い、測定はアガロースゲル電気泳動で行った。
【0076】
実施例1Cについて、茶多糖類をDNase(ssDNA及びdsDNA分解酵素、タカラバイオ社製)、RNase(ssRNA特異的分解酵素、ニッポン・ジーン社製)で処理して核酸がssRNAであることを確認した。確認はアガロースゲル電気泳動で行った。確認結果を図5(b)に示した。
【0077】
図3に示される通り、幼葉から抽出した茶多糖類は、貪食作用の活性化効果に優れることが確認された。そして、図4(a)から明らかなように、実施例1C(図4(a)中のI)、2C(図4(a)中のII)、比較例1C(図4(a)中のIII)では、茶多糖類の分子量分布にほとんど差が無いことが確認された。これに対して、図4(b)の結果から明らかなように、ssRNAの量は実施例1C(図4(b)中のI)が最も多く、次いで、実施例2C(図4(b)中のII)、比較例1C(図4(b)中のIII)の順で多い。ssRNAは抽出物中で不安定であり、また、茶多糖類と複合化しやすい性質を有しているため、図4(a)に示される実施例1C、2C、比較例1Cにおける貪食作用を活性化する効果の差は、ssRNAと茶多糖類との複合体の量に関係していることが確認された。
【0078】
<評価D>
[実施例1D]
実施例1Cと同様の方法で茶多糖類を抽出した。抽出物を実施例1Dとした。
【0079】
[比較例1D]
抽出温度を100℃に変更した以外は、実施例1Cと同様の方法で茶多糖類を抽出した。抽出物を比較例1Dとした。
【0080】
実施例1D、比較例1Dについて、マクロファージの貪食作用の活性化評価を行った。具体的には評価Cと同様の方法で行った。評価結果を図6に示した。
【0081】
図6(a)に示される通り、茶葉から低温の水を用いて得た抽出物から取り出した茶多糖類とRNAとの複合体は、高温の水を用いた場合と比較して、高い貪食作用の活性化効果を示した。
【0082】
図6(b)には、茶の品種をやぶきたからさえみどりに変更した以外は、上記評価Dと同様の方法で、マクロファージの貪食作用の活性化評価を行った結果を示す。図6(a)、(b)から、マクロファージの貪食作用の活性化効果は、茶の品種によらず奏することが確認された。
【0083】
<評価E>
[実施例1E〜3E、比較例1E〜6E]
やぶきた緑茶の芽(心)から四葉までの葉を用い、抽出溶媒としては4℃の水を茶葉の質量に対して40倍量用い、抽出時間は60分として、実施例1E茶抽出物を作製した。実施例2E〜3E、比較例1E〜6Eについても表3に示す抽出温度、抽出時間の条件で同様に行った
【0084】
【表3】

【0085】
実施例1E〜3E、比較例1E〜5Eについて、含有するカテキンの種類及び各カテキンの含有率(mg/100ml)について、HPLC分析で評価した。評価結果を図7(a)に示した。なお、分析条件は以下の通りである。
(分析条件)
上記抽出液をDWで10倍希釈し、以下の分析条件で測定した。
装置 :Shimadzu LC−10 system(LC solution)
ガードカラム:Wakopak Navi C18−5 (4.6*10)
カラム :Wakopak Navi C18−5 (4.6*150)
溶離液 :移動相A:DW:アセトニトリル:リン酸を体積比で400:10:1
移動相B:メタノール:移動相Aを体積比で1:2
検出器 :SPD−M10Avp(242nm,EGC; 272nm,EGCG,ECG,+C,EC;、島津社製)
流速 :1mL/min
カラム温度 :40℃
注入量 :20μL
グラジェント:表4に示す
【表4】

【0086】
上記評価結果において、EGC及びEGCGのみに着目し、抽出温度とEGCの抽出量及びEGCGの抽出量との関係を確認した。確認結果を図7(b)に示した。
【0087】
実施例1E、比較例6Eについて、IgAの産生性を促進する作用の比較を行った。IgAの産生性の評価は、評価Bと同様の方法で行った。結果を図8に示した。
【0088】
図7(b)から明らかなように、抽出溶媒の温度が30℃以下の範囲であれば、質量比(EGC/EGCG)が2以上になる。図1から確認できる通り、質量比(EGC/EGCG)が2以上であれば、マクロファージの貪食作用を活性化する効果が高い。したがって、抽出溶媒の温度を30℃以下の範囲に設定することで、マクロファージの貪食作用を活性化する効果に優れた茶抽出物が得られる。
【0089】
また、抽出溶媒の温度が4℃以上30℃以下の範囲であれば、質量比(EGC/EGCG)がほぼ3以下である。図2から明らかなように、質量比(EGC/EGCG)がほぼ2以上3以下であれば、IgAの産生を促進する効果が高い。したがって、抽出溶媒の温度を4℃以上30℃以下の範囲に設定することで、IgAの産生性を高める効果に優れた茶抽出物が得られる。そして、抽出溶媒の温度が4℃以上20℃以下の範囲であれば、質量比(EGC/EGCG)が約2以上約3以下になる。図3から明らかなように、質量比(EGC/EGCG)が3に近づくほど、IgAの産生を促進する効果が高まるので、抽出溶媒の温度を4℃以上20℃以下の範囲に設定することが好ましいことが確認された。
【0090】
また、図6に示される通り、茶葉から低温の水を用いて得た抽出物から取り出した高分子の茶多糖類とRNAとの複合体は、高温の水を用いた場合と比較して、高い貪食作用の活性化効果を示す。したがって、抽出溶媒の温度を低温にすることで、マクロファージの貪食作用もIgA産生促進作用も極めて高いことが確認された。
【0091】
<評価F>
被験者に、下記試験食を1日2回(朝(朝食後)・晩(夕食後))摂取させた。試験食摂取前の14日間と試験食摂取中の17日間の計31日間、ほぼ毎日、同時刻(15時頃)に被験者の唾液を採取した。唾液中の分泌型IgA含量を、ELISA法で測定した。具体的な測定方法は下記の通りである。なお、採取した唾液は、専用チューブ(Salimetrics社製)に入れて、測定まで−20℃で保存した。
【0092】
[試験食]
試験食として、700mgの煎茶水抽出液乾燥物を用いた。煎茶水抽出液乾燥物700mgは、水溶性多糖約40mg(ssRNAを約16質量%含む)、総カテキン90mg(うち約30mgがEGC、約15mgがEGCG)を含む。
【0093】
煎茶水抽出液乾燥物の製造は、以下の方法で行った。原料として緑茶葉の幼葉を用い、抽出溶媒として4℃の水を茶葉の質量に対して33倍量用い、抽出時間を60分とする条件で、茶抽出物を製造した。この茶抽出物を粉末化することで煎茶水抽出乾燥物を得た。
【0094】
[分泌型IgA含量の測定]
捕捉抗体であるGoat anti−human 分泌型IgA(Cappel社製)を50mMの炭酸緩衝溶液で1000倍に希釈し、96穴マイクロプレート(住友ベークライト株式会社製、「MS−8896F」)の各穴に、希釈した捕捉抗体を100μlずつ入れ4℃で一晩静置した。静置後各穴を、0.05%のTweenを含むPBS(リン酸緩衝食塩水)溶液を用いて洗浄し、1%ウシ血清アルブミン溶液(1%BSA溶液)でブロッキングした。
【0095】
唾液、又は標準溶液であるPurified Human分泌型IgA(Cappel社製)を、各穴に100μl入れ37℃で1時間静置した。静置後各穴を、0.05%のTweenを含むPBS溶液を用いて洗浄した。
【0096】
洗浄後の各穴に、検出抗体であるgoat anti−human 分泌型IgA horseradish peroxidase conjugates(Cappel社製)を1%BSA溶液で2000倍に希釈したものを、100μlずつ入れ37℃で1時間静置した。静置後各穴を、0.05%のTweenを含むPBS溶液を用いて洗浄した。
【0097】
洗浄後の各穴に、ABTS溶液(2,2’−アジノビス(3−エチルベンゾチアゾリン−6−スルホン酸をクエン酸緩衝液で20倍に希釈した溶液)を100μlずつ入れ、7分間反応させた。その後、各穴に1.5%のシュウ酸を100μlずつ入れ、反応を停止させた。
【0098】
415nmでの吸光度をプレートリーダー(Bio−Rad社製)にて測定し、標準試料から作製した校正曲線に照らして、唾液中の分泌型IgA含量を算出した。なお、分泌型IgA含量とは、唾液1mlあたりの分泌型IgAの含量を指す。
【0099】
被験者から採取した唾液中の分泌型IgA含量の変化をグラフにし図9に示した。グラフ中のAVE(破線)は、試験食摂取前の14日間の唾液中の分泌型IgA含量の平均を表す。グラフ中のSD(実線(細線))は、試験食摂取前の14日間の唾液中の分泌型IgA含量の標準偏差を表す。グラフ中の2SD(実線(太線))は、試験食摂取前の14日間の唾液中の分泌型IgA含量の標準偏差の2倍を表す。
【0100】
図9のグラフから、試験食の連続摂取により、唾液中に含まれる分泌型IgA含量が上昇することが確認された。また、試験食摂取前と摂取中とで、ウェルチのt検定を行なったところ、p値は0.028であった。なお、他の被験者3名についても同様の評価を行なったところ、試験食摂取により唾液中の分泌型IgA含量が上昇する結果が得られた。また、これら3名の分泌型IgA含量の変化の傾向は、図9に示されるものと同様であった。
【技術分野】
【0001】
本発明は、免疫賦活剤、当該免疫賦活剤の製造方法及び茶抽出物の免疫賦活力を増進する方法に関する。
【背景技術】
【0002】
病気予防に関する予防医学という概念が知られており、最近の予防医学において、免疫機能が特に注目されている。免疫機能は生体の恒常性維持に役立っており、この免疫機能を向上させて病気を予防しようという提案がなされている。例えば基礎免疫機能を向上させることにより種々の感染症にかからないようにしたり、非特異的な免疫機能を向上させることにより癌や種々の抗原・微生物・ウイルス等を排除するようにしたり、初期免疫機能を向上させることで、免疫機能全体の改善や、免疫機能の調節、さらに特異的免疫機能のバランスを改善したり、異常な免疫作用によって引き起こされる種々の病態、例えば花粉症、アトピー、自己免疫疾患等を予防又は治療しようとする試みが行われている。
【0003】
病気予防のための免疫機能の向上には、免疫賦活作用を有する免疫賦活剤が使用される。免疫賦活剤としては、天然由来のものが望まれている。日常的に摂取することが可能であり、副作用の心配が少ないという点で、天然由来のものが望まれている。
【0004】
免疫賦活作用を有する天然由来の物質として、茶由来成分が知られている。例えば、特許文献1には、ヒト末梢血単核球のIgA産生増強作用をもつ分子量1万以上の茶葉多糖類が開示されている。特許文献2には、IgA産生増強、IgG産生増強作用をもつ茶葉カテキン類が開示されている。特許文献3には、ケール加工物と茶を複合したマクロファージ増強剤が開示されている。特許文献4には、大麦若葉と茶を複合したマクロファージ増強剤が開示されている。
【先行技術文献】
【特許文献】
【0005】
【特許文献1】特開2005−239571号公報
【特許文献2】特開2005−232115号公報
【特許文献3】特開2002−209552号公報
【特許文献4】特開2002−065206号公報
【特許文献5】特開2002−255811号公報
【特許文献6】特開2004−075666号公報
【発明の概要】
【発明が解決しようとする課題】
【0006】
しかし、茶に含まれるカテキン類は免疫抑制作用を有する場合もあることが知られている(例えば、特許文献5、6)。このように茶由来成分の機能としては、免疫賦活作用及び免疫抑制作用が知られているが、いかなる場合にいずれの機能を奏するかは不明である。
【0007】
本発明は、以上の課題を解決するためになされたものであり、その目的は、茶由来の成分を含み、優れた免疫賦活作用を有する免疫賦活剤、当該免疫賦活剤の製造方法、及び茶抽出物の免疫賦活力を増進する方法を提供することにある。
【課題を解決するための手段】
【0008】
本発明者らは、エピガロカテキンとエピガロカテキンガレートとの質量比が免疫賦活活性と高い相関を有することを見出し、本発明を完成するに至った。より具体的には、本発明は以下のものを提供する。
【0009】
(1) エピガロカテキンとエピガロカテキンガレートとを含み、質量比(エピガロカテキン/エピガロカテキンガレート)が2以上である免疫賦活剤。
【0010】
(2) 前記質量比は2以上3以下である(1)に記載の免疫賦活剤。
【0011】
(3) 前記エピガロカテキン及び前記エピガロカテキンガレートの少なくとも一部が核酸と複合体の状態で存在する(1)又は(2)に記載の免疫賦活剤。
【0012】
(4) 前記核酸がRNAである(3)に記載の免疫賦活剤。
【0013】
(5) さらに、高分子茶多糖類を含み、前記茶多糖類が核酸と複合体の状態で存在する(1)から(4)のいずれかに記載の免疫賦活剤。
【0014】
(6) さらに、茶抽出成分を含有する(1)から(5)のいずれかに記載の免疫賦活剤。
【0015】
(7) 貪食能増進剤、IgA産生促進剤の群から選ばれる少なくとも一種である(1)から(6)のいずれかに記載の免疫賦活剤。
【0016】
(8) 免疫賦活剤を製造する方法であって、Camellia sinensisに属する茶葉、Camellia taliensisに属する茶葉及びCamellia irrawadiensisに属する茶葉から選択される少なくとも一種の茶葉から−4℃以上30℃以下の抽出溶媒で茶抽出物を得る茶抽出物製造工程と、前記茶抽出物から免疫賦活剤を製造する免疫賦活剤製造工程と、を有する免疫賦活剤の製造方法。
【0017】
(9) 前記抽出溶媒が20℃以下の水である(8)に記載の免疫賦活剤の製造方法。
【0018】
(10) 前記茶抽出物製造工程において、抽出時間が1時間以上24時間以下である(8)又は(9)に記載の免疫賦活剤の製造方法。
【0019】
(11) 前記茶葉は、幼葉である(8)から(10)のいずれかに記載の免疫賦活剤の製造方法。
【0020】
(12) 茶抽出物中のエピガロカテキンとエピガロカテキンガレートとの、質量比を調整することにより茶抽出物の免疫賦活力を増進する方法。
【0021】
(13) さらに、前記エピガロカテキン及び前記エピガロカテキンガレートの少なくとも一部を核酸と複合体の状態で存在させる(12)に記載の茶抽出物の免疫賦活力を増進する方法。
【発明の効果】
【0022】
本発明の免疫賦活剤は、天然由来成分である特定のカテキンを含み、その特定のカテキンの組み合わせにより優れた免疫賦活作用を有する。このため、本発明の免疫賦活剤によれば、体内の免疫機能を充分に高めることができ、副作用の問題が少なく、効果的に病気にかかることを予防することができる。
【0023】
本発明の免疫賦活剤の製造方法は、茶葉から特定の種類のカテキンを特定の質量比で抽出できる。その結果、本発明の免疫賦活剤の製造方法によれば、優れた免疫賦活作用を有する免疫賦活剤を容易に製造できる。
【0024】
本発明の茶抽出物の免疫賦活力を増進する方法は、茶抽出物中のエピガロカテキンとエピガロカテキンガレートとの、質量比を調整することで、茶抽出物の免疫賦活力を容易に高めることができる。
【図面の簡単な説明】
【0025】
【図1】評価Aのマクロファージの貪食作用活性化評価結果を示す図である。
【図2】評価BのIgA産生促進評価結果を示す図である。
【図3】評価Cのマクロファージの貪食作用活性化評価結果を示す図である。
【図4】評価Cの分子量分画カラムを用いたHPLC分析結果を示す図である。
【図5】評価Cの核酸量の測定結果、核酸の種類の確認結果を示す図である。
【図6】評価Dのマクロファージの貪食作用活性化評価結果を示す図である。
【図7】評価Eのカテキンの種類の分析結果を示す図である。
【図8】評価EのIgA産生促進評価結果を示す図である。
【図9】評価Fの分泌型IgA含量の変化を示す図である。
【発明を実施するための形態】
【0026】
以下、本発明の実施形態について詳細に説明するが、本発明は、以下の実施形態に何ら限定されるものではなく、本発明の目的の範囲内において、適宜変更を加えて実施することができる。なお、説明が重複する箇所については、適宜説明を省略する場合があるが、発明の要旨を限定するものではない。
【0027】
以下、本発明について、免疫賦活剤、免疫賦活剤の製造方法、茶抽出物の免疫賦活力を増進する方法の順で説明する。
【0028】
<免疫賦活剤>
本発明の免疫賦活剤は、エピガロカテキン(EGC)とエピガロカテキンガレート(EGCG)とを含み、これらのカテキンの質量比(EGC/EGCG)が2以上である。これにより、本発明の免疫賦活剤は、マクロファージの貪食作用を活性化でき、マクロファージによるウイルス等の異物を取り込む効果を促進できる。そして、質量比(EGC/EGCG)が1の場合にはこれらのカテキンが核酸と複合体を形成してもマクロファージの貪食作用を充分には活性化しない。
【0029】
EGC、EGCGは、従来公知の茶等の天然物質に含まれる成分である。このため、本発明の免疫賦活剤は、副作用の問題が少なく、日常的に摂取することができる。
【0030】
EGC、EGCGとしては、茶等の天然物質から抽出したものを用いてもよいし、合成したものを用いてもよい。茶等の天然物質から抽出した場合には、EGC、EGCG以外の成分も含まれる可能性が高いが、EGCとEGCGの質量比が上記の範囲内であれば、本発明の効果を奏する。なお、本発明の免疫賦活剤においては、茶葉から抽出して得られたものを用いることが好ましい。茶葉にはEGC、EGCGの両者が含まれ、茶葉から所定の抽出条件で茶抽出物を得ることで、容易に所望のEGC、EGCGの混合物が得られるからであり、また、茶葉に含まれるRNAは、後述する通り、EGC及びEGCGと複合体を形成して、免疫賦活力の増進に寄与するからである。茶葉としては、例えば、Camellia sinensisに属する茶葉、Camellia taliensisに属する茶葉及びCamellia irrawadiensisに属する茶葉が挙げられる。
【0031】
上記質量比(EGC/EGCG)は、IgAの産生も促進できる点で3以下であることが好ましい。IgAは、強力な病原性をもつ微生物の腸管粘膜への結合を阻害する作用、細菌毒素と特異的に結合してその作用を不活化する作用、アレルゲンとして作用する食餌性の抗原と結合し消化管壁を通過することを防止してアレルギ−反応を抑制する作用等を有することが知られている。ただし、マクロファージの貪食作用を活性化する用途に着目すると、上記質量比は3以上であることが好ましい。
【0032】
本発明の免疫賦活剤に含まれるEGC及びEGCGは、EGC及びEGCGの少なくとも一部が核酸と複合体の状態で存在することが好ましい。これにより、マクロファージの貪食作用がさらに活性化できるため、本発明の免疫賦活剤はさらに優れる。
【0033】
免疫賦活剤に含まれるEGCとEGCGとの質量比(EGC/EGCG)と、複合体を形成するEGCとEGCGとの質量比(複合体の状態で存在するEGCの質量/複合体の状態で存在するEGCGの質量)とは、ほぼ等しいと推測される。
【0034】
ここで、複合体とは、EGC、EGCGと核酸とが化学的、電気的等の相互作用を介して挙動を共にする集合体を指し、必ずしも結合体である必要は無い。
【0035】
EGC、EGCGと複合化する核酸は、特に限定されないが、例えばRNA、DNAが挙げられる。これらの中でもRNAが好ましく、複合体の形成によるマクロファージの貪食作用活性化の効果がさらに高まる点で高分子茶多糖類に含まれるssRNAが最も好ましい。なお、核酸はEGC、EGCG等のカテキン類とともに茶葉から抽出してもよいし、EGC、EGCGを所定の質量比で含む混合物に核酸を外部から添加してもよい。なお、分子量分画カラムに通す条件は実施例に記載の条件とする。
【0036】
本発明の免疫賦活剤は、高分子茶多糖類をさらに含み、その高分子の茶多糖類が核酸と複合体を形成した状態で存在していることが好ましい。これにより、マクロファージの貪食作用を活性化する効果が高まる。核酸の種類、好ましい核酸は上記のものと同様である。なお、高分子の茶多糖類と核酸の複合体の存在は、茶多糖類を分子量分画カラムに通したときに検出されるピークの中で、最も大きなピークと同じ位置に核酸のピークが検出されることで確認できる。
【0037】
本発明では、上記成分の含有量は特に限定されないが、本発明の効果を充分に得るためには、EGCは40mg以上(より好ましくは60mg以上)含み、ssRNAを10質量%以上(より好ましくは15質量%以上)含む茶多糖類を5mg以上(より好ましくは15mg以上)含む組成物が好ましい。
【0038】
本発明の免疫賦活剤は、さらに茶抽出成分を含むことが好ましい。これにより、上記マクロファージの貪食作用を活性化する作用、IgAの産生を促進する作用が向上する。茶抽出成分としては、茶に含まれるEGC、EGCG以外のカテキン類、茶に含まれるアミノ酸、たんぱく質等が挙げられる。
【0039】
本発明の免疫賦活剤は、本発明の効果を害さない範囲であれば、上記以外の成分を含有してもよい。上記以外の成分としては、例えば、L−アスコルビン酸やアスコルビン酸ナトリウムのような酸化防止剤、香料、各種エステル類、有機酸類、有機酸塩類、無機酸類、無機酸塩類、無機塩類、色素類、乳化剤、保存料、調味料、甘味料、酸味料、果汁エキス類、野菜エキス類、花蜜エキス類、pH調整剤、品質安定剤等の添加剤が挙げられ、これらを単独、あるいは併用してもよい。
【0040】
本発明の免疫賦活剤の製造方法としては、特に限定されず、従来公知の方法で茶等の天然物質からEGC、EGCG等の各成分を単離してもよいし、各成分の一部又は全部を合成してもよいし、全ての所望成分を含む天然物質から成分を抽出することにより製造してもよい。全ての所望成分を含む天然物質から抽出する方法は、本発明の免疫賦活剤を容易に製造することができるため好ましい。その一例について、以下説明する。
【0041】
<免疫賦活剤の製造方法>
免疫賦活剤の製造方法は、茶抽出物製造工程と免疫賦活剤製造工程とを有する。以下、茶抽出物製造工程、免疫賦活剤製造工程の順で説明する。
【0042】
茶抽出物製造工程では、Camellia sinensisに属する茶葉、Camellia taliensisに属する茶葉及びCamellia irrawadiensisに属する茶葉から選択される少なくとも一種の茶葉から−4℃以上30℃以下の水で茶抽出物を得る。
【0043】
使用する茶葉は幼葉、成熟葉のいずれであってもよいが、カテキンや茶多糖類と複合体を形成する活性の高いRNA(例えば、ssRNA)を多く含み、免疫賦活剤の貪食作用をさらに高める点で、幼葉であることが好ましい。ここで言う幼葉とは、芽(心)から三葉までを指す。
【0044】
上記の茶葉について、種苗法に基づいて登録されている茶品種を例示すると、星野緑、おくゆたか、司みどり、たかねわせ、さとう早生、おくひかり、めいりょく、ふくみどり、いなぐち、寺川早生、みねかおり、みなみかおり、しゅんめい、さえみどり、茶中間母本農1号、ふうしゅん、みなみさやか、さわみずか、べにふうき、ほくめい、みねゆたか、松寿、摩利子、三重緑萌1号、あさのか、藤かおり、山の息吹、茶中間母本農2号、さがらひかり、さがらみどり、香駿、さがらかおり、さがらわせ、さきみどり、りょうふう、みどりの星、むさしかおり、りょくふう、茶中間母本農3号、成里乃、奥の山、はるみどり、つゆひかり、みえうえじま、そうふう、さいのみどり、みやまかおり、はるもえぎ、きら香、鳳春、展みょう、さやまかおり、さやまみどり、おくみどり、やまとみどり等が挙げられる。
【0045】
また、茶葉は、生葉であっても、萎凋処理等の前処理したものであってもよい。前処理は、不発酵、半発酵等の、いずれの方法によるものでもよい。半発酵茶までは単量体カテキンが残存しているという理由から不発酵茶、半発酵茶のいずれも使用できる。不発酵茶としては緑茶(煎茶、玉露、かぶせ茶、番茶、玉緑茶、碾茶、抹茶、ほうじ茶等)、半発酵茶としてはウーロン茶、包種茶等が挙げられる。本発明においては、単量体カテキンが生葉とほとんど変わらず保持されているという理由で緑茶、包種茶が好ましい。
【0046】
上記茶葉を、−4℃以上30℃以下の水を用いて抽出する。これにより、上記の茶葉からEGCを充分に抽出させつつ、EGCGの抽出を抑えることができる。その結果、茶抽出物に含まれる質量比(EGC/EGCG)は2以上になり、マクロファージの貪食作用が活性化され、茶抽出物は優れた免疫賦活剤になる。
【0047】
また、上記温度範囲の水を用いることで、茶抽出物に含まれるEGC、EGCGの質量比(EGC/EGCG)は、2以上3以下になりやすい。上記質量比が2以上3以下の範囲にあれば、IgAの産生も促進されるため、茶抽出物は優れた免疫賦活剤になる。特に、−4℃以上20℃以下の水で上記茶葉を抽出することで、上記質量比(EGC/EGCG)を3に近づけることができ、IgAの産生を促進する作用がさらに高まるため、さらに優れた免疫賦活剤が得られる。なお、0℃以上10℃以下の温度範囲の水を用いることが、より効果の高い免疫賦活剤を得る観点から最も好ましい。
【0048】
また、−4℃以上30℃以下の温度範囲の水を用いることで、茶葉から抽出されるRNAは活性が高くなる。活性の高いRNAは、単独では茶抽出物中で不安定であり、カテキンと複合化しやすい傾向にあるため、茶抽出物中に質量比(EGC/EGCG)が2以上の状態で存在するEGC及びEGCGと複合体を形成すると推測される。そして、この複合体がマクロファージの貪食作用を活性化させるため、優れた免疫賦活剤が得られる。特に、4℃以上20℃以下、好ましくは4℃以上10℃以下、より好ましくは約4℃の水を用いることで、茶多糖類と活性の高いRNAとの複合体により奏されるマクロファージの貪食作用活性の効果が高まる。
【0049】
本工程において、茶葉から茶抽出物を抽出する時間(抽出時間)は特に限定されないが、1時間以上24時間以内であることが好ましい。抽出時間が1時間以上であれば、EGC、EGCGを充分な量抽出しやすく、EGC/EGCGを3以下に抑えやすいため好ましい。抽出時間が4時間以内であればEGCに遅延してEGCGが抽出されることを防ぎやすいため好ましい。
【0050】
抽出溶媒としては、有効物質が水溶性の点で水を単独で使用することが好ましいが、本発明の効果を害さない範囲で、抽出溶媒である水に水以外の溶媒を含有させて用いることができる。水以外の溶媒としては、例えば、メタノール、エタノール、プロパノール等の極性有機溶媒が挙げられる。また、酸化重合等によるカテキン類の減少を防ぐ為にアスコルビン酸等の抗酸化性物質を添加してもよい。
【0051】
抽出に用いる抽出溶媒の量は、特に限定されず、使用する茶葉の種類、茶葉の量等によって、適宜好ましい量に設定できるが、茶葉(質量)の10倍量以上40倍量以下の抽出溶媒を用いることが、充分な溶出率を得られるという理由で好ましい。
【0052】
なお、茶葉から茶抽出物を得る具体的な抽出手順は特に限定されず、静置抽出、振とう抽出、抽出機を用いた抽出等従来公知の方法に従ってよい。
【0053】
次いで、免疫賦活剤製造工程について説明する。免疫賦活剤製造工程では、上記の茶抽出物製造工程で得られた茶抽出物から免疫賦活剤を製造する。
【0054】
本工程で得る免疫賦活剤の剤型としては、液剤、散剤、顆粒、錠剤、糖衣錠、カプセル、トローチ剤、シロップ剤等が挙げられる。目的となる剤型に応じて、茶抽出物を従来公知の方法で加工することにより、所望の剤型の免疫賦活剤を得ることができる。
【0055】
また、本工程では、茶抽出物又は茶抽出物を粉末化等させたものを、飲食品、医薬品、医薬部外品、動物用飼料に含有させてもよい。茶抽出物等の飲食品等への添加は、特に限定されず従来公知の方法で行うことができる。
【0056】
<免疫賦活力を増進する方法>
本発明の免疫賦活力を増進する方法は、EGC、EGCGの質量比を調整することで茶抽出物の免疫賦活力を増進する。従来からカテキン類の中には免疫賦活作用を有するもの、免疫抑制作用を有するものが知られているが、特定のカテキン、特定のカテキンの組み合わせが免疫賦活作用、免疫抑制作用を有することが知られているのみである。どのカテキンをどのような組み合わせで使用すれば、免疫賦活力が増進するかについて知られていなかったため、免疫賦活力を増進させるためには無数の組み合わせを検討する必要があり、多大な時間と手間がかかっていた。本発明者は、EGCとEGCGの質量比を調整することで、マクロファージ貪食作用を活性化できること、IgAの産生を促進できることを見出した。本発明によれば、EGCとEGCGの質量比を調整するという容易な工程で、茶抽出物の免疫賦活力を増進することができる。
【0057】
EGCとEGCGの質量比を調整する方法は、特に限定されないが、例えば、使用する茶葉、茶抽出物の抽出条件(抽出温度、抽出時間等)を調整すればよい。また、例えば、質量比(EGC/EGCG)が1の茶抽出物にEGCを添加する方法、質量比(EGC/EGCG)が1.5の茶抽出物にEGCを添加する方法、質量比(EGC/EGCG)が2の茶抽出物にEGCを添加する方法、質量比(EGC/EGCG)が3の茶抽出物にEGCを添加する方法、質量比(EGC/EGCG)が4の茶抽出物にEGCGを添加する方法、質量比(EGC/EGCG)が3の茶抽出物にEGCGを添加する方法等、茶抽出物にEGC、EGCG等のカテキンを添加する方法でも調整可能である。
【0058】
茶抽出物中のEGCの質量をEGCGの質量に対して増加させることで、茶抽出物の免疫賦活力は増進される。免疫賦活力が増進されるEGCとEGCGの好ましい質量比等は、上記の免疫賦活剤の発明で説明したものと同様であるため、説明を省略する。
【0059】
本発明の方法においては、EGC及びEGCGの少なくとも一部を核酸と複合体の状態で存在させることにより、茶抽出物の免疫賦活力をさらに増進することができる。本発明者は、質量比(EGC/EGCG)が2以上で茶抽出物中に含まれるEGCと核酸、EGCGと核酸が複合体を形成することで、マクロファージの貪食作用が活性化される点を見出した。本発明の方法によれば、EGCと核酸、EGCGと核酸とが複合体の状態で茶抽出物中に存在することで、容易に茶抽出物の免疫賦活力を増進することができる。
【0060】
EGCと核酸とを複合体の状態にする方法、EGCGと核酸とを複合体の状態にする方法は、特に限定されない。通常、茶葉から抽出された核酸は、茶抽出物中で不安定であり、カテキンと核酸とは複合化しやすいため、特別な操作を行わなくても、カテキンと核酸とが混合した状態にあれば、カテキンと核酸とは複合化すると推測される。
【0061】
核酸、複合体等については、本発明の免疫賦活剤で説明したものと同様であるため説明を省略する。
【実施例】
【0062】
以下、本発明の実施例について説明するが、この実施例は現時点で最良と考えられるデータ等を挙げたものである。したがって、本発明はこの実施例に限定されるものではない。
【0063】
<評価A>
[実施例1A〜3A、比較例1A]
評価Aで使用したEGC、EGCGは、茶から分離して得られたカテキンであり、茶に含まれる活性の高いssRNAは含まない。評価Aでは培養液中のEGCとEGCGの合計が100μg/mLになるように、実施例1A〜3A、比較例1Aを表1に示すように調製した。
【表1】

【0064】
[貪食作用活性化の評価]
実施例1A〜3A、比較例1Aの免疫賦活剤について、マクロファージの貪食作用の活性化評価を行った。具体的には以下の方法で行った。
10%FBS及び120nmolカルシトリオールを含有させたRPMI1640培地でHL−60細胞を7日以上培養し、48wellプレートに2.5×105cells/well/250μLになるよう分取した。分取した細胞を37℃に加温し、濃度調整したYG蛍光ビーズを25μLずつ加え、さらに実施例1A〜3A及び比較例1A〜4Aの免疫賦活剤を25μL(培養液中で必要な濃度の12倍量濃度。例えばEGCを培養液中で50μg/mLにしたい場合は600μg/mL濃度のEGCを25μL添加する。)添加し、シェイカー(1100rpm、30秒)で混和した。37℃、5%CO2の環境下で16時間培養し、培養終了後、2%ホルムアルデヒドを用いて細胞を固定し、フローサイトメーター(FCM(FL1);BeckmanCoulter製)にて蛍光ビーズから貪食した細胞を測定した。結果は、総細胞数に対する蛍光ビーズ貪食細胞数の比を、対照品を100%として相対値で表し、対照品より高い値を示すものを活性ありとし、対照品との有意差検定にはPaired−t−teatを用いた。評価結果を図1に示した。なお、対照品には滅菌水(DW)を用いた。
【0065】
図1の結果から明らかなように、EGCとEGCGの質量比(EGC/EGCG)が2以上であれば、マクロファージの貪食作用が活性化されることが確認された。
【0066】
<評価B>
[実施例1B〜3B、比較例1B〜6B]
評価Bでは、EGC、EGCGの質量比(EGC/EGCG)を、以下の表2に記載される通り調製した。使用したEGC、EGCGは評価Aで使用したものと同様である。
【0067】
【表2】

【0068】
実施例1B〜3B及び比較例1B〜6Bについて、IgAの産生促進効果の評価を行った。具体的には以下の方法で行った。
使用動物は、BALB/cマウス雌7週齢で、24℃、60%湿度のコンベンショナル環境下で飼育した。明期は7:00−19:00、暗期は19:00−7:00までとし、飼料と水はマウスに自由に摂取させた。マウスには、2週間連続で、1日1回1mL(EGC、EGCGの総量1mg相当)の実施例及び比較例の免疫賦活剤、対照品のDWを経口投与した。屠殺後、小腸からパイエル板を分離し、注射器用プランジャーの底を利用して潰し、パイエル板細胞を得た。パイエル板細胞をナイロンメッシュでろ過後、2回洗浄し、10%非働化FBS含有のRPMI1640培養液に浮遊させ、96ウエルプレートに5×105cells/200μLとなるように播種し、37℃、5%CO2インキュベータ内で5日間培養した。5日後、細胞上清中のIgA含量をELISA法で測定した。(capture抗体:goat anti−mouse IgA (Zymed)、1000倍希釈, blocking:1%BSA,detect抗体:goat anti−mouse IgA horseradish peroxidase conjugates (Zymed)、2000倍希釈、ABTS溶液で発色、1.5%シュウ酸で反応停止)。IgAは免疫賦活の指標として使用した。評価結果は図2に示した。なお、効果はDWの効果を100%としたときの、それぞれの効果を%で表した。
【0069】
図2から明らかなように、EGCとEGCGの質量比(EGC/EGCG)が2以上3以下の範囲にあれば、IgAの産生が促進されることが確認された。
評価A、Bの結果から明らかなように、EGCとEGCGの質量比(EGC/EGCG)が2以上3以下であれば、マクロファージの貪食作用を活性化するとともにIgAの産生も促進する。したがって、EGCとEGCGの質量比(EGC/EGCG)が2以上3以下の免疫賦活剤であれば、さらに優れた免疫賦活剤になる。
【0070】
<評価C>
[実施例1C]
幼葉から茶抽出物を抽出した。抽出条件は以下の通りである。
幼葉としてはやぶきた緑茶の芽(心)から三葉を用い、抽出溶媒としては4℃の水を茶葉の質量に対して10倍量用い、抽出時間は60分とした。
上記の方法で得られた茶抽出物から茶多糖類をエタノール沈殿法で抽出した。得られた茶多糖類を実施例1Cとした。なお、後述する通り、茶多糖類には、ssRNAが含まれている。
【0071】
[実施例2C]
成熟葉から茶抽出物を抽出した。抽出条件は幼葉の代わりに成熟葉(四〜五葉)を用いた以外は、実施例1Cと同様である。また、実施例1Cと同様にして茶抽出物から茶多糖類を抽出した。
【0072】
[比較例1C]
緑茶の茎から茶抽出物を抽出した。抽出条件は幼葉の代わりに緑茶の茎を用いた以外は、実施例1Cと同様である。また、実施例1Cと同様にして緑茶の茎の抽出物から茶多糖類を抽出した。なお、緑茶の茎は実施例1C、2Cで使用したものと同じ品種の茶の茎である。
【0073】
実施例1C、2C、比較例1Cについて、マクロファージの貪食作用の活性化評価を行った。具体的には評価Aと同様の方法で行った。
【0074】
実施例1C、2C、比較例1Cについて、分子量分画カラムを用いたHPLC分析を行った。茶多糖類の分析結果を図4(a)に示し、RNAの分析結果は図4(b)に示した。なお、分析条件は以下の通りである。
装置 :Shimadzu LC−10 system (LC solution)
カラム :Shodex OHpak SB−806 M HQ column
溶離液 :DW
検出器 :茶多糖類については示差屈折率検出器(商品名「RID−10A」、島津製作所社製)
RNAについてはUV検出器(商品名「SPD−M10Avp」、島津製作所社製)
流速 :1mL/min
カラム温度:25℃
注入量 :10μL
【0075】
実施例1C、2C、比較例1Cについて、エチジウムブロマイド染色による核酸量の測定を行った。測定結果を図5(a)に示した。なお、多糖の濃度が10mg/mLの水溶液を用い、測定はアガロースゲル電気泳動で行った。
【0076】
実施例1Cについて、茶多糖類をDNase(ssDNA及びdsDNA分解酵素、タカラバイオ社製)、RNase(ssRNA特異的分解酵素、ニッポン・ジーン社製)で処理して核酸がssRNAであることを確認した。確認はアガロースゲル電気泳動で行った。確認結果を図5(b)に示した。
【0077】
図3に示される通り、幼葉から抽出した茶多糖類は、貪食作用の活性化効果に優れることが確認された。そして、図4(a)から明らかなように、実施例1C(図4(a)中のI)、2C(図4(a)中のII)、比較例1C(図4(a)中のIII)では、茶多糖類の分子量分布にほとんど差が無いことが確認された。これに対して、図4(b)の結果から明らかなように、ssRNAの量は実施例1C(図4(b)中のI)が最も多く、次いで、実施例2C(図4(b)中のII)、比較例1C(図4(b)中のIII)の順で多い。ssRNAは抽出物中で不安定であり、また、茶多糖類と複合化しやすい性質を有しているため、図4(a)に示される実施例1C、2C、比較例1Cにおける貪食作用を活性化する効果の差は、ssRNAと茶多糖類との複合体の量に関係していることが確認された。
【0078】
<評価D>
[実施例1D]
実施例1Cと同様の方法で茶多糖類を抽出した。抽出物を実施例1Dとした。
【0079】
[比較例1D]
抽出温度を100℃に変更した以外は、実施例1Cと同様の方法で茶多糖類を抽出した。抽出物を比較例1Dとした。
【0080】
実施例1D、比較例1Dについて、マクロファージの貪食作用の活性化評価を行った。具体的には評価Cと同様の方法で行った。評価結果を図6に示した。
【0081】
図6(a)に示される通り、茶葉から低温の水を用いて得た抽出物から取り出した茶多糖類とRNAとの複合体は、高温の水を用いた場合と比較して、高い貪食作用の活性化効果を示した。
【0082】
図6(b)には、茶の品種をやぶきたからさえみどりに変更した以外は、上記評価Dと同様の方法で、マクロファージの貪食作用の活性化評価を行った結果を示す。図6(a)、(b)から、マクロファージの貪食作用の活性化効果は、茶の品種によらず奏することが確認された。
【0083】
<評価E>
[実施例1E〜3E、比較例1E〜6E]
やぶきた緑茶の芽(心)から四葉までの葉を用い、抽出溶媒としては4℃の水を茶葉の質量に対して40倍量用い、抽出時間は60分として、実施例1E茶抽出物を作製した。実施例2E〜3E、比較例1E〜6Eについても表3に示す抽出温度、抽出時間の条件で同様に行った
【0084】
【表3】

【0085】
実施例1E〜3E、比較例1E〜5Eについて、含有するカテキンの種類及び各カテキンの含有率(mg/100ml)について、HPLC分析で評価した。評価結果を図7(a)に示した。なお、分析条件は以下の通りである。
(分析条件)
上記抽出液をDWで10倍希釈し、以下の分析条件で測定した。
装置 :Shimadzu LC−10 system(LC solution)
ガードカラム:Wakopak Navi C18−5 (4.6*10)
カラム :Wakopak Navi C18−5 (4.6*150)
溶離液 :移動相A:DW:アセトニトリル:リン酸を体積比で400:10:1
移動相B:メタノール:移動相Aを体積比で1:2
検出器 :SPD−M10Avp(242nm,EGC; 272nm,EGCG,ECG,+C,EC;、島津社製)
流速 :1mL/min
カラム温度 :40℃
注入量 :20μL
グラジェント:表4に示す
【表4】

【0086】
上記評価結果において、EGC及びEGCGのみに着目し、抽出温度とEGCの抽出量及びEGCGの抽出量との関係を確認した。確認結果を図7(b)に示した。
【0087】
実施例1E、比較例6Eについて、IgAの産生性を促進する作用の比較を行った。IgAの産生性の評価は、評価Bと同様の方法で行った。結果を図8に示した。
【0088】
図7(b)から明らかなように、抽出溶媒の温度が30℃以下の範囲であれば、質量比(EGC/EGCG)が2以上になる。図1から確認できる通り、質量比(EGC/EGCG)が2以上であれば、マクロファージの貪食作用を活性化する効果が高い。したがって、抽出溶媒の温度を30℃以下の範囲に設定することで、マクロファージの貪食作用を活性化する効果に優れた茶抽出物が得られる。
【0089】
また、抽出溶媒の温度が4℃以上30℃以下の範囲であれば、質量比(EGC/EGCG)がほぼ3以下である。図2から明らかなように、質量比(EGC/EGCG)がほぼ2以上3以下であれば、IgAの産生を促進する効果が高い。したがって、抽出溶媒の温度を4℃以上30℃以下の範囲に設定することで、IgAの産生性を高める効果に優れた茶抽出物が得られる。そして、抽出溶媒の温度が4℃以上20℃以下の範囲であれば、質量比(EGC/EGCG)が約2以上約3以下になる。図3から明らかなように、質量比(EGC/EGCG)が3に近づくほど、IgAの産生を促進する効果が高まるので、抽出溶媒の温度を4℃以上20℃以下の範囲に設定することが好ましいことが確認された。
【0090】
また、図6に示される通り、茶葉から低温の水を用いて得た抽出物から取り出した高分子の茶多糖類とRNAとの複合体は、高温の水を用いた場合と比較して、高い貪食作用の活性化効果を示す。したがって、抽出溶媒の温度を低温にすることで、マクロファージの貪食作用もIgA産生促進作用も極めて高いことが確認された。
【0091】
<評価F>
被験者に、下記試験食を1日2回(朝(朝食後)・晩(夕食後))摂取させた。試験食摂取前の14日間と試験食摂取中の17日間の計31日間、ほぼ毎日、同時刻(15時頃)に被験者の唾液を採取した。唾液中の分泌型IgA含量を、ELISA法で測定した。具体的な測定方法は下記の通りである。なお、採取した唾液は、専用チューブ(Salimetrics社製)に入れて、測定まで−20℃で保存した。
【0092】
[試験食]
試験食として、700mgの煎茶水抽出液乾燥物を用いた。煎茶水抽出液乾燥物700mgは、水溶性多糖約40mg(ssRNAを約16質量%含む)、総カテキン90mg(うち約30mgがEGC、約15mgがEGCG)を含む。
【0093】
煎茶水抽出液乾燥物の製造は、以下の方法で行った。原料として緑茶葉の幼葉を用い、抽出溶媒として4℃の水を茶葉の質量に対して33倍量用い、抽出時間を60分とする条件で、茶抽出物を製造した。この茶抽出物を粉末化することで煎茶水抽出乾燥物を得た。
【0094】
[分泌型IgA含量の測定]
捕捉抗体であるGoat anti−human 分泌型IgA(Cappel社製)を50mMの炭酸緩衝溶液で1000倍に希釈し、96穴マイクロプレート(住友ベークライト株式会社製、「MS−8896F」)の各穴に、希釈した捕捉抗体を100μlずつ入れ4℃で一晩静置した。静置後各穴を、0.05%のTweenを含むPBS(リン酸緩衝食塩水)溶液を用いて洗浄し、1%ウシ血清アルブミン溶液(1%BSA溶液)でブロッキングした。
【0095】
唾液、又は標準溶液であるPurified Human分泌型IgA(Cappel社製)を、各穴に100μl入れ37℃で1時間静置した。静置後各穴を、0.05%のTweenを含むPBS溶液を用いて洗浄した。
【0096】
洗浄後の各穴に、検出抗体であるgoat anti−human 分泌型IgA horseradish peroxidase conjugates(Cappel社製)を1%BSA溶液で2000倍に希釈したものを、100μlずつ入れ37℃で1時間静置した。静置後各穴を、0.05%のTweenを含むPBS溶液を用いて洗浄した。
【0097】
洗浄後の各穴に、ABTS溶液(2,2’−アジノビス(3−エチルベンゾチアゾリン−6−スルホン酸をクエン酸緩衝液で20倍に希釈した溶液)を100μlずつ入れ、7分間反応させた。その後、各穴に1.5%のシュウ酸を100μlずつ入れ、反応を停止させた。
【0098】
415nmでの吸光度をプレートリーダー(Bio−Rad社製)にて測定し、標準試料から作製した校正曲線に照らして、唾液中の分泌型IgA含量を算出した。なお、分泌型IgA含量とは、唾液1mlあたりの分泌型IgAの含量を指す。
【0099】
被験者から採取した唾液中の分泌型IgA含量の変化をグラフにし図9に示した。グラフ中のAVE(破線)は、試験食摂取前の14日間の唾液中の分泌型IgA含量の平均を表す。グラフ中のSD(実線(細線))は、試験食摂取前の14日間の唾液中の分泌型IgA含量の標準偏差を表す。グラフ中の2SD(実線(太線))は、試験食摂取前の14日間の唾液中の分泌型IgA含量の標準偏差の2倍を表す。
【0100】
図9のグラフから、試験食の連続摂取により、唾液中に含まれる分泌型IgA含量が上昇することが確認された。また、試験食摂取前と摂取中とで、ウェルチのt検定を行なったところ、p値は0.028であった。なお、他の被験者3名についても同様の評価を行なったところ、試験食摂取により唾液中の分泌型IgA含量が上昇する結果が得られた。また、これら3名の分泌型IgA含量の変化の傾向は、図9に示されるものと同様であった。
【特許請求の範囲】
【請求項1】
エピガロカテキンとエピガロカテキンガレートとを含み、
質量比(エピガロカテキン/エピガロカテキンガレート)が2以上である免疫賦活剤。
【請求項2】
前記質量比は2以上3以下である請求項1に記載の免疫賦活剤。
【請求項3】
前記エピガロカテキン及び前記エピガロカテキンガレートの少なくとも一部が核酸と複合体の状態で存在する請求項1又は2に記載の免疫賦活剤。
【請求項4】
前記核酸がRNAである請求項3に記載の免疫賦活剤。
【請求項5】
さらに、高分子茶多糖類を含み、前記高分子茶多糖類が核酸と複合体の状態で存在する請求項1から4のいずれかに記載の免疫賦活剤。
【請求項6】
さらに、茶抽出成分を含有する請求項1から5のいずれかに記載の免疫賦活剤。
【請求項7】
貪食能増進剤、IgA産生促進剤の群から選ばれる少なくとも一種である請求項1から6のいずれかに記載の免疫賦活剤。
【請求項8】
免疫賦活剤を製造する方法であって、
Camellia sinensisに属する茶葉、Camellia taliensisに属する茶葉及びCamellia irrawadiensisに属する茶葉から選択される少なくとも一種の茶葉から−4℃以上30℃以下の抽出溶媒で茶抽出物を得る茶抽出物製造工程と、
前記茶抽出物から免疫賦活剤を製造する免疫賦活剤製造工程と、を有する免疫賦活剤の製造方法。
【請求項9】
前記抽出溶媒が20℃以下の水である請求項8に記載の免疫賦活剤の製造方法。
【請求項10】
前記茶抽出物製造工程において、抽出時間が1時間以上24時間以下である請求項8又は9に記載の免疫賦活剤の製造方法。
【請求項11】
前記茶葉は、幼葉である請求項8から10のいずれかに記載の免疫賦活剤の製造方法。
【請求項12】
茶抽出物中のエピガロカテキンとエピガロカテキンガレートとの、質量比を調整することにより茶抽出物の免疫賦活力を増進する方法。
【請求項13】
さらに、前記エピガロカテキン及び前記エピガロカテキンガレートの少なくとも一部を核酸と複合体の状態で存在させる請求項12に記載の茶抽出物の免疫賦活力を増進する方法。
【請求項1】
エピガロカテキンとエピガロカテキンガレートとを含み、
質量比(エピガロカテキン/エピガロカテキンガレート)が2以上である免疫賦活剤。
【請求項2】
前記質量比は2以上3以下である請求項1に記載の免疫賦活剤。
【請求項3】
前記エピガロカテキン及び前記エピガロカテキンガレートの少なくとも一部が核酸と複合体の状態で存在する請求項1又は2に記載の免疫賦活剤。
【請求項4】
前記核酸がRNAである請求項3に記載の免疫賦活剤。
【請求項5】
さらに、高分子茶多糖類を含み、前記高分子茶多糖類が核酸と複合体の状態で存在する請求項1から4のいずれかに記載の免疫賦活剤。
【請求項6】
さらに、茶抽出成分を含有する請求項1から5のいずれかに記載の免疫賦活剤。
【請求項7】
貪食能増進剤、IgA産生促進剤の群から選ばれる少なくとも一種である請求項1から6のいずれかに記載の免疫賦活剤。
【請求項8】
免疫賦活剤を製造する方法であって、
Camellia sinensisに属する茶葉、Camellia taliensisに属する茶葉及びCamellia irrawadiensisに属する茶葉から選択される少なくとも一種の茶葉から−4℃以上30℃以下の抽出溶媒で茶抽出物を得る茶抽出物製造工程と、
前記茶抽出物から免疫賦活剤を製造する免疫賦活剤製造工程と、を有する免疫賦活剤の製造方法。
【請求項9】
前記抽出溶媒が20℃以下の水である請求項8に記載の免疫賦活剤の製造方法。
【請求項10】
前記茶抽出物製造工程において、抽出時間が1時間以上24時間以下である請求項8又は9に記載の免疫賦活剤の製造方法。
【請求項11】
前記茶葉は、幼葉である請求項8から10のいずれかに記載の免疫賦活剤の製造方法。
【請求項12】
茶抽出物中のエピガロカテキンとエピガロカテキンガレートとの、質量比を調整することにより茶抽出物の免疫賦活力を増進する方法。
【請求項13】
さらに、前記エピガロカテキン及び前記エピガロカテキンガレートの少なくとも一部を核酸と複合体の状態で存在させる請求項12に記載の茶抽出物の免疫賦活力を増進する方法。
【図1】


【図2】


【図3】


【図4】


【図6】


【図7】


【図8】


【図9】


【図5】




【図2】


【図3】


【図4】


【図6】


【図7】


【図8】


【図9】


【図5】


【公開番号】特開2011−168579(P2011−168579A)
【公開日】平成23年9月1日(2011.9.1)
【国際特許分類】
【出願番号】特願2011−5654(P2011−5654)
【出願日】平成23年1月14日(2011.1.14)
【出願人】(501203344)独立行政法人農業・食品産業技術総合研究機構 (827)
【Fターム(参考)】
【公開日】平成23年9月1日(2011.9.1)
【国際特許分類】
【出願日】平成23年1月14日(2011.1.14)
【出願人】(501203344)独立行政法人農業・食品産業技術総合研究機構 (827)
【Fターム(参考)】
[ Back to top ]

