免疫賦活剤及び抗アレルギー剤並びにそれを含む食品、化粧品、医薬部外品及び動物飼料
【課題】中東において有用な食品とされてきたデーツについて、その生理的機能を明らかにするとともに、それに関与する成分について明らかにすることを目的とする。
【解決手段】ペラルゴニン及びフェルラ酸のいずれか1以上を主成分とすることを特徴とする免疫賦活剤である。また、プロトカテキュ酸、ペラルゴニン及びフェルラ酸のいずれか1以上を主成分とすることを特徴とする抗アレルギー剤である。また、デーツ由来のプロトカテキュ酸、ペラルゴニン、カフェ酸、フェルラ酸及びシリンガ酸のいずれか1以上が含まれていることを特徴とする食品、化粧品、医薬部外品及び動物飼料である。
【解決手段】ペラルゴニン及びフェルラ酸のいずれか1以上を主成分とすることを特徴とする免疫賦活剤である。また、プロトカテキュ酸、ペラルゴニン及びフェルラ酸のいずれか1以上を主成分とすることを特徴とする抗アレルギー剤である。また、デーツ由来のプロトカテキュ酸、ペラルゴニン、カフェ酸、フェルラ酸及びシリンガ酸のいずれか1以上が含まれていることを特徴とする食品、化粧品、医薬部外品及び動物飼料である。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、デーツに含有される機能性成分及びその機能性成分を含有する食品、化粧品、医薬部外品及び動物飼料に関する。
【背景技術】
【0002】
赤ワインや茶、リンゴ、ブルーベリー、ゴマなどに含まれるポリフェノール(polyphenol)は、近年、抗アレルギー作用、免疫賦活作用、動脈硬化や脳梗塞を防ぐ抗酸化作用、ホルモン促進作用等の機能性を有することから、食品分野など様々な分野で使用されている。
【0003】
例えば、特許文献1には、ブドウの種子及び/又は果皮を原料とし、ブドウの乳酸発酵物を有効成分として含有する抗アレルギー組成物が記載されている。特許文献1においては、ブドウに含まれるポリフェノール類や糖類が、乳酸発酵により、配糖体が切断されたり、有機酸が結合する等の要因により、より多く体内へ吸収され、ポリフェノール類による生理活性効果が高まり、IgEが関与するI型アレルギー反応を効果的に抑制でき、花粉アレルギーなどの様々なI型アレルギー性疾患の発症を予防したり、その症状を緩和ないし治療ができることが記載されている。また、例えば、特許文献2には、ホップの組織の冷水抽出物からなる抗アレルギー組成物が記載されている。特許文献2に記載の抗アレルギー組成物は、ヒスタミン遊離抑制作用を有し、抽出方法も特殊な必要はなく冷水で行うために、副作用を生じるおそれが少なく、人体や皮膚に緩和な抗アレルギー組成物として適用でき、抗アレルギー剤として使用できることが記載されている。
【0004】
一方、ナツメヤシの果実であるデーツは、砂漠で生育でき、乾燥地帯に多く栽培ができるため「生命の樹」と呼ばれ、中東や北アフリカが主なる原産地で、中東はじめヨーロッパ等で多く食されている。デーツは古代メソポタミアやエジプトの壁画にも描かれている古代5000年以上前から食されていた最古の果実である。デーツは果糖・ブドウ糖が主なる成分で、さらにミネラルや食物繊維が豊富で栄養価の高い食品と考えられている。
【先行技術文献】
【特許文献】
【0005】
【特許文献1】特開2010−280602号公報
【特許文献2】国際公開第2006/093194号
【発明の概要】
【発明が解決しようとする課題】
【0006】
しかしながら、デーツは、その生理的機能についてはほとんど知られておらず、特に果実特有のポリフェノールの生理的機能や多糖としてのβ−グルカンの生理的機能が解明されていないという問題がある。
【0007】
本発明は、上記問題点に鑑みてなされたものであり、中東において有用な食品とされてきたデーツについて、その生理的機能を明らかにするとともに、それに関与する成分について明らかにすることを目的とする。
【課題を解決するための手段】
【0008】
本発明者らは、以上の目的を達成するために、鋭意検討した結果、デーツ抽出物に含まれるプロトカテキュ酸、ペラルゴニン、カフェ酸、クロロゲン酸、フェルラ酸及びシリンガ酸が免疫賦活作用に優れていること、及びデーツ抽出物に含まれるプロトカテキュ酸、ペラルゴニン、カフェ酸、クロロゲン酸、フェルラ酸及びシリンガ酸が抗アレルギー作用に優れていることを見出した。すなわち、本発明は、ペラルゴニン及びフェルラ酸のいずれか1以上を主成分とすることを特徴とする免疫賦活剤であり、またプロトカテキュ酸、ペラルゴニン及びフェルラ酸のいずれか1以上を主成分とすることを特徴とする抗アレルギー剤である。
【発明の効果】
【0009】
以上のように、本発明によれば、デーツ抽出物より得られる免疫賦活剤及び抗アレルギー剤並びにそれを含む食品、化粧品、医薬部外品及び動物飼料を提供することができる。
【図面の簡単な説明】
【0010】
【図1】脾臓中のマクロファージ数を示すグラフである。
【図2】脾臓中のナチュラルキラー(NK)細胞数を示すグラフである。
【図3】デーツ抽出物分子量画分のIFN−γ mRNA発現への作用を示すグラフである。
【図4】デーツ抽出物のUPLCによるポリフェノールの解析を示すグラフである。
【図5】デーツ抽出物中に検出されたポリフェノールのIFN−γ mRNA発現への作用を示すグラフである。
【図6】鼻炎アレルギーモデルマウスにおけるデーツ抽出物の効果(くしゃみの回数)を示すグラフである。
【図7】鼻炎アレルギーモデルマウスにおけるデーツ抽出物の効果(鼻部引っかき行動の回数)を示すグラフである。
【図8】アトピー性皮膚炎モデルマウスにおけるデーツ抽出物の効果(アレルギースコア)を示すグラフである。
【図9】鼻炎アレルギーモデルマウスにおけるデーツ抽出物の効果(血中の抗体レベル)を示すグラフである。(a)総IgE量を示す。(b)抗原特異的IgE吸光度を示す。
【図10】鼻炎アレルギーモデルマウスにおけるデーツ抽出物の効果(脾臓中の免疫細胞(IgE産生細胞)数)を示すグラフである。
【図11】脾臓細胞培養系におけるデーツポリフェノールの効果(脾臓細胞中のIgE産生細胞数)を示すグラフである。
【図12】脾臓細胞培養系におけるデーツポリフェノールの効果(脾臓細胞中のTh2型細胞数)を示すグラフである。
【図13】鼻炎アレルギーモデルマウスにおけるデーツ抽出物の効果(脾臓中の免疫細胞(肥満細胞)数)を示すグラフである。
【図14】脾臓細胞培養系におけるデーツポリフェノールの効果(脾臓細胞中の肥満細胞数)を示すグラフである。
【図15】アトピー性皮膚炎モデルマウスにおけるデーツ抽出物の効果(アレルギー関連遺伝子の発現)を示すグラフである。
【図16】デーツ抽出物中に検出されたポリフェノールのITK mRNA発現への作用を示すグラフである。
【図17】デーツ抽出物中に検出されたポリフェノールのBTK mRNA発現への作用を示すグラフである。
【発明を実施するための形態】
【0011】
(原料デーツ及びその抽出物)
本発明に係る免疫賦活剤や抗アレルギー剤に用いられるプロトカテキュ酸、ペラルゴニン、カフェ酸、フェルラ酸及びシリンガ酸は、特に限定されないが、例えばデーツから抽出することが好ましい。原料となるデーツの生産地や品種は特に限定されず、生産地としては、例えば、エジプト、モロッコ、サウジアラビア、UAE、イラン、イラクなど中東・北アフリカの国々などが挙げられる。上記デーツは、ポリフェノール含量が他の果実に比べて多いという特徴を有している。
【0012】
デーツ抽出物の抽出方法は、特に限定されず、一般に公知の種々の方法が用いられる。例えば、デーツを刻み、抽出溶媒中に浸漬するかまたは抽出溶媒中で加熱還流し、次いでろ過、遠心分離等により不溶物を除去して抽出溶液を得ることができる。デーツの抽出に用いる溶媒は、通常のポリフェノール等の抽出に用いられる溶媒でよく、例えば、メタノール、エタノール等のアルコール、アセトン、酢酸エチル等の有機溶媒、水単独あるいは水と好ましくはエタノール等の他の溶媒との組み合わせ等を用いることができる。これらの抽出溶液は、凍結乾燥、またはスプレードライにより、抽出物にすることができる。
【0013】
デーツの水抽出物は、例えば、デーツを刻み、それを水に加えて煮沸して煮詰めることにより製造することができる。また、デーツを蒸留水に加えて放置すること、デーツを蒸留水に加え煮立たせた後放置することによっても製造することができる。これらの処理物は、次いで、ろ過、遠心分離等により不純物を除去して抽出溶液を得る。これらの抽出溶液は、凍結乾燥、またはスプレードライにより、粉末にすることができる。
【0014】
デーツ抽出物には、上述したように多量のポリフェノールが含まれているため、本発明においては、デーツの抽出の抽出物を免疫賦活剤又は抗アレルギー剤としてそのまま食品等に添加しても良い。また、デーツ抽出物をHPLCを使用して分画することによって免疫調節機能や生体調節機能にそれぞれ有効な物質を同定することができる。
【0015】
(免疫賦活剤)
本発明に係る免疫賦活剤は、デーツ由来のプロトカテキュ酸、ペラルゴニン、カフェ酸、フェルラ酸、シリンガ酸、クロロゲン酸のいずれか1以上が有効成分として含まれていることが好ましい。中でも、ペラルゴニン及びフェルラ酸のいずれか1以上を主成分とすることが特に好ましい。
【0016】
本発明において、その免疫賦活の評価は、NK細胞数を測定して行われ、デーツ由来のプロトカテキュ酸、ペラルゴニン、カフェ酸、フェルラ酸、シリンガ酸、クロロゲン酸のいずれか1以上により免疫賦活作用があることを解明した。
【0017】
生体の免疫システムには先天的な自然免疫と後天的に生じる獲得免疫の2種類があることが知られており、自然免疫を担当する細胞(マクロファージや樹状細胞等)は、外界からウイルスや病原細菌等が侵入すると、すばやくこれを探知し、食作用等の直接的な攻撃に加え、サイトカイン等の警戒シグナルを発して獲得免疫系を活性化する(抗原提示)といった感染防御の第一段階として機能している。例えば、マクロファージから分泌されるサイトカインの中で、インターロイキン12(以下、「IL−12」という場合がある。)は、ナチュラルキラー細胞(以下、「NK細胞」という場合がある。)やヘルパーT細胞に作用して、マクロファージを活性化するインターフェロン−γ(以下、「IFN−γ」という場合がある。)の産生を誘導する。一方、NK細胞もまた、自然免疫系に属し、上記IFN−γ産生作用のみならず、外界から侵入した異物である細菌やウイルス、また体内で異物化したがん細胞などを直接攻撃して破壊する。
【0018】
本発明に係る免疫賦活剤は、その中でもマクロファージ増加機能、ナチュラルキラー(NK)細胞増加機能、IFN−γ分泌増加機能のうち、少なくとも1以上の機能を有することが好ましい。
【0019】
(抗アレルギー剤)
本発明に係る抗アレルギー剤は、デーツ由来のプロトカテキュ酸、ペラルゴニン、カフェ酸、フェルラ酸、シリンガ酸、クロロゲン酸のいずれか1以上が有効成分として含まれていることが好ましい。中でも、プロトカテキュ酸、ペラルゴニン及びフェルラ酸のいずれか1以上を主成分とすることが特に好ましい。
【0020】
本発明において、その抗アレルギーの評価は、アレルギーモデルマウスへの経口投与試験により行われ、デーツ由来のプロトカテキュ酸、ペラルゴニン、カフェ酸、フェルラ酸、シリンガ酸、クロロゲン酸のいずれか1以上により抗アレルギー作用があることを解明した。
【0021】
花粉アレルギー(花粉症)、アレルギー性気管支喘息、アレルギー性鼻炎、アトピー性皮膚炎などのアレルギーは、アレルゲン特異的IgEの誘導に起因するI型アレルギーに分類される。I型アレルギー反応について詳しく説明すると、抗原の侵入に対してヘルパーT細胞(Th2型細胞)より分泌されるサイトカインの影響により、B細胞がIgE抗体を産生する。産生されたIgE抗体が肥満細胞(マスト細胞)や好塩基球に結合する。この状態で、再びアレルゲンが侵入すると、数分以内にマスト細胞や好塩基球からヒスタミンなどのメディエーターが遊離され(脱顆粒)、これらの働きにより気管支の収縮や蕁麻疹など様々なアレルギー症状を引き起こす。
【0022】
本発明に係る抗アレルギー剤は、その中でも血中の抗原特異的IgE減少機能、IgE産生細胞減少機能、Th2型細胞減少機能、肥満細胞減少機能、ヒスタミンの放出を促進する遺伝子抑制機能のうち、少なくとも1以上の機能を有することが好ましい。
【0023】
(免疫賦活剤及び抗アレルギー剤の用途)
本発明に係る免疫賦活剤及び抗アレルギー剤は、液剤、散剤、細粒剤、顆粒剤、カプセル剤、錠剤の形で経口投与されることが好ましい。
【0024】
投与量は、症状の程度、疾患の相違、患者の年齢、体重、健康状態、同時処理がある場合はその種類、所望の効果の性質、処置頻度などによって異なり、特に限定されないが、成人1日あたり経口では、原生薬量に換算して約10mg〜1000mgを1日1回もしくはそれ以上の回数で投与される。
【0025】
経口投与の場合、それに適用される液剤、散剤、細粒剤、顆粒剤、カプセル剤、丸剤、錠剤などは、それらの組成物中に製剤上一般に使用される賦形剤、結合剤、崩壊剤、滑沢剤、着色剤、矯味矯臭剤のような添加物を含有してもよい。また、経口用液剤製剤として使用する場合、懸濁液剤、シロップ剤の形態であってもよく、また、使用する前に再溶解させる乾燥生成物の形態であってもよい。さらに、このような液体製剤は普通用いられる添加剤、保存剤のいずれを含有してもよい。
【0026】
賦形剤としては、例えば乳糖、コーンスターチ、白糖、ブドウ糖、ソルビット、マンニット、結晶セルロース、デンプン、二酸化ケイ素、無機塩類などが、結合剤としては、例えばポリビニルアルコール、ポリビニルエーテル、エチルセルロース、メチルセルロース、アラビアゴム、トラガント、ゼラチン、シェラック、ヒドロキシプロピルセルロース、ヒドロキシプロピルスターチ、ポリビニルピロリドンなどが、崩壊剤としては、例えばデンプン、寒天、ゼラチン末、結晶セルロース、ヒドロキシプロピルセルロース、カルボキシメチルセルロース、カルボキシメチルセルロースカルシウム、カルボキシメチルセルロースナトリウム、炭酸カルシウム、炭酸水素ナトリウム、クエン酸カルシウム、デキストリン、ペクチン、ショ糖脂肪酸エステル、レシチン、ポリソルべート80、ラウリル硫酸ナトリウムなどが、滑沢剤としては、例えばステアリン酸マグネシウム、タルク、ポリエチレングリコール、シリカ、硬化植物油などが、着色剤としては、医薬品に添加することが許可されているものが、矯味矯臭剤としては、例えばココア末、ハッカ脳、芳香酸、ハッカ油、竜脳、桂皮末などが用いられる。これらの錠剤、顆粒剤には、糖衣、ゼラチン衣、その他必要により適宜コーティングすることは勿論差し支えない。また、これらの錠剤、顆粒剤、カプセル剤を徐放剤とすることは勿論差し支えない。
【0027】
注射用の場合、その組成物は安定剤、緩衝剤、保存剤、等張化剤などの添加物を含有してもよい。なお、上記組成物は懸濁液、溶液、油剤のような形態であってもよい。
【0028】
その他の非経口剤としては、直腸内投与のための坐剤が挙げられ、常法に従って製造される。
【0029】
また、本発明は、上記免疫賦活剤及び抗アレルギー剤が含まれたことを特徴とする食品であり、特に限定されないが、例えばお茶、ジュースといった清涼飲料水、ゼリー、飴、チョコレート、チューインガム、栄養補助食品、畜肉製品、菓子、パン、冷菓、嚥下食品、漬物などが挙げられる。また、本発明に係る食品は、健康食品(機能性食品、健康補助食品)などが含まれ、液剤、粉剤、粒剤、カプセル剤、錠剤などの形で製造される。
【0030】
さらに、本発明は、上記免疫賦活剤及び抗アレルギー剤が含まれたことを特徴とする化粧品であり、例えば洗顔料、化粧水、乳液、クリームなどのスキンケア化粧品、ファンデーション、口紅、アイシャドー、頬紅などメーキャップ化粧品などがあり、クリーム状、水溶液、エマルジョン、ジェル状、粉末状などの形状で製造される。
【0031】
さらにまた、本発明は、上記免疫賦活剤及び抗アレルギー剤が含まれたことを特徴とする医薬部外品であり、例えばのど清涼剤、健胃清涼剤、ビタミン含有保健剤などがあり、液剤、散剤、細粒剤、顆粒剤、カプセル剤、丸剤、錠剤などの形で製造される。
【0032】
また、本発明は、上記免疫賦活剤及び抗アレルギー剤が含まれたことを特徴とする動物飼料であり、例えば犬猫用ペットフードなどがあり畜産用飼料などの形で製造される。
【実施例】
【0033】
以下、本発明を実施例に基づいて具体的に説明するが、これらは本発明の目的を限定するものではない。
【0034】
(実験例1)
被検体として5週齢、雄、C3H/HeN系マウスを用いた。飼料と水は自由摂取とし、12時間/12時間の明暗サイクルおよび23±2℃の飼育環境を保った。デーツ、プルーンおよびイチジク抽出物は、10倍容の熱水で還流抽出し試料とした。上記試料はコントロール飼料(市販マウス用試料)とカロリーが同一になるように10%の割合で添加し、6週齢より給餌した。30日間飼育後、C3H/HeN系マウスから無菌的に脾臓を採取し、1.0×106cells/mlになるよう調製した。脾臓細胞浮遊液を、1mM EDTA、5%FBSを含むHank’s Balanced Salt Solution(HBSS)で遠心洗浄(4℃、2,000rpm、3分間)した。洗浄したマウス脾臓細胞1.0×106cellsを活性化培地(10%FBSを含むRPMI1640培地にブレフェルジンA20μg/ml、イオノマイシン2μg/mlおよびPMA20ng/mlを含む)1,000μlに懸濁し、37℃、5%CO2存在下で4時間培養し、細胞内にサイトカインを産生および蓄積させた。培養したマウス脾臓細胞をHBSSで遠心洗浄(4℃、2,000rpm、3分間)した後、ビオチン標識抗マウスCD11bを1μl添加し、4℃で15分間反応させた。さらに、ストレプトアビジン−PE/Cy5を1μl添加して4℃、遮光下で15分間放置した。反応液をHBSSで洗浄(4℃、2,000rpm、3分間)後、IntraPrepTMReagent1を100μl加え、室温遮光下で15分間放置し細胞を固定した。HBSSで洗浄(4℃、2,000rpm、3分間)後、IntraPrepTMReagent2を100μl加え、室温遮光下で5分間反応させ膜透過処理を行った。次いで、IL−12を測定するため、PE標識抗マウスIL−12を1μlを添加し、4℃遮光下で15分間放置した後、再度HBSSで遠心洗浄(4℃、2,000rpm、3分間)した。洗浄後、Guava(R)Personal Cell Function Analyzer(PCA)を用いて、培養細胞中の活性型マクロファージ細胞数の測定を行った。結果を図1に示す。
【0035】
図1より、デーツ抽出物添加飼料で飼育したマウスの脾臓では、マクロファージ(生体内に侵入した細菌、ウイルス、又は死んだ細胞を捕食し消化する)の数が増えた。また、デーツはプルーンやイチジクより効果があった。
【0036】
(実験例2)
上記と同様にマウスを飼育し、脾臓細胞培養液を調製し、活性化培地で4時間培養した。さらに上記と同様に、培養したマウス脾臓細胞をHBSSで遠心洗浄した後、ビオチン標識抗マウスCD49bを1μl添加し、4℃で15分間反応させた。さらに、ストレプトアビジン−PE/Cy5を1μl添加して4℃、遮光下で15分間放置した。反応液をHBSSで洗浄後、IntraPrepTMReagent1を100μl加え、室温遮光下で15分間放置し細胞を固定した。HBSSで洗浄後、IntraPrepTMReagent2を100μl加え、室温遮光下で5分間反応させ膜透過処理を行った。次いで、IFN−γを測定するため、PE標識抗マウスIFN−γを1μl添加し、4℃遮光下で15分間放置した後、再度HBSSで遠心洗浄した。洗浄後、Guava(R)PCAを用いて、培養細胞中の活性型NK細胞数の測定を行った。結果を図2に示す。
【0037】
図2より、デーツ抽出物添加飼料で飼育したマウスの脾臓では、NK細胞(腫瘍細胞やウイルス感染細胞を殺す)の数が増えた。また、デーツはプルーンやイチジクより効果があった。
【0038】
(実験例3)
デーツ抽出物を限外濾過で分子量500−1,000、1,000−5,000、5,000−10,000、10,000−30,000、および30,000以上の画分に分離した。6週齢、雄のC3H/HeN系マウスから無菌的にパイエル板を採取し、上記と同様にパイエル板細胞を1.0×106cells/mlになるよう調製し、パイエル板細胞浮遊液とした。そこへ各画分を50もしくは100μg/mLになるように添加して、37℃、5%CO2存在下で24時間培養した。培養後、遠心(10,000rpm、15秒)して細胞を回収し、TRIZOLを添加して細胞を破壊、クロロホルムおよびアルコールを用いてRNAを調製した。逆転写酵素を用いてcDNAを調製し、それを鋳型にIFN−γ mRNAの発現量をリアルタイムPCRで測定した。結果を図3に示す。
【0039】
図3より、分子量500−1,000の低分子画分と、30,000以上の高分子画分がインターフェロン−γ(IFN−γ:抗ウイルス効果、NK細胞やマクロファージの増強作用がある)の分泌を増やした。ポリフェノールとβ−グルカンと予想される。
【0040】
(実験例4)
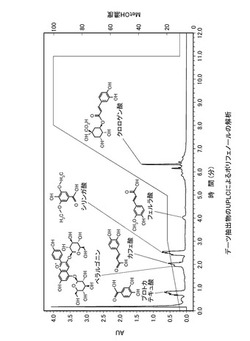
デーツ抽出物をSep−Pak(Waters)に通し、吸着部を50%メタノールを用いて溶出させ、これを粗デーツポリフェノール画分とした。上記画分をUPLC(Waters)に供した。結果を図4に示す。
【0041】
図4より、プロトカテキュ酸、ペラルゴニン、カフェ酸(コーヒー酸)、フェルラ酸、シリンガ酸、クロロゲン酸を同定した。このうちペラルゴニンはアントシアニンの1種だが他果実にほとんど入っていない。
【0042】
(実験例5)
6週齢、雄のC3H/HeN系マウスから無菌的にパイエル板を採取し、上記と同様にパイエル板細胞を1.0×106cells/mlになるよう調製し、パイエル板細胞浮遊液とした。そこへデーツ抽出物中に検出された市販のポリフェノールを4μMになるように添加して、37℃、5%CO2存在下で24時間培養した。培養後、遠心(10,000rpm、15秒)して細胞を回収し、TRIZOLを添加して細胞を破壊、クロロホルムおよびアルコールを用いてRNAを調製した。逆転写酵素を用いてcDNAを調製し、それを鋳型にIFN−γ mRNAの発現量をリアルタイムPCRで測定した。結果を図5に示す。
【0043】
図5より、ペラルゴニン、カフェ酸(コーヒー酸)、フェルラ酸、クロロゲン酸がIFN−γの分泌を増やした。
【0044】
(実験例6)
被検体として4週齢、雄、BALB/c系マウスを用いた。飼料と水は自由摂取とし、12時間/12時間の明暗サイクルおよび23±2℃の飼育環境を保った。デーツ抽出物は、10倍容の熱水で還流抽出し、分子量500以下を通す限外濾過膜を用いて調製し、試料とした。上記試料はコントロール飼料(市販マウス用試料)とカロリーが同一になるように1%の割合で添加し、5週齢より給餌した。ダニ抗原による免疫は、5、6、および7週齢目にマウス腹腔内にダニ抗原を水酸化アルミニウムゲルとともに注射することで行なった。鼻炎アレルギーは、生理食塩水にダニ抗原を溶解したものを、週に1回、鼻腔内注射することで誘導し、くしゃみと鼻部引っかき行動の回数を30分間測定した。結果を図6及び7に示す。
【0045】
図6及び7より、デーツ抽出物を添加した飼料を投与したマウスでは、対照食と比較してくしゃみと鼻部引っかき行動の回数が有意に軽減した。
【0046】
(実験例7)
被検体として4週齢、雄、NC/Nga系マウスを用いた。飼料と水は自由摂取とし、12時間/12時間の明暗サイクルおよび23±2℃の飼育環境を保った。デーツ抽出物は、10倍容の熱水で還流抽出し、分子量500以下を通す限外濾過膜を用いて調製し、試料とした。上記試料はコントロール飼料(市販マウス用試料)とカロリーが同一になるように1%の割合で添加し、5週齢より給餌した。ダニ抗原による感作は、生理食塩水10μlに市販ダニ抗原5μgを溶解したものを、週に1回、右耳介部に皮内注射することで誘導し、右耳介部の厚さを1週間に1回測定した。また、右耳介部位のアレルギー症状は、アレルギースコアにより評価した。結果を図8に示す。
【0047】
図8より、デーツ抽出物を添加した飼料を投与したマウスでは、対照食と比較して皮膚炎の症状が有意に軽減した。
【0048】
(実験例8)
鼻炎モデルマウス飼育後のマウスの腹部門脈から採血し、直ちに遠心分離(4℃、3,000rpm、30分間)を行い、血清を回収した。回収した血清は、使用する直前まで−30℃で保存した。抗原特異的IgE量はELISA法で測定した。まず、0.1M炭酸緩衝液(pH9.6)に溶解した市販ダニ抗原(100μg/ml)100μlを96穴マイクロプレートの各ウェルに分注し、4℃で一晩静置した。PBS−Tweenで3回洗浄した後、0.1M炭酸緩衝液に溶解した0.4%BSA溶液300μlを加え、25℃で120分静置した。再びPBS−Tweenで3回洗浄した後、2%ポリビニルピロリドン(PVP)を含むPBS−Tweenで10倍に希釈したマウス血清100μlを各ウェルに分注し、25℃で120分間反応させた。反応終了後は、上記と同様の方法で処理し、モデル550マイクロプレートリーダーを用いて、450nmにおける吸光度を測定した。結果を図9に示す。
【0049】
図9より、デーツ抽出物を添加した飼料を投与したマウスでは、対照食と比較して血液中のIgE(アレルギー症状の原因となる体内物質で、抗原と反応する抗体)が有意に低減した。
【0050】
(実験例9)
飼育期間終了後の鼻炎モデルマウスから無菌的に脾臓を採取し、上記と同様に脾臓細胞を1.0×106cells/mlになるよう調製し、脾臓細胞浮遊液とした。脾臓細胞浮遊液を、1mM EDTA、5%FBSを含むHank’s Balanced Salt Solution(HBSS)で遠心洗浄(4℃、2,000rpm、3分間)した。洗浄したマウス脾臓細胞1.0×106cellsを活性化培地(10%FBSを含むRPMI1640培地にブレフェルジンA20μg/ml、イオノマイシン2μg/mlおよびPMA20ng/mlを含む)1,000μlに懸濁し、37℃、5%CO2存在下で4時間培養し、細胞内にサイトカインを産生および蓄積させた。培養したマウス脾臓細胞をHBSSで遠心洗浄(4℃、2,000rpm、3分間)した後、ビオチン標識抗マウスB220/CD45Rを1μl添加し、4℃で15分間反応させた。さらに、ストレプトアビジン−PE/Cy5を1μl添加して4℃、遮光下で15分間放置した。反応液をHBSSで洗浄(4℃、2,000rpm、3分間)後、IntraPrepTMReagent1を100μl加え、室温遮光下で15分間放置し細胞を固定した。HBSSで洗浄(4℃、2,000rpm、3分間)後、IntraPrepTMReagent2を100μl加え、室温遮光下で5分間反応させ膜透過処理を行った。次いで、IgEを測定するため、抗マウスIgEを1μlを添加し、4℃遮光下で15分間放置した後、再度HBSSで遠心洗浄(4℃、2,000rpm、3分間)した。洗浄後、PE/Cy5−抗ヤギIgGを1μl添加して4℃、遮光下で15分間放置した。反応液をHBSSで洗浄(4℃、2,000rpm、3分間)後、Guava(R)Personal Cell Function Analyzer(PCA)を用いて、培養細胞中のIgE産生B細胞数の測定を行った。結果を図10に示す。
【0051】
図10より、デーツ抽出物を添加した飼料を投与したマウスでは、対照食と比較して脾臓中のIgE産生細胞数が有意に低減した。
【0052】
また、6週齢、雄のC3H/HeN系マウスから無菌的に脾臓を採取し、上記と同様に脾臓細胞を1.0×106cells/mlになるよう調製し、脾臓細胞浮遊液とした。そこへデーツ抽出物中に検出された市販のポリフェノールを4μMになるように添加して、37℃、5%CO2存在下で48時間培養した。マウス脾臓細胞1.0×106cellsを活性化培地(10%FBSを含むRPMI1640培地にブレフェルジンA20μg/ml、イオノマイシン2μg/mlおよびPMA20ng/mlを含む)1,000μlに懸濁し、37℃、5%CO2存在下で4時間培養し、細胞内にサイトカインを産生および蓄積させた。培養したマウス脾臓細胞をHBSSで遠心洗浄(4℃、2,000rpm、3分間)した後、ビオチン標識抗マウスB220を1μl添加し、4℃で15分間反応させた。さらに、ストレプトアビジン−PE/Cy5を1μl添加して4℃、遮光下で15分間放置した。反応液をHBSSで洗浄(4℃、2,000rpm、3分間)後、IntraPrepTMReagent1を100μl加え、室温遮光下で15分間放置し細胞を固定した。HBSSで洗浄(4℃、2,000rpm、3分間)後、IntraPrepTMReagent2を100μl加え、室温遮光下で5分間反応させ膜透過処理を行った。次いで、抗マウスIgEを1μl添加し、4℃遮光下で15分間放置した後、再度HBSSで遠心洗浄(4℃、2,000rpm、3分間)した。洗浄後、PE/Cy5−抗ヤギIgGを1μl添加して4℃、遮光下で15分間放置した。反応液をHBSSで洗浄(4℃、2,000rpm、3分間)後、Guava(R)Personal Cell Function Analyzer(PCA)を用いて、培養細胞中のIgE産生細胞数の測定を行った。結果を図11に示す。
【0053】
図11より、ポリフェノール無添加と比較して、ペラルゴニンとフェルラ酸を添加すると脾臓細胞中のIgE産生細胞数が有意に減少した。
【0054】
(実験例10)
6週齢、雄のC3H/HeN系マウスから無菌的に脾臓を採取し、上記と同様に脾臓細胞を1.0×106cells/mlになるよう調製し、脾臓細胞浮遊液とした。そこへデーツ抽出物中に検出された市販のポリフェノールを4μMになるように添加して、37℃、5%CO2存在下で48時間培養した。マウス脾臓細胞1.0×106cellsを活性化培地(10%FBSを含むRPMI1640培地にブレフェルジンA20μg/ml、イオノマイシン2μg/mlおよびPMA20ng/mlを含む)1,000μlに懸濁し、37℃、5%CO2存在下で4時間培養し、細胞内にサイトカインを産生および蓄積させた。培養したマウス脾臓細胞をHBSSで遠心洗浄(4℃、2,000rpm、3分間)した後、ビオチン標識抗マウスCD4を1μl添加し、4℃で15分間反応させた。さらに、ストレプトアビジン−PE/Cy5を1μl添加して4℃、遮光下で15分間放置した。反応液をHBSSで洗浄(4℃、2,000rpm、3分間)後、IntraPrepTMReagent1を100μl加え、室温遮光下で15分間放置し細胞を固定した。HBSSで洗浄(4℃、2,000rpm、3分間)後、IntraPrepTMReagent2を100μl加え、室温遮光下で5分間反応させ膜透過処理を行った。次いで、抗マウスIL−4を1μl添加し、4℃遮光下で15分間放置した。反応液をHBSSで洗浄(4℃、2,000rpm、3分間)後、Guava(R)Personal Cell Function Analyzer(PCA)を用いて、培養細胞中のTh2型細胞数の測定を行った。結果を図12に示す。
【0055】
図12より、ポリフェノール無添加と比較して、クロロゲン酸、ペラルゴニン、およびフェルラ酸を添加すると脾臓細胞中のTh2型細胞数が有意に減少した。
【0056】
(実験例11)
飼育期間終了後の鼻炎モデルマウスから無菌的に脾臓を採取し、上記と同様に脾臓細胞を1.0×106cells/mlになるよう調製し、脾臓細胞浮遊液とした。脾臓細胞浮遊液を、1mM EDTA、5%FBSを含むHank’s Balanced Salt Solution(HBSS)で遠心洗浄(4℃、2,000rpm、3分間)した。洗浄したマウス脾臓細胞1.0×106cellsを活性化培地(10%FBSを含むRPMI1640培地にブレフェルジンA20μg/ml、イオノマイシン2μg/mlおよびPMA20ng/mlを含む)1,000μlに懸濁し、37℃、5%CO2存在下で4時間培養し、細胞内にサイトカインを産生および蓄積させた。培養したマウス脾臓細胞をHBSSで遠心洗浄(4℃、2,000rpm、3分間)した後、ビオチン標識抗マウスCD117を1μl添加し、4℃で15分間反応させた。さらに、ストレプトアビジン−PE/Cy5を1μl添加して4℃、遮光下で15分間放置した。反応液をHBSSで洗浄(4℃、2,000rpm、3分間)後、IntraPrepTMReagent1を100μl加え、室温遮光下で15分間放置し細胞を固定した。HBSSで洗浄(4℃、2,000rpm、3分間)後、IntraPrepTMReagent2を100μl加え、室温遮光下で5分間反応させ膜透過処理を行った。次いで、IgEを測定するため、抗マウスFcεRIαを1μlを添加し、4℃遮光下で15分間放置した後、再度HBSSで遠心洗浄(4℃、2,000rpm、3分間)した。洗浄後、PE/Cy5−抗ヤギIgGを1μl添加して4℃、遮光下で15分間放置した。反応液をHBSSで洗浄(4℃、2,000rpm、3分間)後、Guava(R)Personal Cell Function Analyzer(PCA)を用いて、培養細胞中の肥満細胞数の測定を行った。結果を図13に示す。
また、6週齢、雄のC3H/HeN系マウスから無菌的に脾臓を採取し、上記と同様に脾臓細胞を1.0×106cells/mlになるよう調製し、脾臓細胞浮遊液とした。そこへデーツ抽出物中に検出された市販のポリフェノールを4μMになるように添加して、37℃、5%CO2存在下で48時間培養した。その後上記と同様の方法で測定した。結果を図14に示す。
【0057】
図13及び14より、デーツ抽出物を添加した飼料を投与したマウスでは、対照食と比較して脾臓中の肥満細胞(アレルギーの時ヒスタミンなどの炎症性化学物質を放出する細胞)が有意に低減した。特に、ペラルゴニンが、肥満細胞の数を減らす効果が高かった。
【0058】
(実験例12)
飼育期間終了後のアトピー性皮膚炎モデルマウスから無菌的に脾臓を採取し、遠心(10,000rpm、15秒)して細胞を回収し、TRIZOLを添加して細胞を破壊、クロロホルムおよびアルコールを用いてRNAを調製した。逆転写酵素を用いてcDNAを調製し、それを鋳型にヒスタミン放出関連遺伝子mRNAの発現量をリアルタイムPCRで測定した。
また、6週齢、雄のC3H/HeN系マウスから無菌的に脾臓を採取し、上記と同様に脾臓細胞を1.0×106cells/mlになるよう調製し、脾臓細胞浮遊液とした。そこへデーツ抽出物中に検出された市販のポリフェノールを4μMになるように添加して、37℃、5%CO2存在下で48時間培養した。その後上記と同様の方法で測定した。結果を図15乃至17に示す。
【0059】
図15乃至17より、デーツ抽出物を添加した飼料を投与したマウスでは、対照食と比較して脾臓中のヒスタミンなどの炎症性化学物質の放出を促進する遺伝子の発現が有意に低減した。また、肥満細胞内に発現するITKやBTKといった遺伝子(肥満細胞からヒスタミンが出る際に活性化する)を抑制した。特に、ITKを減らしたのはペラルゴニン、クロロゲン酸の作用で、BTKを減らしたのはペラルゴニンの作用と考えられる。
【技術分野】
【0001】
本発明は、デーツに含有される機能性成分及びその機能性成分を含有する食品、化粧品、医薬部外品及び動物飼料に関する。
【背景技術】
【0002】
赤ワインや茶、リンゴ、ブルーベリー、ゴマなどに含まれるポリフェノール(polyphenol)は、近年、抗アレルギー作用、免疫賦活作用、動脈硬化や脳梗塞を防ぐ抗酸化作用、ホルモン促進作用等の機能性を有することから、食品分野など様々な分野で使用されている。
【0003】
例えば、特許文献1には、ブドウの種子及び/又は果皮を原料とし、ブドウの乳酸発酵物を有効成分として含有する抗アレルギー組成物が記載されている。特許文献1においては、ブドウに含まれるポリフェノール類や糖類が、乳酸発酵により、配糖体が切断されたり、有機酸が結合する等の要因により、より多く体内へ吸収され、ポリフェノール類による生理活性効果が高まり、IgEが関与するI型アレルギー反応を効果的に抑制でき、花粉アレルギーなどの様々なI型アレルギー性疾患の発症を予防したり、その症状を緩和ないし治療ができることが記載されている。また、例えば、特許文献2には、ホップの組織の冷水抽出物からなる抗アレルギー組成物が記載されている。特許文献2に記載の抗アレルギー組成物は、ヒスタミン遊離抑制作用を有し、抽出方法も特殊な必要はなく冷水で行うために、副作用を生じるおそれが少なく、人体や皮膚に緩和な抗アレルギー組成物として適用でき、抗アレルギー剤として使用できることが記載されている。
【0004】
一方、ナツメヤシの果実であるデーツは、砂漠で生育でき、乾燥地帯に多く栽培ができるため「生命の樹」と呼ばれ、中東や北アフリカが主なる原産地で、中東はじめヨーロッパ等で多く食されている。デーツは古代メソポタミアやエジプトの壁画にも描かれている古代5000年以上前から食されていた最古の果実である。デーツは果糖・ブドウ糖が主なる成分で、さらにミネラルや食物繊維が豊富で栄養価の高い食品と考えられている。
【先行技術文献】
【特許文献】
【0005】
【特許文献1】特開2010−280602号公報
【特許文献2】国際公開第2006/093194号
【発明の概要】
【発明が解決しようとする課題】
【0006】
しかしながら、デーツは、その生理的機能についてはほとんど知られておらず、特に果実特有のポリフェノールの生理的機能や多糖としてのβ−グルカンの生理的機能が解明されていないという問題がある。
【0007】
本発明は、上記問題点に鑑みてなされたものであり、中東において有用な食品とされてきたデーツについて、その生理的機能を明らかにするとともに、それに関与する成分について明らかにすることを目的とする。
【課題を解決するための手段】
【0008】
本発明者らは、以上の目的を達成するために、鋭意検討した結果、デーツ抽出物に含まれるプロトカテキュ酸、ペラルゴニン、カフェ酸、クロロゲン酸、フェルラ酸及びシリンガ酸が免疫賦活作用に優れていること、及びデーツ抽出物に含まれるプロトカテキュ酸、ペラルゴニン、カフェ酸、クロロゲン酸、フェルラ酸及びシリンガ酸が抗アレルギー作用に優れていることを見出した。すなわち、本発明は、ペラルゴニン及びフェルラ酸のいずれか1以上を主成分とすることを特徴とする免疫賦活剤であり、またプロトカテキュ酸、ペラルゴニン及びフェルラ酸のいずれか1以上を主成分とすることを特徴とする抗アレルギー剤である。
【発明の効果】
【0009】
以上のように、本発明によれば、デーツ抽出物より得られる免疫賦活剤及び抗アレルギー剤並びにそれを含む食品、化粧品、医薬部外品及び動物飼料を提供することができる。
【図面の簡単な説明】
【0010】
【図1】脾臓中のマクロファージ数を示すグラフである。
【図2】脾臓中のナチュラルキラー(NK)細胞数を示すグラフである。
【図3】デーツ抽出物分子量画分のIFN−γ mRNA発現への作用を示すグラフである。
【図4】デーツ抽出物のUPLCによるポリフェノールの解析を示すグラフである。
【図5】デーツ抽出物中に検出されたポリフェノールのIFN−γ mRNA発現への作用を示すグラフである。
【図6】鼻炎アレルギーモデルマウスにおけるデーツ抽出物の効果(くしゃみの回数)を示すグラフである。
【図7】鼻炎アレルギーモデルマウスにおけるデーツ抽出物の効果(鼻部引っかき行動の回数)を示すグラフである。
【図8】アトピー性皮膚炎モデルマウスにおけるデーツ抽出物の効果(アレルギースコア)を示すグラフである。
【図9】鼻炎アレルギーモデルマウスにおけるデーツ抽出物の効果(血中の抗体レベル)を示すグラフである。(a)総IgE量を示す。(b)抗原特異的IgE吸光度を示す。
【図10】鼻炎アレルギーモデルマウスにおけるデーツ抽出物の効果(脾臓中の免疫細胞(IgE産生細胞)数)を示すグラフである。
【図11】脾臓細胞培養系におけるデーツポリフェノールの効果(脾臓細胞中のIgE産生細胞数)を示すグラフである。
【図12】脾臓細胞培養系におけるデーツポリフェノールの効果(脾臓細胞中のTh2型細胞数)を示すグラフである。
【図13】鼻炎アレルギーモデルマウスにおけるデーツ抽出物の効果(脾臓中の免疫細胞(肥満細胞)数)を示すグラフである。
【図14】脾臓細胞培養系におけるデーツポリフェノールの効果(脾臓細胞中の肥満細胞数)を示すグラフである。
【図15】アトピー性皮膚炎モデルマウスにおけるデーツ抽出物の効果(アレルギー関連遺伝子の発現)を示すグラフである。
【図16】デーツ抽出物中に検出されたポリフェノールのITK mRNA発現への作用を示すグラフである。
【図17】デーツ抽出物中に検出されたポリフェノールのBTK mRNA発現への作用を示すグラフである。
【発明を実施するための形態】
【0011】
(原料デーツ及びその抽出物)
本発明に係る免疫賦活剤や抗アレルギー剤に用いられるプロトカテキュ酸、ペラルゴニン、カフェ酸、フェルラ酸及びシリンガ酸は、特に限定されないが、例えばデーツから抽出することが好ましい。原料となるデーツの生産地や品種は特に限定されず、生産地としては、例えば、エジプト、モロッコ、サウジアラビア、UAE、イラン、イラクなど中東・北アフリカの国々などが挙げられる。上記デーツは、ポリフェノール含量が他の果実に比べて多いという特徴を有している。
【0012】
デーツ抽出物の抽出方法は、特に限定されず、一般に公知の種々の方法が用いられる。例えば、デーツを刻み、抽出溶媒中に浸漬するかまたは抽出溶媒中で加熱還流し、次いでろ過、遠心分離等により不溶物を除去して抽出溶液を得ることができる。デーツの抽出に用いる溶媒は、通常のポリフェノール等の抽出に用いられる溶媒でよく、例えば、メタノール、エタノール等のアルコール、アセトン、酢酸エチル等の有機溶媒、水単独あるいは水と好ましくはエタノール等の他の溶媒との組み合わせ等を用いることができる。これらの抽出溶液は、凍結乾燥、またはスプレードライにより、抽出物にすることができる。
【0013】
デーツの水抽出物は、例えば、デーツを刻み、それを水に加えて煮沸して煮詰めることにより製造することができる。また、デーツを蒸留水に加えて放置すること、デーツを蒸留水に加え煮立たせた後放置することによっても製造することができる。これらの処理物は、次いで、ろ過、遠心分離等により不純物を除去して抽出溶液を得る。これらの抽出溶液は、凍結乾燥、またはスプレードライにより、粉末にすることができる。
【0014】
デーツ抽出物には、上述したように多量のポリフェノールが含まれているため、本発明においては、デーツの抽出の抽出物を免疫賦活剤又は抗アレルギー剤としてそのまま食品等に添加しても良い。また、デーツ抽出物をHPLCを使用して分画することによって免疫調節機能や生体調節機能にそれぞれ有効な物質を同定することができる。
【0015】
(免疫賦活剤)
本発明に係る免疫賦活剤は、デーツ由来のプロトカテキュ酸、ペラルゴニン、カフェ酸、フェルラ酸、シリンガ酸、クロロゲン酸のいずれか1以上が有効成分として含まれていることが好ましい。中でも、ペラルゴニン及びフェルラ酸のいずれか1以上を主成分とすることが特に好ましい。
【0016】
本発明において、その免疫賦活の評価は、NK細胞数を測定して行われ、デーツ由来のプロトカテキュ酸、ペラルゴニン、カフェ酸、フェルラ酸、シリンガ酸、クロロゲン酸のいずれか1以上により免疫賦活作用があることを解明した。
【0017】
生体の免疫システムには先天的な自然免疫と後天的に生じる獲得免疫の2種類があることが知られており、自然免疫を担当する細胞(マクロファージや樹状細胞等)は、外界からウイルスや病原細菌等が侵入すると、すばやくこれを探知し、食作用等の直接的な攻撃に加え、サイトカイン等の警戒シグナルを発して獲得免疫系を活性化する(抗原提示)といった感染防御の第一段階として機能している。例えば、マクロファージから分泌されるサイトカインの中で、インターロイキン12(以下、「IL−12」という場合がある。)は、ナチュラルキラー細胞(以下、「NK細胞」という場合がある。)やヘルパーT細胞に作用して、マクロファージを活性化するインターフェロン−γ(以下、「IFN−γ」という場合がある。)の産生を誘導する。一方、NK細胞もまた、自然免疫系に属し、上記IFN−γ産生作用のみならず、外界から侵入した異物である細菌やウイルス、また体内で異物化したがん細胞などを直接攻撃して破壊する。
【0018】
本発明に係る免疫賦活剤は、その中でもマクロファージ増加機能、ナチュラルキラー(NK)細胞増加機能、IFN−γ分泌増加機能のうち、少なくとも1以上の機能を有することが好ましい。
【0019】
(抗アレルギー剤)
本発明に係る抗アレルギー剤は、デーツ由来のプロトカテキュ酸、ペラルゴニン、カフェ酸、フェルラ酸、シリンガ酸、クロロゲン酸のいずれか1以上が有効成分として含まれていることが好ましい。中でも、プロトカテキュ酸、ペラルゴニン及びフェルラ酸のいずれか1以上を主成分とすることが特に好ましい。
【0020】
本発明において、その抗アレルギーの評価は、アレルギーモデルマウスへの経口投与試験により行われ、デーツ由来のプロトカテキュ酸、ペラルゴニン、カフェ酸、フェルラ酸、シリンガ酸、クロロゲン酸のいずれか1以上により抗アレルギー作用があることを解明した。
【0021】
花粉アレルギー(花粉症)、アレルギー性気管支喘息、アレルギー性鼻炎、アトピー性皮膚炎などのアレルギーは、アレルゲン特異的IgEの誘導に起因するI型アレルギーに分類される。I型アレルギー反応について詳しく説明すると、抗原の侵入に対してヘルパーT細胞(Th2型細胞)より分泌されるサイトカインの影響により、B細胞がIgE抗体を産生する。産生されたIgE抗体が肥満細胞(マスト細胞)や好塩基球に結合する。この状態で、再びアレルゲンが侵入すると、数分以内にマスト細胞や好塩基球からヒスタミンなどのメディエーターが遊離され(脱顆粒)、これらの働きにより気管支の収縮や蕁麻疹など様々なアレルギー症状を引き起こす。
【0022】
本発明に係る抗アレルギー剤は、その中でも血中の抗原特異的IgE減少機能、IgE産生細胞減少機能、Th2型細胞減少機能、肥満細胞減少機能、ヒスタミンの放出を促進する遺伝子抑制機能のうち、少なくとも1以上の機能を有することが好ましい。
【0023】
(免疫賦活剤及び抗アレルギー剤の用途)
本発明に係る免疫賦活剤及び抗アレルギー剤は、液剤、散剤、細粒剤、顆粒剤、カプセル剤、錠剤の形で経口投与されることが好ましい。
【0024】
投与量は、症状の程度、疾患の相違、患者の年齢、体重、健康状態、同時処理がある場合はその種類、所望の効果の性質、処置頻度などによって異なり、特に限定されないが、成人1日あたり経口では、原生薬量に換算して約10mg〜1000mgを1日1回もしくはそれ以上の回数で投与される。
【0025】
経口投与の場合、それに適用される液剤、散剤、細粒剤、顆粒剤、カプセル剤、丸剤、錠剤などは、それらの組成物中に製剤上一般に使用される賦形剤、結合剤、崩壊剤、滑沢剤、着色剤、矯味矯臭剤のような添加物を含有してもよい。また、経口用液剤製剤として使用する場合、懸濁液剤、シロップ剤の形態であってもよく、また、使用する前に再溶解させる乾燥生成物の形態であってもよい。さらに、このような液体製剤は普通用いられる添加剤、保存剤のいずれを含有してもよい。
【0026】
賦形剤としては、例えば乳糖、コーンスターチ、白糖、ブドウ糖、ソルビット、マンニット、結晶セルロース、デンプン、二酸化ケイ素、無機塩類などが、結合剤としては、例えばポリビニルアルコール、ポリビニルエーテル、エチルセルロース、メチルセルロース、アラビアゴム、トラガント、ゼラチン、シェラック、ヒドロキシプロピルセルロース、ヒドロキシプロピルスターチ、ポリビニルピロリドンなどが、崩壊剤としては、例えばデンプン、寒天、ゼラチン末、結晶セルロース、ヒドロキシプロピルセルロース、カルボキシメチルセルロース、カルボキシメチルセルロースカルシウム、カルボキシメチルセルロースナトリウム、炭酸カルシウム、炭酸水素ナトリウム、クエン酸カルシウム、デキストリン、ペクチン、ショ糖脂肪酸エステル、レシチン、ポリソルべート80、ラウリル硫酸ナトリウムなどが、滑沢剤としては、例えばステアリン酸マグネシウム、タルク、ポリエチレングリコール、シリカ、硬化植物油などが、着色剤としては、医薬品に添加することが許可されているものが、矯味矯臭剤としては、例えばココア末、ハッカ脳、芳香酸、ハッカ油、竜脳、桂皮末などが用いられる。これらの錠剤、顆粒剤には、糖衣、ゼラチン衣、その他必要により適宜コーティングすることは勿論差し支えない。また、これらの錠剤、顆粒剤、カプセル剤を徐放剤とすることは勿論差し支えない。
【0027】
注射用の場合、その組成物は安定剤、緩衝剤、保存剤、等張化剤などの添加物を含有してもよい。なお、上記組成物は懸濁液、溶液、油剤のような形態であってもよい。
【0028】
その他の非経口剤としては、直腸内投与のための坐剤が挙げられ、常法に従って製造される。
【0029】
また、本発明は、上記免疫賦活剤及び抗アレルギー剤が含まれたことを特徴とする食品であり、特に限定されないが、例えばお茶、ジュースといった清涼飲料水、ゼリー、飴、チョコレート、チューインガム、栄養補助食品、畜肉製品、菓子、パン、冷菓、嚥下食品、漬物などが挙げられる。また、本発明に係る食品は、健康食品(機能性食品、健康補助食品)などが含まれ、液剤、粉剤、粒剤、カプセル剤、錠剤などの形で製造される。
【0030】
さらに、本発明は、上記免疫賦活剤及び抗アレルギー剤が含まれたことを特徴とする化粧品であり、例えば洗顔料、化粧水、乳液、クリームなどのスキンケア化粧品、ファンデーション、口紅、アイシャドー、頬紅などメーキャップ化粧品などがあり、クリーム状、水溶液、エマルジョン、ジェル状、粉末状などの形状で製造される。
【0031】
さらにまた、本発明は、上記免疫賦活剤及び抗アレルギー剤が含まれたことを特徴とする医薬部外品であり、例えばのど清涼剤、健胃清涼剤、ビタミン含有保健剤などがあり、液剤、散剤、細粒剤、顆粒剤、カプセル剤、丸剤、錠剤などの形で製造される。
【0032】
また、本発明は、上記免疫賦活剤及び抗アレルギー剤が含まれたことを特徴とする動物飼料であり、例えば犬猫用ペットフードなどがあり畜産用飼料などの形で製造される。
【実施例】
【0033】
以下、本発明を実施例に基づいて具体的に説明するが、これらは本発明の目的を限定するものではない。
【0034】
(実験例1)
被検体として5週齢、雄、C3H/HeN系マウスを用いた。飼料と水は自由摂取とし、12時間/12時間の明暗サイクルおよび23±2℃の飼育環境を保った。デーツ、プルーンおよびイチジク抽出物は、10倍容の熱水で還流抽出し試料とした。上記試料はコントロール飼料(市販マウス用試料)とカロリーが同一になるように10%の割合で添加し、6週齢より給餌した。30日間飼育後、C3H/HeN系マウスから無菌的に脾臓を採取し、1.0×106cells/mlになるよう調製した。脾臓細胞浮遊液を、1mM EDTA、5%FBSを含むHank’s Balanced Salt Solution(HBSS)で遠心洗浄(4℃、2,000rpm、3分間)した。洗浄したマウス脾臓細胞1.0×106cellsを活性化培地(10%FBSを含むRPMI1640培地にブレフェルジンA20μg/ml、イオノマイシン2μg/mlおよびPMA20ng/mlを含む)1,000μlに懸濁し、37℃、5%CO2存在下で4時間培養し、細胞内にサイトカインを産生および蓄積させた。培養したマウス脾臓細胞をHBSSで遠心洗浄(4℃、2,000rpm、3分間)した後、ビオチン標識抗マウスCD11bを1μl添加し、4℃で15分間反応させた。さらに、ストレプトアビジン−PE/Cy5を1μl添加して4℃、遮光下で15分間放置した。反応液をHBSSで洗浄(4℃、2,000rpm、3分間)後、IntraPrepTMReagent1を100μl加え、室温遮光下で15分間放置し細胞を固定した。HBSSで洗浄(4℃、2,000rpm、3分間)後、IntraPrepTMReagent2を100μl加え、室温遮光下で5分間反応させ膜透過処理を行った。次いで、IL−12を測定するため、PE標識抗マウスIL−12を1μlを添加し、4℃遮光下で15分間放置した後、再度HBSSで遠心洗浄(4℃、2,000rpm、3分間)した。洗浄後、Guava(R)Personal Cell Function Analyzer(PCA)を用いて、培養細胞中の活性型マクロファージ細胞数の測定を行った。結果を図1に示す。
【0035】
図1より、デーツ抽出物添加飼料で飼育したマウスの脾臓では、マクロファージ(生体内に侵入した細菌、ウイルス、又は死んだ細胞を捕食し消化する)の数が増えた。また、デーツはプルーンやイチジクより効果があった。
【0036】
(実験例2)
上記と同様にマウスを飼育し、脾臓細胞培養液を調製し、活性化培地で4時間培養した。さらに上記と同様に、培養したマウス脾臓細胞をHBSSで遠心洗浄した後、ビオチン標識抗マウスCD49bを1μl添加し、4℃で15分間反応させた。さらに、ストレプトアビジン−PE/Cy5を1μl添加して4℃、遮光下で15分間放置した。反応液をHBSSで洗浄後、IntraPrepTMReagent1を100μl加え、室温遮光下で15分間放置し細胞を固定した。HBSSで洗浄後、IntraPrepTMReagent2を100μl加え、室温遮光下で5分間反応させ膜透過処理を行った。次いで、IFN−γを測定するため、PE標識抗マウスIFN−γを1μl添加し、4℃遮光下で15分間放置した後、再度HBSSで遠心洗浄した。洗浄後、Guava(R)PCAを用いて、培養細胞中の活性型NK細胞数の測定を行った。結果を図2に示す。
【0037】
図2より、デーツ抽出物添加飼料で飼育したマウスの脾臓では、NK細胞(腫瘍細胞やウイルス感染細胞を殺す)の数が増えた。また、デーツはプルーンやイチジクより効果があった。
【0038】
(実験例3)
デーツ抽出物を限外濾過で分子量500−1,000、1,000−5,000、5,000−10,000、10,000−30,000、および30,000以上の画分に分離した。6週齢、雄のC3H/HeN系マウスから無菌的にパイエル板を採取し、上記と同様にパイエル板細胞を1.0×106cells/mlになるよう調製し、パイエル板細胞浮遊液とした。そこへ各画分を50もしくは100μg/mLになるように添加して、37℃、5%CO2存在下で24時間培養した。培養後、遠心(10,000rpm、15秒)して細胞を回収し、TRIZOLを添加して細胞を破壊、クロロホルムおよびアルコールを用いてRNAを調製した。逆転写酵素を用いてcDNAを調製し、それを鋳型にIFN−γ mRNAの発現量をリアルタイムPCRで測定した。結果を図3に示す。
【0039】
図3より、分子量500−1,000の低分子画分と、30,000以上の高分子画分がインターフェロン−γ(IFN−γ:抗ウイルス効果、NK細胞やマクロファージの増強作用がある)の分泌を増やした。ポリフェノールとβ−グルカンと予想される。
【0040】
(実験例4)
デーツ抽出物をSep−Pak(Waters)に通し、吸着部を50%メタノールを用いて溶出させ、これを粗デーツポリフェノール画分とした。上記画分をUPLC(Waters)に供した。結果を図4に示す。
【0041】
図4より、プロトカテキュ酸、ペラルゴニン、カフェ酸(コーヒー酸)、フェルラ酸、シリンガ酸、クロロゲン酸を同定した。このうちペラルゴニンはアントシアニンの1種だが他果実にほとんど入っていない。
【0042】
(実験例5)
6週齢、雄のC3H/HeN系マウスから無菌的にパイエル板を採取し、上記と同様にパイエル板細胞を1.0×106cells/mlになるよう調製し、パイエル板細胞浮遊液とした。そこへデーツ抽出物中に検出された市販のポリフェノールを4μMになるように添加して、37℃、5%CO2存在下で24時間培養した。培養後、遠心(10,000rpm、15秒)して細胞を回収し、TRIZOLを添加して細胞を破壊、クロロホルムおよびアルコールを用いてRNAを調製した。逆転写酵素を用いてcDNAを調製し、それを鋳型にIFN−γ mRNAの発現量をリアルタイムPCRで測定した。結果を図5に示す。
【0043】
図5より、ペラルゴニン、カフェ酸(コーヒー酸)、フェルラ酸、クロロゲン酸がIFN−γの分泌を増やした。
【0044】
(実験例6)
被検体として4週齢、雄、BALB/c系マウスを用いた。飼料と水は自由摂取とし、12時間/12時間の明暗サイクルおよび23±2℃の飼育環境を保った。デーツ抽出物は、10倍容の熱水で還流抽出し、分子量500以下を通す限外濾過膜を用いて調製し、試料とした。上記試料はコントロール飼料(市販マウス用試料)とカロリーが同一になるように1%の割合で添加し、5週齢より給餌した。ダニ抗原による免疫は、5、6、および7週齢目にマウス腹腔内にダニ抗原を水酸化アルミニウムゲルとともに注射することで行なった。鼻炎アレルギーは、生理食塩水にダニ抗原を溶解したものを、週に1回、鼻腔内注射することで誘導し、くしゃみと鼻部引っかき行動の回数を30分間測定した。結果を図6及び7に示す。
【0045】
図6及び7より、デーツ抽出物を添加した飼料を投与したマウスでは、対照食と比較してくしゃみと鼻部引っかき行動の回数が有意に軽減した。
【0046】
(実験例7)
被検体として4週齢、雄、NC/Nga系マウスを用いた。飼料と水は自由摂取とし、12時間/12時間の明暗サイクルおよび23±2℃の飼育環境を保った。デーツ抽出物は、10倍容の熱水で還流抽出し、分子量500以下を通す限外濾過膜を用いて調製し、試料とした。上記試料はコントロール飼料(市販マウス用試料)とカロリーが同一になるように1%の割合で添加し、5週齢より給餌した。ダニ抗原による感作は、生理食塩水10μlに市販ダニ抗原5μgを溶解したものを、週に1回、右耳介部に皮内注射することで誘導し、右耳介部の厚さを1週間に1回測定した。また、右耳介部位のアレルギー症状は、アレルギースコアにより評価した。結果を図8に示す。
【0047】
図8より、デーツ抽出物を添加した飼料を投与したマウスでは、対照食と比較して皮膚炎の症状が有意に軽減した。
【0048】
(実験例8)
鼻炎モデルマウス飼育後のマウスの腹部門脈から採血し、直ちに遠心分離(4℃、3,000rpm、30分間)を行い、血清を回収した。回収した血清は、使用する直前まで−30℃で保存した。抗原特異的IgE量はELISA法で測定した。まず、0.1M炭酸緩衝液(pH9.6)に溶解した市販ダニ抗原(100μg/ml)100μlを96穴マイクロプレートの各ウェルに分注し、4℃で一晩静置した。PBS−Tweenで3回洗浄した後、0.1M炭酸緩衝液に溶解した0.4%BSA溶液300μlを加え、25℃で120分静置した。再びPBS−Tweenで3回洗浄した後、2%ポリビニルピロリドン(PVP)を含むPBS−Tweenで10倍に希釈したマウス血清100μlを各ウェルに分注し、25℃で120分間反応させた。反応終了後は、上記と同様の方法で処理し、モデル550マイクロプレートリーダーを用いて、450nmにおける吸光度を測定した。結果を図9に示す。
【0049】
図9より、デーツ抽出物を添加した飼料を投与したマウスでは、対照食と比較して血液中のIgE(アレルギー症状の原因となる体内物質で、抗原と反応する抗体)が有意に低減した。
【0050】
(実験例9)
飼育期間終了後の鼻炎モデルマウスから無菌的に脾臓を採取し、上記と同様に脾臓細胞を1.0×106cells/mlになるよう調製し、脾臓細胞浮遊液とした。脾臓細胞浮遊液を、1mM EDTA、5%FBSを含むHank’s Balanced Salt Solution(HBSS)で遠心洗浄(4℃、2,000rpm、3分間)した。洗浄したマウス脾臓細胞1.0×106cellsを活性化培地(10%FBSを含むRPMI1640培地にブレフェルジンA20μg/ml、イオノマイシン2μg/mlおよびPMA20ng/mlを含む)1,000μlに懸濁し、37℃、5%CO2存在下で4時間培養し、細胞内にサイトカインを産生および蓄積させた。培養したマウス脾臓細胞をHBSSで遠心洗浄(4℃、2,000rpm、3分間)した後、ビオチン標識抗マウスB220/CD45Rを1μl添加し、4℃で15分間反応させた。さらに、ストレプトアビジン−PE/Cy5を1μl添加して4℃、遮光下で15分間放置した。反応液をHBSSで洗浄(4℃、2,000rpm、3分間)後、IntraPrepTMReagent1を100μl加え、室温遮光下で15分間放置し細胞を固定した。HBSSで洗浄(4℃、2,000rpm、3分間)後、IntraPrepTMReagent2を100μl加え、室温遮光下で5分間反応させ膜透過処理を行った。次いで、IgEを測定するため、抗マウスIgEを1μlを添加し、4℃遮光下で15分間放置した後、再度HBSSで遠心洗浄(4℃、2,000rpm、3分間)した。洗浄後、PE/Cy5−抗ヤギIgGを1μl添加して4℃、遮光下で15分間放置した。反応液をHBSSで洗浄(4℃、2,000rpm、3分間)後、Guava(R)Personal Cell Function Analyzer(PCA)を用いて、培養細胞中のIgE産生B細胞数の測定を行った。結果を図10に示す。
【0051】
図10より、デーツ抽出物を添加した飼料を投与したマウスでは、対照食と比較して脾臓中のIgE産生細胞数が有意に低減した。
【0052】
また、6週齢、雄のC3H/HeN系マウスから無菌的に脾臓を採取し、上記と同様に脾臓細胞を1.0×106cells/mlになるよう調製し、脾臓細胞浮遊液とした。そこへデーツ抽出物中に検出された市販のポリフェノールを4μMになるように添加して、37℃、5%CO2存在下で48時間培養した。マウス脾臓細胞1.0×106cellsを活性化培地(10%FBSを含むRPMI1640培地にブレフェルジンA20μg/ml、イオノマイシン2μg/mlおよびPMA20ng/mlを含む)1,000μlに懸濁し、37℃、5%CO2存在下で4時間培養し、細胞内にサイトカインを産生および蓄積させた。培養したマウス脾臓細胞をHBSSで遠心洗浄(4℃、2,000rpm、3分間)した後、ビオチン標識抗マウスB220を1μl添加し、4℃で15分間反応させた。さらに、ストレプトアビジン−PE/Cy5を1μl添加して4℃、遮光下で15分間放置した。反応液をHBSSで洗浄(4℃、2,000rpm、3分間)後、IntraPrepTMReagent1を100μl加え、室温遮光下で15分間放置し細胞を固定した。HBSSで洗浄(4℃、2,000rpm、3分間)後、IntraPrepTMReagent2を100μl加え、室温遮光下で5分間反応させ膜透過処理を行った。次いで、抗マウスIgEを1μl添加し、4℃遮光下で15分間放置した後、再度HBSSで遠心洗浄(4℃、2,000rpm、3分間)した。洗浄後、PE/Cy5−抗ヤギIgGを1μl添加して4℃、遮光下で15分間放置した。反応液をHBSSで洗浄(4℃、2,000rpm、3分間)後、Guava(R)Personal Cell Function Analyzer(PCA)を用いて、培養細胞中のIgE産生細胞数の測定を行った。結果を図11に示す。
【0053】
図11より、ポリフェノール無添加と比較して、ペラルゴニンとフェルラ酸を添加すると脾臓細胞中のIgE産生細胞数が有意に減少した。
【0054】
(実験例10)
6週齢、雄のC3H/HeN系マウスから無菌的に脾臓を採取し、上記と同様に脾臓細胞を1.0×106cells/mlになるよう調製し、脾臓細胞浮遊液とした。そこへデーツ抽出物中に検出された市販のポリフェノールを4μMになるように添加して、37℃、5%CO2存在下で48時間培養した。マウス脾臓細胞1.0×106cellsを活性化培地(10%FBSを含むRPMI1640培地にブレフェルジンA20μg/ml、イオノマイシン2μg/mlおよびPMA20ng/mlを含む)1,000μlに懸濁し、37℃、5%CO2存在下で4時間培養し、細胞内にサイトカインを産生および蓄積させた。培養したマウス脾臓細胞をHBSSで遠心洗浄(4℃、2,000rpm、3分間)した後、ビオチン標識抗マウスCD4を1μl添加し、4℃で15分間反応させた。さらに、ストレプトアビジン−PE/Cy5を1μl添加して4℃、遮光下で15分間放置した。反応液をHBSSで洗浄(4℃、2,000rpm、3分間)後、IntraPrepTMReagent1を100μl加え、室温遮光下で15分間放置し細胞を固定した。HBSSで洗浄(4℃、2,000rpm、3分間)後、IntraPrepTMReagent2を100μl加え、室温遮光下で5分間反応させ膜透過処理を行った。次いで、抗マウスIL−4を1μl添加し、4℃遮光下で15分間放置した。反応液をHBSSで洗浄(4℃、2,000rpm、3分間)後、Guava(R)Personal Cell Function Analyzer(PCA)を用いて、培養細胞中のTh2型細胞数の測定を行った。結果を図12に示す。
【0055】
図12より、ポリフェノール無添加と比較して、クロロゲン酸、ペラルゴニン、およびフェルラ酸を添加すると脾臓細胞中のTh2型細胞数が有意に減少した。
【0056】
(実験例11)
飼育期間終了後の鼻炎モデルマウスから無菌的に脾臓を採取し、上記と同様に脾臓細胞を1.0×106cells/mlになるよう調製し、脾臓細胞浮遊液とした。脾臓細胞浮遊液を、1mM EDTA、5%FBSを含むHank’s Balanced Salt Solution(HBSS)で遠心洗浄(4℃、2,000rpm、3分間)した。洗浄したマウス脾臓細胞1.0×106cellsを活性化培地(10%FBSを含むRPMI1640培地にブレフェルジンA20μg/ml、イオノマイシン2μg/mlおよびPMA20ng/mlを含む)1,000μlに懸濁し、37℃、5%CO2存在下で4時間培養し、細胞内にサイトカインを産生および蓄積させた。培養したマウス脾臓細胞をHBSSで遠心洗浄(4℃、2,000rpm、3分間)した後、ビオチン標識抗マウスCD117を1μl添加し、4℃で15分間反応させた。さらに、ストレプトアビジン−PE/Cy5を1μl添加して4℃、遮光下で15分間放置した。反応液をHBSSで洗浄(4℃、2,000rpm、3分間)後、IntraPrepTMReagent1を100μl加え、室温遮光下で15分間放置し細胞を固定した。HBSSで洗浄(4℃、2,000rpm、3分間)後、IntraPrepTMReagent2を100μl加え、室温遮光下で5分間反応させ膜透過処理を行った。次いで、IgEを測定するため、抗マウスFcεRIαを1μlを添加し、4℃遮光下で15分間放置した後、再度HBSSで遠心洗浄(4℃、2,000rpm、3分間)した。洗浄後、PE/Cy5−抗ヤギIgGを1μl添加して4℃、遮光下で15分間放置した。反応液をHBSSで洗浄(4℃、2,000rpm、3分間)後、Guava(R)Personal Cell Function Analyzer(PCA)を用いて、培養細胞中の肥満細胞数の測定を行った。結果を図13に示す。
また、6週齢、雄のC3H/HeN系マウスから無菌的に脾臓を採取し、上記と同様に脾臓細胞を1.0×106cells/mlになるよう調製し、脾臓細胞浮遊液とした。そこへデーツ抽出物中に検出された市販のポリフェノールを4μMになるように添加して、37℃、5%CO2存在下で48時間培養した。その後上記と同様の方法で測定した。結果を図14に示す。
【0057】
図13及び14より、デーツ抽出物を添加した飼料を投与したマウスでは、対照食と比較して脾臓中の肥満細胞(アレルギーの時ヒスタミンなどの炎症性化学物質を放出する細胞)が有意に低減した。特に、ペラルゴニンが、肥満細胞の数を減らす効果が高かった。
【0058】
(実験例12)
飼育期間終了後のアトピー性皮膚炎モデルマウスから無菌的に脾臓を採取し、遠心(10,000rpm、15秒)して細胞を回収し、TRIZOLを添加して細胞を破壊、クロロホルムおよびアルコールを用いてRNAを調製した。逆転写酵素を用いてcDNAを調製し、それを鋳型にヒスタミン放出関連遺伝子mRNAの発現量をリアルタイムPCRで測定した。
また、6週齢、雄のC3H/HeN系マウスから無菌的に脾臓を採取し、上記と同様に脾臓細胞を1.0×106cells/mlになるよう調製し、脾臓細胞浮遊液とした。そこへデーツ抽出物中に検出された市販のポリフェノールを4μMになるように添加して、37℃、5%CO2存在下で48時間培養した。その後上記と同様の方法で測定した。結果を図15乃至17に示す。
【0059】
図15乃至17より、デーツ抽出物を添加した飼料を投与したマウスでは、対照食と比較して脾臓中のヒスタミンなどの炎症性化学物質の放出を促進する遺伝子の発現が有意に低減した。また、肥満細胞内に発現するITKやBTKといった遺伝子(肥満細胞からヒスタミンが出る際に活性化する)を抑制した。特に、ITKを減らしたのはペラルゴニン、クロロゲン酸の作用で、BTKを減らしたのはペラルゴニンの作用と考えられる。
【特許請求の範囲】
【請求項1】
ペラルゴニン及びフェルラ酸のいずれか1以上を主成分とすることを特徴とする免疫賦活剤。
【請求項2】
マクロファージ増加機能を有する請求項1記載の免疫賦活剤。
【請求項3】
ナチュラルキラー(NK)細胞増加機能を有する請求項1記載の免疫賦活剤。
【請求項4】
IFN−γ分泌増加機能を有する請求項1記載の免疫賦活剤。
【請求項5】
プロトカテキュ酸、ペラルゴニン及びフェルラ酸のいずれか1以上を主成分とすることを特徴とする抗アレルギー剤。
【請求項6】
IgE産生抑制機能を有する請求項5記載の抗アレルギー剤。
【請求項7】
肥満細胞減少機能を有する請求項5記載の抗アレルギー剤。
【請求項8】
脱顆粒抑制機能を有する請求項5記載の抗アレルギー剤。
【請求項9】
ヒスタミンの放出を促進する遺伝子抑制機能を有する請求項5記載の抗アレルギー剤。
【請求項10】
デーツ由来のプロトカテキュ酸、ペラルゴニン、カフェ酸、フェルラ酸及びシリンガ酸のいずれか1以上が含まれていることを特徴とする食品。
【請求項11】
デーツ由来のプロトカテキュ酸、ペラルゴニン、カフェ酸、フェルラ酸及びシリンガ酸のいずれか1以上が含まれていることを特徴とする化粧品。
【請求項12】
デーツ由来のプロトカテキュ酸、ペラルゴニン、カフェ酸、フェルラ酸及びシリンガ酸のいずれか1以上が含まれていることを特徴とする医薬部外品。
【請求項13】
デーツ由来のプロトカテキュ酸、ペラルゴニン、カフェ酸、フェルラ酸及びシリンガ酸のいずれか1以上が含まれていることを特徴とする動物飼料。
【請求項1】
ペラルゴニン及びフェルラ酸のいずれか1以上を主成分とすることを特徴とする免疫賦活剤。
【請求項2】
マクロファージ増加機能を有する請求項1記載の免疫賦活剤。
【請求項3】
ナチュラルキラー(NK)細胞増加機能を有する請求項1記載の免疫賦活剤。
【請求項4】
IFN−γ分泌増加機能を有する請求項1記載の免疫賦活剤。
【請求項5】
プロトカテキュ酸、ペラルゴニン及びフェルラ酸のいずれか1以上を主成分とすることを特徴とする抗アレルギー剤。
【請求項6】
IgE産生抑制機能を有する請求項5記載の抗アレルギー剤。
【請求項7】
肥満細胞減少機能を有する請求項5記載の抗アレルギー剤。
【請求項8】
脱顆粒抑制機能を有する請求項5記載の抗アレルギー剤。
【請求項9】
ヒスタミンの放出を促進する遺伝子抑制機能を有する請求項5記載の抗アレルギー剤。
【請求項10】
デーツ由来のプロトカテキュ酸、ペラルゴニン、カフェ酸、フェルラ酸及びシリンガ酸のいずれか1以上が含まれていることを特徴とする食品。
【請求項11】
デーツ由来のプロトカテキュ酸、ペラルゴニン、カフェ酸、フェルラ酸及びシリンガ酸のいずれか1以上が含まれていることを特徴とする化粧品。
【請求項12】
デーツ由来のプロトカテキュ酸、ペラルゴニン、カフェ酸、フェルラ酸及びシリンガ酸のいずれか1以上が含まれていることを特徴とする医薬部外品。
【請求項13】
デーツ由来のプロトカテキュ酸、ペラルゴニン、カフェ酸、フェルラ酸及びシリンガ酸のいずれか1以上が含まれていることを特徴とする動物飼料。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【図17】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【図17】


【公開番号】特開2012−240996(P2012−240996A)
【公開日】平成24年12月10日(2012.12.10)
【国際特許分類】
【出願番号】特願2011−115538(P2011−115538)
【出願日】平成23年5月24日(2011.5.24)
【新規性喪失の例外の表示】特許法第30条第1項適用申請有り 平成23年4月25日社団法人日本栄養・食糧学会発行の第65回日本栄養・食糧学会大会講演要旨集において発表
【出願人】(000118615)伊那食品工業株式会社 (95)
【出願人】(504180239)国立大学法人信州大学 (759)
【Fターム(参考)】
【公開日】平成24年12月10日(2012.12.10)
【国際特許分類】
【出願日】平成23年5月24日(2011.5.24)
【新規性喪失の例外の表示】特許法第30条第1項適用申請有り 平成23年4月25日社団法人日本栄養・食糧学会発行の第65回日本栄養・食糧学会大会講演要旨集において発表
【出願人】(000118615)伊那食品工業株式会社 (95)
【出願人】(504180239)国立大学法人信州大学 (759)
【Fターム(参考)】
[ Back to top ]

