免疫関連疾患を予防および治療するための組成物および方法
本発明はペプチドを含む免疫調節剤、重症敗血症または急性呼吸不全症候群(ARDS)などの免疫関連疾患を予防または治療するための薬剤学的組成物および方法、および抗炎症剤、抗菌剤、または免疫細胞自滅死の阻害剤に対するペプチドの用途に関する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、ペプチドを含む免疫調節剤、および重症敗血症、急性呼吸不全症候群(acute respiratory distress syndrome,ARDS)などの免疫関連疾患を予防または治療するための薬学組成物および方法、そして抗炎症剤、抗菌剤または免疫細胞自滅死(apoptosis)の阻害剤に関するペプチド用途に関する。
【背景技術】
【0002】
FPRは好中球、単球、マクロファージおよび樹枝状細胞などの食細胞(phagocytic cell)で発見される伝統的な化学走性物質の受容体として、G−蛋白質と結合する。3種類のFPR(FPR、FPR−類似(FPRL)1、およびFPRL2)と2種類のFPR(ヒトのFPRに対応するFPR1、およびヒトのFPRL1に対応するFPR2)がヒトおよびマウスでそれぞれ同定された。FPRファミリーの一員の活性化は白血球の化学走性による移動を誘導し、好中球および単球でスーパーオキサイド陰イオンの生成を通して殺菌活性を誘導する。食細胞で化学走性による移動を促進することができる合成ペプチドであるWKYMVmはFPRファミリー(マウスでFPR1およびFPR2、ヒトでFPR、FPRL1およびFPRL2)の一員に試験管内で結合し、スーパーオキサイド陰イオンの生成を通して単球および好中球の殺菌活性を増加させる。WKYMVmはまた、自滅死を防止することによって単球の生存率を向上させると報告された(非特許文献1)。したがって、かかる実験は微生物感染後、重症敗血症への進行でFPR作動剤(agonist)であるWKYMVmの治療効果および機能的メカニズムを研究し、かかる根拠は敗血症−誘導致死率の主要原因は制御されていない細菌感染であり、FPR活性化が免疫細胞および炎症細胞の殺菌活性を増加させるという考えに基づいたものである。
【0003】
最近の研究によれば、敗血症−誘導致死は初期敗血症(つまり、最初6時間)の間に先天的免疫システムの実質的な損傷により炎症反応の調節能がないのが伴われる。また、敗血症の間に過度なリンパ球の自滅死の結果で多くの器官破壊の臨床的兆候が現れる。さらに、最近の研究によれば、サイトカインの水準が敗血症の間に急激に変化し、特にTNF−α and IL−1βなどの前炎症性サイトカインの水準が急激に増加する。かかる考察は、重症敗血症または敗血症ショックによる致死を効果的に防止するためには、食細胞の殺菌活性を増加させ、前炎症性調節者の生成を阻害し、抗原−特異的後天性免疫反応を延長させる薬品が必要である。
【0004】
重症敗血症または敗血症ショックを有する多くの患者は積極的な治療にもかかわらず死ぬ。重症敗血症を予防する一つの方法は、エンドトキシンの中和であるが、かかる治療的介入の目標は逆説的である(非特許文献2)。プラセボ対照臨床試験で、エンドトキシンに対する単クローン抗体は重症グラム−陰性バクテリア敗血症を病む患者の死を止めることができなかった(非特許文献3)。微生物磁極源に関係なく炎症を治療するための他の付属治療法、例えば、直間接的に炎症調節者(血小板活性化因子の拮抗筋(非特許文献4)、再結合IL−1β受容体の拮抗筋(非特許文献5)、TNF−αに対する遺伝的に製造された水溶性受容体、およびTNF−αに対する単クローン抗体)の活性を遮断する治療法は、重症敗血症または敗血症ショックを有する患者の死を止めることができなかった(非特許文献6)。
【先行技術文献】
【非特許文献】
【0005】
【非特許文献1】Bae, Y.S., et al., J. Leukoc. Biol. 71:329〜338, 2002
【非特許文献2】Riedemann, N.C., et al., Nat. Med. 9:517〜524
【非特許文献3】Cohen, J. Br. Med. Bull. 55:212〜225, 1999
【非特許文献4】Dhainaut, J.F., et al., Crit. Care Med. 26:1963〜1971, 1998
【非特許文献5】Fisher, C.J. et al., JAMA. 271:1836〜1843, 1994
【非特許文献6】Riedemann, N.C., et al., Nat. Med. 9:517〜524, 2003
【発明の概要】
【発明が解決しようとする課題】
【0006】
本発明は、CLPで敗血症を誘導した後に、WKYMVmでFPRを活性化させ、食細胞の直接的および/またはIFN−γ−媒介殺菌活性化経路、IL−17生産の増加(up−regulation)によって部分的に調節される前炎症性調節者の生産を減少させた(down regulation)抗炎症活性効果、および免疫細胞における抗−自滅死効果などの多重治療経路を通してマウスで効果的にCLP−誘導致死を防止する。WKYMVmによるFPR活性化は、多重経路を通して微生物感染後、重症敗血症への進行を効果的に防止する。したがって、FPR活性化は、敗血症治療のための新たな且つ効果的な治療標的になり得る。
【0007】
本発明の発明者らは、トリプトファン−リシン−チロシン−メチオニン−バリン−D−メチオニン(Trp−Lys−Tyr−Met−Val−D−Met、WKYMVm)によるホルミルペプチド受容体(FPR)の活性化が死から保護し、肺炎症を阻害し、免疫細胞自滅死を防止し、殺菌活性を増加させることを糾明して本発明を完成した。
本発明の目的は、配列番号1で示されるトリプトファン−リシン−チロシン−メチオニン−バリン−D−メチオニン(WKYMVm)のアミノ酸配列からなるペプチドを含む免疫調節剤を提供することにある。
【0008】
本発明の他の目的は、WKYMVmのアミノ酸配列からなるペプチドを含む免疫調節剤を含有する薬学組成物であって、急性呼吸不全症(ARDS)または重症敗血症を予防または治療するための薬学組成物を提供することにある。
【0009】
本発明のさらに他の目的は、重症敗血症によって誘導される脾臓リンパ球または胸腺細胞の減少を阻害する、前記免疫調節剤を含有する薬学組成物を提供することにある。
【0010】
本発明のさらに他の目的は、WKYMVmのアミノ酸配列からなるペプチドを含む免疫調節剤を対象に治療学的有効量で投与することを含む対象の免疫反応を調節する方法を提供することにある。かかる方法における免疫反応の調節は、抗炎症反応、抗菌反応、免疫細胞自滅死阻害、または重症敗血症またはARDSの予防または治療に関連する。
【課題を解決するための手段】
【0011】
後述する詳細な説明で本明細書の一部分である図面を参照して説明する。図面において、類似する符号は文脈上異なって指示しない限り、通常類似する構成要素を意味する。詳細な説明で記述された実施例、図面、および請求の範囲は制限されるのを意味しない。本明細書で提示された主題の範囲または精神を逸脱しない他の具現例が活用されることができ、他の変形が可能である。
【0012】
本発明の一例は、配列番号1で示されるトリプトファン−リシン−チロシン−メチオニン−バリン−D−メチオニン(WKYMVm)のアミノ酸配列からなるペプチドを含む免疫調節剤を提供するものである。本発明のさらに他の一例は、WKYMVmのアミノ酸配列からなるペプチドを含む免疫調節剤を対象に治療学的有効量で投与することを含む対象の免疫反応を調節する方法に関するものである。
【0013】
WKYMVmペプチドは、マウスでホルミルペプチド受容体1(FPR1)およびホルミルペプチド受容体2(FPR2)、およびヒトではFPR、FPRL1およびFPRL2に結合して活性化させることによって、対象で免疫反応を調節する。WKYMVmはFPRファミリー受容体に結合すると報告されたため、他のFPRリガンドに対する治療効果を評価したが、WKYMVmペプチドは治療効果がなかった(図1G)。
【0014】
また、前記ペプチドは、インターロイキン−1β(IL−1β)、腫よう死滅因子TNF−α(TNF−α)、またはインターロイキン−6(IL−6)などの炎症性サイトカインの発現を減少させ、インターフェロン−γ(IFN−γ)、インターロイキン−2(IL−2)、またはインターロイキン−12(IL−12)などのTh1サイトカインの発現を増加させる。前記ペプチドは、インターロイキン−17(IL−17)の発現を増加させ、転換成長因子−β(TGF−β)またはIL−10などの抗炎症サイトカインの発現を増加させる。
【0015】
WKYMVmペプチドは、前炎症性サイトカインの生産が減少するように調節し、FPR活性化は、前炎症性サイトカインの生産の直接的阻害を通して急性炎症を防止することによって治療効果を現わすため、WKYMVmは抗炎症剤として使用される。
【0016】
本発明によれば、免疫反応の調節はまた、免疫細胞の自滅死を阻害することを含む。
【0017】
WKYMVmによるFPR活性化は、腹膜液から細菌の除去に影響を与え、向上された細菌除去と関連のあるH2O2の生産を向上させる。したがって、WKYMVmペプチドは抗菌剤として使用される。CLPで敗血症を誘導した後WKYMVmによるFPR活性化は、食細胞の直接的および/またはIFN−γ−媒介殺菌活性化経路、IL−17生産の増加(up−regulation)によって部分的に調節される前炎症性調節者の生産を減少させた(down regulation)抗炎症活性効果、および免疫細胞における抗−自滅死効果などの多重治療経路を通して、マウスでCLP−誘導致死を効果的に防止する。WKYMVm(配列番号1)によるFPR活性化は、多重経路を通して微生物感染以降に重症敗血症へ進行されることを効果的に防止する。したがって、FPR活性化は重症敗血症および急性呼吸不全症の治療のための新たな且つ効果的な治療標的になり得る。WKYMVmペプチドの抗炎症剤、抗菌剤、または免疫細胞自滅死の阻害剤は、炎症性サイトカインの発現減少およびTh1サイトカインの増加による、重症敗血症の予防および治療効果と主に関連する。また、IL−10、およびTFG−βおよびIL−10抗炎症サイトカインなどの抗炎症サイトカインのWKYMVmペプチドによる発現増加のような免疫調節活性は主にARDS予防および治療と関連する。
【0018】
WKYMVmペプチドとは異なり、WKYMVm類似体であるWRYMVm(配列番号2)、WKWMVm(配列番号3)、WKRMVm(配列番号4)、WKFMVm(配列番号5)、WHYMVm(配列番号6)、WKYMYm(配列番号7)、WKYMFm(配列番号8)、WKYMWm(配列番号9)、WKYMVV(配列番号10)、またはWKEMVm(配列番号11)は、実験的敗血症に対して治療効果がない(図1H)。
【0019】
好ましくは、WKYMVmペプチドはヒトで0.0064乃至6.4mg/kg・day、より好ましくは、0.064乃至0.64mg/kg・dayを投与することができる。前記投与量の範囲で、WKYMVmペプチドはWKYMVm類似体よりCLPのマウスのモデルでより優秀な治療効果を現わす。
【0020】
前記WKYMVmペプチドを活性成分として含む組成物は、食塩水、緩衝食塩水、デキストロース、水、グリセロールおよびエタノールからなる群より選択された1種以上の薬学的担体を含むことができ、前記担体は前記例示した担体に限定されない。
【0021】
前記活性成分は多様な関連因子を考慮して投与量を決定することができ、前記関連因子は治療状態、患者の症状の深刻性、他の薬品との併用投与(例えば、化学療法剤)、年齢、性別、個々の患者別体重、食べ物、投与時間、選択された投与経路、および組成物の含量などを含む。前記組成物は1日に1回または1〜3回で分割投与することができ、疾患の種類および重症度を考慮して投与経路および投与量を決定することができるが、好ましくは、12時間の間隔で1日2回投与することができる。
【0022】
本発明によるペプチドを含む前記組成物は、経口または非経口投与することができる。非経口投与は口以外の経路を通して薬品を投与することで、直腸、静脈、腹膜内、筋肉内、動脈内、経皮、経鼻、吸入、目および皮下で投与することができる。
前記ペプチドを含む薬学製剤は、経口投与形態、注射液、または局所製剤などのような如何なる形態にも製造することができる。前記製剤は、好ましくは、経口および注射投与形態(真溶液、懸濁液またはエマルジョン)に製造されることができ、最も好ましくは、タブレット(tablet)、カプセル、軟質カプセル、受容製剤、ピル(pill)、顆粒などのような経口製剤であってもよい。
【0023】
前記製剤を製造することにおいて、前記ペプチドは賦形剤なく軟質カプセルに充填されたり、担体と混合または希釈された後に適切な製剤形態に製造されることができる。前記適切な担体の例としては、デンプン、水、食塩水、リンゲル液、デキストロースなどがある。
【0024】
CLP敗血症誘導後、WKYMVmによるFPR活性化は、食細胞の直接的および/またはIFN−γ−媒介殺菌活性化経路、前炎症性調節者の生産を減少させること(down regulation)を通した抗炎症効果、および免疫細胞における抗−自滅死効果などの多重治療経路を通して、マウスでCLP−誘導致死を効果的に防止することができる。WKYMVmによるFPR活性化は、多重経路を通して微生物感染後、重症敗血症への進行を効果的に防止することができる。したがって、FPR活性化は、敗血症の治療のための新たな且つ効果的な治療標的になり得る。
【0025】
集中治療室で死亡の主要原因である重症敗血症は宿主の免疫反応が侵入した微生物との戦いに失敗する時に起きる。WKYMVmペプチドによるホルミルペプチド受容体(FPR)活性化は、盲腸結紮および穿孔(CLP)敗血症のマウスのモデルで死から保護し、肺炎症を防止し、免疫細胞自滅死を遮断し、殺菌活性を増加させる。WKYMVmによるFPR活性化は、試験管内(in vitro)でマウスの好中球によるH2O2生成および殺菌活性を増加させる。FPR活性化はまた、CLPのマウスでIFN−γの生産を増加させる。FPR活性化の治療および殺菌効果(bactericidal effect)はIFN−γ欠乏のマウスで部分的に逆転される反面、標的器官の炎症がない。これと対照的に、FPR活性化は、CLPのマウスでTNF−αおよびIL−1βの生産を阻害する。さらに、FPR活性化はグラム−陰性バクテリアで主な病原体−関連分子パターンであるLPSに誘導された前炎症性調節者の生産を阻害する。最後に、FPR活性化は、CLP−誘導免疫細胞自滅死を阻害し、かかる活性はCLP−誘導IFN−γ欠乏のマウスでは発生しない。かかる実験結果によれば、FPR活性化が多重経路を通して、微生物の感染後、重症敗血症へ進行されることを効果的に防止することを提示する。
【0026】
敗血症に伴う免疫性の減少調節(down regulation)はリンパ球自滅死の進行と関連する。したがって、敗血症−誘導リンパ球自滅死の阻害は良い治療標的になり得る。WKYMVmによるFPR活性化は優れた治療接近法になり得る。試験管内(in vitro)および生体内(in vivo)実験によれば、FPR活性化はLPS−誘導前炎症性サイトカインの生産を阻害する。かかる発見は、FPR活性化が前炎症性サイトカインの生産の直接的な阻害を通して急性炎症反応を防止することによってその治療的効果を現わすということを提示する。したがって、WKYMVmによるFPR活性化は敗血症治療において個別の前炎症性調節者を効果的に遮断することができる。
【発明の効果】
【0027】
前記で詳細に記述した通り、本発明によるWKYMVmまたはその類似体は、炎症性サイトカインであるIL−1β(interleukin−1β)、TNF−α(tumornecrosis factor−α)およびIL−6の発現減少、Th1サイトカインであるIFN−γ(interferon−γ)、IL−2およびIL−12の発現増加および反応性酸素の生成増加、敗血症によって誘発される脾臓リンパ球(splenocyte)または胸腺細胞(thymocyte)の減少抑制などの効果を現わすため、敗血症の治療剤として作用することができて敗血症の予防または治療に有用である。
【図面の簡単な説明】
【0028】
【図1A】動物のモデルで敗血症−誘導致死に対するWKYMVmの保護効果を示したものである。
【図1B】動物のモデルで敗血症−誘導致死に対するWKYMVmの保護効果を示したものである。
【図1C】動物のモデルで敗血症−誘導致死に対するWKYMVmの保護効果を示したものである。
【図1D】動物のモデルで敗血症−誘導致死に対するWKYMVmの保護効果を示したものである。
【図1E】動物のモデルで敗血症−誘導致死に対するWKYMVmの保護効果を示したものである。
【図1F】動物のモデルで敗血症−誘導致死に対するWKYMVmの保護効果を示したものである。
【図1G】他のFPRリガンドに対するWKYMVmおよびWKYMVm類似体の治療効果を示したものである。
【図1H】他のFPRリガンドに対するWKYMVmおよびWKYMVm類似体の治療効果を示したものである。
【図2A】CLP−誘導細菌コロニー数、脾臓リンパ球死滅および肺炎症に対するWKYMVmの効果を示したものである。
【図2B】CLP−誘導細菌コロニー数、脾臓リンパ球死滅および肺炎症に対するWKYMVmの効果を示したものである。
【図2C】CLP−誘導細菌コロニー数、脾臓リンパ球死滅および肺炎症に対するWKYMVmの効果を示したものである。
【図2D】CLP−誘導細菌コロニー数、脾臓リンパ球死滅および肺炎症に対するWKYMVmの効果を示したものである。
【図3A】WKYMVmがH2O2の生成を通して試験管内で殺菌活性を増加させることを示したものである。
【図3B】WKYMVmがH2O2の生成を通して試験管内で殺菌活性を増加させることを示したものである。
【図3C】WKYMVmがH2O2の生成を通して試験管内で殺菌活性を増加させることを示したものである。
【図3D】WKYMVmがH2O2の生成を通して試験管内で殺菌活性を増加させることを示したものである。
【図3E】WKYMVmがH2O2の生成を通して試験管内で殺菌活性を増加させることを示したものである。
【図4A】Th1およびTh2のマウスのモデルで不活性抗原に対する反応としてCLP−誘導脾臓リンパ球自滅死(apoptosis)および脾臓リンパ球の増殖に対するWKYMVmの効果を示したものである。
【図4B】Th1およびTh2のマウスのモデルで不活性抗原に対する反応としてCLP−誘導脾臓リンパ球自滅死(apoptosis)および脾臓リンパ球の増殖に対するWKYMVmの効果を示したものである。
【図4C】Th1およびTh2のマウスのモデルで不活性抗原に対する反応としてCLP−誘導脾臓リンパ球自滅死(apoptosis)および脾臓リンパ球の増殖に対するWKYMVmの効果を示したものである。
【図4D】Th1およびTh2のマウスのモデルで不活性抗原に対する反応としてCLP−誘導脾臓リンパ球自滅死(apoptosis)および脾臓リンパ球の増殖に対するWKYMVmの効果を示したものである。
【図4E】Th1およびTh2のマウスのモデルで不活性抗原に対する反応としてCLP−誘導脾臓リンパ球自滅死(apoptosis)および脾臓リンパ球の増殖に対するWKYMVmの効果を示したものである。
【図4F】Th1およびTh2のマウスのモデルで不活性抗原に対する反応としてCLP−誘導脾臓リンパ球自滅死(apoptosis)および脾臓リンパ球の増殖に対するWKYMVmの効果を示したものである。
【図5A】重症敗血症に対するWKYMVm−誘導保護において、IL−12およびIFN−γの役割を示したものである。
【図5B】重症敗血症に対するWKYMVm−誘導保護において、IL−12およびIFN−γの役割を示したものである。
【図5C】重症敗血症に対するWKYMVm−誘導保護において、IL−12およびIFN−γの役割を示したものである。
【図5D】重症敗血症に対するWKYMVm−誘導保護において、IL−12およびIFN−γの役割を示したものである。
【図5E】重症敗血症に対するWKYMVm−誘導保護において、IL−12およびIFN−γの役割を示したものである。
【図5F】重症敗血症に対するWKYMVm−誘導保護において、IL−12およびIFN−γの役割を示したものである。
【図5G】重症敗血症に対するWKYMVm−誘導保護において、IL−12およびIFN−γの役割を示したものである。
【図6A】炎症性サイトカインの生成の変化に与えるWKYMVmの役割を示したものである。
【図6B】炎症性サイトカインの生成の変化に与えるWKYMVmの役割を示したものである。
【図6C】炎症性サイトカインの生成の変化に与えるWKYMVmの役割を示したものである。
【図6D】炎症性サイトカインの生成の変化に与えるWKYMVmの役割を示したものである。
【図7A】WKYMVmの抗炎症効果がIL−17媒介経路に依存的であることを示すものである。
【図7B】WKYMVmの抗炎症効果がIL−17媒介経路に依存的であることを示すものである。
【図7C】WKYMVmの抗炎症効果がIL−17媒介経路に依存的であることを示すものである。
【図7D】WKYMVmの抗炎症効果がIL−17媒介経路に依存的であることを示すものである。
【図7E】WKYMVmの抗炎症効果がIL−17媒介経路に依存的であることを示すものである。
【発明を実施するための形態】
【0029】
以下、実施例を通して本発明をより詳しく説明する。しかしながら、これら実施例は如何なる方式でも本発明の範囲を制限するものと解釈されてはいけない。
【0030】
〔実施例1〕
〔1−1.CLPのマウスのモデルにおけるWKYMVmの治療効果〕
前記論文に記述した通り(Yan, J.J., Nat. Med. 10:161−167,2004)、雄性のWT ICRのマウスおよびIL−12R 2−、IFN−γ−欠乏およびWT C57BL/6のマウス(大韓民国、浦項工科大学教 Y.C. Sungから寄贈を受ける)を敗血症のモデルの動物として使用した。動物関連のすべての実験は東亜大学校の動物管理及び利用に関する臨床審議委員会のガイドラインに従い、その承認を受けた。CLPのために、マウスをペントタールナトリウム(腹膜内注入、50mg/Kg)で麻酔させ、腹部正中線を若干切除して盲腸を露出させた。前記盲腸を回盲弁(ileocecal valve)の下部を結紮した後、盲腸に22ゲージの針で両面にわたって2度穿孔し(またはサイトカインの生産量の測定のために1度)腹部を縫合した。シャム(Sham)CLPのマウスも前記方法と同様に行ったが、盲腸の結紮および穿孔を行わなかった。10日間、1日1回生存率を観察した。
【0031】
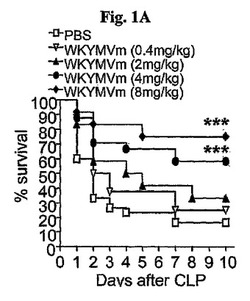
実験的敗血症に対するWKYMVmの治療効果を調査するために、アルビノICR(癌研究センター、Institute of Cancer Research)マウスに対してもCLPを行い、生存率を10日まで観察した。CLP後2日目、マウスの致死率が急激に増加した(図1A)。CLP手術後、2、14、26、および38時間経過時に多様な濃度でWKYMVmをCLPのマウスに4回皮下注射した。
【0032】
WKYMVmの治療効果を調査するために、陰性対照群として多様な濃度のペプチドまたはPBSをCLP後2時間から始めて皮下に注射した。PBS投与群に比べて4または8mg/kgのWKYMVm投与群で顕著にマウスの生存率が増加した(図1A)。CLP遂行後10時間目にWKYMVmを投与した場合、治療効果はCLP遂行後2時間目にペプチドを投与した場合と類似していた(図1B)。多様な濃度のWKYMVmを皮下に4回、CLPのマウスにCLP遂行後10、22、34および48時間目に投与した。
【0033】
注射の頻度面において、4mg/kgのWKYMVmをCLP遂行後2時間目に投与し、12時間の間隔で3または4回追加投与した場合に生存率が大きく増加した(図1C)。WKYMVm(4mg/kg、皮下注射)を0、1、2、3、4、または5回CLPのマウスに注入した。前記結果から、以降の実験は、4mg/kgのWKYMVmをCLP遂行後2時間目に投与し、12時間の間隔で3回追加投与したCLPのマウスを使用して行った。
【0034】
FPR1およびFPR2の機能を評価するために、FPR1拮抗剤[N−t−butoxycarbonyl−Phe−Leu−Phe−Leu−Phe(Boc−PLPLP)(配列番号12)](La, M., et al., FASEB J. 15:2247〜2256)、およびFPR2拮抗剤[Trp−Arg−Trp−Trp−Trp−Trp;WRWWWW(WRW4)(配列番号13)](Bae, Y.S et al., J. Immunol. 173:607〜614.)をCLPのマウスにWKYMVm投与前に投与した。WRW4を先に投与した場合、WKYMVmの治療効果は完全に逆転され、Boc−PLPLPを先に投与した場合には部分的にのみ逆転された(図1D)。CLPを行う2時間前にBoc−PLPLP(4mg/kg)、WRW4(4mg/kg)、またはBoc−PLPLP(4mg/kg)+WRW4(4mg/kg)を皮下で投与した。CLPを行った後に、Boc−PLPLP(4mg/kg)またはWRW4(4mg/kg)をWKYMVm処理する(4mg/kg、皮下投与)2時間前に12時間の間隔で4回皮下投与した。
【0035】
統計分析:生存データをlog−rankテスト法で分析した。すべての他のデータはANOVAを使用して分析した。Bonferroniテストを使用して事後比較を行い、統計的有意性はP<0.05で先験的設定した。
【0036】
〔1−2:大腸菌(E.coli)接種のマウスのモデルでWKYMVmの治療効果〕
マウスに大腸菌(1×109細胞/マウス)を腹膜内投与した後、2、14、26、および38時間にWKYMVm(4mg/kg)を4回皮下注射した。本実施例はまた、他の敗血症のマウスのモデルでWKYMVmの治療効果を評価した。PBSを投与した大腸菌接種のマウスに比べて、大腸菌(1×109)を接種し接種後2時間目から始めて12時間の間隔で4mg/kgのWKYMVmを4回皮下投与したマウスで致死率が減少した(図1E)。
【0037】
〔1−3:LPSを注射したマウスのモデルでWKYMVmの治療効果〕
さらに、WKYMVmはまた、60mg/kgのLPSを腹膜内に注射したマウスの致死率を減少させた(図1F)。60mg/kgのLPSを腹膜内投与した後、2、14、26および38時間目にPBSまたはWKYMVm(4mg/kg)を皮下で4回注射した。実験結果は平均±標準誤差で示した。溶媒対照群(a〜g)に比べて、*P<0.05;**P<0.01;***P<0.001であり、サンプルの大きさn=16〜24(a〜e)またはn=8(f、g)マウス/グループである。
【0038】
〔比較例1〕
〔1−1:FPRリガンドに対するWKYMVmの治療効果〕
WKYMVmはFPRファミリー受容体に結合するため、他のFPRリガンドの治療効果も評価した。Trp−Lys−Tyr−Met−Val−Met(WKYMVM)(配列番号14)(Baek, S.H., et al., J. Biol. Chem. 271:8170〜8175)、N−formyl−Met−Leu−Phe(fMLF)(配列番号15)、およびMMK−1ペプチド(LESIFRSLLFRVM)(配列番号16)(Klein, C., et al., Nat. Biotechnol. 16:1334〜1337)の治療効果はWKYMVmより低かった(図1G)。
【0039】
また、不活性スクランブルペプチドであるVal−Trp−Met−Tyr−D−Met−Lys(VWMYmK)(配列番号17)は治療効果がなかった(図1G)。FPR−ファミリー作用剤(WKYMVm(配列番号1)、WKYMVM(配列番号14)、fMLF(配列番号15)、およびMMK−1(配列番号16))またはスクランブルペプチド(VWMYmK:配列番号17)(それぞれ4mg/kg)をCLPのマウスにCLP遂行後2、14、26、および38時間に4回皮下注射した。
【0040】
〔1−2.WKYMVm類似体の治療効果〕
WKYMVm(配列番号1)の類似体、WRYMVm(配列番号2)、WKWMVm(配列番号3)、WKRMVm(配列番号4)、WKFMVm(配列番号5)、WHYMVm(配列番号6)、WKYMYm(配列番号7)、WKYMFm(配列番号8)、WKYMWm(配列番号9)、WKYMVV(配列番号10)、およびWKEMVm(配列番号11)が実験的敗血症に対して治療効果があるかを検査するために、アルビノICRマウスにCLPを行い、10日まで生存率を観察した。CLP遂行後2日目に、マウスの致死率を急激に増加した(図1H)。WKYMVmまたはWKYMVmの各類似体4mg/kgをCLP遂行後2、14、26、および38時間目にCLPのマウスに4回皮下注射した(図1H)。
【0041】
〔実施例2〕
〔WKYMVmによる生存増加はバクテリアコロニー数、脾臓リンパ球死滅および肺炎症の減少と関連する〕
〔2−1.殺菌活性〕
CLP−誘導致死率が腹膜液内バクテリアコロニー数と相当に関連しているため、実験はWKYMVmによるFPR活性化が腹膜液から細菌の除去に影響を与えたかを調査した。WKYMVm投与はCLP後24時間目に腹膜内バクテリアコロニー数を99.8%まで急激に減少させた(図2A)。WKYMVm(4mg/kg)をCLPのマウスにCLP後2および14時間目に4回皮下注射した。シャム(Sham)、CLPまたはCLP+WKYMVm投与後24時間目に収集した腹膜洗浄液を血液寒天培地平板(blood−agar base plates)上に37℃で一晩中培養してコロニー形成ユニット(CFUs)の数を測定した。
【0042】
〔2−2.リンパ球自滅死の阻害〕
敗血症が広範囲なリンパ球自滅死を誘導するという観測から(Ayala, A., et al., Blood. 87:4261〜4275)、実験はまたWKYMVmが脾臓リンパ球死滅を予防することができるかを評価した。CLP遂行後24時間目に脾臓リンパ球死滅はWKYMVm投与によって顕著に阻害された(図2B)。WKYMVm(4mg/kg、皮下投与)がCLP後2および14時間目に投与され、脾臓リンパ球数をICRマウス内にCLP遂行後24時間目に測定した。
【0043】
〔2−3.抗炎症活性〕
敗血症後致死率は生命器官炎症と関連したと知られている。本発明者らはPBSを投与したCLP−誘導マウス内に急性肺炎症の標識である、湿/乾(wet/dry、W/D)重量比が顕著に増加したことを発見し、またこの標識がWKYMVm投与によって完全に逆転されたことを発見した(図2C)。肺浮腫の大きさは、従来記載された通り、肺のW/D重量比を測定して定量化した(Liu, D., et al., Inflamm. Res. 54:464〜470)。獲得した全体湿潤肺(wet lungs)の重量を測定し、オーブンに60℃で48時間置いた。その後、乾燥重量を測定し、W/D重量比を計算した。
【0044】
WKYMVm(4mg/kg、皮下投与)をCLP後2および14時間後に投与し、ICRマウス内のCLP後24時間目の肺のW/D重量比を測定した。実験結果は平均±標準誤差(a、bでn=16、cでn=5)で示す。*P<0.05;**P<0.01;***P<0.001。PBSまたはWKYMVm(4mg/kg、皮下投与)をCLP後2時間および14時間後に投与した。前記マウスは手術後24時間目に死んだ。
【0045】
また、組織学的分析はCLP−誘導肺炎症がWKYMVmによって完全に逆転されたことを示した(図2D)。前記肺はヘマトキシリンおよびエオシン(hematoxylin and eosin)(倍率、×100)で染色した。実験結果はグループ当り8匹のマウスの見本である。マウスにCLP手術を行い、PBSまたはWKYMVmを2時間後に4mg/kgの量で投与した。マウスは手術後24時間目に安楽死させ、肺を固定して切断し、形態学的分析のためにヘマトキシリンおよびエオシンで染色した。
【0046】
〔実施例3〕
〔WKYMVmは食細胞内の細菌の除去および過酸化水素の生産を向上させる〕
WKYMVm投与が試験管内殺菌活性を増加させるかを測定するために、マウスの好中球が1時間の間に大腸菌を摂取するようにし、その後20分間、0.1〜1000nMのWKYMVmで刺激した。これは投与量に依存して好中球の殺菌活性を顕著に向上させた(図3A)。付着された好中球はオプソニン化された(opsonized)大腸菌106と1時間培養し、溶媒(PBS)またはWKYMVm(0.1、1、10、100、および1000nM)で1時間刺激した。
【0047】
FPR1およびFPR2が好中球内に現れたため(データに現れない)、この実験はWKYMVm−誘導殺菌活性において、FPR1−1およびFPR2−媒介された経路の役割を調査した。WKYMVm投与前にBoc−PLPLPまたはWRW4で前処理された好中球は殺菌活性を顕著に阻害した(図3B)。マウスの好中球を従来記載されたヒストペイク(Histopaque)−1077溶液(Sigma)で末梢血から分離した(Bae, Y.S., et al., J. Immunol. 171:6807〜6813, 2003)。WKYMVm(100nM)を添加する30分前にBoc−PLPLP(10μM)、WRW4(10μM)、またはBoc−PLPLP(10μM)+WRW4(10μM)を添加した。その後、好中球内生菌の数を測定した。
【0048】
食細胞の殺菌効果がH2O2の生産と関連しているため、(Hampton, M.B., et al., Blood. 92:3007〜3017)、マウスの好中球内H2O2の生成に対するWKYMVmの影響を測定した。WKYMVmは100〜1000nMで最大反応で好中球内H2O2の生産を向上させた(図3C)。マウスの好中球を15分間溶媒(PBS)またはWKYMVm(1〜1000nM)で刺激した。シャム、CLP−、またはCLP+WKYMVm−投与されたマウスから分離した好中球を100nMのPMAに1時間の間、刺激した。正常のマウスから新たに分離した好中球をサイトカラシン(cytochalasin)B(5μM)の存在下で多様な濃度のWKYMVmで10分間刺激した。
【0049】
FPR1およびFPR2の役割を調査するために、WKYMVm(100nM)を10分間添加する前に好中球をBoc−PLPLP(10μM)、WRW4(10μM)、または溶媒(DMSO)と30分間前培養を行った。上澄み液内のH2O2はH2O2分析キット(Molecular Probes)で測定した。
【0050】
さらに、前記効果はBoc−PLPLPまたはWRW4で前処理することによって部分的に逆転された(図3D)。しかしながら、WKYMVm−誘導H2O2の生成はFPR1+FPR2拮抗剤に前処理することによって完全に逆転された(図3D)。WKYMVm(100nM)を添加する5分前にBoc−PLPLP(10μM)、WRW4(10μM)、またはBoc−PLPLP(10μM)+WRW4(10μM)を添加した。
【0051】
前記テストはCLP−誘導マウスから由来した好中球がPMAに応じて H2O2を生産することに失敗したことを発見した(図3E)。しかしながら、WKYMVmが投与されたCLP−誘導のマウスから由来した好中球内ではそれが投与されないものに比べてH2O2の生産が顕著に向上された(図3E)。PBSまたはWKYMVm(4mg/kg)をCLP後2時間および14時間目にCLPのマウス内に4回皮下注射した。CLP後24時間目に腹膜内好中球を分離した。シャム、CLP、またはCLP+WKYMVmマウスから分離した好中球をPMA(100nM)で30分間刺激した。実験結果は平均±標準誤差(a、bでn=8;c〜eでn=16)で示す。*P<0.05;**P<0.01;***P<0.001。
【0052】
好中球の殺菌活性は、Yan、 J.J., et al., Nat. Med. 10:161〜167, 2004.の方法により測定した。好中球は60−mmプラスチック培養ディッシュ(1×106好中球/カバースリップ)内の13−mmプラスチックカバースリップ上で1時間の間、37℃で培養した。付着されない細胞はPBSで隔離した。付着された好中球はオプソニン化された大腸菌106と1時間の培養した。貪食されない大腸菌を洗浄した後、いくつかの濃度のWKYMVmまたは溶媒との1時間の培養前および後に好中球内生菌数を測定した。死菌の比率は100×(1−WKYMVmの刺激後のCFU数/WKYMVmの刺激前のCFU数)で計算した。FPR1およびFPR2の役割を調査するために、WKYMVm(1μM)を1時間の間、添加する前に好中球をBoc−PLPLP(10μM)、WRW4(10μM)、または溶媒(DMSO)と30分間の前培養した。
【0053】
初期宿主−細菌の相互作用によって、先天的免疫体系の広範囲な活性化が行われ、これは宿主防御反応を調整する。食細胞を含む核心防御機作の一つは反応性酸素(reactive oxygen species)および酸化窒素などの細胞内毒性調節者(toxic mediators)の合成である。実験的結果はWKYMVmによるFPR活性化が、向上された細菌の除去と関連したH2O2の生産を向上させたことを明確に示す。FPR1およびFPR2はWKYMVmに対する受容体として知られている。FPR1およびFPR2に対する拮抗剤は好中球内WKYMVm−誘導H2O2の生産を顕著に阻害した。かかる結果はWKYMVmで向上された生存は食細胞の殺菌効果と関連し、これはFPR1およびFPR2によって媒介されることを提示する。かかる実験的結果はまた、WKYMVmで向上された生存は完全にFPR2経路に依存し、FPR1経路には単に部分的にのみ依存するということを示す。したがって、WKYMVmは食細胞の直接的な殺菌活性での役割以外に付加的な効果を有し、これは恐らくFPR2によって媒介される。
【0054】
〔実施例4〕
〔WKYMVmはCLP−誘導脾臓リンパ球自滅死を阻害し、不活性抗原に反応してTh1細胞の増殖を向上させる〕
〔4−1.Th1およびTh2のマウスで脾臓リンパ球の増殖の分析〕
Th1およびTh2のマウスのモデル(図4B)を作るために、6週齢のC57BL/6WTマウスを75μgのOVA+10μgのLPSまたは2mgの明礬(alum)で0および7日目に腹膜内2回免疫させ、その後50μgのOVAで14、15、および16日目に腹膜内免疫性検査を行った。分離された脾臓リンパ球をOVAと培養または培養せずに細胞増殖分析を行った。要約すれば、脾臓リンパ球はRPMI 1640培地で収穫し、96ウェルのフラットボトムプレート(96−well flat−bottom plates)で37℃で96時間、培地のみ、あるいは5、50または500μgのOVA/mlと培養した(2×105細胞/ウェル)。前記実施例は1μCi[3H]thymidineと72時間培養期間後に細胞のチミジン(thymidine)挿入を測定した。
【0055】
CLP−誘導敗血症は脾臓リンパ球自滅死を起こした;しかしながら、かかる作用はWKYMVmによって非常に効果的に阻害された(図4A)。WKYMVm(4mg/kg)をCLPのマウスにCLP後2および14時間目に4回皮下注射した。シャム、CLP+PBSまたはCLP+WKYMVmの投与後24時間目に収集した脾臓をTUNEL分析(上部)(倍率、×400)に使用した。TUNEL−陽性細胞を計数した(下部)。TUNEL分析は標準組織学的プロトコルを使用して最初に脱パラフィン化されたパラフィン包埋(paraffin−embedded)組織切片をもって行った。その後、前記切片を4℃で2分間のトリトン(Triton)X−100で透過し、TdT酵素およびジゴキシゲニン(digoxigenin)−dUTP反応バッファー(TUNEL)試薬で37℃で60分間満たした。死滅細胞(TUNEL−陽性細胞)の比率を光学顕微鏡下で脾臓リンパ球500個を計数して測定した。
【0056】
従来の文献はリンパ球自滅死がカスパーゼ−3(caspase−3)を含むいくつかの重要なカースパー剤によって媒介されるということを明らかにした(Hotchkiss, R.S., et al., Crit. Care Med. 27:1230〜1251, 1999)。これと類似して、CLP−誘導敗血症はカスパーゼ−3の活性化を増進させた反面、WKYMVmは非常に効果的にそれを阻害した(図4B)。(a)に表示されたマウスから由来した脾臓は分離されたカスパーゼ−3(cleaved−caspase−3)抗体と免疫組織化学に使用した(倍率、×100)。実験結果はグループ当り8匹のマウスの見本である(a、b)。本実施例は標準組織学的プロトコルを使用して最初に脱パラフィン化されたパラフィン包埋組織切片で免疫組織化学を行った。
【0057】
分離されたカスパーゼ−3に対する1次抗体と培養した後に(細胞信号(Cell Signaling))、蛍光色素と結合された2次抗体を有するすべての切片を染色した。
【0058】
WKYMVmはCLP後24時間目に腹膜液内IL−2の量を増加させた(図4C)。IL−2がT−細胞増殖を促進するため(Benczik, M., et al., Immunol. Invest. 33:109〜142)、WKYMVmによるFPR活性化のTh1およびTh2細胞増殖に対する効果を不活性抗原を使用して測定した。
【0059】
CLP後2、14、26および38時間目にWKYMVm(4mg/kg)をCLPのマウス内に4回皮下注射した。分離された動物グループにシャム、CLP+PBS、またはCLP+WKYMVmを投与した。実験結果は平均±標準誤差で示した(n=8)。CLP+PBSに比べて、*P<0.05;**P<0.01であった。C57BL/6 WTマウスは脾臓内にTh1およびTh2細胞らを作り出すためにそれぞれLPSまたは明礬にOVAを添加して腹膜内を免疫化させた(図4D)。
【0060】
以下、Th1およびTh2マウス(図4D)のためのプロトコルを記載した。OVA+LPS(e)またはOVA+明礬(f)で免疫化されたマウス内OVAで培養後72時間目に脾臓リンパ球増殖した。実験結果は平均±標準誤差で示し(e、fでn=5)、*はOVA+PBSグループに比べて、P<0.05であることを示し;**は他のグループに比べて、P<0.05であることを示す。Th1のマウスのモデルで、脾臓リンパ球増殖は72時間後にシャム−投与マウスに比べて、WKYMVm−投与マウスでは増進されたが、Boc−PLPLP−またはWRW4−投与マウスでは阻害された(図4E)。これと対照的に、Th2のモデルでは、脾臓リンパ球の増殖が72時間後にシャム−投与マウスに比べて、WKYMVm−投与マウスでは阻害され、拮抗剤−投与マウスでは増進された(図4F)。
【0061】
〔実施例5〕
〔WKYMVmの効果はIFN−γ−媒介経路に部分的に依存する〕
本発明者らはWKYMVmがCLP後24時間目に腹膜液内IL−12の水準を増加させたことを確認した(図5A)。反面、腹膜液内IFN−γの水準はCLP後8および24時間目に増加した(図5B)。CLP後2、14、26、および38時間目にCLPのマウス内にWKYMVm(4mg/kg)を4回皮下注射した。その後、腹膜液内に存在するサイトカインをELISA(BD Biosciences Pharmingen)で測定した。
【0062】
分離された動物グループにシャム、CLP+PBS、またはCLP+WKYMVmを投与した。a,IL−12;b,IFN−γ;実験結果は平均±標準誤差で示す(a、bでn=8)。CLP+PBSに比べて、*P<0.05;**P<0.01であった。腹膜洗浄液内CLP−誘導サイトカインを測定するために、マウスにWKYMVmをCLP後2、14、26および38時間目に投与した。腹膜洗浄液をCLP後4時間から72時間の間の多様な時間帯に収集し、腹膜液内存在するサイトカインをELISA(BD Biosciences Pharmingen)で測定した。
【0063】
敗血症以降WKYMVm−誘導生存に対するTh1サイトカイン(IL−12およびIFN−γ)の役割を調査するために、CLPのモデルをIL−12Rβ2−およびIFN−γ−欠乏のマウス(C57BL/6背景)に適用させた。CLP−誘導致死率はWKYMVmを投与したWT C57BL/6マウスで顕著に減少したが(図5C)、その効果はIL−12Rβ2−およびIFN−γ−欠乏マウスで部分的に逆転された(図5Cおよび図5D)。WT C57BL/6またはIL−12Rβ2−欠乏のマウスにWKYMVm(4mg/kg)またはPBSをCLP後2、14、26、および38時間目にCLPのマウスに4回皮下注射した。図5Dで、WT C57BL/6またはIFN−γ−欠乏のマウスにWKYMVm(4mg/kg)またはPBSをCLP後2、14、26、および38時間目にCLPのマウスに4回皮下注射した。実験結果は平均±標準誤差で示す。溶媒に比べて、*P<0.05;**P<0.01であった(c、d)。n=グループ当り10〜16マウス(c、d)
【0064】
本実験はWKYMVm−誘導生存がTh1サイトカイン−媒介経路に部分的に依存したという発見に基づいて、殺菌活性、標的器官炎症および脾臓リンパ球自滅死もTh1サイトカイン−依存的であるかを測定した。腹膜液内細菌コロニー数はWKYMVmを投与したCLP−誘導WTのマウスに比べてWKYMVmを投与したCLP−誘導IFN−γ−欠乏のマウスでより高かった(図5E)。CLP後2および14時間目にCLPのマウスにWKYMVm(4mg/kg)を4回皮下注射した。CLPまたはCLP+WKYMVm投与後24時間目に収集した腹膜洗浄液を37℃で血液寒天培地平板上に一晩中培養してCFUの数を測定した。
【0065】
これと対照的に、W/D重量比はPBSを投与したCLP−誘導WT、IL−12R 2−およびIFN−γ−欠乏のマウスでより高かったが、この効果はWKYMVmを投与したCLP−誘導WT、IL−12Rβ2−およびIFN−γ−欠乏のマウスで完全に逆転された(図5F)。C57BL/6、IL−12Rβ2−欠乏およびIFN−γ−欠乏のマウス内CLP後24時間目にW/D重量比を測定するために肺を使用した。面白いことに、IL−12Rβ2−欠乏のマウス内CLPで誘導され、WKYMVmで逆転されたにもかかわらず、CLP−誘導脾臓リンパ球自滅死はIFN−γ−欠乏のマウス内で観測されなかった(図5G)。CLP後2および14時間目にCLPのマウス内にWKYMVm(4mg/kg)を4回皮下注射した。シャム、CLPまたはCLP+WKYMVm投与後、24時間目に収集された脾臓をTUNEL分析(左側)(倍率、×400)に使用した。TUNEL−陽性細胞を計数した(右側)。実験結果は平均±標準誤差で示す。*P<0.05;**P<0.01;***P<0.001であった(e〜gでn=8)。
【0066】
重症敗血症以降に、Th2サイトカインの水準が増加し、Th1サイトカインの水準が減少し、これが損傷された細胞免疫力をもたらすだろう(Kox, W.J., et al., Intensive Care Med. 26:S124〜S128, 2000)。したがって、Th1サイトカインの生産を増加させるためにデザインされた治療は腹膜炎以降重症敗血症の治療に有益であろう。自然殺害細胞(natural killer cell)および大食細胞(macrophage)などの、先天性免疫細胞およびTh1細胞がIFN−γを分泌する(Trinchieri, G. Curr. Opin. Immunol. 9:17〜23, 1997)。微生物に対する防御のためのIFN−γの特性は食細胞殺菌活性の刺激、クラスIおよびクラスIIのMHC分子を通した抗原提示の刺激、および白血球−内皮相互作用の結合を含む(Dighe, A.S., et al., Immunity. 3:657〜666, 1995)。重症敗血症はIFN−γ生産を低くめる調節(down−regulate)をする(Kox, W.J., Intensive Care Med. 26:S124〜S128, 2000)。ある臨床研究は再結合IFN−γを投与した敗血症患者が向上した臨床経過を示したことを立証した(Kox, W.J., et al., Arch. Intern. Med. 157:389〜393, 1997)。実験結果は敗血症のマウスのモデルでWKYMVmとFPR活性化に起因した増加されたIFN−γ生産を示す。さらに、FPR活性化は抗原を不活性化させるためにTh1細胞の増殖を増進させたが、Th2細胞増殖を阻害した。これと対照的に、FPR活性化の効果はIFN−γ欠乏のマウスで部分的に逆転された。生存効果はIFN−γ−欠乏のマウス内細菌コロニー数と陽の連関を示した。これはFPR活性化の生存および殺菌効果はFPR活性化以降IFN−γ生産に部分的に依存するということを提示する。
【0067】
〔実施例6〕
〔WKYMVmの抗炎症効果は前炎症性サイトカインの下降調節(down−regulation)に直接的に関連する〕
マウスの好中球(neutrophil)(3×106細胞/0.3ml)を24−ウェルのプレート内5%のFBSを含有しているRPMI 1640培地に置き、5%のCO2培養機内で37℃で維持した。その後、前記好中球をWKYMVm(0.1および1μM)の存在または不存在下で、LPS(100ng/ml)とそれぞれ3時間および6時間培養した。
【0068】
30分後に前記細胞にLPS(100ng/ml)を追加し、無細胞上澄み液(cell−free supernatant)を収集し、遠心分離した後、製造会社の方法によりELISA(BD Biosciences Pharmingen)でIL−1βまたはTNF−αを測定した。
【0069】
前炎症性サイトカインIL−1βおよびTNF−γの水準はWKYMVm投与されたCLP−誘導WTマウスの腹膜液内で顕著に減少した。WKYMVm(4mg/kg)をCLP後2、14、26、および38時間目にCLPのマウス内に4回皮下注射した。分離された動物グループにシャム、CLP+PBS、またはCLP+WKYMVmを投与した。a,IL−1β;b,TNF−α。実験結果は平均±標準誤差で示す(n=8)。CLP+PBSに比べて、*P<0.05であった(a、b)。
【0070】
かかる下降調節が前炎症性サイトカインの生産に対するWKYMVmの直接的な阻害効果によって発生されたかを測定するために、腹膜内に60mg/kgのLPSを投与した後、生体内(in vivo)前炎症性サイトカインの生産を測定した。LPSの投与後4時間目にIL−1βおよびTNF−αのプラズマ水準(plasma level)はPBSを投与したマウスに比べて、4mg/kgのWKYMVmを投与したマウスで顕著に減少した。LPSの60mg/kgを腹膜内に注射した後2時間目であるマウス内にWKYMVm(4mg/kg)を皮下注射した;4時間後にプラズマを収集した。IL−1βおよびTNF−αのプラズマ水準を測定した。
【0071】
また、マウスの好中球からLPS−誘導IL−1βおよびTNF−αの試験管内放出はWKYMVmの投与量に依存して阻害された(図6D)。マウスの好中球は30分間のPBSまたはWKYMVm(0.1および1μM)と前培養し、その後3時間の間、PBSまたはLPS(100ng/ml)で刺激した。IL−1βおよびTNF−αの水準をELISAで測定した(d)。実験結果は平均±標準誤差で示す(c、dでn=16)。*P<0.05;***P<0.001。
【0072】
敗血症に伴う免疫力の下降調節はリンパ球自滅死の進行と関連する;したがって、敗血症−誘導リンパ球自滅死の阻害は良い治療標的である。実際に、WKYMVmによるFPR活性化は脾臓内免疫細胞の自滅死を阻害した。最近の証拠はIFN−γが脾臓内抗原特異的Th1細胞で自滅死を誘導すると報告する(Berner, V., et al., Nat. Med. 13:354〜360, 2007)。実験的結果はまた、脾臓内免疫細胞自滅死はIFN−γに依存的であるということを示す。かかる発見は再結合IFN−γで敗血症を治療することは、IFN−γの治療効果を落とす副作用を誘発するということと、WKYMVmによるFPR活性化がより優れた治療的な接近法であるかもしれないということを提示する。
【0073】
如何なる環境下で、感染に対する多くの先天性免疫反応は複合的な器官不全(重症敗血症の臨床的な特徴)をもたらす細胞および組織損傷を誘発することができる。組織食細胞による微生物分子の認知は感染された組織へ血流を増加させ、局所血管(local blood vessel)の透過性を向上させ、感染部位へ炎症性細胞を集める伝染症因子の生産または放出を触発する。その結果は、WKYMVmによるFPR活性化が急性炎症に起因した生命器官障害と関連した、CLPで誘導されたIL−1βおよびTNF−γを含むいくつかの前炎症性サイトカインの生産を阻害することを示す。また、試験管内および生体内実験はFPR活性化がLPS−誘導前炎症性サイトカインの生産を阻害することを示す。かかる発見はFPR活性化が前炎症性サイトカインの生産の直接的な阻害を通して急性炎症を予防した上で、治療効果を発揮することを提示する。これは敗血症治療においてWKYMVmによるFPR活性化がそれぞれの前炎症性因子を防ぐよりはるかに優れていることを示す。
【0074】
〔実施例7〕
〔WKYMVmの抗炎症効果はIL−17−媒介経路に依存的である〕
WKYMVmはCLP後4時間目にすでに腹膜液内IL−17の水準を増加させた(図7A)。WKYMVmの投与はまた、CLP後8および12時間目からIL−10およびTGF−をそれぞれ増加させた(図7Bおよび図7C)。FPR活性化による向上した生存効果におけるIL−17の役割を調査するために、CLPのモデルをIL−17欠乏およびWT統制のマウス(C57BL/6背景)に適用した。本研究はWKYMVm投与で向上された生存はIL−17−欠乏のマウスで部分的に逆転されたことを示した(図7D)。FPR活性化の抗炎症効果におけるIL−17の役割側面から、WTのマウスでWKYMVmによって阻害された肺のW/D重量比はIL−17欠乏のマウスでは観測されなかった(図7E)。
【技術分野】
【0001】
本発明は、ペプチドを含む免疫調節剤、および重症敗血症、急性呼吸不全症候群(acute respiratory distress syndrome,ARDS)などの免疫関連疾患を予防または治療するための薬学組成物および方法、そして抗炎症剤、抗菌剤または免疫細胞自滅死(apoptosis)の阻害剤に関するペプチド用途に関する。
【背景技術】
【0002】
FPRは好中球、単球、マクロファージおよび樹枝状細胞などの食細胞(phagocytic cell)で発見される伝統的な化学走性物質の受容体として、G−蛋白質と結合する。3種類のFPR(FPR、FPR−類似(FPRL)1、およびFPRL2)と2種類のFPR(ヒトのFPRに対応するFPR1、およびヒトのFPRL1に対応するFPR2)がヒトおよびマウスでそれぞれ同定された。FPRファミリーの一員の活性化は白血球の化学走性による移動を誘導し、好中球および単球でスーパーオキサイド陰イオンの生成を通して殺菌活性を誘導する。食細胞で化学走性による移動を促進することができる合成ペプチドであるWKYMVmはFPRファミリー(マウスでFPR1およびFPR2、ヒトでFPR、FPRL1およびFPRL2)の一員に試験管内で結合し、スーパーオキサイド陰イオンの生成を通して単球および好中球の殺菌活性を増加させる。WKYMVmはまた、自滅死を防止することによって単球の生存率を向上させると報告された(非特許文献1)。したがって、かかる実験は微生物感染後、重症敗血症への進行でFPR作動剤(agonist)であるWKYMVmの治療効果および機能的メカニズムを研究し、かかる根拠は敗血症−誘導致死率の主要原因は制御されていない細菌感染であり、FPR活性化が免疫細胞および炎症細胞の殺菌活性を増加させるという考えに基づいたものである。
【0003】
最近の研究によれば、敗血症−誘導致死は初期敗血症(つまり、最初6時間)の間に先天的免疫システムの実質的な損傷により炎症反応の調節能がないのが伴われる。また、敗血症の間に過度なリンパ球の自滅死の結果で多くの器官破壊の臨床的兆候が現れる。さらに、最近の研究によれば、サイトカインの水準が敗血症の間に急激に変化し、特にTNF−α and IL−1βなどの前炎症性サイトカインの水準が急激に増加する。かかる考察は、重症敗血症または敗血症ショックによる致死を効果的に防止するためには、食細胞の殺菌活性を増加させ、前炎症性調節者の生成を阻害し、抗原−特異的後天性免疫反応を延長させる薬品が必要である。
【0004】
重症敗血症または敗血症ショックを有する多くの患者は積極的な治療にもかかわらず死ぬ。重症敗血症を予防する一つの方法は、エンドトキシンの中和であるが、かかる治療的介入の目標は逆説的である(非特許文献2)。プラセボ対照臨床試験で、エンドトキシンに対する単クローン抗体は重症グラム−陰性バクテリア敗血症を病む患者の死を止めることができなかった(非特許文献3)。微生物磁極源に関係なく炎症を治療するための他の付属治療法、例えば、直間接的に炎症調節者(血小板活性化因子の拮抗筋(非特許文献4)、再結合IL−1β受容体の拮抗筋(非特許文献5)、TNF−αに対する遺伝的に製造された水溶性受容体、およびTNF−αに対する単クローン抗体)の活性を遮断する治療法は、重症敗血症または敗血症ショックを有する患者の死を止めることができなかった(非特許文献6)。
【先行技術文献】
【非特許文献】
【0005】
【非特許文献1】Bae, Y.S., et al., J. Leukoc. Biol. 71:329〜338, 2002
【非特許文献2】Riedemann, N.C., et al., Nat. Med. 9:517〜524
【非特許文献3】Cohen, J. Br. Med. Bull. 55:212〜225, 1999
【非特許文献4】Dhainaut, J.F., et al., Crit. Care Med. 26:1963〜1971, 1998
【非特許文献5】Fisher, C.J. et al., JAMA. 271:1836〜1843, 1994
【非特許文献6】Riedemann, N.C., et al., Nat. Med. 9:517〜524, 2003
【発明の概要】
【発明が解決しようとする課題】
【0006】
本発明は、CLPで敗血症を誘導した後に、WKYMVmでFPRを活性化させ、食細胞の直接的および/またはIFN−γ−媒介殺菌活性化経路、IL−17生産の増加(up−regulation)によって部分的に調節される前炎症性調節者の生産を減少させた(down regulation)抗炎症活性効果、および免疫細胞における抗−自滅死効果などの多重治療経路を通してマウスで効果的にCLP−誘導致死を防止する。WKYMVmによるFPR活性化は、多重経路を通して微生物感染後、重症敗血症への進行を効果的に防止する。したがって、FPR活性化は、敗血症治療のための新たな且つ効果的な治療標的になり得る。
【0007】
本発明の発明者らは、トリプトファン−リシン−チロシン−メチオニン−バリン−D−メチオニン(Trp−Lys−Tyr−Met−Val−D−Met、WKYMVm)によるホルミルペプチド受容体(FPR)の活性化が死から保護し、肺炎症を阻害し、免疫細胞自滅死を防止し、殺菌活性を増加させることを糾明して本発明を完成した。
本発明の目的は、配列番号1で示されるトリプトファン−リシン−チロシン−メチオニン−バリン−D−メチオニン(WKYMVm)のアミノ酸配列からなるペプチドを含む免疫調節剤を提供することにある。
【0008】
本発明の他の目的は、WKYMVmのアミノ酸配列からなるペプチドを含む免疫調節剤を含有する薬学組成物であって、急性呼吸不全症(ARDS)または重症敗血症を予防または治療するための薬学組成物を提供することにある。
【0009】
本発明のさらに他の目的は、重症敗血症によって誘導される脾臓リンパ球または胸腺細胞の減少を阻害する、前記免疫調節剤を含有する薬学組成物を提供することにある。
【0010】
本発明のさらに他の目的は、WKYMVmのアミノ酸配列からなるペプチドを含む免疫調節剤を対象に治療学的有効量で投与することを含む対象の免疫反応を調節する方法を提供することにある。かかる方法における免疫反応の調節は、抗炎症反応、抗菌反応、免疫細胞自滅死阻害、または重症敗血症またはARDSの予防または治療に関連する。
【課題を解決するための手段】
【0011】
後述する詳細な説明で本明細書の一部分である図面を参照して説明する。図面において、類似する符号は文脈上異なって指示しない限り、通常類似する構成要素を意味する。詳細な説明で記述された実施例、図面、および請求の範囲は制限されるのを意味しない。本明細書で提示された主題の範囲または精神を逸脱しない他の具現例が活用されることができ、他の変形が可能である。
【0012】
本発明の一例は、配列番号1で示されるトリプトファン−リシン−チロシン−メチオニン−バリン−D−メチオニン(WKYMVm)のアミノ酸配列からなるペプチドを含む免疫調節剤を提供するものである。本発明のさらに他の一例は、WKYMVmのアミノ酸配列からなるペプチドを含む免疫調節剤を対象に治療学的有効量で投与することを含む対象の免疫反応を調節する方法に関するものである。
【0013】
WKYMVmペプチドは、マウスでホルミルペプチド受容体1(FPR1)およびホルミルペプチド受容体2(FPR2)、およびヒトではFPR、FPRL1およびFPRL2に結合して活性化させることによって、対象で免疫反応を調節する。WKYMVmはFPRファミリー受容体に結合すると報告されたため、他のFPRリガンドに対する治療効果を評価したが、WKYMVmペプチドは治療効果がなかった(図1G)。
【0014】
また、前記ペプチドは、インターロイキン−1β(IL−1β)、腫よう死滅因子TNF−α(TNF−α)、またはインターロイキン−6(IL−6)などの炎症性サイトカインの発現を減少させ、インターフェロン−γ(IFN−γ)、インターロイキン−2(IL−2)、またはインターロイキン−12(IL−12)などのTh1サイトカインの発現を増加させる。前記ペプチドは、インターロイキン−17(IL−17)の発現を増加させ、転換成長因子−β(TGF−β)またはIL−10などの抗炎症サイトカインの発現を増加させる。
【0015】
WKYMVmペプチドは、前炎症性サイトカインの生産が減少するように調節し、FPR活性化は、前炎症性サイトカインの生産の直接的阻害を通して急性炎症を防止することによって治療効果を現わすため、WKYMVmは抗炎症剤として使用される。
【0016】
本発明によれば、免疫反応の調節はまた、免疫細胞の自滅死を阻害することを含む。
【0017】
WKYMVmによるFPR活性化は、腹膜液から細菌の除去に影響を与え、向上された細菌除去と関連のあるH2O2の生産を向上させる。したがって、WKYMVmペプチドは抗菌剤として使用される。CLPで敗血症を誘導した後WKYMVmによるFPR活性化は、食細胞の直接的および/またはIFN−γ−媒介殺菌活性化経路、IL−17生産の増加(up−regulation)によって部分的に調節される前炎症性調節者の生産を減少させた(down regulation)抗炎症活性効果、および免疫細胞における抗−自滅死効果などの多重治療経路を通して、マウスでCLP−誘導致死を効果的に防止する。WKYMVm(配列番号1)によるFPR活性化は、多重経路を通して微生物感染以降に重症敗血症へ進行されることを効果的に防止する。したがって、FPR活性化は重症敗血症および急性呼吸不全症の治療のための新たな且つ効果的な治療標的になり得る。WKYMVmペプチドの抗炎症剤、抗菌剤、または免疫細胞自滅死の阻害剤は、炎症性サイトカインの発現減少およびTh1サイトカインの増加による、重症敗血症の予防および治療効果と主に関連する。また、IL−10、およびTFG−βおよびIL−10抗炎症サイトカインなどの抗炎症サイトカインのWKYMVmペプチドによる発現増加のような免疫調節活性は主にARDS予防および治療と関連する。
【0018】
WKYMVmペプチドとは異なり、WKYMVm類似体であるWRYMVm(配列番号2)、WKWMVm(配列番号3)、WKRMVm(配列番号4)、WKFMVm(配列番号5)、WHYMVm(配列番号6)、WKYMYm(配列番号7)、WKYMFm(配列番号8)、WKYMWm(配列番号9)、WKYMVV(配列番号10)、またはWKEMVm(配列番号11)は、実験的敗血症に対して治療効果がない(図1H)。
【0019】
好ましくは、WKYMVmペプチドはヒトで0.0064乃至6.4mg/kg・day、より好ましくは、0.064乃至0.64mg/kg・dayを投与することができる。前記投与量の範囲で、WKYMVmペプチドはWKYMVm類似体よりCLPのマウスのモデルでより優秀な治療効果を現わす。
【0020】
前記WKYMVmペプチドを活性成分として含む組成物は、食塩水、緩衝食塩水、デキストロース、水、グリセロールおよびエタノールからなる群より選択された1種以上の薬学的担体を含むことができ、前記担体は前記例示した担体に限定されない。
【0021】
前記活性成分は多様な関連因子を考慮して投与量を決定することができ、前記関連因子は治療状態、患者の症状の深刻性、他の薬品との併用投与(例えば、化学療法剤)、年齢、性別、個々の患者別体重、食べ物、投与時間、選択された投与経路、および組成物の含量などを含む。前記組成物は1日に1回または1〜3回で分割投与することができ、疾患の種類および重症度を考慮して投与経路および投与量を決定することができるが、好ましくは、12時間の間隔で1日2回投与することができる。
【0022】
本発明によるペプチドを含む前記組成物は、経口または非経口投与することができる。非経口投与は口以外の経路を通して薬品を投与することで、直腸、静脈、腹膜内、筋肉内、動脈内、経皮、経鼻、吸入、目および皮下で投与することができる。
前記ペプチドを含む薬学製剤は、経口投与形態、注射液、または局所製剤などのような如何なる形態にも製造することができる。前記製剤は、好ましくは、経口および注射投与形態(真溶液、懸濁液またはエマルジョン)に製造されることができ、最も好ましくは、タブレット(tablet)、カプセル、軟質カプセル、受容製剤、ピル(pill)、顆粒などのような経口製剤であってもよい。
【0023】
前記製剤を製造することにおいて、前記ペプチドは賦形剤なく軟質カプセルに充填されたり、担体と混合または希釈された後に適切な製剤形態に製造されることができる。前記適切な担体の例としては、デンプン、水、食塩水、リンゲル液、デキストロースなどがある。
【0024】
CLP敗血症誘導後、WKYMVmによるFPR活性化は、食細胞の直接的および/またはIFN−γ−媒介殺菌活性化経路、前炎症性調節者の生産を減少させること(down regulation)を通した抗炎症効果、および免疫細胞における抗−自滅死効果などの多重治療経路を通して、マウスでCLP−誘導致死を効果的に防止することができる。WKYMVmによるFPR活性化は、多重経路を通して微生物感染後、重症敗血症への進行を効果的に防止することができる。したがって、FPR活性化は、敗血症の治療のための新たな且つ効果的な治療標的になり得る。
【0025】
集中治療室で死亡の主要原因である重症敗血症は宿主の免疫反応が侵入した微生物との戦いに失敗する時に起きる。WKYMVmペプチドによるホルミルペプチド受容体(FPR)活性化は、盲腸結紮および穿孔(CLP)敗血症のマウスのモデルで死から保護し、肺炎症を防止し、免疫細胞自滅死を遮断し、殺菌活性を増加させる。WKYMVmによるFPR活性化は、試験管内(in vitro)でマウスの好中球によるH2O2生成および殺菌活性を増加させる。FPR活性化はまた、CLPのマウスでIFN−γの生産を増加させる。FPR活性化の治療および殺菌効果(bactericidal effect)はIFN−γ欠乏のマウスで部分的に逆転される反面、標的器官の炎症がない。これと対照的に、FPR活性化は、CLPのマウスでTNF−αおよびIL−1βの生産を阻害する。さらに、FPR活性化はグラム−陰性バクテリアで主な病原体−関連分子パターンであるLPSに誘導された前炎症性調節者の生産を阻害する。最後に、FPR活性化は、CLP−誘導免疫細胞自滅死を阻害し、かかる活性はCLP−誘導IFN−γ欠乏のマウスでは発生しない。かかる実験結果によれば、FPR活性化が多重経路を通して、微生物の感染後、重症敗血症へ進行されることを効果的に防止することを提示する。
【0026】
敗血症に伴う免疫性の減少調節(down regulation)はリンパ球自滅死の進行と関連する。したがって、敗血症−誘導リンパ球自滅死の阻害は良い治療標的になり得る。WKYMVmによるFPR活性化は優れた治療接近法になり得る。試験管内(in vitro)および生体内(in vivo)実験によれば、FPR活性化はLPS−誘導前炎症性サイトカインの生産を阻害する。かかる発見は、FPR活性化が前炎症性サイトカインの生産の直接的な阻害を通して急性炎症反応を防止することによってその治療的効果を現わすということを提示する。したがって、WKYMVmによるFPR活性化は敗血症治療において個別の前炎症性調節者を効果的に遮断することができる。
【発明の効果】
【0027】
前記で詳細に記述した通り、本発明によるWKYMVmまたはその類似体は、炎症性サイトカインであるIL−1β(interleukin−1β)、TNF−α(tumornecrosis factor−α)およびIL−6の発現減少、Th1サイトカインであるIFN−γ(interferon−γ)、IL−2およびIL−12の発現増加および反応性酸素の生成増加、敗血症によって誘発される脾臓リンパ球(splenocyte)または胸腺細胞(thymocyte)の減少抑制などの効果を現わすため、敗血症の治療剤として作用することができて敗血症の予防または治療に有用である。
【図面の簡単な説明】
【0028】
【図1A】動物のモデルで敗血症−誘導致死に対するWKYMVmの保護効果を示したものである。
【図1B】動物のモデルで敗血症−誘導致死に対するWKYMVmの保護効果を示したものである。
【図1C】動物のモデルで敗血症−誘導致死に対するWKYMVmの保護効果を示したものである。
【図1D】動物のモデルで敗血症−誘導致死に対するWKYMVmの保護効果を示したものである。
【図1E】動物のモデルで敗血症−誘導致死に対するWKYMVmの保護効果を示したものである。
【図1F】動物のモデルで敗血症−誘導致死に対するWKYMVmの保護効果を示したものである。
【図1G】他のFPRリガンドに対するWKYMVmおよびWKYMVm類似体の治療効果を示したものである。
【図1H】他のFPRリガンドに対するWKYMVmおよびWKYMVm類似体の治療効果を示したものである。
【図2A】CLP−誘導細菌コロニー数、脾臓リンパ球死滅および肺炎症に対するWKYMVmの効果を示したものである。
【図2B】CLP−誘導細菌コロニー数、脾臓リンパ球死滅および肺炎症に対するWKYMVmの効果を示したものである。
【図2C】CLP−誘導細菌コロニー数、脾臓リンパ球死滅および肺炎症に対するWKYMVmの効果を示したものである。
【図2D】CLP−誘導細菌コロニー数、脾臓リンパ球死滅および肺炎症に対するWKYMVmの効果を示したものである。
【図3A】WKYMVmがH2O2の生成を通して試験管内で殺菌活性を増加させることを示したものである。
【図3B】WKYMVmがH2O2の生成を通して試験管内で殺菌活性を増加させることを示したものである。
【図3C】WKYMVmがH2O2の生成を通して試験管内で殺菌活性を増加させることを示したものである。
【図3D】WKYMVmがH2O2の生成を通して試験管内で殺菌活性を増加させることを示したものである。
【図3E】WKYMVmがH2O2の生成を通して試験管内で殺菌活性を増加させることを示したものである。
【図4A】Th1およびTh2のマウスのモデルで不活性抗原に対する反応としてCLP−誘導脾臓リンパ球自滅死(apoptosis)および脾臓リンパ球の増殖に対するWKYMVmの効果を示したものである。
【図4B】Th1およびTh2のマウスのモデルで不活性抗原に対する反応としてCLP−誘導脾臓リンパ球自滅死(apoptosis)および脾臓リンパ球の増殖に対するWKYMVmの効果を示したものである。
【図4C】Th1およびTh2のマウスのモデルで不活性抗原に対する反応としてCLP−誘導脾臓リンパ球自滅死(apoptosis)および脾臓リンパ球の増殖に対するWKYMVmの効果を示したものである。
【図4D】Th1およびTh2のマウスのモデルで不活性抗原に対する反応としてCLP−誘導脾臓リンパ球自滅死(apoptosis)および脾臓リンパ球の増殖に対するWKYMVmの効果を示したものである。
【図4E】Th1およびTh2のマウスのモデルで不活性抗原に対する反応としてCLP−誘導脾臓リンパ球自滅死(apoptosis)および脾臓リンパ球の増殖に対するWKYMVmの効果を示したものである。
【図4F】Th1およびTh2のマウスのモデルで不活性抗原に対する反応としてCLP−誘導脾臓リンパ球自滅死(apoptosis)および脾臓リンパ球の増殖に対するWKYMVmの効果を示したものである。
【図5A】重症敗血症に対するWKYMVm−誘導保護において、IL−12およびIFN−γの役割を示したものである。
【図5B】重症敗血症に対するWKYMVm−誘導保護において、IL−12およびIFN−γの役割を示したものである。
【図5C】重症敗血症に対するWKYMVm−誘導保護において、IL−12およびIFN−γの役割を示したものである。
【図5D】重症敗血症に対するWKYMVm−誘導保護において、IL−12およびIFN−γの役割を示したものである。
【図5E】重症敗血症に対するWKYMVm−誘導保護において、IL−12およびIFN−γの役割を示したものである。
【図5F】重症敗血症に対するWKYMVm−誘導保護において、IL−12およびIFN−γの役割を示したものである。
【図5G】重症敗血症に対するWKYMVm−誘導保護において、IL−12およびIFN−γの役割を示したものである。
【図6A】炎症性サイトカインの生成の変化に与えるWKYMVmの役割を示したものである。
【図6B】炎症性サイトカインの生成の変化に与えるWKYMVmの役割を示したものである。
【図6C】炎症性サイトカインの生成の変化に与えるWKYMVmの役割を示したものである。
【図6D】炎症性サイトカインの生成の変化に与えるWKYMVmの役割を示したものである。
【図7A】WKYMVmの抗炎症効果がIL−17媒介経路に依存的であることを示すものである。
【図7B】WKYMVmの抗炎症効果がIL−17媒介経路に依存的であることを示すものである。
【図7C】WKYMVmの抗炎症効果がIL−17媒介経路に依存的であることを示すものである。
【図7D】WKYMVmの抗炎症効果がIL−17媒介経路に依存的であることを示すものである。
【図7E】WKYMVmの抗炎症効果がIL−17媒介経路に依存的であることを示すものである。
【発明を実施するための形態】
【0029】
以下、実施例を通して本発明をより詳しく説明する。しかしながら、これら実施例は如何なる方式でも本発明の範囲を制限するものと解釈されてはいけない。
【0030】
〔実施例1〕
〔1−1.CLPのマウスのモデルにおけるWKYMVmの治療効果〕
前記論文に記述した通り(Yan, J.J., Nat. Med. 10:161−167,2004)、雄性のWT ICRのマウスおよびIL−12R 2−、IFN−γ−欠乏およびWT C57BL/6のマウス(大韓民国、浦項工科大学教 Y.C. Sungから寄贈を受ける)を敗血症のモデルの動物として使用した。動物関連のすべての実験は東亜大学校の動物管理及び利用に関する臨床審議委員会のガイドラインに従い、その承認を受けた。CLPのために、マウスをペントタールナトリウム(腹膜内注入、50mg/Kg)で麻酔させ、腹部正中線を若干切除して盲腸を露出させた。前記盲腸を回盲弁(ileocecal valve)の下部を結紮した後、盲腸に22ゲージの針で両面にわたって2度穿孔し(またはサイトカインの生産量の測定のために1度)腹部を縫合した。シャム(Sham)CLPのマウスも前記方法と同様に行ったが、盲腸の結紮および穿孔を行わなかった。10日間、1日1回生存率を観察した。
【0031】
実験的敗血症に対するWKYMVmの治療効果を調査するために、アルビノICR(癌研究センター、Institute of Cancer Research)マウスに対してもCLPを行い、生存率を10日まで観察した。CLP後2日目、マウスの致死率が急激に増加した(図1A)。CLP手術後、2、14、26、および38時間経過時に多様な濃度でWKYMVmをCLPのマウスに4回皮下注射した。
【0032】
WKYMVmの治療効果を調査するために、陰性対照群として多様な濃度のペプチドまたはPBSをCLP後2時間から始めて皮下に注射した。PBS投与群に比べて4または8mg/kgのWKYMVm投与群で顕著にマウスの生存率が増加した(図1A)。CLP遂行後10時間目にWKYMVmを投与した場合、治療効果はCLP遂行後2時間目にペプチドを投与した場合と類似していた(図1B)。多様な濃度のWKYMVmを皮下に4回、CLPのマウスにCLP遂行後10、22、34および48時間目に投与した。
【0033】
注射の頻度面において、4mg/kgのWKYMVmをCLP遂行後2時間目に投与し、12時間の間隔で3または4回追加投与した場合に生存率が大きく増加した(図1C)。WKYMVm(4mg/kg、皮下注射)を0、1、2、3、4、または5回CLPのマウスに注入した。前記結果から、以降の実験は、4mg/kgのWKYMVmをCLP遂行後2時間目に投与し、12時間の間隔で3回追加投与したCLPのマウスを使用して行った。
【0034】
FPR1およびFPR2の機能を評価するために、FPR1拮抗剤[N−t−butoxycarbonyl−Phe−Leu−Phe−Leu−Phe(Boc−PLPLP)(配列番号12)](La, M., et al., FASEB J. 15:2247〜2256)、およびFPR2拮抗剤[Trp−Arg−Trp−Trp−Trp−Trp;WRWWWW(WRW4)(配列番号13)](Bae, Y.S et al., J. Immunol. 173:607〜614.)をCLPのマウスにWKYMVm投与前に投与した。WRW4を先に投与した場合、WKYMVmの治療効果は完全に逆転され、Boc−PLPLPを先に投与した場合には部分的にのみ逆転された(図1D)。CLPを行う2時間前にBoc−PLPLP(4mg/kg)、WRW4(4mg/kg)、またはBoc−PLPLP(4mg/kg)+WRW4(4mg/kg)を皮下で投与した。CLPを行った後に、Boc−PLPLP(4mg/kg)またはWRW4(4mg/kg)をWKYMVm処理する(4mg/kg、皮下投与)2時間前に12時間の間隔で4回皮下投与した。
【0035】
統計分析:生存データをlog−rankテスト法で分析した。すべての他のデータはANOVAを使用して分析した。Bonferroniテストを使用して事後比較を行い、統計的有意性はP<0.05で先験的設定した。
【0036】
〔1−2:大腸菌(E.coli)接種のマウスのモデルでWKYMVmの治療効果〕
マウスに大腸菌(1×109細胞/マウス)を腹膜内投与した後、2、14、26、および38時間にWKYMVm(4mg/kg)を4回皮下注射した。本実施例はまた、他の敗血症のマウスのモデルでWKYMVmの治療効果を評価した。PBSを投与した大腸菌接種のマウスに比べて、大腸菌(1×109)を接種し接種後2時間目から始めて12時間の間隔で4mg/kgのWKYMVmを4回皮下投与したマウスで致死率が減少した(図1E)。
【0037】
〔1−3:LPSを注射したマウスのモデルでWKYMVmの治療効果〕
さらに、WKYMVmはまた、60mg/kgのLPSを腹膜内に注射したマウスの致死率を減少させた(図1F)。60mg/kgのLPSを腹膜内投与した後、2、14、26および38時間目にPBSまたはWKYMVm(4mg/kg)を皮下で4回注射した。実験結果は平均±標準誤差で示した。溶媒対照群(a〜g)に比べて、*P<0.05;**P<0.01;***P<0.001であり、サンプルの大きさn=16〜24(a〜e)またはn=8(f、g)マウス/グループである。
【0038】
〔比較例1〕
〔1−1:FPRリガンドに対するWKYMVmの治療効果〕
WKYMVmはFPRファミリー受容体に結合するため、他のFPRリガンドの治療効果も評価した。Trp−Lys−Tyr−Met−Val−Met(WKYMVM)(配列番号14)(Baek, S.H., et al., J. Biol. Chem. 271:8170〜8175)、N−formyl−Met−Leu−Phe(fMLF)(配列番号15)、およびMMK−1ペプチド(LESIFRSLLFRVM)(配列番号16)(Klein, C., et al., Nat. Biotechnol. 16:1334〜1337)の治療効果はWKYMVmより低かった(図1G)。
【0039】
また、不活性スクランブルペプチドであるVal−Trp−Met−Tyr−D−Met−Lys(VWMYmK)(配列番号17)は治療効果がなかった(図1G)。FPR−ファミリー作用剤(WKYMVm(配列番号1)、WKYMVM(配列番号14)、fMLF(配列番号15)、およびMMK−1(配列番号16))またはスクランブルペプチド(VWMYmK:配列番号17)(それぞれ4mg/kg)をCLPのマウスにCLP遂行後2、14、26、および38時間に4回皮下注射した。
【0040】
〔1−2.WKYMVm類似体の治療効果〕
WKYMVm(配列番号1)の類似体、WRYMVm(配列番号2)、WKWMVm(配列番号3)、WKRMVm(配列番号4)、WKFMVm(配列番号5)、WHYMVm(配列番号6)、WKYMYm(配列番号7)、WKYMFm(配列番号8)、WKYMWm(配列番号9)、WKYMVV(配列番号10)、およびWKEMVm(配列番号11)が実験的敗血症に対して治療効果があるかを検査するために、アルビノICRマウスにCLPを行い、10日まで生存率を観察した。CLP遂行後2日目に、マウスの致死率を急激に増加した(図1H)。WKYMVmまたはWKYMVmの各類似体4mg/kgをCLP遂行後2、14、26、および38時間目にCLPのマウスに4回皮下注射した(図1H)。
【0041】
〔実施例2〕
〔WKYMVmによる生存増加はバクテリアコロニー数、脾臓リンパ球死滅および肺炎症の減少と関連する〕
〔2−1.殺菌活性〕
CLP−誘導致死率が腹膜液内バクテリアコロニー数と相当に関連しているため、実験はWKYMVmによるFPR活性化が腹膜液から細菌の除去に影響を与えたかを調査した。WKYMVm投与はCLP後24時間目に腹膜内バクテリアコロニー数を99.8%まで急激に減少させた(図2A)。WKYMVm(4mg/kg)をCLPのマウスにCLP後2および14時間目に4回皮下注射した。シャム(Sham)、CLPまたはCLP+WKYMVm投与後24時間目に収集した腹膜洗浄液を血液寒天培地平板(blood−agar base plates)上に37℃で一晩中培養してコロニー形成ユニット(CFUs)の数を測定した。
【0042】
〔2−2.リンパ球自滅死の阻害〕
敗血症が広範囲なリンパ球自滅死を誘導するという観測から(Ayala, A., et al., Blood. 87:4261〜4275)、実験はまたWKYMVmが脾臓リンパ球死滅を予防することができるかを評価した。CLP遂行後24時間目に脾臓リンパ球死滅はWKYMVm投与によって顕著に阻害された(図2B)。WKYMVm(4mg/kg、皮下投与)がCLP後2および14時間目に投与され、脾臓リンパ球数をICRマウス内にCLP遂行後24時間目に測定した。
【0043】
〔2−3.抗炎症活性〕
敗血症後致死率は生命器官炎症と関連したと知られている。本発明者らはPBSを投与したCLP−誘導マウス内に急性肺炎症の標識である、湿/乾(wet/dry、W/D)重量比が顕著に増加したことを発見し、またこの標識がWKYMVm投与によって完全に逆転されたことを発見した(図2C)。肺浮腫の大きさは、従来記載された通り、肺のW/D重量比を測定して定量化した(Liu, D., et al., Inflamm. Res. 54:464〜470)。獲得した全体湿潤肺(wet lungs)の重量を測定し、オーブンに60℃で48時間置いた。その後、乾燥重量を測定し、W/D重量比を計算した。
【0044】
WKYMVm(4mg/kg、皮下投与)をCLP後2および14時間後に投与し、ICRマウス内のCLP後24時間目の肺のW/D重量比を測定した。実験結果は平均±標準誤差(a、bでn=16、cでn=5)で示す。*P<0.05;**P<0.01;***P<0.001。PBSまたはWKYMVm(4mg/kg、皮下投与)をCLP後2時間および14時間後に投与した。前記マウスは手術後24時間目に死んだ。
【0045】
また、組織学的分析はCLP−誘導肺炎症がWKYMVmによって完全に逆転されたことを示した(図2D)。前記肺はヘマトキシリンおよびエオシン(hematoxylin and eosin)(倍率、×100)で染色した。実験結果はグループ当り8匹のマウスの見本である。マウスにCLP手術を行い、PBSまたはWKYMVmを2時間後に4mg/kgの量で投与した。マウスは手術後24時間目に安楽死させ、肺を固定して切断し、形態学的分析のためにヘマトキシリンおよびエオシンで染色した。
【0046】
〔実施例3〕
〔WKYMVmは食細胞内の細菌の除去および過酸化水素の生産を向上させる〕
WKYMVm投与が試験管内殺菌活性を増加させるかを測定するために、マウスの好中球が1時間の間に大腸菌を摂取するようにし、その後20分間、0.1〜1000nMのWKYMVmで刺激した。これは投与量に依存して好中球の殺菌活性を顕著に向上させた(図3A)。付着された好中球はオプソニン化された(opsonized)大腸菌106と1時間培養し、溶媒(PBS)またはWKYMVm(0.1、1、10、100、および1000nM)で1時間刺激した。
【0047】
FPR1およびFPR2が好中球内に現れたため(データに現れない)、この実験はWKYMVm−誘導殺菌活性において、FPR1−1およびFPR2−媒介された経路の役割を調査した。WKYMVm投与前にBoc−PLPLPまたはWRW4で前処理された好中球は殺菌活性を顕著に阻害した(図3B)。マウスの好中球を従来記載されたヒストペイク(Histopaque)−1077溶液(Sigma)で末梢血から分離した(Bae, Y.S., et al., J. Immunol. 171:6807〜6813, 2003)。WKYMVm(100nM)を添加する30分前にBoc−PLPLP(10μM)、WRW4(10μM)、またはBoc−PLPLP(10μM)+WRW4(10μM)を添加した。その後、好中球内生菌の数を測定した。
【0048】
食細胞の殺菌効果がH2O2の生産と関連しているため、(Hampton, M.B., et al., Blood. 92:3007〜3017)、マウスの好中球内H2O2の生成に対するWKYMVmの影響を測定した。WKYMVmは100〜1000nMで最大反応で好中球内H2O2の生産を向上させた(図3C)。マウスの好中球を15分間溶媒(PBS)またはWKYMVm(1〜1000nM)で刺激した。シャム、CLP−、またはCLP+WKYMVm−投与されたマウスから分離した好中球を100nMのPMAに1時間の間、刺激した。正常のマウスから新たに分離した好中球をサイトカラシン(cytochalasin)B(5μM)の存在下で多様な濃度のWKYMVmで10分間刺激した。
【0049】
FPR1およびFPR2の役割を調査するために、WKYMVm(100nM)を10分間添加する前に好中球をBoc−PLPLP(10μM)、WRW4(10μM)、または溶媒(DMSO)と30分間前培養を行った。上澄み液内のH2O2はH2O2分析キット(Molecular Probes)で測定した。
【0050】
さらに、前記効果はBoc−PLPLPまたはWRW4で前処理することによって部分的に逆転された(図3D)。しかしながら、WKYMVm−誘導H2O2の生成はFPR1+FPR2拮抗剤に前処理することによって完全に逆転された(図3D)。WKYMVm(100nM)を添加する5分前にBoc−PLPLP(10μM)、WRW4(10μM)、またはBoc−PLPLP(10μM)+WRW4(10μM)を添加した。
【0051】
前記テストはCLP−誘導マウスから由来した好中球がPMAに応じて H2O2を生産することに失敗したことを発見した(図3E)。しかしながら、WKYMVmが投与されたCLP−誘導のマウスから由来した好中球内ではそれが投与されないものに比べてH2O2の生産が顕著に向上された(図3E)。PBSまたはWKYMVm(4mg/kg)をCLP後2時間および14時間目にCLPのマウス内に4回皮下注射した。CLP後24時間目に腹膜内好中球を分離した。シャム、CLP、またはCLP+WKYMVmマウスから分離した好中球をPMA(100nM)で30分間刺激した。実験結果は平均±標準誤差(a、bでn=8;c〜eでn=16)で示す。*P<0.05;**P<0.01;***P<0.001。
【0052】
好中球の殺菌活性は、Yan、 J.J., et al., Nat. Med. 10:161〜167, 2004.の方法により測定した。好中球は60−mmプラスチック培養ディッシュ(1×106好中球/カバースリップ)内の13−mmプラスチックカバースリップ上で1時間の間、37℃で培養した。付着されない細胞はPBSで隔離した。付着された好中球はオプソニン化された大腸菌106と1時間の培養した。貪食されない大腸菌を洗浄した後、いくつかの濃度のWKYMVmまたは溶媒との1時間の培養前および後に好中球内生菌数を測定した。死菌の比率は100×(1−WKYMVmの刺激後のCFU数/WKYMVmの刺激前のCFU数)で計算した。FPR1およびFPR2の役割を調査するために、WKYMVm(1μM)を1時間の間、添加する前に好中球をBoc−PLPLP(10μM)、WRW4(10μM)、または溶媒(DMSO)と30分間の前培養した。
【0053】
初期宿主−細菌の相互作用によって、先天的免疫体系の広範囲な活性化が行われ、これは宿主防御反応を調整する。食細胞を含む核心防御機作の一つは反応性酸素(reactive oxygen species)および酸化窒素などの細胞内毒性調節者(toxic mediators)の合成である。実験的結果はWKYMVmによるFPR活性化が、向上された細菌の除去と関連したH2O2の生産を向上させたことを明確に示す。FPR1およびFPR2はWKYMVmに対する受容体として知られている。FPR1およびFPR2に対する拮抗剤は好中球内WKYMVm−誘導H2O2の生産を顕著に阻害した。かかる結果はWKYMVmで向上された生存は食細胞の殺菌効果と関連し、これはFPR1およびFPR2によって媒介されることを提示する。かかる実験的結果はまた、WKYMVmで向上された生存は完全にFPR2経路に依存し、FPR1経路には単に部分的にのみ依存するということを示す。したがって、WKYMVmは食細胞の直接的な殺菌活性での役割以外に付加的な効果を有し、これは恐らくFPR2によって媒介される。
【0054】
〔実施例4〕
〔WKYMVmはCLP−誘導脾臓リンパ球自滅死を阻害し、不活性抗原に反応してTh1細胞の増殖を向上させる〕
〔4−1.Th1およびTh2のマウスで脾臓リンパ球の増殖の分析〕
Th1およびTh2のマウスのモデル(図4B)を作るために、6週齢のC57BL/6WTマウスを75μgのOVA+10μgのLPSまたは2mgの明礬(alum)で0および7日目に腹膜内2回免疫させ、その後50μgのOVAで14、15、および16日目に腹膜内免疫性検査を行った。分離された脾臓リンパ球をOVAと培養または培養せずに細胞増殖分析を行った。要約すれば、脾臓リンパ球はRPMI 1640培地で収穫し、96ウェルのフラットボトムプレート(96−well flat−bottom plates)で37℃で96時間、培地のみ、あるいは5、50または500μgのOVA/mlと培養した(2×105細胞/ウェル)。前記実施例は1μCi[3H]thymidineと72時間培養期間後に細胞のチミジン(thymidine)挿入を測定した。
【0055】
CLP−誘導敗血症は脾臓リンパ球自滅死を起こした;しかしながら、かかる作用はWKYMVmによって非常に効果的に阻害された(図4A)。WKYMVm(4mg/kg)をCLPのマウスにCLP後2および14時間目に4回皮下注射した。シャム、CLP+PBSまたはCLP+WKYMVmの投与後24時間目に収集した脾臓をTUNEL分析(上部)(倍率、×400)に使用した。TUNEL−陽性細胞を計数した(下部)。TUNEL分析は標準組織学的プロトコルを使用して最初に脱パラフィン化されたパラフィン包埋(paraffin−embedded)組織切片をもって行った。その後、前記切片を4℃で2分間のトリトン(Triton)X−100で透過し、TdT酵素およびジゴキシゲニン(digoxigenin)−dUTP反応バッファー(TUNEL)試薬で37℃で60分間満たした。死滅細胞(TUNEL−陽性細胞)の比率を光学顕微鏡下で脾臓リンパ球500個を計数して測定した。
【0056】
従来の文献はリンパ球自滅死がカスパーゼ−3(caspase−3)を含むいくつかの重要なカースパー剤によって媒介されるということを明らかにした(Hotchkiss, R.S., et al., Crit. Care Med. 27:1230〜1251, 1999)。これと類似して、CLP−誘導敗血症はカスパーゼ−3の活性化を増進させた反面、WKYMVmは非常に効果的にそれを阻害した(図4B)。(a)に表示されたマウスから由来した脾臓は分離されたカスパーゼ−3(cleaved−caspase−3)抗体と免疫組織化学に使用した(倍率、×100)。実験結果はグループ当り8匹のマウスの見本である(a、b)。本実施例は標準組織学的プロトコルを使用して最初に脱パラフィン化されたパラフィン包埋組織切片で免疫組織化学を行った。
【0057】
分離されたカスパーゼ−3に対する1次抗体と培養した後に(細胞信号(Cell Signaling))、蛍光色素と結合された2次抗体を有するすべての切片を染色した。
【0058】
WKYMVmはCLP後24時間目に腹膜液内IL−2の量を増加させた(図4C)。IL−2がT−細胞増殖を促進するため(Benczik, M., et al., Immunol. Invest. 33:109〜142)、WKYMVmによるFPR活性化のTh1およびTh2細胞増殖に対する効果を不活性抗原を使用して測定した。
【0059】
CLP後2、14、26および38時間目にWKYMVm(4mg/kg)をCLPのマウス内に4回皮下注射した。分離された動物グループにシャム、CLP+PBS、またはCLP+WKYMVmを投与した。実験結果は平均±標準誤差で示した(n=8)。CLP+PBSに比べて、*P<0.05;**P<0.01であった。C57BL/6 WTマウスは脾臓内にTh1およびTh2細胞らを作り出すためにそれぞれLPSまたは明礬にOVAを添加して腹膜内を免疫化させた(図4D)。
【0060】
以下、Th1およびTh2マウス(図4D)のためのプロトコルを記載した。OVA+LPS(e)またはOVA+明礬(f)で免疫化されたマウス内OVAで培養後72時間目に脾臓リンパ球増殖した。実験結果は平均±標準誤差で示し(e、fでn=5)、*はOVA+PBSグループに比べて、P<0.05であることを示し;**は他のグループに比べて、P<0.05であることを示す。Th1のマウスのモデルで、脾臓リンパ球増殖は72時間後にシャム−投与マウスに比べて、WKYMVm−投与マウスでは増進されたが、Boc−PLPLP−またはWRW4−投与マウスでは阻害された(図4E)。これと対照的に、Th2のモデルでは、脾臓リンパ球の増殖が72時間後にシャム−投与マウスに比べて、WKYMVm−投与マウスでは阻害され、拮抗剤−投与マウスでは増進された(図4F)。
【0061】
〔実施例5〕
〔WKYMVmの効果はIFN−γ−媒介経路に部分的に依存する〕
本発明者らはWKYMVmがCLP後24時間目に腹膜液内IL−12の水準を増加させたことを確認した(図5A)。反面、腹膜液内IFN−γの水準はCLP後8および24時間目に増加した(図5B)。CLP後2、14、26、および38時間目にCLPのマウス内にWKYMVm(4mg/kg)を4回皮下注射した。その後、腹膜液内に存在するサイトカインをELISA(BD Biosciences Pharmingen)で測定した。
【0062】
分離された動物グループにシャム、CLP+PBS、またはCLP+WKYMVmを投与した。a,IL−12;b,IFN−γ;実験結果は平均±標準誤差で示す(a、bでn=8)。CLP+PBSに比べて、*P<0.05;**P<0.01であった。腹膜洗浄液内CLP−誘導サイトカインを測定するために、マウスにWKYMVmをCLP後2、14、26および38時間目に投与した。腹膜洗浄液をCLP後4時間から72時間の間の多様な時間帯に収集し、腹膜液内存在するサイトカインをELISA(BD Biosciences Pharmingen)で測定した。
【0063】
敗血症以降WKYMVm−誘導生存に対するTh1サイトカイン(IL−12およびIFN−γ)の役割を調査するために、CLPのモデルをIL−12Rβ2−およびIFN−γ−欠乏のマウス(C57BL/6背景)に適用させた。CLP−誘導致死率はWKYMVmを投与したWT C57BL/6マウスで顕著に減少したが(図5C)、その効果はIL−12Rβ2−およびIFN−γ−欠乏マウスで部分的に逆転された(図5Cおよび図5D)。WT C57BL/6またはIL−12Rβ2−欠乏のマウスにWKYMVm(4mg/kg)またはPBSをCLP後2、14、26、および38時間目にCLPのマウスに4回皮下注射した。図5Dで、WT C57BL/6またはIFN−γ−欠乏のマウスにWKYMVm(4mg/kg)またはPBSをCLP後2、14、26、および38時間目にCLPのマウスに4回皮下注射した。実験結果は平均±標準誤差で示す。溶媒に比べて、*P<0.05;**P<0.01であった(c、d)。n=グループ当り10〜16マウス(c、d)
【0064】
本実験はWKYMVm−誘導生存がTh1サイトカイン−媒介経路に部分的に依存したという発見に基づいて、殺菌活性、標的器官炎症および脾臓リンパ球自滅死もTh1サイトカイン−依存的であるかを測定した。腹膜液内細菌コロニー数はWKYMVmを投与したCLP−誘導WTのマウスに比べてWKYMVmを投与したCLP−誘導IFN−γ−欠乏のマウスでより高かった(図5E)。CLP後2および14時間目にCLPのマウスにWKYMVm(4mg/kg)を4回皮下注射した。CLPまたはCLP+WKYMVm投与後24時間目に収集した腹膜洗浄液を37℃で血液寒天培地平板上に一晩中培養してCFUの数を測定した。
【0065】
これと対照的に、W/D重量比はPBSを投与したCLP−誘導WT、IL−12R 2−およびIFN−γ−欠乏のマウスでより高かったが、この効果はWKYMVmを投与したCLP−誘導WT、IL−12Rβ2−およびIFN−γ−欠乏のマウスで完全に逆転された(図5F)。C57BL/6、IL−12Rβ2−欠乏およびIFN−γ−欠乏のマウス内CLP後24時間目にW/D重量比を測定するために肺を使用した。面白いことに、IL−12Rβ2−欠乏のマウス内CLPで誘導され、WKYMVmで逆転されたにもかかわらず、CLP−誘導脾臓リンパ球自滅死はIFN−γ−欠乏のマウス内で観測されなかった(図5G)。CLP後2および14時間目にCLPのマウス内にWKYMVm(4mg/kg)を4回皮下注射した。シャム、CLPまたはCLP+WKYMVm投与後、24時間目に収集された脾臓をTUNEL分析(左側)(倍率、×400)に使用した。TUNEL−陽性細胞を計数した(右側)。実験結果は平均±標準誤差で示す。*P<0.05;**P<0.01;***P<0.001であった(e〜gでn=8)。
【0066】
重症敗血症以降に、Th2サイトカインの水準が増加し、Th1サイトカインの水準が減少し、これが損傷された細胞免疫力をもたらすだろう(Kox, W.J., et al., Intensive Care Med. 26:S124〜S128, 2000)。したがって、Th1サイトカインの生産を増加させるためにデザインされた治療は腹膜炎以降重症敗血症の治療に有益であろう。自然殺害細胞(natural killer cell)および大食細胞(macrophage)などの、先天性免疫細胞およびTh1細胞がIFN−γを分泌する(Trinchieri, G. Curr. Opin. Immunol. 9:17〜23, 1997)。微生物に対する防御のためのIFN−γの特性は食細胞殺菌活性の刺激、クラスIおよびクラスIIのMHC分子を通した抗原提示の刺激、および白血球−内皮相互作用の結合を含む(Dighe, A.S., et al., Immunity. 3:657〜666, 1995)。重症敗血症はIFN−γ生産を低くめる調節(down−regulate)をする(Kox, W.J., Intensive Care Med. 26:S124〜S128, 2000)。ある臨床研究は再結合IFN−γを投与した敗血症患者が向上した臨床経過を示したことを立証した(Kox, W.J., et al., Arch. Intern. Med. 157:389〜393, 1997)。実験結果は敗血症のマウスのモデルでWKYMVmとFPR活性化に起因した増加されたIFN−γ生産を示す。さらに、FPR活性化は抗原を不活性化させるためにTh1細胞の増殖を増進させたが、Th2細胞増殖を阻害した。これと対照的に、FPR活性化の効果はIFN−γ欠乏のマウスで部分的に逆転された。生存効果はIFN−γ−欠乏のマウス内細菌コロニー数と陽の連関を示した。これはFPR活性化の生存および殺菌効果はFPR活性化以降IFN−γ生産に部分的に依存するということを提示する。
【0067】
〔実施例6〕
〔WKYMVmの抗炎症効果は前炎症性サイトカインの下降調節(down−regulation)に直接的に関連する〕
マウスの好中球(neutrophil)(3×106細胞/0.3ml)を24−ウェルのプレート内5%のFBSを含有しているRPMI 1640培地に置き、5%のCO2培養機内で37℃で維持した。その後、前記好中球をWKYMVm(0.1および1μM)の存在または不存在下で、LPS(100ng/ml)とそれぞれ3時間および6時間培養した。
【0068】
30分後に前記細胞にLPS(100ng/ml)を追加し、無細胞上澄み液(cell−free supernatant)を収集し、遠心分離した後、製造会社の方法によりELISA(BD Biosciences Pharmingen)でIL−1βまたはTNF−αを測定した。
【0069】
前炎症性サイトカインIL−1βおよびTNF−γの水準はWKYMVm投与されたCLP−誘導WTマウスの腹膜液内で顕著に減少した。WKYMVm(4mg/kg)をCLP後2、14、26、および38時間目にCLPのマウス内に4回皮下注射した。分離された動物グループにシャム、CLP+PBS、またはCLP+WKYMVmを投与した。a,IL−1β;b,TNF−α。実験結果は平均±標準誤差で示す(n=8)。CLP+PBSに比べて、*P<0.05であった(a、b)。
【0070】
かかる下降調節が前炎症性サイトカインの生産に対するWKYMVmの直接的な阻害効果によって発生されたかを測定するために、腹膜内に60mg/kgのLPSを投与した後、生体内(in vivo)前炎症性サイトカインの生産を測定した。LPSの投与後4時間目にIL−1βおよびTNF−αのプラズマ水準(plasma level)はPBSを投与したマウスに比べて、4mg/kgのWKYMVmを投与したマウスで顕著に減少した。LPSの60mg/kgを腹膜内に注射した後2時間目であるマウス内にWKYMVm(4mg/kg)を皮下注射した;4時間後にプラズマを収集した。IL−1βおよびTNF−αのプラズマ水準を測定した。
【0071】
また、マウスの好中球からLPS−誘導IL−1βおよびTNF−αの試験管内放出はWKYMVmの投与量に依存して阻害された(図6D)。マウスの好中球は30分間のPBSまたはWKYMVm(0.1および1μM)と前培養し、その後3時間の間、PBSまたはLPS(100ng/ml)で刺激した。IL−1βおよびTNF−αの水準をELISAで測定した(d)。実験結果は平均±標準誤差で示す(c、dでn=16)。*P<0.05;***P<0.001。
【0072】
敗血症に伴う免疫力の下降調節はリンパ球自滅死の進行と関連する;したがって、敗血症−誘導リンパ球自滅死の阻害は良い治療標的である。実際に、WKYMVmによるFPR活性化は脾臓内免疫細胞の自滅死を阻害した。最近の証拠はIFN−γが脾臓内抗原特異的Th1細胞で自滅死を誘導すると報告する(Berner, V., et al., Nat. Med. 13:354〜360, 2007)。実験的結果はまた、脾臓内免疫細胞自滅死はIFN−γに依存的であるということを示す。かかる発見は再結合IFN−γで敗血症を治療することは、IFN−γの治療効果を落とす副作用を誘発するということと、WKYMVmによるFPR活性化がより優れた治療的な接近法であるかもしれないということを提示する。
【0073】
如何なる環境下で、感染に対する多くの先天性免疫反応は複合的な器官不全(重症敗血症の臨床的な特徴)をもたらす細胞および組織損傷を誘発することができる。組織食細胞による微生物分子の認知は感染された組織へ血流を増加させ、局所血管(local blood vessel)の透過性を向上させ、感染部位へ炎症性細胞を集める伝染症因子の生産または放出を触発する。その結果は、WKYMVmによるFPR活性化が急性炎症に起因した生命器官障害と関連した、CLPで誘導されたIL−1βおよびTNF−γを含むいくつかの前炎症性サイトカインの生産を阻害することを示す。また、試験管内および生体内実験はFPR活性化がLPS−誘導前炎症性サイトカインの生産を阻害することを示す。かかる発見はFPR活性化が前炎症性サイトカインの生産の直接的な阻害を通して急性炎症を予防した上で、治療効果を発揮することを提示する。これは敗血症治療においてWKYMVmによるFPR活性化がそれぞれの前炎症性因子を防ぐよりはるかに優れていることを示す。
【0074】
〔実施例7〕
〔WKYMVmの抗炎症効果はIL−17−媒介経路に依存的である〕
WKYMVmはCLP後4時間目にすでに腹膜液内IL−17の水準を増加させた(図7A)。WKYMVmの投与はまた、CLP後8および12時間目からIL−10およびTGF−をそれぞれ増加させた(図7Bおよび図7C)。FPR活性化による向上した生存効果におけるIL−17の役割を調査するために、CLPのモデルをIL−17欠乏およびWT統制のマウス(C57BL/6背景)に適用した。本研究はWKYMVm投与で向上された生存はIL−17−欠乏のマウスで部分的に逆転されたことを示した(図7D)。FPR活性化の抗炎症効果におけるIL−17の役割側面から、WTのマウスでWKYMVmによって阻害された肺のW/D重量比はIL−17欠乏のマウスでは観測されなかった(図7E)。
【特許請求の範囲】
【請求項1】
配列番号1で示されるトリプトファン−リシン−チロシン−メチオニン−バリン−D−メチオニン(Trp−Lys−Tyr−Met−Val−D−Met、WKYMVm)のアミノ酸配列からなるペプチドを含む免疫調節剤。
【請求項2】
前記ペプチドは、マウスでホルミルペプチド受容体1(FPR1)またはホルミルペプチド受容体2(FPR2)と結合してこれらを活性化させる、請求項1に記載の免疫調節剤。
【請求項3】
前記ペプチドは、ヒトでFPR、FPRL1またはFPRL2と結合する、請求項1に記載の免疫調節剤。
【請求項4】
前記免疫調節剤は、インターロイキン−1β(IL−1β)、腫よう死滅因子−α(TNF−α)、またはインターロイキン−6(IL−6)である炎症性サイトカインの発現を減少させる、請求項1に記載の免疫調節剤。
【請求項5】
前記免疫調節剤はインターフェロン−γ(IFN−γ)、インターロイキン−2(IL−2)、またはインターロイキン−12(IL−12)であるTh1サイトカインの発現を増加させる、請求項1に記載の免疫調節剤。
【請求項6】
前記免疫調節剤は、インターロイキン−10(IL−10)の発現を増加させる、請求項1に記載の免疫調節剤
【請求項7】
前記免疫調節剤は、転換成長因子−β(TGF−β)またはインターロイキン−10(IL−10)である抗炎症性サイトカインの発現を増加させる、請求項1に記載の免疫調節剤。
【請求項8】
抗炎症剤、抗菌剤または免疫細胞自滅死の阻害剤として使用される、請求項1に記載の免疫調節剤。
【請求項9】
トリプトファン−リシン−チロシン−メチオニン−バリン−ジ−メチオニン(Trp−Lys−Tyr−Met−Val−D−Met、WKYMVm)のアミノ酸配列からなるペプチドを含む請求項1乃至請求項8のいずれか一項に記載の免疫調節剤を含む、重症敗血症または急性呼吸不全症候群(ARDS)の予防または治療用薬剤学的組成物。
【請求項10】
前記免疫調節剤は、重症敗血症によって誘導される脾臓リンパ球または胸腺細胞の減少を阻害する、請求項9に記載の薬剤学的組成物。
【請求項11】
前記重症敗血症は、炎症反応を伴う、請求項9に記載の薬剤学的組成物
【請求項12】
前記ペプチドは、0.0064乃至6.4mg/kg・dayの量で投与される、請求項9に記載の薬剤学的組成物。
【請求項13】
前記ペプチドは、0.064乃至0.64mg/kg・dayの量で投与される、請求項12に記載の薬剤学的組成物。
【請求項14】
前記組成物は、経口または非経口投与される、請求項9に記載の薬剤学的組成物。
【請求項15】
前記組成物は、薬剤学的に受容可能な担体または賦形剤をさらに含む、請求項9に記載の薬剤学的組成物。
【請求項16】
トリプトファン−リシン−チロシン−メチオニン−バリン−D−メチオニン(Trp−Lys−Tyr−Met−Val−D−Met、WKYMVm)のアミノ酸配列からなるペプチドを含む免疫調節剤を治療学的有効量で対象に投与することを含む、対象内免疫反応調節方法。
【請求項17】
前記ペプチドは、マウスでホルミルペプチド受容体1(FPR1)またはホルミルペプチド受容体2(FPR2)と結合してこれらを活性化させる、請求項16に記載の免疫反応調節方法。
【請求項18】
前記ペプチドは、ヒトでFPR、FPRL1またはFPRL2と結合および活性化させる、請求項16に記載の免疫反応調節方法。
【請求項19】
前記ペプチドは、インターロイキン−1β(IL−1β)、腫よう死滅因子−α(TNF−α)、またはインターロイキン−6(IL−6)である炎症性サイトカインの発現を減少させる、請求項16に記載の免疫反応調節方法。
【請求項20】
前記ペプチドは、インターフェロン−γ(IFN−γ)、インターロイキン−2(IL−2)、またはインターロイキン−12(IL−12)であるTh1サイトカインの発現を増加させる、請求項16に記載の免疫反応調節方法。
【請求項21】
前記ペプチドは、インターロイキン−17(IL−17)の発現を増加させる、請求項16に記載の免疫反応調節方法。
【請求項22】
前記ペプチドは、転換成長因子−β(TGF−β)またはインターロイキン−10(IL−10)である抗炎症性サイトカインの発現を増加させる、請求項16に記載の免疫反応調節方法。
【請求項23】
前記免疫反応調節は、抗炎症反応、抗菌反応、または免疫細胞自滅死の阻害を含む、請求項16に記載の免疫反応調節方法。
【請求項24】
前記免疫反応調節は、重症敗血症または急性呼吸不全症候群(ARDS)の予防または治療を含む、請求項16に記載の免疫反応調節方法。
【請求項25】
前記免疫反応調節は、重症敗血症によって誘導される脾臓リンパ球または胸腺細胞の減少を阻害することを含む、請求項16に記載の免疫反応調節方法。
【請求項26】
前記ペプチドは、0.0064乃至6.4mg/kg・dayの量で投与される、請求項16に記載の免疫反応調節方法。
【請求項27】
前記ペプチドは、0.064乃至0.64mg/kg・dayの量で投与される、請求項26に記載の免疫反応調節方法。
【請求項28】
前記ペプチドは、経口または非経口投与される、請求項16に記載の免疫反応調節方法。
【請求項1】
配列番号1で示されるトリプトファン−リシン−チロシン−メチオニン−バリン−D−メチオニン(Trp−Lys−Tyr−Met−Val−D−Met、WKYMVm)のアミノ酸配列からなるペプチドを含む免疫調節剤。
【請求項2】
前記ペプチドは、マウスでホルミルペプチド受容体1(FPR1)またはホルミルペプチド受容体2(FPR2)と結合してこれらを活性化させる、請求項1に記載の免疫調節剤。
【請求項3】
前記ペプチドは、ヒトでFPR、FPRL1またはFPRL2と結合する、請求項1に記載の免疫調節剤。
【請求項4】
前記免疫調節剤は、インターロイキン−1β(IL−1β)、腫よう死滅因子−α(TNF−α)、またはインターロイキン−6(IL−6)である炎症性サイトカインの発現を減少させる、請求項1に記載の免疫調節剤。
【請求項5】
前記免疫調節剤はインターフェロン−γ(IFN−γ)、インターロイキン−2(IL−2)、またはインターロイキン−12(IL−12)であるTh1サイトカインの発現を増加させる、請求項1に記載の免疫調節剤。
【請求項6】
前記免疫調節剤は、インターロイキン−10(IL−10)の発現を増加させる、請求項1に記載の免疫調節剤
【請求項7】
前記免疫調節剤は、転換成長因子−β(TGF−β)またはインターロイキン−10(IL−10)である抗炎症性サイトカインの発現を増加させる、請求項1に記載の免疫調節剤。
【請求項8】
抗炎症剤、抗菌剤または免疫細胞自滅死の阻害剤として使用される、請求項1に記載の免疫調節剤。
【請求項9】
トリプトファン−リシン−チロシン−メチオニン−バリン−ジ−メチオニン(Trp−Lys−Tyr−Met−Val−D−Met、WKYMVm)のアミノ酸配列からなるペプチドを含む請求項1乃至請求項8のいずれか一項に記載の免疫調節剤を含む、重症敗血症または急性呼吸不全症候群(ARDS)の予防または治療用薬剤学的組成物。
【請求項10】
前記免疫調節剤は、重症敗血症によって誘導される脾臓リンパ球または胸腺細胞の減少を阻害する、請求項9に記載の薬剤学的組成物。
【請求項11】
前記重症敗血症は、炎症反応を伴う、請求項9に記載の薬剤学的組成物
【請求項12】
前記ペプチドは、0.0064乃至6.4mg/kg・dayの量で投与される、請求項9に記載の薬剤学的組成物。
【請求項13】
前記ペプチドは、0.064乃至0.64mg/kg・dayの量で投与される、請求項12に記載の薬剤学的組成物。
【請求項14】
前記組成物は、経口または非経口投与される、請求項9に記載の薬剤学的組成物。
【請求項15】
前記組成物は、薬剤学的に受容可能な担体または賦形剤をさらに含む、請求項9に記載の薬剤学的組成物。
【請求項16】
トリプトファン−リシン−チロシン−メチオニン−バリン−D−メチオニン(Trp−Lys−Tyr−Met−Val−D−Met、WKYMVm)のアミノ酸配列からなるペプチドを含む免疫調節剤を治療学的有効量で対象に投与することを含む、対象内免疫反応調節方法。
【請求項17】
前記ペプチドは、マウスでホルミルペプチド受容体1(FPR1)またはホルミルペプチド受容体2(FPR2)と結合してこれらを活性化させる、請求項16に記載の免疫反応調節方法。
【請求項18】
前記ペプチドは、ヒトでFPR、FPRL1またはFPRL2と結合および活性化させる、請求項16に記載の免疫反応調節方法。
【請求項19】
前記ペプチドは、インターロイキン−1β(IL−1β)、腫よう死滅因子−α(TNF−α)、またはインターロイキン−6(IL−6)である炎症性サイトカインの発現を減少させる、請求項16に記載の免疫反応調節方法。
【請求項20】
前記ペプチドは、インターフェロン−γ(IFN−γ)、インターロイキン−2(IL−2)、またはインターロイキン−12(IL−12)であるTh1サイトカインの発現を増加させる、請求項16に記載の免疫反応調節方法。
【請求項21】
前記ペプチドは、インターロイキン−17(IL−17)の発現を増加させる、請求項16に記載の免疫反応調節方法。
【請求項22】
前記ペプチドは、転換成長因子−β(TGF−β)またはインターロイキン−10(IL−10)である抗炎症性サイトカインの発現を増加させる、請求項16に記載の免疫反応調節方法。
【請求項23】
前記免疫反応調節は、抗炎症反応、抗菌反応、または免疫細胞自滅死の阻害を含む、請求項16に記載の免疫反応調節方法。
【請求項24】
前記免疫反応調節は、重症敗血症または急性呼吸不全症候群(ARDS)の予防または治療を含む、請求項16に記載の免疫反応調節方法。
【請求項25】
前記免疫反応調節は、重症敗血症によって誘導される脾臓リンパ球または胸腺細胞の減少を阻害することを含む、請求項16に記載の免疫反応調節方法。
【請求項26】
前記ペプチドは、0.0064乃至6.4mg/kg・dayの量で投与される、請求項16に記載の免疫反応調節方法。
【請求項27】
前記ペプチドは、0.064乃至0.64mg/kg・dayの量で投与される、請求項26に記載の免疫反応調節方法。
【請求項28】
前記ペプチドは、経口または非経口投与される、請求項16に記載の免疫反応調節方法。
【図1A】


【図1B】


【図1C】


【図1D】


【図1E】


【図1F】


【図1G】


【図1H】


【図2A】


【図2B】


【図2C】


【図2D】


【図3A】


【図3B】


【図3C】


【図3D】


【図3E】


【図4A】


【図4B】


【図4C】


【図4D】


【図4E】


【図4F】


【図5A】


【図5B】


【図5C】


【図5D】


【図5E】


【図5F】


【図5G】


【図6A】


【図6B】


【図6C】


【図6D】


【図7A】


【図7B】


【図7C】


【図7D】


【図7E】




【図1B】


【図1C】


【図1D】


【図1E】


【図1F】


【図1G】


【図1H】


【図2A】


【図2B】


【図2C】


【図2D】


【図3A】


【図3B】


【図3C】


【図3D】


【図3E】


【図4A】


【図4B】


【図4C】


【図4D】


【図4E】


【図4F】


【図5A】


【図5B】


【図5C】


【図5D】


【図5E】


【図5F】


【図5G】


【図6A】


【図6B】


【図6C】


【図6D】


【図7A】


【図7B】


【図7C】


【図7D】


【図7E】


【公表番号】特表2011−503054(P2011−503054A)
【公表日】平成23年1月27日(2011.1.27)
【国際特許分類】
【出願番号】特願2010−533003(P2010−533003)
【出願日】平成20年11月3日(2008.11.3)
【国際出願番号】PCT/KR2008/006468
【国際公開番号】WO2009/057982
【国際公開日】平成21年5月7日(2009.5.7)
【出願人】(506376458)ポステック アカデミー−インダストリー ファンデーション (28)
【出願人】(509099202)トンア ユニバーシティ リサーチ ファウンデーション フォー インダストリー−アカデミー コーポレイション (4)
【氏名又は名称原語表記】Dong−A University Research Foundation For Industry−Academy Cooperation
【住所又は居所原語表記】840, Hadan−2dong, Saha−gu, Busan, 604−714, Republic of Korea
【Fターム(参考)】
【公表日】平成23年1月27日(2011.1.27)
【国際特許分類】
【出願日】平成20年11月3日(2008.11.3)
【国際出願番号】PCT/KR2008/006468
【国際公開番号】WO2009/057982
【国際公開日】平成21年5月7日(2009.5.7)
【出願人】(506376458)ポステック アカデミー−インダストリー ファンデーション (28)
【出願人】(509099202)トンア ユニバーシティ リサーチ ファウンデーション フォー インダストリー−アカデミー コーポレイション (4)
【氏名又は名称原語表記】Dong−A University Research Foundation For Industry−Academy Cooperation
【住所又は居所原語表記】840, Hadan−2dong, Saha−gu, Busan, 604−714, Republic of Korea
【Fターム(参考)】
[ Back to top ]

