共役ポリマーの製造方法、共役ポリマー、有機エレクトロニクス素子及び有機エレクトロルミネッセンス素子
【課題】有機エレクトロニクス素子用の材料として有用な共役ポリマーの製造方法、共役ポリマー、並びにこれを用いてなる、電気的特性に優れた有機エレクトロニクス素子及び有機エレクトロルミネッセンス素子を提供する。
【解決手段】鈴木カップリング反応を用いた共役ポリマーの製造方法において、アルキルホスフィン類もしくはコーンアングル(θ)が170度以上190度以下のホスフィン類とパラジウムとからなる触媒を用いる、共役ポリマーの製造方法。
【解決手段】鈴木カップリング反応を用いた共役ポリマーの製造方法において、アルキルホスフィン類もしくはコーンアングル(θ)が170度以上190度以下のホスフィン類とパラジウムとからなる触媒を用いる、共役ポリマーの製造方法。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、共役ポリマーの製造方法、共役ポリマー、有機エレクトロニクス素子及び有機エレクトロルミネッセンス素子に関するものである。
【背景技術】
【0002】
有機エレクトロニクス素子は、有機物を用いて電気的な動作を行う素子であり、省エネルギー、低価格、柔軟性といった特長を発揮できると期待され、従来のシリコンを主体とした無機半導体に替わる技術として注目されている。
【0003】
有機エレクトロニクス素子の中でも有機EL素子は、例えば、白熱ランプ、ガス充填ランプの代替えとして、大面積ソリッドステート光源用途として注目されている。また、フラットパネルディスプレイ(FPD)分野における液晶ディスプレイ(LCD)に置き換わる最有力の自発光ディスプレイとしても注目されており、低消費電力型のフルカラーFPDとして製品化が進んでいる。
【0004】
有機EL素子は、用いる材料及び製膜方法から低分子型有機EL素子、高分子型有機EL素子の2つに大別される。高分子型有機EL素子は、有機材料が高分子材料により構成されており、真空系での成膜が必要な低分子型有機EL素子と比較して、印刷やインクジェットなどの簡易成膜が可能なため、今後の大画面有機ELディスプレイには不可欠な素子である。
【0005】
これまで、高分子型有機EL素子には、共役ポリマー、例えば、ポリ(p−フェニレン−ビニレン)(例えば、特許文献1参照)および非−共役ポリマー(例えば、非特許文献1参照)のいずれかのポリマー材料が使用されてきた。しかしながら、素子としての発光寿命が低く、フルカラーディスプレイを構築する上で障害となっていた。
【0006】
これらの問題点を解決する目的で、近年、種々のポリフルオレン型およびポリ(p−フェニレン)型の共役ポリマーを用いる高分子型有機EL素子が提案されているが、これらも安定性の面では、満足いくものは見出されていない。ポリフルオレン型及び(p−フェニレン)型等の共役ポリマーを合成する有用な方法の1つに、鈴木カップリング反応が挙げられる(非特許文献2参照)。この反応は、通常、反応原系として、パラジウム触媒、水溶性アルカリ炭酸塩または重炭酸塩の無機物塩基、および溶媒、場合によってはさらにポリマー生成物を使用するものである。反応原系のモノマーは、典型的には二ボロン酸モノマーあるいは二ボロン酸塩モノマーと、二臭化モノマーである。
【0007】
特許文献2は、鈴木カップリング反応を改良して芳香族モノマーから共役ポリマーを生成する試みをなしたものである。特許文献2によれば、このような反応は、トルエン等の非極性溶媒を必要とする。しかしながら、この種の非極性溶媒は、反応速度を低下させるものとして認識されている。このような欠点を克服するために特許文献2では、アリコート(Aliquat、登録商標)と呼ばれるトリカプリルアンモニウムクロライド等の相間移動触媒を使用して反応速度を高めることが提案されている。このため、反応混合物は、トルエン等の有機溶剤、ナトリウム重炭酸塩等の無機物塩基、触媒として必要な量のパラジウム錯体、触媒として必要な量の相間移動触媒を含有する。
【0008】
特許文献3は、特許文献2の方法を改良したものである。特許文献3によれば、有機物塩基を使用した場合、無機物塩基を使用する特許文献2に係わる方法に比して、重合に要する反応時間が短くなり、かつ再現性も良好となる。また、反応にアルカリ炭酸塩やアルカリ重炭酸塩を使用しないので、多くの用途において高分子材料の特性を劣化させるアルカリ金属混入物を除去する最終的な精製工程や、そのようなアルカリ金属が混入することを回避するような手段をとることが不要となるという付加的な利点がある。しかも、この反応経路を経て合成された高分子では、従来技術に係る方法で合成された高分子に比して、パラジウムの残留量が少ない。
【0009】
しかしながらPd触媒を用いる上記の反応では、Pd触媒の配位子として結合しているPが、ポリマー中に取り込まれることが指摘されている(非特許文献3)。ポリマー中にPが取り込まれることにより、分岐構造導入などの構造変化、ホスフィンオキサイドなどによる共役構造の破綻など有機ELデバイス特性や電気的特性を低下させる要因になると考えられる。
【先行技術文献】
【特許文献】
【0010】
【特許文献1】国際公開第90/13148号パンフレット
【特許文献2】米国特許第5,777,070号
【特許文献3】国際公開第00/53656号パンフレット
【非特許文献】
【0011】
【非特許文献1】I.Sokolikら.,J.Appl.Phys.1993.74,3584
【非特許文献2】Synthetic Communications 11(7),513,1981
【非特許文献3】Macromolecules 1998,31,2047
【発明の概要】
【発明が解決しようとする課題】
【0012】
本発明は、有機エレクトロニクス素子用の材料として有用な共役ポリマーの製造方法、共役ポリマー、並びにこれを用いてなる、電気的特性に優れた有機エレクトロニクス素子及び有機エレクトロルミネッセンス素子を提供することを目的とする。
【課題を解決するための手段】
【0013】
発明者らは、鋭意検討の結果、鈴木カップリング反応を用いた共役ポリマーの製造方法において、特定のパラジウム触媒を用いることにより、ポリマー中のP含有量が低下することを見出し、本発明を完成するに至った。
すなわち、本発明は、下記(1)〜(9)の事項をその特徴とするものである。
(1)鈴木カップリング反応を用いた共役ポリマーの製造方法において、アルキルホスフィン類もしくはコーンアングル(θ)が170度以上190度以下のホスフィン類と、パラジウムと、からなる触媒を用いる、共役ポリマーの製造方法。
【0014】
(2)前記アルキルホスフィン類が、トリアルキルホスフィン類である、上記(1)記載の共役ポリマーの製造方法。
【0015】
(3)前記アルキルホスフィン類が、トリ−tert−ブチルホスフィンである、上記(1)記載の共役ポリマーの製造方法。
【0016】
(4)前記コーンアングルが180度以上190度以下である、上記(1)記載の共役ポリマーの製造方法。
【0017】
(5)上記(1)〜(4)のいずれかに記載の共役ポリマーの製造方法で製造された共役ポリマー。
【0018】
(6)リン含有量が50ppm以下である上記(5)記載の共役ポリマー。
【0019】
(7)リン含有量が20ppm以下である上記(5)記載の共役ポリマー。
【0020】
(8)上記(5)〜(7)のいずれかに記載の共役ポリマーを用いてなる有機エレクトロニクス素子。
【0021】
(9)上記(5)〜(7)のいずれかに記載の共役ポリマーを用いてなる有機エレクトロルミネッセンス素子。
【0022】
なお、本発明において、用語「共役ポリマー」とは、完全に共役したポリマー、換言すれば、その高分子鎖の全長に亘って共役したポリマー、または、部分的に共役したポリマー、換言すれば、共役した部分と共役していない部分とをともに含んだポリマーのいずれかをいう。
【発明の効果】
【0023】
本発明によれば、P含有量が従来よりも極めて小さい共役ポリマーを得ることができるため、当該共役ポリマーを用いて優れた電力効率、電流効率、素子寿命等の電気的特性を有する有機エレクトロニクス素子及び有機エレクトロルミネッセンス素子を提供することが可能となる。
【図面の簡単な説明】
【0024】
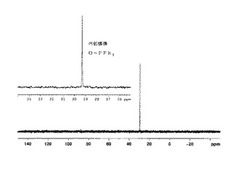
【図1】実施例1で合成した共役ポリマーの31P−NMRチャート(溶媒 CDCl3、内部標準物質としてO=PPh3を添加)である。
【図2】比較例1で合成した共役ポリマーの31P−NMRチャート(溶媒 CDCl3、内部標準物質としてO=PPh3を添加)である。
【発明を実施するための形態】
【0025】
本発明の共役ポリマーの製造方法は、鈴木カップリング反応において、アルキルホスフィン類もしくはコーンアングル(θ)が170度以上190度以下のホスフィン類とパラジウムとからなる触媒を用いることをその特徴とするものである。
【0026】
以下、本発明の実施の形態について詳細に説明する。
本発明の共役ポリマーの製造方法において用いうる原料モノマーとしては、鈴木カップリング反応を起こすのに適切な官能基を有するものであれば良く、特に限定されない。第1の形態では、第1の反応性二ハロゲン化モノマーと、2つのホウ素誘導体官能基を有する第2のモノマーとの重合である。第1のモノマーと第2のモノマーは、同一のモノマーであっても、異なるモノマーであってもよい。モノマーが同一であれば、ホモポリマーが生成する。モノマーが異なるものであれば、共重合体が生成する。第2の形態では、ホウ素誘導体官能基と反応性ハロゲン化物官能基とを有する単一のモノマーの重合で、ホモポリマーが形成される。第2の形態においても、両方の官能基を有し、かつ互いに異なる種類のモノマーを2以上重合させることによって、共重合体を得ることができる。
【0027】
上記反応性二ハロゲン化モノマーまたは上記反応性ハロゲン化物官能基を有するモノマーにおける好適な反応性ハロゲン化物官能基は、BrまたはIである。しかしながら、これらの他、塩素、トリフレート(CF3SO3−)、トシラートまたはメシラートであってもよい。
【0028】
上記ホウ素誘導体官能基としては、−B(OH)2で表されるボロン酸基、好適なものとして−B(OR1)(OR2)、または−B(OR5O)で例示されるボロン酸エステル基、好適なものとして−BR3BR4で例示されるボラン基が挙げられる。ここでR1、R2は互いに独立にHまたは炭素数が1〜6のアルキル基であり、置換されていなくてもよく、置換されていてもよい。また、R3、R4は、互いに独立に炭素数が1〜6のアルキル基であり、置換されていなくてもよく、置換されていてもよい。そして、R5は2価の炭化水素ラジカルが最終的に5員環または6員環となったエステル環である。2価の炭化水素ラジカルは、置換されていなくてもよく、置換されていてもよい。R5としての適切な官能基には、炭素数が2または3のアルキレン基、オルト−またはメタ−フェニレン基が含まれる。なお、これらのアルキレン基およびフェニレン基は、置換されていなくてもよく、置換されていてもよい。また、適切なボロン酸エステル基には、例えば、1価の炭素数が1〜6のアルコール、ピナコール等のエタンジオール、プロパンジオールまたは1,2−ジヒドロキシベンゼン等のオルト芳香族ジオールと、対応するボロン酸とのエステル化による生成物が含まれる。
【0029】
有機エレクトロニクス素子用材料として好適な共役ポリマーを得るためには、原料モノマーとして、例えば、上記のような官能基を有するアリーレン、ヘテロアリーレン、ビフェニレン等の芳香族モノマーやナフタレン、フルオレン等の縮合芳香族モノマーなどを用いることが好ましく、上記のような官能基を有するアリーレン、ヘテロアリーレン、トリアリールアミンまたはビスアリーレンビニレンなどを用いることがより好ましく、ジアルキルフェニレン、ジアルコキシフェニレン、置換されたチオフェン、置換されていないチオフェン、ベンゾチアジアゾール、9,9−ジ−n−オクチルフルオレン等のジアルキルフルオレンなどを用いることが特に好ましい。なお、高分子鎖の所望の位置に官能基を付加するのであれば、1以上のモノマーから、数個〜数十個程度の比較的小さな単位からなる鎖を予め形成しておくこともできる。また、用語「芳香族モノマー」とは、1以上の芳香族環と直接的に置換可能な置換基を有するあらゆるモノマーを指称する。1以上の芳香族環を有するモノマーの場合、官能基を、同一の芳香族環または相違する芳香族環のいずれかに置換することができる。
【0030】
本発明の製造方法において用いうる反応溶媒は、モノマーおよび共役ポリマーを溶解することが可能なものであり、本反応を著しく阻害しないものが好ましい。このような溶媒としては、特に限定されないが、例えば、ベンゼン、トルエン、キシレン等の芳香族系有機溶媒、ジエチルエーテル、テトラハイドロフラン、ジオキサンなどのエーテル系有機溶媒、アセトニトリル、ジメチルホルムアミド、ジメチルスルホキシド、ヘキサメチルホスホトリアミド等を挙げることができる。例えば、共役ポリマーがポリフルオレン誘導体、ポリ(p−フェニレン)誘導体である場合には、アニソール、ベンゼン、エチルベンゼン、メシチレン、キシレン等の非極性芳香族溶媒を使用することができ、トルエン、アニソールが好ましい。
【0031】
また、溶媒中におけるモノマーの濃度は、0.01〜3.0mol/Lが好ましく、さらに好ましくは0.05〜1.5mol/Lである。モノマーが低濃度では、反応に時間を要し、かつ高分子量な共役ポリマーが得られにくく、高濃度では、溶媒の粘性が増加しやすく、均一な反応が起こりにくい。なお、これらの数値は、使用されたモノマーの全モル数に基づいて算出されたものである。
【0032】
本発明の製造方法において用いる触媒は、アルキルホスフィン類もしくはコーンアングル(θ)170度以上190度以下のホスフィン類がパラジウムに配位してなるものであり、もちろん、コーンアングル(θ)が170度以上190度以下のアルキルホスフィン類がパラジウムに配位してなるものを用いることもできる。
【0033】
上記触媒を調製するために用いるパラジウム化合物としては、特に限定されないが、例えば、ヘキサクロロパラジウム(IV)酸ナトリウム四水和物、ヘキサクロロパラジウム(IV)酸カリウム等の4価パラジウム化合物類、塩化パラジウム(II)、臭化パラジウム(II)、酢酸パラジウム(II)、パラジウムアセチルアセトナート(II)、ジクロロビス(ベンゾニトリル)パラジウム(II)、ジクロロビス(アセトニトリル)パラジウム(II)、ジクロロビス(トリフェニルホスフィン)パラジウム(II)、ジクロロテトラアンミンパラジウム(II)、ジクロロ(シクロオクタ−1,5−ジエン)パラジウム(II)、パラジウムトリフルオロアセテート(II)等の2価パラジウム化合物類、パラジウム(I)トリ−tert−ブチルホスフィンブロマイドダイマー等の1価のパラジウム化合物類、トリス(ジベンジリデンアセトン)二パラジウム(0)、トリス(ジベンジリデンアセトン)二パラジウムクロロホルム錯体(0)、テトラキス(トリフェニルホスフィン)パラジウム(0)、ビス(トリ−tert−ブチルホスフィン)パラジウム(0)等の0価パラジウム化合物類等が挙げられる。
【0034】
上記パラジウム化合物の使用量は、特に限定するものではないが、ハロゲン化モノマー1モルに対しパラジウム換算で通常0.0001〜20モル%の範囲である。パラジウム化合物が上記範囲内であれば合成できるが、活性を更に向上させ重合を進行させるため、また、高価なパラジウム化合物を使用することから、より好ましいパラジウム化合物の使用量は、ハロゲン化モノマー1モルに対し、パラジウム換算で0.001〜5モル%の範囲である。
【0035】
また、上記パラジウム化合物のパラジウムに配位させる上記アルキルホスフィン類としては、特に限定されないが、例えば、下記一般式(1)または(2)で表されるトリアルキルホスフィン類であることが好ましい。
【化1】

【0036】
ここで、Pと結合する置換基であるR6〜R13は、それぞれ独立に、炭素数が1〜12の直鎖もしくは分岐鎖アルキル基もしくはアルコキシ基であることが好ましく、置換基があっても良い。アルキルホスフィン類として、より具体的には、例えば、トリメチルホスフィン、トリエチルホスフィン、トリス−(2−シアノエチル)ホスフィン、トリプロピルホスフィン、トリ−イソプロピルホスフィン、tert−ブチル(ジイソプロピルホスフィン)、トリ−n−ブチルホスフィン、トリ−iso−ブチルホスフィン、トリ−sec−ブチルホスフィン、トリ−tert−ブチルホスフィン、トリ−シクロヘキシルホスフィン、トリオクチルホスフィントリドデシルホスフィン、トリベンジルホスフィン、ジ(tert−ブチル)2−{[ジ(tert−ブチル)ホスフィノ]メチル}ベンジル)ホスフィン、ジシクロヘキシル[2−(ジシクロヘキシルホスフィノ)エチル]ホスフィン、ジシクロヘキシル[2−(ジシクロヘキシルホスフィノ)プロピル]ホスフィン、ジシクロヘキシル[2−(ジシクロヘキシルホスフィノ)ブチル]ホスフィン、(R)−1−[(1S)−2(ジフェニルホスフィノ)フェロセニル]エチルジ−tert−ブチルホスフィン、トリメチルホスファイト、トリエチルホスファイト、トリプロピルホスファイト、トリイソプロピルホスファイト等を用いることができる。これらのうち、反応性の高さ、ポリマ中へのP存在量の低減の観点から、トリ−tert−ブチルホスフィンがより好ましい。
【0037】
また、上記パラジウム化合物のパラジウムに配位させる上記コーンアングル(θ)が170度以上190度以下のホスフィン類としては、例えば、トリシクロヘキシルホスフィン、ジ(tert−ブチル)フェニルホスフィン、トリス(tert−ブチル)ホスファイト、トリス(o−tert−ブチルフェニル)ホスファイト、トリネオペンチルホスフィン、トリ(tert−ブチル)ホスフィン、トリス(2,3,4,5,6−ペンタフルオロフェニル)ホスフィン、トリス(2,6−ジメチルフェニル)ホスファイトなどが挙げられる。共役ポリマー中へのP挿入量を低減させるためには、コーンアングル(θ)が180度以上190度以下のものがより好ましく、このようなホスフィン類としては、例えば、トリ(tert−ブチル)ホスフィン、トリス(2,3,4,5,6−ペンタフルオロフェニル)ホスフィン、トリス(2,6−ジメチルフェニル)ホスファイトなどが挙げられる。コーンアングルが170度以上190度以下の範囲にないホスフィン類を用いると、共役ポリマー中へのP挿入量が増加もしくはモノマーの反応性が低下することがある。なお、リン配位子のコーンアングル(θ)は、文献(Chemical Reviews,1977,vol.77,No.3)から得ることができる。
【0038】
上記ホスフィン類の使用量は、上記パラジウム化合物に対して通常0.01〜10000倍モルの範囲で使用すればよい。活性を更に向上させるため、また、高価なホスフィン類を使用することから、より好ましいホスフィン類の使用量は、パラジウム化合物に対して0.1〜10倍モルの範囲である。なお、本発明における触媒は、例えば、上記パラジウム化合物と上記ホスフィン類を適当な溶媒中にて混合、攪拌することで調製することができる。また、本発明では、上記のようなホスフィン類を有する市販のパラジウム触媒を用いてもよく、この場合には上記のような調製は必要なくなる。
【0039】
本発明の製造方法において用いうる塩基としては、無機塩基及び/又は有機塩基から選択すればよく、特に限定するものではない。無機塩基の例としては、炭酸ナトリウム、炭酸カリウム、炭酸セシウム、リン酸カリウムなどが挙げられる。また、水溶液の状態で用いられ、例えば1M〜2Mの炭酸カリウム等である。塩基の量は、モノマーのモル量よりも多ければよく、好ましくはハロゲン化物モノマーに対し5倍以上が好ましく、さらに好ましくは10倍以上である。有機塩基の例としては、アルキルアンモニウム水酸化物、アルキルアンモニウム炭酸塩、アルキルアンモニウム重炭酸塩、アルキルアンモニウムボロン酸塩、1,5−ジアザビシクロ[4.3.0]ノナ−5−エン(DBN)、1,8−ジアザビシクロ[5.4.0]ウンデセ−7−エン(DBU)、1,4−ジアザビシクロ[2.2.2]オクタン(DABCO)、ジメチルアミノピリジン(DMAP)、ピリジン、トリアルキルアミン、テトラアルキルアンモニウムフルオライド等のアルキルアンモニウムフルオライドを例示することができ、テトラメチルアンモニウム水酸化物、テトラエチルアンモニウム水酸化物、テトラ−n−プロピルアンモニウム水酸化物等のテトラアルキルアンモニウム水酸化物が好適である。有機塩基は、ハロゲン化物モノマーに対して少なくとも1.5当量であることが好ましく、少なくとも2当量であることがより好ましい。
【0040】
本発明の製造方法において用いうる相間移動触媒としては、例えば、テトラアルキルハロゲン化アンモニウム、テトラアルキル硫酸水素アンモニウム、テトラアルキル水酸化アンモニウムなどが挙げられる。ただし、塩基としてテトラアルキルアンモニウム水酸化物を用いるときには相関移動触媒を用いなくても良い。具体的な例としては、トリカプリルアルキルアンモニウムクロライド等が挙げられる。相間移動触媒の量としては、上記反応溶媒に対して1重量%〜8重量%が好ましく、さらに好ましくは2重量%〜4重量%である。少なすぎると、反応が進行しにくくなり、多すぎると精製による相間移動触媒除去が煩雑となる。
【0041】
本発明の製造方法は、常圧下、加圧下でも行うことができる。また、窒素、アルゴン等の不活性ガス雰囲気下で行うことが、共役ポリマーの酸化反応や触媒失活などの副反応を防ぐために好ましい。また、本発明における反応温度は、50〜150℃が好ましく、さらに好ましくは70〜130℃である。反応温度が低すぎると、反応に時間が長くなり、収率が低下する一方、反応温度が高すぎると、副反応が進行しやすくなる。また、反応させる際にマイクロ波を照射しつつ加熱してもよい。また、本発明における反応時間は、溶媒、モノマー、塩基、パラジウム化合物とアルキルホスフィン類からなる触媒の量や反応温度によって一定しないが、好ましくは、数分〜72時間の範囲の範囲から適宜選択する。反応終了後には、常法によって処理することにより目的とする共役ポリマーを得ることができる。
【0042】
本発明の製造方法で得られる共役ポリマーは、有機エレクトロニクス素子用材料、特に有機エレクトロルミネッセンス素子(有機EL素子)用材料として好適であり、例えば、単独で有機EL素子の、正孔注入層、正孔輸送層、電子ブロック層、発光層、正孔ブロック層、電子輸送層、電子注入層などの活性層として使用することができる。
【0043】
本発明の製造方法で得られる、有機エレクトロニクス素子用材料として好適な共役ポリマーとしては、例えば、主骨格として、ポリフェニレン、ポリフルオレン、ポリフェナントレン、ポリピレン等のポリ(アリーレン)またはその誘導体、ポリチオフェン、ポリキノリン、ポリカルバゾール等のポリ(ヘテロアリーレン)またはその誘導体、ポリ(アリーレンビニレン)またはその誘導体、ポリ(アリーレンエチニレン)またはその誘導体を含むポリマーもしくはオリゴマーを有し、また、ユニットとして(即ち、主骨格中の構造だけではなく、側鎖の構造であってもよい)、ベンゼン、ナフタレン、アントラセン、フェナントレン、クリセン、ルブレン、ピレン、ペリレン、インデン、アズレン、アダマンタン、フルオレン、フルオレノン、ジベンゾフラン、カルバゾール、ジベンゾチオフェン、フラン、ピロール、ピロリン、ピロリジン、チオフェン、ジオキソラン、ピラゾール、ピラゾリン、ピラゾリジン、イミダゾール、オキサゾール、チアゾール、オキサジアゾール、トリアゾール、チアジアゾール、ピラン、ピリジン、ピペリジン、ジオキサン、モルホリン、ピリダジン、ピリミジン、ピラジン、ピペラジン、トリアジン、トリチアン、ノルボルネン、ベンゾフラン、インドール、ベンゾチオフェン、ベンズイミダゾール、ベンゾオキサゾール、ベンゾチアゾール、ベンゾチアジアゾール、ベンゾオキサジアゾール、プリン、キノリン、イソキノリン、クマリン、シンノリン、キノキサリン、アクリジン、フェナントロリン、フェノチアジン、フラボン、トリフェニルアミン、アセチルアセトン、ジベンゾイルメタン、ピコリン酸、シロール、ポルフィリン、イリジウム等の金属配位化合物等又はそれらの誘導体の構造を含むポリマーもしくはオリゴマー等を有するものが挙げられ、これらの骨格を有する低分子化合物であってもよい。なかでも、主骨格として、ポリ(アリーレン)またはその誘導体、ポリ(ヘテロアリーレン)またはその誘導体を含むポリマーもしくはオリゴマーを有し、また、ユニットとして、ベンゼン、ナフタレン、アントラセン、フェナントレン、ピレン、フルオレン、ジベンゾフラン、カルバゾール、ジベンゾチオフェン、フラン、チオフェン、オキサジアゾール、トリアゾール、チアジアゾール、ピリジン、トリアジン、ベンゾチオフェン、ベンズイミダゾール、ベンゾオキサゾール、ベンゾチアゾール、ベンゾチアジアゾール、ベンゾオキサジアゾール、キノリン、イソキノリン、アクリジン、フェナントロリン、トリフェニルアミン、アセチルアセトン、ジベンゾイルメタン、イリジウム等の金属配位化合物等またはその誘導体を含むポリマーもしくはオリゴマーを有する共役ポリマーが好ましい。
【0044】
また、本発明の製造方法で得られる共役ポリマーは、リンの含有量が50ppm以下であることが好ましく、20ppm以下であることがより好ましい。リン含有量が50ppm以下の共役ポリマーを用いて有機エレクトロニクス素子を製造することで、当該素子の電気的特性をより優れたものにすることができる。
【0045】
また、本発明の共役ポリマーに、種々の添加剤を添加させた状態でも有機エレクトロニクス素子用材料や有機EL素子用材料として使用することができる。添加剤としては、例えば、有機EL素子の発光層に用いるのであればIrやPtなどの中心金属を含む金属錯体などが、正孔注入層、正孔輸送層に用いるのであればトリフェニルアミン誘導体、テトラシアノキノジメタン等の電子受容体、種々の酸化剤が使用可能である。
【0046】
本発明の有機エレクトロニクス素子および有機EL素子は、上記したような本発明の共役ポリマーまたはこれを含む材料からなる活性層を備えるものであればよく、その構造などは特に限定されない。なお、有機ELの一般的な構造は、例えば、米国特許第4,539,507号や米国特許第5,151,629号等に開示されているものがあり、また、ポリマー含有の有機EL素子については、例えば、国際公開WO第90/13148号や欧州特許公開第0443861号等に開示されている。これらは通常、電極の少なくとも1つが透明であるカソード(陰極)とアノード(陽極)との間に、エレクトロルミネセント層(発光層)を含むものである。さらに、1つ以上の電子注入層及び/又は電子輸送層がエレクトロルミネセント層(発光層)とカソードとの間に挿入されているもの、1つ以上の正孔注入層及び/又は正孔輸送層がエレクトロルミネセント層(発光層)とアノードとの間に挿入されているものもある。
【0047】
上記カソード材料としては、例えば、Li、Ca、Mg、Al、In、Cs、Ba、Mg/Ag、LiF、CsF等の金属又は金属合金であることが好ましい。アノード材料としては、透明基体(例えば、ガラス又は透明ポリマー)上に、金属(例えば、Au)又は金属導電率を有する他の材料、例えば、酸化物(例えば、ITO:酸化インジウム/酸化錫)を使用することもできる。
【0048】
本発明の共役ポリマーまたはこれを含む材料を用いて有機エレクトロニクス素子の活性層を形成するためには、例えば、本発明の共役ポリマーまたはこれを含む材料を含有する溶液を、例えば、インクジェット法、キャスト法、浸漬法、凸版印刷、凹版印刷、オフセット印刷、平板印刷、凸版反転オフセット印刷、スクリーン印刷、グラビア印刷等の印刷法、スピンコーティング法などの公知の方法で所望の基体上に塗布し、光照射する、または光照射後もしくは光照射と同時に加熱処理することによって達成でき、これを繰り返すことで有機エレクトロニクス素子や有機EL素子の多層化を図ることが可能である。
【0049】
上記塗布方法は、通常、−20〜+300℃の温度範囲、好ましくは10〜100℃、特に好ましくは15〜50℃で実施することができ、また、上記溶液に用いる溶媒としては、特に限定されないが、例えば、クロロホルム、塩化メチレン、ジクロロエタン、テトラヒドロフラン、トルエン、キシレン、メシチレン、アニソール、アセトン、メチルエチルケトン、酢酸エチル、酢酸ブチル、エチルセロソルブアセテート等を挙げることができる。
【0050】
また、上記光照射には、低圧水銀灯、中圧水銀灯、高圧水銀灯、超高圧水銀灯、メタルハライドランプ、キセノンランプ、蛍光灯、発光ダイオード、太陽光等の光源を用いることができる。また、上記加熱処理は、ホットプレート上やオーブン内で行うことができ、0〜+300℃の温度範囲、好ましくは20〜250℃、特に好ましくは80〜200℃で実施することができる。
【0051】
また、上記活性層の膜厚は、特に限定されないが、10〜100nmであることが好ましく、より好ましくは20〜60nm、さらに好ましくは20〜40nmである。
【実施例】
【0052】
以下、本発明を実施例により詳細に説明するが、本発明は以下の実施例に限定されるものではない。
【0053】
<Pd触媒の調製1>
窒素雰囲気下のグローブボックス中で、室温(25℃)下、サンプル管にトリス(ジベンジリデンアセトン)二パラジウム(73.2mg、80μmol)を秤取り、アニソール(15ml)を加え、30分間攪拌した。同様に、サンプル管にトリ−tert−ブチルホスフィン(129.6mg、640μmol)を秤取り、アニソール(5ml)を加え、5分間攪拌した。これらの溶液を混合し室温(25℃)で30分間攪拌し触媒とした。
【0054】
<Pd触媒の調製2>
窒素雰囲気下のグローブボックス中で、室温(25℃)下、サンプル管にトリス(ジベンジリデンアセトン)二パラジウム(73.2mg、80μmol)を秤取り、アニソール(15ml)を加え、30分間攪拌した。同様に、サンプル管にトリス(2,3,4,5,6−ペンタフルオロフェニル)ホスフィン(340.6mg、640μmol)を秤取り、アニソール(5ml)を加え、5分間攪拌した。これらの溶液を混合し室温(25℃)で30分間攪拌し触媒とした。
【0055】
<Pd触媒の調製3>
窒素雰囲気下のグローブボックス中で、室温(25℃)下、サンプル管にトリス(ジベンジリデンアセトン)二パラジウム(73.2mg、80μmol)を秤取り、アニソール(15ml)を加え、30分間攪拌した。同様に、サンプル管にトリフェニルホスフィン(167.9mg、640μmol)を秤取り、アニソール(5ml)を加え、5分間攪拌した。これらの溶液を混合し室温(25℃)で30分間攪拌し触媒とした。
【0056】
<Pd触媒の調製4>
窒素雰囲気下のグローブボックス中で、室温(25℃)下、サンプル管にトリス(ジベンジリデンアセトン)二パラジウム(73.2mg、80μmol)を秤取り、アニソール(15ml)を加え、30分間攪拌した。同様に、サンプル管にトリ−o−トリルホスフィン(194.8mg、640μmol)を秤取り、アニソール(5ml)を加え、5分間攪拌した。これらの溶液を混合し室温(25℃)で30分間攪拌し触媒とした。
【0057】
<Pd触媒の調製5>
窒素雰囲気下のグローブボックス中で、室温(25℃)下、サンプル管にトリス(ジベンジリデンアセトン)二パラジウム(73.2mg、80μmol)を秤取り、アニソール(15ml)を加え、30分間攪拌した。同様に、サンプル管にトリメシチルホスフィン(248.7mg、640μmol)を秤取り、アニソール(5ml)を加え、5分間攪拌した。これらの溶液を混合し室温(25℃)で30分間攪拌し触媒とした。
【0058】
(実施例1)
ポリ(9,9−ジ−n−オクチルフルオレン)の合成1
窒素雰囲気下、三口丸底フラスコに2,7−ジブロモ−9,9−ジオクチルフルオレン(0.4mmol)、9,9−ジオクチルフルオレンのジボロン酸エステル(0.4mmol)を加え、さらに3.75重量%トリカプリルメチルアンモニウムクロライドアニソール溶液(1.5ml)、Pd触媒の調製1で調製した溶液(500μl)を加えた。30分撹拌した後、K2CO3水溶液(2M、5.3ml)を加えた。攪拌しながら、24時間、95℃で加熱・還流した。ここまでの全ての操作は窒素気流下で行った。
【0059】
反応終了後、反応混合物をメタノール−水(9:1)(150ml)に注いだ。生じた沈殿を吸引ろ過し、メタノール−水(9:1)で洗浄した。得られた沈殿を再びトルエンに溶解し、メタノール−アセトン(8:3)(90ml)から再沈殿した。得られた沈殿を吸引ろ過し、メタノール−アセトン(8:3)(90ml)で洗浄した。メタノール−アセトン(8:3)から再び再沈殿し、得られた沈殿を真空乾燥し、目的物を得た(収率64.8重量%)。31P−NMR測定を行い、tert−ブチルホスフィン及びtert−ブチルホスフィンオキサイドが除去されていることを確認した(図1参照)。重量平均分子量Mwは、溶離液にTHFを用いたGPC(ポリスチレン換算)により測定した。Pの定量分析は、ポリマーを秤取り、硫酸、硝酸及び過塩素酸で加熱分解した後、塩酸と硝酸で処理し、希塩酸で定容液としたものについてICP質量分析法により行った。結果を表1に示す。なお、図1において、O=PPh3を添加しないときには、同ケミカルシフトにピークは検出されない。
【0060】
(比較例1)
ポリ(9,9−ジ−n−オクチルフルオレン)の合成2
窒素雰囲気下、三口丸底フラスコに2,7−ジブロモ−9,9−ジオクチルフルオレン)(0.4mmol)、9,9−ジオクチルフルオレンのジボロン酸エステル(0.4mmol)を加え、さらに3.75重量%トリカプリルメチルアンモニウムクロライドアニソール溶液(1.5ml)、Pd触媒の調製3で調製した溶液(500μl)を加えた。30分撹拌した後、2M K2CO3水溶液(5.3ml)を加え、さらに、攪拌しながら、24時間、95℃で加熱・還流した。ここまでの全ての操作は窒素気流下で行った。実施例1と同様の精製を行い、目的物を得た(収率、73.2重量%)。31P−NMR測定を行い、トリフェニルホスフィン及びトリフェニルホスフィンオキサイドが除去されていることを確認した(図2参照)。分子量測定及びPの定量分析は、実施例1と同様な手法で行った。結果を表1に示す。なお、図2において、O=PPh3を添加しないときには、同ケミカルシフトにピークは検出されない。
【0061】
(比較例2)
ポリ(9,9−ジ−n−オクチルフルオレン)の合成3
窒素雰囲気下、三口丸底フラスコに2,7−ジブロモ−9,9−ジオクチルフルオレン(0.4mmol)、9,9−ジオクチルフルオレンのジボロン酸エステル(0.4mmol)を加え、さらに3.75重量%トリカプリルメチルアンモニウムクロライドアニソール溶液(1.5ml)、Pd触媒の調製4で調製した溶液(500μl)を加えた。30分撹拌した後、2M K2CO3水溶液(5.3ml)を加え、さらに、攪拌しながら、24時間、95℃で加熱・還流した。ここまでの操作は全て窒素気流下で行った。実施例1と同様の精製を行い、目的物を得た(収率75.0重量%)。31P−NMR測定を行い、トリ−o−トリルホスフィン及びトリ−o−トリルホスフィンオキサイドが除去されていることを確認した。分子量測定及びPの定量分析は、実施例1と同様な手法で行った。結果を表1に示す。
【表1】

【0062】
(実施例2)
ポリ(9,9−ジ−n−オクチルフルオレン)の合成4
窒素雰囲気下、三口丸底フラスコに2,7−ジブロモ−9,9−ジオクチルフルオレン(0.4mmol)、9,9−ジオクチルフルオレンのジボロン酸エステル(0.4mmol)を加え、アニソール(1.5ml)、Pd触媒の調製1で調製した溶液(500μl)を加えた。30分撹拌した後、20重量%テトラエチルアンモニウム水酸化物水溶液(1.33ml)及び水(4.0ml)を加え、激しく攪拌しながら、24時間、95℃で加熱・還流した。ここまでの全ての操作は窒素気流下で行った。
【0063】
反応終了後、反応混合物をメタノール−水(9:1)(150mL)に注いだ。生じた沈殿を吸引ろ過し、メタノール−水(9:1)で洗浄した。得られた沈殿を再びトルエンに溶解し、メタノール−水(9:1)(150mL)で再び再沈殿し、生じた沈殿を吸引ろ過し、メタノール−水(9:1)で洗浄した。得られた沈殿を再びトルエンに溶解し、メタノール−アセトン(8:3)(90ml)から再沈殿した。得られた沈殿を吸引ろ過し、メタノール−アセトン(8:3)(90ml)で洗浄した。メタノール−アセトン(8:3)から再び再沈殿し、得られた沈殿を真空乾燥し、目的物を得た(収率69.4重量%)。31P−NMR測定を行い、tert−ブチルホスフィン及びtert−ブチルホスフィンオキサイドが除去されていることを確認した。分子量測定及びPの定量分析は、実施例1と同様な手法で行った。結果を表2に示す。
【0064】
(実施例3)
ポリ(9,9−ジ−n−オクチルフルオレン)の合成5
マイクロ波合成反応装置としてマイルストーンゼネラル社製MicroSYNTHを使用した。反応は、専用のテフロン(登録商標)製反応容器を用いて行った。溶媒は、30分以上窒素バブルにより脱気した後、使用した。反応容器に2,7−ジブロモ−9,9−ジオクチルフルオレン(0.4mmol)、9,9−ジオクチルフルオレンのジボロン酸エステル(0.4mmol)を加え、さらに3.75重量%トリカプリルメチルアンモニウムクロライドアニソール溶液(1.5ml)、Pd触媒の調製1で調製した溶液(500μl)を加えた。30分撹拌した後、K2CO3水溶液(2M、5.3ml)を加えた。ここまでの操作は全て、窒素雰囲気下のグローブボックス中で行った。反応容器を窒素雰囲気下で密閉し、マイクロ波反応装置にセットし、マイクロ波の照射により室温(25℃)から90℃まで10分間で昇温させ、その後90℃で120分間反応させ、目的物を得た(収率78.9重量%)た。温度制御は、反応溶液に浸した温度センサーで内部温度を測定し、マイクロ波出力を制御することで行った。精製及び分析は実施例1と同様な方法で行った。結果を表2に示す。
【表2】

【0065】
(実施例4、5)
原料モノマーとして表3に記載した化合物を用いた以外は、実施例3と同様な手法で共役ポリマーを合成した。精製及び分析は実施例1と同様な方法で行った。結果を表4に示す。
【表3】

【0066】
(比較例3,4)
触媒としてPd触媒の調製3で調製した溶液(500μl)を用いた以外は、実施例4、5と同様な手法で共役ポリマーを合成した。精製及び分析は実施例1と同様な方法で行った。結果を表4に示す。
【表4】

【0067】
(実施例6)
ポリ(9,9−ジ−n−オクチルフルオレン)の合成6
窒素雰囲気下、三口丸底フラスコに2,7−ジブロモ−9,9−ジオクチルフルオレン(0.4mmol)、9,9−ジオクチルフルオレンのジボロン酸エステル(0.4mmol)を加え、アニソール(3.0ml)、Pd触媒の調製2で調製した溶液(1.0ml)を加えた。30分撹拌した後、20重量%テトラエチルアンモニウム水酸化物水溶液(4.0ml)及び水(4.0ml)を加えた。激しく攪拌しながら、24時間、95℃で加熱・還流した。ここまでの全ての操作は窒素気流下で行った。
【0068】
反応終了後、反応混合物をメタノール−水(9:1)(150mL)に注いだ。生じた沈殿を吸引ろ過し、メタノール−水(9:1)で洗浄した。得られた沈殿をトルエンに溶解し、メタノール−水(9:1)(150mL)から再沈殿し、生じた沈殿を吸引ろ過し、メタノール−水(9:1)で洗浄した。得られた沈殿を再びトルエンに溶解し、メタノール−アセトン(8:3)(90ml)から再沈殿し、生じた沈殿を吸引ろ過し、メタノール−アセトン(8:3)で洗浄した。得られた沈殿を再びトルエンに溶解し、メタノール−アセトン(8:3)(90ml)から再沈殿し、得られた沈殿を真空乾燥し、目的物を得た(収率78.3重量%)。31P−NMR測定を行い、トリス(2,3,4,5,6−ペンタフルオロ)ホスフィンとトリス(2,3,4,5,6−ペンタフルオロ)ホスフィンオキサイドが存在しないことを確認した。分子量測定及びPの定量分析は、実施例1と同様な手法で行った。結果を表5に示す。
【0069】
(実施例7)
ポリ(9,9−ジ−n−オクチルフルオレン)の合成7
マイクロ波合成反応装置としてマイルストーンゼネラル社製MicroSYNTHを使用した。反応は、専用のテフロン(登録商標)製反応容器を用いて行った。溶媒は、30分以上窒素バブルにより脱気した後、使用した。反応容器に2,7−ジブロモ−9,9−ジオクチルフルオレン(0.4mmol)、9,9−ジオクチルフルオレンのジボロン酸エステル(0.4mmol)を加え、アニソール(3.0ml)、Pd触媒の調製2で調製した溶液(1.0ml)を加えた。30分撹拌した後、20重量%テトラエチルアンモニウム水酸化物水溶液(4.0ml)及び水(4.0ml)を加えた。ここまでの操作は全て、窒素雰囲気下のグローブボックス中で行った。反応容器を窒素雰囲気下で密閉し、マイクロ波反応装置にセットし、マイクロ波の照射により室温から90℃まで10分間で昇温させ、その後90℃で120分間反応させ、目的物を得た(収率80.2重量%)。温度制御は、反応溶液に浸した温度センサーで内部温度を測定し、マイクロ波出力を制御することで行った。精製及び分析は実施例6と同様な方法で行った。結果を表5に示す。
【0070】
(比較例5)
ポリ(9,9−ジ−n−オクチルフルオレン)の合成8
Pd触媒の調製2で調製した溶液(1.0ml)の代わりに、Pd触媒の調製3で調製した溶液(1.0ml)を用いた以外は、実施例7と同様の操作で合成を行った。精製及び分析は実施例6と同様な方法で行った(収率73.8%)。結果を表5に示す。
【0071】
(比較例6)
ポリ(9,9−ジ−n−オクチルフルオレン)の合成9
Pd触媒の調製2で調製した溶液(1.0ml)の代わりに、Pd触媒の調製4で調製した溶液(1.0ml)を用いた以外は、実施例7と同様の操作で合成を行った。精製及び分析は実施例6と同様な方法で行った(収率85.5%)。結果を表5に示す。
【0072】
(比較例7)
ポリ(9,9−ジ−n−オクチルフルオレン)の合成10
Pd触媒の調製2で調製した溶液(1.0ml)の代わりに、Pd触媒の調製5で調製した溶液(1.0ml)を用いた以外は、実施例7と同様の操作で合成を行ったが、反応が進行せず、目的物は得られなかった。
【表5】

【0073】
(実施例8、9)
原料モノマーとして表6に記載した化合物を用いた以外は、実施例7と同様な手法で共役ポリマーを合成した。精製及び分析は実施例6と同様な方法で行った。結果を表7に示す。
【表6】

【0074】
(比較例8,9)
触媒としてPd触媒の調製3で調製した溶液(1.0ml)を用いた以外は、実施例8、9と同様な手法で共役ポリマーを合成した。精製及び分析は実施例6と同様な方法で行った。結果を表7に示す。
【表7】

【0075】
本発明によれば、P含有量が従来よりも極めて小さい共役ポリマーを得ることができるため、当該共役ポリマーを用いて優れた電気的特性を有する有機エレクトロニクス素子及び有機エレクトロルミネッセンス素子を提供することが可能となる。
【技術分野】
【0001】
本発明は、共役ポリマーの製造方法、共役ポリマー、有機エレクトロニクス素子及び有機エレクトロルミネッセンス素子に関するものである。
【背景技術】
【0002】
有機エレクトロニクス素子は、有機物を用いて電気的な動作を行う素子であり、省エネルギー、低価格、柔軟性といった特長を発揮できると期待され、従来のシリコンを主体とした無機半導体に替わる技術として注目されている。
【0003】
有機エレクトロニクス素子の中でも有機EL素子は、例えば、白熱ランプ、ガス充填ランプの代替えとして、大面積ソリッドステート光源用途として注目されている。また、フラットパネルディスプレイ(FPD)分野における液晶ディスプレイ(LCD)に置き換わる最有力の自発光ディスプレイとしても注目されており、低消費電力型のフルカラーFPDとして製品化が進んでいる。
【0004】
有機EL素子は、用いる材料及び製膜方法から低分子型有機EL素子、高分子型有機EL素子の2つに大別される。高分子型有機EL素子は、有機材料が高分子材料により構成されており、真空系での成膜が必要な低分子型有機EL素子と比較して、印刷やインクジェットなどの簡易成膜が可能なため、今後の大画面有機ELディスプレイには不可欠な素子である。
【0005】
これまで、高分子型有機EL素子には、共役ポリマー、例えば、ポリ(p−フェニレン−ビニレン)(例えば、特許文献1参照)および非−共役ポリマー(例えば、非特許文献1参照)のいずれかのポリマー材料が使用されてきた。しかしながら、素子としての発光寿命が低く、フルカラーディスプレイを構築する上で障害となっていた。
【0006】
これらの問題点を解決する目的で、近年、種々のポリフルオレン型およびポリ(p−フェニレン)型の共役ポリマーを用いる高分子型有機EL素子が提案されているが、これらも安定性の面では、満足いくものは見出されていない。ポリフルオレン型及び(p−フェニレン)型等の共役ポリマーを合成する有用な方法の1つに、鈴木カップリング反応が挙げられる(非特許文献2参照)。この反応は、通常、反応原系として、パラジウム触媒、水溶性アルカリ炭酸塩または重炭酸塩の無機物塩基、および溶媒、場合によってはさらにポリマー生成物を使用するものである。反応原系のモノマーは、典型的には二ボロン酸モノマーあるいは二ボロン酸塩モノマーと、二臭化モノマーである。
【0007】
特許文献2は、鈴木カップリング反応を改良して芳香族モノマーから共役ポリマーを生成する試みをなしたものである。特許文献2によれば、このような反応は、トルエン等の非極性溶媒を必要とする。しかしながら、この種の非極性溶媒は、反応速度を低下させるものとして認識されている。このような欠点を克服するために特許文献2では、アリコート(Aliquat、登録商標)と呼ばれるトリカプリルアンモニウムクロライド等の相間移動触媒を使用して反応速度を高めることが提案されている。このため、反応混合物は、トルエン等の有機溶剤、ナトリウム重炭酸塩等の無機物塩基、触媒として必要な量のパラジウム錯体、触媒として必要な量の相間移動触媒を含有する。
【0008】
特許文献3は、特許文献2の方法を改良したものである。特許文献3によれば、有機物塩基を使用した場合、無機物塩基を使用する特許文献2に係わる方法に比して、重合に要する反応時間が短くなり、かつ再現性も良好となる。また、反応にアルカリ炭酸塩やアルカリ重炭酸塩を使用しないので、多くの用途において高分子材料の特性を劣化させるアルカリ金属混入物を除去する最終的な精製工程や、そのようなアルカリ金属が混入することを回避するような手段をとることが不要となるという付加的な利点がある。しかも、この反応経路を経て合成された高分子では、従来技術に係る方法で合成された高分子に比して、パラジウムの残留量が少ない。
【0009】
しかしながらPd触媒を用いる上記の反応では、Pd触媒の配位子として結合しているPが、ポリマー中に取り込まれることが指摘されている(非特許文献3)。ポリマー中にPが取り込まれることにより、分岐構造導入などの構造変化、ホスフィンオキサイドなどによる共役構造の破綻など有機ELデバイス特性や電気的特性を低下させる要因になると考えられる。
【先行技術文献】
【特許文献】
【0010】
【特許文献1】国際公開第90/13148号パンフレット
【特許文献2】米国特許第5,777,070号
【特許文献3】国際公開第00/53656号パンフレット
【非特許文献】
【0011】
【非特許文献1】I.Sokolikら.,J.Appl.Phys.1993.74,3584
【非特許文献2】Synthetic Communications 11(7),513,1981
【非特許文献3】Macromolecules 1998,31,2047
【発明の概要】
【発明が解決しようとする課題】
【0012】
本発明は、有機エレクトロニクス素子用の材料として有用な共役ポリマーの製造方法、共役ポリマー、並びにこれを用いてなる、電気的特性に優れた有機エレクトロニクス素子及び有機エレクトロルミネッセンス素子を提供することを目的とする。
【課題を解決するための手段】
【0013】
発明者らは、鋭意検討の結果、鈴木カップリング反応を用いた共役ポリマーの製造方法において、特定のパラジウム触媒を用いることにより、ポリマー中のP含有量が低下することを見出し、本発明を完成するに至った。
すなわち、本発明は、下記(1)〜(9)の事項をその特徴とするものである。
(1)鈴木カップリング反応を用いた共役ポリマーの製造方法において、アルキルホスフィン類もしくはコーンアングル(θ)が170度以上190度以下のホスフィン類と、パラジウムと、からなる触媒を用いる、共役ポリマーの製造方法。
【0014】
(2)前記アルキルホスフィン類が、トリアルキルホスフィン類である、上記(1)記載の共役ポリマーの製造方法。
【0015】
(3)前記アルキルホスフィン類が、トリ−tert−ブチルホスフィンである、上記(1)記載の共役ポリマーの製造方法。
【0016】
(4)前記コーンアングルが180度以上190度以下である、上記(1)記載の共役ポリマーの製造方法。
【0017】
(5)上記(1)〜(4)のいずれかに記載の共役ポリマーの製造方法で製造された共役ポリマー。
【0018】
(6)リン含有量が50ppm以下である上記(5)記載の共役ポリマー。
【0019】
(7)リン含有量が20ppm以下である上記(5)記載の共役ポリマー。
【0020】
(8)上記(5)〜(7)のいずれかに記載の共役ポリマーを用いてなる有機エレクトロニクス素子。
【0021】
(9)上記(5)〜(7)のいずれかに記載の共役ポリマーを用いてなる有機エレクトロルミネッセンス素子。
【0022】
なお、本発明において、用語「共役ポリマー」とは、完全に共役したポリマー、換言すれば、その高分子鎖の全長に亘って共役したポリマー、または、部分的に共役したポリマー、換言すれば、共役した部分と共役していない部分とをともに含んだポリマーのいずれかをいう。
【発明の効果】
【0023】
本発明によれば、P含有量が従来よりも極めて小さい共役ポリマーを得ることができるため、当該共役ポリマーを用いて優れた電力効率、電流効率、素子寿命等の電気的特性を有する有機エレクトロニクス素子及び有機エレクトロルミネッセンス素子を提供することが可能となる。
【図面の簡単な説明】
【0024】
【図1】実施例1で合成した共役ポリマーの31P−NMRチャート(溶媒 CDCl3、内部標準物質としてO=PPh3を添加)である。
【図2】比較例1で合成した共役ポリマーの31P−NMRチャート(溶媒 CDCl3、内部標準物質としてO=PPh3を添加)である。
【発明を実施するための形態】
【0025】
本発明の共役ポリマーの製造方法は、鈴木カップリング反応において、アルキルホスフィン類もしくはコーンアングル(θ)が170度以上190度以下のホスフィン類とパラジウムとからなる触媒を用いることをその特徴とするものである。
【0026】
以下、本発明の実施の形態について詳細に説明する。
本発明の共役ポリマーの製造方法において用いうる原料モノマーとしては、鈴木カップリング反応を起こすのに適切な官能基を有するものであれば良く、特に限定されない。第1の形態では、第1の反応性二ハロゲン化モノマーと、2つのホウ素誘導体官能基を有する第2のモノマーとの重合である。第1のモノマーと第2のモノマーは、同一のモノマーであっても、異なるモノマーであってもよい。モノマーが同一であれば、ホモポリマーが生成する。モノマーが異なるものであれば、共重合体が生成する。第2の形態では、ホウ素誘導体官能基と反応性ハロゲン化物官能基とを有する単一のモノマーの重合で、ホモポリマーが形成される。第2の形態においても、両方の官能基を有し、かつ互いに異なる種類のモノマーを2以上重合させることによって、共重合体を得ることができる。
【0027】
上記反応性二ハロゲン化モノマーまたは上記反応性ハロゲン化物官能基を有するモノマーにおける好適な反応性ハロゲン化物官能基は、BrまたはIである。しかしながら、これらの他、塩素、トリフレート(CF3SO3−)、トシラートまたはメシラートであってもよい。
【0028】
上記ホウ素誘導体官能基としては、−B(OH)2で表されるボロン酸基、好適なものとして−B(OR1)(OR2)、または−B(OR5O)で例示されるボロン酸エステル基、好適なものとして−BR3BR4で例示されるボラン基が挙げられる。ここでR1、R2は互いに独立にHまたは炭素数が1〜6のアルキル基であり、置換されていなくてもよく、置換されていてもよい。また、R3、R4は、互いに独立に炭素数が1〜6のアルキル基であり、置換されていなくてもよく、置換されていてもよい。そして、R5は2価の炭化水素ラジカルが最終的に5員環または6員環となったエステル環である。2価の炭化水素ラジカルは、置換されていなくてもよく、置換されていてもよい。R5としての適切な官能基には、炭素数が2または3のアルキレン基、オルト−またはメタ−フェニレン基が含まれる。なお、これらのアルキレン基およびフェニレン基は、置換されていなくてもよく、置換されていてもよい。また、適切なボロン酸エステル基には、例えば、1価の炭素数が1〜6のアルコール、ピナコール等のエタンジオール、プロパンジオールまたは1,2−ジヒドロキシベンゼン等のオルト芳香族ジオールと、対応するボロン酸とのエステル化による生成物が含まれる。
【0029】
有機エレクトロニクス素子用材料として好適な共役ポリマーを得るためには、原料モノマーとして、例えば、上記のような官能基を有するアリーレン、ヘテロアリーレン、ビフェニレン等の芳香族モノマーやナフタレン、フルオレン等の縮合芳香族モノマーなどを用いることが好ましく、上記のような官能基を有するアリーレン、ヘテロアリーレン、トリアリールアミンまたはビスアリーレンビニレンなどを用いることがより好ましく、ジアルキルフェニレン、ジアルコキシフェニレン、置換されたチオフェン、置換されていないチオフェン、ベンゾチアジアゾール、9,9−ジ−n−オクチルフルオレン等のジアルキルフルオレンなどを用いることが特に好ましい。なお、高分子鎖の所望の位置に官能基を付加するのであれば、1以上のモノマーから、数個〜数十個程度の比較的小さな単位からなる鎖を予め形成しておくこともできる。また、用語「芳香族モノマー」とは、1以上の芳香族環と直接的に置換可能な置換基を有するあらゆるモノマーを指称する。1以上の芳香族環を有するモノマーの場合、官能基を、同一の芳香族環または相違する芳香族環のいずれかに置換することができる。
【0030】
本発明の製造方法において用いうる反応溶媒は、モノマーおよび共役ポリマーを溶解することが可能なものであり、本反応を著しく阻害しないものが好ましい。このような溶媒としては、特に限定されないが、例えば、ベンゼン、トルエン、キシレン等の芳香族系有機溶媒、ジエチルエーテル、テトラハイドロフラン、ジオキサンなどのエーテル系有機溶媒、アセトニトリル、ジメチルホルムアミド、ジメチルスルホキシド、ヘキサメチルホスホトリアミド等を挙げることができる。例えば、共役ポリマーがポリフルオレン誘導体、ポリ(p−フェニレン)誘導体である場合には、アニソール、ベンゼン、エチルベンゼン、メシチレン、キシレン等の非極性芳香族溶媒を使用することができ、トルエン、アニソールが好ましい。
【0031】
また、溶媒中におけるモノマーの濃度は、0.01〜3.0mol/Lが好ましく、さらに好ましくは0.05〜1.5mol/Lである。モノマーが低濃度では、反応に時間を要し、かつ高分子量な共役ポリマーが得られにくく、高濃度では、溶媒の粘性が増加しやすく、均一な反応が起こりにくい。なお、これらの数値は、使用されたモノマーの全モル数に基づいて算出されたものである。
【0032】
本発明の製造方法において用いる触媒は、アルキルホスフィン類もしくはコーンアングル(θ)170度以上190度以下のホスフィン類がパラジウムに配位してなるものであり、もちろん、コーンアングル(θ)が170度以上190度以下のアルキルホスフィン類がパラジウムに配位してなるものを用いることもできる。
【0033】
上記触媒を調製するために用いるパラジウム化合物としては、特に限定されないが、例えば、ヘキサクロロパラジウム(IV)酸ナトリウム四水和物、ヘキサクロロパラジウム(IV)酸カリウム等の4価パラジウム化合物類、塩化パラジウム(II)、臭化パラジウム(II)、酢酸パラジウム(II)、パラジウムアセチルアセトナート(II)、ジクロロビス(ベンゾニトリル)パラジウム(II)、ジクロロビス(アセトニトリル)パラジウム(II)、ジクロロビス(トリフェニルホスフィン)パラジウム(II)、ジクロロテトラアンミンパラジウム(II)、ジクロロ(シクロオクタ−1,5−ジエン)パラジウム(II)、パラジウムトリフルオロアセテート(II)等の2価パラジウム化合物類、パラジウム(I)トリ−tert−ブチルホスフィンブロマイドダイマー等の1価のパラジウム化合物類、トリス(ジベンジリデンアセトン)二パラジウム(0)、トリス(ジベンジリデンアセトン)二パラジウムクロロホルム錯体(0)、テトラキス(トリフェニルホスフィン)パラジウム(0)、ビス(トリ−tert−ブチルホスフィン)パラジウム(0)等の0価パラジウム化合物類等が挙げられる。
【0034】
上記パラジウム化合物の使用量は、特に限定するものではないが、ハロゲン化モノマー1モルに対しパラジウム換算で通常0.0001〜20モル%の範囲である。パラジウム化合物が上記範囲内であれば合成できるが、活性を更に向上させ重合を進行させるため、また、高価なパラジウム化合物を使用することから、より好ましいパラジウム化合物の使用量は、ハロゲン化モノマー1モルに対し、パラジウム換算で0.001〜5モル%の範囲である。
【0035】
また、上記パラジウム化合物のパラジウムに配位させる上記アルキルホスフィン類としては、特に限定されないが、例えば、下記一般式(1)または(2)で表されるトリアルキルホスフィン類であることが好ましい。
【化1】

【0036】
ここで、Pと結合する置換基であるR6〜R13は、それぞれ独立に、炭素数が1〜12の直鎖もしくは分岐鎖アルキル基もしくはアルコキシ基であることが好ましく、置換基があっても良い。アルキルホスフィン類として、より具体的には、例えば、トリメチルホスフィン、トリエチルホスフィン、トリス−(2−シアノエチル)ホスフィン、トリプロピルホスフィン、トリ−イソプロピルホスフィン、tert−ブチル(ジイソプロピルホスフィン)、トリ−n−ブチルホスフィン、トリ−iso−ブチルホスフィン、トリ−sec−ブチルホスフィン、トリ−tert−ブチルホスフィン、トリ−シクロヘキシルホスフィン、トリオクチルホスフィントリドデシルホスフィン、トリベンジルホスフィン、ジ(tert−ブチル)2−{[ジ(tert−ブチル)ホスフィノ]メチル}ベンジル)ホスフィン、ジシクロヘキシル[2−(ジシクロヘキシルホスフィノ)エチル]ホスフィン、ジシクロヘキシル[2−(ジシクロヘキシルホスフィノ)プロピル]ホスフィン、ジシクロヘキシル[2−(ジシクロヘキシルホスフィノ)ブチル]ホスフィン、(R)−1−[(1S)−2(ジフェニルホスフィノ)フェロセニル]エチルジ−tert−ブチルホスフィン、トリメチルホスファイト、トリエチルホスファイト、トリプロピルホスファイト、トリイソプロピルホスファイト等を用いることができる。これらのうち、反応性の高さ、ポリマ中へのP存在量の低減の観点から、トリ−tert−ブチルホスフィンがより好ましい。
【0037】
また、上記パラジウム化合物のパラジウムに配位させる上記コーンアングル(θ)が170度以上190度以下のホスフィン類としては、例えば、トリシクロヘキシルホスフィン、ジ(tert−ブチル)フェニルホスフィン、トリス(tert−ブチル)ホスファイト、トリス(o−tert−ブチルフェニル)ホスファイト、トリネオペンチルホスフィン、トリ(tert−ブチル)ホスフィン、トリス(2,3,4,5,6−ペンタフルオロフェニル)ホスフィン、トリス(2,6−ジメチルフェニル)ホスファイトなどが挙げられる。共役ポリマー中へのP挿入量を低減させるためには、コーンアングル(θ)が180度以上190度以下のものがより好ましく、このようなホスフィン類としては、例えば、トリ(tert−ブチル)ホスフィン、トリス(2,3,4,5,6−ペンタフルオロフェニル)ホスフィン、トリス(2,6−ジメチルフェニル)ホスファイトなどが挙げられる。コーンアングルが170度以上190度以下の範囲にないホスフィン類を用いると、共役ポリマー中へのP挿入量が増加もしくはモノマーの反応性が低下することがある。なお、リン配位子のコーンアングル(θ)は、文献(Chemical Reviews,1977,vol.77,No.3)から得ることができる。
【0038】
上記ホスフィン類の使用量は、上記パラジウム化合物に対して通常0.01〜10000倍モルの範囲で使用すればよい。活性を更に向上させるため、また、高価なホスフィン類を使用することから、より好ましいホスフィン類の使用量は、パラジウム化合物に対して0.1〜10倍モルの範囲である。なお、本発明における触媒は、例えば、上記パラジウム化合物と上記ホスフィン類を適当な溶媒中にて混合、攪拌することで調製することができる。また、本発明では、上記のようなホスフィン類を有する市販のパラジウム触媒を用いてもよく、この場合には上記のような調製は必要なくなる。
【0039】
本発明の製造方法において用いうる塩基としては、無機塩基及び/又は有機塩基から選択すればよく、特に限定するものではない。無機塩基の例としては、炭酸ナトリウム、炭酸カリウム、炭酸セシウム、リン酸カリウムなどが挙げられる。また、水溶液の状態で用いられ、例えば1M〜2Mの炭酸カリウム等である。塩基の量は、モノマーのモル量よりも多ければよく、好ましくはハロゲン化物モノマーに対し5倍以上が好ましく、さらに好ましくは10倍以上である。有機塩基の例としては、アルキルアンモニウム水酸化物、アルキルアンモニウム炭酸塩、アルキルアンモニウム重炭酸塩、アルキルアンモニウムボロン酸塩、1,5−ジアザビシクロ[4.3.0]ノナ−5−エン(DBN)、1,8−ジアザビシクロ[5.4.0]ウンデセ−7−エン(DBU)、1,4−ジアザビシクロ[2.2.2]オクタン(DABCO)、ジメチルアミノピリジン(DMAP)、ピリジン、トリアルキルアミン、テトラアルキルアンモニウムフルオライド等のアルキルアンモニウムフルオライドを例示することができ、テトラメチルアンモニウム水酸化物、テトラエチルアンモニウム水酸化物、テトラ−n−プロピルアンモニウム水酸化物等のテトラアルキルアンモニウム水酸化物が好適である。有機塩基は、ハロゲン化物モノマーに対して少なくとも1.5当量であることが好ましく、少なくとも2当量であることがより好ましい。
【0040】
本発明の製造方法において用いうる相間移動触媒としては、例えば、テトラアルキルハロゲン化アンモニウム、テトラアルキル硫酸水素アンモニウム、テトラアルキル水酸化アンモニウムなどが挙げられる。ただし、塩基としてテトラアルキルアンモニウム水酸化物を用いるときには相関移動触媒を用いなくても良い。具体的な例としては、トリカプリルアルキルアンモニウムクロライド等が挙げられる。相間移動触媒の量としては、上記反応溶媒に対して1重量%〜8重量%が好ましく、さらに好ましくは2重量%〜4重量%である。少なすぎると、反応が進行しにくくなり、多すぎると精製による相間移動触媒除去が煩雑となる。
【0041】
本発明の製造方法は、常圧下、加圧下でも行うことができる。また、窒素、アルゴン等の不活性ガス雰囲気下で行うことが、共役ポリマーの酸化反応や触媒失活などの副反応を防ぐために好ましい。また、本発明における反応温度は、50〜150℃が好ましく、さらに好ましくは70〜130℃である。反応温度が低すぎると、反応に時間が長くなり、収率が低下する一方、反応温度が高すぎると、副反応が進行しやすくなる。また、反応させる際にマイクロ波を照射しつつ加熱してもよい。また、本発明における反応時間は、溶媒、モノマー、塩基、パラジウム化合物とアルキルホスフィン類からなる触媒の量や反応温度によって一定しないが、好ましくは、数分〜72時間の範囲の範囲から適宜選択する。反応終了後には、常法によって処理することにより目的とする共役ポリマーを得ることができる。
【0042】
本発明の製造方法で得られる共役ポリマーは、有機エレクトロニクス素子用材料、特に有機エレクトロルミネッセンス素子(有機EL素子)用材料として好適であり、例えば、単独で有機EL素子の、正孔注入層、正孔輸送層、電子ブロック層、発光層、正孔ブロック層、電子輸送層、電子注入層などの活性層として使用することができる。
【0043】
本発明の製造方法で得られる、有機エレクトロニクス素子用材料として好適な共役ポリマーとしては、例えば、主骨格として、ポリフェニレン、ポリフルオレン、ポリフェナントレン、ポリピレン等のポリ(アリーレン)またはその誘導体、ポリチオフェン、ポリキノリン、ポリカルバゾール等のポリ(ヘテロアリーレン)またはその誘導体、ポリ(アリーレンビニレン)またはその誘導体、ポリ(アリーレンエチニレン)またはその誘導体を含むポリマーもしくはオリゴマーを有し、また、ユニットとして(即ち、主骨格中の構造だけではなく、側鎖の構造であってもよい)、ベンゼン、ナフタレン、アントラセン、フェナントレン、クリセン、ルブレン、ピレン、ペリレン、インデン、アズレン、アダマンタン、フルオレン、フルオレノン、ジベンゾフラン、カルバゾール、ジベンゾチオフェン、フラン、ピロール、ピロリン、ピロリジン、チオフェン、ジオキソラン、ピラゾール、ピラゾリン、ピラゾリジン、イミダゾール、オキサゾール、チアゾール、オキサジアゾール、トリアゾール、チアジアゾール、ピラン、ピリジン、ピペリジン、ジオキサン、モルホリン、ピリダジン、ピリミジン、ピラジン、ピペラジン、トリアジン、トリチアン、ノルボルネン、ベンゾフラン、インドール、ベンゾチオフェン、ベンズイミダゾール、ベンゾオキサゾール、ベンゾチアゾール、ベンゾチアジアゾール、ベンゾオキサジアゾール、プリン、キノリン、イソキノリン、クマリン、シンノリン、キノキサリン、アクリジン、フェナントロリン、フェノチアジン、フラボン、トリフェニルアミン、アセチルアセトン、ジベンゾイルメタン、ピコリン酸、シロール、ポルフィリン、イリジウム等の金属配位化合物等又はそれらの誘導体の構造を含むポリマーもしくはオリゴマー等を有するものが挙げられ、これらの骨格を有する低分子化合物であってもよい。なかでも、主骨格として、ポリ(アリーレン)またはその誘導体、ポリ(ヘテロアリーレン)またはその誘導体を含むポリマーもしくはオリゴマーを有し、また、ユニットとして、ベンゼン、ナフタレン、アントラセン、フェナントレン、ピレン、フルオレン、ジベンゾフラン、カルバゾール、ジベンゾチオフェン、フラン、チオフェン、オキサジアゾール、トリアゾール、チアジアゾール、ピリジン、トリアジン、ベンゾチオフェン、ベンズイミダゾール、ベンゾオキサゾール、ベンゾチアゾール、ベンゾチアジアゾール、ベンゾオキサジアゾール、キノリン、イソキノリン、アクリジン、フェナントロリン、トリフェニルアミン、アセチルアセトン、ジベンゾイルメタン、イリジウム等の金属配位化合物等またはその誘導体を含むポリマーもしくはオリゴマーを有する共役ポリマーが好ましい。
【0044】
また、本発明の製造方法で得られる共役ポリマーは、リンの含有量が50ppm以下であることが好ましく、20ppm以下であることがより好ましい。リン含有量が50ppm以下の共役ポリマーを用いて有機エレクトロニクス素子を製造することで、当該素子の電気的特性をより優れたものにすることができる。
【0045】
また、本発明の共役ポリマーに、種々の添加剤を添加させた状態でも有機エレクトロニクス素子用材料や有機EL素子用材料として使用することができる。添加剤としては、例えば、有機EL素子の発光層に用いるのであればIrやPtなどの中心金属を含む金属錯体などが、正孔注入層、正孔輸送層に用いるのであればトリフェニルアミン誘導体、テトラシアノキノジメタン等の電子受容体、種々の酸化剤が使用可能である。
【0046】
本発明の有機エレクトロニクス素子および有機EL素子は、上記したような本発明の共役ポリマーまたはこれを含む材料からなる活性層を備えるものであればよく、その構造などは特に限定されない。なお、有機ELの一般的な構造は、例えば、米国特許第4,539,507号や米国特許第5,151,629号等に開示されているものがあり、また、ポリマー含有の有機EL素子については、例えば、国際公開WO第90/13148号や欧州特許公開第0443861号等に開示されている。これらは通常、電極の少なくとも1つが透明であるカソード(陰極)とアノード(陽極)との間に、エレクトロルミネセント層(発光層)を含むものである。さらに、1つ以上の電子注入層及び/又は電子輸送層がエレクトロルミネセント層(発光層)とカソードとの間に挿入されているもの、1つ以上の正孔注入層及び/又は正孔輸送層がエレクトロルミネセント層(発光層)とアノードとの間に挿入されているものもある。
【0047】
上記カソード材料としては、例えば、Li、Ca、Mg、Al、In、Cs、Ba、Mg/Ag、LiF、CsF等の金属又は金属合金であることが好ましい。アノード材料としては、透明基体(例えば、ガラス又は透明ポリマー)上に、金属(例えば、Au)又は金属導電率を有する他の材料、例えば、酸化物(例えば、ITO:酸化インジウム/酸化錫)を使用することもできる。
【0048】
本発明の共役ポリマーまたはこれを含む材料を用いて有機エレクトロニクス素子の活性層を形成するためには、例えば、本発明の共役ポリマーまたはこれを含む材料を含有する溶液を、例えば、インクジェット法、キャスト法、浸漬法、凸版印刷、凹版印刷、オフセット印刷、平板印刷、凸版反転オフセット印刷、スクリーン印刷、グラビア印刷等の印刷法、スピンコーティング法などの公知の方法で所望の基体上に塗布し、光照射する、または光照射後もしくは光照射と同時に加熱処理することによって達成でき、これを繰り返すことで有機エレクトロニクス素子や有機EL素子の多層化を図ることが可能である。
【0049】
上記塗布方法は、通常、−20〜+300℃の温度範囲、好ましくは10〜100℃、特に好ましくは15〜50℃で実施することができ、また、上記溶液に用いる溶媒としては、特に限定されないが、例えば、クロロホルム、塩化メチレン、ジクロロエタン、テトラヒドロフラン、トルエン、キシレン、メシチレン、アニソール、アセトン、メチルエチルケトン、酢酸エチル、酢酸ブチル、エチルセロソルブアセテート等を挙げることができる。
【0050】
また、上記光照射には、低圧水銀灯、中圧水銀灯、高圧水銀灯、超高圧水銀灯、メタルハライドランプ、キセノンランプ、蛍光灯、発光ダイオード、太陽光等の光源を用いることができる。また、上記加熱処理は、ホットプレート上やオーブン内で行うことができ、0〜+300℃の温度範囲、好ましくは20〜250℃、特に好ましくは80〜200℃で実施することができる。
【0051】
また、上記活性層の膜厚は、特に限定されないが、10〜100nmであることが好ましく、より好ましくは20〜60nm、さらに好ましくは20〜40nmである。
【実施例】
【0052】
以下、本発明を実施例により詳細に説明するが、本発明は以下の実施例に限定されるものではない。
【0053】
<Pd触媒の調製1>
窒素雰囲気下のグローブボックス中で、室温(25℃)下、サンプル管にトリス(ジベンジリデンアセトン)二パラジウム(73.2mg、80μmol)を秤取り、アニソール(15ml)を加え、30分間攪拌した。同様に、サンプル管にトリ−tert−ブチルホスフィン(129.6mg、640μmol)を秤取り、アニソール(5ml)を加え、5分間攪拌した。これらの溶液を混合し室温(25℃)で30分間攪拌し触媒とした。
【0054】
<Pd触媒の調製2>
窒素雰囲気下のグローブボックス中で、室温(25℃)下、サンプル管にトリス(ジベンジリデンアセトン)二パラジウム(73.2mg、80μmol)を秤取り、アニソール(15ml)を加え、30分間攪拌した。同様に、サンプル管にトリス(2,3,4,5,6−ペンタフルオロフェニル)ホスフィン(340.6mg、640μmol)を秤取り、アニソール(5ml)を加え、5分間攪拌した。これらの溶液を混合し室温(25℃)で30分間攪拌し触媒とした。
【0055】
<Pd触媒の調製3>
窒素雰囲気下のグローブボックス中で、室温(25℃)下、サンプル管にトリス(ジベンジリデンアセトン)二パラジウム(73.2mg、80μmol)を秤取り、アニソール(15ml)を加え、30分間攪拌した。同様に、サンプル管にトリフェニルホスフィン(167.9mg、640μmol)を秤取り、アニソール(5ml)を加え、5分間攪拌した。これらの溶液を混合し室温(25℃)で30分間攪拌し触媒とした。
【0056】
<Pd触媒の調製4>
窒素雰囲気下のグローブボックス中で、室温(25℃)下、サンプル管にトリス(ジベンジリデンアセトン)二パラジウム(73.2mg、80μmol)を秤取り、アニソール(15ml)を加え、30分間攪拌した。同様に、サンプル管にトリ−o−トリルホスフィン(194.8mg、640μmol)を秤取り、アニソール(5ml)を加え、5分間攪拌した。これらの溶液を混合し室温(25℃)で30分間攪拌し触媒とした。
【0057】
<Pd触媒の調製5>
窒素雰囲気下のグローブボックス中で、室温(25℃)下、サンプル管にトリス(ジベンジリデンアセトン)二パラジウム(73.2mg、80μmol)を秤取り、アニソール(15ml)を加え、30分間攪拌した。同様に、サンプル管にトリメシチルホスフィン(248.7mg、640μmol)を秤取り、アニソール(5ml)を加え、5分間攪拌した。これらの溶液を混合し室温(25℃)で30分間攪拌し触媒とした。
【0058】
(実施例1)
ポリ(9,9−ジ−n−オクチルフルオレン)の合成1
窒素雰囲気下、三口丸底フラスコに2,7−ジブロモ−9,9−ジオクチルフルオレン(0.4mmol)、9,9−ジオクチルフルオレンのジボロン酸エステル(0.4mmol)を加え、さらに3.75重量%トリカプリルメチルアンモニウムクロライドアニソール溶液(1.5ml)、Pd触媒の調製1で調製した溶液(500μl)を加えた。30分撹拌した後、K2CO3水溶液(2M、5.3ml)を加えた。攪拌しながら、24時間、95℃で加熱・還流した。ここまでの全ての操作は窒素気流下で行った。
【0059】
反応終了後、反応混合物をメタノール−水(9:1)(150ml)に注いだ。生じた沈殿を吸引ろ過し、メタノール−水(9:1)で洗浄した。得られた沈殿を再びトルエンに溶解し、メタノール−アセトン(8:3)(90ml)から再沈殿した。得られた沈殿を吸引ろ過し、メタノール−アセトン(8:3)(90ml)で洗浄した。メタノール−アセトン(8:3)から再び再沈殿し、得られた沈殿を真空乾燥し、目的物を得た(収率64.8重量%)。31P−NMR測定を行い、tert−ブチルホスフィン及びtert−ブチルホスフィンオキサイドが除去されていることを確認した(図1参照)。重量平均分子量Mwは、溶離液にTHFを用いたGPC(ポリスチレン換算)により測定した。Pの定量分析は、ポリマーを秤取り、硫酸、硝酸及び過塩素酸で加熱分解した後、塩酸と硝酸で処理し、希塩酸で定容液としたものについてICP質量分析法により行った。結果を表1に示す。なお、図1において、O=PPh3を添加しないときには、同ケミカルシフトにピークは検出されない。
【0060】
(比較例1)
ポリ(9,9−ジ−n−オクチルフルオレン)の合成2
窒素雰囲気下、三口丸底フラスコに2,7−ジブロモ−9,9−ジオクチルフルオレン)(0.4mmol)、9,9−ジオクチルフルオレンのジボロン酸エステル(0.4mmol)を加え、さらに3.75重量%トリカプリルメチルアンモニウムクロライドアニソール溶液(1.5ml)、Pd触媒の調製3で調製した溶液(500μl)を加えた。30分撹拌した後、2M K2CO3水溶液(5.3ml)を加え、さらに、攪拌しながら、24時間、95℃で加熱・還流した。ここまでの全ての操作は窒素気流下で行った。実施例1と同様の精製を行い、目的物を得た(収率、73.2重量%)。31P−NMR測定を行い、トリフェニルホスフィン及びトリフェニルホスフィンオキサイドが除去されていることを確認した(図2参照)。分子量測定及びPの定量分析は、実施例1と同様な手法で行った。結果を表1に示す。なお、図2において、O=PPh3を添加しないときには、同ケミカルシフトにピークは検出されない。
【0061】
(比較例2)
ポリ(9,9−ジ−n−オクチルフルオレン)の合成3
窒素雰囲気下、三口丸底フラスコに2,7−ジブロモ−9,9−ジオクチルフルオレン(0.4mmol)、9,9−ジオクチルフルオレンのジボロン酸エステル(0.4mmol)を加え、さらに3.75重量%トリカプリルメチルアンモニウムクロライドアニソール溶液(1.5ml)、Pd触媒の調製4で調製した溶液(500μl)を加えた。30分撹拌した後、2M K2CO3水溶液(5.3ml)を加え、さらに、攪拌しながら、24時間、95℃で加熱・還流した。ここまでの操作は全て窒素気流下で行った。実施例1と同様の精製を行い、目的物を得た(収率75.0重量%)。31P−NMR測定を行い、トリ−o−トリルホスフィン及びトリ−o−トリルホスフィンオキサイドが除去されていることを確認した。分子量測定及びPの定量分析は、実施例1と同様な手法で行った。結果を表1に示す。
【表1】

【0062】
(実施例2)
ポリ(9,9−ジ−n−オクチルフルオレン)の合成4
窒素雰囲気下、三口丸底フラスコに2,7−ジブロモ−9,9−ジオクチルフルオレン(0.4mmol)、9,9−ジオクチルフルオレンのジボロン酸エステル(0.4mmol)を加え、アニソール(1.5ml)、Pd触媒の調製1で調製した溶液(500μl)を加えた。30分撹拌した後、20重量%テトラエチルアンモニウム水酸化物水溶液(1.33ml)及び水(4.0ml)を加え、激しく攪拌しながら、24時間、95℃で加熱・還流した。ここまでの全ての操作は窒素気流下で行った。
【0063】
反応終了後、反応混合物をメタノール−水(9:1)(150mL)に注いだ。生じた沈殿を吸引ろ過し、メタノール−水(9:1)で洗浄した。得られた沈殿を再びトルエンに溶解し、メタノール−水(9:1)(150mL)で再び再沈殿し、生じた沈殿を吸引ろ過し、メタノール−水(9:1)で洗浄した。得られた沈殿を再びトルエンに溶解し、メタノール−アセトン(8:3)(90ml)から再沈殿した。得られた沈殿を吸引ろ過し、メタノール−アセトン(8:3)(90ml)で洗浄した。メタノール−アセトン(8:3)から再び再沈殿し、得られた沈殿を真空乾燥し、目的物を得た(収率69.4重量%)。31P−NMR測定を行い、tert−ブチルホスフィン及びtert−ブチルホスフィンオキサイドが除去されていることを確認した。分子量測定及びPの定量分析は、実施例1と同様な手法で行った。結果を表2に示す。
【0064】
(実施例3)
ポリ(9,9−ジ−n−オクチルフルオレン)の合成5
マイクロ波合成反応装置としてマイルストーンゼネラル社製MicroSYNTHを使用した。反応は、専用のテフロン(登録商標)製反応容器を用いて行った。溶媒は、30分以上窒素バブルにより脱気した後、使用した。反応容器に2,7−ジブロモ−9,9−ジオクチルフルオレン(0.4mmol)、9,9−ジオクチルフルオレンのジボロン酸エステル(0.4mmol)を加え、さらに3.75重量%トリカプリルメチルアンモニウムクロライドアニソール溶液(1.5ml)、Pd触媒の調製1で調製した溶液(500μl)を加えた。30分撹拌した後、K2CO3水溶液(2M、5.3ml)を加えた。ここまでの操作は全て、窒素雰囲気下のグローブボックス中で行った。反応容器を窒素雰囲気下で密閉し、マイクロ波反応装置にセットし、マイクロ波の照射により室温(25℃)から90℃まで10分間で昇温させ、その後90℃で120分間反応させ、目的物を得た(収率78.9重量%)た。温度制御は、反応溶液に浸した温度センサーで内部温度を測定し、マイクロ波出力を制御することで行った。精製及び分析は実施例1と同様な方法で行った。結果を表2に示す。
【表2】

【0065】
(実施例4、5)
原料モノマーとして表3に記載した化合物を用いた以外は、実施例3と同様な手法で共役ポリマーを合成した。精製及び分析は実施例1と同様な方法で行った。結果を表4に示す。
【表3】

【0066】
(比較例3,4)
触媒としてPd触媒の調製3で調製した溶液(500μl)を用いた以外は、実施例4、5と同様な手法で共役ポリマーを合成した。精製及び分析は実施例1と同様な方法で行った。結果を表4に示す。
【表4】

【0067】
(実施例6)
ポリ(9,9−ジ−n−オクチルフルオレン)の合成6
窒素雰囲気下、三口丸底フラスコに2,7−ジブロモ−9,9−ジオクチルフルオレン(0.4mmol)、9,9−ジオクチルフルオレンのジボロン酸エステル(0.4mmol)を加え、アニソール(3.0ml)、Pd触媒の調製2で調製した溶液(1.0ml)を加えた。30分撹拌した後、20重量%テトラエチルアンモニウム水酸化物水溶液(4.0ml)及び水(4.0ml)を加えた。激しく攪拌しながら、24時間、95℃で加熱・還流した。ここまでの全ての操作は窒素気流下で行った。
【0068】
反応終了後、反応混合物をメタノール−水(9:1)(150mL)に注いだ。生じた沈殿を吸引ろ過し、メタノール−水(9:1)で洗浄した。得られた沈殿をトルエンに溶解し、メタノール−水(9:1)(150mL)から再沈殿し、生じた沈殿を吸引ろ過し、メタノール−水(9:1)で洗浄した。得られた沈殿を再びトルエンに溶解し、メタノール−アセトン(8:3)(90ml)から再沈殿し、生じた沈殿を吸引ろ過し、メタノール−アセトン(8:3)で洗浄した。得られた沈殿を再びトルエンに溶解し、メタノール−アセトン(8:3)(90ml)から再沈殿し、得られた沈殿を真空乾燥し、目的物を得た(収率78.3重量%)。31P−NMR測定を行い、トリス(2,3,4,5,6−ペンタフルオロ)ホスフィンとトリス(2,3,4,5,6−ペンタフルオロ)ホスフィンオキサイドが存在しないことを確認した。分子量測定及びPの定量分析は、実施例1と同様な手法で行った。結果を表5に示す。
【0069】
(実施例7)
ポリ(9,9−ジ−n−オクチルフルオレン)の合成7
マイクロ波合成反応装置としてマイルストーンゼネラル社製MicroSYNTHを使用した。反応は、専用のテフロン(登録商標)製反応容器を用いて行った。溶媒は、30分以上窒素バブルにより脱気した後、使用した。反応容器に2,7−ジブロモ−9,9−ジオクチルフルオレン(0.4mmol)、9,9−ジオクチルフルオレンのジボロン酸エステル(0.4mmol)を加え、アニソール(3.0ml)、Pd触媒の調製2で調製した溶液(1.0ml)を加えた。30分撹拌した後、20重量%テトラエチルアンモニウム水酸化物水溶液(4.0ml)及び水(4.0ml)を加えた。ここまでの操作は全て、窒素雰囲気下のグローブボックス中で行った。反応容器を窒素雰囲気下で密閉し、マイクロ波反応装置にセットし、マイクロ波の照射により室温から90℃まで10分間で昇温させ、その後90℃で120分間反応させ、目的物を得た(収率80.2重量%)。温度制御は、反応溶液に浸した温度センサーで内部温度を測定し、マイクロ波出力を制御することで行った。精製及び分析は実施例6と同様な方法で行った。結果を表5に示す。
【0070】
(比較例5)
ポリ(9,9−ジ−n−オクチルフルオレン)の合成8
Pd触媒の調製2で調製した溶液(1.0ml)の代わりに、Pd触媒の調製3で調製した溶液(1.0ml)を用いた以外は、実施例7と同様の操作で合成を行った。精製及び分析は実施例6と同様な方法で行った(収率73.8%)。結果を表5に示す。
【0071】
(比較例6)
ポリ(9,9−ジ−n−オクチルフルオレン)の合成9
Pd触媒の調製2で調製した溶液(1.0ml)の代わりに、Pd触媒の調製4で調製した溶液(1.0ml)を用いた以外は、実施例7と同様の操作で合成を行った。精製及び分析は実施例6と同様な方法で行った(収率85.5%)。結果を表5に示す。
【0072】
(比較例7)
ポリ(9,9−ジ−n−オクチルフルオレン)の合成10
Pd触媒の調製2で調製した溶液(1.0ml)の代わりに、Pd触媒の調製5で調製した溶液(1.0ml)を用いた以外は、実施例7と同様の操作で合成を行ったが、反応が進行せず、目的物は得られなかった。
【表5】

【0073】
(実施例8、9)
原料モノマーとして表6に記載した化合物を用いた以外は、実施例7と同様な手法で共役ポリマーを合成した。精製及び分析は実施例6と同様な方法で行った。結果を表7に示す。
【表6】

【0074】
(比較例8,9)
触媒としてPd触媒の調製3で調製した溶液(1.0ml)を用いた以外は、実施例8、9と同様な手法で共役ポリマーを合成した。精製及び分析は実施例6と同様な方法で行った。結果を表7に示す。
【表7】

【0075】
本発明によれば、P含有量が従来よりも極めて小さい共役ポリマーを得ることができるため、当該共役ポリマーを用いて優れた電気的特性を有する有機エレクトロニクス素子及び有機エレクトロルミネッセンス素子を提供することが可能となる。
【特許請求の範囲】
【請求項1】
鈴木カップリング反応を用いた共役ポリマーの製造方法において、アルキルホスフィン類もしくはコーンアングル(θ)が170度以上190度以下のホスフィン類と、パラジウムと、からなる触媒を用いる、共役ポリマーの製造方法。
【請求項2】
前記アルキルホスフィン類が、トリアルキルホスフィン類である、請求項1記載の共役ポリマーの製造方法。
【請求項3】
前記アルキルホスフィン類が、トリ−tert−ブチルホスフィンである、請求項1記載の共役ポリマーの製造方法。
【請求項4】
前記コーンアングルが180度以上190度以下である、請求項1記載の共役ポリマーの製造方法。
【請求項5】
請求項1〜4のいずれかに記載の共役ポリマーの製造方法で製造された共役ポリマー。
【請求項6】
リン含有量が50ppm以下である請求項5記載の共役ポリマー。
【請求項7】
リン含有量が20ppm以下である請求項5記載の共役ポリマー。
【請求項8】
請求項5〜7のいずれかに記載の共役ポリマーを用いてなる有機エレクトロニクス素子。
【請求項9】
請求項5〜7のいずれかに記載の共役ポリマーを用いてなる有機エレクトロルミネッセンス素子。
【請求項1】
鈴木カップリング反応を用いた共役ポリマーの製造方法において、アルキルホスフィン類もしくはコーンアングル(θ)が170度以上190度以下のホスフィン類と、パラジウムと、からなる触媒を用いる、共役ポリマーの製造方法。
【請求項2】
前記アルキルホスフィン類が、トリアルキルホスフィン類である、請求項1記載の共役ポリマーの製造方法。
【請求項3】
前記アルキルホスフィン類が、トリ−tert−ブチルホスフィンである、請求項1記載の共役ポリマーの製造方法。
【請求項4】
前記コーンアングルが180度以上190度以下である、請求項1記載の共役ポリマーの製造方法。
【請求項5】
請求項1〜4のいずれかに記載の共役ポリマーの製造方法で製造された共役ポリマー。
【請求項6】
リン含有量が50ppm以下である請求項5記載の共役ポリマー。
【請求項7】
リン含有量が20ppm以下である請求項5記載の共役ポリマー。
【請求項8】
請求項5〜7のいずれかに記載の共役ポリマーを用いてなる有機エレクトロニクス素子。
【請求項9】
請求項5〜7のいずれかに記載の共役ポリマーを用いてなる有機エレクトロルミネッセンス素子。
【図1】


【図2】




【図2】


【公開番号】特開2013−100545(P2013−100545A)
【公開日】平成25年5月23日(2013.5.23)
【国際特許分類】
【出願番号】特願2013−27912(P2013−27912)
【出願日】平成25年2月15日(2013.2.15)
【分割の表示】特願2007−121028(P2007−121028)の分割
【原出願日】平成19年5月1日(2007.5.1)
【出願人】(000004455)日立化成株式会社 (4,649)
【Fターム(参考)】
【公開日】平成25年5月23日(2013.5.23)
【国際特許分類】
【出願日】平成25年2月15日(2013.2.15)
【分割の表示】特願2007−121028(P2007−121028)の分割
【原出願日】平成19年5月1日(2007.5.1)
【出願人】(000004455)日立化成株式会社 (4,649)
【Fターム(参考)】
[ Back to top ]

