共有ゾーンを有する分析デバイス
【課題】液体サンプル中の1種以上の分析物の存在および/または量を決定するための分析デバイスが開示される。
【解決手段】上記分析デバイスが、
(a)各々標識付き結合剤を固定化するための検出ゾーンを有する流路を含み、1つまたは両方の検出ゾーンでの標識付き結合剤の検出が1種以上の分析物の存在および/または量を示す第1および第2分析部と、
(b)共有参照ゾーンと、
(c)検出ゾーンおよび参照ゾーンを照明するための1つ以上の光源と、
(d)検出ゾーンおよび参照ゾーンからの光を検出するための1つ以上の光検出器であって、大きさが検出された光の量に関連する信号を発生する、光検出器と、
(e)光検出器からの信号を処理するための信号処理手段とを含む。
【解決手段】上記分析デバイスが、
(a)各々標識付き結合剤を固定化するための検出ゾーンを有する流路を含み、1つまたは両方の検出ゾーンでの標識付き結合剤の検出が1種以上の分析物の存在および/または量を示す第1および第2分析部と、
(b)共有参照ゾーンと、
(c)検出ゾーンおよび参照ゾーンを照明するための1つ以上の光源と、
(d)検出ゾーンおよび参照ゾーンからの光を検出するための1つ以上の光検出器であって、大きさが検出された光の量に関連する信号を発生する、光検出器と、
(e)光検出器からの信号を処理するための信号処理手段とを含む。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、分析物の存在または量を決定するための分析デバイス、キット、および方法に関する。詳細には、広い濃度範囲にわたる分析物の決定に関する。
【背景技術】
【0002】
簡単な側方流免疫学的分析デバイスが開発され、流体サンプル中の分析物の検出用に市販された(例えば、欧州特許第291194号明細書参照)。典型的にそのようなデバイスは対象分析物に結合することのできる乾燥された移動可能な標識を付けた結合剤、および標識付き結合剤の下流の検出ゾーンに提供された分析物に結合することのできる固定化された(immobilized)結合剤を含む多孔質担体を含む。固定化された標識付き結合剤が検出ゾーンで検出されることはサンプル中に分析物が存在することを示す。
【0003】
代わりに、対象分析物がハプテンであるとき、免疫学的分析デバイスは、標識付き分析物または類似分析物が固定化結合剤用のサンプル中に存在する分析物と検出ゾーンで競合する競合反応を用いることができる。代わりに、分析デバイスは抑制反応を用いることができ、それによって固定化分析物または類似分析物が検出ゾーンに提供され、分析デバイスは分析物用の移動可能な標識付き結合剤を含む。
【0004】
分析デバイスは、1種以上の分析物を決定することができる。例えば、不正使用薬物の存在を決定する分析の場合、デバイスは全種類の薬物を決定することができる。そのような側方流免疫学的分析デバイスには、複数の検出ゾーンが設けられ、そのようなゾーンは単一または複数の側方流担体上に提供される。
【0005】
分析結果の決定は従来目視によって行われた。しかし、そのようなデバイスは使用者によって解釈される結果を必要とし、これには望ましくない程度に主観が入る。
【0006】
したがって、分析結果を決定するように構成された光学的検出手段、ならびに分析結果を表示する表示手段を含むデジタルデバイスが開発された。流体サンプル中の分析物の濃度および/量を決定する分析試験ストリップと組み合わせて使用するためのデジタル分析読み取り機は、一体化されたデジタル分析読み取り機を含む分析デバイスとして知られる。
【0007】
発光ダイオード(LED)などの光源からの光は多孔質担体の一部を照らし、反射または透過した光は光検出器によって検出される。典型的に、読み取り機は担体のさまざまな領域を照明するために1つより多くのLEDを有し、複数の各LEDのために対応する光検出器が提供される。欧州特許第1484601号明細書は、デバイス中の光検出器の数を削減することのできるバッフル構成を含む側方流試験ストリップのデジタル読み取りデバイス用の光学的構成を開示する。
【0008】
そのようなデバイスは、しばしば1回だけ使用するように設計され、したがって、特に高価な光学および電子部品が含まれる場合、そのようなデバイスのコストを可能な限り低くすることが望ましい。
【特許文献1】欧州特許第291194号明細書
【特許文献2】欧州特許第1484601号明細書
【発明の開示】
【発明が解決しようとする課題】
【0009】
本発明の一態様による目的は、2つ以上の分析流路を含む分析デバイスに必要な光学部品の数を削減することのできる1つ以上の共有ゾーンを有する分析デバイスを提供することである。
【課題を解決するための手段】
【0010】
第1の態様によれば、本発明は液体サンプル中の1種以上の分析物の存在および/または量を決定するための分析デバイスを提供し、このデバイスは、
(a)各々標識付き結合剤を固定化するための検出ゾーンを有する流路を含み、1つまたは両方の検出ゾーンでの標識付き結合剤の検出が1種以上の分析物の存在および/または量を示す第1および第2分析部と、
(b)共有参照ゾーンと、
(c)検出ゾーンおよび参照ゾーンを照明するための1つ以上の光源と、
(d)検出ゾーンおよび参照ゾーンからの光を検出するための1つ以上の光検出器であって、大きさが検出された光の量に関連する信号を発生する、光検出器と、
(e)光検出器からの信号を処理するための信号処理手段とを含む。
【0011】
本発明のさらに他の目的は、2つ以上の分析流路を含む1つ以上の分析試験ストリップとともに使用するための分析読み取り機を提供することであり、分析読み取り機は典型的に必要な光学部品の数を削減する。
【0012】
第2態様によれば、本発明は、各々1つの流路を含む第1および第2分析部の結果を読み取るための分析読み取り機を提供し、各流路は、1つまたは両方の検出ゾーンでの標識付き結合剤の検出が1種以上の分析物の存在および/または量を示す標識付き結合剤を固定化するための検出ゾーンと、共有参照ゾーンとを含み、この分析読み取り機は、
(a)検出ゾーンおよび共有参照ゾーンを照明するための1つ以上の光源と、
(b)検出ゾーンおよび参照ゾーンからの光を検出するための1つ以上の光検出器であって、大きさが検出された光の量に関連する信号を発生する、光検出器と、
光検出器からの信号を処理するための信号処理手段とを含み、共有参照ゾーンから得た信号は検出ゾーンから得た信号の値を補償するために用いられる。
【0013】
読み取り機が読み取り運転可能な分析は、各々この検出ゾーンの1つをそれぞれ含む第1および第2流路を含む1つ以上の分析試験ストリップ上で行われるのが好ましい。第1および/または第2分析部は、デバイスの使用前に乾燥状態で検出ゾーンの上流に移動可能な形で提供される標識付き結合剤を含むことができる。
【0014】
共有参照ゾーンは、第1または第2分析部のいずれかの部分として含むことができる。代わりに、参照ゾーンは、第1および第2分析部への副流路上に提供することができる。参照ゾーンは検出ゾーンに相当しない流路の一部、または、乾燥した標識付き薬剤が検出ゾーンの上流に存在する場合、乾燥した標識付き薬剤が存在する場所に相当しない一部から選択することができる。参照ゾーンは、検出ゾーンの下流または上流に提供することができる。参照ゾーンの測定は、流路から反射または透過された光のバックグラウンドレベルの測定を可能にする。バックグラウンドレベルは、例えば、多孔質担体の光学的反射率、液体サンプルまたは標識付き結合剤などの分析要素の存在によって影響を受け得る。したがって、検出ゾーンで測定された光のレベルは、バックグラウンドの光のレベルに対して補正され得、検出ゾーンに存在する標識付き結合剤の量をより正確に示す補償された信号を提供する。また、参照ゾーンでの測定は、分析デバイスに用いられる流体サンプル間のあらゆる変動に対して補償し、例えば、尿サンプルは色が広範囲に変動することができる。1つの分析部について参照ゾーンで得られた信号の値は、他の分析部について検出ゾーンで得られる信号の値を補償するために用いることができる。そのような参照ゾーンは両方の分析部間で「共有」される。共有参照ゾーンの提供は、各参照ゾーンが典型的に1つの光源しか必要としないので、分析デバイスに必要な部品の数を削減することができる。
【0015】
共有参照ゾーンの概念は、直感的にはわかりにくい(counter−intuitive)。参照測定の目的は、特に、薬剤または分析ストリップ組成物における変動の結果として、発生し得る信号のバックグラウンド読み取りにおける変動を可能にすることである。したがって、通常の実施は、各分析部上の分離した参照ゾーンを用いることであり、「専用の」参照測定を各分析部について行うことができる。しかし、本発明者らは分離した参照ゾーンを省き得、替わりに単一の共有参照ゾーンが十分であることを見出した。
【0016】
光源は、LEDであることが便利である。複数のLEDを用いることができる。一実施形態において、分析部の各ゾーン(検出、参照または対照ゾーン)はそれぞれのLEDによって照明される。1つ以上の光検出器は1つのフォトダイオードを含むことが便利である。好ましい実施形態において、単一のフォトダイオードまたは他の光検出器が用いられる。一実施形態において、4つのLEDと1つのフォトダイオードが存在する。
【0017】
分析デバイスは、第1または第2分析部のいずれかの部分として提供される単一の対照ゾーンをさらに含むことができる。替わりに、対照ゾーンは第1または第2分析部の副次的流路上に提供することができる。単一対照ゾーンの提供は、必要な光源の数をさらに削減する。対照ゾーンの目的は、分析が正しく行われたことを示す、すなわち、流体サンプルがデバイスに供給され標識付き結合剤が流路に沿ってある程度動いたことを示すことである。対照ゾーンは、検出ゾーンの下流に提供することができる。適切な対照ゾーンは、欧州特許第291194号明細書に開示され、標識付き結合剤用の固定化結合剤を含むことができる。標識付き結合剤の分離した集団は、検出ゾーンおよび対照ゾーンの上流に提供することができ、この標識付き結合剤の分離集団は対照ゾーンで固定化することができるが、分析物の存在または不在下、検出ゾーンで固定化されない。対照ゾーンは典型的に検出ゾーンの下流に提供される。また、対照ゾーンで得られる信号は、参照ゾーンで得られる信号に関して参照することができる。
【0018】
したがって、対照ゾーンでの信号の測定は、その分析部について試験が正確に(または不正確に)行われた値または表示を提供する。例えば、対照ゾーンが、試験が1つの分析部について正確に行われたことを示すならば、他の分析部についても試験が正確に行われたことが想定される。したがって、対照ゾーンは分析デバイスの分析間で「共有」されていると考えることができる。共有参照ゾーンの場合、単一または「共有」対照ゾーンはデバイスで用いられる光学部品の数の削減を可能にする。これを仮定する根拠は、液体サンプルが1つの分析流路に加えられたならば、特に、2つの分析流路が、例えば、共通のサンプル受容手段、例えば多孔質サンプル受容器によって接続されるならば、液体サンプルが他の流路に与えられた可能性が高いことである。さらに、分析デバイスが、例えば、移動可能な薬剤の再懸濁を悪くする湿気の侵入、または結合剤を劣化させ得る高い温度などの状況に曝されたならば、両方の流路が影響を受ける可能性が高い。また、共有参照ゾーンの場合、共有対照ゾーンの概念は直感的にはわかりにくい。対照ゾーンでの信号は、参照ゾーンの信号に関して計算される。
【0019】
参照および対照ゾーンは同じ分析部の部分として提供することができ、または異なる分析部の部分として提供することができる。例示的実施形態において、共有の参照および対照ゾーンは、各々分離した分析部に提供され、例えば、1つの分析部は検出ゾーンと参照ゾーンを含み、他の分析部は検出ゾーンと対照ゾーンを含む。
【0020】
第3の態様によれば、本発明は液体サンプル中の1種以上の分析物の存在および/または量を決定するための分析デバイスを提供し、このデバイスは、
(a)各々標識付き結合剤を固定化するための検出ゾーンを有する流路を含み、1つまたは両方の検出ゾーンでの標識付き結合剤の検出が1種以上の分析物の存在および/または量を示す第1および第2分析部と、
(b)共有対照ゾーンと、
(c)検出ゾーンおよび対照ゾーンを照明するための1つ以上の光源と、
(d)検出ゾーンおよび対照ゾーンからの光を検出するための1つ以上の光検出器であって、大きさが検出された光の量に関連する信号を発生する、光検出器と、
(e)光検出器からの信号を処理するための信号処理手段とを含む。
【0021】
第4の態様によれば、本発明は第1および第2分析部の結果を読み取るための分析読み取り機を提供し、各々が、
標識付き結合剤を固定化するための検出ゾーンを有する流路を含み、1つまたは両方の検出ゾーンでの標識付き結合剤の検出は1種以上の分析物の存在および/または量を示す第1および第2分析部と、共有対照ゾーンとを含み、この分析読み取り機は、
(a)検出ゾーンおよび共有対照ゾーンを照明するための1つ以上の光源と、
(b)記憶された対照信号閾値と、
(c)検出ゾーンおよび対照ゾーンからの光を検出するための1つ以上の光検出器であって、大きさが検出された光の量に関連する対照信号および検出信号を発生する、光検出器と、
(d)光検出器からの信号を処理して対照ゾーンから得た信号を対照信号閾値と比較し、対照信号が対照信号閾値と等しいか対照信号閾値より大きければ、両方の分析部が正確に行われたことを決定する信号処理手段とを含む。
【0022】
本発明の第1、第2、および第3の態様による分析デバイスおよび読み取り機は、対照信号閾値を含むことができる。
【0023】
対照信号閾値は、デバイスまたは読み取り機に記憶することができる。対照ゾーンから測定された信号を対照信号閾値と比較して十分な標識付き結合剤がこのゾーンで固定化されたかどうかを決定することができる。対照信号の値が対照信号閾値と等しいかまたは対照信号閾値を超えるならば、デバイスまたは読み取り機は分析が十分行われたことを決定することができる。対照信号が対照信号閾値よりも小さければ、デバイスまたは読み取り機は分析が十分行われなかったことを決定することができ、エラーメッセージを提供する。
【0024】
対照ゾーンから検出された信号は、参照ゾーンから得た信号に対して参照することができる。
【0025】
また、第3の態様による分析デバイスも共有参照ゾーンを含むことができる。
【0026】
第1および第2分析部は、検出ゾーンで固定化された形で提供された分析物用の結合剤または標識付き結合剤を含むことができるのが便利である。
【0027】
共有参照および/または共有対照ゾーンを用いることによって、本発明の分析デバイスは応答司令を求める必要のあるゾーンの数、したがって、用いる必要のある光学部品の数を削減する。共有ゾーンの使用は、第1および第2分析部の分析構造が非常に類似しているとき、または参照および/または対照ゾーンが1つ以上の副次的流路に提供されるならば、1つ以上の副次的流路の分析部構造が第1および第2分析部に類似するとき、最も効果的である。したがって、例えば、分析部は典型的に両方とも類似材料の多孔質担体を含むであろう(例えば、両方ともニトロセルロース担体を含む)。また、各分析部に同じ液体サンプルを用いるのが有利である。これは両方の分析部に流体連絡する共通のサンプル添加領域を提供することによって都合よく達成することができる。したがって、共通のサンプル添加領域を経由してデバイスに添加された単一の液体サンプルは、第1および第2分析部の両方を通って流れることができる。第1および第2分析部が同一ではない場合、各分析部で検出される光のバックグラウンドレベルが互いに十分類似している限り、共有参照ゾーンの提供を許容することができる。
【0028】
信号処理手段は、それぞれのゾーンの光検出器から得た信号を処理し試験ゾーンで得た値を参照ゾーンに関して計算することのできる中央プロセッサを含むことができる。測定データは分析中に様々な時間で取り出すことができ、光透過率または反射率の光学的な値を乾燥状態で得るために、デバイスが起動された後であるが流体サンプルがデバイスに添加される前に取り出すことができる。
【0029】
吸収性「シンク(sink)」を分析流路の末端部に提供することができる。共通のシンクを提供することができ、または各分析部の末端部にシンクを提供することができる。吸収性シンクは、例えば、CF7 Whatman紙などの高度に吸収性の材料を含むことが好ましく、検出ゾーン、参照ゾーン、および対照ゾーンの近傍から未結合の共役物を除去する十分な吸収能力を提供すべきである。そのようなシンクの代替として、検出ゾーンを超えて延在する所定長さの多孔質固体相材料を有することも十分であり得る。高度な吸収性シンクを提供する利点は、それが、それぞれの分析部の流路から過剰の標識付き結合剤を除去する、または実質的に除去することである。これはそれぞれのゾーンの近傍の未結合標識付き結合剤の量を最小化する効果を有し、したがって、異なる量の標識付き結合剤を有することのあるデバイスにおいて分析流路の使用が可能になる。
【0030】
検出ゾーンに固定化結合剤を提供する替わりに、結合剤は分析物−標識付き結合剤複合体に結合することのできる移動可能な形で提供することができる。結合剤は、例えば、アガロースなどの大きな粒子に共役することができ、検出ゾーンは、存在するいかなる標識付き結合剤/分析物/結合剤複合体もフィルターが捕捉することができ、捕捉剤に複合化されていない標識付き結合剤がフィルターを通過することができるように、その孔サイズが大きな粒子よりも小さいが標識付き結合剤のサイズよりも大きな寸法を有するフィルターを含むことができる。さらに替わりに、薬剤は検出ゾーンで移動可能な標識付き結合剤/分析物/結合剤複合体を結合することのできる固定化された形で提供することができる。例えば、結合剤を移動可能な形で提供し、ビオチンなどの結合化学種に共役することができ、検出ゾーンで固定化された薬剤はストレプトアビジンなどの補完的な結合相手である。
【0031】
分析デバイスは、サンドイッチ免疫学的分析および/または分析物の決定のための競合/抑制分析を用いることができる。サンドイッチ免疫学的分析の例は、標識付き結合剤/分析物/結合剤複合体が形成される場合である。デバイスは、典型的に分析物用の固定化結合剤を含む検出ゾーンの上流に提供された分析物用の移動可能な形の標識付き結合剤を含む。替わりに、特に対象分析物がハプテンであるとき、免疫学的分析デバイスは、標識付き分析物または標識付き類似分析物が検出ゾーンで固定化結合剤のためのサンプルに存在する分析物と競合する競合反応を用いることができる。標識付き分析物または標識付き類似分析物は、検出ゾーンの上流に移動可能な形で提供することができる。さらに代替として分析デバイスは、固定化分析物または類似分析物が検出ゾーンに提供される抑制反応を用いることができ、分析デバイスは分析物用に移動可能な標識付き結合剤を含む。
【0032】
本発明の目的のための用語「流路」は、第1位置から第2位置へ液体を移動することのできる基体を指し、例えば、毛管チャネル、微小流体流路、または側方流多孔質担体などの多孔質担体とすることができる。多孔質担体は1つまたは複数の多孔質材料を含むことができ、線状または積み重ね構成で重なり合うことができ、または流体接続される。多孔質担体材料は同じとすることができ、または異なることができる。第1および第2分析部は分離した基体上に提供することができ、またはそれらは第1分析部の流路に沿って運ばれている液体が第2分析部の流路と交差できないように、共通の基体上に提供することができる。例えば、第1および第2分析部は第1および第2流路が互いに分離されるように、同じ多孔質担体上に提供することができる。これは、例えば、多孔質担体の部品をレーザー切断してそれを非多孔質にし、したがって第1と第2分析部を分離することによって達成することができる。替わりに、非多孔質ブロッキング材料をストリップに沿って貼付し、同じ多孔質担体上に2つの流路(典型的に本質的に平行)を提供することができる。
【0033】
特に流路は、側方流多孔質担体とすることができる。多孔質担体として用いることのできる適切な材料は、ニトロセルロース、アセテート繊維、セルロースまたはセルロース誘導体、ポリエステル、ポリオレフィン、またはガラス繊維を含む。多孔質担体は、ニトロセルロースを含むことができる。これは予め化学処理しなくても結合剤を堅固に固定化することができる利点を有する。多孔質固体相材料が、例えば、紙を含むならば、第2ゾーンの抗体は、例えばCNBr、カルボニルジイミダゾール、または塩化トレシルを用いる化学的結合によって固定化する必要がある。
【0034】
用語「結合剤」は、結合対、すなわち、分子の1つが化学的および/または物理的手段によって第2分子と結合する2つの異なる分子の1つを指す。互いの結合はそれらが類似の特徴を有する他の分析構成要素からその結合相手を識別することのできるものであるという意味で2つの分子は関連性がある。結合対の分子はリガンドとレセプター(反リガンド)、結合対分子と結合対パートナー、などと呼ばれる。また、分子は分子の凝集のための結合対分子とすることができ、例えば、第2抗体の免疫学的複合体に対して発生した抗体とその対応する抗原は、免疫学的複合体の結合対分子であると考えることができる。
【0035】
抗原および抗体結合対分子に加えて、他の結合対は、制限することのない例として、ビオチンとアビジン、炭水化物とレクチン、補完的ヌクレオチド配列、補完的ペプチド配列、エフェクターとレセプター分子、酵素共同因子と酵素、酵素阻害剤と酵素、ペプチド配列と配列のための特定の抗体またはプロテイン全体、ポリマー酸と塩基、染料とプロテイン結合剤、ペプチドと特定のプロテイン結合剤(例えば、リボヌクレアーゼ、S−ペプチドとリボヌクレアーゼS−プロテイン)などを含む。さらに、特定の結合対は元の特定の結合分子の類似分子を含むことができる。
【0036】
標識付き結合剤の文脈において用いられるとき、「標識」は目視または機器手段によって検出可能な信号を発生することのできるいかなる物質をも指す。本発明に使用するのに適したさまざまな標識は、光学的に検出可能であるような化学的または物理的手段のいずれかによって信号を発生する標識を含む。そのような標識は酵素と基体、クロモゲン、触媒、蛍光化合物、化学ルミネセンス化合物、電気活性種、染料分子、放射性活性標識および粒子標識を含む。分析物自体、本質的に検出可能な信号を発生することができる。標識は、共有結合的に結合剤に付着することができる。特に、標識は光学的に検出可能なものから選択することができる。
【0037】
標識は金、銀などの粒子、セレニウムまたはテルリウムなどのコロイド状非金属粒子、染料または染料ゾルを組み込んだポリマー粒子などの染色された粒子または着色された粒子を含むことができる。染料は、任意の適切な色、例えば青とすることができる。染料は蛍光性とすることができる。染料ゾルは、Foron Blue SRP(Sandoz)およびResolin Blue BBLS(Bayer)などの市場で入手可能な疎水性染料物質から調製することができる。適切なポリマー標識は、ポリスチレン、ポリビニルトルエン、ポリスチレン−アクリル酸、ポリアクロレインなどの広範囲の合成ポリマーから選択することができる。用いられるモノマーは通常非水溶性であり、モノマーミセルが形成されるように水性界面活性剤中に乳化され、これは次いでエマルジョンに開始剤を加えることによってポリマー化が誘起される。実質的に球状のポリマー粒子が製造される。そのようなポリマー粒子の理想的なサイズ範囲は、約0.05μmから約0.5μmである。例示的実施形態によれば、標識は青いポリマー粒子である。
【0038】
乾燥された結合剤は、検出ゾーンを含む多孔質担体材料の上流に提供された多孔質担体材料上に提供することができる。上流の多孔質担体材料は、マクロポーラス(macroporous)とすることができる。マクロポーラス担体材料は低または非プロテイン結合とすべきであり、または非特定の結合を最小化しマクロポーラス本体が液体サンプルで濡れた後に標識付き薬剤の自由な動きを促進するために、BSAまたはPVAなどの薬剤によって容易にブロック化可能であるべきである。マクロポーラス担体材料は、必要であれば、それに高い親水性を与え、液体サンプルの急速な吸い上げを促進するために界面活性剤または溶媒で予備処理を行うことができる。マクロポーラス担体用の適切な材料は、ポリエチレンおよびポリプロピレンなどのプラスチック材料または紙またはガラス繊維などの他の材料を含む。標識付き結合剤が検出可能な粒子で標識を付けられる場合、マクロポーラス本体は粒子標識の最大粒子サイズよりも少なくとも10倍大きい孔サイズを有することができる。より大きな孔サイズは標識付き薬剤の放出をより良好にする。マクロポーラス担体の代替として、標識付き結合剤は検出ゾーンの上流に提供された非多孔質基体上に提供することができ、この非多孔質基体は流路の部分を形成する。
【0039】
多孔質担体は、ニトロセルロース多孔質担体の末端部の上流に重なり合ってガラス繊維マクロポーラス担体を含むことができる。
【0040】
液体サンプルは工業、環境、農業、または生物源など任意の源から誘導することができる。サンプルは、血液、血清、血漿、間質性流体、唾液、痰、眼のレンズ液体、汗、尿、ミルク、粘液、滑液、腹膜液、経皮滲出物、咽頭滲出物、気管支肺胞洗浄、気管吸引、脳脊髄液、精液、子宮頸粘液、膣または尿道分泌物、および羊膜液を含む生理的な源から誘導し、または構成することができる。特に源はヒトとすることができ、特にサンプルは尿とすることができる。
【0041】
本明細書に用いられる「光」は、波長にかかわらず任意の適切な電磁放射線を含むことが意図される。これにも拘わらず、本発明は主としてスペクトルの可視部分の光を用いることが意図され、したがって、「光源」および「光検出器」は、それぞれ電磁放射線、特に可視波長(すなわち、約390から800nmの範囲)の照射線に関する任意の源および検出手段を包含するものと解釈すべきである。
【0042】
光検出器は、分析デバイスの1つ以上のゾーンからの光を検出するであろう。光は、例えば、標識が蛍光などであるならば、これらのゾーンから実際に発生することができる。しかし、より通常的には光検出器はこれらのゾーンから放射するように見える光、すなわち、光源から発生しゾーンによって光検出器上に反射および/または透過される光を検出する。
【0043】
分析物は、トキシン、有機化合物、プロテイン、ペプチド、微生物、バクテリア、ウィルス、アミノ酸、核酸、炭水化物、ホルモン、ステロイド、ビタミン、麻薬(治療目的で投与されるもの、ならびに違法目的で服用するものを含む)、汚染物質、農薬、および任意の上記物質の代謝産物、または抗体を含むが、これらに制限されない。また、用語の分析物は、任意の抗原性物質、ハプテン、抗体、巨大分子、およびその組み合わせを含む。
【0044】
分析デバイスは、1種以上の分析物を決定することができる。
【0045】
分析デバイスは広い範囲の分析物にわたって分析物の量または存在を決定することができ、第1分析部は低濃度範囲の分析物のレベルを決定することができ、第2分析部は高濃度範囲の液体サンプル中の分析物のレベルを決定することができる。
【0046】
高い分析物範囲で分析物を測定するために分析部を調製することのできるいくつかの方法がある。
【0047】
例えば、分析デバイスは検出ゾーンの上流に提供された分析物用の標識付き結合剤と分析物用のスカベンジャー結合剤を含むスカベンジャー分析部を含むことができる。スカベンジャー結合剤は、過剰の分析物を除去し分析の感度を低下させる働きをする。これは分析のダイナミックレンジを増加させる効果を有し、高いレベルの分析物での測定を可能にする。スカベンジャー結合剤は固定化、移動可能化、またはその両方が可能である。スカベンジャー結合剤は、移動可能な標識付き結合剤と同じ多孔質担体の領域の上流または下流のいずれかに提供することができる。スカベンジャー結合剤は、移動可能な標識付き結合剤と同じ分析物の結合領域、または標識付き結合剤とは異なる分析物の領域に結合することができる。スカベンジャー剤は、第2分析部の移動可能な標識付き結合剤とは異なる分析物への親和性を有することができる。例示的実施形態において、スカベンジャー結合剤は、第2分析部の移動可能な結合剤よりも高い分析物への親和性を有することができる。分析物濃度に対する分析の感度を変化させるために、スカベンジャー結合剤の量を変化させることができる。スカベンジャー結合剤はより多くの分析物に結合することができ、検出ゾーンに結合することのできる標識付き結合剤の割合を効率的に低下させるという事実から、存在するスカベンジャー結合剤の量の増加は分析の感度を低下させる。
【0048】
分析のダイナミックレンジを増加するために、分析デバイスは例えば複数の検出ゾーンを含むことができ、各検出ゾーンは異なる分析物濃度レベルで分析物を結合することができる。例えば、それぞれのゾーンは分析物に対して異なる親和性を有する分析物用の結合剤を含むことができる。
【0049】
分析のダイナミックレンジを増加する他の方法は、サンドイッチ結合分析および競合または抑制分析を含む分析デバイスを提供することである。例えば、サンドイッチ分析は高感度分析とすることができ、すなわち、低濃度範囲の分析物を測定することができ、抑制または競合分析は低感度分析とすることができ、すなわち、高濃度範囲の分析物を測定することができる。さらに他の方法は、検出ゾーンの標識付き結合剤または固定化剤の親和性または量を変化させることである。高親和性の結合剤は、低親和性結合剤よりも高い分析物感度を有するであろう。同様に、低濃度の結合剤は、高濃度の結合剤よりも低い分析物感度を有するであろう。分析感度は標識付き結合剤の標識に対する結合剤の割合を変更することによって変化させることができる。標識として粒子が用いられるならば、標識に加えられた結合剤の量を変更して分析感度を変更することができる。分析の感度を操作するさらに他の方法は、分析に用いられる標識の量を変化させることである。例えば、分析の感度は標識付き結合剤用の標識付き化学種に対する結合剤の割合を低減することによって低くすることができる。
【0050】
分析感度を操作するさらに他の手段は、標識の光学的濃度を変更することである。分析感度は、低い光学密度を有する標識の使用によって低くすることができる。これは、例えば、低い濃度の染料を有するポリマー粒子標識の提供によって、または光学検出器に対して感度の低い着色標識を使用することによって達成することができる。
【0051】
高い分析物レベルを測定するさらに他の方法は、非粒子状標識付き結合剤を使用することである。サンドイッチ結合分析によって測定するとき、高レベルの分析物は高レベルの結合剤を必要とする。標識が粒子標識である場合、多孔質担体の内部または上に高レベルの分析物を提供することは立体障害を起こすことがあり、低い分析感度をもたらす。逆に、低い分析物レベルでの非粒子状標識付き結合剤の使用は、低い光学密度のため低い信号を発生することがある。しかし、高い分析物レベルで、非粒子状標識は検出の容易な十分高いレベルで存在することができる。光学的に検出可能な非粒子状標識の例は、染料とすることができる。染料は蛍光性とすることができる。
【0052】
分析感度は、多孔質担体の流量によって影響を与えることができる。分析の感度を低下させる方法は、より高い流量を有する多孔質担体(ニトロセルロースなど)を用いることである。
【0053】
分析の感度は、標識付き結合剤がその発生源から放出される速度を変更することによってさらに操作することができる。分析物の感度を低下させるさらに他の方法は、液体サンプルと接触する間に、多孔質担体からの標識付き結合剤を急速に放出させることである。標識付き結合剤の放出はデバイス内に砂糖、プロテイン、またはメチルセルロースなどの他のポリマー物質を提供することによって変更することができる。
【0054】
特定の実施形態によれば、分析デバイスは、検出ゾーン上流に提供された分析物用の移動可能な第2(スカベンジャー)結合剤および分析物用の移動可能な結合剤を含むスカベンジャー分析を含む。
【0055】
特定の実施形態によれば、第1分析部は低濃度範囲の分析物を測定することができ、第2分析部は高濃度範囲の分析物を測定することができる。第1分析部は共有参照ゾーンを含むことができ、第2分析部は共有対照ゾーンを含むことができる。
【0056】
第1分析部は、検出ゾーンの上流に提供された標識付き結合剤を含むことができ、第2分析部は検出ゾーンの上流に提供された標識付き結合剤と移動可能なスカベンジャー結合剤を含むことができる。スカベンジャー結合剤は、検出ゾーンの上流の標識付き結合剤の同じ位置または領域に提供することができる。
【0057】
特に、決定される分析物はhCGとすることができ、この場合、液体サンプルは尿とすることができる。
【0058】
分析デバイスはhCGなどの単一分析物を決定することができ、第1分析部は第1濃度範囲での液体サンプルのhCGレベルを決定することができ、第2分析部は第2濃度範囲での液体サンプルのhCGレベルを決定することができる。
【0059】
ある範囲の分析物の濃度を測定するために、分析信号が飽和しないように標識付き結合剤が十分存在することが保証されることが重要である。多量の分析物の測定は、増加する分析物濃度と共にいわゆる分析信号の「繋留効果(hook effect)」または飽和を避けるために、しばしばこれに相当する標識付き結合剤の量の増加を必要とする。対照信号の変動は、特に存在する結合剤の量の増加がある場合に発生することが判明した。
【0060】
第1および第2分析部が異なる量の標識付き結合剤を有して提供される場合、低レベルの標識付き結合剤を有する分析部の部分として参照ゾーンを提供することが有利であることが判明した。
【0061】
実施形態によれば、分析デバイスは分析物をより高い分析物範囲で測定することができる。そのようなデバイスを提供するいくつかの方法がある。
【0062】
例えば、分析デバイスは、検出ゾーンの上流に提供された分析物用の標識付き結合剤および分析物用の第2結合剤を含むことができる。第2結合剤は、過剰の分析物を除去して分析の感度を低下させる働きをする。これは分析のダイナミックレンジを増加する効果を有し高レベルの分析物での測定を可能にする。第2結合剤は固定化するか、移動可能化することができ、または両方が可能である。第2結合剤は、移動可能な標識付き結合剤と同じ多孔質担体の領域の上流または下流のいずれかに提供することができる。第2結合剤は、移動可能な標識付き結合剤と同じ分析物の結合領域、または標識付き結合剤と異なる分析物の領域に結合することができる。第2薬剤は第2分析部の移動可能な標識付き結合剤と異なる分析物への親和性を有することができる。例示的実施形態において、第2結合剤は第2分析部の移動可能な結合剤よりも高い分析物への親和性を有する。第2結合剤の量を変化させて分析物濃度に対する分析物の感度を変化させることができる。存在する第2結合剤量の増加は、第2結合剤がより多くの分析物に結合することができるという事実から分析物の感度を低下させ、検出ゾーンに結合できる標識付き結合剤の割合を効果的に低下させる。
【0063】
分析のダイナミックレンジを増加させるために、分析デバイスは、例えば複数の検出ゾーンを含むことができ、各検出ゾーンは異なる分析物の濃度レベルで分析物と結合することができる。例えば、それぞれのゾーンは分析物に対して異なる親和性を有する分析物用の結合剤を含むことができる。
【0064】
分析のダイナミックレンジを増加させる他の方法は、サンドイッチ結合分析および競合または抑制分析を含む分析デバイスを提供することである。例えば、サンドイッチ分析は高感度分析とすることができ、すなわち、それは低濃度範囲の分析物を測定することができ、抑制または競合分析は低感度の分析とすることができ、すなわち、それは高濃度範囲の分析物を測定することができる。さらに他の方法は検出ゾーンの標識付き結合剤または固定化された薬剤の親和性または量を変更することである。高い親和性の結合剤は低い親和性の結合剤よりも高い分析物感度を有するであろう。同様に、低濃度の結合剤は高濃度の結合剤よりも低い分析物感度を有するであろう。分析感度は標識付き結合剤の標識に対する結合剤の比を変更することによって変化させることができる。標識として粒子が使用されるならば、標識に加えられる結合剤の量を変更して分析感度を変更することができる。分析の感度を操作するさらに他の方法は、分析に用いられる標識の量を変更することである。例えば、分析の感度は標識付き結合剤用の標識付き化学種に対する結合剤の比を低減することによって低くすることができる。
【0065】
分析の感度を操作するさらに他の手段は、標識の光学密度を変更することである。分析感度は低い光学密度を有する標識の使用によって低くすることができる。これは、例えば、低濃度の染料を有するポリマー粒子標識の提供によって、または光検出器に感度の低い着色標識を使用することによって達成することができる。
【0066】
高レベルの分析物を測定するさらに他の方法は、非粒子状標識付き結合剤を用いることである。高レベルの分析物は、サンドイッチ結合分析によって測定するとき、高レベルの結合剤を必要とする。標識が粒子標識である場合、多孔質担体内または上へ高レベルの分析物を提供することは立体障害を発生することがあり、分析感度を悪くする。逆に、低レベルの分析物では非粒子状標識付き結合剤の使用は、低い光学密度のため低い信号を発生することがある。しかし、高レベルの分析物では非粒子状標識は容易に検出される十分高いレベルで存在することができる。光学的に検出可能な非粒子状標識の実施例は、染料とすることができる。染料は蛍光性とすることができる。
【0067】
分析感度は、多孔質担体の流量によって影響を与えることができる。分析の感度を低下させる方法は、高流量の多孔質担体(ニトロセルロースなど)を用いることである。
【0068】
分析の感度は、標識付き結合剤がその源から放出される速度を変更することによってさらに操作することができる。分析物感度を低くするさらに他の方法は、液体サンプルに接触している間に多孔質担体から標識付き結合剤を急速に放出させることである。標識付き結合剤の放出はデバイス内に砂糖、プロテイン、またはメチルセルロースなどの他のポリマー物質を提供することによって変更することができる。
【0069】
特定の実施形態によれば、分析デバイスは検出ゾーンの上流に提供された分析物用の移動可能な第2結合剤および分析物用の移動可能な結合剤を含む。第2結合剤は、標識付き結合剤と同じまたは類似の検出ゾーンの上流位置に提供することができる。
【0070】
特定の実施形態によれば、分析デバイスは各々流路を含む2つの分析部を含み、第1分析部は低い分析物濃度範囲の分析物を測定することができ、第2分析部は高い分析物濃度範囲の分析物を測定することができる。第1分析部は共有参照ゾーンを含むことができ、第2分析部は共有対照ゾーンを含むことができる。
【0071】
本発明の分析デバイスは広い濃度範囲にわたってhCGの量または存在を測定するのに用いることができる。範囲は約10mlUから約250,000mlUで変動することができる。
【0072】
第2分析部は、分析物用の標識付き結合剤および分析物用の第2結合剤を含むことができる。第1分析部は検出ゾーンの上流に提供された分析物用の標識付き結合剤を含むことができる。
【0073】
分析デバイスは、ある分析物範囲の分析物レベルを示すさらに他の1つ以上の測定閾値を含むことができる。一実施形態において、分析デバイスは第1および第2測定閾値を含み、第1測定閾値未満の分析物測定信号は分析物の不在またはあるレベルを超える分析物の不在を示し、第2閾値を超える分析物測定信号は第2濃度範囲の分析物レベルを示し、第2閾値未満の分析物測定信号は第1濃度範囲の分析物のレベルを示す。特定の実施形態によれば、分析デバイスはさらに第3の測定閾値を含み、第3閾値を超える分析物測定信号は第3濃度範囲の分析物のレベルを示す。
【0074】
特に、分析デバイスは液体サンプル中の分析物、特に雌の哺乳類被検者の尿のhCG分析物の存在または量を決定することができる。分析デバイスは第1測定閾値を含むことができ、閾値を下回るhCG分析物信号レベルは妊娠していないことを示し、第1測定閾値より大きいかまたは等しいhCG分析物信号レベルは妊娠していることを示し、デバイスは少なくともさらに他の測定閾値を含む。さらに、分析デバイスは妊娠の長さを示すことができる。分析デバイスは使用者に日または週単位による妊娠の長さなど、時間ベースの指示を提供することができる。
【0075】
尿中のhCGを決定する分析試験用の典型的な全分析展開時間は、3分間である。
【0076】
光学部品の数を削減することは本発明の望ましい目的であり、これは、参照ゾーンが1つの分析部の部分として提供され、対照ゾーンが他の分析部の部分として提供される場合、都合よく達成することができる。一実施形態によれば、参照ゾーンは低レベルの標識付き結合剤を有する第1分析部の部分として提供され、対照ゾーンは高レベルの結合剤を有する第2分析部の部分として提供される。
【0077】
一実施形態によれば、分析デバイスは4つの光源を含み、光源は第1および第2分析部の検出ゾーンならびに共有対照ゾーンおよび参照ゾーンを照明するように構成され、各ゾーンはそれぞれの光源によって照明される。1つ以上の光検出器は、それぞれのゾーンから反射および/または透過した光を検出するように配置することができる。一実施形態によれば、単一の光検出器を用いて全てのゾーンからの光を検出することができる。これは、例えば、デバイスが光検出器で検出された光がどのゾーンから放射されているかを識別することが可能なように、それぞれのゾーンを逐次的に照明することによって達成することができる。逐次的照明工程は分析の期間中、各ゾーンでの経時的な信号レベルを監視することができるように固定または変動周期で繰り返すことができる。さらに、1つ以上のゾーンから検出される光のレベルの変化を用いて流体サンプルがデバイスに添加されたかどうか、また、その時を決定し、デバイスに沿う液体サンプルの流量を決定することができる。流量の決定は、さらに他の品質管理チェックとして用いることができ、例えば、流量が設定したレベルよりも大きいかまたは小さいならば分析を拒絶することができる。適切な流量検出方法および手段は、欧州特許第1484641号明細書に開示される。
【0078】
標識付き結合剤は、典型的に経時的にサンドイッチ免疫学的分析の検出ゾーンに蓄積し、したがって、経時的な信号の増加速度を監視することができる。デバイスは信号が平衡に達した後、またはより典型的に反応が平衡に達する前の結果を決定することができる。デバイスは、個々の値などの量的な結果、1から10、11から20などの半量的結果または範囲、またはYES/NOなどの質的結果を提供することができる。デバイスは1つ以上の信号閾値に対する結果を決定することができる。デバイスは固定の測定時間を有することができ、または固定の測定時間が経過する前に早期結果を提供することができる。早期結果は、例えば、信号レベルが特定の閾値を決して超えない、または早期段階で特定の閾値を超えることをデバイスが決定する場合に得ることができる。これらの特定の場合に、デバイスは早期のNOまたはYES測定を呼び出すことができ、特定のベースレベル(ゼロとすることができる)に対する分析物の不在または存在を示す。早期の結果決定方法を用いる分析デバイスは、欧州特許第1464613号明細書に開示される。
【0079】
分析デバイスは、被検者が妊娠しているかどうか(すなわち、液体サンプルがあるレベルを超えるhCGを含むかどうか)を決定するのに用いることができ、さらに他の閾値を用いて使用者に妊娠の長さを示すこともできる。妊娠の長さは時間に基づく、または濃度に基づく測定に関して表示することができる。
【0080】
分析デバイスは典型的にハウジングを含む。ハウジングは流体浸透可能であり、ABSなどの適切なプラスチック材料から作ることができる。分析デバイスは、流体サンプルを受容するためのサンプル受容部材をさらに含むことができる。サンプル受容部材はハウジングから延在することができる。
【0081】
ハウジングは、流体浸透可能な材料から作ることができる。また、ハウジングは周囲の光を排除するのが望ましい。デバイスの外部に入射する可視光の10%未満、好ましくは5%未満、最も好ましくは1%未満の光がデバイスの内部に対して透過するならば、ハウジングまたはケーシングは実質的に周囲の光を排除していると考えられる。ポリカーボネート、ABS、ポリスチレン、ポリスチロール、高密度ポリエチレンなどの光透過可能な合成プラスチック材料、または適切な光遮蔽顔料を含むポリプロピレンはハウジングの製造に用いるための適切な選択物である。ハウジング内の内部空間内に提供された分析部と連絡するアパーチャをハウジングの外部に設けることができる。替わりに、アパーチャは多孔質サンプル受容器がハウジングからハウジングの外部の位置まで延在することを可能にする働きをすることができる。
【0082】
また、典型的にハウジングの内部には電源が設けられる。デバイスは典型的に分析の結果を表示する表示手段、ならびにデータを記憶するメモリー手段を含む。表示手段はLCDを含むのが都合がよい。
【0083】
表示手段は、エラーメッセージ、個人詳細、時間、日付、および使用者に分析が測定された長さを通知するタイマーなどのさらに他の情報をさらに表示することができる。分析によって表示される情報は、任意のフォント、アルファベットまたは言語の単語、数または記号、例えば、「陽性」、「陰性」、「+」、「−」、「妊娠」、「妊娠していない」、「医師に相談せよ」、「試験を繰り返せ」などで示すことができる。
【0084】
分析デバイスは、分析部の1つまたは両方の流路の上流に流体接続するサンプル受容多孔質部材を含むサンプル受容器をさらに含むことができる。分析デバイスは各々検出ゾーンを含む1つ以上の分析流路を含むことができ、この場合、複数の分析流路に共通の単一のサンプル受容多孔質部材を設けることができる。したがって、デバイスの多孔質部材に添加された流体サンプルは、それぞれの分析部の流路に沿ってそれぞれの検出ゾーンまで移動することができる。多孔質部材はハウジングの内部に設けることができ、または、例えば、このハウジングの外へ少なくとも部分的に延在し、例えば、尿流を採取する働きをすることができる。多孔質部材は流体貯蔵器として働くことができる。多孔質部材は液体を急速吸収することのできる任意の吸収性、多孔質または繊維質材料から作ることができる。材料の多孔質性は単一方向性(すなわち、孔または繊維が完全にまたは主として部材の軸に平行に走る)または多方向性(すなわち、全方向性であり、部材は非晶質のスポンジ状構造を有する)とすることができる。ポリプロピレン、ポリエチレン(好ましくは非常に高分子量の)、ポリフッ化ビニリデン、エチレンビニルアセテート、アクリロニトリル、およびポリテトラフルオロエチレンなどの多孔質プラスチック材料を用いることができる。他の適切な材料は、ガラス繊維を含む。共通のサンプル受容多孔質部材を提供することは、第1および第2分析部の流路に単一サンプルを同時に提供することを可能にし、共有参照および/または共有対照ゾーンの提供の効果をさらに高める。
【0085】
第5の態様において、本発明は1種以上の分析物の存在/または量を決定する分析の実施方法を提供し、方法は、液体サンプルを本発明の第1および第3態様による分析デバイスに接触させるステップを含む。
【発明を実施するための最良の形態】
【0086】
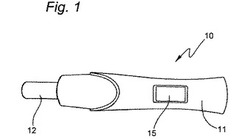
分析デバイスの外部上面が図1に示される。デバイス(10)は長さ約14cmおよび幅約25mmに引き伸ばされる。ケーシング(11)はポリカーボネート、ABS、ポリスチレン、高密度ポリエチレン、またはポリプロピレンなどの適切な液体浸透可能なケーシングから形成され得る。外部の多孔質サンプル受容器(12)は液体を急速に吸収することのできる任意の吸収性、多孔質または繊維材料から形成することができる。また、分析結果を表示するためのLCDディスプレイ(15)が示される。また、分析デバイス内部には、図示されない分析流路、光源、光検出器、電源および付属電子部品が提供される。
【0087】
図2は、例示的実施形態による分析デバイスの光検出器および個々の分析多孔質担体の配置を示す。分析デバイス(20)は、第1分析部(22)と第2分析部(23)を流体接続する共通のサンプル添加領域(21)を有する。単一の光検出器(4)が2つの分析部の間に提供されてそれぞれのゾーンからの光を検出する。ゾーン(24)および(25)は、第1分析部(22)の検出および対照ゾーンにそれぞれ相当する。ゾーン(26)および(27)は、第2分析部(23)の検出および参照ゾーンにそれぞれ相当する。それぞれのゾーンを適切に配置された窓を通して照明する対応する4つのLEDは示されない。
【0088】
図3は、単一の光検出器(32)と4つのLED(31)を含む例示的実施形態による配置図を示す。光検出器の活性領域は、1.5mm×1.5mmである。
【0089】
図4は、分析デバイス(40)の概略断面図を示し、いくつかの部品の相対位置を示す。LED(41)からの光はストリップ(42)のゾーンを照明し、ゾーンから反射した光は光検出器(44)によって検出される。同様に、LED(45)からの光はストリップ(46)のゾーンを照明し、反射した光は光検出器によって検出される。LEDからの光が直接光検出器上に入射することを防止する分割器(47)が提供される。また、LED(41)によるストリップ(46)の照明、したがって、LED(45)によるストリップ(42)の照明を防止する働きをするが、それぞれの試験ストリップから反射した光が光検出器によって検出されることを可能にする傾斜部材(48)が提供される。また、傾斜部材は、試験ストリップから反射した光を光検出器へ案内する働きをする。LEDは印刷回路基板から作られた表面(49)上に搭載される。
【0090】
図5aは例示的実施形態のバッフル構成の下側図を示す。その中の1つが示されるLED(参照符号51で表わされる)からの光はアパーチャを通して分析ストリップ(図示せず)のゾーンを照明する。各LEDはそれぞれのアパーチャに付属する。図において、例示的アパーチャは参照符号55で表わされる。光はストリップから光検出器(52)へ反射される。また、傾斜部材(53)および分割器(56)も示される。隣接するLEDは、バッフル(54)によって互いに遮蔽される。
【0091】
図5bは、異なる斜視方向からの例示的実施形態のバッフル構成の下側図を示す。傾斜部材(53)は軸(57)の周りに対称であり、4つのLED(図示せず)からの反射された光を光検出器(図示せず)へ案内する働きをする。
【0092】
図6は、アパーチャ(62)上に配置され位置決めピン(63)によって位置が保持された試験ストリップ(61)を見下ろす分析デバイスの上面図を示す。LEDおよび光検出器は、アパーチャを通して部分的に見ることができる。
【0093】
(実施例1)
低感度試験ゾーン(高濃度の分析物の測定用)および高感度試験ゾーン(低濃度の分析物の測定用)を含む分析デバイス用のそれぞれのゾーンから決定された信号値は、以下の信号演算手段によって求められる。
【0094】
ストリップおよび窓の使用は、以下の表(図2参照)に定義される。
【表1】

【0095】
各窓から反射された光の測定は毎秒約2回で行われ、ローパスデジタルフィルターを用いてノイズを除去しデータが平滑化される。フィルタリングされた値が、流れを検出し、結果を求めるために用いられ、正規化された相対減衰パーセント(%A)で表わされる。これはデバイス内とデバイス間の両方の光学部品におけるあらゆる変動を考慮して最小にする。
【0096】
測定値は、反射された光の量に逆比例する。
【0097】
各窓について、参照窓、対照窓、および試験窓の窓比は、多孔質担体が乾燥している、t=0(サンプルを加える前)ときの測定値を、サンプルの添加後の時間tの測定値で除したものに等しい。
【0098】
フィルタリングされた窓比の計算
各時間点tについて、各窓の窓比は次のように計算される。
Ref比t=(フィルタリングされた参照窓の値)時間=0/(フィルタリングされた参照窓の値)時間=t
HS比t=(フィルタリングされたHS試験窓の値)時間=0/(フィルタリングされたHS試験窓の値)時間=t
LS比t=(フィルタリングされたLS試験窓の値)時間=0/(フィルタリングされたLS試験窓の値)時間=t
Ctrl比t=(フィルタリングされたCtrl試験窓の値)時間=0/(フィルタリングされたCtrl試験窓の値)時間=t
【0099】
フィルタリングされた%A値の計算
正規化された相対減衰パーセント(%A)は、参照(ref.)窓の窓比と考えている窓比(対照または試験窓)との差を参照窓の窓比で除し、100%を掛けることによって与えられる。
【0100】
各時間点tについて、%A値はHS試験ライン、LS試験ライン、および対照ラインについて計算され、
HSt(%A)=[(参照比t−HS試験比t)/参照比t]×100%
LSt(%A)=[(参照比t−LS試験比t)/参照比t]×100%
Ctrlt(%A)=[(参照比t−Ctrl試験比t)/参照比t]×100%
【0101】
(分析デバイスの構造)
本発明の第1態様による分析デバイスは、検出ゾーンの上流に提供された標識付き結合剤を含む第1分析試験ストリップと、分析物用の標識付き結合剤および第2(スカベンジャー)結合剤、ならびに検出ゾーンおよび対照ゾーンの上流に提供された対照ゾーン用の標識付き結合剤を含む第2分析試験ストリップを含んで構成された。
【0102】
(第1分析試験ストリップの調製)
検出ゾーンは、PBSAバッファー中の濃度3mg/mlの抗β−hCG抗体(インハウスクローン3468)のラインを、1μl/cmの速度で長さ350mm×幅40mm(Whatman)、厚さ90から100ミクロンの175ミクロンの裏打ち層に積層された8ミクロンの孔サイズを有する寸法のニトロセルロース帯上に分配することによって調製した。抗β−hCG抗体は、Biodot xyz3050分配プラットフォームを用いて、ライン幅約1.2mmおよび長さ約300mmとしてニトロセルロースの長さに沿って10mmの位置に加えた。
【0103】
ニトロセルロースの帯は、Hedinair乾燥炉シリーズ#17494セットを用いて55℃およびスピード5(1回のパス)で乾燥した。
【0104】
続いて、ニトロセルロースは、5%エタノール(BDH Analar 104766P)+150mMの塩化ナトリウム(BDH Analar 10241AP)+(Sigma T1503)からの50mMのトリス塩基+Tween20(Sigma P1379)と1%(w/v)のポリビニルアルコール(PVA、Sigma 360627)との混合物を含む遮断バッファーを用いて遮断した。
【0105】
遮断バッファーは1.75μl/mmの速度で帯の隣接端部に加えた。遮断溶液が膜に吸い込まれると、2%(w/v)のスクロース(脱イオン水中のSigma S8501)溶液を同じ装置を用いて1.6μl/mmの速度で加え、ニトロセルロース膜に約5分間吸い込ませた。
【0106】
次いで、NCの帯はHedinair乾燥炉シリーズ#17494セットを用いて75℃およびスピード5(1回のパス)で乾燥した。
【0107】
(第1多孔質担体材料上の移動可能な標識付き結合剤の調製)
標識付き結合剤を以下の計画にしたがって調製した。
【0108】
(抗αhCGを有するラテックス粒子のコーティング)
(1)Duke Scientific製の青ラテックス粒子(直径400nm、10%固体(w/v)のDB1040CB)を100mMの四ホウ素二ナトリウムバッファーpH8.5(BDH AnalaR 102676G)(DTB)で2%固体(w/v)に希釈する。
(2)2つのEppendorf遠心チューブ中の体積2mlの希釈ラテックスを17000rpm(25,848rcf)で10分間、Heraeus Biofuge 17RS遠心機で遠心して希釈ラテックスを洗浄する。上澄み液を除去して廃棄し、ペレットを100mMのDTB中に再懸濁させて1mlの総体積中に4%固体(w/v)を得る。
(3)エタノールと酢酸ナトリウム(5%w/vの酢酸ナトリウムSigmaS−2889と95%エタノールBDH AnalaR 104766P)の混合物を調製する。
(4)100μlのエタノール−酢酸ナトリウム溶液をステップ2で洗浄したラテックスに加える(これはラテックス体積の10%である)。
(5)抗体株(インハウスクローン3299)を希釈してDTB中の約1200μg/mlの抗体を得る。
(6)ステップ5で希釈した抗体1ml体積を41.5℃に設定した水浴で約2分間加熱する。また、ステップ4の洗浄したラテックス+エタノール−酢酸ナトリウムを同じ水浴で2分間加熱する。
(7)希釈抗体をラテックス+酢酸エタノールに加えて良く混合し、磁気攪拌装置と混合物中に置いた磁気攪拌棒(magnetic flea)を用いて混合しながら41.5℃に設定した水浴中で1時間インキュベートする。
(8)40mg/mlのBovine Serum Albumin(BSA)溶液(脱イオン水中のIntergen W22903)を調製する。40mg/mlのBSAと等しい体積をラテックス/抗体/酢酸エタノールの混合物に加えることによってラテックスを遮断し、連続的に攪拌しながら水浴中で41.5℃で30分間インキュベートする。
(9)ステップ2のように混合物を17000rpmで10分間遠心する(体積をEppendorfチューブ間で1mlのロットに分割する)。上澄み液を除去して廃棄し、ペレットを100mMのDTB中に再懸濁させる。ステップ2の遠心を繰り返し、上澄み液を除去して廃棄し、Air Brushing Buffer(20%(w/v)のスクロースSigma S8501、100mMのTrizma Base Sigma T1503 pH9中の10%のBSA(w/v))中でペレットを再懸濁させる。Air Brushing Bufferを加えて4%(w/v)固体ラテックスを得る。
【0109】
共役ラテックスをガラス繊維多孔質担体(F529−09、Whatman)上のBSAとスクロースの混合物に50g/時間および110mm/秒の速度で噴霧し、Hedinar Conveyor炉シリーズ番号17494セットを用いて65℃およびスピード5(1回のパス)で乾燥した。
【0110】
参照ゾーンとして選択したゾーンは、ニトロセルロースに沿って13mmの距離、すなわち検出ゾーンの下流にあった。
【0111】
標識付き薬剤が最上部にあり、ガラス繊維がニトロセルロースの表面をニトロセルロース膜の帯の長さ(350mm)に沿って約2mm重なり合うように配置された透明な接着剤コーティング積層フィルム(Ferrisgate、幅38mm)を用いて標識付き結合剤を含むガラス繊維材料をニトロセルロース膜に取り付けた。ガラス繊維は、それが検出ゾーンの上流にあるようにニトロセルロースの端部に取り付けた。
【0112】
続いて、積層シートを幅6mmおよび長さ25mmのガラス繊維多孔質担体材料を含む試験ストリップに切断し、標識付き薬剤を2mm重なり合い上流に提供されたガラス繊維の長さに沿って20mmに添加し、ニトロセルロース膜は幅6mmおよび長さ40mmを有した。
【0113】
(第2分析部試験ストリップの調製)
検出ゾーンは以下のように調製した。
PBSAバッファー中のMAbマウス抗ヒトβ−hCG抗体(クローン3468)3mg/mlをBiodot XYZ3050分配プラットフォームを用いてニトロセルロース(第1分析部による種類と寸法)上10mmの位置に1μl/cmでプロットし、第1分析部用の単一の検出ゾーンを提供した。
【0114】
対照ゾーンは以下のように調製した。
PBSAバッファー中2mg/mlのヤギ抗ウサギ抗体(Lampire)を第2分析部に使用したものと同じニトロセルロース上にBiodot XYZ3050分配プラットフォームを用いて13mmの位置に1μl/cmでプロットし、分析デバイス用の単一の対照ゾーンを提供した。
【0115】
400nmの青ポリスチレンラテックス(Duke Scientifc)に共役させたマウス抗ヒトα−hCG mAb(クローン3299)をスカベンジャー抗体mAbマウス抗ヒトβ−hCG(インハウスクローン3468)に3mg/mlで混合し、最終的に3%の青ラテックス、0.075mg/mlの最終3468濃度、および0.06mg/ml濃度の遊離抗βhCG抗体を得た。得られた混合物をBIODOT XYZS(シリーズ番号1673)を用いてWhatmanガラス繊維(F529、25mm幅のリール)上にエアブラシし、90g/時間でF529−09ガラス繊維上の約20mm位置に2.02μg/cm噴霧した。噴霧された溶液は、広がって約7mm長さの帯を形成した。
【0116】
また、対照ゾーン用の標識付き結合剤も分析物用の標識付き結合剤と同じ多孔質担体の領域に以下のようにして堆積した。
【0117】
ウサギIgG(Dako)をBSA/スクロース中の400nmの青ラテックスポリスチレンラテックス(Duke Scientific)に共役させて最終的に0.7%固体の青ラテックスを得て65g/時間でガラス繊維上に噴霧した。
【0118】
ガラス繊維をHedinar Conveyor炉シリーズ番号17494セットを用いて65℃およびスピード5(1回のパス)で乾燥した。上記を繰り返してガラス繊維上にラテックスの第2パスを堆積したが、元の噴霧位置から約0.8mm偏らせた(ガラス繊維のさらに下流)。ガラス繊維は上で説明したようにして乾燥した。
【0119】
ラテックスを噴霧したガラス繊維材料は、噴霧されたラテックスが最上部にあり、ガラス繊維がニトロセルロースの表面をニトロセルロース膜の帯の長さ(350mm)に沿って約2mm重なり合うように配置された透明な接着剤コーティング積層フィルム(Ferrisgate、幅38mm)を用いてニトロセルロース膜に取り付けた。ガラス繊維はニトロセルロース膜の上流に提供し、結合剤はガラス繊維の末端部に向かって提供した。
【0120】
続いて、積層シートは、幅6mmおよび長さ25mmのガラス繊維多孔質担体材料を含む試験ストリップに切断し、標識付き薬剤は2mm重なり合う上流に提供されたガラス繊維の長さに沿って20mmに添加し、ニトロセルロース膜は幅6mmおよび長さ40mmを有した。長さ45mm、幅12mmおよび厚さ約2.5mmの多孔質サンプル受容器(Filtrona)を第1多孔質担体材料の上流に約3mm重なり合わせて提供した。
【0121】
また、対照ゾーン用の標識付き結合剤は、分析物用標識付き結合剤と同じ多孔質担体の領域上に以下のようにして堆積した。
【0122】
ウサギIgG(Dako)をBSA/スクロース中の400nmの青ラテックスポリスチレンラテックス(Duke Scientific)に共役させて最終的に0.7%固体の青ラテックスを得て65g/時間でガラス繊維(F529−09)上に噴霧した。
【0123】
第1および第2分析部試験ストリップを互いに平行に配置し、共通のポリエステルサンプル添加パッド(505521、Filtrona)を両方の分析部の上流端部に重ねた。共通の綿吸収材シンクパッド(CF7、Whatman)を参照および対照ゾーンの下流に重ねた。
【0124】
分析デバイスは、光学部品を含むプラスチックハウジング中に分析ストリップを並行構成で搭載することによって調製した。LEDは、4つのLEDがそれぞれ偏らせた位置の4つのゾーン(2つの検出ゾーンおよび参照と対照ゾーン)に近接して分析部の面上に位置するように配置した。単一光検出器を2つの分析部の面上および間に配置し、分析ストリップの中間に配置した(図2参照)。
【図面の簡単な説明】
【0125】
【図1】本発明による分析デバイスの図である。
【図2】本発明による例示的実施形態による分析流路の概略図である。
【図3】図2に示した実施形態の光源と光検出器の配置図である。
【図4】いくつかの分析部品の相対位置を示す分析デバイスの実施形態の部分断面概略図である。
【図5a】図3に示した実施形態のいくつかの光学部品を示すバッフル構成の下側の図である。
【図5b】図3に示した実施形態のいくつかの光学部品を示すバッフル構成の下側の図である。
【図6】前出の図に示した分析デバイス実施形態の部分上面図および分析デバイスのインサイチュ(in situ)での側方流試験ストリップを示す図である。
【符号の説明】
【0126】
4、32、44、52 光検出器
10 デバイス
11 ケーシング
12 多孔質サンプル受容器
15 LCDディスプレイ
20、40 分析デバイス
21 サンプル添加領域
22 第1分析部
23 第2分析部
24、25、26、27 ゾーン
31、41、45 LED
42、46 ストリップ
47、56 分割器
48、53 傾斜部材
49 表面
54 LEDバッフル
57 軸
61 試験ストリップ
62 アパーチャ
63 位置決めピン
【技術分野】
【0001】
本発明は、分析物の存在または量を決定するための分析デバイス、キット、および方法に関する。詳細には、広い濃度範囲にわたる分析物の決定に関する。
【背景技術】
【0002】
簡単な側方流免疫学的分析デバイスが開発され、流体サンプル中の分析物の検出用に市販された(例えば、欧州特許第291194号明細書参照)。典型的にそのようなデバイスは対象分析物に結合することのできる乾燥された移動可能な標識を付けた結合剤、および標識付き結合剤の下流の検出ゾーンに提供された分析物に結合することのできる固定化された(immobilized)結合剤を含む多孔質担体を含む。固定化された標識付き結合剤が検出ゾーンで検出されることはサンプル中に分析物が存在することを示す。
【0003】
代わりに、対象分析物がハプテンであるとき、免疫学的分析デバイスは、標識付き分析物または類似分析物が固定化結合剤用のサンプル中に存在する分析物と検出ゾーンで競合する競合反応を用いることができる。代わりに、分析デバイスは抑制反応を用いることができ、それによって固定化分析物または類似分析物が検出ゾーンに提供され、分析デバイスは分析物用の移動可能な標識付き結合剤を含む。
【0004】
分析デバイスは、1種以上の分析物を決定することができる。例えば、不正使用薬物の存在を決定する分析の場合、デバイスは全種類の薬物を決定することができる。そのような側方流免疫学的分析デバイスには、複数の検出ゾーンが設けられ、そのようなゾーンは単一または複数の側方流担体上に提供される。
【0005】
分析結果の決定は従来目視によって行われた。しかし、そのようなデバイスは使用者によって解釈される結果を必要とし、これには望ましくない程度に主観が入る。
【0006】
したがって、分析結果を決定するように構成された光学的検出手段、ならびに分析結果を表示する表示手段を含むデジタルデバイスが開発された。流体サンプル中の分析物の濃度および/量を決定する分析試験ストリップと組み合わせて使用するためのデジタル分析読み取り機は、一体化されたデジタル分析読み取り機を含む分析デバイスとして知られる。
【0007】
発光ダイオード(LED)などの光源からの光は多孔質担体の一部を照らし、反射または透過した光は光検出器によって検出される。典型的に、読み取り機は担体のさまざまな領域を照明するために1つより多くのLEDを有し、複数の各LEDのために対応する光検出器が提供される。欧州特許第1484601号明細書は、デバイス中の光検出器の数を削減することのできるバッフル構成を含む側方流試験ストリップのデジタル読み取りデバイス用の光学的構成を開示する。
【0008】
そのようなデバイスは、しばしば1回だけ使用するように設計され、したがって、特に高価な光学および電子部品が含まれる場合、そのようなデバイスのコストを可能な限り低くすることが望ましい。
【特許文献1】欧州特許第291194号明細書
【特許文献2】欧州特許第1484601号明細書
【発明の開示】
【発明が解決しようとする課題】
【0009】
本発明の一態様による目的は、2つ以上の分析流路を含む分析デバイスに必要な光学部品の数を削減することのできる1つ以上の共有ゾーンを有する分析デバイスを提供することである。
【課題を解決するための手段】
【0010】
第1の態様によれば、本発明は液体サンプル中の1種以上の分析物の存在および/または量を決定するための分析デバイスを提供し、このデバイスは、
(a)各々標識付き結合剤を固定化するための検出ゾーンを有する流路を含み、1つまたは両方の検出ゾーンでの標識付き結合剤の検出が1種以上の分析物の存在および/または量を示す第1および第2分析部と、
(b)共有参照ゾーンと、
(c)検出ゾーンおよび参照ゾーンを照明するための1つ以上の光源と、
(d)検出ゾーンおよび参照ゾーンからの光を検出するための1つ以上の光検出器であって、大きさが検出された光の量に関連する信号を発生する、光検出器と、
(e)光検出器からの信号を処理するための信号処理手段とを含む。
【0011】
本発明のさらに他の目的は、2つ以上の分析流路を含む1つ以上の分析試験ストリップとともに使用するための分析読み取り機を提供することであり、分析読み取り機は典型的に必要な光学部品の数を削減する。
【0012】
第2態様によれば、本発明は、各々1つの流路を含む第1および第2分析部の結果を読み取るための分析読み取り機を提供し、各流路は、1つまたは両方の検出ゾーンでの標識付き結合剤の検出が1種以上の分析物の存在および/または量を示す標識付き結合剤を固定化するための検出ゾーンと、共有参照ゾーンとを含み、この分析読み取り機は、
(a)検出ゾーンおよび共有参照ゾーンを照明するための1つ以上の光源と、
(b)検出ゾーンおよび参照ゾーンからの光を検出するための1つ以上の光検出器であって、大きさが検出された光の量に関連する信号を発生する、光検出器と、
光検出器からの信号を処理するための信号処理手段とを含み、共有参照ゾーンから得た信号は検出ゾーンから得た信号の値を補償するために用いられる。
【0013】
読み取り機が読み取り運転可能な分析は、各々この検出ゾーンの1つをそれぞれ含む第1および第2流路を含む1つ以上の分析試験ストリップ上で行われるのが好ましい。第1および/または第2分析部は、デバイスの使用前に乾燥状態で検出ゾーンの上流に移動可能な形で提供される標識付き結合剤を含むことができる。
【0014】
共有参照ゾーンは、第1または第2分析部のいずれかの部分として含むことができる。代わりに、参照ゾーンは、第1および第2分析部への副流路上に提供することができる。参照ゾーンは検出ゾーンに相当しない流路の一部、または、乾燥した標識付き薬剤が検出ゾーンの上流に存在する場合、乾燥した標識付き薬剤が存在する場所に相当しない一部から選択することができる。参照ゾーンは、検出ゾーンの下流または上流に提供することができる。参照ゾーンの測定は、流路から反射または透過された光のバックグラウンドレベルの測定を可能にする。バックグラウンドレベルは、例えば、多孔質担体の光学的反射率、液体サンプルまたは標識付き結合剤などの分析要素の存在によって影響を受け得る。したがって、検出ゾーンで測定された光のレベルは、バックグラウンドの光のレベルに対して補正され得、検出ゾーンに存在する標識付き結合剤の量をより正確に示す補償された信号を提供する。また、参照ゾーンでの測定は、分析デバイスに用いられる流体サンプル間のあらゆる変動に対して補償し、例えば、尿サンプルは色が広範囲に変動することができる。1つの分析部について参照ゾーンで得られた信号の値は、他の分析部について検出ゾーンで得られる信号の値を補償するために用いることができる。そのような参照ゾーンは両方の分析部間で「共有」される。共有参照ゾーンの提供は、各参照ゾーンが典型的に1つの光源しか必要としないので、分析デバイスに必要な部品の数を削減することができる。
【0015】
共有参照ゾーンの概念は、直感的にはわかりにくい(counter−intuitive)。参照測定の目的は、特に、薬剤または分析ストリップ組成物における変動の結果として、発生し得る信号のバックグラウンド読み取りにおける変動を可能にすることである。したがって、通常の実施は、各分析部上の分離した参照ゾーンを用いることであり、「専用の」参照測定を各分析部について行うことができる。しかし、本発明者らは分離した参照ゾーンを省き得、替わりに単一の共有参照ゾーンが十分であることを見出した。
【0016】
光源は、LEDであることが便利である。複数のLEDを用いることができる。一実施形態において、分析部の各ゾーン(検出、参照または対照ゾーン)はそれぞれのLEDによって照明される。1つ以上の光検出器は1つのフォトダイオードを含むことが便利である。好ましい実施形態において、単一のフォトダイオードまたは他の光検出器が用いられる。一実施形態において、4つのLEDと1つのフォトダイオードが存在する。
【0017】
分析デバイスは、第1または第2分析部のいずれかの部分として提供される単一の対照ゾーンをさらに含むことができる。替わりに、対照ゾーンは第1または第2分析部の副次的流路上に提供することができる。単一対照ゾーンの提供は、必要な光源の数をさらに削減する。対照ゾーンの目的は、分析が正しく行われたことを示す、すなわち、流体サンプルがデバイスに供給され標識付き結合剤が流路に沿ってある程度動いたことを示すことである。対照ゾーンは、検出ゾーンの下流に提供することができる。適切な対照ゾーンは、欧州特許第291194号明細書に開示され、標識付き結合剤用の固定化結合剤を含むことができる。標識付き結合剤の分離した集団は、検出ゾーンおよび対照ゾーンの上流に提供することができ、この標識付き結合剤の分離集団は対照ゾーンで固定化することができるが、分析物の存在または不在下、検出ゾーンで固定化されない。対照ゾーンは典型的に検出ゾーンの下流に提供される。また、対照ゾーンで得られる信号は、参照ゾーンで得られる信号に関して参照することができる。
【0018】
したがって、対照ゾーンでの信号の測定は、その分析部について試験が正確に(または不正確に)行われた値または表示を提供する。例えば、対照ゾーンが、試験が1つの分析部について正確に行われたことを示すならば、他の分析部についても試験が正確に行われたことが想定される。したがって、対照ゾーンは分析デバイスの分析間で「共有」されていると考えることができる。共有参照ゾーンの場合、単一または「共有」対照ゾーンはデバイスで用いられる光学部品の数の削減を可能にする。これを仮定する根拠は、液体サンプルが1つの分析流路に加えられたならば、特に、2つの分析流路が、例えば、共通のサンプル受容手段、例えば多孔質サンプル受容器によって接続されるならば、液体サンプルが他の流路に与えられた可能性が高いことである。さらに、分析デバイスが、例えば、移動可能な薬剤の再懸濁を悪くする湿気の侵入、または結合剤を劣化させ得る高い温度などの状況に曝されたならば、両方の流路が影響を受ける可能性が高い。また、共有参照ゾーンの場合、共有対照ゾーンの概念は直感的にはわかりにくい。対照ゾーンでの信号は、参照ゾーンの信号に関して計算される。
【0019】
参照および対照ゾーンは同じ分析部の部分として提供することができ、または異なる分析部の部分として提供することができる。例示的実施形態において、共有の参照および対照ゾーンは、各々分離した分析部に提供され、例えば、1つの分析部は検出ゾーンと参照ゾーンを含み、他の分析部は検出ゾーンと対照ゾーンを含む。
【0020】
第3の態様によれば、本発明は液体サンプル中の1種以上の分析物の存在および/または量を決定するための分析デバイスを提供し、このデバイスは、
(a)各々標識付き結合剤を固定化するための検出ゾーンを有する流路を含み、1つまたは両方の検出ゾーンでの標識付き結合剤の検出が1種以上の分析物の存在および/または量を示す第1および第2分析部と、
(b)共有対照ゾーンと、
(c)検出ゾーンおよび対照ゾーンを照明するための1つ以上の光源と、
(d)検出ゾーンおよび対照ゾーンからの光を検出するための1つ以上の光検出器であって、大きさが検出された光の量に関連する信号を発生する、光検出器と、
(e)光検出器からの信号を処理するための信号処理手段とを含む。
【0021】
第4の態様によれば、本発明は第1および第2分析部の結果を読み取るための分析読み取り機を提供し、各々が、
標識付き結合剤を固定化するための検出ゾーンを有する流路を含み、1つまたは両方の検出ゾーンでの標識付き結合剤の検出は1種以上の分析物の存在および/または量を示す第1および第2分析部と、共有対照ゾーンとを含み、この分析読み取り機は、
(a)検出ゾーンおよび共有対照ゾーンを照明するための1つ以上の光源と、
(b)記憶された対照信号閾値と、
(c)検出ゾーンおよび対照ゾーンからの光を検出するための1つ以上の光検出器であって、大きさが検出された光の量に関連する対照信号および検出信号を発生する、光検出器と、
(d)光検出器からの信号を処理して対照ゾーンから得た信号を対照信号閾値と比較し、対照信号が対照信号閾値と等しいか対照信号閾値より大きければ、両方の分析部が正確に行われたことを決定する信号処理手段とを含む。
【0022】
本発明の第1、第2、および第3の態様による分析デバイスおよび読み取り機は、対照信号閾値を含むことができる。
【0023】
対照信号閾値は、デバイスまたは読み取り機に記憶することができる。対照ゾーンから測定された信号を対照信号閾値と比較して十分な標識付き結合剤がこのゾーンで固定化されたかどうかを決定することができる。対照信号の値が対照信号閾値と等しいかまたは対照信号閾値を超えるならば、デバイスまたは読み取り機は分析が十分行われたことを決定することができる。対照信号が対照信号閾値よりも小さければ、デバイスまたは読み取り機は分析が十分行われなかったことを決定することができ、エラーメッセージを提供する。
【0024】
対照ゾーンから検出された信号は、参照ゾーンから得た信号に対して参照することができる。
【0025】
また、第3の態様による分析デバイスも共有参照ゾーンを含むことができる。
【0026】
第1および第2分析部は、検出ゾーンで固定化された形で提供された分析物用の結合剤または標識付き結合剤を含むことができるのが便利である。
【0027】
共有参照および/または共有対照ゾーンを用いることによって、本発明の分析デバイスは応答司令を求める必要のあるゾーンの数、したがって、用いる必要のある光学部品の数を削減する。共有ゾーンの使用は、第1および第2分析部の分析構造が非常に類似しているとき、または参照および/または対照ゾーンが1つ以上の副次的流路に提供されるならば、1つ以上の副次的流路の分析部構造が第1および第2分析部に類似するとき、最も効果的である。したがって、例えば、分析部は典型的に両方とも類似材料の多孔質担体を含むであろう(例えば、両方ともニトロセルロース担体を含む)。また、各分析部に同じ液体サンプルを用いるのが有利である。これは両方の分析部に流体連絡する共通のサンプル添加領域を提供することによって都合よく達成することができる。したがって、共通のサンプル添加領域を経由してデバイスに添加された単一の液体サンプルは、第1および第2分析部の両方を通って流れることができる。第1および第2分析部が同一ではない場合、各分析部で検出される光のバックグラウンドレベルが互いに十分類似している限り、共有参照ゾーンの提供を許容することができる。
【0028】
信号処理手段は、それぞれのゾーンの光検出器から得た信号を処理し試験ゾーンで得た値を参照ゾーンに関して計算することのできる中央プロセッサを含むことができる。測定データは分析中に様々な時間で取り出すことができ、光透過率または反射率の光学的な値を乾燥状態で得るために、デバイスが起動された後であるが流体サンプルがデバイスに添加される前に取り出すことができる。
【0029】
吸収性「シンク(sink)」を分析流路の末端部に提供することができる。共通のシンクを提供することができ、または各分析部の末端部にシンクを提供することができる。吸収性シンクは、例えば、CF7 Whatman紙などの高度に吸収性の材料を含むことが好ましく、検出ゾーン、参照ゾーン、および対照ゾーンの近傍から未結合の共役物を除去する十分な吸収能力を提供すべきである。そのようなシンクの代替として、検出ゾーンを超えて延在する所定長さの多孔質固体相材料を有することも十分であり得る。高度な吸収性シンクを提供する利点は、それが、それぞれの分析部の流路から過剰の標識付き結合剤を除去する、または実質的に除去することである。これはそれぞれのゾーンの近傍の未結合標識付き結合剤の量を最小化する効果を有し、したがって、異なる量の標識付き結合剤を有することのあるデバイスにおいて分析流路の使用が可能になる。
【0030】
検出ゾーンに固定化結合剤を提供する替わりに、結合剤は分析物−標識付き結合剤複合体に結合することのできる移動可能な形で提供することができる。結合剤は、例えば、アガロースなどの大きな粒子に共役することができ、検出ゾーンは、存在するいかなる標識付き結合剤/分析物/結合剤複合体もフィルターが捕捉することができ、捕捉剤に複合化されていない標識付き結合剤がフィルターを通過することができるように、その孔サイズが大きな粒子よりも小さいが標識付き結合剤のサイズよりも大きな寸法を有するフィルターを含むことができる。さらに替わりに、薬剤は検出ゾーンで移動可能な標識付き結合剤/分析物/結合剤複合体を結合することのできる固定化された形で提供することができる。例えば、結合剤を移動可能な形で提供し、ビオチンなどの結合化学種に共役することができ、検出ゾーンで固定化された薬剤はストレプトアビジンなどの補完的な結合相手である。
【0031】
分析デバイスは、サンドイッチ免疫学的分析および/または分析物の決定のための競合/抑制分析を用いることができる。サンドイッチ免疫学的分析の例は、標識付き結合剤/分析物/結合剤複合体が形成される場合である。デバイスは、典型的に分析物用の固定化結合剤を含む検出ゾーンの上流に提供された分析物用の移動可能な形の標識付き結合剤を含む。替わりに、特に対象分析物がハプテンであるとき、免疫学的分析デバイスは、標識付き分析物または標識付き類似分析物が検出ゾーンで固定化結合剤のためのサンプルに存在する分析物と競合する競合反応を用いることができる。標識付き分析物または標識付き類似分析物は、検出ゾーンの上流に移動可能な形で提供することができる。さらに代替として分析デバイスは、固定化分析物または類似分析物が検出ゾーンに提供される抑制反応を用いることができ、分析デバイスは分析物用に移動可能な標識付き結合剤を含む。
【0032】
本発明の目的のための用語「流路」は、第1位置から第2位置へ液体を移動することのできる基体を指し、例えば、毛管チャネル、微小流体流路、または側方流多孔質担体などの多孔質担体とすることができる。多孔質担体は1つまたは複数の多孔質材料を含むことができ、線状または積み重ね構成で重なり合うことができ、または流体接続される。多孔質担体材料は同じとすることができ、または異なることができる。第1および第2分析部は分離した基体上に提供することができ、またはそれらは第1分析部の流路に沿って運ばれている液体が第2分析部の流路と交差できないように、共通の基体上に提供することができる。例えば、第1および第2分析部は第1および第2流路が互いに分離されるように、同じ多孔質担体上に提供することができる。これは、例えば、多孔質担体の部品をレーザー切断してそれを非多孔質にし、したがって第1と第2分析部を分離することによって達成することができる。替わりに、非多孔質ブロッキング材料をストリップに沿って貼付し、同じ多孔質担体上に2つの流路(典型的に本質的に平行)を提供することができる。
【0033】
特に流路は、側方流多孔質担体とすることができる。多孔質担体として用いることのできる適切な材料は、ニトロセルロース、アセテート繊維、セルロースまたはセルロース誘導体、ポリエステル、ポリオレフィン、またはガラス繊維を含む。多孔質担体は、ニトロセルロースを含むことができる。これは予め化学処理しなくても結合剤を堅固に固定化することができる利点を有する。多孔質固体相材料が、例えば、紙を含むならば、第2ゾーンの抗体は、例えばCNBr、カルボニルジイミダゾール、または塩化トレシルを用いる化学的結合によって固定化する必要がある。
【0034】
用語「結合剤」は、結合対、すなわち、分子の1つが化学的および/または物理的手段によって第2分子と結合する2つの異なる分子の1つを指す。互いの結合はそれらが類似の特徴を有する他の分析構成要素からその結合相手を識別することのできるものであるという意味で2つの分子は関連性がある。結合対の分子はリガンドとレセプター(反リガンド)、結合対分子と結合対パートナー、などと呼ばれる。また、分子は分子の凝集のための結合対分子とすることができ、例えば、第2抗体の免疫学的複合体に対して発生した抗体とその対応する抗原は、免疫学的複合体の結合対分子であると考えることができる。
【0035】
抗原および抗体結合対分子に加えて、他の結合対は、制限することのない例として、ビオチンとアビジン、炭水化物とレクチン、補完的ヌクレオチド配列、補完的ペプチド配列、エフェクターとレセプター分子、酵素共同因子と酵素、酵素阻害剤と酵素、ペプチド配列と配列のための特定の抗体またはプロテイン全体、ポリマー酸と塩基、染料とプロテイン結合剤、ペプチドと特定のプロテイン結合剤(例えば、リボヌクレアーゼ、S−ペプチドとリボヌクレアーゼS−プロテイン)などを含む。さらに、特定の結合対は元の特定の結合分子の類似分子を含むことができる。
【0036】
標識付き結合剤の文脈において用いられるとき、「標識」は目視または機器手段によって検出可能な信号を発生することのできるいかなる物質をも指す。本発明に使用するのに適したさまざまな標識は、光学的に検出可能であるような化学的または物理的手段のいずれかによって信号を発生する標識を含む。そのような標識は酵素と基体、クロモゲン、触媒、蛍光化合物、化学ルミネセンス化合物、電気活性種、染料分子、放射性活性標識および粒子標識を含む。分析物自体、本質的に検出可能な信号を発生することができる。標識は、共有結合的に結合剤に付着することができる。特に、標識は光学的に検出可能なものから選択することができる。
【0037】
標識は金、銀などの粒子、セレニウムまたはテルリウムなどのコロイド状非金属粒子、染料または染料ゾルを組み込んだポリマー粒子などの染色された粒子または着色された粒子を含むことができる。染料は、任意の適切な色、例えば青とすることができる。染料は蛍光性とすることができる。染料ゾルは、Foron Blue SRP(Sandoz)およびResolin Blue BBLS(Bayer)などの市場で入手可能な疎水性染料物質から調製することができる。適切なポリマー標識は、ポリスチレン、ポリビニルトルエン、ポリスチレン−アクリル酸、ポリアクロレインなどの広範囲の合成ポリマーから選択することができる。用いられるモノマーは通常非水溶性であり、モノマーミセルが形成されるように水性界面活性剤中に乳化され、これは次いでエマルジョンに開始剤を加えることによってポリマー化が誘起される。実質的に球状のポリマー粒子が製造される。そのようなポリマー粒子の理想的なサイズ範囲は、約0.05μmから約0.5μmである。例示的実施形態によれば、標識は青いポリマー粒子である。
【0038】
乾燥された結合剤は、検出ゾーンを含む多孔質担体材料の上流に提供された多孔質担体材料上に提供することができる。上流の多孔質担体材料は、マクロポーラス(macroporous)とすることができる。マクロポーラス担体材料は低または非プロテイン結合とすべきであり、または非特定の結合を最小化しマクロポーラス本体が液体サンプルで濡れた後に標識付き薬剤の自由な動きを促進するために、BSAまたはPVAなどの薬剤によって容易にブロック化可能であるべきである。マクロポーラス担体材料は、必要であれば、それに高い親水性を与え、液体サンプルの急速な吸い上げを促進するために界面活性剤または溶媒で予備処理を行うことができる。マクロポーラス担体用の適切な材料は、ポリエチレンおよびポリプロピレンなどのプラスチック材料または紙またはガラス繊維などの他の材料を含む。標識付き結合剤が検出可能な粒子で標識を付けられる場合、マクロポーラス本体は粒子標識の最大粒子サイズよりも少なくとも10倍大きい孔サイズを有することができる。より大きな孔サイズは標識付き薬剤の放出をより良好にする。マクロポーラス担体の代替として、標識付き結合剤は検出ゾーンの上流に提供された非多孔質基体上に提供することができ、この非多孔質基体は流路の部分を形成する。
【0039】
多孔質担体は、ニトロセルロース多孔質担体の末端部の上流に重なり合ってガラス繊維マクロポーラス担体を含むことができる。
【0040】
液体サンプルは工業、環境、農業、または生物源など任意の源から誘導することができる。サンプルは、血液、血清、血漿、間質性流体、唾液、痰、眼のレンズ液体、汗、尿、ミルク、粘液、滑液、腹膜液、経皮滲出物、咽頭滲出物、気管支肺胞洗浄、気管吸引、脳脊髄液、精液、子宮頸粘液、膣または尿道分泌物、および羊膜液を含む生理的な源から誘導し、または構成することができる。特に源はヒトとすることができ、特にサンプルは尿とすることができる。
【0041】
本明細書に用いられる「光」は、波長にかかわらず任意の適切な電磁放射線を含むことが意図される。これにも拘わらず、本発明は主としてスペクトルの可視部分の光を用いることが意図され、したがって、「光源」および「光検出器」は、それぞれ電磁放射線、特に可視波長(すなわち、約390から800nmの範囲)の照射線に関する任意の源および検出手段を包含するものと解釈すべきである。
【0042】
光検出器は、分析デバイスの1つ以上のゾーンからの光を検出するであろう。光は、例えば、標識が蛍光などであるならば、これらのゾーンから実際に発生することができる。しかし、より通常的には光検出器はこれらのゾーンから放射するように見える光、すなわち、光源から発生しゾーンによって光検出器上に反射および/または透過される光を検出する。
【0043】
分析物は、トキシン、有機化合物、プロテイン、ペプチド、微生物、バクテリア、ウィルス、アミノ酸、核酸、炭水化物、ホルモン、ステロイド、ビタミン、麻薬(治療目的で投与されるもの、ならびに違法目的で服用するものを含む)、汚染物質、農薬、および任意の上記物質の代謝産物、または抗体を含むが、これらに制限されない。また、用語の分析物は、任意の抗原性物質、ハプテン、抗体、巨大分子、およびその組み合わせを含む。
【0044】
分析デバイスは、1種以上の分析物を決定することができる。
【0045】
分析デバイスは広い範囲の分析物にわたって分析物の量または存在を決定することができ、第1分析部は低濃度範囲の分析物のレベルを決定することができ、第2分析部は高濃度範囲の液体サンプル中の分析物のレベルを決定することができる。
【0046】
高い分析物範囲で分析物を測定するために分析部を調製することのできるいくつかの方法がある。
【0047】
例えば、分析デバイスは検出ゾーンの上流に提供された分析物用の標識付き結合剤と分析物用のスカベンジャー結合剤を含むスカベンジャー分析部を含むことができる。スカベンジャー結合剤は、過剰の分析物を除去し分析の感度を低下させる働きをする。これは分析のダイナミックレンジを増加させる効果を有し、高いレベルの分析物での測定を可能にする。スカベンジャー結合剤は固定化、移動可能化、またはその両方が可能である。スカベンジャー結合剤は、移動可能な標識付き結合剤と同じ多孔質担体の領域の上流または下流のいずれかに提供することができる。スカベンジャー結合剤は、移動可能な標識付き結合剤と同じ分析物の結合領域、または標識付き結合剤とは異なる分析物の領域に結合することができる。スカベンジャー剤は、第2分析部の移動可能な標識付き結合剤とは異なる分析物への親和性を有することができる。例示的実施形態において、スカベンジャー結合剤は、第2分析部の移動可能な結合剤よりも高い分析物への親和性を有することができる。分析物濃度に対する分析の感度を変化させるために、スカベンジャー結合剤の量を変化させることができる。スカベンジャー結合剤はより多くの分析物に結合することができ、検出ゾーンに結合することのできる標識付き結合剤の割合を効率的に低下させるという事実から、存在するスカベンジャー結合剤の量の増加は分析の感度を低下させる。
【0048】
分析のダイナミックレンジを増加するために、分析デバイスは例えば複数の検出ゾーンを含むことができ、各検出ゾーンは異なる分析物濃度レベルで分析物を結合することができる。例えば、それぞれのゾーンは分析物に対して異なる親和性を有する分析物用の結合剤を含むことができる。
【0049】
分析のダイナミックレンジを増加する他の方法は、サンドイッチ結合分析および競合または抑制分析を含む分析デバイスを提供することである。例えば、サンドイッチ分析は高感度分析とすることができ、すなわち、低濃度範囲の分析物を測定することができ、抑制または競合分析は低感度分析とすることができ、すなわち、高濃度範囲の分析物を測定することができる。さらに他の方法は、検出ゾーンの標識付き結合剤または固定化剤の親和性または量を変化させることである。高親和性の結合剤は、低親和性結合剤よりも高い分析物感度を有するであろう。同様に、低濃度の結合剤は、高濃度の結合剤よりも低い分析物感度を有するであろう。分析感度は標識付き結合剤の標識に対する結合剤の割合を変更することによって変化させることができる。標識として粒子が用いられるならば、標識に加えられた結合剤の量を変更して分析感度を変更することができる。分析の感度を操作するさらに他の方法は、分析に用いられる標識の量を変化させることである。例えば、分析の感度は標識付き結合剤用の標識付き化学種に対する結合剤の割合を低減することによって低くすることができる。
【0050】
分析感度を操作するさらに他の手段は、標識の光学的濃度を変更することである。分析感度は、低い光学密度を有する標識の使用によって低くすることができる。これは、例えば、低い濃度の染料を有するポリマー粒子標識の提供によって、または光学検出器に対して感度の低い着色標識を使用することによって達成することができる。
【0051】
高い分析物レベルを測定するさらに他の方法は、非粒子状標識付き結合剤を使用することである。サンドイッチ結合分析によって測定するとき、高レベルの分析物は高レベルの結合剤を必要とする。標識が粒子標識である場合、多孔質担体の内部または上に高レベルの分析物を提供することは立体障害を起こすことがあり、低い分析感度をもたらす。逆に、低い分析物レベルでの非粒子状標識付き結合剤の使用は、低い光学密度のため低い信号を発生することがある。しかし、高い分析物レベルで、非粒子状標識は検出の容易な十分高いレベルで存在することができる。光学的に検出可能な非粒子状標識の例は、染料とすることができる。染料は蛍光性とすることができる。
【0052】
分析感度は、多孔質担体の流量によって影響を与えることができる。分析の感度を低下させる方法は、より高い流量を有する多孔質担体(ニトロセルロースなど)を用いることである。
【0053】
分析の感度は、標識付き結合剤がその発生源から放出される速度を変更することによってさらに操作することができる。分析物の感度を低下させるさらに他の方法は、液体サンプルと接触する間に、多孔質担体からの標識付き結合剤を急速に放出させることである。標識付き結合剤の放出はデバイス内に砂糖、プロテイン、またはメチルセルロースなどの他のポリマー物質を提供することによって変更することができる。
【0054】
特定の実施形態によれば、分析デバイスは、検出ゾーン上流に提供された分析物用の移動可能な第2(スカベンジャー)結合剤および分析物用の移動可能な結合剤を含むスカベンジャー分析を含む。
【0055】
特定の実施形態によれば、第1分析部は低濃度範囲の分析物を測定することができ、第2分析部は高濃度範囲の分析物を測定することができる。第1分析部は共有参照ゾーンを含むことができ、第2分析部は共有対照ゾーンを含むことができる。
【0056】
第1分析部は、検出ゾーンの上流に提供された標識付き結合剤を含むことができ、第2分析部は検出ゾーンの上流に提供された標識付き結合剤と移動可能なスカベンジャー結合剤を含むことができる。スカベンジャー結合剤は、検出ゾーンの上流の標識付き結合剤の同じ位置または領域に提供することができる。
【0057】
特に、決定される分析物はhCGとすることができ、この場合、液体サンプルは尿とすることができる。
【0058】
分析デバイスはhCGなどの単一分析物を決定することができ、第1分析部は第1濃度範囲での液体サンプルのhCGレベルを決定することができ、第2分析部は第2濃度範囲での液体サンプルのhCGレベルを決定することができる。
【0059】
ある範囲の分析物の濃度を測定するために、分析信号が飽和しないように標識付き結合剤が十分存在することが保証されることが重要である。多量の分析物の測定は、増加する分析物濃度と共にいわゆる分析信号の「繋留効果(hook effect)」または飽和を避けるために、しばしばこれに相当する標識付き結合剤の量の増加を必要とする。対照信号の変動は、特に存在する結合剤の量の増加がある場合に発生することが判明した。
【0060】
第1および第2分析部が異なる量の標識付き結合剤を有して提供される場合、低レベルの標識付き結合剤を有する分析部の部分として参照ゾーンを提供することが有利であることが判明した。
【0061】
実施形態によれば、分析デバイスは分析物をより高い分析物範囲で測定することができる。そのようなデバイスを提供するいくつかの方法がある。
【0062】
例えば、分析デバイスは、検出ゾーンの上流に提供された分析物用の標識付き結合剤および分析物用の第2結合剤を含むことができる。第2結合剤は、過剰の分析物を除去して分析の感度を低下させる働きをする。これは分析のダイナミックレンジを増加する効果を有し高レベルの分析物での測定を可能にする。第2結合剤は固定化するか、移動可能化することができ、または両方が可能である。第2結合剤は、移動可能な標識付き結合剤と同じ多孔質担体の領域の上流または下流のいずれかに提供することができる。第2結合剤は、移動可能な標識付き結合剤と同じ分析物の結合領域、または標識付き結合剤と異なる分析物の領域に結合することができる。第2薬剤は第2分析部の移動可能な標識付き結合剤と異なる分析物への親和性を有することができる。例示的実施形態において、第2結合剤は第2分析部の移動可能な結合剤よりも高い分析物への親和性を有する。第2結合剤の量を変化させて分析物濃度に対する分析物の感度を変化させることができる。存在する第2結合剤量の増加は、第2結合剤がより多くの分析物に結合することができるという事実から分析物の感度を低下させ、検出ゾーンに結合できる標識付き結合剤の割合を効果的に低下させる。
【0063】
分析のダイナミックレンジを増加させるために、分析デバイスは、例えば複数の検出ゾーンを含むことができ、各検出ゾーンは異なる分析物の濃度レベルで分析物と結合することができる。例えば、それぞれのゾーンは分析物に対して異なる親和性を有する分析物用の結合剤を含むことができる。
【0064】
分析のダイナミックレンジを増加させる他の方法は、サンドイッチ結合分析および競合または抑制分析を含む分析デバイスを提供することである。例えば、サンドイッチ分析は高感度分析とすることができ、すなわち、それは低濃度範囲の分析物を測定することができ、抑制または競合分析は低感度の分析とすることができ、すなわち、それは高濃度範囲の分析物を測定することができる。さらに他の方法は検出ゾーンの標識付き結合剤または固定化された薬剤の親和性または量を変更することである。高い親和性の結合剤は低い親和性の結合剤よりも高い分析物感度を有するであろう。同様に、低濃度の結合剤は高濃度の結合剤よりも低い分析物感度を有するであろう。分析感度は標識付き結合剤の標識に対する結合剤の比を変更することによって変化させることができる。標識として粒子が使用されるならば、標識に加えられる結合剤の量を変更して分析感度を変更することができる。分析の感度を操作するさらに他の方法は、分析に用いられる標識の量を変更することである。例えば、分析の感度は標識付き結合剤用の標識付き化学種に対する結合剤の比を低減することによって低くすることができる。
【0065】
分析の感度を操作するさらに他の手段は、標識の光学密度を変更することである。分析感度は低い光学密度を有する標識の使用によって低くすることができる。これは、例えば、低濃度の染料を有するポリマー粒子標識の提供によって、または光検出器に感度の低い着色標識を使用することによって達成することができる。
【0066】
高レベルの分析物を測定するさらに他の方法は、非粒子状標識付き結合剤を用いることである。高レベルの分析物は、サンドイッチ結合分析によって測定するとき、高レベルの結合剤を必要とする。標識が粒子標識である場合、多孔質担体内または上へ高レベルの分析物を提供することは立体障害を発生することがあり、分析感度を悪くする。逆に、低レベルの分析物では非粒子状標識付き結合剤の使用は、低い光学密度のため低い信号を発生することがある。しかし、高レベルの分析物では非粒子状標識は容易に検出される十分高いレベルで存在することができる。光学的に検出可能な非粒子状標識の実施例は、染料とすることができる。染料は蛍光性とすることができる。
【0067】
分析感度は、多孔質担体の流量によって影響を与えることができる。分析の感度を低下させる方法は、高流量の多孔質担体(ニトロセルロースなど)を用いることである。
【0068】
分析の感度は、標識付き結合剤がその源から放出される速度を変更することによってさらに操作することができる。分析物感度を低くするさらに他の方法は、液体サンプルに接触している間に多孔質担体から標識付き結合剤を急速に放出させることである。標識付き結合剤の放出はデバイス内に砂糖、プロテイン、またはメチルセルロースなどの他のポリマー物質を提供することによって変更することができる。
【0069】
特定の実施形態によれば、分析デバイスは検出ゾーンの上流に提供された分析物用の移動可能な第2結合剤および分析物用の移動可能な結合剤を含む。第2結合剤は、標識付き結合剤と同じまたは類似の検出ゾーンの上流位置に提供することができる。
【0070】
特定の実施形態によれば、分析デバイスは各々流路を含む2つの分析部を含み、第1分析部は低い分析物濃度範囲の分析物を測定することができ、第2分析部は高い分析物濃度範囲の分析物を測定することができる。第1分析部は共有参照ゾーンを含むことができ、第2分析部は共有対照ゾーンを含むことができる。
【0071】
本発明の分析デバイスは広い濃度範囲にわたってhCGの量または存在を測定するのに用いることができる。範囲は約10mlUから約250,000mlUで変動することができる。
【0072】
第2分析部は、分析物用の標識付き結合剤および分析物用の第2結合剤を含むことができる。第1分析部は検出ゾーンの上流に提供された分析物用の標識付き結合剤を含むことができる。
【0073】
分析デバイスは、ある分析物範囲の分析物レベルを示すさらに他の1つ以上の測定閾値を含むことができる。一実施形態において、分析デバイスは第1および第2測定閾値を含み、第1測定閾値未満の分析物測定信号は分析物の不在またはあるレベルを超える分析物の不在を示し、第2閾値を超える分析物測定信号は第2濃度範囲の分析物レベルを示し、第2閾値未満の分析物測定信号は第1濃度範囲の分析物のレベルを示す。特定の実施形態によれば、分析デバイスはさらに第3の測定閾値を含み、第3閾値を超える分析物測定信号は第3濃度範囲の分析物のレベルを示す。
【0074】
特に、分析デバイスは液体サンプル中の分析物、特に雌の哺乳類被検者の尿のhCG分析物の存在または量を決定することができる。分析デバイスは第1測定閾値を含むことができ、閾値を下回るhCG分析物信号レベルは妊娠していないことを示し、第1測定閾値より大きいかまたは等しいhCG分析物信号レベルは妊娠していることを示し、デバイスは少なくともさらに他の測定閾値を含む。さらに、分析デバイスは妊娠の長さを示すことができる。分析デバイスは使用者に日または週単位による妊娠の長さなど、時間ベースの指示を提供することができる。
【0075】
尿中のhCGを決定する分析試験用の典型的な全分析展開時間は、3分間である。
【0076】
光学部品の数を削減することは本発明の望ましい目的であり、これは、参照ゾーンが1つの分析部の部分として提供され、対照ゾーンが他の分析部の部分として提供される場合、都合よく達成することができる。一実施形態によれば、参照ゾーンは低レベルの標識付き結合剤を有する第1分析部の部分として提供され、対照ゾーンは高レベルの結合剤を有する第2分析部の部分として提供される。
【0077】
一実施形態によれば、分析デバイスは4つの光源を含み、光源は第1および第2分析部の検出ゾーンならびに共有対照ゾーンおよび参照ゾーンを照明するように構成され、各ゾーンはそれぞれの光源によって照明される。1つ以上の光検出器は、それぞれのゾーンから反射および/または透過した光を検出するように配置することができる。一実施形態によれば、単一の光検出器を用いて全てのゾーンからの光を検出することができる。これは、例えば、デバイスが光検出器で検出された光がどのゾーンから放射されているかを識別することが可能なように、それぞれのゾーンを逐次的に照明することによって達成することができる。逐次的照明工程は分析の期間中、各ゾーンでの経時的な信号レベルを監視することができるように固定または変動周期で繰り返すことができる。さらに、1つ以上のゾーンから検出される光のレベルの変化を用いて流体サンプルがデバイスに添加されたかどうか、また、その時を決定し、デバイスに沿う液体サンプルの流量を決定することができる。流量の決定は、さらに他の品質管理チェックとして用いることができ、例えば、流量が設定したレベルよりも大きいかまたは小さいならば分析を拒絶することができる。適切な流量検出方法および手段は、欧州特許第1484641号明細書に開示される。
【0078】
標識付き結合剤は、典型的に経時的にサンドイッチ免疫学的分析の検出ゾーンに蓄積し、したがって、経時的な信号の増加速度を監視することができる。デバイスは信号が平衡に達した後、またはより典型的に反応が平衡に達する前の結果を決定することができる。デバイスは、個々の値などの量的な結果、1から10、11から20などの半量的結果または範囲、またはYES/NOなどの質的結果を提供することができる。デバイスは1つ以上の信号閾値に対する結果を決定することができる。デバイスは固定の測定時間を有することができ、または固定の測定時間が経過する前に早期結果を提供することができる。早期結果は、例えば、信号レベルが特定の閾値を決して超えない、または早期段階で特定の閾値を超えることをデバイスが決定する場合に得ることができる。これらの特定の場合に、デバイスは早期のNOまたはYES測定を呼び出すことができ、特定のベースレベル(ゼロとすることができる)に対する分析物の不在または存在を示す。早期の結果決定方法を用いる分析デバイスは、欧州特許第1464613号明細書に開示される。
【0079】
分析デバイスは、被検者が妊娠しているかどうか(すなわち、液体サンプルがあるレベルを超えるhCGを含むかどうか)を決定するのに用いることができ、さらに他の閾値を用いて使用者に妊娠の長さを示すこともできる。妊娠の長さは時間に基づく、または濃度に基づく測定に関して表示することができる。
【0080】
分析デバイスは典型的にハウジングを含む。ハウジングは流体浸透可能であり、ABSなどの適切なプラスチック材料から作ることができる。分析デバイスは、流体サンプルを受容するためのサンプル受容部材をさらに含むことができる。サンプル受容部材はハウジングから延在することができる。
【0081】
ハウジングは、流体浸透可能な材料から作ることができる。また、ハウジングは周囲の光を排除するのが望ましい。デバイスの外部に入射する可視光の10%未満、好ましくは5%未満、最も好ましくは1%未満の光がデバイスの内部に対して透過するならば、ハウジングまたはケーシングは実質的に周囲の光を排除していると考えられる。ポリカーボネート、ABS、ポリスチレン、ポリスチロール、高密度ポリエチレンなどの光透過可能な合成プラスチック材料、または適切な光遮蔽顔料を含むポリプロピレンはハウジングの製造に用いるための適切な選択物である。ハウジング内の内部空間内に提供された分析部と連絡するアパーチャをハウジングの外部に設けることができる。替わりに、アパーチャは多孔質サンプル受容器がハウジングからハウジングの外部の位置まで延在することを可能にする働きをすることができる。
【0082】
また、典型的にハウジングの内部には電源が設けられる。デバイスは典型的に分析の結果を表示する表示手段、ならびにデータを記憶するメモリー手段を含む。表示手段はLCDを含むのが都合がよい。
【0083】
表示手段は、エラーメッセージ、個人詳細、時間、日付、および使用者に分析が測定された長さを通知するタイマーなどのさらに他の情報をさらに表示することができる。分析によって表示される情報は、任意のフォント、アルファベットまたは言語の単語、数または記号、例えば、「陽性」、「陰性」、「+」、「−」、「妊娠」、「妊娠していない」、「医師に相談せよ」、「試験を繰り返せ」などで示すことができる。
【0084】
分析デバイスは、分析部の1つまたは両方の流路の上流に流体接続するサンプル受容多孔質部材を含むサンプル受容器をさらに含むことができる。分析デバイスは各々検出ゾーンを含む1つ以上の分析流路を含むことができ、この場合、複数の分析流路に共通の単一のサンプル受容多孔質部材を設けることができる。したがって、デバイスの多孔質部材に添加された流体サンプルは、それぞれの分析部の流路に沿ってそれぞれの検出ゾーンまで移動することができる。多孔質部材はハウジングの内部に設けることができ、または、例えば、このハウジングの外へ少なくとも部分的に延在し、例えば、尿流を採取する働きをすることができる。多孔質部材は流体貯蔵器として働くことができる。多孔質部材は液体を急速吸収することのできる任意の吸収性、多孔質または繊維質材料から作ることができる。材料の多孔質性は単一方向性(すなわち、孔または繊維が完全にまたは主として部材の軸に平行に走る)または多方向性(すなわち、全方向性であり、部材は非晶質のスポンジ状構造を有する)とすることができる。ポリプロピレン、ポリエチレン(好ましくは非常に高分子量の)、ポリフッ化ビニリデン、エチレンビニルアセテート、アクリロニトリル、およびポリテトラフルオロエチレンなどの多孔質プラスチック材料を用いることができる。他の適切な材料は、ガラス繊維を含む。共通のサンプル受容多孔質部材を提供することは、第1および第2分析部の流路に単一サンプルを同時に提供することを可能にし、共有参照および/または共有対照ゾーンの提供の効果をさらに高める。
【0085】
第5の態様において、本発明は1種以上の分析物の存在/または量を決定する分析の実施方法を提供し、方法は、液体サンプルを本発明の第1および第3態様による分析デバイスに接触させるステップを含む。
【発明を実施するための最良の形態】
【0086】
分析デバイスの外部上面が図1に示される。デバイス(10)は長さ約14cmおよび幅約25mmに引き伸ばされる。ケーシング(11)はポリカーボネート、ABS、ポリスチレン、高密度ポリエチレン、またはポリプロピレンなどの適切な液体浸透可能なケーシングから形成され得る。外部の多孔質サンプル受容器(12)は液体を急速に吸収することのできる任意の吸収性、多孔質または繊維材料から形成することができる。また、分析結果を表示するためのLCDディスプレイ(15)が示される。また、分析デバイス内部には、図示されない分析流路、光源、光検出器、電源および付属電子部品が提供される。
【0087】
図2は、例示的実施形態による分析デバイスの光検出器および個々の分析多孔質担体の配置を示す。分析デバイス(20)は、第1分析部(22)と第2分析部(23)を流体接続する共通のサンプル添加領域(21)を有する。単一の光検出器(4)が2つの分析部の間に提供されてそれぞれのゾーンからの光を検出する。ゾーン(24)および(25)は、第1分析部(22)の検出および対照ゾーンにそれぞれ相当する。ゾーン(26)および(27)は、第2分析部(23)の検出および参照ゾーンにそれぞれ相当する。それぞれのゾーンを適切に配置された窓を通して照明する対応する4つのLEDは示されない。
【0088】
図3は、単一の光検出器(32)と4つのLED(31)を含む例示的実施形態による配置図を示す。光検出器の活性領域は、1.5mm×1.5mmである。
【0089】
図4は、分析デバイス(40)の概略断面図を示し、いくつかの部品の相対位置を示す。LED(41)からの光はストリップ(42)のゾーンを照明し、ゾーンから反射した光は光検出器(44)によって検出される。同様に、LED(45)からの光はストリップ(46)のゾーンを照明し、反射した光は光検出器によって検出される。LEDからの光が直接光検出器上に入射することを防止する分割器(47)が提供される。また、LED(41)によるストリップ(46)の照明、したがって、LED(45)によるストリップ(42)の照明を防止する働きをするが、それぞれの試験ストリップから反射した光が光検出器によって検出されることを可能にする傾斜部材(48)が提供される。また、傾斜部材は、試験ストリップから反射した光を光検出器へ案内する働きをする。LEDは印刷回路基板から作られた表面(49)上に搭載される。
【0090】
図5aは例示的実施形態のバッフル構成の下側図を示す。その中の1つが示されるLED(参照符号51で表わされる)からの光はアパーチャを通して分析ストリップ(図示せず)のゾーンを照明する。各LEDはそれぞれのアパーチャに付属する。図において、例示的アパーチャは参照符号55で表わされる。光はストリップから光検出器(52)へ反射される。また、傾斜部材(53)および分割器(56)も示される。隣接するLEDは、バッフル(54)によって互いに遮蔽される。
【0091】
図5bは、異なる斜視方向からの例示的実施形態のバッフル構成の下側図を示す。傾斜部材(53)は軸(57)の周りに対称であり、4つのLED(図示せず)からの反射された光を光検出器(図示せず)へ案内する働きをする。
【0092】
図6は、アパーチャ(62)上に配置され位置決めピン(63)によって位置が保持された試験ストリップ(61)を見下ろす分析デバイスの上面図を示す。LEDおよび光検出器は、アパーチャを通して部分的に見ることができる。
【0093】
(実施例1)
低感度試験ゾーン(高濃度の分析物の測定用)および高感度試験ゾーン(低濃度の分析物の測定用)を含む分析デバイス用のそれぞれのゾーンから決定された信号値は、以下の信号演算手段によって求められる。
【0094】
ストリップおよび窓の使用は、以下の表(図2参照)に定義される。
【表1】

【0095】
各窓から反射された光の測定は毎秒約2回で行われ、ローパスデジタルフィルターを用いてノイズを除去しデータが平滑化される。フィルタリングされた値が、流れを検出し、結果を求めるために用いられ、正規化された相対減衰パーセント(%A)で表わされる。これはデバイス内とデバイス間の両方の光学部品におけるあらゆる変動を考慮して最小にする。
【0096】
測定値は、反射された光の量に逆比例する。
【0097】
各窓について、参照窓、対照窓、および試験窓の窓比は、多孔質担体が乾燥している、t=0(サンプルを加える前)ときの測定値を、サンプルの添加後の時間tの測定値で除したものに等しい。
【0098】
フィルタリングされた窓比の計算
各時間点tについて、各窓の窓比は次のように計算される。
Ref比t=(フィルタリングされた参照窓の値)時間=0/(フィルタリングされた参照窓の値)時間=t
HS比t=(フィルタリングされたHS試験窓の値)時間=0/(フィルタリングされたHS試験窓の値)時間=t
LS比t=(フィルタリングされたLS試験窓の値)時間=0/(フィルタリングされたLS試験窓の値)時間=t
Ctrl比t=(フィルタリングされたCtrl試験窓の値)時間=0/(フィルタリングされたCtrl試験窓の値)時間=t
【0099】
フィルタリングされた%A値の計算
正規化された相対減衰パーセント(%A)は、参照(ref.)窓の窓比と考えている窓比(対照または試験窓)との差を参照窓の窓比で除し、100%を掛けることによって与えられる。
【0100】
各時間点tについて、%A値はHS試験ライン、LS試験ライン、および対照ラインについて計算され、
HSt(%A)=[(参照比t−HS試験比t)/参照比t]×100%
LSt(%A)=[(参照比t−LS試験比t)/参照比t]×100%
Ctrlt(%A)=[(参照比t−Ctrl試験比t)/参照比t]×100%
【0101】
(分析デバイスの構造)
本発明の第1態様による分析デバイスは、検出ゾーンの上流に提供された標識付き結合剤を含む第1分析試験ストリップと、分析物用の標識付き結合剤および第2(スカベンジャー)結合剤、ならびに検出ゾーンおよび対照ゾーンの上流に提供された対照ゾーン用の標識付き結合剤を含む第2分析試験ストリップを含んで構成された。
【0102】
(第1分析試験ストリップの調製)
検出ゾーンは、PBSAバッファー中の濃度3mg/mlの抗β−hCG抗体(インハウスクローン3468)のラインを、1μl/cmの速度で長さ350mm×幅40mm(Whatman)、厚さ90から100ミクロンの175ミクロンの裏打ち層に積層された8ミクロンの孔サイズを有する寸法のニトロセルロース帯上に分配することによって調製した。抗β−hCG抗体は、Biodot xyz3050分配プラットフォームを用いて、ライン幅約1.2mmおよび長さ約300mmとしてニトロセルロースの長さに沿って10mmの位置に加えた。
【0103】
ニトロセルロースの帯は、Hedinair乾燥炉シリーズ#17494セットを用いて55℃およびスピード5(1回のパス)で乾燥した。
【0104】
続いて、ニトロセルロースは、5%エタノール(BDH Analar 104766P)+150mMの塩化ナトリウム(BDH Analar 10241AP)+(Sigma T1503)からの50mMのトリス塩基+Tween20(Sigma P1379)と1%(w/v)のポリビニルアルコール(PVA、Sigma 360627)との混合物を含む遮断バッファーを用いて遮断した。
【0105】
遮断バッファーは1.75μl/mmの速度で帯の隣接端部に加えた。遮断溶液が膜に吸い込まれると、2%(w/v)のスクロース(脱イオン水中のSigma S8501)溶液を同じ装置を用いて1.6μl/mmの速度で加え、ニトロセルロース膜に約5分間吸い込ませた。
【0106】
次いで、NCの帯はHedinair乾燥炉シリーズ#17494セットを用いて75℃およびスピード5(1回のパス)で乾燥した。
【0107】
(第1多孔質担体材料上の移動可能な標識付き結合剤の調製)
標識付き結合剤を以下の計画にしたがって調製した。
【0108】
(抗αhCGを有するラテックス粒子のコーティング)
(1)Duke Scientific製の青ラテックス粒子(直径400nm、10%固体(w/v)のDB1040CB)を100mMの四ホウ素二ナトリウムバッファーpH8.5(BDH AnalaR 102676G)(DTB)で2%固体(w/v)に希釈する。
(2)2つのEppendorf遠心チューブ中の体積2mlの希釈ラテックスを17000rpm(25,848rcf)で10分間、Heraeus Biofuge 17RS遠心機で遠心して希釈ラテックスを洗浄する。上澄み液を除去して廃棄し、ペレットを100mMのDTB中に再懸濁させて1mlの総体積中に4%固体(w/v)を得る。
(3)エタノールと酢酸ナトリウム(5%w/vの酢酸ナトリウムSigmaS−2889と95%エタノールBDH AnalaR 104766P)の混合物を調製する。
(4)100μlのエタノール−酢酸ナトリウム溶液をステップ2で洗浄したラテックスに加える(これはラテックス体積の10%である)。
(5)抗体株(インハウスクローン3299)を希釈してDTB中の約1200μg/mlの抗体を得る。
(6)ステップ5で希釈した抗体1ml体積を41.5℃に設定した水浴で約2分間加熱する。また、ステップ4の洗浄したラテックス+エタノール−酢酸ナトリウムを同じ水浴で2分間加熱する。
(7)希釈抗体をラテックス+酢酸エタノールに加えて良く混合し、磁気攪拌装置と混合物中に置いた磁気攪拌棒(magnetic flea)を用いて混合しながら41.5℃に設定した水浴中で1時間インキュベートする。
(8)40mg/mlのBovine Serum Albumin(BSA)溶液(脱イオン水中のIntergen W22903)を調製する。40mg/mlのBSAと等しい体積をラテックス/抗体/酢酸エタノールの混合物に加えることによってラテックスを遮断し、連続的に攪拌しながら水浴中で41.5℃で30分間インキュベートする。
(9)ステップ2のように混合物を17000rpmで10分間遠心する(体積をEppendorfチューブ間で1mlのロットに分割する)。上澄み液を除去して廃棄し、ペレットを100mMのDTB中に再懸濁させる。ステップ2の遠心を繰り返し、上澄み液を除去して廃棄し、Air Brushing Buffer(20%(w/v)のスクロースSigma S8501、100mMのTrizma Base Sigma T1503 pH9中の10%のBSA(w/v))中でペレットを再懸濁させる。Air Brushing Bufferを加えて4%(w/v)固体ラテックスを得る。
【0109】
共役ラテックスをガラス繊維多孔質担体(F529−09、Whatman)上のBSAとスクロースの混合物に50g/時間および110mm/秒の速度で噴霧し、Hedinar Conveyor炉シリーズ番号17494セットを用いて65℃およびスピード5(1回のパス)で乾燥した。
【0110】
参照ゾーンとして選択したゾーンは、ニトロセルロースに沿って13mmの距離、すなわち検出ゾーンの下流にあった。
【0111】
標識付き薬剤が最上部にあり、ガラス繊維がニトロセルロースの表面をニトロセルロース膜の帯の長さ(350mm)に沿って約2mm重なり合うように配置された透明な接着剤コーティング積層フィルム(Ferrisgate、幅38mm)を用いて標識付き結合剤を含むガラス繊維材料をニトロセルロース膜に取り付けた。ガラス繊維は、それが検出ゾーンの上流にあるようにニトロセルロースの端部に取り付けた。
【0112】
続いて、積層シートを幅6mmおよび長さ25mmのガラス繊維多孔質担体材料を含む試験ストリップに切断し、標識付き薬剤を2mm重なり合い上流に提供されたガラス繊維の長さに沿って20mmに添加し、ニトロセルロース膜は幅6mmおよび長さ40mmを有した。
【0113】
(第2分析部試験ストリップの調製)
検出ゾーンは以下のように調製した。
PBSAバッファー中のMAbマウス抗ヒトβ−hCG抗体(クローン3468)3mg/mlをBiodot XYZ3050分配プラットフォームを用いてニトロセルロース(第1分析部による種類と寸法)上10mmの位置に1μl/cmでプロットし、第1分析部用の単一の検出ゾーンを提供した。
【0114】
対照ゾーンは以下のように調製した。
PBSAバッファー中2mg/mlのヤギ抗ウサギ抗体(Lampire)を第2分析部に使用したものと同じニトロセルロース上にBiodot XYZ3050分配プラットフォームを用いて13mmの位置に1μl/cmでプロットし、分析デバイス用の単一の対照ゾーンを提供した。
【0115】
400nmの青ポリスチレンラテックス(Duke Scientifc)に共役させたマウス抗ヒトα−hCG mAb(クローン3299)をスカベンジャー抗体mAbマウス抗ヒトβ−hCG(インハウスクローン3468)に3mg/mlで混合し、最終的に3%の青ラテックス、0.075mg/mlの最終3468濃度、および0.06mg/ml濃度の遊離抗βhCG抗体を得た。得られた混合物をBIODOT XYZS(シリーズ番号1673)を用いてWhatmanガラス繊維(F529、25mm幅のリール)上にエアブラシし、90g/時間でF529−09ガラス繊維上の約20mm位置に2.02μg/cm噴霧した。噴霧された溶液は、広がって約7mm長さの帯を形成した。
【0116】
また、対照ゾーン用の標識付き結合剤も分析物用の標識付き結合剤と同じ多孔質担体の領域に以下のようにして堆積した。
【0117】
ウサギIgG(Dako)をBSA/スクロース中の400nmの青ラテックスポリスチレンラテックス(Duke Scientific)に共役させて最終的に0.7%固体の青ラテックスを得て65g/時間でガラス繊維上に噴霧した。
【0118】
ガラス繊維をHedinar Conveyor炉シリーズ番号17494セットを用いて65℃およびスピード5(1回のパス)で乾燥した。上記を繰り返してガラス繊維上にラテックスの第2パスを堆積したが、元の噴霧位置から約0.8mm偏らせた(ガラス繊維のさらに下流)。ガラス繊維は上で説明したようにして乾燥した。
【0119】
ラテックスを噴霧したガラス繊維材料は、噴霧されたラテックスが最上部にあり、ガラス繊維がニトロセルロースの表面をニトロセルロース膜の帯の長さ(350mm)に沿って約2mm重なり合うように配置された透明な接着剤コーティング積層フィルム(Ferrisgate、幅38mm)を用いてニトロセルロース膜に取り付けた。ガラス繊維はニトロセルロース膜の上流に提供し、結合剤はガラス繊維の末端部に向かって提供した。
【0120】
続いて、積層シートは、幅6mmおよび長さ25mmのガラス繊維多孔質担体材料を含む試験ストリップに切断し、標識付き薬剤は2mm重なり合う上流に提供されたガラス繊維の長さに沿って20mmに添加し、ニトロセルロース膜は幅6mmおよび長さ40mmを有した。長さ45mm、幅12mmおよび厚さ約2.5mmの多孔質サンプル受容器(Filtrona)を第1多孔質担体材料の上流に約3mm重なり合わせて提供した。
【0121】
また、対照ゾーン用の標識付き結合剤は、分析物用標識付き結合剤と同じ多孔質担体の領域上に以下のようにして堆積した。
【0122】
ウサギIgG(Dako)をBSA/スクロース中の400nmの青ラテックスポリスチレンラテックス(Duke Scientific)に共役させて最終的に0.7%固体の青ラテックスを得て65g/時間でガラス繊維(F529−09)上に噴霧した。
【0123】
第1および第2分析部試験ストリップを互いに平行に配置し、共通のポリエステルサンプル添加パッド(505521、Filtrona)を両方の分析部の上流端部に重ねた。共通の綿吸収材シンクパッド(CF7、Whatman)を参照および対照ゾーンの下流に重ねた。
【0124】
分析デバイスは、光学部品を含むプラスチックハウジング中に分析ストリップを並行構成で搭載することによって調製した。LEDは、4つのLEDがそれぞれ偏らせた位置の4つのゾーン(2つの検出ゾーンおよび参照と対照ゾーン)に近接して分析部の面上に位置するように配置した。単一光検出器を2つの分析部の面上および間に配置し、分析ストリップの中間に配置した(図2参照)。
【図面の簡単な説明】
【0125】
【図1】本発明による分析デバイスの図である。
【図2】本発明による例示的実施形態による分析流路の概略図である。
【図3】図2に示した実施形態の光源と光検出器の配置図である。
【図4】いくつかの分析部品の相対位置を示す分析デバイスの実施形態の部分断面概略図である。
【図5a】図3に示した実施形態のいくつかの光学部品を示すバッフル構成の下側の図である。
【図5b】図3に示した実施形態のいくつかの光学部品を示すバッフル構成の下側の図である。
【図6】前出の図に示した分析デバイス実施形態の部分上面図および分析デバイスのインサイチュ(in situ)での側方流試験ストリップを示す図である。
【符号の説明】
【0126】
4、32、44、52 光検出器
10 デバイス
11 ケーシング
12 多孔質サンプル受容器
15 LCDディスプレイ
20、40 分析デバイス
21 サンプル添加領域
22 第1分析部
23 第2分析部
24、25、26、27 ゾーン
31、41、45 LED
42、46 ストリップ
47、56 分割器
48、53 傾斜部材
49 表面
54 LEDバッフル
57 軸
61 試験ストリップ
62 アパーチャ
63 位置決めピン
【特許請求の範囲】
【請求項1】
液体サンプル中の1種以上の分析物の存在および/または量を決定するための分析デバイスであって、
(a)各々標識付き結合剤を固定化するための検出ゾーンを有する流路を含み、1つまたは両方の検出ゾーンでの標識付き結合剤の検出が1種以上の分析物の存在および/または量を示す第1および第2分析部と、
(b)共有参照ゾーンと、
(c)検出ゾーンおよび参照ゾーンを照明するための1つ以上の光源と、
(d)検出ゾーンおよび参照ゾーンからの光を検出するための1つ以上の光検出器であって、大きさが検出された光の量に関連する信号を発生する、光検出器と、
(e)光検出器からの信号を処理するための信号処理手段とを含む、分析デバイス。
【請求項2】
第1および/または第2分析部が、デバイスの使用の前に乾燥状態で検出ゾーンの上流に移動可能な形で提供される分析物または類似分析物用の標識付き結合剤を含む、請求項1に記載の分析デバイス。
【請求項3】
第1および/または第2分析部が、検出ゾーンで固定化された形で提供される分析物用結合剤または標識付き結合剤を含む、請求項1または2に記載の分析デバイス。
【請求項4】
共有参照ゾーンが第1または第2分析部のいずれかの部分として含まれる、請求項1から3のいずれか一項に記載の分析デバイス。
【請求項5】
共有対照ゾーンをさらに含む、請求項1から4のいずれか一項に記載の分析デバイス。
【請求項6】
対照ゾーンが第1または第2分析部のいずれかの部分として含まれる、請求項5に記載の分析デバイス。
【請求項7】
対照ゾーンが1つの分析部の部分として含まれ、共有参照ゾーンが他の分析部の部分として含まれる、請求項5または6に記載の分析デバイス。
【請求項8】
第1および第2分析部が異なる濃度範囲の分析物の存在を検出することができる、請求項1から7のいずれか一項に記載の分析デバイス。
【請求項9】
第1および第2分析部の流路が各々多孔質担体を含む、請求項1から8のいずれか一項に記載の分析デバイス。
【請求項10】
多孔質担体がニトロセルロースを含む、請求項9に記載の分析デバイス。
【請求項11】
第1および第2分析部の上流に提供された単一の多孔質サンプル受容器を含む、請求項1から10のいずれか一項に記載の分析デバイス。
【請求項12】
分析流路の末端部に提供されたシンクをさらに含む、請求項1から11のいずれか一項に記載の分析デバイス。
【請求項13】
第1および第2分析部が各々異なる量の標識付き結合剤を含む、請求項1から12のいずれか一項に記載の分析デバイス。
【請求項14】
低い範囲の分析物の検出用の第1分析部および高い範囲の分析物の検出用の第2分析部を含む、請求項1から13のいずれか一項に記載の分析デバイス。
【請求項15】
第2分析部が第1分析部よりも多量の標識付き結合剤を有する、請求項14に記載の分析デバイス。
【請求項16】
第1分析部が検出ゾーンの上流に提供された分析物用の標識付き結合剤を含み、第2分析部が検出ゾーンの上流に提供された分析物用の標識付き結合剤と、分析物用の第2結合剤とを含む、請求項1から15のいずれか一項に記載の分析デバイス。
【請求項17】
第1分析部が共有参照ゾーンを含み、第2分析部が共有対照ゾーンを含む、請求項15および16に記載の分析デバイス。
【請求項18】
参照ゾーンが検出ゾーンの下流に提供される、請求項17に記載の分析デバイス。
【請求項19】
対照ゾーンが検出ゾーンの下流に提供される、請求項17および18に記載の分析デバイス。
【請求項20】
光検出器が複数のゾーンからの光を検出する、請求項1から19のいずれか一項に記載の分析デバイス。
【請求項21】
2つの検出ゾーン、参照ゾーン、および対照ゾーンからの光を検出する単一の光検出器を含む、請求項4から20に記載の分析デバイス。
【請求項22】
2つの検出ゾーン、参照ゾーン、および対照ゾーンを照明する4つの光源を含む、請求項4から21に記載の分析デバイス。
【請求項23】
光検出器によって検出された検出ゾーンおよび参照ゾーンからの光の量が分析デバイスにサンプルを添加する前および分析デバイスにサンプルが添加された後に再び測定され、2つの測定の比が各ゾーンについて計算される、請求項1から22のいずれか一項に記載の分析デバイス。
【請求項24】
正規化された相対減衰パーセント(%A)が、検出および/または対照ゾーンについて計算され、
HSt(%A)=[(参照比t−HS試験比t)/参照比t]×100%
LSt(%A)=[(参照比t−LS試験比t)/参照比t]×100%
Ctrlt(%A)=[(参照比t−対照比t)/参照比t]×100%
である、請求項20に記載の分析デバイス。
【請求項25】
液体サンプル中の1種以上の分析物の存在および/または量を決定するための分析デバイスであって、
(a)各々標識付き結合剤を固定化するための検出ゾーンを有する流路を含み、1つまたは両方の検出ゾーンでの標識付き結合剤の検出が1種以上の分析物の存在および/または量を示す第1および第2分析部と、
(b)共有対照ゾーンと、
(c)検出ゾーンおよび対照ゾーンを照明するための1つ以上の光源と、
(d)検出ゾーンおよび対照ゾーンからの光を検出するための1つ以上の光検出器であって、大きさが検出された光の量に関連する信号を発生する、光検出器と、
(e)光検出器からの信号を処理するための信号処理手段とを含む、分析デバイス。
【請求項26】
光源が1つ以上のLEDを含む、請求項1から25のいずれか一項に記載の分析デバイス。
【請求項27】
決定される分析物がhCGである、請求項1から26のいずれか一項に記載の分析デバイス。
【請求項28】
液体サンプルが尿である、請求項1から27のいずれか一項に記載の分析デバイス。
【請求項29】
液体サンプル中の分析物の存在および/または量を決定するために分析を行う方法であって、方法がサンプルを請求項1から28のいずれか一項に記載の分析デバイスに接触させるステップを含む、方法。
【請求項30】
実質的に前述し添付図面で参照された、請求項1から28のいずれか一項に記載の分析デバイス。
【請求項1】
液体サンプル中の1種以上の分析物の存在および/または量を決定するための分析デバイスであって、
(a)各々標識付き結合剤を固定化するための検出ゾーンを有する流路を含み、1つまたは両方の検出ゾーンでの標識付き結合剤の検出が1種以上の分析物の存在および/または量を示す第1および第2分析部と、
(b)共有参照ゾーンと、
(c)検出ゾーンおよび参照ゾーンを照明するための1つ以上の光源と、
(d)検出ゾーンおよび参照ゾーンからの光を検出するための1つ以上の光検出器であって、大きさが検出された光の量に関連する信号を発生する、光検出器と、
(e)光検出器からの信号を処理するための信号処理手段とを含む、分析デバイス。
【請求項2】
第1および/または第2分析部が、デバイスの使用の前に乾燥状態で検出ゾーンの上流に移動可能な形で提供される分析物または類似分析物用の標識付き結合剤を含む、請求項1に記載の分析デバイス。
【請求項3】
第1および/または第2分析部が、検出ゾーンで固定化された形で提供される分析物用結合剤または標識付き結合剤を含む、請求項1または2に記載の分析デバイス。
【請求項4】
共有参照ゾーンが第1または第2分析部のいずれかの部分として含まれる、請求項1から3のいずれか一項に記載の分析デバイス。
【請求項5】
共有対照ゾーンをさらに含む、請求項1から4のいずれか一項に記載の分析デバイス。
【請求項6】
対照ゾーンが第1または第2分析部のいずれかの部分として含まれる、請求項5に記載の分析デバイス。
【請求項7】
対照ゾーンが1つの分析部の部分として含まれ、共有参照ゾーンが他の分析部の部分として含まれる、請求項5または6に記載の分析デバイス。
【請求項8】
第1および第2分析部が異なる濃度範囲の分析物の存在を検出することができる、請求項1から7のいずれか一項に記載の分析デバイス。
【請求項9】
第1および第2分析部の流路が各々多孔質担体を含む、請求項1から8のいずれか一項に記載の分析デバイス。
【請求項10】
多孔質担体がニトロセルロースを含む、請求項9に記載の分析デバイス。
【請求項11】
第1および第2分析部の上流に提供された単一の多孔質サンプル受容器を含む、請求項1から10のいずれか一項に記載の分析デバイス。
【請求項12】
分析流路の末端部に提供されたシンクをさらに含む、請求項1から11のいずれか一項に記載の分析デバイス。
【請求項13】
第1および第2分析部が各々異なる量の標識付き結合剤を含む、請求項1から12のいずれか一項に記載の分析デバイス。
【請求項14】
低い範囲の分析物の検出用の第1分析部および高い範囲の分析物の検出用の第2分析部を含む、請求項1から13のいずれか一項に記載の分析デバイス。
【請求項15】
第2分析部が第1分析部よりも多量の標識付き結合剤を有する、請求項14に記載の分析デバイス。
【請求項16】
第1分析部が検出ゾーンの上流に提供された分析物用の標識付き結合剤を含み、第2分析部が検出ゾーンの上流に提供された分析物用の標識付き結合剤と、分析物用の第2結合剤とを含む、請求項1から15のいずれか一項に記載の分析デバイス。
【請求項17】
第1分析部が共有参照ゾーンを含み、第2分析部が共有対照ゾーンを含む、請求項15および16に記載の分析デバイス。
【請求項18】
参照ゾーンが検出ゾーンの下流に提供される、請求項17に記載の分析デバイス。
【請求項19】
対照ゾーンが検出ゾーンの下流に提供される、請求項17および18に記載の分析デバイス。
【請求項20】
光検出器が複数のゾーンからの光を検出する、請求項1から19のいずれか一項に記載の分析デバイス。
【請求項21】
2つの検出ゾーン、参照ゾーン、および対照ゾーンからの光を検出する単一の光検出器を含む、請求項4から20に記載の分析デバイス。
【請求項22】
2つの検出ゾーン、参照ゾーン、および対照ゾーンを照明する4つの光源を含む、請求項4から21に記載の分析デバイス。
【請求項23】
光検出器によって検出された検出ゾーンおよび参照ゾーンからの光の量が分析デバイスにサンプルを添加する前および分析デバイスにサンプルが添加された後に再び測定され、2つの測定の比が各ゾーンについて計算される、請求項1から22のいずれか一項に記載の分析デバイス。
【請求項24】
正規化された相対減衰パーセント(%A)が、検出および/または対照ゾーンについて計算され、
HSt(%A)=[(参照比t−HS試験比t)/参照比t]×100%
LSt(%A)=[(参照比t−LS試験比t)/参照比t]×100%
Ctrlt(%A)=[(参照比t−対照比t)/参照比t]×100%
である、請求項20に記載の分析デバイス。
【請求項25】
液体サンプル中の1種以上の分析物の存在および/または量を決定するための分析デバイスであって、
(a)各々標識付き結合剤を固定化するための検出ゾーンを有する流路を含み、1つまたは両方の検出ゾーンでの標識付き結合剤の検出が1種以上の分析物の存在および/または量を示す第1および第2分析部と、
(b)共有対照ゾーンと、
(c)検出ゾーンおよび対照ゾーンを照明するための1つ以上の光源と、
(d)検出ゾーンおよび対照ゾーンからの光を検出するための1つ以上の光検出器であって、大きさが検出された光の量に関連する信号を発生する、光検出器と、
(e)光検出器からの信号を処理するための信号処理手段とを含む、分析デバイス。
【請求項26】
光源が1つ以上のLEDを含む、請求項1から25のいずれか一項に記載の分析デバイス。
【請求項27】
決定される分析物がhCGである、請求項1から26のいずれか一項に記載の分析デバイス。
【請求項28】
液体サンプルが尿である、請求項1から27のいずれか一項に記載の分析デバイス。
【請求項29】
液体サンプル中の分析物の存在および/または量を決定するために分析を行う方法であって、方法がサンプルを請求項1から28のいずれか一項に記載の分析デバイスに接触させるステップを含む、方法。
【請求項30】
実質的に前述し添付図面で参照された、請求項1から28のいずれか一項に記載の分析デバイス。
【図1】


【図2】


【図3】


【図4】


【図5a】


【図5b】


【図6】




【図2】


【図3】


【図4】


【図5a】


【図5b】


【図6】


【公開番号】特開2009−58507(P2009−58507A)
【公開日】平成21年3月19日(2009.3.19)
【国際特許分類】
【外国語出願】
【出願番号】特願2008−213632(P2008−213632)
【出願日】平成20年8月22日(2008.8.22)
【出願人】(302044591)インバーネス・メデイカル・スウイツツアーランド・ゲゼルシヤフト・ミツト・ベシユレンクテル・ハフツング (38)
【Fターム(参考)】
【公開日】平成21年3月19日(2009.3.19)
【国際特許分類】
【出願番号】特願2008−213632(P2008−213632)
【出願日】平成20年8月22日(2008.8.22)
【出願人】(302044591)インバーネス・メデイカル・スウイツツアーランド・ゲゼルシヤフト・ミツト・ベシユレンクテル・ハフツング (38)
【Fターム(参考)】
[ Back to top ]

