共重合体及びその製造方法
【課題】12−ヒドロキシステアリン酸オリゴマー又はリシノレイン酸オリゴマーと、ジカルボン酸エステルオリゴマーとの重合により得られることを特徴とする共重合体、及びその製造方法を提供する。
【解決手段】共重合体は、12−ヒドロキシステアリン酸オリゴマー又はリシノレイン酸オリゴマーと、ジカルボン酸エステルオリゴマーとの重合により得られることを特徴とする共重合体である。また、共重合体の製造方法は、12−ヒドロキシステアリン酸及びリシノレイン酸のいずれか一方のカルボン酸と炭素数2〜4の二価アルコールとによりエステルを製造するエステル製造工程と、上記エステルから上記二価アルコールを留去させながら、上記カルボン酸を重合させるカルボン酸オリゴマー製造工程と、上記カルボン酸オリゴマーとジカルボン酸ヒドロキシジエステルオリゴマーとを重合させる重合工程とを備える。
【解決手段】共重合体は、12−ヒドロキシステアリン酸オリゴマー又はリシノレイン酸オリゴマーと、ジカルボン酸エステルオリゴマーとの重合により得られることを特徴とする共重合体である。また、共重合体の製造方法は、12−ヒドロキシステアリン酸及びリシノレイン酸のいずれか一方のカルボン酸と炭素数2〜4の二価アルコールとによりエステルを製造するエステル製造工程と、上記エステルから上記二価アルコールを留去させながら、上記カルボン酸を重合させるカルボン酸オリゴマー製造工程と、上記カルボン酸オリゴマーとジカルボン酸ヒドロキシジエステルオリゴマーとを重合させる重合工程とを備える。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、共重合体及びその製造方法に関する。更に詳しくは、本発明は、12−ヒドロキシステアリン酸オリゴマー又はリシノレイン酸オリゴマーと、ジカルボン酸エステルオリゴマーとの重合により得られることを特徴とする共重合体、及びその製造方法に関する。
【背景技術】
【0002】
従来、ヒマシ油由来のリシノレイン酸は、様々な用途に用いられているが、例えば、反応性の生分解性共重合ポリエステルとして、リシノレイン酸を乳酸と重縮合することにより生分解性共重合体ポリエステルが得られることが知られている(特許文献1)。
また、リシノレイン酸を用いた6量体のマクロラクトン及びポリエステルへの重合が知られている(非特許文献1)。
【0003】
【特許文献1】特開2005−113001号公報
【非特許文献1】Biomacromolecuels,Vol.6,No.3,2005 1679−1688
【発明の開示】
【発明が解決しようとする課題】
【0004】
12−ヒドロキシステアリン酸及びリシノレイン酸は、ヒマ植物に含まれるヒマシ油から容易に誘導される脂肪酸である。上記の2つの脂肪酸は、側鎖に光学活性を持つ水酸基を有することにより、他の植物由来の脂肪酸にない特徴を持っている。また、上記2つの脂肪酸は、1つの分子中に水酸基とカルボキシル基とを持つため、エステル結合により重合させることにより高分子化させることが期待される。しかし、リシノレイン酸においては、環状ラクトン及び環状ラクチド等のような無水物を経由する開環重合となるのみである(非特許文献1)。更に、12−ヒドロキシステアリン酸についても高分子化が期待されているが、上記非特許文献1の記載内容から、12−ヒドロキシステアリン酸もリシノレイン酸と同様に無水物を経由する開環重合となるのみであることは、当業者においては当然理解されている。
また、一般的なヒドロキシ脂肪酸にみられるような重縮合でも、これらの脂肪酸では水酸基の反応性が低いこと、及びエステル交換反応がおきるため、他の共重合を形成させる成分を入れても重量平均分子量を2万以上に高分子化させることは困難である(特許文献1)。
【0005】
本発明は、上記の従来の問題を解決するためになされたものであり、12−ヒドロキシステアリン酸又はリシノレイン酸の水酸基を保持したままで高分子化した共重合体及びその製造方法を提供するものである。
【課題を解決するための手段】
【0006】
本発明は以下のとおりである。
1.12−ヒドロキシステアリン酸及びリシノレイン酸のいずれか一方のカルボン酸と炭素数2〜4の2価アルコールとによりエステルを製造するエステル製造工程と、上記エステルから上記2価アルコールを留去させながら、上記カルボン酸を重合させるカルボン酸オリゴマー製造工程と、を備えることを特徴とするカルボン酸オリゴマーの製造方法。
2.上記2価アルコールが1,2−プロパンジオールである上記1.に記載のカルボン酸オリゴマーの製造方法。
3.12−ヒドロキシステアリン酸及びリシノレイン酸のいずれか一方のカルボン酸と炭素数2〜4の2価アルコールとによりエステルを製造するエステル製造工程と、上記エステルから上記2価アルコールを留去させながら、上記カルボン酸を重合させるカルボン酸オリゴマー製造工程と、上記カルボン酸オリゴマーと下記一般式(3)に表されるジカルボン酸エステルオリゴマーとを重合させる重合工程と、を備えることを特徴とする共重合体の製造方法。
【化3】

〔但し、一般式(3)において、R4は炭素数1〜6の炭化水素基を示し、R3は炭素数2〜4の炭化水素基を示し、nは2以上の整数を示す。〕
4.上記2価アルコールが1,2−プロパンジオールである上記3.に記載の共重合体の製造方法。
5.下記一般式(1)で表される12−ヒドロキシステアリン酸オリゴマー又は下記一般式(2)で表されるリシノレイン酸オリゴマーと、下記一般式(3)で表されるジカルボン酸エステルオリゴマーとの重合により得られることを特徴とする共重合体。
【化1】

【化2】

【化3】

〔但し、一般式(1)、(2)及び(3)において、R1、R2及びR3は同一であっても、異なっていてもよく、炭素数2〜4の炭化水素基を示し、式(3)において、R4は炭素数1〜6の炭化水素基を示す。また、一般式(1)、(2)及び(3)において、l、m及びnは2以上の整数を示す。〕
6.上記R1、R2及びR3がプロピレン基である上記5.に記載の共重合体。
7.上記R4がビニレン基、エチレン基又はフェニレン基である上記5.又は上記6.に記載の共重合体。
8.上記l及びmが2〜10の整数である上記5.乃至上記7.のいずれかに記載の共重合体。
9.上記nが2〜5の整数である上記5.乃至上記8.のいずれかに記載の共重合体。
10.上記R1、R2及びR3がイソプロピレン基である上記5.乃至上記9.のいずれかに記載の共重合体。
【発明の効果】
【0007】
本発明のカルボン酸オリゴマーの製造方法によれば、12−ヒドロキシステアリン酸又はリシノレイン酸の水酸基を保持したままで、12−ヒドロキシステアリン酸又はリシノレイン酸から形成された高分子を提供することができる。
また、2価アルコールとして1,2−プロパンジオールを用いた場合、より効率的にカルボン酸オリゴマーを製造することができる。
更に、本発明の共重合体の製造方法によれば、12−ヒドロキシステアリン酸又はリシノレイン酸から形成された高分子について、重量平均分子量をより大きくした共重合体を提供することができる。
また、本発明の共重合体は、12−ヒドロキシステアリン酸オリゴマー又はリシノレイン酸オリゴマーと、ジカルボン酸エステルオリゴマーとの重合により得られる共重合体であるため、植物材料である12−ヒドロキシステアリン酸又はリシノレイン酸を構成成分とする共重合体を提供することができる。
また、本発明の共重合体における用途にあわせて、オリゴマーの平均分子量を調整し、共重合体を提供することができる。
また、ジカルボン酸エステルオリゴマーを形成する炭化水素基を選択することにより、共重合体の特性を設計することが可能であり、各種の用途に用いる共重合体を提供することができる。
また、12−ヒドロキシステアリン酸又はリシノレイン酸の水酸基を保持したままで高分子化した共重体を提供することができる。
【発明を実施するための最良の形態】
【0008】
以下、本発明を詳しく説明する。
〔1〕共重合体
本発明の共重合体は、下記一般式(1)で表される12−ヒドロキシステアリン酸オリゴマー又は下記一般式(2)で表されるリシノレイン酸オリゴマーと、下記一般式(3)で表されるジカルボン酸エステルオリゴマーとの重合により得られることを特徴とする。
【化1】

【化2】

【化3】

〔但し、一般式(1)、(2)及び(3)において、R1、R2及びR3は同一であっても、異なっていてもよく、炭素数2〜4の炭化水素基を示し、式(3)において、R4は炭素数1〜6の炭化水素基を示す。また、一般式(1)、(2)及び(3)において、l、m及びnは2以上の整数を示す。〕
【0009】
本発明の共重合体を形成する12−ヒドロキシステアリン酸オリゴマーは上記一般式(1)で表され、リシノレイン酸オリゴマーは上記一般式(2)で表される。
上記一般式(1)及び(2)において、R1及びR2は炭素数2〜4の炭化水素基であり、好ましくはプロピレン基であり、更に好ましくはイソプロピレン基である。但しR1は同一であっても、異なっていてもよく、R2は同一であっても、異なっていてもよい。
また、上記一般式(1)及び(2)において、l及びmは2以上の整数であり、好ましくは2〜10の整数であり、更に好ましくは3〜7の整数である。l及びmを2〜10とすることにより、高分子化反応の促進及び攪拌効率の点において優れる。
【0010】
上記12−ヒドロキシステアリン酸オリゴマー、又はリシノレイン酸オリゴマーは、12−ヒドロキシステアリン酸、又はリシノレイン酸と二価アルコールとからエステルを製造し、そのエステルから二価アルコールを脱落させながら重合して得られる。この重合方法は後述する。この12−ヒドロキシステアリン酸オリゴマー、又はリシノレイン酸オリゴマーの分子量(MwNMR)は、600〜3000が好ましく、より好ましくは900〜2000である。分子量が600〜3000であると、高分子化反応の促進及び攪拌効率の点において優れる。
尚、上記オリゴマーの分子量(MwNMR)は、Calculated Molecular Weightを意味し、以下の方法により、1H−NMRスペクトル測定におけるスペクトルの積分比より算出した分子量をいう(以下、同様)。
オリゴマー分子量であるMwNMRの算出方法は、以下の通りである。
(1)12−ヒドロキシステアリン酸オリゴマー又はリシノレイン酸オリゴマーについては、水酸基に隣接するメチンプロトンと末端の1,2−プロパンジオールのメチルプロトンの比から算出した。
(2)ジカルボン酸エステルオリゴマーについては、重合が起こった1,2−プロパンジオールのメチルプロトンと末端のメチルプロトンの比から算出した。
【0011】
本発明の共重合体を形成するジカルボン酸エステルオリゴマーは、上記一般式(3)で表され、ジカルボン酸ジエステルから形成されるオリゴマーである。
上記一般式(3)において、R3は、炭素数2〜4の炭化水素基であり、好ましくはプロピレン基であり、更に好ましくはイソプロピレン基である。但し、R3は同一であっても、異なっていてもよい。また、一般式(3)において、R4は炭素数1〜6の炭化水素基を示す。その中でもR4はビニレン基、エチレン基又はフェニレン基が好ましい。但し、R4は同一であっても、異なっていてもよい。
更に、上記一般式(3)において、nは2以上の整数であり、好ましくは、2〜5の整数であり、更に好ましくは2〜3の整数である。nを2〜5とすることにより、高分子化反応の促進及び攪拌効率の点において優れる。
【0012】
上記ジカルボン酸エステルオリゴマーは、ジカルボン酸ジエステルに対して、二価アルコールをエステル交換することにより2つの水酸基を有するジカルボン酸ジヒドロキシジエステルを製造し、そのジカルボン酸ジヒドロキシジエステルを重合することにより得られる。この重合方法は後述する。このジカルボン酸エステルオリゴマーの分子量(MwNMR)は、200〜3000が好ましく、より好ましくは900〜2000である。分子量(MwNMR)が200〜3000であると、高分子化反応の促進及び攪拌効率の点において優れる。
【0013】
上記ジカルボン酸ジエステルを形成するジカルボン酸としては、フタル酸、イソフタル酸、テレフタル酸等の芳香族ジカルボン酸;マロン酸、コハク酸、グルタル酸、アジピン酸、ピメリン酸、スベリン酸等の脂肪族飽和ジカルボン酸;マレイン酸、フマル酸、イタコン酸、メサコン酸、シトラコン酸、グルタコン酸、アリルマロン酸、ムコン酸等の脂肪族不飽和ジカルボン酸が挙げられる。これらは、1種類単独であるいは2種類以上を組み合わせて用いることができる。その中でも、テレフタル酸、フマル酸及びコハク酸が好ましい。
また、上記ジカルボン酸ジエステルを形成するアルコールとしては、メタノール、エタノール、プロパノール、イソプロパノール、n−ブタノール、イソブチルアルコール等が挙げられる。これらは、1種類単独であるいは2種類以上を組み合わせて用いることができる。その中でもメタノール及びエタノールが好ましい。
尚、上記ジカルボン酸ジエステルは、ジカルボン酸ジメチル、ジカルボン酸ジエチルが好ましく、具体的にはテレフタル酸ジエチル、フマル酸ジエチル、コハク酸ジエチルがより好ましい。
【0014】
上記ジカルボン酸ジヒドロキシジエステルの製造に用いるアルコールは二価アルコールが好ましい。この二価アルコールとしては、1,2−プロパンジオール、1,3−プロパンジオール、エチレングリコール、1,2−ブタンジオール及び1,3−ブタンジオール等が挙げられる。これらは、1種類単独であるいは2種類以上を組み合わせて用いることができる。その中でも、1,2−プロパンジオールがより好ましい。
【0015】
本発明の共重合体における12−ヒドロキシステアリン酸オリゴマー又はリシノレイン酸オリゴマーと、ジカルボン酸エステルオリゴマーとの配合割合は、特に限定されないが、12−ヒドロキシステアリン酸オリゴマー又はリシノレイン酸オリゴマーとジカルボン酸エステルオリゴマーとの配合割合は質量比において5:95〜90:10、より好ましくは5:95〜70:30、更に好ましくは10:90〜50:50である。
配合割合は、共重合体を用いる用途により選択できる。即ち、12−ヒドロキシステアリン酸オリゴマー又はリシノレイン酸オリゴマーの配合量を高くすると、同一条件での製造工程においては、共重合体の重量平均分子量(Mw)が高くなる。更に、12−ヒドロキシステアリン酸オリゴマー又はリシノレイン酸オリゴマーの配合量を高くすると共重合体のガラス転移温度(Tg)が高くなる。
【0016】
上記共重合体の重量平均分子量(Mw)は特に限定されず、上記共重合体の用途により重量平均分子量を選択することができる。
但し、本発明の共重合体は、12−ヒドロキシステアリン酸オリゴマー又はリシノレイン酸オリゴマーを重合体構成オリゴマー単位とし、重量平均分子量(Mw)が20,000以上の共重合体とすることができる。
尚、共重合体の重量平均分子量(Mw)の測定条件は、ゲルパーミエーションクロマトグラフィー(GPC)により下記測定条件で測定した(以下、同様)。
(1)装置 ; 「LC−VPシリーズ」(株式会社島津製作所製)
(1)カラム ; 「Shodex K−806M」
(2)カラム温度; 30℃
(3)溶解液 ; クロロホルム
(4)検出器 ; RI
(5)検出器温度; 30℃
(6)標準物質 ; ポリスチレン
【0017】
上記高分子(共重合体)のガラス転移温度(Tg)は、本発明の共重合体の用途によって選択することができる。
尚、上記高分子のガラス転移温度(Tg)は、JIS−K−7121に準拠し、示査走査熱量計(DSC)「WS−002N」(株式会社マックサイエンス社製)により、ガラス転移温度を測定した(以下、同様)。
【0018】
本発明の共重合体の用途は、特に限定さないが、各種潤滑油、加工油、一般樹脂等の材料、充填用、癒着防止膜用、細胞接着用等の医療用材料、並びに塗料用、シーラント用等の添加剤などが挙げられる。例えば、本発明の共重合体は、ジカルボン酸エステルオリゴマーを形成する炭化水素基の選択等により、共重合体の特性を選択し、各種の用途に用いることができる。即ち、上記一般式(3)におけるR4にビニレン基等のエチレン系二重結合を備えた場合、更に、重合が形成されることにより共重合体は3次元構造を形成し、共重合体は硬化していく。例えば、そのように3次元構造を形成された共重合体は塗料等に用いることができる。
【0019】
本発明の共重合体は下記一般式(4)の反復単位、及び下記一般式(5)の反復単位のいずれか一方と、下記一般式(6)の反復単位と、を有する。
【化4】

【化5】

【化6】

〔但し、一般式(6)において、R3は炭素数2〜4の炭化水素基を示し、R4は炭素数1〜6の炭化水素基を示す。〕
【0020】
上記一般式(4)の反復単位は、12−ヒドロキシステアリン酸から形成された反復単位であり、上記一般式(5)は、リシノレイン酸から形成された反復単位である。本発明の共重合体は、上記一般式(4)の反復単位及び上記一般式(5)の反復単位のいずれか一方を有している。
上記共重合体における(4)又は(5)の含有量は、特に限定されないが、共重合体全量を100質量%とした場合、好ましくは5〜90質量%であり、より好ましくは5〜70質量%であり、更に好ましくは10〜50重量%である。
【0021】
上記一般式(6)の反復単位は、ジカルボン酸ジエステルから形成された反復単位である。その一般式(6)の反復単位は、ジカルボン酸ジエステルに対して、二価アルコールをエステル交換することにより2つの水酸基を有するジカルボン酸ジヒドロキシジエステルを製造し、そのジカルボン酸ジヒドロキシジエステルを重合することにより形成される。その二価アルコールとしては、1,2−プロパンジオール、1,3−プロパンジオール、エチレングリコール、1,2−ブタンジオール及び1,3−ブタンジオール等が挙げられる。これらは、1種類単独であるいは2種類以上を組み合わせて用いることができる。その中でも、1,2−プロパンジオールがより好ましい。
【0022】
上記一般式(6)において、R3は炭素数2〜4の炭化水素基を示す。その中でもR3はプロピレン基が好ましく、イソプロピレン基がより好ましい。
また、R4は炭素数1〜6の炭化水素基を示す。その中でもR4はビニレン基、エチレン基又はフェニレン基が好ましい。
また、上記一般式(6)の反復単位は、ジカルボン酸ジエステルから形成されるが、そのジカルボン酸ジエステルを形成するジカルボン酸としては、フタル酸、イソフタル酸、テレフタル酸等の芳香族ジカルボン酸;マロン酸、コハク酸、グルタル酸、アジピン酸、ピメリン酸、スベリン酸等の脂肪族飽和ジカルボン酸;マレイン酸、フマル酸、イタコン酸、メサコン酸、シトラコン酸、グルタコン酸、アリルマロン酸、ムコン酸等の脂肪族不飽和ジカルボン酸が挙げられる。これらは、1種類単独であるいは2種類以上を組み合わせて用いることができる。その中でも、テレフタル酸及びフマル酸並びにコハク酸が好ましい。
また、上記ジカルボン酸ジエステルを形成するアルコールとしては、メタノール、エタノール、プロパノール、イソプロパノール、n−ブタノール、イソブチルアルコール等が挙げられる。これらは、1種類単独であるいは2種類以上を組み合わせて用いることができる。その中でもメタノール及びエタノールが好ましい。
尚、上記ジカルボン酸ジエステルは、ジカルボン酸ジメチル、ジカルボン酸ジエチルが好ましく、具体的にはテレフタル酸ジエチル、フマル酸ジエチル、コハク酸ジエチルがより好ましい。
【0023】
上記共重合体における(6)の含有量は、特に限定されないが、共重合体全量を100質量%とした場合、好ましくは10〜95質量%であり、より好ましくは30〜95質量%であり、更に好ましくは50〜90重量%である。
【0024】
〔2〕カルボン酸オリゴマーの製造方法
本発明のカルボン酸オリゴマーの製造方法は、12−ヒドロキシステアリン酸及びリシノレイン酸のいずれか一方のカルボン酸と炭素数2〜4の2価アルコールとによりエステルを製造するエステル製造工程と、上記エステルから上記2価アルコールを留去させながら、上記カルボン酸を重合させるカルボン酸オリゴマー製造工程と、を備える。
下記式(7)又は(8)に示すように12−ヒドロキシステアリン酸又はリシノレイン酸と二価アルコールとにより、水酸基を2個有するカルボン酸エステルを製造し、その後、そのカルボン酸エステルを下記式(9)又は(10)に示すように重合させることにより、12−ヒドロキシステアリン酸オリゴマー又はリシノレイン酸オリゴマー(以下、「カルボン酸オリゴマー」と略記する。)を製造する。尚、式(7)及び(9)はオリゴマーを形成するカルボン酸が12−ヒドロキシステアリン酸による場合のものであり、式(8)及び(10)はオリゴマーを形成するカルボン酸がリシノレイン酸による場合のものである。
【化7】

【化8】

【化9】

【化10】

〔但し、式(7)及び(9)において、R1は炭素数2〜4の炭化水素基を示し、式(8)及び(10)において、R2は炭素数2〜4の炭化水素基を示し、式(9)において、lは2以上の整数を示し、式(10)において、mは2以上の整数を示す。〕
【0025】
12−ヒドロキシステアリン酸又はリシノレイン酸と反応させる上記二価アルコールとしては、1,2−プロパンジオール、1,3−プロパンジオール、エチレングリコール、1,2−ブタンジオール及び1,3−ブタンジオール等が挙げられる。これらは、1種類単独であるいは2種類以上を組み合わせて用いることができる。その中でも1,2−プロパンジオールが好ましい。オリゴマー形成の際にアルコールを留去しながら重合させるため、低分子量の二価アルコールが好ましい。
【0026】
エステル製造に用いられる溶媒としては、エステル化反応に不活性な溶媒であれば非極性溶媒であっても極性溶媒であっても特に限定されない。例えば、ヘキサン、ヘプタン、オクタン等のアルカン類;塩化メチレン、クロロホルム、四塩化炭素、塩化エチレン等のハロアルカン類;ベンゼン、トルエン、キシレン、メシチレン、ペンタメチルベンゼン等のベンゼン類;クロルベンゼン、ブロムベンゼン等のハロベンゼン類;ジエチルエーテル、アニソール等のエーテル類;が挙げられる。その中でも、非極性溶媒であるトルエン、キシレン及びメシチレンが好ましい。尚、上記エステル製造は、無溶媒であっても進行する。
上記溶媒の使用量は、その種類及びエステル製造条件等により異なるが、上記12−ヒドロキシステアリン酸又はリシノレイン酸100質量部に対して、通常、100〜1000質量部である。
【0027】
エステル製造に用いられる触媒としては強酸触媒が好ましい。この強酸触媒としては、硫酸、メタンスルホン酸、パラトルエンスルホン酸、タングストリン酸、タングストケイ酸、モリブドリン酸、モリブドケイ酸、三フッ化ホウ素エチラート、四塩化スズ等が挙げられる。
上記触媒の使用量は、その種類及びエステル製造条件等により異なるが、上記12−ヒドロキシステアリン酸又はリシノレイン酸100質量部に対して、通常、0.1〜10質量部である。
【0028】
エステル製造の反応温度は、触媒の種類等により異なるが、通常、40〜180℃、好ましくは50〜150℃、より好ましくは60〜130℃の範囲から選択される。
また、上記反応は、大気雰囲気下(常圧)で行われ、反応時間は、反応温度及等により異なるが、通常、大気雰囲気下で、10〜40時間である。
【0029】
上記エステル製造工程により得られた12−ヒドロキシステアリン酸又はリシノレイン酸と二価アルコールとのエステル(以下、「カルボン酸エステル」と略記する。)を重合させることにより、12−ヒドロキシステアリン酸オリゴマー又はリシノレイン酸オリゴマー(以下、「カルボン酸オリゴマー」と略記する。)を製造する。
上記カルボン酸エステルからカルボン酸オリゴマーへの重合は、カルボン酸エステルを形成している二価アルコールを脱落させながら、カルボン酸エステルを形成しているカルボン酸を重合させることによる。つまり、上記カルボン酸オリゴマーは、上記カルボン酸エステルから二価アルコールを留去させながら、カルボン酸を重合されることにより得られる。
【0030】
上記カルボン酸オリゴマーへの重合は、通常、オルトチタン酸テトラ−n−ブチル等の有機金属触媒が使用される。
重合温度は、触媒の種類等により異なるが、通常、100〜200℃、好ましくは120〜180℃の範囲から選択される。
また、重合は、通常、減圧条件下で行われ、減圧する場合の圧力は、0.1〜2.0mmHgの範囲から選択される。
重合時間は、重合温度及び減圧条件等により異なるが、通常、0.3mmHgの減圧下で、3〜50時間である。この重合時間等により得られるカルボン酸オリゴマーの平均分子量を変化させることができる。
【0031】
尚、上記のカルボン酸オリゴマーの製造方法において、リシノレイン酸と12−ヒドロキシステアリン酸との混合物を用いることもできる。リシノレイン酸及び12−ヒドロキシステアリン酸は、共にヒマシ油誘導体であり、この2種のカルボン酸は炭素数が全く同じ18であり、2個の水酸基を全く同様に有していることから、上記2種のカルボン酸は同作用を有し、上記のカルボン酸オリゴマーの製造方法において上記2種のカルボン酸混合物を用いることもできる。
また、上記混合物を用いた場合、リシノレイン酸及び12−ヒドロキシステアリン酸がランダムに重合され、その製造されるカルボン酸オリゴマーの構成単位を形成するカルボン酸は、リシノレイン酸及び12−ヒドロキシステアリン酸から選ばれる少なくとも1種のカルボン酸となる。
また、ヒマシ油を加水分解して得られるリシノレイン酸含有ヒマシ油誘導体組成物を上記のカルボン酸オリゴマーの製造方法に用いて、リシノレイン酸オリゴマーを製造することもできる。この場合、ヒマシ油誘導体組成物におけるリシノレイン酸の含有量は、ヒマシ油誘導体組成物全体を100重量%として、85〜100重量%が好ましく、90重量%以上がより好ましく、95重量%が更に好ましい。この範囲とすることで、リシノレイン酸以外の脂肪酸及びその他の組成物により生じる恐れがある反応阻害を免れることができる。
更に、上記リシノール酸含有ヒマシ油誘導体組成物に水素を添加することにより得られる12−ヒドロキシステアリン酸含有ヒマシ油誘導体組成物を用いて、12−ヒドロキシステアリン酸オリゴマーを製造することもできる。この場合、ヒマシ油誘導体組成物における12−ヒドロキシステアリン酸の含有量は、ヒマシ油誘導体組成物全体を100重量%として、85〜100重量%が好ましく、90重量%以上がより好ましく、95重量%が更に好ましい。この範囲とすることで、12−ヒドロキシステアリン酸以外の脂肪酸及びその他の組成物により生じる恐れがある重合反応での反応阻害を免れることができる。
【0032】
〔3〕共重合体の製造方法
本発明の共重合体の製造方法は、12−ヒドロキシステアリン酸及びリシノレイン酸のいずれか一方のカルボン酸と炭素数2〜4の二価アルコールとによりエステルを製造するエステル製造工程と、上記エステルから上記二価アルコールを留去させながら、上記カルボン酸を重合させるカルボン酸オリゴマー製造工程と、上記カルボン酸オリゴマーと下記一般式(3)に表されるジカルボン酸エステルオリゴマーとを重合させる重合工程と、を備えることを特徴とする。
【化3】

〔但し、一般式(3)において、R3は炭素数2〜4の炭化水素基を示し、R4は炭素数1〜6の炭化水素基を示し、nは2以上の整数を示す。〕
尚、上記共重合体の製造方法は、上述のカルボン酸オリゴマー製造方法に対して、更に
そのカルボン酸オリゴマー製造方法により得られたカルボン酸オリゴマーと、上記一般式(3)に表されるジカルボン酸エステルオリゴマーと、を重合させる重合工程とを備えるものである。
また、上記の製造方法により本発明の共重合体を製造することができる。
(1)ジカルボン酸エステルオリゴマーの製造方法
下記式(11)に示すようにジカルボン酸ジエステルを二価アルコールとのエステル交換反応により、2つの水酸基を有するジカルボン酸ジヒドロキシジエステルを製造し、その後、そのジカルボン酸ジヒドロキシジエステルを下記式(12)に示すように重合させることにより、ジカルボン酸エステルオリゴマーを製造する。
【化11】

【化12】

〔但し、式(11)及び(12)において、R3は炭素数2〜4の炭化水素基を示し、R4は炭素数1〜6の炭化水素基を示し、式(12)において、nは2以上の整数を示す。〕
【0033】
上記一般式(11)及び(12)において、R4は炭素数1〜6の炭化水素基を示す。その中でもR4はビニレン基、エチレン基又はフェニレン基が好ましい。
また、上記ジカルボン酸ジエステルを形成するジカルボン酸としては、フタル酸、イソフタル酸、テレフタル酸等の芳香族ジカルボン酸;マロン酸、コハク酸、グルタル酸、アジピン酸、ピメリン酸、スベリン酸等の脂肪族飽和ジカルボン酸;マレイン酸、フマル酸、イタコン酸、メサコン酸、シトラコン酸、グルタコン酸、アリルマロン酸、ムコン酸等の脂肪族不飽和ジカルボン酸が挙げられる。これらは、1種類単独であるいは2種類以上を組み合わせて用いることができる。その中でもテレフタル酸、フマル酸及びコハク酸が好ましい。
【0034】
上記ジカルボン酸ジエステルを形成するアルコールとしては、メタノール、エタノール、プロパノール、イソプロパノール、n−ブタノール、イソブチルアルコール等が挙げられる。これらは、1種類単独であるいは2種類以上を組み合わせて用いることができる。その中でもメタノール及びエタノールが好ましい。
尚、上記ジカルボン酸ジエステルは、ジカルボン酸ジメチル、ジカルボン酸ジエチルが好ましく、具体的にはテレフタル酸ジエチル、フマル酸ジエチル、コハク酸ジエチルがより好ましい。
【0035】
上記一般式(11)及び(12)において、R3は炭素数2〜4の炭化水素基を示す。その中でもR3はプロピレン基が好ましく、イソプロピレン基がより好ましい。
上記ジカルボン酸ジエステルとエステル交換に用いる上記二価アルコールとしては、1,2−プロパンジオール、1,3−プロパンジオール、エチレングリコール、1,2−ブタンジオール及び1,3−ブタンジオール等が挙げられる。これらは、1種類単独であるいは2種類以上を組み合わせて用いることができる。その中でも1,2−プロパンジオールが好ましい。
【0036】
上記エステル交換反応には触媒を用いることができる。エステル交換反応に使用する触媒は、ハロゲン化金属化合物が好ましく、このハロゲン化金属化合物としては、塩化マグネシウム、塩化亜鉛、塩化カルシウム、三塩化アンチモン、五塩化アンチモン、三ヨウ化リン、三塩化リン、三臭化リン、五塩化リン、四塩化スズ、四臭化スズ、四ヨウ化チタン、四塩化チタン、六塩化タングステン、ヨウ化マグネシウム(II)無水物、ペンタカルボニル臭化マンガン、過塩素酸マンガン(II)・6水和物、塩化マンガン(II)無水物、塩化マンガン(II)・4水和物、臭化マンガン(II) 無水物、臭化マンガン(II)・4水和物、ペンタカルボニル塩化レニウム、ペンタカルボニル臭化レニウム、塩化レニウム(III)及び塩化レニウム(V)などが挙げられる。これらは、1種類単独であるいは2種類以上を組み合わせて用いることができる。その中でも、塩化亜鉛がより好ましい。
上記触媒の使用量は、その種類及びエステル交換反応の条件等により異なるが、上記ジカルボン酸ジエステルと上記二価アルコールとの総量に対して、通常、0.1〜0.5質量%である。
【0037】
上記エステル交換反応における反応は、通常、常圧において、窒素雰囲気下で行われる。上記反応温度は、触媒の種類等により異なるが、通常、100〜300℃、好ましくは150〜250℃の範囲から選択される。
また反応時間は、反応温度等により異なるが、通常、1〜10時間、好ましくは3〜5時間である。
上記反応条件とすることでエステル交換反応を効果的に行うことができる。
【0038】
上記ジカルボン酸エステルオリゴマーは上記ジカルボン酸ジヒドロキシジエステルを重合して得られる。
上記ジカルボン酸ジヒドロキシジエステルからジカルボン酸エステルオリゴマーへの重合は、ジカルボン酸ジヒドロキシジエステルを形成している2個の二価アルコールの内の1個を脱落させながら、ジカルボン酸ジヒドロキシジエステルを形成しているジカルボン酸エステルを重合させることによる。つまり、上記ジカルボン酸エステルオリゴマーは、上記ジカルボン酸ジヒドロキシジエステルから二価アルコールを留去させながら、ジカルボン酸エステルを重合されることにより得られる。
【0039】
上記ジカルボン酸エステルオリゴマーへの重合は、上記エステル交換に用いた触媒をそのまま使用することができる。
上記重合は、通常、減圧条件下で行われ、減圧する場合の圧力は、好ましくは0.1〜2.0mmHgの範囲から選択される。
重合温度は、減圧条件等により異なるが、通常、80〜150℃、好ましくは90〜110℃の範囲から選択される。
重合時間は、減圧条件及び重合温度等により異なるが、通常、0.3mmHgの減圧下で、4〜24時間である。
上記重合条件とすることで、効率的に、二価アルコールを留去させながら、ジカルボン酸エステルオリゴマーへの重合を行うことができる。
【0040】
(2)12−ヒドロキシステアリン酸オリゴマー又はリシノレイン酸オリゴマーとジカルボン酸エステルオリゴマーとの重合
下記式(13)に示すように上記12−ヒドロキシステアリン酸オリゴマー又は上記リシノレイン酸オリゴマーと上記ジカルボン酸エステルオリゴマーとを重合させる。そして、それにより、本発明の共重合体を得ることができる。尚、反応式(13)は12−ヒドロキシステアリン酸オリゴマーを用いた場合の例であるが、リシノレイン酸オリゴマーを用いた場合も同様のスキームである。
【化13】

〔但し、式(13)において、R1及びR3は炭素数2〜4の炭化水素基を示し、R4は炭素数1〜6の炭化水素基を示し、l及びnは2以上の整数を示し、aはl以下の2以上の整数を示し、bはn以下の2以上の整数を示し、cはl以下の0又は1以上の整数を示し、dはn以下の0又は1以上の整数を示す。〕
上記共重合体は、上記12−ヒドロキシステアリン酸オリゴマー又はリシノレイン酸オリゴマー、とジカルボン酸エステルオリゴマーとから二価アルコールを留去(除去)させながら重合されることにより得られる。
上記12−ヒドロキシステアリン酸オリゴマー及びリシノレイン酸オリゴマーは、一方にヒドロキシアルキル基及び他方にヒドロキシル基を有している。また、ジカルボン酸エステルオリゴマーは両末端にヒドロキシアルキル基を有している。一方のオリゴマーのヒドロキシアルキレン基と他方のオリゴマーのヒドロキシル基(又はヒドロキシアルキル基のヒドロキシル基部分)とから二価アルコールが脱離して、オリゴマーの縮合により上記共重合体が得られる。即ち、上記12−ヒドロキシステアリン酸オリゴマー又はリシノレイン酸オリゴマーとジカルボン酸エステルオリゴマーとの重合は、上記12−ヒドロキシステアリン酸オリゴマー、リシノレイン酸オリゴマー、及びジカルボン酸エステルオリゴマーの末端において形成されている二価アルコール残基を脱落させながら、上記オリゴマーを重合させることによる。
尚、上記重合においては、エステル交換反応も起きることがある。この場合は、ランダムなポリマーとなるが、構造的にはポリエステルである。
【0041】
上記オリゴマー同士の重合には、三酸化アンチモン、四酸化アンチモン,五酸化アンチモンまたはアンチモン酸ソーダ等のアンチモン系化合物を用いることが好ましい。上記触媒の使用量は、その種類及びエステル重合反応の条件等により異なるが、上記12−ヒドロキシステアリン酸オリゴマー又はリシノレイン酸オリゴマーと上記ジカルボン酸エステルオリゴマーとの総量に対して、通常、0.1〜0.5質量%である。
【0042】
また、上記オリゴマー同士の重合は、常圧条件下の第一工程と減圧条件下の第二工程との2つの工程を備えることが好ましい。
上記第一工程は、乾燥した窒素を積極的に吹き込み、窒素雰囲気下で行われる。反応温度は、触媒の種類等により異なるが、通常、80〜100℃、好ましくは90〜100℃の範囲から選択される。また反応時間は、通常、10分〜1時間、好ましくは20〜40分である。即ち、この第一工程では反応系から水を追い出すと共に、反応の初期は二価アルコールの留出が多いことから上記条件で反応を行うことが好ましい。
上記第一工程の後、徐々に温度を上げ、次に窒素の流入を止めた後、減圧していく。
第二工程の、圧力は0.1〜2.0mmHgの範囲から選択され、また、反応時間は10〜100時間の範囲から選択され、並びに反応温度は100〜200℃の範囲から選択されることが好ましい。即ち、この第二工程で共重合体への重合を進め、分子量を高めて高分子量化していく。
【0043】
上記オリゴマー同士の重合における12−ヒドロキシステアリン酸オリゴマー又はリシノレイン酸オリゴマーと、ジカルボン酸エステルオリゴマーとの配合割合は、特に限定されないが、12−ヒドロキシステアリン酸オリゴマー又はリシノレイン酸オリゴマーとジカルボン酸エステルオリゴマーとの配合割合は質量比において5:95〜90:10、より好ましくは5:95〜70:30、更に好ましくは10:90〜50:50である。配合割合は、共重合体を用いる用途により選択できる。
尚、上記共重合体の製造において、12−ヒドロキシステアリン酸とリシノレイン酸との混合物から製造されるカルボン酸オリゴマーを用いることもできる。その場合の製造条件及びスキーム等は上述の場合と全く同様である。
【実施例】
【0044】
以下、本発明を実施例により具体的に説明する。
〔1〕実施例1
12−ヒドロキシステアリン酸オリゴマー(A1〜A3)の製造
(1)12−ヒドロキシステアリン酸オリゴマー(A1)の製造
12−ヒドロキシステアリン酸30gと、1,2−プロパンジオール18gとを無水トルエン200mlに溶解し、次いで、触媒としてp−トルエンスルホン酸0.15gを添加し、200mlナス型フラスコ中にて110℃にて、20時間還流を行なった。
上記還流工程の後、その反応液を0.05モルの炭酸水素ナトリウム溶液で洗浄した後、無水硫酸マグネシウムで乾燥し、溶媒及び未反応の1,2−プロパンジオールを減圧下で留去させた。
その後、触媒としてオルトチタン酸テトラ−n−ブチル0.5重量%を反応物0.5mlに加え、温度150℃及び0.3mmHgの減圧条件下で攪拌しながら、1,2−プロパンジオールを除去しながら再び反応させ、5時間後に12−ヒドロキシステアリン酸オリゴマーの固形物(A1)〔分子量(MwNMR)=920〕を得た。尚、実施例1における重合反応時間及び分子量(MwNMR)を表1に示す。
【0045】
【表1】

【0046】
(2)12−ヒドロキシステアリン酸オリゴマー(A2)の製造
減圧下の重合反応時間を5時間から7時間に変更した以外は、上記(1)の(A1)の製造方法と同様にして、12−ヒドロキシステアリン酸オリゴマーの固形物(A2)を得た。
尚、12−ヒドロキシステアリン酸オリゴマーの固形物(A2)における重合反応時間及び分子量(MwNMR)を表1に併記する。
【0047】
(3)12−ヒドロキシステアリン酸オリゴマー(A3)の製造
上記減圧下の重合反応時間を5時間から10時間に変更した以外は、上記(1)の(A1)の製造方法と同様にして、12−ヒドロキシステアリン酸オリゴマーの固形物(A3)を得た。
尚、12−ヒドロキシステアリン酸オリゴマーの固形物(A3)における重合反応時間及び分子量(MwNMR)を表1に併記する。
【0048】
〔2〕実施例2
リシノレイン酸オリゴマー(B1〜B3)の製造
(1)リシノレイン酸オリゴマー(B1)の製造
実施例1での(1)12−ヒドロキシステアリン酸オリゴマー(A1)の製造方法における12−ヒドロキシステアリン酸の替わりにリシノレイン酸を用いた以外は、実施例1における(1)12−ヒドロキシステアリン酸オリゴマー(A1)の製造方法と同様にして、リシノレイン酸オリゴマーの固形物(B1)〔分子量(MwNMR)=870〕を得た。尚、実施例2における重合反応時間及び分子量(MwNMR)を表2に示す。
【0049】
【表2】

【0050】
(2)リシノレイン酸オリゴマー(B2)の製造
減圧下の重合反応時間を5時間から7時間に変更した以外は、上記(1)の(B1)の製造方法と同様にして、リシノレイン酸オリゴマーの固形物(B2)を得た。
尚、リシノレイン酸オリゴマーの固形物(B2)における重合反応時間及び分子量(MwNMR)を表2に併記する。
【0051】
(3)リシノレイン酸オリゴマー(B3)の製造
減圧下の重合反応時間を5時間から10時間に変更した以外は、上記(1)の(B1)の製造方法と同様にして、リシノレイン酸オリゴマーの固形物(B3)を得た。
尚、リシノレイン酸オリゴマーの固形物(B3)における重合反応時間及び分子量(MwNMR)を表2に併記する。
【0052】
〔3〕実施例3
12−ヒドロキシステアリン酸オリゴマー又はリシノレイン酸オリゴマーに共重合させるオリゴマー(ジカルボン酸エステルオリゴマー)の製造
(1)イソプロピレンテレフタレートオリゴマー(以下、「テレフタル酸オリゴマー」ともいう。)(C)の製造
テレフタル酸ジエチル2.22g(0.01モル)と1,2−プロパンジオール2.28g(0.03モル)とに、触媒として塩化亜鉛0.1〜0.5質量%(テレフタル酸ジエチル及び1,2−プロパンジオールの総質量%を100%として)を加え、窒素雰囲気下で、195℃において4時間、攪拌しながら反応させた後、
反応容器内を0.3mmHgに減圧し、温度を100℃として、更に、攪拌しながら反応させることによりテレフタル酸オリゴマー(C)を製造した。そして、上記減圧下での反応時間として8時間行ったテレフタル酸オリゴマー(C1)〔分子量(MwNMR)=690〕、及び4時間行ったテレフタル酸オリゴマー(C2)〔分子量(MwNMR)=490〕を得た。
尚、化学構造はNMRスペクトルの測定により確認した。
【0053】
(2)イソプロピレンフマレートオリゴマー(以下、「フマル酸オリゴマー」ともいう)(D)の製造
フマル酸ジエチル1.72g(0.01モル)及び1,2−プロパンジオール2.28g(0.03モル)に、触媒として塩化亜鉛0.1〜0.5質量%(フマル酸ジエチル及び1,2−プロパンジオールの総質量%を100%として)加え、窒素雰囲気下、150℃で4時間、攪拌しながら反応させた。
その後、反応容器内を0.3mmHgに減圧し、温度を80℃として、更に、攪拌しながら反応させることによりフマル酸オリゴマー(D)を製造した。そして、上記減圧下での反応時間として8時間行ったフマル酸オリゴマー(D1)〔分子量(MwNMR)=1000〕、及び4時間行ったフマル酸オリゴマー(D2)〔分子量(MwNMR)=400〕を得た。
尚、化学構造はNMRスペクトルの測定により確認した。
また、フマル酸オリゴマーの上記製造方法において、フマル酸が有する二重結合同士による架橋を防止するため、1−4ベンゾキノンを0.5重量%加えることもできる。
【0054】
(3)イソプロピレンサクシネートオリゴマー(以下、「コハク酸オリゴマー」ともいう)(E)の製造
コハク酸ジエチル1.74g(0.01モル)及び1,2−プロパンジオール2.28g(0.03モル)に、触媒として塩化亜鉛を0.1〜0.5質量%(コハク酸ジエチル及び1,2−プロパンジオールの総質量%を100%として)加え、窒素雰囲気下、150℃で4時間、攪拌しながら反応させた。
その後、反応容器内を0.3mmHgに減圧し、温度を80℃として、更に、攪拌しながら反応させることによりコハク酸オリゴマー(E)を製造した。そして、上記減圧下での反応時間として10時間行ったコハク酸オリゴマー(E1)〔分子量(MwNMR)=1150〕、8時間行ったコハク酸オリゴマー(E2)〔分子量(MwNMR)=1050〕、4時間行ったコハク酸オリゴマー(E3)〔分子量(MwNMR)=450〕、及び4時間行ったコハク酸オリゴマー(E4)〔分子量(MwNMR)=410〕を得た。
【0055】
〔4〕実施例4
12−ヒドロキシステアリン酸オリゴマー(A)とテレフタル酸オリゴマー(C)との共重合体(F1〜F5)の製造
実施例1で製造した12−ヒドロキシステアリン酸オリゴマー(A1、A2及びA3)と実施例3で製造したテレフタル酸オリゴマー(C1及びC2)とを表3に記載の配合オリゴマー及び配合割合で、窒素雰囲気下で混合し、触媒として三酸化アンチモンを0.1〜0.5質量%(12−ヒドロキシステアリン酸オリゴマー及びテレフタル酸オリゴマーの総質量%を100%として)加え、100℃で30間、攪拌しながら反応させた。
その後、反応温度を徐々に温度を上げ、次に窒素の流入を止めた後、減圧した。反応容器内を0.3mmHgの減圧条件、及び温度を160℃とし、表3に記載の反応時間により重合を行い、共重合体(F1〜F5)を得た。
尚、実施例4における共重合体の重量平均分子量(Mw)、多分散度(Mw/Mn)及び共重合体のガラス転移温度(Tg)を表3に併記する。
また、共重合体F1〜F5のDSC測定結果を図1に示す。
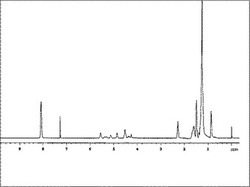
更に、共重合体を重クロロホルムにて溶解して、NMR装置「UNITY INOVA 400」(バリアン テクノロジー ジャパン リミテッド製)を用いて、測定周波数400MHzにおいてプロトンNMR測定を行ない、得られたスペクトルから各成分の存在比を算出した。共重合体F1の1H−NMRスペクトルの測定結果を図2に示す。
【0056】
【表3】

【0057】
〔5〕実施例5
12−ヒドロキシステアリン酸オリゴマー(A)とフマル酸オリゴマー(D)との共重合体(G1〜G4)の製造
実施例4におけるテレフタル酸オリゴマー(C1及びC2)にかえて、フマル酸オリゴマー(D1及びD2)を用いた以外は、実施例4と同様にして、共重合体(G1〜G4)を得た。
尚、12−ヒドロキシステアリン酸オリゴマー(A)とフマル酸オリゴマー(D)との配合割合、減圧条件下での反応時間、実施例5における共重合体の重量平均分子量(Mw)、多分散度(Mw/Mn)及び共重合体のガラス転移温度(Tg)を表4に示す。
また、共重合体(G1〜G4)のDSC測定結果を図3に示し、実施例4と同様に測定した共重合体G1の1H−NMRスペクトルの測定結果を図4に示す。
【0058】
【表4】

【0059】
〔6〕実施例6
12−ヒドロキシステアリン酸オリゴマー(A)とコハク酸オリゴマー(E)との共重合体(H1〜H5)の製造
実施例4におけるテレフタル酸オリゴマー(C1及びC2)にかえて、コハク酸オリゴマー(E1〜E4)を用いた以外は、実施例4と同様にして、共重合体(H1〜H4)を得た。
尚、12−ヒドロキシステアリン酸オリゴマー(A)とコハク酸オリゴマー(E)との配合割合、減圧条件下での反応時間、実施例6における共重合体の重量平均分子量(Mw)、多分散度(Mw/Mn)及び共重合体のガラス転移温度(Tg)を表5に示す。
【0060】
【表5】

【0061】
〔7〕実施例7
リシノレイン酸オリゴマー(B)とテレフタル酸オリゴマー(C)との共重合体(I1〜I5)の製造
実施例4における12−ヒドロキシステアリン酸オリゴマー(A1、A2及びA3)にかえて、リシノレイン酸オリゴマー(B1,B2及びB3)を用いた以外は、実施例4と同様にして、共重合体(I1〜I5)を得た。
尚、リシノレイン酸オリゴマー(B)とテレフタル酸オリゴマー(C)との配合割合、減圧条件下での反応時間、実施例7における共重合体の重量平均分子量(Mw)、多分散度(Mw/Mn)及び共重合体のガラス転移温度(Tg)を表6に示す。
【0062】
【表6】

【0063】
〔8〕実施例8
リシノレイン酸オリゴマー(B)とフマル酸オリゴマー(D)との共重合体(J1〜J4)の製造
実施例7におけるテレフタル酸オリゴマー(C1及びC2)にかえて、フマル酸オリゴマー(D1及びD2)を用いた以外は、実施例7と同様にして、共重合体(J1〜J4)を得た。
尚、リシノレイン酸オリゴマー(B)とフマル酸オリゴマー(D)との配合割合、減圧条件下での反応時間、実施例8における共重合体の重量平均分子量(Mw)、多分散度(Mw/Mn)及び共重合体のガラス転移温度(Tg)を表7に示す。
【0064】
【表7】

【0065】
〔9〕実施例9
リシノレイン酸オリゴマー(B)とコハク酸オリゴマー(E)との共重合体(K1〜K4)の製造
実施例7におけるテレフタル酸オリゴマー(C1及びC2)にかえて、コハク酸オリゴマー(E1〜E4)を用いた以外は、実施例4と同様にして、共重合体(K1〜K4)を得た。
尚、リシノレイン酸オリゴマー(B)とコハク酸オリゴマー(E)との配合割合、減圧条件下での反応時間、実施例9における共重合体の重量平均分子量(Mw)、多分散度(Mw/Mn)及び共重合体のガラス転移温度(Tg)を表8に示す。
【0066】
【表8】

【0067】
〔10〕実施例10
二価アルコールを用いた12−ヒドロキシステアリン酸からのポリマー製造
実施例1における重合反応時間を100時間とした以外は、実施例1と同様にして12−ヒドロキシステアリン酸からのポリマー(L)を得た。実施例10におけるポリマー(L)の重量平均分子量(Mw)は15000であった。尚、実施例4と同様に測定した重合体Lの1H−NMRスペクトルの測定結果を図5に示す。
【0068】
〔11〕比較例1
実施例における1,2−プロパンジオールにかえてメタノールを用いた以外は、実施例1と同様にして12−ヒドロキシステアリン酸からのポリマー(M)を得た。比較例1におけるポリマー(M)の重量平均分子量(Mw)は5000であった。
【0069】
〔12〕実施例の効果
実施例1及び実施例2より、12−ヒドロキシステアリン酸及びリシノレイン酸は、二価アルコールとエステルを形成させ、更に、そのエステルから二価アルコールを反応系から脱落させながら縮合させることにより高分子化ができる。それにより、12−ヒドロキシステアリン酸及びリシノレイン酸の高分子オリゴマーを得ることができる。即ち、12−ヒドロキシステアリン酸及びリシノレイン酸は、二価アルコールとエステル形成後、エステル交換反応による重合により高分子化させることができる。
更に、実施例10では、二価アルコールを用いた場合には、重量平均分子量(Mw)が15000の12−ヒドロキシステアリン酸オリゴマーとなったが、一価アルコールであるメタノールを用いた比較例1の場合には、エステル交換反応による重合での高分子化であるが、重量平均分子量(Mw)が5000の12−ヒドロキシステアリン酸オリゴマーしか得られなかった。
また、実施例3〜9より、12−ヒドロキシステアリン酸及びリシノレイン酸の高分子を含む共重合を得られることが確認できた。更に、共重合体形成に用いるオリゴマーの種類及び分子量(MwNMR)を変えることにより、共重合体の特性を変化させることができることが確認できた。これにより、本発明の共重合体は、上述の実施例に示すものに限られず、目的、用途に応じて本発明の範囲内で種々変更した重合体とすることができる。
【図面の簡単な説明】
【0070】
【図1】12−ヒドロキシステアリン酸オリゴマーとテレフタル酸オリゴマーとの共重合体(F1〜F5)のDSC測定結果を示すグラフである。
【図2】12−ヒドロキシステアリン酸オリゴマーとテレフタル酸オリゴマーとの共重合体の1H−NMRスペクトル測定結果を示すグラフである。
【図3】12−ヒドロキシステアリン酸オリゴマーとフマル酸オリゴマーとの共重合体(G1〜G4)のDSC測定結果を示すグラフである。
【図4】12−ヒドロキシステアリン酸オリゴマーとフマル酸オリゴマーとの共重合体の1H−NMRスペクトル測定結果を示すグラフである。
【図5】12−ヒドロキシステアリン酸からのポリマーの1H−NMRスペクトル測定結果を示すグラフである。
【技術分野】
【0001】
本発明は、共重合体及びその製造方法に関する。更に詳しくは、本発明は、12−ヒドロキシステアリン酸オリゴマー又はリシノレイン酸オリゴマーと、ジカルボン酸エステルオリゴマーとの重合により得られることを特徴とする共重合体、及びその製造方法に関する。
【背景技術】
【0002】
従来、ヒマシ油由来のリシノレイン酸は、様々な用途に用いられているが、例えば、反応性の生分解性共重合ポリエステルとして、リシノレイン酸を乳酸と重縮合することにより生分解性共重合体ポリエステルが得られることが知られている(特許文献1)。
また、リシノレイン酸を用いた6量体のマクロラクトン及びポリエステルへの重合が知られている(非特許文献1)。
【0003】
【特許文献1】特開2005−113001号公報
【非特許文献1】Biomacromolecuels,Vol.6,No.3,2005 1679−1688
【発明の開示】
【発明が解決しようとする課題】
【0004】
12−ヒドロキシステアリン酸及びリシノレイン酸は、ヒマ植物に含まれるヒマシ油から容易に誘導される脂肪酸である。上記の2つの脂肪酸は、側鎖に光学活性を持つ水酸基を有することにより、他の植物由来の脂肪酸にない特徴を持っている。また、上記2つの脂肪酸は、1つの分子中に水酸基とカルボキシル基とを持つため、エステル結合により重合させることにより高分子化させることが期待される。しかし、リシノレイン酸においては、環状ラクトン及び環状ラクチド等のような無水物を経由する開環重合となるのみである(非特許文献1)。更に、12−ヒドロキシステアリン酸についても高分子化が期待されているが、上記非特許文献1の記載内容から、12−ヒドロキシステアリン酸もリシノレイン酸と同様に無水物を経由する開環重合となるのみであることは、当業者においては当然理解されている。
また、一般的なヒドロキシ脂肪酸にみられるような重縮合でも、これらの脂肪酸では水酸基の反応性が低いこと、及びエステル交換反応がおきるため、他の共重合を形成させる成分を入れても重量平均分子量を2万以上に高分子化させることは困難である(特許文献1)。
【0005】
本発明は、上記の従来の問題を解決するためになされたものであり、12−ヒドロキシステアリン酸又はリシノレイン酸の水酸基を保持したままで高分子化した共重合体及びその製造方法を提供するものである。
【課題を解決するための手段】
【0006】
本発明は以下のとおりである。
1.12−ヒドロキシステアリン酸及びリシノレイン酸のいずれか一方のカルボン酸と炭素数2〜4の2価アルコールとによりエステルを製造するエステル製造工程と、上記エステルから上記2価アルコールを留去させながら、上記カルボン酸を重合させるカルボン酸オリゴマー製造工程と、を備えることを特徴とするカルボン酸オリゴマーの製造方法。
2.上記2価アルコールが1,2−プロパンジオールである上記1.に記載のカルボン酸オリゴマーの製造方法。
3.12−ヒドロキシステアリン酸及びリシノレイン酸のいずれか一方のカルボン酸と炭素数2〜4の2価アルコールとによりエステルを製造するエステル製造工程と、上記エステルから上記2価アルコールを留去させながら、上記カルボン酸を重合させるカルボン酸オリゴマー製造工程と、上記カルボン酸オリゴマーと下記一般式(3)に表されるジカルボン酸エステルオリゴマーとを重合させる重合工程と、を備えることを特徴とする共重合体の製造方法。
【化3】

〔但し、一般式(3)において、R4は炭素数1〜6の炭化水素基を示し、R3は炭素数2〜4の炭化水素基を示し、nは2以上の整数を示す。〕
4.上記2価アルコールが1,2−プロパンジオールである上記3.に記載の共重合体の製造方法。
5.下記一般式(1)で表される12−ヒドロキシステアリン酸オリゴマー又は下記一般式(2)で表されるリシノレイン酸オリゴマーと、下記一般式(3)で表されるジカルボン酸エステルオリゴマーとの重合により得られることを特徴とする共重合体。
【化1】

【化2】

【化3】

〔但し、一般式(1)、(2)及び(3)において、R1、R2及びR3は同一であっても、異なっていてもよく、炭素数2〜4の炭化水素基を示し、式(3)において、R4は炭素数1〜6の炭化水素基を示す。また、一般式(1)、(2)及び(3)において、l、m及びnは2以上の整数を示す。〕
6.上記R1、R2及びR3がプロピレン基である上記5.に記載の共重合体。
7.上記R4がビニレン基、エチレン基又はフェニレン基である上記5.又は上記6.に記載の共重合体。
8.上記l及びmが2〜10の整数である上記5.乃至上記7.のいずれかに記載の共重合体。
9.上記nが2〜5の整数である上記5.乃至上記8.のいずれかに記載の共重合体。
10.上記R1、R2及びR3がイソプロピレン基である上記5.乃至上記9.のいずれかに記載の共重合体。
【発明の効果】
【0007】
本発明のカルボン酸オリゴマーの製造方法によれば、12−ヒドロキシステアリン酸又はリシノレイン酸の水酸基を保持したままで、12−ヒドロキシステアリン酸又はリシノレイン酸から形成された高分子を提供することができる。
また、2価アルコールとして1,2−プロパンジオールを用いた場合、より効率的にカルボン酸オリゴマーを製造することができる。
更に、本発明の共重合体の製造方法によれば、12−ヒドロキシステアリン酸又はリシノレイン酸から形成された高分子について、重量平均分子量をより大きくした共重合体を提供することができる。
また、本発明の共重合体は、12−ヒドロキシステアリン酸オリゴマー又はリシノレイン酸オリゴマーと、ジカルボン酸エステルオリゴマーとの重合により得られる共重合体であるため、植物材料である12−ヒドロキシステアリン酸又はリシノレイン酸を構成成分とする共重合体を提供することができる。
また、本発明の共重合体における用途にあわせて、オリゴマーの平均分子量を調整し、共重合体を提供することができる。
また、ジカルボン酸エステルオリゴマーを形成する炭化水素基を選択することにより、共重合体の特性を設計することが可能であり、各種の用途に用いる共重合体を提供することができる。
また、12−ヒドロキシステアリン酸又はリシノレイン酸の水酸基を保持したままで高分子化した共重体を提供することができる。
【発明を実施するための最良の形態】
【0008】
以下、本発明を詳しく説明する。
〔1〕共重合体
本発明の共重合体は、下記一般式(1)で表される12−ヒドロキシステアリン酸オリゴマー又は下記一般式(2)で表されるリシノレイン酸オリゴマーと、下記一般式(3)で表されるジカルボン酸エステルオリゴマーとの重合により得られることを特徴とする。
【化1】

【化2】

【化3】

〔但し、一般式(1)、(2)及び(3)において、R1、R2及びR3は同一であっても、異なっていてもよく、炭素数2〜4の炭化水素基を示し、式(3)において、R4は炭素数1〜6の炭化水素基を示す。また、一般式(1)、(2)及び(3)において、l、m及びnは2以上の整数を示す。〕
【0009】
本発明の共重合体を形成する12−ヒドロキシステアリン酸オリゴマーは上記一般式(1)で表され、リシノレイン酸オリゴマーは上記一般式(2)で表される。
上記一般式(1)及び(2)において、R1及びR2は炭素数2〜4の炭化水素基であり、好ましくはプロピレン基であり、更に好ましくはイソプロピレン基である。但しR1は同一であっても、異なっていてもよく、R2は同一であっても、異なっていてもよい。
また、上記一般式(1)及び(2)において、l及びmは2以上の整数であり、好ましくは2〜10の整数であり、更に好ましくは3〜7の整数である。l及びmを2〜10とすることにより、高分子化反応の促進及び攪拌効率の点において優れる。
【0010】
上記12−ヒドロキシステアリン酸オリゴマー、又はリシノレイン酸オリゴマーは、12−ヒドロキシステアリン酸、又はリシノレイン酸と二価アルコールとからエステルを製造し、そのエステルから二価アルコールを脱落させながら重合して得られる。この重合方法は後述する。この12−ヒドロキシステアリン酸オリゴマー、又はリシノレイン酸オリゴマーの分子量(MwNMR)は、600〜3000が好ましく、より好ましくは900〜2000である。分子量が600〜3000であると、高分子化反応の促進及び攪拌効率の点において優れる。
尚、上記オリゴマーの分子量(MwNMR)は、Calculated Molecular Weightを意味し、以下の方法により、1H−NMRスペクトル測定におけるスペクトルの積分比より算出した分子量をいう(以下、同様)。
オリゴマー分子量であるMwNMRの算出方法は、以下の通りである。
(1)12−ヒドロキシステアリン酸オリゴマー又はリシノレイン酸オリゴマーについては、水酸基に隣接するメチンプロトンと末端の1,2−プロパンジオールのメチルプロトンの比から算出した。
(2)ジカルボン酸エステルオリゴマーについては、重合が起こった1,2−プロパンジオールのメチルプロトンと末端のメチルプロトンの比から算出した。
【0011】
本発明の共重合体を形成するジカルボン酸エステルオリゴマーは、上記一般式(3)で表され、ジカルボン酸ジエステルから形成されるオリゴマーである。
上記一般式(3)において、R3は、炭素数2〜4の炭化水素基であり、好ましくはプロピレン基であり、更に好ましくはイソプロピレン基である。但し、R3は同一であっても、異なっていてもよい。また、一般式(3)において、R4は炭素数1〜6の炭化水素基を示す。その中でもR4はビニレン基、エチレン基又はフェニレン基が好ましい。但し、R4は同一であっても、異なっていてもよい。
更に、上記一般式(3)において、nは2以上の整数であり、好ましくは、2〜5の整数であり、更に好ましくは2〜3の整数である。nを2〜5とすることにより、高分子化反応の促進及び攪拌効率の点において優れる。
【0012】
上記ジカルボン酸エステルオリゴマーは、ジカルボン酸ジエステルに対して、二価アルコールをエステル交換することにより2つの水酸基を有するジカルボン酸ジヒドロキシジエステルを製造し、そのジカルボン酸ジヒドロキシジエステルを重合することにより得られる。この重合方法は後述する。このジカルボン酸エステルオリゴマーの分子量(MwNMR)は、200〜3000が好ましく、より好ましくは900〜2000である。分子量(MwNMR)が200〜3000であると、高分子化反応の促進及び攪拌効率の点において優れる。
【0013】
上記ジカルボン酸ジエステルを形成するジカルボン酸としては、フタル酸、イソフタル酸、テレフタル酸等の芳香族ジカルボン酸;マロン酸、コハク酸、グルタル酸、アジピン酸、ピメリン酸、スベリン酸等の脂肪族飽和ジカルボン酸;マレイン酸、フマル酸、イタコン酸、メサコン酸、シトラコン酸、グルタコン酸、アリルマロン酸、ムコン酸等の脂肪族不飽和ジカルボン酸が挙げられる。これらは、1種類単独であるいは2種類以上を組み合わせて用いることができる。その中でも、テレフタル酸、フマル酸及びコハク酸が好ましい。
また、上記ジカルボン酸ジエステルを形成するアルコールとしては、メタノール、エタノール、プロパノール、イソプロパノール、n−ブタノール、イソブチルアルコール等が挙げられる。これらは、1種類単独であるいは2種類以上を組み合わせて用いることができる。その中でもメタノール及びエタノールが好ましい。
尚、上記ジカルボン酸ジエステルは、ジカルボン酸ジメチル、ジカルボン酸ジエチルが好ましく、具体的にはテレフタル酸ジエチル、フマル酸ジエチル、コハク酸ジエチルがより好ましい。
【0014】
上記ジカルボン酸ジヒドロキシジエステルの製造に用いるアルコールは二価アルコールが好ましい。この二価アルコールとしては、1,2−プロパンジオール、1,3−プロパンジオール、エチレングリコール、1,2−ブタンジオール及び1,3−ブタンジオール等が挙げられる。これらは、1種類単独であるいは2種類以上を組み合わせて用いることができる。その中でも、1,2−プロパンジオールがより好ましい。
【0015】
本発明の共重合体における12−ヒドロキシステアリン酸オリゴマー又はリシノレイン酸オリゴマーと、ジカルボン酸エステルオリゴマーとの配合割合は、特に限定されないが、12−ヒドロキシステアリン酸オリゴマー又はリシノレイン酸オリゴマーとジカルボン酸エステルオリゴマーとの配合割合は質量比において5:95〜90:10、より好ましくは5:95〜70:30、更に好ましくは10:90〜50:50である。
配合割合は、共重合体を用いる用途により選択できる。即ち、12−ヒドロキシステアリン酸オリゴマー又はリシノレイン酸オリゴマーの配合量を高くすると、同一条件での製造工程においては、共重合体の重量平均分子量(Mw)が高くなる。更に、12−ヒドロキシステアリン酸オリゴマー又はリシノレイン酸オリゴマーの配合量を高くすると共重合体のガラス転移温度(Tg)が高くなる。
【0016】
上記共重合体の重量平均分子量(Mw)は特に限定されず、上記共重合体の用途により重量平均分子量を選択することができる。
但し、本発明の共重合体は、12−ヒドロキシステアリン酸オリゴマー又はリシノレイン酸オリゴマーを重合体構成オリゴマー単位とし、重量平均分子量(Mw)が20,000以上の共重合体とすることができる。
尚、共重合体の重量平均分子量(Mw)の測定条件は、ゲルパーミエーションクロマトグラフィー(GPC)により下記測定条件で測定した(以下、同様)。
(1)装置 ; 「LC−VPシリーズ」(株式会社島津製作所製)
(1)カラム ; 「Shodex K−806M」
(2)カラム温度; 30℃
(3)溶解液 ; クロロホルム
(4)検出器 ; RI
(5)検出器温度; 30℃
(6)標準物質 ; ポリスチレン
【0017】
上記高分子(共重合体)のガラス転移温度(Tg)は、本発明の共重合体の用途によって選択することができる。
尚、上記高分子のガラス転移温度(Tg)は、JIS−K−7121に準拠し、示査走査熱量計(DSC)「WS−002N」(株式会社マックサイエンス社製)により、ガラス転移温度を測定した(以下、同様)。
【0018】
本発明の共重合体の用途は、特に限定さないが、各種潤滑油、加工油、一般樹脂等の材料、充填用、癒着防止膜用、細胞接着用等の医療用材料、並びに塗料用、シーラント用等の添加剤などが挙げられる。例えば、本発明の共重合体は、ジカルボン酸エステルオリゴマーを形成する炭化水素基の選択等により、共重合体の特性を選択し、各種の用途に用いることができる。即ち、上記一般式(3)におけるR4にビニレン基等のエチレン系二重結合を備えた場合、更に、重合が形成されることにより共重合体は3次元構造を形成し、共重合体は硬化していく。例えば、そのように3次元構造を形成された共重合体は塗料等に用いることができる。
【0019】
本発明の共重合体は下記一般式(4)の反復単位、及び下記一般式(5)の反復単位のいずれか一方と、下記一般式(6)の反復単位と、を有する。
【化4】

【化5】

【化6】

〔但し、一般式(6)において、R3は炭素数2〜4の炭化水素基を示し、R4は炭素数1〜6の炭化水素基を示す。〕
【0020】
上記一般式(4)の反復単位は、12−ヒドロキシステアリン酸から形成された反復単位であり、上記一般式(5)は、リシノレイン酸から形成された反復単位である。本発明の共重合体は、上記一般式(4)の反復単位及び上記一般式(5)の反復単位のいずれか一方を有している。
上記共重合体における(4)又は(5)の含有量は、特に限定されないが、共重合体全量を100質量%とした場合、好ましくは5〜90質量%であり、より好ましくは5〜70質量%であり、更に好ましくは10〜50重量%である。
【0021】
上記一般式(6)の反復単位は、ジカルボン酸ジエステルから形成された反復単位である。その一般式(6)の反復単位は、ジカルボン酸ジエステルに対して、二価アルコールをエステル交換することにより2つの水酸基を有するジカルボン酸ジヒドロキシジエステルを製造し、そのジカルボン酸ジヒドロキシジエステルを重合することにより形成される。その二価アルコールとしては、1,2−プロパンジオール、1,3−プロパンジオール、エチレングリコール、1,2−ブタンジオール及び1,3−ブタンジオール等が挙げられる。これらは、1種類単独であるいは2種類以上を組み合わせて用いることができる。その中でも、1,2−プロパンジオールがより好ましい。
【0022】
上記一般式(6)において、R3は炭素数2〜4の炭化水素基を示す。その中でもR3はプロピレン基が好ましく、イソプロピレン基がより好ましい。
また、R4は炭素数1〜6の炭化水素基を示す。その中でもR4はビニレン基、エチレン基又はフェニレン基が好ましい。
また、上記一般式(6)の反復単位は、ジカルボン酸ジエステルから形成されるが、そのジカルボン酸ジエステルを形成するジカルボン酸としては、フタル酸、イソフタル酸、テレフタル酸等の芳香族ジカルボン酸;マロン酸、コハク酸、グルタル酸、アジピン酸、ピメリン酸、スベリン酸等の脂肪族飽和ジカルボン酸;マレイン酸、フマル酸、イタコン酸、メサコン酸、シトラコン酸、グルタコン酸、アリルマロン酸、ムコン酸等の脂肪族不飽和ジカルボン酸が挙げられる。これらは、1種類単独であるいは2種類以上を組み合わせて用いることができる。その中でも、テレフタル酸及びフマル酸並びにコハク酸が好ましい。
また、上記ジカルボン酸ジエステルを形成するアルコールとしては、メタノール、エタノール、プロパノール、イソプロパノール、n−ブタノール、イソブチルアルコール等が挙げられる。これらは、1種類単独であるいは2種類以上を組み合わせて用いることができる。その中でもメタノール及びエタノールが好ましい。
尚、上記ジカルボン酸ジエステルは、ジカルボン酸ジメチル、ジカルボン酸ジエチルが好ましく、具体的にはテレフタル酸ジエチル、フマル酸ジエチル、コハク酸ジエチルがより好ましい。
【0023】
上記共重合体における(6)の含有量は、特に限定されないが、共重合体全量を100質量%とした場合、好ましくは10〜95質量%であり、より好ましくは30〜95質量%であり、更に好ましくは50〜90重量%である。
【0024】
〔2〕カルボン酸オリゴマーの製造方法
本発明のカルボン酸オリゴマーの製造方法は、12−ヒドロキシステアリン酸及びリシノレイン酸のいずれか一方のカルボン酸と炭素数2〜4の2価アルコールとによりエステルを製造するエステル製造工程と、上記エステルから上記2価アルコールを留去させながら、上記カルボン酸を重合させるカルボン酸オリゴマー製造工程と、を備える。
下記式(7)又は(8)に示すように12−ヒドロキシステアリン酸又はリシノレイン酸と二価アルコールとにより、水酸基を2個有するカルボン酸エステルを製造し、その後、そのカルボン酸エステルを下記式(9)又は(10)に示すように重合させることにより、12−ヒドロキシステアリン酸オリゴマー又はリシノレイン酸オリゴマー(以下、「カルボン酸オリゴマー」と略記する。)を製造する。尚、式(7)及び(9)はオリゴマーを形成するカルボン酸が12−ヒドロキシステアリン酸による場合のものであり、式(8)及び(10)はオリゴマーを形成するカルボン酸がリシノレイン酸による場合のものである。
【化7】

【化8】

【化9】

【化10】

〔但し、式(7)及び(9)において、R1は炭素数2〜4の炭化水素基を示し、式(8)及び(10)において、R2は炭素数2〜4の炭化水素基を示し、式(9)において、lは2以上の整数を示し、式(10)において、mは2以上の整数を示す。〕
【0025】
12−ヒドロキシステアリン酸又はリシノレイン酸と反応させる上記二価アルコールとしては、1,2−プロパンジオール、1,3−プロパンジオール、エチレングリコール、1,2−ブタンジオール及び1,3−ブタンジオール等が挙げられる。これらは、1種類単独であるいは2種類以上を組み合わせて用いることができる。その中でも1,2−プロパンジオールが好ましい。オリゴマー形成の際にアルコールを留去しながら重合させるため、低分子量の二価アルコールが好ましい。
【0026】
エステル製造に用いられる溶媒としては、エステル化反応に不活性な溶媒であれば非極性溶媒であっても極性溶媒であっても特に限定されない。例えば、ヘキサン、ヘプタン、オクタン等のアルカン類;塩化メチレン、クロロホルム、四塩化炭素、塩化エチレン等のハロアルカン類;ベンゼン、トルエン、キシレン、メシチレン、ペンタメチルベンゼン等のベンゼン類;クロルベンゼン、ブロムベンゼン等のハロベンゼン類;ジエチルエーテル、アニソール等のエーテル類;が挙げられる。その中でも、非極性溶媒であるトルエン、キシレン及びメシチレンが好ましい。尚、上記エステル製造は、無溶媒であっても進行する。
上記溶媒の使用量は、その種類及びエステル製造条件等により異なるが、上記12−ヒドロキシステアリン酸又はリシノレイン酸100質量部に対して、通常、100〜1000質量部である。
【0027】
エステル製造に用いられる触媒としては強酸触媒が好ましい。この強酸触媒としては、硫酸、メタンスルホン酸、パラトルエンスルホン酸、タングストリン酸、タングストケイ酸、モリブドリン酸、モリブドケイ酸、三フッ化ホウ素エチラート、四塩化スズ等が挙げられる。
上記触媒の使用量は、その種類及びエステル製造条件等により異なるが、上記12−ヒドロキシステアリン酸又はリシノレイン酸100質量部に対して、通常、0.1〜10質量部である。
【0028】
エステル製造の反応温度は、触媒の種類等により異なるが、通常、40〜180℃、好ましくは50〜150℃、より好ましくは60〜130℃の範囲から選択される。
また、上記反応は、大気雰囲気下(常圧)で行われ、反応時間は、反応温度及等により異なるが、通常、大気雰囲気下で、10〜40時間である。
【0029】
上記エステル製造工程により得られた12−ヒドロキシステアリン酸又はリシノレイン酸と二価アルコールとのエステル(以下、「カルボン酸エステル」と略記する。)を重合させることにより、12−ヒドロキシステアリン酸オリゴマー又はリシノレイン酸オリゴマー(以下、「カルボン酸オリゴマー」と略記する。)を製造する。
上記カルボン酸エステルからカルボン酸オリゴマーへの重合は、カルボン酸エステルを形成している二価アルコールを脱落させながら、カルボン酸エステルを形成しているカルボン酸を重合させることによる。つまり、上記カルボン酸オリゴマーは、上記カルボン酸エステルから二価アルコールを留去させながら、カルボン酸を重合されることにより得られる。
【0030】
上記カルボン酸オリゴマーへの重合は、通常、オルトチタン酸テトラ−n−ブチル等の有機金属触媒が使用される。
重合温度は、触媒の種類等により異なるが、通常、100〜200℃、好ましくは120〜180℃の範囲から選択される。
また、重合は、通常、減圧条件下で行われ、減圧する場合の圧力は、0.1〜2.0mmHgの範囲から選択される。
重合時間は、重合温度及び減圧条件等により異なるが、通常、0.3mmHgの減圧下で、3〜50時間である。この重合時間等により得られるカルボン酸オリゴマーの平均分子量を変化させることができる。
【0031】
尚、上記のカルボン酸オリゴマーの製造方法において、リシノレイン酸と12−ヒドロキシステアリン酸との混合物を用いることもできる。リシノレイン酸及び12−ヒドロキシステアリン酸は、共にヒマシ油誘導体であり、この2種のカルボン酸は炭素数が全く同じ18であり、2個の水酸基を全く同様に有していることから、上記2種のカルボン酸は同作用を有し、上記のカルボン酸オリゴマーの製造方法において上記2種のカルボン酸混合物を用いることもできる。
また、上記混合物を用いた場合、リシノレイン酸及び12−ヒドロキシステアリン酸がランダムに重合され、その製造されるカルボン酸オリゴマーの構成単位を形成するカルボン酸は、リシノレイン酸及び12−ヒドロキシステアリン酸から選ばれる少なくとも1種のカルボン酸となる。
また、ヒマシ油を加水分解して得られるリシノレイン酸含有ヒマシ油誘導体組成物を上記のカルボン酸オリゴマーの製造方法に用いて、リシノレイン酸オリゴマーを製造することもできる。この場合、ヒマシ油誘導体組成物におけるリシノレイン酸の含有量は、ヒマシ油誘導体組成物全体を100重量%として、85〜100重量%が好ましく、90重量%以上がより好ましく、95重量%が更に好ましい。この範囲とすることで、リシノレイン酸以外の脂肪酸及びその他の組成物により生じる恐れがある反応阻害を免れることができる。
更に、上記リシノール酸含有ヒマシ油誘導体組成物に水素を添加することにより得られる12−ヒドロキシステアリン酸含有ヒマシ油誘導体組成物を用いて、12−ヒドロキシステアリン酸オリゴマーを製造することもできる。この場合、ヒマシ油誘導体組成物における12−ヒドロキシステアリン酸の含有量は、ヒマシ油誘導体組成物全体を100重量%として、85〜100重量%が好ましく、90重量%以上がより好ましく、95重量%が更に好ましい。この範囲とすることで、12−ヒドロキシステアリン酸以外の脂肪酸及びその他の組成物により生じる恐れがある重合反応での反応阻害を免れることができる。
【0032】
〔3〕共重合体の製造方法
本発明の共重合体の製造方法は、12−ヒドロキシステアリン酸及びリシノレイン酸のいずれか一方のカルボン酸と炭素数2〜4の二価アルコールとによりエステルを製造するエステル製造工程と、上記エステルから上記二価アルコールを留去させながら、上記カルボン酸を重合させるカルボン酸オリゴマー製造工程と、上記カルボン酸オリゴマーと下記一般式(3)に表されるジカルボン酸エステルオリゴマーとを重合させる重合工程と、を備えることを特徴とする。
【化3】

〔但し、一般式(3)において、R3は炭素数2〜4の炭化水素基を示し、R4は炭素数1〜6の炭化水素基を示し、nは2以上の整数を示す。〕
尚、上記共重合体の製造方法は、上述のカルボン酸オリゴマー製造方法に対して、更に
そのカルボン酸オリゴマー製造方法により得られたカルボン酸オリゴマーと、上記一般式(3)に表されるジカルボン酸エステルオリゴマーと、を重合させる重合工程とを備えるものである。
また、上記の製造方法により本発明の共重合体を製造することができる。
(1)ジカルボン酸エステルオリゴマーの製造方法
下記式(11)に示すようにジカルボン酸ジエステルを二価アルコールとのエステル交換反応により、2つの水酸基を有するジカルボン酸ジヒドロキシジエステルを製造し、その後、そのジカルボン酸ジヒドロキシジエステルを下記式(12)に示すように重合させることにより、ジカルボン酸エステルオリゴマーを製造する。
【化11】

【化12】

〔但し、式(11)及び(12)において、R3は炭素数2〜4の炭化水素基を示し、R4は炭素数1〜6の炭化水素基を示し、式(12)において、nは2以上の整数を示す。〕
【0033】
上記一般式(11)及び(12)において、R4は炭素数1〜6の炭化水素基を示す。その中でもR4はビニレン基、エチレン基又はフェニレン基が好ましい。
また、上記ジカルボン酸ジエステルを形成するジカルボン酸としては、フタル酸、イソフタル酸、テレフタル酸等の芳香族ジカルボン酸;マロン酸、コハク酸、グルタル酸、アジピン酸、ピメリン酸、スベリン酸等の脂肪族飽和ジカルボン酸;マレイン酸、フマル酸、イタコン酸、メサコン酸、シトラコン酸、グルタコン酸、アリルマロン酸、ムコン酸等の脂肪族不飽和ジカルボン酸が挙げられる。これらは、1種類単独であるいは2種類以上を組み合わせて用いることができる。その中でもテレフタル酸、フマル酸及びコハク酸が好ましい。
【0034】
上記ジカルボン酸ジエステルを形成するアルコールとしては、メタノール、エタノール、プロパノール、イソプロパノール、n−ブタノール、イソブチルアルコール等が挙げられる。これらは、1種類単独であるいは2種類以上を組み合わせて用いることができる。その中でもメタノール及びエタノールが好ましい。
尚、上記ジカルボン酸ジエステルは、ジカルボン酸ジメチル、ジカルボン酸ジエチルが好ましく、具体的にはテレフタル酸ジエチル、フマル酸ジエチル、コハク酸ジエチルがより好ましい。
【0035】
上記一般式(11)及び(12)において、R3は炭素数2〜4の炭化水素基を示す。その中でもR3はプロピレン基が好ましく、イソプロピレン基がより好ましい。
上記ジカルボン酸ジエステルとエステル交換に用いる上記二価アルコールとしては、1,2−プロパンジオール、1,3−プロパンジオール、エチレングリコール、1,2−ブタンジオール及び1,3−ブタンジオール等が挙げられる。これらは、1種類単独であるいは2種類以上を組み合わせて用いることができる。その中でも1,2−プロパンジオールが好ましい。
【0036】
上記エステル交換反応には触媒を用いることができる。エステル交換反応に使用する触媒は、ハロゲン化金属化合物が好ましく、このハロゲン化金属化合物としては、塩化マグネシウム、塩化亜鉛、塩化カルシウム、三塩化アンチモン、五塩化アンチモン、三ヨウ化リン、三塩化リン、三臭化リン、五塩化リン、四塩化スズ、四臭化スズ、四ヨウ化チタン、四塩化チタン、六塩化タングステン、ヨウ化マグネシウム(II)無水物、ペンタカルボニル臭化マンガン、過塩素酸マンガン(II)・6水和物、塩化マンガン(II)無水物、塩化マンガン(II)・4水和物、臭化マンガン(II) 無水物、臭化マンガン(II)・4水和物、ペンタカルボニル塩化レニウム、ペンタカルボニル臭化レニウム、塩化レニウム(III)及び塩化レニウム(V)などが挙げられる。これらは、1種類単独であるいは2種類以上を組み合わせて用いることができる。その中でも、塩化亜鉛がより好ましい。
上記触媒の使用量は、その種類及びエステル交換反応の条件等により異なるが、上記ジカルボン酸ジエステルと上記二価アルコールとの総量に対して、通常、0.1〜0.5質量%である。
【0037】
上記エステル交換反応における反応は、通常、常圧において、窒素雰囲気下で行われる。上記反応温度は、触媒の種類等により異なるが、通常、100〜300℃、好ましくは150〜250℃の範囲から選択される。
また反応時間は、反応温度等により異なるが、通常、1〜10時間、好ましくは3〜5時間である。
上記反応条件とすることでエステル交換反応を効果的に行うことができる。
【0038】
上記ジカルボン酸エステルオリゴマーは上記ジカルボン酸ジヒドロキシジエステルを重合して得られる。
上記ジカルボン酸ジヒドロキシジエステルからジカルボン酸エステルオリゴマーへの重合は、ジカルボン酸ジヒドロキシジエステルを形成している2個の二価アルコールの内の1個を脱落させながら、ジカルボン酸ジヒドロキシジエステルを形成しているジカルボン酸エステルを重合させることによる。つまり、上記ジカルボン酸エステルオリゴマーは、上記ジカルボン酸ジヒドロキシジエステルから二価アルコールを留去させながら、ジカルボン酸エステルを重合されることにより得られる。
【0039】
上記ジカルボン酸エステルオリゴマーへの重合は、上記エステル交換に用いた触媒をそのまま使用することができる。
上記重合は、通常、減圧条件下で行われ、減圧する場合の圧力は、好ましくは0.1〜2.0mmHgの範囲から選択される。
重合温度は、減圧条件等により異なるが、通常、80〜150℃、好ましくは90〜110℃の範囲から選択される。
重合時間は、減圧条件及び重合温度等により異なるが、通常、0.3mmHgの減圧下で、4〜24時間である。
上記重合条件とすることで、効率的に、二価アルコールを留去させながら、ジカルボン酸エステルオリゴマーへの重合を行うことができる。
【0040】
(2)12−ヒドロキシステアリン酸オリゴマー又はリシノレイン酸オリゴマーとジカルボン酸エステルオリゴマーとの重合
下記式(13)に示すように上記12−ヒドロキシステアリン酸オリゴマー又は上記リシノレイン酸オリゴマーと上記ジカルボン酸エステルオリゴマーとを重合させる。そして、それにより、本発明の共重合体を得ることができる。尚、反応式(13)は12−ヒドロキシステアリン酸オリゴマーを用いた場合の例であるが、リシノレイン酸オリゴマーを用いた場合も同様のスキームである。
【化13】

〔但し、式(13)において、R1及びR3は炭素数2〜4の炭化水素基を示し、R4は炭素数1〜6の炭化水素基を示し、l及びnは2以上の整数を示し、aはl以下の2以上の整数を示し、bはn以下の2以上の整数を示し、cはl以下の0又は1以上の整数を示し、dはn以下の0又は1以上の整数を示す。〕
上記共重合体は、上記12−ヒドロキシステアリン酸オリゴマー又はリシノレイン酸オリゴマー、とジカルボン酸エステルオリゴマーとから二価アルコールを留去(除去)させながら重合されることにより得られる。
上記12−ヒドロキシステアリン酸オリゴマー及びリシノレイン酸オリゴマーは、一方にヒドロキシアルキル基及び他方にヒドロキシル基を有している。また、ジカルボン酸エステルオリゴマーは両末端にヒドロキシアルキル基を有している。一方のオリゴマーのヒドロキシアルキレン基と他方のオリゴマーのヒドロキシル基(又はヒドロキシアルキル基のヒドロキシル基部分)とから二価アルコールが脱離して、オリゴマーの縮合により上記共重合体が得られる。即ち、上記12−ヒドロキシステアリン酸オリゴマー又はリシノレイン酸オリゴマーとジカルボン酸エステルオリゴマーとの重合は、上記12−ヒドロキシステアリン酸オリゴマー、リシノレイン酸オリゴマー、及びジカルボン酸エステルオリゴマーの末端において形成されている二価アルコール残基を脱落させながら、上記オリゴマーを重合させることによる。
尚、上記重合においては、エステル交換反応も起きることがある。この場合は、ランダムなポリマーとなるが、構造的にはポリエステルである。
【0041】
上記オリゴマー同士の重合には、三酸化アンチモン、四酸化アンチモン,五酸化アンチモンまたはアンチモン酸ソーダ等のアンチモン系化合物を用いることが好ましい。上記触媒の使用量は、その種類及びエステル重合反応の条件等により異なるが、上記12−ヒドロキシステアリン酸オリゴマー又はリシノレイン酸オリゴマーと上記ジカルボン酸エステルオリゴマーとの総量に対して、通常、0.1〜0.5質量%である。
【0042】
また、上記オリゴマー同士の重合は、常圧条件下の第一工程と減圧条件下の第二工程との2つの工程を備えることが好ましい。
上記第一工程は、乾燥した窒素を積極的に吹き込み、窒素雰囲気下で行われる。反応温度は、触媒の種類等により異なるが、通常、80〜100℃、好ましくは90〜100℃の範囲から選択される。また反応時間は、通常、10分〜1時間、好ましくは20〜40分である。即ち、この第一工程では反応系から水を追い出すと共に、反応の初期は二価アルコールの留出が多いことから上記条件で反応を行うことが好ましい。
上記第一工程の後、徐々に温度を上げ、次に窒素の流入を止めた後、減圧していく。
第二工程の、圧力は0.1〜2.0mmHgの範囲から選択され、また、反応時間は10〜100時間の範囲から選択され、並びに反応温度は100〜200℃の範囲から選択されることが好ましい。即ち、この第二工程で共重合体への重合を進め、分子量を高めて高分子量化していく。
【0043】
上記オリゴマー同士の重合における12−ヒドロキシステアリン酸オリゴマー又はリシノレイン酸オリゴマーと、ジカルボン酸エステルオリゴマーとの配合割合は、特に限定されないが、12−ヒドロキシステアリン酸オリゴマー又はリシノレイン酸オリゴマーとジカルボン酸エステルオリゴマーとの配合割合は質量比において5:95〜90:10、より好ましくは5:95〜70:30、更に好ましくは10:90〜50:50である。配合割合は、共重合体を用いる用途により選択できる。
尚、上記共重合体の製造において、12−ヒドロキシステアリン酸とリシノレイン酸との混合物から製造されるカルボン酸オリゴマーを用いることもできる。その場合の製造条件及びスキーム等は上述の場合と全く同様である。
【実施例】
【0044】
以下、本発明を実施例により具体的に説明する。
〔1〕実施例1
12−ヒドロキシステアリン酸オリゴマー(A1〜A3)の製造
(1)12−ヒドロキシステアリン酸オリゴマー(A1)の製造
12−ヒドロキシステアリン酸30gと、1,2−プロパンジオール18gとを無水トルエン200mlに溶解し、次いで、触媒としてp−トルエンスルホン酸0.15gを添加し、200mlナス型フラスコ中にて110℃にて、20時間還流を行なった。
上記還流工程の後、その反応液を0.05モルの炭酸水素ナトリウム溶液で洗浄した後、無水硫酸マグネシウムで乾燥し、溶媒及び未反応の1,2−プロパンジオールを減圧下で留去させた。
その後、触媒としてオルトチタン酸テトラ−n−ブチル0.5重量%を反応物0.5mlに加え、温度150℃及び0.3mmHgの減圧条件下で攪拌しながら、1,2−プロパンジオールを除去しながら再び反応させ、5時間後に12−ヒドロキシステアリン酸オリゴマーの固形物(A1)〔分子量(MwNMR)=920〕を得た。尚、実施例1における重合反応時間及び分子量(MwNMR)を表1に示す。
【0045】
【表1】

【0046】
(2)12−ヒドロキシステアリン酸オリゴマー(A2)の製造
減圧下の重合反応時間を5時間から7時間に変更した以外は、上記(1)の(A1)の製造方法と同様にして、12−ヒドロキシステアリン酸オリゴマーの固形物(A2)を得た。
尚、12−ヒドロキシステアリン酸オリゴマーの固形物(A2)における重合反応時間及び分子量(MwNMR)を表1に併記する。
【0047】
(3)12−ヒドロキシステアリン酸オリゴマー(A3)の製造
上記減圧下の重合反応時間を5時間から10時間に変更した以外は、上記(1)の(A1)の製造方法と同様にして、12−ヒドロキシステアリン酸オリゴマーの固形物(A3)を得た。
尚、12−ヒドロキシステアリン酸オリゴマーの固形物(A3)における重合反応時間及び分子量(MwNMR)を表1に併記する。
【0048】
〔2〕実施例2
リシノレイン酸オリゴマー(B1〜B3)の製造
(1)リシノレイン酸オリゴマー(B1)の製造
実施例1での(1)12−ヒドロキシステアリン酸オリゴマー(A1)の製造方法における12−ヒドロキシステアリン酸の替わりにリシノレイン酸を用いた以外は、実施例1における(1)12−ヒドロキシステアリン酸オリゴマー(A1)の製造方法と同様にして、リシノレイン酸オリゴマーの固形物(B1)〔分子量(MwNMR)=870〕を得た。尚、実施例2における重合反応時間及び分子量(MwNMR)を表2に示す。
【0049】
【表2】

【0050】
(2)リシノレイン酸オリゴマー(B2)の製造
減圧下の重合反応時間を5時間から7時間に変更した以外は、上記(1)の(B1)の製造方法と同様にして、リシノレイン酸オリゴマーの固形物(B2)を得た。
尚、リシノレイン酸オリゴマーの固形物(B2)における重合反応時間及び分子量(MwNMR)を表2に併記する。
【0051】
(3)リシノレイン酸オリゴマー(B3)の製造
減圧下の重合反応時間を5時間から10時間に変更した以外は、上記(1)の(B1)の製造方法と同様にして、リシノレイン酸オリゴマーの固形物(B3)を得た。
尚、リシノレイン酸オリゴマーの固形物(B3)における重合反応時間及び分子量(MwNMR)を表2に併記する。
【0052】
〔3〕実施例3
12−ヒドロキシステアリン酸オリゴマー又はリシノレイン酸オリゴマーに共重合させるオリゴマー(ジカルボン酸エステルオリゴマー)の製造
(1)イソプロピレンテレフタレートオリゴマー(以下、「テレフタル酸オリゴマー」ともいう。)(C)の製造
テレフタル酸ジエチル2.22g(0.01モル)と1,2−プロパンジオール2.28g(0.03モル)とに、触媒として塩化亜鉛0.1〜0.5質量%(テレフタル酸ジエチル及び1,2−プロパンジオールの総質量%を100%として)を加え、窒素雰囲気下で、195℃において4時間、攪拌しながら反応させた後、
反応容器内を0.3mmHgに減圧し、温度を100℃として、更に、攪拌しながら反応させることによりテレフタル酸オリゴマー(C)を製造した。そして、上記減圧下での反応時間として8時間行ったテレフタル酸オリゴマー(C1)〔分子量(MwNMR)=690〕、及び4時間行ったテレフタル酸オリゴマー(C2)〔分子量(MwNMR)=490〕を得た。
尚、化学構造はNMRスペクトルの測定により確認した。
【0053】
(2)イソプロピレンフマレートオリゴマー(以下、「フマル酸オリゴマー」ともいう)(D)の製造
フマル酸ジエチル1.72g(0.01モル)及び1,2−プロパンジオール2.28g(0.03モル)に、触媒として塩化亜鉛0.1〜0.5質量%(フマル酸ジエチル及び1,2−プロパンジオールの総質量%を100%として)加え、窒素雰囲気下、150℃で4時間、攪拌しながら反応させた。
その後、反応容器内を0.3mmHgに減圧し、温度を80℃として、更に、攪拌しながら反応させることによりフマル酸オリゴマー(D)を製造した。そして、上記減圧下での反応時間として8時間行ったフマル酸オリゴマー(D1)〔分子量(MwNMR)=1000〕、及び4時間行ったフマル酸オリゴマー(D2)〔分子量(MwNMR)=400〕を得た。
尚、化学構造はNMRスペクトルの測定により確認した。
また、フマル酸オリゴマーの上記製造方法において、フマル酸が有する二重結合同士による架橋を防止するため、1−4ベンゾキノンを0.5重量%加えることもできる。
【0054】
(3)イソプロピレンサクシネートオリゴマー(以下、「コハク酸オリゴマー」ともいう)(E)の製造
コハク酸ジエチル1.74g(0.01モル)及び1,2−プロパンジオール2.28g(0.03モル)に、触媒として塩化亜鉛を0.1〜0.5質量%(コハク酸ジエチル及び1,2−プロパンジオールの総質量%を100%として)加え、窒素雰囲気下、150℃で4時間、攪拌しながら反応させた。
その後、反応容器内を0.3mmHgに減圧し、温度を80℃として、更に、攪拌しながら反応させることによりコハク酸オリゴマー(E)を製造した。そして、上記減圧下での反応時間として10時間行ったコハク酸オリゴマー(E1)〔分子量(MwNMR)=1150〕、8時間行ったコハク酸オリゴマー(E2)〔分子量(MwNMR)=1050〕、4時間行ったコハク酸オリゴマー(E3)〔分子量(MwNMR)=450〕、及び4時間行ったコハク酸オリゴマー(E4)〔分子量(MwNMR)=410〕を得た。
【0055】
〔4〕実施例4
12−ヒドロキシステアリン酸オリゴマー(A)とテレフタル酸オリゴマー(C)との共重合体(F1〜F5)の製造
実施例1で製造した12−ヒドロキシステアリン酸オリゴマー(A1、A2及びA3)と実施例3で製造したテレフタル酸オリゴマー(C1及びC2)とを表3に記載の配合オリゴマー及び配合割合で、窒素雰囲気下で混合し、触媒として三酸化アンチモンを0.1〜0.5質量%(12−ヒドロキシステアリン酸オリゴマー及びテレフタル酸オリゴマーの総質量%を100%として)加え、100℃で30間、攪拌しながら反応させた。
その後、反応温度を徐々に温度を上げ、次に窒素の流入を止めた後、減圧した。反応容器内を0.3mmHgの減圧条件、及び温度を160℃とし、表3に記載の反応時間により重合を行い、共重合体(F1〜F5)を得た。
尚、実施例4における共重合体の重量平均分子量(Mw)、多分散度(Mw/Mn)及び共重合体のガラス転移温度(Tg)を表3に併記する。
また、共重合体F1〜F5のDSC測定結果を図1に示す。
更に、共重合体を重クロロホルムにて溶解して、NMR装置「UNITY INOVA 400」(バリアン テクノロジー ジャパン リミテッド製)を用いて、測定周波数400MHzにおいてプロトンNMR測定を行ない、得られたスペクトルから各成分の存在比を算出した。共重合体F1の1H−NMRスペクトルの測定結果を図2に示す。
【0056】
【表3】

【0057】
〔5〕実施例5
12−ヒドロキシステアリン酸オリゴマー(A)とフマル酸オリゴマー(D)との共重合体(G1〜G4)の製造
実施例4におけるテレフタル酸オリゴマー(C1及びC2)にかえて、フマル酸オリゴマー(D1及びD2)を用いた以外は、実施例4と同様にして、共重合体(G1〜G4)を得た。
尚、12−ヒドロキシステアリン酸オリゴマー(A)とフマル酸オリゴマー(D)との配合割合、減圧条件下での反応時間、実施例5における共重合体の重量平均分子量(Mw)、多分散度(Mw/Mn)及び共重合体のガラス転移温度(Tg)を表4に示す。
また、共重合体(G1〜G4)のDSC測定結果を図3に示し、実施例4と同様に測定した共重合体G1の1H−NMRスペクトルの測定結果を図4に示す。
【0058】
【表4】

【0059】
〔6〕実施例6
12−ヒドロキシステアリン酸オリゴマー(A)とコハク酸オリゴマー(E)との共重合体(H1〜H5)の製造
実施例4におけるテレフタル酸オリゴマー(C1及びC2)にかえて、コハク酸オリゴマー(E1〜E4)を用いた以外は、実施例4と同様にして、共重合体(H1〜H4)を得た。
尚、12−ヒドロキシステアリン酸オリゴマー(A)とコハク酸オリゴマー(E)との配合割合、減圧条件下での反応時間、実施例6における共重合体の重量平均分子量(Mw)、多分散度(Mw/Mn)及び共重合体のガラス転移温度(Tg)を表5に示す。
【0060】
【表5】

【0061】
〔7〕実施例7
リシノレイン酸オリゴマー(B)とテレフタル酸オリゴマー(C)との共重合体(I1〜I5)の製造
実施例4における12−ヒドロキシステアリン酸オリゴマー(A1、A2及びA3)にかえて、リシノレイン酸オリゴマー(B1,B2及びB3)を用いた以外は、実施例4と同様にして、共重合体(I1〜I5)を得た。
尚、リシノレイン酸オリゴマー(B)とテレフタル酸オリゴマー(C)との配合割合、減圧条件下での反応時間、実施例7における共重合体の重量平均分子量(Mw)、多分散度(Mw/Mn)及び共重合体のガラス転移温度(Tg)を表6に示す。
【0062】
【表6】

【0063】
〔8〕実施例8
リシノレイン酸オリゴマー(B)とフマル酸オリゴマー(D)との共重合体(J1〜J4)の製造
実施例7におけるテレフタル酸オリゴマー(C1及びC2)にかえて、フマル酸オリゴマー(D1及びD2)を用いた以外は、実施例7と同様にして、共重合体(J1〜J4)を得た。
尚、リシノレイン酸オリゴマー(B)とフマル酸オリゴマー(D)との配合割合、減圧条件下での反応時間、実施例8における共重合体の重量平均分子量(Mw)、多分散度(Mw/Mn)及び共重合体のガラス転移温度(Tg)を表7に示す。
【0064】
【表7】

【0065】
〔9〕実施例9
リシノレイン酸オリゴマー(B)とコハク酸オリゴマー(E)との共重合体(K1〜K4)の製造
実施例7におけるテレフタル酸オリゴマー(C1及びC2)にかえて、コハク酸オリゴマー(E1〜E4)を用いた以外は、実施例4と同様にして、共重合体(K1〜K4)を得た。
尚、リシノレイン酸オリゴマー(B)とコハク酸オリゴマー(E)との配合割合、減圧条件下での反応時間、実施例9における共重合体の重量平均分子量(Mw)、多分散度(Mw/Mn)及び共重合体のガラス転移温度(Tg)を表8に示す。
【0066】
【表8】

【0067】
〔10〕実施例10
二価アルコールを用いた12−ヒドロキシステアリン酸からのポリマー製造
実施例1における重合反応時間を100時間とした以外は、実施例1と同様にして12−ヒドロキシステアリン酸からのポリマー(L)を得た。実施例10におけるポリマー(L)の重量平均分子量(Mw)は15000であった。尚、実施例4と同様に測定した重合体Lの1H−NMRスペクトルの測定結果を図5に示す。
【0068】
〔11〕比較例1
実施例における1,2−プロパンジオールにかえてメタノールを用いた以外は、実施例1と同様にして12−ヒドロキシステアリン酸からのポリマー(M)を得た。比較例1におけるポリマー(M)の重量平均分子量(Mw)は5000であった。
【0069】
〔12〕実施例の効果
実施例1及び実施例2より、12−ヒドロキシステアリン酸及びリシノレイン酸は、二価アルコールとエステルを形成させ、更に、そのエステルから二価アルコールを反応系から脱落させながら縮合させることにより高分子化ができる。それにより、12−ヒドロキシステアリン酸及びリシノレイン酸の高分子オリゴマーを得ることができる。即ち、12−ヒドロキシステアリン酸及びリシノレイン酸は、二価アルコールとエステル形成後、エステル交換反応による重合により高分子化させることができる。
更に、実施例10では、二価アルコールを用いた場合には、重量平均分子量(Mw)が15000の12−ヒドロキシステアリン酸オリゴマーとなったが、一価アルコールであるメタノールを用いた比較例1の場合には、エステル交換反応による重合での高分子化であるが、重量平均分子量(Mw)が5000の12−ヒドロキシステアリン酸オリゴマーしか得られなかった。
また、実施例3〜9より、12−ヒドロキシステアリン酸及びリシノレイン酸の高分子を含む共重合を得られることが確認できた。更に、共重合体形成に用いるオリゴマーの種類及び分子量(MwNMR)を変えることにより、共重合体の特性を変化させることができることが確認できた。これにより、本発明の共重合体は、上述の実施例に示すものに限られず、目的、用途に応じて本発明の範囲内で種々変更した重合体とすることができる。
【図面の簡単な説明】
【0070】
【図1】12−ヒドロキシステアリン酸オリゴマーとテレフタル酸オリゴマーとの共重合体(F1〜F5)のDSC測定結果を示すグラフである。
【図2】12−ヒドロキシステアリン酸オリゴマーとテレフタル酸オリゴマーとの共重合体の1H−NMRスペクトル測定結果を示すグラフである。
【図3】12−ヒドロキシステアリン酸オリゴマーとフマル酸オリゴマーとの共重合体(G1〜G4)のDSC測定結果を示すグラフである。
【図4】12−ヒドロキシステアリン酸オリゴマーとフマル酸オリゴマーとの共重合体の1H−NMRスペクトル測定結果を示すグラフである。
【図5】12−ヒドロキシステアリン酸からのポリマーの1H−NMRスペクトル測定結果を示すグラフである。
【特許請求の範囲】
【請求項1】
12−ヒドロキシステアリン酸及びリシノレイン酸のいずれか一方のカルボン酸と炭素数2〜4の2価アルコールとによりエステルを製造するエステル製造工程と、
上記エステルから上記2価アルコールを留去させながら、上記カルボン酸を重合させるカルボン酸オリゴマー製造工程と、を備えることを特徴とするカルボン酸オリゴマーの製造方法。
【請求項2】
上記2価アルコールが1,2−プロパンジオールである請求項1に記載のカルボン酸オリゴマーの製造方法。
【請求項3】
12−ヒドロキシステアリン酸及びリシノレイン酸のいずれか一方のカルボン酸と炭素数2〜4の2価アルコールとによりエステルを製造するエステル製造工程と、
上記エステルから上記2価アルコールを留去させながら、上記カルボン酸を重合させるカルボン酸オリゴマー製造工程と、
上記カルボン酸オリゴマーと下記一般式(3)に表されるジカルボン酸エステルオリゴマーとを重合させる重合工程と、を備えることを特徴とする共重合体の製造方法。
【化3】

〔但し、一般式(3)において、R4は炭素数1〜6の炭化水素基を示し、R3は炭素数2〜4の炭化水素基を示し、nは2以上の整数を示す。〕
【請求項4】
上記2価アルコールが1,2−プロパンジオールである請求項3に記載の共重合体の製造方法。
【請求項5】
下記一般式(1)で表される12−ヒドロキシステアリン酸オリゴマー又は下記一般式(2)で表されるリシノレイン酸オリゴマーと、下記一般式(3)で表されるジカルボン酸エステルオリゴマーとの重合により得られることを特徴とする共重合体。
【化1】

【化2】

【化3】

〔但し、一般式(1)、(2)及び(3)において、R1、R2及びR3は同一であっても、異なっていてもよく、炭素数2〜4の炭化水素基を示し、式(3)において、R4は炭素数1〜6の炭化水素基を示す。また、一般式(1)、(2)及び(3)において、l、m及びnは2以上の整数を示す。〕
【請求項6】
上記R1、R2及びR3がプロピレン基である請求項5に記載の共重合体。
【請求項7】
上記R4がビニレン基、エチレン基又はフェニレン基である請求項5又は6に記載の共重合体。
【請求項8】
上記l及びmが2〜10の整数である請求項5乃至7のいずれか一項に記載の共重合体。
【請求項9】
上記nが2〜5の整数である請求項5乃至8のいずれか一項に記載の共重合体。
【請求項10】
上記R1、R2及びR3がイソプロピレン基である請求項5乃至9のいずれか一項に記載の共重合体。
【請求項1】
12−ヒドロキシステアリン酸及びリシノレイン酸のいずれか一方のカルボン酸と炭素数2〜4の2価アルコールとによりエステルを製造するエステル製造工程と、
上記エステルから上記2価アルコールを留去させながら、上記カルボン酸を重合させるカルボン酸オリゴマー製造工程と、を備えることを特徴とするカルボン酸オリゴマーの製造方法。
【請求項2】
上記2価アルコールが1,2−プロパンジオールである請求項1に記載のカルボン酸オリゴマーの製造方法。
【請求項3】
12−ヒドロキシステアリン酸及びリシノレイン酸のいずれか一方のカルボン酸と炭素数2〜4の2価アルコールとによりエステルを製造するエステル製造工程と、
上記エステルから上記2価アルコールを留去させながら、上記カルボン酸を重合させるカルボン酸オリゴマー製造工程と、
上記カルボン酸オリゴマーと下記一般式(3)に表されるジカルボン酸エステルオリゴマーとを重合させる重合工程と、を備えることを特徴とする共重合体の製造方法。
【化3】

〔但し、一般式(3)において、R4は炭素数1〜6の炭化水素基を示し、R3は炭素数2〜4の炭化水素基を示し、nは2以上の整数を示す。〕
【請求項4】
上記2価アルコールが1,2−プロパンジオールである請求項3に記載の共重合体の製造方法。
【請求項5】
下記一般式(1)で表される12−ヒドロキシステアリン酸オリゴマー又は下記一般式(2)で表されるリシノレイン酸オリゴマーと、下記一般式(3)で表されるジカルボン酸エステルオリゴマーとの重合により得られることを特徴とする共重合体。
【化1】

【化2】

【化3】

〔但し、一般式(1)、(2)及び(3)において、R1、R2及びR3は同一であっても、異なっていてもよく、炭素数2〜4の炭化水素基を示し、式(3)において、R4は炭素数1〜6の炭化水素基を示す。また、一般式(1)、(2)及び(3)において、l、m及びnは2以上の整数を示す。〕
【請求項6】
上記R1、R2及びR3がプロピレン基である請求項5に記載の共重合体。
【請求項7】
上記R4がビニレン基、エチレン基又はフェニレン基である請求項5又は6に記載の共重合体。
【請求項8】
上記l及びmが2〜10の整数である請求項5乃至7のいずれか一項に記載の共重合体。
【請求項9】
上記nが2〜5の整数である請求項5乃至8のいずれか一項に記載の共重合体。
【請求項10】
上記R1、R2及びR3がイソプロピレン基である請求項5乃至9のいずれか一項に記載の共重合体。
【図1】


【図2】


【図3】


【図4】


【図5】




【図2】


【図3】


【図4】


【図5】


【公開番号】特開2009−191175(P2009−191175A)
【公開日】平成21年8月27日(2009.8.27)
【国際特許分類】
【出願番号】特願2008−33706(P2008−33706)
【出願日】平成20年2月14日(2008.2.14)
【出願人】(591270556)名古屋市 (77)
【出願人】(000118556)伊藤製油株式会社 (15)
【Fターム(参考)】
【公開日】平成21年8月27日(2009.8.27)
【国際特許分類】
【出願日】平成20年2月14日(2008.2.14)
【出願人】(591270556)名古屋市 (77)
【出願人】(000118556)伊藤製油株式会社 (15)
【Fターム(参考)】
[ Back to top ]

