内因性エリスロポエチン発現増強剤及び有機イオントランスポーター発現増強剤
【課題】本発明の課題は、慢性腎臓病(CKD)の主要な合併症のひとつである腎性貧血に、腎機能の評価である推定糸球体濾過量(estimated glomerular filtration rate:eGFR)の低下と共に蓄積する尿毒症物質が、どのように関与しているかを明らかにすることを課題とした。
【解決手段】本発明者らは、尿毒症物質のひとつインドキシル硫酸が、GATA3の発現を増強すること及び、有機アニオントランスポーターSLCO4C1の発現を抑制すること、さらにエリスロポエチンの発現を抑制することを見いだした。そして、活性炭の一種である球形吸着炭(クレメジン)が内因性エリスロポエチン発現を増強する機能を有し、腎性貧血治療薬として利用できること、また有機アニオントランスポーター(SLCO4C1)の発現を増強する機能を有し、尿毒症物質排泄増強剤として利用できることを明らかにした。
【解決手段】本発明者らは、尿毒症物質のひとつインドキシル硫酸が、GATA3の発現を増強すること及び、有機アニオントランスポーターSLCO4C1の発現を抑制すること、さらにエリスロポエチンの発現を抑制することを見いだした。そして、活性炭の一種である球形吸着炭(クレメジン)が内因性エリスロポエチン発現を増強する機能を有し、腎性貧血治療薬として利用できること、また有機アニオントランスポーター(SLCO4C1)の発現を増強する機能を有し、尿毒症物質排泄増強剤として利用できることを明らかにした。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、吸着炭等の尿毒症物質吸着剤を有効成分とする、内因性エリスロポエチン発現増強剤及び有機イオントランスポーター発現増強剤などに関する。
【背景技術】
【0002】
腎不全患者等の腎疾患を有する患者、特に腎透析を受ける患者の数は年々増加の一途を辿っている。腎臓の機能のひとつは、血液中に流れている薬物や尿毒症物質などを取り込み、尿中に送り出して体外に排泄する排泄作用である。そのため腎機能が低下すると、薬物や尿毒症物質が体内に蓄積しやすくなり、腎臓の細胞が傷害され腎機能のさらなる低下を引き起こす。また、腎機能の低下した人は、正常の人と較べて何倍も脳卒中や心筋梗塞になりやすいことが知られている。したがって尿毒症物質などを排泄する機能を維持することは、腎障害を悪化させない上で非常に重要な意味を持つと同時に、脳卒中や心臓病の予防という点でも重要である。現在20万人の患者が、尿毒症物質などを人工的に除去するために透析治療を行っており、さらに毎年3万人以上が新たに透析導入に至っている。透析療法には、一人あたり年間約500万円の費用がかかるため、20万人に対して約1兆円の医療費が恒常的に必要となり社会的な問題でもある。
【0003】
近年、慢性腎臓病(Chronic Kidney Disease:CKD)という疾患概念が提唱され、その予防・治療の重要性に対する認識が高まりを見せている。CKDとは、腎障害を示す所見や腎機能低下が慢性的に続く状態で、適切な治療を行わずにいると末期腎不全となり、人工透析や腎移植を受けなければ生きられなくなる疾患である。末期腎不全は全世界的に増え続けており、現在、日本には約1,330万人のCKD患者がいるといわれており、成人の約8人に1人にあたる数である。また、人工透析を受けている患者も、前述したように増え続けているのが現状であり、CKDの早期発見、早期治療が急務の課題となっている。このような状況下において、腎不全やCKD等の腎疾患の症状の予防法や、そのような症状を緩和し、透析導入を遅らせる治療法が開発されれば、患者のQOL(クオリティオブライフ)に資するだけでなく、医療費の大幅な削減が可能となり社会に大きく貢献することが期待されている。
【0004】
CKDにおいて腎性貧血は主要な合併症のひとつであり、腎性貧血の病態は、内因性エリスロポエチン(Epo)産生の低下を基盤とすることが知られている。腎機能の低下がどのようにエリスロポエチン産生に影響を及ぼすかは明らかになっていないが、血液透析によって腎性貧血が改善したという報告があることから、尿毒症物質がその原因のひとつである可能性が示唆されている。エリスロポエチンは赤血球の産生を促進する造血促進因子の一つであり、エリスロポエチンの欠乏は貧血の一因となる。エリスロポエチンは主に腎臓で生成されるため、慢性腎不全によりエリスロポエチンの発現量が低下し、貧血が起こる。そのため、腎性貧血の主な治療法はエリスロポエチンの投与であるが、エリスロポエチン製剤は高価で、頻回の注射が必要であるなどの問題があった。
【0005】
これまで発明者らは、ヒト腎臓近位尿細管血管側にのみ発現する有機アニオントランスポーターSLCO4C1が尿毒症物質の排泄に関わっており、SLCO4C1の発現を調節することで尿毒症物質排泄を制御するという新たなCKD治療の可能性を報告した(非特許文献1)。
【0006】
また、エリスロポエチン遺伝子の上流のGATA配列にGATA転写因子が結合し、エリスロポエチン遺伝子発現を負に制御しているため、GATA3阻害剤によって、エリスロポエチンの発現が増強されることが知られている。そして、腎不全で蓄積されるL−NMMA(NG-monomethyl L-arginine)により、GATA結合活性・mRNA発現レベルが亢進することによりエリスロポエチン遺伝子発現が抑制されて腎性貧血が発症することが報告されている(非特許文献2)。
【0007】
現在臨床的に使用されている腎不全用製剤のひとつに、経口投与可能な尿毒症物質吸着機能を有する製剤として、活性炭の一種、球形吸着炭クレメジン(登録商標:呉羽化学)がある。クレメジンは、石油系炭化水素由来の球形微多孔質炭素を高温で酸化・還元処理して得た黒色球形の粒子であり、体内に吸収されずに、消化管に存在する有害物質を吸着し、便とともに排泄されることにより尿毒症物質の除去及び腎機能の低下を抑える目的で使用されている経口吸着剤である。また、クレメジンは、腎性貧血治療のために投与された遺伝子組換えヒトエリスロポエチン製剤(rHuEPO)の作用を増強することも知られているが、その詳細なメカニズムは明らかではない(特許文献1)。
【0008】
本願発明者らは、キャピラリー電気泳動質量分析計(CE−MS)を用いてCKD患者41名の血清を解析し、腎機能の評価である推定糸球体濾過量(estimated glomerular filtration rate:eGFR)の低下と共に蓄積する尿毒症物質としてインドキシル硫酸を含めた52個(うち新規物質36個)の物質を同定した(非特許文献3)。
【先行技術文献】
【特許文献】
【0009】
【特許文献1】特開平6−199689号公報
【非特許文献】
【0010】
【非特許文献1】Toyohara T. et al., J Am Soc Nephrol., 20: 2546-2555 (2009)
【非特許文献2】Imagawa S. et al., Kidney International. 61. 396-404 (2002)
【非特許文献3】Toyohara T. et al., Hypertens Res. 2010 Sep;33(9):944-52. (2010)
【発明の概要】
【発明が解決しようとする課題】
【0011】
本願発明者らは、腎機能の評価であるeGFRの低下と共に蓄積する尿毒症物質を同定したが(特願2009−205033、非特許文献3)、これらの物質がどのようにCKDの病態に関与しているかはほとんどわかっていなかった。そこで、本発明の課題は、CKDの主要な合併症のひとつである腎性貧血に、これらの尿毒症物質がどのように関与しているか明らかにすることを課題とした。
【課題を解決するための手段】
【0012】
本発明者らは、尿毒症物質のひとつであるインドキシル硫酸(IS;Indoxyl Sulfate)が、GATA3の発現やSLCO4C1トランスポーターの発現に与える影響を調べ、エリスロポエチン産生に与える作用とその機序を検証した。さらに、活性炭(クレメジン)がSLCO4C1トランスポーターの発現を増強し、内因性エリスロポエチンの発現を増強することを見いだし、本発明を完成するに至った。
【0013】
すなわち本発明は、(1)尿毒症物質吸着剤を有効成分とする内因性エリスロポエチン発現増強剤や、(2)尿毒症物質吸着剤が活性炭である上記(1)記載の内因性エリスロポエチン発現増強剤や、(3)活性炭が球形吸着炭である上記(2)記載の内因性エリスロポエチン発現増強剤や、(4)上記(1)〜(3)のいずれか記載の内因性エリスロポエチン発現増強剤を含む腎性貧血治療薬に関する。
【0014】
また、本発明は(5)尿毒症物質吸着剤を有効成分とする有機イオントランスポーター発現増強剤や、(6)尿毒症物質吸着剤が活性炭である上記(5)記載の有機イオントランスポーター発現増強剤や、(7)活性炭が球形吸着炭である上記(6)記載の有機イオントランスポーター発現増強剤や、(8)有機イオントランスポーターが、有機アニオントランスポーターSLCO4C1である上記(5)〜(7)のいずれか記載の有機イオントランスポーター発現増強剤や、(9)上記(5)〜(8)のいずれか記載の有機イオントランスポーター発現増強剤を含む尿毒症物質排泄増強剤に関する。
【発明の効果】
【0015】
本発明の活性炭を有効成分とする内因性エリスロポエチン発現増強剤によれば、生体内で発現するエリスロポエチン量を増強し、腎性貧血を治療することができる。また、本発明の活性炭を有効成分とする有機アニオントランスポーターSLCO4C1発現増強剤によれば、SLCO4C1量を増加させ、尿毒症物質排泄作用を増強することができる。
【図面の簡単な説明】
【0016】
【図1】エリスロポエチン産生ヒト肝細胞株Hep3Bに尿毒症物質(アニオン)を添加し、エリスロポエチン産生能への影響を調べた結果を示す図である。
【図2】エリスロポエチン産生ヒト肝細胞株Hep3Bに尿毒症物質(カチオン)を添加し、エリスロポエチン産生能への影響を調べた結果を示す図である。
【図3】HK−2細胞においてインドキシル硫酸(IS)がSLCO4C1のmRNA発現を抑制することを示す図である。
【図4】HK−2細胞においてインドキシル硫酸(IS)がGATA3のmRNA発現を増強することを示す図である。
【図5】腎不全ラットおいて、クレメジン投与によりSLCO4C1のmRNA発現が増強されることを示す図である。
【図6】ACHN細胞においてインドキシル硫酸(IS)や1−メチルアデノシン(1-Methyladenosine)がエリスロポエチンの発現を転写レベルで抑制することを示す図である。
【図7】ACHN細胞においてインドキシル硫酸(IS)がSLCO4C1の発現を転写レベルで抑制し(左のグラフ)、GATA3の発現を転写レベルで増強する(右のグラフ)ことを示す図である。
【図8】腎性貧血患者に対するクレメジン投与により、エリスロポエチンの発現が増強されることを示す図である。
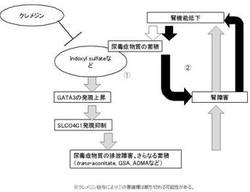
【図9】クレメジンが尿毒症物質を吸着、排除し、尿毒症物質によるGATA3の発現増強及びSLCO4C1トランスポーターの発現抑制を抑えることにより、SLCO4C1トランスポーターやエリスロポエチンの発現を増強する機序を表す図である。
【発明を実施するための形態】
【0017】
本発明における尿毒症物質吸着剤としては、尿毒症物質を吸着し体外に排出することにより体内の尿毒症物質を減少させ、それにより尿毒症物質が増強していたGATA3の発現が減少し、GATA3によるエリスロポエチンの発現抑制が解除されて内因性エリスロポエチンの発現が増強される目的で使用できる尿毒症物質を吸着する物質や、GATA3による有機イオントランスポーターの発現抑制が解除されて、有機イオントランスポーターの発現が増強される目的で使用できる尿毒症物質を吸着する物質であれば特に制限されない。例えば、活性炭、有機ポリマー、ゼオライトや白土、クレイなどの無機吸着剤、デンプン類やセルロース類、キチンやキトサン等の経口吸着剤を挙げることができ、中でも活性炭が好ましい。さらに、活性炭の中でも、石油系炭化水素由来の微多孔質炭素を高温で酸化・還元処理して得た黒色粒子であり、直径0.05〜2mm、好ましくは直径0.1〜1mm、さらに好ましくは直径0.2〜0.4mmの、無数の細孔を有する高純度炭素微粒子である球形吸着炭が好ましい。かかる球形吸着炭は、市販の製品、クレメジン(Kremezin、登録商標)として入手することができ、例えば呉羽化学工業株式会社製「クレメジン(登録商標)細粒」や「クレメジン(登録商標)カプセル200」、マイラン製薬株式会社製「球形吸着炭細粒マイラン」を使用することができる。本明細書においては、これらの球形吸着炭を総称してクレメジンと記載することもある。
【0018】
本発明の内因性エリスロポエチン発現増強剤の好ましい態様は、尿毒症物質吸着剤として球形吸着炭を有効成分とするものであり、その有効量を、ヒトを含む哺乳動物に投与することによってエリスロポエチンの発現量を増強することができるものであり、賦形剤等の担体と併用することにより薬剤やサプリメントとすることができる。この薬剤やサプリメントを腎不全のヒトを含む哺乳動物に投与することによって、生体内のエリスロポエチンの発現量が増加し、腎性貧血の予防又は治療に利用することができる。かかるエリスロポエチンとしては、例えばマウスエリスロポエチン遺伝子(NM_007942;GenBankアクセッション番号)、ラットエリスロポエチン遺伝子(NM_017001)やヒトエリスロポエチン遺伝子(NM_000799)、及びこれらから発現するタンパク質などを挙げることができる。
【0019】
本発明の有機イオントランスポーター発現増強剤の好ましい態様は、尿毒症物質吸着剤として球形吸着炭を有効成分とするものであり、その有効量を、ヒトを含む哺乳動物に投与することによって有機イオントランスポーターの発現量を増強することができる薬剤である。この薬剤は、腎不全のヒトを含む哺乳動物に投与することによって、有機イオントランスポーターの発現量を増加させることにより、尿毒症物質の排出を増加させることができる。有機イオントランスポーターとしては、SLCO4C1、OCT1(organic cation transporter1)、OCT2及びOCT3、OCTN1(novelorganic cation transporter1)やOCTN2、OAT1(organic anion transporter1)、OAT2及びOAT3を挙げることができ、中でも有機アニオントランスポーターであるSLCO4C1を好適に示すことができる。かかるSLCO4C1としては、ラットSLCO4C1遺伝子(NM_001002024)、マウスSLCO4C1遺伝子(NM_172658)やヒトSLCO4C1遺伝子(AY273896)、及びこれらから発現する発現するタンパク質などを挙げることができる。
【0020】
上記本発明の内因性エリスロポエチン発現増強剤を含む本発明の腎性貧血治療薬や、上記本発明の有機イオントランスポーター発現増強剤を含む本発明の尿毒症物質排泄増強剤は、経口的に投与されるが、その投与量は、対象(動物又はヒト)、年齢、個人差、病状などに依存する。例えば、球形吸着炭(クレメジン)をヒトに経口投与する場合の投与量は、通常1日当たり、クレメジン0.1〜100g、好ましくは1〜50g、さらに好ましくは3〜20gであり、1回又は2〜4回に分けて服用してもよく、また症状により投与量を適宜増減してもよい。例えば、クレメジン等の活性炭は、顆粒、錠剤、糖衣錠、カプセル剤、スティック剤、分包包装体又は懸濁剤などの任意の投与形態で与えることができる。なお、本明細書における腎性貧血治療薬及び尿毒症物質排泄増強剤の投与対象は、ヒトだけでなく、他の非ヒト動物含むが、ヒト及び非ヒト哺乳動物が好ましく、ヒトがより好ましい。
【実施例】
【0021】
以下、実施例によって本発明を具体的に説明するが、これらは本発明の範囲を限定するものではない。
【0022】
本願発明者らは、キャピラリー電気泳動質量分析計(CE−MS)を用いてCKD患者41名の血清を解析し、腎機能の評価である推定糸球体濾過量(estimated glomerular filtration rate:eGFR)の低下と共に蓄積する尿毒症物質としてインドキシル硫酸を含めた52個(うち新規物質36個)を同定した(非特許文献3、特願2009−205033)。このうち31種類の尿毒症物質化合物を入手し、これらの化合物を含んだ培地で、低酸素条件下でエリスロポエチン産生が誘導される細胞を培養し、エリスロポエチン産生能への影響を以下の方法で評価した。
【0023】
エリスロポエチン産生ヒト肝細胞株Hep3B(ATCC(American Type Culture Collection)より入手)は、100U/mLペニシリン(GIBCO社製)、100μg/mLストレプトマイシン(GIBCO社製)、10%ウシ胎児血清(GIBCO社製)を含むDulbecco’s modified Eagle’s medium(DMEM)(GIBCO社製)で5%CO2/95%空気、37℃で維持した。各種薬物のエリスロポエチン産生能に対する影響を検討するために、12穴細胞培養プレートに1穴あたり1×105個のHep3B細胞をまき、24時間後に培養液を被検物質(各1mM、1−メチルアデノシンは0.1mM)あるいは1%DMSO又は水が入った培養液に交換した。コントロール群は通常の培養細胞装置で5%CO2/95%空気、37℃の条件で、エリスロポエチン産生誘導群は低酸素チャンバーを用いて5%CO2/1%O2、37℃の低酸素条件で24時間培養した。24時間培養の後、上清中のエリスロポエチンの濃度をBender Med Systems社製のヒトエリスロポエチンELISAキットを用いて測定し、また細胞のタンパク濃度をBio-Rad社製のBCA蛋白測定キットを用いて測定した。測定した上清中のエリスロポエチン量の値を、細胞のタンパク質量の値で割り、一定細胞量あたりのエリスロポエチン産生量を算出した。さらに1%DMSO又は水を含む培養液、5%CO2/1%O2、37℃条件下で培養した場合の一定細胞量あたりのエリスロポエチン産生量を100%として、各被検物質を添加した場合のエリスロポエチン産生量を求めた。アニオンの被検物質を用いた場合の結果のグラフを図1に、カチオンの被検物質を用いた場合の結果のグラフを図2に示す。
【0024】
その結果、アニオンではインドキシル硫酸(Indoxyl sulfate:IS)、イソクエン酸(Isocitrate)、シトラコン酸(Citraconate)、N−アセチル−L−グルタミン酸(N-Ace-L-Glu)、ホモバニリン酸(Homovanilate)、N−アセチル−アスパラギン酸−グルタミン酸(N-Ace-Asp-Glu)、マンデル酸(Mandelate)、L−システイン−S−硫酸(L-cystein-S-sulfate)、カチオンではヒポタウリン(Hypotaurine)、1−メチルアデノシン(1-Methyladenosine)、インドール−3−酢酸(Indole-3-acetate)、キヌレニン(Kynurenine)、N−モノメチル−アルギニン(NMMA)の13種類の物質(図1、2にアスタリスク及びシャープで示す)は、その添加によりエリスロポエチン産生能の有意な低下が認められた。
【0025】
[インドキシル硫酸によるSLCO4C1発現抑制作用]
HK−2細胞におけるインドキシル硫酸(IS)によるSLCO4C1発現抑制作用について検証した。6穴細胞培養プレートに5×105個のHK−2細胞を蒔いた後、24時間インキュベーションした。その後インドキシル硫酸(0.3、1、3mMの3濃度)又は水を含んだ培地に交換し、24時間インキュベーションした後にRNAを抽出した。SuperScript III(Invitrogen社製)を用いてcDNAを作製したのち、GAPDHを内部標準としてSLCO4C1のmRNAの発現を定量PCRで測定した。細胞培養培地には腎上皮細胞培養キット(Lonza社製)を用い、定量PCRはTaqMan(登録商標)Gene Expression Assaysを使用し(GAPDH;Assay ID: Rn99999916_s1、SLCO4C1;Assay ID: Rn01427754_m1のTaqMan(登録商標)プローブ(Applied Biosystems社製)を使用)、Step One Plus Real-Time PCR System(Applied Biosystems社製)により行った。その結果、インドキシル硫酸の濃度依存的にSLCO4C1のmRNAの発現が抑制されることが示された(図3)。すなわち、尿毒症物質のひとつであるインドキシル硫酸は、SLCO4C1の発現を抑制することにより、尿毒症物質の排出を抑制して腎不全を亢進する可能性が示唆された。
【0026】
[インドキシル硫酸によるGATA3発現誘導作用]
HK−2細胞におけるインドキシル硫酸(IS)によるGATA3発現誘導作用について検証した。6穴細胞培養プレートに5×105個のHK−2細胞を蒔いた後、24時間インキュベーションした。その後インドキシル硫酸(0.3、1、3mMの3濃度)又は水を含んだ培地に交換し、24時間インキュベーションした後にRNAを抽出した。SuperScript III(Invitrogen社製)を用いてcDNAを作製したのち、GAPDHを内部標準としてGATA3のmRNAの発現を定量PCRで測定した。細胞培養培地には腎上皮細胞培養キット(Lonza社製)を用い、定量PCRはTaqMan(登録商標)Gene Expression Assaysを使用し(GAPDH;Assay ID: Rn99999916_s1、GATA3;Assay ID: Hs00231122_m1のTaqMan(登録商標)プローブ(Applied Biosystems社製)を使用)、Step One Plus Real-Time PCR System(Applied Biosystems社製)により行った。その結果、インドキシル硫酸の濃度依存的にGATA3のmRNAの発現が誘導されることが示された(図4)。すなわち、尿毒症物質のひとつであるインドキシル硫酸は、エリスロポエチンの発現を抑制する因子であるGATA3の発現を誘導することにより、エリスロポエチンの発現を抑制する可能性が示唆された。
【0027】
[腎不全ラットおけるクレメジン投与によるSLCO4C1発現誘導作用]
次に、尿毒症物質を吸着することにより体外に排出する機能を有する球形吸着炭、クレメジンが、腎不全ラットにおけるSLCO4C1のmRNA発現へ与える影響を調べた。10週齢のオスのWistarラットに対し5/6腎摘出を施し、慢性腎不全ラットを作成した。腎摘後10週に血圧、採血、24時間蓄尿を行い、コントロール群13、クレメジン群11に振り分け、クレメジン(粉餌に8%混合)投与を開始した。4週間投与を行った後に再び血圧測定、採血、24時間蓄尿を行った後、安楽死させた。摘出腎臓からRNAを抽出し、SuperScript III(Invitrogen社製)を用いてcDNAを作製した後、GAPDHを内部標準としてSLCO4C1のmRNA発現を測定した(図5)。クレメジン4週投与後のCcr(クレアチニンクリアランス;Creatinine Clearance)が1.0ml/minから2.0ml/minのラット(コントロール10、クレメジン8)に対しSLCO4C1のmRNAの発現量をt検定にて検定したところ、有意差が確認された。すなわち、腎不全ラットに対するクレメジン投与により、SLCO4C1の発現が増強されることが確認された。
【0028】
[インドキシル硫酸及び1−メチルアデノシンによるエリスロポエチン発現抑制作用]
インドキシル硫酸及び1−メチルアデノシンがエリスロポエチン転写活性へ与える影響を調べるため、マウスエリスロポエチン遺伝子の5’上流域を用いたルシフェラーゼアッセイを以下の方法で行った。
【0029】
[プラスミドDNA]
マウスエリスロポエチン遺伝子の5’上流転写調節領域のプロモーター活性ルシフェラーゼアッセイ用のプラスミドベクターHE-mPro-lucは、マウスエリスロポエチン遺伝子のエクソン1の翻訳開始点を起点として−571から+53bpの長さの領域を制限酵素XbaIとSacIで切り出し、ルシフェラーゼレポーターベクターpXP2(Nordeeen SK. BioTechniques. 6:454-453.1988) に挿入して作製した。
【0030】
[培養細胞]
ヒト腎癌由来培養細胞株ACHNはRPMI1640培地(GIBCO社製)に最終濃度で10%ウシ胎児血清(FBS)(GIBCO社製)、100IU/mlペニシリンと10μg/mlストレプトマイシン(GIBCO社製)となるように添加し、37℃、5%CO2濃度の条件で培養した。
【0031】
[トランスフェクションとルシフェラーゼレポーターアッセイ]
Hep3B細胞は24穴細胞培養プレートに1穴あたり10×104個の細胞数で調整して継代し、検鏡下で70−80%の細胞密度となったHep3B細胞に対してルシフェラーゼレポーターアッセイ用のプラスミドDNAのトランスフェクションを施行した。トランスフェクション用の溶液組成は1穴あたりHE-mPro-luc 2μg、pRh-TK(Promega社製)50ng、Lipofectamine2000(Invitrogen社製)2μlをOptiMEM−I(GIBCO社製)100μlに混合してから室温で20分インキュベーションして調製し、無血清のOptiMEM−I培地0.5mlでプレインキュベーションした24穴細胞培養プレートACHN細胞に添加した後、37℃、5%CO2/95%空気の条件にて無血清かつ抗生物質添加無しで4時間インキュベーションした。その後、インドキシル硫酸(10μM)、1−メチルアデノシン(1μM)、又はDMSO(0.1%)を添加した通常培地(RPMI1640/10%FBS/100IU/mlペニシリン、10μg/mlストレプトマイシン)に交換し、さらに37℃、5%CO2/1%O2の低酸素条件で36時間インキュベートした。その後、培地を無血清のPBS 0.5mlに交換して細胞を穏やかに洗浄後PBSを吸引除去する作業を2回施行してから、passive lysis buffer(Promega社製)100μlを加えて20分室温にて混和し溶解した。ルシフェラーゼレポーターアッセイはDual Luciferase Reporter Assay System(Promega社製)を使用し、測定はルミノメーターLumat LB9507(NERTHOLD TECHNOLOGIES社製)を用いてFire fly及びRenillaのルシフェラーゼ量を測定した。そして、Fire flyルシフェラーゼ量をRenillaルシフェラーゼ量で割ることにより、エリスロポエチン遺伝子の転写活性を算出した。
【0032】
その結果、DMSOを添加したコントロールに比べ、インドキシル硫酸の添加によりエリスロポエチン遺伝子の転写活性は53%、1−メチルアデノシンの添加によりエリスロポエチン遺伝子の転写活性63%に減少した(図6)。すなわち、尿毒症物質であるインドキシル硫酸及び1−メチルアデノシンがエリスロポエチン遺伝子の転写活性を有意に低下させることが明らかとなった。
【0033】
[インドキシル硫酸によるSLCO4C1発現抑制及びGATA3発現誘導作用]
次に、インドキシル硫酸及び1−メチルアデノシンがSLCO4C1遺伝子転写活性へ与える影響を調べるため、ヒトSLCO4C1遺伝子の5’上流転写調節領域及びGATA3遺伝子の5’上流転写調節領域のプロモーター活性を検出するルシフェラーゼアッセイを以下の方法で行った。
【0034】
[プラスミドDNA]
SLCO4C1遺伝子の5’上流転写調節領域のプロモーター活性ルシフェラーゼアッセイ用のプラスミドベクターSLCO4C1-3886/+110-pGL3cは、翻訳開始点より−3886から+110bpの長さの領域をPCR法を用いて増幅し、pGL3 basic luciferase expression vector(Promega社製)に挿入して作製した。GATA3遺伝子の5’上流転写調節領域のプロモーター活性ルシフェラーゼアッセイ用のプラスミドベクターpGATA3-lucは、GATA3プロモーター領域の3.5kbを制限酵素BamHIとNcoIで切り出し、ルシフェラーゼ蛋白をコードする2kbの遺伝子カセットと連続してpBluscriptSK+(Novagen社製)ベクターに挿入することで作製した。
【0035】
[トランスフェクションとルシフェラーゼレポーターアッセイ]
ACHN細胞は上述の方法で維持し、24穴細胞培養プレートに1穴あたり20×104個の細胞数で調整して継代し、検鏡下で70−80%の細胞密度となったACHN細胞に対してルシフェラーゼレポーターアッセイ用のプラスミドDNAのトランスフェクションを施行した。トランスフェクション用の溶液組成は、1穴あたりFire fly luciferase vector(SLCO4C1-3886/+110-pGL 1.2μg又はpGATA3-luc 2μg)、Renilla Luciferase Reporter VectorとしてpRh-TK (Promega社製)50ng、トランスフェクション試薬としてLipofectamine2000(Invitrogen社製)2μlを無血清培地のOptiMEM−I(GIBCO社製)100μlに混合してから室温で20分インキュベーションして調製した。このトランスフェクション用溶液を、無血清のOptiMEM−I培地0.5mlでプレインキュベーションした24穴細胞培養プレートのACHN細胞に添加し、37℃、5%CO2にて無血清かつ抗生物質添加無しで4時間インキュベーションした。その後培地をインドキシル硫酸(100μM)又はDMSOを添加した通常培地(10%FBS、100IU/mlペニシリン、10μg/mlストレプトマイシンを含むRPMI1640培地)に交換し、さらに37℃、5%CO2にて44時間インキュベーションした。その後に、培地を無血清のPBS0.5mlに置換して細胞を穏やかに洗浄しPBSを吸引除去する作業を2回施行してから、passive lysis buffer(Promega社製)100μl加えて20分室温にて混和し溶解した。ルシフェラーゼレポーターアッセイはDual Luciferase Reporter Assay System(Promega社製)にて、ルミノメーターLumat LB9507(NERTHOLD TECHNOLOGIES社製)を用いてFire fly及びRenillaのルシフェラーゼ量を測定した。そして、Fire flyルシフェラーゼ量をRenillaルシフェラーゼ量で割ることにより、SLCO4C1遺伝子及びGATA3遺伝子の転写活性を算出した。
【0036】
DMSOを添加したコントロールサンプルの転写活性を1とした場合の、インドキシル硫酸を添加した場合のSLCO4C1遺伝子又はGATA3遺伝子の転写活性を図7に示す。その結果、インドキシル硫酸添加により、SLCO4C1遺伝子の転写活性が減少し、GATA3の転写活性が増加することが示された。すなわち、インドキシル硫酸は、転写レベルでSLCO4C1遺伝子発現を減少させ、GATA3遺伝子発現を増加させる制御を行うことが示された。
【0037】
[腎性貧血患者に対するクレメジン投与によるエリスロポエチン発現増強作用]
腎性貧血を示す腎不全疾患の成人男性3人、女性1人の計4人の患者に、クレメジンを1日6g、3回に分けて、22ヶ月にわたり投与した。クレメジン投与の前と後に血液を採取し、血中のエリスロポエチンの濃度をBender Med Systems社製のヒトエリスロポエチンELISAキットを用いて測定した。その結果、クレメジン投与前と比較して、クレメジン投与後には、血液中のエリスロポエチン量が3人で増加し、一人では変化がなかった(図8)。腎不全によりエリスロポエチン量が減少することが知られており、すなわち、クレメジン投与により、内因性エリスロポエチンの発現量が増加した結果、エリスロポエチン量の減少が防がれ、増加したことが示唆された。
【0038】
以上より、尿毒症物質のひとつであるインドキシル硫酸が、GATA3の発現を増強すること、SLCO4C1トランスポーターの発現を抑制すること、さらにエリスロポエチンの発現を抑制することが明らかになった。そして、クレメジンの投与により、SLCO4C1トランスポーターの発現が増強し、エリスロポエチン発現も増強されることが示された。これは、クレメジンに尿毒症物質が吸着、排除されることによって、尿毒症物質によるGATA3の発現増強及びSLCO4C1トランスポーターの発現抑制が抑えられ、それにより、GATA3によるエリスロポエチンの発現抑制が解除され、またSLCO4C1トランスポーターの発現が増強されることによりSLCO4C1トランスポーターによる尿毒症物質の排泄が促進されることにより、内因性エリスロポエチン発現も増強されると考えられる(図9)。
【0039】
[腎不全ラットにおけるクレメジン投与により変動する物質のCE−MS解析]
10週齢のオスのWistarラットに対し5/6腎摘出を施し、慢性腎不全ラットを作成した。基本飼料を与えた慢性腎不全ラット(n=12)をコントロール群、クレメジンを添加した飼料(粉餌に8%混合)を与えた慢性腎不全ラット(n=10)をクレメジン群、クレメジを添加した飼料(粉餌に8%混合)を与えた正常なWistarラットをSham群(n=3)とした。4週間飼育した後、血漿サンプルを採取し、以下の方法でCE−MS分析を行った。内標準物質を調整したメタノール溶液を各血漿サンプルに添加して撹拌し、さらにクロロホルムを加えて撹拌し、4600gで5分間遠心分離した後、上清を限外ろ過フィルター(分画分子量5000)にとり、4℃、9100gで2時間遠心分離した後、ろ液を遠心濃縮してCE−TOFMSにて測定を行った。
【0040】
その結果、コントロール群とクレメジン群で有意差のあるアニオン6物質は、4−オキソペンタン酸(4-oxopentanoate)、o−ヒドロキシ安息香酸(o-Hydroxybenzoate)、馬尿酸(Hippurate)、3−インドキシル硫酸(3-Indoxyl sulfate)、N−アセチルノイラミン酸(N-Acetylneuraminate)、コール酸(Cholate)であり、これらは全てコントロール群に比べクレメジン群で低い値であった。また、コントロール群とクレメジン群で有意差のあるカチオン15物質は、グリシン(Glycine)トリメチルアミンN−オキシド(Trimethylamine N-oxide)、ヒポタウリン(Hypotaurine)、シトシン(Cytosine)、ニコチン酸アミド(Nicotinamide)、イミダゾール−4−酢酸(Imidazole-4-acetate)、クレアチン(Creatine)、アスパラギン(Asparagine)、γ−グアニジノブチラート(γ-Guanidinobutyrate)、γ−ブチロベタイン(γ-Butyrobetaine)、グルタミン(Glutamine)、アラントイン(Allantoin)、N−γ−エチルグルタミン(N-γ-Ethylglutamine)、トリプトファン(Tryptophan)、グリセリルホスホリルコリン(Glycerophosphorylcholine)であり、このうちトリメチルアミンN−オキシドとトリプトファンはコントロール群に比べクレメジン群で有意に高い値であった。また、カチオンである5−メチルシトシン(5-Methylcytosine)とアントラニル酸(Anthranilate、別名o−アミノ安息香酸)はコントロール群のみで検出され、Shamやクレメジン群ではほとんど検出されなかった。
【産業上の利用可能性】
【0041】
本発明は、腎性貧血治療薬や、尿毒症物質排泄薬の分野に好適に利用することができる。
【技術分野】
【0001】
本発明は、吸着炭等の尿毒症物質吸着剤を有効成分とする、内因性エリスロポエチン発現増強剤及び有機イオントランスポーター発現増強剤などに関する。
【背景技術】
【0002】
腎不全患者等の腎疾患を有する患者、特に腎透析を受ける患者の数は年々増加の一途を辿っている。腎臓の機能のひとつは、血液中に流れている薬物や尿毒症物質などを取り込み、尿中に送り出して体外に排泄する排泄作用である。そのため腎機能が低下すると、薬物や尿毒症物質が体内に蓄積しやすくなり、腎臓の細胞が傷害され腎機能のさらなる低下を引き起こす。また、腎機能の低下した人は、正常の人と較べて何倍も脳卒中や心筋梗塞になりやすいことが知られている。したがって尿毒症物質などを排泄する機能を維持することは、腎障害を悪化させない上で非常に重要な意味を持つと同時に、脳卒中や心臓病の予防という点でも重要である。現在20万人の患者が、尿毒症物質などを人工的に除去するために透析治療を行っており、さらに毎年3万人以上が新たに透析導入に至っている。透析療法には、一人あたり年間約500万円の費用がかかるため、20万人に対して約1兆円の医療費が恒常的に必要となり社会的な問題でもある。
【0003】
近年、慢性腎臓病(Chronic Kidney Disease:CKD)という疾患概念が提唱され、その予防・治療の重要性に対する認識が高まりを見せている。CKDとは、腎障害を示す所見や腎機能低下が慢性的に続く状態で、適切な治療を行わずにいると末期腎不全となり、人工透析や腎移植を受けなければ生きられなくなる疾患である。末期腎不全は全世界的に増え続けており、現在、日本には約1,330万人のCKD患者がいるといわれており、成人の約8人に1人にあたる数である。また、人工透析を受けている患者も、前述したように増え続けているのが現状であり、CKDの早期発見、早期治療が急務の課題となっている。このような状況下において、腎不全やCKD等の腎疾患の症状の予防法や、そのような症状を緩和し、透析導入を遅らせる治療法が開発されれば、患者のQOL(クオリティオブライフ)に資するだけでなく、医療費の大幅な削減が可能となり社会に大きく貢献することが期待されている。
【0004】
CKDにおいて腎性貧血は主要な合併症のひとつであり、腎性貧血の病態は、内因性エリスロポエチン(Epo)産生の低下を基盤とすることが知られている。腎機能の低下がどのようにエリスロポエチン産生に影響を及ぼすかは明らかになっていないが、血液透析によって腎性貧血が改善したという報告があることから、尿毒症物質がその原因のひとつである可能性が示唆されている。エリスロポエチンは赤血球の産生を促進する造血促進因子の一つであり、エリスロポエチンの欠乏は貧血の一因となる。エリスロポエチンは主に腎臓で生成されるため、慢性腎不全によりエリスロポエチンの発現量が低下し、貧血が起こる。そのため、腎性貧血の主な治療法はエリスロポエチンの投与であるが、エリスロポエチン製剤は高価で、頻回の注射が必要であるなどの問題があった。
【0005】
これまで発明者らは、ヒト腎臓近位尿細管血管側にのみ発現する有機アニオントランスポーターSLCO4C1が尿毒症物質の排泄に関わっており、SLCO4C1の発現を調節することで尿毒症物質排泄を制御するという新たなCKD治療の可能性を報告した(非特許文献1)。
【0006】
また、エリスロポエチン遺伝子の上流のGATA配列にGATA転写因子が結合し、エリスロポエチン遺伝子発現を負に制御しているため、GATA3阻害剤によって、エリスロポエチンの発現が増強されることが知られている。そして、腎不全で蓄積されるL−NMMA(NG-monomethyl L-arginine)により、GATA結合活性・mRNA発現レベルが亢進することによりエリスロポエチン遺伝子発現が抑制されて腎性貧血が発症することが報告されている(非特許文献2)。
【0007】
現在臨床的に使用されている腎不全用製剤のひとつに、経口投与可能な尿毒症物質吸着機能を有する製剤として、活性炭の一種、球形吸着炭クレメジン(登録商標:呉羽化学)がある。クレメジンは、石油系炭化水素由来の球形微多孔質炭素を高温で酸化・還元処理して得た黒色球形の粒子であり、体内に吸収されずに、消化管に存在する有害物質を吸着し、便とともに排泄されることにより尿毒症物質の除去及び腎機能の低下を抑える目的で使用されている経口吸着剤である。また、クレメジンは、腎性貧血治療のために投与された遺伝子組換えヒトエリスロポエチン製剤(rHuEPO)の作用を増強することも知られているが、その詳細なメカニズムは明らかではない(特許文献1)。
【0008】
本願発明者らは、キャピラリー電気泳動質量分析計(CE−MS)を用いてCKD患者41名の血清を解析し、腎機能の評価である推定糸球体濾過量(estimated glomerular filtration rate:eGFR)の低下と共に蓄積する尿毒症物質としてインドキシル硫酸を含めた52個(うち新規物質36個)の物質を同定した(非特許文献3)。
【先行技術文献】
【特許文献】
【0009】
【特許文献1】特開平6−199689号公報
【非特許文献】
【0010】
【非特許文献1】Toyohara T. et al., J Am Soc Nephrol., 20: 2546-2555 (2009)
【非特許文献2】Imagawa S. et al., Kidney International. 61. 396-404 (2002)
【非特許文献3】Toyohara T. et al., Hypertens Res. 2010 Sep;33(9):944-52. (2010)
【発明の概要】
【発明が解決しようとする課題】
【0011】
本願発明者らは、腎機能の評価であるeGFRの低下と共に蓄積する尿毒症物質を同定したが(特願2009−205033、非特許文献3)、これらの物質がどのようにCKDの病態に関与しているかはほとんどわかっていなかった。そこで、本発明の課題は、CKDの主要な合併症のひとつである腎性貧血に、これらの尿毒症物質がどのように関与しているか明らかにすることを課題とした。
【課題を解決するための手段】
【0012】
本発明者らは、尿毒症物質のひとつであるインドキシル硫酸(IS;Indoxyl Sulfate)が、GATA3の発現やSLCO4C1トランスポーターの発現に与える影響を調べ、エリスロポエチン産生に与える作用とその機序を検証した。さらに、活性炭(クレメジン)がSLCO4C1トランスポーターの発現を増強し、内因性エリスロポエチンの発現を増強することを見いだし、本発明を完成するに至った。
【0013】
すなわち本発明は、(1)尿毒症物質吸着剤を有効成分とする内因性エリスロポエチン発現増強剤や、(2)尿毒症物質吸着剤が活性炭である上記(1)記載の内因性エリスロポエチン発現増強剤や、(3)活性炭が球形吸着炭である上記(2)記載の内因性エリスロポエチン発現増強剤や、(4)上記(1)〜(3)のいずれか記載の内因性エリスロポエチン発現増強剤を含む腎性貧血治療薬に関する。
【0014】
また、本発明は(5)尿毒症物質吸着剤を有効成分とする有機イオントランスポーター発現増強剤や、(6)尿毒症物質吸着剤が活性炭である上記(5)記載の有機イオントランスポーター発現増強剤や、(7)活性炭が球形吸着炭である上記(6)記載の有機イオントランスポーター発現増強剤や、(8)有機イオントランスポーターが、有機アニオントランスポーターSLCO4C1である上記(5)〜(7)のいずれか記載の有機イオントランスポーター発現増強剤や、(9)上記(5)〜(8)のいずれか記載の有機イオントランスポーター発現増強剤を含む尿毒症物質排泄増強剤に関する。
【発明の効果】
【0015】
本発明の活性炭を有効成分とする内因性エリスロポエチン発現増強剤によれば、生体内で発現するエリスロポエチン量を増強し、腎性貧血を治療することができる。また、本発明の活性炭を有効成分とする有機アニオントランスポーターSLCO4C1発現増強剤によれば、SLCO4C1量を増加させ、尿毒症物質排泄作用を増強することができる。
【図面の簡単な説明】
【0016】
【図1】エリスロポエチン産生ヒト肝細胞株Hep3Bに尿毒症物質(アニオン)を添加し、エリスロポエチン産生能への影響を調べた結果を示す図である。
【図2】エリスロポエチン産生ヒト肝細胞株Hep3Bに尿毒症物質(カチオン)を添加し、エリスロポエチン産生能への影響を調べた結果を示す図である。
【図3】HK−2細胞においてインドキシル硫酸(IS)がSLCO4C1のmRNA発現を抑制することを示す図である。
【図4】HK−2細胞においてインドキシル硫酸(IS)がGATA3のmRNA発現を増強することを示す図である。
【図5】腎不全ラットおいて、クレメジン投与によりSLCO4C1のmRNA発現が増強されることを示す図である。
【図6】ACHN細胞においてインドキシル硫酸(IS)や1−メチルアデノシン(1-Methyladenosine)がエリスロポエチンの発現を転写レベルで抑制することを示す図である。
【図7】ACHN細胞においてインドキシル硫酸(IS)がSLCO4C1の発現を転写レベルで抑制し(左のグラフ)、GATA3の発現を転写レベルで増強する(右のグラフ)ことを示す図である。
【図8】腎性貧血患者に対するクレメジン投与により、エリスロポエチンの発現が増強されることを示す図である。
【図9】クレメジンが尿毒症物質を吸着、排除し、尿毒症物質によるGATA3の発現増強及びSLCO4C1トランスポーターの発現抑制を抑えることにより、SLCO4C1トランスポーターやエリスロポエチンの発現を増強する機序を表す図である。
【発明を実施するための形態】
【0017】
本発明における尿毒症物質吸着剤としては、尿毒症物質を吸着し体外に排出することにより体内の尿毒症物質を減少させ、それにより尿毒症物質が増強していたGATA3の発現が減少し、GATA3によるエリスロポエチンの発現抑制が解除されて内因性エリスロポエチンの発現が増強される目的で使用できる尿毒症物質を吸着する物質や、GATA3による有機イオントランスポーターの発現抑制が解除されて、有機イオントランスポーターの発現が増強される目的で使用できる尿毒症物質を吸着する物質であれば特に制限されない。例えば、活性炭、有機ポリマー、ゼオライトや白土、クレイなどの無機吸着剤、デンプン類やセルロース類、キチンやキトサン等の経口吸着剤を挙げることができ、中でも活性炭が好ましい。さらに、活性炭の中でも、石油系炭化水素由来の微多孔質炭素を高温で酸化・還元処理して得た黒色粒子であり、直径0.05〜2mm、好ましくは直径0.1〜1mm、さらに好ましくは直径0.2〜0.4mmの、無数の細孔を有する高純度炭素微粒子である球形吸着炭が好ましい。かかる球形吸着炭は、市販の製品、クレメジン(Kremezin、登録商標)として入手することができ、例えば呉羽化学工業株式会社製「クレメジン(登録商標)細粒」や「クレメジン(登録商標)カプセル200」、マイラン製薬株式会社製「球形吸着炭細粒マイラン」を使用することができる。本明細書においては、これらの球形吸着炭を総称してクレメジンと記載することもある。
【0018】
本発明の内因性エリスロポエチン発現増強剤の好ましい態様は、尿毒症物質吸着剤として球形吸着炭を有効成分とするものであり、その有効量を、ヒトを含む哺乳動物に投与することによってエリスロポエチンの発現量を増強することができるものであり、賦形剤等の担体と併用することにより薬剤やサプリメントとすることができる。この薬剤やサプリメントを腎不全のヒトを含む哺乳動物に投与することによって、生体内のエリスロポエチンの発現量が増加し、腎性貧血の予防又は治療に利用することができる。かかるエリスロポエチンとしては、例えばマウスエリスロポエチン遺伝子(NM_007942;GenBankアクセッション番号)、ラットエリスロポエチン遺伝子(NM_017001)やヒトエリスロポエチン遺伝子(NM_000799)、及びこれらから発現するタンパク質などを挙げることができる。
【0019】
本発明の有機イオントランスポーター発現増強剤の好ましい態様は、尿毒症物質吸着剤として球形吸着炭を有効成分とするものであり、その有効量を、ヒトを含む哺乳動物に投与することによって有機イオントランスポーターの発現量を増強することができる薬剤である。この薬剤は、腎不全のヒトを含む哺乳動物に投与することによって、有機イオントランスポーターの発現量を増加させることにより、尿毒症物質の排出を増加させることができる。有機イオントランスポーターとしては、SLCO4C1、OCT1(organic cation transporter1)、OCT2及びOCT3、OCTN1(novelorganic cation transporter1)やOCTN2、OAT1(organic anion transporter1)、OAT2及びOAT3を挙げることができ、中でも有機アニオントランスポーターであるSLCO4C1を好適に示すことができる。かかるSLCO4C1としては、ラットSLCO4C1遺伝子(NM_001002024)、マウスSLCO4C1遺伝子(NM_172658)やヒトSLCO4C1遺伝子(AY273896)、及びこれらから発現する発現するタンパク質などを挙げることができる。
【0020】
上記本発明の内因性エリスロポエチン発現増強剤を含む本発明の腎性貧血治療薬や、上記本発明の有機イオントランスポーター発現増強剤を含む本発明の尿毒症物質排泄増強剤は、経口的に投与されるが、その投与量は、対象(動物又はヒト)、年齢、個人差、病状などに依存する。例えば、球形吸着炭(クレメジン)をヒトに経口投与する場合の投与量は、通常1日当たり、クレメジン0.1〜100g、好ましくは1〜50g、さらに好ましくは3〜20gであり、1回又は2〜4回に分けて服用してもよく、また症状により投与量を適宜増減してもよい。例えば、クレメジン等の活性炭は、顆粒、錠剤、糖衣錠、カプセル剤、スティック剤、分包包装体又は懸濁剤などの任意の投与形態で与えることができる。なお、本明細書における腎性貧血治療薬及び尿毒症物質排泄増強剤の投与対象は、ヒトだけでなく、他の非ヒト動物含むが、ヒト及び非ヒト哺乳動物が好ましく、ヒトがより好ましい。
【実施例】
【0021】
以下、実施例によって本発明を具体的に説明するが、これらは本発明の範囲を限定するものではない。
【0022】
本願発明者らは、キャピラリー電気泳動質量分析計(CE−MS)を用いてCKD患者41名の血清を解析し、腎機能の評価である推定糸球体濾過量(estimated glomerular filtration rate:eGFR)の低下と共に蓄積する尿毒症物質としてインドキシル硫酸を含めた52個(うち新規物質36個)を同定した(非特許文献3、特願2009−205033)。このうち31種類の尿毒症物質化合物を入手し、これらの化合物を含んだ培地で、低酸素条件下でエリスロポエチン産生が誘導される細胞を培養し、エリスロポエチン産生能への影響を以下の方法で評価した。
【0023】
エリスロポエチン産生ヒト肝細胞株Hep3B(ATCC(American Type Culture Collection)より入手)は、100U/mLペニシリン(GIBCO社製)、100μg/mLストレプトマイシン(GIBCO社製)、10%ウシ胎児血清(GIBCO社製)を含むDulbecco’s modified Eagle’s medium(DMEM)(GIBCO社製)で5%CO2/95%空気、37℃で維持した。各種薬物のエリスロポエチン産生能に対する影響を検討するために、12穴細胞培養プレートに1穴あたり1×105個のHep3B細胞をまき、24時間後に培養液を被検物質(各1mM、1−メチルアデノシンは0.1mM)あるいは1%DMSO又は水が入った培養液に交換した。コントロール群は通常の培養細胞装置で5%CO2/95%空気、37℃の条件で、エリスロポエチン産生誘導群は低酸素チャンバーを用いて5%CO2/1%O2、37℃の低酸素条件で24時間培養した。24時間培養の後、上清中のエリスロポエチンの濃度をBender Med Systems社製のヒトエリスロポエチンELISAキットを用いて測定し、また細胞のタンパク濃度をBio-Rad社製のBCA蛋白測定キットを用いて測定した。測定した上清中のエリスロポエチン量の値を、細胞のタンパク質量の値で割り、一定細胞量あたりのエリスロポエチン産生量を算出した。さらに1%DMSO又は水を含む培養液、5%CO2/1%O2、37℃条件下で培養した場合の一定細胞量あたりのエリスロポエチン産生量を100%として、各被検物質を添加した場合のエリスロポエチン産生量を求めた。アニオンの被検物質を用いた場合の結果のグラフを図1に、カチオンの被検物質を用いた場合の結果のグラフを図2に示す。
【0024】
その結果、アニオンではインドキシル硫酸(Indoxyl sulfate:IS)、イソクエン酸(Isocitrate)、シトラコン酸(Citraconate)、N−アセチル−L−グルタミン酸(N-Ace-L-Glu)、ホモバニリン酸(Homovanilate)、N−アセチル−アスパラギン酸−グルタミン酸(N-Ace-Asp-Glu)、マンデル酸(Mandelate)、L−システイン−S−硫酸(L-cystein-S-sulfate)、カチオンではヒポタウリン(Hypotaurine)、1−メチルアデノシン(1-Methyladenosine)、インドール−3−酢酸(Indole-3-acetate)、キヌレニン(Kynurenine)、N−モノメチル−アルギニン(NMMA)の13種類の物質(図1、2にアスタリスク及びシャープで示す)は、その添加によりエリスロポエチン産生能の有意な低下が認められた。
【0025】
[インドキシル硫酸によるSLCO4C1発現抑制作用]
HK−2細胞におけるインドキシル硫酸(IS)によるSLCO4C1発現抑制作用について検証した。6穴細胞培養プレートに5×105個のHK−2細胞を蒔いた後、24時間インキュベーションした。その後インドキシル硫酸(0.3、1、3mMの3濃度)又は水を含んだ培地に交換し、24時間インキュベーションした後にRNAを抽出した。SuperScript III(Invitrogen社製)を用いてcDNAを作製したのち、GAPDHを内部標準としてSLCO4C1のmRNAの発現を定量PCRで測定した。細胞培養培地には腎上皮細胞培養キット(Lonza社製)を用い、定量PCRはTaqMan(登録商標)Gene Expression Assaysを使用し(GAPDH;Assay ID: Rn99999916_s1、SLCO4C1;Assay ID: Rn01427754_m1のTaqMan(登録商標)プローブ(Applied Biosystems社製)を使用)、Step One Plus Real-Time PCR System(Applied Biosystems社製)により行った。その結果、インドキシル硫酸の濃度依存的にSLCO4C1のmRNAの発現が抑制されることが示された(図3)。すなわち、尿毒症物質のひとつであるインドキシル硫酸は、SLCO4C1の発現を抑制することにより、尿毒症物質の排出を抑制して腎不全を亢進する可能性が示唆された。
【0026】
[インドキシル硫酸によるGATA3発現誘導作用]
HK−2細胞におけるインドキシル硫酸(IS)によるGATA3発現誘導作用について検証した。6穴細胞培養プレートに5×105個のHK−2細胞を蒔いた後、24時間インキュベーションした。その後インドキシル硫酸(0.3、1、3mMの3濃度)又は水を含んだ培地に交換し、24時間インキュベーションした後にRNAを抽出した。SuperScript III(Invitrogen社製)を用いてcDNAを作製したのち、GAPDHを内部標準としてGATA3のmRNAの発現を定量PCRで測定した。細胞培養培地には腎上皮細胞培養キット(Lonza社製)を用い、定量PCRはTaqMan(登録商標)Gene Expression Assaysを使用し(GAPDH;Assay ID: Rn99999916_s1、GATA3;Assay ID: Hs00231122_m1のTaqMan(登録商標)プローブ(Applied Biosystems社製)を使用)、Step One Plus Real-Time PCR System(Applied Biosystems社製)により行った。その結果、インドキシル硫酸の濃度依存的にGATA3のmRNAの発現が誘導されることが示された(図4)。すなわち、尿毒症物質のひとつであるインドキシル硫酸は、エリスロポエチンの発現を抑制する因子であるGATA3の発現を誘導することにより、エリスロポエチンの発現を抑制する可能性が示唆された。
【0027】
[腎不全ラットおけるクレメジン投与によるSLCO4C1発現誘導作用]
次に、尿毒症物質を吸着することにより体外に排出する機能を有する球形吸着炭、クレメジンが、腎不全ラットにおけるSLCO4C1のmRNA発現へ与える影響を調べた。10週齢のオスのWistarラットに対し5/6腎摘出を施し、慢性腎不全ラットを作成した。腎摘後10週に血圧、採血、24時間蓄尿を行い、コントロール群13、クレメジン群11に振り分け、クレメジン(粉餌に8%混合)投与を開始した。4週間投与を行った後に再び血圧測定、採血、24時間蓄尿を行った後、安楽死させた。摘出腎臓からRNAを抽出し、SuperScript III(Invitrogen社製)を用いてcDNAを作製した後、GAPDHを内部標準としてSLCO4C1のmRNA発現を測定した(図5)。クレメジン4週投与後のCcr(クレアチニンクリアランス;Creatinine Clearance)が1.0ml/minから2.0ml/minのラット(コントロール10、クレメジン8)に対しSLCO4C1のmRNAの発現量をt検定にて検定したところ、有意差が確認された。すなわち、腎不全ラットに対するクレメジン投与により、SLCO4C1の発現が増強されることが確認された。
【0028】
[インドキシル硫酸及び1−メチルアデノシンによるエリスロポエチン発現抑制作用]
インドキシル硫酸及び1−メチルアデノシンがエリスロポエチン転写活性へ与える影響を調べるため、マウスエリスロポエチン遺伝子の5’上流域を用いたルシフェラーゼアッセイを以下の方法で行った。
【0029】
[プラスミドDNA]
マウスエリスロポエチン遺伝子の5’上流転写調節領域のプロモーター活性ルシフェラーゼアッセイ用のプラスミドベクターHE-mPro-lucは、マウスエリスロポエチン遺伝子のエクソン1の翻訳開始点を起点として−571から+53bpの長さの領域を制限酵素XbaIとSacIで切り出し、ルシフェラーゼレポーターベクターpXP2(Nordeeen SK. BioTechniques. 6:454-453.1988) に挿入して作製した。
【0030】
[培養細胞]
ヒト腎癌由来培養細胞株ACHNはRPMI1640培地(GIBCO社製)に最終濃度で10%ウシ胎児血清(FBS)(GIBCO社製)、100IU/mlペニシリンと10μg/mlストレプトマイシン(GIBCO社製)となるように添加し、37℃、5%CO2濃度の条件で培養した。
【0031】
[トランスフェクションとルシフェラーゼレポーターアッセイ]
Hep3B細胞は24穴細胞培養プレートに1穴あたり10×104個の細胞数で調整して継代し、検鏡下で70−80%の細胞密度となったHep3B細胞に対してルシフェラーゼレポーターアッセイ用のプラスミドDNAのトランスフェクションを施行した。トランスフェクション用の溶液組成は1穴あたりHE-mPro-luc 2μg、pRh-TK(Promega社製)50ng、Lipofectamine2000(Invitrogen社製)2μlをOptiMEM−I(GIBCO社製)100μlに混合してから室温で20分インキュベーションして調製し、無血清のOptiMEM−I培地0.5mlでプレインキュベーションした24穴細胞培養プレートACHN細胞に添加した後、37℃、5%CO2/95%空気の条件にて無血清かつ抗生物質添加無しで4時間インキュベーションした。その後、インドキシル硫酸(10μM)、1−メチルアデノシン(1μM)、又はDMSO(0.1%)を添加した通常培地(RPMI1640/10%FBS/100IU/mlペニシリン、10μg/mlストレプトマイシン)に交換し、さらに37℃、5%CO2/1%O2の低酸素条件で36時間インキュベートした。その後、培地を無血清のPBS 0.5mlに交換して細胞を穏やかに洗浄後PBSを吸引除去する作業を2回施行してから、passive lysis buffer(Promega社製)100μlを加えて20分室温にて混和し溶解した。ルシフェラーゼレポーターアッセイはDual Luciferase Reporter Assay System(Promega社製)を使用し、測定はルミノメーターLumat LB9507(NERTHOLD TECHNOLOGIES社製)を用いてFire fly及びRenillaのルシフェラーゼ量を測定した。そして、Fire flyルシフェラーゼ量をRenillaルシフェラーゼ量で割ることにより、エリスロポエチン遺伝子の転写活性を算出した。
【0032】
その結果、DMSOを添加したコントロールに比べ、インドキシル硫酸の添加によりエリスロポエチン遺伝子の転写活性は53%、1−メチルアデノシンの添加によりエリスロポエチン遺伝子の転写活性63%に減少した(図6)。すなわち、尿毒症物質であるインドキシル硫酸及び1−メチルアデノシンがエリスロポエチン遺伝子の転写活性を有意に低下させることが明らかとなった。
【0033】
[インドキシル硫酸によるSLCO4C1発現抑制及びGATA3発現誘導作用]
次に、インドキシル硫酸及び1−メチルアデノシンがSLCO4C1遺伝子転写活性へ与える影響を調べるため、ヒトSLCO4C1遺伝子の5’上流転写調節領域及びGATA3遺伝子の5’上流転写調節領域のプロモーター活性を検出するルシフェラーゼアッセイを以下の方法で行った。
【0034】
[プラスミドDNA]
SLCO4C1遺伝子の5’上流転写調節領域のプロモーター活性ルシフェラーゼアッセイ用のプラスミドベクターSLCO4C1-3886/+110-pGL3cは、翻訳開始点より−3886から+110bpの長さの領域をPCR法を用いて増幅し、pGL3 basic luciferase expression vector(Promega社製)に挿入して作製した。GATA3遺伝子の5’上流転写調節領域のプロモーター活性ルシフェラーゼアッセイ用のプラスミドベクターpGATA3-lucは、GATA3プロモーター領域の3.5kbを制限酵素BamHIとNcoIで切り出し、ルシフェラーゼ蛋白をコードする2kbの遺伝子カセットと連続してpBluscriptSK+(Novagen社製)ベクターに挿入することで作製した。
【0035】
[トランスフェクションとルシフェラーゼレポーターアッセイ]
ACHN細胞は上述の方法で維持し、24穴細胞培養プレートに1穴あたり20×104個の細胞数で調整して継代し、検鏡下で70−80%の細胞密度となったACHN細胞に対してルシフェラーゼレポーターアッセイ用のプラスミドDNAのトランスフェクションを施行した。トランスフェクション用の溶液組成は、1穴あたりFire fly luciferase vector(SLCO4C1-3886/+110-pGL 1.2μg又はpGATA3-luc 2μg)、Renilla Luciferase Reporter VectorとしてpRh-TK (Promega社製)50ng、トランスフェクション試薬としてLipofectamine2000(Invitrogen社製)2μlを無血清培地のOptiMEM−I(GIBCO社製)100μlに混合してから室温で20分インキュベーションして調製した。このトランスフェクション用溶液を、無血清のOptiMEM−I培地0.5mlでプレインキュベーションした24穴細胞培養プレートのACHN細胞に添加し、37℃、5%CO2にて無血清かつ抗生物質添加無しで4時間インキュベーションした。その後培地をインドキシル硫酸(100μM)又はDMSOを添加した通常培地(10%FBS、100IU/mlペニシリン、10μg/mlストレプトマイシンを含むRPMI1640培地)に交換し、さらに37℃、5%CO2にて44時間インキュベーションした。その後に、培地を無血清のPBS0.5mlに置換して細胞を穏やかに洗浄しPBSを吸引除去する作業を2回施行してから、passive lysis buffer(Promega社製)100μl加えて20分室温にて混和し溶解した。ルシフェラーゼレポーターアッセイはDual Luciferase Reporter Assay System(Promega社製)にて、ルミノメーターLumat LB9507(NERTHOLD TECHNOLOGIES社製)を用いてFire fly及びRenillaのルシフェラーゼ量を測定した。そして、Fire flyルシフェラーゼ量をRenillaルシフェラーゼ量で割ることにより、SLCO4C1遺伝子及びGATA3遺伝子の転写活性を算出した。
【0036】
DMSOを添加したコントロールサンプルの転写活性を1とした場合の、インドキシル硫酸を添加した場合のSLCO4C1遺伝子又はGATA3遺伝子の転写活性を図7に示す。その結果、インドキシル硫酸添加により、SLCO4C1遺伝子の転写活性が減少し、GATA3の転写活性が増加することが示された。すなわち、インドキシル硫酸は、転写レベルでSLCO4C1遺伝子発現を減少させ、GATA3遺伝子発現を増加させる制御を行うことが示された。
【0037】
[腎性貧血患者に対するクレメジン投与によるエリスロポエチン発現増強作用]
腎性貧血を示す腎不全疾患の成人男性3人、女性1人の計4人の患者に、クレメジンを1日6g、3回に分けて、22ヶ月にわたり投与した。クレメジン投与の前と後に血液を採取し、血中のエリスロポエチンの濃度をBender Med Systems社製のヒトエリスロポエチンELISAキットを用いて測定した。その結果、クレメジン投与前と比較して、クレメジン投与後には、血液中のエリスロポエチン量が3人で増加し、一人では変化がなかった(図8)。腎不全によりエリスロポエチン量が減少することが知られており、すなわち、クレメジン投与により、内因性エリスロポエチンの発現量が増加した結果、エリスロポエチン量の減少が防がれ、増加したことが示唆された。
【0038】
以上より、尿毒症物質のひとつであるインドキシル硫酸が、GATA3の発現を増強すること、SLCO4C1トランスポーターの発現を抑制すること、さらにエリスロポエチンの発現を抑制することが明らかになった。そして、クレメジンの投与により、SLCO4C1トランスポーターの発現が増強し、エリスロポエチン発現も増強されることが示された。これは、クレメジンに尿毒症物質が吸着、排除されることによって、尿毒症物質によるGATA3の発現増強及びSLCO4C1トランスポーターの発現抑制が抑えられ、それにより、GATA3によるエリスロポエチンの発現抑制が解除され、またSLCO4C1トランスポーターの発現が増強されることによりSLCO4C1トランスポーターによる尿毒症物質の排泄が促進されることにより、内因性エリスロポエチン発現も増強されると考えられる(図9)。
【0039】
[腎不全ラットにおけるクレメジン投与により変動する物質のCE−MS解析]
10週齢のオスのWistarラットに対し5/6腎摘出を施し、慢性腎不全ラットを作成した。基本飼料を与えた慢性腎不全ラット(n=12)をコントロール群、クレメジンを添加した飼料(粉餌に8%混合)を与えた慢性腎不全ラット(n=10)をクレメジン群、クレメジを添加した飼料(粉餌に8%混合)を与えた正常なWistarラットをSham群(n=3)とした。4週間飼育した後、血漿サンプルを採取し、以下の方法でCE−MS分析を行った。内標準物質を調整したメタノール溶液を各血漿サンプルに添加して撹拌し、さらにクロロホルムを加えて撹拌し、4600gで5分間遠心分離した後、上清を限外ろ過フィルター(分画分子量5000)にとり、4℃、9100gで2時間遠心分離した後、ろ液を遠心濃縮してCE−TOFMSにて測定を行った。
【0040】
その結果、コントロール群とクレメジン群で有意差のあるアニオン6物質は、4−オキソペンタン酸(4-oxopentanoate)、o−ヒドロキシ安息香酸(o-Hydroxybenzoate)、馬尿酸(Hippurate)、3−インドキシル硫酸(3-Indoxyl sulfate)、N−アセチルノイラミン酸(N-Acetylneuraminate)、コール酸(Cholate)であり、これらは全てコントロール群に比べクレメジン群で低い値であった。また、コントロール群とクレメジン群で有意差のあるカチオン15物質は、グリシン(Glycine)トリメチルアミンN−オキシド(Trimethylamine N-oxide)、ヒポタウリン(Hypotaurine)、シトシン(Cytosine)、ニコチン酸アミド(Nicotinamide)、イミダゾール−4−酢酸(Imidazole-4-acetate)、クレアチン(Creatine)、アスパラギン(Asparagine)、γ−グアニジノブチラート(γ-Guanidinobutyrate)、γ−ブチロベタイン(γ-Butyrobetaine)、グルタミン(Glutamine)、アラントイン(Allantoin)、N−γ−エチルグルタミン(N-γ-Ethylglutamine)、トリプトファン(Tryptophan)、グリセリルホスホリルコリン(Glycerophosphorylcholine)であり、このうちトリメチルアミンN−オキシドとトリプトファンはコントロール群に比べクレメジン群で有意に高い値であった。また、カチオンである5−メチルシトシン(5-Methylcytosine)とアントラニル酸(Anthranilate、別名o−アミノ安息香酸)はコントロール群のみで検出され、Shamやクレメジン群ではほとんど検出されなかった。
【産業上の利用可能性】
【0041】
本発明は、腎性貧血治療薬や、尿毒症物質排泄薬の分野に好適に利用することができる。
【特許請求の範囲】
【請求項1】
尿毒症物質吸着剤を有効成分とする内因性エリスロポエチン発現増強剤。
【請求項2】
尿毒症物質吸着剤が活性炭である請求項1記載の内因性エリスロポエチン発現増強剤。
【請求項3】
活性炭が球形吸着炭である請求項2記載の内因性エリスロポエチン発現増強剤。
【請求項4】
請求項1〜3のいずれか記載の内因性エリスロポエチン発現増強剤を含む腎性貧血治療薬。
【請求項5】
尿毒症物質吸着剤を有効成分とする有機イオントランスポーター発現増強剤。
【請求項6】
尿毒症物質吸着剤が活性炭である請求項5記載の有機イオントランスポーター発現増強剤。
【請求項7】
活性炭が球形吸着炭である請求項6記載の有機イオントランスポーター発現増強剤。
【請求項8】
有機イオントランスポーターが、有機アニオントランスポーターSLCO4C1である請求項5〜7のいずれか記載の有機イオントランスポーター発現増強剤。
【請求項9】
請求項5〜8のいずれか記載の有機イオントランスポーター発現増強剤を含む尿毒症物質排泄増強剤。
【請求項1】
尿毒症物質吸着剤を有効成分とする内因性エリスロポエチン発現増強剤。
【請求項2】
尿毒症物質吸着剤が活性炭である請求項1記載の内因性エリスロポエチン発現増強剤。
【請求項3】
活性炭が球形吸着炭である請求項2記載の内因性エリスロポエチン発現増強剤。
【請求項4】
請求項1〜3のいずれか記載の内因性エリスロポエチン発現増強剤を含む腎性貧血治療薬。
【請求項5】
尿毒症物質吸着剤を有効成分とする有機イオントランスポーター発現増強剤。
【請求項6】
尿毒症物質吸着剤が活性炭である請求項5記載の有機イオントランスポーター発現増強剤。
【請求項7】
活性炭が球形吸着炭である請求項6記載の有機イオントランスポーター発現増強剤。
【請求項8】
有機イオントランスポーターが、有機アニオントランスポーターSLCO4C1である請求項5〜7のいずれか記載の有機イオントランスポーター発現増強剤。
【請求項9】
請求項5〜8のいずれか記載の有機イオントランスポーター発現増強剤を含む尿毒症物質排泄増強剤。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【公開番号】特開2012−82181(P2012−82181A)
【公開日】平成24年4月26日(2012.4.26)
【国際特許分類】
【出願番号】特願2010−231709(P2010−231709)
【出願日】平成22年10月14日(2010.10.14)
【出願人】(899000035)株式会社 東北テクノアーチ (68)
【出願人】(000001100)株式会社クレハ (477)
【Fターム(参考)】
【公開日】平成24年4月26日(2012.4.26)
【国際特許分類】
【出願日】平成22年10月14日(2010.10.14)
【出願人】(899000035)株式会社 東北テクノアーチ (68)
【出願人】(000001100)株式会社クレハ (477)
【Fターム(参考)】
[ Back to top ]

