内皮細胞を含む微小凝集体
生検が行われた組織に含まれる、細胞の自然の環境を擬態する微小凝集体は、微小凝集体に含まれる細胞のタイプの生存能力に関し、様々な処置の効果の評価及び予測に用いられる。
【発明の詳細な説明】
【関連出願】
【0001】
この出願は、2005年12月16日に出願された米国仮出願番号第60/751,127の35U.S.C.§119(e)に基づく利益を主張し、この出願の開示も参照により本願開示中に組込まれる。
【技術分野】
【0002】
本発明は、自然の形態を維持する、微小凝集体(microaggregates)における組織の微小血管系(tissue microvasculature)の生存能力の研究に関し、より詳細には、この微小凝集体における微小血管系の生存及び/又は増殖の破壊、破裂、若しくは促進する方法の研究に関する。特に本発明は、腫瘍(特に、特異的及び直接的に新生血管系(neovasculature)の成長を阻害するもの)の処置(ないし治療)のための候補薬剤の効果の評価に有用である。
【背景技術】
【0003】
組織(正常及び腫瘍性)のサイズが増大するとき、それらの細胞は、細胞の成長を継続するために栄養を提供する微小毛細血管(microcapillaries)(血管新生)の形成を必要とする。それら微小毛細血管の構成物は、最も顕著に内皮細胞を含むが、関連した間葉細胞、線維芽細胞、平滑筋細胞及び周皮細胞を含む。血管新生は、例えば、創傷などの通常のプロセスで重要なだけでなく、例えば、癌、乾癬、糖尿病、リウマチ性関節炎及び加齢黄斑変性などの疾病においても重要である。
【0004】
正常組織及び疾病組織の両組織において、in vitroで微小毛細血管を研究するための改善方法が必要とされる。現在知られている方法の要約が提供される(例えば、Staton等の非特許文献1参照)。In vivoモデルは有用であるが扱い難い。In vitroモデルは、それほど扱い難くないが、より人工的であり、より適切でない。
【0005】
特に、腫瘍の微小血管系を標的とする、抗癌剤及び他の処置の活動を予測するための改善方法が必要とされる。例えば、ベバシズマブ(Avastin(商標))は、腫瘍の微小血管系を標的とする、FDA認可の抗癌剤である。Avastin(商標)の卸売りコストは、10ヶ月の処置で$40,000以上であり、まだ比較的少ない割合の患者のみ実質的な利益をうけるに止まる。顕著な関心ごとは、どの患者がそのような処置に最も応答しそうかについて予測し得る、バイオマーカーの同定である(例えば、Ince等の非特許文献2参照)。
【0006】
最も一般的に使用されているin vitro方法は、内皮細胞の分離及び培養を含む。細胞が一旦培養されると、多様な細胞増殖及び/又は細胞死のエンドポイントを用いて、薬剤の効果(又は他の障害(perturbation))が試験され得る。細胞増殖のエンドポイントの例は、放射性チミジンの取り込み、細胞数のカウント、BrdUの取り込み及びコロニー形成を含む。細胞死のエンドポイントの例は、細胞性ATPの測定、MTTのミトコンドリア減少、フルオレセイン二酢酸の代謝及び細胞間トラッピング(及びフルオレセイン二酢酸の損失)、色素排除による細胞膜完全性(cell membrane integrity)の損失、並びにTUNELアッセイ又はカスパーゼ発現などのアポトーシスのより特異的な測定を含む。幾つかの場合において、既に分離した内皮細胞は、既に分離した他の細胞と共に共培養されて、異なる細胞集団に関する薬剤の異なる影響が研究されている。
【0007】
他のin vitro方法は器官の培養物に基づく。例えば、非特許文献1を参照のこと。それらの方法は、ラット大動脈輪(aortic ring)、トリ大動脈弓、ブタの頚動脈、胎盤の静脈円板(vein disk)及び胎児マウス骨移植を含む。
【0008】
細胞培養のアッセイは明らかに欠点を有する。第一に、そのアッセイは生存可能な内皮細胞の分離及び培養に依存しており、特に、ヒトの新鮮な腫瘍の場合に問題になり得る。一旦分離されて培養されると、それらの細胞は自然のミクロな環境(native microenvironment)から移動させられ、そこには腫瘍細胞(又は、正常組織の場合の正常細胞)によって放出される因子は存在しない。原理的に、分離された腫瘍細胞(又は、正常細胞)が共培養されたとしても、これは、in vivoで存在する空間関係(spatial relation)及び細胞と細胞との相互作用に近似しないであろう。Staton等の非特許文献1に記載されているように、「腫瘍細胞によって放出される多数の因子及び腫瘍細胞自体が存在しないので、モデルは腫瘍増殖において出会う微小血管環境を正確に表していない」ということから、既存の器官の培養には同様の制限がある(例えば、非特許文献3も参照されたい)。
【0009】
ベバシズマブの効果を研究して予測する、非細胞培養、非器官培養、アプローチが開示されている(例えば、Ince等の非特許文献2参照)。Inceは、k-ras、b-raf及びp53状態をベバシズマブの処置効果と互いに関係づけることを試みたが、彼らは、“ベバシズマブ治療に応答しそうであった、転移性結腸直腸癌の患者のいずれのサブグループも同定しなかった”と結論づけた。彼らの議論において、Ince等は、“現在まで、ほとんどの研究では、クリニックでの血管新生を阻害する治療に対して、どの患者が応答しそうであるかを予測する上でのバイオマーカーの潜在的有用性が評価されなかった”、及び臨床的な利点を予測するマーカーは全く見出せなかった、と特記している。これらの著者は、“すべての血管新生制御因子の効果を集約するバイオマーカーが、単一の成長因子又はシグナル誘導経路(signal induction pathway)の分析よりも、患者の結果を良好に予測し得る”と提案しているが、この目的のためのin vitro方法は何も提案しなかった。代わりに、彼らは、患者自身が彼ら自身の結果を予測するための実験的なモデルとして用いられる作業が進行中であることに言及した。
【0010】
それらの研究において、ベバシズマブ(及び/又は他の処置(治療))は、トライアルベースで患者に投与され、次いで、“初期”の処置効果は、処置効果の病理組織学的評価と共に、外部診断スキャニング(external diagnostic scanning)(例えば、MRI)及び/又は処置後の腫瘍生検によって評価される(例えば、Willett等の非特許文献4参照)。このアプローチは、処置費用、最終的に無効治療の潜在的毒性に対する患者の曝露及び診断試験(例えば、MRI)費用も含め、多くの明らかな欠点を有する。このような研究もまた、in vitro方法で可能であるように、患者に対して危険なく、同時に複数の異なる処置をテストする性能を欠如する。
【0011】
明らかに、ヒトの腫瘍の微小血管系を研究するにあたり、有用なin vitroモデルの不足は、腫瘍の微小血管系を標的とする、革新的で、より効果的な処置のアプローチの同定及び開発に対する障害である。
【非特許文献1】Staton, et al., "Current Methods for Assaying Angiogenesis in vitro and in vivo," Int J Exp Path (2004) 85:233-248
【非特許文献2】Ince, et al., "Association of k-ras, b-raf, and p53 Status with the Treatment Effect of Bevacizumab," J natl cancer Inst (2005) 97:981-989
【非特許文献3】Auerbach, et al., "Angiogenesis assays: problems pitfalls," Cancer Metastasis Rev. (2000) 19:167-172
【非特許文献4】Willett, et al., Nature Med (2004) 10:145-147
【発明の開示】
【0012】
本発明の組成物及び方法は、化学的、生物的及び/又は物理的処置に応答する、生検が行われた腫瘍又は正常組織から分離される、細胞の微小凝集体(microaggregates)の微小血管系における変化(例えば、生存能力の変化)を検出及び/又は定量できる。これらの微小凝集体がin vivo状態を擬態するので、一般的に、分離された微小凝集体に対して処置が施される。また、時に、in vivoで施される、処置の結果を決定するために、これらの分離体を活用することが有用である。
【0013】
観察された微小血管及び他の細胞の変化が、テストされた処置のin vivo活動を予測するテストとして役に立ち、したがって、本発明の方法は、内皮(endothelial)細胞に対する特定の効果を検出できる一方で、その周辺(surrounding)細胞における同様の又は同時に施された処置の効果の観察もできる。したがって、特定の薬剤は、内皮細胞とその周辺細胞の両細胞に作用し得る。
【0014】
これらの方法は、新規な又は検査ないし研究的(investigational)処置の発見及び/又は開発を支援するために使用され得る。
【0015】
したがって、一つの視点において、本発明は、少なくとも生存可能な内皮細胞と自然な周辺の生存可能な非内皮細胞(natively surrounding viable non-endothelial cells)とを含んで構成される分離した微小凝集体(microaggregate)を対象とし、この微小凝集体は顕微鏡観察に適した表面に提示される。微小凝集体は、生検された組織から調製され、生検材料が採取された組織(腫瘍又は正常)のミクロ生態系を表す。したがって、生存可能な内皮細胞はそれら細胞の自然の形態で存在し、その自然の形態は腫瘍細胞(癌の場合)、正常の組織細胞、結合組織細胞、炎症細胞及び他の自然に関連した細胞を含み得る。内皮細胞は、毛細血管の構成要素である内皮細胞と他の細胞を含んで、微小毛細血管自体の正常部分(intact segments)を含み得る。微小凝集体は、幾つか(several)ないし数十ないし数百ないし数千(several to tens to hundreds to thousands)の細胞を含んでよい。
【0016】
微小凝集体は、標準組織及び/又は器官の培養器で、標準組織及び/又は器官の培養培地では、数週ないし数日ないし数時間の期間(a period of hours to days to weeks)、適切な栄養(及び栄養補助剤)を含み、培養されてよい。培養することは、微小凝集体に含まれる内皮細胞と、さらに周辺細胞でも同様に、両細胞について、様々な処置又は要因若しくはプロトコールの効果を評価する機会を提供する。
【0017】
別の視点において、本発明は、少なくとも生存可能な内皮細胞と自然な周辺の生存可能な非内皮細胞とを含んで構成される分離した微小凝集体を調製する方法に関し、この方法における微小凝集体は顕微鏡観察に適した表面に沈着(沈降)される。この方法は、細かく切り刻まれた生検サンプルに、本明細書でクイックスピン(quickspin)と称する一連の遠心分離ステップを施すことを含む。これは下記でより詳細に記載される。各ステップにおいて、サンプルは、50−500xgの力を受けるようにもたらされ、次いで、直ちに1xgに戻されて、細胞クラスタペレット及び上澄みを得る。上澄みが除去され、ペレットが再懸濁されて、適切に分離された微小凝集体が形成されるまでこのプロセスが繰り返される。
【0018】
次いで、微小凝集体は、任意で、上述したように培養でき、又は顕微鏡検査のための表面上に直ちに沈降できる。あるいは、微小凝集体の初期調製は、生存可能な細胞から排除(excluded)される色素指示薬(ないし標識染料(indicator dye))で処理できるか、又は、色素での処理は培養中若しくは培養後に施すことができるが、いずれの場合にせよ、微小凝集体の表面への沈降に先立ってなされる。また別の代替として、上記の色素指示薬は、表面への沈降がなされた後に適用されてよい。
【0019】
好ましい視点において、本発明は、内皮細胞の死を特異的にもたらす薬剤を同定する方法を提供し、この方法は、上記で調製した分離された微小凝集体を候補薬剤で処理すること、効果をもたらすように薬剤に十分な時間を及ぼさせること、生存可能な細胞から排除される第一指示薬で微小凝集体を処理すること、及び微小凝集体での細胞による指示薬の取り込み又は取り込みの欠損を観察することを含み、それによって、その周辺細胞ではなく、内皮細胞で上記指示薬の取り込みに作用する薬剤が、内皮細胞の死を特異的にもたらす薬剤として同定される。
【0020】
本発明の様々な他の視点が下記の記載から明らかになるであろう。
【発明を実施するための最良の形態】
【0021】
一つの視点において、本発明は、自然の状態を擬態する、微小凝集体で生存可能な組織の微小血管(microvascularity)を研究ないしテストする方法を対象とする。この方法は、生検された組織からの細胞の微小凝集体又はクラスタ(cluster)の分離を含む。それらのクラスタは、生検材料が採取された組織(腫瘍又は正常)のミクロ生態系を表し、腫瘍細胞(癌の場合)、正常の組織細胞、結合組織細胞、炎症細胞、及び、幾つかの場合には、毛細血管の構成要素である内皮細胞と他の細胞を含み、微小毛細血管の正常部分を含む。このクラスタは、幾つか(several)、数十、数百、数千の細胞を含んでよい。次いで、このクラスタは、標準的な組織及び/又は器官の培養器で培養されてよく、標準的な組織及び/又は器官の培養培地(適切な栄養及び栄養補助剤を含む)で、数時間ないし数日ないし数週の期間で培養されてよい。細胞は、微小毛細血管及び/又は微小毛細血管の構成細胞に対して潜在的に影響を及ぼすと推定される様々な処置に生検(つまり、患者の)に先立ってか、又は生検後であるが細胞培養の前か、又は培養期間中に曝されてよい。処置は、微小毛細血管及び/又は構成細胞の生存及び/又は増殖を、損傷、死滅、促進あるいは増強し得る。
【0022】
これらの処置後、微小凝集体での細胞の存在及び/又は生存能力は、生存可能でない細胞をラベルする第一指示薬の物質又は染料を添加することによって評価され(例えば、ファーストグリーン色素(fast green dye)、フルオレセイン二酢酸、等)、所望であれば、第二指示薬(生存可能な細胞をラベルする、例えば、細胞若しくは組織染色、H/Eなど)を添加する。顕微鏡スライドなどの表面へのクラスタ(clusters)の沈降又は沈着(限定されないが、例えば、細胞遠心分離(cytocentrifugation))は、一つ又は2以上の染料が添加される前後のいずれかで行われる。所望の場合、第一指示薬の添加は省略されてよい。所望の場合、クラスタ内の特定の細胞の同定を支援するために、第三指示薬(例えば、抗原に対する免疫細胞化学染色、CD31など)が添加されてよい。次いで、表面が試験されて、細胞の状態が評価される。
【0023】
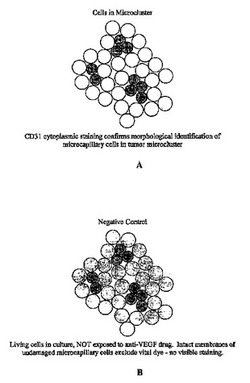
本発明の主題である、微小凝集体の特徴が、図1A−1Cに概略して示される。各場合において、生検がなされた組織から本明細書に記載されるように、細胞のマイクロクラスタ(microclusters)が調製されて示される。図1Aにおいて、内皮細胞はCD31での染色によって存在が確認され、それらの細胞は、明暗(shaded)をつけて示され、塗りつぶしのない円(ないしオープンサークル)(open circle)で示される付随的な細胞に囲まれている。図1A−1Cの概略図において、意図された処置は、抗VEGF薬剤に対する曝露である。図1Bは処置を施されていないネガティブコントロール(対照)を示しており、示されるように、このクラスタが生存細胞からは排除されるが死細胞からは排除されない色素に曝露されるとき、細胞は損傷を受けていないので外観上の変化は起こらない。しかしながら、図1Cにおいて、このクラスタが抗VEGF薬剤に対して曝露されたとき、色素は内皮細胞によって取り込まれ、したがって、それらは薬剤によって影響を受けたものとして同定される。塗りつぶしのない円(ないしオープンサークル)として示される周辺細胞は色素を取り込まずにそのままである。
【0024】
したがって、示されたクラスタを調製することによって、抗VEGF薬剤(説明のための使用例)に対する反応(応答)を示す、個々の内皮細胞の能力が実証される。
【0025】
したがって、一つの視点において、本発明の方法は、毛細血管関連細胞(capillary-associated cells)が混在した(interlaced)細胞の微小凝集体を分離することと、細胞のマイクロクラスタの一般的に多大な部分を含む非毛細血管関連細胞(non-capillary-associated cells)と対比して毛細血管関連細胞での選択的な変化が認識できる指示薬方法を活用することを含む。
【0026】
本発明は、腫瘍性及び/又は正常の組織由来の培養前及び/又は培養後の細胞の微小凝集体での微小血管の生存能力の検出を可能とし、その方法は、
“クイックスピン”の手段によって生検された細胞の微小凝集体を分離すること;
その微小凝集体を、顕微鏡スライドなどの表面に移動すること;
その微小凝集体を、ファーストグリーン染料及び/又はH/Eなどの色素で染色すること;及び
微小毛細血管関連細胞及び/又は周辺細胞の生存能力をスコアリングすることを含む。
【0027】
染色は、表面への移動の前後のいずれかで適用されてよい。
【0028】
培養期間中、細胞は、微小毛細血管及び/又は微小毛細血管の構成細胞及び/又は周辺細胞に対して影響を及ぼす可能性があると推定される様々な処置に曝露されてよい。処置としては、関連する観察細胞を損傷するか若しくは死滅させる処置、又は、微小毛細血管及び/若しくは構成細胞の生き残り及び/若しくは増殖を促進ないしは強化する処置が、研究され得る。
【0029】
より詳細には、それらの処置後、微小凝集体の細胞の存在及び/又は生存能力は、先ず、生存可能でない細胞を選択的にラベルする、第一指示薬の物質(例えば、ファーストグリーン色素、フルオレセイン二酢酸など)を添加することによって評価されてよく、続いて、顕微鏡スライド上にマイクロクラスタの沈降又は沈着がなされ(例えば、制限されないが、細胞遠心分離の具体的な方法によって)、続いて、有利な場合には、第二指示薬に対するスライド上のクラスタの曝露がなされる(例えば、ヘマトキシリン/エオシンなどの細胞若しくは組織染色)。この指示薬は生存可能な細胞によって排除されず、第一指示薬の視感度を増強するコントラスト(造影)剤として用いられる。あるいは、第一指示薬は、クラスタの沈着後に添加してもよい。さらに、所望の場合、第一指示薬の物質の添加は省略してもよい。加えて、所望の場合、クラスタ内の特定の細胞の同定を支援するために、第三指示薬の物質(例えば、CD31など、抗原に対する免疫細胞化学染色)が添加されてよい。この後、表面は顕微鏡検査され、微小血管系及び/若しくは他の周辺細胞の状態が、“マニュアル”方法によって、つまり、訓練された観察者及び/若しくはイメージアナライザーなどの機器の使用によって評価され、スコアリングされ、並びに/又は定量化される。微小血管系での細胞に対する影響に加えて、クラスタ(例えば、腫瘍細胞)内の他の細胞に対する薬剤の影響は、同時に又は異時性に試験されてよい。
【0030】
正常組織及び腫瘍組織のいずれかの組織又は両組織は、本発明の方法によってテストされ、薬剤又は他の処置の効果は、クラスタ内に存在する他の細胞と対比して毛細血管関連細胞において差異的(differentially)に決定され得る。
【0031】
様々な細胞の生存能力はまた、細胞培養期間無しで、生検後に短期で決定でき得る。毛細血管及び他の細胞の生存能力が測定でき得、例えば、処置を何ら受けていない患者、又は生検(針を用いて実施若しくは他の生検器具で実施)前に若干の期間の臨床処置を受けている患者で測定でき得る。
【0032】
本明細書で使用されるように、“処置”(treatment)とは微小凝集体の環境にもたらされる任意の意図的(deliberate)な変化を意味する。最も一般的には、処置は、微小凝集体の培養に対して、化学療法剤などの医薬品を添加することである。しかしながら、他の処置は、温度、pH、培養状態(条件)及び組成の変化を含んでよい。例えば、組成の変化は、供給される栄養分の変化、又は小さな分子若しくは小さなペプチドなど様々な化学物質の組み合わせである。処置はまた、ケモカインの封入又は意図的に投与(ないし管理)されたプロトコールを含んでよい。
【0033】
本明細書で使用されるように、“微小凝集体”(microaggregates)は、ここでテストされている細胞の自然の環境を効果的に擬態する、細胞の群を示す。一つの実施態様において、内皮細胞に対する処置の効果は興味深い。この場合、微小凝集体は少なくとも内皮細胞と、内皮細胞の自然環境の代理(ないし代替)を提供する十分な周囲細胞を含むであろう。理論上、単に一つの内皮細胞と一つの同伴的な細胞が含まれてよい。本出願において、“微小凝集体”、“マイクロクラスタ(microclusters)”及び“クラスタ(clusters)”の語は互換可能に使用される。
【実施例】
【0034】
調製A
腫瘍及び/又は正常組織検体
【0035】
新鮮な生検材料又は流体の吸引物が、癌若しくは他の疾病を患う患者あるいは正常のドナーから得られる。
【0036】
検体は、典型的には 提出元病院の解剖病理学研究室を経て本発明の方法の実行のために、又は、場合によっては、手術室若しくは外科医/医者オフィスから直接的に、提出される。固形腫瘍の検体(固定液に曝露されていない又は凍結されていない)は、冷却輸送培地(CO2独立型培地(CO2-independent medium)、InvitroGen/GIBCO, Grand Island, NY, ペニシリン/ストレプトマイシン、アンホテリシンB、インスリン/セレニウム/トランスフェリン、及び10%低エンドトキシン、熱不活性化ウシ胎仔血清が補給されたもの)に配置される。次いで、検体は、マイナス20℃に凍結された“ブルーアイス(blue ice)”の350gmのブロックを含有する、頑丈な発泡スチロール(Styrofoam商標)製移動箱に配置される。次いで、検体は、夜間優先配送サービス又はローカルランドクーリエのいずれかによって輸送される。流体の検体は十分混合して細胞のクラスタを懸濁し、次いで、500mlの無菌ポリプロピレン輸送ボトルに注がれる。提出された流体1mlにつき、10−15単位のヘパリン硫酸が添加される。
【0037】
提出元病院からの公式な病理組織レポートのコピーが受理される。
【0038】
下記の実施例が例示のために提供されるが、本発明を限定しない。
【0039】
実施例1
腫瘍細胞の微小凝集体の分離
【0040】
固形腫瘍は、高性能湾曲型外科ハサミで1mmよりも小さい片(標準型使い捨て10mlピペットに吸引されるように十分に小さい)に細かく切り刻まれる。上記の腫瘍が輸送された培地は、組織の細かく切り刻んだ片からの上澄みと共に保存される。ハサミで細かく切り刻まれた腫瘍片は、抗生物質及び10%ウシ胎仔血清を含有するRPMI-1640のコラゲナーゼ/DNaseで消化される。検体は、撹拌プレート上でプラスチックコーティングの磁性撹拌棒を用いて穏やかに混合することによって、使い捨て50mlポリプロピレン遠心分離チューブ内で消化される。検体は、完全に全体が消化されるまで、このように混合される。典型的には、1−3グラムの検体で約2−3時間行われる。次いで、サイトスピンスライド(cytospin slides)がすべての細胞画分(輸送培地、組織の細かく切り刻んだ片からの上澄み及び酵素の消化物(digestate))から調製され、上述したようにファーストグリーン−H/Eで染色される(Weisenthal, et al., "A Novel Dye Exclusion Method for Testing in vitro Chemosensitivity of Human Tumors," Cancer Res. (1983) 43:749-757)。
【0041】
流体の検体は、検体中のすべての細胞を集めるために完全に遠心分離される。次いで、細胞は、上述したRPMI-1640に基づいた培地で再懸濁され、上述したようにサイトスピンが調製される。
【0042】
生存可能な微小凝集体は、単一細胞、正常細胞、赤血球細胞、死細胞及び“クイックスピン”の手段による破片屑(デブリ)に加えて、細かく切り刻んで消化された組織に存在する、マイクロクラスタの混合物を含有する培地から濃縮ないし富化(enrich)される。クイックスピンは、50−500xgの超速遠心分離を繰り返すことによってなされ、この場合遠心分離チューブは、最初に穏やかに手で振ることによって混合され、標準的な、室温での、前段階の遠心分離機に配置され、次いで、所望の速度(夫々の遠心分離器で経験的な試行によって決定される)まで加速されて、次いで、一旦遠心分離が所望の速度に到達すると、直ちに遠心分離器を止め、停止するまで慣性回転させる。夫々のクイックスピンの後、上澄みが吸引されて保存される一方、細胞クラスタのペレットが収集されて繰り返し操作遠心分離ステップのために再懸濁される。
【0043】
細胞クラスタとして90%の生存可能な細胞を含有する画分が得られるまで、このプロセスは、再懸濁された細胞クラスタのサイトスピンを調製することによって観察(monitored)される。この理想が達成できない可能性がある場合、最も高い可能性の割合でクラスタ状の細胞を含有する画分が組み合わされる。
【0044】
サイトスピンの細胞の“ディスク”(“スポット”)の領域のほぼ25%が赤ピンク色(生存可能)の腫瘍細胞クラスタとなり、75%が空白領域となるように、細胞クラスタの濃度が調節される。オーバープレイティング(overplating)及びアンダープレイティング(underplating)が人為現象的な薬剤耐性と感度の結果を生じ得ることがあり、及び/又は、その後の培養中の細胞クラスタの生き残りに悪影響を与え得るかもしれないので、この細胞濃度は極めて重要である。下記のように、結果が比較アッセイの領域との比較に基づくので、アッセイ条件は標準化されるべきである。
【0045】
結果を正規化するために、アッセイの開始時において処置に曝露されない細胞条件を表す、“0(ゼロ)日”のスライドが用意され、さらにネガティブコントロール(非曝露細胞)の“培養終点(end culture)”スライドが用意される。処置の効果と無関係な要因を排除し(factored out)得るように、0日と培養終点のスライドは、(1)クラスタ(単一細胞であることと対照的に)にある全ての生存可能な腫瘍細胞(又は関心のある他の細胞)の割合;(2)細胞クラスタの平均密度、ここで、“緩い(loose)”クラスタはサイトスピン遠心分離後に細胞間に明らかな空間を有し、“ミディアム”クラスタは細胞間に明らかな空間を含まないが、二次元の外観で平らになる、及び“タイト(tight)”クラスタはサイトスピン遠心後でも三次元の外観を維持する;並びに(3)接眼ミクロメーターで測定される、細胞クラスタの二次元領域の中央値;に関して主観的、即ち、観察によって(subjectively)にスコアリングされる。これらの要因はすべて処置能に影響を与え、関連細胞に達するので、結果を比較する際に、それらの要因が考慮されなければならない。抗体などの高分子による、容易な侵入を許容するために“タイト”な培養を緩めることは有利であるかもしれない。これは、ヒアルロニダーゼのような酵素を消化に加えることによってもたらされることができる。それらクラスタの測定に加えて、培養開始時(ゼロ時間又は“0日”)の生存可能な細胞数と比較した培養の終点における生存可能な細胞の比率を決定するために、スライドは主観的にスコアリングされる。
【0046】
実施例2
培養/処理ステップ
【0047】
薬剤の作用などの処置の効果をテストするために、細胞クラスタの懸濁液は、10%(volume/volume)の薬剤溶液又は対照ビークル(vehicle control)(最も典型的には、0.9%NaCl)と混合される。培養のためにプレート化された(plated)細胞懸濁液/薬剤溶液(又はビークル)の終量は0.12mlである。培養は、丸底で96穴(ウェル)のポリプロピレン培養器を用い、湿度37℃のインキュベータにおいて標準的な時間で行った。
【0048】
ストック溶液は、一般的に、所望濃度の10倍で、使い捨てタイプの0.5ml円錐ポリプロピレンチューブにアリコートし、使用に先立って−70℃で凍結される。製造者の推奨に従い、幾つかの薬剤は冷蔵庫温度で維持される。
【0049】
細胞は各薬剤の指標(指定)濃度(index concentration)で培養され、所望であれば、指標濃度を希釈して培養される。ここで、指標濃度はトレーニングセットアッセイ(training set assays)又は文献から決定される。一般的に、ネガティブコントロールは、0.9%NaCl及び/又は関心ある薬剤が溶解されるビークルから構成される。腫瘍サンプルにおいて、ポジティブコントロールは、100μg/mlのシスプラチンプラス1μg/mlのアンギジン(anguidine)(National Cancer Instituteから得られる)として供給される。レプリカの96穴(ウェル)プレートがテストされる。
【0050】
実施例3
In situ微小毛細血管の生存能力アッセイ(ISMCVA)
【0051】
培養4日目に、0.010mlのアラマーブルー(Alamar Blue)色素溶液(Trek Diagnostic Systems, Westlake, OH)が96穴培養器のすべての培養穴(ウェル)に添加される。4時間後、570mμ及び600mμでの吸光度が標準的マイクロプレートリーダー(standard microplate reader)(Dynatech)に記録される。600 mμでの吸光度は570 mμでの吸光度から減じられ、ポジティブコントロール(高濃度シスプラチン/アンギジン)ウェルでの対応する読み取り値は、各薬剤で曝露されたウェルの読み取り値から減じられる。そのように決定された各値は、ネガティブ(ビークル)コントロールウェル(0.9%NaCl)からの対応値で割算され、さらに、ポジティブコントロールの読み取り値が引かれる。上記の結果は、薬剤が引き起こす細胞死の粗い(比較的感度不良)指標(培養のすべての細胞において、細胞の異なる集団の間での死を区別しない)を提供するが、それでもなお、マイクロプレートウェルが正確にラベルされたISMCVAサイトスピンスライドで正確にスピンダウンすることを確実とするために、追加的な品質管理として有用である。
【0052】
アッセイサイトスピンスライド(Assay cytospin slides)は、上述したように(Weisenthal, et al., supra (1983))、アセトアルデヒドで固定されたアヒル赤血球(Weisenthal, et al., "Comparison of Dye Exclusion Assays with a Clonogenic Assay in the Determination of Drug-Induced Cytotoxicity," Cancer Res (1983) 43:258-264)を添加して調製され、現行のアッセイにおいて、サイトスピン細胞の“ディスク”(“スポット”)の均一性を測定する、品質管理(コントロール)として主に使用される。培養後のスライド(post-culture slides)は、下記のように細胞死を測定するために主観的にスコアリングされる。
【0053】
第一に、スライドはどの細胞とクラスタが腫瘍細胞であるか、あるとしても、どれが正常の細胞であるかを決定するために、標準の細胞病理的基準(standard cytopathologic criteria)を用いて調べられる。特定の関心は、推定される毛細血管関連細胞であり、それら細胞は典型的にクラスタの全体に亘り(すみからすみまで)散在し、類似した外観で一つ以上の他の細胞と極く近接し、小さく、しばしば角形成した(angulated)細胞として、経験上で認められることができる。これらの細胞は、相当多くの場合、いくぶん高色素性(hyperchromatic)である。
【0054】
次いで、ファーストグリーン及びH/Eで染色された、ISMCVAサイトスピンスライド“ディスク”は、主に40倍の倍率でスコアリングされる。スライドは、大部分が生存可能で、形態的に保存が良好な細胞クラスタを同定するために走査される。理想的に、細胞クラスタは、毛細血管細胞でない細胞を、最低でも20細胞は含むべきである。
【0055】
ネガティブコントロール(0.9%NaClビークル)スライドは、薬剤効果の完全な欠如においてスライドがどのように現れるかを決定する(精神的に(mentally))ように走査される。良好に保存されたネガティブコントロールの細胞クラスタは、 “プレーンパンケーキ(plain pancakes)”と称することができ、それらの比較的均一な外観を暗示する。薬剤に曝露された培養物は試験されて、良く保存され、大部分が生存可能な細胞クラスタを選択する。低出力では、微小凝集体は、“プレーンパンケーキ”(大部分が均一な外観であれば)か、“ブルーベリーパンケーキ(blueberry pancake)”かのいずれかであるようにスコアリングされる。高出力で青緑色に染色の複数の斑状地域があるならば、“ブルーベリーパンケーキ”は、死んだ(ファーストグリーン染色の)毛細血管関連細胞と一致していると分かる。所望であれば、追加的なスライドが調製でき、例えば、内皮細胞に対して合理的に特異的なCD31抗原の染色などの毛細血管関連細胞を特異的に同定できる免疫細胞化学方法で染色できる。
【0056】
“ブルーベリーパンケーキ”効果が、コントロール培養で現れるよりも、テスト培養において多大に観察されるならば、この効果は主観的ではあるが、“1+ブルーベリー”、“4+ブルーベリー”などの標準化した評価スケールでスコアリングされてよい。あるいは、顕微鏡の接眼レンズグリッドを、関心の細胞クラスタの上に重ねてよく、グリッド(格子)単位当たりの“ブルーベリー”数が標準的な手集計カウンターでカウントできる。また“ブルーベリー”は、自動画像解析システムを用いてスコアリングでき得る。
【0057】
実施例4
卵巣癌
【0058】
ヒト卵巣癌の検体で行った研究において、実施例1-3に記載のように、培養の開始時における微小凝集体(非会合性ないし非凝集性)(discohesive)な細胞であることと対照的に)での全腫瘍細胞の中央値パーセントは80であり、培養終点での中央値は85であった。培養開始時での細胞クラスタの二次元領域の中央値は870平方ミクロンであり、培養終点では2300平方ミクロンであった。細胞培養の開始時において、10のすべての検体は非凝集性単一細胞から完全に成り、これは培養終点で1%残存した。微小凝集体を含有する検体において、細胞培養の開始時にスコアリングされたように、それらが含まれているもののうち17%は主に“緩い”クラスタ(上記で定義)であり、78%は主に“中間密度”クラスタであり、4%は支配的に“タイト”なクラスタである。細胞培養終点での所定密度の細胞クラスタを有するアッセイの対応する割合は、25%が主に“緩い”クラスタ、69%が“中間密度”クラスタ、6%が“タイト”なクラスタであった。
【0059】
実施例5
正常な肺
【0060】
ヒトの肺の生検材料が、手術用ハサミで機械的に細かく切り刻まれ、その後、コラゲナーゼ/DNaseで消化された。実施例1で記載のように、様々な細胞の画分はファーストグリーンで染色され、細胞遠心分離されて、ヘマトキシリン/エオシン(H/E)で対比染色された。特記するが、生存可能な細胞がピンクから赤(H/Eで)に染まり、一方で、死細胞は青から緑(ファーストグリーンで)に染まる。アセトアルデヒドで固定されたアヒルの赤血球細胞(青−緑の楕円赤血球)は内部基準として存在する。倍率40倍の図2Aに示されるように、酵素消化物は、大量の生存可能でない(青緑で染色された)細胞、線維及びデブリを含み、非凝集性の単一細胞が混在し、また、様々なサイズ(元の倍率は40倍)の幾らかの三次元細胞クラスタを含む。図2Aに示される調製からの三次元マイクロクラスタは、実施例1に記載のように250xgで多段階の“クイックスピン”で富化(濃縮)され、その後、少量に濃縮し、その後、細胞遠心分離及びファーストグリーンH/E染色が行われる。結果となる微小凝集体は、倍率40倍で図2Bに示され、倍率200倍で図2Cに示され、及び倍率400倍で図2Dに示される。
【0061】
実施例6
神経内分泌腫瘍
【0062】
ヒト神経内分泌(肺カルチノイド)腫瘍の生検が行われ、消化され、マイクロクラスタに濃縮され、一般的には実施例1−3に記載のようにベバシズマブの存在の有無の場合で96時間培養された。マイクロクラスタはファーストグリーンで染色され(細胞遠心分離前に)、H/Eで対比染色された(細胞遠心分離後に)。上述で特記したように、生存可能な細胞がピンク色から赤色(H/Eで)に染まり、一方で、死細胞は青色から緑色(ファーストグリーンで)に染まり、アセトアルデヒドで固定されたアヒルの赤血球細胞(青−緑の楕円赤血球)は内部基準として存在する。腫瘍細胞は大きく、薄いピンクで染まった細胞であり、毛細血管関連細胞(ほとんどは内皮細胞)はより小さく、赤ピンクで濃く染まった細胞で、しばしば鋭く角形成している。図3A及び図4Aは、コントロール培養からのマイクロクラスタを示し、ほとんどが生存可能な腫瘍細胞及び毛細血管関連細胞で、それぞれ倍率100倍と200倍の図面である。図3C及び図4Cは、同定を容易にするために毛細血管関連細胞が円で囲まれた、図3A及び4Aの注釈した形態である。図3B及び図4Bは、ベバシズマブに曝露された細胞からのマイクロクラスタを、それぞれ倍率100倍と200倍に拡大したものを示し、図3C及び3D[訳注:図3D及び4Dの誤記]はそれらの注釈した形態を示す。示されるように、腫瘍細胞は生存可能性(ピンク色に染色)を維持し、一方で、ほとんどの毛細血管関連細胞は死んでいる(青−緑に染色)。
【0063】
ベバシズマブは毛細血管細胞を含む細胞に対する直接的な影響を有さないが、マイクロクラスタ内で腫瘍細胞によって局所的に産生される血管内皮増殖因子(VEGF)と複合体(complexes)を形成することが知られている。VEGFは、ベバシズマブに反応する腫瘍において、内皮細胞の増殖及び生存に必要とされる。これらの結果は、VEGFの連続した存在が、毛細血管関連細胞の生存能力を維持するために必要とされることを示す。培養組織のVEGFをベバシズマブで阻害することは、VEGFに依存する毛細血管関連細胞の死をもたらす。ベバシズマブに反応する“ブルーベリーパンケーキ”クラスタを形成する腫瘍は、ベバシズマブを用いた臨床化学療法に応答する可能性が高く、一方で、“ブルーベリーパンケーキ”クラスタを形成しない腫瘍はベバシズマブを用いた臨床化学療法に応答する可能性は低い。また、記載されたアッセイシステムは、ベバシズマブ耐性微小毛細血管に対して作用するであろう、治療の形態を発見するために使用され得る。
【図面の簡単な説明】
【0064】
【図1A】本発明の微小凝集体の概略図を示す。
【図1B】本発明の微小凝集体の概略図を示す。
【図1C】本発明の微小凝集体の概略図を示す。
【図2A】本発明の微小凝集体の様々な調製段階の顕微鏡写真を示す。
【図2B】本発明の微小凝集体の様々な調製段階の顕微鏡写真を示す。
【図2C】本発明の微小凝集体の様々な調製段階の顕微鏡写真を示す。
【図2D】本発明の微小凝集体の様々な調製段階の顕微鏡写真を示す。
【図3A】ベバシズマブ無処理における本発明の微小凝集体の100倍に拡大した顕微鏡写真を示す。
【図3B】ベバシズマブ有処理における本発明の微小凝集体の100倍に拡大した顕微鏡写真を示す。
【図3C】ベバシズマブ無処理における本発明の微小凝集体の100倍に拡大した顕微鏡写真を示す。
【図3D】ベバシズマブ有処理における本発明の微小凝集体の100倍に拡大した顕微鏡写真を示す。
【図4A】200倍に拡大した、図3Aと同様の微小凝集体の顕微鏡写真を示す。
【図4B】200倍に拡大した、図3Bと同様の微小凝集体の顕微鏡写真を示す。
【図4C】200倍に拡大した、図3Cと同様の微小凝集体の顕微鏡写真を示す。
【図4D】200倍に拡大した、図3Dと同様の微小凝集体の顕微鏡写真を示す。
【関連出願】
【0001】
この出願は、2005年12月16日に出願された米国仮出願番号第60/751,127の35U.S.C.§119(e)に基づく利益を主張し、この出願の開示も参照により本願開示中に組込まれる。
【技術分野】
【0002】
本発明は、自然の形態を維持する、微小凝集体(microaggregates)における組織の微小血管系(tissue microvasculature)の生存能力の研究に関し、より詳細には、この微小凝集体における微小血管系の生存及び/又は増殖の破壊、破裂、若しくは促進する方法の研究に関する。特に本発明は、腫瘍(特に、特異的及び直接的に新生血管系(neovasculature)の成長を阻害するもの)の処置(ないし治療)のための候補薬剤の効果の評価に有用である。
【背景技術】
【0003】
組織(正常及び腫瘍性)のサイズが増大するとき、それらの細胞は、細胞の成長を継続するために栄養を提供する微小毛細血管(microcapillaries)(血管新生)の形成を必要とする。それら微小毛細血管の構成物は、最も顕著に内皮細胞を含むが、関連した間葉細胞、線維芽細胞、平滑筋細胞及び周皮細胞を含む。血管新生は、例えば、創傷などの通常のプロセスで重要なだけでなく、例えば、癌、乾癬、糖尿病、リウマチ性関節炎及び加齢黄斑変性などの疾病においても重要である。
【0004】
正常組織及び疾病組織の両組織において、in vitroで微小毛細血管を研究するための改善方法が必要とされる。現在知られている方法の要約が提供される(例えば、Staton等の非特許文献1参照)。In vivoモデルは有用であるが扱い難い。In vitroモデルは、それほど扱い難くないが、より人工的であり、より適切でない。
【0005】
特に、腫瘍の微小血管系を標的とする、抗癌剤及び他の処置の活動を予測するための改善方法が必要とされる。例えば、ベバシズマブ(Avastin(商標))は、腫瘍の微小血管系を標的とする、FDA認可の抗癌剤である。Avastin(商標)の卸売りコストは、10ヶ月の処置で$40,000以上であり、まだ比較的少ない割合の患者のみ実質的な利益をうけるに止まる。顕著な関心ごとは、どの患者がそのような処置に最も応答しそうかについて予測し得る、バイオマーカーの同定である(例えば、Ince等の非特許文献2参照)。
【0006】
最も一般的に使用されているin vitro方法は、内皮細胞の分離及び培養を含む。細胞が一旦培養されると、多様な細胞増殖及び/又は細胞死のエンドポイントを用いて、薬剤の効果(又は他の障害(perturbation))が試験され得る。細胞増殖のエンドポイントの例は、放射性チミジンの取り込み、細胞数のカウント、BrdUの取り込み及びコロニー形成を含む。細胞死のエンドポイントの例は、細胞性ATPの測定、MTTのミトコンドリア減少、フルオレセイン二酢酸の代謝及び細胞間トラッピング(及びフルオレセイン二酢酸の損失)、色素排除による細胞膜完全性(cell membrane integrity)の損失、並びにTUNELアッセイ又はカスパーゼ発現などのアポトーシスのより特異的な測定を含む。幾つかの場合において、既に分離した内皮細胞は、既に分離した他の細胞と共に共培養されて、異なる細胞集団に関する薬剤の異なる影響が研究されている。
【0007】
他のin vitro方法は器官の培養物に基づく。例えば、非特許文献1を参照のこと。それらの方法は、ラット大動脈輪(aortic ring)、トリ大動脈弓、ブタの頚動脈、胎盤の静脈円板(vein disk)及び胎児マウス骨移植を含む。
【0008】
細胞培養のアッセイは明らかに欠点を有する。第一に、そのアッセイは生存可能な内皮細胞の分離及び培養に依存しており、特に、ヒトの新鮮な腫瘍の場合に問題になり得る。一旦分離されて培養されると、それらの細胞は自然のミクロな環境(native microenvironment)から移動させられ、そこには腫瘍細胞(又は、正常組織の場合の正常細胞)によって放出される因子は存在しない。原理的に、分離された腫瘍細胞(又は、正常細胞)が共培養されたとしても、これは、in vivoで存在する空間関係(spatial relation)及び細胞と細胞との相互作用に近似しないであろう。Staton等の非特許文献1に記載されているように、「腫瘍細胞によって放出される多数の因子及び腫瘍細胞自体が存在しないので、モデルは腫瘍増殖において出会う微小血管環境を正確に表していない」ということから、既存の器官の培養には同様の制限がある(例えば、非特許文献3も参照されたい)。
【0009】
ベバシズマブの効果を研究して予測する、非細胞培養、非器官培養、アプローチが開示されている(例えば、Ince等の非特許文献2参照)。Inceは、k-ras、b-raf及びp53状態をベバシズマブの処置効果と互いに関係づけることを試みたが、彼らは、“ベバシズマブ治療に応答しそうであった、転移性結腸直腸癌の患者のいずれのサブグループも同定しなかった”と結論づけた。彼らの議論において、Ince等は、“現在まで、ほとんどの研究では、クリニックでの血管新生を阻害する治療に対して、どの患者が応答しそうであるかを予測する上でのバイオマーカーの潜在的有用性が評価されなかった”、及び臨床的な利点を予測するマーカーは全く見出せなかった、と特記している。これらの著者は、“すべての血管新生制御因子の効果を集約するバイオマーカーが、単一の成長因子又はシグナル誘導経路(signal induction pathway)の分析よりも、患者の結果を良好に予測し得る”と提案しているが、この目的のためのin vitro方法は何も提案しなかった。代わりに、彼らは、患者自身が彼ら自身の結果を予測するための実験的なモデルとして用いられる作業が進行中であることに言及した。
【0010】
それらの研究において、ベバシズマブ(及び/又は他の処置(治療))は、トライアルベースで患者に投与され、次いで、“初期”の処置効果は、処置効果の病理組織学的評価と共に、外部診断スキャニング(external diagnostic scanning)(例えば、MRI)及び/又は処置後の腫瘍生検によって評価される(例えば、Willett等の非特許文献4参照)。このアプローチは、処置費用、最終的に無効治療の潜在的毒性に対する患者の曝露及び診断試験(例えば、MRI)費用も含め、多くの明らかな欠点を有する。このような研究もまた、in vitro方法で可能であるように、患者に対して危険なく、同時に複数の異なる処置をテストする性能を欠如する。
【0011】
明らかに、ヒトの腫瘍の微小血管系を研究するにあたり、有用なin vitroモデルの不足は、腫瘍の微小血管系を標的とする、革新的で、より効果的な処置のアプローチの同定及び開発に対する障害である。
【非特許文献1】Staton, et al., "Current Methods for Assaying Angiogenesis in vitro and in vivo," Int J Exp Path (2004) 85:233-248
【非特許文献2】Ince, et al., "Association of k-ras, b-raf, and p53 Status with the Treatment Effect of Bevacizumab," J natl cancer Inst (2005) 97:981-989
【非特許文献3】Auerbach, et al., "Angiogenesis assays: problems pitfalls," Cancer Metastasis Rev. (2000) 19:167-172
【非特許文献4】Willett, et al., Nature Med (2004) 10:145-147
【発明の開示】
【0012】
本発明の組成物及び方法は、化学的、生物的及び/又は物理的処置に応答する、生検が行われた腫瘍又は正常組織から分離される、細胞の微小凝集体(microaggregates)の微小血管系における変化(例えば、生存能力の変化)を検出及び/又は定量できる。これらの微小凝集体がin vivo状態を擬態するので、一般的に、分離された微小凝集体に対して処置が施される。また、時に、in vivoで施される、処置の結果を決定するために、これらの分離体を活用することが有用である。
【0013】
観察された微小血管及び他の細胞の変化が、テストされた処置のin vivo活動を予測するテストとして役に立ち、したがって、本発明の方法は、内皮(endothelial)細胞に対する特定の効果を検出できる一方で、その周辺(surrounding)細胞における同様の又は同時に施された処置の効果の観察もできる。したがって、特定の薬剤は、内皮細胞とその周辺細胞の両細胞に作用し得る。
【0014】
これらの方法は、新規な又は検査ないし研究的(investigational)処置の発見及び/又は開発を支援するために使用され得る。
【0015】
したがって、一つの視点において、本発明は、少なくとも生存可能な内皮細胞と自然な周辺の生存可能な非内皮細胞(natively surrounding viable non-endothelial cells)とを含んで構成される分離した微小凝集体(microaggregate)を対象とし、この微小凝集体は顕微鏡観察に適した表面に提示される。微小凝集体は、生検された組織から調製され、生検材料が採取された組織(腫瘍又は正常)のミクロ生態系を表す。したがって、生存可能な内皮細胞はそれら細胞の自然の形態で存在し、その自然の形態は腫瘍細胞(癌の場合)、正常の組織細胞、結合組織細胞、炎症細胞及び他の自然に関連した細胞を含み得る。内皮細胞は、毛細血管の構成要素である内皮細胞と他の細胞を含んで、微小毛細血管自体の正常部分(intact segments)を含み得る。微小凝集体は、幾つか(several)ないし数十ないし数百ないし数千(several to tens to hundreds to thousands)の細胞を含んでよい。
【0016】
微小凝集体は、標準組織及び/又は器官の培養器で、標準組織及び/又は器官の培養培地では、数週ないし数日ないし数時間の期間(a period of hours to days to weeks)、適切な栄養(及び栄養補助剤)を含み、培養されてよい。培養することは、微小凝集体に含まれる内皮細胞と、さらに周辺細胞でも同様に、両細胞について、様々な処置又は要因若しくはプロトコールの効果を評価する機会を提供する。
【0017】
別の視点において、本発明は、少なくとも生存可能な内皮細胞と自然な周辺の生存可能な非内皮細胞とを含んで構成される分離した微小凝集体を調製する方法に関し、この方法における微小凝集体は顕微鏡観察に適した表面に沈着(沈降)される。この方法は、細かく切り刻まれた生検サンプルに、本明細書でクイックスピン(quickspin)と称する一連の遠心分離ステップを施すことを含む。これは下記でより詳細に記載される。各ステップにおいて、サンプルは、50−500xgの力を受けるようにもたらされ、次いで、直ちに1xgに戻されて、細胞クラスタペレット及び上澄みを得る。上澄みが除去され、ペレットが再懸濁されて、適切に分離された微小凝集体が形成されるまでこのプロセスが繰り返される。
【0018】
次いで、微小凝集体は、任意で、上述したように培養でき、又は顕微鏡検査のための表面上に直ちに沈降できる。あるいは、微小凝集体の初期調製は、生存可能な細胞から排除(excluded)される色素指示薬(ないし標識染料(indicator dye))で処理できるか、又は、色素での処理は培養中若しくは培養後に施すことができるが、いずれの場合にせよ、微小凝集体の表面への沈降に先立ってなされる。また別の代替として、上記の色素指示薬は、表面への沈降がなされた後に適用されてよい。
【0019】
好ましい視点において、本発明は、内皮細胞の死を特異的にもたらす薬剤を同定する方法を提供し、この方法は、上記で調製した分離された微小凝集体を候補薬剤で処理すること、効果をもたらすように薬剤に十分な時間を及ぼさせること、生存可能な細胞から排除される第一指示薬で微小凝集体を処理すること、及び微小凝集体での細胞による指示薬の取り込み又は取り込みの欠損を観察することを含み、それによって、その周辺細胞ではなく、内皮細胞で上記指示薬の取り込みに作用する薬剤が、内皮細胞の死を特異的にもたらす薬剤として同定される。
【0020】
本発明の様々な他の視点が下記の記載から明らかになるであろう。
【発明を実施するための最良の形態】
【0021】
一つの視点において、本発明は、自然の状態を擬態する、微小凝集体で生存可能な組織の微小血管(microvascularity)を研究ないしテストする方法を対象とする。この方法は、生検された組織からの細胞の微小凝集体又はクラスタ(cluster)の分離を含む。それらのクラスタは、生検材料が採取された組織(腫瘍又は正常)のミクロ生態系を表し、腫瘍細胞(癌の場合)、正常の組織細胞、結合組織細胞、炎症細胞、及び、幾つかの場合には、毛細血管の構成要素である内皮細胞と他の細胞を含み、微小毛細血管の正常部分を含む。このクラスタは、幾つか(several)、数十、数百、数千の細胞を含んでよい。次いで、このクラスタは、標準的な組織及び/又は器官の培養器で培養されてよく、標準的な組織及び/又は器官の培養培地(適切な栄養及び栄養補助剤を含む)で、数時間ないし数日ないし数週の期間で培養されてよい。細胞は、微小毛細血管及び/又は微小毛細血管の構成細胞に対して潜在的に影響を及ぼすと推定される様々な処置に生検(つまり、患者の)に先立ってか、又は生検後であるが細胞培養の前か、又は培養期間中に曝されてよい。処置は、微小毛細血管及び/又は構成細胞の生存及び/又は増殖を、損傷、死滅、促進あるいは増強し得る。
【0022】
これらの処置後、微小凝集体での細胞の存在及び/又は生存能力は、生存可能でない細胞をラベルする第一指示薬の物質又は染料を添加することによって評価され(例えば、ファーストグリーン色素(fast green dye)、フルオレセイン二酢酸、等)、所望であれば、第二指示薬(生存可能な細胞をラベルする、例えば、細胞若しくは組織染色、H/Eなど)を添加する。顕微鏡スライドなどの表面へのクラスタ(clusters)の沈降又は沈着(限定されないが、例えば、細胞遠心分離(cytocentrifugation))は、一つ又は2以上の染料が添加される前後のいずれかで行われる。所望の場合、第一指示薬の添加は省略されてよい。所望の場合、クラスタ内の特定の細胞の同定を支援するために、第三指示薬(例えば、抗原に対する免疫細胞化学染色、CD31など)が添加されてよい。次いで、表面が試験されて、細胞の状態が評価される。
【0023】
本発明の主題である、微小凝集体の特徴が、図1A−1Cに概略して示される。各場合において、生検がなされた組織から本明細書に記載されるように、細胞のマイクロクラスタ(microclusters)が調製されて示される。図1Aにおいて、内皮細胞はCD31での染色によって存在が確認され、それらの細胞は、明暗(shaded)をつけて示され、塗りつぶしのない円(ないしオープンサークル)(open circle)で示される付随的な細胞に囲まれている。図1A−1Cの概略図において、意図された処置は、抗VEGF薬剤に対する曝露である。図1Bは処置を施されていないネガティブコントロール(対照)を示しており、示されるように、このクラスタが生存細胞からは排除されるが死細胞からは排除されない色素に曝露されるとき、細胞は損傷を受けていないので外観上の変化は起こらない。しかしながら、図1Cにおいて、このクラスタが抗VEGF薬剤に対して曝露されたとき、色素は内皮細胞によって取り込まれ、したがって、それらは薬剤によって影響を受けたものとして同定される。塗りつぶしのない円(ないしオープンサークル)として示される周辺細胞は色素を取り込まずにそのままである。
【0024】
したがって、示されたクラスタを調製することによって、抗VEGF薬剤(説明のための使用例)に対する反応(応答)を示す、個々の内皮細胞の能力が実証される。
【0025】
したがって、一つの視点において、本発明の方法は、毛細血管関連細胞(capillary-associated cells)が混在した(interlaced)細胞の微小凝集体を分離することと、細胞のマイクロクラスタの一般的に多大な部分を含む非毛細血管関連細胞(non-capillary-associated cells)と対比して毛細血管関連細胞での選択的な変化が認識できる指示薬方法を活用することを含む。
【0026】
本発明は、腫瘍性及び/又は正常の組織由来の培養前及び/又は培養後の細胞の微小凝集体での微小血管の生存能力の検出を可能とし、その方法は、
“クイックスピン”の手段によって生検された細胞の微小凝集体を分離すること;
その微小凝集体を、顕微鏡スライドなどの表面に移動すること;
その微小凝集体を、ファーストグリーン染料及び/又はH/Eなどの色素で染色すること;及び
微小毛細血管関連細胞及び/又は周辺細胞の生存能力をスコアリングすることを含む。
【0027】
染色は、表面への移動の前後のいずれかで適用されてよい。
【0028】
培養期間中、細胞は、微小毛細血管及び/又は微小毛細血管の構成細胞及び/又は周辺細胞に対して影響を及ぼす可能性があると推定される様々な処置に曝露されてよい。処置としては、関連する観察細胞を損傷するか若しくは死滅させる処置、又は、微小毛細血管及び/若しくは構成細胞の生き残り及び/若しくは増殖を促進ないしは強化する処置が、研究され得る。
【0029】
より詳細には、それらの処置後、微小凝集体の細胞の存在及び/又は生存能力は、先ず、生存可能でない細胞を選択的にラベルする、第一指示薬の物質(例えば、ファーストグリーン色素、フルオレセイン二酢酸など)を添加することによって評価されてよく、続いて、顕微鏡スライド上にマイクロクラスタの沈降又は沈着がなされ(例えば、制限されないが、細胞遠心分離の具体的な方法によって)、続いて、有利な場合には、第二指示薬に対するスライド上のクラスタの曝露がなされる(例えば、ヘマトキシリン/エオシンなどの細胞若しくは組織染色)。この指示薬は生存可能な細胞によって排除されず、第一指示薬の視感度を増強するコントラスト(造影)剤として用いられる。あるいは、第一指示薬は、クラスタの沈着後に添加してもよい。さらに、所望の場合、第一指示薬の物質の添加は省略してもよい。加えて、所望の場合、クラスタ内の特定の細胞の同定を支援するために、第三指示薬の物質(例えば、CD31など、抗原に対する免疫細胞化学染色)が添加されてよい。この後、表面は顕微鏡検査され、微小血管系及び/若しくは他の周辺細胞の状態が、“マニュアル”方法によって、つまり、訓練された観察者及び/若しくはイメージアナライザーなどの機器の使用によって評価され、スコアリングされ、並びに/又は定量化される。微小血管系での細胞に対する影響に加えて、クラスタ(例えば、腫瘍細胞)内の他の細胞に対する薬剤の影響は、同時に又は異時性に試験されてよい。
【0030】
正常組織及び腫瘍組織のいずれかの組織又は両組織は、本発明の方法によってテストされ、薬剤又は他の処置の効果は、クラスタ内に存在する他の細胞と対比して毛細血管関連細胞において差異的(differentially)に決定され得る。
【0031】
様々な細胞の生存能力はまた、細胞培養期間無しで、生検後に短期で決定でき得る。毛細血管及び他の細胞の生存能力が測定でき得、例えば、処置を何ら受けていない患者、又は生検(針を用いて実施若しくは他の生検器具で実施)前に若干の期間の臨床処置を受けている患者で測定でき得る。
【0032】
本明細書で使用されるように、“処置”(treatment)とは微小凝集体の環境にもたらされる任意の意図的(deliberate)な変化を意味する。最も一般的には、処置は、微小凝集体の培養に対して、化学療法剤などの医薬品を添加することである。しかしながら、他の処置は、温度、pH、培養状態(条件)及び組成の変化を含んでよい。例えば、組成の変化は、供給される栄養分の変化、又は小さな分子若しくは小さなペプチドなど様々な化学物質の組み合わせである。処置はまた、ケモカインの封入又は意図的に投与(ないし管理)されたプロトコールを含んでよい。
【0033】
本明細書で使用されるように、“微小凝集体”(microaggregates)は、ここでテストされている細胞の自然の環境を効果的に擬態する、細胞の群を示す。一つの実施態様において、内皮細胞に対する処置の効果は興味深い。この場合、微小凝集体は少なくとも内皮細胞と、内皮細胞の自然環境の代理(ないし代替)を提供する十分な周囲細胞を含むであろう。理論上、単に一つの内皮細胞と一つの同伴的な細胞が含まれてよい。本出願において、“微小凝集体”、“マイクロクラスタ(microclusters)”及び“クラスタ(clusters)”の語は互換可能に使用される。
【実施例】
【0034】
調製A
腫瘍及び/又は正常組織検体
【0035】
新鮮な生検材料又は流体の吸引物が、癌若しくは他の疾病を患う患者あるいは正常のドナーから得られる。
【0036】
検体は、典型的には 提出元病院の解剖病理学研究室を経て本発明の方法の実行のために、又は、場合によっては、手術室若しくは外科医/医者オフィスから直接的に、提出される。固形腫瘍の検体(固定液に曝露されていない又は凍結されていない)は、冷却輸送培地(CO2独立型培地(CO2-independent medium)、InvitroGen/GIBCO, Grand Island, NY, ペニシリン/ストレプトマイシン、アンホテリシンB、インスリン/セレニウム/トランスフェリン、及び10%低エンドトキシン、熱不活性化ウシ胎仔血清が補給されたもの)に配置される。次いで、検体は、マイナス20℃に凍結された“ブルーアイス(blue ice)”の350gmのブロックを含有する、頑丈な発泡スチロール(Styrofoam商標)製移動箱に配置される。次いで、検体は、夜間優先配送サービス又はローカルランドクーリエのいずれかによって輸送される。流体の検体は十分混合して細胞のクラスタを懸濁し、次いで、500mlの無菌ポリプロピレン輸送ボトルに注がれる。提出された流体1mlにつき、10−15単位のヘパリン硫酸が添加される。
【0037】
提出元病院からの公式な病理組織レポートのコピーが受理される。
【0038】
下記の実施例が例示のために提供されるが、本発明を限定しない。
【0039】
実施例1
腫瘍細胞の微小凝集体の分離
【0040】
固形腫瘍は、高性能湾曲型外科ハサミで1mmよりも小さい片(標準型使い捨て10mlピペットに吸引されるように十分に小さい)に細かく切り刻まれる。上記の腫瘍が輸送された培地は、組織の細かく切り刻んだ片からの上澄みと共に保存される。ハサミで細かく切り刻まれた腫瘍片は、抗生物質及び10%ウシ胎仔血清を含有するRPMI-1640のコラゲナーゼ/DNaseで消化される。検体は、撹拌プレート上でプラスチックコーティングの磁性撹拌棒を用いて穏やかに混合することによって、使い捨て50mlポリプロピレン遠心分離チューブ内で消化される。検体は、完全に全体が消化されるまで、このように混合される。典型的には、1−3グラムの検体で約2−3時間行われる。次いで、サイトスピンスライド(cytospin slides)がすべての細胞画分(輸送培地、組織の細かく切り刻んだ片からの上澄み及び酵素の消化物(digestate))から調製され、上述したようにファーストグリーン−H/Eで染色される(Weisenthal, et al., "A Novel Dye Exclusion Method for Testing in vitro Chemosensitivity of Human Tumors," Cancer Res. (1983) 43:749-757)。
【0041】
流体の検体は、検体中のすべての細胞を集めるために完全に遠心分離される。次いで、細胞は、上述したRPMI-1640に基づいた培地で再懸濁され、上述したようにサイトスピンが調製される。
【0042】
生存可能な微小凝集体は、単一細胞、正常細胞、赤血球細胞、死細胞及び“クイックスピン”の手段による破片屑(デブリ)に加えて、細かく切り刻んで消化された組織に存在する、マイクロクラスタの混合物を含有する培地から濃縮ないし富化(enrich)される。クイックスピンは、50−500xgの超速遠心分離を繰り返すことによってなされ、この場合遠心分離チューブは、最初に穏やかに手で振ることによって混合され、標準的な、室温での、前段階の遠心分離機に配置され、次いで、所望の速度(夫々の遠心分離器で経験的な試行によって決定される)まで加速されて、次いで、一旦遠心分離が所望の速度に到達すると、直ちに遠心分離器を止め、停止するまで慣性回転させる。夫々のクイックスピンの後、上澄みが吸引されて保存される一方、細胞クラスタのペレットが収集されて繰り返し操作遠心分離ステップのために再懸濁される。
【0043】
細胞クラスタとして90%の生存可能な細胞を含有する画分が得られるまで、このプロセスは、再懸濁された細胞クラスタのサイトスピンを調製することによって観察(monitored)される。この理想が達成できない可能性がある場合、最も高い可能性の割合でクラスタ状の細胞を含有する画分が組み合わされる。
【0044】
サイトスピンの細胞の“ディスク”(“スポット”)の領域のほぼ25%が赤ピンク色(生存可能)の腫瘍細胞クラスタとなり、75%が空白領域となるように、細胞クラスタの濃度が調節される。オーバープレイティング(overplating)及びアンダープレイティング(underplating)が人為現象的な薬剤耐性と感度の結果を生じ得ることがあり、及び/又は、その後の培養中の細胞クラスタの生き残りに悪影響を与え得るかもしれないので、この細胞濃度は極めて重要である。下記のように、結果が比較アッセイの領域との比較に基づくので、アッセイ条件は標準化されるべきである。
【0045】
結果を正規化するために、アッセイの開始時において処置に曝露されない細胞条件を表す、“0(ゼロ)日”のスライドが用意され、さらにネガティブコントロール(非曝露細胞)の“培養終点(end culture)”スライドが用意される。処置の効果と無関係な要因を排除し(factored out)得るように、0日と培養終点のスライドは、(1)クラスタ(単一細胞であることと対照的に)にある全ての生存可能な腫瘍細胞(又は関心のある他の細胞)の割合;(2)細胞クラスタの平均密度、ここで、“緩い(loose)”クラスタはサイトスピン遠心分離後に細胞間に明らかな空間を有し、“ミディアム”クラスタは細胞間に明らかな空間を含まないが、二次元の外観で平らになる、及び“タイト(tight)”クラスタはサイトスピン遠心後でも三次元の外観を維持する;並びに(3)接眼ミクロメーターで測定される、細胞クラスタの二次元領域の中央値;に関して主観的、即ち、観察によって(subjectively)にスコアリングされる。これらの要因はすべて処置能に影響を与え、関連細胞に達するので、結果を比較する際に、それらの要因が考慮されなければならない。抗体などの高分子による、容易な侵入を許容するために“タイト”な培養を緩めることは有利であるかもしれない。これは、ヒアルロニダーゼのような酵素を消化に加えることによってもたらされることができる。それらクラスタの測定に加えて、培養開始時(ゼロ時間又は“0日”)の生存可能な細胞数と比較した培養の終点における生存可能な細胞の比率を決定するために、スライドは主観的にスコアリングされる。
【0046】
実施例2
培養/処理ステップ
【0047】
薬剤の作用などの処置の効果をテストするために、細胞クラスタの懸濁液は、10%(volume/volume)の薬剤溶液又は対照ビークル(vehicle control)(最も典型的には、0.9%NaCl)と混合される。培養のためにプレート化された(plated)細胞懸濁液/薬剤溶液(又はビークル)の終量は0.12mlである。培養は、丸底で96穴(ウェル)のポリプロピレン培養器を用い、湿度37℃のインキュベータにおいて標準的な時間で行った。
【0048】
ストック溶液は、一般的に、所望濃度の10倍で、使い捨てタイプの0.5ml円錐ポリプロピレンチューブにアリコートし、使用に先立って−70℃で凍結される。製造者の推奨に従い、幾つかの薬剤は冷蔵庫温度で維持される。
【0049】
細胞は各薬剤の指標(指定)濃度(index concentration)で培養され、所望であれば、指標濃度を希釈して培養される。ここで、指標濃度はトレーニングセットアッセイ(training set assays)又は文献から決定される。一般的に、ネガティブコントロールは、0.9%NaCl及び/又は関心ある薬剤が溶解されるビークルから構成される。腫瘍サンプルにおいて、ポジティブコントロールは、100μg/mlのシスプラチンプラス1μg/mlのアンギジン(anguidine)(National Cancer Instituteから得られる)として供給される。レプリカの96穴(ウェル)プレートがテストされる。
【0050】
実施例3
In situ微小毛細血管の生存能力アッセイ(ISMCVA)
【0051】
培養4日目に、0.010mlのアラマーブルー(Alamar Blue)色素溶液(Trek Diagnostic Systems, Westlake, OH)が96穴培養器のすべての培養穴(ウェル)に添加される。4時間後、570mμ及び600mμでの吸光度が標準的マイクロプレートリーダー(standard microplate reader)(Dynatech)に記録される。600 mμでの吸光度は570 mμでの吸光度から減じられ、ポジティブコントロール(高濃度シスプラチン/アンギジン)ウェルでの対応する読み取り値は、各薬剤で曝露されたウェルの読み取り値から減じられる。そのように決定された各値は、ネガティブ(ビークル)コントロールウェル(0.9%NaCl)からの対応値で割算され、さらに、ポジティブコントロールの読み取り値が引かれる。上記の結果は、薬剤が引き起こす細胞死の粗い(比較的感度不良)指標(培養のすべての細胞において、細胞の異なる集団の間での死を区別しない)を提供するが、それでもなお、マイクロプレートウェルが正確にラベルされたISMCVAサイトスピンスライドで正確にスピンダウンすることを確実とするために、追加的な品質管理として有用である。
【0052】
アッセイサイトスピンスライド(Assay cytospin slides)は、上述したように(Weisenthal, et al., supra (1983))、アセトアルデヒドで固定されたアヒル赤血球(Weisenthal, et al., "Comparison of Dye Exclusion Assays with a Clonogenic Assay in the Determination of Drug-Induced Cytotoxicity," Cancer Res (1983) 43:258-264)を添加して調製され、現行のアッセイにおいて、サイトスピン細胞の“ディスク”(“スポット”)の均一性を測定する、品質管理(コントロール)として主に使用される。培養後のスライド(post-culture slides)は、下記のように細胞死を測定するために主観的にスコアリングされる。
【0053】
第一に、スライドはどの細胞とクラスタが腫瘍細胞であるか、あるとしても、どれが正常の細胞であるかを決定するために、標準の細胞病理的基準(standard cytopathologic criteria)を用いて調べられる。特定の関心は、推定される毛細血管関連細胞であり、それら細胞は典型的にクラスタの全体に亘り(すみからすみまで)散在し、類似した外観で一つ以上の他の細胞と極く近接し、小さく、しばしば角形成した(angulated)細胞として、経験上で認められることができる。これらの細胞は、相当多くの場合、いくぶん高色素性(hyperchromatic)である。
【0054】
次いで、ファーストグリーン及びH/Eで染色された、ISMCVAサイトスピンスライド“ディスク”は、主に40倍の倍率でスコアリングされる。スライドは、大部分が生存可能で、形態的に保存が良好な細胞クラスタを同定するために走査される。理想的に、細胞クラスタは、毛細血管細胞でない細胞を、最低でも20細胞は含むべきである。
【0055】
ネガティブコントロール(0.9%NaClビークル)スライドは、薬剤効果の完全な欠如においてスライドがどのように現れるかを決定する(精神的に(mentally))ように走査される。良好に保存されたネガティブコントロールの細胞クラスタは、 “プレーンパンケーキ(plain pancakes)”と称することができ、それらの比較的均一な外観を暗示する。薬剤に曝露された培養物は試験されて、良く保存され、大部分が生存可能な細胞クラスタを選択する。低出力では、微小凝集体は、“プレーンパンケーキ”(大部分が均一な外観であれば)か、“ブルーベリーパンケーキ(blueberry pancake)”かのいずれかであるようにスコアリングされる。高出力で青緑色に染色の複数の斑状地域があるならば、“ブルーベリーパンケーキ”は、死んだ(ファーストグリーン染色の)毛細血管関連細胞と一致していると分かる。所望であれば、追加的なスライドが調製でき、例えば、内皮細胞に対して合理的に特異的なCD31抗原の染色などの毛細血管関連細胞を特異的に同定できる免疫細胞化学方法で染色できる。
【0056】
“ブルーベリーパンケーキ”効果が、コントロール培養で現れるよりも、テスト培養において多大に観察されるならば、この効果は主観的ではあるが、“1+ブルーベリー”、“4+ブルーベリー”などの標準化した評価スケールでスコアリングされてよい。あるいは、顕微鏡の接眼レンズグリッドを、関心の細胞クラスタの上に重ねてよく、グリッド(格子)単位当たりの“ブルーベリー”数が標準的な手集計カウンターでカウントできる。また“ブルーベリー”は、自動画像解析システムを用いてスコアリングでき得る。
【0057】
実施例4
卵巣癌
【0058】
ヒト卵巣癌の検体で行った研究において、実施例1-3に記載のように、培養の開始時における微小凝集体(非会合性ないし非凝集性)(discohesive)な細胞であることと対照的に)での全腫瘍細胞の中央値パーセントは80であり、培養終点での中央値は85であった。培養開始時での細胞クラスタの二次元領域の中央値は870平方ミクロンであり、培養終点では2300平方ミクロンであった。細胞培養の開始時において、10のすべての検体は非凝集性単一細胞から完全に成り、これは培養終点で1%残存した。微小凝集体を含有する検体において、細胞培養の開始時にスコアリングされたように、それらが含まれているもののうち17%は主に“緩い”クラスタ(上記で定義)であり、78%は主に“中間密度”クラスタであり、4%は支配的に“タイト”なクラスタである。細胞培養終点での所定密度の細胞クラスタを有するアッセイの対応する割合は、25%が主に“緩い”クラスタ、69%が“中間密度”クラスタ、6%が“タイト”なクラスタであった。
【0059】
実施例5
正常な肺
【0060】
ヒトの肺の生検材料が、手術用ハサミで機械的に細かく切り刻まれ、その後、コラゲナーゼ/DNaseで消化された。実施例1で記載のように、様々な細胞の画分はファーストグリーンで染色され、細胞遠心分離されて、ヘマトキシリン/エオシン(H/E)で対比染色された。特記するが、生存可能な細胞がピンクから赤(H/Eで)に染まり、一方で、死細胞は青から緑(ファーストグリーンで)に染まる。アセトアルデヒドで固定されたアヒルの赤血球細胞(青−緑の楕円赤血球)は内部基準として存在する。倍率40倍の図2Aに示されるように、酵素消化物は、大量の生存可能でない(青緑で染色された)細胞、線維及びデブリを含み、非凝集性の単一細胞が混在し、また、様々なサイズ(元の倍率は40倍)の幾らかの三次元細胞クラスタを含む。図2Aに示される調製からの三次元マイクロクラスタは、実施例1に記載のように250xgで多段階の“クイックスピン”で富化(濃縮)され、その後、少量に濃縮し、その後、細胞遠心分離及びファーストグリーンH/E染色が行われる。結果となる微小凝集体は、倍率40倍で図2Bに示され、倍率200倍で図2Cに示され、及び倍率400倍で図2Dに示される。
【0061】
実施例6
神経内分泌腫瘍
【0062】
ヒト神経内分泌(肺カルチノイド)腫瘍の生検が行われ、消化され、マイクロクラスタに濃縮され、一般的には実施例1−3に記載のようにベバシズマブの存在の有無の場合で96時間培養された。マイクロクラスタはファーストグリーンで染色され(細胞遠心分離前に)、H/Eで対比染色された(細胞遠心分離後に)。上述で特記したように、生存可能な細胞がピンク色から赤色(H/Eで)に染まり、一方で、死細胞は青色から緑色(ファーストグリーンで)に染まり、アセトアルデヒドで固定されたアヒルの赤血球細胞(青−緑の楕円赤血球)は内部基準として存在する。腫瘍細胞は大きく、薄いピンクで染まった細胞であり、毛細血管関連細胞(ほとんどは内皮細胞)はより小さく、赤ピンクで濃く染まった細胞で、しばしば鋭く角形成している。図3A及び図4Aは、コントロール培養からのマイクロクラスタを示し、ほとんどが生存可能な腫瘍細胞及び毛細血管関連細胞で、それぞれ倍率100倍と200倍の図面である。図3C及び図4Cは、同定を容易にするために毛細血管関連細胞が円で囲まれた、図3A及び4Aの注釈した形態である。図3B及び図4Bは、ベバシズマブに曝露された細胞からのマイクロクラスタを、それぞれ倍率100倍と200倍に拡大したものを示し、図3C及び3D[訳注:図3D及び4Dの誤記]はそれらの注釈した形態を示す。示されるように、腫瘍細胞は生存可能性(ピンク色に染色)を維持し、一方で、ほとんどの毛細血管関連細胞は死んでいる(青−緑に染色)。
【0063】
ベバシズマブは毛細血管細胞を含む細胞に対する直接的な影響を有さないが、マイクロクラスタ内で腫瘍細胞によって局所的に産生される血管内皮増殖因子(VEGF)と複合体(complexes)を形成することが知られている。VEGFは、ベバシズマブに反応する腫瘍において、内皮細胞の増殖及び生存に必要とされる。これらの結果は、VEGFの連続した存在が、毛細血管関連細胞の生存能力を維持するために必要とされることを示す。培養組織のVEGFをベバシズマブで阻害することは、VEGFに依存する毛細血管関連細胞の死をもたらす。ベバシズマブに反応する“ブルーベリーパンケーキ”クラスタを形成する腫瘍は、ベバシズマブを用いた臨床化学療法に応答する可能性が高く、一方で、“ブルーベリーパンケーキ”クラスタを形成しない腫瘍はベバシズマブを用いた臨床化学療法に応答する可能性は低い。また、記載されたアッセイシステムは、ベバシズマブ耐性微小毛細血管に対して作用するであろう、治療の形態を発見するために使用され得る。
【図面の簡単な説明】
【0064】
【図1A】本発明の微小凝集体の概略図を示す。
【図1B】本発明の微小凝集体の概略図を示す。
【図1C】本発明の微小凝集体の概略図を示す。
【図2A】本発明の微小凝集体の様々な調製段階の顕微鏡写真を示す。
【図2B】本発明の微小凝集体の様々な調製段階の顕微鏡写真を示す。
【図2C】本発明の微小凝集体の様々な調製段階の顕微鏡写真を示す。
【図2D】本発明の微小凝集体の様々な調製段階の顕微鏡写真を示す。
【図3A】ベバシズマブ無処理における本発明の微小凝集体の100倍に拡大した顕微鏡写真を示す。
【図3B】ベバシズマブ有処理における本発明の微小凝集体の100倍に拡大した顕微鏡写真を示す。
【図3C】ベバシズマブ無処理における本発明の微小凝集体の100倍に拡大した顕微鏡写真を示す。
【図3D】ベバシズマブ有処理における本発明の微小凝集体の100倍に拡大した顕微鏡写真を示す。
【図4A】200倍に拡大した、図3Aと同様の微小凝集体の顕微鏡写真を示す。
【図4B】200倍に拡大した、図3Bと同様の微小凝集体の顕微鏡写真を示す。
【図4C】200倍に拡大した、図3Cと同様の微小凝集体の顕微鏡写真を示す。
【図4D】200倍に拡大した、図3Dと同様の微小凝集体の顕微鏡写真を示す。
【特許請求の範囲】
【請求項1】
少なくとも生存可能な内皮細胞と、自然な周辺の生存可能な非内皮細胞(natively surrounding viable non-endothelial cells)とを含んで構成される分離された微小凝集体(microaggregate)であって、該微小凝集体は顕微鏡観察に適切な表面に提示(displayed)される、分離された微小凝集体。
【請求項2】
前記内皮細胞は毛細血管の内皮細胞である、請求項1に記載の微小凝集体。
【請求項3】
前記周辺細胞は腫瘍細胞である、請求項1に記載の微小凝集体。
【請求項4】
請求項1に記載の微小凝集体の調製方法であって、該方法は、細かく切り刻んだ生検サンプルに一連の遠心分離ステップを施すことを含み、
各ステップにおいて、該サンプルは50−500xgの力を受けるようにもたらされ、次いで、直ちに1xgに戻され、このようにして細胞クラスタペレット及び上澄みを得て、該上澄みを除去し、該ペレットを再懸濁して、
前記分離された微小凝集体が形成されるまで該一連の遠心分離ステップが繰り返される、方法。
【請求項5】
微小凝集体の細胞の生存能力に関して処置(treatment)の効果を決定する方法であって、該方法は、
少なくとも生存可能な内皮細胞と、自然な周辺の生存可能な非内皮細胞とを含んで構成される少なくとも一つの微小凝集体を含む組成物を該処置と接触すること、及び
前記微小凝集体の細胞の生存能力に関して前記処置の効果を顕微鏡観察によって観察することを含む方法。
【請求項6】
前記構成物は前記微小凝集体の培養物である、請求項5に記載の方法。
【請求項7】
前記方法は前記微小凝集体を顕微鏡観察のための表面に沈着することを含む、請求項5に記載の方法。
【請求項8】
前記観察ステップは、生細胞により排除される第一指示薬を添加すること、及び前記微小凝集体に存在する細胞による該指示薬の取り込みを観察することを含む、請求項5に記載の方法。
【請求項9】
前記観察ステップは、生細胞により排除される第一指示薬を添加すること、及び前記微小凝集体に存在する細胞による該指示薬の取り込みを観察することを含む、請求項7に記載の方法。
【請求項10】
前記第一指示薬は前記微小凝集体の前記培養物に添加される、請求項6に記載の方法。
【請求項11】
前記第一指示薬は顕微鏡観察に適切な表面上の前記微小凝集体に添加される、請求項7に記載の方法。
【請求項12】
前記微小凝集体を、生細胞により排除されない第二指示薬で処理することをさらに含む、請求項10に記載の方法。
【請求項13】
前記微小凝集体を、生細胞により排除されない第二指示薬で処理することをさらに含む、請求項11に記載の方法。
【請求項14】
前記第二指示薬が顕微鏡観察に適切な表面上に提示される前記微小凝集体に添加される、請求項13に記載の方法。
【請求項15】
前記第一指示薬はファーストグリーンである、請求項8に記載の方法。
【請求項16】
前記第一指示薬はファーストグリーンであり、前記第二指示薬はヘマチン[ヘマトキシリンの誤記]/エオシン(H/E)である、請求項12に記載の方法。
【請求項17】
前記微小凝集体の周辺細胞は腫瘍細胞である、請求項5に記載の方法。
【請求項18】
前記微小凝集体の周辺細胞は正常細胞である、請求項5に記載の方法。
【請求項19】
内皮細胞の死を特異的にもたらす薬剤を同定する方法であって、該方法は、
候補薬剤で、少なくとも生存可能な内皮細胞と、自然な周辺の生存可能な非内皮細胞とを含んで構成される微小凝集体を処理すること、
効果をもたらすように該薬剤に十分な時間を及ぼさせること、
生存可能な細胞により排除される第一色素で該微小凝集体を処理すること、及び
該微小凝集体の細胞による該色素の取り込み又は取り込みの欠損を観察することを含み、
それによって、前記微小凝集体の前記周辺細胞ではなく、前記微小凝集体の前記内皮細胞内で前記色素の取り込みに作用する薬剤が、内皮細胞の死を特異的にもたらす薬剤として同定される、方法。
【請求項20】
前記観察ステップに先立ち、第二色素の溶液で前記微小凝集体を処理することをさらに含み、該溶液は前記第一色素に多大な視感度(visibility)をもたらす、請求項19に記載の方法。
【請求項1】
少なくとも生存可能な内皮細胞と、自然な周辺の生存可能な非内皮細胞(natively surrounding viable non-endothelial cells)とを含んで構成される分離された微小凝集体(microaggregate)であって、該微小凝集体は顕微鏡観察に適切な表面に提示(displayed)される、分離された微小凝集体。
【請求項2】
前記内皮細胞は毛細血管の内皮細胞である、請求項1に記載の微小凝集体。
【請求項3】
前記周辺細胞は腫瘍細胞である、請求項1に記載の微小凝集体。
【請求項4】
請求項1に記載の微小凝集体の調製方法であって、該方法は、細かく切り刻んだ生検サンプルに一連の遠心分離ステップを施すことを含み、
各ステップにおいて、該サンプルは50−500xgの力を受けるようにもたらされ、次いで、直ちに1xgに戻され、このようにして細胞クラスタペレット及び上澄みを得て、該上澄みを除去し、該ペレットを再懸濁して、
前記分離された微小凝集体が形成されるまで該一連の遠心分離ステップが繰り返される、方法。
【請求項5】
微小凝集体の細胞の生存能力に関して処置(treatment)の効果を決定する方法であって、該方法は、
少なくとも生存可能な内皮細胞と、自然な周辺の生存可能な非内皮細胞とを含んで構成される少なくとも一つの微小凝集体を含む組成物を該処置と接触すること、及び
前記微小凝集体の細胞の生存能力に関して前記処置の効果を顕微鏡観察によって観察することを含む方法。
【請求項6】
前記構成物は前記微小凝集体の培養物である、請求項5に記載の方法。
【請求項7】
前記方法は前記微小凝集体を顕微鏡観察のための表面に沈着することを含む、請求項5に記載の方法。
【請求項8】
前記観察ステップは、生細胞により排除される第一指示薬を添加すること、及び前記微小凝集体に存在する細胞による該指示薬の取り込みを観察することを含む、請求項5に記載の方法。
【請求項9】
前記観察ステップは、生細胞により排除される第一指示薬を添加すること、及び前記微小凝集体に存在する細胞による該指示薬の取り込みを観察することを含む、請求項7に記載の方法。
【請求項10】
前記第一指示薬は前記微小凝集体の前記培養物に添加される、請求項6に記載の方法。
【請求項11】
前記第一指示薬は顕微鏡観察に適切な表面上の前記微小凝集体に添加される、請求項7に記載の方法。
【請求項12】
前記微小凝集体を、生細胞により排除されない第二指示薬で処理することをさらに含む、請求項10に記載の方法。
【請求項13】
前記微小凝集体を、生細胞により排除されない第二指示薬で処理することをさらに含む、請求項11に記載の方法。
【請求項14】
前記第二指示薬が顕微鏡観察に適切な表面上に提示される前記微小凝集体に添加される、請求項13に記載の方法。
【請求項15】
前記第一指示薬はファーストグリーンである、請求項8に記載の方法。
【請求項16】
前記第一指示薬はファーストグリーンであり、前記第二指示薬はヘマチン[ヘマトキシリンの誤記]/エオシン(H/E)である、請求項12に記載の方法。
【請求項17】
前記微小凝集体の周辺細胞は腫瘍細胞である、請求項5に記載の方法。
【請求項18】
前記微小凝集体の周辺細胞は正常細胞である、請求項5に記載の方法。
【請求項19】
内皮細胞の死を特異的にもたらす薬剤を同定する方法であって、該方法は、
候補薬剤で、少なくとも生存可能な内皮細胞と、自然な周辺の生存可能な非内皮細胞とを含んで構成される微小凝集体を処理すること、
効果をもたらすように該薬剤に十分な時間を及ぼさせること、
生存可能な細胞により排除される第一色素で該微小凝集体を処理すること、及び
該微小凝集体の細胞による該色素の取り込み又は取り込みの欠損を観察することを含み、
それによって、前記微小凝集体の前記周辺細胞ではなく、前記微小凝集体の前記内皮細胞内で前記色素の取り込みに作用する薬剤が、内皮細胞の死を特異的にもたらす薬剤として同定される、方法。
【請求項20】
前記観察ステップに先立ち、第二色素の溶液で前記微小凝集体を処理することをさらに含み、該溶液は前記第一色素に多大な視感度(visibility)をもたらす、請求項19に記載の方法。
【図1A】


【図1B】


【図1C】


【図2A】


【図2B】


【図2C】


【図2D】


【図3A】


【図3B】


【図3C】


【図3D】


【図4A】


【図4B】


【図4C】


【図4D】




【図1B】


【図1C】


【図2A】


【図2B】


【図2C】


【図2D】


【図3A】


【図3B】


【図3C】


【図3D】


【図4A】


【図4B】


【図4C】


【図4D】


【公表番号】特表2009−519714(P2009−519714A)
【公表日】平成21年5月21日(2009.5.21)
【国際特許分類】
【出願番号】特願2008−545851(P2008−545851)
【出願日】平成18年12月15日(2006.12.15)
【国際出願番号】PCT/US2006/047954
【国際公開番号】WO2007/075440
【国際公開日】平成19年7月5日(2007.7.5)
【出願人】(508180644)
【Fターム(参考)】
【公表日】平成21年5月21日(2009.5.21)
【国際特許分類】
【出願日】平成18年12月15日(2006.12.15)
【国際出願番号】PCT/US2006/047954
【国際公開番号】WO2007/075440
【国際公開日】平成19年7月5日(2007.7.5)
【出願人】(508180644)

【Fターム(参考)】
[ Back to top ]

