内皮細胞保護・閉鎖性動脈硬化予防効果を有するガノデルマ・ツガエの活性物質及びその組成物
【課題】閉鎖性動脈硬化の予防効果を有するガノデルマ・ツガエの活性物質を提供する。
【解決手段】ガノデルマ・ツガエ活性物質であって、ガノデルマ・ツガエを下記ステップによって産生する、(1)ガノデルマ・ツガエを液体発酵培養する、(2)取得した発酵ろ過液をエタノール抽出し、エタノール抽出沈殿物を得る、(3)得られたエタノール抽出沈殿物をゲルろ過クロマグラフィによって純化し、ゲルろ過クロマグラフ分析物を得る、(4)得られたゲルろ過クロマグラフ分析物をアセトンで抽出し、得られた上清液が即ちガノデルマ・ツガエ活性物質である。本発明は又、上述ステップを経て産生したガノデルマ・ツガエ活性物質を含有する組成物を提供する。
【解決手段】ガノデルマ・ツガエ活性物質であって、ガノデルマ・ツガエを下記ステップによって産生する、(1)ガノデルマ・ツガエを液体発酵培養する、(2)取得した発酵ろ過液をエタノール抽出し、エタノール抽出沈殿物を得る、(3)得られたエタノール抽出沈殿物をゲルろ過クロマグラフィによって純化し、ゲルろ過クロマグラフ分析物を得る、(4)得られたゲルろ過クロマグラフ分析物をアセトンで抽出し、得られた上清液が即ちガノデルマ・ツガエ活性物質である。本発明は又、上述ステップを経て産生したガノデルマ・ツガエ活性物質を含有する組成物を提供する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、ガノデルマ・ツガエの活性物質、特に閉鎖性動脈硬化を予防できるガノデルマ・ツガエの活性物質に関する。
【背景技術】
【0002】
数千年来、東洋国家において、レイシ科(Ganodermataceae family)植物には薬用効果があることが証明されており、レイシの耐酸化効果は、その医薬効果の中の一つである。
【0003】
ガノデルマ・ツガエ(Ganoderma tsugae)は、レイシ属扁平状多孔性キノコ類で、又台湾では食膳補充材とされている栽培品種でもある。近年では、ガノデルマ・ツガエ固体培養による子実体及び菌糸体の抽出物には免疫調節・抗ガン・抗炎症及び耐酸化などの治療効果があることが報道されている。
しかしながら、ガノデルマ・ツガエ液体発酵培養により産生する菌体外多糖体(exopolysaccharides)の耐酸化特性又はその他活性成分についてはあまりよく知られていない。
【0004】
酸化ストレス(oxidative stress)は、閉鎖性動脈硬化(Atherosclerosis)の病理生理学上で重要な役割を持っている。酸化ストレスは、酸化物(oxidants)の過度産生による病理結果と定義され、該酸化物は、可溶性耐酸化剤(soluble antioxidants)及びフリーラジカル抑制酵素(free radical-quenching enzymes)の耐酸化能力を抑制する。
近頃の研究では、第一型ヘムオキシゲナーゼ(heme oxygenase-1, HO-1)には耐酸化能力があることが分かっており、該酵素には細胞保護の効果がある。文献でも、第一型ヘムオキシゲナーゼの発現は、閉鎖性動脈硬化の発生を減少させることが指摘されている、これによっても、第一型ヘムオキシゲナーゼ(HO-1)には心血管疾病予防の新規治療標的としての潜在力がることが分かる。
【0005】
最近、酸化還元敏感性転写因子(redox-sensitive transcription factor)、NF-E2相関因子2 (Nuclear factor-erythroid 2 related factor 2, Nrf2)が多くの耐酸化剤タンパク質を調節できることが発表され、これらのタンパク質は、第一型ヘムオキシゲナーゼ(HO-1)、グルタチオンSトランスフェラーゼ(glutathione S-transferase, GST)、γ-グルタミルシステイン(Glutamylcystein synthase, GCS)及びチオレドキシン還元酵素(Thioredoxin reductases, TrxR)を含む。
従って、斬新で一層潜在力を持った転写因子Nrf2関連遺伝子の誘導剤を発見することは、心血管失調の予防又は治療に対する新治療法の発展に寄与するであろう。
【0006】
本案発明者は、上述レイシに備わる広範な効能、及び閉鎖性動脈硬化の学理研究に鑑み、ガノデルマ・ツガエ液体培養により産生する活性物質の、内皮細胞中第一型ヘムオキシゲナーゼ(HO-1)及び第一型チオレドキシン還元酵素(TrxR1)発現に対する影響を追及した。
【発明の概要】
【発明が解決しようとする課題】
【0007】
本発明の目的は、閉鎖性動脈硬化の予防効果を有するガノデルマ・ツガエの活性物質を提供することにある。
【課題を解決するための手段】
【0008】
上述発明目的を達成できるガノデルマ・ツガエの活性物質は、ガノデルマ・ツガエの菌糸体に対し、下記のステップを経て産生したものである。
ステップ1:ガノデルマ・ツガエを培養し、培養物を取得する。
ステップ2:ステップ1によって得られた培養物を、圧搾ろ過して取得したろ過液に対し、エタノール抽出を行い、エタノール抽出沈殿物を得る。
ステップ3:ステップ2で得られたエタノール抽出沈殿物をゲルろ過クロマトグラフィによって純化し、ゲルろ過クロマトグラフ分析物を得る。
ステップ4:ステップ3で得られたゲルろ過クロマトグラフ分析物をアセトンで抽出し、得られた上清液がガノデルマ・ツガエの活性物質である。
ステップ1に述べられた培養方式には、液体発酵培養、固体培養又はその他本発明を適用する培養方法を含み、但しこれに限らない。
好ましい実施例において使われたガノデルマ・ツガエは、中国微生物菌種保蔵管理委員会普通微生物センター(China General Micro-biological Culture Collection Center, CGMCC)に預けられた受託番号CGMCC 2861、受領日付2009年1月8日の分から取った物であるが、本発明に述べられたガノデルマ・ツガエの活性物質は、この菌株から得られた物に限らない。
【0009】
好ましい実施例において、前記液体発酵培養ステップは、タンパク質水分解物0.1〜1%、総合性窒素源0.2〜2%、微量鉱物質0.01〜0.1%、無機塩類0.01〜0.1%及び総合性炭素源2〜10%を含む培養液の中で、20〜35℃、槽圧0.5〜1 vvm、20〜100 rpm攪拌スピードの条件下で、5〜15日間培養した。前記総合性炭素源は、穀物類又は豆類であってよく、前記無機塩類は、硫酸マグネシウム、リン酸二水素カリウム、硫酸鉄などであってよく、前記総合性炭素源は、ブドウ糖、蔗糖、フルクトース、麦芽糖などであってよい。
【0010】
好ましい実施例において、前記エタノール抽出ステップは、最終濃度10%エタノールで30〜60分間抽出した後、遠心分離で取得した上清液を更に最終濃度20%エタノールで30〜60分間抽出した。
【0011】
別の好ましい実施例において、前記エタノール抽出ステップは、最終濃度20%のエタノールで30〜60分間抽出した。
【0012】
好ましい実施例において、前記ゲルろ過クロマトグラフィのステップは、前記エタノール抽出沈殿物をセファクリル S-400ゲルろ過カラムへ注入し、0.05〜0.5のトリス(ヒドロキシメチル)アミノメタン(tris(hydroxymethyl)aminomethane, Tris)緩衝溶液(pH 6.8〜7.2)を移動相とし、流速は0.5ml/min、第161〜200ml又は第321〜400分間目のろ過液を収集した。
【0013】
好ましい実施例において、前記アセトン抽出ステップは、8〜-20℃下で、最終濃度55%アセトンで30〜120分間抽出した。
尚、本発明は、閉鎖性動脈硬化を予防する組成物を提供し、上述ガノデルマ・ツガエの活性物質、及び適当な希釈液、賦形剤或いは担体を含む。
【発明の効果】
【0014】
本発明に係るガノデルマ・ツガエの活性物質は、その他従来の技術又は物質に比べ、更に下記のような長所がある。
本発明に係るガノデルマ・ツガエの活性物質は、細胞核内の転写因子Nrf 2の数量(Nrf 2が転移して細胞核へ入るのを促進する)を増加させることによって、耐酸化反応断片のプロモーター(ARE promoter)の活性、チオレドキシン還元酵素(TrxR promoter)の活性、更に第一型ヘムオキシゲナーゼ(HO-1)、及び第一型チオレドキシン還元酵素(TrxR)の発現を向上させ、閉鎖性動脈硬化を予防する効果を達成できることが試験によって証明されている。これに比べ、従来のガノデルマ・ツガエの活性物質にはこのような効果が見られない。
【図面の簡単な説明】
【0015】
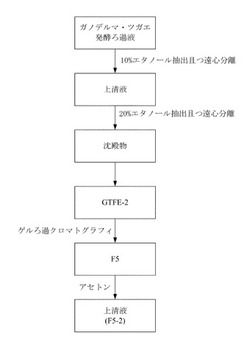
【図1】本発明ガノデルマ・ツガエ活性物質抽出のフローチャートであり、ガノデルマ・ツガエ液体培養ろ過液から異なる抽出物を調製するステップを示す。
【図2】ガノデルマ・ツガエ抽出物F5-2の内皮細胞中における第一型ヘムオキシゲナーゼ(HO-1)の発現誘導についての分析である。図中記号−は、制御組を表す(抽出物添加なしで処理)。
【図3】PNGase F酵素の水分解後のガノデルマ・ツガエ抽出物F5-2の第一型ヘムオキシゲナーゼ(HO-1)の発現誘導弱化についての分析である。図中記号−は、前記処理を行わないことを表す。記号+は、前記処理を行ったことを示し、例えば、第一laneは、内皮細胞に対してF5-2の未処理、F5-2のPNGase F酵素の水分解未処理及び沸騰処理を行っていないことを表す。
【図4A】ガノデルマ・ツガエ抽出物F5-2の第一型チオレドキシン還元酵素(TrxR-1)の発現誘導についての分析を表す。
【図4B】ガノデルマ・ツガエ抽出物F5-2のチオレドキシン還元酵素(Thioredoxin reductases, TrxR)プロモーター活性の誘導についての分析である。図中記号−は、制御組(抽出物添加なしで処理)を表す。
【図5A】ガノデルマ・ツガエ抽出物F5-2の細胞核内転写因子Nrf 2転移の増加及びARE-luciferaseレポーター遺伝子の活性発現誘導についての分析である。図中記号−は、制御組(抽出物添加なしで処理)を表す。
【図5B】ガノデルマ・ツガエ抽出物F5-2の細胞核内転写因子Nrf 2転移の増加及びARE-luciferaseレポーター遺伝子の活性発現誘導についての分析である。図中記号−は、制御組(抽出物添加なしで処理)を表す。
【図6A】ガノデルマ・ツガエ抽出物F5-2の耐酸化環境ストレスに対する保護効果についての分析である。結果は、mean ± SEMで表示した、該試験は独立で5回以上繰り返した。*p<0.05は、未処理対照組に相対して、顕著な差異があることを表す。#p<0.05は、ただH2O2処理のみを行った対照組に相対して、顕著な差異があることを表す。
【図6B】ガノデルマ・ツガエ抽出物F5-2のグルタチオン(Glutathione, GSH)発現についての分析である。図中記号−は、制御組(抽出物添加なしで処理)を表す。
【発明を実施するための形態】
【0016】
本願発明は、下記の実施例で説明する、但し、本願発明は下記実施例に制限されるものではない。
【実施例】
【0017】
実施例1 ガノデルマ・ツガエ発酵液の調製
1.1 ガノデルマ・ツガエの来源
本実施例に使用したガノデルマ・ツガエは、中国微生物菌種保蔵管理委員会普通微生物センター(China General Microbiological Culture Collection Center, CGMCC)に預けられた受託番号CGMCC2861、受領日付2009年1月8日の分から取った物である。但し本発明に述べられたガノデルマ・ツガエの活性物質は、この菌株から得られた物に限らない。
【0018】
1.2 ガノデルマ・ツガエの培養
ガノデルマ・ツガエをポテトブドウ糖寒天培地(Potato Dextrose Agar, PDA, DifcoTM, REF213400) の培養皿に接種し、20〜35℃の条件下で5〜10日間培養した後、細切れに割いてポテトブドウ糖培養液(Potato Dextrose Broth, PDB, DifcoTM, REF254920)を含む3L三角フラスコの中に入れ、20〜35℃、100〜200 rpm振蕩スピード条件下で5〜10日間培養した。
3L三角フラスコ内で培養を完成したガノデルマ・ツガエ種菌を、無菌操作台の中にて無菌接菌瓶の中に入れ、更に蒸気にて滅菌した後、無菌パイプでタンパク質水分解物0.1〜1%、総合性窒素源0.2〜2%、微量鉱物質0.01〜0.1%、無機塩類0.01〜0.1%、総合性炭素源2〜10%などの栄養源を含む50L発酵植菌槽の中にいれ、初期発酵Ph4〜6 、20〜35 ℃、槽圧0.5〜1vvm(無菌空気)、90〜120 rpmの攪拌スピード条件下で3〜7日間培養した。
更に50L発酵槽内に植菌し、蒸気によって2時間滅菌後無菌パイプでタンパク質水分解物0.1〜1%、総合性窒素源0.2〜2%、微量鉱物質0.01〜0.1%、無機塩類0.01〜0.1%、総合性炭素源2〜10%などの栄養源を含む500L発酵植菌槽の中にいれ、初期発酵Ph4〜6 、20〜35 ℃、槽圧0.5〜1vvm(無菌空気)、20〜50 rpmの攪拌スピード条件下で3〜7日間培養した。
次に、500L発酵槽に植菌し、蒸気によって2時間滅菌後無菌パイプでタンパク質水分解物0.1〜1%、総合性窒素源0.2〜2%、微量鉱物質0.01〜0.1%、無機塩類0.01〜0.1%、総合性炭素源2〜10%などの栄養源を含む5000L発酵生産槽の中にいれ、初期発酵Ph4〜6 、20〜35 ℃、槽圧0.5〜1vvm(無菌空気)、20〜60 rpmの攪拌スピード条件下で5〜10日間培養した。
【0019】
ガノデルマ・ツガエ発酵液の圧搾
ケイソウ土(Celite)を5〜10%の添加量で5000L発酵生産槽の中に混入し、ガノデルマ・ツガエ菌糸体発酵液と攪拌して均一に混合し、更に無菌パイプによって板式圧搾機へ送り、圧搾作業を行った。圧搾終了した液体はガノデルマ・ツガエ発酵ろ過液となる。
【0020】
実施例2 ガノデルマ・ツガエ活性物質の調製成分及び生物活性分析
2.1 材料
第一型ヘムオキシゲナーゼ(HO-1)の初級抗体(primary anti-body)は、Stressgen Biotechnologies 社(SB,サンジアゴ、カリフォルニア州、アメリカ)から購入した。耐転写因子Nrf2の抗体は、Santa Cruz Biotechnology社(Santa Cruz、カリフォルニア州、アメリカ)から購入した。過酸化物酵素(peroxidase)を結合した抗−ウサギ抗体及び抗−マウス抗体は、Amersham 社(Arlington Heigths, イリノイ州、アメリカ)から購入した。その他全ての試薬又は材料は、Sigma社(St. Louis、ミズーリ州、アメリカ )、又はその他入手し易い市販ルートから購入してよい。
【0021】
2.2 方法
(1)内皮細胞培養
牛主動脈内皮細胞(bovine aortic endothelial cells, BAECs)をDMEM培養液(Dulbecco’s modified Eagle’s medium, Invitrogen 社)にて培養し、且つ10%の子牛血清(fetal bovine serum, FBS, Invitrogen 社)及び適当な濃度の適用抗生物質を添加した。細胞を37℃、5%CO2培養箱に入れて培養皿一杯になるまで培養を行った。培養液を取り除いた後、無血清のDMEM培養液を代わりに入れ、且つ試験前に、先ず細胞を12時間培養箱に放置した。
【0022】
(2)細胞溶解物(cell lysates)の準備
内皮細胞の総溶解物(whole lysates)を従来の総溶解物(whole lysates)取得技術によって取得した。細胞核抽出物を調製するため、冷え切ったリン酸緩衝液(PBS)の中でコンラージ棒によって内皮細胞を収集した。細胞団塊は、この後10 mM HEPES、1.5 mM MgCL2、10 mM KCL、1 mM DTT、0.5 mM PMSF 及び0.3% Nonidet P-40 で溶解した。更に25% glycerol 20 mM HEPES、0.6 M KCL 、1.5 mM MgCL2、及び0.2 Mm EDTAを含む緩衝液で細胞核タンパク質を抽出した。タンパク質の濃度は、protein assay DC システム(Bio-Rad, Richmond, カリフォルニア州、アメリカ)で決定した。
【0023】
(3)ウェスタン ブロッティング(Western blotting)
慣用ウェスタン ブロッティングの技術手順を参照して、以下簡単に述べる。
総量1x106個の細胞を分解緩衝液(1% NP-40、0.5% sodium deoxycholate、 0.1% SDS及びタンパク質水分解酵素抑制剤混合液)を氷の上に放置、取得した総細胞抽出物を10%電気泳動フィルム(SDS-PAGE)で分離した。更にタンパク質をガラス繊維膜(Millipore)の上に転写し、第一型ヘムオキシゲナーゼ(HO-1)抗体を加えて4℃でゆっくり振蕩した。結果を、ECL 試薬(Amersham Pharmacia Biotech)で化学発光反応によって観測し、操作方法はメーカーの提案によって行った。
【0024】
(4)細胞生存能力の測定(Cell Viability Assay)
細胞生存能力の評価は、Alarmar blue分析法によって測定し、操作方法は、メーカー(Serotec, オックスフォード、英国)の提案によって行った。前記分析法は、酸化態(青色)から還元態(赤色)へ変化する酸化還元指示剤を使用し、生きた細胞内の代謝活性を検査した。赤色の強度は細胞生存能力と正比例であり、且つ前記強度は波長570 nm 及び600 nm吸光値の差異によって計算され、前記数値は対照組の百分比で表示される。
【0025】
(5)過渡的形質転換作用(Transient transfection)及びルシフェラーゼ(Luciferase)の活性分析
形質転換の前の日に、1x106個の内皮細胞を培養皿の中に入れ、継代培養を行った。細胞がほぼ一杯になったとき、lipofectaminenによって耐酸化反応断片(antioxidant response element, ARE)配列を持ったプラスミド(plasmid)を細胞内に形質転換した、操作方法は、メーカーの提案によって行った。これらの細胞は各組中において、相互形質転換(co-transfected)によってPsv-β-galactosidase遺伝子のプラスミドを帯びさせ、形質転換効率を標準化した。一晩形質転換した後、該細胞を異なる濃度のF5-2抽出液で処理し、次にリン酸緩衝液(PBS)で洗い、且つレポーター遺伝子溶菌緩衝液(reporter lysis buffer, Promega)で細胞を溶解し、遠心分離で上清液を取り、ONPG(oetho-nitrophenyl-β-D-galactopyranoside)を加えて混合し、2〜3日間放置した後、酵素免疫分析器(ELISA reader)によって420 nm波長の値(A)を読み取った。又別途に、上清液にルシフェラーゼ活性分析試薬を加えて混合した、混合後、直ちに単管冷光メーターでレポーター遺伝子発現のLuciferase活性数値(B)を測定、二つの数値を計算(B/A)した後、更に制御組の数値で割り、棒グラフを作成した。
【0026】
(6)グルタチオン(GSH)の含有量分析
F5-2で処理した後の細胞を、培養液を吸い取って除き、リン酸緩衝液(PBS)で洗い、且つmonochlorobimane(MCB, 40 μM)によって暗処理を行った後、細胞を溶解した。蛍光分光測定装置(Shimadzu, Rf-5301PC)を使用して、波長380nm及び放射波長470nmを激発させ、GSHの含有相対値を測定した。
【0027】
(7)ガノデルマ・ツガエから活性物質F5-2を生物分析ガイド(Bioassay-guided)によって分離
ガノデルマ・ツガエ発酵ろ過液を図1のフローチャートによって抽出を行う。先ず、凍結乾燥したガノデルマ・ツガエ発酵ろ過液を水で溶解させ、且つ10%、20%のエタノールで抽出、遠心分離によって抽出液の沈殿物を収集し、沈殿物を40℃下で真空乾燥した後、除イオン水で溶解させ、GTFE-2と標示した。
GTFE-2を更にゲルろ過クロマトグラフィ(Gel filtration chomatography)によってによってGTFE-2の成分を分離した。
SephacrylTMS-400カラム(16mmx100cm)(GE Healthcare,Little Chalfont, Buckinghamshire, アメリカ)を使用し、0.05〜0.5Mのトリス(ヒドロキシメチル)アミノメタン(Tris)緩衝溶液(pH 6.8〜7.2)によって、0.5mL/minのスピードで洗い流した。4Ml毎に一本収集し、第161〜200ml又は第321〜400分間目のろ過液を収集して、F-5と命名した。
F-5を更にアセトンで抽出且つ遠心分離させ、上清液を40℃真空下でアセトンを除去し、取得した分離液をF5-2と命名した。F5-2に対し更に化学分析及び生物活性分析を行った。
【0028】
F5-2の特性描写
(8)F5-2をPNGase Fによって酵素解糖(Glycolysis)した後、第一型ヘムオキシゲナーゼ(HO-1)の発現誘導能力分析
F5-2抽出物を取り、0.5M sodium phosphate (pH 7.5)、50mM EDTA 、0.5%(w/v)SDS及び5%(v/v)β-mercaptoethanolを加え、ペプチドF(Peptide-N-glycosidase F, PNGase F, BioLabs@Inc., ニュウイングランド)によって水分解作用(glycolysis)を行った。37℃下で、PNGase Fによって12時間水分解した。1.6%のF5-2を取り、牛主動脈内皮細胞(BAECs)に対して6時間作用させ、別途沸騰したF5-2又はPNGase Fで解糖したF5-2によって細胞を処理した。細胞溶解物を収集し且つ第一型ヘムオキシゲナーゼ(HO-1)抗体又は微小管タンパク(Tubulin、サンプル内対照として)をウェスタン ブロッティング法で分析した。
【0029】
(9)統計分析
全ての試験データは、少なくとも3回独立した試験からなり、毎回試験を3回繰り返した。変異数分析方法(ANOVA)でこれらのデータを分析し、次に、顕著な変異数に対する分析は、Tukey test (SPSS software package、シカゴ、イリノイ州、アメリ)事後比較(post hoc Comparison)によって対照組と試験組の間の一対比較(pair-wise comparison)を行った。*p<0.05をグループの間に顕著な差異のある指標とする。全ての図表の中で、データは平均値±標準値(mean±SD )で標示した。
【0030】
2.3 結果
(1)ガノデルマ・ツガエ活性物質F5-2の第一型ヘムオキシゲナーゼ(HO-1)発現誘導
F5-2をウェスタン ブロッティング法によって内皮細胞中の第一型ヘムオキシゲナーゼ(HO-1)の発現量を分析した。子牛動脈内皮細胞(BAECs)をそれぞれ抽出物F5-2で(1、1.3、1.6又は2.0%で)6時間処理、ウェスタン ブロッティング法によって細胞内(HO-1)タンパク質の発現量を分析し、微小管タンパクをサンプル内対照とした、結果は図2に示すとおり、F5-2は明らかに第一型ヘムオキシゲナーゼ(HO-1)の発現を誘導している。
【0031】
(2)F5-2をPNGase F(糖タンパク分解酵素)によって酵素水分解後、第一型ヘムオキシゲナーゼ(HO-1)の発現誘導能力の減弱
PNGase F酵素は、主としてN-glycanを有する糖タンパク又はペプチドのGlcNAc及びasparaginesの結合部位に作用する。F5-2をPNGase F酵素で水分解した後、細胞HO-1活性測定を行った、結果は、図3に示すように、PNGase Fで処理したF5-2の誘導活 性は減弱した。従って、F5-2が誘導する内皮細胞の第一型ヘムオキシゲナーゼ(HO-1)活性の発現は、N-glycanから来ている可能性がある。
【0032】
(3)F5-2は、ペプチドグリカン(peptidoglycan)の類似物である
F5-2の総糖及びタンパク質含有量を分析、硫酸法によって総糖含有量を測定、Lowry-Folin法によってタンパク質濃度を測定した、結果は、総糖含有量:63.7mg/mL、タンパク質含有量:0.77 mg/mL、総糖及びタンパク質含有量の比例は82対1であった。分析の結果では、F5-2には16種類の異なるアミノ酸を含有し、これらアミノ酸の名称及び濃度(mg/ mL)は、それぞれ、アスパラギン酸(Asp)0.83、トレオニン酸(Thr)0.44、セリン酸(Ser)0.41、グルタミン酸(Glu)1.63、プロリン酸(Pro)0.54、グリシン酸(Gly)0.46、アラニン酸(Ala)0.70、システイン酸(Cys)0.17、バリン酸(Val)0.43、メチオニン酸(Met)0.10、イソロイシン酸(Ile)0.31、ロイシン酸(Leu)0.44、チロシン酸(Tyr)0.10、フェニルアラニン酸(Phe)0.26、リシン酸(Lys)0.20、ヒスチジン酸(His)0.36、アルギニン酸(Arg)0.35であった。トリフルオロ酢酸(TFA)によってF5-2を水分解した後、異なる単糖のモル比をガスクロマトグラフィーで測定した。F5-2には、6種類の異なる単糖:D-グルコース(D-glucose)、D-マンノース(D-mannose)、N-アセチル−グルコサミン(N-acetylglucosamine)、L-アラビノース(L-arabinose)、D-ガラクトース(D-galactose)、L-フコース(L-fucose)が含まれ、これら単糖のモル比は、12.8:3.2:5.2:5.2:1.2:1であった。又、F5-2は、Coomassie blue染料剤で分析したSDS-PAGE上ではタンパク質バンドを有することを示し、Schiff's reagent染料剤で分析したSDS-PAGE上では赤色多糖体バンドを有することを示した。F5-2を、ゲル浸透クロマトグラフィー(gel permeation chromatography, GPC)によって分析した分子量は11KDaであった、以上の結果から、F5-2はペプチドグリカン(peptidoglycan)の類似物であることが分かる。
【0033】
(4)F5-2は第一型チオレドキシン還元酵素(Thioredoxin reductases, TrxR-1)の発現を誘導する
内比細胞に対してF5-2処理を行うと、第一型ヘムオキシゲナーゼ(HO-1)の発現が増加することが分かった。そこで、F5-2がその他の転写因子Nrf2と関係のある遺伝子の発現を誘導するかどうかを更に分析した。図4Aに示すように、内皮細胞を1.3%、2.0%、2.3%濃度のF5-2で処理した場合、第一型チオレドキシン還元酵素(TrxR-1)(もう一つの転写因子Nrf2と関係のある遺伝子)のタンパク発現も増加した。細胞にTrxR-luciferaseを帯びた構築物(周知のTrxRプロモーターによってレポーター遺伝子Luciferaseを構築物の上に接続)を形質転換し、12時間待った後、形質転換された細胞を低血清培地で6時間培養し、次にそれぞれ異なる濃度(1.3、1.6、2.0%)のF5-2で処理した、時間は12時間であった。その後、細胞を溶解し、且つluciferaseの活性を分析した。結果は図4Bに示すように、チオレドキシン還元酵素(Thioredoxin reductases, TrxR)のプロモーター活性もF5-2の処理によって活性化された。
(5)F5-2は、転写因子Nrf2の転移(translocation)速度を強め且つ耐酸化反応断片プロモーター(ARE promoter)-luciferaseレポーター遺伝子の活性を誘導する
一歩進んで、内皮細胞の中で、転写因子Nrf2自身がF5-2によって活性化されるかどうかを調べた。結果は、図5Aに示すように、未処理の細胞に比べ、1.3%及び1.6% F5-2で処理した内皮細胞は、その細胞核抽出物中により多くの転写因子Nrf2が累積し、且つ処理後30分間の時点で既に転写因子Nrf2の累積が観察された。
転写因子Nrf2は、耐酸化反応断片(ARE)を調節して遺伝子発現を駆動させる主要な転写因子であることが知られている。耐酸化反応断片プロモーター(ARE promoter)−ルシフェラーゼ(Luciferase)レポーター遺伝子構築物を形質転換した内皮細胞によってF5-2のARE序列に対する専一性を分析した、その結果は、図5Bに示すように、F5-2で処理した細胞は、そのARE-luciferaseの活性が増加することを示した。
【0034】
(6)F5-2の酸化ストレスに対する保護効果
以上の試験データから、F5-2は、第一型ヘムオキシゲナーゼ(HO-1)及び第一型チオレドキシン還元酵素(Thioredoxin reductases, TrxR-1)の発現に対する有効な誘導剤であることが分かった。そこで、一歩進めて、F5-2が内皮細胞の酸化ストレスに対抗する保護効果があるかどうかをテストした。内皮細胞を先ず1.6% F5-2で6時間処理して、転写因子Nrf2相関遺伝子の誘導を促進した。次に、10%過酸化水素(H2O2)を含む培地で元の培地に取替え、2時間処理した後、細胞生存能力を分析した。結果は図6Aに示すように、未処理の内皮細胞は過酸化水素の環境下に暴露され、細胞生存能力が大幅に低下した。しかし、予め内皮細胞に対してF5-2処理を行うと、この細胞の毒性を減弱できた。
【0035】
グルタチオン(Glutathione, GSH)は、耐酸化剤であり、且つγ−グルタミルシステイン合成酵素(glutamylcystein synthase、転写因子に依存する酵素)の誘導によって増加する。従って、予めF5-2処理を行い、異なる時間経過後、内皮細胞内のGSH濃度を再テストした。その結果は、図6Bに示すように、細胞内のGSH濃度は、F5-2処理後6時間で増加し、12時間経過後も引き続き増加した。前記データは、F5-2の誘導する遺伝子は、細胞が酸化反応に対抗するために必要であることを表している。
【産業上の利用可能性】
【0036】
上記詳細な説明は、本案発明の実行可能な実施例の具体的説明であり、但し前記実施例は、本案発明の特許請求範囲を制限するものではなく、凡そ本案発明の技芸精神を逸脱せずになされる等価実施または変更は、全て本案の特許請求範囲に含まれるものとする。
【受託番号】
【0037】
名称: Ganoderma tsugae SG-GT、受託番号:CGMCC NO.2861
【技術分野】
【0001】
本発明は、ガノデルマ・ツガエの活性物質、特に閉鎖性動脈硬化を予防できるガノデルマ・ツガエの活性物質に関する。
【背景技術】
【0002】
数千年来、東洋国家において、レイシ科(Ganodermataceae family)植物には薬用効果があることが証明されており、レイシの耐酸化効果は、その医薬効果の中の一つである。
【0003】
ガノデルマ・ツガエ(Ganoderma tsugae)は、レイシ属扁平状多孔性キノコ類で、又台湾では食膳補充材とされている栽培品種でもある。近年では、ガノデルマ・ツガエ固体培養による子実体及び菌糸体の抽出物には免疫調節・抗ガン・抗炎症及び耐酸化などの治療効果があることが報道されている。
しかしながら、ガノデルマ・ツガエ液体発酵培養により産生する菌体外多糖体(exopolysaccharides)の耐酸化特性又はその他活性成分についてはあまりよく知られていない。
【0004】
酸化ストレス(oxidative stress)は、閉鎖性動脈硬化(Atherosclerosis)の病理生理学上で重要な役割を持っている。酸化ストレスは、酸化物(oxidants)の過度産生による病理結果と定義され、該酸化物は、可溶性耐酸化剤(soluble antioxidants)及びフリーラジカル抑制酵素(free radical-quenching enzymes)の耐酸化能力を抑制する。
近頃の研究では、第一型ヘムオキシゲナーゼ(heme oxygenase-1, HO-1)には耐酸化能力があることが分かっており、該酵素には細胞保護の効果がある。文献でも、第一型ヘムオキシゲナーゼの発現は、閉鎖性動脈硬化の発生を減少させることが指摘されている、これによっても、第一型ヘムオキシゲナーゼ(HO-1)には心血管疾病予防の新規治療標的としての潜在力がることが分かる。
【0005】
最近、酸化還元敏感性転写因子(redox-sensitive transcription factor)、NF-E2相関因子2 (Nuclear factor-erythroid 2 related factor 2, Nrf2)が多くの耐酸化剤タンパク質を調節できることが発表され、これらのタンパク質は、第一型ヘムオキシゲナーゼ(HO-1)、グルタチオンSトランスフェラーゼ(glutathione S-transferase, GST)、γ-グルタミルシステイン(Glutamylcystein synthase, GCS)及びチオレドキシン還元酵素(Thioredoxin reductases, TrxR)を含む。
従って、斬新で一層潜在力を持った転写因子Nrf2関連遺伝子の誘導剤を発見することは、心血管失調の予防又は治療に対する新治療法の発展に寄与するであろう。
【0006】
本案発明者は、上述レイシに備わる広範な効能、及び閉鎖性動脈硬化の学理研究に鑑み、ガノデルマ・ツガエ液体培養により産生する活性物質の、内皮細胞中第一型ヘムオキシゲナーゼ(HO-1)及び第一型チオレドキシン還元酵素(TrxR1)発現に対する影響を追及した。
【発明の概要】
【発明が解決しようとする課題】
【0007】
本発明の目的は、閉鎖性動脈硬化の予防効果を有するガノデルマ・ツガエの活性物質を提供することにある。
【課題を解決するための手段】
【0008】
上述発明目的を達成できるガノデルマ・ツガエの活性物質は、ガノデルマ・ツガエの菌糸体に対し、下記のステップを経て産生したものである。
ステップ1:ガノデルマ・ツガエを培養し、培養物を取得する。
ステップ2:ステップ1によって得られた培養物を、圧搾ろ過して取得したろ過液に対し、エタノール抽出を行い、エタノール抽出沈殿物を得る。
ステップ3:ステップ2で得られたエタノール抽出沈殿物をゲルろ過クロマトグラフィによって純化し、ゲルろ過クロマトグラフ分析物を得る。
ステップ4:ステップ3で得られたゲルろ過クロマトグラフ分析物をアセトンで抽出し、得られた上清液がガノデルマ・ツガエの活性物質である。
ステップ1に述べられた培養方式には、液体発酵培養、固体培養又はその他本発明を適用する培養方法を含み、但しこれに限らない。
好ましい実施例において使われたガノデルマ・ツガエは、中国微生物菌種保蔵管理委員会普通微生物センター(China General Micro-biological Culture Collection Center, CGMCC)に預けられた受託番号CGMCC 2861、受領日付2009年1月8日の分から取った物であるが、本発明に述べられたガノデルマ・ツガエの活性物質は、この菌株から得られた物に限らない。
【0009】
好ましい実施例において、前記液体発酵培養ステップは、タンパク質水分解物0.1〜1%、総合性窒素源0.2〜2%、微量鉱物質0.01〜0.1%、無機塩類0.01〜0.1%及び総合性炭素源2〜10%を含む培養液の中で、20〜35℃、槽圧0.5〜1 vvm、20〜100 rpm攪拌スピードの条件下で、5〜15日間培養した。前記総合性炭素源は、穀物類又は豆類であってよく、前記無機塩類は、硫酸マグネシウム、リン酸二水素カリウム、硫酸鉄などであってよく、前記総合性炭素源は、ブドウ糖、蔗糖、フルクトース、麦芽糖などであってよい。
【0010】
好ましい実施例において、前記エタノール抽出ステップは、最終濃度10%エタノールで30〜60分間抽出した後、遠心分離で取得した上清液を更に最終濃度20%エタノールで30〜60分間抽出した。
【0011】
別の好ましい実施例において、前記エタノール抽出ステップは、最終濃度20%のエタノールで30〜60分間抽出した。
【0012】
好ましい実施例において、前記ゲルろ過クロマトグラフィのステップは、前記エタノール抽出沈殿物をセファクリル S-400ゲルろ過カラムへ注入し、0.05〜0.5のトリス(ヒドロキシメチル)アミノメタン(tris(hydroxymethyl)aminomethane, Tris)緩衝溶液(pH 6.8〜7.2)を移動相とし、流速は0.5ml/min、第161〜200ml又は第321〜400分間目のろ過液を収集した。
【0013】
好ましい実施例において、前記アセトン抽出ステップは、8〜-20℃下で、最終濃度55%アセトンで30〜120分間抽出した。
尚、本発明は、閉鎖性動脈硬化を予防する組成物を提供し、上述ガノデルマ・ツガエの活性物質、及び適当な希釈液、賦形剤或いは担体を含む。
【発明の効果】
【0014】
本発明に係るガノデルマ・ツガエの活性物質は、その他従来の技術又は物質に比べ、更に下記のような長所がある。
本発明に係るガノデルマ・ツガエの活性物質は、細胞核内の転写因子Nrf 2の数量(Nrf 2が転移して細胞核へ入るのを促進する)を増加させることによって、耐酸化反応断片のプロモーター(ARE promoter)の活性、チオレドキシン還元酵素(TrxR promoter)の活性、更に第一型ヘムオキシゲナーゼ(HO-1)、及び第一型チオレドキシン還元酵素(TrxR)の発現を向上させ、閉鎖性動脈硬化を予防する効果を達成できることが試験によって証明されている。これに比べ、従来のガノデルマ・ツガエの活性物質にはこのような効果が見られない。
【図面の簡単な説明】
【0015】
【図1】本発明ガノデルマ・ツガエ活性物質抽出のフローチャートであり、ガノデルマ・ツガエ液体培養ろ過液から異なる抽出物を調製するステップを示す。
【図2】ガノデルマ・ツガエ抽出物F5-2の内皮細胞中における第一型ヘムオキシゲナーゼ(HO-1)の発現誘導についての分析である。図中記号−は、制御組を表す(抽出物添加なしで処理)。
【図3】PNGase F酵素の水分解後のガノデルマ・ツガエ抽出物F5-2の第一型ヘムオキシゲナーゼ(HO-1)の発現誘導弱化についての分析である。図中記号−は、前記処理を行わないことを表す。記号+は、前記処理を行ったことを示し、例えば、第一laneは、内皮細胞に対してF5-2の未処理、F5-2のPNGase F酵素の水分解未処理及び沸騰処理を行っていないことを表す。
【図4A】ガノデルマ・ツガエ抽出物F5-2の第一型チオレドキシン還元酵素(TrxR-1)の発現誘導についての分析を表す。
【図4B】ガノデルマ・ツガエ抽出物F5-2のチオレドキシン還元酵素(Thioredoxin reductases, TrxR)プロモーター活性の誘導についての分析である。図中記号−は、制御組(抽出物添加なしで処理)を表す。
【図5A】ガノデルマ・ツガエ抽出物F5-2の細胞核内転写因子Nrf 2転移の増加及びARE-luciferaseレポーター遺伝子の活性発現誘導についての分析である。図中記号−は、制御組(抽出物添加なしで処理)を表す。
【図5B】ガノデルマ・ツガエ抽出物F5-2の細胞核内転写因子Nrf 2転移の増加及びARE-luciferaseレポーター遺伝子の活性発現誘導についての分析である。図中記号−は、制御組(抽出物添加なしで処理)を表す。
【図6A】ガノデルマ・ツガエ抽出物F5-2の耐酸化環境ストレスに対する保護効果についての分析である。結果は、mean ± SEMで表示した、該試験は独立で5回以上繰り返した。*p<0.05は、未処理対照組に相対して、顕著な差異があることを表す。#p<0.05は、ただH2O2処理のみを行った対照組に相対して、顕著な差異があることを表す。
【図6B】ガノデルマ・ツガエ抽出物F5-2のグルタチオン(Glutathione, GSH)発現についての分析である。図中記号−は、制御組(抽出物添加なしで処理)を表す。
【発明を実施するための形態】
【0016】
本願発明は、下記の実施例で説明する、但し、本願発明は下記実施例に制限されるものではない。
【実施例】
【0017】
実施例1 ガノデルマ・ツガエ発酵液の調製
1.1 ガノデルマ・ツガエの来源
本実施例に使用したガノデルマ・ツガエは、中国微生物菌種保蔵管理委員会普通微生物センター(China General Microbiological Culture Collection Center, CGMCC)に預けられた受託番号CGMCC2861、受領日付2009年1月8日の分から取った物である。但し本発明に述べられたガノデルマ・ツガエの活性物質は、この菌株から得られた物に限らない。
【0018】
1.2 ガノデルマ・ツガエの培養
ガノデルマ・ツガエをポテトブドウ糖寒天培地(Potato Dextrose Agar, PDA, DifcoTM, REF213400) の培養皿に接種し、20〜35℃の条件下で5〜10日間培養した後、細切れに割いてポテトブドウ糖培養液(Potato Dextrose Broth, PDB, DifcoTM, REF254920)を含む3L三角フラスコの中に入れ、20〜35℃、100〜200 rpm振蕩スピード条件下で5〜10日間培養した。
3L三角フラスコ内で培養を完成したガノデルマ・ツガエ種菌を、無菌操作台の中にて無菌接菌瓶の中に入れ、更に蒸気にて滅菌した後、無菌パイプでタンパク質水分解物0.1〜1%、総合性窒素源0.2〜2%、微量鉱物質0.01〜0.1%、無機塩類0.01〜0.1%、総合性炭素源2〜10%などの栄養源を含む50L発酵植菌槽の中にいれ、初期発酵Ph4〜6 、20〜35 ℃、槽圧0.5〜1vvm(無菌空気)、90〜120 rpmの攪拌スピード条件下で3〜7日間培養した。
更に50L発酵槽内に植菌し、蒸気によって2時間滅菌後無菌パイプでタンパク質水分解物0.1〜1%、総合性窒素源0.2〜2%、微量鉱物質0.01〜0.1%、無機塩類0.01〜0.1%、総合性炭素源2〜10%などの栄養源を含む500L発酵植菌槽の中にいれ、初期発酵Ph4〜6 、20〜35 ℃、槽圧0.5〜1vvm(無菌空気)、20〜50 rpmの攪拌スピード条件下で3〜7日間培養した。
次に、500L発酵槽に植菌し、蒸気によって2時間滅菌後無菌パイプでタンパク質水分解物0.1〜1%、総合性窒素源0.2〜2%、微量鉱物質0.01〜0.1%、無機塩類0.01〜0.1%、総合性炭素源2〜10%などの栄養源を含む5000L発酵生産槽の中にいれ、初期発酵Ph4〜6 、20〜35 ℃、槽圧0.5〜1vvm(無菌空気)、20〜60 rpmの攪拌スピード条件下で5〜10日間培養した。
【0019】
ガノデルマ・ツガエ発酵液の圧搾
ケイソウ土(Celite)を5〜10%の添加量で5000L発酵生産槽の中に混入し、ガノデルマ・ツガエ菌糸体発酵液と攪拌して均一に混合し、更に無菌パイプによって板式圧搾機へ送り、圧搾作業を行った。圧搾終了した液体はガノデルマ・ツガエ発酵ろ過液となる。
【0020】
実施例2 ガノデルマ・ツガエ活性物質の調製成分及び生物活性分析
2.1 材料
第一型ヘムオキシゲナーゼ(HO-1)の初級抗体(primary anti-body)は、Stressgen Biotechnologies 社(SB,サンジアゴ、カリフォルニア州、アメリカ)から購入した。耐転写因子Nrf2の抗体は、Santa Cruz Biotechnology社(Santa Cruz、カリフォルニア州、アメリカ)から購入した。過酸化物酵素(peroxidase)を結合した抗−ウサギ抗体及び抗−マウス抗体は、Amersham 社(Arlington Heigths, イリノイ州、アメリカ)から購入した。その他全ての試薬又は材料は、Sigma社(St. Louis、ミズーリ州、アメリカ )、又はその他入手し易い市販ルートから購入してよい。
【0021】
2.2 方法
(1)内皮細胞培養
牛主動脈内皮細胞(bovine aortic endothelial cells, BAECs)をDMEM培養液(Dulbecco’s modified Eagle’s medium, Invitrogen 社)にて培養し、且つ10%の子牛血清(fetal bovine serum, FBS, Invitrogen 社)及び適当な濃度の適用抗生物質を添加した。細胞を37℃、5%CO2培養箱に入れて培養皿一杯になるまで培養を行った。培養液を取り除いた後、無血清のDMEM培養液を代わりに入れ、且つ試験前に、先ず細胞を12時間培養箱に放置した。
【0022】
(2)細胞溶解物(cell lysates)の準備
内皮細胞の総溶解物(whole lysates)を従来の総溶解物(whole lysates)取得技術によって取得した。細胞核抽出物を調製するため、冷え切ったリン酸緩衝液(PBS)の中でコンラージ棒によって内皮細胞を収集した。細胞団塊は、この後10 mM HEPES、1.5 mM MgCL2、10 mM KCL、1 mM DTT、0.5 mM PMSF 及び0.3% Nonidet P-40 で溶解した。更に25% glycerol 20 mM HEPES、0.6 M KCL 、1.5 mM MgCL2、及び0.2 Mm EDTAを含む緩衝液で細胞核タンパク質を抽出した。タンパク質の濃度は、protein assay DC システム(Bio-Rad, Richmond, カリフォルニア州、アメリカ)で決定した。
【0023】
(3)ウェスタン ブロッティング(Western blotting)
慣用ウェスタン ブロッティングの技術手順を参照して、以下簡単に述べる。
総量1x106個の細胞を分解緩衝液(1% NP-40、0.5% sodium deoxycholate、 0.1% SDS及びタンパク質水分解酵素抑制剤混合液)を氷の上に放置、取得した総細胞抽出物を10%電気泳動フィルム(SDS-PAGE)で分離した。更にタンパク質をガラス繊維膜(Millipore)の上に転写し、第一型ヘムオキシゲナーゼ(HO-1)抗体を加えて4℃でゆっくり振蕩した。結果を、ECL 試薬(Amersham Pharmacia Biotech)で化学発光反応によって観測し、操作方法はメーカーの提案によって行った。
【0024】
(4)細胞生存能力の測定(Cell Viability Assay)
細胞生存能力の評価は、Alarmar blue分析法によって測定し、操作方法は、メーカー(Serotec, オックスフォード、英国)の提案によって行った。前記分析法は、酸化態(青色)から還元態(赤色)へ変化する酸化還元指示剤を使用し、生きた細胞内の代謝活性を検査した。赤色の強度は細胞生存能力と正比例であり、且つ前記強度は波長570 nm 及び600 nm吸光値の差異によって計算され、前記数値は対照組の百分比で表示される。
【0025】
(5)過渡的形質転換作用(Transient transfection)及びルシフェラーゼ(Luciferase)の活性分析
形質転換の前の日に、1x106個の内皮細胞を培養皿の中に入れ、継代培養を行った。細胞がほぼ一杯になったとき、lipofectaminenによって耐酸化反応断片(antioxidant response element, ARE)配列を持ったプラスミド(plasmid)を細胞内に形質転換した、操作方法は、メーカーの提案によって行った。これらの細胞は各組中において、相互形質転換(co-transfected)によってPsv-β-galactosidase遺伝子のプラスミドを帯びさせ、形質転換効率を標準化した。一晩形質転換した後、該細胞を異なる濃度のF5-2抽出液で処理し、次にリン酸緩衝液(PBS)で洗い、且つレポーター遺伝子溶菌緩衝液(reporter lysis buffer, Promega)で細胞を溶解し、遠心分離で上清液を取り、ONPG(oetho-nitrophenyl-β-D-galactopyranoside)を加えて混合し、2〜3日間放置した後、酵素免疫分析器(ELISA reader)によって420 nm波長の値(A)を読み取った。又別途に、上清液にルシフェラーゼ活性分析試薬を加えて混合した、混合後、直ちに単管冷光メーターでレポーター遺伝子発現のLuciferase活性数値(B)を測定、二つの数値を計算(B/A)した後、更に制御組の数値で割り、棒グラフを作成した。
【0026】
(6)グルタチオン(GSH)の含有量分析
F5-2で処理した後の細胞を、培養液を吸い取って除き、リン酸緩衝液(PBS)で洗い、且つmonochlorobimane(MCB, 40 μM)によって暗処理を行った後、細胞を溶解した。蛍光分光測定装置(Shimadzu, Rf-5301PC)を使用して、波長380nm及び放射波長470nmを激発させ、GSHの含有相対値を測定した。
【0027】
(7)ガノデルマ・ツガエから活性物質F5-2を生物分析ガイド(Bioassay-guided)によって分離
ガノデルマ・ツガエ発酵ろ過液を図1のフローチャートによって抽出を行う。先ず、凍結乾燥したガノデルマ・ツガエ発酵ろ過液を水で溶解させ、且つ10%、20%のエタノールで抽出、遠心分離によって抽出液の沈殿物を収集し、沈殿物を40℃下で真空乾燥した後、除イオン水で溶解させ、GTFE-2と標示した。
GTFE-2を更にゲルろ過クロマトグラフィ(Gel filtration chomatography)によってによってGTFE-2の成分を分離した。
SephacrylTMS-400カラム(16mmx100cm)(GE Healthcare,Little Chalfont, Buckinghamshire, アメリカ)を使用し、0.05〜0.5Mのトリス(ヒドロキシメチル)アミノメタン(Tris)緩衝溶液(pH 6.8〜7.2)によって、0.5mL/minのスピードで洗い流した。4Ml毎に一本収集し、第161〜200ml又は第321〜400分間目のろ過液を収集して、F-5と命名した。
F-5を更にアセトンで抽出且つ遠心分離させ、上清液を40℃真空下でアセトンを除去し、取得した分離液をF5-2と命名した。F5-2に対し更に化学分析及び生物活性分析を行った。
【0028】
F5-2の特性描写
(8)F5-2をPNGase Fによって酵素解糖(Glycolysis)した後、第一型ヘムオキシゲナーゼ(HO-1)の発現誘導能力分析
F5-2抽出物を取り、0.5M sodium phosphate (pH 7.5)、50mM EDTA 、0.5%(w/v)SDS及び5%(v/v)β-mercaptoethanolを加え、ペプチドF(Peptide-N-glycosidase F, PNGase F, BioLabs@Inc., ニュウイングランド)によって水分解作用(glycolysis)を行った。37℃下で、PNGase Fによって12時間水分解した。1.6%のF5-2を取り、牛主動脈内皮細胞(BAECs)に対して6時間作用させ、別途沸騰したF5-2又はPNGase Fで解糖したF5-2によって細胞を処理した。細胞溶解物を収集し且つ第一型ヘムオキシゲナーゼ(HO-1)抗体又は微小管タンパク(Tubulin、サンプル内対照として)をウェスタン ブロッティング法で分析した。
【0029】
(9)統計分析
全ての試験データは、少なくとも3回独立した試験からなり、毎回試験を3回繰り返した。変異数分析方法(ANOVA)でこれらのデータを分析し、次に、顕著な変異数に対する分析は、Tukey test (SPSS software package、シカゴ、イリノイ州、アメリ)事後比較(post hoc Comparison)によって対照組と試験組の間の一対比較(pair-wise comparison)を行った。*p<0.05をグループの間に顕著な差異のある指標とする。全ての図表の中で、データは平均値±標準値(mean±SD )で標示した。
【0030】
2.3 結果
(1)ガノデルマ・ツガエ活性物質F5-2の第一型ヘムオキシゲナーゼ(HO-1)発現誘導
F5-2をウェスタン ブロッティング法によって内皮細胞中の第一型ヘムオキシゲナーゼ(HO-1)の発現量を分析した。子牛動脈内皮細胞(BAECs)をそれぞれ抽出物F5-2で(1、1.3、1.6又は2.0%で)6時間処理、ウェスタン ブロッティング法によって細胞内(HO-1)タンパク質の発現量を分析し、微小管タンパクをサンプル内対照とした、結果は図2に示すとおり、F5-2は明らかに第一型ヘムオキシゲナーゼ(HO-1)の発現を誘導している。
【0031】
(2)F5-2をPNGase F(糖タンパク分解酵素)によって酵素水分解後、第一型ヘムオキシゲナーゼ(HO-1)の発現誘導能力の減弱
PNGase F酵素は、主としてN-glycanを有する糖タンパク又はペプチドのGlcNAc及びasparaginesの結合部位に作用する。F5-2をPNGase F酵素で水分解した後、細胞HO-1活性測定を行った、結果は、図3に示すように、PNGase Fで処理したF5-2の誘導活 性は減弱した。従って、F5-2が誘導する内皮細胞の第一型ヘムオキシゲナーゼ(HO-1)活性の発現は、N-glycanから来ている可能性がある。
【0032】
(3)F5-2は、ペプチドグリカン(peptidoglycan)の類似物である
F5-2の総糖及びタンパク質含有量を分析、硫酸法によって総糖含有量を測定、Lowry-Folin法によってタンパク質濃度を測定した、結果は、総糖含有量:63.7mg/mL、タンパク質含有量:0.77 mg/mL、総糖及びタンパク質含有量の比例は82対1であった。分析の結果では、F5-2には16種類の異なるアミノ酸を含有し、これらアミノ酸の名称及び濃度(mg/ mL)は、それぞれ、アスパラギン酸(Asp)0.83、トレオニン酸(Thr)0.44、セリン酸(Ser)0.41、グルタミン酸(Glu)1.63、プロリン酸(Pro)0.54、グリシン酸(Gly)0.46、アラニン酸(Ala)0.70、システイン酸(Cys)0.17、バリン酸(Val)0.43、メチオニン酸(Met)0.10、イソロイシン酸(Ile)0.31、ロイシン酸(Leu)0.44、チロシン酸(Tyr)0.10、フェニルアラニン酸(Phe)0.26、リシン酸(Lys)0.20、ヒスチジン酸(His)0.36、アルギニン酸(Arg)0.35であった。トリフルオロ酢酸(TFA)によってF5-2を水分解した後、異なる単糖のモル比をガスクロマトグラフィーで測定した。F5-2には、6種類の異なる単糖:D-グルコース(D-glucose)、D-マンノース(D-mannose)、N-アセチル−グルコサミン(N-acetylglucosamine)、L-アラビノース(L-arabinose)、D-ガラクトース(D-galactose)、L-フコース(L-fucose)が含まれ、これら単糖のモル比は、12.8:3.2:5.2:5.2:1.2:1であった。又、F5-2は、Coomassie blue染料剤で分析したSDS-PAGE上ではタンパク質バンドを有することを示し、Schiff's reagent染料剤で分析したSDS-PAGE上では赤色多糖体バンドを有することを示した。F5-2を、ゲル浸透クロマトグラフィー(gel permeation chromatography, GPC)によって分析した分子量は11KDaであった、以上の結果から、F5-2はペプチドグリカン(peptidoglycan)の類似物であることが分かる。
【0033】
(4)F5-2は第一型チオレドキシン還元酵素(Thioredoxin reductases, TrxR-1)の発現を誘導する
内比細胞に対してF5-2処理を行うと、第一型ヘムオキシゲナーゼ(HO-1)の発現が増加することが分かった。そこで、F5-2がその他の転写因子Nrf2と関係のある遺伝子の発現を誘導するかどうかを更に分析した。図4Aに示すように、内皮細胞を1.3%、2.0%、2.3%濃度のF5-2で処理した場合、第一型チオレドキシン還元酵素(TrxR-1)(もう一つの転写因子Nrf2と関係のある遺伝子)のタンパク発現も増加した。細胞にTrxR-luciferaseを帯びた構築物(周知のTrxRプロモーターによってレポーター遺伝子Luciferaseを構築物の上に接続)を形質転換し、12時間待った後、形質転換された細胞を低血清培地で6時間培養し、次にそれぞれ異なる濃度(1.3、1.6、2.0%)のF5-2で処理した、時間は12時間であった。その後、細胞を溶解し、且つluciferaseの活性を分析した。結果は図4Bに示すように、チオレドキシン還元酵素(Thioredoxin reductases, TrxR)のプロモーター活性もF5-2の処理によって活性化された。
(5)F5-2は、転写因子Nrf2の転移(translocation)速度を強め且つ耐酸化反応断片プロモーター(ARE promoter)-luciferaseレポーター遺伝子の活性を誘導する
一歩進んで、内皮細胞の中で、転写因子Nrf2自身がF5-2によって活性化されるかどうかを調べた。結果は、図5Aに示すように、未処理の細胞に比べ、1.3%及び1.6% F5-2で処理した内皮細胞は、その細胞核抽出物中により多くの転写因子Nrf2が累積し、且つ処理後30分間の時点で既に転写因子Nrf2の累積が観察された。
転写因子Nrf2は、耐酸化反応断片(ARE)を調節して遺伝子発現を駆動させる主要な転写因子であることが知られている。耐酸化反応断片プロモーター(ARE promoter)−ルシフェラーゼ(Luciferase)レポーター遺伝子構築物を形質転換した内皮細胞によってF5-2のARE序列に対する専一性を分析した、その結果は、図5Bに示すように、F5-2で処理した細胞は、そのARE-luciferaseの活性が増加することを示した。
【0034】
(6)F5-2の酸化ストレスに対する保護効果
以上の試験データから、F5-2は、第一型ヘムオキシゲナーゼ(HO-1)及び第一型チオレドキシン還元酵素(Thioredoxin reductases, TrxR-1)の発現に対する有効な誘導剤であることが分かった。そこで、一歩進めて、F5-2が内皮細胞の酸化ストレスに対抗する保護効果があるかどうかをテストした。内皮細胞を先ず1.6% F5-2で6時間処理して、転写因子Nrf2相関遺伝子の誘導を促進した。次に、10%過酸化水素(H2O2)を含む培地で元の培地に取替え、2時間処理した後、細胞生存能力を分析した。結果は図6Aに示すように、未処理の内皮細胞は過酸化水素の環境下に暴露され、細胞生存能力が大幅に低下した。しかし、予め内皮細胞に対してF5-2処理を行うと、この細胞の毒性を減弱できた。
【0035】
グルタチオン(Glutathione, GSH)は、耐酸化剤であり、且つγ−グルタミルシステイン合成酵素(glutamylcystein synthase、転写因子に依存する酵素)の誘導によって増加する。従って、予めF5-2処理を行い、異なる時間経過後、内皮細胞内のGSH濃度を再テストした。その結果は、図6Bに示すように、細胞内のGSH濃度は、F5-2処理後6時間で増加し、12時間経過後も引き続き増加した。前記データは、F5-2の誘導する遺伝子は、細胞が酸化反応に対抗するために必要であることを表している。
【産業上の利用可能性】
【0036】
上記詳細な説明は、本案発明の実行可能な実施例の具体的説明であり、但し前記実施例は、本案発明の特許請求範囲を制限するものではなく、凡そ本案発明の技芸精神を逸脱せずになされる等価実施または変更は、全て本案の特許請求範囲に含まれるものとする。
【受託番号】
【0037】
名称: Ganoderma tsugae SG-GT、受託番号:CGMCC NO.2861
【特許請求の範囲】
【請求項1】
ガノデルマ・ツガエ活性物質であって、
ガノデルマ・ツガエ(中国微生物菌種保蔵管理委員会普通微生物センター(China General Microbiological Culture Collection Center, CGMCC)に預けられ、受託番号CGMCC2861、受領日付2009年1月8日)を培養して培養物を取得する、ステップ(1)と、
ガノデルマ・ツガエ培養物をエタノール抽出し、エタノール抽出沈殿物を得る、ステップ(2)と、
ステップ(2)で得られたエタノール抽出沈殿物をゲルろ過クロマグラフィーによって純化し、ゲルろ過クロマグラフ分析物を得る、ステップ(3)と、
ステップ3で得られたゲルろ過クロマグラフ分析物をアセトンで抽出し、得られた上清液が即ちガノデルマ・ツガエ活性物質である、ステップ(4)と、によって産正した、
ガノデルマ・ツガエ活性物質。
【請求項2】
閉鎖性動脈硬化を予防する組成物であって、請求項1に記載のガノデルマ・ツガエ活性物質及び適当な希釈剤・賦形剤又は担体を含むことを特徴とする、閉鎖性動脈硬化を予防する組成物。
【請求項3】
第一型ヘムオキシゲナーゼ及び第一型チオレドキシン還元酵素の活性を誘導、及び転写因子Nrf2の細胞核への進入を促進することを特徴とする請求項2に記載の組成物。
【請求項1】
ガノデルマ・ツガエ活性物質であって、
ガノデルマ・ツガエ(中国微生物菌種保蔵管理委員会普通微生物センター(China General Microbiological Culture Collection Center, CGMCC)に預けられ、受託番号CGMCC2861、受領日付2009年1月8日)を培養して培養物を取得する、ステップ(1)と、
ガノデルマ・ツガエ培養物をエタノール抽出し、エタノール抽出沈殿物を得る、ステップ(2)と、
ステップ(2)で得られたエタノール抽出沈殿物をゲルろ過クロマグラフィーによって純化し、ゲルろ過クロマグラフ分析物を得る、ステップ(3)と、
ステップ3で得られたゲルろ過クロマグラフ分析物をアセトンで抽出し、得られた上清液が即ちガノデルマ・ツガエ活性物質である、ステップ(4)と、によって産正した、
ガノデルマ・ツガエ活性物質。
【請求項2】
閉鎖性動脈硬化を予防する組成物であって、請求項1に記載のガノデルマ・ツガエ活性物質及び適当な希釈剤・賦形剤又は担体を含むことを特徴とする、閉鎖性動脈硬化を予防する組成物。
【請求項3】
第一型ヘムオキシゲナーゼ及び第一型チオレドキシン還元酵素の活性を誘導、及び転写因子Nrf2の細胞核への進入を促進することを特徴とする請求項2に記載の組成物。
【図1】


【図4B】


【図5B】


【図6A】


【図6B】


【図2】


【図3】


【図4A】


【図5A】




【図4B】


【図5B】


【図6A】


【図6B】


【図2】


【図3】


【図4A】


【図5A】


【公開番号】特開2010−285366(P2010−285366A)
【公開日】平成22年12月24日(2010.12.24)
【国際特許分類】
【出願番号】特願2009−139186(P2009−139186)
【出願日】平成21年6月10日(2009.6.10)
【出願人】(509013611)生展生物科技股▲分▼有限公司 (3)
【Fターム(参考)】
【公開日】平成22年12月24日(2010.12.24)
【国際特許分類】
【出願日】平成21年6月10日(2009.6.10)
【出願人】(509013611)生展生物科技股▲分▼有限公司 (3)
【Fターム(参考)】
[ Back to top ]

