内皮細胞接着を促進するコーティング
【課題】マトリックス、および内皮細胞抗原と反応する抗体でコーティングした、ステントまたは合成移植片のような医療用デバイスを生産するための組成物および方法の提供。
【解決手段】医療用デバイスをコーティングするマトリックスは、ポリウレタン、ポリL−乳酸、セルロースエステルまたはポリエチレングリコールのような合成材料から構成される。別の実施形態では、マトリックスは、コラーゲン、フィブリン、エラスチン、非晶質炭素のような天然材料から構成される。第3の実施形態では、マトリックスは、約C60〜約C100の範囲のフラーレンから構成されてもよい。抗体は、マトリックスと混合されてもよく、あるいはマトリックスに、リンカー分子を通じて共有結合的に拘束されてもよい。医療用デバイスへの接着後、内皮細胞は、医療用デバイス上で分化および増殖する。抗体は、種々の型のモノクローナル抗体であり得る。
【解決手段】医療用デバイスをコーティングするマトリックスは、ポリウレタン、ポリL−乳酸、セルロースエステルまたはポリエチレングリコールのような合成材料から構成される。別の実施形態では、マトリックスは、コラーゲン、フィブリン、エラスチン、非晶質炭素のような天然材料から構成される。第3の実施形態では、マトリックスは、約C60〜約C100の範囲のフラーレンから構成されてもよい。抗体は、マトリックスと混合されてもよく、あるいはマトリックスに、リンカー分子を通じて共有結合的に拘束されてもよい。医療用デバイスへの接着後、内皮細胞は、医療用デバイス上で分化および増殖する。抗体は、種々の型のモノクローナル抗体であり得る。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、体内の血管に移植される医療用デバイスの分野に関する。より詳細には、本発明は、ステントまたは合成移植片への内皮細胞の接着を促進するマトリックスを組み入れる、血管に移植されるステントまたは合成移植片に関する。
【0002】
本出願は、2000年3月15日に提出した米国仮出願第60/189,674号、および2000年5月4日に提出した米国仮出願第60/201,789号の利益を主張する。
【背景技術】
【0003】
アテローム性動脈硬化症は、世界において死亡および障害の主な原因の1つである。アテローム性動脈硬化症は、動脈の管腔表面上の脂肪プラークの沈着を伴う。動脈の管腔表面上の脂肪プラークの沈着は、動脈の断面積の狭窄を引き起こす。最終的には、この沈着は、その病変から遠位への血流を遮断し、動脈により供給される組織への虚血性損傷を引き起こす。
【0004】
冠動脈は、心臓に血液を供給する。冠動脈アテローム性動脈硬化症疾患(CAD)は、米国において最も一般的で深刻な慢性の生命に関わる病気であり、一千百万人を超える人々が冒されている。冠動脈アテローム性動脈硬化症の社会的および経済的費用は、たいていの他の疾患の費用を膨大に超える。冠動脈管腔の狭窄は、心筋の破壊を引き起こし、まずアンギナを生じ、その後心筋梗塞、最終的には死をもたらす結果となる。米国では、年毎に、一千五百万人以上の心筋梗塞が見られる。そのような患者の六十万人(または40%)が、急性心筋梗塞を患い、そのような患者の三十万人を超える人々が、病院にたどり着く前に死亡している(Harrison's Principles of Internal Medicine,14th Edition,1998)。
【0005】
CADは、経皮経腔冠動脈バルーン血管形成術(PTCA)を用いて治療することができる。米国では年毎に、400,000以上のPTCA処置が実施される。PTCAでは、バルーンカテーテルを、末梢動脈に挿入し、動脈系を通して、遮断された冠動脈へと通す。次に、バルーンを膨張させ、動脈を引き伸ばし、閉塞している脂肪プラークを平らにし、それにより病気に冒された動脈を通る血液の断面流量を増加させる。しかしながら、この療法は通常、病気に冒された冠動脈の永久的開口を生じる結果にはならない。PTCAにより治療される患者の50%程度が、冠動脈の再狭窄を治すために、6ヶ月以内に反復処置が必要となる。医学上、PTCAによる治療後の動脈のこの再びの狭窄は、再狭窄と呼ばれる。再狭窄は、ひどく、血管のリコイルおよび収縮を伴う。続いて、血管のリコイル(recoil)および収縮の後、PTCAによる動脈の損傷に応じて、中間平滑筋細胞が増殖する。いくぶん、平滑筋細胞の増殖は、トロンボキサンA2、血小板由来増殖因子(PDGF)および線維芽細胞増殖因子(FGF)を含めた、損傷した領域由来の様々な炎症性因子の放出によって媒介される。様々な薬物またはステントでの動脈開口の機械的保持を用いた患者の治療を含めた多数の種々の技法を用いて、再狭窄という問題を克服している(Harrison's Principles of Internal Medicine,14th Edition,1998)。
【0006】
再狭窄を克服するのに用いられる様々な手法のうち、ステントは、最も効果的であることが証明されている。ステントは、正常な血管腔を創出するための、罹病血管区に位置される金属スカフォールド(scaffold)である。罹病動脈区におけるステントの配置は、動脈のリコイル、続く閉鎖を防止する。ステントはまた、動脈の中間層に沿った動脈の局所解離を防止することもできる。PTCA単独を用いて創出された管腔よりも大きな管腔を保持することにより、ステントは、30%程度分再狭窄を減少させる。それらの成功にも関わらず、ステントは、完全に再狭窄を排除してはいない(Suryapranata et al 1998.の「急性心筋梗塞を有する選択患者におけるバルーン血管形成術を用いた冠動脈ステント使用の無作為比較」(Randomized comparison of coronary stenting with balloon angioplasty in selected patients with acute myocardial infarction).Circulation 97:2502−2502)。
【0007】
動脈の狭窄は、大動脈回腸動脈、鼡径部下動脈、遠位大腿深動脈、遠位膝窩動脈、脛骨動脈、鎖骨下動脈および腸間膜動脈を含む冠動脈以外の血管で起き得る。末梢動脈アテローム性動脈硬化症疾患(PAD)の有病率は、病気に冒された特定解剖学的部位、ならびに閉塞診断用に用いられる診断基準に依存する。伝統的に、医師は、PADが存在するかどうかを確定するために、間欠性跛行試験を使用している。しかしながら、この測定は、集団における疾患の実際の発生を非常に過少評価する可能性がある。PADの割合は、年齢とともに変化するようであり、老齢者ではPADの発生が増加する。ナショナルホスピタルディスチャージサーベイ(National Hospital Discharge Survey)からのデータは、毎年、55,000人の男性および44,000人の女性が、慢性PADであると新規に診断され、60,000人の男性および50,000人の女性が、急性PADであると新規に診断されていると概算する。急性PADの場合の91%が、下肢に関わっていた。PADを有する患者における共存CADの有病率は、50%を上回り得る。さらに、PADを有する患者の間に、脳血管疾患の有病率の増加が見られる。
【0008】
PADは、経皮経腔バルーン血管形成術(PTA)を用いて治療することができる。PTAと併用したステントの使用は、再狭窄の発生を減少させる。しかしながら、ステントのような医療用デバイスを用いて得られる術後の結果は、標準的な手術的血管再生処置、すなわち静脈またはプロテーゼバイパス材料を用いたものを用いて得られる結果に匹敵しない(Principles of Surgery,Schwartz et al.eds,Chapter 20,Arterial Disease,7th Edition,McGraw−Hill Health Professions Division,New York 1999)。
【0009】
好ましくは、PADは、動脈の遮断面が移植片を用いてバイパスされるバイパス法を用いて治療される(Principles of Surgery,Schwartz et al.eds,Chapter 20,Arterial Disease,7th Edition,McGraw−Hill Health Professions Division,New York 1999)。移植片は、伏在静脈のような自己静脈区、またはポリエステル、ポリテトラフルオロエチレン(PTFE)または発泡ポリテトラフルオロエチレン(ePTFE)から作製されるもののような合成移植片から構成され得る。術後の開通割合は、バイパス移植片の管腔寸法、移植片に用いる合成材料の型および流出部位を含む多数の異なる要素に依存する。しかしながら、再狭窄および血栓症は、バイパス移植片を使用してさえも依然として重要な問題である。例えば、ePTFEバイパス移植片を用いた3年目での鼡径部下バイバス法の開通性は、大腿−膝窩バイバスに関しては54%であり、大腿−脛骨バイパスに関してはわずか12%である。
【0010】
したがって、CADおよびPADの罹患率ならびに死亡率をさらに減少させるために、ステントおよび合成バイパス移植片の両方の性能を改良する必要性が多いにある。
【0011】
ステントを用いる場合、そのアプローチは、血栓および再狭窄を減少させるために、様々な抗血栓または抗再狭窄剤でステントをコーティングすることであった。例えば、放射性物質をステントにしみ込ませることは、筋線維芽細胞の移動および増殖を抑制することにより再狭窄を抑制するようである(米国特許第5,059,166号、第5,199,939号および第5,302,168号)。処理した血管の照射は、医師および患者に関する安全性の問題を引き起こし得る。さらに、照射は、病気に冒された血管の均一な治療を可能にしない。
【0012】
あるいは、ステントはまた、ヘパリンまたはホスホリルコリンのような化学薬剤でコーテングされ、それらの両方が、血栓および再狭窄を減少させるようである。ヘパリンおよびホスホリルコリンは、短期間の動物モデルにおいて、再狭窄を著しく減少させるようであるが、これらの薬剤での治療は、再狭窄の防止に対して長期の効果をもたらさないようである。さらに、ヘパリンは、血小板減少症を誘発し、発作のような重篤な血栓塞栓性合併症を引き起こし得る。それにもかかわらず、この様式で、再狭窄の治療を実践させるのに十分な治療上有効な量のヘパリンまたはホスホリルコリンをステントに負荷することは、実現不可能である。
【0013】
合成移植片は、術後の再狭窄および血栓を減少させるための様々な方法で扱われてきた(Bos et al.1988.の「小寸法の血管移植片プロテーゼ:現状」(Small−Diameter Vascular Graft Prostheses:Current Status)Archives Physio.Biochem 106.100−115)。例えば、メッシュのポリカーボネートウレタンのようなポリウレタンの複合材料は、ePTFE移植片と比べて再狭窄を減少させることが報告されている。移植片の表面はまた、高周波グロー放電を用いて修飾して、ePTFE移植片にポリテレフタレートを付加してきた。合成移植片にまた、コラーゲンのような生体分子をしみ込ませてきた。しかしながら、これらのアプローチはいずれも、長期間にわたって血栓または再狭窄の発生を有意に減少させなかった。
【0014】
内皮細胞は、血栓または再狭窄の発生を減少させる細胞調節分子のようなある固有の性質を有するので、ステントまたは合成移植片の表面上の内皮細胞の単層の発達を刺激することは、再狭窄および血栓の両方を防止する可能性がある(Belle et al.1997.Stent Endothelialization.Circulation 95:438−448;Bos et al.,1998.Small−Diameter Vascular Graft Prostheses Current Status Archives Physio Biochem 106.100−115)。
【0015】
内皮細胞は、ステント移植後に、内皮細胞マイトジェンである血管内皮増殖因子(VEGF)の局所送達によりステント表面に沈着されてきた(Belle et al.1997.Stent Endothelialization.Circulation 95.438−448)。VEGFの適用は、全身性ならびに局所的効果を有し得るので、この形態の治療は、信頼できない可能性がある。
【0016】
合成移植片はまた、内皮細胞を播種されてきたが、内皮播種を用いた臨床的結果は、一般に乏しく、すなわち、術後の開通割合が低かった(Lio et al.1998.New concepts and Materials in Microvascular Grafting:Prosthetic Graft Endothelial Cell Seeding and Gene Therapy.Microsurgery 18:263−256)。
【0017】
したがって、内皮細胞で、ステントおよび合成移植片を含む医療用デバイスをコーティングするための新規方法および組成物を開発する必要性がある。この型のコーティングは、再狭窄だけでなく、ステント移植に起因する血栓塞栓性合併症をも防止するであろう。かかる改善を提供する方法および組成物は、従来技術の短所を排除し、CADおよびPADに関連する罹患率ならびに死亡率に対して有意に上向きの影響を与える。ステントまたは合成移植片のような医療用デバイスへの内皮細胞の接着を刺激するような様式でコーティングしたステントおよび合成移植片を調製することが、本発明の目的である。
【発明の概要】
【課題を解決するための手段】
【0018】
本発明は、医療用デバイスへの内皮細胞の接着を促進するマトリックスで医療用デバイスをコーティングするための方法および組成物を提供する。このマトリックスは、医療用デバイスの表面への内皮細胞の接着を刺激する抗体を組み入れている。
【0019】
本明細書中で用いる場合、「医療用デバイス」は、医学的症状の予防および治療のために、哺乳動物に一時的または永久的に導入されるデバイスを指す。これらのデバイスには、皮下的に、経皮的に、または外科的に導入されて、臓器、組織または管腔内に残されるいずれのものも含まれる。医療用デバイスとしては、ステント、ポリテトラフルオロエチレン(PTFE)または発泡ポリテトラフルオロエチレン(ePTFE)で被覆したもののような被覆ステント、合成移植片、人工心臓弁、人工心臓および血管循環へ人工臓器を接続するための取付具(fixture)、静脈弁、腹部大動脈瘤(AAA)移植片、下大静脈フィルタ、永久薬剤注入カテーテル、塞栓コイル、血管塞栓形成に用いられる塞栓材料(例えば、PVA発泡体)、および血管縫合糸を挙げることができる。
【0020】
本発明の組成物および方法を用いた医療用デバイスのコーティングは、医療用デバイスの表面上の内皮細胞層の発達を刺激して、それにより再狭窄ならびに医療用デバイスの移植に起因する他の血栓塞栓性合併症を防止し得る。
【0021】
合成移植片およびステントは、CADまたはPADを治療するのに使用することができる。ステントまたは合成移植片は、医療用デバイスへの循環性始原内皮細胞の接着を刺激する抗体を組み入れるマトリックスでコーティングされてもよい。抗体は、始原内皮細胞の表面上で発現される抗体であるCD34のような内皮細胞表面抗原との反応性を有するモノクローナル抗体を含んでもよい。モノクローナル抗体のFab断片を用いてもよい。別の実施形態では、KDRまたはTie−2のような他の内皮表面抗原に対するモノクローナル抗体もまた使用され得る。一実施形態では、1つの抗原と反応する単一型の抗体を用いてもよい。あるいは、種々の内皮細胞表面抗原に対する複数の種々の抗体を一緒に混合し、マトリックスに添加してもよい。
【0022】
医療用デバイスをコーティングするマトリックスは、ポリウレタン、ポリL−乳酸、セルロースエステルまたはポリエチレングリコールのような合成材料で構成されてもよい。別の実施形態では、マトリックスは、コラーゲン、フィブリン、エラスチンまたは非晶質炭素のような天然材料で構成される。マトリックスは、合成材料または天然材料から構成される第1の層および抗体から構成される第2の層を有する複数層を含んでもよい。層は、第1の層がステントまたは合成移植片表面に直接接触し、第2の層が第1の層に接触する一方の表面および血管腔と接触する反対の表面を有して、順次整列されてもよい。
【0023】
第3の実施形態では、マトリックスは、フラーレンを含んでもよく、ここでフラーレンは、約C60〜約C100の範囲である。フラーレンはまた、ナノチューブとして配列されてもよく、それは分子またはタンパク質を組み入れる。フラーレンマトリックスはまた、ポリテトラフルオロエチレンまたは発泡テトラフルオロエチレン、あるいは抗体と混合してもよい。あるいは、ポリテトラフルオロエチレンまたは発泡テトラフルオロエチレンは、医療用デバイス上に第1に層を成し、続いてフラーレンが第2の層を成してもよい。
【0024】
マトリックスは、医療用デバイスに、非共有結合的にまたは供給結合的に結合され得る。抗体は、異種または同種二官能性架橋試薬を用いて、マトリックスに共有結合的に結合されてもよい。
【0025】
アテローム性動脈硬化症の治療方法もまた提供される。動脈は、冠動脈または大腿動脈のような末梢動脈のいずれかであり得る。
【0026】
概要
本発明は、医療用デバイスをコーテングするのに使用されるマトリックスで、ステントまたは合成用移植片のような医療用デバイスをコーテングすることを包含する方法および組成物を提供する。一実施形態では、マトリックスは、治療上有効な量の、医療用デバイスへの内皮細胞の接着を促進する少なくとも1つの型の抗体を組み入れる。接着後、内皮細胞は、マトリックスの表面上で分化および増殖する。医療用デバイス上の内皮細胞の存在は、医療用デバイスの血管への移植後に、再狭窄および血栓の発生を減少させる。
【0027】
本明細書で使用する場合、「抗体」という用語は、1つの型のモノクローナルまたはポリクローナル抗体を指し、ここでモノクローナルまたはポリクローナル抗体は、1つの抗原またはその抗原の機能的等価物に結合する。抗体という用語は、Fab、F(ab')2またはFc断片のような抗体のいかなる断片も包含する。(抗体は、抗体1モル当たり6.022×1023個の分子に等しい複数の別個の抗体を含む。)
【0028】
本明細書で用いる場合、「治療上有効な量の抗体」とは、医療用デバイスへの内皮細胞の接着を促進する抗体の量を意味する。特許請求する本発明を実施するのに必要な抗体の量は、使用する抗体の性質により様々である。例えば、使用する抗体の量は、抗体およびそれが反応する抗原間の結合定数に依存するであろう。特定の抗原を用いるための治療上有効な量の抗体の決定方法は、当業者に既知でである。
【0029】
本明細書で使用する場合、「医療用デバイス」は、医学的症状の予防および治療のために、哺乳動物に一時的または永久的に導入されるデバイスを指す。これらのデバイスには、皮下的に、経皮的に、または外科的に導入されて、臓器、組織または管腔内に残されるいずれのものも含まれる。医療用デバイスとしては、ステント、ポリテトラフルオロエチレン(PTFE)または発泡ポリテロラフルオロエチレン(ePTFE)で被覆したもののような被覆ステント、合成移植片、人工心臓弁、人工心臓および血管循環へ人工臓器を接続するための取付具(fixture)、静脈弁、腹部大動脈瘤(AAA)移植片、下大動脈フィルタ、永久薬剤注入カテーテル、塞栓コイル、血管塞栓形成に用いられる塞栓材料(例えば、PVA発泡体)、および血管縫合糸を挙げることができる。
【0030】
本明細書で使用する場合、「再狭窄」は、動脈壁の内膜での平滑筋およびマトリックスタンパク質の層の蓄積を指す。血管は、再狭窄が理由で閉塞されるようになり得る。PTCAまたはPTA後、中膜および外膜由来の平滑筋は、通常は内膜に存在しないが、増殖して、内膜へ移動し、タンパク質を分泌し、内膜内に平滑筋およびマトリックスタンパク質の蓄積を形成する。この蓄積が、動脈の管腔の狭窄を引き起こし、狭窄部から遠位への血流を減少させる。本明細書で使用する場合、「再狭窄の抑制」は、再狭窄およびそれから生じる合併症を防止するように、タンパク質分泌の防止により達成される、平滑筋の移動および増殖の抑制を指す。
【0031】
本発明の方法および組成物を用いて治療され得る対象体は、哺乳動物、より具体的には、ヒト、イヌ、ネコ、ブタ、げっ歯類またはサルであり得る。
【0032】
本発明の方法は、生体条件内(in vivo)または生体条件外(in vitro)で実施されてもよい。
【0033】
「内皮細胞」という用語は、始源から成熟までの任意の発達段階における内皮細胞を指す。完全に分化した内皮細胞は、動脈またはヒト臍静脈のような静脈から単離され得るが、一方始原内皮細胞は、末梢血または骨髄から単離される。内皮細胞へ接着する抗体または他の作用物質を組み入れるマトリックスでコーティングした医療用デバイスとともに、内皮細胞をインキュベート(incubate)することにより、内皮細胞は医療用デバイスに結合される。
【0034】
本発明の方法は、いかなる動脈または静脈において実施されてもよい。冠動脈、鼡径部下動脈、大動脈回腸動脈、鎖骨下動脈、腸間膜動脈および腎動脈を含むいかなる動脈のアテローム性動脈硬化症が、本発明の範囲内に包含される。解離性動脈瘤に起因するもののような他の型の血管閉塞もまた、本発明に包含される。
【0035】
医療用デバイスは、血管への挿入後に、内皮細胞でコーティングされてもよい。あるいは、医療用デバイスへの挿入前に、医療用デバイスを内皮細胞でコーティングしてもよい。どちらの場合でも、医療用デバイスの管腔表面上の内皮細胞の存在が、再狭窄および血栓を抑制または防止する。
【0036】
内皮細胞
ヒト臍静脈内皮細胞 ヒューベック(HUVEC)は、Jaffe et al.,j.Clin.Invest.,52:2745−2757,1973(参照により本明細書に援用される)の方法に従って、臍帯から得られる。簡潔に述べると、コラゲナーゼでの処理により、細胞を血管壁からはがし取り、10%の低エンドトキシンウシ胎児血清、90μg/mlの防腐剤非含有ブタヘパリン、20μg/mlの内皮細胞増殖補充(ECGS)、グルタミンおよび抗体を含有するM199培地中で、ゼラチンコート組織培養フラスコにて培養する。
【0037】
始原内皮細胞は、Asahara等の方法(血管新生のための推定始原内皮細胞の単離(Isolation of putative progenitor endothelial cells for angiogenesis),Science 275:964−967,1997、参照により本明細書に援用される)に従って、ヒト末梢血から単離される。CD34に対する抗体でコーティングした磁気ビーズを、ヒト末梢血とともにインキュベートする。インキュベーション(incubation)後、結合した細胞を溶出させ、20%のウシ胎児血清およびウシ脳抽出物(Clonetics,San Diego,CA)を含有するM−199にて培養することができる。CD45、CD34、CD31、Flk−1、Tie−2およびE−セレクチンに対する蛍光抗体により、細胞を特性化する。
【0038】
従来の方法を用いて、血小板由来増殖因子(PDGF)、線維芽細胞増殖因子(FGF)、または酸化窒素シンターゼ(NOS)のようなタンパク質をコードする任意のクローン化遺伝子を含有する任意の動物の発現ベクター(vector)で、内皮細胞をトランスフェクト(形質導入)(transfect)する(例えば、ストラテジン社(Stratagene,San Diego,CA)から市販されている哺乳動物発現ベクターおよびトランスフェクションキット(形質導入キット)(transfection kit)を参照)。例えば、精製ブタ始原内皮細胞は、ローゼンガルト(Rosengart)等の方法(VEGF121 cDNAを発現するアデノウイルスベクターの直接心筋内投与を用いた冠状動脈疾患を治療するための血管新生遺伝子治療の第I相治験の6ヶ月目の評価 (Six−month assessment of a phase I trial of angiogenic gene therapy for the treatment of coronary artery disease using direct intramyocardial administration of an adenovirus vector expressing the VEGF121 cDNA).Ann Surg.230(4):466−470(1999)、参照により本明細書に援用される)に従って、VEGF cDNAを発現するアデノウイルス発現ベクターを用いて、血管内皮増殖因子(VEGF)によりトランスフェクト(transfect)される。
【0039】
抗体
本発明の方法に有用なモノクローナル抗体は、KohlerおよびMilsteinの標準的技法(所定の特異性の抗体を分泌する融合細胞の連続培養(Continuous cultures of fused cells secreting antibody of predefined specificity.Nature 265:495−497,1975、参照により本明細書に援用される)に従って産生され得る。内皮細胞は、内皮細胞表面抗原に対するモノクローナル抗体を産生するための免疫原として使用することができる。
【0040】
内皮細胞に対するモノクローナル抗体は、マウスまたはラットに、ヒューベックまたは精製始原内皮細胞を注射することにより調製される。十分な時間が経った後、マウスを屠殺して、脾臓細胞を得る。一般的に例えばポリエチレングリコールのような非イオン性洗浄剤の存在下にて、骨髄腫細胞またはリンパ腫細胞と脾臓細胞を融合することにより、脾臓細胞を不朽化する。得られた細胞は、融合ハイブリドーマ(hybridoma)を含み、それをHAT培養基のような選択培養基にて成長させ限界希釈条件を用いて、残存細胞をかかる培養基にて成長させる。細胞を適切な容器(例えば、マイクロタイターウェル(microtiter well))にて成長させ、所望の特異性、すなわち内皮細胞抗原に対する反応性を有するモノクローナル抗体を得るべく、上清をスクリーニングする。
【0041】
細胞を受け入れる哺乳動物宿主の腹膜腔へのハイブリドーマ細胞の注入のようにモノクローナル抗体の収量を高めた後に、腹水液を収集するための様々な技法が存在する。不十分な量のモノクローナル抗体が腹水液中に集まる場合、抗体は、宿主の血液から収集される。モノクローナル抗体を他のタンパク質および他の汚染菌から分離するためのモノクローナル抗体の単離および精製のための様々な従来法が存在する。
【0042】
これらのモノクローナル抗体のFab、F(ab')2またはFc断片のような抗内皮細胞モノクローナル抗体の有用な結合断片もまた、本発明の範囲内に包含される。抗体断片は、従来の技法により得られる。例えば、有用な結合断片は、パパインまたはペプシンを用いた抗体のペプチダーゼ消化により調製されてもよい。
【0043】
本発明の抗体は、マウス源由来のIgGクラスの抗体に関するが、これは、限定を意味しない。上記抗体および上記抗体と機能的等価性を有する抗体(それは、マウス源であろうと、ヒトを含む哺乳動物源であろうと、他の供給源であろうと、またそれらの組合せであろうと)、ならびにIgM、IgA、IgE等のような他のクラス(かかるクラスのアイソタイプを含む)は、本発明の範囲内に包含される。抗体の場合において、「機能的等価性」という用語は、2つの異なる抗体各々が抗原上の同じ抗原部位に結合すること、換言すると、抗体が同じ抗原に結合するのを競うことを意味する。抗原は、同じまたは異なる分子上にあってもよい。
【0044】
一実施形態では、内皮細胞表面抗原CD34と反応するモノクローナル抗体が用いられる。固体支持体に結合された抗CD34モノクローナル抗体は、ヒト末梢血由来の始原内皮細胞を捕獲することが示されている。捕獲後、これらの始原細胞は、内皮細胞に分化することが可能である(Asahara et al.の1997.血管新生のための推定始原内皮細胞の単離(Isolation of putative progenitor endothelial cells for angiogenesis).Science 275:964−967)。CD34に対するモノクローナル抗体を産生するハイブリドーマは、アメリカ型組織集(American Type Tissue Collection(Rockville,MD))から得ることができる。別の実施形態では、内皮細胞表面抗原Flk−1またはTie−2と反応性を有するモノクローナル抗体が使用される。
【0045】
医療用デバイス移植片を受け入れるのと同種から単離した内皮細胞に対して反応性を有するポリクローナル抗体もまた使用され得る。
【0046】
ステント
本明細書中で「ステント」という用語は、血管の管腔に挿入されると、血管の断面管腔を拡張するいずれかの医療用デバイスを意味する。「ステント」という用語には、PTFEまたはePTFEで被覆したもののような被覆ステントが含まれる。一実施形態では、これは、冠状動脈閉塞を治療するのに、または脾血管、頚動脈血管、腸骨血管および膝窩血管の切開もしくは動脈瘤を封鎖するために、経皮的に送達されるステントを包含する。別の実施形態では、ステントは、静脈血管に送達される。ステントは、高分子または金属構造要素(その構造要素上に、マトリックスが塗布される)から構成することができ、あるいはステントは、ポリマー混合されたマトリックスの複合材料であり得る。例えば、米国特許第4,886,062号(Wiktor、参照により本明細書に援用される)に開示されるもののような変形可能な金属ワイヤステントを使用することができる。国際特許公開番号第91/12779号(「管腔内薬剤溶出プロテーゼ」、参照により本明細書に援用される)に開示されるもののような弾性高分子材料の自己拡張ステントもまた使用することができる。ステントはまた、ステンレス鋼、ポリマー、ニッケル−チタニウム、タンタル、金、白金−イリジウム、またはエルジロイ(Elgiloy)およびMP35Nならびに他の鉄材料を用いて製造されてもよい。ステントは、カテーテルにより体管腔を通して、ステントがカテーテルから放出される治療部位に送達され、血管の管腔壁と直接接触させて、ステントを拡張させることが可能である。他の自己拡張ステント設計(例えば、弾性金属ステント設計)が、本発明の抗体およびマトリックスとともに使用することができることは、当業者には明らかであろう。
【0047】
合成移植片
「合成移植片」という用語は、生体適合特性を有する任意の人工補綴物を意味する。一実施形態では、これは、ダクロン(Dacron)(ポリエチレンテレフタレート、PET)またはテフロン(登録商標)(Teflon)(ePTFE)から作製される合成移植片を包含する。別の実施形態では、合成移植片は、ポリウレタンで構成される。さらに第3の実施形態では、合成移植片は、メッシュのポリカーボネートウレタンの内層およびメッシュのダクロンの外層で構成される。いかなる生体適合性合成移植片も、本発明の抗体およびマトリックスとともに使用することができることは、当業者には明らかであろう(Bos et al.の1998.小直径の血管プロテーゼ:現状(Small−Diameter vascular Prostheses:Current Status,Archives Physio Biochem.106:100−115、参照により本明細書に援用される)。合成移植片は、血管の切端吻合のために、または罹病した血管セグメントのバイバスのために使用することができる。
【0048】
マトリックス
(A)合成材料
ステントまたは合成移植片をコーティングするのに使用されるマトリックスは、ポリウレタン、セグメント化ポリウレタン−尿素/ヘパリン、ポリL−乳酸、セルロースエステルまたはポリエチレングリコールのような合成材料から選択されてもよい。
【0049】
(B)天然材料
マトリックスは、コラーゲン、ラミニン、ヘパリン、フィブリン、セルロースまたは炭素のような天然に存在する物質から選択されてもよい。マトリックスの第1の要件は、ステントまたは合成移植片の露出表面上で破壊されない状態を保つのために、十分弾性かつ柔軟であるということである。
【0050】
(C)フラーレン
マトリックスはまた、フラーレンを含んでもよい(「フラーレン」という用語は、複数のフラーレン分子を包含する)。フラーレンは、炭素ケージの分子である。フラーレン種における炭素分子の数は、約C60から約C100まで様々である。フラーレンは、当業者に既知のプロセスにより、例えば、炭素のレーザー蒸発、アークにおける炭素加熱、またはすす処理用火炎(sooting flames)における炭化水素の燃焼(米国特許第5,292,813号(Patel et al.)、参照により本明細書に援用、および米国特許第5,558,903号(Bhushan et al)、参照により本明細書に援用)により、炭素元素、または炭素含有種の高温反応によって生産される。各場合において、炭素質の沈積物またはすすが生産される。このすすから、トルエンのような適切な溶媒を用いた抽出により、様々なフラーレンが得られる。フラーレンは、既知の方法により、特に高速液体クロマトグラフィ(HPLC)により分離される。フラーレンは、合成されてもよく、またはダイナミックエンタープライズ社(Dynamic Enterprises,Ltd.,Berkshire,England)、もしくはサザーンケミカルグループ社(Southern Chemical Group,LLC,Tucker,Georgia)から商業的に得てもよい。
【0051】
フラーレンは、米国特許第5,558,903号に開示されるように、昇華、レーザー蒸発、スパッタリング、イオンビーム、スプレーコーティング、浸漬コーティング、ロールオンまたはブラシコーティングを含む多種多様の方法にて、表面に沈着されてもよい。
【0052】
フラーレンの重要な特徴は、それらの「活性炭」を形成する能力である。フラーレンの電子構造は、多数の結合電子が分子表面の周囲に協同的に存在するように、π軌道を重ね合わせた系である(Chemical and Engineering News,Apr.8,1991,page 59、参照により本明細書に援用される)。活性炭の形態としては、フラーレンは、弱い相互作用のための相当のファンデルワールス(van der Waals)力を示す。フラーレン表面の吸着の性質は、特定の細胞膜相互作用を誘導する目的で、それ自身にさらなる修飾を加えてもよい。例えば、特定細胞型の細胞膜に、または細胞膜の特定構成成分に選択的に結合する化学特性を有する特異的な分子(例えば、レクチンまたは抗体)をフラーレン表面に吸着することができる。フラーレン表面はまた、細胞膜に対して特異的に反応性を有する基(例えば、酸化体または還元体)を付与するように、化学的に修飾してもよい。フラーレン表面への種々の分子の結合は、様々な細胞型、例えば内皮細胞、線維芽細胞、一次外植片またはT細胞部分集団を選択的に結合する表面を創出するように操作されてもよい(米国特許第5,310,669号(Richmond et al.)、参照により本明細書に援用、Stephen r Wilsonの、「フラーレンの生物学的側面」(Biological Aspects of Fullerenes),Kadish et al.の、「フラーレン:その化学、物理学および技法」(Fullerenes:Chemistry,Physics and Technology),eds.,John Wiley&Sons,NY2000、参照により本明細書に援用)。
【0053】
フラーレンはまた、他の原子または分子を組み入れるナノチューブを形成してもよい(Liu et al.Science 280:1253−1256(1998)、参照により本明細書に援用される)。カーボンナノチューブの合成および調製は、当該技術分野で既知である(米国特許第5,753,088号(Olk et al)、および米国特許第5,641,466号(Ebbsen et al.)、ともに参照により本明細書に援用される)。タンパク質のような分子もまた、カーボンナノチューブ内部に組み入れられてもよい。例えば、ナノチューブには、ナノチューブの端を切断した後に、酵素、例えば、Zn2Cd2−メタロチオネイン、チトクロームCおよびC3、ならびにβ−ラクタマーゼを充填してもよい(Davis et al.Inorganica Chim.Acta 272:261(1998);Cook et al.Full Sci.Tech.5(4):695(1997)、ともに参照により本明細書に援用される)。
【0054】
三次元フラーレン構造もまた、使用され得る。米国特許第5,338,571号(Mirkin et al.,参照により本明細書に援用される)は、(i)フラーレンを化学的に修飾して、結合形成種を提供し、(ii)基質の表面を化学的に処理して、溶液中にてフラーレンの結合形成種と共有結合するのに有効な結合形成種を提供し、(iii)処理した基質表面と、修飾したフラーレンの溶液を接触させて、処理した基質表面に共有結合したフラーレン層を形成することにより、基質表面上に形成される三次元多層フラーレン構造を開示している。
【0055】
(D)医療用デバイスへのマトリックス塗布
マトリックスは、ステントまたは合成移植片の表面にしっかりと接着すべきである。好ましくは、このことは、連続薄層にマトリックスを塗布することにより達成される。マトリックスの各層は、抗体を組み入れてもよい。あるいは、抗体は、血管腔と直接接触する層のみに塗布されてもよい。種々の型のマトリックスは、連続層において連続的に適用されてもよい。抗体は、ステントへのマトリックス塗布後に、マトリックス上に共有結合的にまたは非共有結合的にコーティングされてもよい。
【0056】
ステントのような医療用デバイスをコーティングするために、ステントは、中程度の粘性を有するマトリックスの溶液を用いて、浸漬されるか、または噴霧される。各層が塗布された後、次の層の塗布前に、ステントは乾燥される。一実施形態では、薄い塗料状マトリックスコーティングは、全厚100μmを超えない。
【0057】
例えば、適切なマトリックスコーティング溶液は、無菌条件下にて、クロロホスム3ミリリットル(ml)中に、ポリD−乳酸(ベーリンガー社)(Boehringer Inc.,Ingelheim,Germany)のR203として入手可能)のような薬剤キャリア480ミリグラム(mg)を溶解させることにより調製される。しかしながら、原則として、血液および組織適合性(生体適合性)であり、溶解、分散または乳化することが可能な任意の生分解性(または非生分解性)マトリックスは、塗布後に、医療用デバイス上の粘着性ラッカーまたは塗料状コーティングへの比較的迅速な乾燥を受ける場合には、マトリックスとして使用してもよい。
【0058】
例えば、フィブリンでステントをコーティングすることは当業者に既知である。ムラー等(Muller et al.)に発行された米国特許第4,548,736号(参照により本明細書に援用される)においては、フィブリンは、トロンビンとフィブリノーゲンを接触させることにより凝固される。好ましくは、移植されたデバイスの機械的特性および生体安定性を改善するために、ジェレンダ(Gerendas)に発行された米国特許第3,523,807号(参照により本明細書に援用される)に記載されるように、または公開済欧州特許出願第0366564号(参照により本明細書に援用される)に記載されるように、本発明のフィブリン含有ステント中のフィブリンは、凝固中に存在する第XIII因子およびカルシウムを有する。好ましくは、本発明においてフィブリンを作製するのに使用されるフィブリノーゲンおよびトロンビンは、任意の種間免疫応答(例えば、ヒト抗ウシ)を回避するために、ステントが移植されるであろう種と同じ動物またはヒト種由来のものである。フィブリン生成物は、フィブリノーゲンおよびトロンビンを組合せたものをフィルムにキャストした後に、浸透圧的に半透膜を通して、フィルムから水分を除去することにより生産される微細フィブリンフィルムの形態であり得る。欧州特許出願第0366564号では、基板(好ましくは、高い多孔性またはトロンビンまたはフィブリノーゲンのいずれかに対する高い親和性を有する)を、フィブリノーゲン溶液およびトロンビン溶液と接触させる。医療用デバイスの表面上でのフィブリノーゲンの重合によりフィブリン層が形成される結果となる。この方法により塗布されるフィブリンの複数層は、任意の所望の厚さのフィブリン層を提供することを可能とする。あるいは、まずフィブリンが凝固された後、粉末へとすりつぶされ、水と混合され、熱金型にて所望の形状に型押しされ得る(米国特許第3,523,807号)。安定性の増加もまた、グルタルアルデヒドまたはホルムアルデヒドのような固定剤とフィブリンを接触させることにより、成形されたフィブリンにて達成することできる。フィブリンを製造および形成するための当業者に既知のこれらおよび他の方法は、本発明に使用され得る。
【0059】
合成移植片がコラーゲンでコーティングされる場合、コラーゲンを調製し、それを合成移植片デバイス上で形成する方法は、米国特許第5,851,230号(Weadock et al.,参照により本明細書に援用される)に記載されるように既知である。この出願は、合成移植片をコラーゲンでコーティングする方法について記載する。多孔質基板にコラーゲンを接着する方法は、典型的に、基板にコラーゲン分散液を塗布し、それを乾燥させて、このプロセスを繰り返すことを含む。コラーゲン分散液は典型的に、酸性pH(2〜4の範囲のpH)にて分散液中に不溶性コラーゲン(約1〜2重量%)をブレンドすることにより作製される。分散液は典型的に、移植片の管腔に、シリンジにより注入され、コラーゲンスラリーで内部表面全体を被覆するように手で操作する。過剰なコラーゲンスラリーは、移植片の開口端の一方を通じて取り除かれる。コーティングおよび乾燥工程は、十分な処理を提供するために数回繰り返される。
【0060】
さらに別の実施形態では、ステントまたは合成移植片は、非晶質炭素でコーティングされる。米国特許第5,198,263号(参照により本明細書に援用される)では、フッ素化ガスまたは他のハロゲン化ガスの存在下にて、非晶質炭素フィルムの高速低温沈着を生産する方法が記載されている。この発明の方法による沈着は、高周波のプラズマ補助化学的蒸着プロセスを用いて、外気室温を含む100℃未満で実施することができる。この発明の方法を用いて生産される非晶質炭素フィルムは、例えば、ガラス、金属、半導体およびプラスチックを含む、多くの型の基板に十分に接着する。
【0061】
フラーレン−移植片、アミン含有ポリマーを形成するためのアミン含有ポリマーの反応性アミノ基部位へのフラーレン部分の結合は、米国特許第5,292,813号に記載されるように実施されてもよい。この方法での化学的修飾は、ステントへのフラーレンの直接的組み込みを可能にする。別の実施形態では、フラーレンは、上述するように、ステントまたは合成移植片の表面上に沈着されてもよい(国際公開第99/32184号(Leone et al.)を参照、参照により本明細書に援用される)。フラーレンはまた、アルデヒド結合により結合されてもよい(Yamago et al.の、「酸化、還元ならびにC−OおよびC−C結合形成反応による有機フラーレンの化学的誘導体化」(Chemical Derivatization of Organofullerenes through Oxidation,Reduction and C−O and C−C Bond Forming Reactions) J Org Chem,58 4796−4798(1998)、参照により本明細書に援用される)。C60Oはまた、フラーレン上のエポキシ基を直接的に介して、ステントに結合されてもよい。結合は、酸素への共有結合を介するものである。カップリング用のこの化合物およびプロトコルは、バッキィユーエスエイ社(BuckyUSA,Houston,Texas)から市販されている。
【0062】
(E)マトリックスへの抗体の添加
始原内皮細胞の接着を促進する抗体は、共有結合的に、または非共有結合的に、マトリックス内に組み入れられることができる。抗体は、マトリックスコーティング溶液と抗体を混合することにより、マトリックスの各層に組み入れられてもよい。あるいは、抗体は、医療用デバイスに塗布されるマトリックスの最終層上に、共有結合的に、または非共有結合的にコーティングされてもよい。
【0063】
一実施形態では、抗体は、マトリックスを含有する溶液に添加される。例えば、抗D34モノクローナル抗体上のFab断片は、500〜800mg/mlの濃度のヒトフィブリノーゲン含有溶液とともにインキュベートされる。抗CD34Fab断片の濃度は様々であり、当業者は過度の実験をすることなく最適濃度を決定することができることは理解されるであろう。ステントを、Fab/フィブリン混合物に添加して、濃縮トロンビン(少なくとも1000U/mlの濃度にある)の添加により、フィブリンは活性化される。得られたマトリックス中に直接組み入れられたFab断片を含有する重合フィブリン混合物を、ステントまたは合成移植片の表面上に薄膜状(0.12cm未満)にプレスする。実際には、いかなる型の抗体または抗体断片も、この方法で、ステントまたは合成移植片のコーティング前に、マトリックス溶液中に組み入れることができる。
【0064】
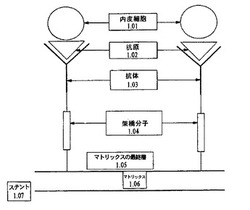
別の実施形態では、抗体は、マトリックスに共有結合される。一実施形態では,抗体は、異種または同種二官能性リンカー分子を用いて、マトリックスに共有結合的に拘束される。本明細書で使用する場合、「拘束される」という用語は、リンカー分子により、抗体がマトリックスに共有結合されることを指す。本発明に関連したリンカー分子の使用は、典型的に、マトリックスがステントに接着された後に、マトリックスにリンカー分子を共有結合させることを含む。マトリックスの共有結合した後、リンカー分子は、1つまたはそれ以上の抗体を共有結合するのに使用することができる幾つかの活性な官能基をマトリックスに提供する。図1は、架橋分子を介した結合の図を提供する。内皮細胞1.01は、細胞表面抗原1.02により、抗体1.03に結合する。抗体は、架橋分子1.04によりマトリックス1.05〜1.06に拘束される。マトリックス1.05〜1.06は、ステント1.07の接着する。リンカー分子は、直接的に(すなわち、カルボキシル基により)、または既知のカップリング化学(例えば、エステル化、アミド化、およびアシル化)により、マトリックスに結合されてもよい。リンカー分子は、アミド結合の直接的な形成によりマトリックスに結合され、抗体との反応に利用可能なアミン官能基を提供するジアミンまたはトリアミン官能性化合物であってもよい。例えば、リンカー分子は、ポリエチレンイミン(PEI)、ポリアリルアミン(PALLA)またはポリエチレングリコール(PEG)のようなポリアミン官能性ポリマーであり得る。様々なPEG誘導体、例えば、mPEG−スクシンイミジルプロピオネート(succinimidyl propriate)、またはmPEG−N−ヒドロキシスクシンイミドは、共有結合のためのプロトコルとともに、シェアウォーター社(Shearwater Corporation,Birmingham,Alabama)から入手可能である(また、Weiner et al.の,「固定化抗体による抗原捕獲に対するポリエチレングリコールスペーサーの影響」(Influence of a poly−ethyleneglycol spacer on antigen capture by immobilized antibodies).J.Biochem.Biophys.Methods 45:211−219(2000)も参照、参照により本明細書に援用される)。特定のカップリング剤の選択は、使用する抗体の型に依存し、かかる選択は、過度の実験をすることなくなされ得ることは理解されるであろう。これらのポリマーの混合物もまた使用することができる。これらの分子は、1つまたはそれ以上の抗体を表面固定化するのに使用され得る複数のペンダントアミン官能基を含有する。
【0065】
抗体は、ステントの表面上に直接沈着されたC60Oフラーレン層に結合させてもよい。架橋剤は、フラーレンに共有結合的に結合されてもよい。次に、抗体を架橋剤に結合し、続いてそれがステントに結合される。図2は、C60Oによる結合の図を提供する。内皮細胞2.01は、細胞表面抗原2.02を介して、抗体2.03に結合され、続いてマトリックス2.04に、共有結合的に、または非共有結合的に結合される。マトリックス2.04は、C60O(2.05)を介して、ステント2.06に共有結合される。
【図面の簡単な説明】
【0066】
【図1】架橋分子によりマトリックスに共有結合的に拘束される抗体を示す。
【図2】マトリックスを固着するC60O分子の図を示す。
【発明を実施するための形態】
【0067】
[実験例]
本発明は、以下の実験的詳細な節にて説明される。これらの節は、本発明の理解のために以下に記載するが、上記の特許請求の範囲に記載するように、本発明をいかなる場合においても限定するためのものでなく、また限定するものと解釈されるべきではない。
【0068】
実施例1
CD34fab−コーティングステントへのヒト内皮細胞の接着
材料および方法
1 細胞
ヒューベック(ヒト臍静脈内皮細胞)(HUVEC)は、ジャッフェ(Jaffe,E.A.,「内皮細胞の生物学(Biology of Endothelial Cells)」にて、E.A.Jaffe,ed.,Martinus−Nijhoff,THE Hague(1984)、参照により本明細書に援用される)の方法によりヒト臍帯から調製され、20%ウシ胎児血清(FCS)、L−グルタミン酸、抗生物質、130μg/mlのヘパリンおよび1.2mg/mlの内皮細胞成長補助(Sigma−Aldrich,St.Louis,MO)を補充した培養基199中で培養される。
【0069】
始原内皮細胞は、Asahara等の方法(血管新生のための推定始原内皮細胞の単離(Isolation of Putative progenitor endothelial cells for angiogenesis),Science 275:964−967)により、ヒト末梢血から単離される。モノクローナル抗CD34抗体は、磁気ビーズに結合され、ヒト全血の白血球画分とともにインキュベートされる。インキュベーション後、結合した細胞を溶出し、20%ウシ胎児血清およびウシ脳抽出物(Clonetics,San Diego,CA)を含有するM−199中で培養される。細胞は、CD45、CD34、CD31、Flk−1、Tie−2およびE−セレクチ(selectin)ンにより特性化される。
【0070】
2 ステントのコーティング
A.オーバスインターナショナル社(Orbus International B.V(Leusden,THE Netherlands))により生産されるRステントを、抗CD34モノクローナル抗体のFab断片とともに、ヒトフィブリノーゲン(Sigma,St Louis,MO)500〜800mg/mlとともにインキュベートし、トロンビン1000ユニット/mlの添加により、フィブリノーゲンを重合させる。抗CD34モノクローナル抗体断片を含有する重合したフィブリン混合物とのステントのインキュベーション後、R−ステントに対して、フィブリンを薄膜(0.012cm未満)に圧縮する。Fab断片を含有する薄いフィブリン膜を、室温にて、0.5%ウシ血清アルブミン(BSA)を含有するリン酸緩衝生理食塩水(PBS)で3回洗浄する。
【0071】
B.あるいは、Rステントを、mPEG−スクシンイミジルプロピオネート(succinimidyl propionate)シェアウォーター社(Shearwater Corporation(Birmingham,Alabama))でコーティングする。スクシンイミジル基を、製造指示書に従って、抗CD34モノクローナルFab断片と反応させ(Fab−PEGコーテングRステント)、PEG誘導体およびFab断片間に安定なアミド結合を形成させる。
【0072】
3 内皮細胞結合アッセイ
フィブリン−抗CD34FabコーティングRステント、またはFab−PEGコーティングRステントを、5%CO2の加湿雰囲気中で、37℃にて、0.5%BSAを含有するM199にて、100,000から1,000,000細胞/mlの細胞濃度で、単離HUVECまたは単離始原内皮細胞ととともにインキュベートする。ステントとのインキュベーション前に、ヒューベック(HUVEC)または始原内皮細胞を、[3H]−チミジンで、24時間標識する。フィブリンおよびFab抗CD34でコーテングしたステントと標識内皮細胞を、4〜72時間インキュベーションした後に、溶液からステントを取り出し、0.5%BSAを含有するM199で5回洗浄する。結合した内皮細胞を、トリプシン処理により取り外して、ステントへの標識内皮細胞の結合を、[3H]−チミジンのシンチレーションカウンティングにより評価する。陰性対照として、フィブリン単独でコーティングしたステント、またはコーティングしていないステントを、[3H]−チミジン標識した内皮細胞とインキュベートする。t−検定を用いて統計的に結果を評価して、特徴的な結合を確定する。モノクローナル抗CD34Fab断片を組み入れるフィブリンでコーティングしたステントは、コーティングしていないステントと比較して、内皮細胞の結合の有意な増加を示す。
【0073】
実施例2
ヒト内皮細胞の増殖
CD34Fabコーティングステント上にて
内皮細胞増殖アッセイ
抗CD34Fab断片を組み入れるフィブリンでコーティングしたRステントを、0.5%BSAを含有するM199にて、4〜72時間、ヒューベックまたは始原内皮細胞とともにインキュベートする。ヒューベックまたは始原内皮細胞とともにステントをインキュベーションした後に、ステントを、0.5%BSAを含有するM199で5回洗浄した後に、[3H]−チミジンとともにインキュベートする。[3H]−チミジンの取り込みを、洗浄および収集したヒューベックまたは始原内皮細胞にて評価する(細胞は、トリプシンを用いて収集される)。フィブリンコーティングステント上でのヒューベックまたは始原内皮細胞の増殖を、標準的なマイクロタイターディッシュにて、内皮細胞増殖と比較する。フィブリンコーティングステント上でのヒューベックまたは始原内皮細胞の増殖は、マイクロタイターディッシュにおける内皮細胞の増殖と等しいか、またはそれを超える。
【0074】
実施例3
ヒューベックおよび始原内皮細胞と反応性を有するモノクローナル抗体の産生 BALB/cマウスを、PBS中の1.5×106ヒューベック、または1.5×106始原内皮細胞で、2〜4週間に3〜4回の間隔で腹腔内に免疫化し、脾細胞を取り出す3日前に、1.5×106ヒューベック、または1.5×106始原内皮細胞で攻撃する。脾細胞懸濁液を調製し、骨髄腫NS1/1AG4.1と融合させ、ハイブリドーマを成長させ、クローニング(cloned)する。ハイブリドーマの成長およびクローニングの効率を改善するために、10%の内皮細胞調整培体(HUVEC)を培養基に含入させる。始めに、ハイブリドーマ培養上清を、免疫蛍光フローサイトメトリー(FACS)により、ヒューベックまたは始原内皮細胞との反応性に関して試験する。簡潔に述べると、ヒューベック(1.5×104)または始原内皮細胞(1.5×104)を、未希釈のハイブリドーマ上清とともにインキュベートし(30分、4℃)、洗浄して、フルオレセイン−イソチオシアネート(FITC)−ヒツジF(ab')2抗マウスIg(100μg/ml)とともにインキュベートする。最終洗浄後、免疫蛍光フローサイトメトリー分析により、モノクローナル抗体結合に関して、内皮細胞を検査する。陽性のハイブリドーマ上清を、ヒト黒色腫細胞系MM−170に関してスクリーニングし、非内皮特異的mAbを排除する。ヒト腫瘍細胞系、ならびにヒト白血球、単球、好中球、赤血球および血小板のパネルにおけるモノクローナル抗体のスクリーニングにより、内皮特異性をさらに確認する。
【0075】
実施例4
ブタバルーン損傷の研究
体重25〜30kgの若年のヨークシャーブタにて、抗体で被覆したステントの移植を実施する。動物管理は、「実験室動物の管理および使用に関するガイド(Guide for the Care and Use of Laboratory Animals)」(NIH publication NO.80−23,revised 1985)に従う。一晩の断食後、ケタミン塩酸塩(20mg/kg)で動物を鎮静させる。チオペンタール(12mg/kg)での麻酔誘導後、動物に挿管し、酸素および亜酸化窒素の混合物(1:2[vol/vol])を投与する通気口を接続する。0.5〜25容量%のイソフルランで麻酔を持続させる。ペニシリンGプロカインおよびペニシリンGベンザチン(ストレプトマイシン)の混合物1,000mgの筋内注射により、抗生予防が提供される。
【0076】
無菌条件下にて、左冠状動脈の動脈切開を実施し、9F−導入針シースを左冠状動脈に設置する。全ての動物に、ヘパリンナトリウム7,500IUおよびアセチルサリチル酸100mgを静脈内に与える。300秒以上の活性凝固時間を維持するために、処置全体にわたって、さらに2,500IUボーラスのヘパリンを定期的に投与する。8F誘導カテーテルを、頚動脈鞘を通して導入し、腸骨動脈の起点まで通す。イソソルビドジニトレート1mgの投与後、血管造影を行い、定量的冠動脈造影システムを用いて、画像を分析する。3F−塞栓切除カテーテルを、総大腿動脈に挿入し、ステント移植のための選択区から遠位に通す。塞栓切開バルーンは、動脈区によりも0.5mm大きい大きさにふくらませ、2回引っ張って、血管を露出させる。露出直後、モノクローナル抗体のFab断片を組み入れたフィブリンコーティングステントを、誘導カテーテルを通して挿入し、大腿動脈の露出区に配置させる。ステント移植後、3日目および8週目の両方で、動物を屠殺する。上記のように、動物をまず鎮静させ、麻酔をかける。ステントを入れた大腿区を外移植させた後に、4℃にて、48時間、0.1Mリン酸緩衝液(pH7.2)中の4%パラホルムアルデヒド中に入れる。内皮細胞の表面被覆率の電子顕微鏡評価のためのさらなる加工のために、血管壁の長方形の切片を取り出す。ステントを入れた血管のこの部分を0.15カコジレート(cacodylate)緩衝液に入れ、0.15Mカコジレート中の2.5%グルタルアルデヒドでさらに固定する。次に、1%OsO4および50mMフェリシアニド(K3[Fe(CN)6]を含有する0.1Mカコジレート緩衝液でこの組織を後固定し、さらに加工する(正常ブタ冠動脈におけるヘパリンコーテングパルマ−シャッツ(Palmaz−Schatz)ステントを用いた血栓現象の減少がある。(Reduction in thrombotic events with heparin−coated Palmaz−Schatz stents in normal porcine coronary arteries),Circulation 93 423−430、参照により本明細書に援用される)。
【0077】
ステントを入れた動脈区の残存切片は、ヴァンボイセコム他(van Beusekom et al.)(Cardiovasc Pathol 5:69−76(1996)、参照により本明細書に援用される)により記載されるように、3態のメタクリル酸メチルをしみ込ませる。適所にステントを有する包埋動脈区を、ステンレス鋼使い捨てナイフを用いて、電動回転式ミクロトーム(HM−350、Microm Gmbh,Munich,Germany)にて3〜5μm厚の切片に切断する。クロムアルミニウムをコーティングしたスライド上で、水中の60%2−ブトキシエタノールおよび10%エタノールを用いて、40℃でホットプレート上にて切片を引き伸ばす。切片をプラスチックフィルムで被覆し、過剰のブトキシエタノール−エタノール混合物を除去し、40℃のオーブンに一晩置いて、スライドを乾燥させる。続いて、等量のキシレン−クロロホルム溶液中で、30〜60分間、切片からプラスチックを取り外す(deplasticize)。次に、調製した切片にて、光学顕微鏡用の標準的な染色手順を行う。統計データを、別個の実験の平均値±平均値の標準誤差(SD)として表す。統計学的有意性は、分散の一方向分析(ANOVA)およびフィッシャーのPLSD検定(Stat View 4.01,Brain Power,Inc,Calabasas,Calif)により確定される。大腿動脈の処理および未処理区のデータに関して、有対t検定(paired t test)(Stat View 4.01)が使用される。0.05未満のp値は、平均値間の統計学的に有意な差異であるとみなされる。抗ブタ内皮細胞モノクローナルFab断片を組み入れるステントで処理した動物は、移植したコーティングしていないステントを有する対照と比較して、内皮細胞被覆の増加を示し、また再狭窄の有意な減少を示す。
【0078】
実施例5
ブタ始原内皮細胞のトランスフェクション
ブタ始原内皮細胞は、Asahara等の方法(血管新生のための推定始原内皮細胞の単離(Isolation of Putative progenitor endothelial cells for angiogenesis),Science 275:964−967)により、ブタ末梢血から単離される。モノクローナル抗CD34抗体は、磁気ビーズに結合され、ブタ全血の白血球画分とともにインキュベートされる。インキュベーション後、結合した細胞を溶出し、20%ウシ胎児血清およびウシ脳抽出物(Clonetics,San Diego,CA)を含有するM−199中で培養される。細胞は、CD45、CD34、CD31、Flk−1、Tie−2およびE−セレクチンにより特性化される。
【0079】
例えば、精製ブタ始原内皮細胞は、ローゼンガルト(Rosengart)等の方法(VEGF121cDNAを発現するアデノウイルスベクターの直接心筋内投与を用いた冠状動脈疾患を治療するための血管新生遺伝子治療の第I相治験の6ヶ月目の評価(Six−month assessment of a phase I trial of angiogenic gene therapy for the treatment of coronary artery disease using direct intramyocardial administration of an adenovirus vector expressing THE VEGF121 cDNA).Ann Surg.230(4):466−470(1999)、参照により本明細書に援用される)に従って、VEGF cDNAを発現するアデノウイルス発現ベクターを用いて、血管内皮増殖因子(VEGF)によりトランスフェクトされる。
【0080】
トランスフェクトされた、VEGFを発現する精製ブタ始原細胞を、二重バルーンチャンバ注入カテーテル(Cordis Corp)を用いて、実施例4に記載するようにバルーン損傷およびステント移植の後に、ブタ大腿動脈モデルに注入し、大腿動脈のステントを入れた部分を単離する。トランスフェクションされてないブタ始原内皮細胞を注入したブタに対して、VEGFをトランスフェクトしたブタ始原細胞を注入したバルーン血管形成用ステント処理ブタにおける再狭窄を比較する。再注入したブタ始原内皮細胞におけるVEGFの発現は、結果として、抗CD34コーティングステントにおいて再狭窄の発生および重篤度の減少をもたらす。
【0081】
実施例6
アミノシランPEOで拘束された抗体の調製
ステント調製
ステントは、316Lステンレス鋼で作製され、超音波クリーナーにて、陰イオン性洗浄剤中でまず洗浄することにより洗浄および不動態化し、次に攪拌しながら熱硝酸中に浸し、続いて最終的に脱イオン水ですすぐ。
【0082】
誘導体化ステントは、以下のように調製される:ステントを、95%エタノール中のN−(2−アミノエチル−3−アミノプロピル)トリメトキシシランの2%混合物に、3分間浸漬させ、取り出して、室温にて風乾させた後、110℃にて10分間硬化させる。
【0083】
ポリエチレングリコール(PEG)スペーサーのカップリング誘導体化ステントを、10mMのジカルボキシメチル−PEGを含有する0.1MのMES緩衝液100ml中に入れ、EDC500mgを添加し、2時間絶え間なく攪拌しながら25℃にてインキュベートする。
【0084】
拘束抗体
マウス抗CD34IgG1抗体1.0mgが溶解している0.1MのMES緩衝液(pH4.5)150ml中にステントを浸漬することにより、内皮細胞に対する抗体を、一段階のカルボジイミドカップリング反応にてPEG官能基化ステントに固定化させ、25℃にて2時間インキュベートする。溶液からステントを取り出し、0.02%ツイーン(Tween)20を有するリン酸緩衝生理食塩水50ml(pH7.2)で5回すすぐ。
【0085】
試薬としては、N−(2−アミノエチル−3−アミノプロピル)トリメトキシシラン(DegussA−Huls)、MES緩衝液−モルホリンエタンスルホン酸緩衝液(Sigma,st.Louis,MO)、EDC−1−エチル−3−(3−ジメチルアミノプロピル)カルボジイミド(Sigma,st.Louis,MO)、ジカルボキシメチル−PEG−ジカルボキシメチル−ポリ(エチレングリコール)[MW 3400](Shearwater,Huntsville,AL)が挙げられる。
【0086】
本発明の幾つかの異なる実施形態を記載してきたが、本発明は、これらの実施形態に限定されることを意図しておらず、当業者により、特許請求の範囲に規定する本発明の精神および範囲から逸脱することなく、変更および変形がなされ得ることを意図するものである。
【技術分野】
【0001】
本発明は、体内の血管に移植される医療用デバイスの分野に関する。より詳細には、本発明は、ステントまたは合成移植片への内皮細胞の接着を促進するマトリックスを組み入れる、血管に移植されるステントまたは合成移植片に関する。
【0002】
本出願は、2000年3月15日に提出した米国仮出願第60/189,674号、および2000年5月4日に提出した米国仮出願第60/201,789号の利益を主張する。
【背景技術】
【0003】
アテローム性動脈硬化症は、世界において死亡および障害の主な原因の1つである。アテローム性動脈硬化症は、動脈の管腔表面上の脂肪プラークの沈着を伴う。動脈の管腔表面上の脂肪プラークの沈着は、動脈の断面積の狭窄を引き起こす。最終的には、この沈着は、その病変から遠位への血流を遮断し、動脈により供給される組織への虚血性損傷を引き起こす。
【0004】
冠動脈は、心臓に血液を供給する。冠動脈アテローム性動脈硬化症疾患(CAD)は、米国において最も一般的で深刻な慢性の生命に関わる病気であり、一千百万人を超える人々が冒されている。冠動脈アテローム性動脈硬化症の社会的および経済的費用は、たいていの他の疾患の費用を膨大に超える。冠動脈管腔の狭窄は、心筋の破壊を引き起こし、まずアンギナを生じ、その後心筋梗塞、最終的には死をもたらす結果となる。米国では、年毎に、一千五百万人以上の心筋梗塞が見られる。そのような患者の六十万人(または40%)が、急性心筋梗塞を患い、そのような患者の三十万人を超える人々が、病院にたどり着く前に死亡している(Harrison's Principles of Internal Medicine,14th Edition,1998)。
【0005】
CADは、経皮経腔冠動脈バルーン血管形成術(PTCA)を用いて治療することができる。米国では年毎に、400,000以上のPTCA処置が実施される。PTCAでは、バルーンカテーテルを、末梢動脈に挿入し、動脈系を通して、遮断された冠動脈へと通す。次に、バルーンを膨張させ、動脈を引き伸ばし、閉塞している脂肪プラークを平らにし、それにより病気に冒された動脈を通る血液の断面流量を増加させる。しかしながら、この療法は通常、病気に冒された冠動脈の永久的開口を生じる結果にはならない。PTCAにより治療される患者の50%程度が、冠動脈の再狭窄を治すために、6ヶ月以内に反復処置が必要となる。医学上、PTCAによる治療後の動脈のこの再びの狭窄は、再狭窄と呼ばれる。再狭窄は、ひどく、血管のリコイルおよび収縮を伴う。続いて、血管のリコイル(recoil)および収縮の後、PTCAによる動脈の損傷に応じて、中間平滑筋細胞が増殖する。いくぶん、平滑筋細胞の増殖は、トロンボキサンA2、血小板由来増殖因子(PDGF)および線維芽細胞増殖因子(FGF)を含めた、損傷した領域由来の様々な炎症性因子の放出によって媒介される。様々な薬物またはステントでの動脈開口の機械的保持を用いた患者の治療を含めた多数の種々の技法を用いて、再狭窄という問題を克服している(Harrison's Principles of Internal Medicine,14th Edition,1998)。
【0006】
再狭窄を克服するのに用いられる様々な手法のうち、ステントは、最も効果的であることが証明されている。ステントは、正常な血管腔を創出するための、罹病血管区に位置される金属スカフォールド(scaffold)である。罹病動脈区におけるステントの配置は、動脈のリコイル、続く閉鎖を防止する。ステントはまた、動脈の中間層に沿った動脈の局所解離を防止することもできる。PTCA単独を用いて創出された管腔よりも大きな管腔を保持することにより、ステントは、30%程度分再狭窄を減少させる。それらの成功にも関わらず、ステントは、完全に再狭窄を排除してはいない(Suryapranata et al 1998.の「急性心筋梗塞を有する選択患者におけるバルーン血管形成術を用いた冠動脈ステント使用の無作為比較」(Randomized comparison of coronary stenting with balloon angioplasty in selected patients with acute myocardial infarction).Circulation 97:2502−2502)。
【0007】
動脈の狭窄は、大動脈回腸動脈、鼡径部下動脈、遠位大腿深動脈、遠位膝窩動脈、脛骨動脈、鎖骨下動脈および腸間膜動脈を含む冠動脈以外の血管で起き得る。末梢動脈アテローム性動脈硬化症疾患(PAD)の有病率は、病気に冒された特定解剖学的部位、ならびに閉塞診断用に用いられる診断基準に依存する。伝統的に、医師は、PADが存在するかどうかを確定するために、間欠性跛行試験を使用している。しかしながら、この測定は、集団における疾患の実際の発生を非常に過少評価する可能性がある。PADの割合は、年齢とともに変化するようであり、老齢者ではPADの発生が増加する。ナショナルホスピタルディスチャージサーベイ(National Hospital Discharge Survey)からのデータは、毎年、55,000人の男性および44,000人の女性が、慢性PADであると新規に診断され、60,000人の男性および50,000人の女性が、急性PADであると新規に診断されていると概算する。急性PADの場合の91%が、下肢に関わっていた。PADを有する患者における共存CADの有病率は、50%を上回り得る。さらに、PADを有する患者の間に、脳血管疾患の有病率の増加が見られる。
【0008】
PADは、経皮経腔バルーン血管形成術(PTA)を用いて治療することができる。PTAと併用したステントの使用は、再狭窄の発生を減少させる。しかしながら、ステントのような医療用デバイスを用いて得られる術後の結果は、標準的な手術的血管再生処置、すなわち静脈またはプロテーゼバイパス材料を用いたものを用いて得られる結果に匹敵しない(Principles of Surgery,Schwartz et al.eds,Chapter 20,Arterial Disease,7th Edition,McGraw−Hill Health Professions Division,New York 1999)。
【0009】
好ましくは、PADは、動脈の遮断面が移植片を用いてバイパスされるバイパス法を用いて治療される(Principles of Surgery,Schwartz et al.eds,Chapter 20,Arterial Disease,7th Edition,McGraw−Hill Health Professions Division,New York 1999)。移植片は、伏在静脈のような自己静脈区、またはポリエステル、ポリテトラフルオロエチレン(PTFE)または発泡ポリテトラフルオロエチレン(ePTFE)から作製されるもののような合成移植片から構成され得る。術後の開通割合は、バイパス移植片の管腔寸法、移植片に用いる合成材料の型および流出部位を含む多数の異なる要素に依存する。しかしながら、再狭窄および血栓症は、バイパス移植片を使用してさえも依然として重要な問題である。例えば、ePTFEバイパス移植片を用いた3年目での鼡径部下バイバス法の開通性は、大腿−膝窩バイバスに関しては54%であり、大腿−脛骨バイパスに関してはわずか12%である。
【0010】
したがって、CADおよびPADの罹患率ならびに死亡率をさらに減少させるために、ステントおよび合成バイパス移植片の両方の性能を改良する必要性が多いにある。
【0011】
ステントを用いる場合、そのアプローチは、血栓および再狭窄を減少させるために、様々な抗血栓または抗再狭窄剤でステントをコーティングすることであった。例えば、放射性物質をステントにしみ込ませることは、筋線維芽細胞の移動および増殖を抑制することにより再狭窄を抑制するようである(米国特許第5,059,166号、第5,199,939号および第5,302,168号)。処理した血管の照射は、医師および患者に関する安全性の問題を引き起こし得る。さらに、照射は、病気に冒された血管の均一な治療を可能にしない。
【0012】
あるいは、ステントはまた、ヘパリンまたはホスホリルコリンのような化学薬剤でコーテングされ、それらの両方が、血栓および再狭窄を減少させるようである。ヘパリンおよびホスホリルコリンは、短期間の動物モデルにおいて、再狭窄を著しく減少させるようであるが、これらの薬剤での治療は、再狭窄の防止に対して長期の効果をもたらさないようである。さらに、ヘパリンは、血小板減少症を誘発し、発作のような重篤な血栓塞栓性合併症を引き起こし得る。それにもかかわらず、この様式で、再狭窄の治療を実践させるのに十分な治療上有効な量のヘパリンまたはホスホリルコリンをステントに負荷することは、実現不可能である。
【0013】
合成移植片は、術後の再狭窄および血栓を減少させるための様々な方法で扱われてきた(Bos et al.1988.の「小寸法の血管移植片プロテーゼ:現状」(Small−Diameter Vascular Graft Prostheses:Current Status)Archives Physio.Biochem 106.100−115)。例えば、メッシュのポリカーボネートウレタンのようなポリウレタンの複合材料は、ePTFE移植片と比べて再狭窄を減少させることが報告されている。移植片の表面はまた、高周波グロー放電を用いて修飾して、ePTFE移植片にポリテレフタレートを付加してきた。合成移植片にまた、コラーゲンのような生体分子をしみ込ませてきた。しかしながら、これらのアプローチはいずれも、長期間にわたって血栓または再狭窄の発生を有意に減少させなかった。
【0014】
内皮細胞は、血栓または再狭窄の発生を減少させる細胞調節分子のようなある固有の性質を有するので、ステントまたは合成移植片の表面上の内皮細胞の単層の発達を刺激することは、再狭窄および血栓の両方を防止する可能性がある(Belle et al.1997.Stent Endothelialization.Circulation 95:438−448;Bos et al.,1998.Small−Diameter Vascular Graft Prostheses Current Status Archives Physio Biochem 106.100−115)。
【0015】
内皮細胞は、ステント移植後に、内皮細胞マイトジェンである血管内皮増殖因子(VEGF)の局所送達によりステント表面に沈着されてきた(Belle et al.1997.Stent Endothelialization.Circulation 95.438−448)。VEGFの適用は、全身性ならびに局所的効果を有し得るので、この形態の治療は、信頼できない可能性がある。
【0016】
合成移植片はまた、内皮細胞を播種されてきたが、内皮播種を用いた臨床的結果は、一般に乏しく、すなわち、術後の開通割合が低かった(Lio et al.1998.New concepts and Materials in Microvascular Grafting:Prosthetic Graft Endothelial Cell Seeding and Gene Therapy.Microsurgery 18:263−256)。
【0017】
したがって、内皮細胞で、ステントおよび合成移植片を含む医療用デバイスをコーティングするための新規方法および組成物を開発する必要性がある。この型のコーティングは、再狭窄だけでなく、ステント移植に起因する血栓塞栓性合併症をも防止するであろう。かかる改善を提供する方法および組成物は、従来技術の短所を排除し、CADおよびPADに関連する罹患率ならびに死亡率に対して有意に上向きの影響を与える。ステントまたは合成移植片のような医療用デバイスへの内皮細胞の接着を刺激するような様式でコーティングしたステントおよび合成移植片を調製することが、本発明の目的である。
【発明の概要】
【課題を解決するための手段】
【0018】
本発明は、医療用デバイスへの内皮細胞の接着を促進するマトリックスで医療用デバイスをコーティングするための方法および組成物を提供する。このマトリックスは、医療用デバイスの表面への内皮細胞の接着を刺激する抗体を組み入れている。
【0019】
本明細書中で用いる場合、「医療用デバイス」は、医学的症状の予防および治療のために、哺乳動物に一時的または永久的に導入されるデバイスを指す。これらのデバイスには、皮下的に、経皮的に、または外科的に導入されて、臓器、組織または管腔内に残されるいずれのものも含まれる。医療用デバイスとしては、ステント、ポリテトラフルオロエチレン(PTFE)または発泡ポリテトラフルオロエチレン(ePTFE)で被覆したもののような被覆ステント、合成移植片、人工心臓弁、人工心臓および血管循環へ人工臓器を接続するための取付具(fixture)、静脈弁、腹部大動脈瘤(AAA)移植片、下大静脈フィルタ、永久薬剤注入カテーテル、塞栓コイル、血管塞栓形成に用いられる塞栓材料(例えば、PVA発泡体)、および血管縫合糸を挙げることができる。
【0020】
本発明の組成物および方法を用いた医療用デバイスのコーティングは、医療用デバイスの表面上の内皮細胞層の発達を刺激して、それにより再狭窄ならびに医療用デバイスの移植に起因する他の血栓塞栓性合併症を防止し得る。
【0021】
合成移植片およびステントは、CADまたはPADを治療するのに使用することができる。ステントまたは合成移植片は、医療用デバイスへの循環性始原内皮細胞の接着を刺激する抗体を組み入れるマトリックスでコーティングされてもよい。抗体は、始原内皮細胞の表面上で発現される抗体であるCD34のような内皮細胞表面抗原との反応性を有するモノクローナル抗体を含んでもよい。モノクローナル抗体のFab断片を用いてもよい。別の実施形態では、KDRまたはTie−2のような他の内皮表面抗原に対するモノクローナル抗体もまた使用され得る。一実施形態では、1つの抗原と反応する単一型の抗体を用いてもよい。あるいは、種々の内皮細胞表面抗原に対する複数の種々の抗体を一緒に混合し、マトリックスに添加してもよい。
【0022】
医療用デバイスをコーティングするマトリックスは、ポリウレタン、ポリL−乳酸、セルロースエステルまたはポリエチレングリコールのような合成材料で構成されてもよい。別の実施形態では、マトリックスは、コラーゲン、フィブリン、エラスチンまたは非晶質炭素のような天然材料で構成される。マトリックスは、合成材料または天然材料から構成される第1の層および抗体から構成される第2の層を有する複数層を含んでもよい。層は、第1の層がステントまたは合成移植片表面に直接接触し、第2の層が第1の層に接触する一方の表面および血管腔と接触する反対の表面を有して、順次整列されてもよい。
【0023】
第3の実施形態では、マトリックスは、フラーレンを含んでもよく、ここでフラーレンは、約C60〜約C100の範囲である。フラーレンはまた、ナノチューブとして配列されてもよく、それは分子またはタンパク質を組み入れる。フラーレンマトリックスはまた、ポリテトラフルオロエチレンまたは発泡テトラフルオロエチレン、あるいは抗体と混合してもよい。あるいは、ポリテトラフルオロエチレンまたは発泡テトラフルオロエチレンは、医療用デバイス上に第1に層を成し、続いてフラーレンが第2の層を成してもよい。
【0024】
マトリックスは、医療用デバイスに、非共有結合的にまたは供給結合的に結合され得る。抗体は、異種または同種二官能性架橋試薬を用いて、マトリックスに共有結合的に結合されてもよい。
【0025】
アテローム性動脈硬化症の治療方法もまた提供される。動脈は、冠動脈または大腿動脈のような末梢動脈のいずれかであり得る。
【0026】
概要
本発明は、医療用デバイスをコーテングするのに使用されるマトリックスで、ステントまたは合成用移植片のような医療用デバイスをコーテングすることを包含する方法および組成物を提供する。一実施形態では、マトリックスは、治療上有効な量の、医療用デバイスへの内皮細胞の接着を促進する少なくとも1つの型の抗体を組み入れる。接着後、内皮細胞は、マトリックスの表面上で分化および増殖する。医療用デバイス上の内皮細胞の存在は、医療用デバイスの血管への移植後に、再狭窄および血栓の発生を減少させる。
【0027】
本明細書で使用する場合、「抗体」という用語は、1つの型のモノクローナルまたはポリクローナル抗体を指し、ここでモノクローナルまたはポリクローナル抗体は、1つの抗原またはその抗原の機能的等価物に結合する。抗体という用語は、Fab、F(ab')2またはFc断片のような抗体のいかなる断片も包含する。(抗体は、抗体1モル当たり6.022×1023個の分子に等しい複数の別個の抗体を含む。)
【0028】
本明細書で用いる場合、「治療上有効な量の抗体」とは、医療用デバイスへの内皮細胞の接着を促進する抗体の量を意味する。特許請求する本発明を実施するのに必要な抗体の量は、使用する抗体の性質により様々である。例えば、使用する抗体の量は、抗体およびそれが反応する抗原間の結合定数に依存するであろう。特定の抗原を用いるための治療上有効な量の抗体の決定方法は、当業者に既知でである。
【0029】
本明細書で使用する場合、「医療用デバイス」は、医学的症状の予防および治療のために、哺乳動物に一時的または永久的に導入されるデバイスを指す。これらのデバイスには、皮下的に、経皮的に、または外科的に導入されて、臓器、組織または管腔内に残されるいずれのものも含まれる。医療用デバイスとしては、ステント、ポリテトラフルオロエチレン(PTFE)または発泡ポリテロラフルオロエチレン(ePTFE)で被覆したもののような被覆ステント、合成移植片、人工心臓弁、人工心臓および血管循環へ人工臓器を接続するための取付具(fixture)、静脈弁、腹部大動脈瘤(AAA)移植片、下大動脈フィルタ、永久薬剤注入カテーテル、塞栓コイル、血管塞栓形成に用いられる塞栓材料(例えば、PVA発泡体)、および血管縫合糸を挙げることができる。
【0030】
本明細書で使用する場合、「再狭窄」は、動脈壁の内膜での平滑筋およびマトリックスタンパク質の層の蓄積を指す。血管は、再狭窄が理由で閉塞されるようになり得る。PTCAまたはPTA後、中膜および外膜由来の平滑筋は、通常は内膜に存在しないが、増殖して、内膜へ移動し、タンパク質を分泌し、内膜内に平滑筋およびマトリックスタンパク質の蓄積を形成する。この蓄積が、動脈の管腔の狭窄を引き起こし、狭窄部から遠位への血流を減少させる。本明細書で使用する場合、「再狭窄の抑制」は、再狭窄およびそれから生じる合併症を防止するように、タンパク質分泌の防止により達成される、平滑筋の移動および増殖の抑制を指す。
【0031】
本発明の方法および組成物を用いて治療され得る対象体は、哺乳動物、より具体的には、ヒト、イヌ、ネコ、ブタ、げっ歯類またはサルであり得る。
【0032】
本発明の方法は、生体条件内(in vivo)または生体条件外(in vitro)で実施されてもよい。
【0033】
「内皮細胞」という用語は、始源から成熟までの任意の発達段階における内皮細胞を指す。完全に分化した内皮細胞は、動脈またはヒト臍静脈のような静脈から単離され得るが、一方始原内皮細胞は、末梢血または骨髄から単離される。内皮細胞へ接着する抗体または他の作用物質を組み入れるマトリックスでコーティングした医療用デバイスとともに、内皮細胞をインキュベート(incubate)することにより、内皮細胞は医療用デバイスに結合される。
【0034】
本発明の方法は、いかなる動脈または静脈において実施されてもよい。冠動脈、鼡径部下動脈、大動脈回腸動脈、鎖骨下動脈、腸間膜動脈および腎動脈を含むいかなる動脈のアテローム性動脈硬化症が、本発明の範囲内に包含される。解離性動脈瘤に起因するもののような他の型の血管閉塞もまた、本発明に包含される。
【0035】
医療用デバイスは、血管への挿入後に、内皮細胞でコーティングされてもよい。あるいは、医療用デバイスへの挿入前に、医療用デバイスを内皮細胞でコーティングしてもよい。どちらの場合でも、医療用デバイスの管腔表面上の内皮細胞の存在が、再狭窄および血栓を抑制または防止する。
【0036】
内皮細胞
ヒト臍静脈内皮細胞 ヒューベック(HUVEC)は、Jaffe et al.,j.Clin.Invest.,52:2745−2757,1973(参照により本明細書に援用される)の方法に従って、臍帯から得られる。簡潔に述べると、コラゲナーゼでの処理により、細胞を血管壁からはがし取り、10%の低エンドトキシンウシ胎児血清、90μg/mlの防腐剤非含有ブタヘパリン、20μg/mlの内皮細胞増殖補充(ECGS)、グルタミンおよび抗体を含有するM199培地中で、ゼラチンコート組織培養フラスコにて培養する。
【0037】
始原内皮細胞は、Asahara等の方法(血管新生のための推定始原内皮細胞の単離(Isolation of putative progenitor endothelial cells for angiogenesis),Science 275:964−967,1997、参照により本明細書に援用される)に従って、ヒト末梢血から単離される。CD34に対する抗体でコーティングした磁気ビーズを、ヒト末梢血とともにインキュベートする。インキュベーション(incubation)後、結合した細胞を溶出させ、20%のウシ胎児血清およびウシ脳抽出物(Clonetics,San Diego,CA)を含有するM−199にて培養することができる。CD45、CD34、CD31、Flk−1、Tie−2およびE−セレクチンに対する蛍光抗体により、細胞を特性化する。
【0038】
従来の方法を用いて、血小板由来増殖因子(PDGF)、線維芽細胞増殖因子(FGF)、または酸化窒素シンターゼ(NOS)のようなタンパク質をコードする任意のクローン化遺伝子を含有する任意の動物の発現ベクター(vector)で、内皮細胞をトランスフェクト(形質導入)(transfect)する(例えば、ストラテジン社(Stratagene,San Diego,CA)から市販されている哺乳動物発現ベクターおよびトランスフェクションキット(形質導入キット)(transfection kit)を参照)。例えば、精製ブタ始原内皮細胞は、ローゼンガルト(Rosengart)等の方法(VEGF121 cDNAを発現するアデノウイルスベクターの直接心筋内投与を用いた冠状動脈疾患を治療するための血管新生遺伝子治療の第I相治験の6ヶ月目の評価 (Six−month assessment of a phase I trial of angiogenic gene therapy for the treatment of coronary artery disease using direct intramyocardial administration of an adenovirus vector expressing the VEGF121 cDNA).Ann Surg.230(4):466−470(1999)、参照により本明細書に援用される)に従って、VEGF cDNAを発現するアデノウイルス発現ベクターを用いて、血管内皮増殖因子(VEGF)によりトランスフェクト(transfect)される。
【0039】
抗体
本発明の方法に有用なモノクローナル抗体は、KohlerおよびMilsteinの標準的技法(所定の特異性の抗体を分泌する融合細胞の連続培養(Continuous cultures of fused cells secreting antibody of predefined specificity.Nature 265:495−497,1975、参照により本明細書に援用される)に従って産生され得る。内皮細胞は、内皮細胞表面抗原に対するモノクローナル抗体を産生するための免疫原として使用することができる。
【0040】
内皮細胞に対するモノクローナル抗体は、マウスまたはラットに、ヒューベックまたは精製始原内皮細胞を注射することにより調製される。十分な時間が経った後、マウスを屠殺して、脾臓細胞を得る。一般的に例えばポリエチレングリコールのような非イオン性洗浄剤の存在下にて、骨髄腫細胞またはリンパ腫細胞と脾臓細胞を融合することにより、脾臓細胞を不朽化する。得られた細胞は、融合ハイブリドーマ(hybridoma)を含み、それをHAT培養基のような選択培養基にて成長させ限界希釈条件を用いて、残存細胞をかかる培養基にて成長させる。細胞を適切な容器(例えば、マイクロタイターウェル(microtiter well))にて成長させ、所望の特異性、すなわち内皮細胞抗原に対する反応性を有するモノクローナル抗体を得るべく、上清をスクリーニングする。
【0041】
細胞を受け入れる哺乳動物宿主の腹膜腔へのハイブリドーマ細胞の注入のようにモノクローナル抗体の収量を高めた後に、腹水液を収集するための様々な技法が存在する。不十分な量のモノクローナル抗体が腹水液中に集まる場合、抗体は、宿主の血液から収集される。モノクローナル抗体を他のタンパク質および他の汚染菌から分離するためのモノクローナル抗体の単離および精製のための様々な従来法が存在する。
【0042】
これらのモノクローナル抗体のFab、F(ab')2またはFc断片のような抗内皮細胞モノクローナル抗体の有用な結合断片もまた、本発明の範囲内に包含される。抗体断片は、従来の技法により得られる。例えば、有用な結合断片は、パパインまたはペプシンを用いた抗体のペプチダーゼ消化により調製されてもよい。
【0043】
本発明の抗体は、マウス源由来のIgGクラスの抗体に関するが、これは、限定を意味しない。上記抗体および上記抗体と機能的等価性を有する抗体(それは、マウス源であろうと、ヒトを含む哺乳動物源であろうと、他の供給源であろうと、またそれらの組合せであろうと)、ならびにIgM、IgA、IgE等のような他のクラス(かかるクラスのアイソタイプを含む)は、本発明の範囲内に包含される。抗体の場合において、「機能的等価性」という用語は、2つの異なる抗体各々が抗原上の同じ抗原部位に結合すること、換言すると、抗体が同じ抗原に結合するのを競うことを意味する。抗原は、同じまたは異なる分子上にあってもよい。
【0044】
一実施形態では、内皮細胞表面抗原CD34と反応するモノクローナル抗体が用いられる。固体支持体に結合された抗CD34モノクローナル抗体は、ヒト末梢血由来の始原内皮細胞を捕獲することが示されている。捕獲後、これらの始原細胞は、内皮細胞に分化することが可能である(Asahara et al.の1997.血管新生のための推定始原内皮細胞の単離(Isolation of putative progenitor endothelial cells for angiogenesis).Science 275:964−967)。CD34に対するモノクローナル抗体を産生するハイブリドーマは、アメリカ型組織集(American Type Tissue Collection(Rockville,MD))から得ることができる。別の実施形態では、内皮細胞表面抗原Flk−1またはTie−2と反応性を有するモノクローナル抗体が使用される。
【0045】
医療用デバイス移植片を受け入れるのと同種から単離した内皮細胞に対して反応性を有するポリクローナル抗体もまた使用され得る。
【0046】
ステント
本明細書中で「ステント」という用語は、血管の管腔に挿入されると、血管の断面管腔を拡張するいずれかの医療用デバイスを意味する。「ステント」という用語には、PTFEまたはePTFEで被覆したもののような被覆ステントが含まれる。一実施形態では、これは、冠状動脈閉塞を治療するのに、または脾血管、頚動脈血管、腸骨血管および膝窩血管の切開もしくは動脈瘤を封鎖するために、経皮的に送達されるステントを包含する。別の実施形態では、ステントは、静脈血管に送達される。ステントは、高分子または金属構造要素(その構造要素上に、マトリックスが塗布される)から構成することができ、あるいはステントは、ポリマー混合されたマトリックスの複合材料であり得る。例えば、米国特許第4,886,062号(Wiktor、参照により本明細書に援用される)に開示されるもののような変形可能な金属ワイヤステントを使用することができる。国際特許公開番号第91/12779号(「管腔内薬剤溶出プロテーゼ」、参照により本明細書に援用される)に開示されるもののような弾性高分子材料の自己拡張ステントもまた使用することができる。ステントはまた、ステンレス鋼、ポリマー、ニッケル−チタニウム、タンタル、金、白金−イリジウム、またはエルジロイ(Elgiloy)およびMP35Nならびに他の鉄材料を用いて製造されてもよい。ステントは、カテーテルにより体管腔を通して、ステントがカテーテルから放出される治療部位に送達され、血管の管腔壁と直接接触させて、ステントを拡張させることが可能である。他の自己拡張ステント設計(例えば、弾性金属ステント設計)が、本発明の抗体およびマトリックスとともに使用することができることは、当業者には明らかであろう。
【0047】
合成移植片
「合成移植片」という用語は、生体適合特性を有する任意の人工補綴物を意味する。一実施形態では、これは、ダクロン(Dacron)(ポリエチレンテレフタレート、PET)またはテフロン(登録商標)(Teflon)(ePTFE)から作製される合成移植片を包含する。別の実施形態では、合成移植片は、ポリウレタンで構成される。さらに第3の実施形態では、合成移植片は、メッシュのポリカーボネートウレタンの内層およびメッシュのダクロンの外層で構成される。いかなる生体適合性合成移植片も、本発明の抗体およびマトリックスとともに使用することができることは、当業者には明らかであろう(Bos et al.の1998.小直径の血管プロテーゼ:現状(Small−Diameter vascular Prostheses:Current Status,Archives Physio Biochem.106:100−115、参照により本明細書に援用される)。合成移植片は、血管の切端吻合のために、または罹病した血管セグメントのバイバスのために使用することができる。
【0048】
マトリックス
(A)合成材料
ステントまたは合成移植片をコーティングするのに使用されるマトリックスは、ポリウレタン、セグメント化ポリウレタン−尿素/ヘパリン、ポリL−乳酸、セルロースエステルまたはポリエチレングリコールのような合成材料から選択されてもよい。
【0049】
(B)天然材料
マトリックスは、コラーゲン、ラミニン、ヘパリン、フィブリン、セルロースまたは炭素のような天然に存在する物質から選択されてもよい。マトリックスの第1の要件は、ステントまたは合成移植片の露出表面上で破壊されない状態を保つのために、十分弾性かつ柔軟であるということである。
【0050】
(C)フラーレン
マトリックスはまた、フラーレンを含んでもよい(「フラーレン」という用語は、複数のフラーレン分子を包含する)。フラーレンは、炭素ケージの分子である。フラーレン種における炭素分子の数は、約C60から約C100まで様々である。フラーレンは、当業者に既知のプロセスにより、例えば、炭素のレーザー蒸発、アークにおける炭素加熱、またはすす処理用火炎(sooting flames)における炭化水素の燃焼(米国特許第5,292,813号(Patel et al.)、参照により本明細書に援用、および米国特許第5,558,903号(Bhushan et al)、参照により本明細書に援用)により、炭素元素、または炭素含有種の高温反応によって生産される。各場合において、炭素質の沈積物またはすすが生産される。このすすから、トルエンのような適切な溶媒を用いた抽出により、様々なフラーレンが得られる。フラーレンは、既知の方法により、特に高速液体クロマトグラフィ(HPLC)により分離される。フラーレンは、合成されてもよく、またはダイナミックエンタープライズ社(Dynamic Enterprises,Ltd.,Berkshire,England)、もしくはサザーンケミカルグループ社(Southern Chemical Group,LLC,Tucker,Georgia)から商業的に得てもよい。
【0051】
フラーレンは、米国特許第5,558,903号に開示されるように、昇華、レーザー蒸発、スパッタリング、イオンビーム、スプレーコーティング、浸漬コーティング、ロールオンまたはブラシコーティングを含む多種多様の方法にて、表面に沈着されてもよい。
【0052】
フラーレンの重要な特徴は、それらの「活性炭」を形成する能力である。フラーレンの電子構造は、多数の結合電子が分子表面の周囲に協同的に存在するように、π軌道を重ね合わせた系である(Chemical and Engineering News,Apr.8,1991,page 59、参照により本明細書に援用される)。活性炭の形態としては、フラーレンは、弱い相互作用のための相当のファンデルワールス(van der Waals)力を示す。フラーレン表面の吸着の性質は、特定の細胞膜相互作用を誘導する目的で、それ自身にさらなる修飾を加えてもよい。例えば、特定細胞型の細胞膜に、または細胞膜の特定構成成分に選択的に結合する化学特性を有する特異的な分子(例えば、レクチンまたは抗体)をフラーレン表面に吸着することができる。フラーレン表面はまた、細胞膜に対して特異的に反応性を有する基(例えば、酸化体または還元体)を付与するように、化学的に修飾してもよい。フラーレン表面への種々の分子の結合は、様々な細胞型、例えば内皮細胞、線維芽細胞、一次外植片またはT細胞部分集団を選択的に結合する表面を創出するように操作されてもよい(米国特許第5,310,669号(Richmond et al.)、参照により本明細書に援用、Stephen r Wilsonの、「フラーレンの生物学的側面」(Biological Aspects of Fullerenes),Kadish et al.の、「フラーレン:その化学、物理学および技法」(Fullerenes:Chemistry,Physics and Technology),eds.,John Wiley&Sons,NY2000、参照により本明細書に援用)。
【0053】
フラーレンはまた、他の原子または分子を組み入れるナノチューブを形成してもよい(Liu et al.Science 280:1253−1256(1998)、参照により本明細書に援用される)。カーボンナノチューブの合成および調製は、当該技術分野で既知である(米国特許第5,753,088号(Olk et al)、および米国特許第5,641,466号(Ebbsen et al.)、ともに参照により本明細書に援用される)。タンパク質のような分子もまた、カーボンナノチューブ内部に組み入れられてもよい。例えば、ナノチューブには、ナノチューブの端を切断した後に、酵素、例えば、Zn2Cd2−メタロチオネイン、チトクロームCおよびC3、ならびにβ−ラクタマーゼを充填してもよい(Davis et al.Inorganica Chim.Acta 272:261(1998);Cook et al.Full Sci.Tech.5(4):695(1997)、ともに参照により本明細書に援用される)。
【0054】
三次元フラーレン構造もまた、使用され得る。米国特許第5,338,571号(Mirkin et al.,参照により本明細書に援用される)は、(i)フラーレンを化学的に修飾して、結合形成種を提供し、(ii)基質の表面を化学的に処理して、溶液中にてフラーレンの結合形成種と共有結合するのに有効な結合形成種を提供し、(iii)処理した基質表面と、修飾したフラーレンの溶液を接触させて、処理した基質表面に共有結合したフラーレン層を形成することにより、基質表面上に形成される三次元多層フラーレン構造を開示している。
【0055】
(D)医療用デバイスへのマトリックス塗布
マトリックスは、ステントまたは合成移植片の表面にしっかりと接着すべきである。好ましくは、このことは、連続薄層にマトリックスを塗布することにより達成される。マトリックスの各層は、抗体を組み入れてもよい。あるいは、抗体は、血管腔と直接接触する層のみに塗布されてもよい。種々の型のマトリックスは、連続層において連続的に適用されてもよい。抗体は、ステントへのマトリックス塗布後に、マトリックス上に共有結合的にまたは非共有結合的にコーティングされてもよい。
【0056】
ステントのような医療用デバイスをコーティングするために、ステントは、中程度の粘性を有するマトリックスの溶液を用いて、浸漬されるか、または噴霧される。各層が塗布された後、次の層の塗布前に、ステントは乾燥される。一実施形態では、薄い塗料状マトリックスコーティングは、全厚100μmを超えない。
【0057】
例えば、適切なマトリックスコーティング溶液は、無菌条件下にて、クロロホスム3ミリリットル(ml)中に、ポリD−乳酸(ベーリンガー社)(Boehringer Inc.,Ingelheim,Germany)のR203として入手可能)のような薬剤キャリア480ミリグラム(mg)を溶解させることにより調製される。しかしながら、原則として、血液および組織適合性(生体適合性)であり、溶解、分散または乳化することが可能な任意の生分解性(または非生分解性)マトリックスは、塗布後に、医療用デバイス上の粘着性ラッカーまたは塗料状コーティングへの比較的迅速な乾燥を受ける場合には、マトリックスとして使用してもよい。
【0058】
例えば、フィブリンでステントをコーティングすることは当業者に既知である。ムラー等(Muller et al.)に発行された米国特許第4,548,736号(参照により本明細書に援用される)においては、フィブリンは、トロンビンとフィブリノーゲンを接触させることにより凝固される。好ましくは、移植されたデバイスの機械的特性および生体安定性を改善するために、ジェレンダ(Gerendas)に発行された米国特許第3,523,807号(参照により本明細書に援用される)に記載されるように、または公開済欧州特許出願第0366564号(参照により本明細書に援用される)に記載されるように、本発明のフィブリン含有ステント中のフィブリンは、凝固中に存在する第XIII因子およびカルシウムを有する。好ましくは、本発明においてフィブリンを作製するのに使用されるフィブリノーゲンおよびトロンビンは、任意の種間免疫応答(例えば、ヒト抗ウシ)を回避するために、ステントが移植されるであろう種と同じ動物またはヒト種由来のものである。フィブリン生成物は、フィブリノーゲンおよびトロンビンを組合せたものをフィルムにキャストした後に、浸透圧的に半透膜を通して、フィルムから水分を除去することにより生産される微細フィブリンフィルムの形態であり得る。欧州特許出願第0366564号では、基板(好ましくは、高い多孔性またはトロンビンまたはフィブリノーゲンのいずれかに対する高い親和性を有する)を、フィブリノーゲン溶液およびトロンビン溶液と接触させる。医療用デバイスの表面上でのフィブリノーゲンの重合によりフィブリン層が形成される結果となる。この方法により塗布されるフィブリンの複数層は、任意の所望の厚さのフィブリン層を提供することを可能とする。あるいは、まずフィブリンが凝固された後、粉末へとすりつぶされ、水と混合され、熱金型にて所望の形状に型押しされ得る(米国特許第3,523,807号)。安定性の増加もまた、グルタルアルデヒドまたはホルムアルデヒドのような固定剤とフィブリンを接触させることにより、成形されたフィブリンにて達成することできる。フィブリンを製造および形成するための当業者に既知のこれらおよび他の方法は、本発明に使用され得る。
【0059】
合成移植片がコラーゲンでコーティングされる場合、コラーゲンを調製し、それを合成移植片デバイス上で形成する方法は、米国特許第5,851,230号(Weadock et al.,参照により本明細書に援用される)に記載されるように既知である。この出願は、合成移植片をコラーゲンでコーティングする方法について記載する。多孔質基板にコラーゲンを接着する方法は、典型的に、基板にコラーゲン分散液を塗布し、それを乾燥させて、このプロセスを繰り返すことを含む。コラーゲン分散液は典型的に、酸性pH(2〜4の範囲のpH)にて分散液中に不溶性コラーゲン(約1〜2重量%)をブレンドすることにより作製される。分散液は典型的に、移植片の管腔に、シリンジにより注入され、コラーゲンスラリーで内部表面全体を被覆するように手で操作する。過剰なコラーゲンスラリーは、移植片の開口端の一方を通じて取り除かれる。コーティングおよび乾燥工程は、十分な処理を提供するために数回繰り返される。
【0060】
さらに別の実施形態では、ステントまたは合成移植片は、非晶質炭素でコーティングされる。米国特許第5,198,263号(参照により本明細書に援用される)では、フッ素化ガスまたは他のハロゲン化ガスの存在下にて、非晶質炭素フィルムの高速低温沈着を生産する方法が記載されている。この発明の方法による沈着は、高周波のプラズマ補助化学的蒸着プロセスを用いて、外気室温を含む100℃未満で実施することができる。この発明の方法を用いて生産される非晶質炭素フィルムは、例えば、ガラス、金属、半導体およびプラスチックを含む、多くの型の基板に十分に接着する。
【0061】
フラーレン−移植片、アミン含有ポリマーを形成するためのアミン含有ポリマーの反応性アミノ基部位へのフラーレン部分の結合は、米国特許第5,292,813号に記載されるように実施されてもよい。この方法での化学的修飾は、ステントへのフラーレンの直接的組み込みを可能にする。別の実施形態では、フラーレンは、上述するように、ステントまたは合成移植片の表面上に沈着されてもよい(国際公開第99/32184号(Leone et al.)を参照、参照により本明細書に援用される)。フラーレンはまた、アルデヒド結合により結合されてもよい(Yamago et al.の、「酸化、還元ならびにC−OおよびC−C結合形成反応による有機フラーレンの化学的誘導体化」(Chemical Derivatization of Organofullerenes through Oxidation,Reduction and C−O and C−C Bond Forming Reactions) J Org Chem,58 4796−4798(1998)、参照により本明細書に援用される)。C60Oはまた、フラーレン上のエポキシ基を直接的に介して、ステントに結合されてもよい。結合は、酸素への共有結合を介するものである。カップリング用のこの化合物およびプロトコルは、バッキィユーエスエイ社(BuckyUSA,Houston,Texas)から市販されている。
【0062】
(E)マトリックスへの抗体の添加
始原内皮細胞の接着を促進する抗体は、共有結合的に、または非共有結合的に、マトリックス内に組み入れられることができる。抗体は、マトリックスコーティング溶液と抗体を混合することにより、マトリックスの各層に組み入れられてもよい。あるいは、抗体は、医療用デバイスに塗布されるマトリックスの最終層上に、共有結合的に、または非共有結合的にコーティングされてもよい。
【0063】
一実施形態では、抗体は、マトリックスを含有する溶液に添加される。例えば、抗D34モノクローナル抗体上のFab断片は、500〜800mg/mlの濃度のヒトフィブリノーゲン含有溶液とともにインキュベートされる。抗CD34Fab断片の濃度は様々であり、当業者は過度の実験をすることなく最適濃度を決定することができることは理解されるであろう。ステントを、Fab/フィブリン混合物に添加して、濃縮トロンビン(少なくとも1000U/mlの濃度にある)の添加により、フィブリンは活性化される。得られたマトリックス中に直接組み入れられたFab断片を含有する重合フィブリン混合物を、ステントまたは合成移植片の表面上に薄膜状(0.12cm未満)にプレスする。実際には、いかなる型の抗体または抗体断片も、この方法で、ステントまたは合成移植片のコーティング前に、マトリックス溶液中に組み入れることができる。
【0064】
別の実施形態では、抗体は、マトリックスに共有結合される。一実施形態では,抗体は、異種または同種二官能性リンカー分子を用いて、マトリックスに共有結合的に拘束される。本明細書で使用する場合、「拘束される」という用語は、リンカー分子により、抗体がマトリックスに共有結合されることを指す。本発明に関連したリンカー分子の使用は、典型的に、マトリックスがステントに接着された後に、マトリックスにリンカー分子を共有結合させることを含む。マトリックスの共有結合した後、リンカー分子は、1つまたはそれ以上の抗体を共有結合するのに使用することができる幾つかの活性な官能基をマトリックスに提供する。図1は、架橋分子を介した結合の図を提供する。内皮細胞1.01は、細胞表面抗原1.02により、抗体1.03に結合する。抗体は、架橋分子1.04によりマトリックス1.05〜1.06に拘束される。マトリックス1.05〜1.06は、ステント1.07の接着する。リンカー分子は、直接的に(すなわち、カルボキシル基により)、または既知のカップリング化学(例えば、エステル化、アミド化、およびアシル化)により、マトリックスに結合されてもよい。リンカー分子は、アミド結合の直接的な形成によりマトリックスに結合され、抗体との反応に利用可能なアミン官能基を提供するジアミンまたはトリアミン官能性化合物であってもよい。例えば、リンカー分子は、ポリエチレンイミン(PEI)、ポリアリルアミン(PALLA)またはポリエチレングリコール(PEG)のようなポリアミン官能性ポリマーであり得る。様々なPEG誘導体、例えば、mPEG−スクシンイミジルプロピオネート(succinimidyl propriate)、またはmPEG−N−ヒドロキシスクシンイミドは、共有結合のためのプロトコルとともに、シェアウォーター社(Shearwater Corporation,Birmingham,Alabama)から入手可能である(また、Weiner et al.の,「固定化抗体による抗原捕獲に対するポリエチレングリコールスペーサーの影響」(Influence of a poly−ethyleneglycol spacer on antigen capture by immobilized antibodies).J.Biochem.Biophys.Methods 45:211−219(2000)も参照、参照により本明細書に援用される)。特定のカップリング剤の選択は、使用する抗体の型に依存し、かかる選択は、過度の実験をすることなくなされ得ることは理解されるであろう。これらのポリマーの混合物もまた使用することができる。これらの分子は、1つまたはそれ以上の抗体を表面固定化するのに使用され得る複数のペンダントアミン官能基を含有する。
【0065】
抗体は、ステントの表面上に直接沈着されたC60Oフラーレン層に結合させてもよい。架橋剤は、フラーレンに共有結合的に結合されてもよい。次に、抗体を架橋剤に結合し、続いてそれがステントに結合される。図2は、C60Oによる結合の図を提供する。内皮細胞2.01は、細胞表面抗原2.02を介して、抗体2.03に結合され、続いてマトリックス2.04に、共有結合的に、または非共有結合的に結合される。マトリックス2.04は、C60O(2.05)を介して、ステント2.06に共有結合される。
【図面の簡単な説明】
【0066】
【図1】架橋分子によりマトリックスに共有結合的に拘束される抗体を示す。
【図2】マトリックスを固着するC60O分子の図を示す。
【発明を実施するための形態】
【0067】
[実験例]
本発明は、以下の実験的詳細な節にて説明される。これらの節は、本発明の理解のために以下に記載するが、上記の特許請求の範囲に記載するように、本発明をいかなる場合においても限定するためのものでなく、また限定するものと解釈されるべきではない。
【0068】
実施例1
CD34fab−コーティングステントへのヒト内皮細胞の接着
材料および方法
1 細胞
ヒューベック(ヒト臍静脈内皮細胞)(HUVEC)は、ジャッフェ(Jaffe,E.A.,「内皮細胞の生物学(Biology of Endothelial Cells)」にて、E.A.Jaffe,ed.,Martinus−Nijhoff,THE Hague(1984)、参照により本明細書に援用される)の方法によりヒト臍帯から調製され、20%ウシ胎児血清(FCS)、L−グルタミン酸、抗生物質、130μg/mlのヘパリンおよび1.2mg/mlの内皮細胞成長補助(Sigma−Aldrich,St.Louis,MO)を補充した培養基199中で培養される。
【0069】
始原内皮細胞は、Asahara等の方法(血管新生のための推定始原内皮細胞の単離(Isolation of Putative progenitor endothelial cells for angiogenesis),Science 275:964−967)により、ヒト末梢血から単離される。モノクローナル抗CD34抗体は、磁気ビーズに結合され、ヒト全血の白血球画分とともにインキュベートされる。インキュベーション後、結合した細胞を溶出し、20%ウシ胎児血清およびウシ脳抽出物(Clonetics,San Diego,CA)を含有するM−199中で培養される。細胞は、CD45、CD34、CD31、Flk−1、Tie−2およびE−セレクチ(selectin)ンにより特性化される。
【0070】
2 ステントのコーティング
A.オーバスインターナショナル社(Orbus International B.V(Leusden,THE Netherlands))により生産されるRステントを、抗CD34モノクローナル抗体のFab断片とともに、ヒトフィブリノーゲン(Sigma,St Louis,MO)500〜800mg/mlとともにインキュベートし、トロンビン1000ユニット/mlの添加により、フィブリノーゲンを重合させる。抗CD34モノクローナル抗体断片を含有する重合したフィブリン混合物とのステントのインキュベーション後、R−ステントに対して、フィブリンを薄膜(0.012cm未満)に圧縮する。Fab断片を含有する薄いフィブリン膜を、室温にて、0.5%ウシ血清アルブミン(BSA)を含有するリン酸緩衝生理食塩水(PBS)で3回洗浄する。
【0071】
B.あるいは、Rステントを、mPEG−スクシンイミジルプロピオネート(succinimidyl propionate)シェアウォーター社(Shearwater Corporation(Birmingham,Alabama))でコーティングする。スクシンイミジル基を、製造指示書に従って、抗CD34モノクローナルFab断片と反応させ(Fab−PEGコーテングRステント)、PEG誘導体およびFab断片間に安定なアミド結合を形成させる。
【0072】
3 内皮細胞結合アッセイ
フィブリン−抗CD34FabコーティングRステント、またはFab−PEGコーティングRステントを、5%CO2の加湿雰囲気中で、37℃にて、0.5%BSAを含有するM199にて、100,000から1,000,000細胞/mlの細胞濃度で、単離HUVECまたは単離始原内皮細胞ととともにインキュベートする。ステントとのインキュベーション前に、ヒューベック(HUVEC)または始原内皮細胞を、[3H]−チミジンで、24時間標識する。フィブリンおよびFab抗CD34でコーテングしたステントと標識内皮細胞を、4〜72時間インキュベーションした後に、溶液からステントを取り出し、0.5%BSAを含有するM199で5回洗浄する。結合した内皮細胞を、トリプシン処理により取り外して、ステントへの標識内皮細胞の結合を、[3H]−チミジンのシンチレーションカウンティングにより評価する。陰性対照として、フィブリン単独でコーティングしたステント、またはコーティングしていないステントを、[3H]−チミジン標識した内皮細胞とインキュベートする。t−検定を用いて統計的に結果を評価して、特徴的な結合を確定する。モノクローナル抗CD34Fab断片を組み入れるフィブリンでコーティングしたステントは、コーティングしていないステントと比較して、内皮細胞の結合の有意な増加を示す。
【0073】
実施例2
ヒト内皮細胞の増殖
CD34Fabコーティングステント上にて
内皮細胞増殖アッセイ
抗CD34Fab断片を組み入れるフィブリンでコーティングしたRステントを、0.5%BSAを含有するM199にて、4〜72時間、ヒューベックまたは始原内皮細胞とともにインキュベートする。ヒューベックまたは始原内皮細胞とともにステントをインキュベーションした後に、ステントを、0.5%BSAを含有するM199で5回洗浄した後に、[3H]−チミジンとともにインキュベートする。[3H]−チミジンの取り込みを、洗浄および収集したヒューベックまたは始原内皮細胞にて評価する(細胞は、トリプシンを用いて収集される)。フィブリンコーティングステント上でのヒューベックまたは始原内皮細胞の増殖を、標準的なマイクロタイターディッシュにて、内皮細胞増殖と比較する。フィブリンコーティングステント上でのヒューベックまたは始原内皮細胞の増殖は、マイクロタイターディッシュにおける内皮細胞の増殖と等しいか、またはそれを超える。
【0074】
実施例3
ヒューベックおよび始原内皮細胞と反応性を有するモノクローナル抗体の産生 BALB/cマウスを、PBS中の1.5×106ヒューベック、または1.5×106始原内皮細胞で、2〜4週間に3〜4回の間隔で腹腔内に免疫化し、脾細胞を取り出す3日前に、1.5×106ヒューベック、または1.5×106始原内皮細胞で攻撃する。脾細胞懸濁液を調製し、骨髄腫NS1/1AG4.1と融合させ、ハイブリドーマを成長させ、クローニング(cloned)する。ハイブリドーマの成長およびクローニングの効率を改善するために、10%の内皮細胞調整培体(HUVEC)を培養基に含入させる。始めに、ハイブリドーマ培養上清を、免疫蛍光フローサイトメトリー(FACS)により、ヒューベックまたは始原内皮細胞との反応性に関して試験する。簡潔に述べると、ヒューベック(1.5×104)または始原内皮細胞(1.5×104)を、未希釈のハイブリドーマ上清とともにインキュベートし(30分、4℃)、洗浄して、フルオレセイン−イソチオシアネート(FITC)−ヒツジF(ab')2抗マウスIg(100μg/ml)とともにインキュベートする。最終洗浄後、免疫蛍光フローサイトメトリー分析により、モノクローナル抗体結合に関して、内皮細胞を検査する。陽性のハイブリドーマ上清を、ヒト黒色腫細胞系MM−170に関してスクリーニングし、非内皮特異的mAbを排除する。ヒト腫瘍細胞系、ならびにヒト白血球、単球、好中球、赤血球および血小板のパネルにおけるモノクローナル抗体のスクリーニングにより、内皮特異性をさらに確認する。
【0075】
実施例4
ブタバルーン損傷の研究
体重25〜30kgの若年のヨークシャーブタにて、抗体で被覆したステントの移植を実施する。動物管理は、「実験室動物の管理および使用に関するガイド(Guide for the Care and Use of Laboratory Animals)」(NIH publication NO.80−23,revised 1985)に従う。一晩の断食後、ケタミン塩酸塩(20mg/kg)で動物を鎮静させる。チオペンタール(12mg/kg)での麻酔誘導後、動物に挿管し、酸素および亜酸化窒素の混合物(1:2[vol/vol])を投与する通気口を接続する。0.5〜25容量%のイソフルランで麻酔を持続させる。ペニシリンGプロカインおよびペニシリンGベンザチン(ストレプトマイシン)の混合物1,000mgの筋内注射により、抗生予防が提供される。
【0076】
無菌条件下にて、左冠状動脈の動脈切開を実施し、9F−導入針シースを左冠状動脈に設置する。全ての動物に、ヘパリンナトリウム7,500IUおよびアセチルサリチル酸100mgを静脈内に与える。300秒以上の活性凝固時間を維持するために、処置全体にわたって、さらに2,500IUボーラスのヘパリンを定期的に投与する。8F誘導カテーテルを、頚動脈鞘を通して導入し、腸骨動脈の起点まで通す。イソソルビドジニトレート1mgの投与後、血管造影を行い、定量的冠動脈造影システムを用いて、画像を分析する。3F−塞栓切除カテーテルを、総大腿動脈に挿入し、ステント移植のための選択区から遠位に通す。塞栓切開バルーンは、動脈区によりも0.5mm大きい大きさにふくらませ、2回引っ張って、血管を露出させる。露出直後、モノクローナル抗体のFab断片を組み入れたフィブリンコーティングステントを、誘導カテーテルを通して挿入し、大腿動脈の露出区に配置させる。ステント移植後、3日目および8週目の両方で、動物を屠殺する。上記のように、動物をまず鎮静させ、麻酔をかける。ステントを入れた大腿区を外移植させた後に、4℃にて、48時間、0.1Mリン酸緩衝液(pH7.2)中の4%パラホルムアルデヒド中に入れる。内皮細胞の表面被覆率の電子顕微鏡評価のためのさらなる加工のために、血管壁の長方形の切片を取り出す。ステントを入れた血管のこの部分を0.15カコジレート(cacodylate)緩衝液に入れ、0.15Mカコジレート中の2.5%グルタルアルデヒドでさらに固定する。次に、1%OsO4および50mMフェリシアニド(K3[Fe(CN)6]を含有する0.1Mカコジレート緩衝液でこの組織を後固定し、さらに加工する(正常ブタ冠動脈におけるヘパリンコーテングパルマ−シャッツ(Palmaz−Schatz)ステントを用いた血栓現象の減少がある。(Reduction in thrombotic events with heparin−coated Palmaz−Schatz stents in normal porcine coronary arteries),Circulation 93 423−430、参照により本明細書に援用される)。
【0077】
ステントを入れた動脈区の残存切片は、ヴァンボイセコム他(van Beusekom et al.)(Cardiovasc Pathol 5:69−76(1996)、参照により本明細書に援用される)により記載されるように、3態のメタクリル酸メチルをしみ込ませる。適所にステントを有する包埋動脈区を、ステンレス鋼使い捨てナイフを用いて、電動回転式ミクロトーム(HM−350、Microm Gmbh,Munich,Germany)にて3〜5μm厚の切片に切断する。クロムアルミニウムをコーティングしたスライド上で、水中の60%2−ブトキシエタノールおよび10%エタノールを用いて、40℃でホットプレート上にて切片を引き伸ばす。切片をプラスチックフィルムで被覆し、過剰のブトキシエタノール−エタノール混合物を除去し、40℃のオーブンに一晩置いて、スライドを乾燥させる。続いて、等量のキシレン−クロロホルム溶液中で、30〜60分間、切片からプラスチックを取り外す(deplasticize)。次に、調製した切片にて、光学顕微鏡用の標準的な染色手順を行う。統計データを、別個の実験の平均値±平均値の標準誤差(SD)として表す。統計学的有意性は、分散の一方向分析(ANOVA)およびフィッシャーのPLSD検定(Stat View 4.01,Brain Power,Inc,Calabasas,Calif)により確定される。大腿動脈の処理および未処理区のデータに関して、有対t検定(paired t test)(Stat View 4.01)が使用される。0.05未満のp値は、平均値間の統計学的に有意な差異であるとみなされる。抗ブタ内皮細胞モノクローナルFab断片を組み入れるステントで処理した動物は、移植したコーティングしていないステントを有する対照と比較して、内皮細胞被覆の増加を示し、また再狭窄の有意な減少を示す。
【0078】
実施例5
ブタ始原内皮細胞のトランスフェクション
ブタ始原内皮細胞は、Asahara等の方法(血管新生のための推定始原内皮細胞の単離(Isolation of Putative progenitor endothelial cells for angiogenesis),Science 275:964−967)により、ブタ末梢血から単離される。モノクローナル抗CD34抗体は、磁気ビーズに結合され、ブタ全血の白血球画分とともにインキュベートされる。インキュベーション後、結合した細胞を溶出し、20%ウシ胎児血清およびウシ脳抽出物(Clonetics,San Diego,CA)を含有するM−199中で培養される。細胞は、CD45、CD34、CD31、Flk−1、Tie−2およびE−セレクチンにより特性化される。
【0079】
例えば、精製ブタ始原内皮細胞は、ローゼンガルト(Rosengart)等の方法(VEGF121cDNAを発現するアデノウイルスベクターの直接心筋内投与を用いた冠状動脈疾患を治療するための血管新生遺伝子治療の第I相治験の6ヶ月目の評価(Six−month assessment of a phase I trial of angiogenic gene therapy for the treatment of coronary artery disease using direct intramyocardial administration of an adenovirus vector expressing THE VEGF121 cDNA).Ann Surg.230(4):466−470(1999)、参照により本明細書に援用される)に従って、VEGF cDNAを発現するアデノウイルス発現ベクターを用いて、血管内皮増殖因子(VEGF)によりトランスフェクトされる。
【0080】
トランスフェクトされた、VEGFを発現する精製ブタ始原細胞を、二重バルーンチャンバ注入カテーテル(Cordis Corp)を用いて、実施例4に記載するようにバルーン損傷およびステント移植の後に、ブタ大腿動脈モデルに注入し、大腿動脈のステントを入れた部分を単離する。トランスフェクションされてないブタ始原内皮細胞を注入したブタに対して、VEGFをトランスフェクトしたブタ始原細胞を注入したバルーン血管形成用ステント処理ブタにおける再狭窄を比較する。再注入したブタ始原内皮細胞におけるVEGFの発現は、結果として、抗CD34コーティングステントにおいて再狭窄の発生および重篤度の減少をもたらす。
【0081】
実施例6
アミノシランPEOで拘束された抗体の調製
ステント調製
ステントは、316Lステンレス鋼で作製され、超音波クリーナーにて、陰イオン性洗浄剤中でまず洗浄することにより洗浄および不動態化し、次に攪拌しながら熱硝酸中に浸し、続いて最終的に脱イオン水ですすぐ。
【0082】
誘導体化ステントは、以下のように調製される:ステントを、95%エタノール中のN−(2−アミノエチル−3−アミノプロピル)トリメトキシシランの2%混合物に、3分間浸漬させ、取り出して、室温にて風乾させた後、110℃にて10分間硬化させる。
【0083】
ポリエチレングリコール(PEG)スペーサーのカップリング誘導体化ステントを、10mMのジカルボキシメチル−PEGを含有する0.1MのMES緩衝液100ml中に入れ、EDC500mgを添加し、2時間絶え間なく攪拌しながら25℃にてインキュベートする。
【0084】
拘束抗体
マウス抗CD34IgG1抗体1.0mgが溶解している0.1MのMES緩衝液(pH4.5)150ml中にステントを浸漬することにより、内皮細胞に対する抗体を、一段階のカルボジイミドカップリング反応にてPEG官能基化ステントに固定化させ、25℃にて2時間インキュベートする。溶液からステントを取り出し、0.02%ツイーン(Tween)20を有するリン酸緩衝生理食塩水50ml(pH7.2)で5回すすぐ。
【0085】
試薬としては、N−(2−アミノエチル−3−アミノプロピル)トリメトキシシラン(DegussA−Huls)、MES緩衝液−モルホリンエタンスルホン酸緩衝液(Sigma,st.Louis,MO)、EDC−1−エチル−3−(3−ジメチルアミノプロピル)カルボジイミド(Sigma,st.Louis,MO)、ジカルボキシメチル−PEG−ジカルボキシメチル−ポリ(エチレングリコール)[MW 3400](Shearwater,Huntsville,AL)が挙げられる。
【0086】
本発明の幾つかの異なる実施形態を記載してきたが、本発明は、これらの実施形態に限定されることを意図しておらず、当業者により、特許請求の範囲に規定する本発明の精神および範囲から逸脱することなく、変更および変形がなされ得ることを意図するものである。
【特許請求の範囲】
【請求項1】
治療上有効な量の、内皮細胞抗原と反応する少なくとも1つの型の抗体、および少なくとも1層のマトリックスでコーティングした医療用デバイスであって、該マトリックスは、約C60〜約C100の範囲のフラーレンを含む医療用デバイス。
【請求項2】
前記抗体は、前記医療用デバイスをコーティングする前記マトリックスの最終層に、リンカー分子により共有結合的に拘束される、請求項1に記載の医療用デバイス。
【請求項3】
前記フラーレンは、C60Oである、請求項2に記載の医療用デバイス。
【請求項4】
前記抗体は、モノクローナル抗体である、請求項1に記載の医療用デバイス。
【請求項5】
前記医療用デバイスは、ステントである、請求項1に記載の医療用デバイス。
【請求項6】
前記医療用デバイスは、合成移植片である、請求項1に記載の医療用デバイス。
【請求項7】
前記内皮細胞は、ヒト細胞である、請求項1に記載の医療用デバイス。
【請求項8】
前記モノクローナル抗体は、内皮細胞表面抗原CD34と反応する、請求項4に記載の医療用デバイス。
【請求項9】
前記モノクローナル抗体は、FabまたはF(ab')2断片を含む、請求項4または8に記載の医療用デバイス。
【請求項10】
治療上有効な量の、内皮細胞抗原と反応する少なくとも1つの型の抗体、および少なくとも1層のマトリックスでコーティングした医療用デバイスであって、該マトリックスは、ポリウレタン、セグメント化ポリウレタン−尿素/へパリン、ポリL−乳酸、セルロースエステル、ポリエチレングリコール、コラーゲン、ラミニン、へパリン、フィブリン、セルロースまたは炭素を含む医療用デバイス。
【請求項11】
前記抗体は、前記医療用デバイスをコーティングする前記マトリックスの最終層に、リンカー分子により共有結合的に拘束される、請求項10に記載の医療用デバイス。
【請求項12】
前記抗体は、モノクローナル抗体である、請求項10に記載の医療用デバイス。
【請求項13】
前記医療用デバイスは、ステントである、請求項10に記載の医療用デバイス。
【請求項14】
前記医療用デバイスは、合成移植片である、請求項10に記載の医療用デバイス。
【請求項15】
前記内皮細胞は、ヒト細胞である、請求項10に記載の医療用デバイス。
【請求項16】
前記モノクローナル抗体は、内皮細胞表面抗原であるCD34と反応する、請求項12に記載の医療用デバイス。
【請求項17】
前記モノクローナル抗体は、FabまたはF(ab')2断片を含む、請求項12または16に記載の医療用デバイス。
【請求項18】
マトリックスおよび治療上有効な量の、内皮細胞抗原と反応する少なくとも1つの型の抗体を含む、医療用デバイスにコーティングするための組成物。
【請求項19】
前記マトリックスは、ポリウレタン、セグメント化ポリウレタン−尿素/へパリン、ポリL−乳酸、セルロースエステル、ポリエチレングリコール、コラーゲン、ラミニン、へパリン、フィブリン、セルロースまたは炭素を含む、請求項18に記載の組成物。
【請求項20】
前記マトリックスは、約C60〜約C100の範囲のフラーレンを含む、請求18に記載の組成物。
【請求項21】
前記抗体は、モノクローナル抗体である、請求項19または20に記載の組成物。
【請求項22】
前記内皮細胞は、ヒト細胞である、請求項21に記載の組成物。
【請求項23】
前記モノクローナル抗体は、内皮細胞表面抗原であるCD34と反応する、請求項21に記載の組成物。
【請求項24】
前記モノクローナル抗体は、FabまたはF(ab')2断片を含む、請求項22に記載の組成物。
【請求項25】
下記の:
(a)ポリウレタン、セグメント化ポリウレタン−尿素/へパリン、ポリL−乳酸、セルロースエステル、ポリエチレングリコール、コラーゲン、ラミニン、へパリン、フィブリン、セルロース、フラーレンまたは炭素を含む少なくとも1つ層のマトリックスで医療用デバイスをコーティングする工程と、
(b)該医療用デバイスをコーティングする該マトリックスに、治療上有効な量の、内皮細胞抗原と反応する少なくとも1つの型の抗体を添加する工程とを含む、医療用デバイスをコーティングする方法。
【請求項26】
前記抗体は、前記医療用デバイスをコーティングする前記マトリックスの最終層に非共有結合的にコーティングされる、請求項25に記載の方法。
【請求項27】
前記抗体は、前記医療用デバイスをコーティングする前記マトリックスの最終層に、リンカー分子により共有結合的に拘束される、請求項25に記載の方法。
【請求項28】
前記フラーレンは、C60Oである、請求項25に記載の方法。
【請求項29】
医療用デバイスの動脈への挿入を含む、アテローム性動脈硬化症のための哺乳動物の治療方法であって、該医療用デバイスは、治療上有効な量の、内皮細胞抗原と反応する少なくとも1つの型の抗体および約C60〜C100の範囲のフラーレンを含むマトリックスでコーティングされる治療方法。
【請求項30】
前記抗体は、モノクローナル抗体である、請求項29に記載の治療方法。
【請求項31】
前記アテローム性動脈硬化症は、冠動脈アテローム性動脈硬化症である、請求項29に記載の治療方法。
【請求項32】
前記モノクローナル抗体は、FabまたはF(ab')2断片を含む、請求項30に記載の治療方法。
【請求項33】
医療用デバイスの動脈への挿入を含む、アテローム性動脈硬化症のための哺乳動物の治療方法であって、該医療用デバイスは、ポリウレタン、セグメント化ポリウレタン−尿素/ヘパリン、ポリL−乳酸、セルロースエステル、ポリエチレングリコール、コラーゲン、ラミニン、ヘパリン、フィブリン、セルロースまたは炭素を含む少なくとも1層のマトリックス、および治療上有効な量の、内皮細胞抗原と反応する少なくとも1つの型の抗体でコーティングされる治療方法。
【請求項34】
前記抗体は、モノクローナル抗体である、請求項33に記載の治療方法。
【請求項35】
前記モノクローナル抗体は、FabまたはF(ab')2断片である、請求項34に記載の治療方法。
【請求項36】
ポリウレタン、セグメント化ポリウレタン−尿素/ヘパリン、ポリL−乳酸、セルロースエステル、ポリエチレングリコール、コラーゲン、ラミニン、ヘパリン、フィブリン、セルロースまたは炭素を含む少なくとも1層のマトリックス、および治療上有効な量の、内皮細胞抗原と反応する少なくとも1つの型の抗体でコーティングされた医療用デバイスの血管への挿入を含む、血管の閉塞のための哺乳動物の治療方法。
【請求項37】
前記抗体は、モノクローナル抗体である、請求項36に記載の治療方法。
【請求項38】
約C60〜C100の範囲のフラーレンを含む少なくとも1層のマトリックス、および治療上有効な量の、内皮細胞抗原と反応する少なくとも1つの型の抗体でコーティングした医療用デバイスの血管への挿入を含む、血管の閉塞のための哺乳動物の治療方法。
【請求項39】
前記血管は、動脈である、請求項36または38に記載の治療方法。
【請求項40】
前記血管は、静脈である、請求項36または38に記載の治療方法。
【請求項41】
約C60〜約C100の範囲のフラーレンを含む少なくとも1層のマトリックスでコーティングした医療用デバイス。
【請求項42】
前記マトリックスの第1の層は、前記医療用デバイスに非共有結合的に結合される、請求項41に記載の医療用デバイス。
【請求項43】
前記マトリックスの第1の層は、前記医療用デバイスに共有結合的に結合される、請求項41に記載の医療用デバイス。
【請求項44】
前記マトリックスは、C60Oである、請求項43に記載の医療用デバイス。
【請求項45】
前記医療用デバイスは、ステントである、請求項41に記載の医療用デバイス。
【請求項46】
前記医療用デバイスは、合成移植片である、請求項41に記載の医療用デバイス。
【請求項47】
ナノチューブとして配列されたフラーレンから構成されるマトリックスでコーティングされた医療用デバイス。
【請求項48】
前記マトリックスは、前記医療用デバイスに非共有結合的に結合される、請求項47に記載の医療用デバイス。
【請求項49】
前記マトリックスは、前記医療用デバイスに共有結合的に結合される、請求項47に記載の医療用デバイス。
【請求項50】
前記医療用デバイスは、ステントである、請求項47に記載の医療用デバイス。
【請求項51】
前記医療用デバイスは、合成移植片である、請求項47に記載の医療用デバイス。
【請求項1】
治療上有効な量の、内皮細胞抗原と反応する少なくとも1つの型の抗体、および少なくとも1層のマトリックスでコーティングした医療用デバイスであって、該マトリックスは、約C60〜約C100の範囲のフラーレンを含む医療用デバイス。
【請求項2】
前記抗体は、前記医療用デバイスをコーティングする前記マトリックスの最終層に、リンカー分子により共有結合的に拘束される、請求項1に記載の医療用デバイス。
【請求項3】
前記フラーレンは、C60Oである、請求項2に記載の医療用デバイス。
【請求項4】
前記抗体は、モノクローナル抗体である、請求項1に記載の医療用デバイス。
【請求項5】
前記医療用デバイスは、ステントである、請求項1に記載の医療用デバイス。
【請求項6】
前記医療用デバイスは、合成移植片である、請求項1に記載の医療用デバイス。
【請求項7】
前記内皮細胞は、ヒト細胞である、請求項1に記載の医療用デバイス。
【請求項8】
前記モノクローナル抗体は、内皮細胞表面抗原CD34と反応する、請求項4に記載の医療用デバイス。
【請求項9】
前記モノクローナル抗体は、FabまたはF(ab')2断片を含む、請求項4または8に記載の医療用デバイス。
【請求項10】
治療上有効な量の、内皮細胞抗原と反応する少なくとも1つの型の抗体、および少なくとも1層のマトリックスでコーティングした医療用デバイスであって、該マトリックスは、ポリウレタン、セグメント化ポリウレタン−尿素/へパリン、ポリL−乳酸、セルロースエステル、ポリエチレングリコール、コラーゲン、ラミニン、へパリン、フィブリン、セルロースまたは炭素を含む医療用デバイス。
【請求項11】
前記抗体は、前記医療用デバイスをコーティングする前記マトリックスの最終層に、リンカー分子により共有結合的に拘束される、請求項10に記載の医療用デバイス。
【請求項12】
前記抗体は、モノクローナル抗体である、請求項10に記載の医療用デバイス。
【請求項13】
前記医療用デバイスは、ステントである、請求項10に記載の医療用デバイス。
【請求項14】
前記医療用デバイスは、合成移植片である、請求項10に記載の医療用デバイス。
【請求項15】
前記内皮細胞は、ヒト細胞である、請求項10に記載の医療用デバイス。
【請求項16】
前記モノクローナル抗体は、内皮細胞表面抗原であるCD34と反応する、請求項12に記載の医療用デバイス。
【請求項17】
前記モノクローナル抗体は、FabまたはF(ab')2断片を含む、請求項12または16に記載の医療用デバイス。
【請求項18】
マトリックスおよび治療上有効な量の、内皮細胞抗原と反応する少なくとも1つの型の抗体を含む、医療用デバイスにコーティングするための組成物。
【請求項19】
前記マトリックスは、ポリウレタン、セグメント化ポリウレタン−尿素/へパリン、ポリL−乳酸、セルロースエステル、ポリエチレングリコール、コラーゲン、ラミニン、へパリン、フィブリン、セルロースまたは炭素を含む、請求項18に記載の組成物。
【請求項20】
前記マトリックスは、約C60〜約C100の範囲のフラーレンを含む、請求18に記載の組成物。
【請求項21】
前記抗体は、モノクローナル抗体である、請求項19または20に記載の組成物。
【請求項22】
前記内皮細胞は、ヒト細胞である、請求項21に記載の組成物。
【請求項23】
前記モノクローナル抗体は、内皮細胞表面抗原であるCD34と反応する、請求項21に記載の組成物。
【請求項24】
前記モノクローナル抗体は、FabまたはF(ab')2断片を含む、請求項22に記載の組成物。
【請求項25】
下記の:
(a)ポリウレタン、セグメント化ポリウレタン−尿素/へパリン、ポリL−乳酸、セルロースエステル、ポリエチレングリコール、コラーゲン、ラミニン、へパリン、フィブリン、セルロース、フラーレンまたは炭素を含む少なくとも1つ層のマトリックスで医療用デバイスをコーティングする工程と、
(b)該医療用デバイスをコーティングする該マトリックスに、治療上有効な量の、内皮細胞抗原と反応する少なくとも1つの型の抗体を添加する工程とを含む、医療用デバイスをコーティングする方法。
【請求項26】
前記抗体は、前記医療用デバイスをコーティングする前記マトリックスの最終層に非共有結合的にコーティングされる、請求項25に記載の方法。
【請求項27】
前記抗体は、前記医療用デバイスをコーティングする前記マトリックスの最終層に、リンカー分子により共有結合的に拘束される、請求項25に記載の方法。
【請求項28】
前記フラーレンは、C60Oである、請求項25に記載の方法。
【請求項29】
医療用デバイスの動脈への挿入を含む、アテローム性動脈硬化症のための哺乳動物の治療方法であって、該医療用デバイスは、治療上有効な量の、内皮細胞抗原と反応する少なくとも1つの型の抗体および約C60〜C100の範囲のフラーレンを含むマトリックスでコーティングされる治療方法。
【請求項30】
前記抗体は、モノクローナル抗体である、請求項29に記載の治療方法。
【請求項31】
前記アテローム性動脈硬化症は、冠動脈アテローム性動脈硬化症である、請求項29に記載の治療方法。
【請求項32】
前記モノクローナル抗体は、FabまたはF(ab')2断片を含む、請求項30に記載の治療方法。
【請求項33】
医療用デバイスの動脈への挿入を含む、アテローム性動脈硬化症のための哺乳動物の治療方法であって、該医療用デバイスは、ポリウレタン、セグメント化ポリウレタン−尿素/ヘパリン、ポリL−乳酸、セルロースエステル、ポリエチレングリコール、コラーゲン、ラミニン、ヘパリン、フィブリン、セルロースまたは炭素を含む少なくとも1層のマトリックス、および治療上有効な量の、内皮細胞抗原と反応する少なくとも1つの型の抗体でコーティングされる治療方法。
【請求項34】
前記抗体は、モノクローナル抗体である、請求項33に記載の治療方法。
【請求項35】
前記モノクローナル抗体は、FabまたはF(ab')2断片である、請求項34に記載の治療方法。
【請求項36】
ポリウレタン、セグメント化ポリウレタン−尿素/ヘパリン、ポリL−乳酸、セルロースエステル、ポリエチレングリコール、コラーゲン、ラミニン、ヘパリン、フィブリン、セルロースまたは炭素を含む少なくとも1層のマトリックス、および治療上有効な量の、内皮細胞抗原と反応する少なくとも1つの型の抗体でコーティングされた医療用デバイスの血管への挿入を含む、血管の閉塞のための哺乳動物の治療方法。
【請求項37】
前記抗体は、モノクローナル抗体である、請求項36に記載の治療方法。
【請求項38】
約C60〜C100の範囲のフラーレンを含む少なくとも1層のマトリックス、および治療上有効な量の、内皮細胞抗原と反応する少なくとも1つの型の抗体でコーティングした医療用デバイスの血管への挿入を含む、血管の閉塞のための哺乳動物の治療方法。
【請求項39】
前記血管は、動脈である、請求項36または38に記載の治療方法。
【請求項40】
前記血管は、静脈である、請求項36または38に記載の治療方法。
【請求項41】
約C60〜約C100の範囲のフラーレンを含む少なくとも1層のマトリックスでコーティングした医療用デバイス。
【請求項42】
前記マトリックスの第1の層は、前記医療用デバイスに非共有結合的に結合される、請求項41に記載の医療用デバイス。
【請求項43】
前記マトリックスの第1の層は、前記医療用デバイスに共有結合的に結合される、請求項41に記載の医療用デバイス。
【請求項44】
前記マトリックスは、C60Oである、請求項43に記載の医療用デバイス。
【請求項45】
前記医療用デバイスは、ステントである、請求項41に記載の医療用デバイス。
【請求項46】
前記医療用デバイスは、合成移植片である、請求項41に記載の医療用デバイス。
【請求項47】
ナノチューブとして配列されたフラーレンから構成されるマトリックスでコーティングされた医療用デバイス。
【請求項48】
前記マトリックスは、前記医療用デバイスに非共有結合的に結合される、請求項47に記載の医療用デバイス。
【請求項49】
前記マトリックスは、前記医療用デバイスに共有結合的に結合される、請求項47に記載の医療用デバイス。
【請求項50】
前記医療用デバイスは、ステントである、請求項47に記載の医療用デバイス。
【請求項51】
前記医療用デバイスは、合成移植片である、請求項47に記載の医療用デバイス。
【図1】


【図2】




【図2】


【公開番号】特開2013−46771(P2013−46771A)
【公開日】平成25年3月7日(2013.3.7)
【国際特許分類】
【外国語出願】
【出願番号】特願2012−222595(P2012−222595)
【出願日】平成24年10月5日(2012.10.5)
【分割の表示】特願2001−566720(P2001−566720)の分割
【原出願日】平成13年3月15日(2001.3.15)
【出願人】(500013371)オーバスネイチ メディカル、インコーポレイテッド (4)
【Fターム(参考)】
【公開日】平成25年3月7日(2013.3.7)
【国際特許分類】
【出願番号】特願2012−222595(P2012−222595)
【出願日】平成24年10月5日(2012.10.5)
【分割の表示】特願2001−566720(P2001−566720)の分割
【原出願日】平成13年3月15日(2001.3.15)
【出願人】(500013371)オーバスネイチ メディカル、インコーポレイテッド (4)
【Fターム(参考)】
[ Back to top ]

