凍結乾燥ケーキ製剤
本明細書には、フルチカゾン、サルメテロール、またはそれらの薬学的に許容可能な塩又はそれらの組合せの凍結乾燥ケーキ形態が提供され、それは、長期間の間の室温での安定性を提供する。許容可能な溶媒(例えば、担体又は希釈剤)によって再構成されると、再構成された医薬製剤又は美容製剤は、皮下注射を含む非経口的に注入可能な投与に適した、無菌の、非懸濁液の形態を提供する。
【発明の詳細な説明】
【技術分野】
【0001】
〈相互参照〉
本出願は、2010年1月15日出願の米国特許出願第61/295,646号、表題「凍結乾燥ケーキ製剤」の利益を主張するものであり、その全体における引用により本明細書に組み込まれる。
【背景技術】
【0002】
過剰な体脂肪は現代社会において重大な健康管理である。過剰な体脂肪により促進される慢性の健康疾病は、例えば心血管疾患及び2型糖尿病を含む。更に、過剰な体脂肪は、個人の外観及び自己の姿を大きく蝕む。長く作用するβアドレナリン受容体アゴニスト及び/又はコルチコステロイドは、過剰な体脂肪を減らすために注入可能な医薬製剤で使用される。
【0003】
注入可能な医薬品のような凍結乾燥された生成物は、水溶液では相対的に不安定であり、より安定した及びそれ故より長い貯蔵寿命を有する固相生成物をもたらすことができる。
【発明の概要】
【発明が解決しようとする課題】
【0004】
凍結乾燥された活性成分を含む凍結乾燥ケーキ組成物が本明細書で提供され、該活性成分は、ほんの一例として、キシナホ酸サルメテロール、プロピオン酸フルチカゾン、他の薬学的に許容可能な塩又はそれらの組み合わせ及び混合物、並びに充填剤である。幾つかの実施形態において、凍結乾燥組成物は更に非イオン性界面活性剤を含む。更なる又は追加の実施形態において、凍結乾燥組成物は緩衝剤を含む。また更なる又は追加の実施形態において、本明細書に記載の凍結乾燥組成物は更に抗酸化剤を含む。本明細書に記載の凍結乾燥組成物はバルク溶液から調製され、幾つかの実施形態においてバルク溶液は凍結乾燥の前の濾過法を介して殺菌される。凍結乾燥ケーキ組成物は活性成分の安定した形態を提供し、他の実施形態において活性成分は投与前に容易に再構成することができる。本出願はまた、そのような凍結乾燥ケーキ組成物、再構成された凍結乾燥製剤を含む製剤を調製する方法、再構成された凍結乾燥製剤を調製する方法、及び治療上及び美容上の指標のため、凍結乾燥組成物及び再構成された凍結乾燥製剤を使用する方法を記載する。
【課題を解決するための手段】
【0005】
〈凍結乾燥フルチカゾン組成物〉
第1の態様において、凍結乾燥フルチカゾン又はその薬学的に許容可能な塩、充填剤及び非イオン性界面活性剤を含む無菌のフルチカゾン凍結乾燥組成物が本明細書で提供される。幾つかの実施形態において、無菌のフルチカゾン凍結乾燥物(lyophile)は更に緩衝剤を含む。幾つかの実施形態において、緩衝剤はクエン酸又はクエン酸ナトリウム二水和物である。1つの実施形態において、緩衝剤はクエン酸である。別の実施形態において、緩衝剤はクエン酸二水和物である。結晶相、非晶相、半結晶相、半非晶相、又はそれらの混合物において凍結乾燥フルチカゾンを含む無菌の凍結乾燥組成物も本明細書で提供される。1つの実施形態において、凍結乾燥フルチカゾンは非晶相にある。別の実施形態において、フルチカゾンの薬学的に許容可能な塩はプロピオン酸塩又はフロ酸塩である。また別の実施形態において、薬学的に許容可能な塩はプロピオン酸塩である。
【0006】
幾つかの実施形態において、無菌の凍結乾燥フルチカゾン組成物が提供され、ここで凍結乾燥フルチカゾンは、凍結乾燥物の合計の組み合わせた乾燥重量の約0.001重量%から約0.1重量%までの量で存在する。また更なる実施形態において、凍結乾燥フルチカゾンは、凍結乾燥物の合計の組み合わせた乾燥重量の約0.015重量%から約0.030重量%までの量で存在する。また更なる実施形態において、凍結乾燥フルチカゾンは、凍結乾燥物の合計の組み合わせた乾燥重量の約0.017重量%から約0.023重量%までの量で存在する。1つの実施形態において、凍結乾燥フルチカゾンは、凍結乾燥物の合計の組み合わせた乾燥重量の約0.020重量%の量で存在する。
【0007】
更なる又は追加の実施形態において、約500μg/g以下の量で存在する凍結乾燥フルチカゾンを含む無菌の凍結乾燥フルチカゾン組成物が本明細書で提供される。幾つかの実施形態において、無菌の凍結乾燥フルチカゾン組成物が提供され、ここで凍結乾燥フルチカゾンは約1μg/gから約500μg/gまでの量で存在する。更なる又は追加の実施形態において、無菌の凍結乾燥フルチカゾン組成物が提供され、ここで凍結乾燥フルチカゾンは約5μg/gから約350μg/gまでの量で存在する。特定の実施形態において、無菌の凍結乾燥フルチカゾン組成物が提供され、ここで、凍結乾燥フルチカゾンは約15μg/gから約300μg/gまでの量で存在する。幾つかの実施形態において、無菌のフルチカゾン組成物が本明細書で提供され、ここで凍結乾燥フルチカゾンは約20μg/gから約250μg/gまでの量で存在する。また追加の実施形態において、無菌の凍結乾燥フルチカゾン組成物が提供され、ここで凍結乾燥フルチカゾンは約25μg/gから約225μg/gまでの量で存在する。特定の実施形態において、無菌の凍結乾燥フルチカゾン組成物が本明細書で提供され、ここで凍結乾燥フルチカゾンは約30μg/gから約200μg/gまでの量で存在する。また更なる又は追加の実施形態において、約100μg/gから約300μg/gの量の凍結乾燥フルチカゾンを含む無菌の凍結乾燥フルチカゾン組成物が本明細書に記載される。幾つかの実施形態において、約200μg/gから約300μg/gを含む無菌の凍結乾燥フルチカゾン組成物が本明細書で提供される。1つの実施形態において、約150μg/gの凍結乾燥フルチカゾンを含む無菌の凍結乾燥フルチカゾン組成物が本明細書で提供される。
【0008】
約50μg/gに等しい又はそれ未満の量で存在するフルチカゾンの凍結乾燥物を含む無菌の凍結乾燥フルチカゾン組成物が本明細書で提供される。更なる又は追加の実施形態において、無菌の凍結乾燥フルチカゾン組成物が本明細書で提供され、ここで凍結乾燥フルチカゾンは約1μg/gから約50μg/gまでの量で存在する。特定の実施形態において、無菌の凍結乾燥フルチカゾン組成物が提供され、ここで凍結乾燥フルチカゾンは約5μg/gから約35μg/gの量で存在する。1つの実施形態において、無菌の凍結乾燥フルチカゾン組成物が提供され、ここで凍結乾燥フルチカゾンは約9μg/gから約20μg/gまでの量で存在する。
【0009】
本明細書にはまた、さらなる又は追加の実施形態において、凍結乾燥フルチカゾンまたはその薬学的に許容可能な塩、充填剤およびほんの一例として、ポリソルベート80などの非イオン性界面活性剤を含む無菌のフルチカゾン凍結乾燥(lyophile)組成物が記載される。幾つかの実施形態において、非イオン性界面活性剤は以下から選択される:(N,N−ビス[3−(D−グルコアミド(gluconamido))プロピル]コラミド);ビス(ポリエチレングリコールビス[イミダゾイルカルボニル]);ポリオキシエチレングリコールドデシルエーテル;ポリオキシエチレングリセロールトリリシノリエート(ethylenglyceroltriricinoleate)35;デカエチレングリコールモノドデシルエーテル;N−デカノイル−N−メチルグルカミン;n−デシルα−D−グルコピラノシド;デシルβ−D−マルトピラノシド;n−ドデカノイル−N−メチルグルカミド;n−ドデシルα−D−マルトシド;n−ドデシルβ−D−マルトシド;n−ヘキサデシルβ−D−マルトシド;ヘプタエチレングリコールモノデシルエーテル;ヘプタエチレングリコールモノドデシルエーテル;ヘプタエチレングリコールモノテトラデシルエーテル;ヘキサエチレングリコールモノドデシルエーテル;ヘキサエチレングリコールモノヘキサデシルエーテル;ヘキサエチレングリコールモノオクタデシルエーテル;ヘキサエチレングリコールモノテトラデシルエーテル;オクチルフェニル−ポリエチレングリコール;メチル−6−O−(N−ヘプチルカルバモイル)−α−D−グルコピラノシド;ノナエチレングリコールモノドデシルエーテル;N−ノナノイル−N−メチルグルカミン;N−ノナノイル−N−メチルグルカミン;オクタエチレングリコールモノデシルエーテル;オクタエチレングリコールモノドデシルエーテル;オクタエチレングリコールモノヘキサデシルエーテル;オクタエチレングリコールモノオクタデシルエーテル;オクタエチレングリコールモノテトラデシルエーテル;オクチル−β−D−グルコピラノシド;ペンタエチレングリコールモノデシルエーテル;ペンタエチレングリコールモノドデシルエーテル;ペンタエチレングリコールモノヘキサデシルエーテル;ペンタエチレングリコールモノヘキシルエーテル;ペンタエチレングリコールモノオクタデシルエーテル;ペンタエチレングリコールモノオクチルエーテル;ポリエチレングリコールジグリシジルエーテル;ポリエチレングリコールエーテルW−1;ポリオキシエチレン10トリデシルエーテル;ポリオキシエチレン100ステアレート;ポリオキシエチレン20イソヘキサデシルエーテル;ポリオキシエチレン20オレイルエーテル;ポリオキシエチレン40ステアレート;ポリオキシエチレン50ステアレート;ポリオキシエチレン8ステアレート、ポリオキシエチレンビス(イミダゾリルカルボニル)、ポリオキシエチレン25プロピレングリコールステアレート;サポニン;ラウリン酸ソルビタン、ソルビタンモノパルミタート、ステアリン酸ソルビタン、トリステアリン酸ソルビタン、オレイン酸ソルビタン、トリオレイン酸ソルビタン;ポリエチレングリコールトリメチルノニルエーテル、ノニルフェノールエトキシレート;テトラデシル−β−D−マルトシド;テトラエチレングリコールモノデシルエーテル、テトラエチレングリコールモノドデシルエーテル、テトラエチレングリコールモノテトラデシルエーテル;トリエチレングリコールモノデシルエーテル、トリエチレングリコールモノドデシルエーテル、トリエチレングリコールモノヘキサデシルエーテル、トリエチレングリコールモノオクチルエーテル、トリエチレングリコールモノテトラデシルエーテル;オクトキシノール−9;オクチルフェノールエトキシレート;ポリソルベート20、ポリソルベート21、ポリソルベート40、ポリソルベート60、ポリソルベート61、ポリソルベート65、ポリソルベート80、ポリソルベート81、ポリソルベート85;チロキサポール;およびn−ウンデシルβ−D−グルコピラノシド。具体的な実施形態において、凍結乾燥フルチカゾン組成物は、ポリソルベート80である非イオン性界面活性剤を含む。
【0010】
1つの実施形態において、非イオン性界面活性剤は、凍結乾燥物の合計の組み合わせた乾燥重量の約1重量%から約10重量%までの量で存在する。別の実施形態において、非イオン性界面活性剤は、凍結乾燥物の合計の組み合わせた乾燥重量の約2.5重量%から約7.5重量%までの量で存在する。別の実施形態において、非イオン性界面活性剤は、凍結乾燥物の合計の組み合わせた乾燥重量の約4.2重量%から約5.8重量%までの量で存在する。さらなるの実施形態において、非イオン性界面活性剤は、凍結乾燥物の合計の組み合わせた乾燥重量の約5.0重量%の量で存在する。
【0011】
さらなる実施形態において、充填材がラクトース、マンニトール、デキストロースおよびサッカロースから成る群から選択されることを特徴とする無菌の凍結乾燥フルチカゾン化合物が提供される。別の実施形態において、充填剤はラクトース一水和物である。1つの実施形態において、充填剤は、凍結乾燥物の合計の組み合わせた乾燥重量の約90重量%から約99重量%までの量で存在する。別の実施形態において、充填剤は、凍結乾燥物の合計の組み合わせた乾燥重量の約93重量%から約97重量%までの量で存在する。更に別の実施形態において、充填剤は、凍結乾燥物の合計の組み合わせた乾燥重量の約95重量%の量で存在する。
【0012】
幾つかの実施形態において、非イオン性界面活性剤を含む無菌の凍結乾燥フルチカゾン組成物が提供され、非イオン性界面活性剤は、凍結乾燥物の合計の組み合わせた乾燥重量の約1重量%から約10重量%までの量で存在し、及び/又は充填材は、凍結乾燥物の合計の組み合わせた乾燥重量の約90重量%から約99重量%までの量で存在する。さらなる又は追加の実施形態において、凍結乾燥フルチカゾン組成物は非イオン性界面活性剤を含み、非イオン性界面活性剤は、凍結乾燥物の合計の組み合わせた乾燥重量の約2.5重量%から約7.5重量%までの量で存在し、及び/又は充填材は、凍結乾燥物の合計の組み合わせた乾燥重量の約93重量%から約97重量%までの量で存在する。幾つかの実施形態において、凍結乾燥フルチカゾンは非イオン性界面活性剤を含み、非イオン性界面活性剤は、凍結乾燥物の合計の組み合わせた乾燥重量の約4.2重量%から約5.8重量%までの量で存在し、及び/又は充填材は、凍結乾燥物の合計の組み合わせた乾燥重量の約95重量%の量で存在する。さらなる又は追加の実施形態において、非イオン性界面活性剤を含む凍結乾燥フルチカゾン組成物が提供され、非イオン性界面活性剤は、凍結乾燥物の合計の組み合わせた乾燥重量の約3.5重量%から約5重量%までの量で存在し、及び/又は充填材は、凍結乾燥物の合計の組み合わせた乾燥重量の少なくとも約95重量%の量で存在する。
【0013】
1つの実施形態において、約0℃から約50℃までの温度で少なくとも4週の期間の間安定している無菌の凍結乾燥フルチカゾン組成物が提供される。別の実施形態において、フルチカゾン凍結乾燥組成物は、約0℃から約50℃までの温度で少なくとも6か月の期間の間安定している。
【0014】
別の実施形態において、本明細書には、水溶液によって再構成されるとき、皮下投与、眼窩周囲投与、眼窩内投与、および筋肉内投与に適する無菌の凍結乾燥フルチカゾン組成物が提供される。1つの実施形態において、フルチカゾン凍結乾燥組成物は、水溶液によって再構成されるときに皮下投与に適している。
【0015】
1つの実施形態において、無菌の凍結乾燥フルチカゾン組成物は凍結乾燥物の合計の組み合わせた乾燥重量の約3重量%未満の溶媒又は共溶媒を含む。別の実施形態において、組成物は、凍結乾燥物の合計の組み合わせた乾燥重量の約2重量%未満の溶媒又は共溶媒を含む。さらなる実施形態において、組成物は凍結乾燥物の合計の組み合わせた乾燥重量の約1重量%未満の溶媒又は共溶媒を含む。またさらなる実施形態において、溶媒又は共溶媒は、tert−ブチルアルコール、n−ブタノール、エタノール、イソプロピルアルコール、ジメチルスルホン、クロロブタノール、またはそれらの混合物から選択される。更に別の実施形態において、組成物は、凍結乾燥物の合計の組み合わせた乾燥重量の約2重量%未満の水を含む。
【0016】
〈再構成されたフルチカゾン製剤〉
第2の態様において、本明細書には、凍結乾燥フルチカゾンまたはその薬学的に許容可能な塩、充填剤および非イオン性界面活性剤を含む凍結乾燥組成物から再構成された無菌のフルチカゾン製剤が提供される。幾つかの実施形態において、無菌のフルチカゾンの凍結乾燥物(lyophile)は、緩衝剤を更に含む。幾つかの実施形態において、緩衝剤は、クエン酸又はそのクエン酸ナトリウム二水和物である。1つの実施形態において、緩衝剤はクエン酸である。別の実施形態において、緩衝剤はクエン酸二水和物である。幾つかの実施形態において、再構成された無菌のフルチカゾン製剤は、薬学的に許容可能な希釈剤を更に含む。いくつかの実施形態において、希釈剤は、滅菌注射用蒸留水、0.9%の塩化ナトリウム溶液または5%のデキストロース溶液から選択される。具体的な実施形態において、薬学的に許容可能な希釈剤は滅菌注射用蒸留水である。
【0017】
幾つかの実施形態において、再構成された無菌のフルチカゾン製剤が提供され、再構成されたフルチカゾンは、約100μg/ml以下の量で存在する。さらなる又は追加の実施形態において、再構成された無菌のフルチカゾン製剤は、約100ng/mlから約100μg/mlの量で存在する再構成されたフルチカゾンを含む。幾つかの実施形態において、再構成された無菌のフルチカゾン製剤は、約200ng/mlから約50μg/mlの量で存在する再構成されたフルチカゾンを含む。さらなる又は追加の実施形態において、約300ng/mlから約25μg/mlの量で存在する再構成されたフルチカゾンを含む再構成された無菌のフルチカゾン製剤が提供される。さらなる又は追加の実施形態において、約500ng/mlから約15μg/mlの量で存在する再構成されたフルチカゾンを含む再構成された無菌のフルチカゾン製剤が提供される。幾つかの実施形態において、約600ng/mlから約10μg/mlの量で存在する再構成されたフルチカゾンを再構成された無菌のフルチカゾン製剤が提供される。幾つかの実施形態において、約750ng/mlから約5μg/mlの量で存在する再構成されたフルチカゾンを再構成された無菌のフルチカゾン製剤が提供される。幾つか実施形態において、約800ng/mlから約3μg/mlのフルチカゾンまたはその薬学的に許容可能な塩を含む再構成されたフルチカゾン製剤が提供される。さらなる又は追加の実施形態において、約900ng/mlから約2μg/mlの量で存在する再構成されたフルチカゾンを含む無菌のフルチカゾン製剤が提供される。具体的な実施形態において、約1μg/mlの量で存在する再構成されたフルチカゾンを含む再構成された無菌のフルチカゾン製剤が提供される。
【0018】
本明細書には、特定の実施形態において、凍結乾燥フルチカゾンまたはその薬学的に許容可能な塩、充填剤および非イオン性界面活性剤、および薬学的に許容可能な希釈剤を含む凍結乾燥フルチカゾン組成物から再構成された無菌のフルチカゾン製剤が記載され、再構成された無菌のフルチカゾン製剤は、皮下注入、眼窩周囲注入、眼窩内注入および筋肉内注入のために調剤される。別の実施形態において、再構成された無菌のフルチカゾン製剤は、例えば皮下注入のような皮下投与のために調剤される。1つの実施形態において、凍結乾燥物は薬学的に許容可能な希釈剤に溶解される。別の実施形態で、溶解は約2分未満に生じる。さらなる実施形態において、溶解は約1分で生じる。さらなる別の実施形態において、溶解は約1分未満に生じる。さらなる別の実施形態において、溶解は約30秒未満で生じる。別のさらなる実施形態において、溶解によって実質的に透明な溶液が生じる。
【0019】
幾つかの実施形態において、約2分間の溶解の後のHPLCによって測定されると、再構成の前に存在する凍結乾燥フルチカゾンの量の少なくとも約50%である可溶化された又は溶解された量のフルチカゾンを提供する再構成された凍結乾燥フルチカゾン製剤が提供される。更なるまたは追加の実施形態において、約2分間の溶解の後のHPLCによって測定されると、再構成の前に存在する凍結乾燥フルチカゾンの量の少なくとも約60%である可溶化された又は溶解された量のフルチカゾンを提供する再構成された凍結乾燥フルチカゾン製剤が提供される。幾つかの実施形態において、約2分間の溶解の後のHPLCによって測定されると、再構成の前に存在する凍結乾燥フルチカゾンの量の少なくとも約75%である可溶化された又は溶解された量のフルチカゾンを提供する再構成された凍結乾燥フルチカゾン製剤が提供される。更なるまたは追加の実施形態において、約2分間の溶解の後のHPLCによって測定されると、再構成の前に存在する凍結乾燥フルチカゾンの量の約90%から約100%までである可溶化された又は溶解された量のフルチカゾンを提供する再構成された凍結乾燥フルチカゾン製剤が提供される。幾つかの実施形態において、約2分間の溶解の後のHPLCによって測定されると、再構成の前に存在する凍結乾燥フルチカゾンの量の約90%から約100%までである可溶化された又は溶解された量のフルチカゾンを提供する再構成された凍結乾燥フルチカゾン製剤が提供され、ここで、非イオン性界面活性剤は、凍結乾燥物の合計の組み合わせた乾燥重量の約4%から約5%までの量で、再構成前の凍結乾燥フルチカゾン組成物中に存在した。
【0020】
〈サルメテロールをさらに含む再構成されたフルチカゾン製剤〉
第3の態様において、本明細書には、凍結乾燥フルチカゾンまたはその薬学的に許容可能な塩、充填剤および非イオン性界面活性剤を含む凍結乾燥組成物から再構成された無菌のフルチカゾン製剤が提供され、無菌のフルチカゾン製剤はさらにサルメテロールを含む。幾つかの実施形態において、無菌のフルチカゾンの凍結乾燥物は、緩衝剤をさらに含む。幾つかの実施形態において、緩衝剤は、クエン酸又はそのクエン酸ナトリウム二水和物である。1つの実施形態において、緩衝剤はクエン酸である。別の実施形態において、緩衝剤はクエン酸二水和物である。いくつかの実施形態において、サルメテロールは、凍結乾燥物組成物から再構成されている。他の実施形態において、サルメテロールは凍結乾燥物組成物から再構成されていない。幾つかの実施形態において、再構成された無菌のフルチカゾンの製剤は、一例として滅菌注射用蒸留水を含む薬学的に許容可能な希釈剤を更に含む。幾つかの実施形態において、無菌のフルチカゾン製剤は、サルメテロールまたはその薬学的に許容可能な塩をさらに含むように調剤される。更なる又は追加の実施形態において、製剤は、滅菌注射用蒸留水、0.9%の塩化ナトリウム溶液、または5%のデキストロース溶液から選択される薬学的に許容可能な希釈剤をさらに含む。具体的な実施形態において、薬学的に許容可能な希釈剤は滅菌注射用蒸留水である。
【0021】
幾つかの実施形態において、本明細書には、凍結乾燥フルチカゾンまたはその薬学的に許容可能な塩、充填剤および非イオン性界面活性剤を含む凍結乾燥組成物から再構成された無菌のフルチカゾン製剤が提供され、ここで、無菌のフルチカゾン製剤は、約25μg/ml以下である量のサルメテロールまたはその薬学的に許容可能な塩をさらに含む。いくつかの実施形態において、再構成された無菌のフルチカゾン製剤は、さらに約1μg/ml以下の量で存在するサルメテロールまたはその薬学的に許容可能な塩を含む。さらなる又は追加の実施形態において、本明細書には、約2ng/mlから約25μg/mlまたは約1μg/mlの量で存在するサルメテロールをさらに含む無菌のフルチカゾン製剤が提供される。さらなる又は追加の実施形態において、約5ng/mlから約750ng/mlの量で存在するサルメテロールをさらに含む再構成された無菌のフルチカゾン製剤が提供される。さらなる追加の実施形態において、約10ng/mlから約500ng/mlの量で存在するサルメテロールまたはその薬学的に許容可能な塩をさらに含む再構成された無菌のフルチカゾン製剤が提供される。幾つかの実施形態において、約15ng/mlから約250ng/mlの量で存在するサルメテロールまたはその薬学的に許容可能な塩をさらに含む再構成された無菌のフルチカゾン製剤が提供される。
【0022】
さらなる又は追加の実施形態において、再構成された無菌のフルチカゾン製剤は、約15ng/mlから約50ng/mlの量で存在するサルメテロールまたはその薬学的に許容可能な塩をさらに含む。特定の実施形態において、サルメテロールまたは薬学的に可能な塩をさらに含む再構成された無菌のフルチカゾン製剤が提供され、サルメテロールまたは塩は、約20ng/mlから約25ng/mlの量で存在する。具体的な実施形態において、再構成された無菌のフルチカゾン製剤は、さらに約20ng/mlで存在するサルメテロールまたは薬学的に許容可能な塩を含む。またさらなるまたは追加の実施形態において、再構成された無菌のフルチカゾン製剤は、サルメテロールまたはその薬学的に許容可能な塩、および約1μg/mlのフルチカゾンまたはその薬学的に許容可能な塩をさらに含む。特定の実施形態において、再構成された無菌のフルチカゾン製剤は、サルメテロールまたはその薬学的に許容可能な塩をさらに含み、皮下注入、眼窩周囲注入、眼窩内注入および筋肉内注入のために調剤される。さらなるまたは追加の実施形態において、本明細書には、サルメテロールまたはその薬学的に許容可能な塩をさらに含み、注入による皮下投与のために調剤される再構成された無菌のフルチカゾン製剤が提供される。
【0023】
〈フルチカゾンを使用する治療方法および美容方法(Cosmetic Methods)〉
第4の態様において、本明細書には、凍結乾燥フルチカゾンまたはその薬学的に許容可能な塩、充填剤および非イオン性界面活性剤を含む凍結乾燥組成物から再構成されている無菌のフルチカゾン製剤を、ヒトに投与又は提供する、例えば、皮下投与によることを含む、工程を含む美容方法又は治療方法が提供される。幾つかの実施形態において、無菌のフルチカゾンの凍結乾燥物は、緩衝剤をさらに含む。幾つかの実施形態において、緩衝剤は、クエン酸又はそのクエン酸ナトリウム二水和物である。1つの実施形態において、緩衝剤はクエン酸である。別の実施形態において、緩衝剤はクエン酸二水和物である。いくつかの実施形態において、方法は、治療的である。さらなる又は追加の実施形態において、方法は美容的(cosmetic)である。
【0024】
幾つかの実施形態において、再構成された無菌のフルチカゾン製剤は、腹部脂肪蓄積、局所脂肪過多および甲状腺眼症に起因する眼球突出からなる群から選択される兆候を処置するために(例えば、供給(provision)または投与によって)使用される。特定の実施形態において、再構成された無菌のフルチカゾン製剤は、皮下に投与または提供される。幾つかの実施形態において、再構成された無菌のフルチカゾン製剤は、ヒトに、眼窩周囲または眼窩内の注入として皮下に投与または提供される。幾つかの実施形態において、再構成された無菌のフルチカゾン製剤は、ヒトに、腹部または眼領域に皮下に投与または提供される。更なる又は追加の実施形態において、製剤が、ヒトに、膝の内部領域、上腕の中間又は上方区域(三頭筋領域を含む)、頤下の領域(あごの下の領域、例えば、あごの肉(wattle)(それは患者の頤下の領域の皮膚の肉の襞(fleshy fold of skin)を指すと理解される)を含む)、腹部、腰、内腿、外腿、臀部、下背、背面上部または胸部へ投与または提供されることを特徴とする、再構成されたフルチカゾン製剤が提供される。
【0025】
さらなる実施形態において、本明細書には、凍結乾燥フルチカゾンまたはその薬学的に許容可能な塩、充填剤および非イオン性界面活性剤を含む凍結乾燥組成物から再構成された無菌のフルチカゾン製剤を、ヒトに投与又は提供する、例えば、皮下投与によることを含む、工程を含む美容方法が提供される。いくつかの実施形態において、人体の姿、輪郭または外観に影響を与えるために、ヒトに、再構成された無菌のフルチカゾン製剤が美容的に提供される。さらなる又は追加の実施形態において、姿、輪郭または外観は、ヒトの体の領域(例えば腹部)または眼の領域である。特定の実施形態において、その製剤は、ヒトに、眼窩周囲または眼窩内の注射として皮下に投与または提供される。幾つかの実施形態において、無菌の再構成された凍結乾燥フルチカゾン製剤は、ヒトに、ヒトの腹部または眼の領域に皮下に投与又は提供される。
【0026】
〈フルチカゾン凍結乾燥組成物を製造する方法〉
第5の態様において、本明細書には、凍結乾燥された無菌のフルチカゾン組成物を調製する方法が提供され、該方法は、(i)フルチカゾンまたはその薬学的に許容可能な塩、充填剤、および非イオン性界面活性剤を、バルク溶液を形成するための溶媒又は共溶媒で可溶性にする工程;(ii)バルク溶液を殺菌する工程;および(iii)凍結乾燥された無菌のフルチカゾン組成物を提供するために殺菌されたバルク溶液を凍結乾燥する工程、を含む。幾つかの実施形態において、可溶性にされるフルチカゾンまたはその薬学的に許容可能な塩は、クエン酸またはクエン酸ナトリウム二水和物である緩衝剤をさらに含む。1つの実施形態において、緩衝剤はクエン酸である。別の実施形態において、緩衝剤はクエン酸二水和物である。
【0027】
1つの実施形態において、溶媒又は共溶媒は、tert−ブチルアルコール、n−ブタノール、エタノール、イソプロピルアルコール、ジメチルスルホン、クロロブタノール、またはそれらの混合物から選択される。1つの実施形態において、溶媒または共溶媒は、tert−ブチルアルコールである。別の実施形態において、方法は、バルク溶液の殺菌に備え、フィルタを介してバルク溶液を通す工程を含む。別の実施形態において、フィルタは、0.2ミクロンフィルターである。さらに別の実施形態において、方法は、プロピオン酸塩またはフルチカゾンのフロ酸塩の使用を含む。1つの実施形態において、方法は、プロピオン酸塩の使用を含む。
【0028】
本明細書にはまた、更なるまたは追加の実施形態において、本明細書に記載される凍結乾燥された無菌のフルチカゾン製剤を調製する方法が提供され、非イオン性界面活性剤は、以下から選択される:(N,N−ビス[3−(D−グルコアミド(gluconamido))プロピル]コラミド);ビス(ポリエチレングリコールビス[イミダゾイルカルボニル]);ポリオキシエチレングリコールドデシルエーテル;ポリオキシエチレングリセロールトリリシノリエート(ethylenglyceroltriricinoleate)35;デカエチレングリコールモノドデシルエーテル;N−デカノイル−N−メチルグルカミン;n−デシルα−D−グルコピラノシド;デシルβ−D−マルトピラノシド;n−ドデカノイル−N−メチルグルカミド;n−ドデシルα−D−マルトシド;n−ドデシルβ−D−マルトシド;n−ヘキサデシルβ−D−マルトシド;ヘプタエチレングリコールモノデシルエーテル;ヘプタエチレングリコールモノドデシルエーテル;ヘプタエチレングリコールモノテトラデシルエーテル;ヘキサエチレングリコールモノドデシルエーテル;ヘキサエチレングリコールモノヘキサデシルエーテル;ヘキサエチレングリコールモノオクタデシルエーテル;ヘキサエチレングリコールモノテトラデシルエーテル;オクチルフェニル−ポリエチレングリコール;メチル−6−O−(N−ヘプチルカルバモイル)−α−D−グルコピラノシド;ノナエチレングリコールモノドデシルエーテル;N−ノナノイル−N−メチルグルカミン;N−ノナノイル−N−メチルグルカミン;オクタエチレングリコールモノデシルエーテル;オクタエチレングリコールモノドデシルエーテル;オクタエチレングリコールモノヘキサデシルエーテル;オクタエチレングリコールモノオクタデシルエーテル;オクタエチレングリコールモノテトラデシルエーテル;オクチル−β−D−グルコピラノシド;ペンタエチレングリコールモノデシルエーテル;ペンタエチレングリコールモノドデシルエーテル;ペンタエチレングリコールモノヘキサデシルエーテル;ペンタエチレングリコールモノヘキシルエーテル;ペンタエチレングリコールモノオクタデシルエーテル;ペンタエチレングリコールモノオクチルエーテル;ポリエチレングリコールジグリシジルエーテル;ポリエチレングリコールエーテルW−1;ポリオキシエチレン10トリデシルエーテル;ポリオキシエチレン100ステアレート;ポリオキシエチレン20イソヘキサデシルエーテル;ポリオキシエチレン20オレイルエーテル;ポリオキシエチレン40ステアレート;ポリオキシエチレン50ステアレート;ポリオキシエチレン8ステアレート、ポリオキシエチレンビス(イミダゾリルカルボニル)、ポリオキシエチレン25プロピレングリコールステアレート;サポニン;ラウリン酸ソルビタン、ソルビタンモノパルミタート、ステアリン酸ソルビタン、トリステアリン酸ソルビタン、オレイン酸ソルビタン、トリオレイン酸ソルビタン;ポリエチレングリコールトリメチルノニルエーテル、ノニルフェノールエトキシレート;テトラデシル−β−D−マルトシド;テトラエチレングリコールモノデシルエーテル、テトラエチレングリコールモノドデシルエーテル、テトラエチレングリコールモノテトラデシルエーテル;トリエチレングリコールモノデシルエーテル、トリエチレングリコールモノドデシルエーテル、トリエチレングリコールモノヘキサデシルエーテル、トリエチレングリコールモノオクチルエーテル、トリエチレングリコールモノテトラデシルエーテル;オクトキシノール−9;オクチルフェノールエトキシレート;ポリソルベート20、ポリソルベート21、ポリソルベート40、ポリソルベート60、ポリソルベート61、ポリソルベート65、ポリソルベート80、ポリソルベート81、ポリソルベート85;チロキサポール;およびn−ウンデシルβ−D−グルコピラノシド。具体的な実施形態において、凍結乾燥フルチカゾン組成物は、ポリソルベート80である非イオンの界面活性剤を含む。
【0029】
別の実施形態において、充填材は、ラクトース、マンニトール、デキストロースおよびサッカロースからなる群から選択される。さらなる別の実施形態において、充填剤はラクトース一水和物である。さらなる別の実施形態において、方法は、約−35℃から約−25℃のガラス転移温度を有するバルク溶液を提供する。
【0030】
〈再構成されたフルチカゾン製剤を製造する方法〉
第6の態様において、本明細書には、皮下注射に適している無菌のフルチカゾン製剤を再構成によって調製するための方法が提供され、該方法は、充填剤および非イオン性界面活性剤をさらに含む凍結乾燥された無菌のフルチカゾン組成物を、薬学的に許容可能な希釈剤または担体と接触させる工程を含む。幾つかの実施形態において、無菌のフルチカゾンの凍結乾燥物は、緩衝剤をさらに含む。幾つかの実施形態において、緩衝剤は、クエン酸又はそのクエン酸ナトリウム二水和物である。1つの実施形態において、緩衝剤はクエン酸である。別の実施形態において、緩衝剤はクエン酸二水和物である。幾つかの実施形態において、薬学的に許容可能な希釈剤または担体は、滅菌注射用蒸留水、0.9%の塩化ナトリウム溶液または5%のデキストロース溶液から選択される。1つの実施形態において、滅菌注射用蒸留水である薬学的に許容可能な希釈剤または担体は、再構成された無菌のフルチカゾン製剤を提供するために、フルチカゾンの凍結乾燥物と接触される。さらなるまたは追加の実施形態において、再構成される無菌のフルチカゾンの凍結乾燥された組成物の非イオン性界面活性剤は、凍結乾燥物の合計の組み合わせた乾燥重量の約4%から約5%の量で、凍結乾燥フルチカゾン組成物中に存在する。
【0031】
幾つかの実施形態において、本明細書には、約2分間の溶解の後のHPLCによって測定されると、再構成の前に存在する凍結乾燥フルチカゾンの量の少なくとも約50%である可溶化された又は溶解された量のフルチカゾンを提供する、無菌の凍結乾燥フルチカゾン組成物を再構成する方法が提供される。幾つかの実施形態において、本明細書には、約2分間の溶解の後のHPLCによって測定されると、再構成の前に存在する凍結乾燥フルチカゾンの量の少なくとも約60%である可溶化された又は溶解された量のフルチカゾンを提供する、無菌の凍結乾燥フルチカゾン組成物を再構成する方法が提供される。更なるまたは追加の実施形態において、本明細書に記載の無菌の凍結乾燥フルチカゾン組成物を再構成する方法は、約2分間の溶解の後のHPLCによって測定されると、再構成の前に存在する凍結乾燥フルチカゾンの量の少なくとも約75%である可溶化された又は溶解された量のフルチカゾンを提供する。更なるまたは追加の実施形態において、本明細書に記載の方法は、無菌の凍結乾燥フルチカゾン組成物を再構成し、約2分間の溶解の後のHPLCによって測定されると、再構成の前に存在する凍結乾燥フルチカゾンの量の少なくとも約90%から約100%である可溶化された又は溶解された量のフルチカゾンが提供される。更なる別の又は追加の実施形態において、本明細書に提供される無菌の凍結乾燥フルチカゾン組成物の再構成方法は、無菌のフルチカゾン組成物を再構成し、ここで、非イオン性界面活性剤は、凍結乾燥物の合計の組み合わせた乾燥重量の約4.5%から約5%までの量で、再構成前の凍結乾燥フルチカゾン組成物の中に存在した。さらなるまたは追加の実施形態において、本明細書に記載の凍結乾燥フルチカゾン組成物の再構成方法は、再構成された製剤にサルメテロールまたはその薬学的に許容可能な塩を加える工程をさらに含む。
【0032】
〈凍結乾燥サルメテロール組成物〉
第7の態様において、本明細書には、凍結乾燥サルメテロールまたはその薬学的に許容可能な塩および充填剤を含む無菌のサルメテロール凍結乾燥組成物が提供される。幾つかの実施形態において、無菌のサルメテロール凍結乾燥物は、緩衝剤をさらに含む。幾つかの実施形態において、緩衝剤は、クエン酸又はそのクエン酸ナトリウム二水和物である。1つの実施形態において、緩衝剤はクエン酸である。別の実施形態において、緩衝剤はクエン酸二水和物である。さらなる又は追加の実施形態において、無菌のサルメテロール凍結乾燥物は、非イオン性界面活性剤をさらに含む。1つの実施形態において、凍結乾燥サルメテロール組成物は、さらに抗酸化剤を含む。
【0033】
本明細書にはまた、結晶相、非晶相、半結晶相、半非晶相またはそれらの混合物中に凍結乾燥サルメテロールを含む凍結乾燥組成物も記載される。1つの実施形態において、凍結乾燥サルメテロールは非晶相である。1つの実施形態において、サルメテロールの薬学的に許容可能な塩は、キシナホ酸塩である。1つの実施形態において、凍結乾燥キシナホ酸サルメテロールは、結晶相、多形体の形態、非晶相、半結晶相、半非晶相またはそれらの混合物で存在する。別の実施形態において、多形体の形態は、Form I多形体(Form I polymorph)である。さらなる実施形態において、多形体の形態は、Form II多形体(Form II polymorph)である。別の更なる実施形態において、凍結乾燥キシナホ酸サルメテロールまたはその薬学的に許容可能な塩は、非晶相で存在する。
【0034】
いくつかの実施形態において、本明細書には、凍結乾燥サルメテロールまたはその薬学的に許容可能な塩および充填剤を含む無菌のサルメテロール凍結乾燥組成物が提供され、凍結乾燥サルメテロールは、凍結乾燥物の合計の組み合わせた乾燥重量の体重の約0.00001重量%から約0.1重量%までの量で存在する。幾つかの実施形態において、無菌の凍結乾燥サルメテロールは、凍結乾燥物の合計の組み合わせた乾燥重量の約0.0002重量%から約0.001重量%までの量で存在する。更なるまたは追加の実施形態において、無菌の凍結乾燥サルメテロールは、凍結乾燥物の合計の組み合わせた乾燥重量の約0.00034重量%から約0.00046重量%までの量で存在する。幾つかの実施形態において、サルメテロールは、キシナホ酸サルメテロールである。
【0035】
本明細書にはまた、凍結乾燥サルメテロールまたはその薬学的に許容可能な塩および充填剤を含む無菌のサルメテロール凍結乾燥組成物が提供され、無菌の凍結乾燥サルメテロールは、約250μg/g以下の量で存在する。幾つかの実施形態において、本明細書には、凍結乾燥サルメテロールが約100ng/mlから約250μg/mlの量で存在することを特徴とする、無菌のサルメテロール凍結乾燥組成物がさらに提供される。具体的な実施形態において、本明細書には、凍結乾燥サルメテロールが約250ng/mlから約225μg/mlの量で存在することを特徴とする、無菌のサルメテロール凍結乾燥組成物が提供される。幾つかの実施形態において、本明細書には、約500ng/mlから約200μg/mlの量で存在する凍結乾燥サルメテロールを含む無菌のサルメテロール凍結乾燥組成物が提供される。さらなる又は追加の実施形態において、凍結乾燥サルメテロールが約1μg/gから約175μg/gの量で存在することを特徴とする、無菌のサルメテロール凍結乾燥組成物が提供される。幾つかの実施形態において、凍結乾燥サルメテロールが約2μg/mlから約150μg/mlの量で存在することを特徴とする、無菌のサルメテロール凍結乾燥組成物が提供される。特定の実施形態において、約5μg/gから約125μg/gの量で存在する凍結乾燥サルメテロールを含む無菌のサルメテロール凍結乾燥組成物が提供される。さらなる又は追加の実施形態において、約25μg/gから約115μg/gの量で存在する凍結乾燥サルメテロールを含む無菌のサルメテロール凍結乾燥組成物が提供される。幾つかの実施形態において、凍結乾燥サルメテロールが、約50μg/mlから約100μg/mlの量で存在することを特徴とする無菌のサルメテロール凍結乾燥組成物が提供される。1つの実施形態において、約60μg/gから約80μg/gの量で存在する凍結乾燥サルメテロールを含む無菌のサルメテロール凍結乾燥組成物が提供される。
【0036】
本明細書にはまた、無菌の凍結乾燥サルメテロールが約500ng/g以下である量で存在することを特徴とする、凍結乾燥サルメテロールまたはその薬学的に許容可能な塩および充填剤を含む無菌のサルメテロール凍結乾燥組成物が提供される。特定の実施形態において、無菌のサルメテロール凍結乾燥組成物は、約25ng/mlから約500ng/mlの量で存在する無菌の凍結乾燥サルメテロールを含む。さらなる又は追加の実施形態において、無菌のサルメテロール凍結乾燥組成物は、約100ng/gから約350ng/gの量で存在する無菌の凍結乾燥サルメテロールを含む。1つの実施形態において、無菌のサルメテロール凍結乾燥組成物は、約200ng/mlから約250ng/mlの量で存在する無菌の凍結乾燥サルメテロールを含む。
【0037】
幾つかの実施形態において、本明細書には、以下から選択される非イオン性界面活性剤を含む無菌の凍結乾燥サルメテロール組成物が提供される:(N,N−ビス[3−(D−グルコアミド(gluconamido))プロピル]コラミド);ビス(ポリエチレングリコールビス[イミダゾイルカルボニル]);ポリオキシエチレングリコールドデシルエーテル;ポリオキシエチレングリセロールトリリシノリエート(ethylenglyceroltriricinoleate)35;デカエチレングリコールモノドデシルエーテル;N−デカノイル−N−メチルグルカミン;n−デシルα−D−グルコピラノシド;デシルβ−D−マルトピラノシド;n−ドデカノイル−N−メチルグルカミド;n−ドデシルα−D−マルトシド;n−ドデシルβ−D−マルトシド;n−ヘキサデシルβ−D−マルトシド;ヘプタエチレングリコールモノデシルエーテル;ヘプタエチレングリコールモノドデシルエーテル;ヘプタエチレングリコールモノテトラデシルエーテル;ヘキサエチレングリコールモノドデシルエーテル;ヘキサエチレングリコールモノヘキサデシルエーテル;ヘキサエチレングリコールモノオクタデシルエーテル;ヘキサエチレングリコールモノテトラデシルエーテル;オクチルフェニル−ポリエチレングリコール;メチル−6−O−(N−ヘプチルカルバモイル)−α−D−グルコピラノシド;ノナエチレングリコールモノドデシルエーテル;N−ノナノイル−N−メチルグルカミン;N−ノナノイル−N−メチルグルカミン;オクタエチレングリコールモノデシルエーテル;オクタエチレングリコールモノドデシルエーテル;オクタエチレングリコールモノヘキサデシルエーテル;オクタエチレングリコールモノオクタデシルエーテル;オクタエチレングリコールモノテトラデシルエーテル;オクチル−β−D−グルコピラノシド;ペンタエチレングリコールモノデシルエーテル;ペンタエチレングリコールモノドデシルエーテル;ペンタエチレングリコールモノヘキサデシルエーテル;ペンタエチレングリコールモノヘキシルエーテル;ペンタエチレングリコールモノオクタデシルエーテル;ペンタエチレングリコールモノオクチルエーテル;ポリエチレングリコールジグリシジルエーテル;ポリエチレングリコールエーテルW−1;ポリオキシエチレン10トリデシルエーテル;ポリオキシエチレン100ステアレート;ポリオキシエチレン20イソヘキサデシルエーテル;ポリオキシエチレン20オレイルエーテル;ポリオキシエチレン40ステアレート;ポリオキシエチレン50ステアレート;ポリオキシエチレン8ステアレート、ポリオキシエチレンビス(イミダゾリルカルボニル)、ポリオキシエチレン25プロピレングリコールステアレート;サポニン;ラウリン酸ソルビタン、ソルビタンモノパルミタート、ステアリン酸ソルビタン、トリステアリン酸ソルビタン、オレイン酸ソルビタン、トリオレイン酸ソルビタン;ポリエチレングリコールトリメチルノニルエーテル、ノニルフェノールエトキシレート;テトラデシル−β−D−マルトシド;テトラエチレングリコールモノデシルエーテル、テトラエチレングリコールモノドデシルエーテル、テトラエチレングリコールモノテトラデシルエーテル;トリエチレングリコールモノデシルエーテル、トリエチレングリコールモノドデシルエーテル、トリエチレングリコールモノヘキサデシルエーテル、トリエチレングリコールモノオクチルエーテル、トリエチレングリコールモノテトラデシルエーテル;オクトキシノール−9;オクチルフェノールエトキシレート;ポリソルベート20、ポリソルベート21、ポリソルベート40、ポリソルベート60、ポリソルベート61、ポリソルベート65、ポリソルベート80、ポリソルベート81、ポリソルベート85;チロキサポール;およびn−ウンデシルβ−D−グルコピラノシド。1つの実施形態において、無菌の凍結乾燥サルメテロール組成物は、ポリソルベート80である非イオンの界面活性剤を含む。
【0038】
いくつかの実施形態において、本明細書には、凍結乾燥サルメテロールまたはその薬学的に許容可能な塩および充填剤を含む無菌のサルメテロール凍結乾燥組成物が提供され、ここで、充填剤は、ラクトース、マンニトール、デキストロースおよびスクロースからなる群から選択される。特定の実施形態において、充填剤はラクトース一水和物である。
【0039】
さらなる又は追加の実施形態において、本明細書には、凍結乾燥サルメテロールまたはその薬学的に許容可能な塩、充填剤およびで非イオン性界面活性剤を含む無菌のサルメテロール凍結乾燥組成物が提供され、ここで、非イオン性界面活性剤は、凍結乾燥物の合計の組み合わせた乾燥重量の約1重量%から約10重量%までの量で存在し、及び/又は充填材は、凍結乾燥物の合計の組み合わせた乾燥重量の約90重量%から約99.9重量%までの量で存在する。またさらなる又は追加の実施形態において、非イオン性界面活性剤は、凍結乾燥物の合計の組み合わせた乾燥重量の約2.5重量%から約7.5重量%までの量で存在し、または充填材は、凍結乾燥物の合計の組み合わせた乾燥重量の約93重量%から約97重量%までの量で存在する。またさらなる別の実施形態において、非イオン性界面活性剤は、凍結乾燥物の合計の組み合わせた乾燥重量の約4.2重量%から約5.8重量%までの量で存在し、または充填材は、凍結乾燥物の合計の組み合わせた乾燥重量の約95重量%の量で存在する。
【0040】
いくつかの実施形態において、本明細書には、凍結乾燥サルメテロールまたはその薬学的に許容可能な塩、充填剤および抗酸化剤を含む無菌のサルメテロール凍結乾燥組成物が提供され、ここで、抗酸化剤はアスコルビン酸またはブチルヒドロキシトルエンである。特定の実施形態において、組成物は、約0℃から約50℃までの温度で少なくとも4週の期間の間安定している。さらなる又は追加の実施形態において、組成物は、約0℃から約50℃までの温度で少なくとも6カ月の期間の間安定している。幾つかの実施形態において、無菌のサルメテロール凍結乾燥組成物は、緩衝剤をさらに含む。幾つかの実施形態において、緩衝剤は、クエン酸又はそのクエン酸ナトリウム二水和物である。1つの実施形態において、緩衝剤はクエン酸である。別の実施形態において、緩衝剤はクエン酸二水和物である。またさらなる又は追加の実施形態において、無菌のサルメテロール凍結乾燥物は、非イオン性界面活性剤をさらに含む。1つの実施形態において、凍結乾燥サルメテロール組成物は、さらに抗酸化剤を含む。
【0041】
本明細書にはまた、凍結乾燥サルメテロールまたはその薬学的に許容可能な塩および充填剤を含む無菌のサルメテロール凍結乾燥組成物が提供され、組成物は、水溶液によって再構成するにあたり、皮下の眼窩周囲または眼窩内用に適している。特定の実施形態において、組成物は、水溶液によって再構成するにあたり、皮下投与に適している。幾つかの実施形態において、組成物は凍結乾燥物の合計の組み合わせた乾燥重量の約3重量%未満の溶媒又は共溶媒を含む。さらなる又は追加の実施形態において、組成物は凍結乾燥物の合計の組み合わせた乾燥重量の約2重量%未満の溶媒又は共溶媒を含む。またさらなる実施形態において、組成物は、凍結乾燥物の合計の組み合わせた乾燥重量の約1重量%未満の溶媒又は共溶媒を含む。幾つかの実施形態において、溶媒又は共溶媒は、tert−ブチルアルコール、n−ブタノール、エタノール、イソプロピルアルコール、ジメチルスルホン、クロロブタノール、滅菌注射用蒸留水、0.9%の塩化ナトリウム溶液、5%のデキストロース溶液、またはそれらの混合物から選択される。またさらなる実施形態において、溶媒または共溶媒は、tert−ブチルアルコールまたはエタノールである。1つの実施形態において、共溶媒はエタノールである。別の実施形態において、組成物は、凍結乾燥物の合計の組み合わせた乾燥重量の約2重量%未満の水を含む。
【0042】
〈再構成されたサルメテロール製剤〉
第8の態様において、本明細書には、凍結乾燥サルメテロールまたはその薬学的に許容可能な塩および充填剤を含む凍結乾燥組成物から再構成された無菌のサルメテロール製剤が提供される。さらなる又は追加の実施形態において、無菌のサルメテロール製剤は、非イオン性界面活性剤、抗酸化剤、及び/又は緩衝剤をさらに含む凍結乾燥組成物から再構成されている。幾つかの実施形態において、無菌のサルメテロール製剤は、非イオン性界面活性剤をさらに含む凍結乾燥組成物から再構成されている。1つの実施形態において、無菌のサルメテロール製剤は、抗酸化剤をさらに含む凍結乾燥組成物から再構成されている。別の実施形態において、無菌のサルメテロール凍結乾燥組成物は、緩衝剤をさらに含む。幾つかの実施形態において、緩衝剤は、クエン酸又はクエン酸ナトリウム二水和物である。1つの実施形態において、緩衝剤はクエン酸である。別の実施形態において、緩衝剤はクエン酸二水和物である。
【0043】
幾つかの実施形態において、再構成された無菌のサルメテロール製剤は、滅菌注射用蒸留水、0.9%の塩化ナトリウム溶液、または5%のデキストロース溶液から選択される薬学的に許容可能な希釈剤をさらに含む。具体的な実施形態において、薬学的に許容可能な希釈剤は滅菌注射用蒸留水である。
【0044】
幾つかの実施形態において、再構成された無菌のサルメテロール製剤は、約25μg/ml以下の量で存在するサルメテロールを含む。さらなる又は追加の実施形態において、再構成された無菌のサルメテロール製剤は、約1μg/ml以下の量で存在するサルメテロールを含む。さらなる又は追加の実施形態において、再構成された無菌のサルメテロール製剤は、約2ng/mlから約25μg/mlの量で存在するサルメテロールを含む。またさらなる又は追加の実施形態において、再構成された無菌のサルメテロール製剤は、約2ng/mlから約1μg/mlの量で存在するサルメテロールを含む。
【0045】
またさらなる又は追加の実施形態において、再構成された無菌のサルメテロール製剤は、約4ng/mlから約750ng/mlの量で存在するサルメテロールを含む。幾つかの実施形態において、再構成された無菌のサルメテロール製剤は、約5ng/mlから約500ng/mlの量で存在するサルメテロールを含む。さらなる又は追加の実施形態において、再構成された無菌のサルメテロール製剤は、約10ng/mlから約250ng/mlの量で存在するサルメテロールを含む。幾つかの実施形態において、再構成された無菌のサルメテロール製剤は、約15ng/mlから約50ng/mlの量で存在するサルメテロールを含む。さらなる追加の実施形態において、再構成された無菌のサルメテロール製剤は、約20ng/mlから約25ng/mlの量で存在するサルメテロールを含む。1つの実施形態において、再構成された無菌のサルメテロール製剤は、約20ng/mlの量で存在するサルメテロールを含む。
【0046】
特定の実施形態において、再構成された無菌のサルメテロール製剤は、眼窩周囲又は眼窩内を含む皮下の注入のために調剤される。追加の実施形態において、再構成された無菌のサルメテロール製剤は、皮下投与のために調剤される。幾つかの実施形態において、再構成された無菌のサルメテロール製剤は、薬学的に許容可能な希釈剤中に溶解される。またさらなる実施形態において、溶解は約2分未満に生じる。さらなる実施形態において、溶解は約1分で生じる。まださらなる実施形態において、溶解は約1分未満に生じる。別のさらなる又は追加の実施形態において、溶解によって透明な溶液が生じる。
【0047】
〈フルチカゾンをさらに含む再構成されたサルメテロール製剤〉
第9の態様において、本明細書には、凍結乾燥サルメテロールまたはその薬学的に許容可能な塩および充填剤を含む凍結乾燥組成物から再構成された無菌のサルメテロール製剤が提供される。さらなる又は追加の実施形態において、無菌のサルメテロール製剤は、非イオン性界面活性剤、抗酸化剤、及び/又は緩衝剤をさらに含む凍結乾燥組成物から再構成されている。幾つかの実施形態において、無菌のサルメテロール製剤は、非イオン性界面活性剤をさらに含む凍結乾燥組成物から再構成されている。1つの実施形態において、無菌のサルメテロール製剤は、抗酸化剤をさらに含む凍結乾燥組成物から再構成されている。別の実施形態において、無菌のサルメテロール凍結乾燥組成物は、緩衝剤をさらに含む。幾つかの実施形態において、緩衝剤は、クエン酸又はクエン酸ナトリウム二水和物である。1つの実施形態において、緩衝剤はクエン酸である。別の実施形態において、緩衝剤はクエン酸二水和物である。
【0048】
幾つかの実施形態において、再構成された無菌のサルメテロール製剤は、サルメテロールを含み、およびフルチカゾンまたはその薬学的に許容可能な塩を含むようにさらに調剤される。いくつかの実施形態において、フルチカゾンは、無菌の凍結乾燥物組成物から再構成されている。他の実施形態において、フルチカゾンは、無菌の凍結乾燥物組成物から再構成されていない。幾つかの実施形態において、サルメテロールおよびフルチカゾンを含む再構成された無菌のサルメテロール製剤は、滅菌注射用蒸留水、0.9%の塩化ナトリウム溶液、または5%のデキストロース溶液から選択される薬学的に許容可能な希釈剤をさらに含む。特定の実施形態において、薬学的に許容可能な希釈剤は滅菌注射用蒸留水である。
【0049】
いくつかの実施形態において、凍結乾燥サルメテロールまたはその薬学的に許容可能な塩、充填剤、非イオン性の界面活性剤および抗酸化剤を含む凍結乾燥組成物から再構成されている無菌のサルメテロール製剤が提供され、製剤は、約100ng/mlから約100μg/mlの量で存在するフルチカゾンまたはその薬学的に許容可能な塩をさらに含む。さらなる又は追加の実施形態において、フルチカゾンは、約200ng/mlから約50μg/mlの量で存在する。幾つかの実施形態において、フルチカゾンは、約300ng/mlから約25μg/mlの量で存在する。また追加の実施形態において、フルチカゾンは、約500ng/mlから約15μg/mlの量で存在する。特定の実施形態において、フルチカゾンは、約600ng/mlから約10μg/mlの量で存在する。またさらなる又は追加の実施形態において、フルチカゾンは、約750ng/mlから約5μg/mlの量で存在する。幾つかの実施形態において、フルチカゾンは、約800ng/mlから約3μg/mlの量で存在する。また更なる実施形態において、フルチカゾンは、約900ng/mlから約2μg/mlの量で存在する。1つの実施形態において、フルチカゾンは、約1μg/mlの量で存在する。幾つかの実施形態において、サルメテロールおよびフルチカゾンを含む再構成された無菌の製剤は、皮下の眼窩周囲又は眼窩内の注入のために調剤される。特定の実施形態において、再構成された無菌の製剤は、注射による皮下投与のために調剤される。
【0050】
〈サルメテロールを使用する治療方法および美容方法〉
第10の態様において、本明細書には、凍結乾燥サルメテロールまたはその薬学的に許容可能な塩、および充填材を含む凍結乾燥組成物から再構成された無菌のサルメテロール製剤を、ヒトに投与又は提供する工程を含む、例えば、皮下投与によることを含む、美容方法又は治療方法が提供される。幾つかの実施形態において、凍結乾燥サルメテロール組成物は、非イオン性界面活性剤、抗酸化剤、及び/又は緩衝剤をさらに含む。幾つかの実施形態において、緩衝剤は、クエン酸又はクエン酸ナトリウム二水和物である。1つの実施形態において、緩衝剤はクエン酸である。別の実施形態において、緩衝剤はクエン酸二水和物である。いくつかの実施形態において、方法は、治療的である。さらなる又は追加の実施形態において、方法は美容的(cosmetic)である。
【0051】
幾つかの実施形態において、再構成された無菌のサルメテロール製剤は、腹部脂肪蓄積、地方脂肪過多および甲状腺眼症に起因する眼球突出から成る群から選択される兆候を処置するために(例えば、提供または投与によって)使用される。特定の実施形態において、再構成された無菌のサルメテロール製剤は、皮下に投与または提供される。幾つかの実施形態において、再構成された無菌のサルメテロール製剤は、ヒトに、眼窩周囲または眼窩内の注入として皮下に投与または提供される。幾つかの実施形態において、再構成された無菌のサルメテロール製剤は、ヒトに、腹部または眼領域に皮下に投与または提供される。更なる又は追加の実施形態において、製剤が、ヒトに、膝の内部領域、上腕の中間又は上方区域(三頭筋領域を含む)、頤下の領域(あごの下の領域(例えば、あごの肉(wattle))(それは患者の頤下の領域の皮膚の肉の襞(fleshy fold of skin)を指すと理解される)を含む)、腹部、腰、内腿、外腿、臀部、下背、背面上部または胸部へ投与または提供されることを特徴とする再構成されたサルメテロール製剤が提供される。
【0052】
さらなる実施形態において、本明細書には、凍結乾燥サルメテロールまたはその薬学的に許容可能な塩、および充填材を含む凍結乾燥組成物から再構成された無菌のサルメテロール製剤を、ヒトに投与又は提供する、例えば、皮下投与によることを含む、工程を含む美容方法が提供される。幾つかの実施形態において、凍結乾燥サルメテロール組成物は、非イオン性界面活性剤、抗酸化剤、及び/又は緩衝剤をさらに含む。幾つかの実施形態において、緩衝剤は、クエン酸又はクエン酸ナトリウム二水和物である。1つの実施形態において、緩衝剤はクエン酸である。別の実施形態において、緩衝剤はクエン酸二水和物である。いくつかの実施形態において、方法は、治療的である。さらなる又は追加の実施形態において、方法は美容的である。
【0053】
いくつかの実施形態において、再構成された無菌のサルメテロール製剤は、人体の姿、輪郭または外観に影響を与えるために、ヒトに、美容的に提供される。さらなる又は追加の実施形態において、姿、輪郭または外観は、ヒトの体の領域(例えば腹部)または眼の領域にある。特定の実施形態において、その製剤は、ヒトに、眼窩周囲または眼窩内の注射として皮下に投与または提供される。幾つかの実施形態において、無菌の再構成されたサルメテロール製剤は、ヒトに、ヒトの腹部または眼の領域に皮下に投与又は提供される。
【0054】
〈サルメテロール凍結乾燥組成物を製造する方法〉
第11の態様において、本明細書には、凍結乾燥された無菌のサルメテロール組成物を調製する方法が提供され、該方法は、(i)バルク溶液を形成するために、サルメテロールまたはその薬学的に許容可能な塩および充填剤を、溶媒又は共溶媒で可溶性にする工程;(ii)バルク溶液を殺菌する工程;及び(iii)凍結乾燥された無菌のキシナホ酸サルメテロール組成物を提供するために殺菌されたバルク溶液を凍結乾燥する工程を含む。幾つかの実施形態において、可溶化される凍結乾燥サルメテロール又はその薬学的に許容可能な塩は、非イオン性界面活性剤、抗酸化剤、及び/又は緩衝剤をさらに含む。幾つかの実施形態において、緩衝剤は、クエン酸又はクエン酸ナトリウム二水和物である。1つの実施形態において、緩衝剤はクエン酸である。別の実施形態において、緩衝剤はクエン酸二水和物である。
【0055】
1つの実施形態において、溶媒又は共溶媒は、tert−ブチルアルコール、n−ブタノール、エタノール、イソプロピルアルコール、ジメチルスルホン、クロロブタノール、滅菌注射用蒸留水、0.9%の塩化ナトリウム溶液、5%のデキストロース溶液、またはそれらの混合物から選択される。幾つかの実施形態において、溶媒は、tert−ブチルアルコールである。1つの実施形態において、溶媒はエタノールである。特定の実施形態において、バルク溶液の殺菌は、フィルタを介してバルク溶液を通すことを含む。またさらなる又は追加の実施形態において、フィルタは0.2ミクロンのフィルタである。幾つかの実施形態において、サルメテロールは、キシナホ酸サルメテロールである。
【0056】
いくつかの実施形態において、非イオン性界面活性剤は、以下から選択される:(N,N−ビス[3−(D−グルコアミド(gluconamido))プロピル]コラミド);ビス(ポリエチレングリコールビス[イミダゾイルカルボニル]);ポリオキシエチレングリコールドデシルエーテル;ポリオキシエチレングリセロールトリリシノリエート(ethylenglyceroltriricinoleate)35;デカエチレングリコールモノドデシルエーテル;N−デカノイル−N−メチルグルカミン;n−デシルα−D−グルコピラノシド;デシルβ−D−マルトピラノシド;n−ドデカノイル−N−メチルグルカミド;n−ドデシルα−D−マルトシド;n−ドデシルβ−D−マルトシド;n−ヘキサデシルβ−D−マルトシド;ヘプタエチレングリコールモノデシルエーテル;ヘプタエチレングリコールモノドデシルエーテル;ヘプタエチレングリコールモノテトラデシルエーテル;ヘキサエチレングリコールモノドデシルエーテル;ヘキサエチレングリコールモノヘキサデシルエーテル;ヘキサエチレングリコールモノオクタデシルエーテル;ヘキサエチレングリコールモノテトラデシルエーテル;オクチルフェニル−ポリエチレングリコール;メチル−6−O−(N−ヘプチルカルバモイル)−α−D−グルコピラノシド;ノナエチレングリコールモノドデシルエーテル;N−ノナノイル−N−メチルグルカミン;N−ノナノイル−N−メチルグルカミン;オクタエチレングリコールモノデシルエーテル;オクタエチレングリコールモノドデシルエーテル;オクタエチレングリコールモノヘキサデシルエーテル;オクタエチレングリコールモノオクタデシルエーテル;オクタエチレングリコールモノテトラデシルエーテル;オクチル−β−D−グルコピラノシド;ペンタエチレングリコールモノデシルエーテル;ペンタエチレングリコールモノドデシルエーテル;ペンタエチレングリコールモノヘキサデシルエーテル;ペンタエチレングリコールモノヘキシルエーテル;ペンタエチレングリコールモノオクタデシルエーテル;ペンタエチレングリコールモノオクチルエーテル;ポリエチレングリコールジグリシジルエーテル;ポリエチレングリコールエーテルW−1;ポリオキシエチレン10トリデシルエーテル;ポリオキシエチレン100ステアレート;ポリオキシエチレン20イソヘキサデシルエーテル;ポリオキシエチレン20オレイルエーテル;ポリオキシエチレン40ステアレート;ポリオキシエチレン50ステアレート;ポリオキシエチレン8ステアレート、ポリオキシエチレンビス(イミダゾリルカルボニル)、ポリオキシエチレン25プロピレングリコールステアレート;サポニン;ラウリン酸ソルビタン、ソルビタンモノパルミタート、ステアリン酸ソルビタン、トリステアリン酸ソルビタン、オレイン酸ソルビタン、トリオレイン酸ソルビタン;ポリエチレングリコールトリメチルノニルエーテル、ノニルフェノールエトキシレート;テトラデシル−β−D−マルトシド;テトラエチレングリコールモノデシルエーテル、テトラエチレングリコールモノドデシルエーテル、テトラエチレングリコールモノテトラデシルエーテル;トリエチレングリコールモノデシルエーテル、トリエチレングリコールモノドデシルエーテル、トリエチレングリコールモノヘキサデシルエーテル、トリエチレングリコールモノオクチルエーテル、トリエチレングリコールモノテトラデシルエーテル;オクトキシノール−9;オクチルフェノールエトキシレート;ポリソルベート20、ポリソルベート21、ポリソルベート40、ポリソルベート60、ポリソルベート61、ポリソルベート65、ポリソルベート80、ポリソルベート81、ポリソルベート85;チロキサポール;およびn−ウンデシルβ−D−グルコピラノシド。1つの実施形態において、非イオン性界面活性剤はポリソルベート80である。
【0057】
本明細書に記載の凍結乾燥された無菌のキシナホ酸サルメテロール組成物を調製する方法のいくつかの実施形態において、その方法において使用される充填剤は、ラクトース、マンニトール、デキストロースおよびスクロースからなる群から選択される。1つの実施形態において、充填剤はラクトース一水和物である。さらなる又は追加の実施形態において、無菌の凍結乾燥サルメテロール組成物は、抗酸化剤を含む。1つの実施形態において、抗酸化剤はアスコルビン酸である。別の実施形態において、抗酸化剤はブチルヒドロキシトルエンである。本明細書に記載の凍結乾燥された無菌のサルメテロール組成物を調製する方法のまたさらなる又は追加の実施形態において、バルク溶液は、約−35℃から約−25℃のガラス転移温度を有する。
【0058】
〈再構成されたサルメテロール製剤を製造する方法〉
第12の態様において、本明細書には、皮下注射に適している凍結乾燥された無菌のサルメテロール組成物を再構成によって調製するための方法が提供され、該方法は、充填剤をさらに含む凍結乾燥された無菌のサルメテロール組成物を、薬学的に許容可能な希釈剤または担体と接触させる工程を含む。幾つかの実施形態において、凍結乾燥された無菌の組成物は、非イオン性界面活性剤、抗酸化剤、及び/又は緩衝剤をさらに含む。幾つかの実施形態において、凍結乾燥物は、緩衝剤をさらに含む。更なる又は追加の実施形態において、緩衝剤は、クエン酸又はクエン酸ナトリウム二水和物である。1つの実施形態において、緩衝剤はクエン酸である。別の実施形態において、緩衝剤はクエン酸二水和物である。
【0059】
幾つかの実施形態において、薬学的に許容可能な希釈剤または担体は、滅菌注射用蒸留水、0.9%の塩化ナトリウム溶液、または5%のデキストロース溶液から選択される。1つの実施形態において、滅菌注射用蒸留水である薬学的に許容可能な希釈剤または担体は、再構成された無菌のサルメテロール製剤を提供するために、サルメテロール凍結乾燥物と接触される。さらなるまたは追加の実施形態において、再構成される無菌のサルメテロール凍結乾燥組成部物の非イオン性界面活性剤は、凍結乾燥物の合計の組み合わせた乾燥重量の約4%から約5%の量で、凍結乾燥サルメテロール組成物中に存在する。
【0060】
更なるまたは追加の実施形態において、皮下注入に適している無菌のサルメテロール組成物を再構成によって調製する方法は、約2分間の溶解の後のHPLCによって測定されると、再構成前の組成物中に存在する凍結乾燥サルメテロールの量の約50%から約100%までである組成物中の可溶化された又は溶解された量のサルメテロールを提供する。幾つかの実施形態において、皮下注入に適している無菌のサルメテロール組成物を再構成によって調製する方法は、2分間の溶解の後のHPLCによって測定される場合、再構成前の組成物中に存在する凍結乾燥サルメテロールの量の少なくとも約75%である組成物中の可溶化された溶解された量のサルメテロールを提供される。更なるまたは追加の実施形態において、皮下注入に適している無菌のサルメテロール組成物を再構成によって調製する方法は、約2分間の溶解の後のHPLCによって測定される場合、再構成前の組成物中に存在する凍結乾燥サルメテロールの量の約90%から約100%までである組成物中の可溶化された又は溶解された量のサルメテロールを提供される。またさらなる又は追加の実施形態において、皮下注入に適している無菌のサルメテロール製剤を再構成によって調整する方法は、製剤にフルチカゾンまたはその薬学的に許容可能な塩を加える工程をさらに含む。
【0061】
〈凍結乾燥されたフルチカゾンおよびサルメテロール組成物〉
第13の態様において、本明細書には、以下を含む無菌のフルチカゾンおよびサルメテロールの凍結乾燥組成物が提供される:(a)凍結乾燥フルチカゾンまたはその薬学的に許容可能な塩;(b)凍結乾燥サルメテロールまたはその薬学的に許容可能な塩;(c)充填剤;および(d)非イオン性表面活性剤。幾つかの実施形態において、凍結乾燥組成物は、抗酸化剤、及び/又は緩衝剤をさらに含む。さらなる実施形態において、凍結乾燥物は、緩衝剤をさらに含む。更なる実施形態において、緩衝剤は、クエン酸又はクエン酸ナトリウム二水和物である。1つの実施形態において、緩衝剤はクエン酸である。別の実施形態において、緩衝剤はクエン酸二水和物である。
【0062】
幾つかの実施形態において、サルメテロールは、キシナホ酸サルメテロールの塩形態である。さらなる又は追加の実施形態において、キシナホ酸サルメテロールは多形体である。特定の実施形態において、サルメテロール多形体は、多形Form Iである。追加の実施形態において、サルメテロール多形体は、Form IIである。またさらなる又は追加の実施形態において、サルメテロールは、結晶相、非晶相、半結晶相、半非晶相またはそれらの混合物で存在する。1つの実施形態において、サルメテロールは非晶質である。
【0063】
いくつかの実施形態において、フルチカゾンおよびサルメテロールの凍結乾燥組成物は、プロピオン酸フルチカゾンまたはフロ酸フルチカゾンを含む。1つの実施形態において、フルチカゾンはプロピオン酸フルチカゾンの塩形態である。幾つかの実施形態において、凍結乾燥フルチカゾンは、結晶相、非晶相、半結晶相、半非晶相またはそれらの混合物で存在する。さらなる又は追加の実施形態において、凍結乾燥フルチカゾン又はその薬学的に許容可能な塩は、結晶相、非晶相、半結晶相、半非晶相またはそれらの混合物で存在し;凍結乾燥サルメテロールは、結晶相、多形体の形態、非晶相、半結晶相、半非晶相またはそれらの混合物で存在する。
【0064】
さらなる又は追加の実施形態において、さらに抗酸化剤を含む無菌のフルチカゾンおよびサルメテロール凍結乾燥組成物が提供される。例えば、幾つかの実施形態において、抗酸化剤はアスコルビン酸またはブチルヒドロキシトルエンである。またさらなる又は追加の実施形態において、さらに緩衝剤を含む無菌のフルチカゾンおよびサルメテロール凍結乾燥組成物が提供される。幾つかの実施形態において、緩衝剤は、クエン酸又はクエン酸ナトリウム二水和物である。1つの実施形態において、緩衝剤はクエン酸である。別の実施形態において、緩衝剤はクエン酸二水和物である。
【0065】
いくつかの実施形態において、無菌のフルチカゾンおよびサルメテロール凍結乾燥組成物が提供され、フルチカゾン対サルメテロールの比は約200:1から約1:1までである。さらなる又は追加の実施形態において、フルチカゾン対サルメテロールの比は約150:1から約1:1までである。またさらなる又は追加の実施形態において、フルチカゾン対サルメテロールの比は約100:1から約1:1までである。またさらなる又は追加の実施形態において、フルチカゾン対サルメテロールの比は約50:1から約1:1までである。幾つかの実施形態において、フルチカゾン対サルメテロールの比は約20:1から約1:1までである。さらなる又は追加の実施形態において、フルチカゾン対サルメテロールの比は約10:1から約1:1までである。またさらなる又は追加の実施形態において、フルチカゾン対サルメテロールの比は約50:1である。
【0066】
本明細書にはまた、以下を含む無菌のフルチカゾンおよびサルメテロールの凍結乾燥組成物が提供され:(a)凍結乾燥フルチカゾンまたはその薬学的に許容可能な塩;(b)凍結乾燥サルメテロールまたはその薬学的に許容可能な塩;(c)充填剤;および(d)非イオン性表面活性剤、ここで、凍結乾燥フルチカゾンは、凍結乾燥物の合計の組み合わせた乾燥重量の約0.001重量%から約0.1重量%までの量で存在し、及びサルメテロールは、凍結乾燥物の合計の組み合わせた乾燥重量の約0.00001重量%から約0.1重量%までの量で存在する。本明細書に記載の無菌のフルチカゾンおよびサルメテロールの凍結乾燥組成物の特定の実施形態において、凍結乾燥フルチカゾンは、凍結乾燥物の合計の組み合わせた乾燥重量の約0.015重量%から約0.030重量%までの量で存在し、及び凍結乾燥サルメテロールは、凍結乾燥物の合計の組み合わせた乾燥重量の約0.0002重量%から約0.001重量%までの量で存在する。幾つかの実施形態において、無菌のフルチカゾンおよびサルメテロールの凍結乾燥組成物が提供され、ここで、凍結乾燥フルチカゾンは、凍結乾燥物の合計の組み合わせた乾燥重量の約0.017重量%から約0.023重量%までの量で存在し、及びサルメテロールは、凍結乾燥物の合計の組み合わせた乾燥重量の約0.00034重量%から約0.00046重量%までの量で存在する。
【0067】
本明細書には、以下を含む無菌のフルチカゾンおよびサルメテロールの凍結乾燥組成物が記載され:(a)凍結乾燥フルチカゾンまたはその薬学的に許容可能な塩;(b)凍結乾燥サルメテロールまたはその薬学的に許容可能な塩;(c)充填剤;および(d)非イオン性表面活性剤、ここで、凍結乾燥フルチカゾンは、約500μg/g以下である量で存在し、および凍結乾燥サルメテロールは、約250μg/g以下の量で存在する。特定の実施形態において、凍結乾燥フルチカゾンは、約1μg/gから約500μg/gの量で存在し、および凍結乾燥サルメテロールは、約100ng/gから約250μg/gの量で存在する。また追加の実施形態において、凍結乾燥フルチカゾンは、約5μg/gから約350μg/gの量で存在し、および凍結乾燥サルメテロールは、約250ng/gから約200μg/gの量で存在する。特定の実施形態において、凍結乾燥フルチカゾンは、約15μg/gから約300μg/gの量で存在し、および凍結乾燥サルメテロールは、約500ng/gから約150μg/gの量で存在する。いくつかの実施形態において、凍結乾燥フルチカゾンは、約20μg/gから約250μg/gの量で存在し、および凍結乾燥サルメテロールは、約1μg/gから約100μg/gの量で存在する。またさらなる実施形態において、凍結乾燥フルチカゾンは、約30μg/gから約200μg/gの量で存在し、および凍結乾燥サルメテロールは、約2μg/gから約50μg/gの量で存在する。また更なる又は追加の実施形態において、凍結乾燥フルチカゾンは、約100μg/gから約300μg/gの量で存在し、および凍結乾燥サルメテロールは、約3μg/gから約25μg/gの量で存在する。幾つかの実施形態において、凍結乾燥フルチカゾンは、約200μg/gから約300μg/gの量で存在し、および凍結乾燥サルメテロールは、約4μg/gから約15μg/gの量で存在する。幾つかの実施形態において、凍結乾燥フルチカゾンは、約200μg/gから約300μg/gの量で存在し、および凍結乾燥サルメテロールは、約5μg/gから約10μg/gの量で存在する。また更なる又は追加の実施形態において、凍結乾燥フルチカゾンは、約150μg/gの量で存在し、および凍結乾燥サルメテロールは、約6μg/gから約8μg/gの量で存在する。
【0068】
いくつかの実施形態において、以下を含む無菌のフルチカゾンおよびサルメテロールの凍結乾燥組成物が提供され:(a)凍結乾燥フルチカゾンまたはその薬学的に許容可能な塩;(b)凍結乾燥サルメテロールまたはその薬学的に許容可能な塩;(c)充填剤;および(d)非イオン性表面活性剤、ここで、凍結乾燥フルチカゾンは、約50μg/g以下の量で存在し、および凍結乾燥サルメテロールは、約500ng/g以下の量で存在する。幾つかの実施形態において、凍結乾燥フルチカゾンは、約1μg/gから約50μg/gの量で存在し、および凍結乾燥サルメテロールは、約25ng/gから約500ng/gの量で存在する。特定の実施形態において、凍結乾燥フルチカゾンは、約5μg/gから約35μg/gの量で存在し、および凍結乾燥サルメテロールは、約100ng/gから約350ng/gの量で存在する。1つの実施形態において、凍結乾燥フルチカゾンは、約9μg/gから約20μg/gの量で存在し、および凍結乾燥サルメテロールは、約200ng/gから約250ng/gの量で存在する。
【0069】
更なる又は追加の実施形態において、以下のものを含む無菌のフルチカゾン及びサルメテロール凍結乾燥組成物が提供される:(a)凍結乾燥フルチカゾン又はその薬学的に許容可能な塩;(b)凍結乾燥サルメテロール又はその薬学的に許容可能な塩;(c)充填剤;及び(d)非イオン性界面活性剤、ここで非イオン性界面活性剤は、(N,N−ビス[3−(D−グルコアミド)プロピル]コラミド);ビス(ポリエチレングリコールビス[イミダゾイルカルボニル]);ポリオキシエチレングリコールドデシルエーテル;ポリオキシエチレングリセロールトリリシノリエート35;デカエチレングリコールモノドデシルエーテル;N−デカノイル−N−メチルグルカミン;n−デシルα−D−グルコピラノシド;デシルβ−D−マルトピラノジド;n−ドデカノイル−N−メチルグルカミド;n−ドデシルα−D−マルトシド;n−ドデシルβ−D−マルトシド;n−ヘキサデシルβ−D−マルトシド;ヘプタエチレングリコールモノデシルエーテル;ヘプタエチレングリコールモノドデシルエーテル;ヘプタエチレングリコールモノテトラデシルエーテル;ヘキサエチレングリコールモノドデシルエーテル;ヘキサエチレングリコールモノヘキサデシルエーテル;ヘキサエチレングリコールモノオクタデシルエーテル;ヘキサエチレングリコールモノテトラデシルエーテル;オクチルフェニル−ポリエチレングリコール;メチル−6−O−(N−へプチルカルバモイル)−α−D−グルコピラノシド;ノナエチレングリコールモノドデシルエーテル;N−ノナノイル−N−メチルグルカミン;N−ノナノイル−N−メチルグルカミン;オクタエチレングリコールモノデシルエーテル;オクタエチレングリコールモノドデシルエーテル;オクタエチレングリコールモノヘキサデシルエーテル;オクタエチレングリコールモノオクタデシルエーテル;オクタエチレングリコールモノテトラデシルエーテル;オクチル−β−D−グルコピラノシド;ペンタエチレングリコールモノデシルエーテル;ペンタエチレングリコールモノドデシルエーテル;ペンタエチレングリコールモノヘキサデシルエーテル;ペンタエチレングリコールモノヘキシルエーテル;ペンタエチレングリコールモノオクタデシルエーテル;ペンタエチレングリコールモノオクチルエーテル;ポリエチレングリコールジグリシジルエーテル;ポリエチレングリコールエーテルW−1;ポリオキシエチレン10トリデシルエーテル;ポリオキシエチレン100ステアレート;ポリオキシエチレン20イソヘキサデシルエーテル;ポリオキシエチレン20オレイルエーテル;ポリオキシエチレン40ステアレート;ポリオキシエチレン50ステアレート;ポリオキシエチレン8ステアレート、ポリオキシエチレンビス(イミダゾリルカルボニル)、ポリオキシエチレン25プロピレングリコールステアレート;サポニン;ラウリン酸ソルビタン、ソルビタンモノパルミタート、ステアリン酸ソルビタン、トリステアリン酸ソルビタン、オレイン酸ソルビタン、トリオレイン酸ソルビタン;ポリエチレングリコールトリメチルノニルエーテル、ノニルフェニルエトキシラート;テトラデシル−β−D−マルトシド;テトラエチレングリコールモノデシルエーテル、テトラエチレングリコールモノドデシルエーテル、テトラエチレングリコールモノテトラデシルエーテル;トリエチレングリコールモノデシルエーテル、トリエチレングリコールモノドデシルエーテル、トリエチレングリコールモノヘキサデシルエーテル、トリエチレングリコールモノオクチルエーテル、トリエチレングリコールモノテトラデシルエーテル;オクトキシノール−9;オクチルフェノ−ルエトキシラート;ポリソルベート20、ポリソルベート21、ポリソルベート40、ポリソルベート60、ポリソルベート61、ポリソルベート65、ポリソルベート80、ポリソルベート81、ポリソルベート85;チロキサポール;及びn−ウンデシルβ−D−グルコピラノシドから選択される。1つの実施形態において、非イオン性界面活性剤はポリソルベート80である。また更なる又は追加の実施形態において、充填剤は、ラクトース、マンニトール、デキストロース、及びサッカロースから成る群から選択される。1つの実施形態において、充填剤はラクトースである。幾つかの実施形態において、充填剤はラクトース一水和物である。
【0070】
無菌のフルチカゾン及びサルメテロール凍結乾燥組成物の幾つかの実施形態において、非イオン性界面活性剤は、凍結乾燥物の合計の組み合わせた乾燥重量の約1.0重量%から約10重量%までに存在し、又は充填剤は、凍結乾燥物の合計の組み合わせた乾燥重量の約90重量%から約99重量%までの量で存在する。更なる又は追加の実施形態において、非イオン性界面活性剤は、凍結乾燥物の合計の組み合わせた乾燥重量の約2.5重量%から約7.5重量%までに存在し、又は充填剤は、凍結乾燥物の合計の組み合わせた乾燥重量の約93重量%から約97重量%の量で存在する。また追加の実施形態において、非イオン性界面活性剤は、凍結乾燥物の合計の組み合わせた乾燥重量の約4.2重量%から約5.8重量%までに存在し、又は充填剤は、凍結乾燥物の合計の組み合わせた乾燥重量の約95重量%の量で存在する。
【0071】
本明細書で提供される無菌のフルチカゾン及びサルメテロール凍結乾燥組成物の更なる又は追加の実施形態において、組成物は、水溶液によって再構成されるにあたり、皮下投与、眼窩周囲投与、眼窩内投与、又は筋肉内投与に適する。幾つかの実施形態において、組成物は、水溶液によって再構成されるにあたり、皮下投与に適する。また更なる又は追加の実施形態において、組成物は凍結乾燥物の合計の組み合わせた乾燥重量の約3重量%未満の溶媒又は共溶媒を含む。特定の実施形態において、組成物は凍結乾燥物の合計の組み合わせた乾燥重量の約2重量%未満の溶媒又は共溶媒を含む。幾つかの実施形態において、組成物は凍結乾燥物の合計の組み合わせた乾燥重量の約1重量%未満の溶媒又は共溶媒を含む。また更なる又は追加の実施形態において、組成物は凍結乾燥物の合計の組み合わせた乾燥重量の約2重量%未満の水を含む。特定の実施形態において、組成物は約0℃から約50℃の温度で少なくとも4週の期間の間安定している。また更なる又は追加の実施形態において、組成物は約0℃から約50℃の温度で少なくとも6か月の期間の間安定している。
【0072】
〈再構成されたフルチカゾン及びサルメテロール製剤〉
第14の態様において、フルチカゾン又はその薬学的に許容可能な塩;サルメテロール又はその薬学的に許容可能な塩;充填剤;および非イオン性界面活性剤を含んだ凍結乾燥された組成物から再構成される、無菌の製剤が提供される。幾つかの実施形態において、凍結乾燥された組成物は、酸化防止剤をさらに含む。幾つかの実施形態において、凍結乾燥された無菌の組成物は、酸化防止剤及び/又は緩衝剤をさらに含む。幾つかの実施形態において、凍結乾燥物は緩衝剤をさらに含む。更なる又は追加の実施形態において、緩衝剤はクエン酸又はクエン酸ナトリウム二水和物である。1つの実施形態において、緩衝剤はクエン酸である。別の実施形態において、緩衝剤はクエン酸二水和物である。
【0073】
幾つかの実施形態において、再構成された無菌の製剤は、滅菌注射用蒸留水、0.9%の塩化ナトリウム溶液、又は5%のデキストロ−ス溶液から選択される薬学的に許容可能な希釈剤をさらに含んだ。1つの実施形態において、薬学的に許容可能な希釈剤は滅菌注射用蒸留水である。
【0074】
幾つかの実施形態において、再構成された無菌の製剤は、約100μg/ml以下の量で存在する再構成されたフルチカゾン、及び約25μg/ml以下の量で存在する再構成されたサルメテロールをさらに含む。幾つかの実施形態において、再構成されたフルチカゾンは約100ng/mlから約100μg/mlまでの量で存在し、及び再構成されたサルメテロールは約2ng/mlから約25μg/mlまでの量で存在する。更なる又は追加の実施形態において、再構成されたフルチカゾンは約200ng/mlから約50μg/mlまでの量で存在し、及び再構成されたサルメテロールは約2ng/mlから約1μg/mlまでの量で存在する。また更なる又は追加の実施形態において、再構成されたフルチカゾンは約300ng/mlから約25μg/mlまでの量で存在し、及び再構成されたサルメテロールは約2ng/mlから約1μg/mlまでの量で存在する。特定の実施形態において、再構成されたフルチカゾンは約400ng/mlから約20μg/mlまでの量で存在し、及び再構成されたサルメテロールは約4ng/mlから約750ng/mlまでの量で存在する。また更なる実施形態において、再構成されたフルチカゾンは約500ng/mlから約15μg/mlまでの量で存在し、及び再構成されたサルメテロールは約5ng/mlから約500ng/mlまでの量で存在する。幾つかの実施形態において、再構成されたフルチカゾンは約600ng/mlから約10μg/mlまでの量で存在し、及び再構成されたサルメテロールは約10ng/mlから約250ng/mlまでの量で存在する。幾つかの実施形態において、再構成されたフルチカゾンは約750ng/mlから約5μg/mlまでの量で存在し、及び再構成されたサルメテロールは約15ng/mlから約50ng/mlまでの量で存在する。また更なる又は追加の実施形態において、再構成されたフルチカゾンは約800ng/mlから約3μg/mlまでの量で存在し、及び再構成されたサルメテロールは約20ng/mlから約25ng/mlまでの量で存在する。幾つかの実施形態において、再構成されたフルチカゾンは約900ng/mlから約2μg/mlの量で存在し、及び再構成されたサルメテロールは約20ng/mlから約25ng/mlまでの量で存在する。1つの実施形態において、再構成されたフルチカゾンは約1μg/mlの量で存在し、及び再構成されたサルメテロールは約20ng/mlの量で存在する。
【0075】
幾つかの実施形態において、フルチカゾン又はその薬学的に許容可能な塩;サルメテロール又はその薬学的に許容可能な塩;充填剤;および非イオン性界面活性剤を含んだ凍結乾燥された組成物から再構成される、無菌の製剤が本明細書で提供される。ここで、製剤は、再構成の前に存在する凍結乾燥フルチカゾンの量の少なくとも約50%である可溶化された又は溶解された量のフルチカゾン、及び/又は約2分の溶解の後にHPLCによって測定されると、再構成の前に存在する凍結乾燥サルメテロールの量の少なくとも約50%である可溶化された又は溶解された量のサルメテロールを提供する。幾つかの実施形態において、無菌の再構成された製剤は、再構成の前に存在する凍結乾燥フルチカゾンの量の少なくとも約60%である可溶化された又は溶解された量のフルチカゾン、及び/又は約2分の溶解の後にHPLCによって測定されると、再構成の前に存在する凍結乾燥サルメテロールの量の少なくとも約60%である可溶化された又は溶解された量のサルメテロールを提供する。更なる又は追加の実施形態において、無菌の再構成された製剤は、再構成の前に存在する凍結乾燥フルチカゾンの量の少なくとも約75%である可溶化された又は溶解された量のフルチカゾン、及び/又は約2分の溶解の後にHPLCによって測定されると、再構成の前に存在する凍結乾燥サルメテロールの量の少なくとも約75%である可溶化された又は溶解された量のサルメテロールを提供する。また更なる又は追加の実施形態において、無菌の再構成された製剤は、再構成の前に存在する凍結乾燥フルチカゾンの量の約90%から約100%である可溶化された又は溶解された量のフルチカゾン、及び/又は約2分の溶解の後にHPLCによって測定されると、再構成の前に存在する凍結乾燥サルメテロールの量の少なくとも約90%から100%である可溶化された又は溶解された量のサルメテロールを提供する。
【0076】
1つの実施形態において、フルチカゾン又はその薬学的に許容可能な塩;サルメテロール又はその薬学的に許容可能な塩;充填剤;および非イオン性界面活性剤を含んだ凍結乾燥された組成物から再構成される、無菌の製剤が本明細書で提供される。ここで、非イオン性界面活性剤は、凍結乾燥物の合計の組み合わせた乾燥重量の約4%から約5%の量で再構成前の凍結乾燥組成物で存在した。特定の実施形態において、再構成された無菌の製剤は皮下投与のために調剤される。更なる又は追加の実施形態において、再構成された無菌の製剤は、薬学的に許容可能な希釈剤中のサルメテロール及びフルチカゾンを含む凍結乾燥物を溶解することにより形成される。幾つかの実施形態において、溶解は約2分未満で生じる。更なる又は追加の実施形態において、溶解は約1分で生じる。また他の実施形態において、溶解は約1分未満で生じる。1つの実施形態において、溶解により透明な溶液がもたらされる。
【0077】
〈フルチカゾン及びサルメテロールを使用する治療方法及び美容方法〉
第15の実施形態において、フルチカゾン又はその薬学的に許容可能な塩;サルメテロール又はその薬学的に許容可能な塩;充填剤;および非イオン性界面活性剤を含んだ凍結乾燥された組成物から再構成される無菌のフルチカゾン及びサルメテロール製剤を、ヒトに投与する工程又は提供する、例えば、皮下投与によることを含む、工程を含む治療方法及び美容方法が本明細書で提供される。幾つかの実施形態において、凍結乾燥された組成物は抗酸化剤をさらに含む。幾つかの実施形態において、凍結乾燥された無菌の組成物は抗酸化剤及び/又は緩衝剤をさらに含む。幾つかの実施形態において、凍結乾燥物は緩衝剤を含む。更なる又は追加の実施形態において、緩衝剤はクエン酸又はクエン酸ナトリウム二水和物である。1つの実施形態において、緩衝剤はクエン酸である。別の実施形態において、緩衝剤はクエン酸二水和物である。
【0078】
幾つかの実施形態において、再構成された無菌の製剤は、滅菌注射用蒸留水、0.9%の塩化ナトリウム溶液、又は5%のデキストロ−ス溶液から選択される薬学的に許容可能な希釈剤をさらに含む。1つの実施形態において、薬学的に許容可能な希釈剤は滅菌注射用蒸留水である。幾つかの実施形態において、方法は治療的である。更なる又は追加の実施形態において、方法は美容的である。
【0079】
幾つかの実施形態において、再構成された無菌のサルメテロール及びフルチカゾン製剤は、腹部脂肪蓄積、局所脂肪過多、及び甲状腺眼症に起因する眼球突出からなる群から選択される兆候を処置するために(例えば供給又は投与によって)使用される。特定の実施形態において、再構成された無菌のサルメテロール及びフルチカゾン製剤は皮下に投与又は提供される。幾つかの実施形態において、再構成された無菌のサルメテロール及びフルチカゾン製剤は、ヒトに、眼窩周囲又は眼窩内の注入として皮下に投与又は提供される。幾つかの実施形態において、再構成された無菌のサルメテロール及びフルチカゾン製剤は、ヒトに、腹部又は眼領域に皮下に投与又は提供される。更なる又は追加の実施形態において、再構成された無菌のサルメテロール及びフルチカゾン製剤が提供され、ここで、製剤は、ヒトに、膝の内部領域、上腕の中間又は上方区域(三頭筋領域を含む)、頤下の領域(あごの上の領域、例えばあごの肉(それは患者の頤下の領域の皮膚の肉の壁を指すと理解される)を含む)、腹部、腰、内腿、外腿、殿部、下背、背面上部又は胸部へ投与又は提供される。
【0080】
更なる実施形態において、凍結乾燥されたサルメテロール又はその薬学的に許容可能な塩、凍結乾燥されたフルチカゾン又はその薬学的に許容可能な塩、充填剤および非イオン性界面活性剤を含んだ凍結乾燥された組成物から再構成された無菌のフルチカゾン及びサルメテロール製剤を、ヒトに投与する工程又は提供する、例えば、皮下投与によることを含む、工程を含む美容方法が本明細書で提供される。幾つかの実施形態において、凍結乾燥された組成物は抗酸化剤をさらに含む。
【0081】
幾つかの実施形態において、再構成された無菌のサルメテロール及びフルチカゾン製剤は、人体の姿、輪郭、又は外観に影響を与えるため、ヒトに美容的に提供される。更なる又は追加の実施形態において、姿、輪郭、又は外観は、ヒトの体の領域(例えば、腹部)又は眼領域である。特定の実施形態において、製剤は、ヒトに、眼窩周囲又は眼窩内の注入として皮下に投与又は提供される。幾つかの実施形態において、無菌の再構成されたフルチカゾン及びサルメテロール製剤は、ヒトに、ヒトの腹部又は眼の領域に皮下に投与又は提供される。
【0082】
〈フルチカゾン及びサルメテロール凍結乾燥物を製造する方法〉
第16の態様において、以下のものを含む凍結乾燥された無菌の組成物を調製する方法が本明細書で提供される:(i)バルク溶液を形成するため、溶媒又は共溶媒で、フルチカゾン又はその薬学的に許容可能な塩、サルメテロール又はその薬学的に許容可能な塩、充填剤、非イオン性界面活性剤、及び随意に酸化防止剤を可溶性にする工程;(ii)バルク溶液を殺菌する工程;及び(iii)凍結乾燥された無菌の組成物を提供するために殺菌されたバルク溶液を凍結乾燥する工程。幾つかの実施形態において、可溶化工程は、抗酸化剤及び/又は緩衝剤を可溶性にする工程をさらに含む。幾つかの実施形態において、可溶化工程は緩衝剤を可溶性にする工程をさらに含む。更なる又は追加の実施形態において、緩衝剤はクエン酸又はクエン酸ナトリウム二水和物である。1つの実施形態において、緩衝剤はクエン酸である。別の実施形態において、緩衝剤はクエン酸二水和物である。
【0083】
幾つかの実施形態において、溶媒又は共溶媒は、tert−ブチルアルコール、n−ブタノール、エタノール、イソプロピルアルコール、ジメチルスルホン、クロロブタノール、滅菌注射用蒸留水、0.9%の塩化ナトリウム溶液、5%のデキストロ−ス溶液、又はその混合物から選択される。特定の実施形態において、本明細書に記載の方法は、バルク溶液をフィルタに通す工程を含む、バルク溶液を殺菌する工程をさらに含む。1つの実施形態において、フィルタは0.2ミクロンのフィルタである。更なる又は追加の実施形態において、バルク溶液は、約−35℃から約−25℃のガラス転移温度を有する。幾つかの実施形態において、凍結乾燥されたフルチカゾン及び/又はサルメテロールは非晶相にある。また更なる又は追加の実施形態において、凍結乾燥された組成物内の非イオン性界面活性剤は、凍結乾燥物の合計の組み合わせた乾燥重量の約5.0重量%の量で存在する。
【0084】
〈フルチカゾン及びサルメテロール凍結乾燥物を再構成する方法〉
第17の態様において、薬学的に許容可能な希釈剤又は担体と、以下のものを含む凍結乾燥された物質とを接触させる工程を含む、皮下注射に適した製剤を調製する方法が本明細書で提供される:(a)凍結乾燥されたフルチカゾン又はその薬学的に許容可能な塩;(b)凍結乾燥されたサルメテロール又はその薬学的に許容可能な塩;(c)充填剤;及び(d)非イオン性界面活性剤。幾つかの実施形態において、凍結乾燥された物質は抗酸化剤をさらに含む。幾つかの実施形態において、凍結乾燥された物質は抗酸化剤及び/又は緩衝剤をさらに含む。幾つかの実施形態において、凍結乾燥物質(lyophile material)は緩衝剤をさらに含む。更なる又は追加の実施形態において、緩衝剤はクエン酸又はクエン酸ナトリウム二水和物である。1つの実施形態において、緩衝剤はクエン酸である。別の実施形態において、緩衝剤はクエン酸二水和物である。
【0085】
幾つかの実施形態において、再構成された無菌のフルチカゾン及びサルメテロール製剤は、滅菌注射用蒸留水、0.9%の塩化ナトリウム溶液、又は5%のデキストロ−ス溶液から選択される薬学的に許容可能な希釈剤又は担体をさらに含む。幾つかの実施形態において、薬学的に許容可能な希釈剤又は担体は、滅菌注射用蒸留水である。特定の実施形態において、非イオン性界面活性剤は、凍結乾燥物の合計の組み合わせた乾燥重量の約4重量%から約5重量%の量で存在する。また更なる又は追加の実施形態において、方法は、再構成の前の組成物に存在する凍結乾燥フルチカゾンの量の約90%から約100%である可溶化された又は溶解された量のフルチカゾン、又は約2分の溶解の後にHPLCによって測定されると、再構成の前の組成物に存在する凍結乾燥サルメテロールの量の約90%から約100%までである可溶化された又は溶解された量のサルメテロールを提供する。
【0086】
〈治療上及び美容上の使用のためのキット〉
第17の態様において、治療上及び美容上の使用のためのキットが本明細書で提供される。1つの実施形態において、以下のものを含むキットが提供される:(a)凍結乾燥されたフルチカゾン及び/又は凍結乾燥されたサルメテロールを含むバイアル;(b)薬学的に許容可能な希釈剤又は担体を含むバイアル;(c)注射器;及び(d)凍結乾燥された物質の再構成及び随意にヒトへの投与に関する指示書。幾つかの実施形態において、キットはフルチカゾンを含む凍結乾燥された物質を中に含むバイアルを含む。更なる又は追加の実施形態において、キットはサルメテロールを含む凍結乾燥された物質を中に含むバイアルを含む。更なる又は追加の実施形態において、凍結乾燥フルチカゾン及び凍結乾燥サルメテロールを含む凍結乾燥された物質を中に含む、単一のバイアルを含むキットが提供される。また更なる又は追加の実施形態において、滅菌注射用蒸留水、0.9%の塩化ナトリウム溶液、又は5%のデキストロ−ス溶液から選択される薬学的に許容可能な希釈剤又は担体を含むキットが提供される。また更なる又は追加の実施形態において、注射器を含むキットが提供され、ここで注射器は、針を含むもの、針が無いもの、又は皮下への塗布具を含むものである。
【図面の簡単な説明】
【0087】
本明細書に記載の実施形態の特徴は、添付の請求項における特殊性により説明される。本明細書に現在記載される特徴及び利点のより良い理解は、原理が利用される実例となる実施形態を説明する以下の詳細な説明に対する引用、及び以下の添付の図面によって得られるであろう。
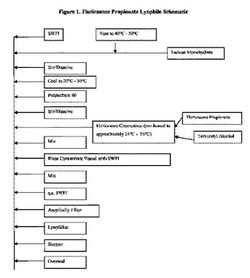
【図1】プロピオン酸フルチカゾン凍結乾燥物の調製に関する例示となるプロセスの概略図である。
【図2】キシナホ酸サルメテロール凍結乾燥物の調製に関する例示となるプロセスの概略図である。
【図3】プロピオン酸フルチカゾン凍結乾燥物及びキシナホ酸サルメテロール凍結乾燥物の調製に関する例示となるプロセスの概略図である。
【発明を実施するための形態】
【0088】
〈発明の詳細な説明〉
伝統的に、懸濁形態は、異なる疾病を処置するための様々な治療剤を送達するために使用されてきた。それらはしかしながら、凝集及び/又は集合により身体的な不安定性を対象とする。懸濁は、ひとたび投与されると意図された処置の部位で分散する薬中の治療剤の能力と、そのバイオアベイラビリティとの両方に影響を与える。プロピオン酸フルチカゾンは、承認学名S−フルオロメチル−6α,9α−ジフルオロ−11β−ヒドロキシ−16α−メチル−17α−プロピオニルオキシ−3−オキサンドロスタ(oxandrosta)−1,4−ジエン−17α−カルボチオエート(carbothioate)、局所的な抗炎症作用を示すと知られるコルチコステロイドである。エアロゾル形態において、プロピオン酸フルチカゾンは微粒子化によって従来通りに調製される。プロピオン酸フルチカゾンはまた、特定の溶媒と混合されると懸濁液を形成する。フルチカゾンを使用する疾病の有効な局所処置は、処置の部位にわたって効果的に分散される粉末剤又は懸濁液に含まれるフルチカゾンの能力によって限定される。この限定は、フルチカゾンでの幾つかの疾病の処置を非実用的なものにする。さらに、治療剤を含む溶液形態の使用が望ましい一方で、治療剤が長時間の間溶液中にある場合、治療剤は崩壊すると知られているため、治療剤は有効なものではない。
【0089】
フルチカゾン又はサルメテロール又はそれらの組合せを含む組成物の凍結乾燥された形態が本明細書に記載され、それらは適切な溶媒において再構成されると、溶液を適切な0.2ミクロンのフィルタに通すことにより無菌的に殺菌され、続いて非経口の(例えば、皮下、眼窩周囲、眼窩内、及び筋肉内)投与のために皮下に投与される、非懸濁(例えば、可溶性の)形態を提供する。再構成された非懸濁形態は、他の実施形態において、ひとたび投与されると意図された処置の部位に分散してすぐに生物学的に利用可能となる透明溶液を提供する。さらに、本明細書に記載の組成物の凍結乾燥形態は、実質的により安定した形態を提供し、それは必要な場合、ほんの一例として投与前に非懸濁の注入可能な形態を提供する滅菌注射用蒸留水などの、許容可能な溶媒系で再構成することができる。さらに、本明細書記載の実施形態は、ほんの一例ではあるが20秒などの比較的短い期間の間、凍結乾燥ケ−キ製剤と許容可能な溶媒又は担体を含むバイアルを単に振ることによって、再構成された形態を提供する。本明細書に記載されるようなそのような安定した形態は、他の実施形態において、長時間の間様々な温度で安定している。さらに、透明な溶液は無菌ろ過を許容し、サルメテロール及び/又はフルチカゾン薬物製品の安定性を含む最終滅菌などの滅菌技術の要求の必要性を取り除く。
【0090】
本明細書に記載の凍結乾燥された組成物及び再構成された製剤は、既存技術の組成物及び製剤に多数の利点を提供する。例えば、幾つかの実施形態において、孤立して本明細書で提供される組成物及び製剤の活性成分は、水溶液における可溶性が乏しい。本明細書でより詳しく議論されるように、凍結乾燥溶媒を含む共溶媒が提供される。本明細書に記載されるように、特定の実施形態において、共溶媒は、本明細書に記載の製剤および組成物の乏しい水溶性の活性成分を可溶性にするために利用され、その結果、それらは無菌的に濾過される。充填剤も記載される。充填剤は、幾つかの実施形態において、乏しい可溶性の活性成分(非晶形態及び結晶形態を含む)の凍結乾燥を促進するために利用される。さらに、非イオン性界面活性剤が本明細書に記載される。特定の実施形態において、非イオン性界面活性剤は、乏しい水溶性の活性成分(フルチカゾン及びサルメテロールを含む)を含む凍結乾燥された組成物のより遅い再構成を促進するために利用される。例えば、特定の状況において、非イオン性界面活性剤は、極性溶媒がある所で、凍結乾燥された疎水性の活性成分を溶液に入れる(force into)ことを必要とする。
【0091】
特定の実施形態において、凍結乾燥されたフルチカゾン又はその薬学的に許容可能な塩、充填剤及び非イオン性界面活性剤を含む凍結乾燥フルチカゾン組成物が本明細書に記載される。更なる又は追加の実施形態において、凍結乾燥されたフルチカゾン又はその薬学的に許容可能な塩、充填剤及び非イオン性界面活性剤を含む凍結乾燥された組成物から再構成された無菌のフルチカゾン組成物が提供される。更なる又は追加の実施形態において、再構成前に、凍結乾燥されたフルチカゾン又はその薬学的に許容可能な塩、充填剤及び非イオン性界面活性剤を含む再構成された無菌のフルチカゾン製剤を、ヒトに、皮下に投与又は提供する工程を含む美容方法及び/又は治療方法が提供される。また、以下のものを含む凍結乾燥された無菌のフルチカゾン組成物を調製する方法も本明細書で提供される:(i)バルク溶液を形成するため、溶媒又は共溶媒で、フルチカゾン又はその薬学的に許容可能な塩;充填剤、及び非イオン性界面活性剤を可溶性にする工程;(ii)バルク溶液を殺菌する工程;及び(iii)凍結乾燥された無菌のフルチカゾン組成物を提供するために殺菌されたバルク溶液を凍結乾燥する工程。また更なる又は追加の実施形態において、充填剤と非イオン性界面活性剤をさらに含む凍結乾燥された無菌のフルチカゾン組成物と、薬学的に許容可能な希釈剤又は担体を接触させる工程を含む、皮下注射に適したフルチカゾン製剤を調製する再構成方法が提供される。
【0092】
また、特定の実施形態において、凍結乾燥されたサルメテロール又はその薬学的に許容可能な塩及び充填剤を含む凍結乾燥サルメテロール組成物が本明細書に記載される。幾つかの実施形態において、サルメテロール凍結乾燥物は、非イオン性界面活性剤、酸化防止剤、及び/又は緩衝剤をさらに含む。幾つかの実施形態において、サルメテロール又はその薬学的に許容可能な塩及び充填剤から再構成された無菌のサルメテロール製剤が提供される。幾つかの実施形態において、再構成前に、凍結乾燥されたサルメテロール又はその薬学的に許容可能な塩及び充填剤を含む再構成された無菌のサルメテロール製剤を、ヒトに、皮下に投与又は提供する工程を含む美容方法及び/又は治療方法がさらに提供される。幾つかの実施形態において、以下のものを含む凍結乾燥された無菌のサルメテロール組成物を調製する方法が本明細書で提供される:(i)バルク溶液を形成するため溶媒又は共溶媒で、サルメテロール又はその薬学的に許容可能な塩及び充填剤、そして随意に緩衝剤を可溶性にする工程;(ii)バルク溶液を殺菌する工程;及び(iii)凍結乾燥された無菌のサルメテロール組成物を提供するために殺菌されたバルク溶液を凍結乾燥する工程。特定の実施形態において、充填剤をさらに含む凍結乾燥された無菌のサルメテロール組成物と、薬学的に許容可能な希釈剤又は担体を接触させる工程を含む、皮下注射に適したサルメテロール製剤を調製する再構成方法が提供される。
【0093】
特定の実施形態において、以下のものを含む凍結乾燥組成物が本明細書に記載される:(a)凍結乾燥フルチカゾン又はその薬学的に許容可能な塩;(b)凍結乾燥サルメテロール又はその薬学的に許容可能な塩;(c)充填剤;及び(d)非イオン性界面活性剤。幾つかの実施形態において、フルチカゾン又はその薬学的に許容可能な塩;サルメテロール又はその薬学的に許容可能な塩;充填剤;及び非イオン性界面活性剤を含む凍結乾燥された組成物から再構成される、無菌の製剤が提供される。幾つかの実施形態において、再構成前に、フルチカゾン又はその薬学的に許容可能な塩;サルメテロール又はその薬学的に許容可能な塩;充填剤;及び非イオン性界面活性剤を含む再構成された無菌の製剤を、ヒトに、皮下に投与又は提供する工程を含む美容方法及び/又は治療方法が提供される。さらに、以下のものを含む凍結乾燥された無菌の組成物を調製する方法が本明細書に記載される:(i)バルク溶液を形成するため溶媒又は共溶媒で、フルチカゾン又はその薬学的に許容可能な塩;サルメテロール又はその薬学的に許容可能な塩、充填剤、非イオン性界面活性剤、及び酸化防止剤を可溶性にする工程;(ii)バルク溶液を殺菌する工程;及び(iii)凍結乾燥された無菌の組成物を提供するために殺菌されたバルク溶液を凍結乾燥する工程。幾つかの実施形態において、薬学的に許容可能な希釈剤又は担体と、以下のものを含む凍結乾燥された物質とを接触させる工程を含む、皮下注射に適した製剤を調製する再構成方法が提供される:(a)フルチカゾン又はその薬学的に許容可能な塩;(b)サルメテロール又はその薬学的に許容可能な塩;(c)充填剤;及び(d)非イオン性界面活性剤。また更なる実施形態において、以下のものを含むキットが提供される:(a)凍結乾燥フルチカゾン又は凍結乾燥サルメテロールを含むバイアル;(b)薬学的に許容可能な希釈剤又は担体を含むバイアル;(c)注射器;及び(d)凍結乾燥された物質の再構成及び随意にヒトへの投与又は供給に関する指示書。
【0094】
本明細書で使用されるような「約(About)」は、量、一時的な持続時間等の測定可能な値を指す場合、+/−20%又は+/−10%の変異を含み、又は他の実施形態において+/−5%の変異を含み、又は更なる実施形態において、+/−1%の変異を含み、又はまた更なる実施形態において、特定の値から+/−0.1%の変異を含むことを意味し、そのような変異は、本開示の方法を行うのに適切であり、及び/又は所望の組成物または製剤を調製するのに適切である。
【0095】
特定の実施形態において、凍結乾燥組成物(重量/gで表わされる)及び再構成された製剤(重量/mlで表わされる)における薬剤(フルチカゾン及びその塩、サルメテロール及びその塩、並びにそれらの組合せを含む)の重量が本明細書で提供される。凍結乾燥組成物に関して、表わされる重量は組成物の合計の乾燥重量に関する。例えば、1つの実施形態において、約150μg/gの凍結乾燥されたフルチカゾンを含む無菌の凍結乾燥されたフルチカゾン組成物が提供される。したがって、この実施形態において、1gの凍結乾燥組成物の合計の乾燥重量につき約150μgの凍結乾燥されたフルチカゾンが提供される。再構成された製剤に関して、表わされる重量は再構成された製剤の合計の容積に関する。実施例のように、1つの実施形態において、約1μg/mlの量で存在する再構成されたフルチカゾンを含む、再構成された無菌のフルチカゾン製剤が提供される。そのため、この実施形態において、1mlの再構成された製剤の総容積につき約1μgの再構成されたフルチカゾンが提供される。
【0096】
特定の実施形態において、(1)フルチカゾン及びその塩、(2)サルメテロール及びその塩、(3)それらの組合せの投与又は供給を含む、治療方法及び/又は美容方法及びその使用が本明細書で提供される。1以上の薬剤の投与又は供給が提供される場合の実施形態において、投与又は供給は、随伴して(例えば、同じ製剤の一部として)、連続して(例えば、別々に1つの薬剤を投与し、その後許容可能な時間内に他の薬剤を投与する)、及び並行して(例えば、同時であるが、薬剤が例えば異なる製剤中にある)行われる事が理解される。
【0097】
そうでないと定義されない限り、本明細書で使用される全ての技術的及び科学用語は、当該技術分野における共通の理解として同じ意味を有する。
【0098】
〈バルク溶液〉
ほんの一例として、サルメテロール、フルチカゾン又はそれらの薬学的に許容可能な塩、又はそれらの組合せ等の活性成分を含むバルク溶液を凍結乾燥することにより調整される凍結乾燥された組成物が本明細書に記載される。1つの実施形態において、凍結乾燥される本明細書に記載の活性成分は、水性及び/又は有機溶媒系において少なくとも1つの非イオン性界面活性剤及び少なくとも1つの充填剤と実質上均質的に混合される。用語「実質上均質の(substantially homogeneous)」は、例えば、溶液又はバルク溶液におけるように、互いに実質上一様に分散される成分として定義される。
【0099】
フルチカゾンは合成のグルココルチコステロイドであり、以下の化学構造を有する:
【0100】
【化1】

【0101】
フルチカゾンの薬学的に許容可能な塩は、限定されないがプロピオン酸塩及びフロ酸塩を含む。
【0102】
サルメテロールは、長く作用する、選択的な、及び凍結乾燥βアドレナリン作用性受容体アゴニストであり、以下の化学構造を有する:
【0103】
【化2】

【0104】
例示のサルメテロールの薬学的に許容可能な塩はキシナホ酸塩を含み、以下に示される:
【0105】
【化3】

【0106】
上述の通り、本明細書で提示される凍結乾燥物はバルク溶液の凍結乾燥によって形成される。バルク溶液は、他の構成要素内に、フルチカゾン及び/又はサルメテロール又はそれらの薬学的に許容可能な塩及び適切な有機溶媒系を含む。有機溶媒系は、幾つかの実施形態において、例えばプロピオン酸フルチカゾン又はキシナホ酸サルメテロール又はそれらの組合せ等の活性成分を可溶性にし、実質上均質の液状混合物 (図 1、2、及び3は、「濃縮物」として実質上均質の液状混合物を指す)を形成するのに十分な量の有機溶媒を含む。幾つかの実施形態において、低級アルコール及びフルチカゾン又はサルメテロール又はそれらの薬学的に許容可能な塩等の治療剤のような溶媒は、治療剤を溶解するのに充分な温度で組み合わせられ、溶媒が確実に液体状態にあるようにし、その後、実質上均質な液状混合物を形成するために攪拌することによって混合される。幾つかの実施形態において、混合は約10分から約3時間かかる。特定の実施形態において、混合は約15分から約2時間生じる。更なる又は追加の実施形態において、混合は約30分から約90分間生じる。1つの実施形態において、混合は約60分間生じる。随意に、幾つかの実施形態では、溶解を確実に完了させるために、音波処理、静的ミキサー、ブレード型ミキサー、ホモジナイザー等の使用をあとで伴う。
【0107】
1つの実施形態において、有機溶媒は低級オキシヒドロカルボン、低級ハロヒドロカルボン、低級ハロキシヒドロカルボン、低級スルホキシヒドロカルボン、低級シクロヒドロカルボン及びそれらの組合せを含む。1つの実施形態において、溶媒系は、tert−ブチルアルコール、イソプロピルアルコール、メタノール、エタノール、アセトン、アセトニトリル、シクロヘキサン、クロロブタノール、ジメチルスルホキシド、ヘキサノール、ベンジルアルコール、酢酸、ペンタノール、n−プロパノール、n−ブタノール、メチルエチルケトン、ジメチルスルホン、クロロブタノール及びそれらの組合せを含むが、これらに限定されない。他の実施形態において、本明細書に記載の凍結乾燥された組成物を調製するのに使用するための溶媒は、ほんの一例として、エタノール、イソプロピルアルコール及びtert−ブチルアルコールなどの低級アルカノールを含む。他の実施形態において、溶媒はtert−ブチルアルコールである。また更なる又は追加の実施形態において、溶媒はエタノールである。
【0108】
本明細書で言及されるように、用語「低級オキシヒドロカルボン」は、ヒドロカルビルラジカルを有する化合物、及び1から8の炭素原子及び1から4の酸素原子を有する酸素原子を意味する。「低級オキシヒドロカルボン」の例は、限定されないが、低級アルカノール、低級ケトン、低級カルボン酸、低級カルボン酸エステル、低級カーボネイトなどである。
【0109】
幾つかの実施形態において、有機溶媒はバルク溶液の約0.1容積%から約30容積%である。他の実施形態において、有機溶媒はバルク溶液の約0.5容積%から約15容積%である。更なる実施形態において、有機溶媒はバルク溶液の約0.1容積%から約1容積%である。他の実施形態において、有機溶媒はバルク溶液の約10容積%未満である。
【0110】
他の実施形態において、バルク溶液は、約−10℃から約50℃の範囲内の温度を有する実質上均質な混合剤を形成する。
【0111】
更なる実施形態において、バルク溶液は充填剤を含む。幾つかの実施形態において、充填剤は、ラクトース、DL−アラニン、グルコース、D(+)トレハロース二水和物、スクロース、マルトース、D(+)ラフィノース五水和物、サッカリンナトリウム、デンプン、修正されたセルロース、デキストリン、デキストラン、グリシン、塩化ナトリウム、炭酸カルシウム、酒石酸ナトリウム及び乳酸カルシウムから選択される。他の実施形態において、充填剤はラクトース一水和物である。
【0112】
幾つかの実施形態において、充填剤は、例えば滅菌注射用蒸留水などの薬学的に許容可能な担体の中で溶解され、溶解するのに充分な温度にまで加熱される。他の実施形態において、充填剤の混合物は室温にまで冷却され、非イオン性界面活性剤が加えられる。
【0113】
非イオン性界面活性剤は以下のものを含む:(N,N−ビス[3−(D−グルコアミド)プロピル]コラミド);ビス(ポリエチレングリコールビス[イミダゾリルカルボニル]);ポリオキシエチレングリコールドデシルエーテル;ポリオキシエチレングリセロールトリリシノレアート35;デカエチレングリコールモノドデシルエーテル;N−デカノイル−N−メチルグルカミン;n−デシルα−D−グルコピラノシド;デシルβ−D−マルトピラノジド;n−ドデカノイル−N−メチルグルカミド;n−ドデシルα−D−マルトシド;n−ドデシルβ−D−マルトシド;n−ヘキサデシルβ−D−マルトシド;ヘプタエチレングリコールモノデシルエーテル;ヘプタエチレングリコールモノドデシルエーテル;ヘプタエチレングリコールモノテトラデシルエーテル;ヘキサエチレングリコールモノドデシルエーテル;ヘキサエチレングリコールモノヘキサデシルエーテル;ヘキサエチレングリコールモノオクタデシルエーテル;ヘキサエチレングリコールモノテトラデシルエーテル;オクチルフェニル−ポリエチレングリコール;メチル−6−O−(N−へプチルカルバモイル)−α−D−グルコピラノシド;ノナエチレングリコールモノドデシルエーテル;N−ノナノイル−N−メチルグルカミン;N−ノナノイル−N−メチルグルカミン;オクタエチレングリコールモノデシルエーテル;オクタエチレングリコールモノドデシルエーテル;オクタエチレングリコールモノヘキサデシルエーテル;オクタエチレングリコールモノオクタデシルエーテル;オクタエチレングリコールモノテトラデシルエーテル;オクチル−β−D−グルコピラノシド;ペンタエチレングリコールモノデシルエーテル;ペンタエチレングリコールモノドデシルエーテル;ペンタエチレングリコールモノヘキサデシルエーテル;ペンタエチレングリコールモノヘキシルエーテル;ペンタエチレングリコールモノオクタデシルエーテル;ペンタエチレングリコールモノオクチルエーテル;ポリエチレングリコールジグリシジルエーテル;ポリエチレングリコールエーテルW−1;ポリオキシエチレン10トリデシルエーテル;ポリオキシエチレン100ステアレート;ポリオキシエチレン20イソヘキサデシルエーテル;ポリオキシエチレン20オレイルエーテル;ポリオキシエチレン40ステアレート;ポリオキシエチレン50ステアレート;ポリオキシエチレン8ステアレート、ポリオキシエチレンビス(イミダゾリルカルボニル)、ポリオキシエチレン25プロピレングリコールステアレート;サポニン;ラウリン酸ソルビタン、ソルビタンモノパルミタート、ステアリン酸ソルビタン、トリステアリン酸ソルビタン、オレイン酸ソルビタン、トリオレイン酸ソルビタン;ポリエチレングリコールトリメチルノニルエーテル、ノニルフェニルエトキシラート;テトラデシル−β−D−マルトシド;テトラエチレングリコールモノデシルエーテル、テトラエチレングリコールモノドデシルエーテル、テトラエチレングリコールモノテトラデシルエーテル;トリエチレングリコールモノデシルエーテル、トリエチレングリコールモノドデシルエーテル、トリエチレングリコールモノヘキサデシルエーテル、トリエチレングリコールモノオクチルエーテル、トリエチレングリコールモノテトラデシルエーテル;オクトキシノール−9;オクチルフェノールエトキシラート;ポリソルベート20、ポリソルベート21、ポリソルベート40、ポリソルベート60、ポリソルベート61、ポリソルベート65、ポリソルベート80、ポリソルベート81、ポリソルベート85;チロキサポ−ル;及びn−ウンデシルβ−D−グルコピラノシド。1つの実施形態において、バルク溶液中で使用される非イオン性界面活性剤はポリソルベート80である。
【0114】
更なる実施形態において、サルメテロール濃縮物が充填剤/非イオン性界面活性剤の混合剤に加えられ、本明細書に記載の方法を使用して混合される。
【0115】
更なる実施形態において、抗酸化剤はバルク溶液に加えられる。また別の実施形態において、抗酸化剤はアスコルビン酸である。
【0116】
更なる実施形態において、緩衝剤はバルク溶液に加えられる。また別の実施形態において、緩衝剤はクエン酸一水和物及び/又はクエン酸ナトリウム二水和物である。
【0117】
〈濾過法〉
バルク溶液/液状混合物を形成するために結合されるフルチカゾン、サルメテロール及び/又はそれらの組合せの混合物が本明細書で提供され、液状混合物は殺菌される。1つの実施形態において、実質上均質なバルク溶液/液状混合物は、凍結乾燥前に濾過して殺菌される。別の実施形態において、濾過滅菌工程は、バルク溶液/液状混合物内の任意の不純物、例えば汚染微生物数を除去し、比較的/実質上無菌の溶液を提供するために行われる。「殺菌された(Sterilized)」又は「実質上無菌の(substantially sterile)」は、確率関数に基づいて、微生物の全ての生存可能な形態が除去又は破壊されるプロセスによって定義される。
【0118】
適切なフィルタは、有機溶媒で適合する細菌濾過器を含む。適切な充填材は、例えばセルロースフィルタを含む。1つの実施形態において、バルク溶液を殺菌する方法は、tert−ブチルアルコール及び/又はエタノールを含む、アルコール及び関連する有機又は有機−水性媒体に一般的に適合するように、ポリ(テトラフルオロエチレン)(PTFE)フィルタの使用を含む。別の実施形態において、本明細書に記載の方法で使用されるフィルタは、ポリ(エーテルスルホン)からなる。更なる実施形態において、フィルタは、ポリフッ化ビニリデン、ポリプロピレン及びナイロンから成るフィルタから選択される。
【0119】
幾つかの実施形態において、フィルタの有孔性は約0.1から約0.5ミクロンである。別の実施形態において、本明細書に記載の無菌の凍結乾燥された組成物を調製するのに使用されるフィルタの有孔性は、約0.2ミクロンである。フィルタの大きさ及び表面積は、フィルタに通される液体混合物の容積を決定する。他の実施形態において、濾過の後、組成物は適切な凍結乾燥バイアルに入れられ、更なる実施形態においては、再構成後の一回量の製剤である。また他の実施形態において、バイアルは一般的に発熱性物質が除かれて殺菌され、更なる実施形態においては約1mL乃至3mLのバイアルに及ぶ。他の実施形態において、本明細書に記載の凍結乾燥された組成物は、終末に殺菌され、例えば、凍結乾燥が生じた後に殺菌される。また他の実施形態において、終末滅菌はγ線照射、又はe−ビーム殺菌を介する。
【0120】
〈凍結乾燥法〉
凍結乾燥は、「凍結乾燥(freeze−drying)」としてしばしば称されるプロセスの技術的な名称である。このプロセスにおいて、水性の混合物又は懸濁液は固体へと凍結され、その後一般的に、相当な時間の間真空にさらされる。真空は水分子を昇華させる。
【0121】
本明細書に記載の方法は、例えばサルメテロール又はフルチカゾン、又は双方の組合せ、又はそれらの薬学的に許容可能な塩などの活性成分を凍結乾燥する工程を含む。1つの実施形態において、凍結乾燥は殺菌後に生じる。
【0122】
1つの実施形態において、凍結乾燥プロセスの間、ほんの一例としてtert−ブチルアルコール及び滅菌注射用蒸留水などの、使用される溶媒系は、昇華により実質的に除去される。別の実施形態において、5%未満の残留溶媒は凍結乾燥後に残る;他の実施形態において、3%未満が残る;また他の実施形態において、2%が残る;更なる実施形態において、約1%又は約0.1%が残る。
【0123】
1つの実施形態において、凍結乾燥プロセスは以下の工程を含む:(1)適切なバイアル内に凍結乾燥されるサンプル(サルメテロール、フルチカゾン又はそれらの組合せ、又はそれらの薬学的に許容可能な塩)を配置し、バイアルを凍結乾燥チャンバに配し、棚温度(shelf temperature)を大気圧で約−30℃から約−50℃に低下させる工程;(2)上述の温度範囲での棚温度を、サンプルの温度が約−30℃から約−50℃になるまで保つ工程;(3)凍結乾燥を約1時間から2時間アニールするため約−10℃から約−20℃にまで温度を上昇させる工程;(4)棚温度を約−30℃から約−50℃にまで低下させ、系の圧力を約50mTorrから約100mTorrにまで減らす工程;及び溶媒系の昇華が実質的に完了するまで保つ工程。生成物の温度は、ケ−キの崩壊を避けるため約−25℃乃至約−28℃以下であるべきである;(5)温度を約30℃乃至約50℃にまで上げる工程;及び(6)結合水又は溶媒のレベルを除去する時間のあいだ、サンプルが約20℃乃至約30℃の温度に達する様に許容する工程;(7)バイアルが無菌的に密封された後、窒素又は適切なガスでバイアルを埋戻す(back−filing)工程。表7は、1つの実施形態において、フルチカゾン又はサルメテロール又はそれらの薬学的に許容可能な塩或いはそれらの組合せを含むバルク溶液を凍結乾燥するための凍結乾燥サイクルを記載する。1つの実施形態において、プロセスは、適切な及び実質的に完了した昇華を確実にするため、1分につき0.5℃から1分につき約1℃の割合で、系の温度を段階的に低下又は上昇させる工程を必要とする。凍結乾燥工程は、長時間の間室温で貯蔵できる、例えば、サルメテロール又はフルチカゾン、又はそれらの薬学的に許容可能な塩又はそれらの組合せなどの、活性化合物を含む組成物を提供する。加えて、本明細書に記載の凍結乾燥された組成物は、少なくとも4週の期間の間、約0℃から約50℃の温度で安定している。幾つかの実施形態において、凍結乾燥された組成物は、少なくとも約5年の期間の間、約0℃から約50℃の温度で安定している。特定の実施形態において、凍結乾燥された組成物は、少なくとも約4カ月から約4年の期間の間、約0℃から約50℃の温度で安定している。また更なる又は追加の実施形態において、凍結乾燥された組成物は、少なくとも約6カ月から約2年の期間の間、約0℃から約50℃の温度で安定している。幾つかの実施形態において、凍結乾燥された組成物は、少なくとも約3カ月、少なくとも約6カ月、少なくとも約1年、少なくとも約2年、少なくとも約3年、少なくとも約4年、又は少なくとも約5年の間、約0℃から約50℃の温度で安定している。他の実施形態において、本明細書に記載の凍結乾燥された組成物は、ケ−キ又は自由流動粉末(free flowing powder)の形態である。他の実施形態において、凍結乾燥された組成物はケ−キである。
【0124】
〈再構成〉
幾つかの実施形態において、本明細書に記載の凍結乾燥された組成物は、十分な量の薬学的に許容可能な担体と接触すると、急速に再構成する。例えば、幾つかの実施形態において、凍結乾燥された組成物は、皮下、眼窩周囲、眼窩内、及び筋肉内注射に適切な再構成された組成物を提供するため、滅菌注射用蒸留水、0.9%の塩化ナトリウム溶液、又は5%のデキストロ−ス溶液などの薬学的に許容可能な担体とともに、例えば約1から約3分間振り混ぜられながら、該組成物が入れられたバイアル内で混合される。1つの実施形態において、凍結乾燥された組成物は、例えば1分未満、30秒未満、及び他の実施形態において約20秒未満の比較的短い時間で再構成される。特定の実施形態において、凍結乾燥された組成物は、2分未満の時間で再構成する。これらの短い再構成時間は、治療剤が投与前の長時間の間、溶液中にさらされながらも分解しなかったという利点を提供する。1つの実施形態において、再構成された組成物は、例えば皮下注射などの皮下投与に適している。別の実施形態において、再構成された形態は非懸濁液である。更なる実施形態において、再構成された形態は透明な溶液であり、投与前に実質的に透明なまま残る。
【0125】
本明細書に記載の主題の創造性のある特徴は、最小の量の非イオン性界面活性剤で調剤され、凍結乾燥物として製造され、及び短時間の担体又は賦形剤での十分な再構成に適用可能である凍結乾燥された組成物(フルチカゾン、サルメテロール、及び/又はそれらの混合物を含む)である。例えば、実施例3及び表3を参照。
【0126】
従って、1つの実施形態において、約2分の溶解の後にHPLCによって再構成されると、再構成の前に存在する凍結乾燥フルチカゾンの量の少なくとも約50%である可溶化された又は溶解された量のフルチカゾンを提供する再構成された凍結乾燥フルチカゾン製剤が提供される。更なる又は追加の実施形態において、約2分の溶解の後にHPLCによって再構成されると、再構成の前に存在する凍結乾燥フルチカゾンの量の少なくとも約60%である可溶化された又は溶解された量のフルチカゾンを提供する再構成された凍結乾燥フルチカゾン製剤が本明細書で提供される。幾つかの実施形態において、約2分の溶解の後にHPLCによって再構成されると、再構成の前に存在する凍結乾燥フルチカゾンの量の少なくとも約75%である可溶化された又は溶解された量のフルチカゾンを提供する再構成された凍結乾燥フルチカゾン製剤が提供される。更なる又は追加の実施形態において、約2分の溶解の後にHPLCによって再構成されると、再構成の前に存在する凍結乾燥フルチカゾンの量の少なくとも約90%から約100%である可溶化された又は溶解された量のフルチカゾンを提供する再構成された凍結乾燥フルチカゾン製剤が提供される。幾つかの実施形態において、約2分の溶解の後にHPLCによって再構成されると、再構成の前に存在する凍結乾燥フルチカゾンの量の少なくとも約90%から約100%である可溶化された又は溶解された量のフルチカゾンを提供する再構成された凍結乾燥フルチカゾン製剤が提供され、ここで非イオン性界面活性剤は、約4%から約5%の量の凍結乾燥物の合計の組み合わせた乾燥重量での再構成の前に、凍結乾燥フルチカゾン組成物内に存在した。
【0127】
更なる又は追加の実施形態において、約2分の溶解の後にHPLCによって再構成されると、再構成の前に存在する凍結乾燥サルメテロールの量の少なくとも約50%である可溶化された又は溶解された量のサルメテロールを提供する再構成された凍結乾燥サルメテロール製剤が提供される。更なる又は追加の実施形態において、約2分の溶解の後にHPLCによって再構成されると、再構成の前に存在する凍結乾燥サルメテロールの量の少なくとも約60%である可溶化された又は溶解された量のサルメテロールを提供する再構成された凍結乾燥サルメテロール製剤が提供される。幾つかの実施形態において、約2分の溶解の後にHPLCによって再構成されると、再構成の前に存在する凍結乾燥サルメテロールの量の少なくとも約75%である可溶化された又は溶解された量のサルメテロールを提供する再構成された凍結乾燥サルメテロール製剤が提供される。更なる又は追加の実施形態において、約2分の溶解の後にHPLCによって再構成されると、再構成の前に存在する凍結乾燥サルメテロールの量の少なくとも約90%から約100%である可溶化された又は溶解された量を提供する再構成された凍結乾燥サルメテロール製剤が提供される。
【0128】
更なる又は追加の実施形態において、約2分の溶解の後にHPLCによって再構成されると、再構成の前に存在する凍結乾燥薬剤の量の少なくとも約50%である可溶化された又は溶解された量のフルチカゾン及び/又はサルメテロールを提供する再構成された凍結乾燥フルチカゾン及びサルメテロール製剤が提供される。更なる又は追加の実施形態において、約2分の溶解の後にHPLCによって再構成されると、再構成の前に存在する凍結乾燥薬剤の量の少なくとも約60%である可溶化された又は溶解された量のフルチカゾン及び/又はサルメテロールを提供する再構成された凍結乾燥フルチカゾン及びサルメテロール製剤が提供される。幾つかの実施形態において、約2分の溶解の後にHPLCによって再構成されると、再構成の前に存在する凍結乾燥薬剤の量の少なくとも約75%である可溶化された又は溶解された量のフルチカゾン及び/又はサルメテロールを提供する再構成された凍結乾燥フルチカゾン及びサルメテロール製剤が提供される。更なる又は追加の実施形態において、約2分の溶解の後にHPLCによって再構成されると、再構成の前に存在する凍結乾燥薬剤の量の少なくとも約90%から約100%である可溶化された又は溶解された量のフルチカゾン及び/又はサルメテロールを提供する再構成された凍結乾燥フルチカゾン及びサルメテロール製剤が提供される。更なる又は追加の実施形態において、約2分の溶解の後にHPLCによって再構成されると、再構成の前に存在する凍結乾燥薬剤の量の少なくとも約90%から約100%である可溶化された又は溶解された量のフルチカゾン及び/又はサルメテロールを提供する再構成された凍結乾燥フルチカゾン及びサルメテロール製剤が提供され、ここで非イオン性界面活性剤は、約4%乃至約5%の量の凍結乾燥物の合計の組み合わせた乾燥重量での再構成の前に、凍結乾燥サルメテロール組成物内に存在する。
【0129】
特定の実施形態が記載されてきたが、これら実施形態はほんの一例として存在するものであり、本開示の範囲を限定しないように意図されている。本明細書に記載の製剤、方法、及び系は、様々な他の形態において具体化される。さらに、製剤の形態における省略、置換及び変更、本明細書に記載の製剤、方法、及び系は、この開示の精神から逸脱することなく作られ得る。添付の請求項およびそれらの同等物は、そのような形態又は変更を覆うように意図される。
【0130】
〈実施例〉
以下の具体的な実施形態は単なる例示として構成されるものであるが、どんな任意の方法における本開示注意を限定するものではない。本明細書に記載の実施例は、一連の段落に記載される様々な実施形態への非限定的な支持を指し、又はそれを提供する。
【0131】
〈実施例1:プロピオン酸フルチカゾン凍結乾燥物〉
プロピオン酸フルチカゾン凍結乾燥物を、下の表1に示されるように、各々の量で構成要素を混合することにより調製した:
【0132】
【表1】

【0133】
実施例1の凍結乾燥製剤の製造は、図1の概略図で描かれる。簡潔には、ラクトース一水和物を、およそ40℃から50度になるまで予め加熱した滅菌注射用蒸留水の中で溶解した。ラクトース溶液を20℃から25℃にまで冷却した後、ポリソルベート80を加えて均質になるまで混合した。プロピオン酸フルチカゾンをtert−ブチルアルコール溶液内で溶解し、およそ25℃から35℃にまで予め加熱し、水性のラクトース−ポリソルベート溶液に加え、均質になるまで混合した。滅菌注射用蒸留水を標的重量に加える。溶液を0.2ミクロンのフィルタを通して無菌で濾過し、その後適切なガラスバイアルに充填した。バイアルを凍結乾燥器に充填し、水と溶媒を、表7に記載のものに類似したサイクルを行った後に除去した。サイクルの結果、栓をして過剰密封(oversealing)する前に、バイアルを窒素のような不活性ガス内に埋戻す(back−filled)。
【0134】
〈プロピオン酸フルチカゾン凍結乾燥物の安定性〉
以下の表4に記載されるようなアッセイの有効性に関する方法論を、上記表1に記載されるように調剤された製剤が特定の状態にて制御された安定性チャンバに貯蔵された後、表2にある安定性データの生成において利用した。
【0135】
【表2】

【0136】
〈実施例3:フルチカゾン凍結乾燥製剤の再構成アッセイ及び再構成時間〉
本明細書に記載されるように、本明細書に記載の内容の発明の特徴は、最小の量の非イオン性界面活性剤で調剤され、及び短時間の担体又は希釈剤での十分な再構成に適用可能である凍結乾燥組成物(フルチカゾン、サルメテロール、及び/又はそれらの混合物を含む)である。HPLCで測定されるように滅菌注射用蒸留水を伴うプロピオン酸フルチカゾンの有効性及び各々の再構成時間を、表3に示す。再構成時間及びアッセイ評価を、1.0mLの滅菌注射用蒸留水で製剤を再構成することにより決定した。再構成時間を、溶液中に目に見える粒子状物質が無い時間として決定し、この場合、製剤は「透明」であると言える。表3に示されるように、5mg/gのポリソルベート80がフルチカゾン凍結乾燥物内で使用される際、凍結乾燥組成物中の約100%のプロピオン酸フルチカゾンを、約15秒の溶解後に分解又は可溶化した。
【0137】
【表3】

【0138】
以下表4に記載されるようなHPLCに関する方法論は、実施例2の安定性データ及び実施例3の再構成アッセイと時間データの生成で利用される。
【0139】
【表4】

【0140】
〈実施例4:キシナホ酸サルメテロール凍結乾燥物〉
キシナホ酸サルメテロール凍結乾燥物を、以下表5に記載のように構成要素を各々の量で混合することにより調製した。
【0141】
【表5】

【0142】
実施例4の(及び表5に示される)凍結乾燥組成物の製造を図2の概略図に記載する。実施例4で使用される調整のプロセスは実施例1で説明されるようなプロセスを反映する。
【0143】
〈実施例5:凍結乾燥物の組合せ〉
プロピオン酸フルチカゾンとキシナホ酸サルメテロールを組み合わせた凍結乾燥物を、以下表6に示されるように構成要素を各々の量で混合することにより調製した:
【0144】
【表6】

【0145】
実施例5の凍結乾燥組成物の製造を図3の概略図に記載する。実施例5で使用されるプロセスは実施例1で使用されるプロセスを反映する。
【0146】
〈実施例6:凍結乾燥サイクル〉
およそ1mLの濾過された溶液を各々の製剤のため3−mLのガラスバイアルに充填し、凍結乾燥器に充填した。製剤を以下表7に記載の凍結乾燥サイクルに従って凍結乾燥した。
【0147】
【表7−1】

【0148】
【表7−2】

【0149】
凍結乾燥サイクルの結果、特徴付けと分析の前にバイアルに栓をして密封した。
【0150】
〈実施例7:バルク溶液に関するガラス転移実験〉
【0151】
バルク溶液に関するガラス転移(Tg)デ−タを、示差走査熱量測定法を使用して生成した。およそ10から20mgのバルク溶液をピペットでアルミニウムパンへ移し、圧着した(crimped)。空のクリンプパン(crimped pan)は参考として機能した。DSC分析のため使用される温度プログラムを、25℃で1分間保持し、その後10/分で25℃から−50℃にまで冷却した。
【0152】
本明細書に記載の実施例及び実施形態は例示目的のためだけのものであり、様々な修正又は変更は、本出願の精神及び範囲、並びに添付の請求項の範囲内に含まれる。
【技術分野】
【0001】
〈相互参照〉
本出願は、2010年1月15日出願の米国特許出願第61/295,646号、表題「凍結乾燥ケーキ製剤」の利益を主張するものであり、その全体における引用により本明細書に組み込まれる。
【背景技術】
【0002】
過剰な体脂肪は現代社会において重大な健康管理である。過剰な体脂肪により促進される慢性の健康疾病は、例えば心血管疾患及び2型糖尿病を含む。更に、過剰な体脂肪は、個人の外観及び自己の姿を大きく蝕む。長く作用するβアドレナリン受容体アゴニスト及び/又はコルチコステロイドは、過剰な体脂肪を減らすために注入可能な医薬製剤で使用される。
【0003】
注入可能な医薬品のような凍結乾燥された生成物は、水溶液では相対的に不安定であり、より安定した及びそれ故より長い貯蔵寿命を有する固相生成物をもたらすことができる。
【発明の概要】
【発明が解決しようとする課題】
【0004】
凍結乾燥された活性成分を含む凍結乾燥ケーキ組成物が本明細書で提供され、該活性成分は、ほんの一例として、キシナホ酸サルメテロール、プロピオン酸フルチカゾン、他の薬学的に許容可能な塩又はそれらの組み合わせ及び混合物、並びに充填剤である。幾つかの実施形態において、凍結乾燥組成物は更に非イオン性界面活性剤を含む。更なる又は追加の実施形態において、凍結乾燥組成物は緩衝剤を含む。また更なる又は追加の実施形態において、本明細書に記載の凍結乾燥組成物は更に抗酸化剤を含む。本明細書に記載の凍結乾燥組成物はバルク溶液から調製され、幾つかの実施形態においてバルク溶液は凍結乾燥の前の濾過法を介して殺菌される。凍結乾燥ケーキ組成物は活性成分の安定した形態を提供し、他の実施形態において活性成分は投与前に容易に再構成することができる。本出願はまた、そのような凍結乾燥ケーキ組成物、再構成された凍結乾燥製剤を含む製剤を調製する方法、再構成された凍結乾燥製剤を調製する方法、及び治療上及び美容上の指標のため、凍結乾燥組成物及び再構成された凍結乾燥製剤を使用する方法を記載する。
【課題を解決するための手段】
【0005】
〈凍結乾燥フルチカゾン組成物〉
第1の態様において、凍結乾燥フルチカゾン又はその薬学的に許容可能な塩、充填剤及び非イオン性界面活性剤を含む無菌のフルチカゾン凍結乾燥組成物が本明細書で提供される。幾つかの実施形態において、無菌のフルチカゾン凍結乾燥物(lyophile)は更に緩衝剤を含む。幾つかの実施形態において、緩衝剤はクエン酸又はクエン酸ナトリウム二水和物である。1つの実施形態において、緩衝剤はクエン酸である。別の実施形態において、緩衝剤はクエン酸二水和物である。結晶相、非晶相、半結晶相、半非晶相、又はそれらの混合物において凍結乾燥フルチカゾンを含む無菌の凍結乾燥組成物も本明細書で提供される。1つの実施形態において、凍結乾燥フルチカゾンは非晶相にある。別の実施形態において、フルチカゾンの薬学的に許容可能な塩はプロピオン酸塩又はフロ酸塩である。また別の実施形態において、薬学的に許容可能な塩はプロピオン酸塩である。
【0006】
幾つかの実施形態において、無菌の凍結乾燥フルチカゾン組成物が提供され、ここで凍結乾燥フルチカゾンは、凍結乾燥物の合計の組み合わせた乾燥重量の約0.001重量%から約0.1重量%までの量で存在する。また更なる実施形態において、凍結乾燥フルチカゾンは、凍結乾燥物の合計の組み合わせた乾燥重量の約0.015重量%から約0.030重量%までの量で存在する。また更なる実施形態において、凍結乾燥フルチカゾンは、凍結乾燥物の合計の組み合わせた乾燥重量の約0.017重量%から約0.023重量%までの量で存在する。1つの実施形態において、凍結乾燥フルチカゾンは、凍結乾燥物の合計の組み合わせた乾燥重量の約0.020重量%の量で存在する。
【0007】
更なる又は追加の実施形態において、約500μg/g以下の量で存在する凍結乾燥フルチカゾンを含む無菌の凍結乾燥フルチカゾン組成物が本明細書で提供される。幾つかの実施形態において、無菌の凍結乾燥フルチカゾン組成物が提供され、ここで凍結乾燥フルチカゾンは約1μg/gから約500μg/gまでの量で存在する。更なる又は追加の実施形態において、無菌の凍結乾燥フルチカゾン組成物が提供され、ここで凍結乾燥フルチカゾンは約5μg/gから約350μg/gまでの量で存在する。特定の実施形態において、無菌の凍結乾燥フルチカゾン組成物が提供され、ここで、凍結乾燥フルチカゾンは約15μg/gから約300μg/gまでの量で存在する。幾つかの実施形態において、無菌のフルチカゾン組成物が本明細書で提供され、ここで凍結乾燥フルチカゾンは約20μg/gから約250μg/gまでの量で存在する。また追加の実施形態において、無菌の凍結乾燥フルチカゾン組成物が提供され、ここで凍結乾燥フルチカゾンは約25μg/gから約225μg/gまでの量で存在する。特定の実施形態において、無菌の凍結乾燥フルチカゾン組成物が本明細書で提供され、ここで凍結乾燥フルチカゾンは約30μg/gから約200μg/gまでの量で存在する。また更なる又は追加の実施形態において、約100μg/gから約300μg/gの量の凍結乾燥フルチカゾンを含む無菌の凍結乾燥フルチカゾン組成物が本明細書に記載される。幾つかの実施形態において、約200μg/gから約300μg/gを含む無菌の凍結乾燥フルチカゾン組成物が本明細書で提供される。1つの実施形態において、約150μg/gの凍結乾燥フルチカゾンを含む無菌の凍結乾燥フルチカゾン組成物が本明細書で提供される。
【0008】
約50μg/gに等しい又はそれ未満の量で存在するフルチカゾンの凍結乾燥物を含む無菌の凍結乾燥フルチカゾン組成物が本明細書で提供される。更なる又は追加の実施形態において、無菌の凍結乾燥フルチカゾン組成物が本明細書で提供され、ここで凍結乾燥フルチカゾンは約1μg/gから約50μg/gまでの量で存在する。特定の実施形態において、無菌の凍結乾燥フルチカゾン組成物が提供され、ここで凍結乾燥フルチカゾンは約5μg/gから約35μg/gの量で存在する。1つの実施形態において、無菌の凍結乾燥フルチカゾン組成物が提供され、ここで凍結乾燥フルチカゾンは約9μg/gから約20μg/gまでの量で存在する。
【0009】
本明細書にはまた、さらなる又は追加の実施形態において、凍結乾燥フルチカゾンまたはその薬学的に許容可能な塩、充填剤およびほんの一例として、ポリソルベート80などの非イオン性界面活性剤を含む無菌のフルチカゾン凍結乾燥(lyophile)組成物が記載される。幾つかの実施形態において、非イオン性界面活性剤は以下から選択される:(N,N−ビス[3−(D−グルコアミド(gluconamido))プロピル]コラミド);ビス(ポリエチレングリコールビス[イミダゾイルカルボニル]);ポリオキシエチレングリコールドデシルエーテル;ポリオキシエチレングリセロールトリリシノリエート(ethylenglyceroltriricinoleate)35;デカエチレングリコールモノドデシルエーテル;N−デカノイル−N−メチルグルカミン;n−デシルα−D−グルコピラノシド;デシルβ−D−マルトピラノシド;n−ドデカノイル−N−メチルグルカミド;n−ドデシルα−D−マルトシド;n−ドデシルβ−D−マルトシド;n−ヘキサデシルβ−D−マルトシド;ヘプタエチレングリコールモノデシルエーテル;ヘプタエチレングリコールモノドデシルエーテル;ヘプタエチレングリコールモノテトラデシルエーテル;ヘキサエチレングリコールモノドデシルエーテル;ヘキサエチレングリコールモノヘキサデシルエーテル;ヘキサエチレングリコールモノオクタデシルエーテル;ヘキサエチレングリコールモノテトラデシルエーテル;オクチルフェニル−ポリエチレングリコール;メチル−6−O−(N−ヘプチルカルバモイル)−α−D−グルコピラノシド;ノナエチレングリコールモノドデシルエーテル;N−ノナノイル−N−メチルグルカミン;N−ノナノイル−N−メチルグルカミン;オクタエチレングリコールモノデシルエーテル;オクタエチレングリコールモノドデシルエーテル;オクタエチレングリコールモノヘキサデシルエーテル;オクタエチレングリコールモノオクタデシルエーテル;オクタエチレングリコールモノテトラデシルエーテル;オクチル−β−D−グルコピラノシド;ペンタエチレングリコールモノデシルエーテル;ペンタエチレングリコールモノドデシルエーテル;ペンタエチレングリコールモノヘキサデシルエーテル;ペンタエチレングリコールモノヘキシルエーテル;ペンタエチレングリコールモノオクタデシルエーテル;ペンタエチレングリコールモノオクチルエーテル;ポリエチレングリコールジグリシジルエーテル;ポリエチレングリコールエーテルW−1;ポリオキシエチレン10トリデシルエーテル;ポリオキシエチレン100ステアレート;ポリオキシエチレン20イソヘキサデシルエーテル;ポリオキシエチレン20オレイルエーテル;ポリオキシエチレン40ステアレート;ポリオキシエチレン50ステアレート;ポリオキシエチレン8ステアレート、ポリオキシエチレンビス(イミダゾリルカルボニル)、ポリオキシエチレン25プロピレングリコールステアレート;サポニン;ラウリン酸ソルビタン、ソルビタンモノパルミタート、ステアリン酸ソルビタン、トリステアリン酸ソルビタン、オレイン酸ソルビタン、トリオレイン酸ソルビタン;ポリエチレングリコールトリメチルノニルエーテル、ノニルフェノールエトキシレート;テトラデシル−β−D−マルトシド;テトラエチレングリコールモノデシルエーテル、テトラエチレングリコールモノドデシルエーテル、テトラエチレングリコールモノテトラデシルエーテル;トリエチレングリコールモノデシルエーテル、トリエチレングリコールモノドデシルエーテル、トリエチレングリコールモノヘキサデシルエーテル、トリエチレングリコールモノオクチルエーテル、トリエチレングリコールモノテトラデシルエーテル;オクトキシノール−9;オクチルフェノールエトキシレート;ポリソルベート20、ポリソルベート21、ポリソルベート40、ポリソルベート60、ポリソルベート61、ポリソルベート65、ポリソルベート80、ポリソルベート81、ポリソルベート85;チロキサポール;およびn−ウンデシルβ−D−グルコピラノシド。具体的な実施形態において、凍結乾燥フルチカゾン組成物は、ポリソルベート80である非イオン性界面活性剤を含む。
【0010】
1つの実施形態において、非イオン性界面活性剤は、凍結乾燥物の合計の組み合わせた乾燥重量の約1重量%から約10重量%までの量で存在する。別の実施形態において、非イオン性界面活性剤は、凍結乾燥物の合計の組み合わせた乾燥重量の約2.5重量%から約7.5重量%までの量で存在する。別の実施形態において、非イオン性界面活性剤は、凍結乾燥物の合計の組み合わせた乾燥重量の約4.2重量%から約5.8重量%までの量で存在する。さらなるの実施形態において、非イオン性界面活性剤は、凍結乾燥物の合計の組み合わせた乾燥重量の約5.0重量%の量で存在する。
【0011】
さらなる実施形態において、充填材がラクトース、マンニトール、デキストロースおよびサッカロースから成る群から選択されることを特徴とする無菌の凍結乾燥フルチカゾン化合物が提供される。別の実施形態において、充填剤はラクトース一水和物である。1つの実施形態において、充填剤は、凍結乾燥物の合計の組み合わせた乾燥重量の約90重量%から約99重量%までの量で存在する。別の実施形態において、充填剤は、凍結乾燥物の合計の組み合わせた乾燥重量の約93重量%から約97重量%までの量で存在する。更に別の実施形態において、充填剤は、凍結乾燥物の合計の組み合わせた乾燥重量の約95重量%の量で存在する。
【0012】
幾つかの実施形態において、非イオン性界面活性剤を含む無菌の凍結乾燥フルチカゾン組成物が提供され、非イオン性界面活性剤は、凍結乾燥物の合計の組み合わせた乾燥重量の約1重量%から約10重量%までの量で存在し、及び/又は充填材は、凍結乾燥物の合計の組み合わせた乾燥重量の約90重量%から約99重量%までの量で存在する。さらなる又は追加の実施形態において、凍結乾燥フルチカゾン組成物は非イオン性界面活性剤を含み、非イオン性界面活性剤は、凍結乾燥物の合計の組み合わせた乾燥重量の約2.5重量%から約7.5重量%までの量で存在し、及び/又は充填材は、凍結乾燥物の合計の組み合わせた乾燥重量の約93重量%から約97重量%までの量で存在する。幾つかの実施形態において、凍結乾燥フルチカゾンは非イオン性界面活性剤を含み、非イオン性界面活性剤は、凍結乾燥物の合計の組み合わせた乾燥重量の約4.2重量%から約5.8重量%までの量で存在し、及び/又は充填材は、凍結乾燥物の合計の組み合わせた乾燥重量の約95重量%の量で存在する。さらなる又は追加の実施形態において、非イオン性界面活性剤を含む凍結乾燥フルチカゾン組成物が提供され、非イオン性界面活性剤は、凍結乾燥物の合計の組み合わせた乾燥重量の約3.5重量%から約5重量%までの量で存在し、及び/又は充填材は、凍結乾燥物の合計の組み合わせた乾燥重量の少なくとも約95重量%の量で存在する。
【0013】
1つの実施形態において、約0℃から約50℃までの温度で少なくとも4週の期間の間安定している無菌の凍結乾燥フルチカゾン組成物が提供される。別の実施形態において、フルチカゾン凍結乾燥組成物は、約0℃から約50℃までの温度で少なくとも6か月の期間の間安定している。
【0014】
別の実施形態において、本明細書には、水溶液によって再構成されるとき、皮下投与、眼窩周囲投与、眼窩内投与、および筋肉内投与に適する無菌の凍結乾燥フルチカゾン組成物が提供される。1つの実施形態において、フルチカゾン凍結乾燥組成物は、水溶液によって再構成されるときに皮下投与に適している。
【0015】
1つの実施形態において、無菌の凍結乾燥フルチカゾン組成物は凍結乾燥物の合計の組み合わせた乾燥重量の約3重量%未満の溶媒又は共溶媒を含む。別の実施形態において、組成物は、凍結乾燥物の合計の組み合わせた乾燥重量の約2重量%未満の溶媒又は共溶媒を含む。さらなる実施形態において、組成物は凍結乾燥物の合計の組み合わせた乾燥重量の約1重量%未満の溶媒又は共溶媒を含む。またさらなる実施形態において、溶媒又は共溶媒は、tert−ブチルアルコール、n−ブタノール、エタノール、イソプロピルアルコール、ジメチルスルホン、クロロブタノール、またはそれらの混合物から選択される。更に別の実施形態において、組成物は、凍結乾燥物の合計の組み合わせた乾燥重量の約2重量%未満の水を含む。
【0016】
〈再構成されたフルチカゾン製剤〉
第2の態様において、本明細書には、凍結乾燥フルチカゾンまたはその薬学的に許容可能な塩、充填剤および非イオン性界面活性剤を含む凍結乾燥組成物から再構成された無菌のフルチカゾン製剤が提供される。幾つかの実施形態において、無菌のフルチカゾンの凍結乾燥物(lyophile)は、緩衝剤を更に含む。幾つかの実施形態において、緩衝剤は、クエン酸又はそのクエン酸ナトリウム二水和物である。1つの実施形態において、緩衝剤はクエン酸である。別の実施形態において、緩衝剤はクエン酸二水和物である。幾つかの実施形態において、再構成された無菌のフルチカゾン製剤は、薬学的に許容可能な希釈剤を更に含む。いくつかの実施形態において、希釈剤は、滅菌注射用蒸留水、0.9%の塩化ナトリウム溶液または5%のデキストロース溶液から選択される。具体的な実施形態において、薬学的に許容可能な希釈剤は滅菌注射用蒸留水である。
【0017】
幾つかの実施形態において、再構成された無菌のフルチカゾン製剤が提供され、再構成されたフルチカゾンは、約100μg/ml以下の量で存在する。さらなる又は追加の実施形態において、再構成された無菌のフルチカゾン製剤は、約100ng/mlから約100μg/mlの量で存在する再構成されたフルチカゾンを含む。幾つかの実施形態において、再構成された無菌のフルチカゾン製剤は、約200ng/mlから約50μg/mlの量で存在する再構成されたフルチカゾンを含む。さらなる又は追加の実施形態において、約300ng/mlから約25μg/mlの量で存在する再構成されたフルチカゾンを含む再構成された無菌のフルチカゾン製剤が提供される。さらなる又は追加の実施形態において、約500ng/mlから約15μg/mlの量で存在する再構成されたフルチカゾンを含む再構成された無菌のフルチカゾン製剤が提供される。幾つかの実施形態において、約600ng/mlから約10μg/mlの量で存在する再構成されたフルチカゾンを再構成された無菌のフルチカゾン製剤が提供される。幾つかの実施形態において、約750ng/mlから約5μg/mlの量で存在する再構成されたフルチカゾンを再構成された無菌のフルチカゾン製剤が提供される。幾つか実施形態において、約800ng/mlから約3μg/mlのフルチカゾンまたはその薬学的に許容可能な塩を含む再構成されたフルチカゾン製剤が提供される。さらなる又は追加の実施形態において、約900ng/mlから約2μg/mlの量で存在する再構成されたフルチカゾンを含む無菌のフルチカゾン製剤が提供される。具体的な実施形態において、約1μg/mlの量で存在する再構成されたフルチカゾンを含む再構成された無菌のフルチカゾン製剤が提供される。
【0018】
本明細書には、特定の実施形態において、凍結乾燥フルチカゾンまたはその薬学的に許容可能な塩、充填剤および非イオン性界面活性剤、および薬学的に許容可能な希釈剤を含む凍結乾燥フルチカゾン組成物から再構成された無菌のフルチカゾン製剤が記載され、再構成された無菌のフルチカゾン製剤は、皮下注入、眼窩周囲注入、眼窩内注入および筋肉内注入のために調剤される。別の実施形態において、再構成された無菌のフルチカゾン製剤は、例えば皮下注入のような皮下投与のために調剤される。1つの実施形態において、凍結乾燥物は薬学的に許容可能な希釈剤に溶解される。別の実施形態で、溶解は約2分未満に生じる。さらなる実施形態において、溶解は約1分で生じる。さらなる別の実施形態において、溶解は約1分未満に生じる。さらなる別の実施形態において、溶解は約30秒未満で生じる。別のさらなる実施形態において、溶解によって実質的に透明な溶液が生じる。
【0019】
幾つかの実施形態において、約2分間の溶解の後のHPLCによって測定されると、再構成の前に存在する凍結乾燥フルチカゾンの量の少なくとも約50%である可溶化された又は溶解された量のフルチカゾンを提供する再構成された凍結乾燥フルチカゾン製剤が提供される。更なるまたは追加の実施形態において、約2分間の溶解の後のHPLCによって測定されると、再構成の前に存在する凍結乾燥フルチカゾンの量の少なくとも約60%である可溶化された又は溶解された量のフルチカゾンを提供する再構成された凍結乾燥フルチカゾン製剤が提供される。幾つかの実施形態において、約2分間の溶解の後のHPLCによって測定されると、再構成の前に存在する凍結乾燥フルチカゾンの量の少なくとも約75%である可溶化された又は溶解された量のフルチカゾンを提供する再構成された凍結乾燥フルチカゾン製剤が提供される。更なるまたは追加の実施形態において、約2分間の溶解の後のHPLCによって測定されると、再構成の前に存在する凍結乾燥フルチカゾンの量の約90%から約100%までである可溶化された又は溶解された量のフルチカゾンを提供する再構成された凍結乾燥フルチカゾン製剤が提供される。幾つかの実施形態において、約2分間の溶解の後のHPLCによって測定されると、再構成の前に存在する凍結乾燥フルチカゾンの量の約90%から約100%までである可溶化された又は溶解された量のフルチカゾンを提供する再構成された凍結乾燥フルチカゾン製剤が提供され、ここで、非イオン性界面活性剤は、凍結乾燥物の合計の組み合わせた乾燥重量の約4%から約5%までの量で、再構成前の凍結乾燥フルチカゾン組成物中に存在した。
【0020】
〈サルメテロールをさらに含む再構成されたフルチカゾン製剤〉
第3の態様において、本明細書には、凍結乾燥フルチカゾンまたはその薬学的に許容可能な塩、充填剤および非イオン性界面活性剤を含む凍結乾燥組成物から再構成された無菌のフルチカゾン製剤が提供され、無菌のフルチカゾン製剤はさらにサルメテロールを含む。幾つかの実施形態において、無菌のフルチカゾンの凍結乾燥物は、緩衝剤をさらに含む。幾つかの実施形態において、緩衝剤は、クエン酸又はそのクエン酸ナトリウム二水和物である。1つの実施形態において、緩衝剤はクエン酸である。別の実施形態において、緩衝剤はクエン酸二水和物である。いくつかの実施形態において、サルメテロールは、凍結乾燥物組成物から再構成されている。他の実施形態において、サルメテロールは凍結乾燥物組成物から再構成されていない。幾つかの実施形態において、再構成された無菌のフルチカゾンの製剤は、一例として滅菌注射用蒸留水を含む薬学的に許容可能な希釈剤を更に含む。幾つかの実施形態において、無菌のフルチカゾン製剤は、サルメテロールまたはその薬学的に許容可能な塩をさらに含むように調剤される。更なる又は追加の実施形態において、製剤は、滅菌注射用蒸留水、0.9%の塩化ナトリウム溶液、または5%のデキストロース溶液から選択される薬学的に許容可能な希釈剤をさらに含む。具体的な実施形態において、薬学的に許容可能な希釈剤は滅菌注射用蒸留水である。
【0021】
幾つかの実施形態において、本明細書には、凍結乾燥フルチカゾンまたはその薬学的に許容可能な塩、充填剤および非イオン性界面活性剤を含む凍結乾燥組成物から再構成された無菌のフルチカゾン製剤が提供され、ここで、無菌のフルチカゾン製剤は、約25μg/ml以下である量のサルメテロールまたはその薬学的に許容可能な塩をさらに含む。いくつかの実施形態において、再構成された無菌のフルチカゾン製剤は、さらに約1μg/ml以下の量で存在するサルメテロールまたはその薬学的に許容可能な塩を含む。さらなる又は追加の実施形態において、本明細書には、約2ng/mlから約25μg/mlまたは約1μg/mlの量で存在するサルメテロールをさらに含む無菌のフルチカゾン製剤が提供される。さらなる又は追加の実施形態において、約5ng/mlから約750ng/mlの量で存在するサルメテロールをさらに含む再構成された無菌のフルチカゾン製剤が提供される。さらなる追加の実施形態において、約10ng/mlから約500ng/mlの量で存在するサルメテロールまたはその薬学的に許容可能な塩をさらに含む再構成された無菌のフルチカゾン製剤が提供される。幾つかの実施形態において、約15ng/mlから約250ng/mlの量で存在するサルメテロールまたはその薬学的に許容可能な塩をさらに含む再構成された無菌のフルチカゾン製剤が提供される。
【0022】
さらなる又は追加の実施形態において、再構成された無菌のフルチカゾン製剤は、約15ng/mlから約50ng/mlの量で存在するサルメテロールまたはその薬学的に許容可能な塩をさらに含む。特定の実施形態において、サルメテロールまたは薬学的に可能な塩をさらに含む再構成された無菌のフルチカゾン製剤が提供され、サルメテロールまたは塩は、約20ng/mlから約25ng/mlの量で存在する。具体的な実施形態において、再構成された無菌のフルチカゾン製剤は、さらに約20ng/mlで存在するサルメテロールまたは薬学的に許容可能な塩を含む。またさらなるまたは追加の実施形態において、再構成された無菌のフルチカゾン製剤は、サルメテロールまたはその薬学的に許容可能な塩、および約1μg/mlのフルチカゾンまたはその薬学的に許容可能な塩をさらに含む。特定の実施形態において、再構成された無菌のフルチカゾン製剤は、サルメテロールまたはその薬学的に許容可能な塩をさらに含み、皮下注入、眼窩周囲注入、眼窩内注入および筋肉内注入のために調剤される。さらなるまたは追加の実施形態において、本明細書には、サルメテロールまたはその薬学的に許容可能な塩をさらに含み、注入による皮下投与のために調剤される再構成された無菌のフルチカゾン製剤が提供される。
【0023】
〈フルチカゾンを使用する治療方法および美容方法(Cosmetic Methods)〉
第4の態様において、本明細書には、凍結乾燥フルチカゾンまたはその薬学的に許容可能な塩、充填剤および非イオン性界面活性剤を含む凍結乾燥組成物から再構成されている無菌のフルチカゾン製剤を、ヒトに投与又は提供する、例えば、皮下投与によることを含む、工程を含む美容方法又は治療方法が提供される。幾つかの実施形態において、無菌のフルチカゾンの凍結乾燥物は、緩衝剤をさらに含む。幾つかの実施形態において、緩衝剤は、クエン酸又はそのクエン酸ナトリウム二水和物である。1つの実施形態において、緩衝剤はクエン酸である。別の実施形態において、緩衝剤はクエン酸二水和物である。いくつかの実施形態において、方法は、治療的である。さらなる又は追加の実施形態において、方法は美容的(cosmetic)である。
【0024】
幾つかの実施形態において、再構成された無菌のフルチカゾン製剤は、腹部脂肪蓄積、局所脂肪過多および甲状腺眼症に起因する眼球突出からなる群から選択される兆候を処置するために(例えば、供給(provision)または投与によって)使用される。特定の実施形態において、再構成された無菌のフルチカゾン製剤は、皮下に投与または提供される。幾つかの実施形態において、再構成された無菌のフルチカゾン製剤は、ヒトに、眼窩周囲または眼窩内の注入として皮下に投与または提供される。幾つかの実施形態において、再構成された無菌のフルチカゾン製剤は、ヒトに、腹部または眼領域に皮下に投与または提供される。更なる又は追加の実施形態において、製剤が、ヒトに、膝の内部領域、上腕の中間又は上方区域(三頭筋領域を含む)、頤下の領域(あごの下の領域、例えば、あごの肉(wattle)(それは患者の頤下の領域の皮膚の肉の襞(fleshy fold of skin)を指すと理解される)を含む)、腹部、腰、内腿、外腿、臀部、下背、背面上部または胸部へ投与または提供されることを特徴とする、再構成されたフルチカゾン製剤が提供される。
【0025】
さらなる実施形態において、本明細書には、凍結乾燥フルチカゾンまたはその薬学的に許容可能な塩、充填剤および非イオン性界面活性剤を含む凍結乾燥組成物から再構成された無菌のフルチカゾン製剤を、ヒトに投与又は提供する、例えば、皮下投与によることを含む、工程を含む美容方法が提供される。いくつかの実施形態において、人体の姿、輪郭または外観に影響を与えるために、ヒトに、再構成された無菌のフルチカゾン製剤が美容的に提供される。さらなる又は追加の実施形態において、姿、輪郭または外観は、ヒトの体の領域(例えば腹部)または眼の領域である。特定の実施形態において、その製剤は、ヒトに、眼窩周囲または眼窩内の注射として皮下に投与または提供される。幾つかの実施形態において、無菌の再構成された凍結乾燥フルチカゾン製剤は、ヒトに、ヒトの腹部または眼の領域に皮下に投与又は提供される。
【0026】
〈フルチカゾン凍結乾燥組成物を製造する方法〉
第5の態様において、本明細書には、凍結乾燥された無菌のフルチカゾン組成物を調製する方法が提供され、該方法は、(i)フルチカゾンまたはその薬学的に許容可能な塩、充填剤、および非イオン性界面活性剤を、バルク溶液を形成するための溶媒又は共溶媒で可溶性にする工程;(ii)バルク溶液を殺菌する工程;および(iii)凍結乾燥された無菌のフルチカゾン組成物を提供するために殺菌されたバルク溶液を凍結乾燥する工程、を含む。幾つかの実施形態において、可溶性にされるフルチカゾンまたはその薬学的に許容可能な塩は、クエン酸またはクエン酸ナトリウム二水和物である緩衝剤をさらに含む。1つの実施形態において、緩衝剤はクエン酸である。別の実施形態において、緩衝剤はクエン酸二水和物である。
【0027】
1つの実施形態において、溶媒又は共溶媒は、tert−ブチルアルコール、n−ブタノール、エタノール、イソプロピルアルコール、ジメチルスルホン、クロロブタノール、またはそれらの混合物から選択される。1つの実施形態において、溶媒または共溶媒は、tert−ブチルアルコールである。別の実施形態において、方法は、バルク溶液の殺菌に備え、フィルタを介してバルク溶液を通す工程を含む。別の実施形態において、フィルタは、0.2ミクロンフィルターである。さらに別の実施形態において、方法は、プロピオン酸塩またはフルチカゾンのフロ酸塩の使用を含む。1つの実施形態において、方法は、プロピオン酸塩の使用を含む。
【0028】
本明細書にはまた、更なるまたは追加の実施形態において、本明細書に記載される凍結乾燥された無菌のフルチカゾン製剤を調製する方法が提供され、非イオン性界面活性剤は、以下から選択される:(N,N−ビス[3−(D−グルコアミド(gluconamido))プロピル]コラミド);ビス(ポリエチレングリコールビス[イミダゾイルカルボニル]);ポリオキシエチレングリコールドデシルエーテル;ポリオキシエチレングリセロールトリリシノリエート(ethylenglyceroltriricinoleate)35;デカエチレングリコールモノドデシルエーテル;N−デカノイル−N−メチルグルカミン;n−デシルα−D−グルコピラノシド;デシルβ−D−マルトピラノシド;n−ドデカノイル−N−メチルグルカミド;n−ドデシルα−D−マルトシド;n−ドデシルβ−D−マルトシド;n−ヘキサデシルβ−D−マルトシド;ヘプタエチレングリコールモノデシルエーテル;ヘプタエチレングリコールモノドデシルエーテル;ヘプタエチレングリコールモノテトラデシルエーテル;ヘキサエチレングリコールモノドデシルエーテル;ヘキサエチレングリコールモノヘキサデシルエーテル;ヘキサエチレングリコールモノオクタデシルエーテル;ヘキサエチレングリコールモノテトラデシルエーテル;オクチルフェニル−ポリエチレングリコール;メチル−6−O−(N−ヘプチルカルバモイル)−α−D−グルコピラノシド;ノナエチレングリコールモノドデシルエーテル;N−ノナノイル−N−メチルグルカミン;N−ノナノイル−N−メチルグルカミン;オクタエチレングリコールモノデシルエーテル;オクタエチレングリコールモノドデシルエーテル;オクタエチレングリコールモノヘキサデシルエーテル;オクタエチレングリコールモノオクタデシルエーテル;オクタエチレングリコールモノテトラデシルエーテル;オクチル−β−D−グルコピラノシド;ペンタエチレングリコールモノデシルエーテル;ペンタエチレングリコールモノドデシルエーテル;ペンタエチレングリコールモノヘキサデシルエーテル;ペンタエチレングリコールモノヘキシルエーテル;ペンタエチレングリコールモノオクタデシルエーテル;ペンタエチレングリコールモノオクチルエーテル;ポリエチレングリコールジグリシジルエーテル;ポリエチレングリコールエーテルW−1;ポリオキシエチレン10トリデシルエーテル;ポリオキシエチレン100ステアレート;ポリオキシエチレン20イソヘキサデシルエーテル;ポリオキシエチレン20オレイルエーテル;ポリオキシエチレン40ステアレート;ポリオキシエチレン50ステアレート;ポリオキシエチレン8ステアレート、ポリオキシエチレンビス(イミダゾリルカルボニル)、ポリオキシエチレン25プロピレングリコールステアレート;サポニン;ラウリン酸ソルビタン、ソルビタンモノパルミタート、ステアリン酸ソルビタン、トリステアリン酸ソルビタン、オレイン酸ソルビタン、トリオレイン酸ソルビタン;ポリエチレングリコールトリメチルノニルエーテル、ノニルフェノールエトキシレート;テトラデシル−β−D−マルトシド;テトラエチレングリコールモノデシルエーテル、テトラエチレングリコールモノドデシルエーテル、テトラエチレングリコールモノテトラデシルエーテル;トリエチレングリコールモノデシルエーテル、トリエチレングリコールモノドデシルエーテル、トリエチレングリコールモノヘキサデシルエーテル、トリエチレングリコールモノオクチルエーテル、トリエチレングリコールモノテトラデシルエーテル;オクトキシノール−9;オクチルフェノールエトキシレート;ポリソルベート20、ポリソルベート21、ポリソルベート40、ポリソルベート60、ポリソルベート61、ポリソルベート65、ポリソルベート80、ポリソルベート81、ポリソルベート85;チロキサポール;およびn−ウンデシルβ−D−グルコピラノシド。具体的な実施形態において、凍結乾燥フルチカゾン組成物は、ポリソルベート80である非イオンの界面活性剤を含む。
【0029】
別の実施形態において、充填材は、ラクトース、マンニトール、デキストロースおよびサッカロースからなる群から選択される。さらなる別の実施形態において、充填剤はラクトース一水和物である。さらなる別の実施形態において、方法は、約−35℃から約−25℃のガラス転移温度を有するバルク溶液を提供する。
【0030】
〈再構成されたフルチカゾン製剤を製造する方法〉
第6の態様において、本明細書には、皮下注射に適している無菌のフルチカゾン製剤を再構成によって調製するための方法が提供され、該方法は、充填剤および非イオン性界面活性剤をさらに含む凍結乾燥された無菌のフルチカゾン組成物を、薬学的に許容可能な希釈剤または担体と接触させる工程を含む。幾つかの実施形態において、無菌のフルチカゾンの凍結乾燥物は、緩衝剤をさらに含む。幾つかの実施形態において、緩衝剤は、クエン酸又はそのクエン酸ナトリウム二水和物である。1つの実施形態において、緩衝剤はクエン酸である。別の実施形態において、緩衝剤はクエン酸二水和物である。幾つかの実施形態において、薬学的に許容可能な希釈剤または担体は、滅菌注射用蒸留水、0.9%の塩化ナトリウム溶液または5%のデキストロース溶液から選択される。1つの実施形態において、滅菌注射用蒸留水である薬学的に許容可能な希釈剤または担体は、再構成された無菌のフルチカゾン製剤を提供するために、フルチカゾンの凍結乾燥物と接触される。さらなるまたは追加の実施形態において、再構成される無菌のフルチカゾンの凍結乾燥された組成物の非イオン性界面活性剤は、凍結乾燥物の合計の組み合わせた乾燥重量の約4%から約5%の量で、凍結乾燥フルチカゾン組成物中に存在する。
【0031】
幾つかの実施形態において、本明細書には、約2分間の溶解の後のHPLCによって測定されると、再構成の前に存在する凍結乾燥フルチカゾンの量の少なくとも約50%である可溶化された又は溶解された量のフルチカゾンを提供する、無菌の凍結乾燥フルチカゾン組成物を再構成する方法が提供される。幾つかの実施形態において、本明細書には、約2分間の溶解の後のHPLCによって測定されると、再構成の前に存在する凍結乾燥フルチカゾンの量の少なくとも約60%である可溶化された又は溶解された量のフルチカゾンを提供する、無菌の凍結乾燥フルチカゾン組成物を再構成する方法が提供される。更なるまたは追加の実施形態において、本明細書に記載の無菌の凍結乾燥フルチカゾン組成物を再構成する方法は、約2分間の溶解の後のHPLCによって測定されると、再構成の前に存在する凍結乾燥フルチカゾンの量の少なくとも約75%である可溶化された又は溶解された量のフルチカゾンを提供する。更なるまたは追加の実施形態において、本明細書に記載の方法は、無菌の凍結乾燥フルチカゾン組成物を再構成し、約2分間の溶解の後のHPLCによって測定されると、再構成の前に存在する凍結乾燥フルチカゾンの量の少なくとも約90%から約100%である可溶化された又は溶解された量のフルチカゾンが提供される。更なる別の又は追加の実施形態において、本明細書に提供される無菌の凍結乾燥フルチカゾン組成物の再構成方法は、無菌のフルチカゾン組成物を再構成し、ここで、非イオン性界面活性剤は、凍結乾燥物の合計の組み合わせた乾燥重量の約4.5%から約5%までの量で、再構成前の凍結乾燥フルチカゾン組成物の中に存在した。さらなるまたは追加の実施形態において、本明細書に記載の凍結乾燥フルチカゾン組成物の再構成方法は、再構成された製剤にサルメテロールまたはその薬学的に許容可能な塩を加える工程をさらに含む。
【0032】
〈凍結乾燥サルメテロール組成物〉
第7の態様において、本明細書には、凍結乾燥サルメテロールまたはその薬学的に許容可能な塩および充填剤を含む無菌のサルメテロール凍結乾燥組成物が提供される。幾つかの実施形態において、無菌のサルメテロール凍結乾燥物は、緩衝剤をさらに含む。幾つかの実施形態において、緩衝剤は、クエン酸又はそのクエン酸ナトリウム二水和物である。1つの実施形態において、緩衝剤はクエン酸である。別の実施形態において、緩衝剤はクエン酸二水和物である。さらなる又は追加の実施形態において、無菌のサルメテロール凍結乾燥物は、非イオン性界面活性剤をさらに含む。1つの実施形態において、凍結乾燥サルメテロール組成物は、さらに抗酸化剤を含む。
【0033】
本明細書にはまた、結晶相、非晶相、半結晶相、半非晶相またはそれらの混合物中に凍結乾燥サルメテロールを含む凍結乾燥組成物も記載される。1つの実施形態において、凍結乾燥サルメテロールは非晶相である。1つの実施形態において、サルメテロールの薬学的に許容可能な塩は、キシナホ酸塩である。1つの実施形態において、凍結乾燥キシナホ酸サルメテロールは、結晶相、多形体の形態、非晶相、半結晶相、半非晶相またはそれらの混合物で存在する。別の実施形態において、多形体の形態は、Form I多形体(Form I polymorph)である。さらなる実施形態において、多形体の形態は、Form II多形体(Form II polymorph)である。別の更なる実施形態において、凍結乾燥キシナホ酸サルメテロールまたはその薬学的に許容可能な塩は、非晶相で存在する。
【0034】
いくつかの実施形態において、本明細書には、凍結乾燥サルメテロールまたはその薬学的に許容可能な塩および充填剤を含む無菌のサルメテロール凍結乾燥組成物が提供され、凍結乾燥サルメテロールは、凍結乾燥物の合計の組み合わせた乾燥重量の体重の約0.00001重量%から約0.1重量%までの量で存在する。幾つかの実施形態において、無菌の凍結乾燥サルメテロールは、凍結乾燥物の合計の組み合わせた乾燥重量の約0.0002重量%から約0.001重量%までの量で存在する。更なるまたは追加の実施形態において、無菌の凍結乾燥サルメテロールは、凍結乾燥物の合計の組み合わせた乾燥重量の約0.00034重量%から約0.00046重量%までの量で存在する。幾つかの実施形態において、サルメテロールは、キシナホ酸サルメテロールである。
【0035】
本明細書にはまた、凍結乾燥サルメテロールまたはその薬学的に許容可能な塩および充填剤を含む無菌のサルメテロール凍結乾燥組成物が提供され、無菌の凍結乾燥サルメテロールは、約250μg/g以下の量で存在する。幾つかの実施形態において、本明細書には、凍結乾燥サルメテロールが約100ng/mlから約250μg/mlの量で存在することを特徴とする、無菌のサルメテロール凍結乾燥組成物がさらに提供される。具体的な実施形態において、本明細書には、凍結乾燥サルメテロールが約250ng/mlから約225μg/mlの量で存在することを特徴とする、無菌のサルメテロール凍結乾燥組成物が提供される。幾つかの実施形態において、本明細書には、約500ng/mlから約200μg/mlの量で存在する凍結乾燥サルメテロールを含む無菌のサルメテロール凍結乾燥組成物が提供される。さらなる又は追加の実施形態において、凍結乾燥サルメテロールが約1μg/gから約175μg/gの量で存在することを特徴とする、無菌のサルメテロール凍結乾燥組成物が提供される。幾つかの実施形態において、凍結乾燥サルメテロールが約2μg/mlから約150μg/mlの量で存在することを特徴とする、無菌のサルメテロール凍結乾燥組成物が提供される。特定の実施形態において、約5μg/gから約125μg/gの量で存在する凍結乾燥サルメテロールを含む無菌のサルメテロール凍結乾燥組成物が提供される。さらなる又は追加の実施形態において、約25μg/gから約115μg/gの量で存在する凍結乾燥サルメテロールを含む無菌のサルメテロール凍結乾燥組成物が提供される。幾つかの実施形態において、凍結乾燥サルメテロールが、約50μg/mlから約100μg/mlの量で存在することを特徴とする無菌のサルメテロール凍結乾燥組成物が提供される。1つの実施形態において、約60μg/gから約80μg/gの量で存在する凍結乾燥サルメテロールを含む無菌のサルメテロール凍結乾燥組成物が提供される。
【0036】
本明細書にはまた、無菌の凍結乾燥サルメテロールが約500ng/g以下である量で存在することを特徴とする、凍結乾燥サルメテロールまたはその薬学的に許容可能な塩および充填剤を含む無菌のサルメテロール凍結乾燥組成物が提供される。特定の実施形態において、無菌のサルメテロール凍結乾燥組成物は、約25ng/mlから約500ng/mlの量で存在する無菌の凍結乾燥サルメテロールを含む。さらなる又は追加の実施形態において、無菌のサルメテロール凍結乾燥組成物は、約100ng/gから約350ng/gの量で存在する無菌の凍結乾燥サルメテロールを含む。1つの実施形態において、無菌のサルメテロール凍結乾燥組成物は、約200ng/mlから約250ng/mlの量で存在する無菌の凍結乾燥サルメテロールを含む。
【0037】
幾つかの実施形態において、本明細書には、以下から選択される非イオン性界面活性剤を含む無菌の凍結乾燥サルメテロール組成物が提供される:(N,N−ビス[3−(D−グルコアミド(gluconamido))プロピル]コラミド);ビス(ポリエチレングリコールビス[イミダゾイルカルボニル]);ポリオキシエチレングリコールドデシルエーテル;ポリオキシエチレングリセロールトリリシノリエート(ethylenglyceroltriricinoleate)35;デカエチレングリコールモノドデシルエーテル;N−デカノイル−N−メチルグルカミン;n−デシルα−D−グルコピラノシド;デシルβ−D−マルトピラノシド;n−ドデカノイル−N−メチルグルカミド;n−ドデシルα−D−マルトシド;n−ドデシルβ−D−マルトシド;n−ヘキサデシルβ−D−マルトシド;ヘプタエチレングリコールモノデシルエーテル;ヘプタエチレングリコールモノドデシルエーテル;ヘプタエチレングリコールモノテトラデシルエーテル;ヘキサエチレングリコールモノドデシルエーテル;ヘキサエチレングリコールモノヘキサデシルエーテル;ヘキサエチレングリコールモノオクタデシルエーテル;ヘキサエチレングリコールモノテトラデシルエーテル;オクチルフェニル−ポリエチレングリコール;メチル−6−O−(N−ヘプチルカルバモイル)−α−D−グルコピラノシド;ノナエチレングリコールモノドデシルエーテル;N−ノナノイル−N−メチルグルカミン;N−ノナノイル−N−メチルグルカミン;オクタエチレングリコールモノデシルエーテル;オクタエチレングリコールモノドデシルエーテル;オクタエチレングリコールモノヘキサデシルエーテル;オクタエチレングリコールモノオクタデシルエーテル;オクタエチレングリコールモノテトラデシルエーテル;オクチル−β−D−グルコピラノシド;ペンタエチレングリコールモノデシルエーテル;ペンタエチレングリコールモノドデシルエーテル;ペンタエチレングリコールモノヘキサデシルエーテル;ペンタエチレングリコールモノヘキシルエーテル;ペンタエチレングリコールモノオクタデシルエーテル;ペンタエチレングリコールモノオクチルエーテル;ポリエチレングリコールジグリシジルエーテル;ポリエチレングリコールエーテルW−1;ポリオキシエチレン10トリデシルエーテル;ポリオキシエチレン100ステアレート;ポリオキシエチレン20イソヘキサデシルエーテル;ポリオキシエチレン20オレイルエーテル;ポリオキシエチレン40ステアレート;ポリオキシエチレン50ステアレート;ポリオキシエチレン8ステアレート、ポリオキシエチレンビス(イミダゾリルカルボニル)、ポリオキシエチレン25プロピレングリコールステアレート;サポニン;ラウリン酸ソルビタン、ソルビタンモノパルミタート、ステアリン酸ソルビタン、トリステアリン酸ソルビタン、オレイン酸ソルビタン、トリオレイン酸ソルビタン;ポリエチレングリコールトリメチルノニルエーテル、ノニルフェノールエトキシレート;テトラデシル−β−D−マルトシド;テトラエチレングリコールモノデシルエーテル、テトラエチレングリコールモノドデシルエーテル、テトラエチレングリコールモノテトラデシルエーテル;トリエチレングリコールモノデシルエーテル、トリエチレングリコールモノドデシルエーテル、トリエチレングリコールモノヘキサデシルエーテル、トリエチレングリコールモノオクチルエーテル、トリエチレングリコールモノテトラデシルエーテル;オクトキシノール−9;オクチルフェノールエトキシレート;ポリソルベート20、ポリソルベート21、ポリソルベート40、ポリソルベート60、ポリソルベート61、ポリソルベート65、ポリソルベート80、ポリソルベート81、ポリソルベート85;チロキサポール;およびn−ウンデシルβ−D−グルコピラノシド。1つの実施形態において、無菌の凍結乾燥サルメテロール組成物は、ポリソルベート80である非イオンの界面活性剤を含む。
【0038】
いくつかの実施形態において、本明細書には、凍結乾燥サルメテロールまたはその薬学的に許容可能な塩および充填剤を含む無菌のサルメテロール凍結乾燥組成物が提供され、ここで、充填剤は、ラクトース、マンニトール、デキストロースおよびスクロースからなる群から選択される。特定の実施形態において、充填剤はラクトース一水和物である。
【0039】
さらなる又は追加の実施形態において、本明細書には、凍結乾燥サルメテロールまたはその薬学的に許容可能な塩、充填剤およびで非イオン性界面活性剤を含む無菌のサルメテロール凍結乾燥組成物が提供され、ここで、非イオン性界面活性剤は、凍結乾燥物の合計の組み合わせた乾燥重量の約1重量%から約10重量%までの量で存在し、及び/又は充填材は、凍結乾燥物の合計の組み合わせた乾燥重量の約90重量%から約99.9重量%までの量で存在する。またさらなる又は追加の実施形態において、非イオン性界面活性剤は、凍結乾燥物の合計の組み合わせた乾燥重量の約2.5重量%から約7.5重量%までの量で存在し、または充填材は、凍結乾燥物の合計の組み合わせた乾燥重量の約93重量%から約97重量%までの量で存在する。またさらなる別の実施形態において、非イオン性界面活性剤は、凍結乾燥物の合計の組み合わせた乾燥重量の約4.2重量%から約5.8重量%までの量で存在し、または充填材は、凍結乾燥物の合計の組み合わせた乾燥重量の約95重量%の量で存在する。
【0040】
いくつかの実施形態において、本明細書には、凍結乾燥サルメテロールまたはその薬学的に許容可能な塩、充填剤および抗酸化剤を含む無菌のサルメテロール凍結乾燥組成物が提供され、ここで、抗酸化剤はアスコルビン酸またはブチルヒドロキシトルエンである。特定の実施形態において、組成物は、約0℃から約50℃までの温度で少なくとも4週の期間の間安定している。さらなる又は追加の実施形態において、組成物は、約0℃から約50℃までの温度で少なくとも6カ月の期間の間安定している。幾つかの実施形態において、無菌のサルメテロール凍結乾燥組成物は、緩衝剤をさらに含む。幾つかの実施形態において、緩衝剤は、クエン酸又はそのクエン酸ナトリウム二水和物である。1つの実施形態において、緩衝剤はクエン酸である。別の実施形態において、緩衝剤はクエン酸二水和物である。またさらなる又は追加の実施形態において、無菌のサルメテロール凍結乾燥物は、非イオン性界面活性剤をさらに含む。1つの実施形態において、凍結乾燥サルメテロール組成物は、さらに抗酸化剤を含む。
【0041】
本明細書にはまた、凍結乾燥サルメテロールまたはその薬学的に許容可能な塩および充填剤を含む無菌のサルメテロール凍結乾燥組成物が提供され、組成物は、水溶液によって再構成するにあたり、皮下の眼窩周囲または眼窩内用に適している。特定の実施形態において、組成物は、水溶液によって再構成するにあたり、皮下投与に適している。幾つかの実施形態において、組成物は凍結乾燥物の合計の組み合わせた乾燥重量の約3重量%未満の溶媒又は共溶媒を含む。さらなる又は追加の実施形態において、組成物は凍結乾燥物の合計の組み合わせた乾燥重量の約2重量%未満の溶媒又は共溶媒を含む。またさらなる実施形態において、組成物は、凍結乾燥物の合計の組み合わせた乾燥重量の約1重量%未満の溶媒又は共溶媒を含む。幾つかの実施形態において、溶媒又は共溶媒は、tert−ブチルアルコール、n−ブタノール、エタノール、イソプロピルアルコール、ジメチルスルホン、クロロブタノール、滅菌注射用蒸留水、0.9%の塩化ナトリウム溶液、5%のデキストロース溶液、またはそれらの混合物から選択される。またさらなる実施形態において、溶媒または共溶媒は、tert−ブチルアルコールまたはエタノールである。1つの実施形態において、共溶媒はエタノールである。別の実施形態において、組成物は、凍結乾燥物の合計の組み合わせた乾燥重量の約2重量%未満の水を含む。
【0042】
〈再構成されたサルメテロール製剤〉
第8の態様において、本明細書には、凍結乾燥サルメテロールまたはその薬学的に許容可能な塩および充填剤を含む凍結乾燥組成物から再構成された無菌のサルメテロール製剤が提供される。さらなる又は追加の実施形態において、無菌のサルメテロール製剤は、非イオン性界面活性剤、抗酸化剤、及び/又は緩衝剤をさらに含む凍結乾燥組成物から再構成されている。幾つかの実施形態において、無菌のサルメテロール製剤は、非イオン性界面活性剤をさらに含む凍結乾燥組成物から再構成されている。1つの実施形態において、無菌のサルメテロール製剤は、抗酸化剤をさらに含む凍結乾燥組成物から再構成されている。別の実施形態において、無菌のサルメテロール凍結乾燥組成物は、緩衝剤をさらに含む。幾つかの実施形態において、緩衝剤は、クエン酸又はクエン酸ナトリウム二水和物である。1つの実施形態において、緩衝剤はクエン酸である。別の実施形態において、緩衝剤はクエン酸二水和物である。
【0043】
幾つかの実施形態において、再構成された無菌のサルメテロール製剤は、滅菌注射用蒸留水、0.9%の塩化ナトリウム溶液、または5%のデキストロース溶液から選択される薬学的に許容可能な希釈剤をさらに含む。具体的な実施形態において、薬学的に許容可能な希釈剤は滅菌注射用蒸留水である。
【0044】
幾つかの実施形態において、再構成された無菌のサルメテロール製剤は、約25μg/ml以下の量で存在するサルメテロールを含む。さらなる又は追加の実施形態において、再構成された無菌のサルメテロール製剤は、約1μg/ml以下の量で存在するサルメテロールを含む。さらなる又は追加の実施形態において、再構成された無菌のサルメテロール製剤は、約2ng/mlから約25μg/mlの量で存在するサルメテロールを含む。またさらなる又は追加の実施形態において、再構成された無菌のサルメテロール製剤は、約2ng/mlから約1μg/mlの量で存在するサルメテロールを含む。
【0045】
またさらなる又は追加の実施形態において、再構成された無菌のサルメテロール製剤は、約4ng/mlから約750ng/mlの量で存在するサルメテロールを含む。幾つかの実施形態において、再構成された無菌のサルメテロール製剤は、約5ng/mlから約500ng/mlの量で存在するサルメテロールを含む。さらなる又は追加の実施形態において、再構成された無菌のサルメテロール製剤は、約10ng/mlから約250ng/mlの量で存在するサルメテロールを含む。幾つかの実施形態において、再構成された無菌のサルメテロール製剤は、約15ng/mlから約50ng/mlの量で存在するサルメテロールを含む。さらなる追加の実施形態において、再構成された無菌のサルメテロール製剤は、約20ng/mlから約25ng/mlの量で存在するサルメテロールを含む。1つの実施形態において、再構成された無菌のサルメテロール製剤は、約20ng/mlの量で存在するサルメテロールを含む。
【0046】
特定の実施形態において、再構成された無菌のサルメテロール製剤は、眼窩周囲又は眼窩内を含む皮下の注入のために調剤される。追加の実施形態において、再構成された無菌のサルメテロール製剤は、皮下投与のために調剤される。幾つかの実施形態において、再構成された無菌のサルメテロール製剤は、薬学的に許容可能な希釈剤中に溶解される。またさらなる実施形態において、溶解は約2分未満に生じる。さらなる実施形態において、溶解は約1分で生じる。まださらなる実施形態において、溶解は約1分未満に生じる。別のさらなる又は追加の実施形態において、溶解によって透明な溶液が生じる。
【0047】
〈フルチカゾンをさらに含む再構成されたサルメテロール製剤〉
第9の態様において、本明細書には、凍結乾燥サルメテロールまたはその薬学的に許容可能な塩および充填剤を含む凍結乾燥組成物から再構成された無菌のサルメテロール製剤が提供される。さらなる又は追加の実施形態において、無菌のサルメテロール製剤は、非イオン性界面活性剤、抗酸化剤、及び/又は緩衝剤をさらに含む凍結乾燥組成物から再構成されている。幾つかの実施形態において、無菌のサルメテロール製剤は、非イオン性界面活性剤をさらに含む凍結乾燥組成物から再構成されている。1つの実施形態において、無菌のサルメテロール製剤は、抗酸化剤をさらに含む凍結乾燥組成物から再構成されている。別の実施形態において、無菌のサルメテロール凍結乾燥組成物は、緩衝剤をさらに含む。幾つかの実施形態において、緩衝剤は、クエン酸又はクエン酸ナトリウム二水和物である。1つの実施形態において、緩衝剤はクエン酸である。別の実施形態において、緩衝剤はクエン酸二水和物である。
【0048】
幾つかの実施形態において、再構成された無菌のサルメテロール製剤は、サルメテロールを含み、およびフルチカゾンまたはその薬学的に許容可能な塩を含むようにさらに調剤される。いくつかの実施形態において、フルチカゾンは、無菌の凍結乾燥物組成物から再構成されている。他の実施形態において、フルチカゾンは、無菌の凍結乾燥物組成物から再構成されていない。幾つかの実施形態において、サルメテロールおよびフルチカゾンを含む再構成された無菌のサルメテロール製剤は、滅菌注射用蒸留水、0.9%の塩化ナトリウム溶液、または5%のデキストロース溶液から選択される薬学的に許容可能な希釈剤をさらに含む。特定の実施形態において、薬学的に許容可能な希釈剤は滅菌注射用蒸留水である。
【0049】
いくつかの実施形態において、凍結乾燥サルメテロールまたはその薬学的に許容可能な塩、充填剤、非イオン性の界面活性剤および抗酸化剤を含む凍結乾燥組成物から再構成されている無菌のサルメテロール製剤が提供され、製剤は、約100ng/mlから約100μg/mlの量で存在するフルチカゾンまたはその薬学的に許容可能な塩をさらに含む。さらなる又は追加の実施形態において、フルチカゾンは、約200ng/mlから約50μg/mlの量で存在する。幾つかの実施形態において、フルチカゾンは、約300ng/mlから約25μg/mlの量で存在する。また追加の実施形態において、フルチカゾンは、約500ng/mlから約15μg/mlの量で存在する。特定の実施形態において、フルチカゾンは、約600ng/mlから約10μg/mlの量で存在する。またさらなる又は追加の実施形態において、フルチカゾンは、約750ng/mlから約5μg/mlの量で存在する。幾つかの実施形態において、フルチカゾンは、約800ng/mlから約3μg/mlの量で存在する。また更なる実施形態において、フルチカゾンは、約900ng/mlから約2μg/mlの量で存在する。1つの実施形態において、フルチカゾンは、約1μg/mlの量で存在する。幾つかの実施形態において、サルメテロールおよびフルチカゾンを含む再構成された無菌の製剤は、皮下の眼窩周囲又は眼窩内の注入のために調剤される。特定の実施形態において、再構成された無菌の製剤は、注射による皮下投与のために調剤される。
【0050】
〈サルメテロールを使用する治療方法および美容方法〉
第10の態様において、本明細書には、凍結乾燥サルメテロールまたはその薬学的に許容可能な塩、および充填材を含む凍結乾燥組成物から再構成された無菌のサルメテロール製剤を、ヒトに投与又は提供する工程を含む、例えば、皮下投与によることを含む、美容方法又は治療方法が提供される。幾つかの実施形態において、凍結乾燥サルメテロール組成物は、非イオン性界面活性剤、抗酸化剤、及び/又は緩衝剤をさらに含む。幾つかの実施形態において、緩衝剤は、クエン酸又はクエン酸ナトリウム二水和物である。1つの実施形態において、緩衝剤はクエン酸である。別の実施形態において、緩衝剤はクエン酸二水和物である。いくつかの実施形態において、方法は、治療的である。さらなる又は追加の実施形態において、方法は美容的(cosmetic)である。
【0051】
幾つかの実施形態において、再構成された無菌のサルメテロール製剤は、腹部脂肪蓄積、地方脂肪過多および甲状腺眼症に起因する眼球突出から成る群から選択される兆候を処置するために(例えば、提供または投与によって)使用される。特定の実施形態において、再構成された無菌のサルメテロール製剤は、皮下に投与または提供される。幾つかの実施形態において、再構成された無菌のサルメテロール製剤は、ヒトに、眼窩周囲または眼窩内の注入として皮下に投与または提供される。幾つかの実施形態において、再構成された無菌のサルメテロール製剤は、ヒトに、腹部または眼領域に皮下に投与または提供される。更なる又は追加の実施形態において、製剤が、ヒトに、膝の内部領域、上腕の中間又は上方区域(三頭筋領域を含む)、頤下の領域(あごの下の領域(例えば、あごの肉(wattle))(それは患者の頤下の領域の皮膚の肉の襞(fleshy fold of skin)を指すと理解される)を含む)、腹部、腰、内腿、外腿、臀部、下背、背面上部または胸部へ投与または提供されることを特徴とする再構成されたサルメテロール製剤が提供される。
【0052】
さらなる実施形態において、本明細書には、凍結乾燥サルメテロールまたはその薬学的に許容可能な塩、および充填材を含む凍結乾燥組成物から再構成された無菌のサルメテロール製剤を、ヒトに投与又は提供する、例えば、皮下投与によることを含む、工程を含む美容方法が提供される。幾つかの実施形態において、凍結乾燥サルメテロール組成物は、非イオン性界面活性剤、抗酸化剤、及び/又は緩衝剤をさらに含む。幾つかの実施形態において、緩衝剤は、クエン酸又はクエン酸ナトリウム二水和物である。1つの実施形態において、緩衝剤はクエン酸である。別の実施形態において、緩衝剤はクエン酸二水和物である。いくつかの実施形態において、方法は、治療的である。さらなる又は追加の実施形態において、方法は美容的である。
【0053】
いくつかの実施形態において、再構成された無菌のサルメテロール製剤は、人体の姿、輪郭または外観に影響を与えるために、ヒトに、美容的に提供される。さらなる又は追加の実施形態において、姿、輪郭または外観は、ヒトの体の領域(例えば腹部)または眼の領域にある。特定の実施形態において、その製剤は、ヒトに、眼窩周囲または眼窩内の注射として皮下に投与または提供される。幾つかの実施形態において、無菌の再構成されたサルメテロール製剤は、ヒトに、ヒトの腹部または眼の領域に皮下に投与又は提供される。
【0054】
〈サルメテロール凍結乾燥組成物を製造する方法〉
第11の態様において、本明細書には、凍結乾燥された無菌のサルメテロール組成物を調製する方法が提供され、該方法は、(i)バルク溶液を形成するために、サルメテロールまたはその薬学的に許容可能な塩および充填剤を、溶媒又は共溶媒で可溶性にする工程;(ii)バルク溶液を殺菌する工程;及び(iii)凍結乾燥された無菌のキシナホ酸サルメテロール組成物を提供するために殺菌されたバルク溶液を凍結乾燥する工程を含む。幾つかの実施形態において、可溶化される凍結乾燥サルメテロール又はその薬学的に許容可能な塩は、非イオン性界面活性剤、抗酸化剤、及び/又は緩衝剤をさらに含む。幾つかの実施形態において、緩衝剤は、クエン酸又はクエン酸ナトリウム二水和物である。1つの実施形態において、緩衝剤はクエン酸である。別の実施形態において、緩衝剤はクエン酸二水和物である。
【0055】
1つの実施形態において、溶媒又は共溶媒は、tert−ブチルアルコール、n−ブタノール、エタノール、イソプロピルアルコール、ジメチルスルホン、クロロブタノール、滅菌注射用蒸留水、0.9%の塩化ナトリウム溶液、5%のデキストロース溶液、またはそれらの混合物から選択される。幾つかの実施形態において、溶媒は、tert−ブチルアルコールである。1つの実施形態において、溶媒はエタノールである。特定の実施形態において、バルク溶液の殺菌は、フィルタを介してバルク溶液を通すことを含む。またさらなる又は追加の実施形態において、フィルタは0.2ミクロンのフィルタである。幾つかの実施形態において、サルメテロールは、キシナホ酸サルメテロールである。
【0056】
いくつかの実施形態において、非イオン性界面活性剤は、以下から選択される:(N,N−ビス[3−(D−グルコアミド(gluconamido))プロピル]コラミド);ビス(ポリエチレングリコールビス[イミダゾイルカルボニル]);ポリオキシエチレングリコールドデシルエーテル;ポリオキシエチレングリセロールトリリシノリエート(ethylenglyceroltriricinoleate)35;デカエチレングリコールモノドデシルエーテル;N−デカノイル−N−メチルグルカミン;n−デシルα−D−グルコピラノシド;デシルβ−D−マルトピラノシド;n−ドデカノイル−N−メチルグルカミド;n−ドデシルα−D−マルトシド;n−ドデシルβ−D−マルトシド;n−ヘキサデシルβ−D−マルトシド;ヘプタエチレングリコールモノデシルエーテル;ヘプタエチレングリコールモノドデシルエーテル;ヘプタエチレングリコールモノテトラデシルエーテル;ヘキサエチレングリコールモノドデシルエーテル;ヘキサエチレングリコールモノヘキサデシルエーテル;ヘキサエチレングリコールモノオクタデシルエーテル;ヘキサエチレングリコールモノテトラデシルエーテル;オクチルフェニル−ポリエチレングリコール;メチル−6−O−(N−ヘプチルカルバモイル)−α−D−グルコピラノシド;ノナエチレングリコールモノドデシルエーテル;N−ノナノイル−N−メチルグルカミン;N−ノナノイル−N−メチルグルカミン;オクタエチレングリコールモノデシルエーテル;オクタエチレングリコールモノドデシルエーテル;オクタエチレングリコールモノヘキサデシルエーテル;オクタエチレングリコールモノオクタデシルエーテル;オクタエチレングリコールモノテトラデシルエーテル;オクチル−β−D−グルコピラノシド;ペンタエチレングリコールモノデシルエーテル;ペンタエチレングリコールモノドデシルエーテル;ペンタエチレングリコールモノヘキサデシルエーテル;ペンタエチレングリコールモノヘキシルエーテル;ペンタエチレングリコールモノオクタデシルエーテル;ペンタエチレングリコールモノオクチルエーテル;ポリエチレングリコールジグリシジルエーテル;ポリエチレングリコールエーテルW−1;ポリオキシエチレン10トリデシルエーテル;ポリオキシエチレン100ステアレート;ポリオキシエチレン20イソヘキサデシルエーテル;ポリオキシエチレン20オレイルエーテル;ポリオキシエチレン40ステアレート;ポリオキシエチレン50ステアレート;ポリオキシエチレン8ステアレート、ポリオキシエチレンビス(イミダゾリルカルボニル)、ポリオキシエチレン25プロピレングリコールステアレート;サポニン;ラウリン酸ソルビタン、ソルビタンモノパルミタート、ステアリン酸ソルビタン、トリステアリン酸ソルビタン、オレイン酸ソルビタン、トリオレイン酸ソルビタン;ポリエチレングリコールトリメチルノニルエーテル、ノニルフェノールエトキシレート;テトラデシル−β−D−マルトシド;テトラエチレングリコールモノデシルエーテル、テトラエチレングリコールモノドデシルエーテル、テトラエチレングリコールモノテトラデシルエーテル;トリエチレングリコールモノデシルエーテル、トリエチレングリコールモノドデシルエーテル、トリエチレングリコールモノヘキサデシルエーテル、トリエチレングリコールモノオクチルエーテル、トリエチレングリコールモノテトラデシルエーテル;オクトキシノール−9;オクチルフェノールエトキシレート;ポリソルベート20、ポリソルベート21、ポリソルベート40、ポリソルベート60、ポリソルベート61、ポリソルベート65、ポリソルベート80、ポリソルベート81、ポリソルベート85;チロキサポール;およびn−ウンデシルβ−D−グルコピラノシド。1つの実施形態において、非イオン性界面活性剤はポリソルベート80である。
【0057】
本明細書に記載の凍結乾燥された無菌のキシナホ酸サルメテロール組成物を調製する方法のいくつかの実施形態において、その方法において使用される充填剤は、ラクトース、マンニトール、デキストロースおよびスクロースからなる群から選択される。1つの実施形態において、充填剤はラクトース一水和物である。さらなる又は追加の実施形態において、無菌の凍結乾燥サルメテロール組成物は、抗酸化剤を含む。1つの実施形態において、抗酸化剤はアスコルビン酸である。別の実施形態において、抗酸化剤はブチルヒドロキシトルエンである。本明細書に記載の凍結乾燥された無菌のサルメテロール組成物を調製する方法のまたさらなる又は追加の実施形態において、バルク溶液は、約−35℃から約−25℃のガラス転移温度を有する。
【0058】
〈再構成されたサルメテロール製剤を製造する方法〉
第12の態様において、本明細書には、皮下注射に適している凍結乾燥された無菌のサルメテロール組成物を再構成によって調製するための方法が提供され、該方法は、充填剤をさらに含む凍結乾燥された無菌のサルメテロール組成物を、薬学的に許容可能な希釈剤または担体と接触させる工程を含む。幾つかの実施形態において、凍結乾燥された無菌の組成物は、非イオン性界面活性剤、抗酸化剤、及び/又は緩衝剤をさらに含む。幾つかの実施形態において、凍結乾燥物は、緩衝剤をさらに含む。更なる又は追加の実施形態において、緩衝剤は、クエン酸又はクエン酸ナトリウム二水和物である。1つの実施形態において、緩衝剤はクエン酸である。別の実施形態において、緩衝剤はクエン酸二水和物である。
【0059】
幾つかの実施形態において、薬学的に許容可能な希釈剤または担体は、滅菌注射用蒸留水、0.9%の塩化ナトリウム溶液、または5%のデキストロース溶液から選択される。1つの実施形態において、滅菌注射用蒸留水である薬学的に許容可能な希釈剤または担体は、再構成された無菌のサルメテロール製剤を提供するために、サルメテロール凍結乾燥物と接触される。さらなるまたは追加の実施形態において、再構成される無菌のサルメテロール凍結乾燥組成部物の非イオン性界面活性剤は、凍結乾燥物の合計の組み合わせた乾燥重量の約4%から約5%の量で、凍結乾燥サルメテロール組成物中に存在する。
【0060】
更なるまたは追加の実施形態において、皮下注入に適している無菌のサルメテロール組成物を再構成によって調製する方法は、約2分間の溶解の後のHPLCによって測定されると、再構成前の組成物中に存在する凍結乾燥サルメテロールの量の約50%から約100%までである組成物中の可溶化された又は溶解された量のサルメテロールを提供する。幾つかの実施形態において、皮下注入に適している無菌のサルメテロール組成物を再構成によって調製する方法は、2分間の溶解の後のHPLCによって測定される場合、再構成前の組成物中に存在する凍結乾燥サルメテロールの量の少なくとも約75%である組成物中の可溶化された溶解された量のサルメテロールを提供される。更なるまたは追加の実施形態において、皮下注入に適している無菌のサルメテロール組成物を再構成によって調製する方法は、約2分間の溶解の後のHPLCによって測定される場合、再構成前の組成物中に存在する凍結乾燥サルメテロールの量の約90%から約100%までである組成物中の可溶化された又は溶解された量のサルメテロールを提供される。またさらなる又は追加の実施形態において、皮下注入に適している無菌のサルメテロール製剤を再構成によって調整する方法は、製剤にフルチカゾンまたはその薬学的に許容可能な塩を加える工程をさらに含む。
【0061】
〈凍結乾燥されたフルチカゾンおよびサルメテロール組成物〉
第13の態様において、本明細書には、以下を含む無菌のフルチカゾンおよびサルメテロールの凍結乾燥組成物が提供される:(a)凍結乾燥フルチカゾンまたはその薬学的に許容可能な塩;(b)凍結乾燥サルメテロールまたはその薬学的に許容可能な塩;(c)充填剤;および(d)非イオン性表面活性剤。幾つかの実施形態において、凍結乾燥組成物は、抗酸化剤、及び/又は緩衝剤をさらに含む。さらなる実施形態において、凍結乾燥物は、緩衝剤をさらに含む。更なる実施形態において、緩衝剤は、クエン酸又はクエン酸ナトリウム二水和物である。1つの実施形態において、緩衝剤はクエン酸である。別の実施形態において、緩衝剤はクエン酸二水和物である。
【0062】
幾つかの実施形態において、サルメテロールは、キシナホ酸サルメテロールの塩形態である。さらなる又は追加の実施形態において、キシナホ酸サルメテロールは多形体である。特定の実施形態において、サルメテロール多形体は、多形Form Iである。追加の実施形態において、サルメテロール多形体は、Form IIである。またさらなる又は追加の実施形態において、サルメテロールは、結晶相、非晶相、半結晶相、半非晶相またはそれらの混合物で存在する。1つの実施形態において、サルメテロールは非晶質である。
【0063】
いくつかの実施形態において、フルチカゾンおよびサルメテロールの凍結乾燥組成物は、プロピオン酸フルチカゾンまたはフロ酸フルチカゾンを含む。1つの実施形態において、フルチカゾンはプロピオン酸フルチカゾンの塩形態である。幾つかの実施形態において、凍結乾燥フルチカゾンは、結晶相、非晶相、半結晶相、半非晶相またはそれらの混合物で存在する。さらなる又は追加の実施形態において、凍結乾燥フルチカゾン又はその薬学的に許容可能な塩は、結晶相、非晶相、半結晶相、半非晶相またはそれらの混合物で存在し;凍結乾燥サルメテロールは、結晶相、多形体の形態、非晶相、半結晶相、半非晶相またはそれらの混合物で存在する。
【0064】
さらなる又は追加の実施形態において、さらに抗酸化剤を含む無菌のフルチカゾンおよびサルメテロール凍結乾燥組成物が提供される。例えば、幾つかの実施形態において、抗酸化剤はアスコルビン酸またはブチルヒドロキシトルエンである。またさらなる又は追加の実施形態において、さらに緩衝剤を含む無菌のフルチカゾンおよびサルメテロール凍結乾燥組成物が提供される。幾つかの実施形態において、緩衝剤は、クエン酸又はクエン酸ナトリウム二水和物である。1つの実施形態において、緩衝剤はクエン酸である。別の実施形態において、緩衝剤はクエン酸二水和物である。
【0065】
いくつかの実施形態において、無菌のフルチカゾンおよびサルメテロール凍結乾燥組成物が提供され、フルチカゾン対サルメテロールの比は約200:1から約1:1までである。さらなる又は追加の実施形態において、フルチカゾン対サルメテロールの比は約150:1から約1:1までである。またさらなる又は追加の実施形態において、フルチカゾン対サルメテロールの比は約100:1から約1:1までである。またさらなる又は追加の実施形態において、フルチカゾン対サルメテロールの比は約50:1から約1:1までである。幾つかの実施形態において、フルチカゾン対サルメテロールの比は約20:1から約1:1までである。さらなる又は追加の実施形態において、フルチカゾン対サルメテロールの比は約10:1から約1:1までである。またさらなる又は追加の実施形態において、フルチカゾン対サルメテロールの比は約50:1である。
【0066】
本明細書にはまた、以下を含む無菌のフルチカゾンおよびサルメテロールの凍結乾燥組成物が提供され:(a)凍結乾燥フルチカゾンまたはその薬学的に許容可能な塩;(b)凍結乾燥サルメテロールまたはその薬学的に許容可能な塩;(c)充填剤;および(d)非イオン性表面活性剤、ここで、凍結乾燥フルチカゾンは、凍結乾燥物の合計の組み合わせた乾燥重量の約0.001重量%から約0.1重量%までの量で存在し、及びサルメテロールは、凍結乾燥物の合計の組み合わせた乾燥重量の約0.00001重量%から約0.1重量%までの量で存在する。本明細書に記載の無菌のフルチカゾンおよびサルメテロールの凍結乾燥組成物の特定の実施形態において、凍結乾燥フルチカゾンは、凍結乾燥物の合計の組み合わせた乾燥重量の約0.015重量%から約0.030重量%までの量で存在し、及び凍結乾燥サルメテロールは、凍結乾燥物の合計の組み合わせた乾燥重量の約0.0002重量%から約0.001重量%までの量で存在する。幾つかの実施形態において、無菌のフルチカゾンおよびサルメテロールの凍結乾燥組成物が提供され、ここで、凍結乾燥フルチカゾンは、凍結乾燥物の合計の組み合わせた乾燥重量の約0.017重量%から約0.023重量%までの量で存在し、及びサルメテロールは、凍結乾燥物の合計の組み合わせた乾燥重量の約0.00034重量%から約0.00046重量%までの量で存在する。
【0067】
本明細書には、以下を含む無菌のフルチカゾンおよびサルメテロールの凍結乾燥組成物が記載され:(a)凍結乾燥フルチカゾンまたはその薬学的に許容可能な塩;(b)凍結乾燥サルメテロールまたはその薬学的に許容可能な塩;(c)充填剤;および(d)非イオン性表面活性剤、ここで、凍結乾燥フルチカゾンは、約500μg/g以下である量で存在し、および凍結乾燥サルメテロールは、約250μg/g以下の量で存在する。特定の実施形態において、凍結乾燥フルチカゾンは、約1μg/gから約500μg/gの量で存在し、および凍結乾燥サルメテロールは、約100ng/gから約250μg/gの量で存在する。また追加の実施形態において、凍結乾燥フルチカゾンは、約5μg/gから約350μg/gの量で存在し、および凍結乾燥サルメテロールは、約250ng/gから約200μg/gの量で存在する。特定の実施形態において、凍結乾燥フルチカゾンは、約15μg/gから約300μg/gの量で存在し、および凍結乾燥サルメテロールは、約500ng/gから約150μg/gの量で存在する。いくつかの実施形態において、凍結乾燥フルチカゾンは、約20μg/gから約250μg/gの量で存在し、および凍結乾燥サルメテロールは、約1μg/gから約100μg/gの量で存在する。またさらなる実施形態において、凍結乾燥フルチカゾンは、約30μg/gから約200μg/gの量で存在し、および凍結乾燥サルメテロールは、約2μg/gから約50μg/gの量で存在する。また更なる又は追加の実施形態において、凍結乾燥フルチカゾンは、約100μg/gから約300μg/gの量で存在し、および凍結乾燥サルメテロールは、約3μg/gから約25μg/gの量で存在する。幾つかの実施形態において、凍結乾燥フルチカゾンは、約200μg/gから約300μg/gの量で存在し、および凍結乾燥サルメテロールは、約4μg/gから約15μg/gの量で存在する。幾つかの実施形態において、凍結乾燥フルチカゾンは、約200μg/gから約300μg/gの量で存在し、および凍結乾燥サルメテロールは、約5μg/gから約10μg/gの量で存在する。また更なる又は追加の実施形態において、凍結乾燥フルチカゾンは、約150μg/gの量で存在し、および凍結乾燥サルメテロールは、約6μg/gから約8μg/gの量で存在する。
【0068】
いくつかの実施形態において、以下を含む無菌のフルチカゾンおよびサルメテロールの凍結乾燥組成物が提供され:(a)凍結乾燥フルチカゾンまたはその薬学的に許容可能な塩;(b)凍結乾燥サルメテロールまたはその薬学的に許容可能な塩;(c)充填剤;および(d)非イオン性表面活性剤、ここで、凍結乾燥フルチカゾンは、約50μg/g以下の量で存在し、および凍結乾燥サルメテロールは、約500ng/g以下の量で存在する。幾つかの実施形態において、凍結乾燥フルチカゾンは、約1μg/gから約50μg/gの量で存在し、および凍結乾燥サルメテロールは、約25ng/gから約500ng/gの量で存在する。特定の実施形態において、凍結乾燥フルチカゾンは、約5μg/gから約35μg/gの量で存在し、および凍結乾燥サルメテロールは、約100ng/gから約350ng/gの量で存在する。1つの実施形態において、凍結乾燥フルチカゾンは、約9μg/gから約20μg/gの量で存在し、および凍結乾燥サルメテロールは、約200ng/gから約250ng/gの量で存在する。
【0069】
更なる又は追加の実施形態において、以下のものを含む無菌のフルチカゾン及びサルメテロール凍結乾燥組成物が提供される:(a)凍結乾燥フルチカゾン又はその薬学的に許容可能な塩;(b)凍結乾燥サルメテロール又はその薬学的に許容可能な塩;(c)充填剤;及び(d)非イオン性界面活性剤、ここで非イオン性界面活性剤は、(N,N−ビス[3−(D−グルコアミド)プロピル]コラミド);ビス(ポリエチレングリコールビス[イミダゾイルカルボニル]);ポリオキシエチレングリコールドデシルエーテル;ポリオキシエチレングリセロールトリリシノリエート35;デカエチレングリコールモノドデシルエーテル;N−デカノイル−N−メチルグルカミン;n−デシルα−D−グルコピラノシド;デシルβ−D−マルトピラノジド;n−ドデカノイル−N−メチルグルカミド;n−ドデシルα−D−マルトシド;n−ドデシルβ−D−マルトシド;n−ヘキサデシルβ−D−マルトシド;ヘプタエチレングリコールモノデシルエーテル;ヘプタエチレングリコールモノドデシルエーテル;ヘプタエチレングリコールモノテトラデシルエーテル;ヘキサエチレングリコールモノドデシルエーテル;ヘキサエチレングリコールモノヘキサデシルエーテル;ヘキサエチレングリコールモノオクタデシルエーテル;ヘキサエチレングリコールモノテトラデシルエーテル;オクチルフェニル−ポリエチレングリコール;メチル−6−O−(N−へプチルカルバモイル)−α−D−グルコピラノシド;ノナエチレングリコールモノドデシルエーテル;N−ノナノイル−N−メチルグルカミン;N−ノナノイル−N−メチルグルカミン;オクタエチレングリコールモノデシルエーテル;オクタエチレングリコールモノドデシルエーテル;オクタエチレングリコールモノヘキサデシルエーテル;オクタエチレングリコールモノオクタデシルエーテル;オクタエチレングリコールモノテトラデシルエーテル;オクチル−β−D−グルコピラノシド;ペンタエチレングリコールモノデシルエーテル;ペンタエチレングリコールモノドデシルエーテル;ペンタエチレングリコールモノヘキサデシルエーテル;ペンタエチレングリコールモノヘキシルエーテル;ペンタエチレングリコールモノオクタデシルエーテル;ペンタエチレングリコールモノオクチルエーテル;ポリエチレングリコールジグリシジルエーテル;ポリエチレングリコールエーテルW−1;ポリオキシエチレン10トリデシルエーテル;ポリオキシエチレン100ステアレート;ポリオキシエチレン20イソヘキサデシルエーテル;ポリオキシエチレン20オレイルエーテル;ポリオキシエチレン40ステアレート;ポリオキシエチレン50ステアレート;ポリオキシエチレン8ステアレート、ポリオキシエチレンビス(イミダゾリルカルボニル)、ポリオキシエチレン25プロピレングリコールステアレート;サポニン;ラウリン酸ソルビタン、ソルビタンモノパルミタート、ステアリン酸ソルビタン、トリステアリン酸ソルビタン、オレイン酸ソルビタン、トリオレイン酸ソルビタン;ポリエチレングリコールトリメチルノニルエーテル、ノニルフェニルエトキシラート;テトラデシル−β−D−マルトシド;テトラエチレングリコールモノデシルエーテル、テトラエチレングリコールモノドデシルエーテル、テトラエチレングリコールモノテトラデシルエーテル;トリエチレングリコールモノデシルエーテル、トリエチレングリコールモノドデシルエーテル、トリエチレングリコールモノヘキサデシルエーテル、トリエチレングリコールモノオクチルエーテル、トリエチレングリコールモノテトラデシルエーテル;オクトキシノール−9;オクチルフェノ−ルエトキシラート;ポリソルベート20、ポリソルベート21、ポリソルベート40、ポリソルベート60、ポリソルベート61、ポリソルベート65、ポリソルベート80、ポリソルベート81、ポリソルベート85;チロキサポール;及びn−ウンデシルβ−D−グルコピラノシドから選択される。1つの実施形態において、非イオン性界面活性剤はポリソルベート80である。また更なる又は追加の実施形態において、充填剤は、ラクトース、マンニトール、デキストロース、及びサッカロースから成る群から選択される。1つの実施形態において、充填剤はラクトースである。幾つかの実施形態において、充填剤はラクトース一水和物である。
【0070】
無菌のフルチカゾン及びサルメテロール凍結乾燥組成物の幾つかの実施形態において、非イオン性界面活性剤は、凍結乾燥物の合計の組み合わせた乾燥重量の約1.0重量%から約10重量%までに存在し、又は充填剤は、凍結乾燥物の合計の組み合わせた乾燥重量の約90重量%から約99重量%までの量で存在する。更なる又は追加の実施形態において、非イオン性界面活性剤は、凍結乾燥物の合計の組み合わせた乾燥重量の約2.5重量%から約7.5重量%までに存在し、又は充填剤は、凍結乾燥物の合計の組み合わせた乾燥重量の約93重量%から約97重量%の量で存在する。また追加の実施形態において、非イオン性界面活性剤は、凍結乾燥物の合計の組み合わせた乾燥重量の約4.2重量%から約5.8重量%までに存在し、又は充填剤は、凍結乾燥物の合計の組み合わせた乾燥重量の約95重量%の量で存在する。
【0071】
本明細書で提供される無菌のフルチカゾン及びサルメテロール凍結乾燥組成物の更なる又は追加の実施形態において、組成物は、水溶液によって再構成されるにあたり、皮下投与、眼窩周囲投与、眼窩内投与、又は筋肉内投与に適する。幾つかの実施形態において、組成物は、水溶液によって再構成されるにあたり、皮下投与に適する。また更なる又は追加の実施形態において、組成物は凍結乾燥物の合計の組み合わせた乾燥重量の約3重量%未満の溶媒又は共溶媒を含む。特定の実施形態において、組成物は凍結乾燥物の合計の組み合わせた乾燥重量の約2重量%未満の溶媒又は共溶媒を含む。幾つかの実施形態において、組成物は凍結乾燥物の合計の組み合わせた乾燥重量の約1重量%未満の溶媒又は共溶媒を含む。また更なる又は追加の実施形態において、組成物は凍結乾燥物の合計の組み合わせた乾燥重量の約2重量%未満の水を含む。特定の実施形態において、組成物は約0℃から約50℃の温度で少なくとも4週の期間の間安定している。また更なる又は追加の実施形態において、組成物は約0℃から約50℃の温度で少なくとも6か月の期間の間安定している。
【0072】
〈再構成されたフルチカゾン及びサルメテロール製剤〉
第14の態様において、フルチカゾン又はその薬学的に許容可能な塩;サルメテロール又はその薬学的に許容可能な塩;充填剤;および非イオン性界面活性剤を含んだ凍結乾燥された組成物から再構成される、無菌の製剤が提供される。幾つかの実施形態において、凍結乾燥された組成物は、酸化防止剤をさらに含む。幾つかの実施形態において、凍結乾燥された無菌の組成物は、酸化防止剤及び/又は緩衝剤をさらに含む。幾つかの実施形態において、凍結乾燥物は緩衝剤をさらに含む。更なる又は追加の実施形態において、緩衝剤はクエン酸又はクエン酸ナトリウム二水和物である。1つの実施形態において、緩衝剤はクエン酸である。別の実施形態において、緩衝剤はクエン酸二水和物である。
【0073】
幾つかの実施形態において、再構成された無菌の製剤は、滅菌注射用蒸留水、0.9%の塩化ナトリウム溶液、又は5%のデキストロ−ス溶液から選択される薬学的に許容可能な希釈剤をさらに含んだ。1つの実施形態において、薬学的に許容可能な希釈剤は滅菌注射用蒸留水である。
【0074】
幾つかの実施形態において、再構成された無菌の製剤は、約100μg/ml以下の量で存在する再構成されたフルチカゾン、及び約25μg/ml以下の量で存在する再構成されたサルメテロールをさらに含む。幾つかの実施形態において、再構成されたフルチカゾンは約100ng/mlから約100μg/mlまでの量で存在し、及び再構成されたサルメテロールは約2ng/mlから約25μg/mlまでの量で存在する。更なる又は追加の実施形態において、再構成されたフルチカゾンは約200ng/mlから約50μg/mlまでの量で存在し、及び再構成されたサルメテロールは約2ng/mlから約1μg/mlまでの量で存在する。また更なる又は追加の実施形態において、再構成されたフルチカゾンは約300ng/mlから約25μg/mlまでの量で存在し、及び再構成されたサルメテロールは約2ng/mlから約1μg/mlまでの量で存在する。特定の実施形態において、再構成されたフルチカゾンは約400ng/mlから約20μg/mlまでの量で存在し、及び再構成されたサルメテロールは約4ng/mlから約750ng/mlまでの量で存在する。また更なる実施形態において、再構成されたフルチカゾンは約500ng/mlから約15μg/mlまでの量で存在し、及び再構成されたサルメテロールは約5ng/mlから約500ng/mlまでの量で存在する。幾つかの実施形態において、再構成されたフルチカゾンは約600ng/mlから約10μg/mlまでの量で存在し、及び再構成されたサルメテロールは約10ng/mlから約250ng/mlまでの量で存在する。幾つかの実施形態において、再構成されたフルチカゾンは約750ng/mlから約5μg/mlまでの量で存在し、及び再構成されたサルメテロールは約15ng/mlから約50ng/mlまでの量で存在する。また更なる又は追加の実施形態において、再構成されたフルチカゾンは約800ng/mlから約3μg/mlまでの量で存在し、及び再構成されたサルメテロールは約20ng/mlから約25ng/mlまでの量で存在する。幾つかの実施形態において、再構成されたフルチカゾンは約900ng/mlから約2μg/mlの量で存在し、及び再構成されたサルメテロールは約20ng/mlから約25ng/mlまでの量で存在する。1つの実施形態において、再構成されたフルチカゾンは約1μg/mlの量で存在し、及び再構成されたサルメテロールは約20ng/mlの量で存在する。
【0075】
幾つかの実施形態において、フルチカゾン又はその薬学的に許容可能な塩;サルメテロール又はその薬学的に許容可能な塩;充填剤;および非イオン性界面活性剤を含んだ凍結乾燥された組成物から再構成される、無菌の製剤が本明細書で提供される。ここで、製剤は、再構成の前に存在する凍結乾燥フルチカゾンの量の少なくとも約50%である可溶化された又は溶解された量のフルチカゾン、及び/又は約2分の溶解の後にHPLCによって測定されると、再構成の前に存在する凍結乾燥サルメテロールの量の少なくとも約50%である可溶化された又は溶解された量のサルメテロールを提供する。幾つかの実施形態において、無菌の再構成された製剤は、再構成の前に存在する凍結乾燥フルチカゾンの量の少なくとも約60%である可溶化された又は溶解された量のフルチカゾン、及び/又は約2分の溶解の後にHPLCによって測定されると、再構成の前に存在する凍結乾燥サルメテロールの量の少なくとも約60%である可溶化された又は溶解された量のサルメテロールを提供する。更なる又は追加の実施形態において、無菌の再構成された製剤は、再構成の前に存在する凍結乾燥フルチカゾンの量の少なくとも約75%である可溶化された又は溶解された量のフルチカゾン、及び/又は約2分の溶解の後にHPLCによって測定されると、再構成の前に存在する凍結乾燥サルメテロールの量の少なくとも約75%である可溶化された又は溶解された量のサルメテロールを提供する。また更なる又は追加の実施形態において、無菌の再構成された製剤は、再構成の前に存在する凍結乾燥フルチカゾンの量の約90%から約100%である可溶化された又は溶解された量のフルチカゾン、及び/又は約2分の溶解の後にHPLCによって測定されると、再構成の前に存在する凍結乾燥サルメテロールの量の少なくとも約90%から100%である可溶化された又は溶解された量のサルメテロールを提供する。
【0076】
1つの実施形態において、フルチカゾン又はその薬学的に許容可能な塩;サルメテロール又はその薬学的に許容可能な塩;充填剤;および非イオン性界面活性剤を含んだ凍結乾燥された組成物から再構成される、無菌の製剤が本明細書で提供される。ここで、非イオン性界面活性剤は、凍結乾燥物の合計の組み合わせた乾燥重量の約4%から約5%の量で再構成前の凍結乾燥組成物で存在した。特定の実施形態において、再構成された無菌の製剤は皮下投与のために調剤される。更なる又は追加の実施形態において、再構成された無菌の製剤は、薬学的に許容可能な希釈剤中のサルメテロール及びフルチカゾンを含む凍結乾燥物を溶解することにより形成される。幾つかの実施形態において、溶解は約2分未満で生じる。更なる又は追加の実施形態において、溶解は約1分で生じる。また他の実施形態において、溶解は約1分未満で生じる。1つの実施形態において、溶解により透明な溶液がもたらされる。
【0077】
〈フルチカゾン及びサルメテロールを使用する治療方法及び美容方法〉
第15の実施形態において、フルチカゾン又はその薬学的に許容可能な塩;サルメテロール又はその薬学的に許容可能な塩;充填剤;および非イオン性界面活性剤を含んだ凍結乾燥された組成物から再構成される無菌のフルチカゾン及びサルメテロール製剤を、ヒトに投与する工程又は提供する、例えば、皮下投与によることを含む、工程を含む治療方法及び美容方法が本明細書で提供される。幾つかの実施形態において、凍結乾燥された組成物は抗酸化剤をさらに含む。幾つかの実施形態において、凍結乾燥された無菌の組成物は抗酸化剤及び/又は緩衝剤をさらに含む。幾つかの実施形態において、凍結乾燥物は緩衝剤を含む。更なる又は追加の実施形態において、緩衝剤はクエン酸又はクエン酸ナトリウム二水和物である。1つの実施形態において、緩衝剤はクエン酸である。別の実施形態において、緩衝剤はクエン酸二水和物である。
【0078】
幾つかの実施形態において、再構成された無菌の製剤は、滅菌注射用蒸留水、0.9%の塩化ナトリウム溶液、又は5%のデキストロ−ス溶液から選択される薬学的に許容可能な希釈剤をさらに含む。1つの実施形態において、薬学的に許容可能な希釈剤は滅菌注射用蒸留水である。幾つかの実施形態において、方法は治療的である。更なる又は追加の実施形態において、方法は美容的である。
【0079】
幾つかの実施形態において、再構成された無菌のサルメテロール及びフルチカゾン製剤は、腹部脂肪蓄積、局所脂肪過多、及び甲状腺眼症に起因する眼球突出からなる群から選択される兆候を処置するために(例えば供給又は投与によって)使用される。特定の実施形態において、再構成された無菌のサルメテロール及びフルチカゾン製剤は皮下に投与又は提供される。幾つかの実施形態において、再構成された無菌のサルメテロール及びフルチカゾン製剤は、ヒトに、眼窩周囲又は眼窩内の注入として皮下に投与又は提供される。幾つかの実施形態において、再構成された無菌のサルメテロール及びフルチカゾン製剤は、ヒトに、腹部又は眼領域に皮下に投与又は提供される。更なる又は追加の実施形態において、再構成された無菌のサルメテロール及びフルチカゾン製剤が提供され、ここで、製剤は、ヒトに、膝の内部領域、上腕の中間又は上方区域(三頭筋領域を含む)、頤下の領域(あごの上の領域、例えばあごの肉(それは患者の頤下の領域の皮膚の肉の壁を指すと理解される)を含む)、腹部、腰、内腿、外腿、殿部、下背、背面上部又は胸部へ投与又は提供される。
【0080】
更なる実施形態において、凍結乾燥されたサルメテロール又はその薬学的に許容可能な塩、凍結乾燥されたフルチカゾン又はその薬学的に許容可能な塩、充填剤および非イオン性界面活性剤を含んだ凍結乾燥された組成物から再構成された無菌のフルチカゾン及びサルメテロール製剤を、ヒトに投与する工程又は提供する、例えば、皮下投与によることを含む、工程を含む美容方法が本明細書で提供される。幾つかの実施形態において、凍結乾燥された組成物は抗酸化剤をさらに含む。
【0081】
幾つかの実施形態において、再構成された無菌のサルメテロール及びフルチカゾン製剤は、人体の姿、輪郭、又は外観に影響を与えるため、ヒトに美容的に提供される。更なる又は追加の実施形態において、姿、輪郭、又は外観は、ヒトの体の領域(例えば、腹部)又は眼領域である。特定の実施形態において、製剤は、ヒトに、眼窩周囲又は眼窩内の注入として皮下に投与又は提供される。幾つかの実施形態において、無菌の再構成されたフルチカゾン及びサルメテロール製剤は、ヒトに、ヒトの腹部又は眼の領域に皮下に投与又は提供される。
【0082】
〈フルチカゾン及びサルメテロール凍結乾燥物を製造する方法〉
第16の態様において、以下のものを含む凍結乾燥された無菌の組成物を調製する方法が本明細書で提供される:(i)バルク溶液を形成するため、溶媒又は共溶媒で、フルチカゾン又はその薬学的に許容可能な塩、サルメテロール又はその薬学的に許容可能な塩、充填剤、非イオン性界面活性剤、及び随意に酸化防止剤を可溶性にする工程;(ii)バルク溶液を殺菌する工程;及び(iii)凍結乾燥された無菌の組成物を提供するために殺菌されたバルク溶液を凍結乾燥する工程。幾つかの実施形態において、可溶化工程は、抗酸化剤及び/又は緩衝剤を可溶性にする工程をさらに含む。幾つかの実施形態において、可溶化工程は緩衝剤を可溶性にする工程をさらに含む。更なる又は追加の実施形態において、緩衝剤はクエン酸又はクエン酸ナトリウム二水和物である。1つの実施形態において、緩衝剤はクエン酸である。別の実施形態において、緩衝剤はクエン酸二水和物である。
【0083】
幾つかの実施形態において、溶媒又は共溶媒は、tert−ブチルアルコール、n−ブタノール、エタノール、イソプロピルアルコール、ジメチルスルホン、クロロブタノール、滅菌注射用蒸留水、0.9%の塩化ナトリウム溶液、5%のデキストロ−ス溶液、又はその混合物から選択される。特定の実施形態において、本明細書に記載の方法は、バルク溶液をフィルタに通す工程を含む、バルク溶液を殺菌する工程をさらに含む。1つの実施形態において、フィルタは0.2ミクロンのフィルタである。更なる又は追加の実施形態において、バルク溶液は、約−35℃から約−25℃のガラス転移温度を有する。幾つかの実施形態において、凍結乾燥されたフルチカゾン及び/又はサルメテロールは非晶相にある。また更なる又は追加の実施形態において、凍結乾燥された組成物内の非イオン性界面活性剤は、凍結乾燥物の合計の組み合わせた乾燥重量の約5.0重量%の量で存在する。
【0084】
〈フルチカゾン及びサルメテロール凍結乾燥物を再構成する方法〉
第17の態様において、薬学的に許容可能な希釈剤又は担体と、以下のものを含む凍結乾燥された物質とを接触させる工程を含む、皮下注射に適した製剤を調製する方法が本明細書で提供される:(a)凍結乾燥されたフルチカゾン又はその薬学的に許容可能な塩;(b)凍結乾燥されたサルメテロール又はその薬学的に許容可能な塩;(c)充填剤;及び(d)非イオン性界面活性剤。幾つかの実施形態において、凍結乾燥された物質は抗酸化剤をさらに含む。幾つかの実施形態において、凍結乾燥された物質は抗酸化剤及び/又は緩衝剤をさらに含む。幾つかの実施形態において、凍結乾燥物質(lyophile material)は緩衝剤をさらに含む。更なる又は追加の実施形態において、緩衝剤はクエン酸又はクエン酸ナトリウム二水和物である。1つの実施形態において、緩衝剤はクエン酸である。別の実施形態において、緩衝剤はクエン酸二水和物である。
【0085】
幾つかの実施形態において、再構成された無菌のフルチカゾン及びサルメテロール製剤は、滅菌注射用蒸留水、0.9%の塩化ナトリウム溶液、又は5%のデキストロ−ス溶液から選択される薬学的に許容可能な希釈剤又は担体をさらに含む。幾つかの実施形態において、薬学的に許容可能な希釈剤又は担体は、滅菌注射用蒸留水である。特定の実施形態において、非イオン性界面活性剤は、凍結乾燥物の合計の組み合わせた乾燥重量の約4重量%から約5重量%の量で存在する。また更なる又は追加の実施形態において、方法は、再構成の前の組成物に存在する凍結乾燥フルチカゾンの量の約90%から約100%である可溶化された又は溶解された量のフルチカゾン、又は約2分の溶解の後にHPLCによって測定されると、再構成の前の組成物に存在する凍結乾燥サルメテロールの量の約90%から約100%までである可溶化された又は溶解された量のサルメテロールを提供する。
【0086】
〈治療上及び美容上の使用のためのキット〉
第17の態様において、治療上及び美容上の使用のためのキットが本明細書で提供される。1つの実施形態において、以下のものを含むキットが提供される:(a)凍結乾燥されたフルチカゾン及び/又は凍結乾燥されたサルメテロールを含むバイアル;(b)薬学的に許容可能な希釈剤又は担体を含むバイアル;(c)注射器;及び(d)凍結乾燥された物質の再構成及び随意にヒトへの投与に関する指示書。幾つかの実施形態において、キットはフルチカゾンを含む凍結乾燥された物質を中に含むバイアルを含む。更なる又は追加の実施形態において、キットはサルメテロールを含む凍結乾燥された物質を中に含むバイアルを含む。更なる又は追加の実施形態において、凍結乾燥フルチカゾン及び凍結乾燥サルメテロールを含む凍結乾燥された物質を中に含む、単一のバイアルを含むキットが提供される。また更なる又は追加の実施形態において、滅菌注射用蒸留水、0.9%の塩化ナトリウム溶液、又は5%のデキストロ−ス溶液から選択される薬学的に許容可能な希釈剤又は担体を含むキットが提供される。また更なる又は追加の実施形態において、注射器を含むキットが提供され、ここで注射器は、針を含むもの、針が無いもの、又は皮下への塗布具を含むものである。
【図面の簡単な説明】
【0087】
本明細書に記載の実施形態の特徴は、添付の請求項における特殊性により説明される。本明細書に現在記載される特徴及び利点のより良い理解は、原理が利用される実例となる実施形態を説明する以下の詳細な説明に対する引用、及び以下の添付の図面によって得られるであろう。
【図1】プロピオン酸フルチカゾン凍結乾燥物の調製に関する例示となるプロセスの概略図である。
【図2】キシナホ酸サルメテロール凍結乾燥物の調製に関する例示となるプロセスの概略図である。
【図3】プロピオン酸フルチカゾン凍結乾燥物及びキシナホ酸サルメテロール凍結乾燥物の調製に関する例示となるプロセスの概略図である。
【発明を実施するための形態】
【0088】
〈発明の詳細な説明〉
伝統的に、懸濁形態は、異なる疾病を処置するための様々な治療剤を送達するために使用されてきた。それらはしかしながら、凝集及び/又は集合により身体的な不安定性を対象とする。懸濁は、ひとたび投与されると意図された処置の部位で分散する薬中の治療剤の能力と、そのバイオアベイラビリティとの両方に影響を与える。プロピオン酸フルチカゾンは、承認学名S−フルオロメチル−6α,9α−ジフルオロ−11β−ヒドロキシ−16α−メチル−17α−プロピオニルオキシ−3−オキサンドロスタ(oxandrosta)−1,4−ジエン−17α−カルボチオエート(carbothioate)、局所的な抗炎症作用を示すと知られるコルチコステロイドである。エアロゾル形態において、プロピオン酸フルチカゾンは微粒子化によって従来通りに調製される。プロピオン酸フルチカゾンはまた、特定の溶媒と混合されると懸濁液を形成する。フルチカゾンを使用する疾病の有効な局所処置は、処置の部位にわたって効果的に分散される粉末剤又は懸濁液に含まれるフルチカゾンの能力によって限定される。この限定は、フルチカゾンでの幾つかの疾病の処置を非実用的なものにする。さらに、治療剤を含む溶液形態の使用が望ましい一方で、治療剤が長時間の間溶液中にある場合、治療剤は崩壊すると知られているため、治療剤は有効なものではない。
【0089】
フルチカゾン又はサルメテロール又はそれらの組合せを含む組成物の凍結乾燥された形態が本明細書に記載され、それらは適切な溶媒において再構成されると、溶液を適切な0.2ミクロンのフィルタに通すことにより無菌的に殺菌され、続いて非経口の(例えば、皮下、眼窩周囲、眼窩内、及び筋肉内)投与のために皮下に投与される、非懸濁(例えば、可溶性の)形態を提供する。再構成された非懸濁形態は、他の実施形態において、ひとたび投与されると意図された処置の部位に分散してすぐに生物学的に利用可能となる透明溶液を提供する。さらに、本明細書に記載の組成物の凍結乾燥形態は、実質的により安定した形態を提供し、それは必要な場合、ほんの一例として投与前に非懸濁の注入可能な形態を提供する滅菌注射用蒸留水などの、許容可能な溶媒系で再構成することができる。さらに、本明細書記載の実施形態は、ほんの一例ではあるが20秒などの比較的短い期間の間、凍結乾燥ケ−キ製剤と許容可能な溶媒又は担体を含むバイアルを単に振ることによって、再構成された形態を提供する。本明細書に記載されるようなそのような安定した形態は、他の実施形態において、長時間の間様々な温度で安定している。さらに、透明な溶液は無菌ろ過を許容し、サルメテロール及び/又はフルチカゾン薬物製品の安定性を含む最終滅菌などの滅菌技術の要求の必要性を取り除く。
【0090】
本明細書に記載の凍結乾燥された組成物及び再構成された製剤は、既存技術の組成物及び製剤に多数の利点を提供する。例えば、幾つかの実施形態において、孤立して本明細書で提供される組成物及び製剤の活性成分は、水溶液における可溶性が乏しい。本明細書でより詳しく議論されるように、凍結乾燥溶媒を含む共溶媒が提供される。本明細書に記載されるように、特定の実施形態において、共溶媒は、本明細書に記載の製剤および組成物の乏しい水溶性の活性成分を可溶性にするために利用され、その結果、それらは無菌的に濾過される。充填剤も記載される。充填剤は、幾つかの実施形態において、乏しい可溶性の活性成分(非晶形態及び結晶形態を含む)の凍結乾燥を促進するために利用される。さらに、非イオン性界面活性剤が本明細書に記載される。特定の実施形態において、非イオン性界面活性剤は、乏しい水溶性の活性成分(フルチカゾン及びサルメテロールを含む)を含む凍結乾燥された組成物のより遅い再構成を促進するために利用される。例えば、特定の状況において、非イオン性界面活性剤は、極性溶媒がある所で、凍結乾燥された疎水性の活性成分を溶液に入れる(force into)ことを必要とする。
【0091】
特定の実施形態において、凍結乾燥されたフルチカゾン又はその薬学的に許容可能な塩、充填剤及び非イオン性界面活性剤を含む凍結乾燥フルチカゾン組成物が本明細書に記載される。更なる又は追加の実施形態において、凍結乾燥されたフルチカゾン又はその薬学的に許容可能な塩、充填剤及び非イオン性界面活性剤を含む凍結乾燥された組成物から再構成された無菌のフルチカゾン組成物が提供される。更なる又は追加の実施形態において、再構成前に、凍結乾燥されたフルチカゾン又はその薬学的に許容可能な塩、充填剤及び非イオン性界面活性剤を含む再構成された無菌のフルチカゾン製剤を、ヒトに、皮下に投与又は提供する工程を含む美容方法及び/又は治療方法が提供される。また、以下のものを含む凍結乾燥された無菌のフルチカゾン組成物を調製する方法も本明細書で提供される:(i)バルク溶液を形成するため、溶媒又は共溶媒で、フルチカゾン又はその薬学的に許容可能な塩;充填剤、及び非イオン性界面活性剤を可溶性にする工程;(ii)バルク溶液を殺菌する工程;及び(iii)凍結乾燥された無菌のフルチカゾン組成物を提供するために殺菌されたバルク溶液を凍結乾燥する工程。また更なる又は追加の実施形態において、充填剤と非イオン性界面活性剤をさらに含む凍結乾燥された無菌のフルチカゾン組成物と、薬学的に許容可能な希釈剤又は担体を接触させる工程を含む、皮下注射に適したフルチカゾン製剤を調製する再構成方法が提供される。
【0092】
また、特定の実施形態において、凍結乾燥されたサルメテロール又はその薬学的に許容可能な塩及び充填剤を含む凍結乾燥サルメテロール組成物が本明細書に記載される。幾つかの実施形態において、サルメテロール凍結乾燥物は、非イオン性界面活性剤、酸化防止剤、及び/又は緩衝剤をさらに含む。幾つかの実施形態において、サルメテロール又はその薬学的に許容可能な塩及び充填剤から再構成された無菌のサルメテロール製剤が提供される。幾つかの実施形態において、再構成前に、凍結乾燥されたサルメテロール又はその薬学的に許容可能な塩及び充填剤を含む再構成された無菌のサルメテロール製剤を、ヒトに、皮下に投与又は提供する工程を含む美容方法及び/又は治療方法がさらに提供される。幾つかの実施形態において、以下のものを含む凍結乾燥された無菌のサルメテロール組成物を調製する方法が本明細書で提供される:(i)バルク溶液を形成するため溶媒又は共溶媒で、サルメテロール又はその薬学的に許容可能な塩及び充填剤、そして随意に緩衝剤を可溶性にする工程;(ii)バルク溶液を殺菌する工程;及び(iii)凍結乾燥された無菌のサルメテロール組成物を提供するために殺菌されたバルク溶液を凍結乾燥する工程。特定の実施形態において、充填剤をさらに含む凍結乾燥された無菌のサルメテロール組成物と、薬学的に許容可能な希釈剤又は担体を接触させる工程を含む、皮下注射に適したサルメテロール製剤を調製する再構成方法が提供される。
【0093】
特定の実施形態において、以下のものを含む凍結乾燥組成物が本明細書に記載される:(a)凍結乾燥フルチカゾン又はその薬学的に許容可能な塩;(b)凍結乾燥サルメテロール又はその薬学的に許容可能な塩;(c)充填剤;及び(d)非イオン性界面活性剤。幾つかの実施形態において、フルチカゾン又はその薬学的に許容可能な塩;サルメテロール又はその薬学的に許容可能な塩;充填剤;及び非イオン性界面活性剤を含む凍結乾燥された組成物から再構成される、無菌の製剤が提供される。幾つかの実施形態において、再構成前に、フルチカゾン又はその薬学的に許容可能な塩;サルメテロール又はその薬学的に許容可能な塩;充填剤;及び非イオン性界面活性剤を含む再構成された無菌の製剤を、ヒトに、皮下に投与又は提供する工程を含む美容方法及び/又は治療方法が提供される。さらに、以下のものを含む凍結乾燥された無菌の組成物を調製する方法が本明細書に記載される:(i)バルク溶液を形成するため溶媒又は共溶媒で、フルチカゾン又はその薬学的に許容可能な塩;サルメテロール又はその薬学的に許容可能な塩、充填剤、非イオン性界面活性剤、及び酸化防止剤を可溶性にする工程;(ii)バルク溶液を殺菌する工程;及び(iii)凍結乾燥された無菌の組成物を提供するために殺菌されたバルク溶液を凍結乾燥する工程。幾つかの実施形態において、薬学的に許容可能な希釈剤又は担体と、以下のものを含む凍結乾燥された物質とを接触させる工程を含む、皮下注射に適した製剤を調製する再構成方法が提供される:(a)フルチカゾン又はその薬学的に許容可能な塩;(b)サルメテロール又はその薬学的に許容可能な塩;(c)充填剤;及び(d)非イオン性界面活性剤。また更なる実施形態において、以下のものを含むキットが提供される:(a)凍結乾燥フルチカゾン又は凍結乾燥サルメテロールを含むバイアル;(b)薬学的に許容可能な希釈剤又は担体を含むバイアル;(c)注射器;及び(d)凍結乾燥された物質の再構成及び随意にヒトへの投与又は供給に関する指示書。
【0094】
本明細書で使用されるような「約(About)」は、量、一時的な持続時間等の測定可能な値を指す場合、+/−20%又は+/−10%の変異を含み、又は他の実施形態において+/−5%の変異を含み、又は更なる実施形態において、+/−1%の変異を含み、又はまた更なる実施形態において、特定の値から+/−0.1%の変異を含むことを意味し、そのような変異は、本開示の方法を行うのに適切であり、及び/又は所望の組成物または製剤を調製するのに適切である。
【0095】
特定の実施形態において、凍結乾燥組成物(重量/gで表わされる)及び再構成された製剤(重量/mlで表わされる)における薬剤(フルチカゾン及びその塩、サルメテロール及びその塩、並びにそれらの組合せを含む)の重量が本明細書で提供される。凍結乾燥組成物に関して、表わされる重量は組成物の合計の乾燥重量に関する。例えば、1つの実施形態において、約150μg/gの凍結乾燥されたフルチカゾンを含む無菌の凍結乾燥されたフルチカゾン組成物が提供される。したがって、この実施形態において、1gの凍結乾燥組成物の合計の乾燥重量につき約150μgの凍結乾燥されたフルチカゾンが提供される。再構成された製剤に関して、表わされる重量は再構成された製剤の合計の容積に関する。実施例のように、1つの実施形態において、約1μg/mlの量で存在する再構成されたフルチカゾンを含む、再構成された無菌のフルチカゾン製剤が提供される。そのため、この実施形態において、1mlの再構成された製剤の総容積につき約1μgの再構成されたフルチカゾンが提供される。
【0096】
特定の実施形態において、(1)フルチカゾン及びその塩、(2)サルメテロール及びその塩、(3)それらの組合せの投与又は供給を含む、治療方法及び/又は美容方法及びその使用が本明細書で提供される。1以上の薬剤の投与又は供給が提供される場合の実施形態において、投与又は供給は、随伴して(例えば、同じ製剤の一部として)、連続して(例えば、別々に1つの薬剤を投与し、その後許容可能な時間内に他の薬剤を投与する)、及び並行して(例えば、同時であるが、薬剤が例えば異なる製剤中にある)行われる事が理解される。
【0097】
そうでないと定義されない限り、本明細書で使用される全ての技術的及び科学用語は、当該技術分野における共通の理解として同じ意味を有する。
【0098】
〈バルク溶液〉
ほんの一例として、サルメテロール、フルチカゾン又はそれらの薬学的に許容可能な塩、又はそれらの組合せ等の活性成分を含むバルク溶液を凍結乾燥することにより調整される凍結乾燥された組成物が本明細書に記載される。1つの実施形態において、凍結乾燥される本明細書に記載の活性成分は、水性及び/又は有機溶媒系において少なくとも1つの非イオン性界面活性剤及び少なくとも1つの充填剤と実質上均質的に混合される。用語「実質上均質の(substantially homogeneous)」は、例えば、溶液又はバルク溶液におけるように、互いに実質上一様に分散される成分として定義される。
【0099】
フルチカゾンは合成のグルココルチコステロイドであり、以下の化学構造を有する:
【0100】
【化1】

【0101】
フルチカゾンの薬学的に許容可能な塩は、限定されないがプロピオン酸塩及びフロ酸塩を含む。
【0102】
サルメテロールは、長く作用する、選択的な、及び凍結乾燥βアドレナリン作用性受容体アゴニストであり、以下の化学構造を有する:
【0103】
【化2】

【0104】
例示のサルメテロールの薬学的に許容可能な塩はキシナホ酸塩を含み、以下に示される:
【0105】
【化3】

【0106】
上述の通り、本明細書で提示される凍結乾燥物はバルク溶液の凍結乾燥によって形成される。バルク溶液は、他の構成要素内に、フルチカゾン及び/又はサルメテロール又はそれらの薬学的に許容可能な塩及び適切な有機溶媒系を含む。有機溶媒系は、幾つかの実施形態において、例えばプロピオン酸フルチカゾン又はキシナホ酸サルメテロール又はそれらの組合せ等の活性成分を可溶性にし、実質上均質の液状混合物 (図 1、2、及び3は、「濃縮物」として実質上均質の液状混合物を指す)を形成するのに十分な量の有機溶媒を含む。幾つかの実施形態において、低級アルコール及びフルチカゾン又はサルメテロール又はそれらの薬学的に許容可能な塩等の治療剤のような溶媒は、治療剤を溶解するのに充分な温度で組み合わせられ、溶媒が確実に液体状態にあるようにし、その後、実質上均質な液状混合物を形成するために攪拌することによって混合される。幾つかの実施形態において、混合は約10分から約3時間かかる。特定の実施形態において、混合は約15分から約2時間生じる。更なる又は追加の実施形態において、混合は約30分から約90分間生じる。1つの実施形態において、混合は約60分間生じる。随意に、幾つかの実施形態では、溶解を確実に完了させるために、音波処理、静的ミキサー、ブレード型ミキサー、ホモジナイザー等の使用をあとで伴う。
【0107】
1つの実施形態において、有機溶媒は低級オキシヒドロカルボン、低級ハロヒドロカルボン、低級ハロキシヒドロカルボン、低級スルホキシヒドロカルボン、低級シクロヒドロカルボン及びそれらの組合せを含む。1つの実施形態において、溶媒系は、tert−ブチルアルコール、イソプロピルアルコール、メタノール、エタノール、アセトン、アセトニトリル、シクロヘキサン、クロロブタノール、ジメチルスルホキシド、ヘキサノール、ベンジルアルコール、酢酸、ペンタノール、n−プロパノール、n−ブタノール、メチルエチルケトン、ジメチルスルホン、クロロブタノール及びそれらの組合せを含むが、これらに限定されない。他の実施形態において、本明細書に記載の凍結乾燥された組成物を調製するのに使用するための溶媒は、ほんの一例として、エタノール、イソプロピルアルコール及びtert−ブチルアルコールなどの低級アルカノールを含む。他の実施形態において、溶媒はtert−ブチルアルコールである。また更なる又は追加の実施形態において、溶媒はエタノールである。
【0108】
本明細書で言及されるように、用語「低級オキシヒドロカルボン」は、ヒドロカルビルラジカルを有する化合物、及び1から8の炭素原子及び1から4の酸素原子を有する酸素原子を意味する。「低級オキシヒドロカルボン」の例は、限定されないが、低級アルカノール、低級ケトン、低級カルボン酸、低級カルボン酸エステル、低級カーボネイトなどである。
【0109】
幾つかの実施形態において、有機溶媒はバルク溶液の約0.1容積%から約30容積%である。他の実施形態において、有機溶媒はバルク溶液の約0.5容積%から約15容積%である。更なる実施形態において、有機溶媒はバルク溶液の約0.1容積%から約1容積%である。他の実施形態において、有機溶媒はバルク溶液の約10容積%未満である。
【0110】
他の実施形態において、バルク溶液は、約−10℃から約50℃の範囲内の温度を有する実質上均質な混合剤を形成する。
【0111】
更なる実施形態において、バルク溶液は充填剤を含む。幾つかの実施形態において、充填剤は、ラクトース、DL−アラニン、グルコース、D(+)トレハロース二水和物、スクロース、マルトース、D(+)ラフィノース五水和物、サッカリンナトリウム、デンプン、修正されたセルロース、デキストリン、デキストラン、グリシン、塩化ナトリウム、炭酸カルシウム、酒石酸ナトリウム及び乳酸カルシウムから選択される。他の実施形態において、充填剤はラクトース一水和物である。
【0112】
幾つかの実施形態において、充填剤は、例えば滅菌注射用蒸留水などの薬学的に許容可能な担体の中で溶解され、溶解するのに充分な温度にまで加熱される。他の実施形態において、充填剤の混合物は室温にまで冷却され、非イオン性界面活性剤が加えられる。
【0113】
非イオン性界面活性剤は以下のものを含む:(N,N−ビス[3−(D−グルコアミド)プロピル]コラミド);ビス(ポリエチレングリコールビス[イミダゾリルカルボニル]);ポリオキシエチレングリコールドデシルエーテル;ポリオキシエチレングリセロールトリリシノレアート35;デカエチレングリコールモノドデシルエーテル;N−デカノイル−N−メチルグルカミン;n−デシルα−D−グルコピラノシド;デシルβ−D−マルトピラノジド;n−ドデカノイル−N−メチルグルカミド;n−ドデシルα−D−マルトシド;n−ドデシルβ−D−マルトシド;n−ヘキサデシルβ−D−マルトシド;ヘプタエチレングリコールモノデシルエーテル;ヘプタエチレングリコールモノドデシルエーテル;ヘプタエチレングリコールモノテトラデシルエーテル;ヘキサエチレングリコールモノドデシルエーテル;ヘキサエチレングリコールモノヘキサデシルエーテル;ヘキサエチレングリコールモノオクタデシルエーテル;ヘキサエチレングリコールモノテトラデシルエーテル;オクチルフェニル−ポリエチレングリコール;メチル−6−O−(N−へプチルカルバモイル)−α−D−グルコピラノシド;ノナエチレングリコールモノドデシルエーテル;N−ノナノイル−N−メチルグルカミン;N−ノナノイル−N−メチルグルカミン;オクタエチレングリコールモノデシルエーテル;オクタエチレングリコールモノドデシルエーテル;オクタエチレングリコールモノヘキサデシルエーテル;オクタエチレングリコールモノオクタデシルエーテル;オクタエチレングリコールモノテトラデシルエーテル;オクチル−β−D−グルコピラノシド;ペンタエチレングリコールモノデシルエーテル;ペンタエチレングリコールモノドデシルエーテル;ペンタエチレングリコールモノヘキサデシルエーテル;ペンタエチレングリコールモノヘキシルエーテル;ペンタエチレングリコールモノオクタデシルエーテル;ペンタエチレングリコールモノオクチルエーテル;ポリエチレングリコールジグリシジルエーテル;ポリエチレングリコールエーテルW−1;ポリオキシエチレン10トリデシルエーテル;ポリオキシエチレン100ステアレート;ポリオキシエチレン20イソヘキサデシルエーテル;ポリオキシエチレン20オレイルエーテル;ポリオキシエチレン40ステアレート;ポリオキシエチレン50ステアレート;ポリオキシエチレン8ステアレート、ポリオキシエチレンビス(イミダゾリルカルボニル)、ポリオキシエチレン25プロピレングリコールステアレート;サポニン;ラウリン酸ソルビタン、ソルビタンモノパルミタート、ステアリン酸ソルビタン、トリステアリン酸ソルビタン、オレイン酸ソルビタン、トリオレイン酸ソルビタン;ポリエチレングリコールトリメチルノニルエーテル、ノニルフェニルエトキシラート;テトラデシル−β−D−マルトシド;テトラエチレングリコールモノデシルエーテル、テトラエチレングリコールモノドデシルエーテル、テトラエチレングリコールモノテトラデシルエーテル;トリエチレングリコールモノデシルエーテル、トリエチレングリコールモノドデシルエーテル、トリエチレングリコールモノヘキサデシルエーテル、トリエチレングリコールモノオクチルエーテル、トリエチレングリコールモノテトラデシルエーテル;オクトキシノール−9;オクチルフェノールエトキシラート;ポリソルベート20、ポリソルベート21、ポリソルベート40、ポリソルベート60、ポリソルベート61、ポリソルベート65、ポリソルベート80、ポリソルベート81、ポリソルベート85;チロキサポ−ル;及びn−ウンデシルβ−D−グルコピラノシド。1つの実施形態において、バルク溶液中で使用される非イオン性界面活性剤はポリソルベート80である。
【0114】
更なる実施形態において、サルメテロール濃縮物が充填剤/非イオン性界面活性剤の混合剤に加えられ、本明細書に記載の方法を使用して混合される。
【0115】
更なる実施形態において、抗酸化剤はバルク溶液に加えられる。また別の実施形態において、抗酸化剤はアスコルビン酸である。
【0116】
更なる実施形態において、緩衝剤はバルク溶液に加えられる。また別の実施形態において、緩衝剤はクエン酸一水和物及び/又はクエン酸ナトリウム二水和物である。
【0117】
〈濾過法〉
バルク溶液/液状混合物を形成するために結合されるフルチカゾン、サルメテロール及び/又はそれらの組合せの混合物が本明細書で提供され、液状混合物は殺菌される。1つの実施形態において、実質上均質なバルク溶液/液状混合物は、凍結乾燥前に濾過して殺菌される。別の実施形態において、濾過滅菌工程は、バルク溶液/液状混合物内の任意の不純物、例えば汚染微生物数を除去し、比較的/実質上無菌の溶液を提供するために行われる。「殺菌された(Sterilized)」又は「実質上無菌の(substantially sterile)」は、確率関数に基づいて、微生物の全ての生存可能な形態が除去又は破壊されるプロセスによって定義される。
【0118】
適切なフィルタは、有機溶媒で適合する細菌濾過器を含む。適切な充填材は、例えばセルロースフィルタを含む。1つの実施形態において、バルク溶液を殺菌する方法は、tert−ブチルアルコール及び/又はエタノールを含む、アルコール及び関連する有機又は有機−水性媒体に一般的に適合するように、ポリ(テトラフルオロエチレン)(PTFE)フィルタの使用を含む。別の実施形態において、本明細書に記載の方法で使用されるフィルタは、ポリ(エーテルスルホン)からなる。更なる実施形態において、フィルタは、ポリフッ化ビニリデン、ポリプロピレン及びナイロンから成るフィルタから選択される。
【0119】
幾つかの実施形態において、フィルタの有孔性は約0.1から約0.5ミクロンである。別の実施形態において、本明細書に記載の無菌の凍結乾燥された組成物を調製するのに使用されるフィルタの有孔性は、約0.2ミクロンである。フィルタの大きさ及び表面積は、フィルタに通される液体混合物の容積を決定する。他の実施形態において、濾過の後、組成物は適切な凍結乾燥バイアルに入れられ、更なる実施形態においては、再構成後の一回量の製剤である。また他の実施形態において、バイアルは一般的に発熱性物質が除かれて殺菌され、更なる実施形態においては約1mL乃至3mLのバイアルに及ぶ。他の実施形態において、本明細書に記載の凍結乾燥された組成物は、終末に殺菌され、例えば、凍結乾燥が生じた後に殺菌される。また他の実施形態において、終末滅菌はγ線照射、又はe−ビーム殺菌を介する。
【0120】
〈凍結乾燥法〉
凍結乾燥は、「凍結乾燥(freeze−drying)」としてしばしば称されるプロセスの技術的な名称である。このプロセスにおいて、水性の混合物又は懸濁液は固体へと凍結され、その後一般的に、相当な時間の間真空にさらされる。真空は水分子を昇華させる。
【0121】
本明細書に記載の方法は、例えばサルメテロール又はフルチカゾン、又は双方の組合せ、又はそれらの薬学的に許容可能な塩などの活性成分を凍結乾燥する工程を含む。1つの実施形態において、凍結乾燥は殺菌後に生じる。
【0122】
1つの実施形態において、凍結乾燥プロセスの間、ほんの一例としてtert−ブチルアルコール及び滅菌注射用蒸留水などの、使用される溶媒系は、昇華により実質的に除去される。別の実施形態において、5%未満の残留溶媒は凍結乾燥後に残る;他の実施形態において、3%未満が残る;また他の実施形態において、2%が残る;更なる実施形態において、約1%又は約0.1%が残る。
【0123】
1つの実施形態において、凍結乾燥プロセスは以下の工程を含む:(1)適切なバイアル内に凍結乾燥されるサンプル(サルメテロール、フルチカゾン又はそれらの組合せ、又はそれらの薬学的に許容可能な塩)を配置し、バイアルを凍結乾燥チャンバに配し、棚温度(shelf temperature)を大気圧で約−30℃から約−50℃に低下させる工程;(2)上述の温度範囲での棚温度を、サンプルの温度が約−30℃から約−50℃になるまで保つ工程;(3)凍結乾燥を約1時間から2時間アニールするため約−10℃から約−20℃にまで温度を上昇させる工程;(4)棚温度を約−30℃から約−50℃にまで低下させ、系の圧力を約50mTorrから約100mTorrにまで減らす工程;及び溶媒系の昇華が実質的に完了するまで保つ工程。生成物の温度は、ケ−キの崩壊を避けるため約−25℃乃至約−28℃以下であるべきである;(5)温度を約30℃乃至約50℃にまで上げる工程;及び(6)結合水又は溶媒のレベルを除去する時間のあいだ、サンプルが約20℃乃至約30℃の温度に達する様に許容する工程;(7)バイアルが無菌的に密封された後、窒素又は適切なガスでバイアルを埋戻す(back−filing)工程。表7は、1つの実施形態において、フルチカゾン又はサルメテロール又はそれらの薬学的に許容可能な塩或いはそれらの組合せを含むバルク溶液を凍結乾燥するための凍結乾燥サイクルを記載する。1つの実施形態において、プロセスは、適切な及び実質的に完了した昇華を確実にするため、1分につき0.5℃から1分につき約1℃の割合で、系の温度を段階的に低下又は上昇させる工程を必要とする。凍結乾燥工程は、長時間の間室温で貯蔵できる、例えば、サルメテロール又はフルチカゾン、又はそれらの薬学的に許容可能な塩又はそれらの組合せなどの、活性化合物を含む組成物を提供する。加えて、本明細書に記載の凍結乾燥された組成物は、少なくとも4週の期間の間、約0℃から約50℃の温度で安定している。幾つかの実施形態において、凍結乾燥された組成物は、少なくとも約5年の期間の間、約0℃から約50℃の温度で安定している。特定の実施形態において、凍結乾燥された組成物は、少なくとも約4カ月から約4年の期間の間、約0℃から約50℃の温度で安定している。また更なる又は追加の実施形態において、凍結乾燥された組成物は、少なくとも約6カ月から約2年の期間の間、約0℃から約50℃の温度で安定している。幾つかの実施形態において、凍結乾燥された組成物は、少なくとも約3カ月、少なくとも約6カ月、少なくとも約1年、少なくとも約2年、少なくとも約3年、少なくとも約4年、又は少なくとも約5年の間、約0℃から約50℃の温度で安定している。他の実施形態において、本明細書に記載の凍結乾燥された組成物は、ケ−キ又は自由流動粉末(free flowing powder)の形態である。他の実施形態において、凍結乾燥された組成物はケ−キである。
【0124】
〈再構成〉
幾つかの実施形態において、本明細書に記載の凍結乾燥された組成物は、十分な量の薬学的に許容可能な担体と接触すると、急速に再構成する。例えば、幾つかの実施形態において、凍結乾燥された組成物は、皮下、眼窩周囲、眼窩内、及び筋肉内注射に適切な再構成された組成物を提供するため、滅菌注射用蒸留水、0.9%の塩化ナトリウム溶液、又は5%のデキストロ−ス溶液などの薬学的に許容可能な担体とともに、例えば約1から約3分間振り混ぜられながら、該組成物が入れられたバイアル内で混合される。1つの実施形態において、凍結乾燥された組成物は、例えば1分未満、30秒未満、及び他の実施形態において約20秒未満の比較的短い時間で再構成される。特定の実施形態において、凍結乾燥された組成物は、2分未満の時間で再構成する。これらの短い再構成時間は、治療剤が投与前の長時間の間、溶液中にさらされながらも分解しなかったという利点を提供する。1つの実施形態において、再構成された組成物は、例えば皮下注射などの皮下投与に適している。別の実施形態において、再構成された形態は非懸濁液である。更なる実施形態において、再構成された形態は透明な溶液であり、投与前に実質的に透明なまま残る。
【0125】
本明細書に記載の主題の創造性のある特徴は、最小の量の非イオン性界面活性剤で調剤され、凍結乾燥物として製造され、及び短時間の担体又は賦形剤での十分な再構成に適用可能である凍結乾燥された組成物(フルチカゾン、サルメテロール、及び/又はそれらの混合物を含む)である。例えば、実施例3及び表3を参照。
【0126】
従って、1つの実施形態において、約2分の溶解の後にHPLCによって再構成されると、再構成の前に存在する凍結乾燥フルチカゾンの量の少なくとも約50%である可溶化された又は溶解された量のフルチカゾンを提供する再構成された凍結乾燥フルチカゾン製剤が提供される。更なる又は追加の実施形態において、約2分の溶解の後にHPLCによって再構成されると、再構成の前に存在する凍結乾燥フルチカゾンの量の少なくとも約60%である可溶化された又は溶解された量のフルチカゾンを提供する再構成された凍結乾燥フルチカゾン製剤が本明細書で提供される。幾つかの実施形態において、約2分の溶解の後にHPLCによって再構成されると、再構成の前に存在する凍結乾燥フルチカゾンの量の少なくとも約75%である可溶化された又は溶解された量のフルチカゾンを提供する再構成された凍結乾燥フルチカゾン製剤が提供される。更なる又は追加の実施形態において、約2分の溶解の後にHPLCによって再構成されると、再構成の前に存在する凍結乾燥フルチカゾンの量の少なくとも約90%から約100%である可溶化された又は溶解された量のフルチカゾンを提供する再構成された凍結乾燥フルチカゾン製剤が提供される。幾つかの実施形態において、約2分の溶解の後にHPLCによって再構成されると、再構成の前に存在する凍結乾燥フルチカゾンの量の少なくとも約90%から約100%である可溶化された又は溶解された量のフルチカゾンを提供する再構成された凍結乾燥フルチカゾン製剤が提供され、ここで非イオン性界面活性剤は、約4%から約5%の量の凍結乾燥物の合計の組み合わせた乾燥重量での再構成の前に、凍結乾燥フルチカゾン組成物内に存在した。
【0127】
更なる又は追加の実施形態において、約2分の溶解の後にHPLCによって再構成されると、再構成の前に存在する凍結乾燥サルメテロールの量の少なくとも約50%である可溶化された又は溶解された量のサルメテロールを提供する再構成された凍結乾燥サルメテロール製剤が提供される。更なる又は追加の実施形態において、約2分の溶解の後にHPLCによって再構成されると、再構成の前に存在する凍結乾燥サルメテロールの量の少なくとも約60%である可溶化された又は溶解された量のサルメテロールを提供する再構成された凍結乾燥サルメテロール製剤が提供される。幾つかの実施形態において、約2分の溶解の後にHPLCによって再構成されると、再構成の前に存在する凍結乾燥サルメテロールの量の少なくとも約75%である可溶化された又は溶解された量のサルメテロールを提供する再構成された凍結乾燥サルメテロール製剤が提供される。更なる又は追加の実施形態において、約2分の溶解の後にHPLCによって再構成されると、再構成の前に存在する凍結乾燥サルメテロールの量の少なくとも約90%から約100%である可溶化された又は溶解された量を提供する再構成された凍結乾燥サルメテロール製剤が提供される。
【0128】
更なる又は追加の実施形態において、約2分の溶解の後にHPLCによって再構成されると、再構成の前に存在する凍結乾燥薬剤の量の少なくとも約50%である可溶化された又は溶解された量のフルチカゾン及び/又はサルメテロールを提供する再構成された凍結乾燥フルチカゾン及びサルメテロール製剤が提供される。更なる又は追加の実施形態において、約2分の溶解の後にHPLCによって再構成されると、再構成の前に存在する凍結乾燥薬剤の量の少なくとも約60%である可溶化された又は溶解された量のフルチカゾン及び/又はサルメテロールを提供する再構成された凍結乾燥フルチカゾン及びサルメテロール製剤が提供される。幾つかの実施形態において、約2分の溶解の後にHPLCによって再構成されると、再構成の前に存在する凍結乾燥薬剤の量の少なくとも約75%である可溶化された又は溶解された量のフルチカゾン及び/又はサルメテロールを提供する再構成された凍結乾燥フルチカゾン及びサルメテロール製剤が提供される。更なる又は追加の実施形態において、約2分の溶解の後にHPLCによって再構成されると、再構成の前に存在する凍結乾燥薬剤の量の少なくとも約90%から約100%である可溶化された又は溶解された量のフルチカゾン及び/又はサルメテロールを提供する再構成された凍結乾燥フルチカゾン及びサルメテロール製剤が提供される。更なる又は追加の実施形態において、約2分の溶解の後にHPLCによって再構成されると、再構成の前に存在する凍結乾燥薬剤の量の少なくとも約90%から約100%である可溶化された又は溶解された量のフルチカゾン及び/又はサルメテロールを提供する再構成された凍結乾燥フルチカゾン及びサルメテロール製剤が提供され、ここで非イオン性界面活性剤は、約4%乃至約5%の量の凍結乾燥物の合計の組み合わせた乾燥重量での再構成の前に、凍結乾燥サルメテロール組成物内に存在する。
【0129】
特定の実施形態が記載されてきたが、これら実施形態はほんの一例として存在するものであり、本開示の範囲を限定しないように意図されている。本明細書に記載の製剤、方法、及び系は、様々な他の形態において具体化される。さらに、製剤の形態における省略、置換及び変更、本明細書に記載の製剤、方法、及び系は、この開示の精神から逸脱することなく作られ得る。添付の請求項およびそれらの同等物は、そのような形態又は変更を覆うように意図される。
【0130】
〈実施例〉
以下の具体的な実施形態は単なる例示として構成されるものであるが、どんな任意の方法における本開示注意を限定するものではない。本明細書に記載の実施例は、一連の段落に記載される様々な実施形態への非限定的な支持を指し、又はそれを提供する。
【0131】
〈実施例1:プロピオン酸フルチカゾン凍結乾燥物〉
プロピオン酸フルチカゾン凍結乾燥物を、下の表1に示されるように、各々の量で構成要素を混合することにより調製した:
【0132】
【表1】

【0133】
実施例1の凍結乾燥製剤の製造は、図1の概略図で描かれる。簡潔には、ラクトース一水和物を、およそ40℃から50度になるまで予め加熱した滅菌注射用蒸留水の中で溶解した。ラクトース溶液を20℃から25℃にまで冷却した後、ポリソルベート80を加えて均質になるまで混合した。プロピオン酸フルチカゾンをtert−ブチルアルコール溶液内で溶解し、およそ25℃から35℃にまで予め加熱し、水性のラクトース−ポリソルベート溶液に加え、均質になるまで混合した。滅菌注射用蒸留水を標的重量に加える。溶液を0.2ミクロンのフィルタを通して無菌で濾過し、その後適切なガラスバイアルに充填した。バイアルを凍結乾燥器に充填し、水と溶媒を、表7に記載のものに類似したサイクルを行った後に除去した。サイクルの結果、栓をして過剰密封(oversealing)する前に、バイアルを窒素のような不活性ガス内に埋戻す(back−filled)。
【0134】
〈プロピオン酸フルチカゾン凍結乾燥物の安定性〉
以下の表4に記載されるようなアッセイの有効性に関する方法論を、上記表1に記載されるように調剤された製剤が特定の状態にて制御された安定性チャンバに貯蔵された後、表2にある安定性データの生成において利用した。
【0135】
【表2】

【0136】
〈実施例3:フルチカゾン凍結乾燥製剤の再構成アッセイ及び再構成時間〉
本明細書に記載されるように、本明細書に記載の内容の発明の特徴は、最小の量の非イオン性界面活性剤で調剤され、及び短時間の担体又は希釈剤での十分な再構成に適用可能である凍結乾燥組成物(フルチカゾン、サルメテロール、及び/又はそれらの混合物を含む)である。HPLCで測定されるように滅菌注射用蒸留水を伴うプロピオン酸フルチカゾンの有効性及び各々の再構成時間を、表3に示す。再構成時間及びアッセイ評価を、1.0mLの滅菌注射用蒸留水で製剤を再構成することにより決定した。再構成時間を、溶液中に目に見える粒子状物質が無い時間として決定し、この場合、製剤は「透明」であると言える。表3に示されるように、5mg/gのポリソルベート80がフルチカゾン凍結乾燥物内で使用される際、凍結乾燥組成物中の約100%のプロピオン酸フルチカゾンを、約15秒の溶解後に分解又は可溶化した。
【0137】
【表3】

【0138】
以下表4に記載されるようなHPLCに関する方法論は、実施例2の安定性データ及び実施例3の再構成アッセイと時間データの生成で利用される。
【0139】
【表4】

【0140】
〈実施例4:キシナホ酸サルメテロール凍結乾燥物〉
キシナホ酸サルメテロール凍結乾燥物を、以下表5に記載のように構成要素を各々の量で混合することにより調製した。
【0141】
【表5】

【0142】
実施例4の(及び表5に示される)凍結乾燥組成物の製造を図2の概略図に記載する。実施例4で使用される調整のプロセスは実施例1で説明されるようなプロセスを反映する。
【0143】
〈実施例5:凍結乾燥物の組合せ〉
プロピオン酸フルチカゾンとキシナホ酸サルメテロールを組み合わせた凍結乾燥物を、以下表6に示されるように構成要素を各々の量で混合することにより調製した:
【0144】
【表6】

【0145】
実施例5の凍結乾燥組成物の製造を図3の概略図に記載する。実施例5で使用されるプロセスは実施例1で使用されるプロセスを反映する。
【0146】
〈実施例6:凍結乾燥サイクル〉
およそ1mLの濾過された溶液を各々の製剤のため3−mLのガラスバイアルに充填し、凍結乾燥器に充填した。製剤を以下表7に記載の凍結乾燥サイクルに従って凍結乾燥した。
【0147】
【表7−1】

【0148】
【表7−2】

【0149】
凍結乾燥サイクルの結果、特徴付けと分析の前にバイアルに栓をして密封した。
【0150】
〈実施例7:バルク溶液に関するガラス転移実験〉
【0151】
バルク溶液に関するガラス転移(Tg)デ−タを、示差走査熱量測定法を使用して生成した。およそ10から20mgのバルク溶液をピペットでアルミニウムパンへ移し、圧着した(crimped)。空のクリンプパン(crimped pan)は参考として機能した。DSC分析のため使用される温度プログラムを、25℃で1分間保持し、その後10/分で25℃から−50℃にまで冷却した。
【0152】
本明細書に記載の実施例及び実施形態は例示目的のためだけのものであり、様々な修正又は変更は、本出願の精神及び範囲、並びに添付の請求項の範囲内に含まれる。
【特許請求の範囲】
【請求項1】
凍結乾燥フルチカゾンまたはその薬学的に許容可能な塩、充填剤および非イオン性界面活性剤を含む凍結乾燥フルチカゾン組成物。
【請求項2】
さらに緩衝剤を含む請求項1に記載の凍結乾燥フルチカゾン組成物。
【請求項3】
前記凍結乾燥フルチカゾンが、結晶相、非晶相、半結晶相、半非晶相またはそれらの混合物であることを特徴とする請求項1に記載の凍結乾燥フルチカゾン組成物。
【請求項4】
前記薬学的に許容可能な塩が、プロピオン酸塩またはフロ酸塩であることを特徴とする請求項1に記載の凍結乾燥フルチカゾン組成物。
【請求項5】
前記薬学的に許容可能な塩がプロピオン酸塩であることを特徴とする請求項1に記載の凍結乾燥フルチカゾン組成物。
【請求項6】
前記凍結乾燥フルチカゾンが、凍結乾燥物の合計の組み合わせた乾燥重量の約0.001重量%から約0.1重量%までの量で存在することを特徴とする請求項1に記載の凍結乾燥フルチカゾン組成物。
【請求項7】
前記凍結乾燥フルチカゾンが、凍結乾燥物の合計の組み合わせた乾燥重量の約0.015重量%から約0.030重量%までの量で存在することを特徴とする請求項1に記載の凍結乾燥フルチカゾン組成物。
【請求項8】
前記凍結乾燥フルチカゾンが、凍結乾燥物の合計の組み合わせた乾燥重量の約0.017重量%から約0.023重量%までの量で存在することを特徴とする請求項1に記載の凍結乾燥フルチカゾン組成物。
【請求項9】
前記凍結乾燥フルチカゾンが約500μg/g以下の量で存在することを特徴とする請求項1に記載の凍結乾燥フルチカゾン組成物。
【請求項10】
前記凍結乾燥フルチカゾンが約1μg/gから約500μg/gまでの量で存在することを特徴とする請求項1に記載の凍結乾燥フルチカゾン組成物。
【請求項11】
前記凍結乾燥フルチカゾンが約25μg/gから約225μg/gまでの量で存在することを特徴とする請求項1に記載の凍結乾燥フルチカゾン組成物。
【請求項12】
前記凍結乾燥フルチカゾンが約9μg/gから約20μg/gまでの量で存在することを特徴とする請求項1に記載の凍結乾燥フルチカゾン組成物。
【請求項13】
前記非イオン性界面活性剤がポリソルベート80であることを特徴とする請求項1に記載の凍結乾燥フルチカゾン組成物。
【請求項14】
前記充填剤が、ラクトース、マンニトール、デキストロースおよびサッカロースからなる群から選択されることを特徴とする請求項1のいずれかに記載の凍結乾燥フルチカゾン組成物。
【請求項15】
前記非イオン性界面活性剤が、凍結乾燥物の合計の組み合わせた乾燥重量の約1重量%から約10重量%までの量で存在し、及び前記充填材が、凍結乾燥物の合計の組み合わせた乾燥重量の約90重量%から約99重量%までの量で存在することを特徴とする請求項1に記載の凍結乾燥フルチカゾン組成物。
【請求項16】
前記組成物が約0℃から約50℃までの温度で少なくとも6か月の期間の間安定していることを特徴とする請求項1に記載の凍結乾燥フルチカゾン組成物。
【請求項17】
前記組成物が、凍結乾燥物の合計の組み合わせた乾燥重量の約3重量%未満の溶媒又は共溶媒を含むことを特徴とする請求項1に記載の凍結乾燥フルチカゾン組成物。
【請求項18】
前記溶媒又は共溶媒が、tert−ブチルアルコール、n−ブタノール、エタノール、イソプロピルアルコール、ジメチルスルホン、クロロブタノールまたはそれらの混合物から選択されることを特徴とする請求項17に記載の凍結乾燥フルチカゾン組成物。
【請求項19】
凍結乾燥フルチカゾンまたはその薬学的に許容可能な塩、充填剤および非イオン性界面活性剤を含む凍結乾燥組成物から再構成された無菌のフルチカゾン製剤。
【請求項20】
注射用蒸留水、0.9%の塩化ナトリウム溶液または5%のデキストロース溶液から選択される薬学的に許容可能な希釈剤をさらに含む請求項19に記載の再構成された無菌のフルチカゾン製剤。
【請求項21】
前記薬学的に許容可能な希釈剤が注射用蒸留水であることを特徴とする請求項19に記載の再構成された無菌のフルチカゾン製剤。
【請求項22】
前記再構成されたフルチカゾンが約100μg/ml以下である量で存在することを特徴とする請求項19に記載の再構成された無菌のフルチカゾン製剤。
【請求項23】
前記再構成されたフルチカゾンが約900ng/mlから約2μg/mlの量で存在することを特徴とする請求項19に記載の再構成された無菌のフルチカゾン製剤。
【請求項24】
前記再構成されたフルチカゾンが約1μg/mlの量で存在することを特徴とする請求項19に記載の再構成された無菌のフルチカゾン製剤。
【請求項25】
溶解が約2分以内に生じることを特徴とする請求項19に記載の再構成された無菌のフルチカゾン製剤。
【請求項26】
約2分間の溶解の後のHPLCによって測定した時、再構成の前に存在する凍結乾燥フルチカゾンの量の少なくとも約50%である可溶化された又は溶解された量のフルチカゾンを提供する請求項25に記載の再構成された凍結乾燥フルチカゾン製剤。
【請求項27】
約2分間の溶解の後のHPLCによって測定した時、再構成の前に存在する凍結乾燥フルチカゾンの量の少なくとも約90%から約100%までである可溶化された又は溶解された量のフルチカゾンを提供する請求項25に記載の再構成された凍結乾燥フルチカゾン製剤。
【請求項28】
前記非イオン性界面活性剤が、凍結乾燥物の合計の組み合わせた乾燥重量の約4%から約5%までの量で、再構成前の凍結乾燥フルチカゾン組成物中に存在したことを特徴とする請求項27に記載の再構成された凍結乾燥フルチカゾン製剤。
【請求項29】
サルメテロールまたはその薬学的に許容可能な塩をさらに含むように調剤される請求項19に記載の再構成された凍結乾燥フルチカゾン製剤。
【請求項30】
ヒトに、請求項29に記載の再構成された無菌のフルチカゾン製剤を皮下に投与又は提供する工程を含む美容若しくは処置の方法又は使用。
【請求項31】
前記再構成された無菌のフルチカゾン製剤が、腹部脂肪蓄積、局所脂肪過多および甲状腺眼症に起因する眼球突出からなる群から選択される兆候を処置するために、ヒトに投与されることを特徴とする請求項30に記載の処置の方法又は使用。
【請求項32】
凍結乾燥された無菌のフルチカゾン組成物を調製する方法であって、該方法は、
(i)バルク溶液を形成するために、フルチカゾンまたはその薬学的に許容可能な塩、充填剤、および非イオン性界面活性剤を、溶媒又は共溶媒で可溶性にする工程と、
(ii)バルク溶液を殺菌する工程と、および
(iii)凍結乾燥された無菌のフルチカゾン組成物を提供するために殺菌されたバルク溶液を凍結乾燥する工程と、
を含むことを特徴とする方法。
【請求項33】
皮下注射に適しているフルチカゾン製剤を調製する再構成方法であって、該方法は、充填剤および非イオン性界面活性剤をさらに含む凍結乾燥された無菌のフルチカゾン組成物を、薬学的に許容可能な希釈剤または担体と接触させる工程を含むことを特徴とする方法。
【請求項34】
凍結乾燥サルメテロールまたはその薬学的に許容可能な塩および充填剤を含む凍結乾燥サルメテロール組成物。
【請求項35】
緩衝剤をさらに含む請求項34に記載の凍結乾燥サルメテロール組成物。
【請求項36】
抗酸化剤をさらに含む請求項34に記載の凍結乾燥サルメテロール組成物。
【請求項37】
前記凍結乾燥サルメテロールが約200ng/gから約250ng/gの量で存在することを特徴とする請求項34に記載の凍結乾燥サルメテロール組成物。
【請求項38】
凍結乾燥サルメテロールまたはその薬学的に許容可能な塩および充填剤を含む凍結乾燥組成物から再構成された無菌のサルメテロール製剤。
【請求項39】
フルチカゾンまたはその薬学的に許容可能な塩をさらに含むように調剤される請求項38に記載の再構成された凍結乾燥サルメテロール製剤。
【請求項40】
前記再構成されたフルチカゾンが、約100ng/mlから約100μg/mlの量で存在することを特徴とする請求項39に記載の製剤。
【請求項41】
前記フルチカゾンが、約900ng/mlから約2μg/mlの量で存在することを特徴とする請求項39に記載の製剤。
【請求項42】
ヒトに、請求項39に記載の再構成された無菌のサルメテロール製剤を皮下に投与又は提供する工程を含む美容若しくは処置の方法又は使用。
【請求項43】
凍結乾燥された無菌のサルメテロール組成物を調製する方法であって、該方法は、
(i)バルク溶液を形成するために、サルメテロールまたはその薬学的に許容可能な塩および充填剤を、溶媒又は共溶媒で可溶性にする工程と、
(ii)バルク溶液を殺菌する工程と、および
(iii)凍結乾燥された無菌のサルメテロール組成物を提供するために殺菌されたバルク溶液を凍結乾燥する工程と、
を含むことを特徴とする方法。
【請求項44】
皮下注射に適しているサルメテロール製剤を調製する再構成方法であって、該方法は、充填剤をさらに含む凍結乾燥された無菌のサルメテロール組成物を、薬学的に許容可能な希釈剤または担体と接触させる工程を含むことを特徴とする方法。
【請求項45】
(a)凍結乾燥フルチカゾンまたはその薬学的に許容可能な塩と、
(b)凍結乾燥サルメテロールまたはその薬学的に許容可能な塩と、
(c)充填剤と、および
(d)非イオン性界面活性剤と、
を含む凍結乾燥組成物。
【請求項46】
フルチカゾン対サルメテロールの比が約150:約1から約1:1であることを特徴とする請求項45に記載の凍結乾燥組成物。
【請求項47】
前記凍結乾燥フルチカゾンが、約500μg/g以下である量で存在し、および前記凍結乾燥サルメテロールが、約250μg/g以下の量で存在することを特徴とする請求項45に記載の凍結乾燥組成物。
【請求項48】
前記凍結乾燥フルチカゾンが、約200μg/gから約300μg/gまでの量で存在し、および前記凍結乾燥サルメテロールが、約4μg/gから約15μg/gまでの量で存在するを特徴とする請求項45に記載の凍結乾燥組成物。
【請求項49】
前記凍結乾燥フルチカゾンが、約9μg/gから約20μg/gまでの量で存在し、および前記凍結乾燥サルメテロールが、約200ng/gから約250ng/gまでの量で存在することを特徴とする請求項45に記載の凍結乾燥組成物。
【請求項50】
フルチカゾンまたはその薬学的に許容可能な塩、サルメテロール又はその薬学的に許容可能な塩、充填材、および非イオン性界面活性剤を含む凍結乾燥組成物から再構成された無菌の製剤。
【請求項51】
前記再構成されたフルチカゾンが、約100μg/ml以下の量で存在し、および前記再構成されたサルメテロールが、約25μg/ml以下の量で存在することを特徴とする請求項47に記載の再構成された無菌の製剤。
【請求項52】
前記再構成されたフルチカゾンが、約900ng/mlから約2μg/mlまでの量で存在し、前記サルメテロールが、約20ng/mlから約25ng/ml以下の量で存在することを特徴とする請求項47に記載の再構成された無菌の製剤。
【請求項53】
ヒトに、請求項50に記載の再構成された無菌の製剤を皮下に投与又は提供する工程を含む美容若しくは処置の方法又は使用。
【請求項54】
凍結乾燥された無菌の組成物を調製する方法であって、該方法は、
(i)バルク溶液を形成するために、フルチカゾンまたはその薬学的に許容可能な塩、サルメテロールまたはその薬学的に許容可能な塩、充填剤、および非イオン性界面活性剤を、溶媒又は共溶媒で可溶化する工程と、
(ii)バルク溶液を殺菌する工程と、および
(iii)凍結乾燥された無菌の組成物を提供するために、殺菌されたバルク溶液を凍結乾燥する工程と、
を含むことを特徴とする方法。
【請求項55】
(a)フルチカゾンまたはその薬学的に許容可能な塩と、
(b)サルメテロールまたはその薬学的に許容可能な塩と、
(c)充填剤と、および
(d)非イオン性界面活性剤と、
を含む凍結乾燥された物質を、薬学的に許容可能な希釈剤または担体と接触させる工程を含む、皮下注射に適している製剤を調製する再構成方法。
【請求項1】
凍結乾燥フルチカゾンまたはその薬学的に許容可能な塩、充填剤および非イオン性界面活性剤を含む凍結乾燥フルチカゾン組成物。
【請求項2】
さらに緩衝剤を含む請求項1に記載の凍結乾燥フルチカゾン組成物。
【請求項3】
前記凍結乾燥フルチカゾンが、結晶相、非晶相、半結晶相、半非晶相またはそれらの混合物であることを特徴とする請求項1に記載の凍結乾燥フルチカゾン組成物。
【請求項4】
前記薬学的に許容可能な塩が、プロピオン酸塩またはフロ酸塩であることを特徴とする請求項1に記載の凍結乾燥フルチカゾン組成物。
【請求項5】
前記薬学的に許容可能な塩がプロピオン酸塩であることを特徴とする請求項1に記載の凍結乾燥フルチカゾン組成物。
【請求項6】
前記凍結乾燥フルチカゾンが、凍結乾燥物の合計の組み合わせた乾燥重量の約0.001重量%から約0.1重量%までの量で存在することを特徴とする請求項1に記載の凍結乾燥フルチカゾン組成物。
【請求項7】
前記凍結乾燥フルチカゾンが、凍結乾燥物の合計の組み合わせた乾燥重量の約0.015重量%から約0.030重量%までの量で存在することを特徴とする請求項1に記載の凍結乾燥フルチカゾン組成物。
【請求項8】
前記凍結乾燥フルチカゾンが、凍結乾燥物の合計の組み合わせた乾燥重量の約0.017重量%から約0.023重量%までの量で存在することを特徴とする請求項1に記載の凍結乾燥フルチカゾン組成物。
【請求項9】
前記凍結乾燥フルチカゾンが約500μg/g以下の量で存在することを特徴とする請求項1に記載の凍結乾燥フルチカゾン組成物。
【請求項10】
前記凍結乾燥フルチカゾンが約1μg/gから約500μg/gまでの量で存在することを特徴とする請求項1に記載の凍結乾燥フルチカゾン組成物。
【請求項11】
前記凍結乾燥フルチカゾンが約25μg/gから約225μg/gまでの量で存在することを特徴とする請求項1に記載の凍結乾燥フルチカゾン組成物。
【請求項12】
前記凍結乾燥フルチカゾンが約9μg/gから約20μg/gまでの量で存在することを特徴とする請求項1に記載の凍結乾燥フルチカゾン組成物。
【請求項13】
前記非イオン性界面活性剤がポリソルベート80であることを特徴とする請求項1に記載の凍結乾燥フルチカゾン組成物。
【請求項14】
前記充填剤が、ラクトース、マンニトール、デキストロースおよびサッカロースからなる群から選択されることを特徴とする請求項1のいずれかに記載の凍結乾燥フルチカゾン組成物。
【請求項15】
前記非イオン性界面活性剤が、凍結乾燥物の合計の組み合わせた乾燥重量の約1重量%から約10重量%までの量で存在し、及び前記充填材が、凍結乾燥物の合計の組み合わせた乾燥重量の約90重量%から約99重量%までの量で存在することを特徴とする請求項1に記載の凍結乾燥フルチカゾン組成物。
【請求項16】
前記組成物が約0℃から約50℃までの温度で少なくとも6か月の期間の間安定していることを特徴とする請求項1に記載の凍結乾燥フルチカゾン組成物。
【請求項17】
前記組成物が、凍結乾燥物の合計の組み合わせた乾燥重量の約3重量%未満の溶媒又は共溶媒を含むことを特徴とする請求項1に記載の凍結乾燥フルチカゾン組成物。
【請求項18】
前記溶媒又は共溶媒が、tert−ブチルアルコール、n−ブタノール、エタノール、イソプロピルアルコール、ジメチルスルホン、クロロブタノールまたはそれらの混合物から選択されることを特徴とする請求項17に記載の凍結乾燥フルチカゾン組成物。
【請求項19】
凍結乾燥フルチカゾンまたはその薬学的に許容可能な塩、充填剤および非イオン性界面活性剤を含む凍結乾燥組成物から再構成された無菌のフルチカゾン製剤。
【請求項20】
注射用蒸留水、0.9%の塩化ナトリウム溶液または5%のデキストロース溶液から選択される薬学的に許容可能な希釈剤をさらに含む請求項19に記載の再構成された無菌のフルチカゾン製剤。
【請求項21】
前記薬学的に許容可能な希釈剤が注射用蒸留水であることを特徴とする請求項19に記載の再構成された無菌のフルチカゾン製剤。
【請求項22】
前記再構成されたフルチカゾンが約100μg/ml以下である量で存在することを特徴とする請求項19に記載の再構成された無菌のフルチカゾン製剤。
【請求項23】
前記再構成されたフルチカゾンが約900ng/mlから約2μg/mlの量で存在することを特徴とする請求項19に記載の再構成された無菌のフルチカゾン製剤。
【請求項24】
前記再構成されたフルチカゾンが約1μg/mlの量で存在することを特徴とする請求項19に記載の再構成された無菌のフルチカゾン製剤。
【請求項25】
溶解が約2分以内に生じることを特徴とする請求項19に記載の再構成された無菌のフルチカゾン製剤。
【請求項26】
約2分間の溶解の後のHPLCによって測定した時、再構成の前に存在する凍結乾燥フルチカゾンの量の少なくとも約50%である可溶化された又は溶解された量のフルチカゾンを提供する請求項25に記載の再構成された凍結乾燥フルチカゾン製剤。
【請求項27】
約2分間の溶解の後のHPLCによって測定した時、再構成の前に存在する凍結乾燥フルチカゾンの量の少なくとも約90%から約100%までである可溶化された又は溶解された量のフルチカゾンを提供する請求項25に記載の再構成された凍結乾燥フルチカゾン製剤。
【請求項28】
前記非イオン性界面活性剤が、凍結乾燥物の合計の組み合わせた乾燥重量の約4%から約5%までの量で、再構成前の凍結乾燥フルチカゾン組成物中に存在したことを特徴とする請求項27に記載の再構成された凍結乾燥フルチカゾン製剤。
【請求項29】
サルメテロールまたはその薬学的に許容可能な塩をさらに含むように調剤される請求項19に記載の再構成された凍結乾燥フルチカゾン製剤。
【請求項30】
ヒトに、請求項29に記載の再構成された無菌のフルチカゾン製剤を皮下に投与又は提供する工程を含む美容若しくは処置の方法又は使用。
【請求項31】
前記再構成された無菌のフルチカゾン製剤が、腹部脂肪蓄積、局所脂肪過多および甲状腺眼症に起因する眼球突出からなる群から選択される兆候を処置するために、ヒトに投与されることを特徴とする請求項30に記載の処置の方法又は使用。
【請求項32】
凍結乾燥された無菌のフルチカゾン組成物を調製する方法であって、該方法は、
(i)バルク溶液を形成するために、フルチカゾンまたはその薬学的に許容可能な塩、充填剤、および非イオン性界面活性剤を、溶媒又は共溶媒で可溶性にする工程と、
(ii)バルク溶液を殺菌する工程と、および
(iii)凍結乾燥された無菌のフルチカゾン組成物を提供するために殺菌されたバルク溶液を凍結乾燥する工程と、
を含むことを特徴とする方法。
【請求項33】
皮下注射に適しているフルチカゾン製剤を調製する再構成方法であって、該方法は、充填剤および非イオン性界面活性剤をさらに含む凍結乾燥された無菌のフルチカゾン組成物を、薬学的に許容可能な希釈剤または担体と接触させる工程を含むことを特徴とする方法。
【請求項34】
凍結乾燥サルメテロールまたはその薬学的に許容可能な塩および充填剤を含む凍結乾燥サルメテロール組成物。
【請求項35】
緩衝剤をさらに含む請求項34に記載の凍結乾燥サルメテロール組成物。
【請求項36】
抗酸化剤をさらに含む請求項34に記載の凍結乾燥サルメテロール組成物。
【請求項37】
前記凍結乾燥サルメテロールが約200ng/gから約250ng/gの量で存在することを特徴とする請求項34に記載の凍結乾燥サルメテロール組成物。
【請求項38】
凍結乾燥サルメテロールまたはその薬学的に許容可能な塩および充填剤を含む凍結乾燥組成物から再構成された無菌のサルメテロール製剤。
【請求項39】
フルチカゾンまたはその薬学的に許容可能な塩をさらに含むように調剤される請求項38に記載の再構成された凍結乾燥サルメテロール製剤。
【請求項40】
前記再構成されたフルチカゾンが、約100ng/mlから約100μg/mlの量で存在することを特徴とする請求項39に記載の製剤。
【請求項41】
前記フルチカゾンが、約900ng/mlから約2μg/mlの量で存在することを特徴とする請求項39に記載の製剤。
【請求項42】
ヒトに、請求項39に記載の再構成された無菌のサルメテロール製剤を皮下に投与又は提供する工程を含む美容若しくは処置の方法又は使用。
【請求項43】
凍結乾燥された無菌のサルメテロール組成物を調製する方法であって、該方法は、
(i)バルク溶液を形成するために、サルメテロールまたはその薬学的に許容可能な塩および充填剤を、溶媒又は共溶媒で可溶性にする工程と、
(ii)バルク溶液を殺菌する工程と、および
(iii)凍結乾燥された無菌のサルメテロール組成物を提供するために殺菌されたバルク溶液を凍結乾燥する工程と、
を含むことを特徴とする方法。
【請求項44】
皮下注射に適しているサルメテロール製剤を調製する再構成方法であって、該方法は、充填剤をさらに含む凍結乾燥された無菌のサルメテロール組成物を、薬学的に許容可能な希釈剤または担体と接触させる工程を含むことを特徴とする方法。
【請求項45】
(a)凍結乾燥フルチカゾンまたはその薬学的に許容可能な塩と、
(b)凍結乾燥サルメテロールまたはその薬学的に許容可能な塩と、
(c)充填剤と、および
(d)非イオン性界面活性剤と、
を含む凍結乾燥組成物。
【請求項46】
フルチカゾン対サルメテロールの比が約150:約1から約1:1であることを特徴とする請求項45に記載の凍結乾燥組成物。
【請求項47】
前記凍結乾燥フルチカゾンが、約500μg/g以下である量で存在し、および前記凍結乾燥サルメテロールが、約250μg/g以下の量で存在することを特徴とする請求項45に記載の凍結乾燥組成物。
【請求項48】
前記凍結乾燥フルチカゾンが、約200μg/gから約300μg/gまでの量で存在し、および前記凍結乾燥サルメテロールが、約4μg/gから約15μg/gまでの量で存在するを特徴とする請求項45に記載の凍結乾燥組成物。
【請求項49】
前記凍結乾燥フルチカゾンが、約9μg/gから約20μg/gまでの量で存在し、および前記凍結乾燥サルメテロールが、約200ng/gから約250ng/gまでの量で存在することを特徴とする請求項45に記載の凍結乾燥組成物。
【請求項50】
フルチカゾンまたはその薬学的に許容可能な塩、サルメテロール又はその薬学的に許容可能な塩、充填材、および非イオン性界面活性剤を含む凍結乾燥組成物から再構成された無菌の製剤。
【請求項51】
前記再構成されたフルチカゾンが、約100μg/ml以下の量で存在し、および前記再構成されたサルメテロールが、約25μg/ml以下の量で存在することを特徴とする請求項47に記載の再構成された無菌の製剤。
【請求項52】
前記再構成されたフルチカゾンが、約900ng/mlから約2μg/mlまでの量で存在し、前記サルメテロールが、約20ng/mlから約25ng/ml以下の量で存在することを特徴とする請求項47に記載の再構成された無菌の製剤。
【請求項53】
ヒトに、請求項50に記載の再構成された無菌の製剤を皮下に投与又は提供する工程を含む美容若しくは処置の方法又は使用。
【請求項54】
凍結乾燥された無菌の組成物を調製する方法であって、該方法は、
(i)バルク溶液を形成するために、フルチカゾンまたはその薬学的に許容可能な塩、サルメテロールまたはその薬学的に許容可能な塩、充填剤、および非イオン性界面活性剤を、溶媒又は共溶媒で可溶化する工程と、
(ii)バルク溶液を殺菌する工程と、および
(iii)凍結乾燥された無菌の組成物を提供するために、殺菌されたバルク溶液を凍結乾燥する工程と、
を含むことを特徴とする方法。
【請求項55】
(a)フルチカゾンまたはその薬学的に許容可能な塩と、
(b)サルメテロールまたはその薬学的に許容可能な塩と、
(c)充填剤と、および
(d)非イオン性界面活性剤と、
を含む凍結乾燥された物質を、薬学的に許容可能な希釈剤または担体と接触させる工程を含む、皮下注射に適している製剤を調製する再構成方法。
【図1】


【図2】


【図3】




【図2】


【図3】


【公表番号】特表2013−517294(P2013−517294A)
【公表日】平成25年5月16日(2013.5.16)
【国際特許分類】
【出願番号】特願2012−549145(P2012−549145)
【出願日】平成23年1月14日(2011.1.14)
【国際出願番号】PCT/US2011/021424
【国際公開番号】WO2011/088413
【国際公開日】平成23年7月21日(2011.7.21)
【出願人】(512183172)リセラ,インク. (1)
【Fターム(参考)】
【公表日】平成25年5月16日(2013.5.16)
【国際特許分類】
【出願日】平成23年1月14日(2011.1.14)
【国際出願番号】PCT/US2011/021424
【国際公開番号】WO2011/088413
【国際公開日】平成23年7月21日(2011.7.21)
【出願人】(512183172)リセラ,インク. (1)
【Fターム(参考)】
[ Back to top ]

