処理具
【課題】処理具に収納すべき液体を、無駄なく優れた精度で収納することができる処理具を提供すること。
【解決手段】本発明の処理具は、液体を収納可能な有底筒状の本体部1と、本体部1の開口側に設けられた口部2とを有する反応容器(処理具本体)10を備え、この口部2に移動促進手段が設けられたものである。このような移動促進手段を有することで、反応容器10の本体部1内に液体を収納した状態で、処理具を遠心機に装着して遠心した際に、口部2の内面に付着した液体の液滴の本体部1内への移動を促進することができる。また、移動促進手段は、傾斜面6で構成されるのが好ましい。
【解決手段】本発明の処理具は、液体を収納可能な有底筒状の本体部1と、本体部1の開口側に設けられた口部2とを有する反応容器(処理具本体)10を備え、この口部2に移動促進手段が設けられたものである。このような移動促進手段を有することで、反応容器10の本体部1内に液体を収納した状態で、処理具を遠心機に装着して遠心した際に、口部2の内面に付着した液体の液滴の本体部1内への移動を促進することができる。また、移動促進手段は、傾斜面6で構成されるのが好ましい。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、処理具、特に、糖タンパク質が有する糖鎖を精製する際に用いられる処理具に関する。
【背景技術】
【0002】
糖鎖とは、グルコース、ガラクトース、マンノース、フコース、キシロース、N−アセチルグルコサミン、N−アセチルガラクトサミン、シアル酸等の単糖およびこれらの誘導体がグリコシド結合によって鎖状に複数結合した分子の総称である。
【0003】
糖鎖は、非常に多様性に富んでおり、天然に存在する生物が有する様々な機能に関与する物質である。糖鎖は生体内でタンパク質や脂質等に結合した複合糖質として存在することが多く、生体内の重要な構成成分の一つである。生体内の糖鎖は細胞間情報伝達、タンパク質の機能や相互作用の調整等に深く関わっていることが明らかになりつつある。
【0004】
糖鎖を有する生体高分子としては、例えば、細胞の安定化に寄与する植物細胞の細胞壁のプロテオグリカン、細胞の分化、増殖、接着、移動等に影響を与える糖脂質、および細胞間相互作用や細胞認識に関与している糖タンパク質等が挙げられるが、これらの高分子の糖鎖が、互いに機能を代行、補助、増幅、調節、あるいは阻害しあいながら高度で精密な生体反応を制御する機構が次第に明らかにされつつある。さらに、このような糖鎖と細胞の分化増殖、細胞接着、免疫、および細胞の癌化との関係が明確にされれば、この糖鎖工学と、医学、細胞工学、あるいは臓器工学とを密接に関連させて新たな展開を図ることが期待できる(非特許文献1)。
【0005】
特に細胞表面に存在する糖鎖は、様々な生体反応の足場として重要な役割をしている事が明らかとなってきた。例えば、レセプターとの相互作用異常による疾病の発生、あるいはエイズウイルスやインフルエンザウイルス等の感染、病原性大腸菌O157の毒素やコレラ毒素の細胞への侵入に関わるとされている。また、ある種の癌細胞では特異的な糖鎖が細胞表面に現れる等、細胞表面糖鎖は細胞に個性をあたえる重要な分子とされている。
【0006】
これらの解析のため、糖鎖構造解析の技術が開発されており、これらの技術は、複合糖質からの糖鎖切り出し、糖鎖の分離精製、糖鎖の標識化等の工程を組み合わせたものであるが、これらの工程はきわめて煩雑である。
【0007】
細胞表面の糖鎖を解析する方法として、例えば、超遠心等の大型の装置を用いて細胞表面タンパク質を分画した後、結合している糖鎖を回収、解析する方法がある。
【0008】
しかしながら、この方法を用いた場合、必ずしも表面に存在する糖タンパク質の全てを回収できているとは言えなく、また、高額な装置である超遠心機を必要とする。そのため特別な装置を必要とせず、また表面糖鎖を容易に網羅的に回収できる方法が求められている。
【0009】
さらに、糖鎖の分離精製には、例えば、イオン交換樹脂、逆相クロマトグラフィ、活性炭、ゲル濾過クロマトグラフィ等の手法が用いられるが、これらの分離手段は糖を特異的に認識する方法ではないので、莢雑物(ペプチド、タンパク質等)の混入が避けられず、また糖鎖の構造によって回収率に差異が生じることが多い。
【0010】
また、クロマトグラフィで糖鎖を高精度に分離する場合には、糖鎖にピリジルアミノ化等の蛍光標識を施す必要があり、煩雑な操作が必要となる。そして、蛍光標識した糖鎖を分析するには、標識後の反応液中より未反応の2−アミノピリジン等の夾雑物を除き、この標識化糖鎖を精製することが必要である。
【0011】
一般には、標識化糖鎖と夾雑物の分子量の差を利用してゲルろ過を行い、夾雑物を除去する。しかしながら、この方法は器具を多く用いる点と、操作に多くの時間を要する点から、多数の試料を短時間に処理するのは困難である。
【0012】
また、簡易な方法として共沸により夾雑物を留去する方法も試みられているが、十分に夾雑物を除去するのは難しい。糖鎖構造と各種疾患の関係を調べるためには、統計的処理が可能な多数の検体の糖鎖構造を調べる必要がある。
【0013】
上述したような従来法では、糖鎖を分離するために、煩雑な工程を経る必要があり、膨大なコストと時間が必要となるため、簡単な作業でかつ無駄なく優れた精度で糖鎖を分離精製する手段が求められていた。さらに、かかる分離精製手段を実現するために用いられる処理具の開発が求められていた。
【先行技術文献】
【非特許文献】
【0014】
【非特許文献1】糖鎖生物学入門 化学同人 2005年11月1日発行 第1版
【発明の概要】
【発明が解決しようとする課題】
【0015】
本発明の目的は、処理具に収納すべき液体を、無駄なく優れた精度で収納することができる処理具を提供することにある。
【課題を解決するための手段】
【0016】
このような目的は、下記(1)〜(9)に記載の本発明により達成される。
(1) 遠心機に装着して使用する処理具であって、
液体を収納可能な有底筒状の本体部と、該本体部の開口側に設けられた筒状の口部とを備える処理具本体を有し、
前記処理具本体の前記本体部内に前記液体を収納した状態で、前記処理具を前記遠心機に装着して遠心した際に、前記口部の内面に付着した前記液体の前記本体部内への移動を促進する移動促進手段を、前記口部に設けたことを特徴とする処理具。
【0017】
(2) 前記移動促進手段は、前記口部の開口面積を、前記本体部に向かって漸減させて形成された面積漸減部で構成されている上記(1)に記載の処理具。
【0018】
(3) 前記面積漸減部は、前記口部の軸方向の全体にわたって設けられている上記(2)に記載の処理具。
【0019】
(4) 前記移動促進手段は、前記付着した液体の前記口部の周方向に沿った移動を規制する機能を有する上記(1)に記載の処理具。
【0020】
(5) 前記移動促進手段は、前記口部の軸方向に沿った凸条または溝で構成されている上記(4)に記載の処理具。
【0021】
(6) 前記本体部の底部には、貫通孔が形成され、
前記処理具本体は、さらに、前記貫通孔を塞ぐように設けられたフィルターを備える上記(1)ないし(5)のいずれかに記載の処理具。
【0022】
(7) さらに、前記処理具本体に装着され、前記処理具を前記遠心機に装着して遠心した際に、前記貫通孔を通過した前記本体部内の前記液体を貯留する外側容器を有する上記(6)に記載の処理具。
【0023】
(8) 前記外側容器は、一端が閉塞した筒状の部材で構成され、
前記処理具本体は、前記本体部と前記口部との境界付近に、前記外側容器を装着した際に、その開口縁部に係合する係合部を備える上記(7)に記載の処理具。
【0024】
(9) さらに、前記処理具本体の前記口部に装着して封止する蓋部を有する上記(1)ないし(8)のいずれかに記載の処理具。
【発明の効果】
【0025】
本発明によれば、処理具に収納すべき液体を、無駄なく優れた精度で処理具が備える反応容器の本体部に移動させることができるため、液体の無駄を的確に防止または抑制することができる。
【0026】
そのため、この処理具を、糖鎖の精製に用いた場合には、簡単な作業でかつ無駄なく優れた精度で糖鎖を精製することができる。
【図面の簡単な説明】
【0027】
【図1】本発明の処理具が備える反応容器の第1実施形態を示す縦断面図(a)、平面図(b)である。
【図2】本発明の処理具が備える反応容器の第2実施形態を示す平面図である。
【図3】本発明の処理具が備える反応容器の第3実施形態を示す平面図である。
【図4】本発明の処理具が備える反応容器の第4実施形態を示す平面図である。
【図5】糖タンパク質から糖鎖を精製する際に用いられる処理具の一例を示す縦断面図である。
【図6】図5に示す処理具を用いて糖タンパク質から糖鎖を精製する方法を説明するための縦断面図である。
【図7】図5に示す処理具を用いて糖タンパク質から糖鎖を精製する方法を説明するための縦断面図である。
【図8】図5に示す処理具を用いて糖タンパク質から糖鎖を精製する方法を説明するための縦断面図である。
【図9】図5に示す処理具を用いて糖タンパク質から糖鎖を精製する際に用いられる遠心機の一例を模式的に示す部分縦断面図である。
【発明を実施するための形態】
【0028】
以下、本発明の処理具について、好適実施形態に基づいて詳細に説明する。
なお、以下では、本発明の処理具の説明を行うのに先立って、糖タンパク質から糖鎖を処理具を用いて精製(糖鎖精製)する方法の一例について説明する。
【0029】
<糖鎖精製>
図5は、糖タンパク質から糖鎖を精製する際に用いられる処理具の一例を示す縦断面図、図6〜8は、図5に示す処理具を用いて糖タンパク質から糖鎖を精製する方法を説明するための縦断面図、図9は、図5に示す処理具を用いて糖タンパク質から糖鎖を精製する際に用いられる遠心機の一例を模式的に示す部分縦断面図である。また、以下の説明では、図5〜8中の上側を「上」、下側を「下」という。なお、以下に示す糖タンパク質の精製方法では、電気泳動により分離されたゲル中の糖タンパク質から糖鎖を精製する場合について説明する。
【0030】
以下に示す糖鎖の精製方法では、[1]糖タンパク質が保持されたゲルを得る工程と、[2]ゲルを糖鎖遊離手段で処理することで糖鎖を遊離させる工程と、[3]遊離した糖鎖をゲルから溶出させて糖鎖を含有する溶液を得る工程と、[4]糖鎖を含有する溶液を糖鎖と特異的に結合する捕捉担体に接触させて、この捕捉担体上に糖鎖を捕捉する工程と、[5]上記捕捉担体に結合しなかった糖鎖以外の物質を除去する工程と、[6]捕捉担体に結合した糖鎖を再遊離するとともに、この糖鎖を別の化合物でラベル化する工程と、[7]ラベル化された糖鎖を精製する工程とを有する。
【0031】
以下、各工程について詳述する。
[1]まず、糖タンパク質を含有する試料を用意し、この試料に対して所定の処理を施すことにより、糖タンパク質が保持されたゲルを得る。
【0032】
用意する糖タンパク質を含む試料としては、特に限定されないが、例えば、全血、血清、血漿、尿、唾液、細胞、組織等の生体試料が挙げられる。また、予め所定の方法を用いて精製された、または未精製の糖タンパク質を用いることができる。
【0033】
なお、この試料は脱脂、脱塩、タンパク質分画糖の方法により前処理されていてもよい。
【0034】
次いで、試料を、例えば、SDS−PAGE(SDS変性ポリアクリルアミドゲル電気泳動)や、等電点電気泳動とSDS−PAGEを組み合わせた二次元電気泳動等の所定処理を施すことにより、ゲル中において試料に含まれる糖タンパク質を分離する。
【0035】
次いで、泳動後のゲルを、例えば、クーマシーブリリアントブルー等の染色剤を用いて染色する。これにより、染色された糖タンパク質が保持されたゲルを得ることができる。
【0036】
[2]次に、染色された糖タンパク質を備える電気泳動後のゲルにおいてバンドを確認し、このバンドを、刃物等を用いて切り出す。そして、これを刃物等で細片化し、染色剤を洗浄除去したのち、ゲル内に保持されている糖タンパク質から、糖鎖遊離手段を用いて糖鎖を遊離させる。
【0037】
糖鎖を遊離させる手段としては、特に限定されないが、例えば、N−グリコシダーゼまたはO−グリコシダーゼを用いたグリコシダーゼ処理、ヒドラジン分解、アルカリ処理によるβ脱離等の方法を用いることができる。
【0038】
なお、N型糖鎖の分析を行う場合は、N−グリコシダーゼを用いる方法が好ましい。また、N−グリコシダーゼ処理に先立って、トリプシンやキモトリプシン等を用いてプロテアーゼ処理を行ってもよい。
【0039】
[3]次に、糖鎖遊離処理後のゲルを取り出し、このゲルを、洗浄液を用いてリンスすることで、遊離された糖鎖をゲルから洗浄液中に溶出させる。そして、洗浄液中においてゲルを沈殿させた後、この上清を回収することで、糖鎖を含有する溶液を得る。
【0040】
洗浄液としては、特に限定されないが、例えば、水、各種緩衝液、各種有機溶媒等が挙げられ、これらのうちの1種または2種以上を組み合わせて用いることができる。
【0041】
なお、この溶液は、必要に応じて濃縮することで、溶液中における糖鎖の含有率を増大させるようにしてもよい。
【0042】
また、前記工程[1]〜[3]における、糖タンパク質を含有する試料からの糖タンパク質の分離および糖タンパク質からの糖鎖の遊離は、電気泳動処理を施すことにより得られたゲル中から糖鎖を遊離することにより行うこととしたが、この場合に限定されず、アフィニティークロマトグラフィ処理やイオン交換クロマトグラフィ処理を前記試料に施すことにより精製された糖タンパク質から糖鎖を遊離するようにしてもよい。さらに、前記試料からの糖タンパク質の精製を省略してもよい場合には、前記試料に含まれる糖タンパク質に対して直接糖鎖を遊離させる処理を施すようにしてもよい。
【0043】
[4]次に、糖鎖を含有する溶液を糖鎖と特異的に結合する捕捉担体に接触させて、この捕捉担体上に糖鎖を捕捉する。
【0044】
ここで、糖鎖は生体内物質のなかで唯一、アルデヒド基をもつ物質である。すなわち、糖鎖は水溶液等の状態で環状のヘミアセタール型と、非環状型のアルデヒド型とが平衡で存在する。
【0045】
これに対して、タンパク質、核酸および脂質等の糖鎖以外の生体内物質にはアルデヒド基が含まれていない。
【0046】
このことから、アルデヒド基と特異的に反応して安定な結合を形成する官能基を有する捕捉担体を利用すれば、糖鎖のみを選択的に捕捉することが可能である。
【0047】
アルデヒド基と特異的に反応する官能基としては、例えば、ヒドラジド基、オキシルアミノ基、アミノ基、セミチオカルバジド基およびそれらの誘導体が好ましく、ヒドラジド基またはオキシルアミノ基がより好ましく用いられる。オキシルアミノ基とアルデヒド基との反応によって生じるオキシム結合、およびヒドラジド基とアルデヒド基との反応によって生じるヒドラゾン結合は、酸処理等によって容易に切断されるため、糖鎖を捕捉したのち、糖鎖を担体から簡単に切り離すことができる。
【0048】
なお、一般的に,生理活性物質の捕捉・担持にはアミノ基が多用されているが、アミノ基とアルデヒド基の反応によって生じる結合(シッフ塩基)は結合力が弱いため、還元剤等を用いた二次処理が必要であることから、アミノ基は糖鎖の捕捉には好ましくない。
【0049】
糖鎖を捕捉するための担体としては、ポリマー粒子を用いることが好ましい。さらに、このポリマー粒子は、少なくとも表面の一部に糖鎖のアルデヒド基と特異的に反応する官能基を有した固体またはゲル粒子であることが好ましい。
【0050】
ポリマー粒子が固体粒子またはゲル粒子であれば、ポリマー粒子に糖鎖を捕捉させた後、遠心分離やろ過等の手段によって、かかる粒子を容易に回収することができる。また、ポリマー粒子をカラムに充填して用いることも可能である。
【0051】
このようなポリマー粒子としては、例えば、下記一般式(1)で表されるものが挙げられる。
【0052】
【化1】

【0053】
以下、捕捉担体としてポリマー粒子20を用い、さらに遠心分離やろ過等の各種手段を用いることで、ポリマー粒子20上に糖鎖を捕捉する場合を一例に説明する。
【0054】
[4−1]まず、ポリマー粒子20を、純水21中に分散させて、ポリマー粒子が分散された粒子分散液22を得る。
【0055】
このポリマー粒子20の形状は、特に限定されないが、例えば、球状またはそれに類する形状が好ましい。
【0056】
ポリマー粒子20が球状の場合、平均粒径は、好ましくは0.05〜1000μm程度、より好ましくは0.05〜200μm程度、さらに好ましくは0.1〜200μm程度、最も好ましくは0.1〜100μm程度に設定される。平均粒径が下限値未満では、ポリマー粒子20を遠心分離やろ過で回収することが困難となるおそれがある。また、平均粒径が上限値を超えると、ポリマー粒子20と、後述する試料溶液との接触面積が少なくなり、糖鎖捕捉の効率が低下するおそれがある。
【0057】
[4−2]次に、図5(a)に示すような、反応容器(処理具本体)100を用意する。
【0058】
この反応容器100は、液体を収納可能な本体部101と、この本体部101の開口側(上側)に設けられた口部102とを有する。そして、通常、エッペンドルフチューブのような、一端が閉塞した筒状の部材である外側容器200に装着して、処理具300が備える1つの部材として使用される(図5(b)参照。)。
【0059】
本体部101は、その全体形状が有底筒状をなしており、内径および外径の双方が高さ方向に向かってほぼ一定となっており、その下側に底面103を備えている。
【0060】
また、この底面103のほぼ中心に対応して、貫通孔104が設けられており、これにより、この貫通孔104を介した、本体部101に供給(収納)された液体の外部への流出、すなわち、液体の外側容器200への供給が可能となる。
【0061】
さらに、本体部101の下側には、貫通孔104を塞ぐようにフィルター105が配置されている。これにより、反応容器100の静置時には、本体部101に供給された液体が貫通孔104を介して、その外部(外側容器200)へ流出することが阻害される。これに対して、処理具300を遠心機に装着して反応容器100を遠心させた際には、前記液体のフィルター105の透過が許容されるため、前記液体が貫通孔104を介して、その外部に流出される。すなわち、前記液体が外側容器200に供給される。
【0062】
フィルター105の素材としては、特に限定されないが、例えば、多孔性フィルムおよび不織布等が挙げられる。また、その構成材料としては、ポリテトラフルオロエチレン、セルロースエステル、フッ化ビニリデン、ポリカーボネート、ポリエチレン、ポリプロピレンおよびナイロン等が挙げられ、これらのうちの1種または2種以上を組み合わせて用いることができる。
【0063】
フィルター105が備える細孔の孔径は、好ましくは0.1〜50μm程度、より好ましくは0.5〜20μm程度、さらに好ましくは1〜10μmに設定される。これにより、前記液体に含まれる液状成分の透過は許容されるとともに、ポリマー粒子20の透過は確実に許容されなくなる。
【0064】
口部102は、本体部101の上側に設けられ、その全体形状が筒状をなしており、内径および外径が、本体部101の内径および外径より共に大きくなっている。
【0065】
このように内径を大きくすることで、液体の本体部101への注入を容易かつ確実に行うことができるようになる。
【0066】
また、外径を大きくすることで、口部102は、本体部101と比較して、その外側に円周状に張り出すこととなる。したがって、この反応容器100を外側容器200に装着した際に、口部102と本体部101との境界付近は、外側容器200の開口縁部201に係合する係合部として機能する。
【0067】
反応容器100をかかる構成のものとすることで、反応容器100の静置時には、本体部101において、供給された液体の反応を進行させることができる。さらに、反応容器100の遠心により、液体に含まれる固形成分(ポリマー粒子20)を本体部101に残存させた状態で、この液体を、貫通孔104を通過させて外側容器200に選択的に供給(貯留)することができる。すなわち、反応容器100の遠心により、本体部101に供給した液体中に含まれる固定成分と、液体との分離を容易に行うことができる。
【0068】
[4−3]次に、図6(a)に示すように、前記工程[3]で予め調製した粒子分散液22を反応容器100内に供給した後、反応容器100を外側容器200に装着した処理具300を、遠心機を用いて遠心する(図6(b)参照。)。
【0069】
これにより、図6(c)に示すように、粒子分散液22中に含まれる純水21が、外側容器200内に選択的に供給されることから、ポリマー粒子20が反応容器100内に単独で充填された状態となる。
【0070】
ここで用いる遠心機としては、特に限定されないが、例えば、図9に示すような遠心機500が用いられる。
【0071】
遠心機500は、ケーシング501と、処理具300を固定する回転体530と、回転体530を回転させる駆動手段520と、駆動手段520を支持する支持板511とを有している。
【0072】
回転体530は、処理具300を挿入(装着)可能な穴部531を複数備え、本実施形態では、その全体形状が円盤状をなしており、また、その中心を通る縦断面形状が上底よりも下底が長い台形となっている。
【0073】
この回転体530において、各穴部531は、回転体530の中心軸を対称軸とする線対称な位置に、その中心軸532の傾きが、支持板511に対して角度θ1となるように設けられている。
【0074】
角度θ1は、30〜80°程度、好ましくは40〜60°程度、さらに好ましくは45°程度に設定される。角度θ1をかかる範囲内に設定することで、回転体530の静止時においても、処理具300を穴部531に挿入した際に、この傾きにより、反応容器100から粒子分散液22が漏出してしまうのを確実に防止することができる。また、回転体530の回転時には、これにより生じる遠心力によって、粒子分散液22中の純水21を、フィルター105を確実に透過させることができるようになる。
【0075】
駆動手段520は、回転体530の中心軸から下方へ延設された回転軸522と、この回転軸522の下端に接続されかつ回転軸522をその軸周りに回転させるモーター521とを有し、モーター521を回転させることにより、回転軸522を中心として回転体530が回転する。
【0076】
支持板511は、ケーシング501内を上下に分離する隔壁を構成し、この支持板511のほぼ中心には、厚さ方向に貫通する貫通孔が形成されており、支持板511の上側に回転体530が下側にモーター521が配置され、これらが貫通孔内に配置された回転軸522を介して接続されている。かかる構成とすることにより、駆動手段520が支持板511によりケーシング501内に支持され、結果として、装置を構成する各部がケーシング501内に支持されることとなる。
【0077】
かかる構成の遠心機500において、回転体530に処理具300を挿入した状態で、駆動手段520を駆動させることにより回転体530を回転させると、これにより生じた遠心力によって、粒子分散液22中の純水21はフィルター105を透過する。これに対して、フィルター105の細孔径と、ポリマー粒子20の粒径との関係により、ポリマー粒子20はフィルター105を透過することができない。そのため、フィルター105を透過した純水21が、貫通孔104を介して外側容器200内に選択的に供給されることとなり、その結果、ポリマー粒子20が反応容器100内に単独で充填される。
【0078】
[4−4]次に、図6(d)に示すように、前記工程[3]で得られた糖鎖を含有する溶液(以下、「糖鎖含有液23」という。)を、ポリマー粒子20が充填された反応容器100内に供給する。
【0079】
[4−5]次に、糖鎖含有液23を加熱することで、供給した糖鎖含有液23が乾燥するまで、糖鎖含有液23を一定の温度範囲に保つ(図6(e)参照。)。
【0080】
これにより、ポリマー粒子20と、糖鎖含有液23中に含まれる糖鎖とが反応し、ポリマー粒子20上に糖鎖が捕捉される。
【0081】
この際の反応系のpHは、好ましくは2〜9、より好ましくは2〜7であり、さらに好ましくは2〜6である。なお、pH調整は、例えば、前記工程[4−4]の後に、各種緩衝液または有機溶媒を添加することにより行うことができる。
【0082】
糖鎖捕捉時の温度は、好ましくは4〜90℃程度、より好ましくは4〜70℃程度、さらに好ましくは30〜80℃程度、最も好ましくは40〜80℃程度の温度範囲に保たれるように設定する。
【0083】
また、反応時間、すなわち溶液が乾燥するまでの時間は、かかる温度範囲に設定した場合、通常、0.1〜3時間程度、好ましくは、0.6〜2時間程度に設定される。
【0084】
かかる条件で、ポリマー粒子20と糖鎖とを反応させることで、ポリマー粒子20上に糖鎖が確実に捕捉されることとなる。
【0085】
なお、本実施形態のように、糖鎖含有液23が乾燥するまで加熱する構成とすることにより、ポリマー粒子20と糖鎖との反応率の向上を確実に図ることができる。
【0086】
以上のような工程[4−1]〜[4−5]を経ることで、ポリマー粒子20上に糖鎖が捕捉される。
【0087】
なお、ポリマー粒子20がヒドラジド基を有するものである場合、ヒドラジド基と、糖鎖が有する還元末端との間で、下記式(2)で表される反応が進行することで、ポリマー粒子20上に糖鎖が捕捉される。
【0088】
【化2】

【0089】
[5]次に、捕捉担体に捕捉された糖鎖以外の物質を除去する。
ここで、上記のように捕捉担体としてポリマー粒子20を用いた場合、ポリマー粒子20に捕捉された糖鎖以外の物質としては、例えば、ポリマー粒子20に捕捉されなかった糖鎖の他、ポリマー粒子20の表面に、非特異的に吸着している糖鎖以外の莢雑物(タンパク質、脂質等)が挙げられる。
そのため、本工程[5]では、これらの物質を洗浄することで除去する。
【0090】
以下、前記工程[4]と同様に、反応容器100を用いて、遠心分離やろ過等の手段によって、ポリマー粒子20に捕捉された糖鎖以外の物質(以下、この物質を「洗浄物質」ということもある。)を洗浄除去する場合について説明する。
【0091】
[5−1]まず、図7(a)に示すように、前記工程[4−5]において得られた、反応容器100中で乾燥したポリマー粒子20に対して、洗浄液24を添加する。
【0092】
洗浄液24としては、特に限定されないが、水、各種緩衝液、各種有機溶剤や、これらに各種界面活性剤を添加したもの等が挙げられ、これらを適宜組み合わせて用いることができる。
【0093】
[5−2]次に、反応容器100を外側容器200に装着した処理具300を、遠心機を用いて遠心する(図7(b)参照。)。
【0094】
これにより、図7(c)に示すように、洗浄液24を、フィルター105を透過させることで、反応容器100にポリマー粒子20を残存させた状態で、反応容器100から選択的に洗浄液24を除去することができるとともに、洗浄液24中に溶解した洗浄物質を除去することができる。
【0095】
これら工程[5−1]および工程[5−2]で構成される洗浄を、複数回(繰り返して)行うことで、洗浄物質を洗浄液24中に溶解させた状態で、外側容器200に分離することができるため、洗浄物質を糖鎖が捕捉されたポリマー粒子20から確実に除去することができる。
【0096】
なお、この場合、界面活性剤を含む水または緩衝液を洗浄液24として用いて十分にポリマー粒子20を洗浄したのち、有機溶剤の洗浄液24でさらに洗浄し、最後に水を洗浄液24として洗浄するのが好ましい。これにより、洗浄物質、特に、非特異的にポリマー粒子20の表面に吸着する夾雑物をより確実に除去することができるようになる。
【0097】
[6]次に、捕捉担体に結合した糖鎖を再遊離させるとともに、この糖鎖を他の化合物(以下、「化合物A」と言うこともある。)に置換する。
【0098】
なお、この化合物Aとしては、蛍光物質、吸光物質および放射性物質等を備えるラベル化試薬が好ましく用いられる。
【0099】
以下、前記工程[4]、[5]と同様に、反応容器100を用いて、化合物Aで糖鎖をラベル化する場合について説明する。
【0100】
[6−1]まず、図7(d)に示すように、化合物Aを含有する化合物含有液25を、糖鎖が捕捉されたポリマー粒子20が充填された反応容器100内に添加する。
【0101】
反応容器100内に添加する化合物Aの添加量は、糖鎖が捕捉されたポリマー粒子20に対して、過剰量となっているのが好ましい。これにより、次工程[6−2]における糖鎖に対する化合物Aの置換率の向上を図ることができる。
【0102】
具体的には、化合物Aの添加量は、ポリマー粒子20が有する糖鎖と特異的に反応する官能基量に対して、好ましくは1.5倍量以上、より好ましくは3倍量以上、さらに好ましくは5倍量以上であり、最も好ましくは10倍量以上に設定される。
【0103】
[6−2]次に、化合物含有液25を加熱することで、添加した化合物含有液25が乾燥するまで、化合物含有液25を一定の温度範囲に保つ(図7(e)参照。)。
【0104】
これにより、捕捉された糖鎖はポリマー粒子20から切り離され、それとほぼ同時に糖鎖に化合物Aが付加することとなるため、糖鎖は化合物Aでラベル化されることとなる。
【0105】
この際の反応系のpHは、好ましくは2〜9、より好ましくは2〜7であり、さらに好ましくは2〜6である。なお、pH調整は、例えば、前記工程[6−1]の後に、各種緩衝液を添加することにより行うことができる。
【0106】
ラベル化時の温度は、好ましくは4〜90℃程度、より好ましくは4〜70℃程度、さらに好ましくは30〜80℃程度、最も好ましくは40〜80℃程度の温度範囲に保たれるように設定する。
【0107】
また、反応時間、すなわち溶液が乾燥するまでの時間は、かかる温度範囲に設定した場合、通常、0.1〜3時間程度、好ましくは、0.6〜2時間程度に設定される。
かかる条件で、ラベル化を行うことで、糖鎖が確実に化合物Aによりラベル化される。
【0108】
なお、本実施形態のように、化合物含有液25が乾燥するまで加熱する構成とすることにより、糖鎖と化合物Aとの反応率の向上を確実に図ることができる。
【0109】
以上のような工程[6−1]、[6−2]を経ることで、糖鎖が化合物Aでラベル化される。
【0110】
なお、化合物Aとしては、アミノオキシ基またはヒドラジド基を有する化合物が好ましく用いられ、ポリマー粒子20がヒドラジド基を有するものである場合、特に、下記化学式(3)で表されるN-aminooxyacetyl-tryptophanyl(arginine methyl ester)が好ましく用いられる。
【0111】
【化3】

【0112】
また、この化合物Aとしては、前記化合物の他、芳香族アミンで構成される蛍光物質を用いることができる。
【0113】
化合物Aとして、このような芳香族アミンを用いた場合、捕捉された糖鎖は、まずポリマー粒子20から切り離されて再遊離した後に、化合物Aによりラベル化されることとなる。
【0114】
以下、化合物Aとして芳香族アミンを用いて、糖鎖を化合物Aでラベル化する場合について説明する。
【0115】
[6−1’]まず、糖鎖を再遊離させる糖鎖遊離液を、糖鎖が捕捉されたポリマー粒子20が充填された反応容器100内に添加する。
【0116】
[6−2’]次に、糖鎖遊離液を加熱することで、添加した糖鎖遊離液が乾燥するまで、糖鎖遊離液を一定の温度範囲に保つ。
【0117】
これにより、捕捉された糖鎖がポリマー粒子20から切り離されることで、糖鎖は再遊離する。
【0118】
この際の反応系のpHは、好ましくは2〜9、より好ましくは2〜7であり、さらに好ましくは2〜6である。このpH調整が、前記工程[6−1’]における糖鎖遊離液の添加により行われ、各種緩衝液等が糖鎖遊離液として用いられる。
【0119】
糖鎖遊離時の温度は、好ましくは4〜100℃程度、より好ましくは25〜90℃程度、さらに好ましくは30〜80℃程度、最も好ましくは60〜80℃程度の温度範囲に保たれるように設定する。
【0120】
また、反応時間、すなわち溶液(糖鎖遊離液)が乾燥するまでの時間は、かかる温度範囲に設定した場合、通常、0.1〜3時間程度、好ましくは、0.6〜2時間程度に設定される。
【0121】
かかる条件で、糖鎖の再遊離を行うことで、糖鎖がポリマー粒子20から確実に切り離される。
【0122】
なお、本実施形態のように、糖鎖遊離液が乾燥するまで加熱する構成とすることにより、糖鎖の遊離率の向上を確実に図ることができる。
【0123】
[6−3’]次に、化合物Aとして芳香族アミンを含有する化合物含有液25を、ポリマー粒子20から糖鎖が遊離している、反応容器100内に添加する。
【0124】
芳香族アミン(化合物A)としては、特に限定されないが、例えば、2−Aminobenzamide、2−Aminobenzoic acid、8−Aminopyrene−1,3,6−trisulfonate、8−Aminonaphthalene−1,3,6−trisulphonate、2−Amino9(10H)−acridone、5−Aminofluorescein、Dansylethylenediamine、7−Amino−4−methylcoumarine、3−Aminobenzoic acid、7−Amino−1−naphtholおよび3−(Acetylamino)−6−aminoacridine等が挙げられる。中でも2−aminobenzamideまたは2−aminobenzoic acidであるのが好ましい。これらの化合物は、試薬としての入手、反応の簡便性から好適に用いられる。
【0125】
また、芳香族アミンとして2−aminobenzamideまたは2−aminobenzoic acidを用いる場合、一般的な条件では0.35mol/Lで使用されるが、本工程では、化合物含有液25添加後の反応容器100内の溶液、すなわち、再遊離した糖鎖を含む溶液における芳香族アミンの濃度は、好ましくは0.5mol/L以上、より好ましくは1.4mol/L以上に設定される。これにより、化合物Aによる糖鎖の標識効率を向上させることが可能となる。ただし、濃度が3mol/L以上になると、後工程[7]において、反応に使用されなかった芳香族アミン(化合物A)を除去するのが困難となるおそれがあるため、最も好ましい濃度は1.4mol/L以上3mol/L以下に設定される。
【0126】
また、液量に関して、反応容器100内に充填されたポリマー粒子20で規定する場合、通常はポリマー粒子20が浸る程度の液量、例えば、5mgのポリマー粒子20に対して50μL程度に設定されるが、液量(容量)を倍量の100μL程度に設定するのが好ましい。これにより、化合物Aによる糖鎖の標識効率を向上させることが可能となる。ただし、液量は100μLを超えても良いが、一定量を超えると、後工程[7]において、反応に使用されなかった芳香族アミン(化合物A)を除去するのが困難となるおそれがあるため、最も好まし液量は100μL〜200μLの間に設定される。
【0127】
より具体的には、芳香族アミンとして2−aminobenzamideを用いる場合、反応容器100内に、1.4 M 2-Aminobenzamid, 1 M sodium cyanoborohydrideの濃度になるように30%酢酸/ジメチルスルホキシド(DMSO)に溶解させた溶液100μLを化合物含有液25として添加する。
【0128】
[6−4’]次に、化合物含有液25を加熱することで、化合物含有液25を一定の温度範囲に保つ。
【0129】
これにより、ポリマー粒子20から再遊離している糖鎖は化合物Aと反応し、その結果、糖鎖は化合物Aでラベル化されることとなる。
【0130】
この際の反応系のpHは、好ましくは2〜9、より好ましくは2〜7であり、さらに好ましくは2〜6である。
【0131】
ラベル化時の温度は、好ましくは0〜100℃程度、より好ましくは4〜95℃程度、さらに好ましくは30〜90℃程度の温度範囲に保たれるように設定する。
【0132】
また、反応時間は、かかる温度範囲に設定した場合、通常、0.1〜20時間程度、好ましくは、0.6〜12時間程度に設定される。
【0133】
より具体的には、芳香族アミンとして2−aminobenzamideを用いた場合、化合物含有液25を30〜70℃の温度範囲で加熱して、1〜10時間程度、反応する。
かかる条件で、ラベル化を行うことで、糖鎖が確実に化合物Aによりラベル化される。
【0134】
なお、化合物Aとして芳香族アミンを用いた場合、前記工程[6−2]で説明したような、化合物含有液25の乾燥を省略することができる。
【0135】
以上のような工程[6−1’]〜[6−4’]によっても、糖鎖が化合物Aでラベル化される。
【0136】
さらに、本工程において、糖鎖のラベル化が必要ない場合には、糖鎖の化合物Aによる置換を省略することができる。
【0137】
[7]次に、化合物Aでラベル化された糖鎖(以下、「ラベル化糖鎖」と言うこともある。)を精製する。
【0138】
ここで、上記のようにポリマー粒子20に捕捉された糖鎖を再遊離させることで、ラベル化糖鎖を得た場合、化合物Aでラベル化された糖鎖以外に、反応容器100中に含まれる物質としては、糖鎖が遊離したポリマー粒子20および糖鎖のラベル化に使用されなかった化合物A(以下、「未使用化合物A」と言うこともある。)が挙げられる。
【0139】
そのため、本工程[7]では、これらポリマー粒子20および未使用化合物Aを除去することで、ラベル化糖鎖の精製を行う。
【0140】
以下、前記工程[4]〜[6]と同様に、反応容器100を用いて、遠心分離やろ過等の手段によって、ラベル化糖鎖を精製する場合について説明する。
【0141】
[7−1]まず、図8(a)に示すように、前記工程[6−2]において得られた、反応容器100中で乾燥したラベル化糖鎖と、ポリマー粒子20とに対して、溶解液26を添加する。
【0142】
溶解液26としては、ラベル化糖鎖を溶解し得る液剤であればよく、特に限定されるものではないが、水、各種緩衝液および各種有機溶剤等が挙げられる。
【0143】
なお、前記工程[6−2]における化合物含有液25の加熱によりポリマー粒子20が乾燥していない場合には、本工程[7−1]における反応容器100内への溶解液26の添加を省略することができる。
【0144】
さらに、化合物Aとして、芳香族アミンで構成される蛍光物質を用いた場合には、前記工程[6−1’]〜[6−4’]で得られる化合物Aでラベル化された糖鎖が乾燥していないため、この場合についても、本工程[7−1]における反応容器100内への溶解液26の添加を省略することができる。
【0145】
[7−2]次に、反応容器100を外側容器200に装着した処理具300を、遠心機を用いて遠心する(図8(b)参照。)。
【0146】
これにより、図8(c)に示すように、溶解液26を、フィルター105を透過させることで、反応容器100にポリマー粒子20を残存させた状態で、反応容器100から選択的に溶解液26を外側容器200に貯留することができるとともに、この溶解液26中に溶解したラベル化糖鎖を外側容器200に移動させることができる。その結果、ラベル化糖鎖とポリマー粒子20とが分離される。
【0147】
なお、この際、未使用化合物Aも、通常、溶解液26に対して溶解性を示すため、溶解液26に溶解した状態で、外側容器200側に移動する。
【0148】
[7−3]次に、フィルター105に代えて、シリカゲル106が本体部101の下側に配置された容器100’を用意し、この容器100’が外側容器200に装着した処理具300’を得る。
【0149】
そして、図8(d)に示すように、前記工程[7−2]において、外側容器200に分離された、ラベル化糖鎖を含有する溶解液26をアセトニトリル等の非水溶媒で希釈し、シリカゲル106を備える容器100’内に供給する。
【0150】
これにより、図8(e)に示すように、シリカゲル106を透過した溶解液26が貫通孔104を介して、外側容器200に液滴として流出することとなる。
【0151】
この際、シリカゲル106をアセトニトリル等の非水溶媒で希釈した溶解液26が透過するため、溶解液26に含まれるラベル化糖鎖と未使用化合物Aとは、シリカゲルに吸着する。シリカゲルへの吸着力は、未使用化合物Aよりもラベル化糖鎖の方が高い。したがって、容器100’内にアセトニトリル等の非水溶媒を供給し、シリカゲル106を洗浄することにより、未使用化合物Aの少なくとも一部をシリカゲルから除去することができる。その後、容器100’内に水を加え、シリカゲルを透過させることにより、未使用化合物Aの混在が的確に防止または抑制された状態で、ラベル化糖鎖を精製(分離)することができる。
【0152】
以上のような工程を経ることで、化合物Aでラベル化された糖鎖を精製することができる。
【0153】
なお、未使用化合物A除去する必要がない場合には、本工程[7]を省略するようにしてもよい。
【0154】
また、化合物Aでラベル化された糖鎖は、MALDI-TOF MSに代表される質量分析、さらに高速液体クロマトグラフィ(HPLC)等の手法で分析することができる。
【0155】
特に、糖鎖が前述した化学式(2)で表されるN-aminooxyacetyl-tryptophanyl(arginine methyl ester)でラベル化されている場合、MALDI-TOF MSを用いて高感度分析を行うことができる。
【0156】
さて、このような糖鎖の精製方法においては、補足担体(ポリマー粒子20)および処理具300を用い、遠心分離やろ過等の手段を利用することで、前述した従来法と比較して、工程の簡略化を図ることができるため、コストと時間の無駄の減少を実現することができる。
【0157】
そして、より優れた精度で糖鎖を精製するためには、前記各工程で説明したように、粒子分散液22、糖鎖含有液23、洗浄液24、化合物含有液25および溶解液26を、それぞれ反応容器100(本体部101)に供給する構成となっていることから、これら液体を精度よく本体部101に供給することが求められる。
【0158】
しかしながら、反応容器100では、上述したように、本体部101および口部102の内径が口部102の方が大きい構成となっているため、これらの境界部に段差107が形成されている。そのため、例えば、口部102の内周面(内壁)に伝わせて前記液体を本体部101に供給した場合には、段差107に前記液体が残存する。したがって、このように残存した状態で各工程を行うと、糖鎖の精製の精度が低下してしまう。
【0159】
特に、上記の糖鎖の精製方法では、遠心分離により本体部101に供給された上記液体を、外側容器200側に移動させる構成となっているが、このような遠心分離を行ったとしても、反応容器100が段差107を備える構成であると、この段差107に前記液体が残存してしまう。
【0160】
本発明の処理具は、かかる問題を解消するために用いられるものである。
<処理具>
以下、本発明の処理具について説明するが、本発明では、処理具が備える反応容器(処理具本体)の構成に特徴を有するため、以下では、この反応容器について詳述する。
【0161】
<<第1実施形態>>
まず、本発明の処理具が備える反応容器の第1実施形態について説明する。
【0162】
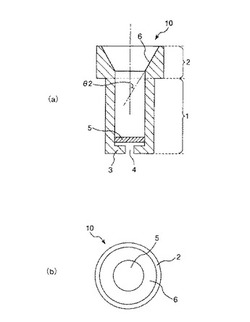
図1は、本発明の処理具が備える反応容器の第1実施形態を示す縦断面図(a)、平面図(b)である。なお、以下の説明では、図1中の上側を「上」、下側を「下」という。
【0163】
図1に示す反応容器10は、液体を収納可能な本体部1と、この本体部1の開口側(上側)に設けられた口部2とを有する。
【0164】
本体部1は、その全体形状が有底筒状をなしており、内径および外径の双方が高さ方向に向かってほぼ一定となっている。
【0165】
この本体部1は、底面3と、貫通孔4と、フィルター5とを有しており、前述した反応容器100が有する本体部101と同様の構成をなしている。
【0166】
口部2は、本体部1の上側に設けられ、その全体形状が筒状をなしている。
口部2の内径は、下端から上端に向かって高さ方向の途中までほぼ一定であるが、途中から上端に向かって漸増する構成となっている。すなわち、その内径が、口部2の下端では、本体部1の内径とほぼ同一であるが、その途中から上端に向かって、本体部1の内径に対して漸増する。
【0167】
換言すれば、口部2の内周面(内面)は、その全体形状がロート状をなしており、その上部内周面が、口部2の外周面側から内周面側に向かって傾斜する傾斜面(テーパ部)6となっている。
【0168】
口部2をかかる構成とすることで、傾斜面6により、口部2の開口面積が、口部2から本体部1側に向かって漸減する面積漸減部が形成される。これにより、前述した反応容器100のように、本体部101と口部102との境界に段差107が形成されることがない。そのため、口部2の内周面に伝わせるようにして、粒子分散液22、糖鎖含有液23、洗浄液24、化合物含有液25、溶解液26のような液体を供給したとしても、口部2の内周面にこの液体の液滴が残存することなく、本体部1内へ液体を供給することができる。したがって、この傾斜面6(面積漸減部)は、口部2の内周面に供給された液滴を、本体部1内への移動を促進する移動促進手段としての機能を発揮する。
【0169】
したがって、口部2の内周面すなわち傾斜面6に供給された前記液体は、処理具300(反応容器100)を、遠心機を用いて遠心すると、傾斜面6に沿って、その下側に向かって移動し最終的には本体部1内に誘導される。換言すれば、傾斜面6により、口部2の内周面に付着した液体の本体部1への移動が促進される。
【0170】
このようなことから、糖タンパク質から分離した糖鎖を、無駄なくかつ確実に本体部1内に供給することができる。よって、このように無駄が生じないことから、より優れた精度で糖鎖を精製することができるようになる。すなわち、糖鎖の収率の向上を図ることができる。
【0171】
傾斜面6は、特に限定されないが、口部2の中心軸に対しする角度θ2が、好ましくは15〜65°程度、より好ましくは25〜55°程度となるように傾斜している。これにより、かかる反応容器100を備える処理具300を、前述したような遠心機500の穴部531に装着した際に、角度θ1と角度θ2との差を小さくすることができる。すなわち、傾斜面6の支持板511に対する傾斜角度を小さくすることができる。したがって、かかる遠心機500を用いて処理具300を遠心した際には、傾斜面6に付着している液体(液滴)に対して、より大きな遠心力を付与することができる。そのため、傾斜面6に供給された液体を、本体部1内により確実に誘導することができるようになる。
【0172】
また、傾斜面6には、液体が付着するのを防止または低減する付着防止処理が施されているのが好ましい。かかる処理が施されることで、遠心力により液体を傾斜面6に沿ってより確実に本体部1にまで移動させることができるようになる。
【0173】
この付着防止処理としては、特に限定されないが、例えば、傾斜面6に撥液膜を形成する撥液処理、傾斜面6の凹凸を低減して平滑面で形成する平滑化処理等が挙げられる。
なお、移動促進手段は、図1に示すような傾斜面6で構成されている場合に限らず、例えば、湾曲凹面、湾曲凸面、または傾斜面6を含み、これらのうちの任意の2以上を組み合わせたもので構成されていてもよい。
【0174】
一方、口部2の外径は、その高さ方向に沿ってほぼ一定であり、その大きさは本体部1の外径よりも大きくなっている。これにより、口部2は、本体部1と比較して、その外側に円周状に張り出すこととなる。したがって、この反応容器10を外側容器200に装着した際に、口部2は、外側容器200の開口縁部201に係合する係合部として機能する。
【0175】
このような反応容器10の構成材料としては、特に限定されないが、例えば、ポリプロピレン、ポリエチレン、ポリスチレン、ポリ塩化ビニル、ポリテトラフルオロエチレン等が挙げられ、これらのうちの1種または2種以上を組み合わせて用いることができる。
【0176】
なお、本実施形態では、口部2の内径が、その下端では、一定であるが、その途中から上端に向かって漸増する構成、すなわち傾斜面6が口部2の途中から上端に形成される構成としたが、かかる構成に限定されず、傾斜面6が口部2の下端から上端にわたって設けられていてもよい。換言すれば、面積漸減部が、口部2の軸方向の全体にわたって設けられていてもよい。かかる構成とすることで、傾斜面6の角度の設定を容易に行うことができるという利点が得られる。
【0177】
<<第2実施形態>>
次に、本発明の処理具が備える反応容器の第2実施形態について説明する。
【0178】
図2は、本発明の処理具が備える反応容器の第2実施形態を示す平面図である。なお、以下の説明では、図2中の上側を「上」、下側を「下」という。
【0179】
以下、第2実施形態について説明するが、前記第1実施形態と異なる点を中心に説明し、同様の事項についてはその説明を省略する。
【0180】
第2実施形態では、口部2の構成が異なり、それ以外は、前記第1実施形態と同様である。
【0181】
図2に示すように、口部2には、傾斜面6において口部2の上下方向(軸方法)に沿うように溝7が形成されている。
【0182】
本実施形態では、8つの溝7が傾斜面6の周方向に沿って、それぞれ、等間隔で形成されている。すなわち、各溝7は、口部2の軸を中心に放射状に位置している。
【0183】
このような構成により、処理具300(反応容器100)を、遠心機を用いて遠心した際に、傾斜面6に供給された(付着した)液体が、傾斜面6の周方向に沿って移動してしまうのを確実に防止することができる。したがって、各溝7は、液滴が傾斜面6の周方向に沿った移動を規制する規制手段として機能する。
【0184】
なお、本実施形態の溝7は、その横断面(長手方向に垂直な方向における断面)の縁部がコ字状(矩形状)をなしていたが、その他、例えば、半円形状、U字状、V字状等であってもよい。
【0185】
<<第3実施形態>>
次に、本発明の処理具が備える反応容器の第3実施形態について説明する。
【0186】
図3は、本発明の処理具が備える反応容器の第3実施形態を示す平面図である。なお、以下の説明では、図3中の上側を「上」、下側を「下」という。
【0187】
以下、第3実施形態について説明するが、前記第1実施形態と異なる点を中心に説明し、同様の事項についてはその説明を省略する。
【0188】
第3実施形態では、口部2の構成が異なり、それ以外は、前記第1実施形態と同様である。
【0189】
図3に示すように、口部2には、傾斜面6において口部2の上下方向に沿うように凸条(リブ)8が形成されている。
【0190】
本実施形態では、8つのリブ8が傾斜面6の周方向に沿って、それぞれ、等間隔で形成されている。すなわち、各リブ8は、口部2の中心軸を中心に放射状に位置している。
【0191】
このような構成により、処理具300(反応容器100)を、遠心機を用いて遠心した際に、傾斜面6に供給された液体が、傾斜面6の周方向に沿って移動してしまうのを確実に防止することができる。したがって、各リブ8は、液滴が傾斜面6の周方向に沿った移動を規制する規制手段として機能する。
【0192】
なお、本実施形態のリブ8は、その横断面(長手方向に垂直な方向における断面)の縁部がコ字状(矩形状)をなしていたが、その他、例えば、半円形状、U字状、V字状等であってもよい。
【0193】
<<第4実施形態>>
次に、本発明の処理具が備える反応容器の第4実施形態について説明する。
【0194】
図4は、本発明の処理具が備える反応容器の第4実施形態を示す平面図である。なお、以下の説明では、図4中の上側を「上」、下側を「下」という。
【0195】
以下、第4実施形態について説明するが、前記第2実施形態と異なる点を中心に説明し、同様の事項についてはその説明を省略する。
【0196】
第4実施形態では、口部2の構成が異なり、それ以外は、前記第2実施形態と同様である。
【0197】
本実施形態では、8つの溝7が、口部2の上下方向に沿って、直線状に形成されているのに代えて、溝7の長手方向に湾曲して形成されている。
【0198】
このような構成により、前記第2実施形態と同様に、処理具300(反応容器100)を、遠心機を用いて遠心した際に、各溝7は、液滴が傾斜面6の周方向に沿った移動を規制する規制手段として機能するが、さらに、長手方向に湾曲していることで、液体の本体部1への移動を促進することができるため、移動促進手段としても機能する。
なお、溝7は、長手方向に湾曲する場合の他、螺旋状に形成されていてもよい。
【0199】
また、前記実施形態2〜4で説明したように、口部2に溝7または凸条8を設ける構成とした場合、口部2に蓋部を装着して、反応容器100を封止するようにしてもよい。この場合、溝7または凸条8が蓋部を係止する係止部として機能することから、蓋部の脱落を確実に防止することができる。
【0200】
以上、本発明の処理具を図示の実施形態に基づいて説明したが、本発明はこれらに限定されるものではない。例えば、本発明の処理具は、各前記実施形態のうち任意の2以上の構成(特徴)を組み合わせたものであってもよい。
【0201】
また、本発明の処理具の各部の構成は、同様の機能を発揮し得る任意のものと置換することができ、または、任意の構成のものを付加することもできる。
【符号の説明】
【0202】
1 本体部
2 口部
3 底面
4 貫通孔
5 フィルター
6 傾斜面
7 溝
8 凸条
10 反応容器
20 ポリマー粒子
21 純水
22 粒子分散液
23 糖鎖含有液
24 洗浄液
25 化合物含有液
26 溶解液
100 反応容器
100’ 容器
101 本体部
102 口部
103 底面
104 貫通孔
105 フィルター
106 シリカゲル
107 段差
200 外側容器
201 開口縁部
300、300’ 処理具
500 遠心機
501 ケーシング
511 支持板
520 駆動手段
521 モーター
522 回転軸
530 回転体
531 穴部
532 中心軸
【技術分野】
【0001】
本発明は、処理具、特に、糖タンパク質が有する糖鎖を精製する際に用いられる処理具に関する。
【背景技術】
【0002】
糖鎖とは、グルコース、ガラクトース、マンノース、フコース、キシロース、N−アセチルグルコサミン、N−アセチルガラクトサミン、シアル酸等の単糖およびこれらの誘導体がグリコシド結合によって鎖状に複数結合した分子の総称である。
【0003】
糖鎖は、非常に多様性に富んでおり、天然に存在する生物が有する様々な機能に関与する物質である。糖鎖は生体内でタンパク質や脂質等に結合した複合糖質として存在することが多く、生体内の重要な構成成分の一つである。生体内の糖鎖は細胞間情報伝達、タンパク質の機能や相互作用の調整等に深く関わっていることが明らかになりつつある。
【0004】
糖鎖を有する生体高分子としては、例えば、細胞の安定化に寄与する植物細胞の細胞壁のプロテオグリカン、細胞の分化、増殖、接着、移動等に影響を与える糖脂質、および細胞間相互作用や細胞認識に関与している糖タンパク質等が挙げられるが、これらの高分子の糖鎖が、互いに機能を代行、補助、増幅、調節、あるいは阻害しあいながら高度で精密な生体反応を制御する機構が次第に明らかにされつつある。さらに、このような糖鎖と細胞の分化増殖、細胞接着、免疫、および細胞の癌化との関係が明確にされれば、この糖鎖工学と、医学、細胞工学、あるいは臓器工学とを密接に関連させて新たな展開を図ることが期待できる(非特許文献1)。
【0005】
特に細胞表面に存在する糖鎖は、様々な生体反応の足場として重要な役割をしている事が明らかとなってきた。例えば、レセプターとの相互作用異常による疾病の発生、あるいはエイズウイルスやインフルエンザウイルス等の感染、病原性大腸菌O157の毒素やコレラ毒素の細胞への侵入に関わるとされている。また、ある種の癌細胞では特異的な糖鎖が細胞表面に現れる等、細胞表面糖鎖は細胞に個性をあたえる重要な分子とされている。
【0006】
これらの解析のため、糖鎖構造解析の技術が開発されており、これらの技術は、複合糖質からの糖鎖切り出し、糖鎖の分離精製、糖鎖の標識化等の工程を組み合わせたものであるが、これらの工程はきわめて煩雑である。
【0007】
細胞表面の糖鎖を解析する方法として、例えば、超遠心等の大型の装置を用いて細胞表面タンパク質を分画した後、結合している糖鎖を回収、解析する方法がある。
【0008】
しかしながら、この方法を用いた場合、必ずしも表面に存在する糖タンパク質の全てを回収できているとは言えなく、また、高額な装置である超遠心機を必要とする。そのため特別な装置を必要とせず、また表面糖鎖を容易に網羅的に回収できる方法が求められている。
【0009】
さらに、糖鎖の分離精製には、例えば、イオン交換樹脂、逆相クロマトグラフィ、活性炭、ゲル濾過クロマトグラフィ等の手法が用いられるが、これらの分離手段は糖を特異的に認識する方法ではないので、莢雑物(ペプチド、タンパク質等)の混入が避けられず、また糖鎖の構造によって回収率に差異が生じることが多い。
【0010】
また、クロマトグラフィで糖鎖を高精度に分離する場合には、糖鎖にピリジルアミノ化等の蛍光標識を施す必要があり、煩雑な操作が必要となる。そして、蛍光標識した糖鎖を分析するには、標識後の反応液中より未反応の2−アミノピリジン等の夾雑物を除き、この標識化糖鎖を精製することが必要である。
【0011】
一般には、標識化糖鎖と夾雑物の分子量の差を利用してゲルろ過を行い、夾雑物を除去する。しかしながら、この方法は器具を多く用いる点と、操作に多くの時間を要する点から、多数の試料を短時間に処理するのは困難である。
【0012】
また、簡易な方法として共沸により夾雑物を留去する方法も試みられているが、十分に夾雑物を除去するのは難しい。糖鎖構造と各種疾患の関係を調べるためには、統計的処理が可能な多数の検体の糖鎖構造を調べる必要がある。
【0013】
上述したような従来法では、糖鎖を分離するために、煩雑な工程を経る必要があり、膨大なコストと時間が必要となるため、簡単な作業でかつ無駄なく優れた精度で糖鎖を分離精製する手段が求められていた。さらに、かかる分離精製手段を実現するために用いられる処理具の開発が求められていた。
【先行技術文献】
【非特許文献】
【0014】
【非特許文献1】糖鎖生物学入門 化学同人 2005年11月1日発行 第1版
【発明の概要】
【発明が解決しようとする課題】
【0015】
本発明の目的は、処理具に収納すべき液体を、無駄なく優れた精度で収納することができる処理具を提供することにある。
【課題を解決するための手段】
【0016】
このような目的は、下記(1)〜(9)に記載の本発明により達成される。
(1) 遠心機に装着して使用する処理具であって、
液体を収納可能な有底筒状の本体部と、該本体部の開口側に設けられた筒状の口部とを備える処理具本体を有し、
前記処理具本体の前記本体部内に前記液体を収納した状態で、前記処理具を前記遠心機に装着して遠心した際に、前記口部の内面に付着した前記液体の前記本体部内への移動を促進する移動促進手段を、前記口部に設けたことを特徴とする処理具。
【0017】
(2) 前記移動促進手段は、前記口部の開口面積を、前記本体部に向かって漸減させて形成された面積漸減部で構成されている上記(1)に記載の処理具。
【0018】
(3) 前記面積漸減部は、前記口部の軸方向の全体にわたって設けられている上記(2)に記載の処理具。
【0019】
(4) 前記移動促進手段は、前記付着した液体の前記口部の周方向に沿った移動を規制する機能を有する上記(1)に記載の処理具。
【0020】
(5) 前記移動促進手段は、前記口部の軸方向に沿った凸条または溝で構成されている上記(4)に記載の処理具。
【0021】
(6) 前記本体部の底部には、貫通孔が形成され、
前記処理具本体は、さらに、前記貫通孔を塞ぐように設けられたフィルターを備える上記(1)ないし(5)のいずれかに記載の処理具。
【0022】
(7) さらに、前記処理具本体に装着され、前記処理具を前記遠心機に装着して遠心した際に、前記貫通孔を通過した前記本体部内の前記液体を貯留する外側容器を有する上記(6)に記載の処理具。
【0023】
(8) 前記外側容器は、一端が閉塞した筒状の部材で構成され、
前記処理具本体は、前記本体部と前記口部との境界付近に、前記外側容器を装着した際に、その開口縁部に係合する係合部を備える上記(7)に記載の処理具。
【0024】
(9) さらに、前記処理具本体の前記口部に装着して封止する蓋部を有する上記(1)ないし(8)のいずれかに記載の処理具。
【発明の効果】
【0025】
本発明によれば、処理具に収納すべき液体を、無駄なく優れた精度で処理具が備える反応容器の本体部に移動させることができるため、液体の無駄を的確に防止または抑制することができる。
【0026】
そのため、この処理具を、糖鎖の精製に用いた場合には、簡単な作業でかつ無駄なく優れた精度で糖鎖を精製することができる。
【図面の簡単な説明】
【0027】
【図1】本発明の処理具が備える反応容器の第1実施形態を示す縦断面図(a)、平面図(b)である。
【図2】本発明の処理具が備える反応容器の第2実施形態を示す平面図である。
【図3】本発明の処理具が備える反応容器の第3実施形態を示す平面図である。
【図4】本発明の処理具が備える反応容器の第4実施形態を示す平面図である。
【図5】糖タンパク質から糖鎖を精製する際に用いられる処理具の一例を示す縦断面図である。
【図6】図5に示す処理具を用いて糖タンパク質から糖鎖を精製する方法を説明するための縦断面図である。
【図7】図5に示す処理具を用いて糖タンパク質から糖鎖を精製する方法を説明するための縦断面図である。
【図8】図5に示す処理具を用いて糖タンパク質から糖鎖を精製する方法を説明するための縦断面図である。
【図9】図5に示す処理具を用いて糖タンパク質から糖鎖を精製する際に用いられる遠心機の一例を模式的に示す部分縦断面図である。
【発明を実施するための形態】
【0028】
以下、本発明の処理具について、好適実施形態に基づいて詳細に説明する。
なお、以下では、本発明の処理具の説明を行うのに先立って、糖タンパク質から糖鎖を処理具を用いて精製(糖鎖精製)する方法の一例について説明する。
【0029】
<糖鎖精製>
図5は、糖タンパク質から糖鎖を精製する際に用いられる処理具の一例を示す縦断面図、図6〜8は、図5に示す処理具を用いて糖タンパク質から糖鎖を精製する方法を説明するための縦断面図、図9は、図5に示す処理具を用いて糖タンパク質から糖鎖を精製する際に用いられる遠心機の一例を模式的に示す部分縦断面図である。また、以下の説明では、図5〜8中の上側を「上」、下側を「下」という。なお、以下に示す糖タンパク質の精製方法では、電気泳動により分離されたゲル中の糖タンパク質から糖鎖を精製する場合について説明する。
【0030】
以下に示す糖鎖の精製方法では、[1]糖タンパク質が保持されたゲルを得る工程と、[2]ゲルを糖鎖遊離手段で処理することで糖鎖を遊離させる工程と、[3]遊離した糖鎖をゲルから溶出させて糖鎖を含有する溶液を得る工程と、[4]糖鎖を含有する溶液を糖鎖と特異的に結合する捕捉担体に接触させて、この捕捉担体上に糖鎖を捕捉する工程と、[5]上記捕捉担体に結合しなかった糖鎖以外の物質を除去する工程と、[6]捕捉担体に結合した糖鎖を再遊離するとともに、この糖鎖を別の化合物でラベル化する工程と、[7]ラベル化された糖鎖を精製する工程とを有する。
【0031】
以下、各工程について詳述する。
[1]まず、糖タンパク質を含有する試料を用意し、この試料に対して所定の処理を施すことにより、糖タンパク質が保持されたゲルを得る。
【0032】
用意する糖タンパク質を含む試料としては、特に限定されないが、例えば、全血、血清、血漿、尿、唾液、細胞、組織等の生体試料が挙げられる。また、予め所定の方法を用いて精製された、または未精製の糖タンパク質を用いることができる。
【0033】
なお、この試料は脱脂、脱塩、タンパク質分画糖の方法により前処理されていてもよい。
【0034】
次いで、試料を、例えば、SDS−PAGE(SDS変性ポリアクリルアミドゲル電気泳動)や、等電点電気泳動とSDS−PAGEを組み合わせた二次元電気泳動等の所定処理を施すことにより、ゲル中において試料に含まれる糖タンパク質を分離する。
【0035】
次いで、泳動後のゲルを、例えば、クーマシーブリリアントブルー等の染色剤を用いて染色する。これにより、染色された糖タンパク質が保持されたゲルを得ることができる。
【0036】
[2]次に、染色された糖タンパク質を備える電気泳動後のゲルにおいてバンドを確認し、このバンドを、刃物等を用いて切り出す。そして、これを刃物等で細片化し、染色剤を洗浄除去したのち、ゲル内に保持されている糖タンパク質から、糖鎖遊離手段を用いて糖鎖を遊離させる。
【0037】
糖鎖を遊離させる手段としては、特に限定されないが、例えば、N−グリコシダーゼまたはO−グリコシダーゼを用いたグリコシダーゼ処理、ヒドラジン分解、アルカリ処理によるβ脱離等の方法を用いることができる。
【0038】
なお、N型糖鎖の分析を行う場合は、N−グリコシダーゼを用いる方法が好ましい。また、N−グリコシダーゼ処理に先立って、トリプシンやキモトリプシン等を用いてプロテアーゼ処理を行ってもよい。
【0039】
[3]次に、糖鎖遊離処理後のゲルを取り出し、このゲルを、洗浄液を用いてリンスすることで、遊離された糖鎖をゲルから洗浄液中に溶出させる。そして、洗浄液中においてゲルを沈殿させた後、この上清を回収することで、糖鎖を含有する溶液を得る。
【0040】
洗浄液としては、特に限定されないが、例えば、水、各種緩衝液、各種有機溶媒等が挙げられ、これらのうちの1種または2種以上を組み合わせて用いることができる。
【0041】
なお、この溶液は、必要に応じて濃縮することで、溶液中における糖鎖の含有率を増大させるようにしてもよい。
【0042】
また、前記工程[1]〜[3]における、糖タンパク質を含有する試料からの糖タンパク質の分離および糖タンパク質からの糖鎖の遊離は、電気泳動処理を施すことにより得られたゲル中から糖鎖を遊離することにより行うこととしたが、この場合に限定されず、アフィニティークロマトグラフィ処理やイオン交換クロマトグラフィ処理を前記試料に施すことにより精製された糖タンパク質から糖鎖を遊離するようにしてもよい。さらに、前記試料からの糖タンパク質の精製を省略してもよい場合には、前記試料に含まれる糖タンパク質に対して直接糖鎖を遊離させる処理を施すようにしてもよい。
【0043】
[4]次に、糖鎖を含有する溶液を糖鎖と特異的に結合する捕捉担体に接触させて、この捕捉担体上に糖鎖を捕捉する。
【0044】
ここで、糖鎖は生体内物質のなかで唯一、アルデヒド基をもつ物質である。すなわち、糖鎖は水溶液等の状態で環状のヘミアセタール型と、非環状型のアルデヒド型とが平衡で存在する。
【0045】
これに対して、タンパク質、核酸および脂質等の糖鎖以外の生体内物質にはアルデヒド基が含まれていない。
【0046】
このことから、アルデヒド基と特異的に反応して安定な結合を形成する官能基を有する捕捉担体を利用すれば、糖鎖のみを選択的に捕捉することが可能である。
【0047】
アルデヒド基と特異的に反応する官能基としては、例えば、ヒドラジド基、オキシルアミノ基、アミノ基、セミチオカルバジド基およびそれらの誘導体が好ましく、ヒドラジド基またはオキシルアミノ基がより好ましく用いられる。オキシルアミノ基とアルデヒド基との反応によって生じるオキシム結合、およびヒドラジド基とアルデヒド基との反応によって生じるヒドラゾン結合は、酸処理等によって容易に切断されるため、糖鎖を捕捉したのち、糖鎖を担体から簡単に切り離すことができる。
【0048】
なお、一般的に,生理活性物質の捕捉・担持にはアミノ基が多用されているが、アミノ基とアルデヒド基の反応によって生じる結合(シッフ塩基)は結合力が弱いため、還元剤等を用いた二次処理が必要であることから、アミノ基は糖鎖の捕捉には好ましくない。
【0049】
糖鎖を捕捉するための担体としては、ポリマー粒子を用いることが好ましい。さらに、このポリマー粒子は、少なくとも表面の一部に糖鎖のアルデヒド基と特異的に反応する官能基を有した固体またはゲル粒子であることが好ましい。
【0050】
ポリマー粒子が固体粒子またはゲル粒子であれば、ポリマー粒子に糖鎖を捕捉させた後、遠心分離やろ過等の手段によって、かかる粒子を容易に回収することができる。また、ポリマー粒子をカラムに充填して用いることも可能である。
【0051】
このようなポリマー粒子としては、例えば、下記一般式(1)で表されるものが挙げられる。
【0052】
【化1】

【0053】
以下、捕捉担体としてポリマー粒子20を用い、さらに遠心分離やろ過等の各種手段を用いることで、ポリマー粒子20上に糖鎖を捕捉する場合を一例に説明する。
【0054】
[4−1]まず、ポリマー粒子20を、純水21中に分散させて、ポリマー粒子が分散された粒子分散液22を得る。
【0055】
このポリマー粒子20の形状は、特に限定されないが、例えば、球状またはそれに類する形状が好ましい。
【0056】
ポリマー粒子20が球状の場合、平均粒径は、好ましくは0.05〜1000μm程度、より好ましくは0.05〜200μm程度、さらに好ましくは0.1〜200μm程度、最も好ましくは0.1〜100μm程度に設定される。平均粒径が下限値未満では、ポリマー粒子20を遠心分離やろ過で回収することが困難となるおそれがある。また、平均粒径が上限値を超えると、ポリマー粒子20と、後述する試料溶液との接触面積が少なくなり、糖鎖捕捉の効率が低下するおそれがある。
【0057】
[4−2]次に、図5(a)に示すような、反応容器(処理具本体)100を用意する。
【0058】
この反応容器100は、液体を収納可能な本体部101と、この本体部101の開口側(上側)に設けられた口部102とを有する。そして、通常、エッペンドルフチューブのような、一端が閉塞した筒状の部材である外側容器200に装着して、処理具300が備える1つの部材として使用される(図5(b)参照。)。
【0059】
本体部101は、その全体形状が有底筒状をなしており、内径および外径の双方が高さ方向に向かってほぼ一定となっており、その下側に底面103を備えている。
【0060】
また、この底面103のほぼ中心に対応して、貫通孔104が設けられており、これにより、この貫通孔104を介した、本体部101に供給(収納)された液体の外部への流出、すなわち、液体の外側容器200への供給が可能となる。
【0061】
さらに、本体部101の下側には、貫通孔104を塞ぐようにフィルター105が配置されている。これにより、反応容器100の静置時には、本体部101に供給された液体が貫通孔104を介して、その外部(外側容器200)へ流出することが阻害される。これに対して、処理具300を遠心機に装着して反応容器100を遠心させた際には、前記液体のフィルター105の透過が許容されるため、前記液体が貫通孔104を介して、その外部に流出される。すなわち、前記液体が外側容器200に供給される。
【0062】
フィルター105の素材としては、特に限定されないが、例えば、多孔性フィルムおよび不織布等が挙げられる。また、その構成材料としては、ポリテトラフルオロエチレン、セルロースエステル、フッ化ビニリデン、ポリカーボネート、ポリエチレン、ポリプロピレンおよびナイロン等が挙げられ、これらのうちの1種または2種以上を組み合わせて用いることができる。
【0063】
フィルター105が備える細孔の孔径は、好ましくは0.1〜50μm程度、より好ましくは0.5〜20μm程度、さらに好ましくは1〜10μmに設定される。これにより、前記液体に含まれる液状成分の透過は許容されるとともに、ポリマー粒子20の透過は確実に許容されなくなる。
【0064】
口部102は、本体部101の上側に設けられ、その全体形状が筒状をなしており、内径および外径が、本体部101の内径および外径より共に大きくなっている。
【0065】
このように内径を大きくすることで、液体の本体部101への注入を容易かつ確実に行うことができるようになる。
【0066】
また、外径を大きくすることで、口部102は、本体部101と比較して、その外側に円周状に張り出すこととなる。したがって、この反応容器100を外側容器200に装着した際に、口部102と本体部101との境界付近は、外側容器200の開口縁部201に係合する係合部として機能する。
【0067】
反応容器100をかかる構成のものとすることで、反応容器100の静置時には、本体部101において、供給された液体の反応を進行させることができる。さらに、反応容器100の遠心により、液体に含まれる固形成分(ポリマー粒子20)を本体部101に残存させた状態で、この液体を、貫通孔104を通過させて外側容器200に選択的に供給(貯留)することができる。すなわち、反応容器100の遠心により、本体部101に供給した液体中に含まれる固定成分と、液体との分離を容易に行うことができる。
【0068】
[4−3]次に、図6(a)に示すように、前記工程[3]で予め調製した粒子分散液22を反応容器100内に供給した後、反応容器100を外側容器200に装着した処理具300を、遠心機を用いて遠心する(図6(b)参照。)。
【0069】
これにより、図6(c)に示すように、粒子分散液22中に含まれる純水21が、外側容器200内に選択的に供給されることから、ポリマー粒子20が反応容器100内に単独で充填された状態となる。
【0070】
ここで用いる遠心機としては、特に限定されないが、例えば、図9に示すような遠心機500が用いられる。
【0071】
遠心機500は、ケーシング501と、処理具300を固定する回転体530と、回転体530を回転させる駆動手段520と、駆動手段520を支持する支持板511とを有している。
【0072】
回転体530は、処理具300を挿入(装着)可能な穴部531を複数備え、本実施形態では、その全体形状が円盤状をなしており、また、その中心を通る縦断面形状が上底よりも下底が長い台形となっている。
【0073】
この回転体530において、各穴部531は、回転体530の中心軸を対称軸とする線対称な位置に、その中心軸532の傾きが、支持板511に対して角度θ1となるように設けられている。
【0074】
角度θ1は、30〜80°程度、好ましくは40〜60°程度、さらに好ましくは45°程度に設定される。角度θ1をかかる範囲内に設定することで、回転体530の静止時においても、処理具300を穴部531に挿入した際に、この傾きにより、反応容器100から粒子分散液22が漏出してしまうのを確実に防止することができる。また、回転体530の回転時には、これにより生じる遠心力によって、粒子分散液22中の純水21を、フィルター105を確実に透過させることができるようになる。
【0075】
駆動手段520は、回転体530の中心軸から下方へ延設された回転軸522と、この回転軸522の下端に接続されかつ回転軸522をその軸周りに回転させるモーター521とを有し、モーター521を回転させることにより、回転軸522を中心として回転体530が回転する。
【0076】
支持板511は、ケーシング501内を上下に分離する隔壁を構成し、この支持板511のほぼ中心には、厚さ方向に貫通する貫通孔が形成されており、支持板511の上側に回転体530が下側にモーター521が配置され、これらが貫通孔内に配置された回転軸522を介して接続されている。かかる構成とすることにより、駆動手段520が支持板511によりケーシング501内に支持され、結果として、装置を構成する各部がケーシング501内に支持されることとなる。
【0077】
かかる構成の遠心機500において、回転体530に処理具300を挿入した状態で、駆動手段520を駆動させることにより回転体530を回転させると、これにより生じた遠心力によって、粒子分散液22中の純水21はフィルター105を透過する。これに対して、フィルター105の細孔径と、ポリマー粒子20の粒径との関係により、ポリマー粒子20はフィルター105を透過することができない。そのため、フィルター105を透過した純水21が、貫通孔104を介して外側容器200内に選択的に供給されることとなり、その結果、ポリマー粒子20が反応容器100内に単独で充填される。
【0078】
[4−4]次に、図6(d)に示すように、前記工程[3]で得られた糖鎖を含有する溶液(以下、「糖鎖含有液23」という。)を、ポリマー粒子20が充填された反応容器100内に供給する。
【0079】
[4−5]次に、糖鎖含有液23を加熱することで、供給した糖鎖含有液23が乾燥するまで、糖鎖含有液23を一定の温度範囲に保つ(図6(e)参照。)。
【0080】
これにより、ポリマー粒子20と、糖鎖含有液23中に含まれる糖鎖とが反応し、ポリマー粒子20上に糖鎖が捕捉される。
【0081】
この際の反応系のpHは、好ましくは2〜9、より好ましくは2〜7であり、さらに好ましくは2〜6である。なお、pH調整は、例えば、前記工程[4−4]の後に、各種緩衝液または有機溶媒を添加することにより行うことができる。
【0082】
糖鎖捕捉時の温度は、好ましくは4〜90℃程度、より好ましくは4〜70℃程度、さらに好ましくは30〜80℃程度、最も好ましくは40〜80℃程度の温度範囲に保たれるように設定する。
【0083】
また、反応時間、すなわち溶液が乾燥するまでの時間は、かかる温度範囲に設定した場合、通常、0.1〜3時間程度、好ましくは、0.6〜2時間程度に設定される。
【0084】
かかる条件で、ポリマー粒子20と糖鎖とを反応させることで、ポリマー粒子20上に糖鎖が確実に捕捉されることとなる。
【0085】
なお、本実施形態のように、糖鎖含有液23が乾燥するまで加熱する構成とすることにより、ポリマー粒子20と糖鎖との反応率の向上を確実に図ることができる。
【0086】
以上のような工程[4−1]〜[4−5]を経ることで、ポリマー粒子20上に糖鎖が捕捉される。
【0087】
なお、ポリマー粒子20がヒドラジド基を有するものである場合、ヒドラジド基と、糖鎖が有する還元末端との間で、下記式(2)で表される反応が進行することで、ポリマー粒子20上に糖鎖が捕捉される。
【0088】
【化2】

【0089】
[5]次に、捕捉担体に捕捉された糖鎖以外の物質を除去する。
ここで、上記のように捕捉担体としてポリマー粒子20を用いた場合、ポリマー粒子20に捕捉された糖鎖以外の物質としては、例えば、ポリマー粒子20に捕捉されなかった糖鎖の他、ポリマー粒子20の表面に、非特異的に吸着している糖鎖以外の莢雑物(タンパク質、脂質等)が挙げられる。
そのため、本工程[5]では、これらの物質を洗浄することで除去する。
【0090】
以下、前記工程[4]と同様に、反応容器100を用いて、遠心分離やろ過等の手段によって、ポリマー粒子20に捕捉された糖鎖以外の物質(以下、この物質を「洗浄物質」ということもある。)を洗浄除去する場合について説明する。
【0091】
[5−1]まず、図7(a)に示すように、前記工程[4−5]において得られた、反応容器100中で乾燥したポリマー粒子20に対して、洗浄液24を添加する。
【0092】
洗浄液24としては、特に限定されないが、水、各種緩衝液、各種有機溶剤や、これらに各種界面活性剤を添加したもの等が挙げられ、これらを適宜組み合わせて用いることができる。
【0093】
[5−2]次に、反応容器100を外側容器200に装着した処理具300を、遠心機を用いて遠心する(図7(b)参照。)。
【0094】
これにより、図7(c)に示すように、洗浄液24を、フィルター105を透過させることで、反応容器100にポリマー粒子20を残存させた状態で、反応容器100から選択的に洗浄液24を除去することができるとともに、洗浄液24中に溶解した洗浄物質を除去することができる。
【0095】
これら工程[5−1]および工程[5−2]で構成される洗浄を、複数回(繰り返して)行うことで、洗浄物質を洗浄液24中に溶解させた状態で、外側容器200に分離することができるため、洗浄物質を糖鎖が捕捉されたポリマー粒子20から確実に除去することができる。
【0096】
なお、この場合、界面活性剤を含む水または緩衝液を洗浄液24として用いて十分にポリマー粒子20を洗浄したのち、有機溶剤の洗浄液24でさらに洗浄し、最後に水を洗浄液24として洗浄するのが好ましい。これにより、洗浄物質、特に、非特異的にポリマー粒子20の表面に吸着する夾雑物をより確実に除去することができるようになる。
【0097】
[6]次に、捕捉担体に結合した糖鎖を再遊離させるとともに、この糖鎖を他の化合物(以下、「化合物A」と言うこともある。)に置換する。
【0098】
なお、この化合物Aとしては、蛍光物質、吸光物質および放射性物質等を備えるラベル化試薬が好ましく用いられる。
【0099】
以下、前記工程[4]、[5]と同様に、反応容器100を用いて、化合物Aで糖鎖をラベル化する場合について説明する。
【0100】
[6−1]まず、図7(d)に示すように、化合物Aを含有する化合物含有液25を、糖鎖が捕捉されたポリマー粒子20が充填された反応容器100内に添加する。
【0101】
反応容器100内に添加する化合物Aの添加量は、糖鎖が捕捉されたポリマー粒子20に対して、過剰量となっているのが好ましい。これにより、次工程[6−2]における糖鎖に対する化合物Aの置換率の向上を図ることができる。
【0102】
具体的には、化合物Aの添加量は、ポリマー粒子20が有する糖鎖と特異的に反応する官能基量に対して、好ましくは1.5倍量以上、より好ましくは3倍量以上、さらに好ましくは5倍量以上であり、最も好ましくは10倍量以上に設定される。
【0103】
[6−2]次に、化合物含有液25を加熱することで、添加した化合物含有液25が乾燥するまで、化合物含有液25を一定の温度範囲に保つ(図7(e)参照。)。
【0104】
これにより、捕捉された糖鎖はポリマー粒子20から切り離され、それとほぼ同時に糖鎖に化合物Aが付加することとなるため、糖鎖は化合物Aでラベル化されることとなる。
【0105】
この際の反応系のpHは、好ましくは2〜9、より好ましくは2〜7であり、さらに好ましくは2〜6である。なお、pH調整は、例えば、前記工程[6−1]の後に、各種緩衝液を添加することにより行うことができる。
【0106】
ラベル化時の温度は、好ましくは4〜90℃程度、より好ましくは4〜70℃程度、さらに好ましくは30〜80℃程度、最も好ましくは40〜80℃程度の温度範囲に保たれるように設定する。
【0107】
また、反応時間、すなわち溶液が乾燥するまでの時間は、かかる温度範囲に設定した場合、通常、0.1〜3時間程度、好ましくは、0.6〜2時間程度に設定される。
かかる条件で、ラベル化を行うことで、糖鎖が確実に化合物Aによりラベル化される。
【0108】
なお、本実施形態のように、化合物含有液25が乾燥するまで加熱する構成とすることにより、糖鎖と化合物Aとの反応率の向上を確実に図ることができる。
【0109】
以上のような工程[6−1]、[6−2]を経ることで、糖鎖が化合物Aでラベル化される。
【0110】
なお、化合物Aとしては、アミノオキシ基またはヒドラジド基を有する化合物が好ましく用いられ、ポリマー粒子20がヒドラジド基を有するものである場合、特に、下記化学式(3)で表されるN-aminooxyacetyl-tryptophanyl(arginine methyl ester)が好ましく用いられる。
【0111】
【化3】

【0112】
また、この化合物Aとしては、前記化合物の他、芳香族アミンで構成される蛍光物質を用いることができる。
【0113】
化合物Aとして、このような芳香族アミンを用いた場合、捕捉された糖鎖は、まずポリマー粒子20から切り離されて再遊離した後に、化合物Aによりラベル化されることとなる。
【0114】
以下、化合物Aとして芳香族アミンを用いて、糖鎖を化合物Aでラベル化する場合について説明する。
【0115】
[6−1’]まず、糖鎖を再遊離させる糖鎖遊離液を、糖鎖が捕捉されたポリマー粒子20が充填された反応容器100内に添加する。
【0116】
[6−2’]次に、糖鎖遊離液を加熱することで、添加した糖鎖遊離液が乾燥するまで、糖鎖遊離液を一定の温度範囲に保つ。
【0117】
これにより、捕捉された糖鎖がポリマー粒子20から切り離されることで、糖鎖は再遊離する。
【0118】
この際の反応系のpHは、好ましくは2〜9、より好ましくは2〜7であり、さらに好ましくは2〜6である。このpH調整が、前記工程[6−1’]における糖鎖遊離液の添加により行われ、各種緩衝液等が糖鎖遊離液として用いられる。
【0119】
糖鎖遊離時の温度は、好ましくは4〜100℃程度、より好ましくは25〜90℃程度、さらに好ましくは30〜80℃程度、最も好ましくは60〜80℃程度の温度範囲に保たれるように設定する。
【0120】
また、反応時間、すなわち溶液(糖鎖遊離液)が乾燥するまでの時間は、かかる温度範囲に設定した場合、通常、0.1〜3時間程度、好ましくは、0.6〜2時間程度に設定される。
【0121】
かかる条件で、糖鎖の再遊離を行うことで、糖鎖がポリマー粒子20から確実に切り離される。
【0122】
なお、本実施形態のように、糖鎖遊離液が乾燥するまで加熱する構成とすることにより、糖鎖の遊離率の向上を確実に図ることができる。
【0123】
[6−3’]次に、化合物Aとして芳香族アミンを含有する化合物含有液25を、ポリマー粒子20から糖鎖が遊離している、反応容器100内に添加する。
【0124】
芳香族アミン(化合物A)としては、特に限定されないが、例えば、2−Aminobenzamide、2−Aminobenzoic acid、8−Aminopyrene−1,3,6−trisulfonate、8−Aminonaphthalene−1,3,6−trisulphonate、2−Amino9(10H)−acridone、5−Aminofluorescein、Dansylethylenediamine、7−Amino−4−methylcoumarine、3−Aminobenzoic acid、7−Amino−1−naphtholおよび3−(Acetylamino)−6−aminoacridine等が挙げられる。中でも2−aminobenzamideまたは2−aminobenzoic acidであるのが好ましい。これらの化合物は、試薬としての入手、反応の簡便性から好適に用いられる。
【0125】
また、芳香族アミンとして2−aminobenzamideまたは2−aminobenzoic acidを用いる場合、一般的な条件では0.35mol/Lで使用されるが、本工程では、化合物含有液25添加後の反応容器100内の溶液、すなわち、再遊離した糖鎖を含む溶液における芳香族アミンの濃度は、好ましくは0.5mol/L以上、より好ましくは1.4mol/L以上に設定される。これにより、化合物Aによる糖鎖の標識効率を向上させることが可能となる。ただし、濃度が3mol/L以上になると、後工程[7]において、反応に使用されなかった芳香族アミン(化合物A)を除去するのが困難となるおそれがあるため、最も好ましい濃度は1.4mol/L以上3mol/L以下に設定される。
【0126】
また、液量に関して、反応容器100内に充填されたポリマー粒子20で規定する場合、通常はポリマー粒子20が浸る程度の液量、例えば、5mgのポリマー粒子20に対して50μL程度に設定されるが、液量(容量)を倍量の100μL程度に設定するのが好ましい。これにより、化合物Aによる糖鎖の標識効率を向上させることが可能となる。ただし、液量は100μLを超えても良いが、一定量を超えると、後工程[7]において、反応に使用されなかった芳香族アミン(化合物A)を除去するのが困難となるおそれがあるため、最も好まし液量は100μL〜200μLの間に設定される。
【0127】
より具体的には、芳香族アミンとして2−aminobenzamideを用いる場合、反応容器100内に、1.4 M 2-Aminobenzamid, 1 M sodium cyanoborohydrideの濃度になるように30%酢酸/ジメチルスルホキシド(DMSO)に溶解させた溶液100μLを化合物含有液25として添加する。
【0128】
[6−4’]次に、化合物含有液25を加熱することで、化合物含有液25を一定の温度範囲に保つ。
【0129】
これにより、ポリマー粒子20から再遊離している糖鎖は化合物Aと反応し、その結果、糖鎖は化合物Aでラベル化されることとなる。
【0130】
この際の反応系のpHは、好ましくは2〜9、より好ましくは2〜7であり、さらに好ましくは2〜6である。
【0131】
ラベル化時の温度は、好ましくは0〜100℃程度、より好ましくは4〜95℃程度、さらに好ましくは30〜90℃程度の温度範囲に保たれるように設定する。
【0132】
また、反応時間は、かかる温度範囲に設定した場合、通常、0.1〜20時間程度、好ましくは、0.6〜12時間程度に設定される。
【0133】
より具体的には、芳香族アミンとして2−aminobenzamideを用いた場合、化合物含有液25を30〜70℃の温度範囲で加熱して、1〜10時間程度、反応する。
かかる条件で、ラベル化を行うことで、糖鎖が確実に化合物Aによりラベル化される。
【0134】
なお、化合物Aとして芳香族アミンを用いた場合、前記工程[6−2]で説明したような、化合物含有液25の乾燥を省略することができる。
【0135】
以上のような工程[6−1’]〜[6−4’]によっても、糖鎖が化合物Aでラベル化される。
【0136】
さらに、本工程において、糖鎖のラベル化が必要ない場合には、糖鎖の化合物Aによる置換を省略することができる。
【0137】
[7]次に、化合物Aでラベル化された糖鎖(以下、「ラベル化糖鎖」と言うこともある。)を精製する。
【0138】
ここで、上記のようにポリマー粒子20に捕捉された糖鎖を再遊離させることで、ラベル化糖鎖を得た場合、化合物Aでラベル化された糖鎖以外に、反応容器100中に含まれる物質としては、糖鎖が遊離したポリマー粒子20および糖鎖のラベル化に使用されなかった化合物A(以下、「未使用化合物A」と言うこともある。)が挙げられる。
【0139】
そのため、本工程[7]では、これらポリマー粒子20および未使用化合物Aを除去することで、ラベル化糖鎖の精製を行う。
【0140】
以下、前記工程[4]〜[6]と同様に、反応容器100を用いて、遠心分離やろ過等の手段によって、ラベル化糖鎖を精製する場合について説明する。
【0141】
[7−1]まず、図8(a)に示すように、前記工程[6−2]において得られた、反応容器100中で乾燥したラベル化糖鎖と、ポリマー粒子20とに対して、溶解液26を添加する。
【0142】
溶解液26としては、ラベル化糖鎖を溶解し得る液剤であればよく、特に限定されるものではないが、水、各種緩衝液および各種有機溶剤等が挙げられる。
【0143】
なお、前記工程[6−2]における化合物含有液25の加熱によりポリマー粒子20が乾燥していない場合には、本工程[7−1]における反応容器100内への溶解液26の添加を省略することができる。
【0144】
さらに、化合物Aとして、芳香族アミンで構成される蛍光物質を用いた場合には、前記工程[6−1’]〜[6−4’]で得られる化合物Aでラベル化された糖鎖が乾燥していないため、この場合についても、本工程[7−1]における反応容器100内への溶解液26の添加を省略することができる。
【0145】
[7−2]次に、反応容器100を外側容器200に装着した処理具300を、遠心機を用いて遠心する(図8(b)参照。)。
【0146】
これにより、図8(c)に示すように、溶解液26を、フィルター105を透過させることで、反応容器100にポリマー粒子20を残存させた状態で、反応容器100から選択的に溶解液26を外側容器200に貯留することができるとともに、この溶解液26中に溶解したラベル化糖鎖を外側容器200に移動させることができる。その結果、ラベル化糖鎖とポリマー粒子20とが分離される。
【0147】
なお、この際、未使用化合物Aも、通常、溶解液26に対して溶解性を示すため、溶解液26に溶解した状態で、外側容器200側に移動する。
【0148】
[7−3]次に、フィルター105に代えて、シリカゲル106が本体部101の下側に配置された容器100’を用意し、この容器100’が外側容器200に装着した処理具300’を得る。
【0149】
そして、図8(d)に示すように、前記工程[7−2]において、外側容器200に分離された、ラベル化糖鎖を含有する溶解液26をアセトニトリル等の非水溶媒で希釈し、シリカゲル106を備える容器100’内に供給する。
【0150】
これにより、図8(e)に示すように、シリカゲル106を透過した溶解液26が貫通孔104を介して、外側容器200に液滴として流出することとなる。
【0151】
この際、シリカゲル106をアセトニトリル等の非水溶媒で希釈した溶解液26が透過するため、溶解液26に含まれるラベル化糖鎖と未使用化合物Aとは、シリカゲルに吸着する。シリカゲルへの吸着力は、未使用化合物Aよりもラベル化糖鎖の方が高い。したがって、容器100’内にアセトニトリル等の非水溶媒を供給し、シリカゲル106を洗浄することにより、未使用化合物Aの少なくとも一部をシリカゲルから除去することができる。その後、容器100’内に水を加え、シリカゲルを透過させることにより、未使用化合物Aの混在が的確に防止または抑制された状態で、ラベル化糖鎖を精製(分離)することができる。
【0152】
以上のような工程を経ることで、化合物Aでラベル化された糖鎖を精製することができる。
【0153】
なお、未使用化合物A除去する必要がない場合には、本工程[7]を省略するようにしてもよい。
【0154】
また、化合物Aでラベル化された糖鎖は、MALDI-TOF MSに代表される質量分析、さらに高速液体クロマトグラフィ(HPLC)等の手法で分析することができる。
【0155】
特に、糖鎖が前述した化学式(2)で表されるN-aminooxyacetyl-tryptophanyl(arginine methyl ester)でラベル化されている場合、MALDI-TOF MSを用いて高感度分析を行うことができる。
【0156】
さて、このような糖鎖の精製方法においては、補足担体(ポリマー粒子20)および処理具300を用い、遠心分離やろ過等の手段を利用することで、前述した従来法と比較して、工程の簡略化を図ることができるため、コストと時間の無駄の減少を実現することができる。
【0157】
そして、より優れた精度で糖鎖を精製するためには、前記各工程で説明したように、粒子分散液22、糖鎖含有液23、洗浄液24、化合物含有液25および溶解液26を、それぞれ反応容器100(本体部101)に供給する構成となっていることから、これら液体を精度よく本体部101に供給することが求められる。
【0158】
しかしながら、反応容器100では、上述したように、本体部101および口部102の内径が口部102の方が大きい構成となっているため、これらの境界部に段差107が形成されている。そのため、例えば、口部102の内周面(内壁)に伝わせて前記液体を本体部101に供給した場合には、段差107に前記液体が残存する。したがって、このように残存した状態で各工程を行うと、糖鎖の精製の精度が低下してしまう。
【0159】
特に、上記の糖鎖の精製方法では、遠心分離により本体部101に供給された上記液体を、外側容器200側に移動させる構成となっているが、このような遠心分離を行ったとしても、反応容器100が段差107を備える構成であると、この段差107に前記液体が残存してしまう。
【0160】
本発明の処理具は、かかる問題を解消するために用いられるものである。
<処理具>
以下、本発明の処理具について説明するが、本発明では、処理具が備える反応容器(処理具本体)の構成に特徴を有するため、以下では、この反応容器について詳述する。
【0161】
<<第1実施形態>>
まず、本発明の処理具が備える反応容器の第1実施形態について説明する。
【0162】
図1は、本発明の処理具が備える反応容器の第1実施形態を示す縦断面図(a)、平面図(b)である。なお、以下の説明では、図1中の上側を「上」、下側を「下」という。
【0163】
図1に示す反応容器10は、液体を収納可能な本体部1と、この本体部1の開口側(上側)に設けられた口部2とを有する。
【0164】
本体部1は、その全体形状が有底筒状をなしており、内径および外径の双方が高さ方向に向かってほぼ一定となっている。
【0165】
この本体部1は、底面3と、貫通孔4と、フィルター5とを有しており、前述した反応容器100が有する本体部101と同様の構成をなしている。
【0166】
口部2は、本体部1の上側に設けられ、その全体形状が筒状をなしている。
口部2の内径は、下端から上端に向かって高さ方向の途中までほぼ一定であるが、途中から上端に向かって漸増する構成となっている。すなわち、その内径が、口部2の下端では、本体部1の内径とほぼ同一であるが、その途中から上端に向かって、本体部1の内径に対して漸増する。
【0167】
換言すれば、口部2の内周面(内面)は、その全体形状がロート状をなしており、その上部内周面が、口部2の外周面側から内周面側に向かって傾斜する傾斜面(テーパ部)6となっている。
【0168】
口部2をかかる構成とすることで、傾斜面6により、口部2の開口面積が、口部2から本体部1側に向かって漸減する面積漸減部が形成される。これにより、前述した反応容器100のように、本体部101と口部102との境界に段差107が形成されることがない。そのため、口部2の内周面に伝わせるようにして、粒子分散液22、糖鎖含有液23、洗浄液24、化合物含有液25、溶解液26のような液体を供給したとしても、口部2の内周面にこの液体の液滴が残存することなく、本体部1内へ液体を供給することができる。したがって、この傾斜面6(面積漸減部)は、口部2の内周面に供給された液滴を、本体部1内への移動を促進する移動促進手段としての機能を発揮する。
【0169】
したがって、口部2の内周面すなわち傾斜面6に供給された前記液体は、処理具300(反応容器100)を、遠心機を用いて遠心すると、傾斜面6に沿って、その下側に向かって移動し最終的には本体部1内に誘導される。換言すれば、傾斜面6により、口部2の内周面に付着した液体の本体部1への移動が促進される。
【0170】
このようなことから、糖タンパク質から分離した糖鎖を、無駄なくかつ確実に本体部1内に供給することができる。よって、このように無駄が生じないことから、より優れた精度で糖鎖を精製することができるようになる。すなわち、糖鎖の収率の向上を図ることができる。
【0171】
傾斜面6は、特に限定されないが、口部2の中心軸に対しする角度θ2が、好ましくは15〜65°程度、より好ましくは25〜55°程度となるように傾斜している。これにより、かかる反応容器100を備える処理具300を、前述したような遠心機500の穴部531に装着した際に、角度θ1と角度θ2との差を小さくすることができる。すなわち、傾斜面6の支持板511に対する傾斜角度を小さくすることができる。したがって、かかる遠心機500を用いて処理具300を遠心した際には、傾斜面6に付着している液体(液滴)に対して、より大きな遠心力を付与することができる。そのため、傾斜面6に供給された液体を、本体部1内により確実に誘導することができるようになる。
【0172】
また、傾斜面6には、液体が付着するのを防止または低減する付着防止処理が施されているのが好ましい。かかる処理が施されることで、遠心力により液体を傾斜面6に沿ってより確実に本体部1にまで移動させることができるようになる。
【0173】
この付着防止処理としては、特に限定されないが、例えば、傾斜面6に撥液膜を形成する撥液処理、傾斜面6の凹凸を低減して平滑面で形成する平滑化処理等が挙げられる。
なお、移動促進手段は、図1に示すような傾斜面6で構成されている場合に限らず、例えば、湾曲凹面、湾曲凸面、または傾斜面6を含み、これらのうちの任意の2以上を組み合わせたもので構成されていてもよい。
【0174】
一方、口部2の外径は、その高さ方向に沿ってほぼ一定であり、その大きさは本体部1の外径よりも大きくなっている。これにより、口部2は、本体部1と比較して、その外側に円周状に張り出すこととなる。したがって、この反応容器10を外側容器200に装着した際に、口部2は、外側容器200の開口縁部201に係合する係合部として機能する。
【0175】
このような反応容器10の構成材料としては、特に限定されないが、例えば、ポリプロピレン、ポリエチレン、ポリスチレン、ポリ塩化ビニル、ポリテトラフルオロエチレン等が挙げられ、これらのうちの1種または2種以上を組み合わせて用いることができる。
【0176】
なお、本実施形態では、口部2の内径が、その下端では、一定であるが、その途中から上端に向かって漸増する構成、すなわち傾斜面6が口部2の途中から上端に形成される構成としたが、かかる構成に限定されず、傾斜面6が口部2の下端から上端にわたって設けられていてもよい。換言すれば、面積漸減部が、口部2の軸方向の全体にわたって設けられていてもよい。かかる構成とすることで、傾斜面6の角度の設定を容易に行うことができるという利点が得られる。
【0177】
<<第2実施形態>>
次に、本発明の処理具が備える反応容器の第2実施形態について説明する。
【0178】
図2は、本発明の処理具が備える反応容器の第2実施形態を示す平面図である。なお、以下の説明では、図2中の上側を「上」、下側を「下」という。
【0179】
以下、第2実施形態について説明するが、前記第1実施形態と異なる点を中心に説明し、同様の事項についてはその説明を省略する。
【0180】
第2実施形態では、口部2の構成が異なり、それ以外は、前記第1実施形態と同様である。
【0181】
図2に示すように、口部2には、傾斜面6において口部2の上下方向(軸方法)に沿うように溝7が形成されている。
【0182】
本実施形態では、8つの溝7が傾斜面6の周方向に沿って、それぞれ、等間隔で形成されている。すなわち、各溝7は、口部2の軸を中心に放射状に位置している。
【0183】
このような構成により、処理具300(反応容器100)を、遠心機を用いて遠心した際に、傾斜面6に供給された(付着した)液体が、傾斜面6の周方向に沿って移動してしまうのを確実に防止することができる。したがって、各溝7は、液滴が傾斜面6の周方向に沿った移動を規制する規制手段として機能する。
【0184】
なお、本実施形態の溝7は、その横断面(長手方向に垂直な方向における断面)の縁部がコ字状(矩形状)をなしていたが、その他、例えば、半円形状、U字状、V字状等であってもよい。
【0185】
<<第3実施形態>>
次に、本発明の処理具が備える反応容器の第3実施形態について説明する。
【0186】
図3は、本発明の処理具が備える反応容器の第3実施形態を示す平面図である。なお、以下の説明では、図3中の上側を「上」、下側を「下」という。
【0187】
以下、第3実施形態について説明するが、前記第1実施形態と異なる点を中心に説明し、同様の事項についてはその説明を省略する。
【0188】
第3実施形態では、口部2の構成が異なり、それ以外は、前記第1実施形態と同様である。
【0189】
図3に示すように、口部2には、傾斜面6において口部2の上下方向に沿うように凸条(リブ)8が形成されている。
【0190】
本実施形態では、8つのリブ8が傾斜面6の周方向に沿って、それぞれ、等間隔で形成されている。すなわち、各リブ8は、口部2の中心軸を中心に放射状に位置している。
【0191】
このような構成により、処理具300(反応容器100)を、遠心機を用いて遠心した際に、傾斜面6に供給された液体が、傾斜面6の周方向に沿って移動してしまうのを確実に防止することができる。したがって、各リブ8は、液滴が傾斜面6の周方向に沿った移動を規制する規制手段として機能する。
【0192】
なお、本実施形態のリブ8は、その横断面(長手方向に垂直な方向における断面)の縁部がコ字状(矩形状)をなしていたが、その他、例えば、半円形状、U字状、V字状等であってもよい。
【0193】
<<第4実施形態>>
次に、本発明の処理具が備える反応容器の第4実施形態について説明する。
【0194】
図4は、本発明の処理具が備える反応容器の第4実施形態を示す平面図である。なお、以下の説明では、図4中の上側を「上」、下側を「下」という。
【0195】
以下、第4実施形態について説明するが、前記第2実施形態と異なる点を中心に説明し、同様の事項についてはその説明を省略する。
【0196】
第4実施形態では、口部2の構成が異なり、それ以外は、前記第2実施形態と同様である。
【0197】
本実施形態では、8つの溝7が、口部2の上下方向に沿って、直線状に形成されているのに代えて、溝7の長手方向に湾曲して形成されている。
【0198】
このような構成により、前記第2実施形態と同様に、処理具300(反応容器100)を、遠心機を用いて遠心した際に、各溝7は、液滴が傾斜面6の周方向に沿った移動を規制する規制手段として機能するが、さらに、長手方向に湾曲していることで、液体の本体部1への移動を促進することができるため、移動促進手段としても機能する。
なお、溝7は、長手方向に湾曲する場合の他、螺旋状に形成されていてもよい。
【0199】
また、前記実施形態2〜4で説明したように、口部2に溝7または凸条8を設ける構成とした場合、口部2に蓋部を装着して、反応容器100を封止するようにしてもよい。この場合、溝7または凸条8が蓋部を係止する係止部として機能することから、蓋部の脱落を確実に防止することができる。
【0200】
以上、本発明の処理具を図示の実施形態に基づいて説明したが、本発明はこれらに限定されるものではない。例えば、本発明の処理具は、各前記実施形態のうち任意の2以上の構成(特徴)を組み合わせたものであってもよい。
【0201】
また、本発明の処理具の各部の構成は、同様の機能を発揮し得る任意のものと置換することができ、または、任意の構成のものを付加することもできる。
【符号の説明】
【0202】
1 本体部
2 口部
3 底面
4 貫通孔
5 フィルター
6 傾斜面
7 溝
8 凸条
10 反応容器
20 ポリマー粒子
21 純水
22 粒子分散液
23 糖鎖含有液
24 洗浄液
25 化合物含有液
26 溶解液
100 反応容器
100’ 容器
101 本体部
102 口部
103 底面
104 貫通孔
105 フィルター
106 シリカゲル
107 段差
200 外側容器
201 開口縁部
300、300’ 処理具
500 遠心機
501 ケーシング
511 支持板
520 駆動手段
521 モーター
522 回転軸
530 回転体
531 穴部
532 中心軸
【特許請求の範囲】
【請求項1】
遠心機に装着して使用する処理具であって、
液体を収納可能な有底筒状の本体部と、該本体部の開口側に設けられた筒状の口部とを備える処理具本体を有し、
前記処理具本体の前記本体部内に前記液体を収納した状態で、前記処理具を前記遠心機に装着して遠心した際に、前記口部の内面に付着した前記液体の前記本体部内への移動を促進する移動促進手段を、前記口部に設けたことを特徴とする処理具。
【請求項2】
前記移動促進手段は、前記口部の開口面積を、前記本体部に向かって漸減させて形成された面積漸減部で構成されている請求項1に記載の処理具。
【請求項3】
前記面積漸減部は、前記口部の軸方向の全体にわたって設けられている請求項2に記載の処理具。
【請求項4】
前記移動促進手段は、前記付着した液体の前記口部の周方向に沿った移動を規制する機能を有する請求項1に記載の処理具。
【請求項5】
前記移動促進手段は、前記口部の軸方向に沿った凸条または溝で構成されている請求項4に記載の処理具。
【請求項6】
前記本体部の底部には、貫通孔が形成され、
前記処理具本体は、さらに、前記貫通孔を塞ぐように設けられたフィルターを備える請求項1ないし5のいずれかに記載の処理具。
【請求項7】
さらに、前記処理具本体に装着され、前記処理具を前記遠心機に装着して遠心した際に、前記貫通孔を通過した前記本体部内の前記液体を貯留する外側容器を有する請求項6に記載の処理具。
【請求項8】
前記外側容器は、一端が閉塞した筒状の部材で構成され、
前記処理具本体は、前記本体部と前記口部との境界付近に、前記外側容器を装着した際に、その開口縁部に係合する係合部を備える請求項7に記載の処理具。
【請求項9】
さらに、前記処理具本体の前記口部に装着して封止する蓋部を有する請求項1ないし8のいずれかに記載の処理具。
【請求項1】
遠心機に装着して使用する処理具であって、
液体を収納可能な有底筒状の本体部と、該本体部の開口側に設けられた筒状の口部とを備える処理具本体を有し、
前記処理具本体の前記本体部内に前記液体を収納した状態で、前記処理具を前記遠心機に装着して遠心した際に、前記口部の内面に付着した前記液体の前記本体部内への移動を促進する移動促進手段を、前記口部に設けたことを特徴とする処理具。
【請求項2】
前記移動促進手段は、前記口部の開口面積を、前記本体部に向かって漸減させて形成された面積漸減部で構成されている請求項1に記載の処理具。
【請求項3】
前記面積漸減部は、前記口部の軸方向の全体にわたって設けられている請求項2に記載の処理具。
【請求項4】
前記移動促進手段は、前記付着した液体の前記口部の周方向に沿った移動を規制する機能を有する請求項1に記載の処理具。
【請求項5】
前記移動促進手段は、前記口部の軸方向に沿った凸条または溝で構成されている請求項4に記載の処理具。
【請求項6】
前記本体部の底部には、貫通孔が形成され、
前記処理具本体は、さらに、前記貫通孔を塞ぐように設けられたフィルターを備える請求項1ないし5のいずれかに記載の処理具。
【請求項7】
さらに、前記処理具本体に装着され、前記処理具を前記遠心機に装着して遠心した際に、前記貫通孔を通過した前記本体部内の前記液体を貯留する外側容器を有する請求項6に記載の処理具。
【請求項8】
前記外側容器は、一端が閉塞した筒状の部材で構成され、
前記処理具本体は、前記本体部と前記口部との境界付近に、前記外側容器を装着した際に、その開口縁部に係合する係合部を備える請求項7に記載の処理具。
【請求項9】
さらに、前記処理具本体の前記口部に装着して封止する蓋部を有する請求項1ないし8のいずれかに記載の処理具。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【公開番号】特開2013−63064(P2013−63064A)
【公開日】平成25年4月11日(2013.4.11)
【国際特許分類】
【出願番号】特願2012−187916(P2012−187916)
【出願日】平成24年8月28日(2012.8.28)
【出願人】(000002141)住友ベークライト株式会社 (2,927)
【Fターム(参考)】
【公開日】平成25年4月11日(2013.4.11)
【国際特許分類】
【出願日】平成24年8月28日(2012.8.28)
【出願人】(000002141)住友ベークライト株式会社 (2,927)
【Fターム(参考)】
[ Back to top ]

