分子検出システム
本発明は、プローブ-センサー接触検出、メッシュプローブ、メッシュレポーターを含む。また、メッシュプローブとメッシュレポーターはポリマーの骨格と共有接合又は非共有接合によりクロスリンクされる。本発明は、分子検出のために、感度が高くて、コストが安い携帯便利の検出システムを提供することができる。このシステムは多くの応用可能性があるが、その一つとして、多くの形態で溶胞液粗品の中の核酸に対して、核酸を抽出して拡大することがいらずに、直接検出することができる。この真新しい発明は、現行の臨床核酸サンプルやほかの核酸サンプルの応用分野における遺伝子タイプ区分け、遺伝子表現グラフの応用現状を変えてしまう可能性がある。もう一つの応用は、多くの形の超高感度ELISAによる検出である。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は分子検出システムに関する。具体的には、本発明は検体に対して光学検出を行うバイオセンサーにアレイを形成するために用いるメッシュプローブに関する。
【背景技術】
【0002】
本発明に使われる技術用語の定義は以下の通りとする。
メッシュポリマーは、一つ又は複数の化学的又は生物種がポリマーのメインチェーンとクロスリンクしているポリマー誘導体をいう。
メッシュプローブは、クロスリンクしている化学分子又は生物分子は選択的に、専門的に標的分子と結合する機能を持つ捕獲分子を備えているポリマー誘導体をいう。
【0003】
メッシュレポーターは、前記化学又は生物分子は認識分子と信号分子を含む捕獲分子であることが可能とする派生ポリマーをいう。化学又はナチュラルの生物分子であってもよいものとし、同一のポリマーの骨格にクロスリンクしているため、物理的に密着している。認識分子の機能は特別に、選択的に通常標的分子に関する「分子タグ」と結合することにあり、信号分子の機能は検出のためのコントロール可能の信号を発生することにあり、例えば、蛍光又は化学発光のように、直接又は後発事象により間接的に信号を発生することができる。
【0004】
ブリッジング分子はクロスリンカーであって、ポリマーの骨格に分子内又は分子間のクロスリンクを導入する。これらは通常双方向機能のクロスリンカーであり、その官能基はポリマーの骨格又は導入された派生グループのみと反応するが、例外もある。例えば、ポリマーの骨格にクロスリンクしている一端に反応基のあるGの豊富なオリゴヌクレオチドにおいて、クロスリンクのチェーンが長いので、オリゴヌクレオチド内にHoosteenアルカリベースペアリングが発生し、ポリマーの中に又はポリマーの間で非共有のクロスリンクが形成する。
【0005】
生物分子とほかの検体はそれに結合できる選択的又は特別なプローブアレイにより検出できる。従来、バイオセンサーレー技術の原理に基づき、プローブスポットを基板又はバイオチップに配列する方案が提案されている。(M.SchenaとR.W.DAVISDNAマイクロアレイ:実用新案、M. Schena編集、オックスフォーだ大学出版社1999年)という本には多くの方案が記載され、アレイは遺伝子配列の検出と発見や、薬物分子の候補の選択と測定、毒性と薬理作用の研究、及びその他用途に使われる。 標的ポイントは核酸のアルカリバースペアリング又は交配、蛋白質と蛋白質の相互作用、蛋白質と配位子との相互作用、酵素と基板の相互作用、受体と配位子との相互作用、及びその他化学反応など多くの相互作用によりプローブと結合することができる。
【0006】
バイオセンサーは同時に多くの生物分子間の反応を検出できる。例えば、マイクロアレイで蛋白質又は核酸を検出するような技術は人類遺伝子プロジェクトとその他生物遺伝子配列測定からの情報を利用するための有力な手段となっている。
【発明の概要】
【発明が解決しようとする課題】
【0007】
検体からの信号はいつも小さいし、また、様々なソースの背景によりこのような測定方法の信号対雑音比が比較的弱いため、検体が検出しにくい。一つの解決方法としては、検体の信号を強くしてその固有の信号対雑音比を高めることが考えられる。信号対雑音比を高めることは検体に対する検出限度を下げることに有利で、より低濃度の検体を検出することが可能となり、分子検出応用の新しい扉を開いた。
【課題を解決するための手段】
【0008】
前記課題を解決するために、本願申請者は以下の発明を提供する。本発明の分子検出システムは、一つの光学センサーと一つの捕獲分子のアレイを備え、この捕獲分子のアレイは複数のポリマーチェーン間の相互結合を限定するポリマーとセンサー表面にクロスリンクされている。
発明に関わるの捕獲分子のアレイは複数のポリマーチェーン間の相互結合を妨げるポリマーとのクロスリンクにより薄い透明基板又は多孔質基板の表面に接続し、前記透明基板は光学センサーの表面に固定されている。
【0009】
前記ポリマーはナチュラルポリマーである。
前記ナチュラルポリマーは直鎖状または分岐多糖類である。
前記直鎖状多糖類はデキストランである。
前記分岐多糖類はグリコーゲンやアミロペクチンである。
前記ポリマーは分岐DNAである。
【0010】
前記ポリマーはヒドロゲルである。
前記捕獲分子は生物分子である。
前記生物分子は 蛋白質である。
前記生物分子はRNA構造を持つDNAである。
前記捕獲分子はPNA又はLNAである。
【0011】
前記ポリマーは合成高分子ポリマーである。
前記合成ポリマーはポリ(メチルビニルエーテルのalt -無水マレイン酸)である。
前記複数のポリマーチェーン間の相互結合は共有接合と双方向機能のクロスリンカーによるクロスリンクからなる。
前記双方向機能のクロスリンカーは4,7,10トリオ-1,13-トリデキャンジアミンである。
【0012】
前記相互結合は非共有接合の形を取っている。
前記非共有接合の相互作用はポリマーにクロスリンクされるGの豊富なオリゴヌクレオチドの間にHoogsteenアルカリベースペアリングにより形成される四本鎖DNAまたはRNAの構造とする。
前記Gの豊富なオリゴヌクレオチドは末端にポリマーにクロスリンクできる官能基を備えるQ3誘導体である。
【0013】
また、本発明は分子検出システムに使われるポリマーを生成する方法を提供する。この方法は、
a)ヨウ素酸ナトリウムと多糖が反応して、多数のアルデヒド基を持つ直鎖状又は分岐ポリマーを生成し、
b )反応性アミノ基がある又はアミノ基を誘導できる分子を入れ、
c ) NaCNBrBH3が存在する条件でカップリング反応を実現するステップを備え、
前記ポリマーチェーンの間に限定的なインターコネクトがあることを特徴とした。
【0014】
前記記録分子の二つの信号分子と少なく一つの認識分子は前記にて製作されたポリマーとクロスリンクしている。
前記報告物の信号分子はホースラディシュ・ペルオキシダーゼ(HRP)又はアルカリフォースフォターゼで、認識分子はstreptavidinである。
本発明は検体を検出する方法を提供し、この検体検出する方法は、
a )請求1に記載の分子のアレイは検体と接触し、
b )分子のアレイは請求21に記載の報告分子と接触し、
c )このアレイに化学発光基質を入れ、
d )外部のスキャナーを使わずに直接光学センサーからデーターを読み取るステップを含むことを特徴とした。
【0015】
前記検体は核酸であるとともに、検体サンプルはしずれの酵素により増幅されていない。
光学センサーの上の検体を検出するための捕獲分子のアレイは、ほかのポリマーチェーンと限定的なインターコネクトがあるポリマーとのクロスリンクにより薄い透明固体又は多孔質基板の表面に接続しており、前記薄い透明固体は光学センサーの表面に固定されていること。
【図面の簡単な説明】
【0016】
【図1】ローライトイメージセンサーと読取装置との連続の一例を示す図。
【図2】ローライトイメージセンサーのケースの一例を示す側面図。
【図3】CMOSイメージセンサーを使ってプローブポイントに対して蛍光プローブ検出を行う一例を示す図。
【図4】検体検出データと検体アレイデータの表示に用いるバイオセンサーシステムの一例を示す図。
【図5a】AFP検出信号の一例を示す図。
【図5b】PSA検出信号の一例を示す図。
【図5c】AFP(左)とPSA検出信号の一例を示す図。
【発明を実施するための形態】
【0017】
発明内容
メッシュプローブ
通常、メッシュプローブにより検体を捕獲し、縛る。プローブによる捕獲又は標的結合分子には核酸、ポリヌクレオチド、タンパク質、ペプチド核酸、小分子、および様々の生物分子を含む。標的結合プローブ配体は抗体を含む。例えばstreptavadinはビオチンマーク分子を検出するのに使用される。
【0018】
一方、この発明は各アレイとスポットの検体の数の増加を表明する。各スポットにおける検体の数の増加は増加した分子を捕獲できるメッシュプローブの組み合わせにより実現できる。
また、メッシュポリマーはポリマーと化学分子又は生物分子にリンクすることにより形成し、化学又は生物分子はプローブ又は複数のプローブを含むによりメッシュプローブを構成する。含まれる化学又は生物分子プローブは、共有接合又は非共有接合、例えばイオン接合、弱い結合力などの化学作用力によりポリマーにカップリングする。このようなポリマーは直鎖状又は分岐ポリマー、例えば、直鎖状又は分岐の多糖類又はオリゴヌクレオチドであってよい。
【0019】
ポリマーは層、ビーズ、ディスクまたはそれらの組合せの形の固体、ゲルまたは無定形の構造であっても良いし、均質の又は異種の、直鎖状又は分岐した側鎖状、くし、星または木のような構造であってもよい。ポリマーのブランチは長連鎖ブランチであっても短連鎖ブランチであってもよい。当該ポリマーは化学方法により合成されてもよく、天然物より分離して得ることもできる。通常のポリマーは、炭水化物、糖類、ホモ多糖、ヘテロ多糖、アガロース、アミロース、アミロペクチン、グリコーゲン、デキストラン、セルロース、キチン質、キトサン、ペプチドグリカン、およびグルコサミノグリカンを上げられる。場合によっては、ポリマーは非常に分岐したデキストランである。また、ポリマーはヒドロゲル、またはポリアクリルアミドゲルなどの水和されたデキストランかアガロースである場合もある。更に、メッシュポリマー用の高分子ポリマーはオリゴヌクレオチド、ペプチド、ペプチド核酸、プロテオグリカン、糖蛋白質、および糖脂質を含む。更に言えば、ポリマーは抗体又は抗体のフラグメントであってもよい。
【0020】
メッシュ高分子ポリマーを作るのに役立つほかものはジオールポリマー、例えば宝石ジオールと隣接ジオール基のある高分子ポリマーを含む。もう一つの例はエステル基に隣接する水酸基を含むRNAにリンクするホスホジエステルというポリマーがある。
また、多くの水酸基を含むポリマーも挙げられる。これらのポリマーの混合物は全て本発明に利用される。
【0021】
ポリ(メチルビニルエーテルのalt -無水マレイン酸)の単体は以下の通りとなる。
【0022】
【化1】

【0023】
中に含まれた無水物グループは、タンパク質のアミン基又はメッシュプローブを形成する派生オリゴヌクレオチドと反応しやすい。
もう一つの例はポリー、(o-クレジルグリシジル・エーテル)、-、共同、-ホルムアルデヒド}で、その繰返しの単位は以下の通りである。
【0024】
【化2】

【0025】
当該ポリマーの中のエポキシ基は先ずアルカリ性のペーハーでリングオープンしてジオール基を形成し、そして、NaIO4(ヨウ素酸ナトリウム)による酸化によりアルデヒド基に変換する。そして、酸化後のポリマーは還元アミノ化により第一のアミンを含む分子カップリングできる。
メッシュプローブは化学分子及び/又は生物分子とポリマーのカップリングにより製作される。場合によって、メッシュプローブは分子又は生物分子の官能基又は活性基とポリマーとの抱合反応(化学分子又は生物分子をポリマーにカップリングする)により製作できる。官能基又は反応基には、アルデヒド、水酸基、アミン基、アミノ基、カルボン酸エステルと、sulthydryl、及びそれらの混合物を含む。
【0026】
化学又は生物分子とポリマーとのカップリング又は反応によりメッシュプローブを製作する時、ポリマーは多くのスポットにおける反応基により直接又は基グループの接続により間接的に化学又は生物分子的官能基又は反応基と結合できる。生成されたポリマーは化学分子又は生物分子に結合できる反応基を備える。 このような反応基には、アルデヒド、水酸基、アミン基、アミノ基、カルボン酸エステル、スルフヒドリル、イソチオシアン酸塩、N-hydroxysuccinimideエステル、ケトン、グリオキサール、エポキシド、oxiranes、imidoesters、carbodiimides、alkylphosphates、無水物、maleimides、アジリジン、acryloyls、fluorophenyls、diazoacetyls、N-acylimidazoles、succinimidyl炭酸塩、carboxymethylグループ、イソシアナート、ヒドラジッドグループ、とそれらの混合物を含む。
【0027】
ポリマーはキトサンのアミノ基のような反応アミン基があってもよく、硫酸基、カルボン酸エステル、またはリン酸基などの反応性官能基があってもよい。硫酸基のあるポリマーは、コンドロイチン硫酸、デルマタン硫酸、ヘパリン硫酸塩、およびケラチン硫酸塩が挙げられ、カルボン酸エステルを含むポリマーは、多糖類より派生するシアリン酸、アルドン酸、uronic酸、oxoaldonic酸、およびアスコルビン酸が挙げられる。
【0028】
リン酸基のあるポリマーはDNAとRNAがあり、この種類のポリマーは異なる機能を持つリンカー、例えば官能基クロスリンカー、双方向機能のクロスリンカー、多官能基クロスリンカーにより化学又は生物分子とカップリングできる。例えば、メッシュプローブは、一つのポリヌクレオチドがほかのポリヌクレオチドと結合されたものであってよく、RNAが酸化されてアルデヒド基を提供して化学又は生物分子とカップリングしてできるものであってもよい。
【0029】
複数の化学又は生物分子はポリマーとカップリングして複数の標的物質を結合できるメッシュプローブを構成できる。言い換えれば、一つのポリマーチェーンは複数種類の化学又は生物分子にカップリングして一つのメッシュプローブを構成できる。このような混合メッシュプローブも本発明の応用である。
例えば、1種類のプローブを製作するのに、ポリマーと化学又は生物分子のアミン基のリンクにはdithiobis(succinimidylpropionate), disuccinimidyl tartarate, or disuccinimidyl glutarateを利用し、化学又は生物分子のスルフヒドリル基とポリマーのアミン基のリンクには-succinimidyl3-- (2-pyridyldithio)プロピオン酸かm-maleimidobenzoyl-N-hydroxysuccinimideエステルを利用し、化学又は生物分子のスルフヒドリル基とポリマーのアルデヒド基のリンクには4 (N-maleimidomethyl)シクロヘキサン1カルボキシルヒドラジッドか3(2-pyridyldithio)プロピオニルヒドラジッドを利用し、化学又は生物分子のスルフヒドリル基とポリマーのカルボン酸エステルのリンクには4 (p-azidosalicylamido)ブチルアミンを利用する。
【0030】
化学又は生物分子とポリマーのアミノ基はheterobifunctional crosslinkers N-5アジド基の2-nitrobenzoyloxysuccinimideまたはN-hydroxysulfosuccinimidyl-4-azidobenzoateのような別種類のクロスリンカーによりリンクしてもよい。
ポリマーに含まれる水酸基はカルボニル基化されたエージェント、例えばN,'N -カルボニルジミダゾールと反応して中間的イミダゾリルカルバメート系を形成する場合もある。そして、アミンのような求核物質、ペプチドやタンパク質などのようなアミノを含むものと反応してN-アルキルカルバメート系リンケージを生成する。水酸基を含むポリマーはまたN、N'-disuccinimidylcarbonateと反応し、そしてアミノ基を含むオリゴヌクレオチド上一つのアミノ基と反応する。このアミノ基はオリゴヌクレオチドの一端にあってはよく、末端に近いところにあるものでもよい。このようなポリマーは、3-maleimidopropionic酸と反応し、オリゴヌクレオチド上のアミノ基と反応することができる。また、このようなポリマーは化学又は生物分子の末端ハロゲン化アルキルと反応してメッシュプローブのリンケージを構成することができる。
【0031】
ポリマーは隣接している炭素原子に水酸基 (例えば、糖類か糖蛋白質)を含む場合、ヨウ素酸ナトリウムと反応してアルデヒド基を生成することにより、アミノ基のある化学又は生物分子とSchiff'sアルカリを生成する。Schiff's アルカリは水素化ホウ素ナトリウム又はナトリウムcyanoborohydrideのような還元剤と反応することにより、ポリマーと化学分子又は生物分子とは二次の、または、第三のアミンリンケージができる。
【0032】
また、メッシュプローブはフォトリアクティブクロスリンカーにより製作することもできる。例えば、ポリマーとアミノ基のある化学又は生物分子の上のアミノ基とはフォトリアクティブクロスリンカーによりカップリングしてメッシュポリマーを形成する。形成されるメッシュポリマーには、ポリマーと化学分子又は生物分子とは一つのクロスリンク基でカップリングされている。例えば、ポリマーの上のアミノ基はN-hydroxysuccinimidyl-4-azidosalicylic酸にカップリングできる。化学又は生物分子のアミノ基は光解作用により一つのポリマーを形成できる。当該ポリマーはクロスリンク基により化学或生物とカップリングする。
【0033】
また、化学又は生物分子のスルフヒドリル基は、1 (p-azidosalicylamido)-4(iodoacetamido)のブタンとカップリングし、そしてポリマーのアミノ基は光分解によりそれとカップリングすることができる。
また、ポリマーのアルデヒド基はp-azidobenzoylヒドラジッドとカップリングし、そして化学又は生物分子のアミノ基は光分解によりそれとカップリングすることができる。
【0034】
実用上、ポリマー内の分子間又は分子内の物理的的なリンケージを導入することが望ましい。サイズの関係で、メッシュプローブ自身は液の移動や撹拌器などによる機械切断力により骨格が折れてしまう恐れがある。特に直鎖状骨格のポリマーの場合は断裂の問題が目立つ。ポリマーの骨格に物理的なリンケージ(分子内リンケージを含む)を導入することによりこの問題を改善できる。実際、物理的なリンケージは共用接合でも非共用接合でもよい。同一種類の双機能クロスリンク、例えば4、7、10-Trioxa-1、13-tridecanediamineは共用接合を形成できる。他の強い分子間相互作用により非共用接合を形成できる。例えば、quaninesの間のHoogsteenのベースペアリングにより四本鎖DNAを形成できる 。ポリマーが水溶液の中でかなりコンパクトなランダムコイルを形成する特徴に鑑みて、その骨格のリンクは主に分子内ではなく、分子間になっている。
【0035】
メッシュプローブをセンサーの表面にカップリングするには多くの方法を採用できる。例えば、センサーにメッシュプローブ上の反応活性-OH又は-NH2と反応可能のエポキシドを導入することができる。また、センサーの表面をポリー(リジン)で処理し、そしてメッシュプローブ又は生物分子はセンサーの表面上にスポットされる。紫外線照射によりメッシュプローブ又は生物分子を電器デバイスと接続しているガラススライド又は不動態化層にクロスリンクする。メッシュプローブはアルデヒド、アミン又はイソシアシアニデ基より派生されたセンサーの表面にクロスリンクされる。
【0036】
アレイの形成方法はスポット染み法、インクジェット印刷法、又は直接チップに合成させる方法がある。
デジタル画像バイオセンサーシステム
本発明の一形態として、バイオセンサーシステムはバイオセンサーにより検体に対してデジタル画像又は「マシンビジョン」センサー技術を使ってアレイに結合している検体の信号を読取れ、バックランドが少ないことと信号対騒音比が高い特徴があり、強化された検体検出用のバイオセンサーシステムである。このようなバイオセンサーシステムは姉妹板の上のデジタルイメージセンサー、メッシュプローブを含むアレイ、センサー降温装置を含むローライト包囲物と検体信号の積分方法などの信号センサー技術を活用している。
【0037】
デジタルイメージセンサーのアレイにスポット可能或いは共用又は非共用接合によりデジタルイメージセンサー的表面上カップリングできるメッシュプローブを含むアレイにより発生する光学信号は、光センサー素子のアレイを含むデジタルイメージセンサーにより検出される。ファイバーオプティカルカプラは好きなようにガラススライドとセンサーの間に設置できる。
【0038】
メッシュプローブはまず、スポット染みされてから非常に薄い透明の基板にクロスリンクされる。基板は多孔質でもよく、固体でもよい。薄い透明固体基板の例としてはガラススライドが挙げられる。そして、薄い透明基板は直接デジタルイメージセンサーの表面に、メッシュプローブの面が上に向くように接続され、固定される。機械的な方法又は透明の粘着剤により固定すればよい。
【0039】
このような薄い基板は壊れやすいため、実際にマイクロアレイの基板として使えない。しかしながら、この潜在的薄い基板の折損は、直接ディジタル画像センサの表面にそれを付けることによって、回避される。新しい透明基板で古い基板を変えれば、デジタルセンサーは再利用できる。実際の応用において、デジタルセンサーが取り外し可能のユニットとして構成される場合には、この特徴は非常に有利である。また、「薄い」透明基いたを使うことが重要である。厚いものを使えば、又は光感応点(pixels )と光源(メッシュプローブ)の間の距離が増えるとシステムのこの機能が落ちる。その理由は、光感応点(pixels )に集まる光信号はその距離の立方と反比例するからである。普通のガラスは厚いため、これに使うことが考えられない。
【0040】
アレイの一つ一つのプローブポイントの局部区域はデジタルイメージセンサーの一つ一つの光センサー素子より大きくてよい。同様に、プローブポイントのサイズは一つ一つの光センサー素子と同じでよい。
デジタルイメージセンサーはCMOS 活性画素センサーであってよく、その一つ一つの画素にはデジタルコンバータ、アンプ、およびレジスタのダイオードが接続されている。CMOS 活性画素センサーのトップ層は不動態化層、例えば光透過がよいシリコンであり、アレイが検出する検体の溶液と半導体回路を隔離するバリアとして機能する。
【0041】
また、本発明はアレイを直接デジタルイメージセンサーに設置してその検出信号を増強するようになっている。これはデジタルイメージセンサーのトップにある薄い不動態化層の上に形成されているアレイより放射される化学発光を検出することにより実現するもので、信号はアレイに近いデジタルイメージセンサー感光素子により容易に増強される。
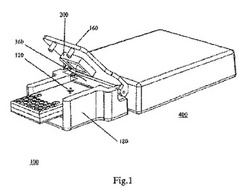
本発明はイメージセンサーとプローブを密接に接触させることによりバックランドの輻射を下げて、アレイの上の検体の光学信号測定の信号対騒音比を高めている。図1に示すように、ローライト包囲物100は光学イメージセンサーとアレイを含め、上面蓋160一つと、光学イメージセンサーのプリント基板 と選択可能のセンサー冷却素子を支えるとともに上面蓋160と機械的に接続している底蓋180一つを備えている。
【0042】
図1に示すように、光学イメージセンサーのプリント基板にはコネクター360(図2に示す)に接続されている第二層包囲物150を備えている。上面蓋160を底蓋180にカバーした場合、アレイ120を囲む密閉バリア200により定められるローライト区域300ができあがり、液体はバリア 200に制限によりこのローライト区域においてアレイに接触する。
上面蓋160には液体入口通路240があり、操作する時に液体入口通路240より標的分子を含む液体を注射してアレイ120に加えて、ローライト区域300に集中させる。検体は包囲物 100内に加工された毛細構造または液体入口通路240を経由してアレイ120まで輸送される。液体入口通路240は液体を導入する隔膜があり、液体と光を遮蔽できる。
【0043】
底蓋180に選択可能の液体入口通路320を設置する場合もある。選択可能の液体通路340により選択可能の液体入口通路320とローライト区域300をつながる。
バリア200はガラススライドの底窓280に接着されており、上面蓋160が底蓋180にカバーした時にイメージセンサーに接近し、液体もガラススライドの底窓28に集中する。また、アレイもローライト区域300におけるガラススライドの底窓280に加工されている。
【0044】
包囲物100は読取ワークステーション400に接続されることにより十分に水平に維持される。包囲物は読取ワークステーションに接続してもよく、いずれの重力の方向にて操作してもよい。この場合、液体入口通路と包囲物はいずれの方向において表面張力と毛細管作用により検体液体を密閉できるため、検体アレイ信号が読取れるようになっている。
図1、図2に示すように、光学イメージセンサー140を支持するプリント基板380は回路コネクター 360を介して読取ワークステーション400と電気的に接続される。底蓋180にも光学イメージセンサー140の電子回路を接続する開口 220を設置してもよい。
【0045】
バイオセンサーシステムは検体の信号を積分することにより検出の信号対騒音比を高めるが、積分はアレイよりの光の收集を検出する時間を増やすこととイメージセンサー以外の信号データ輸送の比率を下げることにより実現される。検体信号の積分に使われるデータ輸送方法はCMOS 活性画素センサーを使う。代表的な活性画素センサーはカメラに利用できる快速フィールド設備である。CMOS 活性画素センサーは非常に遅いスピードの状態でセンサーに密着しているアレイ信号を積分することができる。積分信号はメモリーに記憶されてから繰り返して積分されるが、検体信号の時間に伴う変化率を観察する。CMOS 活性画素センサーのフィールドはコントロール可能で、例えば零時タイミングでチップにある全ての記録をクリアして、固定時間帯の検体より発射する信号を収集し、イメージセンサーの一つ一つの光センサー素子は同時に違うサイクルを積分できる。検体信号の積分により信号対騒音比が増えるため、検体に対する検出を増強し、より低濃度の検体を検出することが可能となる。
【0046】
検体信号はローライト包囲物の中のCMOS 活性画素センサーを冷却してその固有の「暗い電流」のノイズを下げることにより増強される。センサーは熱電素子、スプレー口拡大、制冷、冷液浸漬などの方法により冷却することができる。一般的に言えば、センサーを7℃冷却させれば「暗い電流」のノイズを半分低減できる。したがって、センサーを4℃まで冷却させればこのようなノイズを室温レベルの1/10に低減できる。尚、検体を含む又は含まない液体をローライト包囲物の中に注入する時もセンサーを冷却できる。
【0047】
検体アレイ信号
メッシュプローブに付着している検体に対する光学検出は蛍光検出、化学発光検出、生物発光検出と量子スポット検出などの方法がある。マーカー又は信号分子はポリマーやメッシュプローブ又は標的混合物の中の検体に付着されており、放射性同位素、蛍光剤、化学発光剤、化学発光体、生物発光剤、酵素、抗体、磁気ビーズのような顆粒、と量子スポットがある。アミノ基のある短かいオリゴヌクレオチド上の蛍光染料はマーカーとして使われ、そのアミノ基はポリマーとリンクしている。検体検出用の信号分子には放射性同位素,蛍光染料例えばCy3、Cy5マーカー、Alexa Fluor 488、コロイド金、アゾ染料、キノリン染料、シアニン染料などのフルオレセイン、rodamine、テキサス赤、ローズベンガル、塩化ダンシル、エチジウムブロマイド、aminonapthalenes、ピレン、ポルフィリン、ルミノールや、dioxetanesや、acridiniumフェニル基エステルや、ルセニウム塩などの化学発光システム、発色団、および比色プローブ。
【0048】
マーカーはアゴニスト、敵対者、毒素、エピトープ、ホルモン、抗体、ペプチド、酵素、オリゴヌクレオチド、ペプチド核酸、植物性凝集素、炭水化物、タンパク質、およびドラッグを含み、例えばELISA検出用の酵素は蛍光検出に利用でき、また、蛍光にラベルされたアビジンやstreptavadinがある。
特定の検体に対して、多くのマーカーにより多くの検出方法を構成できる。例えば、メッシュレポーターのポリマーは多くの蛍光又は化学発光マーカーにリンクできる。このほか、メッシュレポーターは多くの標的スポットを結合できるため、メッシュプローブのポリマーは多くの標的スポット結合分子と多くの異なるマーカーにリンクできる。
【0049】
蛍光検出について、蛍光物の発光はアレイ又はCMOS センサー包囲物に近いLED 板より提供されるが、アレイ付近のアレイポイントとフォトダイオードとの間のナローバンドフィルターによりアレイの読取信号からエミットライトを除去することができ、放射光を選んで検出することが可能となる。
もう一つの方法は、化学発光を光学検出して検体信号を読取ることである。化学発光は化学反応により発生する光であり、フィルターなしのブロードバンドディテクターにより検出することができる。例えばCMOS 活性画素センサー、アレイスポットより発生する光は直接検出され、バックランド信号は主に「暗い電流」より来ている。メッシュレポーターはstreptavadinかanit-ジゴキシゲニン抗体と、化学発光タグにより形成される。例えばアルカリフォースフォターゼ又はホースラディシュ・ペルオキシダーゼ(HRP)は化学発光検出に用いられる。検出効率はある程度マーカーに対する選択性や特異性付着効率に依存する。ラベルは、酵素検出システムで認識できるビオチンかジゴキシゲニンのどちらかであってよいが、その後に化学発光反応して化学結合分裂からエネルギーを放出して離散的な波長の光子を発生する。
【0050】
メッシュレポーターの骨格にある信号分子又は染料分子の認識分子に対する数量比率は相当高い。3、4、5の場合もあり、通常は少なくとも6、7、8、9、又は少なくとも10、20、 30、40、50、60、70、80、90ひいては100である場合もあり、それぞれの組合せでメッシュレポーターを構成する。
本発明の中のアレイ信号検出はデジタルイメージセンサーを使ってもよく、電荷カップリング装置 (CCD)、光電倍増(PMT )又は雪崩光電ダイオードにより完成することもできる。検体の検出は例えば導電検出で違うアレイを完成してもよい。
【0051】
本発明のほかの形態はメッシュプローブの工業、環境、バイオ医学、バイオテクノロジー領域における応用に関わり、この発明のメッシュプローブは液体、気体又は固体形態の検体を分析、検出することに利用可能で、メッシュプローブはバイオセンサーと組み合わせて検体又は液相、非液相、気相の中の有機、無機或いは顆粒に対して検出することができる。
【0052】
センサーシステム
本発明のまたほかの目的は、読取ワークステーション、イメージセンサーの携帯式包囲物を含むバイオセンサーシステムを提供することにある。
図4に示すように、バイオセンサーシステムは、ローライト包囲物100の中にあるデジタルイメージセンサー600、データスループットの高い読取ワークステーション400と通用PC700を含む。読取ワークステーション400は少なくともCMOS デジタルイメージセンサー600のローライト包囲物100が挿入するソケットを備えており、センサー包囲物と読取ワークステーションとを電気接続と機械接続している。読取ワークステーションはユニバーサルシリアルバス(USB)454、並行パラレルポートインタフェースデバイス452又はイサネットインターフェース 456によりPCと接続している。
【0053】
図4に基づき、読取ワークステーション400の基盤にプログラム編集可能設備460がPC700と接続しており、デジタルイメージセンサー600とも接続している。スタートからエンドまでのフィールド、ライン、クロックマルスを含む画像信号を検出するして、同期的にデジタルイメージセンサーの検体データを読取る。プログラム編集可能設備460は画像データを、PC700よりデータ輸送の指令が来るまでに、イメージセンサー600よりローカルFIFD メモリーに輸送する。プログラム編集可能設備460 の代表的なサイクルは、PC700がセンサーに画像一つ輸出させる、画像を捕捉して読取ワークステーション400基板にあるローカルFIFDメモリに入力する、捕捉した画像をPC700に輸送するステップを含む。グラフィカルユーザーインターフェース(GUI)は、コンピュータユーザに画像キャプチャと表示サイクル、スナップショットモードまたは連続的な変化(生中継ビデオモード)を容易に実現させる。フィルタとイメージプロセッシングツールはユーザにローライト条件の下でセンサを操作させることができる。これらのツールは、センサ(イメージ、背景画像か「暗い」イメージを引き算するルーチン、および雑音を無視するルーチンを共同加えるソフトウェアルーチン)からの小さい信号を上げるためにイメージプロセッシングルーチンを含む。また、GUIはチップでのセンサ設定のユーザ支配力を与える。これで、ユーザはセンサの統合時間や、利得や、AD変換器などのチップに関するパラメタを調整できる。
【0054】
読取ワークステーションは、イメージセンサーとローライト包囲物をマッチングさせるコネクターを備えているが、目的はデジタルイメージセンサー検体センサーと読取ワークステーションを便利に分離させて、当該バイオセンサーシステムのスループットを増やし、デジタルイメージセンサー包囲物でローライト包囲物を構成することにある。このバイオセンサーシステムの挿入するたびに使える特徴により、使い捨てのデジタルイメージセンサー包囲物を使えることが可能となり、生物センサーの包囲物はほかのアレイに再利用することも可能となる。
【0055】
読取ワークステーションはUSBマイクロコンピューターポートを備え、マイクロソフト容量拡張ポート (ECP )インターフェースを備え、ソースポートを判断するためのユーザーコントロールスイッチを備えてもよい。読取ワークステーション基板はUSBケーブルから給電することができるが、ECPについては9Vの直流給電が必要とする。ハンドスイッチはバイオセンサー基板を再起動できる。プログラム編集可能設備も手動で再起動できる。
【0056】
本発明は時間積分により検体信号検出を増強する方法に関わり、標的物質の中の検体パラメータのデータスループットと測定はデジタルイメージセンサーがアレイ検出する時に発生する光の固有の信号対騒音比により決まる。信号対騒音比は検体信号を数秒以上の積分をすることにより向上することができる。積分の時間は通常10ms〜2分前後で30〜約1000ms、場合によっては50〜約600msであることもある。この時間は一系列のアレイ信号フィールド(画面)を保存することにより実現できるが、各フィールドも一定の時間帯の検体信号を積分することにより取得する。
【0057】
USB ポートはイメージセンサーとプログラム編集可能設備にメインクロックを提供する。イメージセンサーより輸出される画素データとパルスはコネクターを経由して基板へ輸送され、FIFDメモリに保存される。パルスは FIFO 指針に使われ、書込可能のFIFO 、FIFO に保存されている画素データについて左上の画素をゼロスタートとするように手配する。
【0058】
画像は一旦FIFDに保存されてから、二つのポートの内の一つから読取られる。図4に示すように、ECPはアレイ画像データが平行ポート(PP)452に読取られることを許容し、一回毎に一つの画素を読取る。PP452より逆方向のリクエストを出す度に読取る。プログラム編集可能設備460は452へのプログラム輸出を許容し、プログラム編集可能設備460がクロックを出す度に、PP452が一回応答し、PC700が1フィールドの画素読取を完了するまでにクロック応答が継続する。プログラム編集可能設備460はPP452でデータビット0と1でそれぞれI2CパスのSDAとSCLとする。
【0059】
また、FIFOの中の画像データはUポートより読取ることもできる。従来のUSB輸送に対して、データ輸送のバンドを高めることによりバイオセンサーの使用性を向上できるが、従来のUSB輸送において、FIFOより二つのデータパッケージを読取るにはその間に時間間隔がある。例えば、FIFOより63画素のデータを読取って従来のUSBポートのデータラインで輸送し、FIFDに二つのエンドを指定して二つのバッファー保存を作り、実際の実行では一つのバッファーはもう一つが満了した状況で読取ってUSBで輸送することができるため、普通のパスより100%の輸送バンドが増えている。一つ目のバッファーデータ輸送が完了しようとする前に、例えば1時間又は数時間のクロックパルスの前に、二つ目のバッファーは通用のパスで輸送開始し、二つ目のバッファーのデータ輸送が完了しようとする時に、一つ目のバッファーも同じ時間でデータをロードしたことになる。輸送しようとするデータが全部輸送完了するまで、前記ステップが繰り返されるため、従来のUSBより輸送速度が高まる。
【0060】
具体的な実施形態
次に、具体的な実施例に基づき、本発明を詳しく説明する。本発明は下記実施例に限るものではない。
本発明での説明は、同業者が変更、更改されており、本発明の宗旨と範囲を脱離していないことを認識できる。補足声明に定めている本発明の真の範囲内の変更、調整も本発明に含まれる。
【0061】
本願に引用される全てのファイル、プレス、契約、協議条項、特許は参考文献として挙げている。
【実施例1】
【0062】
直鎖状デキストラン(Sigma )をアミノ基のあるオリゴンウケルオチドに使用
直鎖状デキストラン(Sigma )をデイオン水に溶かし、1%の最終濃度にする。高圧殺菌して、室温、暗い環境にて、44mlのデキストラン溶液用に対して44μl、0.5M のヨウ素酸ナトリウムで酸化させ、振動させて一晩放置する。酸化された後のデキストランを3MのNaOAcと2倍容積のエタノールで2回沈殿、洗浄する。沈殿顆粒を空気で乾燥してから再び0.4ml、5mM、pH=7.2のリン酸ナトリウムバッファー溶液に溶かす。
【0063】
Eppendorff遠心チューブに1μlの酸化デキストラン7μl、10mMのNa2CO3溶液(pH 9.0)と2μlのオリゴンウケルオチド〔2μMの水溶液)を入れる。オリゴンウケルオチドの長さ25 - 45mer、合成する時に3’又は5’端にプリマリアミノ基を導入する。37℃の水に入れて一晩置く。そしてNaBH44室温で30分保温して、0.3MのNaOAcと2 倍容積のエタノールで沈殿させ、沈殿顆粒をTEで溶解させる。一部を取って1%アガロセゲルに入れて、EtBrで色付けする。遊離するオリゴンウケルオチドはスイミングして塩の前端に近づけていくが、デキストランとカップリングしたオリゴンウケルオチドは非常に遅いスピードでスイミングする。
【実施例2】
【0064】
高分子量分岐多糖、グリコーゲン(Sigma )とアミロペクチン(Sigma )をアミノ基のあるオリゴンウケルオチドのクロスリンクに使用。
これらポリマーの双水酸基はヨウ素酸ナトリウム(NaIO4)によりアルデヒド基に酸化される。0.4mlの1%の多糖水溶液にヨウ素酸ナトリウムを入れ、グリコーゲンとアミロペクチンの最終濃度をそれぞれ25mMと20mMにする。室温、暗い環境において振動、酸化させて一晩放置してから、0.3MのNaOAcと2倍容積のエタノールで2回沈殿させて、余分のNaIO4を除去する。沈殿物を空気で乾燥させてから再び0.4mlの5mM、pH=7.2のリン酸ナトリウムバッファー溶液に溶かす。アミノ基のあるオリゴンウケルオチドのカップリング及びその産物であるゲルの分析は実施例1のデキストランと同様である。
【実施例3】
【0065】
実施例2で製作されたメッシュポリマーのカップリング密度は、10個の葡萄糖単体が1個のオリゴンウケルオチドとカップリングし、平均として1個のグリコーゲン分子が約1000個のオリゴンウケルオチド分子とカップリングするものである。
【実施例4】
【0066】
信号分子 5’-ACTGCT-3' (BP001) の5’末端にアミノ基があり、3’末端に蛍光染料Cy5がある。末端にアミノ基のある認識プローブオリゴンウケルオチド分子AKH108(5'-CCGTGCAGATCTTAATGTGCCAGTAAAAG-3〉は同一多糖とクロスリンクし、 インフルエンザ遺伝子グループの中の番号3-フォスフォグリシレートキナセ遺伝子ピースの引物 5'-CCGTGCAGATCTTAATGTGC-3'と5'-GCGCTGTACCAAAGGCATC-3'が拡大したPCR産物と交配する。交配物はマイクロアレイの形でポリ(リセイン)を塗布したガラススライドにスポット塗りする。 クロスリンク反応とは、20nmolの酸化グリコーゲンと10mMのNa2CO3を入れたEppendorff遠心チューブに0.2nmolのAKH と2nmolの BP001を入れて、最終容積を10μlにして37℃で一晩放置する。
【0067】
Eppendorff遠心チューブに最終濃度が4mM になるようにNaBH4を入れて、室温で90分保温する。最終産物をエタノールで沈殿、遠心分離させたら、クロスリンクの産物と遊離のAKH108は小顆粒で遠心チューブの底に沈み、遊離のBP001は上の澄み通った部分に残す。それを捨てて、沈殿顆粒を10plの3XSSPE/0. 1% SDS/1.0 mg/ml BSAに溶解させて、マイクロアレイの表面に加える。更に室温で5時間交配させてから、10μlの新鮮な0.1XSSPE/0.1%SDSでガラススライドを3回洗浄して、レーザースキャナーで走査し、PCR産物のスポットパターンを観察する。
【実施例5】
【0068】
特異的にエンタロココスフェカリスよりのRecA 遺伝子と交配できる拡張的な産物オリゴンウケルオチド 5'-NH2-CCGATGCCTTAGTTTCAA-GTGGTGCGATTGACATCGTTGTCAT-3'は、グリコーゲンやアミロペクチンとのクロスリンクに利用される。多糖の酸化は実施例2と同様である。クロスリンク反応とは、20 nmolの酸化糖、2nmolのアミノ基のあるオリゴンウケルオチドと10mMのNa2CO3バッファー容積(pH9.0)と最終容積が10μlとなるように混合して、37℃で保温しながら一晩放置する。クロスリンク反応終了後、最終濃度が4mMのNaBH4を入れて引き続き室温で60分保温する。
【0069】
最終産物を0.3 MのNaOAc(酢酸ナトリウム)と2倍容積のエタノールで沈殿させてから、10 mMのNa2CO3 (pH 9.0)に溶かす。 一部のクロスリンクされたオリゴンウケルオチドをエポキシド処理されたガラススライドにスポットして、等量のオリゴンウケルオチドと酸化されていない多糖の混合物も同じガラススライドにスポットして比較させる。チップ上での交配とは、Alexa Fluor 546 (Molecular Probes Inc)Rec A PCR の産物を3xSSPE/0.1% SDS/1.0 mg/ml BSAの溶液に溶かしてからガラススライドの表面に加えて、室温で3時間交配させる。そして、0. lxSSPE/0. 1% SDSで洗浄してから、レーザースキャナーでガラススライドを走査する。グリコーゲンとクロスリンクしたオリゴンウケルオチドのスポット信号は酸化されていないグリコーゲンのスポットに対して5.86倍、アミロペクチンとクロスリンクしたオリゴンウケルオチドのスポット信号は酸化されていないアミロペクチンのスポットに対して5.63倍となっている。
【実施例6】
【0070】
CMOSイメージセンサーを使って直接チップ上で交配信号を検出
PB0330(Photobit)単色イメージセンサーの裸のモジュールはソケットにより姉妹板に接続され、接続線はエポキシ樹脂でシールして固定する。モジュールの表面を殺菌蒸留水で3回洗い流して、空気で乾燥させる。メタノールに溶かした〔3-グリシドシプロフィ〕トリメソシーシランをモジュールの表面に加えて、室温で10分保温し、更にメタノールで2回洗浄してから空気で乾燥させることにより、モジュールの表面を酸化させる。
【0071】
4種類のプローブ(100 pmol/ml in 50 mM NaC03バッファー溶液, pH 10.5) を2回ずつ手動でエポキシド処理されたモジュールの表面にスポットする。
スポットが乾燥してから、50mM Na2CO3(pH 10.5)に溶かしたエタノールアミネで速く1回洗って、そして同じ密閉液に室温で10分ほど育成する。そして殺菌蒸留水で表面を4回洗い流す。
【0072】
チップ上での交配は、モジュール表面を3xSSPE/50% formamide/1 mg/mlBSAで室温で20分保温してから20mlの3xSSPE/50%formamide/1 mg/ml BSAに溶かしたPCR産物〔末端に生物素とマーク、後で詳しく述べる)と交配する(この前にお湯で2分加熱してから急速に4℃まで冷却させる)。湿っぽいボックスの中に交配、一晩放置してから室温で、0. lxSSPEで4回洗浄する。洗浄時間は5分/1回とする。ストレプタビディン-アルカリフォースフォターゼで交配産物上の生物素を結合する。先ず、モジュールの表面をlmg/ml BSA を含むTBSで、室温で20分保温し、そしてAvidx-AP (Tropix)1:100で1 mg/ml BSAに希釈したTBSで室温で2 時間保温してから、更にTBSで室温で5分/1回に5回洗浄する。
【0073】
チップ上の交配信号を検出するが、モジュールの表面にTBSを備えた姉妹板を読取ワークステーションの光遮蔽包囲物のコネクターに挿入し、PCにインストールされている授権ソフトにより「暗い画像」(即ちバックランド画像、Idark)を読取る。姉妹板は読取ワークステーションに挿入されており、TBSは化学発光基質溶液に変換される。納入説明書に基づいて製作されたCDP-star増強剤Emerald II (Tropixより由来する)も含む。
【0074】
約0.1秒分積分されたイメージシールド(I )はセンサーより受信し、I-Iブラックピクチャは本当の信号写真とされる。ソフトには連続処理される写真を合体して一枚の画像として結果を表示するプログラムがあるため、積分の時間がより延長できる。
センサーのレジスターの設置としては、(レジスター53、43-46〕は増益を最大に設定、(レジスター9、10〉は積分時間を1秒/1シールド、(レジスター32、57)はアナログマイナスシフトを最大に設定、〔レジスター62〉は増益クラスを74に設定、その他のレジスターはデフォルト設定のままであることが望ましい。
【実施例7】
【0075】
TOTDA塗布でポリマー合成
Eppendorff チューブに8μlの5mMリン酸バッファー溶液(pH 7.2〉に溶解した1%酸化デキストラン-500、1mM 5’にアミノ基のあるオリゴンウケルオチド誘導体、2μlの0.2MのNa2BO3 (pH 9.0〉、 2μlの20mM のNaBH3CN、1μlの0.3mM のTOTDAと6μlの水を入れて、均一になるように混合して、4℃で保温しながら一晩放置する。そして、4μlの水と6μlのDMSOを入れてからマイクロドロッププレートに移動し、GeneMachine OmniGridAccent arrayerのチップの表面に印刷する。塗布されたクロスリンカーは捕獲分子の比率は10: 1〜 1: 1000でよい。
【実施例8】
【0076】
四鎖メッシュレポーター
Gの豊富なオリゴンウケルオチドTP (TGGACCAGACCAGCTATGGGGG AGCTGGGGAAGGTGGGAATGTGA)はグアニネス(下線付きG)の間のHoogsteenアルカリ基対により形成される四本鎖 G4-DNA構造を含む免疫球蛋白遺伝子の転換区から獲得できる。(Sen and Gilbert (1988) Nature 334:364-366, Sen and Gilbert (1990) Nature 344: 410-414に記載).切断されたTP、例えば,オリゴヌケルオチドQ3(5'-CACGTATGGGGGAGCTGGGGTAT-3')はG4-DNA 特殊核酸酵素のG4-DNAのマトリックスに利用される(Liu and Gilbert (1994) Cell 77: 1083-1092に記載)。ナトリウムとカリウムイオンが存在する条件で、四本鎖の構造は非常に安定的である。
【0077】
Eppendorff遠心チューブに25μlの2 mM HRP、0.3mM の濃度で5’の尾端にアミノ基一つ持っているQ 3オリゴ5μl、20mM濃度のNaCNBRH3 10μl、0.1mm濃度の抗生物素蛋白 5μl、1%の酸化デキストラン-500 40μlと水5μlを入れて、4℃で保温しながら一晩放置する。そしてBio-Gel P-50マトリックスであるスピンコーラムに通す。スピンコーラムを通して流出した一部のフラクションを集めて40%のグリセロール、200 mMの塩化ナトリウムと100mMの塩化カリウムのバッファー液で1:1で混合して、-20℃で保管する。このものは分子に生物素タグを含むサンプルを検出でき、感度を増強できる。直接的なHRPポリと比べて、現在の方法で取得するポリHRPは多くのメリットがある。HRPの間に多くの間隔があるが、このようなポリHRPの形成浮力の密度が小さいため、沈殿により検出対象の表面と粘着してしまうことがあまりなく、非特異結合によるノイズ信号を低減できる。また、適正な間隔により基板のダメージや拡散という減速の可能性を低減でき、発光信号の収集を減らすことができる。アルカリフォースフォターゼ又は蛍光染料はHRPの代わりにほかのメッシュレポーターとすることができる。
【0078】
デキストランの骨格の中のQ3オリゴは主に機械的な安定性を形成するものであり、機械切断による骨格損傷を軽減できる。周知の通り、Xイオンが存在する状況において、Gの豊富なオリゴンウケルオチドはHoosteenのアルカリベースペアリングにより安定な四級構造を構成できる(G4又はG四ポリマーと呼ぶ)。
Q3オリゴのデキストランにおける役割は、ある程度未満の物理的なリンク(又はリンクブリッジ)を提供して、ポリマーの骨格の中で自然な状況において分子内部にも分子間にも非共有の物理的なリンクを形成できる。
【0079】
勿論、アミノ基のあるQ3オリゴンウケルオチドは、例えばTOTDAの変わりに、メッシュプローブの製作にも利用できる。実施例8に述べたように、安定な、ポリマーの骨格の中の非共有の物理的リンクを形成でき、より良い機械安定性を実現できる。
【実施例9】
【0080】
Watson-Crickアルカリベースペアリングによるメッシュレポーターの安定化
ポリマーの骨格の非共有接合を構成するほかの方法もある。一例として、相互補完のオリゴンウケルオチドの間の特異アルカリベースペアリングをさせることが考えられる。3’端にアミノ基グループのある17merランダムシーケンスのオリゴンウケルオチドを合成でき、そして、その補完となるオリゴンウケルオチド(同じように3’端にアミノ基を持つ)を合成する。実施例8に記載のメッシュレポーターの準備プロセスのように、この二つのオリゴンウケルオチドを使ってQ3オリゴンウケルオチドを代替できる。
【実施例10】
【0081】
オリゴ交配による敏感ドロップ
直接的なプローブセンサーによる方法においてメッシュプローブとメッシュレポーターを共用する重要な理由の一つは、その感度を大きく改善できることにある。本実施例ではこの組合せシステムの感度を検証する。
実施例6に述べたように、二つの異なるオリゴンウケルオチドRHB105とNHY207は、それぞれ酸化デキストランとクロスリンクする。各メッシュプローブは2×2のマトリックスとしてCMOSセンサーに印刷され、合計7枚のチップが印刷される。印刷されたチップを湿度70%の小さい部屋に2時間乾燥させてから、80℃の真空炉の中でベーキングしながら一晩放置。そしてSolution I、Solution IIで順番に洗浄する。生物素化された相互補完のオリゴBCRHB101とBCNHY205の交配溶液を前記チップに加える。7枚のチップにつき、各チップ(又は交配反応)毎のBCRHB101数量は10-17ml、オリゴBCNHY205の数量は10倍減らして約10-16〜10-21mlの間とする。第7枚のチップは、BCNHY205が交配反応途中に除去される。交配が終わった後、0. IX SSPEでチップを完全に洗浄して、そして1%BSAのストラプタビディン-ポリHRPを含むTBSバッファー液の中に入れて1時間保温する。更にTBSでチップを数回洗い落とす。よって、発光するサブストレート(底物)はチップに加えられ、交配の結果はUSB読取ワークステーションを経由して直接パーソナルコンピューターのデスクトップに読取れる。
【0082】
多くのデータによりこのシステムの感度は500分子(遊離のものも、交配後の結合状態の化合物も含む総量をさす)であることが検証されている。BCNHY205がない場合、NHY205メッシュプローブの「スポット」に交配信号がない。このシステムの動態範囲を検証するために、NHY205よりの交配信号数量はRHB101の交配信号数量で割り算してから又は統一化してから、BCNHY205の濃度グラフを作成する。ダブルログプロットグラフでは、その直鎖状範囲から少なくとも4.5のログの数量級が見られる。
【実施例11】
【0083】
血清の中の遺伝子の無拡大検出
患者の血液10mlを取って遠心処理する。遠心チューブから血清の白い細胞層を取り出して3 mlの細かいガラスビーズと6mlのPBSバッファーを入れてある15mlの遠心チューブに入れる。そして、卓上式超音波粉粋機で1分間粉粋し、4回以上繰り返す。20μl溶胞粗産物を人間のCYP450遺伝子を含む捕獲プローブセンサーチップに加えて、1μlの末端に生物素タグを持っているとともに捕獲プローブと交配可能の報告プローブを入れる。2時間の交配をさせてから、厳しい条件において洗浄して、straptavidinと Poly-HRP(ポリ辣根ペルオキシダーゼ)を含むメッシュレポーターを入れて、室温で1時間育成する。そしてPBSバッファー液で数回洗浄し、化学発光基質(LMA-6,Lumigen)をチップの上に加える。交配の結果は携帯式USB読取装置によりノートパソコンまで輸送される。
【0084】
10μlの血液の中に一百二十万个白細胞が含まれている。ある特定のCYP450単倍体を検出するとすれば、前記プロセスによるサンプル回収率は70%と高く、20μlの溶胞粗産物にはチップ交配検出に利用できる10,000 CYP遺伝子コピーが入っている。このシステムは特異交配検出よりも感度が高いため、前に述べたようにターゲットシーケンスに対する拡大という手順を削除してもよい。
【実施例12】
【0085】
微生物病原体の無拡大検出
生きている細胞の中には、核糖体RNAは大いに存在する核酸である。一つの細胞の中に約10,000個も入っている。このようなRNAはシーケンスについて非常に保守的であるが、特異核酸交配により、異種シーケンスの差異により物種の鑑定を十分にできる。次は微生物病原体検出の一例である。
【0086】
例を挙げて大体の検出原理を説明する。沙眼衣原体溶液を10,000 cfu/mlに濃縮して準備しておく。EPチューブの中に0.3mlのCT 溶液と0.3mlの2%SDSを含むPBSバッファー液と0.3ml(容積)のガラスビーズを混合させる。そして、最高速度で渦撹拌器で回転して均一に混合させる。10μlの上清液に10μlの90%フォルマミドと6XSSPEを含む溶液を入れ、更に1μlの生物素指示プローブを入れて、ポリマー骨格によりリンクされた捕獲プローブ(メッシュプローブとして合体)を含む感受チップに移動して1時間交配させる。特定の交配条件において、生物素指示プローブも捕獲プローブも同時に同一の核糖体RNAに交配され、二者は近い。生物素指示プローブと捕獲プローブの長さは7〜45個の个オリゴンウケルオチド残基分とする。交配後のチップの処理プロセスは前記実施例と同様である。このような臨床検出は、ほかの捕獲プローブをチップに付着させて陽性、陰性の対照をする必要がある。
【0087】
ガラスビーズの渦による細胞溶菌の破裂率が約10%とすれば、いずれの指定核糖体RNAにつき、標的分子が各交配反応に出てくる数量は前に述べたように約150000個であることが算出できる。これは下限にすぎないが、なにも酵素による拡大のないシステムにとっては、この数値が十分に検出に利用できる。
この例では、メッシュプローブは透明の薄い層にスポットされてから0103光電センサーの表面上的感受チップに固定されるようになっている。 指示プローブと捕獲プローブは所定の交配条件において同一の核糖体とリンクする。しかも、同じ検出のもう一種類の病原体、例えば淋球菌の捕獲と指示プローブが必要であるかもしれない。
【0088】
最もよく見られる性的伝染病CT/NCの臨床検出する時、普通はコットンボールを膣に挿入してサンプルを取る。サンプリングしたコットンボールはPBSバッファー液で大半の細胞を洗い取って、改めて1mlのPBSに浮遊させる。CT/NCが陽性の患者は、このような方法で集める細胞は少なくとも10,000個/mlに達す。このように、前記検出方法は完全に適用できる。ここに掲示する原理は水や食品により伝播される病原体の無拡大検出にも応用できる。
【実施例13】
【0089】
スリップ(3.6×3.6mm)を1MのNaOH溶液に浸して2時間振動して、デイオン水で2回洗浄してから窒素吹き付けで乾燥させる。その表面は〔3-グリシドックスグリセロール〕トリメソックスシランで真空乾燥器に反応させ、真空乾燥器内に80℃で3時間ベーキングする。
AFP又はPSAの捕獲抗体を1×PBS/2mM NaBO3/5%aグリセロールバッファー液(pH 8.0)に溶かして、最終濃度が0.3mg/mlとする。各抗体を2×2のマトリックスとするスリップに印刷する。印刷してから、湿度70%の温室に2時間乾燥させて、4℃の真空乾燥器に保管する。
【0090】
スリップを1×PBS/1%エタノールアミン(pH 8.4)に30分浸して、バッファー液(1×TBS/5%グリセロール/0.1%BSA)で2回洗浄してから、密閉バッファー液(1×TBS/5%グリセロール/1%BSA)で密閉する。AFP(5ng/ml)とPSA(0.5ng/ml)を別々に又はいっしょにスリップに加えて、ロッキングプラットフォームの上で室温で1時間育成する。3回洗浄した後に、スリップ上にそれぞれ同じバッファー液で1:10,000に希釈(即ち10,000倍希釈)された生物素化されたAFP又は/及びPSA検出抗体(Tianjina Biotehnologies)を取得する。その後、スリップは1:12,000に希釈された密閉バッファー液とstreptavadin-HRPとでロッキングプラットフォームの上で30分育成してから5回洗浄する。
交配信号を検出する時、表面にTBSがあるスリップは直接CMOSセンサーのモジュールの表面に接続され、そしてセンサーを光遮蔽の包囲物の中の読取ワークステーションのコネクターに挿入する。PCに授権ソフトをインストールして、「暗い画像」を受信し、バックランドの信号を取得する。ECL化発光底物溶液でTBSを1分間代替すれば、センサーから信号画像を取得できる。
【技術分野】
【0001】
本発明は分子検出システムに関する。具体的には、本発明は検体に対して光学検出を行うバイオセンサーにアレイを形成するために用いるメッシュプローブに関する。
【背景技術】
【0002】
本発明に使われる技術用語の定義は以下の通りとする。
メッシュポリマーは、一つ又は複数の化学的又は生物種がポリマーのメインチェーンとクロスリンクしているポリマー誘導体をいう。
メッシュプローブは、クロスリンクしている化学分子又は生物分子は選択的に、専門的に標的分子と結合する機能を持つ捕獲分子を備えているポリマー誘導体をいう。
【0003】
メッシュレポーターは、前記化学又は生物分子は認識分子と信号分子を含む捕獲分子であることが可能とする派生ポリマーをいう。化学又はナチュラルの生物分子であってもよいものとし、同一のポリマーの骨格にクロスリンクしているため、物理的に密着している。認識分子の機能は特別に、選択的に通常標的分子に関する「分子タグ」と結合することにあり、信号分子の機能は検出のためのコントロール可能の信号を発生することにあり、例えば、蛍光又は化学発光のように、直接又は後発事象により間接的に信号を発生することができる。
【0004】
ブリッジング分子はクロスリンカーであって、ポリマーの骨格に分子内又は分子間のクロスリンクを導入する。これらは通常双方向機能のクロスリンカーであり、その官能基はポリマーの骨格又は導入された派生グループのみと反応するが、例外もある。例えば、ポリマーの骨格にクロスリンクしている一端に反応基のあるGの豊富なオリゴヌクレオチドにおいて、クロスリンクのチェーンが長いので、オリゴヌクレオチド内にHoosteenアルカリベースペアリングが発生し、ポリマーの中に又はポリマーの間で非共有のクロスリンクが形成する。
【0005】
生物分子とほかの検体はそれに結合できる選択的又は特別なプローブアレイにより検出できる。従来、バイオセンサーレー技術の原理に基づき、プローブスポットを基板又はバイオチップに配列する方案が提案されている。(M.SchenaとR.W.DAVISDNAマイクロアレイ:実用新案、M. Schena編集、オックスフォーだ大学出版社1999年)という本には多くの方案が記載され、アレイは遺伝子配列の検出と発見や、薬物分子の候補の選択と測定、毒性と薬理作用の研究、及びその他用途に使われる。 標的ポイントは核酸のアルカリバースペアリング又は交配、蛋白質と蛋白質の相互作用、蛋白質と配位子との相互作用、酵素と基板の相互作用、受体と配位子との相互作用、及びその他化学反応など多くの相互作用によりプローブと結合することができる。
【0006】
バイオセンサーは同時に多くの生物分子間の反応を検出できる。例えば、マイクロアレイで蛋白質又は核酸を検出するような技術は人類遺伝子プロジェクトとその他生物遺伝子配列測定からの情報を利用するための有力な手段となっている。
【発明の概要】
【発明が解決しようとする課題】
【0007】
検体からの信号はいつも小さいし、また、様々なソースの背景によりこのような測定方法の信号対雑音比が比較的弱いため、検体が検出しにくい。一つの解決方法としては、検体の信号を強くしてその固有の信号対雑音比を高めることが考えられる。信号対雑音比を高めることは検体に対する検出限度を下げることに有利で、より低濃度の検体を検出することが可能となり、分子検出応用の新しい扉を開いた。
【課題を解決するための手段】
【0008】
前記課題を解決するために、本願申請者は以下の発明を提供する。本発明の分子検出システムは、一つの光学センサーと一つの捕獲分子のアレイを備え、この捕獲分子のアレイは複数のポリマーチェーン間の相互結合を限定するポリマーとセンサー表面にクロスリンクされている。
発明に関わるの捕獲分子のアレイは複数のポリマーチェーン間の相互結合を妨げるポリマーとのクロスリンクにより薄い透明基板又は多孔質基板の表面に接続し、前記透明基板は光学センサーの表面に固定されている。
【0009】
前記ポリマーはナチュラルポリマーである。
前記ナチュラルポリマーは直鎖状または分岐多糖類である。
前記直鎖状多糖類はデキストランである。
前記分岐多糖類はグリコーゲンやアミロペクチンである。
前記ポリマーは分岐DNAである。
【0010】
前記ポリマーはヒドロゲルである。
前記捕獲分子は生物分子である。
前記生物分子は 蛋白質である。
前記生物分子はRNA構造を持つDNAである。
前記捕獲分子はPNA又はLNAである。
【0011】
前記ポリマーは合成高分子ポリマーである。
前記合成ポリマーはポリ(メチルビニルエーテルのalt -無水マレイン酸)である。
前記複数のポリマーチェーン間の相互結合は共有接合と双方向機能のクロスリンカーによるクロスリンクからなる。
前記双方向機能のクロスリンカーは4,7,10トリオ-1,13-トリデキャンジアミンである。
【0012】
前記相互結合は非共有接合の形を取っている。
前記非共有接合の相互作用はポリマーにクロスリンクされるGの豊富なオリゴヌクレオチドの間にHoogsteenアルカリベースペアリングにより形成される四本鎖DNAまたはRNAの構造とする。
前記Gの豊富なオリゴヌクレオチドは末端にポリマーにクロスリンクできる官能基を備えるQ3誘導体である。
【0013】
また、本発明は分子検出システムに使われるポリマーを生成する方法を提供する。この方法は、
a)ヨウ素酸ナトリウムと多糖が反応して、多数のアルデヒド基を持つ直鎖状又は分岐ポリマーを生成し、
b )反応性アミノ基がある又はアミノ基を誘導できる分子を入れ、
c ) NaCNBrBH3が存在する条件でカップリング反応を実現するステップを備え、
前記ポリマーチェーンの間に限定的なインターコネクトがあることを特徴とした。
【0014】
前記記録分子の二つの信号分子と少なく一つの認識分子は前記にて製作されたポリマーとクロスリンクしている。
前記報告物の信号分子はホースラディシュ・ペルオキシダーゼ(HRP)又はアルカリフォースフォターゼで、認識分子はstreptavidinである。
本発明は検体を検出する方法を提供し、この検体検出する方法は、
a )請求1に記載の分子のアレイは検体と接触し、
b )分子のアレイは請求21に記載の報告分子と接触し、
c )このアレイに化学発光基質を入れ、
d )外部のスキャナーを使わずに直接光学センサーからデーターを読み取るステップを含むことを特徴とした。
【0015】
前記検体は核酸であるとともに、検体サンプルはしずれの酵素により増幅されていない。
光学センサーの上の検体を検出するための捕獲分子のアレイは、ほかのポリマーチェーンと限定的なインターコネクトがあるポリマーとのクロスリンクにより薄い透明固体又は多孔質基板の表面に接続しており、前記薄い透明固体は光学センサーの表面に固定されていること。
【図面の簡単な説明】
【0016】
【図1】ローライトイメージセンサーと読取装置との連続の一例を示す図。
【図2】ローライトイメージセンサーのケースの一例を示す側面図。
【図3】CMOSイメージセンサーを使ってプローブポイントに対して蛍光プローブ検出を行う一例を示す図。
【図4】検体検出データと検体アレイデータの表示に用いるバイオセンサーシステムの一例を示す図。
【図5a】AFP検出信号の一例を示す図。
【図5b】PSA検出信号の一例を示す図。
【図5c】AFP(左)とPSA検出信号の一例を示す図。
【発明を実施するための形態】
【0017】
発明内容
メッシュプローブ
通常、メッシュプローブにより検体を捕獲し、縛る。プローブによる捕獲又は標的結合分子には核酸、ポリヌクレオチド、タンパク質、ペプチド核酸、小分子、および様々の生物分子を含む。標的結合プローブ配体は抗体を含む。例えばstreptavadinはビオチンマーク分子を検出するのに使用される。
【0018】
一方、この発明は各アレイとスポットの検体の数の増加を表明する。各スポットにおける検体の数の増加は増加した分子を捕獲できるメッシュプローブの組み合わせにより実現できる。
また、メッシュポリマーはポリマーと化学分子又は生物分子にリンクすることにより形成し、化学又は生物分子はプローブ又は複数のプローブを含むによりメッシュプローブを構成する。含まれる化学又は生物分子プローブは、共有接合又は非共有接合、例えばイオン接合、弱い結合力などの化学作用力によりポリマーにカップリングする。このようなポリマーは直鎖状又は分岐ポリマー、例えば、直鎖状又は分岐の多糖類又はオリゴヌクレオチドであってよい。
【0019】
ポリマーは層、ビーズ、ディスクまたはそれらの組合せの形の固体、ゲルまたは無定形の構造であっても良いし、均質の又は異種の、直鎖状又は分岐した側鎖状、くし、星または木のような構造であってもよい。ポリマーのブランチは長連鎖ブランチであっても短連鎖ブランチであってもよい。当該ポリマーは化学方法により合成されてもよく、天然物より分離して得ることもできる。通常のポリマーは、炭水化物、糖類、ホモ多糖、ヘテロ多糖、アガロース、アミロース、アミロペクチン、グリコーゲン、デキストラン、セルロース、キチン質、キトサン、ペプチドグリカン、およびグルコサミノグリカンを上げられる。場合によっては、ポリマーは非常に分岐したデキストランである。また、ポリマーはヒドロゲル、またはポリアクリルアミドゲルなどの水和されたデキストランかアガロースである場合もある。更に、メッシュポリマー用の高分子ポリマーはオリゴヌクレオチド、ペプチド、ペプチド核酸、プロテオグリカン、糖蛋白質、および糖脂質を含む。更に言えば、ポリマーは抗体又は抗体のフラグメントであってもよい。
【0020】
メッシュ高分子ポリマーを作るのに役立つほかものはジオールポリマー、例えば宝石ジオールと隣接ジオール基のある高分子ポリマーを含む。もう一つの例はエステル基に隣接する水酸基を含むRNAにリンクするホスホジエステルというポリマーがある。
また、多くの水酸基を含むポリマーも挙げられる。これらのポリマーの混合物は全て本発明に利用される。
【0021】
ポリ(メチルビニルエーテルのalt -無水マレイン酸)の単体は以下の通りとなる。
【0022】
【化1】

【0023】
中に含まれた無水物グループは、タンパク質のアミン基又はメッシュプローブを形成する派生オリゴヌクレオチドと反応しやすい。
もう一つの例はポリー、(o-クレジルグリシジル・エーテル)、-、共同、-ホルムアルデヒド}で、その繰返しの単位は以下の通りである。
【0024】
【化2】

【0025】
当該ポリマーの中のエポキシ基は先ずアルカリ性のペーハーでリングオープンしてジオール基を形成し、そして、NaIO4(ヨウ素酸ナトリウム)による酸化によりアルデヒド基に変換する。そして、酸化後のポリマーは還元アミノ化により第一のアミンを含む分子カップリングできる。
メッシュプローブは化学分子及び/又は生物分子とポリマーのカップリングにより製作される。場合によって、メッシュプローブは分子又は生物分子の官能基又は活性基とポリマーとの抱合反応(化学分子又は生物分子をポリマーにカップリングする)により製作できる。官能基又は反応基には、アルデヒド、水酸基、アミン基、アミノ基、カルボン酸エステルと、sulthydryl、及びそれらの混合物を含む。
【0026】
化学又は生物分子とポリマーとのカップリング又は反応によりメッシュプローブを製作する時、ポリマーは多くのスポットにおける反応基により直接又は基グループの接続により間接的に化学又は生物分子的官能基又は反応基と結合できる。生成されたポリマーは化学分子又は生物分子に結合できる反応基を備える。 このような反応基には、アルデヒド、水酸基、アミン基、アミノ基、カルボン酸エステル、スルフヒドリル、イソチオシアン酸塩、N-hydroxysuccinimideエステル、ケトン、グリオキサール、エポキシド、oxiranes、imidoesters、carbodiimides、alkylphosphates、無水物、maleimides、アジリジン、acryloyls、fluorophenyls、diazoacetyls、N-acylimidazoles、succinimidyl炭酸塩、carboxymethylグループ、イソシアナート、ヒドラジッドグループ、とそれらの混合物を含む。
【0027】
ポリマーはキトサンのアミノ基のような反応アミン基があってもよく、硫酸基、カルボン酸エステル、またはリン酸基などの反応性官能基があってもよい。硫酸基のあるポリマーは、コンドロイチン硫酸、デルマタン硫酸、ヘパリン硫酸塩、およびケラチン硫酸塩が挙げられ、カルボン酸エステルを含むポリマーは、多糖類より派生するシアリン酸、アルドン酸、uronic酸、oxoaldonic酸、およびアスコルビン酸が挙げられる。
【0028】
リン酸基のあるポリマーはDNAとRNAがあり、この種類のポリマーは異なる機能を持つリンカー、例えば官能基クロスリンカー、双方向機能のクロスリンカー、多官能基クロスリンカーにより化学又は生物分子とカップリングできる。例えば、メッシュプローブは、一つのポリヌクレオチドがほかのポリヌクレオチドと結合されたものであってよく、RNAが酸化されてアルデヒド基を提供して化学又は生物分子とカップリングしてできるものであってもよい。
【0029】
複数の化学又は生物分子はポリマーとカップリングして複数の標的物質を結合できるメッシュプローブを構成できる。言い換えれば、一つのポリマーチェーンは複数種類の化学又は生物分子にカップリングして一つのメッシュプローブを構成できる。このような混合メッシュプローブも本発明の応用である。
例えば、1種類のプローブを製作するのに、ポリマーと化学又は生物分子のアミン基のリンクにはdithiobis(succinimidylpropionate), disuccinimidyl tartarate, or disuccinimidyl glutarateを利用し、化学又は生物分子のスルフヒドリル基とポリマーのアミン基のリンクには-succinimidyl3-- (2-pyridyldithio)プロピオン酸かm-maleimidobenzoyl-N-hydroxysuccinimideエステルを利用し、化学又は生物分子のスルフヒドリル基とポリマーのアルデヒド基のリンクには4 (N-maleimidomethyl)シクロヘキサン1カルボキシルヒドラジッドか3(2-pyridyldithio)プロピオニルヒドラジッドを利用し、化学又は生物分子のスルフヒドリル基とポリマーのカルボン酸エステルのリンクには4 (p-azidosalicylamido)ブチルアミンを利用する。
【0030】
化学又は生物分子とポリマーのアミノ基はheterobifunctional crosslinkers N-5アジド基の2-nitrobenzoyloxysuccinimideまたはN-hydroxysulfosuccinimidyl-4-azidobenzoateのような別種類のクロスリンカーによりリンクしてもよい。
ポリマーに含まれる水酸基はカルボニル基化されたエージェント、例えばN,'N -カルボニルジミダゾールと反応して中間的イミダゾリルカルバメート系を形成する場合もある。そして、アミンのような求核物質、ペプチドやタンパク質などのようなアミノを含むものと反応してN-アルキルカルバメート系リンケージを生成する。水酸基を含むポリマーはまたN、N'-disuccinimidylcarbonateと反応し、そしてアミノ基を含むオリゴヌクレオチド上一つのアミノ基と反応する。このアミノ基はオリゴヌクレオチドの一端にあってはよく、末端に近いところにあるものでもよい。このようなポリマーは、3-maleimidopropionic酸と反応し、オリゴヌクレオチド上のアミノ基と反応することができる。また、このようなポリマーは化学又は生物分子の末端ハロゲン化アルキルと反応してメッシュプローブのリンケージを構成することができる。
【0031】
ポリマーは隣接している炭素原子に水酸基 (例えば、糖類か糖蛋白質)を含む場合、ヨウ素酸ナトリウムと反応してアルデヒド基を生成することにより、アミノ基のある化学又は生物分子とSchiff'sアルカリを生成する。Schiff's アルカリは水素化ホウ素ナトリウム又はナトリウムcyanoborohydrideのような還元剤と反応することにより、ポリマーと化学分子又は生物分子とは二次の、または、第三のアミンリンケージができる。
【0032】
また、メッシュプローブはフォトリアクティブクロスリンカーにより製作することもできる。例えば、ポリマーとアミノ基のある化学又は生物分子の上のアミノ基とはフォトリアクティブクロスリンカーによりカップリングしてメッシュポリマーを形成する。形成されるメッシュポリマーには、ポリマーと化学分子又は生物分子とは一つのクロスリンク基でカップリングされている。例えば、ポリマーの上のアミノ基はN-hydroxysuccinimidyl-4-azidosalicylic酸にカップリングできる。化学又は生物分子のアミノ基は光解作用により一つのポリマーを形成できる。当該ポリマーはクロスリンク基により化学或生物とカップリングする。
【0033】
また、化学又は生物分子のスルフヒドリル基は、1 (p-azidosalicylamido)-4(iodoacetamido)のブタンとカップリングし、そしてポリマーのアミノ基は光分解によりそれとカップリングすることができる。
また、ポリマーのアルデヒド基はp-azidobenzoylヒドラジッドとカップリングし、そして化学又は生物分子のアミノ基は光分解によりそれとカップリングすることができる。
【0034】
実用上、ポリマー内の分子間又は分子内の物理的的なリンケージを導入することが望ましい。サイズの関係で、メッシュプローブ自身は液の移動や撹拌器などによる機械切断力により骨格が折れてしまう恐れがある。特に直鎖状骨格のポリマーの場合は断裂の問題が目立つ。ポリマーの骨格に物理的なリンケージ(分子内リンケージを含む)を導入することによりこの問題を改善できる。実際、物理的なリンケージは共用接合でも非共用接合でもよい。同一種類の双機能クロスリンク、例えば4、7、10-Trioxa-1、13-tridecanediamineは共用接合を形成できる。他の強い分子間相互作用により非共用接合を形成できる。例えば、quaninesの間のHoogsteenのベースペアリングにより四本鎖DNAを形成できる 。ポリマーが水溶液の中でかなりコンパクトなランダムコイルを形成する特徴に鑑みて、その骨格のリンクは主に分子内ではなく、分子間になっている。
【0035】
メッシュプローブをセンサーの表面にカップリングするには多くの方法を採用できる。例えば、センサーにメッシュプローブ上の反応活性-OH又は-NH2と反応可能のエポキシドを導入することができる。また、センサーの表面をポリー(リジン)で処理し、そしてメッシュプローブ又は生物分子はセンサーの表面上にスポットされる。紫外線照射によりメッシュプローブ又は生物分子を電器デバイスと接続しているガラススライド又は不動態化層にクロスリンクする。メッシュプローブはアルデヒド、アミン又はイソシアシアニデ基より派生されたセンサーの表面にクロスリンクされる。
【0036】
アレイの形成方法はスポット染み法、インクジェット印刷法、又は直接チップに合成させる方法がある。
デジタル画像バイオセンサーシステム
本発明の一形態として、バイオセンサーシステムはバイオセンサーにより検体に対してデジタル画像又は「マシンビジョン」センサー技術を使ってアレイに結合している検体の信号を読取れ、バックランドが少ないことと信号対騒音比が高い特徴があり、強化された検体検出用のバイオセンサーシステムである。このようなバイオセンサーシステムは姉妹板の上のデジタルイメージセンサー、メッシュプローブを含むアレイ、センサー降温装置を含むローライト包囲物と検体信号の積分方法などの信号センサー技術を活用している。
【0037】
デジタルイメージセンサーのアレイにスポット可能或いは共用又は非共用接合によりデジタルイメージセンサー的表面上カップリングできるメッシュプローブを含むアレイにより発生する光学信号は、光センサー素子のアレイを含むデジタルイメージセンサーにより検出される。ファイバーオプティカルカプラは好きなようにガラススライドとセンサーの間に設置できる。
【0038】
メッシュプローブはまず、スポット染みされてから非常に薄い透明の基板にクロスリンクされる。基板は多孔質でもよく、固体でもよい。薄い透明固体基板の例としてはガラススライドが挙げられる。そして、薄い透明基板は直接デジタルイメージセンサーの表面に、メッシュプローブの面が上に向くように接続され、固定される。機械的な方法又は透明の粘着剤により固定すればよい。
【0039】
このような薄い基板は壊れやすいため、実際にマイクロアレイの基板として使えない。しかしながら、この潜在的薄い基板の折損は、直接ディジタル画像センサの表面にそれを付けることによって、回避される。新しい透明基板で古い基板を変えれば、デジタルセンサーは再利用できる。実際の応用において、デジタルセンサーが取り外し可能のユニットとして構成される場合には、この特徴は非常に有利である。また、「薄い」透明基いたを使うことが重要である。厚いものを使えば、又は光感応点(pixels )と光源(メッシュプローブ)の間の距離が増えるとシステムのこの機能が落ちる。その理由は、光感応点(pixels )に集まる光信号はその距離の立方と反比例するからである。普通のガラスは厚いため、これに使うことが考えられない。
【0040】
アレイの一つ一つのプローブポイントの局部区域はデジタルイメージセンサーの一つ一つの光センサー素子より大きくてよい。同様に、プローブポイントのサイズは一つ一つの光センサー素子と同じでよい。
デジタルイメージセンサーはCMOS 活性画素センサーであってよく、その一つ一つの画素にはデジタルコンバータ、アンプ、およびレジスタのダイオードが接続されている。CMOS 活性画素センサーのトップ層は不動態化層、例えば光透過がよいシリコンであり、アレイが検出する検体の溶液と半導体回路を隔離するバリアとして機能する。
【0041】
また、本発明はアレイを直接デジタルイメージセンサーに設置してその検出信号を増強するようになっている。これはデジタルイメージセンサーのトップにある薄い不動態化層の上に形成されているアレイより放射される化学発光を検出することにより実現するもので、信号はアレイに近いデジタルイメージセンサー感光素子により容易に増強される。
本発明はイメージセンサーとプローブを密接に接触させることによりバックランドの輻射を下げて、アレイの上の検体の光学信号測定の信号対騒音比を高めている。図1に示すように、ローライト包囲物100は光学イメージセンサーとアレイを含め、上面蓋160一つと、光学イメージセンサーのプリント基板 と選択可能のセンサー冷却素子を支えるとともに上面蓋160と機械的に接続している底蓋180一つを備えている。
【0042】
図1に示すように、光学イメージセンサーのプリント基板にはコネクター360(図2に示す)に接続されている第二層包囲物150を備えている。上面蓋160を底蓋180にカバーした場合、アレイ120を囲む密閉バリア200により定められるローライト区域300ができあがり、液体はバリア 200に制限によりこのローライト区域においてアレイに接触する。
上面蓋160には液体入口通路240があり、操作する時に液体入口通路240より標的分子を含む液体を注射してアレイ120に加えて、ローライト区域300に集中させる。検体は包囲物 100内に加工された毛細構造または液体入口通路240を経由してアレイ120まで輸送される。液体入口通路240は液体を導入する隔膜があり、液体と光を遮蔽できる。
【0043】
底蓋180に選択可能の液体入口通路320を設置する場合もある。選択可能の液体通路340により選択可能の液体入口通路320とローライト区域300をつながる。
バリア200はガラススライドの底窓280に接着されており、上面蓋160が底蓋180にカバーした時にイメージセンサーに接近し、液体もガラススライドの底窓28に集中する。また、アレイもローライト区域300におけるガラススライドの底窓280に加工されている。
【0044】
包囲物100は読取ワークステーション400に接続されることにより十分に水平に維持される。包囲物は読取ワークステーションに接続してもよく、いずれの重力の方向にて操作してもよい。この場合、液体入口通路と包囲物はいずれの方向において表面張力と毛細管作用により検体液体を密閉できるため、検体アレイ信号が読取れるようになっている。
図1、図2に示すように、光学イメージセンサー140を支持するプリント基板380は回路コネクター 360を介して読取ワークステーション400と電気的に接続される。底蓋180にも光学イメージセンサー140の電子回路を接続する開口 220を設置してもよい。
【0045】
バイオセンサーシステムは検体の信号を積分することにより検出の信号対騒音比を高めるが、積分はアレイよりの光の收集を検出する時間を増やすこととイメージセンサー以外の信号データ輸送の比率を下げることにより実現される。検体信号の積分に使われるデータ輸送方法はCMOS 活性画素センサーを使う。代表的な活性画素センサーはカメラに利用できる快速フィールド設備である。CMOS 活性画素センサーは非常に遅いスピードの状態でセンサーに密着しているアレイ信号を積分することができる。積分信号はメモリーに記憶されてから繰り返して積分されるが、検体信号の時間に伴う変化率を観察する。CMOS 活性画素センサーのフィールドはコントロール可能で、例えば零時タイミングでチップにある全ての記録をクリアして、固定時間帯の検体より発射する信号を収集し、イメージセンサーの一つ一つの光センサー素子は同時に違うサイクルを積分できる。検体信号の積分により信号対騒音比が増えるため、検体に対する検出を増強し、より低濃度の検体を検出することが可能となる。
【0046】
検体信号はローライト包囲物の中のCMOS 活性画素センサーを冷却してその固有の「暗い電流」のノイズを下げることにより増強される。センサーは熱電素子、スプレー口拡大、制冷、冷液浸漬などの方法により冷却することができる。一般的に言えば、センサーを7℃冷却させれば「暗い電流」のノイズを半分低減できる。したがって、センサーを4℃まで冷却させればこのようなノイズを室温レベルの1/10に低減できる。尚、検体を含む又は含まない液体をローライト包囲物の中に注入する時もセンサーを冷却できる。
【0047】
検体アレイ信号
メッシュプローブに付着している検体に対する光学検出は蛍光検出、化学発光検出、生物発光検出と量子スポット検出などの方法がある。マーカー又は信号分子はポリマーやメッシュプローブ又は標的混合物の中の検体に付着されており、放射性同位素、蛍光剤、化学発光剤、化学発光体、生物発光剤、酵素、抗体、磁気ビーズのような顆粒、と量子スポットがある。アミノ基のある短かいオリゴヌクレオチド上の蛍光染料はマーカーとして使われ、そのアミノ基はポリマーとリンクしている。検体検出用の信号分子には放射性同位素,蛍光染料例えばCy3、Cy5マーカー、Alexa Fluor 488、コロイド金、アゾ染料、キノリン染料、シアニン染料などのフルオレセイン、rodamine、テキサス赤、ローズベンガル、塩化ダンシル、エチジウムブロマイド、aminonapthalenes、ピレン、ポルフィリン、ルミノールや、dioxetanesや、acridiniumフェニル基エステルや、ルセニウム塩などの化学発光システム、発色団、および比色プローブ。
【0048】
マーカーはアゴニスト、敵対者、毒素、エピトープ、ホルモン、抗体、ペプチド、酵素、オリゴヌクレオチド、ペプチド核酸、植物性凝集素、炭水化物、タンパク質、およびドラッグを含み、例えばELISA検出用の酵素は蛍光検出に利用でき、また、蛍光にラベルされたアビジンやstreptavadinがある。
特定の検体に対して、多くのマーカーにより多くの検出方法を構成できる。例えば、メッシュレポーターのポリマーは多くの蛍光又は化学発光マーカーにリンクできる。このほか、メッシュレポーターは多くの標的スポットを結合できるため、メッシュプローブのポリマーは多くの標的スポット結合分子と多くの異なるマーカーにリンクできる。
【0049】
蛍光検出について、蛍光物の発光はアレイ又はCMOS センサー包囲物に近いLED 板より提供されるが、アレイ付近のアレイポイントとフォトダイオードとの間のナローバンドフィルターによりアレイの読取信号からエミットライトを除去することができ、放射光を選んで検出することが可能となる。
もう一つの方法は、化学発光を光学検出して検体信号を読取ることである。化学発光は化学反応により発生する光であり、フィルターなしのブロードバンドディテクターにより検出することができる。例えばCMOS 活性画素センサー、アレイスポットより発生する光は直接検出され、バックランド信号は主に「暗い電流」より来ている。メッシュレポーターはstreptavadinかanit-ジゴキシゲニン抗体と、化学発光タグにより形成される。例えばアルカリフォースフォターゼ又はホースラディシュ・ペルオキシダーゼ(HRP)は化学発光検出に用いられる。検出効率はある程度マーカーに対する選択性や特異性付着効率に依存する。ラベルは、酵素検出システムで認識できるビオチンかジゴキシゲニンのどちらかであってよいが、その後に化学発光反応して化学結合分裂からエネルギーを放出して離散的な波長の光子を発生する。
【0050】
メッシュレポーターの骨格にある信号分子又は染料分子の認識分子に対する数量比率は相当高い。3、4、5の場合もあり、通常は少なくとも6、7、8、9、又は少なくとも10、20、 30、40、50、60、70、80、90ひいては100である場合もあり、それぞれの組合せでメッシュレポーターを構成する。
本発明の中のアレイ信号検出はデジタルイメージセンサーを使ってもよく、電荷カップリング装置 (CCD)、光電倍増(PMT )又は雪崩光電ダイオードにより完成することもできる。検体の検出は例えば導電検出で違うアレイを完成してもよい。
【0051】
本発明のほかの形態はメッシュプローブの工業、環境、バイオ医学、バイオテクノロジー領域における応用に関わり、この発明のメッシュプローブは液体、気体又は固体形態の検体を分析、検出することに利用可能で、メッシュプローブはバイオセンサーと組み合わせて検体又は液相、非液相、気相の中の有機、無機或いは顆粒に対して検出することができる。
【0052】
センサーシステム
本発明のまたほかの目的は、読取ワークステーション、イメージセンサーの携帯式包囲物を含むバイオセンサーシステムを提供することにある。
図4に示すように、バイオセンサーシステムは、ローライト包囲物100の中にあるデジタルイメージセンサー600、データスループットの高い読取ワークステーション400と通用PC700を含む。読取ワークステーション400は少なくともCMOS デジタルイメージセンサー600のローライト包囲物100が挿入するソケットを備えており、センサー包囲物と読取ワークステーションとを電気接続と機械接続している。読取ワークステーションはユニバーサルシリアルバス(USB)454、並行パラレルポートインタフェースデバイス452又はイサネットインターフェース 456によりPCと接続している。
【0053】
図4に基づき、読取ワークステーション400の基盤にプログラム編集可能設備460がPC700と接続しており、デジタルイメージセンサー600とも接続している。スタートからエンドまでのフィールド、ライン、クロックマルスを含む画像信号を検出するして、同期的にデジタルイメージセンサーの検体データを読取る。プログラム編集可能設備460は画像データを、PC700よりデータ輸送の指令が来るまでに、イメージセンサー600よりローカルFIFD メモリーに輸送する。プログラム編集可能設備460 の代表的なサイクルは、PC700がセンサーに画像一つ輸出させる、画像を捕捉して読取ワークステーション400基板にあるローカルFIFDメモリに入力する、捕捉した画像をPC700に輸送するステップを含む。グラフィカルユーザーインターフェース(GUI)は、コンピュータユーザに画像キャプチャと表示サイクル、スナップショットモードまたは連続的な変化(生中継ビデオモード)を容易に実現させる。フィルタとイメージプロセッシングツールはユーザにローライト条件の下でセンサを操作させることができる。これらのツールは、センサ(イメージ、背景画像か「暗い」イメージを引き算するルーチン、および雑音を無視するルーチンを共同加えるソフトウェアルーチン)からの小さい信号を上げるためにイメージプロセッシングルーチンを含む。また、GUIはチップでのセンサ設定のユーザ支配力を与える。これで、ユーザはセンサの統合時間や、利得や、AD変換器などのチップに関するパラメタを調整できる。
【0054】
読取ワークステーションは、イメージセンサーとローライト包囲物をマッチングさせるコネクターを備えているが、目的はデジタルイメージセンサー検体センサーと読取ワークステーションを便利に分離させて、当該バイオセンサーシステムのスループットを増やし、デジタルイメージセンサー包囲物でローライト包囲物を構成することにある。このバイオセンサーシステムの挿入するたびに使える特徴により、使い捨てのデジタルイメージセンサー包囲物を使えることが可能となり、生物センサーの包囲物はほかのアレイに再利用することも可能となる。
【0055】
読取ワークステーションはUSBマイクロコンピューターポートを備え、マイクロソフト容量拡張ポート (ECP )インターフェースを備え、ソースポートを判断するためのユーザーコントロールスイッチを備えてもよい。読取ワークステーション基板はUSBケーブルから給電することができるが、ECPについては9Vの直流給電が必要とする。ハンドスイッチはバイオセンサー基板を再起動できる。プログラム編集可能設備も手動で再起動できる。
【0056】
本発明は時間積分により検体信号検出を増強する方法に関わり、標的物質の中の検体パラメータのデータスループットと測定はデジタルイメージセンサーがアレイ検出する時に発生する光の固有の信号対騒音比により決まる。信号対騒音比は検体信号を数秒以上の積分をすることにより向上することができる。積分の時間は通常10ms〜2分前後で30〜約1000ms、場合によっては50〜約600msであることもある。この時間は一系列のアレイ信号フィールド(画面)を保存することにより実現できるが、各フィールドも一定の時間帯の検体信号を積分することにより取得する。
【0057】
USB ポートはイメージセンサーとプログラム編集可能設備にメインクロックを提供する。イメージセンサーより輸出される画素データとパルスはコネクターを経由して基板へ輸送され、FIFDメモリに保存される。パルスは FIFO 指針に使われ、書込可能のFIFO 、FIFO に保存されている画素データについて左上の画素をゼロスタートとするように手配する。
【0058】
画像は一旦FIFDに保存されてから、二つのポートの内の一つから読取られる。図4に示すように、ECPはアレイ画像データが平行ポート(PP)452に読取られることを許容し、一回毎に一つの画素を読取る。PP452より逆方向のリクエストを出す度に読取る。プログラム編集可能設備460は452へのプログラム輸出を許容し、プログラム編集可能設備460がクロックを出す度に、PP452が一回応答し、PC700が1フィールドの画素読取を完了するまでにクロック応答が継続する。プログラム編集可能設備460はPP452でデータビット0と1でそれぞれI2CパスのSDAとSCLとする。
【0059】
また、FIFOの中の画像データはUポートより読取ることもできる。従来のUSB輸送に対して、データ輸送のバンドを高めることによりバイオセンサーの使用性を向上できるが、従来のUSB輸送において、FIFOより二つのデータパッケージを読取るにはその間に時間間隔がある。例えば、FIFOより63画素のデータを読取って従来のUSBポートのデータラインで輸送し、FIFDに二つのエンドを指定して二つのバッファー保存を作り、実際の実行では一つのバッファーはもう一つが満了した状況で読取ってUSBで輸送することができるため、普通のパスより100%の輸送バンドが増えている。一つ目のバッファーデータ輸送が完了しようとする前に、例えば1時間又は数時間のクロックパルスの前に、二つ目のバッファーは通用のパスで輸送開始し、二つ目のバッファーのデータ輸送が完了しようとする時に、一つ目のバッファーも同じ時間でデータをロードしたことになる。輸送しようとするデータが全部輸送完了するまで、前記ステップが繰り返されるため、従来のUSBより輸送速度が高まる。
【0060】
具体的な実施形態
次に、具体的な実施例に基づき、本発明を詳しく説明する。本発明は下記実施例に限るものではない。
本発明での説明は、同業者が変更、更改されており、本発明の宗旨と範囲を脱離していないことを認識できる。補足声明に定めている本発明の真の範囲内の変更、調整も本発明に含まれる。
【0061】
本願に引用される全てのファイル、プレス、契約、協議条項、特許は参考文献として挙げている。
【実施例1】
【0062】
直鎖状デキストラン(Sigma )をアミノ基のあるオリゴンウケルオチドに使用
直鎖状デキストラン(Sigma )をデイオン水に溶かし、1%の最終濃度にする。高圧殺菌して、室温、暗い環境にて、44mlのデキストラン溶液用に対して44μl、0.5M のヨウ素酸ナトリウムで酸化させ、振動させて一晩放置する。酸化された後のデキストランを3MのNaOAcと2倍容積のエタノールで2回沈殿、洗浄する。沈殿顆粒を空気で乾燥してから再び0.4ml、5mM、pH=7.2のリン酸ナトリウムバッファー溶液に溶かす。
【0063】
Eppendorff遠心チューブに1μlの酸化デキストラン7μl、10mMのNa2CO3溶液(pH 9.0)と2μlのオリゴンウケルオチド〔2μMの水溶液)を入れる。オリゴンウケルオチドの長さ25 - 45mer、合成する時に3’又は5’端にプリマリアミノ基を導入する。37℃の水に入れて一晩置く。そしてNaBH44室温で30分保温して、0.3MのNaOAcと2 倍容積のエタノールで沈殿させ、沈殿顆粒をTEで溶解させる。一部を取って1%アガロセゲルに入れて、EtBrで色付けする。遊離するオリゴンウケルオチドはスイミングして塩の前端に近づけていくが、デキストランとカップリングしたオリゴンウケルオチドは非常に遅いスピードでスイミングする。
【実施例2】
【0064】
高分子量分岐多糖、グリコーゲン(Sigma )とアミロペクチン(Sigma )をアミノ基のあるオリゴンウケルオチドのクロスリンクに使用。
これらポリマーの双水酸基はヨウ素酸ナトリウム(NaIO4)によりアルデヒド基に酸化される。0.4mlの1%の多糖水溶液にヨウ素酸ナトリウムを入れ、グリコーゲンとアミロペクチンの最終濃度をそれぞれ25mMと20mMにする。室温、暗い環境において振動、酸化させて一晩放置してから、0.3MのNaOAcと2倍容積のエタノールで2回沈殿させて、余分のNaIO4を除去する。沈殿物を空気で乾燥させてから再び0.4mlの5mM、pH=7.2のリン酸ナトリウムバッファー溶液に溶かす。アミノ基のあるオリゴンウケルオチドのカップリング及びその産物であるゲルの分析は実施例1のデキストランと同様である。
【実施例3】
【0065】
実施例2で製作されたメッシュポリマーのカップリング密度は、10個の葡萄糖単体が1個のオリゴンウケルオチドとカップリングし、平均として1個のグリコーゲン分子が約1000個のオリゴンウケルオチド分子とカップリングするものである。
【実施例4】
【0066】
信号分子 5’-ACTGCT-3' (BP001) の5’末端にアミノ基があり、3’末端に蛍光染料Cy5がある。末端にアミノ基のある認識プローブオリゴンウケルオチド分子AKH108(5'-CCGTGCAGATCTTAATGTGCCAGTAAAAG-3〉は同一多糖とクロスリンクし、 インフルエンザ遺伝子グループの中の番号3-フォスフォグリシレートキナセ遺伝子ピースの引物 5'-CCGTGCAGATCTTAATGTGC-3'と5'-GCGCTGTACCAAAGGCATC-3'が拡大したPCR産物と交配する。交配物はマイクロアレイの形でポリ(リセイン)を塗布したガラススライドにスポット塗りする。 クロスリンク反応とは、20nmolの酸化グリコーゲンと10mMのNa2CO3を入れたEppendorff遠心チューブに0.2nmolのAKH と2nmolの BP001を入れて、最終容積を10μlにして37℃で一晩放置する。
【0067】
Eppendorff遠心チューブに最終濃度が4mM になるようにNaBH4を入れて、室温で90分保温する。最終産物をエタノールで沈殿、遠心分離させたら、クロスリンクの産物と遊離のAKH108は小顆粒で遠心チューブの底に沈み、遊離のBP001は上の澄み通った部分に残す。それを捨てて、沈殿顆粒を10plの3XSSPE/0. 1% SDS/1.0 mg/ml BSAに溶解させて、マイクロアレイの表面に加える。更に室温で5時間交配させてから、10μlの新鮮な0.1XSSPE/0.1%SDSでガラススライドを3回洗浄して、レーザースキャナーで走査し、PCR産物のスポットパターンを観察する。
【実施例5】
【0068】
特異的にエンタロココスフェカリスよりのRecA 遺伝子と交配できる拡張的な産物オリゴンウケルオチド 5'-NH2-CCGATGCCTTAGTTTCAA-GTGGTGCGATTGACATCGTTGTCAT-3'は、グリコーゲンやアミロペクチンとのクロスリンクに利用される。多糖の酸化は実施例2と同様である。クロスリンク反応とは、20 nmolの酸化糖、2nmolのアミノ基のあるオリゴンウケルオチドと10mMのNa2CO3バッファー容積(pH9.0)と最終容積が10μlとなるように混合して、37℃で保温しながら一晩放置する。クロスリンク反応終了後、最終濃度が4mMのNaBH4を入れて引き続き室温で60分保温する。
【0069】
最終産物を0.3 MのNaOAc(酢酸ナトリウム)と2倍容積のエタノールで沈殿させてから、10 mMのNa2CO3 (pH 9.0)に溶かす。 一部のクロスリンクされたオリゴンウケルオチドをエポキシド処理されたガラススライドにスポットして、等量のオリゴンウケルオチドと酸化されていない多糖の混合物も同じガラススライドにスポットして比較させる。チップ上での交配とは、Alexa Fluor 546 (Molecular Probes Inc)Rec A PCR の産物を3xSSPE/0.1% SDS/1.0 mg/ml BSAの溶液に溶かしてからガラススライドの表面に加えて、室温で3時間交配させる。そして、0. lxSSPE/0. 1% SDSで洗浄してから、レーザースキャナーでガラススライドを走査する。グリコーゲンとクロスリンクしたオリゴンウケルオチドのスポット信号は酸化されていないグリコーゲンのスポットに対して5.86倍、アミロペクチンとクロスリンクしたオリゴンウケルオチドのスポット信号は酸化されていないアミロペクチンのスポットに対して5.63倍となっている。
【実施例6】
【0070】
CMOSイメージセンサーを使って直接チップ上で交配信号を検出
PB0330(Photobit)単色イメージセンサーの裸のモジュールはソケットにより姉妹板に接続され、接続線はエポキシ樹脂でシールして固定する。モジュールの表面を殺菌蒸留水で3回洗い流して、空気で乾燥させる。メタノールに溶かした〔3-グリシドシプロフィ〕トリメソシーシランをモジュールの表面に加えて、室温で10分保温し、更にメタノールで2回洗浄してから空気で乾燥させることにより、モジュールの表面を酸化させる。
【0071】
4種類のプローブ(100 pmol/ml in 50 mM NaC03バッファー溶液, pH 10.5) を2回ずつ手動でエポキシド処理されたモジュールの表面にスポットする。
スポットが乾燥してから、50mM Na2CO3(pH 10.5)に溶かしたエタノールアミネで速く1回洗って、そして同じ密閉液に室温で10分ほど育成する。そして殺菌蒸留水で表面を4回洗い流す。
【0072】
チップ上での交配は、モジュール表面を3xSSPE/50% formamide/1 mg/mlBSAで室温で20分保温してから20mlの3xSSPE/50%formamide/1 mg/ml BSAに溶かしたPCR産物〔末端に生物素とマーク、後で詳しく述べる)と交配する(この前にお湯で2分加熱してから急速に4℃まで冷却させる)。湿っぽいボックスの中に交配、一晩放置してから室温で、0. lxSSPEで4回洗浄する。洗浄時間は5分/1回とする。ストレプタビディン-アルカリフォースフォターゼで交配産物上の生物素を結合する。先ず、モジュールの表面をlmg/ml BSA を含むTBSで、室温で20分保温し、そしてAvidx-AP (Tropix)1:100で1 mg/ml BSAに希釈したTBSで室温で2 時間保温してから、更にTBSで室温で5分/1回に5回洗浄する。
【0073】
チップ上の交配信号を検出するが、モジュールの表面にTBSを備えた姉妹板を読取ワークステーションの光遮蔽包囲物のコネクターに挿入し、PCにインストールされている授権ソフトにより「暗い画像」(即ちバックランド画像、Idark)を読取る。姉妹板は読取ワークステーションに挿入されており、TBSは化学発光基質溶液に変換される。納入説明書に基づいて製作されたCDP-star増強剤Emerald II (Tropixより由来する)も含む。
【0074】
約0.1秒分積分されたイメージシールド(I )はセンサーより受信し、I-Iブラックピクチャは本当の信号写真とされる。ソフトには連続処理される写真を合体して一枚の画像として結果を表示するプログラムがあるため、積分の時間がより延長できる。
センサーのレジスターの設置としては、(レジスター53、43-46〕は増益を最大に設定、(レジスター9、10〉は積分時間を1秒/1シールド、(レジスター32、57)はアナログマイナスシフトを最大に設定、〔レジスター62〉は増益クラスを74に設定、その他のレジスターはデフォルト設定のままであることが望ましい。
【実施例7】
【0075】
TOTDA塗布でポリマー合成
Eppendorff チューブに8μlの5mMリン酸バッファー溶液(pH 7.2〉に溶解した1%酸化デキストラン-500、1mM 5’にアミノ基のあるオリゴンウケルオチド誘導体、2μlの0.2MのNa2BO3 (pH 9.0〉、 2μlの20mM のNaBH3CN、1μlの0.3mM のTOTDAと6μlの水を入れて、均一になるように混合して、4℃で保温しながら一晩放置する。そして、4μlの水と6μlのDMSOを入れてからマイクロドロッププレートに移動し、GeneMachine OmniGridAccent arrayerのチップの表面に印刷する。塗布されたクロスリンカーは捕獲分子の比率は10: 1〜 1: 1000でよい。
【実施例8】
【0076】
四鎖メッシュレポーター
Gの豊富なオリゴンウケルオチドTP (TGGACCAGACCAGCTATGGGGG AGCTGGGGAAGGTGGGAATGTGA)はグアニネス(下線付きG)の間のHoogsteenアルカリ基対により形成される四本鎖 G4-DNA構造を含む免疫球蛋白遺伝子の転換区から獲得できる。(Sen and Gilbert (1988) Nature 334:364-366, Sen and Gilbert (1990) Nature 344: 410-414に記載).切断されたTP、例えば,オリゴヌケルオチドQ3(5'-CACGTATGGGGGAGCTGGGGTAT-3')はG4-DNA 特殊核酸酵素のG4-DNAのマトリックスに利用される(Liu and Gilbert (1994) Cell 77: 1083-1092に記載)。ナトリウムとカリウムイオンが存在する条件で、四本鎖の構造は非常に安定的である。
【0077】
Eppendorff遠心チューブに25μlの2 mM HRP、0.3mM の濃度で5’の尾端にアミノ基一つ持っているQ 3オリゴ5μl、20mM濃度のNaCNBRH3 10μl、0.1mm濃度の抗生物素蛋白 5μl、1%の酸化デキストラン-500 40μlと水5μlを入れて、4℃で保温しながら一晩放置する。そしてBio-Gel P-50マトリックスであるスピンコーラムに通す。スピンコーラムを通して流出した一部のフラクションを集めて40%のグリセロール、200 mMの塩化ナトリウムと100mMの塩化カリウムのバッファー液で1:1で混合して、-20℃で保管する。このものは分子に生物素タグを含むサンプルを検出でき、感度を増強できる。直接的なHRPポリと比べて、現在の方法で取得するポリHRPは多くのメリットがある。HRPの間に多くの間隔があるが、このようなポリHRPの形成浮力の密度が小さいため、沈殿により検出対象の表面と粘着してしまうことがあまりなく、非特異結合によるノイズ信号を低減できる。また、適正な間隔により基板のダメージや拡散という減速の可能性を低減でき、発光信号の収集を減らすことができる。アルカリフォースフォターゼ又は蛍光染料はHRPの代わりにほかのメッシュレポーターとすることができる。
【0078】
デキストランの骨格の中のQ3オリゴは主に機械的な安定性を形成するものであり、機械切断による骨格損傷を軽減できる。周知の通り、Xイオンが存在する状況において、Gの豊富なオリゴンウケルオチドはHoosteenのアルカリベースペアリングにより安定な四級構造を構成できる(G4又はG四ポリマーと呼ぶ)。
Q3オリゴのデキストランにおける役割は、ある程度未満の物理的なリンク(又はリンクブリッジ)を提供して、ポリマーの骨格の中で自然な状況において分子内部にも分子間にも非共有の物理的なリンクを形成できる。
【0079】
勿論、アミノ基のあるQ3オリゴンウケルオチドは、例えばTOTDAの変わりに、メッシュプローブの製作にも利用できる。実施例8に述べたように、安定な、ポリマーの骨格の中の非共有の物理的リンクを形成でき、より良い機械安定性を実現できる。
【実施例9】
【0080】
Watson-Crickアルカリベースペアリングによるメッシュレポーターの安定化
ポリマーの骨格の非共有接合を構成するほかの方法もある。一例として、相互補完のオリゴンウケルオチドの間の特異アルカリベースペアリングをさせることが考えられる。3’端にアミノ基グループのある17merランダムシーケンスのオリゴンウケルオチドを合成でき、そして、その補完となるオリゴンウケルオチド(同じように3’端にアミノ基を持つ)を合成する。実施例8に記載のメッシュレポーターの準備プロセスのように、この二つのオリゴンウケルオチドを使ってQ3オリゴンウケルオチドを代替できる。
【実施例10】
【0081】
オリゴ交配による敏感ドロップ
直接的なプローブセンサーによる方法においてメッシュプローブとメッシュレポーターを共用する重要な理由の一つは、その感度を大きく改善できることにある。本実施例ではこの組合せシステムの感度を検証する。
実施例6に述べたように、二つの異なるオリゴンウケルオチドRHB105とNHY207は、それぞれ酸化デキストランとクロスリンクする。各メッシュプローブは2×2のマトリックスとしてCMOSセンサーに印刷され、合計7枚のチップが印刷される。印刷されたチップを湿度70%の小さい部屋に2時間乾燥させてから、80℃の真空炉の中でベーキングしながら一晩放置。そしてSolution I、Solution IIで順番に洗浄する。生物素化された相互補完のオリゴBCRHB101とBCNHY205の交配溶液を前記チップに加える。7枚のチップにつき、各チップ(又は交配反応)毎のBCRHB101数量は10-17ml、オリゴBCNHY205の数量は10倍減らして約10-16〜10-21mlの間とする。第7枚のチップは、BCNHY205が交配反応途中に除去される。交配が終わった後、0. IX SSPEでチップを完全に洗浄して、そして1%BSAのストラプタビディン-ポリHRPを含むTBSバッファー液の中に入れて1時間保温する。更にTBSでチップを数回洗い落とす。よって、発光するサブストレート(底物)はチップに加えられ、交配の結果はUSB読取ワークステーションを経由して直接パーソナルコンピューターのデスクトップに読取れる。
【0082】
多くのデータによりこのシステムの感度は500分子(遊離のものも、交配後の結合状態の化合物も含む総量をさす)であることが検証されている。BCNHY205がない場合、NHY205メッシュプローブの「スポット」に交配信号がない。このシステムの動態範囲を検証するために、NHY205よりの交配信号数量はRHB101の交配信号数量で割り算してから又は統一化してから、BCNHY205の濃度グラフを作成する。ダブルログプロットグラフでは、その直鎖状範囲から少なくとも4.5のログの数量級が見られる。
【実施例11】
【0083】
血清の中の遺伝子の無拡大検出
患者の血液10mlを取って遠心処理する。遠心チューブから血清の白い細胞層を取り出して3 mlの細かいガラスビーズと6mlのPBSバッファーを入れてある15mlの遠心チューブに入れる。そして、卓上式超音波粉粋機で1分間粉粋し、4回以上繰り返す。20μl溶胞粗産物を人間のCYP450遺伝子を含む捕獲プローブセンサーチップに加えて、1μlの末端に生物素タグを持っているとともに捕獲プローブと交配可能の報告プローブを入れる。2時間の交配をさせてから、厳しい条件において洗浄して、straptavidinと Poly-HRP(ポリ辣根ペルオキシダーゼ)を含むメッシュレポーターを入れて、室温で1時間育成する。そしてPBSバッファー液で数回洗浄し、化学発光基質(LMA-6,Lumigen)をチップの上に加える。交配の結果は携帯式USB読取装置によりノートパソコンまで輸送される。
【0084】
10μlの血液の中に一百二十万个白細胞が含まれている。ある特定のCYP450単倍体を検出するとすれば、前記プロセスによるサンプル回収率は70%と高く、20μlの溶胞粗産物にはチップ交配検出に利用できる10,000 CYP遺伝子コピーが入っている。このシステムは特異交配検出よりも感度が高いため、前に述べたようにターゲットシーケンスに対する拡大という手順を削除してもよい。
【実施例12】
【0085】
微生物病原体の無拡大検出
生きている細胞の中には、核糖体RNAは大いに存在する核酸である。一つの細胞の中に約10,000個も入っている。このようなRNAはシーケンスについて非常に保守的であるが、特異核酸交配により、異種シーケンスの差異により物種の鑑定を十分にできる。次は微生物病原体検出の一例である。
【0086】
例を挙げて大体の検出原理を説明する。沙眼衣原体溶液を10,000 cfu/mlに濃縮して準備しておく。EPチューブの中に0.3mlのCT 溶液と0.3mlの2%SDSを含むPBSバッファー液と0.3ml(容積)のガラスビーズを混合させる。そして、最高速度で渦撹拌器で回転して均一に混合させる。10μlの上清液に10μlの90%フォルマミドと6XSSPEを含む溶液を入れ、更に1μlの生物素指示プローブを入れて、ポリマー骨格によりリンクされた捕獲プローブ(メッシュプローブとして合体)を含む感受チップに移動して1時間交配させる。特定の交配条件において、生物素指示プローブも捕獲プローブも同時に同一の核糖体RNAに交配され、二者は近い。生物素指示プローブと捕獲プローブの長さは7〜45個の个オリゴンウケルオチド残基分とする。交配後のチップの処理プロセスは前記実施例と同様である。このような臨床検出は、ほかの捕獲プローブをチップに付着させて陽性、陰性の対照をする必要がある。
【0087】
ガラスビーズの渦による細胞溶菌の破裂率が約10%とすれば、いずれの指定核糖体RNAにつき、標的分子が各交配反応に出てくる数量は前に述べたように約150000個であることが算出できる。これは下限にすぎないが、なにも酵素による拡大のないシステムにとっては、この数値が十分に検出に利用できる。
この例では、メッシュプローブは透明の薄い層にスポットされてから0103光電センサーの表面上的感受チップに固定されるようになっている。 指示プローブと捕獲プローブは所定の交配条件において同一の核糖体とリンクする。しかも、同じ検出のもう一種類の病原体、例えば淋球菌の捕獲と指示プローブが必要であるかもしれない。
【0088】
最もよく見られる性的伝染病CT/NCの臨床検出する時、普通はコットンボールを膣に挿入してサンプルを取る。サンプリングしたコットンボールはPBSバッファー液で大半の細胞を洗い取って、改めて1mlのPBSに浮遊させる。CT/NCが陽性の患者は、このような方法で集める細胞は少なくとも10,000個/mlに達す。このように、前記検出方法は完全に適用できる。ここに掲示する原理は水や食品により伝播される病原体の無拡大検出にも応用できる。
【実施例13】
【0089】
スリップ(3.6×3.6mm)を1MのNaOH溶液に浸して2時間振動して、デイオン水で2回洗浄してから窒素吹き付けで乾燥させる。その表面は〔3-グリシドックスグリセロール〕トリメソックスシランで真空乾燥器に反応させ、真空乾燥器内に80℃で3時間ベーキングする。
AFP又はPSAの捕獲抗体を1×PBS/2mM NaBO3/5%aグリセロールバッファー液(pH 8.0)に溶かして、最終濃度が0.3mg/mlとする。各抗体を2×2のマトリックスとするスリップに印刷する。印刷してから、湿度70%の温室に2時間乾燥させて、4℃の真空乾燥器に保管する。
【0090】
スリップを1×PBS/1%エタノールアミン(pH 8.4)に30分浸して、バッファー液(1×TBS/5%グリセロール/0.1%BSA)で2回洗浄してから、密閉バッファー液(1×TBS/5%グリセロール/1%BSA)で密閉する。AFP(5ng/ml)とPSA(0.5ng/ml)を別々に又はいっしょにスリップに加えて、ロッキングプラットフォームの上で室温で1時間育成する。3回洗浄した後に、スリップ上にそれぞれ同じバッファー液で1:10,000に希釈(即ち10,000倍希釈)された生物素化されたAFP又は/及びPSA検出抗体(Tianjina Biotehnologies)を取得する。その後、スリップは1:12,000に希釈された密閉バッファー液とstreptavadin-HRPとでロッキングプラットフォームの上で30分育成してから5回洗浄する。
交配信号を検出する時、表面にTBSがあるスリップは直接CMOSセンサーのモジュールの表面に接続され、そしてセンサーを光遮蔽の包囲物の中の読取ワークステーションのコネクターに挿入する。PCに授権ソフトをインストールして、「暗い画像」を受信し、バックランドの信号を取得する。ECL化発光底物溶液でTBSを1分間代替すれば、センサーから信号画像を取得できる。
【特許請求の範囲】
【請求項1】
分子検出システムであって、
前記分子検出システムは一つの光学センサーと捕獲分子のアレイを含む、
前記捕獲分子のアレイはほかのポリマーチェーンと限定的なインターコネクトがあるポリマーとのクロスリンクにより光学センサーの表面と接続していることを特徴とした分子検出システム。
【請求項2】
請求項1に記載の分子検出システムであって、
前記捕獲分子のアレイはポリマーとのクロスリンクにより薄い透明固体または多孔質基板の表面に接続し、
前記ポリマーはほかのポリマーチェーンと限定的なインターコネクトがあり,
前記薄い透明固体は光学センサーの表面に固定されていることを特徴とした分子検出システム。
【請求項3】
請求項1又は請求項2に記載の分子検出システムであって、
前記ポリマーはナチュラルポリマーであることを特徴とした分子検出システム。
【請求項4】
請求項3に記載の分子検出システムであって、
前記ナチュラルポリマーは直鎖状または分岐多糖類であることを特徴とした分子検出システム。
【請求項5】
請求項4に記載の分子検出システムであって、
前記直鎖状多糖類はデキストランであることを特徴とした分子検出システム。
【請求項6】
請求項4に記載の分子検出システムであって、
前記分岐多糖類はグリコーゲンやアミロペクチンであることを特徴とした分子検出システム。
【請求項7】
請求項3に記載の分子検出システムであって、
前記ポリマーは分岐DNAであることを特徴とした分子検出システム。
【請求項8】
請求項3に記載の分子検出システムであって、
前記ポリマーはヒドロゲルであることを特徴とした分子検出システム。
【請求項9】
請求項1に記載の分子検出システムであって、
前記捕獲分子は生物分子であるいことを特徴とした分子検出システム。
【請求項10】
請求項9に記載の分子検出システムであって、
前記生物分子は 蛋白質であることを特徴とした分子検出システム。
【請求項11】
請求項9に記載の分子検出システムであって、
前記生物分子はRNAの構造を持つDNAであることを特徴とした分子検出システム。
【請求項12】
請求項1に記載の分子検出システムであって、
前記捕獲分子はPNA又はLNAであることを特徴とした分子検出システム。
【請求項13】
請求項1に記載の分子検出システムであって、
前記ポリマーは合成ポリマーであることを特徴とした分子検出システム。
【請求項14】
請求項13に記載の分子検出システムであって、
前記合成ポリマーはポリ(メチルビニルエーテルのalt -無水マレイン酸)であることを特徴とした分子検出システム。
【請求項15】
請求項1に記載の分子検出システムであって、
前記ポリマーチェーン間の結合は共有接合又は非共有接合と双方向機能のクロスリンカーによるクロスリンクからなることを特徴とした分子検出システム。
【請求項16】
請求項15に記載の分子検出システムであって、
前記双方向機能のクロスリンカーは4,7,10トリオ-1,13-トリデキャンジアミンであることを特徴とした分子検出システム。
【請求項17】
請求項1に記載の分子検出システムであって、
前記結合は非共有結合であることを特徴とした分子検出システム。
【請求項18】
請求項17に記載の分子検出システムであって、
非共有結合はポリマーにクロスリンクしているGの豊富なオリゴヌクレオチドの間でHoogsteenのベーススペアリングすることにより形成する四本鎖DNAまたはRNAの構造であることを特徴とした分子検出システム。
【請求項19】
請求項18に記載の分子検出システムであって、
Gの豊富なオリゴヌクレオチドは末端にポリマーまでクロスリンクできる官能基があるQ3誘導体であることを特徴とした分子検出システム。
【請求項20】
前記分子検出システムに使われるポリマーの製作方法であって、
a)ヨウ素酸ナトリウムと多糖が反応して、多数のアルデヒド基を持つ直鎖状又は分岐ポリマーを生成し、
b )反応性アミノ基がある又はアミノ基を誘導できる分子を入れ、
c ) NaCNBrBH3が存在する条件でカップリング反応を実現するステップを備え、
前記ポリマーチェーンの間に限定的なインターコネクトがあることを特徴としたポリマーの製作方法。
【請求項21】
請求20に記載の分子検出システムに使われるポリマーの製作方法であって、
報告分子の信号分子と少なく一つの認識分子は共に製作されたポリマーとクロスリンクしていることを特徴としたポリマーの製作方法。
【請求項22】
請求21に記載の分子検出システムに使われるポリマーの製作方法であって、
前記報告物の信号分子はホースラディシュ・ペルオキシダーゼ(HRP)又はアルカリフォースフォターゼで、認識分子はstreptavidinであることを特徴としたポリマーの製作方法。
【請求項23】
検体を検出する方法であって、
a )請求1に記載の分子のアレイは検体と接触し、
b )分子のアレイは請求21に記載の報告分子と接触し、
c )このアレイに化学発光基質を入れ、
d )外部のスキャナーを使わずに直接光学センサーからデーターを読み取るステップを含むことを特徴とした検体検出方法。
【請求項24】
請求23に記載の検体検出方法であって、
前記検体は核酸であるとともに、検体サンプルはしずれの酵素により増幅されていないことを特徴とした検体検出方法。
【請求項25】
光学センサーの上の検体を検出する捕獲分子のアレイであって、
前記捕獲分子のアレイはほかのポリマーチェーンと限定的なインターコネクトがあるポリマーとのクロスリンクにより薄い透明固体又は多孔質基板の表面に接続しており、前記薄い透明固体は光学センサーの表面に固定されていることを特徴としたアレイ。
【請求項1】
分子検出システムであって、
前記分子検出システムは一つの光学センサーと捕獲分子のアレイを含む、
前記捕獲分子のアレイはほかのポリマーチェーンと限定的なインターコネクトがあるポリマーとのクロスリンクにより光学センサーの表面と接続していることを特徴とした分子検出システム。
【請求項2】
請求項1に記載の分子検出システムであって、
前記捕獲分子のアレイはポリマーとのクロスリンクにより薄い透明固体または多孔質基板の表面に接続し、
前記ポリマーはほかのポリマーチェーンと限定的なインターコネクトがあり,
前記薄い透明固体は光学センサーの表面に固定されていることを特徴とした分子検出システム。
【請求項3】
請求項1又は請求項2に記載の分子検出システムであって、
前記ポリマーはナチュラルポリマーであることを特徴とした分子検出システム。
【請求項4】
請求項3に記載の分子検出システムであって、
前記ナチュラルポリマーは直鎖状または分岐多糖類であることを特徴とした分子検出システム。
【請求項5】
請求項4に記載の分子検出システムであって、
前記直鎖状多糖類はデキストランであることを特徴とした分子検出システム。
【請求項6】
請求項4に記載の分子検出システムであって、
前記分岐多糖類はグリコーゲンやアミロペクチンであることを特徴とした分子検出システム。
【請求項7】
請求項3に記載の分子検出システムであって、
前記ポリマーは分岐DNAであることを特徴とした分子検出システム。
【請求項8】
請求項3に記載の分子検出システムであって、
前記ポリマーはヒドロゲルであることを特徴とした分子検出システム。
【請求項9】
請求項1に記載の分子検出システムであって、
前記捕獲分子は生物分子であるいことを特徴とした分子検出システム。
【請求項10】
請求項9に記載の分子検出システムであって、
前記生物分子は 蛋白質であることを特徴とした分子検出システム。
【請求項11】
請求項9に記載の分子検出システムであって、
前記生物分子はRNAの構造を持つDNAであることを特徴とした分子検出システム。
【請求項12】
請求項1に記載の分子検出システムであって、
前記捕獲分子はPNA又はLNAであることを特徴とした分子検出システム。
【請求項13】
請求項1に記載の分子検出システムであって、
前記ポリマーは合成ポリマーであることを特徴とした分子検出システム。
【請求項14】
請求項13に記載の分子検出システムであって、
前記合成ポリマーはポリ(メチルビニルエーテルのalt -無水マレイン酸)であることを特徴とした分子検出システム。
【請求項15】
請求項1に記載の分子検出システムであって、
前記ポリマーチェーン間の結合は共有接合又は非共有接合と双方向機能のクロスリンカーによるクロスリンクからなることを特徴とした分子検出システム。
【請求項16】
請求項15に記載の分子検出システムであって、
前記双方向機能のクロスリンカーは4,7,10トリオ-1,13-トリデキャンジアミンであることを特徴とした分子検出システム。
【請求項17】
請求項1に記載の分子検出システムであって、
前記結合は非共有結合であることを特徴とした分子検出システム。
【請求項18】
請求項17に記載の分子検出システムであって、
非共有結合はポリマーにクロスリンクしているGの豊富なオリゴヌクレオチドの間でHoogsteenのベーススペアリングすることにより形成する四本鎖DNAまたはRNAの構造であることを特徴とした分子検出システム。
【請求項19】
請求項18に記載の分子検出システムであって、
Gの豊富なオリゴヌクレオチドは末端にポリマーまでクロスリンクできる官能基があるQ3誘導体であることを特徴とした分子検出システム。
【請求項20】
前記分子検出システムに使われるポリマーの製作方法であって、
a)ヨウ素酸ナトリウムと多糖が反応して、多数のアルデヒド基を持つ直鎖状又は分岐ポリマーを生成し、
b )反応性アミノ基がある又はアミノ基を誘導できる分子を入れ、
c ) NaCNBrBH3が存在する条件でカップリング反応を実現するステップを備え、
前記ポリマーチェーンの間に限定的なインターコネクトがあることを特徴としたポリマーの製作方法。
【請求項21】
請求20に記載の分子検出システムに使われるポリマーの製作方法であって、
報告分子の信号分子と少なく一つの認識分子は共に製作されたポリマーとクロスリンクしていることを特徴としたポリマーの製作方法。
【請求項22】
請求21に記載の分子検出システムに使われるポリマーの製作方法であって、
前記報告物の信号分子はホースラディシュ・ペルオキシダーゼ(HRP)又はアルカリフォースフォターゼで、認識分子はstreptavidinであることを特徴としたポリマーの製作方法。
【請求項23】
検体を検出する方法であって、
a )請求1に記載の分子のアレイは検体と接触し、
b )分子のアレイは請求21に記載の報告分子と接触し、
c )このアレイに化学発光基質を入れ、
d )外部のスキャナーを使わずに直接光学センサーからデーターを読み取るステップを含むことを特徴とした検体検出方法。
【請求項24】
請求23に記載の検体検出方法であって、
前記検体は核酸であるとともに、検体サンプルはしずれの酵素により増幅されていないことを特徴とした検体検出方法。
【請求項25】
光学センサーの上の検体を検出する捕獲分子のアレイであって、
前記捕獲分子のアレイはほかのポリマーチェーンと限定的なインターコネクトがあるポリマーとのクロスリンクにより薄い透明固体又は多孔質基板の表面に接続しており、前記薄い透明固体は光学センサーの表面に固定されていることを特徴としたアレイ。
【図1】


【図2】


【図3】


【図4】


【図5a】


【図5b】


【図5c】




【図2】


【図3】


【図4】


【図5a】


【図5b】


【図5c】


【公表番号】特表2011−520111(P2011−520111A)
【公表日】平成23年7月14日(2011.7.14)
【国際特許分類】
【出願番号】特願2011−507777(P2011−507777)
【出願日】平成21年5月11日(2009.5.11)
【国際出願番号】PCT/CN2009/000507
【国際公開番号】WO2009/135388
【国際公開日】平成21年11月12日(2009.11.12)
【出願人】(510296041)
【氏名又は名称原語表記】LIU,ZHIPING
【出願人】(510296052)
【氏名又は名称原語表記】LUAN,SHENG
【Fターム(参考)】
【公表日】平成23年7月14日(2011.7.14)
【国際特許分類】
【出願日】平成21年5月11日(2009.5.11)
【国際出願番号】PCT/CN2009/000507
【国際公開番号】WO2009/135388
【国際公開日】平成21年11月12日(2009.11.12)
【出願人】(510296041)

【氏名又は名称原語表記】LIU,ZHIPING
【出願人】(510296052)

【氏名又は名称原語表記】LUAN,SHENG
【Fターム(参考)】
[ Back to top ]

