分析チップ
【課題】本発明は、分析チップを水平方向に回転させることで微粒子を移動させて、被検物質が含まれた溶液を撹拌する際に、水平面の僅かな傾きによって撹拌のむらが起きないようにする手段を提供する。
【解決手段】表面に選択結合性物質が固定化された担体と、選択結合性物質と反応する被検物質を含む溶液を保持するための容器と、該担体と該容器によって形成される空隙に微粒子が充填されており、該微粒子の充填率が30〜60%であることを特徴とする分析チップ。
【解決手段】表面に選択結合性物質が固定化された担体と、選択結合性物質と反応する被検物質を含む溶液を保持するための容器と、該担体と該容器によって形成される空隙に微粒子が充填されており、該微粒子の充填率が30〜60%であることを特徴とする分析チップ。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、被検物質と選択的に結合する物質(本明細書において「選択結合性物質」)が固定化された担体と、被検物質を含む溶液を保持する容器と、該担体と該容器によって形成される空隙に充填された微粒子からなり、被検物質と選択結合性物質を結合させることで被検物質を分析するための分析チップに関する。
【背景技術】
【0002】
近年、多数の遺伝子発現を一度に解析する手法として、DNAチップ法(DNAマイククロアレイ法)と呼ばれる新しい分析法が開発され、注目を集めている。DNAチップは、数百〜数万という多数の遺伝子発現を同時に測定するための小型装置であり、ガラス、シリコンなどの基材の基板上にDNAなどの分子を高密度に配置したものである。DNAチップを使用することによって、各種疾患動物モデルや細胞生物学現象における体系的かつ網羅的な遺伝子発現解析を行うことができる。具体的には、遺伝子の機能、すなわち遺伝子がコードするタンパク質を明らかにするとともに、タンパク質が発現する時期や作用する場所を特定することが可能になる。生物の細胞又は組織レベルでの遺伝子発現の変動をDNAチップによって解析し、生理学的、細胞生物学的、生化学的事象データと組み合わせて遺伝子発現プロファイルデータベースを構築することによって、疾患遺伝子、治療関連遺伝子の検索や治療方法の探索が可能になると思われる。
【0003】
現在、DNAチップの作製は、主に2つの基本的な方法、すなわちGeneChip法及びcDNAマイクロアレイ法が採用されている。
【0004】
GeneChip法はAffymetrix社によって開発された方法で、フォトリソグラフ法によりガラス板上で25マー(mer)程度のオリゴDNAを合成し、1つの遺伝子あたり、塩基配列データから16カ所から20カ所の25マーを設定し、25マーの完全一致と13塩基目を意図的に違えた1塩基ミスマッチのオリゴマーセットを組にしてプローブDNAとする。この方法は、プローブDNAの長さが一定であり、配列が既知なため、ハイブリダイゼーションの強さに影響をあたえるGC含量を一定にすることができるので、発現量の定量的解析には理想的なアレイと考えられている。
【0005】
一方、cDNAマイクロアレイ法は、Stanford大学によって開発された方法で、キャピラリー状のペンによるスポッティング方式や、インクジェット方式などの手法により、ガラス板にDNAを固定するものである。いずれの方法も、あらかじめ蛍光標識した測定する試料(遺伝子)を、DNAチップ上のプローブとハイブリダイゼーションにより結合させ、スキャナーを用いてその蛍光強度を測定することにより、遺伝子の発現を測定するものである。
【0006】
現在、DNAチップは、チップ上に数万から数千種類の多数の遺伝子を載せ、一度に大量の遺伝子の発現を調べる研究用として用いられていることが多い。また今後、診断用途でのDNAチップが使用されることが期待されている。しかし、診断で使用する場合、一般的に採取できる検体の量が非常に少ないものと予想される。さらに現状、発現量の低い遺伝子についてはハイブリダイゼーション後の蛍光強度が非常に微弱であり、このような遺伝子は実質上解析できないという問題点を有している。従って、検体が少ない場合や発現量の少ない遺伝子でも、ハイブリダイゼーション後の蛍光の強度をいかに大きくするかということが課題であり、この課題を解決するためには検体中の被験物質であるDNAとプローブDNAとをいかに効率よく反応させるかがポイントとなる。効率よくDNAとプローブを反応させる方法としては、被験物質を含む溶液を攪拌することで、効率よくプローブDNAと被験物質との反応を促進することが考えられている。
【0007】
被検物質を含む検体溶液を攪拌する例として、特許文献1には、分析チップを用いた微粒子又は気泡を混合した検体溶液を、被検物質と反応する選択結合性物質を固定化させた担体に接触させ、微粒子又は気泡を移動させることにより検体溶液を攪拌して、被検物質との反応効率を高める方法が開示されている。
【先行技術文献】
【特許文献】
【0008】
【特許文献1】国際公開第2005/090997号
【発明の概要】
【発明が解決しようとする課題】
【0009】
被験物質を含む溶液を均一に撹拌するためには、溶液中の微粒子を、片寄りなく移動させることが必要である。しかし、溶液中の微粒子を分析チップの置かれた水平面上において回転運動等によって移動させる場合、分析チップを完全な水平面に設置することは現実には困難を伴い、水平器を用いたとしても、多少の傾斜が生じてしまうことは避け難い。しかしながら、この傾斜が生じると、微粒子は常に重力方向に沿って移動し、分析チップ中で片寄って存在することになる。この状態で分析チップを回転等させて微粒子を移動させると、傾斜方向への重力の影響を受け、溶液の撹拌のムラが起きてしまうという問題があった。
【0010】
本発明は、上記課題を解決するためのもので、分析チップの設置が水平面から多少ずれて傾斜している場合であっても、被験物質を含む溶液をムラなく撹拌することができ、正確な分析を可能にする分析チップを提供することを目的とする。
【課題を解決するための手段】
【0011】
上記課題に鑑みて、本発明者らは鋭意検討した結果、分析チップの空隙内に充填する微粒子の充填率を30〜60%とすることで上記課題を解決できることを見出し、本発明を完成させた。
【0012】
すなわち、本発明は以下の(1)〜(4)で構成される。
(1)表面に選択結合性物質が固定化された担体と、選択結合性物質と反応する被検物質を含む溶液を保持するための容器と、該担体と該容器によって形成される空隙に充填された微粒子からなり、該微粒子の充填率が30%以上60%以下であることを特徴とする分析チップ。
(2)微粒子の密度が2g/cm3以上7g/cm3以下である、上記(1)に記載の分析チップ。
(3)微粒子の材質がジルコニアである、上記(1)又は(2)に記載の分析チップ。
(4)担体と容器とがシーリング部材を介して接触している、上記(1)〜(3)のいずれか1項に記載の分析チップ。
【発明の効果】
【0013】
本発明の分析チップによれば、回転運動等によって分析チップ中の微粒子を移動させて被験物質を含む溶液(以下「検体溶液」ということがある。)を撹拌する際に、分析チップの設置方向が水平方向より傾いている場合であっても、検体溶液をムラなく撹拌することができる。つまり、分析チップが厳密に水平に設置されていなくても、検体溶液をムラなく撹拌することができる。その結果、分析チップでの選択結合性物質と被検物質の反応をムラなく均一に促進することが可能となり、高感度で、高い精度の分析が可能となる。
【図面の簡単な説明】
【0014】
【図1】図1は、本発明の分析チップの一例を概略的に示す斜視図(A)と破線Aに沿った断面図(B)である。
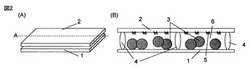
【図2】図2は、本発明の分析チップの一例を概略的に示す斜視図(A)と破線Aに沿った断面図(B)である。
【図3】図3は、本発明の分析チップの一例を概略的に示す斜視図(A)と破線Aに沿った断面図(B)である。
【図4】図4は、本発明の分析チップの担体の一例を概略的に示す斜視図である。
【図5】図5は、本発明の分析チップの一例を概略的に示す斜視図(A)と破線Aに沿った断面図(B)である。
【図6】図6は、実施例及び比較例で用いた担体を概略的に示す斜視図である。
【図7】図7は、実施例及び比較例で用いた溶液を保持する容器を概略的に示す斜視図(A)と破線Aに沿った断面図(B)である。
【図8】図8は、実施例及び比較例で用いた両面テープを上方から見た外観図である。
【図9】図9は、本発明の分析チップの一例を概略的に示す斜視図(A)と破線Aに沿った断面図(B)である。
【図10】図10は、本発明の選択結合性物質が固定化された担体を概略的に示す斜視図である。
【図11】図11は、図3に示す分析チップの溶液を保持する容器における1つのウェル構造を上方から見た平面図である。
【発明を実施するための形態】
【0015】
本発明は、表面に選択結合性物質が固定化された担体と、選択結合性物質と反応する被検物質を含む溶液を保持するための容器と、該担体と該容器によって形成される空隙に充填された微粒子からなる分析チップであって、該微粒子の充填率が30%以上60%以下であることを特徴とする。本発明の分析チップは、検体溶液、すわなち被検物質を含む溶液を当該チップにアプライし、被検物質の存在の有無や、被検物質の量や、被験物質の性状等を測定するために用いるチップである。具体的には、担体表面に固定化された選択結合性物質と被検物質との反応により、被検物質の量や、被検物質の有無を調べるバイオチップが挙げられる。より具体的には、核酸を担体表面に固定化したDNAチップ、抗体に代表されるタンパク質を担体表面に固定化したタンパク質チップ、糖鎖を担体表面に固定化した糖鎖チップ、及び担体表面に細胞を固定化した細胞チップ等が挙げられる。
【0016】
本発明の分析チップの担体は、その表面に選択結合性物質が固定化される表面を有する基材であり、被検物質を含む溶液を接触させることで、選択結合性物質固定化表面で選択結合性物質と被検物質とを反応させる。担体の形状は、平坦な板状の基材であってもよく、板状基材にウェル構造や凹凸構造がある基材であっても良い。平坦な板状の基材の例としては、スライドガラスやカバーガラスなどがある。また、ウェル形状を有する基材としては、市販品として入手可能なマイクロプレートのように、複数のウェルが配列された基材を用いることができ、この場合のウェルは後述する検体溶液を保持する空隙として利用することができる。
【0017】
本発明の分析チップの容器は、担体と組み合わせて、選択結合性物質が固定化された担体表面を覆い、被検物質を含む溶液を保持する空隙を形成する基材である。被検物質を含む溶液を保持するために、担体と容器とは互いに接着されうる形状を選択することができる。
【0018】
本発明の分析チップは、担体と容器によって形成される空隙に微粒子が充填される。微粒子は、空隙で保持される検体溶液を撹拌するための撹拌子の役目をなす。
【0019】
微粒子の形状は、溶液を攪拌することができる形状であれば球状、多角形、円筒形などの任意の形状をとることができるが検体溶液中で滞ることなくスムーズに移動でき、結果的に撹拌が良好に行えるので、球状が好ましい。微粒子のサイズは、担体や容器の形状、空隙の形状や体積に応じて攪拌の効果が得られる適切なサイズを選択することができる。例えば球状の微粒子の場合、平均粒径が0.2mm〜0.5mmの範囲の微粒子を用いることが好ましい。
【0020】
微粒子の材質は、検体溶液中に微粒子成分が溶出して分析に影響を及ぼさないものであれば特に限定されず、ガラス、石英、セラミック、金属(例えば金、白金、ステンレス)、プラスチック(例えばナイロンやポリスチレン)等を用いることができる。特に微粒子の材質としては、撹拌効率の点から比重が大きいことが好ましく、容易に入手可能であると言うことから、比重が2〜7g/cm3であるジルコニア系セラミック製(例えばイットリウム部分安定化ジルコニア製)の微粒子を好ましく用いることができる。
【0021】
本発明の分析チップへの微粒子の充填率は、担体と容器によって形成される空隙に対して30%〜60%である。ここでいう充填率は、空隙内において担体上の選択結合性物質の固定化面に対向する容器の表面上に微粒子を一層に並べたときに、全微粒子の該容器表面への垂直投影面の総面積が該容器において微粒子が移動可能な表面の表面積に対して占める割合(%)を示す。具体的には、微粒子の充填率は、分析チップに微粒子を充填後に分析チップを傾けるなどして微粒子一層で整列させて垂直投影面の総面積を算出することができる。微粒子が球状の場合は、その平均粒径から求められる微粒子1個が占める投影面(円)の面積と、微粒子の密度と重量から充填される微粒子数とを求めることで、充填率を算出することも可能である。例えば、後述する図3に示す分析チップの場合、1ウェルに注目すると、溶液を保持する容器1の上に一層に微粒子を並べ、上方から二次元的に見た時の像は図11に示すようになる。この場合、微粒子が占める面積は、微粒子径を直径とする円の面積に微粒子数を乗じた値となり、これを、微粒子が移動可能な表面13であるウェル底面の面積で除した値が微粒子の充填率ということになる。
【0022】
本発明の分析チップは、担体と容器とを組み合わせて空隙を形成するが、担体と容器との接合部はシーリング部材を介して、接着又は密着固定されてもよい。ここで用いるシーリング部材は、担体と容器とを接着又は密着固定できる部材であって、接着部材やO−リングなどの密着固定部材を用いることができる。担体と容器とをシーリング部材を介して、接着又は密着固定する場合、該空隙は担体、容器、シーリング部材に囲まれる形態で形成されてもよい。
【0023】
シーリング部材の厚みを調整することで、担体及び容器の形状に合わせて、空隙の高さを調整することができる。被験物質を含む溶液の液量などを考慮すると、好ましい空隙の高さは0.3mm〜1.2mmとすることができる。
【0024】
容器は、担体に脱離可能に接着されていても、担体に脱離不可能に接着されていてもよい。容器が担体に脱離可能に接着されている場合は、被検物質とのハイブリダイゼーション反応を行った後、分析チップを解体して容器を脱離させ、担体のみをスキャナーにセットして蛍光等のシグナル強度を測定することができる。担体と容器とを脱離可能に接着する場合の接着部材としては、担体が損傷されることなく脱離することが可能である態様が好ましく、両面テープ(例えば、日東電工株式会社製の製品番号No.535A、住友スリーエム株式会社製の製品番号9415PC及び4591HL、株式会社寺岡製作所製の製品番号No.7691等)、樹脂組成物(例えば、アクリル系ポリマー、シリコーン系ポリマー(シリコーン系のエラストマー等)、これらの混合物等)の接着部材を用いることができる。
【0025】
次に、分析チップの形態について更に詳細に説明する。もっとも、本発明は下記形態に限定されるものではない。
【0026】
図1に示す分析チップは、平坦な板状の担体2と、平坦な板状の溶液を保持する容器1からなり、これらの担体及び溶液を保持する容器とシーリング部材4とで形成される空隙6に微粒子3が充填されている。選択結合性物質5は、担体2の表面(選択結合性物質固定化領域)に固定化されている。
【0027】
図2に示す分析チップは、平坦な板状の担体2と、平坦な板状の溶液を保持する容器1からなり、担体2が空隙6を覆うように配置され、担体1の選択結合性物質5の固定化面が鉛直下向きである。また、図2に示す分析チップは、担体2と容器1とシーリング部材4とで囲まれた空隙6が、一つの分析チップにおいて複数に区画されて、担体2上に複数の選択結合性物質固定化領域が存在しており、それぞれの空隙に、同一又は異なる被験物質溶液をアプライして同時に使用することができる。一つの分析チップにおいて区画された複数の各空隙に存在する選択結合性物質固定化領域10は、該空隙のレイアウトに合わせた任意のレイアウトとすることができる。例えば、選択結合性物質固定化領域の個数は、固定化する選択結合性物質の種類に応じて、4〜24個であれば使い勝手がよく、好ましく用いられる。図10に、選択結合性物質固定化領域10の個数が10個の例を示す。この場合、シーリング部材は、各固定化領域(空隙)の仕切りの役目をなし、各領域を別個に囲む形態でもよいし、複数の領域又は全部の領域を囲む形態であってもよい。
【0028】
図9に示す分析チップは、図2に示す分析チップと同様に、平坦な板状の担体2が空隙6を覆うように配置され、選択結合性物質5の固定化面が鉛直下向きであるが、溶液を保持する容器1がウェル構造を備えることを特徴とする。そして、溶液を保持する容器1の複数のウェル構造を有することにより、容器1と担体2とシーリング部材4とで囲まれた空隙6が複数に区画されて、複数の選択結合性物質固定化領域が存在する。
【0029】
図3に示す分析チップは、図9に示す分析チップと同様に、溶液を保持する容器1がウェル構造を備え、担体2が空隙6を覆うように配置され、選択結合性物質5の固定化面が鉛直下向きである分析チップであるが、担体2が凹凸構造を有することを特徴とする。選択結合性物質5は、担体2の凸構造の上端面に固定化され、凸構造とウェルを1対1で対応させる形態とすることができる。容器1の各ウェル構造と担体2とにより各空隙を閉空間とすることができるので、シーリング部材4は用いなくてもよいが、シーリング部材を用いる方が被験物質溶液の蒸発を確実に抑制することができる。担体の凸部構造は、一つの担体に1個又は複数個設けることが可能であるが、複数個配置されているほうが、一工程で複数の被験物質を扱うことが可能であるので好ましい。一つの担体に配置される凸部構造の数は、組み合わせる容器の構造に合わせて任意の位置に設けることができる。例えば、後述する被検物質類の保存や試薬を用いた化学処理時の処理容器として良く使われる入手が容易な市販品であるマイクロプレート(例えば384穴や96穴タイプ)の構造に合わせて配置することが好ましい。
【0030】
図3に示す分析チップにおいて、担体2として、担体がベース担体7と凸部構造部材8から構成され、ベース担体7に対して任意の数の凸部構造部材8を所望のレイアウトで組み合わせて設置するタイプである、図4に示す担体を用いることができる。凸部構造部材8の表面には、選択結合性物質5が固定化されている。ベース担体には、凸部構造部材8を一つ一つ設置可能な構造を備える。図4に示す担体を用いれば、一つの凸部構造部材に予期せぬ不良が発生した場合でも、その対象の凸部構造部材のみを交換するだけで他の凸部構造部材を生かすことができる。また、凸部構造部材をベース担体の全面又は任意の一部分にのみ組み込むことも可能であるため、凸部構造部材の数を被験物質の数に合わせた担体を提供することが可能となる。
【0031】
図5に示す分析チップは、図2に示す分析チップと同様に、平坦な板状の担体が空隙6を覆うように配置され、選択結合性物質5の固定化面が鉛直下向きであるが、溶液を保持する容器1に被験物質溶液をアプライするための空隙に連通する貫通孔11を有することを特徴とする。貫通孔を有する容器を用いると、予め担体2と容器1とをシーリング部材4を介して接着し、貫通孔11から空隙6に微粒子を充填しておくことができる。分析チップに予め微粒子を充填しておくことで、使用者は、調製した被験物質溶液をアプライするのみであり、操作工程が少ないという点で優れている。貫通孔は、1つの空隙に対して複数有することが、検体溶液のアプライが容易となるので好ましい。溶液を保持する容器が複数の貫通孔を有する場合、それらの孔径は同一でも異なっていてもよいが、検体溶液のアプライ口をその他の貫通孔をより広い孔径とすることが好ましい。貫通孔11は、その少なくとも1つが、その径を変化させて、上端に径の広い部分、いわゆる液面駐止用チャンバー12を備えるものとしてもよい。液面駐止用チャンバーを備えることにより、貫通孔11からアプライされ空隙6に充填された検体溶液の液面の上昇を抑え、貫通孔を封止部材で封止する際の封止を容易かつ確実に行うことが可能となるとともに、検体溶液の中に多数の気泡が入ったり、検体溶液の流出を防ぐことができるので好ましい。
【0032】
図1、図2に示す分析チップへの被験物質溶液のアプライは、以下の方法で行うことができる。例えば、担体表面の選択結合性物質固定化領域を囲むようにO−リングを設置する。その後、O−リングの内側に被験物質溶液をアプライし、続いて微粒子を添加する。確実に被験物質溶液、微粒子が保持されていることを確認した後、上から溶液を保持する容器を被せ、上下をクリップ等で挟みこむことで密閉する。
【0033】
図3に示すウェル構造の分析チップの場合、被験物質溶液をウェルにアプライし、その後、微粒子を添加し、その上から、選択結合性物質が固定化された担体を固定化面を下向きに被せることで、被験物質溶液をアプライすることができる。また、予めウェル内に微粒子を充填しておくことが可能であり、この場合は前述した図5の分析チップの場合と同様に、使用者は、被験物質溶液をアプライするだけという形態とすることも可能である。この場合、担体と溶液を保持する容器とをO−リングを介して密閉することは、被験物質溶液の蒸発を抑制できるため好ましい。
【0034】
本発明の分析チップは、空隙に充填された微粒子を移動させることで検体溶液を撹拌することができる。具体的には、分析チップは水平又は略水平な面(重力方向に垂直又は略垂直な面)に設置され、該水平面又は略水平面内において往復運動や回転運動(遠心力)を加えることによって微粒子を移動させることができる。
【0035】
ここで、本発明の分析チップは、人的操作により水平方向に設置されるが、分析チップを完全な水平面に設置することは現実には困難であって、水平器などを用いて慎重に水平方向に合わせたとしても、水平面を基準として僅かなずれ(傾斜)が生じてしまうことは避け難い。この僅かな傾斜が存在する略水平面においては、特に球状の微粒子は重力方向に沿って移動して、分析チップの空隙内で片寄って存在しようとする。このような状態で微粒子を移動させて検体溶液を撹拌しようとすると、傾斜方向への重力の影響を受け、溶液の撹拌のムラが生じる等、溶液の撹拌が不十分になる。本発明の分析チップは、微粒子の充填率を30%以上60%以下とすることで、この問題を解消することができる。本発明の分析チップは、特に0.06度以下の僅かな傾斜の存在する略水平面で用いる場合において有効である。
【0036】
分析チップを水平面又は略水平面内において回転運動させて微粒子を移動させる方法は、分析チップを任意の回転軸を基準としてその周囲を回転させる方法である。この場合、任意の回転軸の周囲を、分析チップ上の任意の位置が、円軌道を描くように回転することが好ましい。分析チップ自体は回転してもしなくてもよいが、回転しない方が装置が簡便であり、微粒子に大きな加速度や、遠心力がかかることから撹拌効率が向上するので好ましい。回転の回転方向は特に限定されず、連続して一定方向に回転するのであっても良いし、一回又は二回以上の等周期若しくはランダムな周期で、正方向と逆方向に切り替えるパターンであっても良い。
【0037】
分析チップを回転させる際の回転数としては、100rpmから500rpmが好ましい。また回転の回転数は、撹拌処理の時間を通じて一定であっても良いし、周期的又はランダムに変化させても良い。
【0038】
回転時間は、選択結合性物質に被検物質が反応するために十分な範囲で適宜決定することができる。選択結合性物質と被検物質の反応の間を通じて、連続して公転させていても良いし、その一部の時間のみ回転させたり、断続的に回転させたりしても良い。回転させる時間の好ましい範囲は、特には限定されないが、延べ4時間以上回転させることが好ましく、選択結合性物質と被検物質の反応の間を通じて連続して回転させておくことが最も好ましい。なお、回転による遠心力の好ましい範囲としては、0.3m/s2〜50m/s2である。
【0039】
また、分析チップを水平方向にマルチ回転させて、微粒子を動かすことも可能である。この場合も微粒子が十分な速度で移動し、かつ、微粒子同士がランダムに衝突を繰り返すことになり、より複雑な運動を行うので十分な検体溶液の撹拌が達成される。マルチ回転とは、任意の複数の回転軸を基準とした、それぞれの回転軸の周囲を回転する運動が組み合わさった回転をいう。それぞれの回転軸の周囲での回転においては、回転数、回転方向、回転半径は任意に決めることができる。マルチ回転の例としては、二つの軸を基準とした回転が組み合わさった8の字回転がある。8の字回転とは、それぞれの回転軸での周囲の回転について、回転方向のみが逆向きとなった回転が、交互に繰り返される回転である。この回転は、一部の市販のシェーカーにおいても設定が可能であり、簡単に実施することができる。
【0040】
また、分析チップを水平面又は略水平面内において往復運動させて、微粒子を動かすことも可能である。この場合も微粒子が十分な速度で移動し、かつ、微粒子同士がランダムに衝突を繰り返すことになり、より複雑な運動を行うので十分な溶液の撹拌が達成される。往復運動は、任意の直線に沿った直線運動であり、かつ、ある一定の又は任意の周期で運動の向きが逆になる運動のことをいう。この場合、運動の向きが変わる直前での速度が大きいほど、微粒子に与えることができる加速度が大きくなるために、より撹拌が促進されるために好ましい。
【0041】
微粒子は、分析チップ内の微粒子を移動させて被験物質を含む溶液を攪拌させる前に充填される。分析チップに予め充填した製品形態とすることができる他、担体と容器からなる分析チップと微粒子とから構成され、使用時に微粒子を分析チップの空隙内に充填するようなる製品形態であってもよい。使用時に微粒子を空隙内に充填する方法としては、被検物質が含まれる溶液に微粒子を混入させて、該溶液のアプライと同時に微粒子を充填してもよく、又は被検物質が含まれる溶液のアプライの前又は後に、微粒子を別途添加してもよい。
【0042】
本発明における被検物質としては、測定すべき核酸、例えば、病原菌やウイルス等の遺伝子や、遺伝病の原因遺伝子等及びその一部分、抗原性を有する各種生体成分、病原菌やウイルス等に対する抗体等を挙げることができるが、これらに限定されるものではない。また、これらの被検物質を含む検体としては、血液、血清、血漿、尿、便、髄液、唾液、各種組織液等の体液や、各種飲食物並びにそれらの希釈物等を挙げることができるがこれらに限定されるものではない。また、被験物質となる核酸は、血液や細胞から常法により抽出した核酸を標識してもよいし、該核酸を鋳型として、PCR等の核酸増幅法によって増幅したものであってもよい。後者の場合には、本発明の撹拌方法を行った後の測定感度を大幅に向上させることが可能である。核酸増幅産物を検体とする場合には、蛍光物質等で標識したヌクレオシド三リン酸の存在下で増幅を行うことにより、増幅核酸を標識することが可能である。また、被験物質が抗原又は抗体の場合には、被験物質である抗原や抗体を常法により直接標識してもよいし、被験物質である抗原又は抗体を選択結合性物質と結合させた後、担体を洗浄し、該抗原又は抗体と抗原抗体反応する標識した抗体又は抗原を反応させ、担体に結合した標識を測定することもできる。
【0043】
本発明においては、上述のような標識、増幅等を施した検体を水溶液や適当な緩衝液等に溶解させて、被検物質を含む溶液(検体溶液)とする。上記被検物質を含む溶液の分析チップへのアプライは、ピペット等の通常の器具で注入することにより行うことができる。
【0044】
本発明の分析チップの担体の材質は特に限定はされないが、例えば、ガラス、セラミックス、シリコンなどの無機材料、ポリメチルメタクリレート(PMMA)、ポリエチレンテレフタレート、酢酸セルロース、ポリカーボネート、ポリスチレン、ポリジメチルシロキサン、シリコンゴムなどのポリマーを挙げることができる。これらのうち、ガラスは、加工が容易で表面が平坦でかつ滑らかであること、化学的に安定であること、洗浄が容易であること、低蛍光であることから好ましく用いることができ、要求特性に合わせて、ソーダガラス、耐熱ガラス(パイレックス(登録商標))、バイコールガラス、無アルカリガラス、石英ガラスなどを用いることができる。
【0045】
また、担体の全体又は一部を黒色にすることもできる。黒色にすることにより、担体からの自家蛍光を低減することができる。ここで、担体が黒色であるとは、可視光(波長400nm〜800nm)において、担体の黒色部分の分光反射率が特定のスペクトルパターン(特定のピークなど)を持たず、一様に低い値であり、かつ、担体の黒色部分の分光透過率も、特定のスペクトルパターンを持たず、一様に低い値であることを意味する。この分光反射率、分光透過率の値としては、可視光(波長400nm〜800nm)の範囲の分光反射率が7%以下であり、同波長範囲での分光透過率が2%以下であることが好ましい。ここで言う分光反射率は、JISZ 8722の条件Cに適合した、照明・受光光学系で、担体からの正反射光を取り込んだ場合の分光反射率をいう。黒色にする手段としては、担体に黒色物質を含有させることが挙げられる。この黒色物質は、光を反射したり透過し難いものであれば、特に制限はないが、カーボンブラック、グラファイト、チタンブラック、アニリンブラック、Ru、Mn、Ni、Cr、Fe、Co、及びCuの酸化物、Si、Ti、Ta、Zr及びCrの炭化物などの黒色物質が好ましく使用できる。これらの黒色物質は単独で含有させる他、2種類以上を混合して含有させることもできる。
【0046】
担体は、選択結合性物質をその表面に固定化するのに先立ち、必要に応じて各種の表面処理を施すことができる。かかる表面処理としては、具体的には、例えば特開2004−264289号公報に記載されるものなどを挙げることができる。
【0047】
本発明の溶液を保持する容器の材質は、特に限定はされないが、ガラスやプラスチックなどを挙げることができる。容器の形状が平坦な板状の場合であると、カバーガラスやスライドガラスなどのガラス製の板を好ましく用いることができる。一方、例えば図3や図5に示すような、容器が凹凸構造を備える場合は、ポリメチルメタクリレートやポリカーボネート、ポリプロピレンなどのプラスチック材料が、射出成形による製造が可能であり生産性の面から好ましい。
【0048】
本発明において、選択結合性物質とは、被験物質と直接的又は間接的に、選択的に結合し得る各種の物質を意味する。担体の表面に結合しうる選択結合性物質の代表的な例としては、核酸、蛋白質、ペプチド、糖類、脂質を挙げることができる。核酸としては、DNAやRNAでも良く、またPNAでも良い。特定の塩基配列を有する一本鎖核酸は、該塩基配列又はその一部と相補的な塩基配列を有する一本鎖核酸と選択的にハイブリダイズして結合するので、本発明でいう選択結合性物質に該当する。
【0049】
核酸は、生細胞等天然物由来のものであっても良いし、核酸合成装置により合成されたものであっても良い。生細胞からのDNA又はRNAの調製は、公知の方法、例えばDNAの抽出については、Blinらの方法(Blin et al., Nucleic Acids Res., 3: 2303 (1976))等により、またRNAの抽出については、Favaloroらの方法(Favaloro et al., Methods Enzymol., 65: 718 (1980))等により行うことができる。固定化する核酸としては、更に、鎖状若しくは環状のプラスミドDNAや染色体DNA、これらを制限酵素により若しくは化学的に切断したDNA断片、試験管内で酵素等により合成されたDNA、又は化学合成したオリゴヌクレオチド等を用いることもできる。また、蛋白質としては、抗体及びFabフラグメントやF(ab´)2フラグメントのような、抗体の抗原結合性断片、並びに種々の抗原を挙げることができる。抗体やその抗原結合性断片は、対応する抗原と選択的に結合し、抗原は対応する抗体と選択的に結合するので、選択結合性物質に該当する。
【0050】
糖類としては、各種単糖のほか、オリゴ糖や多糖などの糖鎖を挙げることができる。
【0051】
脂質としては、単純脂質の他、複合脂質であっても良い。更に、上記核酸、蛋白質、糖類、脂質以外の抗原性を有する物質を固定化することもできる。また、選択結合性物質として、担体の表面に細胞を固定化してもよい。
【0052】
これらの選択結合性物質のうち特に好ましいものとして、DNA、RNA、蛋白質、ペプチド、糖、糖鎖又は脂質を挙げることができる。
【0053】
選択結合性物質を担体に固定化する方法としては、選択結合性物質を含む溶液を担体表面に点着する方法が挙げられる。例えば、キャピラリー状のペンでスポッティングする方式、インクジェット方式などの公知の手法を利用することができる。スポッティング方式は、スポッター又はアレイヤーと呼ばれる高密度分注機を用いて選択結合性物質をスポットする方法である。具体的には、例えば多数のウェルをもつプレートの各ウェルに異なる選択結合性物質を含む溶液を入れておき、この溶液をピン(針)で取り上げて担体上に順番にスポットする。インクジェット方式は、ノズルから微少な液滴を圧電素子などにより噴射し、選択結合性物質を含む溶液を担体に吹き付ける方法である。具体的には、ノズルより遺伝子を噴射し、担体上に高速度で選択結合性物質を整列配置する。選択結合性物質が核酸である場合は、担体上で順次ヌクレオチドを合成することが可能であり、フォトリソグラフ法や、一塩基ずつ担体上に噴射して担体上で合成を行うインクジェットプリント方式を用いることができる。
【0054】
担体の材質がガラスである場合、スポッティング方式やインクジェット方式による点着によって選択結合性物質を固定化する方法としては、例えば、予め担体表面にシランカップリング処理を行うことで、アミノ基、エポキシ基、アルデヒド基、SH基、スクシンイミド基等の官能基を担体表面に生成させ、これを足がかりにDNAなどの選択結合性物質を担体に固定化する方法が適用可能である。例えば、アミノアルキルシランなどを用いて、ガラスの表面にアミノ基を生成させ、このアミノ基のプラスチャージとDNAのマイナスチャージとによる静電的な力により固定化することが可能となる。
【0055】
また、アミノ基に無水コハク酸を反応させることで、ガラスの担体表面にカルボキシル基を導入し、このカルボキシル基を、末端にアミノ基を導入したDNAと縮合剤を用いて反応させることにより、アミド結合を介して担体表面と選択結合性物質とを固定化することができる。さらに、選択結合性物質を固定化しやすいように、予め表面を改質したスライドガラスも市販されており、例えば、アミノシランコートガラス、ポリLリジンコートガラス、エポキシ基導入ガラス、SH基導入ガラス、アルデヒド基導入ガラスを用いることができる。
【0056】
担体の材質がポリマーの場合、担体表面に、選択結合性物質と結合可能な官能基(例えばアミノ基、ヒドロキシ基、カルボキシル基、アルデヒド基、エポキシ基など)を導入し、選択結合性物質の官能基(例えば、アミノ基を導入したDNA)と反応させることで、選択結合性物質を固定化することができる。担体表面へのこのような官能基の導入は、例えば担体表面にプラズマ処理や放射線処理(例えばγ線、電子線など)を施す方法、アルカリや酸により担体表面に処理を施す方法などの表面処理によって行うことができる。具体的な例としては、担体の材質がポリメチルメタクリレート(PMMA)の場合、水酸化ナトリウム又は硫酸の水溶液(好ましい濃度は、1N〜20N)等の酸又はアルカリ水溶液に担体を漬け込み、好ましくは30℃から80℃の温度にして、1時間から100時間の間保持すれば、担体表面にカルボキシル基を導入することができる。担体表面にカルボキシル基がある場合には、縮合剤を用いて反応させることで、例えば末端にアミノ基を導入したDNAを固定化することができる。この場合の縮合剤としては、例えば、ジシクロヘキシルカルボジイミド、N−エチル−5−フェニルイソオキサゾリウム−3’−スルホナート、1−エチル−3−(3−ジメチルアミノプロピル)カルボジイミド(EDC)を用いることができる。
【0057】
上述の方法により得られた選択結合性物質が固定化された担体は、選択結合性物質を固定した後、適当な処理をすることができる。例えば、熱処理、アルカリ処理、界面活性剤処理などを行うことにより、固定された選択結合性物質を変性させることもできる。
【0058】
選択結合性物質固定化担体は、蛍光標識化された被験物質と担体に固定化された選択結合性物質とをハイブリダイゼーション反応させ、スキャナーと呼ばれる装置で蛍光を読みとることが一般的である。スキャナーは励起光であるレーザー光を対物レンズで絞り込み、レーザー光を集光する。しかし、担体表面から自家蛍光が生じる場合、その発光がノイズとなり検出精度の低下に繋がることがある。前述したように、これを防ぎ、担体自身からの自家蛍光を低減させるために、レーザー照射により発光を生じない物質を含有させて表面を黒色にすることが好ましい。例えば、前記の黒色の担体を用いることにより、検出の際の担体からの自家蛍光を低減できる。
【0059】
選択的結合の際の反応温度及び時間は、ハイブリダイズさせる被験物質の核酸の鎖長や、免疫反応に関与する抗原及び/又は抗体の種類等に応じて適宜選択されるが、核酸のハイブリダイゼーションの場合、通常、30℃〜70℃程度で1分間〜十数時間、免疫反応の場合には、通常、室温〜40℃程度で1分間〜数時間程度である。なお、本発明の分析チップを用いる分析では、この選択的結合における反応時間を通して行っても良いし、その一部だけとしても良い。
【0060】
本発明の分析チップにおいては、上記の選択的結合反応の後、選択結合性物質固定化担体上に選択結合性物質を介して結合した被検物質の質量を測定する。この測定も、従来の分析チップにおける操作と全く同様に行うことができる。例えば、適宜蛍光標識され、選択結合性物質と結合した被検物質の質量について、公知のスキャナ等により、その蛍光量を読み取ることにより測定することができる。
【実施例】
【0061】
本発明を以下の実施例によって更に詳細に説明する。もっとも、本発明は下記実施例に限定されるものではない。
【0062】
実施例1
(基板の作製)
公知の技術である射出成型法により、図6に示すカーボンブラックを含有したポリメチルメタクリレート(PMMA)製の平板の担体を作製した。すなわち、担体の外形は75mm×25mm×1mmである。
【0063】
(プローブDNAの固定化)
上記の担体を10Nの水酸化ナトリウム水溶液に65℃で12時間浸漬した。次いで、純水、0.1NHCl水溶液、純水の順で洗浄した。このようにして、担体表面のPMMAの側鎖を加水分解して、カルボキシル基を生成した。
【0064】
担体上に固定化する選択結合性物質として、配列番号1(60塩基、5’末端アミノ化)で表される塩基配列を有するDNA(以下、配列番号1のDNAと記載することがある)を合成した。配列番号1のDNAは5’末端がアミノ化されている。
【0065】
これらのDNAを、純水に0.27nmol/μlの濃度で溶かして、ストックソリューションとした。担体に点着する際は、PBS(NaClを8g、Na2HPO4・12H2Oを2.9g、KClを0.2g、KH2PO4を0.2g純水に溶かし1lにメスアップしたものにpH調整用の塩酸を加えてpH5.5としたもの)でプローブの終濃度を0.027nmol/μlとし、かつ、担体表面のカルボン酸とプローブDNAの末端のアミノとを縮合させるため、1−エチル−3−(3−ジメチルアミノプロピル)カルボジイミド(EDC)を加え、この終濃度を50mg/mlとした。そして、これらの混合溶液をおよそ40μl取り出して、スポッティング用ロボット(日本レーザー電子(株)、GTMASStamp−2)を用い、担体中央部に6×4=24個のDNAのスポットを行った。次いで、担体を密閉したプラスチック容器に入れて、37℃、湿度100%の条件で20時間程度インキュベートして、純水で洗浄した。
【0066】
(検体DNAの調製)
検体DNA(被験物質)として、上記DNA固定化担体とハイブリダイズ可能な塩基配列を持つ配列番号4のDNA(968塩基)を用いた。調製方法を以下に示す。配列番号2と配列番号3のDNAを合成した。これを純水にとかして濃度を100μMとした。次いで、pKF3プラスミドDNA(タカラバイオ(株)製品番号;3100)(配列番号5で表される塩基配列を有するDNA:2264塩基)を用意して、これをテンプレートとし、配列番号2及び配列番号3のDNAをプライマーとして、PCR反応(PolymeraseChain Reaction)により増幅を行った。
【0067】
PCRの条件は以下の通りである。すなわち、ExTaq2μl、10×ExBuffer 40μl、dNTP Mix32μl(以上はタカラバイオ(株)製 製品番号RR001Aに付属)、配列番号2で表される塩基配列を有するDNAの溶液を2μl、配列番号3で表される塩基配列を有するDNAの溶液を2μl、テンプレート(配列番号5で表される塩基配列を有するDNA)を0.2μl加え、純水によりトータル400μlにメスアップした。これらの混合液を、4つのマイクロチューブに分け、サーマルサイクラーを用いてPCR反応を行った。これを、エタノール沈殿により精製し、40μlの純水に溶解した。PCR反応後の溶液の一部をとり電気泳動で確認したところ、増幅したDNAの塩基長は、およそ960塩基であり配列番号4のDNA(968塩基)が増幅されていることを確認した。
【0068】
次いで、9塩基のランダムプライマー(タカラバイオ(株)製;製品番号3802)を6mg/mlの濃度に溶かし、上記のPCR反応後精製したDNA溶液に2μl加えた。この溶液を100℃に加熱した後、氷上で急冷した。これらにKlenowFragment(タカラバイオ(株)製;製品番号2140AK)付属のバッファーを5μl、dNTP混合物(dATP、dTTP、dGTPの濃度はそれぞれ2.5mM、dCTPの濃度は400μM)を2.5μl加えた。さらに、Cy3−dCTP(アマシャムファルマシアバイオテク製;製品番号PA53021)を2μl加えた。この溶液に10UのKlenow Fragmentを加え、37℃で20時間インキュベートし、Cy3で標識された検体DNAを得た。なお、標識の際ランダムプライマーを用いたので検体DNAの長さには、ばらつきがある。最も長い検体DNAは配列番号4のDNA(968塩基)となる。なお、検体DNAの溶液を取り出して、電気泳動で確認したところ、960塩基に相当する付近にもっとも強いバンドが現れ、それより短い塩基長に対応する領域に薄くスメアがかかった状態であった。そして、これをエタノール沈殿により精製し、乾燥した。
【0069】
この標識化された検体DNAを、1重量%BSA(ウシ血清アルブミン)、5×SSC(5×SSCとはNaClを43.8g、クエン酸3ナトリウム水和物を22.1gの純水にとかし、200mlにメスアップしたもの。またNaClを43.8g、クエン酸3ナトリウム水和物を22.1g純水にとかし、1lにメスアップしたものを1×SSCと表記し、これの10倍濃縮液を10×SSC、5倍希釈液を0.2×SSCと表記する)、0.1重量%SDS(ドデシル硫酸ナトリウム)、0.01重量%サケ精子DNAの溶液(各濃度はいずれも終濃度)、800μlに溶解し、ハイブリダイゼーション用検体のストック溶液とした。
【0070】
以下の実施例、比較例において、ハイブリダイゼーションの際の検体溶液は、特に断りのない限り、上記で調製したストック溶液を、1重量%BSA、5×SSC、0.01重量%サケ精子DNA、0.1重量%SDSの溶液(各濃度はいずれも終濃度)で200倍に希釈したものを用いた。なお、この溶液の検体DNAの濃度を測定したところ、1.5ng/μLであった。
【0071】
(溶液を保持する容器の接着)
厚さ1mmのPMMA板から切削加工により図7に示す貫通孔を4つ有する溶液を保持する容器を作製し、これを図8に示す両面テープ9(厚さ120μm)を5枚重ねて用いて、プローブDNAの固定化領域に被さるように担体と接着した。両面テープの内枠のサイズは、11×13.5mmである。
【0072】
(微粒子の調製と充填)
表面粗さが20(nm)、平均粒径が200μmの市販ジルコニア製微粒子(東レ株式会社製)を、炭化珪素質研磨材(粒度#20)を用い遠心式バレル研磨機で1時間、水中にて研磨を行い、水洗して乾燥した。前記微粒子の表面粗さは、Ra=165nmであった。かかる微粒子の表面粗さの測定は、その表面をAuで真空蒸着した後、走査型電子顕微鏡(株式会社エリオニクス製、型式ESA−2000)で表面粗さRa(nm)を測定した。前記表面粗さは、観察倍率を10,000倍、カットオフ値を0とし、任意の10個について測定し、その平均値を求めた。かかる微粒子の粒径は、実体顕微鏡で任意の100個以上の微粒子の画像を50〜150倍で撮影した後、画像処理解析ソフト(三谷商事社株式会社製、Win Roof)により円相当径を求めて平均値を算出し、それを平均粒径とした。その後エタノール溶液に浸漬し、超音波洗浄を5分間行った。さらに同様の洗浄を2回繰り返した。この微粒子を溶液を保持する容器の貫通孔から、充填率が、30%、40%、50%、60%となるように、4枚のDNAチップに充填した。
【0073】
(ハイブリダイゼーション)
微粒子が充填されたDNAチップ4枚にマイクロピペットを用いて、溶液を保持する容器の貫通孔より、微粒子が充填された空隙に、上記で調製したハイブリダイゼーション検体溶液を貫通孔から少し溢れる程度まで注入した。その後、封止部材としてシリコンテープ(アズワン)を用い、4つの貫通孔を塞いだ。ハイブリダイゼーションチャンバー(Takara Hybridization chamber(タカラバイオ(株))をシート振盪台(東京理化器械(株)製 MMS FIT−S)に密着させて固定し、分析チップを水平面を基準に0.06度傾くように、選択結合性物質の固定化面が鉛直下向きとなるように、ハイブリダイゼーションチャンバー内にセットした。この時、チップをセットする位置の両端の凹みに、15μLずつ超純水を滴下した。ハイブリダイゼーションチャンバーのふたを閉めて6本の固定ネジを締めて固定後、42℃に設定した恒温チャンバー(東京理化器械(株)製 FMS−1000)内に据え付けた振盪機(東京理化器械(株)製 MMS−310)の上に載せて固定した。恒温チャンバーの前面をアルミホイルで遮光して、250回転/分で回転振盪しながら、42℃で16時間インキュベートした。インキュベート後、ハイブリダイゼーションチャンバーからチップを取り出し、溶液を保持する容器と両面テープを剥がし、洗浄、乾燥した。
【0074】
(測定)
DNAチップ用のスキャナー(Axon Instruments社 GenePix 4000B)に、上記処理後の担体をセットし、レーザー出力33%、フォトマルチプライヤーの電圧設定を500にした状態で、選択結合性物質であるDNAを固定化した担体上の24個のスポットの蛍光強度の測定を行った。その結果を表1に示す。表1中に示す数値(%)は、1枚の担体内の24個のスポットの蛍光強度のCV値である。結果をみると、30〜60%の各充填率において、蛍光強度のばらつきを表すCV値が10%以下であり、24個の各スポットにおいて、微粒子による溶液の撹拌のムラが生じることなく、担体に固定化されたDNAと検体DNAとが均一に反応したことが分かった。
【0075】
比較例1
微粒子の充填率を20%と70%としたこと以外は、実施例1と同様の操作を行った。結果を表1に示す。結果をみると、充填率20%と70%共に蛍光強度のCV値が10%以上と大きく、24個の各スポットにおいて、微粒子による溶液の撹拌のムラが生じ、担体に固定化されたDNAと検体DNAとが均一に反応しなかったことが分かった。
【0076】
実施例2
平均粒径が500μmの微粒子を用いたこと以外は実施例1と同様の操作を行った。結果を表1に示す。結果をみると、30〜60%の各充填率において、蛍光強度のばらつきを表すCV値が10%以下であり、24個の各スポットにおいて、微粒子による溶液の撹拌のムラが生じることなく、担体に固定化されたDNAと検体DNAとが均一に反応したことが分かった。
【0077】
比較例2
微粒子の充填率を20%と70%としたこと以外は、実施例2と同様の操作を行った。結果を表1に示す。結果をみると、充填率20%と70%共に蛍光強度のCV値が10%以上と大きく、24個の各スポットにおいて、微粒子による溶液の撹拌のムラが生じ、担体に固定化されたDNAと検体DNAとが均一に反応しなかったことが分かった。
【0078】
実施例3
実施例1で用いたジルコニア製微粒子の代わりに、以下のようにして調製したガラスビーズを用いて、実施例1と同様の操作を行った。
【0079】
(ガラスビーズの修飾と充填)
直径が200μmのガラスビーズ10gを10NNaOH溶液に浸漬した後、純水で洗浄した。ついで、APS(3−アミノプロピルトリエトキシシラン;信越化学工業(株)製)を2重量%の割合で純水に溶解した後、上記のガラスビーズを1時間浸漬し、この溶液から取り出した後に110℃で10分間乾燥した。このようにして、ガラスビーズの表面にアミノ基を導入した。
【0080】
ついで、5.5gの無水コハク酸を1−メチル−2−ピロリドン335mlに溶解させた。1Mの50mlのホウ酸ナトリウム(ホウ酸3.09gとpH調整用の水酸化ナトリウムを加えて、純水で50mlにメスアップしたもの。pH8.0)に上記コハク酸溶液に加えた。この混合液に上記のガラスビーズを20分間浸漬した。浸漬後、純水で洗浄及び乾燥した。このようにして、ガラスビーズの表面のアミノ基と無水コハク酸を反応させて、ガラスビーズ表面にカルボキシル基を導入した。このガラスビーズを溶液を保持する容器の貫通孔から、充填率が、30%、40%、50%、60%となるように、4枚に充填した。
【0081】
結果を表1に示す。結果をみると、実施例1と同様に、30〜60%の各充填率において、蛍光強度のばらつきを表すCV値が10%であり、24個の各スポットにおいて、微粒子による溶液の撹拌のムラが生じることなく、担体に固定化されたDNAと検体DNAとが均一に反応したことが分かった。
【0082】
比較例3
ガラスビーズの充填率を20%と70%としたこと以外は、実施例3と同様の操作を行った。結果を表1に示す。結果をみると、充填率20%と70%共に蛍光強度のCV値が10%以上と大きく、24個の各スポットにおいて、微粒子による溶液の撹拌のムラが生じ、担体に固定化されたDNAと検体DNAとが均一に反応しなかったことが分かった。
【0083】
実施例4
平均粒径が500μmのガラスビーズを用いたこと以外は実施例3と同様の操作を行った。結果を表1に示す。結果をみると、実施例3と同様に、30〜60%の各充填率において、蛍光強度のばらつきを表すCV値が10%以下であり、24個の各スポットにおいて、微粒子による溶液の撹拌のムラが生じることなく、担体に固定化されたDNAと検体DNAとが均一に反応したことが分かった。
【0084】
比較例4
ガラスビーズの充填率を20%と70%としたこと以外は、実施例4と同様の操作を行った。結果を表1に示す。結果をみると、充填率20%と70%共に蛍光強度のCV値が10%以上と大きく、24個の各スポットにおいて、微粒子による溶液の撹拌のムラが生じ、担体に固定化されたDNAと検体DNAとが均一に反応しなかったことが分かった。
【0085】
【表1】

【符号の説明】
【0086】
1 溶液を保持する容器
2 担体
3 微粒子
4 シーリング部材
5 選択結合性物質
6 空隙(被験物質溶液が含まれていてもよい)
7 ベース担体
8 凸部構造部材
9 両面テープ
10 選択結合性物質固定化領域
11 貫通孔
12 液面駐止用チャンバー
13 微粒子が移動可能な表面
【技術分野】
【0001】
本発明は、被検物質と選択的に結合する物質(本明細書において「選択結合性物質」)が固定化された担体と、被検物質を含む溶液を保持する容器と、該担体と該容器によって形成される空隙に充填された微粒子からなり、被検物質と選択結合性物質を結合させることで被検物質を分析するための分析チップに関する。
【背景技術】
【0002】
近年、多数の遺伝子発現を一度に解析する手法として、DNAチップ法(DNAマイククロアレイ法)と呼ばれる新しい分析法が開発され、注目を集めている。DNAチップは、数百〜数万という多数の遺伝子発現を同時に測定するための小型装置であり、ガラス、シリコンなどの基材の基板上にDNAなどの分子を高密度に配置したものである。DNAチップを使用することによって、各種疾患動物モデルや細胞生物学現象における体系的かつ網羅的な遺伝子発現解析を行うことができる。具体的には、遺伝子の機能、すなわち遺伝子がコードするタンパク質を明らかにするとともに、タンパク質が発現する時期や作用する場所を特定することが可能になる。生物の細胞又は組織レベルでの遺伝子発現の変動をDNAチップによって解析し、生理学的、細胞生物学的、生化学的事象データと組み合わせて遺伝子発現プロファイルデータベースを構築することによって、疾患遺伝子、治療関連遺伝子の検索や治療方法の探索が可能になると思われる。
【0003】
現在、DNAチップの作製は、主に2つの基本的な方法、すなわちGeneChip法及びcDNAマイクロアレイ法が採用されている。
【0004】
GeneChip法はAffymetrix社によって開発された方法で、フォトリソグラフ法によりガラス板上で25マー(mer)程度のオリゴDNAを合成し、1つの遺伝子あたり、塩基配列データから16カ所から20カ所の25マーを設定し、25マーの完全一致と13塩基目を意図的に違えた1塩基ミスマッチのオリゴマーセットを組にしてプローブDNAとする。この方法は、プローブDNAの長さが一定であり、配列が既知なため、ハイブリダイゼーションの強さに影響をあたえるGC含量を一定にすることができるので、発現量の定量的解析には理想的なアレイと考えられている。
【0005】
一方、cDNAマイクロアレイ法は、Stanford大学によって開発された方法で、キャピラリー状のペンによるスポッティング方式や、インクジェット方式などの手法により、ガラス板にDNAを固定するものである。いずれの方法も、あらかじめ蛍光標識した測定する試料(遺伝子)を、DNAチップ上のプローブとハイブリダイゼーションにより結合させ、スキャナーを用いてその蛍光強度を測定することにより、遺伝子の発現を測定するものである。
【0006】
現在、DNAチップは、チップ上に数万から数千種類の多数の遺伝子を載せ、一度に大量の遺伝子の発現を調べる研究用として用いられていることが多い。また今後、診断用途でのDNAチップが使用されることが期待されている。しかし、診断で使用する場合、一般的に採取できる検体の量が非常に少ないものと予想される。さらに現状、発現量の低い遺伝子についてはハイブリダイゼーション後の蛍光強度が非常に微弱であり、このような遺伝子は実質上解析できないという問題点を有している。従って、検体が少ない場合や発現量の少ない遺伝子でも、ハイブリダイゼーション後の蛍光の強度をいかに大きくするかということが課題であり、この課題を解決するためには検体中の被験物質であるDNAとプローブDNAとをいかに効率よく反応させるかがポイントとなる。効率よくDNAとプローブを反応させる方法としては、被験物質を含む溶液を攪拌することで、効率よくプローブDNAと被験物質との反応を促進することが考えられている。
【0007】
被検物質を含む検体溶液を攪拌する例として、特許文献1には、分析チップを用いた微粒子又は気泡を混合した検体溶液を、被検物質と反応する選択結合性物質を固定化させた担体に接触させ、微粒子又は気泡を移動させることにより検体溶液を攪拌して、被検物質との反応効率を高める方法が開示されている。
【先行技術文献】
【特許文献】
【0008】
【特許文献1】国際公開第2005/090997号
【発明の概要】
【発明が解決しようとする課題】
【0009】
被験物質を含む溶液を均一に撹拌するためには、溶液中の微粒子を、片寄りなく移動させることが必要である。しかし、溶液中の微粒子を分析チップの置かれた水平面上において回転運動等によって移動させる場合、分析チップを完全な水平面に設置することは現実には困難を伴い、水平器を用いたとしても、多少の傾斜が生じてしまうことは避け難い。しかしながら、この傾斜が生じると、微粒子は常に重力方向に沿って移動し、分析チップ中で片寄って存在することになる。この状態で分析チップを回転等させて微粒子を移動させると、傾斜方向への重力の影響を受け、溶液の撹拌のムラが起きてしまうという問題があった。
【0010】
本発明は、上記課題を解決するためのもので、分析チップの設置が水平面から多少ずれて傾斜している場合であっても、被験物質を含む溶液をムラなく撹拌することができ、正確な分析を可能にする分析チップを提供することを目的とする。
【課題を解決するための手段】
【0011】
上記課題に鑑みて、本発明者らは鋭意検討した結果、分析チップの空隙内に充填する微粒子の充填率を30〜60%とすることで上記課題を解決できることを見出し、本発明を完成させた。
【0012】
すなわち、本発明は以下の(1)〜(4)で構成される。
(1)表面に選択結合性物質が固定化された担体と、選択結合性物質と反応する被検物質を含む溶液を保持するための容器と、該担体と該容器によって形成される空隙に充填された微粒子からなり、該微粒子の充填率が30%以上60%以下であることを特徴とする分析チップ。
(2)微粒子の密度が2g/cm3以上7g/cm3以下である、上記(1)に記載の分析チップ。
(3)微粒子の材質がジルコニアである、上記(1)又は(2)に記載の分析チップ。
(4)担体と容器とがシーリング部材を介して接触している、上記(1)〜(3)のいずれか1項に記載の分析チップ。
【発明の効果】
【0013】
本発明の分析チップによれば、回転運動等によって分析チップ中の微粒子を移動させて被験物質を含む溶液(以下「検体溶液」ということがある。)を撹拌する際に、分析チップの設置方向が水平方向より傾いている場合であっても、検体溶液をムラなく撹拌することができる。つまり、分析チップが厳密に水平に設置されていなくても、検体溶液をムラなく撹拌することができる。その結果、分析チップでの選択結合性物質と被検物質の反応をムラなく均一に促進することが可能となり、高感度で、高い精度の分析が可能となる。
【図面の簡単な説明】
【0014】
【図1】図1は、本発明の分析チップの一例を概略的に示す斜視図(A)と破線Aに沿った断面図(B)である。
【図2】図2は、本発明の分析チップの一例を概略的に示す斜視図(A)と破線Aに沿った断面図(B)である。
【図3】図3は、本発明の分析チップの一例を概略的に示す斜視図(A)と破線Aに沿った断面図(B)である。
【図4】図4は、本発明の分析チップの担体の一例を概略的に示す斜視図である。
【図5】図5は、本発明の分析チップの一例を概略的に示す斜視図(A)と破線Aに沿った断面図(B)である。
【図6】図6は、実施例及び比較例で用いた担体を概略的に示す斜視図である。
【図7】図7は、実施例及び比較例で用いた溶液を保持する容器を概略的に示す斜視図(A)と破線Aに沿った断面図(B)である。
【図8】図8は、実施例及び比較例で用いた両面テープを上方から見た外観図である。
【図9】図9は、本発明の分析チップの一例を概略的に示す斜視図(A)と破線Aに沿った断面図(B)である。
【図10】図10は、本発明の選択結合性物質が固定化された担体を概略的に示す斜視図である。
【図11】図11は、図3に示す分析チップの溶液を保持する容器における1つのウェル構造を上方から見た平面図である。
【発明を実施するための形態】
【0015】
本発明は、表面に選択結合性物質が固定化された担体と、選択結合性物質と反応する被検物質を含む溶液を保持するための容器と、該担体と該容器によって形成される空隙に充填された微粒子からなる分析チップであって、該微粒子の充填率が30%以上60%以下であることを特徴とする。本発明の分析チップは、検体溶液、すわなち被検物質を含む溶液を当該チップにアプライし、被検物質の存在の有無や、被検物質の量や、被験物質の性状等を測定するために用いるチップである。具体的には、担体表面に固定化された選択結合性物質と被検物質との反応により、被検物質の量や、被検物質の有無を調べるバイオチップが挙げられる。より具体的には、核酸を担体表面に固定化したDNAチップ、抗体に代表されるタンパク質を担体表面に固定化したタンパク質チップ、糖鎖を担体表面に固定化した糖鎖チップ、及び担体表面に細胞を固定化した細胞チップ等が挙げられる。
【0016】
本発明の分析チップの担体は、その表面に選択結合性物質が固定化される表面を有する基材であり、被検物質を含む溶液を接触させることで、選択結合性物質固定化表面で選択結合性物質と被検物質とを反応させる。担体の形状は、平坦な板状の基材であってもよく、板状基材にウェル構造や凹凸構造がある基材であっても良い。平坦な板状の基材の例としては、スライドガラスやカバーガラスなどがある。また、ウェル形状を有する基材としては、市販品として入手可能なマイクロプレートのように、複数のウェルが配列された基材を用いることができ、この場合のウェルは後述する検体溶液を保持する空隙として利用することができる。
【0017】
本発明の分析チップの容器は、担体と組み合わせて、選択結合性物質が固定化された担体表面を覆い、被検物質を含む溶液を保持する空隙を形成する基材である。被検物質を含む溶液を保持するために、担体と容器とは互いに接着されうる形状を選択することができる。
【0018】
本発明の分析チップは、担体と容器によって形成される空隙に微粒子が充填される。微粒子は、空隙で保持される検体溶液を撹拌するための撹拌子の役目をなす。
【0019】
微粒子の形状は、溶液を攪拌することができる形状であれば球状、多角形、円筒形などの任意の形状をとることができるが検体溶液中で滞ることなくスムーズに移動でき、結果的に撹拌が良好に行えるので、球状が好ましい。微粒子のサイズは、担体や容器の形状、空隙の形状や体積に応じて攪拌の効果が得られる適切なサイズを選択することができる。例えば球状の微粒子の場合、平均粒径が0.2mm〜0.5mmの範囲の微粒子を用いることが好ましい。
【0020】
微粒子の材質は、検体溶液中に微粒子成分が溶出して分析に影響を及ぼさないものであれば特に限定されず、ガラス、石英、セラミック、金属(例えば金、白金、ステンレス)、プラスチック(例えばナイロンやポリスチレン)等を用いることができる。特に微粒子の材質としては、撹拌効率の点から比重が大きいことが好ましく、容易に入手可能であると言うことから、比重が2〜7g/cm3であるジルコニア系セラミック製(例えばイットリウム部分安定化ジルコニア製)の微粒子を好ましく用いることができる。
【0021】
本発明の分析チップへの微粒子の充填率は、担体と容器によって形成される空隙に対して30%〜60%である。ここでいう充填率は、空隙内において担体上の選択結合性物質の固定化面に対向する容器の表面上に微粒子を一層に並べたときに、全微粒子の該容器表面への垂直投影面の総面積が該容器において微粒子が移動可能な表面の表面積に対して占める割合(%)を示す。具体的には、微粒子の充填率は、分析チップに微粒子を充填後に分析チップを傾けるなどして微粒子一層で整列させて垂直投影面の総面積を算出することができる。微粒子が球状の場合は、その平均粒径から求められる微粒子1個が占める投影面(円)の面積と、微粒子の密度と重量から充填される微粒子数とを求めることで、充填率を算出することも可能である。例えば、後述する図3に示す分析チップの場合、1ウェルに注目すると、溶液を保持する容器1の上に一層に微粒子を並べ、上方から二次元的に見た時の像は図11に示すようになる。この場合、微粒子が占める面積は、微粒子径を直径とする円の面積に微粒子数を乗じた値となり、これを、微粒子が移動可能な表面13であるウェル底面の面積で除した値が微粒子の充填率ということになる。
【0022】
本発明の分析チップは、担体と容器とを組み合わせて空隙を形成するが、担体と容器との接合部はシーリング部材を介して、接着又は密着固定されてもよい。ここで用いるシーリング部材は、担体と容器とを接着又は密着固定できる部材であって、接着部材やO−リングなどの密着固定部材を用いることができる。担体と容器とをシーリング部材を介して、接着又は密着固定する場合、該空隙は担体、容器、シーリング部材に囲まれる形態で形成されてもよい。
【0023】
シーリング部材の厚みを調整することで、担体及び容器の形状に合わせて、空隙の高さを調整することができる。被験物質を含む溶液の液量などを考慮すると、好ましい空隙の高さは0.3mm〜1.2mmとすることができる。
【0024】
容器は、担体に脱離可能に接着されていても、担体に脱離不可能に接着されていてもよい。容器が担体に脱離可能に接着されている場合は、被検物質とのハイブリダイゼーション反応を行った後、分析チップを解体して容器を脱離させ、担体のみをスキャナーにセットして蛍光等のシグナル強度を測定することができる。担体と容器とを脱離可能に接着する場合の接着部材としては、担体が損傷されることなく脱離することが可能である態様が好ましく、両面テープ(例えば、日東電工株式会社製の製品番号No.535A、住友スリーエム株式会社製の製品番号9415PC及び4591HL、株式会社寺岡製作所製の製品番号No.7691等)、樹脂組成物(例えば、アクリル系ポリマー、シリコーン系ポリマー(シリコーン系のエラストマー等)、これらの混合物等)の接着部材を用いることができる。
【0025】
次に、分析チップの形態について更に詳細に説明する。もっとも、本発明は下記形態に限定されるものではない。
【0026】
図1に示す分析チップは、平坦な板状の担体2と、平坦な板状の溶液を保持する容器1からなり、これらの担体及び溶液を保持する容器とシーリング部材4とで形成される空隙6に微粒子3が充填されている。選択結合性物質5は、担体2の表面(選択結合性物質固定化領域)に固定化されている。
【0027】
図2に示す分析チップは、平坦な板状の担体2と、平坦な板状の溶液を保持する容器1からなり、担体2が空隙6を覆うように配置され、担体1の選択結合性物質5の固定化面が鉛直下向きである。また、図2に示す分析チップは、担体2と容器1とシーリング部材4とで囲まれた空隙6が、一つの分析チップにおいて複数に区画されて、担体2上に複数の選択結合性物質固定化領域が存在しており、それぞれの空隙に、同一又は異なる被験物質溶液をアプライして同時に使用することができる。一つの分析チップにおいて区画された複数の各空隙に存在する選択結合性物質固定化領域10は、該空隙のレイアウトに合わせた任意のレイアウトとすることができる。例えば、選択結合性物質固定化領域の個数は、固定化する選択結合性物質の種類に応じて、4〜24個であれば使い勝手がよく、好ましく用いられる。図10に、選択結合性物質固定化領域10の個数が10個の例を示す。この場合、シーリング部材は、各固定化領域(空隙)の仕切りの役目をなし、各領域を別個に囲む形態でもよいし、複数の領域又は全部の領域を囲む形態であってもよい。
【0028】
図9に示す分析チップは、図2に示す分析チップと同様に、平坦な板状の担体2が空隙6を覆うように配置され、選択結合性物質5の固定化面が鉛直下向きであるが、溶液を保持する容器1がウェル構造を備えることを特徴とする。そして、溶液を保持する容器1の複数のウェル構造を有することにより、容器1と担体2とシーリング部材4とで囲まれた空隙6が複数に区画されて、複数の選択結合性物質固定化領域が存在する。
【0029】
図3に示す分析チップは、図9に示す分析チップと同様に、溶液を保持する容器1がウェル構造を備え、担体2が空隙6を覆うように配置され、選択結合性物質5の固定化面が鉛直下向きである分析チップであるが、担体2が凹凸構造を有することを特徴とする。選択結合性物質5は、担体2の凸構造の上端面に固定化され、凸構造とウェルを1対1で対応させる形態とすることができる。容器1の各ウェル構造と担体2とにより各空隙を閉空間とすることができるので、シーリング部材4は用いなくてもよいが、シーリング部材を用いる方が被験物質溶液の蒸発を確実に抑制することができる。担体の凸部構造は、一つの担体に1個又は複数個設けることが可能であるが、複数個配置されているほうが、一工程で複数の被験物質を扱うことが可能であるので好ましい。一つの担体に配置される凸部構造の数は、組み合わせる容器の構造に合わせて任意の位置に設けることができる。例えば、後述する被検物質類の保存や試薬を用いた化学処理時の処理容器として良く使われる入手が容易な市販品であるマイクロプレート(例えば384穴や96穴タイプ)の構造に合わせて配置することが好ましい。
【0030】
図3に示す分析チップにおいて、担体2として、担体がベース担体7と凸部構造部材8から構成され、ベース担体7に対して任意の数の凸部構造部材8を所望のレイアウトで組み合わせて設置するタイプである、図4に示す担体を用いることができる。凸部構造部材8の表面には、選択結合性物質5が固定化されている。ベース担体には、凸部構造部材8を一つ一つ設置可能な構造を備える。図4に示す担体を用いれば、一つの凸部構造部材に予期せぬ不良が発生した場合でも、その対象の凸部構造部材のみを交換するだけで他の凸部構造部材を生かすことができる。また、凸部構造部材をベース担体の全面又は任意の一部分にのみ組み込むことも可能であるため、凸部構造部材の数を被験物質の数に合わせた担体を提供することが可能となる。
【0031】
図5に示す分析チップは、図2に示す分析チップと同様に、平坦な板状の担体が空隙6を覆うように配置され、選択結合性物質5の固定化面が鉛直下向きであるが、溶液を保持する容器1に被験物質溶液をアプライするための空隙に連通する貫通孔11を有することを特徴とする。貫通孔を有する容器を用いると、予め担体2と容器1とをシーリング部材4を介して接着し、貫通孔11から空隙6に微粒子を充填しておくことができる。分析チップに予め微粒子を充填しておくことで、使用者は、調製した被験物質溶液をアプライするのみであり、操作工程が少ないという点で優れている。貫通孔は、1つの空隙に対して複数有することが、検体溶液のアプライが容易となるので好ましい。溶液を保持する容器が複数の貫通孔を有する場合、それらの孔径は同一でも異なっていてもよいが、検体溶液のアプライ口をその他の貫通孔をより広い孔径とすることが好ましい。貫通孔11は、その少なくとも1つが、その径を変化させて、上端に径の広い部分、いわゆる液面駐止用チャンバー12を備えるものとしてもよい。液面駐止用チャンバーを備えることにより、貫通孔11からアプライされ空隙6に充填された検体溶液の液面の上昇を抑え、貫通孔を封止部材で封止する際の封止を容易かつ確実に行うことが可能となるとともに、検体溶液の中に多数の気泡が入ったり、検体溶液の流出を防ぐことができるので好ましい。
【0032】
図1、図2に示す分析チップへの被験物質溶液のアプライは、以下の方法で行うことができる。例えば、担体表面の選択結合性物質固定化領域を囲むようにO−リングを設置する。その後、O−リングの内側に被験物質溶液をアプライし、続いて微粒子を添加する。確実に被験物質溶液、微粒子が保持されていることを確認した後、上から溶液を保持する容器を被せ、上下をクリップ等で挟みこむことで密閉する。
【0033】
図3に示すウェル構造の分析チップの場合、被験物質溶液をウェルにアプライし、その後、微粒子を添加し、その上から、選択結合性物質が固定化された担体を固定化面を下向きに被せることで、被験物質溶液をアプライすることができる。また、予めウェル内に微粒子を充填しておくことが可能であり、この場合は前述した図5の分析チップの場合と同様に、使用者は、被験物質溶液をアプライするだけという形態とすることも可能である。この場合、担体と溶液を保持する容器とをO−リングを介して密閉することは、被験物質溶液の蒸発を抑制できるため好ましい。
【0034】
本発明の分析チップは、空隙に充填された微粒子を移動させることで検体溶液を撹拌することができる。具体的には、分析チップは水平又は略水平な面(重力方向に垂直又は略垂直な面)に設置され、該水平面又は略水平面内において往復運動や回転運動(遠心力)を加えることによって微粒子を移動させることができる。
【0035】
ここで、本発明の分析チップは、人的操作により水平方向に設置されるが、分析チップを完全な水平面に設置することは現実には困難であって、水平器などを用いて慎重に水平方向に合わせたとしても、水平面を基準として僅かなずれ(傾斜)が生じてしまうことは避け難い。この僅かな傾斜が存在する略水平面においては、特に球状の微粒子は重力方向に沿って移動して、分析チップの空隙内で片寄って存在しようとする。このような状態で微粒子を移動させて検体溶液を撹拌しようとすると、傾斜方向への重力の影響を受け、溶液の撹拌のムラが生じる等、溶液の撹拌が不十分になる。本発明の分析チップは、微粒子の充填率を30%以上60%以下とすることで、この問題を解消することができる。本発明の分析チップは、特に0.06度以下の僅かな傾斜の存在する略水平面で用いる場合において有効である。
【0036】
分析チップを水平面又は略水平面内において回転運動させて微粒子を移動させる方法は、分析チップを任意の回転軸を基準としてその周囲を回転させる方法である。この場合、任意の回転軸の周囲を、分析チップ上の任意の位置が、円軌道を描くように回転することが好ましい。分析チップ自体は回転してもしなくてもよいが、回転しない方が装置が簡便であり、微粒子に大きな加速度や、遠心力がかかることから撹拌効率が向上するので好ましい。回転の回転方向は特に限定されず、連続して一定方向に回転するのであっても良いし、一回又は二回以上の等周期若しくはランダムな周期で、正方向と逆方向に切り替えるパターンであっても良い。
【0037】
分析チップを回転させる際の回転数としては、100rpmから500rpmが好ましい。また回転の回転数は、撹拌処理の時間を通じて一定であっても良いし、周期的又はランダムに変化させても良い。
【0038】
回転時間は、選択結合性物質に被検物質が反応するために十分な範囲で適宜決定することができる。選択結合性物質と被検物質の反応の間を通じて、連続して公転させていても良いし、その一部の時間のみ回転させたり、断続的に回転させたりしても良い。回転させる時間の好ましい範囲は、特には限定されないが、延べ4時間以上回転させることが好ましく、選択結合性物質と被検物質の反応の間を通じて連続して回転させておくことが最も好ましい。なお、回転による遠心力の好ましい範囲としては、0.3m/s2〜50m/s2である。
【0039】
また、分析チップを水平方向にマルチ回転させて、微粒子を動かすことも可能である。この場合も微粒子が十分な速度で移動し、かつ、微粒子同士がランダムに衝突を繰り返すことになり、より複雑な運動を行うので十分な検体溶液の撹拌が達成される。マルチ回転とは、任意の複数の回転軸を基準とした、それぞれの回転軸の周囲を回転する運動が組み合わさった回転をいう。それぞれの回転軸の周囲での回転においては、回転数、回転方向、回転半径は任意に決めることができる。マルチ回転の例としては、二つの軸を基準とした回転が組み合わさった8の字回転がある。8の字回転とは、それぞれの回転軸での周囲の回転について、回転方向のみが逆向きとなった回転が、交互に繰り返される回転である。この回転は、一部の市販のシェーカーにおいても設定が可能であり、簡単に実施することができる。
【0040】
また、分析チップを水平面又は略水平面内において往復運動させて、微粒子を動かすことも可能である。この場合も微粒子が十分な速度で移動し、かつ、微粒子同士がランダムに衝突を繰り返すことになり、より複雑な運動を行うので十分な溶液の撹拌が達成される。往復運動は、任意の直線に沿った直線運動であり、かつ、ある一定の又は任意の周期で運動の向きが逆になる運動のことをいう。この場合、運動の向きが変わる直前での速度が大きいほど、微粒子に与えることができる加速度が大きくなるために、より撹拌が促進されるために好ましい。
【0041】
微粒子は、分析チップ内の微粒子を移動させて被験物質を含む溶液を攪拌させる前に充填される。分析チップに予め充填した製品形態とすることができる他、担体と容器からなる分析チップと微粒子とから構成され、使用時に微粒子を分析チップの空隙内に充填するようなる製品形態であってもよい。使用時に微粒子を空隙内に充填する方法としては、被検物質が含まれる溶液に微粒子を混入させて、該溶液のアプライと同時に微粒子を充填してもよく、又は被検物質が含まれる溶液のアプライの前又は後に、微粒子を別途添加してもよい。
【0042】
本発明における被検物質としては、測定すべき核酸、例えば、病原菌やウイルス等の遺伝子や、遺伝病の原因遺伝子等及びその一部分、抗原性を有する各種生体成分、病原菌やウイルス等に対する抗体等を挙げることができるが、これらに限定されるものではない。また、これらの被検物質を含む検体としては、血液、血清、血漿、尿、便、髄液、唾液、各種組織液等の体液や、各種飲食物並びにそれらの希釈物等を挙げることができるがこれらに限定されるものではない。また、被験物質となる核酸は、血液や細胞から常法により抽出した核酸を標識してもよいし、該核酸を鋳型として、PCR等の核酸増幅法によって増幅したものであってもよい。後者の場合には、本発明の撹拌方法を行った後の測定感度を大幅に向上させることが可能である。核酸増幅産物を検体とする場合には、蛍光物質等で標識したヌクレオシド三リン酸の存在下で増幅を行うことにより、増幅核酸を標識することが可能である。また、被験物質が抗原又は抗体の場合には、被験物質である抗原や抗体を常法により直接標識してもよいし、被験物質である抗原又は抗体を選択結合性物質と結合させた後、担体を洗浄し、該抗原又は抗体と抗原抗体反応する標識した抗体又は抗原を反応させ、担体に結合した標識を測定することもできる。
【0043】
本発明においては、上述のような標識、増幅等を施した検体を水溶液や適当な緩衝液等に溶解させて、被検物質を含む溶液(検体溶液)とする。上記被検物質を含む溶液の分析チップへのアプライは、ピペット等の通常の器具で注入することにより行うことができる。
【0044】
本発明の分析チップの担体の材質は特に限定はされないが、例えば、ガラス、セラミックス、シリコンなどの無機材料、ポリメチルメタクリレート(PMMA)、ポリエチレンテレフタレート、酢酸セルロース、ポリカーボネート、ポリスチレン、ポリジメチルシロキサン、シリコンゴムなどのポリマーを挙げることができる。これらのうち、ガラスは、加工が容易で表面が平坦でかつ滑らかであること、化学的に安定であること、洗浄が容易であること、低蛍光であることから好ましく用いることができ、要求特性に合わせて、ソーダガラス、耐熱ガラス(パイレックス(登録商標))、バイコールガラス、無アルカリガラス、石英ガラスなどを用いることができる。
【0045】
また、担体の全体又は一部を黒色にすることもできる。黒色にすることにより、担体からの自家蛍光を低減することができる。ここで、担体が黒色であるとは、可視光(波長400nm〜800nm)において、担体の黒色部分の分光反射率が特定のスペクトルパターン(特定のピークなど)を持たず、一様に低い値であり、かつ、担体の黒色部分の分光透過率も、特定のスペクトルパターンを持たず、一様に低い値であることを意味する。この分光反射率、分光透過率の値としては、可視光(波長400nm〜800nm)の範囲の分光反射率が7%以下であり、同波長範囲での分光透過率が2%以下であることが好ましい。ここで言う分光反射率は、JISZ 8722の条件Cに適合した、照明・受光光学系で、担体からの正反射光を取り込んだ場合の分光反射率をいう。黒色にする手段としては、担体に黒色物質を含有させることが挙げられる。この黒色物質は、光を反射したり透過し難いものであれば、特に制限はないが、カーボンブラック、グラファイト、チタンブラック、アニリンブラック、Ru、Mn、Ni、Cr、Fe、Co、及びCuの酸化物、Si、Ti、Ta、Zr及びCrの炭化物などの黒色物質が好ましく使用できる。これらの黒色物質は単独で含有させる他、2種類以上を混合して含有させることもできる。
【0046】
担体は、選択結合性物質をその表面に固定化するのに先立ち、必要に応じて各種の表面処理を施すことができる。かかる表面処理としては、具体的には、例えば特開2004−264289号公報に記載されるものなどを挙げることができる。
【0047】
本発明の溶液を保持する容器の材質は、特に限定はされないが、ガラスやプラスチックなどを挙げることができる。容器の形状が平坦な板状の場合であると、カバーガラスやスライドガラスなどのガラス製の板を好ましく用いることができる。一方、例えば図3や図5に示すような、容器が凹凸構造を備える場合は、ポリメチルメタクリレートやポリカーボネート、ポリプロピレンなどのプラスチック材料が、射出成形による製造が可能であり生産性の面から好ましい。
【0048】
本発明において、選択結合性物質とは、被験物質と直接的又は間接的に、選択的に結合し得る各種の物質を意味する。担体の表面に結合しうる選択結合性物質の代表的な例としては、核酸、蛋白質、ペプチド、糖類、脂質を挙げることができる。核酸としては、DNAやRNAでも良く、またPNAでも良い。特定の塩基配列を有する一本鎖核酸は、該塩基配列又はその一部と相補的な塩基配列を有する一本鎖核酸と選択的にハイブリダイズして結合するので、本発明でいう選択結合性物質に該当する。
【0049】
核酸は、生細胞等天然物由来のものであっても良いし、核酸合成装置により合成されたものであっても良い。生細胞からのDNA又はRNAの調製は、公知の方法、例えばDNAの抽出については、Blinらの方法(Blin et al., Nucleic Acids Res., 3: 2303 (1976))等により、またRNAの抽出については、Favaloroらの方法(Favaloro et al., Methods Enzymol., 65: 718 (1980))等により行うことができる。固定化する核酸としては、更に、鎖状若しくは環状のプラスミドDNAや染色体DNA、これらを制限酵素により若しくは化学的に切断したDNA断片、試験管内で酵素等により合成されたDNA、又は化学合成したオリゴヌクレオチド等を用いることもできる。また、蛋白質としては、抗体及びFabフラグメントやF(ab´)2フラグメントのような、抗体の抗原結合性断片、並びに種々の抗原を挙げることができる。抗体やその抗原結合性断片は、対応する抗原と選択的に結合し、抗原は対応する抗体と選択的に結合するので、選択結合性物質に該当する。
【0050】
糖類としては、各種単糖のほか、オリゴ糖や多糖などの糖鎖を挙げることができる。
【0051】
脂質としては、単純脂質の他、複合脂質であっても良い。更に、上記核酸、蛋白質、糖類、脂質以外の抗原性を有する物質を固定化することもできる。また、選択結合性物質として、担体の表面に細胞を固定化してもよい。
【0052】
これらの選択結合性物質のうち特に好ましいものとして、DNA、RNA、蛋白質、ペプチド、糖、糖鎖又は脂質を挙げることができる。
【0053】
選択結合性物質を担体に固定化する方法としては、選択結合性物質を含む溶液を担体表面に点着する方法が挙げられる。例えば、キャピラリー状のペンでスポッティングする方式、インクジェット方式などの公知の手法を利用することができる。スポッティング方式は、スポッター又はアレイヤーと呼ばれる高密度分注機を用いて選択結合性物質をスポットする方法である。具体的には、例えば多数のウェルをもつプレートの各ウェルに異なる選択結合性物質を含む溶液を入れておき、この溶液をピン(針)で取り上げて担体上に順番にスポットする。インクジェット方式は、ノズルから微少な液滴を圧電素子などにより噴射し、選択結合性物質を含む溶液を担体に吹き付ける方法である。具体的には、ノズルより遺伝子を噴射し、担体上に高速度で選択結合性物質を整列配置する。選択結合性物質が核酸である場合は、担体上で順次ヌクレオチドを合成することが可能であり、フォトリソグラフ法や、一塩基ずつ担体上に噴射して担体上で合成を行うインクジェットプリント方式を用いることができる。
【0054】
担体の材質がガラスである場合、スポッティング方式やインクジェット方式による点着によって選択結合性物質を固定化する方法としては、例えば、予め担体表面にシランカップリング処理を行うことで、アミノ基、エポキシ基、アルデヒド基、SH基、スクシンイミド基等の官能基を担体表面に生成させ、これを足がかりにDNAなどの選択結合性物質を担体に固定化する方法が適用可能である。例えば、アミノアルキルシランなどを用いて、ガラスの表面にアミノ基を生成させ、このアミノ基のプラスチャージとDNAのマイナスチャージとによる静電的な力により固定化することが可能となる。
【0055】
また、アミノ基に無水コハク酸を反応させることで、ガラスの担体表面にカルボキシル基を導入し、このカルボキシル基を、末端にアミノ基を導入したDNAと縮合剤を用いて反応させることにより、アミド結合を介して担体表面と選択結合性物質とを固定化することができる。さらに、選択結合性物質を固定化しやすいように、予め表面を改質したスライドガラスも市販されており、例えば、アミノシランコートガラス、ポリLリジンコートガラス、エポキシ基導入ガラス、SH基導入ガラス、アルデヒド基導入ガラスを用いることができる。
【0056】
担体の材質がポリマーの場合、担体表面に、選択結合性物質と結合可能な官能基(例えばアミノ基、ヒドロキシ基、カルボキシル基、アルデヒド基、エポキシ基など)を導入し、選択結合性物質の官能基(例えば、アミノ基を導入したDNA)と反応させることで、選択結合性物質を固定化することができる。担体表面へのこのような官能基の導入は、例えば担体表面にプラズマ処理や放射線処理(例えばγ線、電子線など)を施す方法、アルカリや酸により担体表面に処理を施す方法などの表面処理によって行うことができる。具体的な例としては、担体の材質がポリメチルメタクリレート(PMMA)の場合、水酸化ナトリウム又は硫酸の水溶液(好ましい濃度は、1N〜20N)等の酸又はアルカリ水溶液に担体を漬け込み、好ましくは30℃から80℃の温度にして、1時間から100時間の間保持すれば、担体表面にカルボキシル基を導入することができる。担体表面にカルボキシル基がある場合には、縮合剤を用いて反応させることで、例えば末端にアミノ基を導入したDNAを固定化することができる。この場合の縮合剤としては、例えば、ジシクロヘキシルカルボジイミド、N−エチル−5−フェニルイソオキサゾリウム−3’−スルホナート、1−エチル−3−(3−ジメチルアミノプロピル)カルボジイミド(EDC)を用いることができる。
【0057】
上述の方法により得られた選択結合性物質が固定化された担体は、選択結合性物質を固定した後、適当な処理をすることができる。例えば、熱処理、アルカリ処理、界面活性剤処理などを行うことにより、固定された選択結合性物質を変性させることもできる。
【0058】
選択結合性物質固定化担体は、蛍光標識化された被験物質と担体に固定化された選択結合性物質とをハイブリダイゼーション反応させ、スキャナーと呼ばれる装置で蛍光を読みとることが一般的である。スキャナーは励起光であるレーザー光を対物レンズで絞り込み、レーザー光を集光する。しかし、担体表面から自家蛍光が生じる場合、その発光がノイズとなり検出精度の低下に繋がることがある。前述したように、これを防ぎ、担体自身からの自家蛍光を低減させるために、レーザー照射により発光を生じない物質を含有させて表面を黒色にすることが好ましい。例えば、前記の黒色の担体を用いることにより、検出の際の担体からの自家蛍光を低減できる。
【0059】
選択的結合の際の反応温度及び時間は、ハイブリダイズさせる被験物質の核酸の鎖長や、免疫反応に関与する抗原及び/又は抗体の種類等に応じて適宜選択されるが、核酸のハイブリダイゼーションの場合、通常、30℃〜70℃程度で1分間〜十数時間、免疫反応の場合には、通常、室温〜40℃程度で1分間〜数時間程度である。なお、本発明の分析チップを用いる分析では、この選択的結合における反応時間を通して行っても良いし、その一部だけとしても良い。
【0060】
本発明の分析チップにおいては、上記の選択的結合反応の後、選択結合性物質固定化担体上に選択結合性物質を介して結合した被検物質の質量を測定する。この測定も、従来の分析チップにおける操作と全く同様に行うことができる。例えば、適宜蛍光標識され、選択結合性物質と結合した被検物質の質量について、公知のスキャナ等により、その蛍光量を読み取ることにより測定することができる。
【実施例】
【0061】
本発明を以下の実施例によって更に詳細に説明する。もっとも、本発明は下記実施例に限定されるものではない。
【0062】
実施例1
(基板の作製)
公知の技術である射出成型法により、図6に示すカーボンブラックを含有したポリメチルメタクリレート(PMMA)製の平板の担体を作製した。すなわち、担体の外形は75mm×25mm×1mmである。
【0063】
(プローブDNAの固定化)
上記の担体を10Nの水酸化ナトリウム水溶液に65℃で12時間浸漬した。次いで、純水、0.1NHCl水溶液、純水の順で洗浄した。このようにして、担体表面のPMMAの側鎖を加水分解して、カルボキシル基を生成した。
【0064】
担体上に固定化する選択結合性物質として、配列番号1(60塩基、5’末端アミノ化)で表される塩基配列を有するDNA(以下、配列番号1のDNAと記載することがある)を合成した。配列番号1のDNAは5’末端がアミノ化されている。
【0065】
これらのDNAを、純水に0.27nmol/μlの濃度で溶かして、ストックソリューションとした。担体に点着する際は、PBS(NaClを8g、Na2HPO4・12H2Oを2.9g、KClを0.2g、KH2PO4を0.2g純水に溶かし1lにメスアップしたものにpH調整用の塩酸を加えてpH5.5としたもの)でプローブの終濃度を0.027nmol/μlとし、かつ、担体表面のカルボン酸とプローブDNAの末端のアミノとを縮合させるため、1−エチル−3−(3−ジメチルアミノプロピル)カルボジイミド(EDC)を加え、この終濃度を50mg/mlとした。そして、これらの混合溶液をおよそ40μl取り出して、スポッティング用ロボット(日本レーザー電子(株)、GTMASStamp−2)を用い、担体中央部に6×4=24個のDNAのスポットを行った。次いで、担体を密閉したプラスチック容器に入れて、37℃、湿度100%の条件で20時間程度インキュベートして、純水で洗浄した。
【0066】
(検体DNAの調製)
検体DNA(被験物質)として、上記DNA固定化担体とハイブリダイズ可能な塩基配列を持つ配列番号4のDNA(968塩基)を用いた。調製方法を以下に示す。配列番号2と配列番号3のDNAを合成した。これを純水にとかして濃度を100μMとした。次いで、pKF3プラスミドDNA(タカラバイオ(株)製品番号;3100)(配列番号5で表される塩基配列を有するDNA:2264塩基)を用意して、これをテンプレートとし、配列番号2及び配列番号3のDNAをプライマーとして、PCR反応(PolymeraseChain Reaction)により増幅を行った。
【0067】
PCRの条件は以下の通りである。すなわち、ExTaq2μl、10×ExBuffer 40μl、dNTP Mix32μl(以上はタカラバイオ(株)製 製品番号RR001Aに付属)、配列番号2で表される塩基配列を有するDNAの溶液を2μl、配列番号3で表される塩基配列を有するDNAの溶液を2μl、テンプレート(配列番号5で表される塩基配列を有するDNA)を0.2μl加え、純水によりトータル400μlにメスアップした。これらの混合液を、4つのマイクロチューブに分け、サーマルサイクラーを用いてPCR反応を行った。これを、エタノール沈殿により精製し、40μlの純水に溶解した。PCR反応後の溶液の一部をとり電気泳動で確認したところ、増幅したDNAの塩基長は、およそ960塩基であり配列番号4のDNA(968塩基)が増幅されていることを確認した。
【0068】
次いで、9塩基のランダムプライマー(タカラバイオ(株)製;製品番号3802)を6mg/mlの濃度に溶かし、上記のPCR反応後精製したDNA溶液に2μl加えた。この溶液を100℃に加熱した後、氷上で急冷した。これらにKlenowFragment(タカラバイオ(株)製;製品番号2140AK)付属のバッファーを5μl、dNTP混合物(dATP、dTTP、dGTPの濃度はそれぞれ2.5mM、dCTPの濃度は400μM)を2.5μl加えた。さらに、Cy3−dCTP(アマシャムファルマシアバイオテク製;製品番号PA53021)を2μl加えた。この溶液に10UのKlenow Fragmentを加え、37℃で20時間インキュベートし、Cy3で標識された検体DNAを得た。なお、標識の際ランダムプライマーを用いたので検体DNAの長さには、ばらつきがある。最も長い検体DNAは配列番号4のDNA(968塩基)となる。なお、検体DNAの溶液を取り出して、電気泳動で確認したところ、960塩基に相当する付近にもっとも強いバンドが現れ、それより短い塩基長に対応する領域に薄くスメアがかかった状態であった。そして、これをエタノール沈殿により精製し、乾燥した。
【0069】
この標識化された検体DNAを、1重量%BSA(ウシ血清アルブミン)、5×SSC(5×SSCとはNaClを43.8g、クエン酸3ナトリウム水和物を22.1gの純水にとかし、200mlにメスアップしたもの。またNaClを43.8g、クエン酸3ナトリウム水和物を22.1g純水にとかし、1lにメスアップしたものを1×SSCと表記し、これの10倍濃縮液を10×SSC、5倍希釈液を0.2×SSCと表記する)、0.1重量%SDS(ドデシル硫酸ナトリウム)、0.01重量%サケ精子DNAの溶液(各濃度はいずれも終濃度)、800μlに溶解し、ハイブリダイゼーション用検体のストック溶液とした。
【0070】
以下の実施例、比較例において、ハイブリダイゼーションの際の検体溶液は、特に断りのない限り、上記で調製したストック溶液を、1重量%BSA、5×SSC、0.01重量%サケ精子DNA、0.1重量%SDSの溶液(各濃度はいずれも終濃度)で200倍に希釈したものを用いた。なお、この溶液の検体DNAの濃度を測定したところ、1.5ng/μLであった。
【0071】
(溶液を保持する容器の接着)
厚さ1mmのPMMA板から切削加工により図7に示す貫通孔を4つ有する溶液を保持する容器を作製し、これを図8に示す両面テープ9(厚さ120μm)を5枚重ねて用いて、プローブDNAの固定化領域に被さるように担体と接着した。両面テープの内枠のサイズは、11×13.5mmである。
【0072】
(微粒子の調製と充填)
表面粗さが20(nm)、平均粒径が200μmの市販ジルコニア製微粒子(東レ株式会社製)を、炭化珪素質研磨材(粒度#20)を用い遠心式バレル研磨機で1時間、水中にて研磨を行い、水洗して乾燥した。前記微粒子の表面粗さは、Ra=165nmであった。かかる微粒子の表面粗さの測定は、その表面をAuで真空蒸着した後、走査型電子顕微鏡(株式会社エリオニクス製、型式ESA−2000)で表面粗さRa(nm)を測定した。前記表面粗さは、観察倍率を10,000倍、カットオフ値を0とし、任意の10個について測定し、その平均値を求めた。かかる微粒子の粒径は、実体顕微鏡で任意の100個以上の微粒子の画像を50〜150倍で撮影した後、画像処理解析ソフト(三谷商事社株式会社製、Win Roof)により円相当径を求めて平均値を算出し、それを平均粒径とした。その後エタノール溶液に浸漬し、超音波洗浄を5分間行った。さらに同様の洗浄を2回繰り返した。この微粒子を溶液を保持する容器の貫通孔から、充填率が、30%、40%、50%、60%となるように、4枚のDNAチップに充填した。
【0073】
(ハイブリダイゼーション)
微粒子が充填されたDNAチップ4枚にマイクロピペットを用いて、溶液を保持する容器の貫通孔より、微粒子が充填された空隙に、上記で調製したハイブリダイゼーション検体溶液を貫通孔から少し溢れる程度まで注入した。その後、封止部材としてシリコンテープ(アズワン)を用い、4つの貫通孔を塞いだ。ハイブリダイゼーションチャンバー(Takara Hybridization chamber(タカラバイオ(株))をシート振盪台(東京理化器械(株)製 MMS FIT−S)に密着させて固定し、分析チップを水平面を基準に0.06度傾くように、選択結合性物質の固定化面が鉛直下向きとなるように、ハイブリダイゼーションチャンバー内にセットした。この時、チップをセットする位置の両端の凹みに、15μLずつ超純水を滴下した。ハイブリダイゼーションチャンバーのふたを閉めて6本の固定ネジを締めて固定後、42℃に設定した恒温チャンバー(東京理化器械(株)製 FMS−1000)内に据え付けた振盪機(東京理化器械(株)製 MMS−310)の上に載せて固定した。恒温チャンバーの前面をアルミホイルで遮光して、250回転/分で回転振盪しながら、42℃で16時間インキュベートした。インキュベート後、ハイブリダイゼーションチャンバーからチップを取り出し、溶液を保持する容器と両面テープを剥がし、洗浄、乾燥した。
【0074】
(測定)
DNAチップ用のスキャナー(Axon Instruments社 GenePix 4000B)に、上記処理後の担体をセットし、レーザー出力33%、フォトマルチプライヤーの電圧設定を500にした状態で、選択結合性物質であるDNAを固定化した担体上の24個のスポットの蛍光強度の測定を行った。その結果を表1に示す。表1中に示す数値(%)は、1枚の担体内の24個のスポットの蛍光強度のCV値である。結果をみると、30〜60%の各充填率において、蛍光強度のばらつきを表すCV値が10%以下であり、24個の各スポットにおいて、微粒子による溶液の撹拌のムラが生じることなく、担体に固定化されたDNAと検体DNAとが均一に反応したことが分かった。
【0075】
比較例1
微粒子の充填率を20%と70%としたこと以外は、実施例1と同様の操作を行った。結果を表1に示す。結果をみると、充填率20%と70%共に蛍光強度のCV値が10%以上と大きく、24個の各スポットにおいて、微粒子による溶液の撹拌のムラが生じ、担体に固定化されたDNAと検体DNAとが均一に反応しなかったことが分かった。
【0076】
実施例2
平均粒径が500μmの微粒子を用いたこと以外は実施例1と同様の操作を行った。結果を表1に示す。結果をみると、30〜60%の各充填率において、蛍光強度のばらつきを表すCV値が10%以下であり、24個の各スポットにおいて、微粒子による溶液の撹拌のムラが生じることなく、担体に固定化されたDNAと検体DNAとが均一に反応したことが分かった。
【0077】
比較例2
微粒子の充填率を20%と70%としたこと以外は、実施例2と同様の操作を行った。結果を表1に示す。結果をみると、充填率20%と70%共に蛍光強度のCV値が10%以上と大きく、24個の各スポットにおいて、微粒子による溶液の撹拌のムラが生じ、担体に固定化されたDNAと検体DNAとが均一に反応しなかったことが分かった。
【0078】
実施例3
実施例1で用いたジルコニア製微粒子の代わりに、以下のようにして調製したガラスビーズを用いて、実施例1と同様の操作を行った。
【0079】
(ガラスビーズの修飾と充填)
直径が200μmのガラスビーズ10gを10NNaOH溶液に浸漬した後、純水で洗浄した。ついで、APS(3−アミノプロピルトリエトキシシラン;信越化学工業(株)製)を2重量%の割合で純水に溶解した後、上記のガラスビーズを1時間浸漬し、この溶液から取り出した後に110℃で10分間乾燥した。このようにして、ガラスビーズの表面にアミノ基を導入した。
【0080】
ついで、5.5gの無水コハク酸を1−メチル−2−ピロリドン335mlに溶解させた。1Mの50mlのホウ酸ナトリウム(ホウ酸3.09gとpH調整用の水酸化ナトリウムを加えて、純水で50mlにメスアップしたもの。pH8.0)に上記コハク酸溶液に加えた。この混合液に上記のガラスビーズを20分間浸漬した。浸漬後、純水で洗浄及び乾燥した。このようにして、ガラスビーズの表面のアミノ基と無水コハク酸を反応させて、ガラスビーズ表面にカルボキシル基を導入した。このガラスビーズを溶液を保持する容器の貫通孔から、充填率が、30%、40%、50%、60%となるように、4枚に充填した。
【0081】
結果を表1に示す。結果をみると、実施例1と同様に、30〜60%の各充填率において、蛍光強度のばらつきを表すCV値が10%であり、24個の各スポットにおいて、微粒子による溶液の撹拌のムラが生じることなく、担体に固定化されたDNAと検体DNAとが均一に反応したことが分かった。
【0082】
比較例3
ガラスビーズの充填率を20%と70%としたこと以外は、実施例3と同様の操作を行った。結果を表1に示す。結果をみると、充填率20%と70%共に蛍光強度のCV値が10%以上と大きく、24個の各スポットにおいて、微粒子による溶液の撹拌のムラが生じ、担体に固定化されたDNAと検体DNAとが均一に反応しなかったことが分かった。
【0083】
実施例4
平均粒径が500μmのガラスビーズを用いたこと以外は実施例3と同様の操作を行った。結果を表1に示す。結果をみると、実施例3と同様に、30〜60%の各充填率において、蛍光強度のばらつきを表すCV値が10%以下であり、24個の各スポットにおいて、微粒子による溶液の撹拌のムラが生じることなく、担体に固定化されたDNAと検体DNAとが均一に反応したことが分かった。
【0084】
比較例4
ガラスビーズの充填率を20%と70%としたこと以外は、実施例4と同様の操作を行った。結果を表1に示す。結果をみると、充填率20%と70%共に蛍光強度のCV値が10%以上と大きく、24個の各スポットにおいて、微粒子による溶液の撹拌のムラが生じ、担体に固定化されたDNAと検体DNAとが均一に反応しなかったことが分かった。
【0085】
【表1】

【符号の説明】
【0086】
1 溶液を保持する容器
2 担体
3 微粒子
4 シーリング部材
5 選択結合性物質
6 空隙(被験物質溶液が含まれていてもよい)
7 ベース担体
8 凸部構造部材
9 両面テープ
10 選択結合性物質固定化領域
11 貫通孔
12 液面駐止用チャンバー
13 微粒子が移動可能な表面
【特許請求の範囲】
【請求項1】
表面に選択結合性物質が固定化された担体と、選択結合性物質と反応する被検物質を含む溶液を保持するための容器と、該担体と該容器によって形成される空隙に充填された微粒子からなり、該微粒子の充填率が30%以上60%以下であることを特徴とする分析チップ。
【請求項2】
微粒子の密度が2g/cm3以上7g/cm3以下である、請求項1に記載の分析チップ。
【請求項3】
微粒子の材質がジルコニアである、請求項1又は2に記載の分析チップ。
【請求項4】
担体と容器とがシーリング部材を介して接触している、請求項1〜3のいずれか1項に記載の分析チップ。
【請求項1】
表面に選択結合性物質が固定化された担体と、選択結合性物質と反応する被検物質を含む溶液を保持するための容器と、該担体と該容器によって形成される空隙に充填された微粒子からなり、該微粒子の充填率が30%以上60%以下であることを特徴とする分析チップ。
【請求項2】
微粒子の密度が2g/cm3以上7g/cm3以下である、請求項1に記載の分析チップ。
【請求項3】
微粒子の材質がジルコニアである、請求項1又は2に記載の分析チップ。
【請求項4】
担体と容器とがシーリング部材を介して接触している、請求項1〜3のいずれか1項に記載の分析チップ。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【公開番号】特開2012−233752(P2012−233752A)
【公開日】平成24年11月29日(2012.11.29)
【国際特許分類】
【出願番号】特願2011−101577(P2011−101577)
【出願日】平成23年4月28日(2011.4.28)
【出願人】(000003159)東レ株式会社 (7,677)
【Fターム(参考)】
【公開日】平成24年11月29日(2012.11.29)
【国際特許分類】
【出願日】平成23年4月28日(2011.4.28)
【出願人】(000003159)東レ株式会社 (7,677)
【Fターム(参考)】
[ Back to top ]

