分析方法およびキット
【課題】核酸配列の検出または分析のためのRNAプローブを使用する分析方法を提供する。
【解決手段】RNAプローブ3を、該核酸配列を含有する疑いのあるサンプル1と接触させ、それが二本鎖を形成したら、それを加水分解する。これは、例えば増幅反応中に行うことができる。該加水分解により生成したAMPをATPに変換する。ついで生物発光試薬を使用して、該ATPを検出することができる。RNA加水分解プローブ2は、サンプル中の非常に特異的な核酸配列の存在を示すシグナルを生成するための非常に多用途の手段となる。生物発光検出系と組合せてそのようなプローブを使用するアッセイの感度は高く、シグナルを迅速に生成させることが可能である。
【解決手段】RNAプローブ3を、該核酸配列を含有する疑いのあるサンプル1と接触させ、それが二本鎖を形成したら、それを加水分解する。これは、例えば増幅反応中に行うことができる。該加水分解により生成したAMPをATPに変換する。ついで生物発光試薬を使用して、該ATPを検出することができる。RNA加水分解プローブ2は、サンプル中の非常に特異的な核酸配列の存在を示すシグナルを生成するための非常に多用途の手段となる。生物発光検出系と組合せてそのようなプローブを使用するアッセイの感度は高く、シグナルを迅速に生成させることが可能である。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、例えばサンプル中の特定の配列の存在を検出したり特定の核酸の厳密な配列を決定するために核酸配列を分析するための方法、ならびにこれらの方法において使用するキットおよび試薬に関する。
【背景技術】
【0002】
現在、核酸の分析を行うための多種多様な方法が存在する。特定の核酸配列を含有する疑いのあるサンプル中で該核酸配列の存在または量を検出するような分析方法もあり、また、情報を得るために又は診断目的のために核酸の構造を明らかにしてそのヌクレオチド配列を決定するような方法もある。
【0003】
特定の核酸配列が微量でしか存在しない場合には特に、この分析を行うために又はこの分析を補助するために、増幅反応が一般に用いられる。標的核酸配列を検出するためにポリメラーゼ連鎖反応(PCR)のような増幅反応を用いることがよく知られている。増幅反応混合物は、特定の配列に特異的な1以上のプライマーを含む。これらはサンプルチューブ中の一本鎖形態の特異的標的配列にハイブリダイズする。標的配列が存在すれば、プライマーはそれに結合し、該混合物中に存在するポリメラーゼ酵素が、ある温度条件でプライマーを伸長させて完全な相補鎖を形成する。ついでこの物質は、変性、プライマーアニーリングおよび伸長の後続サイクルにおける増幅のための更なる鋳型を形成する。
【0004】
増幅産物は、例えば、電気泳動ゲル上で検出することができる。一方、増幅反応が生じた時点を検出するために、および/または、その進行をモニターするために、現在では蛍光標識法が頻繁に用いられている。そのようなアッセイの具体例には、TAQMAN(商標)アッセイ、およびWO 99/28500、WO 99/28501、WO 99/42611およびWO 99/66071に記載され特許請求されているアッセイが含まれる。WO 98/04728には、標識リボオリゴヌクレオチドプローブを使用するアッセイが記載されている。しかし、プローブの標識は、コストを増大させる複雑な工程である。
【0005】
核酸配列の配列決定方法もよく知られている。ゲル法が常套手段である。より新しい方法は、Pyrosequencing ABから入手可能なPyrosequencerのような装置を使用して行われ、これは、一本鎖核酸鋳型上での相補鎖の構築中に正しいヌクレオチドが付加された場合に可視シグナルが生成することに基づく。WO 99/46409には、ピロホスホロリシス反応を用いて核酸サンプル中の特定の塩基の同一性を調べるための他の方法が記載されている。
【先行技術文献】
【特許文献】
【0006】
【特許文献1】国際公開第99/28500号
【特許文献2】国際公開第99/28501号
【特許文献3】国際公開第99/42611号
【特許文献4】国際公開第99/66071号
【特許文献5】国際公開第98/04728号
【特許文献6】国際公開第99/46409号
【発明の概要】
【0007】
本出願人は、標識されていないRNAプローブが、そのような事象をモニターまたは検出するための有利な手段となりうることを見出した。
【0008】
本発明は、サンプル中の核酸配列を検出または分析するための方法であって、該配列とRNAプローブとを、該プローブが該配列に結合する条件下で接触させ、核酸/プローブ複合体を、核酸に結合したRNAプローブが加水分解される条件に付してアデノシン一リン酸(AMP)を生成させ、生成したAMPを検出し、これを、該サンプル中の核酸配列の存在または性質と関連づけることを含んでなる方法を提供する。
【0009】
RNAプローブは、二本鎖形態である場合には、種々の酵素により容易に加水分解されうる。これらには、PCR反応において一般に使用されるポリメラーゼ酵素、例えばTaqポリメラーゼが含まれる。あるいは、RNAプローブは、それが二本鎖形態(例えば、RNA/DNA二本鎖)である場合にのみそれを加水分解するRNアーゼ酵素により加水分解されうる。そのような二本鎖はPCR反応のような増幅反応の過程で形成されうるが、必ずしもこのようになる訳ではない。
【0010】
本発明の方法において行うRNAの加水分解はアデノシン一リン酸(AMP)を与える。これは、直接的に又はアデノシン二リン酸の生成を介して、アデノシン三リン酸(ATP)に酵素によりリン酸化されうる。
【0011】
ATPは、生物発光系を用いて容易に検出することが可能であり、その具体例として、ルシフェラーゼ/ルシフェリン検出系が挙げられる。そのような検出系の適用の具体例は、例えば、WO 96/02665に記載されている。
【0012】
ルシフェラーゼ/ルシフェリン系のような生物発光系は、必要なポリメラーゼ活性を得るためにPCR反応において通常加えられるデオキシATP(dATP)とは反応しない。したがって、それは、RNAプローブの加水分解により生成したATPと、他の目的で該反応混合物に加えることが必要となりうる任意のdATPとを識別しうるであろう。
【0013】
生物発光検出系は蛍光系より高感度である。したがって、分析方法においてRNA加水分解プローブを使用すると、サンプル中の核酸レベルでの相互作用の検出が促進されるため、分析方法が改善される。
【0014】
特定の実施形態においては、本発明は、サンプル中の標的核酸の存在または量を検出するための方法であって、サンプル中の核酸を変性させ、これを、該標的核酸の少なくとも一部に特異的であるRNA加水分解プローブと接触させて、該プローブが該標的核酸と二本鎖を形成するようにし、二本鎖形態(例えば、RNA/DNA二本鎖)であるRNAを加水分解する酵素と、生成したアデノシン一リン酸をアデノシン三リン酸に変換するのに必要な1以上の酵素または試薬とを加え、ATPの存在に反応する生物発光試薬を該サンプルに加え、該生物発光試薬からのシグナルを検出し、それを、該標的核酸配列の存在または量と関連づけることを含んでなる方法を提供する。
【0015】
この方法は、増幅反応において頻繁に行われるであろう。したがって、もう1つの特定の実施形態において、本発明は、サンプル中の標的核酸の存在または量を検出するための方法であって、(a)該標的核酸の少なくとも一部に特異的なRNAプローブ、(b)二本鎖形態(例えば、RNA/DNA二本鎖)であるRNAを加水分解する酵素、および(c)生成したアデノシン一リン酸をアデノシン三リン酸に変換するのに必要な1以上の酵素または試薬の存在下、ポリメラーゼ連鎖反応のような増幅反応を行い、ATPの存在に反応する生物発光試薬を該サンプルに加え、該生物発光試薬からのシグナルを検出し、それを、該標的核酸配列の存在または量と関連づけることを含んでなる方法を提供する。
【0016】
二本鎖形態のRNAを加水分解する酵素(前記(b))は、増幅反応において使用するポリメラーゼであるのが適当である。本発明において使用しうる適当なDNAポリメラーゼの具体例としては、熱安定ポリメラーゼ、例えば、テルムス・アクアティカス(Thermus aquaticus)ポリメラーゼ(Taq)、テルムス・サーモフィルス(Thermus thermophilus)ポリメラーゼ(Tth)、テルムス属種(Thermus species)NHポリメラーゼ(TspNH)、テルムス・ブロッキアヌス(Thermus brockianus)ポリメラーゼ(Tbr)(すべて、例えば、GeneSys Limited,Farnborough,U.K.から入手可能)、ピロコッカス・フリオサス(Pyrococcus furiosus)ポリメラーゼ(Pfu)(Stratageneから入手可能)、9°N7エキソDNAポリメラーゼおよびテルモコッカス・リトラリス(Thermococcus litoraris)DNAポリメラーゼ(New England BiolabsからVENT(商標)DNAポリメラーゼとして入手可能)が挙げられる。しかし、これが該RNAを十分に速く加水分解しない場合、例えば、迅速なPCRを行う場合には、当技術分野において公知の適当なRNアーゼ、特にDNA依存性RNアーゼを加えることも可能であろう。
【0017】
生成したアデノシン一リン酸をアデノシン三リン酸に変換するのに必要な1以上の酵素(前記(c))は、例えば、同様に該反応混合物に試薬として加えるリン酸(ホスファート)およびホスホエノールピルビン酸(ホスホエノールピルバート)の存在下でAMPから直接的にATPを生成するホスホエノールピルビン酸シンターゼから選ばれうる。あるいは、ヌクレオシド三リン酸−アデニル酸キナーゼとNTPとの組合せはアデノシン二リン酸(ADP)を与え、ついでこれは、アデニル酸キナーゼのような酵素を含有させること又は添加することによりATPに変換されうる。
【0018】
適当な酵素の他の具体例には、Eisakiら,Biochim.et Biophys Acta 1431(1999)363−373に記載されているようなピルビン酸リン酸ジキナーゼが含まれる。
【0019】
ATPの存在に反応する特に適した生物発光試薬には、ルシフェリンおよびルシフェラーゼが含まれ、それらは、必要に応じて、酢酸マグネシウムのようなマグネシウムイオン源を伴う。ATPの存在下、これらの試薬は発光シグナルを生成し、これは、通常のルミノメーター装置を使用して容易にモニターすることができる。
【0020】
シグナルの生成の際、これらの試薬はAMP分子を再生し、これは、(c)の酵素および/または試薬の存在下、再びATPに変換される。したがって、該シグナルは指数関数的に増加し、したがって容易かつ迅速に検出される。そのような系の一例は、Sakakibaraら,Analytical Biochemistry,268,94−101(1999)に記載されている。シグナルのこの指数関数的増加は、従来は増幅反応を要したかもしれない状況において、直接的に検出を行いうることを意味するであろう。
【0021】
増幅反応の進行をモニターできるよう、増幅反応の全体を通じて生物発光試薬を存在させるか添加するのが適当である。一般には、ルシフェラーゼのような試薬の熱安定性は、増幅反応の全体を通じてそれが存在しうるのに十分なものではなく、したがって、各サイクルの終了時にそれを加えるのが適切である。ついで、当技術分野で公知のアルゴリズムなどを用いて、サンプル中の標的核酸配列の定量において、そのような情報を利用することができる。
【0022】
該増幅反応は、通常の方法で、例えば、反応混合物を変性温度、アニーリング温度および伸長温度の循環(サイクリング)に付すことにより行うことができる。
【0023】
前記の反応は、種々の通常の装置中で行うことができる。これらには、例えば、適当なシグナル検出手段を既に備えたPyrosequencer(Pyrosequencing AB,Swedenから入手可能)が含まれる。あるいは、例えば、EP−A−0810030に記載されThe Perkin−Elmer Corporationにより供給されるブロック(block)加熱装置、Idaho Technologys Inc.のRapidCycler(商標)およびLightCycler(商標)のような高速熱風サーマルサイクラー、またはWO98/24548に記載されているような他のタイプのサーマルサイクラーを使用して、該反応を行うことができる。
【図面の簡単な説明】
【0024】
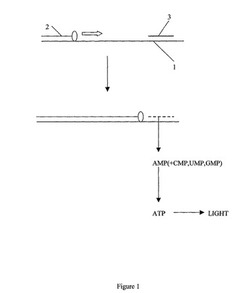
【図1】図1は、本発明の方法の例を示す。
【0025】
図1は、本方法の概要を例示する。PCR反応の初期段階においては、特定の核酸配列を含有する又は含有する疑いのあるサンプルを、DNAが変性する温度に加熱して、一本鎖鋳型鎖(1)を形成させる。通常のPCRプライマー(2)は該鋳型鎖の一方の末端に結合し、一方、相補的RNAプローブ(3)は該標的配列上のその他の位置に結合する。ついでポリメラーゼ酵素が該反応の伸長段階中に作用して、矢印の方向にプライマー(2)を伸長させて、完全長相補鎖を形成させる。この過程の経過中、RNAプローブ(3)が、破線で例示されているとおりに加水分解されてAMPを遊離し、これはin situでATPに変換される。ついでこのATPは光シグナルとして検出される。
【0026】
本発明の方法は、配列決定用途および/またはDNAもしくはRNA配列中の多型もしくは変異の検出にも応用することができる。
【0027】
もう1つの態様において、本発明は、核酸の配列の決定方法であって、
(i)該配列の既知領域にRNAプローブを結合させて、該プローブの末端の少なくとも1つのヌクレオチドが該配列の未知または不明領域内に達するようにし、
(ii)二本鎖形態(例えば、RNA/DNA二本鎖)であるRNAを加水分解する酵素を使用して、該RNAプローブを加水分解し、
(iii)生成したアデノシン一リン酸をアデノシン三リン酸に変換し、
(iv)ATPの存在に反応する生物発光試薬を該サンプルに加え、
(v)該生物発光試薬からのシグナルを検出し、
(vi)そのシグナルを、該プローブの末端に相補的である又はそうでない配列の領域の存在と関連づけることを含んでなる方法を提供する。
【0028】
そのような場合、該プローブの末端の1以上のヌクレオチドが該未知または不明配列と厳密に相補的であれば、該プローブはそれに最も効率的に結合し、工程(ii)において該結合プローブを効率的に加水分解するであろう。その結果、AMPが生成し、前記のとおり、これはATPに変換され、生物発光系を用いて検出される。
【0029】
しかし、RNAプローブの末端のヌクレオチドが鋳型DNAに厳密にマッチしたものでない場合には、(ii)における該酵素の効果は、該プローブを無傷のまま該鋳型からほぼ除去するものとなろう。その結果、有意な加水分解は生じず、これは、生成した生物発光シグナルの欠如または実質的な減少として表されるであろう。
【0030】
この反応は、異なるヌクレオチドを末端領域に有するプローブを使用して、2回以上行うことが可能である。例えば、この位置の配列中に見出されるヌクレオチドが既知でない場合には、4個の異なるプローブ(それぞれは、異なるヌクレオチドC、G、UおよびAを末端に有する)を調製することができる。これらのそれぞれを個々に使用して本発明の方法を行うことにより、生成したシグナルのレベルから、この位置にはどれが妥当なヌクレオチドであるかが容易に判明するはずである。該プローブが末端に相補的ヌクレオチドを含む反応においてのみ、良好なシグナルが予想されるであろう。
【0031】
所望により、2以上の未知ヌクレオチド(例えば、3個までのヌクレオチド)を末端に含有させることが可能である。そのような場合には、すべての可能な配列の組合せを表すプローブを、それらの位置において使用することができる。厳密に相補的な配列を末端に有するプローブが効率的に加水分解されると予想されるであろう。
【0032】
用いられる末端は、未知または不明配列と比較した場合の既知配列の性質に応じて、プローブの3’または5’末端でありうる。このことを考慮して、工程(ii)で使用する酵素を選択する。該末端が3’末端であり、工程(ii)で使用する酵素が、良好な「プルーフリーディング」機能を有するとみなされる酵素でしばしば見られる3’−5’加水分解を引き起こしうる場合に(3’−5’加水分解と比較した場合)、強固に結合したRNAプローブの加水分解が、より良好に生じうる。
【0033】
多数の反応を行う場合には、アレイとして配置された別々の反応チューブ、ウェルまたは容器中でこれらを同時に適切に行うことができる。それらのチューブ、ウェルまたは容器を一緒に循環(サイクリング)させ、配置された適当なルミノメーターを使用して各チューブからのシグナルをモニターすることができる。
【0034】
あるいは、例えば、後記の特定の試験配列中の多型または対立遺伝子変異に関する診断試験を行うために、例えば「ディップスティック」形態の支持体上にプローブを固定化することができる。
【0035】
該方法で使用する酵素および試薬は、後記の核酸サンプルの存在または量を検出するために用いる方法で使用するものに類似している。同様に、該反応は前記の装置内で行うことができる。
【0036】
該反応は、PCR反応のような増幅反応と共に用いることができる。例えば、該反応は、PCR反応の後に行うことができる。工程(ii)の加水分解を達成するために、PCR反応の少なくとも幾つかの段階を行うことができる。しかし、一般には、これは必ずしも必要ではない。なぜなら、検出されたAMPの「再利用(リサイクリング)」の結果、該系自体が、良好な増幅シグナルを与えるからである。
【0037】
そのような方法は、例えば万能(universal)プライミング配列の場合のように出発配列の少なくとも一部が既知である配列決定において有用であろう。ついで、該配列の長さに沿って該方法を繰返すことにより、該配列を分離することができる。例えばリボタイピングにおいて行われるとおり、例えば、該配列がその長さに沿って幾つかの保存領域を含有することが知られている場合には、RNAオリゴヌクレオチドライブラリーをプローブとして使用して、該配列を明らかにするための平行反応が可能であろう。該RNAプローブを配置するために、これらの領域のそれぞれはを既知配列として使用することができる。
【0038】
本発明の方法を用いて、確認のために逆方向の配列決定を行うことも可能である。保存領域の存在により可能な場合には、反応のアレイを使用して、これを平行して行うことができる。
【0039】
あるいは、診断のための多型または対立遺伝子変異の検出において該方法を用いることができる。そのような場合、該配列は、多型または変異の遺伝子座においては不明でありうる1以上のヌクレオチドの小さな領域以外は、概ね既知でありうる。そのような場合には、少なくとも末端領域ヌクレオチドが該配列中の多型または変異に対応するようRNAプローブを設計する。この場合、効率的な加水分解であるかどうかが、実際の配列がプローブ配列に相補的であるか否かを示す。
【0040】
これらの反応は、前記の反応チューブ、ウェルまたは容器中で行うことができる。この場合も、多数の反応が行われるアレイにおいて、それらを行うのが便宜である。
【0041】
さらにもう1つの態様においては、本発明は、前記の方法において使用するキットを提供する。そのようなキットは、標的配列に特異的である少なくとも1つのRNAプローブと、所望により更に、AMPをATPに変換するための手段とを含む。多型の検出方法の場合には、該キットは、異なるヌクレオチドが3’末端に存在することにおいてのみ異なる4個までの類似したRNAプローブを含みうる。
【0042】
キットは、適切には、該方法において使用する1以上の更なる試薬を含む。特に、それは、ルシフェラーゼおよび/またはルシフェリンのような生物発光試薬をも含みうる。所望により使用する、キットの他の特定の成分には、特定の増幅において使用するプライマーが含まれうる。また、キットは、RNAを加水分解するDNAポリメラーゼまたはRNアーゼ(前記のとおり)を含有しうる。
【0043】
増幅を引き起こすために要求されうるバッファー、ヌクレオチド、ポリメラーゼ酵素などのような他の試薬も含まれうる。
【0044】
したがって、RNA加水分解プローブは、サンプル中の非常に特異的な核酸配列の存在を示すシグナルを生成するための非常に多用途の手段となる。生物発光検出系と組合せてそのようなプローブを使用するアッセイの感度は高く、シグナルを迅速に生成させることが可能である。
【技術分野】
【0001】
本発明は、例えばサンプル中の特定の配列の存在を検出したり特定の核酸の厳密な配列を決定するために核酸配列を分析するための方法、ならびにこれらの方法において使用するキットおよび試薬に関する。
【背景技術】
【0002】
現在、核酸の分析を行うための多種多様な方法が存在する。特定の核酸配列を含有する疑いのあるサンプル中で該核酸配列の存在または量を検出するような分析方法もあり、また、情報を得るために又は診断目的のために核酸の構造を明らかにしてそのヌクレオチド配列を決定するような方法もある。
【0003】
特定の核酸配列が微量でしか存在しない場合には特に、この分析を行うために又はこの分析を補助するために、増幅反応が一般に用いられる。標的核酸配列を検出するためにポリメラーゼ連鎖反応(PCR)のような増幅反応を用いることがよく知られている。増幅反応混合物は、特定の配列に特異的な1以上のプライマーを含む。これらはサンプルチューブ中の一本鎖形態の特異的標的配列にハイブリダイズする。標的配列が存在すれば、プライマーはそれに結合し、該混合物中に存在するポリメラーゼ酵素が、ある温度条件でプライマーを伸長させて完全な相補鎖を形成する。ついでこの物質は、変性、プライマーアニーリングおよび伸長の後続サイクルにおける増幅のための更なる鋳型を形成する。
【0004】
増幅産物は、例えば、電気泳動ゲル上で検出することができる。一方、増幅反応が生じた時点を検出するために、および/または、その進行をモニターするために、現在では蛍光標識法が頻繁に用いられている。そのようなアッセイの具体例には、TAQMAN(商標)アッセイ、およびWO 99/28500、WO 99/28501、WO 99/42611およびWO 99/66071に記載され特許請求されているアッセイが含まれる。WO 98/04728には、標識リボオリゴヌクレオチドプローブを使用するアッセイが記載されている。しかし、プローブの標識は、コストを増大させる複雑な工程である。
【0005】
核酸配列の配列決定方法もよく知られている。ゲル法が常套手段である。より新しい方法は、Pyrosequencing ABから入手可能なPyrosequencerのような装置を使用して行われ、これは、一本鎖核酸鋳型上での相補鎖の構築中に正しいヌクレオチドが付加された場合に可視シグナルが生成することに基づく。WO 99/46409には、ピロホスホロリシス反応を用いて核酸サンプル中の特定の塩基の同一性を調べるための他の方法が記載されている。
【先行技術文献】
【特許文献】
【0006】
【特許文献1】国際公開第99/28500号
【特許文献2】国際公開第99/28501号
【特許文献3】国際公開第99/42611号
【特許文献4】国際公開第99/66071号
【特許文献5】国際公開第98/04728号
【特許文献6】国際公開第99/46409号
【発明の概要】
【0007】
本出願人は、標識されていないRNAプローブが、そのような事象をモニターまたは検出するための有利な手段となりうることを見出した。
【0008】
本発明は、サンプル中の核酸配列を検出または分析するための方法であって、該配列とRNAプローブとを、該プローブが該配列に結合する条件下で接触させ、核酸/プローブ複合体を、核酸に結合したRNAプローブが加水分解される条件に付してアデノシン一リン酸(AMP)を生成させ、生成したAMPを検出し、これを、該サンプル中の核酸配列の存在または性質と関連づけることを含んでなる方法を提供する。
【0009】
RNAプローブは、二本鎖形態である場合には、種々の酵素により容易に加水分解されうる。これらには、PCR反応において一般に使用されるポリメラーゼ酵素、例えばTaqポリメラーゼが含まれる。あるいは、RNAプローブは、それが二本鎖形態(例えば、RNA/DNA二本鎖)である場合にのみそれを加水分解するRNアーゼ酵素により加水分解されうる。そのような二本鎖はPCR反応のような増幅反応の過程で形成されうるが、必ずしもこのようになる訳ではない。
【0010】
本発明の方法において行うRNAの加水分解はアデノシン一リン酸(AMP)を与える。これは、直接的に又はアデノシン二リン酸の生成を介して、アデノシン三リン酸(ATP)に酵素によりリン酸化されうる。
【0011】
ATPは、生物発光系を用いて容易に検出することが可能であり、その具体例として、ルシフェラーゼ/ルシフェリン検出系が挙げられる。そのような検出系の適用の具体例は、例えば、WO 96/02665に記載されている。
【0012】
ルシフェラーゼ/ルシフェリン系のような生物発光系は、必要なポリメラーゼ活性を得るためにPCR反応において通常加えられるデオキシATP(dATP)とは反応しない。したがって、それは、RNAプローブの加水分解により生成したATPと、他の目的で該反応混合物に加えることが必要となりうる任意のdATPとを識別しうるであろう。
【0013】
生物発光検出系は蛍光系より高感度である。したがって、分析方法においてRNA加水分解プローブを使用すると、サンプル中の核酸レベルでの相互作用の検出が促進されるため、分析方法が改善される。
【0014】
特定の実施形態においては、本発明は、サンプル中の標的核酸の存在または量を検出するための方法であって、サンプル中の核酸を変性させ、これを、該標的核酸の少なくとも一部に特異的であるRNA加水分解プローブと接触させて、該プローブが該標的核酸と二本鎖を形成するようにし、二本鎖形態(例えば、RNA/DNA二本鎖)であるRNAを加水分解する酵素と、生成したアデノシン一リン酸をアデノシン三リン酸に変換するのに必要な1以上の酵素または試薬とを加え、ATPの存在に反応する生物発光試薬を該サンプルに加え、該生物発光試薬からのシグナルを検出し、それを、該標的核酸配列の存在または量と関連づけることを含んでなる方法を提供する。
【0015】
この方法は、増幅反応において頻繁に行われるであろう。したがって、もう1つの特定の実施形態において、本発明は、サンプル中の標的核酸の存在または量を検出するための方法であって、(a)該標的核酸の少なくとも一部に特異的なRNAプローブ、(b)二本鎖形態(例えば、RNA/DNA二本鎖)であるRNAを加水分解する酵素、および(c)生成したアデノシン一リン酸をアデノシン三リン酸に変換するのに必要な1以上の酵素または試薬の存在下、ポリメラーゼ連鎖反応のような増幅反応を行い、ATPの存在に反応する生物発光試薬を該サンプルに加え、該生物発光試薬からのシグナルを検出し、それを、該標的核酸配列の存在または量と関連づけることを含んでなる方法を提供する。
【0016】
二本鎖形態のRNAを加水分解する酵素(前記(b))は、増幅反応において使用するポリメラーゼであるのが適当である。本発明において使用しうる適当なDNAポリメラーゼの具体例としては、熱安定ポリメラーゼ、例えば、テルムス・アクアティカス(Thermus aquaticus)ポリメラーゼ(Taq)、テルムス・サーモフィルス(Thermus thermophilus)ポリメラーゼ(Tth)、テルムス属種(Thermus species)NHポリメラーゼ(TspNH)、テルムス・ブロッキアヌス(Thermus brockianus)ポリメラーゼ(Tbr)(すべて、例えば、GeneSys Limited,Farnborough,U.K.から入手可能)、ピロコッカス・フリオサス(Pyrococcus furiosus)ポリメラーゼ(Pfu)(Stratageneから入手可能)、9°N7エキソDNAポリメラーゼおよびテルモコッカス・リトラリス(Thermococcus litoraris)DNAポリメラーゼ(New England BiolabsからVENT(商標)DNAポリメラーゼとして入手可能)が挙げられる。しかし、これが該RNAを十分に速く加水分解しない場合、例えば、迅速なPCRを行う場合には、当技術分野において公知の適当なRNアーゼ、特にDNA依存性RNアーゼを加えることも可能であろう。
【0017】
生成したアデノシン一リン酸をアデノシン三リン酸に変換するのに必要な1以上の酵素(前記(c))は、例えば、同様に該反応混合物に試薬として加えるリン酸(ホスファート)およびホスホエノールピルビン酸(ホスホエノールピルバート)の存在下でAMPから直接的にATPを生成するホスホエノールピルビン酸シンターゼから選ばれうる。あるいは、ヌクレオシド三リン酸−アデニル酸キナーゼとNTPとの組合せはアデノシン二リン酸(ADP)を与え、ついでこれは、アデニル酸キナーゼのような酵素を含有させること又は添加することによりATPに変換されうる。
【0018】
適当な酵素の他の具体例には、Eisakiら,Biochim.et Biophys Acta 1431(1999)363−373に記載されているようなピルビン酸リン酸ジキナーゼが含まれる。
【0019】
ATPの存在に反応する特に適した生物発光試薬には、ルシフェリンおよびルシフェラーゼが含まれ、それらは、必要に応じて、酢酸マグネシウムのようなマグネシウムイオン源を伴う。ATPの存在下、これらの試薬は発光シグナルを生成し、これは、通常のルミノメーター装置を使用して容易にモニターすることができる。
【0020】
シグナルの生成の際、これらの試薬はAMP分子を再生し、これは、(c)の酵素および/または試薬の存在下、再びATPに変換される。したがって、該シグナルは指数関数的に増加し、したがって容易かつ迅速に検出される。そのような系の一例は、Sakakibaraら,Analytical Biochemistry,268,94−101(1999)に記載されている。シグナルのこの指数関数的増加は、従来は増幅反応を要したかもしれない状況において、直接的に検出を行いうることを意味するであろう。
【0021】
増幅反応の進行をモニターできるよう、増幅反応の全体を通じて生物発光試薬を存在させるか添加するのが適当である。一般には、ルシフェラーゼのような試薬の熱安定性は、増幅反応の全体を通じてそれが存在しうるのに十分なものではなく、したがって、各サイクルの終了時にそれを加えるのが適切である。ついで、当技術分野で公知のアルゴリズムなどを用いて、サンプル中の標的核酸配列の定量において、そのような情報を利用することができる。
【0022】
該増幅反応は、通常の方法で、例えば、反応混合物を変性温度、アニーリング温度および伸長温度の循環(サイクリング)に付すことにより行うことができる。
【0023】
前記の反応は、種々の通常の装置中で行うことができる。これらには、例えば、適当なシグナル検出手段を既に備えたPyrosequencer(Pyrosequencing AB,Swedenから入手可能)が含まれる。あるいは、例えば、EP−A−0810030に記載されThe Perkin−Elmer Corporationにより供給されるブロック(block)加熱装置、Idaho Technologys Inc.のRapidCycler(商標)およびLightCycler(商標)のような高速熱風サーマルサイクラー、またはWO98/24548に記載されているような他のタイプのサーマルサイクラーを使用して、該反応を行うことができる。
【図面の簡単な説明】
【0024】
【図1】図1は、本発明の方法の例を示す。
【0025】
図1は、本方法の概要を例示する。PCR反応の初期段階においては、特定の核酸配列を含有する又は含有する疑いのあるサンプルを、DNAが変性する温度に加熱して、一本鎖鋳型鎖(1)を形成させる。通常のPCRプライマー(2)は該鋳型鎖の一方の末端に結合し、一方、相補的RNAプローブ(3)は該標的配列上のその他の位置に結合する。ついでポリメラーゼ酵素が該反応の伸長段階中に作用して、矢印の方向にプライマー(2)を伸長させて、完全長相補鎖を形成させる。この過程の経過中、RNAプローブ(3)が、破線で例示されているとおりに加水分解されてAMPを遊離し、これはin situでATPに変換される。ついでこのATPは光シグナルとして検出される。
【0026】
本発明の方法は、配列決定用途および/またはDNAもしくはRNA配列中の多型もしくは変異の検出にも応用することができる。
【0027】
もう1つの態様において、本発明は、核酸の配列の決定方法であって、
(i)該配列の既知領域にRNAプローブを結合させて、該プローブの末端の少なくとも1つのヌクレオチドが該配列の未知または不明領域内に達するようにし、
(ii)二本鎖形態(例えば、RNA/DNA二本鎖)であるRNAを加水分解する酵素を使用して、該RNAプローブを加水分解し、
(iii)生成したアデノシン一リン酸をアデノシン三リン酸に変換し、
(iv)ATPの存在に反応する生物発光試薬を該サンプルに加え、
(v)該生物発光試薬からのシグナルを検出し、
(vi)そのシグナルを、該プローブの末端に相補的である又はそうでない配列の領域の存在と関連づけることを含んでなる方法を提供する。
【0028】
そのような場合、該プローブの末端の1以上のヌクレオチドが該未知または不明配列と厳密に相補的であれば、該プローブはそれに最も効率的に結合し、工程(ii)において該結合プローブを効率的に加水分解するであろう。その結果、AMPが生成し、前記のとおり、これはATPに変換され、生物発光系を用いて検出される。
【0029】
しかし、RNAプローブの末端のヌクレオチドが鋳型DNAに厳密にマッチしたものでない場合には、(ii)における該酵素の効果は、該プローブを無傷のまま該鋳型からほぼ除去するものとなろう。その結果、有意な加水分解は生じず、これは、生成した生物発光シグナルの欠如または実質的な減少として表されるであろう。
【0030】
この反応は、異なるヌクレオチドを末端領域に有するプローブを使用して、2回以上行うことが可能である。例えば、この位置の配列中に見出されるヌクレオチドが既知でない場合には、4個の異なるプローブ(それぞれは、異なるヌクレオチドC、G、UおよびAを末端に有する)を調製することができる。これらのそれぞれを個々に使用して本発明の方法を行うことにより、生成したシグナルのレベルから、この位置にはどれが妥当なヌクレオチドであるかが容易に判明するはずである。該プローブが末端に相補的ヌクレオチドを含む反応においてのみ、良好なシグナルが予想されるであろう。
【0031】
所望により、2以上の未知ヌクレオチド(例えば、3個までのヌクレオチド)を末端に含有させることが可能である。そのような場合には、すべての可能な配列の組合せを表すプローブを、それらの位置において使用することができる。厳密に相補的な配列を末端に有するプローブが効率的に加水分解されると予想されるであろう。
【0032】
用いられる末端は、未知または不明配列と比較した場合の既知配列の性質に応じて、プローブの3’または5’末端でありうる。このことを考慮して、工程(ii)で使用する酵素を選択する。該末端が3’末端であり、工程(ii)で使用する酵素が、良好な「プルーフリーディング」機能を有するとみなされる酵素でしばしば見られる3’−5’加水分解を引き起こしうる場合に(3’−5’加水分解と比較した場合)、強固に結合したRNAプローブの加水分解が、より良好に生じうる。
【0033】
多数の反応を行う場合には、アレイとして配置された別々の反応チューブ、ウェルまたは容器中でこれらを同時に適切に行うことができる。それらのチューブ、ウェルまたは容器を一緒に循環(サイクリング)させ、配置された適当なルミノメーターを使用して各チューブからのシグナルをモニターすることができる。
【0034】
あるいは、例えば、後記の特定の試験配列中の多型または対立遺伝子変異に関する診断試験を行うために、例えば「ディップスティック」形態の支持体上にプローブを固定化することができる。
【0035】
該方法で使用する酵素および試薬は、後記の核酸サンプルの存在または量を検出するために用いる方法で使用するものに類似している。同様に、該反応は前記の装置内で行うことができる。
【0036】
該反応は、PCR反応のような増幅反応と共に用いることができる。例えば、該反応は、PCR反応の後に行うことができる。工程(ii)の加水分解を達成するために、PCR反応の少なくとも幾つかの段階を行うことができる。しかし、一般には、これは必ずしも必要ではない。なぜなら、検出されたAMPの「再利用(リサイクリング)」の結果、該系自体が、良好な増幅シグナルを与えるからである。
【0037】
そのような方法は、例えば万能(universal)プライミング配列の場合のように出発配列の少なくとも一部が既知である配列決定において有用であろう。ついで、該配列の長さに沿って該方法を繰返すことにより、該配列を分離することができる。例えばリボタイピングにおいて行われるとおり、例えば、該配列がその長さに沿って幾つかの保存領域を含有することが知られている場合には、RNAオリゴヌクレオチドライブラリーをプローブとして使用して、該配列を明らかにするための平行反応が可能であろう。該RNAプローブを配置するために、これらの領域のそれぞれはを既知配列として使用することができる。
【0038】
本発明の方法を用いて、確認のために逆方向の配列決定を行うことも可能である。保存領域の存在により可能な場合には、反応のアレイを使用して、これを平行して行うことができる。
【0039】
あるいは、診断のための多型または対立遺伝子変異の検出において該方法を用いることができる。そのような場合、該配列は、多型または変異の遺伝子座においては不明でありうる1以上のヌクレオチドの小さな領域以外は、概ね既知でありうる。そのような場合には、少なくとも末端領域ヌクレオチドが該配列中の多型または変異に対応するようRNAプローブを設計する。この場合、効率的な加水分解であるかどうかが、実際の配列がプローブ配列に相補的であるか否かを示す。
【0040】
これらの反応は、前記の反応チューブ、ウェルまたは容器中で行うことができる。この場合も、多数の反応が行われるアレイにおいて、それらを行うのが便宜である。
【0041】
さらにもう1つの態様においては、本発明は、前記の方法において使用するキットを提供する。そのようなキットは、標的配列に特異的である少なくとも1つのRNAプローブと、所望により更に、AMPをATPに変換するための手段とを含む。多型の検出方法の場合には、該キットは、異なるヌクレオチドが3’末端に存在することにおいてのみ異なる4個までの類似したRNAプローブを含みうる。
【0042】
キットは、適切には、該方法において使用する1以上の更なる試薬を含む。特に、それは、ルシフェラーゼおよび/またはルシフェリンのような生物発光試薬をも含みうる。所望により使用する、キットの他の特定の成分には、特定の増幅において使用するプライマーが含まれうる。また、キットは、RNAを加水分解するDNAポリメラーゼまたはRNアーゼ(前記のとおり)を含有しうる。
【0043】
増幅を引き起こすために要求されうるバッファー、ヌクレオチド、ポリメラーゼ酵素などのような他の試薬も含まれうる。
【0044】
したがって、RNA加水分解プローブは、サンプル中の非常に特異的な核酸配列の存在を示すシグナルを生成するための非常に多用途の手段となる。生物発光検出系と組合せてそのようなプローブを使用するアッセイの感度は高く、シグナルを迅速に生成させることが可能である。
【特許請求の範囲】
【請求項1】
核酸配列とRNAプローブとを、該プローブが該配列に結合する条件下で接触させ、核酸/プローブ複合体を、核酸に結合したRNAプローブが加水分解される条件に付してアデノシン一リン酸(AMP)を生成させ、生成したAMPを検出し、これを、該サンプル中の核酸配列の存在または性質と関連づけることを含んでなる、サンプル中の核酸配列を検出または分析するための方法。
【請求項2】
生成したアデノシン一リン酸(AMP)をアデノシン三リン酸(ATP)に変換し、生物発光試薬を使用して該ATPを検出する、請求項1記載の方法。
【請求項3】
該AMPを酵素によりATPに変換する、請求項2記載の方法。
【請求項4】
該生物発光試薬がルシフェラーゼ/ルシフェリン検出系を含む、請求項2または請求項3記載の方法。
【請求項5】
二本鎖形態であるRNAプローブを、PCR反応において使用するポリメラーゼ酵素により加水分解する、前記請求項のいずれか1項記載の方法。
【請求項6】
(a)標的核酸の少なくとも一部に特異的なRNAプローブ、(b)二本鎖形態であるRNAを加水分解する酵素、および(c)生成したアデノシン一リン酸をアデノシン三リン酸に変換するのに必要な1以上の酵素および/または試薬、の存在下で増幅反応を行うこと、ATPの存在に反応する生物発光試薬を該サンプルに加えること、該生物発光試薬からのシグナルを検出すること、および該シグナルを、該標的核酸配列の存在または量と関連づけることを含んでなる、サンプル中の標的核酸の存在または量を検出するための方法。
【請求項7】
該増幅反応がポリメラーゼ連鎖反応(PCR)である、請求項6記載の方法。
【請求項8】
(b)の酵素が、該増幅反応において使用するDNAポリメラーゼまたはRNアーゼである、請求項7記載の方法。
【請求項9】
(c)が、ホスホエノールビルビン酸シンターゼ、リン酸およびホスホエノールピルビン酸を含む、請求項6から8のいずれか1項記載の方法。
【請求項10】
(c)が、ヌクレオシド三リン酸−アデニル酸キナーゼ、ヌクレオシド5’−三リン酸(NTP)およびアデニル酸キナーゼの組合せを含む、請求項6から8のいずれか1項記載の方法。
【請求項11】
生物発光試薬がルシフェリンおよびルシフェラーゼを含む、請求項6から10のいずれか1項記載の方法。
【請求項12】
該生物発光試薬が更にマグネシウムイオン源を含む、請求項11記載の方法。
【請求項13】
該増幅反応の全体にわたり該生物発光試薬を加える、請求項6から12のいずれか1項記載の方法。
【請求項14】
(i)核酸配列の既知領域にRNAプローブを結合させて、該プローブの末端の少なくとも1つのヌクレオチドが該配列の未知または不明領域内に達するようにすること、
(ii)二本鎖形態(例えば、RNA/DNA二本鎖)である場合のみのRNAを加水分解する酵素を使用して、該RNAプローブを加水分解すること、
(iii)生成したアデノシン一リン酸をアデノシン三リン酸に変換すること、
(iv)ATPの存在に反応する生物発光試薬を該サンプルに加えること、
(v)該生物発光試薬からのシグナルを検出すること、
(vi)該シグナルを、該プローブの末端に相補的である又はそうでない配列の領域の存在と関連づけることを含んでなる、核酸の配列の決定方法。
【請求項15】
異なるヌクレオチドを末端に有するRNA加水分解プローブを使用して2回以上行う、請求項14記載の方法。
【請求項16】
C、G、UおよびAのうちの異なるものを末端に有する類似したRNA加水分解プローブで該反応を4回行う、請求項15記載の方法。
【請求項17】
上記反応を同時に行う、請求項15または請求項16記載の方法。
【請求項18】
上記反応を、アレイとして配置された別々の反応チューブ、ウェルまたは容器中で行う、請求項17記載の方法。
【請求項19】
工程(iii)において、ホスホエノールピルビン酸シンターゼ、リン酸およびホスホエノールピルビン酸を加えることにより該変換を行う、請求項14から18のいずれか1項記載の方法。
【請求項20】
工程(iii)において、ヌクレオシド三リン酸−アデニル酸キナーゼ、ヌクレオシド5’−三リン酸(NTP)およびアデニル酸キナーゼの組合せを加えることにより該変換を行う、請求項14から18のいずれか1項記載の方法。
【請求項21】
工程(iv)で使用する生物発光試薬がルシフェリンおよびルシフェラーゼを含む、請求項14から20のいずれか1項記載の方法。
【請求項22】
該生物発光試薬が更にマグネシウムイオン源を含む、請求項21記載の方法。
【請求項23】
多型または対立遺伝子変異を検出するために使用する、請求項14から22のいずれか1項記載の方法。
【請求項24】
該RNAプローブをディップスティックのような支持体上に固定化する、請求項23記載の方法。
【請求項25】
核酸を配列決定するために使用する、請求項14から22のいずれか1項記載の方法。
【請求項26】
標的配列に特異的な少なくとも1つのRNAプローブと、二本鎖形態であるRNAを加水分解しうる酵素とを含んでなる、分析において使用するキット。
【請求項27】
AMPをATPに変換するための手段を更に含む、請求項26記載のキット。
【請求項28】
該手段が、ホスホエノールピルビン酸シンターゼ、リン酸およびホスホエノールピルビン酸の組合せ、またはヌクレオシド三リン酸−アデニル酸キナーゼ、ヌクレオシド5’−三リン酸(NTP)およびアデニル酸キナーゼの組合せを含む、請求項27記載のキット。
【請求項29】
異なるヌクレオチドが末端に存在する点においてのみ異なる4個までの類似したRNAプローブを含む、請求項27から28のいずれか1項記載のキット。
【請求項30】
更に生物発光試薬を含む、請求項27から29のいずれか1項記載のキット。
【請求項31】
ルシフェラーゼおよび/またはルシフェリンを含む、請求項30記載のキット。
【請求項32】
更に増幅プライマーを含む、請求項27から31のいずれか1項記載のキット。
【請求項33】
RNAを加水分解するDNAポリメラーゼまたはRNアーゼを更に含む、請求項27から32のいずれか1項記載のキット。
【請求項34】
サンプル中の核酸を変性させること、これを、該標的核酸の少なくとも一部に特異的であるRNA加水分解プローブと接触させて、該プローブが該標的核酸と二本鎖を形成するようにすること、二本鎖形態(例えば、RNA/DNA二本鎖)であるRNAを加水分解する酵素と、生成したアデノシン一リン酸をアデノシン三リン酸に変換するのに必要な1以上の酵素または試薬とを加えること、ATPの存在に反応する生物発光試薬を該サンプルに加え、該生物発光試薬からのシグナルを検出すること、該シグナルを、該標的核酸配列の存在または量と関連づけることを含んでなる、サンプル中の標的核酸の存在または量を検出するための方法。
【請求項35】
請求項1から26または34のいずれか1項記載の方法におけるRNAプローブの使用。
【請求項1】
核酸配列とRNAプローブとを、該プローブが該配列に結合する条件下で接触させ、核酸/プローブ複合体を、核酸に結合したRNAプローブが加水分解される条件に付してアデノシン一リン酸(AMP)を生成させ、生成したAMPを検出し、これを、該サンプル中の核酸配列の存在または性質と関連づけることを含んでなる、サンプル中の核酸配列を検出または分析するための方法。
【請求項2】
生成したアデノシン一リン酸(AMP)をアデノシン三リン酸(ATP)に変換し、生物発光試薬を使用して該ATPを検出する、請求項1記載の方法。
【請求項3】
該AMPを酵素によりATPに変換する、請求項2記載の方法。
【請求項4】
該生物発光試薬がルシフェラーゼ/ルシフェリン検出系を含む、請求項2または請求項3記載の方法。
【請求項5】
二本鎖形態であるRNAプローブを、PCR反応において使用するポリメラーゼ酵素により加水分解する、前記請求項のいずれか1項記載の方法。
【請求項6】
(a)標的核酸の少なくとも一部に特異的なRNAプローブ、(b)二本鎖形態であるRNAを加水分解する酵素、および(c)生成したアデノシン一リン酸をアデノシン三リン酸に変換するのに必要な1以上の酵素および/または試薬、の存在下で増幅反応を行うこと、ATPの存在に反応する生物発光試薬を該サンプルに加えること、該生物発光試薬からのシグナルを検出すること、および該シグナルを、該標的核酸配列の存在または量と関連づけることを含んでなる、サンプル中の標的核酸の存在または量を検出するための方法。
【請求項7】
該増幅反応がポリメラーゼ連鎖反応(PCR)である、請求項6記載の方法。
【請求項8】
(b)の酵素が、該増幅反応において使用するDNAポリメラーゼまたはRNアーゼである、請求項7記載の方法。
【請求項9】
(c)が、ホスホエノールビルビン酸シンターゼ、リン酸およびホスホエノールピルビン酸を含む、請求項6から8のいずれか1項記載の方法。
【請求項10】
(c)が、ヌクレオシド三リン酸−アデニル酸キナーゼ、ヌクレオシド5’−三リン酸(NTP)およびアデニル酸キナーゼの組合せを含む、請求項6から8のいずれか1項記載の方法。
【請求項11】
生物発光試薬がルシフェリンおよびルシフェラーゼを含む、請求項6から10のいずれか1項記載の方法。
【請求項12】
該生物発光試薬が更にマグネシウムイオン源を含む、請求項11記載の方法。
【請求項13】
該増幅反応の全体にわたり該生物発光試薬を加える、請求項6から12のいずれか1項記載の方法。
【請求項14】
(i)核酸配列の既知領域にRNAプローブを結合させて、該プローブの末端の少なくとも1つのヌクレオチドが該配列の未知または不明領域内に達するようにすること、
(ii)二本鎖形態(例えば、RNA/DNA二本鎖)である場合のみのRNAを加水分解する酵素を使用して、該RNAプローブを加水分解すること、
(iii)生成したアデノシン一リン酸をアデノシン三リン酸に変換すること、
(iv)ATPの存在に反応する生物発光試薬を該サンプルに加えること、
(v)該生物発光試薬からのシグナルを検出すること、
(vi)該シグナルを、該プローブの末端に相補的である又はそうでない配列の領域の存在と関連づけることを含んでなる、核酸の配列の決定方法。
【請求項15】
異なるヌクレオチドを末端に有するRNA加水分解プローブを使用して2回以上行う、請求項14記載の方法。
【請求項16】
C、G、UおよびAのうちの異なるものを末端に有する類似したRNA加水分解プローブで該反応を4回行う、請求項15記載の方法。
【請求項17】
上記反応を同時に行う、請求項15または請求項16記載の方法。
【請求項18】
上記反応を、アレイとして配置された別々の反応チューブ、ウェルまたは容器中で行う、請求項17記載の方法。
【請求項19】
工程(iii)において、ホスホエノールピルビン酸シンターゼ、リン酸およびホスホエノールピルビン酸を加えることにより該変換を行う、請求項14から18のいずれか1項記載の方法。
【請求項20】
工程(iii)において、ヌクレオシド三リン酸−アデニル酸キナーゼ、ヌクレオシド5’−三リン酸(NTP)およびアデニル酸キナーゼの組合せを加えることにより該変換を行う、請求項14から18のいずれか1項記載の方法。
【請求項21】
工程(iv)で使用する生物発光試薬がルシフェリンおよびルシフェラーゼを含む、請求項14から20のいずれか1項記載の方法。
【請求項22】
該生物発光試薬が更にマグネシウムイオン源を含む、請求項21記載の方法。
【請求項23】
多型または対立遺伝子変異を検出するために使用する、請求項14から22のいずれか1項記載の方法。
【請求項24】
該RNAプローブをディップスティックのような支持体上に固定化する、請求項23記載の方法。
【請求項25】
核酸を配列決定するために使用する、請求項14から22のいずれか1項記載の方法。
【請求項26】
標的配列に特異的な少なくとも1つのRNAプローブと、二本鎖形態であるRNAを加水分解しうる酵素とを含んでなる、分析において使用するキット。
【請求項27】
AMPをATPに変換するための手段を更に含む、請求項26記載のキット。
【請求項28】
該手段が、ホスホエノールピルビン酸シンターゼ、リン酸およびホスホエノールピルビン酸の組合せ、またはヌクレオシド三リン酸−アデニル酸キナーゼ、ヌクレオシド5’−三リン酸(NTP)およびアデニル酸キナーゼの組合せを含む、請求項27記載のキット。
【請求項29】
異なるヌクレオチドが末端に存在する点においてのみ異なる4個までの類似したRNAプローブを含む、請求項27から28のいずれか1項記載のキット。
【請求項30】
更に生物発光試薬を含む、請求項27から29のいずれか1項記載のキット。
【請求項31】
ルシフェラーゼおよび/またはルシフェリンを含む、請求項30記載のキット。
【請求項32】
更に増幅プライマーを含む、請求項27から31のいずれか1項記載のキット。
【請求項33】
RNAを加水分解するDNAポリメラーゼまたはRNアーゼを更に含む、請求項27から32のいずれか1項記載のキット。
【請求項34】
サンプル中の核酸を変性させること、これを、該標的核酸の少なくとも一部に特異的であるRNA加水分解プローブと接触させて、該プローブが該標的核酸と二本鎖を形成するようにすること、二本鎖形態(例えば、RNA/DNA二本鎖)であるRNAを加水分解する酵素と、生成したアデノシン一リン酸をアデノシン三リン酸に変換するのに必要な1以上の酵素または試薬とを加えること、ATPの存在に反応する生物発光試薬を該サンプルに加え、該生物発光試薬からのシグナルを検出すること、該シグナルを、該標的核酸配列の存在または量と関連づけることを含んでなる、サンプル中の標的核酸の存在または量を検出するための方法。
【請求項35】
請求項1から26または34のいずれか1項記載の方法におけるRNAプローブの使用。
【図1】




【公開番号】特開2010−148506(P2010−148506A)
【公開日】平成22年7月8日(2010.7.8)
【国際特許分類】
【外国語出願】
【出願番号】特願2009−286010(P2009−286010)
【出願日】平成21年12月17日(2009.12.17)
【分割の表示】特願2002−587645(P2002−587645)の分割
【原出願日】平成14年5月7日(2002.5.7)
【出願人】(390040604)イギリス国 (58)
【氏名又は名称原語表記】THE SECRETARY OF STATE FOR DEFENCE IN HER BRITANNIC MAJESTY’S GOVERNMENT OF THE UNETED KINGDOM OF GREAT BRITAIN AND NORTHERN IRELAND
【Fターム(参考)】
【公開日】平成22年7月8日(2010.7.8)
【国際特許分類】
【出願番号】特願2009−286010(P2009−286010)
【出願日】平成21年12月17日(2009.12.17)
【分割の表示】特願2002−587645(P2002−587645)の分割
【原出願日】平成14年5月7日(2002.5.7)
【出願人】(390040604)イギリス国 (58)
【氏名又は名称原語表記】THE SECRETARY OF STATE FOR DEFENCE IN HER BRITANNIC MAJESTY’S GOVERNMENT OF THE UNETED KINGDOM OF GREAT BRITAIN AND NORTHERN IRELAND
【Fターム(参考)】
[ Back to top ]

