分析方法
【課題】測定対象分子を含む試料が少量であっても分析可能で、簡便に信頼性の高い情報を得ることができる分析方法を提供し、微量な生体試料由来の分子又は生体試料中の分子に適用して、その機能解明や病態の解明に有用な情報を得ることもできる分析方法を提供すること。
【解決手段】試料支持部材上の誘導体化した測定対象分子を分析する方法であって、該測定対象分子を含む試料及び誘導体化剤を試料支持部材上に載せて反応させ、反応後の試料支持部材上を、誘導体化剤と反応後の測定対象分子を実質的に溶解せず、誘導体化剤を溶解する洗浄用溶媒で洗浄した後に分析することを特徴とする分析方法。
【解決手段】試料支持部材上の誘導体化した測定対象分子を分析する方法であって、該測定対象分子を含む試料及び誘導体化剤を試料支持部材上に載せて反応させ、反応後の試料支持部材上を、誘導体化剤と反応後の測定対象分子を実質的に溶解せず、誘導体化剤を溶解する洗浄用溶媒で洗浄した後に分析することを特徴とする分析方法。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、測定対象分子の分析方法に関し、更に詳細には、測定対象分子を含む試料が微量のとき等に有効な測定対象分子の分析方法に関する。
【背景技術】
【0002】
測定対象分子の、化学構造、分子量、分子中の特定の官能基の有無、測定対象分子自体の量、測定対象分子自体の物性、対照物質との相対的な物性、固体表面への吸着性、異なる分子の混合比等を種々の分析方法で分析する場合、測定対象分子の分析の感度を上げる必要がある場合が多い。特に、生体試料由来の測定対象分子等、分析のために与えられた試料の絶対量が少ない場合には、測定対象分子の分析の感度を上げることが特に必要となる。
【0003】
一方、測定対象分子を、フラスコ、ビーカー、試験管等の容器内で予め誘導体化して、別の分子に変換してから分析すると、誘導体化前の測定対象分子の情報がより得られるような分析手段は多い。上記した測定対象分子の絶対的な物性や量、又は相対的な物性には、測定対象分子を誘導体化した分子の分析をした方が、感度が上昇し、測定対象分子の正確な情報が得られるものは多い。また、測定試料に複数の測定対象分子が存在したり測定対象分子以外の分子も共存したりする場合に、その中の特定の分子のみが誘導体化されることによって他の分子と区別されることを利用して、より詳細な、あるいは正確な情報を得る分析方法も考えられる。
【0004】
特に、測定対象分子の一部の物性を測定したり、測定対象分子のフラグメントを測定したり、誘導体化に用いた誘導体化剤の情報が測定対象分子の情報を阻害しなかったり、誘導体化剤の情報のみを除去できるような分析等に関しては、測定対象分子の誘導体化が好適に用いられ得る。
【0005】
例えば、非特許文献1には、4−アミノ安息香酸エチルエステル、2−アミノピリジン、1−ピレンブタン酸ヒドラジド(1-pyrenebutanoic acid hydrazide;PBH)等を用いて、予め糖鎖を誘導体化した後に試料支持部材に載せ、マトリックス支援レーザー脱離イオン化質量分析(MALDI−MS)する方法が提案されている。
【0006】
また、特許文献1には、測定対象分子及び誘導体化剤を、質量分析法に用いる試料支持部材上に載せ、測定対象分子と誘導体化剤とを試料支持部材上で反応させることを特徴とする質量分析法が開示されており、測定対象分子が、糖、タンパク質又は糖タンパク質等で、微量しかない場合でも分析が可能であることが示されている。
【0007】
しかしながら、ノイズに対するシグナルを強くしたり、微量の測定対象分子を含む試料を精度よく分析したりするためには、更なる改良が望まれていた。
【先行技術文献】
【特許文献】
【0008】
【特許文献1】特開2008−051790号公報
【非特許文献】
【0009】
【非特許文献1】Sugahara, D. et al.,Anal.Sci.,19,第167〜169頁 (2003)
【発明の概要】
【発明が解決しようとする課題】
【0010】
本発明は上記背景技術に鑑みてなされたものであり、その課題は、測定対象分子を含む試料が微量であっても分析可能な分析方法を提供することにある。また、簡便に信頼性の高い情報を得ることができる分析方法を提供することにあり、微量な生体試料由来の分子又は生体試料中の分子等に適用して、その機能解明や病態の解明に有用な情報を得ることもできる分析方法を提供することにある。
【課題を解決するための手段】
【0011】
本発明者は、上記の課題を解決すべく鋭意検討を重ねた結果、測定対象分子と誘導体化剤を試料支持部材上で反応させ、次いで、反応した測定対象分子を実質的に溶解せず誘導体化剤を溶解する洗浄用溶媒で洗浄することによって、驚くべきことに反応後の測定対象分子を流失させることなく、過剰に残存する誘導体化剤を除去できることを見出し、その後に分析することにより上記課題を解決できることを見出した。具体的には、例えば、質量分析に用いる試料支持部材上で直接反応を行うことによって、試料が減量することなく、簡便に効率良く分子の安定な誘導体を作成し、イオン化が困難であった分子のイオン化効率の向上及び生成したイオンの安定化を実現して、質量分析の感度を向上させることができることを見いだして本発明を完成するに至った。
【0012】
すなわち、本発明は、試料支持部材上の誘導体化した測定対象分子を分析する方法であって、該測定対象分子を含む試料及び誘導体化剤を試料支持部材上に載せて反応させ、反応後の試料支持部材上を、「誘導体化剤と反応後の測定対象分子を実質的に溶解せず、誘導体化剤を溶解する洗浄用溶媒」で洗浄した後に分析することを特徴とする分析方法を提供するものである。
【発明の効果】
【0013】
本発明によれば、測定対象分子を含む試料の量や、それに対する誘導体化剤等の反応試薬等の量及びそれらの反応溶液量を減らしても分析可能な分析方法を提供することができる。それにより、測定対象分子を含む試料が微量であっても分析可能で、また簡便に信頼性の高い情報を得ることができる。具体的には、試料支持部材上で測定対象分子に誘導体化剤を反応させることによって、用いる測定対象分子を含む試料の量、誘導体化剤及びそれらの反応溶液量を減らすことができ、すなわち、別途容器中で反応させるよりも高収量化を可能にし、緩和な条件で測定対象分子を減量させることなく、ノイズに対するシグナルの比を上げることができる。
【0014】
本発明は微量な生体試料由来の分子や生体試料中の分子に適用できるので、例えば、糖鎖、タンパク質(ペプチドを含む)、糖タンパク質(糖ペプチドを含む)、核酸、糖脂質等の分子の機能解明や病態の解明に有用な情報を得る方法を提供できる。
【0015】
特に、本発明の分析方法における測定試料の調製法を質量分析に適用すれば、十分な量の分子イオンを生成させることができ、高感度の質量分析法用の測定試料を簡便に調製できる。その結果、通常の処理工程では、分析可能な量以下になってしまうような微量の「測定対象分子を含む試料」しか得られない場合でも質量分析が可能となる。また、その結果、イオン化効率を向上させ、切断イオン化位置を制御したり、生成イオンの安定化を達成したりして、測定の再現性を向上させることができ、信頼性の高い化学構造情報を得ることができる。
【図面の簡単な説明】
【0016】
【図1】糖ペプチド1及び糖ペプチド2の構造を示す図である。
【図2】Au/C18プレートを用い、糖ペプチド1(100fmol)と誘導体化剤を試料支持部材上に載せて反応させ、洗浄を行った場合(a〜d)と行わなかった場合(e〜g)の、プレートの光学顕微鏡写真(a〜c、e、f)とスイートスポット(d、g)を示す図である(実施例1、比較例1)。 (a)誘導体化後、(b)洗浄後、(c)洗浄した場合のマトリックス溶液乾燥後、(d)上記(c)のスイートスポット;(e)誘導体化後、(f)洗浄しなかった場合のマトリックス溶液乾燥後、(g)上記(f)のスイートスポット
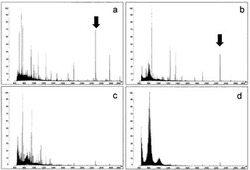
【図3】Au/C18プレートを用い、洗浄の有無による質量分析のシグナルとノイズの状態を示すスぺクトルであり、a、cがネガティブイオンスペクトルを示す図であり、b、dがポジティブイオンスペクトルを示す図である。 a、b:洗浄あり(実施例1)、c、d:洗浄なし(比較例1)
【図4】Au/C18プレートを用い、糖ペプチド2(100fmol)を誘導体化後、洗浄をビーカーに満たした洗浄用溶媒に浸漬して行った場合のポジティブイオンスペクトルを示す図である(実施例3)。
【図5】ステンレスプレートを用い、糖ペプチド1(100fmol)と誘導体化剤を試料支持部材上に載せて反応させ、洗浄を行った場合(a〜d)と行わなかった場合(e〜g)の、プレートの光学顕微鏡写真(a〜c、e、f)とスイートスポット(d、g)を示す図である(実施例4、比較例2)。 (a)誘導体化後、(b)洗浄後、(c)洗浄した場合のマトリックス溶液乾燥後、(d)上記(c)のスイートスポット;(e)誘導体化後、(f)洗浄しなかった場合のマトリックス溶液乾燥後、(g)上記(f)のスイートスポット
【図6】ステンレスプレートを用い、洗浄の有無による質量分析のシグナルとノイズの状態を示したネガティブイオンスぺクトルを示す図である(実施例4、比較例2)。 上段:洗浄あり(実施例4)、下段:洗浄なし(比較例2)
【図7】ステンレスプレートを用い、ヒト血清アルブミン由来ペプチド(約1500fmol)を糖ペプチド2(500fmol)に加えた測定試料について、(a)誘導体化しなかった場合のポジティブイオンスペクトル(比較例3)、(b)誘導体化剤を500pmol、又は、(c)誘導体化剤を2.5nmolを試料支持部材上に載せて反応させ、洗浄を行った場合のポジティブイオンスペクトル(実施例5)を示す図である。 白矢印はペプチドイオンであり、黒矢印は糖ペプチドイオンである。
【図8】Au/C18プレートを用い、糖ペプチド2(10fmol)、誘導体化剤を試料支持部材上に載せて反応させ、洗浄を行った場合(上段、実施例6)と、同量の糖ペプチド及び誘導体化剤をエッペンドルフチューブ中で反応させた場合(下段、比較例4)のポジティブイオンスペクトルを示す図である。
【発明を実施するための形態】
【0017】
以下、本発明について説明するが、本発明は以下の実施の具体的態様に限定されるものではなく、任意に変形して実施することができる。
【0018】
本発明の分析方法では、該測定対象分子を含む試料及び誘導体化剤を試料支持部材上に載せて試料支持部材上で反応させ、その後、反応後の試料支持部材上を「誘導体化剤と反応後の測定対象分子を実質的に溶解せず、誘導体化剤を溶解する洗浄用溶媒」で洗浄して測定試料を調製する。本発明においては、以下、括弧内「誘導体化剤と反応後の測定対象分子を実質的に溶解せず、誘導体化剤を溶解する洗浄用溶媒」を、単に「洗浄用溶媒」と略記する。
【0019】
<測定対象分子を含む試料>
「測定対象分子を含む試料」は特に限定はないが、少量しか得られない試料、試料中に含まれる測定対象分子が少量である試料(純度が低い試料)、誘導体化剤を反応させることによって感度が上昇し易い試料、誘導体化剤を反応させて測定対象分子を分析し易く変化させることのできる試料、誘導体化した場合としない場合の差を分析したい試料、測定試料を調製する過程で損失が大きくならざるを得ない試料、誘導体化剤を反応させることによって測定対象分子の分析を妨げる夾雑分子の感度が低下する試料、特定の測定対象分子だけを区別して分析したい試料等が挙げられる。測定対象分子は、具体的には特に限定はないが、多糖、単糖等の糖;タンパク質(ペプチドを含む);糖タンパク質(糖ペプチドを含む)、糖脂質等の複合糖質;修飾タンパク質(修飾ペプチドを含む);核酸;生体代謝物等であることが、本発明の効果を発揮できるので好ましい。
【0020】
「測定対象分子を含む試料」は、測定対象分子自体のみからなる試料でもよいし、測定対象分子以外の分子を含む試料でもよい。本発明では、試料支持部材上の測定対象分子を分析するので、測定対象分子を含む試料は試料支持部材の上に載せる必要がある。
【0021】
具体的な「測定対象分子を含む試料」としては特に限定はないが、天然物、天然物から抽出されるもの、天然物を化学的又は酵素学的に一部改変して調製されるもの、化学的又は酵素学的に調製されるもの等が好ましい。また、生体に含まれる分子の部分構造を有するものや生体に含まれる分子を模倣して作製されたものも好ましい。また、生体の組織、細胞、体液や分泌物(例えば、血液、血清、尿、精液、唾液、涙液、汗、糞便等)等、直接生体試料を用いてもよい。また、試料を試料支持部材上に載せ、酵素処理等を行なって、測定対象分子を含む試料を調製してもよい。以上の試料は、測定対象分子が微量になる場合が多い点で本発明にとって好ましい。
【0022】
<分析方法>
本発明の分析方法は、測定対象分子を含む試料及び測定対象分子が、試料支持部材上に載るものである。本発明の分析方法は、試料支持部材上に測定試料を調製し、それを分析するものであれば特に限定はなく、具体的には例えば、質量分析(MS)、水晶天秤分析(QCM)、二次イオン質量分析(SIMS)、電子プローブマクロアナライザー(EPMA)(X線マイクロアナライザー(XMA))、イオンマイクロアナライザー(IMA))、蛍光X線分析(XFL、XRF、FX)、赤外分光分析、顕微赤外分光分析、ラマン分光分析、顕微ラマン分光分析、紫外可視分光分析、蛍光分析、時間分解蛍光分析、偏光分析、顕微質量分析、顕微イメージング、表面プラズモン共鳴測定、電気泳動、クロマトグラフィー等が挙げられる。
【0023】
本発明における「試料支持部材」とは、分子が反応できる場を提供する表面をもち、実質的に全量を分析に供し得るものであり、使用する分析方法に適したものであれば特に限定されないが、好ましくは、サンプルプレート、オートサンプラー用サンプル管等の分析試料を分析装置に供給専用のサンプル管、ミクロウエルプレート、スライドグラス、キャピラリー、膜、ゲル等が挙げられる。質量分析の場合、特に好ましいプレートについては後述するが、質量分析用のサンプルプレートは、表面が金でコーティングされていたり、表面が化学的修飾又は物理的加工がしてあったりしてもよい。
【0024】
本発明において、「試料支持部材上に載せる」という表現は、例えば上記サンプル管の内壁上に載せることも意味する。すなわち、「試料支持部材」には板状、皿状、筒状のみならず、容器状のものも含まれ、「上に載せる」は、容器状のものの中に載せる、すなわち容器状のものの中に入れることをも含むものである。
【0025】
<<質量分析>>
1.質量分析の種類
以下、質量分析を例にとって本発明を説明する。
質量分析(以下、「MS」と略記することがある)は、マトリックス支援レーザー脱離イオン化質量分析法(MALDI−MS)、エレクトロスプレーイオン化質量分析法(ESI−MS)等によって化学構造情報を得る。これらの分子は、分子イオン([M+Na]+、[M+H]+、[M−H]−等)生成が効率よく起こるかどうかが検出感度に大きく影響する。特に、糖は分子量及び組成が同一の異性体が複数存在するので、分子イオンをプリカーサーイオンとして選択し断片化し、更に生じたイオンをプリカーサーイオンとして選択し断片化することを繰り返すMSn(nは2以上の整数)解析が必須である。
【0026】
一般に、MS/MS測定により得られるイオンのシグナル強度は前段階のイオンの約1/10に減少する。従って、多段階MS測定(MSn)を行うことによって、構造情報は極めて多くなるが、検出感度は低下していくので、はじめの分子イオン生成量が十分に多いことが必要となる。しかも、生体試料由来の分子等の場合は、そのままではイオン化されにくく、また分子の破壊が起り易く、特に、糖;糖タンパク質、糖脂質等の複合糖質等又はそれらから化学的若しくは酵素学的に遊離させて得たものは、分子量と組成が同一の異性体が複数存在するので、なおさら十分な量の「測定対象分子を含む試料」が必要になる。例えば、糖鎖をそのままマトリックス支援レーザー脱離イオン化−飛行時間型質量分析法(MALDI−TOF MS)で解析しようとすると10pmol以上を要する。
【0027】
2.誘導体化
しかしながら、生体試料等の場合は、採取又は入手できる絶対量が少ない場合が多く、検出感度を上げるしか方法はない。この問題に関して、本発明では、測定対象分子を誘導体化し、その誘導体化した測定対象分子を分析する。
【0028】
2−1.誘導体化に好ましい測定対象分子
誘導体化する場合に測定対象分子の有している好ましい官能基としては、誘導体化剤と反応しやすく、反応してできたものが質量分析において悪影響を及ぼさないものであれば特に限定はないが、アルデヒド基、カルボキシル基、アミノ基、メルカプト基又は水酸基が好ましい。すなわち、本発明における測定対象分子は、アルデヒド基、カルボキシル基、アミノ基、メルカプト基及び水酸基よりなる群から選ばれた1種以上の官能基を有するものであることが好ましい。
【0029】
以下に、本発明の分析方法が好適に適用できる測定対象分子について、上記好ましい官能基毎に詳しく説明する。
(a)アルデヒド基を有する測定対象分子
非還元末端やC2、C4又はC6位のみに置換基をもつヘキソース等のように隣り合うジオールを持つ糖鎖は、過ヨウ素酸酸化によってアルデヒド基を生じるので、測定対象分子として好ましい。特に、シアル酸を含む糖鎖は、シアル酸のC7−9位のみを選択的に過ヨウ素酸で酸化してアルデヒド基を生じさせることができる。シアル酸のC7−9位の選択的酸化は、例えば、5mMのNaIO4水溶液中で0℃、10〜20分間にわたり反応させることによってなされる。かかる、シアル酸由来のアルデヒド基を有している測定対象分子は、後述するように、アミノ基、ヒドラジド基等を有する誘導体化剤と反応して、質量分析に供される誘導体化された分子を、容易に試料支持部材上で反応させて好適に得ることができるので、本発明の分析法で測定対象分子として好ましい。
【0030】
非還元末端にガラクトースを含む糖鎖も好ましい。その非還元末端のガラクトースを特異的にガラクトースオキシダーゼによってC6位を酸化し、アルデヒド基を生じさせることができるからである。酵素反応は、例えば、中性の緩衝液中で、室温、2時間で行うことができる。アミノ基、ヒドラジド基等を有する誘導体化剤を用いて、上記の酵素的酸化により生じたアルデヒド基と、アミノ基やヒドラジド基を、試料支持部材上で縮合反応を行い、次いで要すれば還元することによって、質量分析に供される誘導体化された分子を容易に試料支持部材上で反応させて好適に得ることができる。
【0031】
上記必要に応じて行う還元は特に限定はないが、NaCNBH3、NaBH4、NaBH(OCOCH3)3等の還元剤を加えて、加温又は室温で反応を行うことが好ましい。また、測定対象分子と誘導体化剤との反応溶液中に始めから還元剤を共存させておくことも可能である。還元することによって、誘導体化された分子が安定するという効果がある。
【0032】
例えば、アルデヒド基を有する測定対象分子に、例えば、ヒドラジド基を有する誘導体化剤を反応させる化学反応は下記式(1)で表される。
R1CONHNH2 + R2CHO → R1CONHN=CHR2 (1)
[式中、R1、R2は、互いに独立に任意の有機基を示す。]
【0033】
還元は、例えば上記の場合、化学反応は下記式(2)で表される。
R1CONHN=CHR2 → R1CONHNH−CH2R2 (2)
[式中、R1、R2は、互いに独立に任意の有機基を示す。]
【0034】
シアル酸やガラクトース等に標識を行う上記の方法を、糖タンパク質分子上のシアル酸やガラクトース等に適用することも可能である。その場合、糖タンパク質分子を標識できるので、該分子のイオン化効率が高くなり、質量分析が特に高感度になるので好ましい。また、本発明においては、糖鎖を遊離することなく、分子上の糖鎖を標識することができるので、糖鎖を含むタンパク質のタンデム質量分析スペクトル解析ができ、タンパク質のペプチド鎖上の糖鎖構造の有無及び糖鎖結合位置が特定できる。
【0035】
糖タンパク質の機能を解明する上で、糖鎖がペプチド鎖上のどこの位置に、どのような構造を有して付加しているのかを明らかにすることは極めて重要である。多くの場合、複数の異なる構造の糖鎖がペプチド鎖の複数の結合位置に結合しているので、糖鎖の位置と構造の対応を明確にする必要がある。本発明は、標識された糖鎖部分やペプチド部分の構造情報を得ることを可能とする。従って、本発明における測定対象分子として、糖タンパク質は特に好ましい。
【0036】
(b)カルボキシル基、アミノ基、メルカプト基、水酸基等を有する測定対象分子
例えば、タンパク質や糖タンパク質は、その中に含まれるカルボキシル基、アミノ基、メルカプト基、水酸基等を用いて誘導体化剤と反応させることができる。
【0037】
(イ)測定対象分子の中に含まれるカルボキシル基を用いて反応させる場合には、それらと、アミノ基、ヒドラジド基、ジアゾメチル基等を有する誘導体化剤とを試料支持部材上で反応させることによって、質量分析に供される化合物を好適に得ることができる。また、測定対象分子中のカルボキシル基は、誘導体化剤であるヨウ化メチルやトリメチルシリルジアゾメタンと反応してメチルエステルとなり、質量分析に供される誘導体化された分子を、容易に試料支持部材上での反応により得ることができる。必要に応じて、脱水縮合剤を加えて反応させることもできる。シアル酸を有する分子の場合には、シアル酸のカルボキシル基を用いてもよい。
【0038】
(ロ)また、測定対象分子の中に含まれるアミノ基を用いて反応させる場合には、スクシニミジルエステル基、塩化スルホニル基等を有する誘導体化剤を反応させることによって、質量分析に供される誘導体化された分子を、試料支持部材上での反応で容易に好適に得ることができる。
【0039】
(ハ)また、例えば、タンパク質や糖タンパク質に含まれるシステイン残基等のメルカプト基を用いて反応させる場合には、ヨード基(−I)等を有する誘導体化剤を反応させることによって、質量分析に供される誘導体化された分子を試料支持部材上で好適に得ることができる。
【0040】
2−2.誘導体化剤
官能基を有する測定対象分子は、誘導体化剤を反応させることによって、質量分析に供される分子を得る。誘導体化剤は特に限定はないが、誘導体化された分子すなわち質量分析に供される分子のイオン化効率を高めるものであることが好ましい。レーザー脱離イオン化法においてイオン化効率を高めるものであっても、エレクトロスプレーイオン化法においてイオン化効率を高めるものであってもよい。測定対象分子のイオン化を妨害する夾雑分子のイオン化効率を低下するものであってもよい。質量分析法におけるマトリックス分子としての効果を有する化合物、又はそれらに後記する反応性官能基やスペーサ部分を更に有する化合物も好ましい。
【0041】
かかる誘導体化剤の化学構造は上記効果を奏するものであれば特に限定はないが、その分子内にナフタレン、アントラセン、ピレン等の縮合多環を有する縮合多環誘導体化合物等が上記効果を好適に奏するので特に好ましい。ここで「縮合多環誘導体化合物」とは、窒素、硫黄又は酸素分子を含む複素環を一部に含んでいてもよい縮合多環部分と、測定対象分子と結合することが可能である反応性官能基と、要すれば、該縮合多環部分と該反応性官能基とを連結するスぺーサ部分とを有する化合物をいう。特に、芳香族環を有する化合物であることが更に好ましい。
【0042】
誘導体化剤は、測定対象分子を含む試料に反応することによって、誘導体化された分子すなわち質量分析に供される分子の、イオン化切断位置を制御できるようにするものであることが好ましい。
【0043】
誘導体化剤の有する好適な官能基は、測定対象分子の項で、誘導体化剤の官能基として記載したものが挙げられる。すなわち、アミノ基、ヒドラジド基、ジアゾメチル基、スクシニミジルエステル基、塩化スルホニル基、ヨード基(−I)等を有する誘導体化剤が好ましい。特に好ましい誘導体化剤としては、具体的には、ナフタレン環、アントラセン環、ピレン環等の縮合多環に、上記基が直接若しくは他の基(スペーサ部分)を介して結合した縮合多環誘導体化合物;ヨウ化メチル;ジアゾメタン;トリメチルシリルジアゾメタン;4−アミノ安息香酸エチルエステル;2−アミノピリジン等が挙げられる。
【0044】
このうち、誘導体化された測定対象分子すなわち質量分析に供される分子のイオン化効率を高めたり、イオン化切断位置を制御できるようにしたりする点等で、ピレン誘導体化合物が特に好ましい。ここで「ピレン誘導体化合物」とは、ピレン環と、「測定対象分子に結合することが可能である反応性官能基」と、要すれば「該ピレン環と該反応性官能基とを連結するスペーサ部分」とを有する化合物をいう。
【0045】
具体的には、1−ピレンブタン酸ヒドラジド(1-pyrenebutanoic acid, hydrazide)(以下、「PBH」と略記する)、1−ピレン酢酸ヒドラジド(1-pyreneacetic acid, hydrazide)、1−ピレンプロピオン酸ヒドラジド(1-pyrenepropionic acid, hydrazide)、1−ピレン酢酸スクシニミジルエステル(1-pyreneacetic acid, succinimidyl ester)、1−ピレンプロピオン酸スクシニミジルエステル(1-pyrenepropionic acid, succinimidyl ester)、1−ピレンブタン酸スクシニミジルエステル(1-pyrenebutanoic acid, succinimidyl ester)、N−(1−ピレンブタノイル)システイン酸スクシニミジルエステル(N-(1-pyrenebutanoyl)cysteic acid, succinimidyl ester)、N−(1−ピレン)ヨードアセトアミド(N-(1-pyrene) iodoacetamide)、N−(1−ピレン)ヨードマレイミド(N-(1-pyrene) maleimide)、N−(1−ピレンメチル)ヨードアセトアミド(N-(1-pyrenemethyl) iodoacetamide)、1−ピレンメチルヨードアセテート(1-pyrenemethyl iodoacetate)、アミノピレン(aminopyrene)、1−ピレンメチルアミン(1-pyrenemethyl amine)、1−ピレンプロピルアミン(3-(1-pyrenyl)propylamine)、1−ピレンブチルアミン(4-(1-pyrenyl)butylamine)、1−ピレンスルホン酸クロリド(1-pyrenesulfonyl chloride)、1−ピレニルジアゾメタン(1-pyrenyldiazomethane)(以下、「PDAM」と略記する)、1−ピレンカルバルデヒド ヒドラゾン(1-pyrenecarbaldehyde hydrazone)、1−ピレニルチオシアネート(1-pyrenylthiocyanate)、1−ピレニルイソチオシアネート(1-pyrenylisothiocyanate)等が好ましいものとして挙げられる。このうち最も好ましくはPBH又はPDAMである。
【0046】
誘導体化剤としては、上記具体的化合物において、ピレン環を、ナフタレン環又はアントラセン環に代えたものも好ましいものとして挙げられる。また、ヨウ化メチル、ジアゾメタン又はトリメチルシリルジアゾメタンも好ましい。
【0047】
2−3.測定対象分子を含む試料と誘導体化剤の組み合わせ
好ましい「測定対象分子と誘導体化剤との組み合わせ」としては、測定対象分子がアルデヒド基を含有する糖鎖を有する分子であり、誘導体化剤がアミノ基又はヒドラジド基等を有するものである場合が挙げられる。また、好ましい組み合わせとしては、測定対象分子が、カルボキシル基、アミノ基又はメルカプト基を有するタンパク質若しくは糖タンパク質であり、誘導体化剤が、アミノ基、ヒドラジド基又はジアゾメチル基等を有するものである場合が挙げられ、更に、測定対象分子が、カルボキシル基を有するタンパク質若しくは糖タンパク質であり、誘導体化剤がヨウ化メチル又はトリメチルシリルジアゾメタン、PDAMである場合が挙げられる。
【0048】
これらの組み合わせは、「測定対象分子を含む試料」及び誘導体化剤を、容易に試料支持部材上で反応させることができる点、イオン化を阻害しない点、反応が選択的である点、一般に微量での分析の必要性が高いので上記効果を奏しやすい点等で好ましい。
【0049】
2−4.誘導体化の方法
本発明においては、測定対象分子を含む試料及び誘導体化剤を、試料支持部材上に載せて反応させることを特徴としている。誘導体化は、質量分析に先立って通常は容器内で行われるが、反応操作や過剰の試薬除去の操作が多工程含まれ、時間と労力がかかることに加えて、試料が散逸したり、ある程度の量で操作をしなくてはならないため分析に供せずに無駄になる試料が出てきたりして、生体試料由来の測定対象分子等の微量分析には適用し難かった。
【0050】
2−5.試料支持部材上での測定試料の調製方法
本発明の分析方法を質量分析に適用する場合、少なくとも下記工程を含む質量分析法が好ましい。
(1)測定対象分子を含む試料及び誘導体化剤を、質量分析法に用いる試料支持部材上に載せる工程
(2)測定対象分子を含む試料及び誘導体化剤を、試料支持部材上で反応させる工程
(3)洗浄用溶媒で試料支持部材上を洗浄する工程
(5)試料支持部材上の、反応して生成した測定対象分子を含む試料の誘導体を質量分析計に供する工程
(6)測定対象分子を含む試料の誘導体をイオン化する工程
【0051】
更に、工程(3)と工程(5)の間に、
(4)マトリックス溶液を試料支持部材上に載置して乾燥させ結晶を析出させる工程、
を行うことが、質量分析の感度向上のために特に好ましい。
【0052】
(1)測定対象分子を含む試料及び誘導体化剤を、質量分析法に用いる試料支持部材上に載せる工程
「測定対象分子を含む試料」は、溶媒に溶解又は分散した状態で載せることが好ましい。特に好ましくは、均一に載せることができる点で溶解した方がよい。試料支持部材上に載せる「測定対象分子」の量は特に限定はないが、1amol〜100pmolが本発明の前記効果を奏するために好ましく、1fmol〜1pmolが特に好ましい。実際に試料支持部材上に載せる「測定対象分子を含む試料」の量は、「測定対象分子を含む試料」中の測定対象分子の含有量に比例して増量させる。
【0053】
また、試料支持部材上に載せる「測定対象分子を含む試料」の溶液の液量は特に限定はないが、溶液全体又は分散液全体として10pL〜50μLが好ましく、10nL〜1μLが特に好ましい。溶媒としては特に限定はないが、水、エタノール、ジメチルスルホキシド(以下、「DMSO」と略記する)、アセトニトリル、それらの混合液等が挙げられる。
【0054】
「測定対象分子を含む試料」を溶解又は分散させる最適溶媒が、後述する洗浄用溶媒と異なる場合、測定対象分子の損失を極力避けたい場合等は、一旦乾燥してから誘導体化剤を載せることが好ましい。また、例えば、生体の組織、細胞、体液や分泌液(血液、尿、唾液、涙液等)等のような生体試料等を、質量分析法に用いる試料支持部材上に直接載せることもできるが、その場合には、組織は超薄切片にしたり、細胞は分散状態で載せたり、体液や分泌液は塗布したりして、必要に応じて乾燥したり、メタノールやエタノール等で固定したりすることが好ましい。
【0055】
誘導体化剤は、溶媒に溶解又は分散した状態で載せる。好ましくは、均一に載せることができる点で溶媒に溶解した方がよい。試料支持部材上に載せる誘導体化剤の量は特に限定はないが、1fmol〜10nmolが好ましく、10pmol〜5nmolが特に好ましい。液量は特に限定はないが、溶液全体又は分散液全体として1nL〜50μLが好ましく、10nL〜500nLが特に好ましい。溶媒としては特に限定はないが、誘導体化剤及び測定対象分子を含む試料の溶解性及び揮発性の点で、DMSO、イソプロパノール、n−ブタノール、メタノール、エタノール、アセトニトリル、それらの混液等が好ましい。
【0056】
試料支持部材上に載せる誘導体化剤の好適なモル数は、試料支持部材上に載せる測定対象分子の好適なモル数の10〜100000倍であることが、誘導体化の反応を完結させるため、過剰の誘導体化剤を「洗浄」により除去できるため、夾雑分子等による消費のため等の点で好ましい。1000〜10000倍であることが特に好ましい。
【0057】
洗浄しない場合では、過剰の誘導体化剤がノイズを大きくするので、100ng程度しか使用できず、夾雑分子に消費されて測定対象分子が十分に標識できないことがあった。しかし、洗浄の工程を加えることによって、1μg程度まで使用することが可能になったり、洗浄後に再度誘導体化剤を加えて反応を完結させることが可能になったりするため、測定対象分子の測定感度を極めて向上させる効果が得られる。
【0058】
本発明の分析方法では、測定対象分子と誘導体化剤を試料支持部材上で反応させてから、洗浄用溶媒で洗浄することが必須であり、使用した余分の誘導体化剤を除去できるので、使用する誘導体化剤の使用量を増やすことや繰り返し反応させることができる。誘導体化剤の使用量を増やすことによって、試料支持部材上に、誘導体化した測定対象分子を多く生成させることが可能である。また、夾雑分子に消費されてしまっても誘導体化した測定対象分子を十分に得ることができるという効果を奏し、ノイズを増やすことなく測定対象分子の検出限界を向上させることが可能となる。
【0059】
また、ピレン誘導体化は糖ペプチドのイオン化を向上し、かつ、ペプチドのイオン化を抑制するので、二重の効果として、ペプチド存在化でも糖ペプチドのイオン化は極めて増強する。しかし、多量のペプチドが共存した場合、誘導体化剤が不足し、糖ペプチドのイオン化向上もペプチドのイオン化抑制も完全に起こらず誘導体化による効果が期待できなかったが、実施例にも記載した通り、洗浄によりこの問題点を克服した。
【0060】
誘導体化剤を先に試料支持部材上に載せてもよく、その場合は、誘導体化剤をメタノールやエタノール等の揮発性の高い溶媒で溶解し、試料支持部材上に載せた後、溶媒を揮発させてから、溶媒に溶解した「測定対象分子を含む試料」を載せることも好ましい。また、試料支持部材上で、測定対象分子及び誘導体化剤を最終的に同一溶媒に溶解させたい場合は、どちらを先に試料支持部材上に載せてもよい。すなわち、どちらかを載せる度に乾燥及び/又は反応させてもよいし、乾燥又は/反応を実質的にさせずに次のものを載せて、その後に乾燥及び/又は反応をさせてもよい。
【0061】
更に、誘導体化剤は1種を用いてもよいし、2種以上を用いてもよい。また、誘導体化剤を2種以上用いる場合、同時に2種以上の誘導体化剤を試料支持部材上に載せて反応させてもよいし、試料支持部材上に測定対象分子を含む試料を載せて乾燥後、誘導体化剤Aを載せて、乾燥及び/又は反応をさせた後に、誘導体化剤Bを載せて、乾燥及び/又は反応させることも好ましい。
【0062】
例えば、上記化学反応式(1)で表される化学反応は、従来は、通常、例えば、メタノール、DMSO等の有機溶媒中(溶液として10μL〜100μL)で、触媒としての酢酸等の存在下又は非存在下において、例えば糖鎖と大過剰の反応試薬とを加温(例えば80℃)して行わざるを得なかったが、本発明では、試料支持部材上で反応を行うことにより、DMSO中(50nL〜500nL)で、例えば純度の高い糖鎖や糖ペプチド(1fmol〜500fmol)と誘導体化剤(1pmol〜500pmol)とを反応させて高収率を得るという極めて微量の反応系を容易に実現させることができる。なお、括弧内は、糖鎖と誘導体化剤とを、化学反応式(1)を用いて反応させるときのそれぞれの最も好ましい使用量を示す。
【0063】
(2)測定対象分子を含む試料及び誘導体化剤を、試料支持部材上で反応させる工程
反応は、溶媒を留去してから(乾燥してから)行ってもよく、溶媒の留去と同時に(乾燥しながら)行ってもよい。反応温度に関しては、試料支持部材を0℃〜120℃に維持することにより行うことが好ましい。反応温度は特に好ましくは、20℃〜100℃であり、より好ましくは40℃〜90℃である。反応時間は反応の種類毎に及び/又は溶媒の種類毎に、最適な範囲を選べばよいが、溶媒が乾く時間が好ましい。通常1分〜24時間、好ましくは2分〜20分である。
【0064】
反応終了後、溶媒が残っている場合は、溶媒を除去する。真空デシケーター等を用いる場合は、室温で通常10分〜24時間程度維持することが好ましい。
【0065】
(3)洗浄用溶媒で試料支持部材上を洗浄する工程
本発明の分析方法では、測定対象分子を含む試料及び誘導体化剤を試料支持部材上で反応させた後に、洗浄用溶媒で試料支持部材上を洗浄する。「洗浄用溶媒」とは、前述のように、「誘導体化剤と反応後の測定対象分子」を実質的に溶解せず、誘導体化剤を溶解する溶媒をいう。ここで、「実質的に溶解せず」とは、全く溶解しないことには限定されず、若干の溶解は許容されるが、分析に支障がでる程には溶解されない状態をいう。
【0066】
本発明は、洗浄用溶媒で洗浄しても、試料支持部材上の誘導体化した測定対象分子が意外にも洗浄されて消失することがないという発見に基づいてなされたものである。また、若干の測定対象分子の消失はあっても(又は消失のリスクはあっても)、意外にも誘導体化剤の除去がその消失を補って余りあるという発見に基づいてなされたものである。
【0067】
洗浄の方法については特に限定はないが、洗浄用溶媒の試料支持部材上への滴下を含む操作であることが、機械的な力を試料支持部材上の「測定対象分子を含む試料」に加えない点、同一試料支持部材上の他の測定対象分子を含む試料と混和しない点等から好ましい。
【0068】
また、上記試料支持部材の上記洗浄用溶媒への浸漬を含む操作であることが、均一に洗浄が行われる点、効率よく洗浄される点、すぐに希釈されるので他の測定対象分子を含む試料と容易に混和しない点等から好ましい。かかる操作は、大量の洗浄用溶媒中に試料支持部材を静かに浸して引き上げることが好ましい。
【0069】
反応後に、余剰の誘導体化剤を洗浄によって除去する操作が必須であるために、過剰の誘導体化剤を用いることができ、そして過剰の誘導体化剤を用いることができるために、溶媒等が蒸発するオープンな状態である試料支持部材上での反応であるにも拘らず、誘導体化反応を完結させることができる。
【0070】
特に、測定対象分子以外の夾雑分子に誘導体化剤が消費されてしまう場合に、誘導体化剤の量を増加させたり、洗浄後に誘導体化剤を載せて反応を繰り返したりできるので、測定対象分子への誘導体化反応が完全に行うことが可能である。更に、通常の溶液中の反応の場合、使用する誘導体化剤の量が増加すると、測定対象分子の誘導体化反応生成物が大量の未反応誘導体化剤とともに容器に付着して回収が低下することに加えて、未反応誘導体化剤を除く精製工程(分液抽出やカラムクロマトグラフィー等)が必要となるが、本発明によれば、試料支持部材の上に測定対象分子が載っているので簡単な洗浄操作を繰り返すのみでよい。
【0071】
洗浄用溶媒を試料支持部材上に滴下した後、試料支持部材を傾けて重力により、「誘導体化剤が溶解した溶液」や余分な洗浄用溶媒を除去することが好ましい。また、試料支持部材を予め傾けておき、そこに、洗浄用溶媒を滴下することも好ましい。
【0072】
「誘導体化剤が溶解した溶液」や余分な洗浄用溶媒を除去する方法は特に限定はなく、上記した重力による方法の他にも、スピナー等を用いて遠心力により除去する方法、ろ紙等に吸わせる方法等により除去する方法が挙げられる。
【0073】
洗浄用溶媒は具体的には特に限定はないが、トルエン、キシレン、エチルベンゼン等の芳香族炭化水素系溶媒;アセトン、メチルエチルケトン、シクロヘキサノン等のケトン系溶媒;酢酸エチル、プロピオン酸メチル等のエステル系溶媒;それらの混合溶媒等が挙げられる。中でも、質量分析においては、トルエン、キシレン、エチルベンゼン等の芳香族炭化水素系溶媒が、縮合多環誘導体化合物の溶解性が高い等の点で特に好ましい。
【0074】
特に、上記誘導体化剤が縮合多環誘導体化合物であり、上記洗浄用溶媒が、芳香族炭化水素系溶媒であることが好ましく、上記誘導体化剤がピレン誘導体化合物であり、上記洗浄用溶媒が、トルエン、キシレン若しくはエチルベンゼン、又はこれらの組合せ(これらの混合溶媒)であることが、ピレン誘導体化合物等の縮合多環誘導体化合物が優れた誘導体化剤であって、かかる溶媒が、縮合多環誘導体化合物に対する溶解性が高いために特に好ましい。
【0075】
反応後の試料支持部材上を、洗浄用溶媒で洗浄しさえすればよく、試料支持部材上の測定対象分子と反応していない過剰の誘導体化剤を全て除去する必要はない。好ましくは、測定対象分子と反応した誘導体化剤のモル数に対して、未反応の誘導体化剤のモル数が、1/100倍〜10倍の範囲となるくらいまで洗浄することが好ましい。特に好ましくは、1/100倍〜1倍の範囲である。
【0076】
試料支持部材上に誘導体化剤が残存していると、比較例1における図2(f)に示したように、過剰な誘導体化剤によって、試料支持部材上のマトリックス溶液を載置した部分であって、極めてイオン化効率の高い点(スイートスポット)となるべき結晶化の起点である境界の周辺部分の一部に、マトリックス結晶が生成しない箇所があり、図2gに示したように、洗浄したものに比べて強いシグナルを示した点がまばらとなる。このように、洗浄しない場合には、過剰の誘導体化剤が、マトリックスの結晶化を阻害し、スイートスポットを少なくし、シグナルの検出を抑制する。
【0077】
本発明によらない場合、すなわち、測定対象分子と誘導体化剤を容器で反応させる場合、反応後に過剰の誘導体化剤等を除くために、有機溶媒−水混液等による抽出や、C18等のカラムによる分離操作が必要であり、微量の生体試料由来の糖鎖等にこれらの操作を行うと、工程毎に減量して最終的に検出が困難になる場合があった。
【0078】
しかしながら、本発明によると、試料支持部材上で直接反応を行うことで試料の損失もなく、対象の体積や面積が最小量であるため大過剰の誘導体化剤を用いる必要もなく、しかも、洗浄により過剰の誘導体化剤が試料支持部材上から除去され、一方、洗浄により誘導体化した測定対象分子は意外にも試料支持部材上に十分に残存するので、そのままではイオン化しにくい糖等の質量分析において、測定対象分子のロス(消失)もなく、簡便で効率よく分子イオンを多く生成させることができ、結果として十分な感度を得ることができる。洗浄による「誘導体化した測定対象分子」の消失は皆無ではないが、それにも増して、良好なシグナルを得るには、ノイズの原因である誘導体化剤の除去が支配的であることを新たに見出して本発明に至った。
【0079】
試験管やフラスコ内で起こる反応は、試料支持部材上でも起こることは想像できる。しかしながら、従来は、撹拌できないことやふたをしないと乾固すること等のため、反応が不十分となってしまうと考えられていたため、試料支持部材上で反応させようとは通常考えられていなかった。また、未反応の誘導体化剤はイオン化を阻害する場合があるので、反応収率を上げたり、精製をしたりする必要があると考えられていたため、本発明を想到できなかったと考えられる。本発明によれば、誘導体化した測定対象分子を分析に十分な量で試料支持部材上に残したままで、未反応の誘導体化剤を洗浄により除去できるので、上記したように、未反応の誘導体化剤の残存や使用量が限られるため夾雑分子による誘導体化剤の消費が問題となる試料支持部材上での反応の欠点を補うことができる。
【0080】
(4)マトリックス溶液を試料支持部材上に載置して乾燥させ結晶を析出させる工程
レーザー脱離イオン化法を用いる場合、マトリックス分子を共存させてもよい。すなわち、上記質量分析が、マトリックス支援レーザー脱離イオン化(MALDI)質量分析であることが、本発明の効果をより奏するために特に好ましい。具体的には、上記工程(3)の後、マトリックス溶液を載置して、MALDI−MS用の測定試料を調製する。
【0081】
マトリックスとしては特に限定はなく、公知のものが使用可能であり、2,5−ジヒドロキシ安息香酸(以下、「DHBA」と略記する)、1,5−ジアミノナフタレン、nor−Harman(9H−ピリド[3,4−b]インドール)等が挙げられる。
【0082】
試料支持部材上に載せるマトリックス分子の量は特に限定はないが、マトリックス分子として、0.1μg〜20μgが好ましく、0.2μg〜1μgが特に好ましい。溶媒としては特に限定はないが、測定対象分子を含む試料とマトリックスがよく混和する点で、水又はエタノール−水、アセトニトリル−水の混液等が好ましい。特に好ましくは、水又はアセトニトリル−水の混液である。
【0083】
(5)試料支持部材上の、反応して生成した測定対象分子を含む試料の誘導体を質量分析計に供する工程
質量分析に用いられる質量分析計は公知のものが使用できる。レーザー脱離イオン化法によって測定する場合、反応終了後、溶媒を除去した試料支持部材をそのまま質量分析計に供することができる。MALDI法によって測定する場合、反応終了後、溶媒を除去した試料支持部材にマトリックスを載せた後、そのまま質量分析計に供することができる。ESI法によって測定する場合は、試料支持部材上の測定対象分子を含む試料を、酢酸アンモニウム水溶液−アセトニトリル混液等に溶解して、フローインジェクションあるいはカラムを介して液体クロマトグラフ質量分析計に注入する。この場合、試料支持部材はオートサンプラーに供するサンプル管が好ましい。
【0084】
(6)測定対象分子を含む試料の誘導体をイオン化する工程
イオン化する方法については特に限定はなく、大気圧イオン化(APCI)法、電子衝撃でイオン化したアルゴンやキセノンを中性原子にあてて生じた中性イオンビームを試料にあてるFAB法、レーザー脱離イオン化(LDI)法、マトリックス支援レーザー脱離イオン化(MALDI)法等が挙げられる。
【0085】
このうち、レーザー脱離イオン化(LDI)法が、測定対象分子を含む試料と誘導体化剤が試料支持部材上で反応して生成した誘導体が、イオン化効率を向上させたり、切断イオン化位置を制御したり、生成イオンの安定化に寄与したりできる点で好ましい。糖鎖、タンパク質、糖タンパク質、核酸、糖脂質等の生体試料由来の高分子のイオン化は困難であるが、それらの測定対象分子と誘導体化剤が試料支持部材上で反応して誘導体を生成することによって、マトリックスによるイオン化効率を更に倍増させる点、試料支持部材上に載せた測定対象分子を含む試料を実質的に全て質量分析計に供することができる点、高分子を好適に1価にイオン化できる点、過剰の誘導体化剤がノイズの原因になり易いがそれを除去できる点等から、MALDI法が特に好ましい。
【0086】
レーザー脱離イオン化(LDI)法、マトリックス支援レーザー脱離イオン化(MALDI)法で用いられるレーザーとしては、窒素レーザー(337nm)、YAGレーザー3倍波(355nm)、NdYAGレーザー(256nm)、炭酸ガスレーザー(2940nm)等が挙げられるが、窒素レーザーが好ましい。また、誘導体化剤として、ピレン誘導体化合物等の縮合多環誘導体化合物を用いた場合には、窒素レーザーが特に好ましい。本発明で、測定対象分子を含む試料と誘導体化剤が試料支持部材上で反応して誘導体になることによって、また、過剰の誘導体化剤を除去できること等によって、レーザー強度を通常の20%〜80%まで減ずることができる。レーザー強度の低下は分解能を向上させる効果がある。
【0087】
次いで、二重収束法、四重極集束法(四重極(Q)フィルター法)、タンデム型四重極(QQ)法、イオントラップ法、四重極イオントラップ(QIT)法、飛行時間(TOF)法、四重極イオントラップ飛行時間(QIT−TOF)法等を用いて、イオン化した分子を質量/電荷比(m/z)に従って分離し検出する。好ましくは、QIT−TOFである。
【0088】
糖鎖、タンパク質、糖タンパク質、核酸、糖脂質等の分子は、分子量や組成が同じ異性体を多く含むので、誘導体化を行いイオンの生成効率を向上させ、分子のフラグメント化をn回繰り返す(MSn)法が好ましい。本発明は誘導体化剤を試料支持部材上で反応させ標識化し、MSnにより、選択した標識を含むイオンを解析することで、分子中の結合位置等を決定できる。本発明では、MS2(MS/MS)、MS3又はMS4を行なうことが好ましい。以下、「MS2」を「MS/MS」と表す。
【0089】
2−6.質量分析で特に好ましい試料支持部材
表面にマトリックス結晶化の起点となる閉じた境界が形成されており、該境界で囲まれた領域の表面におけるマトリックス溶液の接触角が、上記境界の外の領域の表面におけるマトリックス溶液の接触角より小さい試料支持部材が、本発明の分析方法が質量分析である場合に、より好ましい試料支持部材となる。また、該境界で囲まれた領域の表面における水の接触角が、上記境界の外の領域の表面における水の接触角より小さい試料支持部材が、特に好ましい試料支持部材となる。マトリックス溶液の溶媒が水や水を主成分とするものである場合には、上記境界で囲まれた領域の表面は親水性で、上記境界の外の領域の表面は疎水性であることが好ましい。その中でも、上記境界で囲まれた領域の表面が金で修飾され、上記境界の外の領域の表面がアルキル基又はアリール基で修飾されている上記試料支持部材が更に好ましい。
【0090】
このような試料支持部材であると、マトリックス溶液を「閉じた境界」の内側に滴下することによって、マトリックス溶液を「閉じた境界」の内側に閉じ込めることができる。そして、該マトリックス溶液を乾燥させると、該境界を起点としてマトリックスの結晶が析出して、該境界の周辺部分からシグナルを得ると、極めてイオン化効率の良い質量分析が可能となる。すなわち、該境界を起点として結晶を析出させると該境界の周辺部分が、極めてイオン化効率の高い点(以下、「スイートスポット」と略記する場合がある)となる。
【0091】
かかる試料支持部材を用いると、測定対象分子を含む試料と誘導体化剤を試料支持部材上の「閉じた境界」に載せて反応させればよく、反応後の試料支持部材上の「閉じた境界」を、洗浄用溶媒で洗浄した後に分析すればよいので、誘導体化及び洗浄が何れも容易となり、更に微量の測定対象分子で分析が可能となる。また、洗浄によって誘導体化剤が除去されるので境界に沿ってマトリックス結晶が再現性よく析出するという顕著な相乗効果がある。
【0092】
このような境界を有するプレートの作製方法としては、以下の具体的作製方法に限定される訳ではないが、プレート表面の有機基による修飾は、例えば、Micro・Contact・Printing法(Harvard大、Whitesidesら、Langmuir・Vol.10.1498〜1511(1994))に従って行うことができる。具体的には、図1に示したような、ポリジメチルシロキサン製の真ん中が抜けた凸版材(真ん中が凹となっていて次の化合物が付着しない版材)を準備し、この版材を、オクタデシルメルカプタンのエタノール希釈液に所定時間浸して風乾する。次いで、この版材を別途準備した金(Au)基板の表面にスタンプする。
【0093】
このようにすれば、版材の凸部上に存在する上記化合物のメルカプト基が金表面と反応してAu−S結合を生じ、金表面にドーナツ型の自己組織化単分子膜(SAMs)を形成する。最後に、金基板をエタノールで洗浄、乾燥し、表面が有機基で修飾され、真中が金のままのプレートを得ることができる。
【0094】
金基板の表面を有機基で修飾する方法は、上記スタンプ法に限られず、スピンコート、ロールコート、スクリーン印刷等の各種塗布方法を採用することもできる。
【0095】
ここで使用する基板の金属材料としては、チオールが吸着可能な金、銀、白金、パラジウム、ロジウム、ルテニウム又はこれらの合金が使用可能である。これらの中でも、大気中で表面酸化が進行しない、安定に作製可能な金が実用上好ましい。
【0096】
修飾に用いる上記有機基は、ブチル基、オクチル基、ドデシル基、ステアリル基等の任意の炭素数のアルキル基;フェニル基、チエニル基、ピロリル基、ピリジル基等の単環式のアリール基;ナフチル基、アンスリル基、ピレニル基、キノリル基、インドリル基、アクリリジニル基、ベンゾチアゾリル基等の縮合多環式のアリール基等が挙げられる。また、一種類の有機基のみでなく、複数種類の有機基をプレート表面に導入することもできる。また、上記アルキル基にはアリール基が置換基として結合していてもよく、上記アリール基にはアルキル基が置換基として結合していてもよい。また、COOH、SO3H、NH2、NO2、OH、COOCH3、CN等の官能基が結合していてもよい。水素がフッ素に置換されていてもよい。
【実施例】
【0097】
以下に、実施例及び比較例を挙げて本発明を更に具体的に説明するが、本発明は、その要旨を超えない限りこれらの実施例に限定されるものではない。
【0098】
実施例1
本発明の分析方法を質量分析に適用した場合の実施例を以下に示す。Micro・Contact・Printing法に従って、プレートへのオクタデシル基の導入を行なった。以下、その表面を「C18」と略記する。具体的には、ポリジメチルシロキサン製の版材を準備し、オクタデシルメルカプタンのエタノール希釈液(2mM)に10分間浸して風乾した。次いで、別途準備した金(Au)基板に3秒間スタンプした。その後、基板をエタノールで洗浄し、乾燥した。内側に1.4mm径の金露出部分を残し、その外側に5mm径のドーナツ状にC18基を導入したものを作製した。以下、オクタデシル基の導入がなされなかった中心部分を「Au」と略記する。
【0099】
このプレート上の「Au」の上に、測定対象分子として、図1に示す構造の糖ペプチド1(0.5fmol〜5pmol)又は糖ペプチド2(0.5fmol〜5pmol)を含有する水溶液0.5〜20μLを載せ乾燥させた。その上に、誘導体化剤として1−ピレニルジアゾメタン500pmol含有DMSO溶液0.25μLを滴下し、約5分にわたって80℃に加熱して乾燥させることにより、ピレン誘導体化を行った。
【0100】
過剰の誘導体化剤を除くために、プレートを傾けて、炭化水素系溶媒であるトルエンを、パスツールピペットにより数滴を滴下して、重力により下に流した。
【0101】
マトリックス溶液として、20mg/mLのDHBA水溶液0.5μLを、上記プレートの「Au」上の誘導体化された測定対象分子の上に載置し乾燥した。
【0102】
糖ペプチドとマトリックスの結晶物を、質量分析計(AXIMA−QIT、島津製作所)のラスタースキャンによってポジティブ及びネガティブイオンを測定した。
【0103】
図2に、ペプチド1を100fmol用いたときの、ピレン誘導体化後(a)、トルエン洗浄後(b)及びマトリックス溶液乾燥後(c)の光学顕微鏡写真を示した。トルエン洗浄後に過剰の試薬が除去されていることが分かる。結晶物は、C18とAuの界面に沿って生成し正円になった。
【0104】
この糖ペプチド・マトリックス結晶物を、マトリックス支援レーザー脱離イオン化(MALDI)質量分析し、得られたスペクトルを図3上段a、bに示す。洗浄しなかった比較例1(図3下段c、d)に比べて、m/zが1000以下の試料由来のノイズが減少し、測定対象分子である糖ペプチドのシグナルm/z=2284が顕著に検出された。この糖ペプチドのシグナルの結晶物での分布を図2dに示した。C18とAuの界面に沿った、結晶物の外縁に強いシグナルが分布していることが分かった。
【0105】
この結果から、洗浄しても誘導体化した測定対象分子の量が測定結果に影響を与える程にまで減少することはなく、それ以上に、洗浄によってノイズに対するシグナルの比率を上げられることが分かった。
【0106】
更に、図には示さなかったが、「糖ペプチド1を100fmol」に代えて、上記濃度(0.5fmol〜5pmol)内の他の濃度で用いたときも、図に示したものとほぼ同様の結果が得られた。また、糖ペプチド1に代えて、糖ペプチド2を0.5fmol〜5pmol用いたときも、上記とほぼ同様の結果が得られた。
【0107】
実施例2
実施例1と同様であるが、トルエンの代わりに脱水キシレン類(キシレン異性体及びエチルベンゼン混合物、和光純薬工業)で洗浄したところ、実施例1と同様な結果が得られた。
【0108】
実施例3
実施例1と同様に誘導体化後、洗浄を滴下でなく、ビーカーに満たした溶媒(トルエン、p−キシレン、又はエチルベンゼン)にプレートを入れて数秒後引き上げ、乾く前にふたたび溶媒に浸すことを3回繰り返して行った。図4に示したように何れの溶媒でも低分子領域のノイズがほとんどなくなり洗浄の効果が明白であった。また、滴下でなく、溶媒に浸漬しても糖ペプチドを失うことなく検出可能であった。
【0109】
比較例1
実施例1において、ピレン誘導体化後にトルエンで洗浄しない以外は実施例1と同様の操作を行い、MS測定を行った。図2に、ピレン誘導体化後(e)及びマトリックス溶液乾燥後(f)の光学顕微鏡写真を示した。図2(f)には、過剰な誘導体化剤によって一部マトリックスの結晶物が生成しない箇所が見られた。
【0110】
図3下段c、dに示したように、洗浄した実施例1に比べて、m/zが1000以下の試薬由来のノイズが顕著で、糖ペプチドのシグナルm/z=2284がほとんど検出されなかった。この糖ペプチドのシグナルの結晶物での分布を図2gに示したが、洗浄したものに比べて強いシグナルを示した点はまばらであった。
【0111】
洗浄しない場合には、明らかに、過剰の誘導体化剤が、糖ペプチド・マトリックス結晶物形成を阻害し、また、共雑イオンを生成することによって、糖ペプチドの検出を抑制していることが判明した。
【0112】
実施例4
通常のステンレスプレートを用いて、実施例1と同様な操作を行い、マトリックス支援レーザー脱離イオン化(MALDI)質量分析を実施した。図5に、ピレン誘導体化後(a)、トルエン洗浄後(b)及びマトリックス溶液乾燥後(c)の光学顕微鏡写真を示した。トルエン洗浄後に過剰の試薬が除去されていることが分かった。ウェルの外側に溝があり、また、実施例1のプレートのような表面処理が施されていないので、トルエンによる洗浄が完全には行えなかったが、図6上段に示すように、低分子側の試薬由来のノイズが軽減され、測定対象分子である糖ペプチドのシグナルm/z=2282が顕著に検出された。
【0113】
比較例2
実施例4と同様な操作を行ったが、ピレン誘導体化後、トルエンで洗浄しないでMS測定を行った。図5に、ピレン誘導体化後(e)及びマトリックス溶液乾燥後(f)の光学顕微鏡写真を示した。
【0114】
図5gに示したように、測定対象分子である糖ペプチドのシグナルが検出される点もわずかであった。また、図6下段に示したように、実施例4で洗浄したもの(図6上段)に比べて、低分子側のノイズが非常に多く、糖ペプチドシグナルm/z=2282も低かった。
【0115】
実施例5
ヒト血清アルブミン5μgを、10mMジチオスレイトールの10mM重炭酸アンモニウム中で55°C、45分処理した後、15mMヨードアセタミドを加えて室温暗所で反応させた。その反応混合物に0.1%RapiGest SF(ウォーターズ)を加え、100℃、5分間処理した後、トリプシン水溶液1μg/2μL、25mM重炭酸アンモニウム中で37℃、3時間反応させた。
【0116】
50%アセトニトリルで2回洗浄し、5%アセトニトリル/0.5%トリフルオロ酢酸で平衡化したPepClean C−18 Spin Column(PIERCE)に、トリプシン反応混合物を添加し、5%アセトニトリル/0.5%トリフルオロ酢酸で洗浄した。70%アセトニトリルでペプチド画分を溶出し、乾固した。
【0117】
このようにして得られたヒト血清アルブミン消化物の1/50(約1.5pmol)を糖ペプチド2(500fmol)に加えた測定試料について、実施例4と同様な操作を行った。その際に、誘導体化剤の量を500pmol又は2.5nmol使用し、洗浄については、実施例3と同様に、トルエンを満たしたビーカーにプレートを入れて数秒後引き上げ、乾く前にふたたびトルエンに浸すことを3回行った。
【0118】
図7bに誘導体化剤を500pmol使用した場合、図7cに誘導体化剤を2.5nmolを使用したときのポジティブイオンスペクトルを示す。白矢印はペプチドイオンであり、黒矢印は糖ペプチドイオンである。
【0119】
ステンレスプレートの場合にも、誘導体化反応後、過剰の誘導体化剤を滴下でなく、トルエンに浸しても、以下に示すように測定対象分子は洗い流されることなく検出された。むしろ、滴下よりも、トルエンに完全に接触するので好ましかった。比較例3で誘導体化反応を行わなかった場合には検出できなかったが、誘導体化剤を500pmol使用した場合は図7bに示したように、黒矢印で示した糖ペプチドのシグナルが検出された。反対に、白矢印で示したアルブミン由来ペプチドのシグナルが低下した。
【0120】
更に、2.5nmolの誘導体化剤を用いた場合(図7c)には、500pmolに比べて糖ペプチドのシグナルの顕著な増強は認められなかったが、ペプチドのシグナルは明らかに抑制された。このことから、測定対象分子の糖ペプチド以外にペプチドが存在すると、500pmolでは誘導体化剤が不足し、誘導体化剤の量を増加させるとより効果的であることが判明した。しかし、洗浄という操作がないと誘導体化剤の増量に限界があった。このように、夾雑ペプチドのイオン化が抑制され、糖ペプチドシグナルが増強する効果は、洗浄という操作を加える本発明によってより顕著になった。
【0121】
比較例3
実施例5において、誘導体化しない以外は実施例5と同様にして、測定試料を作製し測定を行った。ポジティブイオンスペクトルの結果を図7aに示した。誘導体化をしないと、洗浄の有無にかかわらず、白矢印で示したアルブミン由来ペプチドのみが検出され、糖ペプチドは検出できなかった。
【0122】
比較例4
測定対象分子として実施例1と同じ糖ペプチド2を10fmol用いて、誘導体化をエッペンチューブ内で行い、反応混合物全量をプレートに置いたが、図8下に示したように、質量分析がそもそもできないことが分かった。
【0123】
実施例6
一方、比較例4と同量の糖ペプチド2を用いて、プレート上で直接誘導体化、洗浄を行った結果、明確なシグナルが得られた(図8上)。
【産業上の利用可能性】
【0124】
本発明の分析法は、質量分析に適用した場合、イオン化効率の良いスイートスポットを多く含む測定試料を提供でき、それによって信頼性の高い化学構造についての情報を得ることができるので、微量な生体試料由来の分子や生体試料中の分子の化学構造解析はもちろん、機能解明や病態の解明の分野にも広く利用されるものである。また、質量分析以外に適用した場合でも、微量の分子の分析に広く利用されるものである。
【技術分野】
【0001】
本発明は、測定対象分子の分析方法に関し、更に詳細には、測定対象分子を含む試料が微量のとき等に有効な測定対象分子の分析方法に関する。
【背景技術】
【0002】
測定対象分子の、化学構造、分子量、分子中の特定の官能基の有無、測定対象分子自体の量、測定対象分子自体の物性、対照物質との相対的な物性、固体表面への吸着性、異なる分子の混合比等を種々の分析方法で分析する場合、測定対象分子の分析の感度を上げる必要がある場合が多い。特に、生体試料由来の測定対象分子等、分析のために与えられた試料の絶対量が少ない場合には、測定対象分子の分析の感度を上げることが特に必要となる。
【0003】
一方、測定対象分子を、フラスコ、ビーカー、試験管等の容器内で予め誘導体化して、別の分子に変換してから分析すると、誘導体化前の測定対象分子の情報がより得られるような分析手段は多い。上記した測定対象分子の絶対的な物性や量、又は相対的な物性には、測定対象分子を誘導体化した分子の分析をした方が、感度が上昇し、測定対象分子の正確な情報が得られるものは多い。また、測定試料に複数の測定対象分子が存在したり測定対象分子以外の分子も共存したりする場合に、その中の特定の分子のみが誘導体化されることによって他の分子と区別されることを利用して、より詳細な、あるいは正確な情報を得る分析方法も考えられる。
【0004】
特に、測定対象分子の一部の物性を測定したり、測定対象分子のフラグメントを測定したり、誘導体化に用いた誘導体化剤の情報が測定対象分子の情報を阻害しなかったり、誘導体化剤の情報のみを除去できるような分析等に関しては、測定対象分子の誘導体化が好適に用いられ得る。
【0005】
例えば、非特許文献1には、4−アミノ安息香酸エチルエステル、2−アミノピリジン、1−ピレンブタン酸ヒドラジド(1-pyrenebutanoic acid hydrazide;PBH)等を用いて、予め糖鎖を誘導体化した後に試料支持部材に載せ、マトリックス支援レーザー脱離イオン化質量分析(MALDI−MS)する方法が提案されている。
【0006】
また、特許文献1には、測定対象分子及び誘導体化剤を、質量分析法に用いる試料支持部材上に載せ、測定対象分子と誘導体化剤とを試料支持部材上で反応させることを特徴とする質量分析法が開示されており、測定対象分子が、糖、タンパク質又は糖タンパク質等で、微量しかない場合でも分析が可能であることが示されている。
【0007】
しかしながら、ノイズに対するシグナルを強くしたり、微量の測定対象分子を含む試料を精度よく分析したりするためには、更なる改良が望まれていた。
【先行技術文献】
【特許文献】
【0008】
【特許文献1】特開2008−051790号公報
【非特許文献】
【0009】
【非特許文献1】Sugahara, D. et al.,Anal.Sci.,19,第167〜169頁 (2003)
【発明の概要】
【発明が解決しようとする課題】
【0010】
本発明は上記背景技術に鑑みてなされたものであり、その課題は、測定対象分子を含む試料が微量であっても分析可能な分析方法を提供することにある。また、簡便に信頼性の高い情報を得ることができる分析方法を提供することにあり、微量な生体試料由来の分子又は生体試料中の分子等に適用して、その機能解明や病態の解明に有用な情報を得ることもできる分析方法を提供することにある。
【課題を解決するための手段】
【0011】
本発明者は、上記の課題を解決すべく鋭意検討を重ねた結果、測定対象分子と誘導体化剤を試料支持部材上で反応させ、次いで、反応した測定対象分子を実質的に溶解せず誘導体化剤を溶解する洗浄用溶媒で洗浄することによって、驚くべきことに反応後の測定対象分子を流失させることなく、過剰に残存する誘導体化剤を除去できることを見出し、その後に分析することにより上記課題を解決できることを見出した。具体的には、例えば、質量分析に用いる試料支持部材上で直接反応を行うことによって、試料が減量することなく、簡便に効率良く分子の安定な誘導体を作成し、イオン化が困難であった分子のイオン化効率の向上及び生成したイオンの安定化を実現して、質量分析の感度を向上させることができることを見いだして本発明を完成するに至った。
【0012】
すなわち、本発明は、試料支持部材上の誘導体化した測定対象分子を分析する方法であって、該測定対象分子を含む試料及び誘導体化剤を試料支持部材上に載せて反応させ、反応後の試料支持部材上を、「誘導体化剤と反応後の測定対象分子を実質的に溶解せず、誘導体化剤を溶解する洗浄用溶媒」で洗浄した後に分析することを特徴とする分析方法を提供するものである。
【発明の効果】
【0013】
本発明によれば、測定対象分子を含む試料の量や、それに対する誘導体化剤等の反応試薬等の量及びそれらの反応溶液量を減らしても分析可能な分析方法を提供することができる。それにより、測定対象分子を含む試料が微量であっても分析可能で、また簡便に信頼性の高い情報を得ることができる。具体的には、試料支持部材上で測定対象分子に誘導体化剤を反応させることによって、用いる測定対象分子を含む試料の量、誘導体化剤及びそれらの反応溶液量を減らすことができ、すなわち、別途容器中で反応させるよりも高収量化を可能にし、緩和な条件で測定対象分子を減量させることなく、ノイズに対するシグナルの比を上げることができる。
【0014】
本発明は微量な生体試料由来の分子や生体試料中の分子に適用できるので、例えば、糖鎖、タンパク質(ペプチドを含む)、糖タンパク質(糖ペプチドを含む)、核酸、糖脂質等の分子の機能解明や病態の解明に有用な情報を得る方法を提供できる。
【0015】
特に、本発明の分析方法における測定試料の調製法を質量分析に適用すれば、十分な量の分子イオンを生成させることができ、高感度の質量分析法用の測定試料を簡便に調製できる。その結果、通常の処理工程では、分析可能な量以下になってしまうような微量の「測定対象分子を含む試料」しか得られない場合でも質量分析が可能となる。また、その結果、イオン化効率を向上させ、切断イオン化位置を制御したり、生成イオンの安定化を達成したりして、測定の再現性を向上させることができ、信頼性の高い化学構造情報を得ることができる。
【図面の簡単な説明】
【0016】
【図1】糖ペプチド1及び糖ペプチド2の構造を示す図である。
【図2】Au/C18プレートを用い、糖ペプチド1(100fmol)と誘導体化剤を試料支持部材上に載せて反応させ、洗浄を行った場合(a〜d)と行わなかった場合(e〜g)の、プレートの光学顕微鏡写真(a〜c、e、f)とスイートスポット(d、g)を示す図である(実施例1、比較例1)。 (a)誘導体化後、(b)洗浄後、(c)洗浄した場合のマトリックス溶液乾燥後、(d)上記(c)のスイートスポット;(e)誘導体化後、(f)洗浄しなかった場合のマトリックス溶液乾燥後、(g)上記(f)のスイートスポット
【図3】Au/C18プレートを用い、洗浄の有無による質量分析のシグナルとノイズの状態を示すスぺクトルであり、a、cがネガティブイオンスペクトルを示す図であり、b、dがポジティブイオンスペクトルを示す図である。 a、b:洗浄あり(実施例1)、c、d:洗浄なし(比較例1)
【図4】Au/C18プレートを用い、糖ペプチド2(100fmol)を誘導体化後、洗浄をビーカーに満たした洗浄用溶媒に浸漬して行った場合のポジティブイオンスペクトルを示す図である(実施例3)。
【図5】ステンレスプレートを用い、糖ペプチド1(100fmol)と誘導体化剤を試料支持部材上に載せて反応させ、洗浄を行った場合(a〜d)と行わなかった場合(e〜g)の、プレートの光学顕微鏡写真(a〜c、e、f)とスイートスポット(d、g)を示す図である(実施例4、比較例2)。 (a)誘導体化後、(b)洗浄後、(c)洗浄した場合のマトリックス溶液乾燥後、(d)上記(c)のスイートスポット;(e)誘導体化後、(f)洗浄しなかった場合のマトリックス溶液乾燥後、(g)上記(f)のスイートスポット
【図6】ステンレスプレートを用い、洗浄の有無による質量分析のシグナルとノイズの状態を示したネガティブイオンスぺクトルを示す図である(実施例4、比較例2)。 上段:洗浄あり(実施例4)、下段:洗浄なし(比較例2)
【図7】ステンレスプレートを用い、ヒト血清アルブミン由来ペプチド(約1500fmol)を糖ペプチド2(500fmol)に加えた測定試料について、(a)誘導体化しなかった場合のポジティブイオンスペクトル(比較例3)、(b)誘導体化剤を500pmol、又は、(c)誘導体化剤を2.5nmolを試料支持部材上に載せて反応させ、洗浄を行った場合のポジティブイオンスペクトル(実施例5)を示す図である。 白矢印はペプチドイオンであり、黒矢印は糖ペプチドイオンである。
【図8】Au/C18プレートを用い、糖ペプチド2(10fmol)、誘導体化剤を試料支持部材上に載せて反応させ、洗浄を行った場合(上段、実施例6)と、同量の糖ペプチド及び誘導体化剤をエッペンドルフチューブ中で反応させた場合(下段、比較例4)のポジティブイオンスペクトルを示す図である。
【発明を実施するための形態】
【0017】
以下、本発明について説明するが、本発明は以下の実施の具体的態様に限定されるものではなく、任意に変形して実施することができる。
【0018】
本発明の分析方法では、該測定対象分子を含む試料及び誘導体化剤を試料支持部材上に載せて試料支持部材上で反応させ、その後、反応後の試料支持部材上を「誘導体化剤と反応後の測定対象分子を実質的に溶解せず、誘導体化剤を溶解する洗浄用溶媒」で洗浄して測定試料を調製する。本発明においては、以下、括弧内「誘導体化剤と反応後の測定対象分子を実質的に溶解せず、誘導体化剤を溶解する洗浄用溶媒」を、単に「洗浄用溶媒」と略記する。
【0019】
<測定対象分子を含む試料>
「測定対象分子を含む試料」は特に限定はないが、少量しか得られない試料、試料中に含まれる測定対象分子が少量である試料(純度が低い試料)、誘導体化剤を反応させることによって感度が上昇し易い試料、誘導体化剤を反応させて測定対象分子を分析し易く変化させることのできる試料、誘導体化した場合としない場合の差を分析したい試料、測定試料を調製する過程で損失が大きくならざるを得ない試料、誘導体化剤を反応させることによって測定対象分子の分析を妨げる夾雑分子の感度が低下する試料、特定の測定対象分子だけを区別して分析したい試料等が挙げられる。測定対象分子は、具体的には特に限定はないが、多糖、単糖等の糖;タンパク質(ペプチドを含む);糖タンパク質(糖ペプチドを含む)、糖脂質等の複合糖質;修飾タンパク質(修飾ペプチドを含む);核酸;生体代謝物等であることが、本発明の効果を発揮できるので好ましい。
【0020】
「測定対象分子を含む試料」は、測定対象分子自体のみからなる試料でもよいし、測定対象分子以外の分子を含む試料でもよい。本発明では、試料支持部材上の測定対象分子を分析するので、測定対象分子を含む試料は試料支持部材の上に載せる必要がある。
【0021】
具体的な「測定対象分子を含む試料」としては特に限定はないが、天然物、天然物から抽出されるもの、天然物を化学的又は酵素学的に一部改変して調製されるもの、化学的又は酵素学的に調製されるもの等が好ましい。また、生体に含まれる分子の部分構造を有するものや生体に含まれる分子を模倣して作製されたものも好ましい。また、生体の組織、細胞、体液や分泌物(例えば、血液、血清、尿、精液、唾液、涙液、汗、糞便等)等、直接生体試料を用いてもよい。また、試料を試料支持部材上に載せ、酵素処理等を行なって、測定対象分子を含む試料を調製してもよい。以上の試料は、測定対象分子が微量になる場合が多い点で本発明にとって好ましい。
【0022】
<分析方法>
本発明の分析方法は、測定対象分子を含む試料及び測定対象分子が、試料支持部材上に載るものである。本発明の分析方法は、試料支持部材上に測定試料を調製し、それを分析するものであれば特に限定はなく、具体的には例えば、質量分析(MS)、水晶天秤分析(QCM)、二次イオン質量分析(SIMS)、電子プローブマクロアナライザー(EPMA)(X線マイクロアナライザー(XMA))、イオンマイクロアナライザー(IMA))、蛍光X線分析(XFL、XRF、FX)、赤外分光分析、顕微赤外分光分析、ラマン分光分析、顕微ラマン分光分析、紫外可視分光分析、蛍光分析、時間分解蛍光分析、偏光分析、顕微質量分析、顕微イメージング、表面プラズモン共鳴測定、電気泳動、クロマトグラフィー等が挙げられる。
【0023】
本発明における「試料支持部材」とは、分子が反応できる場を提供する表面をもち、実質的に全量を分析に供し得るものであり、使用する分析方法に適したものであれば特に限定されないが、好ましくは、サンプルプレート、オートサンプラー用サンプル管等の分析試料を分析装置に供給専用のサンプル管、ミクロウエルプレート、スライドグラス、キャピラリー、膜、ゲル等が挙げられる。質量分析の場合、特に好ましいプレートについては後述するが、質量分析用のサンプルプレートは、表面が金でコーティングされていたり、表面が化学的修飾又は物理的加工がしてあったりしてもよい。
【0024】
本発明において、「試料支持部材上に載せる」という表現は、例えば上記サンプル管の内壁上に載せることも意味する。すなわち、「試料支持部材」には板状、皿状、筒状のみならず、容器状のものも含まれ、「上に載せる」は、容器状のものの中に載せる、すなわち容器状のものの中に入れることをも含むものである。
【0025】
<<質量分析>>
1.質量分析の種類
以下、質量分析を例にとって本発明を説明する。
質量分析(以下、「MS」と略記することがある)は、マトリックス支援レーザー脱離イオン化質量分析法(MALDI−MS)、エレクトロスプレーイオン化質量分析法(ESI−MS)等によって化学構造情報を得る。これらの分子は、分子イオン([M+Na]+、[M+H]+、[M−H]−等)生成が効率よく起こるかどうかが検出感度に大きく影響する。特に、糖は分子量及び組成が同一の異性体が複数存在するので、分子イオンをプリカーサーイオンとして選択し断片化し、更に生じたイオンをプリカーサーイオンとして選択し断片化することを繰り返すMSn(nは2以上の整数)解析が必須である。
【0026】
一般に、MS/MS測定により得られるイオンのシグナル強度は前段階のイオンの約1/10に減少する。従って、多段階MS測定(MSn)を行うことによって、構造情報は極めて多くなるが、検出感度は低下していくので、はじめの分子イオン生成量が十分に多いことが必要となる。しかも、生体試料由来の分子等の場合は、そのままではイオン化されにくく、また分子の破壊が起り易く、特に、糖;糖タンパク質、糖脂質等の複合糖質等又はそれらから化学的若しくは酵素学的に遊離させて得たものは、分子量と組成が同一の異性体が複数存在するので、なおさら十分な量の「測定対象分子を含む試料」が必要になる。例えば、糖鎖をそのままマトリックス支援レーザー脱離イオン化−飛行時間型質量分析法(MALDI−TOF MS)で解析しようとすると10pmol以上を要する。
【0027】
2.誘導体化
しかしながら、生体試料等の場合は、採取又は入手できる絶対量が少ない場合が多く、検出感度を上げるしか方法はない。この問題に関して、本発明では、測定対象分子を誘導体化し、その誘導体化した測定対象分子を分析する。
【0028】
2−1.誘導体化に好ましい測定対象分子
誘導体化する場合に測定対象分子の有している好ましい官能基としては、誘導体化剤と反応しやすく、反応してできたものが質量分析において悪影響を及ぼさないものであれば特に限定はないが、アルデヒド基、カルボキシル基、アミノ基、メルカプト基又は水酸基が好ましい。すなわち、本発明における測定対象分子は、アルデヒド基、カルボキシル基、アミノ基、メルカプト基及び水酸基よりなる群から選ばれた1種以上の官能基を有するものであることが好ましい。
【0029】
以下に、本発明の分析方法が好適に適用できる測定対象分子について、上記好ましい官能基毎に詳しく説明する。
(a)アルデヒド基を有する測定対象分子
非還元末端やC2、C4又はC6位のみに置換基をもつヘキソース等のように隣り合うジオールを持つ糖鎖は、過ヨウ素酸酸化によってアルデヒド基を生じるので、測定対象分子として好ましい。特に、シアル酸を含む糖鎖は、シアル酸のC7−9位のみを選択的に過ヨウ素酸で酸化してアルデヒド基を生じさせることができる。シアル酸のC7−9位の選択的酸化は、例えば、5mMのNaIO4水溶液中で0℃、10〜20分間にわたり反応させることによってなされる。かかる、シアル酸由来のアルデヒド基を有している測定対象分子は、後述するように、アミノ基、ヒドラジド基等を有する誘導体化剤と反応して、質量分析に供される誘導体化された分子を、容易に試料支持部材上で反応させて好適に得ることができるので、本発明の分析法で測定対象分子として好ましい。
【0030】
非還元末端にガラクトースを含む糖鎖も好ましい。その非還元末端のガラクトースを特異的にガラクトースオキシダーゼによってC6位を酸化し、アルデヒド基を生じさせることができるからである。酵素反応は、例えば、中性の緩衝液中で、室温、2時間で行うことができる。アミノ基、ヒドラジド基等を有する誘導体化剤を用いて、上記の酵素的酸化により生じたアルデヒド基と、アミノ基やヒドラジド基を、試料支持部材上で縮合反応を行い、次いで要すれば還元することによって、質量分析に供される誘導体化された分子を容易に試料支持部材上で反応させて好適に得ることができる。
【0031】
上記必要に応じて行う還元は特に限定はないが、NaCNBH3、NaBH4、NaBH(OCOCH3)3等の還元剤を加えて、加温又は室温で反応を行うことが好ましい。また、測定対象分子と誘導体化剤との反応溶液中に始めから還元剤を共存させておくことも可能である。還元することによって、誘導体化された分子が安定するという効果がある。
【0032】
例えば、アルデヒド基を有する測定対象分子に、例えば、ヒドラジド基を有する誘導体化剤を反応させる化学反応は下記式(1)で表される。
R1CONHNH2 + R2CHO → R1CONHN=CHR2 (1)
[式中、R1、R2は、互いに独立に任意の有機基を示す。]
【0033】
還元は、例えば上記の場合、化学反応は下記式(2)で表される。
R1CONHN=CHR2 → R1CONHNH−CH2R2 (2)
[式中、R1、R2は、互いに独立に任意の有機基を示す。]
【0034】
シアル酸やガラクトース等に標識を行う上記の方法を、糖タンパク質分子上のシアル酸やガラクトース等に適用することも可能である。その場合、糖タンパク質分子を標識できるので、該分子のイオン化効率が高くなり、質量分析が特に高感度になるので好ましい。また、本発明においては、糖鎖を遊離することなく、分子上の糖鎖を標識することができるので、糖鎖を含むタンパク質のタンデム質量分析スペクトル解析ができ、タンパク質のペプチド鎖上の糖鎖構造の有無及び糖鎖結合位置が特定できる。
【0035】
糖タンパク質の機能を解明する上で、糖鎖がペプチド鎖上のどこの位置に、どのような構造を有して付加しているのかを明らかにすることは極めて重要である。多くの場合、複数の異なる構造の糖鎖がペプチド鎖の複数の結合位置に結合しているので、糖鎖の位置と構造の対応を明確にする必要がある。本発明は、標識された糖鎖部分やペプチド部分の構造情報を得ることを可能とする。従って、本発明における測定対象分子として、糖タンパク質は特に好ましい。
【0036】
(b)カルボキシル基、アミノ基、メルカプト基、水酸基等を有する測定対象分子
例えば、タンパク質や糖タンパク質は、その中に含まれるカルボキシル基、アミノ基、メルカプト基、水酸基等を用いて誘導体化剤と反応させることができる。
【0037】
(イ)測定対象分子の中に含まれるカルボキシル基を用いて反応させる場合には、それらと、アミノ基、ヒドラジド基、ジアゾメチル基等を有する誘導体化剤とを試料支持部材上で反応させることによって、質量分析に供される化合物を好適に得ることができる。また、測定対象分子中のカルボキシル基は、誘導体化剤であるヨウ化メチルやトリメチルシリルジアゾメタンと反応してメチルエステルとなり、質量分析に供される誘導体化された分子を、容易に試料支持部材上での反応により得ることができる。必要に応じて、脱水縮合剤を加えて反応させることもできる。シアル酸を有する分子の場合には、シアル酸のカルボキシル基を用いてもよい。
【0038】
(ロ)また、測定対象分子の中に含まれるアミノ基を用いて反応させる場合には、スクシニミジルエステル基、塩化スルホニル基等を有する誘導体化剤を反応させることによって、質量分析に供される誘導体化された分子を、試料支持部材上での反応で容易に好適に得ることができる。
【0039】
(ハ)また、例えば、タンパク質や糖タンパク質に含まれるシステイン残基等のメルカプト基を用いて反応させる場合には、ヨード基(−I)等を有する誘導体化剤を反応させることによって、質量分析に供される誘導体化された分子を試料支持部材上で好適に得ることができる。
【0040】
2−2.誘導体化剤
官能基を有する測定対象分子は、誘導体化剤を反応させることによって、質量分析に供される分子を得る。誘導体化剤は特に限定はないが、誘導体化された分子すなわち質量分析に供される分子のイオン化効率を高めるものであることが好ましい。レーザー脱離イオン化法においてイオン化効率を高めるものであっても、エレクトロスプレーイオン化法においてイオン化効率を高めるものであってもよい。測定対象分子のイオン化を妨害する夾雑分子のイオン化効率を低下するものであってもよい。質量分析法におけるマトリックス分子としての効果を有する化合物、又はそれらに後記する反応性官能基やスペーサ部分を更に有する化合物も好ましい。
【0041】
かかる誘導体化剤の化学構造は上記効果を奏するものであれば特に限定はないが、その分子内にナフタレン、アントラセン、ピレン等の縮合多環を有する縮合多環誘導体化合物等が上記効果を好適に奏するので特に好ましい。ここで「縮合多環誘導体化合物」とは、窒素、硫黄又は酸素分子を含む複素環を一部に含んでいてもよい縮合多環部分と、測定対象分子と結合することが可能である反応性官能基と、要すれば、該縮合多環部分と該反応性官能基とを連結するスぺーサ部分とを有する化合物をいう。特に、芳香族環を有する化合物であることが更に好ましい。
【0042】
誘導体化剤は、測定対象分子を含む試料に反応することによって、誘導体化された分子すなわち質量分析に供される分子の、イオン化切断位置を制御できるようにするものであることが好ましい。
【0043】
誘導体化剤の有する好適な官能基は、測定対象分子の項で、誘導体化剤の官能基として記載したものが挙げられる。すなわち、アミノ基、ヒドラジド基、ジアゾメチル基、スクシニミジルエステル基、塩化スルホニル基、ヨード基(−I)等を有する誘導体化剤が好ましい。特に好ましい誘導体化剤としては、具体的には、ナフタレン環、アントラセン環、ピレン環等の縮合多環に、上記基が直接若しくは他の基(スペーサ部分)を介して結合した縮合多環誘導体化合物;ヨウ化メチル;ジアゾメタン;トリメチルシリルジアゾメタン;4−アミノ安息香酸エチルエステル;2−アミノピリジン等が挙げられる。
【0044】
このうち、誘導体化された測定対象分子すなわち質量分析に供される分子のイオン化効率を高めたり、イオン化切断位置を制御できるようにしたりする点等で、ピレン誘導体化合物が特に好ましい。ここで「ピレン誘導体化合物」とは、ピレン環と、「測定対象分子に結合することが可能である反応性官能基」と、要すれば「該ピレン環と該反応性官能基とを連結するスペーサ部分」とを有する化合物をいう。
【0045】
具体的には、1−ピレンブタン酸ヒドラジド(1-pyrenebutanoic acid, hydrazide)(以下、「PBH」と略記する)、1−ピレン酢酸ヒドラジド(1-pyreneacetic acid, hydrazide)、1−ピレンプロピオン酸ヒドラジド(1-pyrenepropionic acid, hydrazide)、1−ピレン酢酸スクシニミジルエステル(1-pyreneacetic acid, succinimidyl ester)、1−ピレンプロピオン酸スクシニミジルエステル(1-pyrenepropionic acid, succinimidyl ester)、1−ピレンブタン酸スクシニミジルエステル(1-pyrenebutanoic acid, succinimidyl ester)、N−(1−ピレンブタノイル)システイン酸スクシニミジルエステル(N-(1-pyrenebutanoyl)cysteic acid, succinimidyl ester)、N−(1−ピレン)ヨードアセトアミド(N-(1-pyrene) iodoacetamide)、N−(1−ピレン)ヨードマレイミド(N-(1-pyrene) maleimide)、N−(1−ピレンメチル)ヨードアセトアミド(N-(1-pyrenemethyl) iodoacetamide)、1−ピレンメチルヨードアセテート(1-pyrenemethyl iodoacetate)、アミノピレン(aminopyrene)、1−ピレンメチルアミン(1-pyrenemethyl amine)、1−ピレンプロピルアミン(3-(1-pyrenyl)propylamine)、1−ピレンブチルアミン(4-(1-pyrenyl)butylamine)、1−ピレンスルホン酸クロリド(1-pyrenesulfonyl chloride)、1−ピレニルジアゾメタン(1-pyrenyldiazomethane)(以下、「PDAM」と略記する)、1−ピレンカルバルデヒド ヒドラゾン(1-pyrenecarbaldehyde hydrazone)、1−ピレニルチオシアネート(1-pyrenylthiocyanate)、1−ピレニルイソチオシアネート(1-pyrenylisothiocyanate)等が好ましいものとして挙げられる。このうち最も好ましくはPBH又はPDAMである。
【0046】
誘導体化剤としては、上記具体的化合物において、ピレン環を、ナフタレン環又はアントラセン環に代えたものも好ましいものとして挙げられる。また、ヨウ化メチル、ジアゾメタン又はトリメチルシリルジアゾメタンも好ましい。
【0047】
2−3.測定対象分子を含む試料と誘導体化剤の組み合わせ
好ましい「測定対象分子と誘導体化剤との組み合わせ」としては、測定対象分子がアルデヒド基を含有する糖鎖を有する分子であり、誘導体化剤がアミノ基又はヒドラジド基等を有するものである場合が挙げられる。また、好ましい組み合わせとしては、測定対象分子が、カルボキシル基、アミノ基又はメルカプト基を有するタンパク質若しくは糖タンパク質であり、誘導体化剤が、アミノ基、ヒドラジド基又はジアゾメチル基等を有するものである場合が挙げられ、更に、測定対象分子が、カルボキシル基を有するタンパク質若しくは糖タンパク質であり、誘導体化剤がヨウ化メチル又はトリメチルシリルジアゾメタン、PDAMである場合が挙げられる。
【0048】
これらの組み合わせは、「測定対象分子を含む試料」及び誘導体化剤を、容易に試料支持部材上で反応させることができる点、イオン化を阻害しない点、反応が選択的である点、一般に微量での分析の必要性が高いので上記効果を奏しやすい点等で好ましい。
【0049】
2−4.誘導体化の方法
本発明においては、測定対象分子を含む試料及び誘導体化剤を、試料支持部材上に載せて反応させることを特徴としている。誘導体化は、質量分析に先立って通常は容器内で行われるが、反応操作や過剰の試薬除去の操作が多工程含まれ、時間と労力がかかることに加えて、試料が散逸したり、ある程度の量で操作をしなくてはならないため分析に供せずに無駄になる試料が出てきたりして、生体試料由来の測定対象分子等の微量分析には適用し難かった。
【0050】
2−5.試料支持部材上での測定試料の調製方法
本発明の分析方法を質量分析に適用する場合、少なくとも下記工程を含む質量分析法が好ましい。
(1)測定対象分子を含む試料及び誘導体化剤を、質量分析法に用いる試料支持部材上に載せる工程
(2)測定対象分子を含む試料及び誘導体化剤を、試料支持部材上で反応させる工程
(3)洗浄用溶媒で試料支持部材上を洗浄する工程
(5)試料支持部材上の、反応して生成した測定対象分子を含む試料の誘導体を質量分析計に供する工程
(6)測定対象分子を含む試料の誘導体をイオン化する工程
【0051】
更に、工程(3)と工程(5)の間に、
(4)マトリックス溶液を試料支持部材上に載置して乾燥させ結晶を析出させる工程、
を行うことが、質量分析の感度向上のために特に好ましい。
【0052】
(1)測定対象分子を含む試料及び誘導体化剤を、質量分析法に用いる試料支持部材上に載せる工程
「測定対象分子を含む試料」は、溶媒に溶解又は分散した状態で載せることが好ましい。特に好ましくは、均一に載せることができる点で溶解した方がよい。試料支持部材上に載せる「測定対象分子」の量は特に限定はないが、1amol〜100pmolが本発明の前記効果を奏するために好ましく、1fmol〜1pmolが特に好ましい。実際に試料支持部材上に載せる「測定対象分子を含む試料」の量は、「測定対象分子を含む試料」中の測定対象分子の含有量に比例して増量させる。
【0053】
また、試料支持部材上に載せる「測定対象分子を含む試料」の溶液の液量は特に限定はないが、溶液全体又は分散液全体として10pL〜50μLが好ましく、10nL〜1μLが特に好ましい。溶媒としては特に限定はないが、水、エタノール、ジメチルスルホキシド(以下、「DMSO」と略記する)、アセトニトリル、それらの混合液等が挙げられる。
【0054】
「測定対象分子を含む試料」を溶解又は分散させる最適溶媒が、後述する洗浄用溶媒と異なる場合、測定対象分子の損失を極力避けたい場合等は、一旦乾燥してから誘導体化剤を載せることが好ましい。また、例えば、生体の組織、細胞、体液や分泌液(血液、尿、唾液、涙液等)等のような生体試料等を、質量分析法に用いる試料支持部材上に直接載せることもできるが、その場合には、組織は超薄切片にしたり、細胞は分散状態で載せたり、体液や分泌液は塗布したりして、必要に応じて乾燥したり、メタノールやエタノール等で固定したりすることが好ましい。
【0055】
誘導体化剤は、溶媒に溶解又は分散した状態で載せる。好ましくは、均一に載せることができる点で溶媒に溶解した方がよい。試料支持部材上に載せる誘導体化剤の量は特に限定はないが、1fmol〜10nmolが好ましく、10pmol〜5nmolが特に好ましい。液量は特に限定はないが、溶液全体又は分散液全体として1nL〜50μLが好ましく、10nL〜500nLが特に好ましい。溶媒としては特に限定はないが、誘導体化剤及び測定対象分子を含む試料の溶解性及び揮発性の点で、DMSO、イソプロパノール、n−ブタノール、メタノール、エタノール、アセトニトリル、それらの混液等が好ましい。
【0056】
試料支持部材上に載せる誘導体化剤の好適なモル数は、試料支持部材上に載せる測定対象分子の好適なモル数の10〜100000倍であることが、誘導体化の反応を完結させるため、過剰の誘導体化剤を「洗浄」により除去できるため、夾雑分子等による消費のため等の点で好ましい。1000〜10000倍であることが特に好ましい。
【0057】
洗浄しない場合では、過剰の誘導体化剤がノイズを大きくするので、100ng程度しか使用できず、夾雑分子に消費されて測定対象分子が十分に標識できないことがあった。しかし、洗浄の工程を加えることによって、1μg程度まで使用することが可能になったり、洗浄後に再度誘導体化剤を加えて反応を完結させることが可能になったりするため、測定対象分子の測定感度を極めて向上させる効果が得られる。
【0058】
本発明の分析方法では、測定対象分子と誘導体化剤を試料支持部材上で反応させてから、洗浄用溶媒で洗浄することが必須であり、使用した余分の誘導体化剤を除去できるので、使用する誘導体化剤の使用量を増やすことや繰り返し反応させることができる。誘導体化剤の使用量を増やすことによって、試料支持部材上に、誘導体化した測定対象分子を多く生成させることが可能である。また、夾雑分子に消費されてしまっても誘導体化した測定対象分子を十分に得ることができるという効果を奏し、ノイズを増やすことなく測定対象分子の検出限界を向上させることが可能となる。
【0059】
また、ピレン誘導体化は糖ペプチドのイオン化を向上し、かつ、ペプチドのイオン化を抑制するので、二重の効果として、ペプチド存在化でも糖ペプチドのイオン化は極めて増強する。しかし、多量のペプチドが共存した場合、誘導体化剤が不足し、糖ペプチドのイオン化向上もペプチドのイオン化抑制も完全に起こらず誘導体化による効果が期待できなかったが、実施例にも記載した通り、洗浄によりこの問題点を克服した。
【0060】
誘導体化剤を先に試料支持部材上に載せてもよく、その場合は、誘導体化剤をメタノールやエタノール等の揮発性の高い溶媒で溶解し、試料支持部材上に載せた後、溶媒を揮発させてから、溶媒に溶解した「測定対象分子を含む試料」を載せることも好ましい。また、試料支持部材上で、測定対象分子及び誘導体化剤を最終的に同一溶媒に溶解させたい場合は、どちらを先に試料支持部材上に載せてもよい。すなわち、どちらかを載せる度に乾燥及び/又は反応させてもよいし、乾燥又は/反応を実質的にさせずに次のものを載せて、その後に乾燥及び/又は反応をさせてもよい。
【0061】
更に、誘導体化剤は1種を用いてもよいし、2種以上を用いてもよい。また、誘導体化剤を2種以上用いる場合、同時に2種以上の誘導体化剤を試料支持部材上に載せて反応させてもよいし、試料支持部材上に測定対象分子を含む試料を載せて乾燥後、誘導体化剤Aを載せて、乾燥及び/又は反応をさせた後に、誘導体化剤Bを載せて、乾燥及び/又は反応させることも好ましい。
【0062】
例えば、上記化学反応式(1)で表される化学反応は、従来は、通常、例えば、メタノール、DMSO等の有機溶媒中(溶液として10μL〜100μL)で、触媒としての酢酸等の存在下又は非存在下において、例えば糖鎖と大過剰の反応試薬とを加温(例えば80℃)して行わざるを得なかったが、本発明では、試料支持部材上で反応を行うことにより、DMSO中(50nL〜500nL)で、例えば純度の高い糖鎖や糖ペプチド(1fmol〜500fmol)と誘導体化剤(1pmol〜500pmol)とを反応させて高収率を得るという極めて微量の反応系を容易に実現させることができる。なお、括弧内は、糖鎖と誘導体化剤とを、化学反応式(1)を用いて反応させるときのそれぞれの最も好ましい使用量を示す。
【0063】
(2)測定対象分子を含む試料及び誘導体化剤を、試料支持部材上で反応させる工程
反応は、溶媒を留去してから(乾燥してから)行ってもよく、溶媒の留去と同時に(乾燥しながら)行ってもよい。反応温度に関しては、試料支持部材を0℃〜120℃に維持することにより行うことが好ましい。反応温度は特に好ましくは、20℃〜100℃であり、より好ましくは40℃〜90℃である。反応時間は反応の種類毎に及び/又は溶媒の種類毎に、最適な範囲を選べばよいが、溶媒が乾く時間が好ましい。通常1分〜24時間、好ましくは2分〜20分である。
【0064】
反応終了後、溶媒が残っている場合は、溶媒を除去する。真空デシケーター等を用いる場合は、室温で通常10分〜24時間程度維持することが好ましい。
【0065】
(3)洗浄用溶媒で試料支持部材上を洗浄する工程
本発明の分析方法では、測定対象分子を含む試料及び誘導体化剤を試料支持部材上で反応させた後に、洗浄用溶媒で試料支持部材上を洗浄する。「洗浄用溶媒」とは、前述のように、「誘導体化剤と反応後の測定対象分子」を実質的に溶解せず、誘導体化剤を溶解する溶媒をいう。ここで、「実質的に溶解せず」とは、全く溶解しないことには限定されず、若干の溶解は許容されるが、分析に支障がでる程には溶解されない状態をいう。
【0066】
本発明は、洗浄用溶媒で洗浄しても、試料支持部材上の誘導体化した測定対象分子が意外にも洗浄されて消失することがないという発見に基づいてなされたものである。また、若干の測定対象分子の消失はあっても(又は消失のリスクはあっても)、意外にも誘導体化剤の除去がその消失を補って余りあるという発見に基づいてなされたものである。
【0067】
洗浄の方法については特に限定はないが、洗浄用溶媒の試料支持部材上への滴下を含む操作であることが、機械的な力を試料支持部材上の「測定対象分子を含む試料」に加えない点、同一試料支持部材上の他の測定対象分子を含む試料と混和しない点等から好ましい。
【0068】
また、上記試料支持部材の上記洗浄用溶媒への浸漬を含む操作であることが、均一に洗浄が行われる点、効率よく洗浄される点、すぐに希釈されるので他の測定対象分子を含む試料と容易に混和しない点等から好ましい。かかる操作は、大量の洗浄用溶媒中に試料支持部材を静かに浸して引き上げることが好ましい。
【0069】
反応後に、余剰の誘導体化剤を洗浄によって除去する操作が必須であるために、過剰の誘導体化剤を用いることができ、そして過剰の誘導体化剤を用いることができるために、溶媒等が蒸発するオープンな状態である試料支持部材上での反応であるにも拘らず、誘導体化反応を完結させることができる。
【0070】
特に、測定対象分子以外の夾雑分子に誘導体化剤が消費されてしまう場合に、誘導体化剤の量を増加させたり、洗浄後に誘導体化剤を載せて反応を繰り返したりできるので、測定対象分子への誘導体化反応が完全に行うことが可能である。更に、通常の溶液中の反応の場合、使用する誘導体化剤の量が増加すると、測定対象分子の誘導体化反応生成物が大量の未反応誘導体化剤とともに容器に付着して回収が低下することに加えて、未反応誘導体化剤を除く精製工程(分液抽出やカラムクロマトグラフィー等)が必要となるが、本発明によれば、試料支持部材の上に測定対象分子が載っているので簡単な洗浄操作を繰り返すのみでよい。
【0071】
洗浄用溶媒を試料支持部材上に滴下した後、試料支持部材を傾けて重力により、「誘導体化剤が溶解した溶液」や余分な洗浄用溶媒を除去することが好ましい。また、試料支持部材を予め傾けておき、そこに、洗浄用溶媒を滴下することも好ましい。
【0072】
「誘導体化剤が溶解した溶液」や余分な洗浄用溶媒を除去する方法は特に限定はなく、上記した重力による方法の他にも、スピナー等を用いて遠心力により除去する方法、ろ紙等に吸わせる方法等により除去する方法が挙げられる。
【0073】
洗浄用溶媒は具体的には特に限定はないが、トルエン、キシレン、エチルベンゼン等の芳香族炭化水素系溶媒;アセトン、メチルエチルケトン、シクロヘキサノン等のケトン系溶媒;酢酸エチル、プロピオン酸メチル等のエステル系溶媒;それらの混合溶媒等が挙げられる。中でも、質量分析においては、トルエン、キシレン、エチルベンゼン等の芳香族炭化水素系溶媒が、縮合多環誘導体化合物の溶解性が高い等の点で特に好ましい。
【0074】
特に、上記誘導体化剤が縮合多環誘導体化合物であり、上記洗浄用溶媒が、芳香族炭化水素系溶媒であることが好ましく、上記誘導体化剤がピレン誘導体化合物であり、上記洗浄用溶媒が、トルエン、キシレン若しくはエチルベンゼン、又はこれらの組合せ(これらの混合溶媒)であることが、ピレン誘導体化合物等の縮合多環誘導体化合物が優れた誘導体化剤であって、かかる溶媒が、縮合多環誘導体化合物に対する溶解性が高いために特に好ましい。
【0075】
反応後の試料支持部材上を、洗浄用溶媒で洗浄しさえすればよく、試料支持部材上の測定対象分子と反応していない過剰の誘導体化剤を全て除去する必要はない。好ましくは、測定対象分子と反応した誘導体化剤のモル数に対して、未反応の誘導体化剤のモル数が、1/100倍〜10倍の範囲となるくらいまで洗浄することが好ましい。特に好ましくは、1/100倍〜1倍の範囲である。
【0076】
試料支持部材上に誘導体化剤が残存していると、比較例1における図2(f)に示したように、過剰な誘導体化剤によって、試料支持部材上のマトリックス溶液を載置した部分であって、極めてイオン化効率の高い点(スイートスポット)となるべき結晶化の起点である境界の周辺部分の一部に、マトリックス結晶が生成しない箇所があり、図2gに示したように、洗浄したものに比べて強いシグナルを示した点がまばらとなる。このように、洗浄しない場合には、過剰の誘導体化剤が、マトリックスの結晶化を阻害し、スイートスポットを少なくし、シグナルの検出を抑制する。
【0077】
本発明によらない場合、すなわち、測定対象分子と誘導体化剤を容器で反応させる場合、反応後に過剰の誘導体化剤等を除くために、有機溶媒−水混液等による抽出や、C18等のカラムによる分離操作が必要であり、微量の生体試料由来の糖鎖等にこれらの操作を行うと、工程毎に減量して最終的に検出が困難になる場合があった。
【0078】
しかしながら、本発明によると、試料支持部材上で直接反応を行うことで試料の損失もなく、対象の体積や面積が最小量であるため大過剰の誘導体化剤を用いる必要もなく、しかも、洗浄により過剰の誘導体化剤が試料支持部材上から除去され、一方、洗浄により誘導体化した測定対象分子は意外にも試料支持部材上に十分に残存するので、そのままではイオン化しにくい糖等の質量分析において、測定対象分子のロス(消失)もなく、簡便で効率よく分子イオンを多く生成させることができ、結果として十分な感度を得ることができる。洗浄による「誘導体化した測定対象分子」の消失は皆無ではないが、それにも増して、良好なシグナルを得るには、ノイズの原因である誘導体化剤の除去が支配的であることを新たに見出して本発明に至った。
【0079】
試験管やフラスコ内で起こる反応は、試料支持部材上でも起こることは想像できる。しかしながら、従来は、撹拌できないことやふたをしないと乾固すること等のため、反応が不十分となってしまうと考えられていたため、試料支持部材上で反応させようとは通常考えられていなかった。また、未反応の誘導体化剤はイオン化を阻害する場合があるので、反応収率を上げたり、精製をしたりする必要があると考えられていたため、本発明を想到できなかったと考えられる。本発明によれば、誘導体化した測定対象分子を分析に十分な量で試料支持部材上に残したままで、未反応の誘導体化剤を洗浄により除去できるので、上記したように、未反応の誘導体化剤の残存や使用量が限られるため夾雑分子による誘導体化剤の消費が問題となる試料支持部材上での反応の欠点を補うことができる。
【0080】
(4)マトリックス溶液を試料支持部材上に載置して乾燥させ結晶を析出させる工程
レーザー脱離イオン化法を用いる場合、マトリックス分子を共存させてもよい。すなわち、上記質量分析が、マトリックス支援レーザー脱離イオン化(MALDI)質量分析であることが、本発明の効果をより奏するために特に好ましい。具体的には、上記工程(3)の後、マトリックス溶液を載置して、MALDI−MS用の測定試料を調製する。
【0081】
マトリックスとしては特に限定はなく、公知のものが使用可能であり、2,5−ジヒドロキシ安息香酸(以下、「DHBA」と略記する)、1,5−ジアミノナフタレン、nor−Harman(9H−ピリド[3,4−b]インドール)等が挙げられる。
【0082】
試料支持部材上に載せるマトリックス分子の量は特に限定はないが、マトリックス分子として、0.1μg〜20μgが好ましく、0.2μg〜1μgが特に好ましい。溶媒としては特に限定はないが、測定対象分子を含む試料とマトリックスがよく混和する点で、水又はエタノール−水、アセトニトリル−水の混液等が好ましい。特に好ましくは、水又はアセトニトリル−水の混液である。
【0083】
(5)試料支持部材上の、反応して生成した測定対象分子を含む試料の誘導体を質量分析計に供する工程
質量分析に用いられる質量分析計は公知のものが使用できる。レーザー脱離イオン化法によって測定する場合、反応終了後、溶媒を除去した試料支持部材をそのまま質量分析計に供することができる。MALDI法によって測定する場合、反応終了後、溶媒を除去した試料支持部材にマトリックスを載せた後、そのまま質量分析計に供することができる。ESI法によって測定する場合は、試料支持部材上の測定対象分子を含む試料を、酢酸アンモニウム水溶液−アセトニトリル混液等に溶解して、フローインジェクションあるいはカラムを介して液体クロマトグラフ質量分析計に注入する。この場合、試料支持部材はオートサンプラーに供するサンプル管が好ましい。
【0084】
(6)測定対象分子を含む試料の誘導体をイオン化する工程
イオン化する方法については特に限定はなく、大気圧イオン化(APCI)法、電子衝撃でイオン化したアルゴンやキセノンを中性原子にあてて生じた中性イオンビームを試料にあてるFAB法、レーザー脱離イオン化(LDI)法、マトリックス支援レーザー脱離イオン化(MALDI)法等が挙げられる。
【0085】
このうち、レーザー脱離イオン化(LDI)法が、測定対象分子を含む試料と誘導体化剤が試料支持部材上で反応して生成した誘導体が、イオン化効率を向上させたり、切断イオン化位置を制御したり、生成イオンの安定化に寄与したりできる点で好ましい。糖鎖、タンパク質、糖タンパク質、核酸、糖脂質等の生体試料由来の高分子のイオン化は困難であるが、それらの測定対象分子と誘導体化剤が試料支持部材上で反応して誘導体を生成することによって、マトリックスによるイオン化効率を更に倍増させる点、試料支持部材上に載せた測定対象分子を含む試料を実質的に全て質量分析計に供することができる点、高分子を好適に1価にイオン化できる点、過剰の誘導体化剤がノイズの原因になり易いがそれを除去できる点等から、MALDI法が特に好ましい。
【0086】
レーザー脱離イオン化(LDI)法、マトリックス支援レーザー脱離イオン化(MALDI)法で用いられるレーザーとしては、窒素レーザー(337nm)、YAGレーザー3倍波(355nm)、NdYAGレーザー(256nm)、炭酸ガスレーザー(2940nm)等が挙げられるが、窒素レーザーが好ましい。また、誘導体化剤として、ピレン誘導体化合物等の縮合多環誘導体化合物を用いた場合には、窒素レーザーが特に好ましい。本発明で、測定対象分子を含む試料と誘導体化剤が試料支持部材上で反応して誘導体になることによって、また、過剰の誘導体化剤を除去できること等によって、レーザー強度を通常の20%〜80%まで減ずることができる。レーザー強度の低下は分解能を向上させる効果がある。
【0087】
次いで、二重収束法、四重極集束法(四重極(Q)フィルター法)、タンデム型四重極(QQ)法、イオントラップ法、四重極イオントラップ(QIT)法、飛行時間(TOF)法、四重極イオントラップ飛行時間(QIT−TOF)法等を用いて、イオン化した分子を質量/電荷比(m/z)に従って分離し検出する。好ましくは、QIT−TOFである。
【0088】
糖鎖、タンパク質、糖タンパク質、核酸、糖脂質等の分子は、分子量や組成が同じ異性体を多く含むので、誘導体化を行いイオンの生成効率を向上させ、分子のフラグメント化をn回繰り返す(MSn)法が好ましい。本発明は誘導体化剤を試料支持部材上で反応させ標識化し、MSnにより、選択した標識を含むイオンを解析することで、分子中の結合位置等を決定できる。本発明では、MS2(MS/MS)、MS3又はMS4を行なうことが好ましい。以下、「MS2」を「MS/MS」と表す。
【0089】
2−6.質量分析で特に好ましい試料支持部材
表面にマトリックス結晶化の起点となる閉じた境界が形成されており、該境界で囲まれた領域の表面におけるマトリックス溶液の接触角が、上記境界の外の領域の表面におけるマトリックス溶液の接触角より小さい試料支持部材が、本発明の分析方法が質量分析である場合に、より好ましい試料支持部材となる。また、該境界で囲まれた領域の表面における水の接触角が、上記境界の外の領域の表面における水の接触角より小さい試料支持部材が、特に好ましい試料支持部材となる。マトリックス溶液の溶媒が水や水を主成分とするものである場合には、上記境界で囲まれた領域の表面は親水性で、上記境界の外の領域の表面は疎水性であることが好ましい。その中でも、上記境界で囲まれた領域の表面が金で修飾され、上記境界の外の領域の表面がアルキル基又はアリール基で修飾されている上記試料支持部材が更に好ましい。
【0090】
このような試料支持部材であると、マトリックス溶液を「閉じた境界」の内側に滴下することによって、マトリックス溶液を「閉じた境界」の内側に閉じ込めることができる。そして、該マトリックス溶液を乾燥させると、該境界を起点としてマトリックスの結晶が析出して、該境界の周辺部分からシグナルを得ると、極めてイオン化効率の良い質量分析が可能となる。すなわち、該境界を起点として結晶を析出させると該境界の周辺部分が、極めてイオン化効率の高い点(以下、「スイートスポット」と略記する場合がある)となる。
【0091】
かかる試料支持部材を用いると、測定対象分子を含む試料と誘導体化剤を試料支持部材上の「閉じた境界」に載せて反応させればよく、反応後の試料支持部材上の「閉じた境界」を、洗浄用溶媒で洗浄した後に分析すればよいので、誘導体化及び洗浄が何れも容易となり、更に微量の測定対象分子で分析が可能となる。また、洗浄によって誘導体化剤が除去されるので境界に沿ってマトリックス結晶が再現性よく析出するという顕著な相乗効果がある。
【0092】
このような境界を有するプレートの作製方法としては、以下の具体的作製方法に限定される訳ではないが、プレート表面の有機基による修飾は、例えば、Micro・Contact・Printing法(Harvard大、Whitesidesら、Langmuir・Vol.10.1498〜1511(1994))に従って行うことができる。具体的には、図1に示したような、ポリジメチルシロキサン製の真ん中が抜けた凸版材(真ん中が凹となっていて次の化合物が付着しない版材)を準備し、この版材を、オクタデシルメルカプタンのエタノール希釈液に所定時間浸して風乾する。次いで、この版材を別途準備した金(Au)基板の表面にスタンプする。
【0093】
このようにすれば、版材の凸部上に存在する上記化合物のメルカプト基が金表面と反応してAu−S結合を生じ、金表面にドーナツ型の自己組織化単分子膜(SAMs)を形成する。最後に、金基板をエタノールで洗浄、乾燥し、表面が有機基で修飾され、真中が金のままのプレートを得ることができる。
【0094】
金基板の表面を有機基で修飾する方法は、上記スタンプ法に限られず、スピンコート、ロールコート、スクリーン印刷等の各種塗布方法を採用することもできる。
【0095】
ここで使用する基板の金属材料としては、チオールが吸着可能な金、銀、白金、パラジウム、ロジウム、ルテニウム又はこれらの合金が使用可能である。これらの中でも、大気中で表面酸化が進行しない、安定に作製可能な金が実用上好ましい。
【0096】
修飾に用いる上記有機基は、ブチル基、オクチル基、ドデシル基、ステアリル基等の任意の炭素数のアルキル基;フェニル基、チエニル基、ピロリル基、ピリジル基等の単環式のアリール基;ナフチル基、アンスリル基、ピレニル基、キノリル基、インドリル基、アクリリジニル基、ベンゾチアゾリル基等の縮合多環式のアリール基等が挙げられる。また、一種類の有機基のみでなく、複数種類の有機基をプレート表面に導入することもできる。また、上記アルキル基にはアリール基が置換基として結合していてもよく、上記アリール基にはアルキル基が置換基として結合していてもよい。また、COOH、SO3H、NH2、NO2、OH、COOCH3、CN等の官能基が結合していてもよい。水素がフッ素に置換されていてもよい。
【実施例】
【0097】
以下に、実施例及び比較例を挙げて本発明を更に具体的に説明するが、本発明は、その要旨を超えない限りこれらの実施例に限定されるものではない。
【0098】
実施例1
本発明の分析方法を質量分析に適用した場合の実施例を以下に示す。Micro・Contact・Printing法に従って、プレートへのオクタデシル基の導入を行なった。以下、その表面を「C18」と略記する。具体的には、ポリジメチルシロキサン製の版材を準備し、オクタデシルメルカプタンのエタノール希釈液(2mM)に10分間浸して風乾した。次いで、別途準備した金(Au)基板に3秒間スタンプした。その後、基板をエタノールで洗浄し、乾燥した。内側に1.4mm径の金露出部分を残し、その外側に5mm径のドーナツ状にC18基を導入したものを作製した。以下、オクタデシル基の導入がなされなかった中心部分を「Au」と略記する。
【0099】
このプレート上の「Au」の上に、測定対象分子として、図1に示す構造の糖ペプチド1(0.5fmol〜5pmol)又は糖ペプチド2(0.5fmol〜5pmol)を含有する水溶液0.5〜20μLを載せ乾燥させた。その上に、誘導体化剤として1−ピレニルジアゾメタン500pmol含有DMSO溶液0.25μLを滴下し、約5分にわたって80℃に加熱して乾燥させることにより、ピレン誘導体化を行った。
【0100】
過剰の誘導体化剤を除くために、プレートを傾けて、炭化水素系溶媒であるトルエンを、パスツールピペットにより数滴を滴下して、重力により下に流した。
【0101】
マトリックス溶液として、20mg/mLのDHBA水溶液0.5μLを、上記プレートの「Au」上の誘導体化された測定対象分子の上に載置し乾燥した。
【0102】
糖ペプチドとマトリックスの結晶物を、質量分析計(AXIMA−QIT、島津製作所)のラスタースキャンによってポジティブ及びネガティブイオンを測定した。
【0103】
図2に、ペプチド1を100fmol用いたときの、ピレン誘導体化後(a)、トルエン洗浄後(b)及びマトリックス溶液乾燥後(c)の光学顕微鏡写真を示した。トルエン洗浄後に過剰の試薬が除去されていることが分かる。結晶物は、C18とAuの界面に沿って生成し正円になった。
【0104】
この糖ペプチド・マトリックス結晶物を、マトリックス支援レーザー脱離イオン化(MALDI)質量分析し、得られたスペクトルを図3上段a、bに示す。洗浄しなかった比較例1(図3下段c、d)に比べて、m/zが1000以下の試料由来のノイズが減少し、測定対象分子である糖ペプチドのシグナルm/z=2284が顕著に検出された。この糖ペプチドのシグナルの結晶物での分布を図2dに示した。C18とAuの界面に沿った、結晶物の外縁に強いシグナルが分布していることが分かった。
【0105】
この結果から、洗浄しても誘導体化した測定対象分子の量が測定結果に影響を与える程にまで減少することはなく、それ以上に、洗浄によってノイズに対するシグナルの比率を上げられることが分かった。
【0106】
更に、図には示さなかったが、「糖ペプチド1を100fmol」に代えて、上記濃度(0.5fmol〜5pmol)内の他の濃度で用いたときも、図に示したものとほぼ同様の結果が得られた。また、糖ペプチド1に代えて、糖ペプチド2を0.5fmol〜5pmol用いたときも、上記とほぼ同様の結果が得られた。
【0107】
実施例2
実施例1と同様であるが、トルエンの代わりに脱水キシレン類(キシレン異性体及びエチルベンゼン混合物、和光純薬工業)で洗浄したところ、実施例1と同様な結果が得られた。
【0108】
実施例3
実施例1と同様に誘導体化後、洗浄を滴下でなく、ビーカーに満たした溶媒(トルエン、p−キシレン、又はエチルベンゼン)にプレートを入れて数秒後引き上げ、乾く前にふたたび溶媒に浸すことを3回繰り返して行った。図4に示したように何れの溶媒でも低分子領域のノイズがほとんどなくなり洗浄の効果が明白であった。また、滴下でなく、溶媒に浸漬しても糖ペプチドを失うことなく検出可能であった。
【0109】
比較例1
実施例1において、ピレン誘導体化後にトルエンで洗浄しない以外は実施例1と同様の操作を行い、MS測定を行った。図2に、ピレン誘導体化後(e)及びマトリックス溶液乾燥後(f)の光学顕微鏡写真を示した。図2(f)には、過剰な誘導体化剤によって一部マトリックスの結晶物が生成しない箇所が見られた。
【0110】
図3下段c、dに示したように、洗浄した実施例1に比べて、m/zが1000以下の試薬由来のノイズが顕著で、糖ペプチドのシグナルm/z=2284がほとんど検出されなかった。この糖ペプチドのシグナルの結晶物での分布を図2gに示したが、洗浄したものに比べて強いシグナルを示した点はまばらであった。
【0111】
洗浄しない場合には、明らかに、過剰の誘導体化剤が、糖ペプチド・マトリックス結晶物形成を阻害し、また、共雑イオンを生成することによって、糖ペプチドの検出を抑制していることが判明した。
【0112】
実施例4
通常のステンレスプレートを用いて、実施例1と同様な操作を行い、マトリックス支援レーザー脱離イオン化(MALDI)質量分析を実施した。図5に、ピレン誘導体化後(a)、トルエン洗浄後(b)及びマトリックス溶液乾燥後(c)の光学顕微鏡写真を示した。トルエン洗浄後に過剰の試薬が除去されていることが分かった。ウェルの外側に溝があり、また、実施例1のプレートのような表面処理が施されていないので、トルエンによる洗浄が完全には行えなかったが、図6上段に示すように、低分子側の試薬由来のノイズが軽減され、測定対象分子である糖ペプチドのシグナルm/z=2282が顕著に検出された。
【0113】
比較例2
実施例4と同様な操作を行ったが、ピレン誘導体化後、トルエンで洗浄しないでMS測定を行った。図5に、ピレン誘導体化後(e)及びマトリックス溶液乾燥後(f)の光学顕微鏡写真を示した。
【0114】
図5gに示したように、測定対象分子である糖ペプチドのシグナルが検出される点もわずかであった。また、図6下段に示したように、実施例4で洗浄したもの(図6上段)に比べて、低分子側のノイズが非常に多く、糖ペプチドシグナルm/z=2282も低かった。
【0115】
実施例5
ヒト血清アルブミン5μgを、10mMジチオスレイトールの10mM重炭酸アンモニウム中で55°C、45分処理した後、15mMヨードアセタミドを加えて室温暗所で反応させた。その反応混合物に0.1%RapiGest SF(ウォーターズ)を加え、100℃、5分間処理した後、トリプシン水溶液1μg/2μL、25mM重炭酸アンモニウム中で37℃、3時間反応させた。
【0116】
50%アセトニトリルで2回洗浄し、5%アセトニトリル/0.5%トリフルオロ酢酸で平衡化したPepClean C−18 Spin Column(PIERCE)に、トリプシン反応混合物を添加し、5%アセトニトリル/0.5%トリフルオロ酢酸で洗浄した。70%アセトニトリルでペプチド画分を溶出し、乾固した。
【0117】
このようにして得られたヒト血清アルブミン消化物の1/50(約1.5pmol)を糖ペプチド2(500fmol)に加えた測定試料について、実施例4と同様な操作を行った。その際に、誘導体化剤の量を500pmol又は2.5nmol使用し、洗浄については、実施例3と同様に、トルエンを満たしたビーカーにプレートを入れて数秒後引き上げ、乾く前にふたたびトルエンに浸すことを3回行った。
【0118】
図7bに誘導体化剤を500pmol使用した場合、図7cに誘導体化剤を2.5nmolを使用したときのポジティブイオンスペクトルを示す。白矢印はペプチドイオンであり、黒矢印は糖ペプチドイオンである。
【0119】
ステンレスプレートの場合にも、誘導体化反応後、過剰の誘導体化剤を滴下でなく、トルエンに浸しても、以下に示すように測定対象分子は洗い流されることなく検出された。むしろ、滴下よりも、トルエンに完全に接触するので好ましかった。比較例3で誘導体化反応を行わなかった場合には検出できなかったが、誘導体化剤を500pmol使用した場合は図7bに示したように、黒矢印で示した糖ペプチドのシグナルが検出された。反対に、白矢印で示したアルブミン由来ペプチドのシグナルが低下した。
【0120】
更に、2.5nmolの誘導体化剤を用いた場合(図7c)には、500pmolに比べて糖ペプチドのシグナルの顕著な増強は認められなかったが、ペプチドのシグナルは明らかに抑制された。このことから、測定対象分子の糖ペプチド以外にペプチドが存在すると、500pmolでは誘導体化剤が不足し、誘導体化剤の量を増加させるとより効果的であることが判明した。しかし、洗浄という操作がないと誘導体化剤の増量に限界があった。このように、夾雑ペプチドのイオン化が抑制され、糖ペプチドシグナルが増強する効果は、洗浄という操作を加える本発明によってより顕著になった。
【0121】
比較例3
実施例5において、誘導体化しない以外は実施例5と同様にして、測定試料を作製し測定を行った。ポジティブイオンスペクトルの結果を図7aに示した。誘導体化をしないと、洗浄の有無にかかわらず、白矢印で示したアルブミン由来ペプチドのみが検出され、糖ペプチドは検出できなかった。
【0122】
比較例4
測定対象分子として実施例1と同じ糖ペプチド2を10fmol用いて、誘導体化をエッペンチューブ内で行い、反応混合物全量をプレートに置いたが、図8下に示したように、質量分析がそもそもできないことが分かった。
【0123】
実施例6
一方、比較例4と同量の糖ペプチド2を用いて、プレート上で直接誘導体化、洗浄を行った結果、明確なシグナルが得られた(図8上)。
【産業上の利用可能性】
【0124】
本発明の分析法は、質量分析に適用した場合、イオン化効率の良いスイートスポットを多く含む測定試料を提供でき、それによって信頼性の高い化学構造についての情報を得ることができるので、微量な生体試料由来の分子や生体試料中の分子の化学構造解析はもちろん、機能解明や病態の解明の分野にも広く利用されるものである。また、質量分析以外に適用した場合でも、微量の分子の分析に広く利用されるものである。
【特許請求の範囲】
【請求項1】
試料支持部材上の誘導体化した測定対象分子を分析する方法であって、該測定対象分子を含む試料及び誘導体化剤を試料支持部材上に載せて反応させ、反応後の試料支持部材上を、誘導体化剤と反応後の測定対象分子を実質的に溶解せず、誘導体化剤を溶解する洗浄用溶媒で洗浄した後に分析することを特徴とする分析方法。
【請求項2】
上記洗浄が、上記洗浄用溶媒の試料支持部材上への滴下、又は上記試料支持部材の上記洗浄用溶媒への浸漬を含む操作である請求項1に記載の分析方法。
【請求項3】
上記誘導体化剤が縮合多環誘導体化合物であり、上記洗浄用溶媒が芳香族炭化水素系溶媒である請求項1又は請求項2に記載の分析方法。
【請求項4】
上記誘導体化剤がピレン誘導体化合物であり、上記洗浄用溶媒がトルエン、キシレン若しくはエチルベンゼン、又はこれらの組合せである請求項3に記載の分析方法。
【請求項5】
上記分析が質量分析である請求項1ないし請求項4の何れかの請求項に記載の分析方法。
【請求項6】
上記質量分析が、マトリックス支援レーザー脱離イオン化(MALDI)質量分析である請求項5に記載の分析方法。
【請求項1】
試料支持部材上の誘導体化した測定対象分子を分析する方法であって、該測定対象分子を含む試料及び誘導体化剤を試料支持部材上に載せて反応させ、反応後の試料支持部材上を、誘導体化剤と反応後の測定対象分子を実質的に溶解せず、誘導体化剤を溶解する洗浄用溶媒で洗浄した後に分析することを特徴とする分析方法。
【請求項2】
上記洗浄が、上記洗浄用溶媒の試料支持部材上への滴下、又は上記試料支持部材の上記洗浄用溶媒への浸漬を含む操作である請求項1に記載の分析方法。
【請求項3】
上記誘導体化剤が縮合多環誘導体化合物であり、上記洗浄用溶媒が芳香族炭化水素系溶媒である請求項1又は請求項2に記載の分析方法。
【請求項4】
上記誘導体化剤がピレン誘導体化合物であり、上記洗浄用溶媒がトルエン、キシレン若しくはエチルベンゼン、又はこれらの組合せである請求項3に記載の分析方法。
【請求項5】
上記分析が質量分析である請求項1ないし請求項4の何れかの請求項に記載の分析方法。
【請求項6】
上記質量分析が、マトリックス支援レーザー脱離イオン化(MALDI)質量分析である請求項5に記載の分析方法。
【図1】


【図3】


【図4】


【図6】


【図7】


【図8】


【図2】


【図5】




【図3】


【図4】


【図6】


【図7】


【図8】


【図2】


【図5】


【公開番号】特開2011−53086(P2011−53086A)
【公開日】平成23年3月17日(2011.3.17)
【国際特許分類】
【出願番号】特願2009−202306(P2009−202306)
【出願日】平成21年9月2日(2009.9.2)
【国等の委託研究の成果に係る記載事項】(出願人による申告)平成21年度、独立行政法人科学技術振興機構、先端計測分析技術・機器開発事業に係る委託研究契約、産業技術力強化法第19条の適用を受ける特許出願
【出願人】(000173924)公益財団法人野口研究所 (108)
【Fターム(参考)】
【公開日】平成23年3月17日(2011.3.17)
【国際特許分類】
【出願日】平成21年9月2日(2009.9.2)
【国等の委託研究の成果に係る記載事項】(出願人による申告)平成21年度、独立行政法人科学技術振興機構、先端計測分析技術・機器開発事業に係る委託研究契約、産業技術力強化法第19条の適用を受ける特許出願
【出願人】(000173924)公益財団法人野口研究所 (108)
【Fターム(参考)】
[ Back to top ]

