分析用チップ
【課題】検体と選択的に結合する物質を固定化した基板を備えた分析用チップにおいて、検体と固定化された選択結合性物質との選択的結合を阻害する気泡の発生を抑え、反応むらによる検出感度のばらつきや検出感度の低下を抑える。
【解決手段】選択結合性物質がその表面に固定された基板1と、該基板と接着されたカバー部材3とを備え、該基板と該カバー部材との間に空隙を有し、該空隙に微粒子2が移動可能に格納又は注入された分析用チップであって、該空隙に該選択結合性物質と検体の結合反応のための反応液であって消泡剤及び/又は非イオン界面活性剤を含有する反応液を保持する分析用チップ。
【解決手段】選択結合性物質がその表面に固定された基板1と、該基板と接着されたカバー部材3とを備え、該基板と該カバー部材との間に空隙を有し、該空隙に微粒子2が移動可能に格納又は注入された分析用チップであって、該空隙に該選択結合性物質と検体の結合反応のための反応液であって消泡剤及び/又は非イオン界面活性剤を含有する反応液を保持する分析用チップ。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、選択結合性物質、すなわち検体と選択的に結合する物質を固定化した基板を備えた分析用チップに関する。
【背景技術】
【0002】
分析用チップは、遺伝子、タンパク質、脂質、糖などの選択結合性物質が固定化された基板を有し、この基板上の選択結合性物質と検体を通常溶液として反応させて、反応結果からの存在の有無、状態又は量などを分析するために用いられる。この基板としては、一般にガラス製、金属製、樹脂製のものが用いられる。
【0003】
分析用チップの一態様として、数百〜数万という多数の遺伝子発現を同時に測定することを目的として、基板上にDNAなどの分子を高密度に配置した分析用チップであって、マイクロアレイと呼ばれるものがある。マイクロアレイを使用することによって、各種疾患動物モデルや細胞生物学現象における体系的かつ網羅的な遺伝子発現解析を行うことができる。具体的には、遺伝子の機能、すなわち遺伝子がコードするタンパク質を明らかにするとともに、タンパク質が発現する時期や作用する場所を特定することが可能になる。生物の細胞又は組織レベルでの遺伝子発現の変動をマイクロアレイによって解析し、生理学的、細胞生物学的、生化学的事象データと組み合わせて遺伝子発現プロファイルデータベースを構築することによって、疾患遺伝子、治療関連遺伝子の検索や治療方法の探索が可能になる。
【0004】
分析用チップは、DNA等の核酸だけでなく、タンパク質や糖類などの検査、解析手段としても利用されるようになってきた。とりわけ、プロテイン分析用チップでは、抗体、抗原、酵素基質などのタンパク質が基板上に固定される。
【0005】
分析用チップの使用時は、調製した検体を含む溶液を、分析用チップ上の選択結合性物質が固定化された領域全体に均等に拡がるようにアプライすることが重要である。このための工夫として、分析用チップ内部に、検体を含む溶液を攪拌するための微粒子を備えた分析用チップが知られている。
【0006】
特許文献1には、検体DNA溶液にあらかじめ微粒子を添加した微粒子分散溶液を分析用チップにアプライして、カバーガラスを被せ、シール剤により密閉し、カバーガラス、分析用チップ基板及びシール剤により規定される密閉された空隙を形成するような分析用チップが開示されている。この分析用チップは、微粒子の運動を利用して撹拌を行いながら、検体溶液が蒸発することなくハイブリダイゼーションを行うことができる。
【0007】
また、特許文献2には、分析用チップ基板に凹凸を設け、凸部上端面に選択結合性物質を固定化し、凹部に攪拌用微粒子を移動可能に格納して、反応液の攪拌を行うことができる分析用チップが開示されている。この分析用チップは、微粒子が凸部上端面と接触することがないため、選択結合性物質を傷つけずに微粒子による攪拌を行うことができる。
【0008】
しかし、このように微粒子を用いて攪拌を行う分析用チップにおいては、検体を含む液体をアプライする際に分析用チップ基板内部の表面又は微粒子表面に気泡が残留したり、反応液中に気泡が発生したりすることがある。生じた気泡が障害となって、気泡が滞留した部分において選択結合性物質と検体との反応が阻害されるという問題があった。また、気泡の滞留した部分とそれ以外の部分とで反応むらが生じるため、分析用チップ上で検出感度のばらつき又は検出感度の低下を生じるという問題があった。
【0009】
特許文献3には、DNAチップ使用時に気泡が発生すること、気泡がハイブリダイゼーション反応の均一性を阻害することが言及され、更にハイブリダイゼーション反応液組成に抑泡剤を添加することについて言及があるが、抑泡剤添加の実際的効果、使用する抑泡剤の種類には言及がなく、いかなる種類の抑泡剤が実際的に気泡抑泡効果をもつのか全く検討されていない。
【特許文献1】特許第3557419号公報
【特許文献2】国際公開第2005/090997号パンフレット
【特許文献3】特開2007−209236号公報
【発明の開示】
【発明が解決しようとする課題】
【0010】
本発明は、前記課題を解決するものであり、検体と固定化された選択結合性物質との選択的反応を阻害する気泡の発生を抑え、反応むらによる検出感度のばらつきや検出感度の低下を抑える分析用チップを提供するものである。
【課題を解決するための手段】
【0011】
本発明者らは鋭意検討を重ねた結果、分析用チップの選択結合性物質と反応する検体を含む反応液に消泡剤(以下、抑泡剤、破泡剤、溶泡剤、脱泡剤とも称する)及び/又は非イオン系界面活性剤を添加することにより、上記課題を解決することができることを見出し、本発明を完成するに至った。
【0012】
すなわち本発明は、選択結合性物質が表面に固定化された基板と、該基板と接着されたカバー部材とを備え、該基板と該カバー部材との間に空隙を有し、該空隙に微粒子が移動可能に格納された分析用チップであって、該空隙に該選択結合性物質と検体の結合反応のための反応液であって消泡剤及び/又は非イオン系界面活性剤を含有する反応液を保持する分析用チップである。
【0013】
本発明の分析用チップの好ましい一態様は、前記消泡剤がポリエーテル系消泡剤又はシリコーン系消泡剤である。
【0014】
また、本発明の分析チップの好ましい一態様は、前記微粒子の表面に界面活性剤がコーティングされている。
【0015】
また、本発明の分析チップの好ましい一態様は、前記界面活性剤が陰イオン界面活性剤又は非イオン界面活性剤である。
【0016】
また、本発明の分析用チップの好ましい一態様は、基板が、その表面に凹部及び凸部からなる凹凸部を有し、該凸部の上端面に選択結合性物質が固定化された基板である。
【0017】
また、本発明の分析用チップの好ましい一態様は、カバー部材が、前記空隙に連通する1つ以上の貫通孔を有するものである。
【0018】
また、本発明の分析用チップの好ましい一態様は、基板の選択結合性物質固定化面とカバー部材との間隔の最短距離が、微粒子の直径未満である。
【0019】
また、本発明の分析用チップの好ましい一態様は、選択結合性物質が、DNA、RNA、蛋白質、ペプチド、糖、糖鎖又は脂質である。
【0020】
さらに本発明は、選択結合性物質が表面に固定化された基板と、該基板と接着されたカバー部材とを備え、該基板と該カバー部材との間に空隙を有し、該空隙に微粒子が移動可能に格納された分析用チップと、該選択結合性物質と検体の結合反応のための反応液であって消泡剤及び/又は非イオン系界面活性剤を含有する反応液を含む分析用キットである。
【発明の効果】
【0021】
本発明の分析用チップによれば、分析用チップ内部の反応液中での気泡の残留や発生が抑えられる。この結果、気泡が選択結合性物質と検体との反応を阻害して反応むらによる検出感度のばらつきや検出感度の低下が抑制され、検体を高い感度で検出することができる。
【発明を実施するための最良の形態】
【0022】
本発明の分析用チップは、選択結合性物質がその表面に固定された基板と、該基板と接着されたカバー部材との間に空隙を有し、該空隙に微粒子が移動可能に格納又は注入された分析用チップであって、該空隙に該選択結合性物質と検体の結合反応のための反応液であって消泡剤及び/又は非イオン系界面活性剤を含有する反応液を保持することを特徴とする。
【0023】
本発明の微粒子を格納した分析用チップの例を図1に示す。図1に示す例において、基板1の表面は、凹部10及び凸部11からなる凹凸部により構成されている。凹部10に微粒子2が格納されており、凸部11の上面には、選択結合性物質45(例えば核酸)が固定化されている。
【0024】
この基板1に固定化された選択結合性物質45(例えば核酸)と反応させるために、分析用チップに検体を含む溶液を加えると、微粒子2の表面に付着した微小気泡が液体中に遊離し、図2に示すように気泡26となって凸部を覆うため、覆われた凸部表面上の選択結合性物質は検体と反応できない。本発明の分析用チップにおいては、該選択結合性物質と検体との反応液が消泡剤及び/又は非イオン系界面活性剤を含有することにより、微粒子表面に気泡が付着しない又は付着しにくいので、気泡の発生を抑制することができる。これにより、基板1表面の全ての選択結合性物質45が検体と反応することが可能となり、得られるデータの信頼性と再現性とを上昇させることができる。
【0025】
選択結合性物質と検体の結合反応のための反応液に含まれる消泡剤としては、シリコーン系、ポリエーテル系、アルコール系の消泡剤が挙げられる。
【0026】
シリコーン系消泡剤としては、和光純薬工業製のSI、TEGO製のAirex901W及びFoamax810が挙げられる。
【0027】
ポリエーテル系消泡剤としては、ポリオキシエチレンポリオキシプロピレンアルキルエーテル、ポリオキシエチレンポリオキシプロピレンモノアルキルエーテル、及び和光純薬工業株式会社製の3種の消泡剤(PE-H、 PE-M、 PE-L) が挙げられる。
【0028】
アルコール系消泡剤としては、オクチルアルコール、グリコール酸、シクロヘキサノール、高級アルコール、ポリアルキレングリコール、ポリアルキレングリコールアルキルエーテル、ジエチレングリコールラウレート、ポリオキシアルキレンソルビタンモノオレートが挙げられる。
【0029】
これら消泡剤の中でもポリエーテル系又はシリコーン系の消泡剤が好ましく、ポリエーテル系消泡剤がより好ましく用いられる。
【0030】
選択結合性物質と検体の結合反応のための反応液に含まれる非イオン界面活性剤としては特に限定はないが、ジメチルデシルホスフィンオキシド(APO−10)、ドデシルジメチルホスフィンオキシド(APO−12)、ポリオキシエチレンラウリルエーテル(BRIJ−35)、ポリオキシエチレン(20)セチルエーテル(BRIJ−58)、ポリオキシエチレン(80)ソルビタンモノオレイン酸エステル(ポリソルベート80、Tween80)、ポリオキシエチレン(60)ソルビタンモノオレイン酸エステル(ポリソルベート60、Tween60)、ポリオキシエチレン(20)ソルビタンモノラウリン酸エステル(ポリソルベート20、Tween20)、ポリエチレングリコールp−(1,1,3,3−テトラメチルブチル)フェニルエーテル(TRITON X−100)、TRITON X−114、n−デカノイル−N−メチル−D−グルカミン(MEGA−10)、n−ノナノイル−N−メチル−D−グルカミン(MEGA−9)、n−オクタノイル−N−メチル−D−グルカミン(MEGA−8)、ノニルフェニル−ポリエチレングリコール(NP−40)、ポリオキシエチレンポリオキシプロピレングリコール、モノステアリン酸エチレングリコール、モノステアリン酸ソルビタン、モノステアリン酸プロピレングリコール、モノステアリン酸ポリオキシエチレンソルビタン、ポリオキシエチレン(160)ポリオキシプロピレン(30)グリコール(プルロニックF68)、ポリオキシエチレン(196)ポリオキシプロピレン(67)グリコール(プルロニックF127)などが挙げられる。
【0031】
これら非イオン系界面活性剤の中でも、ポリオキシエチレン(80)ソルビタンモノオレイン酸エステル(ポリソルベート80、Tween80)、ポリオキシエチレン(60)ソルビタンモノオレイン酸エステル(ポリソルベート60、Tween60)、ポリオキシエチレン(20)ソルビタンモノラウリン酸エステル(ポリソルベート20、Tween20)、ノニルフェニル−ポリエチレングリコール(NP−40)、ポリエチレングリコールp−(1,1,3,3−テトラメチルブチル)フェニルエーテル(TRITON X−100)、TRITON X−114、ポリオキシエチレン(160)ポリオキシプロピレン(30)グリコール(プルロニックF68)、ポリオキシエチレン(196)ポリオキシプロピレン(67)グリコール(プルロニックF127)が好ましく、ポリオキシエチレン(80)ソルビタンモノオレイン酸エステル(ポリソルベート80、Tween80)、ポリオキシエチレン(60)ソルビタンモノオレイン酸エステル(ポリソルベート60、Tween60)、ポリオキシエチレン(20)ソルビタンモノラウリン酸エステル(ポリソルベート20、Tween20)、ポリオキシエチレン(160)ポリオキシプロピレン(30)グリコール(プルロニックF68)、ポリオキシエチレン(196)ポリオキシプロピレン(67)グリコール(プルロニックF127)がより好ましく用いられる。
【0032】
本発明で使用される消泡剤及び/又は非イオン界面活性剤は、分析チップが保持する反応液中の気泡の発生を抑制する効果を有していれば使用される組み合わせに限定はなく、消泡剤及び非イオン界面活性剤からなる群から一種類又は二種類以上の薬剤が選択されうるが、非イオン界面活性剤から一種類又は二種類以上選択されることが好ましく、非イオン界面活性剤から一種類選択されることがより好ましい。
【0033】
微粒子の形状は、検体溶液を攪拌することができれば特に限定されず、球状の形状以外に、多角形でも良く、円筒形、角柱形などのマイクロロッド状(微細な棒状)など任意の形状とすることができる。
【0034】
微粒子のサイズも特に限定されないが、微粒子の直径が、前記基板の選択結合性物質固定化面とカバー部材との間隔の最短距離未満であることが好ましい。例えば球状の微粒子の場合、0.1μm〜300μmの範囲とすることができる。微粒子が円筒形の微粒子の場合は、その底面直径を微粒子の直径と見なして、底面直径が前記基板の選択結合性物質固定化面とカバー部材との間隔の最短距離未満であることが好ましい。例えば、円筒形の微粒子の場合、長さ50μm〜5000μm、底面直径10μm〜300μmの範囲とすることができる。
【0035】
微粒子の材質も、特に限定されないが、ガラス、セラミック(例えばイットリウム部分安定化ジルコニア)、金、白金、ステンレス、鉄、酸化アルミ(アルミナ)、酸化チタン(チタニア)等の金属若しくは金属酸化物、ナイロンやポリスチレン等のプラスチックを用いることができる。
【0036】
微粒子の表面に界面活性剤をコーティングすることは、微粒子表面に気泡が付着しない又は付着しにくくし、気泡の発生を抑制することができるため、本発明の好ましい態様の1つである。
【0037】
微粒子表面を界面活性剤でコーティングする方法としては、微粒子を、界面活性剤を含む溶液に浸漬したのちに取り出して乾燥させる方法、微粒子表面に界面活性剤を含む溶液を噴霧したのちに乾燥させる方法、微粒子を界面活性剤の溶液を含んだ物質に触れさせる方法、微粒子を液体に触れさせた後、粉末状の界面活性剤をまぶして付着させる方法など、公知の方法を用いることができる。これらの方法で用いる界面活性剤を含む溶液の濃度は、0.01%〜10%が、より好ましくは0.05%〜2%の濃度が用いられる。
【0038】
微粒子の表面処理に使用する界面活性剤は、陰イオン界面活性剤、陽イオン界面活性剤、両性界面活性剤、非イオン界面活性剤が挙げられ、これらの中でも陰イオン界面活性剤、非イオン界面活性剤が好ましく用いられる。
【0039】
陰イオン界面活性剤としては、ドデシル硫酸ナトリウム(SDS)、コール酸ナトリウム、デオキシコール酸ナトリウム、ラウリルサルコシンナトリウム、ポリオキシエチレンアルキルエーテルリン酸、ポリオキシエチレンアルキルフェニルエーテルリン酸、ラウリル硫酸トリエタノールアミン、ラウロイルサルコシンナトリウムなどが挙げられる。
【0040】
陽イオン界面活性剤としては、臭化セチルトリメチルアンモニウム(CTAB)、エチル硫酸ラノリン脂肪酸アミノプロピルエチルジメチルアンモニウム、塩化アルキルトリメチルアンモニウム、塩化ジアルキルジメチルアンモニウム、塩化ジステアリルジメチルアンモニウム、塩化ジステアリルジメチルベンジルアンモニウム、塩化ステアリルトリメチルアンモニウムなどが挙げられる。
【0041】
両性界面活性剤としては、3−[(3−コールアミドプロピル)ジメチルアンモニオ]−2−ヒドロキシプロパンスルホナート(CHAPSO)、3−[(3−コールアミドプロピル)ジメチルアンモニオ]プロパンスルホナート(CHAPS)、n−ドデシル−N,N−ジメチル−3−アンモニオ−1−プロパンスルホナート(ZWITTERGENT 3−12 Detergent)などが挙げられる。
【0042】
非イオン界面活性剤としては、ジメチルデシルホスフィンオキシド(APO−10)、ドデシルジメチルホスフィンオキシド(APO−12)、ポリオキシエチレンラウリルエーテル(BRIJ−35)、ポリオキシエチレン(20)セチルエーテル(BRIJ−58)、ポリオキシエチレン(80)ソルビタンモノオレイン酸エステル(ポリソルベート80、Tween80)、ポリオキシエチレン(60)ソルビタンモノオレイン酸エステル(ポリソルベート60、Tween60)、ポリオキシエチレン(20)ソルビタンモノラウリン酸エステル(ポリソルベート20、Tween20)、ポリエチレングリコールp−(1,1,3,3−テトラメチルブチル)フェニルエーテル(TRITON X−100)、TRITON X−114、n−デカノイル−N−メチル−D−グルカミン(MEGA−10)、n−ノナノイル−N−メチル−D−グルカミン(MEGA−9)、n−オクタノイル−N−メチル−D−グルカミン(MEGA−8)、ノニルフェニル−ポリエチレングリコール(NP−40)、ポリオキシエチレンポリオキシプロピレングリコール、モノステアリン酸エチレングリコール、モノステアリン酸ソルビタン、モノステアリン酸プロピレングリコール、モノステアリン酸ポリオキシエチレンソルビタン、ポリオキシエチレン(160)ポリオキシプロピレン(30)グリコール(プルロニックF68)、ポリオキシエチレン(196)ポリオキシプロピレン(67)グリコール(プルロニックF127)などが挙げられる。
【0043】
これらの中でも、陰イオン界面活性剤としては、界面活性効果が強力であることからドデシル硫酸ナトリウム(SDS)、デオキシコール酸ナトリウムが特に好ましく用いられ、非イオン界面活性剤としては、プルロニックF68、プルロニックF127が特に好ましく用いられる。
【0044】
また、界面活性剤がコーティングされる微粒子の表面は、適度な粗さを有していることが好ましい。即ち、微粒子の表面の中心線平均粗さ(Ra値)が40nm以上300nm以下であることが好ましい。この範囲の表面粗さを有する微粒子を使用することで、ビーズの表面積がより大きいためにより多くの界面活性剤を微粒子表面にコーティングすることが可能となる。セラミックス製微粒子の場合、材質の強度を考慮すると、Ra値が40nm以上200nm以下であることが好ましい。
【0045】
本発明の分析用チップを構成する基板は、その表面に、凹部及び選択結合性物質を固定化する凸部からなる凹凸部を有することが好ましい。このような構造をとることにより、検出の際、非特異的に吸着した検体を検出することがないので、ノイズが小さく、結果的によりS/Nが良好な結果を得ることができる。ノイズが小さくなる具体的な理由は、凸部上面に選択結合性物質を固定化した基板をスキャナーと呼ばれる装置を用いてスキャンすると、凹凸部の凸部上面にレーザー光の焦点が合っているため、凹部では、レーザー光がぼやけ、凹部に非特異的に吸着した検体の望まざる蛍光(ノイズ)を検出しがたいという効果があるためである。
【0046】
凹凸部の凸部の高さに関しては、それぞれの凸部上面の高さが略同一であることが好ましい。ここで、高さが略同一とは、多少高さの違う凸部の表面に選択結合性物質を固定化し、これと蛍光標識した検体とを反応させ、そして、スキャナーでスキャンした際、その信号レベルの強度差が問題とならない高さをいう。具体的には、高さが略同一とは、高さの差が50μm以下であることをいう。高さの差は30μm以下であることがより好ましく、高さが同一であればなお好ましい。なお、本発明でいう同一の高さとは、生産等で発生するばらつきによる誤差も含むものとする。最も高い凸部上面の高さと、最も低い凸部上面の高さの差が50μmより大きいと、高さのずれた凸部上面でのレーザー光がぼやけてしまい、この凸部上面に固定化された選択結合性物質と反応した検体からのシグナル強度が弱くなる場合があるため好ましくない。
【0047】
本発明の分析用チップを構成する基板において、選択結合性物質(例えば核酸)が固定化される領域は、該基板の表面であり、上述のような粗面化がなされていない領域であれば、特に限定されないが、具体的には、上述した凹凸部のうち凸部の上面(上端面)であることが好ましい。選択結合性物質の固定化は、予めなされるものであっても良いし、固定化しないで基板のみを用意しておき、検体の分析の際に所望の検体に応じた選択結合性物質を適宜選択し固定することもできる。
【0048】
凸部の上面に固定化できる選択結合性物質(例えば核酸)は、データとして必要なものを適宜選択することができるが、単なるダミーの選択結合性物質であっても良い。また、すべての凸部上面に選択結合性物質を結合する必要は無く、何も固定化していない凸部上面を有していても良い。
【0049】
本発明の分析用チップを構成する基板において、凸部上面に選択結合性物質が固定化される場合、当該凸部の上面の面積は略同一であることが好ましい。凸部の上面の面積が略同一であることにより、多種の選択結合性物質が固定化される部分の面積を同一にできるので、後の解析に有利である。ここで、凸部の上部の面積が略同一とは、凸部の中で最も大きい上面面積を、最も小さい上面面積で割った値が1.2以下であることを言う。
【0050】
選択結合性物質が固定化された凸部の上面の面積は、特に限定されるものではないが、選択結合性物質の量を少なくすることができる点とハンドリングの容易さの点から、10μm2以上、1mm2以下であることが好ましく、300μm2以上、0.8mm2以下であることがより好ましい。
【0051】
本発明の分析用チップを構成する基板において、さらに好ましくは、その基板における選択結合性物質が固定化された領域を有する面の周囲がさらに凹凸部の凸部上端と略同一の高さの平坦部で囲まれていることが好ましい。このような構造とすることにより、凹凸部に検体を含む溶液をアプライすることが容易となり、攪拌用の微粒子を選択結合性物質に接触させること無く凹部に保持することが可能となる。
【0052】
凹凸部の凸部の上面の高さと平坦部の高さは、略同一であることが好ましい。すなわち、平坦部の高さと凸部上面の高さの差は、50μm以下であることが好ましい。凸部上面の高さと平坦部の高さの差が50μmを超えると、検出できる蛍光強度が弱くなる場合があるため好ましくない。平坦部の高さと凸部上面の高さの差は、より好ましくは30μm以下であり、最も好ましくは、平坦部の高さと凸部の高さは同一である。
【0053】
本発明の分析用チップで好ましく用いられる基板の凹凸部における凸部の高さ、即ち凸部上面と凹部底面との高さの差は、10μm以上、500μm以下が好ましく、50μm以上、300μm以下がより好ましい。凸部の高さが10μmより低いと、スポット以外の部分の非特異的に吸着した検体試料を検出してしまうことがあり、結果的にS/Nが悪くなることがあるため好ましくない。また、凸部の高さが500μmより高いと、凸部が折れて破損しやすいなどの問題が生じる場合があり好ましくない。
【0054】
本発明の分析用チップを構成する基板の具体例を、図3及び図4に例示する。
【0055】
図3及び図4に示す例において、基板1の表面は、複数の凸部11を含む凹凸部12により構成されており、その周りに平坦部13が設けられている。凸部11の上面には、選択結合性物質(例えば核酸)が固定化されている。この平坦部を使って、容易にスキャナーの励起光等の測定用の光線の焦点を凸部の上面に合わせることが可能となる。
【0056】
本発明の分析用チップの基板の材質は、特に限定されないが、ガラス、セラミック、シリコーン樹脂、ポリエチレンテレフタレート、酢酸セルロース、ポリカーボネート、ポリスチレン、ポリメチルメタクリレート(PMMA)、ポリジメチルシロキサン(PDMS)エラストマー等のシリコーンゴムなどを挙げることができる。これらの中でも、ポリメチルメタクリレート、ポリスチレン、ポリジメチルシロキサン(PDMS)エラストマー、ガラス又はシリコーン樹脂を好ましく用いることができる。
【0057】
本発明の分析用チップの基板は、少なくとも一部が黒色であることが好ましい。このようにすることにより、基板からの自家蛍光を低減することができる。基板の黒色にする部分としては、凹凸部が設けられた基板の本体でも良いし、凸部の側面、凹部に設けられた疎水的な材料や絶縁層でも良いし、これらの全部でも良い。
【0058】
本発明の分析用チップを構成する基板は、各種製法にて製造することができる。例えば、材質がポリマー等の場合、射出成形法、ホットエンボス法、鋳型内で重合させる方法等により成型することができる。また、材質がガラスやセラミック等の無機物の場合、サンドブラスト法、シリコーン樹脂の場合は公知の半導体プロセスなどで成型することができる。
【0059】
成型した基板は、選択結合性物質をその表面に固定化するのに先立ち、必要に応じて各種の表面処理を施すことができる。かかる表面処理としては、具体的には例えば特開2004−264289号公報に記載されるものなどを挙げることができる。
【0060】
本発明において、分析用チップとは、検体が含まれる溶液を当該チップにアプライし、検体の存在の有無や、検体の量や、検体の性状等を測定するために用いるチップをいう。具体的には、基板表面に固定化された選択結合性物質と検体との反応により、検体の量や、検体の有無を測定するバイオチップが挙げられる。より具体的には、核酸を基板表面に固定化したDNAチップ、抗体に代表されるタンパク質を基板表面に固定化したタンパク質チップ、糖鎖を基板表面に固定化した糖鎖チップ、及び基板表面に細胞を固定化した細胞チップ等が挙げられる。
【0061】
本発明において、選択結合性物質とは、検体と直接的又は間接的に、選択的に結合し得る各種の物質を意味する。基板の表面に結合しうる選択結合性物質の代表的な例としては、核酸、蛋白質、ペプチド、糖類、脂質を挙げることができる。
【0062】
核酸としては、DNAやRNAでも良く、またPNAでも良い。特定の塩基配列を有する一本鎖核酸は、該塩基配列又はその一部と相補的な塩基配列を有する一本鎖核酸と選択的にハイブリダイズして結合するので、本発明でいう「選択結合性物質」に該当する。
【0063】
核酸は、生細胞等天然物由来のものであっても良いし、核酸合成装置により合成されたものであっても良い。生細胞からのDNA又はRNAの調製は、公知の方法、例えばDNAの抽出については、Blinらの方法(Blin et al., Nucleic Acids Res. 3: 2303 (1976))等により、また、RNAの抽出については、Favaloroらの方法(Favaloro et al., Methods Enzymol.65: 718 (1980))等により行うことができる。固定化する核酸としては、更に、鎖状若しくは環状のプラスミドDNAや染色体DNA、これらを制限酵素により若しくは化学的に切断したDNA断片、試験管内で酵素等により合成されたDNA、又は化学合成したオリゴヌクレオチド等を用いることもできる。
【0064】
また、蛋白質としては、抗体及びFabフラグメントやF(ab’)2フラグメントのような、抗体の抗原結合性断片、並びに種々の抗原を挙げることができる。抗体やその抗原結合性断片は、対応する抗原と選択的に結合し、抗原は対応する抗体と選択的に結合するので、「選択結合性物質」に該当する。
【0065】
糖類としては、各種単糖のほか、オリゴ糖や多糖などの糖鎖を挙げることができる。
【0066】
脂質としては、単純脂質の他、複合脂質であっても良い。
【0067】
更に、上記核酸、蛋白質、糖類、脂質以外の抗原性を有する物質を固定化することもできる。また、選択結合性物質として、基板の表面に細胞を固定化してもよい。
【0068】
本発明の分析用チップは、該基板の表面を覆い該基板と接着されたカバー部材を更に備えるものである。カバー部材を備えることにより、検体が含まれる溶液を簡便に密閉保持することができ、その結果、検体と、基板の領域(図3又は図4中の12)に固定化された選択結合性物質との反応を、安定して行うことができる。また、本発明の分析用チップには予め微粒子を注入(格納)しておくことができ、検体溶液をアプライする作業を容易に行うことが可能である。そして、検体溶液をアプライした後の貫通孔を塞ぐ作業においてもテープやシール剤が検体溶液と接触することがないので、バックグラウンドノイズが上昇しないという利点もある。
【0069】
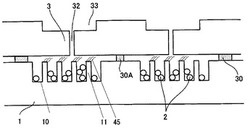
図5は、前記基板に加え、更にカバー部材、接着部材、貫通孔及び液面駐止用チャンバーを有する本発明の分析用チップの概略的な態様の例を示す斜視図である。
【0070】
前記カバー部材は、前記基板の表面の少なくとも一面の一部を覆い、基板と、カバー部材との間に空隙を有するよう接着されることができる。そして、基板は、好ましくはその表面であって前記空隙内に位置する領域上に固定化された選択結合性物質を有する。即ち、好ましくは、前記選択結合性物質が固定化された領域が、当該空隙内に存在するように、前記カバー部材は前記基板に接着される。前記カバー部材は、前記空隙が形成される限りにおいて、どのような態様で接着されてもよいが、好ましくは、両面テープ、樹脂組成物等の接着部材を介して接着される。
【0071】
前記カバー部材は、前記空隙に連通する1つ以上の貫通孔を有するものとすることができ、複数の貫通孔を有することが好ましい。より具体的には、貫通孔は、一つの空隙に対して複数あることが好ましく、中でも3個から6個とすることにより、検体が含まれる溶液の充填が容易となるので特に好ましい。なお、後述するように、空隙が、互いに連通しない複数の空間に分かれている場合は、各空間あたりに複数個、より好ましくは3〜6個の貫通孔を有することが好ましい。カバー部材が複数の貫通孔を有する場合、それらの孔径は、同一でも異なっていてもよいが、複数の貫通孔のうちの一つをアプライ口とし、他の貫通孔を空気の抜け口として機能させる場合、検体溶液のアプライの容易さ及び該溶液の密閉保持性の点から、アプライ口のみをアプライに必要な広い孔径としその他の貫通孔をより狭い孔径とすることが、好ましい。具体的には、アプライ口の貫通孔サイズは上記の通り直径0.01mmから2.0mmの範囲内とし、その他の貫通孔の直径を0.01mm〜1.0mmとすることが好ましい。
【0072】
このようなカバー部材は、前述の基板に、脱離可能に接着されていることが好ましい。本発明の分析用チップをDNAチップとして用いる場合、通常、DNAチップを専用スキャナーで読み取ることが必要であるが、カバー部材が接着された状態では、専用スキャナーにセットすることが難しく、セットされたとしてもスキャン操作を実施するとカバー部材とスキャナーの光学系部品が接触し、故障の原因となることがある。また、カバー部材を介しての読み取りが可能であっても、読み取り値が不正確となりうる。そのため、読み取りの工程においてカバー部材を取り外せるよう、カバー部材が脱離可能であることが好ましい。
【0073】
カバー部材を基板に脱離可能に接着する態様は、特に限定されないが、カバー部材と基板が損傷されることなく脱離することが可能である態様が好ましい。例えば、両面テープ、樹脂組成物等の接着部材を介して接着することができる。
【0074】
上記カバー部材の形状は、前記基板の表面の少なくとも一面の一部を覆い、基板と、カバー部材との間に空隙を有するよう接着されうるものであれば特に限定されないが、その外周部分において、基板に近い部分より基板に遠い部分において突出した部分を有する構造、すなわちオーバーハング構造が設けられたものとすることができる。オーバーハング構造を設けることにより、基板を損傷せずにカバー部材を脱離することが容易となるので、好ましい。
【0075】
本発明の分析用チップを構成するカバー部材の材料としては、特に限定されるものではないが、検体溶液をアプライした際に、溶液の様子を観察可能とするために、透明な材料が好ましい。そのような材質としては、ガラス又はプラスチックが挙げられる。特に、貫通孔や液面駐止チャンバー等の構造を容易に作製可能という点から、ポリスチレン、ポリメチルメタクリレート、ポリカーボネート等の透明樹脂を好ましく用いることができる。カバー部材の作製方法も特に限定されるものではなく、切削加工や射出成型法による加工が可能である。大量生産が可能という観点から、射出成型法を好ましく用いることができる。
【0076】
本発明の分析用チップにおける、凹凸部、カバー部材及び微粒子の関係の好ましい例を、図12を参照して説明する。図6に示した例では、DNA等の選択結合性物質45は、基板1の凸部11の上面に固定化されている。そして、微粒子(この場合は球状のビーズ)2は、基板1の凹部の空隙内に載置されている。選択結合性物質45及び微粒子2は、検体が含まれる溶液(図示せず)に触れることになる。検体溶液は、基板1、接着部材30及びカバー部材3により規定される空隙内で保持されることになる。図6の例においては、基板の凸部11上面とカバー部材3との間隔の最短距離が、微粒子2の直径未満となっている。それにより、微粒子が凸部11上面に接触できなくなり、凸部11上面上の選択結合性物質45を傷つけることを防ぐことができる。微粒子が、例えば楕円形等の非球状の形状である場合は、凸部上面と容器との最短距離が微粒子の最小径未満であれば、同様に凸部11上面と微粒子との接触を防ぎ、選択結合性物質45の損傷を防ぐことが可能となる。
【0077】
このような本発明の分析用チップは、各種検体の分析に利用することができる。すなわち、本発明の分析用チップの選択結合性物質を固定化した基板に、検体を接触させて該選択結合性物質と選択的に結合させ、基板上に該選択結合性物質を介して結合した該検体の有無又は量を測定することにより、検体を分析することができる。
【0078】
前記検体の分析方法においては、まず、前記本発明の分析用チップを構成する選択結合性物質を固定化した基板に検体を接触させて選択的に結合させる。すなわち、基板に上述のような標識、増幅等を施した検体を水溶液や適当な緩衝液等に溶解させた溶液(本明細書において「検体溶液」ということがある)とし、基板に接触させれば良い。
【0079】
選択結合性物質が結合された基板への接触は、検体を水溶液や適当な緩衝液等の溶液とし、該基板の凹凸部にピペット等の通常の器具で注入することにより行うことができる。貫通孔からの検体のアプライは、例えば、前記貫通孔からピペット等の通常の器具で注入して行うことができる。
【0080】
カバー部材への封止部材の貼付は、貫通孔の一部又は全て、好ましくは全てを封止する態様にて行うことができる。前記封止部材としては、例えばカプトン(登録商標、東レ・デュポン社製)などのポリイミドフィルム製、ポリエステル製、セロハン製又は塩化ビニル製の粘着テープ等の可とう性のテープを好ましく挙げることができるが、これに限らず、非可とう性の板状の接着可能な任意の部材を用いることもでき、非定型のシーリング剤を用いることもできる。液面駐止用チャンバーによる本発明の効果をより良好に得るという観点からは、可とう性のテープ及び板状の部材が好ましく、操作の簡便性などの観点から、可とう性のテープがさらに好ましい。
【0081】
封止の具体例を、再び図6を参照して説明する。図6の例では、検体溶液(図示せず)を貫通孔32よりアプライした後、封止部材として可とう性の粘着テープ34を、液面駐止用チャンバー33の全面を覆うように貼付し、貫通孔を封止している。このような態様により、簡便で且つ検体溶液の漏出や測定誤差を招かない封止を達成できる。
【0082】
前記検体の分析方法において、選択的な結合とは、選択結合性物質と検体とを相互作用させ、前記検体を、前記選択結合性物質を介して前記選択結合性物質を固定化した基板に結合させることを意味する。本発明の分析用チップの場合には、前記チップを揺動、回転させることにより、重量、振動、遠心力によって微粒子が検体溶液中を移動するので、選択的結合を効率よく進めることができる。
【0083】
前記選択結合性物質と検体の選択的結合を行う際の反応温度及び時間は、ハイブリダイズさせる検体の核酸の鎖長や、免疫反応に関与する抗原及び/又は抗体の種類等に応じて適宜選択されるが、核酸のハイブリダイゼーションの場合、通常、40℃〜70℃程度で1分間〜十数時間、免疫反応の場合には、通常、室温〜50℃程度で1分間〜数時間程度である。また、必要に応じて、選択結合性物質を固定化した基板を揺動、回転等させ、選択的結合を促進することができる。
【0084】
本発明の分析用チップは、分析用チップ内の微粒子を移動させることにより、検体溶液を効率よく撹拌することができる。微粒子を移動させる手段としては、好ましくは分析チップを回転させて重力方向に微粒子を落下させる方法や、振とう機に微粒子を含んだ分析チップをセットし基板を振とう若しくは揺動させる方法や、磁性微粒子を用いて磁力により微粒子を移動させる方法が用いられるが、チップを振とう機にセットし、水平面内で旋回回転させる方法が、微粒子の移動範囲が大きく、偏り無く移動するため、その結果、効率よく液を攪拌できるため好ましく用いられる。このとき、旋回回転の回転数は、好ましくは10〜1000回転/分であり、より好ましくは100〜500回転/分である。
【0085】
選択的結合の終了後、通常はカバー部材を脱離させた後、次の工程に供することができる。
【0086】
分析方法においては、上述の選択的結合の後、前記基板上に前記選択結合性物質を介して結合した前記検体の質量を測定する。この測定も、従来の分析用チップにおける操作と全く同様に行うことができる。例えば、適宜蛍光標識され、選択結合性物質と結合した検体の質量について、公知のスキャナー等により、その蛍光量を読み取ることにより測定することができる。
【0087】
前記検体の分析方法において、選択結合性物質として核酸を固定化した場合には、この核酸又はその一部と相補的な配列を有する核酸を測定することができる。また、選択結合性物質として抗体又は抗原を固定化した場合には、この抗体又は抗原と免疫反応する抗原又は抗体を測定することができる。なお、本明細書でいう「測定」には検出と定量の両者の意味が含まれる。
【0088】
さらに本発明は分析用キットに関する。ここでいう分析用キットとは、本発明の分析用チップを構成するためのものであり、少なくとも選択結合性物質が表面に固定化された基板と、該基板と接着されたカバー部材とを備え、該基板と該カバー部材との間に空隙を有し、該空隙に微粒子が移動可能に格納された分析用チップと、該選択結合性物質と検体の結合反応のための反応液であって消泡剤及び/又は非イオン界面活性剤を含有する反応液が含まれる。
【0089】
その他、上記に加えて本発明の分析用キットに含まれうるものとしては、封止シール、アプライ用ティップ、アプライ用スタンド、綿棒等が挙げられるが、それらに限定されない。
【0090】
本発明の分析用キットの使用方法としては、分析用チップに固定化された選択結合性物質と選択的に結合する検体の検出に使用できる。具体的には、検体を標識し、上記の「反応液」と混合し、これを前記基板と接着されたカバー部材に設けられている貫通孔から分析用チップ内部に注入する。注入終了後の分析用チップの貫通孔を封止シールで塞ぎ、検体と分析用チップ基板表面の選択結合性物質の反応を行ない、検体の標識を検出することで該選択結合性物質と特異的に結合する検体を検出することができる。
【実施例】
【0091】
本発明を以下の実施例によって更に詳細に説明する。本発明は下記実施例に限定されない。
【0092】
比較例1
(1)分析用チップの基板の作製
公知の方法であるLIGA(Lithographie Galvanoformung Abformung)プロセスを用いて、射出成形用の型を作製し、射出成型法により後述するような形状を有するポリメチルメタクリレート(PMMA)製の基板を得た。用いたPMMAの平均分子量は5万であり、PMMA中には1重量%の割合で、カーボンブラック(三菱化学製 #3050B)を含有させて、基板を黒色にした。この黒色基板の分光反射率と分光透過率を測定したところ、分光反射率は、可視光領域(波長が400nmから800nm)のいずれの波長でも5%以下であり、また、同範囲の波長で、透過率は0.5%以下であった。分光反射率、分光透過率とも、可視光領域において特定のスペクトルパターン(ピークなど)はなく、スペクトルは一様にフラットであった。なお、分光反射率は、JIS Z 8722の条件Cに適合した照明・受光光学系を搭載した装置(ミノルタカメラ製、CM−2002)を用いて、基板からの正反射光を取り込んだ場合の分光反射率を測定した。
【0093】
基板としては、図3及び図4に例示される形状を有する基板である、外形が縦76mm、横26mm、厚み1mmであり、基板の中央部に、縦39.4mm、横19.0mm、深さ0.15mmの凹部(図3の凹部10に相当)を設け、この凹部の中に、直径0.1mm、高さ0.15mmの凸部(図3の凸部11に相当)を9248箇所設けた基板(以下「基板A」とする)を用いた。この基板Aにおいて、凸部(図3の凸部11に相当)上面と平坦部(図3の凸部13に相当)上面との高さの差(凸部は高さの平均値)は、3μm以下であった。また、凸部(図3の凸部13に相当)上面の高さのばらつき(最も高い凸部上面の高さと最も低い凸部上面との高さの差)は、3μm以下であった。また、凸部のピッチ(図4のL1;凸部中央部から隣接した凸部中央部までの距離)を0.5mmとした。
【0094】
上記基板Aを10Nの水酸化ナトリウム水溶液に70℃で12時間浸漬した。これを、純水、0.1NのHCl水溶液、純水の順で洗浄し、基板表面にカルボキシル基を生成させた。
【0095】
(2)選択結合性物質の固定化
基板Aに対し、以下の条件で、それぞれ選択結合性物質(プローブDNA)としてオリゴヌクレオチドを固定化した。オリゴヌクレオチドとしては、オペロン社製DNAマイクロアレイ用オリゴヌクレオチドセット“Homo sapiens (human) AROS V4.0(各60塩基)”を用いた。このオリゴヌクレオチドを、純水に0.3nmol/μLの濃度となるよう溶解させて、ストック溶液とした。このストック溶液を基板にスポット(点着)する際は、PBS(8gのNaCl、2.9gのNa2HPO4・12H2O、0.2gのKCl、及び0.2gのKH2PO4を合わせて純水に溶かし、1Lにメスアップしたものに、塩酸を加えてpH5.5に調整したもの)で10倍希釈して、プローブDNAの終濃度を0.03nmol/μLとし、かつ、PMMA製基板表面に生成させたカルボキシル基とプローブDNAの末端アミノ基とを縮合させるため、1−エチル−3−(3−ジメチルアミノプロピル)カルボジイミド(EDC)を加え、この終濃度を50mg/mLとした。この溶液をアレイヤー(スポッター)(日本レーザー電子製;Gene Stamp−II)を用いて、基板Aの全ての凸部上面にスポットした。次いで、スポットした基板を密閉したプラスチック容器に入れて、37℃、湿度100%の条件で20時間程度インキュベートした。最後に純水で基板を洗浄し、スピンドライヤーで遠心して乾燥した。
【0096】
(3)分析用チップ基板へのカバー部材の貼付
選択結合性物質を固定化した上記基板Aに対し、次のようにカバー部材を貼付した。カバー部材としては、縦41.4mm、横21mm、厚さ1mmのPMMA平板を切削加工により作製してカバー部材とした。作製した該カバー部材には、貫通孔及び液面駐止用チャンバーを図6の32、33に例示するように設けた。そして接着部材として縦41.4mm、横21mmを幅1mmの両面テープを用い、この両面テープをカバー部材を縁取るように、かつ厚さ50μmで積層させて貼り付けたのち、該カバー部材を基板Aに貼付した。
【0097】
(4)検体の調製
検体としては、マイクロアレイの検体として一般的な、aRNA(antisense RNA)を用いた。市販のヒト培養細胞由来total RNA(CLONTECH社製Human Reference RNA)5μgから、Ambion社製aRNA調製キットを使用して、5μgのCy3標識aRNAを得た
(5)選択結合性物質と検体とのハイブリダイゼーションのための反応液
以下の実施例、比較例で特に断りのない限り、上記で調製した標識aRNAを、1重量%BSA、5×SSC、0.01重量%サケ精子DNA、0.1重量%SDSの溶液(各濃度はいずれも終濃度)で希釈したものを用いた。
【0098】
(6)分析用チップへの微粒子の注入(格納)
上記(3)でカバー部材を貼りつけた基板Aに、直径180μmのジルコニア製微粒子(東レ(株)製)120mgを、基板Aとカバー部材とで形成される空隙(基板A表面の凹凸構造の凹部)に注入(格納)した。微粒子の注入は、カバー部材の貫通孔(図1、2、6に例示される貫通孔32)から行った。以上のようにして得られた分析用チップを、「分析用チップ1」とした。
【0099】
検体としては、マイクロアレイの検体として一般的な、aRNA(antisense RNA)を用いた。市販のヒト培養細胞由来total RNA(CLONTECH社製Human Reference RNA)5μgから、Ambion社製aRNA調製キットを使用して、5μgのCy3標識aRNAを得た。
【0100】
(7)ハイブリダイゼーション反応と気泡発生数の評価
マイクロピペットを用いて、分析用チップ1の基板Aとカバー部材との空隙(反応槽)に、Cy3標識aRNA200ngを含む反応液165μLを貫通孔より注入した。このとき、容易に溶液を注入でき、気泡が混入することはなかった。封止材としてカプトンテープ(アズワン)を用い、4つの貫通孔を塞いだ。ハイブリダイゼーションチャンバー(Takara Hybridization chamber(タカラバイオ(株)製))を、シート振盪台(東京理化器械(株)製 MMS FIT−S)に密着させて固定し、分析用チップ1をハイブリダイゼーションチャンバー内にセットした。このとき、分析用チップ1をセットする位置の両端の凹みに、15μLずつ超純水を滴下した。ハイブリダイゼーションチャンバー蓋を閉めた後、6本の固定ネジを締めて固定し、42℃に設定した恒温チャンバー(東京理化器械(株)製 FMS−1000)内に据え付けた振盪機(東京理化器械(株)製 MMS−310)の上に載せて固定した。恒温チャンバーの前面をアルミホイルで遮光して、250回転/分で旋回振盪しながら、42℃で16時間インキュベートした。インキュベート後、ハイブリダイゼーションチャンバーから分析用チップ1を取り出した。
【0101】
カバー部材を通して、分析用チップ1の基板A上に観察された反応液中の気泡数を計数した。分析用チップ1を用いたハイブリダイゼーション反応を10回実施した結果、反応液中に発生した気泡数は、1回当たりの平均で13.0個であった(表1)。
【0102】
(8)蛍光シグナル値の測定と検出感度ばらつきの評価
分析用チップ1の基板Aに接着したカバー部材と両面テープを脱離した後、基板Aを洗浄、乾燥した。DNAチップ用のスキャナー(Axon Instruments社製 GenePix 4000B)に上記処理後の基板Aをセットし、レーザー出力33%、フォトマルチプライヤーの電圧設定を500にした状態において、ハイブリダイゼーション反応した検体の標識体シグナル値(蛍光強度)、バックグラウンドノイズを測定した。全9248個のスポットのうち、32個をバックグラウンド蛍光値測定用のネガティブコントロールスポットとし、個々のシグナル値からバックグラウンドシグナル値を差し引いて各スポットの真のシグナル値を算出した。
【0103】
気泡の出現によるハイブリダイゼーション反応の反応むらによる検出感度のばらつきの評価として、分析用チップ1を用いたハイブリダイゼーション反応を10回実施し、各回におけるバックグラウンドシグナル値のばらつき(CV値=全回のバックグラウンドシグナル値の標準偏差/全回のバックグラウンドシグナル値の平均値(%))を計算した。その結果、10回の評価におけるバックグラウンドシグナル値のばらつき(CV値)の平均値は12.1%であった(表1)。
【0104】
比較例2
比較例1(5)で調製した反応液を次のように脱気処理を行ったこと以外は、比較例1と同様に作製した分析用チップ1を用いた評価を実施した。反応液175μlを0.2mlPCRチューブ(アシスト社製72.737.002)にいれ、フタを開けたまま脱気装置(ULVAC社製アスピレーターNDA−015型)にセットして脱気を行った。脱気時の到達圧力は、装置の表示で50hPa、脱気時間は25分間とした。
【0105】
比較例1(7)と同様にして、ハイブリダイゼーション反応後の発生気泡数を計数したところ、10回の評価の平均が9.0個であった(表1)。また、実施例1(8)と同様にしてバックグラウンドシグナル値のばらつき(CV値)を計算したところ、10.5%であった(表1)。
【0106】
実施例1
比較例1(5)で調製した反応液に、消泡剤として和光純薬工業株式会社製消泡剤“PE-L”をv/v濃度で0.05%となるよう添加し、反応液を次のように脱気処理を行ったこと以外は、比較例1と同様に作製した分析用チップ1を用いた評価を実施した。反応液175μlを0.2mlPCRチューブ(アシスト社製72.737.002)にいれ、フタを開けたまま脱気装置(ULVAC社製アスピレーターNDA−015型)にセットして脱気を行った。脱気時の到達圧力は装置表示で50hPa、脱気時間は25分間とした。
【0107】
比較例1(7)と同様にして、ハイブリダイゼーション反応後の基板上に観察された反応液中の気泡数を計数したところ、気泡数は、10回の回実施した結果の1回当たりの平均値が1.2個であった(表1)。また、実施例1(8)と同様にしてバックグラウンドシグナル値のばらつき(CV値)を計算したところ、6.9%であった(表1)。
【0108】
実施例2
反応液に、消泡剤として和光純薬工業株式会社製消泡剤“SI”をv/v濃度で0.05%となるよう添加したこと以外は、実施例1と同様に脱気した分析用チップ1を用いた評価を実施した。脱気時間は25分間とした。
【0109】
比較例1(7)と同様にして、ハイブリダイゼーション反応後の発生気泡数を計数したところ、10回の評価の平均が2.9個であった(表1)。また、比較例1(8)と同様にしてバックグラウンドシグナル値のばらつき(CV値)を計算したところ、7.3%であった(表1)。
【0110】
実施例3
反応液に、消泡剤として和光純薬工業株式会社製“グリコール酸”をv/v濃度で0.05%となるよう添加したこと以外は、実施例1と同様に脱気した分析用チップ1を用いた評価を実施した。脱気時間は25分間とした。
【0111】
比較例1(7)と同様にして、ハイブリダイゼーション反応後の発生気泡数を計数したところ、10回の評価の平均が4.7個であった(表1)。また、比較例1(8)と同様にしてバックグラウンドシグナル値のばらつき(CV値)を計算したところ、7.8%であった(表1)。
【0112】
実施例4
比較例1(3)でカバー部材を貼りつけた基板Aに、界面活性剤ドデシル硫酸ナトリウム(SDS)をコーティングした直径180μmのジルコニア製微粒子(東レ(株)製)120mgを、基板Aとカバー部材とで形成される空隙(基板A表面の凹凸構造の凹部)に注入(格納)し、その他は実施例1と同様に分析用チップを作製した。微粒子の注入は、カバー部材の貫通孔(図1、2、6に例示される貫通孔32)から行った。以上のようにして得られた分析用チップを、「分析用チップ2」とした。また、反応液については実施例1と同様に調整した。
【0113】
SDSをコーティングした微粒子は、直径180μmのジルコニア製微粒子(東レ(株)製)10gを、ステンレス製バット(10cm×10cm×5cm)に入れ、0.1%SDS水溶液50mlを加えた。これを10分間超音波処理したのち、上清(SDS成分)を除去し、オーブンを用いて微粒子を70℃にて、12時間乾燥させて得た。なお、処理前の微粒子の表面粗さを測定したところ、表面の中心線平均粗さ(Ra値)は165nmであった。微粒子表面のRa値の測定は、その表面をAuで真空蒸着した後、走査型電子顕微鏡(株式会社エリオニクス製、型式ESA−2000)で測定した。中心線平均粗さは、観察倍率を10,000倍、カットオフ値を0とし、任意の10個について測定し、その平均値を求めた。
【0114】
比較例1(7)と同様にして、ハイブリダイゼーション反応後の発生気泡数を計数したところ、10回の評価の平均が0.3個であった(表1)。また、比較例1(8)と同様にしてバックグラウンドシグナル値のばらつき(CV値)を計算したところ、6.2%であった(表1)。
【0115】
実施例5
比較例1(3)でカバー部材を貼りつけた基板Aに、界面活性剤ポリオキシエチレン(20)ソルビタンモノラウリン酸エステル(ポリソルベート20、Tween20)をコーティングした直径180μmのジルコニア製微粒子120mgを、基板Aとカバー部材とで形成される空隙(基板A表面の凹凸構造の凹部)に注入(格納)し、その他は実施例1と同様に分析用チップを作製した。微粒子の注入は、カバー部材の貫通孔(図1、2、6に例示される貫通孔32)から行った。以上のようにして得られた分析用チップを、「分析用チップ3」とした。また、反応液については実施例1と同様に調整した。
【0116】
Tween20をコーティングした微粒子は、実施例4と同様の手順で処理を行った後、さらに、脱イオン水(ミリQ水)400mLで1回洗浄し、70℃で4時間乾燥して得た。
【0117】
比較例1(7)と同様にして、ハイブリダイゼーション反応後の発生気泡数を計数したところ、10回の評価の平均が1.3個であった(表1)。また、比較例1(8)と同様にしてバックグラウンドシグナル値のばらつき(CV値)を計算したところ、6.5%であった(表1)。
【0118】
実施例6
比較例1(3)でカバー部材を貼りつけた基板Aに、界面活性剤臭化セチルトリメチルアンモニウム(Cetyltrimethylammonium Bromide、CTAB)をコーティングした直径180μmのジルコニア製微粒子120mgを、基板Aとカバー部材とで形成される空隙(基板A表面の凹凸構造の凹部)に注入(格納)し、その他は実施例1と同様に分析用チップを作製した。微粒子の注入は、カバー部材の貫通孔(図1、2、6に例示される貫通孔32)から行った。以上のようにして得られた分析用チップを、「分析用チップ4」とした。また、反応液については実施例1と同様に調整した。
【0119】
CTABをコーティングした微粒子は、実施例4と同様の手順で処理を行った後、さらに、脱イオン水(ミリQ水)400mLで1回洗浄し、70℃で4時間乾燥して得た。
【0120】
比較例1(7)と同様にして、ハイブリダイゼーション反応後の発生気泡数を計数したところ、10回の評価の平均が3.1個であった(表1)。また、比較例1(8)と同様にしてバックグラウンドシグナル値のばらつき(CV値)を計算したところ、7.7%であった(表1)。
【0121】
実施例7
実施例4と同様に「分析用チップ2」を用い、反応液については実施例1の反応液に含まれる界面活性剤SDS濃度を0.1%から2%に増やしたものを使用した。
【0122】
比較例1(7)と同様にして、ハイブリダイゼーション反応後の発生気泡数を計数したところ、10回の評価の平均が0.2個であった(表1)。また、比較例1(8)と同様にしてバックグラウンドシグナル値のばらつき(CV値)を計算したところ、6.1%であった(表1)。
【0123】
実施例8
比較例1(5)で調製した反応液に、和光純薬工業株式会社製消泡剤“PE-L”をv/v濃度で0.05%となるよう添加したこと以外は、比較例1と同様に作製した分析用チップ1を用いた評価を実施した。
【0124】
比較例1(7)と同様にして、ハイブリダイゼーション反応後の発生気泡数を計数したところ、10回の評価の平均が6.2個であった(表1)。また、比較例1(8)と同様にしてバックグラウンドシグナル値のばらつき(CV値)を計算したところ、8.7%であった(表1)。
【0125】
実施例9
実施例4と同様に「分析用チップ2」を用い、反応液については比較例2の反応液に含まれる界面活性剤を0.1%SDSから0.1%Tween20に変更したものを使用した。
【0126】
比較例1(7)と同様にして、ハイブリダイゼーション反応後の発生気泡数を計数したところ、10回の評価の平均が0.7個であった(表1)。また、比較例1(8)と同様にしてバックグラウンドシグナル値のばらつき(CV値)を計算したところ、7.0%であった(表1)。
【0127】
実施例10
実施例4及び8と同様に「分析用チップ2」を用い、反応液については比較例2の反応液に含まれる界面活性剤を0.1%SDSから10%Tween20に変更したものを使用した。
【0128】
比較例1(7)と同様にして、ハイブリダイゼーション反応後の発生気泡数を計数したところ、10回の評価の平均が0.4個であった(表1)。 また、比較例1(8)と同様にしてバックグラウンドシグナル値のばらつき(CV値)を計算したところ、6.6%であった(表1)。
【0129】
実施例11
実施例5と同様に「分析用チップ3」を用い、反応液については比較例2の反応液に含まれる界面活性剤を0.1%SDSから0.1%Tween20に変更したものを使用した。
【0130】
比較例1(7)と同様にして、ハイブリダイゼーション反応後の発生気泡数を計数したところ、10回の評価の平均が0.5個であった(表1)。また、比較例1(8)と同様にしてバックグラウンドシグナル値のばらつき(CV値)を計算したところ、6.3%であった(表1)。
【0131】
実施例12
実施例5及び10と同様に「分析用チップ3」を用い、反応液については比較例2の反応液に含まれる界面活性剤を0.1%SDSから10%Tween20に変更したものを使用した。
【0132】
比較例1(7)と同様にして、ハイブリダイゼーション反応後の発生気泡数を計数したところ、10回の評価の平均が0.4個であった(表1)。また、比較例1(8)と同様にしてバックグラウンドシグナル値のばらつき(CV値)を計算したところ、6.1%であった(表1)。
【0133】
実施例13
比較例1(3)でカバー部材を貼りつけた基板Aに、界面活性剤Tween60をコーティングした直径180μmのジルコニア製微粒子(東レ(株)製)120mgを、基板Aとカバー部材とで形成される空隙(基板A表面の凹凸構造の凹部)に注入(格納)し、その他は実施例1と同様に分析用チップを作製した。微粒子の注入は、カバー部材の貫通孔(図1、2、6に例示される貫通孔32)から行った。以上のようにして得られた分析用チップを、「分析用チップ5」とした。
【0134】
Tween60をコーティングした微粒子は、直径180μmのジルコニア製微粒子(東レ(株)製)10gを、ステンレス製バット(10cm×10cm×5cm)に入れ、5%Tween60水溶液50mlを加えた。これを10分間超音波処理したのち、上清(Tween20成分)を除去し、オーブンを用いて微粒子を70℃にて、12時間乾燥させて得た。
【0135】
反応液については比較例2の反応液に含まれる界面活性剤を0.1%SDSから0.1%Tween60に変更したものを使用した。
【0136】
比較例1(7)と同様にして、ハイブリダイゼーション反応後の発生気泡数を計数し、10回の評価の平均値を求めたところ、0.6個であった(表1)。また、比較例1(8)と同様にしてバックグラウンドシグナル値のばらつき(CV値)を計算したところ、6.3%であった(表1)。
【0137】
実施例14
実施例13と同様に「分析用チップ5」を用い、反応液については比較例2の反応液に含まれる界面活性剤を0.1%SDSから10%Tween60に変更したものを使用した。
【0138】
比較例1(7)と同様にして、ハイブリダイゼーション反応後の発生気泡数を計数したところ、10回の評価の平均が0.4個であった(表1)。また、比較例1(8)と同様にしてバックグラウンドシグナル値のばらつき(CV値)を計算したところ、6.1%であった(表1)。
【0139】
実施例15
比較例1(3)でカバー部材を貼りつけた基板Aに、界面活性剤Tween80をコーティングした直径180μmのジルコニア製微粒子(東レ(株)製)120mgを、基板Aとカバー部材とで形成される空隙(基板A表面の凹凸構造の凹部)に注入(格納)し、その他は実施例1と同様に分析用チップを作製した。微粒子の注入は、カバー部材の貫通孔(図1、2、6に例示される貫通孔32)から行った。以上のようにして得られた分析用チップを、「分析用チップ6」とした。
【0140】
Tween80をコーティングした微粒子は、直径180μmのジルコニア製微粒子(東レ(株)製)10gを、ステンレス製バット(10cm×10cm×5cm)に入れ、5%Tween80水溶液50mlを加えた。これを10分間超音波処理したのち、上清(Tween80成分)を除去し、オーブンを用いて微粒子を70℃にて、12時間乾燥させて得た。
【0141】
反応液については比較例2の反応液に含まれる界面活性剤を0.1%SDSから0.1%Tween80に変更したものを使用した。
【0142】
比較例1(7)と同様にして、ハイブリダイゼーション反応後の発生気泡数を計数し、10回の評価の平均値を求めたところ、0.5個であった(表1)。また、比較例1(8)と同様にしてバックグラウンドシグナル値のばらつき(CV値)を計算したところ、6.3%であった(表1)。
【0143】
実施例16
実施例15と同様に「分析用チップ6」を用い、反応液については比較例2の反応液に含まれる界面活性剤を0.1%SDSから10%Tween80に変更したものを使用した。
【0144】
比較例1(7)と同様にして、ハイブリダイゼーション反応後の発生気泡数を計数したところ、10回の評価の平均が0.4個であった(表1)。また、比較例1(8)と同様にしてバックグラウンドシグナル値のばらつき(CV値)を計算したところ、5.9%であった(表1)。
【0145】
実施例17
実施例4及び9と同様に「分析用チップ2」を用い、反応液については比較例2の反応液に含まれる界面活性剤を0.1%SDSから0.1%PluronicF−68に変更したものを使用した。
【0146】
比較例1(7)と同様にして、ハイブリダイゼーション反応後の発生気泡数を計数したところ、10回の評価の平均が0.9個であった(表1)。また、比較例1(8)と同様にしてバックグラウンドシグナル値のばらつき(CV値)を計算したところ、6.8%であった(表1)。
【0147】
実施例18
比較例1(3)でカバー部材を貼りつけた基板Aに、界面活性剤PluronicF−68をコーティングした直径180μmのジルコニア製微粒子(東レ(株)製)120mgを、基板Aとカバー部材とで形成される空隙(基板A表面の凹凸構造の凹部)に注入(格納)し、その他は実施例1と同様に分析用チップを作製した。微粒子の注入は、カバー部材の貫通孔(図1、2、6に例示される貫通孔32)から行った。以上のようにして得られた分析用チップを、「分析用チップ7」とした。
【0148】
PluronicF−68をコーティングした微粒子は、直径180μmのジルコニア製微粒子(東レ(株)製)10gを、ステンレス製バット(10cm×10cm×5cm)に入れ、3%PluronicF−68水溶液50mlを加えた。これを10分間超音波処理したのち、上清(PluronicF−68成分)を除去し、オーブンを用いて微粒子を70℃にて、12時間乾燥させて得た。
【0149】
反応液については比較例2の反応液に含まれる界面活性剤を0.1%SDSから0.1%PluronicF−68に変更したものを使用した。
【0150】
比較例1(7)と同様にして、ハイブリダイゼーション反応後の発生気泡数を計数し、10回の評価の平均値を求めたところ、0.7個であった(表1)。また、比較例1(8)と同様にしてバックグラウンドシグナル値のばらつき(CV値)を計算したところ、6.8%であった(表1)。
【0151】
実施例19
実施例15と同様に「分析用チップ7」を用い、反応液については比較例2の反応液に含まれる界面活性剤を0.1%SDSから3%PluronicF−68に変更したものを使用した。
【0152】
比較例1(7)と同様にして、ハイブリダイゼーション反応後の発生気泡数を計数したところ、10回の評価の平均が0.5個であった(表1)。また、比較例1(8)と同様にしてバックグラウンドシグナル値のばらつき(CV値)を計算したところ、6.8%であった(表1)。
【0153】
実施例20
実施例4及び8と同様に「分析用チップ2」を用い、反応液については比較例2の反応液に含まれる界面活性剤を0.1%SDSから0.1%PluronicF−127に変更したものを使用した。
【0154】
比較例1(7)と同様にして、ハイブリダイゼーション反応後の発生気泡数を計数したところ、10回の評価の平均が0.7個であった(表1)。また、比較例1(8)と同様にしてバックグラウンドシグナル値のばらつき(CV値)を計算したところ、6.5%であった(表1)。
【0155】
実施例21
比較例1(3)でカバー部材を貼りつけた基板Aに、界面活性剤Pluronic F−127をコーティングした直径180μmのジルコニア製微粒子(東レ(株)製)120mgを、基板Aとカバー部材とで形成される空隙(基板A表面の凹凸構造の凹部)に注入(格納)し、その他は実施例1と同様に分析用チップを作製した。微粒子の注入は、カバー部材の貫通孔(図1、2、6に例示される貫通孔32)から行った。以上のようにして得られた分析用チップを、「分析用チップ8」とした。
【0156】
PluronicF−127をコーティングした微粒子は、直径180μmのジルコニア製微粒子(東レ(株)製)10gを、ステンレス製バット(10cm×10cm×5cm)に入れ、3%Pluronic F−127水溶液50mlを加えた。これを10分間超音波処理したのち、上清(Pluronic F−127成分)を除去し、オーブンを用いて微粒子を70℃にて、12時間乾燥させて得た。
【0157】
反応液については比較例2の反応液に含まれる界面活性剤を0.1%SDSから0.1%PluronicF−127に変更したものを使用した。
【0158】
比較例1(7)と同様にして、ハイブリダイゼーション反応後の発生気泡数を計数し、10回の評価の平均値を求めたところ、0.8個であった(表1)。また、比較例1(8)と同様にしてバックグラウンドシグナル値のばらつき(CV値)を計算したところ、6.7%であった(表1)。
【0159】
実施例22
実施例21と同様に「分析用チップ8」を用い、反応液については比較例2の反応液に含まれる界面活性剤を0.1%SDSから3%Pluronic F−127に変更したものを使用した。
【0160】
比較例1(7)と同様にして、ハイブリダイゼーション反応後の発生気泡数を計数したところ、10回の評価の平均が0.4個であった(表1)。また、比較例1(8)と同様にしてバックグラウンドシグナル値のばらつき(CV値)を計算したところ、6.3%であった(表1)。
【0161】
実施例23
実施例4及び9と同様に「分析用チップ2」を用い、反応液については比較例2の反応液に含まれる界面活性剤を0.1%SDSから0.1%TritonX−100に変更したものを使用した。
【0162】
比較例1(7)と同様にして、ハイブリダイゼーション反応後の発生気泡数を計数したところ、10回の評価の平均が1.6個であった(表1)。また、比較例1(8)と同様にしてバックグラウンドシグナル値のばらつき(CV値)を計算したところ、6.0%であった(表1)。
【0163】
実施例24
比較例1(3)でカバー部材を貼りつけた基板Aに、界面活性剤Triton X−100をコーティングした直径180μmのジルコニア製微粒子(東レ(株)製)120mgを、基板Aとカバー部材とで形成される空隙(基板A表面の凹凸構造の凹部)に注入(格納)し、その他は実施例1と同様に分析用チップを作製した。微粒子の注入は、カバー部材の貫通孔(図1、2、6に例示される貫通孔32)から行った。以上のようにして得られた分析用チップを、「分析用チップ9」とした。
【0164】
Triton X−100をコーティングした微粒子は、直径180μmのジルコニア製微粒子(東レ(株)製)10gを、ステンレス製バット(10cm×10cm×5cm)に入れ、5%Pluronic F−127水溶液50mlを加えた。これを10分間超音波処理したのち、上清(Pluronic F−127成分)を除去し、オーブンを用いて微粒子を70℃にて、12時間乾燥させて得た。
【0165】
反応液については比較例2の反応液に含まれる界面活性剤を0.1%SDSから0.1%TritonX−100に変更したものを使用した。
【0166】
比較例1(7)と同様にして、ハイブリダイゼーション反応後の発生気泡数を計数し、10回の評価の平均値を求めたところ、1.3個であった(表1)。また、比較例1(8)と同様にしてバックグラウンドシグナル値のばらつき(CV値)を計算したところ、7.2%であった(表1)。
【0167】
実施例25
実施例24と同様に「分析用チップ9」を用い、反応液については比較例2の反応液に含まれる界面活性剤を0.1%SDSから0.1%TritonX−100に変更したものを使用した。
【0168】
比較例1(7)と同様にして、ハイブリダイゼーション反応後の発生気泡数を計数したところ、10回の評価の平均が1.1個であった(表1)。また、比較例1(8)と同様にしてバックグラウンドシグナル値のばらつき(CV値)を計算したところ、5.9%であった(表1)。
【0169】
実施例26
実施例4及び9と同様に「分析用チップ2」を用い、反応液については比較例2の反応液に含まれる界面活性剤を0.1%SDSから0.1%NP−40に変更したものを使用した。
【0170】
比較例1(7)と同様にして、ハイブリダイゼーション反応後の発生気泡数を計数したところ、10回の評価の平均が2.1個であった(表1)。また、比較例1(8)と同様にしてバックグラウンドシグナル値のばらつき(CV値)を計算したところ、7.2%であった(表1)。
【0171】
実施例27
比較例1(3)でカバー部材を貼りつけた基板Aに、界面活性剤NP−40をコーティングした直径180μmのジルコニア製微粒子(東レ(株)製)120mgを、基板Aとカバー部材とで形成される空隙(基板A表面の凹凸構造の凹部)に注入(格納)し、その他は実施例1と同様に分析用チップを作製した。微粒子の注入は、カバー部材の貫通孔(図1、2、6に例示される貫通孔32)から行った。以上のようにして得られた分析用チップを、「分析用チップ10」とした。
【0172】
NP−40をコーティングした微粒子は、直径180μmのジルコニア製微粒子(東レ(株)製)10gを、ステンレス製バット(10cm×10cm×5cm)に入れ、5%0.1% NP−40水溶液50mlを加えた。これを10分間超音波処理したのち、上清(0.1% NP−40成分)を除去し、オーブンを用いて微粒子を70℃にて、12時間乾燥させて得た。
【0173】
反応液については比較例2の反応液に含まれる界面活性剤を0.1%SDSから0.1%NP−40に変更したものを使用した。
【0174】
比較例1(7)と同様にして、ハイブリダイゼーション反応後の発生気泡数を計数し、10回の評価の平均値を求めたところ、1.8個であった(表1)。また、比較例1(8)と同様にしてバックグラウンドシグナル値のばらつき(CV値)を計算したところ、6.7%であった(表1)。
【0175】
実施例28
実施例27と同様に「分析用チップ9」を用い、反応液については比較例2の反応液に含まれる界面活性剤を0.1%SDSから10%NP−40に変更したものを使用した。
【0176】
比較例1(7)と同様にして、ハイブリダイゼーション反応後の発生気泡数を計数したところ、10回の評価の平均が1.6個であった(表1)。また、比較例1(8)と同様にしてバックグラウンドシグナル値のばらつき(CV値)を計算したところ、6.9%であった(表1)。
【0177】
比較例3
比較例1(3)でカバー部材を貼りつけた基板Aに、界面活性剤CHAPSOをコーティングした直径180μmのジルコニア製微粒子(東レ(株)製)120mgを、基板Aとカバー部材とで形成される空隙(基板A表面の凹凸構造の凹部)に注入(格納)し、その他は実施例1と同様に分析用チップを作製した。微粒子の注入は、カバー部材の貫通孔(図1、2、6に例示される貫通孔32)から行った。以上のようにして得られた分析用チップを、「分析用チップ11」とした。
【0178】
CHAPSOをコーティングした微粒子は、直径180μmのジルコニア製微粒子(東レ(株)製)10gを、ステンレス製バット(10cm×10cm×5cm)に入れ、1%CHAPSO水溶液50mlを加えた。これを10分間超音波処理したのち、上清(CHAPSO成分)を除去し、オーブンを用いて微粒子を70℃にて、12時間乾燥させて得た。
【0179】
反応液については比較例2の反応液に含まれる界面活性剤を0.1%SDSから0.1%CHAPSOに変更したものを使用した。
【0180】
比較例1(7)と同様にして、ハイブリダイゼーション反応後の発生気泡数を計数し、10回の評価の平均値を求めたところ、2.0個であった(表1)。また、比較例1(8)と同様にしてバックグラウンドシグナル値のばらつき(CV値)を計算したところ、9.0%であった(表1)。
【0181】
比較例4
比較例3と同様に「分析用チップ11」を用い、反応液については比較例2の反応液に含まれる界面活性剤を0.1%SDSから1%CHAPSOに変更したものを使用した。
【0182】
比較例1(7)と同様にして、ハイブリダイゼーション反応後の発生気泡数を計数したところ、10回の評価の平均が4.5個であった(表1)。また、比較例1(8)と同様にしてバックグラウンドシグナル値のばらつき(CV値)を計算したところ、8.1%であった(表1)。
【0183】
【表1−1】

【0184】
【表1−2】

【0185】
【表1−3】

【0186】
以上の実施例1〜28、比較例1〜4の結果から、該チップと検体との反応液が消泡剤、又は非イオン系界面活性剤を含有させることによって、気泡の発生が抑制されてデータのばらつき(バックグラウンドシグナルのCV値)を低減できること、また検体溶液の脱気処理及びビーズ表面の界面活性剤処理と組み合わせることにより、さらに効果的に気泡の発生を抑制できることがわかった。
【産業上の利用可能性】
【0187】
本発明は、検体と選択的に結合する選択結合性物質を固定化した基板を備え、微粒子によって検体溶液を攪拌することのできる分析用チップにおいて、検出感度のばらつきを抑え、高感度の検出を可能とするものである。本発明は、特に医薬・医療分野における様々な生体関連物質の検出等のための分析用チップとして有用であり、その他、食品、環境分野における微量物質の検出のための分析用チップとしても有用である。
【図面の簡単な説明】
【0188】
【図1】図1は、本発明の分析用チップを構成する選択結合性物質が固定化された基板の一例を概略的に示す断面図である。
【図2】図2は、図1の基板の使用により、基板表面に気泡が発生した例を概略的に示す断面図である。
【図3】図3は、本発明の分析用チップを構成する選択結合性物質が固定化された基板の一例を概略的に示す斜視図である。
【図4】図4は、図3の本発明の分析用チップを構成する選択結合性物質が固定化された基板の一例を概略的に示す断面図である。
【図5】図5は、本発明の分析用チップの凹凸部、カバー部材及び微粒子の好ましい関係の一例を概略的に示す斜視図である。
【図6】図6は、本発明の分析用チップの凹凸部、カバー部材及び微粒子の好ましい関係の一例を概略的に示す縦断面図である。
【符号の説明】
【0189】
1 基板
2 微粒子
3 カバー部材
10 凹部
11 凸部
12 選択結合性物質が固定化された領域(凹凸部)
13 平坦部
26 発生した気泡の例
30 接着部材
30A 仕切り構造の接着部材
32 貫通孔
33 液面駐止用チャンバー
34 封止部材(テープ)
45 基板に固定化された選択結合性物質
L1 凸部ピッチ
【技術分野】
【0001】
本発明は、選択結合性物質、すなわち検体と選択的に結合する物質を固定化した基板を備えた分析用チップに関する。
【背景技術】
【0002】
分析用チップは、遺伝子、タンパク質、脂質、糖などの選択結合性物質が固定化された基板を有し、この基板上の選択結合性物質と検体を通常溶液として反応させて、反応結果からの存在の有無、状態又は量などを分析するために用いられる。この基板としては、一般にガラス製、金属製、樹脂製のものが用いられる。
【0003】
分析用チップの一態様として、数百〜数万という多数の遺伝子発現を同時に測定することを目的として、基板上にDNAなどの分子を高密度に配置した分析用チップであって、マイクロアレイと呼ばれるものがある。マイクロアレイを使用することによって、各種疾患動物モデルや細胞生物学現象における体系的かつ網羅的な遺伝子発現解析を行うことができる。具体的には、遺伝子の機能、すなわち遺伝子がコードするタンパク質を明らかにするとともに、タンパク質が発現する時期や作用する場所を特定することが可能になる。生物の細胞又は組織レベルでの遺伝子発現の変動をマイクロアレイによって解析し、生理学的、細胞生物学的、生化学的事象データと組み合わせて遺伝子発現プロファイルデータベースを構築することによって、疾患遺伝子、治療関連遺伝子の検索や治療方法の探索が可能になる。
【0004】
分析用チップは、DNA等の核酸だけでなく、タンパク質や糖類などの検査、解析手段としても利用されるようになってきた。とりわけ、プロテイン分析用チップでは、抗体、抗原、酵素基質などのタンパク質が基板上に固定される。
【0005】
分析用チップの使用時は、調製した検体を含む溶液を、分析用チップ上の選択結合性物質が固定化された領域全体に均等に拡がるようにアプライすることが重要である。このための工夫として、分析用チップ内部に、検体を含む溶液を攪拌するための微粒子を備えた分析用チップが知られている。
【0006】
特許文献1には、検体DNA溶液にあらかじめ微粒子を添加した微粒子分散溶液を分析用チップにアプライして、カバーガラスを被せ、シール剤により密閉し、カバーガラス、分析用チップ基板及びシール剤により規定される密閉された空隙を形成するような分析用チップが開示されている。この分析用チップは、微粒子の運動を利用して撹拌を行いながら、検体溶液が蒸発することなくハイブリダイゼーションを行うことができる。
【0007】
また、特許文献2には、分析用チップ基板に凹凸を設け、凸部上端面に選択結合性物質を固定化し、凹部に攪拌用微粒子を移動可能に格納して、反応液の攪拌を行うことができる分析用チップが開示されている。この分析用チップは、微粒子が凸部上端面と接触することがないため、選択結合性物質を傷つけずに微粒子による攪拌を行うことができる。
【0008】
しかし、このように微粒子を用いて攪拌を行う分析用チップにおいては、検体を含む液体をアプライする際に分析用チップ基板内部の表面又は微粒子表面に気泡が残留したり、反応液中に気泡が発生したりすることがある。生じた気泡が障害となって、気泡が滞留した部分において選択結合性物質と検体との反応が阻害されるという問題があった。また、気泡の滞留した部分とそれ以外の部分とで反応むらが生じるため、分析用チップ上で検出感度のばらつき又は検出感度の低下を生じるという問題があった。
【0009】
特許文献3には、DNAチップ使用時に気泡が発生すること、気泡がハイブリダイゼーション反応の均一性を阻害することが言及され、更にハイブリダイゼーション反応液組成に抑泡剤を添加することについて言及があるが、抑泡剤添加の実際的効果、使用する抑泡剤の種類には言及がなく、いかなる種類の抑泡剤が実際的に気泡抑泡効果をもつのか全く検討されていない。
【特許文献1】特許第3557419号公報
【特許文献2】国際公開第2005/090997号パンフレット
【特許文献3】特開2007−209236号公報
【発明の開示】
【発明が解決しようとする課題】
【0010】
本発明は、前記課題を解決するものであり、検体と固定化された選択結合性物質との選択的反応を阻害する気泡の発生を抑え、反応むらによる検出感度のばらつきや検出感度の低下を抑える分析用チップを提供するものである。
【課題を解決するための手段】
【0011】
本発明者らは鋭意検討を重ねた結果、分析用チップの選択結合性物質と反応する検体を含む反応液に消泡剤(以下、抑泡剤、破泡剤、溶泡剤、脱泡剤とも称する)及び/又は非イオン系界面活性剤を添加することにより、上記課題を解決することができることを見出し、本発明を完成するに至った。
【0012】
すなわち本発明は、選択結合性物質が表面に固定化された基板と、該基板と接着されたカバー部材とを備え、該基板と該カバー部材との間に空隙を有し、該空隙に微粒子が移動可能に格納された分析用チップであって、該空隙に該選択結合性物質と検体の結合反応のための反応液であって消泡剤及び/又は非イオン系界面活性剤を含有する反応液を保持する分析用チップである。
【0013】
本発明の分析用チップの好ましい一態様は、前記消泡剤がポリエーテル系消泡剤又はシリコーン系消泡剤である。
【0014】
また、本発明の分析チップの好ましい一態様は、前記微粒子の表面に界面活性剤がコーティングされている。
【0015】
また、本発明の分析チップの好ましい一態様は、前記界面活性剤が陰イオン界面活性剤又は非イオン界面活性剤である。
【0016】
また、本発明の分析用チップの好ましい一態様は、基板が、その表面に凹部及び凸部からなる凹凸部を有し、該凸部の上端面に選択結合性物質が固定化された基板である。
【0017】
また、本発明の分析用チップの好ましい一態様は、カバー部材が、前記空隙に連通する1つ以上の貫通孔を有するものである。
【0018】
また、本発明の分析用チップの好ましい一態様は、基板の選択結合性物質固定化面とカバー部材との間隔の最短距離が、微粒子の直径未満である。
【0019】
また、本発明の分析用チップの好ましい一態様は、選択結合性物質が、DNA、RNA、蛋白質、ペプチド、糖、糖鎖又は脂質である。
【0020】
さらに本発明は、選択結合性物質が表面に固定化された基板と、該基板と接着されたカバー部材とを備え、該基板と該カバー部材との間に空隙を有し、該空隙に微粒子が移動可能に格納された分析用チップと、該選択結合性物質と検体の結合反応のための反応液であって消泡剤及び/又は非イオン系界面活性剤を含有する反応液を含む分析用キットである。
【発明の効果】
【0021】
本発明の分析用チップによれば、分析用チップ内部の反応液中での気泡の残留や発生が抑えられる。この結果、気泡が選択結合性物質と検体との反応を阻害して反応むらによる検出感度のばらつきや検出感度の低下が抑制され、検体を高い感度で検出することができる。
【発明を実施するための最良の形態】
【0022】
本発明の分析用チップは、選択結合性物質がその表面に固定された基板と、該基板と接着されたカバー部材との間に空隙を有し、該空隙に微粒子が移動可能に格納又は注入された分析用チップであって、該空隙に該選択結合性物質と検体の結合反応のための反応液であって消泡剤及び/又は非イオン系界面活性剤を含有する反応液を保持することを特徴とする。
【0023】
本発明の微粒子を格納した分析用チップの例を図1に示す。図1に示す例において、基板1の表面は、凹部10及び凸部11からなる凹凸部により構成されている。凹部10に微粒子2が格納されており、凸部11の上面には、選択結合性物質45(例えば核酸)が固定化されている。
【0024】
この基板1に固定化された選択結合性物質45(例えば核酸)と反応させるために、分析用チップに検体を含む溶液を加えると、微粒子2の表面に付着した微小気泡が液体中に遊離し、図2に示すように気泡26となって凸部を覆うため、覆われた凸部表面上の選択結合性物質は検体と反応できない。本発明の分析用チップにおいては、該選択結合性物質と検体との反応液が消泡剤及び/又は非イオン系界面活性剤を含有することにより、微粒子表面に気泡が付着しない又は付着しにくいので、気泡の発生を抑制することができる。これにより、基板1表面の全ての選択結合性物質45が検体と反応することが可能となり、得られるデータの信頼性と再現性とを上昇させることができる。
【0025】
選択結合性物質と検体の結合反応のための反応液に含まれる消泡剤としては、シリコーン系、ポリエーテル系、アルコール系の消泡剤が挙げられる。
【0026】
シリコーン系消泡剤としては、和光純薬工業製のSI、TEGO製のAirex901W及びFoamax810が挙げられる。
【0027】
ポリエーテル系消泡剤としては、ポリオキシエチレンポリオキシプロピレンアルキルエーテル、ポリオキシエチレンポリオキシプロピレンモノアルキルエーテル、及び和光純薬工業株式会社製の3種の消泡剤(PE-H、 PE-M、 PE-L) が挙げられる。
【0028】
アルコール系消泡剤としては、オクチルアルコール、グリコール酸、シクロヘキサノール、高級アルコール、ポリアルキレングリコール、ポリアルキレングリコールアルキルエーテル、ジエチレングリコールラウレート、ポリオキシアルキレンソルビタンモノオレートが挙げられる。
【0029】
これら消泡剤の中でもポリエーテル系又はシリコーン系の消泡剤が好ましく、ポリエーテル系消泡剤がより好ましく用いられる。
【0030】
選択結合性物質と検体の結合反応のための反応液に含まれる非イオン界面活性剤としては特に限定はないが、ジメチルデシルホスフィンオキシド(APO−10)、ドデシルジメチルホスフィンオキシド(APO−12)、ポリオキシエチレンラウリルエーテル(BRIJ−35)、ポリオキシエチレン(20)セチルエーテル(BRIJ−58)、ポリオキシエチレン(80)ソルビタンモノオレイン酸エステル(ポリソルベート80、Tween80)、ポリオキシエチレン(60)ソルビタンモノオレイン酸エステル(ポリソルベート60、Tween60)、ポリオキシエチレン(20)ソルビタンモノラウリン酸エステル(ポリソルベート20、Tween20)、ポリエチレングリコールp−(1,1,3,3−テトラメチルブチル)フェニルエーテル(TRITON X−100)、TRITON X−114、n−デカノイル−N−メチル−D−グルカミン(MEGA−10)、n−ノナノイル−N−メチル−D−グルカミン(MEGA−9)、n−オクタノイル−N−メチル−D−グルカミン(MEGA−8)、ノニルフェニル−ポリエチレングリコール(NP−40)、ポリオキシエチレンポリオキシプロピレングリコール、モノステアリン酸エチレングリコール、モノステアリン酸ソルビタン、モノステアリン酸プロピレングリコール、モノステアリン酸ポリオキシエチレンソルビタン、ポリオキシエチレン(160)ポリオキシプロピレン(30)グリコール(プルロニックF68)、ポリオキシエチレン(196)ポリオキシプロピレン(67)グリコール(プルロニックF127)などが挙げられる。
【0031】
これら非イオン系界面活性剤の中でも、ポリオキシエチレン(80)ソルビタンモノオレイン酸エステル(ポリソルベート80、Tween80)、ポリオキシエチレン(60)ソルビタンモノオレイン酸エステル(ポリソルベート60、Tween60)、ポリオキシエチレン(20)ソルビタンモノラウリン酸エステル(ポリソルベート20、Tween20)、ノニルフェニル−ポリエチレングリコール(NP−40)、ポリエチレングリコールp−(1,1,3,3−テトラメチルブチル)フェニルエーテル(TRITON X−100)、TRITON X−114、ポリオキシエチレン(160)ポリオキシプロピレン(30)グリコール(プルロニックF68)、ポリオキシエチレン(196)ポリオキシプロピレン(67)グリコール(プルロニックF127)が好ましく、ポリオキシエチレン(80)ソルビタンモノオレイン酸エステル(ポリソルベート80、Tween80)、ポリオキシエチレン(60)ソルビタンモノオレイン酸エステル(ポリソルベート60、Tween60)、ポリオキシエチレン(20)ソルビタンモノラウリン酸エステル(ポリソルベート20、Tween20)、ポリオキシエチレン(160)ポリオキシプロピレン(30)グリコール(プルロニックF68)、ポリオキシエチレン(196)ポリオキシプロピレン(67)グリコール(プルロニックF127)がより好ましく用いられる。
【0032】
本発明で使用される消泡剤及び/又は非イオン界面活性剤は、分析チップが保持する反応液中の気泡の発生を抑制する効果を有していれば使用される組み合わせに限定はなく、消泡剤及び非イオン界面活性剤からなる群から一種類又は二種類以上の薬剤が選択されうるが、非イオン界面活性剤から一種類又は二種類以上選択されることが好ましく、非イオン界面活性剤から一種類選択されることがより好ましい。
【0033】
微粒子の形状は、検体溶液を攪拌することができれば特に限定されず、球状の形状以外に、多角形でも良く、円筒形、角柱形などのマイクロロッド状(微細な棒状)など任意の形状とすることができる。
【0034】
微粒子のサイズも特に限定されないが、微粒子の直径が、前記基板の選択結合性物質固定化面とカバー部材との間隔の最短距離未満であることが好ましい。例えば球状の微粒子の場合、0.1μm〜300μmの範囲とすることができる。微粒子が円筒形の微粒子の場合は、その底面直径を微粒子の直径と見なして、底面直径が前記基板の選択結合性物質固定化面とカバー部材との間隔の最短距離未満であることが好ましい。例えば、円筒形の微粒子の場合、長さ50μm〜5000μm、底面直径10μm〜300μmの範囲とすることができる。
【0035】
微粒子の材質も、特に限定されないが、ガラス、セラミック(例えばイットリウム部分安定化ジルコニア)、金、白金、ステンレス、鉄、酸化アルミ(アルミナ)、酸化チタン(チタニア)等の金属若しくは金属酸化物、ナイロンやポリスチレン等のプラスチックを用いることができる。
【0036】
微粒子の表面に界面活性剤をコーティングすることは、微粒子表面に気泡が付着しない又は付着しにくくし、気泡の発生を抑制することができるため、本発明の好ましい態様の1つである。
【0037】
微粒子表面を界面活性剤でコーティングする方法としては、微粒子を、界面活性剤を含む溶液に浸漬したのちに取り出して乾燥させる方法、微粒子表面に界面活性剤を含む溶液を噴霧したのちに乾燥させる方法、微粒子を界面活性剤の溶液を含んだ物質に触れさせる方法、微粒子を液体に触れさせた後、粉末状の界面活性剤をまぶして付着させる方法など、公知の方法を用いることができる。これらの方法で用いる界面活性剤を含む溶液の濃度は、0.01%〜10%が、より好ましくは0.05%〜2%の濃度が用いられる。
【0038】
微粒子の表面処理に使用する界面活性剤は、陰イオン界面活性剤、陽イオン界面活性剤、両性界面活性剤、非イオン界面活性剤が挙げられ、これらの中でも陰イオン界面活性剤、非イオン界面活性剤が好ましく用いられる。
【0039】
陰イオン界面活性剤としては、ドデシル硫酸ナトリウム(SDS)、コール酸ナトリウム、デオキシコール酸ナトリウム、ラウリルサルコシンナトリウム、ポリオキシエチレンアルキルエーテルリン酸、ポリオキシエチレンアルキルフェニルエーテルリン酸、ラウリル硫酸トリエタノールアミン、ラウロイルサルコシンナトリウムなどが挙げられる。
【0040】
陽イオン界面活性剤としては、臭化セチルトリメチルアンモニウム(CTAB)、エチル硫酸ラノリン脂肪酸アミノプロピルエチルジメチルアンモニウム、塩化アルキルトリメチルアンモニウム、塩化ジアルキルジメチルアンモニウム、塩化ジステアリルジメチルアンモニウム、塩化ジステアリルジメチルベンジルアンモニウム、塩化ステアリルトリメチルアンモニウムなどが挙げられる。
【0041】
両性界面活性剤としては、3−[(3−コールアミドプロピル)ジメチルアンモニオ]−2−ヒドロキシプロパンスルホナート(CHAPSO)、3−[(3−コールアミドプロピル)ジメチルアンモニオ]プロパンスルホナート(CHAPS)、n−ドデシル−N,N−ジメチル−3−アンモニオ−1−プロパンスルホナート(ZWITTERGENT 3−12 Detergent)などが挙げられる。
【0042】
非イオン界面活性剤としては、ジメチルデシルホスフィンオキシド(APO−10)、ドデシルジメチルホスフィンオキシド(APO−12)、ポリオキシエチレンラウリルエーテル(BRIJ−35)、ポリオキシエチレン(20)セチルエーテル(BRIJ−58)、ポリオキシエチレン(80)ソルビタンモノオレイン酸エステル(ポリソルベート80、Tween80)、ポリオキシエチレン(60)ソルビタンモノオレイン酸エステル(ポリソルベート60、Tween60)、ポリオキシエチレン(20)ソルビタンモノラウリン酸エステル(ポリソルベート20、Tween20)、ポリエチレングリコールp−(1,1,3,3−テトラメチルブチル)フェニルエーテル(TRITON X−100)、TRITON X−114、n−デカノイル−N−メチル−D−グルカミン(MEGA−10)、n−ノナノイル−N−メチル−D−グルカミン(MEGA−9)、n−オクタノイル−N−メチル−D−グルカミン(MEGA−8)、ノニルフェニル−ポリエチレングリコール(NP−40)、ポリオキシエチレンポリオキシプロピレングリコール、モノステアリン酸エチレングリコール、モノステアリン酸ソルビタン、モノステアリン酸プロピレングリコール、モノステアリン酸ポリオキシエチレンソルビタン、ポリオキシエチレン(160)ポリオキシプロピレン(30)グリコール(プルロニックF68)、ポリオキシエチレン(196)ポリオキシプロピレン(67)グリコール(プルロニックF127)などが挙げられる。
【0043】
これらの中でも、陰イオン界面活性剤としては、界面活性効果が強力であることからドデシル硫酸ナトリウム(SDS)、デオキシコール酸ナトリウムが特に好ましく用いられ、非イオン界面活性剤としては、プルロニックF68、プルロニックF127が特に好ましく用いられる。
【0044】
また、界面活性剤がコーティングされる微粒子の表面は、適度な粗さを有していることが好ましい。即ち、微粒子の表面の中心線平均粗さ(Ra値)が40nm以上300nm以下であることが好ましい。この範囲の表面粗さを有する微粒子を使用することで、ビーズの表面積がより大きいためにより多くの界面活性剤を微粒子表面にコーティングすることが可能となる。セラミックス製微粒子の場合、材質の強度を考慮すると、Ra値が40nm以上200nm以下であることが好ましい。
【0045】
本発明の分析用チップを構成する基板は、その表面に、凹部及び選択結合性物質を固定化する凸部からなる凹凸部を有することが好ましい。このような構造をとることにより、検出の際、非特異的に吸着した検体を検出することがないので、ノイズが小さく、結果的によりS/Nが良好な結果を得ることができる。ノイズが小さくなる具体的な理由は、凸部上面に選択結合性物質を固定化した基板をスキャナーと呼ばれる装置を用いてスキャンすると、凹凸部の凸部上面にレーザー光の焦点が合っているため、凹部では、レーザー光がぼやけ、凹部に非特異的に吸着した検体の望まざる蛍光(ノイズ)を検出しがたいという効果があるためである。
【0046】
凹凸部の凸部の高さに関しては、それぞれの凸部上面の高さが略同一であることが好ましい。ここで、高さが略同一とは、多少高さの違う凸部の表面に選択結合性物質を固定化し、これと蛍光標識した検体とを反応させ、そして、スキャナーでスキャンした際、その信号レベルの強度差が問題とならない高さをいう。具体的には、高さが略同一とは、高さの差が50μm以下であることをいう。高さの差は30μm以下であることがより好ましく、高さが同一であればなお好ましい。なお、本発明でいう同一の高さとは、生産等で発生するばらつきによる誤差も含むものとする。最も高い凸部上面の高さと、最も低い凸部上面の高さの差が50μmより大きいと、高さのずれた凸部上面でのレーザー光がぼやけてしまい、この凸部上面に固定化された選択結合性物質と反応した検体からのシグナル強度が弱くなる場合があるため好ましくない。
【0047】
本発明の分析用チップを構成する基板において、選択結合性物質(例えば核酸)が固定化される領域は、該基板の表面であり、上述のような粗面化がなされていない領域であれば、特に限定されないが、具体的には、上述した凹凸部のうち凸部の上面(上端面)であることが好ましい。選択結合性物質の固定化は、予めなされるものであっても良いし、固定化しないで基板のみを用意しておき、検体の分析の際に所望の検体に応じた選択結合性物質を適宜選択し固定することもできる。
【0048】
凸部の上面に固定化できる選択結合性物質(例えば核酸)は、データとして必要なものを適宜選択することができるが、単なるダミーの選択結合性物質であっても良い。また、すべての凸部上面に選択結合性物質を結合する必要は無く、何も固定化していない凸部上面を有していても良い。
【0049】
本発明の分析用チップを構成する基板において、凸部上面に選択結合性物質が固定化される場合、当該凸部の上面の面積は略同一であることが好ましい。凸部の上面の面積が略同一であることにより、多種の選択結合性物質が固定化される部分の面積を同一にできるので、後の解析に有利である。ここで、凸部の上部の面積が略同一とは、凸部の中で最も大きい上面面積を、最も小さい上面面積で割った値が1.2以下であることを言う。
【0050】
選択結合性物質が固定化された凸部の上面の面積は、特に限定されるものではないが、選択結合性物質の量を少なくすることができる点とハンドリングの容易さの点から、10μm2以上、1mm2以下であることが好ましく、300μm2以上、0.8mm2以下であることがより好ましい。
【0051】
本発明の分析用チップを構成する基板において、さらに好ましくは、その基板における選択結合性物質が固定化された領域を有する面の周囲がさらに凹凸部の凸部上端と略同一の高さの平坦部で囲まれていることが好ましい。このような構造とすることにより、凹凸部に検体を含む溶液をアプライすることが容易となり、攪拌用の微粒子を選択結合性物質に接触させること無く凹部に保持することが可能となる。
【0052】
凹凸部の凸部の上面の高さと平坦部の高さは、略同一であることが好ましい。すなわち、平坦部の高さと凸部上面の高さの差は、50μm以下であることが好ましい。凸部上面の高さと平坦部の高さの差が50μmを超えると、検出できる蛍光強度が弱くなる場合があるため好ましくない。平坦部の高さと凸部上面の高さの差は、より好ましくは30μm以下であり、最も好ましくは、平坦部の高さと凸部の高さは同一である。
【0053】
本発明の分析用チップで好ましく用いられる基板の凹凸部における凸部の高さ、即ち凸部上面と凹部底面との高さの差は、10μm以上、500μm以下が好ましく、50μm以上、300μm以下がより好ましい。凸部の高さが10μmより低いと、スポット以外の部分の非特異的に吸着した検体試料を検出してしまうことがあり、結果的にS/Nが悪くなることがあるため好ましくない。また、凸部の高さが500μmより高いと、凸部が折れて破損しやすいなどの問題が生じる場合があり好ましくない。
【0054】
本発明の分析用チップを構成する基板の具体例を、図3及び図4に例示する。
【0055】
図3及び図4に示す例において、基板1の表面は、複数の凸部11を含む凹凸部12により構成されており、その周りに平坦部13が設けられている。凸部11の上面には、選択結合性物質(例えば核酸)が固定化されている。この平坦部を使って、容易にスキャナーの励起光等の測定用の光線の焦点を凸部の上面に合わせることが可能となる。
【0056】
本発明の分析用チップの基板の材質は、特に限定されないが、ガラス、セラミック、シリコーン樹脂、ポリエチレンテレフタレート、酢酸セルロース、ポリカーボネート、ポリスチレン、ポリメチルメタクリレート(PMMA)、ポリジメチルシロキサン(PDMS)エラストマー等のシリコーンゴムなどを挙げることができる。これらの中でも、ポリメチルメタクリレート、ポリスチレン、ポリジメチルシロキサン(PDMS)エラストマー、ガラス又はシリコーン樹脂を好ましく用いることができる。
【0057】
本発明の分析用チップの基板は、少なくとも一部が黒色であることが好ましい。このようにすることにより、基板からの自家蛍光を低減することができる。基板の黒色にする部分としては、凹凸部が設けられた基板の本体でも良いし、凸部の側面、凹部に設けられた疎水的な材料や絶縁層でも良いし、これらの全部でも良い。
【0058】
本発明の分析用チップを構成する基板は、各種製法にて製造することができる。例えば、材質がポリマー等の場合、射出成形法、ホットエンボス法、鋳型内で重合させる方法等により成型することができる。また、材質がガラスやセラミック等の無機物の場合、サンドブラスト法、シリコーン樹脂の場合は公知の半導体プロセスなどで成型することができる。
【0059】
成型した基板は、選択結合性物質をその表面に固定化するのに先立ち、必要に応じて各種の表面処理を施すことができる。かかる表面処理としては、具体的には例えば特開2004−264289号公報に記載されるものなどを挙げることができる。
【0060】
本発明において、分析用チップとは、検体が含まれる溶液を当該チップにアプライし、検体の存在の有無や、検体の量や、検体の性状等を測定するために用いるチップをいう。具体的には、基板表面に固定化された選択結合性物質と検体との反応により、検体の量や、検体の有無を測定するバイオチップが挙げられる。より具体的には、核酸を基板表面に固定化したDNAチップ、抗体に代表されるタンパク質を基板表面に固定化したタンパク質チップ、糖鎖を基板表面に固定化した糖鎖チップ、及び基板表面に細胞を固定化した細胞チップ等が挙げられる。
【0061】
本発明において、選択結合性物質とは、検体と直接的又は間接的に、選択的に結合し得る各種の物質を意味する。基板の表面に結合しうる選択結合性物質の代表的な例としては、核酸、蛋白質、ペプチド、糖類、脂質を挙げることができる。
【0062】
核酸としては、DNAやRNAでも良く、またPNAでも良い。特定の塩基配列を有する一本鎖核酸は、該塩基配列又はその一部と相補的な塩基配列を有する一本鎖核酸と選択的にハイブリダイズして結合するので、本発明でいう「選択結合性物質」に該当する。
【0063】
核酸は、生細胞等天然物由来のものであっても良いし、核酸合成装置により合成されたものであっても良い。生細胞からのDNA又はRNAの調製は、公知の方法、例えばDNAの抽出については、Blinらの方法(Blin et al., Nucleic Acids Res. 3: 2303 (1976))等により、また、RNAの抽出については、Favaloroらの方法(Favaloro et al., Methods Enzymol.65: 718 (1980))等により行うことができる。固定化する核酸としては、更に、鎖状若しくは環状のプラスミドDNAや染色体DNA、これらを制限酵素により若しくは化学的に切断したDNA断片、試験管内で酵素等により合成されたDNA、又は化学合成したオリゴヌクレオチド等を用いることもできる。
【0064】
また、蛋白質としては、抗体及びFabフラグメントやF(ab’)2フラグメントのような、抗体の抗原結合性断片、並びに種々の抗原を挙げることができる。抗体やその抗原結合性断片は、対応する抗原と選択的に結合し、抗原は対応する抗体と選択的に結合するので、「選択結合性物質」に該当する。
【0065】
糖類としては、各種単糖のほか、オリゴ糖や多糖などの糖鎖を挙げることができる。
【0066】
脂質としては、単純脂質の他、複合脂質であっても良い。
【0067】
更に、上記核酸、蛋白質、糖類、脂質以外の抗原性を有する物質を固定化することもできる。また、選択結合性物質として、基板の表面に細胞を固定化してもよい。
【0068】
本発明の分析用チップは、該基板の表面を覆い該基板と接着されたカバー部材を更に備えるものである。カバー部材を備えることにより、検体が含まれる溶液を簡便に密閉保持することができ、その結果、検体と、基板の領域(図3又は図4中の12)に固定化された選択結合性物質との反応を、安定して行うことができる。また、本発明の分析用チップには予め微粒子を注入(格納)しておくことができ、検体溶液をアプライする作業を容易に行うことが可能である。そして、検体溶液をアプライした後の貫通孔を塞ぐ作業においてもテープやシール剤が検体溶液と接触することがないので、バックグラウンドノイズが上昇しないという利点もある。
【0069】
図5は、前記基板に加え、更にカバー部材、接着部材、貫通孔及び液面駐止用チャンバーを有する本発明の分析用チップの概略的な態様の例を示す斜視図である。
【0070】
前記カバー部材は、前記基板の表面の少なくとも一面の一部を覆い、基板と、カバー部材との間に空隙を有するよう接着されることができる。そして、基板は、好ましくはその表面であって前記空隙内に位置する領域上に固定化された選択結合性物質を有する。即ち、好ましくは、前記選択結合性物質が固定化された領域が、当該空隙内に存在するように、前記カバー部材は前記基板に接着される。前記カバー部材は、前記空隙が形成される限りにおいて、どのような態様で接着されてもよいが、好ましくは、両面テープ、樹脂組成物等の接着部材を介して接着される。
【0071】
前記カバー部材は、前記空隙に連通する1つ以上の貫通孔を有するものとすることができ、複数の貫通孔を有することが好ましい。より具体的には、貫通孔は、一つの空隙に対して複数あることが好ましく、中でも3個から6個とすることにより、検体が含まれる溶液の充填が容易となるので特に好ましい。なお、後述するように、空隙が、互いに連通しない複数の空間に分かれている場合は、各空間あたりに複数個、より好ましくは3〜6個の貫通孔を有することが好ましい。カバー部材が複数の貫通孔を有する場合、それらの孔径は、同一でも異なっていてもよいが、複数の貫通孔のうちの一つをアプライ口とし、他の貫通孔を空気の抜け口として機能させる場合、検体溶液のアプライの容易さ及び該溶液の密閉保持性の点から、アプライ口のみをアプライに必要な広い孔径としその他の貫通孔をより狭い孔径とすることが、好ましい。具体的には、アプライ口の貫通孔サイズは上記の通り直径0.01mmから2.0mmの範囲内とし、その他の貫通孔の直径を0.01mm〜1.0mmとすることが好ましい。
【0072】
このようなカバー部材は、前述の基板に、脱離可能に接着されていることが好ましい。本発明の分析用チップをDNAチップとして用いる場合、通常、DNAチップを専用スキャナーで読み取ることが必要であるが、カバー部材が接着された状態では、専用スキャナーにセットすることが難しく、セットされたとしてもスキャン操作を実施するとカバー部材とスキャナーの光学系部品が接触し、故障の原因となることがある。また、カバー部材を介しての読み取りが可能であっても、読み取り値が不正確となりうる。そのため、読み取りの工程においてカバー部材を取り外せるよう、カバー部材が脱離可能であることが好ましい。
【0073】
カバー部材を基板に脱離可能に接着する態様は、特に限定されないが、カバー部材と基板が損傷されることなく脱離することが可能である態様が好ましい。例えば、両面テープ、樹脂組成物等の接着部材を介して接着することができる。
【0074】
上記カバー部材の形状は、前記基板の表面の少なくとも一面の一部を覆い、基板と、カバー部材との間に空隙を有するよう接着されうるものであれば特に限定されないが、その外周部分において、基板に近い部分より基板に遠い部分において突出した部分を有する構造、すなわちオーバーハング構造が設けられたものとすることができる。オーバーハング構造を設けることにより、基板を損傷せずにカバー部材を脱離することが容易となるので、好ましい。
【0075】
本発明の分析用チップを構成するカバー部材の材料としては、特に限定されるものではないが、検体溶液をアプライした際に、溶液の様子を観察可能とするために、透明な材料が好ましい。そのような材質としては、ガラス又はプラスチックが挙げられる。特に、貫通孔や液面駐止チャンバー等の構造を容易に作製可能という点から、ポリスチレン、ポリメチルメタクリレート、ポリカーボネート等の透明樹脂を好ましく用いることができる。カバー部材の作製方法も特に限定されるものではなく、切削加工や射出成型法による加工が可能である。大量生産が可能という観点から、射出成型法を好ましく用いることができる。
【0076】
本発明の分析用チップにおける、凹凸部、カバー部材及び微粒子の関係の好ましい例を、図12を参照して説明する。図6に示した例では、DNA等の選択結合性物質45は、基板1の凸部11の上面に固定化されている。そして、微粒子(この場合は球状のビーズ)2は、基板1の凹部の空隙内に載置されている。選択結合性物質45及び微粒子2は、検体が含まれる溶液(図示せず)に触れることになる。検体溶液は、基板1、接着部材30及びカバー部材3により規定される空隙内で保持されることになる。図6の例においては、基板の凸部11上面とカバー部材3との間隔の最短距離が、微粒子2の直径未満となっている。それにより、微粒子が凸部11上面に接触できなくなり、凸部11上面上の選択結合性物質45を傷つけることを防ぐことができる。微粒子が、例えば楕円形等の非球状の形状である場合は、凸部上面と容器との最短距離が微粒子の最小径未満であれば、同様に凸部11上面と微粒子との接触を防ぎ、選択結合性物質45の損傷を防ぐことが可能となる。
【0077】
このような本発明の分析用チップは、各種検体の分析に利用することができる。すなわち、本発明の分析用チップの選択結合性物質を固定化した基板に、検体を接触させて該選択結合性物質と選択的に結合させ、基板上に該選択結合性物質を介して結合した該検体の有無又は量を測定することにより、検体を分析することができる。
【0078】
前記検体の分析方法においては、まず、前記本発明の分析用チップを構成する選択結合性物質を固定化した基板に検体を接触させて選択的に結合させる。すなわち、基板に上述のような標識、増幅等を施した検体を水溶液や適当な緩衝液等に溶解させた溶液(本明細書において「検体溶液」ということがある)とし、基板に接触させれば良い。
【0079】
選択結合性物質が結合された基板への接触は、検体を水溶液や適当な緩衝液等の溶液とし、該基板の凹凸部にピペット等の通常の器具で注入することにより行うことができる。貫通孔からの検体のアプライは、例えば、前記貫通孔からピペット等の通常の器具で注入して行うことができる。
【0080】
カバー部材への封止部材の貼付は、貫通孔の一部又は全て、好ましくは全てを封止する態様にて行うことができる。前記封止部材としては、例えばカプトン(登録商標、東レ・デュポン社製)などのポリイミドフィルム製、ポリエステル製、セロハン製又は塩化ビニル製の粘着テープ等の可とう性のテープを好ましく挙げることができるが、これに限らず、非可とう性の板状の接着可能な任意の部材を用いることもでき、非定型のシーリング剤を用いることもできる。液面駐止用チャンバーによる本発明の効果をより良好に得るという観点からは、可とう性のテープ及び板状の部材が好ましく、操作の簡便性などの観点から、可とう性のテープがさらに好ましい。
【0081】
封止の具体例を、再び図6を参照して説明する。図6の例では、検体溶液(図示せず)を貫通孔32よりアプライした後、封止部材として可とう性の粘着テープ34を、液面駐止用チャンバー33の全面を覆うように貼付し、貫通孔を封止している。このような態様により、簡便で且つ検体溶液の漏出や測定誤差を招かない封止を達成できる。
【0082】
前記検体の分析方法において、選択的な結合とは、選択結合性物質と検体とを相互作用させ、前記検体を、前記選択結合性物質を介して前記選択結合性物質を固定化した基板に結合させることを意味する。本発明の分析用チップの場合には、前記チップを揺動、回転させることにより、重量、振動、遠心力によって微粒子が検体溶液中を移動するので、選択的結合を効率よく進めることができる。
【0083】
前記選択結合性物質と検体の選択的結合を行う際の反応温度及び時間は、ハイブリダイズさせる検体の核酸の鎖長や、免疫反応に関与する抗原及び/又は抗体の種類等に応じて適宜選択されるが、核酸のハイブリダイゼーションの場合、通常、40℃〜70℃程度で1分間〜十数時間、免疫反応の場合には、通常、室温〜50℃程度で1分間〜数時間程度である。また、必要に応じて、選択結合性物質を固定化した基板を揺動、回転等させ、選択的結合を促進することができる。
【0084】
本発明の分析用チップは、分析用チップ内の微粒子を移動させることにより、検体溶液を効率よく撹拌することができる。微粒子を移動させる手段としては、好ましくは分析チップを回転させて重力方向に微粒子を落下させる方法や、振とう機に微粒子を含んだ分析チップをセットし基板を振とう若しくは揺動させる方法や、磁性微粒子を用いて磁力により微粒子を移動させる方法が用いられるが、チップを振とう機にセットし、水平面内で旋回回転させる方法が、微粒子の移動範囲が大きく、偏り無く移動するため、その結果、効率よく液を攪拌できるため好ましく用いられる。このとき、旋回回転の回転数は、好ましくは10〜1000回転/分であり、より好ましくは100〜500回転/分である。
【0085】
選択的結合の終了後、通常はカバー部材を脱離させた後、次の工程に供することができる。
【0086】
分析方法においては、上述の選択的結合の後、前記基板上に前記選択結合性物質を介して結合した前記検体の質量を測定する。この測定も、従来の分析用チップにおける操作と全く同様に行うことができる。例えば、適宜蛍光標識され、選択結合性物質と結合した検体の質量について、公知のスキャナー等により、その蛍光量を読み取ることにより測定することができる。
【0087】
前記検体の分析方法において、選択結合性物質として核酸を固定化した場合には、この核酸又はその一部と相補的な配列を有する核酸を測定することができる。また、選択結合性物質として抗体又は抗原を固定化した場合には、この抗体又は抗原と免疫反応する抗原又は抗体を測定することができる。なお、本明細書でいう「測定」には検出と定量の両者の意味が含まれる。
【0088】
さらに本発明は分析用キットに関する。ここでいう分析用キットとは、本発明の分析用チップを構成するためのものであり、少なくとも選択結合性物質が表面に固定化された基板と、該基板と接着されたカバー部材とを備え、該基板と該カバー部材との間に空隙を有し、該空隙に微粒子が移動可能に格納された分析用チップと、該選択結合性物質と検体の結合反応のための反応液であって消泡剤及び/又は非イオン界面活性剤を含有する反応液が含まれる。
【0089】
その他、上記に加えて本発明の分析用キットに含まれうるものとしては、封止シール、アプライ用ティップ、アプライ用スタンド、綿棒等が挙げられるが、それらに限定されない。
【0090】
本発明の分析用キットの使用方法としては、分析用チップに固定化された選択結合性物質と選択的に結合する検体の検出に使用できる。具体的には、検体を標識し、上記の「反応液」と混合し、これを前記基板と接着されたカバー部材に設けられている貫通孔から分析用チップ内部に注入する。注入終了後の分析用チップの貫通孔を封止シールで塞ぎ、検体と分析用チップ基板表面の選択結合性物質の反応を行ない、検体の標識を検出することで該選択結合性物質と特異的に結合する検体を検出することができる。
【実施例】
【0091】
本発明を以下の実施例によって更に詳細に説明する。本発明は下記実施例に限定されない。
【0092】
比較例1
(1)分析用チップの基板の作製
公知の方法であるLIGA(Lithographie Galvanoformung Abformung)プロセスを用いて、射出成形用の型を作製し、射出成型法により後述するような形状を有するポリメチルメタクリレート(PMMA)製の基板を得た。用いたPMMAの平均分子量は5万であり、PMMA中には1重量%の割合で、カーボンブラック(三菱化学製 #3050B)を含有させて、基板を黒色にした。この黒色基板の分光反射率と分光透過率を測定したところ、分光反射率は、可視光領域(波長が400nmから800nm)のいずれの波長でも5%以下であり、また、同範囲の波長で、透過率は0.5%以下であった。分光反射率、分光透過率とも、可視光領域において特定のスペクトルパターン(ピークなど)はなく、スペクトルは一様にフラットであった。なお、分光反射率は、JIS Z 8722の条件Cに適合した照明・受光光学系を搭載した装置(ミノルタカメラ製、CM−2002)を用いて、基板からの正反射光を取り込んだ場合の分光反射率を測定した。
【0093】
基板としては、図3及び図4に例示される形状を有する基板である、外形が縦76mm、横26mm、厚み1mmであり、基板の中央部に、縦39.4mm、横19.0mm、深さ0.15mmの凹部(図3の凹部10に相当)を設け、この凹部の中に、直径0.1mm、高さ0.15mmの凸部(図3の凸部11に相当)を9248箇所設けた基板(以下「基板A」とする)を用いた。この基板Aにおいて、凸部(図3の凸部11に相当)上面と平坦部(図3の凸部13に相当)上面との高さの差(凸部は高さの平均値)は、3μm以下であった。また、凸部(図3の凸部13に相当)上面の高さのばらつき(最も高い凸部上面の高さと最も低い凸部上面との高さの差)は、3μm以下であった。また、凸部のピッチ(図4のL1;凸部中央部から隣接した凸部中央部までの距離)を0.5mmとした。
【0094】
上記基板Aを10Nの水酸化ナトリウム水溶液に70℃で12時間浸漬した。これを、純水、0.1NのHCl水溶液、純水の順で洗浄し、基板表面にカルボキシル基を生成させた。
【0095】
(2)選択結合性物質の固定化
基板Aに対し、以下の条件で、それぞれ選択結合性物質(プローブDNA)としてオリゴヌクレオチドを固定化した。オリゴヌクレオチドとしては、オペロン社製DNAマイクロアレイ用オリゴヌクレオチドセット“Homo sapiens (human) AROS V4.0(各60塩基)”を用いた。このオリゴヌクレオチドを、純水に0.3nmol/μLの濃度となるよう溶解させて、ストック溶液とした。このストック溶液を基板にスポット(点着)する際は、PBS(8gのNaCl、2.9gのNa2HPO4・12H2O、0.2gのKCl、及び0.2gのKH2PO4を合わせて純水に溶かし、1Lにメスアップしたものに、塩酸を加えてpH5.5に調整したもの)で10倍希釈して、プローブDNAの終濃度を0.03nmol/μLとし、かつ、PMMA製基板表面に生成させたカルボキシル基とプローブDNAの末端アミノ基とを縮合させるため、1−エチル−3−(3−ジメチルアミノプロピル)カルボジイミド(EDC)を加え、この終濃度を50mg/mLとした。この溶液をアレイヤー(スポッター)(日本レーザー電子製;Gene Stamp−II)を用いて、基板Aの全ての凸部上面にスポットした。次いで、スポットした基板を密閉したプラスチック容器に入れて、37℃、湿度100%の条件で20時間程度インキュベートした。最後に純水で基板を洗浄し、スピンドライヤーで遠心して乾燥した。
【0096】
(3)分析用チップ基板へのカバー部材の貼付
選択結合性物質を固定化した上記基板Aに対し、次のようにカバー部材を貼付した。カバー部材としては、縦41.4mm、横21mm、厚さ1mmのPMMA平板を切削加工により作製してカバー部材とした。作製した該カバー部材には、貫通孔及び液面駐止用チャンバーを図6の32、33に例示するように設けた。そして接着部材として縦41.4mm、横21mmを幅1mmの両面テープを用い、この両面テープをカバー部材を縁取るように、かつ厚さ50μmで積層させて貼り付けたのち、該カバー部材を基板Aに貼付した。
【0097】
(4)検体の調製
検体としては、マイクロアレイの検体として一般的な、aRNA(antisense RNA)を用いた。市販のヒト培養細胞由来total RNA(CLONTECH社製Human Reference RNA)5μgから、Ambion社製aRNA調製キットを使用して、5μgのCy3標識aRNAを得た
(5)選択結合性物質と検体とのハイブリダイゼーションのための反応液
以下の実施例、比較例で特に断りのない限り、上記で調製した標識aRNAを、1重量%BSA、5×SSC、0.01重量%サケ精子DNA、0.1重量%SDSの溶液(各濃度はいずれも終濃度)で希釈したものを用いた。
【0098】
(6)分析用チップへの微粒子の注入(格納)
上記(3)でカバー部材を貼りつけた基板Aに、直径180μmのジルコニア製微粒子(東レ(株)製)120mgを、基板Aとカバー部材とで形成される空隙(基板A表面の凹凸構造の凹部)に注入(格納)した。微粒子の注入は、カバー部材の貫通孔(図1、2、6に例示される貫通孔32)から行った。以上のようにして得られた分析用チップを、「分析用チップ1」とした。
【0099】
検体としては、マイクロアレイの検体として一般的な、aRNA(antisense RNA)を用いた。市販のヒト培養細胞由来total RNA(CLONTECH社製Human Reference RNA)5μgから、Ambion社製aRNA調製キットを使用して、5μgのCy3標識aRNAを得た。
【0100】
(7)ハイブリダイゼーション反応と気泡発生数の評価
マイクロピペットを用いて、分析用チップ1の基板Aとカバー部材との空隙(反応槽)に、Cy3標識aRNA200ngを含む反応液165μLを貫通孔より注入した。このとき、容易に溶液を注入でき、気泡が混入することはなかった。封止材としてカプトンテープ(アズワン)を用い、4つの貫通孔を塞いだ。ハイブリダイゼーションチャンバー(Takara Hybridization chamber(タカラバイオ(株)製))を、シート振盪台(東京理化器械(株)製 MMS FIT−S)に密着させて固定し、分析用チップ1をハイブリダイゼーションチャンバー内にセットした。このとき、分析用チップ1をセットする位置の両端の凹みに、15μLずつ超純水を滴下した。ハイブリダイゼーションチャンバー蓋を閉めた後、6本の固定ネジを締めて固定し、42℃に設定した恒温チャンバー(東京理化器械(株)製 FMS−1000)内に据え付けた振盪機(東京理化器械(株)製 MMS−310)の上に載せて固定した。恒温チャンバーの前面をアルミホイルで遮光して、250回転/分で旋回振盪しながら、42℃で16時間インキュベートした。インキュベート後、ハイブリダイゼーションチャンバーから分析用チップ1を取り出した。
【0101】
カバー部材を通して、分析用チップ1の基板A上に観察された反応液中の気泡数を計数した。分析用チップ1を用いたハイブリダイゼーション反応を10回実施した結果、反応液中に発生した気泡数は、1回当たりの平均で13.0個であった(表1)。
【0102】
(8)蛍光シグナル値の測定と検出感度ばらつきの評価
分析用チップ1の基板Aに接着したカバー部材と両面テープを脱離した後、基板Aを洗浄、乾燥した。DNAチップ用のスキャナー(Axon Instruments社製 GenePix 4000B)に上記処理後の基板Aをセットし、レーザー出力33%、フォトマルチプライヤーの電圧設定を500にした状態において、ハイブリダイゼーション反応した検体の標識体シグナル値(蛍光強度)、バックグラウンドノイズを測定した。全9248個のスポットのうち、32個をバックグラウンド蛍光値測定用のネガティブコントロールスポットとし、個々のシグナル値からバックグラウンドシグナル値を差し引いて各スポットの真のシグナル値を算出した。
【0103】
気泡の出現によるハイブリダイゼーション反応の反応むらによる検出感度のばらつきの評価として、分析用チップ1を用いたハイブリダイゼーション反応を10回実施し、各回におけるバックグラウンドシグナル値のばらつき(CV値=全回のバックグラウンドシグナル値の標準偏差/全回のバックグラウンドシグナル値の平均値(%))を計算した。その結果、10回の評価におけるバックグラウンドシグナル値のばらつき(CV値)の平均値は12.1%であった(表1)。
【0104】
比較例2
比較例1(5)で調製した反応液を次のように脱気処理を行ったこと以外は、比較例1と同様に作製した分析用チップ1を用いた評価を実施した。反応液175μlを0.2mlPCRチューブ(アシスト社製72.737.002)にいれ、フタを開けたまま脱気装置(ULVAC社製アスピレーターNDA−015型)にセットして脱気を行った。脱気時の到達圧力は、装置の表示で50hPa、脱気時間は25分間とした。
【0105】
比較例1(7)と同様にして、ハイブリダイゼーション反応後の発生気泡数を計数したところ、10回の評価の平均が9.0個であった(表1)。また、実施例1(8)と同様にしてバックグラウンドシグナル値のばらつき(CV値)を計算したところ、10.5%であった(表1)。
【0106】
実施例1
比較例1(5)で調製した反応液に、消泡剤として和光純薬工業株式会社製消泡剤“PE-L”をv/v濃度で0.05%となるよう添加し、反応液を次のように脱気処理を行ったこと以外は、比較例1と同様に作製した分析用チップ1を用いた評価を実施した。反応液175μlを0.2mlPCRチューブ(アシスト社製72.737.002)にいれ、フタを開けたまま脱気装置(ULVAC社製アスピレーターNDA−015型)にセットして脱気を行った。脱気時の到達圧力は装置表示で50hPa、脱気時間は25分間とした。
【0107】
比較例1(7)と同様にして、ハイブリダイゼーション反応後の基板上に観察された反応液中の気泡数を計数したところ、気泡数は、10回の回実施した結果の1回当たりの平均値が1.2個であった(表1)。また、実施例1(8)と同様にしてバックグラウンドシグナル値のばらつき(CV値)を計算したところ、6.9%であった(表1)。
【0108】
実施例2
反応液に、消泡剤として和光純薬工業株式会社製消泡剤“SI”をv/v濃度で0.05%となるよう添加したこと以外は、実施例1と同様に脱気した分析用チップ1を用いた評価を実施した。脱気時間は25分間とした。
【0109】
比較例1(7)と同様にして、ハイブリダイゼーション反応後の発生気泡数を計数したところ、10回の評価の平均が2.9個であった(表1)。また、比較例1(8)と同様にしてバックグラウンドシグナル値のばらつき(CV値)を計算したところ、7.3%であった(表1)。
【0110】
実施例3
反応液に、消泡剤として和光純薬工業株式会社製“グリコール酸”をv/v濃度で0.05%となるよう添加したこと以外は、実施例1と同様に脱気した分析用チップ1を用いた評価を実施した。脱気時間は25分間とした。
【0111】
比較例1(7)と同様にして、ハイブリダイゼーション反応後の発生気泡数を計数したところ、10回の評価の平均が4.7個であった(表1)。また、比較例1(8)と同様にしてバックグラウンドシグナル値のばらつき(CV値)を計算したところ、7.8%であった(表1)。
【0112】
実施例4
比較例1(3)でカバー部材を貼りつけた基板Aに、界面活性剤ドデシル硫酸ナトリウム(SDS)をコーティングした直径180μmのジルコニア製微粒子(東レ(株)製)120mgを、基板Aとカバー部材とで形成される空隙(基板A表面の凹凸構造の凹部)に注入(格納)し、その他は実施例1と同様に分析用チップを作製した。微粒子の注入は、カバー部材の貫通孔(図1、2、6に例示される貫通孔32)から行った。以上のようにして得られた分析用チップを、「分析用チップ2」とした。また、反応液については実施例1と同様に調整した。
【0113】
SDSをコーティングした微粒子は、直径180μmのジルコニア製微粒子(東レ(株)製)10gを、ステンレス製バット(10cm×10cm×5cm)に入れ、0.1%SDS水溶液50mlを加えた。これを10分間超音波処理したのち、上清(SDS成分)を除去し、オーブンを用いて微粒子を70℃にて、12時間乾燥させて得た。なお、処理前の微粒子の表面粗さを測定したところ、表面の中心線平均粗さ(Ra値)は165nmであった。微粒子表面のRa値の測定は、その表面をAuで真空蒸着した後、走査型電子顕微鏡(株式会社エリオニクス製、型式ESA−2000)で測定した。中心線平均粗さは、観察倍率を10,000倍、カットオフ値を0とし、任意の10個について測定し、その平均値を求めた。
【0114】
比較例1(7)と同様にして、ハイブリダイゼーション反応後の発生気泡数を計数したところ、10回の評価の平均が0.3個であった(表1)。また、比較例1(8)と同様にしてバックグラウンドシグナル値のばらつき(CV値)を計算したところ、6.2%であった(表1)。
【0115】
実施例5
比較例1(3)でカバー部材を貼りつけた基板Aに、界面活性剤ポリオキシエチレン(20)ソルビタンモノラウリン酸エステル(ポリソルベート20、Tween20)をコーティングした直径180μmのジルコニア製微粒子120mgを、基板Aとカバー部材とで形成される空隙(基板A表面の凹凸構造の凹部)に注入(格納)し、その他は実施例1と同様に分析用チップを作製した。微粒子の注入は、カバー部材の貫通孔(図1、2、6に例示される貫通孔32)から行った。以上のようにして得られた分析用チップを、「分析用チップ3」とした。また、反応液については実施例1と同様に調整した。
【0116】
Tween20をコーティングした微粒子は、実施例4と同様の手順で処理を行った後、さらに、脱イオン水(ミリQ水)400mLで1回洗浄し、70℃で4時間乾燥して得た。
【0117】
比較例1(7)と同様にして、ハイブリダイゼーション反応後の発生気泡数を計数したところ、10回の評価の平均が1.3個であった(表1)。また、比較例1(8)と同様にしてバックグラウンドシグナル値のばらつき(CV値)を計算したところ、6.5%であった(表1)。
【0118】
実施例6
比較例1(3)でカバー部材を貼りつけた基板Aに、界面活性剤臭化セチルトリメチルアンモニウム(Cetyltrimethylammonium Bromide、CTAB)をコーティングした直径180μmのジルコニア製微粒子120mgを、基板Aとカバー部材とで形成される空隙(基板A表面の凹凸構造の凹部)に注入(格納)し、その他は実施例1と同様に分析用チップを作製した。微粒子の注入は、カバー部材の貫通孔(図1、2、6に例示される貫通孔32)から行った。以上のようにして得られた分析用チップを、「分析用チップ4」とした。また、反応液については実施例1と同様に調整した。
【0119】
CTABをコーティングした微粒子は、実施例4と同様の手順で処理を行った後、さらに、脱イオン水(ミリQ水)400mLで1回洗浄し、70℃で4時間乾燥して得た。
【0120】
比較例1(7)と同様にして、ハイブリダイゼーション反応後の発生気泡数を計数したところ、10回の評価の平均が3.1個であった(表1)。また、比較例1(8)と同様にしてバックグラウンドシグナル値のばらつき(CV値)を計算したところ、7.7%であった(表1)。
【0121】
実施例7
実施例4と同様に「分析用チップ2」を用い、反応液については実施例1の反応液に含まれる界面活性剤SDS濃度を0.1%から2%に増やしたものを使用した。
【0122】
比較例1(7)と同様にして、ハイブリダイゼーション反応後の発生気泡数を計数したところ、10回の評価の平均が0.2個であった(表1)。また、比較例1(8)と同様にしてバックグラウンドシグナル値のばらつき(CV値)を計算したところ、6.1%であった(表1)。
【0123】
実施例8
比較例1(5)で調製した反応液に、和光純薬工業株式会社製消泡剤“PE-L”をv/v濃度で0.05%となるよう添加したこと以外は、比較例1と同様に作製した分析用チップ1を用いた評価を実施した。
【0124】
比較例1(7)と同様にして、ハイブリダイゼーション反応後の発生気泡数を計数したところ、10回の評価の平均が6.2個であった(表1)。また、比較例1(8)と同様にしてバックグラウンドシグナル値のばらつき(CV値)を計算したところ、8.7%であった(表1)。
【0125】
実施例9
実施例4と同様に「分析用チップ2」を用い、反応液については比較例2の反応液に含まれる界面活性剤を0.1%SDSから0.1%Tween20に変更したものを使用した。
【0126】
比較例1(7)と同様にして、ハイブリダイゼーション反応後の発生気泡数を計数したところ、10回の評価の平均が0.7個であった(表1)。また、比較例1(8)と同様にしてバックグラウンドシグナル値のばらつき(CV値)を計算したところ、7.0%であった(表1)。
【0127】
実施例10
実施例4及び8と同様に「分析用チップ2」を用い、反応液については比較例2の反応液に含まれる界面活性剤を0.1%SDSから10%Tween20に変更したものを使用した。
【0128】
比較例1(7)と同様にして、ハイブリダイゼーション反応後の発生気泡数を計数したところ、10回の評価の平均が0.4個であった(表1)。 また、比較例1(8)と同様にしてバックグラウンドシグナル値のばらつき(CV値)を計算したところ、6.6%であった(表1)。
【0129】
実施例11
実施例5と同様に「分析用チップ3」を用い、反応液については比較例2の反応液に含まれる界面活性剤を0.1%SDSから0.1%Tween20に変更したものを使用した。
【0130】
比較例1(7)と同様にして、ハイブリダイゼーション反応後の発生気泡数を計数したところ、10回の評価の平均が0.5個であった(表1)。また、比較例1(8)と同様にしてバックグラウンドシグナル値のばらつき(CV値)を計算したところ、6.3%であった(表1)。
【0131】
実施例12
実施例5及び10と同様に「分析用チップ3」を用い、反応液については比較例2の反応液に含まれる界面活性剤を0.1%SDSから10%Tween20に変更したものを使用した。
【0132】
比較例1(7)と同様にして、ハイブリダイゼーション反応後の発生気泡数を計数したところ、10回の評価の平均が0.4個であった(表1)。また、比較例1(8)と同様にしてバックグラウンドシグナル値のばらつき(CV値)を計算したところ、6.1%であった(表1)。
【0133】
実施例13
比較例1(3)でカバー部材を貼りつけた基板Aに、界面活性剤Tween60をコーティングした直径180μmのジルコニア製微粒子(東レ(株)製)120mgを、基板Aとカバー部材とで形成される空隙(基板A表面の凹凸構造の凹部)に注入(格納)し、その他は実施例1と同様に分析用チップを作製した。微粒子の注入は、カバー部材の貫通孔(図1、2、6に例示される貫通孔32)から行った。以上のようにして得られた分析用チップを、「分析用チップ5」とした。
【0134】
Tween60をコーティングした微粒子は、直径180μmのジルコニア製微粒子(東レ(株)製)10gを、ステンレス製バット(10cm×10cm×5cm)に入れ、5%Tween60水溶液50mlを加えた。これを10分間超音波処理したのち、上清(Tween20成分)を除去し、オーブンを用いて微粒子を70℃にて、12時間乾燥させて得た。
【0135】
反応液については比較例2の反応液に含まれる界面活性剤を0.1%SDSから0.1%Tween60に変更したものを使用した。
【0136】
比較例1(7)と同様にして、ハイブリダイゼーション反応後の発生気泡数を計数し、10回の評価の平均値を求めたところ、0.6個であった(表1)。また、比較例1(8)と同様にしてバックグラウンドシグナル値のばらつき(CV値)を計算したところ、6.3%であった(表1)。
【0137】
実施例14
実施例13と同様に「分析用チップ5」を用い、反応液については比較例2の反応液に含まれる界面活性剤を0.1%SDSから10%Tween60に変更したものを使用した。
【0138】
比較例1(7)と同様にして、ハイブリダイゼーション反応後の発生気泡数を計数したところ、10回の評価の平均が0.4個であった(表1)。また、比較例1(8)と同様にしてバックグラウンドシグナル値のばらつき(CV値)を計算したところ、6.1%であった(表1)。
【0139】
実施例15
比較例1(3)でカバー部材を貼りつけた基板Aに、界面活性剤Tween80をコーティングした直径180μmのジルコニア製微粒子(東レ(株)製)120mgを、基板Aとカバー部材とで形成される空隙(基板A表面の凹凸構造の凹部)に注入(格納)し、その他は実施例1と同様に分析用チップを作製した。微粒子の注入は、カバー部材の貫通孔(図1、2、6に例示される貫通孔32)から行った。以上のようにして得られた分析用チップを、「分析用チップ6」とした。
【0140】
Tween80をコーティングした微粒子は、直径180μmのジルコニア製微粒子(東レ(株)製)10gを、ステンレス製バット(10cm×10cm×5cm)に入れ、5%Tween80水溶液50mlを加えた。これを10分間超音波処理したのち、上清(Tween80成分)を除去し、オーブンを用いて微粒子を70℃にて、12時間乾燥させて得た。
【0141】
反応液については比較例2の反応液に含まれる界面活性剤を0.1%SDSから0.1%Tween80に変更したものを使用した。
【0142】
比較例1(7)と同様にして、ハイブリダイゼーション反応後の発生気泡数を計数し、10回の評価の平均値を求めたところ、0.5個であった(表1)。また、比較例1(8)と同様にしてバックグラウンドシグナル値のばらつき(CV値)を計算したところ、6.3%であった(表1)。
【0143】
実施例16
実施例15と同様に「分析用チップ6」を用い、反応液については比較例2の反応液に含まれる界面活性剤を0.1%SDSから10%Tween80に変更したものを使用した。
【0144】
比較例1(7)と同様にして、ハイブリダイゼーション反応後の発生気泡数を計数したところ、10回の評価の平均が0.4個であった(表1)。また、比較例1(8)と同様にしてバックグラウンドシグナル値のばらつき(CV値)を計算したところ、5.9%であった(表1)。
【0145】
実施例17
実施例4及び9と同様に「分析用チップ2」を用い、反応液については比較例2の反応液に含まれる界面活性剤を0.1%SDSから0.1%PluronicF−68に変更したものを使用した。
【0146】
比較例1(7)と同様にして、ハイブリダイゼーション反応後の発生気泡数を計数したところ、10回の評価の平均が0.9個であった(表1)。また、比較例1(8)と同様にしてバックグラウンドシグナル値のばらつき(CV値)を計算したところ、6.8%であった(表1)。
【0147】
実施例18
比較例1(3)でカバー部材を貼りつけた基板Aに、界面活性剤PluronicF−68をコーティングした直径180μmのジルコニア製微粒子(東レ(株)製)120mgを、基板Aとカバー部材とで形成される空隙(基板A表面の凹凸構造の凹部)に注入(格納)し、その他は実施例1と同様に分析用チップを作製した。微粒子の注入は、カバー部材の貫通孔(図1、2、6に例示される貫通孔32)から行った。以上のようにして得られた分析用チップを、「分析用チップ7」とした。
【0148】
PluronicF−68をコーティングした微粒子は、直径180μmのジルコニア製微粒子(東レ(株)製)10gを、ステンレス製バット(10cm×10cm×5cm)に入れ、3%PluronicF−68水溶液50mlを加えた。これを10分間超音波処理したのち、上清(PluronicF−68成分)を除去し、オーブンを用いて微粒子を70℃にて、12時間乾燥させて得た。
【0149】
反応液については比較例2の反応液に含まれる界面活性剤を0.1%SDSから0.1%PluronicF−68に変更したものを使用した。
【0150】
比較例1(7)と同様にして、ハイブリダイゼーション反応後の発生気泡数を計数し、10回の評価の平均値を求めたところ、0.7個であった(表1)。また、比較例1(8)と同様にしてバックグラウンドシグナル値のばらつき(CV値)を計算したところ、6.8%であった(表1)。
【0151】
実施例19
実施例15と同様に「分析用チップ7」を用い、反応液については比較例2の反応液に含まれる界面活性剤を0.1%SDSから3%PluronicF−68に変更したものを使用した。
【0152】
比較例1(7)と同様にして、ハイブリダイゼーション反応後の発生気泡数を計数したところ、10回の評価の平均が0.5個であった(表1)。また、比較例1(8)と同様にしてバックグラウンドシグナル値のばらつき(CV値)を計算したところ、6.8%であった(表1)。
【0153】
実施例20
実施例4及び8と同様に「分析用チップ2」を用い、反応液については比較例2の反応液に含まれる界面活性剤を0.1%SDSから0.1%PluronicF−127に変更したものを使用した。
【0154】
比較例1(7)と同様にして、ハイブリダイゼーション反応後の発生気泡数を計数したところ、10回の評価の平均が0.7個であった(表1)。また、比較例1(8)と同様にしてバックグラウンドシグナル値のばらつき(CV値)を計算したところ、6.5%であった(表1)。
【0155】
実施例21
比較例1(3)でカバー部材を貼りつけた基板Aに、界面活性剤Pluronic F−127をコーティングした直径180μmのジルコニア製微粒子(東レ(株)製)120mgを、基板Aとカバー部材とで形成される空隙(基板A表面の凹凸構造の凹部)に注入(格納)し、その他は実施例1と同様に分析用チップを作製した。微粒子の注入は、カバー部材の貫通孔(図1、2、6に例示される貫通孔32)から行った。以上のようにして得られた分析用チップを、「分析用チップ8」とした。
【0156】
PluronicF−127をコーティングした微粒子は、直径180μmのジルコニア製微粒子(東レ(株)製)10gを、ステンレス製バット(10cm×10cm×5cm)に入れ、3%Pluronic F−127水溶液50mlを加えた。これを10分間超音波処理したのち、上清(Pluronic F−127成分)を除去し、オーブンを用いて微粒子を70℃にて、12時間乾燥させて得た。
【0157】
反応液については比較例2の反応液に含まれる界面活性剤を0.1%SDSから0.1%PluronicF−127に変更したものを使用した。
【0158】
比較例1(7)と同様にして、ハイブリダイゼーション反応後の発生気泡数を計数し、10回の評価の平均値を求めたところ、0.8個であった(表1)。また、比較例1(8)と同様にしてバックグラウンドシグナル値のばらつき(CV値)を計算したところ、6.7%であった(表1)。
【0159】
実施例22
実施例21と同様に「分析用チップ8」を用い、反応液については比較例2の反応液に含まれる界面活性剤を0.1%SDSから3%Pluronic F−127に変更したものを使用した。
【0160】
比較例1(7)と同様にして、ハイブリダイゼーション反応後の発生気泡数を計数したところ、10回の評価の平均が0.4個であった(表1)。また、比較例1(8)と同様にしてバックグラウンドシグナル値のばらつき(CV値)を計算したところ、6.3%であった(表1)。
【0161】
実施例23
実施例4及び9と同様に「分析用チップ2」を用い、反応液については比較例2の反応液に含まれる界面活性剤を0.1%SDSから0.1%TritonX−100に変更したものを使用した。
【0162】
比較例1(7)と同様にして、ハイブリダイゼーション反応後の発生気泡数を計数したところ、10回の評価の平均が1.6個であった(表1)。また、比較例1(8)と同様にしてバックグラウンドシグナル値のばらつき(CV値)を計算したところ、6.0%であった(表1)。
【0163】
実施例24
比較例1(3)でカバー部材を貼りつけた基板Aに、界面活性剤Triton X−100をコーティングした直径180μmのジルコニア製微粒子(東レ(株)製)120mgを、基板Aとカバー部材とで形成される空隙(基板A表面の凹凸構造の凹部)に注入(格納)し、その他は実施例1と同様に分析用チップを作製した。微粒子の注入は、カバー部材の貫通孔(図1、2、6に例示される貫通孔32)から行った。以上のようにして得られた分析用チップを、「分析用チップ9」とした。
【0164】
Triton X−100をコーティングした微粒子は、直径180μmのジルコニア製微粒子(東レ(株)製)10gを、ステンレス製バット(10cm×10cm×5cm)に入れ、5%Pluronic F−127水溶液50mlを加えた。これを10分間超音波処理したのち、上清(Pluronic F−127成分)を除去し、オーブンを用いて微粒子を70℃にて、12時間乾燥させて得た。
【0165】
反応液については比較例2の反応液に含まれる界面活性剤を0.1%SDSから0.1%TritonX−100に変更したものを使用した。
【0166】
比較例1(7)と同様にして、ハイブリダイゼーション反応後の発生気泡数を計数し、10回の評価の平均値を求めたところ、1.3個であった(表1)。また、比較例1(8)と同様にしてバックグラウンドシグナル値のばらつき(CV値)を計算したところ、7.2%であった(表1)。
【0167】
実施例25
実施例24と同様に「分析用チップ9」を用い、反応液については比較例2の反応液に含まれる界面活性剤を0.1%SDSから0.1%TritonX−100に変更したものを使用した。
【0168】
比較例1(7)と同様にして、ハイブリダイゼーション反応後の発生気泡数を計数したところ、10回の評価の平均が1.1個であった(表1)。また、比較例1(8)と同様にしてバックグラウンドシグナル値のばらつき(CV値)を計算したところ、5.9%であった(表1)。
【0169】
実施例26
実施例4及び9と同様に「分析用チップ2」を用い、反応液については比較例2の反応液に含まれる界面活性剤を0.1%SDSから0.1%NP−40に変更したものを使用した。
【0170】
比較例1(7)と同様にして、ハイブリダイゼーション反応後の発生気泡数を計数したところ、10回の評価の平均が2.1個であった(表1)。また、比較例1(8)と同様にしてバックグラウンドシグナル値のばらつき(CV値)を計算したところ、7.2%であった(表1)。
【0171】
実施例27
比較例1(3)でカバー部材を貼りつけた基板Aに、界面活性剤NP−40をコーティングした直径180μmのジルコニア製微粒子(東レ(株)製)120mgを、基板Aとカバー部材とで形成される空隙(基板A表面の凹凸構造の凹部)に注入(格納)し、その他は実施例1と同様に分析用チップを作製した。微粒子の注入は、カバー部材の貫通孔(図1、2、6に例示される貫通孔32)から行った。以上のようにして得られた分析用チップを、「分析用チップ10」とした。
【0172】
NP−40をコーティングした微粒子は、直径180μmのジルコニア製微粒子(東レ(株)製)10gを、ステンレス製バット(10cm×10cm×5cm)に入れ、5%0.1% NP−40水溶液50mlを加えた。これを10分間超音波処理したのち、上清(0.1% NP−40成分)を除去し、オーブンを用いて微粒子を70℃にて、12時間乾燥させて得た。
【0173】
反応液については比較例2の反応液に含まれる界面活性剤を0.1%SDSから0.1%NP−40に変更したものを使用した。
【0174】
比較例1(7)と同様にして、ハイブリダイゼーション反応後の発生気泡数を計数し、10回の評価の平均値を求めたところ、1.8個であった(表1)。また、比較例1(8)と同様にしてバックグラウンドシグナル値のばらつき(CV値)を計算したところ、6.7%であった(表1)。
【0175】
実施例28
実施例27と同様に「分析用チップ9」を用い、反応液については比較例2の反応液に含まれる界面活性剤を0.1%SDSから10%NP−40に変更したものを使用した。
【0176】
比較例1(7)と同様にして、ハイブリダイゼーション反応後の発生気泡数を計数したところ、10回の評価の平均が1.6個であった(表1)。また、比較例1(8)と同様にしてバックグラウンドシグナル値のばらつき(CV値)を計算したところ、6.9%であった(表1)。
【0177】
比較例3
比較例1(3)でカバー部材を貼りつけた基板Aに、界面活性剤CHAPSOをコーティングした直径180μmのジルコニア製微粒子(東レ(株)製)120mgを、基板Aとカバー部材とで形成される空隙(基板A表面の凹凸構造の凹部)に注入(格納)し、その他は実施例1と同様に分析用チップを作製した。微粒子の注入は、カバー部材の貫通孔(図1、2、6に例示される貫通孔32)から行った。以上のようにして得られた分析用チップを、「分析用チップ11」とした。
【0178】
CHAPSOをコーティングした微粒子は、直径180μmのジルコニア製微粒子(東レ(株)製)10gを、ステンレス製バット(10cm×10cm×5cm)に入れ、1%CHAPSO水溶液50mlを加えた。これを10分間超音波処理したのち、上清(CHAPSO成分)を除去し、オーブンを用いて微粒子を70℃にて、12時間乾燥させて得た。
【0179】
反応液については比較例2の反応液に含まれる界面活性剤を0.1%SDSから0.1%CHAPSOに変更したものを使用した。
【0180】
比較例1(7)と同様にして、ハイブリダイゼーション反応後の発生気泡数を計数し、10回の評価の平均値を求めたところ、2.0個であった(表1)。また、比較例1(8)と同様にしてバックグラウンドシグナル値のばらつき(CV値)を計算したところ、9.0%であった(表1)。
【0181】
比較例4
比較例3と同様に「分析用チップ11」を用い、反応液については比較例2の反応液に含まれる界面活性剤を0.1%SDSから1%CHAPSOに変更したものを使用した。
【0182】
比較例1(7)と同様にして、ハイブリダイゼーション反応後の発生気泡数を計数したところ、10回の評価の平均が4.5個であった(表1)。また、比較例1(8)と同様にしてバックグラウンドシグナル値のばらつき(CV値)を計算したところ、8.1%であった(表1)。
【0183】
【表1−1】

【0184】
【表1−2】

【0185】
【表1−3】

【0186】
以上の実施例1〜28、比較例1〜4の結果から、該チップと検体との反応液が消泡剤、又は非イオン系界面活性剤を含有させることによって、気泡の発生が抑制されてデータのばらつき(バックグラウンドシグナルのCV値)を低減できること、また検体溶液の脱気処理及びビーズ表面の界面活性剤処理と組み合わせることにより、さらに効果的に気泡の発生を抑制できることがわかった。
【産業上の利用可能性】
【0187】
本発明は、検体と選択的に結合する選択結合性物質を固定化した基板を備え、微粒子によって検体溶液を攪拌することのできる分析用チップにおいて、検出感度のばらつきを抑え、高感度の検出を可能とするものである。本発明は、特に医薬・医療分野における様々な生体関連物質の検出等のための分析用チップとして有用であり、その他、食品、環境分野における微量物質の検出のための分析用チップとしても有用である。
【図面の簡単な説明】
【0188】
【図1】図1は、本発明の分析用チップを構成する選択結合性物質が固定化された基板の一例を概略的に示す断面図である。
【図2】図2は、図1の基板の使用により、基板表面に気泡が発生した例を概略的に示す断面図である。
【図3】図3は、本発明の分析用チップを構成する選択結合性物質が固定化された基板の一例を概略的に示す斜視図である。
【図4】図4は、図3の本発明の分析用チップを構成する選択結合性物質が固定化された基板の一例を概略的に示す断面図である。
【図5】図5は、本発明の分析用チップの凹凸部、カバー部材及び微粒子の好ましい関係の一例を概略的に示す斜視図である。
【図6】図6は、本発明の分析用チップの凹凸部、カバー部材及び微粒子の好ましい関係の一例を概略的に示す縦断面図である。
【符号の説明】
【0189】
1 基板
2 微粒子
3 カバー部材
10 凹部
11 凸部
12 選択結合性物質が固定化された領域(凹凸部)
13 平坦部
26 発生した気泡の例
30 接着部材
30A 仕切り構造の接着部材
32 貫通孔
33 液面駐止用チャンバー
34 封止部材(テープ)
45 基板に固定化された選択結合性物質
L1 凸部ピッチ
【特許請求の範囲】
【請求項1】
選択結合性物質が表面に固定化された基板と、該基板と接着されたカバー部材とを備え、該基板と該カバー部材との間に空隙を有し、該空隙に微粒子が移動可能に格納された分析用チップであって、該空隙に該選択結合性物質と検体の結合反応のための反応液であって消泡剤及び/又は非イオン界面活性剤を含有する反応液を保持する分析用チップ。
【請求項2】
前記消泡剤が、ポリエーテル系消泡剤又はシリコーン系消泡剤である請求項1に記載の分析用チップ。
【請求項3】
前記微粒子の表面に界面活性剤がコーティングされている、請求項1又は2に記載の分析用チップ。
【請求項4】
前記界面活性剤が陰イオン界面活性剤又は非イオン界面活性剤である、請求項3に記載の分析用チップ。
【請求項5】
前記基板が、その表面に凹部及び凸部からなる凹凸部を有し、該凸部の上端面に選択結合性物質が固定化された基板である、請求項1〜4のいずれか一項に記載の分析用チップ。
【請求項6】
前記カバー部材が前記空隙に連通する1つ以上の貫通孔を有する、請求項1〜5のいずれか一項に記載の分析用チップ。
【請求項7】
前記基板の選択結合性物質固定化面とカバー部材との間隔の最短距離が、微粒子の直径未満である請求項1〜6のいずれか一項に記載の分析用チップ。
【請求項8】
前記選択結合性物質が、DNA、RNA、蛋白質、ペプチド、糖、糖鎖又は脂質である、請求項1〜7のいずれか一項に記載の分析用チップ。
【請求項9】
選択結合性物質が表面に固定化された基板と、該基板と接着されたカバー部材とを備え、該基板と該カバー部材との間に空隙を有し、該空隙に微粒子が移動可能に格納された分析用チップと、該選択結合性物質と検体の結合反応のための反応液であって消泡剤及び/又は非イオン界面活性剤を含有する反応液を含む分析用キット。
【請求項1】
選択結合性物質が表面に固定化された基板と、該基板と接着されたカバー部材とを備え、該基板と該カバー部材との間に空隙を有し、該空隙に微粒子が移動可能に格納された分析用チップであって、該空隙に該選択結合性物質と検体の結合反応のための反応液であって消泡剤及び/又は非イオン界面活性剤を含有する反応液を保持する分析用チップ。
【請求項2】
前記消泡剤が、ポリエーテル系消泡剤又はシリコーン系消泡剤である請求項1に記載の分析用チップ。
【請求項3】
前記微粒子の表面に界面活性剤がコーティングされている、請求項1又は2に記載の分析用チップ。
【請求項4】
前記界面活性剤が陰イオン界面活性剤又は非イオン界面活性剤である、請求項3に記載の分析用チップ。
【請求項5】
前記基板が、その表面に凹部及び凸部からなる凹凸部を有し、該凸部の上端面に選択結合性物質が固定化された基板である、請求項1〜4のいずれか一項に記載の分析用チップ。
【請求項6】
前記カバー部材が前記空隙に連通する1つ以上の貫通孔を有する、請求項1〜5のいずれか一項に記載の分析用チップ。
【請求項7】
前記基板の選択結合性物質固定化面とカバー部材との間隔の最短距離が、微粒子の直径未満である請求項1〜6のいずれか一項に記載の分析用チップ。
【請求項8】
前記選択結合性物質が、DNA、RNA、蛋白質、ペプチド、糖、糖鎖又は脂質である、請求項1〜7のいずれか一項に記載の分析用チップ。
【請求項9】
選択結合性物質が表面に固定化された基板と、該基板と接着されたカバー部材とを備え、該基板と該カバー部材との間に空隙を有し、該空隙に微粒子が移動可能に格納された分析用チップと、該選択結合性物質と検体の結合反応のための反応液であって消泡剤及び/又は非イオン界面活性剤を含有する反応液を含む分析用キット。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】




【図2】


【図3】


【図4】


【図5】


【図6】


【公開番号】特開2010−8391(P2010−8391A)
【公開日】平成22年1月14日(2010.1.14)
【国際特許分類】
【出願番号】特願2008−190086(P2008−190086)
【出願日】平成20年7月23日(2008.7.23)
【出願人】(000003159)東レ株式会社 (7,677)
【Fターム(参考)】
【公開日】平成22年1月14日(2010.1.14)
【国際特許分類】
【出願日】平成20年7月23日(2008.7.23)
【出願人】(000003159)東レ株式会社 (7,677)
【Fターム(参考)】
[ Back to top ]

