分析用デバイス
【課題】分析試薬が飛散しない分析試薬を有する分析用デバイスを提供することを目的とする。
【解決手段】遠心力と毛細管力で分析試料を移送し、反応部で分析試薬と分析試料とを攪拌して分析を行う分析用デバイスであって、分析試薬18aにはブロッキング用タンパク質が添加されていることを特徴とする。
【解決手段】遠心力と毛細管力で分析試料を移送し、反応部で分析試薬と分析試料とを攪拌して分析を行う分析用デバイスであって、分析試薬18aにはブロッキング用タンパク質が添加されていることを特徴とする。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、生物などから採取した液体の分析に使用する分析用デバイスに関するものであり、具体的には、遠心力と毛細管力で分析試料を移送し、反応部で分析試薬と前記分析試料とを攪拌して分析を行う技術に関する。
【背景技術】
【0002】
生物学的試料中の任意の物質を定量する分析装置の中で、試薬を乾燥した状態で安定化させた試験片を用いて、測定時に生物学的試料によって液相を生じさせ反応が行われるドライケミストリーシステムが知られている。ドライケミストリーシステムの特長としては、分離操作や反応セルを用いる必要がなく簡単に測定できること、さらに分析試薬の保存安定性が優れており室温でも保存できることなどが挙げられる。
【0003】
分析試薬の乾燥方法であるが、
・ 試薬をニトロセルロース、ガラス繊維濾紙など任意の多孔質性担体に染込ませ固定化乾燥させる方法、
・ 試薬を凍結乾燥させ、試薬が保持できる構成のチャンバーに置く方法、
・ 試薬を基盤上に直接に塗布し乾燥させる方法
がある。特許文献1では、遠心分離機内の血液試料の分析用の組成物および乾燥試薬の製造方法に関して記載されており、乾燥方法として凍結乾燥が採用されている。製造された球状試薬は、代表的には約10秒より短い時間で、迅速に、かつ完全に溶液中に溶解することが記載されている。
【先行技術文献】
【特許文献】
【0004】
【特許文献1】特開2001−272394号公報
【特許文献2】特開2009−92390号公報
【発明の概要】
【発明が解決しようとする課題】
【0005】
しかしながら、凍結試薬の中には高湿度環境に置かれるなどした場合、即時に収縮してしまい溶解性が悪化するものがある。
さらには、球状試薬は、所望の試薬(1種または2種以上)の水溶性液を調製し、この水溶性溶液の正確に測量されている滴を冷凍剤中に分散させ、次いでこの冷凍された滴を凍結乾燥させることによって生成されるので、製造工程が複雑である。また微少担持が困難である。
【0006】
液状試薬を基盤上に直接に塗布し乾燥させる方法は、多孔質性担体を必要とせず、チャンバー形状の工夫も必要としないため使い勝手がよく、また自然乾燥させるため製造工程が簡素化できるが、潮解性の高い試薬を含む乾燥試薬が高湿度条件に曝されると液状化するので、特許文献2に見られるように、遠心力と毛細管力で分析試料を移送し、反応部で分析試薬と前記分析試料とを攪拌して分析を行う分析用デバイスにおいて分析試薬とした場合には、分析試薬が所定の場所から遠心力によって飛散するという問題を有している。
【0007】
なお、ここでいう潮解性とは、湿気をもつ環境におかれた物質が空気中の水(水蒸気)を取り込んで自発的に水溶液となる性質のことである。
本発明は、前記従来の課題を解決するもので、分析試薬が所定の場所から飛散しない組成の分析試薬を有する分析用デバイスを提供することを目的とする。
【課題を解決するための手段】
【0008】
本発明の分析用デバイスは、遠心力と毛細管力で分析試料を移送し、反応部で分析試薬と前記分析試料とを攪拌して分析を行う分析用デバイスであって、前記分析試薬にはブロッキング用タンパク質が添加されていることを特徴とする。
【0009】
前記分析試薬は乾燥状態で配置されている。具体的には、前記分析試薬は塗布した液体を風乾で乾燥されていることを特徴とする。
また、添加される前記ブロッキング用タンパク質は、親水/疎水率が0.6付近で構成されるタンパク質であることを特徴とする。更に具体的には、前記ブロッキング用タンパク質は、BPF−301(Blocking Peptide Fragment)を0.1重量%〜10重量%含有していることを特徴とする。
【発明の効果】
【0010】
本発明の分析用デバイスの分析試薬には、ブロッキング用タンパク質が添加されており、この試薬組成によれば、乾燥状態で保持されている分析試薬が、高湿度条件にさらされたとしても、該試薬が所定の場所から飛散することが解消され、それにともなう不具合が発生せずに精度よく分析できる。
【図面の簡単な説明】
【0011】
【図1】本発明の実施の形態1における分析用デバイスを使用する分析装置の構成図
【図2】分析装置の回転駆動部とこれにセットされた分析用デバイスの外観斜視図
【図3】同実施の形態の分析用デバイスの内部の構造図
【図4】親水/疎水率とブロッキング能と試薬潮解への効果を示す実験結果説明図
【図5】同実施の形態におけるトリグリセリド測定試薬のトリグリセリド濃度依存性をブロッキング用タンパク質を添加したときと添加していないときで比較した説明図
【発明を実施するための形態】
【0012】
以下、本発明の分析用デバイスを図1〜図5に基づいて説明する。
(実施の形態1)
図1と図2は分析用デバイスがセットされる分析装置を示す。
【0013】
分析装置1は、分析用デバイス2を回転させる回転駆動部3と、光源4と、光検出部5と、光検出部5の検出結果を処理する処理部6とを備えている。
分析試料をセットした分析用デバイス2は回転駆動部3に装着される。回転駆動部3が分析用デバイス2を矢印Rの方向に軸心周りに回転させることにより、分析用デバイス2に遠心力をかけ、この遠心力と分析用デバイス2内に配置された連絡流路(図3を参照)に働く毛細管力とを合わせることで、分析用デバイス2内に収容される分析試料の移動を制御することができる。分析用デバイス2内の分析試料の流れの状態、化学的な状態は、光源4から照射される光7に対する分析試料の光吸収特性を光検出部5で測定することによって検出することができる。
【0014】
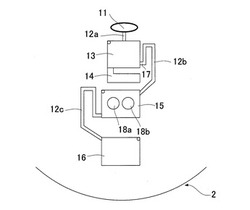
分析用デバイス2の内部は、図3に示すように構成されている。
分析用デバイス2はその軸心側から外周側との間に、分析試料を注入するための注入口11と、注入口11より外周側に配置され注入口11と移送用流路12aで連結されたチャンバー13と、チャンバー13と移送用流路12bの連結口17より外側に配置されたチャンバー14と、チャンバー13より外周側に配置されチャンバー13と移送用流路12bで連結されたチャンバー15と、チャンバー15より外周側に配置されチャンバー15と移送用流路12cで連結されたチャンバー16が設けられている。チャンバー13,14,15,16は、それぞれ、0.5〜5マイクロリットルの容量を有する。
【0015】
このうち、チャンバー15には分析試料の分析に必要な第一試薬18a,第二試薬18bが乾燥状態で保持されている。
分析試料を測定する具体的な分析方法を説明する。
【0016】
まず、5マイクロリットルの分析試料を分析用デバイス2の注入口11より注入する。
この分析試料がセットされた分析用デバイス2を図2に示すように回転駆動部3に装着する。
【0017】
回転駆動部3により分析用デバイスを矢印Rの方向に軸心周りに遠心力1800Gで約1分間回転させることにより、注入口11より注入された分析試料を、チャンバー13へ移送させると同時にチャンバー14へ血球など分析に不必要な固形成分を分離させる。
【0018】
回転を停止させると、分析に必要な液体成分は毛細管力によって移送用流路12bを通り、エアーバルブとして機能しているチャンバー15への出口手前で停止する。約30秒間回転を停止した後、分析用デバイス2を矢印Rの方向に軸心周りに遠心力1200Gで約1分間回転させることにより、前記液体成分はサイフォンの原理でチャンバー15へ移送用流路12bを通り一気に流入し、あらかじめ乾燥状態で保持された第一試薬18a,第二試薬18bが前記液体成分中に溶解する。
【0019】
分析用デバイス2の前記回転を停止させると、前記液体成分は毛細管力によって移送用流路12cを通り、エアーバルブとして機能しているチャンバー16への出口手前で停止する。
【0020】
約10秒間回転を停止した後、分析用デバイス2を矢印Rの方向に軸心周りに遠心力1200Gで回転させることにより、チャンバー15にある前記液体成分はサイフォンの原理で移送用流路12cを通りチャンバー16へ一気に流入する。
【0021】
光源4から照射される光7はチャンバー16を透過し、光検出部5で得られた光量から処理部6にて分析試料中の分析対象物の測定値を算出する。
第一試薬18a,第二試薬18bの組成を具体的に説明する。
【0022】
注入口11より分析試料として血液を注入し、血液中の総コレステロール、トリグリセリド、HDLコレステロール、ALT、ASTなどを分析対象物として測定する場合などの例えば、トリグリセリドの分析に必要な試薬組成を例に挙げて説明する。
【0023】
(比較例1)
− 第一試薬18a −
GYD-301(グリセロールデヒドロゲナーゼ、東洋紡績製)・・720u/ml
LPL-311(リポプロテインリパーゼ、東洋紡績製)・・・・・・96u/ml
DAD-301(ジアホラーゼ、東洋紡績製)・・・・・・・・・・120u/ml
Tricine-NaOH pH8.5 ・・・・・・・・・・・・300mM
− 第二試薬18b −
WST−8(同仁化学製)・・・・・・・・・・・・・・・・・・・35mM
NAD+(オリエンタル酵母製)・・・・・・・・・・・・・・・・30mM
第一試薬18aはトリグリセリドの反応に必要な酵素および緩衝液を含み、第二試薬18bは、比色法で測定するための色素および電子メディエーターを含む。上記試薬を混合して1つにまとめると、ブランク反応により徐々に呈色するので、測定までは第一試薬18aと第二試薬18bに分けてチャンバー15に塗布、乾燥する必要がある。
【0024】
第一試薬18aの調製方法の一例を説明する。
GYD-301の凍結乾燥品を純水で溶解させ2880u/mlの溶液を調製し、LPL-311の凍結乾燥品を純水で溶解させ384u/mlの溶液を調製し、DAD-301の凍結乾燥品を純水で溶解させ480u/mlの溶液を調製し、既知の方法でTricine-NaOH pH8.5 1200mMを調製したあと、以上4試薬を等量ずつ混合させる。第二試薬18bも同様の方法で調製できる。
【0025】
チャンバー15への試薬塗布乾燥プロセスの一例を説明する。
液状の第一試薬18aをチャンバー15の所定の場所に1.2マイクロリットル塗布し、さらに、チャンバー15の第一試薬18aを塗布した場所とは別の場所に液状の第二試薬18bを1.2マイクロリットル塗布し、これらを風乾させる。
【0026】
風乾の条件は限定されないが、本検討では、温度25℃、湿度30%の環境下、1時間放置して乾燥させた。
この分析用デバイス2を温度40℃、湿度80%の環境下に30分放置させると、第一試薬18aは潮解性をもつ水酸化ナトリウムを含むため、水分を吸収することによって乾燥状態から液状に変化する。第二試薬18bに関しては潮解性を示さなかった。
【0027】
温度40℃、湿度80%の環境下で比較例1の分析用デバイス2を用いた場合、分析用デバイス2を遠心力1800Gで約1分間回転させることにより、第一試薬18aが遠心力方向へ飛散し、測定精度に影響を与えた。
【0028】
(実施例1)
比較例1の課題を解決するため鋭意検討した結果、比較例1の第一試薬18a,第二試薬18bのどちらか一方または両方に、ブロッキング用たんぱく質を添加することによって高湿度環境下でも試薬の飛散を防止でき、試薬の固定化技術として有用である。
【0029】
ここでいうブロッキングとは、容器や担体などへの成分の非特異的吸着を妨げることを言い、特にプラスチックなどの樹脂へのタンパク質の非特異的吸着を妨げることをいう。様々な測定において、測定対象の成分が非特異的に器壁に吸着することにより、バックグラウンドとして測定を妨げることが問題となる。特に免疫学的測定において、抗体のポリスチレンプレートへの吸着は顕著であり、通常、あらかじめ樹脂等に吸着しやすいタンパク質を添加して、抗体の非特異的吸着を妨げる操作、すなわちブロッキングを行うことが広く行われている。ブロッキング能を示すには、タンパク質分子の中の比較的疎水的な領域に加え、親水的な領域が必要であるということが条件になっていることが知られている。
【0030】
潮解性を持つ試薬にブロッキング用タンパク質を添加することによって、ブロッキング用タンパク質の親水的な領域が、潮解性を持つ試薬のうち水を取り込む物質と結合し、疎水的な領域が水を取り込む物質と空気中の水(水蒸気)との接触を阻害し、結果として試薬の液状化を防止できるということが推察される。
【0031】
ブロッキング用タンパク質としては、ウシ血清アルブミン(BSA)、ウシ由来カゼインや、東洋紡績製のBPF−301(Blocking Peptide Fragment)について検討を行った。それぞれのタンパク質全体の親水/疎水率は図4に示すように、BSAは0.90、ウシ由来αカゼインは0.76、BPF−301は0.64であって、添加される前記ブロッキング用タンパク質は、親水/疎水率が0.6付近で構成されるタンパク質が好ましい。具体的には、親水/疎水率が0.5より大きく0.7以下で構成されるタンパク質が使用可能である。
【0032】
ここでいう「親水/疎水率」を説明する。
タンパク質のアミノ酸配列のうち、アスパラギン酸、グルタミン酸、リジン、ヒスチジン、アルギニン、チロシンを親水性アミノ酸として定義し、また、グリシン、アラニン、バリン、ロイシン、イソロイシン、メチオニン、フェニルアラニン、トリプトファン、プロリンを疎水性アミノ酸として定義した場合に、タンパク質の親疎水性を数値化するために、親水性アミノ酸含有率を疎水性アミノ酸含有率で割った値を「親水/疎水率」と定義する。
【0033】
この実施例1では、比較例1の第一試薬18aの試薬組成を以下に変更して、その効果の検討を行った。
− 第一試薬18aの改良品 −
GYD-301(グリセロールデヒドロゲナーゼ、東洋紡績製)・・720u/ml
LPL-311(リポプロテインリパーゼ、東洋紡績製)・・・・・・96u/ml
DAD-301(ジアホラーゼ、東洋紡績製)・・・・・・・・・・120u/ml
Tricine-NaOH pH8.5 ・・・・・・・・・・・・・300mM
ブロッキング用タンパク質・・・・・・・・・・・・・0.1〜2.0%(w/w)
第一試薬18aの改良品の調製方法の一例を説明する。
【0034】
まず、ブロッキング用タンパク質の凍結乾燥品を純水で溶解させ0.1%から2.0%(w/w)の範囲における特定の濃度のブロッキング用タンパク質溶液を調製し、GYD-301の凍結乾燥品を前記ブロッキング用タンパク質溶液で溶解させ2880u/mlの溶液を調製し、LPL-311の凍結乾燥品を前記ブロッキング用タンパク質溶液で溶解させ384u/mlの溶液を調製し、DAD-301の凍結乾燥品を前記ブロッキング用タンパク質溶液で溶解させ480u/mlの溶液を調製し、既知の方法で純水の代わりにブロッキング用タンパク質溶液を用いてTricine-NaOH pH8.5 1200mMを調製したあと、以上4試薬を等量ずつ混合させる。
【0035】
第一試薬18aの改良品をチャンバー15に1.2マイクロリットルだけ塗布し充分に自然乾燥(風乾)させたあと、40℃、80%条件で30分放置した。遠心治具を用いて遠心力を1分間かけて試薬の状態を目視チェックした。
【0036】
ブロッキング用タンパク質を添加しない場合(比較例1)においては、1070Gまでは試薬の飛散が認められなかったものの、1250G以上になると飛散したのに対して、BSAを1.5%添加した実施例1の場合には、1250Gまでは試薬の飛散が認められず、効果があることが示された。しかしながら、1600G以上になるとBSAを2.0%添加しても試薬は飛散した。BSAを2.0%以上添加した場合は、試薬反応の感度が低下し精度も悪化した。
【0037】
カゼインを0.5%添加した実施例1の場合、1250Gまでは試薬の飛散が認められず、効果があることが示された。しかしながら、1600G以上になると試薬は飛散した。カゼインを1.0%以上添加した場合は、試薬反応の感度が低下し精度も悪化した。
【0038】
BPF−301を添加した実施例1の場合、0.5%添加することによって1250Gまでは試薬の飛散が認められなかった。また、1.0%添加することによって1800G以上でも試薬の飛散が認められず、非常に効果が高いことが示された。
【0039】
比較例として、ブロッキング能が備わっていないPseudomonas由来リパーゼを2.0%添加したが1250G以上になると飛散した。Pseudomonas由来リパーゼの親水/疎水率は、0.41であり、疎水性が大きすぎても効果が発揮されないことが分かった。
【0040】
このように、潮解性を持つ試薬にブロッキング用タンパク質を添加することにより、高湿度環境下に放置された場合でも試薬の液状化を防止し、遠心力による試薬の飛散を防止することができる。親水/疎水率と試薬潮解への効果を図4にまとめた。
【0041】
潮解への効果として、試薬の飛散を確認する実験で、1800G以上で回転させたときにも飛散を防止したタンパク質を○、1800G以上で回転させたときには飛散するものの、1250Gで回転させたときに飛散を防止したタンパク質を△、1250Gで回転させたときに試薬飛散したタンパク質を×と表記した。したがって、ブロッキング用タンパク質は試薬飛散防止機能をもち、特にBPF−301は飛散防止機能に優れていることが分かった。BPF−301では0.1重量%〜10重量%含有させた場合に良好な結果が得られた。
【0042】
(実施の形態2)
この実施の形態2では、潮解性を持つ試薬にブロッキング用タンパク質を添加することにより、高湿度環境下に放置された場合でも試薬の液状化を防止し、遠心力による試薬の飛散を防止することができるが、ブロッキング用タンパク質が試薬反応に悪影響を及ぼさないかどうかを確認した。
【0043】
例としてトリグリセリドの分析におけるBPF−301の試薬反応への影響を確認した。
下記の組成からなるトリグリセリド用分析試薬を調製した。
【0044】
(実施例2)
− 試薬組成1の第一試薬18a −
GYD-301(グリセロールデヒドロゲナーゼ、東洋紡績製)・・720u/ml
LPL-311(リポプロテインリパーゼ、東洋紡績製)・・・・・・96u/ml
DAD-301(ジアホラーゼ、東洋紡績製)・・・・・・・・・・120u/ml
Tricine-NaOH pH8.5 ・・・・・・・・・・・・300mM
BPF−301(東洋紡績製)・・・・・・・・・・・・・・・・・・2.0%
− 試薬組成1の第二試薬18b −
WST−8(同仁化学製)・・・・・・・・・・・・・・・・・・・35mM
NAD+(オリエンタル酵母製)・・・・・・・・・・・・・・・・30mM
(比較例2)
比較例2として、以下の組成からなるトリグリセリド用分析試薬を調製した。
【0045】
− 試薬組成2の第一試薬18a −
GYD-301(グリセロールデヒドロゲナーゼ、東洋紡績製)・・720u/ml
LPL-311(リポプロテインリパーゼ、東洋紡績製)・・・・・・96u/ml
DAD-301(ジアホラーゼ、東洋紡績製)・・・・・・・・・・120u/ml
Tricine−NaOH pH8.5 ・・・・・・・・・・・・・・・300mM
− 試薬組成2の第二試薬18b −
WST−8(同仁化学製)・・・・・・・・・・・・・・・・・・・35mM
NAD+(オリエンタル酵母製)・・・・・・・・・・・・・・・・30mM
本発明の実施例2の試薬組成1、比較例2の試薬組成2の試薬を用いて、PBS溶液およびヒト血漿中のトリグリセリド濃度に依存した吸光度を次のようにして測定した。
【0046】
先ず、第一試薬18aを12μl、第二試薬18b12μlを同一容器内に塗布し、温度25℃、湿度30%の環境化で12時間放置することによって乾燥を行った。乾燥後、前記容器内にPBS溶液およびヒト血漿を60μl加え、攪拌することによって乾燥状態の第一試薬18a、第二試薬18bを溶解させた。前記容器を37℃恒温槽内に3分間放置することによって反応を行った。光路長600μmにて波長460nmの光量を測光することによって、吸光度を求めた。それぞれのトリグリセリド濃度依存性を図5にグラフ化した。
【0047】
この図5から明らかなように、本発明の実施例2の試薬組成1と比較例2の試薬組成2を比較して、測定値に大きな乖離が認められないため、BPF−301を2.0%添加した場合でもトリグリセリドの反応性に影響を及ぼすことはないことが確認された。
【0048】
上記の各実施例では、第一試薬18a,第二試薬18bのうちの潮解性が高い第一試薬18aにブロッキング用タンパク質を含有させたが、測定する分析対象物によって必要とされる試薬が複数あって、それぞれが潮解性が高い場合には、全部の試薬にブロッキング用タンパク質を含有させてもよい。
【0049】
また、乾燥方法として風乾を採用したことによって、凍結乾燥によって製造する場合に比べて製造工程を簡素化できる。なお、出来上がった分析用デバイスの試薬を見てブロッキング用タンパク質を含有させて風乾させた実施品は、凍結乾燥されたものとは異なり平面状に薄く広がった仕上がりになり、風乾された試薬か凍結乾燥された試薬か乾燥方法を区別できる。
【産業上の利用可能性】
【0050】
本発明は、分析用デバイスにおける試薬の固定化技術として有用であり、分析精度の向上に寄与する。
【符号の説明】
【0051】
1 分析装置
2 分析用デバイス
3 回転駆動部
4 光源
5 光検出部
6 処理部
7 光
11 注入口
12a,12b,12c 移送用流路
13,14,15,16 チャンバー
17 連結口
18a 第一試薬
18b 第二試薬
【技術分野】
【0001】
本発明は、生物などから採取した液体の分析に使用する分析用デバイスに関するものであり、具体的には、遠心力と毛細管力で分析試料を移送し、反応部で分析試薬と前記分析試料とを攪拌して分析を行う技術に関する。
【背景技術】
【0002】
生物学的試料中の任意の物質を定量する分析装置の中で、試薬を乾燥した状態で安定化させた試験片を用いて、測定時に生物学的試料によって液相を生じさせ反応が行われるドライケミストリーシステムが知られている。ドライケミストリーシステムの特長としては、分離操作や反応セルを用いる必要がなく簡単に測定できること、さらに分析試薬の保存安定性が優れており室温でも保存できることなどが挙げられる。
【0003】
分析試薬の乾燥方法であるが、
・ 試薬をニトロセルロース、ガラス繊維濾紙など任意の多孔質性担体に染込ませ固定化乾燥させる方法、
・ 試薬を凍結乾燥させ、試薬が保持できる構成のチャンバーに置く方法、
・ 試薬を基盤上に直接に塗布し乾燥させる方法
がある。特許文献1では、遠心分離機内の血液試料の分析用の組成物および乾燥試薬の製造方法に関して記載されており、乾燥方法として凍結乾燥が採用されている。製造された球状試薬は、代表的には約10秒より短い時間で、迅速に、かつ完全に溶液中に溶解することが記載されている。
【先行技術文献】
【特許文献】
【0004】
【特許文献1】特開2001−272394号公報
【特許文献2】特開2009−92390号公報
【発明の概要】
【発明が解決しようとする課題】
【0005】
しかしながら、凍結試薬の中には高湿度環境に置かれるなどした場合、即時に収縮してしまい溶解性が悪化するものがある。
さらには、球状試薬は、所望の試薬(1種または2種以上)の水溶性液を調製し、この水溶性溶液の正確に測量されている滴を冷凍剤中に分散させ、次いでこの冷凍された滴を凍結乾燥させることによって生成されるので、製造工程が複雑である。また微少担持が困難である。
【0006】
液状試薬を基盤上に直接に塗布し乾燥させる方法は、多孔質性担体を必要とせず、チャンバー形状の工夫も必要としないため使い勝手がよく、また自然乾燥させるため製造工程が簡素化できるが、潮解性の高い試薬を含む乾燥試薬が高湿度条件に曝されると液状化するので、特許文献2に見られるように、遠心力と毛細管力で分析試料を移送し、反応部で分析試薬と前記分析試料とを攪拌して分析を行う分析用デバイスにおいて分析試薬とした場合には、分析試薬が所定の場所から遠心力によって飛散するという問題を有している。
【0007】
なお、ここでいう潮解性とは、湿気をもつ環境におかれた物質が空気中の水(水蒸気)を取り込んで自発的に水溶液となる性質のことである。
本発明は、前記従来の課題を解決するもので、分析試薬が所定の場所から飛散しない組成の分析試薬を有する分析用デバイスを提供することを目的とする。
【課題を解決するための手段】
【0008】
本発明の分析用デバイスは、遠心力と毛細管力で分析試料を移送し、反応部で分析試薬と前記分析試料とを攪拌して分析を行う分析用デバイスであって、前記分析試薬にはブロッキング用タンパク質が添加されていることを特徴とする。
【0009】
前記分析試薬は乾燥状態で配置されている。具体的には、前記分析試薬は塗布した液体を風乾で乾燥されていることを特徴とする。
また、添加される前記ブロッキング用タンパク質は、親水/疎水率が0.6付近で構成されるタンパク質であることを特徴とする。更に具体的には、前記ブロッキング用タンパク質は、BPF−301(Blocking Peptide Fragment)を0.1重量%〜10重量%含有していることを特徴とする。
【発明の効果】
【0010】
本発明の分析用デバイスの分析試薬には、ブロッキング用タンパク質が添加されており、この試薬組成によれば、乾燥状態で保持されている分析試薬が、高湿度条件にさらされたとしても、該試薬が所定の場所から飛散することが解消され、それにともなう不具合が発生せずに精度よく分析できる。
【図面の簡単な説明】
【0011】
【図1】本発明の実施の形態1における分析用デバイスを使用する分析装置の構成図
【図2】分析装置の回転駆動部とこれにセットされた分析用デバイスの外観斜視図
【図3】同実施の形態の分析用デバイスの内部の構造図
【図4】親水/疎水率とブロッキング能と試薬潮解への効果を示す実験結果説明図
【図5】同実施の形態におけるトリグリセリド測定試薬のトリグリセリド濃度依存性をブロッキング用タンパク質を添加したときと添加していないときで比較した説明図
【発明を実施するための形態】
【0012】
以下、本発明の分析用デバイスを図1〜図5に基づいて説明する。
(実施の形態1)
図1と図2は分析用デバイスがセットされる分析装置を示す。
【0013】
分析装置1は、分析用デバイス2を回転させる回転駆動部3と、光源4と、光検出部5と、光検出部5の検出結果を処理する処理部6とを備えている。
分析試料をセットした分析用デバイス2は回転駆動部3に装着される。回転駆動部3が分析用デバイス2を矢印Rの方向に軸心周りに回転させることにより、分析用デバイス2に遠心力をかけ、この遠心力と分析用デバイス2内に配置された連絡流路(図3を参照)に働く毛細管力とを合わせることで、分析用デバイス2内に収容される分析試料の移動を制御することができる。分析用デバイス2内の分析試料の流れの状態、化学的な状態は、光源4から照射される光7に対する分析試料の光吸収特性を光検出部5で測定することによって検出することができる。
【0014】
分析用デバイス2の内部は、図3に示すように構成されている。
分析用デバイス2はその軸心側から外周側との間に、分析試料を注入するための注入口11と、注入口11より外周側に配置され注入口11と移送用流路12aで連結されたチャンバー13と、チャンバー13と移送用流路12bの連結口17より外側に配置されたチャンバー14と、チャンバー13より外周側に配置されチャンバー13と移送用流路12bで連結されたチャンバー15と、チャンバー15より外周側に配置されチャンバー15と移送用流路12cで連結されたチャンバー16が設けられている。チャンバー13,14,15,16は、それぞれ、0.5〜5マイクロリットルの容量を有する。
【0015】
このうち、チャンバー15には分析試料の分析に必要な第一試薬18a,第二試薬18bが乾燥状態で保持されている。
分析試料を測定する具体的な分析方法を説明する。
【0016】
まず、5マイクロリットルの分析試料を分析用デバイス2の注入口11より注入する。
この分析試料がセットされた分析用デバイス2を図2に示すように回転駆動部3に装着する。
【0017】
回転駆動部3により分析用デバイスを矢印Rの方向に軸心周りに遠心力1800Gで約1分間回転させることにより、注入口11より注入された分析試料を、チャンバー13へ移送させると同時にチャンバー14へ血球など分析に不必要な固形成分を分離させる。
【0018】
回転を停止させると、分析に必要な液体成分は毛細管力によって移送用流路12bを通り、エアーバルブとして機能しているチャンバー15への出口手前で停止する。約30秒間回転を停止した後、分析用デバイス2を矢印Rの方向に軸心周りに遠心力1200Gで約1分間回転させることにより、前記液体成分はサイフォンの原理でチャンバー15へ移送用流路12bを通り一気に流入し、あらかじめ乾燥状態で保持された第一試薬18a,第二試薬18bが前記液体成分中に溶解する。
【0019】
分析用デバイス2の前記回転を停止させると、前記液体成分は毛細管力によって移送用流路12cを通り、エアーバルブとして機能しているチャンバー16への出口手前で停止する。
【0020】
約10秒間回転を停止した後、分析用デバイス2を矢印Rの方向に軸心周りに遠心力1200Gで回転させることにより、チャンバー15にある前記液体成分はサイフォンの原理で移送用流路12cを通りチャンバー16へ一気に流入する。
【0021】
光源4から照射される光7はチャンバー16を透過し、光検出部5で得られた光量から処理部6にて分析試料中の分析対象物の測定値を算出する。
第一試薬18a,第二試薬18bの組成を具体的に説明する。
【0022】
注入口11より分析試料として血液を注入し、血液中の総コレステロール、トリグリセリド、HDLコレステロール、ALT、ASTなどを分析対象物として測定する場合などの例えば、トリグリセリドの分析に必要な試薬組成を例に挙げて説明する。
【0023】
(比較例1)
− 第一試薬18a −
GYD-301(グリセロールデヒドロゲナーゼ、東洋紡績製)・・720u/ml
LPL-311(リポプロテインリパーゼ、東洋紡績製)・・・・・・96u/ml
DAD-301(ジアホラーゼ、東洋紡績製)・・・・・・・・・・120u/ml
Tricine-NaOH pH8.5 ・・・・・・・・・・・・300mM
− 第二試薬18b −
WST−8(同仁化学製)・・・・・・・・・・・・・・・・・・・35mM
NAD+(オリエンタル酵母製)・・・・・・・・・・・・・・・・30mM
第一試薬18aはトリグリセリドの反応に必要な酵素および緩衝液を含み、第二試薬18bは、比色法で測定するための色素および電子メディエーターを含む。上記試薬を混合して1つにまとめると、ブランク反応により徐々に呈色するので、測定までは第一試薬18aと第二試薬18bに分けてチャンバー15に塗布、乾燥する必要がある。
【0024】
第一試薬18aの調製方法の一例を説明する。
GYD-301の凍結乾燥品を純水で溶解させ2880u/mlの溶液を調製し、LPL-311の凍結乾燥品を純水で溶解させ384u/mlの溶液を調製し、DAD-301の凍結乾燥品を純水で溶解させ480u/mlの溶液を調製し、既知の方法でTricine-NaOH pH8.5 1200mMを調製したあと、以上4試薬を等量ずつ混合させる。第二試薬18bも同様の方法で調製できる。
【0025】
チャンバー15への試薬塗布乾燥プロセスの一例を説明する。
液状の第一試薬18aをチャンバー15の所定の場所に1.2マイクロリットル塗布し、さらに、チャンバー15の第一試薬18aを塗布した場所とは別の場所に液状の第二試薬18bを1.2マイクロリットル塗布し、これらを風乾させる。
【0026】
風乾の条件は限定されないが、本検討では、温度25℃、湿度30%の環境下、1時間放置して乾燥させた。
この分析用デバイス2を温度40℃、湿度80%の環境下に30分放置させると、第一試薬18aは潮解性をもつ水酸化ナトリウムを含むため、水分を吸収することによって乾燥状態から液状に変化する。第二試薬18bに関しては潮解性を示さなかった。
【0027】
温度40℃、湿度80%の環境下で比較例1の分析用デバイス2を用いた場合、分析用デバイス2を遠心力1800Gで約1分間回転させることにより、第一試薬18aが遠心力方向へ飛散し、測定精度に影響を与えた。
【0028】
(実施例1)
比較例1の課題を解決するため鋭意検討した結果、比較例1の第一試薬18a,第二試薬18bのどちらか一方または両方に、ブロッキング用たんぱく質を添加することによって高湿度環境下でも試薬の飛散を防止でき、試薬の固定化技術として有用である。
【0029】
ここでいうブロッキングとは、容器や担体などへの成分の非特異的吸着を妨げることを言い、特にプラスチックなどの樹脂へのタンパク質の非特異的吸着を妨げることをいう。様々な測定において、測定対象の成分が非特異的に器壁に吸着することにより、バックグラウンドとして測定を妨げることが問題となる。特に免疫学的測定において、抗体のポリスチレンプレートへの吸着は顕著であり、通常、あらかじめ樹脂等に吸着しやすいタンパク質を添加して、抗体の非特異的吸着を妨げる操作、すなわちブロッキングを行うことが広く行われている。ブロッキング能を示すには、タンパク質分子の中の比較的疎水的な領域に加え、親水的な領域が必要であるということが条件になっていることが知られている。
【0030】
潮解性を持つ試薬にブロッキング用タンパク質を添加することによって、ブロッキング用タンパク質の親水的な領域が、潮解性を持つ試薬のうち水を取り込む物質と結合し、疎水的な領域が水を取り込む物質と空気中の水(水蒸気)との接触を阻害し、結果として試薬の液状化を防止できるということが推察される。
【0031】
ブロッキング用タンパク質としては、ウシ血清アルブミン(BSA)、ウシ由来カゼインや、東洋紡績製のBPF−301(Blocking Peptide Fragment)について検討を行った。それぞれのタンパク質全体の親水/疎水率は図4に示すように、BSAは0.90、ウシ由来αカゼインは0.76、BPF−301は0.64であって、添加される前記ブロッキング用タンパク質は、親水/疎水率が0.6付近で構成されるタンパク質が好ましい。具体的には、親水/疎水率が0.5より大きく0.7以下で構成されるタンパク質が使用可能である。
【0032】
ここでいう「親水/疎水率」を説明する。
タンパク質のアミノ酸配列のうち、アスパラギン酸、グルタミン酸、リジン、ヒスチジン、アルギニン、チロシンを親水性アミノ酸として定義し、また、グリシン、アラニン、バリン、ロイシン、イソロイシン、メチオニン、フェニルアラニン、トリプトファン、プロリンを疎水性アミノ酸として定義した場合に、タンパク質の親疎水性を数値化するために、親水性アミノ酸含有率を疎水性アミノ酸含有率で割った値を「親水/疎水率」と定義する。
【0033】
この実施例1では、比較例1の第一試薬18aの試薬組成を以下に変更して、その効果の検討を行った。
− 第一試薬18aの改良品 −
GYD-301(グリセロールデヒドロゲナーゼ、東洋紡績製)・・720u/ml
LPL-311(リポプロテインリパーゼ、東洋紡績製)・・・・・・96u/ml
DAD-301(ジアホラーゼ、東洋紡績製)・・・・・・・・・・120u/ml
Tricine-NaOH pH8.5 ・・・・・・・・・・・・・300mM
ブロッキング用タンパク質・・・・・・・・・・・・・0.1〜2.0%(w/w)
第一試薬18aの改良品の調製方法の一例を説明する。
【0034】
まず、ブロッキング用タンパク質の凍結乾燥品を純水で溶解させ0.1%から2.0%(w/w)の範囲における特定の濃度のブロッキング用タンパク質溶液を調製し、GYD-301の凍結乾燥品を前記ブロッキング用タンパク質溶液で溶解させ2880u/mlの溶液を調製し、LPL-311の凍結乾燥品を前記ブロッキング用タンパク質溶液で溶解させ384u/mlの溶液を調製し、DAD-301の凍結乾燥品を前記ブロッキング用タンパク質溶液で溶解させ480u/mlの溶液を調製し、既知の方法で純水の代わりにブロッキング用タンパク質溶液を用いてTricine-NaOH pH8.5 1200mMを調製したあと、以上4試薬を等量ずつ混合させる。
【0035】
第一試薬18aの改良品をチャンバー15に1.2マイクロリットルだけ塗布し充分に自然乾燥(風乾)させたあと、40℃、80%条件で30分放置した。遠心治具を用いて遠心力を1分間かけて試薬の状態を目視チェックした。
【0036】
ブロッキング用タンパク質を添加しない場合(比較例1)においては、1070Gまでは試薬の飛散が認められなかったものの、1250G以上になると飛散したのに対して、BSAを1.5%添加した実施例1の場合には、1250Gまでは試薬の飛散が認められず、効果があることが示された。しかしながら、1600G以上になるとBSAを2.0%添加しても試薬は飛散した。BSAを2.0%以上添加した場合は、試薬反応の感度が低下し精度も悪化した。
【0037】
カゼインを0.5%添加した実施例1の場合、1250Gまでは試薬の飛散が認められず、効果があることが示された。しかしながら、1600G以上になると試薬は飛散した。カゼインを1.0%以上添加した場合は、試薬反応の感度が低下し精度も悪化した。
【0038】
BPF−301を添加した実施例1の場合、0.5%添加することによって1250Gまでは試薬の飛散が認められなかった。また、1.0%添加することによって1800G以上でも試薬の飛散が認められず、非常に効果が高いことが示された。
【0039】
比較例として、ブロッキング能が備わっていないPseudomonas由来リパーゼを2.0%添加したが1250G以上になると飛散した。Pseudomonas由来リパーゼの親水/疎水率は、0.41であり、疎水性が大きすぎても効果が発揮されないことが分かった。
【0040】
このように、潮解性を持つ試薬にブロッキング用タンパク質を添加することにより、高湿度環境下に放置された場合でも試薬の液状化を防止し、遠心力による試薬の飛散を防止することができる。親水/疎水率と試薬潮解への効果を図4にまとめた。
【0041】
潮解への効果として、試薬の飛散を確認する実験で、1800G以上で回転させたときにも飛散を防止したタンパク質を○、1800G以上で回転させたときには飛散するものの、1250Gで回転させたときに飛散を防止したタンパク質を△、1250Gで回転させたときに試薬飛散したタンパク質を×と表記した。したがって、ブロッキング用タンパク質は試薬飛散防止機能をもち、特にBPF−301は飛散防止機能に優れていることが分かった。BPF−301では0.1重量%〜10重量%含有させた場合に良好な結果が得られた。
【0042】
(実施の形態2)
この実施の形態2では、潮解性を持つ試薬にブロッキング用タンパク質を添加することにより、高湿度環境下に放置された場合でも試薬の液状化を防止し、遠心力による試薬の飛散を防止することができるが、ブロッキング用タンパク質が試薬反応に悪影響を及ぼさないかどうかを確認した。
【0043】
例としてトリグリセリドの分析におけるBPF−301の試薬反応への影響を確認した。
下記の組成からなるトリグリセリド用分析試薬を調製した。
【0044】
(実施例2)
− 試薬組成1の第一試薬18a −
GYD-301(グリセロールデヒドロゲナーゼ、東洋紡績製)・・720u/ml
LPL-311(リポプロテインリパーゼ、東洋紡績製)・・・・・・96u/ml
DAD-301(ジアホラーゼ、東洋紡績製)・・・・・・・・・・120u/ml
Tricine-NaOH pH8.5 ・・・・・・・・・・・・300mM
BPF−301(東洋紡績製)・・・・・・・・・・・・・・・・・・2.0%
− 試薬組成1の第二試薬18b −
WST−8(同仁化学製)・・・・・・・・・・・・・・・・・・・35mM
NAD+(オリエンタル酵母製)・・・・・・・・・・・・・・・・30mM
(比較例2)
比較例2として、以下の組成からなるトリグリセリド用分析試薬を調製した。
【0045】
− 試薬組成2の第一試薬18a −
GYD-301(グリセロールデヒドロゲナーゼ、東洋紡績製)・・720u/ml
LPL-311(リポプロテインリパーゼ、東洋紡績製)・・・・・・96u/ml
DAD-301(ジアホラーゼ、東洋紡績製)・・・・・・・・・・120u/ml
Tricine−NaOH pH8.5 ・・・・・・・・・・・・・・・300mM
− 試薬組成2の第二試薬18b −
WST−8(同仁化学製)・・・・・・・・・・・・・・・・・・・35mM
NAD+(オリエンタル酵母製)・・・・・・・・・・・・・・・・30mM
本発明の実施例2の試薬組成1、比較例2の試薬組成2の試薬を用いて、PBS溶液およびヒト血漿中のトリグリセリド濃度に依存した吸光度を次のようにして測定した。
【0046】
先ず、第一試薬18aを12μl、第二試薬18b12μlを同一容器内に塗布し、温度25℃、湿度30%の環境化で12時間放置することによって乾燥を行った。乾燥後、前記容器内にPBS溶液およびヒト血漿を60μl加え、攪拌することによって乾燥状態の第一試薬18a、第二試薬18bを溶解させた。前記容器を37℃恒温槽内に3分間放置することによって反応を行った。光路長600μmにて波長460nmの光量を測光することによって、吸光度を求めた。それぞれのトリグリセリド濃度依存性を図5にグラフ化した。
【0047】
この図5から明らかなように、本発明の実施例2の試薬組成1と比較例2の試薬組成2を比較して、測定値に大きな乖離が認められないため、BPF−301を2.0%添加した場合でもトリグリセリドの反応性に影響を及ぼすことはないことが確認された。
【0048】
上記の各実施例では、第一試薬18a,第二試薬18bのうちの潮解性が高い第一試薬18aにブロッキング用タンパク質を含有させたが、測定する分析対象物によって必要とされる試薬が複数あって、それぞれが潮解性が高い場合には、全部の試薬にブロッキング用タンパク質を含有させてもよい。
【0049】
また、乾燥方法として風乾を採用したことによって、凍結乾燥によって製造する場合に比べて製造工程を簡素化できる。なお、出来上がった分析用デバイスの試薬を見てブロッキング用タンパク質を含有させて風乾させた実施品は、凍結乾燥されたものとは異なり平面状に薄く広がった仕上がりになり、風乾された試薬か凍結乾燥された試薬か乾燥方法を区別できる。
【産業上の利用可能性】
【0050】
本発明は、分析用デバイスにおける試薬の固定化技術として有用であり、分析精度の向上に寄与する。
【符号の説明】
【0051】
1 分析装置
2 分析用デバイス
3 回転駆動部
4 光源
5 光検出部
6 処理部
7 光
11 注入口
12a,12b,12c 移送用流路
13,14,15,16 チャンバー
17 連結口
18a 第一試薬
18b 第二試薬
【特許請求の範囲】
【請求項1】
遠心力と毛細管力で分析試料を移送し、反応部で分析試薬と前記分析試料とを攪拌して分析を行う分析用デバイスであって、
前記分析試薬にはブロッキング用タンパク質が添加されている
分析用デバイス。
【請求項2】
前記分析試薬は乾燥状態で配置されている
請求項1記載の分析用デバイス。
【請求項3】
前記分析試薬は、塗布した液体を風乾で乾燥されている
請求項1記載の分析用デバイス。
【請求項4】
添加される前記ブロッキング用タンパク質は、親水/疎水率が0.6付近で構成されるタンパク質である
請求項1記載の分析用デバイス。
【請求項5】
前記ブロッキング用タンパク質は、BPF−301(Blocking Peptide Fragment)である
請求項1記載の分析用デバイス。
【請求項6】
前記ブロッキング用タンパク質は、BPF−301(Blocking Peptide Fragment)を0.1重量%〜10重量%含有している
請求項1記載の分析用デバイス。
【請求項1】
遠心力と毛細管力で分析試料を移送し、反応部で分析試薬と前記分析試料とを攪拌して分析を行う分析用デバイスであって、
前記分析試薬にはブロッキング用タンパク質が添加されている
分析用デバイス。
【請求項2】
前記分析試薬は乾燥状態で配置されている
請求項1記載の分析用デバイス。
【請求項3】
前記分析試薬は、塗布した液体を風乾で乾燥されている
請求項1記載の分析用デバイス。
【請求項4】
添加される前記ブロッキング用タンパク質は、親水/疎水率が0.6付近で構成されるタンパク質である
請求項1記載の分析用デバイス。
【請求項5】
前記ブロッキング用タンパク質は、BPF−301(Blocking Peptide Fragment)である
請求項1記載の分析用デバイス。
【請求項6】
前記ブロッキング用タンパク質は、BPF−301(Blocking Peptide Fragment)を0.1重量%〜10重量%含有している
請求項1記載の分析用デバイス。
【図1】


【図2】


【図3】


【図4】


【図5】




【図2】


【図3】


【図4】


【図5】


【公開番号】特開2011−69674(P2011−69674A)
【公開日】平成23年4月7日(2011.4.7)
【国際特許分類】
【出願番号】特願2009−219832(P2009−219832)
【出願日】平成21年9月25日(2009.9.25)
【出願人】(000005821)パナソニック株式会社 (73,050)
【Fターム(参考)】
【公開日】平成23年4月7日(2011.4.7)
【国際特許分類】
【出願日】平成21年9月25日(2009.9.25)
【出願人】(000005821)パナソニック株式会社 (73,050)
【Fターム(参考)】
[ Back to top ]

