分析用試薬および分析用デバイス
【課題】ドライケミストリー方式の装置において、極めて溶解性が高く、血中のHDLコレステロール濃度を正確かつ迅速に測定できる前処理試薬を提供することを目的とする。
【解決手段】ポリアニオン化合物と二価の陽イオン化合物の組み合わせからなる試薬中に、コハク酸またはグルコン酸またはアラニンまたはグリシンまたはバリンまたはヒスチジンまたはマルチトールまたはマンニトールの内の何れかまたはその化合物を少なくとも1つ以上含んだことを特徴とし、試薬のドライ化および潮解性を改善できる。
【解決手段】ポリアニオン化合物と二価の陽イオン化合物の組み合わせからなる試薬中に、コハク酸またはグルコン酸またはアラニンまたはグリシンまたはバリンまたはヒスチジンまたはマルチトールまたはマンニトールの内の何れかまたはその化合物を少なくとも1つ以上含んだことを特徴とし、試薬のドライ化および潮解性を改善できる。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、生物学的試料の高比重リポ蛋白コレステロールを精度よく分析するための試薬および分析用デバイスに関するものである。
【背景技術】
【0002】
従来、1台の装置により血液等の生物学的試料と分析試薬と反応させ、生物学的試料中の様々な成分を定量可能な大型の自動分析装置が実用化されており、医療分野においては無くてはならない存在となっている。
【0003】
しかしながら、すべての病院においてそのような装置が導入されているわけではなく、特に診療所等の小規模な医療機関においては、運用コスト等の様々な理由により、試料の分析を外部委託するという形態をとる病院も少なくない。分析を外部委託する形態をとる場合、分析結果を得るまでに時間を要し、その結果、患者は検査結果に基づく適切な治療を受けるために、必然的に再来院を余儀なくされるという不便さや、急患等の緊急を要する場合の迅速対応が難しい等の問題がある。
【0004】
そのような背景により、医療の現場から低コスト、試料液の少量化、装置の小型化、短時間測定など、より高精度で、運用の自由度が高い分析装置の登場が望まれている。このような迅速で簡便な診断システムは、ポイント・オブ・ケア・テスティング(以下、POCT)と呼ばれ、検査の必要性が生じた時、被検者の傍らで迅速に検査結果が得られ、医療の質の向上、患者の生活の質向上ということに主眼を置いた検査として定義されている。
【0005】
POCTで定義されるような運用の自由度、および医療サービスの質を向上させることができるような分析装置を実現するためには、例えば、患者負担の少ない指先採血等で採取される少量の検体から複数種の成分濃度を短時間で高精度に測定できるという条件を満たすことが一つの理想形であろう。しかしながら、指先採血等でストレス無く得られる検体量は、せいぜい十数マイクロリットル程度であり、そのような少量の検体から前述の条件、特に複数種の成分分析を高精度に行うことは、技術的に難しい。特に、前処理を必要とする分析項目については、少量の検体に対し短時間で繰り返し精度のよい前処理を行うことが難しく、十分な測定精度を持つ製品はいまだ数少ない状況にある。
【0006】
特許文献1には、前処理用の試薬が多孔質体に担持されており、そこに検体を浸透させることにより検体の前処理(血球分離および沈澱、分離処理)を実施し、高比重リポ蛋白コレステロール(以下、HDLコレステロール)を測定している。
【先行技術文献】
【特許文献】
【0007】
【特許文献1】特公平7−66001
【発明の概要】
【発明が解決しようとする課題】
【0008】
血中のコレステロールは、脂質と蛋白質の複合体であるリポ蛋白の構成成分として体内を循環する。リポ蛋白は比重の差によって分類されており、比重の低い順にカイロミクロン、超低比重リポ蛋白、低比重リポ蛋白、高比重リポ蛋白(以下HDL)と大きく分かれている。このHDLに含まれるコレステロールがHDLコレステロールであり、俗に善玉コレステロールと呼ばれるように動脈硬化の負の因子であることが明らかとなっている。そのため、このHDLコレステロールは主に動脈硬化のリスク評価や、脂質代謝異常のスクリーニング用途に分析されている。
【0009】
HDLコレステロールの測定方法は、大きく2通りに分けることができる。
第1の分析手法は、HDL以外のリポ蛋白を沈殿、除去後、残存したHDLに含まれるHDLコレステロールを分析する手法があるが、この手法は手技により煩雑な前処理を実施しなければならない問題が存在する。また、特許文献1のように、小型の多孔質体に前処理試薬を担持させ、その多孔質体に少量の検体を浸透させることで、沈殿発生と沈殿除去処理を自動で行うドライケミストリーと呼ばれる装置も存在するが、前処理反応が多孔質体と毛細管力を利用したものであるため、多孔質体の孔径等の物理的形状のばらつきや、多孔質体内部に先に導入された検体先端部とその後に導入された検体の間の前処理試薬濃度勾配や、検体の物理特性のばらつきにより、沈殿生成除去にムラが生じやすい等の問題が存在する。また前記前処理試薬としては、ポリアニオンと二価の陽イオンからなるものが一般的であるが、そのままではドライ化時の潮解性および溶解性に問題がある。
【0010】
第2の分析手法は、ある特定の高分子材料や界面活性剤を使用することにより、HDLコレステロール以外のリポ蛋白コレステロールの反応性を阻害する等の効果を発揮し、沈殿生成、除去等の前処理行程自体を省略するものである。これは直接法と呼ばれ、現在HDLコレステロールの分析方法として主流となっているが、前記大型の自動分析装置用に開発された方法であるため、前述の通り装置が大型であったり、運用コストの問題から全ての医療機関での導入が難しい。また、試薬形状が液体であるということを前提に設計されているため、その使用には多くの機械的機構が必要であり装置の小型化も難しく、POCTとして運用するにあたっての短所を有し、POCTで定義されるような運用に至っていないというのが現状である。
【0011】
本発明は、POCTで定義されるような医療サービスの質、患者の生活の質向上を実現するために、我々は、患者負担軽減のために指先採血による十数マイクロリットル以下の血液検体で分析が可能、かつ数分という短時間で高精度に血中の目的成分を測定できるシステムが必要であると考え、それを満たすための方法としてドライケミストリー方式の測定システムを選択し、その方式において血中のHDLコレステロール濃度を正確で短時間に測定できる極めて溶解性が高く、かつ安定性の高い前処理試薬を提供することを目的とする。
【課題を解決するための手段】
【0012】
本発明の分析用試薬は、生物学的試料に含まれるHDLコレステロールを分析するに当たり、HDL以外のリポ蛋白を沈殿させる分析用試薬であって、ポリアニオン化合物と二価の陽イオン化合物の組み合わせからなる試薬中に、コハク酸またはグルコン酸またはアラニンまたはグリシンまたはバリンまたはヒスチジンまたはマルチトールの何れかまたはその化合物を少なくとも1つ以上含んだことを特徴とする。
【0013】
また、本発明の分析用試薬は、生物学的試料に含まれるHDLコレステロールを分析するに当たり、HDL以外のリポ蛋白を沈殿させる分析用試薬であって、ポリアニオン化合物と二価の陽イオン化合物の組み合わせからなる試薬中に、ジカルボン酸またはアラニンまたはグリシンまたはバリンまたはヒスチジンまたはタウリンまたは糖アルコールまたは単糖類のキシロースまたは二糖類,三糖類の内の何れかまたはその化合物を少なくとも1つ以上含んだことを特徴とする。
【0014】
具体的には、前記ジカルボン酸が、コハク酸またはグルタル酸またはグルコン酸のいずれかであることを特徴とする。
具体的には、前記糖アルコールが、マルチトールまたはグリシトールまたはラクチトールまたはマンニトールのいずれかであることを特徴とする。
【0015】
具体的には、前記二糖類が、スクロールまたはラクトースまたはトレハロースのいずれかであることを特徴とする。
具体的には、前記三糖類が、ラフィノースまたはマルトトリオースのいずれかであることを特徴とする。
【0016】
具体的には、前記ポリアニオン化合物が、リンタングステン酸、またはリンタングステン酸塩、リンモリブデン酸、またはリンモリブデン酸塩からからなる群の少なくとも一種から選択されることを特徴とする。
【0017】
具体的には、前記二価の陽イオン化合物が、マグネシウムイオン化合物、またはマグネシウムイオン化合物塩、カルシウムイオン化合物、またはカルシウムイオン化合物塩からなる群の少なくとも一種から選択されることを特徴とする。
【0018】
本発明の分析用デバイスは、試料液を遠心力によって測定チャンバーに向かって移送するマイクロチャネル構造を有し前記測定チャンバーにおける反応液にアクセスする読み取りに使用される分析用デバイスであって、ポリアニオン化合物と二価の陽イオン化合物の組み合わせからなる試薬中に、コハク酸またはグルコン酸またはアラニンまたはグリシンまたはバリンまたはヒスチジンまたはマルチトールまたはマンニトールの何れかまたはその化合物を少なくとも1つ以上含んだ固体状態の分析用試薬を、前記測定チャンバーへ到着前のマイクロチャネル構造の流路に担持していることを特徴とする。
【0019】
また、本発明の分析用デバイスは、試料液を遠心力によって測定チャンバーに向かって移送するマイクロチャネル構造を有し前記測定チャンバーにおける反応液にアクセスする読み取りに使用される分析用デバイスであって、ポリアニオン化合物と二価の陽イオン化合物の組み合わせからなる試薬中に、ジカルボン酸またはアラニンまたはグリシンまたはバリンまたはヒスチジンまたはタウリンまたは糖アルコールまたは単糖類のキシロースまたは二糖類,三糖類のうちの何れかまたはその化合物を少なくとも1つ以上含んだ固体状態の分析用試薬を、前記測定チャンバーへ到着前のマイクロチャネル構造の流路に担持していることを特徴とする。
【発明の効果】
【0020】
本発明の分析用試薬は、コハク酸またはアラニンまたはグリシンまたはバリンまたはヒスチジンまたはマルチトールまたはマンニトールから選択される化合物を少なくとも1つ以上含んでいることによって、前処理試薬の溶解性を高めることができ、短時間で前処理が可能であり、濃度勾配や検体毎に異なる物理的性質の影響を受けにくいことから均一な処理が可能である。これにより、HDLコレステロールを短時間で高精度に測定することができる。
【0021】
詳しくは、本発明の分析用試薬は、ポリアニオンと二価の陽イオンからなる公知の技術を基にするが、そのままではドライ化時の潮解性および溶解性に問題があり、前記課題を解決することができない。その課題を解決するためにドライ化時の潮解性の軽減とその溶解性を向上させたものである。
【0022】
前処理試薬の潮解性を軽減し、溶解性を向上させるための手段として、各試薬成分の塩の種類や添加剤の選定が重要になってくる。これは塩の種類や添加剤によって、潮解性の強弱や溶解性が大きく変化するからである。試薬成分の塩の種類としては、全ての化合物について当てはまるとはいえないが、例えば塩酸塩よりも硫酸塩の方が潮解性が低い傾向がある。また、添加剤については、試薬混合物の乾燥時の結晶状態を例えば巨大な結晶が析出し、溶解性の面で不利となる単結晶多寡の状態から、より溶解性の面で有利となる細かい結晶の集まりである多結晶状態やアモルファス、無結晶状態へと変化させ溶解性を向上させたり、潮解性の高い試薬成分を添加剤の結晶構造中に取り込み、コーティングするような効果で潮解性を低減させる効果を有している。ポリアニオン化合物については、非HDLを沈殿させるという機能を実現するのみであれば以下にあげる、リンタングステン酸、リンモリブデン酸、タングステン酸、モリブデン酸、それらの無機塩類、またはデキストラン硫酸、ヘパリン、硫酸アミロース、アミロペクチン硫酸等の硫酸多糖類から選択することができるが、前記条件を満たすためにはリンタングステン酸、リンモリブデン酸、またはそれらの塩から選択することが望ましく、更にいえばリンタングステン酸ナトリウムがよい。次に前記ポリアニオン化合物と組み合わされる二価の陽イオン化合物としては、非HDLを沈殿させるという機能を実現させるのみであれば以下に挙げるように、カルシウム、マグネシウム、マンガン、コバルト、ニッケル、ストロンチウム、亜鉛、バリウム、銅の2価のイオン、またはアルミニウム、鉄、クロムの二価以外のイオン、またはアンモニウムイオンから選択することができる。しかしながら前記ポリアニオンの場合と同じく前記条件を満たすためにはカルシウム、またはマグネシウムイオンから選択することが望ましく、更に化合物名でいえば、硫酸カルシウムと硫酸マグネシウムを選択することが望ましく、これらを組み合わせて用いるのがよい。非HDLを沈殿させるためには前記ポリアニオン化合物と二価の陽イオン化合物の組み合わせで実施可能であるが、前述の通り固体状態での溶解性や潮解性の低減条件を満たすためには、さらに添加剤の追加が必須である。添加剤としては糖類、アミノ酸、常温で固体のジカルボン酸またはその塩が望ましく、更に言えば糖類であればマンニトール、マルチトールが望ましく、アミノ酸であればアラニン、グリシン、ヒスチジン、ジカルボン酸であればコハク酸またはその塩が望ましく、前記ポリアニオンと二価の陽イオンの組み合わせと本発明の分析用デバイスに最も適するものはコハク酸二ナトリウムである。
【0023】
この組み合わせからなる前処理試薬は、ドライ化時の潮解性が低く、かつ生物学的試料接触時の溶解性が極めて高いという性質を有し、この前処理試薬を使用することによる分析システムを使用することにより、前記POCTの定義に合致したHDLコレステロールの測定が可能になる。
【図面の簡単な説明】
【0024】
【図1】参照試薬と参照試薬に各種の添加剤を入れた試薬の実験結果の説明図
【図2】本発明の試薬を有する分析用デバイスを使用したHDLコレステロールの分析フロー図
【図3】同分析用デバイスによるHDLコレステロールの測定値の直線性の説明図
【図4】同実施の形態の分析装置のドアを開いた状態の斜視図
【図5】同実施の形態の分析装置の断面図
【図6】同実施の形態の分析装置の構成図
【図7】同実施の形態の分析用デバイスに点着しターンテーブルにセットして回転させる前の状態図
【図8】同実施の形態において分析用デバイスを揺動させる状態図とターンテーブルを時計方向に回転駆動して測定チャンバーおよび保持キャビティに流れ込んだ状態図
【図9】同実施の形態において分析用デバイスを揺動させる状態図とターンテーブルを時計方向に回転駆動させて操作キャビティの試薬と反応した希釈血漿が分離キャビティに流れ込み、さらに高速回転を維持することで、操作キャビティ内で生成された凝集物を遠心分離する状態図
【図10】同実施の形態においてターンテーブルを停止させ希釈血漿が計量流路に流れて定量が保持された状態図と計量流路に保持されていた希釈血漿が測定チャンバーに流れ込んだ状態図
【図11】同実施の形態において測定チャンバーの希釈血漿と試薬との反応が開始される状態図と試薬と希釈血漿の攪拌の状態図
【図12】同実施の形態の分析用デバイスの図8におけるF−F断面図
【図13】同実施の形態の分析用デバイスの毛細管エリアにおける試薬の担持状態を示す拡大平面図とG−G断面図
【図14】同実施の形態の分析用デバイスの操作キャビティにおける試薬の担持状態を示す拡大平面図とH−H断面図
【発明を実施するための形態】
【0025】
以下、本発明の実施の形態を図1〜図14に基づいて説明する。
図4〜図6は分析用ディスク1とこれを使用する分析装置100を示し、図7〜図14は分析用ディスク1の内部の具体的な流路を示している。
【0026】
分析用デバイス1は、微細な凹凸形状を表面に有するマイクロチャネル構造が片面に形成されたベース基板3と、ベース基板3の表面を覆うカバー基板4とを貼り合わせたものに、試料液飛散防止用の保護キャップ2が取り付けられている。
【0027】
図7は、カバー基板4との貼り合わせ面から見たベース基板3を示しており、この図7から分かるように、分析用デバイス1の内部には、希釈液が入った希釈液容器5がセットされるとともに、収容エリアのうちの必要なものには各種の分析に必要な前処理剤としての試薬58a1,58a2,58b1,58b2,58b3,58c1,58c2,67a,67bが予め担持されている。
【0028】
保護キャップ2を開いて露出した注入口13に試料液を点着して保護キャップ2を閉じることによって、希釈液容器5が分析用デバイス1の内部で移動して開封リブ11aによってシール部材9が破られて、希釈液が希釈液容器5から流出する。
【0029】
この分析用デバイス1を、図4に示す分析装置100のターンテーブル101にセットした後にドア103を閉じると、セットされた分析用デバイス1は、図5に示すようにドア103の側に設けられたクランパ104によって、ターンテーブル101の回転軸心上の位置が付勢手段としてのバネ105aの付勢力でターンテーブル101の側に押さえられて、分析用デバイス1は回転駆動手段106のブラシレスモータ71aによって回転駆動されるターンテーブル101と一体に回転する。107はターンテーブル101の回転中の軸心を示している。
【0030】
この実施の形態では、ターンテーブル101は、傾斜した回転軸心107に取り付けられて水平線Hに対して角度θ°だけ傾斜しており、分析用デバイス1の回転停止位置に応じて、分析用デバイス1内の溶液にかかる重力の方向を制御できる。
【0031】
分析装置100の電気制御系は図6に示すように構成されている。
この分析装置100は、ターンテーブル101を回転させるための回転駆動手段106と、分析用デバイス1内の溶液を光学的に測定するための光学測定手段108と、ターンテーブル101の回転速度や回転方向および光学測定手段の測定タイミングなどを制御する制御手段109と、光学測定手段108によって得られた信号を処理し測定結果を演算するための演算部110と、演算部110で得られた結果を表示するための表示部111とで構成されている。
【0032】
回転駆動手段106は、ターンテーブル101を介して分析用デバイス1を回転軸心107の回りに任意の方向に所定の回転速度で回転させるだけではなく、所定の停止位置で回転軸心107を中心に所定の振幅範囲、周期で左右に往復運動をさせて分析用デバイス1を揺動させることができるように構成されている。
【0033】
光学測定手段108には、分析用デバイス1の測定部に特定の波長光を照射するための光源112と、光源112から照射された光のうち、分析用デバイス1を通過した透過光の光量を検出するフォトディテクタ113とを備えている。
【0034】
分析用デバイス1をターンテーブル101によって回転駆動すると、注入口13から内部に取り込んだ試料液が、注入口13よりも内周にある回転軸心107を中心に分析用デバイス1を回転させて発生する遠心力と、分析用デバイス1内に設けられた毛細管流路の毛細管力を用いて、分析用デバイス1の内部で移送していくよう構成されており、この分析用デバイス1のマイクロチャネル構造を分析工程とともに詳しく説明する。
【0035】
保護キャップ2を開いて注入口13に試料液を直接に分析用デバイス1に付けることによって、注入口13の付近に付着した試料液が誘導部17の毛細管力によって分析用デバイス1の内部に取り込まれる。図7の25a〜25mはベース基板3に形成された空気孔である。
【0036】
ドア103を閉じた後にターンテーブル101を時計方向(C2方向)に回転駆動すると、保持されている試料液が毛細管キャビティ19と受容キャビティ23aを介して分離キャビティ23b,23cに流入し、分離キャビティ23b,23cで血漿成分と血球成分とに遠心分離される。希釈液容器5から流出した希釈液は、排出流路26を介して保持キャビティ27に流入する。
【0037】
次に、ターンテーブル101の回転を停止させると、血漿成分は分離キャビティ23bの壁面に形成された毛細管キャビティ33に吸い上げられ、連結流路30を介して計量流路38に流れて定量が保持される。
【0038】
また、希釈液8は保持キャビティ27と混合キャビティ39を連結しているサイホン形状を有する連結流路41内に呼び水される。
ターンテーブル101を時計方向(C2方向)に回転駆動すると、計量流路38に保持されていた血漿成分は大気開放キャビティ31の位置で破断し、定量だけ混合キャビティ39に流れ込み、保持キャビティ27内の希釈液8も連結流路41を介して混合キャビティ39に流れ込む。
【0039】
次に、ターンテーブル101の回転を停止し、±1mm程度の揺動を分析用デバイス1に与えるようにターンテーブル101を40〜80Hzの周波数で制御して、混合キャビティ39内に移送された希釈液8と血漿成分からなる測定対象の希釈血漿40を攪拌する。
【0040】
その後に、分析用デバイス1を図8(a)に示す位置にして、±1mm程度の揺動を分析用デバイス1に与えるようにターンテーブル101を80〜200Hzの周波数で制御して、混合キャビティ39に保持される希釈血漿40を希釈血漿40の液面よりも内周側に形成された毛細管流路37の入口まで移送する。
【0041】
毛細管流路37の入口まで移送された希釈血漿40は、毛細管力によって毛細管流路37内に吸い出され、毛細管流路37、計量流路47a,47b,47c、溢流流路47dに順次移送される。
【0042】
ターンテーブル101を時計方向(C2方向)に回転駆動すると、図8(b)に示すように、計量流路47a,47b,47cに保持されていた希釈血漿40は、大気と連通する大気開放キャビティ50との連結部である屈曲部48a,48b,48c,48dの位置で破断して、定量だけ測定チャンバー52b,52cおよび保持キャビティ53に流れ込む。
【0043】
また、このとき溢流流路47dに保持されていた希釈血漿40は、逆流防止通路55を介して溢流キャビティ54に流れ込む。また、このとき毛細管流路37内の希釈血漿40は、溢流キャビティ29b,溢流流路28bを介して溢流キャビティ29cに流れ込む。計量流路47aの一部の側壁は屈曲部48aの近傍に大気開放キャビティ50と連通するよう凹部49が形成されている。測定チャンバー52a〜50cの形状は、遠心力の働く方向に伸長した形状で、分析用デバイス1の回転中心から最外周に向かって分析用デバイス1の周方向の幅が細く形成されている。複数の測定チャンバー52a〜52cの外周側の底部は、分析用デバイス1の同一半径上に配置されている。
【0044】
さらに、各測定チャンバー52a〜52cの周方向に位置する側壁の一側壁には、前記測定チャンバーの外周位置から内周方向に伸長するように毛細管エリア56a〜56cが形成されている。図8(b)におけるF−F断面を図12に示す。
【0045】
測定チャンバー52a〜52cの光路長は、それぞれの検査対象の成分と試薬を反応させた後の混合溶液から得られる吸光度の範囲によって調整されている。
また、毛細管エリア56a,56b,56c内には図13(a)に示すように、それぞれの検査対象の成分と反応させるための試薬58a1,58a2,58b1,58b2,58b3,58c1,58c2が、毛細管エリア56a,56b,56c内に形成された試薬担持部57a1,57a2,57b1,57b2,57b3,57c1,57c2に担持されている。図13(a)におけるG−G断面を図13(b)に示す。
【0046】
試薬担持部57b1,57b2,57b3のカバー基板4との隙は、毛細管エリア56bのカバー基板4との隙より薄くなるよう毛細管エリア56bより突出して形成している。
【0047】
毛細管エリア56bは、50〜300μm程度の毛細管力が作用する隙で形成しているため、試薬担持部57b1,57b2,57b3は毛細管エリア56bよりも数十μm程度突出するように形成している。毛細管エリア56a,56cにおいても同様に構成されている。
【0048】
次に、ターンテーブル101の回転を停止し、分析用デバイス1を図9(a)に示す位置にして、±1mm程度の揺動を分析用デバイス1に与えるようにターンテーブル101を60〜120Hzの周波数で制御して、保持キャビティ53に保持される希釈血漿40を希釈血漿40の液面に浸かるよう保持キャビティ53の側壁に形成された連結部59を介して毛細管力の作用により操作キャビティ61に移送する。
【0049】
さらにターンテーブル101を120〜200Hzの周波数で制御して、図14(a)に示す操作キャビティ61に担持された試薬67a,67bと希釈血漿40を攪拌し、希釈血漿40内に含まれる特定の成分と試薬を反応させる。ここで操作キャビティ61は測定チャンバー52aへ到着前のマイクロチャネル構造の流路である。
【0050】
また、測定チャンバー52b,52cに移送された希釈血漿40は、毛細管力によって図9(a)に示すように毛細管エリア56b,56cに吸い上げられ、この時点で試薬58b1,58b2,58b3,58c1,58c2の溶解が開始され、希釈血漿40内に含まれる特定の成分と試薬の反応が開始される。
【0051】
次に、ターンテーブル101を時計方向(C2方向)に回転駆動すると、図9(b)に示すように、操作キャビティ61の試薬と反応した希釈血漿が連結通路64を通過して分離キャビティ66に流れ込み、さらに高速回転を維持することで、操作キャビティ61内で生成された凝集物を遠心分離する。ここで、この実施の形態では、検査対象の成分と試薬を反応させる際に、前記反応を阻害する成分を前工程で排除するよう構成しており、操作キャビティ61で希釈血漿を試薬と反応させることで、後工程の反応を阻害する特定の成分を凝集処理し、次工程で遠心分離することで前記凝集物を排除している。
【0052】
また、毛細管エリア56b,56cに保持されていた試薬と希釈血漿の混合溶液は、遠心力によって測定チャンバー52b,52cの外周側に移送することで、試薬と希釈血漿の攪拌が行われる。
【0053】
次に、ターンテーブル101の回転を停止させると、希釈血漿40は分離キャビティ66の壁面に形成された毛細管キャビティ69に吸い上げられ、毛細管キャビティ69と連通する連結流路70を介して図10(a)に示すように計量流路80に流れて定量が保持される。
【0054】
また、分離キャビティ66内の凝集物を含む希釈血漿40は、分離キャビティ66と溢流キャビティ81aを連結しているサイホン形状を有する連結流路68内に呼び水される。
【0055】
また、測定チャンバー52b,52cに移送された試薬と希釈血漿の混合溶液は、毛細管力によって再び毛細管エリア56b,56cに吸い上げられる。
ターンテーブル101を時計方向(C2方向)に回転駆動すると、図10(b)に示すように、計量流路80に保持されていた希釈血漿40は、大気と連通する大気開放キャビティ83との連結部である屈曲部84の位置で破断して、定量だけ測定チャンバー52aに流れ込む。
【0056】
また、分離キャビティ66および連結通路70、毛細管キャビティ69内の希釈血漿40はサイホン形状の連結流路68を介して溢流キャビティ81aに流れ込む。
また、毛細管エリア56b,56cに保持されていた試薬と希釈血漿の混合溶液は、遠心力によって測定チャンバー52b,52cの外周側に移送することで、試薬と希釈血漿の攪拌が行われる。
【0057】
次に、ターンテーブル101の回転を停止させると、測定チャンバー52aに移送された希釈血漿40は、毛細管力によって図11(a)に示すように毛細管エリア56aに吸い上げられ、この時点で試薬58a1,58a2の溶解が開始され、希釈血漿40内に含まれる特定の成分と試薬の反応が開始される。
【0058】
また、測定チャンバー52b,52cに移送された試薬と希釈血漿の混合溶液は、毛細管力によって再び毛細管エリア56b,56cに吸い上げられる。
ターンテーブル101を時計方向(C2方向)に回転駆動すると、図11(b)に示すように、毛細管エリア56a,56b,56cに保持されていた試薬と希釈血漿の混合溶液は、遠心力によって測定チャンバー52a,52b,52cの外周側に移送することで、試薬と希釈血漿の攪拌が行われる。
【0059】
分析用デバイス1を反時計方向(C1方向)または時計方向(C2方向)に回転駆動して、各測定チャンバー52a,52b,52cが光源112とフォトディテクタ113の間を通過するタイミングに、演算部110がフォトディテクタ113の検出値を読み取って、特定成分の濃度を算出する。
【0060】
測定チャンバー52aにおいてHDLコレステロールを定量測定する場合には、試薬67a,67bとして、次のように調製したものを使用している。
血液検体から、HDL以外のリポ蛋白である非HDLを除去するにあたっては、ポリアニオンと二価の陽イオンが必要である。一般的にポリアニオンとしては前述の通りリンタングステン酸、リンモリブデン酸、タングステン酸、モリブデン酸、それらの無機塩類、またはデキストラン硫酸、ヘパリン、硫酸アミロース、アミロペクチン硫酸等の硫酸多糖類からなる群より選択することができるが、溶解性や分析用デバイス上に固体状態で長期間安定に配置する必要性があることを考慮した場合、これらの内の無機化合物が望ましく、リンタングステン酸、またはリンタングステン酸塩、リンモリブデン酸、またはリンモリブデン酸塩からなる群の少なくとも一種から選択されることが望ましい。二価の陽イオンとしては、前述の通りカルシウム、マグネシウム、マンガン、コバルト、ニッケル、ストロンチウム、亜鉛、バリウム、銅のイオンからなる群の少なくとも一種より選択できるが、分析用デバイス内で酵素による反応を行うことを考慮すると、酵素を失活させる可能性を有する金属イオンは望ましくなく、入手難易度を考慮するとカルシウムおよびマグネシウムから選択することが望ましい。さらに溶解性を考慮するとマグネシウムが望ましく、また潮解性を考慮すると硫酸塩つまり硫酸マグネシウムを使用することが望ましい。また、さらに前記リンタングステン酸ナトリウムと硫酸マグネシウム混合物に硫酸カルシウムを添加することが望ましく、これは結晶状態を変化させ試薬の溶解性を向上させる働きを有している。
【0061】
リンタングステン酸ナトリウム 20mg/ml
硫酸マグネシウム 40mg/ml
硫酸カルシウム 12mM
コハク酸二ナトリウム 15mg/ml
非HDLの除去方法は、まず上記組成の試薬を調整し試験管へ20μl滴下し、乾燥させた。一般人から採取した血液検体をリン酸緩衝生理食塩水(pH7.4)で4倍に希釈し、その検体200μlを前記乾燥させた試薬へ加え、ボルテックスミキサーにより45秒攪拌後、75秒静置し、生じた非HDLの凝集を1500Gで30秒間遠心分離した。検体の希釈倍率は2倍以上であれば本実施例の試薬がそのまま適用可能であるが、それ以下の検体希釈倍率の場合は各試薬成分の濃度を調整することで適用可能である。非HDLが除去された上澄み液を分取し、液中のコレステロール(HDLコレステロールに当る)を、株式会社日立ハイテクノロジーズ製7020形自動分析装置によって積水メディカル株式会社製「コレステスト−CHO」を使用して測定した。
【0062】
試薬の潮解性の判断方法としては、試薬を樹脂基板上に乾燥担持し、気温30℃湿度80%の条件下で30分暴露後、樹脂基板水平方向に遠心力がかかるように500Gで遠心し、遠心力方向への試薬の流れ出しの有無により潮解性の有無を判断した。この潮解性の有無の判断については、分析用デバイス1は、内部の検体移送等に遠心力を利用しており、それにより遠心力がかかった状態で試薬が飛散しないことが重要な判断基準になることを理由としている。
【0063】
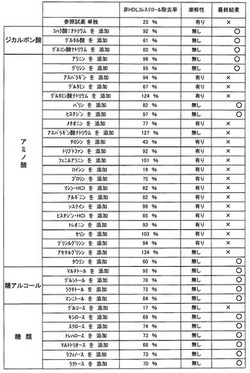
上記手順による非HDLコレステロールの除去率と潮解性の有無について本試薬とコハク酸二ナトリウムを含まない参照試薬、およびコハク酸二ナトリウム以外の添加剤を添加した試薬についての比較を実験結果を示す図1に示した。
【0064】
ここでは前記添加剤として、図1に示すように下記のものを実験した。
ジカルボン酸では、コハク酸二ナトリウム、グルタル酸、グルコン酸ナトリウムを実験した。
【0065】
アミノ酸では、アラニン、グリシン、アスパラギン、グルタミン、グルタミン酸ナトリウム、バリン、ヒスチジン、メチオニン、アスパラギン酸ナトリウム、チロシン、トリプトファン、フェニルアラニン、ロイシン、プロリン、リシン・HCl、アルギニン、システイン、ヒスチジン・HCl、トレオニン、セリン、グリシルグリシン、アセチルグリシリン、アミノ酸様化合物であるタウリンを実験した。
【0066】
糖アルコールでは、マルチトール、グルシトール、ラクチトール、マンニトールを実験した。
糖類では、単糖類ではグルコース、キシロースを実験し、二糖類ではスクロース、トレハロースを実験し、三糖類ではマルトトリオース、ラフィノース、ラクトースを実験した。
【0067】
非HDLコレステロール除去率が100%を大きく超えているものについては、HDLコレステロール自体も除去される過剰または異常な反応を起こしていると推測される。また潮解性については添加剤の種類と濃度が重要なファクターであり、図1の潮解性の欄には参考として潮解しにくい添加濃度条件について示している。添加剤を含まない参照試薬の非HDLコレステロール除去率25%を上回る有効な添加剤は数多く存在することがわかるが、さらにより短い時間での検体中の非HDLコレステロールの除去、および分析用デバイス上に安定に固体状態で配置するための潮解性の無さが重要である。
【0068】
図1より、コハク酸二ナトリウムを含まない公知の参照試薬では非HDLコレステロールの除去が25%と不十分で、かつ潮解性を有するのに対し、コハク酸二ナトリウムを含んだ本試薬は非HDLコレステロールの除去が92%と高い除去率と潮解性の無さを両立させている。
【0069】
また非HDLコレステロール除去率については100±20%の範囲に入っていることを最適な添加剤の条件とし、その結果、最適な添加剤として、コハク酸二ナトリウム以外では、グルコン酸ナトリウム、アラニン、グリシンまたはバリン、ヒスチジン、マルチトールおよびマンニトールも優れた除去率、および潮解性の無さを有している。
【0070】
また、これらの添加剤について潮解性を低減する添加濃度についてはコハク酸二ナトリウム、グルコン酸ナトリウム、アラニン、グリシンまたはバリンおよびヒスチジンについては5mg/ml以上、マルチトールとマンニトールでは1mg/ml以上10mg/ml以下の濃度で効果を有している。
【0071】
前記の本試薬を、分析用デバイス1の操作キャビティ61の上に固体状態で配置して
HDLコレステロール濃度を測定する場合を、図2により説明する。
まず、ステップS1では、血液検体を検体導入部としての誘導部17へ導入する。導入方法としては、指先採血による血液を注入部13へ直接に点着するか、注射器等で採血管へ採血された血液をピペット等の器具を使用し採血管から血液を取り出して注入部13へ点着しても良い。
【0072】
ステップS2では、導入された血液検体を血球分離部としての分離キャビティ23b,23cへ移送し、遠心力により血球成分と血漿成分を分離する。なお、血液検体としては全血に限定するものではなく、血清の導入も可能であり、その場合、分離キャビティ23b,23cの省略も可能である。また、検体の移送に関しては毛細管力、サイフォン構造および遠心力を組み合わせて行った。
【0073】
ステップS3では、分離キャビティ23b,23cで分離された血漿成分を検体定量部としての計量流路38へ移送し、任意の量の検体を定量分取する。
ステップS4では、定量された検体を検体希釈部としての混合キャビティ39へ移送し、検体を任意の希釈倍率に希釈する。この検体の希釈倍率は分析システムの検出感度や分析用デバイスに必要な液量等により設定される。
【0074】
ステップS5では、希釈された検体を希釈検体定量部としての計量流路47aへ移送し、希釈検体から任意の量の検体を定量分取する。
ステップS6では、その定量された検体を固体状態で配置された前処理試薬担持部としての操作キャビティ61へ移送する。この操作キャビティ61の試薬67a,67bで非HDLを凝集させる。
【0075】
ステップS7では、非HDL分離部としての分離キャビティ66へ移送し遠心力により非HDLの凝集を取り除く。
ステップS8では、HDLが残った上澄み部分を酵素試薬担持部としての毛細管エリア56aへ移送する。この一連の非HDLの分離除去動作は攪拌を60秒行い、その後、静置することなく500Gで30秒遠心分離することで行った。毛細管エリア56aにはコレステロールと特異的に反応し、コレステロールの濃度に応じた呈色反応する公知の酵素、色原体等の試薬58a1,58a2が固体状態で配置されている。
【0076】
ステップS9では、毛細管エリア56aでHDLコレステロール濃度に応じ呈色した検体を測定部としての測定チャンバー52aへ移送し、呈色の度合いを測定装置により光を照射しその吸光度を測定する。この検体の吸光度から、あらかじめ作成した検量線によりコレステロール濃度へと換算することで、検体中のHDLコレステロール濃度を求めることができる。
【0077】
図3は、一般人から採取した血液検体について、分析用デバイス1を使用してHDLコレステロール濃度の測定を行った結果であり、株式会社日立ハイテクノロジーズ製7020形自動分析装置によって積水メディカル株式会社製HDL−コレストロールキット「コレステストN−HDL」を使用した測定値を参照値として示した。
【0078】
本試薬を使用した分析用デバイス1によるHDLコレステロール濃度の測定では、参照値に対して相関係数0.979の良好な直線性を有しており、短時間の前処理でも十分なHDLコレステロール濃度の測定能力を有していることがわかる。また本試薬は固体状態で分析用デバイス上に配置されるため、分析用デバイス自体を小型化することが可能であり、本実施例に必要な血液検体量は十数マイクロリットルであって、少ない検体量で短時間に高精度でHDLコレステロール濃度を自動的に測定することができるので、POCTに定める所の医療の質向上や患者負担の軽減に有用である。
【0079】
上記の添加剤の選別にあたっては100±20%の範囲に入っていることを最適な添加剤の条件としたが、参照試薬が単独の場合の非HDLコレステロール除去率が25%であるのに比べると、非HDLコレステロール除去率が25%を越えて100+20%に選別の条件を拡大した場合であっても、分析装置の高性能化を実現できる。この条件に拡大することによって前記添加剤としては、図1の実験結果におけるグルタル酸、タウリン、グルシトール、ラクチトール、キシロース、スクロース、トレハロース、マルトトリオース、ラフィノース、ラクトースを添加剤とすることができる。このように条件に拡大することによって前記添加剤とできた各添加剤の添加濃度は、それぞれグルタル酸、タウリン、ラクチトール、キシロース、スクロース、トレハロース、マルトトリオース、ラフィノース、ラクトースについては5mg/ml以上、グルシトールについては5mg/ml以上20mg/ml以下程度であった。
【0080】
なお、図1の実験例では添加剤として何れかを添加して前処理試薬としての試薬67a,67bとしたが、有効な添加剤の内の何れかまたはその化合物を少なくとも1つ以上含む場合であっても同様である。
【産業上の利用可能性】
【0081】
本発明は、生物などから採取した液体の成分分析に使用する分析用デバイスの小型化ならびに高性能化に寄与できる。
【符号の説明】
【0082】
1 分析用ディスク
2 保護キャップ
3 ベース基板
4 カバー基板
5 希釈液容器
8 希釈液
9 シール部材
11a 開封リブ
13 注入口
28b 溢流流路
29b 溢流キャビティ
29c 溢流キャビティ
17 誘導部(検体導入部)
19 毛細管キャビティ
23a 受容キャビティ
23b,23c 分離キャビティ(血球分離部)
25a〜25m 空気孔
26 排出流路
27 保持キャビティ
30 連結流路
31 大気開放キャビティ
33 毛細管キャビティ
37 毛細管流路
38 計量流路(検体定量部)
39 混合キャビティ(検体希釈部)
40 希釈血漿
41 連結流路
47a 計量流路(希釈検体定量部)
47b,47c 計量流路
47d 溢流流路
48a,48b,48c,48d 屈曲部
49 凹部
50 大気開放キャビティ
52a 測定チャンバー(測定部)
52b,52c 測定チャンバー
53 保持キャビティ
54 溢流キャビティ
55 逆流防止通路
56a〜56c毛細管エリア(酵素試薬担持部)
57a1,57a2 試薬担持部
57b1,57b2,57b3 試薬担持部
57c1,57c2 試薬担持部
58b1,58b2,58b3,58c1,58c2 試薬
58a1,58a2 試薬
59 連結部
61 操作キャビティ(前処理試薬担持部)
64 連結通路
66 分離キャビティ(非HDL分離部)
67a,67b 試薬
68 連結流路
69 毛細管キャビティ
70 連結流路
71a ブラシレスモータ
80 計量流路
81a 溢流キャビティ
83 大気開放キャビティ
84 屈曲部
100 分析装置
101 ターンテーブル
103 ドア
104 クランパ
105a バネ
106 回転駆動手段
107 回転軸心
108 光学測定手段
109 制御手段
110 演算部
111 表示部
112 光源
113 フォトディテクタ
【技術分野】
【0001】
本発明は、生物学的試料の高比重リポ蛋白コレステロールを精度よく分析するための試薬および分析用デバイスに関するものである。
【背景技術】
【0002】
従来、1台の装置により血液等の生物学的試料と分析試薬と反応させ、生物学的試料中の様々な成分を定量可能な大型の自動分析装置が実用化されており、医療分野においては無くてはならない存在となっている。
【0003】
しかしながら、すべての病院においてそのような装置が導入されているわけではなく、特に診療所等の小規模な医療機関においては、運用コスト等の様々な理由により、試料の分析を外部委託するという形態をとる病院も少なくない。分析を外部委託する形態をとる場合、分析結果を得るまでに時間を要し、その結果、患者は検査結果に基づく適切な治療を受けるために、必然的に再来院を余儀なくされるという不便さや、急患等の緊急を要する場合の迅速対応が難しい等の問題がある。
【0004】
そのような背景により、医療の現場から低コスト、試料液の少量化、装置の小型化、短時間測定など、より高精度で、運用の自由度が高い分析装置の登場が望まれている。このような迅速で簡便な診断システムは、ポイント・オブ・ケア・テスティング(以下、POCT)と呼ばれ、検査の必要性が生じた時、被検者の傍らで迅速に検査結果が得られ、医療の質の向上、患者の生活の質向上ということに主眼を置いた検査として定義されている。
【0005】
POCTで定義されるような運用の自由度、および医療サービスの質を向上させることができるような分析装置を実現するためには、例えば、患者負担の少ない指先採血等で採取される少量の検体から複数種の成分濃度を短時間で高精度に測定できるという条件を満たすことが一つの理想形であろう。しかしながら、指先採血等でストレス無く得られる検体量は、せいぜい十数マイクロリットル程度であり、そのような少量の検体から前述の条件、特に複数種の成分分析を高精度に行うことは、技術的に難しい。特に、前処理を必要とする分析項目については、少量の検体に対し短時間で繰り返し精度のよい前処理を行うことが難しく、十分な測定精度を持つ製品はいまだ数少ない状況にある。
【0006】
特許文献1には、前処理用の試薬が多孔質体に担持されており、そこに検体を浸透させることにより検体の前処理(血球分離および沈澱、分離処理)を実施し、高比重リポ蛋白コレステロール(以下、HDLコレステロール)を測定している。
【先行技術文献】
【特許文献】
【0007】
【特許文献1】特公平7−66001
【発明の概要】
【発明が解決しようとする課題】
【0008】
血中のコレステロールは、脂質と蛋白質の複合体であるリポ蛋白の構成成分として体内を循環する。リポ蛋白は比重の差によって分類されており、比重の低い順にカイロミクロン、超低比重リポ蛋白、低比重リポ蛋白、高比重リポ蛋白(以下HDL)と大きく分かれている。このHDLに含まれるコレステロールがHDLコレステロールであり、俗に善玉コレステロールと呼ばれるように動脈硬化の負の因子であることが明らかとなっている。そのため、このHDLコレステロールは主に動脈硬化のリスク評価や、脂質代謝異常のスクリーニング用途に分析されている。
【0009】
HDLコレステロールの測定方法は、大きく2通りに分けることができる。
第1の分析手法は、HDL以外のリポ蛋白を沈殿、除去後、残存したHDLに含まれるHDLコレステロールを分析する手法があるが、この手法は手技により煩雑な前処理を実施しなければならない問題が存在する。また、特許文献1のように、小型の多孔質体に前処理試薬を担持させ、その多孔質体に少量の検体を浸透させることで、沈殿発生と沈殿除去処理を自動で行うドライケミストリーと呼ばれる装置も存在するが、前処理反応が多孔質体と毛細管力を利用したものであるため、多孔質体の孔径等の物理的形状のばらつきや、多孔質体内部に先に導入された検体先端部とその後に導入された検体の間の前処理試薬濃度勾配や、検体の物理特性のばらつきにより、沈殿生成除去にムラが生じやすい等の問題が存在する。また前記前処理試薬としては、ポリアニオンと二価の陽イオンからなるものが一般的であるが、そのままではドライ化時の潮解性および溶解性に問題がある。
【0010】
第2の分析手法は、ある特定の高分子材料や界面活性剤を使用することにより、HDLコレステロール以外のリポ蛋白コレステロールの反応性を阻害する等の効果を発揮し、沈殿生成、除去等の前処理行程自体を省略するものである。これは直接法と呼ばれ、現在HDLコレステロールの分析方法として主流となっているが、前記大型の自動分析装置用に開発された方法であるため、前述の通り装置が大型であったり、運用コストの問題から全ての医療機関での導入が難しい。また、試薬形状が液体であるということを前提に設計されているため、その使用には多くの機械的機構が必要であり装置の小型化も難しく、POCTとして運用するにあたっての短所を有し、POCTで定義されるような運用に至っていないというのが現状である。
【0011】
本発明は、POCTで定義されるような医療サービスの質、患者の生活の質向上を実現するために、我々は、患者負担軽減のために指先採血による十数マイクロリットル以下の血液検体で分析が可能、かつ数分という短時間で高精度に血中の目的成分を測定できるシステムが必要であると考え、それを満たすための方法としてドライケミストリー方式の測定システムを選択し、その方式において血中のHDLコレステロール濃度を正確で短時間に測定できる極めて溶解性が高く、かつ安定性の高い前処理試薬を提供することを目的とする。
【課題を解決するための手段】
【0012】
本発明の分析用試薬は、生物学的試料に含まれるHDLコレステロールを分析するに当たり、HDL以外のリポ蛋白を沈殿させる分析用試薬であって、ポリアニオン化合物と二価の陽イオン化合物の組み合わせからなる試薬中に、コハク酸またはグルコン酸またはアラニンまたはグリシンまたはバリンまたはヒスチジンまたはマルチトールの何れかまたはその化合物を少なくとも1つ以上含んだことを特徴とする。
【0013】
また、本発明の分析用試薬は、生物学的試料に含まれるHDLコレステロールを分析するに当たり、HDL以外のリポ蛋白を沈殿させる分析用試薬であって、ポリアニオン化合物と二価の陽イオン化合物の組み合わせからなる試薬中に、ジカルボン酸またはアラニンまたはグリシンまたはバリンまたはヒスチジンまたはタウリンまたは糖アルコールまたは単糖類のキシロースまたは二糖類,三糖類の内の何れかまたはその化合物を少なくとも1つ以上含んだことを特徴とする。
【0014】
具体的には、前記ジカルボン酸が、コハク酸またはグルタル酸またはグルコン酸のいずれかであることを特徴とする。
具体的には、前記糖アルコールが、マルチトールまたはグリシトールまたはラクチトールまたはマンニトールのいずれかであることを特徴とする。
【0015】
具体的には、前記二糖類が、スクロールまたはラクトースまたはトレハロースのいずれかであることを特徴とする。
具体的には、前記三糖類が、ラフィノースまたはマルトトリオースのいずれかであることを特徴とする。
【0016】
具体的には、前記ポリアニオン化合物が、リンタングステン酸、またはリンタングステン酸塩、リンモリブデン酸、またはリンモリブデン酸塩からからなる群の少なくとも一種から選択されることを特徴とする。
【0017】
具体的には、前記二価の陽イオン化合物が、マグネシウムイオン化合物、またはマグネシウムイオン化合物塩、カルシウムイオン化合物、またはカルシウムイオン化合物塩からなる群の少なくとも一種から選択されることを特徴とする。
【0018】
本発明の分析用デバイスは、試料液を遠心力によって測定チャンバーに向かって移送するマイクロチャネル構造を有し前記測定チャンバーにおける反応液にアクセスする読み取りに使用される分析用デバイスであって、ポリアニオン化合物と二価の陽イオン化合物の組み合わせからなる試薬中に、コハク酸またはグルコン酸またはアラニンまたはグリシンまたはバリンまたはヒスチジンまたはマルチトールまたはマンニトールの何れかまたはその化合物を少なくとも1つ以上含んだ固体状態の分析用試薬を、前記測定チャンバーへ到着前のマイクロチャネル構造の流路に担持していることを特徴とする。
【0019】
また、本発明の分析用デバイスは、試料液を遠心力によって測定チャンバーに向かって移送するマイクロチャネル構造を有し前記測定チャンバーにおける反応液にアクセスする読み取りに使用される分析用デバイスであって、ポリアニオン化合物と二価の陽イオン化合物の組み合わせからなる試薬中に、ジカルボン酸またはアラニンまたはグリシンまたはバリンまたはヒスチジンまたはタウリンまたは糖アルコールまたは単糖類のキシロースまたは二糖類,三糖類のうちの何れかまたはその化合物を少なくとも1つ以上含んだ固体状態の分析用試薬を、前記測定チャンバーへ到着前のマイクロチャネル構造の流路に担持していることを特徴とする。
【発明の効果】
【0020】
本発明の分析用試薬は、コハク酸またはアラニンまたはグリシンまたはバリンまたはヒスチジンまたはマルチトールまたはマンニトールから選択される化合物を少なくとも1つ以上含んでいることによって、前処理試薬の溶解性を高めることができ、短時間で前処理が可能であり、濃度勾配や検体毎に異なる物理的性質の影響を受けにくいことから均一な処理が可能である。これにより、HDLコレステロールを短時間で高精度に測定することができる。
【0021】
詳しくは、本発明の分析用試薬は、ポリアニオンと二価の陽イオンからなる公知の技術を基にするが、そのままではドライ化時の潮解性および溶解性に問題があり、前記課題を解決することができない。その課題を解決するためにドライ化時の潮解性の軽減とその溶解性を向上させたものである。
【0022】
前処理試薬の潮解性を軽減し、溶解性を向上させるための手段として、各試薬成分の塩の種類や添加剤の選定が重要になってくる。これは塩の種類や添加剤によって、潮解性の強弱や溶解性が大きく変化するからである。試薬成分の塩の種類としては、全ての化合物について当てはまるとはいえないが、例えば塩酸塩よりも硫酸塩の方が潮解性が低い傾向がある。また、添加剤については、試薬混合物の乾燥時の結晶状態を例えば巨大な結晶が析出し、溶解性の面で不利となる単結晶多寡の状態から、より溶解性の面で有利となる細かい結晶の集まりである多結晶状態やアモルファス、無結晶状態へと変化させ溶解性を向上させたり、潮解性の高い試薬成分を添加剤の結晶構造中に取り込み、コーティングするような効果で潮解性を低減させる効果を有している。ポリアニオン化合物については、非HDLを沈殿させるという機能を実現するのみであれば以下にあげる、リンタングステン酸、リンモリブデン酸、タングステン酸、モリブデン酸、それらの無機塩類、またはデキストラン硫酸、ヘパリン、硫酸アミロース、アミロペクチン硫酸等の硫酸多糖類から選択することができるが、前記条件を満たすためにはリンタングステン酸、リンモリブデン酸、またはそれらの塩から選択することが望ましく、更にいえばリンタングステン酸ナトリウムがよい。次に前記ポリアニオン化合物と組み合わされる二価の陽イオン化合物としては、非HDLを沈殿させるという機能を実現させるのみであれば以下に挙げるように、カルシウム、マグネシウム、マンガン、コバルト、ニッケル、ストロンチウム、亜鉛、バリウム、銅の2価のイオン、またはアルミニウム、鉄、クロムの二価以外のイオン、またはアンモニウムイオンから選択することができる。しかしながら前記ポリアニオンの場合と同じく前記条件を満たすためにはカルシウム、またはマグネシウムイオンから選択することが望ましく、更に化合物名でいえば、硫酸カルシウムと硫酸マグネシウムを選択することが望ましく、これらを組み合わせて用いるのがよい。非HDLを沈殿させるためには前記ポリアニオン化合物と二価の陽イオン化合物の組み合わせで実施可能であるが、前述の通り固体状態での溶解性や潮解性の低減条件を満たすためには、さらに添加剤の追加が必須である。添加剤としては糖類、アミノ酸、常温で固体のジカルボン酸またはその塩が望ましく、更に言えば糖類であればマンニトール、マルチトールが望ましく、アミノ酸であればアラニン、グリシン、ヒスチジン、ジカルボン酸であればコハク酸またはその塩が望ましく、前記ポリアニオンと二価の陽イオンの組み合わせと本発明の分析用デバイスに最も適するものはコハク酸二ナトリウムである。
【0023】
この組み合わせからなる前処理試薬は、ドライ化時の潮解性が低く、かつ生物学的試料接触時の溶解性が極めて高いという性質を有し、この前処理試薬を使用することによる分析システムを使用することにより、前記POCTの定義に合致したHDLコレステロールの測定が可能になる。
【図面の簡単な説明】
【0024】
【図1】参照試薬と参照試薬に各種の添加剤を入れた試薬の実験結果の説明図
【図2】本発明の試薬を有する分析用デバイスを使用したHDLコレステロールの分析フロー図
【図3】同分析用デバイスによるHDLコレステロールの測定値の直線性の説明図
【図4】同実施の形態の分析装置のドアを開いた状態の斜視図
【図5】同実施の形態の分析装置の断面図
【図6】同実施の形態の分析装置の構成図
【図7】同実施の形態の分析用デバイスに点着しターンテーブルにセットして回転させる前の状態図
【図8】同実施の形態において分析用デバイスを揺動させる状態図とターンテーブルを時計方向に回転駆動して測定チャンバーおよび保持キャビティに流れ込んだ状態図
【図9】同実施の形態において分析用デバイスを揺動させる状態図とターンテーブルを時計方向に回転駆動させて操作キャビティの試薬と反応した希釈血漿が分離キャビティに流れ込み、さらに高速回転を維持することで、操作キャビティ内で生成された凝集物を遠心分離する状態図
【図10】同実施の形態においてターンテーブルを停止させ希釈血漿が計量流路に流れて定量が保持された状態図と計量流路に保持されていた希釈血漿が測定チャンバーに流れ込んだ状態図
【図11】同実施の形態において測定チャンバーの希釈血漿と試薬との反応が開始される状態図と試薬と希釈血漿の攪拌の状態図
【図12】同実施の形態の分析用デバイスの図8におけるF−F断面図
【図13】同実施の形態の分析用デバイスの毛細管エリアにおける試薬の担持状態を示す拡大平面図とG−G断面図
【図14】同実施の形態の分析用デバイスの操作キャビティにおける試薬の担持状態を示す拡大平面図とH−H断面図
【発明を実施するための形態】
【0025】
以下、本発明の実施の形態を図1〜図14に基づいて説明する。
図4〜図6は分析用ディスク1とこれを使用する分析装置100を示し、図7〜図14は分析用ディスク1の内部の具体的な流路を示している。
【0026】
分析用デバイス1は、微細な凹凸形状を表面に有するマイクロチャネル構造が片面に形成されたベース基板3と、ベース基板3の表面を覆うカバー基板4とを貼り合わせたものに、試料液飛散防止用の保護キャップ2が取り付けられている。
【0027】
図7は、カバー基板4との貼り合わせ面から見たベース基板3を示しており、この図7から分かるように、分析用デバイス1の内部には、希釈液が入った希釈液容器5がセットされるとともに、収容エリアのうちの必要なものには各種の分析に必要な前処理剤としての試薬58a1,58a2,58b1,58b2,58b3,58c1,58c2,67a,67bが予め担持されている。
【0028】
保護キャップ2を開いて露出した注入口13に試料液を点着して保護キャップ2を閉じることによって、希釈液容器5が分析用デバイス1の内部で移動して開封リブ11aによってシール部材9が破られて、希釈液が希釈液容器5から流出する。
【0029】
この分析用デバイス1を、図4に示す分析装置100のターンテーブル101にセットした後にドア103を閉じると、セットされた分析用デバイス1は、図5に示すようにドア103の側に設けられたクランパ104によって、ターンテーブル101の回転軸心上の位置が付勢手段としてのバネ105aの付勢力でターンテーブル101の側に押さえられて、分析用デバイス1は回転駆動手段106のブラシレスモータ71aによって回転駆動されるターンテーブル101と一体に回転する。107はターンテーブル101の回転中の軸心を示している。
【0030】
この実施の形態では、ターンテーブル101は、傾斜した回転軸心107に取り付けられて水平線Hに対して角度θ°だけ傾斜しており、分析用デバイス1の回転停止位置に応じて、分析用デバイス1内の溶液にかかる重力の方向を制御できる。
【0031】
分析装置100の電気制御系は図6に示すように構成されている。
この分析装置100は、ターンテーブル101を回転させるための回転駆動手段106と、分析用デバイス1内の溶液を光学的に測定するための光学測定手段108と、ターンテーブル101の回転速度や回転方向および光学測定手段の測定タイミングなどを制御する制御手段109と、光学測定手段108によって得られた信号を処理し測定結果を演算するための演算部110と、演算部110で得られた結果を表示するための表示部111とで構成されている。
【0032】
回転駆動手段106は、ターンテーブル101を介して分析用デバイス1を回転軸心107の回りに任意の方向に所定の回転速度で回転させるだけではなく、所定の停止位置で回転軸心107を中心に所定の振幅範囲、周期で左右に往復運動をさせて分析用デバイス1を揺動させることができるように構成されている。
【0033】
光学測定手段108には、分析用デバイス1の測定部に特定の波長光を照射するための光源112と、光源112から照射された光のうち、分析用デバイス1を通過した透過光の光量を検出するフォトディテクタ113とを備えている。
【0034】
分析用デバイス1をターンテーブル101によって回転駆動すると、注入口13から内部に取り込んだ試料液が、注入口13よりも内周にある回転軸心107を中心に分析用デバイス1を回転させて発生する遠心力と、分析用デバイス1内に設けられた毛細管流路の毛細管力を用いて、分析用デバイス1の内部で移送していくよう構成されており、この分析用デバイス1のマイクロチャネル構造を分析工程とともに詳しく説明する。
【0035】
保護キャップ2を開いて注入口13に試料液を直接に分析用デバイス1に付けることによって、注入口13の付近に付着した試料液が誘導部17の毛細管力によって分析用デバイス1の内部に取り込まれる。図7の25a〜25mはベース基板3に形成された空気孔である。
【0036】
ドア103を閉じた後にターンテーブル101を時計方向(C2方向)に回転駆動すると、保持されている試料液が毛細管キャビティ19と受容キャビティ23aを介して分離キャビティ23b,23cに流入し、分離キャビティ23b,23cで血漿成分と血球成分とに遠心分離される。希釈液容器5から流出した希釈液は、排出流路26を介して保持キャビティ27に流入する。
【0037】
次に、ターンテーブル101の回転を停止させると、血漿成分は分離キャビティ23bの壁面に形成された毛細管キャビティ33に吸い上げられ、連結流路30を介して計量流路38に流れて定量が保持される。
【0038】
また、希釈液8は保持キャビティ27と混合キャビティ39を連結しているサイホン形状を有する連結流路41内に呼び水される。
ターンテーブル101を時計方向(C2方向)に回転駆動すると、計量流路38に保持されていた血漿成分は大気開放キャビティ31の位置で破断し、定量だけ混合キャビティ39に流れ込み、保持キャビティ27内の希釈液8も連結流路41を介して混合キャビティ39に流れ込む。
【0039】
次に、ターンテーブル101の回転を停止し、±1mm程度の揺動を分析用デバイス1に与えるようにターンテーブル101を40〜80Hzの周波数で制御して、混合キャビティ39内に移送された希釈液8と血漿成分からなる測定対象の希釈血漿40を攪拌する。
【0040】
その後に、分析用デバイス1を図8(a)に示す位置にして、±1mm程度の揺動を分析用デバイス1に与えるようにターンテーブル101を80〜200Hzの周波数で制御して、混合キャビティ39に保持される希釈血漿40を希釈血漿40の液面よりも内周側に形成された毛細管流路37の入口まで移送する。
【0041】
毛細管流路37の入口まで移送された希釈血漿40は、毛細管力によって毛細管流路37内に吸い出され、毛細管流路37、計量流路47a,47b,47c、溢流流路47dに順次移送される。
【0042】
ターンテーブル101を時計方向(C2方向)に回転駆動すると、図8(b)に示すように、計量流路47a,47b,47cに保持されていた希釈血漿40は、大気と連通する大気開放キャビティ50との連結部である屈曲部48a,48b,48c,48dの位置で破断して、定量だけ測定チャンバー52b,52cおよび保持キャビティ53に流れ込む。
【0043】
また、このとき溢流流路47dに保持されていた希釈血漿40は、逆流防止通路55を介して溢流キャビティ54に流れ込む。また、このとき毛細管流路37内の希釈血漿40は、溢流キャビティ29b,溢流流路28bを介して溢流キャビティ29cに流れ込む。計量流路47aの一部の側壁は屈曲部48aの近傍に大気開放キャビティ50と連通するよう凹部49が形成されている。測定チャンバー52a〜50cの形状は、遠心力の働く方向に伸長した形状で、分析用デバイス1の回転中心から最外周に向かって分析用デバイス1の周方向の幅が細く形成されている。複数の測定チャンバー52a〜52cの外周側の底部は、分析用デバイス1の同一半径上に配置されている。
【0044】
さらに、各測定チャンバー52a〜52cの周方向に位置する側壁の一側壁には、前記測定チャンバーの外周位置から内周方向に伸長するように毛細管エリア56a〜56cが形成されている。図8(b)におけるF−F断面を図12に示す。
【0045】
測定チャンバー52a〜52cの光路長は、それぞれの検査対象の成分と試薬を反応させた後の混合溶液から得られる吸光度の範囲によって調整されている。
また、毛細管エリア56a,56b,56c内には図13(a)に示すように、それぞれの検査対象の成分と反応させるための試薬58a1,58a2,58b1,58b2,58b3,58c1,58c2が、毛細管エリア56a,56b,56c内に形成された試薬担持部57a1,57a2,57b1,57b2,57b3,57c1,57c2に担持されている。図13(a)におけるG−G断面を図13(b)に示す。
【0046】
試薬担持部57b1,57b2,57b3のカバー基板4との隙は、毛細管エリア56bのカバー基板4との隙より薄くなるよう毛細管エリア56bより突出して形成している。
【0047】
毛細管エリア56bは、50〜300μm程度の毛細管力が作用する隙で形成しているため、試薬担持部57b1,57b2,57b3は毛細管エリア56bよりも数十μm程度突出するように形成している。毛細管エリア56a,56cにおいても同様に構成されている。
【0048】
次に、ターンテーブル101の回転を停止し、分析用デバイス1を図9(a)に示す位置にして、±1mm程度の揺動を分析用デバイス1に与えるようにターンテーブル101を60〜120Hzの周波数で制御して、保持キャビティ53に保持される希釈血漿40を希釈血漿40の液面に浸かるよう保持キャビティ53の側壁に形成された連結部59を介して毛細管力の作用により操作キャビティ61に移送する。
【0049】
さらにターンテーブル101を120〜200Hzの周波数で制御して、図14(a)に示す操作キャビティ61に担持された試薬67a,67bと希釈血漿40を攪拌し、希釈血漿40内に含まれる特定の成分と試薬を反応させる。ここで操作キャビティ61は測定チャンバー52aへ到着前のマイクロチャネル構造の流路である。
【0050】
また、測定チャンバー52b,52cに移送された希釈血漿40は、毛細管力によって図9(a)に示すように毛細管エリア56b,56cに吸い上げられ、この時点で試薬58b1,58b2,58b3,58c1,58c2の溶解が開始され、希釈血漿40内に含まれる特定の成分と試薬の反応が開始される。
【0051】
次に、ターンテーブル101を時計方向(C2方向)に回転駆動すると、図9(b)に示すように、操作キャビティ61の試薬と反応した希釈血漿が連結通路64を通過して分離キャビティ66に流れ込み、さらに高速回転を維持することで、操作キャビティ61内で生成された凝集物を遠心分離する。ここで、この実施の形態では、検査対象の成分と試薬を反応させる際に、前記反応を阻害する成分を前工程で排除するよう構成しており、操作キャビティ61で希釈血漿を試薬と反応させることで、後工程の反応を阻害する特定の成分を凝集処理し、次工程で遠心分離することで前記凝集物を排除している。
【0052】
また、毛細管エリア56b,56cに保持されていた試薬と希釈血漿の混合溶液は、遠心力によって測定チャンバー52b,52cの外周側に移送することで、試薬と希釈血漿の攪拌が行われる。
【0053】
次に、ターンテーブル101の回転を停止させると、希釈血漿40は分離キャビティ66の壁面に形成された毛細管キャビティ69に吸い上げられ、毛細管キャビティ69と連通する連結流路70を介して図10(a)に示すように計量流路80に流れて定量が保持される。
【0054】
また、分離キャビティ66内の凝集物を含む希釈血漿40は、分離キャビティ66と溢流キャビティ81aを連結しているサイホン形状を有する連結流路68内に呼び水される。
【0055】
また、測定チャンバー52b,52cに移送された試薬と希釈血漿の混合溶液は、毛細管力によって再び毛細管エリア56b,56cに吸い上げられる。
ターンテーブル101を時計方向(C2方向)に回転駆動すると、図10(b)に示すように、計量流路80に保持されていた希釈血漿40は、大気と連通する大気開放キャビティ83との連結部である屈曲部84の位置で破断して、定量だけ測定チャンバー52aに流れ込む。
【0056】
また、分離キャビティ66および連結通路70、毛細管キャビティ69内の希釈血漿40はサイホン形状の連結流路68を介して溢流キャビティ81aに流れ込む。
また、毛細管エリア56b,56cに保持されていた試薬と希釈血漿の混合溶液は、遠心力によって測定チャンバー52b,52cの外周側に移送することで、試薬と希釈血漿の攪拌が行われる。
【0057】
次に、ターンテーブル101の回転を停止させると、測定チャンバー52aに移送された希釈血漿40は、毛細管力によって図11(a)に示すように毛細管エリア56aに吸い上げられ、この時点で試薬58a1,58a2の溶解が開始され、希釈血漿40内に含まれる特定の成分と試薬の反応が開始される。
【0058】
また、測定チャンバー52b,52cに移送された試薬と希釈血漿の混合溶液は、毛細管力によって再び毛細管エリア56b,56cに吸い上げられる。
ターンテーブル101を時計方向(C2方向)に回転駆動すると、図11(b)に示すように、毛細管エリア56a,56b,56cに保持されていた試薬と希釈血漿の混合溶液は、遠心力によって測定チャンバー52a,52b,52cの外周側に移送することで、試薬と希釈血漿の攪拌が行われる。
【0059】
分析用デバイス1を反時計方向(C1方向)または時計方向(C2方向)に回転駆動して、各測定チャンバー52a,52b,52cが光源112とフォトディテクタ113の間を通過するタイミングに、演算部110がフォトディテクタ113の検出値を読み取って、特定成分の濃度を算出する。
【0060】
測定チャンバー52aにおいてHDLコレステロールを定量測定する場合には、試薬67a,67bとして、次のように調製したものを使用している。
血液検体から、HDL以外のリポ蛋白である非HDLを除去するにあたっては、ポリアニオンと二価の陽イオンが必要である。一般的にポリアニオンとしては前述の通りリンタングステン酸、リンモリブデン酸、タングステン酸、モリブデン酸、それらの無機塩類、またはデキストラン硫酸、ヘパリン、硫酸アミロース、アミロペクチン硫酸等の硫酸多糖類からなる群より選択することができるが、溶解性や分析用デバイス上に固体状態で長期間安定に配置する必要性があることを考慮した場合、これらの内の無機化合物が望ましく、リンタングステン酸、またはリンタングステン酸塩、リンモリブデン酸、またはリンモリブデン酸塩からなる群の少なくとも一種から選択されることが望ましい。二価の陽イオンとしては、前述の通りカルシウム、マグネシウム、マンガン、コバルト、ニッケル、ストロンチウム、亜鉛、バリウム、銅のイオンからなる群の少なくとも一種より選択できるが、分析用デバイス内で酵素による反応を行うことを考慮すると、酵素を失活させる可能性を有する金属イオンは望ましくなく、入手難易度を考慮するとカルシウムおよびマグネシウムから選択することが望ましい。さらに溶解性を考慮するとマグネシウムが望ましく、また潮解性を考慮すると硫酸塩つまり硫酸マグネシウムを使用することが望ましい。また、さらに前記リンタングステン酸ナトリウムと硫酸マグネシウム混合物に硫酸カルシウムを添加することが望ましく、これは結晶状態を変化させ試薬の溶解性を向上させる働きを有している。
【0061】
リンタングステン酸ナトリウム 20mg/ml
硫酸マグネシウム 40mg/ml
硫酸カルシウム 12mM
コハク酸二ナトリウム 15mg/ml
非HDLの除去方法は、まず上記組成の試薬を調整し試験管へ20μl滴下し、乾燥させた。一般人から採取した血液検体をリン酸緩衝生理食塩水(pH7.4)で4倍に希釈し、その検体200μlを前記乾燥させた試薬へ加え、ボルテックスミキサーにより45秒攪拌後、75秒静置し、生じた非HDLの凝集を1500Gで30秒間遠心分離した。検体の希釈倍率は2倍以上であれば本実施例の試薬がそのまま適用可能であるが、それ以下の検体希釈倍率の場合は各試薬成分の濃度を調整することで適用可能である。非HDLが除去された上澄み液を分取し、液中のコレステロール(HDLコレステロールに当る)を、株式会社日立ハイテクノロジーズ製7020形自動分析装置によって積水メディカル株式会社製「コレステスト−CHO」を使用して測定した。
【0062】
試薬の潮解性の判断方法としては、試薬を樹脂基板上に乾燥担持し、気温30℃湿度80%の条件下で30分暴露後、樹脂基板水平方向に遠心力がかかるように500Gで遠心し、遠心力方向への試薬の流れ出しの有無により潮解性の有無を判断した。この潮解性の有無の判断については、分析用デバイス1は、内部の検体移送等に遠心力を利用しており、それにより遠心力がかかった状態で試薬が飛散しないことが重要な判断基準になることを理由としている。
【0063】
上記手順による非HDLコレステロールの除去率と潮解性の有無について本試薬とコハク酸二ナトリウムを含まない参照試薬、およびコハク酸二ナトリウム以外の添加剤を添加した試薬についての比較を実験結果を示す図1に示した。
【0064】
ここでは前記添加剤として、図1に示すように下記のものを実験した。
ジカルボン酸では、コハク酸二ナトリウム、グルタル酸、グルコン酸ナトリウムを実験した。
【0065】
アミノ酸では、アラニン、グリシン、アスパラギン、グルタミン、グルタミン酸ナトリウム、バリン、ヒスチジン、メチオニン、アスパラギン酸ナトリウム、チロシン、トリプトファン、フェニルアラニン、ロイシン、プロリン、リシン・HCl、アルギニン、システイン、ヒスチジン・HCl、トレオニン、セリン、グリシルグリシン、アセチルグリシリン、アミノ酸様化合物であるタウリンを実験した。
【0066】
糖アルコールでは、マルチトール、グルシトール、ラクチトール、マンニトールを実験した。
糖類では、単糖類ではグルコース、キシロースを実験し、二糖類ではスクロース、トレハロースを実験し、三糖類ではマルトトリオース、ラフィノース、ラクトースを実験した。
【0067】
非HDLコレステロール除去率が100%を大きく超えているものについては、HDLコレステロール自体も除去される過剰または異常な反応を起こしていると推測される。また潮解性については添加剤の種類と濃度が重要なファクターであり、図1の潮解性の欄には参考として潮解しにくい添加濃度条件について示している。添加剤を含まない参照試薬の非HDLコレステロール除去率25%を上回る有効な添加剤は数多く存在することがわかるが、さらにより短い時間での検体中の非HDLコレステロールの除去、および分析用デバイス上に安定に固体状態で配置するための潮解性の無さが重要である。
【0068】
図1より、コハク酸二ナトリウムを含まない公知の参照試薬では非HDLコレステロールの除去が25%と不十分で、かつ潮解性を有するのに対し、コハク酸二ナトリウムを含んだ本試薬は非HDLコレステロールの除去が92%と高い除去率と潮解性の無さを両立させている。
【0069】
また非HDLコレステロール除去率については100±20%の範囲に入っていることを最適な添加剤の条件とし、その結果、最適な添加剤として、コハク酸二ナトリウム以外では、グルコン酸ナトリウム、アラニン、グリシンまたはバリン、ヒスチジン、マルチトールおよびマンニトールも優れた除去率、および潮解性の無さを有している。
【0070】
また、これらの添加剤について潮解性を低減する添加濃度についてはコハク酸二ナトリウム、グルコン酸ナトリウム、アラニン、グリシンまたはバリンおよびヒスチジンについては5mg/ml以上、マルチトールとマンニトールでは1mg/ml以上10mg/ml以下の濃度で効果を有している。
【0071】
前記の本試薬を、分析用デバイス1の操作キャビティ61の上に固体状態で配置して
HDLコレステロール濃度を測定する場合を、図2により説明する。
まず、ステップS1では、血液検体を検体導入部としての誘導部17へ導入する。導入方法としては、指先採血による血液を注入部13へ直接に点着するか、注射器等で採血管へ採血された血液をピペット等の器具を使用し採血管から血液を取り出して注入部13へ点着しても良い。
【0072】
ステップS2では、導入された血液検体を血球分離部としての分離キャビティ23b,23cへ移送し、遠心力により血球成分と血漿成分を分離する。なお、血液検体としては全血に限定するものではなく、血清の導入も可能であり、その場合、分離キャビティ23b,23cの省略も可能である。また、検体の移送に関しては毛細管力、サイフォン構造および遠心力を組み合わせて行った。
【0073】
ステップS3では、分離キャビティ23b,23cで分離された血漿成分を検体定量部としての計量流路38へ移送し、任意の量の検体を定量分取する。
ステップS4では、定量された検体を検体希釈部としての混合キャビティ39へ移送し、検体を任意の希釈倍率に希釈する。この検体の希釈倍率は分析システムの検出感度や分析用デバイスに必要な液量等により設定される。
【0074】
ステップS5では、希釈された検体を希釈検体定量部としての計量流路47aへ移送し、希釈検体から任意の量の検体を定量分取する。
ステップS6では、その定量された検体を固体状態で配置された前処理試薬担持部としての操作キャビティ61へ移送する。この操作キャビティ61の試薬67a,67bで非HDLを凝集させる。
【0075】
ステップS7では、非HDL分離部としての分離キャビティ66へ移送し遠心力により非HDLの凝集を取り除く。
ステップS8では、HDLが残った上澄み部分を酵素試薬担持部としての毛細管エリア56aへ移送する。この一連の非HDLの分離除去動作は攪拌を60秒行い、その後、静置することなく500Gで30秒遠心分離することで行った。毛細管エリア56aにはコレステロールと特異的に反応し、コレステロールの濃度に応じた呈色反応する公知の酵素、色原体等の試薬58a1,58a2が固体状態で配置されている。
【0076】
ステップS9では、毛細管エリア56aでHDLコレステロール濃度に応じ呈色した検体を測定部としての測定チャンバー52aへ移送し、呈色の度合いを測定装置により光を照射しその吸光度を測定する。この検体の吸光度から、あらかじめ作成した検量線によりコレステロール濃度へと換算することで、検体中のHDLコレステロール濃度を求めることができる。
【0077】
図3は、一般人から採取した血液検体について、分析用デバイス1を使用してHDLコレステロール濃度の測定を行った結果であり、株式会社日立ハイテクノロジーズ製7020形自動分析装置によって積水メディカル株式会社製HDL−コレストロールキット「コレステストN−HDL」を使用した測定値を参照値として示した。
【0078】
本試薬を使用した分析用デバイス1によるHDLコレステロール濃度の測定では、参照値に対して相関係数0.979の良好な直線性を有しており、短時間の前処理でも十分なHDLコレステロール濃度の測定能力を有していることがわかる。また本試薬は固体状態で分析用デバイス上に配置されるため、分析用デバイス自体を小型化することが可能であり、本実施例に必要な血液検体量は十数マイクロリットルであって、少ない検体量で短時間に高精度でHDLコレステロール濃度を自動的に測定することができるので、POCTに定める所の医療の質向上や患者負担の軽減に有用である。
【0079】
上記の添加剤の選別にあたっては100±20%の範囲に入っていることを最適な添加剤の条件としたが、参照試薬が単独の場合の非HDLコレステロール除去率が25%であるのに比べると、非HDLコレステロール除去率が25%を越えて100+20%に選別の条件を拡大した場合であっても、分析装置の高性能化を実現できる。この条件に拡大することによって前記添加剤としては、図1の実験結果におけるグルタル酸、タウリン、グルシトール、ラクチトール、キシロース、スクロース、トレハロース、マルトトリオース、ラフィノース、ラクトースを添加剤とすることができる。このように条件に拡大することによって前記添加剤とできた各添加剤の添加濃度は、それぞれグルタル酸、タウリン、ラクチトール、キシロース、スクロース、トレハロース、マルトトリオース、ラフィノース、ラクトースについては5mg/ml以上、グルシトールについては5mg/ml以上20mg/ml以下程度であった。
【0080】
なお、図1の実験例では添加剤として何れかを添加して前処理試薬としての試薬67a,67bとしたが、有効な添加剤の内の何れかまたはその化合物を少なくとも1つ以上含む場合であっても同様である。
【産業上の利用可能性】
【0081】
本発明は、生物などから採取した液体の成分分析に使用する分析用デバイスの小型化ならびに高性能化に寄与できる。
【符号の説明】
【0082】
1 分析用ディスク
2 保護キャップ
3 ベース基板
4 カバー基板
5 希釈液容器
8 希釈液
9 シール部材
11a 開封リブ
13 注入口
28b 溢流流路
29b 溢流キャビティ
29c 溢流キャビティ
17 誘導部(検体導入部)
19 毛細管キャビティ
23a 受容キャビティ
23b,23c 分離キャビティ(血球分離部)
25a〜25m 空気孔
26 排出流路
27 保持キャビティ
30 連結流路
31 大気開放キャビティ
33 毛細管キャビティ
37 毛細管流路
38 計量流路(検体定量部)
39 混合キャビティ(検体希釈部)
40 希釈血漿
41 連結流路
47a 計量流路(希釈検体定量部)
47b,47c 計量流路
47d 溢流流路
48a,48b,48c,48d 屈曲部
49 凹部
50 大気開放キャビティ
52a 測定チャンバー(測定部)
52b,52c 測定チャンバー
53 保持キャビティ
54 溢流キャビティ
55 逆流防止通路
56a〜56c毛細管エリア(酵素試薬担持部)
57a1,57a2 試薬担持部
57b1,57b2,57b3 試薬担持部
57c1,57c2 試薬担持部
58b1,58b2,58b3,58c1,58c2 試薬
58a1,58a2 試薬
59 連結部
61 操作キャビティ(前処理試薬担持部)
64 連結通路
66 分離キャビティ(非HDL分離部)
67a,67b 試薬
68 連結流路
69 毛細管キャビティ
70 連結流路
71a ブラシレスモータ
80 計量流路
81a 溢流キャビティ
83 大気開放キャビティ
84 屈曲部
100 分析装置
101 ターンテーブル
103 ドア
104 クランパ
105a バネ
106 回転駆動手段
107 回転軸心
108 光学測定手段
109 制御手段
110 演算部
111 表示部
112 光源
113 フォトディテクタ
【特許請求の範囲】
【請求項1】
生物学的試料に含まれる高比重リポ蛋白コレステロールを分析するに当たり、高比重リポ蛋白以外のリポ蛋白を沈殿させる分析用試薬であって、
ポリアニオン化合物と二価の陽イオン化合物の組み合わせからなる試薬中に、コハク酸
またはグルコン酸またはアラニンまたはグリシンまたはバリンまたはヒスチジンまたはマルチトールまたはマンニトールの内の何れかまたはその化合物を少なくとも1つ以上含んだことを特徴とする分析用試薬。
【請求項2】
生物学的試料に含まれる高比重リポ蛋白コレステロールを分析するに当たり、高比重リポ蛋白以外のリポ蛋白を沈殿させる分析用試薬であって、
ポリアニオン化合物と二価の陽イオン化合物の組み合わせからなる試薬中に、ジカルボン酸またはアラニンまたはグリシンまたはバリンまたはヒスチジンまたはタウリンまたは糖アルコールまたは単糖類のキシロースまたは二糖類,三糖類の内の何れかまたはその化合物を少なくとも1つ以上含んだことを特徴とする分析用試薬。
【請求項3】
前記ジカルボン酸が、コハク酸またはグルタル酸またはグルコン酸のいずれかである
請求項2記載の分析用試薬。
【請求項4】
前記糖アルコールが、マルチトールまたはグリシトールまたはラクチトールまたはマンニトールのいずれかである
請求項2記載の分析用試薬。
【請求項5】
前記二糖類が、スクロールまたはラクトースまたはトレハロースのいずれかである
請求項2記載の分析用試薬。
【請求項6】
前記三糖類が、ラフィノースまたはマルトトリオースのいずれかである
請求項2記載の分析用試薬。
【請求項7】
前記ポリアニオン化合物が、リンタングステン酸、またはリンタングステン酸塩、リンモリブデン酸、またはリンモリブデン酸塩からからなる群の少なくとも一種から選択されることを特徴とする
請求項1または請求項2記載の分析用試薬。
【請求項8】
前記二価の陽イオン化合物が、マグネシウムイオン化合物、またはマグネシウムイオン化合物塩、カルシウムイオン化合物、またはカルシウムイオン化合物塩からなる群の少なくとも一種から選択されることを特徴とする
請求項1または請求項2記載の分析用試薬。
【請求項9】
試料液を遠心力によって測定チャンバーに向かって移送するマイクロチャネル構造を有し前記測定チャンバーにおける反応液にアクセスする読み取りに使用される分析用デバイスであって、
ポリアニオン化合物と二価の陽イオン化合物の組み合わせからなる試薬中に、
コハク酸またはグルコン酸またはアラニンまたはグリシンまたはバリンまたはヒスチジンまたはマルチトールまたはマンニトールの何れかまたはその化合物を少なくとも1つ以上含んだ固体状態の分析用試薬を、前記測定チャンバーへ到着前のマイクロチャネル構造の流路に担持している
分析用デバイス。
【請求項10】
試料液を遠心力によって測定チャンバーに向かって移送するマイクロチャネル構造を有し前記測定チャンバーにおける反応液にアクセスする読み取りに使用される分析用デバイスであって、
ポリアニオン化合物と二価の陽イオン化合物の組み合わせからなる試薬中に、ジカルボン酸またはアラニンまたはグリシンまたはバリンまたはヒスチジンまたはタウリンまたは糖アルコールまたは単糖類のキシロースまたは二糖類,三糖類のうちの何れかまたはその化合物を少なくとも1つ以上含んだ固体状態の分析用試薬を、前記測定チャンバーへ到着前のマイクロチャネル構造の流路に担持している
分析用デバイス。
【請求項1】
生物学的試料に含まれる高比重リポ蛋白コレステロールを分析するに当たり、高比重リポ蛋白以外のリポ蛋白を沈殿させる分析用試薬であって、
ポリアニオン化合物と二価の陽イオン化合物の組み合わせからなる試薬中に、コハク酸
またはグルコン酸またはアラニンまたはグリシンまたはバリンまたはヒスチジンまたはマルチトールまたはマンニトールの内の何れかまたはその化合物を少なくとも1つ以上含んだことを特徴とする分析用試薬。
【請求項2】
生物学的試料に含まれる高比重リポ蛋白コレステロールを分析するに当たり、高比重リポ蛋白以外のリポ蛋白を沈殿させる分析用試薬であって、
ポリアニオン化合物と二価の陽イオン化合物の組み合わせからなる試薬中に、ジカルボン酸またはアラニンまたはグリシンまたはバリンまたはヒスチジンまたはタウリンまたは糖アルコールまたは単糖類のキシロースまたは二糖類,三糖類の内の何れかまたはその化合物を少なくとも1つ以上含んだことを特徴とする分析用試薬。
【請求項3】
前記ジカルボン酸が、コハク酸またはグルタル酸またはグルコン酸のいずれかである
請求項2記載の分析用試薬。
【請求項4】
前記糖アルコールが、マルチトールまたはグリシトールまたはラクチトールまたはマンニトールのいずれかである
請求項2記載の分析用試薬。
【請求項5】
前記二糖類が、スクロールまたはラクトースまたはトレハロースのいずれかである
請求項2記載の分析用試薬。
【請求項6】
前記三糖類が、ラフィノースまたはマルトトリオースのいずれかである
請求項2記載の分析用試薬。
【請求項7】
前記ポリアニオン化合物が、リンタングステン酸、またはリンタングステン酸塩、リンモリブデン酸、またはリンモリブデン酸塩からからなる群の少なくとも一種から選択されることを特徴とする
請求項1または請求項2記載の分析用試薬。
【請求項8】
前記二価の陽イオン化合物が、マグネシウムイオン化合物、またはマグネシウムイオン化合物塩、カルシウムイオン化合物、またはカルシウムイオン化合物塩からなる群の少なくとも一種から選択されることを特徴とする
請求項1または請求項2記載の分析用試薬。
【請求項9】
試料液を遠心力によって測定チャンバーに向かって移送するマイクロチャネル構造を有し前記測定チャンバーにおける反応液にアクセスする読み取りに使用される分析用デバイスであって、
ポリアニオン化合物と二価の陽イオン化合物の組み合わせからなる試薬中に、
コハク酸またはグルコン酸またはアラニンまたはグリシンまたはバリンまたはヒスチジンまたはマルチトールまたはマンニトールの何れかまたはその化合物を少なくとも1つ以上含んだ固体状態の分析用試薬を、前記測定チャンバーへ到着前のマイクロチャネル構造の流路に担持している
分析用デバイス。
【請求項10】
試料液を遠心力によって測定チャンバーに向かって移送するマイクロチャネル構造を有し前記測定チャンバーにおける反応液にアクセスする読み取りに使用される分析用デバイスであって、
ポリアニオン化合物と二価の陽イオン化合物の組み合わせからなる試薬中に、ジカルボン酸またはアラニンまたはグリシンまたはバリンまたはヒスチジンまたはタウリンまたは糖アルコールまたは単糖類のキシロースまたは二糖類,三糖類のうちの何れかまたはその化合物を少なくとも1つ以上含んだ固体状態の分析用試薬を、前記測定チャンバーへ到着前のマイクロチャネル構造の流路に担持している
分析用デバイス。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【公開番号】特開2011−47835(P2011−47835A)
【公開日】平成23年3月10日(2011.3.10)
【国際特許分類】
【出願番号】特願2009−197508(P2009−197508)
【出願日】平成21年8月28日(2009.8.28)
【出願人】(000005821)パナソニック株式会社 (73,050)
【Fターム(参考)】
【公開日】平成23年3月10日(2011.3.10)
【国際特許分類】
【出願日】平成21年8月28日(2009.8.28)
【出願人】(000005821)パナソニック株式会社 (73,050)
【Fターム(参考)】
[ Back to top ]

