分析装置、試料操作針および試料取り出し方法
【課題】 DNA等の微小な試料を分析・操作する分析装置を、小型で、かつ、安価に実現すること。
【解決手段】 分析装置1において、微小流路24c内を移動する試料からの蛍光を測定するための光学系を内蔵する。具体的には、試料の蛍光を励起するための光を発生させる光源と、その光源からの光を微小流路24c内に導くライトガイド(光案内手段)とが設けられ、微小流路24cの試料の蛍光を良好に励起するように構成される。そして、試料の蛍光を観測するために、微小流路24cの壁面に設けられ、試料からの蛍光を捕捉する集光光学素子26とセンサ部11とを設けることで微小流路内24c内の試料の蛍光を良好に観測できる。
【解決手段】 分析装置1において、微小流路24c内を移動する試料からの蛍光を測定するための光学系を内蔵する。具体的には、試料の蛍光を励起するための光を発生させる光源と、その光源からの光を微小流路24c内に導くライトガイド(光案内手段)とが設けられ、微小流路24cの試料の蛍光を良好に励起するように構成される。そして、試料の蛍光を観測するために、微小流路24cの壁面に設けられ、試料からの蛍光を捕捉する集光光学素子26とセンサ部11とを設けることで微小流路内24c内の試料の蛍光を良好に観測できる。
【発明の詳細な説明】
【0001】
【発明の属する技術分野】この発明は、MEMS(Micro Electro Mechanical Systems)やMOEMS(Micro Opto Electro Mechanical Systems)等の技術を用いて、DNA(deoxyribonucleic acid)の解析等のように生物的または生化学的な微小試料を分析する分析装置、そのような分析のための試料操作針、および、その試料操作針を用いた試料取り出し方法に関する。
【0002】
【従来の技術】従来より、微小流路を流れる溶液中の試料(DNA等の微小物質)の蛍光を計測して、各種の分析を行う装置(いわゆる、μTAS等と呼ばれる装置)が研究されている。この装置において蛍光の計測は、微小流路に励起光を投光するための光源や光学系、および、蛍光を計測するための光学系や光検出素子を微小流路が形成された装置の周辺に個別に組み立てることによって実現されている。このため、組み立てられたシステム全体として分析装置としての機能を有するのである。
【0003】このような装置の一例が米国特許5858195号公報に開示されている。この装置は、試料に対する複雑な生物的または生化学的な操作(分析や合成)を電子的な制御により約5cm×2.5cm程度の大きさの分析チップ(マイクロチップ)上で行うように構成されている。具体的には、分析チップ上に、化学物質を貯める複数の貯水槽と、複数の貯水槽を結ぶ微小流路とが形成されており、各貯水槽はそれぞれが制御された電気ポテンシャルを有しており、そのポテンシャルによって各貯水槽間で試料が微小流路を移動するように構成されている。
【0004】試料を測定する検出器として、例えば、光学的な吸収、屈折率変化、蛍光発光、化学発光、種々のラマンスペクトル、電気伝導度、電気化学的電流、音波伝播などを検出するようなものを使用することで試料の特性等を検出することができる。
【0005】分析チップにて分析を行う際には、DNAを制限酵素により異なる長さの断片に分けた後、各断片を電気泳動によって微小流路中を移動させる。微小流路中のある一点では、蛍光を励起するためのレーザ光等の光が外部より与えられており、その一点を断片が通過するときに所定の蛍光染料が励起され、その蛍光特性を外部に設置される受光光学系によって検出することで断片の分析が行われる。
【0006】
【発明が解決しようとする課題】しかしながら、上記のような従来の技術では、分析チップの外部から蛍光を励起するためのレーザ光等を投光する光学系や、蛍光を計測するための光学系等が分析チップの周辺に設置されることで分析システムとして機能するものであるため、システム全体のサイズやコストが大きくなるという問題を有している。また、微小流路が形成された分析チップの周辺に各部材を配置する際の準備や位置調整に多大な手間がかかることになり、効率よく分析を行うことができないという問題を有している。
【0007】また、光学系等を調整して蛍光計測の感度やSN比を向上させようとしても、比較的低いレベルで限界に到達し、それ以上に向上させることは困難になる。
【0008】さらに、安定した分析を効率よく繰り返して行うためには、試料の供給および取り出し、分析チップの交換等を自動的に行うことが望まれる。また、試料の取り出しを行う際には、複雑な操作を行うことなく簡単に対象となる試料を取り出せることが望まれる。
【0009】この発明は、上記課題に鑑みてなされたものであって、小型で、かつ、安価に実現できる分析装置を提供するとともに、試料の取り出しを容易に行うことのできる試料操作針および試料取り出し方法を提供することを目的とする。
【0010】
【課題を解決するための手段】上記目的を達成するために、請求項1に記載の発明は、微小流路内を移動する試料からの蛍光を測定して前記試料の特性を分析する分析装置であって、前記試料の蛍光を励起するための光を発生させる光源と、前記光源からの光を前記微小流路内に導く光案内手段と、前記微小流路の壁面に設けられ、前記試料からの蛍光を捕捉する集光光学素子と、前記集光光学素子で捕捉された光を検出する光検出素子とを備えている。
【0011】請求項2に記載の発明は、請求項1に記載の分析装置において、前記試料を前記微小流路内において前記集光光学素子に近づける偏向手段をさらに備えている。
【0012】請求項3に記載の発明は、請求項2に記載の分析装置において、前記偏向手段が、前記集光光学素子近傍で前記微小流路に面して設けられた第1の電極と、前記第1の電極に対向する位置であって、前記微小流路に面して設けられた第2の電極とを備えており、前記第1の電極と前記第2の電極との間に所定の電界を与えることにより前記試料を前記集光光学素子に近づけることを特徴としている。
【0013】請求項4に記載の発明は、請求項1ないし請求項3のいずれかに記載の分析装置において、前記試料を所定の供給位置に供給する第1のマイクロマニピュレータをさらに備えている。
【0014】請求項5に記載の発明は、請求項4に記載の分析装置において、前記試料を収容する複数の容器を搭載可能であって、前記複数の容器のうちの任意の容器を選択的に前記第1のマイクロマニピュレータの操作可能範囲内に移動させる手段をさらに備えている。
【0015】請求項6に記載の発明は、請求項1ないし請求項5のいずれかに記載の分析装置において、前記光検出素子にて検出される光の特性に応じて、前記微小流路を移動する前記試料に含まれる特定の試料を抽出する抽出手段をさらに備えている。
【0016】請求項7に記載の発明は、請求項6に記載の分析装置において、前記微小流路は所定位置にて複数方向に分岐しており、前記抽出手段が、前記複数方向のうちから前記試料の移動方向を選択的に切り換えることによって、前記特定の試料を前記複数方向のうちの一の方向に導くことで抽出することを特徴としている。
【0017】請求項8に記載の発明は、請求項6に記載の分析装置において、前記抽出手段が、前記微小流路中の前記特定の試料との結合性を有する物質が付着されたエンドエフェクタを含む第2のマイクロマニピュレータを備えており、前記第2のマイクロマニピュレータが前記エンドエフェクタの前記物質を前記微小流路中に配置することで前記特定の試料を抽出することを特徴としている。
【0018】請求項9に記載の発明は、請求項7に記載の分析装置において、前記複数方向のうちの一の方向に導かれた前記特定の試料を含む溶液を取り出す第2のマイクロマニピュレータをさらに備えている。
【0019】請求項10に記載の発明は、請求項9に記載の分析装置において、前記特定の試料を含む溶液を保管するための複数の容器を搭載可能であって、前記複数の容器のうちの任意の容器を選択的に前記第2のマイクロマニピュレータの操作可能範囲内に移動させる手段をさらに備えている。
【0020】請求項11に記載の発明は、請求項8ないし請求項10のいずれかに記載の分析装置において、前記第2のマイクロマニピュレータの先端部に装着されるエンドエフェクタを複数保持可能なホルダをさらに備えており、前記第2のマイクロマニピュレータが、前記エンドエフェクタを前記ホルダに保持される複数のエンドエフェクタと交換することを特徴としている。
【0021】請求項12に記載の発明は、請求項1ないし請求項11のいずれかに記載の分析装置において、前記光源と前記光検出素子とが設けられたセンサユニットに対して、前記微小流路と前記光案内手段と前記集光光学素子とが設けられた分析チップが着脱自在に構成されており、前記分析チップが前記センサユニットに対して装着された際に、前記光源からの光が前記光案内手段を介して前記微小流路に導かれ、前記集光光学素子によって捕捉された前記蛍光が前記光検出素子に導かれるとともに、前記試料を移動させるためのエネルギーが前記センサユニットから前記分析チップに対して供給されることを特徴としている。
【0022】請求項13に記載の発明は、請求項12に記載の分析装置において、前記センサユニットに隣接して設置され、前記センサユニットに対して前記分析チップを供給して装着を行うとともに、前記センサユニットに装着された前記分析チップの回収を行う分析チップ交換手段をさらに備えている。
【0023】請求項14に記載の発明は、抽出対象となる微小な試料を所定の溶液中から取り出すための試料操作針であって、先端部が微小径で形成されており、前記先端部に前記試料と生物的または生化学的な結合性を有する物質が付着されていることを特徴としている。
【0024】請求項15に記載の発明は、先端部が微小径で形成されており、抽出対象となる試料と生物的または生化学的な結合性を有する物質が前記先端部に付着された試料操作針を用いて、前記試料を所定の溶液中から取り出すための方法であって、前記先端部を前記溶液中に浸漬させる工程と、前記溶液中にて前記物質と前記試料とを反応させて互いに結合させる工程と、前記先端部を前記溶液中から取り出す工程とを行うことを特徴としている。
【0025】
【発明の実施の形態】以下、この発明の実施の形態について図面を参照しつつ説明する。
【0026】<1.分析装置の基本構成>図1は、この実施の形態における分析装置1の一構成例を示す斜視図である。この分析装置1は、センサユニット10と分析チップ20とマイクロマニピュレータ30a,30bとを備えて構成されている。
【0027】センサユニット10の上面側は平板状の分析チップ20を嵌め込むための凹部が形成されており、試料分析の際には分析チップ20がその凹部に嵌め込まれて図1に示すようにセンサユニット10と分析チップ20とが一体となる。
【0028】分析チップ20には、異なる試料をそれぞれに供給するための複数の供給槽と、異なる試料を分析チップ20にて反応させるための反応槽と、反応槽にて反応した試料を排出するための複数の排出槽とが形成されている。具体的には、図1に示すように、複数の供給槽として、分析対象となる試料を含んだサンプル溶液を供給するためのサンプル槽21aと、分析のために使用する試薬を供給するための試薬槽21bとが形成されており、これらの槽には反応槽22に向かって微小流路24a,24bがそれぞれに形成されている。また、複数の排出槽として、抽出対象となる反応物を最終的に導くための抽出槽23aと、不必要な溶液を最終的に貯めるための廃棄槽23bと、抽出槽23aに向かって反応物を移動させるためのバッファ液を貯留しておくバッファ槽23cとが形成されている。反応槽22と廃棄槽23bとは直線的な微小流路24c,24eによって互いに接続されており、抽出槽23aとバッファ槽23cとは直線的な微小流路24d,24fによって互いに接続されており、微小流路24d,24fは反応槽22からの微小流路24cと交差点Pにて直交する。
【0029】これらの各槽は、分析チップ20の表面に設けられた窪みであり、分析チップ表面に彫り込まれた微小流路24a〜24fと同じ深さとなるように形成されている。また、微小流路24a〜24fはカバープレート25で覆われており、管路として形成される。なお、微小流路24a〜24fは、幅が約60μm程度であり、深さが10〜20μm程度で形成される。
【0030】サンプル溶液や試薬等の試料は分析チップ20上の各供給槽に直接供給されるか、あるいは、サンプルポット41aや試薬ポット41b等のような取扱いやすい供給ポット(容器)41に入れられて、各ポットから分析チップ20上のサンプル槽21aや試薬槽21bに供給される。各ポット41からの各槽への試料の供給は、試料供給用として設けられた第1のマイクロマニピュレータ30aによって行われる。そして、各供給槽に供給された試料は電気泳動によって反応槽および排出槽の方向に向かって微小流路中を移動する。最終的に抽出槽23aに導かれた抽出対象となる試料は、第2のマイクロマニピュレータ30bによって抽出ポット51に収容される。
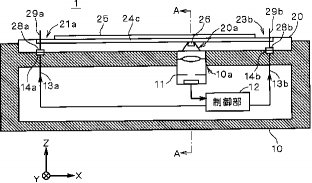
【0031】図2は、センサユニット10を微小流路24cを含むXZ平面で切断したときの断面図である。
【0032】図2に示すようにセンサユニット10の上面側は平板状の分析チップ20を嵌め込むための凹部が形成されており、その内部側にセンサ部11と制御部12と電極13a,13bとが設けられている。センサ部11は、凹部に設けられた開口部10aに設置されており、開口10a上方側の光を内部に取り込むことが可能なように構成されている。また、電極13a,13bの上面側は、それぞれ所定面積を有するコネクタ14a,14bとして形成されている。制御部12は、センサ部11にて検出される光を電気信号として入力し、各電極13a,13bに対して電圧を印加する。
【0033】なお、図2において電極は13a,13bの2つのみ図示しているが、制御部12によって制御される電極は分析チップ20に形成された各槽ごとに設けられる。
【0034】一方、分析チップ20は、センサユニット10の凹部に嵌め込まれたときに、各コネクタ14a,14bと接合されるコネクタ28a,28bが下面側に形成され、そのコネクタ28a,28bのそれぞれから分析チップ20の内部を連通して各槽の上面付近まで達する電気泳動電極29a,29bが接続されている。つまり、電気泳動電極29a,29bは分析チップ20に埋め込まれていて、一端は分析チップ20上の各槽内に突き出していて、他端はセンサユニット10からの電位を与えるためのコネクタ28a,28bを備えている。また、分析チップ20に形成された微小流路24cの下側の所定位置にテーパ状の孔20aが形成されており、その孔20aに集光光学素子26が設置されている。集光光学素子26の配置される位置は、分析チップ20がセンサユニット10に装着された際に、センサユニット10におけるセンサ部11の上方位置となるように設計製作される。
【0035】したがって、分析チップ20がセンサユニット10に対して装着されると、コネクタ14aと28aとが、また、コネクタ14bと28bとがそれぞれ接合するとともに、集光光学素子26とセンサ部11とが一体となって光学的機能を発揮するようになり、微小流路24c内の蛍光測定を良好に行うことが可能になる。そして、図2のような装着状態において、制御部12が電気泳動電極29aを高電位に、電気泳動電極29bを低電位に設定することで、微小流路24c内でX方向の電界が発生し、それによって試料がサンプル槽21aから廃棄槽23bに向かって電気泳動することになる。
【0036】集光光学素子26とセンサ部11とが一体となって実現される光学的機能の原理の詳細は、公知文献Applied Optics /Vol.38,No.4/1 February 1999(p.724-732)に所載の「Highly efficient detection of surface-generated fluorescene」に記述されている。この文献には、ガラス製の回転放物面体の先端部を、回転軸に垂直であって焦点の近傍の点を含む平面で切断した形状の集光光学素子で微弱な光を捕捉し、集光光学素子の放物面で反射された平行光を集光レンズでアバランシェフォトダイオードのような光検出素子に収束させて蛍光を測定する方法が記載することが記載されている。
【0037】この実施の形態においても、これと同様の手法にて試料の蛍光を測定するように構成されている。図3は、図2のセンサ部11周辺の拡大図である。
【0038】図3に示すように、分析チップ20の微小流路24cの所定位置には、微小流路24cを移動するDNAなどの微小粒子(試料)に付けられた蛍光マーカからの蛍光を捕捉するための集光光学素子26が取り付けられている。また、センサユニット10のセンサ部11には、集光レンズ11aとマスク板11bと光検出素子11cとが設けられており、集光光学素子26から得られる平行光を集光レンズ11aによって光検出素子11cに収束させることで微小流路24c中の試料に付着された蛍光マーカからの蛍光を測定することができるように構成されている。
【0039】集光光学素子26は上記切断によって形成される平面である光取り込み面26aが微小流路24cに面するように配置されており、光取り込み面に蛍光マーカが接近すると蛍光を効率よく捕捉することができる。特に、光取り込み面26aから100nm程度以内まで蛍光マーカを接近させることができれば、通常は溶液と集光光学素子26との界面となる光取り込み面26aで反射される光も、いわゆる近接場の効果でエバネッセント光が集光光学素子26内に取り込まれるようになるので、蛍光測定における総合的な感度を向上させることが可能になる。つまり、焦点近傍の点を含む平面に蛍光を発生する試料を近付けることで集光光学素子26内に効率よく蛍光を捕捉し、放物面で反射された光を集光レンズ11aでアバランシェフォトダイオードなどの光検出素子11cに入射させることで高感度のセンシングが可能になるのである。集光光学素子26に取り込まれた光は集光光学素子26の放物面で反射し、ほぼ平行光となって集光光学素子26から射出する。
【0040】光検出素子11cの直前にはピンホールを有するマスク板11bが設けられピンホールの像が分析チップ20内の集光光学素子26の光取り込み面26a付近に形成されるようにして光取り込み面26aから離れた部分からの背景光をカットする働きをする。微弱な光を測定する場合には背景光を測定する光を分離することが重要であり、このマスク板11bの作用により、不必要な散乱光や励起光を有効にカットすることができ、その結果、センサ部11における測定値のSN比が向上する。
【0041】分析チップ20上の集光光学素子26とセンサユニット10側の集光レンズ11aの相対位置は正確に設定される必要があるので、センサユニット10への分析チップ20の取付けが精度良く行われるように、分析チップ20の外形やセンサユニット10との電気的、光学的接続部の精度と、分析チップ20を嵌め込むセンサユニット10の凹部(彫り込み部)や分析チップ20との電気的、光学的接続部の精度は所定の精度範囲内で厳密に管理しておくことが望ましい。
【0042】また、上述のように集光効率を上げるためには、蛍光を発生する試料は集光光学素子26の光取り込み面26aから100nm程度以下に近接させる必要があるので、集光光学素子26の近傍で微小流路24cの内側には偏向電極44,45が設けられている。つまり、偏向電極44,45は、試料を微小流路24c内において集光光学素子26に近づけるための偏向手段として機能するのである。
【0043】そして、偏向電極44,45間に電界をかけることによりDNAなどの試料を微小流路24cを横断する方向に偏向させることができる。具体的には、偏向電極44はカバープレート25の微小流路24cに面する位置に設けられており、偏向電極45は微小流路24cにおける集光光学素子26の設置された位置よりも上流側であって、微小流路24cの底面に設けられる。これらの偏向電極44,45に与える電位も、既述の電気泳動用の電極と同様に、センサユニット10との接合機構によって、センサユニット10側の制御部12から制御されるように構成される。制御部12は、偏向電極45に対して偏向電極44を高電位に設定することにより、蛍光を発生する試料を微小流路24c内の底面付近に移動させることができる。この結果、集光光学素子26の光取り込み面26aの近傍に試料を接近させることが可能になる。偏向電極部での溶液の電気分解による気泡の発生を防ぐために、偏向電極間に交流電界をかけて発生する電界勾配による誘電泳動により粒子を集光光学素子に近付けてもよい。また、電気泳動や誘電泳動の作用によって、偏向電極45に試料を吸引しておくことも可能となり、微小流路24cに沿った移動を停止させた状態で蛍光の強さやスペクトルを精密に測定することが可能になる。
【0044】図4は、図2における分析装置1のA−A断面図であって、集光光学素子26周辺の拡大図である。図4に示すように微小流路24cは下底よりも上底が長い台形状の断面形状をなし、各側面は傾斜面となっている。また、制御部12から上述の偏向電極44,45に対して印加される電位は、コネクタ28c,28dを介して微小流路24c内に供給されている。
【0045】そして、図4に示すように、センサユニット10には、蛍光励起用の光源15が設けられている。光源15としては、レーザ、LED、各種ランプ等のように使用する蛍光マーカに応じて任意の光源を使用することができる。この光源15は、上側に向かって所定の励起光を射出する。そして、光源15からの励起光を微小流路24c内に導くために、分析チップ20の内部に光案内手段としてライトガイド27が設けられている。ライトガイド27は、分析チップ20に埋め込んだ光ファイバを用いたり、分析チップ20内に導波路を設けたりして構成することができる。
【0046】ライトガイド27の先端部は微小流路24cに面しており、ライトガイド27の設けられた位置において、ライトガイド27からの光の出射面が微小流路24cの側壁面となっている。そして、ライトガイド27の出射面も微小流路24cの側面と同様の傾斜を有するように形成されている。この結果、ライトガイド27の出射面から出射する光は、その出射面で屈折作用を生じることとなり、微小流路24cの底面側に向けて励起光が照射されるようになる。つまり、集光光学素子26の光取り込み面26aに励起光が集中して照射されるように構成されているのである。
【0047】なお、図4では微小流路24cの側面でライトガイド27から射出した光が屈折して集光光学素子26の光取り込み面26aの中心に向かうようになっているが、ライトガイド27の終端部にマイクロレンズや回折光学素子を付けて励起光の向きや光束幅を制御することもできる。
【0048】そして、センサ部11で蛍光を測定し、抽出対象となるDNAなどの微小粒子(試料)がセンサ部11上方の流路を通過したことが分かった場合は、電気泳動の原理によって流路の切り替えを行うことにより、抽出対象となる試料を抽出槽23aに導いたり、その試料をマイクロマニピュレータ30bにより釣り上げたりすることで、抽出手段としての機能を実現し、抽出対象となる試料を取り出して種々の用途に利用することができる。
【0049】流路の切り替えによる抽出の場合は、制御部12が図1に示すバッファ槽23cの電位を抽出槽23aの電位よりも高電位にしておき、廃棄槽23bの電位を抽出槽23aよりも高い適当な電位に設定することで、抽出対象となる試料は交差点Pを左方向に進ませることができ、抽出槽23aに導くことができる。
【0050】そして、マイクロマニピュレータ30bが抽出槽23a内の溶液を取り出して抽出ポット51に収容することで、抽出ポット51に抽出対象となる試料を収めることができる。
【0051】このように、超小型で高感度の蛍光検出機構を分析装置1に組み込むことにより、DNAの解析など生物学的、生化学的な分析を小型、安価な装置で高速に行えるようになる。つまり、この実施の形態では、蛍光検出のための機構が、センサユニット10および分析チップ20で構成される分析装置1に内蔵されているため、装置周辺に別途光学系を設置して調整する必要がなく、速やかに分析処理を開始することができるとともに、小型化、低コスト化を図ることが可能になるのである。
【0052】また、高感度の蛍光検出機構が実現されるので、1分子あるいは数個の分子であっても良好に分析を行うことが可能になるため、分析対象となるサンプルや試薬等の試料の必要量を最小限に抑えることができる。このため、微少サンプルからの分析を可能にし、DNAの解析の分野では、事前に行われるポリメラーゼ連鎖反応(PCR)などの増幅作業を省いたり、または、その回数を減らしたりすることが可能になる。
【0053】また、分析装置1にマイクロマニピュレータ30a,30bを備えることで、微小な試料に対する操作(供給や抽出操作)を自動的に行うことが可能になる。
【0054】また、分析装置1では、分析チップ20をセンサユニット10に嵌め込むだけで、蛍光を検出するための光学系が最適な状態にセットされるため、光学系の調整等に時間がかかることはなく、試料分析のための準備時間を短縮することができる。
【0055】<2.マイクロマニピュレータ>ここで、マイクロマニピュレータ30a,30bの構成について説明する。
【0056】図5は、マイクロマニピュレータ30aの概略構成図である。
【0057】マイクロマニピュレータ30aは第1リニアアクチュエータ31と第2リニアアクチュエータ32と第3リニアアクチュエータ33と回転系アクチュエータ34とを備えて構成され、回転系アクチュエータ34の先端部にはエンドエフェクタ35が着脱自在なように構成されている。
【0058】第1ないし第3リニアアクチュエータ31〜33は互いに直交するように順次に連結されており、複数の直進自由度が実現されている。また、回転系アクチュエータ34はその先端部分に結合されたエンドエフェクタ35の姿勢を任意の角度に変化させることが可能なよう構成されている。
【0059】第1リニアアクチュエータ31は圧電素子31aとスプライン軸31bとスライダ31cとを備えており、Z軸方向に沿ってスライダ31cを移動させることができるように構成されている。
【0060】圧電素子31aは積層圧電セラミックス等によって構成され、制御部12からの電圧の印加によってZ軸方向に沿って伸縮動作を行う。そして圧電素子31aの一端側はセンサユニット10の縁部側に固着されており、他端側はスプライン軸31bの端面に固着されている。したがって、スプライン軸31bは圧電素子31aの伸縮動作に伴ってその長手方向であるZ軸方向に移動する。
【0061】また、スライダ31cはスプライン軸31bに嵌め込まれており、スライダ31cの内部に装着された弾性部材がスライダ31cとスプライン軸31bとの間に一定の摩擦を生じさせることにより、通常はスライダ31cがスプライン軸31bに対して位置固定された状態となる。なお、スプライン軸31bに設けられた凸部とスライダ31cの凹部とが嵌合することにより、スライダ31cのスプライン軸31bの周方向への回転を抑制できることは言うまでもない。
【0062】第2リニアアクチュエータ32は、第1リニアアクチュエータ31のスライダ31cに固定されており、第1リニアアクチュエータ31と同様に、圧電素子32aとスプライン軸32bとスライダ32cとを備えて構成され、X軸方向に沿ってスライダ32cを移動させることができるようになっている。また、第3リニアアクチュエータ33は、第2リニアアクチュエータ32のスライダ32cに固定されており、上記各リニアアクチュエータと同様に、圧電素子33aとスプライン軸33bとスライダ33cとを備えてY軸方向に沿ってスライダ33cを移動させることができるように構成されている。
【0063】そして、第3リニアアクチュエータ33のスライダ33cにはZ軸方向に沿って回転系アクチュエータ34が固着されている。回転系アクチュエータ34はステッピングモータ34aと回転板34bとピッチヨーアクチュエータ34cとを備えている。
【0064】ステッピングモータ34aは本体が小径の円筒状に構成され、第3リニアアクチュエータ33のスライダ33cに固定されている。ステッピングモータ34aに対して制御部12から通電が行われることにより、ステッピングモータ34aの内部に設けられるロータに連結された回転板34bがステッピングモータ34aの回転軸周りに回転するように構成されている。なお、図5においてはステッピングモータ34aの回転軸はZ軸に平行なように設けられている。このステッピングモータ34aにより回転系の動作のうちのZ軸に平行な回転軸を中心とする回転動作が可能になる。
【0065】回転板34bにはピッチヨーアクチュエータ34cの一端側が着設されており、このピッチヨーアクチュエータ34cは回転板34bの回転に伴ってステッピングモータ34aの回転軸を中心に回転する。そして、ピッチヨーアクチュエータ34cの他端側には所定の傾斜板がピボット軸受の構成で配設されており、内部に張設された形状記憶合金製ワイヤに通電を行うことで当該ワイヤが伸縮し、傾斜板を任意の方向に傾斜させることが可能になるのである。
【0066】このように、ピッチヨーアクチュエータ34cが駆動されることによって傾斜板がXY平面に平行な状態から任意の方向および角度に傾斜するように構成されている。このピッチヨーアクチュエータ34cにより回転系の動作のうちのX軸に平行な回転軸を中心とする回転動作(ピッチング)とY軸に平行な回転軸を中心とする回転動作(ヨーイング)が可能になる。
【0067】そして回転系アクチュエータ34の先端部には、マイクロマニピュレータ30aのエンドエフェクタ35の基部側が接続配置されている。エンドエフェクタ35はDNA等の微小な試料に対して所定の操作を行うために適した機構のものが採用される。例えば、所定量の溶液を収容・吐出することができるマイクロピペットや、先端部が1〜50μm程度の微小径で形成されたニードル等がエンドエフェクタ35として使用される。
【0068】マイクロマニピュレータ30aは上記のように構成されており、第1から第3リニアアクチュエータ31〜33はエンドエフェクタ35の位置をX,Y,Zの3軸方向に直進移動させることができ、回転系アクチュエータ34はエンドエフェクタ35をロール・ピッチ・ヨーの3方向に回転移動させることができる。つまり、上記のような構成とすることにより、エンドエフェクタ35を直進運動させるための3自由度と回転運動させるための3自由度との合計6自由度が実現されている。なお、回転系3自由度は、ステッピングモータ34aによるロール角運動と、ピッチヨーアクチュエータ34cによるピッチ角およびヨー角運動とで実現される。
【0069】したがって、マイクロマニピュレータ30aの構成を上記のようにすることでエンドエフェクタ35を任意の位置に移動させることが可能になるとともに、エンドエフェクタ35を任意の姿勢に変化させることも可能になる。
【0070】ここで、第1リニアアクチュエータ31による直進動作について説明する。図6は、圧電素子31aに印加する電圧波形の一例としてのこぎり波形のような非対称な電圧波形を示す図である。そして図6(a)はスライダ31cを+Z方向に移動させる場合の電圧波形を示しており、図6(b)はスライダ31cを−Z方向に移動させる場合の電圧波形を示している。
【0071】この実施の形態では、圧電素子31aに対して負の電圧が印加されれば圧電素子31aが収縮し、逆に、圧電素子31aに対して正の電圧が印加されれば圧電素子31aが伸長する。そして、その伸縮量は印加電圧の絶対値によって可変させることができる。このため、圧電素子31aに対する印加電圧を制御することによってその伸縮量を制御することができ、その結果、スプライン軸31bのZ軸に沿った移動を制御することが可能になる。
【0072】例えば、図6(a)の電圧波形は立ち上がり部において緩やかな傾斜を示し、立ち下がり部において急峻な傾斜を示している。このため、のこぎり波形の緩やかな立ち上がり部ではスプライン軸31bとスライダ31cとの間の摩擦力により、スライダ31cがスプライン軸31bと一体となって圧電素子31aの伸縮量に応じてZ軸に沿って移動する。一方、のこぎり波形の急峻な立ち下がり部では圧電素子31aは急激に元の位置に戻ろうとするのに対して、スライダ31cには移動後の位置に留まろうとする大きな慣性力が生じ、この慣性力が摩擦力よりも大きくなり、それによってスライダ31cとスプライン軸31bとの間にすべりが生じる。この結果、スライダ31cがスプライン軸31bに対してすべりを生じた距離分だけ相対的に+Z方向側に移動することになる。そして、図6(a)に示すようなのこぎり波形を繰り返し圧電素子31aに与えることにより、スライダ31cはスプライン軸31bに沿って段階的に+Z方向側に移動していくのである。
【0073】一方、図6(b)の電圧波形は図6(a)の波形に対して逆極性となっているため、のこぎり波形の緩やかな立ち上がり部ではスプライン軸31bとスライダ31cとの間の摩擦力により、スライダ31cがスプライン軸31bと一体となって圧電素子31aの伸縮量に応じてZ軸に沿って移動する。圧電素子31aは負の電圧が印加されることによって収縮するので、図6(b)の緩やかな立ち上がり部では圧電素子31aはゆっくりと収縮する。これに対して、図6(b)の急峻な立ち下がり部では、圧電素子31aは収縮した状態から急激に元の状態に戻ろうとするため、スライダ31cには大きな慣性力が生じ、この慣性力が摩擦力よりも大きくなり、それによってスライダ31cとスプライン軸31bとの間にすべりが生じる。この結果、スライダ31cがスプライン軸31bに対してすべりを生じた距離分だけ相対的に−Z方向側に移動することになる。そして、図6(b)に示すようなのこぎり波形を繰り返し圧電素子31aに与えることにより、スライダ31cはスプライン軸31bに沿って段階的に−Z方向側に移動していくのである。
【0074】このように第1リニアアクチュエータ31は、駆動手段となる圧電素子31aを非対称な速度で往復移動させることによって圧電素子31aに結合されたスプライン軸31bを往復移動させることができ、それによってスライダ31cを相対的に慣性移動させることが可能なように構成されている。なお、圧電素子31aを駆動する際の印加電圧を厳密に制御すれば、1回のすべりによってスライダ31cが移動する移動量をほぼ一定値に制御することが可能である。つまり、印加電圧の電圧レベルや波形の傾斜を制御すれば、1回のすべりによってスライダ13が移動する移動量を可変させることもできるのである。例えば、電圧レベルを高く、かつ、急峻な立ち下がり部の傾斜をより急峻なものとすれば、1回のすべりによって移動する移動量が大きくなるので、エンドエフェクタ35を高速で移動させることが可能になる。逆に、電圧レベルを低く、かつ、急峻な立ち下がり部の傾斜を若干緩やかなものとすれば、1回のすべりによって移動する移動量が小さくなるので、エンドエフェクタ35を低速で微少量ずつ移動させることが可能になる。
【0075】また、圧電素子31aに対して上記のようなのこぎり波形を連続的に印加すると、スライダ31cの動作は段階的に移動する粗動となる。これに対し、圧電素子31aに印可する電圧値を制御することで、圧電素子31aはその電圧値に応じた伸縮量を示すので、スライダ31cの動作は微小範囲を連続的に移動する微動となる。したがって、リニアアクチュエータの駆動手段として圧電素子を使用することで、粗動および微動を使い分けることが可能となり、スライダ31cの位置精度を高めることが可能になる。
【0076】なお、スプライン軸31bの凸部に着磁パターン形成部を形成し、スライダ31cの内部にさらに磁気抵抗素子等を設けることにより、それらが一体となって、リニアエンコーダを構成することができ、スライダ31cの移動に伴って磁気抵抗素子から移動量に応じたパルス信号を発生させることができる。そして、このパルス信号に基づいて所定の演算を行うことで、スプライン軸31bに対するスライダ31cの位置を検出することができ、この位置に基づいた移動制御を行うことも可能になるのである。
【0077】以上、第1リニアアクチュエータ31の動作について説明したが、第2リニアアクチュエータ32および第3リニアアクチュエータ33についても同様の構成および動作である。また、上記においては、マイクロマニピュレータ30aを例に挙げて説明したが、マイクロマニピュレータ30bについても同様に構成されており、動作についても同様である。
【0078】このようなマイクロマニピュレータ30a,30bが図1に示すようにセンサユニット10における試料の供給側と抽出側との2箇所の端部側に着設されており、各アクチュエータに対しては、センサユニット10内の制御部12によって電気的制御信号が供給されるように構成されている。
【0079】また、上記のようなマイクロマニピュレータ30a,30bは約20mm立方程度の大きさに収まり、エンドエフェクタ35を1μm前後の分解能で制御することができるので、分析装置1全体の大きさを大きくすることなく装置に組み込んで精密な操作を行うことが可能である。
【0080】<3.分析装置における分析動作>図1に戻り、サンプルポット41aと試薬ポット41bとで供給されたサンプル溶液および試薬といった試料はセンサユニット10の端部に取り付けられた第1のマイクロマニピュレータ30aによって、それぞれサンプル槽21aと試薬槽21bに必要量が供給される。マイクロマニピュレータ30aの先端部には定量の溶液を出し入れできるマイクロピペットが装着され、各ポットから各槽への溶液の供給が可能になっている。
【0081】分析チップ20の微小流路24a〜24fには、予めバッファ液などの溶液を充填しておくことで流路中から空気を追い出しておき、供給されたサンプルや試薬が電気泳動などの方法ですぐに微小流路24a〜24f内を移動できるようにする。
【0082】そして、サンプル槽21aと試薬槽21bに供給された試料、すなわちサンプルと試薬とは電気泳動によって微小流路24a〜24fを下流に向かって(廃棄槽23bの方向に向かって)移動する。このとき、サンプル槽21aと試薬槽21bとを廃棄槽23bに対して高い電位にしておき、微小流路24a〜24cの下流に向かっての電界を発生させ、その電界に沿って電気泳動による流れが発生するようにする。サンプルと試薬は反応槽22にて合流し反応を起こす。
【0083】ここで、サンプル溶液として制限酵素で切断された複数種類のDNA断片の溶液を使用し、試薬として蛍光マーカでラベル付けされ、サンプル溶液中の複数種類のDNA断片と相補的な塩基配列を有する複数種類のプローブDNA溶液を使用する場合について説明する。
【0084】サンプル槽21aと試薬槽21bとに対して所定の溶液が供給されるとサンプル槽21aおよび試薬槽21bと反応槽22との間にかけられた電界による電気泳動で、サンプルと試薬は反応槽22に向かって移動する。反応槽22において、DNA断片で構成されるサンプルDNAとプローブDNAとは相補的な塩基配列のもの同士でハイブリダイズする。反応槽22でハイブリダイズしたDNAとハイブリダイズしなかったDNAとは、反応槽22と廃棄槽23bとの間にかけられた電界による電気泳動で微小流路24c中を下流(廃棄槽23bの方向)に移動する。反応槽22と交差点Pとの間の微小流路24cには、ポリアクリルアミドのような高分子が充填されており、電気泳動するDNAの大きさに応じて泳動速度に差ができるように構成されている。
【0085】試薬中のプローブDNAの長さがほぼ同じであるとすると、ハイブリダイズしなかったプローブDNAはほぼ同じ速度で微小流路24cを電気泳動で移動する。また、ハイブリダイズしなかったDNA断片(サンプルDNA)もその長さに応じた速度で微小流路24cを移動する。
【0086】一方、プローブDNAとサンプルDNAとがハイブリダイズしたものは、ハイブリダイズした部分が二本鎖となりその前後に一本鎖のヌクレオチドを持ち全体としては長いDNA断片となるため、プローブDNAやハイブリダイズしなかったサンプルDNAよりも遅い速度で微小流路24cを移動することになる。そして、ハイブリダイズしたDNAの長さがサンプル中のDNA断片の種類により異なるように、制限酵素による切断位置とハイブリダイズするプローブDNAの塩基配列を設定しておくことで、電気泳動の速度の差を測定することでサンプルDNA中のDNA断片の種類を分析することができる。
【0087】そして、微小流路24cの交差点Pよりも少し上流側の所定位置にプローブDNAに付けられた蛍光マーカの蛍光を測定するためのセンシング位置(集光光学素子26の配置される位置)が設定されているため、センサ部11における光検出素子11cの出力から、ハイブリダイズしなかったプローブDNAのセンサ部11の通過時刻と、プローブDNAとサンプルDNAとがハイブリダイズした複数種類の生成物のセンサ部11の通過時刻とを知ることができる。ハイブリダイズしなかったDNA断片(サンプルDNA)は蛍光マーカを持たないのでセンサ出力には影響しない。
【0088】図7はセンサ部11の出力例を示す図である。この例では、測定開始後比較的早い時刻t1に、ハイブリダイズしなかったプローブDNAがセンシング位置を通過し、その時に最初の出力ピークPK1が現れている。その後、時刻t2,t3,t4に複数のピークPK2,PK3,PK4が現れている。つまり、ハイブリダイズしなかったプローブDNAがセンシング位置を通過した後に時間をおいてから、プローブDNAとサンプルDNAとのハイブリダイズした複数種類の生成物がその長さの違いに応じた時間差を持ってセンシング位置を通過することになり、複数のピークPK2〜PK4が出現するのである。そして、それぞれの生成物の長さに応じてピークの出現時刻が決まるとともに、それぞれの生成物の量に応じてピークの大きさが決まるため、図7の出力例を分析することによって生成物の種類等を解明することができる。このようにハイブリダイズした生成物が3種類の場合は図7のようにハイブリダイズ生成物によるピークPK2,PK3,PK4が現れる。
【0089】そして、制限酵素の選択とプローブDNAの塩基配列の設計を任意に組合わせることで、分析対象となるDNAの遺伝子修飾の有無や一塩基多型などの塩基配列情報を得ることが可能になる。
【0090】また、プローブDNAにラベル付けするための蛍光マーカをプローブの種類ごとに変えておき、センサ部11に分光機能を持たせて構成すれば、マーカの蛍光の波長を分別することでハイブリダイズ生成物の種類を見分けることも可能になる。この場合はハイブリダイズ生成物がセンシング位置を通過する時刻は厳密に測定する必要はなく、ハイブリダイズしなかったプローブDNAによるピークとハイブリダイズ生成物によるピークを時間的に見分けるだけで良い。
【0091】このようにしてセンサ部11にて蛍光を測定し、抽出対象となる生成物がセンシング位置を通過したことが分かった場合は、上述の電気泳動の原理によって流路の切り替えを行うことによって抽出対象となる生成物を抽出槽23aに導いたり、または、その生成物をマイクロマニピュレータ30bにより釣り上げたりすることで、目的の生成物を取り出すように制御されるのである。
【0092】<4.試料の取り出し>ここで、微小流路中からのDNA等の試料の釣り上げによる取り出し方法について説明する。
【0093】図8は、微小流路中のDNAの釣り上げ方法を示す図である。マイクロマニピュレータ30bの先端部と結合するエンドエフェクタとしては、試料操作針35aを使用する。試料操作針は、ベース部36とベース部36から突き出した微小径の針37とを有する。針37は金属を微細加工したものや、ウイスカーを使用することができる。微小流路24c中の溶液の流れの乱れを少なくするために、針37の少なくとも溶液中に浸される先端部分は1μmから50μm程度に細めておくことが望ましい。針37の先端には捕捉DNA38を付着させる。針37の先端への付着は化学的な手法により行うことができる。この手法の一例が、米国特許5789167号公報にプローブDNAの結合のための処理として記載されている。例えば、本実施例で、ポリペプチドのスペーサの端部を捕捉DNAおよび針37と共有結合で結び付ける方法が利用できる。
【0094】図8において微小流路24cを抽出対象のDNA(目的DNA)7が蛍光マーカ9付きのプローブDNA8とハイブリダイズした状態で移動していくのを、センサ部11が検出する。このとき、微小流路24c上のカバープレート25に設けられた小穴25aからマイクロマニピュレータ30bのエンドエフェクタとして装着された試料操作針35aを微小流路中の溶液内に浸漬させる。試料操作針35aは、上述のように、先端部(針37)が微小径で形成されており、その先端部に抽出すべき試料と、生物的または生化学的な結合性を有する物質が付着されている。その針37を溶液中に浸漬させ、その溶液中にて針37に付着された物質と抽出すべき試料とを反応させて互いに結合させ、その後、針37を溶液中から取り出すことによって抽出すべき試料を溶液中から取り出すことができる。
【0095】この実施の形態において試料操作針35aの針37には、抽出対象となる目的DNAとハイブリダイズする捕捉DNA38が付着されており、微小流路24c中の生成物に含まれる目的DNAと捕捉DNA38とを反応(ハイブリダイズ)させることで、抽出対象となる生成物を捕捉するのである。
【0096】つまり、試料操作針35aの針37を溶液中に浸漬させることにより、針37の先端部に付着している捕捉DNA38が溶液中の生成物とハイブリダイズすることになり、溶液中から目的となる試料のみを抽出することができるのである。このとき、微小流路24cの断面を試料操作針35aの先端がスキャンするようにマイクロマニピュレータ30bを動作させれば、捕捉DNA38と目的DNAとがハイブリダイズする確率を高めることができ、より確実な取り出しを行うことが可能になる。
【0097】上記のようにして、微小流路24c中から釣り上げられたDNAはマイクロマニピュレータ30bの操作により抽出ポット51の中に運ばれ、抽出ポット51で保管される。
【0098】抽出ポット51に搬送したときの処理はいくつか考えられる。
【0099】一例としては、ポット内にバッファ溶液をあらかじめ入れておいてDNAのハイブリダイズしたものを試料操作針35aごとバッファ溶液に浸す。ポット内容液の温度を上げることによりプローブDNAと目的DNAの結合を解き、目的DNAと捕捉DNAのハイブリダイズしたものが試料操作針35aに付着した状態を作る。そして、バッファ溶液を満たした別のポットに試料操作針35aを移動させ、そのポット内容液の温度を上げることにより、目的DNAと捕捉DNAとの結合を解き、溶液中に目的DNAのみが存在するようにする処理がある。この場合はプローブDNAと目的DNAの結合は、捕捉DNAと目的DNAの結合よりも低温で解かれるように、プローブDNAと捕捉DNAの塩基配列を目的DNAの塩基配列に応じて設計しておくことが必要である。そして、最初のポットで上げる温度よりも2番目のポットで上げる温度の方を高く設定し、2個所ある目的DNAの結合個所を所望の順番で解いていくのである。
【0100】他の例としては釣り上げたDNAを試料操作針35aごとに抽出ポット51のバッファ液の中で加熱し、捕捉DNAと目的DNAの結合を解いて、バッファ液の中に目的DNAとプローブDNAとの結合したものを存在させる。そして、プローブDNAの塩基配列を目的DNAのポリメラーゼ連鎖反応(PCR)による増幅のためのプライマとしても使えるように設計しておくと、抽出ポット51にポリメラーゼ酵素とオリゴヌクレオチドを加えて温度制御するだけで目的DNAの増幅を行うことができる。
【0101】図9は、マイクロマニピュレータ30bの試料操作針35aの交換機構の説明図である。
【0102】図9に示すように、複数の試料操作針35aがホルダ39に差込まれて保存されている。ホルダ39内には必要に応じて保存液を所定量入れておいて試料操作針35aの針先を浸しておく。使用時には、マイクロマニピュレータ30bを動作制御して試料操作針35aのベース部36をマイクロマニピュレータ30bの回転系アクチュエータ34の先端部と結合させて使用する。試料操作針35aのベース部36を磁性材料で形成し、マイクロマニピュレータ30bの回転系アクチュエータ34の先端部に磁石を設けておくと、試料操作針35aとマイクロマニピュレータ30bの回転系アクチュエータ34の先端部とを容易に結合することができる。さらに、マイクロマニピュレータ30bにおける回転系アクチュエータ34の先端部に試料操作針35aのベース部36を嵌入させるための凹部を設けておくことで、試料操作針35aが操作中にがたつくことのないように装着することができる。試料操作針35aにおいてはベース部36と針37との形状を所定精度で管理しておくことで、マイクロマニピュレータ30bによる正確な位置制御が可能である。
【0103】そして、マイクロマニピュレータ30bがホルダ39に差込まれた複数の試料操作針35aのうちの任意の試料操作針に対してアクセスし、回転系アクチュエータ34の先端部をベース部36の上部側に移動させることで、マイクロマニピュレータ30bに装着することができる。
【0104】一方、交換するときには、マイクロマニピュレータ30bはホルダ39の試料操作針35aが差し込まれていない部分に使用済みの試料操作針35aを差し込み、所定の動作を行うことで使用済みの試料操作針35aを取り外す。その後、上記装着の際と同様の操作を行うことで、試料操作針35aの交換を行うことが可能になる。
【0105】なお、ホルダ39は、センサユニット10のマイクロマニピュレータ30bがアクセス可能な任意の位置に取り付けられればよい。
【0106】上記では、エンドエフェクタ35が試料操作針35aである場合について説明したが、エンドエフェクタ35が試料操作針35aに限らず、例えば、マイクロピペット等の他のエンドエフェクタについてもホルダ39を使用することで、エンドエフェクタ35の自動装着および自動交換を行うことが可能であることは勿論である。そして、複数のエンドエフェクタ35を収容するホルダ39を各マイクロマニピュレータ30a,30bのアクセス可能な位置に配置しておくことで、分析装置1において異なる分析処理を繰り返して行うような場合であっても、エンドエフェクタ35を自動交換しつつ連続的に処理を進めることが可能になるのである。
【0107】なお、上記の試料操作針35aは、マイクロマニピュレータ30bが特定の試料を釣り上げる場合に限らず、例えば、人が手動操作して微小流路中から特定の試料を取り出す場合にも適した構造となっている。
【0108】<5.分析装置を自動運転を行うための機構>図1で説明したように、分析装置1においては、供給ポット41を使用して試料を供給したり、抽出ポット51を使用して試料を取り出して保管するように構成されている。このように、ポットを使用して試料を供給したり、または、抽出する場合であって、複数種類のサンプルや試薬を順次に取り替えながら分析抽出する動作を連続的に自動運転する場合には、図1に示す分析装置1に対して、オプション装置としてポット交換機構を付加することが好ましい。この場合、ポット交換機構に複数のサンプルポットや試薬ポット等を装填しておいてサンプルや試薬を取り替えて複数回の分析作業を自動で行うことができる。また、抽出ポットについても同様であり、複数の抽出ポットを装填しておいて抽出すべき試料が抽出槽23aに導かれる度に、抽出ポットを取り替えつつ、それぞれの抽出ポットに異なる抽出物を収容するようにして複数回の分析抽出作業を自動的に行うようにすることもできる。
【0109】図10は、ポット交換機構を付加した分析装置1を示す斜視図である。図10に示すように、この分析装置1には、図1に示した構成に加えて、複数の供給ポット41が搭載された回転可能な供給円盤40と、複数の抽出ポット51が搭載された回転可能な抽出円盤50とが設けられている。
【0110】回転可能な供給円盤40上には複数のサンプルポットおよび試薬ポットが搭載されており、円盤の中心位置の下方側(裏面側)には、供給円盤回転駆動手段として、図示しない回転モータが設置されている。この回転モータはセンサユニット10内部の制御部12によって回転制御されるように構成されており、供給円盤40の回転位相角を制御することで、所望のサンプルポット、試薬ポットを分析チップ20上のサンプル槽21aおよび試薬槽21bの近傍に移動させることができる。所望のポットの移動が完了すると、マイクロマニピュレータ30aを動作させてサンプルや試薬を分析チップ20上の各槽に供給する。また、別の反応をチップ上で行うためには、供給円盤40を回転させることによって、サンプルポット、試薬ポットを適宜に切り替えて分析チップ20に供給することで、自動的に複数の反応をさせていくことができる。
【0111】同様に、回転可能な抽出円盤50上には複数の抽出ポット51が搭載されており、その中心位置の下方側(裏面側)には、抽出円盤回転駆動手段として、図示しない回転モータが設置されている。この回転モータもセンサユニット10内の制御部12によって回転制御されるように構成されており、抽出円盤50の回転位相角を制御することで所望の抽出ポットを分析チップ20の抽出槽23aの近傍に移動させることができる。そして、所望のポットの移動が完了すると、マイクロマニピュレータ30bを移動させて抽出対象となる粒子や反応生成物などの試料を抽出槽23aから抽出ポット51に移動させる。また、別の反応をチップ上で行なったときは、抽出円盤50を回転させることにより抽出ポット51を切り替えて抽出対象となる試料を抽出ポット51に移動させる。
【0112】このように、ポット交換機構として複数のポットを搭載可能な供給円盤40および抽出円盤50を設けることによって、複数回の分析抽出作業を連続的かつ自動的に行うことが可能になる。
【0113】一方、分析チップ20も使用回数が限界に達したり、分析内容が変更されることによって取り替えることが必要になる場合がある。そこで、図1の分析装置1に対して、オプション装置として分析チップ交換機構を付加することが好ましい。この場合は分析チップ交換機構に予め複数の分析チップ20を装填しておき、必要に応じてセンサユニット10に装着される分析チップ20を自動的に取り替えることにより、複数回の分析作業を連続的にかつ自動的に行うことが可能になる。また、分析チップ交換機構と上記のポット交換機構とを併用しての連続自動運転も可能である。
【0114】図11は分析チップ交換機構を配置した分析装置1の一構成例を示す図である。なお、図11は、図1のYZ平面に垂直な方向にある点から分析装置1を見た図であり、マイクロマニピュレータ30a,30bについては図示を省略している。
【0115】図11に示す分析装置1では、センサユニット10をはさんで、スタッカ60と回収器70とY軸方向に沿ってが配置される。
【0116】センサユニット10に装着される分析チップ20の下方所定位置には、制御部12によって駆動制御される押し上げアクチュエータ17が設置されている。そして、センサユニット10上の分析チップ20を交換する際には、センサユニット10内の制御部12が押し上げアクチュエータ17を動作させ、センサユニット10の上部における凹部(分析チップ20を嵌め込むための彫り込み部)から分析チップ20を持ち上げる。このとき、分析チップ20の下面位置がセンサユニット10の凹部の土手の高さよりも高くなるようにする。押し上げアクチュエータ17としては、例えばプランジャ型マグネットなどを利用することができる。
【0117】スタッカ60には、未使用の分析チップ20を収納する収納部61、収納部61下部に設けられたチップエレベータ62、分析チップ20をセンサユニット10の凹部まで押し出すチップ押し出し機構63が設けられている。分析チップ20の交換の際には、チップエレベータ62が動作し、収納部61内に収容された複数の分析チップ20のうちの最上段の分析チップ20の下面位置がセンサユニット10の凹部の土手よりもわずかに上の高さ位置となるように持ち上げられる。この後、チップ押し出し機構63が動作して分析チップ20をセンサユニット10の凹部上方まで押し出していく。チップ押し出し機構63による分析チップ20の押し出し量が所定量を超えると、センサユニット10の押し上げアクチュエータ17が停止し、押し上げ部材が動作開始前の状態に戻る。そして、分析チップ20がセンサユニット10の凹部に到達すると、自重により分析チップ20は凹部にはまり込んで、分析チップ20が交換される。センサユニット10に装着されていた分析チップ20は、スタッカ60から押し出される未使用の分析チップ20の先端部で押し出されてセンサユニット10の上部から回収器70の配置されている方向に移動し、自重によって回収器70内に落とし込まれる。
【0118】以上のように構成することで、必要に応じてセンサユニット10に装着される分析チップ20を自動的に取り替えることが可能になり、複数回の分析作業を連続的にかつ自動的に行うことができる。
【0119】なお、上記のチップエレベータ62は、例えば、マイクロモータ62aとネジ機構62bとを組合わせてエレベータ床62cを上下させる機構が利用できる。また、チップ押し出し機構63はマイクロモータ63aとラック63bを組合わせ、ラック63bを押し出し用部材として使用することによって構成することができる。
【0120】さらに、上述のマイクロマニピュレータ30a,30bのエンドエフェクタ35の交換用として複数のエンドエフェクタを収容したホルダ39を併設することで、エンドエフェクタ35を必要に応じて自動交換することができるので、分析作業を連続的かつ自動的に行うことが可能になる。
【0121】このように、分析装置1に対して、マイクロマニピュレータ30a,30bや各種資材供給のための交換機構を組合わせることにより、分析作業の自動化や必要な試料の自動抽出を行うことが可能となる。
【0122】<6.変形例>以上、この発明の一実施形態について説明したが、この発明は上記説明内容に限定されるものではない。
【0123】例えば、上記説明では、DNAのハイブリダイズ反応によって分析および操作を行う場合を例示したが、抗体・抗原反応やリガンド・受容体反応、その他の生物学的、生化学的反応などを利用した分析および操作を行う場合にも、この分析装置が適用可能であることは勿論である。つまり、分析装置において分析および操作対象となる試料は微小な物質であればよいのである。
【0124】また、上記説明では、分析チップ20上の各槽の間で溶液やサンプル、試薬などの試料を移動させる方法として電気泳動を利用する場合を例示したが、他の方法を採用してもよい。例えば、マイクロポンプによる圧力を利用したり、また、各槽の高さ位置を異なるようにして重力ポテンシャルを利用するようにしてもよい。
【0125】
【発明の効果】以上説明したように、請求項1に記載の発明によれば、光源で発生する試料の蛍光を励起するための光を、光案内手段によって微小流路に導き、その微小流路の壁面に設けられた集光光学素子にて試料からの蛍光を捕捉し、光検出素子で光検出を行うように構成されているため、装置周辺に別途光学系等を設置する必要がないので、小型で、かつ、安価に実現できるとともに、速やかに分析処理を開始することができる。
【0126】請求項2に記載の発明によれば、試料を微小流路内において集光光学素子に近づける偏向手段を備えるため、近接場の効果によって試料からの蛍光を高感度に計測することができる。
【0127】請求項3に記載の発明によれば、第1の電極と第2の電極との間に所定の電界を与えることにより試料を集光光学素子に近づけるため、微小流路中において試料を確実に集光光学素子に近づけることが可能である。
【0128】請求項4に記載の発明によれば、試料を所定の供給位置に供給する第1のマイクロマニピュレータを備えるため、試料供給を自動的に行うことが可能である。
【0129】請求項5に記載の発明によれば、試料を収容する複数の容器を搭載可能であって、その複数の容器のうちの任意の容器を選択的に第1のマイクロマニピュレータの操作可能範囲内に移動させる手段を備えるため、連続的かつ自動的に容器を移動させることが可能となり、分析装置の連続自動運転を実現することができる。
【0130】請求項6に記載の発明よれば、光検出素子にて検出される光の特性に応じて、微小流路を移動する試料に含まれる特定の試料を抽出する抽出手段を備えるため、分析装置において特定の試料のみを抽出することが可能である。
【0131】請求項7に記載の発明よれば、微小流路が所定位置にて複数方向に分岐しており、抽出手段が、複数方向のうちから試料の移動方向を選択的に切り換えることによって、特定の試料を複数方向のうちの一の方向に導くことで抽出するように構成されているため、特定の試料のみを一の方向に導いて抽出することができる。
【0132】請求項8に記載の発明によれば、抽出手段は、微小流路中の特定の試料との結合性を有する物質が付着されたエンドエフェクタを含む第2のマイクロマニピュレータを備えており、その第2のマイクロマニピュレータがエンドエフェクタに付着された物質を微小流路中に配置することで特定の試料を抽出するように構成されているため、微小流路中から特定の試料を取り出すことが可能である。
【0133】請求項9に記載の発明によれば、複数方向のうちの一の方向に導かれた特定の試料を含む溶液を取り出す第2のマイクロマニピュレータを備えているため、特定の試料を溶液中から取り出すことが可能である。
【0134】請求項10に記載の発明によれば、特定の試料を含む溶液を保管するための複数の容器を搭載可能であって、複数の容器のうちの任意の容器を選択的に第2のマイクロマニピュレータの操作可能範囲内に移動させる手段を備えるため、連続的かつ自動的に容器を移動させることが可能となり、分析装置の連続自動運転を実現することができる。
【0135】請求項11に記載の発明によれば、第2のマイクロマニピュレータの先端部に装着されるエンドエフェクタを複数保持可能なホルダを備えており、第2のマイクロマニピュレータが、エンドエフェクタをホルダに保持される複数のエンドエフェクタと交換するように構成されているため、エンドエフェクタを交換しつつの分析装置の連続自動運転が可能になる。
【0136】請求項12に記載の発明によれば、光源と光検出素子とが設けられたセンサユニットに対して、微小流路と光案内手段と集光光学素子とが設けられた分析チップが着脱自在に構成されており、分析チップがセンサユニットに対して装着された際に、光源からの光が光案内手段を介して微小流路に導かれ、集光光学素子によって捕捉された蛍光が光検出素子に導かれるとともに、試料を移動させるためのエネルギーがセンサユニットから分析チップに対して供給されるように構成されているため、設置が容易であるとともに、装置全体としての小型化を図ることができる。
【0137】請求項13に記載の発明によれば、センサユニットに隣接して設置され、センサユニットに対して分析チップを供給して装着を行うとともに、センサユニットに装着された分析チップの回収を行う分析チップ交換手段を備えるため、分析チップを交換しつつの分析装置の連続自動運転が可能になる。
【0138】請求項14に記載の発明によれば、先端部が微小径で形成されており、先端部に試料と生物的または生化学的な結合性を有する物質が付着されているため、簡単な操作で特定の試料のみを容易に取り出すことができる。
【0139】請求項15に記載の発明によれば、簡単に特定の試料のみを容易に取り出すことができる。
【図面の簡単な説明】
【図1】分析装置の一構成例を示す斜視図である。
【図2】センサユニットを所定の平面で切断したときの断面図である。
【図3】図2のセンサ部周辺の拡大図である。
【図4】図2のA−A断面における集光光学素子26周辺の拡大図である。
【図5】マイクロマニピュレータの概略構成図である。
【図6】リニアアクチュエータの圧電素子に印加する電圧波形の一例を示す図である。
【図7】センサ部の出力例を示す図である。
【図8】微小流路中の試料の釣り上げ方法を示す図である。
【図9】マイクロマニピュレータの試料操作針の交換機構の説明図である。
【図10】ポット交換機構を付加した分析装置を示す斜視図である。
【図11】分析チップ交換機構を配置した分析装置の一構成例を示す図である。
【符号の説明】
1 分析装置
10 センサユニット
11 センサ部
12 制御部
20 分析チップ
21a サンプル槽
21b 試薬槽
22 反応槽
23a 抽出槽
23b 廃棄槽
23c バッファ槽
24a〜24f 微小流路
26 集光光学素子
27 ライトガイド(光案内手段)
30a,30b マイクロマニピュレータ
35 エンドエフェクタ
35a 試料操作針
39 ホルダ
40 供給円盤
50 抽出円盤
60 スタッカ(分析チップ交換手段)
70 回収器(分析チップ交換手段)
【0001】
【発明の属する技術分野】この発明は、MEMS(Micro Electro Mechanical Systems)やMOEMS(Micro Opto Electro Mechanical Systems)等の技術を用いて、DNA(deoxyribonucleic acid)の解析等のように生物的または生化学的な微小試料を分析する分析装置、そのような分析のための試料操作針、および、その試料操作針を用いた試料取り出し方法に関する。
【0002】
【従来の技術】従来より、微小流路を流れる溶液中の試料(DNA等の微小物質)の蛍光を計測して、各種の分析を行う装置(いわゆる、μTAS等と呼ばれる装置)が研究されている。この装置において蛍光の計測は、微小流路に励起光を投光するための光源や光学系、および、蛍光を計測するための光学系や光検出素子を微小流路が形成された装置の周辺に個別に組み立てることによって実現されている。このため、組み立てられたシステム全体として分析装置としての機能を有するのである。
【0003】このような装置の一例が米国特許5858195号公報に開示されている。この装置は、試料に対する複雑な生物的または生化学的な操作(分析や合成)を電子的な制御により約5cm×2.5cm程度の大きさの分析チップ(マイクロチップ)上で行うように構成されている。具体的には、分析チップ上に、化学物質を貯める複数の貯水槽と、複数の貯水槽を結ぶ微小流路とが形成されており、各貯水槽はそれぞれが制御された電気ポテンシャルを有しており、そのポテンシャルによって各貯水槽間で試料が微小流路を移動するように構成されている。
【0004】試料を測定する検出器として、例えば、光学的な吸収、屈折率変化、蛍光発光、化学発光、種々のラマンスペクトル、電気伝導度、電気化学的電流、音波伝播などを検出するようなものを使用することで試料の特性等を検出することができる。
【0005】分析チップにて分析を行う際には、DNAを制限酵素により異なる長さの断片に分けた後、各断片を電気泳動によって微小流路中を移動させる。微小流路中のある一点では、蛍光を励起するためのレーザ光等の光が外部より与えられており、その一点を断片が通過するときに所定の蛍光染料が励起され、その蛍光特性を外部に設置される受光光学系によって検出することで断片の分析が行われる。
【0006】
【発明が解決しようとする課題】しかしながら、上記のような従来の技術では、分析チップの外部から蛍光を励起するためのレーザ光等を投光する光学系や、蛍光を計測するための光学系等が分析チップの周辺に設置されることで分析システムとして機能するものであるため、システム全体のサイズやコストが大きくなるという問題を有している。また、微小流路が形成された分析チップの周辺に各部材を配置する際の準備や位置調整に多大な手間がかかることになり、効率よく分析を行うことができないという問題を有している。
【0007】また、光学系等を調整して蛍光計測の感度やSN比を向上させようとしても、比較的低いレベルで限界に到達し、それ以上に向上させることは困難になる。
【0008】さらに、安定した分析を効率よく繰り返して行うためには、試料の供給および取り出し、分析チップの交換等を自動的に行うことが望まれる。また、試料の取り出しを行う際には、複雑な操作を行うことなく簡単に対象となる試料を取り出せることが望まれる。
【0009】この発明は、上記課題に鑑みてなされたものであって、小型で、かつ、安価に実現できる分析装置を提供するとともに、試料の取り出しを容易に行うことのできる試料操作針および試料取り出し方法を提供することを目的とする。
【0010】
【課題を解決するための手段】上記目的を達成するために、請求項1に記載の発明は、微小流路内を移動する試料からの蛍光を測定して前記試料の特性を分析する分析装置であって、前記試料の蛍光を励起するための光を発生させる光源と、前記光源からの光を前記微小流路内に導く光案内手段と、前記微小流路の壁面に設けられ、前記試料からの蛍光を捕捉する集光光学素子と、前記集光光学素子で捕捉された光を検出する光検出素子とを備えている。
【0011】請求項2に記載の発明は、請求項1に記載の分析装置において、前記試料を前記微小流路内において前記集光光学素子に近づける偏向手段をさらに備えている。
【0012】請求項3に記載の発明は、請求項2に記載の分析装置において、前記偏向手段が、前記集光光学素子近傍で前記微小流路に面して設けられた第1の電極と、前記第1の電極に対向する位置であって、前記微小流路に面して設けられた第2の電極とを備えており、前記第1の電極と前記第2の電極との間に所定の電界を与えることにより前記試料を前記集光光学素子に近づけることを特徴としている。
【0013】請求項4に記載の発明は、請求項1ないし請求項3のいずれかに記載の分析装置において、前記試料を所定の供給位置に供給する第1のマイクロマニピュレータをさらに備えている。
【0014】請求項5に記載の発明は、請求項4に記載の分析装置において、前記試料を収容する複数の容器を搭載可能であって、前記複数の容器のうちの任意の容器を選択的に前記第1のマイクロマニピュレータの操作可能範囲内に移動させる手段をさらに備えている。
【0015】請求項6に記載の発明は、請求項1ないし請求項5のいずれかに記載の分析装置において、前記光検出素子にて検出される光の特性に応じて、前記微小流路を移動する前記試料に含まれる特定の試料を抽出する抽出手段をさらに備えている。
【0016】請求項7に記載の発明は、請求項6に記載の分析装置において、前記微小流路は所定位置にて複数方向に分岐しており、前記抽出手段が、前記複数方向のうちから前記試料の移動方向を選択的に切り換えることによって、前記特定の試料を前記複数方向のうちの一の方向に導くことで抽出することを特徴としている。
【0017】請求項8に記載の発明は、請求項6に記載の分析装置において、前記抽出手段が、前記微小流路中の前記特定の試料との結合性を有する物質が付着されたエンドエフェクタを含む第2のマイクロマニピュレータを備えており、前記第2のマイクロマニピュレータが前記エンドエフェクタの前記物質を前記微小流路中に配置することで前記特定の試料を抽出することを特徴としている。
【0018】請求項9に記載の発明は、請求項7に記載の分析装置において、前記複数方向のうちの一の方向に導かれた前記特定の試料を含む溶液を取り出す第2のマイクロマニピュレータをさらに備えている。
【0019】請求項10に記載の発明は、請求項9に記載の分析装置において、前記特定の試料を含む溶液を保管するための複数の容器を搭載可能であって、前記複数の容器のうちの任意の容器を選択的に前記第2のマイクロマニピュレータの操作可能範囲内に移動させる手段をさらに備えている。
【0020】請求項11に記載の発明は、請求項8ないし請求項10のいずれかに記載の分析装置において、前記第2のマイクロマニピュレータの先端部に装着されるエンドエフェクタを複数保持可能なホルダをさらに備えており、前記第2のマイクロマニピュレータが、前記エンドエフェクタを前記ホルダに保持される複数のエンドエフェクタと交換することを特徴としている。
【0021】請求項12に記載の発明は、請求項1ないし請求項11のいずれかに記載の分析装置において、前記光源と前記光検出素子とが設けられたセンサユニットに対して、前記微小流路と前記光案内手段と前記集光光学素子とが設けられた分析チップが着脱自在に構成されており、前記分析チップが前記センサユニットに対して装着された際に、前記光源からの光が前記光案内手段を介して前記微小流路に導かれ、前記集光光学素子によって捕捉された前記蛍光が前記光検出素子に導かれるとともに、前記試料を移動させるためのエネルギーが前記センサユニットから前記分析チップに対して供給されることを特徴としている。
【0022】請求項13に記載の発明は、請求項12に記載の分析装置において、前記センサユニットに隣接して設置され、前記センサユニットに対して前記分析チップを供給して装着を行うとともに、前記センサユニットに装着された前記分析チップの回収を行う分析チップ交換手段をさらに備えている。
【0023】請求項14に記載の発明は、抽出対象となる微小な試料を所定の溶液中から取り出すための試料操作針であって、先端部が微小径で形成されており、前記先端部に前記試料と生物的または生化学的な結合性を有する物質が付着されていることを特徴としている。
【0024】請求項15に記載の発明は、先端部が微小径で形成されており、抽出対象となる試料と生物的または生化学的な結合性を有する物質が前記先端部に付着された試料操作針を用いて、前記試料を所定の溶液中から取り出すための方法であって、前記先端部を前記溶液中に浸漬させる工程と、前記溶液中にて前記物質と前記試料とを反応させて互いに結合させる工程と、前記先端部を前記溶液中から取り出す工程とを行うことを特徴としている。
【0025】
【発明の実施の形態】以下、この発明の実施の形態について図面を参照しつつ説明する。
【0026】<1.分析装置の基本構成>図1は、この実施の形態における分析装置1の一構成例を示す斜視図である。この分析装置1は、センサユニット10と分析チップ20とマイクロマニピュレータ30a,30bとを備えて構成されている。
【0027】センサユニット10の上面側は平板状の分析チップ20を嵌め込むための凹部が形成されており、試料分析の際には分析チップ20がその凹部に嵌め込まれて図1に示すようにセンサユニット10と分析チップ20とが一体となる。
【0028】分析チップ20には、異なる試料をそれぞれに供給するための複数の供給槽と、異なる試料を分析チップ20にて反応させるための反応槽と、反応槽にて反応した試料を排出するための複数の排出槽とが形成されている。具体的には、図1に示すように、複数の供給槽として、分析対象となる試料を含んだサンプル溶液を供給するためのサンプル槽21aと、分析のために使用する試薬を供給するための試薬槽21bとが形成されており、これらの槽には反応槽22に向かって微小流路24a,24bがそれぞれに形成されている。また、複数の排出槽として、抽出対象となる反応物を最終的に導くための抽出槽23aと、不必要な溶液を最終的に貯めるための廃棄槽23bと、抽出槽23aに向かって反応物を移動させるためのバッファ液を貯留しておくバッファ槽23cとが形成されている。反応槽22と廃棄槽23bとは直線的な微小流路24c,24eによって互いに接続されており、抽出槽23aとバッファ槽23cとは直線的な微小流路24d,24fによって互いに接続されており、微小流路24d,24fは反応槽22からの微小流路24cと交差点Pにて直交する。
【0029】これらの各槽は、分析チップ20の表面に設けられた窪みであり、分析チップ表面に彫り込まれた微小流路24a〜24fと同じ深さとなるように形成されている。また、微小流路24a〜24fはカバープレート25で覆われており、管路として形成される。なお、微小流路24a〜24fは、幅が約60μm程度であり、深さが10〜20μm程度で形成される。
【0030】サンプル溶液や試薬等の試料は分析チップ20上の各供給槽に直接供給されるか、あるいは、サンプルポット41aや試薬ポット41b等のような取扱いやすい供給ポット(容器)41に入れられて、各ポットから分析チップ20上のサンプル槽21aや試薬槽21bに供給される。各ポット41からの各槽への試料の供給は、試料供給用として設けられた第1のマイクロマニピュレータ30aによって行われる。そして、各供給槽に供給された試料は電気泳動によって反応槽および排出槽の方向に向かって微小流路中を移動する。最終的に抽出槽23aに導かれた抽出対象となる試料は、第2のマイクロマニピュレータ30bによって抽出ポット51に収容される。
【0031】図2は、センサユニット10を微小流路24cを含むXZ平面で切断したときの断面図である。
【0032】図2に示すようにセンサユニット10の上面側は平板状の分析チップ20を嵌め込むための凹部が形成されており、その内部側にセンサ部11と制御部12と電極13a,13bとが設けられている。センサ部11は、凹部に設けられた開口部10aに設置されており、開口10a上方側の光を内部に取り込むことが可能なように構成されている。また、電極13a,13bの上面側は、それぞれ所定面積を有するコネクタ14a,14bとして形成されている。制御部12は、センサ部11にて検出される光を電気信号として入力し、各電極13a,13bに対して電圧を印加する。
【0033】なお、図2において電極は13a,13bの2つのみ図示しているが、制御部12によって制御される電極は分析チップ20に形成された各槽ごとに設けられる。
【0034】一方、分析チップ20は、センサユニット10の凹部に嵌め込まれたときに、各コネクタ14a,14bと接合されるコネクタ28a,28bが下面側に形成され、そのコネクタ28a,28bのそれぞれから分析チップ20の内部を連通して各槽の上面付近まで達する電気泳動電極29a,29bが接続されている。つまり、電気泳動電極29a,29bは分析チップ20に埋め込まれていて、一端は分析チップ20上の各槽内に突き出していて、他端はセンサユニット10からの電位を与えるためのコネクタ28a,28bを備えている。また、分析チップ20に形成された微小流路24cの下側の所定位置にテーパ状の孔20aが形成されており、その孔20aに集光光学素子26が設置されている。集光光学素子26の配置される位置は、分析チップ20がセンサユニット10に装着された際に、センサユニット10におけるセンサ部11の上方位置となるように設計製作される。
【0035】したがって、分析チップ20がセンサユニット10に対して装着されると、コネクタ14aと28aとが、また、コネクタ14bと28bとがそれぞれ接合するとともに、集光光学素子26とセンサ部11とが一体となって光学的機能を発揮するようになり、微小流路24c内の蛍光測定を良好に行うことが可能になる。そして、図2のような装着状態において、制御部12が電気泳動電極29aを高電位に、電気泳動電極29bを低電位に設定することで、微小流路24c内でX方向の電界が発生し、それによって試料がサンプル槽21aから廃棄槽23bに向かって電気泳動することになる。
【0036】集光光学素子26とセンサ部11とが一体となって実現される光学的機能の原理の詳細は、公知文献Applied Optics /Vol.38,No.4/1 February 1999(p.724-732)に所載の「Highly efficient detection of surface-generated fluorescene」に記述されている。この文献には、ガラス製の回転放物面体の先端部を、回転軸に垂直であって焦点の近傍の点を含む平面で切断した形状の集光光学素子で微弱な光を捕捉し、集光光学素子の放物面で反射された平行光を集光レンズでアバランシェフォトダイオードのような光検出素子に収束させて蛍光を測定する方法が記載することが記載されている。
【0037】この実施の形態においても、これと同様の手法にて試料の蛍光を測定するように構成されている。図3は、図2のセンサ部11周辺の拡大図である。
【0038】図3に示すように、分析チップ20の微小流路24cの所定位置には、微小流路24cを移動するDNAなどの微小粒子(試料)に付けられた蛍光マーカからの蛍光を捕捉するための集光光学素子26が取り付けられている。また、センサユニット10のセンサ部11には、集光レンズ11aとマスク板11bと光検出素子11cとが設けられており、集光光学素子26から得られる平行光を集光レンズ11aによって光検出素子11cに収束させることで微小流路24c中の試料に付着された蛍光マーカからの蛍光を測定することができるように構成されている。
【0039】集光光学素子26は上記切断によって形成される平面である光取り込み面26aが微小流路24cに面するように配置されており、光取り込み面に蛍光マーカが接近すると蛍光を効率よく捕捉することができる。特に、光取り込み面26aから100nm程度以内まで蛍光マーカを接近させることができれば、通常は溶液と集光光学素子26との界面となる光取り込み面26aで反射される光も、いわゆる近接場の効果でエバネッセント光が集光光学素子26内に取り込まれるようになるので、蛍光測定における総合的な感度を向上させることが可能になる。つまり、焦点近傍の点を含む平面に蛍光を発生する試料を近付けることで集光光学素子26内に効率よく蛍光を捕捉し、放物面で反射された光を集光レンズ11aでアバランシェフォトダイオードなどの光検出素子11cに入射させることで高感度のセンシングが可能になるのである。集光光学素子26に取り込まれた光は集光光学素子26の放物面で反射し、ほぼ平行光となって集光光学素子26から射出する。
【0040】光検出素子11cの直前にはピンホールを有するマスク板11bが設けられピンホールの像が分析チップ20内の集光光学素子26の光取り込み面26a付近に形成されるようにして光取り込み面26aから離れた部分からの背景光をカットする働きをする。微弱な光を測定する場合には背景光を測定する光を分離することが重要であり、このマスク板11bの作用により、不必要な散乱光や励起光を有効にカットすることができ、その結果、センサ部11における測定値のSN比が向上する。
【0041】分析チップ20上の集光光学素子26とセンサユニット10側の集光レンズ11aの相対位置は正確に設定される必要があるので、センサユニット10への分析チップ20の取付けが精度良く行われるように、分析チップ20の外形やセンサユニット10との電気的、光学的接続部の精度と、分析チップ20を嵌め込むセンサユニット10の凹部(彫り込み部)や分析チップ20との電気的、光学的接続部の精度は所定の精度範囲内で厳密に管理しておくことが望ましい。
【0042】また、上述のように集光効率を上げるためには、蛍光を発生する試料は集光光学素子26の光取り込み面26aから100nm程度以下に近接させる必要があるので、集光光学素子26の近傍で微小流路24cの内側には偏向電極44,45が設けられている。つまり、偏向電極44,45は、試料を微小流路24c内において集光光学素子26に近づけるための偏向手段として機能するのである。
【0043】そして、偏向電極44,45間に電界をかけることによりDNAなどの試料を微小流路24cを横断する方向に偏向させることができる。具体的には、偏向電極44はカバープレート25の微小流路24cに面する位置に設けられており、偏向電極45は微小流路24cにおける集光光学素子26の設置された位置よりも上流側であって、微小流路24cの底面に設けられる。これらの偏向電極44,45に与える電位も、既述の電気泳動用の電極と同様に、センサユニット10との接合機構によって、センサユニット10側の制御部12から制御されるように構成される。制御部12は、偏向電極45に対して偏向電極44を高電位に設定することにより、蛍光を発生する試料を微小流路24c内の底面付近に移動させることができる。この結果、集光光学素子26の光取り込み面26aの近傍に試料を接近させることが可能になる。偏向電極部での溶液の電気分解による気泡の発生を防ぐために、偏向電極間に交流電界をかけて発生する電界勾配による誘電泳動により粒子を集光光学素子に近付けてもよい。また、電気泳動や誘電泳動の作用によって、偏向電極45に試料を吸引しておくことも可能となり、微小流路24cに沿った移動を停止させた状態で蛍光の強さやスペクトルを精密に測定することが可能になる。
【0044】図4は、図2における分析装置1のA−A断面図であって、集光光学素子26周辺の拡大図である。図4に示すように微小流路24cは下底よりも上底が長い台形状の断面形状をなし、各側面は傾斜面となっている。また、制御部12から上述の偏向電極44,45に対して印加される電位は、コネクタ28c,28dを介して微小流路24c内に供給されている。
【0045】そして、図4に示すように、センサユニット10には、蛍光励起用の光源15が設けられている。光源15としては、レーザ、LED、各種ランプ等のように使用する蛍光マーカに応じて任意の光源を使用することができる。この光源15は、上側に向かって所定の励起光を射出する。そして、光源15からの励起光を微小流路24c内に導くために、分析チップ20の内部に光案内手段としてライトガイド27が設けられている。ライトガイド27は、分析チップ20に埋め込んだ光ファイバを用いたり、分析チップ20内に導波路を設けたりして構成することができる。
【0046】ライトガイド27の先端部は微小流路24cに面しており、ライトガイド27の設けられた位置において、ライトガイド27からの光の出射面が微小流路24cの側壁面となっている。そして、ライトガイド27の出射面も微小流路24cの側面と同様の傾斜を有するように形成されている。この結果、ライトガイド27の出射面から出射する光は、その出射面で屈折作用を生じることとなり、微小流路24cの底面側に向けて励起光が照射されるようになる。つまり、集光光学素子26の光取り込み面26aに励起光が集中して照射されるように構成されているのである。
【0047】なお、図4では微小流路24cの側面でライトガイド27から射出した光が屈折して集光光学素子26の光取り込み面26aの中心に向かうようになっているが、ライトガイド27の終端部にマイクロレンズや回折光学素子を付けて励起光の向きや光束幅を制御することもできる。
【0048】そして、センサ部11で蛍光を測定し、抽出対象となるDNAなどの微小粒子(試料)がセンサ部11上方の流路を通過したことが分かった場合は、電気泳動の原理によって流路の切り替えを行うことにより、抽出対象となる試料を抽出槽23aに導いたり、その試料をマイクロマニピュレータ30bにより釣り上げたりすることで、抽出手段としての機能を実現し、抽出対象となる試料を取り出して種々の用途に利用することができる。
【0049】流路の切り替えによる抽出の場合は、制御部12が図1に示すバッファ槽23cの電位を抽出槽23aの電位よりも高電位にしておき、廃棄槽23bの電位を抽出槽23aよりも高い適当な電位に設定することで、抽出対象となる試料は交差点Pを左方向に進ませることができ、抽出槽23aに導くことができる。
【0050】そして、マイクロマニピュレータ30bが抽出槽23a内の溶液を取り出して抽出ポット51に収容することで、抽出ポット51に抽出対象となる試料を収めることができる。
【0051】このように、超小型で高感度の蛍光検出機構を分析装置1に組み込むことにより、DNAの解析など生物学的、生化学的な分析を小型、安価な装置で高速に行えるようになる。つまり、この実施の形態では、蛍光検出のための機構が、センサユニット10および分析チップ20で構成される分析装置1に内蔵されているため、装置周辺に別途光学系を設置して調整する必要がなく、速やかに分析処理を開始することができるとともに、小型化、低コスト化を図ることが可能になるのである。
【0052】また、高感度の蛍光検出機構が実現されるので、1分子あるいは数個の分子であっても良好に分析を行うことが可能になるため、分析対象となるサンプルや試薬等の試料の必要量を最小限に抑えることができる。このため、微少サンプルからの分析を可能にし、DNAの解析の分野では、事前に行われるポリメラーゼ連鎖反応(PCR)などの増幅作業を省いたり、または、その回数を減らしたりすることが可能になる。
【0053】また、分析装置1にマイクロマニピュレータ30a,30bを備えることで、微小な試料に対する操作(供給や抽出操作)を自動的に行うことが可能になる。
【0054】また、分析装置1では、分析チップ20をセンサユニット10に嵌め込むだけで、蛍光を検出するための光学系が最適な状態にセットされるため、光学系の調整等に時間がかかることはなく、試料分析のための準備時間を短縮することができる。
【0055】<2.マイクロマニピュレータ>ここで、マイクロマニピュレータ30a,30bの構成について説明する。
【0056】図5は、マイクロマニピュレータ30aの概略構成図である。
【0057】マイクロマニピュレータ30aは第1リニアアクチュエータ31と第2リニアアクチュエータ32と第3リニアアクチュエータ33と回転系アクチュエータ34とを備えて構成され、回転系アクチュエータ34の先端部にはエンドエフェクタ35が着脱自在なように構成されている。
【0058】第1ないし第3リニアアクチュエータ31〜33は互いに直交するように順次に連結されており、複数の直進自由度が実現されている。また、回転系アクチュエータ34はその先端部分に結合されたエンドエフェクタ35の姿勢を任意の角度に変化させることが可能なよう構成されている。
【0059】第1リニアアクチュエータ31は圧電素子31aとスプライン軸31bとスライダ31cとを備えており、Z軸方向に沿ってスライダ31cを移動させることができるように構成されている。
【0060】圧電素子31aは積層圧電セラミックス等によって構成され、制御部12からの電圧の印加によってZ軸方向に沿って伸縮動作を行う。そして圧電素子31aの一端側はセンサユニット10の縁部側に固着されており、他端側はスプライン軸31bの端面に固着されている。したがって、スプライン軸31bは圧電素子31aの伸縮動作に伴ってその長手方向であるZ軸方向に移動する。
【0061】また、スライダ31cはスプライン軸31bに嵌め込まれており、スライダ31cの内部に装着された弾性部材がスライダ31cとスプライン軸31bとの間に一定の摩擦を生じさせることにより、通常はスライダ31cがスプライン軸31bに対して位置固定された状態となる。なお、スプライン軸31bに設けられた凸部とスライダ31cの凹部とが嵌合することにより、スライダ31cのスプライン軸31bの周方向への回転を抑制できることは言うまでもない。
【0062】第2リニアアクチュエータ32は、第1リニアアクチュエータ31のスライダ31cに固定されており、第1リニアアクチュエータ31と同様に、圧電素子32aとスプライン軸32bとスライダ32cとを備えて構成され、X軸方向に沿ってスライダ32cを移動させることができるようになっている。また、第3リニアアクチュエータ33は、第2リニアアクチュエータ32のスライダ32cに固定されており、上記各リニアアクチュエータと同様に、圧電素子33aとスプライン軸33bとスライダ33cとを備えてY軸方向に沿ってスライダ33cを移動させることができるように構成されている。
【0063】そして、第3リニアアクチュエータ33のスライダ33cにはZ軸方向に沿って回転系アクチュエータ34が固着されている。回転系アクチュエータ34はステッピングモータ34aと回転板34bとピッチヨーアクチュエータ34cとを備えている。
【0064】ステッピングモータ34aは本体が小径の円筒状に構成され、第3リニアアクチュエータ33のスライダ33cに固定されている。ステッピングモータ34aに対して制御部12から通電が行われることにより、ステッピングモータ34aの内部に設けられるロータに連結された回転板34bがステッピングモータ34aの回転軸周りに回転するように構成されている。なお、図5においてはステッピングモータ34aの回転軸はZ軸に平行なように設けられている。このステッピングモータ34aにより回転系の動作のうちのZ軸に平行な回転軸を中心とする回転動作が可能になる。
【0065】回転板34bにはピッチヨーアクチュエータ34cの一端側が着設されており、このピッチヨーアクチュエータ34cは回転板34bの回転に伴ってステッピングモータ34aの回転軸を中心に回転する。そして、ピッチヨーアクチュエータ34cの他端側には所定の傾斜板がピボット軸受の構成で配設されており、内部に張設された形状記憶合金製ワイヤに通電を行うことで当該ワイヤが伸縮し、傾斜板を任意の方向に傾斜させることが可能になるのである。
【0066】このように、ピッチヨーアクチュエータ34cが駆動されることによって傾斜板がXY平面に平行な状態から任意の方向および角度に傾斜するように構成されている。このピッチヨーアクチュエータ34cにより回転系の動作のうちのX軸に平行な回転軸を中心とする回転動作(ピッチング)とY軸に平行な回転軸を中心とする回転動作(ヨーイング)が可能になる。
【0067】そして回転系アクチュエータ34の先端部には、マイクロマニピュレータ30aのエンドエフェクタ35の基部側が接続配置されている。エンドエフェクタ35はDNA等の微小な試料に対して所定の操作を行うために適した機構のものが採用される。例えば、所定量の溶液を収容・吐出することができるマイクロピペットや、先端部が1〜50μm程度の微小径で形成されたニードル等がエンドエフェクタ35として使用される。
【0068】マイクロマニピュレータ30aは上記のように構成されており、第1から第3リニアアクチュエータ31〜33はエンドエフェクタ35の位置をX,Y,Zの3軸方向に直進移動させることができ、回転系アクチュエータ34はエンドエフェクタ35をロール・ピッチ・ヨーの3方向に回転移動させることができる。つまり、上記のような構成とすることにより、エンドエフェクタ35を直進運動させるための3自由度と回転運動させるための3自由度との合計6自由度が実現されている。なお、回転系3自由度は、ステッピングモータ34aによるロール角運動と、ピッチヨーアクチュエータ34cによるピッチ角およびヨー角運動とで実現される。
【0069】したがって、マイクロマニピュレータ30aの構成を上記のようにすることでエンドエフェクタ35を任意の位置に移動させることが可能になるとともに、エンドエフェクタ35を任意の姿勢に変化させることも可能になる。
【0070】ここで、第1リニアアクチュエータ31による直進動作について説明する。図6は、圧電素子31aに印加する電圧波形の一例としてのこぎり波形のような非対称な電圧波形を示す図である。そして図6(a)はスライダ31cを+Z方向に移動させる場合の電圧波形を示しており、図6(b)はスライダ31cを−Z方向に移動させる場合の電圧波形を示している。
【0071】この実施の形態では、圧電素子31aに対して負の電圧が印加されれば圧電素子31aが収縮し、逆に、圧電素子31aに対して正の電圧が印加されれば圧電素子31aが伸長する。そして、その伸縮量は印加電圧の絶対値によって可変させることができる。このため、圧電素子31aに対する印加電圧を制御することによってその伸縮量を制御することができ、その結果、スプライン軸31bのZ軸に沿った移動を制御することが可能になる。
【0072】例えば、図6(a)の電圧波形は立ち上がり部において緩やかな傾斜を示し、立ち下がり部において急峻な傾斜を示している。このため、のこぎり波形の緩やかな立ち上がり部ではスプライン軸31bとスライダ31cとの間の摩擦力により、スライダ31cがスプライン軸31bと一体となって圧電素子31aの伸縮量に応じてZ軸に沿って移動する。一方、のこぎり波形の急峻な立ち下がり部では圧電素子31aは急激に元の位置に戻ろうとするのに対して、スライダ31cには移動後の位置に留まろうとする大きな慣性力が生じ、この慣性力が摩擦力よりも大きくなり、それによってスライダ31cとスプライン軸31bとの間にすべりが生じる。この結果、スライダ31cがスプライン軸31bに対してすべりを生じた距離分だけ相対的に+Z方向側に移動することになる。そして、図6(a)に示すようなのこぎり波形を繰り返し圧電素子31aに与えることにより、スライダ31cはスプライン軸31bに沿って段階的に+Z方向側に移動していくのである。
【0073】一方、図6(b)の電圧波形は図6(a)の波形に対して逆極性となっているため、のこぎり波形の緩やかな立ち上がり部ではスプライン軸31bとスライダ31cとの間の摩擦力により、スライダ31cがスプライン軸31bと一体となって圧電素子31aの伸縮量に応じてZ軸に沿って移動する。圧電素子31aは負の電圧が印加されることによって収縮するので、図6(b)の緩やかな立ち上がり部では圧電素子31aはゆっくりと収縮する。これに対して、図6(b)の急峻な立ち下がり部では、圧電素子31aは収縮した状態から急激に元の状態に戻ろうとするため、スライダ31cには大きな慣性力が生じ、この慣性力が摩擦力よりも大きくなり、それによってスライダ31cとスプライン軸31bとの間にすべりが生じる。この結果、スライダ31cがスプライン軸31bに対してすべりを生じた距離分だけ相対的に−Z方向側に移動することになる。そして、図6(b)に示すようなのこぎり波形を繰り返し圧電素子31aに与えることにより、スライダ31cはスプライン軸31bに沿って段階的に−Z方向側に移動していくのである。
【0074】このように第1リニアアクチュエータ31は、駆動手段となる圧電素子31aを非対称な速度で往復移動させることによって圧電素子31aに結合されたスプライン軸31bを往復移動させることができ、それによってスライダ31cを相対的に慣性移動させることが可能なように構成されている。なお、圧電素子31aを駆動する際の印加電圧を厳密に制御すれば、1回のすべりによってスライダ31cが移動する移動量をほぼ一定値に制御することが可能である。つまり、印加電圧の電圧レベルや波形の傾斜を制御すれば、1回のすべりによってスライダ13が移動する移動量を可変させることもできるのである。例えば、電圧レベルを高く、かつ、急峻な立ち下がり部の傾斜をより急峻なものとすれば、1回のすべりによって移動する移動量が大きくなるので、エンドエフェクタ35を高速で移動させることが可能になる。逆に、電圧レベルを低く、かつ、急峻な立ち下がり部の傾斜を若干緩やかなものとすれば、1回のすべりによって移動する移動量が小さくなるので、エンドエフェクタ35を低速で微少量ずつ移動させることが可能になる。
【0075】また、圧電素子31aに対して上記のようなのこぎり波形を連続的に印加すると、スライダ31cの動作は段階的に移動する粗動となる。これに対し、圧電素子31aに印可する電圧値を制御することで、圧電素子31aはその電圧値に応じた伸縮量を示すので、スライダ31cの動作は微小範囲を連続的に移動する微動となる。したがって、リニアアクチュエータの駆動手段として圧電素子を使用することで、粗動および微動を使い分けることが可能となり、スライダ31cの位置精度を高めることが可能になる。
【0076】なお、スプライン軸31bの凸部に着磁パターン形成部を形成し、スライダ31cの内部にさらに磁気抵抗素子等を設けることにより、それらが一体となって、リニアエンコーダを構成することができ、スライダ31cの移動に伴って磁気抵抗素子から移動量に応じたパルス信号を発生させることができる。そして、このパルス信号に基づいて所定の演算を行うことで、スプライン軸31bに対するスライダ31cの位置を検出することができ、この位置に基づいた移動制御を行うことも可能になるのである。
【0077】以上、第1リニアアクチュエータ31の動作について説明したが、第2リニアアクチュエータ32および第3リニアアクチュエータ33についても同様の構成および動作である。また、上記においては、マイクロマニピュレータ30aを例に挙げて説明したが、マイクロマニピュレータ30bについても同様に構成されており、動作についても同様である。
【0078】このようなマイクロマニピュレータ30a,30bが図1に示すようにセンサユニット10における試料の供給側と抽出側との2箇所の端部側に着設されており、各アクチュエータに対しては、センサユニット10内の制御部12によって電気的制御信号が供給されるように構成されている。
【0079】また、上記のようなマイクロマニピュレータ30a,30bは約20mm立方程度の大きさに収まり、エンドエフェクタ35を1μm前後の分解能で制御することができるので、分析装置1全体の大きさを大きくすることなく装置に組み込んで精密な操作を行うことが可能である。
【0080】<3.分析装置における分析動作>図1に戻り、サンプルポット41aと試薬ポット41bとで供給されたサンプル溶液および試薬といった試料はセンサユニット10の端部に取り付けられた第1のマイクロマニピュレータ30aによって、それぞれサンプル槽21aと試薬槽21bに必要量が供給される。マイクロマニピュレータ30aの先端部には定量の溶液を出し入れできるマイクロピペットが装着され、各ポットから各槽への溶液の供給が可能になっている。
【0081】分析チップ20の微小流路24a〜24fには、予めバッファ液などの溶液を充填しておくことで流路中から空気を追い出しておき、供給されたサンプルや試薬が電気泳動などの方法ですぐに微小流路24a〜24f内を移動できるようにする。
【0082】そして、サンプル槽21aと試薬槽21bに供給された試料、すなわちサンプルと試薬とは電気泳動によって微小流路24a〜24fを下流に向かって(廃棄槽23bの方向に向かって)移動する。このとき、サンプル槽21aと試薬槽21bとを廃棄槽23bに対して高い電位にしておき、微小流路24a〜24cの下流に向かっての電界を発生させ、その電界に沿って電気泳動による流れが発生するようにする。サンプルと試薬は反応槽22にて合流し反応を起こす。
【0083】ここで、サンプル溶液として制限酵素で切断された複数種類のDNA断片の溶液を使用し、試薬として蛍光マーカでラベル付けされ、サンプル溶液中の複数種類のDNA断片と相補的な塩基配列を有する複数種類のプローブDNA溶液を使用する場合について説明する。
【0084】サンプル槽21aと試薬槽21bとに対して所定の溶液が供給されるとサンプル槽21aおよび試薬槽21bと反応槽22との間にかけられた電界による電気泳動で、サンプルと試薬は反応槽22に向かって移動する。反応槽22において、DNA断片で構成されるサンプルDNAとプローブDNAとは相補的な塩基配列のもの同士でハイブリダイズする。反応槽22でハイブリダイズしたDNAとハイブリダイズしなかったDNAとは、反応槽22と廃棄槽23bとの間にかけられた電界による電気泳動で微小流路24c中を下流(廃棄槽23bの方向)に移動する。反応槽22と交差点Pとの間の微小流路24cには、ポリアクリルアミドのような高分子が充填されており、電気泳動するDNAの大きさに応じて泳動速度に差ができるように構成されている。
【0085】試薬中のプローブDNAの長さがほぼ同じであるとすると、ハイブリダイズしなかったプローブDNAはほぼ同じ速度で微小流路24cを電気泳動で移動する。また、ハイブリダイズしなかったDNA断片(サンプルDNA)もその長さに応じた速度で微小流路24cを移動する。
【0086】一方、プローブDNAとサンプルDNAとがハイブリダイズしたものは、ハイブリダイズした部分が二本鎖となりその前後に一本鎖のヌクレオチドを持ち全体としては長いDNA断片となるため、プローブDNAやハイブリダイズしなかったサンプルDNAよりも遅い速度で微小流路24cを移動することになる。そして、ハイブリダイズしたDNAの長さがサンプル中のDNA断片の種類により異なるように、制限酵素による切断位置とハイブリダイズするプローブDNAの塩基配列を設定しておくことで、電気泳動の速度の差を測定することでサンプルDNA中のDNA断片の種類を分析することができる。
【0087】そして、微小流路24cの交差点Pよりも少し上流側の所定位置にプローブDNAに付けられた蛍光マーカの蛍光を測定するためのセンシング位置(集光光学素子26の配置される位置)が設定されているため、センサ部11における光検出素子11cの出力から、ハイブリダイズしなかったプローブDNAのセンサ部11の通過時刻と、プローブDNAとサンプルDNAとがハイブリダイズした複数種類の生成物のセンサ部11の通過時刻とを知ることができる。ハイブリダイズしなかったDNA断片(サンプルDNA)は蛍光マーカを持たないのでセンサ出力には影響しない。
【0088】図7はセンサ部11の出力例を示す図である。この例では、測定開始後比較的早い時刻t1に、ハイブリダイズしなかったプローブDNAがセンシング位置を通過し、その時に最初の出力ピークPK1が現れている。その後、時刻t2,t3,t4に複数のピークPK2,PK3,PK4が現れている。つまり、ハイブリダイズしなかったプローブDNAがセンシング位置を通過した後に時間をおいてから、プローブDNAとサンプルDNAとのハイブリダイズした複数種類の生成物がその長さの違いに応じた時間差を持ってセンシング位置を通過することになり、複数のピークPK2〜PK4が出現するのである。そして、それぞれの生成物の長さに応じてピークの出現時刻が決まるとともに、それぞれの生成物の量に応じてピークの大きさが決まるため、図7の出力例を分析することによって生成物の種類等を解明することができる。このようにハイブリダイズした生成物が3種類の場合は図7のようにハイブリダイズ生成物によるピークPK2,PK3,PK4が現れる。
【0089】そして、制限酵素の選択とプローブDNAの塩基配列の設計を任意に組合わせることで、分析対象となるDNAの遺伝子修飾の有無や一塩基多型などの塩基配列情報を得ることが可能になる。
【0090】また、プローブDNAにラベル付けするための蛍光マーカをプローブの種類ごとに変えておき、センサ部11に分光機能を持たせて構成すれば、マーカの蛍光の波長を分別することでハイブリダイズ生成物の種類を見分けることも可能になる。この場合はハイブリダイズ生成物がセンシング位置を通過する時刻は厳密に測定する必要はなく、ハイブリダイズしなかったプローブDNAによるピークとハイブリダイズ生成物によるピークを時間的に見分けるだけで良い。
【0091】このようにしてセンサ部11にて蛍光を測定し、抽出対象となる生成物がセンシング位置を通過したことが分かった場合は、上述の電気泳動の原理によって流路の切り替えを行うことによって抽出対象となる生成物を抽出槽23aに導いたり、または、その生成物をマイクロマニピュレータ30bにより釣り上げたりすることで、目的の生成物を取り出すように制御されるのである。
【0092】<4.試料の取り出し>ここで、微小流路中からのDNA等の試料の釣り上げによる取り出し方法について説明する。
【0093】図8は、微小流路中のDNAの釣り上げ方法を示す図である。マイクロマニピュレータ30bの先端部と結合するエンドエフェクタとしては、試料操作針35aを使用する。試料操作針は、ベース部36とベース部36から突き出した微小径の針37とを有する。針37は金属を微細加工したものや、ウイスカーを使用することができる。微小流路24c中の溶液の流れの乱れを少なくするために、針37の少なくとも溶液中に浸される先端部分は1μmから50μm程度に細めておくことが望ましい。針37の先端には捕捉DNA38を付着させる。針37の先端への付着は化学的な手法により行うことができる。この手法の一例が、米国特許5789167号公報にプローブDNAの結合のための処理として記載されている。例えば、本実施例で、ポリペプチドのスペーサの端部を捕捉DNAおよび針37と共有結合で結び付ける方法が利用できる。
【0094】図8において微小流路24cを抽出対象のDNA(目的DNA)7が蛍光マーカ9付きのプローブDNA8とハイブリダイズした状態で移動していくのを、センサ部11が検出する。このとき、微小流路24c上のカバープレート25に設けられた小穴25aからマイクロマニピュレータ30bのエンドエフェクタとして装着された試料操作針35aを微小流路中の溶液内に浸漬させる。試料操作針35aは、上述のように、先端部(針37)が微小径で形成されており、その先端部に抽出すべき試料と、生物的または生化学的な結合性を有する物質が付着されている。その針37を溶液中に浸漬させ、その溶液中にて針37に付着された物質と抽出すべき試料とを反応させて互いに結合させ、その後、針37を溶液中から取り出すことによって抽出すべき試料を溶液中から取り出すことができる。
【0095】この実施の形態において試料操作針35aの針37には、抽出対象となる目的DNAとハイブリダイズする捕捉DNA38が付着されており、微小流路24c中の生成物に含まれる目的DNAと捕捉DNA38とを反応(ハイブリダイズ)させることで、抽出対象となる生成物を捕捉するのである。
【0096】つまり、試料操作針35aの針37を溶液中に浸漬させることにより、針37の先端部に付着している捕捉DNA38が溶液中の生成物とハイブリダイズすることになり、溶液中から目的となる試料のみを抽出することができるのである。このとき、微小流路24cの断面を試料操作針35aの先端がスキャンするようにマイクロマニピュレータ30bを動作させれば、捕捉DNA38と目的DNAとがハイブリダイズする確率を高めることができ、より確実な取り出しを行うことが可能になる。
【0097】上記のようにして、微小流路24c中から釣り上げられたDNAはマイクロマニピュレータ30bの操作により抽出ポット51の中に運ばれ、抽出ポット51で保管される。
【0098】抽出ポット51に搬送したときの処理はいくつか考えられる。
【0099】一例としては、ポット内にバッファ溶液をあらかじめ入れておいてDNAのハイブリダイズしたものを試料操作針35aごとバッファ溶液に浸す。ポット内容液の温度を上げることによりプローブDNAと目的DNAの結合を解き、目的DNAと捕捉DNAのハイブリダイズしたものが試料操作針35aに付着した状態を作る。そして、バッファ溶液を満たした別のポットに試料操作針35aを移動させ、そのポット内容液の温度を上げることにより、目的DNAと捕捉DNAとの結合を解き、溶液中に目的DNAのみが存在するようにする処理がある。この場合はプローブDNAと目的DNAの結合は、捕捉DNAと目的DNAの結合よりも低温で解かれるように、プローブDNAと捕捉DNAの塩基配列を目的DNAの塩基配列に応じて設計しておくことが必要である。そして、最初のポットで上げる温度よりも2番目のポットで上げる温度の方を高く設定し、2個所ある目的DNAの結合個所を所望の順番で解いていくのである。
【0100】他の例としては釣り上げたDNAを試料操作針35aごとに抽出ポット51のバッファ液の中で加熱し、捕捉DNAと目的DNAの結合を解いて、バッファ液の中に目的DNAとプローブDNAとの結合したものを存在させる。そして、プローブDNAの塩基配列を目的DNAのポリメラーゼ連鎖反応(PCR)による増幅のためのプライマとしても使えるように設計しておくと、抽出ポット51にポリメラーゼ酵素とオリゴヌクレオチドを加えて温度制御するだけで目的DNAの増幅を行うことができる。
【0101】図9は、マイクロマニピュレータ30bの試料操作針35aの交換機構の説明図である。
【0102】図9に示すように、複数の試料操作針35aがホルダ39に差込まれて保存されている。ホルダ39内には必要に応じて保存液を所定量入れておいて試料操作針35aの針先を浸しておく。使用時には、マイクロマニピュレータ30bを動作制御して試料操作針35aのベース部36をマイクロマニピュレータ30bの回転系アクチュエータ34の先端部と結合させて使用する。試料操作針35aのベース部36を磁性材料で形成し、マイクロマニピュレータ30bの回転系アクチュエータ34の先端部に磁石を設けておくと、試料操作針35aとマイクロマニピュレータ30bの回転系アクチュエータ34の先端部とを容易に結合することができる。さらに、マイクロマニピュレータ30bにおける回転系アクチュエータ34の先端部に試料操作針35aのベース部36を嵌入させるための凹部を設けておくことで、試料操作針35aが操作中にがたつくことのないように装着することができる。試料操作針35aにおいてはベース部36と針37との形状を所定精度で管理しておくことで、マイクロマニピュレータ30bによる正確な位置制御が可能である。
【0103】そして、マイクロマニピュレータ30bがホルダ39に差込まれた複数の試料操作針35aのうちの任意の試料操作針に対してアクセスし、回転系アクチュエータ34の先端部をベース部36の上部側に移動させることで、マイクロマニピュレータ30bに装着することができる。
【0104】一方、交換するときには、マイクロマニピュレータ30bはホルダ39の試料操作針35aが差し込まれていない部分に使用済みの試料操作針35aを差し込み、所定の動作を行うことで使用済みの試料操作針35aを取り外す。その後、上記装着の際と同様の操作を行うことで、試料操作針35aの交換を行うことが可能になる。
【0105】なお、ホルダ39は、センサユニット10のマイクロマニピュレータ30bがアクセス可能な任意の位置に取り付けられればよい。
【0106】上記では、エンドエフェクタ35が試料操作針35aである場合について説明したが、エンドエフェクタ35が試料操作針35aに限らず、例えば、マイクロピペット等の他のエンドエフェクタについてもホルダ39を使用することで、エンドエフェクタ35の自動装着および自動交換を行うことが可能であることは勿論である。そして、複数のエンドエフェクタ35を収容するホルダ39を各マイクロマニピュレータ30a,30bのアクセス可能な位置に配置しておくことで、分析装置1において異なる分析処理を繰り返して行うような場合であっても、エンドエフェクタ35を自動交換しつつ連続的に処理を進めることが可能になるのである。
【0107】なお、上記の試料操作針35aは、マイクロマニピュレータ30bが特定の試料を釣り上げる場合に限らず、例えば、人が手動操作して微小流路中から特定の試料を取り出す場合にも適した構造となっている。
【0108】<5.分析装置を自動運転を行うための機構>図1で説明したように、分析装置1においては、供給ポット41を使用して試料を供給したり、抽出ポット51を使用して試料を取り出して保管するように構成されている。このように、ポットを使用して試料を供給したり、または、抽出する場合であって、複数種類のサンプルや試薬を順次に取り替えながら分析抽出する動作を連続的に自動運転する場合には、図1に示す分析装置1に対して、オプション装置としてポット交換機構を付加することが好ましい。この場合、ポット交換機構に複数のサンプルポットや試薬ポット等を装填しておいてサンプルや試薬を取り替えて複数回の分析作業を自動で行うことができる。また、抽出ポットについても同様であり、複数の抽出ポットを装填しておいて抽出すべき試料が抽出槽23aに導かれる度に、抽出ポットを取り替えつつ、それぞれの抽出ポットに異なる抽出物を収容するようにして複数回の分析抽出作業を自動的に行うようにすることもできる。
【0109】図10は、ポット交換機構を付加した分析装置1を示す斜視図である。図10に示すように、この分析装置1には、図1に示した構成に加えて、複数の供給ポット41が搭載された回転可能な供給円盤40と、複数の抽出ポット51が搭載された回転可能な抽出円盤50とが設けられている。
【0110】回転可能な供給円盤40上には複数のサンプルポットおよび試薬ポットが搭載されており、円盤の中心位置の下方側(裏面側)には、供給円盤回転駆動手段として、図示しない回転モータが設置されている。この回転モータはセンサユニット10内部の制御部12によって回転制御されるように構成されており、供給円盤40の回転位相角を制御することで、所望のサンプルポット、試薬ポットを分析チップ20上のサンプル槽21aおよび試薬槽21bの近傍に移動させることができる。所望のポットの移動が完了すると、マイクロマニピュレータ30aを動作させてサンプルや試薬を分析チップ20上の各槽に供給する。また、別の反応をチップ上で行うためには、供給円盤40を回転させることによって、サンプルポット、試薬ポットを適宜に切り替えて分析チップ20に供給することで、自動的に複数の反応をさせていくことができる。
【0111】同様に、回転可能な抽出円盤50上には複数の抽出ポット51が搭載されており、その中心位置の下方側(裏面側)には、抽出円盤回転駆動手段として、図示しない回転モータが設置されている。この回転モータもセンサユニット10内の制御部12によって回転制御されるように構成されており、抽出円盤50の回転位相角を制御することで所望の抽出ポットを分析チップ20の抽出槽23aの近傍に移動させることができる。そして、所望のポットの移動が完了すると、マイクロマニピュレータ30bを移動させて抽出対象となる粒子や反応生成物などの試料を抽出槽23aから抽出ポット51に移動させる。また、別の反応をチップ上で行なったときは、抽出円盤50を回転させることにより抽出ポット51を切り替えて抽出対象となる試料を抽出ポット51に移動させる。
【0112】このように、ポット交換機構として複数のポットを搭載可能な供給円盤40および抽出円盤50を設けることによって、複数回の分析抽出作業を連続的かつ自動的に行うことが可能になる。
【0113】一方、分析チップ20も使用回数が限界に達したり、分析内容が変更されることによって取り替えることが必要になる場合がある。そこで、図1の分析装置1に対して、オプション装置として分析チップ交換機構を付加することが好ましい。この場合は分析チップ交換機構に予め複数の分析チップ20を装填しておき、必要に応じてセンサユニット10に装着される分析チップ20を自動的に取り替えることにより、複数回の分析作業を連続的にかつ自動的に行うことが可能になる。また、分析チップ交換機構と上記のポット交換機構とを併用しての連続自動運転も可能である。
【0114】図11は分析チップ交換機構を配置した分析装置1の一構成例を示す図である。なお、図11は、図1のYZ平面に垂直な方向にある点から分析装置1を見た図であり、マイクロマニピュレータ30a,30bについては図示を省略している。
【0115】図11に示す分析装置1では、センサユニット10をはさんで、スタッカ60と回収器70とY軸方向に沿ってが配置される。
【0116】センサユニット10に装着される分析チップ20の下方所定位置には、制御部12によって駆動制御される押し上げアクチュエータ17が設置されている。そして、センサユニット10上の分析チップ20を交換する際には、センサユニット10内の制御部12が押し上げアクチュエータ17を動作させ、センサユニット10の上部における凹部(分析チップ20を嵌め込むための彫り込み部)から分析チップ20を持ち上げる。このとき、分析チップ20の下面位置がセンサユニット10の凹部の土手の高さよりも高くなるようにする。押し上げアクチュエータ17としては、例えばプランジャ型マグネットなどを利用することができる。
【0117】スタッカ60には、未使用の分析チップ20を収納する収納部61、収納部61下部に設けられたチップエレベータ62、分析チップ20をセンサユニット10の凹部まで押し出すチップ押し出し機構63が設けられている。分析チップ20の交換の際には、チップエレベータ62が動作し、収納部61内に収容された複数の分析チップ20のうちの最上段の分析チップ20の下面位置がセンサユニット10の凹部の土手よりもわずかに上の高さ位置となるように持ち上げられる。この後、チップ押し出し機構63が動作して分析チップ20をセンサユニット10の凹部上方まで押し出していく。チップ押し出し機構63による分析チップ20の押し出し量が所定量を超えると、センサユニット10の押し上げアクチュエータ17が停止し、押し上げ部材が動作開始前の状態に戻る。そして、分析チップ20がセンサユニット10の凹部に到達すると、自重により分析チップ20は凹部にはまり込んで、分析チップ20が交換される。センサユニット10に装着されていた分析チップ20は、スタッカ60から押し出される未使用の分析チップ20の先端部で押し出されてセンサユニット10の上部から回収器70の配置されている方向に移動し、自重によって回収器70内に落とし込まれる。
【0118】以上のように構成することで、必要に応じてセンサユニット10に装着される分析チップ20を自動的に取り替えることが可能になり、複数回の分析作業を連続的にかつ自動的に行うことができる。
【0119】なお、上記のチップエレベータ62は、例えば、マイクロモータ62aとネジ機構62bとを組合わせてエレベータ床62cを上下させる機構が利用できる。また、チップ押し出し機構63はマイクロモータ63aとラック63bを組合わせ、ラック63bを押し出し用部材として使用することによって構成することができる。
【0120】さらに、上述のマイクロマニピュレータ30a,30bのエンドエフェクタ35の交換用として複数のエンドエフェクタを収容したホルダ39を併設することで、エンドエフェクタ35を必要に応じて自動交換することができるので、分析作業を連続的かつ自動的に行うことが可能になる。
【0121】このように、分析装置1に対して、マイクロマニピュレータ30a,30bや各種資材供給のための交換機構を組合わせることにより、分析作業の自動化や必要な試料の自動抽出を行うことが可能となる。
【0122】<6.変形例>以上、この発明の一実施形態について説明したが、この発明は上記説明内容に限定されるものではない。
【0123】例えば、上記説明では、DNAのハイブリダイズ反応によって分析および操作を行う場合を例示したが、抗体・抗原反応やリガンド・受容体反応、その他の生物学的、生化学的反応などを利用した分析および操作を行う場合にも、この分析装置が適用可能であることは勿論である。つまり、分析装置において分析および操作対象となる試料は微小な物質であればよいのである。
【0124】また、上記説明では、分析チップ20上の各槽の間で溶液やサンプル、試薬などの試料を移動させる方法として電気泳動を利用する場合を例示したが、他の方法を採用してもよい。例えば、マイクロポンプによる圧力を利用したり、また、各槽の高さ位置を異なるようにして重力ポテンシャルを利用するようにしてもよい。
【0125】
【発明の効果】以上説明したように、請求項1に記載の発明によれば、光源で発生する試料の蛍光を励起するための光を、光案内手段によって微小流路に導き、その微小流路の壁面に設けられた集光光学素子にて試料からの蛍光を捕捉し、光検出素子で光検出を行うように構成されているため、装置周辺に別途光学系等を設置する必要がないので、小型で、かつ、安価に実現できるとともに、速やかに分析処理を開始することができる。
【0126】請求項2に記載の発明によれば、試料を微小流路内において集光光学素子に近づける偏向手段を備えるため、近接場の効果によって試料からの蛍光を高感度に計測することができる。
【0127】請求項3に記載の発明によれば、第1の電極と第2の電極との間に所定の電界を与えることにより試料を集光光学素子に近づけるため、微小流路中において試料を確実に集光光学素子に近づけることが可能である。
【0128】請求項4に記載の発明によれば、試料を所定の供給位置に供給する第1のマイクロマニピュレータを備えるため、試料供給を自動的に行うことが可能である。
【0129】請求項5に記載の発明によれば、試料を収容する複数の容器を搭載可能であって、その複数の容器のうちの任意の容器を選択的に第1のマイクロマニピュレータの操作可能範囲内に移動させる手段を備えるため、連続的かつ自動的に容器を移動させることが可能となり、分析装置の連続自動運転を実現することができる。
【0130】請求項6に記載の発明よれば、光検出素子にて検出される光の特性に応じて、微小流路を移動する試料に含まれる特定の試料を抽出する抽出手段を備えるため、分析装置において特定の試料のみを抽出することが可能である。
【0131】請求項7に記載の発明よれば、微小流路が所定位置にて複数方向に分岐しており、抽出手段が、複数方向のうちから試料の移動方向を選択的に切り換えることによって、特定の試料を複数方向のうちの一の方向に導くことで抽出するように構成されているため、特定の試料のみを一の方向に導いて抽出することができる。
【0132】請求項8に記載の発明によれば、抽出手段は、微小流路中の特定の試料との結合性を有する物質が付着されたエンドエフェクタを含む第2のマイクロマニピュレータを備えており、その第2のマイクロマニピュレータがエンドエフェクタに付着された物質を微小流路中に配置することで特定の試料を抽出するように構成されているため、微小流路中から特定の試料を取り出すことが可能である。
【0133】請求項9に記載の発明によれば、複数方向のうちの一の方向に導かれた特定の試料を含む溶液を取り出す第2のマイクロマニピュレータを備えているため、特定の試料を溶液中から取り出すことが可能である。
【0134】請求項10に記載の発明によれば、特定の試料を含む溶液を保管するための複数の容器を搭載可能であって、複数の容器のうちの任意の容器を選択的に第2のマイクロマニピュレータの操作可能範囲内に移動させる手段を備えるため、連続的かつ自動的に容器を移動させることが可能となり、分析装置の連続自動運転を実現することができる。
【0135】請求項11に記載の発明によれば、第2のマイクロマニピュレータの先端部に装着されるエンドエフェクタを複数保持可能なホルダを備えており、第2のマイクロマニピュレータが、エンドエフェクタをホルダに保持される複数のエンドエフェクタと交換するように構成されているため、エンドエフェクタを交換しつつの分析装置の連続自動運転が可能になる。
【0136】請求項12に記載の発明によれば、光源と光検出素子とが設けられたセンサユニットに対して、微小流路と光案内手段と集光光学素子とが設けられた分析チップが着脱自在に構成されており、分析チップがセンサユニットに対して装着された際に、光源からの光が光案内手段を介して微小流路に導かれ、集光光学素子によって捕捉された蛍光が光検出素子に導かれるとともに、試料を移動させるためのエネルギーがセンサユニットから分析チップに対して供給されるように構成されているため、設置が容易であるとともに、装置全体としての小型化を図ることができる。
【0137】請求項13に記載の発明によれば、センサユニットに隣接して設置され、センサユニットに対して分析チップを供給して装着を行うとともに、センサユニットに装着された分析チップの回収を行う分析チップ交換手段を備えるため、分析チップを交換しつつの分析装置の連続自動運転が可能になる。
【0138】請求項14に記載の発明によれば、先端部が微小径で形成されており、先端部に試料と生物的または生化学的な結合性を有する物質が付着されているため、簡単な操作で特定の試料のみを容易に取り出すことができる。
【0139】請求項15に記載の発明によれば、簡単に特定の試料のみを容易に取り出すことができる。
【図面の簡単な説明】
【図1】分析装置の一構成例を示す斜視図である。
【図2】センサユニットを所定の平面で切断したときの断面図である。
【図3】図2のセンサ部周辺の拡大図である。
【図4】図2のA−A断面における集光光学素子26周辺の拡大図である。
【図5】マイクロマニピュレータの概略構成図である。
【図6】リニアアクチュエータの圧電素子に印加する電圧波形の一例を示す図である。
【図7】センサ部の出力例を示す図である。
【図8】微小流路中の試料の釣り上げ方法を示す図である。
【図9】マイクロマニピュレータの試料操作針の交換機構の説明図である。
【図10】ポット交換機構を付加した分析装置を示す斜視図である。
【図11】分析チップ交換機構を配置した分析装置の一構成例を示す図である。
【符号の説明】
1 分析装置
10 センサユニット
11 センサ部
12 制御部
20 分析チップ
21a サンプル槽
21b 試薬槽
22 反応槽
23a 抽出槽
23b 廃棄槽
23c バッファ槽
24a〜24f 微小流路
26 集光光学素子
27 ライトガイド(光案内手段)
30a,30b マイクロマニピュレータ
35 エンドエフェクタ
35a 試料操作針
39 ホルダ
40 供給円盤
50 抽出円盤
60 スタッカ(分析チップ交換手段)
70 回収器(分析チップ交換手段)
【特許請求の範囲】
【請求項1】 微小流路内を移動する試料からの蛍光を測定して前記試料の特性を分析する分析装置であって、前記試料の蛍光を励起するための光を発生させる光源と、前記光源からの光を前記微小流路内に導く光案内手段と、前記微小流路の壁面に設けられ、前記試料からの蛍光を捕捉する集光光学素子と、前記集光光学素子で捕捉された光を検出する光検出素子と、を備えることを特徴とする分析装置。
【請求項2】 請求項1に記載の分析装置において、前記試料を前記微小流路内において前記集光光学素子に近づける偏向手段をさらに備えることを特徴とする分析装置。
【請求項3】 請求項2に記載の分析装置において、前記偏向手段は、前記集光光学素子近傍で前記微小流路に面して設けられた第1の電極と、前記第1の電極に対向する位置であって、前記微小流路に面して設けられた第2の電極と、を備え、前記第1の電極と前記第2の電極との間に所定の電界を与えることにより前記試料を前記集光光学素子に近づけることを特徴とする分析装置。
【請求項4】 請求項1ないし請求項3のいずれかに記載の分析装置において、前記試料を所定の供給位置に供給する第1のマイクロマニピュレータをさらに備えることを特徴とする分析装置。
【請求項5】 請求項4に記載の分析装置において、前記試料を収容する複数の容器を搭載可能であって、前記複数の容器のうちの任意の容器を選択的に前記第1のマイクロマニピュレータの操作可能範囲内に移動させる手段をさらに備えることを特徴とする分析装置。
【請求項6】 請求項1ないし請求項5のいずれかに記載の分析装置において、前記光検出素子にて検出される光の特性に応じて、前記微小流路を移動する前記試料に含まれる特定の試料を抽出する抽出手段をさらに備えることを特徴とする分析装置。
【請求項7】 請求項6に記載の分析装置において、前記微小流路は所定位置にて複数方向に分岐しており、前記抽出手段は、前記複数方向のうちから前記試料の移動方向を選択的に切り換えることによって、前記特定の試料を前記複数方向のうちの一の方向に導くことで抽出することを特徴とする分析装置。
【請求項8】 請求項6に記載の分析装置において、前記抽出手段は、前記微小流路中の前記特定の試料との結合性を有する物質が付着されたエンドエフェクタを含む第2のマイクロマニピュレータを備え、前記第2のマイクロマニピュレータが前記エンドエフェクタの前記物質を前記微小流路中に配置することで前記特定の試料を抽出することを特徴とする分析装置。
【請求項9】 請求項7に記載の分析装置において、前記複数方向のうちの一の方向に導かれた前記特定の試料を含む溶液を取り出す第2のマイクロマニピュレータをさらに備えることを特徴とする分析装置。
【請求項10】 請求項9に記載の分析装置において、前記特定の試料を含む溶液を保管するための複数の容器を搭載可能であって、前記複数の容器のうちの任意の容器を選択的に前記第2のマイクロマニピュレータの操作可能範囲内に移動させる手段をさらに備えることを特徴とする分析装置。
【請求項11】 請求項8ないし請求項10のいずれかに記載の分析装置において、前記第2のマイクロマニピュレータの先端部に装着されるエンドエフェクタを複数保持可能なホルダをさらに備え、前記第2のマイクロマニピュレータは、前記エンドエフェクタを前記ホルダに保持される複数のエンドエフェクタと交換することを特徴とする分析装置。
【請求項12】 請求項1ないし請求項11のいずれかに記載の分析装置において、前記光源と前記光検出素子とが設けられたセンサユニットに対して、前記微小流路と前記光案内手段と前記集光光学素子とが設けられた分析チップが着脱自在に構成されており、前記分析チップが前記センサユニットに対して装着された際に、前記光源からの光が前記光案内手段を介して前記微小流路に導かれ、前記集光光学素子によって捕捉された前記蛍光が前記光検出素子に導かれるとともに、前記試料を移動させるためのエネルギーが前記センサユニットから前記分析チップに対して供給されることを特徴とする分析装置。
【請求項13】 請求項12に記載の分析装置において、前記センサユニットに隣接して設置され、前記センサユニットに対して前記分析チップを供給して装着を行うとともに、前記センサユニットに装着された前記分析チップの回収を行う分析チップ交換手段をさらに備えることを特徴とする分析装置。
【請求項14】 抽出対象となる微小な試料を所定の溶液中から取り出すための試料操作針であって、先端部が微小径で形成されており、前記先端部に前記試料と生物的または生化学的な結合性を有する物質が付着されていることを特徴とする試料操作針。
【請求項15】 先端部が微小径で形成されており、抽出対象となる試料と生物的または生化学的な結合性を有する物質が前記先端部に付着された試料操作針を用いて、前記試料を所定の溶液中から取り出すための方法であって、前記先端部を前記溶液中に浸漬させる工程と、前記溶液中にて前記物質と前記試料とを反応させて互いに結合させる工程と、前記先端部を前記溶液中から取り出す工程と、を行うことを特徴とする試料取り出し方法。
【請求項1】 微小流路内を移動する試料からの蛍光を測定して前記試料の特性を分析する分析装置であって、前記試料の蛍光を励起するための光を発生させる光源と、前記光源からの光を前記微小流路内に導く光案内手段と、前記微小流路の壁面に設けられ、前記試料からの蛍光を捕捉する集光光学素子と、前記集光光学素子で捕捉された光を検出する光検出素子と、を備えることを特徴とする分析装置。
【請求項2】 請求項1に記載の分析装置において、前記試料を前記微小流路内において前記集光光学素子に近づける偏向手段をさらに備えることを特徴とする分析装置。
【請求項3】 請求項2に記載の分析装置において、前記偏向手段は、前記集光光学素子近傍で前記微小流路に面して設けられた第1の電極と、前記第1の電極に対向する位置であって、前記微小流路に面して設けられた第2の電極と、を備え、前記第1の電極と前記第2の電極との間に所定の電界を与えることにより前記試料を前記集光光学素子に近づけることを特徴とする分析装置。
【請求項4】 請求項1ないし請求項3のいずれかに記載の分析装置において、前記試料を所定の供給位置に供給する第1のマイクロマニピュレータをさらに備えることを特徴とする分析装置。
【請求項5】 請求項4に記載の分析装置において、前記試料を収容する複数の容器を搭載可能であって、前記複数の容器のうちの任意の容器を選択的に前記第1のマイクロマニピュレータの操作可能範囲内に移動させる手段をさらに備えることを特徴とする分析装置。
【請求項6】 請求項1ないし請求項5のいずれかに記載の分析装置において、前記光検出素子にて検出される光の特性に応じて、前記微小流路を移動する前記試料に含まれる特定の試料を抽出する抽出手段をさらに備えることを特徴とする分析装置。
【請求項7】 請求項6に記載の分析装置において、前記微小流路は所定位置にて複数方向に分岐しており、前記抽出手段は、前記複数方向のうちから前記試料の移動方向を選択的に切り換えることによって、前記特定の試料を前記複数方向のうちの一の方向に導くことで抽出することを特徴とする分析装置。
【請求項8】 請求項6に記載の分析装置において、前記抽出手段は、前記微小流路中の前記特定の試料との結合性を有する物質が付着されたエンドエフェクタを含む第2のマイクロマニピュレータを備え、前記第2のマイクロマニピュレータが前記エンドエフェクタの前記物質を前記微小流路中に配置することで前記特定の試料を抽出することを特徴とする分析装置。
【請求項9】 請求項7に記載の分析装置において、前記複数方向のうちの一の方向に導かれた前記特定の試料を含む溶液を取り出す第2のマイクロマニピュレータをさらに備えることを特徴とする分析装置。
【請求項10】 請求項9に記載の分析装置において、前記特定の試料を含む溶液を保管するための複数の容器を搭載可能であって、前記複数の容器のうちの任意の容器を選択的に前記第2のマイクロマニピュレータの操作可能範囲内に移動させる手段をさらに備えることを特徴とする分析装置。
【請求項11】 請求項8ないし請求項10のいずれかに記載の分析装置において、前記第2のマイクロマニピュレータの先端部に装着されるエンドエフェクタを複数保持可能なホルダをさらに備え、前記第2のマイクロマニピュレータは、前記エンドエフェクタを前記ホルダに保持される複数のエンドエフェクタと交換することを特徴とする分析装置。
【請求項12】 請求項1ないし請求項11のいずれかに記載の分析装置において、前記光源と前記光検出素子とが設けられたセンサユニットに対して、前記微小流路と前記光案内手段と前記集光光学素子とが設けられた分析チップが着脱自在に構成されており、前記分析チップが前記センサユニットに対して装着された際に、前記光源からの光が前記光案内手段を介して前記微小流路に導かれ、前記集光光学素子によって捕捉された前記蛍光が前記光検出素子に導かれるとともに、前記試料を移動させるためのエネルギーが前記センサユニットから前記分析チップに対して供給されることを特徴とする分析装置。
【請求項13】 請求項12に記載の分析装置において、前記センサユニットに隣接して設置され、前記センサユニットに対して前記分析チップを供給して装着を行うとともに、前記センサユニットに装着された前記分析チップの回収を行う分析チップ交換手段をさらに備えることを特徴とする分析装置。
【請求項14】 抽出対象となる微小な試料を所定の溶液中から取り出すための試料操作針であって、先端部が微小径で形成されており、前記先端部に前記試料と生物的または生化学的な結合性を有する物質が付着されていることを特徴とする試料操作針。
【請求項15】 先端部が微小径で形成されており、抽出対象となる試料と生物的または生化学的な結合性を有する物質が前記先端部に付着された試料操作針を用いて、前記試料を所定の溶液中から取り出すための方法であって、前記先端部を前記溶液中に浸漬させる工程と、前記溶液中にて前記物質と前記試料とを反応させて互いに結合させる工程と、前記先端部を前記溶液中から取り出す工程と、を行うことを特徴とする試料取り出し方法。
【図1】


【図2】


【図3】


【図4】


【図7】


【図5】


【図6】


【図8】


【図9】


【図10】


【図11】




【図2】


【図3】


【図4】


【図7】


【図5】


【図6】


【図8】


【図9】


【図10】


【図11】


【公開番号】特開2001−108619(P2001−108619A)
【公開日】平成13年4月20日(2001.4.20)
【国際特許分類】
【出願番号】特願平11−289319
【出願日】平成11年10月12日(1999.10.12)
【出願人】(000006079)ミノルタ株式会社 (155)
【Fターム(参考)】
【公開日】平成13年4月20日(2001.4.20)
【国際特許分類】
【出願日】平成11年10月12日(1999.10.12)
【出願人】(000006079)ミノルタ株式会社 (155)
【Fターム(参考)】
[ Back to top ]

