分析装置および分析方法
【課題】分析の目的とする物質を含むサンプルを希釈することなく定量的に測定することができる分析装置を提供する。
【解決方法】微細流路内に設けた検出部よりも、流れ方向の上流側にモル量を低減させる物質が固定化された前処理部を設ける。検出されるべき物質は前処理部の捕捉体により捕らえられ減少するため、検出部にて検出される物質の濃度を検出部での検量範囲内に収めることが可能となる。
【解決方法】微細流路内に設けた検出部よりも、流れ方向の上流側にモル量を低減させる物質が固定化された前処理部を設ける。検出されるべき物質は前処理部の捕捉体により捕らえられ減少するため、検出部にて検出される物質の濃度を検出部での検量範囲内に収めることが可能となる。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、分析装置および分析方法に関する。本発明は、特に、血液中に含まれている特定の成分(例えば酵素、基質、サイトカイン、抗体など)を検出および分析する装置、および上記成分を検出および分析する方法に関する。
【背景技術】
【0002】
抗原抗体反応を用いた免疫分析法は、医療分野、生化学分野、またはアレルゲン等を測定する分野などにおける分析および計測に使用される方法として有用である。しかし、従来の免疫分析法は、分析に長時間を要する、操作が煩雑であるなどの問題を有している。
【0003】
近年、半導体の微細加工技術などを応用したマイクロ化技術(Micro Electro Mechanical System、MEMS)が開発されている。そして、タンパク質、遺伝子などの生化学分野における分析においては、抗原抗体反応を用いたマイクロ化技術(Micro Total Analytical System、μ−TAS)が急速に発展している。
【0004】
例えば、特許文献1には、幅がマイクロオーダーの長さである微細流路(以下、「マイクロチャネル」ともいう。)が表面上に形成された基板を有するマイクロチャネル型の分析装置が開示されている。特許文献1に記載の分析装置は、マイクロチャネルに固定化された抗体または人工抗体などを用いて、抗原などの検出対象の物質(以下、「対象物質」ともいう。)を分析するというものであり、このような分析装置を用いて分析時間の短縮化または分析操作の簡略化を実現することが提案されている。
【0005】
特許文献1に開示された分析装置の構造を図12に示す。図12に示すように、このマイクロチャネル型分析装置は、ガラス、プラスチックなどの透光性材料からなる基板200の表面に、マイクロチャネル201、溶液をマイクロチャネル201に注入する注入孔202、溶液を溜める液溜め部203、および溶液を分析装置から排出する排出孔204が形成されている。注入孔202および排出孔204は、それぞれマイクロチャネル201の両端に設けられており、排出孔204には液溜め部203が連結されている。マイクロチャネル201内には、抗体固定部205が設けられている。抗体固定部205には、溶液中の対象物質と特異的に結合する抗体が周知の固定化方法(例えば、物理的な吸着を用いて固定する方法、抗体が有するアミノ基と固定部の官能基との間に共有結合を形成して固定する方法など)によって固定化されている。なお、抗体とは、対象物質に対して特異的な親和性を有する物質である。
【0006】
図13は、図12に示す分析装置を使用した、対象物質の分析方法を説明するための図である。図13に示すように、対象物質220を含むサンプル溶液と、標識抗体223を含む溶液とを混合する。標識抗体223は、光学的に検出可能な標識物質221と、対象物質220に結合可能な抗体222とが結合して形成されたものである。この標識抗体223と対象物質220とが結合して、免疫複合体(標識抗体223と対象物質220との反応によって生じた複合体)224が形成される。
【0007】
次いで、この免疫複合体224を含む溶液を、図12に示す注入孔202から外部ポンプを用いて注入し、マイクロチャネル201に流通させる。免疫複合体224を含む溶液が抗体固定部205に到達すると、図13に示すように、溶液中の免疫複合体224と、抗体固定部205に固定化された抗体225とが結合する。これにより、抗体固定部205において、抗体225−対象物質220−標識抗体223から構成される複合体226が形成される。
【0008】
その後、抗体固定部205にて形成された複合体226中の標識抗体223に結合されている標識物質221を光学的に検出することによって、対象物質220を検出する。標識物質221の検出には、例えば、使用する標識物質221の種類に応じて、紫外可視分光分析、蛍光分析、化学発光分析、熱レンズ分析などの所定の分析機器が用いられて、標識物質221の光吸収、蛍光または発光などを検出することによって実施される。
【0009】
濃度既知の対象物質220を含む標準溶液に対して上述の対象物質の分析方法を適用して、対象物質220の濃度についての検量線を作製する。この検量線を用いて、対象物質220の濃度が不明の溶液における、対象物質220の濃度を測定することが可能となる。
【先行技術文献】
【特許文献】
【0010】
【特許文献1】国際公開第2006/054689号パンフレット(2006年5月26日公開)
【発明の概要】
【発明が解決しようとする課題】
【0011】
特許文献1に開示されたマイクロチャネル型の分析装置の検量範囲は、抗体固定部205に固定化された抗体225の物性にほぼ依存する。このため、サンプル溶液中の対象物質の濃度が、抗体固定部205に固定化された抗体225に結合し得る濃度よりも高い場合、サンプル溶液を分析装置内にアプライする前に、溶液を希釈する必要がある。
【0012】
例えば、抗体を使用した検出系の場合、抗体の検出範囲は、通常、1〜数百ng/mLとなる。しかしながら、サンプル溶液中に含まれる対象物質の濃度がμg/mLのオーダーであることは珍しくない。この場合、溶液を数百〜数千倍に希釈することが必要になる。希釈操作は使用者にとって非常に面倒な操作である。
【0013】
また、特許文献1に開示されたマイクロチャネル型の分析装置に適用される溶液の容量は超微量(数μL〜数百μL)である。このような超微量の取扱い時の希釈は、煩雑な作業となりかねない。
【0014】
このように、従来の分析装置では、分析装置に溶液をアプライする前に、面倒かつ煩雑な希釈操作を実施しなければならないことがあるという問題点がある。
【0015】
本発明は、上記の問題点に鑑みてなされたものであり、その目的は、微細流路を有する分析装置に溶液をアプライする前に溶液を希釈することなく、サンプル溶液中の対象物質を検出し、かつその濃度を測定することができる分析装置、およびこの分析装置を用いた対象物質の測定方法を提供することにある。
【課題を解決するための手段】
【0016】
本発明に係る分析装置は、注入すべき流体を受容する第1の注入部と流体を排出する第1の排出部とを両端に連結している第1の微小流路を備え、第1の微小流路に、流体中の物質を検出する第1の検出部が設けられており、第1の検出部に、検出すべき物質を捕捉する第1の捕捉物質が配置されている分析装置であって、第1の注入部と第1の検出部との間には、流体中の物質の濃度を低減させる第1の前処理部が設けられており、第1の前処理部には、低減すべき物質を捕捉する第2の捕捉物質が配置されていることを特徴としている。
【0017】
このような構成によれば、目的の物質を検出する検出部よりも上流側に、対象物質の濃度を低減させる捕捉物質が固定化された前処理部が設置されている。分析装置の注入部にアプライされ、微小流路へ導入されたサンプルが検出部に到達する前に前処理部を通過するので、前処理部の捕捉物質によってサンプル中の対象物質の一部が捕捉される。これにより、サンプル中の対象物質の濃度を低減することができる。すなわち、分析装置内においてサンプル中の対象物質の濃度が自動的に低減される。したがって、分析装置の注入部にサンプルをアプライする前に希釈操作をすることなく、検出部に送達されるサンプル中に含まれている目的の物質の濃度を、検出部における検出可能な濃度範囲内とすることができ、その結果、目的の物質を首尾よく検出することができる。
【0018】
本明細書において、用語「サンプル」とは、分析装置の注入部にアプライされる検体(被検物)をいい、検出の対象としている目的物質(対象物質)を含んでいてもいなくてもよい。
【0019】
本明細書において、用語「捕捉物質」とは、対象物質と特異的に相互作用することによって、この対象物質と共有結合または非共有結合を形成する物質をいう。捕捉物質は、具体的に、対象物質との間でホストとゲストとの関係を有する物質であり、捕捉物質としては、例えば、抗原、抗体、酵素、基質、リガンド、レセプター、DNA、糖、ペプチド、合成高分子(例えばモレキュラーインプリントポリマー)などが挙げられる。
【0020】
本明細書において、用語「注入部」は、分析されるべきサンプルや分析に用いる流体を装置内へ注入するための入口であり、注入されるべきサンプルを予め貯留する機能を兼ねてもよい。また、用語「排出部」は、分析されたサンプルや分析に用いられた流体を分析装置内から排出するための出口であり、排出されたサンプルや流体を貯留しておく機能を兼ねてもよい。
【0021】
本明細書において、用語「上流」および「下流」は、微小流路内における流体の流れを基準とした概念であり、特に説明を加えない限り、流路における注入部方向が「上流」であり、排出部方向が「下流」である。
【0022】
本発明に係る分析装置は、流体の移動を促進する駆動手段と連結されていることが好ましく、この場合、駆動手段は、第1の注入部および第1の排出部の少なくとも一方に連結されている。
【0023】
本発明に係る分析装置において、第1の微小流路が、表面上にマイクロチャネルが形成されている第1の基板と、該マイクロチャネルを覆う第2の基板とによって形成されており、第1および第2の基板の少なくとも1つを貫く第1および第2の貫通孔が設けられており、第1および第2の貫通孔がそれぞれ第1の注入部および第1の排出部と連絡していることが好ましい。
【0024】
微小流路を基板上に形成させることにより、所望の形状のマイクロチャネルを、種々の公知技術を用いて容易に作製することができる。
【0025】
本発明に係る分析装置は、流体の移動を促進する駆動手段と連結されていることが好ましく、この場合、駆動手段は、第1および第2の貫通孔の少なくとも一方に連結されている。
【0026】
本発明に係る分析装置は、注入すべき第1の流体を受容する第1の注入部と流体を排出する第1の排出部とを両端に連結している第1の微小流路を備え、第1の微小流路に、第1の流体中の物質を検出する第1の検出部が設けられており、第1の検出部に、検出すべき物質を捕捉する第1の捕捉物質が配置されている分析装置であって、注入すべき第2の流体を受容する第2の注入部を一端に連結している第2の微小流路をさらに備え、第2の微小流路の他端が、第1の注入孔と第1の検出部との間の接続部にて第1の微小流路と接続されており、第2の微小流路内に、第1の流体中の物質の濃度を低減させる第1の前処理部が設けられており、第1の前処理部に、低減すべき物質を捕捉する第2の捕捉物質が配置されていることを特徴としている。
【0027】
このような構成によれば、微小流路へ導入されるべき流体およびサンプルを、異なる注入部から適宜導入することを実現し得る。この場合、分析に供されるサンプルを第2の注入部から導入し、検出に用いられる試薬等を第1の注入部から導入することによって、前処理部を通過することなく試薬等を検出部に送達することができる。その結果、前処理部にて生じ得る、分析に不要な反応を排除することができる。
【0028】
本明細書において、「分析に供する」は検出部にて実際の分析をすることが意図される。すなわち、「分析に供されるサンプル」は、注入部にアプライされるサンプルのうち、注入部から微小流路へ導入される部分が意図される。なお、注入部にアプライされるサンプルの全量を分析に供する態様もまた、本発明の範囲に含まれる。
【0029】
本発明に係る分析装置もまた、流体の移動を促進する駆動手段と連結されていることが好ましく、この場合、駆動手段は、第1および第2の注入部の両方に、または第1の排出部に連結されている。
【0030】
本発明に係る分析装置において、第1および第2の微小流路は、表面上にマイクロチャネルが形成されている第1の基板と、該マイクロチャネルを覆う第2の基板とによって形成されており、第1および第2の基板の少なくとも1つを貫く第1、第2および第3の貫通孔が設けられており、第1、第2および第3の貫通孔がそれぞれ第1および第2の注入部および第1の排出部と連絡していることが好ましい。
【0031】
基板を用いて微小流路を形成させることにより、所望の形状のマイクロチャネルを、種々の公知技術を用いて容易に作製することができる。
【0032】
本発明に係る分析装置もまた、流体の移動を促進する駆動手段と連結されていることが好ましく、この場合、駆動手段は、第1および第2の貫通孔の両方に、または第3の貫通孔に連結されている。
【0033】
本発明に係る分析装置は、注入すべき流体を受容する第1の注入部と流体を排出する第1の排出部とを両端に連結している第1の微小流路を備えており、第1の微小流路は、第1の注入部と第1の排出部との間にて分岐しかつ再度合流する第2の微小流路を有しており、第1の微小流路には、流体中の第1の物質を検出する第1の検出部が設けられており、第2の微小流路には、流体中の第2の物質を検出する第2の検出部が設けられており、第1の検出部に、検出すべき物質を捕捉する第1の捕捉物質が配置されており、第2の検出部に、検出すべき物質を捕捉する第3の捕捉物質が配置されている分析装置であって、第1の微小流路の、第1の注入部と第1の検出部との間に、流体中の第1の物質の濃度を低減させる第1の前処理部が設けられており、第1の前処理部に、低減すべき物質を捕捉する第2の捕捉物質が配置されていることを特徴としている。
【0034】
単一サンプル中の複数の物質を分析する場合、通常であれば2回にわけて測定することが必要になるが、本構成を用いれば希釈することなく2つの物質を単一の分析装置にて同時に測定することができる。
【0035】
本発明に係る分析装置において、上記注入部と第2の検出部との間に、第2の物質の濃度を低減させる第2の前処理部が設けられており、第2の前処理部には、低減すべき物質を捕捉する第4の捕捉物質が配置されていてもよい。
【0036】
本発明に係る分析装置もまた、流体の移動を促進する駆動手段と連結されていることが好ましく、この場合、駆動手段は、第1の注入部および第1の排出部の少なくとも一方に連結されている。
【0037】
本発明に係る分析装置において、第1および第2の微小流路は、表面上にマイクロチャネルが形成されている第1の基板と、該マイクロチャネルを覆う第2の基板とによって形成されており、第1および第2の基板の少なくとも1つを貫く第1および第2の貫通孔が設けられており、第1および第2の貫通孔がそれぞれ第1の注入部および第1の排出部と連絡していることが好ましい。
【0038】
基板を用いて微小流路を形成させることにより、所望の形状のマイクロチャネルを、種々の公知技術を用いて容易に作製することができる。
【0039】
本発明に係る分析装置もまた、流体の移動を促進する駆動手段と連結されていることが好ましく、この場合、駆動手段は、第1および第2の貫通孔の少なくとも一方に連結されている。
【0040】
本発明に係る分析装置はまた、注入すべき流体を受容する第1の注入部と流体を排出する第1の排出部とを両端に連結している第1の微小流路を備え、第1の微小流路の分岐部にて分岐して、流体を排出する第2の排出部を一端に連結している第2の微小流路が形成されており、分岐部と第1の排出部との間の第1の微小流路に、流体中の第1の物質を検出する第1の検出部が設けられており、分岐部と第2の排出部との間の第2の微小流路に、流体中の第2の物質を検出する第2の検出部が設けられており、第1の検出部に、検出すべき物質を捕捉する第1の捕捉物質が配置されており、第2の検出部に、検出すべき物質を捕捉する第3の捕捉物質が配置されている分析装置であって、第1の注入部と第1の検出部との間には、流体中の第1の物質の濃度を低減させる第1の前処理部が設けられており、第1の前処理部には、低減すべき物質を捕捉する第2の捕捉物質が配置されていることを特徴としている。
【0041】
本発明に係る分析装置において、前記第1の注入部と第2の検出部との間に、第2の物質の濃度を低減させる第2の前処理部が設けられており、第2の前処理部には、低減すべき物質を捕捉する第4の捕捉物質が配置されていることが好ましい。
【0042】
本発明に係る分析装置は、流体の移動を促進する駆動手段と連結されていることが好ましく、この場合、駆動手段は、第1の注入部に、または第1および第2の排出部の両方に連結されている。
【0043】
本発明に係る分析装置において、第1および第2の微小流路は、表面上にマイクロチャネルが形成されている第1の基板と、該マイクロチャネルを覆う第2の基板とによって形成されており、第1および第2の基板の少なくとも1つを貫く第1、第2および第3の貫通孔が設けられており、第1の貫通孔が第1の注入部と連絡し、第2および第3の貫通孔がそれぞれ第1および第2の排出部と連絡していることが好ましい。
【0044】
基板を用いて微小流路を形成させることにより、所望の形状のマイクロチャネルを、種々の公知技術を用いて容易に作製することができる。
【0045】
本発明に係る分析装置もまた、流体の移動を促進する駆動手段と連結されていることが好ましく、この場合、駆動手段は、第1の貫通孔に、または第2および第3の貫通孔の両方に連結されている。
【0046】
本発明に係る分析装置において、各前処理部を通過した後の、検出すべき物質の濃度が、第1の捕捉物質が捕捉し得る範囲内であることが好ましい。
【0047】
このような構成を用いれば、分析に供されるサンプルが前処理部を通過することで第1の捕捉物質が捕捉し得る範囲内まで対象物質の濃度が低下し、見かけ上、高濃度の検出物質を測定することが可能となる。
【0048】
本発明に係る分析装置において、上記低減すべき物質の最大モル量が、分析に供されるサンプル中に含まれる対象物質のモル量よりも少ないことが好ましい。
【0049】
このような構成を用いれば、分析に供されるサンプル中の対象物質が、前処理部を通過する際に全て捕捉されてしまうことを防ぐことが可能となる。
【0050】
本発明に係る分析装置において、第2の捕捉物質のモル量が、分析に供されるサンプル中に含まれる対象物質のモル量と第1の捕捉物質のモル量との差であることが好ましい。
【0051】
このような構成を用いれば、分析に供されるサンプル中の対象物質のうち、検出部にて検出可能なモル量だけ前処理部を通過させて、それ以外を第2の捕捉物質によって捕捉することが可能である。
【0052】
本発明に係る分析装置において、各微小流路の内部にバルブ構造が設けられていることが好ましい。上記バルブ構造は、対応する検出部と前処理部の間に設けられていること画より好ましい。
【0053】
このような構成を用いれば、サンプル中の対象物質を前処理部にて捕捉する時間を任意に確保することができる。これにより、検出部にて分析される物質の濃度をより低くすることができる。
【0054】
本明細書において、用語「対応する」は、互いに機能的に関連している2つ以上の構成に対して用いられる。例えば、「対応する検出部と前処理部」は、特定の物質の濃度を低減させる前処理部と、低減された特定の物質を分析する検出部とをいう。また、「対応する注入部と検出部」は、特定の検出部と、該検出部にて分析されるべき物質を含むサンプルが注入(導入に対応)される注入部とをいい、「対応する注入部と前処理部」は、特定の前処理部と、該前処理部にて低減されるべき物質を含むサンプルが注入(導入に対応)される注入部とをいう。
【0055】
本発明に係る分析装置において、対応する注入部と検出部の間に、対応する前処理部が複数設けられていてもよい。複数の前処理部は、互いに直接に配置されても並列に配置されてもよく、並列に配置される場合は、各微小流路の少なくとも1つが、対応する注入部と検出部との間にて分岐しかつ再度合流する構成を有しており、形成されている複数の分岐の各々に、対応する前処理部が設けられている。
【0056】
このような構成を用いれば、対象物質を捕捉する第2の捕捉物質が固定化されている前処理部が複数存在するため、効率よく対象物質の濃度を低減することができる。特に、並列の配置を採用する場合は、対象物質を含むサンプルが2つ以上に分配され、分配されたサンプルの各々が独立して前処理部を通ることによって、検出すべき物質の濃度をより短時間で低下させることができる。
【0057】
本発明に係る分析装置において、各前処理部の少なくとも1つが三次元の構造体を備えていることが好ましい。このような構造体は、上記前処理部の壁面から伸びる柱状の構造体であっても、多孔質の構造体であっても、複数の粒子状の構造体であってもよい。
【0058】
このような構成を用いれば、前処理部に三次元の構造物が形成されているため、検出すべき物質の濃度をより効率よく低下することができる。これにより、分析時間の短縮や集積化といったメリットにつながる。柱状構造が採用された場合は、前処理部の面積が立体的に増加するので、効率よく検出物質の濃度を低下することが可能となる。多孔質の構造体が採用された場合は、前処理部の面積が立体的に増加するので、効率よく検出物質の濃度を低下することが可能となる。複数の粒子状の構造体が採用された場合は、前処理部の面積が立体的に増加するので、これにより効率よく検出物質の濃度を低下することが可能となる。
【0059】
本発明に係る分析装置において、第1の捕捉物質が上記検出すべき物質に対する抗体であることが好ましい。また、第2の捕捉物質が上記低減すべき物質に対する抗体であることが好ましい。
【0060】
生化学的な分析に用いられるマイクロチャネル型の分析装置の検出対象となる物質は生体内タンパク質が多い。変性しにくい抗体は、捕捉物質として使用するには最適な物質である。
【0061】
本発明に係る分析装置において、第1の捕捉物質および第2の捕捉物質が同一物質であることが好ましい。
【0062】
このような構成を用いれば、第1および第2の捕捉物質として同一物質を使用するため、材料選択の検討を減らすことができるとともに、分析装置の製造も容易かつ低コストである。
【0063】
本発明に係る分析装置において、上記検出部は透過性の材料からなってもよい。
【0064】
このような構成を用いれば、検出部において対象物質を光学的に検出することが可能となる。光学的に検出される対象物質は、自身が光学特性を有しているものであってもよいし、光学特性を有する物質で修飾されたものであってもよい。光学特性としては、例えば、吸光特性、発光特性および発色特性が挙げられる。なお、発光には蛍光が包含される。光学特性を有する物質としては、例えば、吸光色素、発光色素および発色色素が挙げられる。対象物質を光学的に検出する方法としては、上述の光学特性を検出する方法であればよい。このような方法としては、例えば、紫外可視分光分析法、蛍光分析法、化学発光分析法、または熱レンズ分析法などの従来公知の方法が挙げられる。光学特性を有している対象物質を用いれば、その光学特性を測定(化学発光量変化や蛍光変化、吸光度変化を測定)することによって定量的な測定が可能となる。
【0065】
本発明に係る分析装置において、上記検出部に作用電極および参照電極からなる検出手段が設けられていることが好ましい。
【0066】
このような構成を用いれば、検出部において、対象物質を電気化学的に検出することが可能となる。電気化学的に検出される対象物質は、それ自身が電気化学的に活性なものであってもよいし、電気化学的に活性な物質で修飾されたものであってもよい。対象物質を電気化学的に検出する方法としては、電気化学的に活性な物質から得られる電流値を検出電極にて測定すればよい。
【0067】
本発明に係る分析装置において、上記前処理部は透過性の材料からなってもよい。
【0068】
このような構成を用いれば、前処理部において光学的な検出が可能となるため、蛍光変化や吸光度変化を測定することによって定量的な測定が可能となる。
【0069】
本発明に係る分析装置において、上記前処理部にさらなる検出手段が設けられていることが好ましい。
【0070】
このような構成を用いれば、前処理部の検出電極において、電気化学的に活性な物質を検出することが可能となる。
【0071】
本発明に係る分析装置にアプライされるサンプルは血液が好ましく、上記検出すべき物質が血液成分であることが好ましい。上記血液成分としては、血漿タンパク、リポタンパク、分泌タンパク、ホルモン、補体または糖が挙げられる。
【0072】
このような構成を用いれば、血液中の成分(例えば、血液中の血漿タンパク、リポタンパク、分泌タンパク、ホルモン、補体、または糖)を検出対象物質として分析することが可能となる。
【0073】
本発明に係る分析方法は、上記の分析装置を用いて、サンプルを希釈することなく、サンプル中の対象物質を定量的に測定することを特徴としている。
【0074】
マイクロ化技術に用いられるサンプルの容量は極微量である。微量のサンプルを調製する際に煩雑な希釈操作が含まれていると、調製毎に誤差が生じ、正確な分析を行うことが困難となり、分析の再現性および/または信頼性が低減する。本構成を用いれば、サンプルの希釈操作を省略することができるため、分析の再現性および/または信頼性を向上させることができる。また、使用者が希釈操作を行うことなく定量的な測定が可能になる。
【0075】
本発明に係る分析方法において、上記対象物質が血液成分であることが好ましい。
【0076】
特に、血液を操作する際には、使用者が感染症に罹患する等の危険性を伴うため、その取扱いに細心の注意が必要である。サンプルの調製工程を簡略化することによって、このような危険性を低減することができる。本構成を用いれば、サンプルの希釈操作を省略することができるため、使用者は血液サンプルをより安全かつ容易に取り扱うことができる。
【0077】
本発明に係る分析方法において、各前処理部において対象物質が捕捉されているか否かを測定してもよく、上記前処理部において対象物質が捕捉されていない場合に分析エラーと判定することが好ましい。
【0078】
このような構成を用いれば、検出部で定量的な測定を行うだけではなく、前処理部でも同様に定量的な測定を行うことが可能となる。前処理部にて所望のモル量を捕捉しなかった場合には、検出失敗であることを判定することが可能となる。これは、例えば、捕捉物質の活性が低下していることを知るに有効である。
【発明の効果】
【0079】
本発明を用いれば、検出部での分析可能な範囲を大きく超えた濃度の物質を含んだサンプルを用いた場合であっても、その物質を分析し得る。これにより、使用者がサンプルの希釈を行うことなく、サンプルを分析装置内に直接導入することが可能となり、その上で定量的な測定が実現し得る。
【図面の簡単な説明】
【0080】
【図1】(a)および(b)は、本発明の実施の形態1に係るマイクロチャネル型分析装置の平面図である。
【図2】(a)および(b)は、本発明の実施の形態1に係るマイクロチャネル型分析装置の平面図である。
【図3】(a)および(b)は、本発明の実施の形態1に係るマイクロチャネル型分析装置の一構成要素の一態様を示す図である。
【図4】(a)および(b)は、本発明の実施の形態2に係るマイクロチャネル型分析装置の平面図である。
【図5】(a)および(b)は、本発明の実施の形態3に係るマイクロチャネル型分析装置の平面図である。
【図6】(a)および(b)は、本発明の実施の形態3に係るマイクロチャネル型分析装置の平面図である。
【図7】本発明のマイクロチャネル型の分析装置を示す平面図である。
【図8】本発明のマイクロチャネル型の分析装置を用いて行った分析結果を示すグラフである。
【図9】従来のマイクロチャネル型の分析装置を示す概略図である。
【図10】従来のマイクロチャネル型の分析装置に設けられた抗体の固定部での反応を示す概略図である。
【発明を実施するための形態】
【0081】
以下、本発明に係る分析装置の実施形態について、図面を参照しながら説明する。なお、マイクロチャネル型の分析装置を用いて本発明を説明しているが、本発明に係る分析装置はマイクロチャネル型に限定されず、例えば、マイクロキャピラリ型の分析装置もまた本発明の範囲に含まれる。
【0082】
〔実施の形態1〕
図1〜3に基づいて、本発明の実施の形態1について説明する。図1および図2は、本発明の実施の形態1に係るマイクロチャネル型分析装置の平面図であり、図3は、本発明の実施の形態1に係るマイクロチャネル型分析装置の一構成要素の平面図(左図)および側方からの断面図(右図)である。
【0083】
<1.マイクロチャネル型分析装置>
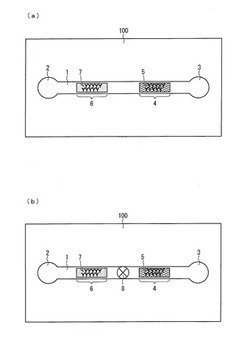
本実施形態にかかるマイクロチャネル型分析装置(マイクロチャネルチップ)は、基板100、および基板100と重ね合わせる蓋101を備えており、基板100の表面には、凹面の微細溝(マイクロチャネル)1が形成されている。なお、本明細書中において、「微細」は、μmオーダーの径を有していることが意図され、具体的には、半導体の微細加工技術を用いて形成され得る程度のサイズが意図される。
【0084】
マイクロチャネル1は本実施形態に係る分析装置の流路を規定する。基板100の表面には、注入すべき流体を受容する注入部2、および流路から流体を排出する排出部3がさらに形成されており、それぞれマイクロチャネル1の両端と連結している。すなわち、マイクロチャネル1は注入部2と排出部3とを基板100の表面上にて接続している。注入部2は、マイクロチャネル1へ注入する流体を貯留する部位であり得、排出部3は、マイクロチャネル1から排出される流体を貯留する部位であり得る。なお、本明細書中において、必要に応じて、マイクロチャネル1と注入部2または排出部3との境界部を注入孔および排出孔(図示せず)と称する。
【0085】
このような基板100に蓋101を重ね合わせることによってマイクロチャネル1は基板外部から隔離される。ただし、基板100または蓋101を貫通する第1および第2の貫通孔(図示せず)が、それぞれ注入部2および排出部3と基板外部とを連通する。これにより、基板外部からマイクロチャネル1へ流体を供給したり、マイクロチャネル1から基板外部へ流体を排出したりすることができる。
【0086】
また、図1(b)に示すように、注入部2から排出部3への流れ方向を規定したり、流体の流れを制御したりするためのバルブ8がマイクロチャネル内に設けられていてもよい。
【0087】
さらに、マイクロチャネル1を流れる流体中の物質を検出する検出部4が設けられている。この検出部4には、検出および分析の対象となる物質を捕捉する捕捉物質5が固定化されている。さらに、マイクロチャネル1内には、流体中の物質(検出部4にて検出されるべき物質)の濃度を低減させる前処理部6が、注入部2と検出部4との間に設けられている。この前処理部6には、目的の物質を捕捉する捕捉物質7が固定化されている。
【0088】
なお、図示していないが、本実施形態に係る分析装置は、マイクロチャネル1内の流体の、注入部2から排出部3への移動を促進する駆動手段が、注入部および排出部の少なくとも一方に連結されていてもよい。このような駆動手段としては、例えば、押出しポンプおよび吸引ポンプが挙げられる。押出しポンプを用いて流体をマイクロチャネル1内へ送り込む場合は、押出しポンプを注入部2に連結すればよく、吸引ポンプを用いて流体をマイクロチャネル1内から引き出す場合は、吸引ポンプを排出部3に連結すればよい。また、上述したようなポンプを用いる以外に、従来公知の方法で毛管現象または吸水物質を用いて溶液を流すこともできる。
【0089】
本実施形態に係る分析装置に提供される流体は、気体であっても液体であってもよいが、マイクロ化技術による生化学的な分析に用いられる場合は、液体であることが好ましい。
【0090】
以下、本実施形態に係る分析装置が備えている部材について詳細に説明する。
【0091】
<1.1 基板>
基板100および蓋101として、例えば、絶縁性を有する基板を用いることができる。絶縁性を有する基板としては、例えば、表面に酸化膜などの絶縁性材料が形成されたシリコン基板、石英基板、酸化アルミニウム基板、ガラス基板又はプラスチック基板などが挙げられる。物質を光学的に検出する場合、光透過性の基板を第1の基板100または蓋101として用いることができる。光透過性の基板としては、例えば、ガラス基板、石英基板、および光透過性樹脂から作成された基板などが挙げられる。また、化学発光を利用して物質を検出する場合、自発蛍光が小さく且つ透明性のあるガラスまたはプラスチック材料(例えば、例えば、ポリイミド、ポリベンツイミダゾール、ポリエーテルエーテルケトン、ポリスルホン、ポリエーテルイミド、ポリエーテルスルホン、ポリフェニレンサルファイトなど)を、第1の基板100または蓋101として用いることもできる。なお、マイクロチャネル型分析装置に用いるに好ましい、基板100の厚みは0.1〜5mm程度である。なお、蓋101は、基板100と同一の厚みを有していても、基板100よりも薄くてもよい。
【0092】
<1.2 マイクロチャネル>
基板100の表面上に形成されるマイクロチャネル1の深さは0.1〜1000μm程度であることが好ましく、幅は0.1〜1000μm程度であることが好ましいが、これらに限定されない。また、マイクロチャネル1の長さは、基板100の大きさに従って適宜設計可能であり、50〜800μm程度であることが好ましい。
【0093】
マイクロチャネル1の流路は、流体の流れ方向に沿って角柱形状であっても円柱形状であってもよい。すなわち、マイクロチャネル1の、流体の流れ方向に対して垂直な断面の形状は、矩形、台形、円形(半円形)であり得る。
【0094】
マイクロチャネル1は、例えば基板100上に凹凸を形成することによって作製することができる。例えば、基板100上に凹部を形成し、この凹部をマイクロチャネル1としてもよいし、基板100上に複数の凸部を形成し、これらの凸部で囲まれた領域をマイクロチャネル1としてもよい。また、凹部と凸部と形成し、凹部と凸部との組合せからマイクロチャネル1を作製してもよい。
【0095】
基板100上に凹凸を形成する方法としては、例えば、直接加工する方法としての機械加工による方法、レーザー加工による方法、金型を用いた射出成型、プレス成型、および鋳造による方法などが挙げられる。金型を用いた射出成型は、量産性に優れ、形状の再現性が高いので、特に好適に利用される。また、基板100の材料がシリコンまたはガラス等である場合、基板100上のマイクロチャネル1のパターンを、フォトリソグラフィ法またはエッチング法により形成することができる。
【0096】
なお、注入部2および排出部3は、予め基板100上に形成されている態様を図示したが、注入部2および排出部3を介してマイクロチャネル1と基板外部とを連絡する構成であれば限定されず、例えば、第1および第2の貫通孔として形成されてもよい。注入部2および排出部3の大きさは、マイクロチャネル1の大きさおよび形状に従って適宜変更可能であるが、本実施形態に係る分析装置をマイクロチャネル型分析装置として用いるためには、径が10μm以上であることが好ましい。なお、基板100と別の部材として形成した注入部2および排出部3を基板外部に配置して、それぞれ第1および第2の貫通孔を介して注入孔および排出孔に連結された態様であってもよい。
【0097】
<1.3 検出部>
検出部4は、上述したように、マイクロチャネル1を流れる流体中の物質を検出する部位であり、図1に示すように、検出部4には、検出および分析の対象となる物質(以下、対象物質とも称する。)を捕捉する捕捉物質5が固定化されている。捕捉物質5は、対象物質とホスト−ゲストの関係がある物質(例えば、抗原、抗体、酵素、基質、リガンド、レセプター、DNA、糖、ペプチド、合成高分子(例えばモレキュラーインプリントポリマー)など)であればよく、特に、抗体または合成高分子は、活性が安定しているので好ましい。また、捕捉物質5を固定化する方法としては、物理的吸着法、化学結合法、共有結合法などの公知の方法が適宜採用され得る。
【0098】
検出部4の構成は、特に限定されず、対象物質の検出方法によって適宜決定され得る。吸光度または発光(蛍光を含む。)などに基づいて、対象物質を光学的に検出する場合、マイクロチャネル1の光透過性の部分を検出部4とすればよい。分析装置の製造を簡便にするために、第1の基板100全体または蓋101全体を、例えば、ガラス、石英および光透過性樹脂などの光透過性の材料にすることが好ましい。このような場合は、図示するように、検出部4のマイクロチャネル1内壁面上に捕捉物質5を固定化すればよい。
【0099】
また、対象物質を電気化学的に検出する場合、検出部4は、マイクロチャネル内に形成した検出電極からなる検出手段を備えていればよい。検出電極は、少なくとも参照電極および作用電極の2電極から構成されていればよいが、参照電極および作用電極に加えて対向電極を備えている3電極から構成されていることが好ましい。図1には、検出部4におけるマイクロチャネル1内部壁面に捕捉物質5が固定化されている構成を示しているが、検出電極を用いる場合には、捕捉物質5が少なくとも作用電極上に固定化されていればよい。
【0100】
参照電極、作用電極および対向電極は、従来のフォトリソグラフィ技術を利用した微細加工技術によってマイクロチャネル1に形成することができる。電極の導電性材料として、例えば金、白金、銀、クロム、チタン、イリジウム、銅またはカーボンなどを用いることができる。参照電極には、基準電位の安定性の観点から、銀/塩化銀電極を用いることが好ましい。
【0101】
<1.4 前処理部>
前処理部6は、上述したように、流体中の物質(検出部4にて検出されるべき物質)の濃度を低減させる部位であり、図1に示すように、注入部2と検出部4との間に設けられた前処理部6には、対象物質を捕捉する捕捉物質7が固定化されている。捕捉物質7は、捕捉物質5と同様に、対象物質とホスト−ゲストの関係がある物質(例えば、抗原、抗体、酵素、基質、リガンド、レセプター、DNA、糖、ペプチド、合成高分子(例えばモレキュラーインプリントポリマー)など)であればよく、特に、抗体または合成高分子は、活性が安定しているので好ましい。なお、捕捉物質7は、捕捉物質5と同じ物質であることが好ましい。同じ特性の捕捉物質を使用することによって、本実施形態に係る分析装置の生産性を向上させたり製造コストを低減させたりするだけでなく、開発効率を向上させることができる。捕捉物質7を固定化する方法もまた、物理的吸着法、化学結合法、共有結合法などの公知の方法が適宜採用され得る。
【0102】
図2に示すように、本実施形態に係る分析装置において、前処理部6は複数設けられてもよい。具体的には、図2(a)に示すように、2つ以上の前処理部6・6’が単一流路内に直列に配置されてもよく、図2(b)に示すように、単一流路から分配されかつ再度合流する複数の流路のそれぞれに前処理部6・6’’が配置されてもよい。
【0103】
前処理部6の構成は、特に限定されず、例えば、図示するように、前処理部6のマイクロチャネル1内壁面上に捕捉物質7を固定化してもよい。また、捕捉物質7を固定化する面積を拡大するために、前処理部6のマイクロチャネル1内に三次元の構造物を配置してもよい。このような三次元の構造物を設けることによって前処理部6に固定化される捕捉物質7のモル量が増加し、その結果、対象物質と捕捉物質7との反応効率が向上し、対象物質の濃度を非常に効率よく低減させることができる。
【0104】
このような構造物としては、例えば、柱状構造物6a(図3(a))や多孔質構造体(図示せず)、図3(b)に示す微粒子6bが挙げられる。図3(b)に示すように、微粒子6bの移動を妨げる堰止め部9を注入部2と検出部4との間のマイクロチャネル1内に設けることによって、注入部2から微粒子6bを含む溶液を導入した際に、微粒子6bを堰止め部9によって留めておくことができる。そして、堰止め部9によって留められた微粒子6bの集合が前処理部6を形成する。堰止め部9は、流体の流れを妨げずに微粒子6bの通過を阻止し得る構造であれば特に限定されない。
【0105】
前処理部6は、さらなる検出手段を備えていることが好ましい。すなわち、検出部4にて対象物質を検出する前に前処理部6にて対象物質を検出することが好ましい。このような検出手段を備えていることにより、前処理部6において対象物質が捕捉されているか否かを確認することが可能となる。この場合、捕捉物質7の劣化、またはその他の異常によって前処理部6での対象物質の捕捉を確認し得なかった際に、分析が失敗である(分析エラー)と判定することが可能となる。すなわち、本実施形態に係る分析装置は、前処理部6における対象物質の有無を判定する判定部をさらに備えていてもよい。なお、前処理部6に備えられる検出手段は、検出部4に備えられる検出手段と同一のものが好ましいが、異なっていてもよい。検出手段の詳細については、上記「1.3 検出部」の項を参照のこと。
【0106】
<1.5 バルブ構造>
バルブ8は、マイクロチャネル1内の流体の流れ方向を規定する構造、マイクロチャネル1内の流体の流れを物理的に停止させる構造、マイクロチャネル1内の流体を切断する構造、マイクロチャネル1内の流体を分離する構造などを有し得、必要に応じて全ての機能を備えていてもよい。好ましいバルブ8の例としては、回転ねじ式バルブ、出し入れ自在の堰板、圧力による閉鎖、気体制御による液体の切断などが挙げられる。バルブを設けることで、前処理部6および検出部4での反応時間を延長することができる。
【0107】
<1.6 第1および第2の捕捉物質の調整方法>
対象物質の濃度を、検出部において検出し得る濃度範囲内に収めるように、第2の捕捉物質の固定化量(モル量)を調整する必要がある。つまり、対象物質の濃度にあわせて、第1の捕捉物質の固定化量と第2の捕捉物質の固定化量とを調整する。第1の捕捉物質の固定化量および第2の捕捉物質の固定化量は、第1の捕捉物質および第2の捕捉物質の特性だけではなく、マイクロチャネル1の形状にも依存するため、分析装置の構成に応じて適宜調整を行う必要がある。固定化濃度による調整方法の一例を、以下に記載する。
(1)検出可能な濃度範囲の確認
前処理部6が設けられていない以外は本実施形態と同一の構成マイクロチャネルを有する分析装置Xにおいて、濃度が既知である対象物質(標準物質)を用いて検出可能な濃度範囲を調べる。
(2)前処理部6の条件検討
種々の濃度の第2の捕捉物質(100、10、1、0.1、0.01μg/mL)を調製し、本実施形態の分析装置のマイクロチャネル1の前処理部6に固定化する。次いで、標準物質を用いて、検出可能な濃度範囲を調べる。
(3)前処理部6の条件決定
所望の濃度範囲と近い条件を示す第2の捕捉物質の濃度を、操作(2)の結果に基づいて選択する。選択した濃度付近の濃度の第2の捕捉物質を用いて操作(2)を再度実行し、前処理部の固定化条件を決定する。
【0108】
以上の手順によって、第1の捕捉物質の固定化条件および第2の捕捉物質の固定化条件を決定する。第2の捕捉物質のモル量は、分析に供されるサンプル中の対象物質のモル量以下、または対象物質のモル量と第1の捕捉物質のモル量との差に調製することが好ましい。
【0109】
また、前処理部の面積を拡大することによって、種々の濃度の第2の捕捉物質を調製することなく、検出に好適な濃度範囲を調整することができる。例えば、図2(a)に示すように前処理部を複数個設ける。対象物質を含んだ分析に供されるサンプルが前処理部を複数回通過することによって、より低濃度まで効率よく濃度を低下させることができる。また、図2(b)に示すように、マイクロチャネル1を分岐させ、複数の前処理部を並列に設けてもよい。なお、複数の前処理部を並列に設ける場合は、対象物質を含んだ分析に供されるサンプルの濃度をより短時間に効率よく低下させることができるので、これらを組み合わせて用いてもよい。
【0110】
このように、前処理部における第2の捕捉物質のモル量、分析に供されるサンプル中の対象物質のモル量、および、検出部における第1の捕捉物質のモル量を、当業者は適宜調整し得る。これらの第1の捕捉物質のモル量、第2の捕捉物質のモル量、および分析に供されるサンプル中の対象物質のモル量には、以下の関係が成立する。
[分析に供されるサンプル中の対象物質のモル量(最大量〜最少量)]−[一定時間内に第2の捕捉物質が捕捉し得るモル量]=[検出部において第1の捕捉物質が検出し得る対象物質の濃度範囲]×[分析に供されるサンプル容量]
好ましくは、第1および第2の捕捉物質が対象物質を1:1にて捕捉する物質であり得る。その場合、第2の捕捉物質のモル量の範囲は、対象物質のモル量(最大量〜最少量)と第2の捕捉物質のモル量との差である。
【0111】
<1.7 測定方法>
本実施形態に係る分析装置を用いた分析方法の一例を、以下に示す。なお、マイクロチャネル1内にて流体を流す駆動手段は、注入部2に連結した押出ポンプを用いる方法、排出部3に連結した吸引ポンプを用いる方法、毛管力および/または吸水物質を用いる方法のいずれでもよい。
【0112】
(1)ブロッキング
分析に供されるサンプル中の、検出対象でない物質(非対象物質)が、マイクロチャネル1、前処理部6および検出部4に非特異的に吸着することを防ぐために、非特異吸着防止剤を注入部2から導入して、マイクロチャネル1内を満たす。次いで、この非特異吸着防止剤を排出部3から排出する。洗浄溶液を注入部2から導入し、マイクロチャネル1内を通過させて排出部3から排出する。これにより、マイクロチャネル1内に残留する余分な非特異吸着防止剤を取り除く。好適な非特異的吸着防止剤としては、例えば、プロテインフリー(Thermo社)が挙げられる。
【0113】
(2)分析に供されるサンプルの導入
分析に供されるサンプルを注入部2からマイクロチャネル1内に導入する。分析に供されるサンプルは、マイクロチャネル1内を移動して前処理部6へ送達される。分析に供されるサンプルが前処理部6を通過する間に、分析に供されるサンプル中の対象物質が前処理部6の第2の捕捉物質と結合して、前処理部6にて捕捉される。これにより、前処理部6を通過した分析に供されるサンプル中の対象物質の濃度が低減する。この際、分析に供されるサンプル中の対象物質と、前処理部6の第2の捕捉物質との結合を十分進行させるために、バルブ8を閉じておくことが好ましい。
【0114】
次いで、必要に応じてバルブ8を開放し、分析に供されるサンプルを、マイクロチャネル1内をさらに移動させて検出部4へ送達する。分析に供されるサンプルが検出部4を通過する間に、分析に供されるサンプル中の対象物質は検出部4の第1の捕捉物質と結合して検出部4にて捕捉される。次いで、洗浄溶液を注入部2から導入し、マイクロチャネル1内を移動させて排出部3から排出する。これにより、マイクロチャネル1内に残留する余分な分析に供されるサンプルを取り除く。
【0115】
マイクロチャネル1内での注入部2から排出部3への分析に供されるサンプルの移動は連続的に行われてもよいし、断続的に行われてもよい。分析に供されるサンプルを断続的に移動させる場合、例えば、分析に供されるサンプルを前処理部6および/または検出部4の領域内にて所定の時間にわたって保持(インキュベート)してもよい。これにより、分析に供されるサンプル中の対象物質と第1および/または第2の捕捉物質との反応時間を最適化することができる。
【0116】
(3)検出部にて捕捉された対象物質の標識化
対象物質に結合し得る標識化合物を、注入部2からマイクロチャネル1内に導入して、検出部4へ送達する。標識化合物が検出部4を通過する間に、標識化合物は検出部4に捕捉されている対象物質と結合する。この操作によって、検出部4内に捕捉された対象物質が標識される。
【0117】
(4)対象物質の検出
検出手段を用いて標識化合物を検出することによって、検出部4での対象物質を検出することが可能となる。標識化合物としては、例えば、蛍光標識抗体または酵素標識抗体を用いることができるが、第1の捕捉物質と異なる抗体が好ましい。
【0118】
(4−1)蛍光標識抗体を用いた対象物質の検出
上記(3)において蛍光標識抗体を用いた場合、検出部4の蛍光を直接観察することによって、対象物質を検出することができる。
【0119】
(4−2)酵素標識抗体を用いた対象物質の検出
上記(3)において酵素標識抗体を用いた場合、酵素標識抗体を対象物質に結合させた後に、この酵素に対する基質溶液を注入部2からマイクロチャネル1内に導入する。基質溶液が検出部4を通過する間に、対象物質に結合した酵素標識抗体と基質溶液とが反応する。この反応の結果によって得られるシグナルを公知の方法を用いて検出することによって対象物質を検出することができる。当業者は、このような方法を、使用する基質の種類に応じて、適宜選択することができる。
【0120】
例えば、上記反応によって蛍光を発する基質を用いた場合は、検出部4の蛍光を直接観察することによって対象物質を検出することができる。また、上記反応によって吸光度が変化する基質を用いた場合は、検出部4の吸光度を測定することによって対象物質を検出することができる。上記反応によって電気化学活性が変化する基質を用いた場合は、電極を用いた電気化学的な手段によって対象物質を検出することができる。
【0121】
本実施形態に係る測定方法は、生化学的な分析に好適であり、用いられるサンプルとしては、特に限定されないが、生化学的な分析に利用される頻度を考慮すると、血液が好ましい。上記測定方法に血液を供することによって、例えば、免疫グロブリン、アルブミン、GOT、GTP、γ−GPT、HDL、LDL、中性脂肪、ヘモグロビンA1C、尿酸、グルコース、アディポネクチン、レプチン、レジスチンおよびTNF−αなどの血液成分を、対象物質として分析することができる。
【0122】
マイクロ化技術に用いられるサンプルの容量は極微量である。微量のサンプルを調製する際に煩雑な希釈操作が含まれていると、調製毎に誤差が生じ、正確な分析を行うことが困難となり、分析の再現性および/または信頼性が低減する。本実施形態に係る分析装置を用いれば、サンプルの希釈操作を省略することができるため、分析の再現性および/または信頼性を向上させることができる。
【0123】
特に、血液を操作する際には、感染症への罹患等の危険性を伴うため、その取扱いに細心の注意が必要である。サンプルの調製工程を簡略化することによって、このような危険性を低減することができる。本実施形態に係る分析装置を用いれば、サンプルの希釈操作を省略することができるため、使用者は血液サンプルをより安全かつ容易に取り扱うことができる。
【0124】
なお、標識化合物および基質溶液を注入部2からマイクロチャネル1内に導入する場合、標識化合物および基質溶液は、検出部4に到達する前に前処理部6を通過する。標識化合物および基質溶液は、前処理部6を通過する間に、前処理部6に捕捉されている対象物質と結合および/または反応し得、この反応によってシグナルが生成し得る。このシグナルが検出部における対象物質の検出に支障をきたす可能性は十分あり得る。このような可能性を回避するためには、検出部4での第1の捕捉物質と標識化合物との結合を生じさせた後に、マイクロチャネル1内の流れ方向を変更して、基質溶液を排出部3から注入すればよい。
【0125】
〔実施の形態2〕
図4に基づいて、本発明の実施の形態2について説明する。図4(a)および(b)は、本発明の実施の形態2に係るマイクロチャネル型分析装置の平面図である。
【0126】
本実施形態にかかるマイクロチャネル型分析装置は、図4に示すように、基板100の表面には、連結された2つのマイクロチャネル21および21’が形成されている。基板100の表面には、注入すべき流体を受容する注入部22、サンプルを受容するサンプル注入部22’、および流路から流体を排出する排出部23がさらに形成されている。マイクロチャネル21は注入部22と排出部23とを基板100の表面上にて接続しており、マイクロチャネル21’はサンプル注入部22’とマイクロチャネル21とを接続している。サンプル注入部22’は、マイクロチャネル21’へ注入する分析に供されるサンプルを貯留する部位であり得、マイクロチャネル21’へ導入された分析に供されるサンプルはマイクロチャネル21へ送達され、引き続いて排出部23から排出される。図4(a)は、直線状のマイクロチャネル21にマイクロチャネル21’が接続している態様を示し、図4(b)は、屈曲しているマイクロチャネル21の屈曲部にマイクロチャネル21’が接続している態様を示している。
【0127】
このような基板100に第2の基板(図示せず)を重ね合わせることによってマイクロチャネル21および21’は基板外部から隔離される。ただし、基板100または第2の基板を貫通する第3の貫通孔(図示せず)が、サンプル注入部22と基板外部とを連通する。これにより、基板外部からマイクロチャネル21’へ分析に供されるサンプルを供給することができる。
【0128】
また、図示するように、注入部22およびサンプル注入部22’から排出部23への流れ方向を規定したり、流体の流れを制御したりするためのバルブ28および28’がマイクロチャネル内に設けられていてもよい。
【0129】
さらに、マイクロチャネル21を流れる流体中の物質を検出する検出部24が設けられている。この検出部24には、検出および分析の対象となる物質を捕捉する捕捉物質25が固定化されている。さらに、マイクロチャネル21または21’内には、流体中の物質(検出部24にて検出されるべき物質)の濃度を低減させる前処理部26が、サンプル注入部22’と検出部4との間に設けられている。この前処理部26には、目的の物質を捕捉する捕捉物質27が固定化されている。
【0130】
なお、図4には、2つのマイクロチャネル21および21’の連結部と、マイクロチャネル21’内のサンプル注入部22’との間に前処理部26が設けられた構成を示しているが、前処理部26は連結部と検出部24との間に設けられていてもよい。
【0131】
また、実施の形態1と同様に、マイクロチャネル21および21’内の流体の、注入部22、サンプル注入部22’から排出部23への移動を促進する駆動手段が、注入部22、サンプル注入部22’および排出部に連結されていてもよい。サンプル注入部22’には、マイクロチャネル21’内へ分析に供されるサンプルを送り込む押出しポンプを連結することができる。
【0132】
なお、本実施形態に係る分析装置における、基板、マイクロチャネル、検出部、前処理部、バルブ構造などの要部構成は、前述した実施の形態1と同じである。また、捕捉物質の調整方法および測定方法についても、前述した実施の形態1と同じである。すなわち、本実施形態に係る分析装置は、マイクロチャネルへ導入されるべき流体およびサンプルを、異なる注入部から適宜導入することを実現するためのものである。この場合、サンプルをサンプル注入部22’から導入し、実施の形態1にて示した標識化合物および基質溶液を注入部22から導入することによって、前処理部26を通過させることなく標識化合物および基質溶液を検出部24に送達することができる。
【0133】
〔実施の形態3〕
図5〜6に基づいて、本発明の実施の形態5について説明する。図5および図6は、本発明の実施の形態3に係るマイクロチャネル型分析装置の平面図である。
【0134】
本実施形態にかかるマイクロチャネル型分析装置は、図5に示すように、基板100の表面上に形成された注入部32と排出部33とを接続するマイクロチャネル31および31’が、基板100の表面に形成されている。マイクロチャネル31’は、マイクロチャネル31が注入部32と排出部33との間にて分岐しかつ再度合流するバイパスチャネルである。マイクロチャネル31が、そのバイパスチャネルとしてマイクロチャネル31’を有していることにより、それぞれに異なる検出部34および34’を設けることが可能になる。検出部34および34’には、検出および分析の対象となる物質を捕捉する捕捉物質35および35’がそれぞれ固定化されている。その結果、注入部32から導入された分析に供されるサンプル中の第1および第2の物質をそれぞれ第1の検出部34および第2の検出部34’によって検出することができる。
【0135】
なお、図示していないが、本実施形態に係る分析装置は、マイクロチャネル31および31’内の流体の、注入部32から排出部33への流れ方向を規定したり、流体の流れを制御したりするためのバルブがマイクロチャネル内に設けられていてもよい。
【0136】
第2の物質が、実施の形態1にて示した前処理部を必要とすることなく首尾よく検出し得るものである場合は、前処理部を有していないマイクロチャネル31’の検出部34’にて第2の物質を検出することができる(図5(a))。そして、検出部34’での検出と同時に、目的の物質を捕捉する捕捉物質37が固定化された前処理部36を備えたマイクロチャネル31では実施の形態1と同様の態様にて第1の物質を検出部34にて検出することができる。
【0137】
もちろん、第2の物質の検出に前処理部が必要とされる場合には、マイクロチャネル31’が、目的の物質を捕捉する捕捉物質37’が固定化された前処理部36’を備えていればよい(図5(b))。例えば、第1の物質を10倍希釈の状態にて測定し、第2の物質を100倍希釈の状態にて測定することが必要な場合、通常であれば2回にわけて測定することが必要になるが、本構成を用いればいずれも希釈することなく2つの物質を同時に測定することができる。
【0138】
このように、本実施形態の構成を用いれば、希釈することなく複数の対象物質を測定することができる。
【0139】
図5には、前処理部36および36’が、それぞれ独立した流路内に設けられた構成を示しているが、マイクロチャネル31からマイクロチャネル31’が分岐する分岐部の上流でも下流でもよい。すなわち、前処理部36は注入部32と検出部36との間に設けられていればよく、前処理部36’は注入部32と検出部36’との間に設けられていればよいといえる。
【0140】
本実施形態に係る分析装置の具体的な構成として、主流路であるマイクロチャネル31から単一のバイパスチャネル(マイクロチャネル31’)が分岐した構成が図5に示されているが、バイパスチャネルの数は特に限定されない。なお、分岐する数が増えることによって、各検出部へ送達されるサンプル濃度が低減するため、この点を考慮した上で、分析に用いるサンプルを調製することが必要である。また、単一の排出部を、複数のマイクロチャネルが共有する構成が図5に示されているが、図6に示すように、複数のマイクロチャネルがそれぞれ独立した排出部と連結されていてもよい。
【0141】
本実施形態にかかるマイクロチャネル型分析装置はまた、図6に示すように、基板100の表面上に形成された注入部42と排出部43とを接続するマイクロチャネル41、および注入部42と排出部43’とを接続するマイクロチャネル41’が、基板100の表面に形成されている。マイクロチャネル41’は、マイクロチャネル41が注入部42と排出部43との間にて分岐して形成された流路である。2つのマイクロチャネル41および41’を有していることにより、それぞれに異なる検出部44および44’を設けることが可能になる。検出部44および44’には、検出および分析の対象となる物質を捕捉する捕捉物質45および45’がそれぞれ固定化されている。その結果、注入部42から導入された分析に供されるサンプル中の第1および第2の物質をそれぞれ第1の検出部44および第2の検出部44’によって検出することができる。
【0142】
なお、図示していないが、本実施形態に係る分析装置は、マイクロチャネル41および41’内の流体の、注入部42から排出部43または43’への流れ方向を規定したり、流体の流れを制御したりするためのバルブがマイクロチャネル内に設けられていてもよい。
【0143】
図6(b)には、前処理部46および46’が、それぞれ独立した流路内に設けられた構成を示しているが、マイクロチャネル41からマイクロチャネル41’が分岐する分岐部の上流でも下流でもよい。すなわち、前処理部46は注入部42と検出部46との間に設けられていればよく、前処理部46’は注入部42と検出部46’との間に設けられていればよいといえる。前処理部46および46’には、目的の物質を捕捉する捕捉物質47および47’がそれぞれ固定化されている。
【0144】
上述したように、第2の物質が、実施の形態1にて示した前処理部を必要とすることなく首尾よく検出し得るものである場合は、前処理部を有していないマイクロチャネル41’の検出部44’にて第2の物質を検出することができる(図6(a))。そして、検出部44’での検出と同時に、前処理部46を備えたマイクロチャネル41では実施の形態1と同様の態様にて第1の物質を検出部44にて検出することができる。
【0145】
もちろん、第2の物質の検出に前処理部が必要とされる場合には、マイクロチャネル41’が前処理部46’を備えていればよい(図6(b))。前処理部46’には、目的の物質を捕捉する捕捉物質47が固定化されている。例えば、第1の物質を10倍希釈の状態にて測定し、第2の物質を100倍希釈の状態にて測定することが必要な場合、通常であれば2回にわけて測定することが必要になるが、本構成を用いればいずれも希釈することなく2つの物質を同時に測定することができる。
【0146】
このように、本実施形態に係る分析装置は、サンプル中の異なる物質を同一サンプルから同時に検出するためのものであり、本実施形態の構成を用いれば、希釈することなく複数の対象物質を測定することができる。なお、本実施形態に係る分析装置における、基板、マイクロチャネル、バルブ構造などの要部構成は、前述した実施の形態1と同じである。検出部および前処理部については、複数の検出部および複数の前処理部を用いている本実施形態と、単一の検出部および単一の前処理部を用いている実施の形態1とは異なるといえるが、本明細書を読んだ当業者は、実施の形態1にて示された検出部および前処理部の構成を適宜改変して本実施形態に適用することができる。また、捕捉物質の調整方法および測定方法についても、本明細書を読んだ当業者は、実施の形態1の構成を適宜改変して本実施形態に適用することができる。
【0147】
以下実施例および比較例を示し、本発明の実施形態についてさらに詳しく説明する。
【実施例】
【0148】
(実施例1)
実施例1において、図7に示すマイクロチャネル型分析装置(マイクロチャネルチップ)を以下のとおりに作製した。すなわち、PDMS(POLYDIMETHYLSILOXANE、東レダウコーニング社)の基板100上に、マイクロチャネル101およびこのマイクロチャネル101の両端にそれぞれ連結する注入部102および103を形成した。さらに、この基板100上に、マイクロチャネル101’、およびマイクロチャネル101’の一端に連結するサンプル注入部102’を形成した。マイクロチャネル101内に、検出部104を設けた。そして、マイクロチャネル101’の他端を注入部102と検出部104との間に連結させた。
【0149】
この基板100を貫く3つの貫通孔(図示しない。)をそれぞれ注入部102、サンプル注入部102’および排出部3と連絡させた。さらに、マイクロチャネル101’内に堰き止め部(図示しない)を設けた。
【0150】
作用電極、参照電極および対向電極から構成された検出電極(図示しない。)を、フォトリソグラフィ法を用いて検出部104に作製した。具体的には、マイクロチャネル101上にレジストパターンを形成し、チタン次いで金をスパッタリングすることによって金電極(作用電極、対向電極)を作製した。また、チタン次いで銀をスパッタリングし、さらに塩化処理をすることによって銀/塩化銀電極(参照電極)を作製した。
【0151】
マイクロチャネル101に関し、幅は600μmであり、長さは2000μmであり、深さは50μmであった。マイクロチャネル101’に関し、幅は600μmであり、長さは2000μmであり、深さは50μmであった。作用電極は、長さ200μm×幅600μmであった。対向電極は長さ200μm×幅600μmであった。参照電極は長さ50μm×幅50μmであった。
【0152】
次いで、10mMのチオールSAM溶液(11-Mercaptoundecanoic acid(同仁化学社):6-Hydroxy-1-hexanethiol(同仁化学社)=1:9)を用いて検出電極上の金の表面にカルボキシル基を導入した。その後、100mg/mLの1-Ethyl-3-[(3-dimethylamino)propyl]carbodiimide hydrochloride(EDC)と100mg/mLのN-Hydroxysulfosuccinimideとを用いてカルボキシル基を活性化させ、100ng/mLのアディポネクチン抗体(R&Dシステム社)の溶液をこのカルボキシル基と30分間反応させた。これにより、アディポネクチン抗体を検出電極上に固定化した。そして、未反応のアディポネクチン抗体を含む溶液を除去した。アディポネクチン抗体の固定化後に、マイクロチャネル101および101’が形成されたPDMSの基板に、蓋としての役割を果たすPDMSの基板(図示しない。)をマイクロチャネル101および101’が覆われるように張り合わせた。
【0153】
直径15μmのポリスチレン微粒子と10μg/mLのアディポネクチン抗体(R&Dシステム社)とを混合し、37℃にて1時間インキュベートした。これにより、アディポネクチン抗体をポリスチレン微粒子上に固定化した。このポリスチレン微粒子を0.05%のツイーン20を含むPBSで十分に洗浄した。洗浄後の1%w/vポリスチレン微粒子を含む溶液10μLを、サンプル注入部102’からマイクロチャネル101’内に注入した。排出部103に吸引ポンプを連結し、吸引ポンプを用いて、このポリスチレン微粒子を含む溶液をマイクロチャネル101’内を移動させ、ポリスチレン微粒子を堰き止め部において堰き止めた。このようにして、ポリスチレン微粒子から形成された前処理部109を作製した。
【0154】
さらに、非特異的な吸着の防止剤であるプロテインフリー(Thermo社)を用いてマイクロチャネル101および101’内のブロッキングを行った。
【0155】
以上のようにして、アディポネクチンを分析するためのマイクロチャネル型の分析装置を作成した。この条件で作製した分析装置についての、アディポネクチンの検量範囲は0.25〜2μg/mLであることは確認済みである。
【0156】
下記表1に示す様々な濃度の標準アディポネクチン溶液を調製した。調製した標準アディポネクチン溶液を1種類づつ上述の分析装置にアプライして、標準アディポネクチン溶液中のアディポネクチンの検出を実施した。
【0157】
具体的には、以下のとおりに実施した。5μLの標準アディポネクチン溶液をサンプル注入部102’からマイクロチャネル101’を介して101内に注入した。吸引ポンプを用いて検出部104までこの溶液を移動させ、検出部104上で3分間停止させた。これにより、この溶液中のアディポネクチンを検出部104上のアディポネクチン抗体に結合させた。その後、吸引ポンプを用いて標準アディポネクチン溶液をマイクロチャネル101から排出した。
【0158】
次いで、PBSをサンプル注入部102’からマイクロチャネル101および101’内に注入し、マイクロチャネル101および101’内を十分に洗浄した。アルカリフォスファターゼ(ALP)ラベリングキット(同仁化学社)を用いて作製した1μg/mLのALP修飾アディポネクチン抗体を含む溶液を、注入部102からマイクロチャネル101内に注入した。吸引ポンプを用いて、検出部104までALP修飾アディポネクチン抗体を含む溶液を移動させ、検出部104上で3分間停止させた。これにより、この溶液中のALP修飾アディポネクチン抗体を検出部104上に捕捉されたアディポネクチンに結合させた。その後、吸引ポンプを用いて、未反応のALP修飾アディポネクチン抗体を含む溶液をマイクロチャネル101から排出した。グリシンNaOHバッファー(pH9.0)を注入部102から注入し、マイクロチャネル101内を十分に洗浄した。
【0159】
次いで、1mMのパラアミノフェニルリン酸の溶液を注入部102からマイクロチャネル101内に注入し、吸引ポンプを用いて検出部104まで移動させ、検出部104上で3分間停止させた。これにより、パラアミノフェニルリン酸とALPとを反応させて電流を発生させた。発生した電流を検出部104によって検出した。検出された電流の値(ピーク電流値(nA))から検量線(図8に示す。)を作製した。
【0160】
(比較例1)
ポリスチレン微粒子を充填しなかったこと(前処理部を形成しなかったこと)を除いて実施例1にて作成した分析装置と同様の分析装置を作成した。また、実施例1にて使用した標準アディポネクチン溶液の代わりに下記表1に示す様々な濃度の標準アディポネクチン溶液を用いたことを除いて、実施例1と同様の操作を行い、検量線を作製した。
【0161】
【表1】

【0162】
(結果)
実施例1および比較例1で得られた検量線のグラフを図8に示す。図8によれば、前処理部のある実施例1では、アディポネクチンの検量範囲が0.5〜20μg/mLであるのに対して、前処理部のない比較例1では、アディポネクチンの検量範囲が0.25〜1ng/mLである。よって、前処理部を設けることによって、アディポネクチンの検量範囲を高濃度側に設定することができた。
【産業上の利用可能性】
【0163】
本発明の分析装置を用いれば、希釈操作を実施すること無く微量なサンプルを、迅速に複数同時に検出することができる。このため、本発明は、微小な化学物質などの検出に用いる化学マイクロデバイス(例えば、マイクロチャネルチップおよびマイクロリアクター)、およびバイオセンサー(例えば、アレルゲンセンサー)などの、μ−TAS技術を用いたマイクロチャネルチップを利用する分野に適用することができる。
【符号の説明】
【0164】
1 マイクロチャネル
2 注入部
3 排出部
4 検出部
5 捕捉物質
6 前処理部
6’ 前処理部
6’’ 前処理部
7 捕捉物質
6a 柱状構造物
6b 微粒子6b
9 堰止め部
8 バルブ
21 マイクロチャネル
21’ マイクロチャネル
22 注入部
22’ サンプル注入部
23 排出部
24 検出部
25 捕捉物質
26 前処理部
27 捕捉物質
28 バルブ
28’ バルブ
31 マイクロチャネル
31’ マイクロチャネル
32 注入部
33 排出部
34 検出部
34’ 検出部
36 前処理部
36’ 前処理部
37 前処理部
37’ 前処理部
41 マイクロチャネル
41’ マイクロチャネル
42 注入部
43 排出部
43’ 排出部
44 検出部
44’ 検出部
46 前処理部
46’ 前処理部
47 捕捉物質
47’ 捕捉物質
100 基板
101 蓋
【技術分野】
【0001】
本発明は、分析装置および分析方法に関する。本発明は、特に、血液中に含まれている特定の成分(例えば酵素、基質、サイトカイン、抗体など)を検出および分析する装置、および上記成分を検出および分析する方法に関する。
【背景技術】
【0002】
抗原抗体反応を用いた免疫分析法は、医療分野、生化学分野、またはアレルゲン等を測定する分野などにおける分析および計測に使用される方法として有用である。しかし、従来の免疫分析法は、分析に長時間を要する、操作が煩雑であるなどの問題を有している。
【0003】
近年、半導体の微細加工技術などを応用したマイクロ化技術(Micro Electro Mechanical System、MEMS)が開発されている。そして、タンパク質、遺伝子などの生化学分野における分析においては、抗原抗体反応を用いたマイクロ化技術(Micro Total Analytical System、μ−TAS)が急速に発展している。
【0004】
例えば、特許文献1には、幅がマイクロオーダーの長さである微細流路(以下、「マイクロチャネル」ともいう。)が表面上に形成された基板を有するマイクロチャネル型の分析装置が開示されている。特許文献1に記載の分析装置は、マイクロチャネルに固定化された抗体または人工抗体などを用いて、抗原などの検出対象の物質(以下、「対象物質」ともいう。)を分析するというものであり、このような分析装置を用いて分析時間の短縮化または分析操作の簡略化を実現することが提案されている。
【0005】
特許文献1に開示された分析装置の構造を図12に示す。図12に示すように、このマイクロチャネル型分析装置は、ガラス、プラスチックなどの透光性材料からなる基板200の表面に、マイクロチャネル201、溶液をマイクロチャネル201に注入する注入孔202、溶液を溜める液溜め部203、および溶液を分析装置から排出する排出孔204が形成されている。注入孔202および排出孔204は、それぞれマイクロチャネル201の両端に設けられており、排出孔204には液溜め部203が連結されている。マイクロチャネル201内には、抗体固定部205が設けられている。抗体固定部205には、溶液中の対象物質と特異的に結合する抗体が周知の固定化方法(例えば、物理的な吸着を用いて固定する方法、抗体が有するアミノ基と固定部の官能基との間に共有結合を形成して固定する方法など)によって固定化されている。なお、抗体とは、対象物質に対して特異的な親和性を有する物質である。
【0006】
図13は、図12に示す分析装置を使用した、対象物質の分析方法を説明するための図である。図13に示すように、対象物質220を含むサンプル溶液と、標識抗体223を含む溶液とを混合する。標識抗体223は、光学的に検出可能な標識物質221と、対象物質220に結合可能な抗体222とが結合して形成されたものである。この標識抗体223と対象物質220とが結合して、免疫複合体(標識抗体223と対象物質220との反応によって生じた複合体)224が形成される。
【0007】
次いで、この免疫複合体224を含む溶液を、図12に示す注入孔202から外部ポンプを用いて注入し、マイクロチャネル201に流通させる。免疫複合体224を含む溶液が抗体固定部205に到達すると、図13に示すように、溶液中の免疫複合体224と、抗体固定部205に固定化された抗体225とが結合する。これにより、抗体固定部205において、抗体225−対象物質220−標識抗体223から構成される複合体226が形成される。
【0008】
その後、抗体固定部205にて形成された複合体226中の標識抗体223に結合されている標識物質221を光学的に検出することによって、対象物質220を検出する。標識物質221の検出には、例えば、使用する標識物質221の種類に応じて、紫外可視分光分析、蛍光分析、化学発光分析、熱レンズ分析などの所定の分析機器が用いられて、標識物質221の光吸収、蛍光または発光などを検出することによって実施される。
【0009】
濃度既知の対象物質220を含む標準溶液に対して上述の対象物質の分析方法を適用して、対象物質220の濃度についての検量線を作製する。この検量線を用いて、対象物質220の濃度が不明の溶液における、対象物質220の濃度を測定することが可能となる。
【先行技術文献】
【特許文献】
【0010】
【特許文献1】国際公開第2006/054689号パンフレット(2006年5月26日公開)
【発明の概要】
【発明が解決しようとする課題】
【0011】
特許文献1に開示されたマイクロチャネル型の分析装置の検量範囲は、抗体固定部205に固定化された抗体225の物性にほぼ依存する。このため、サンプル溶液中の対象物質の濃度が、抗体固定部205に固定化された抗体225に結合し得る濃度よりも高い場合、サンプル溶液を分析装置内にアプライする前に、溶液を希釈する必要がある。
【0012】
例えば、抗体を使用した検出系の場合、抗体の検出範囲は、通常、1〜数百ng/mLとなる。しかしながら、サンプル溶液中に含まれる対象物質の濃度がμg/mLのオーダーであることは珍しくない。この場合、溶液を数百〜数千倍に希釈することが必要になる。希釈操作は使用者にとって非常に面倒な操作である。
【0013】
また、特許文献1に開示されたマイクロチャネル型の分析装置に適用される溶液の容量は超微量(数μL〜数百μL)である。このような超微量の取扱い時の希釈は、煩雑な作業となりかねない。
【0014】
このように、従来の分析装置では、分析装置に溶液をアプライする前に、面倒かつ煩雑な希釈操作を実施しなければならないことがあるという問題点がある。
【0015】
本発明は、上記の問題点に鑑みてなされたものであり、その目的は、微細流路を有する分析装置に溶液をアプライする前に溶液を希釈することなく、サンプル溶液中の対象物質を検出し、かつその濃度を測定することができる分析装置、およびこの分析装置を用いた対象物質の測定方法を提供することにある。
【課題を解決するための手段】
【0016】
本発明に係る分析装置は、注入すべき流体を受容する第1の注入部と流体を排出する第1の排出部とを両端に連結している第1の微小流路を備え、第1の微小流路に、流体中の物質を検出する第1の検出部が設けられており、第1の検出部に、検出すべき物質を捕捉する第1の捕捉物質が配置されている分析装置であって、第1の注入部と第1の検出部との間には、流体中の物質の濃度を低減させる第1の前処理部が設けられており、第1の前処理部には、低減すべき物質を捕捉する第2の捕捉物質が配置されていることを特徴としている。
【0017】
このような構成によれば、目的の物質を検出する検出部よりも上流側に、対象物質の濃度を低減させる捕捉物質が固定化された前処理部が設置されている。分析装置の注入部にアプライされ、微小流路へ導入されたサンプルが検出部に到達する前に前処理部を通過するので、前処理部の捕捉物質によってサンプル中の対象物質の一部が捕捉される。これにより、サンプル中の対象物質の濃度を低減することができる。すなわち、分析装置内においてサンプル中の対象物質の濃度が自動的に低減される。したがって、分析装置の注入部にサンプルをアプライする前に希釈操作をすることなく、検出部に送達されるサンプル中に含まれている目的の物質の濃度を、検出部における検出可能な濃度範囲内とすることができ、その結果、目的の物質を首尾よく検出することができる。
【0018】
本明細書において、用語「サンプル」とは、分析装置の注入部にアプライされる検体(被検物)をいい、検出の対象としている目的物質(対象物質)を含んでいてもいなくてもよい。
【0019】
本明細書において、用語「捕捉物質」とは、対象物質と特異的に相互作用することによって、この対象物質と共有結合または非共有結合を形成する物質をいう。捕捉物質は、具体的に、対象物質との間でホストとゲストとの関係を有する物質であり、捕捉物質としては、例えば、抗原、抗体、酵素、基質、リガンド、レセプター、DNA、糖、ペプチド、合成高分子(例えばモレキュラーインプリントポリマー)などが挙げられる。
【0020】
本明細書において、用語「注入部」は、分析されるべきサンプルや分析に用いる流体を装置内へ注入するための入口であり、注入されるべきサンプルを予め貯留する機能を兼ねてもよい。また、用語「排出部」は、分析されたサンプルや分析に用いられた流体を分析装置内から排出するための出口であり、排出されたサンプルや流体を貯留しておく機能を兼ねてもよい。
【0021】
本明細書において、用語「上流」および「下流」は、微小流路内における流体の流れを基準とした概念であり、特に説明を加えない限り、流路における注入部方向が「上流」であり、排出部方向が「下流」である。
【0022】
本発明に係る分析装置は、流体の移動を促進する駆動手段と連結されていることが好ましく、この場合、駆動手段は、第1の注入部および第1の排出部の少なくとも一方に連結されている。
【0023】
本発明に係る分析装置において、第1の微小流路が、表面上にマイクロチャネルが形成されている第1の基板と、該マイクロチャネルを覆う第2の基板とによって形成されており、第1および第2の基板の少なくとも1つを貫く第1および第2の貫通孔が設けられており、第1および第2の貫通孔がそれぞれ第1の注入部および第1の排出部と連絡していることが好ましい。
【0024】
微小流路を基板上に形成させることにより、所望の形状のマイクロチャネルを、種々の公知技術を用いて容易に作製することができる。
【0025】
本発明に係る分析装置は、流体の移動を促進する駆動手段と連結されていることが好ましく、この場合、駆動手段は、第1および第2の貫通孔の少なくとも一方に連結されている。
【0026】
本発明に係る分析装置は、注入すべき第1の流体を受容する第1の注入部と流体を排出する第1の排出部とを両端に連結している第1の微小流路を備え、第1の微小流路に、第1の流体中の物質を検出する第1の検出部が設けられており、第1の検出部に、検出すべき物質を捕捉する第1の捕捉物質が配置されている分析装置であって、注入すべき第2の流体を受容する第2の注入部を一端に連結している第2の微小流路をさらに備え、第2の微小流路の他端が、第1の注入孔と第1の検出部との間の接続部にて第1の微小流路と接続されており、第2の微小流路内に、第1の流体中の物質の濃度を低減させる第1の前処理部が設けられており、第1の前処理部に、低減すべき物質を捕捉する第2の捕捉物質が配置されていることを特徴としている。
【0027】
このような構成によれば、微小流路へ導入されるべき流体およびサンプルを、異なる注入部から適宜導入することを実現し得る。この場合、分析に供されるサンプルを第2の注入部から導入し、検出に用いられる試薬等を第1の注入部から導入することによって、前処理部を通過することなく試薬等を検出部に送達することができる。その結果、前処理部にて生じ得る、分析に不要な反応を排除することができる。
【0028】
本明細書において、「分析に供する」は検出部にて実際の分析をすることが意図される。すなわち、「分析に供されるサンプル」は、注入部にアプライされるサンプルのうち、注入部から微小流路へ導入される部分が意図される。なお、注入部にアプライされるサンプルの全量を分析に供する態様もまた、本発明の範囲に含まれる。
【0029】
本発明に係る分析装置もまた、流体の移動を促進する駆動手段と連結されていることが好ましく、この場合、駆動手段は、第1および第2の注入部の両方に、または第1の排出部に連結されている。
【0030】
本発明に係る分析装置において、第1および第2の微小流路は、表面上にマイクロチャネルが形成されている第1の基板と、該マイクロチャネルを覆う第2の基板とによって形成されており、第1および第2の基板の少なくとも1つを貫く第1、第2および第3の貫通孔が設けられており、第1、第2および第3の貫通孔がそれぞれ第1および第2の注入部および第1の排出部と連絡していることが好ましい。
【0031】
基板を用いて微小流路を形成させることにより、所望の形状のマイクロチャネルを、種々の公知技術を用いて容易に作製することができる。
【0032】
本発明に係る分析装置もまた、流体の移動を促進する駆動手段と連結されていることが好ましく、この場合、駆動手段は、第1および第2の貫通孔の両方に、または第3の貫通孔に連結されている。
【0033】
本発明に係る分析装置は、注入すべき流体を受容する第1の注入部と流体を排出する第1の排出部とを両端に連結している第1の微小流路を備えており、第1の微小流路は、第1の注入部と第1の排出部との間にて分岐しかつ再度合流する第2の微小流路を有しており、第1の微小流路には、流体中の第1の物質を検出する第1の検出部が設けられており、第2の微小流路には、流体中の第2の物質を検出する第2の検出部が設けられており、第1の検出部に、検出すべき物質を捕捉する第1の捕捉物質が配置されており、第2の検出部に、検出すべき物質を捕捉する第3の捕捉物質が配置されている分析装置であって、第1の微小流路の、第1の注入部と第1の検出部との間に、流体中の第1の物質の濃度を低減させる第1の前処理部が設けられており、第1の前処理部に、低減すべき物質を捕捉する第2の捕捉物質が配置されていることを特徴としている。
【0034】
単一サンプル中の複数の物質を分析する場合、通常であれば2回にわけて測定することが必要になるが、本構成を用いれば希釈することなく2つの物質を単一の分析装置にて同時に測定することができる。
【0035】
本発明に係る分析装置において、上記注入部と第2の検出部との間に、第2の物質の濃度を低減させる第2の前処理部が設けられており、第2の前処理部には、低減すべき物質を捕捉する第4の捕捉物質が配置されていてもよい。
【0036】
本発明に係る分析装置もまた、流体の移動を促進する駆動手段と連結されていることが好ましく、この場合、駆動手段は、第1の注入部および第1の排出部の少なくとも一方に連結されている。
【0037】
本発明に係る分析装置において、第1および第2の微小流路は、表面上にマイクロチャネルが形成されている第1の基板と、該マイクロチャネルを覆う第2の基板とによって形成されており、第1および第2の基板の少なくとも1つを貫く第1および第2の貫通孔が設けられており、第1および第2の貫通孔がそれぞれ第1の注入部および第1の排出部と連絡していることが好ましい。
【0038】
基板を用いて微小流路を形成させることにより、所望の形状のマイクロチャネルを、種々の公知技術を用いて容易に作製することができる。
【0039】
本発明に係る分析装置もまた、流体の移動を促進する駆動手段と連結されていることが好ましく、この場合、駆動手段は、第1および第2の貫通孔の少なくとも一方に連結されている。
【0040】
本発明に係る分析装置はまた、注入すべき流体を受容する第1の注入部と流体を排出する第1の排出部とを両端に連結している第1の微小流路を備え、第1の微小流路の分岐部にて分岐して、流体を排出する第2の排出部を一端に連結している第2の微小流路が形成されており、分岐部と第1の排出部との間の第1の微小流路に、流体中の第1の物質を検出する第1の検出部が設けられており、分岐部と第2の排出部との間の第2の微小流路に、流体中の第2の物質を検出する第2の検出部が設けられており、第1の検出部に、検出すべき物質を捕捉する第1の捕捉物質が配置されており、第2の検出部に、検出すべき物質を捕捉する第3の捕捉物質が配置されている分析装置であって、第1の注入部と第1の検出部との間には、流体中の第1の物質の濃度を低減させる第1の前処理部が設けられており、第1の前処理部には、低減すべき物質を捕捉する第2の捕捉物質が配置されていることを特徴としている。
【0041】
本発明に係る分析装置において、前記第1の注入部と第2の検出部との間に、第2の物質の濃度を低減させる第2の前処理部が設けられており、第2の前処理部には、低減すべき物質を捕捉する第4の捕捉物質が配置されていることが好ましい。
【0042】
本発明に係る分析装置は、流体の移動を促進する駆動手段と連結されていることが好ましく、この場合、駆動手段は、第1の注入部に、または第1および第2の排出部の両方に連結されている。
【0043】
本発明に係る分析装置において、第1および第2の微小流路は、表面上にマイクロチャネルが形成されている第1の基板と、該マイクロチャネルを覆う第2の基板とによって形成されており、第1および第2の基板の少なくとも1つを貫く第1、第2および第3の貫通孔が設けられており、第1の貫通孔が第1の注入部と連絡し、第2および第3の貫通孔がそれぞれ第1および第2の排出部と連絡していることが好ましい。
【0044】
基板を用いて微小流路を形成させることにより、所望の形状のマイクロチャネルを、種々の公知技術を用いて容易に作製することができる。
【0045】
本発明に係る分析装置もまた、流体の移動を促進する駆動手段と連結されていることが好ましく、この場合、駆動手段は、第1の貫通孔に、または第2および第3の貫通孔の両方に連結されている。
【0046】
本発明に係る分析装置において、各前処理部を通過した後の、検出すべき物質の濃度が、第1の捕捉物質が捕捉し得る範囲内であることが好ましい。
【0047】
このような構成を用いれば、分析に供されるサンプルが前処理部を通過することで第1の捕捉物質が捕捉し得る範囲内まで対象物質の濃度が低下し、見かけ上、高濃度の検出物質を測定することが可能となる。
【0048】
本発明に係る分析装置において、上記低減すべき物質の最大モル量が、分析に供されるサンプル中に含まれる対象物質のモル量よりも少ないことが好ましい。
【0049】
このような構成を用いれば、分析に供されるサンプル中の対象物質が、前処理部を通過する際に全て捕捉されてしまうことを防ぐことが可能となる。
【0050】
本発明に係る分析装置において、第2の捕捉物質のモル量が、分析に供されるサンプル中に含まれる対象物質のモル量と第1の捕捉物質のモル量との差であることが好ましい。
【0051】
このような構成を用いれば、分析に供されるサンプル中の対象物質のうち、検出部にて検出可能なモル量だけ前処理部を通過させて、それ以外を第2の捕捉物質によって捕捉することが可能である。
【0052】
本発明に係る分析装置において、各微小流路の内部にバルブ構造が設けられていることが好ましい。上記バルブ構造は、対応する検出部と前処理部の間に設けられていること画より好ましい。
【0053】
このような構成を用いれば、サンプル中の対象物質を前処理部にて捕捉する時間を任意に確保することができる。これにより、検出部にて分析される物質の濃度をより低くすることができる。
【0054】
本明細書において、用語「対応する」は、互いに機能的に関連している2つ以上の構成に対して用いられる。例えば、「対応する検出部と前処理部」は、特定の物質の濃度を低減させる前処理部と、低減された特定の物質を分析する検出部とをいう。また、「対応する注入部と検出部」は、特定の検出部と、該検出部にて分析されるべき物質を含むサンプルが注入(導入に対応)される注入部とをいい、「対応する注入部と前処理部」は、特定の前処理部と、該前処理部にて低減されるべき物質を含むサンプルが注入(導入に対応)される注入部とをいう。
【0055】
本発明に係る分析装置において、対応する注入部と検出部の間に、対応する前処理部が複数設けられていてもよい。複数の前処理部は、互いに直接に配置されても並列に配置されてもよく、並列に配置される場合は、各微小流路の少なくとも1つが、対応する注入部と検出部との間にて分岐しかつ再度合流する構成を有しており、形成されている複数の分岐の各々に、対応する前処理部が設けられている。
【0056】
このような構成を用いれば、対象物質を捕捉する第2の捕捉物質が固定化されている前処理部が複数存在するため、効率よく対象物質の濃度を低減することができる。特に、並列の配置を採用する場合は、対象物質を含むサンプルが2つ以上に分配され、分配されたサンプルの各々が独立して前処理部を通ることによって、検出すべき物質の濃度をより短時間で低下させることができる。
【0057】
本発明に係る分析装置において、各前処理部の少なくとも1つが三次元の構造体を備えていることが好ましい。このような構造体は、上記前処理部の壁面から伸びる柱状の構造体であっても、多孔質の構造体であっても、複数の粒子状の構造体であってもよい。
【0058】
このような構成を用いれば、前処理部に三次元の構造物が形成されているため、検出すべき物質の濃度をより効率よく低下することができる。これにより、分析時間の短縮や集積化といったメリットにつながる。柱状構造が採用された場合は、前処理部の面積が立体的に増加するので、効率よく検出物質の濃度を低下することが可能となる。多孔質の構造体が採用された場合は、前処理部の面積が立体的に増加するので、効率よく検出物質の濃度を低下することが可能となる。複数の粒子状の構造体が採用された場合は、前処理部の面積が立体的に増加するので、これにより効率よく検出物質の濃度を低下することが可能となる。
【0059】
本発明に係る分析装置において、第1の捕捉物質が上記検出すべき物質に対する抗体であることが好ましい。また、第2の捕捉物質が上記低減すべき物質に対する抗体であることが好ましい。
【0060】
生化学的な分析に用いられるマイクロチャネル型の分析装置の検出対象となる物質は生体内タンパク質が多い。変性しにくい抗体は、捕捉物質として使用するには最適な物質である。
【0061】
本発明に係る分析装置において、第1の捕捉物質および第2の捕捉物質が同一物質であることが好ましい。
【0062】
このような構成を用いれば、第1および第2の捕捉物質として同一物質を使用するため、材料選択の検討を減らすことができるとともに、分析装置の製造も容易かつ低コストである。
【0063】
本発明に係る分析装置において、上記検出部は透過性の材料からなってもよい。
【0064】
このような構成を用いれば、検出部において対象物質を光学的に検出することが可能となる。光学的に検出される対象物質は、自身が光学特性を有しているものであってもよいし、光学特性を有する物質で修飾されたものであってもよい。光学特性としては、例えば、吸光特性、発光特性および発色特性が挙げられる。なお、発光には蛍光が包含される。光学特性を有する物質としては、例えば、吸光色素、発光色素および発色色素が挙げられる。対象物質を光学的に検出する方法としては、上述の光学特性を検出する方法であればよい。このような方法としては、例えば、紫外可視分光分析法、蛍光分析法、化学発光分析法、または熱レンズ分析法などの従来公知の方法が挙げられる。光学特性を有している対象物質を用いれば、その光学特性を測定(化学発光量変化や蛍光変化、吸光度変化を測定)することによって定量的な測定が可能となる。
【0065】
本発明に係る分析装置において、上記検出部に作用電極および参照電極からなる検出手段が設けられていることが好ましい。
【0066】
このような構成を用いれば、検出部において、対象物質を電気化学的に検出することが可能となる。電気化学的に検出される対象物質は、それ自身が電気化学的に活性なものであってもよいし、電気化学的に活性な物質で修飾されたものであってもよい。対象物質を電気化学的に検出する方法としては、電気化学的に活性な物質から得られる電流値を検出電極にて測定すればよい。
【0067】
本発明に係る分析装置において、上記前処理部は透過性の材料からなってもよい。
【0068】
このような構成を用いれば、前処理部において光学的な検出が可能となるため、蛍光変化や吸光度変化を測定することによって定量的な測定が可能となる。
【0069】
本発明に係る分析装置において、上記前処理部にさらなる検出手段が設けられていることが好ましい。
【0070】
このような構成を用いれば、前処理部の検出電極において、電気化学的に活性な物質を検出することが可能となる。
【0071】
本発明に係る分析装置にアプライされるサンプルは血液が好ましく、上記検出すべき物質が血液成分であることが好ましい。上記血液成分としては、血漿タンパク、リポタンパク、分泌タンパク、ホルモン、補体または糖が挙げられる。
【0072】
このような構成を用いれば、血液中の成分(例えば、血液中の血漿タンパク、リポタンパク、分泌タンパク、ホルモン、補体、または糖)を検出対象物質として分析することが可能となる。
【0073】
本発明に係る分析方法は、上記の分析装置を用いて、サンプルを希釈することなく、サンプル中の対象物質を定量的に測定することを特徴としている。
【0074】
マイクロ化技術に用いられるサンプルの容量は極微量である。微量のサンプルを調製する際に煩雑な希釈操作が含まれていると、調製毎に誤差が生じ、正確な分析を行うことが困難となり、分析の再現性および/または信頼性が低減する。本構成を用いれば、サンプルの希釈操作を省略することができるため、分析の再現性および/または信頼性を向上させることができる。また、使用者が希釈操作を行うことなく定量的な測定が可能になる。
【0075】
本発明に係る分析方法において、上記対象物質が血液成分であることが好ましい。
【0076】
特に、血液を操作する際には、使用者が感染症に罹患する等の危険性を伴うため、その取扱いに細心の注意が必要である。サンプルの調製工程を簡略化することによって、このような危険性を低減することができる。本構成を用いれば、サンプルの希釈操作を省略することができるため、使用者は血液サンプルをより安全かつ容易に取り扱うことができる。
【0077】
本発明に係る分析方法において、各前処理部において対象物質が捕捉されているか否かを測定してもよく、上記前処理部において対象物質が捕捉されていない場合に分析エラーと判定することが好ましい。
【0078】
このような構成を用いれば、検出部で定量的な測定を行うだけではなく、前処理部でも同様に定量的な測定を行うことが可能となる。前処理部にて所望のモル量を捕捉しなかった場合には、検出失敗であることを判定することが可能となる。これは、例えば、捕捉物質の活性が低下していることを知るに有効である。
【発明の効果】
【0079】
本発明を用いれば、検出部での分析可能な範囲を大きく超えた濃度の物質を含んだサンプルを用いた場合であっても、その物質を分析し得る。これにより、使用者がサンプルの希釈を行うことなく、サンプルを分析装置内に直接導入することが可能となり、その上で定量的な測定が実現し得る。
【図面の簡単な説明】
【0080】
【図1】(a)および(b)は、本発明の実施の形態1に係るマイクロチャネル型分析装置の平面図である。
【図2】(a)および(b)は、本発明の実施の形態1に係るマイクロチャネル型分析装置の平面図である。
【図3】(a)および(b)は、本発明の実施の形態1に係るマイクロチャネル型分析装置の一構成要素の一態様を示す図である。
【図4】(a)および(b)は、本発明の実施の形態2に係るマイクロチャネル型分析装置の平面図である。
【図5】(a)および(b)は、本発明の実施の形態3に係るマイクロチャネル型分析装置の平面図である。
【図6】(a)および(b)は、本発明の実施の形態3に係るマイクロチャネル型分析装置の平面図である。
【図7】本発明のマイクロチャネル型の分析装置を示す平面図である。
【図8】本発明のマイクロチャネル型の分析装置を用いて行った分析結果を示すグラフである。
【図9】従来のマイクロチャネル型の分析装置を示す概略図である。
【図10】従来のマイクロチャネル型の分析装置に設けられた抗体の固定部での反応を示す概略図である。
【発明を実施するための形態】
【0081】
以下、本発明に係る分析装置の実施形態について、図面を参照しながら説明する。なお、マイクロチャネル型の分析装置を用いて本発明を説明しているが、本発明に係る分析装置はマイクロチャネル型に限定されず、例えば、マイクロキャピラリ型の分析装置もまた本発明の範囲に含まれる。
【0082】
〔実施の形態1〕
図1〜3に基づいて、本発明の実施の形態1について説明する。図1および図2は、本発明の実施の形態1に係るマイクロチャネル型分析装置の平面図であり、図3は、本発明の実施の形態1に係るマイクロチャネル型分析装置の一構成要素の平面図(左図)および側方からの断面図(右図)である。
【0083】
<1.マイクロチャネル型分析装置>
本実施形態にかかるマイクロチャネル型分析装置(マイクロチャネルチップ)は、基板100、および基板100と重ね合わせる蓋101を備えており、基板100の表面には、凹面の微細溝(マイクロチャネル)1が形成されている。なお、本明細書中において、「微細」は、μmオーダーの径を有していることが意図され、具体的には、半導体の微細加工技術を用いて形成され得る程度のサイズが意図される。
【0084】
マイクロチャネル1は本実施形態に係る分析装置の流路を規定する。基板100の表面には、注入すべき流体を受容する注入部2、および流路から流体を排出する排出部3がさらに形成されており、それぞれマイクロチャネル1の両端と連結している。すなわち、マイクロチャネル1は注入部2と排出部3とを基板100の表面上にて接続している。注入部2は、マイクロチャネル1へ注入する流体を貯留する部位であり得、排出部3は、マイクロチャネル1から排出される流体を貯留する部位であり得る。なお、本明細書中において、必要に応じて、マイクロチャネル1と注入部2または排出部3との境界部を注入孔および排出孔(図示せず)と称する。
【0085】
このような基板100に蓋101を重ね合わせることによってマイクロチャネル1は基板外部から隔離される。ただし、基板100または蓋101を貫通する第1および第2の貫通孔(図示せず)が、それぞれ注入部2および排出部3と基板外部とを連通する。これにより、基板外部からマイクロチャネル1へ流体を供給したり、マイクロチャネル1から基板外部へ流体を排出したりすることができる。
【0086】
また、図1(b)に示すように、注入部2から排出部3への流れ方向を規定したり、流体の流れを制御したりするためのバルブ8がマイクロチャネル内に設けられていてもよい。
【0087】
さらに、マイクロチャネル1を流れる流体中の物質を検出する検出部4が設けられている。この検出部4には、検出および分析の対象となる物質を捕捉する捕捉物質5が固定化されている。さらに、マイクロチャネル1内には、流体中の物質(検出部4にて検出されるべき物質)の濃度を低減させる前処理部6が、注入部2と検出部4との間に設けられている。この前処理部6には、目的の物質を捕捉する捕捉物質7が固定化されている。
【0088】
なお、図示していないが、本実施形態に係る分析装置は、マイクロチャネル1内の流体の、注入部2から排出部3への移動を促進する駆動手段が、注入部および排出部の少なくとも一方に連結されていてもよい。このような駆動手段としては、例えば、押出しポンプおよび吸引ポンプが挙げられる。押出しポンプを用いて流体をマイクロチャネル1内へ送り込む場合は、押出しポンプを注入部2に連結すればよく、吸引ポンプを用いて流体をマイクロチャネル1内から引き出す場合は、吸引ポンプを排出部3に連結すればよい。また、上述したようなポンプを用いる以外に、従来公知の方法で毛管現象または吸水物質を用いて溶液を流すこともできる。
【0089】
本実施形態に係る分析装置に提供される流体は、気体であっても液体であってもよいが、マイクロ化技術による生化学的な分析に用いられる場合は、液体であることが好ましい。
【0090】
以下、本実施形態に係る分析装置が備えている部材について詳細に説明する。
【0091】
<1.1 基板>
基板100および蓋101として、例えば、絶縁性を有する基板を用いることができる。絶縁性を有する基板としては、例えば、表面に酸化膜などの絶縁性材料が形成されたシリコン基板、石英基板、酸化アルミニウム基板、ガラス基板又はプラスチック基板などが挙げられる。物質を光学的に検出する場合、光透過性の基板を第1の基板100または蓋101として用いることができる。光透過性の基板としては、例えば、ガラス基板、石英基板、および光透過性樹脂から作成された基板などが挙げられる。また、化学発光を利用して物質を検出する場合、自発蛍光が小さく且つ透明性のあるガラスまたはプラスチック材料(例えば、例えば、ポリイミド、ポリベンツイミダゾール、ポリエーテルエーテルケトン、ポリスルホン、ポリエーテルイミド、ポリエーテルスルホン、ポリフェニレンサルファイトなど)を、第1の基板100または蓋101として用いることもできる。なお、マイクロチャネル型分析装置に用いるに好ましい、基板100の厚みは0.1〜5mm程度である。なお、蓋101は、基板100と同一の厚みを有していても、基板100よりも薄くてもよい。
【0092】
<1.2 マイクロチャネル>
基板100の表面上に形成されるマイクロチャネル1の深さは0.1〜1000μm程度であることが好ましく、幅は0.1〜1000μm程度であることが好ましいが、これらに限定されない。また、マイクロチャネル1の長さは、基板100の大きさに従って適宜設計可能であり、50〜800μm程度であることが好ましい。
【0093】
マイクロチャネル1の流路は、流体の流れ方向に沿って角柱形状であっても円柱形状であってもよい。すなわち、マイクロチャネル1の、流体の流れ方向に対して垂直な断面の形状は、矩形、台形、円形(半円形)であり得る。
【0094】
マイクロチャネル1は、例えば基板100上に凹凸を形成することによって作製することができる。例えば、基板100上に凹部を形成し、この凹部をマイクロチャネル1としてもよいし、基板100上に複数の凸部を形成し、これらの凸部で囲まれた領域をマイクロチャネル1としてもよい。また、凹部と凸部と形成し、凹部と凸部との組合せからマイクロチャネル1を作製してもよい。
【0095】
基板100上に凹凸を形成する方法としては、例えば、直接加工する方法としての機械加工による方法、レーザー加工による方法、金型を用いた射出成型、プレス成型、および鋳造による方法などが挙げられる。金型を用いた射出成型は、量産性に優れ、形状の再現性が高いので、特に好適に利用される。また、基板100の材料がシリコンまたはガラス等である場合、基板100上のマイクロチャネル1のパターンを、フォトリソグラフィ法またはエッチング法により形成することができる。
【0096】
なお、注入部2および排出部3は、予め基板100上に形成されている態様を図示したが、注入部2および排出部3を介してマイクロチャネル1と基板外部とを連絡する構成であれば限定されず、例えば、第1および第2の貫通孔として形成されてもよい。注入部2および排出部3の大きさは、マイクロチャネル1の大きさおよび形状に従って適宜変更可能であるが、本実施形態に係る分析装置をマイクロチャネル型分析装置として用いるためには、径が10μm以上であることが好ましい。なお、基板100と別の部材として形成した注入部2および排出部3を基板外部に配置して、それぞれ第1および第2の貫通孔を介して注入孔および排出孔に連結された態様であってもよい。
【0097】
<1.3 検出部>
検出部4は、上述したように、マイクロチャネル1を流れる流体中の物質を検出する部位であり、図1に示すように、検出部4には、検出および分析の対象となる物質(以下、対象物質とも称する。)を捕捉する捕捉物質5が固定化されている。捕捉物質5は、対象物質とホスト−ゲストの関係がある物質(例えば、抗原、抗体、酵素、基質、リガンド、レセプター、DNA、糖、ペプチド、合成高分子(例えばモレキュラーインプリントポリマー)など)であればよく、特に、抗体または合成高分子は、活性が安定しているので好ましい。また、捕捉物質5を固定化する方法としては、物理的吸着法、化学結合法、共有結合法などの公知の方法が適宜採用され得る。
【0098】
検出部4の構成は、特に限定されず、対象物質の検出方法によって適宜決定され得る。吸光度または発光(蛍光を含む。)などに基づいて、対象物質を光学的に検出する場合、マイクロチャネル1の光透過性の部分を検出部4とすればよい。分析装置の製造を簡便にするために、第1の基板100全体または蓋101全体を、例えば、ガラス、石英および光透過性樹脂などの光透過性の材料にすることが好ましい。このような場合は、図示するように、検出部4のマイクロチャネル1内壁面上に捕捉物質5を固定化すればよい。
【0099】
また、対象物質を電気化学的に検出する場合、検出部4は、マイクロチャネル内に形成した検出電極からなる検出手段を備えていればよい。検出電極は、少なくとも参照電極および作用電極の2電極から構成されていればよいが、参照電極および作用電極に加えて対向電極を備えている3電極から構成されていることが好ましい。図1には、検出部4におけるマイクロチャネル1内部壁面に捕捉物質5が固定化されている構成を示しているが、検出電極を用いる場合には、捕捉物質5が少なくとも作用電極上に固定化されていればよい。
【0100】
参照電極、作用電極および対向電極は、従来のフォトリソグラフィ技術を利用した微細加工技術によってマイクロチャネル1に形成することができる。電極の導電性材料として、例えば金、白金、銀、クロム、チタン、イリジウム、銅またはカーボンなどを用いることができる。参照電極には、基準電位の安定性の観点から、銀/塩化銀電極を用いることが好ましい。
【0101】
<1.4 前処理部>
前処理部6は、上述したように、流体中の物質(検出部4にて検出されるべき物質)の濃度を低減させる部位であり、図1に示すように、注入部2と検出部4との間に設けられた前処理部6には、対象物質を捕捉する捕捉物質7が固定化されている。捕捉物質7は、捕捉物質5と同様に、対象物質とホスト−ゲストの関係がある物質(例えば、抗原、抗体、酵素、基質、リガンド、レセプター、DNA、糖、ペプチド、合成高分子(例えばモレキュラーインプリントポリマー)など)であればよく、特に、抗体または合成高分子は、活性が安定しているので好ましい。なお、捕捉物質7は、捕捉物質5と同じ物質であることが好ましい。同じ特性の捕捉物質を使用することによって、本実施形態に係る分析装置の生産性を向上させたり製造コストを低減させたりするだけでなく、開発効率を向上させることができる。捕捉物質7を固定化する方法もまた、物理的吸着法、化学結合法、共有結合法などの公知の方法が適宜採用され得る。
【0102】
図2に示すように、本実施形態に係る分析装置において、前処理部6は複数設けられてもよい。具体的には、図2(a)に示すように、2つ以上の前処理部6・6’が単一流路内に直列に配置されてもよく、図2(b)に示すように、単一流路から分配されかつ再度合流する複数の流路のそれぞれに前処理部6・6’’が配置されてもよい。
【0103】
前処理部6の構成は、特に限定されず、例えば、図示するように、前処理部6のマイクロチャネル1内壁面上に捕捉物質7を固定化してもよい。また、捕捉物質7を固定化する面積を拡大するために、前処理部6のマイクロチャネル1内に三次元の構造物を配置してもよい。このような三次元の構造物を設けることによって前処理部6に固定化される捕捉物質7のモル量が増加し、その結果、対象物質と捕捉物質7との反応効率が向上し、対象物質の濃度を非常に効率よく低減させることができる。
【0104】
このような構造物としては、例えば、柱状構造物6a(図3(a))や多孔質構造体(図示せず)、図3(b)に示す微粒子6bが挙げられる。図3(b)に示すように、微粒子6bの移動を妨げる堰止め部9を注入部2と検出部4との間のマイクロチャネル1内に設けることによって、注入部2から微粒子6bを含む溶液を導入した際に、微粒子6bを堰止め部9によって留めておくことができる。そして、堰止め部9によって留められた微粒子6bの集合が前処理部6を形成する。堰止め部9は、流体の流れを妨げずに微粒子6bの通過を阻止し得る構造であれば特に限定されない。
【0105】
前処理部6は、さらなる検出手段を備えていることが好ましい。すなわち、検出部4にて対象物質を検出する前に前処理部6にて対象物質を検出することが好ましい。このような検出手段を備えていることにより、前処理部6において対象物質が捕捉されているか否かを確認することが可能となる。この場合、捕捉物質7の劣化、またはその他の異常によって前処理部6での対象物質の捕捉を確認し得なかった際に、分析が失敗である(分析エラー)と判定することが可能となる。すなわち、本実施形態に係る分析装置は、前処理部6における対象物質の有無を判定する判定部をさらに備えていてもよい。なお、前処理部6に備えられる検出手段は、検出部4に備えられる検出手段と同一のものが好ましいが、異なっていてもよい。検出手段の詳細については、上記「1.3 検出部」の項を参照のこと。
【0106】
<1.5 バルブ構造>
バルブ8は、マイクロチャネル1内の流体の流れ方向を規定する構造、マイクロチャネル1内の流体の流れを物理的に停止させる構造、マイクロチャネル1内の流体を切断する構造、マイクロチャネル1内の流体を分離する構造などを有し得、必要に応じて全ての機能を備えていてもよい。好ましいバルブ8の例としては、回転ねじ式バルブ、出し入れ自在の堰板、圧力による閉鎖、気体制御による液体の切断などが挙げられる。バルブを設けることで、前処理部6および検出部4での反応時間を延長することができる。
【0107】
<1.6 第1および第2の捕捉物質の調整方法>
対象物質の濃度を、検出部において検出し得る濃度範囲内に収めるように、第2の捕捉物質の固定化量(モル量)を調整する必要がある。つまり、対象物質の濃度にあわせて、第1の捕捉物質の固定化量と第2の捕捉物質の固定化量とを調整する。第1の捕捉物質の固定化量および第2の捕捉物質の固定化量は、第1の捕捉物質および第2の捕捉物質の特性だけではなく、マイクロチャネル1の形状にも依存するため、分析装置の構成に応じて適宜調整を行う必要がある。固定化濃度による調整方法の一例を、以下に記載する。
(1)検出可能な濃度範囲の確認
前処理部6が設けられていない以外は本実施形態と同一の構成マイクロチャネルを有する分析装置Xにおいて、濃度が既知である対象物質(標準物質)を用いて検出可能な濃度範囲を調べる。
(2)前処理部6の条件検討
種々の濃度の第2の捕捉物質(100、10、1、0.1、0.01μg/mL)を調製し、本実施形態の分析装置のマイクロチャネル1の前処理部6に固定化する。次いで、標準物質を用いて、検出可能な濃度範囲を調べる。
(3)前処理部6の条件決定
所望の濃度範囲と近い条件を示す第2の捕捉物質の濃度を、操作(2)の結果に基づいて選択する。選択した濃度付近の濃度の第2の捕捉物質を用いて操作(2)を再度実行し、前処理部の固定化条件を決定する。
【0108】
以上の手順によって、第1の捕捉物質の固定化条件および第2の捕捉物質の固定化条件を決定する。第2の捕捉物質のモル量は、分析に供されるサンプル中の対象物質のモル量以下、または対象物質のモル量と第1の捕捉物質のモル量との差に調製することが好ましい。
【0109】
また、前処理部の面積を拡大することによって、種々の濃度の第2の捕捉物質を調製することなく、検出に好適な濃度範囲を調整することができる。例えば、図2(a)に示すように前処理部を複数個設ける。対象物質を含んだ分析に供されるサンプルが前処理部を複数回通過することによって、より低濃度まで効率よく濃度を低下させることができる。また、図2(b)に示すように、マイクロチャネル1を分岐させ、複数の前処理部を並列に設けてもよい。なお、複数の前処理部を並列に設ける場合は、対象物質を含んだ分析に供されるサンプルの濃度をより短時間に効率よく低下させることができるので、これらを組み合わせて用いてもよい。
【0110】
このように、前処理部における第2の捕捉物質のモル量、分析に供されるサンプル中の対象物質のモル量、および、検出部における第1の捕捉物質のモル量を、当業者は適宜調整し得る。これらの第1の捕捉物質のモル量、第2の捕捉物質のモル量、および分析に供されるサンプル中の対象物質のモル量には、以下の関係が成立する。
[分析に供されるサンプル中の対象物質のモル量(最大量〜最少量)]−[一定時間内に第2の捕捉物質が捕捉し得るモル量]=[検出部において第1の捕捉物質が検出し得る対象物質の濃度範囲]×[分析に供されるサンプル容量]
好ましくは、第1および第2の捕捉物質が対象物質を1:1にて捕捉する物質であり得る。その場合、第2の捕捉物質のモル量の範囲は、対象物質のモル量(最大量〜最少量)と第2の捕捉物質のモル量との差である。
【0111】
<1.7 測定方法>
本実施形態に係る分析装置を用いた分析方法の一例を、以下に示す。なお、マイクロチャネル1内にて流体を流す駆動手段は、注入部2に連結した押出ポンプを用いる方法、排出部3に連結した吸引ポンプを用いる方法、毛管力および/または吸水物質を用いる方法のいずれでもよい。
【0112】
(1)ブロッキング
分析に供されるサンプル中の、検出対象でない物質(非対象物質)が、マイクロチャネル1、前処理部6および検出部4に非特異的に吸着することを防ぐために、非特異吸着防止剤を注入部2から導入して、マイクロチャネル1内を満たす。次いで、この非特異吸着防止剤を排出部3から排出する。洗浄溶液を注入部2から導入し、マイクロチャネル1内を通過させて排出部3から排出する。これにより、マイクロチャネル1内に残留する余分な非特異吸着防止剤を取り除く。好適な非特異的吸着防止剤としては、例えば、プロテインフリー(Thermo社)が挙げられる。
【0113】
(2)分析に供されるサンプルの導入
分析に供されるサンプルを注入部2からマイクロチャネル1内に導入する。分析に供されるサンプルは、マイクロチャネル1内を移動して前処理部6へ送達される。分析に供されるサンプルが前処理部6を通過する間に、分析に供されるサンプル中の対象物質が前処理部6の第2の捕捉物質と結合して、前処理部6にて捕捉される。これにより、前処理部6を通過した分析に供されるサンプル中の対象物質の濃度が低減する。この際、分析に供されるサンプル中の対象物質と、前処理部6の第2の捕捉物質との結合を十分進行させるために、バルブ8を閉じておくことが好ましい。
【0114】
次いで、必要に応じてバルブ8を開放し、分析に供されるサンプルを、マイクロチャネル1内をさらに移動させて検出部4へ送達する。分析に供されるサンプルが検出部4を通過する間に、分析に供されるサンプル中の対象物質は検出部4の第1の捕捉物質と結合して検出部4にて捕捉される。次いで、洗浄溶液を注入部2から導入し、マイクロチャネル1内を移動させて排出部3から排出する。これにより、マイクロチャネル1内に残留する余分な分析に供されるサンプルを取り除く。
【0115】
マイクロチャネル1内での注入部2から排出部3への分析に供されるサンプルの移動は連続的に行われてもよいし、断続的に行われてもよい。分析に供されるサンプルを断続的に移動させる場合、例えば、分析に供されるサンプルを前処理部6および/または検出部4の領域内にて所定の時間にわたって保持(インキュベート)してもよい。これにより、分析に供されるサンプル中の対象物質と第1および/または第2の捕捉物質との反応時間を最適化することができる。
【0116】
(3)検出部にて捕捉された対象物質の標識化
対象物質に結合し得る標識化合物を、注入部2からマイクロチャネル1内に導入して、検出部4へ送達する。標識化合物が検出部4を通過する間に、標識化合物は検出部4に捕捉されている対象物質と結合する。この操作によって、検出部4内に捕捉された対象物質が標識される。
【0117】
(4)対象物質の検出
検出手段を用いて標識化合物を検出することによって、検出部4での対象物質を検出することが可能となる。標識化合物としては、例えば、蛍光標識抗体または酵素標識抗体を用いることができるが、第1の捕捉物質と異なる抗体が好ましい。
【0118】
(4−1)蛍光標識抗体を用いた対象物質の検出
上記(3)において蛍光標識抗体を用いた場合、検出部4の蛍光を直接観察することによって、対象物質を検出することができる。
【0119】
(4−2)酵素標識抗体を用いた対象物質の検出
上記(3)において酵素標識抗体を用いた場合、酵素標識抗体を対象物質に結合させた後に、この酵素に対する基質溶液を注入部2からマイクロチャネル1内に導入する。基質溶液が検出部4を通過する間に、対象物質に結合した酵素標識抗体と基質溶液とが反応する。この反応の結果によって得られるシグナルを公知の方法を用いて検出することによって対象物質を検出することができる。当業者は、このような方法を、使用する基質の種類に応じて、適宜選択することができる。
【0120】
例えば、上記反応によって蛍光を発する基質を用いた場合は、検出部4の蛍光を直接観察することによって対象物質を検出することができる。また、上記反応によって吸光度が変化する基質を用いた場合は、検出部4の吸光度を測定することによって対象物質を検出することができる。上記反応によって電気化学活性が変化する基質を用いた場合は、電極を用いた電気化学的な手段によって対象物質を検出することができる。
【0121】
本実施形態に係る測定方法は、生化学的な分析に好適であり、用いられるサンプルとしては、特に限定されないが、生化学的な分析に利用される頻度を考慮すると、血液が好ましい。上記測定方法に血液を供することによって、例えば、免疫グロブリン、アルブミン、GOT、GTP、γ−GPT、HDL、LDL、中性脂肪、ヘモグロビンA1C、尿酸、グルコース、アディポネクチン、レプチン、レジスチンおよびTNF−αなどの血液成分を、対象物質として分析することができる。
【0122】
マイクロ化技術に用いられるサンプルの容量は極微量である。微量のサンプルを調製する際に煩雑な希釈操作が含まれていると、調製毎に誤差が生じ、正確な分析を行うことが困難となり、分析の再現性および/または信頼性が低減する。本実施形態に係る分析装置を用いれば、サンプルの希釈操作を省略することができるため、分析の再現性および/または信頼性を向上させることができる。
【0123】
特に、血液を操作する際には、感染症への罹患等の危険性を伴うため、その取扱いに細心の注意が必要である。サンプルの調製工程を簡略化することによって、このような危険性を低減することができる。本実施形態に係る分析装置を用いれば、サンプルの希釈操作を省略することができるため、使用者は血液サンプルをより安全かつ容易に取り扱うことができる。
【0124】
なお、標識化合物および基質溶液を注入部2からマイクロチャネル1内に導入する場合、標識化合物および基質溶液は、検出部4に到達する前に前処理部6を通過する。標識化合物および基質溶液は、前処理部6を通過する間に、前処理部6に捕捉されている対象物質と結合および/または反応し得、この反応によってシグナルが生成し得る。このシグナルが検出部における対象物質の検出に支障をきたす可能性は十分あり得る。このような可能性を回避するためには、検出部4での第1の捕捉物質と標識化合物との結合を生じさせた後に、マイクロチャネル1内の流れ方向を変更して、基質溶液を排出部3から注入すればよい。
【0125】
〔実施の形態2〕
図4に基づいて、本発明の実施の形態2について説明する。図4(a)および(b)は、本発明の実施の形態2に係るマイクロチャネル型分析装置の平面図である。
【0126】
本実施形態にかかるマイクロチャネル型分析装置は、図4に示すように、基板100の表面には、連結された2つのマイクロチャネル21および21’が形成されている。基板100の表面には、注入すべき流体を受容する注入部22、サンプルを受容するサンプル注入部22’、および流路から流体を排出する排出部23がさらに形成されている。マイクロチャネル21は注入部22と排出部23とを基板100の表面上にて接続しており、マイクロチャネル21’はサンプル注入部22’とマイクロチャネル21とを接続している。サンプル注入部22’は、マイクロチャネル21’へ注入する分析に供されるサンプルを貯留する部位であり得、マイクロチャネル21’へ導入された分析に供されるサンプルはマイクロチャネル21へ送達され、引き続いて排出部23から排出される。図4(a)は、直線状のマイクロチャネル21にマイクロチャネル21’が接続している態様を示し、図4(b)は、屈曲しているマイクロチャネル21の屈曲部にマイクロチャネル21’が接続している態様を示している。
【0127】
このような基板100に第2の基板(図示せず)を重ね合わせることによってマイクロチャネル21および21’は基板外部から隔離される。ただし、基板100または第2の基板を貫通する第3の貫通孔(図示せず)が、サンプル注入部22と基板外部とを連通する。これにより、基板外部からマイクロチャネル21’へ分析に供されるサンプルを供給することができる。
【0128】
また、図示するように、注入部22およびサンプル注入部22’から排出部23への流れ方向を規定したり、流体の流れを制御したりするためのバルブ28および28’がマイクロチャネル内に設けられていてもよい。
【0129】
さらに、マイクロチャネル21を流れる流体中の物質を検出する検出部24が設けられている。この検出部24には、検出および分析の対象となる物質を捕捉する捕捉物質25が固定化されている。さらに、マイクロチャネル21または21’内には、流体中の物質(検出部24にて検出されるべき物質)の濃度を低減させる前処理部26が、サンプル注入部22’と検出部4との間に設けられている。この前処理部26には、目的の物質を捕捉する捕捉物質27が固定化されている。
【0130】
なお、図4には、2つのマイクロチャネル21および21’の連結部と、マイクロチャネル21’内のサンプル注入部22’との間に前処理部26が設けられた構成を示しているが、前処理部26は連結部と検出部24との間に設けられていてもよい。
【0131】
また、実施の形態1と同様に、マイクロチャネル21および21’内の流体の、注入部22、サンプル注入部22’から排出部23への移動を促進する駆動手段が、注入部22、サンプル注入部22’および排出部に連結されていてもよい。サンプル注入部22’には、マイクロチャネル21’内へ分析に供されるサンプルを送り込む押出しポンプを連結することができる。
【0132】
なお、本実施形態に係る分析装置における、基板、マイクロチャネル、検出部、前処理部、バルブ構造などの要部構成は、前述した実施の形態1と同じである。また、捕捉物質の調整方法および測定方法についても、前述した実施の形態1と同じである。すなわち、本実施形態に係る分析装置は、マイクロチャネルへ導入されるべき流体およびサンプルを、異なる注入部から適宜導入することを実現するためのものである。この場合、サンプルをサンプル注入部22’から導入し、実施の形態1にて示した標識化合物および基質溶液を注入部22から導入することによって、前処理部26を通過させることなく標識化合物および基質溶液を検出部24に送達することができる。
【0133】
〔実施の形態3〕
図5〜6に基づいて、本発明の実施の形態5について説明する。図5および図6は、本発明の実施の形態3に係るマイクロチャネル型分析装置の平面図である。
【0134】
本実施形態にかかるマイクロチャネル型分析装置は、図5に示すように、基板100の表面上に形成された注入部32と排出部33とを接続するマイクロチャネル31および31’が、基板100の表面に形成されている。マイクロチャネル31’は、マイクロチャネル31が注入部32と排出部33との間にて分岐しかつ再度合流するバイパスチャネルである。マイクロチャネル31が、そのバイパスチャネルとしてマイクロチャネル31’を有していることにより、それぞれに異なる検出部34および34’を設けることが可能になる。検出部34および34’には、検出および分析の対象となる物質を捕捉する捕捉物質35および35’がそれぞれ固定化されている。その結果、注入部32から導入された分析に供されるサンプル中の第1および第2の物質をそれぞれ第1の検出部34および第2の検出部34’によって検出することができる。
【0135】
なお、図示していないが、本実施形態に係る分析装置は、マイクロチャネル31および31’内の流体の、注入部32から排出部33への流れ方向を規定したり、流体の流れを制御したりするためのバルブがマイクロチャネル内に設けられていてもよい。
【0136】
第2の物質が、実施の形態1にて示した前処理部を必要とすることなく首尾よく検出し得るものである場合は、前処理部を有していないマイクロチャネル31’の検出部34’にて第2の物質を検出することができる(図5(a))。そして、検出部34’での検出と同時に、目的の物質を捕捉する捕捉物質37が固定化された前処理部36を備えたマイクロチャネル31では実施の形態1と同様の態様にて第1の物質を検出部34にて検出することができる。
【0137】
もちろん、第2の物質の検出に前処理部が必要とされる場合には、マイクロチャネル31’が、目的の物質を捕捉する捕捉物質37’が固定化された前処理部36’を備えていればよい(図5(b))。例えば、第1の物質を10倍希釈の状態にて測定し、第2の物質を100倍希釈の状態にて測定することが必要な場合、通常であれば2回にわけて測定することが必要になるが、本構成を用いればいずれも希釈することなく2つの物質を同時に測定することができる。
【0138】
このように、本実施形態の構成を用いれば、希釈することなく複数の対象物質を測定することができる。
【0139】
図5には、前処理部36および36’が、それぞれ独立した流路内に設けられた構成を示しているが、マイクロチャネル31からマイクロチャネル31’が分岐する分岐部の上流でも下流でもよい。すなわち、前処理部36は注入部32と検出部36との間に設けられていればよく、前処理部36’は注入部32と検出部36’との間に設けられていればよいといえる。
【0140】
本実施形態に係る分析装置の具体的な構成として、主流路であるマイクロチャネル31から単一のバイパスチャネル(マイクロチャネル31’)が分岐した構成が図5に示されているが、バイパスチャネルの数は特に限定されない。なお、分岐する数が増えることによって、各検出部へ送達されるサンプル濃度が低減するため、この点を考慮した上で、分析に用いるサンプルを調製することが必要である。また、単一の排出部を、複数のマイクロチャネルが共有する構成が図5に示されているが、図6に示すように、複数のマイクロチャネルがそれぞれ独立した排出部と連結されていてもよい。
【0141】
本実施形態にかかるマイクロチャネル型分析装置はまた、図6に示すように、基板100の表面上に形成された注入部42と排出部43とを接続するマイクロチャネル41、および注入部42と排出部43’とを接続するマイクロチャネル41’が、基板100の表面に形成されている。マイクロチャネル41’は、マイクロチャネル41が注入部42と排出部43との間にて分岐して形成された流路である。2つのマイクロチャネル41および41’を有していることにより、それぞれに異なる検出部44および44’を設けることが可能になる。検出部44および44’には、検出および分析の対象となる物質を捕捉する捕捉物質45および45’がそれぞれ固定化されている。その結果、注入部42から導入された分析に供されるサンプル中の第1および第2の物質をそれぞれ第1の検出部44および第2の検出部44’によって検出することができる。
【0142】
なお、図示していないが、本実施形態に係る分析装置は、マイクロチャネル41および41’内の流体の、注入部42から排出部43または43’への流れ方向を規定したり、流体の流れを制御したりするためのバルブがマイクロチャネル内に設けられていてもよい。
【0143】
図6(b)には、前処理部46および46’が、それぞれ独立した流路内に設けられた構成を示しているが、マイクロチャネル41からマイクロチャネル41’が分岐する分岐部の上流でも下流でもよい。すなわち、前処理部46は注入部42と検出部46との間に設けられていればよく、前処理部46’は注入部42と検出部46’との間に設けられていればよいといえる。前処理部46および46’には、目的の物質を捕捉する捕捉物質47および47’がそれぞれ固定化されている。
【0144】
上述したように、第2の物質が、実施の形態1にて示した前処理部を必要とすることなく首尾よく検出し得るものである場合は、前処理部を有していないマイクロチャネル41’の検出部44’にて第2の物質を検出することができる(図6(a))。そして、検出部44’での検出と同時に、前処理部46を備えたマイクロチャネル41では実施の形態1と同様の態様にて第1の物質を検出部44にて検出することができる。
【0145】
もちろん、第2の物質の検出に前処理部が必要とされる場合には、マイクロチャネル41’が前処理部46’を備えていればよい(図6(b))。前処理部46’には、目的の物質を捕捉する捕捉物質47が固定化されている。例えば、第1の物質を10倍希釈の状態にて測定し、第2の物質を100倍希釈の状態にて測定することが必要な場合、通常であれば2回にわけて測定することが必要になるが、本構成を用いればいずれも希釈することなく2つの物質を同時に測定することができる。
【0146】
このように、本実施形態に係る分析装置は、サンプル中の異なる物質を同一サンプルから同時に検出するためのものであり、本実施形態の構成を用いれば、希釈することなく複数の対象物質を測定することができる。なお、本実施形態に係る分析装置における、基板、マイクロチャネル、バルブ構造などの要部構成は、前述した実施の形態1と同じである。検出部および前処理部については、複数の検出部および複数の前処理部を用いている本実施形態と、単一の検出部および単一の前処理部を用いている実施の形態1とは異なるといえるが、本明細書を読んだ当業者は、実施の形態1にて示された検出部および前処理部の構成を適宜改変して本実施形態に適用することができる。また、捕捉物質の調整方法および測定方法についても、本明細書を読んだ当業者は、実施の形態1の構成を適宜改変して本実施形態に適用することができる。
【0147】
以下実施例および比較例を示し、本発明の実施形態についてさらに詳しく説明する。
【実施例】
【0148】
(実施例1)
実施例1において、図7に示すマイクロチャネル型分析装置(マイクロチャネルチップ)を以下のとおりに作製した。すなわち、PDMS(POLYDIMETHYLSILOXANE、東レダウコーニング社)の基板100上に、マイクロチャネル101およびこのマイクロチャネル101の両端にそれぞれ連結する注入部102および103を形成した。さらに、この基板100上に、マイクロチャネル101’、およびマイクロチャネル101’の一端に連結するサンプル注入部102’を形成した。マイクロチャネル101内に、検出部104を設けた。そして、マイクロチャネル101’の他端を注入部102と検出部104との間に連結させた。
【0149】
この基板100を貫く3つの貫通孔(図示しない。)をそれぞれ注入部102、サンプル注入部102’および排出部3と連絡させた。さらに、マイクロチャネル101’内に堰き止め部(図示しない)を設けた。
【0150】
作用電極、参照電極および対向電極から構成された検出電極(図示しない。)を、フォトリソグラフィ法を用いて検出部104に作製した。具体的には、マイクロチャネル101上にレジストパターンを形成し、チタン次いで金をスパッタリングすることによって金電極(作用電極、対向電極)を作製した。また、チタン次いで銀をスパッタリングし、さらに塩化処理をすることによって銀/塩化銀電極(参照電極)を作製した。
【0151】
マイクロチャネル101に関し、幅は600μmであり、長さは2000μmであり、深さは50μmであった。マイクロチャネル101’に関し、幅は600μmであり、長さは2000μmであり、深さは50μmであった。作用電極は、長さ200μm×幅600μmであった。対向電極は長さ200μm×幅600μmであった。参照電極は長さ50μm×幅50μmであった。
【0152】
次いで、10mMのチオールSAM溶液(11-Mercaptoundecanoic acid(同仁化学社):6-Hydroxy-1-hexanethiol(同仁化学社)=1:9)を用いて検出電極上の金の表面にカルボキシル基を導入した。その後、100mg/mLの1-Ethyl-3-[(3-dimethylamino)propyl]carbodiimide hydrochloride(EDC)と100mg/mLのN-Hydroxysulfosuccinimideとを用いてカルボキシル基を活性化させ、100ng/mLのアディポネクチン抗体(R&Dシステム社)の溶液をこのカルボキシル基と30分間反応させた。これにより、アディポネクチン抗体を検出電極上に固定化した。そして、未反応のアディポネクチン抗体を含む溶液を除去した。アディポネクチン抗体の固定化後に、マイクロチャネル101および101’が形成されたPDMSの基板に、蓋としての役割を果たすPDMSの基板(図示しない。)をマイクロチャネル101および101’が覆われるように張り合わせた。
【0153】
直径15μmのポリスチレン微粒子と10μg/mLのアディポネクチン抗体(R&Dシステム社)とを混合し、37℃にて1時間インキュベートした。これにより、アディポネクチン抗体をポリスチレン微粒子上に固定化した。このポリスチレン微粒子を0.05%のツイーン20を含むPBSで十分に洗浄した。洗浄後の1%w/vポリスチレン微粒子を含む溶液10μLを、サンプル注入部102’からマイクロチャネル101’内に注入した。排出部103に吸引ポンプを連結し、吸引ポンプを用いて、このポリスチレン微粒子を含む溶液をマイクロチャネル101’内を移動させ、ポリスチレン微粒子を堰き止め部において堰き止めた。このようにして、ポリスチレン微粒子から形成された前処理部109を作製した。
【0154】
さらに、非特異的な吸着の防止剤であるプロテインフリー(Thermo社)を用いてマイクロチャネル101および101’内のブロッキングを行った。
【0155】
以上のようにして、アディポネクチンを分析するためのマイクロチャネル型の分析装置を作成した。この条件で作製した分析装置についての、アディポネクチンの検量範囲は0.25〜2μg/mLであることは確認済みである。
【0156】
下記表1に示す様々な濃度の標準アディポネクチン溶液を調製した。調製した標準アディポネクチン溶液を1種類づつ上述の分析装置にアプライして、標準アディポネクチン溶液中のアディポネクチンの検出を実施した。
【0157】
具体的には、以下のとおりに実施した。5μLの標準アディポネクチン溶液をサンプル注入部102’からマイクロチャネル101’を介して101内に注入した。吸引ポンプを用いて検出部104までこの溶液を移動させ、検出部104上で3分間停止させた。これにより、この溶液中のアディポネクチンを検出部104上のアディポネクチン抗体に結合させた。その後、吸引ポンプを用いて標準アディポネクチン溶液をマイクロチャネル101から排出した。
【0158】
次いで、PBSをサンプル注入部102’からマイクロチャネル101および101’内に注入し、マイクロチャネル101および101’内を十分に洗浄した。アルカリフォスファターゼ(ALP)ラベリングキット(同仁化学社)を用いて作製した1μg/mLのALP修飾アディポネクチン抗体を含む溶液を、注入部102からマイクロチャネル101内に注入した。吸引ポンプを用いて、検出部104までALP修飾アディポネクチン抗体を含む溶液を移動させ、検出部104上で3分間停止させた。これにより、この溶液中のALP修飾アディポネクチン抗体を検出部104上に捕捉されたアディポネクチンに結合させた。その後、吸引ポンプを用いて、未反応のALP修飾アディポネクチン抗体を含む溶液をマイクロチャネル101から排出した。グリシンNaOHバッファー(pH9.0)を注入部102から注入し、マイクロチャネル101内を十分に洗浄した。
【0159】
次いで、1mMのパラアミノフェニルリン酸の溶液を注入部102からマイクロチャネル101内に注入し、吸引ポンプを用いて検出部104まで移動させ、検出部104上で3分間停止させた。これにより、パラアミノフェニルリン酸とALPとを反応させて電流を発生させた。発生した電流を検出部104によって検出した。検出された電流の値(ピーク電流値(nA))から検量線(図8に示す。)を作製した。
【0160】
(比較例1)
ポリスチレン微粒子を充填しなかったこと(前処理部を形成しなかったこと)を除いて実施例1にて作成した分析装置と同様の分析装置を作成した。また、実施例1にて使用した標準アディポネクチン溶液の代わりに下記表1に示す様々な濃度の標準アディポネクチン溶液を用いたことを除いて、実施例1と同様の操作を行い、検量線を作製した。
【0161】
【表1】

【0162】
(結果)
実施例1および比較例1で得られた検量線のグラフを図8に示す。図8によれば、前処理部のある実施例1では、アディポネクチンの検量範囲が0.5〜20μg/mLであるのに対して、前処理部のない比較例1では、アディポネクチンの検量範囲が0.25〜1ng/mLである。よって、前処理部を設けることによって、アディポネクチンの検量範囲を高濃度側に設定することができた。
【産業上の利用可能性】
【0163】
本発明の分析装置を用いれば、希釈操作を実施すること無く微量なサンプルを、迅速に複数同時に検出することができる。このため、本発明は、微小な化学物質などの検出に用いる化学マイクロデバイス(例えば、マイクロチャネルチップおよびマイクロリアクター)、およびバイオセンサー(例えば、アレルゲンセンサー)などの、μ−TAS技術を用いたマイクロチャネルチップを利用する分野に適用することができる。
【符号の説明】
【0164】
1 マイクロチャネル
2 注入部
3 排出部
4 検出部
5 捕捉物質
6 前処理部
6’ 前処理部
6’’ 前処理部
7 捕捉物質
6a 柱状構造物
6b 微粒子6b
9 堰止め部
8 バルブ
21 マイクロチャネル
21’ マイクロチャネル
22 注入部
22’ サンプル注入部
23 排出部
24 検出部
25 捕捉物質
26 前処理部
27 捕捉物質
28 バルブ
28’ バルブ
31 マイクロチャネル
31’ マイクロチャネル
32 注入部
33 排出部
34 検出部
34’ 検出部
36 前処理部
36’ 前処理部
37 前処理部
37’ 前処理部
41 マイクロチャネル
41’ マイクロチャネル
42 注入部
43 排出部
43’ 排出部
44 検出部
44’ 検出部
46 前処理部
46’ 前処理部
47 捕捉物質
47’ 捕捉物質
100 基板
101 蓋
【特許請求の範囲】
【請求項1】
注入すべき流体を受容する第1の注入部と流体を排出する第1の排出部とを両端に連結している第1の微小流路を備え、
第1の微小流路に、流体中の物質を検出する第1の検出部が設けられており、
第1の検出部に、検出すべき物質を捕捉する第1の捕捉物質が配置されている分析装置であって、
第1の注入部と第1の検出部との間に、流体中の物質の濃度を低減させる第1の前処理部が設けられており、
第1の前処理部に、低減すべき物質を捕捉する第2の捕捉物質が配置されている
ことを特徴とする分析装置。
【請求項2】
注入すべき第1の流体を受容する第1の注入部と流体を排出する第1の排出部とを両端に連結している第1の微小流路を備え、
第1の微小流路に、第1の流体中の物質を検出する第1の検出部が設けられており、
第1の検出部に、検出すべき物質を捕捉する第1の捕捉物質が配置されている分析装置であって、
注入すべき第2の流体を受容する第2の注入部を一端に連結している第2の微小流路をさらに備え、
第2の微小流路の他端が、第1の注入孔と第1の検出部との間の接続部にて第1の微小流路と接続されており、
第2の微小流路内に、第1の流体中の物質の濃度を低減させる第1の前処理部が設けられており、
第1の前処理部に、低減すべき物質を捕捉する第2の捕捉物質が配置されている
ことを特徴とする分析装置。
【請求項3】
注入すべき流体を受容する第1の注入部と流体を排出する第1の排出部とを両端に連結している第1の微小流路を備え、
第1の微小流路が、第1の注入部と第1の排出部との間にて分岐しかつ再度合流する第2の微小流路を有しており、
第1の微小流路に、流体中の第1の物質を検出する第1の検出部が設けられており、
第2の微小流路に、流体中の第2の物質を検出する第2の検出部が設けられており、
第1の検出部に、検出すべき物質を捕捉する第1の捕捉物質が配置されており、
第2の検出部に、検出すべき物質を捕捉する第3の捕捉物質が配置されている分析装置であって、
第1の微小流路の、第1の注入部と第1の検出部との間に、流体中の第1の物質の濃度を低減させる第1の前処理部が設けられており、
第1の前処理部に、低減すべき物質を捕捉する第2の捕捉物質が配置されている、
ことを特徴とする分析装置。
【請求項4】
前記注入部と第2の検出部との間に、第2の物質の濃度を低減させる第2の前処理部が設けられており、
第2の前処理部に、低減すべき物質を捕捉する第4の捕捉物質が配置されている
ことを特徴とする請求項3に記載の分析装置。
【請求項5】
注入すべき流体を受容する第1の注入部と流体を排出する第1の排出部とを両端に連結している第1の微小流路を備え、
第1の微小流路の分岐部にて分岐して、流体を排出する第2の排出部を一端に連結している第2の微小流路が形成されており、
分岐部と第1の排出部との間の第1の微小流路に、流体中の第1の物質を検出する第1の検出部が設けられており、
分岐部と第2の排出部との間の第2の微小流路に、流体中の第2の物質を検出する第2の検出部が設けられており、
第1の検出部に、検出すべき物質を捕捉する第1の捕捉物質が配置されており、
第2の検出部に、検出すべき物質を捕捉する第3の捕捉物質が配置されている分析装置であって
第1の注入部と第1の検出部との間に、流体中の第1の物質の濃度を低減させる第1の前処理部が設けられており、
第1の前処理部に、低減すべき物質を捕捉する第2の捕捉物質が配置されている
ことを特徴とする分析装置。
【請求項6】
前記第1の注入部と第2の検出部との間に、第2の物質の濃度を低減させる第2の前処理部が設けられており、第2の前処理部には、低減すべき物質を捕捉する第4の捕捉物質が配置されていることを特徴とする請求項5に記載の分析装置。
【請求項7】
各前処理部を通過した後の、検出すべき物質の濃度が、第1の捕捉物質が捕捉し得る範囲内であることを特徴とする請求項1〜6のいずれか一項に記載の分析装置。
【請求項8】
前記低減すべき物質の最大モル量が、分析に供されるサンプルに含まれる対象物質のモル量よりも少ないことを特徴とする請求項1〜7のいずれか一項に記載の分析装置。
【請求項9】
第2の捕捉物質のモル量が、分析に供されるサンプルに含まれる対象物質のモル量と第1の捕捉物質のモル量との差であることを特徴とする請求項1〜8のいずれか一項に記載の分析装置。
【請求項10】
各微小流路の内部にバルブ構造が設けられていることを特徴とする請求項1〜9のいずれか一項に記載の分析装置。
【請求項11】
対応する検出部と前処理部の間に、前記バルブ構造が設けられていることを特徴とする請求項10に記載の分析装置。
【請求項12】
前記前処理部が透過性の材料からなることを特徴とする請求項1〜11のいずれか一項に記載の分析装置。
【請求項13】
前記前処理部にさらなる検出手段が設けられていることを特徴とする請求項1〜12のいずれか一項に記載の分析装置。
【請求項14】
対応する注入部と検出部の間に、対応する前処理部が複数設けられていることを特徴とする請求項1〜13のいずれか一項に記載の分析装置。
【請求項15】
各微小流路の少なくとも1つが、対応する注入部と検出部との間にて分岐しかつ再度合流する構成を有しており、形成されている複数の分岐の各々に、対応する前処理部が設けられていることを特徴とする請求項14に記載の分析装置。
【請求項16】
各前処理部の少なくとも1つが三次元の構造体を備えていることを特徴とする請求項1〜15のいずれか一項に記載の分析装置。
【請求項17】
前記構造体が、前記前処理部の壁面から伸びる柱状の構造体であることを特徴とする請求項16に記載の分析装置。
【請求項18】
前記構造体が多孔質の構造体であることを特徴とする請求項16に記載の分析装置。
【請求項19】
前記構造体が複数の粒子状の構造体であることを特徴とする請求項16に記載の分析装置。
【請求項20】
第1の捕捉物質が前記検出すべき物質に対する抗体であることを特徴とする請求項1〜19のいずれか一項に記載の分析装置。
【請求項21】
第2の捕捉物質が前記低減すべき物質に対する抗体であることを特徴とする請求項1〜20のいずれか一項に記載の分析装置。
【請求項22】
第1の捕捉物質および第2の捕捉物質が同一物質であることを特徴とする請求項1〜21のいずれか一項に記載の分析装置。
【請求項23】
前記検出部が透過性の材料からなることを特徴とする請求項1〜22のいずれか一項に記載の分析装置。
【請求項24】
前記検出部に作用電極および参照電極からなる検出手段が設けられていることを特徴とする請求項1〜23のいずれか一項に記載の分析装置。
【請求項25】
前記検出すべき物質が血液成分であることを特徴とする請求項1〜24のいずれか一項に記載の分析装置。
【請求項26】
前記血液成分が、血漿タンパク、リポタンパク、分泌タンパク、ホルモン、補体または糖であることを特徴とする請求項25に記載の分析装置。
【請求項27】
流体の移動を促進する駆動手段が、第1の注入部および第1の排出部の少なくとも一方に連結されていることを特徴とする請求項1に記載の分析装置。
【請求項28】
流体の移動を促進する駆動手段が、第1および第2の注入部の両方に、または第1の排出部に連結されていることを特徴とする請求項2に記載の分析装置。
【請求項29】
流体の移動を促進する駆動手段が、第1の注入部および第1の排出部の少なくとも一方に連結されていることを特徴とする請求項3または4に記載の分析装置。
【請求項30】
流体の移動を促進する駆動手段が、第1の貫通孔に、または第2および第3の貫通孔の両方に連結されていることを特徴とする請求項5または6に記載の分析装置。
【請求項31】
第1の微小流路が、表面上にマイクロチャネルが形成されている第1の基板と、該マイクロチャネルを覆う第2の基板とによって形成されており、
第1および第2の基板の少なくとも1つを貫く第1および第2の貫通孔が設けられており、第1および第2の貫通孔がそれぞれ第1の注入部および第1の排出部と連絡している
ことを特徴とする請求項1に記載の分析装置。
【請求項32】
第1および第2の微小流路が、表面上にマイクロチャネルが形成されている第1の基板と、該マイクロチャネルを覆う第2の基板とによって形成されており、
第1および第2の基板の少なくとも1つを貫く第1、第2および第3の貫通孔が設けられており、第1、第2および第3の貫通孔がそれぞれ第1および第2の注入部および第1の排出部と連絡している
ことを特徴とする請求項2に記載の分析装置。
【請求項33】
第1および第2の微小流路が、表面上にマイクロチャネルが形成されている第1の基板と、該マイクロチャネルを覆う第2の基板とによって形成されており、
第1および第2の基板の少なくとも1つを貫く第1および第2の貫通孔が設けられており、第1および第2の貫通孔がそれぞれ第1の注入部および第1の排出部と連絡している
ことを特徴とする請求項3または4に記載の分析装置。
【請求項34】
第1および第2の微小流路は、表面上にマイクロチャネルが形成されている第1の基板と、該マイクロチャネルを覆う第2の基板とによって形成されており、
第1および第2の基板の少なくとも1つを貫く第1、第2および第3の貫通孔が設けられており、第1の貫通孔が第1の注入部と連絡し、第2および第3の貫通孔がそれぞれ第1および第2の排出部と連絡している
ことを特徴とする請求項5または6に記載の分析装置。
【請求項35】
流体の移動を促進する駆動手段が、第1および第2の貫通孔の少なくとも一方に連結されていることを特徴とする請求項31に記載の分析装置。
【請求項36】
流体の移動を促進する駆動手段が、第1および第2の貫通孔の両方に、または第3の貫通孔に連結されていることを特徴とする請求項32に記載の分析装置。
【請求項37】
流体の移動を促進する駆動手段が、第1および第2の貫通孔の少なくとも一方に連結されていることを特徴とする請求項33に記載の分析装置。
【請求項38】
流体の移動を促進する駆動手段が、第1の貫通孔に、または第2および第3の貫通孔の両方に連結されていることを特徴とする請求項34に記載の分析装置。
【請求項39】
請求項1〜38のいずれか一項に記載の分析装置を用いて、サンプルを希釈することなくサンプル中の対象物質を定量的に測定することを特徴とする分析方法。
【請求項40】
前記対象物質が血液成分である、請求項39に記載の分析方法。
【請求項41】
各前処理部において対象物質が捕捉されているか否か測定する、請求項39または40に記載の分析方法。
【請求項42】
前記前処理部において対象物質が捕捉されていない場合に分析エラーと判定する、請求項41に記載の分析方法。
【請求項1】
注入すべき流体を受容する第1の注入部と流体を排出する第1の排出部とを両端に連結している第1の微小流路を備え、
第1の微小流路に、流体中の物質を検出する第1の検出部が設けられており、
第1の検出部に、検出すべき物質を捕捉する第1の捕捉物質が配置されている分析装置であって、
第1の注入部と第1の検出部との間に、流体中の物質の濃度を低減させる第1の前処理部が設けられており、
第1の前処理部に、低減すべき物質を捕捉する第2の捕捉物質が配置されている
ことを特徴とする分析装置。
【請求項2】
注入すべき第1の流体を受容する第1の注入部と流体を排出する第1の排出部とを両端に連結している第1の微小流路を備え、
第1の微小流路に、第1の流体中の物質を検出する第1の検出部が設けられており、
第1の検出部に、検出すべき物質を捕捉する第1の捕捉物質が配置されている分析装置であって、
注入すべき第2の流体を受容する第2の注入部を一端に連結している第2の微小流路をさらに備え、
第2の微小流路の他端が、第1の注入孔と第1の検出部との間の接続部にて第1の微小流路と接続されており、
第2の微小流路内に、第1の流体中の物質の濃度を低減させる第1の前処理部が設けられており、
第1の前処理部に、低減すべき物質を捕捉する第2の捕捉物質が配置されている
ことを特徴とする分析装置。
【請求項3】
注入すべき流体を受容する第1の注入部と流体を排出する第1の排出部とを両端に連結している第1の微小流路を備え、
第1の微小流路が、第1の注入部と第1の排出部との間にて分岐しかつ再度合流する第2の微小流路を有しており、
第1の微小流路に、流体中の第1の物質を検出する第1の検出部が設けられており、
第2の微小流路に、流体中の第2の物質を検出する第2の検出部が設けられており、
第1の検出部に、検出すべき物質を捕捉する第1の捕捉物質が配置されており、
第2の検出部に、検出すべき物質を捕捉する第3の捕捉物質が配置されている分析装置であって、
第1の微小流路の、第1の注入部と第1の検出部との間に、流体中の第1の物質の濃度を低減させる第1の前処理部が設けられており、
第1の前処理部に、低減すべき物質を捕捉する第2の捕捉物質が配置されている、
ことを特徴とする分析装置。
【請求項4】
前記注入部と第2の検出部との間に、第2の物質の濃度を低減させる第2の前処理部が設けられており、
第2の前処理部に、低減すべき物質を捕捉する第4の捕捉物質が配置されている
ことを特徴とする請求項3に記載の分析装置。
【請求項5】
注入すべき流体を受容する第1の注入部と流体を排出する第1の排出部とを両端に連結している第1の微小流路を備え、
第1の微小流路の分岐部にて分岐して、流体を排出する第2の排出部を一端に連結している第2の微小流路が形成されており、
分岐部と第1の排出部との間の第1の微小流路に、流体中の第1の物質を検出する第1の検出部が設けられており、
分岐部と第2の排出部との間の第2の微小流路に、流体中の第2の物質を検出する第2の検出部が設けられており、
第1の検出部に、検出すべき物質を捕捉する第1の捕捉物質が配置されており、
第2の検出部に、検出すべき物質を捕捉する第3の捕捉物質が配置されている分析装置であって
第1の注入部と第1の検出部との間に、流体中の第1の物質の濃度を低減させる第1の前処理部が設けられており、
第1の前処理部に、低減すべき物質を捕捉する第2の捕捉物質が配置されている
ことを特徴とする分析装置。
【請求項6】
前記第1の注入部と第2の検出部との間に、第2の物質の濃度を低減させる第2の前処理部が設けられており、第2の前処理部には、低減すべき物質を捕捉する第4の捕捉物質が配置されていることを特徴とする請求項5に記載の分析装置。
【請求項7】
各前処理部を通過した後の、検出すべき物質の濃度が、第1の捕捉物質が捕捉し得る範囲内であることを特徴とする請求項1〜6のいずれか一項に記載の分析装置。
【請求項8】
前記低減すべき物質の最大モル量が、分析に供されるサンプルに含まれる対象物質のモル量よりも少ないことを特徴とする請求項1〜7のいずれか一項に記載の分析装置。
【請求項9】
第2の捕捉物質のモル量が、分析に供されるサンプルに含まれる対象物質のモル量と第1の捕捉物質のモル量との差であることを特徴とする請求項1〜8のいずれか一項に記載の分析装置。
【請求項10】
各微小流路の内部にバルブ構造が設けられていることを特徴とする請求項1〜9のいずれか一項に記載の分析装置。
【請求項11】
対応する検出部と前処理部の間に、前記バルブ構造が設けられていることを特徴とする請求項10に記載の分析装置。
【請求項12】
前記前処理部が透過性の材料からなることを特徴とする請求項1〜11のいずれか一項に記載の分析装置。
【請求項13】
前記前処理部にさらなる検出手段が設けられていることを特徴とする請求項1〜12のいずれか一項に記載の分析装置。
【請求項14】
対応する注入部と検出部の間に、対応する前処理部が複数設けられていることを特徴とする請求項1〜13のいずれか一項に記載の分析装置。
【請求項15】
各微小流路の少なくとも1つが、対応する注入部と検出部との間にて分岐しかつ再度合流する構成を有しており、形成されている複数の分岐の各々に、対応する前処理部が設けられていることを特徴とする請求項14に記載の分析装置。
【請求項16】
各前処理部の少なくとも1つが三次元の構造体を備えていることを特徴とする請求項1〜15のいずれか一項に記載の分析装置。
【請求項17】
前記構造体が、前記前処理部の壁面から伸びる柱状の構造体であることを特徴とする請求項16に記載の分析装置。
【請求項18】
前記構造体が多孔質の構造体であることを特徴とする請求項16に記載の分析装置。
【請求項19】
前記構造体が複数の粒子状の構造体であることを特徴とする請求項16に記載の分析装置。
【請求項20】
第1の捕捉物質が前記検出すべき物質に対する抗体であることを特徴とする請求項1〜19のいずれか一項に記載の分析装置。
【請求項21】
第2の捕捉物質が前記低減すべき物質に対する抗体であることを特徴とする請求項1〜20のいずれか一項に記載の分析装置。
【請求項22】
第1の捕捉物質および第2の捕捉物質が同一物質であることを特徴とする請求項1〜21のいずれか一項に記載の分析装置。
【請求項23】
前記検出部が透過性の材料からなることを特徴とする請求項1〜22のいずれか一項に記載の分析装置。
【請求項24】
前記検出部に作用電極および参照電極からなる検出手段が設けられていることを特徴とする請求項1〜23のいずれか一項に記載の分析装置。
【請求項25】
前記検出すべき物質が血液成分であることを特徴とする請求項1〜24のいずれか一項に記載の分析装置。
【請求項26】
前記血液成分が、血漿タンパク、リポタンパク、分泌タンパク、ホルモン、補体または糖であることを特徴とする請求項25に記載の分析装置。
【請求項27】
流体の移動を促進する駆動手段が、第1の注入部および第1の排出部の少なくとも一方に連結されていることを特徴とする請求項1に記載の分析装置。
【請求項28】
流体の移動を促進する駆動手段が、第1および第2の注入部の両方に、または第1の排出部に連結されていることを特徴とする請求項2に記載の分析装置。
【請求項29】
流体の移動を促進する駆動手段が、第1の注入部および第1の排出部の少なくとも一方に連結されていることを特徴とする請求項3または4に記載の分析装置。
【請求項30】
流体の移動を促進する駆動手段が、第1の貫通孔に、または第2および第3の貫通孔の両方に連結されていることを特徴とする請求項5または6に記載の分析装置。
【請求項31】
第1の微小流路が、表面上にマイクロチャネルが形成されている第1の基板と、該マイクロチャネルを覆う第2の基板とによって形成されており、
第1および第2の基板の少なくとも1つを貫く第1および第2の貫通孔が設けられており、第1および第2の貫通孔がそれぞれ第1の注入部および第1の排出部と連絡している
ことを特徴とする請求項1に記載の分析装置。
【請求項32】
第1および第2の微小流路が、表面上にマイクロチャネルが形成されている第1の基板と、該マイクロチャネルを覆う第2の基板とによって形成されており、
第1および第2の基板の少なくとも1つを貫く第1、第2および第3の貫通孔が設けられており、第1、第2および第3の貫通孔がそれぞれ第1および第2の注入部および第1の排出部と連絡している
ことを特徴とする請求項2に記載の分析装置。
【請求項33】
第1および第2の微小流路が、表面上にマイクロチャネルが形成されている第1の基板と、該マイクロチャネルを覆う第2の基板とによって形成されており、
第1および第2の基板の少なくとも1つを貫く第1および第2の貫通孔が設けられており、第1および第2の貫通孔がそれぞれ第1の注入部および第1の排出部と連絡している
ことを特徴とする請求項3または4に記載の分析装置。
【請求項34】
第1および第2の微小流路は、表面上にマイクロチャネルが形成されている第1の基板と、該マイクロチャネルを覆う第2の基板とによって形成されており、
第1および第2の基板の少なくとも1つを貫く第1、第2および第3の貫通孔が設けられており、第1の貫通孔が第1の注入部と連絡し、第2および第3の貫通孔がそれぞれ第1および第2の排出部と連絡している
ことを特徴とする請求項5または6に記載の分析装置。
【請求項35】
流体の移動を促進する駆動手段が、第1および第2の貫通孔の少なくとも一方に連結されていることを特徴とする請求項31に記載の分析装置。
【請求項36】
流体の移動を促進する駆動手段が、第1および第2の貫通孔の両方に、または第3の貫通孔に連結されていることを特徴とする請求項32に記載の分析装置。
【請求項37】
流体の移動を促進する駆動手段が、第1および第2の貫通孔の少なくとも一方に連結されていることを特徴とする請求項33に記載の分析装置。
【請求項38】
流体の移動を促進する駆動手段が、第1の貫通孔に、または第2および第3の貫通孔の両方に連結されていることを特徴とする請求項34に記載の分析装置。
【請求項39】
請求項1〜38のいずれか一項に記載の分析装置を用いて、サンプルを希釈することなくサンプル中の対象物質を定量的に測定することを特徴とする分析方法。
【請求項40】
前記対象物質が血液成分である、請求項39に記載の分析方法。
【請求項41】
各前処理部において対象物質が捕捉されているか否か測定する、請求項39または40に記載の分析方法。
【請求項42】
前記前処理部において対象物質が捕捉されていない場合に分析エラーと判定する、請求項41に記載の分析方法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【公開番号】特開2011−220768(P2011−220768A)
【公開日】平成23年11月4日(2011.11.4)
【国際特許分類】
【出願番号】特願2010−88733(P2010−88733)
【出願日】平成22年4月7日(2010.4.7)
【出願人】(000005049)シャープ株式会社 (33,933)
【Fターム(参考)】
【公開日】平成23年11月4日(2011.11.4)
【国際特許分類】
【出願日】平成22年4月7日(2010.4.7)
【出願人】(000005049)シャープ株式会社 (33,933)
【Fターム(参考)】
[ Back to top ]

