分析装置および分析方法
【課題】試料中の薬物を測定する際に、様々な種類や治療域の薬物を含む試料に対して試料ごとに最適な条件で前処理を行う分析装置および分析方法を提供する。
【解決手段】測定試料に含まれる薬物を測定する分析装置100であって、固相抽出カートリッジ104内に固相抽出材を注入する抽出材液分注機構106と、固相抽出材が注入された固相抽出カートリッジ104内に測定試料を注入して固体抽出処理により抽出試料液を生成する前処理手段と、抽出試料液中の薬物を測定する測定手段と、を備える。
【解決手段】測定試料に含まれる薬物を測定する分析装置100であって、固相抽出カートリッジ104内に固相抽出材を注入する抽出材液分注機構106と、固相抽出材が注入された固相抽出カートリッジ104内に測定試料を注入して固体抽出処理により抽出試料液を生成する前処理手段と、抽出試料液中の薬物を測定する測定手段と、を備える。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、分析装置および分析方法に関する。
【背景技術】
【0002】
従来、血液や尿、細胞抽出液などの生体試料をはじめとした複雑な組成を有する液体試料中に微量に存在する化学物質の測定が行われている。このような測定の方法として、液体クロマトグラフィ(Liquid Chromatography,LC)やキャピラリ電気泳動(Capillary Electrophoresis,CE)などの高い分離性能を有する分離手段と、質量分析法(Mass Spectrometry,MS)や紫外可視吸光光度法(Ultraviolet-Visible Spectrophotometry,UV)などの検出器を組み合わせた分析法が、多くの分野で用いられている。
【0003】
質量分析(MS)は、測定対象成分をイオン化し、生成したイオンの質量に基づいて測定する分析法であり、質量分析を複数回実施するMS/MSと呼ばれる分析法は、測定対象成分イオンをフラグメント化することにより、試料溶液中の微量成分を高感度かつ高選択性をもって検出できる。液体クロマトグラフィ(LC)と質量分析(MS)をオンラインで接続したLC−MS(またはLC−MS/MS)は、液体試料中の微量物質分析に汎用されている。
【0004】
また、試料の精製度を高める手段として、固相抽出(Solid Phase Extraction,SPE)や液液抽出(Liquid-Liquid Extraction,LLE)などの前処理を、LC−MS(またはLC−MS/MS)分析の前に実施することが行われている。特に、血液のように高粘度かつ高濃度の主要成分を含む試料について、前処理を行わずに直接LC−MSに注入すると、装置の汚染による測定精度低下を引き起こすのみならず、流路詰まりによって測定が行えなくなってしまう可能性がある。このため、高粘度かつ高濃度の主要成分を含む試料の前処理は必須となる。
【0005】
固相抽出(SPE)とは、固相抽出材と呼ばれる粒子径数μmから数十μmの微粒子に表面に、測定対象である化学物質を相互作用により捕捉させることで、試料溶液中に存在する他の物質と分離精製する方法である。また、液液抽出(LLE)とは、水とヘキサンのように互いに混ざり合わない2種の溶媒に、試料溶液を分注および攪拌して、2種の溶媒に対する分配係数の違いによって測定対象の物質と他の物質を分離する方法である。
特に、固相抽出(SPE)は、LC−MS(またはLC−MS/MS)とのオンライン接続が容易なため、固相抽出(SPE)による前処理とLC−MS(またはLC−MS/MS)による測定の自動化を行うことができる。また、固相抽出(SPE)は、96穴マイクロプレートなどを用いた多試料の同時処理による前処理時間の短縮が可能となる、などの特徴を有する。
【0006】
固相抽出(SPE)とLC−MSを用いた生体試料分析として、例えば特許文献1では、血清や尿などの生体試料を96穴の固相抽出プレートを用いてオフラインで処理し、直接MSに試料注入あるいはLC−MSで測定することにより、アミノ酸、カルニチン類、糖および免疫抑制剤などの定量を行っている。固相抽出(SPE)において、オフライン処理で用いられる固相抽出カートリッジとしては、例えば特許文献1や特許文献2に記載されている96穴プレートや、特許文献3に記載されているようなシリンジ容器などがある。また、固相抽出(SPE)において、オンライン接続して使用される固相抽出カートリッジとしては、特許文献4に記載されているように、高圧に耐えうるように液体クロマトグラフィ(LC)のプレカラムと同様の形状をしたものがある。
【0007】
特許文献1から特許文献4に挙げられたいずれのカートリッジにおいても、固相抽出材はフィルタを介してカートリッジ内に封入された状態で供給される。また、カートリッジに封入されずに測定時に固相抽出カートリッジを形成する手段として、特許文献5では内部にフィルタを備えたピペット先端に固相抽出材を充填して使用する方法を提供している。
【先行技術文献】
【特許文献】
【0008】
【特許文献1】米国特許出願公開第2007/0004044号明細書
【特許文献2】米国特許第6723236号明細書
【特許文献3】特開2002−316002号公報
【特許文献4】欧州特許第1159597号明細書
【特許文献5】米国特許第6770246号明細書
【発明の概要】
【発明が解決しようとする課題】
【0009】
血液中の薬物濃度を測定する自動分析装置において、測定対象となる薬物の種類は、試料すなわち患者ごとに異なる。また、試料中に存在すると想定される測定対象薬物濃度は、薬物の種類ごとに大きく異なる。これは、治療効果が現れる血中薬物濃度(治療域)が薬物ごとに異なるためである。一例として、抗てんかん剤として使用されるバルプロ酸ナトリウムの場合、治療域は50〜100μg/mLであり、免疫抑制剤として使用されるタクロリムスの治療域は2〜20ng/mLと、1000倍以上の濃度差がある。
【0010】
すなわち、自動分析装置では、様々な種類の薬物を、各薬物ごとに想定される広範囲な濃度域において測定することが求められる。そのためには、試料ごとに最適な前処理を施すことが要求される。具体的には、試料液量、抽出液の種類および量、固相抽出材の種類および量を、測定対象ごとにそれぞれ最適化することが望まれる。また、実際に病院などの臨床検査に自動分析装置を使用する場合、緊急性の高い患者試料が装置に供給されると、その試料を優先して測定することが要求される。
【0011】
これらの要求に対して、特許文献1および特許文献2に記載された96穴プレートを用いた前処理装置では、多量の試料を一括処理可能である一方、多連シリンジを備えた分注ヘッドが1つしか配置されておらず、異なる種類あるいは異なる液量の溶出液を用いる多項目の抽出処理を行うことができないという問題点がある。また、臨床検査においては96穴プレートに十分な量の試料を処理動作ごとに確保するのは困難であるという問題点がある。さらに、プレートを用いた前処理装置の場合、一度処理を開始した後、次の処理依頼サンプルは、実行中の処理が終了するまで開始できず、臨機応変な処理をすることが困難であるという問題点がある。
【0012】
特許文献3に記載されたシリンジ型固相抽出カラムや、特許文献4に記載されたカートリッジ型カラムでは、固相抽出材の量を変更する場合、変更したい数だけカラムを装置にあらかじめ準備する必要がある。このため、装置の消耗品コストが上昇するだけでなく、複数種類のカラムを試料ごとに選択する機構も必要となり、装置が複雑かつ大型化するという問題点がある。
【0013】
特許文献5に記載の方法では、ピペット先端に固相抽出材スラリを充填することで、試料ごとに固相抽出材の量を変更可能であるが、ピペット先端から固相抽出材の落下を防止するために、スラリ溶媒にグリセロールなど粘性のある液体を使用する必要がある。このグリセロールが抽出材表面に吸着することによって、薬物の固相抽出効率に影響を与えてしまうという問題点がある。特に、測定対象となる薬物は、その用途により様々な物理化学的性質をもつ化学物質であり、その全ての薬物に対して影響を与えない高粘性液体を準備することは技術的に困難である。また、検出器に質量分析装置を用いた場合、グリセロールのような粘性のある液体をイオン源に導入すると、イオン化効率の低下による信号強度の低下や信号のばらつきを引き起こすという問題点がある。
【0014】
そこで、本発明は、試料中の薬物を測定する際に、様々な種類や治療域の薬物を含む試料に対して試料ごとに最適な条件で前処理を行う分析装置および分析方法を提供することを課題とする。
【課題を解決するための手段】
【0015】
このような課題を解決するために、本発明は、測定試料に含まれる薬物を測定する分析装置であって、固相抽出用容器内に固相抽出材を注入する固相抽出材分注手段と、前記固相抽出材が注入された前記固相抽出用容器内に前記測定試料を注入して固体抽出処理により抽出試料液を生成する前処理手段と、前記抽出試料液中の前記薬物を測定する測定手段と、を備えることを特徴とする分析装置である。
【発明の効果】
【0016】
本発明によれば、試料中の薬物を測定する際に、様々な種類や治療域の薬物を含む試料に対して試料ごとに最適な条件で前処理を行い、質量分析装置において精度よく測定を行うことができる分析装置および分析方法を提供することができる。
【図面の簡単な説明】
【0017】
【図1】第1実施形態に係る自動分析装置の構成図である。
【図2】第1実施形態に係る自動分析装置による固相抽出前処理の工程を示すチャートである。
【図3】試料容器に対する試料情報の付加方法の一例を示す説明図である。
【図4】固相抽出カートリッジの構造を示す断面図である。
【図5】第2実施形態に係る自動分析装置の構成図である。
【図6】第2実施形態に係る自動分析装置による固相抽出前処理の工程を示すチャートである。
【発明を実施するための形態】
【0018】
以下、本発明を実施するための形態(以下「実施形態」という)について、適宜図面を参照しながら詳細に説明する。なお、各図において、共通する部分には同一の符号を付し重複した説明を省略する。
【0019】
≪第1実施形態≫
<自動分析装置100の構成>
図1は、第1実施形態に係る自動分析装置100の構成図である。
自動分析装置100は、測定試料に含まれる薬物の濃度を自動で連続的に測定することができる分析装置であり、第1実施形態では血清試料(測定試料)中に含まれる喘息薬テオフィリン(薬物)の濃度を分析するものとして説明する。
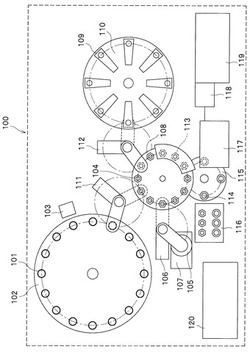
自動分析装置100は、試料容器101と、試料設置部102と、試料情報読み取り部103と、固相抽出カートリッジ(固相抽出容器)104と、抽出材液容器105と、抽出材液分注機構106と、攪拌機構107と、処理部108と、試薬容器109と、試薬配置部110と、試料分注機構111と、試薬分注機構112と、加圧機構113と、抽出容器114と、抽出容器設置部115と、消耗品設置部116と、試料導入部117と、イオン源118と、質量分析部119と、制御部120と、によって構成される。
【0020】
試料容器101は、測定対象となる血清試料(測定試料)が格納されている。試料設置部102は、試料容器101が配置され、試料設置部102が回転することにより試料容器101の位置を移動(回転移動)させることができるようになっている。試料情報読み取り部103は、試料容器101に記載された試料情報を読み取ることができるようになっている。固相抽出カートリッジ104は、固相抽出処理の際に試料が分注される。抽出材液容器105は、抽出材液が格納されている。抽出材液分注機構106は、抽出材液容器105に格納された抽出材液スラリを固相抽出カートリッジ104に分注することができるようになっている。攪拌機構107は、抽出材液容器105内の抽出材液を攪拌することによって抽出材液スラリを形成することができるようになっている。処理部108は、固相抽出カートリッジ104を用いて順次固相抽出処理を行うことができるようになっている。試薬容器109は、各種試薬が格納されている。試薬配置部110は、抽出処理に使用する洗浄液や溶出液等の試薬容器109が配置され、試薬配置部110が回転することにより試薬容器109の位置を移動(回転移動)させることができるようになっている。試料分注機構111は、試料容器101に格納された血清試料(測定試料)を固相抽出カートリッジ104に分注することができるようになっている。試薬分注機構112は、試薬容器109に格納された試薬を固相抽出カートリッジ104に分注することができるようになっている。
【0021】
加圧機構113は、加圧によって固相抽出カートリッジ104内の液を下方に通過させることができるようになっている。抽出容器114は、固相抽出カートリッジ104から排出される前処理済みの試料を回収することができるようになっている。抽出容器設置部115は、抽出容器114が配置され、抽出容器設置部115が回転することにより抽出容器114の位置を移動(回転移動)させることができるようになっている。消耗品設置部116は、固相抽出カートリッジ104および抽出容器114などの消耗品が設置されている。試料導入部117は、抽出試料の分注とイオン源118への送液を行うことができるようになっている。イオン源118は、エレクトロスプレイオン源(Electrospray Ionization,ESI)であり、前処理が終了した試料をイオン化することができるようになっている。質量分析部119は、イオン源118でイオン化された試料の成分を質量分析することができるようになっている。
制御部120は、後述する試料情報や測定条件情報が格納されるとともに、これらの情報を用いて自動分析装置100の動作を制御することができるようになっている。また、制御部120は、質量分析部119で測定された結果の収集と解析を行うことができるようになっている。
【0022】
自動分析装置100の構成のうち、イオン源118、質量分析部119および制御部120の一部機能が、前処理された測定試料中の薬物の濃度を測定する測定手段であり、残りの構成部(制御部120の一部機能を含む)が、測定試料に対して固相抽出処理を含む前処理を行う前処理手段となる。
【0023】
<自動分析装置100による濃度測定>
次に、自動分析装置100による血清試料中のテオフィリン濃度測定手順について、図1を参照しつつ図2を用いて説明する。図2は、第1実施形態に係る自動分析装置100による固相抽出前処理の工程を示すチャートである。
図2の処理に先立って、血清試料(測定試料)を試料容器101に分注して格納し、試料設置部102にセットする。このとき、例えば、検体ID、試料の液性、測定対象薬物などの試料に関する情報(試料情報)を記録したバーコード121があらかじめ作成されており、図3のように試料容器101の側面にバーコード121が貼付されている。
【0024】
図2の説明に戻り、自動分析装置100は、以下のような工程で血清試料中のテオフィリン濃度を測定する。
(工程1:試料情報読み込み)
自動分析装置100は、試料容器101が設置された試料設置部102を回転させ、試料容器101を試料情報読み取り部103の前を通過させる。試料情報読み取り部103は、試料容器101のバーコード121から試料情報を読み取り、読み取った情報を制御部120に送る。
【0025】
(工程2:前処理条件呼び出し)
制御部120には、試料種類および薬物ごとに、試料量、抽出材の種類および量、固相抽出条件(洗浄液、溶出液の種類および量、加圧条件など)などの前処理条件と、質量分析(MS)測定条件とがあらかじめデータベースDBとして記憶されている。ある薬物に対して、濃度分析を行う際に用いられる試料種類が複数ある場合は、その薬物に対してそれぞれの試料種類別にデータベースが作成されている。制御部120は、試料情報読み取り部103から送られてきた試料情報から、テオフィリン測定に使用する前処理条件と質量分析(MS)測定条件を装置制御パラメータとして呼び出し、装置各部に送信する。
【0026】
テオフィリンの場合、治療域は10〜20μg/mLであり、自動分析装置100は治療域を含む1〜50μg/mL程度の濃度範囲で定量する必要がある。この濃度範囲は、テオフィリンに対する質量分析(MS)の検出感度から考えるとかなり高い濃度範囲であるため、使用する検体量は少量でよく、例えば20μL程度で十分である。同様に、想定濃度範囲のテオフィリン測定に最適化された固相抽出材の量や洗浄液、溶出液などに関するパラメータが呼び出されて装置各部に送信される。
【0027】
(工程3:抽出材液スラリ注入)
抽出材液分注機構106は、制御部120から送信された装置制御パラメータに基づいて、設定された一定量の抽出材液スラリを抽出材液容器105から分注し、固相抽出カートリッジ104に注入する。抽出材液は、固相抽出材を含んだ水あるいはメタノールなどの有機溶媒である。固相抽出材としては、例えば逆相固相抽出材である日立ハイテクノロジーズ社製「NOBIAS RP−SG1」が使用できる。この場合、溶媒としては50%メタノール水溶液が適する。また抽出材液スラリの比率は、固相抽出材20mgに対して50%メタノール水溶液1mLが適する。
【0028】
抽出材液スラリは、攪拌機構107によって分注前に十分攪拌され、固相抽出材の均一なスラリを形成する。攪拌機構107としては、マグネティックスターラが簡便である。マグネティックスターラは、棒磁石をテフロン(登録商標)樹脂などで被った攪拌子を攪拌対象物質(この場合は抽出材液スラリ)中に投入しておき、抽出材液容器105の下部に設置された攪拌機構107の内部にある磁石をモータで回転させるものである。マグネティックスターラで攪拌することで、均一なスラリを形成することができる。抽出材液スラリが注入された固相抽出カートリッジ104は、加圧機構113によって上方から加圧されて溶媒が下方に通過する。
【0029】
図4は、固相抽出カートリッジ104の構造を示す断面図である。固相抽出カートリッジ104の内部下方にはフィルタ122が設置されている。本実施形態においては、フィルタ122の孔径は10μmとした。このような構造によれば、加圧機構113によって加圧された溶媒は固相抽出カートリッジ104を通過する一方、固相抽出材はフィルタ122の上部に残留する。
【0030】
(工程4:平衡化)
固相抽出材の平衡化のため、溶媒の通過後の固相抽出カートリッジ104に対して、試薬配置部110に配置された純水を試薬分注機構112によって分注する。注入された純水は加圧機構113によって加圧されて固相抽出カートリッジ104の下方に通過する。ここまでの工程で試料処理の準備が終了する。
【0031】
(工程5:試料注入)
試薬分注機構112は、試薬配置部110からテオフィリンの内標準物質(テオフィリン−d6)溶液を分注し、固相抽出材が注入され試料処理準備が終了した固相抽出カートリッジ104に注入する。続いて、試料分注機構111は、試料容器101から血清試料(測定試料)を分注し、内標準物質が注入された固相抽出カートリッジ104に注入する。固相抽出カートリッジ104に注入された血清試料および内標準物質液は、加圧機構113によって上方より加圧されて固相抽出材を通過し、下方に排出される。この工程によって、血清試料中に含まれるテオフィリン(薬物)と内標準物質は、疎水性相互作用により固相抽出材表面に選択的に吸着する。
【0032】
(工程6:洗浄)
試薬分注機構112は、試薬容器109に格納された洗浄液としての純水200μLを分注する。そして、加圧機構113によって加圧処理を行うことで固相抽出カートリッジ104を洗浄する。この工程によって、固相抽出材表面に非特異的に残存した血清試料中の成分を排出する。
【0033】
(工程7:溶出)
洗浄後、試薬分注機構112は、溶出液として50%メタノール水溶液100μLを固相抽出カートリッジ104に分注する。そして、加圧機構113によって加圧処理を行うことで固相抽出カートリッジ104からテオフィリン(薬物)およびテオフィリン−d6(内標準物質)を溶出させた抽出試料液を抽出容器114で回収する。
【0034】
自動分析装置100は、抽出試料液を回収した抽出容器114を、抽出容器設置部115の回転によって試料導入部117の位置に移動する。抽出試料液は、試料導入部117によってイオン源118に導入される。イオン源118でテオフィリン(薬物)およびテオフィリン−d6(内標準物質)がイオン化され、質量分析部119で両成分が検出される。検出された両成分の信号強度は、制御部120に転送される。制御部120は、転送された両成分の信号強度比と、あらかじめ求めておいたキャリブレータの信号強度比から、血清試料中のテオフィリン濃度を計算する。
以上のような工程で自動分析装置100は、血清試料中のテオフィリン濃度を測定する。
【0035】
<まとめ>
以上説明したように、自動分析装置100は、様々な種類の薬物の定量測定を行うにあたって、それぞれの薬物や測定対象試料の種類に対応する前処理条件をデータベース化しておき、当該データベースの値に従って固相抽出処理を含む前処理を行う。これにより、常に最適な固相抽出材、試料、各種試薬の使用量を選択することができ、無駄な試薬消費を抑え、分析処理にかかるランニングコストを低減することができる。
【0036】
また、従来技術の分析装置によれば、固相抽出材の種類別および使用量別に、異なる複数の固相抽出カートリッジを備えなければならなかった。一方、自動分析装置100では、固相抽出材が封入された固相抽出カートリッジをあらかじめ備える必要がないので、装置構成を簡素化することができ、装置自体の製造コストを低減することができる。
【0037】
≪第2実施形態≫
<自動分析装置500の構成>
図5は、第2実施形態に係る自動分析装置500の構成図である。
第2実施形態に係る自動分析装置500は、第1実施形態に係る自動分析装置100と比較して、固相抽出カートリッジ104に対して容器内を攪拌する攪拌機構123を設けた点が異なっている。
攪拌機構123は、例えば超音波攪拌機を使用することができる。攪拌機構123を設けることによって、固相抽出カートリッジ104内の試料と固相抽出材などの試薬との接触率を向上させることができ、例えば、測定試料内の測定対象物質(薬物)の濃度が低い場合でも精度よく測定を行うことができる。
【0038】
自動分析装置500は、測定試料に含まれる薬物の濃度を自動で連続的に測定することができる分析装置であり、第2実施形態では全血試料中に含まれる免疫抑制剤タクロリムス(薬物)の濃度を分析するものとして説明する。
全血試料中のタクロリムスは血球成分中に存在するため、そのままの状態では固相抽出処理を行うことができない。第2実施形態では、全血試料に対して3倍量の0.5M硫酸亜鉛水溶液および4倍量の10ng/mL濃度のアスコマシンを含むメタノール溶液(全血試料50μLに対して0.5M硫酸亜鉛水溶液150μLならびにメタノール溶液200μL)を添加することによって、血球破壊と沈殿の形成を行い、遠心分離後の上清を全血処理液試料(測定試料)として用いる。ここで、アスコマイシンは、タクロリムスの内標準物質として質量分析(MS)測定時に使用される。
【0039】
また、第2実施形態では、前処理においてバッチ式で固相抽出処理を行う。ここでいうバッチ式とは、固相抽出材をカートリッジの一部分に固定することなく、測定試料液内を自由に移動させることで測定試料中の薬物と固相抽出させる方式のことである。
【0040】
<自動分析装置500による濃度測定>
次に、自動分析装置500による全血試料中のタクロリムス濃度測定手順について、図5を参照しつつ図6を用いて説明する。図6は、第2実施形態に係る自動分析装置500による固相抽出前処理の工程を示すチャートである。
図6の処理に先立って、全血処理液試料(測定試料)を試料容器101に分注して格納し、試料設置部102にセットするとともに、試料情報を記録したバーコード121(図3参照)を試料容器101の側面に貼付しておく。
【0041】
(工程1:試料情報読み込み)
第1実施形態の(工程1:試料情報読み込み)(図2参照)と同様に行う。
【0042】
(工程2:前処理条件呼び出し)
制御部120は、試料情報読み取り部103から送られてきた試料情報から、タクロリムス測定に使用する前処理条件と質量分析(MS)測定条件を装置制御パラメータとして呼び出し、装置各部に送信する。
【0043】
タクロリムスの場合、治療域は2〜20ng/mLであり、自動分析装置500としては治療域を含む0.5〜30ng/mL程度の濃度範囲で定量することが要求される。このように全血中のタクロリムスは、例えば第1実施形態で挙げたテオフィリンなどと比較して低濃度であり、自動分析装置500で精度よく測定するには、検体量は200μL必要である。同様に、想定濃度範囲のタクロリムス測定に最適化された固相抽出材の量や洗浄液、溶出液などに関するパラメータが呼び出されて装置各部に送信される。
【0044】
(工程3:抽出材液スラリ注入)
第1実施形態の(工程3:抽出材液スラリ注入)(図2参照)と同様に、抽出材液分注機構106は、制御部120から送信された装置制御パラメータに基づいて、設定された一定量の抽出材液スラリを抽出材液容器105から分注し、固相抽出カートリッジ104に注入する。そして、抽出材液スラリが注入された固相抽出カートリッジ104は、加圧機構113によって上方から加圧されて溶媒が下方に通過する。
【0045】
(工程5A:試料注入)
試料分注機構111は、試料容器101から全血処理液試料(測定試料)を分注し、固相抽出材が注入された固相抽出カートリッジ104に注入する。
【0046】
(工程5B:攪拌)
自動分析装置100は、処理部108を回転させることにより、固相抽出材および全血処理液試料が(測定試料)分注された固相抽出カートリッジ104を攪拌機構123の位置に移動させ、固相抽出材と全血処理液試料の攪拌を行う。この攪拌によって、固相抽出材と試料液中のタクロリムスおよび内標準アスコマイシンが十分な回数接触することができ、固相抽出材に吸着する。
【0047】
(工程5C:吐出)
自動分析装置100は、処理部108を回転させることにより、攪拌が十分に行われた固相抽出カートリッジ104を加圧機構113の位置に移動させる。加圧機構113の加圧処理によって固相抽出カートリッジ104内の全血処理液試料は下方に通過する。一方、タクロリムスとアスコマイシンは固相抽出材に吸着されたままであり、固相抽出材と共にカートリッジ内のフィルタ122の上部に残留する。
【0048】
(工程6:洗浄)
第1実施形態の(工程6:洗浄)(図2参照)と同様に、試薬分注機構112は、試薬容器109に格納された洗浄液としての純水200μLを分注する。そして、加圧機構113によって加圧処理を行うことで固相抽出カートリッジ104を洗浄する。この工程によって、固相抽出材表面に非特異的に残存した全血処理液試料中の成分を排出する。
【0049】
(工程7:溶出)
洗浄後、試薬分注機構112は、溶出液としてメタノール50μLを固相抽出カートリッジ104に分注する。そして、加圧機構113によって加圧処理を行うことで固相抽出カートリッジ104からタクロリムス(薬物)およびアスコマイシン(内標準物質)を溶出させた抽出試料液を抽出容器114に回収する。
【0050】
自動分析装置500は、抽出試料液を回収した抽出容器114を、抽出容器設置部115の回転によって試料導入部117の位置に移動する。抽出試料液は、試料導入部117によってイオン源118に導入される。イオン源118でタクロリムス(薬物)およびアスコマイシン(内標準物質)がイオン化され、質量分析部119で両成分が検出される。検出された両成分の信号強度は制御部120に転送される。制御部120は、転送された両成分の信号強度比と、あらかじめ求めておいたキャリブレータの信号強度比から、全血試料中のタクロリムス濃度を計算する。
以上のような工程で自動分析装置500は、全血試料中のタクロリムス濃度を測定する。
【0051】
以上説明したように、自動分析装置500によれば、第1実施形態に係る自動分析装置100と同様の効果に加えて、試料内の測定対象物質濃度が低い場合でも精度よく測定を行うことができる。
【0052】
≪変形例≫
なお、本実施形態に係る自動分析装置は、上記実施形態の構成に限定されるものではなく、発明の趣旨を逸脱しない範囲内で種々の変更が可能である。
第1および第2実施形態では、単一の固相抽出材を用いた測定について説明したが、1つの固相抽出カートリッジに対して複数の固相抽出材を供給することも可能である。具体的には、抽出材液分注機構106の動作線上にそれぞれ異なる種類の固相抽出材を入れた抽出材液容器105を複数配置して、(工程3:抽出材液スラリ注入)を複数回繰り返すことで実現することができる。このような方法は、例えば、スルホン酸基を有する陽イオン交換系固相抽出材と逆相固相抽出材を混合することで固相抽出効率が改善する薬物を測定する場合などに有効である。このような方法を採る場合、洗浄液や溶出液のpHの最適化、溶出液の種類や量を変更などの必要があるが、自動分析装置100,500を用いればこれらの変更は容易である。
【0053】
本実施形態に係る自動分析装置100,500の質量分析部119は、抽出試料液中の薬物の濃度を測定する定量分析を行うものとして説明したが、これに限られるものではなく、抽出試料液中の薬物の物質を同定する定性分析を行うものであってもよく、定性分析と定量分析を同時に行うものであってもよい。
【産業上の利用可能性】
【0054】
本発明に係る分析装置は、測定試料に含まれる薬物の濃度を測定する分析装置に有効であり、特に、LC−MS(またはLC−MS/MS)分析装置のような質量分析計を用いて生体試料に含まれる薬物の濃度を測定する分析装置に適している。
【符号の説明】
【0055】
100 自動分析装置(分析装置)
101 試料容器
102 試料設置部(前処理手段)
103 試料情報読み取り部(前処理手段)
104 固相抽出カートリッジ(固相抽出用容器)
105 抽出材液容器(スラリ生成手段)
106 抽出材液分注機構(固相抽出材分注手段)
107 攪拌機構(スラリ生成手段)
108 処理部(前処理手段)
109 試薬容器
110 試薬配置部(前処理手段)
111 試料分注機構(前処理手段)
112 試薬分注機構(前処理手段)
113 加圧機構(前処理手段)
114 抽出容器
115 抽出容器設置部(前処理手段)
116 消耗品設置部
117 試料導入部(前処理手段)
118 イオン源(測定手段)
119 質量分析部(測定手段)
120 制御部
123 攪拌機構(攪拌手段)
500 自動分析装置(分析装置)
【技術分野】
【0001】
本発明は、分析装置および分析方法に関する。
【背景技術】
【0002】
従来、血液や尿、細胞抽出液などの生体試料をはじめとした複雑な組成を有する液体試料中に微量に存在する化学物質の測定が行われている。このような測定の方法として、液体クロマトグラフィ(Liquid Chromatography,LC)やキャピラリ電気泳動(Capillary Electrophoresis,CE)などの高い分離性能を有する分離手段と、質量分析法(Mass Spectrometry,MS)や紫外可視吸光光度法(Ultraviolet-Visible Spectrophotometry,UV)などの検出器を組み合わせた分析法が、多くの分野で用いられている。
【0003】
質量分析(MS)は、測定対象成分をイオン化し、生成したイオンの質量に基づいて測定する分析法であり、質量分析を複数回実施するMS/MSと呼ばれる分析法は、測定対象成分イオンをフラグメント化することにより、試料溶液中の微量成分を高感度かつ高選択性をもって検出できる。液体クロマトグラフィ(LC)と質量分析(MS)をオンラインで接続したLC−MS(またはLC−MS/MS)は、液体試料中の微量物質分析に汎用されている。
【0004】
また、試料の精製度を高める手段として、固相抽出(Solid Phase Extraction,SPE)や液液抽出(Liquid-Liquid Extraction,LLE)などの前処理を、LC−MS(またはLC−MS/MS)分析の前に実施することが行われている。特に、血液のように高粘度かつ高濃度の主要成分を含む試料について、前処理を行わずに直接LC−MSに注入すると、装置の汚染による測定精度低下を引き起こすのみならず、流路詰まりによって測定が行えなくなってしまう可能性がある。このため、高粘度かつ高濃度の主要成分を含む試料の前処理は必須となる。
【0005】
固相抽出(SPE)とは、固相抽出材と呼ばれる粒子径数μmから数十μmの微粒子に表面に、測定対象である化学物質を相互作用により捕捉させることで、試料溶液中に存在する他の物質と分離精製する方法である。また、液液抽出(LLE)とは、水とヘキサンのように互いに混ざり合わない2種の溶媒に、試料溶液を分注および攪拌して、2種の溶媒に対する分配係数の違いによって測定対象の物質と他の物質を分離する方法である。
特に、固相抽出(SPE)は、LC−MS(またはLC−MS/MS)とのオンライン接続が容易なため、固相抽出(SPE)による前処理とLC−MS(またはLC−MS/MS)による測定の自動化を行うことができる。また、固相抽出(SPE)は、96穴マイクロプレートなどを用いた多試料の同時処理による前処理時間の短縮が可能となる、などの特徴を有する。
【0006】
固相抽出(SPE)とLC−MSを用いた生体試料分析として、例えば特許文献1では、血清や尿などの生体試料を96穴の固相抽出プレートを用いてオフラインで処理し、直接MSに試料注入あるいはLC−MSで測定することにより、アミノ酸、カルニチン類、糖および免疫抑制剤などの定量を行っている。固相抽出(SPE)において、オフライン処理で用いられる固相抽出カートリッジとしては、例えば特許文献1や特許文献2に記載されている96穴プレートや、特許文献3に記載されているようなシリンジ容器などがある。また、固相抽出(SPE)において、オンライン接続して使用される固相抽出カートリッジとしては、特許文献4に記載されているように、高圧に耐えうるように液体クロマトグラフィ(LC)のプレカラムと同様の形状をしたものがある。
【0007】
特許文献1から特許文献4に挙げられたいずれのカートリッジにおいても、固相抽出材はフィルタを介してカートリッジ内に封入された状態で供給される。また、カートリッジに封入されずに測定時に固相抽出カートリッジを形成する手段として、特許文献5では内部にフィルタを備えたピペット先端に固相抽出材を充填して使用する方法を提供している。
【先行技術文献】
【特許文献】
【0008】
【特許文献1】米国特許出願公開第2007/0004044号明細書
【特許文献2】米国特許第6723236号明細書
【特許文献3】特開2002−316002号公報
【特許文献4】欧州特許第1159597号明細書
【特許文献5】米国特許第6770246号明細書
【発明の概要】
【発明が解決しようとする課題】
【0009】
血液中の薬物濃度を測定する自動分析装置において、測定対象となる薬物の種類は、試料すなわち患者ごとに異なる。また、試料中に存在すると想定される測定対象薬物濃度は、薬物の種類ごとに大きく異なる。これは、治療効果が現れる血中薬物濃度(治療域)が薬物ごとに異なるためである。一例として、抗てんかん剤として使用されるバルプロ酸ナトリウムの場合、治療域は50〜100μg/mLであり、免疫抑制剤として使用されるタクロリムスの治療域は2〜20ng/mLと、1000倍以上の濃度差がある。
【0010】
すなわち、自動分析装置では、様々な種類の薬物を、各薬物ごとに想定される広範囲な濃度域において測定することが求められる。そのためには、試料ごとに最適な前処理を施すことが要求される。具体的には、試料液量、抽出液の種類および量、固相抽出材の種類および量を、測定対象ごとにそれぞれ最適化することが望まれる。また、実際に病院などの臨床検査に自動分析装置を使用する場合、緊急性の高い患者試料が装置に供給されると、その試料を優先して測定することが要求される。
【0011】
これらの要求に対して、特許文献1および特許文献2に記載された96穴プレートを用いた前処理装置では、多量の試料を一括処理可能である一方、多連シリンジを備えた分注ヘッドが1つしか配置されておらず、異なる種類あるいは異なる液量の溶出液を用いる多項目の抽出処理を行うことができないという問題点がある。また、臨床検査においては96穴プレートに十分な量の試料を処理動作ごとに確保するのは困難であるという問題点がある。さらに、プレートを用いた前処理装置の場合、一度処理を開始した後、次の処理依頼サンプルは、実行中の処理が終了するまで開始できず、臨機応変な処理をすることが困難であるという問題点がある。
【0012】
特許文献3に記載されたシリンジ型固相抽出カラムや、特許文献4に記載されたカートリッジ型カラムでは、固相抽出材の量を変更する場合、変更したい数だけカラムを装置にあらかじめ準備する必要がある。このため、装置の消耗品コストが上昇するだけでなく、複数種類のカラムを試料ごとに選択する機構も必要となり、装置が複雑かつ大型化するという問題点がある。
【0013】
特許文献5に記載の方法では、ピペット先端に固相抽出材スラリを充填することで、試料ごとに固相抽出材の量を変更可能であるが、ピペット先端から固相抽出材の落下を防止するために、スラリ溶媒にグリセロールなど粘性のある液体を使用する必要がある。このグリセロールが抽出材表面に吸着することによって、薬物の固相抽出効率に影響を与えてしまうという問題点がある。特に、測定対象となる薬物は、その用途により様々な物理化学的性質をもつ化学物質であり、その全ての薬物に対して影響を与えない高粘性液体を準備することは技術的に困難である。また、検出器に質量分析装置を用いた場合、グリセロールのような粘性のある液体をイオン源に導入すると、イオン化効率の低下による信号強度の低下や信号のばらつきを引き起こすという問題点がある。
【0014】
そこで、本発明は、試料中の薬物を測定する際に、様々な種類や治療域の薬物を含む試料に対して試料ごとに最適な条件で前処理を行う分析装置および分析方法を提供することを課題とする。
【課題を解決するための手段】
【0015】
このような課題を解決するために、本発明は、測定試料に含まれる薬物を測定する分析装置であって、固相抽出用容器内に固相抽出材を注入する固相抽出材分注手段と、前記固相抽出材が注入された前記固相抽出用容器内に前記測定試料を注入して固体抽出処理により抽出試料液を生成する前処理手段と、前記抽出試料液中の前記薬物を測定する測定手段と、を備えることを特徴とする分析装置である。
【発明の効果】
【0016】
本発明によれば、試料中の薬物を測定する際に、様々な種類や治療域の薬物を含む試料に対して試料ごとに最適な条件で前処理を行い、質量分析装置において精度よく測定を行うことができる分析装置および分析方法を提供することができる。
【図面の簡単な説明】
【0017】
【図1】第1実施形態に係る自動分析装置の構成図である。
【図2】第1実施形態に係る自動分析装置による固相抽出前処理の工程を示すチャートである。
【図3】試料容器に対する試料情報の付加方法の一例を示す説明図である。
【図4】固相抽出カートリッジの構造を示す断面図である。
【図5】第2実施形態に係る自動分析装置の構成図である。
【図6】第2実施形態に係る自動分析装置による固相抽出前処理の工程を示すチャートである。
【発明を実施するための形態】
【0018】
以下、本発明を実施するための形態(以下「実施形態」という)について、適宜図面を参照しながら詳細に説明する。なお、各図において、共通する部分には同一の符号を付し重複した説明を省略する。
【0019】
≪第1実施形態≫
<自動分析装置100の構成>
図1は、第1実施形態に係る自動分析装置100の構成図である。
自動分析装置100は、測定試料に含まれる薬物の濃度を自動で連続的に測定することができる分析装置であり、第1実施形態では血清試料(測定試料)中に含まれる喘息薬テオフィリン(薬物)の濃度を分析するものとして説明する。
自動分析装置100は、試料容器101と、試料設置部102と、試料情報読み取り部103と、固相抽出カートリッジ(固相抽出容器)104と、抽出材液容器105と、抽出材液分注機構106と、攪拌機構107と、処理部108と、試薬容器109と、試薬配置部110と、試料分注機構111と、試薬分注機構112と、加圧機構113と、抽出容器114と、抽出容器設置部115と、消耗品設置部116と、試料導入部117と、イオン源118と、質量分析部119と、制御部120と、によって構成される。
【0020】
試料容器101は、測定対象となる血清試料(測定試料)が格納されている。試料設置部102は、試料容器101が配置され、試料設置部102が回転することにより試料容器101の位置を移動(回転移動)させることができるようになっている。試料情報読み取り部103は、試料容器101に記載された試料情報を読み取ることができるようになっている。固相抽出カートリッジ104は、固相抽出処理の際に試料が分注される。抽出材液容器105は、抽出材液が格納されている。抽出材液分注機構106は、抽出材液容器105に格納された抽出材液スラリを固相抽出カートリッジ104に分注することができるようになっている。攪拌機構107は、抽出材液容器105内の抽出材液を攪拌することによって抽出材液スラリを形成することができるようになっている。処理部108は、固相抽出カートリッジ104を用いて順次固相抽出処理を行うことができるようになっている。試薬容器109は、各種試薬が格納されている。試薬配置部110は、抽出処理に使用する洗浄液や溶出液等の試薬容器109が配置され、試薬配置部110が回転することにより試薬容器109の位置を移動(回転移動)させることができるようになっている。試料分注機構111は、試料容器101に格納された血清試料(測定試料)を固相抽出カートリッジ104に分注することができるようになっている。試薬分注機構112は、試薬容器109に格納された試薬を固相抽出カートリッジ104に分注することができるようになっている。
【0021】
加圧機構113は、加圧によって固相抽出カートリッジ104内の液を下方に通過させることができるようになっている。抽出容器114は、固相抽出カートリッジ104から排出される前処理済みの試料を回収することができるようになっている。抽出容器設置部115は、抽出容器114が配置され、抽出容器設置部115が回転することにより抽出容器114の位置を移動(回転移動)させることができるようになっている。消耗品設置部116は、固相抽出カートリッジ104および抽出容器114などの消耗品が設置されている。試料導入部117は、抽出試料の分注とイオン源118への送液を行うことができるようになっている。イオン源118は、エレクトロスプレイオン源(Electrospray Ionization,ESI)であり、前処理が終了した試料をイオン化することができるようになっている。質量分析部119は、イオン源118でイオン化された試料の成分を質量分析することができるようになっている。
制御部120は、後述する試料情報や測定条件情報が格納されるとともに、これらの情報を用いて自動分析装置100の動作を制御することができるようになっている。また、制御部120は、質量分析部119で測定された結果の収集と解析を行うことができるようになっている。
【0022】
自動分析装置100の構成のうち、イオン源118、質量分析部119および制御部120の一部機能が、前処理された測定試料中の薬物の濃度を測定する測定手段であり、残りの構成部(制御部120の一部機能を含む)が、測定試料に対して固相抽出処理を含む前処理を行う前処理手段となる。
【0023】
<自動分析装置100による濃度測定>
次に、自動分析装置100による血清試料中のテオフィリン濃度測定手順について、図1を参照しつつ図2を用いて説明する。図2は、第1実施形態に係る自動分析装置100による固相抽出前処理の工程を示すチャートである。
図2の処理に先立って、血清試料(測定試料)を試料容器101に分注して格納し、試料設置部102にセットする。このとき、例えば、検体ID、試料の液性、測定対象薬物などの試料に関する情報(試料情報)を記録したバーコード121があらかじめ作成されており、図3のように試料容器101の側面にバーコード121が貼付されている。
【0024】
図2の説明に戻り、自動分析装置100は、以下のような工程で血清試料中のテオフィリン濃度を測定する。
(工程1:試料情報読み込み)
自動分析装置100は、試料容器101が設置された試料設置部102を回転させ、試料容器101を試料情報読み取り部103の前を通過させる。試料情報読み取り部103は、試料容器101のバーコード121から試料情報を読み取り、読み取った情報を制御部120に送る。
【0025】
(工程2:前処理条件呼び出し)
制御部120には、試料種類および薬物ごとに、試料量、抽出材の種類および量、固相抽出条件(洗浄液、溶出液の種類および量、加圧条件など)などの前処理条件と、質量分析(MS)測定条件とがあらかじめデータベースDBとして記憶されている。ある薬物に対して、濃度分析を行う際に用いられる試料種類が複数ある場合は、その薬物に対してそれぞれの試料種類別にデータベースが作成されている。制御部120は、試料情報読み取り部103から送られてきた試料情報から、テオフィリン測定に使用する前処理条件と質量分析(MS)測定条件を装置制御パラメータとして呼び出し、装置各部に送信する。
【0026】
テオフィリンの場合、治療域は10〜20μg/mLであり、自動分析装置100は治療域を含む1〜50μg/mL程度の濃度範囲で定量する必要がある。この濃度範囲は、テオフィリンに対する質量分析(MS)の検出感度から考えるとかなり高い濃度範囲であるため、使用する検体量は少量でよく、例えば20μL程度で十分である。同様に、想定濃度範囲のテオフィリン測定に最適化された固相抽出材の量や洗浄液、溶出液などに関するパラメータが呼び出されて装置各部に送信される。
【0027】
(工程3:抽出材液スラリ注入)
抽出材液分注機構106は、制御部120から送信された装置制御パラメータに基づいて、設定された一定量の抽出材液スラリを抽出材液容器105から分注し、固相抽出カートリッジ104に注入する。抽出材液は、固相抽出材を含んだ水あるいはメタノールなどの有機溶媒である。固相抽出材としては、例えば逆相固相抽出材である日立ハイテクノロジーズ社製「NOBIAS RP−SG1」が使用できる。この場合、溶媒としては50%メタノール水溶液が適する。また抽出材液スラリの比率は、固相抽出材20mgに対して50%メタノール水溶液1mLが適する。
【0028】
抽出材液スラリは、攪拌機構107によって分注前に十分攪拌され、固相抽出材の均一なスラリを形成する。攪拌機構107としては、マグネティックスターラが簡便である。マグネティックスターラは、棒磁石をテフロン(登録商標)樹脂などで被った攪拌子を攪拌対象物質(この場合は抽出材液スラリ)中に投入しておき、抽出材液容器105の下部に設置された攪拌機構107の内部にある磁石をモータで回転させるものである。マグネティックスターラで攪拌することで、均一なスラリを形成することができる。抽出材液スラリが注入された固相抽出カートリッジ104は、加圧機構113によって上方から加圧されて溶媒が下方に通過する。
【0029】
図4は、固相抽出カートリッジ104の構造を示す断面図である。固相抽出カートリッジ104の内部下方にはフィルタ122が設置されている。本実施形態においては、フィルタ122の孔径は10μmとした。このような構造によれば、加圧機構113によって加圧された溶媒は固相抽出カートリッジ104を通過する一方、固相抽出材はフィルタ122の上部に残留する。
【0030】
(工程4:平衡化)
固相抽出材の平衡化のため、溶媒の通過後の固相抽出カートリッジ104に対して、試薬配置部110に配置された純水を試薬分注機構112によって分注する。注入された純水は加圧機構113によって加圧されて固相抽出カートリッジ104の下方に通過する。ここまでの工程で試料処理の準備が終了する。
【0031】
(工程5:試料注入)
試薬分注機構112は、試薬配置部110からテオフィリンの内標準物質(テオフィリン−d6)溶液を分注し、固相抽出材が注入され試料処理準備が終了した固相抽出カートリッジ104に注入する。続いて、試料分注機構111は、試料容器101から血清試料(測定試料)を分注し、内標準物質が注入された固相抽出カートリッジ104に注入する。固相抽出カートリッジ104に注入された血清試料および内標準物質液は、加圧機構113によって上方より加圧されて固相抽出材を通過し、下方に排出される。この工程によって、血清試料中に含まれるテオフィリン(薬物)と内標準物質は、疎水性相互作用により固相抽出材表面に選択的に吸着する。
【0032】
(工程6:洗浄)
試薬分注機構112は、試薬容器109に格納された洗浄液としての純水200μLを分注する。そして、加圧機構113によって加圧処理を行うことで固相抽出カートリッジ104を洗浄する。この工程によって、固相抽出材表面に非特異的に残存した血清試料中の成分を排出する。
【0033】
(工程7:溶出)
洗浄後、試薬分注機構112は、溶出液として50%メタノール水溶液100μLを固相抽出カートリッジ104に分注する。そして、加圧機構113によって加圧処理を行うことで固相抽出カートリッジ104からテオフィリン(薬物)およびテオフィリン−d6(内標準物質)を溶出させた抽出試料液を抽出容器114で回収する。
【0034】
自動分析装置100は、抽出試料液を回収した抽出容器114を、抽出容器設置部115の回転によって試料導入部117の位置に移動する。抽出試料液は、試料導入部117によってイオン源118に導入される。イオン源118でテオフィリン(薬物)およびテオフィリン−d6(内標準物質)がイオン化され、質量分析部119で両成分が検出される。検出された両成分の信号強度は、制御部120に転送される。制御部120は、転送された両成分の信号強度比と、あらかじめ求めておいたキャリブレータの信号強度比から、血清試料中のテオフィリン濃度を計算する。
以上のような工程で自動分析装置100は、血清試料中のテオフィリン濃度を測定する。
【0035】
<まとめ>
以上説明したように、自動分析装置100は、様々な種類の薬物の定量測定を行うにあたって、それぞれの薬物や測定対象試料の種類に対応する前処理条件をデータベース化しておき、当該データベースの値に従って固相抽出処理を含む前処理を行う。これにより、常に最適な固相抽出材、試料、各種試薬の使用量を選択することができ、無駄な試薬消費を抑え、分析処理にかかるランニングコストを低減することができる。
【0036】
また、従来技術の分析装置によれば、固相抽出材の種類別および使用量別に、異なる複数の固相抽出カートリッジを備えなければならなかった。一方、自動分析装置100では、固相抽出材が封入された固相抽出カートリッジをあらかじめ備える必要がないので、装置構成を簡素化することができ、装置自体の製造コストを低減することができる。
【0037】
≪第2実施形態≫
<自動分析装置500の構成>
図5は、第2実施形態に係る自動分析装置500の構成図である。
第2実施形態に係る自動分析装置500は、第1実施形態に係る自動分析装置100と比較して、固相抽出カートリッジ104に対して容器内を攪拌する攪拌機構123を設けた点が異なっている。
攪拌機構123は、例えば超音波攪拌機を使用することができる。攪拌機構123を設けることによって、固相抽出カートリッジ104内の試料と固相抽出材などの試薬との接触率を向上させることができ、例えば、測定試料内の測定対象物質(薬物)の濃度が低い場合でも精度よく測定を行うことができる。
【0038】
自動分析装置500は、測定試料に含まれる薬物の濃度を自動で連続的に測定することができる分析装置であり、第2実施形態では全血試料中に含まれる免疫抑制剤タクロリムス(薬物)の濃度を分析するものとして説明する。
全血試料中のタクロリムスは血球成分中に存在するため、そのままの状態では固相抽出処理を行うことができない。第2実施形態では、全血試料に対して3倍量の0.5M硫酸亜鉛水溶液および4倍量の10ng/mL濃度のアスコマシンを含むメタノール溶液(全血試料50μLに対して0.5M硫酸亜鉛水溶液150μLならびにメタノール溶液200μL)を添加することによって、血球破壊と沈殿の形成を行い、遠心分離後の上清を全血処理液試料(測定試料)として用いる。ここで、アスコマイシンは、タクロリムスの内標準物質として質量分析(MS)測定時に使用される。
【0039】
また、第2実施形態では、前処理においてバッチ式で固相抽出処理を行う。ここでいうバッチ式とは、固相抽出材をカートリッジの一部分に固定することなく、測定試料液内を自由に移動させることで測定試料中の薬物と固相抽出させる方式のことである。
【0040】
<自動分析装置500による濃度測定>
次に、自動分析装置500による全血試料中のタクロリムス濃度測定手順について、図5を参照しつつ図6を用いて説明する。図6は、第2実施形態に係る自動分析装置500による固相抽出前処理の工程を示すチャートである。
図6の処理に先立って、全血処理液試料(測定試料)を試料容器101に分注して格納し、試料設置部102にセットするとともに、試料情報を記録したバーコード121(図3参照)を試料容器101の側面に貼付しておく。
【0041】
(工程1:試料情報読み込み)
第1実施形態の(工程1:試料情報読み込み)(図2参照)と同様に行う。
【0042】
(工程2:前処理条件呼び出し)
制御部120は、試料情報読み取り部103から送られてきた試料情報から、タクロリムス測定に使用する前処理条件と質量分析(MS)測定条件を装置制御パラメータとして呼び出し、装置各部に送信する。
【0043】
タクロリムスの場合、治療域は2〜20ng/mLであり、自動分析装置500としては治療域を含む0.5〜30ng/mL程度の濃度範囲で定量することが要求される。このように全血中のタクロリムスは、例えば第1実施形態で挙げたテオフィリンなどと比較して低濃度であり、自動分析装置500で精度よく測定するには、検体量は200μL必要である。同様に、想定濃度範囲のタクロリムス測定に最適化された固相抽出材の量や洗浄液、溶出液などに関するパラメータが呼び出されて装置各部に送信される。
【0044】
(工程3:抽出材液スラリ注入)
第1実施形態の(工程3:抽出材液スラリ注入)(図2参照)と同様に、抽出材液分注機構106は、制御部120から送信された装置制御パラメータに基づいて、設定された一定量の抽出材液スラリを抽出材液容器105から分注し、固相抽出カートリッジ104に注入する。そして、抽出材液スラリが注入された固相抽出カートリッジ104は、加圧機構113によって上方から加圧されて溶媒が下方に通過する。
【0045】
(工程5A:試料注入)
試料分注機構111は、試料容器101から全血処理液試料(測定試料)を分注し、固相抽出材が注入された固相抽出カートリッジ104に注入する。
【0046】
(工程5B:攪拌)
自動分析装置100は、処理部108を回転させることにより、固相抽出材および全血処理液試料が(測定試料)分注された固相抽出カートリッジ104を攪拌機構123の位置に移動させ、固相抽出材と全血処理液試料の攪拌を行う。この攪拌によって、固相抽出材と試料液中のタクロリムスおよび内標準アスコマイシンが十分な回数接触することができ、固相抽出材に吸着する。
【0047】
(工程5C:吐出)
自動分析装置100は、処理部108を回転させることにより、攪拌が十分に行われた固相抽出カートリッジ104を加圧機構113の位置に移動させる。加圧機構113の加圧処理によって固相抽出カートリッジ104内の全血処理液試料は下方に通過する。一方、タクロリムスとアスコマイシンは固相抽出材に吸着されたままであり、固相抽出材と共にカートリッジ内のフィルタ122の上部に残留する。
【0048】
(工程6:洗浄)
第1実施形態の(工程6:洗浄)(図2参照)と同様に、試薬分注機構112は、試薬容器109に格納された洗浄液としての純水200μLを分注する。そして、加圧機構113によって加圧処理を行うことで固相抽出カートリッジ104を洗浄する。この工程によって、固相抽出材表面に非特異的に残存した全血処理液試料中の成分を排出する。
【0049】
(工程7:溶出)
洗浄後、試薬分注機構112は、溶出液としてメタノール50μLを固相抽出カートリッジ104に分注する。そして、加圧機構113によって加圧処理を行うことで固相抽出カートリッジ104からタクロリムス(薬物)およびアスコマイシン(内標準物質)を溶出させた抽出試料液を抽出容器114に回収する。
【0050】
自動分析装置500は、抽出試料液を回収した抽出容器114を、抽出容器設置部115の回転によって試料導入部117の位置に移動する。抽出試料液は、試料導入部117によってイオン源118に導入される。イオン源118でタクロリムス(薬物)およびアスコマイシン(内標準物質)がイオン化され、質量分析部119で両成分が検出される。検出された両成分の信号強度は制御部120に転送される。制御部120は、転送された両成分の信号強度比と、あらかじめ求めておいたキャリブレータの信号強度比から、全血試料中のタクロリムス濃度を計算する。
以上のような工程で自動分析装置500は、全血試料中のタクロリムス濃度を測定する。
【0051】
以上説明したように、自動分析装置500によれば、第1実施形態に係る自動分析装置100と同様の効果に加えて、試料内の測定対象物質濃度が低い場合でも精度よく測定を行うことができる。
【0052】
≪変形例≫
なお、本実施形態に係る自動分析装置は、上記実施形態の構成に限定されるものではなく、発明の趣旨を逸脱しない範囲内で種々の変更が可能である。
第1および第2実施形態では、単一の固相抽出材を用いた測定について説明したが、1つの固相抽出カートリッジに対して複数の固相抽出材を供給することも可能である。具体的には、抽出材液分注機構106の動作線上にそれぞれ異なる種類の固相抽出材を入れた抽出材液容器105を複数配置して、(工程3:抽出材液スラリ注入)を複数回繰り返すことで実現することができる。このような方法は、例えば、スルホン酸基を有する陽イオン交換系固相抽出材と逆相固相抽出材を混合することで固相抽出効率が改善する薬物を測定する場合などに有効である。このような方法を採る場合、洗浄液や溶出液のpHの最適化、溶出液の種類や量を変更などの必要があるが、自動分析装置100,500を用いればこれらの変更は容易である。
【0053】
本実施形態に係る自動分析装置100,500の質量分析部119は、抽出試料液中の薬物の濃度を測定する定量分析を行うものとして説明したが、これに限られるものではなく、抽出試料液中の薬物の物質を同定する定性分析を行うものであってもよく、定性分析と定量分析を同時に行うものであってもよい。
【産業上の利用可能性】
【0054】
本発明に係る分析装置は、測定試料に含まれる薬物の濃度を測定する分析装置に有効であり、特に、LC−MS(またはLC−MS/MS)分析装置のような質量分析計を用いて生体試料に含まれる薬物の濃度を測定する分析装置に適している。
【符号の説明】
【0055】
100 自動分析装置(分析装置)
101 試料容器
102 試料設置部(前処理手段)
103 試料情報読み取り部(前処理手段)
104 固相抽出カートリッジ(固相抽出用容器)
105 抽出材液容器(スラリ生成手段)
106 抽出材液分注機構(固相抽出材分注手段)
107 攪拌機構(スラリ生成手段)
108 処理部(前処理手段)
109 試薬容器
110 試薬配置部(前処理手段)
111 試料分注機構(前処理手段)
112 試薬分注機構(前処理手段)
113 加圧機構(前処理手段)
114 抽出容器
115 抽出容器設置部(前処理手段)
116 消耗品設置部
117 試料導入部(前処理手段)
118 イオン源(測定手段)
119 質量分析部(測定手段)
120 制御部
123 攪拌機構(攪拌手段)
500 自動分析装置(分析装置)
【特許請求の範囲】
【請求項1】
測定試料に含まれる薬物を測定する分析装置であって、
固相抽出用容器内に固相抽出材を注入する固相抽出材分注手段と、
前記固相抽出材が注入された前記固相抽出用容器内に前記測定試料を注入して固体抽出処理により抽出試料液を生成する前処理手段と、
前記抽出試料液中の前記薬物を測定する測定手段と、を備える
ことを特徴とする分析装置。
【請求項2】
前記固相抽出材および溶媒を攪拌して固相抽出材スラリを生成するスラリ生成手段を更に備え、
前記固相抽出材分注手段は、
前記スラリ生成手段で生成された前記固相抽出材スラリを前記固相抽出用容器内に注入する
ことを特徴とする請求項1に記載の分析装置。
【請求項3】
前記前処理手段は、
前記固相抽出用容器内に注入された前記固相抽出材および前記測定試料を、前記固相抽出用容器内で攪拌する攪拌手段を有する
ことを特徴とする請求項1または請求項2に記載の分析装置。
【請求項4】
前記測定手段は、前記抽出試料液中の前記薬物の物質を同定する定性分析を行う
ことを特徴とする請求項1乃至請求項3のいずれか1項に記載の分析装置。
【請求項5】
前記測定手段は、前記抽出試料液中の前記薬物の濃度を測定する定量分析を行う
ことを特徴とする請求項1乃至請求項4のいずれか1項に記載の分析装置。
【請求項6】
前記固相抽出材分注手段は、
前記測定試料に含まれる前記薬物の想定される濃度に基づいて、前記固相抽出用容器内に注入する前記固相抽出材の量を変更する
ことを特徴とする請求項5に記載の分析装置。
【請求項7】
前記前処理手段は、
前記測定試料に含まれる前記薬物の想定される濃度に基づいて、前記固相抽出用容器内に注入する前記測定試料の量を変更する
ことを特徴とする請求項5または請求項6に記載の分析装置。
【請求項8】
前記固相抽出材分注手段は、
1つの前記固相抽出用容器に対して、複数種類の固相抽出材を注入する
ことを特徴とする請求項1乃至請求項7のいずれか1項に記載の分析装置。
【請求項9】
前記測定手段は、質量分析計である
ことを特徴とする請求項1乃至請求項8のいずれか1項に記載の分析装置。
【請求項10】
前記測定試料は、血液、血清、尿、唾液を含む生体液である
ことを特徴とする請求項1乃至請求項9のいずれか1項に記載の分析装置。
【請求項11】
測定試料に含まれる薬物を測定する分析装置による分析方法あって、
固相抽出用容器内に固相抽出材を注入する注入処理と、
前記注入処理により前記固相抽出材が注入された前記固相抽出用容器内に前記測定試料を注入して固体抽出処理により抽出試料液を生成する前処理と、
前記前処理により前記抽出試料液中の前記薬物を測定する測定処理と、を実行する
ことを特徴とする分析方法。
【請求項1】
測定試料に含まれる薬物を測定する分析装置であって、
固相抽出用容器内に固相抽出材を注入する固相抽出材分注手段と、
前記固相抽出材が注入された前記固相抽出用容器内に前記測定試料を注入して固体抽出処理により抽出試料液を生成する前処理手段と、
前記抽出試料液中の前記薬物を測定する測定手段と、を備える
ことを特徴とする分析装置。
【請求項2】
前記固相抽出材および溶媒を攪拌して固相抽出材スラリを生成するスラリ生成手段を更に備え、
前記固相抽出材分注手段は、
前記スラリ生成手段で生成された前記固相抽出材スラリを前記固相抽出用容器内に注入する
ことを特徴とする請求項1に記載の分析装置。
【請求項3】
前記前処理手段は、
前記固相抽出用容器内に注入された前記固相抽出材および前記測定試料を、前記固相抽出用容器内で攪拌する攪拌手段を有する
ことを特徴とする請求項1または請求項2に記載の分析装置。
【請求項4】
前記測定手段は、前記抽出試料液中の前記薬物の物質を同定する定性分析を行う
ことを特徴とする請求項1乃至請求項3のいずれか1項に記載の分析装置。
【請求項5】
前記測定手段は、前記抽出試料液中の前記薬物の濃度を測定する定量分析を行う
ことを特徴とする請求項1乃至請求項4のいずれか1項に記載の分析装置。
【請求項6】
前記固相抽出材分注手段は、
前記測定試料に含まれる前記薬物の想定される濃度に基づいて、前記固相抽出用容器内に注入する前記固相抽出材の量を変更する
ことを特徴とする請求項5に記載の分析装置。
【請求項7】
前記前処理手段は、
前記測定試料に含まれる前記薬物の想定される濃度に基づいて、前記固相抽出用容器内に注入する前記測定試料の量を変更する
ことを特徴とする請求項5または請求項6に記載の分析装置。
【請求項8】
前記固相抽出材分注手段は、
1つの前記固相抽出用容器に対して、複数種類の固相抽出材を注入する
ことを特徴とする請求項1乃至請求項7のいずれか1項に記載の分析装置。
【請求項9】
前記測定手段は、質量分析計である
ことを特徴とする請求項1乃至請求項8のいずれか1項に記載の分析装置。
【請求項10】
前記測定試料は、血液、血清、尿、唾液を含む生体液である
ことを特徴とする請求項1乃至請求項9のいずれか1項に記載の分析装置。
【請求項11】
測定試料に含まれる薬物を測定する分析装置による分析方法あって、
固相抽出用容器内に固相抽出材を注入する注入処理と、
前記注入処理により前記固相抽出材が注入された前記固相抽出用容器内に前記測定試料を注入して固体抽出処理により抽出試料液を生成する前処理と、
前記前処理により前記抽出試料液中の前記薬物を測定する測定処理と、を実行する
ことを特徴とする分析方法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】




【図2】


【図3】


【図4】


【図5】


【図6】


【公開番号】特開2013−96733(P2013−96733A)
【公開日】平成25年5月20日(2013.5.20)
【国際特許分類】
【出願番号】特願2011−237117(P2011−237117)
【出願日】平成23年10月28日(2011.10.28)
【出願人】(501387839)株式会社日立ハイテクノロジーズ (4,325)
【Fターム(参考)】
【公開日】平成25年5月20日(2013.5.20)
【国際特許分類】
【出願日】平成23年10月28日(2011.10.28)
【出願人】(501387839)株式会社日立ハイテクノロジーズ (4,325)
【Fターム(参考)】
[ Back to top ]

