分析装置用分注ノズル及びそれを搭載した分析装置
【課題】 尿や血液などの検体を分析する自動分析装置において、分析測定値が繰り返し使用する分注ノズルによるキャリーオーバの影響を受けないようにする。
【解決手段】 分析装置で検体を検体容器から前記反応セルに分注する検体分注機構に用いられる析装置用分注ノズルにおいて、分注ノズルの表面をフッ素含有のDLC層で被覆することで、静電容量による液面検知を可能とするとともに、生体高分子の吸着を抑制する分子層を形成し、分注ノズルによるキャリーオーバを低減する。
【解決手段】 分析装置で検体を検体容器から前記反応セルに分注する検体分注機構に用いられる析装置用分注ノズルにおいて、分注ノズルの表面をフッ素含有のDLC層で被覆することで、静電容量による液面検知を可能とするとともに、生体高分子の吸着を抑制する分子層を形成し、分注ノズルによるキャリーオーバを低減する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、分析装置用分注ノズル及びそれを搭載した分析装置に関する。
【背景技術】
【0002】
医療診断用の臨床検査においては、血液や尿などの生体検体中のタンパク、糖、脂質、酵素、ホルモン、無機イオン、疾患マーカー等の生化学分析や免疫学的分析を行う。臨床検査では、複数の検査項目を信頼度高くかつ高速に処理する必要があるため、その大部分を自動分析装置で実行している。自動分析装置としては、例えば、血清等の検体に所望の試薬を混合して反応させた反応溶液を分析対象とし、その吸光度を測定することで生化学分析を行う生化学分析装置が知られている。この種の生化学分析装置は、検体や試薬を収納する容器、検体及び試薬を注入する反応セルを備え、検体及び試薬を反応セルに自動注入する分注ノズルを備えた分注機構と、反応セル内の検体及び試薬を混合する攪拌棒を持つ自動攪拌機構、反応中又は反応が終了した検体の吸光度を計測する機構、計測終了後の反応溶液を吸引・排出し、反応セルを洗浄する自動洗浄機構等を備えている(例えば特許文献1)。
【0003】
こうした自動分析装置では、分注ノズルにより多数の検体及び試薬を次々と分注することが一般的である。例えば検体分注ノズルは、採血管などの検体を収納する容器から所定量の検体を分取して、試薬を反応させる反応セルに検体を吐出する。試薬分注ノズルは、試薬を収納する容器から分取した所定量の試薬を反応セルへ吐出する。この際、分注ノズル表面に残留した被分注液体の成分が次の被分注液体に混入すると、測定結果に影響を及ぼす場合がある。これをキャリーオーバと呼ぶ。
【0004】
キャリーオーバの問題は、近年の自動分析装置の分野における検体及び試薬の微量化の要求と深く関連している。分析項目数の増大に伴い、1つの分析項目に割くことのできる検体量が少量化する。検体自体が貴重で多量に準備できない場合もあり、高感度化への要求もある。また、分析内容が高度化するにつれて、一般に試薬が高価となり、コスト面から試薬微量化への要請がある。こうした検体及び試薬の微量化への要求の高まりにより分注ノズルの細径化が進み、管の外径は0.5mm程度となっている。ノズル径の微小化は、分注される溶液の体積に対しての表面積の割合を増大させる。このため、分注ノズル表面への物質吸着を制御し、キャリーオーバを低減することの重要性が増している。
【0005】
また、生化学項目と測定濃度範囲の広い免疫項目の分析のための検体を同一容器から採取して測定する場合、分注ノズルによる検体間のキャリーオーバを極力低減することが求められている。
【0006】
キャリーオーバを低減するために、従来は、純水や界面活性剤を含む洗剤による洗浄が実施されてきた(特許文献2)。活性酸素により、付着した検体の残渣を失活させるという方法も知られている(特許文献3)。使い捨て可能なディスポーザブルノズル(ディスポーザブルティップ)を用いる方法も、キャリーオーバに対する解決法の一つとして知られている。
【0007】
また、臨床検査にもちいる電気化学センサの分野でも、このようなキャリーオーバを解決するために、センサの電極表面にDLC(ダイアモンドライクカーボン)膜を形成する方法も知られている(特許文献4)。
【0008】
なお、表面上に吸着した化学物質の定量や組成解析にはXPS(X線光電子分光法)などが広く用いられており、例えば自己組織化膜などの単分子膜の組成や化学種の定量について解析が行われている(非特許文献1,2)。これと同様に、表面上に残存したタンパク質の定量もXPSにより定量することが可能である(非特許文献3)。
【先行技術文献】
【特許文献】
【0009】
【特許文献1】特許第1706358号公報
【特許文献2】特開2007−85930号公報
【特許文献3】特許第3330579号公報
【特許文献4】特開2008−215887号公報
【非特許文献】
【0010】
【非特許文献1】Chemical Reviews, 96, pp.1533-1554(1996)
【非特許文献2】Journal of the American Chemical Society, 115, pp.10714-10721 (1993)
【非特許文献3】The Journal of Physical Chemistry B, 107, pp.6766-6773 (2003)
【発明の概要】
【発明が解決しようとする課題】
【0011】
純水や界面活性剤を含む洗剤による洗浄では、タンパク質に代表される生体高分子の洗浄が困難な場合がある。活性酸素により付着した検体の残渣を失活させる方法では、失活した検体の残渣が表面に堆積してしまうため、長期間の使用には耐えられない。また、ディスポーザブルノズルの使用は大量の廃棄物を出し、環境負荷を増大させてしまうという問題点もある。
【0012】
本発明の目的は、表面の清浄度を上げ、キャリーオーバの低減を図った自動分析装置の検体分注ノズル、及びそれを用いた自動分析装置を提供することである。
【課題を解決するための手段】
【0013】
キャリーオーバを回避する必要性の高い分析項目は、分析成分がタンパク質などの生体高分子であることが多い。よってキャリーオーバ低減のためには、分注ノズルの表面にタンパク質など生体高分子が残存するのを抑制することが解決策となる。本発明では、そのために、検体などの生体分子による非特異吸着を抑制する分子層をノズル表面へ固定化した。また、上記分子の固定化に際しては、表面への堅い密着層の形成、特に共有結合を利用した。この際、撥水性を有する分子層をノズルの最表面へ形成できれば、ノズルの材質は限定されない。
【0014】
本発明では、上記課題を解決するために、検体分注ノズルは、酸化ケイ素層を有し、その酸化ケイ素層上に、フッ素―炭素の共有結合を有するDLC(ダイアモンドライクカーボン)層を形成した。このDLC層とノズル表面金属との間に酸化ケイ素層を有することで、DLC層と金属との密着性を向上できる。
【発明の効果】
【0015】
本発明によれば、分注ノズルへのタンパク質や試薬などの生体高分子の吸着を抑制することが出来る。そのため分注動作時のキャリーオーバを低減することが可能となり、自動分析装置の分析信頼性が向上する。また、それにより検体や試薬の微量化に寄与し、自動分析装置のランニングコスト低減にも貢献する。
【図面の簡単な説明】
【0016】
【図1】本発明の実施例にかかる分注ノズルの概略図である。
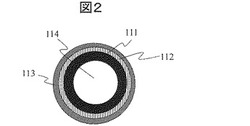
【図2】本発明の実施例にかかる分注ノズルの断面図である。
【図3】本発明の実施例にかかる分注ノズル製造の工程プロセスである。
【図4】本発明の実施例にかかる分注ノズル表面のXPSの結果を示す図である。
【図5】本発明の実施例にかかる分注ノズル表面のXPSの結果を示す図である。
【図6】本発明の実施例にかかる自動分析装置の構成例を示す図である。
【図7】本発明の実施例にかかる液面検知の概念図である。
【図8】本発明の実施例にかかる液面検知の概念図である。
【図9】本発明の実施例にかかる液面検知の概念図である。
【図10】本発明の実施例にかかる液面検知の概念図である。
【発明を実施するための形態】
【0017】
以下、本発明の実施例を、図面を用いて説明する。
【実施例1】
【0018】
図1に本実施例の分注ノズルの概略図を示す。分注ノズル本体部101には、耐腐食性が高く加工性の良い材料としてステンレススチール(SUS)が広く用いられている。しかし、ノズルの材料はステンレススチールに限定されず、樹脂例えばポリジメチルシロキサン(PDMS)、ポリ塩化ビニル、ポリアクリレートや、ガラス、その他金属材料(金、プラチナ、銀、銅、チタン)、セラミックであれば良い。ここでは、導電性のステンレススチールの分注ノズルの例を示す。分注ノズルは角102で曲げられ、吸引・吐出機構へと接続されている。検体や試薬の吸引時は、中空部103に所定量を吸引する。分注時には検体や試薬に対して分注ノズルの外面も浸漬される。このためフッ素含有DLCが化学吸着し被覆する領域としては、中空部103を持つ分注ノズルの場合、内面、外面及び端部105であり、また、分注ノズルが検体又は試薬を分注する際に検体又は試薬に浸漬する領域104よりも十分に大きい。
【0019】
分注ノズルの表面に対してフッ素含有DLC層を密着させるには、ノズル表面に直接DLC層を形成してもよいし、密着性の向上のために密着層となる中間層を設けてもよい。中間層としては、シリコンやゲルマニウムやテルルやまたはそれらの化合物のような4族元素を含むか、チタンやクロムなどの金属またはその酸化物、またはシリコンカーバイド(SiC)があれば、化学結合によりDLC層を強固にノズル表面に固定化できる。
【0020】
先にも述べたように、自動分析装置の分注ノズルには加工性の良さ、耐食性などの観点を踏まえて、ステンレススチールが広く用いられている。従って、実施の形態ではステンレススチールの最表面に酸化ケイ素層をあらかじめ設けた例を示す。なお、ステンレススチール表面にDLC層を直接形成することも可能である。
【0021】
このように処理された分注ノズルの図1に点線で示した位置での処理部断面図を図2に示す。分注ノズル111は本体部であり、ステンレススチールなどからなる。SiO2層112はノズル111上にスパッタリング又はCVD成膜又は薬液(SOG:Spin On Glass、塗布ガラス)の塗布乾燥により形成される。フッ素含有DLC層113はSiO2層112に対して化学結合しており、タンパク質などの生体高分子や水溶液中の成分の吸着を抑制する役割を果たす。分注ノズルは中空部114を備えている。
【0022】
形成されたSiO2層112に対してフッ素含有DLC層113が形成できるようにスパッタリングにより結合を形成する。こうして処理された表面では、フッ素の存在が確認できると共に、炭素―フッ素結合が数種類(C−F、C−F2、C−F3)形成できていることをC1s(炭素1s)のXPS(X線光電子分光)の測定結果から確認できた。
【0023】
本実施例のノズルでは、ノズル外壁のみにSiO2層を形成し、その最表面にフッ素含有DLC層を形成した例を示した。なお、ノズル内壁にも同様にSiO2層とフッ素含有DLC層を形成しても良い。
【0024】
吸着の抑制効果の検証は、タンパク質の吸着量をXPSで測定することにより実施した。具体的にはBSA(ウシ血清アルブミン)の吸着量をN1s(窒素1s) XPSのピーク面積から見積もった。BSAは血清タンパク質の約50〜65%を占める血清アルブミンのモデルとして適している。上記の表面処理を行った基板ではBSAの吸着実験を行った後でもN1sのピーク面積が検出限界以下となることが確認され、従来のステンレススチールやステンレススチールに対してSiO2層を形成したものとは有意な差が認められた。
【0025】
分注ノズルで液面を検知する際には、その静電容量の変化を指標とする電気的計測法が広く用いられている。従って、ステンレススチール製分注ノズル表面に絶縁性のSiO2薄膜層とその表面にフッ素含有DLC層が形成されていても、液面検知に必要な静電容量変化を検出できた。
【0026】
なお、液面を検知した高さ位置から3mm程度下側でノズルが止まり、液体を吸引する設定とした。本実施例では、SiO2層の厚さが約10nmであり、静電容量の変化を容易に検出できる。
【0027】
ノズル表面に何らかの機械的なダメージが加わった場合に、ノズル表面に形成したSiO2層が割れや傷を形成する場合がある。この酸化ケイ素層の割れや傷を静電容量の変化として検出することで、ノズル表面の定期的なメンテナンス実施時期を知らせるセンサを搭載できる。本発明の分注ノズルを使用すれば、検体間の汚染に、より敏感である免疫分析装置を生化学自動分析装置と統合することにも役立つ。
【0028】
ここで、特許文献4で述べられている電極との違いについて述べる。特許文献4では、作用電極としてのDLC膜は、電極として機能する程度の導電性を有する、と述べている。また、DLC膜の表面に、塩素及びヨウ素のようなハロゲンや、酸素を結合させてもよい。これにより、DLC膜のぬれ性や血しょうの付着などを制御できる、とも述べている。
【0029】
しかし、以下の3点で本発明と特許文献4の構造とは異なる。
(相違点1)撥水性の点:本実施例では、先に述べたとおりXPSを用いた分析では、分析深さ範囲(約3nm)で、検出した全元素中にフッ素を20原子%含有している。このように相当量のフッ素の導入が撥水性には必要である。実際、フッ素が0原子%、5原子%存在しても撥水性は低いが、10原子%、15原子%、20原子%存在すると撥水性が示された。従って、表面においてフッ素を10原子%以上含有していることが望ましい。
【0030】
(相違点2)導電性:特許文献4は、電極であり導電性が必要であると述べている。しかし、一般にフッ素を含有するDLC膜は電極として使用できるほどの導電性を有していない。従って、特許文献4ではフッ素添加の効果を述べているが、このフッ素添加により電極として必要な導電性を失うため、臨床検査用のセンサ向け電極として使用できない。一方、本発明では誘電体としての性能を有するように、フッ素含有DLC膜の厚さを最適化しておおり、また中間層のSiO2層の厚さも最適化している。本実施例のような静電容量検知をノズルでは、電極として用いる場合よりも低い導電性でも十分に機能する。このノズル表面の最適構造により、撥水性と静電容量変化による液面検知を両立する。よって、本実施例が公知例とは異なる構造の特徴がある。
【0031】
(相違点3)耐久性:DLC膜の表面のみにフッ素を添加や結合させたノズルは、摩擦などへの耐久性がない。一方、本発明では、DLC構造の中にフッ素が共有結合しており、いくつもの結合状態(C−F、C−F2、C−F3)として相当量入っている。この構造を有するため、本発明は臨床検査用のノズルとして摩擦などへの耐久性が優れる。
【0032】
以上の3点により、本ノズルと公知例電極とは本質的に異なると考える。
【0033】
次に、本発明を実施例により詳細に説明するが、本発明は下記実施例に限定されるものではない。
<実験例>
最初に、解析の信頼性を高めるため、平面基板を用いて効果の検証を行った。用いた基板は、SUS基板で、大きさは10mm×10mm×0.5mmである。
(フッ素含有DLC層が固定化された基板:F−DLC基板の作成)
実験の工程フローを図3に示す。
【0034】
工程1.SUS表面にSiO2層を形成。
まず、ステンレススチール(SUS)表面に残存する油脂を除去するため、アルカリ性の溶剤で脱脂した。その後、酸素(O2)を反応性ガス、Arを放電ガスとする、DCマグネトロンスパッタリング装置を用い、Siをスパッタリングした。SiO2の成膜条件は以下の通りである。チャンバ内の到達真空度は、5×10-5Torrであり、ヒーター設定温度は423Kとした。その結果、SiO2の成膜速度は、0.2nm/秒である。こうして、SUS表面にSiO2層を10nm形成した。なお、スパッタリングでなく、薬液(SOG:Spin On Glass、塗布ガラス)の塗布乾燥によってもSiO2層は形成できる。
【0035】
工程2.SiO2層にフッ素含有DLCを形成。
工程1で作製した基板に対して、イオン蒸着装置を用いて、フッ素化炭化水素ガスを用いて成膜を行った。
【0036】
この時、用いるフッ素化炭化水素のガスを変化させることで、製膜するDLC膜に含まれるフッ素量を調整できる。以下、このようにして作製された基板をF−DLC基板ともいう。
【0037】
本発明による表面処理の効果を検証するために、参照用として以下の2枚の基板を用意した。
(参照基板1. SiO2膜を形成したSUS基板の作成)
まず、1枚目の参照基板の処理手順について説明する。先に述べた工程1の方法で、ステンレススチール基板にスパッタリングによりSiO2膜を形成した。このSiO2層の膜厚は10nmとした。次に、この板をエタノール中で15分間超音波洗浄した。この状態で水に対する接触角を上記と同様の方法により測定した。その結果、基板の水に対する接触角は10±1°であった。これにより表面が清浄となっていることを確認した。このSiO2膜を形成した基板を参照基板1とした。
(参照基板2. SUS基板の作成)
2枚目の参照基板としてステンレススチール基板を用意し、1%NaOH水溶液で15分間超音波洗浄し、その後にエタノールで15分間超音波洗浄を行った。この洗浄を行ったステンレススチール基板を参照基板2とした。
(BSA吸着試験)
生体高分子の吸着抑制効果の検証は、BSA(ウシ血清アルブミン)の吸着試験によって行った。まずBSAの1.0g/L溶液を用意した。溶媒としてはダルベッコリン酸緩衝溶液を用いた。作成した溶液に、準備した基板を30分間浸漬した。基板を引き上げ後、まずダルベッコリン酸緩衝溶液で十分に洗浄した。次いで、純水で十分に洗浄した。最後に窒素ブローにより乾燥させた。
【0038】
こうしてBSAを吸着試験した3枚の基板についてXPS測定を行い、表面組成を定量分析した。XPSの測定はPHI社製QuanteraSXMで行った。X線源としては単色化Al(1486.6eV)を用いた。検出領域はΦ100μmとし、取り出し角は45°とした。
【0039】
ワイドスキャン(結合エネルギー(Biding Energy)0〜1275eV、エネルギーステップ1.0eV)で測定した結果をもとに、検出された元素をナロースキャンした。その後、表面元素濃度の比率を求めた結果を表1に示す。参照基板2のステンレススチール基板からは、炭素(C)、酸素(O)、鉄(Fe)及びクロム(Cr)が検出された。参照基板1からは、ケイ素(Si)及び酸素(O)が検出されており、表面が酸化ケイ素によりコーティングされていることを確認した。F−DLC基板では、炭素が75.4原子%、フッ素が20.5原子%、酸素が4.1原子%検出されたが、鉄(Fe)、クロム(Cr)、ニッケル(Ni)は検出されなかった。このことから、下地である酸化ケイ素やステンレススチール成分が検出されていないことから、フッ素含有するDLC膜が緻密に形成されていることがわかる。なお、今回のXPS分析の検出下限は0.1原子%である。
【0040】
【表1】

【0041】
炭素の結合状態を検討するためにC1s(炭素1s)のナロースキャンを、結合エネルギーが278eVから296eVの範囲をエネルギーステップ0.1eVで測定した。
【0042】
BSA吸着試験後の結果を比較する。F−DLC基板及び参照基板1の測定結果を図4に示す。F−DLC基板の測定結果は、実線310で示す。矢印311の範囲はC−C、C−H結合、矢印312の範囲はC―CFx結合、C−O結合、矢印313の範囲はC=O、矢印314の範囲は、-C−F結合、O=C−O結合、矢印315の範囲は−CF2結合、矢印316の範囲は−CF3結合の検出される範囲である。図4に示されたように、C−C,C−H結合のピークの他に、C−FやC−F2やC−F3結合に帰属されるピークが強く検出された。これはDLC層内に複数の結合状態としてC−F結合があることを反映している。単にフッ素が表面に塗られているわけではないことがわかる。得られた炭素、酸素、フッ素のナロースキャンから求めた、F−DLC基板の炭素の結合存在比率を表2に示す。
【0043】
その結果、C−C及びC−H結合が75.4%、C―CFx(x=1〜3)結合及びC−O結合が14.3%、C=O結合が3.1%、-C−F結合及びO=C−O結合が10.9%、CF2結合が8.0%、CF3結合が2.4%存在した。
【0044】
【表2】

【0045】
一方、参照基板1の測定結果は、太線320で示す。矢印321の範囲はC−C、C−H結合、矢印322の範囲はC−O結合、矢印323の範囲はC=O、O=C−O、CO3結合の検出される範囲である。また、矢印324の範囲は、ガラスに由来するカリウム(K2p)のピークである。
【0046】
次に、基板ごとのBSA吸着量比較について説明する。BSAのステンレススチール表面への吸着についてはXPSにより、BSA中の窒素原子(N)に対応するN1sピークにより定量分析が可能である。ここでN1sピークはBSAに含まれているアミン、アミドに帰属される。そこで本実施例ではBSAの基板ごとの相対吸着量をN1s量により定量し、基板表面へのタンパク質吸着に対する抑制効果を検証した。
【0047】
結果を図5に示す。細線331がフッ素DLC基板のスペクトル、太線332が参照基板1のスペクトル、破線333が参照基板2のスペクトルである。BSAが吸着した、SiO2層を有する基板(参照基板1)の表面及びステンレススチール基板(参照基板2)の表面では、結合エネルギー400eV付近にピークを持つ対称形のN1sのピークが観察された。
【0048】
N1sのピーク面積の解析は、バックグラウンドを395eVから405eVまでを直線で差し引くことで行った。各元素のピーク面積から求まるN1sの表面元素濃度(原子%)を表3に示す。表3は、F−DLC基板、SiO2のみを有する参照基板1をSiO2/SUS基板、参照基板2はステンレススチール基板とした。
【0049】
【表3】

【0050】
SiO2膜を形成したステンレススチール(SUS)基板での窒素比率は5.0%であり、PEG溶液浸漬基板ではN1sは検出限界以下となった。また、ステンレススチール基板では、窒素の表面元素濃度が3.0%であった。本測定での検出限界(窒素の含有量で0.1%)を考慮すると、F−DLC基板では、SiO2膜を形成した基板に対してBSAの吸着量が1/50以下となり、BSAの吸着を抑制できることを確認した。また、PEG溶液浸漬基板では、ステンレススチール基板に対してBSAの吸着量が1/30以下となり、BSAの吸着を抑制できることを確認した。
【0051】
以上の結果から、ステンレススチール上にSiO2層を形成し、フッ素含有DLC層を形成することで、分注ノズル表面のタンパク質に代表される生体高分子の吸着が大幅に抑制されることが示された。
【0052】
本実施例では、分注ノズルに実験例と同様の処理を行う場合について説明する。まずステンレススチール製分注ノズルの表面に、実験例と同様の方法でSiO2層とフッ素含有DLC層を形成した。なお、ノズル形状が円筒形であることから、この表面処理中はノズルを回転させながら均一に表面処理した。この表面処理層を形成する領域は、図1の分注ノズルの端部105及び検体に浸漬される領域104とした。本実施例では、処理されたノズル先端部の外径は0.5mm、内径は0.3mmであり、先端10mmの領域にSiO2層を10nm、フッ素含有DLC層を100nmの厚さに形成した。分注ノズル全面にフッ素含有DLC層を形成することも可能であるが、形成する領域を検体に浸漬される部分に限定することでコストを低減することが出来る。形成した膜構造は実験例と同様にXPS分析で確認した。その結果、実験例と同様の表面が形成されていることを確認した。
【0053】
フッ素含有DLC層形成の検証は、実験例と同様に、BSAの表面残存量の測定をXPSで行った。その結果、分注後の分注ノズル表面に残存するタンパク質が従来のステンレススチール製のノズルと比較して1/50以下(実験例で述べたXPS測定の検出限界以下)に低減されることを確認した。
【0054】
図6は、本実施例による自動分析装置の構成例を示す図であり、次にその基本構成を述べる。検体収納部機構1には、一つ以上の検体容器25が配置されている。ここでは、ディスク状の機構部に搭載された検体収納部機構である検体ディスク機構の例で説明するが、検体収納部機構の他の形態としては自動分析装置で一般的に用いられている検体ラック又は検体ホルダー状の形態であってもよい。またここで言う検体とは、反応容器で反応させるために使用する被検査溶液のことを指し、採集検体原液でもよく、またそれを希釈や前処理等の加工処理をした溶液であってもよい。検体容器25内の検体は、検体供給用分注機構2の検体分注ノズル27によって吸引され、所定の反応容器に注入される。検体分注ノズルは、実施例1に記述した方法でフッ素含有DLC層を形成した。試薬ディスク機構5は、多数の試薬容器6を備えている。また、機構5には、試薬供給用分注機構7が配置されており、試薬は、この機構7の試薬分注ノズル28によって、吸引され所定の反応セルに注入される。10は分光光度計、26は集光フィルタつき光源であり、分光光度計10と集光フィルタつき光源26の間に、測定対象を収容する反応ディスク3が配置される。この反応ディスク3の外周上には、例えば、120個の反応セル4が設置されている。また、反応ディスク3の全体は、恒温槽9によって、所定の温度に保持されている。11は反応セル洗浄機構であり、洗浄剤容器13から洗浄剤が供給され、セル内の吸引は吸引ノズル12で行う。
【0055】
19はコンピュータ、23はインターフェース、18はLog変換器及びA/D変換器、17は試薬用ピペッタ、16は洗浄水ポンプ、15は検体用ピペッタである。また、20はプリンタ、21は表示装置、22は記憶装置としてのフロッピー(登録商標)ディスクやハードディスク、24は操作パネルである。検体ディスク機構は駆動部200により、試薬ディスク機構は駆動部201により、反応ディスクは駆動部202により、それぞれインターフェースを介して制御並びに駆動されている。また自動分析装置の各部はインターフェースを介してマイクロコンピュータ19により制御される。
【0056】
上述の構成において、操作者は、操作パネル24を用いて分析依頼情報の入力を行う。操作者が入力した分析依頼情報は、マイクロコンピュータ19内のメモリに記憶される。検体容器25に入れられ、検体収納部機構1の所定の位置にセットされた測定対象検体はマイクロコンピュータ19のメモリに記憶された分析依頼情報に従って、検体ピペッタ15及び検体供給用分注機構2の表面処理された検体分注ノズル27によって、反応セルに所定量分注される。表面処理された検体分注ノズル27は水洗浄され、次の検体の分注に使用される。
【0057】
この時、フッ素含有DLC層で被覆された検体分注ノズル27を用いることでタンパク質に代表される生体高分子の吸着を抑制し、検体間のキャリーオーバを従来のステンレススチール製分注ノズルに比較して1/2以下に低減することができた。キャリーオーバは洗浄した後での比較である。したがって、キャリーオーバをさらに低下させることは難しいにもかかわらず、ノズルに表面処理することで、キャリーオーバ率を低下できたことは著しい進歩である。またこの時、ノズル表面のSiO2層が10nm、フッ素含有DLC層が100nm以下と薄いため、静電容量の変化を用いて液面検知を行うことが出来る。反応セルに試薬供給用分注機構7の試薬分注ノズル28によって、所定量の試薬が分注される。試薬分注ノズル28は水洗浄された後、次の反応セルのための試薬を分注する。検体と試薬の混合液は、撹拌機構8の攪拌棒29によって撹拌される。撹拌機構8は順次、次の反応セルの混合液を撹拌する。
【0058】
ここで、この装置に搭載されている液面検知の原理を説明する。搭載液面検知の原理には、静電容量方式を採用している。静電容量方式では、ノズルとグラウンド(本実施例の場合では検体容器の底が相当)間の静電容量値を測定する。誘電率の高い物質に接触した際に、静電容量が空気中に比べて大きくなることを利用している。
【0059】
図7に静電容量方式による液面検知の概念図を示す。表面処理をしていない金属ノズルを使用した場合である。金属ノズル410が、検体容器412中の検体413に触れていない。検体容器が接する装置本体411をグラウンドとした場合、ノズルとグラウンド間の静電容量は、空気の静電容量C0と検体(水)の静電容量C1で決まる。この際の合計の静電容量Cは、C=(C0×C1)/(C0+C1)である。
【0060】
一方、図8にノズルが液面に触れた場合の概念図を示す。金属ノズル410が、検体容器412中の液体413に触れている。検体容器が装置本体411をグラウンドとした場合、ノズルとグラウンド間の静電容量はC1である。
【0061】
この方式を利用することで、本実施例の酸化ケイ素(SiO2)およびフッ素含有DLC層で被覆したノズルでも液面検知が可能である。図9に、表面処理層(酸化ケイ素およびフッ素含有DLC)で被覆したノズルでの液面検知の例を示す。表面処理層414を有する金属ノズル410が、検体容器412中の液体413に触れていない場合を示す。検体容器が接する装置本体411をグラウンドとする。表面処理層の静電容量C2とする。表面処理層で被覆したノズルが空気中にある場合の静電容量をCxとすると、1/Cx=1/C0+1/C1+1/C2となる。
【0062】
一方、図10に、表面処理層414を有する金属ノズル410が、検体容器412中の液体413に触れている場合を示す。検体ボトルが接する装置本体411をグラウンドとする。表面処理層の静電容量をC2とする。表面処理層で被覆したノズルが液面に触れている場合の静電容量をCyとすると、1/Cy=1/C1+1/C2となり、空気中の静電容量Cxと異なることから液面を検知できる。
【0063】
何らかの衝撃や接触で、このノズルの表面処理層にあるSiO2層やフッ素含有DLC層が割れた場合、金属ノズルが空気と直接触れるため、表面処理層の静電容量C2を無視できる。すると、静電容量が大幅に変化するので、ノズル上のSiO2層やフッ素含有DLC層の傷や割れを検知できる。SiO2層やフッ素含有DLC層の傷や割れが生じた場合、そこをきっかけとしてキャリーオーバが増加することがあり得る。したがって、表面処理層の傷や割れを検知できることは重要である。また、初期値からの静電容量のズレがある閾値を超えた場合や、ノズル交換に伴う初期値の変更も記憶する記憶媒体32がある。
【0064】
本実施例の自動分析装置には、この静電容量の変化を検知する検知機構31、ノズルの交換時期や分析正確性を知らせるインジケータ30が搭載されている。このインジケータは正常時には青色を示し、静電容量の変化を常に測定しており、ノズル表面の酸化ケイ素層に割れや傷等の異常が発生した際には、静電容量の変化からその異常を検知し、インターフェースを介してインジケータ30を例えば赤色に表示して報知する。また、この際に分析したサンプルについては、装置上で記憶しており、ノズル交換後に分析データを再取得するプログラムを内蔵している。
【0065】
以上の実施例では検体分注ノズルにおけるキャリーオーバを問題としたが、攪拌棒などキャリーオーバの要因となりうる全ての部材において、本発明の処理を行うことで、同様の効果が得られる。
【0066】
本発明によれば、分注ノズル表面へのタンパク質などの生体高分子の非特異吸着を劇的に低減し、キャリーオーバの抑制を図ることで、自動分析装置の信頼性の向上に貢献することが出来る。また、このため検体微量化、試薬の微量化にも貢献し、ランニングコストや環境負荷の低減をすることが出来る。
【符号の説明】
【0067】
1…検体収納部機構、2…検体供給用分注機構、3…反応ディスク、4…反応セル、5…試薬ディスク機構、6…試薬容器、7…試薬供給用分注機構、8…撹拌機構、9…恒温槽、10…分光光度計、11…反応セル洗浄機構、12…吸引ノズル、13…洗浄剤容器、15…検体用ピペッタ、16…洗浄水ポンプ、17…試薬用ピペッタ、25…検体容器、26…集光フィルタつき光源、27…検体分注ノズル、28…試薬分注ノズル、29…撹拌棒、30…インジケータ、31…検知機構、32…記憶媒体、101…分注ノズル本体部、111…分注ノズル本体部、112…金薄膜層、113…親水性分子層、200…駆動部、201…駆動部、202…駆動部、310…実線、311…矢印、312…矢印、313…矢印、314…矢印、315…矢印、316…矢印、320…太線、321…矢印、322…矢印、323…矢印、324…矢印、331…細線、332…太線、332…破線333、410…分注ノズル、411…装置本体、412…検体容器、413…検体、414…表面処理層。
【技術分野】
【0001】
本発明は、分析装置用分注ノズル及びそれを搭載した分析装置に関する。
【背景技術】
【0002】
医療診断用の臨床検査においては、血液や尿などの生体検体中のタンパク、糖、脂質、酵素、ホルモン、無機イオン、疾患マーカー等の生化学分析や免疫学的分析を行う。臨床検査では、複数の検査項目を信頼度高くかつ高速に処理する必要があるため、その大部分を自動分析装置で実行している。自動分析装置としては、例えば、血清等の検体に所望の試薬を混合して反応させた反応溶液を分析対象とし、その吸光度を測定することで生化学分析を行う生化学分析装置が知られている。この種の生化学分析装置は、検体や試薬を収納する容器、検体及び試薬を注入する反応セルを備え、検体及び試薬を反応セルに自動注入する分注ノズルを備えた分注機構と、反応セル内の検体及び試薬を混合する攪拌棒を持つ自動攪拌機構、反応中又は反応が終了した検体の吸光度を計測する機構、計測終了後の反応溶液を吸引・排出し、反応セルを洗浄する自動洗浄機構等を備えている(例えば特許文献1)。
【0003】
こうした自動分析装置では、分注ノズルにより多数の検体及び試薬を次々と分注することが一般的である。例えば検体分注ノズルは、採血管などの検体を収納する容器から所定量の検体を分取して、試薬を反応させる反応セルに検体を吐出する。試薬分注ノズルは、試薬を収納する容器から分取した所定量の試薬を反応セルへ吐出する。この際、分注ノズル表面に残留した被分注液体の成分が次の被分注液体に混入すると、測定結果に影響を及ぼす場合がある。これをキャリーオーバと呼ぶ。
【0004】
キャリーオーバの問題は、近年の自動分析装置の分野における検体及び試薬の微量化の要求と深く関連している。分析項目数の増大に伴い、1つの分析項目に割くことのできる検体量が少量化する。検体自体が貴重で多量に準備できない場合もあり、高感度化への要求もある。また、分析内容が高度化するにつれて、一般に試薬が高価となり、コスト面から試薬微量化への要請がある。こうした検体及び試薬の微量化への要求の高まりにより分注ノズルの細径化が進み、管の外径は0.5mm程度となっている。ノズル径の微小化は、分注される溶液の体積に対しての表面積の割合を増大させる。このため、分注ノズル表面への物質吸着を制御し、キャリーオーバを低減することの重要性が増している。
【0005】
また、生化学項目と測定濃度範囲の広い免疫項目の分析のための検体を同一容器から採取して測定する場合、分注ノズルによる検体間のキャリーオーバを極力低減することが求められている。
【0006】
キャリーオーバを低減するために、従来は、純水や界面活性剤を含む洗剤による洗浄が実施されてきた(特許文献2)。活性酸素により、付着した検体の残渣を失活させるという方法も知られている(特許文献3)。使い捨て可能なディスポーザブルノズル(ディスポーザブルティップ)を用いる方法も、キャリーオーバに対する解決法の一つとして知られている。
【0007】
また、臨床検査にもちいる電気化学センサの分野でも、このようなキャリーオーバを解決するために、センサの電極表面にDLC(ダイアモンドライクカーボン)膜を形成する方法も知られている(特許文献4)。
【0008】
なお、表面上に吸着した化学物質の定量や組成解析にはXPS(X線光電子分光法)などが広く用いられており、例えば自己組織化膜などの単分子膜の組成や化学種の定量について解析が行われている(非特許文献1,2)。これと同様に、表面上に残存したタンパク質の定量もXPSにより定量することが可能である(非特許文献3)。
【先行技術文献】
【特許文献】
【0009】
【特許文献1】特許第1706358号公報
【特許文献2】特開2007−85930号公報
【特許文献3】特許第3330579号公報
【特許文献4】特開2008−215887号公報
【非特許文献】
【0010】
【非特許文献1】Chemical Reviews, 96, pp.1533-1554(1996)
【非特許文献2】Journal of the American Chemical Society, 115, pp.10714-10721 (1993)
【非特許文献3】The Journal of Physical Chemistry B, 107, pp.6766-6773 (2003)
【発明の概要】
【発明が解決しようとする課題】
【0011】
純水や界面活性剤を含む洗剤による洗浄では、タンパク質に代表される生体高分子の洗浄が困難な場合がある。活性酸素により付着した検体の残渣を失活させる方法では、失活した検体の残渣が表面に堆積してしまうため、長期間の使用には耐えられない。また、ディスポーザブルノズルの使用は大量の廃棄物を出し、環境負荷を増大させてしまうという問題点もある。
【0012】
本発明の目的は、表面の清浄度を上げ、キャリーオーバの低減を図った自動分析装置の検体分注ノズル、及びそれを用いた自動分析装置を提供することである。
【課題を解決するための手段】
【0013】
キャリーオーバを回避する必要性の高い分析項目は、分析成分がタンパク質などの生体高分子であることが多い。よってキャリーオーバ低減のためには、分注ノズルの表面にタンパク質など生体高分子が残存するのを抑制することが解決策となる。本発明では、そのために、検体などの生体分子による非特異吸着を抑制する分子層をノズル表面へ固定化した。また、上記分子の固定化に際しては、表面への堅い密着層の形成、特に共有結合を利用した。この際、撥水性を有する分子層をノズルの最表面へ形成できれば、ノズルの材質は限定されない。
【0014】
本発明では、上記課題を解決するために、検体分注ノズルは、酸化ケイ素層を有し、その酸化ケイ素層上に、フッ素―炭素の共有結合を有するDLC(ダイアモンドライクカーボン)層を形成した。このDLC層とノズル表面金属との間に酸化ケイ素層を有することで、DLC層と金属との密着性を向上できる。
【発明の効果】
【0015】
本発明によれば、分注ノズルへのタンパク質や試薬などの生体高分子の吸着を抑制することが出来る。そのため分注動作時のキャリーオーバを低減することが可能となり、自動分析装置の分析信頼性が向上する。また、それにより検体や試薬の微量化に寄与し、自動分析装置のランニングコスト低減にも貢献する。
【図面の簡単な説明】
【0016】
【図1】本発明の実施例にかかる分注ノズルの概略図である。
【図2】本発明の実施例にかかる分注ノズルの断面図である。
【図3】本発明の実施例にかかる分注ノズル製造の工程プロセスである。
【図4】本発明の実施例にかかる分注ノズル表面のXPSの結果を示す図である。
【図5】本発明の実施例にかかる分注ノズル表面のXPSの結果を示す図である。
【図6】本発明の実施例にかかる自動分析装置の構成例を示す図である。
【図7】本発明の実施例にかかる液面検知の概念図である。
【図8】本発明の実施例にかかる液面検知の概念図である。
【図9】本発明の実施例にかかる液面検知の概念図である。
【図10】本発明の実施例にかかる液面検知の概念図である。
【発明を実施するための形態】
【0017】
以下、本発明の実施例を、図面を用いて説明する。
【実施例1】
【0018】
図1に本実施例の分注ノズルの概略図を示す。分注ノズル本体部101には、耐腐食性が高く加工性の良い材料としてステンレススチール(SUS)が広く用いられている。しかし、ノズルの材料はステンレススチールに限定されず、樹脂例えばポリジメチルシロキサン(PDMS)、ポリ塩化ビニル、ポリアクリレートや、ガラス、その他金属材料(金、プラチナ、銀、銅、チタン)、セラミックであれば良い。ここでは、導電性のステンレススチールの分注ノズルの例を示す。分注ノズルは角102で曲げられ、吸引・吐出機構へと接続されている。検体や試薬の吸引時は、中空部103に所定量を吸引する。分注時には検体や試薬に対して分注ノズルの外面も浸漬される。このためフッ素含有DLCが化学吸着し被覆する領域としては、中空部103を持つ分注ノズルの場合、内面、外面及び端部105であり、また、分注ノズルが検体又は試薬を分注する際に検体又は試薬に浸漬する領域104よりも十分に大きい。
【0019】
分注ノズルの表面に対してフッ素含有DLC層を密着させるには、ノズル表面に直接DLC層を形成してもよいし、密着性の向上のために密着層となる中間層を設けてもよい。中間層としては、シリコンやゲルマニウムやテルルやまたはそれらの化合物のような4族元素を含むか、チタンやクロムなどの金属またはその酸化物、またはシリコンカーバイド(SiC)があれば、化学結合によりDLC層を強固にノズル表面に固定化できる。
【0020】
先にも述べたように、自動分析装置の分注ノズルには加工性の良さ、耐食性などの観点を踏まえて、ステンレススチールが広く用いられている。従って、実施の形態ではステンレススチールの最表面に酸化ケイ素層をあらかじめ設けた例を示す。なお、ステンレススチール表面にDLC層を直接形成することも可能である。
【0021】
このように処理された分注ノズルの図1に点線で示した位置での処理部断面図を図2に示す。分注ノズル111は本体部であり、ステンレススチールなどからなる。SiO2層112はノズル111上にスパッタリング又はCVD成膜又は薬液(SOG:Spin On Glass、塗布ガラス)の塗布乾燥により形成される。フッ素含有DLC層113はSiO2層112に対して化学結合しており、タンパク質などの生体高分子や水溶液中の成分の吸着を抑制する役割を果たす。分注ノズルは中空部114を備えている。
【0022】
形成されたSiO2層112に対してフッ素含有DLC層113が形成できるようにスパッタリングにより結合を形成する。こうして処理された表面では、フッ素の存在が確認できると共に、炭素―フッ素結合が数種類(C−F、C−F2、C−F3)形成できていることをC1s(炭素1s)のXPS(X線光電子分光)の測定結果から確認できた。
【0023】
本実施例のノズルでは、ノズル外壁のみにSiO2層を形成し、その最表面にフッ素含有DLC層を形成した例を示した。なお、ノズル内壁にも同様にSiO2層とフッ素含有DLC層を形成しても良い。
【0024】
吸着の抑制効果の検証は、タンパク質の吸着量をXPSで測定することにより実施した。具体的にはBSA(ウシ血清アルブミン)の吸着量をN1s(窒素1s) XPSのピーク面積から見積もった。BSAは血清タンパク質の約50〜65%を占める血清アルブミンのモデルとして適している。上記の表面処理を行った基板ではBSAの吸着実験を行った後でもN1sのピーク面積が検出限界以下となることが確認され、従来のステンレススチールやステンレススチールに対してSiO2層を形成したものとは有意な差が認められた。
【0025】
分注ノズルで液面を検知する際には、その静電容量の変化を指標とする電気的計測法が広く用いられている。従って、ステンレススチール製分注ノズル表面に絶縁性のSiO2薄膜層とその表面にフッ素含有DLC層が形成されていても、液面検知に必要な静電容量変化を検出できた。
【0026】
なお、液面を検知した高さ位置から3mm程度下側でノズルが止まり、液体を吸引する設定とした。本実施例では、SiO2層の厚さが約10nmであり、静電容量の変化を容易に検出できる。
【0027】
ノズル表面に何らかの機械的なダメージが加わった場合に、ノズル表面に形成したSiO2層が割れや傷を形成する場合がある。この酸化ケイ素層の割れや傷を静電容量の変化として検出することで、ノズル表面の定期的なメンテナンス実施時期を知らせるセンサを搭載できる。本発明の分注ノズルを使用すれば、検体間の汚染に、より敏感である免疫分析装置を生化学自動分析装置と統合することにも役立つ。
【0028】
ここで、特許文献4で述べられている電極との違いについて述べる。特許文献4では、作用電極としてのDLC膜は、電極として機能する程度の導電性を有する、と述べている。また、DLC膜の表面に、塩素及びヨウ素のようなハロゲンや、酸素を結合させてもよい。これにより、DLC膜のぬれ性や血しょうの付着などを制御できる、とも述べている。
【0029】
しかし、以下の3点で本発明と特許文献4の構造とは異なる。
(相違点1)撥水性の点:本実施例では、先に述べたとおりXPSを用いた分析では、分析深さ範囲(約3nm)で、検出した全元素中にフッ素を20原子%含有している。このように相当量のフッ素の導入が撥水性には必要である。実際、フッ素が0原子%、5原子%存在しても撥水性は低いが、10原子%、15原子%、20原子%存在すると撥水性が示された。従って、表面においてフッ素を10原子%以上含有していることが望ましい。
【0030】
(相違点2)導電性:特許文献4は、電極であり導電性が必要であると述べている。しかし、一般にフッ素を含有するDLC膜は電極として使用できるほどの導電性を有していない。従って、特許文献4ではフッ素添加の効果を述べているが、このフッ素添加により電極として必要な導電性を失うため、臨床検査用のセンサ向け電極として使用できない。一方、本発明では誘電体としての性能を有するように、フッ素含有DLC膜の厚さを最適化しておおり、また中間層のSiO2層の厚さも最適化している。本実施例のような静電容量検知をノズルでは、電極として用いる場合よりも低い導電性でも十分に機能する。このノズル表面の最適構造により、撥水性と静電容量変化による液面検知を両立する。よって、本実施例が公知例とは異なる構造の特徴がある。
【0031】
(相違点3)耐久性:DLC膜の表面のみにフッ素を添加や結合させたノズルは、摩擦などへの耐久性がない。一方、本発明では、DLC構造の中にフッ素が共有結合しており、いくつもの結合状態(C−F、C−F2、C−F3)として相当量入っている。この構造を有するため、本発明は臨床検査用のノズルとして摩擦などへの耐久性が優れる。
【0032】
以上の3点により、本ノズルと公知例電極とは本質的に異なると考える。
【0033】
次に、本発明を実施例により詳細に説明するが、本発明は下記実施例に限定されるものではない。
<実験例>
最初に、解析の信頼性を高めるため、平面基板を用いて効果の検証を行った。用いた基板は、SUS基板で、大きさは10mm×10mm×0.5mmである。
(フッ素含有DLC層が固定化された基板:F−DLC基板の作成)
実験の工程フローを図3に示す。
【0034】
工程1.SUS表面にSiO2層を形成。
まず、ステンレススチール(SUS)表面に残存する油脂を除去するため、アルカリ性の溶剤で脱脂した。その後、酸素(O2)を反応性ガス、Arを放電ガスとする、DCマグネトロンスパッタリング装置を用い、Siをスパッタリングした。SiO2の成膜条件は以下の通りである。チャンバ内の到達真空度は、5×10-5Torrであり、ヒーター設定温度は423Kとした。その結果、SiO2の成膜速度は、0.2nm/秒である。こうして、SUS表面にSiO2層を10nm形成した。なお、スパッタリングでなく、薬液(SOG:Spin On Glass、塗布ガラス)の塗布乾燥によってもSiO2層は形成できる。
【0035】
工程2.SiO2層にフッ素含有DLCを形成。
工程1で作製した基板に対して、イオン蒸着装置を用いて、フッ素化炭化水素ガスを用いて成膜を行った。
【0036】
この時、用いるフッ素化炭化水素のガスを変化させることで、製膜するDLC膜に含まれるフッ素量を調整できる。以下、このようにして作製された基板をF−DLC基板ともいう。
【0037】
本発明による表面処理の効果を検証するために、参照用として以下の2枚の基板を用意した。
(参照基板1. SiO2膜を形成したSUS基板の作成)
まず、1枚目の参照基板の処理手順について説明する。先に述べた工程1の方法で、ステンレススチール基板にスパッタリングによりSiO2膜を形成した。このSiO2層の膜厚は10nmとした。次に、この板をエタノール中で15分間超音波洗浄した。この状態で水に対する接触角を上記と同様の方法により測定した。その結果、基板の水に対する接触角は10±1°であった。これにより表面が清浄となっていることを確認した。このSiO2膜を形成した基板を参照基板1とした。
(参照基板2. SUS基板の作成)
2枚目の参照基板としてステンレススチール基板を用意し、1%NaOH水溶液で15分間超音波洗浄し、その後にエタノールで15分間超音波洗浄を行った。この洗浄を行ったステンレススチール基板を参照基板2とした。
(BSA吸着試験)
生体高分子の吸着抑制効果の検証は、BSA(ウシ血清アルブミン)の吸着試験によって行った。まずBSAの1.0g/L溶液を用意した。溶媒としてはダルベッコリン酸緩衝溶液を用いた。作成した溶液に、準備した基板を30分間浸漬した。基板を引き上げ後、まずダルベッコリン酸緩衝溶液で十分に洗浄した。次いで、純水で十分に洗浄した。最後に窒素ブローにより乾燥させた。
【0038】
こうしてBSAを吸着試験した3枚の基板についてXPS測定を行い、表面組成を定量分析した。XPSの測定はPHI社製QuanteraSXMで行った。X線源としては単色化Al(1486.6eV)を用いた。検出領域はΦ100μmとし、取り出し角は45°とした。
【0039】
ワイドスキャン(結合エネルギー(Biding Energy)0〜1275eV、エネルギーステップ1.0eV)で測定した結果をもとに、検出された元素をナロースキャンした。その後、表面元素濃度の比率を求めた結果を表1に示す。参照基板2のステンレススチール基板からは、炭素(C)、酸素(O)、鉄(Fe)及びクロム(Cr)が検出された。参照基板1からは、ケイ素(Si)及び酸素(O)が検出されており、表面が酸化ケイ素によりコーティングされていることを確認した。F−DLC基板では、炭素が75.4原子%、フッ素が20.5原子%、酸素が4.1原子%検出されたが、鉄(Fe)、クロム(Cr)、ニッケル(Ni)は検出されなかった。このことから、下地である酸化ケイ素やステンレススチール成分が検出されていないことから、フッ素含有するDLC膜が緻密に形成されていることがわかる。なお、今回のXPS分析の検出下限は0.1原子%である。
【0040】
【表1】

【0041】
炭素の結合状態を検討するためにC1s(炭素1s)のナロースキャンを、結合エネルギーが278eVから296eVの範囲をエネルギーステップ0.1eVで測定した。
【0042】
BSA吸着試験後の結果を比較する。F−DLC基板及び参照基板1の測定結果を図4に示す。F−DLC基板の測定結果は、実線310で示す。矢印311の範囲はC−C、C−H結合、矢印312の範囲はC―CFx結合、C−O結合、矢印313の範囲はC=O、矢印314の範囲は、-C−F結合、O=C−O結合、矢印315の範囲は−CF2結合、矢印316の範囲は−CF3結合の検出される範囲である。図4に示されたように、C−C,C−H結合のピークの他に、C−FやC−F2やC−F3結合に帰属されるピークが強く検出された。これはDLC層内に複数の結合状態としてC−F結合があることを反映している。単にフッ素が表面に塗られているわけではないことがわかる。得られた炭素、酸素、フッ素のナロースキャンから求めた、F−DLC基板の炭素の結合存在比率を表2に示す。
【0043】
その結果、C−C及びC−H結合が75.4%、C―CFx(x=1〜3)結合及びC−O結合が14.3%、C=O結合が3.1%、-C−F結合及びO=C−O結合が10.9%、CF2結合が8.0%、CF3結合が2.4%存在した。
【0044】
【表2】

【0045】
一方、参照基板1の測定結果は、太線320で示す。矢印321の範囲はC−C、C−H結合、矢印322の範囲はC−O結合、矢印323の範囲はC=O、O=C−O、CO3結合の検出される範囲である。また、矢印324の範囲は、ガラスに由来するカリウム(K2p)のピークである。
【0046】
次に、基板ごとのBSA吸着量比較について説明する。BSAのステンレススチール表面への吸着についてはXPSにより、BSA中の窒素原子(N)に対応するN1sピークにより定量分析が可能である。ここでN1sピークはBSAに含まれているアミン、アミドに帰属される。そこで本実施例ではBSAの基板ごとの相対吸着量をN1s量により定量し、基板表面へのタンパク質吸着に対する抑制効果を検証した。
【0047】
結果を図5に示す。細線331がフッ素DLC基板のスペクトル、太線332が参照基板1のスペクトル、破線333が参照基板2のスペクトルである。BSAが吸着した、SiO2層を有する基板(参照基板1)の表面及びステンレススチール基板(参照基板2)の表面では、結合エネルギー400eV付近にピークを持つ対称形のN1sのピークが観察された。
【0048】
N1sのピーク面積の解析は、バックグラウンドを395eVから405eVまでを直線で差し引くことで行った。各元素のピーク面積から求まるN1sの表面元素濃度(原子%)を表3に示す。表3は、F−DLC基板、SiO2のみを有する参照基板1をSiO2/SUS基板、参照基板2はステンレススチール基板とした。
【0049】
【表3】

【0050】
SiO2膜を形成したステンレススチール(SUS)基板での窒素比率は5.0%であり、PEG溶液浸漬基板ではN1sは検出限界以下となった。また、ステンレススチール基板では、窒素の表面元素濃度が3.0%であった。本測定での検出限界(窒素の含有量で0.1%)を考慮すると、F−DLC基板では、SiO2膜を形成した基板に対してBSAの吸着量が1/50以下となり、BSAの吸着を抑制できることを確認した。また、PEG溶液浸漬基板では、ステンレススチール基板に対してBSAの吸着量が1/30以下となり、BSAの吸着を抑制できることを確認した。
【0051】
以上の結果から、ステンレススチール上にSiO2層を形成し、フッ素含有DLC層を形成することで、分注ノズル表面のタンパク質に代表される生体高分子の吸着が大幅に抑制されることが示された。
【0052】
本実施例では、分注ノズルに実験例と同様の処理を行う場合について説明する。まずステンレススチール製分注ノズルの表面に、実験例と同様の方法でSiO2層とフッ素含有DLC層を形成した。なお、ノズル形状が円筒形であることから、この表面処理中はノズルを回転させながら均一に表面処理した。この表面処理層を形成する領域は、図1の分注ノズルの端部105及び検体に浸漬される領域104とした。本実施例では、処理されたノズル先端部の外径は0.5mm、内径は0.3mmであり、先端10mmの領域にSiO2層を10nm、フッ素含有DLC層を100nmの厚さに形成した。分注ノズル全面にフッ素含有DLC層を形成することも可能であるが、形成する領域を検体に浸漬される部分に限定することでコストを低減することが出来る。形成した膜構造は実験例と同様にXPS分析で確認した。その結果、実験例と同様の表面が形成されていることを確認した。
【0053】
フッ素含有DLC層形成の検証は、実験例と同様に、BSAの表面残存量の測定をXPSで行った。その結果、分注後の分注ノズル表面に残存するタンパク質が従来のステンレススチール製のノズルと比較して1/50以下(実験例で述べたXPS測定の検出限界以下)に低減されることを確認した。
【0054】
図6は、本実施例による自動分析装置の構成例を示す図であり、次にその基本構成を述べる。検体収納部機構1には、一つ以上の検体容器25が配置されている。ここでは、ディスク状の機構部に搭載された検体収納部機構である検体ディスク機構の例で説明するが、検体収納部機構の他の形態としては自動分析装置で一般的に用いられている検体ラック又は検体ホルダー状の形態であってもよい。またここで言う検体とは、反応容器で反応させるために使用する被検査溶液のことを指し、採集検体原液でもよく、またそれを希釈や前処理等の加工処理をした溶液であってもよい。検体容器25内の検体は、検体供給用分注機構2の検体分注ノズル27によって吸引され、所定の反応容器に注入される。検体分注ノズルは、実施例1に記述した方法でフッ素含有DLC層を形成した。試薬ディスク機構5は、多数の試薬容器6を備えている。また、機構5には、試薬供給用分注機構7が配置されており、試薬は、この機構7の試薬分注ノズル28によって、吸引され所定の反応セルに注入される。10は分光光度計、26は集光フィルタつき光源であり、分光光度計10と集光フィルタつき光源26の間に、測定対象を収容する反応ディスク3が配置される。この反応ディスク3の外周上には、例えば、120個の反応セル4が設置されている。また、反応ディスク3の全体は、恒温槽9によって、所定の温度に保持されている。11は反応セル洗浄機構であり、洗浄剤容器13から洗浄剤が供給され、セル内の吸引は吸引ノズル12で行う。
【0055】
19はコンピュータ、23はインターフェース、18はLog変換器及びA/D変換器、17は試薬用ピペッタ、16は洗浄水ポンプ、15は検体用ピペッタである。また、20はプリンタ、21は表示装置、22は記憶装置としてのフロッピー(登録商標)ディスクやハードディスク、24は操作パネルである。検体ディスク機構は駆動部200により、試薬ディスク機構は駆動部201により、反応ディスクは駆動部202により、それぞれインターフェースを介して制御並びに駆動されている。また自動分析装置の各部はインターフェースを介してマイクロコンピュータ19により制御される。
【0056】
上述の構成において、操作者は、操作パネル24を用いて分析依頼情報の入力を行う。操作者が入力した分析依頼情報は、マイクロコンピュータ19内のメモリに記憶される。検体容器25に入れられ、検体収納部機構1の所定の位置にセットされた測定対象検体はマイクロコンピュータ19のメモリに記憶された分析依頼情報に従って、検体ピペッタ15及び検体供給用分注機構2の表面処理された検体分注ノズル27によって、反応セルに所定量分注される。表面処理された検体分注ノズル27は水洗浄され、次の検体の分注に使用される。
【0057】
この時、フッ素含有DLC層で被覆された検体分注ノズル27を用いることでタンパク質に代表される生体高分子の吸着を抑制し、検体間のキャリーオーバを従来のステンレススチール製分注ノズルに比較して1/2以下に低減することができた。キャリーオーバは洗浄した後での比較である。したがって、キャリーオーバをさらに低下させることは難しいにもかかわらず、ノズルに表面処理することで、キャリーオーバ率を低下できたことは著しい進歩である。またこの時、ノズル表面のSiO2層が10nm、フッ素含有DLC層が100nm以下と薄いため、静電容量の変化を用いて液面検知を行うことが出来る。反応セルに試薬供給用分注機構7の試薬分注ノズル28によって、所定量の試薬が分注される。試薬分注ノズル28は水洗浄された後、次の反応セルのための試薬を分注する。検体と試薬の混合液は、撹拌機構8の攪拌棒29によって撹拌される。撹拌機構8は順次、次の反応セルの混合液を撹拌する。
【0058】
ここで、この装置に搭載されている液面検知の原理を説明する。搭載液面検知の原理には、静電容量方式を採用している。静電容量方式では、ノズルとグラウンド(本実施例の場合では検体容器の底が相当)間の静電容量値を測定する。誘電率の高い物質に接触した際に、静電容量が空気中に比べて大きくなることを利用している。
【0059】
図7に静電容量方式による液面検知の概念図を示す。表面処理をしていない金属ノズルを使用した場合である。金属ノズル410が、検体容器412中の検体413に触れていない。検体容器が接する装置本体411をグラウンドとした場合、ノズルとグラウンド間の静電容量は、空気の静電容量C0と検体(水)の静電容量C1で決まる。この際の合計の静電容量Cは、C=(C0×C1)/(C0+C1)である。
【0060】
一方、図8にノズルが液面に触れた場合の概念図を示す。金属ノズル410が、検体容器412中の液体413に触れている。検体容器が装置本体411をグラウンドとした場合、ノズルとグラウンド間の静電容量はC1である。
【0061】
この方式を利用することで、本実施例の酸化ケイ素(SiO2)およびフッ素含有DLC層で被覆したノズルでも液面検知が可能である。図9に、表面処理層(酸化ケイ素およびフッ素含有DLC)で被覆したノズルでの液面検知の例を示す。表面処理層414を有する金属ノズル410が、検体容器412中の液体413に触れていない場合を示す。検体容器が接する装置本体411をグラウンドとする。表面処理層の静電容量C2とする。表面処理層で被覆したノズルが空気中にある場合の静電容量をCxとすると、1/Cx=1/C0+1/C1+1/C2となる。
【0062】
一方、図10に、表面処理層414を有する金属ノズル410が、検体容器412中の液体413に触れている場合を示す。検体ボトルが接する装置本体411をグラウンドとする。表面処理層の静電容量をC2とする。表面処理層で被覆したノズルが液面に触れている場合の静電容量をCyとすると、1/Cy=1/C1+1/C2となり、空気中の静電容量Cxと異なることから液面を検知できる。
【0063】
何らかの衝撃や接触で、このノズルの表面処理層にあるSiO2層やフッ素含有DLC層が割れた場合、金属ノズルが空気と直接触れるため、表面処理層の静電容量C2を無視できる。すると、静電容量が大幅に変化するので、ノズル上のSiO2層やフッ素含有DLC層の傷や割れを検知できる。SiO2層やフッ素含有DLC層の傷や割れが生じた場合、そこをきっかけとしてキャリーオーバが増加することがあり得る。したがって、表面処理層の傷や割れを検知できることは重要である。また、初期値からの静電容量のズレがある閾値を超えた場合や、ノズル交換に伴う初期値の変更も記憶する記憶媒体32がある。
【0064】
本実施例の自動分析装置には、この静電容量の変化を検知する検知機構31、ノズルの交換時期や分析正確性を知らせるインジケータ30が搭載されている。このインジケータは正常時には青色を示し、静電容量の変化を常に測定しており、ノズル表面の酸化ケイ素層に割れや傷等の異常が発生した際には、静電容量の変化からその異常を検知し、インターフェースを介してインジケータ30を例えば赤色に表示して報知する。また、この際に分析したサンプルについては、装置上で記憶しており、ノズル交換後に分析データを再取得するプログラムを内蔵している。
【0065】
以上の実施例では検体分注ノズルにおけるキャリーオーバを問題としたが、攪拌棒などキャリーオーバの要因となりうる全ての部材において、本発明の処理を行うことで、同様の効果が得られる。
【0066】
本発明によれば、分注ノズル表面へのタンパク質などの生体高分子の非特異吸着を劇的に低減し、キャリーオーバの抑制を図ることで、自動分析装置の信頼性の向上に貢献することが出来る。また、このため検体微量化、試薬の微量化にも貢献し、ランニングコストや環境負荷の低減をすることが出来る。
【符号の説明】
【0067】
1…検体収納部機構、2…検体供給用分注機構、3…反応ディスク、4…反応セル、5…試薬ディスク機構、6…試薬容器、7…試薬供給用分注機構、8…撹拌機構、9…恒温槽、10…分光光度計、11…反応セル洗浄機構、12…吸引ノズル、13…洗浄剤容器、15…検体用ピペッタ、16…洗浄水ポンプ、17…試薬用ピペッタ、25…検体容器、26…集光フィルタつき光源、27…検体分注ノズル、28…試薬分注ノズル、29…撹拌棒、30…インジケータ、31…検知機構、32…記憶媒体、101…分注ノズル本体部、111…分注ノズル本体部、112…金薄膜層、113…親水性分子層、200…駆動部、201…駆動部、202…駆動部、310…実線、311…矢印、312…矢印、313…矢印、314…矢印、315…矢印、316…矢印、320…太線、321…矢印、322…矢印、323…矢印、324…矢印、331…細線、332…太線、332…破線333、410…分注ノズル、411…装置本体、412…検体容器、413…検体、414…表面処理層。
【特許請求の範囲】
【請求項1】
それぞれが検体を収納する複数の検体容器と、
それぞれが試薬を収納する複数の試薬容器と、
検体と試薬が注入される複数の反応セルと、
検体分注ノズルを備え、検体を前記検体容器から前記反応セルに分注する検体分注機構と、
試薬分注ノズルを備え、試薬を前記試薬容器から前記反応セルに分注する試薬分注機構とを有する分析装置において、
前記検体分注ノズルは、金属性のノズル本体と、前記ノズル本体上に設けられたフッ素含有DLC(ダイアモンドカーボン)層とを有することを特徴とする分析装置。
【請求項2】
請求項1に記載の分析装置において、
前記ノズル本体と前記フッ素含有DLC層との間に、酸化ケイ素層を備えたことを特徴とする分析装置。
【請求項3】
請求項2に記載の分析装置において、
前記検体分注ノズルは、その先端を前記酸化ケイ素層及び前記フッ塩含有DLC層に覆われており、
前記検体分注ノズルのノズル本体に電気的に接続され、前記酸化ケイ素層及び前記フッ素含有DLC層を介して静電容量を検知するによって液面を検知する液面検知機構を備えたことを特徴とする分析装置。
【請求項4】
請求項1乃至3のいずれかに記載の分析装置において、
前記フッ素を有するダイアモンドライクカーボン層が存在する前記検体分注ノズルの領域は、分注動作時に前記検体分注ノズルが検体に浸漬される領域よりも大きいことを特徴とする分析装置。
【請求項5】
請求項1乃至4のいずれかに記載の分析装置において、
前記フッ素含有ダイアモンドカーボン層は、フッ素を10原子%以上含み、厚さが10nm〜100nmであることを特徴とする分析装置。
【請求項6】
請求項3に記載の分析装置において、
前記静電容量の変化に基いて、前記酸化ケイ素層の異常を検知する機構と、
前記異常を検知したとき、それを報知するインジケータを備えることを特徴とする分析装置。
【請求項7】
検体を検体容器から反応セルに分注する分析装置の検体分注機構に用いられる分析装置用分注ノズルにおいて、
金属性のノズル本体と、前記ノズル本体上に設けられたフッ素含有DLC(ダイアモンドカーボン)層とを有することを特徴とする分析装置用分注ノズル。
【請求項8】
検体容器中の検体を反応セルに分注するのに用いられる分析装置用分注ノズルの製造方法において、
スパッタリング又は薬液塗布及び乾燥を用いて分注ノズル本体の表面に酸化ケイ素層を形成する工程と、
前記酸化ケイ素層上にフッ素含有DLC層を形成する工程と、
を有することを特徴とする分析装置用分注ノズルの製造方法。
【請求項1】
それぞれが検体を収納する複数の検体容器と、
それぞれが試薬を収納する複数の試薬容器と、
検体と試薬が注入される複数の反応セルと、
検体分注ノズルを備え、検体を前記検体容器から前記反応セルに分注する検体分注機構と、
試薬分注ノズルを備え、試薬を前記試薬容器から前記反応セルに分注する試薬分注機構とを有する分析装置において、
前記検体分注ノズルは、金属性のノズル本体と、前記ノズル本体上に設けられたフッ素含有DLC(ダイアモンドカーボン)層とを有することを特徴とする分析装置。
【請求項2】
請求項1に記載の分析装置において、
前記ノズル本体と前記フッ素含有DLC層との間に、酸化ケイ素層を備えたことを特徴とする分析装置。
【請求項3】
請求項2に記載の分析装置において、
前記検体分注ノズルは、その先端を前記酸化ケイ素層及び前記フッ塩含有DLC層に覆われており、
前記検体分注ノズルのノズル本体に電気的に接続され、前記酸化ケイ素層及び前記フッ素含有DLC層を介して静電容量を検知するによって液面を検知する液面検知機構を備えたことを特徴とする分析装置。
【請求項4】
請求項1乃至3のいずれかに記載の分析装置において、
前記フッ素を有するダイアモンドライクカーボン層が存在する前記検体分注ノズルの領域は、分注動作時に前記検体分注ノズルが検体に浸漬される領域よりも大きいことを特徴とする分析装置。
【請求項5】
請求項1乃至4のいずれかに記載の分析装置において、
前記フッ素含有ダイアモンドカーボン層は、フッ素を10原子%以上含み、厚さが10nm〜100nmであることを特徴とする分析装置。
【請求項6】
請求項3に記載の分析装置において、
前記静電容量の変化に基いて、前記酸化ケイ素層の異常を検知する機構と、
前記異常を検知したとき、それを報知するインジケータを備えることを特徴とする分析装置。
【請求項7】
検体を検体容器から反応セルに分注する分析装置の検体分注機構に用いられる分析装置用分注ノズルにおいて、
金属性のノズル本体と、前記ノズル本体上に設けられたフッ素含有DLC(ダイアモンドカーボン)層とを有することを特徴とする分析装置用分注ノズル。
【請求項8】
検体容器中の検体を反応セルに分注するのに用いられる分析装置用分注ノズルの製造方法において、
スパッタリング又は薬液塗布及び乾燥を用いて分注ノズル本体の表面に酸化ケイ素層を形成する工程と、
前記酸化ケイ素層上にフッ素含有DLC層を形成する工程と、
を有することを特徴とする分析装置用分注ノズルの製造方法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【公開番号】特開2013−44623(P2013−44623A)
【公開日】平成25年3月4日(2013.3.4)
【国際特許分類】
【出願番号】特願2011−182101(P2011−182101)
【出願日】平成23年8月24日(2011.8.24)
【出願人】(501387839)株式会社日立ハイテクノロジーズ (4,325)
【Fターム(参考)】
【公開日】平成25年3月4日(2013.3.4)
【国際特許分類】
【出願日】平成23年8月24日(2011.8.24)
【出願人】(501387839)株式会社日立ハイテクノロジーズ (4,325)
【Fターム(参考)】
[ Back to top ]

