分泌された三量体受容体類似体及び生物学的活性融合タンパク質を製造するための方法及び組成物
分泌された可溶性受容体及び生物学的活性ポリペプチドを三量体形態で生成するための方法及び組成物が記載される。この方法はリガンド結合ドメインまたは生物学的活性ポリペプチドと共に可溶性受容体をコード化するDNA鋳型を、共有結合された三量体を自己構築できるコラーゲンのC−プロペプチドをコード化するDNA配列と融合することを含む。生成した融合タンパク質は三量体性可溶性受容体類似体で分泌され、これはこれらの天然産出三量体性リガンドの生物学的活性の効果的な中和のために使われることができる。
【発明の詳細な説明】
【技術分野】
【0001】
本発明はタンパク質発現方法、詳細には三量体(trimeric)可溶性受容体(receptor)のような分泌されて生物学的活性である三量体タンパク質の生成及び発現方法に関する。
【背景技術】
【0002】
人間のような多細胞生物において、細胞はいわゆる“信号伝達経路”により相互に疎通され、分泌されたリガンド(例えばサイトカイン、生長因子またはホルモン)はその細胞表面受容体に反応して受容体活性化をもたらす。受容体は、信号を下流に送るのに関与する細胞質ドメイン、中央トランスメンブレイン(transmembrane)領域、およびリガンド結合に関与する細胞外ドメイン(extracellular domain)で構成された膜タンパク質である。信号伝達は次のような3種の方法で実施することができる:分泌された信号の供給源及び受容体を発現する標的細胞の位置によって、周辺分泌(隣接細胞間と疎通)、自己分泌(自身との細胞疎通)及び内分泌(循環を介した遠く離れている細胞間の疎通)。遺伝子発現の活性化をはじめとする細胞膜下の一連の事件を開始させる受容体活性化に対する一般的なメカニズムの一つはサイトカインのようなポリペプチドリガンドが同種二量体(dimer)または三量体(trimer)のようなオリゴマー型で存在して、その単量体受容体が細胞外部表面に結合されれば受容体のオリゴマー化をもたらすものである。信号伝達経路は細菌またはウイルス感染のような外部損傷に反応するだけでなく正常細胞発達及び分化にも重要な役割をする。活性低下(例えばリガンドの不足)または過度な活性(例えば過剰なリガンド)のいずれかの形態である信号伝達経路の異常は関節炎、癌、AIDS及び糖尿病のような病理学的状態及び疾病の原因でもある。
【0003】
これらの疾病を治療するための現在の方法のうちの一つは、リガンドを遮断するために細胞外リガンド結合ドメインだけで構成された可溶性受容体のような誘引(decoy)受容体を用いることによって受容体の過度な活性化を克服するものである。このような戦略の最も顕著な例は、いまはアムジェン社の一部であるイミュネクス(Mohlerなど、1993;Jacobsなど、1997)による二量体性可溶性TNF−α受容体イミュノグロブリンG(IgG)融合タンパク質であるエンブレル(Enbrel)の創製である。サイトカインのTNFファミリーは感染または組織損傷に反応して体内で生じる主要な炎症誘発信号中の一つである。しかし、例えば感染や組織損傷の不在下でこれらサイトカインの非正常的生産は関節炎及び乾癬のような疾病の根本原因中の一つで明らかになった。自然的に、TNF−α受容体は、対照的に同種三量体で存在するそのリガンド、すなわちTNF−αに結合する前に細胞表面上で単量体形態で存在する(Locksleyなど、2001)。したがって、ジスルフィド結合(Sledziewskiなど、1992及び1998)を介して自然的に二量化されることができる免疫グロブリンG1のFc領域と可溶性TNF−α受容体の融合は二量体性可溶性TNF−α受容体の分泌を許す(Mohlerなど、1993;Jacobsなど、1997)。単量体性可溶性受容体と対照的に、二量体性TNF−α受容体II−Fc融合は同種三量体リガンドに対する親和性を顕著に増加させた。これは主要炎症誘発性サイトカインである構成的に増加されたTNF−αが重要な原因役割をする自己免疫疾病であるリウマチ性関節炎(RA)の治療においてその臨床的適用に対する分子的基礎を提供する。エンブレル(Enbrel)はpM範囲(ng/mL)のKiないしTNF−α(Mohleremd、1993)を有することと明らかになっているが、RA患者が臨床的効果を得るためには、μg/mL水準換算で25mgの可溶性受容体皮下注射が週2回必要である(www.enbrel.com)。RA患者当たり周期的な多量のエンブレル消費は薬物供給に対する高費用だけでなく大きい苦痛をもたらして米国国内でだけ数百万の潜在的患者において薬物接近容易性を制限している。
【0004】
強力な炎症誘発性サイトカインのTNF−αファミリー以外に、AIDSを誘発するHIVウイルスは私たちの体内のCD−4陽性Tヘルパー細胞に入るために同種三量体性被膜タンパク質、gp120を利用する(Kwongなど、1998)。HIV感染において最も先に生じる事件のうちの一つはgp120がその受容体CD−4に結合されるのを含み、これはTヘルパー細胞の細胞表面上で固有に発現される(Claphamなど、2001)。単量体性可溶性CD−4は十余年間HIV感染に対する強力な物質で明らかになったが(Claphamなど、1989)、その効能が実験室HIV分離物にだけ限られることが明らかになるにつれ期待は薄まった(Daarなど、1990)。実験室分離物とは違って、AIDS患者から得たHIV株はgp120における配列変異によって単量体性可溶性CD−4に対する親和性がはるかに低いことに明かされた(Daarなど、1990)。二量体性可溶性CD−4−Fc融合タンパク質が作られるが、これら誘引CD−4HIV受容体はgp120に対する低い親和性によって実験室でも臨床試験でもAIDS患者から得た天然産出のHIVに対しては抗ウイルス効果をほとんど示さなかった(Daarなど、1990)。
【0005】
明らかに、結合部位を完全に結合してサイトカインのTNFファミリー及びHIV被膜タンパク質のような天然産出の同種三量体性リガンドに対する親和性がさらに高い、分泌された同種三量体性可溶性受容体または生物学的活性タンパク質の創製が強く要求されている。このような三量体性誘引受容体は理論的に三量体性リガンドに対して二量体性受容体に比べてはるかに高い親和性を有しなければならない。このような理性的に考案された可溶性三量体性受容体類似体は臨床的効果を顕著に向上させることができるだけでなく各患者に対する薬物注射の量または頻度を減らすことができた。免疫グロブリンFcのように治療的に使用可能になるように、所望する三量体性タンパク質残基は理想的には体内に多量に存在して效率的に自己三量体化できる天然分泌されたタンパク質の一部でなければならない。
【0006】
コラーゲンは細胞外マトリックスの主要成分である繊維状タンパク質ファミリーである。これは哺乳動物で最も豊富なタンパク質であり、体内全体タンパク質のほぼ25%を占める。コラーゲンは骨、筋、皮膚、角膜、軟骨、血液及び歯牙の形成に重要な構造的役割を担当する(Stryer、1988)。原繊維性(fibrillar)形態のコラーゲンI、II、III、IV、V及びXIはすべてプロコラーゲンと呼ばれる大型三量体性前駆体で合成され、数百個の“G−X−Y”反復体(またはグリシン反復体)で構成される中央の連続された(uninterrupted)三重螺旋ドメインは非コラーゲン性ドメイン(NC)、N−プロペプチド及びC−プロペプチドと隣接している(Stryer、1988)。C−及びN−末端延長部は、非可溶性細胞マトリックスを形成する成熟タンパク質のコラーゲンフィブリル構築を誘発する事件である、プロコラーゲンの分泌時に、タンパク質分解的に処理される(Prockopなど、1998)。落ちたI形コラーゲンの三量体性C−プロペプチドは正常人の血液に100−600ng/mL濃度で発見され、子供がさらに多量を有しており、これは活発な骨形成を示すものである。
【0007】
I、IV、V及びXI形コラーゲンは主に2個のα−1鎖及び1個のα−2鎖で構成されたり(I、IV、V型)または3個の相異なるα鎖で構成(XI形)されて配列上相同性が高い異種三量体性(heterotrimeric)形態で構築される。II及びIII形コラーゲンはすべてα−1鎖の同種三量体である。最も豊富な形態のコラーゲンであるI形コラーゲンの場合、安定したα−1(I)同種三量体が形成され、相異なる組織で多様な量で存在する(Alvaresなど、1999)。これらコラーゲンC−プロペプチド鎖の大部分は、細胞で単独に過発現されると、同種三量体で自己構築されることができる。N−プロペプチドドメインが先に合成されるが、三量体への分子構築はC−プロペプチドの登録組合(in−register association)により開始される。C−プロペプチド複合体は鎖内ジスルフィド結合形成により安定化されるが、好適な鎖登録のためのジスルフィド結合形成に対する必要性は明らかでない。グリシン反復体の三重螺旋は組み合わされたC−末端からジッパーのような方式でN−末端に延長される。このような知識を基礎にして再組合DNA技術を利用して相異なるコラーゲン鎖のC−プロペプチドを交換することにより非天然類型のコラーゲンマトリックスを創製することに至った(Bulleidなど、2001)。サイトカイン及び生長因子のような非コラーゲン性タンパク質はプロ−コラーゲンまたは成熟コラーゲンのN−末端に融合されて新しいコラーゲンマトリックスを形成し、これは細胞マトリックスから非コラーゲン性タンパク質の遅い放出を許す(Tomitaなど、2001)。しかし、上述した場合すべて、C−プロペプチドは再組合コラーゲンフィブリルが不溶性細胞マトリックスに構築される前に分解される必要がある。
【発明の開示】
【0008】
本発明には分泌されたタンパク質で三量体性形態で製造される可溶性受容体または生物学的活性ポリペプチドが開示されている。本発明の本質はフレームのうちの可溶性受容体及び生物学的活性タンパク質を、自己三量体化されることができる原繊維性コラーゲンのC−プロペプチドドメインに、再組合技術を利用して融合させるものである。生成された融合タンパク質は、真核生物細胞で発現されれば、3個のC−プロペプチド間に形成された分子間ジスルフィド結合により共有結合的に強化された主に三量体性形態の可溶性タンパク質で分泌される。
【0009】
本発明の一つの要旨で、
(a)三量体化される非コラーゲンポリペプチドにフレーム内で連結され、自己三量体化されることができるコラーゲンのC−末端部分にフレーム内で連結された信号ペプチド配列で構成されたオープンリーディングフレームの転写を誘導するプロモーターを含むDNA作成物を真核生物宿主細胞に導入して;
(b)生理的条件下の好適な生長培地で宿主細胞を生長させて前記DNA配列によりコード化されて三量体化された融合タンパク質の分泌を許し;また
(c)分泌された三量体性融合タンパク質を宿主細胞から分離することを含む、分泌された三量体性融合タンパク質の製造方法が記載されている。
【0010】
一つの具体例で、信号ペプチド配列は三量体化されるタンパク質の天然配列である。他の具体例で、信号ペプチド配列は三量体化されるタンパク質とは相異なる分泌されたタンパク質から得たことである。一つの具体例で、三量体化される非コラーゲンポリペプチドはリガンド結合ドメインで構成された可溶性受容体である。一つの具体例で、コラーゲンのC−末端部分はコラーゲンの三重螺旋領域を持たないC−プロペプチドである(配列番号:3−4)。異なる具体例で、C−末端コラーゲンは三量体化される非コラーゲン性タンパク質に対するリンカーでコラーゲンの三重螺旋領域の一部で構成される(配列番号:1−2)。異なる具体例で、コラーゲンのC−末端部分は突然変異されたまたは欠失されたBMP−1プロテアーゼ認識部位(配列番号:3−4)である。
【0011】
本発明の一つの要旨で、
(a)三量体化される非コラーゲンポリペプチドにフレーム内で連結され、自己三量体化されることができて、プロ.α.1(I)、プロ.α.2(I)、プロ.α.1(II)、プロ.α.1(III)、プロ.α.1(V)、プロ.α.2(V)、プロ.α.1(XI)、プロ.α.2(XI)及びプロ.α.3(XI)から選択されるコラーゲンのC−末端部分にフレーム内で連結された信号ペプチド配列で構成されたオープンリーディングフレームの転写を誘導するプロモーターを含むDNA作成物を真核生物宿主細胞に導入して;
(b)生理的条件下の好適な生長培地で宿主細胞を生長させて前記DNA配列によりコード化されて三量体化された融合タンパク質の分泌を許し;また
(c)分泌された三量体性融合タンパク質を宿主細胞から分離することを含む、分泌された三量体性融合タンパク質の製造方法が記載されている。
望ましい具体例で、三量体化される非コラーゲンポリペプチドは可溶性TNF−RII(p75)(配列番号:9−12)である。他の望ましい具体例で、三量体化される非コラーゲンポリペプチドはHIVの共同受容体である可溶性CD−4(配列番号:13−16)である。他の望ましい具体例で、三量体化される非コラーゲンポリペプチドは胎盤分泌されたアルカリ性ホスファターゼである(配列番号:5−8)。
【0012】
本発明の一介具体例で、
(a)三量体化される非コラーゲンポリペプチドにフレーム内で連結され、自己三量体化されることができて、プロ.α.1(I)、プロ.α.2(I)、プロ.α.1(II)、プロ.α.1(III)、プロ.α.1(V)、プロ.α.2(V)、プロ.α.1(XI)、プロ.α.2(XI)及びプロ.α.3(XI)から選択されるコラーゲンのC−末端部分にフレーム内で連結された信号ペプチド配列で構成されたオープンリーディングフレームの転写を誘導するプロモーターを含む第1DNA作成物を真核生物宿主細胞に導入して;
(b)三量体化される第2非コラーゲンポリペプチドにフレーム内で連結され、自己三量体化されることができて、プロ.α.1(I)、プロ.α.2(I)、プロ.α.1(II)、プロ.α.1(III)、プロ.α.1(V)、プロ.α.2(V)、プロ.α.1(XI)、プロ.α.2(XI)及びプロ.α.3(XI)から選択されるコラーゲンの第2C−末端部分に、フレーム内で連結された信号ペプチド配列で構成されたオープンリーディングフレームの転写を誘導するプロモーターを含む第2DNA作成物を真核生物宿主細胞に導入して;
(c)生理的条件下の好適な生長培地で宿主細胞を生長させて前記第1及び第2DNA配列によりコード化されて三量体化された融合タンパク質の分泌を許し;また
(d)分泌された三量体性融合タンパク質を宿主細胞から分離することを含む分泌された三量体性融合タンパク質の製造方法が記載されている。
【0013】
本発明の一介具体例で、
(a)三量体化される非コラーゲンポリペプチドにフレーム内で連結され、自己三量体化されることができて、プロ.α.1(I)、プロ.α.2(I)、プロ.α.1(II)、プロ.α.1(III)、プロ.α.1(V)、プロ.α.2(V)、プロ.α.1(XI)、プロ.α.2(XI)及びプロ.α.3(XI)から選択されるコラーゲンのC−末端部分にフレーム内で連結された信号ペプチド配列で構成されたオープンリーディングフレームの転写を誘導するプロモーターを含む第1DNA作成物を真核生物宿主細胞に導入して;
(b)三量体化される第2非コラーゲンポリペプチドにフレーム内で連結され、自己三量体化されることができて、プロ.α.1(I)、プロ.α.2(I)、プロ.α.1(II)、プロ.α.1(III)、プロ.α.1(V)、プロ.α.2(V)、プロ.α.1(XI)、プロ.α.2(XI)及びプロ.α.3(XI)から選択されるコラーゲンの第2C−末端部分にフレーム内で連結された信号ペプチド配列で構成されたオープンリーディングフレームの転写を誘導するプロモーターを含む第2DNA作成物を真核生物宿主細胞に導入して;
(c)三量体化される第3非コラーゲンポリペプチドに、フレーム内で連結され、自己三量体化されることができて、プロ.α.1(I)、プロ.α.2(I)、プロ.α.1(II)、プロ.α.1(III)、プロ.α.1(V)、プロ.α.2(V)、プロ.α.1(XI)、プロ.α.2(XI)及びプロ.α.3(XI)から選択されるコラーゲンの第3C−末端部分にフレーム内で連結された信号ペプチド配列で構成されたオープンリーディングフレームの転写を誘導するプロモーターを含む第3DNA作成物を真核生物宿主細胞に導入して;
(d)生理的条件下の好適な生長培地で宿主細胞を生長させて前記第1及び第2DNA配列によりコード化されて三量体化された融合タンパク質の分泌を許し;また
(e)分泌された三量体性融合タンパク質を宿主細胞から分離することを含む分泌された三量体性融合タンパク質の製造方法が記載されている。
【0014】
本発明の利点は次のようである:(1)コラーゲンは哺乳動物の体内で分泌される最も豊富なタンパク質で、体内の全体タンパク質のほぼ25%を占める;(2)コラーゲンの主要形態は天然で三量体螺旋で生じて、これらの球形C−プロペプチドは三量体化開始に関与して;(3)成熟コラーゲンからタンパク質分解的に放出されたコラーゲンの三量体性C−プロペプチドは哺乳類の血液でマイクログラム/mL以下の量で天然に発見されて体内に毒性は知られていないで;(4)一定な三重螺旋領域は残基当たり2.9Åスペースを有するリンカーで含まれることができたり、三量体化されるタンパク質とコラーゲンのC−プロペプチド間の距離が最適の生物学的活性を達成するように調整されることができて;(5)プロコラーゲンのC−プロペプチドを切断するBMPIの認識部位は突然変異されたりまたは欠失されて三量体性融合タンパク質の破壊を防止し;(6)C−プロペプチドドメインは普遍的な親和性タグを提供するので、本発明によって創製された分泌された融合タンパク質の精製のために使われることができる。
【0015】
分泌された二量体性融合タンパク質が創製されることができるFcタグ技術(Sledziewskiなど、1992及び1998)と対照的に、本明細書に記載された発明は初めて可溶性三量体性融合タンパク質の創製と分泌を可能にする。同種三量体が三重対称であって同種二量体は二重対称であることを考慮する時、2個の明らかな構造的形態は理論的には決して完全に重なることができない(図1)。したがって、同種二量体性可溶性TNF−R−Fc(例えばエンブレル)だけでなく可溶性CD4−Fc融合タンパク質も相応する同種三量体性リガンドTNF−α及びHIV gp120それぞれに結合する最適のインターフェースを有することができないことである。対照的に、本発明によって創製された同種三量体性可溶性TNF受容体及びCD4は三価であって構造的に相応する同種三量体性リガンドに対して完全に結合することができる可能性を有する。したがって、これら三量体性可溶性受容体類似体はこれらの三量体性リガンドの生物学的活性を中和させるのにさらに効果的であることができる。本発明により、本発明の望ましい具体例に記載された三量体性可溶性TNF−R及びCD4のようなさらに効果的だが値はさらに低廉な薬物を容易にまた関節炎及びAIDSのような衰弱させる疾病を撲滅するために理性的に考案されることができる。三量体性可溶性gp120は本発明によって創製されることができて、HIVウイルスで発見される天然の三量体性gp120被膜タンパク質複合体をさらによく摸倣することができて以前に使われた非三量体性gp120と比較してはるかに効果的なワクチンで使われることができる。三量体性形態のキメラ抗体(chimeric antibodies)を本発明によって製造することができて、その抗原の中和で著しく増加された抗体親和力を与えることができた。
[配列目録の簡単な説明]
配列番号1:(963塩基)
C−プロペプチド人間コラーゲンα(I)T0構造物をコード化するヌクレオチド配列。このcDNA作成物をpAPtag2ベクターにクローニングしてAPコーディング領域を置換した。アンダーラインを引いた配列は相応するpTRIMERベクター作成時使われた制限酵素部位を意味する。濃く表示されたコドンはT0コーディング領域の開始及び終止コドンを意味する。
【0016】
配列番号2:(311アミノ酸)
人間コラーゲンα(I)の予想されたC−プロペプチドT0タンパク質配列。アンダーラインを引いた配列はC−プロペプチドの“グリシン反復体”上流領域を意味する。赤色で表示されたアミノ酸配列はBMP−1プロテアーゼ認識部位を示す。
【0017】
配列番号3:(771塩基)
人間コラーゲンα(I)T2作成物のC−プロペプチドをコード化するヌクレオチド配列。このcDNAをpAPtag2ベクターにクローニングしてAPコーディング領域を置換した。アンダーラインを引いた配列は相応するpTRIMERベクター作成時使われた制限酵素部位を意味する。濃く表示されたコドンはT2コーディング領域の開始及び終止コドンを意味する。
【0018】
配列番号4:(247アミノ酸)
人間コラーゲンα(I)の予想されたC−プロペプチドT2タンパク質配列。赤色で表示されたアミノ酸配列はBMP−1プロテアーゼ認識部位を示す。
【0019】
配列番号5:(2487塩基)
人間α(I)コラーゲン(AP−T0)のT0 C−プロペプチドに融合された人間の胎盤アルカリ性ホスファターゼ(AP)をコード化するヌクレオチド配列。アンダーラインを引いた配列はこの融合物作成に使われた制限部位を示す。配列の中央に示した融合部位を表示した制限部位はBgl IIである。
【0020】
配列番号6:(819アミノ酸)
AP−T0融合タンパク質の予想されたタンパク質配列。青色で表示したアミノ酸残基は人間の胎盤アルカリ性ホスファターゼ(AP)とα(I)コラーゲンT0ポリペプチド間の融合部位を示す。濃い色で表示したコドンは融合タンパク質の開始及び終止コドンを意味する。アンダーラインを引いた配列は人間α(I)コラーゲンのC−プロペプチドの“グリシン反復体”上流領域を意味する。赤色で表示したアミノ酸残基はBMP−1プロテアーゼ認識配列を意味する。
【0021】
配列番号7:(2294塩基)
人間α(I)コラーゲン(AP−T2)のT2 C−プロペプチドに融合された人間の胎盤アルカリ性ホスファターゼ(AP)をコード化するヌクレオチド配列。アンダーラインを引いた配列はこの融合物作成に使われた制限部位を示す。配列の中央に示した融合部位を表示した制限部位はBgl IIである。
【0022】
配列番号8:(755アミノ酸)
AP−T2融合タンパク質の予想されたタンパク質配列。青色で表示したアミノ酸残基は人間の胎盤アルカリ性ホスファターゼ(AP)とα(I)コラーゲンT2ポリペプチド間の融合部位を示す。赤色で表示したアミノ酸残基はBMP−1プロテアーゼ認識配列の位置を示す。
【0023】
配列番号9:(1734塩基)
人間α(I)コラーゲン(sTNF−RII−T0)のT0 C−プロペプチドに融合された人間の胎盤アルカリ性ホスファターゼ(AP)をコード化するヌクレオチド配列。濃い色で表示した配列は融合タンパク質作成時に使われた制限部位を意味する。配列の中央に示した融合部位に示したアンダーラインを引いた配列はBamHI/Bgl II結紮部である。
【0024】
配列番号10:(566アミノ酸)
人間可溶性TNF−RII−T0融合物の予想されたタンパク質配列。青色で表示したアミノ酸残基は人間可溶性TNF−RIIとα(I)コラーゲンT0ポリペプチド間の融合部位を示す。アンダーラインを引いた配列は人間α(I)コラーゲンのC−プロペプチドの“グリシン反復体”上流領域を意味する。赤色で表示したアミノ酸残基はBMP−1プロテアーゼ認識配列を意味する。
【0025】
配列番号11:(1542塩基)
人間α(I)コラーゲン(sTNF−RII−T2)のT2 C−プロペプチドに融合された人間可溶性TNF−RIIをコード化するヌクレオチド配列。濃い色で表示したコドンは融合タンパク質の開始及び終止コドンを意味する。配列の中央に示した融合部位を表示したアンダーラインを引いた配列はBamHI/Bgl II結紮部である。
【0026】
配列番号12:(502アミノ酸)
人間可溶性TNF−RII−T2融合物の予想されたタンパク質配列。青色で表示したアミノ酸残基は人間可溶性TNF−RIIとα(I)コラーゲンT2ポリペプチド間の融合部位を示す。赤色で表示したアミノ酸残基はBMP−1プロテアーゼ認識配列を意味する。
【0027】
配列番号13:(2139塩基)
人間α(I)コラーゲンのT0 C−プロペプチドに融合された人間可溶性CD4をコード化するヌクレオチド配列。アンダーラインを引いた配列は融合物作成に使われた制限部位を意味する。配列の中央に示した融合部位を表示したアンダーラインを引いた配列はBgl II部位である。
【0028】
配列番号14:(699アミノ酸)
人間可溶性CD4−T0融合物の予想されたタンパク質配列。青色で表示したアミノ酸残基は人間可溶性CD4とα(I)コラーゲンT0ポリペプチド間の融合部位を示す。アンダーラインを引いた配列は人間α(I)コラーゲンのC−プロペプチドの“グリシン反復体”上流領域を意味する。赤色で表示したアミノ酸残基はBMP−1プロテアーゼ認識配列を意味する。
【0029】
配列番号15:(1947塩基)
人間α(I)コラーゲンのT2 C−プロペプチドに融合された人間可溶性CD4をコード化するヌクレオチド配列。アンダーラインを引いた配列は融合物作成に使われた制限部位を意味する。配列の中央に示した融合部位を表示したアンダーラインを引いた配列はBgl II部位である。
【0030】
配列番号16:(635アミノ酸)
人間可溶性CD4−T2融合物の予想されたタンパク質配列。青色で表示したアミノ酸残基は人間可溶性CD4とα(I)コラーゲンT2ポリペプチド間の融合部位を示す。赤色で表示したアミノ酸残基はBMP−1プロテアーゼ認識配列を意味する。
【発明の詳細な説明】
【0031】
本発明を説明する前に、本発明で用いられる特定用語の定義に対して説明することが理解に助けになることである。
【0032】
DNA作成物:一般的にプラスミドまたはウイルス性ベクター形態であり、天然的には存在しない方式で結合したDNA切片を含むように再組合DNA技術を介して改変された単一鎖または二重鎖のDNA分子。DNA作成物は目的する暗号化するタンパク質の発現及び/または分離を指示するのに必要な情報を含む。
【0033】
信号ペプチド配列:細胞から成熟ポリペプチドまたはタンパク質の分泌を指示する作用をするアミノ酸配列。信号ペプチドは疎水性アミノ酸のコアを有することを特徴として細胞表面に分泌されたり固着される新しく合成されたタンパク質のアミノ末端で典型的に発見される。信号ペプチドは分泌する間成熟タンパク質から切断される。このような信号ペプチドはタンパク質分泌経路を通過するによって成熟タンパク質から信号ペプチドの分解を許す加工部位を含む。信号ペプチド配列は信号ペプチドなしに他のタンパク質のアミノ末端に連結されれば融合タンパク質の分泌を指示することができる。生長因子、ペプチドホルモン、サイトカイン、及び細胞表面受容体をはじめとする膜タンパク質のような大部分の分泌タンパク質は初期タンパク質で合成される時信号ペプチド配列を含む。
【0034】
可溶性受容体:リガンドと結合することができる細胞表面受容体の一部または全部の細胞外ドメイン。一般的に、これは膜固定に必要な内部の疎水性アミノ酸配列を含まない。
【0035】
コラーゲンのC−プロペプチド:三量体で自己構築されることができるコラーゲンのC−末端の球形であり非三重螺旋ドメイン。コラーゲンの三重螺旋領域と対照的に、C−プロペプチドはグリシン反復配列を含まないしまたコラーゲンフィブリル形成以前にコラーゲン分泌される時プロコラーゲン前駆体からタンパク質分解的に除去される。
【0036】
グリシン反復体:アミノ酸配列に数百個の(Gly−X−Y)n反復体を含むコラーゲンの中央線形三重螺旋形成領域。これら反復体はX及び/またはY位置でプロリンが豊富である。N−及びC−プロペプチドを除去すれば、グリシン−反復体含有コラーゲン三重螺旋は高次元の不溶性コラーゲンフィブリルで構築されることができ、これは細胞マトリックスの主要成分を形成する。
【0037】
cDNA:相補的DNA、またはmRNAに相補的なDNA配列。一般的にcDNA配列はイントロン(非タンパク質コーディング)配列を含まない。
【0038】
本発明以前のほとんどすべての治療抗体及びエンブレルのような可溶性受容体Fc融合タンパク質は二量体構造である(図1)。これら分子は、単量体対応物と比較する時、増加された親和性を有する標的抗原またはリガンドに結合されることと明らかになっているが、これらは構造的制限(constraint)によって、同種三量体性構造を有するこれらの標的に不完全に結合する。このような治療的に重要な三量体リガンドの例はサイトカインのgp120 TNFファミリー及びHIV被膜タンパク質を含む。したがって、構造的観点で、標的三量体性リガンドまたは抗原に完全に結合することができる三量体性可溶性受容体または抗体を生成することができて(図1)、したがってそのリガンド作用を完全に遮断することが望ましいことである。このような三量体性可溶性受容体またはキメラ抗体は標的に対して最も高い親和性を有することと予想されるので、関節炎及びAIDSのような疾病を治療するのにさらに效果的に使われることができる。
【0039】
本発明は三量体で自己構築されることができるコラーゲンのC−プロペプチドに融合させることにより、分泌された三量体性受容体及び生物学的活性タンパク質を生成する方法を開示する。本発明の利点は次のようである:(1)コラーゲンは体内で分泌された最も豊富なタンパク質で、体内全体タンパク質のほとんど25%を占める;(2)コラーゲンの主要形態は天然で三量体螺旋で生じて、これらの球形C−プロペプチドは三量体化開始に関与して、三重螺旋形成時タンパク質分解的に分解されて;(3)可溶性三量体性C−プロペプチドは哺乳類の血液でマイクログラム/mL以下の量で天然に発見されて;(4)一定な三重螺旋領域はリンカーで含まれたり融合タンパク質の一部で除外されるので、三量体化されるタンパク質とコラーゲンのC−プロペプチド間の距離は最適の生物学的活性を達成するように調整されることができて;(5)プロコラーゲンのC−プロペプチドを切断するBMPIの認識部位は突然変異されたりまたは欠失されて三量体性融合タンパク質の破壊を防止し;(6)C−プロペプチドドメインは普遍的な親和性タグを提供するので、本発明によって創製された分泌された融合タンパク質の精製のために使われることができて;(7)自身の細胞表面受容体に結合されることのような他の生物学的作用を有することと公知されたIgG1 Fcタグとは違って、コラーゲンのC−プロペプチドの公知された生物学的作用は隣接プロコラーゲンの三量体化を開始してまた不溶性細胞マトリックスに構築される前に溶解性プロコラーゲン三量体を維持することができることである。コラーゲンのC−プロペプチドのこのような独特の特性は固有な三量体化タグが毒性または免疫原性を持たないことを示唆するため、治療用のための理想的な候補になることができる。
【0040】
分泌された三量体融合タンパク質の製造容易性を示すために、一部グリシン−反復三重螺旋領域(T0作成物、配列番号1−2)または突然変異されたBMP−1認識部位を有する非−グリシン反復体(T2作成物、配列番号3−4)を含む人間α1(I)の全体C−プロペプチドをコード化するcDNA配列はアメリカンタイプカルチャーコレクション(ATCC)から購入したESTクローンを用いてRT−PCRにより増幅させた。増幅されたcDNAはBgl II−XbaI断片としてpAPtag2哺乳動物発現ベクター(GenHunterコポーレーション製造;Lederなど、1996及び1998)にそれぞれクローニングされてAPコーディング領域を置換した(図2)。生成したベクターをpTRIMER、バージョンT2及びT0と称する。このベクターは、固有なHind III及びBgl II部位で、可溶性受容体または生物学的活性タンパク質をコード化するcDNA鋳型の便利なフレーム内融合を許す。このような融合タンパク質は天然プロ−コラーゲンと同様にC末端に位置したコラーゲン三量体化タグを有する。
【0041】
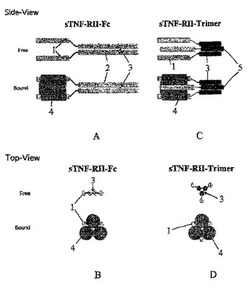
図1A、図1B、図1C及び図1Dは従来の二量体性免疫グロブリンFc融合と比較した本発明による方法の概略図である。
【0042】
図1Aは側面上昇図であって、図1Bは上面図であって、図示したようにリガンド無しまたはリガンド結合された形態のアムジェン社のエンブレルのような同種二量体性可溶性sTNF RII受容体−Fc融合の構造的特徴を図示する。
【0043】
1でラベリングされたドメインは可溶性TNA−RIIを意味する。Fc(鎖内ジスルフィド結合(3)と共に2でラベリングされる)融合タンパク質は二量体構造である。二重対称を考慮する時、二量体性Fc融合タンパク質は二価であるので、理論的に三重対称を有するTNF−α(4でラベリングされる)のような同種三量体性リガンドに結合される最適構造を有しない。
【0044】
図1Cは側面上昇図であってまた図1Dは上面図であって、三量体性可溶性sTNF RII受容体−C−プロペプチド融合の構造的特徴を図示する。三重対称を考慮する時、sTNF RII−三量体融合タンパク質は三価構造であるので、三量体性リガンドTNF−αに完全に結合することができる。自己三量体化されることができるコラーゲンのC−プロペプチドは鎖間ジスルフィド結合(3)によりラベリング(5)されている。
【0045】
図2A及び図2Bは分泌された三量体性融合タンパク質を製造するためのpTRIMERプラスミドベクターの構造を図示する。可溶性受容体−または生物学的活性ポリペプチド−コーディングcDNAは固有なHind IIIまたはBgl II部位にクローニングされて、三量体化のためのC−プロペプチド配列を含むα(I)コラーゲンに対してC−末端でフレーム内融合を許す。図2A:pTRIMER(T0)構造物はC−プロペプチドのグリシン−反復体(GXY)n上流の一部を含む。図2B:pTRIMER(T2)は成熟したBMP−1プロテアーゼ認識部位を有するC−プロペプチドドメインだけを含む。
【0046】
図3A及び図3Bはジスルフィド結合で連結した三量体化コラーゲン融合タンパク質の発現及び分泌を図示する。
【0047】
図3Aはα(I)コラーゲンのC−プロペプチドに融合される時の人間の胎盤アルカリ性ホスファターゼ(AP)の三量体化のウエスタンブロット分析である。pTRIMERベクターでAP単独またはAP−C−プロペプチド融合をコード化する発現ベクターは一時的にHEK293T細胞に形質感染される。48時間後、指示されたような各形質感染された細胞の調節培地(conditioned medium)(20μL)を、還元剤(メルカプトエタノール)を含んだり含まない同じ体積2XSDSサンプル緩衝液中で5分間沸かして、10%SDS−PAGE上で分離させた次に多重クローン抗体を用いてAP(GenHunterコポーレーション製造)にウエスタンブロットにより分析する。分泌された67 kDa AP単独は分子間ジスルフィド結合を形成しない反面、分泌されたAP−T0及びAP−T2はジスルフィド結合で連結した三量体で效果的に構築される。
【0048】
図3B.α(I)コラーゲンのC−プロペプチドに融合される時の人間の可溶性TNF−RIIの三量体化のウエスタンブロット分析。pTRIMERベクターに表示されたようなAP−C−プロペプチド融合(T2)(抗体特異性に対する陰性対照用)または人間可溶性TNF−RII−C−プロペプチドを一時的にHEK293T細胞に形質感染させる。48時間後、指示されたような各形質感染された細胞の調節培地(20μL)を、還元剤(メルカプトエタノール)を含んだり含まない同じ体積2XSDSサンプル緩衝液中で5分間沸かして、10%SDS−PAGE上で分離させた次に人間TNF−RII(クローン226、R & Dシーステムズインコーポレイテッド製造)に対する単一クローン抗体を用いてウエスタンブロットにより分析する。単一クローン抗体はジスルフィド結合を有する分泌されたTNF−RIIだけを認識することができる。可溶性TNF−RII−T0及びTNF−RII−T2融合はジスルフィド結合連結した三量体で效果的に構築される。
【0049】
図4及び図5は人間TNF−α媒介された細胞自殺に対する三量体性可溶性人間TNF−RII−Cプロペプチド融合タンパク質の強力な中和活性を示すバイオアッセイを図示する。
【0050】
図4.TNF−α敏感性WEHI−13VAR細胞(ATCC)を10%FBSを含むRPMI培地中に1百万細胞/mLで懸濁させた。100μLの細胞懸濁液を96−ウェルマイクロタイタープレート内のウェルにプレーティングした。各ウェルに500ng/mLの濃度でアクチノマイシンDを付加した次に三量体化可溶性人間TNF−RII−T2の存在下でまたは不在下で人間TNF−αを500pg/ml(R & Dシーステムズ製造)濃度で付加した。陰性対照用として、三量体性AP−T2をTNF−RII−T2の代わりに付加した。組織培養培養器で16時間の間培養した後、細胞の生存性は20X倍率の反転顕微鏡または各ウェルに10%(v/v)付加した細胞生存能指示剤染料、アラマーブルー(Alamar Blue)(BioSource,Inc.)を用いて調査した。生存細胞は染料色を青色からピンク色へ変更することができる。三量体性可溶性人間TNF−RII−T2は強力な中和活性を示す反面TNF−αはTNF−α媒介された細胞自殺から細胞を保護する。
【0051】
図5.人間TNF−αに対する三量体性可溶性人間TNF−RII−T2の中和活性の定量分析。この実験は図4Aでのように実施した。アラマーブルー(Alamar Blue)染料を付加して2時間後、各ウェルから指示されたような培養培地をOD575で分析した。TNF−αが付加されないウェル(100%生存率)または中和剤なしにTNF−αが付加された(0%生存率)ウェルに対して判読を規準化した。
【実施例1】
【0052】
本発明の実現可能性を示すために、天然の信号ペプチド配列をはじめとする人間の分泌された胎盤アルカリ性ホスファターゼ(AP)をコード化するcDNAをpAPtag4ベクター(GenHunterコポーレーション;Lederなど、1996及び1998)からHind III−Bgl II断片に切断してpTRIMER−T0及びpTRIMER−T2ベクターの相応する部位にクローニングした。生成したAP−コラーゲン融合作成物(配列番号5−8)は形質感染後HEK293T細胞(GenHunterコポーレーション製造)で発現させた。AP−コラーゲン融合タンパク質の成功的な分泌は形質感染された細胞の調節培地を用いたAP活性分析により容易に決定されることができる。形質感染された2日後AP活性は約1単位体/mL(または約1μg/mLの融合タンパク質に相応)に到達した。融合タンパク質を安定に発現するHEK293T細胞を得るために、ピューロマイシン−耐性ベクター、pBabe−Puro(GenHunterコポーレーション製造)と共同感染後安定したクローンを選択した。AP活性を発現するクローンを生長させて融合タンパク質の長期間生産のために保存した。
【0053】
AP−コラーゲン融合タンパク質がジスルフィド結合−連結三量体で構築されるのか決定するために、AP単独またはAP−T0及びAP−T2融合物を含む調節培地をβ−メルカプトエタノールを有しなかったり(非還元)または有する(還元)SDSサンプル緩衝液で沸かして抗−AP多重クローン抗体(GenHunterコポーレーション製造)を用いてウエスタンブロットにより分析した。融合のないAP単独は非還元及び還元条件下ですべて67 kDaバンドで現われて、これは分子間ジスルフィド結合の不足が予想されることと一致した(図3A)。対照的に、分泌されたAP−T0及びAP−T2融合タンパク質は、還元条件下(90−100 kDa)と比較して、非還元条件下で3倍さらに大きい(約300 kDa)ことに明らかになっており、これは両側融合タンパク質が完全に同種三量体で構築されることを示す(図3A)。この結果は本発明の概念を実施するようにさせる。
【実施例2】
【0054】
新しくて治療的に有効な生物学的作用が三量体性融合タンパク質により与えられることができることを証拠を提供するために、ATCCから購入した相応するESTクローンを用いて三量体性人間可溶性TNF−RII(p75)受容体を作成した。実施形態1に記載したように、全体リガンド結合領域は含むがトランスメンブレインドメインを含まない人間TNF−RIIのN−末端領域をBamHI断片としてpTRIMER−T0及びpTRIMER−T2ベクター(配列番号9−12)のBgl II部位にクローニングした。生成した融合作成物は形質感染後HEK293T細胞で発現された。実施形態1に記載したようにピューロマイシン共同選択により安定したクローンを得た。非還元及び還元条件下でウエスタンブロット分析を実施して、生成した可溶性TNF−RII−コラーゲン融合タンパク質が実際に発現されて、分泌されて三量体形態で構築されたのかを決定した。予想したように、人間TNF−RIIに対する単一クローン抗体(R & Dシーステムズインコーポレイテッドから入手したクローン22)はT0及びT2融合ベクターにより220−240 kDaバンドで発現された三量体性可溶性TNF−融合タンパク質を明確に認識し、これは相応する単量体性融合タンパク質より約3倍以上さらに大きい(図3B)。TNF−RII抗体は還元条件下で単量体性融合タンパク質を検出することができなく、これは抗体製造者により特定された特性と一致することである。抗体特異性に対する陰性対照用として、HEK293T細胞単独またはAP−T2融合タンパク質を発現する細胞どれもTNF−RIIを発現しなかった(図3B)。
【0055】
三量体性可溶性TNF−RII受容体が三量体性リガンドTNF−αの強力な抑制剤なのかを決定するために、前で実質的に記載されたような(Mohlerなど、1993)サイトカイン敏感性細胞株WEHI−13VAR(ATCC)を用いてTNF−αバイオアッセイ(bioassay)を実施した。図4に図示した結果は三量体性可溶性TNF−RII−C−プロペプチド融合タンパク質がアクチノマイシンD(500ng/mL)(シグマ製造)の存在下でWEHI−13VAR細胞のTNF−αに媒介された細胞自殺を強く中和させることを明確に示した。人間TNF−α(R & Dシーステムズ製造)が0.5ng/mLで使われると、三量体性可溶性TNF−RII−T2(無血清培地からまたは精製された形態)は約2ng/mLまたは8x10−12M(同種三量体で240 kDa分子量推定)の見かけKi−50(50%抑制)を有した。TNF−αに対する親和性は単量体性TNF−RIIより4倍以上でありエンブレル(Mohlerなど、1993)のような二量体性可溶性TNF−RII−Fc融合物より10−100倍以上さらに高かった。
【0056】
この重要な実施形態は本発明が治療用途を有することができる新規生物学的特性を有する三量体性融合タンパク質を作ることができるということを証明する。このような可溶性三量体性人間TNF受容体は、RAのような自動免疫疾病を治療するために市販される現在の二量体性可溶性TNF受容体(例えばエンブレル)よりはるかに効果的に見える。三量体性TNF受容体の顕著に増加された能力は各患者に毎週注射しなければならないTNF阻害薬の量を顕著に減少させることができながら、治療を改善させてまた患者の費用を顕著に減少させることができる。三量体性TNF受容体の向上した能力は現在米国で約100、000名の患者治療要求だけを充足させることができる二量体性TNF受容体生産での停滞(ボトルネック)問題を軽減させることである。
【実施例3】
【0057】
AIDSの原因であるHIVウイルスは私たちの体内のTリンパ球の特殊な系統を主に感染して破壊する。いわゆるCD4+T細胞は、HIVの受容体であるCD4と呼ばれる細胞表面タンパク質を発現する。HIVはCD4に結合されるウイルス性被膜タンパク質gp120を有するCD4+細胞を認識する。明確に、gp120はウイルス表面上で巨大な同種三量体複合体で存在する反面、CD4は細胞表面上で単量体で存在する。HIV感染に対する現在のモデルはHIVをCD4+T細胞に完全に結合させ、gp120のすべての3個サブユニットがCD4にそれぞれ結合すれば、ウイルスRNAが細胞に入るために必要である。明確に、HIV感染を中止するための直接的な戦略中の一つはウイルスを遮る(blind)ために可溶性CD4を用いることである。実際に、単量体性溶解性CD4及びCD4−Fc融合物を用いるこのような方法は実験室分離物のHIV感染を中止させることに非常に効果的なことに明らかになった(Claphamなど、1989;Daarなど、1990)。不幸にも、これら可溶性CD4は、単量体性及び二量体性可溶性CD4に対する親和性を低下させるgp120のアミノ酸配列変形によって、AIDS患者で発見されたHIVウイルス株感染を中止させることには効果が少なかった(Daarなど、1990)。
【0058】
HIVウイルスに対するgp120変異体に対する可溶性CD4の親和性を顕著に増加させるために、理想的に可溶性CD4は三量体リガンドであるgp120同種三量体と完全に結合するように三量体形態でなければならない。AIDS治療の主要問題中の一つはウイルスゲノムの突然変異率が非常に高くて耐薬品性をもたらす点である。したがって、HIV逆転写酵素(例えばAZT)及びプロテアーゼのようなウイルス遺伝子を直接標的にする薬物はウイルス突然変異の結果によって效果がないと考えられる。対照的に、いくら突然変異されるにしても、HIVウイルスは細胞CD4受容体と反応して感染を開始する。したがって、高親和性可溶性CD4三量体は、gp120遺伝子でウイルス突然変異が三量体性可溶性CD4だけでなく細胞上のCD4にも結合されることができないウイルスをもたらすため、ウイルス突然変異に兔疫性を持たなければならない。
【0059】
このような三量体性可溶性CD4 HIV受容体類似体を製造するために、天然の信号ペプチド配列を含んでトランスメンブレイン及び短い細胞質ドメインを排除しない全体人間可溶性CD4をコード化するcDNAを、ATCCから購入したESTクローンを用いて増幅させた。生成したcDNAはpTRIMER−T0及びp−TRIMER−T2発現ベクターの相応する部位にHind III−Bgl II断片としてクローニングした。生成した可溶性CD4−コラーゲン融合作成物(配列番号13−16)は形質感染後HEK293T細胞(GenHunterコポーレーション製造)で発現させた。融合タンパク質を安定に発現するHEK293T細胞を得るために、ピューロマイシン−耐性ベクターであるpBabe−Puro(GenHunterコポーレーション製造)と共同形質感染させた後安定したクローンを選択した。融合タンパク質を発現するクローンを生長させて融合タンパク質の長期間生産のために保存した。
【0060】
可溶性人間CD4−コラーゲン融合タンパク質がジスルフィド結合−連結三量体で構築されるのか決定するために、可溶性CD4−T0及びCD4−T2融合物を含む調節培地を、β−メルカプトエタノールを有しなかったり(非還元)または有する(還元)SDSサンプル緩衝液で沸かして、SDS PAGEにより分離してまた人間CD4に対する単一クローン抗体(R & Dシーステムズ製造)を用いたウエスタンブロットにより分析した。分泌された可溶性CD4−T0及びCD4−T2融合タンパク質は、還元条件下(90−100 kDa)と比較して、非還元条件下で3倍さらに大きい(約300 kDa)ことに現われ、これは両側融合タンパク質が完全に同種三量体で構築されることを示す(データ示さない)。これら三量体性可溶性CD4はgp120結合及び抗−HIV感染のために容易に試験されることができる。
【図面の簡単な説明】
【0061】
【図1A】同種二量体性可溶性sTNF RII受容体−Fc融合の構造的特徴を図示する側面上昇図である。
【図1B】同種二量体性可溶性sTNF RII受容体−Fc融合の構造的特徴を図示する上面図である。
【図1C】三量体性可溶性sTNF RII受容体−C−プロペプチド融合の構造的特徴を図示する側面上昇図である。
【図1D】三量体性可溶性sTNF RII受容体−C−プロペプチド融合の構造的特徴を図示する上面図である。
【図2A】分泌された三量体性融合タンパク質を製造するためのpTRIMERプラスミドベクターの構造を図示する。
【図2B】分泌された三量体性融合タンパク質を製造するためのpTRIMERプラスミドベクターの構造を図示する。
【図3A】α(I)コラーゲンのC−プロペプチドに融合される時の人間の胎盤アルカリ性ホスファターゼ(AP)の三量体化のウエスタンブロット分析である。
【図3B】α(I)コラーゲンのC−プロペプチドに融合される時の人間の可溶性TNF−RIIの三量体化のウエスタンブロット分析である。
【図4】人間TNF−α媒介された細胞自殺に対する三量体性可溶性人間TNF−RII−Cプロペプチド融合タンパク質の強力な中和活性を示すバイオアッセイを図示する。
【図5】人間TNF−αに対する三量体性可溶性人間TNF−RII−T2の中和活性の定量分析である。
【技術分野】
【0001】
本発明はタンパク質発現方法、詳細には三量体(trimeric)可溶性受容体(receptor)のような分泌されて生物学的活性である三量体タンパク質の生成及び発現方法に関する。
【背景技術】
【0002】
人間のような多細胞生物において、細胞はいわゆる“信号伝達経路”により相互に疎通され、分泌されたリガンド(例えばサイトカイン、生長因子またはホルモン)はその細胞表面受容体に反応して受容体活性化をもたらす。受容体は、信号を下流に送るのに関与する細胞質ドメイン、中央トランスメンブレイン(transmembrane)領域、およびリガンド結合に関与する細胞外ドメイン(extracellular domain)で構成された膜タンパク質である。信号伝達は次のような3種の方法で実施することができる:分泌された信号の供給源及び受容体を発現する標的細胞の位置によって、周辺分泌(隣接細胞間と疎通)、自己分泌(自身との細胞疎通)及び内分泌(循環を介した遠く離れている細胞間の疎通)。遺伝子発現の活性化をはじめとする細胞膜下の一連の事件を開始させる受容体活性化に対する一般的なメカニズムの一つはサイトカインのようなポリペプチドリガンドが同種二量体(dimer)または三量体(trimer)のようなオリゴマー型で存在して、その単量体受容体が細胞外部表面に結合されれば受容体のオリゴマー化をもたらすものである。信号伝達経路は細菌またはウイルス感染のような外部損傷に反応するだけでなく正常細胞発達及び分化にも重要な役割をする。活性低下(例えばリガンドの不足)または過度な活性(例えば過剰なリガンド)のいずれかの形態である信号伝達経路の異常は関節炎、癌、AIDS及び糖尿病のような病理学的状態及び疾病の原因でもある。
【0003】
これらの疾病を治療するための現在の方法のうちの一つは、リガンドを遮断するために細胞外リガンド結合ドメインだけで構成された可溶性受容体のような誘引(decoy)受容体を用いることによって受容体の過度な活性化を克服するものである。このような戦略の最も顕著な例は、いまはアムジェン社の一部であるイミュネクス(Mohlerなど、1993;Jacobsなど、1997)による二量体性可溶性TNF−α受容体イミュノグロブリンG(IgG)融合タンパク質であるエンブレル(Enbrel)の創製である。サイトカインのTNFファミリーは感染または組織損傷に反応して体内で生じる主要な炎症誘発信号中の一つである。しかし、例えば感染や組織損傷の不在下でこれらサイトカインの非正常的生産は関節炎及び乾癬のような疾病の根本原因中の一つで明らかになった。自然的に、TNF−α受容体は、対照的に同種三量体で存在するそのリガンド、すなわちTNF−αに結合する前に細胞表面上で単量体形態で存在する(Locksleyなど、2001)。したがって、ジスルフィド結合(Sledziewskiなど、1992及び1998)を介して自然的に二量化されることができる免疫グロブリンG1のFc領域と可溶性TNF−α受容体の融合は二量体性可溶性TNF−α受容体の分泌を許す(Mohlerなど、1993;Jacobsなど、1997)。単量体性可溶性受容体と対照的に、二量体性TNF−α受容体II−Fc融合は同種三量体リガンドに対する親和性を顕著に増加させた。これは主要炎症誘発性サイトカインである構成的に増加されたTNF−αが重要な原因役割をする自己免疫疾病であるリウマチ性関節炎(RA)の治療においてその臨床的適用に対する分子的基礎を提供する。エンブレル(Enbrel)はpM範囲(ng/mL)のKiないしTNF−α(Mohleremd、1993)を有することと明らかになっているが、RA患者が臨床的効果を得るためには、μg/mL水準換算で25mgの可溶性受容体皮下注射が週2回必要である(www.enbrel.com)。RA患者当たり周期的な多量のエンブレル消費は薬物供給に対する高費用だけでなく大きい苦痛をもたらして米国国内でだけ数百万の潜在的患者において薬物接近容易性を制限している。
【0004】
強力な炎症誘発性サイトカインのTNF−αファミリー以外に、AIDSを誘発するHIVウイルスは私たちの体内のCD−4陽性Tヘルパー細胞に入るために同種三量体性被膜タンパク質、gp120を利用する(Kwongなど、1998)。HIV感染において最も先に生じる事件のうちの一つはgp120がその受容体CD−4に結合されるのを含み、これはTヘルパー細胞の細胞表面上で固有に発現される(Claphamなど、2001)。単量体性可溶性CD−4は十余年間HIV感染に対する強力な物質で明らかになったが(Claphamなど、1989)、その効能が実験室HIV分離物にだけ限られることが明らかになるにつれ期待は薄まった(Daarなど、1990)。実験室分離物とは違って、AIDS患者から得たHIV株はgp120における配列変異によって単量体性可溶性CD−4に対する親和性がはるかに低いことに明かされた(Daarなど、1990)。二量体性可溶性CD−4−Fc融合タンパク質が作られるが、これら誘引CD−4HIV受容体はgp120に対する低い親和性によって実験室でも臨床試験でもAIDS患者から得た天然産出のHIVに対しては抗ウイルス効果をほとんど示さなかった(Daarなど、1990)。
【0005】
明らかに、結合部位を完全に結合してサイトカインのTNFファミリー及びHIV被膜タンパク質のような天然産出の同種三量体性リガンドに対する親和性がさらに高い、分泌された同種三量体性可溶性受容体または生物学的活性タンパク質の創製が強く要求されている。このような三量体性誘引受容体は理論的に三量体性リガンドに対して二量体性受容体に比べてはるかに高い親和性を有しなければならない。このような理性的に考案された可溶性三量体性受容体類似体は臨床的効果を顕著に向上させることができるだけでなく各患者に対する薬物注射の量または頻度を減らすことができた。免疫グロブリンFcのように治療的に使用可能になるように、所望する三量体性タンパク質残基は理想的には体内に多量に存在して效率的に自己三量体化できる天然分泌されたタンパク質の一部でなければならない。
【0006】
コラーゲンは細胞外マトリックスの主要成分である繊維状タンパク質ファミリーである。これは哺乳動物で最も豊富なタンパク質であり、体内全体タンパク質のほぼ25%を占める。コラーゲンは骨、筋、皮膚、角膜、軟骨、血液及び歯牙の形成に重要な構造的役割を担当する(Stryer、1988)。原繊維性(fibrillar)形態のコラーゲンI、II、III、IV、V及びXIはすべてプロコラーゲンと呼ばれる大型三量体性前駆体で合成され、数百個の“G−X−Y”反復体(またはグリシン反復体)で構成される中央の連続された(uninterrupted)三重螺旋ドメインは非コラーゲン性ドメイン(NC)、N−プロペプチド及びC−プロペプチドと隣接している(Stryer、1988)。C−及びN−末端延長部は、非可溶性細胞マトリックスを形成する成熟タンパク質のコラーゲンフィブリル構築を誘発する事件である、プロコラーゲンの分泌時に、タンパク質分解的に処理される(Prockopなど、1998)。落ちたI形コラーゲンの三量体性C−プロペプチドは正常人の血液に100−600ng/mL濃度で発見され、子供がさらに多量を有しており、これは活発な骨形成を示すものである。
【0007】
I、IV、V及びXI形コラーゲンは主に2個のα−1鎖及び1個のα−2鎖で構成されたり(I、IV、V型)または3個の相異なるα鎖で構成(XI形)されて配列上相同性が高い異種三量体性(heterotrimeric)形態で構築される。II及びIII形コラーゲンはすべてα−1鎖の同種三量体である。最も豊富な形態のコラーゲンであるI形コラーゲンの場合、安定したα−1(I)同種三量体が形成され、相異なる組織で多様な量で存在する(Alvaresなど、1999)。これらコラーゲンC−プロペプチド鎖の大部分は、細胞で単独に過発現されると、同種三量体で自己構築されることができる。N−プロペプチドドメインが先に合成されるが、三量体への分子構築はC−プロペプチドの登録組合(in−register association)により開始される。C−プロペプチド複合体は鎖内ジスルフィド結合形成により安定化されるが、好適な鎖登録のためのジスルフィド結合形成に対する必要性は明らかでない。グリシン反復体の三重螺旋は組み合わされたC−末端からジッパーのような方式でN−末端に延長される。このような知識を基礎にして再組合DNA技術を利用して相異なるコラーゲン鎖のC−プロペプチドを交換することにより非天然類型のコラーゲンマトリックスを創製することに至った(Bulleidなど、2001)。サイトカイン及び生長因子のような非コラーゲン性タンパク質はプロ−コラーゲンまたは成熟コラーゲンのN−末端に融合されて新しいコラーゲンマトリックスを形成し、これは細胞マトリックスから非コラーゲン性タンパク質の遅い放出を許す(Tomitaなど、2001)。しかし、上述した場合すべて、C−プロペプチドは再組合コラーゲンフィブリルが不溶性細胞マトリックスに構築される前に分解される必要がある。
【発明の開示】
【0008】
本発明には分泌されたタンパク質で三量体性形態で製造される可溶性受容体または生物学的活性ポリペプチドが開示されている。本発明の本質はフレームのうちの可溶性受容体及び生物学的活性タンパク質を、自己三量体化されることができる原繊維性コラーゲンのC−プロペプチドドメインに、再組合技術を利用して融合させるものである。生成された融合タンパク質は、真核生物細胞で発現されれば、3個のC−プロペプチド間に形成された分子間ジスルフィド結合により共有結合的に強化された主に三量体性形態の可溶性タンパク質で分泌される。
【0009】
本発明の一つの要旨で、
(a)三量体化される非コラーゲンポリペプチドにフレーム内で連結され、自己三量体化されることができるコラーゲンのC−末端部分にフレーム内で連結された信号ペプチド配列で構成されたオープンリーディングフレームの転写を誘導するプロモーターを含むDNA作成物を真核生物宿主細胞に導入して;
(b)生理的条件下の好適な生長培地で宿主細胞を生長させて前記DNA配列によりコード化されて三量体化された融合タンパク質の分泌を許し;また
(c)分泌された三量体性融合タンパク質を宿主細胞から分離することを含む、分泌された三量体性融合タンパク質の製造方法が記載されている。
【0010】
一つの具体例で、信号ペプチド配列は三量体化されるタンパク質の天然配列である。他の具体例で、信号ペプチド配列は三量体化されるタンパク質とは相異なる分泌されたタンパク質から得たことである。一つの具体例で、三量体化される非コラーゲンポリペプチドはリガンド結合ドメインで構成された可溶性受容体である。一つの具体例で、コラーゲンのC−末端部分はコラーゲンの三重螺旋領域を持たないC−プロペプチドである(配列番号:3−4)。異なる具体例で、C−末端コラーゲンは三量体化される非コラーゲン性タンパク質に対するリンカーでコラーゲンの三重螺旋領域の一部で構成される(配列番号:1−2)。異なる具体例で、コラーゲンのC−末端部分は突然変異されたまたは欠失されたBMP−1プロテアーゼ認識部位(配列番号:3−4)である。
【0011】
本発明の一つの要旨で、
(a)三量体化される非コラーゲンポリペプチドにフレーム内で連結され、自己三量体化されることができて、プロ.α.1(I)、プロ.α.2(I)、プロ.α.1(II)、プロ.α.1(III)、プロ.α.1(V)、プロ.α.2(V)、プロ.α.1(XI)、プロ.α.2(XI)及びプロ.α.3(XI)から選択されるコラーゲンのC−末端部分にフレーム内で連結された信号ペプチド配列で構成されたオープンリーディングフレームの転写を誘導するプロモーターを含むDNA作成物を真核生物宿主細胞に導入して;
(b)生理的条件下の好適な生長培地で宿主細胞を生長させて前記DNA配列によりコード化されて三量体化された融合タンパク質の分泌を許し;また
(c)分泌された三量体性融合タンパク質を宿主細胞から分離することを含む、分泌された三量体性融合タンパク質の製造方法が記載されている。
望ましい具体例で、三量体化される非コラーゲンポリペプチドは可溶性TNF−RII(p75)(配列番号:9−12)である。他の望ましい具体例で、三量体化される非コラーゲンポリペプチドはHIVの共同受容体である可溶性CD−4(配列番号:13−16)である。他の望ましい具体例で、三量体化される非コラーゲンポリペプチドは胎盤分泌されたアルカリ性ホスファターゼである(配列番号:5−8)。
【0012】
本発明の一介具体例で、
(a)三量体化される非コラーゲンポリペプチドにフレーム内で連結され、自己三量体化されることができて、プロ.α.1(I)、プロ.α.2(I)、プロ.α.1(II)、プロ.α.1(III)、プロ.α.1(V)、プロ.α.2(V)、プロ.α.1(XI)、プロ.α.2(XI)及びプロ.α.3(XI)から選択されるコラーゲンのC−末端部分にフレーム内で連結された信号ペプチド配列で構成されたオープンリーディングフレームの転写を誘導するプロモーターを含む第1DNA作成物を真核生物宿主細胞に導入して;
(b)三量体化される第2非コラーゲンポリペプチドにフレーム内で連結され、自己三量体化されることができて、プロ.α.1(I)、プロ.α.2(I)、プロ.α.1(II)、プロ.α.1(III)、プロ.α.1(V)、プロ.α.2(V)、プロ.α.1(XI)、プロ.α.2(XI)及びプロ.α.3(XI)から選択されるコラーゲンの第2C−末端部分に、フレーム内で連結された信号ペプチド配列で構成されたオープンリーディングフレームの転写を誘導するプロモーターを含む第2DNA作成物を真核生物宿主細胞に導入して;
(c)生理的条件下の好適な生長培地で宿主細胞を生長させて前記第1及び第2DNA配列によりコード化されて三量体化された融合タンパク質の分泌を許し;また
(d)分泌された三量体性融合タンパク質を宿主細胞から分離することを含む分泌された三量体性融合タンパク質の製造方法が記載されている。
【0013】
本発明の一介具体例で、
(a)三量体化される非コラーゲンポリペプチドにフレーム内で連結され、自己三量体化されることができて、プロ.α.1(I)、プロ.α.2(I)、プロ.α.1(II)、プロ.α.1(III)、プロ.α.1(V)、プロ.α.2(V)、プロ.α.1(XI)、プロ.α.2(XI)及びプロ.α.3(XI)から選択されるコラーゲンのC−末端部分にフレーム内で連結された信号ペプチド配列で構成されたオープンリーディングフレームの転写を誘導するプロモーターを含む第1DNA作成物を真核生物宿主細胞に導入して;
(b)三量体化される第2非コラーゲンポリペプチドにフレーム内で連結され、自己三量体化されることができて、プロ.α.1(I)、プロ.α.2(I)、プロ.α.1(II)、プロ.α.1(III)、プロ.α.1(V)、プロ.α.2(V)、プロ.α.1(XI)、プロ.α.2(XI)及びプロ.α.3(XI)から選択されるコラーゲンの第2C−末端部分にフレーム内で連結された信号ペプチド配列で構成されたオープンリーディングフレームの転写を誘導するプロモーターを含む第2DNA作成物を真核生物宿主細胞に導入して;
(c)三量体化される第3非コラーゲンポリペプチドに、フレーム内で連結され、自己三量体化されることができて、プロ.α.1(I)、プロ.α.2(I)、プロ.α.1(II)、プロ.α.1(III)、プロ.α.1(V)、プロ.α.2(V)、プロ.α.1(XI)、プロ.α.2(XI)及びプロ.α.3(XI)から選択されるコラーゲンの第3C−末端部分にフレーム内で連結された信号ペプチド配列で構成されたオープンリーディングフレームの転写を誘導するプロモーターを含む第3DNA作成物を真核生物宿主細胞に導入して;
(d)生理的条件下の好適な生長培地で宿主細胞を生長させて前記第1及び第2DNA配列によりコード化されて三量体化された融合タンパク質の分泌を許し;また
(e)分泌された三量体性融合タンパク質を宿主細胞から分離することを含む分泌された三量体性融合タンパク質の製造方法が記載されている。
【0014】
本発明の利点は次のようである:(1)コラーゲンは哺乳動物の体内で分泌される最も豊富なタンパク質で、体内の全体タンパク質のほぼ25%を占める;(2)コラーゲンの主要形態は天然で三量体螺旋で生じて、これらの球形C−プロペプチドは三量体化開始に関与して;(3)成熟コラーゲンからタンパク質分解的に放出されたコラーゲンの三量体性C−プロペプチドは哺乳類の血液でマイクログラム/mL以下の量で天然に発見されて体内に毒性は知られていないで;(4)一定な三重螺旋領域は残基当たり2.9Åスペースを有するリンカーで含まれることができたり、三量体化されるタンパク質とコラーゲンのC−プロペプチド間の距離が最適の生物学的活性を達成するように調整されることができて;(5)プロコラーゲンのC−プロペプチドを切断するBMPIの認識部位は突然変異されたりまたは欠失されて三量体性融合タンパク質の破壊を防止し;(6)C−プロペプチドドメインは普遍的な親和性タグを提供するので、本発明によって創製された分泌された融合タンパク質の精製のために使われることができる。
【0015】
分泌された二量体性融合タンパク質が創製されることができるFcタグ技術(Sledziewskiなど、1992及び1998)と対照的に、本明細書に記載された発明は初めて可溶性三量体性融合タンパク質の創製と分泌を可能にする。同種三量体が三重対称であって同種二量体は二重対称であることを考慮する時、2個の明らかな構造的形態は理論的には決して完全に重なることができない(図1)。したがって、同種二量体性可溶性TNF−R−Fc(例えばエンブレル)だけでなく可溶性CD4−Fc融合タンパク質も相応する同種三量体性リガンドTNF−α及びHIV gp120それぞれに結合する最適のインターフェースを有することができないことである。対照的に、本発明によって創製された同種三量体性可溶性TNF受容体及びCD4は三価であって構造的に相応する同種三量体性リガンドに対して完全に結合することができる可能性を有する。したがって、これら三量体性可溶性受容体類似体はこれらの三量体性リガンドの生物学的活性を中和させるのにさらに効果的であることができる。本発明により、本発明の望ましい具体例に記載された三量体性可溶性TNF−R及びCD4のようなさらに効果的だが値はさらに低廉な薬物を容易にまた関節炎及びAIDSのような衰弱させる疾病を撲滅するために理性的に考案されることができる。三量体性可溶性gp120は本発明によって創製されることができて、HIVウイルスで発見される天然の三量体性gp120被膜タンパク質複合体をさらによく摸倣することができて以前に使われた非三量体性gp120と比較してはるかに効果的なワクチンで使われることができる。三量体性形態のキメラ抗体(chimeric antibodies)を本発明によって製造することができて、その抗原の中和で著しく増加された抗体親和力を与えることができた。
[配列目録の簡単な説明]
配列番号1:(963塩基)
C−プロペプチド人間コラーゲンα(I)T0構造物をコード化するヌクレオチド配列。このcDNA作成物をpAPtag2ベクターにクローニングしてAPコーディング領域を置換した。アンダーラインを引いた配列は相応するpTRIMERベクター作成時使われた制限酵素部位を意味する。濃く表示されたコドンはT0コーディング領域の開始及び終止コドンを意味する。
【0016】
配列番号2:(311アミノ酸)
人間コラーゲンα(I)の予想されたC−プロペプチドT0タンパク質配列。アンダーラインを引いた配列はC−プロペプチドの“グリシン反復体”上流領域を意味する。赤色で表示されたアミノ酸配列はBMP−1プロテアーゼ認識部位を示す。
【0017】
配列番号3:(771塩基)
人間コラーゲンα(I)T2作成物のC−プロペプチドをコード化するヌクレオチド配列。このcDNAをpAPtag2ベクターにクローニングしてAPコーディング領域を置換した。アンダーラインを引いた配列は相応するpTRIMERベクター作成時使われた制限酵素部位を意味する。濃く表示されたコドンはT2コーディング領域の開始及び終止コドンを意味する。
【0018】
配列番号4:(247アミノ酸)
人間コラーゲンα(I)の予想されたC−プロペプチドT2タンパク質配列。赤色で表示されたアミノ酸配列はBMP−1プロテアーゼ認識部位を示す。
【0019】
配列番号5:(2487塩基)
人間α(I)コラーゲン(AP−T0)のT0 C−プロペプチドに融合された人間の胎盤アルカリ性ホスファターゼ(AP)をコード化するヌクレオチド配列。アンダーラインを引いた配列はこの融合物作成に使われた制限部位を示す。配列の中央に示した融合部位を表示した制限部位はBgl IIである。
【0020】
配列番号6:(819アミノ酸)
AP−T0融合タンパク質の予想されたタンパク質配列。青色で表示したアミノ酸残基は人間の胎盤アルカリ性ホスファターゼ(AP)とα(I)コラーゲンT0ポリペプチド間の融合部位を示す。濃い色で表示したコドンは融合タンパク質の開始及び終止コドンを意味する。アンダーラインを引いた配列は人間α(I)コラーゲンのC−プロペプチドの“グリシン反復体”上流領域を意味する。赤色で表示したアミノ酸残基はBMP−1プロテアーゼ認識配列を意味する。
【0021】
配列番号7:(2294塩基)
人間α(I)コラーゲン(AP−T2)のT2 C−プロペプチドに融合された人間の胎盤アルカリ性ホスファターゼ(AP)をコード化するヌクレオチド配列。アンダーラインを引いた配列はこの融合物作成に使われた制限部位を示す。配列の中央に示した融合部位を表示した制限部位はBgl IIである。
【0022】
配列番号8:(755アミノ酸)
AP−T2融合タンパク質の予想されたタンパク質配列。青色で表示したアミノ酸残基は人間の胎盤アルカリ性ホスファターゼ(AP)とα(I)コラーゲンT2ポリペプチド間の融合部位を示す。赤色で表示したアミノ酸残基はBMP−1プロテアーゼ認識配列の位置を示す。
【0023】
配列番号9:(1734塩基)
人間α(I)コラーゲン(sTNF−RII−T0)のT0 C−プロペプチドに融合された人間の胎盤アルカリ性ホスファターゼ(AP)をコード化するヌクレオチド配列。濃い色で表示した配列は融合タンパク質作成時に使われた制限部位を意味する。配列の中央に示した融合部位に示したアンダーラインを引いた配列はBamHI/Bgl II結紮部である。
【0024】
配列番号10:(566アミノ酸)
人間可溶性TNF−RII−T0融合物の予想されたタンパク質配列。青色で表示したアミノ酸残基は人間可溶性TNF−RIIとα(I)コラーゲンT0ポリペプチド間の融合部位を示す。アンダーラインを引いた配列は人間α(I)コラーゲンのC−プロペプチドの“グリシン反復体”上流領域を意味する。赤色で表示したアミノ酸残基はBMP−1プロテアーゼ認識配列を意味する。
【0025】
配列番号11:(1542塩基)
人間α(I)コラーゲン(sTNF−RII−T2)のT2 C−プロペプチドに融合された人間可溶性TNF−RIIをコード化するヌクレオチド配列。濃い色で表示したコドンは融合タンパク質の開始及び終止コドンを意味する。配列の中央に示した融合部位を表示したアンダーラインを引いた配列はBamHI/Bgl II結紮部である。
【0026】
配列番号12:(502アミノ酸)
人間可溶性TNF−RII−T2融合物の予想されたタンパク質配列。青色で表示したアミノ酸残基は人間可溶性TNF−RIIとα(I)コラーゲンT2ポリペプチド間の融合部位を示す。赤色で表示したアミノ酸残基はBMP−1プロテアーゼ認識配列を意味する。
【0027】
配列番号13:(2139塩基)
人間α(I)コラーゲンのT0 C−プロペプチドに融合された人間可溶性CD4をコード化するヌクレオチド配列。アンダーラインを引いた配列は融合物作成に使われた制限部位を意味する。配列の中央に示した融合部位を表示したアンダーラインを引いた配列はBgl II部位である。
【0028】
配列番号14:(699アミノ酸)
人間可溶性CD4−T0融合物の予想されたタンパク質配列。青色で表示したアミノ酸残基は人間可溶性CD4とα(I)コラーゲンT0ポリペプチド間の融合部位を示す。アンダーラインを引いた配列は人間α(I)コラーゲンのC−プロペプチドの“グリシン反復体”上流領域を意味する。赤色で表示したアミノ酸残基はBMP−1プロテアーゼ認識配列を意味する。
【0029】
配列番号15:(1947塩基)
人間α(I)コラーゲンのT2 C−プロペプチドに融合された人間可溶性CD4をコード化するヌクレオチド配列。アンダーラインを引いた配列は融合物作成に使われた制限部位を意味する。配列の中央に示した融合部位を表示したアンダーラインを引いた配列はBgl II部位である。
【0030】
配列番号16:(635アミノ酸)
人間可溶性CD4−T2融合物の予想されたタンパク質配列。青色で表示したアミノ酸残基は人間可溶性CD4とα(I)コラーゲンT2ポリペプチド間の融合部位を示す。赤色で表示したアミノ酸残基はBMP−1プロテアーゼ認識配列を意味する。
【発明の詳細な説明】
【0031】
本発明を説明する前に、本発明で用いられる特定用語の定義に対して説明することが理解に助けになることである。
【0032】
DNA作成物:一般的にプラスミドまたはウイルス性ベクター形態であり、天然的には存在しない方式で結合したDNA切片を含むように再組合DNA技術を介して改変された単一鎖または二重鎖のDNA分子。DNA作成物は目的する暗号化するタンパク質の発現及び/または分離を指示するのに必要な情報を含む。
【0033】
信号ペプチド配列:細胞から成熟ポリペプチドまたはタンパク質の分泌を指示する作用をするアミノ酸配列。信号ペプチドは疎水性アミノ酸のコアを有することを特徴として細胞表面に分泌されたり固着される新しく合成されたタンパク質のアミノ末端で典型的に発見される。信号ペプチドは分泌する間成熟タンパク質から切断される。このような信号ペプチドはタンパク質分泌経路を通過するによって成熟タンパク質から信号ペプチドの分解を許す加工部位を含む。信号ペプチド配列は信号ペプチドなしに他のタンパク質のアミノ末端に連結されれば融合タンパク質の分泌を指示することができる。生長因子、ペプチドホルモン、サイトカイン、及び細胞表面受容体をはじめとする膜タンパク質のような大部分の分泌タンパク質は初期タンパク質で合成される時信号ペプチド配列を含む。
【0034】
可溶性受容体:リガンドと結合することができる細胞表面受容体の一部または全部の細胞外ドメイン。一般的に、これは膜固定に必要な内部の疎水性アミノ酸配列を含まない。
【0035】
コラーゲンのC−プロペプチド:三量体で自己構築されることができるコラーゲンのC−末端の球形であり非三重螺旋ドメイン。コラーゲンの三重螺旋領域と対照的に、C−プロペプチドはグリシン反復配列を含まないしまたコラーゲンフィブリル形成以前にコラーゲン分泌される時プロコラーゲン前駆体からタンパク質分解的に除去される。
【0036】
グリシン反復体:アミノ酸配列に数百個の(Gly−X−Y)n反復体を含むコラーゲンの中央線形三重螺旋形成領域。これら反復体はX及び/またはY位置でプロリンが豊富である。N−及びC−プロペプチドを除去すれば、グリシン−反復体含有コラーゲン三重螺旋は高次元の不溶性コラーゲンフィブリルで構築されることができ、これは細胞マトリックスの主要成分を形成する。
【0037】
cDNA:相補的DNA、またはmRNAに相補的なDNA配列。一般的にcDNA配列はイントロン(非タンパク質コーディング)配列を含まない。
【0038】
本発明以前のほとんどすべての治療抗体及びエンブレルのような可溶性受容体Fc融合タンパク質は二量体構造である(図1)。これら分子は、単量体対応物と比較する時、増加された親和性を有する標的抗原またはリガンドに結合されることと明らかになっているが、これらは構造的制限(constraint)によって、同種三量体性構造を有するこれらの標的に不完全に結合する。このような治療的に重要な三量体リガンドの例はサイトカインのgp120 TNFファミリー及びHIV被膜タンパク質を含む。したがって、構造的観点で、標的三量体性リガンドまたは抗原に完全に結合することができる三量体性可溶性受容体または抗体を生成することができて(図1)、したがってそのリガンド作用を完全に遮断することが望ましいことである。このような三量体性可溶性受容体またはキメラ抗体は標的に対して最も高い親和性を有することと予想されるので、関節炎及びAIDSのような疾病を治療するのにさらに效果的に使われることができる。
【0039】
本発明は三量体で自己構築されることができるコラーゲンのC−プロペプチドに融合させることにより、分泌された三量体性受容体及び生物学的活性タンパク質を生成する方法を開示する。本発明の利点は次のようである:(1)コラーゲンは体内で分泌された最も豊富なタンパク質で、体内全体タンパク質のほとんど25%を占める;(2)コラーゲンの主要形態は天然で三量体螺旋で生じて、これらの球形C−プロペプチドは三量体化開始に関与して、三重螺旋形成時タンパク質分解的に分解されて;(3)可溶性三量体性C−プロペプチドは哺乳類の血液でマイクログラム/mL以下の量で天然に発見されて;(4)一定な三重螺旋領域はリンカーで含まれたり融合タンパク質の一部で除外されるので、三量体化されるタンパク質とコラーゲンのC−プロペプチド間の距離は最適の生物学的活性を達成するように調整されることができて;(5)プロコラーゲンのC−プロペプチドを切断するBMPIの認識部位は突然変異されたりまたは欠失されて三量体性融合タンパク質の破壊を防止し;(6)C−プロペプチドドメインは普遍的な親和性タグを提供するので、本発明によって創製された分泌された融合タンパク質の精製のために使われることができて;(7)自身の細胞表面受容体に結合されることのような他の生物学的作用を有することと公知されたIgG1 Fcタグとは違って、コラーゲンのC−プロペプチドの公知された生物学的作用は隣接プロコラーゲンの三量体化を開始してまた不溶性細胞マトリックスに構築される前に溶解性プロコラーゲン三量体を維持することができることである。コラーゲンのC−プロペプチドのこのような独特の特性は固有な三量体化タグが毒性または免疫原性を持たないことを示唆するため、治療用のための理想的な候補になることができる。
【0040】
分泌された三量体融合タンパク質の製造容易性を示すために、一部グリシン−反復三重螺旋領域(T0作成物、配列番号1−2)または突然変異されたBMP−1認識部位を有する非−グリシン反復体(T2作成物、配列番号3−4)を含む人間α1(I)の全体C−プロペプチドをコード化するcDNA配列はアメリカンタイプカルチャーコレクション(ATCC)から購入したESTクローンを用いてRT−PCRにより増幅させた。増幅されたcDNAはBgl II−XbaI断片としてpAPtag2哺乳動物発現ベクター(GenHunterコポーレーション製造;Lederなど、1996及び1998)にそれぞれクローニングされてAPコーディング領域を置換した(図2)。生成したベクターをpTRIMER、バージョンT2及びT0と称する。このベクターは、固有なHind III及びBgl II部位で、可溶性受容体または生物学的活性タンパク質をコード化するcDNA鋳型の便利なフレーム内融合を許す。このような融合タンパク質は天然プロ−コラーゲンと同様にC末端に位置したコラーゲン三量体化タグを有する。
【0041】
図1A、図1B、図1C及び図1Dは従来の二量体性免疫グロブリンFc融合と比較した本発明による方法の概略図である。
【0042】
図1Aは側面上昇図であって、図1Bは上面図であって、図示したようにリガンド無しまたはリガンド結合された形態のアムジェン社のエンブレルのような同種二量体性可溶性sTNF RII受容体−Fc融合の構造的特徴を図示する。
【0043】
1でラベリングされたドメインは可溶性TNA−RIIを意味する。Fc(鎖内ジスルフィド結合(3)と共に2でラベリングされる)融合タンパク質は二量体構造である。二重対称を考慮する時、二量体性Fc融合タンパク質は二価であるので、理論的に三重対称を有するTNF−α(4でラベリングされる)のような同種三量体性リガンドに結合される最適構造を有しない。
【0044】
図1Cは側面上昇図であってまた図1Dは上面図であって、三量体性可溶性sTNF RII受容体−C−プロペプチド融合の構造的特徴を図示する。三重対称を考慮する時、sTNF RII−三量体融合タンパク質は三価構造であるので、三量体性リガンドTNF−αに完全に結合することができる。自己三量体化されることができるコラーゲンのC−プロペプチドは鎖間ジスルフィド結合(3)によりラベリング(5)されている。
【0045】
図2A及び図2Bは分泌された三量体性融合タンパク質を製造するためのpTRIMERプラスミドベクターの構造を図示する。可溶性受容体−または生物学的活性ポリペプチド−コーディングcDNAは固有なHind IIIまたはBgl II部位にクローニングされて、三量体化のためのC−プロペプチド配列を含むα(I)コラーゲンに対してC−末端でフレーム内融合を許す。図2A:pTRIMER(T0)構造物はC−プロペプチドのグリシン−反復体(GXY)n上流の一部を含む。図2B:pTRIMER(T2)は成熟したBMP−1プロテアーゼ認識部位を有するC−プロペプチドドメインだけを含む。
【0046】
図3A及び図3Bはジスルフィド結合で連結した三量体化コラーゲン融合タンパク質の発現及び分泌を図示する。
【0047】
図3Aはα(I)コラーゲンのC−プロペプチドに融合される時の人間の胎盤アルカリ性ホスファターゼ(AP)の三量体化のウエスタンブロット分析である。pTRIMERベクターでAP単独またはAP−C−プロペプチド融合をコード化する発現ベクターは一時的にHEK293T細胞に形質感染される。48時間後、指示されたような各形質感染された細胞の調節培地(conditioned medium)(20μL)を、還元剤(メルカプトエタノール)を含んだり含まない同じ体積2XSDSサンプル緩衝液中で5分間沸かして、10%SDS−PAGE上で分離させた次に多重クローン抗体を用いてAP(GenHunterコポーレーション製造)にウエスタンブロットにより分析する。分泌された67 kDa AP単独は分子間ジスルフィド結合を形成しない反面、分泌されたAP−T0及びAP−T2はジスルフィド結合で連結した三量体で效果的に構築される。
【0048】
図3B.α(I)コラーゲンのC−プロペプチドに融合される時の人間の可溶性TNF−RIIの三量体化のウエスタンブロット分析。pTRIMERベクターに表示されたようなAP−C−プロペプチド融合(T2)(抗体特異性に対する陰性対照用)または人間可溶性TNF−RII−C−プロペプチドを一時的にHEK293T細胞に形質感染させる。48時間後、指示されたような各形質感染された細胞の調節培地(20μL)を、還元剤(メルカプトエタノール)を含んだり含まない同じ体積2XSDSサンプル緩衝液中で5分間沸かして、10%SDS−PAGE上で分離させた次に人間TNF−RII(クローン226、R & Dシーステムズインコーポレイテッド製造)に対する単一クローン抗体を用いてウエスタンブロットにより分析する。単一クローン抗体はジスルフィド結合を有する分泌されたTNF−RIIだけを認識することができる。可溶性TNF−RII−T0及びTNF−RII−T2融合はジスルフィド結合連結した三量体で效果的に構築される。
【0049】
図4及び図5は人間TNF−α媒介された細胞自殺に対する三量体性可溶性人間TNF−RII−Cプロペプチド融合タンパク質の強力な中和活性を示すバイオアッセイを図示する。
【0050】
図4.TNF−α敏感性WEHI−13VAR細胞(ATCC)を10%FBSを含むRPMI培地中に1百万細胞/mLで懸濁させた。100μLの細胞懸濁液を96−ウェルマイクロタイタープレート内のウェルにプレーティングした。各ウェルに500ng/mLの濃度でアクチノマイシンDを付加した次に三量体化可溶性人間TNF−RII−T2の存在下でまたは不在下で人間TNF−αを500pg/ml(R & Dシーステムズ製造)濃度で付加した。陰性対照用として、三量体性AP−T2をTNF−RII−T2の代わりに付加した。組織培養培養器で16時間の間培養した後、細胞の生存性は20X倍率の反転顕微鏡または各ウェルに10%(v/v)付加した細胞生存能指示剤染料、アラマーブルー(Alamar Blue)(BioSource,Inc.)を用いて調査した。生存細胞は染料色を青色からピンク色へ変更することができる。三量体性可溶性人間TNF−RII−T2は強力な中和活性を示す反面TNF−αはTNF−α媒介された細胞自殺から細胞を保護する。
【0051】
図5.人間TNF−αに対する三量体性可溶性人間TNF−RII−T2の中和活性の定量分析。この実験は図4Aでのように実施した。アラマーブルー(Alamar Blue)染料を付加して2時間後、各ウェルから指示されたような培養培地をOD575で分析した。TNF−αが付加されないウェル(100%生存率)または中和剤なしにTNF−αが付加された(0%生存率)ウェルに対して判読を規準化した。
【実施例1】
【0052】
本発明の実現可能性を示すために、天然の信号ペプチド配列をはじめとする人間の分泌された胎盤アルカリ性ホスファターゼ(AP)をコード化するcDNAをpAPtag4ベクター(GenHunterコポーレーション;Lederなど、1996及び1998)からHind III−Bgl II断片に切断してpTRIMER−T0及びpTRIMER−T2ベクターの相応する部位にクローニングした。生成したAP−コラーゲン融合作成物(配列番号5−8)は形質感染後HEK293T細胞(GenHunterコポーレーション製造)で発現させた。AP−コラーゲン融合タンパク質の成功的な分泌は形質感染された細胞の調節培地を用いたAP活性分析により容易に決定されることができる。形質感染された2日後AP活性は約1単位体/mL(または約1μg/mLの融合タンパク質に相応)に到達した。融合タンパク質を安定に発現するHEK293T細胞を得るために、ピューロマイシン−耐性ベクター、pBabe−Puro(GenHunterコポーレーション製造)と共同感染後安定したクローンを選択した。AP活性を発現するクローンを生長させて融合タンパク質の長期間生産のために保存した。
【0053】
AP−コラーゲン融合タンパク質がジスルフィド結合−連結三量体で構築されるのか決定するために、AP単独またはAP−T0及びAP−T2融合物を含む調節培地をβ−メルカプトエタノールを有しなかったり(非還元)または有する(還元)SDSサンプル緩衝液で沸かして抗−AP多重クローン抗体(GenHunterコポーレーション製造)を用いてウエスタンブロットにより分析した。融合のないAP単独は非還元及び還元条件下ですべて67 kDaバンドで現われて、これは分子間ジスルフィド結合の不足が予想されることと一致した(図3A)。対照的に、分泌されたAP−T0及びAP−T2融合タンパク質は、還元条件下(90−100 kDa)と比較して、非還元条件下で3倍さらに大きい(約300 kDa)ことに明らかになっており、これは両側融合タンパク質が完全に同種三量体で構築されることを示す(図3A)。この結果は本発明の概念を実施するようにさせる。
【実施例2】
【0054】
新しくて治療的に有効な生物学的作用が三量体性融合タンパク質により与えられることができることを証拠を提供するために、ATCCから購入した相応するESTクローンを用いて三量体性人間可溶性TNF−RII(p75)受容体を作成した。実施形態1に記載したように、全体リガンド結合領域は含むがトランスメンブレインドメインを含まない人間TNF−RIIのN−末端領域をBamHI断片としてpTRIMER−T0及びpTRIMER−T2ベクター(配列番号9−12)のBgl II部位にクローニングした。生成した融合作成物は形質感染後HEK293T細胞で発現された。実施形態1に記載したようにピューロマイシン共同選択により安定したクローンを得た。非還元及び還元条件下でウエスタンブロット分析を実施して、生成した可溶性TNF−RII−コラーゲン融合タンパク質が実際に発現されて、分泌されて三量体形態で構築されたのかを決定した。予想したように、人間TNF−RIIに対する単一クローン抗体(R & Dシーステムズインコーポレイテッドから入手したクローン22)はT0及びT2融合ベクターにより220−240 kDaバンドで発現された三量体性可溶性TNF−融合タンパク質を明確に認識し、これは相応する単量体性融合タンパク質より約3倍以上さらに大きい(図3B)。TNF−RII抗体は還元条件下で単量体性融合タンパク質を検出することができなく、これは抗体製造者により特定された特性と一致することである。抗体特異性に対する陰性対照用として、HEK293T細胞単独またはAP−T2融合タンパク質を発現する細胞どれもTNF−RIIを発現しなかった(図3B)。
【0055】
三量体性可溶性TNF−RII受容体が三量体性リガンドTNF−αの強力な抑制剤なのかを決定するために、前で実質的に記載されたような(Mohlerなど、1993)サイトカイン敏感性細胞株WEHI−13VAR(ATCC)を用いてTNF−αバイオアッセイ(bioassay)を実施した。図4に図示した結果は三量体性可溶性TNF−RII−C−プロペプチド融合タンパク質がアクチノマイシンD(500ng/mL)(シグマ製造)の存在下でWEHI−13VAR細胞のTNF−αに媒介された細胞自殺を強く中和させることを明確に示した。人間TNF−α(R & Dシーステムズ製造)が0.5ng/mLで使われると、三量体性可溶性TNF−RII−T2(無血清培地からまたは精製された形態)は約2ng/mLまたは8x10−12M(同種三量体で240 kDa分子量推定)の見かけKi−50(50%抑制)を有した。TNF−αに対する親和性は単量体性TNF−RIIより4倍以上でありエンブレル(Mohlerなど、1993)のような二量体性可溶性TNF−RII−Fc融合物より10−100倍以上さらに高かった。
【0056】
この重要な実施形態は本発明が治療用途を有することができる新規生物学的特性を有する三量体性融合タンパク質を作ることができるということを証明する。このような可溶性三量体性人間TNF受容体は、RAのような自動免疫疾病を治療するために市販される現在の二量体性可溶性TNF受容体(例えばエンブレル)よりはるかに効果的に見える。三量体性TNF受容体の顕著に増加された能力は各患者に毎週注射しなければならないTNF阻害薬の量を顕著に減少させることができながら、治療を改善させてまた患者の費用を顕著に減少させることができる。三量体性TNF受容体の向上した能力は現在米国で約100、000名の患者治療要求だけを充足させることができる二量体性TNF受容体生産での停滞(ボトルネック)問題を軽減させることである。
【実施例3】
【0057】
AIDSの原因であるHIVウイルスは私たちの体内のTリンパ球の特殊な系統を主に感染して破壊する。いわゆるCD4+T細胞は、HIVの受容体であるCD4と呼ばれる細胞表面タンパク質を発現する。HIVはCD4に結合されるウイルス性被膜タンパク質gp120を有するCD4+細胞を認識する。明確に、gp120はウイルス表面上で巨大な同種三量体複合体で存在する反面、CD4は細胞表面上で単量体で存在する。HIV感染に対する現在のモデルはHIVをCD4+T細胞に完全に結合させ、gp120のすべての3個サブユニットがCD4にそれぞれ結合すれば、ウイルスRNAが細胞に入るために必要である。明確に、HIV感染を中止するための直接的な戦略中の一つはウイルスを遮る(blind)ために可溶性CD4を用いることである。実際に、単量体性溶解性CD4及びCD4−Fc融合物を用いるこのような方法は実験室分離物のHIV感染を中止させることに非常に効果的なことに明らかになった(Claphamなど、1989;Daarなど、1990)。不幸にも、これら可溶性CD4は、単量体性及び二量体性可溶性CD4に対する親和性を低下させるgp120のアミノ酸配列変形によって、AIDS患者で発見されたHIVウイルス株感染を中止させることには効果が少なかった(Daarなど、1990)。
【0058】
HIVウイルスに対するgp120変異体に対する可溶性CD4の親和性を顕著に増加させるために、理想的に可溶性CD4は三量体リガンドであるgp120同種三量体と完全に結合するように三量体形態でなければならない。AIDS治療の主要問題中の一つはウイルスゲノムの突然変異率が非常に高くて耐薬品性をもたらす点である。したがって、HIV逆転写酵素(例えばAZT)及びプロテアーゼのようなウイルス遺伝子を直接標的にする薬物はウイルス突然変異の結果によって效果がないと考えられる。対照的に、いくら突然変異されるにしても、HIVウイルスは細胞CD4受容体と反応して感染を開始する。したがって、高親和性可溶性CD4三量体は、gp120遺伝子でウイルス突然変異が三量体性可溶性CD4だけでなく細胞上のCD4にも結合されることができないウイルスをもたらすため、ウイルス突然変異に兔疫性を持たなければならない。
【0059】
このような三量体性可溶性CD4 HIV受容体類似体を製造するために、天然の信号ペプチド配列を含んでトランスメンブレイン及び短い細胞質ドメインを排除しない全体人間可溶性CD4をコード化するcDNAを、ATCCから購入したESTクローンを用いて増幅させた。生成したcDNAはpTRIMER−T0及びp−TRIMER−T2発現ベクターの相応する部位にHind III−Bgl II断片としてクローニングした。生成した可溶性CD4−コラーゲン融合作成物(配列番号13−16)は形質感染後HEK293T細胞(GenHunterコポーレーション製造)で発現させた。融合タンパク質を安定に発現するHEK293T細胞を得るために、ピューロマイシン−耐性ベクターであるpBabe−Puro(GenHunterコポーレーション製造)と共同形質感染させた後安定したクローンを選択した。融合タンパク質を発現するクローンを生長させて融合タンパク質の長期間生産のために保存した。
【0060】
可溶性人間CD4−コラーゲン融合タンパク質がジスルフィド結合−連結三量体で構築されるのか決定するために、可溶性CD4−T0及びCD4−T2融合物を含む調節培地を、β−メルカプトエタノールを有しなかったり(非還元)または有する(還元)SDSサンプル緩衝液で沸かして、SDS PAGEにより分離してまた人間CD4に対する単一クローン抗体(R & Dシーステムズ製造)を用いたウエスタンブロットにより分析した。分泌された可溶性CD4−T0及びCD4−T2融合タンパク質は、還元条件下(90−100 kDa)と比較して、非還元条件下で3倍さらに大きい(約300 kDa)ことに現われ、これは両側融合タンパク質が完全に同種三量体で構築されることを示す(データ示さない)。これら三量体性可溶性CD4はgp120結合及び抗−HIV感染のために容易に試験されることができる。
【図面の簡単な説明】
【0061】
【図1A】同種二量体性可溶性sTNF RII受容体−Fc融合の構造的特徴を図示する側面上昇図である。
【図1B】同種二量体性可溶性sTNF RII受容体−Fc融合の構造的特徴を図示する上面図である。
【図1C】三量体性可溶性sTNF RII受容体−C−プロペプチド融合の構造的特徴を図示する側面上昇図である。
【図1D】三量体性可溶性sTNF RII受容体−C−プロペプチド融合の構造的特徴を図示する上面図である。
【図2A】分泌された三量体性融合タンパク質を製造するためのpTRIMERプラスミドベクターの構造を図示する。
【図2B】分泌された三量体性融合タンパク質を製造するためのpTRIMERプラスミドベクターの構造を図示する。
【図3A】α(I)コラーゲンのC−プロペプチドに融合される時の人間の胎盤アルカリ性ホスファターゼ(AP)の三量体化のウエスタンブロット分析である。
【図3B】α(I)コラーゲンのC−プロペプチドに融合される時の人間の可溶性TNF−RIIの三量体化のウエスタンブロット分析である。
【図4】人間TNF−α媒介された細胞自殺に対する三量体性可溶性人間TNF−RII−Cプロペプチド融合タンパク質の強力な中和活性を示すバイオアッセイを図示する。
【図5】人間TNF−αに対する三量体性可溶性人間TNF−RII−T2の中和活性の定量分析である。
【特許請求の範囲】
【請求項1】
(a)三量体化されるポリペプチドにフレーム内で融合され、三量体化される第1ポリペプチドとは異種である自己三量体化されることができるポリペプチドにフレーム内で結合した、信号ペプチド配列をコード化する鋳型に結合された転写プロモーターを含むDNA作成物を作って;
(b)前記DNA作成物を真核生物細胞に導入し;
(c)生理的条件下の好適な生長培地で宿主細胞を生長させて前記DNA配列によりコード化されて三量体化された融合タンパク質の分泌を許し;及び
(d)前記三量体化された融合タンパク質を宿主細胞から分離することを含む、分泌された三量体性融合タンパク質の製造方法。
【請求項2】
第1項において、三量体化されたポリペプチド融合物が同種三量体である方法。
【請求項3】
第1項において、三量体化ポリペプチド残基はプロ.α.1(I)、プロ.α.2(I)、プロ.α.1(II)、プロ.α.1(III)、プロ.α.1(V)、プロ.α.2(V)、プロ.α.1(XI)、プロ.α.2(XI)及びプロ.α.3(XI)で構成された群から選択される三量体に自己構築されることができるコラーゲンのC−末端部分を含む方法。
【請求項4】
(a)三量体化される非コラーゲンポリペプチドにフレーム内で連結され、自己三量体化されることができて、プロ.α.1(I)、プロ.α.2(I)、プロ.α.1(II)、プロ.α.1(III)、プロ.α.1(V)、プロ.α.2(V)、プロ.α.1(XI)、プロ.α.2(XI)及びプロ.α.3(XI)から選択されるコラーゲンのC−末端部分にフレーム内で連結された信号ペプチド配列で構成されたオープンリーディングフレームの転写を誘導するプロモーターを含む第1DNA作成物を真核生物宿主細胞に導入して;
(b)三量体化される第2非コラーゲンポリペプチドにフレーム内で連結され、自己三量体化されることができて、プロ.α.1(I)、プロ.α.2(I)、プロ.α.1(II)、プロ.α.1(III)、プロ.α.1(V)、プロ.α.2(V)、プロ.α.1(XI)、プロ.α.2(XI)及びプロ.α.3(XI)から選択されるコラーゲンの第2C−末端部分にフレーム内で連結された信号ペプチド配列で構成されたオープンリーディングフレームの転写を誘導するプロモーターを含む第2DNA作成物を真核生物宿主細胞に導入して;
(c)生理的条件下の好適な生長培地で宿主細胞を生長させて前記第1及び第2DNA配列によりコード化されて三量体化された融合タンパク質の分泌を許し;及び
(d)分泌された三量体性融合タンパク質を宿主細胞から分離することを含む、分泌された三量体性融合タンパク質の製造方法。
【請求項5】
(a)三量体化される非コラーゲンポリペプチドにフレーム内で連結され、自己三量体化されることができて、プロ.α.1(I)、プロ.α.2(I)、プロ.α.1(II)、プロ.α.1(III)、プロ.α.1(V)、プロ.α.2(V)、プロ.α.1(XI)、プロ.α.2(XI)及びプロ.α.3(XI)から選択されるコラーゲンのC−末端部分にフレーム内で連結された信号ペプチド配列で構成されたオープンリーディングフレームの転写を誘導するプロモーターを含む第1DNA作成物を真核生物宿主細胞に導入して;
(b)三量体化される第2非コラーゲンポリペプチドにフレーム内で連結され、自己三量体化されることができて、プロ.α.1(I)、プロ.α.2(I)、プロ.α.1(II)、プロ.α.1(III)、プロ.α.1(V)、プロ.α.2(V)、プロ.α.1(XI)、プロ.α.2(XI)及びプロ.α.3(XI)から選択されるコラーゲンの第2C−末端部分にフレーム内で連結された信号ペプチド配列で構成されたオープンリーディングフレームの転写を誘導するプロモーターを含む第2DNA作成物を真核生物宿主細胞に導入して;
(c)三量体化される第3非コラーゲンポリペプチドにフレーム内で連結され、自己三量体化されることができて、プロ.α.1(I)、プロ.α.2(I)、プロ.α.1(II)、プロ.α.1(III)、プロ.α.1(V)、プロ.α.2(V)、プロ.α.1(XI)、プロ.α.2(XI)及びプロ.α.3(XI)から選択されるコラーゲンの第3C−末端部分にフレーム内で連結された信号ペプチド配列で構成されたオープンリーディングフレームの転写を誘導するプロモーターを含む第3DNA作成物を真核生物宿主細胞に導入して;
(d)生理的条件下の好適な生長培地で宿主細胞を生長させて前記第1及び第2DNA配列によりコード化されて三量体化された融合タンパク質の分泌を許し;及び
(e)分泌された三量体性融合タンパク質を宿主細胞から分離することを含む、分泌された三量体性融合タンパク質の製造方法。
【請求項6】
第1項ないし第5項のうちいずれか一つの項において、信号ペプチド配列及び三量体化される非コラーゲンポリペプチドは同一天然分泌タンパク質から得たことである方法。
【請求項7】
第1項ないし第5項のうちいずれか一つの項において、信号ペプチド配列及び三量体化される非コラーゲンポリペプチドは2個の相異なる分泌タンパク質から選択された方法。
【請求項8】
第1項、第4項及び第5項のうちいずれか一つの項において、宿主真核生物細胞が真菌または昆虫細胞である方法。
【請求項9】
第1項、第4項及び第5項のうちいずれか一つの項において、前記宿主真核生物細胞が培養された哺乳動物細胞株である方法。
【請求項10】
第1項ないし第5項のうちいずれか一つの項において、コラーゲンのC−末端部分はC−プロペプチドに結合されたコラーゲンの“グリシン反復体”三重螺旋領域を含む方法。
【請求項11】
第10項において、コラーゲンのC−末端部分は配列番号1−2により確認された方法。
【請求項12】
第1項ないし第5項のうちいずれか一つの項において、コラーゲンの三量体化C−末端部分はコラーゲンのグリシン−反復体三重螺旋領域を持たなくてC−プロペプチドだけを含む方法。
【請求項13】
第10項ないし第12項のうちいずれか一つの項において、コラーゲンの三量体化C−末端部分は突然変異されたりまたは欠失されたBMP−1プロテアーゼ認識配列を含むことによって融合タンパク質にプロテアーゼ分解に対する耐性を付与する方法。
【請求項14】
第12項または第13項において、コラーゲンの三量体化C−末端部分は配列番号3−4により確認された方法。
【請求項15】
第1項、第2項、第3項、第10項ないし第14項のうちいずれか一つの項による方法で生成されて配列番号9−12により確認された可溶性三量体性人間TNF−α受容体II(p75)を含む融合タンパク質の組成物。
【請求項16】
第1項、第2項、第3項、第10項ないし第14項のうちいずれか一つの項による方法で生成された融合タンパク質が配列番号13−16により確認された可溶性三量体性人間CD4である組成物。
【請求項17】
第1項、第2項、第3項、第10項ないし第14項のうちいずれか一つの項による方法で生成された融合タンパク質の組成物が配列番号5−8により確認された可溶性三量体性可溶性人間の胎盤アルカリ性ホスファターゼである組成物。
【請求項18】
コラーゲンのC−プロペプチドに結合された受容体のリガンド結合ドメインを含む3個のポリペプチド鎖を含み、ポリペプチド融合物の三量体化が生物学的活性増加をもたらす三量体化されたポリペプチド融合物。
【請求項19】
第15項により生成された三量体化された可溶性TNF−α受容体IIを用いてTNF−α生物学的活性を遮断する方法。
【請求項1】
(a)三量体化されるポリペプチドにフレーム内で融合され、三量体化される第1ポリペプチドとは異種である自己三量体化されることができるポリペプチドにフレーム内で結合した、信号ペプチド配列をコード化する鋳型に結合された転写プロモーターを含むDNA作成物を作って;
(b)前記DNA作成物を真核生物細胞に導入し;
(c)生理的条件下の好適な生長培地で宿主細胞を生長させて前記DNA配列によりコード化されて三量体化された融合タンパク質の分泌を許し;及び
(d)前記三量体化された融合タンパク質を宿主細胞から分離することを含む、分泌された三量体性融合タンパク質の製造方法。
【請求項2】
第1項において、三量体化されたポリペプチド融合物が同種三量体である方法。
【請求項3】
第1項において、三量体化ポリペプチド残基はプロ.α.1(I)、プロ.α.2(I)、プロ.α.1(II)、プロ.α.1(III)、プロ.α.1(V)、プロ.α.2(V)、プロ.α.1(XI)、プロ.α.2(XI)及びプロ.α.3(XI)で構成された群から選択される三量体に自己構築されることができるコラーゲンのC−末端部分を含む方法。
【請求項4】
(a)三量体化される非コラーゲンポリペプチドにフレーム内で連結され、自己三量体化されることができて、プロ.α.1(I)、プロ.α.2(I)、プロ.α.1(II)、プロ.α.1(III)、プロ.α.1(V)、プロ.α.2(V)、プロ.α.1(XI)、プロ.α.2(XI)及びプロ.α.3(XI)から選択されるコラーゲンのC−末端部分にフレーム内で連結された信号ペプチド配列で構成されたオープンリーディングフレームの転写を誘導するプロモーターを含む第1DNA作成物を真核生物宿主細胞に導入して;
(b)三量体化される第2非コラーゲンポリペプチドにフレーム内で連結され、自己三量体化されることができて、プロ.α.1(I)、プロ.α.2(I)、プロ.α.1(II)、プロ.α.1(III)、プロ.α.1(V)、プロ.α.2(V)、プロ.α.1(XI)、プロ.α.2(XI)及びプロ.α.3(XI)から選択されるコラーゲンの第2C−末端部分にフレーム内で連結された信号ペプチド配列で構成されたオープンリーディングフレームの転写を誘導するプロモーターを含む第2DNA作成物を真核生物宿主細胞に導入して;
(c)生理的条件下の好適な生長培地で宿主細胞を生長させて前記第1及び第2DNA配列によりコード化されて三量体化された融合タンパク質の分泌を許し;及び
(d)分泌された三量体性融合タンパク質を宿主細胞から分離することを含む、分泌された三量体性融合タンパク質の製造方法。
【請求項5】
(a)三量体化される非コラーゲンポリペプチドにフレーム内で連結され、自己三量体化されることができて、プロ.α.1(I)、プロ.α.2(I)、プロ.α.1(II)、プロ.α.1(III)、プロ.α.1(V)、プロ.α.2(V)、プロ.α.1(XI)、プロ.α.2(XI)及びプロ.α.3(XI)から選択されるコラーゲンのC−末端部分にフレーム内で連結された信号ペプチド配列で構成されたオープンリーディングフレームの転写を誘導するプロモーターを含む第1DNA作成物を真核生物宿主細胞に導入して;
(b)三量体化される第2非コラーゲンポリペプチドにフレーム内で連結され、自己三量体化されることができて、プロ.α.1(I)、プロ.α.2(I)、プロ.α.1(II)、プロ.α.1(III)、プロ.α.1(V)、プロ.α.2(V)、プロ.α.1(XI)、プロ.α.2(XI)及びプロ.α.3(XI)から選択されるコラーゲンの第2C−末端部分にフレーム内で連結された信号ペプチド配列で構成されたオープンリーディングフレームの転写を誘導するプロモーターを含む第2DNA作成物を真核生物宿主細胞に導入して;
(c)三量体化される第3非コラーゲンポリペプチドにフレーム内で連結され、自己三量体化されることができて、プロ.α.1(I)、プロ.α.2(I)、プロ.α.1(II)、プロ.α.1(III)、プロ.α.1(V)、プロ.α.2(V)、プロ.α.1(XI)、プロ.α.2(XI)及びプロ.α.3(XI)から選択されるコラーゲンの第3C−末端部分にフレーム内で連結された信号ペプチド配列で構成されたオープンリーディングフレームの転写を誘導するプロモーターを含む第3DNA作成物を真核生物宿主細胞に導入して;
(d)生理的条件下の好適な生長培地で宿主細胞を生長させて前記第1及び第2DNA配列によりコード化されて三量体化された融合タンパク質の分泌を許し;及び
(e)分泌された三量体性融合タンパク質を宿主細胞から分離することを含む、分泌された三量体性融合タンパク質の製造方法。
【請求項6】
第1項ないし第5項のうちいずれか一つの項において、信号ペプチド配列及び三量体化される非コラーゲンポリペプチドは同一天然分泌タンパク質から得たことである方法。
【請求項7】
第1項ないし第5項のうちいずれか一つの項において、信号ペプチド配列及び三量体化される非コラーゲンポリペプチドは2個の相異なる分泌タンパク質から選択された方法。
【請求項8】
第1項、第4項及び第5項のうちいずれか一つの項において、宿主真核生物細胞が真菌または昆虫細胞である方法。
【請求項9】
第1項、第4項及び第5項のうちいずれか一つの項において、前記宿主真核生物細胞が培養された哺乳動物細胞株である方法。
【請求項10】
第1項ないし第5項のうちいずれか一つの項において、コラーゲンのC−末端部分はC−プロペプチドに結合されたコラーゲンの“グリシン反復体”三重螺旋領域を含む方法。
【請求項11】
第10項において、コラーゲンのC−末端部分は配列番号1−2により確認された方法。
【請求項12】
第1項ないし第5項のうちいずれか一つの項において、コラーゲンの三量体化C−末端部分はコラーゲンのグリシン−反復体三重螺旋領域を持たなくてC−プロペプチドだけを含む方法。
【請求項13】
第10項ないし第12項のうちいずれか一つの項において、コラーゲンの三量体化C−末端部分は突然変異されたりまたは欠失されたBMP−1プロテアーゼ認識配列を含むことによって融合タンパク質にプロテアーゼ分解に対する耐性を付与する方法。
【請求項14】
第12項または第13項において、コラーゲンの三量体化C−末端部分は配列番号3−4により確認された方法。
【請求項15】
第1項、第2項、第3項、第10項ないし第14項のうちいずれか一つの項による方法で生成されて配列番号9−12により確認された可溶性三量体性人間TNF−α受容体II(p75)を含む融合タンパク質の組成物。
【請求項16】
第1項、第2項、第3項、第10項ないし第14項のうちいずれか一つの項による方法で生成された融合タンパク質が配列番号13−16により確認された可溶性三量体性人間CD4である組成物。
【請求項17】
第1項、第2項、第3項、第10項ないし第14項のうちいずれか一つの項による方法で生成された融合タンパク質の組成物が配列番号5−8により確認された可溶性三量体性可溶性人間の胎盤アルカリ性ホスファターゼである組成物。
【請求項18】
コラーゲンのC−プロペプチドに結合された受容体のリガンド結合ドメインを含む3個のポリペプチド鎖を含み、ポリペプチド融合物の三量体化が生物学的活性増加をもたらす三量体化されたポリペプチド融合物。
【請求項19】
第15項により生成された三量体化された可溶性TNF−α受容体IIを用いてTNF−α生物学的活性を遮断する方法。
【図1A】


【図1B】


【図1C】


【図1D】


【図2A】


【図2B】


【図3A】


【図3B】


【図4】


【図5】




【図1B】


【図1C】


【図1D】


【図2A】


【図2B】


【図3A】


【図3B】


【図4】


【図5】


【公表番号】特表2007−519611(P2007−519611A)
【公表日】平成19年7月19日(2007.7.19)
【国際特許分類】
【出願番号】特願2006−534253(P2006−534253)
【出願日】平成16年10月4日(2004.10.4)
【国際出願番号】PCT/US2004/032753
【国際公開番号】WO2005/047850
【国際公開日】平成17年5月26日(2005.5.26)
【出願人】(506107324)ゲンハンター コーポレーション (1)
【Fターム(参考)】
【公表日】平成19年7月19日(2007.7.19)
【国際特許分類】
【出願日】平成16年10月4日(2004.10.4)
【国際出願番号】PCT/US2004/032753
【国際公開番号】WO2005/047850
【国際公開日】平成17年5月26日(2005.5.26)
【出願人】(506107324)ゲンハンター コーポレーション (1)
【Fターム(参考)】
[ Back to top ]

