創傷治癒促進剤
【課題】 経口投与により充分な創傷治癒効果を発揮し、かつ長期間摂取しても安全な創傷治癒促進剤及び創傷治癒促進効果を有する飲食品を提供する。
【解決手段】 ハナビラタケの子実体及び/又は菌糸体もしくはこれらに由来するβ−グルカンを有効成分として含む創傷治癒促進作用を有する組成物並びに該組成物を有効成分として含有することを特徴とする経口投与剤及び飲食品。古くから薬用・食用として利用されているハナビラタケを原料としているため、極めて安全性が高いことから、飲食品に含ませて用いることができる。
【解決手段】 ハナビラタケの子実体及び/又は菌糸体もしくはこれらに由来するβ−グルカンを有効成分として含む創傷治癒促進作用を有する組成物並びに該組成物を有効成分として含有することを特徴とする経口投与剤及び飲食品。古くから薬用・食用として利用されているハナビラタケを原料としているため、極めて安全性が高いことから、飲食品に含ませて用いることができる。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、ハナビラタケ子実体及び/又は菌糸体に由来する創傷治癒促進作用を有する組成物並びにそれを含有する創傷治癒促進剤及び飲食品に関する。
【背景技術】
【0002】
創傷の治癒過程は、血液凝固期、炎症期、増殖期、成熟期の4つのステージに分類される。血液凝固期は、凝固した血液が創を一時的に閉鎖する、いわば外敵侵入に対する応急処置としてとらえられる。炎症期には創傷部に好中球、マクロファージが遊走し、付着した細菌や壊死組織、異物などの処理にあたる。増殖期には線維芽細胞がコラーゲンなどの細胞外マトリックス成分を産生したり、新生血管が形成されたりし、肉芽組織の形成とともに創が収縮する。成熟期には細胞外マトリックス合成は充分に進み、傷口が目立たなくなる。
【0003】
このような創傷治癒の過程には種々の増殖因子が関与しており、マクロファージなどの免疫担当細胞が重要な役割を果たすことから、創傷治癒は免疫系を介する生理学的プロセスであることが明らかとなっている。
【0004】
健康な患者における創傷治癒では、上記の過程が確実に進行するが、糖尿病患者では細胞の遊走が鈍くなったり、線維芽細胞のコラーゲン産生能が低下していたり、増殖因子の産生量が低下したりしているため、しばしば治癒が遅れるもしくは治癒が一向に進まない状態となり、臨床上の大きな問題となっている。
【0005】
現在、創傷に対する治療法としては、消毒を行った上でガーゼを貼る治療法から、ポリウレタンフィルム、ハイドロコロイド、ハイドロジェル、ハイドロポリマーなどのドレッシング剤を利用した湿潤療法が創傷を速やかに治癒させることができるため、多く適用されるようになってきた。しかし、湿潤療法を選択した場合でも、糖尿病患者では依然として創傷治癒の遅延が起こるため、糖尿病患者の創傷治療に対しては十分ではない。
【0006】
このような状況を踏まえ、線維芽細胞の成長や血管新生を促進させる作用を持ち、糖尿病患者においても高い有効性を発揮する塩基性線維芽細胞増殖因子(bFGF)が創傷治癒促進剤として開発された(非特許文献1、2)。
【0007】
bFGF製剤(商品名:フィブラストスプレー)は、患部に該製剤の溶液をスプレーする局所投与法により優れた創傷治癒効果を発揮するため、外科領域で頻用されているものの、その増殖因子という特性上、腫瘍の増大を引き起こす可能性が懸念されるため、創傷部付近に腫瘍がある患者に対しては適用できず、汎用性という観点からは必ずしも優れていない。
【0008】
一方、キノコ類は古くから薬用/食用として利用されており、1970年代からそれらから抽出した多糖類やβ−グルカンが免疫賦活作用を示すことが次々と示され、アガリクス、メシマコブ、霊芝、ハナビラタケなどに含まれるβ−グルカンに免疫賦活作用を期待し、それらのキノコ類の子実体や菌糸体の乾燥物や抽出物が健康食品素材として近年利用されるようになってきた(例えば、特許文献1、2及び3)。
【0009】
β−グルカンとはβ−グルコースがグルコシド結合により直鎖状に重合した多糖類の総称であり、種々の生物、特に植物、真菌類、細菌類の細胞壁の構成成分として豊富に含まれている。また、その結合様式によって、β−1,3−グルカン、β−1,4−グルカン、β−1,6−グルカンなどに分類されるものである。
【0010】
β−グルカンは免疫賦活作用を有し、抗腫瘍作用、造血促進作用などの機能性を発揮することが知られている(非特許文献3−6)。また、創傷治癒の治療に対しては酵母由来のβ−グルカンやメシマコブから抽出された多糖類について、さらには硫酸化されたβ−1,3−グルカンについてもその有用性が指摘されている(非特許文献7、8及び9、特許文献4及び5)。
【0011】
上記したキノコ類の中でもハナビラタケは、β−グルカン含量が子実体乾燥粉末当たり43質量%以上と非常に高含有である。さらに、ハナビラタケのβ−グルカンについては、担癌マウスや癌患者での試験において有用性が認められており、医薬品分野での用途も提案されている(特許文献6及び7、非特許文献10、11)。
【非特許文献1】M.オクムラ(Okumura)、T.オクダ(Okuda)、T.ナカムラ(Nakamura) and M.ヤジマ(Yajima)、「創傷治癒障害モデル動物の創傷治癒に及ぼす塩基性線維芽細胞増殖因子の影響(Effect of basic fibroblast growth factor in wound healing in healing-impaired animal models)」、Arzneimittelforschung., (1996),46(5):547-551
【非特許文献2】奥村誠、奥田敏明、片岡さゆり、堀敏光、中村勉、矢嶋基之、「遺伝子組換え型ヒト塩基性線維芽細胞成長因子(bFGF)の創傷治療効果に関する研究」―用法および既存薬剤とその有効成分との作用比較―、基礎と臨床、(1996)、30(9):2161-2174
【特許文献1】特開2001−10970号公報
【特許文献2】特開2001−131083号公報
【特許文献3】特開2003−183176号公報
【非特許文献3】N.モハゲポアー(Mohagheghpour)、M.ドーソン(Dawson)、P.ホブズ(Hobbs)、A.ジュド(Judd)、R.ウィナント(Winant)、L.ドウスマン(Dousman)、N.ワルデック(Waldeck)、L.ホカマ(Hokama)、D.ツセ(Tuse)、F.コス(Kos)、C.ベニク(Benike) and E.エングルマン(Engleman)、「免疫アジュバントとしてのグルカン(Glucans as immunological adjuvants)」、アドバンスズイン エクスペリメンタルメディシン アンドバイオロジー(Advances in experimental medicine and biology)、(1995)、383:13-22
【非特許文献4】前田幸子、石村和子、千原呉郎、「抗腫瘍多糖と癌に対する宿主の抵抗―新しい癌免疫化学療法への道―」、蛋白質核酸酵素、(1976)、21(6):425-435
【非特許文献5】池川哲郎、「きのこの生理活性について」、バイオセラピー(Biotherapy)、(2000)、14(10):945-951
【非特許文献6】大野尚仁、「βグルカンの生体防御系修飾作用」、日本細菌学雑誌、(2000)、55(3):527-537
【非特許文献7】M.ウォーク(Wolk)and D.ダノン(Danon)、「一個体で評価された酵母由来グルカンによる創傷治癒の促進(Promotion of wound healing by yeast glucan evaluated by single animals)」、メディカル バイオロジー(Medical Biology)、(1985)、63:73-85
【非特許文献8】W.ブロウダー(Browder)、D.ウィリアムズ(Williams)、P.ルコア(Lucore)、H.プレタス(Pretus)、E.ジョーンズ(Jones) and R.マクナミー(McNamee)、「活性化されたマクロファージの初期創傷治癒における効果(Effect of enhanced macrophage function on early wound healing)」、サージェリー(Surgery)、(1988)、104:224-230
【非特許文献9】J.-S.バエ(Bae)、K.-H.ヤン(Jang)、S.-C.パク(Park) and H.K.ジン(Jin)、「フェリナス・ギルバスから単離した多糖による創傷治癒促進作用(Promotion of dermal wound healing by polysaccharides isolated from Phellinus gilvus in rats)」、ジャーナル オブ ベトリナリー メディカル サイエンス(The Journal of veterinary medical science)、(2005)、67(1):111-114
【特許文献4】特開平11−116604号公報
【特許文献5】特開平11−171784号公報
【特許文献6】特開2000−217543号公報
【特許文献7】特許第3509736号公報
【非特許文献10】N.オオノ(Ohno)、N.N.ミウラ(Miura)、M.ナカジマ(Nakajima) and T.ヤドマエ(Yadomae)、「栽培されたスパラシス・クリスパ子実体由来の抗腫瘍性1,3−ベータグルカン(Antitumor 1,3-beta-glucan from cultured fruit body of Sparassis crispa)」, バイオロジカルアンド ファーマシューティカルブレティン(Biological and Pharmaceutical Bulletin)、(2000)、23(7):866-872
【非特許文献11】N.オオノ(Ohno)、S.ナメダ(Nameda)、T.ハラダ(Harada)、N.N.ミウラ(Miura)、Y.アダチ(Adachi)、M.(Nakajima)、K.ヨシダ(Yoshida)、H.ヨシダ(Yoshida) and T.ヤドマエ(Yadomae)「薬用キノコ スパラシス・クリスパから抽出したβ−グルカン(SCG)の免疫賦活作用と癌患者への投与(Immunomodulating activity of a β-glucan preparation, SCG, extracted from a culinary-medicinal mushroom, Sparasiss crispa Wulf.:Fr (Aphyllophoromycetidae), and application to cancer patents)」、インターナショナル ジャーナルオブ メディシナルマッシュルーム(International Journal of Medicial Mushrooms、(2003)、5:359-368
【発明の開示】
【発明が解決しようとする課題】
【0012】
これまでに、メシマコブから抽出した多糖類や酵母由来のβ−グルカン、さらには硫酸化β−1,3−グルカンの局所投与が創傷治癒促進作用を発揮することが報告されている。これらの物質は創傷治癒促進剤として有用であると考えられるものの、糖尿病患者における有用性についてはいずれも不明である。また、それらの機能性は該有効成分を創面に局所投与もしくは静脈注射による全身投与によるものであり、患者が自分自身で最も簡便に実施できる経口摂取による効果は確認されていない。
【0013】
本発明は、このような実情に鑑みなされたものであり、創傷を有する患者の誰もが自分自身で簡易に実施できる経口摂取により、糖尿病を患っている人に対しても高い効果を発揮でき、かつ長期間摂取し続けても安全な創傷治癒促進剤並びにそれを含有する創傷治癒促進効果を有する飲食品を提供することを目的とするものである。
【課題を解決するための手段】
【0014】
本発明者らは、上記課題を解決するため新規な素材の開発を求めて鋭意検討した結果、ハナビラタケの子実体及び/又は菌糸体の経口投与が創傷治癒を顕著に促進する事実を見いだし、また、上記したハナビラタケの子実体及び/又は菌糸体から抽出又は精製したβ−グルカンを用いた場合でも高い効果を有することを見いだし、本発明に到達した。
【0015】
すなわち、本発明の第一は、ハナビラタケの子実体及び/又は菌糸体もしくはそれらから得られるβ−グルカンを含むことを特徴とする創傷治癒促進作用を有する組成物を要旨とするものである。
【0016】
本発明の第二は、上記の本発明の創傷治癒促進作用を有する組成物を有効成分として含有することを特徴とする創傷治癒促進剤であり、好ましくは経口投与されるものである。
【0017】
本発明の第三は、前記した本発明の創傷治癒促進作用を有する組成物を含有することを特徴とする創傷治癒促進作用を有する飲食品を要旨とするものである。
【発明の効果】
【0018】
本発明によれば、優れた効果を発揮する創傷治癒促進剤が提供できる。また、古くから薬用・食用として利用されているハナビラタケを原料としているため、極めて安全性が高いことから、飲食品に含ませて用いることができる他、経口投与剤に含ませて用いることもできる。従って、患者ごとに適した投与方法を選択することができる。
【0019】
なお、本発明において創傷とは、外的、内的要因によって起こる体表組織の物理的な損傷を指し、切創、裂創、刺創、咬創、擦過傷、銃創、挫傷などはもちろんのこと、これらに加えて、糖尿病性潰瘍や熱傷や褥瘡をも包含するものである。
【発明を実施するための最良の形態】
【0020】
以下、本発明を詳細に説明する。
【0021】
ハナビラタケは、カラマツ等の針葉樹に生えるキノコであって、非常に希少なキノコである。歯ごたえがよく、その純白の色合いと葉牡丹のような形態が特徴である食用キノコである。これまで、このハナビラタケは成長が遅く人工栽培は非常に困難であるとされてきたが、最近になって、比較的短期間で栽培可能な新しい栽培法が確立され、商業規模での供給が可能となっている。
【0022】
本発明において用いられるハナビラタケ子実体は、天然のものでの栽培されたものでもよい。人工栽培の方法としては、従来から知られている人工栽培用の菌床を作成することにより行うことができる(詳細は、例えば、特開平11−56098号公報、特許第3746440号、特許第3509736号参照)。
【0023】
また、本発明においては、ハナビラタケの菌糸体も用いることができる。菌糸体は液体培養法によって得ることができる。培地に使用する炭素源としては、グルコースなどの単糖の他、デキストリン、グリセロールなど通常用いられる炭素源が使用できる。また、窒素源としては無機又は有機窒素源が使用できるが、生育速度の観点からは有機窒素源を用いるほうが好ましい。また、必要に応じて微量元素やビタミン等の生育因子を添加することは通常の培養と何ら変わりはない。培養温度は15℃〜30℃、好ましくは18℃〜28℃、20℃〜25℃が最も好ましい。pHは2.5〜8.0、好ましくは3.0〜7.0、3.5〜5.0が最も好ましい。培地成分には不溶成分を添加することが均一に生育させることができることから好ましい。培養期間は培地組成や菌株により、数日から数週間程度に設定されうる。
【0024】
本発明においては、上記したハナビラタケ子実体及び又は菌糸体をそのまま、もしくは乾燥後に破砕機などを用いてハナビラタケの組織を機械的に破砕することによって得た粉砕物を以て、本発明の創傷治癒促進剤とすることができる。また、より高い効果を期待するためには、これらから有効成分であるβ−グルカンを抽出又は精製することが望ましい。β−グルカンの抽出においては、上記のようにして得られたハナビラタケの子実体あるいは菌糸体をそのまま抽出工程に移してもよいし、まず乾燥した後、破砕機などを用いてハナビラタケの組織を機械的に破砕したものを使用してもよい。乾燥するには、熱風や凍結乾燥のような方法が挙げられる。また、ここで用いられる破砕機としては、ミキサーや石臼などが挙げられる。
【0025】
ハナビラタケのβ−グルカン含量は、人工栽培された子実体乾燥重量当たり40質量%以上であることが知られている。人工培養した菌糸体におけるβ−グルカン含有量は、乾燥重量当たり15〜20質量%前後であることから、本発明のβ−グルカン含有組成物を高効率に抽出するためには子実体を用いることが好ましい。
【0026】
本発明におけるβ−グルカンを抽出する為に、酵素を用いてハナビラタケ中のβ−グルカン以外の成分を分解させる方法を適用することができる。また、熱水やアルカリ溶液を用いてβ−グルカンを抽出することもできる。さらに、得られた抽出液に対してアルコール沈殿を行ったり、凍結乾燥を行ったりすることで、β−グルカンを濃縮することができる。
【0027】
上記の酵素の種類としては、市販されているα−アミラーゼ、アミログルコシダーゼ、プロテアーゼなど、ハナビラタケに含まれるβ−グルカン以外の多糖類やタンパク質成分の分解酵素を使用することが望ましい。このような酵素は単独で使用してもよいし、複数の酵素を組み合わせて使用することもできる。
【0028】
酵素処理に用いる酵素の量に特に制限はないが、ハナビラタケの乾燥粉末重量に対して0.1〜10質量%、0.2〜5質量%を用いることが好ましく、0.5〜2質量%がさらに好ましい。0.2質量%以下では酵素処理の効率が悪く、5質量%以上ではコスト面での負担が高くなる。
【0029】
また、酵素処理は1種又は複数種の酵素を用いて、複数回行うこともできる。複数回行う場合は、ハナビラタケからの抽出でもよいし、ハナビラタケから得られた抽出画分あるいは抽出後のハナビラタケ残渣をさらに抽出してもよい。また、それらを組み合わせて行うことができる。
【0030】
抽出操作の際の温度は、特に制限はないが2〜200℃が好ましく、25〜150℃がさらに好ましく、60〜120℃が最も好ましい。2℃以下では抽出効率が悪く、200℃以上では抽出物が熱変性し性状が変化したりなどする。抽出時間にも特に制限はないが、10分〜12時間程度が好ましく、20分〜6時間がさらに好ましく、30分〜2時間が最も好ましい。10分以下では抽出量が少なく、12時間以上では作業効率が低い。また、抽出は静置のまま行うこともできるが、撹拌又は振盪などすることによって抽出効率を高めることができる。
【0031】
本発明におけるアルカリ抽出で用いるアルカリ成分としては、水酸化ナトリウム、水酸化カリウム、水酸化カルシウムなどを用いることができる。その溶液濃度としては、0.1〜10Mが好ましく、0.5〜5Mがさらに好ましく、1〜2.5Mが最も好ましい。0.1M以下では抽出効率が悪く、10M以上では取り扱いが困難となる。
【0032】
また、アルカリ抽出は複数回行うこともできる。複数回行う場合は、ハナビラタケからの抽出でもよいし、ハナビラタケから得られた抽出画分あるいは抽出後のハナビラタケ残渣をさらに抽出してもよい。また、それらを組み合わせて行うことができる。特に、抽出物中のβ−グルカン含有量を高めるためには、エタノール抽出を済ませたハナビラタケの抽出残渣に対してアルカリ抽出を行うことが、β−グルカンを高濃度で抽出できるため好ましい。
【0033】
アルカリ抽出操作の際の温度は、特に制限はないが2〜100℃が好ましく、4〜65℃がさらに好ましい。2℃以下では抽出効率が悪く、100℃以上では抽出作業に危険性が伴う。抽出時間にも特に制限はないが、30℃以下の低温域で抽出する場合は6時間〜5日間が好ましく、12時間〜3日間がさらに好ましく、1日間〜2日間が最も好ましい。6時間以下では抽出量が少なく、5日間以上では作業効率が悪い。逆に、30℃以上の高温域で抽出する場合は、10分〜1日間程度が好ましく、20分〜8時間がさらに好ましく、30分〜3時間が最も好ましい。10分以下では抽出量が少なく、1日間以上では作業効率が低い。また、抽出は静置のまま行うこともできるが、撹拌又は振盪などすることによって抽出効率を高めることができる。
【0034】
以上のようにして得られた処理液は以下のようにして脱塩・濃縮処理を施すことが好ましい。脱塩の方法としては、透析膜を用いる方法、カラムを用いた方法などが挙げられる。濃縮の方法としては、アルコール沈殿、乾燥などの周知の分離手段が用いられる。具体的には以下のようにして行うことができる。
【0035】
上記のようにして得られたハナビラタケの子実体及び/又は菌糸体の処理液を一旦真空乾燥処理により乾燥物とした後、適当量の水に再懸濁し、透析膜を用いて脱塩処理を行う。透析膜は、市販の透析用セルロースチューブを用いればよく、透析外液には蒸留水を用いる。透析外液(蒸留水)を満たした容器に上記の処理液乾燥物を再懸濁した水溶液を入れた透析膜(チューブ)を浸漬し、1〜3日静置、あるいは攪拌下で放置する。これにより透析内液中の塩類を取り除くことが出来る。また、透析外液を3〜4回交換することで、透析内液中の塩類を完全に除くことができる。
【0036】
次に、得られた透析内液からエタノール沈殿によってβ−グルカンを沈殿させる。すなわち、上記で得られた透析内液に、終濃度が80%になるようにエタノールを添加し、室温に1時間静置する。その後、遠心分離(8000×g、10分)によって沈殿を回収し、上清を破棄することで精製されたβ−グルカンが得られる。
【0037】
本発明の創傷治癒促進作用を有する組成物は、通常、ハナビラタケの子実体及び/または菌糸体もしくはそれらから上記の方法によって抽出・精製されたβ−グルカンを0.01〜100質量%配合するのが好ましい。さらに好ましくは、0.1〜80質量%配合するのが好ましい。この範囲であれば製剤化が容易であり、かつ十分な効果を期待できる。
【0038】
本発明の創傷治癒促進作用を有する組成物の形態は、適用の仕方に応じて種々の形態にすることができる。経口投与する場合には、錠剤、カプセル剤、散剤、顆粒剤、丸剤、液剤、乳剤、懸濁剤、溶液剤、酒精剤、シロップ剤、エキス剤、エリキシル剤とすることができる。
【0039】
製剤には薬剤的に許容できる種々の担体を加えることができる。例えば、賦形剤、結合剤、崩壊剤、滑沢剤、着香剤、着色剤、甘味剤、矯味剤、溶解補助剤、懸濁化剤、乳化剤、コーティング剤を含むことができるが、これらに限定されない。本発明の創傷治癒促進作用を有する組成物を持続性、徐放性のものとしてもよい。
【0040】
本発明の第二の創傷治癒促進剤は、上記した本発明の創傷治癒促進作用を有する組成物を含有するものである。この組成物は、上記したように、ハナビラタケの子実体又は菌糸体に由来するものであり、ハナビラタケは古くから食用・薬用とされてきたことから極めて安全な素材である。この点から、創傷治癒促進効果を有する組成物の使用量は厳しく制限されるものではないと考えられるが、概ね、下限は創傷治癒の促進という目的に応じた効果を発揮しうる量を、上限は使用のしやすさ、経済性等の観点から実際的な量を基準とし、通常、ハナビラタケ子実体乾燥物に換算して成人1日あたり約0.01g〜約100g、好ましくは約0.1g〜約50gを使用すればよい。もちろん、使用する者の年齢、体重、症状、使用期間、治療経過等に応じて変化させることもできる。1日あたりの量を数回に分けて投与することもできる。また、他の創傷治癒促進剤(例えば、他のキノコ類や酵母から同様に抽出したβ−グルカンや多糖類を含む創傷治癒促進剤など)と組み合わせて使用することもできる。
【0041】
本発明の創傷治癒促進剤は、服用の仕方に応じて種々の剤形にすることができる。中でも経口投与することが好ましく、その場合には、錠剤、カプセル剤、散剤、顆粒剤、丸剤、液剤、乳剤、懸濁剤、溶液剤、酒精剤、シロップ剤、エキス剤、エリキシル剤とすることができる。
【0042】
製剤には薬剤的に許容できる種々の担体を加えることができる。例えば、賦形剤、結合剤、崩壊剤、滑沢剤、着香剤、着色剤、甘味剤、矯味剤、溶解補助剤、懸濁化剤、乳化剤、コーティング剤を含むことができるが、これらに限定されない。本発明の創傷治癒促進剤を持続性、徐放性のものとしてもよい。
【0043】
本発明の第三の飲食品は、上記した本発明の創傷治癒促進作用を有する組成物を含有するものである。ハナビラタケは古くから食用・薬用とされてきたことから極めて安全な素材である。この点から、創傷治癒促進作用を有する組成物の使用量は厳しく制限されるものではないと考えられるが、概ね、下限は創傷治癒の促進という目的に応じた効果を発揮しうる量を、上限は摂取のしやすさ、経済性等の観点から実際的な量を基準とし、通常、ハナビラタケ乾燥物に換算して成人1日あたり約0.01g〜約100g、好ましくは約0.1g〜約10gを摂取すればよい。もちろん、摂取する者の年齢、体重、症状、投与期間、治療経過等に応じて変化させることもできる。1日あたりの量を数回に分けて摂取することもできる。
【0044】
本発明の飲食品は、加工飲食品に用いられる水性成分、油性成分、植物抽出液、動物抽出液、粉末、界面効果剤、油剤、アルコール、pH調整剤、防腐剤、酸化防止剤、増粘剤、色素、香料等を本発明の創傷治癒促進作用を有する組成物とともに原材料に配合することにより調製される。形態としては、錠剤、カプセル剤、散剤、顆粒剤、丸剤、液剤、乳剤、懸濁剤、溶液剤、酒精剤、シロップ剤、エキス剤、エリキシル剤などの健康飲食品類;麺類;パン類;無果汁飲料、果汁入り飲料、乳酸菌飲料、茶類飲料、コーヒー飲料、豆乳飲料、スープ類等の飲料類;スナック、クッキー、ガム、キャンディー等の菓子類;アイスクリーム、シャーベット、みぞれなど冷菓類;プリン、ババロア、ゼリー、ヨーグルト、ケーキなどのデザート食品類及びその他のインスタント食品とすることができる。
【0045】
本発明の飲食品は、本発明の創傷治癒促進作用を有する組成物及び上記した成分などのほかに、さらに、鉄、カルシウム等の無機成分、種々のビタミン類、オリゴ糖、キトサン等の食物繊維、大豆抽出物等のタンパク質、レシチンなどの脂質、ショ糖、乳糖等の糖類、乳酸菌を含んでいてもよい。
【0046】
また本発明の飲食品は、既存の健康食品類、飲料類、菓子類、冷菓類、デザート類及びその他インスタント食品類に、上記した本発明の創傷治癒促進作用を有する組成物を含ませることによっても得ることができる。
【実施例】
【0047】
以下、本発明の実施例を挙げるが、これらは本発明を何ら限定するものではない。
【0048】
製造例1〔ハナビラタケ子実体の製造〕
ハナビラタケ子実体を以下のようにして製造した。カラマツの大鋸屑、小麦粉、栄養分(バナナ、蜂蜜、エビオス、ペプトン、塩化カルシウム、ハイポネックス)及び水を、大鋸屑:小麦粉:栄養分:水=100:11.5:1.9:51の重量比で含む菌床基材を準備した。この菌床基材(520g)を、850ml容のポリプロピレン製の培養瓶に入れ、常法に従って培養瓶を滅菌した後に、ハナビラタケの種菌(16g)を接種した。その後、この培養瓶を、23℃の温度下で、56日間放置することによりハナビラタケ子実体を収穫した。子実体の重量は培養瓶1本当たり140gであった。
【0049】
製造例2〔ハナビラタケ菌糸体の製造〕
ハナビラタケ菌糸体を以下のようにして製造した。イーストエキス0.4質量%、グルコース2質量%、リン酸2水素カリウム0.1質量%、リン酸水素2ナトリウム0.1質量%となるように水に溶解し、1Nの塩化水素でpH5.0に調製し、500ml容三角フラスコに200ml入れ、常法に従って滅菌した。この液体培地にハナビラタケの種菌を生育させた平板培地から径6mmの寒天片を打ち抜き、その一片を接種し、24℃の暗黒下で、21日間振とう培養(100rpm)することによりハナビラタケ菌糸体を収穫した。菌糸体の乾燥重量は三角フラスコ1本当たり2gであった。
【0050】
実施例1〔ハナビラタケ子実体からのβ−グルカンの抽出〕
ハナビラタケのβ−グルカン含有画分を以下のようにして抽出した。製造例1のハナビラタケ子実体を凍結乾燥後、石臼を用いて粉末化した。この0.25gを250mlの0.08Mリン酸緩衝液(pH6.0)に懸濁し、耐熱性α−アミラーゼ(SIGMA製)を50μl添加して100℃で30分間反応させた。これを室温まで放冷した後、NaOH溶液を用いてpH7.5に再調整し、プロテアーゼ溶液(50mg/ml;SIGMA製)を50μl添加して60℃で30分間反応させた。これを再度室温まで放冷し、HCl溶液を用いてpH4.3に再調整し、アミログルコシダーゼ液(SIGMA製)を50μl添加して60℃で30分間反応させた。得られた酵素処理液に終濃度が80%になるようにエタノールを添加し、室温下に1時間静置後、遠心分離(8000×g、10分)によって沈殿物を得た。この沈殿をイオン交換水に再懸濁し、蒸留水に対する透析により塩や低分子性の物質を取り除いた。この透析内液を回収し、再度終濃度が80%になるようにエタノールを添加し、室温に1時間静置後、再度遠心分離(8000×g、10分)によって沈殿物を得た。この沈殿物を真空乾燥させ、得られた画分をβ−グルカン含有物とした。なお、本画分の収量は1.54g、収率は61.6%であった。
【0051】
〔抽出したβ−グルカンの成分分析〕
実施例1で得たβ−グルカンをイオン交換水に溶解し、糖含量、タンパク質含量をそれぞれフェノール硫酸法、ブラッドフォード法によって算出した。その結果、糖含量は94.0%、タンパク質含量は3.9%であった。
【0052】
試験例1〔創傷治癒促進作用〕
製造例1で得られたハナビラタケ子実体を含む創傷治癒促進作用を有する組成物のin vivoにおける創傷治癒促進作用を検討するため、ハナビラタケ子実体の乾燥粉末を、創傷を作製した糖尿病モデル動物に投与することによって評価した。
【0053】
すなわち、180-200gの雄性SDラット(日本チャールス・リバー)に65mg/kgのストレプトゾトシン(シグマ社製)を静脈投与し、1週間後の血糖値が300mg/dL以上を呈したものを選択し、これらのラットを10匹づつ2群に群分けした。群分け時をday−7(欠損創作製7日前を意味する。以下同じ。)とし、day−7から試験期間中継続して試験飼料を摂取させた。尚、試験群は、1)糖尿病ラット群(通常飼料)、2)糖尿病ラット/ハナビラタケ投与群(通常飼料にハナビラタケ子実体の乾燥粉末を混餌投与(1000mg/kg))とした。
【0054】
day0にエーテル麻酔下でラットの背部正中部を剃毛し、外科用湾曲ハサミを用いて円形(2cm2)の皮膚全層欠損創を作製した。その後、day4、day8、day12、day16及びday20に皮膚欠損部修復率を計測した。一方、day3、day5、day7、day14には糖尿病ラット群及び糖尿病ラット/ハナビラタケ投与群の創傷部皮膚を採取し、10%ホルマリンによる組織固定の後にパラフィン包埋し、5μm厚の切片を作製した。その後、好中球を特異的エステラーゼ染色で、コラーゲンをアザン-マロリー染色で、マクロファージ、線維芽細胞、血管、サイトケラチンについては、それぞれ、抗マクロファージ抗体(NCL-MAC387、Novo Castra Lab.製)、抗TGF-β1抗体(矢内原研究所社製)、抗von Willebrand抗体(ダコ社製)、抗サイトケラチン抗体(ダコ社製)を用いた免疫組織化学染色により染色した。各サンプルについて上記した細胞数もしくは染色面積をイメージアナライザー(analySIS、オリンパスソフトイメージングソリューションズ製)を用いて計測した。
【0055】
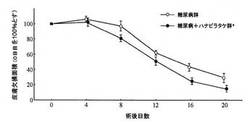
結果を、以下の図1から図2に示す。図中、アスタリスクを付した群もしくは時点においては、糖尿病ラット群と比較した際の統計学的な有意差(*:p<0.05)があることを示す。
【0056】
図1より、ハナビラタケ子実体はin vivoにおいて創傷治癒促進作用を示すことが明らかとなった。
【0057】
図2aより、糖尿病ラット/ハナビラタケ投与群では糖尿病ラット群と比較して、創傷作製3日後のマクロファージの遊走が促進されることが明らかとなった。
【0058】
図2bより、糖尿病ラット/ハナビラタケ投与群では糖尿病ラット群と比較して、創傷作製3日及び5日後の線維芽細胞数が増加することが明らかとなった。
【0059】
図2cより、糖尿病ラット/ハナビラタケ投与群では糖尿病ラット群と比較して、創傷作製7日後のコラーゲン産生量が促進され、また、図2dより、上皮化のマーカーであるサイトケラチンの染色面積も創傷作製14日後において増加することが明らかとなった。
【0060】
試験例2〔コラーゲン産生促進作用〕
実施例1で得られたハナビラタケ子実体由来β−グルカンにつき、創傷治癒において重要な役割を果たす線維芽細胞のコラーゲン産生に対する影響を検討した。
【0061】
すなわち、正常ヒト皮膚線維芽細胞NHDF(AD)(クラボウ社製)を2% ウシ胎児血清(FBS)、10ng/ml ヒト上皮成長因子(hEGF)、3ng/ml ヒト線維芽細胞増殖因子(hFGF-B)、1μg/ml ハイドロコーチゾン、10μg/ml ヘパリン(いずれもクラボウ社製)、を添加した106S培地(クラボウ社製)に懸濁し、96wellプレートに1×104/wellの濃度で播種し、37℃、5%CO2下で培養した。培養開始24時間後にFBSのみを含まない上記の106S培地に交換するとともに、実施例1で抽出したβ−グルカンを培地中に添加した。37℃、5%CO2下でさらに72時間培養後、培養上清を回収し、コラーゲン産生量をプロコラーゲンタイプI-Cペプチド(PIP)EIAキット(タカラバイオ社製)を用いて測定した。
【0062】
結果を図3に示す。図中のアスタリスクはβ−グルカン無添加時と比較して統計学的な有意差(*:p<0.05、**:p<0.01)があることを示す。
【0063】
図3より、ハナビラタケの子実体由来β−グルカンには、コラーゲン産生促進作用があることが示され、β−グルカンがハナビラタケの創傷治癒促進作用物質であることが示された。
【図面の簡単な説明】
【0064】
【図1】ハナビラタケ子実体の経口投与が、糖尿病ラットの創傷治癒を促進することを示した図である。
【図2】糖尿病ラットの創傷部におけるマクロファージ(a)及び線維芽細胞(b)の数、コラーゲン(c)及びサイトケラチン(d)の面積を示す図である。
【図3】ハナビラタケ子実体から抽出したβ−グルカンが正常ヒト皮膚線維芽細胞からのコラーゲン産生を促進することを示した図である。
【技術分野】
【0001】
本発明は、ハナビラタケ子実体及び/又は菌糸体に由来する創傷治癒促進作用を有する組成物並びにそれを含有する創傷治癒促進剤及び飲食品に関する。
【背景技術】
【0002】
創傷の治癒過程は、血液凝固期、炎症期、増殖期、成熟期の4つのステージに分類される。血液凝固期は、凝固した血液が創を一時的に閉鎖する、いわば外敵侵入に対する応急処置としてとらえられる。炎症期には創傷部に好中球、マクロファージが遊走し、付着した細菌や壊死組織、異物などの処理にあたる。増殖期には線維芽細胞がコラーゲンなどの細胞外マトリックス成分を産生したり、新生血管が形成されたりし、肉芽組織の形成とともに創が収縮する。成熟期には細胞外マトリックス合成は充分に進み、傷口が目立たなくなる。
【0003】
このような創傷治癒の過程には種々の増殖因子が関与しており、マクロファージなどの免疫担当細胞が重要な役割を果たすことから、創傷治癒は免疫系を介する生理学的プロセスであることが明らかとなっている。
【0004】
健康な患者における創傷治癒では、上記の過程が確実に進行するが、糖尿病患者では細胞の遊走が鈍くなったり、線維芽細胞のコラーゲン産生能が低下していたり、増殖因子の産生量が低下したりしているため、しばしば治癒が遅れるもしくは治癒が一向に進まない状態となり、臨床上の大きな問題となっている。
【0005】
現在、創傷に対する治療法としては、消毒を行った上でガーゼを貼る治療法から、ポリウレタンフィルム、ハイドロコロイド、ハイドロジェル、ハイドロポリマーなどのドレッシング剤を利用した湿潤療法が創傷を速やかに治癒させることができるため、多く適用されるようになってきた。しかし、湿潤療法を選択した場合でも、糖尿病患者では依然として創傷治癒の遅延が起こるため、糖尿病患者の創傷治療に対しては十分ではない。
【0006】
このような状況を踏まえ、線維芽細胞の成長や血管新生を促進させる作用を持ち、糖尿病患者においても高い有効性を発揮する塩基性線維芽細胞増殖因子(bFGF)が創傷治癒促進剤として開発された(非特許文献1、2)。
【0007】
bFGF製剤(商品名:フィブラストスプレー)は、患部に該製剤の溶液をスプレーする局所投与法により優れた創傷治癒効果を発揮するため、外科領域で頻用されているものの、その増殖因子という特性上、腫瘍の増大を引き起こす可能性が懸念されるため、創傷部付近に腫瘍がある患者に対しては適用できず、汎用性という観点からは必ずしも優れていない。
【0008】
一方、キノコ類は古くから薬用/食用として利用されており、1970年代からそれらから抽出した多糖類やβ−グルカンが免疫賦活作用を示すことが次々と示され、アガリクス、メシマコブ、霊芝、ハナビラタケなどに含まれるβ−グルカンに免疫賦活作用を期待し、それらのキノコ類の子実体や菌糸体の乾燥物や抽出物が健康食品素材として近年利用されるようになってきた(例えば、特許文献1、2及び3)。
【0009】
β−グルカンとはβ−グルコースがグルコシド結合により直鎖状に重合した多糖類の総称であり、種々の生物、特に植物、真菌類、細菌類の細胞壁の構成成分として豊富に含まれている。また、その結合様式によって、β−1,3−グルカン、β−1,4−グルカン、β−1,6−グルカンなどに分類されるものである。
【0010】
β−グルカンは免疫賦活作用を有し、抗腫瘍作用、造血促進作用などの機能性を発揮することが知られている(非特許文献3−6)。また、創傷治癒の治療に対しては酵母由来のβ−グルカンやメシマコブから抽出された多糖類について、さらには硫酸化されたβ−1,3−グルカンについてもその有用性が指摘されている(非特許文献7、8及び9、特許文献4及び5)。
【0011】
上記したキノコ類の中でもハナビラタケは、β−グルカン含量が子実体乾燥粉末当たり43質量%以上と非常に高含有である。さらに、ハナビラタケのβ−グルカンについては、担癌マウスや癌患者での試験において有用性が認められており、医薬品分野での用途も提案されている(特許文献6及び7、非特許文献10、11)。
【非特許文献1】M.オクムラ(Okumura)、T.オクダ(Okuda)、T.ナカムラ(Nakamura) and M.ヤジマ(Yajima)、「創傷治癒障害モデル動物の創傷治癒に及ぼす塩基性線維芽細胞増殖因子の影響(Effect of basic fibroblast growth factor in wound healing in healing-impaired animal models)」、Arzneimittelforschung., (1996),46(5):547-551
【非特許文献2】奥村誠、奥田敏明、片岡さゆり、堀敏光、中村勉、矢嶋基之、「遺伝子組換え型ヒト塩基性線維芽細胞成長因子(bFGF)の創傷治療効果に関する研究」―用法および既存薬剤とその有効成分との作用比較―、基礎と臨床、(1996)、30(9):2161-2174
【特許文献1】特開2001−10970号公報
【特許文献2】特開2001−131083号公報
【特許文献3】特開2003−183176号公報
【非特許文献3】N.モハゲポアー(Mohagheghpour)、M.ドーソン(Dawson)、P.ホブズ(Hobbs)、A.ジュド(Judd)、R.ウィナント(Winant)、L.ドウスマン(Dousman)、N.ワルデック(Waldeck)、L.ホカマ(Hokama)、D.ツセ(Tuse)、F.コス(Kos)、C.ベニク(Benike) and E.エングルマン(Engleman)、「免疫アジュバントとしてのグルカン(Glucans as immunological adjuvants)」、アドバンスズイン エクスペリメンタルメディシン アンドバイオロジー(Advances in experimental medicine and biology)、(1995)、383:13-22
【非特許文献4】前田幸子、石村和子、千原呉郎、「抗腫瘍多糖と癌に対する宿主の抵抗―新しい癌免疫化学療法への道―」、蛋白質核酸酵素、(1976)、21(6):425-435
【非特許文献5】池川哲郎、「きのこの生理活性について」、バイオセラピー(Biotherapy)、(2000)、14(10):945-951
【非特許文献6】大野尚仁、「βグルカンの生体防御系修飾作用」、日本細菌学雑誌、(2000)、55(3):527-537
【非特許文献7】M.ウォーク(Wolk)and D.ダノン(Danon)、「一個体で評価された酵母由来グルカンによる創傷治癒の促進(Promotion of wound healing by yeast glucan evaluated by single animals)」、メディカル バイオロジー(Medical Biology)、(1985)、63:73-85
【非特許文献8】W.ブロウダー(Browder)、D.ウィリアムズ(Williams)、P.ルコア(Lucore)、H.プレタス(Pretus)、E.ジョーンズ(Jones) and R.マクナミー(McNamee)、「活性化されたマクロファージの初期創傷治癒における効果(Effect of enhanced macrophage function on early wound healing)」、サージェリー(Surgery)、(1988)、104:224-230
【非特許文献9】J.-S.バエ(Bae)、K.-H.ヤン(Jang)、S.-C.パク(Park) and H.K.ジン(Jin)、「フェリナス・ギルバスから単離した多糖による創傷治癒促進作用(Promotion of dermal wound healing by polysaccharides isolated from Phellinus gilvus in rats)」、ジャーナル オブ ベトリナリー メディカル サイエンス(The Journal of veterinary medical science)、(2005)、67(1):111-114
【特許文献4】特開平11−116604号公報
【特許文献5】特開平11−171784号公報
【特許文献6】特開2000−217543号公報
【特許文献7】特許第3509736号公報
【非特許文献10】N.オオノ(Ohno)、N.N.ミウラ(Miura)、M.ナカジマ(Nakajima) and T.ヤドマエ(Yadomae)、「栽培されたスパラシス・クリスパ子実体由来の抗腫瘍性1,3−ベータグルカン(Antitumor 1,3-beta-glucan from cultured fruit body of Sparassis crispa)」, バイオロジカルアンド ファーマシューティカルブレティン(Biological and Pharmaceutical Bulletin)、(2000)、23(7):866-872
【非特許文献11】N.オオノ(Ohno)、S.ナメダ(Nameda)、T.ハラダ(Harada)、N.N.ミウラ(Miura)、Y.アダチ(Adachi)、M.(Nakajima)、K.ヨシダ(Yoshida)、H.ヨシダ(Yoshida) and T.ヤドマエ(Yadomae)「薬用キノコ スパラシス・クリスパから抽出したβ−グルカン(SCG)の免疫賦活作用と癌患者への投与(Immunomodulating activity of a β-glucan preparation, SCG, extracted from a culinary-medicinal mushroom, Sparasiss crispa Wulf.:Fr (Aphyllophoromycetidae), and application to cancer patents)」、インターナショナル ジャーナルオブ メディシナルマッシュルーム(International Journal of Medicial Mushrooms、(2003)、5:359-368
【発明の開示】
【発明が解決しようとする課題】
【0012】
これまでに、メシマコブから抽出した多糖類や酵母由来のβ−グルカン、さらには硫酸化β−1,3−グルカンの局所投与が創傷治癒促進作用を発揮することが報告されている。これらの物質は創傷治癒促進剤として有用であると考えられるものの、糖尿病患者における有用性についてはいずれも不明である。また、それらの機能性は該有効成分を創面に局所投与もしくは静脈注射による全身投与によるものであり、患者が自分自身で最も簡便に実施できる経口摂取による効果は確認されていない。
【0013】
本発明は、このような実情に鑑みなされたものであり、創傷を有する患者の誰もが自分自身で簡易に実施できる経口摂取により、糖尿病を患っている人に対しても高い効果を発揮でき、かつ長期間摂取し続けても安全な創傷治癒促進剤並びにそれを含有する創傷治癒促進効果を有する飲食品を提供することを目的とするものである。
【課題を解決するための手段】
【0014】
本発明者らは、上記課題を解決するため新規な素材の開発を求めて鋭意検討した結果、ハナビラタケの子実体及び/又は菌糸体の経口投与が創傷治癒を顕著に促進する事実を見いだし、また、上記したハナビラタケの子実体及び/又は菌糸体から抽出又は精製したβ−グルカンを用いた場合でも高い効果を有することを見いだし、本発明に到達した。
【0015】
すなわち、本発明の第一は、ハナビラタケの子実体及び/又は菌糸体もしくはそれらから得られるβ−グルカンを含むことを特徴とする創傷治癒促進作用を有する組成物を要旨とするものである。
【0016】
本発明の第二は、上記の本発明の創傷治癒促進作用を有する組成物を有効成分として含有することを特徴とする創傷治癒促進剤であり、好ましくは経口投与されるものである。
【0017】
本発明の第三は、前記した本発明の創傷治癒促進作用を有する組成物を含有することを特徴とする創傷治癒促進作用を有する飲食品を要旨とするものである。
【発明の効果】
【0018】
本発明によれば、優れた効果を発揮する創傷治癒促進剤が提供できる。また、古くから薬用・食用として利用されているハナビラタケを原料としているため、極めて安全性が高いことから、飲食品に含ませて用いることができる他、経口投与剤に含ませて用いることもできる。従って、患者ごとに適した投与方法を選択することができる。
【0019】
なお、本発明において創傷とは、外的、内的要因によって起こる体表組織の物理的な損傷を指し、切創、裂創、刺創、咬創、擦過傷、銃創、挫傷などはもちろんのこと、これらに加えて、糖尿病性潰瘍や熱傷や褥瘡をも包含するものである。
【発明を実施するための最良の形態】
【0020】
以下、本発明を詳細に説明する。
【0021】
ハナビラタケは、カラマツ等の針葉樹に生えるキノコであって、非常に希少なキノコである。歯ごたえがよく、その純白の色合いと葉牡丹のような形態が特徴である食用キノコである。これまで、このハナビラタケは成長が遅く人工栽培は非常に困難であるとされてきたが、最近になって、比較的短期間で栽培可能な新しい栽培法が確立され、商業規模での供給が可能となっている。
【0022】
本発明において用いられるハナビラタケ子実体は、天然のものでの栽培されたものでもよい。人工栽培の方法としては、従来から知られている人工栽培用の菌床を作成することにより行うことができる(詳細は、例えば、特開平11−56098号公報、特許第3746440号、特許第3509736号参照)。
【0023】
また、本発明においては、ハナビラタケの菌糸体も用いることができる。菌糸体は液体培養法によって得ることができる。培地に使用する炭素源としては、グルコースなどの単糖の他、デキストリン、グリセロールなど通常用いられる炭素源が使用できる。また、窒素源としては無機又は有機窒素源が使用できるが、生育速度の観点からは有機窒素源を用いるほうが好ましい。また、必要に応じて微量元素やビタミン等の生育因子を添加することは通常の培養と何ら変わりはない。培養温度は15℃〜30℃、好ましくは18℃〜28℃、20℃〜25℃が最も好ましい。pHは2.5〜8.0、好ましくは3.0〜7.0、3.5〜5.0が最も好ましい。培地成分には不溶成分を添加することが均一に生育させることができることから好ましい。培養期間は培地組成や菌株により、数日から数週間程度に設定されうる。
【0024】
本発明においては、上記したハナビラタケ子実体及び又は菌糸体をそのまま、もしくは乾燥後に破砕機などを用いてハナビラタケの組織を機械的に破砕することによって得た粉砕物を以て、本発明の創傷治癒促進剤とすることができる。また、より高い効果を期待するためには、これらから有効成分であるβ−グルカンを抽出又は精製することが望ましい。β−グルカンの抽出においては、上記のようにして得られたハナビラタケの子実体あるいは菌糸体をそのまま抽出工程に移してもよいし、まず乾燥した後、破砕機などを用いてハナビラタケの組織を機械的に破砕したものを使用してもよい。乾燥するには、熱風や凍結乾燥のような方法が挙げられる。また、ここで用いられる破砕機としては、ミキサーや石臼などが挙げられる。
【0025】
ハナビラタケのβ−グルカン含量は、人工栽培された子実体乾燥重量当たり40質量%以上であることが知られている。人工培養した菌糸体におけるβ−グルカン含有量は、乾燥重量当たり15〜20質量%前後であることから、本発明のβ−グルカン含有組成物を高効率に抽出するためには子実体を用いることが好ましい。
【0026】
本発明におけるβ−グルカンを抽出する為に、酵素を用いてハナビラタケ中のβ−グルカン以外の成分を分解させる方法を適用することができる。また、熱水やアルカリ溶液を用いてβ−グルカンを抽出することもできる。さらに、得られた抽出液に対してアルコール沈殿を行ったり、凍結乾燥を行ったりすることで、β−グルカンを濃縮することができる。
【0027】
上記の酵素の種類としては、市販されているα−アミラーゼ、アミログルコシダーゼ、プロテアーゼなど、ハナビラタケに含まれるβ−グルカン以外の多糖類やタンパク質成分の分解酵素を使用することが望ましい。このような酵素は単独で使用してもよいし、複数の酵素を組み合わせて使用することもできる。
【0028】
酵素処理に用いる酵素の量に特に制限はないが、ハナビラタケの乾燥粉末重量に対して0.1〜10質量%、0.2〜5質量%を用いることが好ましく、0.5〜2質量%がさらに好ましい。0.2質量%以下では酵素処理の効率が悪く、5質量%以上ではコスト面での負担が高くなる。
【0029】
また、酵素処理は1種又は複数種の酵素を用いて、複数回行うこともできる。複数回行う場合は、ハナビラタケからの抽出でもよいし、ハナビラタケから得られた抽出画分あるいは抽出後のハナビラタケ残渣をさらに抽出してもよい。また、それらを組み合わせて行うことができる。
【0030】
抽出操作の際の温度は、特に制限はないが2〜200℃が好ましく、25〜150℃がさらに好ましく、60〜120℃が最も好ましい。2℃以下では抽出効率が悪く、200℃以上では抽出物が熱変性し性状が変化したりなどする。抽出時間にも特に制限はないが、10分〜12時間程度が好ましく、20分〜6時間がさらに好ましく、30分〜2時間が最も好ましい。10分以下では抽出量が少なく、12時間以上では作業効率が低い。また、抽出は静置のまま行うこともできるが、撹拌又は振盪などすることによって抽出効率を高めることができる。
【0031】
本発明におけるアルカリ抽出で用いるアルカリ成分としては、水酸化ナトリウム、水酸化カリウム、水酸化カルシウムなどを用いることができる。その溶液濃度としては、0.1〜10Mが好ましく、0.5〜5Mがさらに好ましく、1〜2.5Mが最も好ましい。0.1M以下では抽出効率が悪く、10M以上では取り扱いが困難となる。
【0032】
また、アルカリ抽出は複数回行うこともできる。複数回行う場合は、ハナビラタケからの抽出でもよいし、ハナビラタケから得られた抽出画分あるいは抽出後のハナビラタケ残渣をさらに抽出してもよい。また、それらを組み合わせて行うことができる。特に、抽出物中のβ−グルカン含有量を高めるためには、エタノール抽出を済ませたハナビラタケの抽出残渣に対してアルカリ抽出を行うことが、β−グルカンを高濃度で抽出できるため好ましい。
【0033】
アルカリ抽出操作の際の温度は、特に制限はないが2〜100℃が好ましく、4〜65℃がさらに好ましい。2℃以下では抽出効率が悪く、100℃以上では抽出作業に危険性が伴う。抽出時間にも特に制限はないが、30℃以下の低温域で抽出する場合は6時間〜5日間が好ましく、12時間〜3日間がさらに好ましく、1日間〜2日間が最も好ましい。6時間以下では抽出量が少なく、5日間以上では作業効率が悪い。逆に、30℃以上の高温域で抽出する場合は、10分〜1日間程度が好ましく、20分〜8時間がさらに好ましく、30分〜3時間が最も好ましい。10分以下では抽出量が少なく、1日間以上では作業効率が低い。また、抽出は静置のまま行うこともできるが、撹拌又は振盪などすることによって抽出効率を高めることができる。
【0034】
以上のようにして得られた処理液は以下のようにして脱塩・濃縮処理を施すことが好ましい。脱塩の方法としては、透析膜を用いる方法、カラムを用いた方法などが挙げられる。濃縮の方法としては、アルコール沈殿、乾燥などの周知の分離手段が用いられる。具体的には以下のようにして行うことができる。
【0035】
上記のようにして得られたハナビラタケの子実体及び/又は菌糸体の処理液を一旦真空乾燥処理により乾燥物とした後、適当量の水に再懸濁し、透析膜を用いて脱塩処理を行う。透析膜は、市販の透析用セルロースチューブを用いればよく、透析外液には蒸留水を用いる。透析外液(蒸留水)を満たした容器に上記の処理液乾燥物を再懸濁した水溶液を入れた透析膜(チューブ)を浸漬し、1〜3日静置、あるいは攪拌下で放置する。これにより透析内液中の塩類を取り除くことが出来る。また、透析外液を3〜4回交換することで、透析内液中の塩類を完全に除くことができる。
【0036】
次に、得られた透析内液からエタノール沈殿によってβ−グルカンを沈殿させる。すなわち、上記で得られた透析内液に、終濃度が80%になるようにエタノールを添加し、室温に1時間静置する。その後、遠心分離(8000×g、10分)によって沈殿を回収し、上清を破棄することで精製されたβ−グルカンが得られる。
【0037】
本発明の創傷治癒促進作用を有する組成物は、通常、ハナビラタケの子実体及び/または菌糸体もしくはそれらから上記の方法によって抽出・精製されたβ−グルカンを0.01〜100質量%配合するのが好ましい。さらに好ましくは、0.1〜80質量%配合するのが好ましい。この範囲であれば製剤化が容易であり、かつ十分な効果を期待できる。
【0038】
本発明の創傷治癒促進作用を有する組成物の形態は、適用の仕方に応じて種々の形態にすることができる。経口投与する場合には、錠剤、カプセル剤、散剤、顆粒剤、丸剤、液剤、乳剤、懸濁剤、溶液剤、酒精剤、シロップ剤、エキス剤、エリキシル剤とすることができる。
【0039】
製剤には薬剤的に許容できる種々の担体を加えることができる。例えば、賦形剤、結合剤、崩壊剤、滑沢剤、着香剤、着色剤、甘味剤、矯味剤、溶解補助剤、懸濁化剤、乳化剤、コーティング剤を含むことができるが、これらに限定されない。本発明の創傷治癒促進作用を有する組成物を持続性、徐放性のものとしてもよい。
【0040】
本発明の第二の創傷治癒促進剤は、上記した本発明の創傷治癒促進作用を有する組成物を含有するものである。この組成物は、上記したように、ハナビラタケの子実体又は菌糸体に由来するものであり、ハナビラタケは古くから食用・薬用とされてきたことから極めて安全な素材である。この点から、創傷治癒促進効果を有する組成物の使用量は厳しく制限されるものではないと考えられるが、概ね、下限は創傷治癒の促進という目的に応じた効果を発揮しうる量を、上限は使用のしやすさ、経済性等の観点から実際的な量を基準とし、通常、ハナビラタケ子実体乾燥物に換算して成人1日あたり約0.01g〜約100g、好ましくは約0.1g〜約50gを使用すればよい。もちろん、使用する者の年齢、体重、症状、使用期間、治療経過等に応じて変化させることもできる。1日あたりの量を数回に分けて投与することもできる。また、他の創傷治癒促進剤(例えば、他のキノコ類や酵母から同様に抽出したβ−グルカンや多糖類を含む創傷治癒促進剤など)と組み合わせて使用することもできる。
【0041】
本発明の創傷治癒促進剤は、服用の仕方に応じて種々の剤形にすることができる。中でも経口投与することが好ましく、その場合には、錠剤、カプセル剤、散剤、顆粒剤、丸剤、液剤、乳剤、懸濁剤、溶液剤、酒精剤、シロップ剤、エキス剤、エリキシル剤とすることができる。
【0042】
製剤には薬剤的に許容できる種々の担体を加えることができる。例えば、賦形剤、結合剤、崩壊剤、滑沢剤、着香剤、着色剤、甘味剤、矯味剤、溶解補助剤、懸濁化剤、乳化剤、コーティング剤を含むことができるが、これらに限定されない。本発明の創傷治癒促進剤を持続性、徐放性のものとしてもよい。
【0043】
本発明の第三の飲食品は、上記した本発明の創傷治癒促進作用を有する組成物を含有するものである。ハナビラタケは古くから食用・薬用とされてきたことから極めて安全な素材である。この点から、創傷治癒促進作用を有する組成物の使用量は厳しく制限されるものではないと考えられるが、概ね、下限は創傷治癒の促進という目的に応じた効果を発揮しうる量を、上限は摂取のしやすさ、経済性等の観点から実際的な量を基準とし、通常、ハナビラタケ乾燥物に換算して成人1日あたり約0.01g〜約100g、好ましくは約0.1g〜約10gを摂取すればよい。もちろん、摂取する者の年齢、体重、症状、投与期間、治療経過等に応じて変化させることもできる。1日あたりの量を数回に分けて摂取することもできる。
【0044】
本発明の飲食品は、加工飲食品に用いられる水性成分、油性成分、植物抽出液、動物抽出液、粉末、界面効果剤、油剤、アルコール、pH調整剤、防腐剤、酸化防止剤、増粘剤、色素、香料等を本発明の創傷治癒促進作用を有する組成物とともに原材料に配合することにより調製される。形態としては、錠剤、カプセル剤、散剤、顆粒剤、丸剤、液剤、乳剤、懸濁剤、溶液剤、酒精剤、シロップ剤、エキス剤、エリキシル剤などの健康飲食品類;麺類;パン類;無果汁飲料、果汁入り飲料、乳酸菌飲料、茶類飲料、コーヒー飲料、豆乳飲料、スープ類等の飲料類;スナック、クッキー、ガム、キャンディー等の菓子類;アイスクリーム、シャーベット、みぞれなど冷菓類;プリン、ババロア、ゼリー、ヨーグルト、ケーキなどのデザート食品類及びその他のインスタント食品とすることができる。
【0045】
本発明の飲食品は、本発明の創傷治癒促進作用を有する組成物及び上記した成分などのほかに、さらに、鉄、カルシウム等の無機成分、種々のビタミン類、オリゴ糖、キトサン等の食物繊維、大豆抽出物等のタンパク質、レシチンなどの脂質、ショ糖、乳糖等の糖類、乳酸菌を含んでいてもよい。
【0046】
また本発明の飲食品は、既存の健康食品類、飲料類、菓子類、冷菓類、デザート類及びその他インスタント食品類に、上記した本発明の創傷治癒促進作用を有する組成物を含ませることによっても得ることができる。
【実施例】
【0047】
以下、本発明の実施例を挙げるが、これらは本発明を何ら限定するものではない。
【0048】
製造例1〔ハナビラタケ子実体の製造〕
ハナビラタケ子実体を以下のようにして製造した。カラマツの大鋸屑、小麦粉、栄養分(バナナ、蜂蜜、エビオス、ペプトン、塩化カルシウム、ハイポネックス)及び水を、大鋸屑:小麦粉:栄養分:水=100:11.5:1.9:51の重量比で含む菌床基材を準備した。この菌床基材(520g)を、850ml容のポリプロピレン製の培養瓶に入れ、常法に従って培養瓶を滅菌した後に、ハナビラタケの種菌(16g)を接種した。その後、この培養瓶を、23℃の温度下で、56日間放置することによりハナビラタケ子実体を収穫した。子実体の重量は培養瓶1本当たり140gであった。
【0049】
製造例2〔ハナビラタケ菌糸体の製造〕
ハナビラタケ菌糸体を以下のようにして製造した。イーストエキス0.4質量%、グルコース2質量%、リン酸2水素カリウム0.1質量%、リン酸水素2ナトリウム0.1質量%となるように水に溶解し、1Nの塩化水素でpH5.0に調製し、500ml容三角フラスコに200ml入れ、常法に従って滅菌した。この液体培地にハナビラタケの種菌を生育させた平板培地から径6mmの寒天片を打ち抜き、その一片を接種し、24℃の暗黒下で、21日間振とう培養(100rpm)することによりハナビラタケ菌糸体を収穫した。菌糸体の乾燥重量は三角フラスコ1本当たり2gであった。
【0050】
実施例1〔ハナビラタケ子実体からのβ−グルカンの抽出〕
ハナビラタケのβ−グルカン含有画分を以下のようにして抽出した。製造例1のハナビラタケ子実体を凍結乾燥後、石臼を用いて粉末化した。この0.25gを250mlの0.08Mリン酸緩衝液(pH6.0)に懸濁し、耐熱性α−アミラーゼ(SIGMA製)を50μl添加して100℃で30分間反応させた。これを室温まで放冷した後、NaOH溶液を用いてpH7.5に再調整し、プロテアーゼ溶液(50mg/ml;SIGMA製)を50μl添加して60℃で30分間反応させた。これを再度室温まで放冷し、HCl溶液を用いてpH4.3に再調整し、アミログルコシダーゼ液(SIGMA製)を50μl添加して60℃で30分間反応させた。得られた酵素処理液に終濃度が80%になるようにエタノールを添加し、室温下に1時間静置後、遠心分離(8000×g、10分)によって沈殿物を得た。この沈殿をイオン交換水に再懸濁し、蒸留水に対する透析により塩や低分子性の物質を取り除いた。この透析内液を回収し、再度終濃度が80%になるようにエタノールを添加し、室温に1時間静置後、再度遠心分離(8000×g、10分)によって沈殿物を得た。この沈殿物を真空乾燥させ、得られた画分をβ−グルカン含有物とした。なお、本画分の収量は1.54g、収率は61.6%であった。
【0051】
〔抽出したβ−グルカンの成分分析〕
実施例1で得たβ−グルカンをイオン交換水に溶解し、糖含量、タンパク質含量をそれぞれフェノール硫酸法、ブラッドフォード法によって算出した。その結果、糖含量は94.0%、タンパク質含量は3.9%であった。
【0052】
試験例1〔創傷治癒促進作用〕
製造例1で得られたハナビラタケ子実体を含む創傷治癒促進作用を有する組成物のin vivoにおける創傷治癒促進作用を検討するため、ハナビラタケ子実体の乾燥粉末を、創傷を作製した糖尿病モデル動物に投与することによって評価した。
【0053】
すなわち、180-200gの雄性SDラット(日本チャールス・リバー)に65mg/kgのストレプトゾトシン(シグマ社製)を静脈投与し、1週間後の血糖値が300mg/dL以上を呈したものを選択し、これらのラットを10匹づつ2群に群分けした。群分け時をday−7(欠損創作製7日前を意味する。以下同じ。)とし、day−7から試験期間中継続して試験飼料を摂取させた。尚、試験群は、1)糖尿病ラット群(通常飼料)、2)糖尿病ラット/ハナビラタケ投与群(通常飼料にハナビラタケ子実体の乾燥粉末を混餌投与(1000mg/kg))とした。
【0054】
day0にエーテル麻酔下でラットの背部正中部を剃毛し、外科用湾曲ハサミを用いて円形(2cm2)の皮膚全層欠損創を作製した。その後、day4、day8、day12、day16及びday20に皮膚欠損部修復率を計測した。一方、day3、day5、day7、day14には糖尿病ラット群及び糖尿病ラット/ハナビラタケ投与群の創傷部皮膚を採取し、10%ホルマリンによる組織固定の後にパラフィン包埋し、5μm厚の切片を作製した。その後、好中球を特異的エステラーゼ染色で、コラーゲンをアザン-マロリー染色で、マクロファージ、線維芽細胞、血管、サイトケラチンについては、それぞれ、抗マクロファージ抗体(NCL-MAC387、Novo Castra Lab.製)、抗TGF-β1抗体(矢内原研究所社製)、抗von Willebrand抗体(ダコ社製)、抗サイトケラチン抗体(ダコ社製)を用いた免疫組織化学染色により染色した。各サンプルについて上記した細胞数もしくは染色面積をイメージアナライザー(analySIS、オリンパスソフトイメージングソリューションズ製)を用いて計測した。
【0055】
結果を、以下の図1から図2に示す。図中、アスタリスクを付した群もしくは時点においては、糖尿病ラット群と比較した際の統計学的な有意差(*:p<0.05)があることを示す。
【0056】
図1より、ハナビラタケ子実体はin vivoにおいて創傷治癒促進作用を示すことが明らかとなった。
【0057】
図2aより、糖尿病ラット/ハナビラタケ投与群では糖尿病ラット群と比較して、創傷作製3日後のマクロファージの遊走が促進されることが明らかとなった。
【0058】
図2bより、糖尿病ラット/ハナビラタケ投与群では糖尿病ラット群と比較して、創傷作製3日及び5日後の線維芽細胞数が増加することが明らかとなった。
【0059】
図2cより、糖尿病ラット/ハナビラタケ投与群では糖尿病ラット群と比較して、創傷作製7日後のコラーゲン産生量が促進され、また、図2dより、上皮化のマーカーであるサイトケラチンの染色面積も創傷作製14日後において増加することが明らかとなった。
【0060】
試験例2〔コラーゲン産生促進作用〕
実施例1で得られたハナビラタケ子実体由来β−グルカンにつき、創傷治癒において重要な役割を果たす線維芽細胞のコラーゲン産生に対する影響を検討した。
【0061】
すなわち、正常ヒト皮膚線維芽細胞NHDF(AD)(クラボウ社製)を2% ウシ胎児血清(FBS)、10ng/ml ヒト上皮成長因子(hEGF)、3ng/ml ヒト線維芽細胞増殖因子(hFGF-B)、1μg/ml ハイドロコーチゾン、10μg/ml ヘパリン(いずれもクラボウ社製)、を添加した106S培地(クラボウ社製)に懸濁し、96wellプレートに1×104/wellの濃度で播種し、37℃、5%CO2下で培養した。培養開始24時間後にFBSのみを含まない上記の106S培地に交換するとともに、実施例1で抽出したβ−グルカンを培地中に添加した。37℃、5%CO2下でさらに72時間培養後、培養上清を回収し、コラーゲン産生量をプロコラーゲンタイプI-Cペプチド(PIP)EIAキット(タカラバイオ社製)を用いて測定した。
【0062】
結果を図3に示す。図中のアスタリスクはβ−グルカン無添加時と比較して統計学的な有意差(*:p<0.05、**:p<0.01)があることを示す。
【0063】
図3より、ハナビラタケの子実体由来β−グルカンには、コラーゲン産生促進作用があることが示され、β−グルカンがハナビラタケの創傷治癒促進作用物質であることが示された。
【図面の簡単な説明】
【0064】
【図1】ハナビラタケ子実体の経口投与が、糖尿病ラットの創傷治癒を促進することを示した図である。
【図2】糖尿病ラットの創傷部におけるマクロファージ(a)及び線維芽細胞(b)の数、コラーゲン(c)及びサイトケラチン(d)の面積を示す図である。
【図3】ハナビラタケ子実体から抽出したβ−グルカンが正常ヒト皮膚線維芽細胞からのコラーゲン産生を促進することを示した図である。
【特許請求の範囲】
【請求項1】
ハナビラタケ子実体及び/又は菌糸体を含むことを特徴とする創傷治癒促進作用を有する組成物。
【請求項2】
ハナビラタケ子実体及び/又は菌糸体に由来するβ−グルカンを含むことを特徴とする創傷治癒促進作用を有する組成物。
【請求項3】
請求項1乃至2記載の創傷治癒促進作用を有する組成物を含有することを特徴とする創傷治癒促進剤。
【請求項4】
経口投与されるものである請求項3記載の創傷治癒促進剤。
【請求項5】
請求項1乃至2に記載の創傷治癒促進作用を有する組成物を含有することを特徴とする創傷治癒促進効果を有する飲食品。
【請求項1】
ハナビラタケ子実体及び/又は菌糸体を含むことを特徴とする創傷治癒促進作用を有する組成物。
【請求項2】
ハナビラタケ子実体及び/又は菌糸体に由来するβ−グルカンを含むことを特徴とする創傷治癒促進作用を有する組成物。
【請求項3】
請求項1乃至2記載の創傷治癒促進作用を有する組成物を含有することを特徴とする創傷治癒促進剤。
【請求項4】
経口投与されるものである請求項3記載の創傷治癒促進剤。
【請求項5】
請求項1乃至2に記載の創傷治癒促進作用を有する組成物を含有することを特徴とする創傷治癒促進効果を有する飲食品。
【図1】


【図2】


【図3】




【図2】


【図3】


【公開番号】特開2009−143854(P2009−143854A)
【公開日】平成21年7月2日(2009.7.2)
【国際特許分類】
【出願番号】特願2007−323339(P2007−323339)
【出願日】平成19年12月14日(2007.12.14)
【出願人】(000004503)ユニチカ株式会社 (1,214)
【Fターム(参考)】
【公開日】平成21年7月2日(2009.7.2)
【国際特許分類】
【出願日】平成19年12月14日(2007.12.14)
【出願人】(000004503)ユニチカ株式会社 (1,214)
【Fターム(参考)】
[ Back to top ]

