創面切除のための組織の同定
組織部位における細胞が生存可能であるか生存不能であるかを判定する方法が提供される。また、組織部位から組織を創面切除する方法も提供される。さらに、生存可能細胞と生存不能細胞とを区別する組成物と、組織部位上で前記組成物を使用するための説明書とを備えるキットが提供される。さらに、生存可能細胞と生存不能細胞とを区別する組成物の使用法であって、組織部位における細胞が生存可能であるのかまたは生存不能であるのかを判定するための使用法が提供される。また、生存可能細胞と生存不能細胞とを区別する組成物の使用法であって、上記キットの製造のための使用法が提供される。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、概して組織処置システムに関し、特に、生体内の細胞の生存能力を判定する方法に関するものである。
【背景技術】
【0002】
創傷は、どのように形成されたものであっても、異質または伝染性の物質を満足に取り除くために、積極的な創面切除(創傷清拭)が必要とされる。その他の残骸および壊死組織も、創傷治療の道筋に沿った良好な経過を確実にするために、取り除く必要がある。生存可能な組織と生存不能な組織の早期の同定は、外科医と患者の両方に対して有用である。それは、患者が痛みを伴う追加的な外科処置に耐えることがなくなるようにするだけでなく、処置の結果を補助することもできる(すなわち、ケースの重症度を低減し、生存可能な組織の除去を防止し、機能性を向上させる)。また、生存不能な組織の同定は、適当な組織が取り除かれて組織の適正量が除去されたことに対する高い水準の信頼性を与えると考えられる。生存不能としての適正な組織の同定は、境界組織を視覚的に残す可能性が低いことを意味する。
【0003】
熱傷、大きな外傷性創傷およびある種の慢性的創傷の場合には、組織障害の多数の領域が存在する。例えば、外傷性筋障害において、損傷が筋肉の不可逆的萎縮を引き起こす可能性がある。そのような場合、幾つかの機能を回復させるために、自由筋移行術を行うことができる。ある場合においては、筋肉が生存不能で外科処置が必要であることを判定するのに最大1年かかる可能性もある。初期の処置(筋移行術)が良好な結果に繋がる可能性があり、処置の遅れが復元の選択肢を制限することが知られている(Barrie et al.,2004)。他方、創面切除の後に残る組織がより健康であるほど、結果が良好なものとなる。生存能力のある組織の同定は、生存能力のある組織の不用意な除去を防ぐことができる。
【0004】
異なるレベルの組織障害は、熱傷において同定される“ジャクソンゾーン(Jackson zones)”として、おそらく最も古くから説明されている(Jackson,1953)。最も酷く不可逆的な損傷を受けた領域は、局所タンパク質の破壊による凝固のゾーンとして知られている。この領域は明らかに修復不可能である。それは、多くの場合黒ずんで炭化して壊死したものとなっており、取り除かなければならない。最も外周の最小の損傷領域は、充血のゾーンとして知られている。一般に、この領域の組織は、それが感染するか、または長期の血流低下を受けることが無い限り、外傷から完全に回復する。
【0005】
この中間ゾーンの鬱血における組織は傷つけられており、潜在的に修復可能である。これは鬱血のゾーンとして知られている。熱傷の中間から深い位置において、それら創傷は修復しないか、あるいは壊死のゾーンに変わる可能性がある。Molnar et al.(2005)により、“これは、血管透過性の増加、浮腫、進行性の血液粘性を特徴とし、それにより血栓症および追加的な組織の壊死を引き起こす。患者が到着したときには明らかに生存可能な組織であるが、その後死に至り、第三度全層熱傷のように切除および移植を必要とする深刻な第二度熱傷を示すのは、この鬱血のゾーンである。”と報告されている。これが生じた場合には、創傷治療は妨げられ、患者は、追加的な痛みを伴う創面切除に戻らなくてはならない可能性がある。
【0006】
上述したように、組織の生存可能性は、熱傷から生じる生理的損傷から回復するこの領域の細胞の能力に依存する。細胞がタイミング良く十分なかん流および栄養分を受け取ることができる場合には、その組織は生き残ることができる。一方、それが生じない場合には、浮腫が増加し、かん流が減少し、組織酸素化が減少し、傷が進行して、受傷後48乃至72時間で細胞および組織の壊死に至る。同様の傷のゾーンは、視覚的に顕著ではないが、様々な組織に対して、外傷性創傷や床擦れのような慢性的創傷に生じる。
【0007】
外科医にとってのファウストのジレンマ(Faustian quandary)は、(1)控えめに創面切除して、幾らかの境界組織が定位置に留まることを可能にするとともに、組織が蘇生努力に応答するかどうかと、組織が死んで壊死となり、感染症の病巣を与え、続く処置で取り除く必要があるかどうかとの間のバランスを比較検討するか、あるいは、(2)明らかに傷を負った組織の境界を遙かに超えて積極的に創面切除して、生存可能または修復可能な組織を潜在的に取り除き、この広い組織の切除跡を受け入れることにより、将来の修復の選択肢と機能性を連帯して制限するかどうかである。
【0008】
現在のところ、外傷性創傷における組織除去および創面切除は、一般に、生存可能な組織形態に関しての外科医の知識に依存している。しかしながら、それは多くの場合、100%正確なものではない。領域は疑わしく見える場合があり、後になってやっと、組織が生存不能であることが判定される場合がある。この時点で、再度手術室に戻って、痛みを伴う別の創面切除が必要とされる。反対に、外傷性創傷が積極的な組織除去により処置される。生存可能または修復可能な組織が取り除かれる可能性があり、それは将来の機能性を制限し得る。
【0009】
このため、創傷治療においては、度重なる外科的創面切除手術が必要になる場合がある。老化または生存不能細胞が創傷端部に取り残されると、創傷が治癒に向けて進むことができない場合がある。このため、組織の領域の明確な同定を与えて、傷に屈している明確な標識を示す方法に対する必要性が存在する。かかる方法により、外科医は、創面切除のときにどの領域を摘出すべきであるのか、さらには、組織が創傷から回復して、将来必要とされる任意の復元のための基盤としての機能を果たすことができるようにどれを残留させるべきであるのかを知ることとなる。
【0010】
生体内の老化組織を同定する取り組みには、音響信号を発して受信する機器を説明した米国特許出願公開US2007/0197895A1の取り組みが含まれる。また、国際公開WO07/130423A2には、創傷内からの組織が創傷に隣接する組織とは異なる遺伝発現プロフィールを有する場合に、組織サンプルを組織部位から取得して、その発現プロフィールを評価することにより、創面切除のための境界を特定する方法が記載されている。
【0011】
創面切除を行うべき位置を決定するために、例えば創傷の端部で、タイミング良く生存可能細胞と生存不能細胞の正確で明確な連続的な同定を可能にする追加的方法の必要性が存在する。本出願はその必要性を解決する。
【発明の概要】
【0012】
外科的創面切除の方法が存在することにより提示される課題は、本明細書に記載の例示的な実施形態にかかるシステムおよび方法により解決される。一実施形態においては、組織部位における細胞が生存可能であるのかまたは生存不能であるのかを決定する方法が提供され、その方法が、生存可能細胞と生存不能細胞とを区別する組成物(compound)を組織部位に加えるステップと、細胞が生存可能または生存不能であることを組成物が示すかどうかを判定するステップとを備える。
【0013】
別の実施形態においては、生存可能および生存不能組織を含む組織部位から組織を創面切除する方法が提供され、その方法が、生存可能細胞と生存不能細胞とを区別する組成物を組織部位に加えるステップと、その後に、組織部位内のどこに生存可能または生存不能組織が存在するのかを判定するステップと、その後に、生存不能な組織を外科的に創面切除するステップとを備える。
【0014】
また、組織部位における細胞が生存可能であるのかまたは生存不能であるのかを決定する方法が提供される。その方法は、生存可能細胞を生存不能細胞と区別することができる条件のもとで、組織を可視化するステップを備える。
【0015】
追加的な実施形態においては、生存可能細胞と生存不能細胞とを区別する組成物と、上述した方法により組織部位上で組成物を使用するための説明書とを備えるキットが提供される。
【0016】
更なる実施形態においては、生存可能細胞と生存不能細胞とを区別する組成物の使用法が提供され、その使用法が、組織部位における細胞が生存可能であるのかまたは生存不能であるのかを決定するためのものとなっている。
【0017】
また、生存可能細胞と生存不能細胞とを区別する組成物の更なる使用法が提供され、その使用法が、上述したキットを製造するためのものとなっている。
【0018】
例示的実施形態のその他の目的、特徴および利点は、図面および以下の詳細な説明から明らかなものとなる。
【図面の簡単な説明】
【0019】
【図1】図1は、本発明の実施形態を示す略図および写真である。
【発明を実施するための形態】
【0020】
例示的な実施形態の以下の詳細な説明においては、本出願の一部を構成する添付図面が参照される。それら実施形態は、当業者が本発明を実施できる程度に十分詳細に記載され、その他の実施形態が利用可能で、本発明の精神および範囲を逸脱することなく、論理構造的、機械的、電気的および化学的な変更が可能であることを理解されたい。記載の実施形態を当業者が実施可能とするのに必要のない細部説明を避けるために、当業者に既知の一部の情報を説明から省略する可能性がある。したがって、以下の詳細な説明は、限定の意味で捉えるべきではなく、例示的な実施形態の範囲は、添付の特許請求の範囲によってのみ定義される。
【0021】
本発明者は、その場で組織が生存可能であるか生存不能であるかを判定する方法を開発した。それら方法により、組織部位におけるどの細胞が生存可能でどれが生存不能であるのかを正確に判定することが可能になる。生存可能または生存不能である特定細胞を同定するそれら技術の様々な実施形態の正確さにより、創面切除を、より正確に生存不能細胞を除去して生存可能な無傷細胞を残すものとすることができる。実際に、本方法により、特定の細胞が生存可能または生存不能として同定することができるため、レーザ解離技術のような個別の細胞または細胞の小さい群を対象とする技術は、創面切除手術においてより有用なものとなる。このため、それら技術により、医師は正確に、現在実施されている創面切除手術よりも、多くの生存不能組織を取り除くことができるとともに、多くの生存可能な無傷組織を残すことができる。
【0022】
ある実施形態においては、本出願は、組織部位における細胞が生存可能であるかまたは生存不能であるのかを判定する方法を対象としている。その方法は、生存可能細胞と生存不能細胞とを区別する組成物を組織部位に加えるステップと、続いて、細胞が生存可能または生存不能であることを組成物が示すかどうかを判定するステップとを備える。
【0023】
本明細書に記載のそれら方法およびすべてのその他方法は、馬、猫、犬、牛、ヒツジ、ヤギ、豚およびヒトを含むほ乳類、は虫類および鳥類を含む任意の脊椎動物に使用することができる。
【0024】
本明細書で使用されているように、細胞が生きていて、例えばアポトーシス、壊死または老化により死ぬ運命には無い場合に、細胞は生存可能である。また、“生存可能細胞”には、“衝撃を受けた”が生きている細胞、すなわち、ある損傷が持続して、一時の間適性に機能しないかもしれないが回復が期待される細胞、例えば加熱された熱傷の境界における細胞が含まれる。一般に、細胞はその完全性が失われない場合、回復が期待されることとなる。これは、細胞がある染料に対して浸透可能であるかどうか、代謝産物が周囲の組織に過剰に漏れているかどうか、細胞内または細胞小器官内のタンパク質(例えば、シトクロムc)または酵素(例えば、エステラーゼ)が細胞の外部に存在するかどうか、を判定することにより、本明細書に記載の様々な方法または従来知られた任意のその他手順により、測定することができる。
【0025】
組成物は、従来知られた任意の方法で構成することができる。当業者は、必要以上の実験を行うことなく、任意の特定の用途向けの有用な構成を決定することができる。有用な構成には、ゲル、スプレー、液体、パウダー、クリーム、ローション、軟膏、懸濁液、シートまたはその他の固体、半固体または液体が含まれ、それらは、組織部位がそれらに接触するように、組織部位上にまぶし、塗り、組織部位内に噴霧し、組織部位上に注ぎ、広げ、若しくは組織部位内または組織部位上に投与することができる。
【0026】
本明細書に使用されているように、シートは材料の広く、比較的薄い粘性塊または細片であり、それには、生体吸収性材料および非生体吸収性材料の一方または両方から作られたものが含まれる。実施例には、パッド、スポンジ、紙および薄膜が含まれる。シートは、透明または不透明なものとすることができるとともに、任意の二次元形状とすることができる。組成物は、共有結合させることができ、あるいはシートに単に吸収させるかまたはその一部とすることができる。
【0027】
任意の組成物構成は、生物活性剤、例えば、抗生物質または成長因子を含む任意のその他の化学物質を含むことができる。組成物構成に有用なものとなり得る成長因子の非限定の実施例には、血管内皮細胞増殖因子(VEGF)、線維芽細胞増殖因子(FGF)、血小板由来増殖成長因子(PDGF)、アンギオジェニン、アンジオポイエチン1、座位−1(del-1)、ホリスタチン、顆粒球コロニー刺激因子(G−CSF)、肝細胞増殖成長因子/散乱係数(HGF/SF)、インターロイキン−8(IL−8)、IL−1β、IL−1、IL−6、レプチン、ミッドカイン、胎盤成長因子、血小板由来内皮細胞成長因子(PD−ECGF)、血小板由来増殖因子−BB(PDGF−BB)、PDGF−AB、プレイオトロフィン(PTN)、プログラヌリン(progranulin)、プロリフェリン、表皮成長因子(EGF)、ケラチノサイト成長因子(KGF)、アクチビンA、形質転換成長因子−α(TGF−α)、形質転換成長因子−β(TGF−β)、腫瘍壊死因子−α(TNF−α)、血管内皮細胞増殖因子(VEGF)、マトリクスメタロプロテイナーゼ(MMP)、アンジオポイエチン1(ang1)、ang2およびデルタ状リガンド4(DLL4)が含まれる。
【0028】
それら方法における組成物には、生存不能組織から生存可能組織を区別するのに使用できる任意のものが含まれる。ある実施形態においては、組成物は、生存不能細胞に対して異なる発現パターンを生存可能細胞において有する分子を特定する。異なる発現パターンは量(例えば、生存可能細胞に対して異なる量の分子が生存不能細胞において存在する、あるいは生存不能細胞によって放出される)または位置(例えば、分子の細胞外の存在に対する細胞内の存在)におけるものであってもよい。
【0029】
ある実施形態においては、組成物は、抗体結合部位、例えば、抗体、Fabフラグメント、F(ab)2フラグメントまたは抗体結合部位が組み込まれた異種タンパク質を含む。
【0030】
その他の実施形態においては、組成物は、アプタマーを備える。アプタマーは、体外で生成されるオリゴヌクレオチドであり、これは一般に特定のタンパク質を結合するために使用されるものであるが、細胞の結合に使用することもできる。アプタマーは、殆どのタンパク質またはその他の分子に特にしっかりと結合するために反復選択プロセスにより用意することができる(BrodyおよびGold,2000)。それらの特異性および結合能力のため、アプタマーは、診断用薬として大きな可能性を有すると考えられている(BrodyおよびGold,2000;米国特許第7,052,854号)。アプタマー生成には、動物も培養細胞も不要である。アプタマー合成は、PCRを介して行うことができ、結果として得られるアプタマーは、室温で安定しており、長持ちする。アプタマー結合タンパク質の可視化は、数多くの異なる方法の一つによって、例えば、Seal et al.,2006およびMir et al.,2007年に述べられている方法のように実行することができる。
【0031】
組成物は、例えば、約5000mw,2000mw,1000mwまたは500mw未満の有機小分子も含むことができる。一例としては、酵素の基質(例えば、β−ガラクトシダーゼにより無色基質から有色生成物に変換されるイソプロピル−β−D−チオガラクトピラノシド[IPTG])がある。
【0032】
ある実施形態においては、組成物は、検出可能なマーカ、例えば、抗体、アプタマーまたは有機小分子と結合された検出可能なマーカを含む。フィルタを介して、あるいは有色生成物を得るために酵素基質を加えるような後続処理の後に、カメラ、解剖顕微鏡またはガイガーカウンタのような機器により、マーカを、目に見えてまたは電磁スペクトルのその他の部分を利用して、検出することができるならば、検出可能なマーカは、従来知られたものとすることができる。従来知られているように、検出可能なマーカが蛍光性のときに、フィルタは特に有用であり、その場合に、発光波長を通過させながら励起波長を遮断するのにフィルタが使用される。検出可能なマーカの非限定的な例には、酵素、染料(可視および蛍光染料を含む)、放射性化合物、量子ドット含有の組成物、並びにフェリチンまたは国際公開WO07069040A2に記載されている磁気造影剤のような金属または金属含有の組成物(タンパク質を含む)がある。後者の組成物は、光コヒーレンス・トモグラフィーイメージング(断層影像法)を使用して細胞の生存可能性を評価するのに特に有用である。例えば、米国特許出願公開US2007/0038121A1を参照されたい。
【0033】
検出可能なマーカは、組成物の適用に続いて導入することもできる。例えば、組成物は、生存不能な組織に発現するが生存可能組織には発現しないタンパク質に結合する抗体とすることができる。抗体がタンパク質に結合しているか否かを判定するために、蛍光染料または酵素のような検出可能な部分に結合される第二抗体が加えられた後、組織が洗浄されて、その検出可能な部分が可視化される。検出可能な部分が酵素である場合、有色生成物を形成する酵素基質がその存在を可視化するために加えられる。あるいは、組成物がシートに組み込まれる抗体であり、その組成物が生存不能細胞から放出されたタンパク質に結合する場合には、そのシートを組織部位の上に置いてタンパク質に結合し得る状態とした後、タンパク質に結合する第二抗体をシートに加えて、そこで、第二抗体が検出可能な標識をさらに含んで、抗体−タンパク質−抗体*の“サンドイッチ”を形成する。その後、検出可能な標識(*)は可視化される。そのような分析をその場でシートにより行うことができる。あるいは、シートを組織部位から取り除き、標識が付された第二抗体を加えて標識を可視化するために、さらに処理することができる。
【0034】
一実施形態においては、組成物は、当該構成物または量子ドットに結合するカーボンブラックまたはコロイド金のような不活性の生体適合性粒子を含むか、高周波数変換りん光体技術(UPT)を使用することができる。
【0035】
組成物またはその上の検出可能な標識は、生存可能細胞と生存不能細胞とを区別するために、光によって活性させることもできる。例えば、米国特許第6,057,096号を参照されたい。
【0036】
それら方法のある実施形態においては、組成物は染料である。生存可能性染料、例えば、生存可能細胞において、生存不能細胞よりも目に見える、または蛍光を発する染料が含まれる。非限定的な例には、フルオレセイン二酢酸、トリパン青、カルセインAMが含まれる。http://probes.invitrogen.com/handbook/print.1502.htmlも参照されたい。
【0037】
それら実施形態の一態様においては、組成物が、活性酸素種濃度を示す染料である。正常な細胞は、活性酸素種濃度をもたらすことができる。例えば、ジヒドロローダミン123は、ヒドロペルオキシド感受性蛍光プローブである。生存可能細胞において、それは、非蛍光性の形態で捕捉される。しかしながら、それはヒドロペルオキシドにより、ミトコンドリア選択性形態、ローダミン123に変換される。ローダミン123から発せられる光は、デジタル顕微鏡法により記録することができる。
【0038】
その他の実施形態においては、染料が、生存不能細部において、生存可能細胞よりも目に見えるか、あるいは蛍光を発する。ここでは、生存不能細胞のみの核膜を越える染料が含まれる。例としては、ヨウ化プロピジウムおよび臭化エチジウムがある。
【0039】
ミトコンドリア死を示す染料を、生存可能性染料として使用することもできる。能動的に代謝するミトコンドリアは、高い内膜電位を特徴としている。これは、まさにアポトーシスまたは壊死に至ろうとしている細胞内で消散する。ミトコンドリアの活性は、JC−1染料蓄積により可視化することができる。この染料は、死んだミトコンドリアの細胞質内に散乱性の緑色蛍光を示し、ミトコンドリアが活性であるときに赤色蛍光として見られる。
【0040】
代替的な実施形態には、組成物に結合するタンパク質で覆われたリポソームに生体適合性染料を組み込むことが含まれる。2つの組成物が互いに結合して組織部位が構成体を取り除かれると、染料が、超音波刺激またはその他の適当なエネルギー入力のような有向エネルギーを介して、リポソームから放出される。可視化を生じさせるために適当な形式でエネルギーを発することができる圧電性結晶も本発明に適合するものである。
【0041】
組成物は、生存可能細胞と生存不能細胞との間で分子が異なる発現パターンを有しているならば、分子、例えば、タンパク質(例えば、酵素、電子伝達タンパク質、構造タンパク質、膜タンパク質)、核酸(例えば、ゲノムまたはミトコンドリアのDNA、RNA)、炭水化物(例えば、多糖)、脂質または小分子(例えば、代謝産物)を同定することができる。上述したように、異なる発現パターンは、量または位置におけるものであってもよい。分子は、例えば、タンパク質が生存不能細胞では変性するのに対して生存可能細胞では変性しないというように、生存可能細胞と生存不能細胞との間で異なる構造を有するものであってもよい。
【0042】
ある実施形態においては、組成物はタンパク質を同定する。組成物により同定されるタンパク質は、細胞死のプロセスの間、例えばアポトーシス、老化または細胞壊死の間に増加するものであってもよい。例えば、タンパク質は、死んだ細胞または死に行く細胞の内部で増加するものであってもよい。代替的または追加的には、生存可能細胞よりも多くのタンパク質が死んだ細胞または死に行く細胞から放出されるものであってもよい。本明細書で利用されているように、細胞から放出されたタンパク質は、細胞の内部から外部に移動する。放出は、活性細胞プロセスにより、かつ/または例えば、ミトコンドリアのような細胞または細胞小器官の浸透性の増大による細胞からの受動的な漏出により、行われるものである。
【0043】
組成物により同定されるタンパク質が死んだ細胞または死に行く細胞(すなわち、生存不能細胞)から放出される場合、生存不能細胞の外部の組成物の存在は、組織部位の上に、組成物を含むシートを置くことにより判定することができ、その場合、組成物が組織部位上の放出タンパク質と結合または反応して、タンパク質が組成物に結合または反応するかどうかを判定することができる。それら実施形態においては、組成物に結合するタンパク質を含むシートの領域は、生存不能組織である。その後、組織部位は、生存不能組織を示すシートの領域に隣接して、創面切除される。それら実施形態のシートを使用して生存不能組織を分析した後、シートまたはその一部を取り除くことにより、組織部位の生存可能および生存不能領域の“マップ”を与えることができる。そのような除去されたシートは、患者の記録に蓄えることができる。シートの少なくとも一部は、例えば、創面切除の指針として組織部位に残すこともできる。そのシートは、生物活性剤、例えば、抗生物質または成長因子をさらに含むことができる。生物活性剤が存在する場合には、シートを例えば創面切除の後に組織部位上に残すことにより、生物活性剤が感染を防ぐか、あるいは創傷治療を促進することができる。
【0044】
それら実施形態のシートは、生体吸収性材料および生体分解不可能な材料の一方または両方から形成することができる。シートが組織部位上に残留させるものであるとき、生体吸収性シートが多くの場合望ましい。シートに使用できる材料の非限定的な例には、デンプンフィルム、コラーゲン、ニトロセルロース、再生セルロース、酢酸セルロース、アシル置換酢酸セルロースおよびそれらの派生物が含まれ、それには、エチレン酢酸ビニルポリマ、ポリフッ化ビニリデン(PVDF)、コラーゲン、ポリビニルアルコール、ポリ(D,L−ラクチド−co−グリコリド)、ポリグリコール酸、ポリ−(L−乳酸)、ポリ酸無水物、多糖類(例えば、アルギナート)、ポリホスファゼン、ポリアクリレート、ポリエチレンオキシド−ポリプロピレングリコール・ブロック共重合体、ポリ(カプロラクトン)、ポリカーボネート、ポリアミド、ポリ酸無水物、ポリアミノ酸、ポリオルトエステル、ポリアセタール、ポリシアノアクリレート、分解性ポリウレタン、ポリアクリレート、ポリヒドロキシ酪酸およびポリヒドロキシ吉草酸を含むポリヒドロキシアルカノエート、ポリウレタン、ポリスチレン、ポリ塩化ビニル、ポリフッ化ビニル、ポリ(ビニルイミダゾール)、クロロスルホン化ポリオレフィン、ポリエチレンオキシド、ポリビニルアルコール、テフロン(登録商標)およびナイロンが含まれる。ある実施形態においては、シートはデンプンフィルム、ポリ(D,L−ラクチド−co−グリコリド)、ポリグリコール酸、ポリ−(L−乳酸)またはポリヒドロキシアルカノエートである。通常の技術者であれば、過度の実験を行うことなく、適用方法の任意の特定の実施形態に適したシートを決定して得ることができる。
【0045】
生存不能細胞により放出されるタンパク質を特定するシートにおける組成物は、タンパク質(例えば、抗体)、核酸(例えば、アプタマー)、有機小分子(例えば、酵素基質)、染料または、上述したようにタンパク質に特に結合するその他の任意の組成物とすることができる。組成物は、上述したように、検出可能なマーカ(例えば、染料、無色基質から有色生成物への変換を触媒することができる酵素、放射性部分など)にさらに結合させることができる。ある実施形態においては、放出されたタンパク質は酵素であり、組成物は酵素の基質である。
【0046】
ある実施形態においては、組成物により同定されるタンパク質は、アポトーシスを起こしている細胞において増加する。その他の実施形態においては、タンパク質は細胞壊死または老化の間に増加する。従来知られているように、アポトーシスは、一般に炎症反応を生じることなく、細胞収縮により特徴付けられる能動的過程である。アポトーシスを起こした細胞は、アポトーシスの特徴であるDNA寸断を検出する、末端デオキシヌクレオチドトランスフェラーゼdUTPニック末端標識(terminal deoxynucleotidyl transferase dUTP nick end labeling)を伴う分析またはTUNEL分析を使用して通常は同定される。一方、壊死は、細胞膨張および炎症反応を一般に伴う受動的過程である。老化は、代謝するが増殖しない巨大な細胞を特徴とする。それは、通常、テロメアの短縮化、P21発現またはγ照射により誘発される。
【0047】
細胞死に際して細胞内または細胞の外部で増加し、組成物により検出され得るタンパク質の非限定的な例には、シトクロムc、カスパーゼの第二ミトコンドリア由来の活性剤(Smac)、β−ガラクトシダーゼ、リポフスチン、HMGB1、NF−κB、グリセロアルデヒド3−リン酸デヒドロゲナーゼ、糖化最終産物を有するタンパク質(AGE)、ビメンチン、ラミンA、クレアチンキナーゼ、ペルオキシレドキシン1、可溶性ガラクトース結合レクチン7およびコラーゲンが含まれる。ある実施形態においては、タンパク質は、β−ガラクトシダーゼ、リポフスチン、AGE、シトクロムc、ラミンA、クレアチンキナーゼ、ペルオキシレドキシン1、可溶性ガラクトース結合レクチン7またはコラーゲンである。
【0048】
β−ガラクトシダーゼおよびリポフスチンは、老化細胞を同定する2つのタンパク質である(Gerland et al.,2003)。HMGB1は、アポトーシスと壊死の双方に関連するクロマチン結合タンパク質である。アポトーシスを起こした細胞において、HMGB1は固定化されるが、炎症反応を増大させることはない。しかしながら、壊死細胞において、HMGB1は大量に細胞核から放出されて、更なる細胞死および器官壊死を引き起こす可能性がある(Bustin,2001;Scaffidi,2002)。NF−κBの増加は、筋肉萎縮をもたらす可能性がある。また、タンパク質内の増加するAGEレベルは、細胞死を示すことが可能である。Van Herreweghe et al.,2002を参照されたい。AGEは、糖尿病において特に一般的であり、よって糖尿病動物における細胞死を判定するための特に有用な標的となるであろう。実施例1は、その他のタンパク質の中で、ラミンA、クレアチンキナーゼ、ペルオキシレドキシン、ガラクトース結合レクチン、コラーゲンおよびフィラグリンが死に行く組織において増加することを立証している。
【0049】
ビメンチンのような構造タンパク質は、組成物により同定されるタンパク質である。ビメンチンは、細胞が死に向かうに連れて外面化する。ビメンチンまたは細胞死により外面化するその他のタンパク質の存在は、生存不能組織を示すこととなる。
【0050】
その他の実施形態においては、組成物により同定されるタンパク質が細胞死の間に失われる。非限定的な例としては、γ−アクチン、バイグリカン、補体第三成分、フィブロネクチン1、α1プロテアーゼ阻害剤、セリンプロテアーゼ阻害剤2b、トランスフェリン、アポリポタンパク質A−1、妊娠ゾーンタンパク質およびヘモグロビン(αおよびβ鎖の両方)がある。筋細胞死は、γ−アクチンが存在しないときに生じ得る。その他の例としては、バイグリカンがある(Schaefer et al.,2003)。本発明者は、バイグリカンが細胞死の間に失われることを見出している。また、実施例1は、死に行く細胞における、補体第三成分、フィブロネクチン1、α1プロテアーゼ阻害剤、セリンプロテアーゼ阻害剤2b、トランスフェリン、アポリポタンパク質A−1、妊娠ゾーンタンパク質およびヘモグロビンの減少を説明している。
【0051】
別の実施例においては、ミトコンドリア膜電位が測定される。死んだ細胞または死に行く細胞は無傷のミトコンドリア膜を有していないため、生きている正常細胞のミトコンドリア膜電位により差異が示されることとなる。この目的に有用な組成物は、上述したように、染料JC−1である。
【0052】
追加的な実施形態においては、組成物が、生存可能組織よりも生存不能組織に多く存在する変性タンパク質と特に結合する。生存不能細胞は、多くの場合、変性タンパク質を蓄積する。それらは、例えば、タンパク質の変性形態に特に結合するが非変性形態には結合しないアプタマーまたは抗体により検出することができる。それら実施形態に関しては、任意のタンパク質の変性形態を評価することができる。ある実施形態においては、変性タンパク質が、豊富なコラーゲンである。変性コラーゲンに対する抗体は市販されている。
【0053】
ある実施形態において、それら方法の組成物は、壊死またはアポトーシスを起こした細胞から放出される裸のDNAを検出する。裸のDNAは、例えば、臭化エチジウムのような、DNAに結合する染料を使用して検出することができる。
【0054】
その他の実施形態においては、組成物は、約5000mw未満、約2000mw未満、約1000mw未満または約500mw未満の有機分子を同定する。有機分子は、例えば、生存可能細胞よりも多く生存不能細胞から放出される代謝産物とすることができる。そのような代謝産物の非限定的な例としては、ATP、グルコース、グリセロール、NADPHおよびNADHがある。組成物は、代謝産物のための既知の分析の成分とすることができ、例えば、ATPについては、ルシフェラーゼまたはルシフェリン;グルコースについては、ブドウ糖酸化酵素、ペルオキシダーゼまたはペルオキシダーゼ基質;グリセロールについては、グリセロールキナーゼ、グリセロールリン酸オキシダーゼ、ペルオキシダーゼまたはペルオキシダーゼ基質;NADHについては、アルコール脱水素酵素、テトラゾリウム染料、フェナジンメトサルフェート;NADPHについては、グルコース脱水素酵素、フェナジンメトサルフェート、テトラゾリウム染料とすることができる。1よりも多い組成物を組織部位に加えることができ、例えば、代謝産物がNADHの場合には、組織上のNADHの同定を達成するために、アルコール脱水素酵素、テトラゾリウム染料およびフェナジンメトサルフェートをすべて組織部位に加えることができると考えられる。
【0055】
それら代謝産物に関しては、上記方法はさらに、組成物を含む固体シートを創傷上に置くステップであって、組成物が創傷上の有機分子と結合または反応するステップと、その後に、有機分子が組成物に結合するか、あるいは組成物と反応したかどうかを判定するステップとを備えることができる。それら方法においては、組成物に結合した有機分子を含むシートの任意の領域が生存不能組織となる。
【0056】
それら方法は、任意の組織部位に存在する任意の種類の哺乳類細胞の生存可能性を判定するために使用することができる。非限定的な例には、表皮細胞、真皮細胞、繊維芽細胞、間充織幹細胞、骨芽細胞、軟骨細胞、筋細胞、脂肪細胞、内皮細胞、血管平滑筋細胞およびニューロン細胞が含まれる。
【0057】
それら方法は創傷上で使用するように設計されているが、それらは、正常組織または病変組織(例えば、壊疽性筋膜炎)を含む任意の組織部位における組織の生存可能性を判定するために使用することができる。それら方法は、例えば、膵臓壊死(Parekh,2006)または副鼻腔創面切除の前に、内部器官において使用することもできる。
【0058】
それら方法により診断される組織部位は、細胞の生存可能性をその場で判定することが望まれる、例えば、創面切除が計画されている、哺乳動物の表面または内部の何れの場所であってもよい。利用することができる組織の種類には、上皮、結合組織、筋組織、膵臓組織および神経組織が含まれる。
【0059】
それら方法は、任意の組織部位上で使用することができる。ある実施形態においては、組織部位は創傷である。それら方法は、生存不能組織の存在する可能性のある任意の創傷上で使用することができる。創傷は、例えば、火傷、疾病あるいは外傷によるものである場合がある。
【0060】
多くの実施形態においては、それら方法により同定される生存不能組織は、選択的に創面切除される。それら実施形態の幾つかにおいては、生存不能組織は、従来知られている、鋭利器具、超音波または水噴射により創面切除される。その他の実施形態においては、生存不能組織は、レーザにより創面切除される。個々の生存可能および生存不能細胞を同定するにあたり、それら方法の精度の理由から、レーザを用いた創面切除は生存不能細胞を除去して生存可能細胞を保持するのに有用である。
【0061】
本願は、生存可能および生存不能組織を含む組織部位から組織を創面切除する方法も対象としている。その方法は、生存可能組織と生存不能組織とを区別する組成物を組織部位に加えるステップと、その後、組織部位において生存可能組織および生存不能組織が存在する位置を判定するステップと、その後、生存不能組織を外科的に創面切除するステップとを備える。
【0062】
ある実施形態においては、組織部位が創傷である。それら方法は、生存不能組織の存在する可能性のある任意の創傷上で使用することができる。創傷は、例えば、火傷、疾病あるいは外傷によるものである場合がある。
【0063】
上述した方法と同様に、細胞死に際して増加するタンパク質を同定するために、組成物を選択することができる。あるいは、細胞死の間に失われるタンパク質を同定するために、組成物を選択することができる。
【0064】
ある実施形態においては、組成物が抗体結合部位を含む。その他の実施形態においては、組成物がアプタマーである。さらにその他の実施形態においては、組成物が染料である。
【0065】
それら実施形態の幾つかにおいては、生存不能組織は、鋭利器具、超音波または水噴射により創面切除される。その他の実施形態においては、生存不能組織は、レーザにより創面切除される。
【0066】
組成物の事前追加をすることなく生存可能組織または生存不能組織の直接的な可視化を可能にする、利用可能な様々な光学的手法も存在する。このため、本願は、組織部位における細胞が生存可能であるか生存不能であるかを判定する方法も対象にする。その方法は、生存可能細胞を生存不能細胞と区別できる条件のもとで、組織を可視化するステップを含む。
【0067】
ある実施形態においては、組織が光コヒーレンストモグラフィを使用して可視化される。かかる方法は、組織の状態を判定する上で有用である。例えば、Todorovic et al.,2008を参照されたい。その他の実施形態においては、干渉分光法を使用して組織が可視化される。例えば、Schneider et al.,1997を参照されたい。
【0068】
本方法の追加的実施形態においては、高水準の蛍光を有する組織が生存可能で低水準の蛍光を有する組織が生存不能である条件のもとで、自己蛍光が可視化される。例えば、米国特許第6,174,291号を参照されたい。ある態様においては、それら組成物の自己蛍光がアポトーシスに先だって低下することから、NADHおよびNADPH水準がそれら実施形態により評価される(Toms et al.,2005)。NADHおよびNADPHの自己蛍光が評価される場合、約355nmの励起により約460nmで自己蛍光を可視化することができる。
【0069】
その他の実施形態においては、上記方法は、マルチスペクトルまたはハイパースペクトルカメラを介して組織部位を撮像するステップであって、カメラが生存可能および生存不能細胞を識別するスペクトルを撮像するステップをさらに備える。マルチスペクトルスキャニングは、生存可能性を含む組織の様々な特徴を判定するのに使用されている。米国仮特許出願公開2008/0192248A1および米国特許第7,366,365号を参照されたい。
【0070】
さらに、マルチスペクトルまたはハイパースペクトル技術は、スペクトル特性により分子を同定するのに有用である。それら方法のハイパースペクトルおよびマルチスペクトル撮像により、撮像されたスペクトルは、生存可能細胞におけるスペクトル特性を有する分子を、生存不能細胞内の分子または生存不能細胞から放出された分子と区別することができる。ヘモグロビンおよびシトクロムのような分子はスペクトル特性を有する。そのため、ある実施形態においては、分子がシトクロムまたはヘモグロビン、例えばシトクロムcである。ハイパースペクトル技術は、酸化シトクロムcに対して減少している場合、またはシトクロムcが細胞質に逃避している場合に、ミトコンドリアを同定することができ、それによりアポトーシス細胞を同定することができる。
【0071】
それら方法は、任意の組織部位上で使用することができる。ある実施形態においては、組織部位は創傷である。それら方法は、生存不能組織の存在する可能性のある任意の創傷上で使用することができる。創傷は、例えば、火傷、疾病あるいは外傷によるものである場合がある。
【0072】
多くの実施形態においては、それら方法により同定される生存不能組織は、選択的に創面切除される。それら実施形態の幾つかにおいては、生存不能組織は、鋭利器具、超音波または水噴射により創面切除される。その他の実施形態においては、生存不能組織は、レーザにより創面切除される。
【0073】
本願は、キットも対象とする。このキットは、生存可能細胞と生存不能細胞とを識別する組成物と、上述した方法の何れかにより組織部位上で組成物を使用するための説明書とを備える。その方法は、生存可能細胞と生存不能細胞とを区別する組成物を組織部位に加えるステップと、その後、細胞が生存可能または生存不能であることを組成物が示すかどうかを判定するステップとを備える。
【0074】
組織内の細胞が生存可能かどうかを判定するための様々な方法を体外で使用して、例えば品質制御のために、組織工学構築物(tissue engineering construct)における細胞の生存可能性を判定することができる。それら方法を使用して、不適当な領域を移植の前に切除することができ、それにより、生存不能組織に対する、炎症反応のような望ましくない反応を排除して、上記構築物の成功の可能性を高めることができる。
【0075】
このため、追加的な実施形態においては、本願は、細胞を含む組織工学構築物における細胞の生存可能性を判定する方法を対象とする。その方法は、生存可能細胞と生存不能細胞とを区別する組成物を、組織工学構築物に加えるステップと、その後、細胞が生存可能または生存不能であることを組成物が示すかどうかを判定するステップとを備える。
【0076】
この方法のある態様においては、組成物が、細胞死に際して増加するタンパク質を同定する。その他の態様においては、組成物が、細胞死に際して失われるタンパク質を同定する。追加的な態様においては、組成物が約2000mw未満の有機分子を同定する。更なる態様においては、組成物が染料である。それら方法のための様々な組成物は、上述した通りである。ある態様においては、上記方法は、組織工学構築物から生存不能細胞を除去するステップをさらに備える。
【0077】
更なる実施形態において、本願は、細胞を含む組織工学構築物内の細胞の生存可能性を判定する方法を対象とする。その方法は、生存可能細胞を生存不能細胞と区別できる条件のもとで、組織を可視化するステップを含む。上述した類似方法と同様に、例えば、光コヒーレンストモグラフィ、干渉分光法、自己蛍光の可視化またはマルチスペクトル若しくはハイパースペクトルカメラを使用して、組織を視覚化することができる。ある態様においては、上記方法が、組織工学構築物から生存不能細胞を除去するステップをさらに備える。
【0078】
本願は、組織部位における細胞が生存可能または生存不能であるかを判定するために生存可能細胞と生存不能細胞とを識別する組成物の使用法をさらに対象とする。ある実施形態においては、組織部位における細胞が生存不能である場合に創面切除される。更なる実施形態においては、組織部位は創傷である。それら方法は、生存不能組織の存在する可能性のある任意の創傷上で使用することができる。創傷は、例えば、火傷、疾病あるいは外傷によるものである場合がある。
【0079】
さらに、本願は、キットの製造のために、生存可能細胞と生存不能細胞とを識別する組成物の使用法を対象とする。そのキットは、生存可能細胞と生存不能細胞とを識別する組成物と、上述した方法の何れかにより組織部位上で組成物を使用するための説明書とを備える。
【0080】
本願は、組織工学構築物内の細胞の生存可能性を判定するために、生存可能細胞と生存不能細胞とを識別する組成物の使用法を対象とする。
【0081】
生存可能および生存不能組織の境界の判定の精度を向上させるために、かつ/または、各分析の精度の内部検査を持つために、1以上の上記方法および使用法を組み合わせることが可能であるはずである。例えば、β−ガラクトシダーゼを同定する組成物を使用する上記方法は、上述したマルチスペクトルまたはハイパースペクトルを用いる方法と組み合わせることが可能である。
【0082】
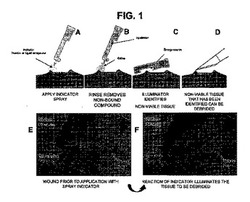
図1は、本発明の一実施形態の例示を与えるものである。この実施形態においては、組織部位に、上述した組成物を含む粉末または液体の指示薬スプレーが散布されている(パネルA)。ここで塗布できる組成物の例には、生存可能性塗料、または例えば蛍光染料で標識される抗体が含まれる。その後、組織部位は洗い流されて、組織に結合していない組成物が除去される(パネルB)。次いで、例えば染料励起波長の光で、組織が照らされる(パネルC)。そして、ここで生存不能として同定された組織が創面切除される(パネルD)。組成物による処置の前後の組織がどのように見えるかの例示がパネルEおよびFに与えられている。
【0083】
好ましい実施形態を以下の実施例において説明する。本発明の範囲内のその他の実施形態は、本明細書に開示されるように、本明細書の検討または本発明の実施から当業者にとって明らかなものとなる。本明細書は、実施例と共に、単に例示的なものとしてみなされ、本発明の範囲および精神が実施例に続く請求の範囲によって示されることを目的としている。
【0084】
[実施例1:損傷組織または瀕死の状態にある組織におけるタンパク質濃度の変化]
以下の実験は、損傷組織または瀕死の状態にある組織内で増加または減少するタンパク質を特定するために行われた。
【0085】
次のように、熱傷がラット(ドブネズミ)の背中に形成された。3ccの注射器の開放シリンダが、皮膚に置かれ、60℃の水で満たされた。この状態が30秒間、皮膚に接触した状態で保たれ、その終わりに、冷水が加えられて、注射器が室温に冷却された。注射器の除去の後に、シルバーデンクリームが全創傷に対して局所的に塗布された。4時間または5日の何れかで、創傷が解剖で除去された。
【0086】
組織は、壊死の領域から1cmの細片に分割された。これは、様々なジャクソンゾーンに対応する。このため、細片は、中心で死んでいるはずであり、中心から2cmの細片は生存可能であり、その中間ゾーンは、外傷の兆候を示すはずである。
【0087】
組織は、タンパク質が抽出され、安定同位体標識(iTRAQ,ABI)を使用して標識された。タンパク質抽出は、最大8の組織種類から、アセトン沈殿により行われ、その分離された各々が、還元され、システイン遮断され、トリプシンで消化され、その後、固有の標識が与えられた。すべてのサンプルが個々に標識されたときに、固有のタンパク質源を同定する各標識との1の混合物を作るために、それらが混合された。塩堆積(MS評価に影響を与え得るよくあること)のような任意の不純物を有するサンプルを洗浄して、混合物を分割するために、消化物を質量対電荷比の違いによりフラクション(少量の部分)に分離するPolyLC社のカラムを利用して混合されたサンプルをHPLCを介して流すことにより、強陽イオン交換(SCX)クロマトグラフィが利用された。集められたフラクションは、その後、質量分析計に導入する前に励起プレート上に斑点を付けるために利用された。
【0088】
“飛行時間”およびペプチド標識“フィンガープリント”に基づく情報が集められ、ペプチド同定およびその他の残留物質の照合のために、タンパク質データベース(この場合は、Mascot)に入力された。これにより、正常組織と損傷組織とを比較するペプチド水準の定量化が可能となった。このため、最終出力は、正常組織と損傷組織との間で上方調整または下方調整されたタンパク質の判定となった。
【0089】
表1に結果を示す。“受託”は遺伝子バンクの受託番号を参照する。115:113列における1未満の数は、壊死組織における指示タンパク質の減少量を示しており、一方、1を越える数は、壊死組織における指示タンパク質の増加量を示している。壊死組織は、生存可能組織よりも、ヘモグロビン(α2鎖およびβ鎖の両方)、補体第二成分、妊娠ゾーンタンパク質、フィブロネクチン1、アルファ−1−阻害剤III(α1プロテアーゼ阻害剤)、セリンプロテアーゼ阻害剤2b、アポリポタンパク質A−1およびトランスフェリンが少ない。壊死組織は、生存可能組織よりも、ラミンA、クレアチンキナーゼ、ペルオキシレドキシン1、可溶性ガラクトース結合レクチン、パルブアルブミン、コラーゲンおよびその他のタンパク質が多い。
【0090】
【表1】

【0091】
[引用文献]
(1)Barrie,K.A.,Steinmann,S.P.,Shin,A.Y.,Spinner,R.J.,およびBishop,A.T.Gracilis free muscle transfer for restoration of function after complete brachial plexus avulsion.Neurosurg.Focus16,2004年,pE8.
(2)Brody,E.N.,およびGold,L.Aptamers as therapeutic and diagnostic agents.Rev Molec Biotech.74,2000年,p5−13.
(3)Bustin,M.At the crossroads of necrosis and apoptosis: Signaling to multiple cellular targets by HMGB1.Sci.STKE.151,2001年,p39.
(4)Gerland,L−M.,Peyrol,S.,Lallemand,C.,Branche,R.,Magaud,J.P.,Ffrench,M.Association of increased autophagic inclusions labeled for B−galactosidase with fibroblastic aging.Exp.Gerontol.38,2003年,p887−895.
(5)Jabloski,E.,Adams,T.,“The merging of nucleic acid detection and immunoassays”IVD Technology,12(9),2006年,p63−70.
(6)Jackson,D.M.,The diagnosis of the depth of burning.Br J Surg.40,1953年,p588−596.
(7)Molnar,J.A.MD,PhD,FACS,Jordan L.Simpson,BS,Denise M.Voignier,CMA,Michael J.Morykwas,PhDおよびLouis C.Argenta,MD,“Management of an Acute Thermal Injury With Subatmospheric Pressure,J Burns Wounds 4,2005年,pe5.
(8)Mir,M.,Katakis,I.,およびVreeke,M.Aptamer biosensors: an alternative to immunosensors.IVD Technol.13(4),2007年,p39−47.
(9)Parekh,D.Laparoscopic−assisted pancreatic necrosectomy.Arch.Surg.141,2006年,p895−903.
(10)Scaffidi,P.,Misteli,T.,Bianchi,M.E.Release of chromatin protein HMGB1 by necrotic cells triggers inflammation.Nature.418,2002年,p191−195.
(11)Schaefer,L.et al.J.Biol.Chem.278,2003年,p.26227−26237.
(12)Schneider,B.H.et al.Clin.Chem.43,1997年,p.1757−1763.
(13)Seal,J.,Braven,H.,Wallace,P.,“Point−of−care nucleic acid lateral−flow tests,”IVD Technology,12(9),2006年,p41−51.
(14)Todorovic,M.et al.Optics Express.16,2008年,p.10279−10284.
(15)Toms,S.A.et al.2005年,in Proceedings,Optical Methods in Drug Discovery and Development.Mostafa AnalouiおよびDavid A.Dunn, Ed.
(16)Van Herreweghe,F.et al.Proc.Natl.Acad.Sci.USA 99,2002年,p.949−954.
(17)米国特許第6,057,096号
(18)米国特許第6,174,291号
(19)米国特許第7,052,854号
(20)米国特許第7,149,567号
(21)米国特許第7,366,365号
(22)米国特許出願公開US2007/0038121
(23)米国特許出願公開US2007/0197895
(24)米国特許出願公開US2008/0192248
(25)国際公開WO07130423A2
(26)国際公開WO07069040A2
【0092】
上述した説明から、顕著な効果を有する発明が提供されるのは明らかである。ほんの幾つかの形態で本発明を示したが、本発明は、それら形態に限定されるものではなく、その精神を逸脱しない範囲で様々な変更および変形を受け入れる余地がある。
【0093】
本明細書で引用したすべての文献は、参照により本明細書に援用されるものである。本明細書における引用文献の検討は、本発明者により与えられる主張を単に要約することを目的としており、如何なる文献も従来技術を構成することを認めるものではない。出願人は、引用文献の精度および適切性を調べる権利を留保する。
【技術分野】
【0001】
本発明は、概して組織処置システムに関し、特に、生体内の細胞の生存能力を判定する方法に関するものである。
【背景技術】
【0002】
創傷は、どのように形成されたものであっても、異質または伝染性の物質を満足に取り除くために、積極的な創面切除(創傷清拭)が必要とされる。その他の残骸および壊死組織も、創傷治療の道筋に沿った良好な経過を確実にするために、取り除く必要がある。生存可能な組織と生存不能な組織の早期の同定は、外科医と患者の両方に対して有用である。それは、患者が痛みを伴う追加的な外科処置に耐えることがなくなるようにするだけでなく、処置の結果を補助することもできる(すなわち、ケースの重症度を低減し、生存可能な組織の除去を防止し、機能性を向上させる)。また、生存不能な組織の同定は、適当な組織が取り除かれて組織の適正量が除去されたことに対する高い水準の信頼性を与えると考えられる。生存不能としての適正な組織の同定は、境界組織を視覚的に残す可能性が低いことを意味する。
【0003】
熱傷、大きな外傷性創傷およびある種の慢性的創傷の場合には、組織障害の多数の領域が存在する。例えば、外傷性筋障害において、損傷が筋肉の不可逆的萎縮を引き起こす可能性がある。そのような場合、幾つかの機能を回復させるために、自由筋移行術を行うことができる。ある場合においては、筋肉が生存不能で外科処置が必要であることを判定するのに最大1年かかる可能性もある。初期の処置(筋移行術)が良好な結果に繋がる可能性があり、処置の遅れが復元の選択肢を制限することが知られている(Barrie et al.,2004)。他方、創面切除の後に残る組織がより健康であるほど、結果が良好なものとなる。生存能力のある組織の同定は、生存能力のある組織の不用意な除去を防ぐことができる。
【0004】
異なるレベルの組織障害は、熱傷において同定される“ジャクソンゾーン(Jackson zones)”として、おそらく最も古くから説明されている(Jackson,1953)。最も酷く不可逆的な損傷を受けた領域は、局所タンパク質の破壊による凝固のゾーンとして知られている。この領域は明らかに修復不可能である。それは、多くの場合黒ずんで炭化して壊死したものとなっており、取り除かなければならない。最も外周の最小の損傷領域は、充血のゾーンとして知られている。一般に、この領域の組織は、それが感染するか、または長期の血流低下を受けることが無い限り、外傷から完全に回復する。
【0005】
この中間ゾーンの鬱血における組織は傷つけられており、潜在的に修復可能である。これは鬱血のゾーンとして知られている。熱傷の中間から深い位置において、それら創傷は修復しないか、あるいは壊死のゾーンに変わる可能性がある。Molnar et al.(2005)により、“これは、血管透過性の増加、浮腫、進行性の血液粘性を特徴とし、それにより血栓症および追加的な組織の壊死を引き起こす。患者が到着したときには明らかに生存可能な組織であるが、その後死に至り、第三度全層熱傷のように切除および移植を必要とする深刻な第二度熱傷を示すのは、この鬱血のゾーンである。”と報告されている。これが生じた場合には、創傷治療は妨げられ、患者は、追加的な痛みを伴う創面切除に戻らなくてはならない可能性がある。
【0006】
上述したように、組織の生存可能性は、熱傷から生じる生理的損傷から回復するこの領域の細胞の能力に依存する。細胞がタイミング良く十分なかん流および栄養分を受け取ることができる場合には、その組織は生き残ることができる。一方、それが生じない場合には、浮腫が増加し、かん流が減少し、組織酸素化が減少し、傷が進行して、受傷後48乃至72時間で細胞および組織の壊死に至る。同様の傷のゾーンは、視覚的に顕著ではないが、様々な組織に対して、外傷性創傷や床擦れのような慢性的創傷に生じる。
【0007】
外科医にとってのファウストのジレンマ(Faustian quandary)は、(1)控えめに創面切除して、幾らかの境界組織が定位置に留まることを可能にするとともに、組織が蘇生努力に応答するかどうかと、組織が死んで壊死となり、感染症の病巣を与え、続く処置で取り除く必要があるかどうかとの間のバランスを比較検討するか、あるいは、(2)明らかに傷を負った組織の境界を遙かに超えて積極的に創面切除して、生存可能または修復可能な組織を潜在的に取り除き、この広い組織の切除跡を受け入れることにより、将来の修復の選択肢と機能性を連帯して制限するかどうかである。
【0008】
現在のところ、外傷性創傷における組織除去および創面切除は、一般に、生存可能な組織形態に関しての外科医の知識に依存している。しかしながら、それは多くの場合、100%正確なものではない。領域は疑わしく見える場合があり、後になってやっと、組織が生存不能であることが判定される場合がある。この時点で、再度手術室に戻って、痛みを伴う別の創面切除が必要とされる。反対に、外傷性創傷が積極的な組織除去により処置される。生存可能または修復可能な組織が取り除かれる可能性があり、それは将来の機能性を制限し得る。
【0009】
このため、創傷治療においては、度重なる外科的創面切除手術が必要になる場合がある。老化または生存不能細胞が創傷端部に取り残されると、創傷が治癒に向けて進むことができない場合がある。このため、組織の領域の明確な同定を与えて、傷に屈している明確な標識を示す方法に対する必要性が存在する。かかる方法により、外科医は、創面切除のときにどの領域を摘出すべきであるのか、さらには、組織が創傷から回復して、将来必要とされる任意の復元のための基盤としての機能を果たすことができるようにどれを残留させるべきであるのかを知ることとなる。
【0010】
生体内の老化組織を同定する取り組みには、音響信号を発して受信する機器を説明した米国特許出願公開US2007/0197895A1の取り組みが含まれる。また、国際公開WO07/130423A2には、創傷内からの組織が創傷に隣接する組織とは異なる遺伝発現プロフィールを有する場合に、組織サンプルを組織部位から取得して、その発現プロフィールを評価することにより、創面切除のための境界を特定する方法が記載されている。
【0011】
創面切除を行うべき位置を決定するために、例えば創傷の端部で、タイミング良く生存可能細胞と生存不能細胞の正確で明確な連続的な同定を可能にする追加的方法の必要性が存在する。本出願はその必要性を解決する。
【発明の概要】
【0012】
外科的創面切除の方法が存在することにより提示される課題は、本明細書に記載の例示的な実施形態にかかるシステムおよび方法により解決される。一実施形態においては、組織部位における細胞が生存可能であるのかまたは生存不能であるのかを決定する方法が提供され、その方法が、生存可能細胞と生存不能細胞とを区別する組成物(compound)を組織部位に加えるステップと、細胞が生存可能または生存不能であることを組成物が示すかどうかを判定するステップとを備える。
【0013】
別の実施形態においては、生存可能および生存不能組織を含む組織部位から組織を創面切除する方法が提供され、その方法が、生存可能細胞と生存不能細胞とを区別する組成物を組織部位に加えるステップと、その後に、組織部位内のどこに生存可能または生存不能組織が存在するのかを判定するステップと、その後に、生存不能な組織を外科的に創面切除するステップとを備える。
【0014】
また、組織部位における細胞が生存可能であるのかまたは生存不能であるのかを決定する方法が提供される。その方法は、生存可能細胞を生存不能細胞と区別することができる条件のもとで、組織を可視化するステップを備える。
【0015】
追加的な実施形態においては、生存可能細胞と生存不能細胞とを区別する組成物と、上述した方法により組織部位上で組成物を使用するための説明書とを備えるキットが提供される。
【0016】
更なる実施形態においては、生存可能細胞と生存不能細胞とを区別する組成物の使用法が提供され、その使用法が、組織部位における細胞が生存可能であるのかまたは生存不能であるのかを決定するためのものとなっている。
【0017】
また、生存可能細胞と生存不能細胞とを区別する組成物の更なる使用法が提供され、その使用法が、上述したキットを製造するためのものとなっている。
【0018】
例示的実施形態のその他の目的、特徴および利点は、図面および以下の詳細な説明から明らかなものとなる。
【図面の簡単な説明】
【0019】
【図1】図1は、本発明の実施形態を示す略図および写真である。
【発明を実施するための形態】
【0020】
例示的な実施形態の以下の詳細な説明においては、本出願の一部を構成する添付図面が参照される。それら実施形態は、当業者が本発明を実施できる程度に十分詳細に記載され、その他の実施形態が利用可能で、本発明の精神および範囲を逸脱することなく、論理構造的、機械的、電気的および化学的な変更が可能であることを理解されたい。記載の実施形態を当業者が実施可能とするのに必要のない細部説明を避けるために、当業者に既知の一部の情報を説明から省略する可能性がある。したがって、以下の詳細な説明は、限定の意味で捉えるべきではなく、例示的な実施形態の範囲は、添付の特許請求の範囲によってのみ定義される。
【0021】
本発明者は、その場で組織が生存可能であるか生存不能であるかを判定する方法を開発した。それら方法により、組織部位におけるどの細胞が生存可能でどれが生存不能であるのかを正確に判定することが可能になる。生存可能または生存不能である特定細胞を同定するそれら技術の様々な実施形態の正確さにより、創面切除を、より正確に生存不能細胞を除去して生存可能な無傷細胞を残すものとすることができる。実際に、本方法により、特定の細胞が生存可能または生存不能として同定することができるため、レーザ解離技術のような個別の細胞または細胞の小さい群を対象とする技術は、創面切除手術においてより有用なものとなる。このため、それら技術により、医師は正確に、現在実施されている創面切除手術よりも、多くの生存不能組織を取り除くことができるとともに、多くの生存可能な無傷組織を残すことができる。
【0022】
ある実施形態においては、本出願は、組織部位における細胞が生存可能であるかまたは生存不能であるのかを判定する方法を対象としている。その方法は、生存可能細胞と生存不能細胞とを区別する組成物を組織部位に加えるステップと、続いて、細胞が生存可能または生存不能であることを組成物が示すかどうかを判定するステップとを備える。
【0023】
本明細書に記載のそれら方法およびすべてのその他方法は、馬、猫、犬、牛、ヒツジ、ヤギ、豚およびヒトを含むほ乳類、は虫類および鳥類を含む任意の脊椎動物に使用することができる。
【0024】
本明細書で使用されているように、細胞が生きていて、例えばアポトーシス、壊死または老化により死ぬ運命には無い場合に、細胞は生存可能である。また、“生存可能細胞”には、“衝撃を受けた”が生きている細胞、すなわち、ある損傷が持続して、一時の間適性に機能しないかもしれないが回復が期待される細胞、例えば加熱された熱傷の境界における細胞が含まれる。一般に、細胞はその完全性が失われない場合、回復が期待されることとなる。これは、細胞がある染料に対して浸透可能であるかどうか、代謝産物が周囲の組織に過剰に漏れているかどうか、細胞内または細胞小器官内のタンパク質(例えば、シトクロムc)または酵素(例えば、エステラーゼ)が細胞の外部に存在するかどうか、を判定することにより、本明細書に記載の様々な方法または従来知られた任意のその他手順により、測定することができる。
【0025】
組成物は、従来知られた任意の方法で構成することができる。当業者は、必要以上の実験を行うことなく、任意の特定の用途向けの有用な構成を決定することができる。有用な構成には、ゲル、スプレー、液体、パウダー、クリーム、ローション、軟膏、懸濁液、シートまたはその他の固体、半固体または液体が含まれ、それらは、組織部位がそれらに接触するように、組織部位上にまぶし、塗り、組織部位内に噴霧し、組織部位上に注ぎ、広げ、若しくは組織部位内または組織部位上に投与することができる。
【0026】
本明細書に使用されているように、シートは材料の広く、比較的薄い粘性塊または細片であり、それには、生体吸収性材料および非生体吸収性材料の一方または両方から作られたものが含まれる。実施例には、パッド、スポンジ、紙および薄膜が含まれる。シートは、透明または不透明なものとすることができるとともに、任意の二次元形状とすることができる。組成物は、共有結合させることができ、あるいはシートに単に吸収させるかまたはその一部とすることができる。
【0027】
任意の組成物構成は、生物活性剤、例えば、抗生物質または成長因子を含む任意のその他の化学物質を含むことができる。組成物構成に有用なものとなり得る成長因子の非限定の実施例には、血管内皮細胞増殖因子(VEGF)、線維芽細胞増殖因子(FGF)、血小板由来増殖成長因子(PDGF)、アンギオジェニン、アンジオポイエチン1、座位−1(del-1)、ホリスタチン、顆粒球コロニー刺激因子(G−CSF)、肝細胞増殖成長因子/散乱係数(HGF/SF)、インターロイキン−8(IL−8)、IL−1β、IL−1、IL−6、レプチン、ミッドカイン、胎盤成長因子、血小板由来内皮細胞成長因子(PD−ECGF)、血小板由来増殖因子−BB(PDGF−BB)、PDGF−AB、プレイオトロフィン(PTN)、プログラヌリン(progranulin)、プロリフェリン、表皮成長因子(EGF)、ケラチノサイト成長因子(KGF)、アクチビンA、形質転換成長因子−α(TGF−α)、形質転換成長因子−β(TGF−β)、腫瘍壊死因子−α(TNF−α)、血管内皮細胞増殖因子(VEGF)、マトリクスメタロプロテイナーゼ(MMP)、アンジオポイエチン1(ang1)、ang2およびデルタ状リガンド4(DLL4)が含まれる。
【0028】
それら方法における組成物には、生存不能組織から生存可能組織を区別するのに使用できる任意のものが含まれる。ある実施形態においては、組成物は、生存不能細胞に対して異なる発現パターンを生存可能細胞において有する分子を特定する。異なる発現パターンは量(例えば、生存可能細胞に対して異なる量の分子が生存不能細胞において存在する、あるいは生存不能細胞によって放出される)または位置(例えば、分子の細胞外の存在に対する細胞内の存在)におけるものであってもよい。
【0029】
ある実施形態においては、組成物は、抗体結合部位、例えば、抗体、Fabフラグメント、F(ab)2フラグメントまたは抗体結合部位が組み込まれた異種タンパク質を含む。
【0030】
その他の実施形態においては、組成物は、アプタマーを備える。アプタマーは、体外で生成されるオリゴヌクレオチドであり、これは一般に特定のタンパク質を結合するために使用されるものであるが、細胞の結合に使用することもできる。アプタマーは、殆どのタンパク質またはその他の分子に特にしっかりと結合するために反復選択プロセスにより用意することができる(BrodyおよびGold,2000)。それらの特異性および結合能力のため、アプタマーは、診断用薬として大きな可能性を有すると考えられている(BrodyおよびGold,2000;米国特許第7,052,854号)。アプタマー生成には、動物も培養細胞も不要である。アプタマー合成は、PCRを介して行うことができ、結果として得られるアプタマーは、室温で安定しており、長持ちする。アプタマー結合タンパク質の可視化は、数多くの異なる方法の一つによって、例えば、Seal et al.,2006およびMir et al.,2007年に述べられている方法のように実行することができる。
【0031】
組成物は、例えば、約5000mw,2000mw,1000mwまたは500mw未満の有機小分子も含むことができる。一例としては、酵素の基質(例えば、β−ガラクトシダーゼにより無色基質から有色生成物に変換されるイソプロピル−β−D−チオガラクトピラノシド[IPTG])がある。
【0032】
ある実施形態においては、組成物は、検出可能なマーカ、例えば、抗体、アプタマーまたは有機小分子と結合された検出可能なマーカを含む。フィルタを介して、あるいは有色生成物を得るために酵素基質を加えるような後続処理の後に、カメラ、解剖顕微鏡またはガイガーカウンタのような機器により、マーカを、目に見えてまたは電磁スペクトルのその他の部分を利用して、検出することができるならば、検出可能なマーカは、従来知られたものとすることができる。従来知られているように、検出可能なマーカが蛍光性のときに、フィルタは特に有用であり、その場合に、発光波長を通過させながら励起波長を遮断するのにフィルタが使用される。検出可能なマーカの非限定的な例には、酵素、染料(可視および蛍光染料を含む)、放射性化合物、量子ドット含有の組成物、並びにフェリチンまたは国際公開WO07069040A2に記載されている磁気造影剤のような金属または金属含有の組成物(タンパク質を含む)がある。後者の組成物は、光コヒーレンス・トモグラフィーイメージング(断層影像法)を使用して細胞の生存可能性を評価するのに特に有用である。例えば、米国特許出願公開US2007/0038121A1を参照されたい。
【0033】
検出可能なマーカは、組成物の適用に続いて導入することもできる。例えば、組成物は、生存不能な組織に発現するが生存可能組織には発現しないタンパク質に結合する抗体とすることができる。抗体がタンパク質に結合しているか否かを判定するために、蛍光染料または酵素のような検出可能な部分に結合される第二抗体が加えられた後、組織が洗浄されて、その検出可能な部分が可視化される。検出可能な部分が酵素である場合、有色生成物を形成する酵素基質がその存在を可視化するために加えられる。あるいは、組成物がシートに組み込まれる抗体であり、その組成物が生存不能細胞から放出されたタンパク質に結合する場合には、そのシートを組織部位の上に置いてタンパク質に結合し得る状態とした後、タンパク質に結合する第二抗体をシートに加えて、そこで、第二抗体が検出可能な標識をさらに含んで、抗体−タンパク質−抗体*の“サンドイッチ”を形成する。その後、検出可能な標識(*)は可視化される。そのような分析をその場でシートにより行うことができる。あるいは、シートを組織部位から取り除き、標識が付された第二抗体を加えて標識を可視化するために、さらに処理することができる。
【0034】
一実施形態においては、組成物は、当該構成物または量子ドットに結合するカーボンブラックまたはコロイド金のような不活性の生体適合性粒子を含むか、高周波数変換りん光体技術(UPT)を使用することができる。
【0035】
組成物またはその上の検出可能な標識は、生存可能細胞と生存不能細胞とを区別するために、光によって活性させることもできる。例えば、米国特許第6,057,096号を参照されたい。
【0036】
それら方法のある実施形態においては、組成物は染料である。生存可能性染料、例えば、生存可能細胞において、生存不能細胞よりも目に見える、または蛍光を発する染料が含まれる。非限定的な例には、フルオレセイン二酢酸、トリパン青、カルセインAMが含まれる。http://probes.invitrogen.com/handbook/print.1502.htmlも参照されたい。
【0037】
それら実施形態の一態様においては、組成物が、活性酸素種濃度を示す染料である。正常な細胞は、活性酸素種濃度をもたらすことができる。例えば、ジヒドロローダミン123は、ヒドロペルオキシド感受性蛍光プローブである。生存可能細胞において、それは、非蛍光性の形態で捕捉される。しかしながら、それはヒドロペルオキシドにより、ミトコンドリア選択性形態、ローダミン123に変換される。ローダミン123から発せられる光は、デジタル顕微鏡法により記録することができる。
【0038】
その他の実施形態においては、染料が、生存不能細部において、生存可能細胞よりも目に見えるか、あるいは蛍光を発する。ここでは、生存不能細胞のみの核膜を越える染料が含まれる。例としては、ヨウ化プロピジウムおよび臭化エチジウムがある。
【0039】
ミトコンドリア死を示す染料を、生存可能性染料として使用することもできる。能動的に代謝するミトコンドリアは、高い内膜電位を特徴としている。これは、まさにアポトーシスまたは壊死に至ろうとしている細胞内で消散する。ミトコンドリアの活性は、JC−1染料蓄積により可視化することができる。この染料は、死んだミトコンドリアの細胞質内に散乱性の緑色蛍光を示し、ミトコンドリアが活性であるときに赤色蛍光として見られる。
【0040】
代替的な実施形態には、組成物に結合するタンパク質で覆われたリポソームに生体適合性染料を組み込むことが含まれる。2つの組成物が互いに結合して組織部位が構成体を取り除かれると、染料が、超音波刺激またはその他の適当なエネルギー入力のような有向エネルギーを介して、リポソームから放出される。可視化を生じさせるために適当な形式でエネルギーを発することができる圧電性結晶も本発明に適合するものである。
【0041】
組成物は、生存可能細胞と生存不能細胞との間で分子が異なる発現パターンを有しているならば、分子、例えば、タンパク質(例えば、酵素、電子伝達タンパク質、構造タンパク質、膜タンパク質)、核酸(例えば、ゲノムまたはミトコンドリアのDNA、RNA)、炭水化物(例えば、多糖)、脂質または小分子(例えば、代謝産物)を同定することができる。上述したように、異なる発現パターンは、量または位置におけるものであってもよい。分子は、例えば、タンパク質が生存不能細胞では変性するのに対して生存可能細胞では変性しないというように、生存可能細胞と生存不能細胞との間で異なる構造を有するものであってもよい。
【0042】
ある実施形態においては、組成物はタンパク質を同定する。組成物により同定されるタンパク質は、細胞死のプロセスの間、例えばアポトーシス、老化または細胞壊死の間に増加するものであってもよい。例えば、タンパク質は、死んだ細胞または死に行く細胞の内部で増加するものであってもよい。代替的または追加的には、生存可能細胞よりも多くのタンパク質が死んだ細胞または死に行く細胞から放出されるものであってもよい。本明細書で利用されているように、細胞から放出されたタンパク質は、細胞の内部から外部に移動する。放出は、活性細胞プロセスにより、かつ/または例えば、ミトコンドリアのような細胞または細胞小器官の浸透性の増大による細胞からの受動的な漏出により、行われるものである。
【0043】
組成物により同定されるタンパク質が死んだ細胞または死に行く細胞(すなわち、生存不能細胞)から放出される場合、生存不能細胞の外部の組成物の存在は、組織部位の上に、組成物を含むシートを置くことにより判定することができ、その場合、組成物が組織部位上の放出タンパク質と結合または反応して、タンパク質が組成物に結合または反応するかどうかを判定することができる。それら実施形態においては、組成物に結合するタンパク質を含むシートの領域は、生存不能組織である。その後、組織部位は、生存不能組織を示すシートの領域に隣接して、創面切除される。それら実施形態のシートを使用して生存不能組織を分析した後、シートまたはその一部を取り除くことにより、組織部位の生存可能および生存不能領域の“マップ”を与えることができる。そのような除去されたシートは、患者の記録に蓄えることができる。シートの少なくとも一部は、例えば、創面切除の指針として組織部位に残すこともできる。そのシートは、生物活性剤、例えば、抗生物質または成長因子をさらに含むことができる。生物活性剤が存在する場合には、シートを例えば創面切除の後に組織部位上に残すことにより、生物活性剤が感染を防ぐか、あるいは創傷治療を促進することができる。
【0044】
それら実施形態のシートは、生体吸収性材料および生体分解不可能な材料の一方または両方から形成することができる。シートが組織部位上に残留させるものであるとき、生体吸収性シートが多くの場合望ましい。シートに使用できる材料の非限定的な例には、デンプンフィルム、コラーゲン、ニトロセルロース、再生セルロース、酢酸セルロース、アシル置換酢酸セルロースおよびそれらの派生物が含まれ、それには、エチレン酢酸ビニルポリマ、ポリフッ化ビニリデン(PVDF)、コラーゲン、ポリビニルアルコール、ポリ(D,L−ラクチド−co−グリコリド)、ポリグリコール酸、ポリ−(L−乳酸)、ポリ酸無水物、多糖類(例えば、アルギナート)、ポリホスファゼン、ポリアクリレート、ポリエチレンオキシド−ポリプロピレングリコール・ブロック共重合体、ポリ(カプロラクトン)、ポリカーボネート、ポリアミド、ポリ酸無水物、ポリアミノ酸、ポリオルトエステル、ポリアセタール、ポリシアノアクリレート、分解性ポリウレタン、ポリアクリレート、ポリヒドロキシ酪酸およびポリヒドロキシ吉草酸を含むポリヒドロキシアルカノエート、ポリウレタン、ポリスチレン、ポリ塩化ビニル、ポリフッ化ビニル、ポリ(ビニルイミダゾール)、クロロスルホン化ポリオレフィン、ポリエチレンオキシド、ポリビニルアルコール、テフロン(登録商標)およびナイロンが含まれる。ある実施形態においては、シートはデンプンフィルム、ポリ(D,L−ラクチド−co−グリコリド)、ポリグリコール酸、ポリ−(L−乳酸)またはポリヒドロキシアルカノエートである。通常の技術者であれば、過度の実験を行うことなく、適用方法の任意の特定の実施形態に適したシートを決定して得ることができる。
【0045】
生存不能細胞により放出されるタンパク質を特定するシートにおける組成物は、タンパク質(例えば、抗体)、核酸(例えば、アプタマー)、有機小分子(例えば、酵素基質)、染料または、上述したようにタンパク質に特に結合するその他の任意の組成物とすることができる。組成物は、上述したように、検出可能なマーカ(例えば、染料、無色基質から有色生成物への変換を触媒することができる酵素、放射性部分など)にさらに結合させることができる。ある実施形態においては、放出されたタンパク質は酵素であり、組成物は酵素の基質である。
【0046】
ある実施形態においては、組成物により同定されるタンパク質は、アポトーシスを起こしている細胞において増加する。その他の実施形態においては、タンパク質は細胞壊死または老化の間に増加する。従来知られているように、アポトーシスは、一般に炎症反応を生じることなく、細胞収縮により特徴付けられる能動的過程である。アポトーシスを起こした細胞は、アポトーシスの特徴であるDNA寸断を検出する、末端デオキシヌクレオチドトランスフェラーゼdUTPニック末端標識(terminal deoxynucleotidyl transferase dUTP nick end labeling)を伴う分析またはTUNEL分析を使用して通常は同定される。一方、壊死は、細胞膨張および炎症反応を一般に伴う受動的過程である。老化は、代謝するが増殖しない巨大な細胞を特徴とする。それは、通常、テロメアの短縮化、P21発現またはγ照射により誘発される。
【0047】
細胞死に際して細胞内または細胞の外部で増加し、組成物により検出され得るタンパク質の非限定的な例には、シトクロムc、カスパーゼの第二ミトコンドリア由来の活性剤(Smac)、β−ガラクトシダーゼ、リポフスチン、HMGB1、NF−κB、グリセロアルデヒド3−リン酸デヒドロゲナーゼ、糖化最終産物を有するタンパク質(AGE)、ビメンチン、ラミンA、クレアチンキナーゼ、ペルオキシレドキシン1、可溶性ガラクトース結合レクチン7およびコラーゲンが含まれる。ある実施形態においては、タンパク質は、β−ガラクトシダーゼ、リポフスチン、AGE、シトクロムc、ラミンA、クレアチンキナーゼ、ペルオキシレドキシン1、可溶性ガラクトース結合レクチン7またはコラーゲンである。
【0048】
β−ガラクトシダーゼおよびリポフスチンは、老化細胞を同定する2つのタンパク質である(Gerland et al.,2003)。HMGB1は、アポトーシスと壊死の双方に関連するクロマチン結合タンパク質である。アポトーシスを起こした細胞において、HMGB1は固定化されるが、炎症反応を増大させることはない。しかしながら、壊死細胞において、HMGB1は大量に細胞核から放出されて、更なる細胞死および器官壊死を引き起こす可能性がある(Bustin,2001;Scaffidi,2002)。NF−κBの増加は、筋肉萎縮をもたらす可能性がある。また、タンパク質内の増加するAGEレベルは、細胞死を示すことが可能である。Van Herreweghe et al.,2002を参照されたい。AGEは、糖尿病において特に一般的であり、よって糖尿病動物における細胞死を判定するための特に有用な標的となるであろう。実施例1は、その他のタンパク質の中で、ラミンA、クレアチンキナーゼ、ペルオキシレドキシン、ガラクトース結合レクチン、コラーゲンおよびフィラグリンが死に行く組織において増加することを立証している。
【0049】
ビメンチンのような構造タンパク質は、組成物により同定されるタンパク質である。ビメンチンは、細胞が死に向かうに連れて外面化する。ビメンチンまたは細胞死により外面化するその他のタンパク質の存在は、生存不能組織を示すこととなる。
【0050】
その他の実施形態においては、組成物により同定されるタンパク質が細胞死の間に失われる。非限定的な例としては、γ−アクチン、バイグリカン、補体第三成分、フィブロネクチン1、α1プロテアーゼ阻害剤、セリンプロテアーゼ阻害剤2b、トランスフェリン、アポリポタンパク質A−1、妊娠ゾーンタンパク質およびヘモグロビン(αおよびβ鎖の両方)がある。筋細胞死は、γ−アクチンが存在しないときに生じ得る。その他の例としては、バイグリカンがある(Schaefer et al.,2003)。本発明者は、バイグリカンが細胞死の間に失われることを見出している。また、実施例1は、死に行く細胞における、補体第三成分、フィブロネクチン1、α1プロテアーゼ阻害剤、セリンプロテアーゼ阻害剤2b、トランスフェリン、アポリポタンパク質A−1、妊娠ゾーンタンパク質およびヘモグロビンの減少を説明している。
【0051】
別の実施例においては、ミトコンドリア膜電位が測定される。死んだ細胞または死に行く細胞は無傷のミトコンドリア膜を有していないため、生きている正常細胞のミトコンドリア膜電位により差異が示されることとなる。この目的に有用な組成物は、上述したように、染料JC−1である。
【0052】
追加的な実施形態においては、組成物が、生存可能組織よりも生存不能組織に多く存在する変性タンパク質と特に結合する。生存不能細胞は、多くの場合、変性タンパク質を蓄積する。それらは、例えば、タンパク質の変性形態に特に結合するが非変性形態には結合しないアプタマーまたは抗体により検出することができる。それら実施形態に関しては、任意のタンパク質の変性形態を評価することができる。ある実施形態においては、変性タンパク質が、豊富なコラーゲンである。変性コラーゲンに対する抗体は市販されている。
【0053】
ある実施形態において、それら方法の組成物は、壊死またはアポトーシスを起こした細胞から放出される裸のDNAを検出する。裸のDNAは、例えば、臭化エチジウムのような、DNAに結合する染料を使用して検出することができる。
【0054】
その他の実施形態においては、組成物は、約5000mw未満、約2000mw未満、約1000mw未満または約500mw未満の有機分子を同定する。有機分子は、例えば、生存可能細胞よりも多く生存不能細胞から放出される代謝産物とすることができる。そのような代謝産物の非限定的な例としては、ATP、グルコース、グリセロール、NADPHおよびNADHがある。組成物は、代謝産物のための既知の分析の成分とすることができ、例えば、ATPについては、ルシフェラーゼまたはルシフェリン;グルコースについては、ブドウ糖酸化酵素、ペルオキシダーゼまたはペルオキシダーゼ基質;グリセロールについては、グリセロールキナーゼ、グリセロールリン酸オキシダーゼ、ペルオキシダーゼまたはペルオキシダーゼ基質;NADHについては、アルコール脱水素酵素、テトラゾリウム染料、フェナジンメトサルフェート;NADPHについては、グルコース脱水素酵素、フェナジンメトサルフェート、テトラゾリウム染料とすることができる。1よりも多い組成物を組織部位に加えることができ、例えば、代謝産物がNADHの場合には、組織上のNADHの同定を達成するために、アルコール脱水素酵素、テトラゾリウム染料およびフェナジンメトサルフェートをすべて組織部位に加えることができると考えられる。
【0055】
それら代謝産物に関しては、上記方法はさらに、組成物を含む固体シートを創傷上に置くステップであって、組成物が創傷上の有機分子と結合または反応するステップと、その後に、有機分子が組成物に結合するか、あるいは組成物と反応したかどうかを判定するステップとを備えることができる。それら方法においては、組成物に結合した有機分子を含むシートの任意の領域が生存不能組織となる。
【0056】
それら方法は、任意の組織部位に存在する任意の種類の哺乳類細胞の生存可能性を判定するために使用することができる。非限定的な例には、表皮細胞、真皮細胞、繊維芽細胞、間充織幹細胞、骨芽細胞、軟骨細胞、筋細胞、脂肪細胞、内皮細胞、血管平滑筋細胞およびニューロン細胞が含まれる。
【0057】
それら方法は創傷上で使用するように設計されているが、それらは、正常組織または病変組織(例えば、壊疽性筋膜炎)を含む任意の組織部位における組織の生存可能性を判定するために使用することができる。それら方法は、例えば、膵臓壊死(Parekh,2006)または副鼻腔創面切除の前に、内部器官において使用することもできる。
【0058】
それら方法により診断される組織部位は、細胞の生存可能性をその場で判定することが望まれる、例えば、創面切除が計画されている、哺乳動物の表面または内部の何れの場所であってもよい。利用することができる組織の種類には、上皮、結合組織、筋組織、膵臓組織および神経組織が含まれる。
【0059】
それら方法は、任意の組織部位上で使用することができる。ある実施形態においては、組織部位は創傷である。それら方法は、生存不能組織の存在する可能性のある任意の創傷上で使用することができる。創傷は、例えば、火傷、疾病あるいは外傷によるものである場合がある。
【0060】
多くの実施形態においては、それら方法により同定される生存不能組織は、選択的に創面切除される。それら実施形態の幾つかにおいては、生存不能組織は、従来知られている、鋭利器具、超音波または水噴射により創面切除される。その他の実施形態においては、生存不能組織は、レーザにより創面切除される。個々の生存可能および生存不能細胞を同定するにあたり、それら方法の精度の理由から、レーザを用いた創面切除は生存不能細胞を除去して生存可能細胞を保持するのに有用である。
【0061】
本願は、生存可能および生存不能組織を含む組織部位から組織を創面切除する方法も対象としている。その方法は、生存可能組織と生存不能組織とを区別する組成物を組織部位に加えるステップと、その後、組織部位において生存可能組織および生存不能組織が存在する位置を判定するステップと、その後、生存不能組織を外科的に創面切除するステップとを備える。
【0062】
ある実施形態においては、組織部位が創傷である。それら方法は、生存不能組織の存在する可能性のある任意の創傷上で使用することができる。創傷は、例えば、火傷、疾病あるいは外傷によるものである場合がある。
【0063】
上述した方法と同様に、細胞死に際して増加するタンパク質を同定するために、組成物を選択することができる。あるいは、細胞死の間に失われるタンパク質を同定するために、組成物を選択することができる。
【0064】
ある実施形態においては、組成物が抗体結合部位を含む。その他の実施形態においては、組成物がアプタマーである。さらにその他の実施形態においては、組成物が染料である。
【0065】
それら実施形態の幾つかにおいては、生存不能組織は、鋭利器具、超音波または水噴射により創面切除される。その他の実施形態においては、生存不能組織は、レーザにより創面切除される。
【0066】
組成物の事前追加をすることなく生存可能組織または生存不能組織の直接的な可視化を可能にする、利用可能な様々な光学的手法も存在する。このため、本願は、組織部位における細胞が生存可能であるか生存不能であるかを判定する方法も対象にする。その方法は、生存可能細胞を生存不能細胞と区別できる条件のもとで、組織を可視化するステップを含む。
【0067】
ある実施形態においては、組織が光コヒーレンストモグラフィを使用して可視化される。かかる方法は、組織の状態を判定する上で有用である。例えば、Todorovic et al.,2008を参照されたい。その他の実施形態においては、干渉分光法を使用して組織が可視化される。例えば、Schneider et al.,1997を参照されたい。
【0068】
本方法の追加的実施形態においては、高水準の蛍光を有する組織が生存可能で低水準の蛍光を有する組織が生存不能である条件のもとで、自己蛍光が可視化される。例えば、米国特許第6,174,291号を参照されたい。ある態様においては、それら組成物の自己蛍光がアポトーシスに先だって低下することから、NADHおよびNADPH水準がそれら実施形態により評価される(Toms et al.,2005)。NADHおよびNADPHの自己蛍光が評価される場合、約355nmの励起により約460nmで自己蛍光を可視化することができる。
【0069】
その他の実施形態においては、上記方法は、マルチスペクトルまたはハイパースペクトルカメラを介して組織部位を撮像するステップであって、カメラが生存可能および生存不能細胞を識別するスペクトルを撮像するステップをさらに備える。マルチスペクトルスキャニングは、生存可能性を含む組織の様々な特徴を判定するのに使用されている。米国仮特許出願公開2008/0192248A1および米国特許第7,366,365号を参照されたい。
【0070】
さらに、マルチスペクトルまたはハイパースペクトル技術は、スペクトル特性により分子を同定するのに有用である。それら方法のハイパースペクトルおよびマルチスペクトル撮像により、撮像されたスペクトルは、生存可能細胞におけるスペクトル特性を有する分子を、生存不能細胞内の分子または生存不能細胞から放出された分子と区別することができる。ヘモグロビンおよびシトクロムのような分子はスペクトル特性を有する。そのため、ある実施形態においては、分子がシトクロムまたはヘモグロビン、例えばシトクロムcである。ハイパースペクトル技術は、酸化シトクロムcに対して減少している場合、またはシトクロムcが細胞質に逃避している場合に、ミトコンドリアを同定することができ、それによりアポトーシス細胞を同定することができる。
【0071】
それら方法は、任意の組織部位上で使用することができる。ある実施形態においては、組織部位は創傷である。それら方法は、生存不能組織の存在する可能性のある任意の創傷上で使用することができる。創傷は、例えば、火傷、疾病あるいは外傷によるものである場合がある。
【0072】
多くの実施形態においては、それら方法により同定される生存不能組織は、選択的に創面切除される。それら実施形態の幾つかにおいては、生存不能組織は、鋭利器具、超音波または水噴射により創面切除される。その他の実施形態においては、生存不能組織は、レーザにより創面切除される。
【0073】
本願は、キットも対象とする。このキットは、生存可能細胞と生存不能細胞とを識別する組成物と、上述した方法の何れかにより組織部位上で組成物を使用するための説明書とを備える。その方法は、生存可能細胞と生存不能細胞とを区別する組成物を組織部位に加えるステップと、その後、細胞が生存可能または生存不能であることを組成物が示すかどうかを判定するステップとを備える。
【0074】
組織内の細胞が生存可能かどうかを判定するための様々な方法を体外で使用して、例えば品質制御のために、組織工学構築物(tissue engineering construct)における細胞の生存可能性を判定することができる。それら方法を使用して、不適当な領域を移植の前に切除することができ、それにより、生存不能組織に対する、炎症反応のような望ましくない反応を排除して、上記構築物の成功の可能性を高めることができる。
【0075】
このため、追加的な実施形態においては、本願は、細胞を含む組織工学構築物における細胞の生存可能性を判定する方法を対象とする。その方法は、生存可能細胞と生存不能細胞とを区別する組成物を、組織工学構築物に加えるステップと、その後、細胞が生存可能または生存不能であることを組成物が示すかどうかを判定するステップとを備える。
【0076】
この方法のある態様においては、組成物が、細胞死に際して増加するタンパク質を同定する。その他の態様においては、組成物が、細胞死に際して失われるタンパク質を同定する。追加的な態様においては、組成物が約2000mw未満の有機分子を同定する。更なる態様においては、組成物が染料である。それら方法のための様々な組成物は、上述した通りである。ある態様においては、上記方法は、組織工学構築物から生存不能細胞を除去するステップをさらに備える。
【0077】
更なる実施形態において、本願は、細胞を含む組織工学構築物内の細胞の生存可能性を判定する方法を対象とする。その方法は、生存可能細胞を生存不能細胞と区別できる条件のもとで、組織を可視化するステップを含む。上述した類似方法と同様に、例えば、光コヒーレンストモグラフィ、干渉分光法、自己蛍光の可視化またはマルチスペクトル若しくはハイパースペクトルカメラを使用して、組織を視覚化することができる。ある態様においては、上記方法が、組織工学構築物から生存不能細胞を除去するステップをさらに備える。
【0078】
本願は、組織部位における細胞が生存可能または生存不能であるかを判定するために生存可能細胞と生存不能細胞とを識別する組成物の使用法をさらに対象とする。ある実施形態においては、組織部位における細胞が生存不能である場合に創面切除される。更なる実施形態においては、組織部位は創傷である。それら方法は、生存不能組織の存在する可能性のある任意の創傷上で使用することができる。創傷は、例えば、火傷、疾病あるいは外傷によるものである場合がある。
【0079】
さらに、本願は、キットの製造のために、生存可能細胞と生存不能細胞とを識別する組成物の使用法を対象とする。そのキットは、生存可能細胞と生存不能細胞とを識別する組成物と、上述した方法の何れかにより組織部位上で組成物を使用するための説明書とを備える。
【0080】
本願は、組織工学構築物内の細胞の生存可能性を判定するために、生存可能細胞と生存不能細胞とを識別する組成物の使用法を対象とする。
【0081】
生存可能および生存不能組織の境界の判定の精度を向上させるために、かつ/または、各分析の精度の内部検査を持つために、1以上の上記方法および使用法を組み合わせることが可能であるはずである。例えば、β−ガラクトシダーゼを同定する組成物を使用する上記方法は、上述したマルチスペクトルまたはハイパースペクトルを用いる方法と組み合わせることが可能である。
【0082】
図1は、本発明の一実施形態の例示を与えるものである。この実施形態においては、組織部位に、上述した組成物を含む粉末または液体の指示薬スプレーが散布されている(パネルA)。ここで塗布できる組成物の例には、生存可能性塗料、または例えば蛍光染料で標識される抗体が含まれる。その後、組織部位は洗い流されて、組織に結合していない組成物が除去される(パネルB)。次いで、例えば染料励起波長の光で、組織が照らされる(パネルC)。そして、ここで生存不能として同定された組織が創面切除される(パネルD)。組成物による処置の前後の組織がどのように見えるかの例示がパネルEおよびFに与えられている。
【0083】
好ましい実施形態を以下の実施例において説明する。本発明の範囲内のその他の実施形態は、本明細書に開示されるように、本明細書の検討または本発明の実施から当業者にとって明らかなものとなる。本明細書は、実施例と共に、単に例示的なものとしてみなされ、本発明の範囲および精神が実施例に続く請求の範囲によって示されることを目的としている。
【0084】
[実施例1:損傷組織または瀕死の状態にある組織におけるタンパク質濃度の変化]
以下の実験は、損傷組織または瀕死の状態にある組織内で増加または減少するタンパク質を特定するために行われた。
【0085】
次のように、熱傷がラット(ドブネズミ)の背中に形成された。3ccの注射器の開放シリンダが、皮膚に置かれ、60℃の水で満たされた。この状態が30秒間、皮膚に接触した状態で保たれ、その終わりに、冷水が加えられて、注射器が室温に冷却された。注射器の除去の後に、シルバーデンクリームが全創傷に対して局所的に塗布された。4時間または5日の何れかで、創傷が解剖で除去された。
【0086】
組織は、壊死の領域から1cmの細片に分割された。これは、様々なジャクソンゾーンに対応する。このため、細片は、中心で死んでいるはずであり、中心から2cmの細片は生存可能であり、その中間ゾーンは、外傷の兆候を示すはずである。
【0087】
組織は、タンパク質が抽出され、安定同位体標識(iTRAQ,ABI)を使用して標識された。タンパク質抽出は、最大8の組織種類から、アセトン沈殿により行われ、その分離された各々が、還元され、システイン遮断され、トリプシンで消化され、その後、固有の標識が与えられた。すべてのサンプルが個々に標識されたときに、固有のタンパク質源を同定する各標識との1の混合物を作るために、それらが混合された。塩堆積(MS評価に影響を与え得るよくあること)のような任意の不純物を有するサンプルを洗浄して、混合物を分割するために、消化物を質量対電荷比の違いによりフラクション(少量の部分)に分離するPolyLC社のカラムを利用して混合されたサンプルをHPLCを介して流すことにより、強陽イオン交換(SCX)クロマトグラフィが利用された。集められたフラクションは、その後、質量分析計に導入する前に励起プレート上に斑点を付けるために利用された。
【0088】
“飛行時間”およびペプチド標識“フィンガープリント”に基づく情報が集められ、ペプチド同定およびその他の残留物質の照合のために、タンパク質データベース(この場合は、Mascot)に入力された。これにより、正常組織と損傷組織とを比較するペプチド水準の定量化が可能となった。このため、最終出力は、正常組織と損傷組織との間で上方調整または下方調整されたタンパク質の判定となった。
【0089】
表1に結果を示す。“受託”は遺伝子バンクの受託番号を参照する。115:113列における1未満の数は、壊死組織における指示タンパク質の減少量を示しており、一方、1を越える数は、壊死組織における指示タンパク質の増加量を示している。壊死組織は、生存可能組織よりも、ヘモグロビン(α2鎖およびβ鎖の両方)、補体第二成分、妊娠ゾーンタンパク質、フィブロネクチン1、アルファ−1−阻害剤III(α1プロテアーゼ阻害剤)、セリンプロテアーゼ阻害剤2b、アポリポタンパク質A−1およびトランスフェリンが少ない。壊死組織は、生存可能組織よりも、ラミンA、クレアチンキナーゼ、ペルオキシレドキシン1、可溶性ガラクトース結合レクチン、パルブアルブミン、コラーゲンおよびその他のタンパク質が多い。
【0090】
【表1】

【0091】
[引用文献]
(1)Barrie,K.A.,Steinmann,S.P.,Shin,A.Y.,Spinner,R.J.,およびBishop,A.T.Gracilis free muscle transfer for restoration of function after complete brachial plexus avulsion.Neurosurg.Focus16,2004年,pE8.
(2)Brody,E.N.,およびGold,L.Aptamers as therapeutic and diagnostic agents.Rev Molec Biotech.74,2000年,p5−13.
(3)Bustin,M.At the crossroads of necrosis and apoptosis: Signaling to multiple cellular targets by HMGB1.Sci.STKE.151,2001年,p39.
(4)Gerland,L−M.,Peyrol,S.,Lallemand,C.,Branche,R.,Magaud,J.P.,Ffrench,M.Association of increased autophagic inclusions labeled for B−galactosidase with fibroblastic aging.Exp.Gerontol.38,2003年,p887−895.
(5)Jabloski,E.,Adams,T.,“The merging of nucleic acid detection and immunoassays”IVD Technology,12(9),2006年,p63−70.
(6)Jackson,D.M.,The diagnosis of the depth of burning.Br J Surg.40,1953年,p588−596.
(7)Molnar,J.A.MD,PhD,FACS,Jordan L.Simpson,BS,Denise M.Voignier,CMA,Michael J.Morykwas,PhDおよびLouis C.Argenta,MD,“Management of an Acute Thermal Injury With Subatmospheric Pressure,J Burns Wounds 4,2005年,pe5.
(8)Mir,M.,Katakis,I.,およびVreeke,M.Aptamer biosensors: an alternative to immunosensors.IVD Technol.13(4),2007年,p39−47.
(9)Parekh,D.Laparoscopic−assisted pancreatic necrosectomy.Arch.Surg.141,2006年,p895−903.
(10)Scaffidi,P.,Misteli,T.,Bianchi,M.E.Release of chromatin protein HMGB1 by necrotic cells triggers inflammation.Nature.418,2002年,p191−195.
(11)Schaefer,L.et al.J.Biol.Chem.278,2003年,p.26227−26237.
(12)Schneider,B.H.et al.Clin.Chem.43,1997年,p.1757−1763.
(13)Seal,J.,Braven,H.,Wallace,P.,“Point−of−care nucleic acid lateral−flow tests,”IVD Technology,12(9),2006年,p41−51.
(14)Todorovic,M.et al.Optics Express.16,2008年,p.10279−10284.
(15)Toms,S.A.et al.2005年,in Proceedings,Optical Methods in Drug Discovery and Development.Mostafa AnalouiおよびDavid A.Dunn, Ed.
(16)Van Herreweghe,F.et al.Proc.Natl.Acad.Sci.USA 99,2002年,p.949−954.
(17)米国特許第6,057,096号
(18)米国特許第6,174,291号
(19)米国特許第7,052,854号
(20)米国特許第7,149,567号
(21)米国特許第7,366,365号
(22)米国特許出願公開US2007/0038121
(23)米国特許出願公開US2007/0197895
(24)米国特許出願公開US2008/0192248
(25)国際公開WO07130423A2
(26)国際公開WO07069040A2
【0092】
上述した説明から、顕著な効果を有する発明が提供されるのは明らかである。ほんの幾つかの形態で本発明を示したが、本発明は、それら形態に限定されるものではなく、その精神を逸脱しない範囲で様々な変更および変形を受け入れる余地がある。
【0093】
本明細書で引用したすべての文献は、参照により本明細書に援用されるものである。本明細書における引用文献の検討は、本発明者により与えられる主張を単に要約することを目的としており、如何なる文献も従来技術を構成することを認めるものではない。出願人は、引用文献の精度および適切性を調べる権利を留保する。
【特許請求の範囲】
【請求項1】
組織部位における細胞が生存可能であるか生存不能であるかを判定する方法であって、
生存可能細胞と生存不能細胞とを区別する組成物を前記組織部位に加えるステップと、
その後に、前記細胞が生存可能または生存不能であることを前記組成物が示すか否かを判定するステップとを備えることを特徴とする方法。
【請求項2】
請求項1に記載の方法において、
前記組成物が、ゲル、スプレー、液体、粉末、クリーム、ローションまたはシートとして構成されることを特徴とする方法。
【請求項3】
請求項1または2に記載の方法において、
前記ゲル、スプレー、液体、粉末、クリーム、ローションまたはシートが生物活性剤をさらに備えることを特徴とする方法。
【請求項4】
請求項3に記載の方法において、
前記生物活性剤が抗体または成長因子であることを特徴とする方法。
【請求項5】
請求項1乃至4の何れか1項に記載の方法において、
前記組成物がタンパク質を同定することを特徴とする方法。
【請求項6】
請求項5に記載の方法において、
前記タンパク質が細胞死に際して増加することを特徴とする方法。
【請求項7】
請求項6に記載の方法において、
前記タンパク質が、死んだ細胞または死に行く細胞内で増加することを特徴とする方法。
【請求項8】
請求項6に記載の方法において、
生存可能な細胞よりも多くのタンパク質が、死んだ細胞または死に行く細胞から放出されることを特徴とする方法。
【請求項9】
請求項8に記載の方法において、
前記組成物を含む固体シートを前記組織部位上に置くステップをさらに備え、このステップにおいて、前記組成物が前記組織部位上の前記放出されたタンパク質と結合または反応することができるとともに、このステップの後に、当該方法が、
前記タンパク質が前記組成物に結合するか否かまたは前記組成物に反応したか否かを判定するステップをさらに備え、このステップにおいて、前記組成物に結合するタンパク質を含む前記シートの領域が生存不能組織であることを特徴とする方法。
【請求項10】
請求項9に記載の方法において、
前記組織部位が、生存不能組織を示す前記シートの領域に隣接して、創面切除されることを特徴とする方法。
【請求項11】
請求項9または10に記載の方法において、
前記シートが、デンプンフィルム、ポリ(D,L−ラクチド−co−グリコリド)、ポリグリコール酸、ポリ−(L−乳酸)またはポリヒドロキシアルカノエートであることを特徴とする方法。
【請求項12】
請求項9乃至11の何れか1項に記載の方法において、
前記組織部位から前記シートの少なくとも一部を除去して、生存可能および生存不能組織の保存可能なテンプレートを与えるステップをさらに備えることを特徴とする方法。
【請求項13】
請求項9乃至12の何れか1項に記載の方法において、
前記シートの少なくとも一部が、創面切除の後に前記組織部位上に残留することを特徴とする方法。
【請求項14】
請求項9乃至13の何れか1項に記載の方法において、
前記組成物が抗体またはアプタマーであることを特徴とする方法。
【請求項15】
請求項9に記載の方法において、
前記放出されたタンパク質が酵素であり、前記組成物が前記酵素の基質であることを特徴とする方法。
【請求項16】
請求項6乃至15の何れか1項に記載の方法において、
前記タンパク質が、アポトーシスを起こしている細胞内で増加することを特徴とする方法。
【請求項17】
請求項6乃至16の何れか1項に記載の方法において、
前記タンパク質が、細胞壊死の間に増加することを特徴とする方法。
【請求項18】
請求項6に記載の方法において、
前記タンパク質が、シトクロムc、第二ミトコンドリア由来のカスパーゼの活性剤(Smac)、β−ガラクトシダーゼ、リポフスチン、HMGB1、NF−κB、グリセロアルデヒド3−リン酸デヒドロゲナーゼ、糖化最終産物を有するタンパク質(AGE)、ビメンチン、ラミンA、クレアチンキナーゼ、ペルオキシレドキシン1、可溶性ガラクトース結合レクチン7またはコラーゲンであることを特徴とする方法。
【請求項19】
請求項6に記載の方法において、
前記タンパク質が、β−ガラクトシダーゼ、リポフスチン、糖化最終産物を有するタンパク質(AGE)、シトクロムc、ラミンA、クレアチンキナーゼ、ペルオキシレドキシン1、可溶性ガラクトース結合レクチン7またはコラーゲンであることを特徴とする方法。
【請求項20】
請求項5に記載の方法において、
前記タンパク質が、細胞死の間に失われることを特徴とする方法。
【請求項21】
請求項20に記載の方法において、
前記タンパク質が、γ−アクチン、バイグリカン、補体第三成分、フィブロネクチン1、α1プロテアーゼ阻害剤、セリンプロテアーゼ阻害剤2b、トランスフェリン、アポリポタンパク質A−1、妊娠ゾーンタンパク質またはヘモグロビンであることを特徴とする方法。
【請求項22】
請求項1に記載の方法において、
前記組成物がミトコンドリア機能を判定することを特徴とする方法。
【請求項23】
請求項5に記載の方法において、
前記組成物が、生存可能組織よりも生存不能組織に多く存在する変性タンパク質に特に結合することを特徴とする方法。
【請求項24】
請求項23に記載の方法において、
前記変性タンパク質がコラーゲンであることを特徴とする方法。
【請求項25】
請求項1に記載の方法において、
前記組成物が、約2000mw未満の有機分子を同定することを特徴とする方法。
【請求項26】
請求項25に記載の方法において、
前記有機分子が、生存可能細胞からよりも生存不能細胞から多く放出される代謝産物であることを特徴とする方法。
【請求項27】
請求項26に記載の方法において、
前記代謝産物が、ATP、グルコース、グリセロール、NADHまたはNADPHであることを特徴とする方法。
【請求項28】
請求項25乃至27の何れか1項に記載の方法において、
前記組成物を含む固体シートを前記組織部位上に置くステップをさらに備え、このステップにおいて、前記組成物が前記組織部位上の前記有機分子と結合または反応することができるとともに、このステップの後に、当該方法が、
前記有機分子が前記組成物に結合するか否かまたは前記組成物に反応したか否かを判定するステップをさらに備え、このステップにおいて、前記組成物に結合する前記有機分子を含む前記シートの任意の領域が生存不能組織であることを特徴とする方法。
【請求項29】
請求項1乃至28の何れか1項に記載の方法において、
前記組成物が抗体結合部位を含むことを特徴とする方法。
【請求項30】
請求項29に記載の方法において、
前記組成物が抗体を含むことを特徴とする方法。
【請求項31】
請求項1乃至28の何れか1項に記載の方法において、
前記組成物がアプタマーを含むことを特徴とする方法。
【請求項32】
請求項1乃至31の何れか1項に記載の方法において、
前記組成物が検出可能なマーカを含むことを特徴とする方法。
【請求項33】
請求項32に記載の方法において、
前記組成物が、前記検出可能なマーカに結合される抗体またはアプタマーであることを特徴とする方法。
【請求項34】
請求項32または33に記載の方法において、
前記検出可能なマーカが、酵素、染料、放射性化合物、量子ドット含有の組成物または金属若しくは金属含有の組成物であることを特徴とする方法。
【請求項35】
請求項1乃至33の何れか1項に記載の方法において、
前記組成物が、光により活性化されて、生存可能細胞と生存不能細胞とを区別することを特徴とする方法。
【請求項36】
請求項1に記載の方法において、
前記組成物が染料であることを特徴とする方法。
【請求項37】
請求項36に記載の方法において、
前記染料が、生存不能細胞よりも生存可能細胞において、より目立つか、より蛍光を発することを特徴とする方法。
【請求項38】
請求項37に記載の方法において、
前記染料が、フルオレセイン二酢酸、ジヒドロローダミン123またはトリパン青であることを特徴とする方法。
【請求項39】
請求項36に記載の方法において、
前記染料が、生存可能細胞よりも生存不能細胞において、より目立つか、より蛍光を発することを特徴とする方法。
【請求項40】
請求項39に記載の方法において、
前記染料が、JC−1またはヨウ化プロピジウムであることを特徴とする方法。
【請求項41】
請求項1乃至40の何れか1項に記載の方法において、
前記組織部位が創傷であることを特徴とする方法。
【請求項42】
請求項41に記載の方法において、
前記創傷が熱傷によるものであることを特徴とする方法。
【請求項43】
請求項41に記載の方法において、
前記創傷が疾病により生じたものあることを特徴とする方法。
【請求項44】
請求項41に記載の方法において、
前記創傷が外傷により生じたものあることを特徴とする方法。
【請求項45】
請求項1乃至44の何れか1項に記載の方法において、
同定された生存不能組織を選択的に創面切除するステップをさらに備えることを特徴とする方法。
【請求項46】
請求項45に記載の方法において、
前記生存不能組織が、鋭利器具、超音波または水噴射により創面切除されることを特徴とする方法。
【請求項47】
請求項45に記載の方法において、
前記生存不能組織が、レーザにより創面切除されることを特徴とする方法。
【請求項48】
生存可能および生存不能組織を含む組織部位から組織を創面切除する方法であって、
生存可能組織と生存不能組織とを区別する組成物を前記組織部位に加えるステップと、
その後に、前記組織部位内のどこに生存可能または生存不能組織が存在するのかを判定するステップと、
その後に、前記生存不能組織を外科的に創面切除するステップとを備えることを特徴とする方法。
【請求項49】
請求項48に記載の方法において、
前記組織部位が創傷であることを特徴とする方法。
【請求項50】
請求項49に記載の方法において、
前記創傷が熱傷によるものであることを特徴とする方法。
【請求項51】
請求項49に記載の方法において、
前記創傷が疾病により生じたものあることを特徴とする方法。
【請求項52】
請求項49に記載の方法において、
前記創傷が外傷により生じたものあることを特徴とする方法。
【請求項53】
請求項48乃至52の何れか1項に記載の方法において、
前記組成物が、細胞死に際して増加するタンパク質を同定することを特徴とする方法。
【請求項54】
請求項48乃至52の何れか1項に記載の方法において、
前記組成物が、細胞死の間に失われるタンパク質を同定することを特徴とする方法。
【請求項55】
請求項48乃至54の何れか1項に記載の方法において、
前記組成物が抗体結合部位を含むことを特徴とする方法。
【請求項56】
請求項48乃至54の何れか1項に記載の方法において、
前記組成物がアプタマーであることを特徴とする方法。
【請求項57】
請求項48乃至54の何れか1項に記載の方法において、
前記組成物が染料であることを特徴とする方法。
【請求項58】
請求項48乃至57の何れか1項に記載の方法において、
前記生存不能組織が、鋭利器具、超音波または水噴射により創面切除されることを特徴とする方法。
【請求項59】
請求項48乃至57の何れか1項に記載の方法において、
前記生存不能組織が、レーザにより創面切除されることを特徴とする方法。
【請求項60】
組織部位における細胞が生存可能であるかまたは生存不能であるのかを判定する方法であって、
生存可能細胞を生存不能細胞と区別することができる条件のもとで、組織を可視化するステップを備えることを特徴とする方法。
【請求項61】
請求項60に記載の方法において、
前記組織が、光コヒーレンストモグラフィを使用して可視化されることを特徴とする方法。
【請求項62】
請求項60に記載の方法において、
前記組織が、干渉分光法を使用して可視化されることを特徴とする方法。
【請求項63】
請求項60に記載の方法において、
高水準の自己蛍光を有する組織が生存可能であり、低水準の自己蛍光を有する組織が生存不能である条件のもとで、自己蛍光が可視化されることを特徴とする方法。
【請求項64】
請求項63に記載の方法において、
前記自己蛍光が、約355nmの励起により約460nmで可視化されることを特徴とする方法。
【請求項65】
請求項60に記載の方法において、
マルチスペクトルまたはハイパースペクトルカメラを介して前記組織部位を撮像するステップをさらに備え、前記カメラが、生存可能および生存不能細胞を区別するスペクトルを撮像することを特徴とする方法。
【請求項66】
請求項65に記載の方法において、
前記撮像されたスペクトルが、生存可能細胞におけるスペクトル特性を有する分子を、生存不能細胞内の分子または生存不能細胞から放出された分子と区別することを特徴とする方法。
【請求項67】
請求項66に記載の方法において、
前記分子が、シトクロムまたはヘモグロビンであることを特徴とする方法。
【請求項68】
請求項66に記載の方法において、
前記分子が、シトクロムcであることを特徴とする方法。
【請求項69】
請求項60乃至68の何れか1項に記載の方法において、
前記組織部位が創傷であることを特徴とする方法。
【請求項70】
請求項69に記載の方法において、
前記創傷が熱傷によるものであることを特徴とする方法。
【請求項71】
請求項69に記載の方法において、
前記創傷が疾病により生じたものあることを特徴とする方法。
【請求項72】
請求項69に記載の方法において、
前記創傷が外傷により生じたものあることを特徴とする方法。
【請求項73】
請求項60乃至72の何れか1項に記載の方法において、
同定された生存不能組織を選択的に創面切除するステップをさらに備えることを特徴とする方法。
【請求項74】
細胞を含む組織工学構築物における細胞の生存可能性を判定する方法であって、
生存可能細胞と生存不能細胞とを区別する組成物を、前記組織工学構築物に加えるステップと、
その後に、前記細胞が生存可能または生存不能であることを前記組成物が示すかどうかを判定するステップとを備えることを特徴とする方法。
【請求項75】
請求項74に記載の方法において、
前記組成物が、細胞死に際して増加するタンパク質を同定することを特徴とする方法。
【請求項76】
請求項74に記載の方法において、
前記組成物が、細胞死に際して失われるタンパク質を同定することを特徴とする方法。
【請求項77】
請求項74に記載の方法において、
前記組成物が、約2000mw未満の有機分子を同定することを特徴とする方法。
【請求項78】
請求項74に記載の方法において、
前記組成物が染料であることを特徴とする方法。
【請求項79】
請求項74乃至78の何れか1項に記載の方法において、
前記組織工学構築物から生存不能細胞を除去するステップをさらに備えることを特徴とする方法。
【請求項80】
細胞を含む組織工学構築物内の細胞の生存可能性を判定する方法であって、
生存可能細胞を生存不能細胞と区別できる条件のもとで、前記組織を可視化するステップを備えることを特徴とする方法。
【請求項81】
請求項80に記載の方法において、
前記組織が、光コヒーレンストモグラフィ、干渉分光法、自己蛍光の可視化またはマルチスペクトル若しくはハイパースペクトルカメラを使用して可視化されることを特徴とする方法。
【請求項82】
請求項80または81に記載の方法において、
前記組織工学構築物から生存不能細胞を除去するステップをさらに備えることを特徴とする方法。
【請求項83】
キットであって、生存可能細胞と生存不能細胞とを区別する組成物と、請求項1乃至59の何れか1項に記載の方法により組織部位上で前記組成物を使用するための説明書とを備えることを特徴とするキット。
【請求項84】
組成物の使用法であって、前記組成物が、生存可能細胞と生存不能細胞とを区別して、組織部位における細胞が生存可能であるのかまたは生存不能であるのかを判定するものであることを特徴とする使用法。
【請求項85】
請求項84に記載の使用法において、
前記組織部位における前記細胞が、生存不能である場合に創面切除されることを特徴とする使用法。
【請求項86】
請求項84または85に記載の使用法において、
前記組織部位が創傷であることを特徴とする使用法。
【請求項87】
組成物の使用法であって、前記組成物が、請求項83に記載のキットの製造のために生存可能細胞と生存不能細胞とを区別するものであることを特徴とする使用法。
【請求項88】
組成物の使用法であって、前記組成物が、組織工学構築物における細胞の生存可能性を判定するために、生存可能細胞と生存不能細胞とを区別するものであることを特徴とする使用法。
【請求項1】
組織部位における細胞が生存可能であるか生存不能であるかを判定する方法であって、
生存可能細胞と生存不能細胞とを区別する組成物を前記組織部位に加えるステップと、
その後に、前記細胞が生存可能または生存不能であることを前記組成物が示すか否かを判定するステップとを備えることを特徴とする方法。
【請求項2】
請求項1に記載の方法において、
前記組成物が、ゲル、スプレー、液体、粉末、クリーム、ローションまたはシートとして構成されることを特徴とする方法。
【請求項3】
請求項1または2に記載の方法において、
前記ゲル、スプレー、液体、粉末、クリーム、ローションまたはシートが生物活性剤をさらに備えることを特徴とする方法。
【請求項4】
請求項3に記載の方法において、
前記生物活性剤が抗体または成長因子であることを特徴とする方法。
【請求項5】
請求項1乃至4の何れか1項に記載の方法において、
前記組成物がタンパク質を同定することを特徴とする方法。
【請求項6】
請求項5に記載の方法において、
前記タンパク質が細胞死に際して増加することを特徴とする方法。
【請求項7】
請求項6に記載の方法において、
前記タンパク質が、死んだ細胞または死に行く細胞内で増加することを特徴とする方法。
【請求項8】
請求項6に記載の方法において、
生存可能な細胞よりも多くのタンパク質が、死んだ細胞または死に行く細胞から放出されることを特徴とする方法。
【請求項9】
請求項8に記載の方法において、
前記組成物を含む固体シートを前記組織部位上に置くステップをさらに備え、このステップにおいて、前記組成物が前記組織部位上の前記放出されたタンパク質と結合または反応することができるとともに、このステップの後に、当該方法が、
前記タンパク質が前記組成物に結合するか否かまたは前記組成物に反応したか否かを判定するステップをさらに備え、このステップにおいて、前記組成物に結合するタンパク質を含む前記シートの領域が生存不能組織であることを特徴とする方法。
【請求項10】
請求項9に記載の方法において、
前記組織部位が、生存不能組織を示す前記シートの領域に隣接して、創面切除されることを特徴とする方法。
【請求項11】
請求項9または10に記載の方法において、
前記シートが、デンプンフィルム、ポリ(D,L−ラクチド−co−グリコリド)、ポリグリコール酸、ポリ−(L−乳酸)またはポリヒドロキシアルカノエートであることを特徴とする方法。
【請求項12】
請求項9乃至11の何れか1項に記載の方法において、
前記組織部位から前記シートの少なくとも一部を除去して、生存可能および生存不能組織の保存可能なテンプレートを与えるステップをさらに備えることを特徴とする方法。
【請求項13】
請求項9乃至12の何れか1項に記載の方法において、
前記シートの少なくとも一部が、創面切除の後に前記組織部位上に残留することを特徴とする方法。
【請求項14】
請求項9乃至13の何れか1項に記載の方法において、
前記組成物が抗体またはアプタマーであることを特徴とする方法。
【請求項15】
請求項9に記載の方法において、
前記放出されたタンパク質が酵素であり、前記組成物が前記酵素の基質であることを特徴とする方法。
【請求項16】
請求項6乃至15の何れか1項に記載の方法において、
前記タンパク質が、アポトーシスを起こしている細胞内で増加することを特徴とする方法。
【請求項17】
請求項6乃至16の何れか1項に記載の方法において、
前記タンパク質が、細胞壊死の間に増加することを特徴とする方法。
【請求項18】
請求項6に記載の方法において、
前記タンパク質が、シトクロムc、第二ミトコンドリア由来のカスパーゼの活性剤(Smac)、β−ガラクトシダーゼ、リポフスチン、HMGB1、NF−κB、グリセロアルデヒド3−リン酸デヒドロゲナーゼ、糖化最終産物を有するタンパク質(AGE)、ビメンチン、ラミンA、クレアチンキナーゼ、ペルオキシレドキシン1、可溶性ガラクトース結合レクチン7またはコラーゲンであることを特徴とする方法。
【請求項19】
請求項6に記載の方法において、
前記タンパク質が、β−ガラクトシダーゼ、リポフスチン、糖化最終産物を有するタンパク質(AGE)、シトクロムc、ラミンA、クレアチンキナーゼ、ペルオキシレドキシン1、可溶性ガラクトース結合レクチン7またはコラーゲンであることを特徴とする方法。
【請求項20】
請求項5に記載の方法において、
前記タンパク質が、細胞死の間に失われることを特徴とする方法。
【請求項21】
請求項20に記載の方法において、
前記タンパク質が、γ−アクチン、バイグリカン、補体第三成分、フィブロネクチン1、α1プロテアーゼ阻害剤、セリンプロテアーゼ阻害剤2b、トランスフェリン、アポリポタンパク質A−1、妊娠ゾーンタンパク質またはヘモグロビンであることを特徴とする方法。
【請求項22】
請求項1に記載の方法において、
前記組成物がミトコンドリア機能を判定することを特徴とする方法。
【請求項23】
請求項5に記載の方法において、
前記組成物が、生存可能組織よりも生存不能組織に多く存在する変性タンパク質に特に結合することを特徴とする方法。
【請求項24】
請求項23に記載の方法において、
前記変性タンパク質がコラーゲンであることを特徴とする方法。
【請求項25】
請求項1に記載の方法において、
前記組成物が、約2000mw未満の有機分子を同定することを特徴とする方法。
【請求項26】
請求項25に記載の方法において、
前記有機分子が、生存可能細胞からよりも生存不能細胞から多く放出される代謝産物であることを特徴とする方法。
【請求項27】
請求項26に記載の方法において、
前記代謝産物が、ATP、グルコース、グリセロール、NADHまたはNADPHであることを特徴とする方法。
【請求項28】
請求項25乃至27の何れか1項に記載の方法において、
前記組成物を含む固体シートを前記組織部位上に置くステップをさらに備え、このステップにおいて、前記組成物が前記組織部位上の前記有機分子と結合または反応することができるとともに、このステップの後に、当該方法が、
前記有機分子が前記組成物に結合するか否かまたは前記組成物に反応したか否かを判定するステップをさらに備え、このステップにおいて、前記組成物に結合する前記有機分子を含む前記シートの任意の領域が生存不能組織であることを特徴とする方法。
【請求項29】
請求項1乃至28の何れか1項に記載の方法において、
前記組成物が抗体結合部位を含むことを特徴とする方法。
【請求項30】
請求項29に記載の方法において、
前記組成物が抗体を含むことを特徴とする方法。
【請求項31】
請求項1乃至28の何れか1項に記載の方法において、
前記組成物がアプタマーを含むことを特徴とする方法。
【請求項32】
請求項1乃至31の何れか1項に記載の方法において、
前記組成物が検出可能なマーカを含むことを特徴とする方法。
【請求項33】
請求項32に記載の方法において、
前記組成物が、前記検出可能なマーカに結合される抗体またはアプタマーであることを特徴とする方法。
【請求項34】
請求項32または33に記載の方法において、
前記検出可能なマーカが、酵素、染料、放射性化合物、量子ドット含有の組成物または金属若しくは金属含有の組成物であることを特徴とする方法。
【請求項35】
請求項1乃至33の何れか1項に記載の方法において、
前記組成物が、光により活性化されて、生存可能細胞と生存不能細胞とを区別することを特徴とする方法。
【請求項36】
請求項1に記載の方法において、
前記組成物が染料であることを特徴とする方法。
【請求項37】
請求項36に記載の方法において、
前記染料が、生存不能細胞よりも生存可能細胞において、より目立つか、より蛍光を発することを特徴とする方法。
【請求項38】
請求項37に記載の方法において、
前記染料が、フルオレセイン二酢酸、ジヒドロローダミン123またはトリパン青であることを特徴とする方法。
【請求項39】
請求項36に記載の方法において、
前記染料が、生存可能細胞よりも生存不能細胞において、より目立つか、より蛍光を発することを特徴とする方法。
【請求項40】
請求項39に記載の方法において、
前記染料が、JC−1またはヨウ化プロピジウムであることを特徴とする方法。
【請求項41】
請求項1乃至40の何れか1項に記載の方法において、
前記組織部位が創傷であることを特徴とする方法。
【請求項42】
請求項41に記載の方法において、
前記創傷が熱傷によるものであることを特徴とする方法。
【請求項43】
請求項41に記載の方法において、
前記創傷が疾病により生じたものあることを特徴とする方法。
【請求項44】
請求項41に記載の方法において、
前記創傷が外傷により生じたものあることを特徴とする方法。
【請求項45】
請求項1乃至44の何れか1項に記載の方法において、
同定された生存不能組織を選択的に創面切除するステップをさらに備えることを特徴とする方法。
【請求項46】
請求項45に記載の方法において、
前記生存不能組織が、鋭利器具、超音波または水噴射により創面切除されることを特徴とする方法。
【請求項47】
請求項45に記載の方法において、
前記生存不能組織が、レーザにより創面切除されることを特徴とする方法。
【請求項48】
生存可能および生存不能組織を含む組織部位から組織を創面切除する方法であって、
生存可能組織と生存不能組織とを区別する組成物を前記組織部位に加えるステップと、
その後に、前記組織部位内のどこに生存可能または生存不能組織が存在するのかを判定するステップと、
その後に、前記生存不能組織を外科的に創面切除するステップとを備えることを特徴とする方法。
【請求項49】
請求項48に記載の方法において、
前記組織部位が創傷であることを特徴とする方法。
【請求項50】
請求項49に記載の方法において、
前記創傷が熱傷によるものであることを特徴とする方法。
【請求項51】
請求項49に記載の方法において、
前記創傷が疾病により生じたものあることを特徴とする方法。
【請求項52】
請求項49に記載の方法において、
前記創傷が外傷により生じたものあることを特徴とする方法。
【請求項53】
請求項48乃至52の何れか1項に記載の方法において、
前記組成物が、細胞死に際して増加するタンパク質を同定することを特徴とする方法。
【請求項54】
請求項48乃至52の何れか1項に記載の方法において、
前記組成物が、細胞死の間に失われるタンパク質を同定することを特徴とする方法。
【請求項55】
請求項48乃至54の何れか1項に記載の方法において、
前記組成物が抗体結合部位を含むことを特徴とする方法。
【請求項56】
請求項48乃至54の何れか1項に記載の方法において、
前記組成物がアプタマーであることを特徴とする方法。
【請求項57】
請求項48乃至54の何れか1項に記載の方法において、
前記組成物が染料であることを特徴とする方法。
【請求項58】
請求項48乃至57の何れか1項に記載の方法において、
前記生存不能組織が、鋭利器具、超音波または水噴射により創面切除されることを特徴とする方法。
【請求項59】
請求項48乃至57の何れか1項に記載の方法において、
前記生存不能組織が、レーザにより創面切除されることを特徴とする方法。
【請求項60】
組織部位における細胞が生存可能であるかまたは生存不能であるのかを判定する方法であって、
生存可能細胞を生存不能細胞と区別することができる条件のもとで、組織を可視化するステップを備えることを特徴とする方法。
【請求項61】
請求項60に記載の方法において、
前記組織が、光コヒーレンストモグラフィを使用して可視化されることを特徴とする方法。
【請求項62】
請求項60に記載の方法において、
前記組織が、干渉分光法を使用して可視化されることを特徴とする方法。
【請求項63】
請求項60に記載の方法において、
高水準の自己蛍光を有する組織が生存可能であり、低水準の自己蛍光を有する組織が生存不能である条件のもとで、自己蛍光が可視化されることを特徴とする方法。
【請求項64】
請求項63に記載の方法において、
前記自己蛍光が、約355nmの励起により約460nmで可視化されることを特徴とする方法。
【請求項65】
請求項60に記載の方法において、
マルチスペクトルまたはハイパースペクトルカメラを介して前記組織部位を撮像するステップをさらに備え、前記カメラが、生存可能および生存不能細胞を区別するスペクトルを撮像することを特徴とする方法。
【請求項66】
請求項65に記載の方法において、
前記撮像されたスペクトルが、生存可能細胞におけるスペクトル特性を有する分子を、生存不能細胞内の分子または生存不能細胞から放出された分子と区別することを特徴とする方法。
【請求項67】
請求項66に記載の方法において、
前記分子が、シトクロムまたはヘモグロビンであることを特徴とする方法。
【請求項68】
請求項66に記載の方法において、
前記分子が、シトクロムcであることを特徴とする方法。
【請求項69】
請求項60乃至68の何れか1項に記載の方法において、
前記組織部位が創傷であることを特徴とする方法。
【請求項70】
請求項69に記載の方法において、
前記創傷が熱傷によるものであることを特徴とする方法。
【請求項71】
請求項69に記載の方法において、
前記創傷が疾病により生じたものあることを特徴とする方法。
【請求項72】
請求項69に記載の方法において、
前記創傷が外傷により生じたものあることを特徴とする方法。
【請求項73】
請求項60乃至72の何れか1項に記載の方法において、
同定された生存不能組織を選択的に創面切除するステップをさらに備えることを特徴とする方法。
【請求項74】
細胞を含む組織工学構築物における細胞の生存可能性を判定する方法であって、
生存可能細胞と生存不能細胞とを区別する組成物を、前記組織工学構築物に加えるステップと、
その後に、前記細胞が生存可能または生存不能であることを前記組成物が示すかどうかを判定するステップとを備えることを特徴とする方法。
【請求項75】
請求項74に記載の方法において、
前記組成物が、細胞死に際して増加するタンパク質を同定することを特徴とする方法。
【請求項76】
請求項74に記載の方法において、
前記組成物が、細胞死に際して失われるタンパク質を同定することを特徴とする方法。
【請求項77】
請求項74に記載の方法において、
前記組成物が、約2000mw未満の有機分子を同定することを特徴とする方法。
【請求項78】
請求項74に記載の方法において、
前記組成物が染料であることを特徴とする方法。
【請求項79】
請求項74乃至78の何れか1項に記載の方法において、
前記組織工学構築物から生存不能細胞を除去するステップをさらに備えることを特徴とする方法。
【請求項80】
細胞を含む組織工学構築物内の細胞の生存可能性を判定する方法であって、
生存可能細胞を生存不能細胞と区別できる条件のもとで、前記組織を可視化するステップを備えることを特徴とする方法。
【請求項81】
請求項80に記載の方法において、
前記組織が、光コヒーレンストモグラフィ、干渉分光法、自己蛍光の可視化またはマルチスペクトル若しくはハイパースペクトルカメラを使用して可視化されることを特徴とする方法。
【請求項82】
請求項80または81に記載の方法において、
前記組織工学構築物から生存不能細胞を除去するステップをさらに備えることを特徴とする方法。
【請求項83】
キットであって、生存可能細胞と生存不能細胞とを区別する組成物と、請求項1乃至59の何れか1項に記載の方法により組織部位上で前記組成物を使用するための説明書とを備えることを特徴とするキット。
【請求項84】
組成物の使用法であって、前記組成物が、生存可能細胞と生存不能細胞とを区別して、組織部位における細胞が生存可能であるのかまたは生存不能であるのかを判定するものであることを特徴とする使用法。
【請求項85】
請求項84に記載の使用法において、
前記組織部位における前記細胞が、生存不能である場合に創面切除されることを特徴とする使用法。
【請求項86】
請求項84または85に記載の使用法において、
前記組織部位が創傷であることを特徴とする使用法。
【請求項87】
組成物の使用法であって、前記組成物が、請求項83に記載のキットの製造のために生存可能細胞と生存不能細胞とを区別するものであることを特徴とする使用法。
【請求項88】
組成物の使用法であって、前記組成物が、組織工学構築物における細胞の生存可能性を判定するために、生存可能細胞と生存不能細胞とを区別するものであることを特徴とする使用法。
【図1】




【公表番号】特表2011−503552(P2011−503552A)
【公表日】平成23年1月27日(2011.1.27)
【国際特許分類】
【出願番号】特願2010−532335(P2010−532335)
【出願日】平成20年11月5日(2008.11.5)
【国際出願番号】PCT/US2008/082499
【国際公開番号】WO2009/061832
【国際公開日】平成21年5月14日(2009.5.14)
【出願人】(508268713)ケーシーアイ ライセンシング インコーポレイテッド (125)
【Fターム(参考)】
【公表日】平成23年1月27日(2011.1.27)
【国際特許分類】
【出願日】平成20年11月5日(2008.11.5)
【国際出願番号】PCT/US2008/082499
【国際公開番号】WO2009/061832
【国際公開日】平成21年5月14日(2009.5.14)
【出願人】(508268713)ケーシーアイ ライセンシング インコーポレイテッド (125)
【Fターム(参考)】
[ Back to top ]

