動物用組成物
【課題】経口送達可能な錠剤の形の動物用組成物、より詳細には、1日1回の投与を可能にする十分に長い持続時間を提供する制御放出組成物を提供すること。
【解決手段】本発明の錠剤は、イヌのGI力に耐えるのに十分な高分子量または高粘度ポリマーを使用する。嚥下されると、本発明の錠剤はイヌの胃の底部に沈降し、迅速に水和して、イヌにおいて1日1回の経口投与に適した長時間の胃貯留を提供する。
【解決手段】本発明の錠剤は、イヌのGI力に耐えるのに十分な高分子量または高粘度ポリマーを使用する。嚥下されると、本発明の錠剤はイヌの胃の底部に沈降し、迅速に水和して、イヌにおいて1日1回の経口投与に適した長時間の胃貯留を提供する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、経口送達可能な錠剤の形の動物用組成物に関し、より詳細には、1日1回の投与を可能にする十分に長い持続時間を提供する制御放出組成物に関する。
【背景技術】
【0002】
薬物分子の長時間放出技術は、1950年代初頭から広く研究され、開発されてきた。多くの重要なヒト用薬剤による療法を向上させるために、経口制御放出剤形が用いられ、商業的成功を収めてきた。
【0003】
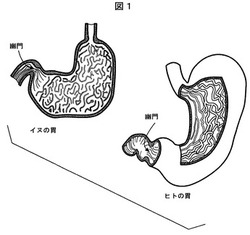
しかしながら、ヒト用に開発された従来の制御放出剤形は、同様にイヌに用いられたとき、目的通りには機能しない。イヌはヒトと比較して胃の筋力が強い。さらに、イヌは胃腸(GI)管がかなり短く(ヒトの約半分の長さ)、したがってGI管通過時間も短い。イヌの筋力の強さとGI管通過時間の短さの組み合わせにより、ヒト用に設計された従来の制御放出錠剤はイヌには適さないものとなる。さらに、図1に例示するとおり、哺乳動物において小腸の最初の部分に連結する胃の部位である幽門をイヌの胃はその上部に有し、ヒトはこの幽門を胃の底部に有する。したがって、イヌの生理学的相違から、胃内貯留に対する新規な非浮遊性のアプローチが必要となる。制御放出投与錠剤は、胃の底部に沈まなければならず、浮遊性または浮動特性を有するべきではない。錠剤を幽門開口部から離し、それによって錠剤が容易に胃を通過するのを防ぐためには、嚥下時の錠剤の「沈降挙動」、その後の迅速な水和が必要とされる。
【先行技術文献】
【特許文献】
【0004】
【特許文献1】米国特許出願第12/542451号
【特許文献2】出願公開第2010/0075996号
【非特許文献】
【0005】
【非特許文献1】The Merck Index、第16版(2006)
【発明の概要】
【発明が解決しようとする課題】
【0006】
現在まで、1日1回のスケジュールでイヌに投与するための固体経口制御放出錠剤剤形は市販されていない。結果として、イヌの胃に吸収のために長時間貯留し、イヌの胃で受ける強い筋力を切り抜けることのできる、経口送達可能な錠剤の形の新規な制御放出組成物の開発が依然として求められている。本発明は、イヌにおいて1日1回の経口投与に適した、長時間の胃貯留を伴う経口送達可能な錠剤の形の動物用組成物を提供する。
【課題を解決するための手段】
【0007】
本発明は、経口送達可能な錠剤の形の制御放出動物用組成物に関する。本発明の錠剤は、イヌのGI力に耐えるのに十分な高分子量または高粘度ポリマーを使用する。嚥下されると、本発明の錠剤はイヌの胃の底部に沈降し、迅速に水和して、イヌにおいて1日1回の経口投与に適した長時間の胃貯留を提供する。
【0008】
具体的には、本発明の動物用組成物は、
(a)動物用の少なくとも1種の生物活性剤、
(b)錠剤の総重量の約5%から約60%の量の、粘度約80000から約120000mPa・sを有するポリマーまたは分子量約1000000から約9000000ダルトンを有するポリマー、および
(c)錠剤の総重量の約10%から約50%の量の少なくとも1種の崩壊剤
を含む。
【0009】
本発明はさらに、経口送達可能な錠剤の形の制御放出動物用組成物を調製する方法を提供する。
【0010】
本発明はさらに、少なくとも1種の生物活性剤が必要とされる状態または障害を有するイヌを治療する方法を提供し、この方法は、経口送達可能な錠剤の形の動物用組成物をイヌに経口投与することを含む。
【図面の簡単な説明】
【0011】
【図1】イヌの胃は胃の上部に幽門を有し、ヒトは胃の底部に幽門を有することを例示する図である。
【図2】実施例1および2のin vitro溶解プロファイルを例示する図である。
【図3】本発明のプレガバリン錠剤、および即時放出錠剤のin vitro溶解プロファイルを例示する図である。
【図4】本発明のアモキシシリン三水和物錠剤のin vitro溶解プロファイルを例示する図である。
【図5】本発明のトラマドール錠剤、および即時放出錠剤のin vitro溶解プロファイルを例示する図である。
【図6】実施例1の時間に対するイヌの化合物A平均血漿濃度を例示する図である。
【図7】実施例2の時間に対するイヌの化合物A平均血漿濃度を例示する図である。
【図8】時間に対するイヌのプレガバリン平均血漿濃度を例示する図である。
【図9】時間に対するイヌのアモキシシリン平均血漿濃度を例示する図である。
【図10】クエン酸緩衝液ビーカー中の実施例2の非浮遊性「沈降錠剤」を例示する図である。
【発明を実施するための形態】
【0012】
生物活性剤
本発明の適切な生物活性剤は、十分な水溶解度を有する化合物、または許容できるその塩もしくはプロドラッグである。典型的に、本発明に適した生物活性剤は、0.1mg/mL超またはそれ以上の溶解度を必要とする。本明細書では、「溶解度」という用語は、任意の生理学的に許容できるpH、たとえば約3から約8の範囲の任意のpHにおける、20〜25℃での水への溶解度を意味する。
【0013】
本発明の生物活性剤は、その生物活性剤が0.1mg/mL超またはそれ以上の十分な水溶解度を有するならば、動物用の任意の薬効分類のもの、たとえばThe Merck Index、第16版(2006)に記載されている任意の薬効分類のものであってもよい。本発明に有用な生物活性剤は、これに限定されるものではないが、鎮痛剤、抗炎症剤、抗寄生虫剤、駆虫剤、内外部駆虫剤(endectocide)、制吐剤、抗菌剤、抗真菌剤および抗ウイルス剤、抗ヒスタミン剤、抗アレルギー剤、疼痛緩和剤、鎮静剤およびトランキライザ、呼吸刺激剤、筋弛緩剤、体重制御および減少剤、抗糖尿病剤、ビタミンおよびミネラル補助剤、ホルモン剤、免疫刺激剤および免疫抑制剤、睡眠補助剤、かゆみ止めを含む皮膚病薬、行動変容剤、抗痙攣剤、ならびにそれらの組み合わせを含む薬効分類のものであってもよい。
【0014】
例示のための生物活性剤の部分的なリストには、これに限定されるものではないが、クエン酸マロピタント、好ましくは商品名Cerenia(商標)Tabletsのもの、アモキシシリン、好ましくは商品名Amoxi−TABS(登録商標)のもの、塩酸デクスメデトミジン、好ましくは商品名Dexdomitor(登録商標)のもの、ツラスロマイシン、好ましくは商品名Draxxin(登録商標)のもの、セラメクチン、好ましくは商品名Revolution(登録商標)のもの、セフチオフル、塩酸リンコマイシン、トラマドール、プレガバリン、ヤヌスキナーゼ(JAK)阻害剤、アスピリン、イブプロフェン、モルヒネ、スペクチノマイシン、ブプレノルフィン、フロセミド、ケトプロフェン、マルボフロキサシン、セレジリンHClおよびL−デプレニルHCl、セフポドキシムプロキセチル、酒石酸トリメプラジン、プレドニゾロン、クリナフロキサシン、エプシプランテル、アモキシシリン三水和物/クラブラン酸カリウム、ジクロフェナクナトリウム、プリミドン、デラコキシブ、ジフェンヒドラミン、メトカルバモール、クロラムフェニコール、テトラサイクリン、ペニシリンVK、フェニルブタゾン、酒石酸ブトルファノール、セファドロキシル、オキシコドン、クリンダマイシン、コハク酸ドキシラミン、フマル酸アミノプロパジンおよび硫酸ネオマイシン、ヨウ化イソプロパミド、リオチロニンナトリウム、テニウムクロシラート、マンデル酸メテンアミンおよびスルファメチゾール、スルファクロルピリダジン、カルバミン酸クロルフェネシン、またはそれらの組み合わせが含まれる。本発明の組み合わせ使用に適した生物活性剤には、クエン酸マロピタントが含まれる。
【0015】
本発明に有用なすべての生物活性剤は、当業者に知られている方法で調製することができ、対象となる具体的な生物活性剤に関する特許、公開特許出願、および他の文献に開示されている方法が含まれる。
【0016】
本発明に有用な具体的な作用剤にはさらに、式Iのヤヌスキナーゼ(JAK)阻害剤
【0017】
【化1】

または許容できるその塩が含まれ、式中、R1は、ヒドロキシで置換されていてもよい−C1〜4アルキルである。具体的には、本発明に有用な作用剤は、N−メチル−1−{trans−4−[メチル(7H−ピロロ[2,3−d]ピリミジン−4−イル)アミノ]シクロヘキシル}メタンスルホンアミド(以下、化合物A)、または許容できるその塩である。式IのJAK化合物、または許容できるその塩を調製する方法は、参照により本明細書の一部とする米国特許出願第12/542451号、米国特許出願公開第2010/0075996号に開示されている。式IのJAK化合物または薬学的に許容できるその塩を含有する本発明の動物用組成物は、イヌを含む動物において、アレルギー反応、アレルギー性皮膚炎、アトピー性皮膚炎、湿疹、掻痒および他の掻痒性状態、ならびに炎症性疾患を含む様々な状態または疾患を治療するために用いることができる。本発明の目的の1つは、イヌを含む動物において、アレルギー反応、アレルギー性皮膚炎、アトピー性皮膚炎、湿疹、掻痒および他の掻痒性状態、ならびに炎症性疾患などの様々な状態または疾患を治療する薬剤を製造するために、式Iの化合物を含有する本発明の動物用組成物を使用することである。本発明の別の目的は、式Iの化合物を含有する有効量の本発明の動物用組成物を必要とする動物に投与することによって、イヌを含む動物において、アレルギー反応、アレルギー性皮膚炎、アトピー性皮膚炎、湿疹、掻痒および他の掻痒性状態、ならびに炎症性疾患などの様々な状態または疾患を治療する方法を提供することである。
【0018】
経口錠剤の形の動物用組成物の生物活性剤の量は、特定の化合物の効力、作用剤の溶解度、および所望の濃度に応じて多様であることができるが、1錠に1日用量を提供するのに十分な量である。治療有効量の決定は、十分に当業者の能力の範囲内である。一般に、治療剤の量は、全体として錠剤の0.1重量%から60重量%の範囲となる。好ましくは、治療剤の量は、全体として錠剤の約1重量%から約40重量%、より好ましくは約1重量%から約25重量%、さらに好ましくは約2重量%から10重量%の範囲となる。
【0019】
錠剤
本発明の経口送達可能な錠剤は、任意の適切な寸法および形状、たとえば円形、長円形、多角形、または枕形であることができ、非機能性の表面刻印を場合により有することができる。
【0020】
本明細書では、「経口送達可能な」という用語は、経口腔(peroral)および口腔内(たとえば、舌下または頬側)投与を含む、経口に適していることを意味するが、本発明の錠剤は、主として経口投与、すなわち典型的には全体または破壊したものを食物、水、または他の飲用流体の助けにより嚥下するのに適している。
【0021】
本明細書に記載の錠剤のおおよその寸法は、必要とするイヌの体重に応じて調節することができる。一般に、おおよその錠剤の寸法は、イヌの体重約10kg(約20ポンド)の場合、約100mgから約1.5g、好ましくは約250mgから約1g、イヌの体重約20kg(約40ポンド)の場合、約400mgから約3g、好ましくは約750mgから約2g、イヌの体重約40kg(約80ポンド)の場合、約600mgから約5g、好ましくは約1gから約3.5g、およびイヌの体重約80kg(約160ポンド)の場合、約1.5gから約7g、好ましくは約2gから約5gの範囲である。
【0022】
組成物
本発明で有用なポリマーは、高分子量を有するマトリクス形成剤として剤形中のいずれかの材料であることができる。「粘度」という用語は、ポリマー溶液が流動する速度を測るために用いられ(溶液の動きが遅いほど、粘度が高い)、ポリマーの分子量は粘度に影響を与える。ポリマー溶液の粘度は溶媒および温度によって決まり、この場合、2%ポリマー水溶液をいう。高分子量または高粘度を有するポリマーは、イヌの胃のGI力に耐え、生物活性剤(複数可)の放出を調節するのに十分である。本発明に有用なポリマーは、典型的に分子量約1000000から約9000000ダルトン、好ましくは約2000000から約4000000ダルトンを有するか、または典型的に見かけ粘度約80000から約120000ミリパスカル秒(mPa・s)を有する。ヒト用の剤形は、イヌの胃に見出される増強された筋力を経験しないため、典型的により低い分子量または低い粘度のポリマーを用いる。したがって、制御放出は、ヒトでは高分子量または高粘度のポリマーを用いずに容易に達成できる。さらに、ヒト用の剤形で用いられるより低い分子量またはより低い粘度の制御放出ポリマーは、崩壊剤を必要とすることなく容易に水和し、GI管では(その全長のため)1日1回の投与に十分な共鳴(resonance)時間を提供しながら、薬物を放出する十分な時間を有する。
【0023】
本発明のそのようなポリマーの例には、これに限定されるものではないが、メチルセルロース、カルボキシメチルセルロースナトリウム、架橋カルボキシメチルセルロースナトリウム、架橋ヒドロキシプロピルセルロース、ヒドロキシプロピルメチルセルロース、カルボキシルメチルスターチ、ポリメタクリラート、ポリビニルピロリドン、ポリビニルアルコール、ポリエチレングリコール、メタクリル酸カリウム−ジビニルベンゼンコポリマー、カルボキシメチルセルロース、アルギナート、アルブミン、ゼラチン、架橋ポリビニルピロリドン、ポリエステル、ポリ無水物、スクレログルカン、ポリメチルビニルエーテル/無水物コポリマー、グルカン、マンナン、ベータシクロデキストリン、ならびに線状および/または分岐ポリマー鎖を含有するシクロデキストリン誘導体、ならびにそれらの混合物が含まれる。これらはすべて市販され入手可能である。
【0024】
一実施形態において、本発明に有用なポリマーは、粘度80000以上を有するヒドロキシプロピルメチルセルロース(HPMC)、好ましくはヒプロメロース2208として知られるもの、または実質的に等価の製品である。別の実施形態において、本発明に有用なポリマーは、高分子量ポリエチレンオキシド(PEO)、好ましくはPolyox WSR n−60kとして知られるもの、または実質的に等価の製品である。ヒプロメロース2208およびPolyox WSR n−60kは、市販され入手可能なポリマーである。
【0025】
一般に、本発明の組成物のポリマーの量は、全体として錠剤の約5から約80重量%、好ましくは約15重量%から約50重量%、より好ましくは約20重量%から約40重量%の量である。ヒプロメロース2208の場合、好ましい量は、全体として錠剤の約25重量%から約40重量%の範囲である。Polyox WSR n−60kの場合、好ましい量は、全体として錠剤の約15重量%から約35重量%の範囲である。
【0026】
本明細書で有用な「崩壊剤」という用語は、水と接触すると、短時間以内、典型的には60秒以内またはそれ以下で、迅速に膨張し、水和し、体積または形態を変える物質を指す。少なくとも1種の高量の崩壊剤が本発明の経口送達可能な錠剤に存在する。崩壊剤は、高分子量ポリマーの非常に迅速な膨張を提供する。これらの錠剤は容易に嚥下され、投与による水和と迅速な膨張のため、胃の中で著しく大きい寸法に達する。これは、錠剤が幽門を通過するのを阻害し、結果として、錠剤はイヌの胃に貯留し、制御放出を助ける。さらに、ここで錠剤の「沈降挙動」が可能になる。図10は、クエン酸緩衝液ビーカー中の実施例2の組成物の非浮遊性「沈降錠剤」を例示する。迅速な錠剤膨張後、高レベルの崩壊剤使用の結果として、典型的にゲル化が観察される。これは、水和されゲル化された錠剤の密度を増大する。錠剤は胃の底に沈降し、それらの胃貯留時間を延長する。従来の即時放出剤形では、「ゲル化現象」は薬物放出の問題を引き起こすことが知られているため、望ましくない。理論に拘束するものではないが、「ゲル化現象」は、胃貯留性にさらなる利益を提供し(ゲル化による)、高分子量ポリマーを用いて製剤化された制御放出剤形の薬物放出を改善すると考えられる。これは予期しない結果である。一実施形態において、本発明に有用な崩壊剤は、クロスカルメロースナトリウムである。別の実施形態において、本発明に有用な崩壊剤は、カルボキシメチルスターチナトリウムである。別の実施形態において、本発明に有用な崩壊剤は、架橋ポビドンである。別の実施形態において、本発明に有用な崩壊剤は、2−ヒドロキシプロピルエーテル(低置換度)である。一般に、本発明の崩壊剤の量は、全体として錠剤の約10重量%から約50重量%、好ましくは約10重量%から約40重量%、より好ましくは約10重量%から約25重量%である。
【0027】
本発明の組成物はさらに、結合剤、充填剤、希釈剤、水、pH緩衝剤、流動促進剤、接着剤または接着防止剤、フィルム被覆材料、イオン性または腸溶性ポリマー、非イオン性ポリマー、セルロースポリマー、カルシウム塩、コポリマー、糖、アルコール、滑沢剤、着色剤、安定化剤、界面活性剤、風味剤、保存剤、抗酸化剤、およびそれらの組み合わせなどの獣医学的に許容できる手段(expedient)を含むことができる。
【0028】
結合剤の例には、これに限定されるものではないが、微結晶性セルロース、アルファ化デンプン、およびポリビニルピロリドンが含まれる。
【0029】
希釈剤の例には、これに限定されるものではないが、微結晶性セルロース、ラクトース、リン酸二カルシウム、マンニトール、および水が含まれる。
【0030】
ゲル化剤の例には、これに限定されるものではないが、カルボマーおよびポリエチレングリコールが含まれる。
【0031】
腸溶性充填剤または腸溶性ポリマーの例には、これに限定されるものではないが、メタクリラートコポリマー、酢酸フタル酸セルロース、および酢酸フタル酸ヒドロキシプロピルメチルセルロースが含まれる。好ましくは、腸溶性充填剤またはポリマーは、pH範囲約5.5〜9.0、より好ましくは約pH5.5を有する。
【0032】
pH緩衝剤の例には、これに限定されるものではないが、クエン酸、クエン酸ナトリウム、およびリン酸二ナトリウムが含まれる。
【0033】
滑沢剤の例には、これに限定されるものではないが、ステアリン酸マグネシウム、フマル酸ステアリルナトリウム、およびステアリン酸が含まれる。
【0034】
調製方法
本明細書に記載の経口送達可能な錠剤の形の動物用組成物は、生物活性剤を適切なポリマー、適切な崩壊剤、および他の賦形剤と混合するなど、当分野で周知の技法を用いて調製できる。続いて、混合物をブレンドまたは粒状化し圧縮して錠剤を形成する。一実施形態において、本発明の調製方法は、1)適切な容器にすべての成分を秤量して入れるステップ、2)乳鉢と乳棒に適切な希釈剤を加えるステップ、3)15秒間ブレンドして乳鉢を被覆するステップ、4)生物活性剤を加え、さらにブレンドした後、混合物をメッシュスクリーンに通すステップ、5)ブレンドを滑沢にするステップ、および6)滑沢にした粉末ブレンドを、適切な打錠機を用いて錠剤に圧縮するステップを含む。
【実施例】
【0035】
本発明は、直接圧縮によって調製された固体錠剤の形の以下の非限定的な実施例1〜7を参照することにより、さらに理解されるであろう。
【0036】
【表1】

【0037】
【表2】

【0038】
【表3】

【0039】
【表4】

【0040】
【表5】

【0041】
【表6】

【0042】
【表7】

【0043】
in vitro溶解試験
生物活性剤を含有する錠剤(実施例1〜7)のin vitro溶解放出プロファイルを図2〜5に示す。溶解方法は、自動サンプラを備えたUSP I溶解装置(Hanson SR8 plus)を用いて行った。クエン酸緩衝液(pH3.6)または水900mLからなる溶解媒質を200rpmで48時間、37±0.5℃で維持した。サンプル体積1.4mLを0、2、4、8、12、16、20、および24時間で採取し、一部のサンプルを36および48時間に抽出した。水和された錠剤系は、薬物を溶解し、ヒドロゲルマトリクス全体に拡散する。時間プロファイルを通じて、生物活性剤の持続および制御放出が観察された。生物活性剤は、UV−HPLCによって、波長288nmで分析した。
【0044】
図2は、本発明の実施例1および2のin vitro溶解プロファイルを例示する。図2において、白い四角を付した線は、実施例1のin vitro溶解プロファイルを示す。黒い菱形を付した線は、実施例2のin vitro溶解プロファイルを示す。クエン酸緩衝液(pH3.6)において化合物Aの従来型の即時放出錠剤またはカプセル剤は、15分以内に完全に薬物を放出するであろう。本発明によって、放出を15分から約48時間に延長することが可能である(in vitro)。
【0045】
図3は、プレガバリン45mg錠剤のin vitro溶解プロファイルを例示する。図3において、黒い菱形を付した線は、本発明の実施例3のin vitro溶解プロファイルを示す。白い四角を付した線は、本発明の実施例4のin vitro溶解プロファイルを示す。黒丸を付した線は、即時放出プレガバリンカプセル剤のin vitro溶解プロファイルを示す。プレガバリンは現在、ヒトの疼痛管理に用いられている。商品名Lyrica(登録商標)のプレガバリンを、1日2または3回投与量で投与する。プレガバリンは市販され入手可能であるが、イヌにおける経口プレガバリンの適切な投与レジメンは未知である。本発明の技術を適用することによって、てんかんを有するイヌの抗発作選択剤として、または疼痛緩和剤として、プレガバリンの投与頻度をイヌにおいて1日1回に低減することが可能である。本発明の目的の1つは、イヌを含む動物において、発作、てんかん、または疼痛を治療する薬剤を製造するために、プレガバリンを含有する本発明の動物用組成物を使用することである。本発明の別の目的は、プレガバリンを含有する有効量の本発明の動物用組成物を必要とする動物に投与することによって、イヌを含む動物において、発作、てんかん、または疼痛を治療する方法を提供することである。
【0046】
図4は、アモキシシリン三水和物300mg錠剤のin vitro溶解プロファイルを例示する。図4において、白い四角を付した線は、本発明の実施例5のin vitro溶解プロファイルを示す。黒い菱形を付した線は、即時放出アモキシシリン錠剤のin vitro溶解プロファイルを示す。アモキシシリンは、創傷、膿瘍、蜂巣炎、ならびに表在性(若年性)および深在性膿皮症などの皮膚および軟部組織感染のためにイヌの治療に適応される。アモキシシリンはまた、好気性細菌および嫌気性細菌両方の感受性系統による歯周感染にも適応される。現在のところ、イヌ治療用の市販製品は、1日2回の投与を必要とする。制御放出アモキシシリン(Augmentin−XR)薬物製品がヒトに用いるために入手可能であるが、依然として1日2回の投与を必要とする。本発明の技術を適用することによって、アモキシシリンの投与頻度をイヌにおいて1日1回に低減することが可能である。本発明の目的の1つは、イヌを含む動物において、創傷、膿瘍、蜂巣炎、表在性(若年性)または深在性膿皮症などの皮膚および軟部組織感染、ならびに歯周感染を治療する薬剤を製造するために、アモキシシリンを含有する本発明の動物用組成物を使用することである。本発明の別の目的は、アモキシシリンを含有する有効量の本発明の動物用組成物を必要とする動物に投与することによって、イヌを含む動物において、創傷、膿瘍、蜂巣炎、表在性(若年性)または深在性膿皮症などの皮膚および軟部組織感染、ならびに歯周感染を治療する方法を提供することである。
【0047】
図5は、トラマドール塩酸塩(HCl)100mg錠剤のin vitro溶解プロファイルを例示する。図5において、黒い三角を付した線は、本発明の実施例6のin vitro溶解プロファイルを示す。白い四角を付した線は、本発明の実施例7のin vitro溶解プロファイルを示す。黒い菱形を付した線は、商標Ultram(登録商標)のトラマドール50mg即時放出錠剤のin vitro溶解プロファイルを示す。トラマドールは、ヒトに用いられてきた疼痛緩和剤であるが、イヌおよびネコにおいて慢性疼痛および術後疼痛を含む様々な疼痛を治療するために、獣医界に導入されている。イヌ関節炎の症状は、イヌ用のトラマドールを用いて制御および治療できる。トラマドールは通常、即時放出錠剤として処方され、必要に応じて4から6時間毎に投与される。本発明の技術を適用することによって、投与頻度をイヌにおいて1日1回に低減することが可能である。本発明の目的の1つは、イヌを含む動物において、慢性疼痛および術後疼痛を含む様々な疼痛を治療する薬剤を製造するために、トラマドールを含有する本発明の動物用組成物を使用することである。本発明の別の目的は、トラマドールを含有する有効量の本発明の動物用組成物を必要とする動物に投与することによって、イヌを含む動物において、イヌの慢性疼痛および術後疼痛を含む様々な疼痛を治療する方法を提供することである。
【0048】
薬物動態試験
本発明の組成物は、1日1回の経口投与のために、イヌにおいて胃貯留時間を16時間まで延長することが可能である。化合物Aの研究では、イヌにおいて並行群間薬物動態試験を行い、本発明の組成物を即時放出製剤と比較した。各処置群は、給餌後に、即時放出製剤または本発明の錠剤の形態の10.75mg化合物Aマレイン酸塩(8mg遊離塩基当量)単回経口投与量を投与した、5頭の雌のビーグルで構成された。薬物投与後の72時間、指定の時間に血液サンプルを採取した。すべてのサンプル採取において、化合物Aの血漿濃度を求め、そこから薬物動態を評価し、そのデータを図6および7に示す。図6において、白い四角を付した線は、即時放出カプセル剤の血漿薬物濃度−時間プロファイルを示す。黒い四角を付した線は、本発明の実施例1の化合物Aの血漿薬物濃度−時間プロファイルを示す。図6からわかるように、本発明の実施例1は、即時放出剤形(1.4h)と比較して、延長されたTmax(4.8h)を有する。同様に、本発明の実施例1の平均滞留時間(MRT)は、即時放出剤形の平均滞留時間(4.8h)と比較して長い(12h)。さらに、実施例1のCmaxは、即時放出剤形より数倍低く、これは長いMRTによる長い有効性持続時間を提供しながら、より広い安全域を提供する。図7において、白丸を付した線は、即時放出カプセル剤の血漿薬物濃度−時間プロファイルを示す。黒丸を付した線は、本発明の実施例2の化合物Aの血漿薬物濃度−時間プロファイルを示す。図7からわかるように、本発明の実施例2は、即時放出剤形(1.2h)と比較して、延長されたTmax(5.2h)を有する。同様に、本発明の実施例2の平均滞留時間(MRT)は、即時放出剤形の平均滞留時間(4.8h)と比較して長い(11.1h)。さらに、実施例2のCmaxは、即時放出剤形より数倍低く、これは長いMRTによる長い有効性持続時間を提供しながら、より広い安全域を提供する。
【0049】
プレガバリンに関する別のPK(薬物動態)試験では、イヌにおいて並行群間薬物動態試験を行い、本発明の組成物を即時放出製剤と比較した。各処置群は、給餌後に、即時放出製剤または本発明の錠剤の形態の45mgプレガバリン単回経口投与量を投与した、5頭の雄のビーグルで構成された。薬物投与後の72時間、指定の時間に血液サンプルを採取した。すべてのサンプル採取において、プレガバリンの血漿濃度を求め、そこから薬物動態を評価し、そのデータを図8に示す。
【0050】
図8において、黒丸を付した線は、即時放出カプセル剤の血漿薬物濃度−時間プロファイルを示す。白い四角を付した線は、本発明の実施例3のプレガバリンの血漿薬物濃度−時間プロファイルを示す。図8からわかるように、本発明の実施例3は、即時放出剤形(1.3h)と比較して、延長されたTmax(8.0h)を有する。同様に、本発明の実施例3の平均滞留時間(MRT)は、即時放出剤形の平均滞留時間(7.27h)と比較して長い(12.4h)。さらに、実施例3のCmaxは、即時放出剤形より著しく低く、これは長いMRTによる長い有効性持続時間を提供しながら、より広い安全域を提供する。黒い三角を付した線は、本発明の実施例4のプレガバリンの血漿薬物濃度−時間プロファイルを示す。図8からわかるように、本発明の実施例4は、即時放出剤形(1.3h)と比較して、延長されたTmax(4.0h)を有する。同様に、本発明の実施例4の平均滞留時間(MRT)は、即時放出剤形の平均滞留時間(7.27h)と比較して長い(10.8h)。さらに、実施例4のCmaxは、即時放出剤形より相当に低く、これは長いMRTによる長い有効性持続時間を提供しながら、より広い安全域を提供する。
【0051】
アモキシシリンに関する別のPK試験では、イヌにおいて並行群間薬物動態試験を行い、本発明の組成物を商品名Clavamox(登録商標)の即時放出製剤と比較した。各処置群は、給餌後に、即時放出製剤として125mgおよび62.5mgClavamox(登録商標)経口投与量、または本発明の錠剤を用いる300mgアモキシシリン単回経口投与量を投与した、5頭の雄のビーグルで構成された。薬物投与後の72時間、指定の時間に血液サンプルを採取した。すべてのサンプル採取において、アモキシシリンの血漿濃度を求め、そこから薬物動態を評価し、そのデータを図9に示す。
【0052】
図9において、黒い三角を付した線は、即時放出錠剤の血漿薬物濃度−時間プロファイルを示す。白い四角を付した線は、本発明の実施例5のアモキシシリンの血漿薬物濃度−時間プロファイルを示す。図9からわかるように、本発明の実施例5は、即時放出剤形(0.75h)と比較して、延長されたTmax(3.5h)を有する。同様に、本発明の実施例5の平均滞留時間(MRT)は、即時放出剤形の平均滞留時間(2.03h)と比較して長い(4.8h)。さらに、実施例5のCmaxは、即時放出剤形より低く、これは長いMRTによる長い有効性持続時間を提供しながら、同様の曝露を提供する。
【技術分野】
【0001】
本発明は、経口送達可能な錠剤の形の動物用組成物に関し、より詳細には、1日1回の投与を可能にする十分に長い持続時間を提供する制御放出組成物に関する。
【背景技術】
【0002】
薬物分子の長時間放出技術は、1950年代初頭から広く研究され、開発されてきた。多くの重要なヒト用薬剤による療法を向上させるために、経口制御放出剤形が用いられ、商業的成功を収めてきた。
【0003】
しかしながら、ヒト用に開発された従来の制御放出剤形は、同様にイヌに用いられたとき、目的通りには機能しない。イヌはヒトと比較して胃の筋力が強い。さらに、イヌは胃腸(GI)管がかなり短く(ヒトの約半分の長さ)、したがってGI管通過時間も短い。イヌの筋力の強さとGI管通過時間の短さの組み合わせにより、ヒト用に設計された従来の制御放出錠剤はイヌには適さないものとなる。さらに、図1に例示するとおり、哺乳動物において小腸の最初の部分に連結する胃の部位である幽門をイヌの胃はその上部に有し、ヒトはこの幽門を胃の底部に有する。したがって、イヌの生理学的相違から、胃内貯留に対する新規な非浮遊性のアプローチが必要となる。制御放出投与錠剤は、胃の底部に沈まなければならず、浮遊性または浮動特性を有するべきではない。錠剤を幽門開口部から離し、それによって錠剤が容易に胃を通過するのを防ぐためには、嚥下時の錠剤の「沈降挙動」、その後の迅速な水和が必要とされる。
【先行技術文献】
【特許文献】
【0004】
【特許文献1】米国特許出願第12/542451号
【特許文献2】出願公開第2010/0075996号
【非特許文献】
【0005】
【非特許文献1】The Merck Index、第16版(2006)
【発明の概要】
【発明が解決しようとする課題】
【0006】
現在まで、1日1回のスケジュールでイヌに投与するための固体経口制御放出錠剤剤形は市販されていない。結果として、イヌの胃に吸収のために長時間貯留し、イヌの胃で受ける強い筋力を切り抜けることのできる、経口送達可能な錠剤の形の新規な制御放出組成物の開発が依然として求められている。本発明は、イヌにおいて1日1回の経口投与に適した、長時間の胃貯留を伴う経口送達可能な錠剤の形の動物用組成物を提供する。
【課題を解決するための手段】
【0007】
本発明は、経口送達可能な錠剤の形の制御放出動物用組成物に関する。本発明の錠剤は、イヌのGI力に耐えるのに十分な高分子量または高粘度ポリマーを使用する。嚥下されると、本発明の錠剤はイヌの胃の底部に沈降し、迅速に水和して、イヌにおいて1日1回の経口投与に適した長時間の胃貯留を提供する。
【0008】
具体的には、本発明の動物用組成物は、
(a)動物用の少なくとも1種の生物活性剤、
(b)錠剤の総重量の約5%から約60%の量の、粘度約80000から約120000mPa・sを有するポリマーまたは分子量約1000000から約9000000ダルトンを有するポリマー、および
(c)錠剤の総重量の約10%から約50%の量の少なくとも1種の崩壊剤
を含む。
【0009】
本発明はさらに、経口送達可能な錠剤の形の制御放出動物用組成物を調製する方法を提供する。
【0010】
本発明はさらに、少なくとも1種の生物活性剤が必要とされる状態または障害を有するイヌを治療する方法を提供し、この方法は、経口送達可能な錠剤の形の動物用組成物をイヌに経口投与することを含む。
【図面の簡単な説明】
【0011】
【図1】イヌの胃は胃の上部に幽門を有し、ヒトは胃の底部に幽門を有することを例示する図である。
【図2】実施例1および2のin vitro溶解プロファイルを例示する図である。
【図3】本発明のプレガバリン錠剤、および即時放出錠剤のin vitro溶解プロファイルを例示する図である。
【図4】本発明のアモキシシリン三水和物錠剤のin vitro溶解プロファイルを例示する図である。
【図5】本発明のトラマドール錠剤、および即時放出錠剤のin vitro溶解プロファイルを例示する図である。
【図6】実施例1の時間に対するイヌの化合物A平均血漿濃度を例示する図である。
【図7】実施例2の時間に対するイヌの化合物A平均血漿濃度を例示する図である。
【図8】時間に対するイヌのプレガバリン平均血漿濃度を例示する図である。
【図9】時間に対するイヌのアモキシシリン平均血漿濃度を例示する図である。
【図10】クエン酸緩衝液ビーカー中の実施例2の非浮遊性「沈降錠剤」を例示する図である。
【発明を実施するための形態】
【0012】
生物活性剤
本発明の適切な生物活性剤は、十分な水溶解度を有する化合物、または許容できるその塩もしくはプロドラッグである。典型的に、本発明に適した生物活性剤は、0.1mg/mL超またはそれ以上の溶解度を必要とする。本明細書では、「溶解度」という用語は、任意の生理学的に許容できるpH、たとえば約3から約8の範囲の任意のpHにおける、20〜25℃での水への溶解度を意味する。
【0013】
本発明の生物活性剤は、その生物活性剤が0.1mg/mL超またはそれ以上の十分な水溶解度を有するならば、動物用の任意の薬効分類のもの、たとえばThe Merck Index、第16版(2006)に記載されている任意の薬効分類のものであってもよい。本発明に有用な生物活性剤は、これに限定されるものではないが、鎮痛剤、抗炎症剤、抗寄生虫剤、駆虫剤、内外部駆虫剤(endectocide)、制吐剤、抗菌剤、抗真菌剤および抗ウイルス剤、抗ヒスタミン剤、抗アレルギー剤、疼痛緩和剤、鎮静剤およびトランキライザ、呼吸刺激剤、筋弛緩剤、体重制御および減少剤、抗糖尿病剤、ビタミンおよびミネラル補助剤、ホルモン剤、免疫刺激剤および免疫抑制剤、睡眠補助剤、かゆみ止めを含む皮膚病薬、行動変容剤、抗痙攣剤、ならびにそれらの組み合わせを含む薬効分類のものであってもよい。
【0014】
例示のための生物活性剤の部分的なリストには、これに限定されるものではないが、クエン酸マロピタント、好ましくは商品名Cerenia(商標)Tabletsのもの、アモキシシリン、好ましくは商品名Amoxi−TABS(登録商標)のもの、塩酸デクスメデトミジン、好ましくは商品名Dexdomitor(登録商標)のもの、ツラスロマイシン、好ましくは商品名Draxxin(登録商標)のもの、セラメクチン、好ましくは商品名Revolution(登録商標)のもの、セフチオフル、塩酸リンコマイシン、トラマドール、プレガバリン、ヤヌスキナーゼ(JAK)阻害剤、アスピリン、イブプロフェン、モルヒネ、スペクチノマイシン、ブプレノルフィン、フロセミド、ケトプロフェン、マルボフロキサシン、セレジリンHClおよびL−デプレニルHCl、セフポドキシムプロキセチル、酒石酸トリメプラジン、プレドニゾロン、クリナフロキサシン、エプシプランテル、アモキシシリン三水和物/クラブラン酸カリウム、ジクロフェナクナトリウム、プリミドン、デラコキシブ、ジフェンヒドラミン、メトカルバモール、クロラムフェニコール、テトラサイクリン、ペニシリンVK、フェニルブタゾン、酒石酸ブトルファノール、セファドロキシル、オキシコドン、クリンダマイシン、コハク酸ドキシラミン、フマル酸アミノプロパジンおよび硫酸ネオマイシン、ヨウ化イソプロパミド、リオチロニンナトリウム、テニウムクロシラート、マンデル酸メテンアミンおよびスルファメチゾール、スルファクロルピリダジン、カルバミン酸クロルフェネシン、またはそれらの組み合わせが含まれる。本発明の組み合わせ使用に適した生物活性剤には、クエン酸マロピタントが含まれる。
【0015】
本発明に有用なすべての生物活性剤は、当業者に知られている方法で調製することができ、対象となる具体的な生物活性剤に関する特許、公開特許出願、および他の文献に開示されている方法が含まれる。
【0016】
本発明に有用な具体的な作用剤にはさらに、式Iのヤヌスキナーゼ(JAK)阻害剤
【0017】
【化1】

または許容できるその塩が含まれ、式中、R1は、ヒドロキシで置換されていてもよい−C1〜4アルキルである。具体的には、本発明に有用な作用剤は、N−メチル−1−{trans−4−[メチル(7H−ピロロ[2,3−d]ピリミジン−4−イル)アミノ]シクロヘキシル}メタンスルホンアミド(以下、化合物A)、または許容できるその塩である。式IのJAK化合物、または許容できるその塩を調製する方法は、参照により本明細書の一部とする米国特許出願第12/542451号、米国特許出願公開第2010/0075996号に開示されている。式IのJAK化合物または薬学的に許容できるその塩を含有する本発明の動物用組成物は、イヌを含む動物において、アレルギー反応、アレルギー性皮膚炎、アトピー性皮膚炎、湿疹、掻痒および他の掻痒性状態、ならびに炎症性疾患を含む様々な状態または疾患を治療するために用いることができる。本発明の目的の1つは、イヌを含む動物において、アレルギー反応、アレルギー性皮膚炎、アトピー性皮膚炎、湿疹、掻痒および他の掻痒性状態、ならびに炎症性疾患などの様々な状態または疾患を治療する薬剤を製造するために、式Iの化合物を含有する本発明の動物用組成物を使用することである。本発明の別の目的は、式Iの化合物を含有する有効量の本発明の動物用組成物を必要とする動物に投与することによって、イヌを含む動物において、アレルギー反応、アレルギー性皮膚炎、アトピー性皮膚炎、湿疹、掻痒および他の掻痒性状態、ならびに炎症性疾患などの様々な状態または疾患を治療する方法を提供することである。
【0018】
経口錠剤の形の動物用組成物の生物活性剤の量は、特定の化合物の効力、作用剤の溶解度、および所望の濃度に応じて多様であることができるが、1錠に1日用量を提供するのに十分な量である。治療有効量の決定は、十分に当業者の能力の範囲内である。一般に、治療剤の量は、全体として錠剤の0.1重量%から60重量%の範囲となる。好ましくは、治療剤の量は、全体として錠剤の約1重量%から約40重量%、より好ましくは約1重量%から約25重量%、さらに好ましくは約2重量%から10重量%の範囲となる。
【0019】
錠剤
本発明の経口送達可能な錠剤は、任意の適切な寸法および形状、たとえば円形、長円形、多角形、または枕形であることができ、非機能性の表面刻印を場合により有することができる。
【0020】
本明細書では、「経口送達可能な」という用語は、経口腔(peroral)および口腔内(たとえば、舌下または頬側)投与を含む、経口に適していることを意味するが、本発明の錠剤は、主として経口投与、すなわち典型的には全体または破壊したものを食物、水、または他の飲用流体の助けにより嚥下するのに適している。
【0021】
本明細書に記載の錠剤のおおよその寸法は、必要とするイヌの体重に応じて調節することができる。一般に、おおよその錠剤の寸法は、イヌの体重約10kg(約20ポンド)の場合、約100mgから約1.5g、好ましくは約250mgから約1g、イヌの体重約20kg(約40ポンド)の場合、約400mgから約3g、好ましくは約750mgから約2g、イヌの体重約40kg(約80ポンド)の場合、約600mgから約5g、好ましくは約1gから約3.5g、およびイヌの体重約80kg(約160ポンド)の場合、約1.5gから約7g、好ましくは約2gから約5gの範囲である。
【0022】
組成物
本発明で有用なポリマーは、高分子量を有するマトリクス形成剤として剤形中のいずれかの材料であることができる。「粘度」という用語は、ポリマー溶液が流動する速度を測るために用いられ(溶液の動きが遅いほど、粘度が高い)、ポリマーの分子量は粘度に影響を与える。ポリマー溶液の粘度は溶媒および温度によって決まり、この場合、2%ポリマー水溶液をいう。高分子量または高粘度を有するポリマーは、イヌの胃のGI力に耐え、生物活性剤(複数可)の放出を調節するのに十分である。本発明に有用なポリマーは、典型的に分子量約1000000から約9000000ダルトン、好ましくは約2000000から約4000000ダルトンを有するか、または典型的に見かけ粘度約80000から約120000ミリパスカル秒(mPa・s)を有する。ヒト用の剤形は、イヌの胃に見出される増強された筋力を経験しないため、典型的により低い分子量または低い粘度のポリマーを用いる。したがって、制御放出は、ヒトでは高分子量または高粘度のポリマーを用いずに容易に達成できる。さらに、ヒト用の剤形で用いられるより低い分子量またはより低い粘度の制御放出ポリマーは、崩壊剤を必要とすることなく容易に水和し、GI管では(その全長のため)1日1回の投与に十分な共鳴(resonance)時間を提供しながら、薬物を放出する十分な時間を有する。
【0023】
本発明のそのようなポリマーの例には、これに限定されるものではないが、メチルセルロース、カルボキシメチルセルロースナトリウム、架橋カルボキシメチルセルロースナトリウム、架橋ヒドロキシプロピルセルロース、ヒドロキシプロピルメチルセルロース、カルボキシルメチルスターチ、ポリメタクリラート、ポリビニルピロリドン、ポリビニルアルコール、ポリエチレングリコール、メタクリル酸カリウム−ジビニルベンゼンコポリマー、カルボキシメチルセルロース、アルギナート、アルブミン、ゼラチン、架橋ポリビニルピロリドン、ポリエステル、ポリ無水物、スクレログルカン、ポリメチルビニルエーテル/無水物コポリマー、グルカン、マンナン、ベータシクロデキストリン、ならびに線状および/または分岐ポリマー鎖を含有するシクロデキストリン誘導体、ならびにそれらの混合物が含まれる。これらはすべて市販され入手可能である。
【0024】
一実施形態において、本発明に有用なポリマーは、粘度80000以上を有するヒドロキシプロピルメチルセルロース(HPMC)、好ましくはヒプロメロース2208として知られるもの、または実質的に等価の製品である。別の実施形態において、本発明に有用なポリマーは、高分子量ポリエチレンオキシド(PEO)、好ましくはPolyox WSR n−60kとして知られるもの、または実質的に等価の製品である。ヒプロメロース2208およびPolyox WSR n−60kは、市販され入手可能なポリマーである。
【0025】
一般に、本発明の組成物のポリマーの量は、全体として錠剤の約5から約80重量%、好ましくは約15重量%から約50重量%、より好ましくは約20重量%から約40重量%の量である。ヒプロメロース2208の場合、好ましい量は、全体として錠剤の約25重量%から約40重量%の範囲である。Polyox WSR n−60kの場合、好ましい量は、全体として錠剤の約15重量%から約35重量%の範囲である。
【0026】
本明細書で有用な「崩壊剤」という用語は、水と接触すると、短時間以内、典型的には60秒以内またはそれ以下で、迅速に膨張し、水和し、体積または形態を変える物質を指す。少なくとも1種の高量の崩壊剤が本発明の経口送達可能な錠剤に存在する。崩壊剤は、高分子量ポリマーの非常に迅速な膨張を提供する。これらの錠剤は容易に嚥下され、投与による水和と迅速な膨張のため、胃の中で著しく大きい寸法に達する。これは、錠剤が幽門を通過するのを阻害し、結果として、錠剤はイヌの胃に貯留し、制御放出を助ける。さらに、ここで錠剤の「沈降挙動」が可能になる。図10は、クエン酸緩衝液ビーカー中の実施例2の組成物の非浮遊性「沈降錠剤」を例示する。迅速な錠剤膨張後、高レベルの崩壊剤使用の結果として、典型的にゲル化が観察される。これは、水和されゲル化された錠剤の密度を増大する。錠剤は胃の底に沈降し、それらの胃貯留時間を延長する。従来の即時放出剤形では、「ゲル化現象」は薬物放出の問題を引き起こすことが知られているため、望ましくない。理論に拘束するものではないが、「ゲル化現象」は、胃貯留性にさらなる利益を提供し(ゲル化による)、高分子量ポリマーを用いて製剤化された制御放出剤形の薬物放出を改善すると考えられる。これは予期しない結果である。一実施形態において、本発明に有用な崩壊剤は、クロスカルメロースナトリウムである。別の実施形態において、本発明に有用な崩壊剤は、カルボキシメチルスターチナトリウムである。別の実施形態において、本発明に有用な崩壊剤は、架橋ポビドンである。別の実施形態において、本発明に有用な崩壊剤は、2−ヒドロキシプロピルエーテル(低置換度)である。一般に、本発明の崩壊剤の量は、全体として錠剤の約10重量%から約50重量%、好ましくは約10重量%から約40重量%、より好ましくは約10重量%から約25重量%である。
【0027】
本発明の組成物はさらに、結合剤、充填剤、希釈剤、水、pH緩衝剤、流動促進剤、接着剤または接着防止剤、フィルム被覆材料、イオン性または腸溶性ポリマー、非イオン性ポリマー、セルロースポリマー、カルシウム塩、コポリマー、糖、アルコール、滑沢剤、着色剤、安定化剤、界面活性剤、風味剤、保存剤、抗酸化剤、およびそれらの組み合わせなどの獣医学的に許容できる手段(expedient)を含むことができる。
【0028】
結合剤の例には、これに限定されるものではないが、微結晶性セルロース、アルファ化デンプン、およびポリビニルピロリドンが含まれる。
【0029】
希釈剤の例には、これに限定されるものではないが、微結晶性セルロース、ラクトース、リン酸二カルシウム、マンニトール、および水が含まれる。
【0030】
ゲル化剤の例には、これに限定されるものではないが、カルボマーおよびポリエチレングリコールが含まれる。
【0031】
腸溶性充填剤または腸溶性ポリマーの例には、これに限定されるものではないが、メタクリラートコポリマー、酢酸フタル酸セルロース、および酢酸フタル酸ヒドロキシプロピルメチルセルロースが含まれる。好ましくは、腸溶性充填剤またはポリマーは、pH範囲約5.5〜9.0、より好ましくは約pH5.5を有する。
【0032】
pH緩衝剤の例には、これに限定されるものではないが、クエン酸、クエン酸ナトリウム、およびリン酸二ナトリウムが含まれる。
【0033】
滑沢剤の例には、これに限定されるものではないが、ステアリン酸マグネシウム、フマル酸ステアリルナトリウム、およびステアリン酸が含まれる。
【0034】
調製方法
本明細書に記載の経口送達可能な錠剤の形の動物用組成物は、生物活性剤を適切なポリマー、適切な崩壊剤、および他の賦形剤と混合するなど、当分野で周知の技法を用いて調製できる。続いて、混合物をブレンドまたは粒状化し圧縮して錠剤を形成する。一実施形態において、本発明の調製方法は、1)適切な容器にすべての成分を秤量して入れるステップ、2)乳鉢と乳棒に適切な希釈剤を加えるステップ、3)15秒間ブレンドして乳鉢を被覆するステップ、4)生物活性剤を加え、さらにブレンドした後、混合物をメッシュスクリーンに通すステップ、5)ブレンドを滑沢にするステップ、および6)滑沢にした粉末ブレンドを、適切な打錠機を用いて錠剤に圧縮するステップを含む。
【実施例】
【0035】
本発明は、直接圧縮によって調製された固体錠剤の形の以下の非限定的な実施例1〜7を参照することにより、さらに理解されるであろう。
【0036】
【表1】

【0037】
【表2】

【0038】
【表3】

【0039】
【表4】

【0040】
【表5】

【0041】
【表6】

【0042】
【表7】

【0043】
in vitro溶解試験
生物活性剤を含有する錠剤(実施例1〜7)のin vitro溶解放出プロファイルを図2〜5に示す。溶解方法は、自動サンプラを備えたUSP I溶解装置(Hanson SR8 plus)を用いて行った。クエン酸緩衝液(pH3.6)または水900mLからなる溶解媒質を200rpmで48時間、37±0.5℃で維持した。サンプル体積1.4mLを0、2、4、8、12、16、20、および24時間で採取し、一部のサンプルを36および48時間に抽出した。水和された錠剤系は、薬物を溶解し、ヒドロゲルマトリクス全体に拡散する。時間プロファイルを通じて、生物活性剤の持続および制御放出が観察された。生物活性剤は、UV−HPLCによって、波長288nmで分析した。
【0044】
図2は、本発明の実施例1および2のin vitro溶解プロファイルを例示する。図2において、白い四角を付した線は、実施例1のin vitro溶解プロファイルを示す。黒い菱形を付した線は、実施例2のin vitro溶解プロファイルを示す。クエン酸緩衝液(pH3.6)において化合物Aの従来型の即時放出錠剤またはカプセル剤は、15分以内に完全に薬物を放出するであろう。本発明によって、放出を15分から約48時間に延長することが可能である(in vitro)。
【0045】
図3は、プレガバリン45mg錠剤のin vitro溶解プロファイルを例示する。図3において、黒い菱形を付した線は、本発明の実施例3のin vitro溶解プロファイルを示す。白い四角を付した線は、本発明の実施例4のin vitro溶解プロファイルを示す。黒丸を付した線は、即時放出プレガバリンカプセル剤のin vitro溶解プロファイルを示す。プレガバリンは現在、ヒトの疼痛管理に用いられている。商品名Lyrica(登録商標)のプレガバリンを、1日2または3回投与量で投与する。プレガバリンは市販され入手可能であるが、イヌにおける経口プレガバリンの適切な投与レジメンは未知である。本発明の技術を適用することによって、てんかんを有するイヌの抗発作選択剤として、または疼痛緩和剤として、プレガバリンの投与頻度をイヌにおいて1日1回に低減することが可能である。本発明の目的の1つは、イヌを含む動物において、発作、てんかん、または疼痛を治療する薬剤を製造するために、プレガバリンを含有する本発明の動物用組成物を使用することである。本発明の別の目的は、プレガバリンを含有する有効量の本発明の動物用組成物を必要とする動物に投与することによって、イヌを含む動物において、発作、てんかん、または疼痛を治療する方法を提供することである。
【0046】
図4は、アモキシシリン三水和物300mg錠剤のin vitro溶解プロファイルを例示する。図4において、白い四角を付した線は、本発明の実施例5のin vitro溶解プロファイルを示す。黒い菱形を付した線は、即時放出アモキシシリン錠剤のin vitro溶解プロファイルを示す。アモキシシリンは、創傷、膿瘍、蜂巣炎、ならびに表在性(若年性)および深在性膿皮症などの皮膚および軟部組織感染のためにイヌの治療に適応される。アモキシシリンはまた、好気性細菌および嫌気性細菌両方の感受性系統による歯周感染にも適応される。現在のところ、イヌ治療用の市販製品は、1日2回の投与を必要とする。制御放出アモキシシリン(Augmentin−XR)薬物製品がヒトに用いるために入手可能であるが、依然として1日2回の投与を必要とする。本発明の技術を適用することによって、アモキシシリンの投与頻度をイヌにおいて1日1回に低減することが可能である。本発明の目的の1つは、イヌを含む動物において、創傷、膿瘍、蜂巣炎、表在性(若年性)または深在性膿皮症などの皮膚および軟部組織感染、ならびに歯周感染を治療する薬剤を製造するために、アモキシシリンを含有する本発明の動物用組成物を使用することである。本発明の別の目的は、アモキシシリンを含有する有効量の本発明の動物用組成物を必要とする動物に投与することによって、イヌを含む動物において、創傷、膿瘍、蜂巣炎、表在性(若年性)または深在性膿皮症などの皮膚および軟部組織感染、ならびに歯周感染を治療する方法を提供することである。
【0047】
図5は、トラマドール塩酸塩(HCl)100mg錠剤のin vitro溶解プロファイルを例示する。図5において、黒い三角を付した線は、本発明の実施例6のin vitro溶解プロファイルを示す。白い四角を付した線は、本発明の実施例7のin vitro溶解プロファイルを示す。黒い菱形を付した線は、商標Ultram(登録商標)のトラマドール50mg即時放出錠剤のin vitro溶解プロファイルを示す。トラマドールは、ヒトに用いられてきた疼痛緩和剤であるが、イヌおよびネコにおいて慢性疼痛および術後疼痛を含む様々な疼痛を治療するために、獣医界に導入されている。イヌ関節炎の症状は、イヌ用のトラマドールを用いて制御および治療できる。トラマドールは通常、即時放出錠剤として処方され、必要に応じて4から6時間毎に投与される。本発明の技術を適用することによって、投与頻度をイヌにおいて1日1回に低減することが可能である。本発明の目的の1つは、イヌを含む動物において、慢性疼痛および術後疼痛を含む様々な疼痛を治療する薬剤を製造するために、トラマドールを含有する本発明の動物用組成物を使用することである。本発明の別の目的は、トラマドールを含有する有効量の本発明の動物用組成物を必要とする動物に投与することによって、イヌを含む動物において、イヌの慢性疼痛および術後疼痛を含む様々な疼痛を治療する方法を提供することである。
【0048】
薬物動態試験
本発明の組成物は、1日1回の経口投与のために、イヌにおいて胃貯留時間を16時間まで延長することが可能である。化合物Aの研究では、イヌにおいて並行群間薬物動態試験を行い、本発明の組成物を即時放出製剤と比較した。各処置群は、給餌後に、即時放出製剤または本発明の錠剤の形態の10.75mg化合物Aマレイン酸塩(8mg遊離塩基当量)単回経口投与量を投与した、5頭の雌のビーグルで構成された。薬物投与後の72時間、指定の時間に血液サンプルを採取した。すべてのサンプル採取において、化合物Aの血漿濃度を求め、そこから薬物動態を評価し、そのデータを図6および7に示す。図6において、白い四角を付した線は、即時放出カプセル剤の血漿薬物濃度−時間プロファイルを示す。黒い四角を付した線は、本発明の実施例1の化合物Aの血漿薬物濃度−時間プロファイルを示す。図6からわかるように、本発明の実施例1は、即時放出剤形(1.4h)と比較して、延長されたTmax(4.8h)を有する。同様に、本発明の実施例1の平均滞留時間(MRT)は、即時放出剤形の平均滞留時間(4.8h)と比較して長い(12h)。さらに、実施例1のCmaxは、即時放出剤形より数倍低く、これは長いMRTによる長い有効性持続時間を提供しながら、より広い安全域を提供する。図7において、白丸を付した線は、即時放出カプセル剤の血漿薬物濃度−時間プロファイルを示す。黒丸を付した線は、本発明の実施例2の化合物Aの血漿薬物濃度−時間プロファイルを示す。図7からわかるように、本発明の実施例2は、即時放出剤形(1.2h)と比較して、延長されたTmax(5.2h)を有する。同様に、本発明の実施例2の平均滞留時間(MRT)は、即時放出剤形の平均滞留時間(4.8h)と比較して長い(11.1h)。さらに、実施例2のCmaxは、即時放出剤形より数倍低く、これは長いMRTによる長い有効性持続時間を提供しながら、より広い安全域を提供する。
【0049】
プレガバリンに関する別のPK(薬物動態)試験では、イヌにおいて並行群間薬物動態試験を行い、本発明の組成物を即時放出製剤と比較した。各処置群は、給餌後に、即時放出製剤または本発明の錠剤の形態の45mgプレガバリン単回経口投与量を投与した、5頭の雄のビーグルで構成された。薬物投与後の72時間、指定の時間に血液サンプルを採取した。すべてのサンプル採取において、プレガバリンの血漿濃度を求め、そこから薬物動態を評価し、そのデータを図8に示す。
【0050】
図8において、黒丸を付した線は、即時放出カプセル剤の血漿薬物濃度−時間プロファイルを示す。白い四角を付した線は、本発明の実施例3のプレガバリンの血漿薬物濃度−時間プロファイルを示す。図8からわかるように、本発明の実施例3は、即時放出剤形(1.3h)と比較して、延長されたTmax(8.0h)を有する。同様に、本発明の実施例3の平均滞留時間(MRT)は、即時放出剤形の平均滞留時間(7.27h)と比較して長い(12.4h)。さらに、実施例3のCmaxは、即時放出剤形より著しく低く、これは長いMRTによる長い有効性持続時間を提供しながら、より広い安全域を提供する。黒い三角を付した線は、本発明の実施例4のプレガバリンの血漿薬物濃度−時間プロファイルを示す。図8からわかるように、本発明の実施例4は、即時放出剤形(1.3h)と比較して、延長されたTmax(4.0h)を有する。同様に、本発明の実施例4の平均滞留時間(MRT)は、即時放出剤形の平均滞留時間(7.27h)と比較して長い(10.8h)。さらに、実施例4のCmaxは、即時放出剤形より相当に低く、これは長いMRTによる長い有効性持続時間を提供しながら、より広い安全域を提供する。
【0051】
アモキシシリンに関する別のPK試験では、イヌにおいて並行群間薬物動態試験を行い、本発明の組成物を商品名Clavamox(登録商標)の即時放出製剤と比較した。各処置群は、給餌後に、即時放出製剤として125mgおよび62.5mgClavamox(登録商標)経口投与量、または本発明の錠剤を用いる300mgアモキシシリン単回経口投与量を投与した、5頭の雄のビーグルで構成された。薬物投与後の72時間、指定の時間に血液サンプルを採取した。すべてのサンプル採取において、アモキシシリンの血漿濃度を求め、そこから薬物動態を評価し、そのデータを図9に示す。
【0052】
図9において、黒い三角を付した線は、即時放出錠剤の血漿薬物濃度−時間プロファイルを示す。白い四角を付した線は、本発明の実施例5のアモキシシリンの血漿薬物濃度−時間プロファイルを示す。図9からわかるように、本発明の実施例5は、即時放出剤形(0.75h)と比較して、延長されたTmax(3.5h)を有する。同様に、本発明の実施例5の平均滞留時間(MRT)は、即時放出剤形の平均滞留時間(2.03h)と比較して長い(4.8h)。さらに、実施例5のCmaxは、即時放出剤形より低く、これは長いMRTによる長い有効性持続時間を提供しながら、同様の曝露を提供する。
【特許請求の範囲】
【請求項1】
(a)動物用の少なくとも1種の生物活性剤、
(b)錠剤の総重量の約5%から約60%の量の、分子量約1000000から約9000000ダルトンを有するポリマーまたは粘度約80000から約120000mPa・sを有するポリマー、および
(c)錠剤の総重量の約10%から約50%の量の少なくとも1種の崩壊剤
を含む、経口送達可能な錠剤の形の制御放出動物用組成物。
【請求項2】
生物活性剤が、錠剤の総重量の約1%から約40%の量である、請求項1に記載の組成物。
【請求項3】
生物活性剤が、錠剤の総重量の約2%から約25%の量である、請求項1に記載の組成物。
【請求項4】
pH範囲約5.5〜9.0を有する1種または複数の腸溶性充填剤または腸溶性ポリマーをさらに含むことができる、請求項1に記載の組成物。
【請求項5】
N−メチル−1−{trans−4−[メチル(7H−ピロロ[2,3−d]ピリミジン−4−イル)アミノ]シクロヘキシル}メタンスルホンアミドである、請求項4に記載の化合物。
【請求項6】
ポリマーが、粘度80000mPa・s以上を有するヒドロキシプロピルメチルセルロースである、請求項1に記載の組成物。
【請求項7】
ポリマーがヒプロメロース2208である、請求項1に記載の組成物。
【請求項8】
ポリマーが、分子量約1000000から約9000000ダルトンを有するポリマーである、請求項1に記載の組成物。
【請求項9】
ポリマーが、分子量約1000000から約4000000ダルトンを有するポリマーである、請求項1に記載の組成物。
【請求項10】
ポリマーがポリエチレンオキシドである、請求項1に記載の組成物。
【請求項11】
ポリマーが約15%から約50%の量である、請求項1に記載の組成物。
【請求項12】
ポリマーが錠剤の約20重量%から約40重量%の量である、請求項1に記載の組成物。
【請求項13】
崩壊剤が、クロスカルメロースナトリウム、カルボキシメチルスターチナトリウム、架橋ポビドン、および2−ヒドロキシプロピルエーテル(低置換度)からなる群から選択される、請求項1に記載の組成物。
【請求項14】
崩壊剤が錠剤の総重量の少なくとも約10%である、請求項1に記載の組成物。
【請求項15】
崩壊剤が約10%から約40%の量である、請求項1に記載の組成物。
【請求項16】
崩壊剤が約10%から約25%の量である、請求項1に記載の組成物。
【請求項17】
獣医学的に許容できる添加剤をさらに含む、請求項1に記載の組成物。
【請求項18】
1日1回の経口投与のために、イヌにおいて胃貯留時間を16時間まで延長することが可能である、請求項1に記載の組成物。
【請求項19】
生物活性剤が、式Iの化合物
【化1】

または許容できるその塩であり、式中、R1は、ヒドロキシで置換されていてもよい−C1〜4アルキルである、請求項1に記載の組成物。
【請求項20】
生物活性剤が、プレガバリン、アモキシシリン、またはトラマドールである、請求項1に記載の組成物。
【請求項21】
イヌにおいて、アレルギー反応、アレルギー性皮膚炎、アトピー性皮膚炎、湿疹、掻痒、および炎症性疾患を治療する薬剤を製造するための請求項1に記載の動物用組成物の使用であって、生物活性剤が式Iの化合物である使用。
【請求項22】
イヌを含む動物において、発作(seizure)、てんかん、または疼痛を治療する薬剤を製造するための請求項1に記載の動物用組成物の使用であって、生物活性剤がプレガバリンである使用。
【請求項23】
イヌを含む動物において、創傷、膿瘍、蜂巣炎、表在性(若年性)または深在性膿皮症などの皮膚および軟部組織感染ならびに歯周感染を治療する薬剤を製造するための請求項1に記載の動物用組成物の使用であって、生物活性剤がアモキシシリンである使用。
【請求項24】
イヌを含む動物において、慢性疼痛および術後疼痛を治療する薬剤を製造するための請求項1に記載の動物用組成物の使用であって、生物活性剤がトラマドールである使用。
【請求項1】
(a)動物用の少なくとも1種の生物活性剤、
(b)錠剤の総重量の約5%から約60%の量の、分子量約1000000から約9000000ダルトンを有するポリマーまたは粘度約80000から約120000mPa・sを有するポリマー、および
(c)錠剤の総重量の約10%から約50%の量の少なくとも1種の崩壊剤
を含む、経口送達可能な錠剤の形の制御放出動物用組成物。
【請求項2】
生物活性剤が、錠剤の総重量の約1%から約40%の量である、請求項1に記載の組成物。
【請求項3】
生物活性剤が、錠剤の総重量の約2%から約25%の量である、請求項1に記載の組成物。
【請求項4】
pH範囲約5.5〜9.0を有する1種または複数の腸溶性充填剤または腸溶性ポリマーをさらに含むことができる、請求項1に記載の組成物。
【請求項5】
N−メチル−1−{trans−4−[メチル(7H−ピロロ[2,3−d]ピリミジン−4−イル)アミノ]シクロヘキシル}メタンスルホンアミドである、請求項4に記載の化合物。
【請求項6】
ポリマーが、粘度80000mPa・s以上を有するヒドロキシプロピルメチルセルロースである、請求項1に記載の組成物。
【請求項7】
ポリマーがヒプロメロース2208である、請求項1に記載の組成物。
【請求項8】
ポリマーが、分子量約1000000から約9000000ダルトンを有するポリマーである、請求項1に記載の組成物。
【請求項9】
ポリマーが、分子量約1000000から約4000000ダルトンを有するポリマーである、請求項1に記載の組成物。
【請求項10】
ポリマーがポリエチレンオキシドである、請求項1に記載の組成物。
【請求項11】
ポリマーが約15%から約50%の量である、請求項1に記載の組成物。
【請求項12】
ポリマーが錠剤の約20重量%から約40重量%の量である、請求項1に記載の組成物。
【請求項13】
崩壊剤が、クロスカルメロースナトリウム、カルボキシメチルスターチナトリウム、架橋ポビドン、および2−ヒドロキシプロピルエーテル(低置換度)からなる群から選択される、請求項1に記載の組成物。
【請求項14】
崩壊剤が錠剤の総重量の少なくとも約10%である、請求項1に記載の組成物。
【請求項15】
崩壊剤が約10%から約40%の量である、請求項1に記載の組成物。
【請求項16】
崩壊剤が約10%から約25%の量である、請求項1に記載の組成物。
【請求項17】
獣医学的に許容できる添加剤をさらに含む、請求項1に記載の組成物。
【請求項18】
1日1回の経口投与のために、イヌにおいて胃貯留時間を16時間まで延長することが可能である、請求項1に記載の組成物。
【請求項19】
生物活性剤が、式Iの化合物
【化1】

または許容できるその塩であり、式中、R1は、ヒドロキシで置換されていてもよい−C1〜4アルキルである、請求項1に記載の組成物。
【請求項20】
生物活性剤が、プレガバリン、アモキシシリン、またはトラマドールである、請求項1に記載の組成物。
【請求項21】
イヌにおいて、アレルギー反応、アレルギー性皮膚炎、アトピー性皮膚炎、湿疹、掻痒、および炎症性疾患を治療する薬剤を製造するための請求項1に記載の動物用組成物の使用であって、生物活性剤が式Iの化合物である使用。
【請求項22】
イヌを含む動物において、発作(seizure)、てんかん、または疼痛を治療する薬剤を製造するための請求項1に記載の動物用組成物の使用であって、生物活性剤がプレガバリンである使用。
【請求項23】
イヌを含む動物において、創傷、膿瘍、蜂巣炎、表在性(若年性)または深在性膿皮症などの皮膚および軟部組織感染ならびに歯周感染を治療する薬剤を製造するための請求項1に記載の動物用組成物の使用であって、生物活性剤がアモキシシリンである使用。
【請求項24】
イヌを含む動物において、慢性疼痛および術後疼痛を治療する薬剤を製造するための請求項1に記載の動物用組成物の使用であって、生物活性剤がトラマドールである使用。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【公開番号】特開2011−173881(P2011−173881A)
【公開日】平成23年9月8日(2011.9.8)
【国際特許分類】
【外国語出願】
【出願番号】特願2011−36219(P2011−36219)
【出願日】平成23年2月22日(2011.2.22)
【出願人】(593141953)ファイザー・インク (302)
【Fターム(参考)】
【公開日】平成23年9月8日(2011.9.8)
【国際特許分類】
【出願番号】特願2011−36219(P2011−36219)
【出願日】平成23年2月22日(2011.2.22)
【出願人】(593141953)ファイザー・インク (302)
【Fターム(参考)】
[ Back to top ]

