動物細胞用発現ベクター
【課題】細胞への遺伝子導入に必要なベクターを、少量の大腸菌の培養で効率良く作製することが可能な動物細胞用ベクターを提供する。
【解決手段】SV40プロモーター、蛋白質発現をする遺伝子組み込み用マルチクローニングサイト及びpolyAシグナルの順に並んでいる特定の遺伝子配列と、ネオマイシンフォスフォトランスフェラーゼ遺伝子を発現するためのプロモーター配列、ネオマイシンフォスフォトランスフェラーゼ遺伝子及びpolyAシグナルの順に並んでいる特定の遺伝子配列と、大腸菌を宿主とするpUC系の複製開始点から構成される特定の遺伝子配列と、を有する動物細胞用発現ベクター。
【解決手段】SV40プロモーター、蛋白質発現をする遺伝子組み込み用マルチクローニングサイト及びpolyAシグナルの順に並んでいる特定の遺伝子配列と、ネオマイシンフォスフォトランスフェラーゼ遺伝子を発現するためのプロモーター配列、ネオマイシンフォスフォトランスフェラーゼ遺伝子及びpolyAシグナルの順に並んでいる特定の遺伝子配列と、大腸菌を宿主とするpUC系の複製開始点から構成される特定の遺伝子配列と、を有する動物細胞用発現ベクター。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、動物細胞を宿主として組換え蛋白質を生産するための動物細胞発現用ベクターに関するものである。
【背景技術】
【0002】
種々の有用な蛋白質を生産する技術は、大腸菌、酵母、動物細胞などを宿主として開発されており、生産された組換え蛋白質は、医薬品、診断用試薬等、多様な分野で使用されている。
【0003】
例えば、インスリンは大腸菌あるいは酵母を発現宿主としてインスリン遺伝子を導入し、それら遺伝子を導入した大腸菌あるいは酵母を培養することにより生産している(例えば特許文献1、特許文献2参照)。エリスロポエチンは、cDNA遺伝子を哺乳動物の細胞に導入し、導入した動物細胞を培養することにより生産している(例えば特許文献3、特許文献4、非特許文献1参照)。G−CSFは、同じく哺乳動物の細胞を発現宿主として遺伝子を導入し、導入した動物細胞を培養することにより生産している(例えば特許文献5参照)。また、組織性プラスミノーゲンアクチベータ(例えば特許文献6参照)、IFN−γ(例えば非特許文献2参照)、IFN−β(例えば非特許文献3参照)等も哺乳動物の細胞を発現宿主として生産している。これらの組換え蛋白質を生産するためには、ベクターに組換え蛋白質の遺伝子を挿入し、該ベクターを宿主である細胞に導入する方法がとられている。
【0004】
また、発現した蛋白質が、正しい立体構造をとることや糖鎖が付加されることで、活性を保持した状態で発現されることから、動物細胞を宿主として組換え蛋白質の生産を行う例が増えてきている。
【0005】
動物細胞を宿主として組換え蛋白質を生産するためには、動物細胞用発現ベクターを用いて、組換え蛋白質の遺伝子を宿主への導入する方法が行われているが、これらの動物細胞用発現ベクターに組換え蛋白質の遺伝子を挿入するための遺伝子組換え操作は、主として大腸菌を宿主として行われている。大腸菌を宿主としてこれらの動物細胞用発現ベクターを作製する調製する場合、宿主に該ベクターを導入後、培養した大腸菌からベクターを抽出することにより行われる。
【0006】
【特許文献1】特許2694840号公報
【特許文献2】特許2511251号公報
【特許文献3】特公平4−35159号公報
【特許文献4】特公平1−44317号公報
【特許文献5】特公平1−44200号公報
【特許文献6】特開昭59−183693号公報
【非特許文献1】Powell JS,et al,“Human erythropoietin gene: high level expression in stably transfected mammalian cells and chromosome localization.”,Proc.Natl.Acad.Sci.USA,83,6465,1986年発行
【非特許文献2】Scahill SJ,et al,“Expression and characterization of the product of a human immune interferon cDNA gene in Chinese hamster ovary cells.”,Proc.Natl.Acad.Sci.USA,80,4654,1983年発行
【非特許文献3】Miyaji H,et al,“Efficient expression of human beta−interferon in Namalwa KJM−1 cells adapted to serum−free medium by a dhfr gene coamplification method.”,Cytrotechnology,4,173,1990年発行
【発明の開示】
【発明が解決しようとする課題】
【0007】
動物細胞を宿主とした組換え蛋白質の生産を行う場合、動物細胞発現用ベクターを大量に調製する必要がある。例えばCOS細胞を宿主として組換え蛋白質を発現させる場合、1回の遺伝子導入に使用するベクターの量は数十マイクログラム必要であり、大量の細胞に遺伝子を導入しようとるすと、数百マイクログラムのベクターが必要である。また、動物細胞で多様な蛋白質を発現させるための遺伝子ライブラリーを作製するためには、蛋白質の遺伝子を組み込んだ発現ベクターを大量に調製する必要がある。
【0008】
これらの蛋白質の遺伝子を組み込んだ発現ベクターの調製は、通常大腸菌を宿主としてとして行われる。大腸菌に発現ベクターを導入し、この発現ベクターが導入された大腸菌を培養し、培養された大腸菌から目的プラスミドを抽出する。その場合、ベクターの保有する複製開始点が低コピー数の大腸菌プラスミドである場合は、これらの遺伝子導入のためのプラスミドを調製するために、該プラスミドを保持した大腸菌を大量に培養する必要があり、費用と多大な労力がかかるという問題点があった。
【0009】
例えば、pSV2neoは哺乳動物細胞を宿主とした発現細胞用のベクターであるが、複製開始点が低コピー数のプラスミドであるため、大腸菌で組換え体を調製する場合に、大腸菌を大量に培養しなくてはならない。
【0010】
本発明の目的は、細胞への遺伝子導入に必要なベクターを、少量の大腸菌の培養で効率良く作製することが可能な動物細胞用ベクターを提供することにある。これにより、少量の大腸菌の培養で効率よく必要なベクターを作製し、目的蛋白質を生産する動物細胞を作製することが可能となる。
【課題を解決するための手段】
【0011】
本発明者らは、少量の大腸菌の培養で効率良く作製することが可能な動物細胞用ベクターを構築した。
【0012】
本発明は、SV40プロモーター(Southern PJ, Berg P.“Transformation of mammalian cells to antibiotic resistance with a bacterial gene under control of the SV40 early region promoter.”,J.Mol.Appli.Genet.,1,327,1982年発行 を参照)、蛋白質発現をするための遺伝子組み込み用マルチクローニングサイト及びpolyAシグナル(ポリアデニレーションシグナル)の順に並んでいる遺伝子配列1と、ネオマイシンフォスフォトランスフェラーゼ遺伝子を発現するためのプロモーター配列、ネオマイシンフォスフォトランスフェラーゼ遺伝子及びpolyAシグナルの順に並んでいる遺伝子配列2と、大腸菌を宿主とするpUC系の複製開始点から構成される遺伝子配列3と、を有する動物細胞用発現ベクターに関するものである。以下、本発明を詳細に説明する。
<遺伝子配列1>
本発明に係る動物細胞用発現ベクターは遺伝子配列1を有しており、SV40プロモーター、蛋白質発現をする遺伝子組み込み用マルチクローニングサイト及びpolyAシグナルの順に並んでいる。
【0013】
ここで、本発現ベクターにおけるSV40プロモーターとは、SV40の初期および後期プロモーターである。
蛋白質発現をするための遺伝子組み込み用マルチクローニングサイトは、目的蛋白質の遺伝子を組み込むための部位であり、ひとつあるいは複数の制限酵素部位から構成される。目的蛋白質の遺伝子を組み込むための制限酵素サイトが一つ以上望ましくは複数入っていれば、どのような配列を使用してもかまわない。構成する制限酵素部位は、本発現ベクター内の他の部位に存在しないものでなくてはならない。
【0014】
polyAシグナルは、ターミネーションシグナルを含んでいれば特に制限はなく、例えばSV40ウイルスゲノム由来のpolyAシグナルやウシ成長ホルモン由来のpolyAシグナルが挙げられる。
<遺伝子配列2>
本発明に係る動物細胞用発現ベクターは遺伝子配列2を有しており、ネオマイシンフォスフォトランスフェラーゼ遺伝子を発現するためのプロモーター配列、ネオマイシンフォスフォトランスフェラーゼ遺伝子及びpolyAシグナルの順に並んでいる。
【0015】
ここで、ネオマイシンフォスフォトランスフェラーゼ遺伝子は、動物細胞を宿主とした形質転換体を作製する場合に抗生物質G418に対する耐性を宿主に与える遺伝子であり、その上流には該ネオマイシンフォスフォトランスフェラーゼ遺伝子を発現誘導するためのプロモーター配列を有する。又該ネオマイシンフォスフォトランスフェラーゼ遺伝子は、大腸菌を宿主とした形質転換体を作製する場合にカナマイシン耐性を与えることができる遺伝子であり、その上流に該カナマイシン耐性遺伝子を発現するためのプロモーターを有する。
【0016】
発現誘導を促すプロモーターは、動物細胞を宿主として遺伝子導入する場合は、動物細胞内で発現誘導を起こすプロモーターであればよく、例えばSV40プロモーターなどが挙げられる。大腸菌を宿主として遺伝子導入する場合は、大腸菌内で発現誘導を起こすプロモーターであればよく、例えばblaプロモーターなどが挙げられる。
【0017】
polyAシグナルは、ターミネーションシグナルを含んでいれば特に制限はなく、例えばSV40ウイルスゲノム由来のpolyAシグナルやウシ成長ホルモン由来のpolyAシグナルが挙げられる。
<遺伝子配列3>
本発明に係る動物細胞用発現ベクターは遺伝子配列3を有しており、大腸菌を宿主とするpUC系の複製開始点から構成されるものである。
【0018】
ここで、大腸菌を宿主とするpUC系の複製開始点(Yanisch−Perron C,et al,“Improved M13 phage cloning vectors and host strains: nucleotide sequences of the M13mp18 and pUC19 vectors.”,Gene,33,103,1985年発行 を参照)は、ColE1系複製開始点であり、大腸菌内でのコピー数が高くプラスミドDNAの収量が多いという特徴を持つ。
【0019】
本発明におけるベクターの遺伝子長は、可能な限り短いほうが良く、この好ましくは遺伝子の長さにして4500塩基以下であることが望ましい。又さらに好ましくは4000塩基以下であることが望ましい。これにより、大腸菌での形質転換効率を上げることが可能となり、多様な蛋白質の遺伝子を組み込んだ発現ベクターライブラリーを調製するのが可能となる。
【発明の効果】
【0020】
本発明は、大腸菌内において高コピーで複製されうる動物細胞用発現ベクターを提供する。そのため、動物細胞に蛋白質を発現させるために該蛋白質の遺伝子を宿主である動物細胞に導入することを目的として、該蛋白質遺伝子を組み込んだ動物細胞用発現ベクターを調製する場合に、少量の培養液を用いた培養で数十マイクログラムの該発現ベクターを得ることができる。これにより、少ない費用と労力で動物細胞用発現ベクターを作製することが可能となる。
【0021】
また、動物細胞で多様な蛋白質を発現させるための遺伝子ライブラリーを作製するためには、蛋白質の遺伝子を組み込んだ発現ベクターを大量に調製する必要があるが、本発明により提供されるベクターを用いて遺伝子ライブラリーを作製することにより、多様な蛋白質の遺伝子を組み込んだ遺伝子ライブラリーを、少ない費用と労力で大量に調製することが可能となる。
【0022】
本発明により作製されたベクターは、哺乳動物の細胞を発現宿主として、有用な蛋白質を生産することに用いることが可能である。有用蛋白質の例としては、インスリン、エリスロポエチン、IL6、IL3などの各種サイトカイン及びそのレセプター、SCFなどの細胞刺激因子、抗体、Fcレセプター等が挙げられる。
【0023】
発現宿主として用いられる哺乳動物細胞は、SV40プロモーターが機能する細胞であればよく、例えばCHO細胞、COS細胞、ミエローマ細胞、Hela細胞などが挙げられる。
【実施例】
【0024】
以下に、発明を更に詳細に説明するために実施例を示すが、本発明はこれら実施例に限定されるものではない。
【0025】
実施例1.SV40プロモーター、蛋白質発現をするための遺伝子組み込み用マルチクローニングサイト、polyAシグナル、pUC系プラスミドの複製開始点を有するプラスミド(pDSP)の作製
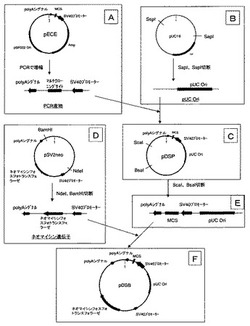
作製のスキームを図1に示す。プラスミドpECE(Ellis L,et al,“Replacement of insulin receptor tyrosine residues 1162 and 1163 compromises insulin−stimulated kinase activity and uptake of 2−deoxyglucose.”,Cell,45,721,1986年発行 を参照)のSV40初期プロモーター及び後期プロモーターからpolyシグナルにかけた部分を、PrimeStarHS DNA Polymerase(タカラバイオ株式会社製)を用いたPCR(Polymerase Chain Reaction)により増幅した(プライマー1及び2。配列表参照。)。これをPCR産物とした(図1−A)。
【0026】
pUC19(Yanisch−Perron C,et al,“Improved M13 phage cloning vectors and host strains: nucleotide sequences of the M13mp18 and pUC19 vectors.”,Gene,33,103,1985年発行 を参照)を制限酵素SspI(タカラバイオ株式会社製)及びSapI(New England BioLabs製)で切断した遺伝子の末端をDNA Blunting Kit(タカラバイオ株式会社製)を用いて平滑化し、続いてアルカリフォスファターゼ(BAP)(タカラバイオ株式会社製)を用いて脱リン酸化した。これをpUC Oriとした(図1−B)。
【0027】
上記のSV40初期プロモーター及び後期プロモーターからpolyシグナルにかけた部分のPCR産物(PCR産物)と、pUC19をSspI及びSapIで切断後、平滑化及び脱リン酸化した遺伝子(pUC Ori)を、DNA Ligation Kit<Mighty Mix>(タカラバイオ株式会社製)を用いて連結した。作製したプラスミドをpDSPとした(図1−C)。
【0028】
実施例2.SV40プロモーター、蛋白質発現をするための遺伝子組み込み用マルチクローニングサイト、polyAシグナル、ネオマイシンフォスフォトランスフェラーゼ遺伝子及びそれを発現誘導するためのプロモーター、pUC系プラスミドの複製開始点を有するプラスミド(pDSB)の作製
プラスミドpSV2neo(Southern PJ, Berg P.,“Transformation of mammalian cells to antibiotic resistance with a bacterial gene under control of the SV40 early region promoter.”,J.Mol.Appli.Genet.,1,327,1982年発行 を参照)を制限酵素NdeI(タカラバイオ株式会社製)及びBamHI(タカラバイオ株式会社製)で切断することにより、ネオマイシンフォスフォトランスフェラーゼ遺伝子及びそれを発現誘導するためのプロモーターを有する遺伝子を調製した。これをネオマイシン遺伝子とした(図1−D)。
【0029】
調製した遺伝子(ネオマイシン遺伝子)を、実施例1で作製したpDSPを制限酵素ScaI(タカラバイオ株式会社製)及びBsaI(New England BioLabs製)で切断した遺伝子(図1−E)に、DNA Ligation Kit<Mighty Mix>(タカラバイオ株式会社製)を用いて挿入した。作製したプラスミドをpDSBとした(図1−F)。
【0030】
実施例3.プラスミドpDSBの調製
実施例2で調製したベクターpDSBのうち3ナノグラム(ng)を用いて、大腸菌のコンピテントセルJM109(タカラバイオ株式会社製)100マイクロリットル(μl)を形質転換した。形質転換はコンピテントセルに添付の資料に従って行った。
【0031】
得られた形質転換体を、2mlの2xYT培地(バクトトリプトン(ベクトンアンドデッキンソン社製)16g/L、イーストエキストラクト(ベクトンアンドデッキンソン社製)10g/L、塩化ナトリウム(関東化学製)5g/L)にて37℃で18時間培養し、該培養液からQIA prep Spin Miniprep Kit(QIAGEN社製)を用いてプラスミドを抽出した。対照として、pBR322由来の複製開始点を持つ動物細胞発現ベクターpSV2neo及びpECEを、同様にコンピテントセルJM109を形質転換し、得られた形質転換体を培養することにより調製した。
【0032】
結果を図2に示した。その結果、プラスミドpDSBは培養液2.5mlから11.5マイクログラム調製できた。一方、プラスミドpSV2neoは培養液2.5mlから1.2マイクログラム調製された。また、プラスミドpECEは培養液2.5mlから1.3マイクログラム調製された。このことは、本発明で提供するベクターは、少量の培養液を用いた培養で数十マイクログラムの該発現ベクターを得ることが可能である動物細胞発現用ベクターであることを示している。これにより、少ない費用と労力で動物細胞用発現ベクターを作製することが可能となる。
【図面の簡単な説明】
【0033】
【図1】プラスミドpDSBの作製スキームを示す。
【図2】図2は、培養液2.5mlから抽出されたプラスミドの量を示したものであり、単位はマイクログラムを示す。
【技術分野】
【0001】
本発明は、動物細胞を宿主として組換え蛋白質を生産するための動物細胞発現用ベクターに関するものである。
【背景技術】
【0002】
種々の有用な蛋白質を生産する技術は、大腸菌、酵母、動物細胞などを宿主として開発されており、生産された組換え蛋白質は、医薬品、診断用試薬等、多様な分野で使用されている。
【0003】
例えば、インスリンは大腸菌あるいは酵母を発現宿主としてインスリン遺伝子を導入し、それら遺伝子を導入した大腸菌あるいは酵母を培養することにより生産している(例えば特許文献1、特許文献2参照)。エリスロポエチンは、cDNA遺伝子を哺乳動物の細胞に導入し、導入した動物細胞を培養することにより生産している(例えば特許文献3、特許文献4、非特許文献1参照)。G−CSFは、同じく哺乳動物の細胞を発現宿主として遺伝子を導入し、導入した動物細胞を培養することにより生産している(例えば特許文献5参照)。また、組織性プラスミノーゲンアクチベータ(例えば特許文献6参照)、IFN−γ(例えば非特許文献2参照)、IFN−β(例えば非特許文献3参照)等も哺乳動物の細胞を発現宿主として生産している。これらの組換え蛋白質を生産するためには、ベクターに組換え蛋白質の遺伝子を挿入し、該ベクターを宿主である細胞に導入する方法がとられている。
【0004】
また、発現した蛋白質が、正しい立体構造をとることや糖鎖が付加されることで、活性を保持した状態で発現されることから、動物細胞を宿主として組換え蛋白質の生産を行う例が増えてきている。
【0005】
動物細胞を宿主として組換え蛋白質を生産するためには、動物細胞用発現ベクターを用いて、組換え蛋白質の遺伝子を宿主への導入する方法が行われているが、これらの動物細胞用発現ベクターに組換え蛋白質の遺伝子を挿入するための遺伝子組換え操作は、主として大腸菌を宿主として行われている。大腸菌を宿主としてこれらの動物細胞用発現ベクターを作製する調製する場合、宿主に該ベクターを導入後、培養した大腸菌からベクターを抽出することにより行われる。
【0006】
【特許文献1】特許2694840号公報
【特許文献2】特許2511251号公報
【特許文献3】特公平4−35159号公報
【特許文献4】特公平1−44317号公報
【特許文献5】特公平1−44200号公報
【特許文献6】特開昭59−183693号公報
【非特許文献1】Powell JS,et al,“Human erythropoietin gene: high level expression in stably transfected mammalian cells and chromosome localization.”,Proc.Natl.Acad.Sci.USA,83,6465,1986年発行
【非特許文献2】Scahill SJ,et al,“Expression and characterization of the product of a human immune interferon cDNA gene in Chinese hamster ovary cells.”,Proc.Natl.Acad.Sci.USA,80,4654,1983年発行
【非特許文献3】Miyaji H,et al,“Efficient expression of human beta−interferon in Namalwa KJM−1 cells adapted to serum−free medium by a dhfr gene coamplification method.”,Cytrotechnology,4,173,1990年発行
【発明の開示】
【発明が解決しようとする課題】
【0007】
動物細胞を宿主とした組換え蛋白質の生産を行う場合、動物細胞発現用ベクターを大量に調製する必要がある。例えばCOS細胞を宿主として組換え蛋白質を発現させる場合、1回の遺伝子導入に使用するベクターの量は数十マイクログラム必要であり、大量の細胞に遺伝子を導入しようとるすと、数百マイクログラムのベクターが必要である。また、動物細胞で多様な蛋白質を発現させるための遺伝子ライブラリーを作製するためには、蛋白質の遺伝子を組み込んだ発現ベクターを大量に調製する必要がある。
【0008】
これらの蛋白質の遺伝子を組み込んだ発現ベクターの調製は、通常大腸菌を宿主としてとして行われる。大腸菌に発現ベクターを導入し、この発現ベクターが導入された大腸菌を培養し、培養された大腸菌から目的プラスミドを抽出する。その場合、ベクターの保有する複製開始点が低コピー数の大腸菌プラスミドである場合は、これらの遺伝子導入のためのプラスミドを調製するために、該プラスミドを保持した大腸菌を大量に培養する必要があり、費用と多大な労力がかかるという問題点があった。
【0009】
例えば、pSV2neoは哺乳動物細胞を宿主とした発現細胞用のベクターであるが、複製開始点が低コピー数のプラスミドであるため、大腸菌で組換え体を調製する場合に、大腸菌を大量に培養しなくてはならない。
【0010】
本発明の目的は、細胞への遺伝子導入に必要なベクターを、少量の大腸菌の培養で効率良く作製することが可能な動物細胞用ベクターを提供することにある。これにより、少量の大腸菌の培養で効率よく必要なベクターを作製し、目的蛋白質を生産する動物細胞を作製することが可能となる。
【課題を解決するための手段】
【0011】
本発明者らは、少量の大腸菌の培養で効率良く作製することが可能な動物細胞用ベクターを構築した。
【0012】
本発明は、SV40プロモーター(Southern PJ, Berg P.“Transformation of mammalian cells to antibiotic resistance with a bacterial gene under control of the SV40 early region promoter.”,J.Mol.Appli.Genet.,1,327,1982年発行 を参照)、蛋白質発現をするための遺伝子組み込み用マルチクローニングサイト及びpolyAシグナル(ポリアデニレーションシグナル)の順に並んでいる遺伝子配列1と、ネオマイシンフォスフォトランスフェラーゼ遺伝子を発現するためのプロモーター配列、ネオマイシンフォスフォトランスフェラーゼ遺伝子及びpolyAシグナルの順に並んでいる遺伝子配列2と、大腸菌を宿主とするpUC系の複製開始点から構成される遺伝子配列3と、を有する動物細胞用発現ベクターに関するものである。以下、本発明を詳細に説明する。
<遺伝子配列1>
本発明に係る動物細胞用発現ベクターは遺伝子配列1を有しており、SV40プロモーター、蛋白質発現をする遺伝子組み込み用マルチクローニングサイト及びpolyAシグナルの順に並んでいる。
【0013】
ここで、本発現ベクターにおけるSV40プロモーターとは、SV40の初期および後期プロモーターである。
蛋白質発現をするための遺伝子組み込み用マルチクローニングサイトは、目的蛋白質の遺伝子を組み込むための部位であり、ひとつあるいは複数の制限酵素部位から構成される。目的蛋白質の遺伝子を組み込むための制限酵素サイトが一つ以上望ましくは複数入っていれば、どのような配列を使用してもかまわない。構成する制限酵素部位は、本発現ベクター内の他の部位に存在しないものでなくてはならない。
【0014】
polyAシグナルは、ターミネーションシグナルを含んでいれば特に制限はなく、例えばSV40ウイルスゲノム由来のpolyAシグナルやウシ成長ホルモン由来のpolyAシグナルが挙げられる。
<遺伝子配列2>
本発明に係る動物細胞用発現ベクターは遺伝子配列2を有しており、ネオマイシンフォスフォトランスフェラーゼ遺伝子を発現するためのプロモーター配列、ネオマイシンフォスフォトランスフェラーゼ遺伝子及びpolyAシグナルの順に並んでいる。
【0015】
ここで、ネオマイシンフォスフォトランスフェラーゼ遺伝子は、動物細胞を宿主とした形質転換体を作製する場合に抗生物質G418に対する耐性を宿主に与える遺伝子であり、その上流には該ネオマイシンフォスフォトランスフェラーゼ遺伝子を発現誘導するためのプロモーター配列を有する。又該ネオマイシンフォスフォトランスフェラーゼ遺伝子は、大腸菌を宿主とした形質転換体を作製する場合にカナマイシン耐性を与えることができる遺伝子であり、その上流に該カナマイシン耐性遺伝子を発現するためのプロモーターを有する。
【0016】
発現誘導を促すプロモーターは、動物細胞を宿主として遺伝子導入する場合は、動物細胞内で発現誘導を起こすプロモーターであればよく、例えばSV40プロモーターなどが挙げられる。大腸菌を宿主として遺伝子導入する場合は、大腸菌内で発現誘導を起こすプロモーターであればよく、例えばblaプロモーターなどが挙げられる。
【0017】
polyAシグナルは、ターミネーションシグナルを含んでいれば特に制限はなく、例えばSV40ウイルスゲノム由来のpolyAシグナルやウシ成長ホルモン由来のpolyAシグナルが挙げられる。
<遺伝子配列3>
本発明に係る動物細胞用発現ベクターは遺伝子配列3を有しており、大腸菌を宿主とするpUC系の複製開始点から構成されるものである。
【0018】
ここで、大腸菌を宿主とするpUC系の複製開始点(Yanisch−Perron C,et al,“Improved M13 phage cloning vectors and host strains: nucleotide sequences of the M13mp18 and pUC19 vectors.”,Gene,33,103,1985年発行 を参照)は、ColE1系複製開始点であり、大腸菌内でのコピー数が高くプラスミドDNAの収量が多いという特徴を持つ。
【0019】
本発明におけるベクターの遺伝子長は、可能な限り短いほうが良く、この好ましくは遺伝子の長さにして4500塩基以下であることが望ましい。又さらに好ましくは4000塩基以下であることが望ましい。これにより、大腸菌での形質転換効率を上げることが可能となり、多様な蛋白質の遺伝子を組み込んだ発現ベクターライブラリーを調製するのが可能となる。
【発明の効果】
【0020】
本発明は、大腸菌内において高コピーで複製されうる動物細胞用発現ベクターを提供する。そのため、動物細胞に蛋白質を発現させるために該蛋白質の遺伝子を宿主である動物細胞に導入することを目的として、該蛋白質遺伝子を組み込んだ動物細胞用発現ベクターを調製する場合に、少量の培養液を用いた培養で数十マイクログラムの該発現ベクターを得ることができる。これにより、少ない費用と労力で動物細胞用発現ベクターを作製することが可能となる。
【0021】
また、動物細胞で多様な蛋白質を発現させるための遺伝子ライブラリーを作製するためには、蛋白質の遺伝子を組み込んだ発現ベクターを大量に調製する必要があるが、本発明により提供されるベクターを用いて遺伝子ライブラリーを作製することにより、多様な蛋白質の遺伝子を組み込んだ遺伝子ライブラリーを、少ない費用と労力で大量に調製することが可能となる。
【0022】
本発明により作製されたベクターは、哺乳動物の細胞を発現宿主として、有用な蛋白質を生産することに用いることが可能である。有用蛋白質の例としては、インスリン、エリスロポエチン、IL6、IL3などの各種サイトカイン及びそのレセプター、SCFなどの細胞刺激因子、抗体、Fcレセプター等が挙げられる。
【0023】
発現宿主として用いられる哺乳動物細胞は、SV40プロモーターが機能する細胞であればよく、例えばCHO細胞、COS細胞、ミエローマ細胞、Hela細胞などが挙げられる。
【実施例】
【0024】
以下に、発明を更に詳細に説明するために実施例を示すが、本発明はこれら実施例に限定されるものではない。
【0025】
実施例1.SV40プロモーター、蛋白質発現をするための遺伝子組み込み用マルチクローニングサイト、polyAシグナル、pUC系プラスミドの複製開始点を有するプラスミド(pDSP)の作製
作製のスキームを図1に示す。プラスミドpECE(Ellis L,et al,“Replacement of insulin receptor tyrosine residues 1162 and 1163 compromises insulin−stimulated kinase activity and uptake of 2−deoxyglucose.”,Cell,45,721,1986年発行 を参照)のSV40初期プロモーター及び後期プロモーターからpolyシグナルにかけた部分を、PrimeStarHS DNA Polymerase(タカラバイオ株式会社製)を用いたPCR(Polymerase Chain Reaction)により増幅した(プライマー1及び2。配列表参照。)。これをPCR産物とした(図1−A)。
【0026】
pUC19(Yanisch−Perron C,et al,“Improved M13 phage cloning vectors and host strains: nucleotide sequences of the M13mp18 and pUC19 vectors.”,Gene,33,103,1985年発行 を参照)を制限酵素SspI(タカラバイオ株式会社製)及びSapI(New England BioLabs製)で切断した遺伝子の末端をDNA Blunting Kit(タカラバイオ株式会社製)を用いて平滑化し、続いてアルカリフォスファターゼ(BAP)(タカラバイオ株式会社製)を用いて脱リン酸化した。これをpUC Oriとした(図1−B)。
【0027】
上記のSV40初期プロモーター及び後期プロモーターからpolyシグナルにかけた部分のPCR産物(PCR産物)と、pUC19をSspI及びSapIで切断後、平滑化及び脱リン酸化した遺伝子(pUC Ori)を、DNA Ligation Kit<Mighty Mix>(タカラバイオ株式会社製)を用いて連結した。作製したプラスミドをpDSPとした(図1−C)。
【0028】
実施例2.SV40プロモーター、蛋白質発現をするための遺伝子組み込み用マルチクローニングサイト、polyAシグナル、ネオマイシンフォスフォトランスフェラーゼ遺伝子及びそれを発現誘導するためのプロモーター、pUC系プラスミドの複製開始点を有するプラスミド(pDSB)の作製
プラスミドpSV2neo(Southern PJ, Berg P.,“Transformation of mammalian cells to antibiotic resistance with a bacterial gene under control of the SV40 early region promoter.”,J.Mol.Appli.Genet.,1,327,1982年発行 を参照)を制限酵素NdeI(タカラバイオ株式会社製)及びBamHI(タカラバイオ株式会社製)で切断することにより、ネオマイシンフォスフォトランスフェラーゼ遺伝子及びそれを発現誘導するためのプロモーターを有する遺伝子を調製した。これをネオマイシン遺伝子とした(図1−D)。
【0029】
調製した遺伝子(ネオマイシン遺伝子)を、実施例1で作製したpDSPを制限酵素ScaI(タカラバイオ株式会社製)及びBsaI(New England BioLabs製)で切断した遺伝子(図1−E)に、DNA Ligation Kit<Mighty Mix>(タカラバイオ株式会社製)を用いて挿入した。作製したプラスミドをpDSBとした(図1−F)。
【0030】
実施例3.プラスミドpDSBの調製
実施例2で調製したベクターpDSBのうち3ナノグラム(ng)を用いて、大腸菌のコンピテントセルJM109(タカラバイオ株式会社製)100マイクロリットル(μl)を形質転換した。形質転換はコンピテントセルに添付の資料に従って行った。
【0031】
得られた形質転換体を、2mlの2xYT培地(バクトトリプトン(ベクトンアンドデッキンソン社製)16g/L、イーストエキストラクト(ベクトンアンドデッキンソン社製)10g/L、塩化ナトリウム(関東化学製)5g/L)にて37℃で18時間培養し、該培養液からQIA prep Spin Miniprep Kit(QIAGEN社製)を用いてプラスミドを抽出した。対照として、pBR322由来の複製開始点を持つ動物細胞発現ベクターpSV2neo及びpECEを、同様にコンピテントセルJM109を形質転換し、得られた形質転換体を培養することにより調製した。
【0032】
結果を図2に示した。その結果、プラスミドpDSBは培養液2.5mlから11.5マイクログラム調製できた。一方、プラスミドpSV2neoは培養液2.5mlから1.2マイクログラム調製された。また、プラスミドpECEは培養液2.5mlから1.3マイクログラム調製された。このことは、本発明で提供するベクターは、少量の培養液を用いた培養で数十マイクログラムの該発現ベクターを得ることが可能である動物細胞発現用ベクターであることを示している。これにより、少ない費用と労力で動物細胞用発現ベクターを作製することが可能となる。
【図面の簡単な説明】
【0033】
【図1】プラスミドpDSBの作製スキームを示す。
【図2】図2は、培養液2.5mlから抽出されたプラスミドの量を示したものであり、単位はマイクログラムを示す。
【特許請求の範囲】
【請求項1】
SV40プロモーター、蛋白質発現をする遺伝子組み込み用マルチクローニングサイト及びpolyAシグナルの順に並んでいる遺伝子配列1と、ネオマイシンフォスフォトランスフェラーゼ遺伝子を発現するためのプロモーター配列、ネオマイシンフォスフォトランスフェラーゼ遺伝子及びpolyAシグナルの順に並んでいる遺伝子配列2と、大腸菌を宿主とするpUC系の複製開始点から構成される遺伝子配列3と、を有する動物細胞用発現ベクター。
【請求項1】
SV40プロモーター、蛋白質発現をする遺伝子組み込み用マルチクローニングサイト及びpolyAシグナルの順に並んでいる遺伝子配列1と、ネオマイシンフォスフォトランスフェラーゼ遺伝子を発現するためのプロモーター配列、ネオマイシンフォスフォトランスフェラーゼ遺伝子及びpolyAシグナルの順に並んでいる遺伝子配列2と、大腸菌を宿主とするpUC系の複製開始点から構成される遺伝子配列3と、を有する動物細胞用発現ベクター。
【図1】


【図2】




【図2】


【公開番号】特開2009−17787(P2009−17787A)
【公開日】平成21年1月29日(2009.1.29)
【国際特許分類】
【出願番号】特願2007−180518(P2007−180518)
【出願日】平成19年7月10日(2007.7.10)
【出願人】(000003300)東ソー株式会社 (1,901)
【Fターム(参考)】
【公開日】平成21年1月29日(2009.1.29)
【国際特許分類】
【出願日】平成19年7月10日(2007.7.10)
【出願人】(000003300)東ソー株式会社 (1,901)
【Fターム(参考)】
[ Back to top ]

