動脈硬化改善・予防効果の評価方法及び評価用キット、並びに、物質のスクリーニング方法
【課題】被検物質が有する動脈硬化の改善効果又は将来の発症リスクの低減効果を評価する方法等を提供する。
【解決手段】動脈硬化を発症している動物又は将来の発症リスクが高い動物に被検物質を摂取させ、該動物の体液中における29種のマーカー物質の少なくとも1つの濃度を基準値と比較し、被検物質が有する動脈硬化の改善効果又は将来の発症リスクの低減効果を評価する。マーカー物質に対する親和性を有する物質を固定化した担体にマーカー物質を捕捉して、体液中のマーカー物質の濃度を算出する構成が推奨される。該評価方法を用いる物質のスクリーニング方法、該評価方法を簡便に行うことができるキットも提供される。
【解決手段】動脈硬化を発症している動物又は将来の発症リスクが高い動物に被検物質を摂取させ、該動物の体液中における29種のマーカー物質の少なくとも1つの濃度を基準値と比較し、被検物質が有する動脈硬化の改善効果又は将来の発症リスクの低減効果を評価する。マーカー物質に対する親和性を有する物質を固定化した担体にマーカー物質を捕捉して、体液中のマーカー物質の濃度を算出する構成が推奨される。該評価方法を用いる物質のスクリーニング方法、該評価方法を簡便に行うことができるキットも提供される。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、動脈硬化改善・予防効果の評価方法及び評価用キット、並びに、物質のスクリーニング方法に関し、さらに詳細には、動脈硬化を発症している動物又は将来の発症リスクが高い動物に被験物質を摂取させ、該動物の体液中におけるマーカー物質の濃度を指標して、被検物質が有する動脈硬化の改善効果又は将来の発症リスクの低減効果を評価する動脈硬化改善・予防効果の評価方法、該評価方法を簡便に行うことができる動脈硬化改善・予防効果の評価用キット、並びに、該評価方法を用いて動脈硬化の改善効果又は将来の発症リスクの低減効果を有する物質をスクリーニングする物質のスクリーニング方法に関する。
【背景技術】
【0002】
近年、食生活の欧米化が進み、それに起因すると考えられる肥満、糖尿病、高脂血症、動脈硬化等の生活習慣病が増加している。これらの発症増加は遺伝的なものではなく、主に環境因子によるものである。例えば、高脂肪食や高カロリー食の摂取による脂質代謝異常が、血中脂質上昇、インスリン抵抗性の発症、脂肪細胞肥大化、インスリン分泌不全等の原因となっている。その結果、糖尿病、肥満、動脈硬化等が高確率で発症し、病態の進展へとつながっている。
【0003】
動脈硬化とは、動脈壁が肥厚して弾力性がなくなる病態の総称である。動脈硬化にはいくつかの種類があるが、アテローム動脈硬化(粥状硬化)と呼ばれる病態が最も多くみられる。特に注記しない場合には、動脈硬化とはアテローム動脈硬化を指すことも多い。アテローム動脈硬化は、動脈内壁に粥状のプラーク(アテローム)が沈着して血流に支障をきたす状態であり、脳、心臓、腎臓、手足などに重篤な損傷をもたらすおそれがある。すなわち、脳梗塞、脳出血、心筋梗塞、狭心症、腎不全、手足の壊死など、生命に直接かかわる症状につながるおそれがある。動脈硬化が起こる原因については、まだ完全には解明されていない部分もあるが、上記のように肥満、糖尿病、高脂血症、高血圧等が発症の危険因子とされている。
【0004】
動脈硬化のような生活習慣病に属する疾病については、予防することの重要性が強調されている。すなわち、生活習慣病は徐々に進行するものが多く、発症初期には自覚症状があまりないことが多い。その結果、発見されたときにはすでに重篤な状態まで進んでいることがあり、予防の重要性が特に高い。このような背景の下、疾病の将来の発症リスクを検出することができるようなバイオマーカー、すなわち「予防マーカー」あるいは「リスクマーカー」と呼ばれるマーカー物質の探索が盛んに行われている。生活習慣病の予防マーカーを用いれば、例えば、当該疾病の将来の発症リスクを判定することが可能となり、事前に生活習慣の是正、食事制限、運動等の適切な処置を行って当該疾病の発症を予防することが可能となる。また、予防マーカーを用いることで、被検物質が当該疾病の発症リスクを低減させるような効果を有するか容易に調べることも可能となり、食品素材の機能性評価やスクリーニングにも有用である。そして、そのような評価・スクリーニング系で選抜された食品素材を含む食品を日常的に摂取することで、生活習慣病を容易に予防することが可能となる。
【0005】
生活習慣病関連では、例えば特許文献1に糖尿病の予防マーカー、特許文献2に高脂血症の予防マーカーについての開示がある。ただし、これらは動脈硬化に特化したバイオマーカーではない。一方、動脈硬化に特化したバイオマーカーを探索する試みもあり、例えば特許文献3には炎症のバイオマーカーであるC反応性タンパク(CRP)が、特許文献4には腫瘍マーカーであるα−フェトプロテイン(AFP)が動脈硬化のバイオマーカーとしても使えるとの記載がある。しかしながら、CRPやAFPについては動脈硬化とは全く異なる臨床的意義(炎症や発がん)が確立しており、動脈硬化のバイオマーカーとしては特異性の面で使いにくい。したがって、動脈硬化の将来の発症リスク診断や、被検物質が有する動脈硬化の改善効果又は将来の発症リスクの低減効果を可能にする新たなマーカー物質を特定することが望まれている。
【0006】
【特許文献1】国際公開第2006/073195号パンフレット
【特許文献2】特開2007−064747号公報
【特許文献3】特表2001−525058号公報
【特許文献4】特開2007−010567号公報
【発明の開示】
【発明が解決しようとする課題】
【0007】
本発明の目的は、動脈硬化の予防マーカーとなり得るマーカー物質を新たに特定し、該マーカー物質を用いて被検物質が有する動脈硬化の改善効果又は将来の発症リスクの低減効果を評価する方法等を提供することにある。
【課題を解決するための手段】
【0008】
上記した課題を解決するための請求項1に記載の発明は、動脈硬化を発症している動物又は将来の発症リスクが高い動物に被検物質を摂取させ、該動物の体液中における下記マーカー物質(M01)〜(M29)の少なくとも1つの濃度を基準値と比較し、被検物質が有する動脈硬化の改善効果又は将来の発症リスクの低減効果を評価することを特徴とする動脈硬化改善・予防効果の評価方法である。
(M01)pH9.0で強陰イオン交換体に結合し、かつ質量分析に供すると質量/電荷比が約3350のイオンピークを生じるタンパク質、
(M02)pH9.0で強陰イオン交換体に結合し、かつ質量分析に供すると質量/電荷比が約4170のイオンピークを生じるタンパク質、
(M03)pH9.0で強陰イオン交換体に結合し、かつ質量分析に供すると質量/電荷比が約4280のイオンピークを生じるタンパク質、
(M04)pH3.0で弱陽イオン交換体に結合し、かつ質量分析に供すると質量/電荷比が約4750のイオンピークを生じるタンパク質、
(M05)pH9.0で強陰イオン交換体に結合し、かつ質量分析に供すると質量/電荷比が約5130のイオンピークを生じるタンパク質、
(M06)pH3.0で弱陽イオン交換体に結合し、かつ質量分析に供すると質量/電荷比が約5200のイオンピークを生じるタンパク質、
(M07)pH3.0で弱陽イオン交換体に結合し、かつ質量分析に供すると質量/電荷比が約6020のイオンピークを生じるタンパク質、
(M08)pH9.0で強陰イオン交換体に結合し、かつ質量分析に供すると質量/電荷比が約6100のイオンピークを生じるタンパク質、
(M09)pH9.0で強陰イオン交換体に結合し、かつ質量分析に供すると質量/電荷比が約6860のイオンピークを生じるタンパク質、
(M10)pH3.0で弱陽イオン交換体に結合し、かつ質量分析に供すると質量/電荷比が約7010のイオンピークを生じるタンパク質、
(M11)pH3.0で弱陽イオン交換体に結合し、かつ質量分析に供すると質量/電荷比が約7100のイオンピークを生じるタンパク質、
(M12)pH3.0で弱陽イオン交換体に結合し、かつ質量分析に供すると質量/電荷比が約7570のイオンピークを生じるタンパク質、
(M13)pH3.0で弱陽イオン交換体に結合し、かつ質量分析に供すると質量/電荷比が約8440のイオンピークを生じるタンパク質、
(M14)pH3.0で弱陽イオン交換体に結合し、かつ質量分析に供すると質量/電荷比が約8530のイオンピークを生じるタンパク質、
(M15)pH3.0で弱陽イオン交換体に結合し、かつ質量分析に供すると質量/電荷比が約8720のイオンピークを生じるタンパク質、
(M16)pH9.0で強陰イオン交換体に結合し、かつ質量分析に供すると質量/電荷比が約8840のイオンピークを生じるタンパク質、
(M17)pH3.0で弱陽イオン交換体に結合し、かつ質量分析に供すると質量/電荷比が約10000のイオンピークを生じるタンパク質、
(M18)pH9.0で強陰イオン交換体に結合し、かつ質量分析に供すると質量/電荷比が約10500のイオンピークを生じるタンパク質、
(M19)pH3.0で弱陽イオン交換体に結合し、かつ質量分析に供すると質量/電荷比が約10700のイオンピークを生じるタンパク質、
(M20)pH9.0で強陰イオン交換体に結合し、かつ質量分析に供すると質量/電荷比が約11700のイオンピークを生じるタンパク質、
(M21)pH9.0で強陰イオン交換体に結合し、かつ質量分析に供すると質量/電荷比が約13700のイオンピークを生じるタンパク質、
(M22)pH9.0で強陰イオン交換体に結合し、かつ質量分析に供すると質量/電荷比が約14000のイオンピークを生じるタンパク質、
(M23)pH9.0で強陰イオン交換体に結合し、かつ質量分析に供すると質量/電荷比が約14200のイオンピークを生じるタンパク質、
(M24)pH9.0で強陰イオン交換体に結合し、かつ質量分析に供すると質量/電荷比が約20400のイオンピークを生じるタンパク質、
(M25)pH9.0で強陰イオン交換体に結合し、かつ質量分析に供すると質量/電荷比が約20900のイオンピークを生じるタンパク質、
(M26)pH3.0で弱陽イオン交換体に結合し、かつ質量分析に供すると質量/電荷比が約21400のイオンピークを生じるタンパク質、
(M27)pH3.0で弱陽イオン交換体に結合し、かつ質量分析に供すると質量/電荷比が約28200のイオンピークを生じるタンパク質、
(M28)pH3.0で弱陽イオン交換体に結合し、かつ質量分析に供すると質量/電荷比が約34400のイオンピークを生じるタンパク質、
(M29)pH9.0で強陰イオン交換体に結合し、かつ質量分析に供すると質量/電荷比が約66000のイオンピークを生じるタンパク質。
【0009】
本発明の動脈硬化改善・予防効果の評価方法は、動脈硬化を発症している動物又は将来の発症リスクが高い動物に被検物質を摂取させ、該動物の体液中における上記(M01)〜(M29)の29種のマーカー物質の少なくとも1つの濃度を基準値と比較し、被検物質が有する動脈硬化の改善効果又は将来の発症リスクの低減効果を評価するものである。上記マーカー物質(M01)〜(M29)は、いずれも動脈硬化の発症直前段階にある動物の体液中で特異的に検出されるタンパク質であり、動脈硬化の予防マーカー・リスクマーカーとして有用なものである。本発明の動脈硬化改善・予防効果の評価方法によれば、被検物質が有する動脈硬化の改善効果又は将来の発症リスクの低減効果を、容易かつ高精度に評価することができる。なお、「動物」には、マウス等の飼育可能な動物の他、ヒトも含むものとする。
【0010】
ここで、各マーカー物質における質量/電荷比(以下、「m/z」と略記することもある。)の「約3350」、「約8440」、「約66000」等の値は、質量分析における測定値の誤差範囲を考慮した値であり、概ね±0.2%の幅を有する。すなわち、約3350は概ね3350±0.2%、約8440は概ね8440±0.2%、約66000は概ね66000±0.2%を表す。他の質量/電荷比についても全く同様に、概ね±0.2%の幅を有する。また、これらのマーカー物質はいずれも主に血液中に存在するタンパク質である。被検物質が動脈硬化の改善効果又は将来の発症リスクの低減効果を有する場合、動物の体液中のマーカー物質(M02)、(M03)、(M08)、(M09)、(M10)、(M16)、(M22)、(M23)、及び(M29)の濃度はより低値を示し、(M01)、(M04)、(M05)、(M06)、(M07)、(M11)、(M12)、(M13)、(M14)、(M15)、(M17)、(M18)、(M19)、(M20)、(M21)、(M24)、(M25)、(M26)、(M27)、及び(M28)の濃度はより高値を示す。
【0011】
請求項2に記載の発明は、下記(a)〜(l)の少なくとも1つを満たすことを特徴とする請求項1に記載の動脈硬化改善・予防効果の評価方法である。
(a)マーカー物質(M06)はアポリポタンパク質A2又はその修飾体である、
(b)マーカー物質(M07)は血清アルブミン又はその修飾体である、
(c)マーカー物質(M09)はアポリポタンパク質C1又はその修飾体である、
(d)マーカー物質(M10)はアポリポタンパク質C1又はその修飾体である、
(e)マーカー物質(M15)はアポリポタンパク質A2又はその修飾体である、
(f)マーカー物質(M16)はアポリポタンパク質C3又はその修飾体である、
(g)マーカー物質(M21)はトランスサイレチン又はその修飾体である、
(h)マーカー物質(M22)はトランスサイレチン又はその修飾体である、
(i)マーカー物質(M23)はトランスサイレチン又はその修飾体である、
(j)マーカー物質(M25)はレチノール結合タンパク質又はその修飾体である、
(k)マーカー物質(M26)はレチノール結合タンパク質又はその修飾体である、
(l)マーカー物質(M27)はアポリポタンパク質A1又はその修飾体である。
【0012】
アポリポタンパク質A2、血清アルブミン、アポリポタンパク質C1、アポリポタンパク質C3、トランスサイレチン、レチノール結合タンパク質、及びアポリポタンパク質A1はいずれも物理化学的性質がよく知られているので、本発明の動脈硬化改善・予防効果の評価方法によればマーカー物質(M06)、(M07)、(M09)、(M10)、(M15)、(M16)、(M21)、(M22)、(M23)、(M25)、(M26)、及び(M27)の解析が容易である。
【0013】
「タンパク質の修飾体」の代表例は、当該タンパク質を構成するアミノ酸残基の少なくとも1つが修飾されたタンパク質である。「修飾」には化合物や官能基の付加(例:リン酸化)のみならず、脱離(例:脱リン酸化)も含まれる。また「タンパク質又はその修飾体」には、当該タンパク質のアイソフォームが含まれる。さらに「タンパク質又はその修飾体」には、当該タンパク質の1次構造において数個のアミノ酸残基が欠失、置換若しくは付加されたような実質的に同一のタンパク質が含まれる。またさらに、「タンパク質又はその修飾体」には、プロテアーゼによる切断を受けた当該タンパク質由来のタンパク質断片が含まれる。なお、複合体タンパク質の場合には「タンパク質又はその修飾体」にはそのサブユニットも含まれるものとする。
【0014】
同様の課題を解決するための請求項3に記載の発明は、動脈硬化を発症している動物又は将来の発症リスクが高い動物に被検物質を摂取させ、該動物の体液中における下記(N1)〜(N7)のいずれかに属する少なくとも1つのマーカー物質の濃度を基準値と比較し、被検物質が有する動脈硬化の改善効果又は将来の発症リスクの低減効果を評価することを特徴とする動脈硬化改善・予防効果の評価方法である。
(N1)アポリポタンパク質A2又はその修飾体、
(N2)血清アルブミン又はその修飾体、
(N3)アポリポタンパク質C1又はその修飾体、
(N4)アポリポタンパク質C3又はその修飾体、
(N5)トランスサイレチン又はその修飾体、
(N6)レチノール結合タンパク質又はその修飾体、
(N7)アポリポタンパク質A1又はその修飾体。
【0015】
本発明の動脈硬化改善・予防効果の評価方法は、動脈硬化を発症している動物又は将来の発症リスクが高い動物に被検物質を摂取させ、該動物の体液中における上記(N1)〜(N7)のいずれかに属する少なくとも1つのマーカー物質の濃度を基準値と比較し、被検物質が有する動脈硬化の改善効果又は将来の発症リスクの低減効果を評価するものである。上記(N1)〜(N7)に属するマーカー物質は、いずれも動脈硬化の発症直前段階にある動物の体液中で特異的に検出されるタンパク質であり、動脈硬化の予防マーカー・リスクマーカーとして有用なものである。本発明の動脈硬化改善・予防効果の評価方法によれば、被検物質が有する動脈硬化の改善効果又は将来の発症リスクの低減効果を、容易かつ高精度に評価することができる。特に、アポリポタンパク質A2、血清アルブミン、アポリポタンパク質C1、アポリポタンパク質C3、トランスサイレチン、レチノール結合タンパク質、及びアポリポタンパク質A1はいずれも物理化学的性質がよく知られているので、解析が容易である。なお本発明においても、「動物」には、マウス等の飼育可能な動物の他、ヒトも含むものとする。(N1)〜(N7)に属するマーカー物質は、いずれも主に血液中に存在する。
【0016】
本発明においても「タンパク質の修飾体」の代表例は、当該タンパク質を構成するアミノ酸残基の少なくとも1つが修飾されたタンパク質であり、「修飾」には化合物や官能基の付加のみならず、脱離も含まれる。また「タンパク質又はその修飾体」には、当該タンパク質のアイソフォーム、当該タンパク質の1次構造において数個のアミノ酸残基が欠失、置換若しくは付加されたような実質的に同一のタンパク質、並びに、プロテアーゼによる切断を受けた当該タンパク質由来のタンパク質断片が含まれる。さらに、複合体タンパク質の場合には「タンパク質又はその修飾体」にはそのサブユニットも含まれるものとする。
【0017】
請求項4に記載の発明は、前記基準値は、動脈硬化を発症している動物又は将来の発症リスクが高い動物に、動脈硬化の改善効果又は将来の発症リスクの低減効果を有さない既知物質を摂取させた際の、該動物の体液中における前記マーカー物質の濃度であることを特徴とする請求項1〜3のいずれか1項に記載の動脈硬化改善・予防効果の評価方法である。
【0018】
かかる構成により、被検物質が有する動脈硬化の改善効果又は将来の発症リスクの低減効果を、より容易かつ高精度に評価することができる。
【0019】
請求項5に記載の発明は、前記動脈硬化を発症している動物又は将来の発症リスクが高い動物は、自然発症モデル動物又は遺伝子操作モデル動物であることを特徴とする請求項1〜4のいずれか1項に記載の動脈硬化改善・予防効果の評価方法である。
【0020】
本発明の動脈硬化改善・予防効果の評価方法では、動脈硬化を発症している動物又は将来の発症リスクが高い動物として、自然発症モデル動物又は遺伝子操作モデル動物を用いる。かかる構成により、動物の飼育が容易となり、被検物質が有する動脈硬化の改善効果又は将来の発症リスクの低減効果を、きわめて容易に評価することができる。なお当該動物の例としては、アポリポタンパク質E遺伝子欠損マウス(以下、「アポE欠損マウス」と略記する。)が挙げられる。アポE欠損マウスは通常の飼育でアテロームを形成し、動脈硬化発症モデル動物の標準として各分野で採用されているものである。
【0021】
請求項6に記載の発明は、前記体液は、血液であることを特徴とする請求項1〜5のいずれか1項に記載の動脈硬化改善・予防効果の評価方法である。
【0022】
かかる構成により、測定試料となる体液を簡単に採取でき、より簡便かつ迅速に、被検物質が有する動脈硬化の改善効果又は将来の発症リスクの低減効果を評価することができる。
【0023】
請求項7に記載の発明は、前記被検物質は、食品素材であることを特徴とする請求項1〜6のいずれか1項に記載の動脈硬化改善・予防効果の評価方法である。
【0024】
かかる構成により、機能性食品の開発を目的として、被検物質が有する動脈硬化の改善効果又は将来の発症リスクの低減効果を評価することができる。
【0025】
請求項8に記載の発明は、前記体液又は体液成分を、前記マーカー物質に対する親和性を有する物質を固定化した担体に接触させて、体液中の前記マーカー物質を担体上に捕捉し、捕捉された前記マーカー物質の量に基づいて体液中の前記マーカー物質の濃度を算出することを特徴とする請求項1〜7のいずれか1項に記載の動脈硬化改善・予防効果の評価方法である。
【0026】
本発明の動脈硬化改善・予防効果の評価方法においては、マーカー物質に対する親和性を有する物質を固定化した担体を使用する。そして、該担体に体液又は体液成分を接触させて、体液又は体液成分に含まれるマーカー物質を、マーカー物質に対する親和性を有する物質を介して担体上に捕捉し、捕捉されたマーカー物質の量に基づいて体液中のマーカー物質の濃度を算出する。本発明の動脈硬化改善・予防効果の評価方法によれば、担体上に捕捉されたマーカー物質を測定対象とするので、測定試料中に含まれる夾雑物質の影響を低減させることができ、より高感度かつ高精度でマーカー物質の濃度を測定することができる。なお、体液成分の例としては、体液が血液である場合の血清又は血漿が挙げられる。
【0027】
請求項9に記載の発明は、前記担体は平面部分を有し、前記マーカー物質に対する親和性を有する物質は、該平面部分の一部に固定化されていることを特徴とする請求項8に記載の動脈硬化改善・予防効果の評価方法である。
【0028】
本発明の動脈硬化改善・予防効果の評価方法では、平面部分を有する担体を用い、マーカー物質に対する親和性を有する物質は該平面部分の一部に固定化されている。かかる構成により、マーカー物質に対する親和性を有する物質を、担体上の複数箇所にスポット的に固定化することができる。その結果、1個の担体で複数の測定試料を同時処理することや、1個の担体で複数のマーカー物質の濃度を同時測定することが可能となり、作業効率がよい。さらに、各スポットの面積を小さくすることにより、微量の測定試料からでもマーカー物質の濃度を測定することができる。なお、平面部分を有する担体の例としては、チップ等の基板が挙げられる。
【0029】
請求項10に記載の発明は、前記マーカー物質に対する親和性を有する物質は、イオン交換体又は抗体であることを特徴とする請求項8又は9に記載の動脈硬化改善・予防効果の評価方法である。
【0030】
本発明の動脈硬化改善・予防効果の評価方法においては、マーカー物質に対する親和性を有する物質としてイオン交換体又は抗体を用い、イオン交換体又は抗体を介して測定試料中のマーカー物質を担体上に捕捉する。当該物質がイオン交換体の場合は各種のものが入手容易であり、マーカー物質を捕捉するための担体を容易に調製することができる。また、当該物質が抗体の場合は、より特異的にマーカー物質を捕捉することができる。捕捉されたマーカー物質の量を測定する方法としては、質量分析、イムノアッセイ(抗体の場合)が挙げられる。
【0031】
請求項11に記載の発明は、請求項1〜10のいずれか1項に記載の動脈硬化改善・予防効果の評価方法によって被検物質を評価し、動脈硬化の改善効果又は将来の発症リスクの低減効果を有する物質をスクリーニングすることを特徴とする物質のスクリーニング方法である。
【0032】
本発明は物質のスクリーニング方法にかかり、動物の体液中における上記(M01)〜(M29)の各マーカー物質および上記(N1)〜(N7)に属する各マーカー物質の少なくとも1つの濃度を基準値と比較し、動脈硬化の改善効果又は将来の発症リスクの低減効果を有する物質をスクリーニングするものである。上記(M01)〜(M29)の各マーカー物質および上記(N1)〜(N7)に属する各マーカー物質は、いずれも動脈硬化の発症直前段階にある動物の体液中で特異的に検出されるタンパク質であり、動脈硬化の予防マーカー・リスクマーカーとして有用なものである。本発明の物質のスクリーニング方法によれば、動脈硬化の改善効果又は将来の発症リスクの低減効果を有する物質を、容易かつ高精度にスクリーニングすることができる。特に、被検物質が食品素材の場合は、動脈硬化の改善効果を有する機能性食品又は将来の発症リスクの低減効果を有する機能性食品の開発に有用な食品素材をスクリーニングすることができる。
【0033】
請求項12に記載の発明は、請求項1〜10のいずれか1項に記載の動脈硬化改善・予防効果の評価方法に用いるためのキットであって、前記マーカー物質に対する親和性を有する物質を固定化した担体を含むことを特徴とする動脈硬化改善・予防効果の評価用キットである。
【0034】
本発明の動脈硬化改善・予防効果の評価用キットは、マーカー物質に対する親和性を有する物質を固定化した担体を含む。かかる構成により、マーカー物質の濃度測定に際して当該担体を別途用意する必要がなく、きわめて簡便にマーカー物質の濃度を測定することができる。
【0035】
請求項13に記載の発明は、前記マーカー物質に対する親和性を有する物質は、イオン交換体であることを特徴とする請求項12に記載の動脈硬化改善・予防効果の評価用キットである。
【0036】
かかる構成により、マーカー物質をより確実に担体上に捕捉することができる。
【0037】
動脈硬化の改善効果又は将来の発症リスクの低減効果を有する物質をスクリーニングするために使用される構成が推奨される(請求項14)。
【発明の効果】
【0038】
本発明の動脈硬化改善・予防効果の評価方法によれば、被検物質が有する動脈硬化の改善効果又は将来の発症リスクの低減効果を、容易かつ高精度に評価することができる。
【0039】
本発明の物質のスクリーニング方法によれば、動脈硬化の改善効果又は将来の発症リスクの低減効果を有する物質を、容易かつ高精度にスクリーニングすることができる。
【0040】
本発明の動脈硬化改善・予防効果の評価用キットによれば、マーカー物質の濃度測定に際して当該担体を別途用意する必要がなく、きわめて簡便にマーカー物質の濃度を測定することができる。
【発明を実施するための最良の形態】
【0041】
以下、本発明を実施するための最良の形態について詳細に説明する。
【0042】
本発明の動脈硬化改善・予防効果の評価方法は2つの様相を含む。1つの様相では、動脈硬化を発症している動物又は将来の発症リスクが高い動物に被検物質を摂取させ、該動物の体液中における下記マーカー物質(M01)〜(M29)の少なくとも1つの濃度を基準値と比較し、被検物質が有する動脈硬化の改善効果又は将来の発症リスクの低減効果を評価する。
(M01)pH9.0で強陰イオン交換体に結合し、かつ質量分析に供すると質量/電荷比が約3350のイオンピークを生じるタンパク質、
(M02)pH9.0で強陰イオン交換体に結合し、かつ質量分析に供すると質量/電荷比が約4170のイオンピークを生じるタンパク質、
(M03)pH9.0で強陰イオン交換体に結合し、かつ質量分析に供すると質量/電荷比が約4280のイオンピークを生じるタンパク質、
(M04)pH3.0で弱陽イオン交換体に結合し、かつ質量分析に供すると質量/電荷比が約4750のイオンピークを生じるタンパク質、
(M05)pH9.0で強陰イオン交換体に結合し、かつ質量分析に供すると質量/電荷比が約5130のイオンピークを生じるタンパク質、
(M06)pH3.0で弱陽イオン交換体に結合し、かつ質量分析に供すると質量/電荷比が約5200のイオンピークを生じるタンパク質、
(M07)pH3.0で弱陽イオン交換体に結合し、かつ質量分析に供すると質量/電荷比が約6020のイオンピークを生じるタンパク質、
(M08)pH9.0で強陰イオン交換体に結合し、かつ質量分析に供すると質量/電荷比が約6100のイオンピークを生じるタンパク質、
(M09)pH9.0で強陰イオン交換体に結合し、かつ質量分析に供すると質量/電荷比が約6860のイオンピークを生じるタンパク質、
(M10)pH3.0で弱陽イオン交換体に結合し、かつ質量分析に供すると質量/電荷比が約7010のイオンピークを生じるタンパク質、
(M11)pH3.0で弱陽イオン交換体に結合し、かつ質量分析に供すると質量/電荷比が約7100のイオンピークを生じるタンパク質、
(M12)pH3.0で弱陽イオン交換体に結合し、かつ質量分析に供すると質量/電荷比が約7570のイオンピークを生じるタンパク質、
(M13)pH3.0で弱陽イオン交換体に結合し、かつ質量分析に供すると質量/電荷比が約8440のイオンピークを生じるタンパク質、
(M14)pH3.0で弱陽イオン交換体に結合し、かつ質量分析に供すると質量/電荷比が約8530のイオンピークを生じるタンパク質、
(M15)pH3.0で弱陽イオン交換体に結合し、かつ質量分析に供すると質量/電荷比が約8720のイオンピークを生じるタンパク質、
(M16)pH9.0で強陰イオン交換体に結合し、かつ質量分析に供すると質量/電荷比が約8840のイオンピークを生じるタンパク質、
(M17)pH3.0で弱陽イオン交換体に結合し、かつ質量分析に供すると質量/電荷比が約10000のイオンピークを生じるタンパク質、
(M18)pH9.0で強陰イオン交換体に結合し、かつ質量分析に供すると質量/電荷比が約10500のイオンピークを生じるタンパク質、
(M19)pH3.0で弱陽イオン交換体に結合し、かつ質量分析に供すると質量/電荷比が約10700のイオンピークを生じるタンパク質、
(M20)pH9.0で強陰イオン交換体に結合し、かつ質量分析に供すると質量/電荷比が約11700のイオンピークを生じるタンパク質、
(M21)pH9.0で強陰イオン交換体に結合し、かつ質量分析に供すると質量/電荷比が約13700のイオンピークを生じるタンパク質、
(M22)pH9.0で強陰イオン交換体に結合し、かつ質量分析に供すると質量/電荷比が約14000のイオンピークを生じるタンパク質、
(M23)pH9.0で強陰イオン交換体に結合し、かつ質量分析に供すると質量/電荷比が約14200のイオンピークを生じるタンパク質、
(M24)pH9.0で強陰イオン交換体に結合し、かつ質量分析に供すると質量/電荷比が約20400のイオンピークを生じるタンパク質、
(M25)pH9.0で強陰イオン交換体に結合し、かつ質量分析に供すると質量/電荷比が約20900のイオンピークを生じるタンパク質、
(M26)pH3.0で弱陽イオン交換体に結合し、かつ質量分析に供すると質量/電荷比が約21400のイオンピークを生じるタンパク質、
(M27)pH3.0で弱陽イオン交換体に結合し、かつ質量分析に供すると質量/電荷比が約28200のイオンピークを生じるタンパク質、
(M28)pH3.0で弱陽イオン交換体に結合し、かつ質量分析に供すると質量/電荷比が約34400のイオンピークを生じるタンパク質、
(M29)pH9.0で強陰イオン交換体に結合し、かつ質量分析に供すると質量/電荷比が約66000のイオンピークを生じるタンパク質。
【0043】
これらのマーカー物質はいずれも主に血液中に存在するタンパク質であり、動脈硬化の発症直前段階にある動物体内で特異的に検出されるものである。なお、(M02)、(M03)、(M08)、(M09)、(M10)、(M16)、(M22)、(M23)、及び(M29)の各マーカー物質(以下、これらのマーカー物質からなるグループを「グループ1」と称することがある。)は、動脈硬化を発症している状態又は動脈硬化の将来の発症リスクが高い状態でより高値を示すものであるので、被検物質が動脈硬化の改善効果又は将来の発症リスクの低減効果を有する場合には、当該被検物質を摂取させた動物においてより低値を示す。一方、(M01)、(M04)、(M05)、(M06)、(M07)、(M11)、(M12)、(M13)、(M14)、(M15)、(M17)、(M18)、(M19)、(M20)、(M21)、(M24)、(M25)、(M26)、(M27)、及び(M28)の各マーカー物質(以下、これらのマーカー物質からなるグループを「グループ2」と称することがある。)は、動脈硬化を発症している状態又は動脈硬化の将来の発症リスクが高い状態でより低値を示すものであるので、被検物質が動脈硬化の改善効果又は将来の発症リスクの低減効果を有する場合には、当該被検物質を摂取させた動物においてより高値を示す。
【0044】
N末端アミノ酸解析の結果と質量/電荷比の情報から、マーカー物質(M06)はアポリポタンパク質A2の断片と同定され得る。また、ある条件のペプチドマッピングによれば、マーカー物質(M07)は血清アルブミン、マーカー物質(M09)と(M10)はアポリポタンパク質C1、マーカー物質(M15)はアポリポタンパク質A2、マーカー物質(M16)はアポリポタンパク質C3、マーカー物質(M21)〜(M23)はトランスサイレチン、マーカー物質(M25)と(M26)はレチノール結合タンパク質、(M27)はアポリポタンパク質A1と同定される。すなわち、ある実施形態では、下記(a)〜(l)の少なくとも1つを満たす。
(a)マーカー物質(M06)はアポリポタンパク質A2又はその修飾体である、
(b)マーカー物質(M07)は血清アルブミン又はその修飾体である、
(c)マーカー物質(M09)はアポリポタンパク質C1又はその修飾体である、
(d)マーカー物質(M10)はアポリポタンパク質C1又はその修飾体である、
(e)マーカー物質(M15)はアポリポタンパク質A2又はその修飾体である、
(f)マーカー物質(M16)はアポリポタンパク質C3又はその修飾体である、
(g)マーカー物質(M21)はトランスサイレチン又はその修飾体である、
(h)マーカー物質(M22)はトランスサイレチン又はその修飾体である、
(i)マーカー物質(M23)はトランスサイレチン又はその修飾体である、
(j)マーカー物質(M25)はレチノール結合タンパク質又はその修飾体である、
(k)マーカー物質(M26)はレチノール結合タンパク質又はその修飾体である、
(l)マーカー物質(M27)はアポリポタンパク質A1又はその修飾体である。
【0045】
本発明の動脈硬化改善・予防効果の評価方法の他の様相では、動脈硬化を発症している動物又は将来の発症リスクが高い動物に被検物質を摂取させ、該動物の体液中における下記(N1)〜(N7)のいずれかに属する少なくとも1つのマーカー物質の濃度を基準値と比較し、被検物質が有する動脈硬化の改善効果又は将来の発症リスクの低減効果を評価する。
(N1)アポリポタンパク質A2又はその修飾体、
(N2)血清アルブミン又はその修飾体、
(N3)アポリポタンパク質C1又はその修飾体、
(N4)アポリポタンパク質C3又はその修飾体、
(N5)トランスサイレチン又はその修飾体、
(N6)レチノール結合タンパク質又はその修飾体、
(N7)アポリポタンパク質A1又はその修飾体。
【0046】
タンパク質の修飾の例としては、N末端αアミノ基やリジンεアミノ基のメチル化、アセチル化、アデニリル化、ミリスチル化等;セリン・スレオニン・アスパラギンへの糖又は糖鎖の付加;セリン・スレオニン・チロシン・アルギニン・ヒスチジンのリン酸化;システインのシステイニル化、ホモシステイニル化、スルホニル化等;グルタミン酸のγ−カルボキシル化;N末端グルタミン酸のピログルタミン酸への変換、等が挙げられる。また、これらの修飾の脱離(脱メチル化、糖又は糖鎖の脱離、脱リン酸化等)も「修飾」に含まれる。
【0047】
「タンパク質又はその修飾体」には、当該タンパク質のアイソフォームが含まれる。アイソフォームとしては、前記した各種の修飾の他、選択的スプライシングによって生じたタンパク質が挙げられる。さらに、「タンパク質又はその修飾体」には、当該タンパク質の1次構造において数個のアミノ酸残基が欠失、置換若しくは付加されたような実質的に同一のタンパク質が含まれる。またさらに、「タンパク質又はその修飾体」には、プロテアーゼによる切断を受けた当該タンパク質由来のタンパク質断片が含まれる。例えば、当該タンパク質由来と認められうる長さのタンパク質断片、例えば20個以上のアミノ酸残基からなるタンパク質断片、分子量が2千以上のタンパク質断片、等が挙げられる。また、複合体タンパク質の場合には「タンパク質又はその修飾体」にはそのサブユニットも含まれるものとする。
【0048】
例えば、血清アルブミン(配列番号6)のアミノ酸番号554(Ala)から565(Ala)の部分に相当するタンパク質断片(配列番号8)は「血清アルブミンの修飾体」に含まれる。
【0049】
例えば、シグナル配列が切断された後のアポリポタンパク質C1(配列番号14)のN末端アミノ酸配列は「Ala−Pro」から始まるが、これら2つのアミノ酸は切断され得ることが報告されている(Oleg Chertov et al., Proteomics, Vol. 4, No. 4, 2004)。このようなN末端の2アミノ酸が欠損したアポリポタンパク質C1の断片(配列番号15)は「アポリポタンパク質C1の修飾体」に含まれる。
【0050】
トランスサイレチン(配列番号30)については、その唯一のCys残基が修飾を受けた種々の修飾トランスサイレチンが見出されている(Amareth Lim et al., J. Biol. Chem., vol. 258, No. 50, 2003)。例えば、トランスサイレチンのCys残基にスルホン基が付加した「S−スルホン化トランスサイレチン」や、グルタチオンが付加した「グルタチオン化トランスサイレチン」は、「トランスサイレチンの修飾体」に含まれる。
【0051】
レチノール結合タンパク質(配列番号38)については、その一部のアミノ酸残基が欠損した数種類のタンパク質断片が血清中に見出されている。これらのタンパク質断片は「レチノール結合タンパク質の修飾体」に含まれる。
【0052】
本発明の動脈硬化改善・予防効果の評価方法では、(M01)〜(M29)の各マーカー物質並びに(N1)〜(N7)に属する各マーカー物質の1つだけを用いてもよいし、複数を組み合わせて用いてもよい。複数を用いる場合の組み合わせ方については特に限定はないが、例えば、グループ1から選択したマーカー物質(1つ又は複数)とグループ2から選択したマーカー物質(1つ又は複数)とを組み合わせることができる。
【0053】
本発明の動脈硬化改善・予防効果の評価方法の好ましい実施形態では、上記基準値として、動脈硬化を発症している動物又は将来の発症リスクが高い動物に、動脈硬化の改善効果又は将来の発症リスクの低減効果を有さない既知物質を摂取させた際の、該動物の体液中における前記マーカー物質の濃度を用いる。すなわち、動脈硬化を発症している動物又は将来の発症リスクが高い動物に、動脈硬化の改善効果又は将来の発症リスクの低減効果を有さない既知物質を摂取させた場合、その体液中の上記マーカー物質の濃度は「異常値」となる。そして、被検物質を摂取させた上記動物における値(測定値)と当該基準値(異常値)とを比較し、測定値が基準値と有意に差がありかつ正常側である場合(正常側に維持された場合)に、当該被検物質が動脈硬化の改善効果又は将来の発症リスクの低減効果を有すると評価することができる。具体的には、グループ1に属するマーカー物質を指標とする場合は、測定値が当該基準値に比べて有意に低いときに、一方、グループ2に属するマーカー物質を指標とする場合は、測定値が基準値に比べて有意に高いときに、当該被検物質が動脈硬化の改善効果又は将来の発症リスクの低減効果を有すると評価することができる。
【0054】
さらに、基準値は複数あってもよい。例えば、上記の異常値に加え、動脈硬化を発症していない動物又は動脈硬化の発症リスクが低い動物における値(正常値。陰性対照。)を基準値に加えることができる。具体的には、(1)動脈硬化を発症していない動物又は動脈硬化の発症リスクが低い動物に、普通食又は被検物質を摂取させる群(正常値を示す群)、(2)動脈硬化を発症している動物又は動脈硬化の発症リスクが高い動物に、動脈硬化の改善効果又は将来の発症リスクの低減効果を有さない既知物質を摂取させる群(異常値を示す群)、及び、(3)動脈硬化を発症している動物又は動脈硬化の発症リスクが高い動物に被検物質を摂取させる群、の計3群を設定し、動物を飼育する。そして、各動物の体液中の上記マーカー物質を測定し、各測定値を比較する。このとき、(1)と(2)とで有意差があり、(3)と(2)とで有意差があり、かつ(3)が(2)に比べて正常側((1)に近い側)である場合(正常側に維持された場合)に、当該被検物質が動脈硬化の改善効果又は将来の発症リスクの低減効果を有すると評価することができる。
【0055】
さらに、基準値として、(4)動脈硬化を発症している動物又は将来の発症リスクが高い動物に、動脈硬化の改善効果又は将来の発症リスクの低減効果を有する既知物質を摂取させる群、の動物における値(陽性対照)を加えることもできる。具体的には、上記(1)〜(3)に加えて、上記(4)の群を設定し、動物を飼育する。このとき、(1)と(2)とで有意差があり、(3)と(2)とで有意差があり、かつ(3)が(2)に比べて正常側((1)及び(4)に近い側)である場合に、当該被検物質が動脈硬化の改善効果又は将来の発症リスクの低減効果を有すると評価することができる。すなわち、このような被検物質は、(4)で採用した上記既知物質と同様の挙動を示し、同様の作用を有する物質といえる。「動脈硬化の改善効果又は将来の発症リスクの低減効果を有する既知物質」の例としては、アゼルニジピン等の降圧剤(カルシウム拮抗薬)が挙げられる。
【0056】
「動脈硬化を発症している動物又は将来の発症リスクが高い動物」における動物の種類には特に限定はなく、例えば、マウス、ラット、ウサギ、ブタ等を採用することができる。また、「動脈硬化を発症している動物又は将来の発症リスクが高い動物」としては、動脈硬化の自然発症モデル動物、あるいはトランスジェニックやジーンターゲッティングによる遺伝子操作モデル動物が好ましく用いられる。当該動物の具体例としては、アポE欠損マウスが挙げられる。アポE欠損マウスは通常飼育で動脈硬化を発症するので、飼育実験を容易に行うことができ、特に好適である。
【0057】
なお、アポE欠損マウスを通常飼育するといずれ動脈硬化を発症するが、その発症は飼育20週目ごろから検出可能となることが分かっている(例えば、Arteriosclerosis, Thrombosis, and Vascular Biology; 2004; 24; 1006-1014)。よって、飼育20週目以前、例えば飼育14週目のアポE欠損マウスは、動脈硬化の発症直前段階にあるといえる。本発明の動脈硬化改善・予防効果の評価方法で用いるマーカー物質(M01)〜(M29)及び(N1)〜(N7)のいずれかに属するマーカー物質は、飼育14週目のアポE欠損マウスの体液中に存在し、動脈硬化の発症直前段階にないマウス(例えば、正常マウス)と比較してその体液中の濃度に有意差を示す。したがって、本発明においてアポE欠損マウスを用いる場合には、例えば、飼育14週目ごろの体液を測定試料として各マーカー物質の濃度を測定すればよい。
【0058】
一方、高コレステロール食を摂取するとアテローム形成するような動脈硬化自然発症モデル動物を用いることもできる。この場合には、例えば、被検物質とコレステロールとを同時摂取させることにより、被検物質が有する動脈硬化の改善効果又は将来の発症リスクの低減効果を評価することができる。さらに、動物としてヒトを採用することもできる。この場合には、臨床試験の結果によって物質を評価することになる。
【0059】
本発明の動脈硬化改善・予防効果の評価方法において使用する動物の体液としては、血液が好ましく用いられる。特に、血液から調製した血清又は血漿(体液成分)を測定試料とすることが好ましい。血清又は血漿は遠心分離等の公知の方法で血液から調製することができる。
【0060】
本発明の動脈硬化改善・予防効果の評価方法における被検物質としては、食品素材、医薬原体などが挙げられる。特に、食品素材を評価対象とする場合は、機能性食品の開発に役立てることができる。
【0061】
本発明の動脈硬化改善・予防効果の評価方法において、マーカー物質の濃度を測定する方法は、そのマーカー物質の濃度を特異的に測定できる方法であれば、タンパク質の定量に一般に用いられている方法をそのまま用いることができる。例えば、各種のイムノアッセイ、質量分析(MS)、クロマトグラフィー、電気泳動等を用いることができる。
【0062】
イムノアッセイによれば、夾雑物質の多い試料のままでも正確にマーカー物質の濃度を測定することができる。イムノアッセイの例としては、抗原抗体結合物を直接的又は間接的に測定する沈降反応、凝集反応、溶血反応などの古典的な方法や、標識法と組み合わせて検出感度を高めたエンザイムイムノアッセイ(EIA)、ラジオイムノアッセイ(RIA)、蛍光イムノアッセイ(FIA)等の方法が挙げられる。なお、これらのイムノアッセイに用いるマーカー物質に特異的な抗体は、モノクローナルでもよいし、ポリクローナルでもよい。
【0063】
質量分析によれば、各マーカー物質由来のイオンピークを特定し、そのイオンピーク強度をもって各マーカー物質の量(濃度)を測定することができる。質量分析によってマーカー物質の濃度を測定する場合のイオン化の方法としては、マトリクス支援レーザーイオン化(matrix-assisted laser desorption/ionization、MALDI)、エレクトロスプレーイオン化(electrospray ionization、ESI)のいずれも適用可能であるが、多価イオンの生成が少ないMALDIが好ましい。特に、飛行時間質量分析計(time-of-flight mass spectrometer、TOF)と組み合わせたMALDI−TOF−MSによれば、より正確にマーカー物質由来のイオンピークを特定することができる。
【0064】
電気泳動によりマーカー物質の濃度を測定する場合は、例えば、検査材料をSDS−ポリアクリルアミドゲル電気泳動(SDS−PAGE)に供して目的のマーカー物質を分離し、適宜の色素や蛍光物質でゲルを染色し、目的のマーカー物質に相当するバンドの濃さや蛍光強度を測定すればよい。SDS−PAGEだけではマーカー物質の分離が不十分な場合は、等電点電気泳動(IEF)と組み合わせた2次元電気泳動を用いることもできる。さらに、ゲルから直接検出するのではなく、ウエスタンブロッティングを行って膜上のマーカー物質の量を測定することもできる。
【0065】
クロマトグラフィーによってマーカー物質の濃度を測定する場合は、例えば、液体高速クロマトグラフィー(HPLC)による方法を用いることができる。すなわち、試料をHPLCに供して目的のマーカー物質を分離し、そのクロマトグラムのピーク面積を測定することにより試料中のマーカー物質の濃度を測定することができる。
【0066】
好ましい実施形態では、マーカー物質を担体上に捕捉し、その捕捉されたマーカー物質を測定対象とする。すなわち、マーカー物質に対する親和性を有する物質を担体に固定化し、その親和性を有する物質を介してマーカー物質を担体上に捕捉する。そして、捕捉された前記マーカー物質の量に基づいて体液中の前記マーカー物質の濃度を算出する。本実施形態によれば、試料中に含まれる夾雑物質の影響を低減させることができ、より高感度かつ高精度でマーカー物質の濃度を測定することができる。本実施形態において用いることができる担体の例としては、ビーズ、金属、ガラス、樹脂等のような一般的なものの他、基板のような、平面部分を有する担体を用いることができる。基板を用いる場合は、その平面部分の一部にマーカー物質に対する親和性を有する物質を固定化することが好ましい。例としては、基板としてチップを用い、その表面の複数箇所にスポット的にマーカー物質に親和性を有する物質を固定化した担体が挙げられる。なお「親和性」の例としては、イオン結合、金属キレート体とタンパク質中のヒスチジン残基等とのアフィニティ、抗原と抗体、酵素と基質、若しくはホルモンとレセプターのようなバイオアフィニティ、及び、疎水性相互作用のような化学的な相互作用、が挙げられる。
【0067】
イオン結合によってマーカー物質を担体に捕捉する場合は、イオン交換体を担体に固定化する。この場合、イオン交換体には陽イオン交換体、陰イオン交換体のいずれも用いることができ、さらに、強陽イオン交換体、弱陽イオン交換体、強陰イオン交換体、弱陰イオン交換体のいずれも用いることができるが、強陰イオン交換体と弱陽イオン交換体が好ましく用いられる。強陰イオン交換体の例としては、4級アンモニウム(トリメチルアミノメチル)(QA)、4級アミノエチル(ジエチル,モノ・2−ヒドロキシブチルアミノエチル)(QAE)、4級アンモニウム(トリメチルアンモニウム)(QMA)等の強陰イオン交換基を有するものが挙げられる。また、弱陽イオン交換体の例としては、カルボキシメチル(CM)等の弱陽イオン交換基を有するものが挙げられる。また、強陽イオン交換体の例としては、スルホプロピル(SP)等の強陽イオン交換基を有するものが挙げられる。さらに、弱陰イオン交換体の例としては、ジメチルアミノエチル(DE)、ジエチルアミノエチル(DEAE)等の弱陰イオン交換基を有するものが挙げられる。
【0068】
金属キレート体を介してマーカー物質を捕捉する場合は、例えば、Cu2+、Zn2+、Ni2+、Co2+、Al3+、Fe3+、Ga3+等の金属キレート体を固定化した担体を用いることができる。
【0069】
抗体によってマーカー物質を担体に捕捉する場合は、マーカー物質に特異的な抗体を担体に固定化すればよい。
【0070】
疎水性相互作用によってマーカー物質を担体に捕捉する場合は、担体に疎水基をもつ物質を固定化する。疎水基の例としては、C4〜C20のアルキル基、フェニル基等が挙げられる。
【0071】
本実施形態においてマーカー物質の測定方法にイムノアッセイを用いる場合は、抗体を固定化した担体を用いることが好ましい。このようにすれば、担体に固定化された抗体を1次抗体としたイムノアッセイの系を簡単に構築することができる。例えば、マーカー物質に特異的でエピトープの異なる2種類の抗体を用意し、一方を1次抗体として担体に固定化し、他方を2次抗体として酵素標識し、サンドイッチEIAの系を構築することができる。その他、結合阻止法や競合法によるイムノアッセイの系も構築可能である。さらに、担体として基板を用いる場合は、抗体チップによるイムノアッセイが可能である。抗体チップによれば、複数のマーカー物質の濃度を同時に測定でき、迅速な測定が可能である。
【0072】
一方、本実施形態において質量分析を用いる場合は、例えば、抗体の他、イオン交換体、金属キレート体又は疎水基を固定化した担体を用いることができる。なお、これらの物質による結合は抗原と抗体等のバイオアフィニティほどの特異性がないので、これらの物質を固定化した担体を用いる場合はマーカー物質以外の物質も担体上に捕捉されうるが、質量分析によれば分子量を反映した質量分析計スペクトルによって定量するので、問題はない。特に、担体として基板を用い、表面エンハンス型レーザー脱離イオン化(surface-enhanced laser desorption/ionization)−飛行時間質量分析(time-of-flight mass spectrometry)(以下、「SELDI−TOF−MS」と称する)を行うことにより、マーカー物質の濃度をより正確に測定することができる。使用できる基板の種類としては、陽イオン交換基板、陰イオン交換基板、順相基板、逆相基板、金属イオン基板、抗体基板等を用いることができるが、陽イオン交換基板、特に弱陽イオン交換基板と、陰イオン交換基板、特に強陰イオン交換基板が好ましく用いられる。
【0073】
本発明の物質のスクリーニング方法は、本発明の動脈硬化改善・予防効果の評価方法によって被検物質を評価し、動脈硬化の改善効果又は将来の発症リスクの低減効果を有する物質をスクリーニングするものである。本発明の物質のスクリーニング方法においても、上記した本発明の動脈硬化改善・予防効果の評価方法の実施形態と全く同様の実施形態をとることができる。
【0074】
本発明の動脈硬化改善・予防効果の評価方法を簡便に行なうために、必要な試薬類をまとめて評価用キットを構築することができる。当該評価用キットとしては、例えば、マーカー物質に対する親和性を有する物質を固定化した担体を含むものが挙げられる。特に、担体として、CM等の弱陽イオン交換体、あるいはQAやQAE等の強陰イオン交換体を固定化した基板を含めた評価用キットによれば、SELDI−TOF−MS等を簡便に行なうことができる。本キット中には他の試薬類、例えば、標準物質、前処理用の各種緩衝液等を含めてもよい。なお本キットは、動脈硬化の改善効果又は将来の発症リスクの低減効果を有する物質をスクリーニングするためのキットとしても使用できる。本発明のキットの構成例を以下に挙げる。
【0075】
〔キットの構成例〕
(1)弱陽イオン交換基板:1枚
(2)強陰イオン交換基板:1枚
(3)基板洗浄用バッファーA(pH3.0):適量
(4)基板洗浄用バッファーB(pH9.0):適量
(5)各マーカー物質の標準品:各適量
【0076】
以下に、実施例をもって本発明をさらに具体的に説明するが、本発明はこれらの実施例に限定されるものではない。
【実施例1】
【0077】
1.動脈硬化発症モデル動物を使った動物実験
動脈硬化発症モデル動物としてアポE欠損マウス(The Jackson Laboratory社)、正常動物としてC57BL/6J系統マウス(日本チャールス・リバー社。以下、単に「正常マウス」と略記する。)を採用した。また、与える飼料としてCE−2(日本クレア社。以下、単に「通常飼料」と略記する。)と、アゼルニジピンを0.006%(3mg/kg体重に相当)含有するCE−2(以下、単に「アゼルニジピン含有飼料」と略記する。)を採用した。アゼルニジピンとしては、カルブロック(登録商標、三共株式会社製)を採用した。
【0078】
マウスの種類と与える飼料の組み合わせが異なる以下の4つの群を設定し、飼育を開始した。各群の個体数は5匹以上とした。
第1群:正常マウスを通常飼料で飼育
第2群:アポE欠損マウスを通常飼料で飼育
第3群:アポE欠損マウスをアゼルニジピン含有飼料で飼育
第4群:正常マウスをアゼルニジピン含有飼料で飼育
すなわち、第1群は動脈硬化を発症しない群、第2群は動脈硬化を発症する群、第3群は動脈硬化の発症が抑制される群、に相当する。第4群はアゼルニジピンの作用検証用の群である。
【0079】
アポE欠損マウスにおいて動脈硬化が発症し始める飼育期間である14週目に各群のマウスから血漿を採取し、体液試料とした。これにより、動脈硬化の発症直前段階の体液試料が得られた。
【0080】
2.プロテインチップによる解析とイオンピークの選抜
採取した各体液試料20μLに、変性バッファー(9M 尿素、2% CHAPS、50mM Tris−HCl(pH9.0))30μLを加えて前処理を行い、タンパク質を変性させた。次に、前処理した各体液試料を強陰イオン交換樹脂カラム(Q−Sepharose、GEヘルスケア社)にアプライした。次いで、pH9.0の緩衝液(50mM Tris−HCl(pH9.0)、0.1%(w/v)1−o−N−オクチル−β−D−グルコピラノシド(以下、「OGP」と称する。))、pH5.0の緩衝液(100mM 酢酸ナトリウム(pH5.0)、0.1%(w/v)OGP)、pH3.0の緩衝液(50mM クエン酸ナトリウム(pH3.0)、0.1%(w/v)OGP)、及び有機溶媒(0.1%トリフルオロ酢酸、50.0%アセトニトリルからなる混合液)各200μLで順に溶出させ、画分1(pH9.0で溶出、素通り)、画分2(pH5.0で溶出)、画分3(pH3.0で溶出)、画分4(有機溶媒で溶出)の4つの粗分画画分を得た。
【0081】
得られた各画分10μLをpH3.0のプロテインチップ結合バッファー(50mM クエン酸ナトリウム)で10倍希釈した後、弱陽イオン交換チップCM10(バイオラッド社)に添加した。同様に、得られた各画分10μLをpH9.0のプロテインチップ結合バッファー(50mM Tris−HCl(pH9.0))で10倍希釈した後、強陰イオン交換チップQ10(バイオラッド社)に添加した。各チップを各結合バッファーで3回洗浄した後に脱イオン水で1回洗浄し、乾燥させた。次に、エネルギー吸収分子であるシナピン酸(SPA−H、SPA−L)又はα−シアノ−4−ヒドロキシケイ皮酸(CHCA)を添加し、プロテインチップリーダーModel PBS IIc(バイオラッド社)を用いて、SELDI−TOF−MSを行なった。なお、測定分子量範囲(m/z)は、3000〜200000の範囲で行なった。また、測定は2連で行い、m/zの平均値を算出した。データ解析は、Protein Chip Software、CiphergenExpress Data Manager、及びBiomarker Patterns Software(いずれもバイオラッド社)を用いて行なった。具体的には、ベースライン補正、分子量校正、スペクトルの正規化処理を行なった後、シングルマーカー解析及び数本のマーカーを組み合わせたマルチフロー解析を行なった。その結果、粗分画画分の種類、プロテインチップの種類、チップの洗浄条件等の組み合わせによって多数のピークが検出された。各ピークについて、p値(Mann−Whitney検定法)、ROC面積、及びイオンピーク強度を算出し、さらに、以下の(1)〜(4)の条件を指標として29個の候補ピークを選抜した。
【0082】
(1)候補ピーク探索(基本)
第1群と第2群との間でイオン強度に有意差がある(p<0.05)。
(2)アゼルニジピン効果検証
第2群と第3群との間でイオン強度に有意差があり(p<0.05)、かつ第3群の値の方が第2群の値よりも第1群の値に近い(第3群の値が第1群側に復帰している)。
(3)増減パターン解析
第2群のみが高値または低値を示し、第1群、第3群および第4群の間ではあまり差がない。なお、第3群と第4群との間に差があっても、第4群の値の方が第3群の値よりも第2群から離れている場合には本条件を満たすものとして取り扱う。
【0083】
3.マーカー物質(M01)の特定
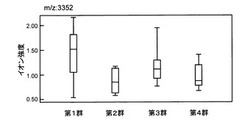
画分4(有機溶媒)を強陰イオン交換チップQ10に接触させ、pH9.0のプロテインチップ結合バッファーで洗浄してSELDI−TOF−MS(EAM:SPA−L)を行なった場合に、質量/電荷比が3352(平均値)のイオンピークが検出された。増減パターン解析の結果、本ピークは第1群、第3群および第4群で高値を示し、第2群で低値を示した。図1に、各群に分けて本ピークのピーク強度をプロットした場合の箱髭図を示す。図中、髭の上端と下端はそれぞれ最大値と最小値、箱の上辺と下辺はそれぞれ第3四分位(75パーセンタイル)と第1四分位(25パーセンタイル)、箱の中の線は中央値である(図2以降も同じ)。その結果、本ピークのROC面積(第1群vs第2群)は0.820、p値(第1群vs第2群)は0.0233、p値(第2群vs第3群)は0.0343であった。
【0084】
以上より、SELDI−TOF−MSに供すると質量/電荷比が約3350のピークを生じるタンパク質(マーカー物質(M01))が、動脈硬化を発症しているマウス、又は動脈硬化の将来の発症リスクが高いマウスに特異的な物質であり、動脈硬化のマーカーとなり得ることがわかった。これにより、被検物質を摂取させた動脈硬化を発症している動物又は将来の発症リスクが高い動物の体液中におけるマーカー物質(M01)の濃度を指標として、被検物質が有する動脈硬化の改善効果又は将来の発症リスクの低減効果の評価、並びに、そのような物質のスクリーニングが行なえることが示された。例えば、所望の被検物質を使用して同様の動物実験を行なって体液試料を調製し、同様の手順でSELDI−TOF−MSを行なった場合に、質量/電荷比が約3350のピークを生じるタンパク質の濃度が正常値に維持されたとき、該被検物質は、動脈硬化の改善効果、又は将来の発症リスクの低減効果を有すると評価することができる。
【0085】
4.マーカー物質(M02)の特定
画分4(有機溶媒)を強陰イオン交換チップQ10に接触させ、pH9.0のプロテインチップ結合バッファーで洗浄してSELDI−TOF−MS(EAM:SPA−L)を行なった場合に、質量/電荷比が4174(平均値)のイオンピークが検出された。増減パターン解析の結果、本ピークは第1群、第3群および第4群で低値を示し、第2群で高値を示した。図2に、各群に分けて本ピークのピーク強度をプロットした場合の箱髭図を示す。その結果、本ピークのROC面積(第1群vs第2群)は0.980、p値(第1群vs第2群)は0.0002、p値(第2群vs第3群)は0.0413であった。
【0086】
以上より、SELDI−TOF−MSに供すると質量/電荷比が約4170のピークを生じるタンパク質(マーカー物質(M02))が、動脈硬化を発症しているマウス、又は動脈硬化の将来の発症リスクが高いマウスに特異的な物質であり、動脈硬化のマーカーとなり得ることがわかった。これにより、被検物質を摂取させた動脈硬化を発症している動物又は将来の発症リスクが高い動物の体液中におけるマーカー物質(M02)の濃度を指標として、被検物質が有する動脈硬化の改善効果又は将来の発症リスクの低減効果の評価、並びに、そのような物質のスクリーニングが行なえることが示された。例えば、所望の被検物質を使用して同様の動物実験を行なって体液試料を調製し、同様の手順でSELDI−TOF−MSを行なった場合に、質量/電荷比が約4170のピークを生じるタンパク質の濃度が正常値に維持されたとき、該被検物質は、動脈硬化の改善効果、又は将来の発症リスクの低減効果を有すると評価することができる。
【0087】
5.マーカー物質(M03)の特定
画分3(pH3.0)を強陰イオン交換チップQ10に接触させ、pH9.0のプロテインチップ結合バッファーで洗浄してSELDI−TOF−MS(EAM:SPA−L)を行なった場合に、質量/電荷比が4281(平均値)のイオンピークが検出された。増減パターン解析の結果、本ピークは第1群、第3群および第4群で低値を示し、第2群で高値を示した。図3に、各群に分けて本ピークのピーク強度をプロットした場合の箱髭図を示す。その結果、本ピークのROC面積(第1群vs第2群)は0.740、p値(第1群vs第2群)は0.0233、p値(第2群vs第3群)は0.0009であった。
【0088】
以上より、SELDI−TOF−MSに供すると質量/電荷比が約4280のピークを生じるタンパク質(マーカー物質(M03))が、動脈硬化を発症しているマウス、又は動脈硬化の将来の発症リスクが高いマウスに特異的な物質であり、動脈硬化のマーカーとなり得ることがわかった。これにより、被検物質を摂取させた動脈硬化を発症している動物又は将来の発症リスクが高い動物の体液中におけるマーカー物質(M03)の濃度を指標として、被検物質が有する動脈硬化の改善効果又は将来の発症リスクの低減効果の評価、並びに、そのような物質のスクリーニングが行なえることが示された。例えば、所望の被検物質を使用して同様の動物実験を行なって体液試料を調製し、同様の手順でSELDI−TOF−MSを行なった場合に、質量/電荷比が約4280のピークを生じるタンパク質の濃度が正常値に維持されたとき、該被検物質は、動脈硬化の改善効果、又は将来の発症リスクの低減効果を有すると評価することができる。
【0089】
6.マーカー物質(M04)の特定
画分3(pH3.0)を弱陽イオン交換チップCM10に接触させ、pH3.0のプロテインチップ結合バッファーで洗浄してSELDI−TOF−MS(EAM:CHCA)を行なった場合に、質量/電荷比が4754(平均値)のイオンピークが検出された。増減パターン解析の結果、本ピークは第1群、第3群および第4群で高値を示し、第2群で低値を示した。図4に、各群に分けて本ピークのピーク強度をプロットした場合の箱髭図を示す。その結果、本ピークのROC面積(第1群vs第2群)は0.860、p値(第1群vs第2群)は0.0126、p値(第2群vs第3群)は0.0494であった。
【0090】
以上より、SELDI−TOF−MSに供すると質量/電荷比が約4750のピークを生じるタンパク質(マーカー物質(M04))が、動脈硬化を発症しているマウス、又は動脈硬化の将来の発症リスクが高いマウスに特異的な物質であり、動脈硬化のマーカーとなり得ることがわかった。これにより、被検物質を摂取させた動脈硬化を発症している動物又は将来の発症リスクが高い動物の体液中におけるマーカー物質(M04)の濃度を指標として、被検物質が有する動脈硬化の改善効果又は将来の発症リスクの低減効果の評価、並びに、そのような物質のスクリーニングが行なえることが示された。例えば、所望の被検物質を使用して同様の動物実験を行なって体液試料を調製し、同様の手順でSELDI−TOF−MSを行なった場合に、質量/電荷比が約4750のピークを生じるタンパク質の濃度が正常値に維持されたとき、該被検物質は、動脈硬化の改善効果、又は将来の発症リスクの低減効果を有すると評価することができる。
【0091】
7.マーカー物質(M05)の特定
画分4(有機溶媒)を強陰イオン交換チップQ10に接触させ、pH9.0のプロテインチップ結合バッファーで洗浄してSELDI−TOF−MS(EAM:SPA−L)を行なった場合に、質量/電荷比が5126(平均値)のイオンピークが検出された。増減パターン解析の結果、本ピークは第1群、第3群および第4群で高値を示し、第2群で低値を示した。図5に、各群に分けて本ピークのピーク強度をプロットした場合の箱髭図を示す。その結果、本ピークのROC面積(第1群vs第2群)は0.820、p値(第1群vs第2群)は0.0126、p値(第2群vs第3群)は0.0233であった。
【0092】
以上より、SELDI−TOF−MSに供すると質量/電荷比が約5130のピークを生じるタンパク質(マーカー物質(M05))が、動脈硬化を発症しているマウス、又は動脈硬化の将来の発症リスクが高いマウスに特異的な物質であり、動脈硬化のマーカーとなり得ることがわかった。これにより、被検物質を摂取させた動脈硬化を発症している動物又は将来の発症リスクが高い動物の体液中におけるマーカー物質(M05)の濃度を指標として、被検物質が有する動脈硬化の改善効果又は将来の発症リスクの低減効果の評価、並びに、そのような物質のスクリーニングが行なえることが示された。例えば、所望の被検物質を使用して同様の動物実験を行なって体液試料を調製し、同様の手順でSELDI−TOF−MSを行なった場合に、質量/電荷比が約5130のピークを生じるタンパク質の濃度が正常値に維持されたとき、該被検物質は、動脈硬化の改善効果、又は将来の発症リスクの低減効果を有すると評価することができる。
【0093】
8.マーカー物質(M06)の特定
画分3(pH3.0)を弱陽イオン交換チップCM10に接触させ、pH3.0のプロテインチップ結合バッファーで洗浄してSELDI−TOF−MS(EAM:SPA−L)を行なった場合に、質量/電荷比が5203(平均値)のイオンピークが検出された。増減パターン解析の結果、本ピークは第1群、第3群および第4群で高値を示し、第2群で低値を示した。図6に、各群に分けて本ピークのピーク強度をプロットした場合の箱髭図を示す。その結果、本ピークのROC面積(第1群vs第2群)は0.980、p値(第1群vs第2群)は0.0002、p値(第2群vs第3群)は0.0082であった。
【0094】
以上より、SELDI−TOF−MSに供すると質量/電荷比が約5200のピークを生じるタンパク質(マーカー物質(M06))が、動脈硬化を発症しているマウス、又は動脈硬化の将来の発症リスクが高いマウスに特異的な物質であり、動脈硬化のマーカーとなり得ることがわかった。これにより、被検物質を摂取させた動脈硬化を発症している動物又は将来の発症リスクが高い動物の体液中におけるマーカー物質(M06)の濃度を指標として、被検物質が有する動脈硬化の改善効果又は将来の発症リスクの低減効果の評価、並びに、そのような物質のスクリーニングが行なえることが示された。例えば、所望の被検物質を使用して同様の動物実験を行なって体液試料を調製し、同様の手順でSELDI−TOF−MSを行なった場合に、質量/電荷比が約5200のピークを生じるタンパク質の濃度が正常値に維持されたとき、該被検物質は、動脈硬化の改善効果、又は将来の発症リスクの低減効果を有すると評価することができる。
【0095】
9.マーカー物質(M07)の特定
画分3(pH3.0)を弱陽イオン交換チップCM10に接触させ、pH3.0のプロテインチップ結合バッファーで洗浄してSELDI−TOF−MS(EAM:SPA−L)を行なった場合に、質量/電荷比が6023(平均値)のイオンピークが検出された。増減パターン解析の結果、本ピークは第1群、第3群および第4群で高値を示し、第2群で低値を示した。図7に、各群に分けて本ピークのピーク強度をプロットした場合の箱髭図を示す。その結果、本ピークのROC面積(第1群vs第2群)は0.780、p値(第1群vs第2群)は0.0082、p値(第2群vs第3群)は0.0343であった。
【0096】
以上より、SELDI−TOF−MSに供すると質量/電荷比が約6020のピークを生じるタンパク質(マーカー物質(M07))が、動脈硬化を発症しているマウス、又は動脈硬化の将来の発症リスクが高いマウスに特異的な物質であり、動脈硬化のマーカーとなり得ることがわかった。これにより、被検物質を摂取させた動脈硬化を発症している動物又は将来の発症リスクが高い動物の体液中におけるマーカー物質(M07)の濃度を指標として、被検物質が有する動脈硬化の改善効果又は将来の発症リスクの低減効果の評価、並びに、そのような物質のスクリーニングが行なえることが示された。例えば、所望の被検物質を使用して同様の動物実験を行なって体液試料を調製し、同様の手順でSELDI−TOF−MSを行なった場合に、質量/電荷比が約6020のピークを生じるタンパク質の濃度が正常値に維持されたとき、該被検物質は、動脈硬化の改善効果、又は将来の発症リスクの低減効果を有すると評価することができる。
【0097】
10.マーカー物質(M08)の特定
画分2(pH5.0)を強陰イオン交換チップQ10に接触させ、pH9.0のプロテインチップ結合バッファーで洗浄してSELDI−TOF−MS(EAM:SPA−L)を行なった場合に、質量/電荷比が6103(平均値)のイオンピークが検出された。増減パターン解析の結果、本ピークは第1群、第3群および第4群で低値を示し、第2群で高値を示した。図8に、各群に分けて本ピークのピーク強度をプロットした場合の箱髭図を示す。その結果、本ピークのROC面積(第1群vs第2群)は0.740、p値(第1群vs第2群)は0.0284、p値(第2群vs第3群)は0.0041であった。
【0098】
以上より、SELDI−TOF−MSに供すると質量/電荷比が約6100のピークを生じるタンパク質(マーカー物質(M08))が、動脈硬化を発症しているマウス、又は動脈硬化の将来の発症リスクが高いマウスに特異的な物質であり、動脈硬化のマーカーとなり得ることがわかった。これにより、被検物質を摂取させた動脈硬化を発症している動物又は将来の発症リスクが高い動物の体液中におけるマーカー物質(M08)の濃度を指標として、被検物質が有する動脈硬化の改善効果又は将来の発症リスクの低減効果の評価、並びに、そのような物質のスクリーニングが行なえることが示された。例えば、所望の被検物質を使用して同様の動物実験を行なって体液試料を調製し、同様の手順でSELDI−TOF−MSを行なった場合に、質量/電荷比が約6100のピークを生じるタンパク質の濃度が正常値に維持されたとき、該被検物質は、動脈硬化の改善効果、又は将来の発症リスクの低減効果を有すると評価することができる。
【0099】
11.マーカー物質(M09)の特定
画分1(pH9.0)を強陰イオン交換チップQ10に接触させ、pH9.0のプロテインチップ結合バッファーで洗浄してSELDI−TOF−MS(EAM:CHCA)を行なった場合に、質量/電荷比が6861(平均値)のイオンピークが検出された。増減パターン解析の結果、本ピークは第1群、第3群および第4群で低値を示し、第2群で高値を示した。図9に、各群に分けて本ピークのピーク強度をプロットした場合の箱髭図を示す。その結果、本ピークのROC面積(第1群vs第2群)は0.980、p値(第1群vs第2群)は0.0003、p値(第2群vs第3群)は0.0494であった。
【0100】
以上より、SELDI−TOF−MSに供すると質量/電荷比が約6860のピークを生じるタンパク質(マーカー物質(M09))が、動脈硬化を発症しているマウス、又は動脈硬化の将来の発症リスクが高いマウスに特異的な物質であり、動脈硬化のマーカーとなり得ることがわかった。これにより、被検物質を摂取させた動脈硬化を発症している動物又は将来の発症リスクが高い動物の体液中におけるマーカー物質(M09)の濃度を指標として、被検物質が有する動脈硬化の改善効果又は将来の発症リスクの低減効果の評価、並びに、そのような物質のスクリーニングが行なえることが示された。例えば、所望の被検物質を使用して同様の動物実験を行なって体液試料を調製し、同様の手順でSELDI−TOF−MSを行なった場合に、質量/電荷比が約6860のピークを生じるタンパク質の濃度が正常値に維持されたとき、該被検物質は、動脈硬化の改善効果、又は将来の発症リスクの低減効果を有すると評価することができる。
【0101】
12.マーカー物質(M10)の特定
画分4(有機溶媒)を弱陽イオン交換チップCM10に接触させ、pH3.0のプロテインチップ結合バッファーで洗浄してSELDI−TOF−MS(EAM:SPA−L)を行なった場合に、質量/電荷比が7005(平均値)のイオンピークが検出された。増減パターン解析の結果、本ピークは第1群、第3群および第4群で低値を示し、第2群で高値を示した。図10に、各群に分けて本ピークのピーク強度をプロットした場合の箱髭図を示す。その結果、本ピークのROC面積(第1群vs第2群)は0.980、p値(第1群vs第2群)は0.0002、p値(第2群vs第3群)は0.0041であった。
【0102】
以上より、SELDI−TOF−MSに供すると質量/電荷比が約7010のピークを生じるタンパク質(マーカー物質(M10))が、動脈硬化を発症しているマウス、又は動脈硬化の将来の発症リスクが高いマウスに特異的な物質であり、動脈硬化のマーカーとなり得ることがわかった。これにより、被検物質を摂取させた動脈硬化を発症している動物又は将来の発症リスクが高い動物の体液中におけるマーカー物質(M10)の濃度を指標として、被検物質が有する動脈硬化の改善効果又は将来の発症リスクの低減効果の評価、並びに、そのような物質のスクリーニングが行なえることが示された。例えば、所望の被検物質を使用して同様の動物実験を行なって体液試料を調製し、同様の手順でSELDI−TOF−MSを行なった場合に、質量/電荷比が約7010のピークを生じるタンパク質の濃度が正常値に維持されたとき、該被検物質は、動脈硬化の改善効果、又は将来の発症リスクの低減効果を有すると評価することができる。
【0103】
13.マーカー物質(M11)の特定
画分3(pH3.0)を弱陽イオン交換チップCM10に接触させ、pH3.0のプロテインチップ結合バッファーで洗浄してSELDI−TOF−MS(EAM:SPA−L)を行なった場合に、質量/電荷比が7095(平均値)のイオンピークが検出された。増減パターン解析の結果、本ピークは第1群、第3群および第4群で高値を示し、第2群で低値を示した。図11に、各群に分けて本ピークのピーク強度をプロットした場合の箱髭図を示す。その結果、本ピークのROC面積(第1群vs第2群)は0.980、p値(第1群vs第2群)は0.0002、p値(第2群vs第3群)は0.0002であった。
【0104】
以上より、SELDI−TOF−MSに供すると質量/電荷比が約7100のピークを生じるタンパク質(マーカー物質(M11))が、動脈硬化を発症しているマウス、又は動脈硬化の将来の発症リスクが高いマウスに特異的な物質であり、動脈硬化のマーカーとなり得ることがわかった。これにより、被検物質を摂取させた動脈硬化を発症している動物又は将来の発症リスクが高い動物の体液中におけるマーカー物質(M11)の濃度を指標として、被検物質が有する動脈硬化の改善効果又は将来の発症リスクの低減効果の評価、並びに、そのような物質のスクリーニングが行なえることが示された。例えば、所望の被検物質を使用して同様の動物実験を行なって体液試料を調製し、同様の手順でSELDI−TOF−MSを行なった場合に、質量/電荷比が約7100のピークを生じるタンパク質の濃度が正常値に維持されたとき、該被検物質は、動脈硬化の改善効果、又は将来の発症リスクの低減効果を有すると評価することができる。
【0105】
14.マーカー物質(M12)の特定
画分4(有機溶剤)を弱陽イオン交換チップCM10に接触させ、pH3.0のプロテインチップ結合バッファーで洗浄してSELDI−TOF−MS(EAM:SPA−L)を行なった場合に、質量/電荷比が7572(平均値)のイオンピークが検出された。増減パターン解析の結果、本ピークは第1群、第3群および第4群で高値を示し、第2群で低値を示した。図12に、各群に分けて本ピークのピーク強度をプロットした場合の箱髭図を示す。その結果、本ピークのROC面積(第1群vs第2群)は0.940、p値(第1群vs第2群)は0.0007、p値(第2群vs第3群)は0.0082であった。
【0106】
以上より、SELDI−TOF−MSに供すると質量/電荷比が約7570のピークを生じるタンパク質(マーカー物質(M12))が、動脈硬化を発症しているマウス、又は動脈硬化の将来の発症リスクが高いマウスに特異的な物質であり、動脈硬化のマーカーとなり得ることがわかった。これにより、被検物質を摂取させた動脈硬化を発症している動物又は将来の発症リスクが高い動物の体液中におけるマーカー物質(M12)の濃度を指標として、被検物質が有する動脈硬化の改善効果又は将来の発症リスクの低減効果の評価、並びに、そのような物質のスクリーニングが行なえることが示された。例えば、所望の被検物質を使用して同様の動物実験を行なって体液試料を調製し、同様の手順でSELDI−TOF−MSを行なった場合に、質量/電荷比が約7570のピークを生じるタンパク質の濃度が正常値に維持されたとき、該被検物質は、動脈硬化の改善効果、又は将来の発症リスクの低減効果を有すると評価することができる。
【0107】
15.マーカー物質(M13)の特定
画分3(pH3.0)を弱陽イオン交換チップCM10に接触させ、pH3.0のプロテインチップ結合バッファーで洗浄してSELDI−TOF−MS(EAM:SPA−L)を行なった場合に、質量/電荷比が8439(平均値)のイオンピークが検出された。増減パターン解析の結果、本ピークは第1群、第3群および第4群で高値を示し、第2群で低値を示した。図13に、各群に分けて本ピークのピーク強度をプロットした場合の箱髭図を示す。その結果、本ピークのROC面積(第1群vs第2群)は0.740、p値(第1群vs第2群)は0.0494、p値(第2群vs第3群)は0.0019であった。
【0108】
以上より、SELDI−TOF−MSに供すると質量/電荷比が約8440のピークを生じるタンパク質(マーカー物質(M13))が、動脈硬化を発症しているマウス、又は動脈硬化の将来の発症リスクが高いマウスに特異的な物質であり、動脈硬化のマーカーとなり得ることがわかった。これにより、被検物質を摂取させた動脈硬化を発症している動物又は将来の発症リスクが高い動物の体液中におけるマーカー物質(M13)の濃度を指標として、被検物質が有する動脈硬化の改善効果又は将来の発症リスクの低減効果の評価、並びに、そのような物質のスクリーニングが行なえることが示された。例えば、所望の被検物質を使用して同様の動物実験を行なって体液試料を調製し、同様の手順でSELDI−TOF−MSを行なった場合に、質量/電荷比が約8440のピークを生じるタンパク質の濃度が正常値に維持されたとき、該被検物質は、動脈硬化の改善効果、又は将来の発症リスクの低減効果を有すると評価することができる。
【0109】
16.マーカー物質(M14)の特定
画分1(pH9.0)を弱陽イオン交換チップCM10に接触させ、pH3.0のプロテインチップ結合バッファーで洗浄してSELDI−TOF−MS(EAM:CHCA)を行なった場合に、質量/電荷比が8534(平均値)のイオンピークが検出された。増減パターン解析の結果、本ピークは第1群、第3群および第4群で高値を示し、第2群で低値を示した。図14に、各群に分けて本ピークのピーク強度をプロットした場合の箱髭図を示す。その結果、本ピークのROC面積(第1群vs第2群)は0.980、p値(第1群vs第2群)は0.0002、p値(第2群vs第3群)は0.0343であった。
【0110】
以上より、SELDI−TOF−MSに供すると質量/電荷比が約8530のピークを生じるタンパク質(マーカー物質(M14))が、動脈硬化を発症しているマウス、又は動脈硬化の将来の発症リスクが高いマウスに特異的な物質であり、動脈硬化のマーカーとなり得ることがわかった。これにより、被検物質を摂取させた動脈硬化を発症している動物又は将来の発症リスクが高い動物の体液中におけるマーカー物質(M14)の濃度を指標として、被検物質が有する動脈硬化の改善効果又は将来の発症リスクの低減効果の評価、並びに、そのような物質のスクリーニングが行なえることが示された。例えば、所望の被検物質を使用して同様の動物実験を行なって体液試料を調製し、同様の手順でSELDI−TOF−MSを行なった場合に、質量/電荷比が約8530のピークを生じるタンパク質の濃度が正常値に維持されたとき、該被検物質は、動脈硬化の改善効果、又は将来の発症リスクの低減効果を有すると評価することができる。
【0111】
17.マーカー物質(M15)の特定
画分1(pH9.0)を弱陽イオン交換チップCM10に接触させ、pH3.0のプロテインチップ結合バッファーで洗浄してSELDI−TOF−MS(EAM:SPA−L)を行なった場合に、質量/電荷比が8723(平均値)のイオンピークが検出された。増減パターン解析の結果、本ピークは第1群、第3群および第4群で高値を示し、第2群で低値を示した。図15に、各群に分けて本ピークのピーク強度をプロットした場合の箱髭図を示す。その結果、本ピークのROC面積(第1群vs第2群)は0.900、p値(第1群vs第2群)は0.0007、p値(第2群vs第3群)は0.0284であった。
【0112】
以上より、SELDI−TOF−MSに供すると質量/電荷比が約8720のピークを生じるタンパク質(マーカー物質(M15))が、動脈硬化を発症しているマウス、又は動脈硬化の将来の発症リスクが高いマウスに特異的な物質であり、動脈硬化のマーカーとなり得ることがわかった。これにより、被検物質を摂取させた動脈硬化を発症している動物又は将来の発症リスクが高い動物の体液中におけるマーカー物質(M15)の濃度を指標として、被検物質が有する動脈硬化の改善効果又は将来の発症リスクの低減効果の評価、並びに、そのような物質のスクリーニングが行なえることが示された。例えば、所望の被検物質を使用して同様の動物実験を行なって体液試料を調製し、同様の手順でSELDI−TOF−MSを行なった場合に、質量/電荷比が約8720のピークを生じるタンパク質の濃度が正常値に維持されたとき、該被検物質は、動脈硬化の改善効果、又は将来の発症リスクの低減効果を有すると評価することができる。
【0113】
18.マーカー物質(M16)の特定
画分4(有機溶媒)を強陰イオン交換チップQ10に接触させ、pH9.0のプロテインチップ結合バッファーで洗浄してSELDI−TOF−MS(EAM:SPA−L)を行なった場合に、質量/電荷比が8840(平均値)のイオンピークが検出された。増減パターン解析の結果、本ピークは第1群、第3群および第4群で低値を示し、第2群で高値を示した。図16に、各群に分けて本ピークのピーク強度をプロットした場合の箱髭図を示す。その結果、本ピークのROC面積(第1群vs第2群)は0.980、p値(第1群vs第2群)は0.0002、p値(第2群vs第3群)は0.0413であった。
【0114】
以上より、SELDI−TOF−MSに供すると質量/電荷比が約8840のピークを生じるタンパク質(マーカー物質(M16))が、動脈硬化を発症しているマウス、又は動脈硬化の将来の発症リスクが高いマウスに特異的な物質であり、動脈硬化のマーカーとなり得ることがわかった。これにより、被検物質を摂取させた動脈硬化を発症している動物又は将来の発症リスクが高い動物の体液中におけるマーカー物質(M16)の濃度を指標として、被検物質が有する動脈硬化の改善効果又は将来の発症リスクの低減効果の評価、並びに、そのような物質のスクリーニングが行なえることが示された。例えば、所望の被検物質を使用して同様の動物実験を行なって体液試料を調製し、同様の手順でSELDI−TOF−MSを行なった場合に、質量/電荷比が約8840のピークを生じるタンパク質の濃度が正常値に維持されたとき、該被検物質は、動脈硬化の改善効果、又は将来の発症リスクの低減効果を有すると評価することができる。
【0115】
19.マーカー物質(M17)の特定
画分3(pH3.0)を弱陽イオン交換チップCM10に接触させ、pH3.0のプロテインチップ結合バッファーで洗浄してSELDI−TOF−MS(EAM:SPA−H)を行なった場合に、質量/電荷比が10012(平均値)のイオンピークが検出された。増減パターン解析の結果、本ピークは第1群、第3群および第4群で高値を示し、第2群で低値を示した。図17に、各群に分けて本ピークのピーク強度をプロットした場合の箱髭図を示す。その結果、本ピークのROC面積(第1群vs第2群)は0.980、p値(第1群vs第2群)は0.0002、p値(第2群vs第3群)は0.0032であった。
【0116】
以上より、SELDI−TOF−MSに供すると質量/電荷比が約10000のピークを生じるタンパク質(マーカー物質(M17))が、動脈硬化を発症しているマウス、又は動脈硬化の将来の発症リスクが高いマウスに特異的な物質であり、動脈硬化のマーカーとなり得ることがわかった。これにより、被検物質を摂取させた動脈硬化を発症している動物又は将来の発症リスクが高い動物の体液中におけるマーカー物質(M17)の濃度を指標として、被検物質が有する動脈硬化の改善効果又は将来の発症リスクの低減効果の評価、並びに、そのような物質のスクリーニングが行なえることが示された。例えば、所望の被検物質を使用して同様の動物実験を行なって体液試料を調製し、同様の手順でSELDI−TOF−MSを行なった場合に、質量/電荷比が約10000のピークを生じるタンパク質の濃度が正常値に維持されたとき、該被検物質は、動脈硬化の改善効果、又は将来の発症リスクの低減効果を有すると評価することができる。
【0117】
20.マーカー物質(M18)の特定
画分4(有機溶媒)を強陰イオン交換チップQ10に接触させ、pH9.0のプロテインチップ結合バッファーで洗浄してSELDI−TOF−MS(EAM:CHCA)を行なった場合に、質量/電荷比が10451(平均値)のイオンピークが検出された。増減パターン解析の結果、本ピークは第1群、第3群および第4群で高値を示し、第2群で低値を示した。図18に、各群に分けて本ピークのピーク強度をプロットした場合の箱髭図を示す。その結果、本ピークのROC面積(第1群vs第2群)は0.940、p値(第1群vs第2群)は0.0004、p値(第2群vs第3群)は0.0284であった。
【0118】
以上より、SELDI−TOF−MSに供すると質量/電荷比が約10500のピークを生じるタンパク質(マーカー物質(M18))が、動脈硬化を発症しているマウス、又は動脈硬化の将来の発症リスクが高いマウスに特異的な物質であり、動脈硬化のマーカーとなり得ることがわかった。これにより、被検物質を摂取させた動脈硬化を発症している動物又は将来の発症リスクが高い動物の体液中におけるマーカー物質(M18)の濃度を指標として、被検物質が有する動脈硬化の改善効果又は将来の発症リスクの低減効果の評価、並びに、そのような物質のスクリーニングが行なえることが示された。例えば、所望の被検物質を使用して同様の動物実験を行なって体液試料を調製し、同様の手順でSELDI−TOF−MSを行なった場合に、質量/電荷比が約10500のピークを生じるタンパク質の濃度が正常値に維持されたとき、該被検物質は、動脈硬化の改善効果、又は将来の発症リスクの低減効果を有すると評価することができる。
【0119】
21.マーカー物質(M19)の特定
画分4(有機溶媒)を弱陽イオン交換チップCM10に接触させ、pH3.0のプロテインチップ結合バッファーで洗浄してSELDI−TOF−MS(EAM:SPA−H)を行なった場合に、質量/電荷比が10704(平均値)のイオンピークが検出された。増減パターン解析の結果、本ピークは第1群、第3群および第4群で高値を示し、第2群で低値を示した。図19に、各群に分けて本ピークのピーク強度をプロットした場合の箱髭図を示す。その結果、本ピークのROC面積(第1群vs第2群)は0.940、p値(第1群vs第2群)は0.0019、p値(第2群vs第3群)は0.0065であった。
【0120】
以上より、SELDI−TOF−MSに供すると質量/電荷比が約10700のピークを生じるタンパク質(マーカー物質(M19))が、動脈硬化を発症しているマウス、又は動脈硬化の将来の発症リスクが高いマウスに特異的な物質であり、動脈硬化のマーカーとなり得ることがわかった。これにより、被検物質を摂取させた動脈硬化を発症している動物又は将来の発症リスクが高い動物の体液中におけるマーカー物質(M19)の濃度を指標として、被検物質が有する動脈硬化の改善効果又は将来の発症リスクの低減効果の評価、並びに、そのような物質のスクリーニングが行なえることが示された。例えば、所望の被検物質を使用して同様の動物実験を行なって体液試料を調製し、同様の手順でSELDI−TOF−MSを行なった場合に、質量/電荷比が約10700のピークを生じるタンパク質の濃度が正常値に維持されたとき、該被検物質は、動脈硬化の改善効果、又は将来の発症リスクの低減効果を有すると評価することができる。
【0121】
22.マーカー物質(M20)の特定
画分1(pH9.0)を強陰イオン交換チップQ10に接触させ、pH9.0のプロテインチップ結合バッファーで洗浄してSELDI−TOF−MS(EAM:SPA−L)を行なった場合に、質量/電荷比が11669(平均値)のイオンピークが検出された。増減パターン解析の結果、本ピークは第1群、第3群および第4群で高値を示し、第2群で低値を示した。図20に、各群に分けて本ピークのピーク強度をプロットした場合の箱髭図を示す。その結果、本ピークのROC面積(第1群vs第2群)は0.820、p値(第1群vs第2群)は0.0284、p値(第2群vs第3群)は0.0494であった。
【0122】
以上より、SELDI−TOF−MSに供すると質量/電荷比が約11700のピークを生じるタンパク質(マーカー物質(M20))が、動脈硬化を発症しているマウス、又は動脈硬化の将来の発症リスクが高いマウスに特異的な物質であり、動脈硬化のマーカーとなり得ることがわかった。これにより、被検物質を摂取させた動脈硬化を発症している動物又は将来の発症リスクが高い動物の体液中におけるマーカー物質(M20)の濃度を指標として、被検物質が有する動脈硬化の改善効果又は将来の発症リスクの低減効果の評価、並びに、そのような物質のスクリーニングが行なえることが示された。例えば、所望の被検物質を使用して同様の動物実験を行なって体液試料を調製し、同様の手順でSELDI−TOF−MSを行なった場合に、質量/電荷比が約11700のピークを生じるタンパク質の濃度が正常値に維持されたとき、該被検物質は、動脈硬化の改善効果、又は将来の発症リスクの低減効果を有すると評価することができる。
【0123】
23.マーカー物質(M21)の特定
画分4(有機溶媒)を強陰イオン交換チップQ10に接触させ、pH9.0のプロテインチップ結合バッファーで洗浄してSELDI−TOF−MS(EAM:SPA−H)を行なった場合に、質量/電荷比が13742(平均値)のイオンピークが検出された。増減パターン解析の結果、本ピークは第1群、第3群および第4群で高値を示し、第2群で低値を示した。図21に、各群に分けて本ピークのピーク強度をプロットした場合の箱髭図を示す。その結果、本ピークのROC面積(第1群vs第2群)は0.940、p値(第1群vs第2群)は0.0015、p値(第2群vs第3群)は0.0082であった。
【0124】
以上より、SELDI−TOF−MSに供すると質量/電荷比が約13700のピークを生じるタンパク質(マーカー物質(M21))が、動脈硬化を発症しているマウス、又は動脈硬化の将来の発症リスクが高いマウスに特異的な物質であり、動脈硬化のマーカーとなり得ることがわかった。これにより、被検物質を摂取させた動脈硬化を発症している動物又は将来の発症リスクが高い動物の体液中におけるマーカー物質(M21)の濃度を指標として、被検物質が有する動脈硬化の改善効果又は将来の発症リスクの低減効果の評価、並びに、そのような物質のスクリーニングが行なえることが示された。例えば、所望の被検物質を使用して同様の動物実験を行なって体液試料を調製し、同様の手順でSELDI−TOF−MSを行なった場合に、質量/電荷比が約13700のピークを生じるタンパク質の濃度が正常値に維持されたとき、該被検物質は、動脈硬化の改善効果、又は将来の発症リスクの低減効果を有すると評価することができる。
【0125】
24.マーカー物質(M22)の特定
画分2(pH5.0)を強陰イオン交換チップQ10に接触させ、pH9.0のプロテインチップ結合バッファーで洗浄してSELDI−TOF−MS(EAM:SPA−H)を行なった場合に、質量/電荷比が13958(平均値)のイオンピークが検出された。増減パターン解析の結果、本ピークは第1群、第3群および第4群で低値を示し、第2群で高値を示した。図22に、各群に分けて本ピークのピーク強度をプロットした場合の箱髭図を示す。その結果、本ピークのROC面積(第1群vs第2群)は0.900、p値(第1群vs第2群)は0.0032、p値(第2群vs第3群)は0.0102であった。
【0126】
以上より、SELDI−TOF−MSに供すると質量/電荷比が約14000のピークを生じるタンパク質(マーカー物質(M22))が、動脈硬化を発症しているマウス、又は動脈硬化の将来の発症リスクが高いマウスに特異的な物質であり、動脈硬化のマーカーとなり得ることがわかった。これにより、被検物質を摂取させた動脈硬化を発症している動物又は将来の発症リスクが高い動物の体液中におけるマーカー物質(M22)の濃度を指標として、被検物質が有する動脈硬化の改善効果又は将来の発症リスクの低減効果の評価、並びに、そのような物質のスクリーニングが行なえることが示された。例えば、所望の被検物質を使用して同様の動物実験を行なって体液試料を調製し、同様の手順でSELDI−TOF−MSを行なった場合に、質量/電荷比が約14000のピークを生じるタンパク質の濃度が正常値に維持されたとき、該被検物質は、動脈硬化の改善効果、又は将来の発症リスクの低減効果を有すると評価することができる。
【0127】
25.マーカー物質(M23)の特定
画分2(pH5.0)を強陰イオン交換チップQ10に接触させ、pH9.0のプロテインチップ結合バッファーで洗浄してSELDI−TOF−MS(EAM:SPA−H)を行なった場合に、質量/電荷比が14167(平均値)のイオンピークが検出された。増減パターン解析の結果、本ピークは第1群、第3群および第4群で低値を示し、第2群で高値を示した。図23に、各群に分けて本ピークのピーク強度をプロットした場合の箱髭図を示す。その結果、本ピークのROC面積(第1群vs第2群)は0.900、p値(第1群vs第2群)は0.0019、p値(第2群vs第3群)は0.0082であった。
【0128】
以上より、SELDI−TOF−MSに供すると質量/電荷比が約14200のピークを生じるタンパク質(マーカー物質(M23))が、動脈硬化を発症しているマウス、又は動脈硬化の将来の発症リスクが高いマウスに特異的な物質であり、動脈硬化のマーカーとなり得ることがわかった。これにより、被検物質を摂取させた動脈硬化を発症している動物又は将来の発症リスクが高い動物の体液中におけるマーカー物質(M23)の濃度を指標として、被検物質が有する動脈硬化の改善効果又は将来の発症リスクの低減効果の評価、並びに、そのような物質のスクリーニングが行なえることが示された。例えば、所望の被検物質を使用して同様の動物実験を行なって体液試料を調製し、同様の手順でSELDI−TOF−MSを行なった場合に、質量/電荷比が約14200のピークを生じるタンパク質の濃度が正常値に維持されたとき、該被検物質は、動脈硬化の改善効果、又は将来の発症リスクの低減効果を有すると評価することができる。
【0129】
26.マーカー物質(M24)の特定
画分4(有機溶媒)を強陰イオン交換チップQ10に接触させ、pH9.0のプロテインチップ結合バッファーで洗浄してSELDI−TOF−MS(EAM:SPA−H)を行なった場合に、質量/電荷比が20441(平均値)のイオンピークが検出された。増減パターン解析の結果、本ピークは第1群、第3群および第4群で高値を示し、第2群で低値を示した。図24に、各群に分けて本ピークのピーク強度をプロットした場合の箱髭図を示す。その結果、本ピークのROC面積(第1群vs第2群)は0.980、p値(第1群vs第2群)は0.0002、p値(第2群vs第3群)は0.0343であった。
【0130】
以上より、SELDI−TOF−MSに供すると質量/電荷比が約20400のピークを生じるタンパク質(マーカー物質(M24))が、動脈硬化を発症しているマウス、又は動脈硬化の将来の発症リスクが高いマウスに特異的な物質であり、動脈硬化のマーカーとなり得ることがわかった。これにより、被検物質を摂取させた動脈硬化を発症している動物又は将来の発症リスクが高い動物の体液中におけるマーカー物質(M24)の濃度を指標として、被検物質が有する動脈硬化の改善効果又は将来の発症リスクの低減効果の評価、並びに、そのような物質のスクリーニングが行なえることが示された。例えば、所望の被検物質を使用して同様の動物実験を行なって体液試料を調製し、同様の手順でSELDI−TOF−MSを行なった場合に、質量/電荷比が約20400のピークを生じるタンパク質の濃度が正常値に維持されたとき、該被検物質は、動脈硬化の改善効果、又は将来の発症リスクの低減効果を有すると評価することができる。
【0131】
27.マーカー物質(M25)の特定
画分4(有機溶媒)を強陰イオン交換チップQ10に接触させ、pH9.0のプロテインチップ結合バッファーで洗浄してSELDI−TOF−MS(EAM:SPA−H)を行なった場合に、質量/電荷比が20908(平均値)のイオンピークが検出された。増減パターン解析の結果、本ピークは第1群、第3群および第4群で高値を示し、第2群で低値を示した。図25に、各群に分けて本ピークのピーク強度をプロットした場合の箱髭図を示す。その結果、本ピークのROC面積(第1群vs第2群)は0.980、p値(第1群vs第2群)は0.0002、p値(第2群vs第3群)は0.0065であった。
【0132】
以上より、SELDI−TOF−MSに供すると質量/電荷比が約20900のピークを生じるタンパク質(マーカー物質(M25))が、動脈硬化を発症しているマウス、又は動脈硬化の将来の発症リスクが高いマウスに特異的な物質であり、動脈硬化のマーカーとなり得ることがわかった。これにより、被検物質を摂取させた動脈硬化を発症している動物又は将来の発症リスクが高い動物の体液中におけるマーカー物質(M25)の濃度を指標として、被検物質が有する動脈硬化の改善効果又は将来の発症リスクの低減効果の評価、並びに、そのような物質のスクリーニングが行なえることが示された。例えば、所望の被検物質を使用して同様の動物実験を行なって体液試料を調製し、同様の手順でSELDI−TOF−MSを行なった場合に、質量/電荷比が約20900のピークを生じるタンパク質の濃度が正常値に維持されたとき、該被検物質は、動脈硬化の改善効果、又は将来の発症リスクの低減効果を有すると評価することができる。
【0133】
28.マーカー物質(M26)の特定
画分1(pH9.0)を弱陽イオン交換チップCM10に接触させ、pH3.0のプロテインチップ結合バッファーで洗浄してSELDI−TOF−MS(EAM:SPA−H)を行なった場合に、質量/電荷比が21353(平均値)のイオンピークが検出された。増減パターン解析の結果、本ピークは第1群、第3群および第4群で高値を示し、第2群で低値を示した。図26に、各群に分けて本ピークのピーク強度をプロットした場合の箱髭図を示す。その結果、本ピークのROC面積(第1群vs第2群)は0.940、p値(第1群vs第2群)は0.0005、p値(第2群vs第3群)は0.0494であった。
【0134】
以上より、SELDI−TOF−MSに供すると質量/電荷比が約21400のピークを生じるタンパク質(マーカー物質(M26))が、動脈硬化を発症しているマウス、又は動脈硬化の将来の発症リスクが高いマウスに特異的な物質であり、動脈硬化のマーカーとなり得ることがわかった。これにより、被検物質を摂取させた動脈硬化を発症している動物又は将来の発症リスクが高い動物の体液中におけるマーカー物質(M26)の濃度を指標として、被検物質が有する動脈硬化の改善効果又は将来の発症リスクの低減効果の評価、並びに、そのような物質のスクリーニングが行なえることが示された。例えば、所望の被検物質を使用して同様の動物実験を行なって体液試料を調製し、同様の手順でSELDI−TOF−MSを行なった場合に、質量/電荷比が約21400のピークを生じるタンパク質の濃度が正常値に維持されたとき、該被検物質は、動脈硬化の改善効果、又は将来の発症リスクの低減効果を有すると評価することができる。
【0135】
29.マーカー物質(M27)の特定
画分3(pH3.0)を弱陽イオン交換チップCM10に接触させ、pH3.0のプロテインチップ結合バッファーで洗浄してSELDI−TOF−MS(EAM:SPA−H)を行なった場合に、質量/電荷比が28161(平均値)のイオンピークが検出された。増減パターン解析の結果、本ピークは第1群、第3群および第4群で高値を示し、第2群で低値を示した。図27に、各群に分けて本ピークのピーク強度をプロットした場合の箱髭図を示す。その結果、本ピークのROC面積(第1群vs第2群)は0.980、p値(第1群vs第2群)は0.0002、p値(第2群vs第3群)は0.0191であった。
【0136】
以上より、SELDI−TOF−MSに供すると質量/電荷比が約28200のピークを生じるタンパク質(マーカー物質(M27))が、動脈硬化を発症しているマウス、又は動脈硬化の将来の発症リスクが高いマウスに特異的な物質であり、動脈硬化のマーカーとなり得ることがわかった。これにより、被検物質を摂取させた動脈硬化を発症している動物又は将来の発症リスクが高い動物の体液中におけるマーカー物質(M27)の濃度を指標として、被検物質が有する動脈硬化の改善効果又は将来の発症リスクの低減効果の評価、並びに、そのような物質のスクリーニングが行なえることが示された。例えば、所望の被検物質を使用して同様の動物実験を行なって体液試料を調製し、同様の手順でSELDI−TOF−MSを行なった場合に、質量/電荷比が約28200のピークを生じるタンパク質の濃度が正常値に維持されたとき、該被検物質は、動脈硬化の改善効果、又は将来の発症リスクの低減効果を有すると評価することができる。
【0137】
30.マーカー物質(M28)の特定
画分3(pH3.0)を弱陽イオン交換チップCM10に接触させ、pH3.0のプロテインチップ結合バッファーで洗浄してSELDI−TOF−MS(EAM:SPA−H)を行なった場合に、質量/電荷比が34393(平均値)のイオンピークが検出された。増減パターン解析の結果、本ピークは第1群、第3群および第4群で高値を示し、第2群で低値を示した。図28に、各群に分けて本ピークのピーク強度をプロットした場合の箱髭図を示す。その結果、本ピークのROC面積(第1群vs第2群)は0.900、p値(第1群vs第2群)は0.0015、p値(第2群vs第3群)は0.0156であった。
【0138】
以上より、SELDI−TOF−MSに供すると質量/電荷比が約34400のピークを生じるタンパク質(マーカー物質(M28))が、動脈硬化を発症しているマウス、又は動脈硬化の将来の発症リスクが高いマウスに特異的な物質であり、動脈硬化のマーカーとなり得ることがわかった。これにより、被検物質を摂取させた動脈硬化を発症している動物又は将来の発症リスクが高い動物の体液中におけるマーカー物質(M28)の濃度を指標として、被検物質が有する動脈硬化の改善効果又は将来の発症リスクの低減効果の評価、並びに、そのような物質のスクリーニングが行なえることが示された。例えば、所望の被検物質を使用して同様の動物実験を行なって体液試料を調製し、同様の手順でSELDI−TOF−MSを行なった場合に、質量/電荷比が約34400のピークを生じるタンパク質の濃度が正常値に維持されたとき、該被検物質は、動脈硬化の改善効果、又は将来の発症リスクの低減効果を有すると評価することができる。
【0139】
31.マーカー物質(M29)の特定
画分4(有機溶剤)を強陰イオン交換チップQ10に接触させ、pH9.0のプロテインチップ結合バッファーで洗浄してSELDI−TOF−MS(EAM:SPA−H)を行なった場合に、質量/電荷比が66090(平均値)のイオンピークが検出された。増減パターン解析の結果、本ピークは第1群、第3群および第4群で低値を示し、第2群で高値を示した。図29に、各群に分けて本ピークのピーク強度をプロットした場合の箱髭図を示す。その結果、本ピークのROC面積(第1群vs第2群)は0.900、p値(第1群vs第2群)は0.0012、p値(第2群vs第3群)は0.0019であった。
【0140】
以上より、SELDI−TOF−MSに供すると質量/電荷比が約66000のピークを生じるタンパク質(マーカー物質(M29))が、動脈硬化を発症しているマウス、又は動脈硬化の将来の発症リスクが高いマウスに特異的な物質であり、動脈硬化のマーカーとなり得ることがわかった。これにより、被検物質を摂取させた動脈硬化を発症している動物又は将来の発症リスクが高い動物の体液中におけるマーカー物質(M29)の濃度を指標として、被検物質が有する動脈硬化の改善効果又は将来の発症リスクの低減効果の評価、並びに、そのような物質のスクリーニングが行なえることが示された。例えば、所望の被検物質を使用して同様の動物実験を行なって体液試料を調製し、同様の手順でSELDI−TOF−MSを行なった場合に、質量/電荷比が約66000のピークを生じるタンパク質の濃度が正常値に維持されたとき、該被検物質は、動脈硬化の改善効果、又は将来の発症リスクの低減効果を有すると評価することができる。
【0141】
なお、ヒトの体液中にもマーカー物質(M01)〜(M29)と同等のタンパク質が存在する場合には、ヒトの体液中における当該タンパク質の濃度を指標として、動脈硬化の発症の有無、又は将来の発症リスクを診断できる可能性も示唆された。
【実施例2】
【0142】
マーカー物質(M06)の精製と同定
強陰イオン交換樹脂Q−Sepharose HP(GEヘルスケア社)を充填したカラム(1mL)を平衡化バッファー(50mM Tris−HCl pH9.0,1M 尿素,0.22% CHAPS)にて平衡化した。C57BLマウス血清(清水実験材料社)500μLに対して変性バッファー(50mM Tris−HCl pH9.0,9M 尿素,2% CHAPS)を750μL加えて4℃で20分間変性処理した。変性処理したサンプルを12,000G、4℃で10分間遠心し、0.45μmのフィルターでろ過した後、平衡化した前記カラムに添加した。50mM Tris−HCl(pH9.0)、及び100mM 酢酸ナトリウムバッファー(pH5.0)で順に洗浄した後、50mM クエン酸ナトリウムバッファー(pH3.0)で溶出し、ピーク画分を分取した。
【0143】
弱陽イオン交換樹脂HiTrap CM FF(GEヘルスケア社)を充填したカラム(1mL)を50mM クエン酸ナトリウムバッファー(pH3.0)にて平衡化した。分取したピーク画分に対して等量の50mM クエン酸ナトリウムバッファー(pH3.0)を添加・混合し、0.45μmのフィルターでろ過した後、平衡化した前記カラムに添加した。50mM クエン酸ナトリウムバッファー(pH3.0)でカラムを洗浄した後、50mM クエン酸ナトリウムバッファー(pH5.0)で溶出し、約1mLずつ分取した。各画分に対してSELDI−TOF−MS分析を行い、3〜5番目の画分に、精製過程における酸化修飾などによる誤差の範囲内でマーカー物質(M06)の質量/電荷比(平均値:5203)と同等の質量/電荷比を示すピークを確認した。
【0144】
分取した画分の一部をアセトン沈殿処理した後、ポリペプチド分離用ゲル(15−20%)NTH−5A0Tゲル(DRC社)を用いてSDS−PAGEを行った(図30)。図30中、レーン1〜5はいずれも回収画分、Mは分子量マーカーである。分離された約5.2kDaのバンド(図30の矢印)を切り出してタンパク質を抽出し、SELDI−TOF−MS分析を行い、マーカー物質(M06)と同等の質量/電荷比を示すピークを確認した(図31の矢印)。
【0145】
あらためて同様のSDS−PAGEを行ってPVDF膜に転写し、約5.2kDaのバンド部分をN末端アミノ酸解析に供した。その結果、配列番号1で表される10アミノ酸が決定された。このアミノ酸配列はマウスアポリポタンパク質A2(配列番号2)の一部と完全一致していた。さらに、配列番号2のアミノ酸番号15(Phe)〜60(Leu)の部分に相当するタンパク質断片の予想される等電点が6.77、分子量が5195であり、これらの値がSELDI−TOF−MS分析の結果とよく一致した。このことから、マーカー物質(M06)はアポリポタンパク質A2の断片と同定された。当該タンパク質断片に相当する、配列番号2のアミノ酸番号15(Phe)〜60(Leu)の部分のアミノ酸配列を配列番号3に示す。
【実施例3】
【0146】
マーカー物質(M07)の精製と同定
強陰イオン交換樹脂Q−Sepharose HP(GEヘルスケア社)を充填したカラム(1mL)を平衡化バッファー(50mM Tris−HCl pH9.0,1M 尿素,0.22% CHAPS)にて平衡化した。マウス標準血漿(Pel-Freez社)500μLに対して変性バッファー(50mM Tris−HCl pH9.0,9M 尿素,2% CHAPS)を750μL加えて変性処理した後、平衡化した前記カラムに添加した。50mM Tris−HCl(pH9.0)、100mM 酢酸ナトリウムバッファー(pH5.0)、50mM クエン酸ナトリウムバッファー(pH3.0)で順に洗浄した後、33.3% 2−プロパノール/16.7% アセトニトリル/0.1% TFAで溶出し、ピーク画分を分取した。
【0147】
弱陽イオン交換樹脂HiTrap CM FF(GEヘルスケア社)を充填したカラム(1mL)を50mM 酢酸ナトリウムバッファー(pH5.0)にて平衡化した。分取した画分の全量を平衡化した前記カラムに添加した。50mM 酢酸ナトリウムバッファー(pH5.0)でカラムを洗浄した後、100mM NaClを含む50mM 酢酸ナトリウムバッファー(pH5.0)で溶出した。溶出した画分に対してSELDI−TOF−MS分析を行い、マーカー物質(M07)の質量/電荷比(平均値:6023)と同等の質量/電荷比を示すピークを確認した。
【0148】
回収した画分の一部をアセトン沈殿処理した後、ポリペプチド分離用ゲル(15−20%)NTH−5A0Tゲル(DRC社)を用いてSDS−PAGEを行った(図32)。図32中、レーン1,2はいずれも回収画分、Mは分子量マーカーである。分離された約6.0kDaのバンド(図32の矢印)を切り出してタンパク質を抽出し、SELDI−TOF−MS分析を行い、マーカー物質(M07)の質量/電荷比(平均値:6023)と同等の質量/電荷比を示すピークを確認した(図33の矢印)。
【0149】
あらためて同様のSDS−PAGEを行って約6.0kDaのバンドを切り出し、還元アルキル化処理した後、0.01μg/μLのトリプシン溶液(50mM 炭酸水素アンモニウム(pH8.0)に溶解)を作用させてゲル内で消化した。消化したサンプル1μLを金属プレート上に滴下し、飽和CHCA溶液0.4μLをさらに滴下して乾燥させた後、質量分析計Proteomics Analyzer 4700(アプライドバイオシステムズ社)で測定したところ、少なくとも2個のピークが検出され、それらの精密質量は「1850.84」及び「1981.99」と算出された。これらのデータを元にMascotデータベース(マトリックスサイエンス社)によって既知タンパク質を検索し、ペプチドマスフィンガープリンティングを行ったところ、これらのペプチドはそれぞれ配列番号4,5で表わされるアミノ酸配列のペプチドと一致し、目的のタンパク質は99%以上の確率で「血清アルブミン」と同定された。各ペプチドの精密質量、アミノ酸配列、及び配列番号の対応関係を第1表に示す。既報のマウス血清アルブミンのアミノ酸配列を配列番号6に示す。
【0150】
【表1】

【0151】
あらためて同様のSDS−PAGEを行ってPVDF膜に転写し、約6.0kDaのバンド部分をN末端アミノ酸解析に供した。その結果、配列番号7で表される12アミノ酸が決定された。このアミノ酸配列は血清アルブミン(配列番号6)のアミノ酸番号554(Ala)から565(Ala)の12アミノ酸と完全一致していた。さらに、配列番号6のアミノ酸番号554(Ala)〜608(Ala)の部分に相当するタンパク質断片の予想される等電点が5.65、分子量が6019であり、これらの値がSELDI−TOF−MS分析の結果とよく一致した。このことから、マーカー物質(M07)は血清アルブミンの断片と同定された。当該タンパク質断片に相当する、配列番号6のアミノ酸番号554(Ala)〜608(Ala)の部分のアミノ酸配列を配列番号8に示す。
【実施例4】
【0152】
マーカー物質(M09)の精製と同定
強陰イオン交換樹脂HiTrap Q HP(GEヘルスケア社)を平衡化バッファー(50mM Tris−HCl pH9.0,1M 尿素,0.22% CHAPS)にて平衡化した。マウス標準血漿(Pel-Freez社)500μLに対して変性バッファー(50mM Tris−HCl pH9.0,9M 尿素,2% CHAPS)を750μL加えて変性処理した後、平衡化した前記カラムに添加した。素通り画分を回収し、さらに、
平衡化バッファーで溶出されたピーク画分を回収した。
【0153】
回収した画分の一部をアセトン沈殿処理した後、ポリペプチド分離用ゲル(15−20%)NTH−5A0Tゲル(DRC社)を用いてSDS−PAGEを行った(図34)。図34中、レーン1は回収画分、Mは分子量マーカーである。分離された約6.8kDaのバンド(図34の矢印)を切り出してタンパク質を抽出し、SELDI−TOF−MS分析を行い、精製過程における酸化修飾などによる誤差の範囲内でマーカー物質(M09)の質量/電荷比(平均値:6861)と同等の質量/電荷比を示すピークを確認した(図35の矢印)。
【0154】
あらためて同様のSDS−PAGEを行って約6.8kDaのバンドを切り出し、実施例3と同様にしてゲル内消化及び質量分析を行ったところ、少なくとも2個のピークが検出され、それらの精密質量は「781.48」及び「1042.40」と算出された。これらのデータを元に実施例3と同様にしてペプチドマスフィンガープリンティングを行ったところ、これらのペプチドはそれぞれ配列番号9,10で表わされるアミノ酸配列のペプチドと一致し、目的のタンパク質は99%以上の確率で「アポリポタンパク質C1」と同定された。各ペプチドの精密質量、アミノ酸配列、及び配列番号の対応関係を第2表に示す。既報のマウスアポリポタンパク質C1のアミノ酸配列を配列番号14に示す。
【0155】
【表2】

【0156】
アポリポタンパク質C1については、N末端の2アミノ酸残基(Ala−Pro)が欠損した「アポリポタンパク質C1の修飾体」(配列番号15)が血清中に存在することが確認されている。本実施例のペプチドマスフィンガープリンティングでは後述の実施例5と同じタンパク質(アポリポタンパク質C1)がヒットしたが、マーカー物質(M09)はその電荷/質量比(平均値:6860)から、当該アポリポタンパク質C1の修飾体(配列番号15)であると考えられた。
【実施例5】
【0157】
マーカー物質(M10)の精製と同定
強陰イオン交換樹脂Q−Sepharose HP(GEヘルスケア社)を充填したカラム(1mL)を平衡化バッファー(50mM Tris−HCl pH9.0,1M 尿素,0.22% CHAPS)にて平衡化した。C57BLマウス血清(清水実験材料社)500μLに対して変性バッファー(50mM Tris−HCl pH9.0,9M 尿素,2% CHAPS)を750μL加えて変性処理し、平衡化した前記カラムに添加した。非吸着画分を回収した。
【0158】
回収した画分の一部をアセトン沈殿処理した後、ポリペプチド分離用ゲル(15−20%)NTH−5A0Tゲル(DRC社)を用いてSDS−PAGEを行った(図36)。図36中、レーン1〜6はいずれも回収画分、Mは分子量マーカーである。分離された約7.0kDaのバンド(図36の矢印)を切り出してタンパク質を抽出し、SELDI−TOF−MS分析を行い、マーカー物質(M10)の質量/電荷比(平均値:7005)と同等の質量/電荷比を示すピークを確認した(図37のa)。
【0159】
あらためて同様のSDS−PAGEを行って約7.0kDaのバンドを切り出し、実施例3と同様にしてゲル内消化及び質量分析を行ったところ、少なくとも3個のピークが検出され、それらの精密質量は、「1279.70」、「1299.71」、及び「1042.53」と算出された。これらのデータを元に実施例3と同様にしてペプチドマスフィンガープリンティングを行ったところ、精密質量「1279.70」、「1299.71」、及び「1042.53」のペプチドはそれぞれ配列番号11〜13で表わされるアミノ酸配列のペプチドと一致し、目的のタンパク質は99%以上の確率で「アポリポタンパク質C1」(配列番号14)と同定された。各ペプチドの精密質量、アミノ酸配列、及び配列番号の対応関係を第3表に示す。
【0160】
【表3】

【0161】
本実施例のペプチドマスフィンガープリンティングでは実施例4と同じタンパク質(アポリポタンパク質C1)がヒットしたが、マーカー物質(M10)はその電荷/質量比(平均値:7005)から、アポリポタンパク質C1の全長と考えられた。
【0162】
なお、図37に示すように、SELDI−TOF−MS分析においてマーカー物質(M10)よりも小さい質量(約6.8kDa)を示すピークも検出された(図37のb)。これら2種のタンパク質は性質が非常に似ていること、並びに、質量の値の比較から、ピークbのタンパク質は、実施例4で述べた、アポリポタンパク質C1(配列番号14)のN末端の2アミノ酸(Ala−Pro)が欠損した「アポリポタンパク質C1の修飾体」(配列番号15)であると考えられた。アミノ酸配列から計算される質量は、ピークaが6993Da、ピークbが6825Daであった。
【実施例6】
【0163】
マーカー物質(M15)の精製と同定
強陰イオン交換樹脂Q−Sepharose HP(GEヘルスケア社)を充填したカラム(1mL)を平衡化バッファー(50mM Tris−HCl pH9.0,1M 尿素,0.22% CHAPS)にて平衡化した。C57BLマウス血清(Innovative Research社)500μLに対して変性バッファー(50mM Tris−HCl pH9.0,9M 尿素,2% CHAPS)を750μL加えて変性処理し、平衡化した前記カラムに添加した。50mM Tris−HCl(pH9.0)、100mM 酢酸ナトリウムバッファー(pH5.0)、及び50mM クエン酸ナトリウムバッファー(pH3.0)で順に洗浄した後、50% アセトニトリル,0.1% TFAで溶出し、ピーク画分を分取した。
【0164】
回収した画分の一部をアセトン沈殿処理した後、ポリペプチド分離用ゲル(15−20%)NTH−5A0Tゲル(DRC社)を用いてSDS−PAGEを行った(図38)。図38中、レーン1,2はいずれも回収画分、Mは分子量マーカーである。分離された約8.7kDaのバンド(図38の矢印A)を切り出してタンパク質を抽出し、SELDI−TOF−MS分析を行い、精製過程における酸化修飾などによる誤差の範囲内でマーカー物質(M15)の質量/電荷比(平均値:8723)と同等の質量/電荷比を示すピークを確認した(図39の矢印)。
【0165】
あらためて同様のSDS−PAGEを行って約8.7kDaのバンドを切り出し、実施例3と同様にしてゲル内消化及び質量分析を行ったところ、少なくとも2個のピークが検出され、それらの精密質量は「1832.01」及び「1193.69」と算出された。これらのデータを元に実施例3と同様にしてペプチドマスフィンガープリンティングを行ったところ、精密質量「1832.01」と「1193.69」のペプチドはそれぞれ配列番号16,17で表わされるアミノ酸配列のペプチドと一致し、目的のタンパク質は99%以上の確率で「アポリポタンパク質A2」と同定された。各ペプチドの精密質量、アミノ酸配列、及び配列番号の対応関係を第4表に示す。既報のマウスアポリポタンパク質A2のアミノ酸配列を配列番号2に示す。
【0166】
【表4】

【実施例7】
【0167】
マーカー物質(M16)の精製と同定
実施例6で行ったSDS−PAGEで分離された約8.8kDaのバンド(図38の矢印B)を切り出してタンパク質を抽出し、SELDI−TOF−MS分析を行った。精製過程における酸化修飾などによる誤差の範囲内でマーカー物質(M16)の質量/電荷比(平均値:8840)と同等の質量/電荷比を示すピークを確認した(図40の矢印)。
【0168】
あらためて同様のSDS−PAGEを行って約8.8kDaのバンドを切り出し、実施例3と同様にしてゲル内消化及び質量分析を行ったところ、少なくとも3個のピークが検出され、それらの精密質量は「1988.08」、「1062.48」、及び「2629.26」と算出された。これらのデータを元に実施例3と同様にしてペプチドマスフィンガープリンティングを行ったところ、これらのペプチドはそれぞれ配列番号18〜20で表わされるアミノ酸配列のペプチドと一致し、目的のタンパク質は99%以上の確率で「アポリポタンパク質C3」と同定された。各ペプチドの精密質量、アミノ酸配列、及び配列番号の対応関係を第5表に示す。既報のマウスアポリポタンパク質C3のアミノ酸配列を配列番号21に示す。
【0169】
【表5】

【実施例8】
【0170】
マーカー物質(M21)〜(M23)の精製と同定
強陰イオン交換樹脂HiTrap Q HP (1mL)(GEヘルスケア社)を平衡化バッファー(50mM Tris−HCl pH9.0,1M 尿素,0.22% CHAPS)にて平衡化した。マウス標準血漿(Pel-Freez社)500μLに対して変性バッファー(50mM Tris−HCl pH9.0,9M 尿素,2% CHAPS)を750μL加えて変性処理した後、平衡化した前記カラムに添加した。50mM Tris−HCl(pH9.0)、50mM Tris−HCl(pH7.0)でカラムを順次洗浄した後、50mM NaClを含む50mM Tris−HCl(pH7.0)で溶出し、ピーク画分を分取した。
【0171】
回収した画分の一部をアセトン沈殿処理した後、ポリペプチド分離用ゲル(15−20%)NTH−5A0Tゲル(DRC社)を用いてSDS−PAGEを行った(図41)。図41中、レーン1〜6はいずれも回収画分、Mは分子量マーカーである。分離された約14.0kDaのバンド(図41の矢印)を切り出してタンパク質を抽出し、SELDI−TOF−MS分析を行い、マーカー物質(M21)〜(M23)の質量/電荷比(平均値:13742,13958,14167)と同等の質量/電荷比を示す複数のピークを確認した(図42)。
【0172】
あらためて同様のSDS−PAGEを行って約14.0kDaのバンドを切り出し、実施例3と同様にしてゲル内消化及び質量分析を行ったところ、少なくとも8個のピークが検出され、それらの精密質量は「1510.75」、「1382.65」、「1587.79」、「2438.25」、「869.46」、「1554.85」、「2517.28」、及び「2597.38」と算出された。これらのデータを元に実施例3と同様にしてペプチドマスフィンガープリンティングを行ったところ、これらのペプチドはそれぞれ配列番号22〜29で表わされるアミノ酸配列のペプチドと一致し、目的のタンパク質は99%以上の確率で「トランスサイレチン」と同定された。各ペプチドの精密質量、アミノ酸配列、及び配列番号の対応関係を第6表に示す。既報のマウストランスサイレチンのアミノ酸配列を配列番号30に示す。
【0173】
【表6】

【0174】
上述したように、トランスサイレチンについては、その唯一のCys残基が修飾を受けた種々の修飾トランスサイレチンが見出されている。マーカー物質(M21)〜(M23)の各電荷/質量比(平均値:13742,13958,14167)から、マーカー物質(M21)は「S−スルホン化トランスサイレチン」、マーカー物質(M22)は「グルタチオン化トランスサイレチン」とそれぞれ同定された。マーカー物質(M23)はグルタチオン化トランスサイレチンにマトリクス(SPA−H)が結合した複合体と考えられた。
【実施例9】
【0175】
マーカー物質(M25)の精製と同定
実施例2と同様にして強陰イオン交換樹脂Q−Sepharose HPを充填したカラム(1mL)の平衡化、並びに、C57BLマウス血清(清水実験材料社)の変性処理とフィルターろ過を行い、カラムにサンプルを添加した。非吸着画分を回収した。
【0176】
強陽イオン交換樹脂HiTrap SP HP(GEヘルスケア社)を充填したカラム(1mL)を50mM 酢酸ナトリウムバッファー(pH4.0)にて平衡化した。回収した非吸着画分を50mM 酢酸ナトリウムバッファー(pH3.0)で10倍希釈し、平衡化した前記カラムに添加した。50mM 酢酸ナトリウムバッファー(pH4.0),200mM NaClにてカラムを洗浄した後、50mM 酢酸ナトリウムバッファー(pH4.0),400mM NaClにて溶出した。ピーク画分を分取した。このピーク画分に対してSELDI−TOF−MS分析を行い、精製過程における酸化修飾などによる誤差の範囲内でマーカー物質(M25)の質量/電荷比(平均値:20908)と同等の質量/電荷比を示すピークを確認した。
【0177】
回収した画分の一部をアセトン沈殿処理した後、ポリペプチド分離用ゲル(15−20%)NTH−5A0Tゲル(DRC社)を用いてSDS−PAGEを行った(図43)。図43中、レーン1,2はいずれも回収画分、Mは分子量マーカーである。分離された約21.0kDaのバンド(図43の矢印)を切り出してタンパク質を抽出し、SELDI−TOF−MS分析を行い、マーカー物質(M25)の質量/電荷比(平均値:20908)と同等の質量/電荷比を示すピークを確認した(図44の矢印)。
【0178】
あらためて同様のSDS−PAGEを行って約21.0kDaのバンドを切り出し、実施例3と同様にしてゲル内消化及び質量分析を行ったところ、少なくとも7個のピークが検出され、それらの精密質量は「1155.66」、「2407.31」、「1501.83」、「1226.68」、「2705.27」、「2080.03」、及び「1360.72」と算出された。これらのデータを元に実施例3と同様にしてペプチドマスフィンガープリンティングを行ったところ、精密質量「1155.66」、「2407.31」、「1501.83」、「1226.68」、「2705.27」、「2080.03」、及び「1360.72」のペプチドはそれぞれ配列番号31〜37で表わされるアミノ酸配列のペプチドと一致し、目的のタンパク質は99%以上の確率で「レチノール結合タンパク質」と同定された。各ペプチドの精密質量、アミノ酸配列、及び配列番号の対応関係を第7表に示す。既報のマウスレチノール結合タンパク質のアミノ酸配列を配列番号38に示す。
【0179】
【表7】

【0180】
レチノール結合タンパク質については、一部のアミノ酸残基が欠損した数種類の「レチノール結合タンパク質の修飾体」が血清中に存在することが確認されている。本実施例のペプチドマスフィンガープリンティングでは後述の実施例9と同じタンパク質(レチノール結合タンパク質)がヒットしたが、マーカー物質(M25)はその電荷/質量比(平均値:20908)から、レチノール結合タンパク質の一部のアミノ酸残基が欠損した「レチノール結合タンパク質の修飾体」であると考えられた。
【実施例10】
【0181】
マーカー物質(M26)の精製と同定
強陰イオン交換樹脂Macro−Prep DEAE(バイオラッド社)を充填したスピンカラム(5mL)を平衡化バッファー(50mM Tris−HCl pH9.0,1M 尿素,0.22% CHAPS)にて平衡化した。マウス標準血漿(Pel-Freez社)3.0mLを20,000G、4℃で10分間遠心後、上清を回収した。回収した上清2.5mLに対して変性バッファー(50mM Tris−HCl pH9.0,9M 尿素,2% CHAPS)を3.75mL加えて変性処理した。この変性処理サンプルに平衡化バッファー6.25mLを加えて希釈し、平衡化した前記カラムに添加した。素通り画分を回収し、さらに、50mM Tris−HCl(pH9.0)で溶出されたピーク画分を回収した。
【0182】
回収した画分の一部をアセトン沈殿処理した後、ポリペプチド分離用ゲル(15−20%)NTH−5A0Tゲル(DRC社)を用いてSDS−PAGEを行った(図45)。図45中、レーン1,2はいずれも回収画分、Mは分子量マーカーである。分離された約21.4kDaのバンド(図45の矢印A)を切り出してタンパク質を抽出し、SELDI−TOF−MS分析を行い、精製過程における酸化修飾などによる誤差の範囲内でマーカー物質(M26)の質量/電荷比(平均値:21353)と同等の質量/電荷比を示すピークを確認した(図46の矢印)。
【0183】
あらためて同様のSDS−PAGEを行って約21.4kDaのバンドを切り出し、実施例3と同様にしてゲル内消化及び質量分析を行ったところ、少なくとも5個のピークが検出され、それらの精密質量は「1155.62」、「1485.77」、「1226.64」、「2079.94」、及び「1360.66」と算出された。これらのデータを元に実施例3と同様にしてペプチドマスフィンガープリンティングを行ったところ、これらのペプチドはそれぞれ配列番号39〜43で表わされるアミノ酸配列のペプチドと一致し、目的のタンパク質は99%以上の確率で「レチノール結合タンパク質」(配列番号38)と同定された。各ペプチドの精密質量、アミノ酸配列、及び配列番号の対応関係を第8表に示す。
【0184】
【表8】

【0185】
なお、本実施例のペプチドマスフィンガープリンティングでは実施例9と同じタンパク質(レチノール結合タンパク質)がヒットしたが、マーカー物質(M26)はその電荷/質量比(平均値:21353)から、レチノール結合タンパク質の全長と考えられた。
【実施例11】
【0186】
マーカー物質(M27)の精製と同定
実施例10で行ったSDS−PAGEで分離された約28.0kDaのバンド(図45の矢印B)を切り出してタンパク質を抽出し、SELDI−TOF−MS分析を行った。精製過程における酸化修飾などによる誤差の範囲内でマーカー物質(M27)の質量/電荷比(平均値:28161)と同等の質量/電荷比を示すピークを確認した(図47の矢印)。
【0187】
あらためて同様のSDS−PAGEを行って約28.0kDaのバンドを切り出し、実施例3と同様にしてゲル内消化及び質量分析を行ったところ、少なくとも12個のピークが検出され、それらの精密質量は「1852.53」、「1394.06」、「1236.86」、「1596.35」、「1340.01」、「1098.77」、「1317.96」、「826.47」、「1296.90」、「1997.80」、「1330.93」、及び「1039.71」と算出された。これらのデータを元に実施例3と同様にしてペプチドマスフィンガープリンティングを行ったところ、これらのペプチドはそれぞれ配列番号44〜55で表わされるアミノ酸配列のペプチドと一致し、目的のタンパク質は99%以上の確率で「アポリポタンパク質A1」と同定された。各ペプチドの精密質量、アミノ酸配列、及び配列番号の対応関係を第9表に示す。既報のマウスアポリポタンパク質A1のアミノ酸配列を配列番号56に示す。
【0188】
【表9】

【図面の簡単な説明】
【0189】
【図1】質量/電荷比が3352(平均値)のイオンピークについての箱髭図である。
【図2】質量/電荷比が4147(平均値)のイオンピークについての箱髭図である。
【図3】質量/電荷比が4281(平均値)のイオンピークについての箱髭図である。
【図4】質量/電荷比が4754(平均値)のイオンピークについての箱髭図である。
【図5】質量/電荷比が5126(平均値)のイオンピークについての箱髭図である。
【図6】質量/電荷比が5203(平均値)のイオンピークについての箱髭図である。
【図7】質量/電荷比が6023(平均値)のイオンピークについての箱髭図である。
【図8】質量/電荷比が6103(平均値)のイオンピークについての箱髭図である。
【図9】質量/電荷比が6861(平均値)のイオンピークについての箱髭図である。
【図10】質量/電荷比が7005(平均値)のイオンピークについての箱髭図である。
【図11】質量/電荷比が7095(平均値)のイオンピークについての箱髭図である。
【図12】質量/電荷比が7572(平均値)のイオンピークについての箱髭図である。
【図13】質量/電荷比が8439(平均値)のイオンピークについての箱髭図である。
【図14】質量/電荷比が8534(平均値)のイオンピークについての箱髭図である。
【図15】質量/電荷比が8723(平均値)のイオンピークについての箱髭図である。
【図16】質量/電荷比が8840(平均値)のイオンピークについての箱髭図である。
【図17】質量/電荷比が10012(平均値)のイオンピークについての箱髭図である。
【図18】質量/電荷比が10451(平均値)のイオンピークについての箱髭図である。
【図19】質量/電荷比が10704(平均値)のイオンピークについての箱髭図である。
【図20】質量/電荷比が11669(平均値)のイオンピークについての箱髭図である。
【図21】質量/電荷比が13742(平均値)のイオンピークについての箱髭図である。
【図22】質量/電荷比が13958(平均値)のイオンピークについての箱髭図である。
【図23】質量/電荷比が14167(平均値)のイオンピークについての箱髭図である。
【図24】質量/電荷比が20441(平均値)のイオンピークについての箱髭図である。
【図25】質量/電荷比が20908(平均値)のイオンピークについての箱髭図である。
【図26】質量/電荷比が21353(平均値)のイオンピークについての箱髭図である。
【図27】質量/電荷比が28161(平均値)のイオンピークについての箱髭図である。
【図28】質量/電荷比が34393(平均値)のイオンピークについての箱髭図である。
【図29】質量/電荷比が66090(平均値)のイオンピークについての箱髭図である。
【図30】実施例2のマーカー物質(M06)の精製過程で行ったSDS−PAGEの結果を示す写真である。
【図31】実施例2のマーカー物質(M06)の精製過程で行ったSELDI−TOF−MS分析の結果を示すイオンピーク図である。
【図32】実施例3のマーカー物質(M07)の精製過程で行ったSDS−PAGEの結果を示す写真である。
【図33】実施例3のマーカー物質(M07)の精製過程で行ったSELDI−TOF−MS分析の結果を示すイオンピーク図である。
【図34】実施例4のマーカー物質(M09)の精製過程で行ったSDS−PAGEの結果を示す写真である。
【図35】実施例4のマーカー物質(M09)の精製過程で行ったSELDI−TOF−MS分析の結果を示すイオンピーク図である。
【図36】実施例5のマーカー物質(M10)の精製過程で行ったSDS−PAGEの結果を示す写真である。
【図37】実施例5のマーカー物質(M10)の精製過程で行ったSELDI−TOF−MS分析の結果を示すイオンピーク図である。
【図38】実施例6のマーカー物質(M15)並びに実施例7のマーカー物質(M16)の精製過程で行ったSDS−PAGEの結果を示す写真である。
【図39】実施例6のマーカー物質(M15)の精製過程で行ったSELDI−TOF−MS分析の結果を示すイオンピーク図である。
【図40】実施例7のマーカー物質(M16)の精製過程で行ったSELDI−TOF−MS分析の結果を示すイオンピーク図である。
【図41】実施例8のマーカー物質(M21)〜(M23)の精製過程で行ったSDS−PAGEの結果を示す写真である。
【図42】実施例8のマーカー物質(M21)〜(M23)の精製過程で行ったSELDI−TOF−MS分析の結果を示すイオンピーク図である。
【図43】実施例9のマーカー物質(M25)の精製過程で行ったSDS−PAGEの結果を示す写真である。
【図44】実施例9のマーカー物質(M25)の精製過程で行ったSELDI−TOF−MS分析の結果を示すイオンピーク図である。
【図45】実施例10のマーカー物質(M26)並びに実施例11のマーカー物質(M27)の精製過程で行ったSDS−PAGEの結果を示す写真である。
【図46】実施例10のマーカー物質(M26)の精製過程で行ったSELDI−TOF−MS分析の結果を示すイオンピーク図である。
【図47】実施例11のマーカー物質(M27)の精製過程で行ったSELDI−TOF−MS分析の結果を示すイオンピーク図である。
【技術分野】
【0001】
本発明は、動脈硬化改善・予防効果の評価方法及び評価用キット、並びに、物質のスクリーニング方法に関し、さらに詳細には、動脈硬化を発症している動物又は将来の発症リスクが高い動物に被験物質を摂取させ、該動物の体液中におけるマーカー物質の濃度を指標して、被検物質が有する動脈硬化の改善効果又は将来の発症リスクの低減効果を評価する動脈硬化改善・予防効果の評価方法、該評価方法を簡便に行うことができる動脈硬化改善・予防効果の評価用キット、並びに、該評価方法を用いて動脈硬化の改善効果又は将来の発症リスクの低減効果を有する物質をスクリーニングする物質のスクリーニング方法に関する。
【背景技術】
【0002】
近年、食生活の欧米化が進み、それに起因すると考えられる肥満、糖尿病、高脂血症、動脈硬化等の生活習慣病が増加している。これらの発症増加は遺伝的なものではなく、主に環境因子によるものである。例えば、高脂肪食や高カロリー食の摂取による脂質代謝異常が、血中脂質上昇、インスリン抵抗性の発症、脂肪細胞肥大化、インスリン分泌不全等の原因となっている。その結果、糖尿病、肥満、動脈硬化等が高確率で発症し、病態の進展へとつながっている。
【0003】
動脈硬化とは、動脈壁が肥厚して弾力性がなくなる病態の総称である。動脈硬化にはいくつかの種類があるが、アテローム動脈硬化(粥状硬化)と呼ばれる病態が最も多くみられる。特に注記しない場合には、動脈硬化とはアテローム動脈硬化を指すことも多い。アテローム動脈硬化は、動脈内壁に粥状のプラーク(アテローム)が沈着して血流に支障をきたす状態であり、脳、心臓、腎臓、手足などに重篤な損傷をもたらすおそれがある。すなわち、脳梗塞、脳出血、心筋梗塞、狭心症、腎不全、手足の壊死など、生命に直接かかわる症状につながるおそれがある。動脈硬化が起こる原因については、まだ完全には解明されていない部分もあるが、上記のように肥満、糖尿病、高脂血症、高血圧等が発症の危険因子とされている。
【0004】
動脈硬化のような生活習慣病に属する疾病については、予防することの重要性が強調されている。すなわち、生活習慣病は徐々に進行するものが多く、発症初期には自覚症状があまりないことが多い。その結果、発見されたときにはすでに重篤な状態まで進んでいることがあり、予防の重要性が特に高い。このような背景の下、疾病の将来の発症リスクを検出することができるようなバイオマーカー、すなわち「予防マーカー」あるいは「リスクマーカー」と呼ばれるマーカー物質の探索が盛んに行われている。生活習慣病の予防マーカーを用いれば、例えば、当該疾病の将来の発症リスクを判定することが可能となり、事前に生活習慣の是正、食事制限、運動等の適切な処置を行って当該疾病の発症を予防することが可能となる。また、予防マーカーを用いることで、被検物質が当該疾病の発症リスクを低減させるような効果を有するか容易に調べることも可能となり、食品素材の機能性評価やスクリーニングにも有用である。そして、そのような評価・スクリーニング系で選抜された食品素材を含む食品を日常的に摂取することで、生活習慣病を容易に予防することが可能となる。
【0005】
生活習慣病関連では、例えば特許文献1に糖尿病の予防マーカー、特許文献2に高脂血症の予防マーカーについての開示がある。ただし、これらは動脈硬化に特化したバイオマーカーではない。一方、動脈硬化に特化したバイオマーカーを探索する試みもあり、例えば特許文献3には炎症のバイオマーカーであるC反応性タンパク(CRP)が、特許文献4には腫瘍マーカーであるα−フェトプロテイン(AFP)が動脈硬化のバイオマーカーとしても使えるとの記載がある。しかしながら、CRPやAFPについては動脈硬化とは全く異なる臨床的意義(炎症や発がん)が確立しており、動脈硬化のバイオマーカーとしては特異性の面で使いにくい。したがって、動脈硬化の将来の発症リスク診断や、被検物質が有する動脈硬化の改善効果又は将来の発症リスクの低減効果を可能にする新たなマーカー物質を特定することが望まれている。
【0006】
【特許文献1】国際公開第2006/073195号パンフレット
【特許文献2】特開2007−064747号公報
【特許文献3】特表2001−525058号公報
【特許文献4】特開2007−010567号公報
【発明の開示】
【発明が解決しようとする課題】
【0007】
本発明の目的は、動脈硬化の予防マーカーとなり得るマーカー物質を新たに特定し、該マーカー物質を用いて被検物質が有する動脈硬化の改善効果又は将来の発症リスクの低減効果を評価する方法等を提供することにある。
【課題を解決するための手段】
【0008】
上記した課題を解決するための請求項1に記載の発明は、動脈硬化を発症している動物又は将来の発症リスクが高い動物に被検物質を摂取させ、該動物の体液中における下記マーカー物質(M01)〜(M29)の少なくとも1つの濃度を基準値と比較し、被検物質が有する動脈硬化の改善効果又は将来の発症リスクの低減効果を評価することを特徴とする動脈硬化改善・予防効果の評価方法である。
(M01)pH9.0で強陰イオン交換体に結合し、かつ質量分析に供すると質量/電荷比が約3350のイオンピークを生じるタンパク質、
(M02)pH9.0で強陰イオン交換体に結合し、かつ質量分析に供すると質量/電荷比が約4170のイオンピークを生じるタンパク質、
(M03)pH9.0で強陰イオン交換体に結合し、かつ質量分析に供すると質量/電荷比が約4280のイオンピークを生じるタンパク質、
(M04)pH3.0で弱陽イオン交換体に結合し、かつ質量分析に供すると質量/電荷比が約4750のイオンピークを生じるタンパク質、
(M05)pH9.0で強陰イオン交換体に結合し、かつ質量分析に供すると質量/電荷比が約5130のイオンピークを生じるタンパク質、
(M06)pH3.0で弱陽イオン交換体に結合し、かつ質量分析に供すると質量/電荷比が約5200のイオンピークを生じるタンパク質、
(M07)pH3.0で弱陽イオン交換体に結合し、かつ質量分析に供すると質量/電荷比が約6020のイオンピークを生じるタンパク質、
(M08)pH9.0で強陰イオン交換体に結合し、かつ質量分析に供すると質量/電荷比が約6100のイオンピークを生じるタンパク質、
(M09)pH9.0で強陰イオン交換体に結合し、かつ質量分析に供すると質量/電荷比が約6860のイオンピークを生じるタンパク質、
(M10)pH3.0で弱陽イオン交換体に結合し、かつ質量分析に供すると質量/電荷比が約7010のイオンピークを生じるタンパク質、
(M11)pH3.0で弱陽イオン交換体に結合し、かつ質量分析に供すると質量/電荷比が約7100のイオンピークを生じるタンパク質、
(M12)pH3.0で弱陽イオン交換体に結合し、かつ質量分析に供すると質量/電荷比が約7570のイオンピークを生じるタンパク質、
(M13)pH3.0で弱陽イオン交換体に結合し、かつ質量分析に供すると質量/電荷比が約8440のイオンピークを生じるタンパク質、
(M14)pH3.0で弱陽イオン交換体に結合し、かつ質量分析に供すると質量/電荷比が約8530のイオンピークを生じるタンパク質、
(M15)pH3.0で弱陽イオン交換体に結合し、かつ質量分析に供すると質量/電荷比が約8720のイオンピークを生じるタンパク質、
(M16)pH9.0で強陰イオン交換体に結合し、かつ質量分析に供すると質量/電荷比が約8840のイオンピークを生じるタンパク質、
(M17)pH3.0で弱陽イオン交換体に結合し、かつ質量分析に供すると質量/電荷比が約10000のイオンピークを生じるタンパク質、
(M18)pH9.0で強陰イオン交換体に結合し、かつ質量分析に供すると質量/電荷比が約10500のイオンピークを生じるタンパク質、
(M19)pH3.0で弱陽イオン交換体に結合し、かつ質量分析に供すると質量/電荷比が約10700のイオンピークを生じるタンパク質、
(M20)pH9.0で強陰イオン交換体に結合し、かつ質量分析に供すると質量/電荷比が約11700のイオンピークを生じるタンパク質、
(M21)pH9.0で強陰イオン交換体に結合し、かつ質量分析に供すると質量/電荷比が約13700のイオンピークを生じるタンパク質、
(M22)pH9.0で強陰イオン交換体に結合し、かつ質量分析に供すると質量/電荷比が約14000のイオンピークを生じるタンパク質、
(M23)pH9.0で強陰イオン交換体に結合し、かつ質量分析に供すると質量/電荷比が約14200のイオンピークを生じるタンパク質、
(M24)pH9.0で強陰イオン交換体に結合し、かつ質量分析に供すると質量/電荷比が約20400のイオンピークを生じるタンパク質、
(M25)pH9.0で強陰イオン交換体に結合し、かつ質量分析に供すると質量/電荷比が約20900のイオンピークを生じるタンパク質、
(M26)pH3.0で弱陽イオン交換体に結合し、かつ質量分析に供すると質量/電荷比が約21400のイオンピークを生じるタンパク質、
(M27)pH3.0で弱陽イオン交換体に結合し、かつ質量分析に供すると質量/電荷比が約28200のイオンピークを生じるタンパク質、
(M28)pH3.0で弱陽イオン交換体に結合し、かつ質量分析に供すると質量/電荷比が約34400のイオンピークを生じるタンパク質、
(M29)pH9.0で強陰イオン交換体に結合し、かつ質量分析に供すると質量/電荷比が約66000のイオンピークを生じるタンパク質。
【0009】
本発明の動脈硬化改善・予防効果の評価方法は、動脈硬化を発症している動物又は将来の発症リスクが高い動物に被検物質を摂取させ、該動物の体液中における上記(M01)〜(M29)の29種のマーカー物質の少なくとも1つの濃度を基準値と比較し、被検物質が有する動脈硬化の改善効果又は将来の発症リスクの低減効果を評価するものである。上記マーカー物質(M01)〜(M29)は、いずれも動脈硬化の発症直前段階にある動物の体液中で特異的に検出されるタンパク質であり、動脈硬化の予防マーカー・リスクマーカーとして有用なものである。本発明の動脈硬化改善・予防効果の評価方法によれば、被検物質が有する動脈硬化の改善効果又は将来の発症リスクの低減効果を、容易かつ高精度に評価することができる。なお、「動物」には、マウス等の飼育可能な動物の他、ヒトも含むものとする。
【0010】
ここで、各マーカー物質における質量/電荷比(以下、「m/z」と略記することもある。)の「約3350」、「約8440」、「約66000」等の値は、質量分析における測定値の誤差範囲を考慮した値であり、概ね±0.2%の幅を有する。すなわち、約3350は概ね3350±0.2%、約8440は概ね8440±0.2%、約66000は概ね66000±0.2%を表す。他の質量/電荷比についても全く同様に、概ね±0.2%の幅を有する。また、これらのマーカー物質はいずれも主に血液中に存在するタンパク質である。被検物質が動脈硬化の改善効果又は将来の発症リスクの低減効果を有する場合、動物の体液中のマーカー物質(M02)、(M03)、(M08)、(M09)、(M10)、(M16)、(M22)、(M23)、及び(M29)の濃度はより低値を示し、(M01)、(M04)、(M05)、(M06)、(M07)、(M11)、(M12)、(M13)、(M14)、(M15)、(M17)、(M18)、(M19)、(M20)、(M21)、(M24)、(M25)、(M26)、(M27)、及び(M28)の濃度はより高値を示す。
【0011】
請求項2に記載の発明は、下記(a)〜(l)の少なくとも1つを満たすことを特徴とする請求項1に記載の動脈硬化改善・予防効果の評価方法である。
(a)マーカー物質(M06)はアポリポタンパク質A2又はその修飾体である、
(b)マーカー物質(M07)は血清アルブミン又はその修飾体である、
(c)マーカー物質(M09)はアポリポタンパク質C1又はその修飾体である、
(d)マーカー物質(M10)はアポリポタンパク質C1又はその修飾体である、
(e)マーカー物質(M15)はアポリポタンパク質A2又はその修飾体である、
(f)マーカー物質(M16)はアポリポタンパク質C3又はその修飾体である、
(g)マーカー物質(M21)はトランスサイレチン又はその修飾体である、
(h)マーカー物質(M22)はトランスサイレチン又はその修飾体である、
(i)マーカー物質(M23)はトランスサイレチン又はその修飾体である、
(j)マーカー物質(M25)はレチノール結合タンパク質又はその修飾体である、
(k)マーカー物質(M26)はレチノール結合タンパク質又はその修飾体である、
(l)マーカー物質(M27)はアポリポタンパク質A1又はその修飾体である。
【0012】
アポリポタンパク質A2、血清アルブミン、アポリポタンパク質C1、アポリポタンパク質C3、トランスサイレチン、レチノール結合タンパク質、及びアポリポタンパク質A1はいずれも物理化学的性質がよく知られているので、本発明の動脈硬化改善・予防効果の評価方法によればマーカー物質(M06)、(M07)、(M09)、(M10)、(M15)、(M16)、(M21)、(M22)、(M23)、(M25)、(M26)、及び(M27)の解析が容易である。
【0013】
「タンパク質の修飾体」の代表例は、当該タンパク質を構成するアミノ酸残基の少なくとも1つが修飾されたタンパク質である。「修飾」には化合物や官能基の付加(例:リン酸化)のみならず、脱離(例:脱リン酸化)も含まれる。また「タンパク質又はその修飾体」には、当該タンパク質のアイソフォームが含まれる。さらに「タンパク質又はその修飾体」には、当該タンパク質の1次構造において数個のアミノ酸残基が欠失、置換若しくは付加されたような実質的に同一のタンパク質が含まれる。またさらに、「タンパク質又はその修飾体」には、プロテアーゼによる切断を受けた当該タンパク質由来のタンパク質断片が含まれる。なお、複合体タンパク質の場合には「タンパク質又はその修飾体」にはそのサブユニットも含まれるものとする。
【0014】
同様の課題を解決するための請求項3に記載の発明は、動脈硬化を発症している動物又は将来の発症リスクが高い動物に被検物質を摂取させ、該動物の体液中における下記(N1)〜(N7)のいずれかに属する少なくとも1つのマーカー物質の濃度を基準値と比較し、被検物質が有する動脈硬化の改善効果又は将来の発症リスクの低減効果を評価することを特徴とする動脈硬化改善・予防効果の評価方法である。
(N1)アポリポタンパク質A2又はその修飾体、
(N2)血清アルブミン又はその修飾体、
(N3)アポリポタンパク質C1又はその修飾体、
(N4)アポリポタンパク質C3又はその修飾体、
(N5)トランスサイレチン又はその修飾体、
(N6)レチノール結合タンパク質又はその修飾体、
(N7)アポリポタンパク質A1又はその修飾体。
【0015】
本発明の動脈硬化改善・予防効果の評価方法は、動脈硬化を発症している動物又は将来の発症リスクが高い動物に被検物質を摂取させ、該動物の体液中における上記(N1)〜(N7)のいずれかに属する少なくとも1つのマーカー物質の濃度を基準値と比較し、被検物質が有する動脈硬化の改善効果又は将来の発症リスクの低減効果を評価するものである。上記(N1)〜(N7)に属するマーカー物質は、いずれも動脈硬化の発症直前段階にある動物の体液中で特異的に検出されるタンパク質であり、動脈硬化の予防マーカー・リスクマーカーとして有用なものである。本発明の動脈硬化改善・予防効果の評価方法によれば、被検物質が有する動脈硬化の改善効果又は将来の発症リスクの低減効果を、容易かつ高精度に評価することができる。特に、アポリポタンパク質A2、血清アルブミン、アポリポタンパク質C1、アポリポタンパク質C3、トランスサイレチン、レチノール結合タンパク質、及びアポリポタンパク質A1はいずれも物理化学的性質がよく知られているので、解析が容易である。なお本発明においても、「動物」には、マウス等の飼育可能な動物の他、ヒトも含むものとする。(N1)〜(N7)に属するマーカー物質は、いずれも主に血液中に存在する。
【0016】
本発明においても「タンパク質の修飾体」の代表例は、当該タンパク質を構成するアミノ酸残基の少なくとも1つが修飾されたタンパク質であり、「修飾」には化合物や官能基の付加のみならず、脱離も含まれる。また「タンパク質又はその修飾体」には、当該タンパク質のアイソフォーム、当該タンパク質の1次構造において数個のアミノ酸残基が欠失、置換若しくは付加されたような実質的に同一のタンパク質、並びに、プロテアーゼによる切断を受けた当該タンパク質由来のタンパク質断片が含まれる。さらに、複合体タンパク質の場合には「タンパク質又はその修飾体」にはそのサブユニットも含まれるものとする。
【0017】
請求項4に記載の発明は、前記基準値は、動脈硬化を発症している動物又は将来の発症リスクが高い動物に、動脈硬化の改善効果又は将来の発症リスクの低減効果を有さない既知物質を摂取させた際の、該動物の体液中における前記マーカー物質の濃度であることを特徴とする請求項1〜3のいずれか1項に記載の動脈硬化改善・予防効果の評価方法である。
【0018】
かかる構成により、被検物質が有する動脈硬化の改善効果又は将来の発症リスクの低減効果を、より容易かつ高精度に評価することができる。
【0019】
請求項5に記載の発明は、前記動脈硬化を発症している動物又は将来の発症リスクが高い動物は、自然発症モデル動物又は遺伝子操作モデル動物であることを特徴とする請求項1〜4のいずれか1項に記載の動脈硬化改善・予防効果の評価方法である。
【0020】
本発明の動脈硬化改善・予防効果の評価方法では、動脈硬化を発症している動物又は将来の発症リスクが高い動物として、自然発症モデル動物又は遺伝子操作モデル動物を用いる。かかる構成により、動物の飼育が容易となり、被検物質が有する動脈硬化の改善効果又は将来の発症リスクの低減効果を、きわめて容易に評価することができる。なお当該動物の例としては、アポリポタンパク質E遺伝子欠損マウス(以下、「アポE欠損マウス」と略記する。)が挙げられる。アポE欠損マウスは通常の飼育でアテロームを形成し、動脈硬化発症モデル動物の標準として各分野で採用されているものである。
【0021】
請求項6に記載の発明は、前記体液は、血液であることを特徴とする請求項1〜5のいずれか1項に記載の動脈硬化改善・予防効果の評価方法である。
【0022】
かかる構成により、測定試料となる体液を簡単に採取でき、より簡便かつ迅速に、被検物質が有する動脈硬化の改善効果又は将来の発症リスクの低減効果を評価することができる。
【0023】
請求項7に記載の発明は、前記被検物質は、食品素材であることを特徴とする請求項1〜6のいずれか1項に記載の動脈硬化改善・予防効果の評価方法である。
【0024】
かかる構成により、機能性食品の開発を目的として、被検物質が有する動脈硬化の改善効果又は将来の発症リスクの低減効果を評価することができる。
【0025】
請求項8に記載の発明は、前記体液又は体液成分を、前記マーカー物質に対する親和性を有する物質を固定化した担体に接触させて、体液中の前記マーカー物質を担体上に捕捉し、捕捉された前記マーカー物質の量に基づいて体液中の前記マーカー物質の濃度を算出することを特徴とする請求項1〜7のいずれか1項に記載の動脈硬化改善・予防効果の評価方法である。
【0026】
本発明の動脈硬化改善・予防効果の評価方法においては、マーカー物質に対する親和性を有する物質を固定化した担体を使用する。そして、該担体に体液又は体液成分を接触させて、体液又は体液成分に含まれるマーカー物質を、マーカー物質に対する親和性を有する物質を介して担体上に捕捉し、捕捉されたマーカー物質の量に基づいて体液中のマーカー物質の濃度を算出する。本発明の動脈硬化改善・予防効果の評価方法によれば、担体上に捕捉されたマーカー物質を測定対象とするので、測定試料中に含まれる夾雑物質の影響を低減させることができ、より高感度かつ高精度でマーカー物質の濃度を測定することができる。なお、体液成分の例としては、体液が血液である場合の血清又は血漿が挙げられる。
【0027】
請求項9に記載の発明は、前記担体は平面部分を有し、前記マーカー物質に対する親和性を有する物質は、該平面部分の一部に固定化されていることを特徴とする請求項8に記載の動脈硬化改善・予防効果の評価方法である。
【0028】
本発明の動脈硬化改善・予防効果の評価方法では、平面部分を有する担体を用い、マーカー物質に対する親和性を有する物質は該平面部分の一部に固定化されている。かかる構成により、マーカー物質に対する親和性を有する物質を、担体上の複数箇所にスポット的に固定化することができる。その結果、1個の担体で複数の測定試料を同時処理することや、1個の担体で複数のマーカー物質の濃度を同時測定することが可能となり、作業効率がよい。さらに、各スポットの面積を小さくすることにより、微量の測定試料からでもマーカー物質の濃度を測定することができる。なお、平面部分を有する担体の例としては、チップ等の基板が挙げられる。
【0029】
請求項10に記載の発明は、前記マーカー物質に対する親和性を有する物質は、イオン交換体又は抗体であることを特徴とする請求項8又は9に記載の動脈硬化改善・予防効果の評価方法である。
【0030】
本発明の動脈硬化改善・予防効果の評価方法においては、マーカー物質に対する親和性を有する物質としてイオン交換体又は抗体を用い、イオン交換体又は抗体を介して測定試料中のマーカー物質を担体上に捕捉する。当該物質がイオン交換体の場合は各種のものが入手容易であり、マーカー物質を捕捉するための担体を容易に調製することができる。また、当該物質が抗体の場合は、より特異的にマーカー物質を捕捉することができる。捕捉されたマーカー物質の量を測定する方法としては、質量分析、イムノアッセイ(抗体の場合)が挙げられる。
【0031】
請求項11に記載の発明は、請求項1〜10のいずれか1項に記載の動脈硬化改善・予防効果の評価方法によって被検物質を評価し、動脈硬化の改善効果又は将来の発症リスクの低減効果を有する物質をスクリーニングすることを特徴とする物質のスクリーニング方法である。
【0032】
本発明は物質のスクリーニング方法にかかり、動物の体液中における上記(M01)〜(M29)の各マーカー物質および上記(N1)〜(N7)に属する各マーカー物質の少なくとも1つの濃度を基準値と比較し、動脈硬化の改善効果又は将来の発症リスクの低減効果を有する物質をスクリーニングするものである。上記(M01)〜(M29)の各マーカー物質および上記(N1)〜(N7)に属する各マーカー物質は、いずれも動脈硬化の発症直前段階にある動物の体液中で特異的に検出されるタンパク質であり、動脈硬化の予防マーカー・リスクマーカーとして有用なものである。本発明の物質のスクリーニング方法によれば、動脈硬化の改善効果又は将来の発症リスクの低減効果を有する物質を、容易かつ高精度にスクリーニングすることができる。特に、被検物質が食品素材の場合は、動脈硬化の改善効果を有する機能性食品又は将来の発症リスクの低減効果を有する機能性食品の開発に有用な食品素材をスクリーニングすることができる。
【0033】
請求項12に記載の発明は、請求項1〜10のいずれか1項に記載の動脈硬化改善・予防効果の評価方法に用いるためのキットであって、前記マーカー物質に対する親和性を有する物質を固定化した担体を含むことを特徴とする動脈硬化改善・予防効果の評価用キットである。
【0034】
本発明の動脈硬化改善・予防効果の評価用キットは、マーカー物質に対する親和性を有する物質を固定化した担体を含む。かかる構成により、マーカー物質の濃度測定に際して当該担体を別途用意する必要がなく、きわめて簡便にマーカー物質の濃度を測定することができる。
【0035】
請求項13に記載の発明は、前記マーカー物質に対する親和性を有する物質は、イオン交換体であることを特徴とする請求項12に記載の動脈硬化改善・予防効果の評価用キットである。
【0036】
かかる構成により、マーカー物質をより確実に担体上に捕捉することができる。
【0037】
動脈硬化の改善効果又は将来の発症リスクの低減効果を有する物質をスクリーニングするために使用される構成が推奨される(請求項14)。
【発明の効果】
【0038】
本発明の動脈硬化改善・予防効果の評価方法によれば、被検物質が有する動脈硬化の改善効果又は将来の発症リスクの低減効果を、容易かつ高精度に評価することができる。
【0039】
本発明の物質のスクリーニング方法によれば、動脈硬化の改善効果又は将来の発症リスクの低減効果を有する物質を、容易かつ高精度にスクリーニングすることができる。
【0040】
本発明の動脈硬化改善・予防効果の評価用キットによれば、マーカー物質の濃度測定に際して当該担体を別途用意する必要がなく、きわめて簡便にマーカー物質の濃度を測定することができる。
【発明を実施するための最良の形態】
【0041】
以下、本発明を実施するための最良の形態について詳細に説明する。
【0042】
本発明の動脈硬化改善・予防効果の評価方法は2つの様相を含む。1つの様相では、動脈硬化を発症している動物又は将来の発症リスクが高い動物に被検物質を摂取させ、該動物の体液中における下記マーカー物質(M01)〜(M29)の少なくとも1つの濃度を基準値と比較し、被検物質が有する動脈硬化の改善効果又は将来の発症リスクの低減効果を評価する。
(M01)pH9.0で強陰イオン交換体に結合し、かつ質量分析に供すると質量/電荷比が約3350のイオンピークを生じるタンパク質、
(M02)pH9.0で強陰イオン交換体に結合し、かつ質量分析に供すると質量/電荷比が約4170のイオンピークを生じるタンパク質、
(M03)pH9.0で強陰イオン交換体に結合し、かつ質量分析に供すると質量/電荷比が約4280のイオンピークを生じるタンパク質、
(M04)pH3.0で弱陽イオン交換体に結合し、かつ質量分析に供すると質量/電荷比が約4750のイオンピークを生じるタンパク質、
(M05)pH9.0で強陰イオン交換体に結合し、かつ質量分析に供すると質量/電荷比が約5130のイオンピークを生じるタンパク質、
(M06)pH3.0で弱陽イオン交換体に結合し、かつ質量分析に供すると質量/電荷比が約5200のイオンピークを生じるタンパク質、
(M07)pH3.0で弱陽イオン交換体に結合し、かつ質量分析に供すると質量/電荷比が約6020のイオンピークを生じるタンパク質、
(M08)pH9.0で強陰イオン交換体に結合し、かつ質量分析に供すると質量/電荷比が約6100のイオンピークを生じるタンパク質、
(M09)pH9.0で強陰イオン交換体に結合し、かつ質量分析に供すると質量/電荷比が約6860のイオンピークを生じるタンパク質、
(M10)pH3.0で弱陽イオン交換体に結合し、かつ質量分析に供すると質量/電荷比が約7010のイオンピークを生じるタンパク質、
(M11)pH3.0で弱陽イオン交換体に結合し、かつ質量分析に供すると質量/電荷比が約7100のイオンピークを生じるタンパク質、
(M12)pH3.0で弱陽イオン交換体に結合し、かつ質量分析に供すると質量/電荷比が約7570のイオンピークを生じるタンパク質、
(M13)pH3.0で弱陽イオン交換体に結合し、かつ質量分析に供すると質量/電荷比が約8440のイオンピークを生じるタンパク質、
(M14)pH3.0で弱陽イオン交換体に結合し、かつ質量分析に供すると質量/電荷比が約8530のイオンピークを生じるタンパク質、
(M15)pH3.0で弱陽イオン交換体に結合し、かつ質量分析に供すると質量/電荷比が約8720のイオンピークを生じるタンパク質、
(M16)pH9.0で強陰イオン交換体に結合し、かつ質量分析に供すると質量/電荷比が約8840のイオンピークを生じるタンパク質、
(M17)pH3.0で弱陽イオン交換体に結合し、かつ質量分析に供すると質量/電荷比が約10000のイオンピークを生じるタンパク質、
(M18)pH9.0で強陰イオン交換体に結合し、かつ質量分析に供すると質量/電荷比が約10500のイオンピークを生じるタンパク質、
(M19)pH3.0で弱陽イオン交換体に結合し、かつ質量分析に供すると質量/電荷比が約10700のイオンピークを生じるタンパク質、
(M20)pH9.0で強陰イオン交換体に結合し、かつ質量分析に供すると質量/電荷比が約11700のイオンピークを生じるタンパク質、
(M21)pH9.0で強陰イオン交換体に結合し、かつ質量分析に供すると質量/電荷比が約13700のイオンピークを生じるタンパク質、
(M22)pH9.0で強陰イオン交換体に結合し、かつ質量分析に供すると質量/電荷比が約14000のイオンピークを生じるタンパク質、
(M23)pH9.0で強陰イオン交換体に結合し、かつ質量分析に供すると質量/電荷比が約14200のイオンピークを生じるタンパク質、
(M24)pH9.0で強陰イオン交換体に結合し、かつ質量分析に供すると質量/電荷比が約20400のイオンピークを生じるタンパク質、
(M25)pH9.0で強陰イオン交換体に結合し、かつ質量分析に供すると質量/電荷比が約20900のイオンピークを生じるタンパク質、
(M26)pH3.0で弱陽イオン交換体に結合し、かつ質量分析に供すると質量/電荷比が約21400のイオンピークを生じるタンパク質、
(M27)pH3.0で弱陽イオン交換体に結合し、かつ質量分析に供すると質量/電荷比が約28200のイオンピークを生じるタンパク質、
(M28)pH3.0で弱陽イオン交換体に結合し、かつ質量分析に供すると質量/電荷比が約34400のイオンピークを生じるタンパク質、
(M29)pH9.0で強陰イオン交換体に結合し、かつ質量分析に供すると質量/電荷比が約66000のイオンピークを生じるタンパク質。
【0043】
これらのマーカー物質はいずれも主に血液中に存在するタンパク質であり、動脈硬化の発症直前段階にある動物体内で特異的に検出されるものである。なお、(M02)、(M03)、(M08)、(M09)、(M10)、(M16)、(M22)、(M23)、及び(M29)の各マーカー物質(以下、これらのマーカー物質からなるグループを「グループ1」と称することがある。)は、動脈硬化を発症している状態又は動脈硬化の将来の発症リスクが高い状態でより高値を示すものであるので、被検物質が動脈硬化の改善効果又は将来の発症リスクの低減効果を有する場合には、当該被検物質を摂取させた動物においてより低値を示す。一方、(M01)、(M04)、(M05)、(M06)、(M07)、(M11)、(M12)、(M13)、(M14)、(M15)、(M17)、(M18)、(M19)、(M20)、(M21)、(M24)、(M25)、(M26)、(M27)、及び(M28)の各マーカー物質(以下、これらのマーカー物質からなるグループを「グループ2」と称することがある。)は、動脈硬化を発症している状態又は動脈硬化の将来の発症リスクが高い状態でより低値を示すものであるので、被検物質が動脈硬化の改善効果又は将来の発症リスクの低減効果を有する場合には、当該被検物質を摂取させた動物においてより高値を示す。
【0044】
N末端アミノ酸解析の結果と質量/電荷比の情報から、マーカー物質(M06)はアポリポタンパク質A2の断片と同定され得る。また、ある条件のペプチドマッピングによれば、マーカー物質(M07)は血清アルブミン、マーカー物質(M09)と(M10)はアポリポタンパク質C1、マーカー物質(M15)はアポリポタンパク質A2、マーカー物質(M16)はアポリポタンパク質C3、マーカー物質(M21)〜(M23)はトランスサイレチン、マーカー物質(M25)と(M26)はレチノール結合タンパク質、(M27)はアポリポタンパク質A1と同定される。すなわち、ある実施形態では、下記(a)〜(l)の少なくとも1つを満たす。
(a)マーカー物質(M06)はアポリポタンパク質A2又はその修飾体である、
(b)マーカー物質(M07)は血清アルブミン又はその修飾体である、
(c)マーカー物質(M09)はアポリポタンパク質C1又はその修飾体である、
(d)マーカー物質(M10)はアポリポタンパク質C1又はその修飾体である、
(e)マーカー物質(M15)はアポリポタンパク質A2又はその修飾体である、
(f)マーカー物質(M16)はアポリポタンパク質C3又はその修飾体である、
(g)マーカー物質(M21)はトランスサイレチン又はその修飾体である、
(h)マーカー物質(M22)はトランスサイレチン又はその修飾体である、
(i)マーカー物質(M23)はトランスサイレチン又はその修飾体である、
(j)マーカー物質(M25)はレチノール結合タンパク質又はその修飾体である、
(k)マーカー物質(M26)はレチノール結合タンパク質又はその修飾体である、
(l)マーカー物質(M27)はアポリポタンパク質A1又はその修飾体である。
【0045】
本発明の動脈硬化改善・予防効果の評価方法の他の様相では、動脈硬化を発症している動物又は将来の発症リスクが高い動物に被検物質を摂取させ、該動物の体液中における下記(N1)〜(N7)のいずれかに属する少なくとも1つのマーカー物質の濃度を基準値と比較し、被検物質が有する動脈硬化の改善効果又は将来の発症リスクの低減効果を評価する。
(N1)アポリポタンパク質A2又はその修飾体、
(N2)血清アルブミン又はその修飾体、
(N3)アポリポタンパク質C1又はその修飾体、
(N4)アポリポタンパク質C3又はその修飾体、
(N5)トランスサイレチン又はその修飾体、
(N6)レチノール結合タンパク質又はその修飾体、
(N7)アポリポタンパク質A1又はその修飾体。
【0046】
タンパク質の修飾の例としては、N末端αアミノ基やリジンεアミノ基のメチル化、アセチル化、アデニリル化、ミリスチル化等;セリン・スレオニン・アスパラギンへの糖又は糖鎖の付加;セリン・スレオニン・チロシン・アルギニン・ヒスチジンのリン酸化;システインのシステイニル化、ホモシステイニル化、スルホニル化等;グルタミン酸のγ−カルボキシル化;N末端グルタミン酸のピログルタミン酸への変換、等が挙げられる。また、これらの修飾の脱離(脱メチル化、糖又は糖鎖の脱離、脱リン酸化等)も「修飾」に含まれる。
【0047】
「タンパク質又はその修飾体」には、当該タンパク質のアイソフォームが含まれる。アイソフォームとしては、前記した各種の修飾の他、選択的スプライシングによって生じたタンパク質が挙げられる。さらに、「タンパク質又はその修飾体」には、当該タンパク質の1次構造において数個のアミノ酸残基が欠失、置換若しくは付加されたような実質的に同一のタンパク質が含まれる。またさらに、「タンパク質又はその修飾体」には、プロテアーゼによる切断を受けた当該タンパク質由来のタンパク質断片が含まれる。例えば、当該タンパク質由来と認められうる長さのタンパク質断片、例えば20個以上のアミノ酸残基からなるタンパク質断片、分子量が2千以上のタンパク質断片、等が挙げられる。また、複合体タンパク質の場合には「タンパク質又はその修飾体」にはそのサブユニットも含まれるものとする。
【0048】
例えば、血清アルブミン(配列番号6)のアミノ酸番号554(Ala)から565(Ala)の部分に相当するタンパク質断片(配列番号8)は「血清アルブミンの修飾体」に含まれる。
【0049】
例えば、シグナル配列が切断された後のアポリポタンパク質C1(配列番号14)のN末端アミノ酸配列は「Ala−Pro」から始まるが、これら2つのアミノ酸は切断され得ることが報告されている(Oleg Chertov et al., Proteomics, Vol. 4, No. 4, 2004)。このようなN末端の2アミノ酸が欠損したアポリポタンパク質C1の断片(配列番号15)は「アポリポタンパク質C1の修飾体」に含まれる。
【0050】
トランスサイレチン(配列番号30)については、その唯一のCys残基が修飾を受けた種々の修飾トランスサイレチンが見出されている(Amareth Lim et al., J. Biol. Chem., vol. 258, No. 50, 2003)。例えば、トランスサイレチンのCys残基にスルホン基が付加した「S−スルホン化トランスサイレチン」や、グルタチオンが付加した「グルタチオン化トランスサイレチン」は、「トランスサイレチンの修飾体」に含まれる。
【0051】
レチノール結合タンパク質(配列番号38)については、その一部のアミノ酸残基が欠損した数種類のタンパク質断片が血清中に見出されている。これらのタンパク質断片は「レチノール結合タンパク質の修飾体」に含まれる。
【0052】
本発明の動脈硬化改善・予防効果の評価方法では、(M01)〜(M29)の各マーカー物質並びに(N1)〜(N7)に属する各マーカー物質の1つだけを用いてもよいし、複数を組み合わせて用いてもよい。複数を用いる場合の組み合わせ方については特に限定はないが、例えば、グループ1から選択したマーカー物質(1つ又は複数)とグループ2から選択したマーカー物質(1つ又は複数)とを組み合わせることができる。
【0053】
本発明の動脈硬化改善・予防効果の評価方法の好ましい実施形態では、上記基準値として、動脈硬化を発症している動物又は将来の発症リスクが高い動物に、動脈硬化の改善効果又は将来の発症リスクの低減効果を有さない既知物質を摂取させた際の、該動物の体液中における前記マーカー物質の濃度を用いる。すなわち、動脈硬化を発症している動物又は将来の発症リスクが高い動物に、動脈硬化の改善効果又は将来の発症リスクの低減効果を有さない既知物質を摂取させた場合、その体液中の上記マーカー物質の濃度は「異常値」となる。そして、被検物質を摂取させた上記動物における値(測定値)と当該基準値(異常値)とを比較し、測定値が基準値と有意に差がありかつ正常側である場合(正常側に維持された場合)に、当該被検物質が動脈硬化の改善効果又は将来の発症リスクの低減効果を有すると評価することができる。具体的には、グループ1に属するマーカー物質を指標とする場合は、測定値が当該基準値に比べて有意に低いときに、一方、グループ2に属するマーカー物質を指標とする場合は、測定値が基準値に比べて有意に高いときに、当該被検物質が動脈硬化の改善効果又は将来の発症リスクの低減効果を有すると評価することができる。
【0054】
さらに、基準値は複数あってもよい。例えば、上記の異常値に加え、動脈硬化を発症していない動物又は動脈硬化の発症リスクが低い動物における値(正常値。陰性対照。)を基準値に加えることができる。具体的には、(1)動脈硬化を発症していない動物又は動脈硬化の発症リスクが低い動物に、普通食又は被検物質を摂取させる群(正常値を示す群)、(2)動脈硬化を発症している動物又は動脈硬化の発症リスクが高い動物に、動脈硬化の改善効果又は将来の発症リスクの低減効果を有さない既知物質を摂取させる群(異常値を示す群)、及び、(3)動脈硬化を発症している動物又は動脈硬化の発症リスクが高い動物に被検物質を摂取させる群、の計3群を設定し、動物を飼育する。そして、各動物の体液中の上記マーカー物質を測定し、各測定値を比較する。このとき、(1)と(2)とで有意差があり、(3)と(2)とで有意差があり、かつ(3)が(2)に比べて正常側((1)に近い側)である場合(正常側に維持された場合)に、当該被検物質が動脈硬化の改善効果又は将来の発症リスクの低減効果を有すると評価することができる。
【0055】
さらに、基準値として、(4)動脈硬化を発症している動物又は将来の発症リスクが高い動物に、動脈硬化の改善効果又は将来の発症リスクの低減効果を有する既知物質を摂取させる群、の動物における値(陽性対照)を加えることもできる。具体的には、上記(1)〜(3)に加えて、上記(4)の群を設定し、動物を飼育する。このとき、(1)と(2)とで有意差があり、(3)と(2)とで有意差があり、かつ(3)が(2)に比べて正常側((1)及び(4)に近い側)である場合に、当該被検物質が動脈硬化の改善効果又は将来の発症リスクの低減効果を有すると評価することができる。すなわち、このような被検物質は、(4)で採用した上記既知物質と同様の挙動を示し、同様の作用を有する物質といえる。「動脈硬化の改善効果又は将来の発症リスクの低減効果を有する既知物質」の例としては、アゼルニジピン等の降圧剤(カルシウム拮抗薬)が挙げられる。
【0056】
「動脈硬化を発症している動物又は将来の発症リスクが高い動物」における動物の種類には特に限定はなく、例えば、マウス、ラット、ウサギ、ブタ等を採用することができる。また、「動脈硬化を発症している動物又は将来の発症リスクが高い動物」としては、動脈硬化の自然発症モデル動物、あるいはトランスジェニックやジーンターゲッティングによる遺伝子操作モデル動物が好ましく用いられる。当該動物の具体例としては、アポE欠損マウスが挙げられる。アポE欠損マウスは通常飼育で動脈硬化を発症するので、飼育実験を容易に行うことができ、特に好適である。
【0057】
なお、アポE欠損マウスを通常飼育するといずれ動脈硬化を発症するが、その発症は飼育20週目ごろから検出可能となることが分かっている(例えば、Arteriosclerosis, Thrombosis, and Vascular Biology; 2004; 24; 1006-1014)。よって、飼育20週目以前、例えば飼育14週目のアポE欠損マウスは、動脈硬化の発症直前段階にあるといえる。本発明の動脈硬化改善・予防効果の評価方法で用いるマーカー物質(M01)〜(M29)及び(N1)〜(N7)のいずれかに属するマーカー物質は、飼育14週目のアポE欠損マウスの体液中に存在し、動脈硬化の発症直前段階にないマウス(例えば、正常マウス)と比較してその体液中の濃度に有意差を示す。したがって、本発明においてアポE欠損マウスを用いる場合には、例えば、飼育14週目ごろの体液を測定試料として各マーカー物質の濃度を測定すればよい。
【0058】
一方、高コレステロール食を摂取するとアテローム形成するような動脈硬化自然発症モデル動物を用いることもできる。この場合には、例えば、被検物質とコレステロールとを同時摂取させることにより、被検物質が有する動脈硬化の改善効果又は将来の発症リスクの低減効果を評価することができる。さらに、動物としてヒトを採用することもできる。この場合には、臨床試験の結果によって物質を評価することになる。
【0059】
本発明の動脈硬化改善・予防効果の評価方法において使用する動物の体液としては、血液が好ましく用いられる。特に、血液から調製した血清又は血漿(体液成分)を測定試料とすることが好ましい。血清又は血漿は遠心分離等の公知の方法で血液から調製することができる。
【0060】
本発明の動脈硬化改善・予防効果の評価方法における被検物質としては、食品素材、医薬原体などが挙げられる。特に、食品素材を評価対象とする場合は、機能性食品の開発に役立てることができる。
【0061】
本発明の動脈硬化改善・予防効果の評価方法において、マーカー物質の濃度を測定する方法は、そのマーカー物質の濃度を特異的に測定できる方法であれば、タンパク質の定量に一般に用いられている方法をそのまま用いることができる。例えば、各種のイムノアッセイ、質量分析(MS)、クロマトグラフィー、電気泳動等を用いることができる。
【0062】
イムノアッセイによれば、夾雑物質の多い試料のままでも正確にマーカー物質の濃度を測定することができる。イムノアッセイの例としては、抗原抗体結合物を直接的又は間接的に測定する沈降反応、凝集反応、溶血反応などの古典的な方法や、標識法と組み合わせて検出感度を高めたエンザイムイムノアッセイ(EIA)、ラジオイムノアッセイ(RIA)、蛍光イムノアッセイ(FIA)等の方法が挙げられる。なお、これらのイムノアッセイに用いるマーカー物質に特異的な抗体は、モノクローナルでもよいし、ポリクローナルでもよい。
【0063】
質量分析によれば、各マーカー物質由来のイオンピークを特定し、そのイオンピーク強度をもって各マーカー物質の量(濃度)を測定することができる。質量分析によってマーカー物質の濃度を測定する場合のイオン化の方法としては、マトリクス支援レーザーイオン化(matrix-assisted laser desorption/ionization、MALDI)、エレクトロスプレーイオン化(electrospray ionization、ESI)のいずれも適用可能であるが、多価イオンの生成が少ないMALDIが好ましい。特に、飛行時間質量分析計(time-of-flight mass spectrometer、TOF)と組み合わせたMALDI−TOF−MSによれば、より正確にマーカー物質由来のイオンピークを特定することができる。
【0064】
電気泳動によりマーカー物質の濃度を測定する場合は、例えば、検査材料をSDS−ポリアクリルアミドゲル電気泳動(SDS−PAGE)に供して目的のマーカー物質を分離し、適宜の色素や蛍光物質でゲルを染色し、目的のマーカー物質に相当するバンドの濃さや蛍光強度を測定すればよい。SDS−PAGEだけではマーカー物質の分離が不十分な場合は、等電点電気泳動(IEF)と組み合わせた2次元電気泳動を用いることもできる。さらに、ゲルから直接検出するのではなく、ウエスタンブロッティングを行って膜上のマーカー物質の量を測定することもできる。
【0065】
クロマトグラフィーによってマーカー物質の濃度を測定する場合は、例えば、液体高速クロマトグラフィー(HPLC)による方法を用いることができる。すなわち、試料をHPLCに供して目的のマーカー物質を分離し、そのクロマトグラムのピーク面積を測定することにより試料中のマーカー物質の濃度を測定することができる。
【0066】
好ましい実施形態では、マーカー物質を担体上に捕捉し、その捕捉されたマーカー物質を測定対象とする。すなわち、マーカー物質に対する親和性を有する物質を担体に固定化し、その親和性を有する物質を介してマーカー物質を担体上に捕捉する。そして、捕捉された前記マーカー物質の量に基づいて体液中の前記マーカー物質の濃度を算出する。本実施形態によれば、試料中に含まれる夾雑物質の影響を低減させることができ、より高感度かつ高精度でマーカー物質の濃度を測定することができる。本実施形態において用いることができる担体の例としては、ビーズ、金属、ガラス、樹脂等のような一般的なものの他、基板のような、平面部分を有する担体を用いることができる。基板を用いる場合は、その平面部分の一部にマーカー物質に対する親和性を有する物質を固定化することが好ましい。例としては、基板としてチップを用い、その表面の複数箇所にスポット的にマーカー物質に親和性を有する物質を固定化した担体が挙げられる。なお「親和性」の例としては、イオン結合、金属キレート体とタンパク質中のヒスチジン残基等とのアフィニティ、抗原と抗体、酵素と基質、若しくはホルモンとレセプターのようなバイオアフィニティ、及び、疎水性相互作用のような化学的な相互作用、が挙げられる。
【0067】
イオン結合によってマーカー物質を担体に捕捉する場合は、イオン交換体を担体に固定化する。この場合、イオン交換体には陽イオン交換体、陰イオン交換体のいずれも用いることができ、さらに、強陽イオン交換体、弱陽イオン交換体、強陰イオン交換体、弱陰イオン交換体のいずれも用いることができるが、強陰イオン交換体と弱陽イオン交換体が好ましく用いられる。強陰イオン交換体の例としては、4級アンモニウム(トリメチルアミノメチル)(QA)、4級アミノエチル(ジエチル,モノ・2−ヒドロキシブチルアミノエチル)(QAE)、4級アンモニウム(トリメチルアンモニウム)(QMA)等の強陰イオン交換基を有するものが挙げられる。また、弱陽イオン交換体の例としては、カルボキシメチル(CM)等の弱陽イオン交換基を有するものが挙げられる。また、強陽イオン交換体の例としては、スルホプロピル(SP)等の強陽イオン交換基を有するものが挙げられる。さらに、弱陰イオン交換体の例としては、ジメチルアミノエチル(DE)、ジエチルアミノエチル(DEAE)等の弱陰イオン交換基を有するものが挙げられる。
【0068】
金属キレート体を介してマーカー物質を捕捉する場合は、例えば、Cu2+、Zn2+、Ni2+、Co2+、Al3+、Fe3+、Ga3+等の金属キレート体を固定化した担体を用いることができる。
【0069】
抗体によってマーカー物質を担体に捕捉する場合は、マーカー物質に特異的な抗体を担体に固定化すればよい。
【0070】
疎水性相互作用によってマーカー物質を担体に捕捉する場合は、担体に疎水基をもつ物質を固定化する。疎水基の例としては、C4〜C20のアルキル基、フェニル基等が挙げられる。
【0071】
本実施形態においてマーカー物質の測定方法にイムノアッセイを用いる場合は、抗体を固定化した担体を用いることが好ましい。このようにすれば、担体に固定化された抗体を1次抗体としたイムノアッセイの系を簡単に構築することができる。例えば、マーカー物質に特異的でエピトープの異なる2種類の抗体を用意し、一方を1次抗体として担体に固定化し、他方を2次抗体として酵素標識し、サンドイッチEIAの系を構築することができる。その他、結合阻止法や競合法によるイムノアッセイの系も構築可能である。さらに、担体として基板を用いる場合は、抗体チップによるイムノアッセイが可能である。抗体チップによれば、複数のマーカー物質の濃度を同時に測定でき、迅速な測定が可能である。
【0072】
一方、本実施形態において質量分析を用いる場合は、例えば、抗体の他、イオン交換体、金属キレート体又は疎水基を固定化した担体を用いることができる。なお、これらの物質による結合は抗原と抗体等のバイオアフィニティほどの特異性がないので、これらの物質を固定化した担体を用いる場合はマーカー物質以外の物質も担体上に捕捉されうるが、質量分析によれば分子量を反映した質量分析計スペクトルによって定量するので、問題はない。特に、担体として基板を用い、表面エンハンス型レーザー脱離イオン化(surface-enhanced laser desorption/ionization)−飛行時間質量分析(time-of-flight mass spectrometry)(以下、「SELDI−TOF−MS」と称する)を行うことにより、マーカー物質の濃度をより正確に測定することができる。使用できる基板の種類としては、陽イオン交換基板、陰イオン交換基板、順相基板、逆相基板、金属イオン基板、抗体基板等を用いることができるが、陽イオン交換基板、特に弱陽イオン交換基板と、陰イオン交換基板、特に強陰イオン交換基板が好ましく用いられる。
【0073】
本発明の物質のスクリーニング方法は、本発明の動脈硬化改善・予防効果の評価方法によって被検物質を評価し、動脈硬化の改善効果又は将来の発症リスクの低減効果を有する物質をスクリーニングするものである。本発明の物質のスクリーニング方法においても、上記した本発明の動脈硬化改善・予防効果の評価方法の実施形態と全く同様の実施形態をとることができる。
【0074】
本発明の動脈硬化改善・予防効果の評価方法を簡便に行なうために、必要な試薬類をまとめて評価用キットを構築することができる。当該評価用キットとしては、例えば、マーカー物質に対する親和性を有する物質を固定化した担体を含むものが挙げられる。特に、担体として、CM等の弱陽イオン交換体、あるいはQAやQAE等の強陰イオン交換体を固定化した基板を含めた評価用キットによれば、SELDI−TOF−MS等を簡便に行なうことができる。本キット中には他の試薬類、例えば、標準物質、前処理用の各種緩衝液等を含めてもよい。なお本キットは、動脈硬化の改善効果又は将来の発症リスクの低減効果を有する物質をスクリーニングするためのキットとしても使用できる。本発明のキットの構成例を以下に挙げる。
【0075】
〔キットの構成例〕
(1)弱陽イオン交換基板:1枚
(2)強陰イオン交換基板:1枚
(3)基板洗浄用バッファーA(pH3.0):適量
(4)基板洗浄用バッファーB(pH9.0):適量
(5)各マーカー物質の標準品:各適量
【0076】
以下に、実施例をもって本発明をさらに具体的に説明するが、本発明はこれらの実施例に限定されるものではない。
【実施例1】
【0077】
1.動脈硬化発症モデル動物を使った動物実験
動脈硬化発症モデル動物としてアポE欠損マウス(The Jackson Laboratory社)、正常動物としてC57BL/6J系統マウス(日本チャールス・リバー社。以下、単に「正常マウス」と略記する。)を採用した。また、与える飼料としてCE−2(日本クレア社。以下、単に「通常飼料」と略記する。)と、アゼルニジピンを0.006%(3mg/kg体重に相当)含有するCE−2(以下、単に「アゼルニジピン含有飼料」と略記する。)を採用した。アゼルニジピンとしては、カルブロック(登録商標、三共株式会社製)を採用した。
【0078】
マウスの種類と与える飼料の組み合わせが異なる以下の4つの群を設定し、飼育を開始した。各群の個体数は5匹以上とした。
第1群:正常マウスを通常飼料で飼育
第2群:アポE欠損マウスを通常飼料で飼育
第3群:アポE欠損マウスをアゼルニジピン含有飼料で飼育
第4群:正常マウスをアゼルニジピン含有飼料で飼育
すなわち、第1群は動脈硬化を発症しない群、第2群は動脈硬化を発症する群、第3群は動脈硬化の発症が抑制される群、に相当する。第4群はアゼルニジピンの作用検証用の群である。
【0079】
アポE欠損マウスにおいて動脈硬化が発症し始める飼育期間である14週目に各群のマウスから血漿を採取し、体液試料とした。これにより、動脈硬化の発症直前段階の体液試料が得られた。
【0080】
2.プロテインチップによる解析とイオンピークの選抜
採取した各体液試料20μLに、変性バッファー(9M 尿素、2% CHAPS、50mM Tris−HCl(pH9.0))30μLを加えて前処理を行い、タンパク質を変性させた。次に、前処理した各体液試料を強陰イオン交換樹脂カラム(Q−Sepharose、GEヘルスケア社)にアプライした。次いで、pH9.0の緩衝液(50mM Tris−HCl(pH9.0)、0.1%(w/v)1−o−N−オクチル−β−D−グルコピラノシド(以下、「OGP」と称する。))、pH5.0の緩衝液(100mM 酢酸ナトリウム(pH5.0)、0.1%(w/v)OGP)、pH3.0の緩衝液(50mM クエン酸ナトリウム(pH3.0)、0.1%(w/v)OGP)、及び有機溶媒(0.1%トリフルオロ酢酸、50.0%アセトニトリルからなる混合液)各200μLで順に溶出させ、画分1(pH9.0で溶出、素通り)、画分2(pH5.0で溶出)、画分3(pH3.0で溶出)、画分4(有機溶媒で溶出)の4つの粗分画画分を得た。
【0081】
得られた各画分10μLをpH3.0のプロテインチップ結合バッファー(50mM クエン酸ナトリウム)で10倍希釈した後、弱陽イオン交換チップCM10(バイオラッド社)に添加した。同様に、得られた各画分10μLをpH9.0のプロテインチップ結合バッファー(50mM Tris−HCl(pH9.0))で10倍希釈した後、強陰イオン交換チップQ10(バイオラッド社)に添加した。各チップを各結合バッファーで3回洗浄した後に脱イオン水で1回洗浄し、乾燥させた。次に、エネルギー吸収分子であるシナピン酸(SPA−H、SPA−L)又はα−シアノ−4−ヒドロキシケイ皮酸(CHCA)を添加し、プロテインチップリーダーModel PBS IIc(バイオラッド社)を用いて、SELDI−TOF−MSを行なった。なお、測定分子量範囲(m/z)は、3000〜200000の範囲で行なった。また、測定は2連で行い、m/zの平均値を算出した。データ解析は、Protein Chip Software、CiphergenExpress Data Manager、及びBiomarker Patterns Software(いずれもバイオラッド社)を用いて行なった。具体的には、ベースライン補正、分子量校正、スペクトルの正規化処理を行なった後、シングルマーカー解析及び数本のマーカーを組み合わせたマルチフロー解析を行なった。その結果、粗分画画分の種類、プロテインチップの種類、チップの洗浄条件等の組み合わせによって多数のピークが検出された。各ピークについて、p値(Mann−Whitney検定法)、ROC面積、及びイオンピーク強度を算出し、さらに、以下の(1)〜(4)の条件を指標として29個の候補ピークを選抜した。
【0082】
(1)候補ピーク探索(基本)
第1群と第2群との間でイオン強度に有意差がある(p<0.05)。
(2)アゼルニジピン効果検証
第2群と第3群との間でイオン強度に有意差があり(p<0.05)、かつ第3群の値の方が第2群の値よりも第1群の値に近い(第3群の値が第1群側に復帰している)。
(3)増減パターン解析
第2群のみが高値または低値を示し、第1群、第3群および第4群の間ではあまり差がない。なお、第3群と第4群との間に差があっても、第4群の値の方が第3群の値よりも第2群から離れている場合には本条件を満たすものとして取り扱う。
【0083】
3.マーカー物質(M01)の特定
画分4(有機溶媒)を強陰イオン交換チップQ10に接触させ、pH9.0のプロテインチップ結合バッファーで洗浄してSELDI−TOF−MS(EAM:SPA−L)を行なった場合に、質量/電荷比が3352(平均値)のイオンピークが検出された。増減パターン解析の結果、本ピークは第1群、第3群および第4群で高値を示し、第2群で低値を示した。図1に、各群に分けて本ピークのピーク強度をプロットした場合の箱髭図を示す。図中、髭の上端と下端はそれぞれ最大値と最小値、箱の上辺と下辺はそれぞれ第3四分位(75パーセンタイル)と第1四分位(25パーセンタイル)、箱の中の線は中央値である(図2以降も同じ)。その結果、本ピークのROC面積(第1群vs第2群)は0.820、p値(第1群vs第2群)は0.0233、p値(第2群vs第3群)は0.0343であった。
【0084】
以上より、SELDI−TOF−MSに供すると質量/電荷比が約3350のピークを生じるタンパク質(マーカー物質(M01))が、動脈硬化を発症しているマウス、又は動脈硬化の将来の発症リスクが高いマウスに特異的な物質であり、動脈硬化のマーカーとなり得ることがわかった。これにより、被検物質を摂取させた動脈硬化を発症している動物又は将来の発症リスクが高い動物の体液中におけるマーカー物質(M01)の濃度を指標として、被検物質が有する動脈硬化の改善効果又は将来の発症リスクの低減効果の評価、並びに、そのような物質のスクリーニングが行なえることが示された。例えば、所望の被検物質を使用して同様の動物実験を行なって体液試料を調製し、同様の手順でSELDI−TOF−MSを行なった場合に、質量/電荷比が約3350のピークを生じるタンパク質の濃度が正常値に維持されたとき、該被検物質は、動脈硬化の改善効果、又は将来の発症リスクの低減効果を有すると評価することができる。
【0085】
4.マーカー物質(M02)の特定
画分4(有機溶媒)を強陰イオン交換チップQ10に接触させ、pH9.0のプロテインチップ結合バッファーで洗浄してSELDI−TOF−MS(EAM:SPA−L)を行なった場合に、質量/電荷比が4174(平均値)のイオンピークが検出された。増減パターン解析の結果、本ピークは第1群、第3群および第4群で低値を示し、第2群で高値を示した。図2に、各群に分けて本ピークのピーク強度をプロットした場合の箱髭図を示す。その結果、本ピークのROC面積(第1群vs第2群)は0.980、p値(第1群vs第2群)は0.0002、p値(第2群vs第3群)は0.0413であった。
【0086】
以上より、SELDI−TOF−MSに供すると質量/電荷比が約4170のピークを生じるタンパク質(マーカー物質(M02))が、動脈硬化を発症しているマウス、又は動脈硬化の将来の発症リスクが高いマウスに特異的な物質であり、動脈硬化のマーカーとなり得ることがわかった。これにより、被検物質を摂取させた動脈硬化を発症している動物又は将来の発症リスクが高い動物の体液中におけるマーカー物質(M02)の濃度を指標として、被検物質が有する動脈硬化の改善効果又は将来の発症リスクの低減効果の評価、並びに、そのような物質のスクリーニングが行なえることが示された。例えば、所望の被検物質を使用して同様の動物実験を行なって体液試料を調製し、同様の手順でSELDI−TOF−MSを行なった場合に、質量/電荷比が約4170のピークを生じるタンパク質の濃度が正常値に維持されたとき、該被検物質は、動脈硬化の改善効果、又は将来の発症リスクの低減効果を有すると評価することができる。
【0087】
5.マーカー物質(M03)の特定
画分3(pH3.0)を強陰イオン交換チップQ10に接触させ、pH9.0のプロテインチップ結合バッファーで洗浄してSELDI−TOF−MS(EAM:SPA−L)を行なった場合に、質量/電荷比が4281(平均値)のイオンピークが検出された。増減パターン解析の結果、本ピークは第1群、第3群および第4群で低値を示し、第2群で高値を示した。図3に、各群に分けて本ピークのピーク強度をプロットした場合の箱髭図を示す。その結果、本ピークのROC面積(第1群vs第2群)は0.740、p値(第1群vs第2群)は0.0233、p値(第2群vs第3群)は0.0009であった。
【0088】
以上より、SELDI−TOF−MSに供すると質量/電荷比が約4280のピークを生じるタンパク質(マーカー物質(M03))が、動脈硬化を発症しているマウス、又は動脈硬化の将来の発症リスクが高いマウスに特異的な物質であり、動脈硬化のマーカーとなり得ることがわかった。これにより、被検物質を摂取させた動脈硬化を発症している動物又は将来の発症リスクが高い動物の体液中におけるマーカー物質(M03)の濃度を指標として、被検物質が有する動脈硬化の改善効果又は将来の発症リスクの低減効果の評価、並びに、そのような物質のスクリーニングが行なえることが示された。例えば、所望の被検物質を使用して同様の動物実験を行なって体液試料を調製し、同様の手順でSELDI−TOF−MSを行なった場合に、質量/電荷比が約4280のピークを生じるタンパク質の濃度が正常値に維持されたとき、該被検物質は、動脈硬化の改善効果、又は将来の発症リスクの低減効果を有すると評価することができる。
【0089】
6.マーカー物質(M04)の特定
画分3(pH3.0)を弱陽イオン交換チップCM10に接触させ、pH3.0のプロテインチップ結合バッファーで洗浄してSELDI−TOF−MS(EAM:CHCA)を行なった場合に、質量/電荷比が4754(平均値)のイオンピークが検出された。増減パターン解析の結果、本ピークは第1群、第3群および第4群で高値を示し、第2群で低値を示した。図4に、各群に分けて本ピークのピーク強度をプロットした場合の箱髭図を示す。その結果、本ピークのROC面積(第1群vs第2群)は0.860、p値(第1群vs第2群)は0.0126、p値(第2群vs第3群)は0.0494であった。
【0090】
以上より、SELDI−TOF−MSに供すると質量/電荷比が約4750のピークを生じるタンパク質(マーカー物質(M04))が、動脈硬化を発症しているマウス、又は動脈硬化の将来の発症リスクが高いマウスに特異的な物質であり、動脈硬化のマーカーとなり得ることがわかった。これにより、被検物質を摂取させた動脈硬化を発症している動物又は将来の発症リスクが高い動物の体液中におけるマーカー物質(M04)の濃度を指標として、被検物質が有する動脈硬化の改善効果又は将来の発症リスクの低減効果の評価、並びに、そのような物質のスクリーニングが行なえることが示された。例えば、所望の被検物質を使用して同様の動物実験を行なって体液試料を調製し、同様の手順でSELDI−TOF−MSを行なった場合に、質量/電荷比が約4750のピークを生じるタンパク質の濃度が正常値に維持されたとき、該被検物質は、動脈硬化の改善効果、又は将来の発症リスクの低減効果を有すると評価することができる。
【0091】
7.マーカー物質(M05)の特定
画分4(有機溶媒)を強陰イオン交換チップQ10に接触させ、pH9.0のプロテインチップ結合バッファーで洗浄してSELDI−TOF−MS(EAM:SPA−L)を行なった場合に、質量/電荷比が5126(平均値)のイオンピークが検出された。増減パターン解析の結果、本ピークは第1群、第3群および第4群で高値を示し、第2群で低値を示した。図5に、各群に分けて本ピークのピーク強度をプロットした場合の箱髭図を示す。その結果、本ピークのROC面積(第1群vs第2群)は0.820、p値(第1群vs第2群)は0.0126、p値(第2群vs第3群)は0.0233であった。
【0092】
以上より、SELDI−TOF−MSに供すると質量/電荷比が約5130のピークを生じるタンパク質(マーカー物質(M05))が、動脈硬化を発症しているマウス、又は動脈硬化の将来の発症リスクが高いマウスに特異的な物質であり、動脈硬化のマーカーとなり得ることがわかった。これにより、被検物質を摂取させた動脈硬化を発症している動物又は将来の発症リスクが高い動物の体液中におけるマーカー物質(M05)の濃度を指標として、被検物質が有する動脈硬化の改善効果又は将来の発症リスクの低減効果の評価、並びに、そのような物質のスクリーニングが行なえることが示された。例えば、所望の被検物質を使用して同様の動物実験を行なって体液試料を調製し、同様の手順でSELDI−TOF−MSを行なった場合に、質量/電荷比が約5130のピークを生じるタンパク質の濃度が正常値に維持されたとき、該被検物質は、動脈硬化の改善効果、又は将来の発症リスクの低減効果を有すると評価することができる。
【0093】
8.マーカー物質(M06)の特定
画分3(pH3.0)を弱陽イオン交換チップCM10に接触させ、pH3.0のプロテインチップ結合バッファーで洗浄してSELDI−TOF−MS(EAM:SPA−L)を行なった場合に、質量/電荷比が5203(平均値)のイオンピークが検出された。増減パターン解析の結果、本ピークは第1群、第3群および第4群で高値を示し、第2群で低値を示した。図6に、各群に分けて本ピークのピーク強度をプロットした場合の箱髭図を示す。その結果、本ピークのROC面積(第1群vs第2群)は0.980、p値(第1群vs第2群)は0.0002、p値(第2群vs第3群)は0.0082であった。
【0094】
以上より、SELDI−TOF−MSに供すると質量/電荷比が約5200のピークを生じるタンパク質(マーカー物質(M06))が、動脈硬化を発症しているマウス、又は動脈硬化の将来の発症リスクが高いマウスに特異的な物質であり、動脈硬化のマーカーとなり得ることがわかった。これにより、被検物質を摂取させた動脈硬化を発症している動物又は将来の発症リスクが高い動物の体液中におけるマーカー物質(M06)の濃度を指標として、被検物質が有する動脈硬化の改善効果又は将来の発症リスクの低減効果の評価、並びに、そのような物質のスクリーニングが行なえることが示された。例えば、所望の被検物質を使用して同様の動物実験を行なって体液試料を調製し、同様の手順でSELDI−TOF−MSを行なった場合に、質量/電荷比が約5200のピークを生じるタンパク質の濃度が正常値に維持されたとき、該被検物質は、動脈硬化の改善効果、又は将来の発症リスクの低減効果を有すると評価することができる。
【0095】
9.マーカー物質(M07)の特定
画分3(pH3.0)を弱陽イオン交換チップCM10に接触させ、pH3.0のプロテインチップ結合バッファーで洗浄してSELDI−TOF−MS(EAM:SPA−L)を行なった場合に、質量/電荷比が6023(平均値)のイオンピークが検出された。増減パターン解析の結果、本ピークは第1群、第3群および第4群で高値を示し、第2群で低値を示した。図7に、各群に分けて本ピークのピーク強度をプロットした場合の箱髭図を示す。その結果、本ピークのROC面積(第1群vs第2群)は0.780、p値(第1群vs第2群)は0.0082、p値(第2群vs第3群)は0.0343であった。
【0096】
以上より、SELDI−TOF−MSに供すると質量/電荷比が約6020のピークを生じるタンパク質(マーカー物質(M07))が、動脈硬化を発症しているマウス、又は動脈硬化の将来の発症リスクが高いマウスに特異的な物質であり、動脈硬化のマーカーとなり得ることがわかった。これにより、被検物質を摂取させた動脈硬化を発症している動物又は将来の発症リスクが高い動物の体液中におけるマーカー物質(M07)の濃度を指標として、被検物質が有する動脈硬化の改善効果又は将来の発症リスクの低減効果の評価、並びに、そのような物質のスクリーニングが行なえることが示された。例えば、所望の被検物質を使用して同様の動物実験を行なって体液試料を調製し、同様の手順でSELDI−TOF−MSを行なった場合に、質量/電荷比が約6020のピークを生じるタンパク質の濃度が正常値に維持されたとき、該被検物質は、動脈硬化の改善効果、又は将来の発症リスクの低減効果を有すると評価することができる。
【0097】
10.マーカー物質(M08)の特定
画分2(pH5.0)を強陰イオン交換チップQ10に接触させ、pH9.0のプロテインチップ結合バッファーで洗浄してSELDI−TOF−MS(EAM:SPA−L)を行なった場合に、質量/電荷比が6103(平均値)のイオンピークが検出された。増減パターン解析の結果、本ピークは第1群、第3群および第4群で低値を示し、第2群で高値を示した。図8に、各群に分けて本ピークのピーク強度をプロットした場合の箱髭図を示す。その結果、本ピークのROC面積(第1群vs第2群)は0.740、p値(第1群vs第2群)は0.0284、p値(第2群vs第3群)は0.0041であった。
【0098】
以上より、SELDI−TOF−MSに供すると質量/電荷比が約6100のピークを生じるタンパク質(マーカー物質(M08))が、動脈硬化を発症しているマウス、又は動脈硬化の将来の発症リスクが高いマウスに特異的な物質であり、動脈硬化のマーカーとなり得ることがわかった。これにより、被検物質を摂取させた動脈硬化を発症している動物又は将来の発症リスクが高い動物の体液中におけるマーカー物質(M08)の濃度を指標として、被検物質が有する動脈硬化の改善効果又は将来の発症リスクの低減効果の評価、並びに、そのような物質のスクリーニングが行なえることが示された。例えば、所望の被検物質を使用して同様の動物実験を行なって体液試料を調製し、同様の手順でSELDI−TOF−MSを行なった場合に、質量/電荷比が約6100のピークを生じるタンパク質の濃度が正常値に維持されたとき、該被検物質は、動脈硬化の改善効果、又は将来の発症リスクの低減効果を有すると評価することができる。
【0099】
11.マーカー物質(M09)の特定
画分1(pH9.0)を強陰イオン交換チップQ10に接触させ、pH9.0のプロテインチップ結合バッファーで洗浄してSELDI−TOF−MS(EAM:CHCA)を行なった場合に、質量/電荷比が6861(平均値)のイオンピークが検出された。増減パターン解析の結果、本ピークは第1群、第3群および第4群で低値を示し、第2群で高値を示した。図9に、各群に分けて本ピークのピーク強度をプロットした場合の箱髭図を示す。その結果、本ピークのROC面積(第1群vs第2群)は0.980、p値(第1群vs第2群)は0.0003、p値(第2群vs第3群)は0.0494であった。
【0100】
以上より、SELDI−TOF−MSに供すると質量/電荷比が約6860のピークを生じるタンパク質(マーカー物質(M09))が、動脈硬化を発症しているマウス、又は動脈硬化の将来の発症リスクが高いマウスに特異的な物質であり、動脈硬化のマーカーとなり得ることがわかった。これにより、被検物質を摂取させた動脈硬化を発症している動物又は将来の発症リスクが高い動物の体液中におけるマーカー物質(M09)の濃度を指標として、被検物質が有する動脈硬化の改善効果又は将来の発症リスクの低減効果の評価、並びに、そのような物質のスクリーニングが行なえることが示された。例えば、所望の被検物質を使用して同様の動物実験を行なって体液試料を調製し、同様の手順でSELDI−TOF−MSを行なった場合に、質量/電荷比が約6860のピークを生じるタンパク質の濃度が正常値に維持されたとき、該被検物質は、動脈硬化の改善効果、又は将来の発症リスクの低減効果を有すると評価することができる。
【0101】
12.マーカー物質(M10)の特定
画分4(有機溶媒)を弱陽イオン交換チップCM10に接触させ、pH3.0のプロテインチップ結合バッファーで洗浄してSELDI−TOF−MS(EAM:SPA−L)を行なった場合に、質量/電荷比が7005(平均値)のイオンピークが検出された。増減パターン解析の結果、本ピークは第1群、第3群および第4群で低値を示し、第2群で高値を示した。図10に、各群に分けて本ピークのピーク強度をプロットした場合の箱髭図を示す。その結果、本ピークのROC面積(第1群vs第2群)は0.980、p値(第1群vs第2群)は0.0002、p値(第2群vs第3群)は0.0041であった。
【0102】
以上より、SELDI−TOF−MSに供すると質量/電荷比が約7010のピークを生じるタンパク質(マーカー物質(M10))が、動脈硬化を発症しているマウス、又は動脈硬化の将来の発症リスクが高いマウスに特異的な物質であり、動脈硬化のマーカーとなり得ることがわかった。これにより、被検物質を摂取させた動脈硬化を発症している動物又は将来の発症リスクが高い動物の体液中におけるマーカー物質(M10)の濃度を指標として、被検物質が有する動脈硬化の改善効果又は将来の発症リスクの低減効果の評価、並びに、そのような物質のスクリーニングが行なえることが示された。例えば、所望の被検物質を使用して同様の動物実験を行なって体液試料を調製し、同様の手順でSELDI−TOF−MSを行なった場合に、質量/電荷比が約7010のピークを生じるタンパク質の濃度が正常値に維持されたとき、該被検物質は、動脈硬化の改善効果、又は将来の発症リスクの低減効果を有すると評価することができる。
【0103】
13.マーカー物質(M11)の特定
画分3(pH3.0)を弱陽イオン交換チップCM10に接触させ、pH3.0のプロテインチップ結合バッファーで洗浄してSELDI−TOF−MS(EAM:SPA−L)を行なった場合に、質量/電荷比が7095(平均値)のイオンピークが検出された。増減パターン解析の結果、本ピークは第1群、第3群および第4群で高値を示し、第2群で低値を示した。図11に、各群に分けて本ピークのピーク強度をプロットした場合の箱髭図を示す。その結果、本ピークのROC面積(第1群vs第2群)は0.980、p値(第1群vs第2群)は0.0002、p値(第2群vs第3群)は0.0002であった。
【0104】
以上より、SELDI−TOF−MSに供すると質量/電荷比が約7100のピークを生じるタンパク質(マーカー物質(M11))が、動脈硬化を発症しているマウス、又は動脈硬化の将来の発症リスクが高いマウスに特異的な物質であり、動脈硬化のマーカーとなり得ることがわかった。これにより、被検物質を摂取させた動脈硬化を発症している動物又は将来の発症リスクが高い動物の体液中におけるマーカー物質(M11)の濃度を指標として、被検物質が有する動脈硬化の改善効果又は将来の発症リスクの低減効果の評価、並びに、そのような物質のスクリーニングが行なえることが示された。例えば、所望の被検物質を使用して同様の動物実験を行なって体液試料を調製し、同様の手順でSELDI−TOF−MSを行なった場合に、質量/電荷比が約7100のピークを生じるタンパク質の濃度が正常値に維持されたとき、該被検物質は、動脈硬化の改善効果、又は将来の発症リスクの低減効果を有すると評価することができる。
【0105】
14.マーカー物質(M12)の特定
画分4(有機溶剤)を弱陽イオン交換チップCM10に接触させ、pH3.0のプロテインチップ結合バッファーで洗浄してSELDI−TOF−MS(EAM:SPA−L)を行なった場合に、質量/電荷比が7572(平均値)のイオンピークが検出された。増減パターン解析の結果、本ピークは第1群、第3群および第4群で高値を示し、第2群で低値を示した。図12に、各群に分けて本ピークのピーク強度をプロットした場合の箱髭図を示す。その結果、本ピークのROC面積(第1群vs第2群)は0.940、p値(第1群vs第2群)は0.0007、p値(第2群vs第3群)は0.0082であった。
【0106】
以上より、SELDI−TOF−MSに供すると質量/電荷比が約7570のピークを生じるタンパク質(マーカー物質(M12))が、動脈硬化を発症しているマウス、又は動脈硬化の将来の発症リスクが高いマウスに特異的な物質であり、動脈硬化のマーカーとなり得ることがわかった。これにより、被検物質を摂取させた動脈硬化を発症している動物又は将来の発症リスクが高い動物の体液中におけるマーカー物質(M12)の濃度を指標として、被検物質が有する動脈硬化の改善効果又は将来の発症リスクの低減効果の評価、並びに、そのような物質のスクリーニングが行なえることが示された。例えば、所望の被検物質を使用して同様の動物実験を行なって体液試料を調製し、同様の手順でSELDI−TOF−MSを行なった場合に、質量/電荷比が約7570のピークを生じるタンパク質の濃度が正常値に維持されたとき、該被検物質は、動脈硬化の改善効果、又は将来の発症リスクの低減効果を有すると評価することができる。
【0107】
15.マーカー物質(M13)の特定
画分3(pH3.0)を弱陽イオン交換チップCM10に接触させ、pH3.0のプロテインチップ結合バッファーで洗浄してSELDI−TOF−MS(EAM:SPA−L)を行なった場合に、質量/電荷比が8439(平均値)のイオンピークが検出された。増減パターン解析の結果、本ピークは第1群、第3群および第4群で高値を示し、第2群で低値を示した。図13に、各群に分けて本ピークのピーク強度をプロットした場合の箱髭図を示す。その結果、本ピークのROC面積(第1群vs第2群)は0.740、p値(第1群vs第2群)は0.0494、p値(第2群vs第3群)は0.0019であった。
【0108】
以上より、SELDI−TOF−MSに供すると質量/電荷比が約8440のピークを生じるタンパク質(マーカー物質(M13))が、動脈硬化を発症しているマウス、又は動脈硬化の将来の発症リスクが高いマウスに特異的な物質であり、動脈硬化のマーカーとなり得ることがわかった。これにより、被検物質を摂取させた動脈硬化を発症している動物又は将来の発症リスクが高い動物の体液中におけるマーカー物質(M13)の濃度を指標として、被検物質が有する動脈硬化の改善効果又は将来の発症リスクの低減効果の評価、並びに、そのような物質のスクリーニングが行なえることが示された。例えば、所望の被検物質を使用して同様の動物実験を行なって体液試料を調製し、同様の手順でSELDI−TOF−MSを行なった場合に、質量/電荷比が約8440のピークを生じるタンパク質の濃度が正常値に維持されたとき、該被検物質は、動脈硬化の改善効果、又は将来の発症リスクの低減効果を有すると評価することができる。
【0109】
16.マーカー物質(M14)の特定
画分1(pH9.0)を弱陽イオン交換チップCM10に接触させ、pH3.0のプロテインチップ結合バッファーで洗浄してSELDI−TOF−MS(EAM:CHCA)を行なった場合に、質量/電荷比が8534(平均値)のイオンピークが検出された。増減パターン解析の結果、本ピークは第1群、第3群および第4群で高値を示し、第2群で低値を示した。図14に、各群に分けて本ピークのピーク強度をプロットした場合の箱髭図を示す。その結果、本ピークのROC面積(第1群vs第2群)は0.980、p値(第1群vs第2群)は0.0002、p値(第2群vs第3群)は0.0343であった。
【0110】
以上より、SELDI−TOF−MSに供すると質量/電荷比が約8530のピークを生じるタンパク質(マーカー物質(M14))が、動脈硬化を発症しているマウス、又は動脈硬化の将来の発症リスクが高いマウスに特異的な物質であり、動脈硬化のマーカーとなり得ることがわかった。これにより、被検物質を摂取させた動脈硬化を発症している動物又は将来の発症リスクが高い動物の体液中におけるマーカー物質(M14)の濃度を指標として、被検物質が有する動脈硬化の改善効果又は将来の発症リスクの低減効果の評価、並びに、そのような物質のスクリーニングが行なえることが示された。例えば、所望の被検物質を使用して同様の動物実験を行なって体液試料を調製し、同様の手順でSELDI−TOF−MSを行なった場合に、質量/電荷比が約8530のピークを生じるタンパク質の濃度が正常値に維持されたとき、該被検物質は、動脈硬化の改善効果、又は将来の発症リスクの低減効果を有すると評価することができる。
【0111】
17.マーカー物質(M15)の特定
画分1(pH9.0)を弱陽イオン交換チップCM10に接触させ、pH3.0のプロテインチップ結合バッファーで洗浄してSELDI−TOF−MS(EAM:SPA−L)を行なった場合に、質量/電荷比が8723(平均値)のイオンピークが検出された。増減パターン解析の結果、本ピークは第1群、第3群および第4群で高値を示し、第2群で低値を示した。図15に、各群に分けて本ピークのピーク強度をプロットした場合の箱髭図を示す。その結果、本ピークのROC面積(第1群vs第2群)は0.900、p値(第1群vs第2群)は0.0007、p値(第2群vs第3群)は0.0284であった。
【0112】
以上より、SELDI−TOF−MSに供すると質量/電荷比が約8720のピークを生じるタンパク質(マーカー物質(M15))が、動脈硬化を発症しているマウス、又は動脈硬化の将来の発症リスクが高いマウスに特異的な物質であり、動脈硬化のマーカーとなり得ることがわかった。これにより、被検物質を摂取させた動脈硬化を発症している動物又は将来の発症リスクが高い動物の体液中におけるマーカー物質(M15)の濃度を指標として、被検物質が有する動脈硬化の改善効果又は将来の発症リスクの低減効果の評価、並びに、そのような物質のスクリーニングが行なえることが示された。例えば、所望の被検物質を使用して同様の動物実験を行なって体液試料を調製し、同様の手順でSELDI−TOF−MSを行なった場合に、質量/電荷比が約8720のピークを生じるタンパク質の濃度が正常値に維持されたとき、該被検物質は、動脈硬化の改善効果、又は将来の発症リスクの低減効果を有すると評価することができる。
【0113】
18.マーカー物質(M16)の特定
画分4(有機溶媒)を強陰イオン交換チップQ10に接触させ、pH9.0のプロテインチップ結合バッファーで洗浄してSELDI−TOF−MS(EAM:SPA−L)を行なった場合に、質量/電荷比が8840(平均値)のイオンピークが検出された。増減パターン解析の結果、本ピークは第1群、第3群および第4群で低値を示し、第2群で高値を示した。図16に、各群に分けて本ピークのピーク強度をプロットした場合の箱髭図を示す。その結果、本ピークのROC面積(第1群vs第2群)は0.980、p値(第1群vs第2群)は0.0002、p値(第2群vs第3群)は0.0413であった。
【0114】
以上より、SELDI−TOF−MSに供すると質量/電荷比が約8840のピークを生じるタンパク質(マーカー物質(M16))が、動脈硬化を発症しているマウス、又は動脈硬化の将来の発症リスクが高いマウスに特異的な物質であり、動脈硬化のマーカーとなり得ることがわかった。これにより、被検物質を摂取させた動脈硬化を発症している動物又は将来の発症リスクが高い動物の体液中におけるマーカー物質(M16)の濃度を指標として、被検物質が有する動脈硬化の改善効果又は将来の発症リスクの低減効果の評価、並びに、そのような物質のスクリーニングが行なえることが示された。例えば、所望の被検物質を使用して同様の動物実験を行なって体液試料を調製し、同様の手順でSELDI−TOF−MSを行なった場合に、質量/電荷比が約8840のピークを生じるタンパク質の濃度が正常値に維持されたとき、該被検物質は、動脈硬化の改善効果、又は将来の発症リスクの低減効果を有すると評価することができる。
【0115】
19.マーカー物質(M17)の特定
画分3(pH3.0)を弱陽イオン交換チップCM10に接触させ、pH3.0のプロテインチップ結合バッファーで洗浄してSELDI−TOF−MS(EAM:SPA−H)を行なった場合に、質量/電荷比が10012(平均値)のイオンピークが検出された。増減パターン解析の結果、本ピークは第1群、第3群および第4群で高値を示し、第2群で低値を示した。図17に、各群に分けて本ピークのピーク強度をプロットした場合の箱髭図を示す。その結果、本ピークのROC面積(第1群vs第2群)は0.980、p値(第1群vs第2群)は0.0002、p値(第2群vs第3群)は0.0032であった。
【0116】
以上より、SELDI−TOF−MSに供すると質量/電荷比が約10000のピークを生じるタンパク質(マーカー物質(M17))が、動脈硬化を発症しているマウス、又は動脈硬化の将来の発症リスクが高いマウスに特異的な物質であり、動脈硬化のマーカーとなり得ることがわかった。これにより、被検物質を摂取させた動脈硬化を発症している動物又は将来の発症リスクが高い動物の体液中におけるマーカー物質(M17)の濃度を指標として、被検物質が有する動脈硬化の改善効果又は将来の発症リスクの低減効果の評価、並びに、そのような物質のスクリーニングが行なえることが示された。例えば、所望の被検物質を使用して同様の動物実験を行なって体液試料を調製し、同様の手順でSELDI−TOF−MSを行なった場合に、質量/電荷比が約10000のピークを生じるタンパク質の濃度が正常値に維持されたとき、該被検物質は、動脈硬化の改善効果、又は将来の発症リスクの低減効果を有すると評価することができる。
【0117】
20.マーカー物質(M18)の特定
画分4(有機溶媒)を強陰イオン交換チップQ10に接触させ、pH9.0のプロテインチップ結合バッファーで洗浄してSELDI−TOF−MS(EAM:CHCA)を行なった場合に、質量/電荷比が10451(平均値)のイオンピークが検出された。増減パターン解析の結果、本ピークは第1群、第3群および第4群で高値を示し、第2群で低値を示した。図18に、各群に分けて本ピークのピーク強度をプロットした場合の箱髭図を示す。その結果、本ピークのROC面積(第1群vs第2群)は0.940、p値(第1群vs第2群)は0.0004、p値(第2群vs第3群)は0.0284であった。
【0118】
以上より、SELDI−TOF−MSに供すると質量/電荷比が約10500のピークを生じるタンパク質(マーカー物質(M18))が、動脈硬化を発症しているマウス、又は動脈硬化の将来の発症リスクが高いマウスに特異的な物質であり、動脈硬化のマーカーとなり得ることがわかった。これにより、被検物質を摂取させた動脈硬化を発症している動物又は将来の発症リスクが高い動物の体液中におけるマーカー物質(M18)の濃度を指標として、被検物質が有する動脈硬化の改善効果又は将来の発症リスクの低減効果の評価、並びに、そのような物質のスクリーニングが行なえることが示された。例えば、所望の被検物質を使用して同様の動物実験を行なって体液試料を調製し、同様の手順でSELDI−TOF−MSを行なった場合に、質量/電荷比が約10500のピークを生じるタンパク質の濃度が正常値に維持されたとき、該被検物質は、動脈硬化の改善効果、又は将来の発症リスクの低減効果を有すると評価することができる。
【0119】
21.マーカー物質(M19)の特定
画分4(有機溶媒)を弱陽イオン交換チップCM10に接触させ、pH3.0のプロテインチップ結合バッファーで洗浄してSELDI−TOF−MS(EAM:SPA−H)を行なった場合に、質量/電荷比が10704(平均値)のイオンピークが検出された。増減パターン解析の結果、本ピークは第1群、第3群および第4群で高値を示し、第2群で低値を示した。図19に、各群に分けて本ピークのピーク強度をプロットした場合の箱髭図を示す。その結果、本ピークのROC面積(第1群vs第2群)は0.940、p値(第1群vs第2群)は0.0019、p値(第2群vs第3群)は0.0065であった。
【0120】
以上より、SELDI−TOF−MSに供すると質量/電荷比が約10700のピークを生じるタンパク質(マーカー物質(M19))が、動脈硬化を発症しているマウス、又は動脈硬化の将来の発症リスクが高いマウスに特異的な物質であり、動脈硬化のマーカーとなり得ることがわかった。これにより、被検物質を摂取させた動脈硬化を発症している動物又は将来の発症リスクが高い動物の体液中におけるマーカー物質(M19)の濃度を指標として、被検物質が有する動脈硬化の改善効果又は将来の発症リスクの低減効果の評価、並びに、そのような物質のスクリーニングが行なえることが示された。例えば、所望の被検物質を使用して同様の動物実験を行なって体液試料を調製し、同様の手順でSELDI−TOF−MSを行なった場合に、質量/電荷比が約10700のピークを生じるタンパク質の濃度が正常値に維持されたとき、該被検物質は、動脈硬化の改善効果、又は将来の発症リスクの低減効果を有すると評価することができる。
【0121】
22.マーカー物質(M20)の特定
画分1(pH9.0)を強陰イオン交換チップQ10に接触させ、pH9.0のプロテインチップ結合バッファーで洗浄してSELDI−TOF−MS(EAM:SPA−L)を行なった場合に、質量/電荷比が11669(平均値)のイオンピークが検出された。増減パターン解析の結果、本ピークは第1群、第3群および第4群で高値を示し、第2群で低値を示した。図20に、各群に分けて本ピークのピーク強度をプロットした場合の箱髭図を示す。その結果、本ピークのROC面積(第1群vs第2群)は0.820、p値(第1群vs第2群)は0.0284、p値(第2群vs第3群)は0.0494であった。
【0122】
以上より、SELDI−TOF−MSに供すると質量/電荷比が約11700のピークを生じるタンパク質(マーカー物質(M20))が、動脈硬化を発症しているマウス、又は動脈硬化の将来の発症リスクが高いマウスに特異的な物質であり、動脈硬化のマーカーとなり得ることがわかった。これにより、被検物質を摂取させた動脈硬化を発症している動物又は将来の発症リスクが高い動物の体液中におけるマーカー物質(M20)の濃度を指標として、被検物質が有する動脈硬化の改善効果又は将来の発症リスクの低減効果の評価、並びに、そのような物質のスクリーニングが行なえることが示された。例えば、所望の被検物質を使用して同様の動物実験を行なって体液試料を調製し、同様の手順でSELDI−TOF−MSを行なった場合に、質量/電荷比が約11700のピークを生じるタンパク質の濃度が正常値に維持されたとき、該被検物質は、動脈硬化の改善効果、又は将来の発症リスクの低減効果を有すると評価することができる。
【0123】
23.マーカー物質(M21)の特定
画分4(有機溶媒)を強陰イオン交換チップQ10に接触させ、pH9.0のプロテインチップ結合バッファーで洗浄してSELDI−TOF−MS(EAM:SPA−H)を行なった場合に、質量/電荷比が13742(平均値)のイオンピークが検出された。増減パターン解析の結果、本ピークは第1群、第3群および第4群で高値を示し、第2群で低値を示した。図21に、各群に分けて本ピークのピーク強度をプロットした場合の箱髭図を示す。その結果、本ピークのROC面積(第1群vs第2群)は0.940、p値(第1群vs第2群)は0.0015、p値(第2群vs第3群)は0.0082であった。
【0124】
以上より、SELDI−TOF−MSに供すると質量/電荷比が約13700のピークを生じるタンパク質(マーカー物質(M21))が、動脈硬化を発症しているマウス、又は動脈硬化の将来の発症リスクが高いマウスに特異的な物質であり、動脈硬化のマーカーとなり得ることがわかった。これにより、被検物質を摂取させた動脈硬化を発症している動物又は将来の発症リスクが高い動物の体液中におけるマーカー物質(M21)の濃度を指標として、被検物質が有する動脈硬化の改善効果又は将来の発症リスクの低減効果の評価、並びに、そのような物質のスクリーニングが行なえることが示された。例えば、所望の被検物質を使用して同様の動物実験を行なって体液試料を調製し、同様の手順でSELDI−TOF−MSを行なった場合に、質量/電荷比が約13700のピークを生じるタンパク質の濃度が正常値に維持されたとき、該被検物質は、動脈硬化の改善効果、又は将来の発症リスクの低減効果を有すると評価することができる。
【0125】
24.マーカー物質(M22)の特定
画分2(pH5.0)を強陰イオン交換チップQ10に接触させ、pH9.0のプロテインチップ結合バッファーで洗浄してSELDI−TOF−MS(EAM:SPA−H)を行なった場合に、質量/電荷比が13958(平均値)のイオンピークが検出された。増減パターン解析の結果、本ピークは第1群、第3群および第4群で低値を示し、第2群で高値を示した。図22に、各群に分けて本ピークのピーク強度をプロットした場合の箱髭図を示す。その結果、本ピークのROC面積(第1群vs第2群)は0.900、p値(第1群vs第2群)は0.0032、p値(第2群vs第3群)は0.0102であった。
【0126】
以上より、SELDI−TOF−MSに供すると質量/電荷比が約14000のピークを生じるタンパク質(マーカー物質(M22))が、動脈硬化を発症しているマウス、又は動脈硬化の将来の発症リスクが高いマウスに特異的な物質であり、動脈硬化のマーカーとなり得ることがわかった。これにより、被検物質を摂取させた動脈硬化を発症している動物又は将来の発症リスクが高い動物の体液中におけるマーカー物質(M22)の濃度を指標として、被検物質が有する動脈硬化の改善効果又は将来の発症リスクの低減効果の評価、並びに、そのような物質のスクリーニングが行なえることが示された。例えば、所望の被検物質を使用して同様の動物実験を行なって体液試料を調製し、同様の手順でSELDI−TOF−MSを行なった場合に、質量/電荷比が約14000のピークを生じるタンパク質の濃度が正常値に維持されたとき、該被検物質は、動脈硬化の改善効果、又は将来の発症リスクの低減効果を有すると評価することができる。
【0127】
25.マーカー物質(M23)の特定
画分2(pH5.0)を強陰イオン交換チップQ10に接触させ、pH9.0のプロテインチップ結合バッファーで洗浄してSELDI−TOF−MS(EAM:SPA−H)を行なった場合に、質量/電荷比が14167(平均値)のイオンピークが検出された。増減パターン解析の結果、本ピークは第1群、第3群および第4群で低値を示し、第2群で高値を示した。図23に、各群に分けて本ピークのピーク強度をプロットした場合の箱髭図を示す。その結果、本ピークのROC面積(第1群vs第2群)は0.900、p値(第1群vs第2群)は0.0019、p値(第2群vs第3群)は0.0082であった。
【0128】
以上より、SELDI−TOF−MSに供すると質量/電荷比が約14200のピークを生じるタンパク質(マーカー物質(M23))が、動脈硬化を発症しているマウス、又は動脈硬化の将来の発症リスクが高いマウスに特異的な物質であり、動脈硬化のマーカーとなり得ることがわかった。これにより、被検物質を摂取させた動脈硬化を発症している動物又は将来の発症リスクが高い動物の体液中におけるマーカー物質(M23)の濃度を指標として、被検物質が有する動脈硬化の改善効果又は将来の発症リスクの低減効果の評価、並びに、そのような物質のスクリーニングが行なえることが示された。例えば、所望の被検物質を使用して同様の動物実験を行なって体液試料を調製し、同様の手順でSELDI−TOF−MSを行なった場合に、質量/電荷比が約14200のピークを生じるタンパク質の濃度が正常値に維持されたとき、該被検物質は、動脈硬化の改善効果、又は将来の発症リスクの低減効果を有すると評価することができる。
【0129】
26.マーカー物質(M24)の特定
画分4(有機溶媒)を強陰イオン交換チップQ10に接触させ、pH9.0のプロテインチップ結合バッファーで洗浄してSELDI−TOF−MS(EAM:SPA−H)を行なった場合に、質量/電荷比が20441(平均値)のイオンピークが検出された。増減パターン解析の結果、本ピークは第1群、第3群および第4群で高値を示し、第2群で低値を示した。図24に、各群に分けて本ピークのピーク強度をプロットした場合の箱髭図を示す。その結果、本ピークのROC面積(第1群vs第2群)は0.980、p値(第1群vs第2群)は0.0002、p値(第2群vs第3群)は0.0343であった。
【0130】
以上より、SELDI−TOF−MSに供すると質量/電荷比が約20400のピークを生じるタンパク質(マーカー物質(M24))が、動脈硬化を発症しているマウス、又は動脈硬化の将来の発症リスクが高いマウスに特異的な物質であり、動脈硬化のマーカーとなり得ることがわかった。これにより、被検物質を摂取させた動脈硬化を発症している動物又は将来の発症リスクが高い動物の体液中におけるマーカー物質(M24)の濃度を指標として、被検物質が有する動脈硬化の改善効果又は将来の発症リスクの低減効果の評価、並びに、そのような物質のスクリーニングが行なえることが示された。例えば、所望の被検物質を使用して同様の動物実験を行なって体液試料を調製し、同様の手順でSELDI−TOF−MSを行なった場合に、質量/電荷比が約20400のピークを生じるタンパク質の濃度が正常値に維持されたとき、該被検物質は、動脈硬化の改善効果、又は将来の発症リスクの低減効果を有すると評価することができる。
【0131】
27.マーカー物質(M25)の特定
画分4(有機溶媒)を強陰イオン交換チップQ10に接触させ、pH9.0のプロテインチップ結合バッファーで洗浄してSELDI−TOF−MS(EAM:SPA−H)を行なった場合に、質量/電荷比が20908(平均値)のイオンピークが検出された。増減パターン解析の結果、本ピークは第1群、第3群および第4群で高値を示し、第2群で低値を示した。図25に、各群に分けて本ピークのピーク強度をプロットした場合の箱髭図を示す。その結果、本ピークのROC面積(第1群vs第2群)は0.980、p値(第1群vs第2群)は0.0002、p値(第2群vs第3群)は0.0065であった。
【0132】
以上より、SELDI−TOF−MSに供すると質量/電荷比が約20900のピークを生じるタンパク質(マーカー物質(M25))が、動脈硬化を発症しているマウス、又は動脈硬化の将来の発症リスクが高いマウスに特異的な物質であり、動脈硬化のマーカーとなり得ることがわかった。これにより、被検物質を摂取させた動脈硬化を発症している動物又は将来の発症リスクが高い動物の体液中におけるマーカー物質(M25)の濃度を指標として、被検物質が有する動脈硬化の改善効果又は将来の発症リスクの低減効果の評価、並びに、そのような物質のスクリーニングが行なえることが示された。例えば、所望の被検物質を使用して同様の動物実験を行なって体液試料を調製し、同様の手順でSELDI−TOF−MSを行なった場合に、質量/電荷比が約20900のピークを生じるタンパク質の濃度が正常値に維持されたとき、該被検物質は、動脈硬化の改善効果、又は将来の発症リスクの低減効果を有すると評価することができる。
【0133】
28.マーカー物質(M26)の特定
画分1(pH9.0)を弱陽イオン交換チップCM10に接触させ、pH3.0のプロテインチップ結合バッファーで洗浄してSELDI−TOF−MS(EAM:SPA−H)を行なった場合に、質量/電荷比が21353(平均値)のイオンピークが検出された。増減パターン解析の結果、本ピークは第1群、第3群および第4群で高値を示し、第2群で低値を示した。図26に、各群に分けて本ピークのピーク強度をプロットした場合の箱髭図を示す。その結果、本ピークのROC面積(第1群vs第2群)は0.940、p値(第1群vs第2群)は0.0005、p値(第2群vs第3群)は0.0494であった。
【0134】
以上より、SELDI−TOF−MSに供すると質量/電荷比が約21400のピークを生じるタンパク質(マーカー物質(M26))が、動脈硬化を発症しているマウス、又は動脈硬化の将来の発症リスクが高いマウスに特異的な物質であり、動脈硬化のマーカーとなり得ることがわかった。これにより、被検物質を摂取させた動脈硬化を発症している動物又は将来の発症リスクが高い動物の体液中におけるマーカー物質(M26)の濃度を指標として、被検物質が有する動脈硬化の改善効果又は将来の発症リスクの低減効果の評価、並びに、そのような物質のスクリーニングが行なえることが示された。例えば、所望の被検物質を使用して同様の動物実験を行なって体液試料を調製し、同様の手順でSELDI−TOF−MSを行なった場合に、質量/電荷比が約21400のピークを生じるタンパク質の濃度が正常値に維持されたとき、該被検物質は、動脈硬化の改善効果、又は将来の発症リスクの低減効果を有すると評価することができる。
【0135】
29.マーカー物質(M27)の特定
画分3(pH3.0)を弱陽イオン交換チップCM10に接触させ、pH3.0のプロテインチップ結合バッファーで洗浄してSELDI−TOF−MS(EAM:SPA−H)を行なった場合に、質量/電荷比が28161(平均値)のイオンピークが検出された。増減パターン解析の結果、本ピークは第1群、第3群および第4群で高値を示し、第2群で低値を示した。図27に、各群に分けて本ピークのピーク強度をプロットした場合の箱髭図を示す。その結果、本ピークのROC面積(第1群vs第2群)は0.980、p値(第1群vs第2群)は0.0002、p値(第2群vs第3群)は0.0191であった。
【0136】
以上より、SELDI−TOF−MSに供すると質量/電荷比が約28200のピークを生じるタンパク質(マーカー物質(M27))が、動脈硬化を発症しているマウス、又は動脈硬化の将来の発症リスクが高いマウスに特異的な物質であり、動脈硬化のマーカーとなり得ることがわかった。これにより、被検物質を摂取させた動脈硬化を発症している動物又は将来の発症リスクが高い動物の体液中におけるマーカー物質(M27)の濃度を指標として、被検物質が有する動脈硬化の改善効果又は将来の発症リスクの低減効果の評価、並びに、そのような物質のスクリーニングが行なえることが示された。例えば、所望の被検物質を使用して同様の動物実験を行なって体液試料を調製し、同様の手順でSELDI−TOF−MSを行なった場合に、質量/電荷比が約28200のピークを生じるタンパク質の濃度が正常値に維持されたとき、該被検物質は、動脈硬化の改善効果、又は将来の発症リスクの低減効果を有すると評価することができる。
【0137】
30.マーカー物質(M28)の特定
画分3(pH3.0)を弱陽イオン交換チップCM10に接触させ、pH3.0のプロテインチップ結合バッファーで洗浄してSELDI−TOF−MS(EAM:SPA−H)を行なった場合に、質量/電荷比が34393(平均値)のイオンピークが検出された。増減パターン解析の結果、本ピークは第1群、第3群および第4群で高値を示し、第2群で低値を示した。図28に、各群に分けて本ピークのピーク強度をプロットした場合の箱髭図を示す。その結果、本ピークのROC面積(第1群vs第2群)は0.900、p値(第1群vs第2群)は0.0015、p値(第2群vs第3群)は0.0156であった。
【0138】
以上より、SELDI−TOF−MSに供すると質量/電荷比が約34400のピークを生じるタンパク質(マーカー物質(M28))が、動脈硬化を発症しているマウス、又は動脈硬化の将来の発症リスクが高いマウスに特異的な物質であり、動脈硬化のマーカーとなり得ることがわかった。これにより、被検物質を摂取させた動脈硬化を発症している動物又は将来の発症リスクが高い動物の体液中におけるマーカー物質(M28)の濃度を指標として、被検物質が有する動脈硬化の改善効果又は将来の発症リスクの低減効果の評価、並びに、そのような物質のスクリーニングが行なえることが示された。例えば、所望の被検物質を使用して同様の動物実験を行なって体液試料を調製し、同様の手順でSELDI−TOF−MSを行なった場合に、質量/電荷比が約34400のピークを生じるタンパク質の濃度が正常値に維持されたとき、該被検物質は、動脈硬化の改善効果、又は将来の発症リスクの低減効果を有すると評価することができる。
【0139】
31.マーカー物質(M29)の特定
画分4(有機溶剤)を強陰イオン交換チップQ10に接触させ、pH9.0のプロテインチップ結合バッファーで洗浄してSELDI−TOF−MS(EAM:SPA−H)を行なった場合に、質量/電荷比が66090(平均値)のイオンピークが検出された。増減パターン解析の結果、本ピークは第1群、第3群および第4群で低値を示し、第2群で高値を示した。図29に、各群に分けて本ピークのピーク強度をプロットした場合の箱髭図を示す。その結果、本ピークのROC面積(第1群vs第2群)は0.900、p値(第1群vs第2群)は0.0012、p値(第2群vs第3群)は0.0019であった。
【0140】
以上より、SELDI−TOF−MSに供すると質量/電荷比が約66000のピークを生じるタンパク質(マーカー物質(M29))が、動脈硬化を発症しているマウス、又は動脈硬化の将来の発症リスクが高いマウスに特異的な物質であり、動脈硬化のマーカーとなり得ることがわかった。これにより、被検物質を摂取させた動脈硬化を発症している動物又は将来の発症リスクが高い動物の体液中におけるマーカー物質(M29)の濃度を指標として、被検物質が有する動脈硬化の改善効果又は将来の発症リスクの低減効果の評価、並びに、そのような物質のスクリーニングが行なえることが示された。例えば、所望の被検物質を使用して同様の動物実験を行なって体液試料を調製し、同様の手順でSELDI−TOF−MSを行なった場合に、質量/電荷比が約66000のピークを生じるタンパク質の濃度が正常値に維持されたとき、該被検物質は、動脈硬化の改善効果、又は将来の発症リスクの低減効果を有すると評価することができる。
【0141】
なお、ヒトの体液中にもマーカー物質(M01)〜(M29)と同等のタンパク質が存在する場合には、ヒトの体液中における当該タンパク質の濃度を指標として、動脈硬化の発症の有無、又は将来の発症リスクを診断できる可能性も示唆された。
【実施例2】
【0142】
マーカー物質(M06)の精製と同定
強陰イオン交換樹脂Q−Sepharose HP(GEヘルスケア社)を充填したカラム(1mL)を平衡化バッファー(50mM Tris−HCl pH9.0,1M 尿素,0.22% CHAPS)にて平衡化した。C57BLマウス血清(清水実験材料社)500μLに対して変性バッファー(50mM Tris−HCl pH9.0,9M 尿素,2% CHAPS)を750μL加えて4℃で20分間変性処理した。変性処理したサンプルを12,000G、4℃で10分間遠心し、0.45μmのフィルターでろ過した後、平衡化した前記カラムに添加した。50mM Tris−HCl(pH9.0)、及び100mM 酢酸ナトリウムバッファー(pH5.0)で順に洗浄した後、50mM クエン酸ナトリウムバッファー(pH3.0)で溶出し、ピーク画分を分取した。
【0143】
弱陽イオン交換樹脂HiTrap CM FF(GEヘルスケア社)を充填したカラム(1mL)を50mM クエン酸ナトリウムバッファー(pH3.0)にて平衡化した。分取したピーク画分に対して等量の50mM クエン酸ナトリウムバッファー(pH3.0)を添加・混合し、0.45μmのフィルターでろ過した後、平衡化した前記カラムに添加した。50mM クエン酸ナトリウムバッファー(pH3.0)でカラムを洗浄した後、50mM クエン酸ナトリウムバッファー(pH5.0)で溶出し、約1mLずつ分取した。各画分に対してSELDI−TOF−MS分析を行い、3〜5番目の画分に、精製過程における酸化修飾などによる誤差の範囲内でマーカー物質(M06)の質量/電荷比(平均値:5203)と同等の質量/電荷比を示すピークを確認した。
【0144】
分取した画分の一部をアセトン沈殿処理した後、ポリペプチド分離用ゲル(15−20%)NTH−5A0Tゲル(DRC社)を用いてSDS−PAGEを行った(図30)。図30中、レーン1〜5はいずれも回収画分、Mは分子量マーカーである。分離された約5.2kDaのバンド(図30の矢印)を切り出してタンパク質を抽出し、SELDI−TOF−MS分析を行い、マーカー物質(M06)と同等の質量/電荷比を示すピークを確認した(図31の矢印)。
【0145】
あらためて同様のSDS−PAGEを行ってPVDF膜に転写し、約5.2kDaのバンド部分をN末端アミノ酸解析に供した。その結果、配列番号1で表される10アミノ酸が決定された。このアミノ酸配列はマウスアポリポタンパク質A2(配列番号2)の一部と完全一致していた。さらに、配列番号2のアミノ酸番号15(Phe)〜60(Leu)の部分に相当するタンパク質断片の予想される等電点が6.77、分子量が5195であり、これらの値がSELDI−TOF−MS分析の結果とよく一致した。このことから、マーカー物質(M06)はアポリポタンパク質A2の断片と同定された。当該タンパク質断片に相当する、配列番号2のアミノ酸番号15(Phe)〜60(Leu)の部分のアミノ酸配列を配列番号3に示す。
【実施例3】
【0146】
マーカー物質(M07)の精製と同定
強陰イオン交換樹脂Q−Sepharose HP(GEヘルスケア社)を充填したカラム(1mL)を平衡化バッファー(50mM Tris−HCl pH9.0,1M 尿素,0.22% CHAPS)にて平衡化した。マウス標準血漿(Pel-Freez社)500μLに対して変性バッファー(50mM Tris−HCl pH9.0,9M 尿素,2% CHAPS)を750μL加えて変性処理した後、平衡化した前記カラムに添加した。50mM Tris−HCl(pH9.0)、100mM 酢酸ナトリウムバッファー(pH5.0)、50mM クエン酸ナトリウムバッファー(pH3.0)で順に洗浄した後、33.3% 2−プロパノール/16.7% アセトニトリル/0.1% TFAで溶出し、ピーク画分を分取した。
【0147】
弱陽イオン交換樹脂HiTrap CM FF(GEヘルスケア社)を充填したカラム(1mL)を50mM 酢酸ナトリウムバッファー(pH5.0)にて平衡化した。分取した画分の全量を平衡化した前記カラムに添加した。50mM 酢酸ナトリウムバッファー(pH5.0)でカラムを洗浄した後、100mM NaClを含む50mM 酢酸ナトリウムバッファー(pH5.0)で溶出した。溶出した画分に対してSELDI−TOF−MS分析を行い、マーカー物質(M07)の質量/電荷比(平均値:6023)と同等の質量/電荷比を示すピークを確認した。
【0148】
回収した画分の一部をアセトン沈殿処理した後、ポリペプチド分離用ゲル(15−20%)NTH−5A0Tゲル(DRC社)を用いてSDS−PAGEを行った(図32)。図32中、レーン1,2はいずれも回収画分、Mは分子量マーカーである。分離された約6.0kDaのバンド(図32の矢印)を切り出してタンパク質を抽出し、SELDI−TOF−MS分析を行い、マーカー物質(M07)の質量/電荷比(平均値:6023)と同等の質量/電荷比を示すピークを確認した(図33の矢印)。
【0149】
あらためて同様のSDS−PAGEを行って約6.0kDaのバンドを切り出し、還元アルキル化処理した後、0.01μg/μLのトリプシン溶液(50mM 炭酸水素アンモニウム(pH8.0)に溶解)を作用させてゲル内で消化した。消化したサンプル1μLを金属プレート上に滴下し、飽和CHCA溶液0.4μLをさらに滴下して乾燥させた後、質量分析計Proteomics Analyzer 4700(アプライドバイオシステムズ社)で測定したところ、少なくとも2個のピークが検出され、それらの精密質量は「1850.84」及び「1981.99」と算出された。これらのデータを元にMascotデータベース(マトリックスサイエンス社)によって既知タンパク質を検索し、ペプチドマスフィンガープリンティングを行ったところ、これらのペプチドはそれぞれ配列番号4,5で表わされるアミノ酸配列のペプチドと一致し、目的のタンパク質は99%以上の確率で「血清アルブミン」と同定された。各ペプチドの精密質量、アミノ酸配列、及び配列番号の対応関係を第1表に示す。既報のマウス血清アルブミンのアミノ酸配列を配列番号6に示す。
【0150】
【表1】

【0151】
あらためて同様のSDS−PAGEを行ってPVDF膜に転写し、約6.0kDaのバンド部分をN末端アミノ酸解析に供した。その結果、配列番号7で表される12アミノ酸が決定された。このアミノ酸配列は血清アルブミン(配列番号6)のアミノ酸番号554(Ala)から565(Ala)の12アミノ酸と完全一致していた。さらに、配列番号6のアミノ酸番号554(Ala)〜608(Ala)の部分に相当するタンパク質断片の予想される等電点が5.65、分子量が6019であり、これらの値がSELDI−TOF−MS分析の結果とよく一致した。このことから、マーカー物質(M07)は血清アルブミンの断片と同定された。当該タンパク質断片に相当する、配列番号6のアミノ酸番号554(Ala)〜608(Ala)の部分のアミノ酸配列を配列番号8に示す。
【実施例4】
【0152】
マーカー物質(M09)の精製と同定
強陰イオン交換樹脂HiTrap Q HP(GEヘルスケア社)を平衡化バッファー(50mM Tris−HCl pH9.0,1M 尿素,0.22% CHAPS)にて平衡化した。マウス標準血漿(Pel-Freez社)500μLに対して変性バッファー(50mM Tris−HCl pH9.0,9M 尿素,2% CHAPS)を750μL加えて変性処理した後、平衡化した前記カラムに添加した。素通り画分を回収し、さらに、
平衡化バッファーで溶出されたピーク画分を回収した。
【0153】
回収した画分の一部をアセトン沈殿処理した後、ポリペプチド分離用ゲル(15−20%)NTH−5A0Tゲル(DRC社)を用いてSDS−PAGEを行った(図34)。図34中、レーン1は回収画分、Mは分子量マーカーである。分離された約6.8kDaのバンド(図34の矢印)を切り出してタンパク質を抽出し、SELDI−TOF−MS分析を行い、精製過程における酸化修飾などによる誤差の範囲内でマーカー物質(M09)の質量/電荷比(平均値:6861)と同等の質量/電荷比を示すピークを確認した(図35の矢印)。
【0154】
あらためて同様のSDS−PAGEを行って約6.8kDaのバンドを切り出し、実施例3と同様にしてゲル内消化及び質量分析を行ったところ、少なくとも2個のピークが検出され、それらの精密質量は「781.48」及び「1042.40」と算出された。これらのデータを元に実施例3と同様にしてペプチドマスフィンガープリンティングを行ったところ、これらのペプチドはそれぞれ配列番号9,10で表わされるアミノ酸配列のペプチドと一致し、目的のタンパク質は99%以上の確率で「アポリポタンパク質C1」と同定された。各ペプチドの精密質量、アミノ酸配列、及び配列番号の対応関係を第2表に示す。既報のマウスアポリポタンパク質C1のアミノ酸配列を配列番号14に示す。
【0155】
【表2】

【0156】
アポリポタンパク質C1については、N末端の2アミノ酸残基(Ala−Pro)が欠損した「アポリポタンパク質C1の修飾体」(配列番号15)が血清中に存在することが確認されている。本実施例のペプチドマスフィンガープリンティングでは後述の実施例5と同じタンパク質(アポリポタンパク質C1)がヒットしたが、マーカー物質(M09)はその電荷/質量比(平均値:6860)から、当該アポリポタンパク質C1の修飾体(配列番号15)であると考えられた。
【実施例5】
【0157】
マーカー物質(M10)の精製と同定
強陰イオン交換樹脂Q−Sepharose HP(GEヘルスケア社)を充填したカラム(1mL)を平衡化バッファー(50mM Tris−HCl pH9.0,1M 尿素,0.22% CHAPS)にて平衡化した。C57BLマウス血清(清水実験材料社)500μLに対して変性バッファー(50mM Tris−HCl pH9.0,9M 尿素,2% CHAPS)を750μL加えて変性処理し、平衡化した前記カラムに添加した。非吸着画分を回収した。
【0158】
回収した画分の一部をアセトン沈殿処理した後、ポリペプチド分離用ゲル(15−20%)NTH−5A0Tゲル(DRC社)を用いてSDS−PAGEを行った(図36)。図36中、レーン1〜6はいずれも回収画分、Mは分子量マーカーである。分離された約7.0kDaのバンド(図36の矢印)を切り出してタンパク質を抽出し、SELDI−TOF−MS分析を行い、マーカー物質(M10)の質量/電荷比(平均値:7005)と同等の質量/電荷比を示すピークを確認した(図37のa)。
【0159】
あらためて同様のSDS−PAGEを行って約7.0kDaのバンドを切り出し、実施例3と同様にしてゲル内消化及び質量分析を行ったところ、少なくとも3個のピークが検出され、それらの精密質量は、「1279.70」、「1299.71」、及び「1042.53」と算出された。これらのデータを元に実施例3と同様にしてペプチドマスフィンガープリンティングを行ったところ、精密質量「1279.70」、「1299.71」、及び「1042.53」のペプチドはそれぞれ配列番号11〜13で表わされるアミノ酸配列のペプチドと一致し、目的のタンパク質は99%以上の確率で「アポリポタンパク質C1」(配列番号14)と同定された。各ペプチドの精密質量、アミノ酸配列、及び配列番号の対応関係を第3表に示す。
【0160】
【表3】

【0161】
本実施例のペプチドマスフィンガープリンティングでは実施例4と同じタンパク質(アポリポタンパク質C1)がヒットしたが、マーカー物質(M10)はその電荷/質量比(平均値:7005)から、アポリポタンパク質C1の全長と考えられた。
【0162】
なお、図37に示すように、SELDI−TOF−MS分析においてマーカー物質(M10)よりも小さい質量(約6.8kDa)を示すピークも検出された(図37のb)。これら2種のタンパク質は性質が非常に似ていること、並びに、質量の値の比較から、ピークbのタンパク質は、実施例4で述べた、アポリポタンパク質C1(配列番号14)のN末端の2アミノ酸(Ala−Pro)が欠損した「アポリポタンパク質C1の修飾体」(配列番号15)であると考えられた。アミノ酸配列から計算される質量は、ピークaが6993Da、ピークbが6825Daであった。
【実施例6】
【0163】
マーカー物質(M15)の精製と同定
強陰イオン交換樹脂Q−Sepharose HP(GEヘルスケア社)を充填したカラム(1mL)を平衡化バッファー(50mM Tris−HCl pH9.0,1M 尿素,0.22% CHAPS)にて平衡化した。C57BLマウス血清(Innovative Research社)500μLに対して変性バッファー(50mM Tris−HCl pH9.0,9M 尿素,2% CHAPS)を750μL加えて変性処理し、平衡化した前記カラムに添加した。50mM Tris−HCl(pH9.0)、100mM 酢酸ナトリウムバッファー(pH5.0)、及び50mM クエン酸ナトリウムバッファー(pH3.0)で順に洗浄した後、50% アセトニトリル,0.1% TFAで溶出し、ピーク画分を分取した。
【0164】
回収した画分の一部をアセトン沈殿処理した後、ポリペプチド分離用ゲル(15−20%)NTH−5A0Tゲル(DRC社)を用いてSDS−PAGEを行った(図38)。図38中、レーン1,2はいずれも回収画分、Mは分子量マーカーである。分離された約8.7kDaのバンド(図38の矢印A)を切り出してタンパク質を抽出し、SELDI−TOF−MS分析を行い、精製過程における酸化修飾などによる誤差の範囲内でマーカー物質(M15)の質量/電荷比(平均値:8723)と同等の質量/電荷比を示すピークを確認した(図39の矢印)。
【0165】
あらためて同様のSDS−PAGEを行って約8.7kDaのバンドを切り出し、実施例3と同様にしてゲル内消化及び質量分析を行ったところ、少なくとも2個のピークが検出され、それらの精密質量は「1832.01」及び「1193.69」と算出された。これらのデータを元に実施例3と同様にしてペプチドマスフィンガープリンティングを行ったところ、精密質量「1832.01」と「1193.69」のペプチドはそれぞれ配列番号16,17で表わされるアミノ酸配列のペプチドと一致し、目的のタンパク質は99%以上の確率で「アポリポタンパク質A2」と同定された。各ペプチドの精密質量、アミノ酸配列、及び配列番号の対応関係を第4表に示す。既報のマウスアポリポタンパク質A2のアミノ酸配列を配列番号2に示す。
【0166】
【表4】

【実施例7】
【0167】
マーカー物質(M16)の精製と同定
実施例6で行ったSDS−PAGEで分離された約8.8kDaのバンド(図38の矢印B)を切り出してタンパク質を抽出し、SELDI−TOF−MS分析を行った。精製過程における酸化修飾などによる誤差の範囲内でマーカー物質(M16)の質量/電荷比(平均値:8840)と同等の質量/電荷比を示すピークを確認した(図40の矢印)。
【0168】
あらためて同様のSDS−PAGEを行って約8.8kDaのバンドを切り出し、実施例3と同様にしてゲル内消化及び質量分析を行ったところ、少なくとも3個のピークが検出され、それらの精密質量は「1988.08」、「1062.48」、及び「2629.26」と算出された。これらのデータを元に実施例3と同様にしてペプチドマスフィンガープリンティングを行ったところ、これらのペプチドはそれぞれ配列番号18〜20で表わされるアミノ酸配列のペプチドと一致し、目的のタンパク質は99%以上の確率で「アポリポタンパク質C3」と同定された。各ペプチドの精密質量、アミノ酸配列、及び配列番号の対応関係を第5表に示す。既報のマウスアポリポタンパク質C3のアミノ酸配列を配列番号21に示す。
【0169】
【表5】

【実施例8】
【0170】
マーカー物質(M21)〜(M23)の精製と同定
強陰イオン交換樹脂HiTrap Q HP (1mL)(GEヘルスケア社)を平衡化バッファー(50mM Tris−HCl pH9.0,1M 尿素,0.22% CHAPS)にて平衡化した。マウス標準血漿(Pel-Freez社)500μLに対して変性バッファー(50mM Tris−HCl pH9.0,9M 尿素,2% CHAPS)を750μL加えて変性処理した後、平衡化した前記カラムに添加した。50mM Tris−HCl(pH9.0)、50mM Tris−HCl(pH7.0)でカラムを順次洗浄した後、50mM NaClを含む50mM Tris−HCl(pH7.0)で溶出し、ピーク画分を分取した。
【0171】
回収した画分の一部をアセトン沈殿処理した後、ポリペプチド分離用ゲル(15−20%)NTH−5A0Tゲル(DRC社)を用いてSDS−PAGEを行った(図41)。図41中、レーン1〜6はいずれも回収画分、Mは分子量マーカーである。分離された約14.0kDaのバンド(図41の矢印)を切り出してタンパク質を抽出し、SELDI−TOF−MS分析を行い、マーカー物質(M21)〜(M23)の質量/電荷比(平均値:13742,13958,14167)と同等の質量/電荷比を示す複数のピークを確認した(図42)。
【0172】
あらためて同様のSDS−PAGEを行って約14.0kDaのバンドを切り出し、実施例3と同様にしてゲル内消化及び質量分析を行ったところ、少なくとも8個のピークが検出され、それらの精密質量は「1510.75」、「1382.65」、「1587.79」、「2438.25」、「869.46」、「1554.85」、「2517.28」、及び「2597.38」と算出された。これらのデータを元に実施例3と同様にしてペプチドマスフィンガープリンティングを行ったところ、これらのペプチドはそれぞれ配列番号22〜29で表わされるアミノ酸配列のペプチドと一致し、目的のタンパク質は99%以上の確率で「トランスサイレチン」と同定された。各ペプチドの精密質量、アミノ酸配列、及び配列番号の対応関係を第6表に示す。既報のマウストランスサイレチンのアミノ酸配列を配列番号30に示す。
【0173】
【表6】

【0174】
上述したように、トランスサイレチンについては、その唯一のCys残基が修飾を受けた種々の修飾トランスサイレチンが見出されている。マーカー物質(M21)〜(M23)の各電荷/質量比(平均値:13742,13958,14167)から、マーカー物質(M21)は「S−スルホン化トランスサイレチン」、マーカー物質(M22)は「グルタチオン化トランスサイレチン」とそれぞれ同定された。マーカー物質(M23)はグルタチオン化トランスサイレチンにマトリクス(SPA−H)が結合した複合体と考えられた。
【実施例9】
【0175】
マーカー物質(M25)の精製と同定
実施例2と同様にして強陰イオン交換樹脂Q−Sepharose HPを充填したカラム(1mL)の平衡化、並びに、C57BLマウス血清(清水実験材料社)の変性処理とフィルターろ過を行い、カラムにサンプルを添加した。非吸着画分を回収した。
【0176】
強陽イオン交換樹脂HiTrap SP HP(GEヘルスケア社)を充填したカラム(1mL)を50mM 酢酸ナトリウムバッファー(pH4.0)にて平衡化した。回収した非吸着画分を50mM 酢酸ナトリウムバッファー(pH3.0)で10倍希釈し、平衡化した前記カラムに添加した。50mM 酢酸ナトリウムバッファー(pH4.0),200mM NaClにてカラムを洗浄した後、50mM 酢酸ナトリウムバッファー(pH4.0),400mM NaClにて溶出した。ピーク画分を分取した。このピーク画分に対してSELDI−TOF−MS分析を行い、精製過程における酸化修飾などによる誤差の範囲内でマーカー物質(M25)の質量/電荷比(平均値:20908)と同等の質量/電荷比を示すピークを確認した。
【0177】
回収した画分の一部をアセトン沈殿処理した後、ポリペプチド分離用ゲル(15−20%)NTH−5A0Tゲル(DRC社)を用いてSDS−PAGEを行った(図43)。図43中、レーン1,2はいずれも回収画分、Mは分子量マーカーである。分離された約21.0kDaのバンド(図43の矢印)を切り出してタンパク質を抽出し、SELDI−TOF−MS分析を行い、マーカー物質(M25)の質量/電荷比(平均値:20908)と同等の質量/電荷比を示すピークを確認した(図44の矢印)。
【0178】
あらためて同様のSDS−PAGEを行って約21.0kDaのバンドを切り出し、実施例3と同様にしてゲル内消化及び質量分析を行ったところ、少なくとも7個のピークが検出され、それらの精密質量は「1155.66」、「2407.31」、「1501.83」、「1226.68」、「2705.27」、「2080.03」、及び「1360.72」と算出された。これらのデータを元に実施例3と同様にしてペプチドマスフィンガープリンティングを行ったところ、精密質量「1155.66」、「2407.31」、「1501.83」、「1226.68」、「2705.27」、「2080.03」、及び「1360.72」のペプチドはそれぞれ配列番号31〜37で表わされるアミノ酸配列のペプチドと一致し、目的のタンパク質は99%以上の確率で「レチノール結合タンパク質」と同定された。各ペプチドの精密質量、アミノ酸配列、及び配列番号の対応関係を第7表に示す。既報のマウスレチノール結合タンパク質のアミノ酸配列を配列番号38に示す。
【0179】
【表7】

【0180】
レチノール結合タンパク質については、一部のアミノ酸残基が欠損した数種類の「レチノール結合タンパク質の修飾体」が血清中に存在することが確認されている。本実施例のペプチドマスフィンガープリンティングでは後述の実施例9と同じタンパク質(レチノール結合タンパク質)がヒットしたが、マーカー物質(M25)はその電荷/質量比(平均値:20908)から、レチノール結合タンパク質の一部のアミノ酸残基が欠損した「レチノール結合タンパク質の修飾体」であると考えられた。
【実施例10】
【0181】
マーカー物質(M26)の精製と同定
強陰イオン交換樹脂Macro−Prep DEAE(バイオラッド社)を充填したスピンカラム(5mL)を平衡化バッファー(50mM Tris−HCl pH9.0,1M 尿素,0.22% CHAPS)にて平衡化した。マウス標準血漿(Pel-Freez社)3.0mLを20,000G、4℃で10分間遠心後、上清を回収した。回収した上清2.5mLに対して変性バッファー(50mM Tris−HCl pH9.0,9M 尿素,2% CHAPS)を3.75mL加えて変性処理した。この変性処理サンプルに平衡化バッファー6.25mLを加えて希釈し、平衡化した前記カラムに添加した。素通り画分を回収し、さらに、50mM Tris−HCl(pH9.0)で溶出されたピーク画分を回収した。
【0182】
回収した画分の一部をアセトン沈殿処理した後、ポリペプチド分離用ゲル(15−20%)NTH−5A0Tゲル(DRC社)を用いてSDS−PAGEを行った(図45)。図45中、レーン1,2はいずれも回収画分、Mは分子量マーカーである。分離された約21.4kDaのバンド(図45の矢印A)を切り出してタンパク質を抽出し、SELDI−TOF−MS分析を行い、精製過程における酸化修飾などによる誤差の範囲内でマーカー物質(M26)の質量/電荷比(平均値:21353)と同等の質量/電荷比を示すピークを確認した(図46の矢印)。
【0183】
あらためて同様のSDS−PAGEを行って約21.4kDaのバンドを切り出し、実施例3と同様にしてゲル内消化及び質量分析を行ったところ、少なくとも5個のピークが検出され、それらの精密質量は「1155.62」、「1485.77」、「1226.64」、「2079.94」、及び「1360.66」と算出された。これらのデータを元に実施例3と同様にしてペプチドマスフィンガープリンティングを行ったところ、これらのペプチドはそれぞれ配列番号39〜43で表わされるアミノ酸配列のペプチドと一致し、目的のタンパク質は99%以上の確率で「レチノール結合タンパク質」(配列番号38)と同定された。各ペプチドの精密質量、アミノ酸配列、及び配列番号の対応関係を第8表に示す。
【0184】
【表8】

【0185】
なお、本実施例のペプチドマスフィンガープリンティングでは実施例9と同じタンパク質(レチノール結合タンパク質)がヒットしたが、マーカー物質(M26)はその電荷/質量比(平均値:21353)から、レチノール結合タンパク質の全長と考えられた。
【実施例11】
【0186】
マーカー物質(M27)の精製と同定
実施例10で行ったSDS−PAGEで分離された約28.0kDaのバンド(図45の矢印B)を切り出してタンパク質を抽出し、SELDI−TOF−MS分析を行った。精製過程における酸化修飾などによる誤差の範囲内でマーカー物質(M27)の質量/電荷比(平均値:28161)と同等の質量/電荷比を示すピークを確認した(図47の矢印)。
【0187】
あらためて同様のSDS−PAGEを行って約28.0kDaのバンドを切り出し、実施例3と同様にしてゲル内消化及び質量分析を行ったところ、少なくとも12個のピークが検出され、それらの精密質量は「1852.53」、「1394.06」、「1236.86」、「1596.35」、「1340.01」、「1098.77」、「1317.96」、「826.47」、「1296.90」、「1997.80」、「1330.93」、及び「1039.71」と算出された。これらのデータを元に実施例3と同様にしてペプチドマスフィンガープリンティングを行ったところ、これらのペプチドはそれぞれ配列番号44〜55で表わされるアミノ酸配列のペプチドと一致し、目的のタンパク質は99%以上の確率で「アポリポタンパク質A1」と同定された。各ペプチドの精密質量、アミノ酸配列、及び配列番号の対応関係を第9表に示す。既報のマウスアポリポタンパク質A1のアミノ酸配列を配列番号56に示す。
【0188】
【表9】

【図面の簡単な説明】
【0189】
【図1】質量/電荷比が3352(平均値)のイオンピークについての箱髭図である。
【図2】質量/電荷比が4147(平均値)のイオンピークについての箱髭図である。
【図3】質量/電荷比が4281(平均値)のイオンピークについての箱髭図である。
【図4】質量/電荷比が4754(平均値)のイオンピークについての箱髭図である。
【図5】質量/電荷比が5126(平均値)のイオンピークについての箱髭図である。
【図6】質量/電荷比が5203(平均値)のイオンピークについての箱髭図である。
【図7】質量/電荷比が6023(平均値)のイオンピークについての箱髭図である。
【図8】質量/電荷比が6103(平均値)のイオンピークについての箱髭図である。
【図9】質量/電荷比が6861(平均値)のイオンピークについての箱髭図である。
【図10】質量/電荷比が7005(平均値)のイオンピークについての箱髭図である。
【図11】質量/電荷比が7095(平均値)のイオンピークについての箱髭図である。
【図12】質量/電荷比が7572(平均値)のイオンピークについての箱髭図である。
【図13】質量/電荷比が8439(平均値)のイオンピークについての箱髭図である。
【図14】質量/電荷比が8534(平均値)のイオンピークについての箱髭図である。
【図15】質量/電荷比が8723(平均値)のイオンピークについての箱髭図である。
【図16】質量/電荷比が8840(平均値)のイオンピークについての箱髭図である。
【図17】質量/電荷比が10012(平均値)のイオンピークについての箱髭図である。
【図18】質量/電荷比が10451(平均値)のイオンピークについての箱髭図である。
【図19】質量/電荷比が10704(平均値)のイオンピークについての箱髭図である。
【図20】質量/電荷比が11669(平均値)のイオンピークについての箱髭図である。
【図21】質量/電荷比が13742(平均値)のイオンピークについての箱髭図である。
【図22】質量/電荷比が13958(平均値)のイオンピークについての箱髭図である。
【図23】質量/電荷比が14167(平均値)のイオンピークについての箱髭図である。
【図24】質量/電荷比が20441(平均値)のイオンピークについての箱髭図である。
【図25】質量/電荷比が20908(平均値)のイオンピークについての箱髭図である。
【図26】質量/電荷比が21353(平均値)のイオンピークについての箱髭図である。
【図27】質量/電荷比が28161(平均値)のイオンピークについての箱髭図である。
【図28】質量/電荷比が34393(平均値)のイオンピークについての箱髭図である。
【図29】質量/電荷比が66090(平均値)のイオンピークについての箱髭図である。
【図30】実施例2のマーカー物質(M06)の精製過程で行ったSDS−PAGEの結果を示す写真である。
【図31】実施例2のマーカー物質(M06)の精製過程で行ったSELDI−TOF−MS分析の結果を示すイオンピーク図である。
【図32】実施例3のマーカー物質(M07)の精製過程で行ったSDS−PAGEの結果を示す写真である。
【図33】実施例3のマーカー物質(M07)の精製過程で行ったSELDI−TOF−MS分析の結果を示すイオンピーク図である。
【図34】実施例4のマーカー物質(M09)の精製過程で行ったSDS−PAGEの結果を示す写真である。
【図35】実施例4のマーカー物質(M09)の精製過程で行ったSELDI−TOF−MS分析の結果を示すイオンピーク図である。
【図36】実施例5のマーカー物質(M10)の精製過程で行ったSDS−PAGEの結果を示す写真である。
【図37】実施例5のマーカー物質(M10)の精製過程で行ったSELDI−TOF−MS分析の結果を示すイオンピーク図である。
【図38】実施例6のマーカー物質(M15)並びに実施例7のマーカー物質(M16)の精製過程で行ったSDS−PAGEの結果を示す写真である。
【図39】実施例6のマーカー物質(M15)の精製過程で行ったSELDI−TOF−MS分析の結果を示すイオンピーク図である。
【図40】実施例7のマーカー物質(M16)の精製過程で行ったSELDI−TOF−MS分析の結果を示すイオンピーク図である。
【図41】実施例8のマーカー物質(M21)〜(M23)の精製過程で行ったSDS−PAGEの結果を示す写真である。
【図42】実施例8のマーカー物質(M21)〜(M23)の精製過程で行ったSELDI−TOF−MS分析の結果を示すイオンピーク図である。
【図43】実施例9のマーカー物質(M25)の精製過程で行ったSDS−PAGEの結果を示す写真である。
【図44】実施例9のマーカー物質(M25)の精製過程で行ったSELDI−TOF−MS分析の結果を示すイオンピーク図である。
【図45】実施例10のマーカー物質(M26)並びに実施例11のマーカー物質(M27)の精製過程で行ったSDS−PAGEの結果を示す写真である。
【図46】実施例10のマーカー物質(M26)の精製過程で行ったSELDI−TOF−MS分析の結果を示すイオンピーク図である。
【図47】実施例11のマーカー物質(M27)の精製過程で行ったSELDI−TOF−MS分析の結果を示すイオンピーク図である。
【特許請求の範囲】
【請求項1】
動脈硬化を発症している動物又は将来の発症リスクが高い動物に被検物質を摂取させ、該動物の体液中における下記マーカー物質(M01)〜(M29)の少なくとも1つの濃度を基準値と比較し、被検物質が有する動脈硬化の改善効果又は将来の発症リスクの低減効果を評価することを特徴とする動脈硬化改善・予防効果の評価方法。
(M01)pH9.0で強陰イオン交換体に結合し、かつ質量分析に供すると質量/電荷比が約3350のイオンピークを生じるタンパク質、
(M02)pH9.0で強陰イオン交換体に結合し、かつ質量分析に供すると質量/電荷比が約4170のイオンピークを生じるタンパク質、
(M03)pH9.0で強陰イオン交換体に結合し、かつ質量分析に供すると質量/電荷比が約4280のイオンピークを生じるタンパク質、
(M04)pH3.0で弱陽イオン交換体に結合し、かつ質量分析に供すると質量/電荷比が約4750のイオンピークを生じるタンパク質、
(M05)pH9.0で強陰イオン交換体に結合し、かつ質量分析に供すると質量/電荷比が約5130のイオンピークを生じるタンパク質、
(M06)pH3.0で弱陽イオン交換体に結合し、かつ質量分析に供すると質量/電荷比が約5200のイオンピークを生じるタンパク質、
(M07)pH3.0で弱陽イオン交換体に結合し、かつ質量分析に供すると質量/電荷比が約6020のイオンピークを生じるタンパク質、
(M08)pH9.0で強陰イオン交換体に結合し、かつ質量分析に供すると質量/電荷比が約6100のイオンピークを生じるタンパク質、
(M09)pH9.0で強陰イオン交換体に結合し、かつ質量分析に供すると質量/電荷比が約6860のイオンピークを生じるタンパク質、
(M10)pH3.0で弱陽イオン交換体に結合し、かつ質量分析に供すると質量/電荷比が約7010のイオンピークを生じるタンパク質、
(M11)pH3.0で弱陽イオン交換体に結合し、かつ質量分析に供すると質量/電荷比が約7100のイオンピークを生じるタンパク質、
(M12)pH3.0で弱陽イオン交換体に結合し、かつ質量分析に供すると質量/電荷比が約7570のイオンピークを生じるタンパク質、
(M13)pH3.0で弱陽イオン交換体に結合し、かつ質量分析に供すると質量/電荷比が約8440のイオンピークを生じるタンパク質、
(M14)pH3.0で弱陽イオン交換体に結合し、かつ質量分析に供すると質量/電荷比が約8530のイオンピークを生じるタンパク質、
(M15)pH3.0で弱陽イオン交換体に結合し、かつ質量分析に供すると質量/電荷比が約8720のイオンピークを生じるタンパク質、
(M16)pH9.0で強陰イオン交換体に結合し、かつ質量分析に供すると質量/電荷比が約8840のイオンピークを生じるタンパク質、
(M17)pH3.0で弱陽イオン交換体に結合し、かつ質量分析に供すると質量/電荷比が約10000のイオンピークを生じるタンパク質、
(M18)pH9.0で強陰イオン交換体に結合し、かつ質量分析に供すると質量/電荷比が約10500のイオンピークを生じるタンパク質、
(M19)pH3.0で弱陽イオン交換体に結合し、かつ質量分析に供すると質量/電荷比が約10700のイオンピークを生じるタンパク質、
(M20)pH9.0で強陰イオン交換体に結合し、かつ質量分析に供すると質量/電荷比が約11700のイオンピークを生じるタンパク質、
(M21)pH9.0で強陰イオン交換体に結合し、かつ質量分析に供すると質量/電荷比が約13700のイオンピークを生じるタンパク質、
(M22)pH9.0で強陰イオン交換体に結合し、かつ質量分析に供すると質量/電荷比が約14000のイオンピークを生じるタンパク質、
(M23)pH9.0で強陰イオン交換体に結合し、かつ質量分析に供すると質量/電荷比が約14200のイオンピークを生じるタンパク質、
(M24)pH9.0で強陰イオン交換体に結合し、かつ質量分析に供すると質量/電荷比が約20400のイオンピークを生じるタンパク質、
(M25)pH9.0で強陰イオン交換体に結合し、かつ質量分析に供すると質量/電荷比が約20900のイオンピークを生じるタンパク質、
(M26)pH3.0で弱陽イオン交換体に結合し、かつ質量分析に供すると質量/電荷比が約21400のイオンピークを生じるタンパク質、
(M27)pH3.0で弱陽イオン交換体に結合し、かつ質量分析に供すると質量/電荷比が約28200のイオンピークを生じるタンパク質、
(M28)pH3.0で弱陽イオン交換体に結合し、かつ質量分析に供すると質量/電荷比が約34400のイオンピークを生じるタンパク質、
(M29)pH9.0で強陰イオン交換体に結合し、かつ質量分析に供すると質量/電荷比が約66000のイオンピークを生じるタンパク質。
【請求項2】
下記(a)〜(l)の少なくとも1つを満たすことを特徴とする請求項1に記載の動脈硬化改善・予防効果の評価方法。
(a)マーカー物質(M06)はアポリポタンパク質A2又はその修飾体である、
(b)マーカー物質(M07)は血清アルブミン又はその修飾体である、
(c)マーカー物質(M09)はアポリポタンパク質C1又はその修飾体である、
(d)マーカー物質(M10)はアポリポタンパク質C1又はその修飾体である、
(e)マーカー物質(M15)はアポリポタンパク質A2又はその修飾体である、
(f)マーカー物質(M16)はアポリポタンパク質C3又はその修飾体である、
(g)マーカー物質(M21)はトランスサイレチン又はその修飾体である、
(h)マーカー物質(M22)はトランスサイレチン又はその修飾体である、
(i)マーカー物質(M23)はトランスサイレチン又はその修飾体である、
(j)マーカー物質(M25)はレチノール結合タンパク質又はその修飾体である、
(k)マーカー物質(M26)はレチノール結合タンパク質又はその修飾体である、
(l)マーカー物質(M27)はアポリポタンパク質A1又はその修飾体である。
【請求項3】
動脈硬化を発症している動物又は将来の発症リスクが高い動物に被検物質を摂取させ、該動物の体液中における下記(N1)〜(N7)のいずれかに属する少なくとも1つのマーカー物質の濃度を基準値と比較し、被検物質が有する動脈硬化の改善効果又は将来の発症リスクの低減効果を評価することを特徴とする動脈硬化改善・予防効果の評価方法。
(N1)アポリポタンパク質A2又はその修飾体、
(N2)血清アルブミン又はその修飾体、
(N3)アポリポタンパク質C1又はその修飾体、
(N4)アポリポタンパク質C3又はその修飾体、
(N5)トランスサイレチン又はその修飾体、
(N6)レチノール結合タンパク質又はその修飾体、
(N7)アポリポタンパク質A1又はその修飾体。
【請求項4】
前記基準値は、動脈硬化を発症している動物又は将来の発症リスクが高い動物に、動脈硬化の改善効果又は将来の発症リスクの低減効果を有さない既知物質を摂取させた際の、該動物の体液中における前記マーカー物質の濃度であることを特徴とする請求項1〜3のいずれか1項に記載の動脈硬化改善・予防効果の評価方法。
【請求項5】
前記動脈硬化を発症している動物又は将来の発症リスクが高い動物は、自然発症モデル動物又は遺伝子操作モデル動物であることを特徴とする請求項1〜4のいずれか1項に記載の動脈硬化改善・予防効果の評価方法。
【請求項6】
前記体液は、血液であることを特徴とする請求項1〜5のいずれか1項に記載の動脈硬化改善・予防効果の評価方法。
【請求項7】
前記被検物質は、食品素材であることを特徴とする請求項1〜6のいずれか1項に記載の動脈硬化改善・予防効果の評価方法。
【請求項8】
前記体液又は体液成分を、前記マーカー物質に対する親和性を有する物質を固定化した担体に接触させて、体液中の前記マーカー物質を担体上に捕捉し、捕捉された前記マーカー物質の量に基づいて体液中の前記マーカー物質の濃度を算出することを特徴とする請求項1〜7のいずれか1項に記載の動脈硬化改善・予防効果の評価方法。
【請求項9】
前記担体は平面部分を有し、前記マーカー物質に対する親和性を有する物質は、該平面部分の一部に固定化されていることを特徴とする請求項8に記載の動脈硬化改善・予防効果の評価方法。
【請求項10】
前記マーカー物質に対する親和性を有する物質は、イオン交換体又は抗体であることを特徴とする請求項8又は9に記載の動脈硬化改善・予防効果の評価方法。
【請求項11】
請求項1〜10のいずれか1項に記載の動脈硬化改善・予防効果の評価方法によって被検物質を評価し、動脈硬化の改善効果又は将来の発症リスクの低減効果を有する物質をスクリーニングすることを特徴とする物質のスクリーニング方法。
【請求項12】
請求項1〜10のいずれか1項に記載の動脈硬化改善・予防効果の評価方法に用いるためのキットであって、前記マーカー物質に対する親和性を有する物質を固定化した担体を含むことを特徴とする動脈硬化改善・予防効果の評価用キット。
【請求項13】
前記マーカー物質に対する親和性を有する物質は、イオン交換体であることを特徴とする請求項12に記載の動脈硬化改善・予防効果の評価用キット。
【請求項14】
動脈硬化の改善効果又は将来の発症リスクの低減効果を有する物質をスクリーニングするために使用されることを特徴とする請求項12又は13に記載の動脈硬化改善・予防効果の評価用キット。
【請求項1】
動脈硬化を発症している動物又は将来の発症リスクが高い動物に被検物質を摂取させ、該動物の体液中における下記マーカー物質(M01)〜(M29)の少なくとも1つの濃度を基準値と比較し、被検物質が有する動脈硬化の改善効果又は将来の発症リスクの低減効果を評価することを特徴とする動脈硬化改善・予防効果の評価方法。
(M01)pH9.0で強陰イオン交換体に結合し、かつ質量分析に供すると質量/電荷比が約3350のイオンピークを生じるタンパク質、
(M02)pH9.0で強陰イオン交換体に結合し、かつ質量分析に供すると質量/電荷比が約4170のイオンピークを生じるタンパク質、
(M03)pH9.0で強陰イオン交換体に結合し、かつ質量分析に供すると質量/電荷比が約4280のイオンピークを生じるタンパク質、
(M04)pH3.0で弱陽イオン交換体に結合し、かつ質量分析に供すると質量/電荷比が約4750のイオンピークを生じるタンパク質、
(M05)pH9.0で強陰イオン交換体に結合し、かつ質量分析に供すると質量/電荷比が約5130のイオンピークを生じるタンパク質、
(M06)pH3.0で弱陽イオン交換体に結合し、かつ質量分析に供すると質量/電荷比が約5200のイオンピークを生じるタンパク質、
(M07)pH3.0で弱陽イオン交換体に結合し、かつ質量分析に供すると質量/電荷比が約6020のイオンピークを生じるタンパク質、
(M08)pH9.0で強陰イオン交換体に結合し、かつ質量分析に供すると質量/電荷比が約6100のイオンピークを生じるタンパク質、
(M09)pH9.0で強陰イオン交換体に結合し、かつ質量分析に供すると質量/電荷比が約6860のイオンピークを生じるタンパク質、
(M10)pH3.0で弱陽イオン交換体に結合し、かつ質量分析に供すると質量/電荷比が約7010のイオンピークを生じるタンパク質、
(M11)pH3.0で弱陽イオン交換体に結合し、かつ質量分析に供すると質量/電荷比が約7100のイオンピークを生じるタンパク質、
(M12)pH3.0で弱陽イオン交換体に結合し、かつ質量分析に供すると質量/電荷比が約7570のイオンピークを生じるタンパク質、
(M13)pH3.0で弱陽イオン交換体に結合し、かつ質量分析に供すると質量/電荷比が約8440のイオンピークを生じるタンパク質、
(M14)pH3.0で弱陽イオン交換体に結合し、かつ質量分析に供すると質量/電荷比が約8530のイオンピークを生じるタンパク質、
(M15)pH3.0で弱陽イオン交換体に結合し、かつ質量分析に供すると質量/電荷比が約8720のイオンピークを生じるタンパク質、
(M16)pH9.0で強陰イオン交換体に結合し、かつ質量分析に供すると質量/電荷比が約8840のイオンピークを生じるタンパク質、
(M17)pH3.0で弱陽イオン交換体に結合し、かつ質量分析に供すると質量/電荷比が約10000のイオンピークを生じるタンパク質、
(M18)pH9.0で強陰イオン交換体に結合し、かつ質量分析に供すると質量/電荷比が約10500のイオンピークを生じるタンパク質、
(M19)pH3.0で弱陽イオン交換体に結合し、かつ質量分析に供すると質量/電荷比が約10700のイオンピークを生じるタンパク質、
(M20)pH9.0で強陰イオン交換体に結合し、かつ質量分析に供すると質量/電荷比が約11700のイオンピークを生じるタンパク質、
(M21)pH9.0で強陰イオン交換体に結合し、かつ質量分析に供すると質量/電荷比が約13700のイオンピークを生じるタンパク質、
(M22)pH9.0で強陰イオン交換体に結合し、かつ質量分析に供すると質量/電荷比が約14000のイオンピークを生じるタンパク質、
(M23)pH9.0で強陰イオン交換体に結合し、かつ質量分析に供すると質量/電荷比が約14200のイオンピークを生じるタンパク質、
(M24)pH9.0で強陰イオン交換体に結合し、かつ質量分析に供すると質量/電荷比が約20400のイオンピークを生じるタンパク質、
(M25)pH9.0で強陰イオン交換体に結合し、かつ質量分析に供すると質量/電荷比が約20900のイオンピークを生じるタンパク質、
(M26)pH3.0で弱陽イオン交換体に結合し、かつ質量分析に供すると質量/電荷比が約21400のイオンピークを生じるタンパク質、
(M27)pH3.0で弱陽イオン交換体に結合し、かつ質量分析に供すると質量/電荷比が約28200のイオンピークを生じるタンパク質、
(M28)pH3.0で弱陽イオン交換体に結合し、かつ質量分析に供すると質量/電荷比が約34400のイオンピークを生じるタンパク質、
(M29)pH9.0で強陰イオン交換体に結合し、かつ質量分析に供すると質量/電荷比が約66000のイオンピークを生じるタンパク質。
【請求項2】
下記(a)〜(l)の少なくとも1つを満たすことを特徴とする請求項1に記載の動脈硬化改善・予防効果の評価方法。
(a)マーカー物質(M06)はアポリポタンパク質A2又はその修飾体である、
(b)マーカー物質(M07)は血清アルブミン又はその修飾体である、
(c)マーカー物質(M09)はアポリポタンパク質C1又はその修飾体である、
(d)マーカー物質(M10)はアポリポタンパク質C1又はその修飾体である、
(e)マーカー物質(M15)はアポリポタンパク質A2又はその修飾体である、
(f)マーカー物質(M16)はアポリポタンパク質C3又はその修飾体である、
(g)マーカー物質(M21)はトランスサイレチン又はその修飾体である、
(h)マーカー物質(M22)はトランスサイレチン又はその修飾体である、
(i)マーカー物質(M23)はトランスサイレチン又はその修飾体である、
(j)マーカー物質(M25)はレチノール結合タンパク質又はその修飾体である、
(k)マーカー物質(M26)はレチノール結合タンパク質又はその修飾体である、
(l)マーカー物質(M27)はアポリポタンパク質A1又はその修飾体である。
【請求項3】
動脈硬化を発症している動物又は将来の発症リスクが高い動物に被検物質を摂取させ、該動物の体液中における下記(N1)〜(N7)のいずれかに属する少なくとも1つのマーカー物質の濃度を基準値と比較し、被検物質が有する動脈硬化の改善効果又は将来の発症リスクの低減効果を評価することを特徴とする動脈硬化改善・予防効果の評価方法。
(N1)アポリポタンパク質A2又はその修飾体、
(N2)血清アルブミン又はその修飾体、
(N3)アポリポタンパク質C1又はその修飾体、
(N4)アポリポタンパク質C3又はその修飾体、
(N5)トランスサイレチン又はその修飾体、
(N6)レチノール結合タンパク質又はその修飾体、
(N7)アポリポタンパク質A1又はその修飾体。
【請求項4】
前記基準値は、動脈硬化を発症している動物又は将来の発症リスクが高い動物に、動脈硬化の改善効果又は将来の発症リスクの低減効果を有さない既知物質を摂取させた際の、該動物の体液中における前記マーカー物質の濃度であることを特徴とする請求項1〜3のいずれか1項に記載の動脈硬化改善・予防効果の評価方法。
【請求項5】
前記動脈硬化を発症している動物又は将来の発症リスクが高い動物は、自然発症モデル動物又は遺伝子操作モデル動物であることを特徴とする請求項1〜4のいずれか1項に記載の動脈硬化改善・予防効果の評価方法。
【請求項6】
前記体液は、血液であることを特徴とする請求項1〜5のいずれか1項に記載の動脈硬化改善・予防効果の評価方法。
【請求項7】
前記被検物質は、食品素材であることを特徴とする請求項1〜6のいずれか1項に記載の動脈硬化改善・予防効果の評価方法。
【請求項8】
前記体液又は体液成分を、前記マーカー物質に対する親和性を有する物質を固定化した担体に接触させて、体液中の前記マーカー物質を担体上に捕捉し、捕捉された前記マーカー物質の量に基づいて体液中の前記マーカー物質の濃度を算出することを特徴とする請求項1〜7のいずれか1項に記載の動脈硬化改善・予防効果の評価方法。
【請求項9】
前記担体は平面部分を有し、前記マーカー物質に対する親和性を有する物質は、該平面部分の一部に固定化されていることを特徴とする請求項8に記載の動脈硬化改善・予防効果の評価方法。
【請求項10】
前記マーカー物質に対する親和性を有する物質は、イオン交換体又は抗体であることを特徴とする請求項8又は9に記載の動脈硬化改善・予防効果の評価方法。
【請求項11】
請求項1〜10のいずれか1項に記載の動脈硬化改善・予防効果の評価方法によって被検物質を評価し、動脈硬化の改善効果又は将来の発症リスクの低減効果を有する物質をスクリーニングすることを特徴とする物質のスクリーニング方法。
【請求項12】
請求項1〜10のいずれか1項に記載の動脈硬化改善・予防効果の評価方法に用いるためのキットであって、前記マーカー物質に対する親和性を有する物質を固定化した担体を含むことを特徴とする動脈硬化改善・予防効果の評価用キット。
【請求項13】
前記マーカー物質に対する親和性を有する物質は、イオン交換体であることを特徴とする請求項12に記載の動脈硬化改善・予防効果の評価用キット。
【請求項14】
動脈硬化の改善効果又は将来の発症リスクの低減効果を有する物質をスクリーニングするために使用されることを特徴とする請求項12又は13に記載の動脈硬化改善・予防効果の評価用キット。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【図17】


【図18】


【図19】


【図20】


【図21】


【図22】


【図23】


【図24】


【図25】


【図26】


【図27】


【図28】


【図29】


【図31】


【図33】


【図35】


【図37】


【図39】


【図40】


【図42】


【図44】


【図46】


【図47】


【図30】


【図32】


【図34】


【図36】


【図38】


【図41】


【図43】


【図45】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【図17】


【図18】


【図19】


【図20】


【図21】


【図22】


【図23】


【図24】


【図25】


【図26】


【図27】


【図28】


【図29】


【図31】


【図33】


【図35】


【図37】


【図39】


【図40】


【図42】


【図44】


【図46】


【図47】


【図30】


【図32】


【図34】


【図36】


【図38】


【図41】


【図43】


【図45】


【公開番号】特開2009−222698(P2009−222698A)
【公開日】平成21年10月1日(2009.10.1)
【国際特許分類】
【出願番号】特願2008−146948(P2008−146948)
【出願日】平成20年6月4日(2008.6.4)
【出願人】(303058708)株式会社バイオマーカーサイエンス (27)
【Fターム(参考)】
【公開日】平成21年10月1日(2009.10.1)
【国際特許分類】
【出願日】平成20年6月4日(2008.6.4)
【出願人】(303058708)株式会社バイオマーカーサイエンス (27)
【Fターム(参考)】
[ Back to top ]

