動脈硬化病変を評価するための方法、キット、装置及び薬剤
【課題】動脈硬化病変の進行に従ってその発現が変動するタンパク質(マーカータンパク質)群を同定し、そのタンパク質を利用して動脈硬化病変を評価する方法及び手段を提供すること。
【解決手段】被験体において、動脈硬化病変において特定の疾患ステージに特徴的な発現パターン(発現の変動)を示すマーカータンパク質を検出するステップと、
その検出結果に基づいて被験体における動脈硬化病変を評価するステップと
を含む、動脈硬化病変の評価方法。
【解決手段】被験体において、動脈硬化病変において特定の疾患ステージに特徴的な発現パターン(発現の変動)を示すマーカータンパク質を検出するステップと、
その検出結果に基づいて被験体における動脈硬化病変を評価するステップと
を含む、動脈硬化病変の評価方法。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、動脈硬化病変を評価するための方法、キット及び装置に関する。より具体的には、本発明は、新規マーカータンパク質に基づいて動脈硬化病変を評価するための方法、キット及び装置に関する。また本発明は、該マーカータンパク質を利用した動脈硬化病変の可視化剤及び動脈硬化病変への標的化剤、並びに動脈硬化病変の治療薬又は治療法の有効性の評価方法に関する。
【背景技術】
【0002】
動脈硬化は長い年月をかけて自覚症状がないうちに進行し、重篤な心筋梗塞等の心血管疾患、脳梗塞や脳出血等の脳血管疾患を誘発する。動脈硬化が進行すると、動脈血管内に粥状動脈硬化病変(粥腫、プラーク)が形成される。プラークには石灰化した繊維性組織に富む安定型と、脂質や炎症細胞に富み繊維性皮膜が菲薄化した不安定型が存在し、心筋梗塞や脳梗塞など急性動脈硬化性疾患の多くは、不安定型プラークの破綻と血栓形成によって誘導される。そのため、急性動脈硬化性疾患において、不安定プラークの形成・成長の状況や破綻リスクを適切に評価・診断することが重要である。現在動脈硬化の検出は、その狭窄度を評価する血管造影が主流であるが、血管内のプラーク形成やその性状に関する情報はあまり得られないことが課題であった。また血管造影は侵襲性が高いことから、侵襲性が低い動脈硬化病変の検出方法が求められていた。
【0003】
一方疾患プロテオミクスは、血液、唾液、尿等の体液や組織試料を材料に、健常状態と比較して特定の疾患によって変動するタンパク質の増減を網羅的に探索する手法であり、従来疾患との関連が知られていなかった複数の因子を同時に抽出・検出できるという特徴がある。二次元電気泳動法、タンパク質マイクロアレイや質量分析装置等の測定装置の多検体化、高感度化が実現し、データ解析技術が整備され、癌や免疫疾患、感染症等の様々な疾患におけるマーカー探索に応用されている(非特許文献1)。
【0004】
例えば、動脈硬化病変の進展に伴って血中レベルが変動する生化学マーカーを利用して動脈硬化又はその関連疾患を診断する方法が報告されている(特許文献1及び2)。しかしながら、動脈硬化病変の正確な診断のためには、さらなるマーカー群の整備が望まれている。
【先行技術文献】
【特許文献】
【0005】
【特許文献1】特開2007-278907号公報
【特許文献2】特開2010-85242号公報
【非特許文献】
【0006】
【非特許文献1】Hanash S., Nature, 第422巻第226-232頁, 2003年
【発明の概要】
【発明が解決しようとする課題】
【0007】
動脈硬化病変、特に不安定病変の形成は心筋梗塞や脳梗塞等重篤な疾患を誘起するため、正確な診断が重要な課題である。動脈硬化の不安定病変の的確な評価が可能になれば、生活習慣改善等による予防、進行・悪化の防止、治療の可能性が生じる。
【0008】
従って、本発明の目的は、動脈硬化病変の進行に従ってその発現が変動するタンパク質(マーカータンパク質)群をプロテオミクス的手法により同定し、その変動を発現プロファイルデータベースとして記録し、被験体より得たサンプル中のマーカータンパク質の発現変動と照らし合わせて、動脈硬化病変の進行ステージを同定することによる、動脈硬化病変の診断、予防又は治療の評価方法を提供することである。
【0009】
本発明はまた、動脈硬化病変の進行に従ってその発現が変動するマーカータンパク質群に対する特異的親和性を有する物質を被験体に投与(例えば静脈投与)すること、ここで当該物質は標識されており、被験体内でマーカータンパク質に結合した親和性物質を検出すること、及びマーカータンパク質に結合した親和性物質のレベルを測定することに基づく動脈硬化病変の評価方法を提供することである。
【課題を解決するための手段】
【0010】
本発明者らは、動脈硬化を好発しかつ高脂肪食の投与と週齢によってその進行が促進されるApoE欠損マウスと野生型マウスより動脈組織を得て、動脈組織中に含まれるタンパク質の発現量を質量分析装置により網羅的に比較解析した。その結果、動脈硬化の進行程度の異なる12、18、25及び35週齢の各時点において得られた動脈組織に含まれるタンパク質発現量比の測定値を用いて発現プロファイルデータベースを構築し、動脈硬化の発症や進行(悪化)と各タンパク質の発現量比の変動傾向が相関し、その傾向が複数のグループに分類できることを見出した。また、本発明者らは、動脈硬化病変の特定のステージに特徴的な発現傾向を示すタンパク質を特定することに成功し、かかるタンパク質を動脈硬化の発症の可能性の程度、リスクの高低と病状進行の可能性を評価するためのマーカーとして使用できるという知見を得、本発明を完成した。
【0011】
従って、本発明は以下を提供する。
[1]以下の(a)〜(d)群に示されるタンパク質のうち、少なくとも(a)群から選択される少なくとも1種のタンパク質に特異的に結合する少なくとも1種の物質を含むことを特徴とする動脈硬化病変の評価用キット。
(a)軟骨オリゴマー基質タンパク質、フィブロモジュリン、フィブロネクチン及びトロンボスポンジン-4;
(b)プラスチン-2、テネイシン、CD5抗原様タンパク質、プロパージン、Cb4結合タンパク質、フィブリノゲンβ鎖及びフィブリノゲンγ鎖;
(c)ビトロネクチン、マトリクス・メタロプロテイナーゼ-2及びトロンボスポンジン-1;
(d)膜結合型イムノグロブリンμ鎖C領域、受容体型チロシンタンパク質ホスファターゼC、イムノグロブリンG-2B鎖-C領域、イムノグロブリンJ鎖、イムノグロブリンκ鎖C領域、血管内皮細胞接着因子-1、α-2-マクログロブリン、ADAMTS様タンパク質-4、カテプシンB、カルボキシペプチダーゼ-B2、補体因子-H、クラスタリン、14型コラーゲン-α-1鎖、上皮型脂肪酸結合タンパク質、マンノース結合レクチン関連セリンプロテアーゼ-2、プロトロンビン、捕体因子-B、インターα-トリプシンインヒビター重鎖-H1、ミオシン-9、ビタミンK依存性因子S、メタロプロプロテアーゼインヒビター3及びトロポミオシンα4
【0012】
[2](a)群から選択されるタンパク質と、(b)〜(d)群の少なくとも1つの群から選択されるタンパク質に特異的に結合する少なくとも2種の物質を含む、[1]に記載のキット。
[3](a)群から選択されるタンパク質と、(b)〜(d)群の少なくとも2つの群から選択されるタンパク質に特異的に結合する少なくとも3種の物質を含む、[1]に記載のキット。
[4](a)群から選択されるタンパク質と、(b)〜(d)群の各群から選択されるタンパク質に特異的に結合する少なくとも4種の物質を含む、[1]に記載のキット。
【0013】
[5]軟骨オリゴマー基質タンパク質、フィブロモジュリン、フィブロネクチン及びトロンボスポンジン-4からなる群より選択される少なくとも1種のタンパク質に特異的に結合する少なくとも1種の物質を含み、中期ステージ以上の動脈硬化病変について評価するための動脈硬化病変の評価用キット。
[6]プラスチン-2、テネイシン、CD5抗原様タンパク質、プロパージン、Cb4結合タンパク質、フィブリノゲンβ鎖及びフィブリノゲンγ鎖からなる群より選択される少なくとも1種のタンパク質に特異的に結合する少なくとも1種の物質を含み、初期又は中期ステージの動脈硬化病変について評価するための動脈硬化病変の評価用キット。
[7]ビトロネクチン、マトリクス・メタロプロテイナーゼ-2及びトロンボスポンジン-1からなる群より選択される少なくとも1種のタンパク質に特異的に結合する少なくとも1種の物質を含み、後期ステージの動脈硬化病変について評価するための動脈硬化病変の評価用キット。
[8]動脈硬化病変の評価が、被験体における動脈硬化病変の存在の判定、被験体に存在する動脈硬化病変のステージの決定、被験体に存在する動脈硬化病変の位置の決定、被験体に存在する動脈硬化の治療効果の評価、及び被験体に存在する動脈硬化の予後の予測からなる群より選択される、[1]〜[7]のいずれかに記載のキット。
[9]タンパク質に特異的に結合する物質が、抗体、抗体様分子、核酸アプタマー、リガンド及び基質からなる群より選択される、[1]〜[8]のいずれかに記載のキット。
[10]タンパク質に特異的に結合する物質が造影剤と結合されている、[1]〜[9]のいずれかに記載のキット。
[11]造影剤が、蛍光物質、発光物質、放射性物質、リポソーム、ミセル、細胞、ウイルス粒子、ウイルス、マイクロ粒子、ナノ粒子、室のあるマイクロデバイス、エマルジョン、脂質ディスク、ポリマー、ガドリニウム結合分子、超常磁性酸化鉄粒子、ペルフルオロカーボンナノ粒子、及び超微粒気泡からなる群より選択される、[10]に記載のキット。
[12]動脈硬化病変が、ポジトロン断層撮影(PET)、単一光子放射断層撮影(SPECT)、γシンチグラフィー、オートラジオグラフィー、蛍光イメージング、磁気共鳴画像(MRI)、超音波、及びコンピュータ断層撮影(CT)からなる群より選択される手段により可視化される、[10]又は[11]に記載のキット。
【0014】
[13]動脈硬化病変を評価するための装置であって、
(i)被験体における、以下の(a)〜(d)群に示されるタンパク質のうち、少なくとも(a)群から選択される少なくとも1種のタンパク質を検出するための手段:
(a)軟骨オリゴマー基質タンパク質、フィブロモジュリン、フィブロネクチン及びトロンボスポンジン-4;
(b)プラスチン-2、テネイシン、CD5抗原様タンパク質、プロパージン、Cb4結合タンパク質、フィブリノゲンβ鎖及びフィブリノゲンγ鎖;
(c)ビトロネクチン、マトリクス・メタロプロテイナーゼ-2及びトロンボスポンジン-1;
(d)膜結合型イムノグロブリンμ鎖C領域、受容体型チロシンタンパク質ホスファターゼC、イムノグロブリンG-2B鎖-C領域、イムノグロブリンJ鎖、イムノグロブリンκ鎖C領域、血管内皮細胞接着因子-1、α-2-マクログロブリン、ADAMTS様タンパク質-4、カテプシンB、カルボキシペプチダーゼ-B2、補体因子-H、クラスタリン、14型コラーゲン-α-1鎖、上皮型脂肪酸結合タンパク質、マンノース結合レクチン関連セリンプロテアーゼ-2、プロトロンビン、捕体因子-B、インターα-トリプシンインヒビター重鎖-H1、ミオシン-9、ビタミンK依存性因子S、メタロプロプロテアーゼインヒビター3及びトロポミオシンα4;
(ii)(i)の手段により得られる検出結果に基づいて被験体における動脈硬化病変を評価するための手段
を備えた装置。
[14](iii)前記タンパク質についての基準値を保管するための手段;
(iv)被験体におけるタンパク質の検出結果と、該基準値とを比較するための手段
をさらに備える、[13]に記載の装置。
【0015】
[15]以下の(a)〜(d)群に示されるタンパク質のうち、少なくとも(a)群から選択される少なくとも1種のタンパク質とそれと結合した造影剤とを含むことを特徴とする、動脈硬化病変の可視化剤。
(a)軟骨オリゴマー基質タンパク質、フィブロモジュリン、フィブロネクチン及びトロンボスポンジン-4;
(b)プラスチン-2、テネイシン、CD5抗原様タンパク質、プロパージン、Cb4結合タンパク質、フィブリノゲンβ鎖及びフィブリノゲンγ鎖;
(c)ビトロネクチン、マトリクス・メタロプロテイナーゼ-2及びトロンボスポンジン-1;
(d)膜結合型イムノグロブリンμ鎖C領域、受容体型チロシンタンパク質ホスファターゼC、イムノグロブリンG-2B鎖-C領域、イムノグロブリンJ鎖、イムノグロブリンκ鎖C領域、血管内皮細胞接着因子-1、α-2-マクログロブリン、ADAMTS様タンパク質-4、カテプシンB、カルボキシペプチダーゼ-B2、補体因子-H、クラスタリン、14型コラーゲン-α-1鎖、上皮型脂肪酸結合タンパク質、マンノース結合レクチン関連セリンプロテアーゼ-2、プロトロンビン、捕体因子-B、インターα-トリプシンインヒビター重鎖-H1、ミオシン-9、ビタミンK依存性因子S、メタロプロプロテアーゼインヒビター3及びトロポミオシンα4
[16]軟骨オリゴマー基質タンパク質、フィブロモジュリン、フィブロネクチン及びトロンボスポンジン-4からなる群より選択される少なくとも1種のタンパク質に特異的に結合する少なくとも1種の物質と、それと結合した造影剤とを含むことを特徴とする、中期ステージ以上の動脈硬化病変の可視化剤。
[17]プラスチン-2、テネイシン、CD5抗原様タンパク質、プロパージン、Cb4結合タンパク質、フィブリノゲンβ鎖及びフィブリノゲンγ鎖からなる群より選択される少なくとも1種のタンパク質に特異的に結合する少なくとも1種の物質と、それと結合した造影剤とを含むことを特徴とする、初期又は中期ステージの動脈硬化病変の可視化剤。
[18]ビトロネクチン、マトリクス・メタロプロテイナーゼ-2及びトロンボスポンジン-1からなる群より選択される少なくとも1種のタンパク質に特異的に結合する少なくとも1種の物質と、それと結合した造影剤とを含むことを特徴とする、後期ステージの動脈硬化病変の可視化剤。
【0016】
[19]以下の(a)〜(d)群のうち、少なくとも(a)群から選択される少なくとも1種のタンパク質に特異的に結合する物質と、それと結合した化合物又は分子とを含むことを特徴とする、動脈硬化病変への化合物又は分子の標的化剤。
(a)軟骨オリゴマー基質タンパク質、フィブロモジュリン、フィブロネクチン及びトロンボスポンジン-4;
(b)プラスチン-2、テネイシン、CD5抗原様タンパク質、プロパージン、Cb4結合タンパク質、フィブリノゲンβ鎖及びフィブリノゲンγ鎖;
(c)ビトロネクチン、マトリクス・メタロプロテイナーゼ-2及びトロンボスポンジン-1;
(d)膜結合型イムノグロブリンμ鎖C領域、受容体型チロシンタンパク質ホスファターゼC、イムノグロブリンG-2B鎖-C領域、イムノグロブリンJ鎖、イムノグロブリンκ鎖C領域、血管内皮細胞接着因子-1、α-2-マクログロブリン、ADAMTS様タンパク質-4、カテプシンB、カルボキシペプチダーゼ-B2、補体因子-H、クラスタリン、14型コラーゲン-α-1鎖、上皮型脂肪酸結合タンパク質、マンノース結合レクチン関連セリンプロテアーゼ-2、プロトロンビン、捕体因子-B、インターα-トリプシンインヒビター重鎖-H1、ミオシン-9、ビタミンK依存性因子S、メタロプロプロテアーゼインヒビター3及びトロポミオシンα4
[20]化合物又は分子が血栓溶解剤である、[19]に記載の標的化剤。
【0017】
[21]動脈硬化病変の治療薬又は治療法の有効性の評価方法であって、
(i)被験治療薬又は治療法による処置を受けた動脈硬化病変を有する動物において、以下の(a)〜(d)群に示されるタンパク質のうち、少なくとも(a)群から選択される少なくとも1種のタンパク質を検出するステップ:
(a)軟骨オリゴマー基質タンパク質、フィブロモジュリン、フィブロネクチン及びトロンボスポンジン-4;
(b)プラスチン-2、テネイシン、CD5抗原様タンパク質、プロパージン、Cb4結合タンパク質、フィブリノゲンβ鎖及びフィブリノゲンγ鎖;
(c)ビトロネクチン、マトリクス・メタロプロテイナーゼ-2及びトロンボスポンジン-1;
(d)膜結合型イムノグロブリンμ鎖C領域、受容体型チロシンタンパク質ホスファターゼC、イムノグロブリンG-2B鎖-C領域、イムノグロブリンJ鎖、イムノグロブリンκ鎖C領域、血管内皮細胞接着因子-1、α-2-マクログロブリン、ADAMTS様タンパク質-4、カテプシンB、カルボキシペプチダーゼ-B2、補体因子-H、クラスタリン、14型コラーゲン-α-1鎖、上皮型脂肪酸結合タンパク質、マンノース結合レクチン関連セリンプロテアーゼ-2、プロトロンビン、捕体因子-B、インターα-トリプシンインヒビター重鎖-H1、ミオシン-9、ビタミンK依存性因子S、メタロプロプロテアーゼインヒビター3及びトロポミオシンα4;
(ii)(i)の結果に基づいて動脈硬化病変に対する被験治療薬又は治療法の有効性を評価するステップ
を含む方法。
[22]被験治療薬又は治療法による処置を行う前に、動脈硬化病変を有する動物において、前記タンパク質を検出するステップをさらに含む、[21]に記載の方法。
[23]動脈硬化病変を有する動物が動脈疾患モデル動物である、[21]又は[22]に記載の方法。
【0018】
[24]動脈硬化病変の評価方法であって、
(i)被験体において、以下の(a)〜(d)群に示されるタンパク質のうち、少なくとも(a)群から選択される少なくとも1種のタンパク質を検出するステップ:
(a)軟骨オリゴマー基質タンパク質、フィブロモジュリン、フィブロネクチン及びトロンボスポンジン-4;
(b)プラスチン-2、テネイシン、CD5抗原様タンパク質、プロパージン、Cb4結合タンパク質、フィブリノゲンβ鎖及びフィブリノゲンγ鎖;
(c)ビトロネクチン、マトリクス・メタロプロテイナーゼ-2及びトロンボスポンジン-1;
(d)膜結合型イムノグロブリンμ鎖C領域、受容体型チロシンタンパク質ホスファターゼC、イムノグロブリンG-2B鎖-C領域、イムノグロブリンJ鎖、イムノグロブリンκ鎖C領域、血管内皮細胞接着因子-1、α-2-マクログロブリン、ADAMTS様タンパク質-4、カテプシンB、カルボキシペプチダーゼ-B2、補体因子-H、クラスタリン、14型コラーゲン-α-1鎖、上皮型脂肪酸結合タンパク質、マンノース結合レクチン関連セリンプロテアーゼ-2、プロトロンビン、捕体因子-B、インターα-トリプシンインヒビター重鎖-H1、ミオシン-9、ビタミンK依存性因子S、メタロプロプロテアーゼインヒビター3及びトロポミオシンα4;
(ii)(i)の結果に基づいて被験体における動脈硬化病変を評価するステップ
を含む方法。
[25](a)群から選択されるタンパク質と、(b)〜(d)群の少なくとも1つの群から選択される少なくとも2種のタンパク質を検出する、[24]に記載の方法。
[26](a)群から選択されるタンパク質と、(b)〜(d)群の少なくとも2つの群から選択される少なくとも3種のタンパク質を検出する、[24]に記載の方法。
[27](a)群から選択されるタンパク質と、(b)〜(d)群の各群から選択される少なくとも4種のタンパク質を検出する、[24]に記載の方法。
【0019】
[28]動脈硬化病変の評価方法であって、
(i)被験体において、軟骨オリゴマー基質タンパク質、フィブロモジュリン、フィブロネクチン及びトロンボスポンジン-4からなる群より選択される少なくとも1種のタンパク質を検出するステップ;
(ii)(i)の結果に基づいて、被験体が中期ステージ以上の動脈硬化病変を有するか否かを評価するステップ
を含む方法。
[29]動脈硬化病変の評価方法であって、
(i)被験体において、プラスチン-2、テネイシン、CD5抗原様タンパク質、プロパージン、Cb4結合タンパク質、フィブリノゲンβ鎖及びフィブリノゲンγ鎖からなる群より選択される少なくとも1種のタンパク質を検出するステップ;
(ii)(i)の結果に基づいて、被験体が初期又は中期ステージの動脈硬化病変を有するか否かを評価するステップ
を含む方法。
[30]動脈硬化病変の評価方法であって、
(i)被験体においてビトロネクチン、マトリクス・メタロプロテイナーゼ-2及びトロンボスポンジン-1からなる群より選択される少なくとも1種のタンパク質を検出するステップ;
(ii)(i)の結果に基づいて、被験体が後期ステージの動脈硬化病変を有するか否かを評価するステップ
を含む方法。
【0020】
[31]ステップ(i)が、タンパク質に特異的に結合する物質を被験体に投与し、該被験体に存在する該タンパク質と結合した該物質を検出することにより行われる、[24]〜[30]のいずれかに記載の方法。
[32]ステップ(i)が、被験体由来のサンプルを調製し、該サンプルとタンパク質に特異的に結合する物質とを接触させ、該タンパク質と該物質との結合を検出することにより行われる、[24]〜[30]のいずれかに記載の方法。
【0021】
[33]動脈硬化病変の評価が、被験体における動脈硬化病変の存在の判定、被験体に存在する動脈硬化病変のステージの決定、被験体に存在する動脈硬化病変の位置の決定、被験体に存在する動脈硬化の治療効果の評価、及び被験体に存在する動脈硬化の予後の予測からなる群より選択される、[24]〜[32]のいずれかに記載の方法。
[34]タンパク質に特異的に結合する物質が、抗体、抗体様分子、核酸アプタマー、リガンド及び基質からなる群より選択される、[31]又は[32]に記載の方法。
[35]タンパク質に特異的に結合する物質が造影剤と結合されている、[31]、[32]及び[34]のいずれかに記載の方法。
[36]造影剤が、蛍光物質、発光物質、放射性物質、リポソーム、ミセル、細胞、ウイルス粒子、ウイルス、マイクロ粒子、ナノ粒子、室のあるマイクロデバイス、エマルジョン、脂質ディスク、ポリマー、ガドリニウム結合分子、超常磁性酸化鉄粒子、ペルフルオロカーボンナノ粒子、及び超微粒気泡からなる群より選択される、[35]に記載の方法。
[37]動脈硬化病変が、ポジトロン断層撮影(PET)、単一光子放射断層撮影(SPECT)、γシンチグラフィー、オートラジオグラフィー、蛍光イメージング、磁気共鳴画像(MRI)、超音波、及びコンピュータ断層撮影(CT)からなる群より選択される手段により可視化される、[35]又は[36]に記載の方法。
[38]評価ステップ(ii)が、健常者におけるタンパク質の測定値、及び動脈硬化の既知のステージに罹患している被験体におけるタンパク質の測定値から選択される基準値との比較を含む、[24]〜[37]のいずれかに記載の方法。
[39]評価ステップ(ii)が、前記基準値と比較して被験体におけるタンパク質の測定値が上昇しているか否かを評価する、[38]に記載の方法。
【発明の効果】
【0022】
本発明により、これまで初期診療や健康診断において、従来の方法により見落とされていた動脈硬化(不安定化)病変の検出や、それにより生じた障害の発生と進行の可能性を検定することが可能となる。本発明を使用して、被験体に存在するタンパク質群の標準サンプルに対する発現量比とその時間経過に伴う変動を測定し、予め記録しておいた発現プロファイルデータベースに照らし合わせることにより、動脈硬化とそれに起因する障害の発生と症状進行の可能性を評価することが可能となる。また本発明は、的確かつ簡便に動脈硬化病変とそれに起因する障害発生と進行の可能性に関する検査又は分析、様々な試薬や医薬の開発や、関連装置の開発にも利用できる。
【0023】
さらに、本研究により選抜したマーカータンパク質群の発現変動を、該タンパク質に対して特異的に結合する物質(抗体、抗体様物質、リガンド、基質等)及び造影剤(蛍光物質、放射性物質等)を用いて、造影剤のイメージングのための公知の手段により可視化し、該タンパク質群の病変における発現の状況(量、局在化、密度又は相対的な分布)から進行ステージを評価できる。これにより動脈硬化病変形成とそれに起因する障害の発生と症状進行の可能性を示す指標として有効利用することが可能となり、的確かつ簡便に動脈硬化とそれに起因する障害発生と進行の可能性に関する検査又は分析、様々な試薬や医薬の開発や、関連装置の開発にも利用できる。
【図面の簡単な説明】
【0024】
【図1】パターン1の変動を示すタンパク質群の各疾患ステージにおける発現量比(ApoE欠損マウス/野生型マウス)を示すグラフである。
【図2】パターン2の変動を示すタンパク質群の各疾患ステージにおける発現量比(ApoE欠損マウス/野生型マウス)を示すグラフである。
【図3】パターン3の変動を示すタンパク質群の各疾患ステージにおける発現量比(ApoE欠損マウス/野生型マウス)を示すグラフである。
【図4】パターン4の変動を示すタンパク質群の各疾患ステージにおける発現量比(ApoE欠損マウス/野生型マウス)を示すグラフである。
【図5】本発明の動脈硬化病変の評価用装置の概要を示す図である。
【図6】動脈硬化病変におけるマーカー(CD5抗原様タンパク質、プロパージン)の発現を示す画像である。図中、*は血管内腔側を示す。
【図7】動脈硬化病変におけるマーカー(軟骨オリゴマー基質タンパク質、フィブロモジュリン、フィブロネクチン、トロンボスポンジン-4)の発現を示す画像である。
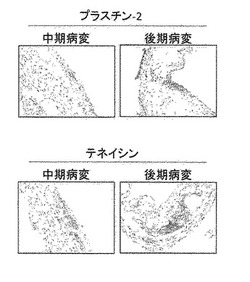
【図8】動脈硬化病変におけるマーカー(プラスチン-2、テネイシン)の発現を示す画像である。
【発明を実施するための形態】
【0025】
本発明は、動脈硬化病変を評価及び可視化するための新規なマーカー及びマーカー群を提供する。本発明により提供されるマーカー及びマーカー群は、動脈硬化病変の進行に伴ってその発現が特徴的に変動するタンパク質であるため、安定狭心症や急性心筋梗塞等の動脈硬化関連疾患の発症の予測や、動脈硬化病変のステージの判定、動脈硬化病変の予後の予測、動脈硬化病変の可視化、動脈硬化関連疾患の治療薬又は治療法の有効性の評価などに有用である。従って、本発明に係る動脈硬化病変の評価方法は、
被験体において、動脈硬化病変において特定の疾患ステージに特徴的な発現パターン(発現の変動)を示すマーカータンパク質を検出するステップと、
その検出結果に基づいて被験体における動脈硬化病変を評価するステップと
を含む。
【0026】
本発明に従って評価の対象となる被験体は、ヒト、及びその他の哺乳動物、例えば霊長類(サル、チンパンジーなど)、家畜動物(ウシ、ウマ、ブタ、ヒツジなど)、ペット用動物(イヌ、ネコなど)、実験動物(マウス、ラット、ウサギなど)であり、さらには爬虫類及び鳥類などであってもよい。
【0027】
なお、本明細書中で使用する用語「マーカー」とは、本発明に従って動脈硬化を評価するために検出する対象となるタンパク質を意味する。また「マーカー群」とは、2以上のマーカーからなる組み合わせである。
【0028】
本発明において使用するマーカーを以下の表1〜4にまとめる。表中の「マウス」及び「ヒト」の欄には、それぞれ「エントリー名」及び「アクセッション番号」の項目があるが、それらはそれぞれ「マウス」及び「ヒト」のマーカータンパク質のUniProtKB/Swiss-Prot(http://www.uniprot.org/)における名称及びアクセッション番号を示す。また表1〜4には、実施例において検出した、各疾患ステージにおけるマーカータンパク質の発現量比も示す。
【0029】
【表1】

【0030】
【表2】

【0031】
【表3】

【0032】
【表4】


【0033】
なお、表及び本明細書中で記載するApoE欠損マウスの12週齢、18週齢、25週齢及び35週齢とは、その週齢に相当する疾患ステージであることを意味する。ApoE欠損マウスの週齢と疾患ステージとの関連性については、例えばNakashima, Y. et al., Arterioscler Thromb. 14:133-140, 1994;Zhao, Y. et al., J. Nucl. Med. 49:1707-1714, 2008などに報告がある。具体的には、12週齢では動脈内膜が肥厚し脂質の蓄積が認められる程度であるが(ステージ1)、18週齢では脂質の蓄積により泡沫細胞が形成され(ステージ2)、25週齢になると動脈広範囲に不安定な粥状プラークが多数観察され(ステージ3)、粥状硬化性動脈硬化症の最も危険な段階を迎え、35週齢では繊維化・石灰化の進んだ安定型病変が多く観察される(ステージ4)。従って、本明細書において、ApoE欠損マウスの「12週齢」は動脈硬化の初期ステージ(病変)に相当し、「18週齢」は動脈硬化の初中期ステージ(病変)に相当し、「25週齢」は動脈硬化の中期ステージ(病変)に相当し、「35週齢」は動脈硬化の後期ステージ(病変)に相当するものとする。
【0034】
表1に示すタンパク質は、18週齢までは有意な存在量の違いはなく、(i)25週齢において野生型に対するApoE欠損マウスの存在量比(以下「発現量比」と呼ぶ)が3倍以上で、(ii)25週齢の発現量比が18週齢の発現量比の2倍以上であるタンパク質であり、中期ステージでプラーク破綻の危険性を示すマーカーである。これらのうち少なくとも1種をマーカーとして使用することにより、このマーカーの発現量に基づいて、18週齢(初中期ステージ)かそれ以降の病変が存在するか否か、特にプラーク破綻の危険性を有するか否かを評価することができる。
【0035】
表2に示すタンパク質は、(i)18週齢において野生型に対するApoE欠損マウスの発現量比が2倍以上で、(ii)18週齢の発現量比が12週齢の発現量比の1.3倍以上で、(iii)25週齢の発現量比が4倍以上で、(iv)25週齢の発現量比が18週齢の発現量比の1.3倍以上であるタンパク質であり、初期から中期ステージでプラークの進展を示すマーカーである。これらのうち少なくとも1種をマーカーとして使用することにより、このマーカーの発現量に基づいて、12週齢(初期ステージ)又は18週齢(初中期ステージ)かそれ以降の病変が存在するか否かを評価することができる。
【0036】
表3に示すタンパク質は、12週齢までは有意な存在量の違いはなく、18週齢及びそれ以降の週齢で、野生型と比較してApoE欠損マウスで存在量が2倍以上増加するタンパク質、及び25週齢までは有意な存在量の違いはなく、35週齢で、野生型と比較してApoE欠損マウスで存在量が2倍以上増加するタンパク質のうち、(i)35週齢の発現量比が4倍以上で、(ii)35週齢の発現量比が25週齢の2倍以上であるタンパク質であり、後期ステージでプラークの安定化を示すマーカーである。これらのうち少なくとも1種をマーカーとして使用することにより、このマーカーの発現量に基づいて、35週齢(後期ステージ)かそれ以降の病変が存在するか否かを評価することができる。
【0037】
表4に示すタンパク質は、ApoE欠損マウスにおいて、野生型と比較して各週齢においてその発現量が変化するマーカーである。これらのうち少なくとも1種をマーカーとして使用することも可能であるし、あるいは表1〜3に示されるマーカーと組み合わせることにより、マーカーの発現量に基づいて、各週齢(初期、初中期、中期及び後期ステージ)の病変が存在するか否かを評価することができる。
【0038】
本発明では、少なくとも表1に示されるマーカーのうち少なくとも1種を検出することにより、動脈硬化病変の評価が可能である。すなわち、表1に示される各マーカーは個々に、プラーク破綻の危険性のある動脈硬化病変を有するか否かについて評価することができる。また本発明では、マーカーを少なくとも2つ組み合わせて使用することによって、より正確かつ高精度な動脈硬化病変の評価が可能となる。例えば、表1に示される少なくとも1種のタンパク質(軟骨オリゴマー基質タンパク質、フィブロモジュリン、フィブロネクチン又はトロンボスポンジン-4)と、表2〜4に示した各群のうち、少なくとも1つ、少なくとも2つ又は少なくとも3つの群から選択される、少なくとも2種のタンパク質とを組み合わせる。
【0039】
例えば、表1に示されるマーカーと表2に示されるマーカーを組み合わせて使用することにより、それらのマーカーの発現量に基づいて、病変が初期ステージ(12週齢)又は初中期ステージ(18週齢)にあるか、あるいは中期ステージ(25週齢)又はそれ以降にあるかの区別が可能となる。また、表1に示されるマーカーと表3に示されるマーカーを組み合わせて使用することにより、それらのマーカーの発現量に基づいて、病変が中期ステージ(25週齢)にあるかあるいは後期ステージ又はそれ以降(35週齢)にあるかの区別が可能となる。また、表1に示されるマーカーと表4に示されるマーカーを組み合わせて使用することにより、それらのマーカーの発現量に基づいて、病変が初期ステージ(12週齢)、初中期ステージ(18週齢)、中期ステージ(25週齢)又は後期ステージ(35週齢)のいずれにあるかの区別が可能となる。
【0040】
あるいは、表1〜表4に示されるマーカーを3つ以上組み合わせて使用することも可能である。例えば、表1から表4までに示されるマーカーをそれぞれ少なくとも1つずつ選択し、それらを組み合わせて使用することにより、それらのマーカーの発現量に基づいて、病変が初期ステージ(12週齢)にあるか、初中期ステージ(18週齢)にあるか、中期ステージ(25週齢)にあるか、後期ステージ(35週齢)にあるかの詳細かつ正確な区別が可能になる。好ましくは3つ以上のマーカー、より好ましくは3〜7つのマーカーを組み合わせる。このような組み合わせは、被験体の種類、性別、年齢や、動脈硬化の評価の目的、評価対象となる疾患ステージなどに応じて、適宜選択することができる。
【0041】
上述の通り、上記のマーカー又はマーカー群は、動脈硬化病変の特定の疾患ステージに特徴的な発現パターンで存在する。そのため、本発明に係る動脈硬化病変の評価方法では、被験体において上記のマーカー又はマーカー群を検出する。2以上のマーカーについて検出する場合、各マーカーを検出するステップは、同時に行ってもよいし、前後して行ってもよい。また本発明では、「マーカー(群)の検出」とは、マーカータンパク質又はその派生物若しくは誘導体の検出であってもよいし、あるいは該タンパク質をコードする遺伝子(mRNA)の検出であってもよい。「派生物」又は「誘導体」とは、マーカータンパク質から派生する物質又はマーカータンパク質の由来する物質を意味し、例えばシグナルペプチドを含むタンパク質、タンパク質の特定のサブユニット分子、修飾タンパク質、タンパク質断片などが含まれるが、これに限定されるものではない。例えば、表2に示すフィブリノゲンはβ鎖及びγ鎖を含むが、本発明においてはフィブリノゲンのインタクト分子を検出してもよいし、その派生物であるβ鎖又はγ鎖のいずれかを検出してもよい。
【0042】
マーカータンパク質の検出は、被験体におけるその量又は濃度を、好ましくは半定量的又は定量的に測定することに関し、その量は、絶対量であってもよいし又は相対量であってもよい。検出は、直接的又は間接的に行うことができる。直接的な検出は、被験体に存在するマーカータンパク質又はmRNAの分子数と直接相関するシグナルに基づいて、その量又は濃度を測定することに関する。そのようなシグナルは、例えばタンパク質又はmRNAの特定の物理的又は化学的な特性に基づいている。間接的な測定は、二次成分(すなわちマーカータンパク質又はmRNA以外の成分)、例えば抗体などのリガンド、標識又は酵素反応生成物から得られるシグナルの測定である。
【0043】
マーカータンパク質を検出するステップは、例えば、マーカータンパク質に特異的に結合する物質を被験体に投与し、被験体に存在するマーカータンパク質と結合した該物質を検出することにより行うことができる。あるいは、マーカータンパク質を検出するステップは、被験体由来のサンプルを調製し、該サンプルとマーカータンパク質に特異的に結合する物質とを接触させ、マーカータンパク質と該物質との結合を検出することにより行うことができる。
【0044】
「マーカータンパク質に特異的に結合する物質」とは、マーカータンパク質やその派生物若しくは誘導体と高い親和性で結合し、マーカータンパク質やその派生物若しくは誘導体とは無関係の分子に対しては低い親和性でしか結合しない又は全く結合しない物質を意味する。そのような物質としては、抗体、抗体様分子、核酸アプタマー、基質及びその他のリガンドが挙げられる。好ましくは、マーカータンパク質に特異的に結合する物質は、抗体又は抗体フラグメントである。例えば、各マーカータンパク質に対する抗体は、モノクローナル抗体又はポリクローナル抗体のいずれであってもよいし、あるいは各マーカータンパク質のエピトープに結合することができるFab、Fab'、F(ab')2、scFv、Fvフラグメントなどであってもよい。抗体及び抗体様分子は、当技術分野で公知の方法により調製することができ、また市販品として入手してもよい。抗体様分子は、ファージディスプレイ法やコンビナトリアル化学など免疫によらない手法により作製された、マーカータンパク質と結合する抗体可変領域と同等なペプチドを含むタンパク質断片であり、アフィボディーがその一例である。抗体様分子は、毒性が高く通常の免疫法では抗体が作製困難な場合に有効である。核酸アプタマーは、当技術分野で公知であり、特定のタンパク質(すなわちマーカータンパク質)と特異的に結合することができる核酸分子である。核酸アプタマーはin vitroで化学的に合成することができ、免疫原性が低いという利点がある。核酸アプタマーの設計は、例えばSELEX法などにより行うことができ、当業者であれば適当な核酸アプタマーを設計し、合成することができる。マーカータンパク質が酵素活性を有する場合、その基質及び基質誘導体は、当該酵素に特異的に結合する物質として利用できる。例えばマーカータンパク質がプロテアーゼ(タンパク質分解酵素)の場合、プロテアーゼインヒビター(天然由来のものでも合成分子でもよい)が利用できる。マーカータンパク質が受容体(レセプター)の場合には、そのリガンド(アゴニスト、アンタゴニスト及びそれらの誘導体)は、当該受容体に特異的に結合する物質として利用できる。特に、細胞膜に局在する受容体の場合、リガンド結合部位が細胞外にあるため、被験体に投与されるリガンドが細胞外から受容体に結合しやすいという利点がある。
【0045】
マーカータンパク質に特異的に結合する物質を被験体に投与することによりマーカータンパク質を検出しようとする場合、マーカータンパク質に特異的に結合する物質は、被験体に投与した場合に、被験体内のマーカータンパク質と結合する。従って、このような物質を利用して、被験体におけるマーカータンパク質の局在を調べ、動脈硬化病変の位置及び疾患ステージなどを評価することが可能である。また、このような物質を造影剤と結合させておくことにより、被験体における動脈硬化病変を可視化することが可能となる。
【0046】
このような可視化剤を使用することにより、マーカータンパク質を簡便かつ非侵襲敵に検出することができる。従って、本発明は動脈硬化病変の可視化剤も提供し、本可視化剤は、少なくとも1種のマーカータンパク質に特異的に結合する物質と、造影剤とを含む。造影剤は、in vivoイメージングの分野において公知の任意の造影剤を用いることができる。そのような造影剤としては、蛍光物質、例えばフルオレセイン、FITC、蛍光放出金属(152Eu、ランタン系列等)など;化学又は生物発光物質、例えばルミノール、イミダゾール、ルシフェリン、ルシフェラーゼ、緑色蛍光タンパク質(GFP)など;放射性物質、例えば99mTc、123I、131I、97Ru、67Cu、11C、13Nなど;常磁性同位体、例えば153Gd、157Gd、55Mn、162Dy、52Cr、56Fe、超常磁性酸化鉄粒子など;その他の造影剤、例えばガドリニウム、ガドリニウム錯体、ヨード造影剤、リポソーム、ミセル、細胞、ウイルス粒子、ウイルス、マイクロ粒子、ナノ粒子、室のあるマイクロデバイス、エマルジョン、脂質ディスク、ポリマー、ペルフルオロカーボンナノ粒子、及び超微粒気泡などが挙げられる。マーカータンパク質に特異的に結合する物質と造影剤との結合は、当技術分野で公知の方法により行うことができ、例えば直接的に化学結合してもよいし、あるいは適当なリンカーを介して間接的に結合してもよい。
【0047】
上述した動脈硬化病変の可視化剤を含む、本発明において使用する薬剤は、マーカータンパク質に特異的に結合する物質の他、薬学的に許容される担体又は添加物を共に含むものであってもよい。このような担体及び添加物の例として、水、薬学的に許容される有機溶剤、コラーゲン、ポリビニルアルコール、ポリビニルピロリドン、カルボキシビニルポリマー、アルギン酸ナトリウム、水溶性デキストラン、カルボキシメチルスターチナトリウム、ペクチン、キサンタンガム、アラビアゴム、カゼイン、ゼラチン、寒天、グリセリン、プロピレングリコール、ポリエチレングリコール、ワセリン、パラフィン、ステアリルアルコール、ステアリン酸、マンニトール、ソルビトール、ラクトースなどが挙げられる。使用される添加物は、剤形に応じて上記の中から適宜又は組み合わせて選択される。
【0048】
本発明の薬剤の投与方法は特に限定されるものではなく、経口投与、又は非経口投与、例えば皮下投与、皮内投与、筋肉内投与、静脈内投与、経皮投与、直腸投与、経鼻投与などにより行うことができる。
【0049】
本発明の薬剤を経口投与する場合は、錠剤、カプセル剤(硬カプセル剤、軟カプセル剤、マイクロカプセルなど)、顆粒剤、散剤、丸剤、トローチ剤、内用水剤、液剤、懸濁剤、乳剤、シロップ剤などのいずれのものであってもよく、使用する際に再溶解させる乾燥生成物にしてもよい。また、本発明の薬剤を非経口投与する場合は、例えば静脈内注射(点滴を含む)、筋肉内注射、腹腔内注射及び皮下注射用の注射剤(例えば溶液、乳剤、懸濁剤)、軟膏剤(特に眼軟膏剤)、クリーム剤、座剤、パップ剤、点眼剤、点鼻剤、吸入剤、リニメント剤、エアゾル剤などの外用剤などの製剤形態を選択することができ、注射剤の場合は単位投与量アンプル又は多投与量容器の状態で提供される。
【0050】
これらの各種製剤は、医薬において通常用いられる賦形剤、増量剤、結合剤、湿潤剤、崩壊剤、滑沢剤、界面活性剤、分散剤、緩衝剤、pH調整剤、保存剤、溶解補助剤、防腐剤、矯味矯臭剤、吸収促進剤、無痛化剤、安定化剤、等張化剤などを適宜選択し、常法により製造することができる。
【0051】
本発明の薬剤に配合する、マーカータンパク質に特異的に結合する物質の量は、該物質の種類、該物質に結合させる造影剤の種類、その用途、剤形、投与経路などにより異なるが、例えば総重量を基準として1〜99重量%、好ましくは5〜90%としうる。
【0052】
また、本発明の薬剤の投与量及び投与間隔は、マーカータンパク質に特異的に結合する物質の種類、該物質に結合させる造影剤の種類、投与対象、被験体の年齢及び体重、投与経路、投与回数により異なり、広範囲に変更することができる。
【0053】
動脈硬化病変の可視化剤の場合には、薬剤の投与後、マーカータンパク質に特異的に結合する物質の被験体における存在又は位置を、造影剤を指標として可視化する。好ましくは、マーカータンパク質に特異的に結合する物質の存在又は位置は、公知の画像化手法により可視化する。画像化手法は、使用する標識、被験体の種類、画像化する部位などにより異なるが、ポジトロン断層撮影(PET)、単一光子放射断層撮影(SPECT)、γシンチグラフィー、オートラジオグラフィー、蛍光イメージング、磁気共鳴画像(MRI)、超音波、コンピュータ断層撮影(CT)、その他のin vivoイメージングシステムを用いることができる。これにより、マーカータンパク質に特異的に結合する物質と結合した造影剤に基づいて、被験体内の動脈硬化病変の存在又は位置を可視化し、判定することができる。
【0054】
また、上述のように可視化されたマーカータンパク質の存在又は位置に加えて、マーカータンパク質の種類及び存在量に基づいて、被験体における動脈硬化病変の疾患ステージの決定、動脈硬化病変の予後の予測、動脈硬化の治療効果の評価などについて評価することもできる。
【0055】
さらに、上述のように動脈硬化病変を可視化することによって、外科手術時の病変部位を簡便かつ正確に特定することが可能となる。
【0056】
別法として、被験体由来のサンプルを調製してマーカータンパク質を検出する場合について説明する。使用するサンプルは、動脈硬化病変について評価しようとする被験体に由来するサンプルであれば特に限定されるものではなく、マーカーを検出するための方法又は手段の種類に応じて適宜選択される。例えば組織又は細胞サンプル(動脈の組織又は細胞等)が挙げられる。また、組織又は細胞サンプルは、採取後に液体窒素、ドライアイスなど当該分野で公知又は汎用されている方法で直ちに凍結し、冷凍保存することが好ましい。
【0057】
本発明の一実施形態では、マーカータンパク質の検出は、サンプル中のタンパク質の量を測定するための手段によって行うことができる。そのような手段は当技術分野で公知であり、例えば免疫アッセイの方法及び試薬などがある。またマーカータンパク質の検出は、マーカータンパク質に特有の物理的又は化学的特性を測定するための手段、例えば正確な分子量又はNMRスペクトル等を測定するための手段によって行うことができる。マーカータンパク質を検出するための手段としては、バイオセンサー、プロテインチップ、免疫アッセイと連結した光学装置、質量分析計、NMR分析計、二次元電気泳動装置又はクロマトグラフィー装置等の分析装置が挙げられる。
【0058】
好ましい実施形態において、マーカータンパク質の検出は、質量分析法(MS)を使用して行うことができる。特に液体クロマトグラフィーと連結した質量分析計(LC/MS)による解析は鋭敏であるため有利である。標識としては、当技術分野で公知の同位体標識試薬を用いることができ、適当な標識試薬を市販品として入手することができる。また分画も当技術分野で公知の方法により行うことができ、例えば市販の強陽イオンカラム等を用いて行うことができる。
【0059】
また別の実施形態では、サンプル中のマーカータンパク質の検出は、免疫アッセイ(免疫学的測定法)により行うことができる。すなわちサンプル中のマーカータンパク質と、該タンパク質に特異的に結合する抗体との反応に基づいて、該タンパク質を検出する。免疫アッセイは、当該分野で汎用されている方法であれば液相系及び固相系のいずれで行ってもよい。検出の容易性の点で、固相系を利用することが好ましい。また免疫アッセイの形式も限定されるものではなく、直接固相法の他、サンドイッチ法、競合法、ウエスタンブロッティング法、ELISA(enzyme linked immunosorbent assay)法などであってもよい。
【0060】
本発明の方法において使用する、各マーカータンパク質に対する抗体はモノクローナル抗体又はポリクローナル抗体のいずれであってもよいし、あるいは各マーカータンパク質のエピトープに結合することができるFab、Fab'、F(ab')2、scFv、Fvフラグメントなどであってもよい。一次抗体と二次抗体を使用する場合には、両方ともモノクローナル抗体を用いることもでき、あるいは、一次抗体と二次抗体のいずれか一方をポリクローナル抗体とすることもできる。抗体は、当技術分野で公知の方法により調製することができ、また市販品として入手してもよい。
【0061】
マーカータンパク質と抗体との結合は、周知の方法に従って測定しうる。当業者であれば、採用する免疫アッセイの種類及び形式、使用する標識の種類などに応じて、各アッセイについての有効かつ最適な測定方法を決定することができる。例えば、サンプル中のマーカータンパク質と抗体との結合を容易に検出するために、該抗体を標識することにより該結合を直接検出するか、又は標識二次抗体若しくはビオチン−アビジン複合体等を用いることにより間接的に検出する。
【0062】
固相系においては、抗体又はサンプル中のタンパク質成分を固相(プレート、膜、ビーズ等)上に固定化し、この固相上においてマーカータンパク質と固体との免疫学的結合を試験する。固相は、当技術分野で慣用的に使用されているものであれば特に限定されるものではなく、例えば市販のニトロセルロース膜又はPVDF膜を用いることができる。抗体又はサンプル中のタンパク質成分を固相上に固定化することによって、未結合のサンプル成分や試薬を容易に除去することができる。また特に、数十種類の抗体を固定化したメンブレンを用いるタンパク質アレイ法では、少量の被験体由来のサンプル(血漿など)を用いて多種類のマーカータンパク質の存在を短時間で解析することができる。またこのような免疫アッセイは、例えば操作が簡便なテストストリップにおいても実施することができる。
【0063】
免疫アッセイとして液相系を選択する場合には、例えば、標識化抗体とサンプルとを接触させて標識化抗体とマーカータンパク質を結合させ、この結合体を分離し、標識シグナルを検出する。あるいは、マーカータンパク質に対する抗体(一次抗体)とサンプルとを接触させて一次抗体とマーカータンパク質を結合させ、この結合体に標識化抗体(二次抗体)を結合させ、この三者の結合体における標識シグナルを検出する。あるいは、さらにシグナルを増強させるためには、非標識の二次抗体を先ず抗体+マーカータンパク質結合体に結合させ、この二次抗体に標識物質を結合させるようにしてもよい。このような二次抗体への標識物質の結合は、例えば二次抗体をビオチン化し、標識物質をアビジン化しておくことによって行うことができる。
【0064】
あるいは、免疫組織化学染色法(例えば免疫染色法)又は免疫電顕法のように、マーカータンパク質をin situで検出することも可能である。in situ検出は、被験体から組織学的サンプルを切除し(生検組織サンプル、組織のパラフィン包埋切片など)、それに標識した抗体又は抗体フラグメントを接触させることにより実施しうる。
【0065】
免疫アッセイにおいて使用する抗体を標識するための標識としては、酵素、放射性同位体、蛍光色素又はアビジン−ビオチン系を使用することができる。酵素としては、通常の酵素免疫アッセイ(EIA)に用いられる酵素、例えば、パーオキシダーゼ、β-ガラクトシダーゼ、アルカリフォスファターゼ等を用いることができる。また、酵素阻害物質や補酵素等を用いることもできる。これら酵素と抗体との結合は、マレイミド化合物等の架橋剤を用いる公知の方法によって行うことができる。放射性同位体としては、125Iや3H等の通常のラジオイムノアッセイ(RIA)で用いられているものを使用することができる。蛍光色素としては、フルオレセインイソチオシアネート(FITC)やテトラメチルローダミンイソチオシアネート(TRITC)等の通常の蛍光抗体法に用いられるものを使用することができる。
【0066】
標識シグナルの検出もまた、当技術分野で公知の方法に従って行うことができる。例えば、酵素標識を用いる場合には、酵素作用によって分解して発色する基質を加え、基質の分解量を光学的に測定することによって酵素活性を求め、これを結合抗体量に換算し、標準値との比較から抗体量が算出される。基質は、使用する酵素の種類に応じて異なり、例えば酵素としてパーオキシダーゼを使用する場合には、3,3’,5,5’-テトラメチルベンジジンを、また酵素としてアルカリフォスファターゼを用いる場合には、パラニトロフェノール等を用いることができる。放射性標識を用いる場合には、放射性標識の発する放射線量をシンチレーションカウンター等により測定する。蛍光標識は、例えば蛍光顕微鏡、プレートリーダー、蛍光イメージング装置等を用いて検出及び定量することができる。
【0067】
以上のようにして、被験体由来のサンプル中のマーカータンパク質を検出し、その結果に基づいて被験体における動脈硬化病変を評価することが可能である。
【0068】
本明細書中、「動脈硬化病変の評価」とは、被験体における動脈硬化病変の存在を判定すること、被験体に存在する動脈硬化病変のステージを決定すること、被験体に存在する動脈硬化病変の位置を決定すること、被験体に存在する動脈硬化の治療効果を評価すること、被験体に存在する動脈硬化の予後を予測することを意味する。また本発明において「評価」は、既に評価又は診断された動脈硬化の継続的なモニタリング、及び既に行った動脈硬化の評価又は診断の確認も包含する。
【0069】
また、動脈硬化病変を評価することにより、動脈硬化に関連する疾患、例えば狭心症(安定狭心症など)、急性心筋梗塞、脳梗塞、脳出血、脳血栓、脳塞栓、大動脈瘤、閉塞性動脈硬化症、急性冠症候群などの発症リスクについても評価することが可能である。
【0070】
当業者であれば、本発明の目的である評価は、評価しようとする被験体の全て(すなわち100%)について必ず正しい結果が得られるものではないことを認識している。本発明においては、「評価」は、統計学的に有意な割合の被験体を評価できることを意図しており、統計的に有意な割合は、様々な周知の統計評価ツール、例えば信頼区間の決定、p値の決定、スチューデントのt検定、マン・ホイットニー検定等を用いて決定することができる。好ましい信頼区間は、少なくとも90%である。p値は、好ましくは、0.1、0.01、0.005又は0.0001である。より好ましくは、被験体の少なくとも60%、少なくとも80%又は少なくとも90%を、本発明によって適切に評価することができる。
【0071】
評価を行う際、被験体におけるマーカータンパク質の検出結果を、基準値と比較する。基準値は、健常者サンプルにおけるマーカータンパク質の測定値、特定のステージであるという診断がなされた被験体サンプルにおけるマーカータンパク質の測定値、治療前の被験体サンプルにおけるマーカータンパク質の測定値などである。個々の被験体に適用する基準値は、被験体の種類、年齢、性別などの様々な生理学的パラメータに応じて変化しうる。
【0072】
好ましくは、動脈硬化に罹患した個体群を疾患の進行程度(ステージ)に従って分類し、それぞれのステージに属する個体群と正常状態に属する個体群よりマーカータンパク質の発現量を得て、マーカータンパク質の発現変動と進行ステージとの相関を発現プロファイルデータベースとして記録する。そして、被験体におけるマーカータンパク質の発現量について、予め準備した標準との発現量比を測定し、得られた測定値を発現プロファイルデータベースに参照することができる。このような発現プロファイルデータベースは、被験体の動脈硬化の有無や進行ステージ、動脈硬化の発症又は進行程度の指標となる「基準値」又は「基準範囲」として有用である。基準値は、単一のカットオフ値、例えば平均値や中央値であってもよいし、あるいは特定の範囲、例えば四分位を範囲とするものであってもよい。データベースを利用して評価する場合、例えば、被験体と標準における発現量比R(i)を測定し、そのうち1又は2以上のマーカータンパク質(i=1-N)を測定し、その測定値をデータベース上に記録した各進行ステージにおける値(Rj(i)、jはステージ番号;0-4)と比較して、被験体の動脈硬化の進行ステージを解釈できる。比較は、例えばΣ{R(i)-Rj(i)}2(i=1〜N)が最小となるステージjを求めることなどによって行うことができる。
【0073】
なお、ヒトを被験体として評価を行う場合には、基準値もヒトにおけるマーカータンパク質の測定値であることが好ましいが、マウスなどの実験動物において得られた基準値も外挿することができる。
【0074】
動脈硬化の評価の具体例は次のとおりである。被験体における表1に示されるマーカータンパク質が基準値と比較して上昇していることは、該被験体に中期ステージ以上の動脈硬化病変が存在することを示す。また被験体における表2に示されるマーカータンパク質が基準値と比較して上昇していることは、該被験体に初期ステージ又は初中期ステージ以上の動脈硬化病変が存在することを示す。被験体における表3に示されるマーカータンパク質が基準値と比較して上昇していることは、被験体に後期ステージ以上の動脈硬化病変が存在することを示す。被験体における表4に示されるマーカータンパク質は、他のマーカータンパク質と組み合わせて、その発現の変動を調べることにより、被験体に動脈硬化病変が存在することを示す。
【0075】
さらに本発明の動脈硬化病変の評価方法は、他の公知の動脈硬化の診断方法と組み合わせて行ってもよい。そのような公知の動脈硬化の診断方法としては、動脈硬化の生理学的及び生化学的マーカーの測定(例えば高血圧、コレステロール値、トリグリセリド値)、心電図による測定、動脈脈波伝播速度(PWV:pulse wave velocity)の測定、血管内造影法が挙げられる。
【0076】
また、本発明の動脈硬化病変の評価方法は、他の動脈硬化マーカーと組み合わせることも可能である。例えば、本発明者は、血漿中のフォン・ウィルブランド因子の発現の上昇及び/又は補体因子Dの発現の低減が、初中期ステージの動脈硬化の指標となること、そして血漿中の補体成分C8の発現の上昇及び/又はビタミンK依存性タンパク質Zの発現の上昇が、中期ステージの動脈硬化の指標となることを明らかにしている。さらに、血漿中の動脈硬化マーカーとして、CD5抗原様タンパク質及びIgμ鎖C領域は、初中期ステージにおいて発現の極大を示し、血漿プロテアーゼC1インヒビター、トロンボスポンジン-4、フェツイン-B及び補体因子Hは、初中期ステージ又は中期ステージにおいて発現の極小を示し、ヘパリン補因子2、α-2-マクログロブリン、補体成分C9、ビタミンK依存性タンパク質C、抗トロンビン-III、EGF含有フィブリン様細胞外マトリックスタンパク質1、インターαトリプシンインヒビター重鎖H1、インターαトリプシンインヒビター重鎖H2及びプロパージンはステージの進展と共に発現の減少を示し、補体C1q亜成分サブユニットBはステージの進展と共に発現の増加を示す。従って、上記のような血漿動脈硬化マーカーを、本発明の動脈硬化病変の評価と組み合わせて、さらに高精度に評価を行うことができる。
【0077】
本発明の動脈硬化病変の評価方法によって、動脈硬化の(不安定)病変の存在を早期に判定することができる。すなわち、現在利用可能な診断手法又は基準によっては認識されない不安定な動脈硬化病変の有無を判定することができる。また、動脈硬化病変が存在する場合には、その個々の病変について疾患ステージ及び位置を詳細に特定することができる。そのため、被験体は、狭心症、心筋梗塞、脳梗塞といった動脈硬化関連疾患の治療を的確に、かつ疾患ステージに適切な治療を適時に受けることが可能となる。本発明の方法は、動脈硬化を信頼性をもって、迅速にかつ侵襲性の低い手法で評価できるという利点もある。
【0078】
本発明の動脈硬化病変の評価方法は、上記マーカーを検出するための手段を備えたキット及び/又は装置を用いることによって、容易かつ簡便に行うことができる。
【0079】
本発明に係る動脈硬化病変の評価用キットは、以下の(a)〜(d)群に示されるタンパク質のうち、少なくとも(a)群から選択される少なくとも1種のタンパク質に特異的に結合する少なくとも1種の物質を少なくとも含む:
(a)軟骨オリゴマー基質タンパク質、フィブロモジュリン、フィブロネクチン及びトロンボスポンジン-4;
(b)プラスチン-2、テネイシン、CD5抗原様タンパク質、プロパージン、Cb4結合タンパク質、フィブリノゲンβ鎖及びフィブリノゲンγ鎖;
(c)ビトロネクチン、マトリクス・メタロプロテイナーゼ-2及びトロンボスポンジン-1;
(d)膜結合型イムノグロブリンμ鎖C領域、受容体型チロシンタンパク質ホスファターゼC、イムノグロブリンG-2B鎖-C領域、イムノグロブリンJ鎖、イムノグロブリンκ鎖C領域、血管内皮細胞接着因子-1、α-2-マクログロブリン、ADAMTS様タンパク質-4、カテプシンB、カルボキシペプチダーゼ-B2、補体因子-H、クラスタリン、14型コラーゲン-α-1鎖、上皮型脂肪酸結合タンパク質、マンノース結合レクチン関連セリンプロテアーゼ-2、プロトロンビン、捕体因子-B、インターα-トリプシンインヒビター重鎖-H1、ミオシン-9、ビタミンK依存性因子S、メタロプロプロテアーゼインヒビター3及びトロポミオシンα4。
【0080】
本発明のキットの一例は、マーカータンパク質に特異的に結合する抗体、造影剤又は標識、希釈や洗浄用緩衝液、さらに必要に応じて標識二次抗体、発色・発光・蛍光を生じさせる基質試薬、手順と評価方法を記載した手順書等により構成される。マーカータンパク質の検出を被験体において行う場合には、キットは、投与のための手段、例えばバイアル、アンプル、注射器などを含んでもよい。またマーカータンパク質の検出を被験者由来のサンプルにおいて行う場合には、抗体は、固相支持体(例えば、メンブレン、ビーズ等)に固定されていてもよい。
【0081】
本発明のキットは、本発明の方法を実施するための手順及びプロトコールを記載した説明書、動脈硬化病化の評価において使用する基準値又は基準範囲を示した表などを含んでもよい。
【0082】
本発明のキットに含まれる構成要素は、個別に提供されてもよいし、又は単一の容器内に提供されてもよい。好ましくは、本発明のキットは、本発明の方法を実施するために必要な構成要素の全てを、即時に使用することができるように、例えば調整された濃度の構成要素として含む。
【0083】
本発明に係る動脈硬化病変を評価するための装置は、以下の手段を備える:
(i)被験体における、上記の(a)〜(d)群に示されるタンパク質のうち、少なくとも(a)群から選択される少なくとも1種のタンパク質を検出するための手段;
(ii)(i)の手段により得られる検出結果に基づいて被験体における動脈硬化病変を評価するための手段。
【0084】
また本発明の装置は、さらに
(iii)前記タンパク質についての基準値を保管するための手段;
(iv)被験体におけるタンパク質の検出結果と、該基準値とを比較するための手段
を備えるものであってもよい。
【0085】
本発明の装置は、本発明の方法を実施することができるように、(i)及び(ii)の手段、また好ましくはさらに(iii)及び(iv)の手段、が互いに動作可能なように連結されたシステムである。本発明の装置の概要を図5に示す。
【0086】
(i)の手段は、タンパク質特異的シグナル検知部102(例えば質量分析部分)に続きシグナルを検知して数値化する数値化部104、又は放射活性・発色・発光・蛍光よりシグナルを検知して数値化若しくは画像化する数値化部104若しくは画像化部103を備えたタンパク質検出部101とすることができる。また(ii)の手段は、例えば検出部101から得られる検出結果(画像・数値データ)を保存する画像・数値データ保存部302、及び検出結果を処理するソフトウエア307と計算機部308を備えた動脈硬化病変評価部301とすることができる。好ましい装置は、専門の臨床医の知識がなくても使用することができるものである。具体的な装置は、検出部101(例えば、PET、SPECT、γシンチグラフィー、オートラジオグラフィー、蛍光イメージング、MRI、超音波、CT、バイオセンサー、マーカーに対する抗体を固定合した固相支持体、質量分析装置、表面プラズモン共鳴装置、NMR分析装置等のタンパク質特異的シグナル検知部102を備える)と、評価部301(例えば、画像・数値データ保存部302、基準値データ保存部303、データを分析するデータ比較部304及びデータ分析部305、データ出力・表示部306、並びにソフトウエア307及び計算機部308を駆動するコンピュータユニット等)とを含む。
【0087】
さらに、(iii)の手段は、動脈硬化病態ステージ別発現データ202を備え、場合により動脈組織データ203、血漿データ204及び雌雄差データ205から選択される少なくとも1つを備えていてもよいタンパク質基準値データベース201とすることができる。この基準値データベース201から、手段(ii)の基準値データ保存部303へと必要なデータが取り込まれ、基準値データと、画像・数値データ保存部302のデータとの比較及び分析が行われる。
【0088】
また本発明においては、造影剤の代わりに薬物若しくはプロドラッグなどの化合物又は分子を、マーカータンパク質に特異的に結合する物質に結合させることにより、該化合物又は分子を被験体のマーカータンパク質存在部位、すなわち動脈硬化病変に送達することが可能である。そのような薬物又はプロドラッグとしては、公知の血栓溶解剤(例えばウロキナーゼ、ストレプトキナーゼ、組織型プラスミノーゲン活性化因子)などが含まれる。そのような薬物又はプロドラッグの動脈硬化病変への標的化剤も本発明に包含される。このような標的化剤は、動脈硬化病変に存在するマーカータンパク質と結合して、化合物又は分子(薬物又はプロドラッグなど)を動脈硬化病変に送達することができ、また長い期間にわたり動脈硬化病変内に留まり、長い期間にわたって薬物効果を発揮し続けるという効果を有する。そのため、本発明の標的化剤は、動脈硬化の予防又は治療剤として使用することが可能である。すなわち、本発明の標的化剤の有効量を被験体に投与することにより、該被験体における動脈硬化を予防又は治療することができる。
【0089】
本発明の標的化剤を投与する被験体は、特に限定されるものではなく、哺乳動物、例えばヒト、家畜(ウシ、ブタなど)、愛玩動物(イヌ、ネコなど)、実験動物(マウス、ラット、サルなど)などが含まれる。特に、動脈硬化の存在が疑われる被験体及び動脈硬化を有する被験体に使用することが好ましい。
【0090】
本発明において治療又は予防の対象となる動脈硬化は、限定されるものではなく、動脈硬化、及び動脈硬化に関連する疾患、例えば狭心症(安定狭心症など)、急性心筋梗塞、脳梗塞、脳出血、脳血栓、脳塞栓、大動脈瘤、閉塞性動脈硬化症、急性冠症候群などである。
【0091】
本発明の標的化剤の調製及び投与は、可視化剤について上述したように行うことができ、当業者であれば、標的化剤に含まれる化合物又は分子(薬物又はプロドラッグなど)を考慮して、適宜選択することができる。
【0092】
さらに、上記マーカー又はマーカー群を利用して、動脈硬化の治療薬又は治療法の有効性を評価したり、動脈硬化の治療薬候補をスクリーニングすることができる。具体的には、本発明のそのような方法は、
(i)被験治療薬又は治療法による処置を受けた動脈硬化を有する動物において、マーカータンパク質を検出するステップ、
(ii)(i)の結果に基づいて動脈硬化に対する被験治療薬又は治療法の有効性を評価するステップ
を含む。
【0093】
本発明の方法では、動脈硬化を有する動物、すなわち動脈硬化を発症している又は発症リスクのある動物においてマーカータンパク質を検出する。好ましくは、被験治療薬又は治療法による処置を行う前に、動脈硬化を有する動物においてマーカータンパク質を検出して、処置前に動脈硬化病変のどの疾患ステージであるのかを確認する。動脈硬化を有する動物に被験治療薬又は治療法による処置が行われた後、適当な時期に、その動物におけるマーカータンパク質を検出する。例えば、処置の直後、30分後、1時間後、3時間後、5時間後、10時間後、15時間後、20時間後、24時間(1日)後、2〜10日後、10〜20日後、20〜30日後、1ヶ月〜6ヵ月後に検出を行うこととする。マーカータンパク質の検出、動脈硬化病変の評価については、前記と同様に行うことができる。
【0094】
また本発明により対象となる動物は、動脈硬化病変を有するヒトであってもよいし、あるいは動脈疾患モデル動物、好ましくは動脈硬化モデル実験動物(マウス、ラット、ウサギなど)であってもよい。一般的には、モデル動物において被験治療薬又は治療法の有効性が確認された後に、ヒトにおいて、例えば臨床試験などにより有効性の評価が行われる。
【0095】
評価又はスクリーニングの対象となる被験治療薬又は治療法の種類は特に限定されるものではない。例えば、被験治療薬又は治療法は、任意の物質的因子、具体的には、天然に生じる分子、例えば、アミノ酸、ペプチド、オリゴペプチド、ポリペプチド、タンパク質、核酸、脂質、炭水化物(糖等)、ステロイド、グリコペプチド、糖タンパク質、プロテオグリカンなど;天然に生じる分子の合成アナログ又は誘導体、例えば、ペプチド擬態物、核酸分子(アプタマー、アンチセンス核酸、二本鎖RNA(RNAi)等)など;天然に生じない分子、例えば低分子有機化合物(無機及び有機化合物ライブラリー、又はコンビナトリアルライブラリー等)など;並びにそれらの混合物を挙げることができる。また治療薬又は治療法は、単一物質であってもよいし、複数の物質から構成される複合体や、食品及び食餌等であってもよい。さらに、被験治療薬又は治療法は、上記のような物質的因子に加えて、放射線、紫外線などであってもよい。
【0096】
動物の被験治療薬又は治療法による処置は、その治療薬又は治療法の種類により異なるが、当業者であれば容易に決定することができる。例えば、被験治療薬の投与量、投与期間、投与経路などの投与条件は、当業者であれば適切に決定することができる。
【0097】
また、被験治療薬又は治療法の有効性は、いくつかの条件で検討することも可能である。そのような条件としては、被験治療薬又は治療法で処置する時間又は期間、量(大小)、回数などが挙げられる。例えば、被験治療薬の希釈系列を調製するなどして複数の用量を設定することができる。
【0098】
さらに、複数の被験治療薬又は治療法の相加作用、相乗作用などを検討する場合には、治療薬又は治療法を組み合わせて用いてもよい。
【0099】
被験治療薬又は治療法の処置後の動物におけるマーカータンパク質の存在量及び/又は位置を、処置前の存在量及び/又は位置と比較することによって、被験治療薬又は治療法が、動脈硬化病変(の不安定性)の改善(例えば中期ステージから初中期若しくは初期ステージへの改善)、動脈硬化病変(の不安定性)の進行の停止又は減速化(例えば、何も処置を行わなかった場合と比較して、中期ステージから後期ステージへの進行が停止する)に有効であるか否かを評価することができる。
【0100】
以上から、本発明に係る動脈硬化病変(の不安定性)の治療薬又は治療法の有効性の評価方法により、動脈硬化を治療又は予防するための治療薬又は治療法を見出し、さらには治療薬又は治療法の有効性を確認することができる。動脈硬化病変(の不安定性)は、特に早期段階(初期、初中期のステージ)では何らかの兆候を検知することができないため、ある被験体において初期又は初中期のステージの動脈硬化であると評価し、何らかの処置を行ったとしても、その処置の有効性を評価することが困難である。そのため、本発明の方法は、動脈硬化の早期段階の治療に有効な治療薬又は治療法を同定するために特に有効といえる。
【0101】
上記の方法と同様にして、ある物質又は因子が動脈硬化に及ぼす影響を判定することも可能であり、動脈硬化病変(の不安定性)の進行の原因となる物質又は因子を同定することもできる。
【実施例】
【0102】
以下に実施例を例示し、本発明を具体的に説明するが、この実施例は単に本発明の説明のために提供するものであり、本出願において開示する発明の範囲を限定したり制限したりするものではない。当業者には、本明細書に記載した本発明の発想に基づく様々な実施形態が可能であることは明らかである。
【0103】
[実施例1]
動脈硬化のモデルとして脂質代謝関連ApoEタンパク質を欠損したApoE欠損マウス(ApoED;B6・KOR/StmSlc-Apoeshl)を用いた(Matsushima, Y. et al., J. Atheroscler. Thromb. 8:71-79, 2008; 日本エスエルシー)。このApoEDマウスは高脂肪食投与により病変進行が促進される。また病変は週齢に従って進行し、12週齢では動脈内膜が肥厚し脂質の蓄積が認められる程度であるが(ステージ1)、18週齢では脂質の蓄積により泡沫細胞が形成され(ステージ2)、25週齢になると動脈広範囲に不安定な粥状プラークが多数観察され(ステージ3)、粥状硬化性動脈硬化症の最も危険な段階を迎える。35週齢では繊維化・石灰化の進んだ安定型病変が多く観察される(ステージ4)。
【0104】
そこで本実施例では、12、18、25及び35週齢の野生型マウス(WT;C57BL/6)とApoEDマウス(オス及びメス各5個体)より動脈組織を採取した。WT及びApoEDマウス動脈組織は液体窒素中で粉砕後、可溶化液(9.5M尿素,2%硫酸-3-[(3-コールアミドプロピル)ジメチルアンモニオ]-1-プロパン(CHAPS),65mMジチオトレイトール(DTT), 40mM TrisHCl,pH 8.3)にて可溶化した。12,000rpm、4℃にて20分間遠心分離後、上清を回収し、氷冷アセトン添加によるアセトン沈殿を行ってタンパク質成分を濃縮した。減圧乾固した沈殿を再可溶化液(0.2%ドデシル硫酸ナトリウム(SDS),50mM Tris-HCl,pH 8.5)にて再可溶化し、タンパク質濃度を測定し、同位体標識に供した。
【0105】
動脈組織より抽出したタンパク質画分各1mgを、終濃度6M尿素、0.05%SDS、50mM Tris pH8.5、5mMエチレンジアミン四酢酸(EDTA)、10mMリン酸トリ-n-ブチル(TBP)、それぞれ総容量800μlになるよう調製し、37℃で30分変性処理した。ここに200μlのアセトニトリルで溶解した「Light標識試薬」をWTマウス試料に、「Heavy標識試薬」をApoEDマウス試料に添加して37℃で2時間標識反応を行った。10mM Tris pH8.0緩衝液を800μl添加してpHを調整後、125μg/mlに調製したトリプシン溶液(Trypsin、TPCK Treated; Cat. No.4352157; アプライドバイオ)を160μl添加し、その後両者を等量混合して37℃で16時間トリプシン消化反応を行った。さらに、トリプシン処理して得たペプチド断片をSCXカラム(poly Sulfoethyl A; 4.6 x 100 mm; ポリエルシー)に供して溶出液を25画分に分離した。分離は溶離液A[10mM KH2PO4(pH2.8)、25%アセトニトリル(ACN)]及び溶離液B[10mM KH2PO4(pH2.8)、25%ACN、0.5M KCl]を用い、Bの割合(%)が10分−0%、70分−20%、85分−50%、90分−60%、95分−60%、100分−100%のリニアグラジエントにより行った。各画分はおよその液量が1/4程度になるまで減圧濃縮し、脱塩カラム(CAPCELL C18 MG; 2.0 x 10 mm; 資生堂)にて脱塩後減圧乾固した。脱塩には溶離液A[2%ACN、0.05%トリフルオロ酢酸(TFA)]及び溶離液B(80%ACN、0.05%TFA)を用いた。
【0106】
SCX各画分をそれぞれ質量分析装置と装置付属のLCシステム装置(NanoFrontier LD; 日立ハイテク)を用いて解析した。緩衝液Aを4〜10μl(水:98%、ACN:2%、ギ酸:0.1%)にて上記試料を溶解し、うち1μLを装置に供した。LCシステムの試料分離カラムにはMonoCap for Fast-flow(50μm φx 150mm; C18; GLサイエンス)を用い、緩衝液Aと緩衝液B(水:2%、ACN:98%、ギ酸:0.1%)が120分で緩衝液B 2%〜30%のリニアグラジエント、流量は200nL/minになるよう設定して行った。装置本体のトラップカラムにはMonolith Trap(50μm φx 150mm; Cat. No.C18-50-150; 日立ハイテク)またカラム先端には石英製噴霧チップPicotip(外径360μm、内径50μm、先端内径10μm; ニューオブジェクティブ)を用い、エレクトロスプレーイオン化によるポジティブイオンモードで質量分析を行った。各25画分より得た試料に対し、IBA(Information Based Acqisition)を用いてそれぞれ2回分析を行った。IBAは1回目に測定したターゲット情報(m/z、電荷数、保持時間)を装置内部データベースに保存し、2回目の分析でターゲット情報とは一致しないイオンに対し、分析を実施する手法であるが、これにより微弱なイオンが分析され、同定数を増やすことが期待された。他の装置条件は以下のとおりである:Curtain Gas Flow 0.7L/min; Spray potential 1700V; Detector potential 2200V; Isolation Time 5ms; Isolation Width 10Da; CID Time 10ms。測定データはICAT比較定量用に開発したソフトウエアに供し、WTマウスとApoEDマウスの2群間の比較解析データを得た。
【0107】
その結果、4種類の週齢すべてで発現が確認されたタンパク質は少なくとも568種類であった。動脈組織において、12週齢以降段階的に発現量が増加又は減少する傾向のあるタンパク質を以下の4種類のパターンに分類して、各タンパク質の発現量比を病変の進行ステージに対してプロットした(図1〜4)。12週齢及びそれ以降の週齢で、野生型と比較してApoE欠損マウスで存在量が2倍以上増加するタンパク質は、3種類見出された(パターン1、図1)。12週齢までは有意な存在量の違いはなく、18週齢及びそれ以降の週齢で、野生型と比較してApoE欠損マウスで存在量が2倍以上増加するタンパク質は12種類見出された(パターン2、図2)。18週齢までは有意な存在量の違いはなく、25週齢及びそれ以降の週齢で、野生型と比較してApoE欠損マウスで存在量が2倍以上増加するタンパク質は14種類見出された(パターン3、図3)。25週齢までは有意な存在量の違いはなく、35週齢で、野生型と比較してApoE欠損マウスで存在量が2倍以上増加するタンパク質は7種類見出された(パターン4、図4)。これらのタンパク質群から、さらに動脈硬化病変の進行に関連するマーカータンパク質を以下の基準に従って抽出した。
【0108】
パターン3に属するタンパク質の中から、(i)25週齢において野生型に対するApoE欠損マウスの存在量比(以下「発現量比」と呼ぶ)が3倍以上で、(ii)25週齢の発現量比が18週齢の発現量比の2倍以上であるタンパク質4種類を、中期ステージでプラーク破綻の危険性を示すマーカーとして選別した(表1)。
【0109】
また、パターン1及び2に属するタンパク質の中から、(i)18週齢の発現量比が2倍以上で、(ii)18週齢の発現量比が12週齢の発現量比の1.3倍以上で、(iii)25週齢の発現量比が4倍以上で、(iV)25週齢の発現量比が18週齢の発現量比の1.3倍以上であるタンパク質7種類を、初期から中期ステージでプラークの進展を示すマーカーとして選別した(表2)。
【0110】
また、パターン2及び4に属するタンパク質の中から、(i)35週齢の発現量比が4倍以上で、(ii)35週齢の発現量比が25週齢の2倍以上であるタンパク質3種類を、後期ステージでプラークの安定化を示すマーカーとして選別した(表3)。
【0111】
なお、パターン1から4までに属するタンパク質のうち、表1〜3に選別されていないタンパク質22種類を、動脈硬化病変の進行に関連するその他のマーカー群として、表4にまとめた。
【0112】
[実施例2]
通常食を投与した系統の異なる12週齢のApoEノックアウトマウス(メス)(ApoEKO; B6.129P2-ApoetmlUnc/J)5個体より動脈組織を摘出し、実施例1に記載の方法と同様にタンパク質画分(プール)を調製した。ApoEKOは実施例1に記載のApoEDとは別系統で(Piedrahita, JA. et al., Proc. Natl. Acad. Sci. USA, 89:4471-4475, 1992;日本チャールス・リバー)、事前の予備検討により動脈に病変が形成されていないことを確認した(データは示さない)。被験体の血液中の脂質の濃度は総コレステロール539 mg/dl、トリグリセリド49 mg/dl、LDLコレステロール404 mg/dl、HDLコレステロール143 mg/dlを示し、動脈硬化の進行が疑われた。そこで実施例1に記載の方法を一部改変し、同週齢の野生型マウス(WT;C57BL/6)より得た動脈組織を標準として、組織中に含まれるタンパク質の発現量比を網羅的に解析した。部分的な改変とは、実施例1に記載の方法のうち、実験手順簡略化のためSCXによる分画を25分画のところ、7分画で行ったことによる。
【0113】
その結果、実施例1で同定されたタンパク質と共通なタンパク質が247種類同定された。その中で、実施例1で野生型と比較してApoE欠損マウスで存在量比が2倍以上となったタンパク質群の挙動について検討した。実施例1において12週齢及びそれ以降の週齢で、野生型と比較してApoE欠損マウスで存在量が2倍以上増加する3種類のタンパク質(C4BPA_MOUSE、MUCM_MOUSE、PROP_MOUSE)は、本測定では同定されなかった。実施例1で、18週齢以降で野生型と比較してApoE欠損マウスで存在量が2倍以上増加したタンパク質(計32種類)については、本測定では11種類同定できたが、そのいずれもが野生型と比較したApoE欠損マウスでの存在量の比は1.35倍以下であった。すなわち、本測定における被験体のマウスは動脈硬化の進行ステージとしては12週齢(初期病変)にある可能性が最も大きいと判定され、本発明の有効性が示された。
【0114】
[実施例3]
動脈組織において、実施例1でApoE欠損マウスに特徴的な存在量の変動を示したマーカー候補タンパク質群の中で代表的なタンパク質を10種類選択し、その動脈硬化病変部位における発現を、ApoE欠損マウス各週齢の動脈組織中の病変部位(プラーク形成部位)の免疫組織染色によって確認した。
【0115】
10%ホルマリン固定した大動脈試料を大動脈弓部分で冠状に切り出し、パラフィン包埋ブロックを調製した。その後3μm厚に薄切し、常法に従ってヘマトキシリン・エオジン(H&E)染色及び抗体を用いた組織免疫染色を検討した。組織免疫染色に用いた一次抗体は以下のとおりである。
【0116】
抗プロパージン抗体(50倍希釈、sc68367;サンタクルズ)、
抗CD5抗原様タンパク質抗体(100倍希釈、ab45408;アブカム)、
抗フィブロネクチン抗体(50倍希釈、sc59826;サンタクルズ)、
抗フィブロモジュリン抗体(50倍希釈、sc33772;サンタクルズ)、
抗トロンボスポンジン-4抗体(50倍希釈、sc68367;サンタクルズ)、
抗プラスチン-2抗体(50倍希釈、13025-1-AP;プロテインテック)、
抗ADAMTS様タンパク質-4抗体(50倍希釈、15304-1-AP;プロテインテック)、
抗マトリクス・メタロプロテイナーゼ-2抗体(50倍希釈、BS1236;バイオワールドテクノロジー)、
抗テネイシン抗体(50倍希釈、3118-1;エピトミクス)、
抗軟骨オリゴマー基質タンパク質抗体(50倍希釈、PC-140;カミヤバイオメディカル)。
【0117】
ビオチン標識二次抗体反応後、ジアミノベンジジン(DAB)添加によりシグナルを可視化した。染色標本は顕微鏡(Biozero,BZ-8000;キーエンス)にて観察し、得た画像をデジタルデータとして保存した。
【0118】
図6に抗CD5抗原様タンパク質抗体と抗プロパージン抗体による組織免疫染色の結果を示す。また、図7に抗軟骨オリゴマー基質タンパク質抗体、抗フィブロモジュリン抗体、抗フィブロネクチン抗体及び抗トロンボスポンジン-4抗体による組織免疫染色の結果を示す。さらに、図8に抗プラスチン-2抗体及び抗テネイシン抗体を用いた組織免疫染色の結果を示す。
【0119】
図に示されるように、抗プロパージン抗体、抗CD5抗原様タンパク質抗体、抗プラスチン-2抗体及び抗テネイシン抗体を用いた組織免疫染色では、特に中期ステージの病変部位に高シグナルを検出し、各抗体が認識する標的タンパク質群の病変における発現を確認し、実施例1における質量分析によって得られた結果を支持した(図6及び8)。また、抗フィブロモジュリン抗体、抗フィブロネクチン抗体及び抗トロンボスポンジン-4抗体を用いた組織免疫染色では、特に中期ステージ及び後期ステージの病変部位に高シグナルを検出し、各抗体が認識する標的タンパク質群の病変における発現を確認し、実施例1の結果を支持した(図7)。また、抗軟骨オリゴマー基質タンパク質抗体を用いた組織免疫染色では、後期ステージと比較して中期ステージの病変部位に高いシグナルを検出し、標的タンパク質の病変における発現を確認した(図7)。35週齢動脈組織には後期病変に加えて中期病変も含まれていることから、軟骨オリゴマー基質タンパク質が中期病変に強い発現を示していることは、実施例1の質量分析結果に矛盾していない。さらに、抗マトリクス・メタロプロテイナーゼ-2抗体を用いた組織免疫染色では、特に後期ステージの病変部位に高シグナルを検出し、該抗体が認識する標的タンパク質の病変における発現を確認し、実施例1の結果を支持した。抗ADAMTS様タンパク質-4抗体を用いた組織免疫染色では、ステージの進展と共にシグナルの上昇が観察され、これらの抗体が認識する標的タンパク質の病変における発現を確認し、実施例1の結果を支持した。
【0120】
以上から、野生型マウスとApoE欠損マウスにおける当該タンパク質の存在量の比は動脈硬化病変における当該タンパク質の存在量と高い相関を有していることを確認した(図6〜図8)。
【0121】
[実施例4]
動脈硬化モデルのWHHLウサギは月齢に従って進行程度の異なる動脈硬化病変を形成する。本実施例では7カ月齢と13カ月齢のWHHLウサギ(オス、北山ラベス)を用い、99mテクネシウム標識した抗プロパージン抗体と125ヨウ素標識した抗CD5L抗体を混合してウサギの耳静脈より投与し(麻酔下)、両者のシグナルが病変にどのように集積するかを検討した。投与後6時間後のシグナル集積を、動物用SPECT装置(R1;日立製作所)を用いて可視化した。
【0122】
7カ月齢のWHHLウサギでは抗プロパージン抗体由来のシグナルのみ検出されるが、13カ月齢のWHHLウサギでは抗プロパージン抗体、抗CD5L抗体由来のシグナルが胸部大動脈弓を中心に検出される。一方、同月齢の野生型のウサギ(日本白色種;北山ラベス)では両者のシグナルは検出されない。
【産業上の利用可能性】
【0123】
本発明により、動脈硬化症の発症の有無とその進行を評価する技術が提供される。本発明により、動脈硬化の有無、その状態又は進行の程度、及び位置を高精度かつ簡便に判定することができる。また、本発明により、動脈硬化の予防及び/又は治療に有用な薬剤のスクリーニング方法が提供される。従って本発明は、動脈硬化の診断、予防及び/又は治療の分野で有用である。
【技術分野】
【0001】
本発明は、動脈硬化病変を評価するための方法、キット及び装置に関する。より具体的には、本発明は、新規マーカータンパク質に基づいて動脈硬化病変を評価するための方法、キット及び装置に関する。また本発明は、該マーカータンパク質を利用した動脈硬化病変の可視化剤及び動脈硬化病変への標的化剤、並びに動脈硬化病変の治療薬又は治療法の有効性の評価方法に関する。
【背景技術】
【0002】
動脈硬化は長い年月をかけて自覚症状がないうちに進行し、重篤な心筋梗塞等の心血管疾患、脳梗塞や脳出血等の脳血管疾患を誘発する。動脈硬化が進行すると、動脈血管内に粥状動脈硬化病変(粥腫、プラーク)が形成される。プラークには石灰化した繊維性組織に富む安定型と、脂質や炎症細胞に富み繊維性皮膜が菲薄化した不安定型が存在し、心筋梗塞や脳梗塞など急性動脈硬化性疾患の多くは、不安定型プラークの破綻と血栓形成によって誘導される。そのため、急性動脈硬化性疾患において、不安定プラークの形成・成長の状況や破綻リスクを適切に評価・診断することが重要である。現在動脈硬化の検出は、その狭窄度を評価する血管造影が主流であるが、血管内のプラーク形成やその性状に関する情報はあまり得られないことが課題であった。また血管造影は侵襲性が高いことから、侵襲性が低い動脈硬化病変の検出方法が求められていた。
【0003】
一方疾患プロテオミクスは、血液、唾液、尿等の体液や組織試料を材料に、健常状態と比較して特定の疾患によって変動するタンパク質の増減を網羅的に探索する手法であり、従来疾患との関連が知られていなかった複数の因子を同時に抽出・検出できるという特徴がある。二次元電気泳動法、タンパク質マイクロアレイや質量分析装置等の測定装置の多検体化、高感度化が実現し、データ解析技術が整備され、癌や免疫疾患、感染症等の様々な疾患におけるマーカー探索に応用されている(非特許文献1)。
【0004】
例えば、動脈硬化病変の進展に伴って血中レベルが変動する生化学マーカーを利用して動脈硬化又はその関連疾患を診断する方法が報告されている(特許文献1及び2)。しかしながら、動脈硬化病変の正確な診断のためには、さらなるマーカー群の整備が望まれている。
【先行技術文献】
【特許文献】
【0005】
【特許文献1】特開2007-278907号公報
【特許文献2】特開2010-85242号公報
【非特許文献】
【0006】
【非特許文献1】Hanash S., Nature, 第422巻第226-232頁, 2003年
【発明の概要】
【発明が解決しようとする課題】
【0007】
動脈硬化病変、特に不安定病変の形成は心筋梗塞や脳梗塞等重篤な疾患を誘起するため、正確な診断が重要な課題である。動脈硬化の不安定病変の的確な評価が可能になれば、生活習慣改善等による予防、進行・悪化の防止、治療の可能性が生じる。
【0008】
従って、本発明の目的は、動脈硬化病変の進行に従ってその発現が変動するタンパク質(マーカータンパク質)群をプロテオミクス的手法により同定し、その変動を発現プロファイルデータベースとして記録し、被験体より得たサンプル中のマーカータンパク質の発現変動と照らし合わせて、動脈硬化病変の進行ステージを同定することによる、動脈硬化病変の診断、予防又は治療の評価方法を提供することである。
【0009】
本発明はまた、動脈硬化病変の進行に従ってその発現が変動するマーカータンパク質群に対する特異的親和性を有する物質を被験体に投与(例えば静脈投与)すること、ここで当該物質は標識されており、被験体内でマーカータンパク質に結合した親和性物質を検出すること、及びマーカータンパク質に結合した親和性物質のレベルを測定することに基づく動脈硬化病変の評価方法を提供することである。
【課題を解決するための手段】
【0010】
本発明者らは、動脈硬化を好発しかつ高脂肪食の投与と週齢によってその進行が促進されるApoE欠損マウスと野生型マウスより動脈組織を得て、動脈組織中に含まれるタンパク質の発現量を質量分析装置により網羅的に比較解析した。その結果、動脈硬化の進行程度の異なる12、18、25及び35週齢の各時点において得られた動脈組織に含まれるタンパク質発現量比の測定値を用いて発現プロファイルデータベースを構築し、動脈硬化の発症や進行(悪化)と各タンパク質の発現量比の変動傾向が相関し、その傾向が複数のグループに分類できることを見出した。また、本発明者らは、動脈硬化病変の特定のステージに特徴的な発現傾向を示すタンパク質を特定することに成功し、かかるタンパク質を動脈硬化の発症の可能性の程度、リスクの高低と病状進行の可能性を評価するためのマーカーとして使用できるという知見を得、本発明を完成した。
【0011】
従って、本発明は以下を提供する。
[1]以下の(a)〜(d)群に示されるタンパク質のうち、少なくとも(a)群から選択される少なくとも1種のタンパク質に特異的に結合する少なくとも1種の物質を含むことを特徴とする動脈硬化病変の評価用キット。
(a)軟骨オリゴマー基質タンパク質、フィブロモジュリン、フィブロネクチン及びトロンボスポンジン-4;
(b)プラスチン-2、テネイシン、CD5抗原様タンパク質、プロパージン、Cb4結合タンパク質、フィブリノゲンβ鎖及びフィブリノゲンγ鎖;
(c)ビトロネクチン、マトリクス・メタロプロテイナーゼ-2及びトロンボスポンジン-1;
(d)膜結合型イムノグロブリンμ鎖C領域、受容体型チロシンタンパク質ホスファターゼC、イムノグロブリンG-2B鎖-C領域、イムノグロブリンJ鎖、イムノグロブリンκ鎖C領域、血管内皮細胞接着因子-1、α-2-マクログロブリン、ADAMTS様タンパク質-4、カテプシンB、カルボキシペプチダーゼ-B2、補体因子-H、クラスタリン、14型コラーゲン-α-1鎖、上皮型脂肪酸結合タンパク質、マンノース結合レクチン関連セリンプロテアーゼ-2、プロトロンビン、捕体因子-B、インターα-トリプシンインヒビター重鎖-H1、ミオシン-9、ビタミンK依存性因子S、メタロプロプロテアーゼインヒビター3及びトロポミオシンα4
【0012】
[2](a)群から選択されるタンパク質と、(b)〜(d)群の少なくとも1つの群から選択されるタンパク質に特異的に結合する少なくとも2種の物質を含む、[1]に記載のキット。
[3](a)群から選択されるタンパク質と、(b)〜(d)群の少なくとも2つの群から選択されるタンパク質に特異的に結合する少なくとも3種の物質を含む、[1]に記載のキット。
[4](a)群から選択されるタンパク質と、(b)〜(d)群の各群から選択されるタンパク質に特異的に結合する少なくとも4種の物質を含む、[1]に記載のキット。
【0013】
[5]軟骨オリゴマー基質タンパク質、フィブロモジュリン、フィブロネクチン及びトロンボスポンジン-4からなる群より選択される少なくとも1種のタンパク質に特異的に結合する少なくとも1種の物質を含み、中期ステージ以上の動脈硬化病変について評価するための動脈硬化病変の評価用キット。
[6]プラスチン-2、テネイシン、CD5抗原様タンパク質、プロパージン、Cb4結合タンパク質、フィブリノゲンβ鎖及びフィブリノゲンγ鎖からなる群より選択される少なくとも1種のタンパク質に特異的に結合する少なくとも1種の物質を含み、初期又は中期ステージの動脈硬化病変について評価するための動脈硬化病変の評価用キット。
[7]ビトロネクチン、マトリクス・メタロプロテイナーゼ-2及びトロンボスポンジン-1からなる群より選択される少なくとも1種のタンパク質に特異的に結合する少なくとも1種の物質を含み、後期ステージの動脈硬化病変について評価するための動脈硬化病変の評価用キット。
[8]動脈硬化病変の評価が、被験体における動脈硬化病変の存在の判定、被験体に存在する動脈硬化病変のステージの決定、被験体に存在する動脈硬化病変の位置の決定、被験体に存在する動脈硬化の治療効果の評価、及び被験体に存在する動脈硬化の予後の予測からなる群より選択される、[1]〜[7]のいずれかに記載のキット。
[9]タンパク質に特異的に結合する物質が、抗体、抗体様分子、核酸アプタマー、リガンド及び基質からなる群より選択される、[1]〜[8]のいずれかに記載のキット。
[10]タンパク質に特異的に結合する物質が造影剤と結合されている、[1]〜[9]のいずれかに記載のキット。
[11]造影剤が、蛍光物質、発光物質、放射性物質、リポソーム、ミセル、細胞、ウイルス粒子、ウイルス、マイクロ粒子、ナノ粒子、室のあるマイクロデバイス、エマルジョン、脂質ディスク、ポリマー、ガドリニウム結合分子、超常磁性酸化鉄粒子、ペルフルオロカーボンナノ粒子、及び超微粒気泡からなる群より選択される、[10]に記載のキット。
[12]動脈硬化病変が、ポジトロン断層撮影(PET)、単一光子放射断層撮影(SPECT)、γシンチグラフィー、オートラジオグラフィー、蛍光イメージング、磁気共鳴画像(MRI)、超音波、及びコンピュータ断層撮影(CT)からなる群より選択される手段により可視化される、[10]又は[11]に記載のキット。
【0014】
[13]動脈硬化病変を評価するための装置であって、
(i)被験体における、以下の(a)〜(d)群に示されるタンパク質のうち、少なくとも(a)群から選択される少なくとも1種のタンパク質を検出するための手段:
(a)軟骨オリゴマー基質タンパク質、フィブロモジュリン、フィブロネクチン及びトロンボスポンジン-4;
(b)プラスチン-2、テネイシン、CD5抗原様タンパク質、プロパージン、Cb4結合タンパク質、フィブリノゲンβ鎖及びフィブリノゲンγ鎖;
(c)ビトロネクチン、マトリクス・メタロプロテイナーゼ-2及びトロンボスポンジン-1;
(d)膜結合型イムノグロブリンμ鎖C領域、受容体型チロシンタンパク質ホスファターゼC、イムノグロブリンG-2B鎖-C領域、イムノグロブリンJ鎖、イムノグロブリンκ鎖C領域、血管内皮細胞接着因子-1、α-2-マクログロブリン、ADAMTS様タンパク質-4、カテプシンB、カルボキシペプチダーゼ-B2、補体因子-H、クラスタリン、14型コラーゲン-α-1鎖、上皮型脂肪酸結合タンパク質、マンノース結合レクチン関連セリンプロテアーゼ-2、プロトロンビン、捕体因子-B、インターα-トリプシンインヒビター重鎖-H1、ミオシン-9、ビタミンK依存性因子S、メタロプロプロテアーゼインヒビター3及びトロポミオシンα4;
(ii)(i)の手段により得られる検出結果に基づいて被験体における動脈硬化病変を評価するための手段
を備えた装置。
[14](iii)前記タンパク質についての基準値を保管するための手段;
(iv)被験体におけるタンパク質の検出結果と、該基準値とを比較するための手段
をさらに備える、[13]に記載の装置。
【0015】
[15]以下の(a)〜(d)群に示されるタンパク質のうち、少なくとも(a)群から選択される少なくとも1種のタンパク質とそれと結合した造影剤とを含むことを特徴とする、動脈硬化病変の可視化剤。
(a)軟骨オリゴマー基質タンパク質、フィブロモジュリン、フィブロネクチン及びトロンボスポンジン-4;
(b)プラスチン-2、テネイシン、CD5抗原様タンパク質、プロパージン、Cb4結合タンパク質、フィブリノゲンβ鎖及びフィブリノゲンγ鎖;
(c)ビトロネクチン、マトリクス・メタロプロテイナーゼ-2及びトロンボスポンジン-1;
(d)膜結合型イムノグロブリンμ鎖C領域、受容体型チロシンタンパク質ホスファターゼC、イムノグロブリンG-2B鎖-C領域、イムノグロブリンJ鎖、イムノグロブリンκ鎖C領域、血管内皮細胞接着因子-1、α-2-マクログロブリン、ADAMTS様タンパク質-4、カテプシンB、カルボキシペプチダーゼ-B2、補体因子-H、クラスタリン、14型コラーゲン-α-1鎖、上皮型脂肪酸結合タンパク質、マンノース結合レクチン関連セリンプロテアーゼ-2、プロトロンビン、捕体因子-B、インターα-トリプシンインヒビター重鎖-H1、ミオシン-9、ビタミンK依存性因子S、メタロプロプロテアーゼインヒビター3及びトロポミオシンα4
[16]軟骨オリゴマー基質タンパク質、フィブロモジュリン、フィブロネクチン及びトロンボスポンジン-4からなる群より選択される少なくとも1種のタンパク質に特異的に結合する少なくとも1種の物質と、それと結合した造影剤とを含むことを特徴とする、中期ステージ以上の動脈硬化病変の可視化剤。
[17]プラスチン-2、テネイシン、CD5抗原様タンパク質、プロパージン、Cb4結合タンパク質、フィブリノゲンβ鎖及びフィブリノゲンγ鎖からなる群より選択される少なくとも1種のタンパク質に特異的に結合する少なくとも1種の物質と、それと結合した造影剤とを含むことを特徴とする、初期又は中期ステージの動脈硬化病変の可視化剤。
[18]ビトロネクチン、マトリクス・メタロプロテイナーゼ-2及びトロンボスポンジン-1からなる群より選択される少なくとも1種のタンパク質に特異的に結合する少なくとも1種の物質と、それと結合した造影剤とを含むことを特徴とする、後期ステージの動脈硬化病変の可視化剤。
【0016】
[19]以下の(a)〜(d)群のうち、少なくとも(a)群から選択される少なくとも1種のタンパク質に特異的に結合する物質と、それと結合した化合物又は分子とを含むことを特徴とする、動脈硬化病変への化合物又は分子の標的化剤。
(a)軟骨オリゴマー基質タンパク質、フィブロモジュリン、フィブロネクチン及びトロンボスポンジン-4;
(b)プラスチン-2、テネイシン、CD5抗原様タンパク質、プロパージン、Cb4結合タンパク質、フィブリノゲンβ鎖及びフィブリノゲンγ鎖;
(c)ビトロネクチン、マトリクス・メタロプロテイナーゼ-2及びトロンボスポンジン-1;
(d)膜結合型イムノグロブリンμ鎖C領域、受容体型チロシンタンパク質ホスファターゼC、イムノグロブリンG-2B鎖-C領域、イムノグロブリンJ鎖、イムノグロブリンκ鎖C領域、血管内皮細胞接着因子-1、α-2-マクログロブリン、ADAMTS様タンパク質-4、カテプシンB、カルボキシペプチダーゼ-B2、補体因子-H、クラスタリン、14型コラーゲン-α-1鎖、上皮型脂肪酸結合タンパク質、マンノース結合レクチン関連セリンプロテアーゼ-2、プロトロンビン、捕体因子-B、インターα-トリプシンインヒビター重鎖-H1、ミオシン-9、ビタミンK依存性因子S、メタロプロプロテアーゼインヒビター3及びトロポミオシンα4
[20]化合物又は分子が血栓溶解剤である、[19]に記載の標的化剤。
【0017】
[21]動脈硬化病変の治療薬又は治療法の有効性の評価方法であって、
(i)被験治療薬又は治療法による処置を受けた動脈硬化病変を有する動物において、以下の(a)〜(d)群に示されるタンパク質のうち、少なくとも(a)群から選択される少なくとも1種のタンパク質を検出するステップ:
(a)軟骨オリゴマー基質タンパク質、フィブロモジュリン、フィブロネクチン及びトロンボスポンジン-4;
(b)プラスチン-2、テネイシン、CD5抗原様タンパク質、プロパージン、Cb4結合タンパク質、フィブリノゲンβ鎖及びフィブリノゲンγ鎖;
(c)ビトロネクチン、マトリクス・メタロプロテイナーゼ-2及びトロンボスポンジン-1;
(d)膜結合型イムノグロブリンμ鎖C領域、受容体型チロシンタンパク質ホスファターゼC、イムノグロブリンG-2B鎖-C領域、イムノグロブリンJ鎖、イムノグロブリンκ鎖C領域、血管内皮細胞接着因子-1、α-2-マクログロブリン、ADAMTS様タンパク質-4、カテプシンB、カルボキシペプチダーゼ-B2、補体因子-H、クラスタリン、14型コラーゲン-α-1鎖、上皮型脂肪酸結合タンパク質、マンノース結合レクチン関連セリンプロテアーゼ-2、プロトロンビン、捕体因子-B、インターα-トリプシンインヒビター重鎖-H1、ミオシン-9、ビタミンK依存性因子S、メタロプロプロテアーゼインヒビター3及びトロポミオシンα4;
(ii)(i)の結果に基づいて動脈硬化病変に対する被験治療薬又は治療法の有効性を評価するステップ
を含む方法。
[22]被験治療薬又は治療法による処置を行う前に、動脈硬化病変を有する動物において、前記タンパク質を検出するステップをさらに含む、[21]に記載の方法。
[23]動脈硬化病変を有する動物が動脈疾患モデル動物である、[21]又は[22]に記載の方法。
【0018】
[24]動脈硬化病変の評価方法であって、
(i)被験体において、以下の(a)〜(d)群に示されるタンパク質のうち、少なくとも(a)群から選択される少なくとも1種のタンパク質を検出するステップ:
(a)軟骨オリゴマー基質タンパク質、フィブロモジュリン、フィブロネクチン及びトロンボスポンジン-4;
(b)プラスチン-2、テネイシン、CD5抗原様タンパク質、プロパージン、Cb4結合タンパク質、フィブリノゲンβ鎖及びフィブリノゲンγ鎖;
(c)ビトロネクチン、マトリクス・メタロプロテイナーゼ-2及びトロンボスポンジン-1;
(d)膜結合型イムノグロブリンμ鎖C領域、受容体型チロシンタンパク質ホスファターゼC、イムノグロブリンG-2B鎖-C領域、イムノグロブリンJ鎖、イムノグロブリンκ鎖C領域、血管内皮細胞接着因子-1、α-2-マクログロブリン、ADAMTS様タンパク質-4、カテプシンB、カルボキシペプチダーゼ-B2、補体因子-H、クラスタリン、14型コラーゲン-α-1鎖、上皮型脂肪酸結合タンパク質、マンノース結合レクチン関連セリンプロテアーゼ-2、プロトロンビン、捕体因子-B、インターα-トリプシンインヒビター重鎖-H1、ミオシン-9、ビタミンK依存性因子S、メタロプロプロテアーゼインヒビター3及びトロポミオシンα4;
(ii)(i)の結果に基づいて被験体における動脈硬化病変を評価するステップ
を含む方法。
[25](a)群から選択されるタンパク質と、(b)〜(d)群の少なくとも1つの群から選択される少なくとも2種のタンパク質を検出する、[24]に記載の方法。
[26](a)群から選択されるタンパク質と、(b)〜(d)群の少なくとも2つの群から選択される少なくとも3種のタンパク質を検出する、[24]に記載の方法。
[27](a)群から選択されるタンパク質と、(b)〜(d)群の各群から選択される少なくとも4種のタンパク質を検出する、[24]に記載の方法。
【0019】
[28]動脈硬化病変の評価方法であって、
(i)被験体において、軟骨オリゴマー基質タンパク質、フィブロモジュリン、フィブロネクチン及びトロンボスポンジン-4からなる群より選択される少なくとも1種のタンパク質を検出するステップ;
(ii)(i)の結果に基づいて、被験体が中期ステージ以上の動脈硬化病変を有するか否かを評価するステップ
を含む方法。
[29]動脈硬化病変の評価方法であって、
(i)被験体において、プラスチン-2、テネイシン、CD5抗原様タンパク質、プロパージン、Cb4結合タンパク質、フィブリノゲンβ鎖及びフィブリノゲンγ鎖からなる群より選択される少なくとも1種のタンパク質を検出するステップ;
(ii)(i)の結果に基づいて、被験体が初期又は中期ステージの動脈硬化病変を有するか否かを評価するステップ
を含む方法。
[30]動脈硬化病変の評価方法であって、
(i)被験体においてビトロネクチン、マトリクス・メタロプロテイナーゼ-2及びトロンボスポンジン-1からなる群より選択される少なくとも1種のタンパク質を検出するステップ;
(ii)(i)の結果に基づいて、被験体が後期ステージの動脈硬化病変を有するか否かを評価するステップ
を含む方法。
【0020】
[31]ステップ(i)が、タンパク質に特異的に結合する物質を被験体に投与し、該被験体に存在する該タンパク質と結合した該物質を検出することにより行われる、[24]〜[30]のいずれかに記載の方法。
[32]ステップ(i)が、被験体由来のサンプルを調製し、該サンプルとタンパク質に特異的に結合する物質とを接触させ、該タンパク質と該物質との結合を検出することにより行われる、[24]〜[30]のいずれかに記載の方法。
【0021】
[33]動脈硬化病変の評価が、被験体における動脈硬化病変の存在の判定、被験体に存在する動脈硬化病変のステージの決定、被験体に存在する動脈硬化病変の位置の決定、被験体に存在する動脈硬化の治療効果の評価、及び被験体に存在する動脈硬化の予後の予測からなる群より選択される、[24]〜[32]のいずれかに記載の方法。
[34]タンパク質に特異的に結合する物質が、抗体、抗体様分子、核酸アプタマー、リガンド及び基質からなる群より選択される、[31]又は[32]に記載の方法。
[35]タンパク質に特異的に結合する物質が造影剤と結合されている、[31]、[32]及び[34]のいずれかに記載の方法。
[36]造影剤が、蛍光物質、発光物質、放射性物質、リポソーム、ミセル、細胞、ウイルス粒子、ウイルス、マイクロ粒子、ナノ粒子、室のあるマイクロデバイス、エマルジョン、脂質ディスク、ポリマー、ガドリニウム結合分子、超常磁性酸化鉄粒子、ペルフルオロカーボンナノ粒子、及び超微粒気泡からなる群より選択される、[35]に記載の方法。
[37]動脈硬化病変が、ポジトロン断層撮影(PET)、単一光子放射断層撮影(SPECT)、γシンチグラフィー、オートラジオグラフィー、蛍光イメージング、磁気共鳴画像(MRI)、超音波、及びコンピュータ断層撮影(CT)からなる群より選択される手段により可視化される、[35]又は[36]に記載の方法。
[38]評価ステップ(ii)が、健常者におけるタンパク質の測定値、及び動脈硬化の既知のステージに罹患している被験体におけるタンパク質の測定値から選択される基準値との比較を含む、[24]〜[37]のいずれかに記載の方法。
[39]評価ステップ(ii)が、前記基準値と比較して被験体におけるタンパク質の測定値が上昇しているか否かを評価する、[38]に記載の方法。
【発明の効果】
【0022】
本発明により、これまで初期診療や健康診断において、従来の方法により見落とされていた動脈硬化(不安定化)病変の検出や、それにより生じた障害の発生と進行の可能性を検定することが可能となる。本発明を使用して、被験体に存在するタンパク質群の標準サンプルに対する発現量比とその時間経過に伴う変動を測定し、予め記録しておいた発現プロファイルデータベースに照らし合わせることにより、動脈硬化とそれに起因する障害の発生と症状進行の可能性を評価することが可能となる。また本発明は、的確かつ簡便に動脈硬化病変とそれに起因する障害発生と進行の可能性に関する検査又は分析、様々な試薬や医薬の開発や、関連装置の開発にも利用できる。
【0023】
さらに、本研究により選抜したマーカータンパク質群の発現変動を、該タンパク質に対して特異的に結合する物質(抗体、抗体様物質、リガンド、基質等)及び造影剤(蛍光物質、放射性物質等)を用いて、造影剤のイメージングのための公知の手段により可視化し、該タンパク質群の病変における発現の状況(量、局在化、密度又は相対的な分布)から進行ステージを評価できる。これにより動脈硬化病変形成とそれに起因する障害の発生と症状進行の可能性を示す指標として有効利用することが可能となり、的確かつ簡便に動脈硬化とそれに起因する障害発生と進行の可能性に関する検査又は分析、様々な試薬や医薬の開発や、関連装置の開発にも利用できる。
【図面の簡単な説明】
【0024】
【図1】パターン1の変動を示すタンパク質群の各疾患ステージにおける発現量比(ApoE欠損マウス/野生型マウス)を示すグラフである。
【図2】パターン2の変動を示すタンパク質群の各疾患ステージにおける発現量比(ApoE欠損マウス/野生型マウス)を示すグラフである。
【図3】パターン3の変動を示すタンパク質群の各疾患ステージにおける発現量比(ApoE欠損マウス/野生型マウス)を示すグラフである。
【図4】パターン4の変動を示すタンパク質群の各疾患ステージにおける発現量比(ApoE欠損マウス/野生型マウス)を示すグラフである。
【図5】本発明の動脈硬化病変の評価用装置の概要を示す図である。
【図6】動脈硬化病変におけるマーカー(CD5抗原様タンパク質、プロパージン)の発現を示す画像である。図中、*は血管内腔側を示す。
【図7】動脈硬化病変におけるマーカー(軟骨オリゴマー基質タンパク質、フィブロモジュリン、フィブロネクチン、トロンボスポンジン-4)の発現を示す画像である。
【図8】動脈硬化病変におけるマーカー(プラスチン-2、テネイシン)の発現を示す画像である。
【発明を実施するための形態】
【0025】
本発明は、動脈硬化病変を評価及び可視化するための新規なマーカー及びマーカー群を提供する。本発明により提供されるマーカー及びマーカー群は、動脈硬化病変の進行に伴ってその発現が特徴的に変動するタンパク質であるため、安定狭心症や急性心筋梗塞等の動脈硬化関連疾患の発症の予測や、動脈硬化病変のステージの判定、動脈硬化病変の予後の予測、動脈硬化病変の可視化、動脈硬化関連疾患の治療薬又は治療法の有効性の評価などに有用である。従って、本発明に係る動脈硬化病変の評価方法は、
被験体において、動脈硬化病変において特定の疾患ステージに特徴的な発現パターン(発現の変動)を示すマーカータンパク質を検出するステップと、
その検出結果に基づいて被験体における動脈硬化病変を評価するステップと
を含む。
【0026】
本発明に従って評価の対象となる被験体は、ヒト、及びその他の哺乳動物、例えば霊長類(サル、チンパンジーなど)、家畜動物(ウシ、ウマ、ブタ、ヒツジなど)、ペット用動物(イヌ、ネコなど)、実験動物(マウス、ラット、ウサギなど)であり、さらには爬虫類及び鳥類などであってもよい。
【0027】
なお、本明細書中で使用する用語「マーカー」とは、本発明に従って動脈硬化を評価するために検出する対象となるタンパク質を意味する。また「マーカー群」とは、2以上のマーカーからなる組み合わせである。
【0028】
本発明において使用するマーカーを以下の表1〜4にまとめる。表中の「マウス」及び「ヒト」の欄には、それぞれ「エントリー名」及び「アクセッション番号」の項目があるが、それらはそれぞれ「マウス」及び「ヒト」のマーカータンパク質のUniProtKB/Swiss-Prot(http://www.uniprot.org/)における名称及びアクセッション番号を示す。また表1〜4には、実施例において検出した、各疾患ステージにおけるマーカータンパク質の発現量比も示す。
【0029】
【表1】

【0030】
【表2】

【0031】
【表3】

【0032】
【表4】


【0033】
なお、表及び本明細書中で記載するApoE欠損マウスの12週齢、18週齢、25週齢及び35週齢とは、その週齢に相当する疾患ステージであることを意味する。ApoE欠損マウスの週齢と疾患ステージとの関連性については、例えばNakashima, Y. et al., Arterioscler Thromb. 14:133-140, 1994;Zhao, Y. et al., J. Nucl. Med. 49:1707-1714, 2008などに報告がある。具体的には、12週齢では動脈内膜が肥厚し脂質の蓄積が認められる程度であるが(ステージ1)、18週齢では脂質の蓄積により泡沫細胞が形成され(ステージ2)、25週齢になると動脈広範囲に不安定な粥状プラークが多数観察され(ステージ3)、粥状硬化性動脈硬化症の最も危険な段階を迎え、35週齢では繊維化・石灰化の進んだ安定型病変が多く観察される(ステージ4)。従って、本明細書において、ApoE欠損マウスの「12週齢」は動脈硬化の初期ステージ(病変)に相当し、「18週齢」は動脈硬化の初中期ステージ(病変)に相当し、「25週齢」は動脈硬化の中期ステージ(病変)に相当し、「35週齢」は動脈硬化の後期ステージ(病変)に相当するものとする。
【0034】
表1に示すタンパク質は、18週齢までは有意な存在量の違いはなく、(i)25週齢において野生型に対するApoE欠損マウスの存在量比(以下「発現量比」と呼ぶ)が3倍以上で、(ii)25週齢の発現量比が18週齢の発現量比の2倍以上であるタンパク質であり、中期ステージでプラーク破綻の危険性を示すマーカーである。これらのうち少なくとも1種をマーカーとして使用することにより、このマーカーの発現量に基づいて、18週齢(初中期ステージ)かそれ以降の病変が存在するか否か、特にプラーク破綻の危険性を有するか否かを評価することができる。
【0035】
表2に示すタンパク質は、(i)18週齢において野生型に対するApoE欠損マウスの発現量比が2倍以上で、(ii)18週齢の発現量比が12週齢の発現量比の1.3倍以上で、(iii)25週齢の発現量比が4倍以上で、(iv)25週齢の発現量比が18週齢の発現量比の1.3倍以上であるタンパク質であり、初期から中期ステージでプラークの進展を示すマーカーである。これらのうち少なくとも1種をマーカーとして使用することにより、このマーカーの発現量に基づいて、12週齢(初期ステージ)又は18週齢(初中期ステージ)かそれ以降の病変が存在するか否かを評価することができる。
【0036】
表3に示すタンパク質は、12週齢までは有意な存在量の違いはなく、18週齢及びそれ以降の週齢で、野生型と比較してApoE欠損マウスで存在量が2倍以上増加するタンパク質、及び25週齢までは有意な存在量の違いはなく、35週齢で、野生型と比較してApoE欠損マウスで存在量が2倍以上増加するタンパク質のうち、(i)35週齢の発現量比が4倍以上で、(ii)35週齢の発現量比が25週齢の2倍以上であるタンパク質であり、後期ステージでプラークの安定化を示すマーカーである。これらのうち少なくとも1種をマーカーとして使用することにより、このマーカーの発現量に基づいて、35週齢(後期ステージ)かそれ以降の病変が存在するか否かを評価することができる。
【0037】
表4に示すタンパク質は、ApoE欠損マウスにおいて、野生型と比較して各週齢においてその発現量が変化するマーカーである。これらのうち少なくとも1種をマーカーとして使用することも可能であるし、あるいは表1〜3に示されるマーカーと組み合わせることにより、マーカーの発現量に基づいて、各週齢(初期、初中期、中期及び後期ステージ)の病変が存在するか否かを評価することができる。
【0038】
本発明では、少なくとも表1に示されるマーカーのうち少なくとも1種を検出することにより、動脈硬化病変の評価が可能である。すなわち、表1に示される各マーカーは個々に、プラーク破綻の危険性のある動脈硬化病変を有するか否かについて評価することができる。また本発明では、マーカーを少なくとも2つ組み合わせて使用することによって、より正確かつ高精度な動脈硬化病変の評価が可能となる。例えば、表1に示される少なくとも1種のタンパク質(軟骨オリゴマー基質タンパク質、フィブロモジュリン、フィブロネクチン又はトロンボスポンジン-4)と、表2〜4に示した各群のうち、少なくとも1つ、少なくとも2つ又は少なくとも3つの群から選択される、少なくとも2種のタンパク質とを組み合わせる。
【0039】
例えば、表1に示されるマーカーと表2に示されるマーカーを組み合わせて使用することにより、それらのマーカーの発現量に基づいて、病変が初期ステージ(12週齢)又は初中期ステージ(18週齢)にあるか、あるいは中期ステージ(25週齢)又はそれ以降にあるかの区別が可能となる。また、表1に示されるマーカーと表3に示されるマーカーを組み合わせて使用することにより、それらのマーカーの発現量に基づいて、病変が中期ステージ(25週齢)にあるかあるいは後期ステージ又はそれ以降(35週齢)にあるかの区別が可能となる。また、表1に示されるマーカーと表4に示されるマーカーを組み合わせて使用することにより、それらのマーカーの発現量に基づいて、病変が初期ステージ(12週齢)、初中期ステージ(18週齢)、中期ステージ(25週齢)又は後期ステージ(35週齢)のいずれにあるかの区別が可能となる。
【0040】
あるいは、表1〜表4に示されるマーカーを3つ以上組み合わせて使用することも可能である。例えば、表1から表4までに示されるマーカーをそれぞれ少なくとも1つずつ選択し、それらを組み合わせて使用することにより、それらのマーカーの発現量に基づいて、病変が初期ステージ(12週齢)にあるか、初中期ステージ(18週齢)にあるか、中期ステージ(25週齢)にあるか、後期ステージ(35週齢)にあるかの詳細かつ正確な区別が可能になる。好ましくは3つ以上のマーカー、より好ましくは3〜7つのマーカーを組み合わせる。このような組み合わせは、被験体の種類、性別、年齢や、動脈硬化の評価の目的、評価対象となる疾患ステージなどに応じて、適宜選択することができる。
【0041】
上述の通り、上記のマーカー又はマーカー群は、動脈硬化病変の特定の疾患ステージに特徴的な発現パターンで存在する。そのため、本発明に係る動脈硬化病変の評価方法では、被験体において上記のマーカー又はマーカー群を検出する。2以上のマーカーについて検出する場合、各マーカーを検出するステップは、同時に行ってもよいし、前後して行ってもよい。また本発明では、「マーカー(群)の検出」とは、マーカータンパク質又はその派生物若しくは誘導体の検出であってもよいし、あるいは該タンパク質をコードする遺伝子(mRNA)の検出であってもよい。「派生物」又は「誘導体」とは、マーカータンパク質から派生する物質又はマーカータンパク質の由来する物質を意味し、例えばシグナルペプチドを含むタンパク質、タンパク質の特定のサブユニット分子、修飾タンパク質、タンパク質断片などが含まれるが、これに限定されるものではない。例えば、表2に示すフィブリノゲンはβ鎖及びγ鎖を含むが、本発明においてはフィブリノゲンのインタクト分子を検出してもよいし、その派生物であるβ鎖又はγ鎖のいずれかを検出してもよい。
【0042】
マーカータンパク質の検出は、被験体におけるその量又は濃度を、好ましくは半定量的又は定量的に測定することに関し、その量は、絶対量であってもよいし又は相対量であってもよい。検出は、直接的又は間接的に行うことができる。直接的な検出は、被験体に存在するマーカータンパク質又はmRNAの分子数と直接相関するシグナルに基づいて、その量又は濃度を測定することに関する。そのようなシグナルは、例えばタンパク質又はmRNAの特定の物理的又は化学的な特性に基づいている。間接的な測定は、二次成分(すなわちマーカータンパク質又はmRNA以外の成分)、例えば抗体などのリガンド、標識又は酵素反応生成物から得られるシグナルの測定である。
【0043】
マーカータンパク質を検出するステップは、例えば、マーカータンパク質に特異的に結合する物質を被験体に投与し、被験体に存在するマーカータンパク質と結合した該物質を検出することにより行うことができる。あるいは、マーカータンパク質を検出するステップは、被験体由来のサンプルを調製し、該サンプルとマーカータンパク質に特異的に結合する物質とを接触させ、マーカータンパク質と該物質との結合を検出することにより行うことができる。
【0044】
「マーカータンパク質に特異的に結合する物質」とは、マーカータンパク質やその派生物若しくは誘導体と高い親和性で結合し、マーカータンパク質やその派生物若しくは誘導体とは無関係の分子に対しては低い親和性でしか結合しない又は全く結合しない物質を意味する。そのような物質としては、抗体、抗体様分子、核酸アプタマー、基質及びその他のリガンドが挙げられる。好ましくは、マーカータンパク質に特異的に結合する物質は、抗体又は抗体フラグメントである。例えば、各マーカータンパク質に対する抗体は、モノクローナル抗体又はポリクローナル抗体のいずれであってもよいし、あるいは各マーカータンパク質のエピトープに結合することができるFab、Fab'、F(ab')2、scFv、Fvフラグメントなどであってもよい。抗体及び抗体様分子は、当技術分野で公知の方法により調製することができ、また市販品として入手してもよい。抗体様分子は、ファージディスプレイ法やコンビナトリアル化学など免疫によらない手法により作製された、マーカータンパク質と結合する抗体可変領域と同等なペプチドを含むタンパク質断片であり、アフィボディーがその一例である。抗体様分子は、毒性が高く通常の免疫法では抗体が作製困難な場合に有効である。核酸アプタマーは、当技術分野で公知であり、特定のタンパク質(すなわちマーカータンパク質)と特異的に結合することができる核酸分子である。核酸アプタマーはin vitroで化学的に合成することができ、免疫原性が低いという利点がある。核酸アプタマーの設計は、例えばSELEX法などにより行うことができ、当業者であれば適当な核酸アプタマーを設計し、合成することができる。マーカータンパク質が酵素活性を有する場合、その基質及び基質誘導体は、当該酵素に特異的に結合する物質として利用できる。例えばマーカータンパク質がプロテアーゼ(タンパク質分解酵素)の場合、プロテアーゼインヒビター(天然由来のものでも合成分子でもよい)が利用できる。マーカータンパク質が受容体(レセプター)の場合には、そのリガンド(アゴニスト、アンタゴニスト及びそれらの誘導体)は、当該受容体に特異的に結合する物質として利用できる。特に、細胞膜に局在する受容体の場合、リガンド結合部位が細胞外にあるため、被験体に投与されるリガンドが細胞外から受容体に結合しやすいという利点がある。
【0045】
マーカータンパク質に特異的に結合する物質を被験体に投与することによりマーカータンパク質を検出しようとする場合、マーカータンパク質に特異的に結合する物質は、被験体に投与した場合に、被験体内のマーカータンパク質と結合する。従って、このような物質を利用して、被験体におけるマーカータンパク質の局在を調べ、動脈硬化病変の位置及び疾患ステージなどを評価することが可能である。また、このような物質を造影剤と結合させておくことにより、被験体における動脈硬化病変を可視化することが可能となる。
【0046】
このような可視化剤を使用することにより、マーカータンパク質を簡便かつ非侵襲敵に検出することができる。従って、本発明は動脈硬化病変の可視化剤も提供し、本可視化剤は、少なくとも1種のマーカータンパク質に特異的に結合する物質と、造影剤とを含む。造影剤は、in vivoイメージングの分野において公知の任意の造影剤を用いることができる。そのような造影剤としては、蛍光物質、例えばフルオレセイン、FITC、蛍光放出金属(152Eu、ランタン系列等)など;化学又は生物発光物質、例えばルミノール、イミダゾール、ルシフェリン、ルシフェラーゼ、緑色蛍光タンパク質(GFP)など;放射性物質、例えば99mTc、123I、131I、97Ru、67Cu、11C、13Nなど;常磁性同位体、例えば153Gd、157Gd、55Mn、162Dy、52Cr、56Fe、超常磁性酸化鉄粒子など;その他の造影剤、例えばガドリニウム、ガドリニウム錯体、ヨード造影剤、リポソーム、ミセル、細胞、ウイルス粒子、ウイルス、マイクロ粒子、ナノ粒子、室のあるマイクロデバイス、エマルジョン、脂質ディスク、ポリマー、ペルフルオロカーボンナノ粒子、及び超微粒気泡などが挙げられる。マーカータンパク質に特異的に結合する物質と造影剤との結合は、当技術分野で公知の方法により行うことができ、例えば直接的に化学結合してもよいし、あるいは適当なリンカーを介して間接的に結合してもよい。
【0047】
上述した動脈硬化病変の可視化剤を含む、本発明において使用する薬剤は、マーカータンパク質に特異的に結合する物質の他、薬学的に許容される担体又は添加物を共に含むものであってもよい。このような担体及び添加物の例として、水、薬学的に許容される有機溶剤、コラーゲン、ポリビニルアルコール、ポリビニルピロリドン、カルボキシビニルポリマー、アルギン酸ナトリウム、水溶性デキストラン、カルボキシメチルスターチナトリウム、ペクチン、キサンタンガム、アラビアゴム、カゼイン、ゼラチン、寒天、グリセリン、プロピレングリコール、ポリエチレングリコール、ワセリン、パラフィン、ステアリルアルコール、ステアリン酸、マンニトール、ソルビトール、ラクトースなどが挙げられる。使用される添加物は、剤形に応じて上記の中から適宜又は組み合わせて選択される。
【0048】
本発明の薬剤の投与方法は特に限定されるものではなく、経口投与、又は非経口投与、例えば皮下投与、皮内投与、筋肉内投与、静脈内投与、経皮投与、直腸投与、経鼻投与などにより行うことができる。
【0049】
本発明の薬剤を経口投与する場合は、錠剤、カプセル剤(硬カプセル剤、軟カプセル剤、マイクロカプセルなど)、顆粒剤、散剤、丸剤、トローチ剤、内用水剤、液剤、懸濁剤、乳剤、シロップ剤などのいずれのものであってもよく、使用する際に再溶解させる乾燥生成物にしてもよい。また、本発明の薬剤を非経口投与する場合は、例えば静脈内注射(点滴を含む)、筋肉内注射、腹腔内注射及び皮下注射用の注射剤(例えば溶液、乳剤、懸濁剤)、軟膏剤(特に眼軟膏剤)、クリーム剤、座剤、パップ剤、点眼剤、点鼻剤、吸入剤、リニメント剤、エアゾル剤などの外用剤などの製剤形態を選択することができ、注射剤の場合は単位投与量アンプル又は多投与量容器の状態で提供される。
【0050】
これらの各種製剤は、医薬において通常用いられる賦形剤、増量剤、結合剤、湿潤剤、崩壊剤、滑沢剤、界面活性剤、分散剤、緩衝剤、pH調整剤、保存剤、溶解補助剤、防腐剤、矯味矯臭剤、吸収促進剤、無痛化剤、安定化剤、等張化剤などを適宜選択し、常法により製造することができる。
【0051】
本発明の薬剤に配合する、マーカータンパク質に特異的に結合する物質の量は、該物質の種類、該物質に結合させる造影剤の種類、その用途、剤形、投与経路などにより異なるが、例えば総重量を基準として1〜99重量%、好ましくは5〜90%としうる。
【0052】
また、本発明の薬剤の投与量及び投与間隔は、マーカータンパク質に特異的に結合する物質の種類、該物質に結合させる造影剤の種類、投与対象、被験体の年齢及び体重、投与経路、投与回数により異なり、広範囲に変更することができる。
【0053】
動脈硬化病変の可視化剤の場合には、薬剤の投与後、マーカータンパク質に特異的に結合する物質の被験体における存在又は位置を、造影剤を指標として可視化する。好ましくは、マーカータンパク質に特異的に結合する物質の存在又は位置は、公知の画像化手法により可視化する。画像化手法は、使用する標識、被験体の種類、画像化する部位などにより異なるが、ポジトロン断層撮影(PET)、単一光子放射断層撮影(SPECT)、γシンチグラフィー、オートラジオグラフィー、蛍光イメージング、磁気共鳴画像(MRI)、超音波、コンピュータ断層撮影(CT)、その他のin vivoイメージングシステムを用いることができる。これにより、マーカータンパク質に特異的に結合する物質と結合した造影剤に基づいて、被験体内の動脈硬化病変の存在又は位置を可視化し、判定することができる。
【0054】
また、上述のように可視化されたマーカータンパク質の存在又は位置に加えて、マーカータンパク質の種類及び存在量に基づいて、被験体における動脈硬化病変の疾患ステージの決定、動脈硬化病変の予後の予測、動脈硬化の治療効果の評価などについて評価することもできる。
【0055】
さらに、上述のように動脈硬化病変を可視化することによって、外科手術時の病変部位を簡便かつ正確に特定することが可能となる。
【0056】
別法として、被験体由来のサンプルを調製してマーカータンパク質を検出する場合について説明する。使用するサンプルは、動脈硬化病変について評価しようとする被験体に由来するサンプルであれば特に限定されるものではなく、マーカーを検出するための方法又は手段の種類に応じて適宜選択される。例えば組織又は細胞サンプル(動脈の組織又は細胞等)が挙げられる。また、組織又は細胞サンプルは、採取後に液体窒素、ドライアイスなど当該分野で公知又は汎用されている方法で直ちに凍結し、冷凍保存することが好ましい。
【0057】
本発明の一実施形態では、マーカータンパク質の検出は、サンプル中のタンパク質の量を測定するための手段によって行うことができる。そのような手段は当技術分野で公知であり、例えば免疫アッセイの方法及び試薬などがある。またマーカータンパク質の検出は、マーカータンパク質に特有の物理的又は化学的特性を測定するための手段、例えば正確な分子量又はNMRスペクトル等を測定するための手段によって行うことができる。マーカータンパク質を検出するための手段としては、バイオセンサー、プロテインチップ、免疫アッセイと連結した光学装置、質量分析計、NMR分析計、二次元電気泳動装置又はクロマトグラフィー装置等の分析装置が挙げられる。
【0058】
好ましい実施形態において、マーカータンパク質の検出は、質量分析法(MS)を使用して行うことができる。特に液体クロマトグラフィーと連結した質量分析計(LC/MS)による解析は鋭敏であるため有利である。標識としては、当技術分野で公知の同位体標識試薬を用いることができ、適当な標識試薬を市販品として入手することができる。また分画も当技術分野で公知の方法により行うことができ、例えば市販の強陽イオンカラム等を用いて行うことができる。
【0059】
また別の実施形態では、サンプル中のマーカータンパク質の検出は、免疫アッセイ(免疫学的測定法)により行うことができる。すなわちサンプル中のマーカータンパク質と、該タンパク質に特異的に結合する抗体との反応に基づいて、該タンパク質を検出する。免疫アッセイは、当該分野で汎用されている方法であれば液相系及び固相系のいずれで行ってもよい。検出の容易性の点で、固相系を利用することが好ましい。また免疫アッセイの形式も限定されるものではなく、直接固相法の他、サンドイッチ法、競合法、ウエスタンブロッティング法、ELISA(enzyme linked immunosorbent assay)法などであってもよい。
【0060】
本発明の方法において使用する、各マーカータンパク質に対する抗体はモノクローナル抗体又はポリクローナル抗体のいずれであってもよいし、あるいは各マーカータンパク質のエピトープに結合することができるFab、Fab'、F(ab')2、scFv、Fvフラグメントなどであってもよい。一次抗体と二次抗体を使用する場合には、両方ともモノクローナル抗体を用いることもでき、あるいは、一次抗体と二次抗体のいずれか一方をポリクローナル抗体とすることもできる。抗体は、当技術分野で公知の方法により調製することができ、また市販品として入手してもよい。
【0061】
マーカータンパク質と抗体との結合は、周知の方法に従って測定しうる。当業者であれば、採用する免疫アッセイの種類及び形式、使用する標識の種類などに応じて、各アッセイについての有効かつ最適な測定方法を決定することができる。例えば、サンプル中のマーカータンパク質と抗体との結合を容易に検出するために、該抗体を標識することにより該結合を直接検出するか、又は標識二次抗体若しくはビオチン−アビジン複合体等を用いることにより間接的に検出する。
【0062】
固相系においては、抗体又はサンプル中のタンパク質成分を固相(プレート、膜、ビーズ等)上に固定化し、この固相上においてマーカータンパク質と固体との免疫学的結合を試験する。固相は、当技術分野で慣用的に使用されているものであれば特に限定されるものではなく、例えば市販のニトロセルロース膜又はPVDF膜を用いることができる。抗体又はサンプル中のタンパク質成分を固相上に固定化することによって、未結合のサンプル成分や試薬を容易に除去することができる。また特に、数十種類の抗体を固定化したメンブレンを用いるタンパク質アレイ法では、少量の被験体由来のサンプル(血漿など)を用いて多種類のマーカータンパク質の存在を短時間で解析することができる。またこのような免疫アッセイは、例えば操作が簡便なテストストリップにおいても実施することができる。
【0063】
免疫アッセイとして液相系を選択する場合には、例えば、標識化抗体とサンプルとを接触させて標識化抗体とマーカータンパク質を結合させ、この結合体を分離し、標識シグナルを検出する。あるいは、マーカータンパク質に対する抗体(一次抗体)とサンプルとを接触させて一次抗体とマーカータンパク質を結合させ、この結合体に標識化抗体(二次抗体)を結合させ、この三者の結合体における標識シグナルを検出する。あるいは、さらにシグナルを増強させるためには、非標識の二次抗体を先ず抗体+マーカータンパク質結合体に結合させ、この二次抗体に標識物質を結合させるようにしてもよい。このような二次抗体への標識物質の結合は、例えば二次抗体をビオチン化し、標識物質をアビジン化しておくことによって行うことができる。
【0064】
あるいは、免疫組織化学染色法(例えば免疫染色法)又は免疫電顕法のように、マーカータンパク質をin situで検出することも可能である。in situ検出は、被験体から組織学的サンプルを切除し(生検組織サンプル、組織のパラフィン包埋切片など)、それに標識した抗体又は抗体フラグメントを接触させることにより実施しうる。
【0065】
免疫アッセイにおいて使用する抗体を標識するための標識としては、酵素、放射性同位体、蛍光色素又はアビジン−ビオチン系を使用することができる。酵素としては、通常の酵素免疫アッセイ(EIA)に用いられる酵素、例えば、パーオキシダーゼ、β-ガラクトシダーゼ、アルカリフォスファターゼ等を用いることができる。また、酵素阻害物質や補酵素等を用いることもできる。これら酵素と抗体との結合は、マレイミド化合物等の架橋剤を用いる公知の方法によって行うことができる。放射性同位体としては、125Iや3H等の通常のラジオイムノアッセイ(RIA)で用いられているものを使用することができる。蛍光色素としては、フルオレセインイソチオシアネート(FITC)やテトラメチルローダミンイソチオシアネート(TRITC)等の通常の蛍光抗体法に用いられるものを使用することができる。
【0066】
標識シグナルの検出もまた、当技術分野で公知の方法に従って行うことができる。例えば、酵素標識を用いる場合には、酵素作用によって分解して発色する基質を加え、基質の分解量を光学的に測定することによって酵素活性を求め、これを結合抗体量に換算し、標準値との比較から抗体量が算出される。基質は、使用する酵素の種類に応じて異なり、例えば酵素としてパーオキシダーゼを使用する場合には、3,3’,5,5’-テトラメチルベンジジンを、また酵素としてアルカリフォスファターゼを用いる場合には、パラニトロフェノール等を用いることができる。放射性標識を用いる場合には、放射性標識の発する放射線量をシンチレーションカウンター等により測定する。蛍光標識は、例えば蛍光顕微鏡、プレートリーダー、蛍光イメージング装置等を用いて検出及び定量することができる。
【0067】
以上のようにして、被験体由来のサンプル中のマーカータンパク質を検出し、その結果に基づいて被験体における動脈硬化病変を評価することが可能である。
【0068】
本明細書中、「動脈硬化病変の評価」とは、被験体における動脈硬化病変の存在を判定すること、被験体に存在する動脈硬化病変のステージを決定すること、被験体に存在する動脈硬化病変の位置を決定すること、被験体に存在する動脈硬化の治療効果を評価すること、被験体に存在する動脈硬化の予後を予測することを意味する。また本発明において「評価」は、既に評価又は診断された動脈硬化の継続的なモニタリング、及び既に行った動脈硬化の評価又は診断の確認も包含する。
【0069】
また、動脈硬化病変を評価することにより、動脈硬化に関連する疾患、例えば狭心症(安定狭心症など)、急性心筋梗塞、脳梗塞、脳出血、脳血栓、脳塞栓、大動脈瘤、閉塞性動脈硬化症、急性冠症候群などの発症リスクについても評価することが可能である。
【0070】
当業者であれば、本発明の目的である評価は、評価しようとする被験体の全て(すなわち100%)について必ず正しい結果が得られるものではないことを認識している。本発明においては、「評価」は、統計学的に有意な割合の被験体を評価できることを意図しており、統計的に有意な割合は、様々な周知の統計評価ツール、例えば信頼区間の決定、p値の決定、スチューデントのt検定、マン・ホイットニー検定等を用いて決定することができる。好ましい信頼区間は、少なくとも90%である。p値は、好ましくは、0.1、0.01、0.005又は0.0001である。より好ましくは、被験体の少なくとも60%、少なくとも80%又は少なくとも90%を、本発明によって適切に評価することができる。
【0071】
評価を行う際、被験体におけるマーカータンパク質の検出結果を、基準値と比較する。基準値は、健常者サンプルにおけるマーカータンパク質の測定値、特定のステージであるという診断がなされた被験体サンプルにおけるマーカータンパク質の測定値、治療前の被験体サンプルにおけるマーカータンパク質の測定値などである。個々の被験体に適用する基準値は、被験体の種類、年齢、性別などの様々な生理学的パラメータに応じて変化しうる。
【0072】
好ましくは、動脈硬化に罹患した個体群を疾患の進行程度(ステージ)に従って分類し、それぞれのステージに属する個体群と正常状態に属する個体群よりマーカータンパク質の発現量を得て、マーカータンパク質の発現変動と進行ステージとの相関を発現プロファイルデータベースとして記録する。そして、被験体におけるマーカータンパク質の発現量について、予め準備した標準との発現量比を測定し、得られた測定値を発現プロファイルデータベースに参照することができる。このような発現プロファイルデータベースは、被験体の動脈硬化の有無や進行ステージ、動脈硬化の発症又は進行程度の指標となる「基準値」又は「基準範囲」として有用である。基準値は、単一のカットオフ値、例えば平均値や中央値であってもよいし、あるいは特定の範囲、例えば四分位を範囲とするものであってもよい。データベースを利用して評価する場合、例えば、被験体と標準における発現量比R(i)を測定し、そのうち1又は2以上のマーカータンパク質(i=1-N)を測定し、その測定値をデータベース上に記録した各進行ステージにおける値(Rj(i)、jはステージ番号;0-4)と比較して、被験体の動脈硬化の進行ステージを解釈できる。比較は、例えばΣ{R(i)-Rj(i)}2(i=1〜N)が最小となるステージjを求めることなどによって行うことができる。
【0073】
なお、ヒトを被験体として評価を行う場合には、基準値もヒトにおけるマーカータンパク質の測定値であることが好ましいが、マウスなどの実験動物において得られた基準値も外挿することができる。
【0074】
動脈硬化の評価の具体例は次のとおりである。被験体における表1に示されるマーカータンパク質が基準値と比較して上昇していることは、該被験体に中期ステージ以上の動脈硬化病変が存在することを示す。また被験体における表2に示されるマーカータンパク質が基準値と比較して上昇していることは、該被験体に初期ステージ又は初中期ステージ以上の動脈硬化病変が存在することを示す。被験体における表3に示されるマーカータンパク質が基準値と比較して上昇していることは、被験体に後期ステージ以上の動脈硬化病変が存在することを示す。被験体における表4に示されるマーカータンパク質は、他のマーカータンパク質と組み合わせて、その発現の変動を調べることにより、被験体に動脈硬化病変が存在することを示す。
【0075】
さらに本発明の動脈硬化病変の評価方法は、他の公知の動脈硬化の診断方法と組み合わせて行ってもよい。そのような公知の動脈硬化の診断方法としては、動脈硬化の生理学的及び生化学的マーカーの測定(例えば高血圧、コレステロール値、トリグリセリド値)、心電図による測定、動脈脈波伝播速度(PWV:pulse wave velocity)の測定、血管内造影法が挙げられる。
【0076】
また、本発明の動脈硬化病変の評価方法は、他の動脈硬化マーカーと組み合わせることも可能である。例えば、本発明者は、血漿中のフォン・ウィルブランド因子の発現の上昇及び/又は補体因子Dの発現の低減が、初中期ステージの動脈硬化の指標となること、そして血漿中の補体成分C8の発現の上昇及び/又はビタミンK依存性タンパク質Zの発現の上昇が、中期ステージの動脈硬化の指標となることを明らかにしている。さらに、血漿中の動脈硬化マーカーとして、CD5抗原様タンパク質及びIgμ鎖C領域は、初中期ステージにおいて発現の極大を示し、血漿プロテアーゼC1インヒビター、トロンボスポンジン-4、フェツイン-B及び補体因子Hは、初中期ステージ又は中期ステージにおいて発現の極小を示し、ヘパリン補因子2、α-2-マクログロブリン、補体成分C9、ビタミンK依存性タンパク質C、抗トロンビン-III、EGF含有フィブリン様細胞外マトリックスタンパク質1、インターαトリプシンインヒビター重鎖H1、インターαトリプシンインヒビター重鎖H2及びプロパージンはステージの進展と共に発現の減少を示し、補体C1q亜成分サブユニットBはステージの進展と共に発現の増加を示す。従って、上記のような血漿動脈硬化マーカーを、本発明の動脈硬化病変の評価と組み合わせて、さらに高精度に評価を行うことができる。
【0077】
本発明の動脈硬化病変の評価方法によって、動脈硬化の(不安定)病変の存在を早期に判定することができる。すなわち、現在利用可能な診断手法又は基準によっては認識されない不安定な動脈硬化病変の有無を判定することができる。また、動脈硬化病変が存在する場合には、その個々の病変について疾患ステージ及び位置を詳細に特定することができる。そのため、被験体は、狭心症、心筋梗塞、脳梗塞といった動脈硬化関連疾患の治療を的確に、かつ疾患ステージに適切な治療を適時に受けることが可能となる。本発明の方法は、動脈硬化を信頼性をもって、迅速にかつ侵襲性の低い手法で評価できるという利点もある。
【0078】
本発明の動脈硬化病変の評価方法は、上記マーカーを検出するための手段を備えたキット及び/又は装置を用いることによって、容易かつ簡便に行うことができる。
【0079】
本発明に係る動脈硬化病変の評価用キットは、以下の(a)〜(d)群に示されるタンパク質のうち、少なくとも(a)群から選択される少なくとも1種のタンパク質に特異的に結合する少なくとも1種の物質を少なくとも含む:
(a)軟骨オリゴマー基質タンパク質、フィブロモジュリン、フィブロネクチン及びトロンボスポンジン-4;
(b)プラスチン-2、テネイシン、CD5抗原様タンパク質、プロパージン、Cb4結合タンパク質、フィブリノゲンβ鎖及びフィブリノゲンγ鎖;
(c)ビトロネクチン、マトリクス・メタロプロテイナーゼ-2及びトロンボスポンジン-1;
(d)膜結合型イムノグロブリンμ鎖C領域、受容体型チロシンタンパク質ホスファターゼC、イムノグロブリンG-2B鎖-C領域、イムノグロブリンJ鎖、イムノグロブリンκ鎖C領域、血管内皮細胞接着因子-1、α-2-マクログロブリン、ADAMTS様タンパク質-4、カテプシンB、カルボキシペプチダーゼ-B2、補体因子-H、クラスタリン、14型コラーゲン-α-1鎖、上皮型脂肪酸結合タンパク質、マンノース結合レクチン関連セリンプロテアーゼ-2、プロトロンビン、捕体因子-B、インターα-トリプシンインヒビター重鎖-H1、ミオシン-9、ビタミンK依存性因子S、メタロプロプロテアーゼインヒビター3及びトロポミオシンα4。
【0080】
本発明のキットの一例は、マーカータンパク質に特異的に結合する抗体、造影剤又は標識、希釈や洗浄用緩衝液、さらに必要に応じて標識二次抗体、発色・発光・蛍光を生じさせる基質試薬、手順と評価方法を記載した手順書等により構成される。マーカータンパク質の検出を被験体において行う場合には、キットは、投与のための手段、例えばバイアル、アンプル、注射器などを含んでもよい。またマーカータンパク質の検出を被験者由来のサンプルにおいて行う場合には、抗体は、固相支持体(例えば、メンブレン、ビーズ等)に固定されていてもよい。
【0081】
本発明のキットは、本発明の方法を実施するための手順及びプロトコールを記載した説明書、動脈硬化病化の評価において使用する基準値又は基準範囲を示した表などを含んでもよい。
【0082】
本発明のキットに含まれる構成要素は、個別に提供されてもよいし、又は単一の容器内に提供されてもよい。好ましくは、本発明のキットは、本発明の方法を実施するために必要な構成要素の全てを、即時に使用することができるように、例えば調整された濃度の構成要素として含む。
【0083】
本発明に係る動脈硬化病変を評価するための装置は、以下の手段を備える:
(i)被験体における、上記の(a)〜(d)群に示されるタンパク質のうち、少なくとも(a)群から選択される少なくとも1種のタンパク質を検出するための手段;
(ii)(i)の手段により得られる検出結果に基づいて被験体における動脈硬化病変を評価するための手段。
【0084】
また本発明の装置は、さらに
(iii)前記タンパク質についての基準値を保管するための手段;
(iv)被験体におけるタンパク質の検出結果と、該基準値とを比較するための手段
を備えるものであってもよい。
【0085】
本発明の装置は、本発明の方法を実施することができるように、(i)及び(ii)の手段、また好ましくはさらに(iii)及び(iv)の手段、が互いに動作可能なように連結されたシステムである。本発明の装置の概要を図5に示す。
【0086】
(i)の手段は、タンパク質特異的シグナル検知部102(例えば質量分析部分)に続きシグナルを検知して数値化する数値化部104、又は放射活性・発色・発光・蛍光よりシグナルを検知して数値化若しくは画像化する数値化部104若しくは画像化部103を備えたタンパク質検出部101とすることができる。また(ii)の手段は、例えば検出部101から得られる検出結果(画像・数値データ)を保存する画像・数値データ保存部302、及び検出結果を処理するソフトウエア307と計算機部308を備えた動脈硬化病変評価部301とすることができる。好ましい装置は、専門の臨床医の知識がなくても使用することができるものである。具体的な装置は、検出部101(例えば、PET、SPECT、γシンチグラフィー、オートラジオグラフィー、蛍光イメージング、MRI、超音波、CT、バイオセンサー、マーカーに対する抗体を固定合した固相支持体、質量分析装置、表面プラズモン共鳴装置、NMR分析装置等のタンパク質特異的シグナル検知部102を備える)と、評価部301(例えば、画像・数値データ保存部302、基準値データ保存部303、データを分析するデータ比較部304及びデータ分析部305、データ出力・表示部306、並びにソフトウエア307及び計算機部308を駆動するコンピュータユニット等)とを含む。
【0087】
さらに、(iii)の手段は、動脈硬化病態ステージ別発現データ202を備え、場合により動脈組織データ203、血漿データ204及び雌雄差データ205から選択される少なくとも1つを備えていてもよいタンパク質基準値データベース201とすることができる。この基準値データベース201から、手段(ii)の基準値データ保存部303へと必要なデータが取り込まれ、基準値データと、画像・数値データ保存部302のデータとの比較及び分析が行われる。
【0088】
また本発明においては、造影剤の代わりに薬物若しくはプロドラッグなどの化合物又は分子を、マーカータンパク質に特異的に結合する物質に結合させることにより、該化合物又は分子を被験体のマーカータンパク質存在部位、すなわち動脈硬化病変に送達することが可能である。そのような薬物又はプロドラッグとしては、公知の血栓溶解剤(例えばウロキナーゼ、ストレプトキナーゼ、組織型プラスミノーゲン活性化因子)などが含まれる。そのような薬物又はプロドラッグの動脈硬化病変への標的化剤も本発明に包含される。このような標的化剤は、動脈硬化病変に存在するマーカータンパク質と結合して、化合物又は分子(薬物又はプロドラッグなど)を動脈硬化病変に送達することができ、また長い期間にわたり動脈硬化病変内に留まり、長い期間にわたって薬物効果を発揮し続けるという効果を有する。そのため、本発明の標的化剤は、動脈硬化の予防又は治療剤として使用することが可能である。すなわち、本発明の標的化剤の有効量を被験体に投与することにより、該被験体における動脈硬化を予防又は治療することができる。
【0089】
本発明の標的化剤を投与する被験体は、特に限定されるものではなく、哺乳動物、例えばヒト、家畜(ウシ、ブタなど)、愛玩動物(イヌ、ネコなど)、実験動物(マウス、ラット、サルなど)などが含まれる。特に、動脈硬化の存在が疑われる被験体及び動脈硬化を有する被験体に使用することが好ましい。
【0090】
本発明において治療又は予防の対象となる動脈硬化は、限定されるものではなく、動脈硬化、及び動脈硬化に関連する疾患、例えば狭心症(安定狭心症など)、急性心筋梗塞、脳梗塞、脳出血、脳血栓、脳塞栓、大動脈瘤、閉塞性動脈硬化症、急性冠症候群などである。
【0091】
本発明の標的化剤の調製及び投与は、可視化剤について上述したように行うことができ、当業者であれば、標的化剤に含まれる化合物又は分子(薬物又はプロドラッグなど)を考慮して、適宜選択することができる。
【0092】
さらに、上記マーカー又はマーカー群を利用して、動脈硬化の治療薬又は治療法の有効性を評価したり、動脈硬化の治療薬候補をスクリーニングすることができる。具体的には、本発明のそのような方法は、
(i)被験治療薬又は治療法による処置を受けた動脈硬化を有する動物において、マーカータンパク質を検出するステップ、
(ii)(i)の結果に基づいて動脈硬化に対する被験治療薬又は治療法の有効性を評価するステップ
を含む。
【0093】
本発明の方法では、動脈硬化を有する動物、すなわち動脈硬化を発症している又は発症リスクのある動物においてマーカータンパク質を検出する。好ましくは、被験治療薬又は治療法による処置を行う前に、動脈硬化を有する動物においてマーカータンパク質を検出して、処置前に動脈硬化病変のどの疾患ステージであるのかを確認する。動脈硬化を有する動物に被験治療薬又は治療法による処置が行われた後、適当な時期に、その動物におけるマーカータンパク質を検出する。例えば、処置の直後、30分後、1時間後、3時間後、5時間後、10時間後、15時間後、20時間後、24時間(1日)後、2〜10日後、10〜20日後、20〜30日後、1ヶ月〜6ヵ月後に検出を行うこととする。マーカータンパク質の検出、動脈硬化病変の評価については、前記と同様に行うことができる。
【0094】
また本発明により対象となる動物は、動脈硬化病変を有するヒトであってもよいし、あるいは動脈疾患モデル動物、好ましくは動脈硬化モデル実験動物(マウス、ラット、ウサギなど)であってもよい。一般的には、モデル動物において被験治療薬又は治療法の有効性が確認された後に、ヒトにおいて、例えば臨床試験などにより有効性の評価が行われる。
【0095】
評価又はスクリーニングの対象となる被験治療薬又は治療法の種類は特に限定されるものではない。例えば、被験治療薬又は治療法は、任意の物質的因子、具体的には、天然に生じる分子、例えば、アミノ酸、ペプチド、オリゴペプチド、ポリペプチド、タンパク質、核酸、脂質、炭水化物(糖等)、ステロイド、グリコペプチド、糖タンパク質、プロテオグリカンなど;天然に生じる分子の合成アナログ又は誘導体、例えば、ペプチド擬態物、核酸分子(アプタマー、アンチセンス核酸、二本鎖RNA(RNAi)等)など;天然に生じない分子、例えば低分子有機化合物(無機及び有機化合物ライブラリー、又はコンビナトリアルライブラリー等)など;並びにそれらの混合物を挙げることができる。また治療薬又は治療法は、単一物質であってもよいし、複数の物質から構成される複合体や、食品及び食餌等であってもよい。さらに、被験治療薬又は治療法は、上記のような物質的因子に加えて、放射線、紫外線などであってもよい。
【0096】
動物の被験治療薬又は治療法による処置は、その治療薬又は治療法の種類により異なるが、当業者であれば容易に決定することができる。例えば、被験治療薬の投与量、投与期間、投与経路などの投与条件は、当業者であれば適切に決定することができる。
【0097】
また、被験治療薬又は治療法の有効性は、いくつかの条件で検討することも可能である。そのような条件としては、被験治療薬又は治療法で処置する時間又は期間、量(大小)、回数などが挙げられる。例えば、被験治療薬の希釈系列を調製するなどして複数の用量を設定することができる。
【0098】
さらに、複数の被験治療薬又は治療法の相加作用、相乗作用などを検討する場合には、治療薬又は治療法を組み合わせて用いてもよい。
【0099】
被験治療薬又は治療法の処置後の動物におけるマーカータンパク質の存在量及び/又は位置を、処置前の存在量及び/又は位置と比較することによって、被験治療薬又は治療法が、動脈硬化病変(の不安定性)の改善(例えば中期ステージから初中期若しくは初期ステージへの改善)、動脈硬化病変(の不安定性)の進行の停止又は減速化(例えば、何も処置を行わなかった場合と比較して、中期ステージから後期ステージへの進行が停止する)に有効であるか否かを評価することができる。
【0100】
以上から、本発明に係る動脈硬化病変(の不安定性)の治療薬又は治療法の有効性の評価方法により、動脈硬化を治療又は予防するための治療薬又は治療法を見出し、さらには治療薬又は治療法の有効性を確認することができる。動脈硬化病変(の不安定性)は、特に早期段階(初期、初中期のステージ)では何らかの兆候を検知することができないため、ある被験体において初期又は初中期のステージの動脈硬化であると評価し、何らかの処置を行ったとしても、その処置の有効性を評価することが困難である。そのため、本発明の方法は、動脈硬化の早期段階の治療に有効な治療薬又は治療法を同定するために特に有効といえる。
【0101】
上記の方法と同様にして、ある物質又は因子が動脈硬化に及ぼす影響を判定することも可能であり、動脈硬化病変(の不安定性)の進行の原因となる物質又は因子を同定することもできる。
【実施例】
【0102】
以下に実施例を例示し、本発明を具体的に説明するが、この実施例は単に本発明の説明のために提供するものであり、本出願において開示する発明の範囲を限定したり制限したりするものではない。当業者には、本明細書に記載した本発明の発想に基づく様々な実施形態が可能であることは明らかである。
【0103】
[実施例1]
動脈硬化のモデルとして脂質代謝関連ApoEタンパク質を欠損したApoE欠損マウス(ApoED;B6・KOR/StmSlc-Apoeshl)を用いた(Matsushima, Y. et al., J. Atheroscler. Thromb. 8:71-79, 2008; 日本エスエルシー)。このApoEDマウスは高脂肪食投与により病変進行が促進される。また病変は週齢に従って進行し、12週齢では動脈内膜が肥厚し脂質の蓄積が認められる程度であるが(ステージ1)、18週齢では脂質の蓄積により泡沫細胞が形成され(ステージ2)、25週齢になると動脈広範囲に不安定な粥状プラークが多数観察され(ステージ3)、粥状硬化性動脈硬化症の最も危険な段階を迎える。35週齢では繊維化・石灰化の進んだ安定型病変が多く観察される(ステージ4)。
【0104】
そこで本実施例では、12、18、25及び35週齢の野生型マウス(WT;C57BL/6)とApoEDマウス(オス及びメス各5個体)より動脈組織を採取した。WT及びApoEDマウス動脈組織は液体窒素中で粉砕後、可溶化液(9.5M尿素,2%硫酸-3-[(3-コールアミドプロピル)ジメチルアンモニオ]-1-プロパン(CHAPS),65mMジチオトレイトール(DTT), 40mM TrisHCl,pH 8.3)にて可溶化した。12,000rpm、4℃にて20分間遠心分離後、上清を回収し、氷冷アセトン添加によるアセトン沈殿を行ってタンパク質成分を濃縮した。減圧乾固した沈殿を再可溶化液(0.2%ドデシル硫酸ナトリウム(SDS),50mM Tris-HCl,pH 8.5)にて再可溶化し、タンパク質濃度を測定し、同位体標識に供した。
【0105】
動脈組織より抽出したタンパク質画分各1mgを、終濃度6M尿素、0.05%SDS、50mM Tris pH8.5、5mMエチレンジアミン四酢酸(EDTA)、10mMリン酸トリ-n-ブチル(TBP)、それぞれ総容量800μlになるよう調製し、37℃で30分変性処理した。ここに200μlのアセトニトリルで溶解した「Light標識試薬」をWTマウス試料に、「Heavy標識試薬」をApoEDマウス試料に添加して37℃で2時間標識反応を行った。10mM Tris pH8.0緩衝液を800μl添加してpHを調整後、125μg/mlに調製したトリプシン溶液(Trypsin、TPCK Treated; Cat. No.4352157; アプライドバイオ)を160μl添加し、その後両者を等量混合して37℃で16時間トリプシン消化反応を行った。さらに、トリプシン処理して得たペプチド断片をSCXカラム(poly Sulfoethyl A; 4.6 x 100 mm; ポリエルシー)に供して溶出液を25画分に分離した。分離は溶離液A[10mM KH2PO4(pH2.8)、25%アセトニトリル(ACN)]及び溶離液B[10mM KH2PO4(pH2.8)、25%ACN、0.5M KCl]を用い、Bの割合(%)が10分−0%、70分−20%、85分−50%、90分−60%、95分−60%、100分−100%のリニアグラジエントにより行った。各画分はおよその液量が1/4程度になるまで減圧濃縮し、脱塩カラム(CAPCELL C18 MG; 2.0 x 10 mm; 資生堂)にて脱塩後減圧乾固した。脱塩には溶離液A[2%ACN、0.05%トリフルオロ酢酸(TFA)]及び溶離液B(80%ACN、0.05%TFA)を用いた。
【0106】
SCX各画分をそれぞれ質量分析装置と装置付属のLCシステム装置(NanoFrontier LD; 日立ハイテク)を用いて解析した。緩衝液Aを4〜10μl(水:98%、ACN:2%、ギ酸:0.1%)にて上記試料を溶解し、うち1μLを装置に供した。LCシステムの試料分離カラムにはMonoCap for Fast-flow(50μm φx 150mm; C18; GLサイエンス)を用い、緩衝液Aと緩衝液B(水:2%、ACN:98%、ギ酸:0.1%)が120分で緩衝液B 2%〜30%のリニアグラジエント、流量は200nL/minになるよう設定して行った。装置本体のトラップカラムにはMonolith Trap(50μm φx 150mm; Cat. No.C18-50-150; 日立ハイテク)またカラム先端には石英製噴霧チップPicotip(外径360μm、内径50μm、先端内径10μm; ニューオブジェクティブ)を用い、エレクトロスプレーイオン化によるポジティブイオンモードで質量分析を行った。各25画分より得た試料に対し、IBA(Information Based Acqisition)を用いてそれぞれ2回分析を行った。IBAは1回目に測定したターゲット情報(m/z、電荷数、保持時間)を装置内部データベースに保存し、2回目の分析でターゲット情報とは一致しないイオンに対し、分析を実施する手法であるが、これにより微弱なイオンが分析され、同定数を増やすことが期待された。他の装置条件は以下のとおりである:Curtain Gas Flow 0.7L/min; Spray potential 1700V; Detector potential 2200V; Isolation Time 5ms; Isolation Width 10Da; CID Time 10ms。測定データはICAT比較定量用に開発したソフトウエアに供し、WTマウスとApoEDマウスの2群間の比較解析データを得た。
【0107】
その結果、4種類の週齢すべてで発現が確認されたタンパク質は少なくとも568種類であった。動脈組織において、12週齢以降段階的に発現量が増加又は減少する傾向のあるタンパク質を以下の4種類のパターンに分類して、各タンパク質の発現量比を病変の進行ステージに対してプロットした(図1〜4)。12週齢及びそれ以降の週齢で、野生型と比較してApoE欠損マウスで存在量が2倍以上増加するタンパク質は、3種類見出された(パターン1、図1)。12週齢までは有意な存在量の違いはなく、18週齢及びそれ以降の週齢で、野生型と比較してApoE欠損マウスで存在量が2倍以上増加するタンパク質は12種類見出された(パターン2、図2)。18週齢までは有意な存在量の違いはなく、25週齢及びそれ以降の週齢で、野生型と比較してApoE欠損マウスで存在量が2倍以上増加するタンパク質は14種類見出された(パターン3、図3)。25週齢までは有意な存在量の違いはなく、35週齢で、野生型と比較してApoE欠損マウスで存在量が2倍以上増加するタンパク質は7種類見出された(パターン4、図4)。これらのタンパク質群から、さらに動脈硬化病変の進行に関連するマーカータンパク質を以下の基準に従って抽出した。
【0108】
パターン3に属するタンパク質の中から、(i)25週齢において野生型に対するApoE欠損マウスの存在量比(以下「発現量比」と呼ぶ)が3倍以上で、(ii)25週齢の発現量比が18週齢の発現量比の2倍以上であるタンパク質4種類を、中期ステージでプラーク破綻の危険性を示すマーカーとして選別した(表1)。
【0109】
また、パターン1及び2に属するタンパク質の中から、(i)18週齢の発現量比が2倍以上で、(ii)18週齢の発現量比が12週齢の発現量比の1.3倍以上で、(iii)25週齢の発現量比が4倍以上で、(iV)25週齢の発現量比が18週齢の発現量比の1.3倍以上であるタンパク質7種類を、初期から中期ステージでプラークの進展を示すマーカーとして選別した(表2)。
【0110】
また、パターン2及び4に属するタンパク質の中から、(i)35週齢の発現量比が4倍以上で、(ii)35週齢の発現量比が25週齢の2倍以上であるタンパク質3種類を、後期ステージでプラークの安定化を示すマーカーとして選別した(表3)。
【0111】
なお、パターン1から4までに属するタンパク質のうち、表1〜3に選別されていないタンパク質22種類を、動脈硬化病変の進行に関連するその他のマーカー群として、表4にまとめた。
【0112】
[実施例2]
通常食を投与した系統の異なる12週齢のApoEノックアウトマウス(メス)(ApoEKO; B6.129P2-ApoetmlUnc/J)5個体より動脈組織を摘出し、実施例1に記載の方法と同様にタンパク質画分(プール)を調製した。ApoEKOは実施例1に記載のApoEDとは別系統で(Piedrahita, JA. et al., Proc. Natl. Acad. Sci. USA, 89:4471-4475, 1992;日本チャールス・リバー)、事前の予備検討により動脈に病変が形成されていないことを確認した(データは示さない)。被験体の血液中の脂質の濃度は総コレステロール539 mg/dl、トリグリセリド49 mg/dl、LDLコレステロール404 mg/dl、HDLコレステロール143 mg/dlを示し、動脈硬化の進行が疑われた。そこで実施例1に記載の方法を一部改変し、同週齢の野生型マウス(WT;C57BL/6)より得た動脈組織を標準として、組織中に含まれるタンパク質の発現量比を網羅的に解析した。部分的な改変とは、実施例1に記載の方法のうち、実験手順簡略化のためSCXによる分画を25分画のところ、7分画で行ったことによる。
【0113】
その結果、実施例1で同定されたタンパク質と共通なタンパク質が247種類同定された。その中で、実施例1で野生型と比較してApoE欠損マウスで存在量比が2倍以上となったタンパク質群の挙動について検討した。実施例1において12週齢及びそれ以降の週齢で、野生型と比較してApoE欠損マウスで存在量が2倍以上増加する3種類のタンパク質(C4BPA_MOUSE、MUCM_MOUSE、PROP_MOUSE)は、本測定では同定されなかった。実施例1で、18週齢以降で野生型と比較してApoE欠損マウスで存在量が2倍以上増加したタンパク質(計32種類)については、本測定では11種類同定できたが、そのいずれもが野生型と比較したApoE欠損マウスでの存在量の比は1.35倍以下であった。すなわち、本測定における被験体のマウスは動脈硬化の進行ステージとしては12週齢(初期病変)にある可能性が最も大きいと判定され、本発明の有効性が示された。
【0114】
[実施例3]
動脈組織において、実施例1でApoE欠損マウスに特徴的な存在量の変動を示したマーカー候補タンパク質群の中で代表的なタンパク質を10種類選択し、その動脈硬化病変部位における発現を、ApoE欠損マウス各週齢の動脈組織中の病変部位(プラーク形成部位)の免疫組織染色によって確認した。
【0115】
10%ホルマリン固定した大動脈試料を大動脈弓部分で冠状に切り出し、パラフィン包埋ブロックを調製した。その後3μm厚に薄切し、常法に従ってヘマトキシリン・エオジン(H&E)染色及び抗体を用いた組織免疫染色を検討した。組織免疫染色に用いた一次抗体は以下のとおりである。
【0116】
抗プロパージン抗体(50倍希釈、sc68367;サンタクルズ)、
抗CD5抗原様タンパク質抗体(100倍希釈、ab45408;アブカム)、
抗フィブロネクチン抗体(50倍希釈、sc59826;サンタクルズ)、
抗フィブロモジュリン抗体(50倍希釈、sc33772;サンタクルズ)、
抗トロンボスポンジン-4抗体(50倍希釈、sc68367;サンタクルズ)、
抗プラスチン-2抗体(50倍希釈、13025-1-AP;プロテインテック)、
抗ADAMTS様タンパク質-4抗体(50倍希釈、15304-1-AP;プロテインテック)、
抗マトリクス・メタロプロテイナーゼ-2抗体(50倍希釈、BS1236;バイオワールドテクノロジー)、
抗テネイシン抗体(50倍希釈、3118-1;エピトミクス)、
抗軟骨オリゴマー基質タンパク質抗体(50倍希釈、PC-140;カミヤバイオメディカル)。
【0117】
ビオチン標識二次抗体反応後、ジアミノベンジジン(DAB)添加によりシグナルを可視化した。染色標本は顕微鏡(Biozero,BZ-8000;キーエンス)にて観察し、得た画像をデジタルデータとして保存した。
【0118】
図6に抗CD5抗原様タンパク質抗体と抗プロパージン抗体による組織免疫染色の結果を示す。また、図7に抗軟骨オリゴマー基質タンパク質抗体、抗フィブロモジュリン抗体、抗フィブロネクチン抗体及び抗トロンボスポンジン-4抗体による組織免疫染色の結果を示す。さらに、図8に抗プラスチン-2抗体及び抗テネイシン抗体を用いた組織免疫染色の結果を示す。
【0119】
図に示されるように、抗プロパージン抗体、抗CD5抗原様タンパク質抗体、抗プラスチン-2抗体及び抗テネイシン抗体を用いた組織免疫染色では、特に中期ステージの病変部位に高シグナルを検出し、各抗体が認識する標的タンパク質群の病変における発現を確認し、実施例1における質量分析によって得られた結果を支持した(図6及び8)。また、抗フィブロモジュリン抗体、抗フィブロネクチン抗体及び抗トロンボスポンジン-4抗体を用いた組織免疫染色では、特に中期ステージ及び後期ステージの病変部位に高シグナルを検出し、各抗体が認識する標的タンパク質群の病変における発現を確認し、実施例1の結果を支持した(図7)。また、抗軟骨オリゴマー基質タンパク質抗体を用いた組織免疫染色では、後期ステージと比較して中期ステージの病変部位に高いシグナルを検出し、標的タンパク質の病変における発現を確認した(図7)。35週齢動脈組織には後期病変に加えて中期病変も含まれていることから、軟骨オリゴマー基質タンパク質が中期病変に強い発現を示していることは、実施例1の質量分析結果に矛盾していない。さらに、抗マトリクス・メタロプロテイナーゼ-2抗体を用いた組織免疫染色では、特に後期ステージの病変部位に高シグナルを検出し、該抗体が認識する標的タンパク質の病変における発現を確認し、実施例1の結果を支持した。抗ADAMTS様タンパク質-4抗体を用いた組織免疫染色では、ステージの進展と共にシグナルの上昇が観察され、これらの抗体が認識する標的タンパク質の病変における発現を確認し、実施例1の結果を支持した。
【0120】
以上から、野生型マウスとApoE欠損マウスにおける当該タンパク質の存在量の比は動脈硬化病変における当該タンパク質の存在量と高い相関を有していることを確認した(図6〜図8)。
【0121】
[実施例4]
動脈硬化モデルのWHHLウサギは月齢に従って進行程度の異なる動脈硬化病変を形成する。本実施例では7カ月齢と13カ月齢のWHHLウサギ(オス、北山ラベス)を用い、99mテクネシウム標識した抗プロパージン抗体と125ヨウ素標識した抗CD5L抗体を混合してウサギの耳静脈より投与し(麻酔下)、両者のシグナルが病変にどのように集積するかを検討した。投与後6時間後のシグナル集積を、動物用SPECT装置(R1;日立製作所)を用いて可視化した。
【0122】
7カ月齢のWHHLウサギでは抗プロパージン抗体由来のシグナルのみ検出されるが、13カ月齢のWHHLウサギでは抗プロパージン抗体、抗CD5L抗体由来のシグナルが胸部大動脈弓を中心に検出される。一方、同月齢の野生型のウサギ(日本白色種;北山ラベス)では両者のシグナルは検出されない。
【産業上の利用可能性】
【0123】
本発明により、動脈硬化症の発症の有無とその進行を評価する技術が提供される。本発明により、動脈硬化の有無、その状態又は進行の程度、及び位置を高精度かつ簡便に判定することができる。また、本発明により、動脈硬化の予防及び/又は治療に有用な薬剤のスクリーニング方法が提供される。従って本発明は、動脈硬化の診断、予防及び/又は治療の分野で有用である。
【特許請求の範囲】
【請求項1】
以下の(a)〜(d)群に示されるタンパク質のうち、少なくとも(a)群から選択される少なくとも1種のタンパク質に特異的に結合する少なくとも1種の物質を含むことを特徴とする動脈硬化病変の評価用キット。
(a)軟骨オリゴマー基質タンパク質、フィブロモジュリン、フィブロネクチン及びトロンボスポンジン-4;
(b)プラスチン-2、テネイシン、CD5抗原様タンパク質、プロパージン、Cb4結合タンパク質、フィブリノゲンβ鎖及びフィブリノゲンγ鎖;
(c)ビトロネクチン、マトリクス・メタロプロテイナーゼ-2及びトロンボスポンジン-1;
(d)膜結合型イムノグロブリンμ鎖C領域、受容体型チロシンタンパク質ホスファターゼC、イムノグロブリンG-2B鎖-C領域、イムノグロブリンJ鎖、イムノグロブリンκ鎖C領域、血管内皮細胞接着因子-1、α-2-マクログロブリン、ADAMTS様タンパク質-4、カテプシンB、カルボキシペプチダーゼ-B2、補体因子-H、クラスタリン、14型コラーゲン-α-1鎖、上皮型脂肪酸結合タンパク質、マンノース結合レクチン関連セリンプロテアーゼ-2、プロトロンビン、捕体因子-B、インターα-トリプシンインヒビター重鎖-H1、ミオシン-9、ビタミンK依存性因子S、メタロプロプロテアーゼインヒビター3及びトロポミオシンα4
【請求項2】
(a)群から選択されるタンパク質と、(b)〜(d)群の少なくとも1つの群から選択されるタンパク質に特異的に結合する少なくとも2種の物質を含む、請求項1に記載のキット。
【請求項3】
(a)群から選択されるタンパク質と、(b)〜(d)群の少なくとも2つの群から選択されるタンパク質に特異的に結合する少なくとも3種の物質を含む、請求項1に記載のキット。
【請求項4】
(a)群から選択されるタンパク質と、(b)〜(d)群の各群から選択されるタンパク質に特異的に結合する少なくとも4種の物質を含む、請求項1に記載のキット。
【請求項5】
軟骨オリゴマー基質タンパク質、フィブロモジュリン、フィブロネクチン及びトロンボスポンジン-4からなる群より選択される少なくとも1種のタンパク質に特異的に結合する少なくとも1種の物質を含み、中期ステージ以上の動脈硬化病変について評価するための動脈硬化病変の評価用キット。
【請求項6】
プラスチン-2、テネイシン、CD5抗原様タンパク質、プロパージン、Cb4結合タンパク質、フィブリノゲンβ鎖及びフィブリノゲンγ鎖からなる群より選択される少なくとも1種のタンパク質に特異的に結合する少なくとも1種の物質を含み、初期又は中期ステージの動脈硬化病変について評価するための動脈硬化病変の評価用キット。
【請求項7】
ビトロネクチン、マトリクス・メタロプロテイナーゼ-2及びトロンボスポンジン-1からなる群より選択される少なくとも1種のタンパク質に特異的に結合する少なくとも1種の物質を含み、後期ステージの動脈硬化病変について評価するための動脈硬化病変の評価用キット。
【請求項8】
動脈硬化病変の評価が、被験体における動脈硬化病変の存在の判定、被験体に存在する動脈硬化病変のステージの決定、被験体に存在する動脈硬化病変の位置の決定、被験体に存在する動脈硬化の治療効果の評価、及び被験体に存在する動脈硬化の予後の予測からなる群より選択される、請求項1〜7のいずれか1項に記載のキット。
【請求項9】
タンパク質に特異的に結合する物質が、抗体、抗体様分子、核酸アプタマー、リガンド及び基質からなる群より選択される、請求項1〜8のいずれか1項に記載のキット。
【請求項10】
タンパク質に特異的に結合する物質が造影剤と結合されている、請求項1〜9のいずれか1項に記載のキット。
【請求項11】
造影剤が、蛍光物質、発光物質、放射性物質、リポソーム、ミセル、細胞、ウイルス粒子、ウイルス、マイクロ粒子、ナノ粒子、室のあるマイクロデバイス、エマルジョン、脂質ディスク、ポリマー、ガドリニウム結合分子、超常磁性酸化鉄粒子、ペルフルオロカーボンナノ粒子、及び超微粒気泡からなる群より選択される、請求項10に記載のキット。
【請求項12】
動脈硬化病変が、ポジトロン断層撮影(PET)、単一光子放射断層撮影(SPECT)、γシンチグラフィー、オートラジオグラフィー、蛍光イメージング、磁気共鳴画像(MRI)、超音波、及びコンピュータ断層撮影(CT)からなる群より選択される手段により可視化される、請求項10又は11に記載のキット。
【請求項13】
動脈硬化病変を評価するための装置であって、
(i)被験体における、以下の(a)〜(d)群に示されるタンパク質のうち、少なくとも(a)群から選択される少なくとも1種のタンパク質を検出するための手段:
(a)軟骨オリゴマー基質タンパク質、フィブロモジュリン、フィブロネクチン及びトロンボスポンジン-4;
(b)プラスチン-2、テネイシン、CD5抗原様タンパク質、プロパージン、Cb4結合タンパク質、フィブリノゲンβ鎖及びフィブリノゲンγ鎖;
(c)ビトロネクチン、マトリクス・メタロプロテイナーゼ-2及びトロンボスポンジン-1;
(d)膜結合型イムノグロブリンμ鎖C領域、受容体型チロシンタンパク質ホスファターゼC、イムノグロブリンG-2B鎖-C領域、イムノグロブリンJ鎖、イムノグロブリンκ鎖C領域、血管内皮細胞接着因子-1、α-2-マクログロブリン、ADAMTS様タンパク質-4、カテプシンB、カルボキシペプチダーゼ-B2、補体因子-H、クラスタリン、14型コラーゲン-α-1鎖、上皮型脂肪酸結合タンパク質、マンノース結合レクチン関連セリンプロテアーゼ-2、プロトロンビン、捕体因子-B、インターα-トリプシンインヒビター重鎖-H1、ミオシン-9、ビタミンK依存性因子S、メタロプロプロテアーゼインヒビター3及びトロポミオシンα4;
(ii)(i)の手段により得られる検出結果に基づいて被験体における動脈硬化病変を評価するための手段
を備えた装置。
【請求項14】
(iii)前記タンパク質についての基準値を保管するための手段;
(iv)被験体におけるタンパク質の検出結果と、該基準値とを比較するための手段
をさらに備える、請求項13に記載の装置。
【請求項15】
以下の(a)〜(d)群に示されるタンパク質のうち、少なくとも(a)群から選択される少なくとも1種のタンパク質とそれと結合した造影剤とを含むことを特徴とする、動脈硬化病変の可視化剤。
(a)軟骨オリゴマー基質タンパク質、フィブロモジュリン、フィブロネクチン及びトロンボスポンジン-4;
(b)プラスチン-2、テネイシン、CD5抗原様タンパク質、プロパージン、Cb4結合タンパク質、フィブリノゲンβ鎖及びフィブリノゲンγ鎖;
(c)ビトロネクチン、マトリクス・メタロプロテイナーゼ-2及びトロンボスポンジン-1;
(d)膜結合型イムノグロブリンμ鎖C領域、受容体型チロシンタンパク質ホスファターゼC、イムノグロブリンG-2B鎖-C領域、イムノグロブリンJ鎖、イムノグロブリンκ鎖C領域、血管内皮細胞接着因子-1、α-2-マクログロブリン、ADAMTS様タンパク質-4、カテプシンB、カルボキシペプチダーゼ-B2、補体因子-H、クラスタリン、14型コラーゲン-α-1鎖、上皮型脂肪酸結合タンパク質、マンノース結合レクチン関連セリンプロテアーゼ-2、プロトロンビン、捕体因子-B、インターα-トリプシンインヒビター重鎖-H1、ミオシン-9、ビタミンK依存性因子S、メタロプロプロテアーゼインヒビター3及びトロポミオシンα4
【請求項16】
軟骨オリゴマー基質タンパク質、フィブロモジュリン、フィブロネクチン及びトロンボスポンジン-4からなる群より選択される少なくとも1種のタンパク質に特異的に結合する少なくとも1種の物質と、それと結合した造影剤とを含むことを特徴とする、中期ステージ以上の動脈硬化病変の可視化剤。
【請求項17】
プラスチン-2、テネイシン、CD5抗原様タンパク質、プロパージン、Cb4結合タンパク質、フィブリノゲンβ鎖及びフィブリノゲンγ鎖からなる群より選択される少なくとも1種のタンパク質に特異的に結合する少なくとも1種の物質と、それと結合した造影剤とを含むことを特徴とする、初期又は中期ステージの動脈硬化病変の可視化剤。
【請求項18】
ビトロネクチン、マトリクス・メタロプロテイナーゼ-2及びトロンボスポンジン-1からなる群より選択される少なくとも1種のタンパク質に特異的に結合する少なくとも1種の物質と、それと結合した造影剤とを含むことを特徴とする、後期ステージの動脈硬化病変の可視化剤。
【請求項19】
以下の(a)〜(d)群のうち、少なくとも(a)群から選択される少なくとも1種のタンパク質に特異的に結合する物質と、それと結合した化合物又は分子とを含むことを特徴とする、動脈硬化病変への化合物又は分子の標的化剤。
(a)軟骨オリゴマー基質タンパク質、フィブロモジュリン、フィブロネクチン及びトロンボスポンジン-4;
(b)プラスチン-2、テネイシン、CD5抗原様タンパク質、プロパージン、Cb4結合タンパク質、フィブリノゲンβ鎖及びフィブリノゲンγ鎖;
(c)ビトロネクチン、マトリクス・メタロプロテイナーゼ-2及びトロンボスポンジン-1;
(d)膜結合型イムノグロブリンμ鎖C領域、受容体型チロシンタンパク質ホスファターゼC、イムノグロブリンG-2B鎖-C領域、イムノグロブリンJ鎖、イムノグロブリンκ鎖C領域、血管内皮細胞接着因子-1、α-2-マクログロブリン、ADAMTS様タンパク質-4、カテプシンB、カルボキシペプチダーゼ-B2、補体因子-H、クラスタリン、14型コラーゲン-α-1鎖、上皮型脂肪酸結合タンパク質、マンノース結合レクチン関連セリンプロテアーゼ-2、プロトロンビン、捕体因子-B、インターα-トリプシンインヒビター重鎖-H1、ミオシン-9、ビタミンK依存性因子S、メタロプロプロテアーゼインヒビター3及びトロポミオシンα4
【請求項20】
化合物又は分子が血栓溶解剤である、請求項19に記載の標的化剤。
【請求項21】
動脈硬化病変の治療薬又は治療法の有効性の評価方法であって、
(i)被験治療薬又は治療法による処置を受けた動脈硬化病変を有する動物において、以下の(a)〜(d)群に示されるタンパク質のうち、少なくとも(a)群から選択される少なくとも1種のタンパク質を検出するステップ:
(a)軟骨オリゴマー基質タンパク質、フィブロモジュリン、フィブロネクチン及びトロンボスポンジン-4;
(b)プラスチン-2、テネイシン、CD5抗原様タンパク質、プロパージン、Cb4結合タンパク質、フィブリノゲンβ鎖及びフィブリノゲンγ鎖;
(c)ビトロネクチン、マトリクス・メタロプロテイナーゼ-2及びトロンボスポンジン-1;
(d)膜結合型イムノグロブリンμ鎖C領域、受容体型チロシンタンパク質ホスファターゼC、イムノグロブリンG-2B鎖-C領域、イムノグロブリンJ鎖、イムノグロブリンκ鎖C領域、血管内皮細胞接着因子-1、α-2-マクログロブリン、ADAMTS様タンパク質-4、カテプシンB、カルボキシペプチダーゼ-B2、補体因子-H、クラスタリン、14型コラーゲン-α-1鎖、上皮型脂肪酸結合タンパク質、マンノース結合レクチン関連セリンプロテアーゼ-2、プロトロンビン、捕体因子-B、インターα-トリプシンインヒビター重鎖-H1、ミオシン-9、ビタミンK依存性因子S、メタロプロプロテアーゼインヒビター3及びトロポミオシンα4;
(ii)(i)の結果に基づいて動脈硬化病変に対する被験治療薬又は治療法の有効性を評価するステップ
を含む方法。
【請求項22】
被験治療薬又は治療法による処置を行う前に、動脈硬化病変を有する動物において、前記タンパク質を検出するステップをさらに含む、請求項21に記載の方法。
【請求項23】
動脈硬化病変を有する動物が動脈疾患モデル動物である、請求項21又は22に記載の方法。
【請求項1】
以下の(a)〜(d)群に示されるタンパク質のうち、少なくとも(a)群から選択される少なくとも1種のタンパク質に特異的に結合する少なくとも1種の物質を含むことを特徴とする動脈硬化病変の評価用キット。
(a)軟骨オリゴマー基質タンパク質、フィブロモジュリン、フィブロネクチン及びトロンボスポンジン-4;
(b)プラスチン-2、テネイシン、CD5抗原様タンパク質、プロパージン、Cb4結合タンパク質、フィブリノゲンβ鎖及びフィブリノゲンγ鎖;
(c)ビトロネクチン、マトリクス・メタロプロテイナーゼ-2及びトロンボスポンジン-1;
(d)膜結合型イムノグロブリンμ鎖C領域、受容体型チロシンタンパク質ホスファターゼC、イムノグロブリンG-2B鎖-C領域、イムノグロブリンJ鎖、イムノグロブリンκ鎖C領域、血管内皮細胞接着因子-1、α-2-マクログロブリン、ADAMTS様タンパク質-4、カテプシンB、カルボキシペプチダーゼ-B2、補体因子-H、クラスタリン、14型コラーゲン-α-1鎖、上皮型脂肪酸結合タンパク質、マンノース結合レクチン関連セリンプロテアーゼ-2、プロトロンビン、捕体因子-B、インターα-トリプシンインヒビター重鎖-H1、ミオシン-9、ビタミンK依存性因子S、メタロプロプロテアーゼインヒビター3及びトロポミオシンα4
【請求項2】
(a)群から選択されるタンパク質と、(b)〜(d)群の少なくとも1つの群から選択されるタンパク質に特異的に結合する少なくとも2種の物質を含む、請求項1に記載のキット。
【請求項3】
(a)群から選択されるタンパク質と、(b)〜(d)群の少なくとも2つの群から選択されるタンパク質に特異的に結合する少なくとも3種の物質を含む、請求項1に記載のキット。
【請求項4】
(a)群から選択されるタンパク質と、(b)〜(d)群の各群から選択されるタンパク質に特異的に結合する少なくとも4種の物質を含む、請求項1に記載のキット。
【請求項5】
軟骨オリゴマー基質タンパク質、フィブロモジュリン、フィブロネクチン及びトロンボスポンジン-4からなる群より選択される少なくとも1種のタンパク質に特異的に結合する少なくとも1種の物質を含み、中期ステージ以上の動脈硬化病変について評価するための動脈硬化病変の評価用キット。
【請求項6】
プラスチン-2、テネイシン、CD5抗原様タンパク質、プロパージン、Cb4結合タンパク質、フィブリノゲンβ鎖及びフィブリノゲンγ鎖からなる群より選択される少なくとも1種のタンパク質に特異的に結合する少なくとも1種の物質を含み、初期又は中期ステージの動脈硬化病変について評価するための動脈硬化病変の評価用キット。
【請求項7】
ビトロネクチン、マトリクス・メタロプロテイナーゼ-2及びトロンボスポンジン-1からなる群より選択される少なくとも1種のタンパク質に特異的に結合する少なくとも1種の物質を含み、後期ステージの動脈硬化病変について評価するための動脈硬化病変の評価用キット。
【請求項8】
動脈硬化病変の評価が、被験体における動脈硬化病変の存在の判定、被験体に存在する動脈硬化病変のステージの決定、被験体に存在する動脈硬化病変の位置の決定、被験体に存在する動脈硬化の治療効果の評価、及び被験体に存在する動脈硬化の予後の予測からなる群より選択される、請求項1〜7のいずれか1項に記載のキット。
【請求項9】
タンパク質に特異的に結合する物質が、抗体、抗体様分子、核酸アプタマー、リガンド及び基質からなる群より選択される、請求項1〜8のいずれか1項に記載のキット。
【請求項10】
タンパク質に特異的に結合する物質が造影剤と結合されている、請求項1〜9のいずれか1項に記載のキット。
【請求項11】
造影剤が、蛍光物質、発光物質、放射性物質、リポソーム、ミセル、細胞、ウイルス粒子、ウイルス、マイクロ粒子、ナノ粒子、室のあるマイクロデバイス、エマルジョン、脂質ディスク、ポリマー、ガドリニウム結合分子、超常磁性酸化鉄粒子、ペルフルオロカーボンナノ粒子、及び超微粒気泡からなる群より選択される、請求項10に記載のキット。
【請求項12】
動脈硬化病変が、ポジトロン断層撮影(PET)、単一光子放射断層撮影(SPECT)、γシンチグラフィー、オートラジオグラフィー、蛍光イメージング、磁気共鳴画像(MRI)、超音波、及びコンピュータ断層撮影(CT)からなる群より選択される手段により可視化される、請求項10又は11に記載のキット。
【請求項13】
動脈硬化病変を評価するための装置であって、
(i)被験体における、以下の(a)〜(d)群に示されるタンパク質のうち、少なくとも(a)群から選択される少なくとも1種のタンパク質を検出するための手段:
(a)軟骨オリゴマー基質タンパク質、フィブロモジュリン、フィブロネクチン及びトロンボスポンジン-4;
(b)プラスチン-2、テネイシン、CD5抗原様タンパク質、プロパージン、Cb4結合タンパク質、フィブリノゲンβ鎖及びフィブリノゲンγ鎖;
(c)ビトロネクチン、マトリクス・メタロプロテイナーゼ-2及びトロンボスポンジン-1;
(d)膜結合型イムノグロブリンμ鎖C領域、受容体型チロシンタンパク質ホスファターゼC、イムノグロブリンG-2B鎖-C領域、イムノグロブリンJ鎖、イムノグロブリンκ鎖C領域、血管内皮細胞接着因子-1、α-2-マクログロブリン、ADAMTS様タンパク質-4、カテプシンB、カルボキシペプチダーゼ-B2、補体因子-H、クラスタリン、14型コラーゲン-α-1鎖、上皮型脂肪酸結合タンパク質、マンノース結合レクチン関連セリンプロテアーゼ-2、プロトロンビン、捕体因子-B、インターα-トリプシンインヒビター重鎖-H1、ミオシン-9、ビタミンK依存性因子S、メタロプロプロテアーゼインヒビター3及びトロポミオシンα4;
(ii)(i)の手段により得られる検出結果に基づいて被験体における動脈硬化病変を評価するための手段
を備えた装置。
【請求項14】
(iii)前記タンパク質についての基準値を保管するための手段;
(iv)被験体におけるタンパク質の検出結果と、該基準値とを比較するための手段
をさらに備える、請求項13に記載の装置。
【請求項15】
以下の(a)〜(d)群に示されるタンパク質のうち、少なくとも(a)群から選択される少なくとも1種のタンパク質とそれと結合した造影剤とを含むことを特徴とする、動脈硬化病変の可視化剤。
(a)軟骨オリゴマー基質タンパク質、フィブロモジュリン、フィブロネクチン及びトロンボスポンジン-4;
(b)プラスチン-2、テネイシン、CD5抗原様タンパク質、プロパージン、Cb4結合タンパク質、フィブリノゲンβ鎖及びフィブリノゲンγ鎖;
(c)ビトロネクチン、マトリクス・メタロプロテイナーゼ-2及びトロンボスポンジン-1;
(d)膜結合型イムノグロブリンμ鎖C領域、受容体型チロシンタンパク質ホスファターゼC、イムノグロブリンG-2B鎖-C領域、イムノグロブリンJ鎖、イムノグロブリンκ鎖C領域、血管内皮細胞接着因子-1、α-2-マクログロブリン、ADAMTS様タンパク質-4、カテプシンB、カルボキシペプチダーゼ-B2、補体因子-H、クラスタリン、14型コラーゲン-α-1鎖、上皮型脂肪酸結合タンパク質、マンノース結合レクチン関連セリンプロテアーゼ-2、プロトロンビン、捕体因子-B、インターα-トリプシンインヒビター重鎖-H1、ミオシン-9、ビタミンK依存性因子S、メタロプロプロテアーゼインヒビター3及びトロポミオシンα4
【請求項16】
軟骨オリゴマー基質タンパク質、フィブロモジュリン、フィブロネクチン及びトロンボスポンジン-4からなる群より選択される少なくとも1種のタンパク質に特異的に結合する少なくとも1種の物質と、それと結合した造影剤とを含むことを特徴とする、中期ステージ以上の動脈硬化病変の可視化剤。
【請求項17】
プラスチン-2、テネイシン、CD5抗原様タンパク質、プロパージン、Cb4結合タンパク質、フィブリノゲンβ鎖及びフィブリノゲンγ鎖からなる群より選択される少なくとも1種のタンパク質に特異的に結合する少なくとも1種の物質と、それと結合した造影剤とを含むことを特徴とする、初期又は中期ステージの動脈硬化病変の可視化剤。
【請求項18】
ビトロネクチン、マトリクス・メタロプロテイナーゼ-2及びトロンボスポンジン-1からなる群より選択される少なくとも1種のタンパク質に特異的に結合する少なくとも1種の物質と、それと結合した造影剤とを含むことを特徴とする、後期ステージの動脈硬化病変の可視化剤。
【請求項19】
以下の(a)〜(d)群のうち、少なくとも(a)群から選択される少なくとも1種のタンパク質に特異的に結合する物質と、それと結合した化合物又は分子とを含むことを特徴とする、動脈硬化病変への化合物又は分子の標的化剤。
(a)軟骨オリゴマー基質タンパク質、フィブロモジュリン、フィブロネクチン及びトロンボスポンジン-4;
(b)プラスチン-2、テネイシン、CD5抗原様タンパク質、プロパージン、Cb4結合タンパク質、フィブリノゲンβ鎖及びフィブリノゲンγ鎖;
(c)ビトロネクチン、マトリクス・メタロプロテイナーゼ-2及びトロンボスポンジン-1;
(d)膜結合型イムノグロブリンμ鎖C領域、受容体型チロシンタンパク質ホスファターゼC、イムノグロブリンG-2B鎖-C領域、イムノグロブリンJ鎖、イムノグロブリンκ鎖C領域、血管内皮細胞接着因子-1、α-2-マクログロブリン、ADAMTS様タンパク質-4、カテプシンB、カルボキシペプチダーゼ-B2、補体因子-H、クラスタリン、14型コラーゲン-α-1鎖、上皮型脂肪酸結合タンパク質、マンノース結合レクチン関連セリンプロテアーゼ-2、プロトロンビン、捕体因子-B、インターα-トリプシンインヒビター重鎖-H1、ミオシン-9、ビタミンK依存性因子S、メタロプロプロテアーゼインヒビター3及びトロポミオシンα4
【請求項20】
化合物又は分子が血栓溶解剤である、請求項19に記載の標的化剤。
【請求項21】
動脈硬化病変の治療薬又は治療法の有効性の評価方法であって、
(i)被験治療薬又は治療法による処置を受けた動脈硬化病変を有する動物において、以下の(a)〜(d)群に示されるタンパク質のうち、少なくとも(a)群から選択される少なくとも1種のタンパク質を検出するステップ:
(a)軟骨オリゴマー基質タンパク質、フィブロモジュリン、フィブロネクチン及びトロンボスポンジン-4;
(b)プラスチン-2、テネイシン、CD5抗原様タンパク質、プロパージン、Cb4結合タンパク質、フィブリノゲンβ鎖及びフィブリノゲンγ鎖;
(c)ビトロネクチン、マトリクス・メタロプロテイナーゼ-2及びトロンボスポンジン-1;
(d)膜結合型イムノグロブリンμ鎖C領域、受容体型チロシンタンパク質ホスファターゼC、イムノグロブリンG-2B鎖-C領域、イムノグロブリンJ鎖、イムノグロブリンκ鎖C領域、血管内皮細胞接着因子-1、α-2-マクログロブリン、ADAMTS様タンパク質-4、カテプシンB、カルボキシペプチダーゼ-B2、補体因子-H、クラスタリン、14型コラーゲン-α-1鎖、上皮型脂肪酸結合タンパク質、マンノース結合レクチン関連セリンプロテアーゼ-2、プロトロンビン、捕体因子-B、インターα-トリプシンインヒビター重鎖-H1、ミオシン-9、ビタミンK依存性因子S、メタロプロプロテアーゼインヒビター3及びトロポミオシンα4;
(ii)(i)の結果に基づいて動脈硬化病変に対する被験治療薬又は治療法の有効性を評価するステップ
を含む方法。
【請求項22】
被験治療薬又は治療法による処置を行う前に、動脈硬化病変を有する動物において、前記タンパク質を検出するステップをさらに含む、請求項21に記載の方法。
【請求項23】
動脈硬化病変を有する動物が動脈疾患モデル動物である、請求項21又は22に記載の方法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【公開番号】特開2012−108150(P2012−108150A)
【公開日】平成24年6月7日(2012.6.7)
【国際特許分類】
【出願番号】特願2012−28084(P2012−28084)
【出願日】平成24年2月13日(2012.2.13)
【分割の表示】特願2010−257065(P2010−257065)の分割
【原出願日】平成22年11月17日(2010.11.17)
【出願人】(000005108)株式会社日立製作所 (27,607)
【出願人】(504173471)国立大学法人北海道大学 (971)
【Fターム(参考)】
【公開日】平成24年6月7日(2012.6.7)
【国際特許分類】
【出願日】平成24年2月13日(2012.2.13)
【分割の表示】特願2010−257065(P2010−257065)の分割
【原出願日】平成22年11月17日(2010.11.17)
【出願人】(000005108)株式会社日立製作所 (27,607)
【出願人】(504173471)国立大学法人北海道大学 (971)
【Fターム(参考)】
[ Back to top ]

