匂いセンサ
【課題】対象となる匂い物質を検出でき、かつ長期間使用可能な匂いセンサを提供する。
【解決手段】基板3上に設けられた容器4に、昆虫の嗅覚受容体タンパク質及び蛍光タンパク質を共発現しているスポドプテラ・フルギペルダ(Spodoptera frugiperda)細胞であって、検出対象となる匂い物質を含む試料を接触させることによって前記細胞内イオン濃度の変化に基づいて光を発する細胞を保持してなる、細胞チップと、前記光を検出すると信号を出力するセンサ12と、前記信号に基づいて前記匂い物質を検出する判定器13と、を有する、匂いセンサ。
【解決手段】基板3上に設けられた容器4に、昆虫の嗅覚受容体タンパク質及び蛍光タンパク質を共発現しているスポドプテラ・フルギペルダ(Spodoptera frugiperda)細胞であって、検出対象となる匂い物質を含む試料を接触させることによって前記細胞内イオン濃度の変化に基づいて光を発する細胞を保持してなる、細胞チップと、前記光を検出すると信号を出力するセンサ12と、前記信号に基づいて前記匂い物質を検出する判定器13と、を有する、匂いセンサ。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、昆虫の嗅覚受容体タンパク質を遺伝子工学により再構成した培養細胞を用いる匂いセンサに関する。
【背景技術】
【0002】
近年、昆虫の匂い受容、識別の分子・神経機構の解析が進み、昆虫の高感度かつ高識別能な匂い識別の仕組みが明らかになりつつあり、昆虫の嗅覚機能を人工的に再現することが可能となっている。昆虫は、匂い物質に対する応答選択性の異なる複数のセンサ細胞の応答パターンの組み合わせにより、匂い物質を識別している。センサ細胞の匂い応答特性は、個々の細胞で合成される嗅覚受容体タンパク質の特性により決定されることから(例えば、非特許文献1、2参照)、匂い物質の情報は嗅覚受容体の応答パターンの組み合わせとして表現されることになる。
【0003】
このような昆虫の嗅覚受容体の機能を利用したセンサとして、本発明者らは、昆虫の嗅覚受容体タンパク質を導入したアフリカツメガエル卵母細胞をセンサ素子とした匂いセンサを報告している(例えば、非特許文献3参照)。当該センサは、導入した嗅覚受容体が応答する匂い物質を高感度かつ高選択的に検出することができる。しかしながら、当該センサでは、アフリカツメガエル卵母細胞の性質上、安定して測定可能な期間が半日程度に限定され、培養に厳密な温度制御を要するという問題点がある。また、応答の検出が電気生理学的手法に限られるため、同時に多数の細胞から測定することが困難であり、細胞間のばらつきを補正することが難しいとの問題点もある。
【先行技術文献】
【非特許文献】
【0004】
【非特許文献1】Dobritsa et al., Neuron, 37, pp. 827-841, 2003
【非特許文献2】Hallem & Carlson, Cell, 125, pp. 143-160, 2006
【非特許文献3】Misawa N, et al., (2010) Proc Natl Acad Sci USA 107: pp. 15340-15344
【発明の概要】
【発明が解決しようとする課題】
【0005】
従って、本発明では、長期間使用可能な、対象となる匂い物質を検出する匂いセンサを提供することを目的とする。
【課題を解決するための手段】
【0006】
本発明者らは、斯かる現状に鑑み鋭意検討した結果、遺伝子工学技術により、検出対象となる匂い物質に対する昆虫の嗅覚受容体タンパク質を安定的に発現しかつ匂い物質を受容することにより光を発する昆虫培養細胞を構築し、そして、当該細胞と、当該細胞を保持してなる基板と、光を検出して信号を出力するセンサとを組み合わせた匂いセンサが、上記課題を解決できることを見出し、本発明を完成した。
すなわち、本発明は、基板上に設けられた容器に、昆虫の嗅覚受容体タンパク質及び蛍光タンパク質を共発現しているスポドプテラ・フルギペルダ(Spodoptera frugiperda)細胞であって、検出対象となる匂い物質を含む試料を接触させることによって前記細胞内イオン濃度の変化に基づいて光を発する細胞を保持してなる、細胞チップと、前記光を検出すると信号を出力するセンサと、前記信号に基づいて前記匂い物質を検出する判定器と、を有する、匂いセンサを提供する。
【0007】
本発明の一つの実施形態によれば、前記匂いセンサにおいて、前記容器は複数個存在し、その複数個の容器の各々に保持された前記細胞は、検出対象となる異なった種類の匂い物質に対して互いに異なった昆虫の嗅覚受容体タンパク質を発現し、かつ前記匂い物質を含む試料を前記複数個の容器の各々に接触させることによって光を発し、前記センサは、前記複数個の容器の各々における光を検出すると信号を出力し、前記判定器は、前記各信号に基づいて異なった種類の匂い物質を検出する。
【0008】
本発明の別の実施形態によれば、前記匂いセンサにおいて、前記出力するセンサが光の強度に応じた信号を出力し、かつ、前記判定器が前記信号の強度に基づいて前記匂い物質を検出する。
【0009】
本発明の別の実施形態によれば、前記匂いセンサにおいて、前記細胞チップは、前記容器中を細胞培養液を流下させる手段をさらに有する。
【0010】
本発明の別の実施形態によれば、前記匂いセンサにおいて、前記蛍光タンパク質は、カルシウム感受性蛍光タンパク質である。
【0011】
本発明のさらに別の実施形態によれば、前記匂いセンサにおいて、前記カルシウム感受性蛍光タンパク質はGCaMP3である。
【発明の効果】
【0012】
本発明の匂いセンサによれば、長期間安定して対象となる匂い物質を検出できる。
【図面の簡単な説明】
【0013】
【図1】図1は、本発明の匂いセンサの1実施態様を示す図である。
【図2】図2は、蛍光タンパク質遺伝子を組み込んだベクターを示す図である。
【図3】図3は、Or83bファミリータンパク質遺伝子、及び昆虫の嗅覚受容体タンパク質遺伝子を組み込んだベクターを示す図である。
【図4】図4は、蛍光画像の模式図を示す。
【図5】図5は、昆虫の嗅覚受容体タンパク質を導入したSf21細胞の匂い応答の結果を示す図である。嗅覚受容体タンパク質BmOR1は、匂い物質ボンビコールに選択的に応答し、嗅覚受容体タンパク質BmOR3は、匂い物質ボンビカールに選択的に応答したことを示す。
【図6】図6は、嗅覚受容体タンパク質BmOR1、BmOR3を各々発現しているSf21細胞が、それぞれ、ボンビコール、ボンビカールに対して濃度依存的に応答したことを示す図である。右端画像の右側バーは蛍光強度変化の割合、すなわち相対蛍光変化量(ΔF(匂い物質で刺激後の蛍光強度の変化量)/F(刺激前の蛍光強度)×100(%))の値を表す。
【図7】図7は、スクリーニングによって選抜されたBmOR1又はBmOR3発現Sf21細胞の中で、2ケ月間継代可能であった細胞の、カルシウムイメージングによる相対蛍光変化量(ΔF(匂い物質で刺激後の蛍光強度の変化量)/F(刺激前の蛍光強度)×100(%))を示す図である。
【図8】図8は、安定発現系統BmOR1-6を発現させた細胞チップを用いたボンビコールの検出を示す図である。
【図9】図9は、昆虫の嗅覚受容体タンパク質を導入したSf21細胞の匂い応答の結果を示す図である。各々の右端画像の右側バーは相対蛍光変化量を示す。
【発明を実施するための形態】
【0014】
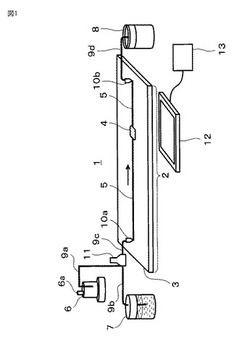
図1に本発明の匂いセンサ1の1実施態様を示す。本発明の匂いセンサ1は、昆虫の嗅覚受容体タンパク質発現細胞(以下、本明細書において、単に「受容体発現細胞」と称することがある)を基板3上の容器4に保持してなる細胞チップ2と、当該細胞が発する光を検出して信号を出力するセンサ12と、当該信号に基づいて匂い物質を検出する判定器13と、検出した結果をディスプレイに表示する手段(図示せず)とを備える。
【0015】
基板3は、電気絶縁性の平板状であって、受容体発現細胞や各種試薬に対して安定であり、本発明の匂いセンサが使用に耐えうる強度を有するための匂いセンサ全体を支持できる素材であれば特に制限されない。例えば、ガラス;ポリエチレンテレフタレート、ポリエチレン、ポリエステル、ポリプロピレン、ポリカーボネート、ポリアミドイミド、フェノール樹脂などのプラスチックやガラスエポキシ樹脂;ポリ乳酸などの生分解性材料、前記細胞や試薬溶液が浸透しないように表面処理された紙などでよい。
基板の厚さは特に制限されないが、例えば好ましくは10〜1000μm、より好ましくは100〜500μm程度の範囲にあればよい。また、その大きさは特に限定されないが、携帯性の点から、縦3〜8cm x 横7〜12cm程度の大きさが適当である。
【0016】
図1において、容器4は、溝状の流路の形状を有し、その大きさは、通常、縦2mm x 横6mm程度、深さ100μm程度である。
【0017】
あるいは、容器は、閉じた微小領域、例えばマイクロウェル(穴)、溝(チャネル)の形状を有するものであってもよい。また、その大きさは、一般に、直径が例えば50〜500μmの範囲で、深さが例えば50〜500μmの範囲にあればよい。容器の形状及び大きさは、受容体発現細胞を培養しながら保持できるものであれば特に制限されない。
【0018】
受容体発現細胞は、一般的な遺伝子工学的手法により作製できる。具体的には、特定の匂い物質に対する昆虫の嗅覚受容体タンパク質をコードする遺伝子と、その匂い物質が当該受容体タンパク質に結合したことを確認するための蛍光タンパク質をコードする遺伝子とを所定の昆虫培養細胞発現用ベクターに組み込み、構築されたベクターを宿主細胞にトランスフェクトすることによって作製できる。
【0019】
昆虫の嗅覚受容体タンパク質としては、これまで、キイロショウジョウバエ(Drosophila melanogaster)、ハマダラカ(Anopheles gambiae)、カイコガ(Bombyx mori)等から100種類以上が特定されている。当該受容体タンパク質は、例えばフェネチルアルコール、メチルベンゾエート、エチルベンゾエート、ベンジルアルコール、メチルサリシレート、ベンズアルデヒド、ペンタナール、ヘキサナール、E2-ヘキサナール、2-ヘプタノン、6-メチル-5-へプテン-2-オン、2-メチルフェノール等の匂い物質に対して高い応答特性を有する(Hallem et al., Cell 125, 143-160, April 7, 2006)。当該受容体はイオンチャネル型受容体として機能し、対象となる匂い物質が当該受容体に結合すると、受容体発現細胞内へのイオンの流入が起こり、当該匂い物質を結合した細胞は細胞内で光を発する。
【0020】
図2及び3に、受容体発現細胞を得るために構築されたベクターの一例を示す。
嗅覚受容体タンパク質をコードする遺伝子は、例えば、昆虫の嗅覚受容体からmRNAを抽出し、cDNAを合成して単離することができる。mRNAの調製は、通常行われる手法により行うことができる。このようにして得られたcDNAから、適当なPCRプライマーを用いて、PCR法にて当該遺伝子の一部を取得することができる。
嗅覚受容体タンパク質をコードする遺伝子の一部は、合成した二本鎖cDNAを適当なベクターに組み込み、当該ベクターを用いて大腸菌等を形質転換してcDNAライブラリーを作製することによって取得することもできる。cDNAは、適当な制限酵素とリガーゼを用いる通常の方法、例えば、得られたcDNAを適当な制限酵素で切断し、適当なベクターDNAの制限酵素部位に挿入してベクターに連結する方法によって昆虫培養細胞発現用ベクターに組込むことができる。
【0021】
昆虫培養細胞発現用ベクターとしては、宿主細胞において複製可能である限り特に制限されないが、例えば、pIZ/VS-His、pIB/V5-His(Invitrogen社製)等を用いることができる。かかるベクターは、複製開始点、選択マーカー及びプロモーターを含み、必要に応じてエンハンサー、転写終結配列(ターミネーター)、リボソーム結合部位、ポリアデニル化シグナル等を含んでいてもよい。
【0022】
昆虫培養細胞発現用ベクターには、好ましくは、嗅覚受容体タンパク質と複合体を形成して細胞内にイオンを流入させるとされているOr83bファミリータンパク質をコードする遺伝子(アクセッション番号:AY567998)が組み込まれる。
【0023】
蛍光タンパク質は細胞内で光を発することから、検出される蛍光強度は蛍光タンパク質の発現量に依存することになる。そのため、その発現量を高くするために、蛍光タンパク質をコードする遺伝子は、嗅覚受容体タンパク質をコードする遺伝子やOr83bタンパク質ファミリーをコードする遺伝子とは別のベクターに組み込むことが好ましい。
【0024】
蛍光タンパク質としては、緑色蛍光タンパク質(GFP)、赤色蛍光タンパク質(DsRed)等も使用できるが、好ましくはカルシウム感受性を有するものであり、かかるカルシウム感受性蛍光タンパク質としてはGCaMP3(Tian L. et al., Nat Methods 6 (2009) pp. 875-881)、エクオリン等が挙げられる。
【0025】
宿主細胞としては、スポドプテラ・フルギペルダ(Spodoptera frugiperda)由来の細胞であれば特に制限されないが、例えばSf21、Sf9等が好ましい。その中でも、Sf21細胞は、18〜40℃と広範囲の温度条件下で生存でき、培養液のpHを調整するための二酸化炭素を必要とせず、半永久的に使用可能な点で(木村滋編「昆虫バイオ工場」工業調査会、2000年)、特に好ましい。また、Sf21細胞は緑色蛍光タンパク質を用いるカルシウムイメージング法によって、実際に蛍光を発することが確認されている(Kiely at al., Journal of Neuroscience Methods 159 (2007) pp. 189-194)。
【0026】
形質転換は、リポフェクション、塩化カルシウム、リン酸カルシウム、DEAE-デキストラン介在トランスフェクション、エレクトロポーレーション等の公知の方法で行うことができる。
【0027】
なお、受容体発現細胞に蛍光タンパク質を共発現させずに、当該細胞に、カルシウムイオン依存性蛍光色素を添加してもよい。カルシウムイオン依存性蛍光色素を共存させることにより、当該受容体が対象となる匂い物質と結合すると細胞内のカルシウムイオン濃度が変化し、蛍光を発する。かかる蛍光色素としては、例えば、Fura-2、Fluo-3、Fluo-4等を用いることができる。
【0028】
このようにして作製された受容体発現細胞を用いて、センサ素子となり得る、長期間安定して匂い応答を検出できる受容体発現細胞の「安定発現系統」を作出することができる。本明細書で「安定発現系統」とは、後出の例3で詳述するように、2ケ月間継代培養が可能であり、対象となる匂い物質を接触させる前の容器の蛍光強度に対する、当該匂い物質を接触させた後のその容器の蛍光強度の増加率が例えば5%以上、好ましくは10%以上、より好ましくは20%以上を示す細胞系統を言う。かかる安定発現系統は、例えば、上記の作製された受容体発現細胞に、特定の匂い物質を接触させずに、イオノマイシン等のイオノフォアで刺激してカルシウムイオン応答を測定して、カルシウムイオンに応答する細胞を選択し;次いで、特定の匂い物質を接触させて、匂い応答を測定することにより、匂いに応答する細胞を選択し;そして、公知の方法によって匂い応答細胞をスクリーニングし、匂い応答細胞の中から受容体タンパク質を安定して発現することができる細胞系統を選抜する、ことによって作出することができる。作出された安定発現系統は、一度構築すると半永久的に使用可能であり、長期間、例えば6ヶ月間以上凍結保存することもできる。
【0029】
本明細書における受容体発現細胞の「保持」とは、容器4の表面に受容体発現細胞が接着又は付着している態様を示す。したがって、培養液中に浮遊している状態又は死滅した状態の細胞等を含まない。
【0030】
細胞チップ2は、対象となる匂い物質を容器4に供給するための手段6(以下、本明細書において、単に「匂い物質供給手段」と称することがある)を細胞チップの上流側に有する。匂い物質供給手段6は、匂い物質取り込み口6aを有する密閉容器からなり、匂い物質は、匂い物質供給手段6から、匂い物質供給管9a、次いで匂い物質(又は後述の培養液)を移送するための移送管9cを経て、流路5に供給される。移送管9cと流路5とはコネクタ10aによって接続される。匂い物質供給管9a及び移送管9cは、例えばキャピラリーチューブでよく、外径0.5mm程度、内径0.3mm程度のものが好ましい。匂い物質は、例えば、特定の溶液に溶解したり又は気泡化させたりして取り込みことができる。匂い物質供給手段6は、例えばシリンジ、マイクロバブラー等でよい。シリンジは、例えば数百μL〜数mL程度の容量のものが好ましい。
ここで、流路5は、コネクタ10aから基板3上を図1の矢印方向に向かい、容器4に接続し、さらに容器4からコネクタ10bまで至る、流下溝である。流路幅は約100〜500μm、好ましくは約200μm、流路深さは約50〜200μm、好ましくは約100μmである。
【0031】
細胞チップ2は、受容体発現細胞を培養するための培養液を供給させる手段7(以下、本明細書において、単に「培養液供給手段」と称することがある)を細胞チップの上流側に有する。培養液供給手段7は、例えばシリンジ、シリンジポンプ等でよい。培養液は、培養液供給手段7から、培養液供給管9b、次いで移送管9cを経て、流路5に供給される。培養液供給手段7中の培養液には受容体発現細胞も含まれ、培養液が流路5を矢印方向に流下することにより、受容体発現細胞は容器4に保持され、そこで培養されることになる。
コネクタ10aの手前には、匂い物質供給管9aと培養液供給管9bが接続されたバルブ11を有し、受容体発現細胞と匂い物質を移送管9cに供給している。
【0032】
図1は、容器の数が1個である細胞チップを例示するが、容器の数は特に制限されず、複数個であってもよい。
複数個の容器を有する細胞チップとしては、例えば、受容体発現細胞を培養するための培養液が流下する方向(図1の矢印方向)に対して並列に、溝状の流路形状を有する容器を複数個有するものでよい。このような細胞チップとしては、図1に示した、コネクタ10aから流路5を介して容器4に至り、容器4から流路5を介してコネクタ10bに至る構造部分を、図1の矢印方向に対して並列に独立させて複数個存在させた構成でもよい。あるいは、上記構造部分において、容器4を矢印方向に対して複数個並列に並べて、複数個の容器の手前に、受容体発現細胞を各容器に分配する分配器を1つ設け、分配器から分岐した流路によって各容器に受容体発現細胞を分配する構成でもよい。前者の場合には、匂い物質供給手段6及び培養液供給手段7は、各容器に一組ずつ有してもよい。
複数個の容器を有する細胞チップの別の態様として、基板の一方の表面に細胞を格納するための複数の容器(マイクロウェル)を有するマイクロウェルアレイチップを使用することもできる。
このような複数個の容器を有する細胞チップでは、各容器に、対象となる異なった種類の匂い物質に対して互いに異なった嗅覚受容体タンパク質を発現している細胞を保持することができる。このような細胞チップでは、対象となる匂い物質を接触させた時の、容器ごとに異なる蛍光強度を示すその応答パターンを確認することにより、当該匂い物質を検出することができる。また、このような細胞チップを用いれば、同一のチップ上で複数の種類の匂い物質を同時に検出することもできる。
【0033】
細胞チップ2の下流側には、廃液回収手段を有する。廃液回収手段は、コネクタ10bによって流路5に接続された廃液管9dと、廃液回収容器8とからなる。廃液回収手段は、容器4で保持されなかった細胞、廃培養液等を回収する。
なお、容器4に保持された細胞であっても死滅すると容器4から浮き上がるため、廃培養液として廃液回収手段にて回収される。これによって、容器4には死滅した細胞が残ることなく、匂い物質の安定した検出が可能になる。
【0034】
培養液は、炭素源、窒素源、金属塩、ミネラル、ビタミン等を含む通常の培地であればよく、培養条件も二酸化炭素の存在を必要としない。培養液のpHは、受容体発現細胞が生育し得る範囲のpHであればよく、pH 6.0〜7.0程度に調整するのが好適である。培養温度は、受容体発現細胞が生育し得る温度であればよく、通常25〜30℃程度に調整するのが好ましい。
【0035】
センサ12は、例えば、細胞チップ2の裏面側に配置され(図1参照)、2次元アレイ状に光電変換素子が配置されたセンサと、センサ上に容器4の像を結合する結像光学系とを有する。細胞チップ2とセンサとの間にバンドパスフィルタをさらに備えてもよい。フィルタは、細胞が発する蛍光が持つ波長の光を透過し、その他の波長の光を透過しないものが好ましい。なお、センサ12は、細胞チップ2の表面側に配置してもよい。
【0036】
センサ12が有する光電変換素子は、例えば、CCD型イメージセンサ又はCOMS型イメージセンサとすることができる。センサ12は、例えば、撮影領域が300万画素以上の解像度を持ち、細胞1つ当たりの蛍光を撮影素子の4画素以上で捕らえることができる機能を持つものであることが好ましい。そして、センサ12は、容器の像が特定の領域に写った蛍光画像を生成する。
【0037】
図4は、蛍光画像の模式図を示す。容器4の像は蛍光画像400の領域4’に生成される。したがって、例えば、容器4内に含まれる細胞が発光すると、領域4’内のその細胞の像が写っている画素の輝度が増加する。
【0038】
センサ12は、生成した蛍光画像を判定器13に渡す。
判定器13は、プロセッサ、半導体メモリ及び周辺回路を有し、センサ12から出力された蛍光画像に基づいて対象となる匂い物質を検出する。判定器13は、センサ12から出力された蛍光画像において、例えば、蛍光画像上の容器の領域について、対象となる匂い物質が接触する前の、その容器が写っている領域の平均輝度値と、当該物質が接触した後の、その領域の平均輝度値とを比較し、後者の平均輝度値が、例えば5%以上、好ましくは10%以上、より好ましくは20%以上増加している場合に、その容器において対象となる匂い物質を検出できたと判定する。
別の実施態様では、判定器13は、例えば、蛍光画像上の容器の領域について、対象となる匂い物質が接触する前の輝度値よりも、当該物質が接触した後の輝度値が、所定の輝度閾値以上(例えば5%以上、好ましくは10%以上、より好ましくは20%以上)高くなった画素数が、その容器に対応する領域に含まれる画素数の所定の割合以上、例えば1/1000〜1/100以上検出された場合に、その容器において対象となる匂い物質が検出されたと判定してよい。
【0039】
図1に示すように容器の数が1個の場合には、センサ12は、フォトダイオード又はフォトマルを用いてもよい。一方、容器の数が複数の場合には、センサ12は、容器ごとにフォトダイオードと集光光学系とを有してもよい。これらの場合には、センサ12は1つの容器について細胞が発する光の蛍光強度に対応した強度を有する1つの信号を出力する。この場合、判定器13は、各容器に対応するフォトダイオード又はフォトマルから出力された信号強度が、匂い物質が接触する前よりも接触した後に5%以上、好ましくは10%以上、より好ましくは20%以上増加していれば、匂い物質が検出されたと判定してよい。
【0040】
本発明の匂いセンサは、場合により判定器13を有さず、センサ12からの信号をそのまま出力してもよい。
【0041】
本発明の匂いセンサは、対象となる匂い物質をppbレベルの高感度でかつ高い識別能で検出でき、長期間にわたり使用可能であり、しかも携帯性を有する。さらに、本発明の匂いセンサは、6ケ月間以上凍結保存することもできる。したがって、本発明の匂いセンサは、日常生活の安全や安心の質の向上のためのさまざまな場面での利用が期待される。例えば、ガス漏れ検知、火災発生の早期発見、有害物質や環境汚染物質のモニタリング、被災地での匂いを手掛かりとした救助活動、さらに空港での麻薬などの検査、爆発物や地雷の検知などである。
【0042】
以下に、昆虫の嗅覚受容体タンパク質発現細胞の作製例、及び匂い物質の検出例を示す。
例1.昆虫の嗅覚受容体タンパク質発現細胞の作製
(1)GCaMP3を発現するベクターの作製
Looger研究室から提供を受けたGCaMP3遺伝子(アクセッション番号:HM143847.1)のcDNAの開始コドンから終止コドンまでを、開始コドン(ATG)の直前にコザック配列(GCCGCC)を付加したプライマーでPCR増幅し、昆虫培養細胞発現用ベクターpIZ/V5-His(Invtrogen社製)のマルチクローニングサイトに挿入し、GCaMP3を発現するpIZ-GCaMP3ベクターを作製した(図2)。
PCR増幅は、各100pMの濃度の以下のフォワードプライマー(配列番号1)及びリバースプライマー(配列番号2)、PrimeSTAR HS DNA polymerase(タカラバイオ(株)R010A)、添付の反応バッファー及びdNTPを使用し、添付のプロトコールに従って行った。PCR反応は、94℃で1分間の反応の後、98℃で10秒間、55℃で15秒間、72℃で1.5分間の温度サイクルを30サイクル、その後72℃で5分間反応させる条件で行った。
フォワード:5'-GCGGCCGCCATGGGTTCTCATCATCATCATC-3’(配列番号1)
リバース:5'-GGTCTAGATTACTTCGCTGTCATCATTTGTAC-3’(配列番号2)
(2)嗅覚受容体タンパク質遺伝子及びOr83bファミリータンパク質遺伝子を共発現するデュアル発現ベクターの構築
卵母細胞を用いた本発明者らの研究(例えば、非特許文献3)に記載されているように、嗅覚受容体タンパク質遺伝子とOr83bファミリータンパク質遺伝子とを1:1の割合で発現させることで当該受容体の機能の発現が可能となることから、カイコガ(Bombyx mori)の性フェロモン受容体タンパク質遺伝子であるBmOR1(アクセッション番号:AB059431)又はBmOR3(アクセッション番号:AB186505)と、カイコガのOr83bファミリー遺伝子であるBmOR2(アクセッション番号:AB100454)を同程度発現できるデュアル発現ベクターを構築した(図3)。
まず、pIBベクター(Invtrogen社製)のマルチクローニングサイトに、カイコガの触角cDNA由来のBmOR2遺伝子の開始コドンから終止コドンまでを、コザック配列(GCCGCC)を付加したプライマーで増幅したBmOR2(ORFの完全長)を挿入し、pIB-BmOR2ベクターを構築した。次に、カイコガの触角cDNA由来のBmOR1遺伝子又はBmOR3遺伝子の開始コドンから終止コドンまでを、それぞれコザック配列を付加したプライマーで増幅して、増幅されたBmOR1又遺伝子(ORFの完全長)又はBmOR3遺伝子(ORFの完全長)を得た。使用したプライマー配列は以下のとおりであり、PCR反応条件は「GCaMP3を発現するベクターの作製」で示した条件と同様である。
BmOR1:
フォワード:5'-GCGGCCGCCATGTTACTATCCTTCAAAGATGAC-3’(配列番号3)
リバース:5'-GGTCTAGATTATGTTGCCACCGTTCGAAG-3’(配列番号4)
BmOR3:
フォワード:5'-GCGGCCGCCATGATATTCGTCGACGATGCTG-3’(配列番号5)
リバース:5'-GGTCTAGATCATTCGGACACGGTACG-3’(配列番号6)
BmOR2:
フォワード:5'-GCGGCCGCCATGATGACCAAGGTCAAGACGC-3’(配列番号7)
リバース:5'-GGTCTAGACTACTTCAGTTGGATCAACACC-3’(配列番号8)
一方、pIZベクター(Invtrogen社製)でタンパク質発現カセット(OpIE2プロモーター(P(OpIE2))→OpIE2ポリA付加シグナル(OpIE2pA))と連なる部分)を構築し、pIB-BmOR2ベクターのBspH1部位に、増幅されたBmOR1又遺伝子又はBmOR3遺伝子を挿入し、2種類のデュアル発現ベクターpIB-BmOR1-BmOR2、及びpIB-BmOR3-BmOR2を構築した。
(3)嗅覚受容体タンパク質発現細胞の作製
前記デュアル発現ベクター及びpIZ-GCaMP3ベクターをリポフェクション法(Cellfectin;Invitrogen社製)により、Sf21細胞に導入した。
【0043】
例2.ディッシュによる昆虫フェロモンの検出
BioCoatコラーゲンディッシュ(Becton, Dickinson and Company、NJ、USA)に例1で作製したSf21細胞の溶液(約1×106 細胞数/ml)を接着させ、培養細胞カルシウムイメージング用のリンガー液(140mM NaCl, 5.6mM KCl, 2.0mM CaCl2, 2.0mM MgCl2, 5mM HEPES, 9.4mM グルコース, 1.25mM KH2PO4, pH7.4)2mlを添加し、1.5ml/分の流速でリンガー液を灌流させた。ここに、室温で、各10μMのボンビコール(BOL)、ボンビカール(BAL)のリンガー液500μlを注入し、これらの匂い物質に対する匂い応答を測定した(図5)。
その結果、嗅覚受容体タンパク質BmOR1はボンビコールに、嗅覚受容体タンパク質BmOR3はボンビカールに選択的に応答することが明らかとなった。
さらに、添加するボンビコール及びボンビカールの濃度を30nM〜10μMまで変化させながら匂い応答を測定した(図6)。
【0044】
例3.昆虫の嗅覚受容体タンパク質発現細胞の安定発現系統の作出
長期間安定して匂い応答を検出できる嗅覚受容体タンパク質発現細胞の安定発現系統を得るため、例1で作製したSf21細胞を希釈法とシリンダー法(InsectSelect(商標)BSD System(Invitrogen社製))によってスクリーニングした。
【0045】
希釈法によるスクリーニングでは、例1で作製したSf21細胞を、ゼオシン入りの培地(例2で使用したリンガー液)(終濃度300μg/ml)及びブラストサイジン(終濃度80μg/ml)で希釈することで、細胞数を減らしつつ、嗅覚受容体タンパク質遺伝子が組み込まれたベクターが導入された細胞のみを選抜する。リポフェクション法による遺伝子の導入効率は、数%〜数十%程度なので、通常、希釈された細胞群の中で、数%〜数十%の細胞が当該ベクターを保持している。したがって、当該ベクターを保持していない細胞は死滅し、当該ベクターを保持した細胞は生き残るため、希釈して生き残った細胞を選抜することにより、同じ形質を持った細胞が得られる。
シリンダー法によるスクリーニングでは、前記Sf21細胞を、上記抗生物質入りの培地で培養し、形成したコロニーを回収する。コロニーは、1つの細胞から形成されるので、1つのコロニーを回収することにより、同じ形質を持った細胞が得られる。
【0046】
その結果、BmOR1-BmOR2-GCaMP3を発現しているSf21細胞では、希釈法及びシリンダー法で24個のコロニーが選抜され、その選抜されたコロニーの中で10系統が2ケ月間継代可能であり、その継代可能な系統の中で8系統(BmOR1-1〜2、BmOR1-4〜8、及びBmOR1-10)がカルシウムイメージングにより蛍光変化量の測定が可能であった。一方、BmOR3-BmOR2-GCaMP3を発現しているSf21細胞では、5個のコロニーが選抜され、5系統が継代可能であり、その中で3系統(BmOR3-1、3及び4)がカルシウムイメージングにより蛍光変化量の測定が可能であった(図7)。本明細書では、上記のBmOR1の8系統及びBmOR3の3系統を「安定発現系統」とする。各細胞系統の左側のパネルは、対象となる匂い物質を接触させる前のカルシウムイメージング画像を、右側のパネルは、対象となる匂い物質を接触させた後のカルシウムイメージング画像を示す。
なお、例3で「蛍光変化量の測定が可能」とは、対象となる匂い物質を接触させる前の蛍光強度に対する、当該匂い物質を接触させた後の蛍光強度の増加率が20%以上であることを意味する。
図7の結果を匂い物質に応答した細胞の割合に換算すると([容器内の全細胞数の内、20%以上の蛍光強度変化を示した細胞数]/[容器内の全細胞数]×100(%))、細胞系統によっては60%以上の細胞が応答している系統も存在することが明らかとなった(表1)。
【0047】
【表1】

【0048】
例4.安定発現系統BmOR1-6を発現した細胞チップによる昆虫フェロモンの検出
図1に示した本発明の細胞チップと同じ構成のガラス製マイクロ化学チップ(マイクロ化学技研株式会社製)に、BmOR1-6を発現したSf21細胞を含む例2のリンガー液(約1×106〜1×105 細胞数/ml)2mlを添加して、当該細胞を接着させた。チップの流路にリンガー液を室温で流速数十〜数百μl/分で72時間流しながら、10μMのボンビコールのリンガー液を接触させて、ボンビコールに対する応答を測定した(図8)。
【0049】
例5.昆虫フェロモン以外の匂い物質の検出
キイロショウジョウバエ(Drosophila melanogaster)の嗅覚受容体タンパク質Or43a(アクセッション番号:NM_078923.2)又はOr47a(アクセッション番号:NM_078965.2)を発現させたSf21細胞を例1と同様に構築し(Or43a、Or47a、及びOr83の各遺伝子については、データベースFlybase(http://flybase.org/)で取得できるCDSの完全長を使用)、例2に記載の方法と同様にして、ペンチルアセテート及びシクロヘキサノンに対する匂い応答を各々測定した(図9)。その結果、Or43aはシクロヘキサノンにより選択的に応答し、Or47aはペンチルアセテートに選択的に応答することが明らかとなった。
【符号の説明】
【0050】
1 匂いセンサ
2 細胞チップ
3 基板
4 容器
5 流路
6 匂い物質供給手段
6a 匂い物質取り込み口
7 培養液供給手段
8 廃液回収手段
9a 匂い物質供給管
9b 培養液供給管
9c 移送管
9d 廃液管
10a、10b コネクタ
11 バルブ
12 センサ
13 判定器
【技術分野】
【0001】
本発明は、昆虫の嗅覚受容体タンパク質を遺伝子工学により再構成した培養細胞を用いる匂いセンサに関する。
【背景技術】
【0002】
近年、昆虫の匂い受容、識別の分子・神経機構の解析が進み、昆虫の高感度かつ高識別能な匂い識別の仕組みが明らかになりつつあり、昆虫の嗅覚機能を人工的に再現することが可能となっている。昆虫は、匂い物質に対する応答選択性の異なる複数のセンサ細胞の応答パターンの組み合わせにより、匂い物質を識別している。センサ細胞の匂い応答特性は、個々の細胞で合成される嗅覚受容体タンパク質の特性により決定されることから(例えば、非特許文献1、2参照)、匂い物質の情報は嗅覚受容体の応答パターンの組み合わせとして表現されることになる。
【0003】
このような昆虫の嗅覚受容体の機能を利用したセンサとして、本発明者らは、昆虫の嗅覚受容体タンパク質を導入したアフリカツメガエル卵母細胞をセンサ素子とした匂いセンサを報告している(例えば、非特許文献3参照)。当該センサは、導入した嗅覚受容体が応答する匂い物質を高感度かつ高選択的に検出することができる。しかしながら、当該センサでは、アフリカツメガエル卵母細胞の性質上、安定して測定可能な期間が半日程度に限定され、培養に厳密な温度制御を要するという問題点がある。また、応答の検出が電気生理学的手法に限られるため、同時に多数の細胞から測定することが困難であり、細胞間のばらつきを補正することが難しいとの問題点もある。
【先行技術文献】
【非特許文献】
【0004】
【非特許文献1】Dobritsa et al., Neuron, 37, pp. 827-841, 2003
【非特許文献2】Hallem & Carlson, Cell, 125, pp. 143-160, 2006
【非特許文献3】Misawa N, et al., (2010) Proc Natl Acad Sci USA 107: pp. 15340-15344
【発明の概要】
【発明が解決しようとする課題】
【0005】
従って、本発明では、長期間使用可能な、対象となる匂い物質を検出する匂いセンサを提供することを目的とする。
【課題を解決するための手段】
【0006】
本発明者らは、斯かる現状に鑑み鋭意検討した結果、遺伝子工学技術により、検出対象となる匂い物質に対する昆虫の嗅覚受容体タンパク質を安定的に発現しかつ匂い物質を受容することにより光を発する昆虫培養細胞を構築し、そして、当該細胞と、当該細胞を保持してなる基板と、光を検出して信号を出力するセンサとを組み合わせた匂いセンサが、上記課題を解決できることを見出し、本発明を完成した。
すなわち、本発明は、基板上に設けられた容器に、昆虫の嗅覚受容体タンパク質及び蛍光タンパク質を共発現しているスポドプテラ・フルギペルダ(Spodoptera frugiperda)細胞であって、検出対象となる匂い物質を含む試料を接触させることによって前記細胞内イオン濃度の変化に基づいて光を発する細胞を保持してなる、細胞チップと、前記光を検出すると信号を出力するセンサと、前記信号に基づいて前記匂い物質を検出する判定器と、を有する、匂いセンサを提供する。
【0007】
本発明の一つの実施形態によれば、前記匂いセンサにおいて、前記容器は複数個存在し、その複数個の容器の各々に保持された前記細胞は、検出対象となる異なった種類の匂い物質に対して互いに異なった昆虫の嗅覚受容体タンパク質を発現し、かつ前記匂い物質を含む試料を前記複数個の容器の各々に接触させることによって光を発し、前記センサは、前記複数個の容器の各々における光を検出すると信号を出力し、前記判定器は、前記各信号に基づいて異なった種類の匂い物質を検出する。
【0008】
本発明の別の実施形態によれば、前記匂いセンサにおいて、前記出力するセンサが光の強度に応じた信号を出力し、かつ、前記判定器が前記信号の強度に基づいて前記匂い物質を検出する。
【0009】
本発明の別の実施形態によれば、前記匂いセンサにおいて、前記細胞チップは、前記容器中を細胞培養液を流下させる手段をさらに有する。
【0010】
本発明の別の実施形態によれば、前記匂いセンサにおいて、前記蛍光タンパク質は、カルシウム感受性蛍光タンパク質である。
【0011】
本発明のさらに別の実施形態によれば、前記匂いセンサにおいて、前記カルシウム感受性蛍光タンパク質はGCaMP3である。
【発明の効果】
【0012】
本発明の匂いセンサによれば、長期間安定して対象となる匂い物質を検出できる。
【図面の簡単な説明】
【0013】
【図1】図1は、本発明の匂いセンサの1実施態様を示す図である。
【図2】図2は、蛍光タンパク質遺伝子を組み込んだベクターを示す図である。
【図3】図3は、Or83bファミリータンパク質遺伝子、及び昆虫の嗅覚受容体タンパク質遺伝子を組み込んだベクターを示す図である。
【図4】図4は、蛍光画像の模式図を示す。
【図5】図5は、昆虫の嗅覚受容体タンパク質を導入したSf21細胞の匂い応答の結果を示す図である。嗅覚受容体タンパク質BmOR1は、匂い物質ボンビコールに選択的に応答し、嗅覚受容体タンパク質BmOR3は、匂い物質ボンビカールに選択的に応答したことを示す。
【図6】図6は、嗅覚受容体タンパク質BmOR1、BmOR3を各々発現しているSf21細胞が、それぞれ、ボンビコール、ボンビカールに対して濃度依存的に応答したことを示す図である。右端画像の右側バーは蛍光強度変化の割合、すなわち相対蛍光変化量(ΔF(匂い物質で刺激後の蛍光強度の変化量)/F(刺激前の蛍光強度)×100(%))の値を表す。
【図7】図7は、スクリーニングによって選抜されたBmOR1又はBmOR3発現Sf21細胞の中で、2ケ月間継代可能であった細胞の、カルシウムイメージングによる相対蛍光変化量(ΔF(匂い物質で刺激後の蛍光強度の変化量)/F(刺激前の蛍光強度)×100(%))を示す図である。
【図8】図8は、安定発現系統BmOR1-6を発現させた細胞チップを用いたボンビコールの検出を示す図である。
【図9】図9は、昆虫の嗅覚受容体タンパク質を導入したSf21細胞の匂い応答の結果を示す図である。各々の右端画像の右側バーは相対蛍光変化量を示す。
【発明を実施するための形態】
【0014】
図1に本発明の匂いセンサ1の1実施態様を示す。本発明の匂いセンサ1は、昆虫の嗅覚受容体タンパク質発現細胞(以下、本明細書において、単に「受容体発現細胞」と称することがある)を基板3上の容器4に保持してなる細胞チップ2と、当該細胞が発する光を検出して信号を出力するセンサ12と、当該信号に基づいて匂い物質を検出する判定器13と、検出した結果をディスプレイに表示する手段(図示せず)とを備える。
【0015】
基板3は、電気絶縁性の平板状であって、受容体発現細胞や各種試薬に対して安定であり、本発明の匂いセンサが使用に耐えうる強度を有するための匂いセンサ全体を支持できる素材であれば特に制限されない。例えば、ガラス;ポリエチレンテレフタレート、ポリエチレン、ポリエステル、ポリプロピレン、ポリカーボネート、ポリアミドイミド、フェノール樹脂などのプラスチックやガラスエポキシ樹脂;ポリ乳酸などの生分解性材料、前記細胞や試薬溶液が浸透しないように表面処理された紙などでよい。
基板の厚さは特に制限されないが、例えば好ましくは10〜1000μm、より好ましくは100〜500μm程度の範囲にあればよい。また、その大きさは特に限定されないが、携帯性の点から、縦3〜8cm x 横7〜12cm程度の大きさが適当である。
【0016】
図1において、容器4は、溝状の流路の形状を有し、その大きさは、通常、縦2mm x 横6mm程度、深さ100μm程度である。
【0017】
あるいは、容器は、閉じた微小領域、例えばマイクロウェル(穴)、溝(チャネル)の形状を有するものであってもよい。また、その大きさは、一般に、直径が例えば50〜500μmの範囲で、深さが例えば50〜500μmの範囲にあればよい。容器の形状及び大きさは、受容体発現細胞を培養しながら保持できるものであれば特に制限されない。
【0018】
受容体発現細胞は、一般的な遺伝子工学的手法により作製できる。具体的には、特定の匂い物質に対する昆虫の嗅覚受容体タンパク質をコードする遺伝子と、その匂い物質が当該受容体タンパク質に結合したことを確認するための蛍光タンパク質をコードする遺伝子とを所定の昆虫培養細胞発現用ベクターに組み込み、構築されたベクターを宿主細胞にトランスフェクトすることによって作製できる。
【0019】
昆虫の嗅覚受容体タンパク質としては、これまで、キイロショウジョウバエ(Drosophila melanogaster)、ハマダラカ(Anopheles gambiae)、カイコガ(Bombyx mori)等から100種類以上が特定されている。当該受容体タンパク質は、例えばフェネチルアルコール、メチルベンゾエート、エチルベンゾエート、ベンジルアルコール、メチルサリシレート、ベンズアルデヒド、ペンタナール、ヘキサナール、E2-ヘキサナール、2-ヘプタノン、6-メチル-5-へプテン-2-オン、2-メチルフェノール等の匂い物質に対して高い応答特性を有する(Hallem et al., Cell 125, 143-160, April 7, 2006)。当該受容体はイオンチャネル型受容体として機能し、対象となる匂い物質が当該受容体に結合すると、受容体発現細胞内へのイオンの流入が起こり、当該匂い物質を結合した細胞は細胞内で光を発する。
【0020】
図2及び3に、受容体発現細胞を得るために構築されたベクターの一例を示す。
嗅覚受容体タンパク質をコードする遺伝子は、例えば、昆虫の嗅覚受容体からmRNAを抽出し、cDNAを合成して単離することができる。mRNAの調製は、通常行われる手法により行うことができる。このようにして得られたcDNAから、適当なPCRプライマーを用いて、PCR法にて当該遺伝子の一部を取得することができる。
嗅覚受容体タンパク質をコードする遺伝子の一部は、合成した二本鎖cDNAを適当なベクターに組み込み、当該ベクターを用いて大腸菌等を形質転換してcDNAライブラリーを作製することによって取得することもできる。cDNAは、適当な制限酵素とリガーゼを用いる通常の方法、例えば、得られたcDNAを適当な制限酵素で切断し、適当なベクターDNAの制限酵素部位に挿入してベクターに連結する方法によって昆虫培養細胞発現用ベクターに組込むことができる。
【0021】
昆虫培養細胞発現用ベクターとしては、宿主細胞において複製可能である限り特に制限されないが、例えば、pIZ/VS-His、pIB/V5-His(Invitrogen社製)等を用いることができる。かかるベクターは、複製開始点、選択マーカー及びプロモーターを含み、必要に応じてエンハンサー、転写終結配列(ターミネーター)、リボソーム結合部位、ポリアデニル化シグナル等を含んでいてもよい。
【0022】
昆虫培養細胞発現用ベクターには、好ましくは、嗅覚受容体タンパク質と複合体を形成して細胞内にイオンを流入させるとされているOr83bファミリータンパク質をコードする遺伝子(アクセッション番号:AY567998)が組み込まれる。
【0023】
蛍光タンパク質は細胞内で光を発することから、検出される蛍光強度は蛍光タンパク質の発現量に依存することになる。そのため、その発現量を高くするために、蛍光タンパク質をコードする遺伝子は、嗅覚受容体タンパク質をコードする遺伝子やOr83bタンパク質ファミリーをコードする遺伝子とは別のベクターに組み込むことが好ましい。
【0024】
蛍光タンパク質としては、緑色蛍光タンパク質(GFP)、赤色蛍光タンパク質(DsRed)等も使用できるが、好ましくはカルシウム感受性を有するものであり、かかるカルシウム感受性蛍光タンパク質としてはGCaMP3(Tian L. et al., Nat Methods 6 (2009) pp. 875-881)、エクオリン等が挙げられる。
【0025】
宿主細胞としては、スポドプテラ・フルギペルダ(Spodoptera frugiperda)由来の細胞であれば特に制限されないが、例えばSf21、Sf9等が好ましい。その中でも、Sf21細胞は、18〜40℃と広範囲の温度条件下で生存でき、培養液のpHを調整するための二酸化炭素を必要とせず、半永久的に使用可能な点で(木村滋編「昆虫バイオ工場」工業調査会、2000年)、特に好ましい。また、Sf21細胞は緑色蛍光タンパク質を用いるカルシウムイメージング法によって、実際に蛍光を発することが確認されている(Kiely at al., Journal of Neuroscience Methods 159 (2007) pp. 189-194)。
【0026】
形質転換は、リポフェクション、塩化カルシウム、リン酸カルシウム、DEAE-デキストラン介在トランスフェクション、エレクトロポーレーション等の公知の方法で行うことができる。
【0027】
なお、受容体発現細胞に蛍光タンパク質を共発現させずに、当該細胞に、カルシウムイオン依存性蛍光色素を添加してもよい。カルシウムイオン依存性蛍光色素を共存させることにより、当該受容体が対象となる匂い物質と結合すると細胞内のカルシウムイオン濃度が変化し、蛍光を発する。かかる蛍光色素としては、例えば、Fura-2、Fluo-3、Fluo-4等を用いることができる。
【0028】
このようにして作製された受容体発現細胞を用いて、センサ素子となり得る、長期間安定して匂い応答を検出できる受容体発現細胞の「安定発現系統」を作出することができる。本明細書で「安定発現系統」とは、後出の例3で詳述するように、2ケ月間継代培養が可能であり、対象となる匂い物質を接触させる前の容器の蛍光強度に対する、当該匂い物質を接触させた後のその容器の蛍光強度の増加率が例えば5%以上、好ましくは10%以上、より好ましくは20%以上を示す細胞系統を言う。かかる安定発現系統は、例えば、上記の作製された受容体発現細胞に、特定の匂い物質を接触させずに、イオノマイシン等のイオノフォアで刺激してカルシウムイオン応答を測定して、カルシウムイオンに応答する細胞を選択し;次いで、特定の匂い物質を接触させて、匂い応答を測定することにより、匂いに応答する細胞を選択し;そして、公知の方法によって匂い応答細胞をスクリーニングし、匂い応答細胞の中から受容体タンパク質を安定して発現することができる細胞系統を選抜する、ことによって作出することができる。作出された安定発現系統は、一度構築すると半永久的に使用可能であり、長期間、例えば6ヶ月間以上凍結保存することもできる。
【0029】
本明細書における受容体発現細胞の「保持」とは、容器4の表面に受容体発現細胞が接着又は付着している態様を示す。したがって、培養液中に浮遊している状態又は死滅した状態の細胞等を含まない。
【0030】
細胞チップ2は、対象となる匂い物質を容器4に供給するための手段6(以下、本明細書において、単に「匂い物質供給手段」と称することがある)を細胞チップの上流側に有する。匂い物質供給手段6は、匂い物質取り込み口6aを有する密閉容器からなり、匂い物質は、匂い物質供給手段6から、匂い物質供給管9a、次いで匂い物質(又は後述の培養液)を移送するための移送管9cを経て、流路5に供給される。移送管9cと流路5とはコネクタ10aによって接続される。匂い物質供給管9a及び移送管9cは、例えばキャピラリーチューブでよく、外径0.5mm程度、内径0.3mm程度のものが好ましい。匂い物質は、例えば、特定の溶液に溶解したり又は気泡化させたりして取り込みことができる。匂い物質供給手段6は、例えばシリンジ、マイクロバブラー等でよい。シリンジは、例えば数百μL〜数mL程度の容量のものが好ましい。
ここで、流路5は、コネクタ10aから基板3上を図1の矢印方向に向かい、容器4に接続し、さらに容器4からコネクタ10bまで至る、流下溝である。流路幅は約100〜500μm、好ましくは約200μm、流路深さは約50〜200μm、好ましくは約100μmである。
【0031】
細胞チップ2は、受容体発現細胞を培養するための培養液を供給させる手段7(以下、本明細書において、単に「培養液供給手段」と称することがある)を細胞チップの上流側に有する。培養液供給手段7は、例えばシリンジ、シリンジポンプ等でよい。培養液は、培養液供給手段7から、培養液供給管9b、次いで移送管9cを経て、流路5に供給される。培養液供給手段7中の培養液には受容体発現細胞も含まれ、培養液が流路5を矢印方向に流下することにより、受容体発現細胞は容器4に保持され、そこで培養されることになる。
コネクタ10aの手前には、匂い物質供給管9aと培養液供給管9bが接続されたバルブ11を有し、受容体発現細胞と匂い物質を移送管9cに供給している。
【0032】
図1は、容器の数が1個である細胞チップを例示するが、容器の数は特に制限されず、複数個であってもよい。
複数個の容器を有する細胞チップとしては、例えば、受容体発現細胞を培養するための培養液が流下する方向(図1の矢印方向)に対して並列に、溝状の流路形状を有する容器を複数個有するものでよい。このような細胞チップとしては、図1に示した、コネクタ10aから流路5を介して容器4に至り、容器4から流路5を介してコネクタ10bに至る構造部分を、図1の矢印方向に対して並列に独立させて複数個存在させた構成でもよい。あるいは、上記構造部分において、容器4を矢印方向に対して複数個並列に並べて、複数個の容器の手前に、受容体発現細胞を各容器に分配する分配器を1つ設け、分配器から分岐した流路によって各容器に受容体発現細胞を分配する構成でもよい。前者の場合には、匂い物質供給手段6及び培養液供給手段7は、各容器に一組ずつ有してもよい。
複数個の容器を有する細胞チップの別の態様として、基板の一方の表面に細胞を格納するための複数の容器(マイクロウェル)を有するマイクロウェルアレイチップを使用することもできる。
このような複数個の容器を有する細胞チップでは、各容器に、対象となる異なった種類の匂い物質に対して互いに異なった嗅覚受容体タンパク質を発現している細胞を保持することができる。このような細胞チップでは、対象となる匂い物質を接触させた時の、容器ごとに異なる蛍光強度を示すその応答パターンを確認することにより、当該匂い物質を検出することができる。また、このような細胞チップを用いれば、同一のチップ上で複数の種類の匂い物質を同時に検出することもできる。
【0033】
細胞チップ2の下流側には、廃液回収手段を有する。廃液回収手段は、コネクタ10bによって流路5に接続された廃液管9dと、廃液回収容器8とからなる。廃液回収手段は、容器4で保持されなかった細胞、廃培養液等を回収する。
なお、容器4に保持された細胞であっても死滅すると容器4から浮き上がるため、廃培養液として廃液回収手段にて回収される。これによって、容器4には死滅した細胞が残ることなく、匂い物質の安定した検出が可能になる。
【0034】
培養液は、炭素源、窒素源、金属塩、ミネラル、ビタミン等を含む通常の培地であればよく、培養条件も二酸化炭素の存在を必要としない。培養液のpHは、受容体発現細胞が生育し得る範囲のpHであればよく、pH 6.0〜7.0程度に調整するのが好適である。培養温度は、受容体発現細胞が生育し得る温度であればよく、通常25〜30℃程度に調整するのが好ましい。
【0035】
センサ12は、例えば、細胞チップ2の裏面側に配置され(図1参照)、2次元アレイ状に光電変換素子が配置されたセンサと、センサ上に容器4の像を結合する結像光学系とを有する。細胞チップ2とセンサとの間にバンドパスフィルタをさらに備えてもよい。フィルタは、細胞が発する蛍光が持つ波長の光を透過し、その他の波長の光を透過しないものが好ましい。なお、センサ12は、細胞チップ2の表面側に配置してもよい。
【0036】
センサ12が有する光電変換素子は、例えば、CCD型イメージセンサ又はCOMS型イメージセンサとすることができる。センサ12は、例えば、撮影領域が300万画素以上の解像度を持ち、細胞1つ当たりの蛍光を撮影素子の4画素以上で捕らえることができる機能を持つものであることが好ましい。そして、センサ12は、容器の像が特定の領域に写った蛍光画像を生成する。
【0037】
図4は、蛍光画像の模式図を示す。容器4の像は蛍光画像400の領域4’に生成される。したがって、例えば、容器4内に含まれる細胞が発光すると、領域4’内のその細胞の像が写っている画素の輝度が増加する。
【0038】
センサ12は、生成した蛍光画像を判定器13に渡す。
判定器13は、プロセッサ、半導体メモリ及び周辺回路を有し、センサ12から出力された蛍光画像に基づいて対象となる匂い物質を検出する。判定器13は、センサ12から出力された蛍光画像において、例えば、蛍光画像上の容器の領域について、対象となる匂い物質が接触する前の、その容器が写っている領域の平均輝度値と、当該物質が接触した後の、その領域の平均輝度値とを比較し、後者の平均輝度値が、例えば5%以上、好ましくは10%以上、より好ましくは20%以上増加している場合に、その容器において対象となる匂い物質を検出できたと判定する。
別の実施態様では、判定器13は、例えば、蛍光画像上の容器の領域について、対象となる匂い物質が接触する前の輝度値よりも、当該物質が接触した後の輝度値が、所定の輝度閾値以上(例えば5%以上、好ましくは10%以上、より好ましくは20%以上)高くなった画素数が、その容器に対応する領域に含まれる画素数の所定の割合以上、例えば1/1000〜1/100以上検出された場合に、その容器において対象となる匂い物質が検出されたと判定してよい。
【0039】
図1に示すように容器の数が1個の場合には、センサ12は、フォトダイオード又はフォトマルを用いてもよい。一方、容器の数が複数の場合には、センサ12は、容器ごとにフォトダイオードと集光光学系とを有してもよい。これらの場合には、センサ12は1つの容器について細胞が発する光の蛍光強度に対応した強度を有する1つの信号を出力する。この場合、判定器13は、各容器に対応するフォトダイオード又はフォトマルから出力された信号強度が、匂い物質が接触する前よりも接触した後に5%以上、好ましくは10%以上、より好ましくは20%以上増加していれば、匂い物質が検出されたと判定してよい。
【0040】
本発明の匂いセンサは、場合により判定器13を有さず、センサ12からの信号をそのまま出力してもよい。
【0041】
本発明の匂いセンサは、対象となる匂い物質をppbレベルの高感度でかつ高い識別能で検出でき、長期間にわたり使用可能であり、しかも携帯性を有する。さらに、本発明の匂いセンサは、6ケ月間以上凍結保存することもできる。したがって、本発明の匂いセンサは、日常生活の安全や安心の質の向上のためのさまざまな場面での利用が期待される。例えば、ガス漏れ検知、火災発生の早期発見、有害物質や環境汚染物質のモニタリング、被災地での匂いを手掛かりとした救助活動、さらに空港での麻薬などの検査、爆発物や地雷の検知などである。
【0042】
以下に、昆虫の嗅覚受容体タンパク質発現細胞の作製例、及び匂い物質の検出例を示す。
例1.昆虫の嗅覚受容体タンパク質発現細胞の作製
(1)GCaMP3を発現するベクターの作製
Looger研究室から提供を受けたGCaMP3遺伝子(アクセッション番号:HM143847.1)のcDNAの開始コドンから終止コドンまでを、開始コドン(ATG)の直前にコザック配列(GCCGCC)を付加したプライマーでPCR増幅し、昆虫培養細胞発現用ベクターpIZ/V5-His(Invtrogen社製)のマルチクローニングサイトに挿入し、GCaMP3を発現するpIZ-GCaMP3ベクターを作製した(図2)。
PCR増幅は、各100pMの濃度の以下のフォワードプライマー(配列番号1)及びリバースプライマー(配列番号2)、PrimeSTAR HS DNA polymerase(タカラバイオ(株)R010A)、添付の反応バッファー及びdNTPを使用し、添付のプロトコールに従って行った。PCR反応は、94℃で1分間の反応の後、98℃で10秒間、55℃で15秒間、72℃で1.5分間の温度サイクルを30サイクル、その後72℃で5分間反応させる条件で行った。
フォワード:5'-GCGGCCGCCATGGGTTCTCATCATCATCATC-3’(配列番号1)
リバース:5'-GGTCTAGATTACTTCGCTGTCATCATTTGTAC-3’(配列番号2)
(2)嗅覚受容体タンパク質遺伝子及びOr83bファミリータンパク質遺伝子を共発現するデュアル発現ベクターの構築
卵母細胞を用いた本発明者らの研究(例えば、非特許文献3)に記載されているように、嗅覚受容体タンパク質遺伝子とOr83bファミリータンパク質遺伝子とを1:1の割合で発現させることで当該受容体の機能の発現が可能となることから、カイコガ(Bombyx mori)の性フェロモン受容体タンパク質遺伝子であるBmOR1(アクセッション番号:AB059431)又はBmOR3(アクセッション番号:AB186505)と、カイコガのOr83bファミリー遺伝子であるBmOR2(アクセッション番号:AB100454)を同程度発現できるデュアル発現ベクターを構築した(図3)。
まず、pIBベクター(Invtrogen社製)のマルチクローニングサイトに、カイコガの触角cDNA由来のBmOR2遺伝子の開始コドンから終止コドンまでを、コザック配列(GCCGCC)を付加したプライマーで増幅したBmOR2(ORFの完全長)を挿入し、pIB-BmOR2ベクターを構築した。次に、カイコガの触角cDNA由来のBmOR1遺伝子又はBmOR3遺伝子の開始コドンから終止コドンまでを、それぞれコザック配列を付加したプライマーで増幅して、増幅されたBmOR1又遺伝子(ORFの完全長)又はBmOR3遺伝子(ORFの完全長)を得た。使用したプライマー配列は以下のとおりであり、PCR反応条件は「GCaMP3を発現するベクターの作製」で示した条件と同様である。
BmOR1:
フォワード:5'-GCGGCCGCCATGTTACTATCCTTCAAAGATGAC-3’(配列番号3)
リバース:5'-GGTCTAGATTATGTTGCCACCGTTCGAAG-3’(配列番号4)
BmOR3:
フォワード:5'-GCGGCCGCCATGATATTCGTCGACGATGCTG-3’(配列番号5)
リバース:5'-GGTCTAGATCATTCGGACACGGTACG-3’(配列番号6)
BmOR2:
フォワード:5'-GCGGCCGCCATGATGACCAAGGTCAAGACGC-3’(配列番号7)
リバース:5'-GGTCTAGACTACTTCAGTTGGATCAACACC-3’(配列番号8)
一方、pIZベクター(Invtrogen社製)でタンパク質発現カセット(OpIE2プロモーター(P(OpIE2))→OpIE2ポリA付加シグナル(OpIE2pA))と連なる部分)を構築し、pIB-BmOR2ベクターのBspH1部位に、増幅されたBmOR1又遺伝子又はBmOR3遺伝子を挿入し、2種類のデュアル発現ベクターpIB-BmOR1-BmOR2、及びpIB-BmOR3-BmOR2を構築した。
(3)嗅覚受容体タンパク質発現細胞の作製
前記デュアル発現ベクター及びpIZ-GCaMP3ベクターをリポフェクション法(Cellfectin;Invitrogen社製)により、Sf21細胞に導入した。
【0043】
例2.ディッシュによる昆虫フェロモンの検出
BioCoatコラーゲンディッシュ(Becton, Dickinson and Company、NJ、USA)に例1で作製したSf21細胞の溶液(約1×106 細胞数/ml)を接着させ、培養細胞カルシウムイメージング用のリンガー液(140mM NaCl, 5.6mM KCl, 2.0mM CaCl2, 2.0mM MgCl2, 5mM HEPES, 9.4mM グルコース, 1.25mM KH2PO4, pH7.4)2mlを添加し、1.5ml/分の流速でリンガー液を灌流させた。ここに、室温で、各10μMのボンビコール(BOL)、ボンビカール(BAL)のリンガー液500μlを注入し、これらの匂い物質に対する匂い応答を測定した(図5)。
その結果、嗅覚受容体タンパク質BmOR1はボンビコールに、嗅覚受容体タンパク質BmOR3はボンビカールに選択的に応答することが明らかとなった。
さらに、添加するボンビコール及びボンビカールの濃度を30nM〜10μMまで変化させながら匂い応答を測定した(図6)。
【0044】
例3.昆虫の嗅覚受容体タンパク質発現細胞の安定発現系統の作出
長期間安定して匂い応答を検出できる嗅覚受容体タンパク質発現細胞の安定発現系統を得るため、例1で作製したSf21細胞を希釈法とシリンダー法(InsectSelect(商標)BSD System(Invitrogen社製))によってスクリーニングした。
【0045】
希釈法によるスクリーニングでは、例1で作製したSf21細胞を、ゼオシン入りの培地(例2で使用したリンガー液)(終濃度300μg/ml)及びブラストサイジン(終濃度80μg/ml)で希釈することで、細胞数を減らしつつ、嗅覚受容体タンパク質遺伝子が組み込まれたベクターが導入された細胞のみを選抜する。リポフェクション法による遺伝子の導入効率は、数%〜数十%程度なので、通常、希釈された細胞群の中で、数%〜数十%の細胞が当該ベクターを保持している。したがって、当該ベクターを保持していない細胞は死滅し、当該ベクターを保持した細胞は生き残るため、希釈して生き残った細胞を選抜することにより、同じ形質を持った細胞が得られる。
シリンダー法によるスクリーニングでは、前記Sf21細胞を、上記抗生物質入りの培地で培養し、形成したコロニーを回収する。コロニーは、1つの細胞から形成されるので、1つのコロニーを回収することにより、同じ形質を持った細胞が得られる。
【0046】
その結果、BmOR1-BmOR2-GCaMP3を発現しているSf21細胞では、希釈法及びシリンダー法で24個のコロニーが選抜され、その選抜されたコロニーの中で10系統が2ケ月間継代可能であり、その継代可能な系統の中で8系統(BmOR1-1〜2、BmOR1-4〜8、及びBmOR1-10)がカルシウムイメージングにより蛍光変化量の測定が可能であった。一方、BmOR3-BmOR2-GCaMP3を発現しているSf21細胞では、5個のコロニーが選抜され、5系統が継代可能であり、その中で3系統(BmOR3-1、3及び4)がカルシウムイメージングにより蛍光変化量の測定が可能であった(図7)。本明細書では、上記のBmOR1の8系統及びBmOR3の3系統を「安定発現系統」とする。各細胞系統の左側のパネルは、対象となる匂い物質を接触させる前のカルシウムイメージング画像を、右側のパネルは、対象となる匂い物質を接触させた後のカルシウムイメージング画像を示す。
なお、例3で「蛍光変化量の測定が可能」とは、対象となる匂い物質を接触させる前の蛍光強度に対する、当該匂い物質を接触させた後の蛍光強度の増加率が20%以上であることを意味する。
図7の結果を匂い物質に応答した細胞の割合に換算すると([容器内の全細胞数の内、20%以上の蛍光強度変化を示した細胞数]/[容器内の全細胞数]×100(%))、細胞系統によっては60%以上の細胞が応答している系統も存在することが明らかとなった(表1)。
【0047】
【表1】

【0048】
例4.安定発現系統BmOR1-6を発現した細胞チップによる昆虫フェロモンの検出
図1に示した本発明の細胞チップと同じ構成のガラス製マイクロ化学チップ(マイクロ化学技研株式会社製)に、BmOR1-6を発現したSf21細胞を含む例2のリンガー液(約1×106〜1×105 細胞数/ml)2mlを添加して、当該細胞を接着させた。チップの流路にリンガー液を室温で流速数十〜数百μl/分で72時間流しながら、10μMのボンビコールのリンガー液を接触させて、ボンビコールに対する応答を測定した(図8)。
【0049】
例5.昆虫フェロモン以外の匂い物質の検出
キイロショウジョウバエ(Drosophila melanogaster)の嗅覚受容体タンパク質Or43a(アクセッション番号:NM_078923.2)又はOr47a(アクセッション番号:NM_078965.2)を発現させたSf21細胞を例1と同様に構築し(Or43a、Or47a、及びOr83の各遺伝子については、データベースFlybase(http://flybase.org/)で取得できるCDSの完全長を使用)、例2に記載の方法と同様にして、ペンチルアセテート及びシクロヘキサノンに対する匂い応答を各々測定した(図9)。その結果、Or43aはシクロヘキサノンにより選択的に応答し、Or47aはペンチルアセテートに選択的に応答することが明らかとなった。
【符号の説明】
【0050】
1 匂いセンサ
2 細胞チップ
3 基板
4 容器
5 流路
6 匂い物質供給手段
6a 匂い物質取り込み口
7 培養液供給手段
8 廃液回収手段
9a 匂い物質供給管
9b 培養液供給管
9c 移送管
9d 廃液管
10a、10b コネクタ
11 バルブ
12 センサ
13 判定器
【特許請求の範囲】
【請求項1】
基板上に設けられた容器に、昆虫の嗅覚受容体タンパク質及び蛍光タンパク質を共発現しているスポドプテラ・フルギペルダ(Spodoptera frugiperda)細胞であって、検出対象となる匂い物質を含む試料を接触させることによって前記細胞内イオン濃度の変化に基づいて光を発する細胞を保持してなる、細胞チップと、
前記光を検出すると信号を出力するセンサと、
前記信号に基づいて前記匂い物質を検出する判定器と、
を有する、匂いセンサ。
【請求項2】
前記容器は複数個存在し、その複数個の容器の各々に保持された前記細胞は、検出対象となる異なった種類の匂い物質に対して互いに異なった昆虫の嗅覚受容体タンパク質を発現し、かつ前記匂い物質を含む試料を前記複数個の容器の各々に接触させることによって光を発し、
前記センサは、前記複数個の容器の各々における光を検出すると信号を出力し、
前記判定器は、前記各信号に基づいて異なった種類の匂い物質を検出する、請求項1に記載の匂いセンサ。
【請求項3】
前記出力するセンサが光の強度に応じた信号を出力し、かつ、前記判定器が前記信号の強度に基づいて前記匂い物質を検出する、請求項1又は2に記載の匂いセンサ。
【請求項4】
前記細胞チップは、前記容器中を細胞培養液を流下させる手段をさらに有する、請求項1〜3のいずれか1項に記載の匂いセンサ。
【請求項5】
前記蛍光タンパク質は、カルシウム感受性蛍光タンパク質である、請求項1〜4のいずれか1項に記載の匂いセンサ。
【請求項6】
前記カルシウム感受性蛍光タンパク質は、GCaMP3である、請求項5に記載の匂いセンサ。
【請求項1】
基板上に設けられた容器に、昆虫の嗅覚受容体タンパク質及び蛍光タンパク質を共発現しているスポドプテラ・フルギペルダ(Spodoptera frugiperda)細胞であって、検出対象となる匂い物質を含む試料を接触させることによって前記細胞内イオン濃度の変化に基づいて光を発する細胞を保持してなる、細胞チップと、
前記光を検出すると信号を出力するセンサと、
前記信号に基づいて前記匂い物質を検出する判定器と、
を有する、匂いセンサ。
【請求項2】
前記容器は複数個存在し、その複数個の容器の各々に保持された前記細胞は、検出対象となる異なった種類の匂い物質に対して互いに異なった昆虫の嗅覚受容体タンパク質を発現し、かつ前記匂い物質を含む試料を前記複数個の容器の各々に接触させることによって光を発し、
前記センサは、前記複数個の容器の各々における光を検出すると信号を出力し、
前記判定器は、前記各信号に基づいて異なった種類の匂い物質を検出する、請求項1に記載の匂いセンサ。
【請求項3】
前記出力するセンサが光の強度に応じた信号を出力し、かつ、前記判定器が前記信号の強度に基づいて前記匂い物質を検出する、請求項1又は2に記載の匂いセンサ。
【請求項4】
前記細胞チップは、前記容器中を細胞培養液を流下させる手段をさらに有する、請求項1〜3のいずれか1項に記載の匂いセンサ。
【請求項5】
前記蛍光タンパク質は、カルシウム感受性蛍光タンパク質である、請求項1〜4のいずれか1項に記載の匂いセンサ。
【請求項6】
前記カルシウム感受性蛍光タンパク質は、GCaMP3である、請求項5に記載の匂いセンサ。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【公開番号】特開2013−27376(P2013−27376A)
【公開日】平成25年2月7日(2013.2.7)
【国際特許分類】
【出願番号】特願2011−167293(P2011−167293)
【出願日】平成23年7月29日(2011.7.29)
【出願人】(511185449)
【出願人】(000108085)セコム株式会社 (596)
【Fターム(参考)】
【公開日】平成25年2月7日(2013.2.7)
【国際特許分類】
【出願日】平成23年7月29日(2011.7.29)
【出願人】(511185449)

【出願人】(000108085)セコム株式会社 (596)
【Fターム(参考)】
[ Back to top ]

