化合物のキャラクタリゼーション法
宿主細胞内での情報伝達経路及び/又は細胞プロセスに対する被験因子の活性及び/又は機能のインビトロキャラクタリゼーション法であって、生細胞で非破壊的に実施される方法について開示する。本発明の方法はイメージング装置及びコンピューター化されたデータ処理装置と共に使用できる。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、情報伝達経路及び細胞プロセスに対する化合物又は分子の影響のキャラクタリゼーション又はプロファイリング法に関する。
【背景技術】
【0002】
新薬の開発は一般に、ハイスループット一次スクリーニングでの多数の化合物の評価とその後の二次スクリーニングにおける化合物の活性及び特異性のさらに詳しい検査を伴う。一次スクリーニング分析は通例リガンド結合性のような簡単な分子検定であり、最も活性な化合物を選択すべくさらに評価するための被験分子の活性に関しては低レベルの情報しか得られない。従って、作用モード、特異性、細胞毒性その他のパラメーターに対処し得る様々な機能検定に基づいて化合物を進展すべきか決定がなされるのは二次スクリーニングである。化合物の進展はこの時点を過ぎるとコストが増大するので、リード化合物の有効なキャラクタリゼーション又はプロファイリング及び最適特性をもつ化合物の選択が、創薬プロセス全体でのキイポイントとなる活動である。有効なリードプロファイリングを達成するには、二次スクリーニングアッセイで、化合物特性の包括的かつ詳細な調査を得る必要があり、そのため創薬業界では多岐にわたるパネルのリードプロファイリング細胞アッセイを並列的に多数のリード化合物に効率的に適用する手段が望まれている。
【0003】
分子アッセイのアレイを用いた化合物のプロファイリングについては様々な方法が考案されている。米国特許第5811231号には、化合物によって引き起こされる細胞の生化学的及び生物物理的ホメオスタシスに対する毒性障害を同定する方法が記載されている。米国特許第6509153号には、核酸ハイブリダイゼーションを用いて細胞での調節解除細胞生存性又は増殖に特徴的な遺伝子の発現を決定するための被験化合物の潜在的毒性の決定法が記載されている。国際公開第03042654号には、同定された疾病特色及び薬剤特色遺伝子の各々に対してスコア値を導き出して、その疾病を治療するのに効果的な薬剤の指標を得ることによって、有効な治療の指標となる1以上の遺伝子を選択する方法が記載されている。国際公開第0039336号には、コンセンサスプロファイルを用いた薬剤活性のキャラクタリゼーションによって、所定の生物学的応答に対する薬剤の有効性又は毒性に関連する応答プロファイルを得る方法が記載されている。
【0004】
従来の方法は総じて、化合物のプロファイリングの際に、遺伝子発現パターンを分析することを特徴とする。かかるパターンはリード化合物の活性の指標となり得るが、規定された細胞経路及び過程に対する化合物の活性の標的又は種類に関する直接的な情報は得られない。別のリードプロファイリング法では、細胞アッセイにおける特定の読取値に基づく分析を用いて、化合物の活性のより直接的なキャラクタリゼーション法を採用している。
【0005】
国際公開第0234881号には、組込みレポーター遺伝子を有する安定な株化細胞を生成、使用し、薬剤候補のライブラリーをスクリーニングして潜在的な治療剤を同定し、組込みレポーターを調節する遺伝子を同定する方法が記載されている。米国特許第5928888号には、β−ラクタマーゼレポーター遺伝子を細胞のゲノムに挿入することによって遺伝子発現を直接的又は間接的に調節するタンパク質又は化合物を同定し、この細胞を所定濃度のモジュレーターと接触させ、細胞のβ−ラクタマーゼ活性を検出する方法が記載されている。国際公開第9706277号には、標的生物の別々に単離された複数の異なる細胞の各々からレポーター遺伝子産物シグナルを検出することによって候補薬剤の生理学的特異性を評価する方法が記載されており、ここで各々の細胞は異なる内因性転写調節要素に連結されたレポーター遺伝子を含有しており、細胞の合計は候補薬剤の生理学的特異性の評価に十分な生物の転写調節要素の全体を含んでいる。
【0006】
これらの検定では、上述の遺伝子発現の広範な調査を用いるアプローチよりも化合物の活性に関して直接的な指標が得られるが、レポーター遺伝子検定が情報伝達経路の終点に位置付けられることと、細胞情報伝達経路内及びそれらの間の相互作用の複雑な性質とが相俟って、プロファイリングプロセスにおいてリード化合物の可能な作用モード間の有効な識別を達成するには、多数のかかる検定を同時に遂行する必要が生じる。さらに、かかるアプローチ用の多数の安定に工学処理された株化細胞を生成し、維持し、有効に利用することの必要性のため、重大な論理学的問題が生じる(Pagliaro & Praestegaard, 2001, J. Biomol. Screen. 6(3), 133−136)。
【0007】
安定に工学処理された細胞を使用することの制限を克服し、従って多様なセットのアッセイを化合物プロファイリングに適用できるようにするべく、細胞を工学処理してアッセイ成分を一過的に発現させるために幾つかの技術が開発されている。米国特許第6544790号には、核酸を含有する複数の混合物をある表面上の離散し規定された位置にデポジットすることによって核酸を発現するトランスフェクトされた細胞のアレイを生成し、その混合物をその表面上で乾燥させ、その表面上で哺乳動物細胞を核酸が細胞に入り込むのに適当な条件下で平板培養する方法が記載されている。この方法によって、多数の異なるアッセイレポーターを哺乳動物細胞で同時に発現させることができる(一般に「細胞アレイ」と呼ばれる)。その後、細胞アレイを被験化合物に曝露することによって、細胞アッセイのパネルに対する化合物の活性を読み取ることができる。リードプロファイリング用のハイスループットの小型化フォーマットが得られるが、この細胞アレイの生成法には2つの欠点がある。すなわち、使用するプラスミドに基づく化学的トランスフェクション法はトランスフェクション効率にばらつきがあり、その使用が限られた数の細胞型に制限され、また、必要とされるプリントされたアレイの固定フォーマットは手順及び/又は検定における変化を包含するためのこの方法の柔軟性を制限する。
【0008】
アデノウィルスベクターは、プラスミドベクターよりも優れた利点があることがよく知られており、トランスジェニックDNAを発現する細胞を高い割合で生成し、広範な宿主細胞を形質導入することが可能であり(Dietz et al, 1998, Blood, 91(2), 392−8、Hatanaka et al, 2003, Mol Ther.8(1):158−66)、従って哺乳動物細胞で広範なリードプロファイリング検定を有効に利用するための取扱い易いルートを与える。アデノウィルスベクターは、機能性ゲノミクスにおいて、遺伝子機能を決定するルートとしてタンパク質を発現させるために広く使用されている。米国特許第6413776号には、アデノウィルスベクター中で核酸ライブラリーを構築し、宿主細胞で発現させて1以上の表現型を変更し、その変化した表現型に関連する核酸にコードされた産物に生物学的機能を割り当てることによって、核酸及びその産物の機能を同定するハイスループット法が記載されている。
【0009】
細胞にレポーター遺伝子を形質導入するためにアデノウィルスベクターを用いた幾つかの限られた使用例も既に記載されている(Hartig et al, 2002, Toxicol Sci.66(1):82−90)。これらの著者らは、公知の一連の内分泌攪乱物質を評価するために細胞溶解を必要とするルシフェラーゼレポーター系に基づくインビトロの検定を開発した。残念ながら、かかるインビトロの技術は細胞溶解に起因する人為的な影響を受け易い可能性があり、生細胞に対するリアルタイムの研究には使用することができない。
【0010】
国際公開第01/81608号には、細胞に感染するHIVウィルスから発現されたHIVタンパク質の存在下でその活性が増大するレポーター遺伝子をコードするウィルスベクターを用いて細胞に形質導入する方法が記載されている。HIV誘導性プロモーターの制御下にGFPレポーターを含むアデノウィルスベクターが記載されており、これは臨床試料中のHIVの存在を検出したり、又は抗−HIV薬剤をスクリーニングしたりするのに使用することができる。この方法によって、単一のアナライトの量を測定することによって、HIV感染の存在を検出したり、及び/又はHIVに対する薬剤の効果をスクリーニングしたりする手段が提供される。
【特許文献1】米国特許第5811231号明細書
【特許文献2】米国特許第6509153号明細書
【特許文献3】国際公開第03/042654号パンフレット
【特許文献4】国際公開第00/39336号パンフレット
【特許文献5】国際公開第02/34881号パンフレット
【特許文献6】米国特許第5928888号明細書
【特許文献7】国際公開第9706277号明細書
【特許文献8】米国特許第6544790号明細書
【特許文献9】米国特許第6413776号明細書
【特許文献10】国際公開第01/81608号パンフレット
【非特許文献1】Pagliaro & Praestegaard, 2001, J. Biomol. Screen. 6(3), 133−136
【非特許文献2】Dietz et al, 1998, Blood, 91(2), 392−8
【非特許文献3】Hatanaka et al, 2003, Mol Ther.8(1):158−66
【非特許文献4】Hartig et al, 2002, Toxicol Sci.66(1):82−90
【発明の開示】
【発明が解決しようとする課題】
【0011】
以上の先行技術文献のいずれにも、広範な細胞経路及び過程を標的とする、多様な範囲のアデノウィルスにコードされた細胞アッセイに同時に適用して、創薬における化合物の機能及び活性の詳細なプロファイリングを可能とすることは記載されていない。
【課題を解決するための手段】
【0012】
本発明の第1の態様では、宿主細胞内での情報伝達経路及び/又は細胞プロセスに対する被験因子の活性及び/又は機能のインビトロキャラクタリゼーション方法であって、
a)複数のウィルスコード化アッセイの第1のセットからのアッセイを、複数の容器を含む第2のセット内に位置する宿主細胞で一過的に発現させ、
b)適宜、被験因子を1以上の容器に添加し、
c)1以上のアッセイの測定を実施し、
d)アッセイの測定値を組合せてデータセットを生成し、
e)データセットを分析して被験因子の機能的特性を求める
ことを含んでなり、上記アッセイの測定を生細胞で非破壊的に実施することを特徴とする方法を提供する。
【0013】
「一過的」という用語は、ウィルス形質導入によって宿主細胞に導入された物質の発現が本質的に安定でないことをいう。
【0014】
「複数」とは、2以上を意味する。好適には、複数とは2、3、4、5、6、7,8、9又は10を意味する。好ましくは、複数とは15、20、25、30、35、40、45又は50を意味する。さらに好ましくは、複数とは75、100、125、150、175又は200を意味する。
【0015】
「セット」という用語は集合を定義するために用いる。セットは、各アッセイ及び/又は容器の位置が既知である特定のフォーマット(例えば、96ウェルマイクロプレート)を有するアレイの形態を取り得る。別の実施形態では、セットはアッセイ又は容器の集合であって、その集合における各アッセイ又は容器の位置が既知であるものであってもよい。
【0016】
好適には、1種以上の異なるウィルスコード化アッセイが各容器内の宿主細胞で発現される。
【0017】
好適には、各容器は異なる宿主細胞を含む。適宜、各容器は同一の宿主細胞又は同一の宿主細胞の遺伝的変異体を含む。
【0018】
好ましくは、アデノウィルスベクター又はレンチウィルスベクターを用いて、ウィルスコード化アッセイを宿主細胞で発現させる。
【0019】
好適には、組換え昆虫ウィルスベクター、例えばBacMam(Ames R.et al, Receptors Channels. 2004;10(3−4):117−24.)を用いて、ウィルスコード化アッセイを宿主細胞で発現させる。
【0020】
好適には、アッセイは検出可能なタンパク質を含む。好ましくは、検出可能なタンパク質は蛍光タンパク質又は改変蛍光タンパク質である。蛍光タンパク質及び色素タンパク質の蛍光タンパク質誘導体は、Aequoria victoria、Anemonia種(例えば、A.majano及びA.sulcata)、Renilla種、Ptilosarcus種、Discosoma種、Claularia種、Dendronephthyla種、Ricordia種、Scolymia種、Zoanthus種、Montastraea種、Heteractis種、Conylactis種及びGoniopara種を始めとする広範な生物から単離されている。
【0021】
さらに好ましくは、蛍光タンパク質は緑色蛍光タンパク質(GFP)又は変性GFPである。最も好ましくは、改変緑色蛍光タンパク質(GFP)は、F64L、Y66H、Y66W、Y66F、S65T、S65A、V68L、Q69K、Q69M、S72A、T2031、E222G、V163A,1167T、S175G、F99S、M153T、V163A、F64L、Y145F、N149K、T203Y、T203Y、T203H、S202F及びL236Rからなる群から選択される1以上の突然変異を含む。
【0022】
好適には、検出可能なタンパク質は酵素である。好ましくは、酵素は、β−ガラクトシダーゼ、ニトロ還元酵素、アルカリホスファターゼ及びβ−ラクタマーゼからなる群から選択される。これらのタンパク質は、細胞に添加した適当な基質に対するその酵素作用によって検出できる。かかる基質の例としては、ニトロ消光性CyDyesTM(GE Healthcare Bio−Sciences社、ニトロ還元酵素基質)、ELF 97(Molecular Probes社、アルカリホスファターゼ基質)及びCCF2(Aurora Biosciences社、β−ラクタマーゼ基質)がある。
【0023】
好適には、アッセイは、MAPKAPキナーゼ2、グルココルチコイド受容体(GCCR)、上皮成長因子(EGF)、ERK1、アンドロゲン受容体(AR)、STAT3、NFAT1、SMAD2、AKT1−PH、FYVE−PH、NFkB、PLC−PH及びRaclからなる群から選択される。MAPKAPキナーゼ2、ERK1、STAT3、NFAT1、SMAD2、AKT1−PH、FYVE−PH、PLC−PH及びRac1緑色蛍光タンパク質アッセイは市販されている(GE Healthcare Bio−Sciences社(英国Little Chalfont))。
【0024】
好適には、宿主細胞は真核細胞であり、遺伝子改変されたものでも、遺伝子改変されていないものでもよい。好ましくは、真核細胞は哺乳動物細胞である。さらに好ましくは、宿主細胞はヒト細胞である。
【0025】
好適には、被験因子は化学作用因子又は物理作用因子である。
【0026】
好適には、化学作用因子は有機又は無機化合物である。かかる有機及び無機化合物が潜在的な薬剤又は医薬として、本発明の方法に従って試験される。これらの化合物は通例低分子量(300ダルトン未満)の合成分子である。好ましくは、有機化合物はペプチド、ポリペプチド、タンパク質、炭水化物、脂質、核酸、ポリヌクレオチド及びタンパク質核酸からなる群から選択される。
【0027】
好適には、物理作用因子は電磁放射線である。
【0028】
好適には、ステップb)を行わずに、被験因子の非存在下で当該方法を実施する。
【0029】
好適には、本発明の方法の分析ステップe)は、被験因子の存在下で得られた各アッセイ測定値を、被験因子の非存在下で得られた同じアッセイの測定値と比較することからなる。
【0030】
適宜、被験因子の非存在下でのアッセイ測定値は既知であり、データベースに記憶されている。これによって、本発明の方法の実施に要する時間が短縮され、スクリーニングスループットを増大させることができる。
【0031】
好ましくは、本発明方法のアッセイは、特にアッセイが緑色蛍光タンパク質のような蛍光性レポーターに基づく場合、イメージング装置を用いて測定される。適当なイメージング装置としては、IN Cell Analyzer 3000又はIN Cell Analyzer 1000(GE Healthcare Bio−Sciences社(英国Little Chalfont))がある。
【0032】
本発明の第2の態様では、上記方法をイメージング装置及びコンピューター化されたデータ処理装置と共に使用することを含む、細胞集団に対する被験因子の活性及び/又は機能を自動化キャラクタリゼーション装置が提供される。
【0033】
本発明の第3の態様では、宿主細胞内での情報伝達経路及び/又は細胞プロセスに対する被験因子の活性及び/又は機能のキャラクタリゼーションのための複数のウィルスコード化アッセイを備える部品のキットが提供される。
【0034】
好適には、ウィルスコード化アッセイはアデノウィルスベクター又は組換えヒト昆虫ウィルスベクターからなる。
【0035】
好ましくは、アッセイはMAPKAPキナーゼ2、グルココルチコイド受容体(GCCR)、上皮成長因子(EGF)、ERK1、アンドロゲン受容体(AR)、STAT3、NFAT1、SMAD2、AKT1−PH、FYVE−PH、PLC−PH及びRac1からなる群から選択される。
【0036】
好適には、アッセイは検出可能なタンパク質からなる。好ましくは、検出可能なタンパク質は蛍光タンパク質又は改変蛍光タンパク質である。さらに好ましくは、蛍光タンパク質は緑色蛍光タンパク質(GFP)又は変性GFPである。最も好ましくは、改変緑色蛍光タンパク質(GFP)は、F64L、Y66H、Y66W、Y66F、S65T、S65A、V68L、Q69K、Q69M、S72A、T2031、E222G、V163A、1167T、S175G、F99S、M153T、V163A、F64L、Y145F、N149K、T203Y、T203Y、T203H、S202F及びL236Rからなる群から選択される1以上の突然変異を含む。
【0037】
好適には、検出可能なタンパク質は酵素である。好ましくは、酵素はβ−ガラクトシダーゼ、ニトロ還元酵素、アルカリホスファターゼ及びβ−ラクタマーゼからなる群から選択される。
【0038】
好ましくは、キットはさらに、酵素に対する基質を含んでいる。従って、タンパク質は、細胞に加えられた適当な基質に対する酵素の作用によって検出することができる。かかる基質の例としては、ニトロでクエンチされるCyDyesTM(GE Healthcare Bio−Sciences、ニトロ還元酵素基質)、ELF 97(Molecular Probes、アルカリホスファターゼ基質)及びCCF2(Aurora Biosciences、β−ラクタマーゼ基質)がある。
【0039】
最も好ましくは、酵素がニトロ還元酵素であり、基質がその基質である。
【発明を実施するための最良の形態】
【0040】
本発明の方法を説明する上で、以下、図を参照する。
【0041】
本発明の方法は幾つかの変形で利用することができ、そのうちの幾つかを図1に示す。
【0042】
図1Aは本発明の方法の一つの適用例を示し、コードされるアッセイの第1のセット又はアレイを使用して第2のセット又はアレイの細胞に形質導入するが、第1及び第2のセット又はアレイは要素の大きさと数が同じであり、例えば、96ウェルの第1のアレイを単一の細胞型を含有する96ウェルの第2のアレイにレプリカ平板培養するものである。
図1Bは本発明の方法の一つの適用例を示し、ウィルスコード化アッセイの第1のセット又はアレイを使用して第2のセット又はアレイの細胞に形質導入し、第2のセット又はアレイが第1のアレイの4倍であるが、第1のアレイの要素の大きさと間隔を保持しており、例えば96ウェルの第1のアレイから4つの同じ96ウェルの第2のアレイにレプリカ平板培養するものであり、各々の第2のアレイは異なる細胞型を含有している。図1Cは第3の可能な構成を示しており、ウィルスコード化アッセイの第1のセット又はアレイを使用して第2のセット又はアレイの細胞に形質導入するものであり、第2のセット又はアレイが第1のアレイと異なる要素の大きさと間隔で第1のアレイの4倍であり、例えば96ウェルの第1のアレイから4倍レプリカ平板培養して384ウェルのプレートにして各々のアッセイに対して4倍の複製を提供するものである。
【0043】
本発明の様々な実施形態のこれらの例は、リード化合物のプロファイリングに対するいろいろなアプローチを可能とする本方法の適用における大きな柔軟性を示している。本方法のさらなる柔軟性が、表1に示す例で例示される。
【0044】
【表1】

本発明の方法では、第1のセット又はアレイは、離散した容器のセット又はアレイ、通例96ウェルマイクロプレート内に配置されたウィルスコード化アッセイを含んでいる。これらのアッセイで表される異なるアナライトの数は2〜Nであることができ、ここでNは第1のアレイ内の要素の数である(すなわち、96ウェルプレートの場合、N=2〜96)。本発明の方法では、ウィルスコード化アッセイは、離散した容器の第2のアレイ、例えば第2の96ウェルプレート中の増殖する細胞に適用される。第2のアレイで増殖する細胞型の数は1〜nであることができ、ここでnは第2のアレイ内の要素の数である(すなわち、96ウェルプレートの場合、n=1〜96)。第1及び第2のアレイのフォーマットにおけるこれらの変動は被験化合物の可変の数と組合せることができ、ここで第2のアレイに適用される被験化合物の数は第1のアレイのアッセイの数と反比例して変動する。例えば、第1のアレイが96の別々のアッセイの96ウェルプレートからなり、これを使用して単一の細胞型を用いる第2のアレイを調製する場合、その第2のアレイを使用して単一の被験化合物の96のアッセイのプロファイリングを実施することができる(表1でN:1:1)。
【0045】
他の変形も可能であり、例えば、細胞型間における内因性経路成分の発現が異なるために異なる宿主細胞型が検定に必要とされる場合には、96の別々のアッセイを含む第1のセット又はアレイを使用して幾つかの細胞型(この例では2〜96)を用いる第2のセット又はアレイを調製することができ、その後これを使用して単一の被験化合物をプロファイリングする(表1でN:n:1)。
【0046】
プロファイリング研究の目的が遺伝的バックグランドが被験化合物の活性又は機能に及ぼす影響を決定することであれば、本方法のさらに別の変形を適用することができ、例えば、第1のアレイが2つの異なるアッセイを含有する96ウェルプレートからなり、このアレイを使用して48の異なる細胞型を用いる第2のアレイを調製する場合、この第2のアレイを使用して48の遺伝的バックグランドにおける単一の被験化合物のプロファイリングをすることができる(表1でN:n:1)。以上の例は限定的なものではなく、別の可能な変形は当業者には明らかであろう。
【0047】
本発明の方法に使用する組換えアデノウィルスベクターは、幾つかの方法によって生成することができる(Wang & Huang、2000, Drug Discovery、Today 5、10−16)。最も一般的な方法の1つで、後述の実施例で使用した方法は、2プラスミドレスキュー法に基づくものである。この方法は他で詳細に記載されている(Bett et al, 1993, PNAS 91、8802−8806、米国特許第6140087号、遺伝子療法用アデノウィルスベクター)。
【0048】
cDNA(例えば、MAPKAPキナーゼ2、又はヒトグルココルチコイド受容体−GCCR、GFPをコードするcDNAと融合している)を、「シャトルプラスミド」と呼ばれる第1の核酸構築物の発現カセット中にクローニングした。シャトルプラスミドは、パッケージングシグナル及び逆方向末端反復(ITR)配列を含むアデノウィルス5型ゲノムの左の約340ヌクレオチド、ポリクローニング部位並びにアデノウィルスE1遺伝子領域の右端付近のウィルス配列を含有している。第2の核酸構築物は比較的大きく、pBHG10として知られている(Bett et al, 1993, PNAS 91、8802−8806)。
【0049】
pBHG10プラスミドは、ウィルスゲノムの大部分を含有しており、パッケージングシグナル及びE1遺伝子領域の部分の欠失がなければ感染性のウィルスを生成することができるであろう。シャトルプラスミド内のE1の右端付近のウィルス配列はpBHG10プラスミド内の配列と重複している。クローニングは標準的な実験室技術を用いて行った。両方のプラスミドを、細菌を形質転換した後一晩LBで増殖することによって増幅させた。細菌を遠心分離で沈降させ、変性アルカリ溶解法で処理した(Sambrook et al, 1989, Molecular Cloning:A Laboratory Manual(Cold Spring Harbour Lab.Press)、2nd edition)。第1及び第2の核酸構築物を、標準的なリン酸カルシウム共沈でHEK 293細胞(アデノウィルス5型で形質転換されたヒト胚性腎株化細胞)に同時にトランスフェクトした(Sambrook et al, 1989, Molecular Cloning:A Laboratory Manual(Cold Spring Harbour Lab.Press)、2nd edition)。トランスフェクションの1日後、細胞に、0.5%アガロースを含有する組織培養培地(10%FCSを補充したDMEM)を被せた。これら2つのプラスミドをHEK 293細胞内に同時トランスフェクションすると、第1及び第2の核酸構築物内の重複している配列間で相同組換えが起こる。得られる組換えアデノウィルスベクターは、シャトルプラスミドに由来するパッケージングシグナルと、シャトルプラスミドのポリクローニング部位にクローニングされたcDNAを含有している。いずれのプラスミドも複製ウィルスを生成する能力をもっておらず、ウィルスの子孫は組換えの結果としてのみ生成することができる。E1領域における欠失は293細胞での構成的産生によって相補される。組換えアデノウィルスDNAは、E1相補的パッケージング細胞で複製し増殖して組換えアデノウィルスベクターを生成することができる。約2週間後、組換えアデノウィルスベクターは293細胞でプラークを形成した。これらをアガロース含有培地下で肉眼で観察した。以下に記載する実験に適する力価を有するアデノウィルスベクターを生成するために、単離されたプラークを増殖させることによってストックを生成した。滅菌ピペットの先端でプラークを培地から取り出し、200ulのPBSに加え、293細胞(E1相補的パッケージング細胞)のコンフルエントな単層の付近に加えた。約48時間後、組換えアデノウィルスベクターによる感染の結果として細胞が剥がされるようになり、これを集めて組織培養培地に入れた。3サイクルの瞬間冷凍/解凍によって、アデノウィルスベクターを生産細胞から放出させた。溶解物を3000rpmで10分の遠心分離で清澄にし、陰イオン交換クロマトグラフィーで組換えアデノウィルスベクターを精製した(www.bdbiosciences.com/clontech/products/cat/HTML/1260.shtml)。
【0050】
組換えアデノウィルスベクターの濃度の評価は免疫細胞化学試験を用いて行った(www.bdbiosciences.com/clontech/archive/APR02UPD/pdf/Adeno−X.pdf )。この組換えアデノウィルスベクターは標的細胞に導入することができ、これを増殖させて、ベクター中にクローニングされたcDNAにコードされた産物の十分な発現を可能にすることができる。GFPと融合したタンパク質の発現によって、そのタンパク質の生物学的活性の検出及び分析が可能になる。下記実施例に記載する2つのタンパク質(MAPKAPキナーゼ2及びGCCR)の場合、生物学的活性は、遺伝子と融合したGFPの細胞の1つの領域から別の領域へのトランスロケーションによって評価することができる(Roquemore et al, 2002, Life Science News 11、1−5 Amersham Biosciences)。ライブラリー中のある化合物の生物学的効果の同定の結果として、ヒト疾病の治療用の小分子薬剤を得ることができる。
【0051】
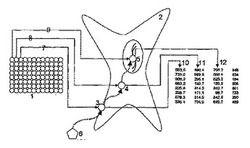
ウィルスにコードされた別々のアッセイのセット又はアレイを用いる本発明の一実施形態に係る、細胞アッセイにおけるリード化合物の活性のプロファイリングへの適用を、図2に示した代表的な例で例証する。ウィルスコード化アッセイのアレイ[1]を使用して、細胞経路及び過程のある範囲のセンサーを宿主細胞[2]内で発現させる。第1のセンサー[7]が細胞表面受容体タンパク質[3]の活性化をモニターし、この受容体タンパク質は第2のタンパク質[4]を活性化し、この第2のタンパク質は第2のセンサー[8]でモニターされ、次に遺伝子発現[5]を活性化し、これが第3のセンサー[9]でモニターされる。ウィルスにコードされたセンサーのこの組合せによって、成分[3]、[4]及び[5]を含む細胞経路に対する被験化合物[6]の活性を、3つのセンサー[10]、[11]及び[12]からの読取値の分析によって決定することができる。本発明のこの実施形態では、ウィルスにコードされたさらに別のアッセイをアレイ[1]中に設けて、さらに追加の細胞経路及び過程を同時に取り扱うために使用する。
【0052】
本発明のこの実施形態は、ある範囲の細胞経路に対する被験化合物の活性を決定するのに適用することができる一般的なアプローチを表している。中間の分子を介して細胞表面受容体に到達するシグナルを最終の遺伝子発現事象に変換するために多くの細胞情報伝達経路が存在する(Gomperts et al, Signal Transduction、Academic Press 2003)。ウィルスコード化アッセイを用いて検知点が適用される、上皮成長因子(EGF)受容体を起源とするかかる経路の典型的な例を図3に示す。EGF受容体(EGFR)[14]はEGF応答性細胞の細胞膜[20]中に存在しており、ここで受容体とEGFが結合する。EGF[13]が結合すると、受容体が活性化され、シグナルが細胞質[21]内でERK1[16]に変換され、EGFR[15]のインターナリゼーションが起こる。活性化されたERK1が細胞質から核[22]にトランスロケーションすると、その活性化されたERK1[17]はERK1応答性制御要素からの遺伝子発現[18]を促進し、cFOS[19]及びその他の遺伝子の発現に至る。従って、この情報伝達経路は3つの事象を有しており、それに対して情報伝達経路に沿ったシグナル変換を報告するようにウィルスコード化アッセイを工学処理することができる。これらの3つの事象とは、受容体のインターナリゼーション[23]、ERK1のトランスロケーション[24]、及びERK1に誘発された遺伝子発現[26]である。
【0053】
EGFRインターナリゼーションは、受容体が酸性小胞中に取り込まれたときに蛍光を変化させるpH応答性蛍光性分子でタグ付けされるように工学処理された受容体のウィルス発現によって測定することができる(Adie et al, 2002, Biotechniques 33(5):1152−4、1156−7)。ERK1トランスロケーションは、GFP−ERK1融合タンパク質のウィルス発現によって測定することができる(Chamberlain & Hahn、2000 Traffic Oct;1(10):755−62)。ERK1で誘発された遺伝子発現は、ERK1応答性プロモーターの制御下のレポーター遺伝子のウィルス発現によって測定することができる。国際公開第0157237号には、生細胞でのレポーター遺伝子の発現をモニターするのに適した方法が記載されている。かかるアッセイは細胞以下のイメージング及び画像分析によって定量的に測定することができる。米国特許第6400487号には、多数の化合物をスクリーニングし、生細胞アッセイを始めとする広範な蛍光アッセイを実施する方法及び装置が記載されている。これらの方法は高速、高分解能及び多波長能を備えたレーザー線走査共焦点顕微鏡及びリアルタイムデータ処理を利用しており、本発明のアッセイの測定に適している。
【0054】
本発明の方法では、図3の情報伝達経路は、各々がマイクロウェルプレートの別々のウェル内の別々の細胞集団で発現される、ウィルスにコードされた3つの別々のアッセイによって探査されて、被験化合物の活性のプロファイリング手段が提供されるであろう。被験化合物の3つの可能な活性点は図3に示されており、EGF受容体のレベル[27]、ERK1のレベル[28]、及び遺伝子発現のレベル[29]である。従って、個々のアッセイからのデータの組合せと検査によって、その経路に対して活性な被験化合物の作用点を決定することができる。例えば、GFPトランスロケーション[24]と遺伝子発現[25]に対して正の結果を示すが受容体活性化[23]は示さない被験化合物は受容体の下流で作用する。被験化合物の刺激又は抑制活性の識別はEGFの存在下及び非存在下で反復アッセイを実施することによって容易に達成される。例えば、EGFの存在下で試験したとき遺伝子発現[25]に対して負の結果を示すがアッセイ[23]及び[24]では正の結果を示す被験化合物は遺伝子発現のレベルでその経路を抑制する。
【0055】
本発明の方法では、別々であるが重複している情報伝達経路の特定の点について、ウィルスコード化アッセイの複数のセット又はアレイの発現によって、多くのかかる情報伝達経路を平行して同時に調べることができる。これらのアッセイのアレイからのデータによって、ある化合物の活性及び特異性を広範な生物学的経路に対してプロファイリングすることができる。このプロセスの概略図を図4に示す。
【0056】
ある化合物のプロファイリングを達成するには、ウィルスコード化アッセイのあるセット又はアレイ[27]を、アッセイのセット又はアレイの各々の成分が別々の細胞集団で発現されるように、対応するセット又はアレイの細胞集団で発現させる。各々の細胞集団に対して、各々の細胞[42]が、特定の細胞経路又は過程の1つの要素について報告する。アッセイアレイ及び対応する細胞アレイ内で、アレイの下位要素[28]が、規定された経路又は過程の個々の成分に対処する。ここで、下位要素[28]内の各々のアッセイが、別々であるがリンクされた成分[29]、[30]及び[31]に対処して、図3について上述の通りシグナル変換を報告する。アレイ内の別の下位要素が別の経路及び過程[32]、[33]、[34]、[35]及び[36]に対処する。各々の細胞がウィルスにコードされた別々のアッセイを発現するアレイ内の複数の細胞集団を被験化合物[37]に曝露することで、アレイ内の全てのアッセイで得られたデータを検査することによって、その被験化合物の活性及び特異性を決定することができる。細胞表面受容体[38]に作用する被験化合物[37]は、その受容体がシグナル変換分子[39]とカップルしており、そのシグナル変換分子がさらに遺伝子発現の活性化[41]とカップルすると共に第2の変換分子[40]にもカップルしており、さらにこの変換分子が遺伝子発現[42]とカップルしていると、センサーが発現される細胞で正のアッセイシグナルを生じ、これが図3について上述の手段で点[38]、[39]、[40]、[41]、及び[42]での活性を報告する。この同じアレイで、他の情報伝達経路及び成分に対処するアレイの下位要素[28]、[32]、[33]及び[34]からのシグナルがないことは、これらの経路に対してその被験化合物が不活性であることを示しており、下位要素[35]と[36]が対処する相互作用する経路に対する特異性が確認される。
【実施例】
【0057】
以下の実施例で、単一の96ウェルプレートの標的細胞での組換えアデノウィルスベクターを用いたアッセイ手順を説明する。
【0058】
アッセイの48時間前に、対数増殖期のHeLa細胞をトリプシン処理で剥がした。細胞数をカウントして1×106/mlに調整し、最終体積を培地で20mlに調節した。組換えアデノウィルスベクター粒子(実施例1及び2参照)を100個/細胞の割合(この数は感染効率(MOI)といわれる)で細胞に加えた。細胞とウィルスを混合し、組織培養フラスコ内で平板培養した。24時間後、細胞を培養プレートから剥がした(上記と同様)。細胞を4×103細胞/100ulで96ウェルプレートのウェルに播種した。さらに24時間培養後、細胞を以下に記載の通りアッセイした。
【0059】
実施例1:MAPKAPキナーゼ2アッセイ
本例に記載するアッセイは、MAPKAPキナーゼ2が核から細胞質へトランスロケーションする過程の拮抗作用(アンタゴニスト)と作動作用(アゴニスト)の両方を含む。ヒトの疾病の治療用化合物を同定しようとするときには、アゴニスト又はアンタゴニストの代わりにライブラリーの化合物を使用することができる。培地をデカントして細胞から除去した。幾つかのウェルでは、培地を新しい培地と交換した。他のウェルでは、培地を300ナノモル濃度のアニソマイシン(アゴニスト)を含有する培地と交換した。その他のウェルでは、培地をアゴニスト及びアンタゴニスト(100マイクロモル濃度のSB203580−HCI)を含有する培地と交換した。細胞を90分、37℃でインキュベートした。培地をデカントして細胞から除去し、細胞を2%ホルマリン溶液で15分固定した。細胞をPBSで洗浄し、Hoechst 33342の2.5マイクロモル濃度溶液を加えて核を染色した。このアッセイの結果を図5に示す。
【0060】
実施例2:グルココルチコイド受容体アッセイ
第2のアッセイでは、グルココルチコイド受容体(GR)が細胞質から核へトランスロケーションする過程の作動作用を例示する。GFPに連結されたGRを含有する100MOIの組換えアデノウィルスベクターを用い、上述の通りHeLa細胞を調製した。アッセイの1時間前に、組織培養培地を、活性炭で処理した血清を含有する培地で1時間37℃で交換した。この培地をデカントし、同じ血清と様々な濃度のデキサメタゾン(800、400、200、100、50、25ナノモル濃度)を含有する培地で20分37℃で交換した。GRの細胞質から核へのトランスロケーションに影響し得るライブラリーからの化合物を含ませることができる。次に、培地をデカントして細胞から除去し、細胞を固定し、上述の通り処理した。このアッセイの結果を図6に示す。
【図面の簡単な説明】
【0061】
【図1】ウィルスコード化アッセイを発現する細胞アレイの調製。
【図2】ウィルスコード化アッセイのセット又はアレイを用いた細胞情報伝達経路の調査。
【図3】EGFR−ERK細胞情報伝達経路。
【図4】ウィルスコード化アッセイのセット又はアレイを用いた複数の細胞情報伝達経路の調査。
【図5】ウィルスコード化MAPKAPキナーゼ2情報伝達アッセイからのデータ。
【図6】ウィルスコード化グルココルチコイド受容体情報伝達アッセイからのデータ。
【技術分野】
【0001】
本発明は、情報伝達経路及び細胞プロセスに対する化合物又は分子の影響のキャラクタリゼーション又はプロファイリング法に関する。
【背景技術】
【0002】
新薬の開発は一般に、ハイスループット一次スクリーニングでの多数の化合物の評価とその後の二次スクリーニングにおける化合物の活性及び特異性のさらに詳しい検査を伴う。一次スクリーニング分析は通例リガンド結合性のような簡単な分子検定であり、最も活性な化合物を選択すべくさらに評価するための被験分子の活性に関しては低レベルの情報しか得られない。従って、作用モード、特異性、細胞毒性その他のパラメーターに対処し得る様々な機能検定に基づいて化合物を進展すべきか決定がなされるのは二次スクリーニングである。化合物の進展はこの時点を過ぎるとコストが増大するので、リード化合物の有効なキャラクタリゼーション又はプロファイリング及び最適特性をもつ化合物の選択が、創薬プロセス全体でのキイポイントとなる活動である。有効なリードプロファイリングを達成するには、二次スクリーニングアッセイで、化合物特性の包括的かつ詳細な調査を得る必要があり、そのため創薬業界では多岐にわたるパネルのリードプロファイリング細胞アッセイを並列的に多数のリード化合物に効率的に適用する手段が望まれている。
【0003】
分子アッセイのアレイを用いた化合物のプロファイリングについては様々な方法が考案されている。米国特許第5811231号には、化合物によって引き起こされる細胞の生化学的及び生物物理的ホメオスタシスに対する毒性障害を同定する方法が記載されている。米国特許第6509153号には、核酸ハイブリダイゼーションを用いて細胞での調節解除細胞生存性又は増殖に特徴的な遺伝子の発現を決定するための被験化合物の潜在的毒性の決定法が記載されている。国際公開第03042654号には、同定された疾病特色及び薬剤特色遺伝子の各々に対してスコア値を導き出して、その疾病を治療するのに効果的な薬剤の指標を得ることによって、有効な治療の指標となる1以上の遺伝子を選択する方法が記載されている。国際公開第0039336号には、コンセンサスプロファイルを用いた薬剤活性のキャラクタリゼーションによって、所定の生物学的応答に対する薬剤の有効性又は毒性に関連する応答プロファイルを得る方法が記載されている。
【0004】
従来の方法は総じて、化合物のプロファイリングの際に、遺伝子発現パターンを分析することを特徴とする。かかるパターンはリード化合物の活性の指標となり得るが、規定された細胞経路及び過程に対する化合物の活性の標的又は種類に関する直接的な情報は得られない。別のリードプロファイリング法では、細胞アッセイにおける特定の読取値に基づく分析を用いて、化合物の活性のより直接的なキャラクタリゼーション法を採用している。
【0005】
国際公開第0234881号には、組込みレポーター遺伝子を有する安定な株化細胞を生成、使用し、薬剤候補のライブラリーをスクリーニングして潜在的な治療剤を同定し、組込みレポーターを調節する遺伝子を同定する方法が記載されている。米国特許第5928888号には、β−ラクタマーゼレポーター遺伝子を細胞のゲノムに挿入することによって遺伝子発現を直接的又は間接的に調節するタンパク質又は化合物を同定し、この細胞を所定濃度のモジュレーターと接触させ、細胞のβ−ラクタマーゼ活性を検出する方法が記載されている。国際公開第9706277号には、標的生物の別々に単離された複数の異なる細胞の各々からレポーター遺伝子産物シグナルを検出することによって候補薬剤の生理学的特異性を評価する方法が記載されており、ここで各々の細胞は異なる内因性転写調節要素に連結されたレポーター遺伝子を含有しており、細胞の合計は候補薬剤の生理学的特異性の評価に十分な生物の転写調節要素の全体を含んでいる。
【0006】
これらの検定では、上述の遺伝子発現の広範な調査を用いるアプローチよりも化合物の活性に関して直接的な指標が得られるが、レポーター遺伝子検定が情報伝達経路の終点に位置付けられることと、細胞情報伝達経路内及びそれらの間の相互作用の複雑な性質とが相俟って、プロファイリングプロセスにおいてリード化合物の可能な作用モード間の有効な識別を達成するには、多数のかかる検定を同時に遂行する必要が生じる。さらに、かかるアプローチ用の多数の安定に工学処理された株化細胞を生成し、維持し、有効に利用することの必要性のため、重大な論理学的問題が生じる(Pagliaro & Praestegaard, 2001, J. Biomol. Screen. 6(3), 133−136)。
【0007】
安定に工学処理された細胞を使用することの制限を克服し、従って多様なセットのアッセイを化合物プロファイリングに適用できるようにするべく、細胞を工学処理してアッセイ成分を一過的に発現させるために幾つかの技術が開発されている。米国特許第6544790号には、核酸を含有する複数の混合物をある表面上の離散し規定された位置にデポジットすることによって核酸を発現するトランスフェクトされた細胞のアレイを生成し、その混合物をその表面上で乾燥させ、その表面上で哺乳動物細胞を核酸が細胞に入り込むのに適当な条件下で平板培養する方法が記載されている。この方法によって、多数の異なるアッセイレポーターを哺乳動物細胞で同時に発現させることができる(一般に「細胞アレイ」と呼ばれる)。その後、細胞アレイを被験化合物に曝露することによって、細胞アッセイのパネルに対する化合物の活性を読み取ることができる。リードプロファイリング用のハイスループットの小型化フォーマットが得られるが、この細胞アレイの生成法には2つの欠点がある。すなわち、使用するプラスミドに基づく化学的トランスフェクション法はトランスフェクション効率にばらつきがあり、その使用が限られた数の細胞型に制限され、また、必要とされるプリントされたアレイの固定フォーマットは手順及び/又は検定における変化を包含するためのこの方法の柔軟性を制限する。
【0008】
アデノウィルスベクターは、プラスミドベクターよりも優れた利点があることがよく知られており、トランスジェニックDNAを発現する細胞を高い割合で生成し、広範な宿主細胞を形質導入することが可能であり(Dietz et al, 1998, Blood, 91(2), 392−8、Hatanaka et al, 2003, Mol Ther.8(1):158−66)、従って哺乳動物細胞で広範なリードプロファイリング検定を有効に利用するための取扱い易いルートを与える。アデノウィルスベクターは、機能性ゲノミクスにおいて、遺伝子機能を決定するルートとしてタンパク質を発現させるために広く使用されている。米国特許第6413776号には、アデノウィルスベクター中で核酸ライブラリーを構築し、宿主細胞で発現させて1以上の表現型を変更し、その変化した表現型に関連する核酸にコードされた産物に生物学的機能を割り当てることによって、核酸及びその産物の機能を同定するハイスループット法が記載されている。
【0009】
細胞にレポーター遺伝子を形質導入するためにアデノウィルスベクターを用いた幾つかの限られた使用例も既に記載されている(Hartig et al, 2002, Toxicol Sci.66(1):82−90)。これらの著者らは、公知の一連の内分泌攪乱物質を評価するために細胞溶解を必要とするルシフェラーゼレポーター系に基づくインビトロの検定を開発した。残念ながら、かかるインビトロの技術は細胞溶解に起因する人為的な影響を受け易い可能性があり、生細胞に対するリアルタイムの研究には使用することができない。
【0010】
国際公開第01/81608号には、細胞に感染するHIVウィルスから発現されたHIVタンパク質の存在下でその活性が増大するレポーター遺伝子をコードするウィルスベクターを用いて細胞に形質導入する方法が記載されている。HIV誘導性プロモーターの制御下にGFPレポーターを含むアデノウィルスベクターが記載されており、これは臨床試料中のHIVの存在を検出したり、又は抗−HIV薬剤をスクリーニングしたりするのに使用することができる。この方法によって、単一のアナライトの量を測定することによって、HIV感染の存在を検出したり、及び/又はHIVに対する薬剤の効果をスクリーニングしたりする手段が提供される。
【特許文献1】米国特許第5811231号明細書
【特許文献2】米国特許第6509153号明細書
【特許文献3】国際公開第03/042654号パンフレット
【特許文献4】国際公開第00/39336号パンフレット
【特許文献5】国際公開第02/34881号パンフレット
【特許文献6】米国特許第5928888号明細書
【特許文献7】国際公開第9706277号明細書
【特許文献8】米国特許第6544790号明細書
【特許文献9】米国特許第6413776号明細書
【特許文献10】国際公開第01/81608号パンフレット
【非特許文献1】Pagliaro & Praestegaard, 2001, J. Biomol. Screen. 6(3), 133−136
【非特許文献2】Dietz et al, 1998, Blood, 91(2), 392−8
【非特許文献3】Hatanaka et al, 2003, Mol Ther.8(1):158−66
【非特許文献4】Hartig et al, 2002, Toxicol Sci.66(1):82−90
【発明の開示】
【発明が解決しようとする課題】
【0011】
以上の先行技術文献のいずれにも、広範な細胞経路及び過程を標的とする、多様な範囲のアデノウィルスにコードされた細胞アッセイに同時に適用して、創薬における化合物の機能及び活性の詳細なプロファイリングを可能とすることは記載されていない。
【課題を解決するための手段】
【0012】
本発明の第1の態様では、宿主細胞内での情報伝達経路及び/又は細胞プロセスに対する被験因子の活性及び/又は機能のインビトロキャラクタリゼーション方法であって、
a)複数のウィルスコード化アッセイの第1のセットからのアッセイを、複数の容器を含む第2のセット内に位置する宿主細胞で一過的に発現させ、
b)適宜、被験因子を1以上の容器に添加し、
c)1以上のアッセイの測定を実施し、
d)アッセイの測定値を組合せてデータセットを生成し、
e)データセットを分析して被験因子の機能的特性を求める
ことを含んでなり、上記アッセイの測定を生細胞で非破壊的に実施することを特徴とする方法を提供する。
【0013】
「一過的」という用語は、ウィルス形質導入によって宿主細胞に導入された物質の発現が本質的に安定でないことをいう。
【0014】
「複数」とは、2以上を意味する。好適には、複数とは2、3、4、5、6、7,8、9又は10を意味する。好ましくは、複数とは15、20、25、30、35、40、45又は50を意味する。さらに好ましくは、複数とは75、100、125、150、175又は200を意味する。
【0015】
「セット」という用語は集合を定義するために用いる。セットは、各アッセイ及び/又は容器の位置が既知である特定のフォーマット(例えば、96ウェルマイクロプレート)を有するアレイの形態を取り得る。別の実施形態では、セットはアッセイ又は容器の集合であって、その集合における各アッセイ又は容器の位置が既知であるものであってもよい。
【0016】
好適には、1種以上の異なるウィルスコード化アッセイが各容器内の宿主細胞で発現される。
【0017】
好適には、各容器は異なる宿主細胞を含む。適宜、各容器は同一の宿主細胞又は同一の宿主細胞の遺伝的変異体を含む。
【0018】
好ましくは、アデノウィルスベクター又はレンチウィルスベクターを用いて、ウィルスコード化アッセイを宿主細胞で発現させる。
【0019】
好適には、組換え昆虫ウィルスベクター、例えばBacMam(Ames R.et al, Receptors Channels. 2004;10(3−4):117−24.)を用いて、ウィルスコード化アッセイを宿主細胞で発現させる。
【0020】
好適には、アッセイは検出可能なタンパク質を含む。好ましくは、検出可能なタンパク質は蛍光タンパク質又は改変蛍光タンパク質である。蛍光タンパク質及び色素タンパク質の蛍光タンパク質誘導体は、Aequoria victoria、Anemonia種(例えば、A.majano及びA.sulcata)、Renilla種、Ptilosarcus種、Discosoma種、Claularia種、Dendronephthyla種、Ricordia種、Scolymia種、Zoanthus種、Montastraea種、Heteractis種、Conylactis種及びGoniopara種を始めとする広範な生物から単離されている。
【0021】
さらに好ましくは、蛍光タンパク質は緑色蛍光タンパク質(GFP)又は変性GFPである。最も好ましくは、改変緑色蛍光タンパク質(GFP)は、F64L、Y66H、Y66W、Y66F、S65T、S65A、V68L、Q69K、Q69M、S72A、T2031、E222G、V163A,1167T、S175G、F99S、M153T、V163A、F64L、Y145F、N149K、T203Y、T203Y、T203H、S202F及びL236Rからなる群から選択される1以上の突然変異を含む。
【0022】
好適には、検出可能なタンパク質は酵素である。好ましくは、酵素は、β−ガラクトシダーゼ、ニトロ還元酵素、アルカリホスファターゼ及びβ−ラクタマーゼからなる群から選択される。これらのタンパク質は、細胞に添加した適当な基質に対するその酵素作用によって検出できる。かかる基質の例としては、ニトロ消光性CyDyesTM(GE Healthcare Bio−Sciences社、ニトロ還元酵素基質)、ELF 97(Molecular Probes社、アルカリホスファターゼ基質)及びCCF2(Aurora Biosciences社、β−ラクタマーゼ基質)がある。
【0023】
好適には、アッセイは、MAPKAPキナーゼ2、グルココルチコイド受容体(GCCR)、上皮成長因子(EGF)、ERK1、アンドロゲン受容体(AR)、STAT3、NFAT1、SMAD2、AKT1−PH、FYVE−PH、NFkB、PLC−PH及びRaclからなる群から選択される。MAPKAPキナーゼ2、ERK1、STAT3、NFAT1、SMAD2、AKT1−PH、FYVE−PH、PLC−PH及びRac1緑色蛍光タンパク質アッセイは市販されている(GE Healthcare Bio−Sciences社(英国Little Chalfont))。
【0024】
好適には、宿主細胞は真核細胞であり、遺伝子改変されたものでも、遺伝子改変されていないものでもよい。好ましくは、真核細胞は哺乳動物細胞である。さらに好ましくは、宿主細胞はヒト細胞である。
【0025】
好適には、被験因子は化学作用因子又は物理作用因子である。
【0026】
好適には、化学作用因子は有機又は無機化合物である。かかる有機及び無機化合物が潜在的な薬剤又は医薬として、本発明の方法に従って試験される。これらの化合物は通例低分子量(300ダルトン未満)の合成分子である。好ましくは、有機化合物はペプチド、ポリペプチド、タンパク質、炭水化物、脂質、核酸、ポリヌクレオチド及びタンパク質核酸からなる群から選択される。
【0027】
好適には、物理作用因子は電磁放射線である。
【0028】
好適には、ステップb)を行わずに、被験因子の非存在下で当該方法を実施する。
【0029】
好適には、本発明の方法の分析ステップe)は、被験因子の存在下で得られた各アッセイ測定値を、被験因子の非存在下で得られた同じアッセイの測定値と比較することからなる。
【0030】
適宜、被験因子の非存在下でのアッセイ測定値は既知であり、データベースに記憶されている。これによって、本発明の方法の実施に要する時間が短縮され、スクリーニングスループットを増大させることができる。
【0031】
好ましくは、本発明方法のアッセイは、特にアッセイが緑色蛍光タンパク質のような蛍光性レポーターに基づく場合、イメージング装置を用いて測定される。適当なイメージング装置としては、IN Cell Analyzer 3000又はIN Cell Analyzer 1000(GE Healthcare Bio−Sciences社(英国Little Chalfont))がある。
【0032】
本発明の第2の態様では、上記方法をイメージング装置及びコンピューター化されたデータ処理装置と共に使用することを含む、細胞集団に対する被験因子の活性及び/又は機能を自動化キャラクタリゼーション装置が提供される。
【0033】
本発明の第3の態様では、宿主細胞内での情報伝達経路及び/又は細胞プロセスに対する被験因子の活性及び/又は機能のキャラクタリゼーションのための複数のウィルスコード化アッセイを備える部品のキットが提供される。
【0034】
好適には、ウィルスコード化アッセイはアデノウィルスベクター又は組換えヒト昆虫ウィルスベクターからなる。
【0035】
好ましくは、アッセイはMAPKAPキナーゼ2、グルココルチコイド受容体(GCCR)、上皮成長因子(EGF)、ERK1、アンドロゲン受容体(AR)、STAT3、NFAT1、SMAD2、AKT1−PH、FYVE−PH、PLC−PH及びRac1からなる群から選択される。
【0036】
好適には、アッセイは検出可能なタンパク質からなる。好ましくは、検出可能なタンパク質は蛍光タンパク質又は改変蛍光タンパク質である。さらに好ましくは、蛍光タンパク質は緑色蛍光タンパク質(GFP)又は変性GFPである。最も好ましくは、改変緑色蛍光タンパク質(GFP)は、F64L、Y66H、Y66W、Y66F、S65T、S65A、V68L、Q69K、Q69M、S72A、T2031、E222G、V163A、1167T、S175G、F99S、M153T、V163A、F64L、Y145F、N149K、T203Y、T203Y、T203H、S202F及びL236Rからなる群から選択される1以上の突然変異を含む。
【0037】
好適には、検出可能なタンパク質は酵素である。好ましくは、酵素はβ−ガラクトシダーゼ、ニトロ還元酵素、アルカリホスファターゼ及びβ−ラクタマーゼからなる群から選択される。
【0038】
好ましくは、キットはさらに、酵素に対する基質を含んでいる。従って、タンパク質は、細胞に加えられた適当な基質に対する酵素の作用によって検出することができる。かかる基質の例としては、ニトロでクエンチされるCyDyesTM(GE Healthcare Bio−Sciences、ニトロ還元酵素基質)、ELF 97(Molecular Probes、アルカリホスファターゼ基質)及びCCF2(Aurora Biosciences、β−ラクタマーゼ基質)がある。
【0039】
最も好ましくは、酵素がニトロ還元酵素であり、基質がその基質である。
【発明を実施するための最良の形態】
【0040】
本発明の方法を説明する上で、以下、図を参照する。
【0041】
本発明の方法は幾つかの変形で利用することができ、そのうちの幾つかを図1に示す。
【0042】
図1Aは本発明の方法の一つの適用例を示し、コードされるアッセイの第1のセット又はアレイを使用して第2のセット又はアレイの細胞に形質導入するが、第1及び第2のセット又はアレイは要素の大きさと数が同じであり、例えば、96ウェルの第1のアレイを単一の細胞型を含有する96ウェルの第2のアレイにレプリカ平板培養するものである。
図1Bは本発明の方法の一つの適用例を示し、ウィルスコード化アッセイの第1のセット又はアレイを使用して第2のセット又はアレイの細胞に形質導入し、第2のセット又はアレイが第1のアレイの4倍であるが、第1のアレイの要素の大きさと間隔を保持しており、例えば96ウェルの第1のアレイから4つの同じ96ウェルの第2のアレイにレプリカ平板培養するものであり、各々の第2のアレイは異なる細胞型を含有している。図1Cは第3の可能な構成を示しており、ウィルスコード化アッセイの第1のセット又はアレイを使用して第2のセット又はアレイの細胞に形質導入するものであり、第2のセット又はアレイが第1のアレイと異なる要素の大きさと間隔で第1のアレイの4倍であり、例えば96ウェルの第1のアレイから4倍レプリカ平板培養して384ウェルのプレートにして各々のアッセイに対して4倍の複製を提供するものである。
【0043】
本発明の様々な実施形態のこれらの例は、リード化合物のプロファイリングに対するいろいろなアプローチを可能とする本方法の適用における大きな柔軟性を示している。本方法のさらなる柔軟性が、表1に示す例で例示される。
【0044】
【表1】

本発明の方法では、第1のセット又はアレイは、離散した容器のセット又はアレイ、通例96ウェルマイクロプレート内に配置されたウィルスコード化アッセイを含んでいる。これらのアッセイで表される異なるアナライトの数は2〜Nであることができ、ここでNは第1のアレイ内の要素の数である(すなわち、96ウェルプレートの場合、N=2〜96)。本発明の方法では、ウィルスコード化アッセイは、離散した容器の第2のアレイ、例えば第2の96ウェルプレート中の増殖する細胞に適用される。第2のアレイで増殖する細胞型の数は1〜nであることができ、ここでnは第2のアレイ内の要素の数である(すなわち、96ウェルプレートの場合、n=1〜96)。第1及び第2のアレイのフォーマットにおけるこれらの変動は被験化合物の可変の数と組合せることができ、ここで第2のアレイに適用される被験化合物の数は第1のアレイのアッセイの数と反比例して変動する。例えば、第1のアレイが96の別々のアッセイの96ウェルプレートからなり、これを使用して単一の細胞型を用いる第2のアレイを調製する場合、その第2のアレイを使用して単一の被験化合物の96のアッセイのプロファイリングを実施することができる(表1でN:1:1)。
【0045】
他の変形も可能であり、例えば、細胞型間における内因性経路成分の発現が異なるために異なる宿主細胞型が検定に必要とされる場合には、96の別々のアッセイを含む第1のセット又はアレイを使用して幾つかの細胞型(この例では2〜96)を用いる第2のセット又はアレイを調製することができ、その後これを使用して単一の被験化合物をプロファイリングする(表1でN:n:1)。
【0046】
プロファイリング研究の目的が遺伝的バックグランドが被験化合物の活性又は機能に及ぼす影響を決定することであれば、本方法のさらに別の変形を適用することができ、例えば、第1のアレイが2つの異なるアッセイを含有する96ウェルプレートからなり、このアレイを使用して48の異なる細胞型を用いる第2のアレイを調製する場合、この第2のアレイを使用して48の遺伝的バックグランドにおける単一の被験化合物のプロファイリングをすることができる(表1でN:n:1)。以上の例は限定的なものではなく、別の可能な変形は当業者には明らかであろう。
【0047】
本発明の方法に使用する組換えアデノウィルスベクターは、幾つかの方法によって生成することができる(Wang & Huang、2000, Drug Discovery、Today 5、10−16)。最も一般的な方法の1つで、後述の実施例で使用した方法は、2プラスミドレスキュー法に基づくものである。この方法は他で詳細に記載されている(Bett et al, 1993, PNAS 91、8802−8806、米国特許第6140087号、遺伝子療法用アデノウィルスベクター)。
【0048】
cDNA(例えば、MAPKAPキナーゼ2、又はヒトグルココルチコイド受容体−GCCR、GFPをコードするcDNAと融合している)を、「シャトルプラスミド」と呼ばれる第1の核酸構築物の発現カセット中にクローニングした。シャトルプラスミドは、パッケージングシグナル及び逆方向末端反復(ITR)配列を含むアデノウィルス5型ゲノムの左の約340ヌクレオチド、ポリクローニング部位並びにアデノウィルスE1遺伝子領域の右端付近のウィルス配列を含有している。第2の核酸構築物は比較的大きく、pBHG10として知られている(Bett et al, 1993, PNAS 91、8802−8806)。
【0049】
pBHG10プラスミドは、ウィルスゲノムの大部分を含有しており、パッケージングシグナル及びE1遺伝子領域の部分の欠失がなければ感染性のウィルスを生成することができるであろう。シャトルプラスミド内のE1の右端付近のウィルス配列はpBHG10プラスミド内の配列と重複している。クローニングは標準的な実験室技術を用いて行った。両方のプラスミドを、細菌を形質転換した後一晩LBで増殖することによって増幅させた。細菌を遠心分離で沈降させ、変性アルカリ溶解法で処理した(Sambrook et al, 1989, Molecular Cloning:A Laboratory Manual(Cold Spring Harbour Lab.Press)、2nd edition)。第1及び第2の核酸構築物を、標準的なリン酸カルシウム共沈でHEK 293細胞(アデノウィルス5型で形質転換されたヒト胚性腎株化細胞)に同時にトランスフェクトした(Sambrook et al, 1989, Molecular Cloning:A Laboratory Manual(Cold Spring Harbour Lab.Press)、2nd edition)。トランスフェクションの1日後、細胞に、0.5%アガロースを含有する組織培養培地(10%FCSを補充したDMEM)を被せた。これら2つのプラスミドをHEK 293細胞内に同時トランスフェクションすると、第1及び第2の核酸構築物内の重複している配列間で相同組換えが起こる。得られる組換えアデノウィルスベクターは、シャトルプラスミドに由来するパッケージングシグナルと、シャトルプラスミドのポリクローニング部位にクローニングされたcDNAを含有している。いずれのプラスミドも複製ウィルスを生成する能力をもっておらず、ウィルスの子孫は組換えの結果としてのみ生成することができる。E1領域における欠失は293細胞での構成的産生によって相補される。組換えアデノウィルスDNAは、E1相補的パッケージング細胞で複製し増殖して組換えアデノウィルスベクターを生成することができる。約2週間後、組換えアデノウィルスベクターは293細胞でプラークを形成した。これらをアガロース含有培地下で肉眼で観察した。以下に記載する実験に適する力価を有するアデノウィルスベクターを生成するために、単離されたプラークを増殖させることによってストックを生成した。滅菌ピペットの先端でプラークを培地から取り出し、200ulのPBSに加え、293細胞(E1相補的パッケージング細胞)のコンフルエントな単層の付近に加えた。約48時間後、組換えアデノウィルスベクターによる感染の結果として細胞が剥がされるようになり、これを集めて組織培養培地に入れた。3サイクルの瞬間冷凍/解凍によって、アデノウィルスベクターを生産細胞から放出させた。溶解物を3000rpmで10分の遠心分離で清澄にし、陰イオン交換クロマトグラフィーで組換えアデノウィルスベクターを精製した(www.bdbiosciences.com/clontech/products/cat/HTML/1260.shtml)。
【0050】
組換えアデノウィルスベクターの濃度の評価は免疫細胞化学試験を用いて行った(www.bdbiosciences.com/clontech/archive/APR02UPD/pdf/Adeno−X.pdf )。この組換えアデノウィルスベクターは標的細胞に導入することができ、これを増殖させて、ベクター中にクローニングされたcDNAにコードされた産物の十分な発現を可能にすることができる。GFPと融合したタンパク質の発現によって、そのタンパク質の生物学的活性の検出及び分析が可能になる。下記実施例に記載する2つのタンパク質(MAPKAPキナーゼ2及びGCCR)の場合、生物学的活性は、遺伝子と融合したGFPの細胞の1つの領域から別の領域へのトランスロケーションによって評価することができる(Roquemore et al, 2002, Life Science News 11、1−5 Amersham Biosciences)。ライブラリー中のある化合物の生物学的効果の同定の結果として、ヒト疾病の治療用の小分子薬剤を得ることができる。
【0051】
ウィルスにコードされた別々のアッセイのセット又はアレイを用いる本発明の一実施形態に係る、細胞アッセイにおけるリード化合物の活性のプロファイリングへの適用を、図2に示した代表的な例で例証する。ウィルスコード化アッセイのアレイ[1]を使用して、細胞経路及び過程のある範囲のセンサーを宿主細胞[2]内で発現させる。第1のセンサー[7]が細胞表面受容体タンパク質[3]の活性化をモニターし、この受容体タンパク質は第2のタンパク質[4]を活性化し、この第2のタンパク質は第2のセンサー[8]でモニターされ、次に遺伝子発現[5]を活性化し、これが第3のセンサー[9]でモニターされる。ウィルスにコードされたセンサーのこの組合せによって、成分[3]、[4]及び[5]を含む細胞経路に対する被験化合物[6]の活性を、3つのセンサー[10]、[11]及び[12]からの読取値の分析によって決定することができる。本発明のこの実施形態では、ウィルスにコードされたさらに別のアッセイをアレイ[1]中に設けて、さらに追加の細胞経路及び過程を同時に取り扱うために使用する。
【0052】
本発明のこの実施形態は、ある範囲の細胞経路に対する被験化合物の活性を決定するのに適用することができる一般的なアプローチを表している。中間の分子を介して細胞表面受容体に到達するシグナルを最終の遺伝子発現事象に変換するために多くの細胞情報伝達経路が存在する(Gomperts et al, Signal Transduction、Academic Press 2003)。ウィルスコード化アッセイを用いて検知点が適用される、上皮成長因子(EGF)受容体を起源とするかかる経路の典型的な例を図3に示す。EGF受容体(EGFR)[14]はEGF応答性細胞の細胞膜[20]中に存在しており、ここで受容体とEGFが結合する。EGF[13]が結合すると、受容体が活性化され、シグナルが細胞質[21]内でERK1[16]に変換され、EGFR[15]のインターナリゼーションが起こる。活性化されたERK1が細胞質から核[22]にトランスロケーションすると、その活性化されたERK1[17]はERK1応答性制御要素からの遺伝子発現[18]を促進し、cFOS[19]及びその他の遺伝子の発現に至る。従って、この情報伝達経路は3つの事象を有しており、それに対して情報伝達経路に沿ったシグナル変換を報告するようにウィルスコード化アッセイを工学処理することができる。これらの3つの事象とは、受容体のインターナリゼーション[23]、ERK1のトランスロケーション[24]、及びERK1に誘発された遺伝子発現[26]である。
【0053】
EGFRインターナリゼーションは、受容体が酸性小胞中に取り込まれたときに蛍光を変化させるpH応答性蛍光性分子でタグ付けされるように工学処理された受容体のウィルス発現によって測定することができる(Adie et al, 2002, Biotechniques 33(5):1152−4、1156−7)。ERK1トランスロケーションは、GFP−ERK1融合タンパク質のウィルス発現によって測定することができる(Chamberlain & Hahn、2000 Traffic Oct;1(10):755−62)。ERK1で誘発された遺伝子発現は、ERK1応答性プロモーターの制御下のレポーター遺伝子のウィルス発現によって測定することができる。国際公開第0157237号には、生細胞でのレポーター遺伝子の発現をモニターするのに適した方法が記載されている。かかるアッセイは細胞以下のイメージング及び画像分析によって定量的に測定することができる。米国特許第6400487号には、多数の化合物をスクリーニングし、生細胞アッセイを始めとする広範な蛍光アッセイを実施する方法及び装置が記載されている。これらの方法は高速、高分解能及び多波長能を備えたレーザー線走査共焦点顕微鏡及びリアルタイムデータ処理を利用しており、本発明のアッセイの測定に適している。
【0054】
本発明の方法では、図3の情報伝達経路は、各々がマイクロウェルプレートの別々のウェル内の別々の細胞集団で発現される、ウィルスにコードされた3つの別々のアッセイによって探査されて、被験化合物の活性のプロファイリング手段が提供されるであろう。被験化合物の3つの可能な活性点は図3に示されており、EGF受容体のレベル[27]、ERK1のレベル[28]、及び遺伝子発現のレベル[29]である。従って、個々のアッセイからのデータの組合せと検査によって、その経路に対して活性な被験化合物の作用点を決定することができる。例えば、GFPトランスロケーション[24]と遺伝子発現[25]に対して正の結果を示すが受容体活性化[23]は示さない被験化合物は受容体の下流で作用する。被験化合物の刺激又は抑制活性の識別はEGFの存在下及び非存在下で反復アッセイを実施することによって容易に達成される。例えば、EGFの存在下で試験したとき遺伝子発現[25]に対して負の結果を示すがアッセイ[23]及び[24]では正の結果を示す被験化合物は遺伝子発現のレベルでその経路を抑制する。
【0055】
本発明の方法では、別々であるが重複している情報伝達経路の特定の点について、ウィルスコード化アッセイの複数のセット又はアレイの発現によって、多くのかかる情報伝達経路を平行して同時に調べることができる。これらのアッセイのアレイからのデータによって、ある化合物の活性及び特異性を広範な生物学的経路に対してプロファイリングすることができる。このプロセスの概略図を図4に示す。
【0056】
ある化合物のプロファイリングを達成するには、ウィルスコード化アッセイのあるセット又はアレイ[27]を、アッセイのセット又はアレイの各々の成分が別々の細胞集団で発現されるように、対応するセット又はアレイの細胞集団で発現させる。各々の細胞集団に対して、各々の細胞[42]が、特定の細胞経路又は過程の1つの要素について報告する。アッセイアレイ及び対応する細胞アレイ内で、アレイの下位要素[28]が、規定された経路又は過程の個々の成分に対処する。ここで、下位要素[28]内の各々のアッセイが、別々であるがリンクされた成分[29]、[30]及び[31]に対処して、図3について上述の通りシグナル変換を報告する。アレイ内の別の下位要素が別の経路及び過程[32]、[33]、[34]、[35]及び[36]に対処する。各々の細胞がウィルスにコードされた別々のアッセイを発現するアレイ内の複数の細胞集団を被験化合物[37]に曝露することで、アレイ内の全てのアッセイで得られたデータを検査することによって、その被験化合物の活性及び特異性を決定することができる。細胞表面受容体[38]に作用する被験化合物[37]は、その受容体がシグナル変換分子[39]とカップルしており、そのシグナル変換分子がさらに遺伝子発現の活性化[41]とカップルすると共に第2の変換分子[40]にもカップルしており、さらにこの変換分子が遺伝子発現[42]とカップルしていると、センサーが発現される細胞で正のアッセイシグナルを生じ、これが図3について上述の手段で点[38]、[39]、[40]、[41]、及び[42]での活性を報告する。この同じアレイで、他の情報伝達経路及び成分に対処するアレイの下位要素[28]、[32]、[33]及び[34]からのシグナルがないことは、これらの経路に対してその被験化合物が不活性であることを示しており、下位要素[35]と[36]が対処する相互作用する経路に対する特異性が確認される。
【実施例】
【0057】
以下の実施例で、単一の96ウェルプレートの標的細胞での組換えアデノウィルスベクターを用いたアッセイ手順を説明する。
【0058】
アッセイの48時間前に、対数増殖期のHeLa細胞をトリプシン処理で剥がした。細胞数をカウントして1×106/mlに調整し、最終体積を培地で20mlに調節した。組換えアデノウィルスベクター粒子(実施例1及び2参照)を100個/細胞の割合(この数は感染効率(MOI)といわれる)で細胞に加えた。細胞とウィルスを混合し、組織培養フラスコ内で平板培養した。24時間後、細胞を培養プレートから剥がした(上記と同様)。細胞を4×103細胞/100ulで96ウェルプレートのウェルに播種した。さらに24時間培養後、細胞を以下に記載の通りアッセイした。
【0059】
実施例1:MAPKAPキナーゼ2アッセイ
本例に記載するアッセイは、MAPKAPキナーゼ2が核から細胞質へトランスロケーションする過程の拮抗作用(アンタゴニスト)と作動作用(アゴニスト)の両方を含む。ヒトの疾病の治療用化合物を同定しようとするときには、アゴニスト又はアンタゴニストの代わりにライブラリーの化合物を使用することができる。培地をデカントして細胞から除去した。幾つかのウェルでは、培地を新しい培地と交換した。他のウェルでは、培地を300ナノモル濃度のアニソマイシン(アゴニスト)を含有する培地と交換した。その他のウェルでは、培地をアゴニスト及びアンタゴニスト(100マイクロモル濃度のSB203580−HCI)を含有する培地と交換した。細胞を90分、37℃でインキュベートした。培地をデカントして細胞から除去し、細胞を2%ホルマリン溶液で15分固定した。細胞をPBSで洗浄し、Hoechst 33342の2.5マイクロモル濃度溶液を加えて核を染色した。このアッセイの結果を図5に示す。
【0060】
実施例2:グルココルチコイド受容体アッセイ
第2のアッセイでは、グルココルチコイド受容体(GR)が細胞質から核へトランスロケーションする過程の作動作用を例示する。GFPに連結されたGRを含有する100MOIの組換えアデノウィルスベクターを用い、上述の通りHeLa細胞を調製した。アッセイの1時間前に、組織培養培地を、活性炭で処理した血清を含有する培地で1時間37℃で交換した。この培地をデカントし、同じ血清と様々な濃度のデキサメタゾン(800、400、200、100、50、25ナノモル濃度)を含有する培地で20分37℃で交換した。GRの細胞質から核へのトランスロケーションに影響し得るライブラリーからの化合物を含ませることができる。次に、培地をデカントして細胞から除去し、細胞を固定し、上述の通り処理した。このアッセイの結果を図6に示す。
【図面の簡単な説明】
【0061】
【図1】ウィルスコード化アッセイを発現する細胞アレイの調製。
【図2】ウィルスコード化アッセイのセット又はアレイを用いた細胞情報伝達経路の調査。
【図3】EGFR−ERK細胞情報伝達経路。
【図4】ウィルスコード化アッセイのセット又はアレイを用いた複数の細胞情報伝達経路の調査。
【図5】ウィルスコード化MAPKAPキナーゼ2情報伝達アッセイからのデータ。
【図6】ウィルスコード化グルココルチコイド受容体情報伝達アッセイからのデータ。
【特許請求の範囲】
【請求項1】
宿主細胞内での情報伝達経路及び/又は細胞プロセスに対する被験因子の活性及び/又は機能のインビトロキャラクタリゼーション方法であって、
a)複数のウィルスコード化アッセイの第1のセットからのアッセイを、複数の容器を含む第2のセット内に位置する宿主細胞で一過的に発現させ、
b)適宜、被験因子を1以上の容器に添加し、
c)1以上のアッセイの測定を実施し、
d)アッセイの測定値を組合せてデータセットを生成し、
e)データセットを分析して被験因子の機能的特性を求める
ことを含んでなり、上記アッセイの測定を生細胞で非破壊的に実施することを特徴とする方法。
【請求項2】
1種以上の異なるウィルスコード化アッセイを各容器内の宿主細胞で発現させる、請求項1記載の方法。
【請求項3】
各容器が異なる宿主細胞を含む、請求項1又は請求項2記載の方法。
【請求項4】
各容器が同一の宿主細胞又は同一の宿主細胞の遺伝的変異体を含む、請求項1又は請求項2記載の方法。
【請求項5】
アデノウィルスベクターを用いてウィルスコード化アッセイを宿主細胞で発現させる、請求項1乃至請求項4のいずれか1項記載の方法。
【請求項6】
組換えヒト昆虫ウィルスベクターを用いてウィルスコード化アッセイを宿主細胞で発現させる、請求項1乃至請求項4のいずれか1項記載の方法。
【請求項7】
前記アッセイが検出可能なタンパク質を含む、請求項1乃至請求項6のいずれか1項記載の方法。
【請求項8】
検出可能なタンパク質が蛍光タンパク質又は改変蛍光タンパク質である、請求項7記載の方法。
【請求項9】
蛍光タンパク質が緑色蛍光タンパク質(GFP)又は変性GFPである、請求項7又は請求項8記載の方法。
【請求項10】
改変緑色蛍光タンパク質(GFP)が、F64L、Y66H、Y66W、Y66F、S65T、S65A、V68L、Q69K、Q69M、S72A、T203I、E222G、V163A、I167T、S175G、F99S、M153T、V163A、F64L、Y145F、N149K、T203Y、T203Y、T203H、S202F及びL236Rからなる群から選択される1以上の突然変異を含む、請求項9記載の方法。
【請求項11】
前記検出可能なタンパク質が酵素である、請求項7記載の方法。
【請求項12】
前記酵素が、β−ガラクトシダーゼ、ニトロ還元酵素、アルカリホスファターゼ及びβ−ラクタマーゼからなる群から選択される、請求項11記載の方法。
【請求項13】
前記アッセイが、MAPKAPキナーゼ2、グルココルチコイド受容体(GCCR)、上皮成長因子(EGF)、ERK1、アンドロゲン受容体(AR)、STAT3、NFAT1、SMAD2、AKT1−PH、FYVE−PH、PLC−PH及びRac1からなる群から選択される、請求項1乃至請求項12のいずれか1項記載の方法。
【請求項14】
前記宿主細胞が真核細胞であり、該細胞が遺伝子改変されたものでも或いは遺伝子改変されていないものでもよい、請求項1乃至請求項13のいずれか1項記載の方法。
【請求項15】
前記真核細胞が哺乳動物細胞である、請求項14記載の方法。
【請求項16】
前記宿主細胞がヒト細胞である、請求項14又は請求項15記載の方法。
【請求項17】
前記被験因子が化学作用因子又は物理作用因子である、請求項1乃至請求項16のいずれか1項記載の方法。
【請求項18】
前記化学作用因子が有機又は無機化合物である、請求項17記載の方法。
【請求項19】
前記有機化合物が、ペプチド、ポリペプチド、タンパク質、炭水化物、脂質、核酸、ポリヌクレオチド及びタンパク質核酸からなる群から選択される、請求項18記載の方法。
【請求項20】
前記物理作用因子が電磁放射線である、請求項17記載の方法。
【請求項21】
ステップb)を行わずに、前記被験因子の非存在下で当該方法を実施する、請求項1乃至請求項20のいずれか1項記載の方法。
【請求項22】
分析ステップe)が、被験因子の存在下で得られた各アッセイ測定値を、被験因子の非存在下での同じアッセイの測定値と比較する、請求項1乃至請求項20のいずれか1項記載の方法。
【請求項23】
被験因子の非存在下でのアッセイ測定値が既知であってデータベースに記憶されている、請求項22記載の方法。
【請求項24】
前記アッセイをイメージング装置を用いて測定する、請求項1乃至請求項23のいずれか1項記載の方法。
【請求項25】
前記イメージング装置がIN Cell Analyzer 3000又はIN Cell Analyzer 1000である、請求項24記載の方法。
【請求項26】
細胞集団に対する被験因子の活性及び/又は機能の自動化キャラクタリゼーション装置であって、請求項1乃至請求項25のいずれか1項記載の方法をイメージング装置及びコンピューター化されたデータ処理装置と共に用いることを含む、装置。
【請求項27】
宿主細胞内での情報伝達経路及び/又は細胞プロセスに対する被験因子の活性及び/又は機能のキャラクタリゼーションのための複数のウィルスコード化アッセイを備える部品のキット。
【請求項28】
前記ウィルスコード化アッセイがアデノウィルスベクター又は組換えヒト昆虫ウィルスベクターを含む、請求項27記載の部品のキット。
【請求項29】
前記アッセイが、MAPKAPキナーゼ2、グルココルチコイド受容体(GCCR)、上皮成長因子(EGF)、ERK1、アンドロゲン受容体(AR)、STAT3、NFAT1、SMAD2、AKT1−PH、FYVE−PH、PLC−PH及びRac1からなる群から選択される、請求項27又は請求項28記載の部品のキット。
【請求項30】
前記アッセイが検出可能なタンパク質を含む、請求項27乃至請求項29のいずれか1項記載の部品のキット。
【請求項31】
前記検出可能なタンパク質が蛍光タンパク質又は改変蛍光タンパク質である、請求項30記載の部品のキット。
【請求項32】
前記検出可能なタンパク質が酵素である、請求項30記載の部品のキット。
【請求項33】
前記酵素が、β−ガラクトシダーゼ、ニトロ還元酵素、アルカリホスファターゼ及びβ−ラクタマーゼからなる群から選択される、請求項32記載の部品のキット。
【請求項34】
前記キットがさらに酵素に対する基質を備える、請求項32又は請求項33記載の部品のキット。
【請求項35】
前記酵素がニトロ還元酵素であり、前記基質がその基質である、請求項34記載の部品のキット。
【請求項1】
宿主細胞内での情報伝達経路及び/又は細胞プロセスに対する被験因子の活性及び/又は機能のインビトロキャラクタリゼーション方法であって、
a)複数のウィルスコード化アッセイの第1のセットからのアッセイを、複数の容器を含む第2のセット内に位置する宿主細胞で一過的に発現させ、
b)適宜、被験因子を1以上の容器に添加し、
c)1以上のアッセイの測定を実施し、
d)アッセイの測定値を組合せてデータセットを生成し、
e)データセットを分析して被験因子の機能的特性を求める
ことを含んでなり、上記アッセイの測定を生細胞で非破壊的に実施することを特徴とする方法。
【請求項2】
1種以上の異なるウィルスコード化アッセイを各容器内の宿主細胞で発現させる、請求項1記載の方法。
【請求項3】
各容器が異なる宿主細胞を含む、請求項1又は請求項2記載の方法。
【請求項4】
各容器が同一の宿主細胞又は同一の宿主細胞の遺伝的変異体を含む、請求項1又は請求項2記載の方法。
【請求項5】
アデノウィルスベクターを用いてウィルスコード化アッセイを宿主細胞で発現させる、請求項1乃至請求項4のいずれか1項記載の方法。
【請求項6】
組換えヒト昆虫ウィルスベクターを用いてウィルスコード化アッセイを宿主細胞で発現させる、請求項1乃至請求項4のいずれか1項記載の方法。
【請求項7】
前記アッセイが検出可能なタンパク質を含む、請求項1乃至請求項6のいずれか1項記載の方法。
【請求項8】
検出可能なタンパク質が蛍光タンパク質又は改変蛍光タンパク質である、請求項7記載の方法。
【請求項9】
蛍光タンパク質が緑色蛍光タンパク質(GFP)又は変性GFPである、請求項7又は請求項8記載の方法。
【請求項10】
改変緑色蛍光タンパク質(GFP)が、F64L、Y66H、Y66W、Y66F、S65T、S65A、V68L、Q69K、Q69M、S72A、T203I、E222G、V163A、I167T、S175G、F99S、M153T、V163A、F64L、Y145F、N149K、T203Y、T203Y、T203H、S202F及びL236Rからなる群から選択される1以上の突然変異を含む、請求項9記載の方法。
【請求項11】
前記検出可能なタンパク質が酵素である、請求項7記載の方法。
【請求項12】
前記酵素が、β−ガラクトシダーゼ、ニトロ還元酵素、アルカリホスファターゼ及びβ−ラクタマーゼからなる群から選択される、請求項11記載の方法。
【請求項13】
前記アッセイが、MAPKAPキナーゼ2、グルココルチコイド受容体(GCCR)、上皮成長因子(EGF)、ERK1、アンドロゲン受容体(AR)、STAT3、NFAT1、SMAD2、AKT1−PH、FYVE−PH、PLC−PH及びRac1からなる群から選択される、請求項1乃至請求項12のいずれか1項記載の方法。
【請求項14】
前記宿主細胞が真核細胞であり、該細胞が遺伝子改変されたものでも或いは遺伝子改変されていないものでもよい、請求項1乃至請求項13のいずれか1項記載の方法。
【請求項15】
前記真核細胞が哺乳動物細胞である、請求項14記載の方法。
【請求項16】
前記宿主細胞がヒト細胞である、請求項14又は請求項15記載の方法。
【請求項17】
前記被験因子が化学作用因子又は物理作用因子である、請求項1乃至請求項16のいずれか1項記載の方法。
【請求項18】
前記化学作用因子が有機又は無機化合物である、請求項17記載の方法。
【請求項19】
前記有機化合物が、ペプチド、ポリペプチド、タンパク質、炭水化物、脂質、核酸、ポリヌクレオチド及びタンパク質核酸からなる群から選択される、請求項18記載の方法。
【請求項20】
前記物理作用因子が電磁放射線である、請求項17記載の方法。
【請求項21】
ステップb)を行わずに、前記被験因子の非存在下で当該方法を実施する、請求項1乃至請求項20のいずれか1項記載の方法。
【請求項22】
分析ステップe)が、被験因子の存在下で得られた各アッセイ測定値を、被験因子の非存在下での同じアッセイの測定値と比較する、請求項1乃至請求項20のいずれか1項記載の方法。
【請求項23】
被験因子の非存在下でのアッセイ測定値が既知であってデータベースに記憶されている、請求項22記載の方法。
【請求項24】
前記アッセイをイメージング装置を用いて測定する、請求項1乃至請求項23のいずれか1項記載の方法。
【請求項25】
前記イメージング装置がIN Cell Analyzer 3000又はIN Cell Analyzer 1000である、請求項24記載の方法。
【請求項26】
細胞集団に対する被験因子の活性及び/又は機能の自動化キャラクタリゼーション装置であって、請求項1乃至請求項25のいずれか1項記載の方法をイメージング装置及びコンピューター化されたデータ処理装置と共に用いることを含む、装置。
【請求項27】
宿主細胞内での情報伝達経路及び/又は細胞プロセスに対する被験因子の活性及び/又は機能のキャラクタリゼーションのための複数のウィルスコード化アッセイを備える部品のキット。
【請求項28】
前記ウィルスコード化アッセイがアデノウィルスベクター又は組換えヒト昆虫ウィルスベクターを含む、請求項27記載の部品のキット。
【請求項29】
前記アッセイが、MAPKAPキナーゼ2、グルココルチコイド受容体(GCCR)、上皮成長因子(EGF)、ERK1、アンドロゲン受容体(AR)、STAT3、NFAT1、SMAD2、AKT1−PH、FYVE−PH、PLC−PH及びRac1からなる群から選択される、請求項27又は請求項28記載の部品のキット。
【請求項30】
前記アッセイが検出可能なタンパク質を含む、請求項27乃至請求項29のいずれか1項記載の部品のキット。
【請求項31】
前記検出可能なタンパク質が蛍光タンパク質又は改変蛍光タンパク質である、請求項30記載の部品のキット。
【請求項32】
前記検出可能なタンパク質が酵素である、請求項30記載の部品のキット。
【請求項33】
前記酵素が、β−ガラクトシダーゼ、ニトロ還元酵素、アルカリホスファターゼ及びβ−ラクタマーゼからなる群から選択される、請求項32記載の部品のキット。
【請求項34】
前記キットがさらに酵素に対する基質を備える、請求項32又は請求項33記載の部品のキット。
【請求項35】
前記酵素がニトロ還元酵素であり、前記基質がその基質である、請求項34記載の部品のキット。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】




【図2】


【図3】


【図4】


【図5】


【図6】


【公表番号】特表2007−535962(P2007−535962A)
【公表日】平成19年12月13日(2007.12.13)
【国際特許分類】
【出願番号】特願2007−512317(P2007−512317)
【出願日】平成17年5月5日(2005.5.5)
【国際出願番号】PCT/GB2005/001705
【国際公開番号】WO2005/109003
【国際公開日】平成17年11月17日(2005.11.17)
【出願人】(398048914)ジーイー・ヘルスケア・ユーケイ・リミテッド (30)
【Fターム(参考)】
【公表日】平成19年12月13日(2007.12.13)
【国際特許分類】
【出願日】平成17年5月5日(2005.5.5)
【国際出願番号】PCT/GB2005/001705
【国際公開番号】WO2005/109003
【国際公開日】平成17年11月17日(2005.11.17)
【出願人】(398048914)ジーイー・ヘルスケア・ユーケイ・リミテッド (30)
【Fターム(参考)】
[ Back to top ]

