化合物
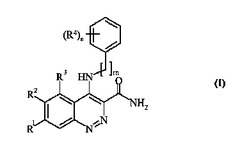
本発明は、CSF−1Rキナーゼ阻害活性を有し、したがってそれらの抗癌活性のため有用であり、そのためヒトまたは動物の身体を処置する方法に有用である、式(I)の化合物またはその医薬的に許容できる塩類に関する。本発明は、それらの化合物の製造方法、それらを含有する医薬組成物、およびヒトなどの温血動物において抗癌作用を発生させる際に使用する医薬の製造におけるそれらの使用にも関する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、コロニー刺激因子1受容体(CSF−1R)キナーゼ阻害活性を有し、したがってそれらの抗癌活性のため有用であり、そのためヒトまたは動物の身体を処置する方法に有用である化合物またはその医薬的に許容できる塩類に関する。本発明は、それらの化合物の製造方法、それらを含有する医薬組成物、およびヒトなどの温血動物において抗癌作用を発生させる際に使用する医薬の製造におけるそれらの使用にも関する。
【背景技術】
【0002】
受容体型チロシンキナーゼ(RTK)は、細胞のシグナル伝達において重要な役割を果たすプロテインキナーゼのサブファミリーであり、細胞の増殖、生存、血管形成、浸潤および転移を含めた多様な癌関連プロセスに関与する。CSF−1Rを含めて少なくとも96の異なるRTKがあると考えられる。
【0003】
CSF−1Rまたはc−fmsは、最初は癌遺伝子v−fmsとしてネコ肉腫ウイルスから同定された。CSF−1Rは、c−Kit、fms−関連チロシンキナーゼ3(Flt3)、ならびに血小板由来増殖因子受容体αおよびβ(PDGFRαおよびPDGFRβ)と共に、クラスIII RTKのメンバーである。これらのキナーゼはすべて、腫瘍形成のプロセスに関係するとされている。CSF−1Rは、普通は未熟な130kDaの膜貫通タンパク質として発現し、最終的には成熟した145〜160kDaの細胞表面N−結合グリコシル化タンパク質になる。CSF−1Rに対するリガンドであるマクロファージコロニー刺激因子(M−CSFまたはCSF−1)がこの受容体に結合して、この受容体の二量体形成、自動リン酸化をもたらし、続いて下流のシグナル伝達カスケードを活性化する(C. J. Sherr, Biochim Biophys Acta, 1988, 948:225-243)。
【0004】
CSF−1Rは普通は、単核食細胞系列の骨髄細胞およびそれらの骨髄前駆体、ならびに乳汁分泌中の乳腺組織(正常な休止中の組織ではなく)における乳腺管および乳腺胞の上皮細胞に発現する。CSF−1Rの活性化により、単球/マクロファージ系列の細胞の増殖、生存、運動性および分化が刺激される。成熟したマクロファージは、正常な組織発達および免疫防御において鍵となる役割を果たす(F. L. Pixley and E. R. Stanley, Trends in Cell Biology, 2004, 14(11): 628-638)。たとえば、骨芽細胞はCSF−1を発現し、破骨細胞前駆体上の受容体を活性化して、成熟した破骨細胞に分化させる(S. L. Teitelbaum, Science, 2000, 289:1504-1508)。CSF−1R軸は、胎盤の発達、胚の着床、乳腺管および乳腺小葉胞の発達ならびに乳汁分泌において重要な役割を果たす(E. Sapi, Exp Biol Med, 2004, 229: 1-11)。
【0005】
CSF−1RをCSF−1と共にまたはCSF−1なしでトランスフェクションすると、NIH3T3(Rat2および卵巣顆粒膜細胞のトランスフォーメーションおよびインビボ腫瘍形成が誘発される。オートクリンおよび/またはパラクリンシグナル伝達機序は、腫瘍上皮および腫瘍関連マクロファージにおけるCSF−1Rの活性化に関係するとされている。CSF−1Rおよび/またはそれのリガンドの異常な発現および活性化が、ヒトの骨髄性白血病、前立腺、乳腺、卵巣、子宮内膜の癌、および他の多様な癌に見いだされた。多くの研究により、CSF−1Rの過剰発現がこれらの癌のうち幾つかにおける予後不良に関連することが証明された。さらにCSF−1/CSF−1R軸は、腫瘍の血管形成、浸潤および進行に際して重要な役割を果たすと主張されている腫瘍関連マクロファージの調節における鍵となる役割を果たす(E. Sapi, Exp Biol Med, 2004, 229: 1-11)。
【0006】
WO2006/124996(Supergen Inc)には、Polo様キナーゼ−1の特定の阻害薬が開示されている。WO2007/045861(AstonらおよびGlaxo Group Limited)には、特定のIV型ホスホジエステラーゼ阻害薬が開示されている。WO2006/067445(AstraZeneca)には、特定のCSF−1R阻害薬が開示されている。
【先行技術文献】
【特許文献】
【0007】
【特許文献1】WO2006/124996
【特許文献2】WO2007/045861
【特許文献3】WO2006/067445
【非特許文献】
【0008】
【非特許文献1】C. J. Sherr, Biochim Biophys Acta, 1988, 948: 225-243
【非特許文献2】F. L. Pixley and E. R. Stanley, Trends in Cell Biology, 2004, 14(11): 628-638
【非特許文献3】S. L. Teitelbaum, Science, 2000, 289: 1504-1508
【非特許文献4】E. Sapi, Exp Biol Med, 2004, 229: 1-11
【発明の概要】
【0009】
本発明者らは新規な一群のシンノリン類がCSF−1Rの阻害薬であることを見いだし、これが本発明の基礎をなす。
【発明を実施するための形態】
【0010】
したがって本発明は、式(I)の化合物:
【0011】
【化1】

【0012】
またはその医薬的に許容できる塩を提供する;
式中:
R1およびR2は、独立して、ハロ、ニトロ、シアノ、ヒドロキシ、トリフルオロメトキシ、アミノ、カルボキシ、カルバモイル、メルカプト、スルファモイル、C1−6アルキル、C2−6アルケニル、C2−6アルキニル、C1−6アルコキシ、C1−6アルカノイル、C1−6アルカノイルオキシ、N−(C1−6アルキル)アミノ、N,N−(C1−6アルキル)2アミノ、N−(C1−6アルキル)−N−(C1−6アルコキシ)アミノ、C1−6アルカノイルアミノ、N−(C1−6アルキル)カルバモイル、N,N−(C1−6アルキル)2カルバモイル、C1−6アルキルS(O)a(aは0〜2である)、C1−6アルコキシカルボニル、N−(C1−6アルキル)スルファモイル、N,N−(C1−6アルキル)2スルファモイル、C1−6アルキルスルホニルアミノ、炭素環または複素環から選択され;その際、R1およびR2は互いに独立して、場合により炭素において1個以上のR5により置換されており;その際、複素環が−NH−部分を含む場合、その窒素は場合によりR6から選択される基により置換されており;
R3は、水素またはハロであり;
mは、0または1であり;
R4は、ハロ、ニトロ、シアノ、ヒドロキシ、トリフルオロメトキシ、トリフルオロメチル、アミノ、カルボキシ、カルバモイル、メルカプト、スルファモイル、C1−4アルキル、C2−4アルケニル、C2−4アルキニル、メトキシ、エトキシ、アセチル、アセトキシ、メチルアミノ、エチルアミノ、ジメチルアミノ、ジエチルアミノ、N−メチル−N−エチルアミノ、アセチルアミノ、N−メチルカルバモイル、N−エチルカルバモイル、N,N−ジメチルカルバモイル、N,N−ジエチルカルバモイル、N−メチル−N−エチルカルバモイル、フェニル、メチルチオ、エチルチオ、メチルスルフィニル、エチルスルフィニル、メシル、エチルスルホニル、メトキシカルボニル、エトキシカルボニル、N−メチルスルファモイル、N−エチルスルファモイル、N,N−ジメチルスルファモイル、N,N−ジエチルスルファモイルまたはN−メチル−N−エチルスルファモイルから選択され;
あるいは、2つのR4基が隣接炭素上にある場合、それらは場合により炭素環式環または複素環式環を形成していてもよく;その際、炭素環式環または複素環式環は、場合により炭素において1個以上のR7により置換されており;その際、複素環式環が−NH−部分を含む場合、その窒素は場合によりR8から選択される基により置換されており;
nは、0〜5であり;その際、R4の意味は同一であるかまたは異なり;
R5は、ハロ、ニトロ、シアノ、ヒドロキシ、トリフルオロメトキシ、アミノ、カルボキシ、カルバモイル、メルカプト、スルファモイル、C1−6アルキル、C2−6アルケニル、C2−6アルキニル、C1−6アルコキシ、C1−6アルカノイル、C1−6アルカノイルオキシ、N−(C1−6アルキル)アミノ、N,N−(C1−6アルキル)2アミノ、N−(C1−6アルキル)−N−(C1−6アルコキシ)アミノ、C1−6アルカノイルアミノ、N−(C1−6アルキル)カルバモイル、N,N−(C1−6アルキル)2カルバモイル、C1−6アルキルS(O)a(aは0〜2である)、C1−6アルコキシカルボニル、C1−6アルコキシカルボニルアミノ、N−(C1−6アルキル)スルファモイル、N,N−(C1−6アルキル)2スルファモイル、C1−6アルキルスルホニルアミノ、炭素環−R9−、または複素環−R10−から選択され;その際、R5は、場合により炭素において1個以上のR11により置換されており;その際、複素環が−NH−部分を含む場合、その窒素は場合によりR12から選択される基により置換されており;
R6およびR12は、独立して、C1−6アルキル、C1−6アルカノイル、C1−6アルキルスルホニル、C1−6アルコキシカルボニル、カルバモイル、N−(C1−6アルキル)カルバモイル、N,N−(C1−6アルキル)カルバモイル、ベンジル、ベンジルオキシカルボニル、ベンゾイルおよびフェニルスルホニルから選択され;その際、R6およびR12は互いに独立して、場合により炭素において1個以上のR13により置換されており;
R13は、ハロ、ニトロ、シアノ、ヒドロキシ、トリフルオロメトキシ、アミノ、カルボキシ、カルバモイル、メルカプト、スルファモイル、C1−6アルキル、C2−6アルケニル、C2−6アルキニル、C1−6アルコキシ、C1−6アルカノイル、C1−6アルカノイルオキシ、N−(C1−6アルキル)アミノ、N,N−(C1−6アルキル)2アミノ、N−(C1−6アルキル)−N−(C1−6アルコキシ)アミノ、C1−6アルカノイルアミノ、N−(C1−6アルキル)カルバモイル、N,N−(C1−6アルキル)2カルバモイル、C1−6アルキルS(0)a(aは0〜2である)、C1−6アルコキシカルボニル、C1−6アルコキシカルボニルアミノ、N−(C1−6アルキル)スルファモイル、N,N−(C1−6アルキル)2スルファモイル、C1−6アルキルスルホニルアミノ、炭素環−R14−、または複素環−R15−から選択され;その際、R13は、場合により炭素において1個以上のR16により置換されており;その際、複素環が−NH−部分を含む場合、その窒素は場合によりR17から選択される基により置換されており;
R9、R10、R14およびR15は、独立して直接結合、−O−、−N(R18)−、−C(O)−、−N(R19)C(O)−、−C(O)N(R20)−、−S(O)s−、−SO2N(R21)−、または−N(R22)SO2−から選択され;これらにおいて、R18、R19、R20、R21およびR22は、独立して水素またはC1−6アルキルから選択され、sは0〜2であり;
R8およびR17は、独立して、C1−6アルキル、C1−6アルカノイル、C1−6アルキルスルホニル、C1−6アルコキシカルボニル、カルバモイル、N−(C1−6アルキル)カルバモイル、N,N−(C1−6アルキル)カルバモイル、ベンジル、ベンジルオキシカルボニル、ベンゾイルおよびフェニルスルホニルから選択され;
R7、R11およびR16は、独立してハロ、ニトロ、シアノ、ヒドロキシ、トリフルオロメトキシ、トリフルオロメチル、アミノ、カルボキシ、カルバモイル、メルカプト、スルファモイル、C1−6アルキル、C2−6アルケニル、C2−6アルキニル、メトキシ、エトキシ、アセチル、アセトキシ、メチルアミノ、エチルアミノ、ジメチルアミノ、ジエチルアミノ、N−メチル−N−エチルアミノ、アセチルアミノ、N−メチルカルバモイル、N−エチルカルバモイル、N,N−ジメチルカルバモイル、N,N−ジエチルカルバモイル、N−メチル−N−エチルカルバモイル、フェニル、メチルチオ、エチルチオ、メチルスルフィニル、エチルスルフィニル、メシル、エチルスルホニル、メトキシカルボニル、エトキシカルボニル、N−メチルスルファモイル、N−エチルスルファモイル、N,N−ジメチルスルファモイル、N,N−ジエチルスルファモイルまたはN−メチル−N−エチルスルファモイルから選択される。
【0013】
ある態様において、本発明は式(I)の化合物:
【0014】
【化2】

【0015】
またはその医薬的に許容できる塩に関する;
式中:
R1およびR2は、独立して、水素、ハロ、ニトロ、シアノ、ヒドロキシ、トリフルオロメトキシ、アミノ、カルボキシ、カルバモイル、メルカプト、スルファモイル、C1−6アルキル、C2−6アルケニル、C2−6アルキニル、C1−6アルコキシ、C1−6アルカノイル、C1−6アルカノイルオキシ、N−(C1−6アルキル)アミノ、N,N−(C1−6アルキル)2アミノ、N−(C1−6アルキル)−N−(C1−6アルコキシ)アミノ、C1−6アルカノイルアミノ、N−(C1−6アルキル)カルバモイル、N,N−(C1−6アルキル)2カルバモイル、C1−6アルコキシカルボニル、N−(C1−6アルキル)スルファモイル、N,N−(C1−6アルキル)2スルファモイル、C1−6アルキルスルホニルアミノ、炭素環または複素環から選択され;その際、R1およびR2は互いに独立して、場合により炭素において1個以上のR5により置換されており;その際、複素環が−NH−部分を含む場合、その窒素は場合によりR6から選択される基により置換されており;
R3は、水素またはハロであり;
mは、0または1であり;
R4は、ハロ、ニトロ、シアノ、ヒドロキシ、トリフルオロメトキシ、トリフルオロメチル、アミノ、カルボキシ、カルバモイル、メルカプト、スルファモイル、C1−4アルキル、C2−4アルケニル、C2−4アルキニル、メトキシ、エトキシ、アセチル、アセトキシ、メチルアミノ、エチルアミノ、ジメチルアミノ、ジエチルアミノ、N−メチル−N−エチルアミノ、アセチルアミノ、N−メチルカルバモイル、N−エチルカルバモイル、N,N−ジメチルカルバモイル、N,N−ジエチルカルバモイル、N−メチル−N−エチルカルバモイル、フェニル、メチルチオ、エチルチオ、メチルスルフィニル、エチルスルフィニル、メシル、エチルスルホニル、メトキシカルボニル、エトキシカルボニル、N−メチルスルファモイル、N−エチルスルファモイル、N,N−ジメチルスルファモイル、N,N−ジエチルスルファモイルまたはN−メチル−N−エチルスルファモイルから選択され;
あるいは、2つのR4基が隣接炭素上にある場合、それらは場合により炭素環式環または複素環式環を形成していてもよく;その際、炭素環式環または複素環式環は、場合により炭素において1個以上のR7により置換されており;その際、複素環式環が−NH−部分を含む場合、その窒素は場合によりR8から選択される基により置換されており;
nは、0〜5であり;その際、R4の意味は同一であるかまたは異なり;
R5は、ハロ、ニトロ、シアノ、ヒドロキシ、トリフルオロメトキシ、アミノ、カルボキシ、カルバモイル、メルカプト、スルファモイル、C1−6アルキル、C2−6アルケニル、C2−6アルキニル、C1−6アルコキシ、C1−6アルカノイル、C1−6アルカノイルオキシ、N−(C1−6アルキル)アミノ、N,N−(C1−6アルキル)2アミノ、N−(C1−6アルキル)−N−(C1−6アルコキシ)アミノ、C1−6アルカノイルアミノ、N−(C1−6アルキル)カルバモイル、N,N−(C1−6アルキル)2カルバモイル、C1−6アルキルS(O)a(aは0〜2である)、C1−6アルコキシカルボニル、C1−6アルコキシカルボニルアミノ、N−(C1−6アルキル)スルファモイル、N,N−(C1−6アルキル)2スルファモイル、C1−6アルキルスルホニルアミノ、炭素環−R9−、または複素環−R10−から選択され;その際、R5は、場合により炭素において1個以上のR11により置換されており;その際、複素環が−NH−部分を含む場合、その窒素は場合によりR12から選択される基により置換されており;
R6およびR12は、独立して、C1−6アルキル、C1−6アルカノイル、C1−6アルキルスルホニル、C1−6アルコキシカルボニル、カルバモイル、N−(C1−6アルキル)カルバモイル、N,N−(C1−6アルキル)カルバモイル、ベンジル、ベンジルオキシカルボニル、ベンゾイルおよびフェニルスルホニルから選択され;その際、R6およびR12は互いに独立して、場合により炭素において1個以上のR13により置換されており;
R13は、ハロ、ニトロ、シアノ、ヒドロキシ、トリフルオロメトキシ、アミノ、カルボキシ、カルバモイル、メルカプト、スルファモイル、C1−6アルキル、C2−6アルケニル、C2−6アルキニル、C1−6アルコキシ、C1−6アルカノイル、C1−6アルカノイルオキシ、N−(C1−6アルキル)アミノ、N,N−(C1−6アルキル)2アミノ、N−(C1−6アルキル)−N−(C1−6アルコキシ)アミノ、C1−6アルカノイルアミノ、N−(C1−6アルキル)カルバモイル、N,N−(C1−6アルキル)2カルバモイル、C1−6アルキルS(0)a(aは0〜2である)、C1−6アルコキシカルボニル、C1−6アルコキシカルボニルアミノ、N−(C1−6アルキル)スルファモイル、N,N−(C1−6アルキル)2スルファモイル、C1−6アルキルスルホニルアミノ、炭素環−R14−、または複素環−R15−から選択され;その際、R13は、場合により炭素において1個以上のR16により置換されており;その際、複素環が−NH−部分を含む場合、その窒素は場合によりR17から選択される基により置換されており;
R9、R10、R14およびR15は、独立して直接結合、−O−、−N(R18)−、−C(O)−、−N(R19)C(O)−、−C(O)N(R20)−、−S(O)s−、−SO2N(R21)−、または−N(R22)SO2−から選択され;これらにおいて、R18、R19、R20、R21およびR22は、独立して水素またはC1−6アルキルから選択され、sは0〜2であり;
R8およびR17は、独立して、C1−6アルキル、C1−6アルカノイル、C1−6アルキルスルホニル、C1−6アルコキシカルボニル、カルバモイル、N−(C1−6アルキル)カルバモイル、N,N−(C1−6アルキル)カルバモイル、ベンジル、ベンジルオキシカルボニル、ベンゾイルおよびフェニルスルホニルから選択され;
R7、R11およびR16は、独立してハロ、ニトロ、シアノ、ヒドロキシ、トリフルオロメトキシ、トリフルオロメチル、アミノ、カルボキシ、カルバモイル、メルカプト、スルファモイル、C1−6アルキル、C2−6アルケニル、C2−6アルキニル、メトキシ、エトキシ、アセチル、アセトキシ、メチルアミノ、エチルアミノ、ジメチルアミノ、ジエチルアミノ、N−メチル−N−エチルアミノ、アセチルアミノ、N−メチルカルバモイル、N−エチルカルバモイル、N,N−ジメチルカルバモイル、N,N−ジエチルカルバモイル、N−メチル−N−エチルカルバモイル、フェニル、メチルチオ、エチルチオ、メチルスルフィニル、エチルスルフィニル、メシル、エチルスルホニル、メトキシカルボニル、エトキシカルボニル、N−メチルスルファモイル、N−エチルスルファモイル、N,N−ジメチルスルファモイル、N,N−ジエチルスルファモイルまたはN−メチル−N−エチルスルファモイルから選択される。
【0016】
ある態様において、本発明は式(IA)をもつ式(I)の化合物:
【0017】
【化3】

【0018】
またはその医薬的に許容できる塩に関する;
式中:
−−−は、単結合および二重結合から選択され;
−−−が単結合である場合、XはCR24およびNから選択され;
−−−が二重結合である場合、XはCであり;
Yは、OおよびSから選択され;
Aは、O、S、NR25およびCR28R29から選択され;
pは、0〜2であり;
mは、0または1であり;
R4は、独立してハロ、ニトロ、シアノ、ヒドロキシ、トリフルオロメトキシ、トリフルオロメチル、アミノ、カルボキシ、カルバモイル、メルカプト、スルファモイル、C1−4アルキル、C2−4アルケニル、C2−4アルキニル、メトキシ、エトキシ、アセチル、アセトキシ、メチルアミノ、エチルアミノ、ジメチルアミノ、ジエチルアミノ、N−メチル−N−エチルアミノ、アセチルアミノ、N−メチルカルバモイル、N−エチルカルバモイル、N,N−ジメチルカルバモイル、N,N−ジエチルカルバモイル、N−メチル−N−エチルカルバモイル、フェニル、メチルチオ、エチルチオ、メチルスルフィニル、エチルスルフィニル、メシル、エチルスルホニル、メトキシカルボニル、エトキシカルボニル、N−メチルスルファモイル、N−エチルスルファモイル、N,N−ジメチルスルファモイル、N,N−ジエチルスルファモイルまたはN−メチル−N−エチルスルファモイルから選択され;
あるいは、2つのR4基が隣接炭素上にある場合、それらは場合により炭素環式環または複素環式環を形成していてもよく;その際、炭素環式環または複素環式環は、場合により炭素において1個以上のR7により置換されており;その際、複素環式環が−NH−部分を含む場合、その窒素は場合によりR8から選択される基により置換されており;
nは、0〜5であり;その際、R4の意味は同一であるかまたは異なり;
R7は、独立してハロ、ニトロ、シアノ、ヒドロキシ、トリフルオロメトキシ、トリフルオロメチル、アミノ、カルボキシ、カルバモイル、メルカプト、スルファモイル、C1−6アルキル、C2−6アルケニル、C2−6アルキニル、メトキシ、エトキシ、アセチル、アセトキシ、メチルアミノ、エチルアミノ、ジメチルアミノ、ジエチルアミノ、N−メチル−N−エチルアミノ、アセチルアミノ、N−メチルカルバモイル、N−エチルカルバモイル、N,N−ジメチルカルバモイル、N,N−ジエチルカルバモイル、N−メチル−N−エチルカルバモイル、フェニル、メチルチオ、エチルチオ、メチルスルフィニル、エチルスルフィニル、メシル、エチルスルホニル、メトキシカルボニル、エトキシカルボニル、N−メチルスルファモイル、N−エチルスルファモイル、N,N−ジメチルスルファモイル、N,N−ジエチルスルファモイルまたはN−メチル−N−エチルスルファモイルから選択され;
R8は、C1−6アルキル、C1−6アルカノイル、C1−6アルキルスルホニル、C1−6アルコキシカルボニル、カルバモイル、N−(C1−6アルキル)カルバモイル、N,N−(C1−6アルキル)カルバモイル、ベンジル、ベンジルオキシカルボニル、ベンゾイルおよびフェニルスルホニルから選択され;
R23は、HおよびC1−6アルキルから選択され、その際、C1−6アルキルは場合によりC1−6アルコキシで置換されており;
R24、R26、R27、R28は、それぞれ独立して水素およびC1−6アルキルから選択され;
R25は、水素、C1−6アルキルおよびC1−6アルカノイルから選択され、その際、C1−6アルキルおよびC1−6アルカノイルは、場合により炭素において1個以上のR30により置換されており;
あるいは、R25とR27は、それらが結合している原子と一緒に場合により複素環式環を形成していてもよく;その際、複素環式環は、場合により炭素において1個以上のR35により置換されており;その際、複素環式環が−NH−部分を含む場合、その窒素は場合によりR36から選択される基により置換されており;
R29は、水素およびアミノから選択され、その際、アミノは、場合により1個以上のC1−6アルキルにより置換されており;
R30は、ハロ、ニトロ、シアノ、ヒドロキシ、トリフルオロメトキシ、トリフルオロメチル、アミノ、カルボキシ、カルバモイル、メルカプト、スルファモイル、C1−6アルキル、C2−6アルケニル、C2−6アルキニル、メトキシ、エトキシ、アセチル、アセトキシ、メチルアミノ、エチルアミノ、ジメチルアミノ、ジエチルアミノ、N−メチル−N−エチルアミノ、アセチルアミノ、N−メチルカルバモイル、N−エチルカルバモイル、N,N−ジメチルカルバモイル、N,N−ジエチルカルバモイル、N−メチル−N−エチルカルバモイル、フェニル、メチルチオ、エチルチオ、メチルスルフィニル、エチルスルフィニル、メシル、エチルスルホニル、メトキシカルボニル、エトキシカルボニル、N−メチルスルファモイル、N−エチルスルファモイル、N,N−ジメチルスルファモイル、N,N−ジエチルスルファモイル、およびN−メチル−N−エチルスルファモイルから選択され;
R35は、独立してハロ、ニトロ、シアノ、ヒドロキシ、トリフルオロメトキシ、トリフルオロメチル、アミノ、カルボキシ、カルバモイル、メルカプト、スルファモイル、C1−6アルキル、C2−6アルケニル、C2−6アルキニル、メトキシ、エトキシ、アセチル、アセトキシ、メチルアミノ、エチルアミノ、ジメチルアミノ、ジエチルアミノ、N−メチル−N−エチルアミノ、アセチルアミノ、N−メチルカルバモイル、N−エチルカルバモイル、N,N−ジメチルカルバモイル、N,N−ジエチルカルバモイル、N−メチル−N−エチルカルバモイル、フェニル、メチルチオ、エチルチオ、メチルスルフィニル、エチルスルフィニル、メシル、エチルスルホニル、メトキシカルボニル、エトキシカルボニル、N−メチルスルファモイル、N−エチルスルファモイル、N,N−ジメチルスルファモイル、N,N−ジエチルスルファモイルまたはN−メチル−N−エチルスルファモイルから選択され;
R36は、C1−6アルキル、C1−6アルカノイル、C1−6アルキルスルホニル、C1−6アルコキシカルボニル、カルバモイル、N−(C1−6アルキル)カルバモイル、N,N−(C1−6アルキル)カルバモイル、ベンジル、ベンジルオキシカルボニル、ベンゾイルおよびフェニルスルホニルから選択される。
【0019】
ある態様において、本発明は式(IB)をもつ式(I)の化合物:
【0020】
【化4】

【0021】
またはその医薬的に許容できる塩に関する;
式中:
R1およびR2は、独立して、水素、ハロ、ニトロ、シアノ、ヒドロキシ、トリフルオロメトキシ、アミノ、カルボキシ、カルバモイル、メルカプト、スルファモイル、C1−6アルキル、C2−6アルケニル、C2−6アルキニル、C1−6アルコキシ、C1−6アルカノイル、C1−6アルカノイルオキシ、N−(C1−6アルキル)アミノ、N,N−(C1−6アルキル)2アミノ、N−(C1−6アルキル)−N−(C1−6アルコキシ)アミノ、C1−6アルカノイルアミノ、N−(C1−6アルキル)カルバモイル、N,N−(C1−6アルキル)2カルバモイル、C1−6アルコキシカルボニル、N−(C1−6アルキル)スルファモイル、N,N−(C1−6アルキル)2スルファモイル、C1−6アルキルスルホニルアミノ、炭素環または複素環から選択され;その際、R1およびR2は互いに独立して、場合により炭素において1個以上のR5により置換されており;その際、複素環が−NH−部分を含む場合、その窒素は場合によりR6から選択される基により置換されており;
R5は、ハロ、ニトロ、シアノ、ヒドロキシ、トリフルオロメトキシ、アミノ、カルボキシ、カルバモイル、メルカプト、スルファモイル、C1−6アルキル、C2−6アルケニル、C2−6アルキニル、C1−6アルコキシ、C1−6アルカノイル、C1−6アルカノイルオキシ、N−(C1−6アルキル)アミノ、N,N−(C1−6アルキル)2アミノ、N−(C1−6アルキル)−N−(C1−6アルコキシ)アミノ、C1−6アルカノイルアミノ、N−(C1−6アルキル)カルバモイル、N,N−(C1−6アルキル)2カルバモイル、C1−6アルキルS(O)a(aは0〜2である)、C1−6アルコキシカルボニル、C1−6アルコキシカルボニルアミノ、N−(C1−6アルキル)スルファモイル、N,N−(C1−6アルキル)2スルファモイル、C1−6アルキルスルホニルアミノ、炭素環−R9−、または複素環−R10−から選択され;その際、R5は、場合により炭素において1個以上のR11により置換されており;その際、複素環が−NH−部分を含む場合、その窒素は場合によりR12から選択される基により置換されており;
R6およびR12は、独立して、C1−6アルキル、C1−6アルカノイル、C1−6アルキルスルホニル、C1−6アルコキシカルボニル、カルバモイル、N−(C1−6アルキル)カルバモイル、N,N−(C1−6アルキル)カルバモイル、ベンジル、ベンジルオキシカルボニル、ベンゾイルおよびフェニルスルホニルから選択され;その際、R6およびR12は互いに独立して、場合により炭素において1個以上のR13により置換されており;
R13は、ハロ、ニトロ、シアノ、ヒドロキシ、トリフルオロメトキシ、アミノ、カルボキシ、カルバモイル、メルカプト、スルファモイル、C1−6アルキル、C2−6アルケニル、C2−6アルキニル、C1−6アルコキシ、C1−6アルカノイル、C1−6アルカノイルオキシ、N−(C1−6アルキル)アミノ、N,N−(C1−6アルキル)2アミノ、N−(C1−6アルキル)−N−(C1−6アルコキシ)アミノ、C1−6アルカノイルアミノ、N−(C1−6アルキル)カルバモイル、N,N−(C1−6アルキル)2カルバモイル、C1−6アルキルS(0)a(aは0〜2である)、C1−6アルコキシカルボニル、C1−6アルコキシカルボニルアミノ、N−(C1−6アルキル)スルファモイル、N,N−(C1−6アルキル)2スルファモイル、C1−6アルキルスルホニルアミノ、炭素環−R14−、または複素環−R15−から選択され;その際、R13は、場合により炭素において1個以上のR16により置換されており;その際、複素環が−NH−部分を含む場合、その窒素は場合によりR17から選択される基により置換されており;
R9、R10、R14およびR15は、独立して直接結合、−O−、−N(R18)−、−C(O)−、−N(R19)C(O)−、−C(O)N(R20)−、−S(O)s−、−SO2N(R21)−、または−N(R22)SO2−から選択され;これらにおいて、R18、R19、R20、R21およびR22は、独立して水素またはC1−6アルキルから選択され、sは0〜2であり;
R17は、独立して、C1−6アルキル、C1−6アルカノイル、C1−6アルキルスルホニル、C1−6アルコキシカルボニル、カルバモイル、N−(C1−6アルキル)カルバモイル、N,N−(C1−6アルキル)カルバモイル、ベンジル、ベンジルオキシカルボニル、ベンゾイルおよびフェニルスルホニルから選択され;
R11およびR16は、独立してハロ、ニトロ、シアノ、ヒドロキシ、トリフルオロメトキシ、トリフルオロメチル、アミノ、カルボキシ、カルバモイル、メルカプト、スルファモイル、C1−6アルキル、C2−6アルケニル、C2−6アルキニル、メトキシ、エトキシ、アセチル、アセトキシ、メチルアミノ、エチルアミノ、ジメチルアミノ、ジエチルアミノ、N−メチル−N−エチルアミノ、アセチルアミノ、N−メチルカルバモイル、N−エチルカルバモイル、N,N−ジメチルカルバモイル、N,N−ジエチルカルバモイル、N−メチル−N−エチルカルバモイル、フェニル、メチルチオ、エチルチオ、メチルスルフィニル、エチルスルフィニル、メシル、エチルスルホニル、メトキシカルボニル、エトキシカルボニル、N−メチルスルファモイル、N−エチルスルファモイル、N,N−ジメチルスルファモイル、N,N−ジエチルスルファモイルまたはN−メチル−N−エチルスルファモイルから選択され;
R31、R32、R33およびR34は、それぞれ独立して水素、ハロおよびC1−4アルキルから選択される。
【0022】
ある態様において、本発明は式(IC)をもつ式(I)の化合物:
【0023】
【化5】

【0024】
またはその医薬的に許容できる塩に関する;
式中:
−−−は、単結合および二重結合から選択され;
−−−が単結合である場合、XはCR24およびNから選択され;
−−−が二重結合である場合、XはCであり;
Yは、OおよびSから選択され;
Aは、O、S、NR25およびCR28R29から選択され;
pは、0〜2であり;
R23は、C1−6アルキルであり;
R24、R26、R27、R28は、それぞれ独立して水素およびC1−6アルキルから選択され;
R25は、水素、C1−6アルキル、およびC1−6アルカノイルから選択され、その際、C1−6アルキルおよびC1−6アルカノイルは、場合により炭素において1個以上のR30により置換されており;
R29は、水素、および場合により1個以上のC1−6アルキルにより置換されたアミノから選択され;
R30は、ハロ、ニトロ、シアノ、ヒドロキシ、トリフルオロメトキシ、トリフルオロメチル、アミノ、カルボキシ、カルバモイル、メルカプト、スルファモイル、C1−6アルキル、C2−6アルケニル、C2−6アルキニル、メトキシ、エトキシ、アセチル、アセトキシ、メチルアミノ、エチルアミノ、ジメチルアミノ、ジエチルアミノ、N−メチル−N−エチルアミノ、アセチルアミノ、N−メチルカルバモイル、N−エチルカルバモイル、N,N−ジメチルカルバモイル、N,N−ジエチルカルバモイル、N−メチル−N−エチルカルバモイル、フェニル、メチルチオ、エチルチオ、メチルスルフィニル、エチルスルフィニル、メシル、エチルスルホニル、メトキシカルボニル、エトキシカルボニル、N−メチルスルファモイル、N−エチルスルファモイル、N,N−ジメチルスルファモイル、N,N−ジエチルスルファモイル、およびN−メチル−N−エチルスルファモイルから選択され;
R31は、水素およびC1−4アルキルから選択され;
R32は、水素、ハロおよびC1−4アルキルから選択され;
R33は、水素およびハロから選択され;
R34は、ハロから選択される。
【0025】
ある態様において、本発明は式(ID)をもつ式(I)の化合物:
【0026】
【化6】

【0027】
またはその医薬的に許容できる塩に関する;
式中:
−−−は、単結合および二重結合から選択され;
−−−が単結合である場合、XはCHおよびNから選択され;
−−−が二重結合である場合、XはCであり;
Aは、O、NR25およびCHR29から選択され;
pは、0〜2であり;
R23は、メチルおよびエチルから選択され;
R25は、水素、メチル、エチル、イソプロピル、tert−ブチル、1−メトキシ−2−エチル、1−ヒドロキシ−2−エチル、1,1,1−トリフルオロ−2−エチル、2−ヒドロキシ−1−プロピオニル、およびメシルから選択され;
R26およびR27は、それぞれ独立して水素およびメチルから選択され;
R29はジメチルアミノであり;
R31は、水素およびメチルから選択され;
R32は、水素、フルオロ、およびメチルから選択され;
R33は、水素およびクロロから選択され;
R34は、フルオロおよびクロロから選択される。
【0028】
ある態様において、本発明は式(IE)をもつ式(I)の化合物:
【0029】
【化7】

【0030】
またはその医薬的に許容できる塩に関する;
式中:
−−−は、単結合および二重結合から選択され;
Aは、NおよびCHから選択され;
Dは、N、NH、CH、およびCH2から選択され;
Eは、N、NH、CH、およびCH2から選択され;
pは、0〜1であり;
R23は、C1−6アルキルから選択され;
R31は、水素およびC1−4アルキルから選択され;
R32は、水素、ハロ、およびC1−4アルキルから選択され;
R33は、水素およびハロから選択され;
R34は、ハロであり;
R37は、HおよびOHから選択される。
【0031】
ある態様において、本発明は式(IC)をもつ式(I)の化合物:
【0032】
【化8】

【0033】
またはその医薬的に許容できる塩に関する;
式中:
−−−は、単結合および二重結合から選択され;
−−−が単結合である場合、XはCR24およびNから選択され;
−−−が二重結合である場合、XはCであり;
Yは、OおよびSから選択され;
Aは、SO2、NR25およびCR28R29から選択され;
pは、0、1および2から選択され;
R23は、C1−6アルキルであり;
R24、R26、R27、R28は、それぞれ独立して水素およびC1−6アルキルから選択され;
R25は、C1−6アルキルスルホニルであり;
R29は、場合により1個以上のR30により置換されたC1−6アルコキシであり;
R30は、ハロ、ニトロ、シアノ、ヒドロキシ、トリフルオロメトキシ、トリフルオロメチル、アミノ、カルボキシ、カルバモイル、メルカプト、スルファモイル、C1−6アルキル、C2−6アルケニル、C2−6アルキニル、メトキシ、エトキシ、アセチル、アセトキシ、メチルアミノ、エチルアミノ、ジメチルアミノ、ジエチルアミノ、N−メチル−N−エチルアミノ、アセチルアミノ、N−メチルカルバモイル、N−エチルカルバモイル、N,N−ジメチルカルバモイル、N,N−ジエチルカルバモイル、N−メチル−N−エチルカルバモイル、フェニル、メチルチオ、エチルチオ、メチルスルフィニル、エチルスルフィニル、メシル、エチルスルホニル、メトキシカルボニル、エトキシカルボニル、N−メチルスルファモイル、N−エチルスルファモイル、N,N−ジメチルスルファモイル、N,N−ジエチルスルファモイル、およびN−メチル−N−エチルスルファモイルから選択され;
R31は、水素およびC1−4アルキルから選択され;
R32は、水素、ハロおよびC1−4アルキルから選択され;
R33は、水素およびハロから選択され;
R34は、ハロから選択される。
【0034】
ある態様において、本発明は式(IF)をもつ式(I)の化合物:
【0035】
【化9】

【0036】
またはその医薬的に許容できる塩に関する;
式中:
−−−は、単結合および二重結合から選択され;
−−−が単結合である場合、XはCR24およびNから選択され;
−−−が二重結合である場合、XはCであり;
Aは、NR25およびCR28R29から選択され;
pは、0〜2であり;
R24、R26、R27、R28は、それぞれ独立して水素およびC1−6アルキルから選択され;
R25は、水素、C1−6アルキル、C1−6アルキルスルホニル、およびC1−6アルカノイルから選択され、その際、C1−6アルキルおよびC1−6アルカノイルは、場合により炭素において1個以上のR30により置換されており;
R29は、水素、アミノ、および場合により炭素において1個以上のR30により置換されたC1−6アルコキシから選択され;
R30は、ハロ、ニトロ、シアノ、ヒドロキシ、トリフルオロメトキシ、トリフルオロメチル、アミノ、カルボキシ、カルバモイル、メルカプト、スルファモイル、C1−6アルキル、C2−6アルケニル、C2−6アルキニル、メトキシ、エトキシ、アセチル、アセトキシ、メチルアミノ、エチルアミノ、ジメチルアミノ、ジエチルアミノ、N−メチル−N−エチルアミノ、アセチルアミノ、N−メチルカルバモイル、N−エチルカルバモイル、N,N−ジメチルカルバモイル、N,N−ジエチルカルバモイル、N−メチル−N−エチルカルバモイル、フェニル、メチルチオ、エチルチオ、メチルスルフィニル、エチルスルフィニル、メシル、エチルスルホニル、メトキシカルボニル、エトキシカルボニル、N−メチルスルファモイル、N−エチルスルファモイル、N,N−ジメチルスルファモイル、N,N−ジエチルスルファモイル、およびN−メチル−N−エチルスルファモイルから選択され;
R31は、水素およびC1−4アルキルから選択され;
R32は、水素、ハロおよびC1−4アルキルから選択され;
R33は、水素およびハロから選択され;
R34は、ハロから選択される。
【0037】
本明細書において、用語「アルキル」は、直鎖および分枝鎖の両方のアルキル基を含む。個々のアルキル基、たとえば「プロピル」という表記は直鎖型のみに特定され、個々の分枝鎖アルキル基、たとえば「イソプロピル」という表記は分枝鎖型のみに特定される。たとえば「C1−6アルキル」には、C1−4アルキル、C1−3アルキル、プロピル、イソプロピルおよびt−ブチルが含まれる。同様な取決めが他の基に適用される;たとえば「フェニルC1−6アルキル」には、フェニルC1−4アルキル、ベンジル、1−フェニルエチルおよび2−フェニルエチルが含まれる。用語「ハロ」は、フルオロ、クロロ、ブロモおよびヨードを表わす。
【0038】
「1個以上の」基から任意置換基を選択する場合、この定義は、特定した基のうち1つから選択されるすべての置換基または特定した基のうち2つ以上から選択される置換基を含むと理解すべきである。
【0039】
「複素環」は、4〜12個の原子を含み、それらのうち少なくとも1個の原子が窒素、硫黄または酸素から選択される、飽和、部分飽和または不飽和の、単環式または二環式の環であり、それらは特記しない限り、炭素結合または窒素結合することができ、その際、−CH2−基は場合により−C(O)−により交換されていてもよく、環硫黄原子は場合により酸化されてS−オキシドを形成している。用語「複素環」の例および適切な意味は、モルホリノ、ピペリジル、ピリジル、ピラニル、ピロリル、ピラゾリル、イソチアゾリル、インドリル、キノリル、チエニル、1,3−ベンゾジオキソリル、チアジアゾリル、ピペラジニル、チアゾリジニル、ピロリジニル、チオモルホリノ、ピロリニル、ホモピペラジニル、3,5−シオキサピペリジニル、テトラヒドロピラニル、イミダゾリル、ピリミジル、ピラジニル、ピリダジニル、イソオキサゾリル、N−メチルピロリル、4−ピリドン、1−イソキノロン、2−ピロリドン、4−チアゾリドン、ピリジン−N−オキシドおよびキノリン−N−オキシドである。用語「複素環」の例は特にピラゾリルである。本発明の1観点において、「複素環」は、5または6個の原子を含み、そのうち少なくとも1つの原子が窒素、硫黄または酸素から選択される、飽和、部分飽和または不飽和の単環式環であり、それは特記しない限り、炭素結合または窒素結合することができ、−CH2−基は場合により−C(O)−により交換されていてもよく、環硫黄原子は場合により酸化されてS−オキシドを形成している。
【0040】
「炭素環」は、3〜12個の原子を含む、飽和、部分飽和または不飽和の、単環式または二環式の炭素環であるが、その際、−CH2−基は場合により−C(O)−により交換されていてもよい。特に、「炭素環」は、5もしくは6個の原子を含む単環式環、または9もしくは10個の原子を含む二環式環である。「炭素環」の適切な意味には、シクロプロピル、シクロブチル、1−オキソシクロペンチル、シクロペンチル、シクロペンテニル、シクロヘキシル、シクロヘキセニル、フェニル、ナフチル、テトラリニル、インダニルまたは1−オキソインダニルが含まれる。「炭素環」の例は特にフェニルである。
【0041】
「2つのR4基が隣接炭素上にある場合、それらは場合により炭素環式環または複素環式環を形成していてもよい」。したがって、そのような「炭素環式環」または「複素環式環」は、式(I)中のフェニル環に縮合している。
【0042】
「炭素環式環」は、3〜8個の炭素原子を含み、それらのうち2個が式(I)のフェニル環と共有された、部分飽和または完全不飽和の単環式環であるが、その際、−CH2−基は場合により−C(O)−により交換されていてもよい。式(I)中のフェニル環に縮合した「炭素環式環」の適切な例には、インダニル(炭素環式環が部分飽和5員環である)およびナフチル(炭素環式環が完全不飽和6員環である)が含まれる。
【0043】
「複素環式環」は、4〜8個の原子を含み、それらのうち少なくとも1個の原子が窒素、硫黄または酸素から選択され、2個の原子が式(I)中のフェニル環と共有された炭素原子である、部分飽和または完全不飽和の単環式環であるが、その際、−CH2−基は場合により−C(O)−により交換されていてもよく、環硫黄原子は場合により酸化されてS−オキシドを形成している。式(I)中のフェニル環に縮合した「複素環式環」の適切な例には、インドリニル(複素環式環が1個の窒素原子を含む部分飽和5員環である)およびキノキサリニル(炭素環式環が2個の窒素原子を含む完全不飽和6員環である)が含まれる。
【0044】
「C1−6アルカノイルオキシ」の例は、アセトキシである。「C1−6アルコキシカルボニル」の例には、メトキシカルボニル、エトキシカルボニル、n−およびt−ブトキシカルボニルが含まれる。「C1−6アルコキシ」の例には、メトキシ、エトキシおよびプロポキシが含まれる。「C1−6アルカノイルアミノ」の例には、ホルムアミド、アセトアミドおよびプロピオニルアミノが含まれる。「C1−6アルキルS(O)a(aは0〜2である)」の例には、メチルチオ、エチルチオ、メチルスルフィニル、エチルスルフィニル、メシルおよびエチルスルホニルが含まれる。「C1−6アルカノイル」の例には、プロピオニルおよびアセチルが含まれる。「N−(C1−6アルキル)アミノ」の例には、メチルアミノおよびエチルアミノが含まれる。「N,N−(C1−6アルキル)2アミノ」の例には、ジ−N−メチルアミノ、ジ−(N−エチル)アミノおよびN−エチル−N−メチルアミノが含まれる。「C2−6アルケニル」の例は、ビニル、アリルおよび1−プロペニルである。「C2−6アルキニル」の例は、エチニル、1−プロピニルおよび2−プロピニルである。「N−(C1−6アルキル)スルファモイル」の例は、N−(メチル)スルファモイルおよびN−(エチル)スルファモイルである。「N−(C1−6アルキル)2スルファモイル」の例は、N,N−(ジメチル)スルファモイルおよびN−(メチル)−N−(エチル)スルファモイルである。「N−(C1−6アルキル)カルバモイル」の例は、N−(C1−4アルキル)カルバモイル、メチルアミノカルボニルおよびエチルアミノカルボニルである。「N,N−(C1−6アルキル)2カルバモイル」の例は、N,N−(C1−4アルキル)2カルバモイル、ジメチルアミノカルボニルおよびメチルエチルアミノカルボニルである。「C1−6アルキルスルホニル」の例は、メシル、エチルスルホニルおよびイソプロピルスルホニルである。「C1−6アルキルスルホニルアミノ」の例は、メシルアミノ、エチルスルホニルアミノおよびイソプロピルスルホニルアミノである。「C1−6アルコキシカルボニルアミノ」の例は、メトキシカルボニルアミノおよびt−ブトキシカルボニルアミノである。「C1−6アルコキシカルボニルアミノ」の例には、メトキシカルボニルアミノおよびt−ブトキシカルボニルアミノが含まれる。
【0045】
本発明化合物の医薬的に許容できる適切な塩は、たとえば十分に塩基性である本発明化合物の酸付加塩、たとえば無機酸または有機酸たとえば塩酸、臭化水素酸、硫酸、リン酸、トリフルオロ酢酸、クエン酸またはマレイン酸との酸付加塩である。さらに、十分に酸性である本発明化合物の医薬的に許容できる適切な塩は、アルカリ金属塩、たとえばナトリウム塩もしくはカリウム塩、アルカリ土類金属塩、たとえばカルシウム塩もしくはマグネシウム塩、アンモニウム塩、または生理的に許容できる陽イオンを供給する有機塩基との塩、たとえばメチルアミン、ジメチルアミン、トリメチルアミン、ピペリジン、モルホリンもしくはトリス−(2−ヒドロキシエチル)アミンとの塩である。
【0046】
式(I)のある化合物は、キラル中心および/または幾何異性中心(E−およびZ−異性体)をもつ場合があり、本発明はCSF−1Rキナーゼ阻害活性をもつそのような光学異性体、ジアステレオ異性体および幾何異性体をすべて包含すると理解すべきである。本発明はさらに、CSF−1Rキナーゼ阻害活性をもつ式(I)の化合物のいずれかおよびすべての互変異性体形態に関する。
【0047】
式(I)の特定の化合物は溶媒和した形態(たとえば水和形)でも溶媒和していない形態でも存在しうることも理解すべきである。本発明はCSF−1Rキナーゼ阻害活性をもつそのような溶媒和形態をすべて包含すると理解すべきである。
【0048】
可変基の具体的な意味は下記のものである。そのような意味を、前記または後記に定めるいずれかの定義、特許請求の範囲または具体的な態様について適宜使用する。
R1およびR2は、独立して、C1−6アルコキシまたは複素環から選択されるが、その際、R1およびR2は互いに独立して、場合により炭素において1個以上のR5により置換されており;その際、複素環が−NH−部分を含む場合、その窒素は場合によりR6から選択される基により置換されており;その際、
R5は、C1−6アルコキシであり;
R6は、C1−6アルキルである。
【0049】
R1およびR2は、独立して、C1−6アルコキシまたは複素環から選択され;その際、複素環が−NH−部分を含む場合、その窒素は場合によりR6から選択される基により置換されており;その際、R6は、C1−6アルキルから選択される。
【0050】
R1およびR2は、独立して、C1−6アルコキシまたはピペラジニルから選択され;その際、R1およびR2は互いに独立して、場合により炭素において1個以上のR5により置換されており;その際、複素環が−NH−部分を含む場合、その窒素は場合によりR6から選択される基により置換されており;その際、
R5は、C1−6アルコキシであり;
R6は、C1−6アルキルである。
【0051】
R1およびR2は、独立して、C1−6アルコキシまたはピペラジニルから選択され;その際、ピペラジニルは場合により窒素においてR6から選択される基により置換されており;その際、R6は、C1−6アルキルから選択される。
【0052】
R1およびR2は、独立して、メトキシ、エトキシまたはピペラジン−1−イルから選択され;その際、R1およびR2は互いに独立して、場合により炭素において1個以上のR5により置換されており;その際、複素環が−NH−部分を含む場合、その窒素は場合によりR6から選択される基により置換されており;その際、
R5は、メトキシであり;
R6は、メチル、エチル、イソプロピルまたはt−ブチルである。
【0053】
R1およびR2は、独立して、メトキシ、エトキシまたはピペラジニルから選択され;その際、ピペラジニルは場合により窒素においてR6から選択される基により置換されており;その際、R6は、メチル、エチルまたはイソプロピルから選択される。
【0054】
R1およびR2は、独立して、2−メトキシエトキシ、エトキシ、メトキシ、4−エチルピペラジン−1−イル、4−イソプロピルピペラジン−1−イル、4−メチルピペラジン−1−イルまたは4−t−ブチルピペラジン−1−イルから選択される。
【0055】
R1およびR2は、独立して、エトキシ、メトキシ、1−メチルピペラジン−4−イル、1−エチルピペラジン−4−イルまたは1−イソプロピルピペラジン−4−イルから選択される。
【0056】
R1およびR2は両方ともメトキシであるか、あるいはR1はエトキシであり、かつR2は1−メチルピペラジン−4−イル、1−エチルピペラジン−4−イルまたは1−イソプロピルピペラジン−4−イルから選択される。
【0057】
R1およびR2は、両方ともメトキシである。
R1はエトキシであり、かつR2は1−メチルピペラジン−4−イル、1−エチルピペラジン−4−イルまたは1−イソプロピルピペラジン−4−イルから選択される。
【0058】
R1は、2−メトキシエトキシ、エトキシまたはメトキシである。
R2は、4−エチルピペラジン−1−イル、4−イソプロピルピペラジン−1−イル、4−メチルピペラジン−1−イル、4−tert−ブチルピペラジン−1−イルまたはメトキシである。
【0059】
R1は2−メトキシエトキシ、エトキシまたはメトキシであり、かつR2は4−エチルピペラジン−1−イル、4−イソプロピルピペラジン−1−イル、4−メチルピペラジン−1−イル、4−tert−ブチルピペラジン−1−イルまたはメトキシである。
【0060】
R3は、水素である。
mは、0である。
mは、1である。
【0061】
R4は、ハロまたはメチルから選択される。
R4は、フルオロ、クロロまたはメチルから選択される。
nは、2であり;その際、R4の意味は同一であるかまたは異なる。
【0062】
R4,nと、それらが結合しているフェニルは、2,3−ジクロロフェニル、2,4−ジフルオロフェニル、2−フルオロ−4−メチル−フェニル、2−フルオロ−5−メチル−フェニルまたは3−クロロ−2−フルオロ−フェニルを形成している。
【0063】
したがって、本発明のさらに他の観点において、式(I)(前記)の化合物またはその医薬的に許容できる塩が提供され、式中:
R1およびR2は、独立して、C1−6アルコキシまたは複素環から選択され;その際、R1およびR2は互いに独立して、場合により炭素において1個以上のR5により置換されており;その際、複素環が−NH−部分を含む場合、その窒素は場合によりR6から選択される基により置換されており;
R3は、水素であり;
mは、0であり;
R4は、ハロまたはメチルから選択され;
nは、2であり;その際、R4の意味は同一であるかまたは異なり;
R5は、C1−6アルコキシであり;
R6は、C1−6アルキルである。
【0064】
したがって、本発明のさらに他の観点において、式(I)(前記)の化合物またはその医薬的に許容できる塩が提供され、式中:
R1およびR2は、独立して、C1−6アルコキシまたは複素環から選択され;その際、複素環が−NH−部分を含む場合、その窒素は場合によりR6から選択される基により置換されており;R6は、C1−6アルキルから選択され;
R3は、水素であり;
mは、0であり;
R4は、ハロまたはメチルから選択され;
nは、2であり;その際、R4の意味は同一であるかまたは異なる。
【0065】
したがって、本発明のさらに他の観点において、式(I)(前記)の化合物またはその医薬的に許容できる塩が提供され、式中:
R1およびR2は、独立して、2−メトキシエトキシ、エトキシ、メトキシ、4−エチルピペラジン−1−イル、4−イソプロピルピペラジン−1−イル、4−メチルピペラジン−1−イルまたは4−tert−ブチルピペラジン−1−イルから選択され;
R3は、水素であり;
mは、0であり;
R4は、フルオロ、クロロまたはメチルから選択され;
nは、2であり;その際、R4の意味は同一であるかまたは異なる。
【0066】
したがって、本発明のさらに他の観点において、式(I)(前記)の化合物またはその医薬的に許容できる塩が提供され、式中:
R1およびR2は、独立して、メトキシ、エトキシ、1−メチルピペラジン−4−イル、1−エチルピペラジン−4−イルまたは1−イソプロピルピペラジン−4−イルから選択され;
R3は、水素であり;
mは、0であり;
R4は、フルオロ、クロロまたはメチルから選択され;
nは、2であり;その際、R4の意味は同一であるかまたは異なる。
【0067】
本発明のさらに他の観点において、本発明の好ましい化合物は、実施例のいずれか1つの化合物またはその医薬的に許容できる塩である。
本発明の他の観点は、式(I)の化合物またはその医薬的に許容できる塩を製造するための方法を提供し、その方法(それらにおいて可変基は特記しない限り、式(I)において定めたものである)は下記を含む:
方法a) 式(II)の化合物:
【0068】
【化10】

【0069】
(式中、Lは置換可能な原子または基である)を式(III)の化合物:
【0070】
【化11】

【0071】
と反応させる;
あるいは
方法b) 式(IV)の化合物:
【0072】
【化12】

【0073】
またはその活性化された誘導体をアンモニアと反応させる;
方法c) 式(V)の化合物:
【0074】
【化13】

【0075】
(式中、RはC1−6アルキル、特にメチルおよびエチルである)をホルムアミドおよび塩基と反応させる;
あるいは
方法d) 式(VI)の化合物:
【0076】
【化14】

【0077】
を加水分解する;
あるいは
方法e) R1およびR2のうち一方が炭素結合した基である式(I)の化合物について、式(VIIa)または(VIIb)の化合物:
【0078】
【化15】

【0079】
(式中、Lは置換可能な基である)を式(VIIIa)または(VIIIb)の化合物:
R1−B(Ra)2 R2−B(Ra)2
(VIIIa) (VIIIb)
(式中、−B(Ra)2はボロン酸誘導体またはトリアルキルボランである)と反応させる;
あるいは
方法f) R1およびR2のうち一方が窒素結合した基である式(I)の化合物について、式(IXa)または(IXb)の化合物:
【0080】
【化16】

【0081】
(式中、Lは置換可能な基である)を式(Xa)または(Xb)の化合物:
R1−H R2−H
(Xa) (Xb)
と反応させる;
その後、必要であれば
i)式(I)の化合物を式(I)の他の化合物に変換し;
ii)いずれかの保護基を除去し;
iii)医薬的に許容できる塩を形成する。
【0082】
Lは置換可能な基であり、Lに適切な意味にはクロロ、ブロモ、トシルおよびトリフルオロメチルスルホニルオキシが含まれる。
−B(Ra)2はボロン酸誘導体であり、ボロン酸誘導体の適切な例には、ジヒドロキシボリル、4,4,5,5−テトラメチル−1,3,2−ジオキサボロラニルが含まれる;トリアルキルボランの適切な例は、9−ボラビシクロ[3.3.1]ノニルである。
【0083】
前記反応のための具体的な反応条件は下記のとおりである:
方法a) 式(II)の化合物と式(III)の化合物を、溶媒、たとえばエタノールまたはジメチルホルムアミド中で、通常はしばしば70〜100℃の範囲の温度条件下おいて、ある場合には酢酸の添加により触媒作用させて反応させることができる。
【0084】
あるいは、式(II)の化合物と式(III)の化合物は、適切な触媒と配位子、たとえばそれぞれPd2(dba)3とBINAP、および適切な塩基、たとえばナトリウムtert−ブトキシドまたは炭酸セシウムを用いて、カップリング化学により反応させることができる。この反応は、通常は80〜100℃の範囲の温度条件を必要とする。
【0085】
式(II)の化合物は、スキーム1またはスキーム2(後記を参照)の変法により製造できる。
式(III)の化合物は市販化合物であるか、あるいはそれらは文献化合物であるか、あるいはそれらは当業者に既知の方法によって容易に製造できる。
【0086】
方法b) 式(IV)の酸とアンモニアを、適切なカップリング試薬の存在下で互いにカップリングさせることができる。当業者に既知の標準的なペプチドカップリング試薬、たとえばカルボニルジイミダゾールおよびジシクロヘキシルカルボジイミドを適切なカップリング試薬として、場合により触媒、たとえばジメチルアミノピリジンまたは4−ピロリジノピリジンの存在下で、場合により塩基、たとえばトリエチルアミン、ピリジン、または2,6−ジ−アルキル−ピリジン、たとえば2,6−ルチジンもしくは2,6−ジ−tert−ブチルピリジンの存在下において使用できる。適切な溶媒には、ジメチルアセトアミド、ジクロロメタン、ベンゼン、テトラヒドロフランおよびジメチルホルムアミドが含まれる。このカップリング反応は、−40〜40℃の範囲の温度で好都合に実施できる。
【0087】
適切な活性化された酸誘導体には、酸ハロゲン化物、たとえば酸塩化物、および活性エステル、たとえばペンタフルオロフェニルエステルが含まれる。これらのタイプの化合物とアミンの反応は当技術分野で周知であり、たとえばそれらを前記に述べた塩基の存在下で、前記に述べた適切な溶媒中において反応させる。この反応は、−40〜40℃の範囲の温度で好都合に実施できる。
【0088】
式(IV)の化合物は、スキーム1またはスキーム2(後記を参照)の変法により製造できる。
方法c) 式(V)のエステルとホルムアミドおよび塩基を互いに反応させることができる。好ましくは、この反応はホルムアミドを最初に添加し、続いて塩基を添加することにより連続して行われる。適切な塩基はアルコキシド塩基、たとえばメトキシドおよびエトキシド塩基、たとえばナトリウムメトキシドである。この反応は一般に100℃の温度で、適切な溶媒、たとえばDMF中において実施される。
【0089】
式(V)の化合物は、スキーム1に従って製造できる。
【0090】
【化17】

【0091】
式(Va)および(Vb)の化合物は市販化合物であるか、あるいはそれらは文献化合物であるか、あるいはそれらは当業者に既知の方法によって容易に製造できる。
方法d) 式(VI)の化合物を、標準的な酸性または塩基性の条件下で加水分解することができる。
【0092】
式(VI)の化合物は、スキーム1またはスキーム2の変法により製造できる。
方法e) 式(VIIa)および(VIIb)の化合物と式(VIIIa)および(VIIIb)のボロン酸誘導体を、パラジウム触媒および塩基を用いて反応させることができる。適切な触媒はPd(PPh3)4であり、適切な塩基は炭酸カリウムである。この反応は一般に100℃の温度で、またはマイクロ波条件下で、適切な溶媒系、たとえばジオキサン/水中において実施される。
【0093】
式(VIIa)および(VIIb)の化合物と式(VIIIa)および(VIIIb)のトリアルキルボランを、標準的な鈴木条件下で、たとえばPd触媒を用い、塩基の存在下で、適切な溶媒、たとえばDMF中において、一般に50℃で反応させることができる。
【0094】
式(VIIa)および(VIIb)の化合物は、スキーム1またはスキーム2の変法により製造できる。
式(VIIIa)および(VIIIb)の化合物は市販化合物であるか、あるいはそれらは文献化合物であるか、あるいはそれらは当業者に既知の方法によって容易に製造できる。
【0095】
方法f) 式(IXa)および(IXb)の化合物と式(Xa)および(Xb)のアミンを、パラジウム触媒、配位子および塩基を用いて反応させることができる。適切な触媒はPd2(dba)3であり、適切な配位子はBINAPであり、適切な塩基は炭酸セシウムである。この反応は一般に100℃の温度で、またはマイクロ波条件下で、適切な溶媒系、たとえばトルエンまたはジメチルアセトアミド中において実施される。
【0096】
式(IXa)および(IXb)の化合物は、スキーム1またはスキーム2の変法により製造できる。
式(Xa)および(Xb)の化合物は市販化合物であるか、あるいはそれらは文献化合物であるか、あるいはそれらは当業者に既知の方法によって容易に製造できる。
【0097】
式(I)の特定の化合物を製造するための別のスキームであって、本明細書中で前記に述べた中間体を製造するために改変することができるスキームを、スキーム2に示す。
【0098】
【化18】

【0099】
ある態様において、本発明は本明細書に開示する式(I)の化合物の製造方法であって、下記を含む方法に関する;式(V)の化合物:
【0100】
【化19】

【0101】
(式中、RはC1−6アルキルである)をホルムアミドおよび塩基と反応させて式(I)の化合物を形成し;
その後、場合により
i)式(I)の化合物を式(I)の他の化合物に変換し;
ii)いずれかの保護基を除去し;あるいは
iii)医薬的に許容できる塩を形成する。
【0102】
さらに他の態様において、Rはメチルおよびエチルから選択される。
ある態様において、本発明は本明細書に開示する式(I)の化合物の製造方法であって、下記を含む方法に関する;式(VI)の化合物:
【0103】
【化20】

【0104】
を加水分解し、これにより式(I)の化合物を形成し;
その後、場合により
i)式(I)の化合物を式(I)の他の化合物に変換し;
ii)いずれかの保護基を除去し;あるいは
iii)医薬的に許容できる塩を形成する。
【0105】
さらに他の態様において、加水分解は式(VI)の化合物と金属水酸化物および分枝鎖アルキルアルコールを混合することにより実施される。
さらに他の態様において、金属水酸化物は水酸化カリウムである。
【0106】
さらに他の態様において、分枝鎖アルキルアルコールは第三級アルコール、たとえばtert−ブチルアルコールである。
本発明化合物中の種々の環置換基のうちあるものは、前記方法の前または直後に、標準的な芳香族置換反応により導入することができ、あるいは一般的な官能基修飾により生成させることができ、したがって本発明の方法の観点に含まれることは認識されるであろう。そのような反応および修飾には、たとえば芳香族置換反応による置換基の導入、置換基の還元、置換基のアルキル化、および置換基の酸化が含まれる。そのような方法のための試薬および反応条件は化学技術分野で周知である。芳香族置換反応の具体例には、濃硝酸を用いるニトロ基導入;たとえばハロゲン化アシルおよびルイス酸(たとえば三塩化アルミニウム)をフリーデル・クラフツ条件下で用いるアシル基導入;ハロゲン化アルキルおよびルイス酸(たとえば三塩化アルミニウム)をフリーデル・クラフツ条件下で用いるアルキル基導入;ならびにハロ基の導入が含まれる。修飾の具体例には、たとえばニッケル触媒を用いる接触水素化による、または塩酸の存在下で加熱しながら鉄で処理することによる、ニトロ基からアミノ基への還元;アルキルチオからアルキルスルフィニルまたはアルキルスルホニルへの酸化が含まれる。
【0107】
本明細書に述べるある態様において、化合物中のいずれかの感受性基を保護するのが必要/望ましいことも認識されるであろう。保護が必要または望ましい例、および適切な保護方法は、当業者に既知である。一般的な保護基を標準法に従って使用できる(説明については、たとえばT. N. Green, Protective Groups in Organic Synthesis, John Wiley and Sons, 1991を参照)。たとえば、反応体がアミノ、カルボキシまたはヒドロキシなどの基を含む場合、本明細書に記載するある反応においてその基を保護することが望ましい可能性がある。
【0108】
アミノまたはアルキルアミノ基に適切な保護基は、たとえばアシル基、たとえばアルカノイル基、たとえばアセチル、アルコキシカルボニル基、たとえばメトキシカルボニル、エトキシカルボニルもしくはt−ブトキシカルボニル基、アリールメトキシカルボニル基、たとえばベンジルオキシカルボニル、またはアロイル基、たとえばベンゾイルである。前記保護基についての脱保護条件は、保護基の選択に伴って必然的に異なる。たとえば、アシル基、たとえばアルカノイル基またはアルコキシカルボニル基またはアロイル基は、たとえば適切な塩基、たとえばアルカリ金属水酸化物、たとえば水酸化リチウムまたはナトリウムで加水分解することにより除去できる。あるいは、アシル基、たとえばt−ブトキシカルボニル基は、たとえば適切な酸、たとえば塩酸、硫酸もしくはリン酸、またはトリフルオロ酢酸で処理することにより除去でき、アリールメトキシカルボニル基、たとえばベンジルオキシカルボニル基は、たとえばカーボン上パラジウムなどの触媒上で水素化することにより、またはルイス酸、たとえばホウ素トリス(トリフルオロアセテート)で処理することにより除去できる。第一級アミノ基に適切な別の保護基は、たとえばフタロイル基であり、これはアルキルアミン、たとえばジメチルアミノプロピルアミン、またはヒドラジンで処理することにより除去できる。
【0109】
ヒドロキシ基に適切な保護基は、たとえばアシル基、たとえばアルカノイル基、たとえばアセチル、アロイル基、たとえばベンゾイル、またはアリールメチル基、たとえばベンジルである。前記保護基についての脱保護条件は、保護基の選択に伴って必然的に異なるであろう。たとえば、アシル基、たとえばアルカノイル基またはアロイル基は、たとえば適切な塩基、たとえばアルカリ金属水酸化物、たとえば水酸化リチウムまたは水酸化ナトリウムで加水分解することにより除去できる。あるいは、アリールメチル基、たとえばベンジル基は、たとえばカーボン上パラジウムなどの触媒上で水素化することにより除去できる。
【0110】
カルボキシ基に適切な保護基は、たとえばエステル化基、たとえばメチルまたはエチル基であり、これらはたとえば塩基、たとえば水酸化ナトリウムで加水分解することにより除去できる;あるいは、たとえばt−ブチル基であり、これはたとえば酸、たとえば有機酸、たとえばトリフルオロ酢酸で処理することにより除去できる;あるいは、たとえばベンジル基であり、これはたとえばカーボン上パラジウムなどの触媒上で水素化することにより除去できる。
【0111】
保護基は合成のいずれか好都合な段階で、当技術分野において周知の一般的な手法を用いて除去することができる。
本明細書に記載する特定の中間体は新規であり、本発明のさらに他の特徴として提供される。
【0112】
前記に述べたように、本発明において定める化合物は抗癌活性をもち、これはこれらの化合物のCSF−1Rキナーゼ阻害活性から生じると考えられる。これらの特性は、たとえば下記に示す方法を用いて評価することができる。
【0113】
ある態様において、本発明は、癌を処置する方法であって、癌のリスクをもつ対象、癌を伴うと診断された対象、または癌の症状を示す対象を提供し、その対象に本明細書に開示する式(I)の化合物を含む医薬組成物を投与することを含む方法に関する。
【0114】
ある態様において、本発明は、CSF−1Rキナーゼを阻害する方法であって、CSF−1Rキナーゼおよび本明細書に開示する式(I)の化合物を提供し、そしてCSF−1Rキナーゼが阻害される条件下で混合することを含む方法に関する。
【0115】
生物活性
アッセイ1:CSF−1RインビトロAlphaScreenアッセイ
精製したCSF−1Rの活性を、Amplified Luminescent Proximity Homogenous Assay(ALPHA)(Perkin Elmer)によりインビトロで測定した;これは、CSF−1Rの基質であるビオチニル化ポリ−グルタミン−チロシンペプチド(pEY−HTRF CisBio 61GT0BLD)のリン酸化を下記に従って測定するものである。CSF−1RのHisタグ付きキナーゼドメイン(すなわち、アミノ酸568−912,GeneBank ID NM_005211;(配列リストについてはWO 2006/067445,25頁13−19行を参照))を、バキュロウイルス感染SF+Express昆虫細胞(1.4x106細胞/ml)から、フレンチプレス処理し、続いてQiagen Ni−NTA、Superflow Mono Q HR 10/10、およびSuperdex 200 SECカラムによりクロマトグラフィー処理して精製した。一般的な収量は、純度>95%の細胞ペレット245μg/lであった。
【0116】
CSF−1Rの基質のリン酸化を目的化合物の存在下および不存在下で測定した。要約すると、0.57nMの精製CSF−1R、5nMのpEY基質、および化合物を、1×緩衝液中において25℃で30分間プレインキュベートした。1×緩衝液中の90μMアデノシン三リン酸(ATP)の添加により反応を開始し、25℃で60分間インキュベートし、下記のものからなる検出ミックス5μlの添加により反応を停止した:136mMのNaCl、102mMのエチレンジアミン四酢酸、1.65mg/mlのBSA、40ug/mlのストレプトアビジンドナービーズ(Perkin Elmer 6760002)、40ug/mlのpTyrl00アクセプタービーズ(Perkin Elmer 6760620)。プレートを25℃で18時間、暗所でインキュベートした。リン酸化された基質をEn Visionプレート読取装置(Perkin Elmer)により680nm励起、520〜620nm発光で検出した。データをグラフにし、IC50をExcel Fit(Microsoft)により計算した。
【0117】
アッセイ2:CSF1RインビトロAlphaScreenアッセイ
精製したCSF−1Rの活性を、Amplified Luminescent Proximity Homogeneous Assay(ALPHA)(Perkin Elmer,MA)によりインビトロで測定した;これは、CSF−1Rの基質であるビオチニル化ポリ−グルタミン−チロシンペプチド(pEY−HTRF CisBio 61GT0BLD)のリン酸化を下記に従って測定するものである。CSF−1RのHisタグ付きキナーゼドメイン(すなわち、アミノ酸568−912,GeneBank ID NM_005211;(配列リストについてはWO 2006/067445,25頁13−19行を参照))を、バキュロウイルス感染SF+Express昆虫細胞(1.4x106細胞/ml)から、フレンチプレス処理し、続いてQIAgen Ni−NTA、Superflow Mono Q HR 10/10、およびSuperdex 200 SECカラムによりクロマトグラフィー処理して精製した。一般的な収量は、純度>95%の細胞ペレット322ug/lであった。
【0118】
CSF−1Rの基質のリン酸化を目的化合物の存在下および不存在下で測定した。要約すると、1.2×緩衝液中の0.46nMの精製CSF−1R、12nMのpEY基質、および12mMのATPからなる、酵素/基質/アデノシン三リン酸(ATP)ミックス5ulを、2ulの化合物と共に25℃で20分間プレインキュベートした。1.2×緩衝液中の24mM MgCl2からなるMetalミックス5ulで反応を開始し、25℃で90分間インキュベートし、下記のものからなる検出ミックス5ulの添加により反応を停止した:20mMのHEPES、102mMのエチレンジアミン四酢酸、1.65mg/mlのBSA、136mMのNaCl、40ug/mlのストレプトアビジンドナービーズ(Perkin Elmer,MA,カタログ番号6760002)、および40ug/mlのホスホチロシン特異性抗体でコートしたアクセプタービーズ(Perkin Elmer,MA,カタログ番号6760620)。プレートを25℃で18時間、暗所でインキュベートした。リン酸化された基質をEn Visionプレート読取装置(Perkin Elmer)により680nm励起、520〜620nm発光で検出した。データをグラフにし、IC50をExcel Fit(Microsoft)により計算した。
【0119】
前記インビトロアッセイの一方または他方で試験した場合、本発明化合物は一般に30μM未満の活性を示した。たとえば、前記アッセイの一方または他方と実質的に類似するアッセイで下記の結果が得られた。
【0120】
【表1−1】

【0121】
【表1−2】

【0122】
本発明の他の観点によれば、前記に定めた式(I)の化合物またはその医薬的に許容できる塩を医薬的に許容できる希釈剤またはキャリヤーと共に含む医薬組成物が提供される。
【0123】
本発明組成物は、経口投与に適切な形態、たとえば錠剤もしくはカプセル剤、非経口注射(静脈内、皮下、筋肉内、血管内、または注入)に適切な形態、たとえば無菌の液剤、懸濁液剤もしくは乳剤、局所投与に適切な形態、たとえば軟膏剤もしくはクリーム剤、または直腸投与に適切な形態、たとえば坐剤であってもよい。
【0124】
一般に、前記組成物は常法により、一般的な賦形剤を用いて調製できる。
式(I)の化合物は、普通は温血動物に1〜1000mg/kgの単位量で投与され、これが普通は療法有効量を供給する。好ましくは、10〜100mg/kgの一日量を用いる。ただし、一日量は、処置されるホスト、個々の投与経路、および処置される疾患の重症度に応じて必然的に異なるであろう。したがって、最適量はいずれか特定の患者を処置する医師が決定することができる。
【0125】
本発明のさらに他の観点によれば、ヒトまたは動物の身体を療法により処置する方法に使用するための、前記に定めた式(I)の化合物またはその医薬的に許容できる塩が提供される。
【0126】
本発明者らは、本発明において定める化合物またはその医薬的に許容できる塩が有効な抗癌剤であることを見いだした;この特性はそれらのCSF−1Rキナーゼ阻害特性から生じると考えられる。したがって、本発明化合物は、専らまたは部分的にCSF−1Rキナーゼにより仲介される疾患または病的状態の処置に有用であると期待される;すなわち、本発明化合物を用いて、その処置を必要とする温血動物においてCSF−1Rキナーゼ阻害作用を発生させることができる。
【0127】
したがって本発明化合物は、CSF−1Rキナーゼの阻害を特徴とする癌処置方法を提供する;すなわち、本発明化合物を用いて、専らまたは部分的にCSF−1Rキナーゼ阻害により仲介される抗癌作用を発生させることができる。
【0128】
CSF1Rおよび/またはCSF1の異常な発現が下記を含めた多数のヒト癌および誘導細胞系(これらに限定されない)において観察されているので、そのような本発明化合物は広域の抗癌特性をもつと期待される:乳腺、卵巣、子宮内膜、前立腺、肺、腎臓および膵臓の腫瘍、ならびに血液学的悪性疾患:脊髄形成異常症候群、急性骨髄性白血病、慢性骨髄性白血病、非ホジキンリンパ腫、ホジキン病、多発性骨髄腫、および慢性リンパ球性白血病を含むが、これらに限定されない。活性化型の変異が造血組織およびリンパ組織ならびに肺の癌においても報告されている。さらに、下記を含めた多数の腫瘍タイプ(これらに限定されない)において腫瘍関連マクロファージが予後不良に関連している:乳癌、子宮内膜癌、腎癌、肺癌、膀胱癌および子宮頚癌、神経膠腫、食道の扁平上皮癌、悪性ブドウ膜黒色腫、ならびに濾胞性リンパ腫。本発明化合物は、腫瘍に対する直接作用により、および/または腫瘍関連マクロファージに対する作用によって間接的に、これらの癌に対して抗癌活性をもつと期待される。
【0129】
本発明のさらに他の観点において、式(I)の化合物は特定の他の適応症の処置に際しても有用となることができる。これらの適応症には下記のものが含まれるが、これらに限定されない:腫瘍関連の骨溶解;骨粗鬆症:卵巣摘除術誘発性の骨損失を含む;整形移植障害;自己免疫障害:全身性紅斑性狼瘡を含む;関節炎:リウマチ性関節炎、骨関節炎を含む;腎炎および糸球体腎炎;炎症性腸疾患;腎臓および骨髄の同種異系移植片ならびに皮膚異種移植片を含めた移植片の拒絶;アテローム性動脈硬化症;肥満症;アルツハイマー病;ならびにランゲルハンス細胞ヒスチオサイトーシス。したがって本発明のさらに他の観点には、これらの疾患のうち1以上、特にリウマチ性関節炎および骨関節炎を含めた関節炎の処置が含まれる。これらの適応症には、慢性閉塞性肺疾患、糖尿病、および乾癬を含めた慢性皮膚障害も含まれるが、これらに限定されない。
【0130】
したがって、本発明のこの観点によれば、医薬として使用するための、前記に定めた式(I)の化合物またはその医薬的に許容できる塩が提供される。
本発明のさらに他の観点によれば、ヒトなどの温血動物においてCSF−1Rキナーゼ阻害作用を発生させる際に使用するための医薬の製造における、前記に定めた式(I)の化合物またはその医薬的に許容できる塩の使用が提供される。
【0131】
本発明のこの観点によれば、ヒトなどの温血動物において抗癌作用を発生させる際に使用するための医薬の製造における、前記に定めた式(I)の化合物またはその医薬的に許容できる塩の使用が提供される。
【0132】
本発明のさらに他の特徴によれば、乳腺、卵巣、膀胱、子宮頚、子宮内膜、前立腺、肺、腎臓および膵臓の腫瘍;血液学的悪性疾患:脊髄形成異常症候群、急性骨髄性白血病、慢性骨髄性白血病、非ホジキンリンパ腫、ホジキン病、多発性骨髄腫および慢性リンパ球性白血病を含む;ならびに神経膠腫、食道の扁平上皮癌、悪性ブドウ膜黒色腫、ならびに濾胞性リンパ腫の処置に使用するための医薬の製造における、前記に定めた式(I)の化合物またはその医薬的に許容できる塩の使用が提供される。
【0133】
本発明のさらに他の特徴によれば、腫瘍関連の骨溶解;骨粗鬆症:卵巣摘除術誘発性の骨損失を含む;整形移植障害;自己免疫障害:全身性紅斑性狼瘡を含む;関節炎:リウマチ性関節炎、骨関節炎を含む;腎炎および糸球体腎炎;炎症性腸疾患;腎臓および骨髄の同種異系移植片ならびに皮膚異種移植片を含めた移植片の拒絶;アテローム性動脈硬化症;肥満症;アルツハイマー病;慢性閉塞性肺疾患;糖尿病;ならびに慢性皮膚障害:乾癬を含む;ならびにランゲルハンス細胞ヒスチオサイトーシスの処置に使用するための医薬の製造における、前記に定めた式(I)の化合物またはその医薬的に許容できる塩の使用が提供される。
【0134】
本発明のこの観点のさらに他の特徴によれば、その処置を必要とするヒトなどの温血動物においてCSF−1Rキナーゼ阻害作用を発生させる方法であって、その動物に有効量の前記に定めた式(I)の化合物またはその医薬的に許容できる塩を投与することを含む方法が提供される。
【0135】
本発明のこの観点のさらに他の特徴によれば、その処置を必要とするヒトなどの温血動物において抗癌作用を発生させる方法であって、その動物に有効量の前記に定めた式(I)の化合物またはその医薬的に許容できる塩を投与することを含む方法が提供される。
【0136】
本発明のこの観点の他の特徴によれば、その処置を必要とするヒトなどの温血動物において乳腺、卵巣、膀胱、子宮頚、子宮内膜、前立腺、肺、腎臓および膵臓の腫瘍;血液学的悪性疾患:骨髄形成異常症候群、急性骨髄性白血病、慢性骨髄性白血病、非ホジキンリンパ腫、ホジキン病、多発性骨髄腫および慢性リンパ球性白血病を含む;ならびに神経膠腫、食道の扁平上皮癌、悪性ブドウ膜黒色腫、ならびに濾胞性リンパ腫を処置する方法であって、その動物に有効量の前記に定めた式(I)の化合物またはその医薬的に許容できる塩を投与することを含む方法が提供される。
【0137】
本発明のこの観点の他の特徴によれば、その処置を必要とするヒトなどの温血動物において腫瘍関連の骨溶解;骨粗鬆症:卵巣摘除術誘発性の骨損失を含む;整形移植障害;自己免疫障害:全身性紅斑性狼瘡を含む;関節炎:リウマチ性関節炎、骨関節炎を含む;腎炎および糸球体腎炎;炎症性腸疾患;腎臓および骨髄の同種異系移植片ならびに皮膚異種移植片を含めた移植片の拒絶;アテローム性動脈硬化症;肥満症;アルツハイマー病;慢性閉塞性肺疾患;糖尿病;ならびに慢性皮膚障害:乾癬を含む;ならびにランゲルハンス細胞ヒスチオサイトーシスを処置する方法であって、その動物に有効量の前記に定めた式(I)の化合物またはその医薬的に許容できる塩を投与することを含む方法が提供される。
【0138】
本発明のさらに他の観点では、ヒトなどの温血動物においてCSF−1Rキナーゼ阻害作用を発生させる際に使用するための、前記に定めた式(I)の化合物またはその医薬的に許容できる塩を医薬的に許容できる希釈剤またはキャリヤーと共に含む医薬組成物が提供される。
【0139】
本発明のさらに他の観点では、ヒトなどの温血動物において抗癌作用を発生させる際に使用するための、前記に定めた式(I)の化合物またはその医薬的に許容できる塩を医薬的に許容できる希釈剤またはキャリヤーと共に含む医薬組成物が提供される。
【0140】
本発明のさらに他の観点では、ヒトなどの温血動物において乳腺、卵巣、膀胱、子宮頚、子宮内膜、前立腺、肺、腎臓および膵臓の腫瘍;血液学的悪性疾患:骨髄形成異常症候群、急性骨髄性白血病、慢性骨髄性白血病、非ホジキンリンパ腫、ホジキン病、多発性骨髄腫および慢性リンパ球性白血病を含む;ならびに神経膠腫、食道の扁平上皮癌、悪性ブドウ膜黒色腫、ならびに濾胞性リンパ腫を処置する際に使用するための、前記に定めた式(I)の化合物またはその医薬的に許容できる塩を医薬的に許容できる希釈剤またはキャリヤーと共に含む医薬組成物が提供される。
【0141】
本発明のさらに他の観点では、ヒトなどの温血動物において腫瘍関連の骨溶解;骨粗鬆症:卵巣摘除術誘発性の骨損失を含む;整形移植障害;自己免疫障害:全身性紅斑性狼瘡を含む;関節炎:リウマチ性関節炎、骨関節炎を含む;腎炎および糸球体腎炎;炎症性腸疾患;腎臓および骨髄の同種異系移植片ならびに皮膚異種移植片を含めた移植片の拒絶;アテローム性動脈硬化症;肥満症;アルツハイマー病;慢性閉塞性肺疾患;糖尿病;ならびに慢性皮膚障害:乾癬を含む;ならびにランゲルハンス細胞ヒスチオサイトーシスを処置する際に使用するための、前記に定めた式(I)の化合物またはその医薬的に許容できる塩を医薬的に許容できる希釈剤またはキャリヤーと共に含む医薬組成物が提供される。
【0142】
本発明のさらに他の観点によれば、ヒトなどの温血動物においてCSF−1Rキナーゼ阻害作用を発生させる際の、前記に定めた式(I)の化合物またはその医薬的に許容できる塩の使用が提供される。
【0143】
本発明のこの観点によれば、ヒトなどの温血動物において抗癌作用を発生させる際の、前記に定めた式(I)の化合物またはその医薬的に許容できる塩の使用が提供される。
本発明のさらに他の特徴によれば、乳腺、卵巣、膀胱、子宮頚、子宮内膜、前立腺、肺、腎臓および膵臓の腫瘍;血液学的悪性疾患:骨髄形成異常症候群、急性骨髄性白血病、慢性骨髄性白血病、非ホジキンリンパ腫、ホジキン病、多発性骨髄腫および慢性リンパ球性白血病を含む;ならびに神経膠腫、食道の扁平上皮癌、悪性ブドウ膜黒色腫、ならびに濾胞性リンパ腫の処置における、前記に定めた式(I)の化合物またはその医薬的に許容できる塩の使用が提供される。
【0144】
本発明のさらに他の特徴によれば、腫瘍関連の骨溶解;骨粗鬆症:卵巣摘除術誘発性の骨損失を含む;整形移植障害;自己免疫障害:全身性紅斑性狼瘡を含む;関節炎:リウマチ性関節炎、骨関節炎を含む;腎炎および糸球体腎炎;炎症性腸疾患;腎臓および骨髄の同種異系移植片ならびに皮膚異種移植片を含めた移植片の拒絶;アテローム性動脈硬化症;肥満症;アルツハイマー病;慢性閉塞性肺疾患;糖尿病;ならびに慢性皮膚障害:乾癬を含む;ならびにランゲルハンス細胞ヒスチオサイトーシスの処置における、前記に定めた式(I)の化合物またはその医薬的に許容できる塩の使用が提供される。
【0145】
前記に定めたCSF−1Rキナーゼ阻害処置を唯一の療法として適用することができ、あるいは本発明化合物のほかに一般的な外科処置または放射線療法または化学療法を伴うことができる。そのような化学療法は、下記のカテゴリーの抗腫瘍薬のうち1以上を含むことができる:
(i)癌医療に用いられる抗増殖/抗新生物薬およびその組合わせ、たとえばアルキル化剤(たとえばシスプラチン(cis−platin)、カルボプラチン(carboplatin)、シクロホスファミド(cyclophosphamide)、ナイトロジェンマスタード、メルファラン(melphalan)、クロラムブシル(chlorambucil)、ブスルファン(busulphan)およびニトロソ尿素);代謝拮抗薬(たとえば葉酸拮抗薬、たとえばフルオロピリミジン類、たとえば5−フルオロウラシルおよびテガフル(tegafur)、ラルチトレキセド(raltitrexed)、メトトレキセート(methotrexate)、シトシンアラビノシド(cytosine arabinoside)およびヒドロキシ尿素);抗腫瘍性抗生物質(たとえばアントラサイクリン類、たとえばアドリアマイシン(adriamycin)、ブレオマイシン(bleomycin)、ドキソルビシン(doxorubicin)、ダウノマイシン(daunomycin)、エピルビシン(epirubicin)、イダルビシン(idarubicin)、マイトマイシン−C(mitomycin−C)、ダクチノマイシン(dactinomycin)およびミトラマイシン(mithramycin));有糸分裂抑制薬(たとえばビンカアルカロイド、たとえばビンクリスチン(vincristine)、ビンブラスチン(vinblastine)、ビンデシン(vindesine)およびビノレルビン(vinorelbine)、ならびにタキソイド類、たとえばタキソール(taxol)およびタキソテール(taxotere));ならびにトポイソメラーゼ阻害薬(たとえばエピポドフィロトキシン類、たとえばエトポシド(etoposide)およびテニポシド(teniposide)、アムサクリン(amsacrine)、トポテカン(topotecan)およびカンプトテシン(camptothecin));
(ii)細胞増殖抑制薬、たとえば抗エストロゲン薬(たとえばタモキシフェン(tamoxifen)、トレミフェン(toremifene)、ラロキシフェン(raloxifene)、ドロロキシフェン(droloxifene)およびヨードキシフェン(iodoxyfene))、エストロゲン受容体ダウンレギュレーター(たとえばフルベストラント(fulvestrant))、抗アンドロゲン薬(たとえばビカルタミド(bicalutamide)、フルタミド(flutamide)、ニルタミド(nilutamide)および酢酸シプロテロン(cyproterone acetate))、LHRHアンタゴニストまたはLHRHアゴニスト(たとえばゴセレリン(goserelin)、ロイプロレリン(leuprorelin)およびブセレリン(buserelin))、プロゲストーゲン類(たとえば酢酸メゲストロール(megestrol acetate))、アロマターゼ阻害薬(たとえばアナストロゾール(anastrozole)、レトロゾール(letrozole)、ボラゾール(vorazole)およびエキセメスタン(exemestane))、ならびに5α−レダクターゼ阻害薬、たとえばフィナステリド(finasteride);
(iii)癌細胞の浸潤を阻害する薬剤(たとえばメタロプロテイナーゼ阻害薬、たとえばマリマスタット(marimastat)、およびウロキナーゼプラスミノーゲンアクチベーター受容体機能の阻害薬);
(iv)増殖因子機能の阻害薬、たとえばそのような阻害薬には下記のものが含まれる:増殖因子抗体、増殖因子受容体抗体(たとえば抗erbb2抗体トラスツヅマブ(trastuzumab)[Herceptin(商標)]および抗erbbl抗体セツキシマブ(cetuximab)[C225])、ファルネシルトランスフェラーゼ阻害薬、MEK阻害薬、チロシンキナーゼ阻害薬、およびセリン/トレオニンキナーゼ阻害薬、たとえば上皮増殖因子ファミリーの阻害薬(たとえばEGFRファミリーのチロシンキナーゼの阻害薬、たとえばN−(3−クロロ−4−フルオロフェニル)−7−メトキシ−6−(3−モルホリノプロポキシ)キナゾリン−4−アミン(ゲフィチニブ(gefitinib)、AZD 1839)、N−(3−エチニルフェニル)−6,7−ビス(2−メトキシエトキシ)キナゾリン−4−アミン(エルロチニブ(erlotinib)、OSI−774)および6−アクリルアミド−N−(3−クロロ−4−フルオロフェニル)−7−(3−モルホリノプロポキシ)キナゾリン−4−アミン(CI 1033))、たとえば血小板由来増殖因子ファミリーの阻害薬、およびたとえば肝細胞増殖因子ファミリーの阻害薬;
(v)抗血管形成薬、たとえば血管内皮増殖因子の作用を阻害するもの(たとえば抗血管内皮細胞増殖因子抗体ベバシズマブ(bevacizumab)[Avastin(商標)]、国際特許出願WO 97/22596、WO 97/30035、WO 97/32856およびWO 98/13354に開示される化合物)、および他の機序により作動する化合物(たとえばリノミド(linomide)、インテグリンαvβ3機能の阻害薬およびアンギオスタチン(angiostatin));
(vi)血管損傷薬、たとえばコンブレタスタチンA4(Combretastatin A4)、ならびに国際特許出願WO 99/02166、WO 00/40529、WO 00/41669、WO 01/92224、WO 02/04434およびWO 02/08213に開示される化合物;
(vii)アンチセンス療法、たとえば前記に挙げた標的を指向するもの、たとえばISIS 2503、抗rasアンチセンス;
(viii)下記を含む遺伝子療法:たとえば異常な遺伝子、たとえば異常なp53または異常なBRCAlもしくはBRCA2を置換する方法、GDEPT(gene−directed enzyme pro−drug therapy、遺伝子指向性酵素プロドラッグ療法)法、たとえばシトシンデアミナーゼ、チミジンキナーゼまたは細菌性ニトロレダクターゼ酵素を使用するもの、あるいは化学療法または放射線療法に対する患者の耐容性を高める方法、たとえば多剤耐性遺伝子療法;
(ix)下記を含む免疫療法:たとえば患者の腫瘍細胞の免疫原性を高めるためのエクスビボ法およびインビボ法、たとえばサイトカイン、たとえばインターロイキン2、インターロイキン4または顆粒球マクロファージコロニー刺激因子によるトランスフェクション、T細胞アネルギーを低下させる方法、トランスフェクションした免疫細胞、たとえばサイトカイントランスフェクションした樹状細胞を使用する方法、サイトカイントランスフェクションした腫瘍細胞系を使用する方法、および抗イディオタイプ抗体を使用する方法;
(x)下記を含む細胞周期阻害薬:たとえばCDK阻害薬(たとえばフラボピリドール(flavopiridol))および細胞周期チェックポイント(たとえばチェックポイントキナーゼ)の他の阻害薬;オーロラキナーゼならびに有糸分裂および細胞分裂の調節に関与する他のキナーゼ(たとえば有糸分裂キネシン)の阻害薬;ならびにヒストンデアセチラーゼ阻害薬;ならびに
(xi)下記を含むエンドセリンアンタゴニスト:たとえばエンドセリンAアンタゴニスト、エンドセリンBアンタゴニスト、およびエンドセリンAとBのアンタゴニスト;たとえばZD4054およびZD1611(WO 96 40681)、アトラセンタン(atrasentan)ならびにYM598。
【0146】
そのような併用療法は、個々の療法成分の同時、逐次または個別投与により達成できる。そのような組合わせ製剤は、前記の用量範囲内の本発明化合物、および承認された用量範囲内の他の医薬有効薬剤を使用する。
【0147】
式(I)の化合物およびそれらの医薬的に許容できる塩は、療法薬におけるそれらの使用のほか、新規療法薬の探査の一部として、CSF−1Rキナーゼ阻害薬の効果を実験動物、たとえばネコ、イヌ、ウサギ、サル、ラットおよびマウスにおいて評価するためのインビトロおよびインビボ試験系の開発および標準化における薬理学的ツールとしても有用である。
【0148】
前記の他の医薬組成物、プロセス、方法、使用および医薬製造の特徴にも、本明細書に記載する本発明化合物の別態様および好ましい態様が適用される。
【実施例】
【0149】
本発明を限定ではない以下の実施例により説明する;実施例において、別途記載しない限り、下記のとおりである:
(i)温度を摂氏温度(℃)で示す;操作は、別途記載しない限り、室温または周囲温度で、すなわち18〜25℃の範囲の温度で実施された;
(ii)有機溶液を無水の硫酸ナトリウムまたは硫酸マグネシウムで乾燥させた;溶媒の蒸発はロータリーエバポレーターを用いて減圧下に(600〜4000パスカル;4.5〜30mmHg)、最高60℃の浴温で実施された;
(iii)一般に、反応経過をTLCにより追跡し、反応時間は説明のために示すにすぎない;
(iv)最終生成物は満足すべきプロトン核磁気共鳴(NMR)スペクトルおよび/または質量スペクトルのデータを示した;
(v)収量は説明のために示すにすぎず、必ずしも綿密なプロセス開発により得ることができるものではない;より多量の物質が必要な場合、製造を繰り返した;
(vii)NMRデータを示す場合、それは主診断プロトンについてのデルタ値の形であり、内標準としてのテトラメチルシラン(TMS)と対比した百万分率(ppm)で示され、400MHzで、別途指示しない限り、溶媒としてペルジュウテリオジメチルスルホキシド(DMSO−d6)を用いて測定された;
(vii)化学記号はそれらの通常の意味をもつ;SI単位および記号を使用する;
(viii)溶媒比を体積:体積(v/v)により示す;ならびに
(ix)質量分析は、70電子ボルトの電子エネルギーで化学イオン化(CI)モードにおいて直接曝露プローブを用いて行われた;イオン化と指示した場合、それは電子衝撃(EI)、高速原子衝突(FAB)またはエレクトロスプレー(ESP)により行われた;m/zについての値を示す;一般に、親質量を指示するイオンのみを報告する;別途記載しない限り、引用した質量イオンは(MH)+である;
(x)合成が先の実施例に記載したものと同様であると記載した場合、使用量は先の実施例で用いたものと同等なミリモル比である;
(xi)「H−Cube」は、H−Cube連続水素化装置(Thales Nanotechnology製)を表わす;ならびに
(xii)以下の略号を用いた:
DMA N,N−ジメチルアセトアミド;
DMF N,N−ジメチルホルムアミド;
EtOAc 酢酸エチル;
MeOH メタノール;
THF テトラヒドロフラン;
TFA トリフルオロ酢酸;
DMSO ジメチルスルホキシド;および
DCM ジクロロメタン。
【0150】
実施例1 4−[(2,4−ジフルオロフェニル)アミノ]−6,7−ジメトキシシンノリン−3−カルボキサミド
磁気撹拌バーを入れた25mLの丸底フラスコに、4−[(2,4−ジフルオロフェニル)アミノ]−6,7−ジメトキシシンノリン−3−カルボン酸エチル(0.195g,0.50mmol)(方法27)、無水DMF(3mL)、ホルムアミド(0.135g,3mmol)、およびMeOH中の0.5Mナトリウムメトキシド溶液3mLを添加した。反応物を100℃に2時間加温した後、室温にまで放冷した。反応物を水(約50mL)に注ぐと、粗生成物が溶液から沈殿した。この固体を、真空濾過によりブーフナーろうとを用いて採集し、40gのシリカ上でEtOAc/MeOH(4:1)を溶離剤として用いて精製して、0.174g(96%)の表題化合物を白色固体として得た。
【0151】
【化21】

【0152】
実施例2〜12
下記の実施例は、実施例1の処理に従って適切な出発物質を用いて製造され、シリカゲルクロマトグラフィーまたは半調製用逆相HPLCにより精製された。
【0153】
【表2−1】

【0154】
【表2−2】

【0155】
【表2−3】

【0156】
【表2−4】

【0157】
実施例6〜12は、場合により、実施例13ならびに方法47、27および24に記載したものと同様な処理に従って適切な出発物質から同様に製造された。
実施例13 4−(2−フルオロ−4−メチルフェニルアミノ)−7−メトキシ−6−(4−メチルピペラジン−1−イル)シンノリン−3−カルボキサミド
100mLの丸底フラスコに、4−(2−フルオロ−4−メチルフェニルアミノ)−7−メトキシ−6−(4−メチルピペラジン−1−イル)シンノリン−3−カルボニトリル(方法60)(360mg,0.89mmol)および水酸化カリウム(4.9g,88.6mmol)を装入した。無水tert−ブチルアルコール(30ml)を添加し、反応物を激しく還流させながら1時間加熱した後、室温にまで放冷した。次いで反応混合物を、水(約100mL)を入れた分液ろうとに注入し、EtOAc(2×200mL)で抽出した。有機層を合わせて飽和NaCl水溶液(約100mL)で洗浄し、MgSO4で乾燥させ、濾過し、真空濃縮して粗生成物を得た。これをシリカゲルクロマトグラフィー(40g)によりEtOAc/MeOH(1:1)を溶離剤として用いて精製すると、表題化合物が黄色固体として得られた。次いでこの固体を5mLのMeOHから再結晶することにより、純粋な表題化合物(184mg,48.9%)を淡黄色固体として得た。
【0158】
【化22】

【0159】
実施例14〜46
下記の実施例は、実施例13の処理に従って適切な出発物質を用いて製造され、シリカゲルクロマトグラフィーまたは半調製用逆相HPLCにより精製された。得られた物質を次いで必要ならば再結晶した。
【0160】
【表3−1】

【0161】
【表3−2】

【0162】
【表3−3】

【0163】
【表3−4】

【0164】
【表3−5】

【0165】
【表3−6】

【0166】
【表3−7】

【0167】
【表3−8】

【0168】
【表3−9】

【0169】
【表3−10】

【0170】
【表3−11】

【0171】
【表3−12】

【0172】
実施例47 4−[(2−フルオロ−4−メチルフェニル)アミノ]−6−(1−イソプロピルピペリジン−4−イル)−7−メトキシシンノリン−3−カルボキサミド塩酸塩
4−(2−フルオロ−4−メチルフェニルアミノ)−6−(1−イソプロピル−1,2,3,6−テトラヒドロピリジン−4−イル)−7−メトキシシンノリン−3−カルボキサミド(実施例29,0.250g,0.56mmol)のMeOH(20ml)(数滴の濃HClを含む)中における溶液を、H−Cube装置に1mL/分で20重量%Pd(OH)2/カーボンカートリッジを用いて10バールで通した。還元が終了したことがLCMSにより判定された時点で溶液を減圧濃縮して、0.234g(86%)の生成物を得た。
【0173】
【化23】

【0174】
実施例48
下記の実施例は、実施例47の処理に従って適切な出発物質を用いて製造され、さらに逆相HPLCにより精製された。
【0175】
【表4】

【0176】
実施例49 4−[(2−フルオロ−4−メチルフェニル)アミノ]−6−{4−[(2R)−2−ヒドロキシプロパノイル]ピペラジン−1−イル}−7−メトキシシンノリン−3−カルボキサミド
4−(2−フルオロ−4−メチルフェニルアミノ)−7−メトキシ−6−(ピペラジン−1−イル)シンノリン−3−カルボキサミド(実施例46,0.395g,0.96mmol)のCH2Cl2(20mL)およびMeOH(5mL)中における溶液に、ベンゾトリアゾール−1−イルオキシトリピロリジノ−ホスホニウムヘキサフルオロホスフェート(0.551g,1.06mmol)、(R)−2−ヒドロキシプロパン酸(0.079mL,1.06mmol)、およびN−エチルジイソプロピルアミン(0.181mL,1.06mmol)を添加した。1時間後、追加分のベンゾトリアゾール−1−イルオキシトリピロリジノ−ホスホニウムヘキサフルオロホスフェート(1.10g,2.12mmol)を添加した。2時間後、水(100mL)を添加し、混合物をCH2Cl2で抽出した。有機抽出液を減圧濃縮し、残留物をシリカクロマトグラフィー(ヘキサン/EtOAc、次いでCH2Cl2/MeOHによる)により精製した。粗生成物をCH3CNで摩砕処理し、濾過して173mg(37%)の黄色固体を得た。
【0177】
【化24】

【0178】
実施例50 4−[(2−フルオロ−4−メチルフェニル)アミノ]−7−メトキシ−6−[1−(メチルスルホニル)ピペリジン−4−イル]シンノリン−3−カルボキサミド
4−(2−フルオロ−4−メチルフェニルアミノ)−7−メトキシ−6−(ピペリジン−4−イル)シンノリン−3−カルボキサミド(実施例51,0.1g,0.24mmol)のCH2Cl2(2.5ml)およびDMF(2.5ml)中における溶液に、N−エチルジイソプロピルアミン(0.127ml,0.73mmol)およびメタンスルホニルクロリド(0.021ml,0.27mmol)を添加した。反応混合物を1時間撹拌し、CH2Cl2で希釈し、水で洗浄した。有機層を減圧濃縮し、残留物を逆相クロマトグラフィーにより水中の0.1%ギ酸およびメタノール(50−70%)を用いて精製して、28mg(24%)の灰白色固体を得た。
【0179】
【化25】

【0180】
実施例51 4−[(2−フルオロ−4−メチルフェニル)アミノ]−7−メトキシ−6−ピペリジン−4−イルシンノリン−3−カルボキサミド
4−(2−フルオロ−4−メチルフェニルアミノ)−7−メトキシ−6−(1,2,3,6−テトラヒドロピリジン−4−イル)シンノリン−3−カルボキサミド(実施例52,0.9g,2.21mmol)のMeOH(44.2ml)(数滴の濃HClを含む)中における溶液を、H Cube装置に20重量%Pd(OH)2/カーボンカートリッジを用いて10バールで通した。溶媒を減圧下で除去し、残留物をシリカクロマトグラフィーCH2Cl2/10% MeOH(1% NH4OH)により精製して、692mg(77%)の淡黄色固体を得た。
【0181】
【化26】

【0182】
実施例52 4−[(2−フルオロ−4−メチルフェニル)アミノ]−7−メトキシ−6−(l,2,3,6−テトラヒドロピリジン−4−イル)シンノリン−3−カルボキサミド
4−(3−カルバモイル−4−(2−フルオロ−4−メチルフェニルアミノ)−7−メトキシシンノリン−6−イル)−5,6−ジヒドロピリジン−1(2H)−カルボン酸tert−ブチル(実施例53,1.5g,2.96mmol)のCH2Cl2(11.84mL)およびトリフルオロ酢酸(11.84mL,153.68mmol)中における溶液を16時間撹拌し、減圧濃縮し、残留物をシリカクロマトグラフィーCH2Cl2/5% MeOH(l% NH4OH)により精製して、960mg(80%)の生成物を得た。m/z 408。
【0183】
実施例53 4−{3−(アミノカルボニル)−4−[(2−フルオロ−4−メチルフェニル)アミノ]−7−メトキシシンノリン−6−イル}−3,6−ジヒドロピリジン−1(2H)−カルボン酸tert−ブチル
6−ブロモ−4−(2−フルオロ−4−メチルフェニルアミノ)−7−メトキシシンノリン−3−カルボキサミド塩酸塩(実施例54,1.40g,3.169mmol)、4−(4,4,5,5−テトラメチル−1,3,2−ジオキサボロラン−2−イル)−5,6−ジヒドロピリジン−1(2H)−カルボン酸tert−ブチル(1.47g,4.75mmol)、リン酸三カリウム(2.018g,9.51mmol)、ジシクロヘキシル(2’,6’−ジメトキシビフェニル−2−イル)ホスフィン(0.260g,0.63mmol)およびトリス(ジベンジリデンアセトン)二パラジウム(0)(0.29g,0.32mmol)のn−ブタノール(4.53ml)および水(1.81ml)中における混合物を、N2(g)下に100℃で一夜撹拌した。反応混合物を冷却し、減圧濃縮し、残留物をシリカクロマトグラフィー(CH2Cl2/MeOH)により精製して、1.54g(96%)の淡褐色固体を得た。
【0184】
【化27】

【0185】
実施例54 6−ブロモ−4−[(2−フルオロ−4−メチルフェニル)アミノ]−7−メトキシシンノリン−3−カルボキサミド塩酸塩
6−ブロモ−4−クロロ−7−メトキシシンノリン−3−カルボキサミド(方法21,8.89g,28.09mmol)のエタノール(70ml)中における懸濁液に、2−フルオロ−4−メチルアニリン(3.49ml,30.89mmol)および酢酸(0.016ml,0.28mmol)を添加した。反応混合物を80℃で1時間撹拌し、冷却し、濾過した。固体物質をエタノールで洗浄し、乾燥させて、9.16g(74%)の褐色固体を得た;HCl塩と推定。
【0186】
【化28】

【0187】
出発物質の製造
方法1 1−{4,5−ジメトキシ−2−[(E)−ピロリジン−1−イルジアゼニル]フェニル}エタノン
磁気撹拌バーおよび1−(2−アミノ−4,5−ジメトキシフェニル)エタノン(1.23g,6.29mmol)を入れた100mLの丸底フラスコに、水(4mL)を添加した。混合物を氷浴で0℃に冷却し、濃HCl水溶液(1.95mL)を反応混合物に添加した。効果的に撹拌しながら、亜硝酸ナトリウム(0.434g,6.9mmol)の水(3mL)中における溶液を反応混合物にパスツールピペットで添加した。反応物をこの温度で5分間撹拌し、続いてピロリジン(0.447g,6.30mmol)の0.4N水酸化カリウム水溶液50mL中における溶液を徐々に添加した。反応物をこの温度で0.5時間撹拌した後、分液ろうとに注入し、DCM(2×100mL)で抽出した。有機抽出液を合わせてMgSO4で乾燥させ、濾過し、真空濃縮すると粗生成物が得られた。これを80gのシリカ上でヘキサン/EtOAc(1:1)を溶離剤として用いて精製して、1.49g(85%)の表題化合物を褐色固体として得た。
【0188】
【化29】

【0189】
方法2
下記の中間体を方法1の処理に従って適切な出発物質を用いて製造した。
【0190】
【表5】

【0191】
方法3 3−{4,5−ジメトキシ−2−[(E)−ピロリジン−1−イルジアゼニル]フェニル}−3−オキソプロパン酸エチルナトリウム塩
磁気撹拌バーおよび無水THF(55mL)を入れた250mLの三つ口フラスコに、水素化ナトリウム(1.73g,43.3mmol)および蒸留したばかりの炭酸ジエチル(1.28g,10.83mmol)を添加した。反応混合物を還流させ、1−{4,5−ジメトキシ−2−[(E)−ピロリジン−1−イルジアゼニル]フェニル}エタノン(3.0g,10.83mmol)(方法1)の無水THF(25mL)中における溶液を添加ろうとにより滴加した。混合物をさらに8時間還流させた後、室温にまで放冷した。淡黄色沈殿を真空濾過によりブーフナーろうとを用いて分離し、ジエチルエーテル(約2×100mL)で洗浄し、採集し、真空乾燥すると、4.03g(99%)の表題化合物がそれのナトリウム塩として得られ、これをさらに精製せずに使用した。
【0192】
【化30】

【0193】
方法4
下記の中間体を方法3の処理に従って適切な出発物質を用いて製造した。
【0194】
【表6】

【0195】
方法5 6,7−ジメトキシ−4−オキソ−1,4−ジヒドロシンノリン−3−カルボン酸エチル
磁気撹拌バーを入れた100mLの丸底フラスコに、TFA(30mL)を添加した。フラスコを氷浴内で0℃に冷却し、3−{4,5−ジメトキシ−2−[(E)−ピロリジン−1−イルジアゼニル]フェニル}−3−オキソプロパン酸エチルナトリウム塩(4.03g,10.83mmol)(方法3)を反応混合物に少量ずつ10分間かけて添加した。混合物をこの温度でさらに2時間撹拌した後、0℃の氷水(約300mL)に注いだ。目的生成物が混合物から沈殿し、これを真空濾過によりブーフナーろうとを用いて採集した。この固体を水(1×100mL)およびジエチルエーテル(1×100mL)ですすぐと、1.55g(51%)の表題化合物が灰白色固体として得られ、これをさらに精製せずに使用した。
【0196】
【化31】

【0197】
方法6
下記の中間体を方法5の処理に従って適切な出発物質を用いて製造した。
【0198】
【表7】

【0199】
方法7 4−クロロ−6,7−ジメトキシシンノリン−3−カルボン酸エチル
磁気撹拌バーおよび6,7−ジメトキシ−4−オキソ−1,4−ジヒドロシンノリン−3−カルボン酸エチル(1.00g,3.6mmol)(方法5)を入れた50mLの丸底フラスコに、オキシ塩化リン(15mL)を添加した。反応フラスコに還流冷却器を取り付け、2時間、加熱還流した後、室温にまで放冷した。粗製反応混合物を真空濃縮し、残留物をNaHCO3水溶液(約25mL)で処理した。粗生成物が溶液から沈殿し、これを真空濾過によりブーフナーろうとを用いて採集した。この固体を水(1×100mL)およびジエチルエーテル(1×100mL)で洗浄すると0.941g(88%)の表題化合物が淡褐色固体として得られ、これをさらに精製せずに使用した。
【0200】
【化32】

【0201】
方法8
下記の中間体を方法7の処理に従って適切な出発物質を用いて製造した。
【0202】
【表8】

【0203】
方法9 2−ブロモ−5−ニトロフェノール
2−ブロモ−5−ニトロアニソール(11.0g,47mmol)を入れた500mLの丸底フラスコに、100mLの無水DCMを添加した。次いで塩化アルミニウム(25g,150mmol)を反応混合物に添加した。得られた懸濁液を50℃で一夜、窒素下で加熱した。反応物を室温にまで放冷し、氷に注ぎ、10% HCl水溶液の添加によりpH4の酸性にした。得られた混合物をセライト床により濾過し、濾液を分液ろうとへ移した。水相を塩化メチレン(約2×200mL)で抽出した。有機相を合わせてNa2SO4で乾燥させ、真空濃縮すると粗製の表題化合物が得られた。これをシリカゲルクロマトグラフィー(330g)によりEtOAc/ヘキサン(1:1)を溶離剤として用いて精製して、表題化合物(8.0g,78%)を得た。m/z:217。
【0204】
方法10 1−ブロモ−2−(2−メトキシエトキシ)−4−ニトロベンゼン
2−ブロモ−5−ニトロフェノール(7.24g,33.2mmol)(方法9)の無水DMF中における溶液に、2−メトキシ−1−ブロモエタン(6.92g,49.8mmol)および触媒量のヨウ化カリウム(約100mg)を添加した。反応物を70℃に4時間加熱した後、室温にまで放冷した。次いで反応物を分液ろうとに注入し、EtOAc(約250mL)と水(約250mL)の間で分配した。有機相をNa2SO4で乾燥させ、真空濃縮すると粗製の表題化合物が得られた。これを最少量の温EtOAcに装入した。得られた溶液を氷浴内で冷却し、ヘキサンを徐々に添加して結晶化を誘発した。生成した沈殿をガラスろうとで真空濾過により分離し、風乾して、純粋な表題化合物(8.3g,91%)を得た。
【0205】
【化33】

【0206】
方法11 4−ブロモ−3−(2−メトキシエトキシ)アニリン
開放式の250mL丸底フラスコに、1−ブロモ−2−(2−メトキシエトキシ)−4−ニトロベンゼン(方法10)(5g,18.11mmol)、SiO2上の5重量%FeCl3(17.6g,5.43mmol)、活性炭(10g)、および100mLのMeOHを装入した。この得られた混合物を撹拌しながら80℃に加熱した。次いでヒドラジン・1水和物(10.6mL,217mmol)を慎重に反応混合物に添加した。ヒドラジン・1水和物の添加が終了した後、反応混合物を80℃でさらに40分間撹拌した。次いで反応物を室温にまで放冷し、セライト床により濾過した。フィルターケークをMeOH(約150mL)およびEtOAc(約150mL)で洗浄した。得られた濾液を真空濃縮すると表題化合物が得られ、これをさらに精製せずに使用した(3.16g,71%)。m/z:247。
【0207】
方法12 2−[(4−ブロモ−3−メトキシフェニル)ジアゼニル]−2−シアノアセトアミド
水(100ml)に溶解した亜硝酸ナトリウム(8.54g,123.7mmol)を、4−ブロモ−3−メトキシアニリン(25g,123.7mmol)の濃HCl(46ml,1514mmol)および水(100ml)中における氷冷懸濁液に添加した。10分間撹拌した後、水(1.8L)中の2−シアノアセトアミド(10.40g,123.7mmol)および酢酸ナトリウム・3水和物(84g,617mmol)を添加し、反応物を一夜撹拌した。生成した固体を濾過により採集し、水で洗浄し、乾燥させると橙色固体が得られ、これを1.4Lのエタノール中で30分間還流させた。混合物を室温にまで冷却し、固体を濾過により採集し、エタノール(100ml×3)で洗浄し、乾燥させて、表題化合物を黄色固体(34.4g,94%)として得た。
【0208】
【化34】

【0209】
方法13〜14
下記の中間体を方法12の処理に従って適切な出発物質を用いて製造した。
【0210】
【表9】

【0211】
方法15 4−アミノ−6−ブロモ−7−メトキシシンノリン−3−カルボキサミド:
2−((4−ブロモ−3−メトキシフェニル)ジアゼニル)−2−シアノアセトアミド(方法12)(34.4g,115.8mmol)のトルエン(250ml)中における混合物に、N2下でTiCl4(51.1ml,463mmol)を添加した。反応混合物を還流しながら4時間撹拌した後、室温にまで放冷した。反応混合物を3N HCl氷冷溶液(約600ml)に慎重に注ぎ、次いで混合物を室温にまで高め、次いで90℃で10分間撹拌した。沈殿が生成し、これを真空濾過により採集し、水(約200mL)、エタノール(約200mL)、エーテル(約200mL)で洗浄し、真空乾燥すると表題化合物が褐色固体として得られ、これをさらに精製せずに使用した(30.0g,87%)。
【0212】
【化35】

【0213】
方法16〜17
下記の中間体を方法15の処理に従って適切な出発物質を用いて製造した。
【0214】
【表10】

【0215】
方法18 6−ブロモ−4−ヒドロキシ−7−メトキシシンノリン−3−カルボン酸
lLのフラスコに、4−アミノ−6−ブロモ−7−メトキシシンノリン−3−カルボキサミド(方法15)(30g,101mmol)およびエタノール(650ml)を装入した。水酸化カリウム(100g,1782mmol)の水(350ml)中における懸濁液を反応物に添加し、混合物を9日間、還流しながら撹拌した。次いで反応物を冷却し、セライトのパッドにより濾過し、これを水(約250mL)で洗浄した。得られた濾液を真空濃縮してエタノールを除去し、得られた水溶液を濃HClでpH約3の酸性にした。沈殿が生成し、これを真空濾過により採集した。得られた固体を1.4Lのエタノールに懸濁し、75℃に15分間加熱し、室温にまで冷却すると粗製沈殿が生成し、これを真空濾過により採集した。フィルターケークをエタノール(約200mL)およびジエチルエーテル(約200mL)で洗浄すると表題化合物が褐色固体として得られ、これをさらに精製せずに使用した(26.0g,86%)。
【0216】
【化36】

【0217】
方法19〜20
下記の中間体を方法18の処理に従って適切な出発物質を用いて製造した。
【0218】
【表11】

【0219】
方法21 6−ブロモ−4−クロロ−7−メトキシシンノリン−3−カルボキサミド
6−ブロモ−4−ヒドロキシ−7−メトキシシンノリン−3−カルボン酸(方法18)(14g,46.8mmol)を入れた1Lの丸底フラスコに、SOCl2(342ml)およびDMF(1ml)を添加した。得られた混合物を4時間、加熱還流した後、室温にまで冷却した。反応混合物を真空濃縮すると残留物が得られ、これをアセトン(約400ml)に懸濁した。この懸濁液を氷浴内で0℃に冷却し、濃アンモニア水(50ml,1284mmol)を添加ろうとにより滴加し、得られた混合物を0℃でさらに15分間撹拌した。沈殿が生成し、これを真空濾過により採集した。フィルターケークを水(3×100mL)、アセトン(3×50mL)で洗浄し、採集し、真空乾燥すると表題化合物が灰白色固体(14.00g,94%)として得られ、これをさらに精製せずに使用した。
【0220】
【化37】

【0221】
方法22〜23
下記の中間体を方法21の処理に従って適切な出発物質を用いて製造した。
【0222】
【表12】

【0223】
方法24 6−ブロモ−4−クロロ−7−メトキシシンノリン−3−カルボニトリル
6−ブロモ−4−クロロ−7−メトキシシンノリン−3−カルボキサミド(方法21)(12g,37.9mmol)のDCM(400ml)中における懸濁液に、POCl3(200ml)を添加した。次いでトリエチルアミン(15ml)を慎重に混合物に添加し、これを7時間、還流しながら撹拌した。次いで反応物を室温にまで放冷し、真空濃縮した。次いで粗製残留物を飽和NaHCO3水溶液により0℃で慎重に処理した。沈殿が生成し、これを真空濾過により採集した。フィルターケークを水(約100mL)で洗浄し、採集し、真空乾燥すると表題化合物が灰色固体(9.80g,87%)として得られ、これをさらに精製せずに使用した。
【0224】
【化38】

【0225】
方法25〜26
下記の中間体を方法24の処理に従って適切な出発物質を用いて製造した。
【0226】
【表13】

【0227】
方法27 4−[(2,4−ジフルオロフェニル)アミノ]−6,7−ジメトキシシンノリン−3−カルボン酸エチル
磁気撹拌バーおよび4−クロロ−6,7−ジメトキシシンノリン−3−カルボン酸エチル(0.200g,0.675mmol)(方法7)を入れた50mLの丸底フラスコに、無水エタノール(10mL)、2,4−ジフルオロアニリン(0.087g,0.675mmol)、および氷酢酸(約100μL)を添加した。次いで反応混合物を75℃に1時間加熱し、室温にまで冷却し、濃アンモニア水(約5mL)で希釈した。粗生成物がこの反応混合物から沈殿し、これを真空濾過によりブーフナーろうとを用いて採集した。この固体を水(1×100mL)およびジエチルエーテル(1×100mL)で洗浄すると粗生成物が得られ、これを40gのシリカ上でEtOAcを溶離剤として用いて精製して、0.231g(88%)の表題化合物を黄色固体として得た。
【0228】
【化39】

【0229】
方法28〜45
下記の中間体を方法27の処理に従って適切な出発物質を用いて製造した。
【0230】
【表14−1】

【0231】
【表14−2】

【0232】
【表14−3】

【0233】
【表14−4】

【0234】
【表14−5】

【0235】
方法37〜45に記載した中間体は、方法21〜23の中間体から2工程で、実施例54に記載したアニリン付加法を用い、続いて方法24に記載したアミドからニトリルへの変換により製造することもできる。
【0236】
方法46 1−(2−アミノ−5−ブロモ−4−エトキシフェニル)エタノン
還流冷却器および添加ろうとを備えたlLの三つ口フラスコに、撹拌バー、4−ブロモ−3−エトキシアニリン塩酸塩(25g,100mmol)、および無水トルエン(300mL)を装入した。反応混合物を0℃に冷却し、DCM中の1M三塩化ホウ素溶液100mLを添加ろうとにより反応物に滴加した。三塩化ホウ素の添加が終了した後、アセトニトリル(6.56mL,125mmol)を添加し、続いてDCM中の1M TiCl4溶液110mLを滴加した。得られた不均質な反応混合物を16時間、加熱還流した後、室温にまで放冷した。粗製反応混合物を慎重に2M HCl水溶液(約250mL)に注ぎ、反応混合物を80℃に1時間加温した。室温にまで冷却した後、2N NaOH水溶液を慎重に添加することにより反応混合物のpHを6に調整した。固体を濾過し、濾液をEtOAc(2×1000mL)で抽出した。有機抽出液を合わせてMgSO4で乾燥させ、濾過し、真空濃縮すると粗生成物が暗色の油として得られた。この粗製の油にMeOH(約100mL)を添加すると目的生成物が沈殿し、これを真空濾過によりブーフナーろうとを用いて採集して、10.9g(42%)の表題化合物を褐色固体として得た。m/z 259。
【0237】
方法47 7−エトキシ−4−[(2−フルオロ−5−メチルフェニル)アミノ]−6−(4−メチルピペラジン−1−イル)シンノリン−3−カルボン酸エチル
磁気撹拌バーおよび6−ブロモ−7−エトキシ−4−[(2−フルオロ−5−メチルフェニル)アミノ]シンノリン−3−カルボン酸エチル(0.100g,0.223mmol)(方法28)を入れた50mLの丸底フラスコに、2.5mLの無水ジメチルアセトアミドを添加した。Pd2(dba)3(50mg,0.55mmol)、ラセミBINAP(70mg,0.11mmol)、炭酸セシウム(150mg,0.45mmol)、および1−メチルピペラジン(0.334mmol)を反応物に添加した。混合物を90℃に4時間加熱した後、室温にまで冷却し、ケイソウ土のパッドにより濾過した。濾液を真空濃縮すると粗生成物が得られ、これを12gのシリカ上でEtOAc/MeOH(4:1)を溶離剤として用いて精製して、0.033g(32%)の表題化合物を黄色固体として得た。m/z 468。
【0238】
方法48〜83
下記の中間体を方法47の処理に従って適切な出発物質を用いて製造した。ある中間体は、ナトリウムtert−ブトキシドを炭酸ナトリウムの代わりに用いて、または2−ジシクロヘキシルホスフィノ−2’,4’,6’−トリ−イソプロピル−1,1’−ビフェニル(XPHOS)をBINAPの代わりに用いて製造された。
【0239】
【表15−1】

【0240】
【表15−2】

【0241】
【表15−3】

【0242】
【表15−4】

【0243】
【表15−5】

【0244】
【表15−6】

【0245】
【表15−7】

【0246】
【表15−8】

【0247】
方法84 4−[(2−フルオロ−4−メチルフェニル)アミノ]−7−メトキシ−6−ピリジン−4−イルシンノリン−3−カルボニトリル
6−ブロモ−4−(2−フルオロ−4−メチルフェニルアミノ)−7−メトキシシンノリン−3−カルボニトリル(方法38,0.25g,0.65mmol)、ピリジン−4−イルボロン酸(0.159g,1.29mmol)およびK2CO33(0.357g,2.58mmol)のDMA(3.0ml)および水(0.30ml)中における混合物に、Pd(Ph3P)4(0.224g,0.19mmol)を添加した。反応物をアルゴン下に90℃で12時間撹拌し、冷却し、水(50mL)で希釈し、EtOAc(2×50mL)で抽出した。有機抽出液を合わせて乾燥させ(MgSO4)、濾過し、残留物をシリカクロマトグラフィー(EtOAc)により精製して、0.175g(64%)の生成物を得た。m/z 386。
【0248】
方法85
下記の中間体を方法84の処理に従って適切な出発物質を用いて製造した。
【0249】
【表16】

【0250】
方法86 4−[(2−フルオロ−4−メチルフェニル)アミノ]−6−(1−イソプロピル−1,2,3,6−テトラヒドロピリジン−4−イル)−7−メトキシシンノリン−3−カルボニトリル
4−(2−フルオロ−4−メチルフェニルアミノ)−7−メトキシ−6−(l,2,3,6−テトラヒドロピリジン−4−イル)シンノリン−3−カルボニトリル(方法88,200mg,0.51mmol)のジクロロエタン(5mL)、アセトン(0.566mL,7.70mmol)、および酢酸(0.147mL,2.57mmol)中における溶液に、ナトリウムトリアセトキシボロヒドリド(544mg,2.57mmol)を添加し、反応物を55℃で6時間撹拌した。反応混合物を減圧濃縮し、残留物をシリカクロマトグラフィー(MeOH/EtOAc(1:1))により精製して、120mg(50%)の生成物を得た。m/z 432。
【0251】
方法87
下記の中間体を方法86の処理に従って適切な出発物質を用いて製造した。
【0252】
【表17】

【0253】
方法88 4−[(2−フルオロ−4−メチルフェニル)アミノ]−7−メトキシ−6−(l,2,3,6−テトラヒドロピリジン−4−イル)シンノリン−3−カルボニトリル
4−(3−シアノ−4−(2−フルオロ−4−メチルフェニルアミノ)−7−メトキシシンノリン−6−イル)−5,6−ジヒドロピリジン−1(2H)−カルボン酸tert−ブチル(方法85,600mg,1.23mmol)のCH2Cl2(4.9mL)およびトリフルオロ酢酸(4.9mL,63.6mmol)中における溶液を、2時間撹拌した。反応混合物を減圧濃縮し、クロロホルムと共沸させてトリフルオロ酢酸を除去し、残留物を逆相HPLC(MeCN/水)により精製して、302mg(63%)の生成物を得た。m/z 390。
【0254】
方法89 1−(2−{[tert−ブチル(ジメチル)シリル]オキシ}エチル)ピペラジン
4−(2−(tert−ブチルジメチルシリルオキシ)エチル)ピペラジン−1−カルボン酸ベンジル(方法90,2.1g,5.55mmol)およびPd/C(0.059g,0.55mmol)のメタノール(30mL)中における混合物を、H2(g)下で24時間撹拌した。反応混合物をセライトのパッドにより濾過し、減圧濃縮して、1.20g(88%)の黄色の油を得た。
【0255】
【化40】

【0256】
方法90 4−(2−{[tert−ブチル(ジメチル)シリル]オキシ}エチル)ピペラジン−1−カルボン酸ベンジル
1−ピペラジンカルボン酸ベンジル(1.751mL,9.08mmol)および2−(tert−ブチルジメチルシリルオキシ)アセトアルデヒド(1.209mL,9.99mmol)のMeOH(5mL)およびジクロロエタン(5mL)中における混合物を、4Åのモレキュラーシーブと共に20分間撹拌した。この混合物を、ナトリウムトリアセトキシボロヒドリド(4.81g,22.70mmol)のテトラヒドロフラン(5mL)中における溶液に添加し、一夜撹拌した。反応混合物を炭酸水素ナトリウム(100mL)に添加し、CH2Cl2(3×50mL)で抽出した。有機抽出液を合わせて減圧濃縮し、残留物をシリカクロマトグラフィー(EtOAc/MeOH)により精製して、2.10g(61%)の透明な油を得た。
【0257】
【化41】

【0258】
実施例55 4−[(2−フルオロ−4−メチルフェニル)アミノ]−7−(4−メチルピペラジン−1−イル)シンノリン−3−カルボキサミド
4−(2−フルオロ−4−メチルフェニルアミノ)−7−(4−メチルピペラジン−1−イル)シンノリン−3−カルボニトリル(方法96,180mg,0.48mmol)のtert−BuOH(4.80ml)中における懸濁液に、粉末状水酸化カリウム(2.154g,38.4mmol)を添加し、反応混合物を100℃で1時間撹拌した。反応混合物を冷却し、減圧濃縮した。水を添加し、混合物をDCM/10%MeOHで抽出した。有機層を乾燥させ(Na2SO4)、濾過し、濃縮し、残留物をシリカクロマトグラフィー(DCM−DCM/10% MeOH/1% NH4OH)により精製して、141mg(74%)の黄色固体を得た。
【0259】
【化42】

【0260】
実施例56〜63
下記の実施例は、実施例55の処理に従って適切な出発物質を用いて製造され、シリカゲルクロマトグラフィーまたは半調製用逆相HPLCにより精製された。
【0261】
【表18−1】

【0262】
【表18−2】

【0263】
【表18−3】

【0264】
実施例64 7−ブロモ−4−[(2−フルオロ−4−メチルフェニル)アミノ]シンノリン−3−カルボキサミド
7−ブロモ−4−クロロシンノリン−3−カルボキサミド(方法94,1.3g,4.54mmol)のエタノール(11.3mL)中における懸濁液に、2−フルオロ−4−メチルアニリン(0.77ml,6.81mmol)および酢酸(0.026mL,0.45mmol)を添加し、反応混合物を80℃で2時間撹拌した。冷却後、反応混合物を濾過し、残留物をエタノールで洗浄し、次いで乾燥させて、1.39g(82%)の褐色固体を得た。
【0265】
【化43】

【0266】
実施例65 4−[(2−フルオロ−4−メチルフェニル)アミノ]−7−メトキシ−6−{4−[2−(メチルスルホニル)エチル]ピペラジン−1−イル}シンノリン−3−カルボキサミド
4−(2−フルオロ−4−メチルフェニルアミノ)−7−メトキシ−6−(ピペラジン−1−イル)シンノリン−3−カルボキサミド(実施例46,0.1g,0.24mmol)のDCM(10mL)中における溶液に、−78℃で1−ブロモ−2−(メチルスルホニル)エタン(0.046g,0.24mmol)を添加した。反応物を室温で20時間撹拌し、N,N−ジイソプロピルエチルアミン(0.042mL,0.24mmol)を添加し、反応物をさらに48時間撹拌した。水(30mL)を添加し、混合物をDCMで抽出した。有機抽出液を濃縮し、残留物をシリカクロマトグラフィー(MeOH/DCM 0−5%)により精製した。クロマトグラフィーから得られた物質をアセトニトリル中で摩砕処理し、濾過して33mg(27%)の固体を得た。
【0267】
【化44】

【0268】
実施例66 4−[(2−フルオロ−4−メチルフェニル)アミノ]−6−{4−[2−ヒドロキシ−1−(ヒドロキシメチル)エチル]ピペラジン−1−イル}−7−メトキシシンノリン−3−カルボキサミド
4−(2−フルオロ−4−メチルフェニルアミノ)−7−メトキシ−6−(ピペラジン−1−イル)シンノリン−3−カルボキサミド(実施例46,0.3g,0.73mmol)のメタノール(15mL)中における溶液に、l,3−ジヒドロキシプロパン−2−オン二量体(0.263g,1.46mmol)、酢酸(1.55mL,27.0mmol)およびナトリウムシアノボロヒドリド(0.092g,1.46mmol)を添加した。48時間撹拌した後、反応混合物を濃縮し、シリカクロマトグラフィー(DCM中の7% MeOH(1% NH4OH))により精製して、56mg(16%)の黄色固体を得た。
【0269】
【化45】

【0270】
実施例67 6−{4−[(2S)−2,3−ジヒドロキシプロピル]ピペラジン−1−イル}−4−[(2−フルオロ−4−メチルフェニル)アミノ]−7−メトキシシンノリン−3−カルボキサミド
4−(2−フルオロ−4−メチルフェニルアミノ)−7−メトキシ−6−(ピペラジン−1−イル)シンノリン−3−カルボキサミド(実施例46,0.12g,0.29mmol)のエタノール(4mL)中における懸濁液に、(R)−オキシラン−2−イルメタノール(0.024g,0.32mmol)を添加した。70℃で4時間撹拌した後、溶媒を減圧下で除去し、残留物をシリカクロマトグラフィー(DCM中の10% MeOH(1% NH4OH))により精製して、54mg(38%)の固体を得た。
【0271】
【化46】

【0272】
下記の実施例を、実施例67で用いたものと同様な処理により、実施例46、(S)−オキシラン−2−イルメタノールから製造した:
実施例68 6−{4−[(2R)−2,3−ジヒドロキシプロピル]ピペラジン−1−イル}−4−[(2−フルオロ−4−メチルフェニル)アミノ]−7−メトキシシンノリン−3−カルボキサミド
【0273】
【化47】

【0274】
実施例69 4−[(2−フルオロ−4−メチルフェニル)アミノ]−6−[4−(2−ヒドロキシ−2−メチルプロパノイル)ピペラジン−1−イル]−7−メトキシシンノリン−3−カルボキサミド
4−(2−フルオロ−4−メチルフェニルアミノ)−7−メトキシ−6−(ピペラジン−1−イル)シンノリン−3−カルボキサミド(実施例46,0.23g,0.56mmol)、N,N−ジイソプロピルエチルアミン(0.146mL,0.84mmol)および2−クロロ−1,1−ジメチル−2−オキソエチルアセテート(0.092g,0.56mmol)のDMF(3mL)中における溶液を、30分間撹拌した。溶媒を減圧下で除去し、DCM(10ml)を添加し、混合物を飽和NaHCO3溶液で洗浄した。有機層を乾燥させ(Na2SO4)、濾過し、濃縮すると、0.29gの2−(4−{3−カルバモイル−4−[(2−フルオロ−4−メチルフェニル)アミノ]−7−メトキシシンノリン−6−イル}ピペラジン−1−イル)−1,1−ジメチル−2−オキソエチルアセテートがガムとして得られ、これをさらに精製せずに使用した。m/z 540。
【0275】
2−(4−{3−カルバモイル−4−[(2−フルオロ−4−メチルフェニル)アミノ]−7−メトキシシンノリン−6−イル}ピペラジン−1−イル)−1,1−ジメチル−2−オキソエチルアセテート(0.29g,0.54mmol)のメタノール(4mL)中における溶液に、水酸化リチウム(0.026g,1.08mmol)を添加した。1.5時間撹拌した後、溶媒を減圧下で除去し、残留物をシリカクロマトグラフィー(DCM中の6% MeOH(1% NH4OH))により精製して、107mg(40%)の固体を得た。
【0276】
【化48】

【0277】
下記の実施例を、実施例69で用いたものと同様な処理により、実施例51および(1S)−2−クロロ−1−メチル−2−オキソエチルアセテートから出発して製造した:
実施例70 4−[(2−フルオロ−4−メチルフェニル)アミノ]−6−{1−[(2S)−2−ヒドロキシプロパノイル]ピペリジン−4−イル}−7−メトキシシンノリン−3−カルボキサミド
【0278】
【化49】

【0279】
実施例71 6−[1−(2,2−ジフルオロエチル)ピペリジン−4−イル]−4−[(2−フルオロ−4−メチルフェニル)アミノ]−7−メトキシシンノリン−3−カルボキサミド
4−(2−フルオロ−4−メチルフェニルアミノ)−7−メトキシ−6−(ピペリジン−4−イル)シンノリン−3−カルボキサミド(実施例51,0.12g,0.29mmol)のDCM(2mL)中における懸濁液に、N,N−ジイソプロピルエチルアミン(0.152ml,0.88mmol)、および2,2−ジフルオロエチル トリフルオロメタンスルホネート(0.075g,0.35mmol)のDCM(1mL)中における溶液を添加した。反応混合物を40℃で1時間撹拌し、冷却し、減圧濃縮した。残留物をシリカクロマトグラフィー(DCM−DCM/10% MeOH(1% NH4OH))により精製し、さらに逆相HPLC(0.1% NH4OH,アセトニトリル/水中)により精製して、0.021g(15%)の灰白色固体を得た。
【0280】
【化50】

【0281】
実施例72 6−[(3R,5S)−4−アセチル−3,5−ジメチルピペラジン−1−イル]−4−[(2−フルオロ−4−メチルフェニル)アミノ]−7−メトキシシンノリン−3−カルボキサミド
6−((3R,5S)−3,5−ジメチルピペラジン−1−イル)−4−(2−フルオロ−4−メチルフェニルアミノ)−7−メトキシシンノリン−3−カルボキサミド(実施例36,171mg,0.39mmol)のDMF(5.5mL)中における溶液に、無水酢酸(0.037mL,0.39mmol)およびトリエチルアミン(0.163mL,1.17mmol)を添加した。反応混合物を72時間撹拌し、濾過して若干の沈殿を分離した。濾液を濃縮し、残留物をシリカクロマトグラフィー(DCM−DCM/5% MeOH)により精製して、98mg(52%)の橙色固体を得た。
【0282】
【化51】

【0283】
実施例73 4−[(2−フルオロ−4−メチルフェニル)アミノ]−7−メトキシ−6−(モルホリン−4−イルメチル)シンノリン−3−カルボキサミド
カリウム4−トリフルオロボラトメチル−モルホリン(方法106,80mg,0.39mmol)、CS2CO3(362mg,1.11mmol)および6−ブロモ−4−(2−フルオロ−4−メチルフェニルアミノ)−7−メトキシシンノリン−3−カルボキサミド塩酸塩(実施例54,150mg,0.34mmol)のジオキサン(6mL)および水(1mL)中における混合物に、Pd(OAc)2(2.5mg,0.01mmol)および2−ジシクロヘキシルホスフィノ−2’,4’,6’−トリイソプロピルビフェニル(10.59mg,0.02mmol)を添加した。反応混合物をN2下に80℃で48時間撹拌した。混合物を水(50mL)に添加し、DCM(3×100mL)で抽出した。有機抽出液を合わせて乾燥させ(Na2SO4)、濾過し、濃縮し、残留物をシリカクロマトグラフィー(DCM中の0−20% MeOH)により精製して、33mg(21%)の黄色固体を得た。
【0284】
【化52】

【0285】
出発物質の製造
方法91 2−[(3−ブロモフェニル)ジアゼニル]−2−シアノアセトアミド
3−ブロモアニリン(6.33mL,58.1mmol)および濃HCl(14.5mL,174mmol)の懸濁液に、0℃で、亜硝酸ナトリウム(3.75mL,58.1mmol)の水(13mL)中における溶液を添加した。15分後、シアノアセトアミド(4.89g,58.1mmol)および酢酸ナトリウム(19.1g,232mmol)の水(85mL)およびエタノール(60mL)中における溶液を、反応混合物に滴加した。反応混合物を室温にまで高め、16時間撹拌した。沈殿を濾過し、水、エタノールおよびジエチルエーテルで洗浄し、次いで真空オーブン内で乾燥させて、4.52g(29%)の黄色固体を得た。m/z 269。
【0286】
方法92 4−アミノ−7−ブロモシンノリン−3−カルボキサミド
塩化アルミニウム(3.60ml,65.9mmol)を、2−[(3−ブロモフェニル)ジアゼニル]−2−シアノアセトアミド(方法91,4.4g,16.47mmol)のトルエン(41.2mL)中における懸濁液に添加し、反応混合物を110℃で16時間撹拌した。反応混合物を冷却し、40mLのHCl水溶液(2M)を滴加し、反応混合物を100℃で2時間撹拌した。反応混合物を冷却し、濾過し、残留物をエタノールおよび水で洗浄し、次いで真空オーブン内で乾燥させて、2.71g(62%)の褐色固体を得た。m/z 269。
【0287】
方法93 7−ブロモ−4−ヒドロキシシンノリン−3−カルボン酸
4−アミノ−7−ブロモシンノリン−3−カルボキサミド(方法92,2.4g,8.99mmol)のジオキサン(22.5mL)中における懸濁液に、水酸化カリウム(9.07g,161.7mmol)の水(36mL)中における溶液を添加した。反応混合物を110℃で16時間撹拌し、冷却し、酢酸を添加した。混合物を濾過し、残留物を水で洗浄し、次いで真空オーブン内で乾燥させて、2.10g(87%)の淡褐色固体を得た。m/z 271。
【0288】
方法94 7−ブロモ−4−クロロシンノリン−3−カルボキサミド
塩化チオニル(46.4mL,635mmol)中の7−ブロモ−4−ヒドロキシシンノリン−3−カルボン酸(方法93,1.90g,7.06mmol)を、80℃で16時間撹拌した。反応混合物を冷却し、減圧濃縮した。残留物をアセトン(20mL)に懸濁し、0℃に冷却し、水酸化アンモニウム(2.75mL,70.62mmol)を滴加した。0℃で30分間撹拌した後、混合物を室温にまで高め、濾過し、残留物を水で洗浄し、次いで真空オーブン内で乾燥させて、1.31g(65%)の褐色固体を得た。
【0289】
【化53】

【0290】
方法95 7−ブロモ−4−[(2−フルオロ−4−メチルフェニル)アミノ]シンノリン−3−カルボニトリル
オキシ塩化リン(0.97mL,10.39mmol)を、7−ブロモ−4−(2−フルオロ−4−メチルフェニルアミノ)シンノリン−3−カルボキサミド(実施例64,1.3g,3.46mmol)のDCM(35mL)中における懸濁液に添加し、反応混合物を45℃で1時間撹拌した。トリエチルアミン(4.8mL,34.6mmol)を反応混合物に滴加した。2時間撹拌した後、反応混合物を冷却し、DCMで希釈し、飽和NaHCO3で洗浄した。有機層を乾燥させ、減圧濃縮し、残留物をシリカクロマトグラフィー(DCM)により精製して、0.752g(61%)の褐色固体を得た。
【0291】
【化54】

【0292】
方法96〜104
下記の中間体は、実施例47〜83に用いたものと同様な処理により、適切な出発物質から製造された。
【0293】
【表19−1】

【0294】
【表19−2】

【0295】
方法105 4−[(2−フルオロ−4−メチルフェニル)アミノ]−7−[4−(2−ヒドロキシエチル)ピペラジン−1−イル]シンノリン−3−カルボニトリル
4−(2−フルオロ−4−メチルフェニルアミノ)−7−(ピペラジン−1−イル)シンノリン−3−カルボニトリル(方法98,0.53g,1.46mmol)、酢酸(0.067ml,1.17mmol)、(tert−ブチルジメチルシリルオキシ)アセトアルデヒド(0.334ml,1.75mmol)およびナトリウムシアノボロヒドリド(0.184g,2.92mmol)のメタノール(14.6mL)中における混合物を、16時間撹拌した。HCl(酢酸中1.0M,7.3ml,7.3mmol)を添加し、4時間撹拌した後、反応混合物を濃縮し、残留物をシリカクロマトグラフィー(DCM−DCM/MeOH/NH4OH(10/1/0.1))により精製して、370mg(62%)の黄色固体を得た。m/z 407。
【0296】
方法106 カリウム4−トリフルオロボラトメチル−モルホリン
アセトン(10.00mL)中の2−(ブロモメチル)−4,4,5,5−テトラメチル−1,3,2−ジオキサボロラン(1.9g,8.60mmol)を0℃に冷却し、フッ化水素カリウム(1.679g,21.50mmol)を添加し、続いて水(10mL)を滴加した。反応混合物を室温にまで高め、30分間撹拌し、溶媒を減圧下で除去した。残留物をアセトンに溶解し、ジエチルエーテルを添加し、沈殿を濾過して、1.60g(93%)のカリウムブロモメチルトリフルオロボレートを白色固体として得た。
【0297】
カリウムブロモメチルトリフルオロボレート(650mg,3.24mmol)およびモルホリン(2ml,22.96mmol)を80℃に30分間加熱した。混合物を室温にまで冷却し、濃縮し、残留物をアセトン(5mL)に溶解した。炭酸水素カリウム(324mg,3.24mmol)を添加し、得られた混合物を20分間撹拌した。混合物を濾過し、濃縮し、残留物をアセトンに溶解した。ジエチルエーテルを添加し、沈殿を濾過して、140mg(21%)の黄色ガムを得た。
【0298】
【化55】

【0299】
方法107 1−(2−{[tert−ブチル(ジメチル)シリル]オキシ}エチル)−1,4−ジアゼパン
4Åのモレキュラーシーブを、1−ホモピペラジンカルボン酸ベンジル(1.06mL,5.12mmol)、2−(tert−ブチルジメチルシリルオキシ)アセトアルデヒド(0.744mL,6.15mmol)、メタノール(5mL)、およびDCM(5mL)の混合物に添加した。20分間撹拌した後、混合物をナトリウムトリアセトキシボロヒドリド(2.71g,12.80mmol)のテトラヒドロフラン(10mL)中における溶液に添加し、1時間撹拌した。反応混合物を飽和NaHCO3溶液(100mL)に添加し、DCMで抽出した。有機抽出液を合わせてシリカ上へ減圧濃縮し、シリカクロマトグラフィー(EtOAcの0−20% MeOH)により精製して、1.02g(51%)の4−(2−(tert−ブチルジメチルシリルオキシ)エチル)−1,4−ジアゼパン−1−カルボン酸ベンジルを透明な油として得た。m/z 393。
【0300】
4−(2−(tert−ブチルジメチルシリルオキシ)エチル)−1,4−ジアゼパン−1−カルボン酸ベンジル(1.02g,2.60mmol)およびカーボン上パラジウム(0.083g,0.78mmol)のメタノール(10mL)中における混合物を、水素ガス下で20時間撹拌した。反応混合物を濾過し、減圧濃縮して、0.66g(98%)の無色の油を得た。
【0301】
【化56】

【0302】
方法108 (3R,5S)−3,5−ジメチルピペラジン−1−カルボン酸ベンジル
(2R,6S)−2,6−ジメチルピペラジン(8.0g,70.1mmol)のDCM(70mL)中における溶液に、トリエチルアミン(9.78mL,70.1mmol)を添加した。反応混合物を0℃に冷却し、クロロ炭酸ベンジル(9.86mL,70.1mmol)を添加した。0℃で1時間撹拌した後、反応物を室温にまで高めた。反応混合物をブラインで洗浄し、乾燥させ(Na2SO4)、濃縮し、残留物をシリカクロマトグラフィー(ヘキサン:EtOAc 1:1−EtOAc−EtOAc:MeOH 10:1)により精製して、13.48g(77%)の無色の油を得た。
【0303】
方法109 (3R,5S)−4−(2−(tert−ブチルジメチルシリルオキシ)エチル)−3,5−ジメチルピペラジン−1−カルボン酸ベンジル
(3R,5S)−3,5−ジメチルピペラジン−1−カルボン酸ベンジル(方法108,5.0g,20.1mmol)のDMA(25mL)中における溶液に、ヨウ化テトラブチルアンモニウム(7.44g,20.1mmol)、炭酸カリウム(5.57g,40.3mmol)および(2−ブロモエトキシ)(tert−ブチル)ジメチルシラン(8.67g,36.2mmol)を添加した。反応混合物を120℃で20時間撹拌し、次いで濃縮した。DCM(50mL)を添加し、有機層をH2Oで洗浄し、乾燥させ(Na2SO4)、濃縮し、シリカクロマトグラフィーにより精製して、7.2g(88%)の褐色の油を得た。
【0304】
方法110 (2R,6S)−1−(2−{[tert−ブチル(ジメチル)シリル]オキシ}エチル)−2,6−ジメチルピペラジン
(3R,5S)−4−(2−(tert−ブチルジメチルシリルオキシ)エチル)−3,5−ジメチルピペラジン−1−カルボン酸ベンジル(方法109,7.6g,18.7mmol)のメタノール(30mL)中における混合物、およびカーボン上パラジウム(l00mg)を、水素ガス下で16時間撹拌した。反応混合物をセライトにより濾過し、減圧濃縮し、残留物をシリカクロマトグラフィー(EtOAc、次いでEtOAc/MeOH/Et3N 10/1/0.1、次いでDCM/MeOH/Et3N 10/1/0.1)により精製して、4.0g(79%)の無色の油を得た。
【0305】
【化57】

【技術分野】
【0001】
本発明は、コロニー刺激因子1受容体(CSF−1R)キナーゼ阻害活性を有し、したがってそれらの抗癌活性のため有用であり、そのためヒトまたは動物の身体を処置する方法に有用である化合物またはその医薬的に許容できる塩類に関する。本発明は、それらの化合物の製造方法、それらを含有する医薬組成物、およびヒトなどの温血動物において抗癌作用を発生させる際に使用する医薬の製造におけるそれらの使用にも関する。
【背景技術】
【0002】
受容体型チロシンキナーゼ(RTK)は、細胞のシグナル伝達において重要な役割を果たすプロテインキナーゼのサブファミリーであり、細胞の増殖、生存、血管形成、浸潤および転移を含めた多様な癌関連プロセスに関与する。CSF−1Rを含めて少なくとも96の異なるRTKがあると考えられる。
【0003】
CSF−1Rまたはc−fmsは、最初は癌遺伝子v−fmsとしてネコ肉腫ウイルスから同定された。CSF−1Rは、c−Kit、fms−関連チロシンキナーゼ3(Flt3)、ならびに血小板由来増殖因子受容体αおよびβ(PDGFRαおよびPDGFRβ)と共に、クラスIII RTKのメンバーである。これらのキナーゼはすべて、腫瘍形成のプロセスに関係するとされている。CSF−1Rは、普通は未熟な130kDaの膜貫通タンパク質として発現し、最終的には成熟した145〜160kDaの細胞表面N−結合グリコシル化タンパク質になる。CSF−1Rに対するリガンドであるマクロファージコロニー刺激因子(M−CSFまたはCSF−1)がこの受容体に結合して、この受容体の二量体形成、自動リン酸化をもたらし、続いて下流のシグナル伝達カスケードを活性化する(C. J. Sherr, Biochim Biophys Acta, 1988, 948:225-243)。
【0004】
CSF−1Rは普通は、単核食細胞系列の骨髄細胞およびそれらの骨髄前駆体、ならびに乳汁分泌中の乳腺組織(正常な休止中の組織ではなく)における乳腺管および乳腺胞の上皮細胞に発現する。CSF−1Rの活性化により、単球/マクロファージ系列の細胞の増殖、生存、運動性および分化が刺激される。成熟したマクロファージは、正常な組織発達および免疫防御において鍵となる役割を果たす(F. L. Pixley and E. R. Stanley, Trends in Cell Biology, 2004, 14(11): 628-638)。たとえば、骨芽細胞はCSF−1を発現し、破骨細胞前駆体上の受容体を活性化して、成熟した破骨細胞に分化させる(S. L. Teitelbaum, Science, 2000, 289:1504-1508)。CSF−1R軸は、胎盤の発達、胚の着床、乳腺管および乳腺小葉胞の発達ならびに乳汁分泌において重要な役割を果たす(E. Sapi, Exp Biol Med, 2004, 229: 1-11)。
【0005】
CSF−1RをCSF−1と共にまたはCSF−1なしでトランスフェクションすると、NIH3T3(Rat2および卵巣顆粒膜細胞のトランスフォーメーションおよびインビボ腫瘍形成が誘発される。オートクリンおよび/またはパラクリンシグナル伝達機序は、腫瘍上皮および腫瘍関連マクロファージにおけるCSF−1Rの活性化に関係するとされている。CSF−1Rおよび/またはそれのリガンドの異常な発現および活性化が、ヒトの骨髄性白血病、前立腺、乳腺、卵巣、子宮内膜の癌、および他の多様な癌に見いだされた。多くの研究により、CSF−1Rの過剰発現がこれらの癌のうち幾つかにおける予後不良に関連することが証明された。さらにCSF−1/CSF−1R軸は、腫瘍の血管形成、浸潤および進行に際して重要な役割を果たすと主張されている腫瘍関連マクロファージの調節における鍵となる役割を果たす(E. Sapi, Exp Biol Med, 2004, 229: 1-11)。
【0006】
WO2006/124996(Supergen Inc)には、Polo様キナーゼ−1の特定の阻害薬が開示されている。WO2007/045861(AstonらおよびGlaxo Group Limited)には、特定のIV型ホスホジエステラーゼ阻害薬が開示されている。WO2006/067445(AstraZeneca)には、特定のCSF−1R阻害薬が開示されている。
【先行技術文献】
【特許文献】
【0007】
【特許文献1】WO2006/124996
【特許文献2】WO2007/045861
【特許文献3】WO2006/067445
【非特許文献】
【0008】
【非特許文献1】C. J. Sherr, Biochim Biophys Acta, 1988, 948: 225-243
【非特許文献2】F. L. Pixley and E. R. Stanley, Trends in Cell Biology, 2004, 14(11): 628-638
【非特許文献3】S. L. Teitelbaum, Science, 2000, 289: 1504-1508
【非特許文献4】E. Sapi, Exp Biol Med, 2004, 229: 1-11
【発明の概要】
【0009】
本発明者らは新規な一群のシンノリン類がCSF−1Rの阻害薬であることを見いだし、これが本発明の基礎をなす。
【発明を実施するための形態】
【0010】
したがって本発明は、式(I)の化合物:
【0011】
【化1】

【0012】
またはその医薬的に許容できる塩を提供する;
式中:
R1およびR2は、独立して、ハロ、ニトロ、シアノ、ヒドロキシ、トリフルオロメトキシ、アミノ、カルボキシ、カルバモイル、メルカプト、スルファモイル、C1−6アルキル、C2−6アルケニル、C2−6アルキニル、C1−6アルコキシ、C1−6アルカノイル、C1−6アルカノイルオキシ、N−(C1−6アルキル)アミノ、N,N−(C1−6アルキル)2アミノ、N−(C1−6アルキル)−N−(C1−6アルコキシ)アミノ、C1−6アルカノイルアミノ、N−(C1−6アルキル)カルバモイル、N,N−(C1−6アルキル)2カルバモイル、C1−6アルキルS(O)a(aは0〜2である)、C1−6アルコキシカルボニル、N−(C1−6アルキル)スルファモイル、N,N−(C1−6アルキル)2スルファモイル、C1−6アルキルスルホニルアミノ、炭素環または複素環から選択され;その際、R1およびR2は互いに独立して、場合により炭素において1個以上のR5により置換されており;その際、複素環が−NH−部分を含む場合、その窒素は場合によりR6から選択される基により置換されており;
R3は、水素またはハロであり;
mは、0または1であり;
R4は、ハロ、ニトロ、シアノ、ヒドロキシ、トリフルオロメトキシ、トリフルオロメチル、アミノ、カルボキシ、カルバモイル、メルカプト、スルファモイル、C1−4アルキル、C2−4アルケニル、C2−4アルキニル、メトキシ、エトキシ、アセチル、アセトキシ、メチルアミノ、エチルアミノ、ジメチルアミノ、ジエチルアミノ、N−メチル−N−エチルアミノ、アセチルアミノ、N−メチルカルバモイル、N−エチルカルバモイル、N,N−ジメチルカルバモイル、N,N−ジエチルカルバモイル、N−メチル−N−エチルカルバモイル、フェニル、メチルチオ、エチルチオ、メチルスルフィニル、エチルスルフィニル、メシル、エチルスルホニル、メトキシカルボニル、エトキシカルボニル、N−メチルスルファモイル、N−エチルスルファモイル、N,N−ジメチルスルファモイル、N,N−ジエチルスルファモイルまたはN−メチル−N−エチルスルファモイルから選択され;
あるいは、2つのR4基が隣接炭素上にある場合、それらは場合により炭素環式環または複素環式環を形成していてもよく;その際、炭素環式環または複素環式環は、場合により炭素において1個以上のR7により置換されており;その際、複素環式環が−NH−部分を含む場合、その窒素は場合によりR8から選択される基により置換されており;
nは、0〜5であり;その際、R4の意味は同一であるかまたは異なり;
R5は、ハロ、ニトロ、シアノ、ヒドロキシ、トリフルオロメトキシ、アミノ、カルボキシ、カルバモイル、メルカプト、スルファモイル、C1−6アルキル、C2−6アルケニル、C2−6アルキニル、C1−6アルコキシ、C1−6アルカノイル、C1−6アルカノイルオキシ、N−(C1−6アルキル)アミノ、N,N−(C1−6アルキル)2アミノ、N−(C1−6アルキル)−N−(C1−6アルコキシ)アミノ、C1−6アルカノイルアミノ、N−(C1−6アルキル)カルバモイル、N,N−(C1−6アルキル)2カルバモイル、C1−6アルキルS(O)a(aは0〜2である)、C1−6アルコキシカルボニル、C1−6アルコキシカルボニルアミノ、N−(C1−6アルキル)スルファモイル、N,N−(C1−6アルキル)2スルファモイル、C1−6アルキルスルホニルアミノ、炭素環−R9−、または複素環−R10−から選択され;その際、R5は、場合により炭素において1個以上のR11により置換されており;その際、複素環が−NH−部分を含む場合、その窒素は場合によりR12から選択される基により置換されており;
R6およびR12は、独立して、C1−6アルキル、C1−6アルカノイル、C1−6アルキルスルホニル、C1−6アルコキシカルボニル、カルバモイル、N−(C1−6アルキル)カルバモイル、N,N−(C1−6アルキル)カルバモイル、ベンジル、ベンジルオキシカルボニル、ベンゾイルおよびフェニルスルホニルから選択され;その際、R6およびR12は互いに独立して、場合により炭素において1個以上のR13により置換されており;
R13は、ハロ、ニトロ、シアノ、ヒドロキシ、トリフルオロメトキシ、アミノ、カルボキシ、カルバモイル、メルカプト、スルファモイル、C1−6アルキル、C2−6アルケニル、C2−6アルキニル、C1−6アルコキシ、C1−6アルカノイル、C1−6アルカノイルオキシ、N−(C1−6アルキル)アミノ、N,N−(C1−6アルキル)2アミノ、N−(C1−6アルキル)−N−(C1−6アルコキシ)アミノ、C1−6アルカノイルアミノ、N−(C1−6アルキル)カルバモイル、N,N−(C1−6アルキル)2カルバモイル、C1−6アルキルS(0)a(aは0〜2である)、C1−6アルコキシカルボニル、C1−6アルコキシカルボニルアミノ、N−(C1−6アルキル)スルファモイル、N,N−(C1−6アルキル)2スルファモイル、C1−6アルキルスルホニルアミノ、炭素環−R14−、または複素環−R15−から選択され;その際、R13は、場合により炭素において1個以上のR16により置換されており;その際、複素環が−NH−部分を含む場合、その窒素は場合によりR17から選択される基により置換されており;
R9、R10、R14およびR15は、独立して直接結合、−O−、−N(R18)−、−C(O)−、−N(R19)C(O)−、−C(O)N(R20)−、−S(O)s−、−SO2N(R21)−、または−N(R22)SO2−から選択され;これらにおいて、R18、R19、R20、R21およびR22は、独立して水素またはC1−6アルキルから選択され、sは0〜2であり;
R8およびR17は、独立して、C1−6アルキル、C1−6アルカノイル、C1−6アルキルスルホニル、C1−6アルコキシカルボニル、カルバモイル、N−(C1−6アルキル)カルバモイル、N,N−(C1−6アルキル)カルバモイル、ベンジル、ベンジルオキシカルボニル、ベンゾイルおよびフェニルスルホニルから選択され;
R7、R11およびR16は、独立してハロ、ニトロ、シアノ、ヒドロキシ、トリフルオロメトキシ、トリフルオロメチル、アミノ、カルボキシ、カルバモイル、メルカプト、スルファモイル、C1−6アルキル、C2−6アルケニル、C2−6アルキニル、メトキシ、エトキシ、アセチル、アセトキシ、メチルアミノ、エチルアミノ、ジメチルアミノ、ジエチルアミノ、N−メチル−N−エチルアミノ、アセチルアミノ、N−メチルカルバモイル、N−エチルカルバモイル、N,N−ジメチルカルバモイル、N,N−ジエチルカルバモイル、N−メチル−N−エチルカルバモイル、フェニル、メチルチオ、エチルチオ、メチルスルフィニル、エチルスルフィニル、メシル、エチルスルホニル、メトキシカルボニル、エトキシカルボニル、N−メチルスルファモイル、N−エチルスルファモイル、N,N−ジメチルスルファモイル、N,N−ジエチルスルファモイルまたはN−メチル−N−エチルスルファモイルから選択される。
【0013】
ある態様において、本発明は式(I)の化合物:
【0014】
【化2】

【0015】
またはその医薬的に許容できる塩に関する;
式中:
R1およびR2は、独立して、水素、ハロ、ニトロ、シアノ、ヒドロキシ、トリフルオロメトキシ、アミノ、カルボキシ、カルバモイル、メルカプト、スルファモイル、C1−6アルキル、C2−6アルケニル、C2−6アルキニル、C1−6アルコキシ、C1−6アルカノイル、C1−6アルカノイルオキシ、N−(C1−6アルキル)アミノ、N,N−(C1−6アルキル)2アミノ、N−(C1−6アルキル)−N−(C1−6アルコキシ)アミノ、C1−6アルカノイルアミノ、N−(C1−6アルキル)カルバモイル、N,N−(C1−6アルキル)2カルバモイル、C1−6アルコキシカルボニル、N−(C1−6アルキル)スルファモイル、N,N−(C1−6アルキル)2スルファモイル、C1−6アルキルスルホニルアミノ、炭素環または複素環から選択され;その際、R1およびR2は互いに独立して、場合により炭素において1個以上のR5により置換されており;その際、複素環が−NH−部分を含む場合、その窒素は場合によりR6から選択される基により置換されており;
R3は、水素またはハロであり;
mは、0または1であり;
R4は、ハロ、ニトロ、シアノ、ヒドロキシ、トリフルオロメトキシ、トリフルオロメチル、アミノ、カルボキシ、カルバモイル、メルカプト、スルファモイル、C1−4アルキル、C2−4アルケニル、C2−4アルキニル、メトキシ、エトキシ、アセチル、アセトキシ、メチルアミノ、エチルアミノ、ジメチルアミノ、ジエチルアミノ、N−メチル−N−エチルアミノ、アセチルアミノ、N−メチルカルバモイル、N−エチルカルバモイル、N,N−ジメチルカルバモイル、N,N−ジエチルカルバモイル、N−メチル−N−エチルカルバモイル、フェニル、メチルチオ、エチルチオ、メチルスルフィニル、エチルスルフィニル、メシル、エチルスルホニル、メトキシカルボニル、エトキシカルボニル、N−メチルスルファモイル、N−エチルスルファモイル、N,N−ジメチルスルファモイル、N,N−ジエチルスルファモイルまたはN−メチル−N−エチルスルファモイルから選択され;
あるいは、2つのR4基が隣接炭素上にある場合、それらは場合により炭素環式環または複素環式環を形成していてもよく;その際、炭素環式環または複素環式環は、場合により炭素において1個以上のR7により置換されており;その際、複素環式環が−NH−部分を含む場合、その窒素は場合によりR8から選択される基により置換されており;
nは、0〜5であり;その際、R4の意味は同一であるかまたは異なり;
R5は、ハロ、ニトロ、シアノ、ヒドロキシ、トリフルオロメトキシ、アミノ、カルボキシ、カルバモイル、メルカプト、スルファモイル、C1−6アルキル、C2−6アルケニル、C2−6アルキニル、C1−6アルコキシ、C1−6アルカノイル、C1−6アルカノイルオキシ、N−(C1−6アルキル)アミノ、N,N−(C1−6アルキル)2アミノ、N−(C1−6アルキル)−N−(C1−6アルコキシ)アミノ、C1−6アルカノイルアミノ、N−(C1−6アルキル)カルバモイル、N,N−(C1−6アルキル)2カルバモイル、C1−6アルキルS(O)a(aは0〜2である)、C1−6アルコキシカルボニル、C1−6アルコキシカルボニルアミノ、N−(C1−6アルキル)スルファモイル、N,N−(C1−6アルキル)2スルファモイル、C1−6アルキルスルホニルアミノ、炭素環−R9−、または複素環−R10−から選択され;その際、R5は、場合により炭素において1個以上のR11により置換されており;その際、複素環が−NH−部分を含む場合、その窒素は場合によりR12から選択される基により置換されており;
R6およびR12は、独立して、C1−6アルキル、C1−6アルカノイル、C1−6アルキルスルホニル、C1−6アルコキシカルボニル、カルバモイル、N−(C1−6アルキル)カルバモイル、N,N−(C1−6アルキル)カルバモイル、ベンジル、ベンジルオキシカルボニル、ベンゾイルおよびフェニルスルホニルから選択され;その際、R6およびR12は互いに独立して、場合により炭素において1個以上のR13により置換されており;
R13は、ハロ、ニトロ、シアノ、ヒドロキシ、トリフルオロメトキシ、アミノ、カルボキシ、カルバモイル、メルカプト、スルファモイル、C1−6アルキル、C2−6アルケニル、C2−6アルキニル、C1−6アルコキシ、C1−6アルカノイル、C1−6アルカノイルオキシ、N−(C1−6アルキル)アミノ、N,N−(C1−6アルキル)2アミノ、N−(C1−6アルキル)−N−(C1−6アルコキシ)アミノ、C1−6アルカノイルアミノ、N−(C1−6アルキル)カルバモイル、N,N−(C1−6アルキル)2カルバモイル、C1−6アルキルS(0)a(aは0〜2である)、C1−6アルコキシカルボニル、C1−6アルコキシカルボニルアミノ、N−(C1−6アルキル)スルファモイル、N,N−(C1−6アルキル)2スルファモイル、C1−6アルキルスルホニルアミノ、炭素環−R14−、または複素環−R15−から選択され;その際、R13は、場合により炭素において1個以上のR16により置換されており;その際、複素環が−NH−部分を含む場合、その窒素は場合によりR17から選択される基により置換されており;
R9、R10、R14およびR15は、独立して直接結合、−O−、−N(R18)−、−C(O)−、−N(R19)C(O)−、−C(O)N(R20)−、−S(O)s−、−SO2N(R21)−、または−N(R22)SO2−から選択され;これらにおいて、R18、R19、R20、R21およびR22は、独立して水素またはC1−6アルキルから選択され、sは0〜2であり;
R8およびR17は、独立して、C1−6アルキル、C1−6アルカノイル、C1−6アルキルスルホニル、C1−6アルコキシカルボニル、カルバモイル、N−(C1−6アルキル)カルバモイル、N,N−(C1−6アルキル)カルバモイル、ベンジル、ベンジルオキシカルボニル、ベンゾイルおよびフェニルスルホニルから選択され;
R7、R11およびR16は、独立してハロ、ニトロ、シアノ、ヒドロキシ、トリフルオロメトキシ、トリフルオロメチル、アミノ、カルボキシ、カルバモイル、メルカプト、スルファモイル、C1−6アルキル、C2−6アルケニル、C2−6アルキニル、メトキシ、エトキシ、アセチル、アセトキシ、メチルアミノ、エチルアミノ、ジメチルアミノ、ジエチルアミノ、N−メチル−N−エチルアミノ、アセチルアミノ、N−メチルカルバモイル、N−エチルカルバモイル、N,N−ジメチルカルバモイル、N,N−ジエチルカルバモイル、N−メチル−N−エチルカルバモイル、フェニル、メチルチオ、エチルチオ、メチルスルフィニル、エチルスルフィニル、メシル、エチルスルホニル、メトキシカルボニル、エトキシカルボニル、N−メチルスルファモイル、N−エチルスルファモイル、N,N−ジメチルスルファモイル、N,N−ジエチルスルファモイルまたはN−メチル−N−エチルスルファモイルから選択される。
【0016】
ある態様において、本発明は式(IA)をもつ式(I)の化合物:
【0017】
【化3】

【0018】
またはその医薬的に許容できる塩に関する;
式中:
−−−は、単結合および二重結合から選択され;
−−−が単結合である場合、XはCR24およびNから選択され;
−−−が二重結合である場合、XはCであり;
Yは、OおよびSから選択され;
Aは、O、S、NR25およびCR28R29から選択され;
pは、0〜2であり;
mは、0または1であり;
R4は、独立してハロ、ニトロ、シアノ、ヒドロキシ、トリフルオロメトキシ、トリフルオロメチル、アミノ、カルボキシ、カルバモイル、メルカプト、スルファモイル、C1−4アルキル、C2−4アルケニル、C2−4アルキニル、メトキシ、エトキシ、アセチル、アセトキシ、メチルアミノ、エチルアミノ、ジメチルアミノ、ジエチルアミノ、N−メチル−N−エチルアミノ、アセチルアミノ、N−メチルカルバモイル、N−エチルカルバモイル、N,N−ジメチルカルバモイル、N,N−ジエチルカルバモイル、N−メチル−N−エチルカルバモイル、フェニル、メチルチオ、エチルチオ、メチルスルフィニル、エチルスルフィニル、メシル、エチルスルホニル、メトキシカルボニル、エトキシカルボニル、N−メチルスルファモイル、N−エチルスルファモイル、N,N−ジメチルスルファモイル、N,N−ジエチルスルファモイルまたはN−メチル−N−エチルスルファモイルから選択され;
あるいは、2つのR4基が隣接炭素上にある場合、それらは場合により炭素環式環または複素環式環を形成していてもよく;その際、炭素環式環または複素環式環は、場合により炭素において1個以上のR7により置換されており;その際、複素環式環が−NH−部分を含む場合、その窒素は場合によりR8から選択される基により置換されており;
nは、0〜5であり;その際、R4の意味は同一であるかまたは異なり;
R7は、独立してハロ、ニトロ、シアノ、ヒドロキシ、トリフルオロメトキシ、トリフルオロメチル、アミノ、カルボキシ、カルバモイル、メルカプト、スルファモイル、C1−6アルキル、C2−6アルケニル、C2−6アルキニル、メトキシ、エトキシ、アセチル、アセトキシ、メチルアミノ、エチルアミノ、ジメチルアミノ、ジエチルアミノ、N−メチル−N−エチルアミノ、アセチルアミノ、N−メチルカルバモイル、N−エチルカルバモイル、N,N−ジメチルカルバモイル、N,N−ジエチルカルバモイル、N−メチル−N−エチルカルバモイル、フェニル、メチルチオ、エチルチオ、メチルスルフィニル、エチルスルフィニル、メシル、エチルスルホニル、メトキシカルボニル、エトキシカルボニル、N−メチルスルファモイル、N−エチルスルファモイル、N,N−ジメチルスルファモイル、N,N−ジエチルスルファモイルまたはN−メチル−N−エチルスルファモイルから選択され;
R8は、C1−6アルキル、C1−6アルカノイル、C1−6アルキルスルホニル、C1−6アルコキシカルボニル、カルバモイル、N−(C1−6アルキル)カルバモイル、N,N−(C1−6アルキル)カルバモイル、ベンジル、ベンジルオキシカルボニル、ベンゾイルおよびフェニルスルホニルから選択され;
R23は、HおよびC1−6アルキルから選択され、その際、C1−6アルキルは場合によりC1−6アルコキシで置換されており;
R24、R26、R27、R28は、それぞれ独立して水素およびC1−6アルキルから選択され;
R25は、水素、C1−6アルキルおよびC1−6アルカノイルから選択され、その際、C1−6アルキルおよびC1−6アルカノイルは、場合により炭素において1個以上のR30により置換されており;
あるいは、R25とR27は、それらが結合している原子と一緒に場合により複素環式環を形成していてもよく;その際、複素環式環は、場合により炭素において1個以上のR35により置換されており;その際、複素環式環が−NH−部分を含む場合、その窒素は場合によりR36から選択される基により置換されており;
R29は、水素およびアミノから選択され、その際、アミノは、場合により1個以上のC1−6アルキルにより置換されており;
R30は、ハロ、ニトロ、シアノ、ヒドロキシ、トリフルオロメトキシ、トリフルオロメチル、アミノ、カルボキシ、カルバモイル、メルカプト、スルファモイル、C1−6アルキル、C2−6アルケニル、C2−6アルキニル、メトキシ、エトキシ、アセチル、アセトキシ、メチルアミノ、エチルアミノ、ジメチルアミノ、ジエチルアミノ、N−メチル−N−エチルアミノ、アセチルアミノ、N−メチルカルバモイル、N−エチルカルバモイル、N,N−ジメチルカルバモイル、N,N−ジエチルカルバモイル、N−メチル−N−エチルカルバモイル、フェニル、メチルチオ、エチルチオ、メチルスルフィニル、エチルスルフィニル、メシル、エチルスルホニル、メトキシカルボニル、エトキシカルボニル、N−メチルスルファモイル、N−エチルスルファモイル、N,N−ジメチルスルファモイル、N,N−ジエチルスルファモイル、およびN−メチル−N−エチルスルファモイルから選択され;
R35は、独立してハロ、ニトロ、シアノ、ヒドロキシ、トリフルオロメトキシ、トリフルオロメチル、アミノ、カルボキシ、カルバモイル、メルカプト、スルファモイル、C1−6アルキル、C2−6アルケニル、C2−6アルキニル、メトキシ、エトキシ、アセチル、アセトキシ、メチルアミノ、エチルアミノ、ジメチルアミノ、ジエチルアミノ、N−メチル−N−エチルアミノ、アセチルアミノ、N−メチルカルバモイル、N−エチルカルバモイル、N,N−ジメチルカルバモイル、N,N−ジエチルカルバモイル、N−メチル−N−エチルカルバモイル、フェニル、メチルチオ、エチルチオ、メチルスルフィニル、エチルスルフィニル、メシル、エチルスルホニル、メトキシカルボニル、エトキシカルボニル、N−メチルスルファモイル、N−エチルスルファモイル、N,N−ジメチルスルファモイル、N,N−ジエチルスルファモイルまたはN−メチル−N−エチルスルファモイルから選択され;
R36は、C1−6アルキル、C1−6アルカノイル、C1−6アルキルスルホニル、C1−6アルコキシカルボニル、カルバモイル、N−(C1−6アルキル)カルバモイル、N,N−(C1−6アルキル)カルバモイル、ベンジル、ベンジルオキシカルボニル、ベンゾイルおよびフェニルスルホニルから選択される。
【0019】
ある態様において、本発明は式(IB)をもつ式(I)の化合物:
【0020】
【化4】

【0021】
またはその医薬的に許容できる塩に関する;
式中:
R1およびR2は、独立して、水素、ハロ、ニトロ、シアノ、ヒドロキシ、トリフルオロメトキシ、アミノ、カルボキシ、カルバモイル、メルカプト、スルファモイル、C1−6アルキル、C2−6アルケニル、C2−6アルキニル、C1−6アルコキシ、C1−6アルカノイル、C1−6アルカノイルオキシ、N−(C1−6アルキル)アミノ、N,N−(C1−6アルキル)2アミノ、N−(C1−6アルキル)−N−(C1−6アルコキシ)アミノ、C1−6アルカノイルアミノ、N−(C1−6アルキル)カルバモイル、N,N−(C1−6アルキル)2カルバモイル、C1−6アルコキシカルボニル、N−(C1−6アルキル)スルファモイル、N,N−(C1−6アルキル)2スルファモイル、C1−6アルキルスルホニルアミノ、炭素環または複素環から選択され;その際、R1およびR2は互いに独立して、場合により炭素において1個以上のR5により置換されており;その際、複素環が−NH−部分を含む場合、その窒素は場合によりR6から選択される基により置換されており;
R5は、ハロ、ニトロ、シアノ、ヒドロキシ、トリフルオロメトキシ、アミノ、カルボキシ、カルバモイル、メルカプト、スルファモイル、C1−6アルキル、C2−6アルケニル、C2−6アルキニル、C1−6アルコキシ、C1−6アルカノイル、C1−6アルカノイルオキシ、N−(C1−6アルキル)アミノ、N,N−(C1−6アルキル)2アミノ、N−(C1−6アルキル)−N−(C1−6アルコキシ)アミノ、C1−6アルカノイルアミノ、N−(C1−6アルキル)カルバモイル、N,N−(C1−6アルキル)2カルバモイル、C1−6アルキルS(O)a(aは0〜2である)、C1−6アルコキシカルボニル、C1−6アルコキシカルボニルアミノ、N−(C1−6アルキル)スルファモイル、N,N−(C1−6アルキル)2スルファモイル、C1−6アルキルスルホニルアミノ、炭素環−R9−、または複素環−R10−から選択され;その際、R5は、場合により炭素において1個以上のR11により置換されており;その際、複素環が−NH−部分を含む場合、その窒素は場合によりR12から選択される基により置換されており;
R6およびR12は、独立して、C1−6アルキル、C1−6アルカノイル、C1−6アルキルスルホニル、C1−6アルコキシカルボニル、カルバモイル、N−(C1−6アルキル)カルバモイル、N,N−(C1−6アルキル)カルバモイル、ベンジル、ベンジルオキシカルボニル、ベンゾイルおよびフェニルスルホニルから選択され;その際、R6およびR12は互いに独立して、場合により炭素において1個以上のR13により置換されており;
R13は、ハロ、ニトロ、シアノ、ヒドロキシ、トリフルオロメトキシ、アミノ、カルボキシ、カルバモイル、メルカプト、スルファモイル、C1−6アルキル、C2−6アルケニル、C2−6アルキニル、C1−6アルコキシ、C1−6アルカノイル、C1−6アルカノイルオキシ、N−(C1−6アルキル)アミノ、N,N−(C1−6アルキル)2アミノ、N−(C1−6アルキル)−N−(C1−6アルコキシ)アミノ、C1−6アルカノイルアミノ、N−(C1−6アルキル)カルバモイル、N,N−(C1−6アルキル)2カルバモイル、C1−6アルキルS(0)a(aは0〜2である)、C1−6アルコキシカルボニル、C1−6アルコキシカルボニルアミノ、N−(C1−6アルキル)スルファモイル、N,N−(C1−6アルキル)2スルファモイル、C1−6アルキルスルホニルアミノ、炭素環−R14−、または複素環−R15−から選択され;その際、R13は、場合により炭素において1個以上のR16により置換されており;その際、複素環が−NH−部分を含む場合、その窒素は場合によりR17から選択される基により置換されており;
R9、R10、R14およびR15は、独立して直接結合、−O−、−N(R18)−、−C(O)−、−N(R19)C(O)−、−C(O)N(R20)−、−S(O)s−、−SO2N(R21)−、または−N(R22)SO2−から選択され;これらにおいて、R18、R19、R20、R21およびR22は、独立して水素またはC1−6アルキルから選択され、sは0〜2であり;
R17は、独立して、C1−6アルキル、C1−6アルカノイル、C1−6アルキルスルホニル、C1−6アルコキシカルボニル、カルバモイル、N−(C1−6アルキル)カルバモイル、N,N−(C1−6アルキル)カルバモイル、ベンジル、ベンジルオキシカルボニル、ベンゾイルおよびフェニルスルホニルから選択され;
R11およびR16は、独立してハロ、ニトロ、シアノ、ヒドロキシ、トリフルオロメトキシ、トリフルオロメチル、アミノ、カルボキシ、カルバモイル、メルカプト、スルファモイル、C1−6アルキル、C2−6アルケニル、C2−6アルキニル、メトキシ、エトキシ、アセチル、アセトキシ、メチルアミノ、エチルアミノ、ジメチルアミノ、ジエチルアミノ、N−メチル−N−エチルアミノ、アセチルアミノ、N−メチルカルバモイル、N−エチルカルバモイル、N,N−ジメチルカルバモイル、N,N−ジエチルカルバモイル、N−メチル−N−エチルカルバモイル、フェニル、メチルチオ、エチルチオ、メチルスルフィニル、エチルスルフィニル、メシル、エチルスルホニル、メトキシカルボニル、エトキシカルボニル、N−メチルスルファモイル、N−エチルスルファモイル、N,N−ジメチルスルファモイル、N,N−ジエチルスルファモイルまたはN−メチル−N−エチルスルファモイルから選択され;
R31、R32、R33およびR34は、それぞれ独立して水素、ハロおよびC1−4アルキルから選択される。
【0022】
ある態様において、本発明は式(IC)をもつ式(I)の化合物:
【0023】
【化5】

【0024】
またはその医薬的に許容できる塩に関する;
式中:
−−−は、単結合および二重結合から選択され;
−−−が単結合である場合、XはCR24およびNから選択され;
−−−が二重結合である場合、XはCであり;
Yは、OおよびSから選択され;
Aは、O、S、NR25およびCR28R29から選択され;
pは、0〜2であり;
R23は、C1−6アルキルであり;
R24、R26、R27、R28は、それぞれ独立して水素およびC1−6アルキルから選択され;
R25は、水素、C1−6アルキル、およびC1−6アルカノイルから選択され、その際、C1−6アルキルおよびC1−6アルカノイルは、場合により炭素において1個以上のR30により置換されており;
R29は、水素、および場合により1個以上のC1−6アルキルにより置換されたアミノから選択され;
R30は、ハロ、ニトロ、シアノ、ヒドロキシ、トリフルオロメトキシ、トリフルオロメチル、アミノ、カルボキシ、カルバモイル、メルカプト、スルファモイル、C1−6アルキル、C2−6アルケニル、C2−6アルキニル、メトキシ、エトキシ、アセチル、アセトキシ、メチルアミノ、エチルアミノ、ジメチルアミノ、ジエチルアミノ、N−メチル−N−エチルアミノ、アセチルアミノ、N−メチルカルバモイル、N−エチルカルバモイル、N,N−ジメチルカルバモイル、N,N−ジエチルカルバモイル、N−メチル−N−エチルカルバモイル、フェニル、メチルチオ、エチルチオ、メチルスルフィニル、エチルスルフィニル、メシル、エチルスルホニル、メトキシカルボニル、エトキシカルボニル、N−メチルスルファモイル、N−エチルスルファモイル、N,N−ジメチルスルファモイル、N,N−ジエチルスルファモイル、およびN−メチル−N−エチルスルファモイルから選択され;
R31は、水素およびC1−4アルキルから選択され;
R32は、水素、ハロおよびC1−4アルキルから選択され;
R33は、水素およびハロから選択され;
R34は、ハロから選択される。
【0025】
ある態様において、本発明は式(ID)をもつ式(I)の化合物:
【0026】
【化6】

【0027】
またはその医薬的に許容できる塩に関する;
式中:
−−−は、単結合および二重結合から選択され;
−−−が単結合である場合、XはCHおよびNから選択され;
−−−が二重結合である場合、XはCであり;
Aは、O、NR25およびCHR29から選択され;
pは、0〜2であり;
R23は、メチルおよびエチルから選択され;
R25は、水素、メチル、エチル、イソプロピル、tert−ブチル、1−メトキシ−2−エチル、1−ヒドロキシ−2−エチル、1,1,1−トリフルオロ−2−エチル、2−ヒドロキシ−1−プロピオニル、およびメシルから選択され;
R26およびR27は、それぞれ独立して水素およびメチルから選択され;
R29はジメチルアミノであり;
R31は、水素およびメチルから選択され;
R32は、水素、フルオロ、およびメチルから選択され;
R33は、水素およびクロロから選択され;
R34は、フルオロおよびクロロから選択される。
【0028】
ある態様において、本発明は式(IE)をもつ式(I)の化合物:
【0029】
【化7】

【0030】
またはその医薬的に許容できる塩に関する;
式中:
−−−は、単結合および二重結合から選択され;
Aは、NおよびCHから選択され;
Dは、N、NH、CH、およびCH2から選択され;
Eは、N、NH、CH、およびCH2から選択され;
pは、0〜1であり;
R23は、C1−6アルキルから選択され;
R31は、水素およびC1−4アルキルから選択され;
R32は、水素、ハロ、およびC1−4アルキルから選択され;
R33は、水素およびハロから選択され;
R34は、ハロであり;
R37は、HおよびOHから選択される。
【0031】
ある態様において、本発明は式(IC)をもつ式(I)の化合物:
【0032】
【化8】

【0033】
またはその医薬的に許容できる塩に関する;
式中:
−−−は、単結合および二重結合から選択され;
−−−が単結合である場合、XはCR24およびNから選択され;
−−−が二重結合である場合、XはCであり;
Yは、OおよびSから選択され;
Aは、SO2、NR25およびCR28R29から選択され;
pは、0、1および2から選択され;
R23は、C1−6アルキルであり;
R24、R26、R27、R28は、それぞれ独立して水素およびC1−6アルキルから選択され;
R25は、C1−6アルキルスルホニルであり;
R29は、場合により1個以上のR30により置換されたC1−6アルコキシであり;
R30は、ハロ、ニトロ、シアノ、ヒドロキシ、トリフルオロメトキシ、トリフルオロメチル、アミノ、カルボキシ、カルバモイル、メルカプト、スルファモイル、C1−6アルキル、C2−6アルケニル、C2−6アルキニル、メトキシ、エトキシ、アセチル、アセトキシ、メチルアミノ、エチルアミノ、ジメチルアミノ、ジエチルアミノ、N−メチル−N−エチルアミノ、アセチルアミノ、N−メチルカルバモイル、N−エチルカルバモイル、N,N−ジメチルカルバモイル、N,N−ジエチルカルバモイル、N−メチル−N−エチルカルバモイル、フェニル、メチルチオ、エチルチオ、メチルスルフィニル、エチルスルフィニル、メシル、エチルスルホニル、メトキシカルボニル、エトキシカルボニル、N−メチルスルファモイル、N−エチルスルファモイル、N,N−ジメチルスルファモイル、N,N−ジエチルスルファモイル、およびN−メチル−N−エチルスルファモイルから選択され;
R31は、水素およびC1−4アルキルから選択され;
R32は、水素、ハロおよびC1−4アルキルから選択され;
R33は、水素およびハロから選択され;
R34は、ハロから選択される。
【0034】
ある態様において、本発明は式(IF)をもつ式(I)の化合物:
【0035】
【化9】

【0036】
またはその医薬的に許容できる塩に関する;
式中:
−−−は、単結合および二重結合から選択され;
−−−が単結合である場合、XはCR24およびNから選択され;
−−−が二重結合である場合、XはCであり;
Aは、NR25およびCR28R29から選択され;
pは、0〜2であり;
R24、R26、R27、R28は、それぞれ独立して水素およびC1−6アルキルから選択され;
R25は、水素、C1−6アルキル、C1−6アルキルスルホニル、およびC1−6アルカノイルから選択され、その際、C1−6アルキルおよびC1−6アルカノイルは、場合により炭素において1個以上のR30により置換されており;
R29は、水素、アミノ、および場合により炭素において1個以上のR30により置換されたC1−6アルコキシから選択され;
R30は、ハロ、ニトロ、シアノ、ヒドロキシ、トリフルオロメトキシ、トリフルオロメチル、アミノ、カルボキシ、カルバモイル、メルカプト、スルファモイル、C1−6アルキル、C2−6アルケニル、C2−6アルキニル、メトキシ、エトキシ、アセチル、アセトキシ、メチルアミノ、エチルアミノ、ジメチルアミノ、ジエチルアミノ、N−メチル−N−エチルアミノ、アセチルアミノ、N−メチルカルバモイル、N−エチルカルバモイル、N,N−ジメチルカルバモイル、N,N−ジエチルカルバモイル、N−メチル−N−エチルカルバモイル、フェニル、メチルチオ、エチルチオ、メチルスルフィニル、エチルスルフィニル、メシル、エチルスルホニル、メトキシカルボニル、エトキシカルボニル、N−メチルスルファモイル、N−エチルスルファモイル、N,N−ジメチルスルファモイル、N,N−ジエチルスルファモイル、およびN−メチル−N−エチルスルファモイルから選択され;
R31は、水素およびC1−4アルキルから選択され;
R32は、水素、ハロおよびC1−4アルキルから選択され;
R33は、水素およびハロから選択され;
R34は、ハロから選択される。
【0037】
本明細書において、用語「アルキル」は、直鎖および分枝鎖の両方のアルキル基を含む。個々のアルキル基、たとえば「プロピル」という表記は直鎖型のみに特定され、個々の分枝鎖アルキル基、たとえば「イソプロピル」という表記は分枝鎖型のみに特定される。たとえば「C1−6アルキル」には、C1−4アルキル、C1−3アルキル、プロピル、イソプロピルおよびt−ブチルが含まれる。同様な取決めが他の基に適用される;たとえば「フェニルC1−6アルキル」には、フェニルC1−4アルキル、ベンジル、1−フェニルエチルおよび2−フェニルエチルが含まれる。用語「ハロ」は、フルオロ、クロロ、ブロモおよびヨードを表わす。
【0038】
「1個以上の」基から任意置換基を選択する場合、この定義は、特定した基のうち1つから選択されるすべての置換基または特定した基のうち2つ以上から選択される置換基を含むと理解すべきである。
【0039】
「複素環」は、4〜12個の原子を含み、それらのうち少なくとも1個の原子が窒素、硫黄または酸素から選択される、飽和、部分飽和または不飽和の、単環式または二環式の環であり、それらは特記しない限り、炭素結合または窒素結合することができ、その際、−CH2−基は場合により−C(O)−により交換されていてもよく、環硫黄原子は場合により酸化されてS−オキシドを形成している。用語「複素環」の例および適切な意味は、モルホリノ、ピペリジル、ピリジル、ピラニル、ピロリル、ピラゾリル、イソチアゾリル、インドリル、キノリル、チエニル、1,3−ベンゾジオキソリル、チアジアゾリル、ピペラジニル、チアゾリジニル、ピロリジニル、チオモルホリノ、ピロリニル、ホモピペラジニル、3,5−シオキサピペリジニル、テトラヒドロピラニル、イミダゾリル、ピリミジル、ピラジニル、ピリダジニル、イソオキサゾリル、N−メチルピロリル、4−ピリドン、1−イソキノロン、2−ピロリドン、4−チアゾリドン、ピリジン−N−オキシドおよびキノリン−N−オキシドである。用語「複素環」の例は特にピラゾリルである。本発明の1観点において、「複素環」は、5または6個の原子を含み、そのうち少なくとも1つの原子が窒素、硫黄または酸素から選択される、飽和、部分飽和または不飽和の単環式環であり、それは特記しない限り、炭素結合または窒素結合することができ、−CH2−基は場合により−C(O)−により交換されていてもよく、環硫黄原子は場合により酸化されてS−オキシドを形成している。
【0040】
「炭素環」は、3〜12個の原子を含む、飽和、部分飽和または不飽和の、単環式または二環式の炭素環であるが、その際、−CH2−基は場合により−C(O)−により交換されていてもよい。特に、「炭素環」は、5もしくは6個の原子を含む単環式環、または9もしくは10個の原子を含む二環式環である。「炭素環」の適切な意味には、シクロプロピル、シクロブチル、1−オキソシクロペンチル、シクロペンチル、シクロペンテニル、シクロヘキシル、シクロヘキセニル、フェニル、ナフチル、テトラリニル、インダニルまたは1−オキソインダニルが含まれる。「炭素環」の例は特にフェニルである。
【0041】
「2つのR4基が隣接炭素上にある場合、それらは場合により炭素環式環または複素環式環を形成していてもよい」。したがって、そのような「炭素環式環」または「複素環式環」は、式(I)中のフェニル環に縮合している。
【0042】
「炭素環式環」は、3〜8個の炭素原子を含み、それらのうち2個が式(I)のフェニル環と共有された、部分飽和または完全不飽和の単環式環であるが、その際、−CH2−基は場合により−C(O)−により交換されていてもよい。式(I)中のフェニル環に縮合した「炭素環式環」の適切な例には、インダニル(炭素環式環が部分飽和5員環である)およびナフチル(炭素環式環が完全不飽和6員環である)が含まれる。
【0043】
「複素環式環」は、4〜8個の原子を含み、それらのうち少なくとも1個の原子が窒素、硫黄または酸素から選択され、2個の原子が式(I)中のフェニル環と共有された炭素原子である、部分飽和または完全不飽和の単環式環であるが、その際、−CH2−基は場合により−C(O)−により交換されていてもよく、環硫黄原子は場合により酸化されてS−オキシドを形成している。式(I)中のフェニル環に縮合した「複素環式環」の適切な例には、インドリニル(複素環式環が1個の窒素原子を含む部分飽和5員環である)およびキノキサリニル(炭素環式環が2個の窒素原子を含む完全不飽和6員環である)が含まれる。
【0044】
「C1−6アルカノイルオキシ」の例は、アセトキシである。「C1−6アルコキシカルボニル」の例には、メトキシカルボニル、エトキシカルボニル、n−およびt−ブトキシカルボニルが含まれる。「C1−6アルコキシ」の例には、メトキシ、エトキシおよびプロポキシが含まれる。「C1−6アルカノイルアミノ」の例には、ホルムアミド、アセトアミドおよびプロピオニルアミノが含まれる。「C1−6アルキルS(O)a(aは0〜2である)」の例には、メチルチオ、エチルチオ、メチルスルフィニル、エチルスルフィニル、メシルおよびエチルスルホニルが含まれる。「C1−6アルカノイル」の例には、プロピオニルおよびアセチルが含まれる。「N−(C1−6アルキル)アミノ」の例には、メチルアミノおよびエチルアミノが含まれる。「N,N−(C1−6アルキル)2アミノ」の例には、ジ−N−メチルアミノ、ジ−(N−エチル)アミノおよびN−エチル−N−メチルアミノが含まれる。「C2−6アルケニル」の例は、ビニル、アリルおよび1−プロペニルである。「C2−6アルキニル」の例は、エチニル、1−プロピニルおよび2−プロピニルである。「N−(C1−6アルキル)スルファモイル」の例は、N−(メチル)スルファモイルおよびN−(エチル)スルファモイルである。「N−(C1−6アルキル)2スルファモイル」の例は、N,N−(ジメチル)スルファモイルおよびN−(メチル)−N−(エチル)スルファモイルである。「N−(C1−6アルキル)カルバモイル」の例は、N−(C1−4アルキル)カルバモイル、メチルアミノカルボニルおよびエチルアミノカルボニルである。「N,N−(C1−6アルキル)2カルバモイル」の例は、N,N−(C1−4アルキル)2カルバモイル、ジメチルアミノカルボニルおよびメチルエチルアミノカルボニルである。「C1−6アルキルスルホニル」の例は、メシル、エチルスルホニルおよびイソプロピルスルホニルである。「C1−6アルキルスルホニルアミノ」の例は、メシルアミノ、エチルスルホニルアミノおよびイソプロピルスルホニルアミノである。「C1−6アルコキシカルボニルアミノ」の例は、メトキシカルボニルアミノおよびt−ブトキシカルボニルアミノである。「C1−6アルコキシカルボニルアミノ」の例には、メトキシカルボニルアミノおよびt−ブトキシカルボニルアミノが含まれる。
【0045】
本発明化合物の医薬的に許容できる適切な塩は、たとえば十分に塩基性である本発明化合物の酸付加塩、たとえば無機酸または有機酸たとえば塩酸、臭化水素酸、硫酸、リン酸、トリフルオロ酢酸、クエン酸またはマレイン酸との酸付加塩である。さらに、十分に酸性である本発明化合物の医薬的に許容できる適切な塩は、アルカリ金属塩、たとえばナトリウム塩もしくはカリウム塩、アルカリ土類金属塩、たとえばカルシウム塩もしくはマグネシウム塩、アンモニウム塩、または生理的に許容できる陽イオンを供給する有機塩基との塩、たとえばメチルアミン、ジメチルアミン、トリメチルアミン、ピペリジン、モルホリンもしくはトリス−(2−ヒドロキシエチル)アミンとの塩である。
【0046】
式(I)のある化合物は、キラル中心および/または幾何異性中心(E−およびZ−異性体)をもつ場合があり、本発明はCSF−1Rキナーゼ阻害活性をもつそのような光学異性体、ジアステレオ異性体および幾何異性体をすべて包含すると理解すべきである。本発明はさらに、CSF−1Rキナーゼ阻害活性をもつ式(I)の化合物のいずれかおよびすべての互変異性体形態に関する。
【0047】
式(I)の特定の化合物は溶媒和した形態(たとえば水和形)でも溶媒和していない形態でも存在しうることも理解すべきである。本発明はCSF−1Rキナーゼ阻害活性をもつそのような溶媒和形態をすべて包含すると理解すべきである。
【0048】
可変基の具体的な意味は下記のものである。そのような意味を、前記または後記に定めるいずれかの定義、特許請求の範囲または具体的な態様について適宜使用する。
R1およびR2は、独立して、C1−6アルコキシまたは複素環から選択されるが、その際、R1およびR2は互いに独立して、場合により炭素において1個以上のR5により置換されており;その際、複素環が−NH−部分を含む場合、その窒素は場合によりR6から選択される基により置換されており;その際、
R5は、C1−6アルコキシであり;
R6は、C1−6アルキルである。
【0049】
R1およびR2は、独立して、C1−6アルコキシまたは複素環から選択され;その際、複素環が−NH−部分を含む場合、その窒素は場合によりR6から選択される基により置換されており;その際、R6は、C1−6アルキルから選択される。
【0050】
R1およびR2は、独立して、C1−6アルコキシまたはピペラジニルから選択され;その際、R1およびR2は互いに独立して、場合により炭素において1個以上のR5により置換されており;その際、複素環が−NH−部分を含む場合、その窒素は場合によりR6から選択される基により置換されており;その際、
R5は、C1−6アルコキシであり;
R6は、C1−6アルキルである。
【0051】
R1およびR2は、独立して、C1−6アルコキシまたはピペラジニルから選択され;その際、ピペラジニルは場合により窒素においてR6から選択される基により置換されており;その際、R6は、C1−6アルキルから選択される。
【0052】
R1およびR2は、独立して、メトキシ、エトキシまたはピペラジン−1−イルから選択され;その際、R1およびR2は互いに独立して、場合により炭素において1個以上のR5により置換されており;その際、複素環が−NH−部分を含む場合、その窒素は場合によりR6から選択される基により置換されており;その際、
R5は、メトキシであり;
R6は、メチル、エチル、イソプロピルまたはt−ブチルである。
【0053】
R1およびR2は、独立して、メトキシ、エトキシまたはピペラジニルから選択され;その際、ピペラジニルは場合により窒素においてR6から選択される基により置換されており;その際、R6は、メチル、エチルまたはイソプロピルから選択される。
【0054】
R1およびR2は、独立して、2−メトキシエトキシ、エトキシ、メトキシ、4−エチルピペラジン−1−イル、4−イソプロピルピペラジン−1−イル、4−メチルピペラジン−1−イルまたは4−t−ブチルピペラジン−1−イルから選択される。
【0055】
R1およびR2は、独立して、エトキシ、メトキシ、1−メチルピペラジン−4−イル、1−エチルピペラジン−4−イルまたは1−イソプロピルピペラジン−4−イルから選択される。
【0056】
R1およびR2は両方ともメトキシであるか、あるいはR1はエトキシであり、かつR2は1−メチルピペラジン−4−イル、1−エチルピペラジン−4−イルまたは1−イソプロピルピペラジン−4−イルから選択される。
【0057】
R1およびR2は、両方ともメトキシである。
R1はエトキシであり、かつR2は1−メチルピペラジン−4−イル、1−エチルピペラジン−4−イルまたは1−イソプロピルピペラジン−4−イルから選択される。
【0058】
R1は、2−メトキシエトキシ、エトキシまたはメトキシである。
R2は、4−エチルピペラジン−1−イル、4−イソプロピルピペラジン−1−イル、4−メチルピペラジン−1−イル、4−tert−ブチルピペラジン−1−イルまたはメトキシである。
【0059】
R1は2−メトキシエトキシ、エトキシまたはメトキシであり、かつR2は4−エチルピペラジン−1−イル、4−イソプロピルピペラジン−1−イル、4−メチルピペラジン−1−イル、4−tert−ブチルピペラジン−1−イルまたはメトキシである。
【0060】
R3は、水素である。
mは、0である。
mは、1である。
【0061】
R4は、ハロまたはメチルから選択される。
R4は、フルオロ、クロロまたはメチルから選択される。
nは、2であり;その際、R4の意味は同一であるかまたは異なる。
【0062】
R4,nと、それらが結合しているフェニルは、2,3−ジクロロフェニル、2,4−ジフルオロフェニル、2−フルオロ−4−メチル−フェニル、2−フルオロ−5−メチル−フェニルまたは3−クロロ−2−フルオロ−フェニルを形成している。
【0063】
したがって、本発明のさらに他の観点において、式(I)(前記)の化合物またはその医薬的に許容できる塩が提供され、式中:
R1およびR2は、独立して、C1−6アルコキシまたは複素環から選択され;その際、R1およびR2は互いに独立して、場合により炭素において1個以上のR5により置換されており;その際、複素環が−NH−部分を含む場合、その窒素は場合によりR6から選択される基により置換されており;
R3は、水素であり;
mは、0であり;
R4は、ハロまたはメチルから選択され;
nは、2であり;その際、R4の意味は同一であるかまたは異なり;
R5は、C1−6アルコキシであり;
R6は、C1−6アルキルである。
【0064】
したがって、本発明のさらに他の観点において、式(I)(前記)の化合物またはその医薬的に許容できる塩が提供され、式中:
R1およびR2は、独立して、C1−6アルコキシまたは複素環から選択され;その際、複素環が−NH−部分を含む場合、その窒素は場合によりR6から選択される基により置換されており;R6は、C1−6アルキルから選択され;
R3は、水素であり;
mは、0であり;
R4は、ハロまたはメチルから選択され;
nは、2であり;その際、R4の意味は同一であるかまたは異なる。
【0065】
したがって、本発明のさらに他の観点において、式(I)(前記)の化合物またはその医薬的に許容できる塩が提供され、式中:
R1およびR2は、独立して、2−メトキシエトキシ、エトキシ、メトキシ、4−エチルピペラジン−1−イル、4−イソプロピルピペラジン−1−イル、4−メチルピペラジン−1−イルまたは4−tert−ブチルピペラジン−1−イルから選択され;
R3は、水素であり;
mは、0であり;
R4は、フルオロ、クロロまたはメチルから選択され;
nは、2であり;その際、R4の意味は同一であるかまたは異なる。
【0066】
したがって、本発明のさらに他の観点において、式(I)(前記)の化合物またはその医薬的に許容できる塩が提供され、式中:
R1およびR2は、独立して、メトキシ、エトキシ、1−メチルピペラジン−4−イル、1−エチルピペラジン−4−イルまたは1−イソプロピルピペラジン−4−イルから選択され;
R3は、水素であり;
mは、0であり;
R4は、フルオロ、クロロまたはメチルから選択され;
nは、2であり;その際、R4の意味は同一であるかまたは異なる。
【0067】
本発明のさらに他の観点において、本発明の好ましい化合物は、実施例のいずれか1つの化合物またはその医薬的に許容できる塩である。
本発明の他の観点は、式(I)の化合物またはその医薬的に許容できる塩を製造するための方法を提供し、その方法(それらにおいて可変基は特記しない限り、式(I)において定めたものである)は下記を含む:
方法a) 式(II)の化合物:
【0068】
【化10】

【0069】
(式中、Lは置換可能な原子または基である)を式(III)の化合物:
【0070】
【化11】

【0071】
と反応させる;
あるいは
方法b) 式(IV)の化合物:
【0072】
【化12】

【0073】
またはその活性化された誘導体をアンモニアと反応させる;
方法c) 式(V)の化合物:
【0074】
【化13】

【0075】
(式中、RはC1−6アルキル、特にメチルおよびエチルである)をホルムアミドおよび塩基と反応させる;
あるいは
方法d) 式(VI)の化合物:
【0076】
【化14】

【0077】
を加水分解する;
あるいは
方法e) R1およびR2のうち一方が炭素結合した基である式(I)の化合物について、式(VIIa)または(VIIb)の化合物:
【0078】
【化15】

【0079】
(式中、Lは置換可能な基である)を式(VIIIa)または(VIIIb)の化合物:
R1−B(Ra)2 R2−B(Ra)2
(VIIIa) (VIIIb)
(式中、−B(Ra)2はボロン酸誘導体またはトリアルキルボランである)と反応させる;
あるいは
方法f) R1およびR2のうち一方が窒素結合した基である式(I)の化合物について、式(IXa)または(IXb)の化合物:
【0080】
【化16】

【0081】
(式中、Lは置換可能な基である)を式(Xa)または(Xb)の化合物:
R1−H R2−H
(Xa) (Xb)
と反応させる;
その後、必要であれば
i)式(I)の化合物を式(I)の他の化合物に変換し;
ii)いずれかの保護基を除去し;
iii)医薬的に許容できる塩を形成する。
【0082】
Lは置換可能な基であり、Lに適切な意味にはクロロ、ブロモ、トシルおよびトリフルオロメチルスルホニルオキシが含まれる。
−B(Ra)2はボロン酸誘導体であり、ボロン酸誘導体の適切な例には、ジヒドロキシボリル、4,4,5,5−テトラメチル−1,3,2−ジオキサボロラニルが含まれる;トリアルキルボランの適切な例は、9−ボラビシクロ[3.3.1]ノニルである。
【0083】
前記反応のための具体的な反応条件は下記のとおりである:
方法a) 式(II)の化合物と式(III)の化合物を、溶媒、たとえばエタノールまたはジメチルホルムアミド中で、通常はしばしば70〜100℃の範囲の温度条件下おいて、ある場合には酢酸の添加により触媒作用させて反応させることができる。
【0084】
あるいは、式(II)の化合物と式(III)の化合物は、適切な触媒と配位子、たとえばそれぞれPd2(dba)3とBINAP、および適切な塩基、たとえばナトリウムtert−ブトキシドまたは炭酸セシウムを用いて、カップリング化学により反応させることができる。この反応は、通常は80〜100℃の範囲の温度条件を必要とする。
【0085】
式(II)の化合物は、スキーム1またはスキーム2(後記を参照)の変法により製造できる。
式(III)の化合物は市販化合物であるか、あるいはそれらは文献化合物であるか、あるいはそれらは当業者に既知の方法によって容易に製造できる。
【0086】
方法b) 式(IV)の酸とアンモニアを、適切なカップリング試薬の存在下で互いにカップリングさせることができる。当業者に既知の標準的なペプチドカップリング試薬、たとえばカルボニルジイミダゾールおよびジシクロヘキシルカルボジイミドを適切なカップリング試薬として、場合により触媒、たとえばジメチルアミノピリジンまたは4−ピロリジノピリジンの存在下で、場合により塩基、たとえばトリエチルアミン、ピリジン、または2,6−ジ−アルキル−ピリジン、たとえば2,6−ルチジンもしくは2,6−ジ−tert−ブチルピリジンの存在下において使用できる。適切な溶媒には、ジメチルアセトアミド、ジクロロメタン、ベンゼン、テトラヒドロフランおよびジメチルホルムアミドが含まれる。このカップリング反応は、−40〜40℃の範囲の温度で好都合に実施できる。
【0087】
適切な活性化された酸誘導体には、酸ハロゲン化物、たとえば酸塩化物、および活性エステル、たとえばペンタフルオロフェニルエステルが含まれる。これらのタイプの化合物とアミンの反応は当技術分野で周知であり、たとえばそれらを前記に述べた塩基の存在下で、前記に述べた適切な溶媒中において反応させる。この反応は、−40〜40℃の範囲の温度で好都合に実施できる。
【0088】
式(IV)の化合物は、スキーム1またはスキーム2(後記を参照)の変法により製造できる。
方法c) 式(V)のエステルとホルムアミドおよび塩基を互いに反応させることができる。好ましくは、この反応はホルムアミドを最初に添加し、続いて塩基を添加することにより連続して行われる。適切な塩基はアルコキシド塩基、たとえばメトキシドおよびエトキシド塩基、たとえばナトリウムメトキシドである。この反応は一般に100℃の温度で、適切な溶媒、たとえばDMF中において実施される。
【0089】
式(V)の化合物は、スキーム1に従って製造できる。
【0090】
【化17】

【0091】
式(Va)および(Vb)の化合物は市販化合物であるか、あるいはそれらは文献化合物であるか、あるいはそれらは当業者に既知の方法によって容易に製造できる。
方法d) 式(VI)の化合物を、標準的な酸性または塩基性の条件下で加水分解することができる。
【0092】
式(VI)の化合物は、スキーム1またはスキーム2の変法により製造できる。
方法e) 式(VIIa)および(VIIb)の化合物と式(VIIIa)および(VIIIb)のボロン酸誘導体を、パラジウム触媒および塩基を用いて反応させることができる。適切な触媒はPd(PPh3)4であり、適切な塩基は炭酸カリウムである。この反応は一般に100℃の温度で、またはマイクロ波条件下で、適切な溶媒系、たとえばジオキサン/水中において実施される。
【0093】
式(VIIa)および(VIIb)の化合物と式(VIIIa)および(VIIIb)のトリアルキルボランを、標準的な鈴木条件下で、たとえばPd触媒を用い、塩基の存在下で、適切な溶媒、たとえばDMF中において、一般に50℃で反応させることができる。
【0094】
式(VIIa)および(VIIb)の化合物は、スキーム1またはスキーム2の変法により製造できる。
式(VIIIa)および(VIIIb)の化合物は市販化合物であるか、あるいはそれらは文献化合物であるか、あるいはそれらは当業者に既知の方法によって容易に製造できる。
【0095】
方法f) 式(IXa)および(IXb)の化合物と式(Xa)および(Xb)のアミンを、パラジウム触媒、配位子および塩基を用いて反応させることができる。適切な触媒はPd2(dba)3であり、適切な配位子はBINAPであり、適切な塩基は炭酸セシウムである。この反応は一般に100℃の温度で、またはマイクロ波条件下で、適切な溶媒系、たとえばトルエンまたはジメチルアセトアミド中において実施される。
【0096】
式(IXa)および(IXb)の化合物は、スキーム1またはスキーム2の変法により製造できる。
式(Xa)および(Xb)の化合物は市販化合物であるか、あるいはそれらは文献化合物であるか、あるいはそれらは当業者に既知の方法によって容易に製造できる。
【0097】
式(I)の特定の化合物を製造するための別のスキームであって、本明細書中で前記に述べた中間体を製造するために改変することができるスキームを、スキーム2に示す。
【0098】
【化18】

【0099】
ある態様において、本発明は本明細書に開示する式(I)の化合物の製造方法であって、下記を含む方法に関する;式(V)の化合物:
【0100】
【化19】

【0101】
(式中、RはC1−6アルキルである)をホルムアミドおよび塩基と反応させて式(I)の化合物を形成し;
その後、場合により
i)式(I)の化合物を式(I)の他の化合物に変換し;
ii)いずれかの保護基を除去し;あるいは
iii)医薬的に許容できる塩を形成する。
【0102】
さらに他の態様において、Rはメチルおよびエチルから選択される。
ある態様において、本発明は本明細書に開示する式(I)の化合物の製造方法であって、下記を含む方法に関する;式(VI)の化合物:
【0103】
【化20】

【0104】
を加水分解し、これにより式(I)の化合物を形成し;
その後、場合により
i)式(I)の化合物を式(I)の他の化合物に変換し;
ii)いずれかの保護基を除去し;あるいは
iii)医薬的に許容できる塩を形成する。
【0105】
さらに他の態様において、加水分解は式(VI)の化合物と金属水酸化物および分枝鎖アルキルアルコールを混合することにより実施される。
さらに他の態様において、金属水酸化物は水酸化カリウムである。
【0106】
さらに他の態様において、分枝鎖アルキルアルコールは第三級アルコール、たとえばtert−ブチルアルコールである。
本発明化合物中の種々の環置換基のうちあるものは、前記方法の前または直後に、標準的な芳香族置換反応により導入することができ、あるいは一般的な官能基修飾により生成させることができ、したがって本発明の方法の観点に含まれることは認識されるであろう。そのような反応および修飾には、たとえば芳香族置換反応による置換基の導入、置換基の還元、置換基のアルキル化、および置換基の酸化が含まれる。そのような方法のための試薬および反応条件は化学技術分野で周知である。芳香族置換反応の具体例には、濃硝酸を用いるニトロ基導入;たとえばハロゲン化アシルおよびルイス酸(たとえば三塩化アルミニウム)をフリーデル・クラフツ条件下で用いるアシル基導入;ハロゲン化アルキルおよびルイス酸(たとえば三塩化アルミニウム)をフリーデル・クラフツ条件下で用いるアルキル基導入;ならびにハロ基の導入が含まれる。修飾の具体例には、たとえばニッケル触媒を用いる接触水素化による、または塩酸の存在下で加熱しながら鉄で処理することによる、ニトロ基からアミノ基への還元;アルキルチオからアルキルスルフィニルまたはアルキルスルホニルへの酸化が含まれる。
【0107】
本明細書に述べるある態様において、化合物中のいずれかの感受性基を保護するのが必要/望ましいことも認識されるであろう。保護が必要または望ましい例、および適切な保護方法は、当業者に既知である。一般的な保護基を標準法に従って使用できる(説明については、たとえばT. N. Green, Protective Groups in Organic Synthesis, John Wiley and Sons, 1991を参照)。たとえば、反応体がアミノ、カルボキシまたはヒドロキシなどの基を含む場合、本明細書に記載するある反応においてその基を保護することが望ましい可能性がある。
【0108】
アミノまたはアルキルアミノ基に適切な保護基は、たとえばアシル基、たとえばアルカノイル基、たとえばアセチル、アルコキシカルボニル基、たとえばメトキシカルボニル、エトキシカルボニルもしくはt−ブトキシカルボニル基、アリールメトキシカルボニル基、たとえばベンジルオキシカルボニル、またはアロイル基、たとえばベンゾイルである。前記保護基についての脱保護条件は、保護基の選択に伴って必然的に異なる。たとえば、アシル基、たとえばアルカノイル基またはアルコキシカルボニル基またはアロイル基は、たとえば適切な塩基、たとえばアルカリ金属水酸化物、たとえば水酸化リチウムまたはナトリウムで加水分解することにより除去できる。あるいは、アシル基、たとえばt−ブトキシカルボニル基は、たとえば適切な酸、たとえば塩酸、硫酸もしくはリン酸、またはトリフルオロ酢酸で処理することにより除去でき、アリールメトキシカルボニル基、たとえばベンジルオキシカルボニル基は、たとえばカーボン上パラジウムなどの触媒上で水素化することにより、またはルイス酸、たとえばホウ素トリス(トリフルオロアセテート)で処理することにより除去できる。第一級アミノ基に適切な別の保護基は、たとえばフタロイル基であり、これはアルキルアミン、たとえばジメチルアミノプロピルアミン、またはヒドラジンで処理することにより除去できる。
【0109】
ヒドロキシ基に適切な保護基は、たとえばアシル基、たとえばアルカノイル基、たとえばアセチル、アロイル基、たとえばベンゾイル、またはアリールメチル基、たとえばベンジルである。前記保護基についての脱保護条件は、保護基の選択に伴って必然的に異なるであろう。たとえば、アシル基、たとえばアルカノイル基またはアロイル基は、たとえば適切な塩基、たとえばアルカリ金属水酸化物、たとえば水酸化リチウムまたは水酸化ナトリウムで加水分解することにより除去できる。あるいは、アリールメチル基、たとえばベンジル基は、たとえばカーボン上パラジウムなどの触媒上で水素化することにより除去できる。
【0110】
カルボキシ基に適切な保護基は、たとえばエステル化基、たとえばメチルまたはエチル基であり、これらはたとえば塩基、たとえば水酸化ナトリウムで加水分解することにより除去できる;あるいは、たとえばt−ブチル基であり、これはたとえば酸、たとえば有機酸、たとえばトリフルオロ酢酸で処理することにより除去できる;あるいは、たとえばベンジル基であり、これはたとえばカーボン上パラジウムなどの触媒上で水素化することにより除去できる。
【0111】
保護基は合成のいずれか好都合な段階で、当技術分野において周知の一般的な手法を用いて除去することができる。
本明細書に記載する特定の中間体は新規であり、本発明のさらに他の特徴として提供される。
【0112】
前記に述べたように、本発明において定める化合物は抗癌活性をもち、これはこれらの化合物のCSF−1Rキナーゼ阻害活性から生じると考えられる。これらの特性は、たとえば下記に示す方法を用いて評価することができる。
【0113】
ある態様において、本発明は、癌を処置する方法であって、癌のリスクをもつ対象、癌を伴うと診断された対象、または癌の症状を示す対象を提供し、その対象に本明細書に開示する式(I)の化合物を含む医薬組成物を投与することを含む方法に関する。
【0114】
ある態様において、本発明は、CSF−1Rキナーゼを阻害する方法であって、CSF−1Rキナーゼおよび本明細書に開示する式(I)の化合物を提供し、そしてCSF−1Rキナーゼが阻害される条件下で混合することを含む方法に関する。
【0115】
生物活性
アッセイ1:CSF−1RインビトロAlphaScreenアッセイ
精製したCSF−1Rの活性を、Amplified Luminescent Proximity Homogenous Assay(ALPHA)(Perkin Elmer)によりインビトロで測定した;これは、CSF−1Rの基質であるビオチニル化ポリ−グルタミン−チロシンペプチド(pEY−HTRF CisBio 61GT0BLD)のリン酸化を下記に従って測定するものである。CSF−1RのHisタグ付きキナーゼドメイン(すなわち、アミノ酸568−912,GeneBank ID NM_005211;(配列リストについてはWO 2006/067445,25頁13−19行を参照))を、バキュロウイルス感染SF+Express昆虫細胞(1.4x106細胞/ml)から、フレンチプレス処理し、続いてQiagen Ni−NTA、Superflow Mono Q HR 10/10、およびSuperdex 200 SECカラムによりクロマトグラフィー処理して精製した。一般的な収量は、純度>95%の細胞ペレット245μg/lであった。
【0116】
CSF−1Rの基質のリン酸化を目的化合物の存在下および不存在下で測定した。要約すると、0.57nMの精製CSF−1R、5nMのpEY基質、および化合物を、1×緩衝液中において25℃で30分間プレインキュベートした。1×緩衝液中の90μMアデノシン三リン酸(ATP)の添加により反応を開始し、25℃で60分間インキュベートし、下記のものからなる検出ミックス5μlの添加により反応を停止した:136mMのNaCl、102mMのエチレンジアミン四酢酸、1.65mg/mlのBSA、40ug/mlのストレプトアビジンドナービーズ(Perkin Elmer 6760002)、40ug/mlのpTyrl00アクセプタービーズ(Perkin Elmer 6760620)。プレートを25℃で18時間、暗所でインキュベートした。リン酸化された基質をEn Visionプレート読取装置(Perkin Elmer)により680nm励起、520〜620nm発光で検出した。データをグラフにし、IC50をExcel Fit(Microsoft)により計算した。
【0117】
アッセイ2:CSF1RインビトロAlphaScreenアッセイ
精製したCSF−1Rの活性を、Amplified Luminescent Proximity Homogeneous Assay(ALPHA)(Perkin Elmer,MA)によりインビトロで測定した;これは、CSF−1Rの基質であるビオチニル化ポリ−グルタミン−チロシンペプチド(pEY−HTRF CisBio 61GT0BLD)のリン酸化を下記に従って測定するものである。CSF−1RのHisタグ付きキナーゼドメイン(すなわち、アミノ酸568−912,GeneBank ID NM_005211;(配列リストについてはWO 2006/067445,25頁13−19行を参照))を、バキュロウイルス感染SF+Express昆虫細胞(1.4x106細胞/ml)から、フレンチプレス処理し、続いてQIAgen Ni−NTA、Superflow Mono Q HR 10/10、およびSuperdex 200 SECカラムによりクロマトグラフィー処理して精製した。一般的な収量は、純度>95%の細胞ペレット322ug/lであった。
【0118】
CSF−1Rの基質のリン酸化を目的化合物の存在下および不存在下で測定した。要約すると、1.2×緩衝液中の0.46nMの精製CSF−1R、12nMのpEY基質、および12mMのATPからなる、酵素/基質/アデノシン三リン酸(ATP)ミックス5ulを、2ulの化合物と共に25℃で20分間プレインキュベートした。1.2×緩衝液中の24mM MgCl2からなるMetalミックス5ulで反応を開始し、25℃で90分間インキュベートし、下記のものからなる検出ミックス5ulの添加により反応を停止した:20mMのHEPES、102mMのエチレンジアミン四酢酸、1.65mg/mlのBSA、136mMのNaCl、40ug/mlのストレプトアビジンドナービーズ(Perkin Elmer,MA,カタログ番号6760002)、および40ug/mlのホスホチロシン特異性抗体でコートしたアクセプタービーズ(Perkin Elmer,MA,カタログ番号6760620)。プレートを25℃で18時間、暗所でインキュベートした。リン酸化された基質をEn Visionプレート読取装置(Perkin Elmer)により680nm励起、520〜620nm発光で検出した。データをグラフにし、IC50をExcel Fit(Microsoft)により計算した。
【0119】
前記インビトロアッセイの一方または他方で試験した場合、本発明化合物は一般に30μM未満の活性を示した。たとえば、前記アッセイの一方または他方と実質的に類似するアッセイで下記の結果が得られた。
【0120】
【表1−1】

【0121】
【表1−2】

【0122】
本発明の他の観点によれば、前記に定めた式(I)の化合物またはその医薬的に許容できる塩を医薬的に許容できる希釈剤またはキャリヤーと共に含む医薬組成物が提供される。
【0123】
本発明組成物は、経口投与に適切な形態、たとえば錠剤もしくはカプセル剤、非経口注射(静脈内、皮下、筋肉内、血管内、または注入)に適切な形態、たとえば無菌の液剤、懸濁液剤もしくは乳剤、局所投与に適切な形態、たとえば軟膏剤もしくはクリーム剤、または直腸投与に適切な形態、たとえば坐剤であってもよい。
【0124】
一般に、前記組成物は常法により、一般的な賦形剤を用いて調製できる。
式(I)の化合物は、普通は温血動物に1〜1000mg/kgの単位量で投与され、これが普通は療法有効量を供給する。好ましくは、10〜100mg/kgの一日量を用いる。ただし、一日量は、処置されるホスト、個々の投与経路、および処置される疾患の重症度に応じて必然的に異なるであろう。したがって、最適量はいずれか特定の患者を処置する医師が決定することができる。
【0125】
本発明のさらに他の観点によれば、ヒトまたは動物の身体を療法により処置する方法に使用するための、前記に定めた式(I)の化合物またはその医薬的に許容できる塩が提供される。
【0126】
本発明者らは、本発明において定める化合物またはその医薬的に許容できる塩が有効な抗癌剤であることを見いだした;この特性はそれらのCSF−1Rキナーゼ阻害特性から生じると考えられる。したがって、本発明化合物は、専らまたは部分的にCSF−1Rキナーゼにより仲介される疾患または病的状態の処置に有用であると期待される;すなわち、本発明化合物を用いて、その処置を必要とする温血動物においてCSF−1Rキナーゼ阻害作用を発生させることができる。
【0127】
したがって本発明化合物は、CSF−1Rキナーゼの阻害を特徴とする癌処置方法を提供する;すなわち、本発明化合物を用いて、専らまたは部分的にCSF−1Rキナーゼ阻害により仲介される抗癌作用を発生させることができる。
【0128】
CSF1Rおよび/またはCSF1の異常な発現が下記を含めた多数のヒト癌および誘導細胞系(これらに限定されない)において観察されているので、そのような本発明化合物は広域の抗癌特性をもつと期待される:乳腺、卵巣、子宮内膜、前立腺、肺、腎臓および膵臓の腫瘍、ならびに血液学的悪性疾患:脊髄形成異常症候群、急性骨髄性白血病、慢性骨髄性白血病、非ホジキンリンパ腫、ホジキン病、多発性骨髄腫、および慢性リンパ球性白血病を含むが、これらに限定されない。活性化型の変異が造血組織およびリンパ組織ならびに肺の癌においても報告されている。さらに、下記を含めた多数の腫瘍タイプ(これらに限定されない)において腫瘍関連マクロファージが予後不良に関連している:乳癌、子宮内膜癌、腎癌、肺癌、膀胱癌および子宮頚癌、神経膠腫、食道の扁平上皮癌、悪性ブドウ膜黒色腫、ならびに濾胞性リンパ腫。本発明化合物は、腫瘍に対する直接作用により、および/または腫瘍関連マクロファージに対する作用によって間接的に、これらの癌に対して抗癌活性をもつと期待される。
【0129】
本発明のさらに他の観点において、式(I)の化合物は特定の他の適応症の処置に際しても有用となることができる。これらの適応症には下記のものが含まれるが、これらに限定されない:腫瘍関連の骨溶解;骨粗鬆症:卵巣摘除術誘発性の骨損失を含む;整形移植障害;自己免疫障害:全身性紅斑性狼瘡を含む;関節炎:リウマチ性関節炎、骨関節炎を含む;腎炎および糸球体腎炎;炎症性腸疾患;腎臓および骨髄の同種異系移植片ならびに皮膚異種移植片を含めた移植片の拒絶;アテローム性動脈硬化症;肥満症;アルツハイマー病;ならびにランゲルハンス細胞ヒスチオサイトーシス。したがって本発明のさらに他の観点には、これらの疾患のうち1以上、特にリウマチ性関節炎および骨関節炎を含めた関節炎の処置が含まれる。これらの適応症には、慢性閉塞性肺疾患、糖尿病、および乾癬を含めた慢性皮膚障害も含まれるが、これらに限定されない。
【0130】
したがって、本発明のこの観点によれば、医薬として使用するための、前記に定めた式(I)の化合物またはその医薬的に許容できる塩が提供される。
本発明のさらに他の観点によれば、ヒトなどの温血動物においてCSF−1Rキナーゼ阻害作用を発生させる際に使用するための医薬の製造における、前記に定めた式(I)の化合物またはその医薬的に許容できる塩の使用が提供される。
【0131】
本発明のこの観点によれば、ヒトなどの温血動物において抗癌作用を発生させる際に使用するための医薬の製造における、前記に定めた式(I)の化合物またはその医薬的に許容できる塩の使用が提供される。
【0132】
本発明のさらに他の特徴によれば、乳腺、卵巣、膀胱、子宮頚、子宮内膜、前立腺、肺、腎臓および膵臓の腫瘍;血液学的悪性疾患:脊髄形成異常症候群、急性骨髄性白血病、慢性骨髄性白血病、非ホジキンリンパ腫、ホジキン病、多発性骨髄腫および慢性リンパ球性白血病を含む;ならびに神経膠腫、食道の扁平上皮癌、悪性ブドウ膜黒色腫、ならびに濾胞性リンパ腫の処置に使用するための医薬の製造における、前記に定めた式(I)の化合物またはその医薬的に許容できる塩の使用が提供される。
【0133】
本発明のさらに他の特徴によれば、腫瘍関連の骨溶解;骨粗鬆症:卵巣摘除術誘発性の骨損失を含む;整形移植障害;自己免疫障害:全身性紅斑性狼瘡を含む;関節炎:リウマチ性関節炎、骨関節炎を含む;腎炎および糸球体腎炎;炎症性腸疾患;腎臓および骨髄の同種異系移植片ならびに皮膚異種移植片を含めた移植片の拒絶;アテローム性動脈硬化症;肥満症;アルツハイマー病;慢性閉塞性肺疾患;糖尿病;ならびに慢性皮膚障害:乾癬を含む;ならびにランゲルハンス細胞ヒスチオサイトーシスの処置に使用するための医薬の製造における、前記に定めた式(I)の化合物またはその医薬的に許容できる塩の使用が提供される。
【0134】
本発明のこの観点のさらに他の特徴によれば、その処置を必要とするヒトなどの温血動物においてCSF−1Rキナーゼ阻害作用を発生させる方法であって、その動物に有効量の前記に定めた式(I)の化合物またはその医薬的に許容できる塩を投与することを含む方法が提供される。
【0135】
本発明のこの観点のさらに他の特徴によれば、その処置を必要とするヒトなどの温血動物において抗癌作用を発生させる方法であって、その動物に有効量の前記に定めた式(I)の化合物またはその医薬的に許容できる塩を投与することを含む方法が提供される。
【0136】
本発明のこの観点の他の特徴によれば、その処置を必要とするヒトなどの温血動物において乳腺、卵巣、膀胱、子宮頚、子宮内膜、前立腺、肺、腎臓および膵臓の腫瘍;血液学的悪性疾患:骨髄形成異常症候群、急性骨髄性白血病、慢性骨髄性白血病、非ホジキンリンパ腫、ホジキン病、多発性骨髄腫および慢性リンパ球性白血病を含む;ならびに神経膠腫、食道の扁平上皮癌、悪性ブドウ膜黒色腫、ならびに濾胞性リンパ腫を処置する方法であって、その動物に有効量の前記に定めた式(I)の化合物またはその医薬的に許容できる塩を投与することを含む方法が提供される。
【0137】
本発明のこの観点の他の特徴によれば、その処置を必要とするヒトなどの温血動物において腫瘍関連の骨溶解;骨粗鬆症:卵巣摘除術誘発性の骨損失を含む;整形移植障害;自己免疫障害:全身性紅斑性狼瘡を含む;関節炎:リウマチ性関節炎、骨関節炎を含む;腎炎および糸球体腎炎;炎症性腸疾患;腎臓および骨髄の同種異系移植片ならびに皮膚異種移植片を含めた移植片の拒絶;アテローム性動脈硬化症;肥満症;アルツハイマー病;慢性閉塞性肺疾患;糖尿病;ならびに慢性皮膚障害:乾癬を含む;ならびにランゲルハンス細胞ヒスチオサイトーシスを処置する方法であって、その動物に有効量の前記に定めた式(I)の化合物またはその医薬的に許容できる塩を投与することを含む方法が提供される。
【0138】
本発明のさらに他の観点では、ヒトなどの温血動物においてCSF−1Rキナーゼ阻害作用を発生させる際に使用するための、前記に定めた式(I)の化合物またはその医薬的に許容できる塩を医薬的に許容できる希釈剤またはキャリヤーと共に含む医薬組成物が提供される。
【0139】
本発明のさらに他の観点では、ヒトなどの温血動物において抗癌作用を発生させる際に使用するための、前記に定めた式(I)の化合物またはその医薬的に許容できる塩を医薬的に許容できる希釈剤またはキャリヤーと共に含む医薬組成物が提供される。
【0140】
本発明のさらに他の観点では、ヒトなどの温血動物において乳腺、卵巣、膀胱、子宮頚、子宮内膜、前立腺、肺、腎臓および膵臓の腫瘍;血液学的悪性疾患:骨髄形成異常症候群、急性骨髄性白血病、慢性骨髄性白血病、非ホジキンリンパ腫、ホジキン病、多発性骨髄腫および慢性リンパ球性白血病を含む;ならびに神経膠腫、食道の扁平上皮癌、悪性ブドウ膜黒色腫、ならびに濾胞性リンパ腫を処置する際に使用するための、前記に定めた式(I)の化合物またはその医薬的に許容できる塩を医薬的に許容できる希釈剤またはキャリヤーと共に含む医薬組成物が提供される。
【0141】
本発明のさらに他の観点では、ヒトなどの温血動物において腫瘍関連の骨溶解;骨粗鬆症:卵巣摘除術誘発性の骨損失を含む;整形移植障害;自己免疫障害:全身性紅斑性狼瘡を含む;関節炎:リウマチ性関節炎、骨関節炎を含む;腎炎および糸球体腎炎;炎症性腸疾患;腎臓および骨髄の同種異系移植片ならびに皮膚異種移植片を含めた移植片の拒絶;アテローム性動脈硬化症;肥満症;アルツハイマー病;慢性閉塞性肺疾患;糖尿病;ならびに慢性皮膚障害:乾癬を含む;ならびにランゲルハンス細胞ヒスチオサイトーシスを処置する際に使用するための、前記に定めた式(I)の化合物またはその医薬的に許容できる塩を医薬的に許容できる希釈剤またはキャリヤーと共に含む医薬組成物が提供される。
【0142】
本発明のさらに他の観点によれば、ヒトなどの温血動物においてCSF−1Rキナーゼ阻害作用を発生させる際の、前記に定めた式(I)の化合物またはその医薬的に許容できる塩の使用が提供される。
【0143】
本発明のこの観点によれば、ヒトなどの温血動物において抗癌作用を発生させる際の、前記に定めた式(I)の化合物またはその医薬的に許容できる塩の使用が提供される。
本発明のさらに他の特徴によれば、乳腺、卵巣、膀胱、子宮頚、子宮内膜、前立腺、肺、腎臓および膵臓の腫瘍;血液学的悪性疾患:骨髄形成異常症候群、急性骨髄性白血病、慢性骨髄性白血病、非ホジキンリンパ腫、ホジキン病、多発性骨髄腫および慢性リンパ球性白血病を含む;ならびに神経膠腫、食道の扁平上皮癌、悪性ブドウ膜黒色腫、ならびに濾胞性リンパ腫の処置における、前記に定めた式(I)の化合物またはその医薬的に許容できる塩の使用が提供される。
【0144】
本発明のさらに他の特徴によれば、腫瘍関連の骨溶解;骨粗鬆症:卵巣摘除術誘発性の骨損失を含む;整形移植障害;自己免疫障害:全身性紅斑性狼瘡を含む;関節炎:リウマチ性関節炎、骨関節炎を含む;腎炎および糸球体腎炎;炎症性腸疾患;腎臓および骨髄の同種異系移植片ならびに皮膚異種移植片を含めた移植片の拒絶;アテローム性動脈硬化症;肥満症;アルツハイマー病;慢性閉塞性肺疾患;糖尿病;ならびに慢性皮膚障害:乾癬を含む;ならびにランゲルハンス細胞ヒスチオサイトーシスの処置における、前記に定めた式(I)の化合物またはその医薬的に許容できる塩の使用が提供される。
【0145】
前記に定めたCSF−1Rキナーゼ阻害処置を唯一の療法として適用することができ、あるいは本発明化合物のほかに一般的な外科処置または放射線療法または化学療法を伴うことができる。そのような化学療法は、下記のカテゴリーの抗腫瘍薬のうち1以上を含むことができる:
(i)癌医療に用いられる抗増殖/抗新生物薬およびその組合わせ、たとえばアルキル化剤(たとえばシスプラチン(cis−platin)、カルボプラチン(carboplatin)、シクロホスファミド(cyclophosphamide)、ナイトロジェンマスタード、メルファラン(melphalan)、クロラムブシル(chlorambucil)、ブスルファン(busulphan)およびニトロソ尿素);代謝拮抗薬(たとえば葉酸拮抗薬、たとえばフルオロピリミジン類、たとえば5−フルオロウラシルおよびテガフル(tegafur)、ラルチトレキセド(raltitrexed)、メトトレキセート(methotrexate)、シトシンアラビノシド(cytosine arabinoside)およびヒドロキシ尿素);抗腫瘍性抗生物質(たとえばアントラサイクリン類、たとえばアドリアマイシン(adriamycin)、ブレオマイシン(bleomycin)、ドキソルビシン(doxorubicin)、ダウノマイシン(daunomycin)、エピルビシン(epirubicin)、イダルビシン(idarubicin)、マイトマイシン−C(mitomycin−C)、ダクチノマイシン(dactinomycin)およびミトラマイシン(mithramycin));有糸分裂抑制薬(たとえばビンカアルカロイド、たとえばビンクリスチン(vincristine)、ビンブラスチン(vinblastine)、ビンデシン(vindesine)およびビノレルビン(vinorelbine)、ならびにタキソイド類、たとえばタキソール(taxol)およびタキソテール(taxotere));ならびにトポイソメラーゼ阻害薬(たとえばエピポドフィロトキシン類、たとえばエトポシド(etoposide)およびテニポシド(teniposide)、アムサクリン(amsacrine)、トポテカン(topotecan)およびカンプトテシン(camptothecin));
(ii)細胞増殖抑制薬、たとえば抗エストロゲン薬(たとえばタモキシフェン(tamoxifen)、トレミフェン(toremifene)、ラロキシフェン(raloxifene)、ドロロキシフェン(droloxifene)およびヨードキシフェン(iodoxyfene))、エストロゲン受容体ダウンレギュレーター(たとえばフルベストラント(fulvestrant))、抗アンドロゲン薬(たとえばビカルタミド(bicalutamide)、フルタミド(flutamide)、ニルタミド(nilutamide)および酢酸シプロテロン(cyproterone acetate))、LHRHアンタゴニストまたはLHRHアゴニスト(たとえばゴセレリン(goserelin)、ロイプロレリン(leuprorelin)およびブセレリン(buserelin))、プロゲストーゲン類(たとえば酢酸メゲストロール(megestrol acetate))、アロマターゼ阻害薬(たとえばアナストロゾール(anastrozole)、レトロゾール(letrozole)、ボラゾール(vorazole)およびエキセメスタン(exemestane))、ならびに5α−レダクターゼ阻害薬、たとえばフィナステリド(finasteride);
(iii)癌細胞の浸潤を阻害する薬剤(たとえばメタロプロテイナーゼ阻害薬、たとえばマリマスタット(marimastat)、およびウロキナーゼプラスミノーゲンアクチベーター受容体機能の阻害薬);
(iv)増殖因子機能の阻害薬、たとえばそのような阻害薬には下記のものが含まれる:増殖因子抗体、増殖因子受容体抗体(たとえば抗erbb2抗体トラスツヅマブ(trastuzumab)[Herceptin(商標)]および抗erbbl抗体セツキシマブ(cetuximab)[C225])、ファルネシルトランスフェラーゼ阻害薬、MEK阻害薬、チロシンキナーゼ阻害薬、およびセリン/トレオニンキナーゼ阻害薬、たとえば上皮増殖因子ファミリーの阻害薬(たとえばEGFRファミリーのチロシンキナーゼの阻害薬、たとえばN−(3−クロロ−4−フルオロフェニル)−7−メトキシ−6−(3−モルホリノプロポキシ)キナゾリン−4−アミン(ゲフィチニブ(gefitinib)、AZD 1839)、N−(3−エチニルフェニル)−6,7−ビス(2−メトキシエトキシ)キナゾリン−4−アミン(エルロチニブ(erlotinib)、OSI−774)および6−アクリルアミド−N−(3−クロロ−4−フルオロフェニル)−7−(3−モルホリノプロポキシ)キナゾリン−4−アミン(CI 1033))、たとえば血小板由来増殖因子ファミリーの阻害薬、およびたとえば肝細胞増殖因子ファミリーの阻害薬;
(v)抗血管形成薬、たとえば血管内皮増殖因子の作用を阻害するもの(たとえば抗血管内皮細胞増殖因子抗体ベバシズマブ(bevacizumab)[Avastin(商標)]、国際特許出願WO 97/22596、WO 97/30035、WO 97/32856およびWO 98/13354に開示される化合物)、および他の機序により作動する化合物(たとえばリノミド(linomide)、インテグリンαvβ3機能の阻害薬およびアンギオスタチン(angiostatin));
(vi)血管損傷薬、たとえばコンブレタスタチンA4(Combretastatin A4)、ならびに国際特許出願WO 99/02166、WO 00/40529、WO 00/41669、WO 01/92224、WO 02/04434およびWO 02/08213に開示される化合物;
(vii)アンチセンス療法、たとえば前記に挙げた標的を指向するもの、たとえばISIS 2503、抗rasアンチセンス;
(viii)下記を含む遺伝子療法:たとえば異常な遺伝子、たとえば異常なp53または異常なBRCAlもしくはBRCA2を置換する方法、GDEPT(gene−directed enzyme pro−drug therapy、遺伝子指向性酵素プロドラッグ療法)法、たとえばシトシンデアミナーゼ、チミジンキナーゼまたは細菌性ニトロレダクターゼ酵素を使用するもの、あるいは化学療法または放射線療法に対する患者の耐容性を高める方法、たとえば多剤耐性遺伝子療法;
(ix)下記を含む免疫療法:たとえば患者の腫瘍細胞の免疫原性を高めるためのエクスビボ法およびインビボ法、たとえばサイトカイン、たとえばインターロイキン2、インターロイキン4または顆粒球マクロファージコロニー刺激因子によるトランスフェクション、T細胞アネルギーを低下させる方法、トランスフェクションした免疫細胞、たとえばサイトカイントランスフェクションした樹状細胞を使用する方法、サイトカイントランスフェクションした腫瘍細胞系を使用する方法、および抗イディオタイプ抗体を使用する方法;
(x)下記を含む細胞周期阻害薬:たとえばCDK阻害薬(たとえばフラボピリドール(flavopiridol))および細胞周期チェックポイント(たとえばチェックポイントキナーゼ)の他の阻害薬;オーロラキナーゼならびに有糸分裂および細胞分裂の調節に関与する他のキナーゼ(たとえば有糸分裂キネシン)の阻害薬;ならびにヒストンデアセチラーゼ阻害薬;ならびに
(xi)下記を含むエンドセリンアンタゴニスト:たとえばエンドセリンAアンタゴニスト、エンドセリンBアンタゴニスト、およびエンドセリンAとBのアンタゴニスト;たとえばZD4054およびZD1611(WO 96 40681)、アトラセンタン(atrasentan)ならびにYM598。
【0146】
そのような併用療法は、個々の療法成分の同時、逐次または個別投与により達成できる。そのような組合わせ製剤は、前記の用量範囲内の本発明化合物、および承認された用量範囲内の他の医薬有効薬剤を使用する。
【0147】
式(I)の化合物およびそれらの医薬的に許容できる塩は、療法薬におけるそれらの使用のほか、新規療法薬の探査の一部として、CSF−1Rキナーゼ阻害薬の効果を実験動物、たとえばネコ、イヌ、ウサギ、サル、ラットおよびマウスにおいて評価するためのインビトロおよびインビボ試験系の開発および標準化における薬理学的ツールとしても有用である。
【0148】
前記の他の医薬組成物、プロセス、方法、使用および医薬製造の特徴にも、本明細書に記載する本発明化合物の別態様および好ましい態様が適用される。
【実施例】
【0149】
本発明を限定ではない以下の実施例により説明する;実施例において、別途記載しない限り、下記のとおりである:
(i)温度を摂氏温度(℃)で示す;操作は、別途記載しない限り、室温または周囲温度で、すなわち18〜25℃の範囲の温度で実施された;
(ii)有機溶液を無水の硫酸ナトリウムまたは硫酸マグネシウムで乾燥させた;溶媒の蒸発はロータリーエバポレーターを用いて減圧下に(600〜4000パスカル;4.5〜30mmHg)、最高60℃の浴温で実施された;
(iii)一般に、反応経過をTLCにより追跡し、反応時間は説明のために示すにすぎない;
(iv)最終生成物は満足すべきプロトン核磁気共鳴(NMR)スペクトルおよび/または質量スペクトルのデータを示した;
(v)収量は説明のために示すにすぎず、必ずしも綿密なプロセス開発により得ることができるものではない;より多量の物質が必要な場合、製造を繰り返した;
(vii)NMRデータを示す場合、それは主診断プロトンについてのデルタ値の形であり、内標準としてのテトラメチルシラン(TMS)と対比した百万分率(ppm)で示され、400MHzで、別途指示しない限り、溶媒としてペルジュウテリオジメチルスルホキシド(DMSO−d6)を用いて測定された;
(vii)化学記号はそれらの通常の意味をもつ;SI単位および記号を使用する;
(viii)溶媒比を体積:体積(v/v)により示す;ならびに
(ix)質量分析は、70電子ボルトの電子エネルギーで化学イオン化(CI)モードにおいて直接曝露プローブを用いて行われた;イオン化と指示した場合、それは電子衝撃(EI)、高速原子衝突(FAB)またはエレクトロスプレー(ESP)により行われた;m/zについての値を示す;一般に、親質量を指示するイオンのみを報告する;別途記載しない限り、引用した質量イオンは(MH)+である;
(x)合成が先の実施例に記載したものと同様であると記載した場合、使用量は先の実施例で用いたものと同等なミリモル比である;
(xi)「H−Cube」は、H−Cube連続水素化装置(Thales Nanotechnology製)を表わす;ならびに
(xii)以下の略号を用いた:
DMA N,N−ジメチルアセトアミド;
DMF N,N−ジメチルホルムアミド;
EtOAc 酢酸エチル;
MeOH メタノール;
THF テトラヒドロフラン;
TFA トリフルオロ酢酸;
DMSO ジメチルスルホキシド;および
DCM ジクロロメタン。
【0150】
実施例1 4−[(2,4−ジフルオロフェニル)アミノ]−6,7−ジメトキシシンノリン−3−カルボキサミド
磁気撹拌バーを入れた25mLの丸底フラスコに、4−[(2,4−ジフルオロフェニル)アミノ]−6,7−ジメトキシシンノリン−3−カルボン酸エチル(0.195g,0.50mmol)(方法27)、無水DMF(3mL)、ホルムアミド(0.135g,3mmol)、およびMeOH中の0.5Mナトリウムメトキシド溶液3mLを添加した。反応物を100℃に2時間加温した後、室温にまで放冷した。反応物を水(約50mL)に注ぐと、粗生成物が溶液から沈殿した。この固体を、真空濾過によりブーフナーろうとを用いて採集し、40gのシリカ上でEtOAc/MeOH(4:1)を溶離剤として用いて精製して、0.174g(96%)の表題化合物を白色固体として得た。
【0151】
【化21】

【0152】
実施例2〜12
下記の実施例は、実施例1の処理に従って適切な出発物質を用いて製造され、シリカゲルクロマトグラフィーまたは半調製用逆相HPLCにより精製された。
【0153】
【表2−1】

【0154】
【表2−2】

【0155】
【表2−3】

【0156】
【表2−4】

【0157】
実施例6〜12は、場合により、実施例13ならびに方法47、27および24に記載したものと同様な処理に従って適切な出発物質から同様に製造された。
実施例13 4−(2−フルオロ−4−メチルフェニルアミノ)−7−メトキシ−6−(4−メチルピペラジン−1−イル)シンノリン−3−カルボキサミド
100mLの丸底フラスコに、4−(2−フルオロ−4−メチルフェニルアミノ)−7−メトキシ−6−(4−メチルピペラジン−1−イル)シンノリン−3−カルボニトリル(方法60)(360mg,0.89mmol)および水酸化カリウム(4.9g,88.6mmol)を装入した。無水tert−ブチルアルコール(30ml)を添加し、反応物を激しく還流させながら1時間加熱した後、室温にまで放冷した。次いで反応混合物を、水(約100mL)を入れた分液ろうとに注入し、EtOAc(2×200mL)で抽出した。有機層を合わせて飽和NaCl水溶液(約100mL)で洗浄し、MgSO4で乾燥させ、濾過し、真空濃縮して粗生成物を得た。これをシリカゲルクロマトグラフィー(40g)によりEtOAc/MeOH(1:1)を溶離剤として用いて精製すると、表題化合物が黄色固体として得られた。次いでこの固体を5mLのMeOHから再結晶することにより、純粋な表題化合物(184mg,48.9%)を淡黄色固体として得た。
【0158】
【化22】

【0159】
実施例14〜46
下記の実施例は、実施例13の処理に従って適切な出発物質を用いて製造され、シリカゲルクロマトグラフィーまたは半調製用逆相HPLCにより精製された。得られた物質を次いで必要ならば再結晶した。
【0160】
【表3−1】

【0161】
【表3−2】

【0162】
【表3−3】

【0163】
【表3−4】

【0164】
【表3−5】

【0165】
【表3−6】

【0166】
【表3−7】

【0167】
【表3−8】

【0168】
【表3−9】

【0169】
【表3−10】

【0170】
【表3−11】

【0171】
【表3−12】

【0172】
実施例47 4−[(2−フルオロ−4−メチルフェニル)アミノ]−6−(1−イソプロピルピペリジン−4−イル)−7−メトキシシンノリン−3−カルボキサミド塩酸塩
4−(2−フルオロ−4−メチルフェニルアミノ)−6−(1−イソプロピル−1,2,3,6−テトラヒドロピリジン−4−イル)−7−メトキシシンノリン−3−カルボキサミド(実施例29,0.250g,0.56mmol)のMeOH(20ml)(数滴の濃HClを含む)中における溶液を、H−Cube装置に1mL/分で20重量%Pd(OH)2/カーボンカートリッジを用いて10バールで通した。還元が終了したことがLCMSにより判定された時点で溶液を減圧濃縮して、0.234g(86%)の生成物を得た。
【0173】
【化23】

【0174】
実施例48
下記の実施例は、実施例47の処理に従って適切な出発物質を用いて製造され、さらに逆相HPLCにより精製された。
【0175】
【表4】

【0176】
実施例49 4−[(2−フルオロ−4−メチルフェニル)アミノ]−6−{4−[(2R)−2−ヒドロキシプロパノイル]ピペラジン−1−イル}−7−メトキシシンノリン−3−カルボキサミド
4−(2−フルオロ−4−メチルフェニルアミノ)−7−メトキシ−6−(ピペラジン−1−イル)シンノリン−3−カルボキサミド(実施例46,0.395g,0.96mmol)のCH2Cl2(20mL)およびMeOH(5mL)中における溶液に、ベンゾトリアゾール−1−イルオキシトリピロリジノ−ホスホニウムヘキサフルオロホスフェート(0.551g,1.06mmol)、(R)−2−ヒドロキシプロパン酸(0.079mL,1.06mmol)、およびN−エチルジイソプロピルアミン(0.181mL,1.06mmol)を添加した。1時間後、追加分のベンゾトリアゾール−1−イルオキシトリピロリジノ−ホスホニウムヘキサフルオロホスフェート(1.10g,2.12mmol)を添加した。2時間後、水(100mL)を添加し、混合物をCH2Cl2で抽出した。有機抽出液を減圧濃縮し、残留物をシリカクロマトグラフィー(ヘキサン/EtOAc、次いでCH2Cl2/MeOHによる)により精製した。粗生成物をCH3CNで摩砕処理し、濾過して173mg(37%)の黄色固体を得た。
【0177】
【化24】

【0178】
実施例50 4−[(2−フルオロ−4−メチルフェニル)アミノ]−7−メトキシ−6−[1−(メチルスルホニル)ピペリジン−4−イル]シンノリン−3−カルボキサミド
4−(2−フルオロ−4−メチルフェニルアミノ)−7−メトキシ−6−(ピペリジン−4−イル)シンノリン−3−カルボキサミド(実施例51,0.1g,0.24mmol)のCH2Cl2(2.5ml)およびDMF(2.5ml)中における溶液に、N−エチルジイソプロピルアミン(0.127ml,0.73mmol)およびメタンスルホニルクロリド(0.021ml,0.27mmol)を添加した。反応混合物を1時間撹拌し、CH2Cl2で希釈し、水で洗浄した。有機層を減圧濃縮し、残留物を逆相クロマトグラフィーにより水中の0.1%ギ酸およびメタノール(50−70%)を用いて精製して、28mg(24%)の灰白色固体を得た。
【0179】
【化25】

【0180】
実施例51 4−[(2−フルオロ−4−メチルフェニル)アミノ]−7−メトキシ−6−ピペリジン−4−イルシンノリン−3−カルボキサミド
4−(2−フルオロ−4−メチルフェニルアミノ)−7−メトキシ−6−(1,2,3,6−テトラヒドロピリジン−4−イル)シンノリン−3−カルボキサミド(実施例52,0.9g,2.21mmol)のMeOH(44.2ml)(数滴の濃HClを含む)中における溶液を、H Cube装置に20重量%Pd(OH)2/カーボンカートリッジを用いて10バールで通した。溶媒を減圧下で除去し、残留物をシリカクロマトグラフィーCH2Cl2/10% MeOH(1% NH4OH)により精製して、692mg(77%)の淡黄色固体を得た。
【0181】
【化26】

【0182】
実施例52 4−[(2−フルオロ−4−メチルフェニル)アミノ]−7−メトキシ−6−(l,2,3,6−テトラヒドロピリジン−4−イル)シンノリン−3−カルボキサミド
4−(3−カルバモイル−4−(2−フルオロ−4−メチルフェニルアミノ)−7−メトキシシンノリン−6−イル)−5,6−ジヒドロピリジン−1(2H)−カルボン酸tert−ブチル(実施例53,1.5g,2.96mmol)のCH2Cl2(11.84mL)およびトリフルオロ酢酸(11.84mL,153.68mmol)中における溶液を16時間撹拌し、減圧濃縮し、残留物をシリカクロマトグラフィーCH2Cl2/5% MeOH(l% NH4OH)により精製して、960mg(80%)の生成物を得た。m/z 408。
【0183】
実施例53 4−{3−(アミノカルボニル)−4−[(2−フルオロ−4−メチルフェニル)アミノ]−7−メトキシシンノリン−6−イル}−3,6−ジヒドロピリジン−1(2H)−カルボン酸tert−ブチル
6−ブロモ−4−(2−フルオロ−4−メチルフェニルアミノ)−7−メトキシシンノリン−3−カルボキサミド塩酸塩(実施例54,1.40g,3.169mmol)、4−(4,4,5,5−テトラメチル−1,3,2−ジオキサボロラン−2−イル)−5,6−ジヒドロピリジン−1(2H)−カルボン酸tert−ブチル(1.47g,4.75mmol)、リン酸三カリウム(2.018g,9.51mmol)、ジシクロヘキシル(2’,6’−ジメトキシビフェニル−2−イル)ホスフィン(0.260g,0.63mmol)およびトリス(ジベンジリデンアセトン)二パラジウム(0)(0.29g,0.32mmol)のn−ブタノール(4.53ml)および水(1.81ml)中における混合物を、N2(g)下に100℃で一夜撹拌した。反応混合物を冷却し、減圧濃縮し、残留物をシリカクロマトグラフィー(CH2Cl2/MeOH)により精製して、1.54g(96%)の淡褐色固体を得た。
【0184】
【化27】

【0185】
実施例54 6−ブロモ−4−[(2−フルオロ−4−メチルフェニル)アミノ]−7−メトキシシンノリン−3−カルボキサミド塩酸塩
6−ブロモ−4−クロロ−7−メトキシシンノリン−3−カルボキサミド(方法21,8.89g,28.09mmol)のエタノール(70ml)中における懸濁液に、2−フルオロ−4−メチルアニリン(3.49ml,30.89mmol)および酢酸(0.016ml,0.28mmol)を添加した。反応混合物を80℃で1時間撹拌し、冷却し、濾過した。固体物質をエタノールで洗浄し、乾燥させて、9.16g(74%)の褐色固体を得た;HCl塩と推定。
【0186】
【化28】

【0187】
出発物質の製造
方法1 1−{4,5−ジメトキシ−2−[(E)−ピロリジン−1−イルジアゼニル]フェニル}エタノン
磁気撹拌バーおよび1−(2−アミノ−4,5−ジメトキシフェニル)エタノン(1.23g,6.29mmol)を入れた100mLの丸底フラスコに、水(4mL)を添加した。混合物を氷浴で0℃に冷却し、濃HCl水溶液(1.95mL)を反応混合物に添加した。効果的に撹拌しながら、亜硝酸ナトリウム(0.434g,6.9mmol)の水(3mL)中における溶液を反応混合物にパスツールピペットで添加した。反応物をこの温度で5分間撹拌し、続いてピロリジン(0.447g,6.30mmol)の0.4N水酸化カリウム水溶液50mL中における溶液を徐々に添加した。反応物をこの温度で0.5時間撹拌した後、分液ろうとに注入し、DCM(2×100mL)で抽出した。有機抽出液を合わせてMgSO4で乾燥させ、濾過し、真空濃縮すると粗生成物が得られた。これを80gのシリカ上でヘキサン/EtOAc(1:1)を溶離剤として用いて精製して、1.49g(85%)の表題化合物を褐色固体として得た。
【0188】
【化29】

【0189】
方法2
下記の中間体を方法1の処理に従って適切な出発物質を用いて製造した。
【0190】
【表5】

【0191】
方法3 3−{4,5−ジメトキシ−2−[(E)−ピロリジン−1−イルジアゼニル]フェニル}−3−オキソプロパン酸エチルナトリウム塩
磁気撹拌バーおよび無水THF(55mL)を入れた250mLの三つ口フラスコに、水素化ナトリウム(1.73g,43.3mmol)および蒸留したばかりの炭酸ジエチル(1.28g,10.83mmol)を添加した。反応混合物を還流させ、1−{4,5−ジメトキシ−2−[(E)−ピロリジン−1−イルジアゼニル]フェニル}エタノン(3.0g,10.83mmol)(方法1)の無水THF(25mL)中における溶液を添加ろうとにより滴加した。混合物をさらに8時間還流させた後、室温にまで放冷した。淡黄色沈殿を真空濾過によりブーフナーろうとを用いて分離し、ジエチルエーテル(約2×100mL)で洗浄し、採集し、真空乾燥すると、4.03g(99%)の表題化合物がそれのナトリウム塩として得られ、これをさらに精製せずに使用した。
【0192】
【化30】

【0193】
方法4
下記の中間体を方法3の処理に従って適切な出発物質を用いて製造した。
【0194】
【表6】

【0195】
方法5 6,7−ジメトキシ−4−オキソ−1,4−ジヒドロシンノリン−3−カルボン酸エチル
磁気撹拌バーを入れた100mLの丸底フラスコに、TFA(30mL)を添加した。フラスコを氷浴内で0℃に冷却し、3−{4,5−ジメトキシ−2−[(E)−ピロリジン−1−イルジアゼニル]フェニル}−3−オキソプロパン酸エチルナトリウム塩(4.03g,10.83mmol)(方法3)を反応混合物に少量ずつ10分間かけて添加した。混合物をこの温度でさらに2時間撹拌した後、0℃の氷水(約300mL)に注いだ。目的生成物が混合物から沈殿し、これを真空濾過によりブーフナーろうとを用いて採集した。この固体を水(1×100mL)およびジエチルエーテル(1×100mL)ですすぐと、1.55g(51%)の表題化合物が灰白色固体として得られ、これをさらに精製せずに使用した。
【0196】
【化31】

【0197】
方法6
下記の中間体を方法5の処理に従って適切な出発物質を用いて製造した。
【0198】
【表7】

【0199】
方法7 4−クロロ−6,7−ジメトキシシンノリン−3−カルボン酸エチル
磁気撹拌バーおよび6,7−ジメトキシ−4−オキソ−1,4−ジヒドロシンノリン−3−カルボン酸エチル(1.00g,3.6mmol)(方法5)を入れた50mLの丸底フラスコに、オキシ塩化リン(15mL)を添加した。反応フラスコに還流冷却器を取り付け、2時間、加熱還流した後、室温にまで放冷した。粗製反応混合物を真空濃縮し、残留物をNaHCO3水溶液(約25mL)で処理した。粗生成物が溶液から沈殿し、これを真空濾過によりブーフナーろうとを用いて採集した。この固体を水(1×100mL)およびジエチルエーテル(1×100mL)で洗浄すると0.941g(88%)の表題化合物が淡褐色固体として得られ、これをさらに精製せずに使用した。
【0200】
【化32】

【0201】
方法8
下記の中間体を方法7の処理に従って適切な出発物質を用いて製造した。
【0202】
【表8】

【0203】
方法9 2−ブロモ−5−ニトロフェノール
2−ブロモ−5−ニトロアニソール(11.0g,47mmol)を入れた500mLの丸底フラスコに、100mLの無水DCMを添加した。次いで塩化アルミニウム(25g,150mmol)を反応混合物に添加した。得られた懸濁液を50℃で一夜、窒素下で加熱した。反応物を室温にまで放冷し、氷に注ぎ、10% HCl水溶液の添加によりpH4の酸性にした。得られた混合物をセライト床により濾過し、濾液を分液ろうとへ移した。水相を塩化メチレン(約2×200mL)で抽出した。有機相を合わせてNa2SO4で乾燥させ、真空濃縮すると粗製の表題化合物が得られた。これをシリカゲルクロマトグラフィー(330g)によりEtOAc/ヘキサン(1:1)を溶離剤として用いて精製して、表題化合物(8.0g,78%)を得た。m/z:217。
【0204】
方法10 1−ブロモ−2−(2−メトキシエトキシ)−4−ニトロベンゼン
2−ブロモ−5−ニトロフェノール(7.24g,33.2mmol)(方法9)の無水DMF中における溶液に、2−メトキシ−1−ブロモエタン(6.92g,49.8mmol)および触媒量のヨウ化カリウム(約100mg)を添加した。反応物を70℃に4時間加熱した後、室温にまで放冷した。次いで反応物を分液ろうとに注入し、EtOAc(約250mL)と水(約250mL)の間で分配した。有機相をNa2SO4で乾燥させ、真空濃縮すると粗製の表題化合物が得られた。これを最少量の温EtOAcに装入した。得られた溶液を氷浴内で冷却し、ヘキサンを徐々に添加して結晶化を誘発した。生成した沈殿をガラスろうとで真空濾過により分離し、風乾して、純粋な表題化合物(8.3g,91%)を得た。
【0205】
【化33】

【0206】
方法11 4−ブロモ−3−(2−メトキシエトキシ)アニリン
開放式の250mL丸底フラスコに、1−ブロモ−2−(2−メトキシエトキシ)−4−ニトロベンゼン(方法10)(5g,18.11mmol)、SiO2上の5重量%FeCl3(17.6g,5.43mmol)、活性炭(10g)、および100mLのMeOHを装入した。この得られた混合物を撹拌しながら80℃に加熱した。次いでヒドラジン・1水和物(10.6mL,217mmol)を慎重に反応混合物に添加した。ヒドラジン・1水和物の添加が終了した後、反応混合物を80℃でさらに40分間撹拌した。次いで反応物を室温にまで放冷し、セライト床により濾過した。フィルターケークをMeOH(約150mL)およびEtOAc(約150mL)で洗浄した。得られた濾液を真空濃縮すると表題化合物が得られ、これをさらに精製せずに使用した(3.16g,71%)。m/z:247。
【0207】
方法12 2−[(4−ブロモ−3−メトキシフェニル)ジアゼニル]−2−シアノアセトアミド
水(100ml)に溶解した亜硝酸ナトリウム(8.54g,123.7mmol)を、4−ブロモ−3−メトキシアニリン(25g,123.7mmol)の濃HCl(46ml,1514mmol)および水(100ml)中における氷冷懸濁液に添加した。10分間撹拌した後、水(1.8L)中の2−シアノアセトアミド(10.40g,123.7mmol)および酢酸ナトリウム・3水和物(84g,617mmol)を添加し、反応物を一夜撹拌した。生成した固体を濾過により採集し、水で洗浄し、乾燥させると橙色固体が得られ、これを1.4Lのエタノール中で30分間還流させた。混合物を室温にまで冷却し、固体を濾過により採集し、エタノール(100ml×3)で洗浄し、乾燥させて、表題化合物を黄色固体(34.4g,94%)として得た。
【0208】
【化34】

【0209】
方法13〜14
下記の中間体を方法12の処理に従って適切な出発物質を用いて製造した。
【0210】
【表9】

【0211】
方法15 4−アミノ−6−ブロモ−7−メトキシシンノリン−3−カルボキサミド:
2−((4−ブロモ−3−メトキシフェニル)ジアゼニル)−2−シアノアセトアミド(方法12)(34.4g,115.8mmol)のトルエン(250ml)中における混合物に、N2下でTiCl4(51.1ml,463mmol)を添加した。反応混合物を還流しながら4時間撹拌した後、室温にまで放冷した。反応混合物を3N HCl氷冷溶液(約600ml)に慎重に注ぎ、次いで混合物を室温にまで高め、次いで90℃で10分間撹拌した。沈殿が生成し、これを真空濾過により採集し、水(約200mL)、エタノール(約200mL)、エーテル(約200mL)で洗浄し、真空乾燥すると表題化合物が褐色固体として得られ、これをさらに精製せずに使用した(30.0g,87%)。
【0212】
【化35】

【0213】
方法16〜17
下記の中間体を方法15の処理に従って適切な出発物質を用いて製造した。
【0214】
【表10】

【0215】
方法18 6−ブロモ−4−ヒドロキシ−7−メトキシシンノリン−3−カルボン酸
lLのフラスコに、4−アミノ−6−ブロモ−7−メトキシシンノリン−3−カルボキサミド(方法15)(30g,101mmol)およびエタノール(650ml)を装入した。水酸化カリウム(100g,1782mmol)の水(350ml)中における懸濁液を反応物に添加し、混合物を9日間、還流しながら撹拌した。次いで反応物を冷却し、セライトのパッドにより濾過し、これを水(約250mL)で洗浄した。得られた濾液を真空濃縮してエタノールを除去し、得られた水溶液を濃HClでpH約3の酸性にした。沈殿が生成し、これを真空濾過により採集した。得られた固体を1.4Lのエタノールに懸濁し、75℃に15分間加熱し、室温にまで冷却すると粗製沈殿が生成し、これを真空濾過により採集した。フィルターケークをエタノール(約200mL)およびジエチルエーテル(約200mL)で洗浄すると表題化合物が褐色固体として得られ、これをさらに精製せずに使用した(26.0g,86%)。
【0216】
【化36】

【0217】
方法19〜20
下記の中間体を方法18の処理に従って適切な出発物質を用いて製造した。
【0218】
【表11】

【0219】
方法21 6−ブロモ−4−クロロ−7−メトキシシンノリン−3−カルボキサミド
6−ブロモ−4−ヒドロキシ−7−メトキシシンノリン−3−カルボン酸(方法18)(14g,46.8mmol)を入れた1Lの丸底フラスコに、SOCl2(342ml)およびDMF(1ml)を添加した。得られた混合物を4時間、加熱還流した後、室温にまで冷却した。反応混合物を真空濃縮すると残留物が得られ、これをアセトン(約400ml)に懸濁した。この懸濁液を氷浴内で0℃に冷却し、濃アンモニア水(50ml,1284mmol)を添加ろうとにより滴加し、得られた混合物を0℃でさらに15分間撹拌した。沈殿が生成し、これを真空濾過により採集した。フィルターケークを水(3×100mL)、アセトン(3×50mL)で洗浄し、採集し、真空乾燥すると表題化合物が灰白色固体(14.00g,94%)として得られ、これをさらに精製せずに使用した。
【0220】
【化37】

【0221】
方法22〜23
下記の中間体を方法21の処理に従って適切な出発物質を用いて製造した。
【0222】
【表12】

【0223】
方法24 6−ブロモ−4−クロロ−7−メトキシシンノリン−3−カルボニトリル
6−ブロモ−4−クロロ−7−メトキシシンノリン−3−カルボキサミド(方法21)(12g,37.9mmol)のDCM(400ml)中における懸濁液に、POCl3(200ml)を添加した。次いでトリエチルアミン(15ml)を慎重に混合物に添加し、これを7時間、還流しながら撹拌した。次いで反応物を室温にまで放冷し、真空濃縮した。次いで粗製残留物を飽和NaHCO3水溶液により0℃で慎重に処理した。沈殿が生成し、これを真空濾過により採集した。フィルターケークを水(約100mL)で洗浄し、採集し、真空乾燥すると表題化合物が灰色固体(9.80g,87%)として得られ、これをさらに精製せずに使用した。
【0224】
【化38】

【0225】
方法25〜26
下記の中間体を方法24の処理に従って適切な出発物質を用いて製造した。
【0226】
【表13】

【0227】
方法27 4−[(2,4−ジフルオロフェニル)アミノ]−6,7−ジメトキシシンノリン−3−カルボン酸エチル
磁気撹拌バーおよび4−クロロ−6,7−ジメトキシシンノリン−3−カルボン酸エチル(0.200g,0.675mmol)(方法7)を入れた50mLの丸底フラスコに、無水エタノール(10mL)、2,4−ジフルオロアニリン(0.087g,0.675mmol)、および氷酢酸(約100μL)を添加した。次いで反応混合物を75℃に1時間加熱し、室温にまで冷却し、濃アンモニア水(約5mL)で希釈した。粗生成物がこの反応混合物から沈殿し、これを真空濾過によりブーフナーろうとを用いて採集した。この固体を水(1×100mL)およびジエチルエーテル(1×100mL)で洗浄すると粗生成物が得られ、これを40gのシリカ上でEtOAcを溶離剤として用いて精製して、0.231g(88%)の表題化合物を黄色固体として得た。
【0228】
【化39】

【0229】
方法28〜45
下記の中間体を方法27の処理に従って適切な出発物質を用いて製造した。
【0230】
【表14−1】

【0231】
【表14−2】

【0232】
【表14−3】

【0233】
【表14−4】

【0234】
【表14−5】

【0235】
方法37〜45に記載した中間体は、方法21〜23の中間体から2工程で、実施例54に記載したアニリン付加法を用い、続いて方法24に記載したアミドからニトリルへの変換により製造することもできる。
【0236】
方法46 1−(2−アミノ−5−ブロモ−4−エトキシフェニル)エタノン
還流冷却器および添加ろうとを備えたlLの三つ口フラスコに、撹拌バー、4−ブロモ−3−エトキシアニリン塩酸塩(25g,100mmol)、および無水トルエン(300mL)を装入した。反応混合物を0℃に冷却し、DCM中の1M三塩化ホウ素溶液100mLを添加ろうとにより反応物に滴加した。三塩化ホウ素の添加が終了した後、アセトニトリル(6.56mL,125mmol)を添加し、続いてDCM中の1M TiCl4溶液110mLを滴加した。得られた不均質な反応混合物を16時間、加熱還流した後、室温にまで放冷した。粗製反応混合物を慎重に2M HCl水溶液(約250mL)に注ぎ、反応混合物を80℃に1時間加温した。室温にまで冷却した後、2N NaOH水溶液を慎重に添加することにより反応混合物のpHを6に調整した。固体を濾過し、濾液をEtOAc(2×1000mL)で抽出した。有機抽出液を合わせてMgSO4で乾燥させ、濾過し、真空濃縮すると粗生成物が暗色の油として得られた。この粗製の油にMeOH(約100mL)を添加すると目的生成物が沈殿し、これを真空濾過によりブーフナーろうとを用いて採集して、10.9g(42%)の表題化合物を褐色固体として得た。m/z 259。
【0237】
方法47 7−エトキシ−4−[(2−フルオロ−5−メチルフェニル)アミノ]−6−(4−メチルピペラジン−1−イル)シンノリン−3−カルボン酸エチル
磁気撹拌バーおよび6−ブロモ−7−エトキシ−4−[(2−フルオロ−5−メチルフェニル)アミノ]シンノリン−3−カルボン酸エチル(0.100g,0.223mmol)(方法28)を入れた50mLの丸底フラスコに、2.5mLの無水ジメチルアセトアミドを添加した。Pd2(dba)3(50mg,0.55mmol)、ラセミBINAP(70mg,0.11mmol)、炭酸セシウム(150mg,0.45mmol)、および1−メチルピペラジン(0.334mmol)を反応物に添加した。混合物を90℃に4時間加熱した後、室温にまで冷却し、ケイソウ土のパッドにより濾過した。濾液を真空濃縮すると粗生成物が得られ、これを12gのシリカ上でEtOAc/MeOH(4:1)を溶離剤として用いて精製して、0.033g(32%)の表題化合物を黄色固体として得た。m/z 468。
【0238】
方法48〜83
下記の中間体を方法47の処理に従って適切な出発物質を用いて製造した。ある中間体は、ナトリウムtert−ブトキシドを炭酸ナトリウムの代わりに用いて、または2−ジシクロヘキシルホスフィノ−2’,4’,6’−トリ−イソプロピル−1,1’−ビフェニル(XPHOS)をBINAPの代わりに用いて製造された。
【0239】
【表15−1】

【0240】
【表15−2】

【0241】
【表15−3】

【0242】
【表15−4】

【0243】
【表15−5】

【0244】
【表15−6】

【0245】
【表15−7】

【0246】
【表15−8】

【0247】
方法84 4−[(2−フルオロ−4−メチルフェニル)アミノ]−7−メトキシ−6−ピリジン−4−イルシンノリン−3−カルボニトリル
6−ブロモ−4−(2−フルオロ−4−メチルフェニルアミノ)−7−メトキシシンノリン−3−カルボニトリル(方法38,0.25g,0.65mmol)、ピリジン−4−イルボロン酸(0.159g,1.29mmol)およびK2CO33(0.357g,2.58mmol)のDMA(3.0ml)および水(0.30ml)中における混合物に、Pd(Ph3P)4(0.224g,0.19mmol)を添加した。反応物をアルゴン下に90℃で12時間撹拌し、冷却し、水(50mL)で希釈し、EtOAc(2×50mL)で抽出した。有機抽出液を合わせて乾燥させ(MgSO4)、濾過し、残留物をシリカクロマトグラフィー(EtOAc)により精製して、0.175g(64%)の生成物を得た。m/z 386。
【0248】
方法85
下記の中間体を方法84の処理に従って適切な出発物質を用いて製造した。
【0249】
【表16】

【0250】
方法86 4−[(2−フルオロ−4−メチルフェニル)アミノ]−6−(1−イソプロピル−1,2,3,6−テトラヒドロピリジン−4−イル)−7−メトキシシンノリン−3−カルボニトリル
4−(2−フルオロ−4−メチルフェニルアミノ)−7−メトキシ−6−(l,2,3,6−テトラヒドロピリジン−4−イル)シンノリン−3−カルボニトリル(方法88,200mg,0.51mmol)のジクロロエタン(5mL)、アセトン(0.566mL,7.70mmol)、および酢酸(0.147mL,2.57mmol)中における溶液に、ナトリウムトリアセトキシボロヒドリド(544mg,2.57mmol)を添加し、反応物を55℃で6時間撹拌した。反応混合物を減圧濃縮し、残留物をシリカクロマトグラフィー(MeOH/EtOAc(1:1))により精製して、120mg(50%)の生成物を得た。m/z 432。
【0251】
方法87
下記の中間体を方法86の処理に従って適切な出発物質を用いて製造した。
【0252】
【表17】

【0253】
方法88 4−[(2−フルオロ−4−メチルフェニル)アミノ]−7−メトキシ−6−(l,2,3,6−テトラヒドロピリジン−4−イル)シンノリン−3−カルボニトリル
4−(3−シアノ−4−(2−フルオロ−4−メチルフェニルアミノ)−7−メトキシシンノリン−6−イル)−5,6−ジヒドロピリジン−1(2H)−カルボン酸tert−ブチル(方法85,600mg,1.23mmol)のCH2Cl2(4.9mL)およびトリフルオロ酢酸(4.9mL,63.6mmol)中における溶液を、2時間撹拌した。反応混合物を減圧濃縮し、クロロホルムと共沸させてトリフルオロ酢酸を除去し、残留物を逆相HPLC(MeCN/水)により精製して、302mg(63%)の生成物を得た。m/z 390。
【0254】
方法89 1−(2−{[tert−ブチル(ジメチル)シリル]オキシ}エチル)ピペラジン
4−(2−(tert−ブチルジメチルシリルオキシ)エチル)ピペラジン−1−カルボン酸ベンジル(方法90,2.1g,5.55mmol)およびPd/C(0.059g,0.55mmol)のメタノール(30mL)中における混合物を、H2(g)下で24時間撹拌した。反応混合物をセライトのパッドにより濾過し、減圧濃縮して、1.20g(88%)の黄色の油を得た。
【0255】
【化40】

【0256】
方法90 4−(2−{[tert−ブチル(ジメチル)シリル]オキシ}エチル)ピペラジン−1−カルボン酸ベンジル
1−ピペラジンカルボン酸ベンジル(1.751mL,9.08mmol)および2−(tert−ブチルジメチルシリルオキシ)アセトアルデヒド(1.209mL,9.99mmol)のMeOH(5mL)およびジクロロエタン(5mL)中における混合物を、4Åのモレキュラーシーブと共に20分間撹拌した。この混合物を、ナトリウムトリアセトキシボロヒドリド(4.81g,22.70mmol)のテトラヒドロフラン(5mL)中における溶液に添加し、一夜撹拌した。反応混合物を炭酸水素ナトリウム(100mL)に添加し、CH2Cl2(3×50mL)で抽出した。有機抽出液を合わせて減圧濃縮し、残留物をシリカクロマトグラフィー(EtOAc/MeOH)により精製して、2.10g(61%)の透明な油を得た。
【0257】
【化41】

【0258】
実施例55 4−[(2−フルオロ−4−メチルフェニル)アミノ]−7−(4−メチルピペラジン−1−イル)シンノリン−3−カルボキサミド
4−(2−フルオロ−4−メチルフェニルアミノ)−7−(4−メチルピペラジン−1−イル)シンノリン−3−カルボニトリル(方法96,180mg,0.48mmol)のtert−BuOH(4.80ml)中における懸濁液に、粉末状水酸化カリウム(2.154g,38.4mmol)を添加し、反応混合物を100℃で1時間撹拌した。反応混合物を冷却し、減圧濃縮した。水を添加し、混合物をDCM/10%MeOHで抽出した。有機層を乾燥させ(Na2SO4)、濾過し、濃縮し、残留物をシリカクロマトグラフィー(DCM−DCM/10% MeOH/1% NH4OH)により精製して、141mg(74%)の黄色固体を得た。
【0259】
【化42】

【0260】
実施例56〜63
下記の実施例は、実施例55の処理に従って適切な出発物質を用いて製造され、シリカゲルクロマトグラフィーまたは半調製用逆相HPLCにより精製された。
【0261】
【表18−1】

【0262】
【表18−2】

【0263】
【表18−3】

【0264】
実施例64 7−ブロモ−4−[(2−フルオロ−4−メチルフェニル)アミノ]シンノリン−3−カルボキサミド
7−ブロモ−4−クロロシンノリン−3−カルボキサミド(方法94,1.3g,4.54mmol)のエタノール(11.3mL)中における懸濁液に、2−フルオロ−4−メチルアニリン(0.77ml,6.81mmol)および酢酸(0.026mL,0.45mmol)を添加し、反応混合物を80℃で2時間撹拌した。冷却後、反応混合物を濾過し、残留物をエタノールで洗浄し、次いで乾燥させて、1.39g(82%)の褐色固体を得た。
【0265】
【化43】

【0266】
実施例65 4−[(2−フルオロ−4−メチルフェニル)アミノ]−7−メトキシ−6−{4−[2−(メチルスルホニル)エチル]ピペラジン−1−イル}シンノリン−3−カルボキサミド
4−(2−フルオロ−4−メチルフェニルアミノ)−7−メトキシ−6−(ピペラジン−1−イル)シンノリン−3−カルボキサミド(実施例46,0.1g,0.24mmol)のDCM(10mL)中における溶液に、−78℃で1−ブロモ−2−(メチルスルホニル)エタン(0.046g,0.24mmol)を添加した。反応物を室温で20時間撹拌し、N,N−ジイソプロピルエチルアミン(0.042mL,0.24mmol)を添加し、反応物をさらに48時間撹拌した。水(30mL)を添加し、混合物をDCMで抽出した。有機抽出液を濃縮し、残留物をシリカクロマトグラフィー(MeOH/DCM 0−5%)により精製した。クロマトグラフィーから得られた物質をアセトニトリル中で摩砕処理し、濾過して33mg(27%)の固体を得た。
【0267】
【化44】

【0268】
実施例66 4−[(2−フルオロ−4−メチルフェニル)アミノ]−6−{4−[2−ヒドロキシ−1−(ヒドロキシメチル)エチル]ピペラジン−1−イル}−7−メトキシシンノリン−3−カルボキサミド
4−(2−フルオロ−4−メチルフェニルアミノ)−7−メトキシ−6−(ピペラジン−1−イル)シンノリン−3−カルボキサミド(実施例46,0.3g,0.73mmol)のメタノール(15mL)中における溶液に、l,3−ジヒドロキシプロパン−2−オン二量体(0.263g,1.46mmol)、酢酸(1.55mL,27.0mmol)およびナトリウムシアノボロヒドリド(0.092g,1.46mmol)を添加した。48時間撹拌した後、反応混合物を濃縮し、シリカクロマトグラフィー(DCM中の7% MeOH(1% NH4OH))により精製して、56mg(16%)の黄色固体を得た。
【0269】
【化45】

【0270】
実施例67 6−{4−[(2S)−2,3−ジヒドロキシプロピル]ピペラジン−1−イル}−4−[(2−フルオロ−4−メチルフェニル)アミノ]−7−メトキシシンノリン−3−カルボキサミド
4−(2−フルオロ−4−メチルフェニルアミノ)−7−メトキシ−6−(ピペラジン−1−イル)シンノリン−3−カルボキサミド(実施例46,0.12g,0.29mmol)のエタノール(4mL)中における懸濁液に、(R)−オキシラン−2−イルメタノール(0.024g,0.32mmol)を添加した。70℃で4時間撹拌した後、溶媒を減圧下で除去し、残留物をシリカクロマトグラフィー(DCM中の10% MeOH(1% NH4OH))により精製して、54mg(38%)の固体を得た。
【0271】
【化46】

【0272】
下記の実施例を、実施例67で用いたものと同様な処理により、実施例46、(S)−オキシラン−2−イルメタノールから製造した:
実施例68 6−{4−[(2R)−2,3−ジヒドロキシプロピル]ピペラジン−1−イル}−4−[(2−フルオロ−4−メチルフェニル)アミノ]−7−メトキシシンノリン−3−カルボキサミド
【0273】
【化47】

【0274】
実施例69 4−[(2−フルオロ−4−メチルフェニル)アミノ]−6−[4−(2−ヒドロキシ−2−メチルプロパノイル)ピペラジン−1−イル]−7−メトキシシンノリン−3−カルボキサミド
4−(2−フルオロ−4−メチルフェニルアミノ)−7−メトキシ−6−(ピペラジン−1−イル)シンノリン−3−カルボキサミド(実施例46,0.23g,0.56mmol)、N,N−ジイソプロピルエチルアミン(0.146mL,0.84mmol)および2−クロロ−1,1−ジメチル−2−オキソエチルアセテート(0.092g,0.56mmol)のDMF(3mL)中における溶液を、30分間撹拌した。溶媒を減圧下で除去し、DCM(10ml)を添加し、混合物を飽和NaHCO3溶液で洗浄した。有機層を乾燥させ(Na2SO4)、濾過し、濃縮すると、0.29gの2−(4−{3−カルバモイル−4−[(2−フルオロ−4−メチルフェニル)アミノ]−7−メトキシシンノリン−6−イル}ピペラジン−1−イル)−1,1−ジメチル−2−オキソエチルアセテートがガムとして得られ、これをさらに精製せずに使用した。m/z 540。
【0275】
2−(4−{3−カルバモイル−4−[(2−フルオロ−4−メチルフェニル)アミノ]−7−メトキシシンノリン−6−イル}ピペラジン−1−イル)−1,1−ジメチル−2−オキソエチルアセテート(0.29g,0.54mmol)のメタノール(4mL)中における溶液に、水酸化リチウム(0.026g,1.08mmol)を添加した。1.5時間撹拌した後、溶媒を減圧下で除去し、残留物をシリカクロマトグラフィー(DCM中の6% MeOH(1% NH4OH))により精製して、107mg(40%)の固体を得た。
【0276】
【化48】

【0277】
下記の実施例を、実施例69で用いたものと同様な処理により、実施例51および(1S)−2−クロロ−1−メチル−2−オキソエチルアセテートから出発して製造した:
実施例70 4−[(2−フルオロ−4−メチルフェニル)アミノ]−6−{1−[(2S)−2−ヒドロキシプロパノイル]ピペリジン−4−イル}−7−メトキシシンノリン−3−カルボキサミド
【0278】
【化49】

【0279】
実施例71 6−[1−(2,2−ジフルオロエチル)ピペリジン−4−イル]−4−[(2−フルオロ−4−メチルフェニル)アミノ]−7−メトキシシンノリン−3−カルボキサミド
4−(2−フルオロ−4−メチルフェニルアミノ)−7−メトキシ−6−(ピペリジン−4−イル)シンノリン−3−カルボキサミド(実施例51,0.12g,0.29mmol)のDCM(2mL)中における懸濁液に、N,N−ジイソプロピルエチルアミン(0.152ml,0.88mmol)、および2,2−ジフルオロエチル トリフルオロメタンスルホネート(0.075g,0.35mmol)のDCM(1mL)中における溶液を添加した。反応混合物を40℃で1時間撹拌し、冷却し、減圧濃縮した。残留物をシリカクロマトグラフィー(DCM−DCM/10% MeOH(1% NH4OH))により精製し、さらに逆相HPLC(0.1% NH4OH,アセトニトリル/水中)により精製して、0.021g(15%)の灰白色固体を得た。
【0280】
【化50】

【0281】
実施例72 6−[(3R,5S)−4−アセチル−3,5−ジメチルピペラジン−1−イル]−4−[(2−フルオロ−4−メチルフェニル)アミノ]−7−メトキシシンノリン−3−カルボキサミド
6−((3R,5S)−3,5−ジメチルピペラジン−1−イル)−4−(2−フルオロ−4−メチルフェニルアミノ)−7−メトキシシンノリン−3−カルボキサミド(実施例36,171mg,0.39mmol)のDMF(5.5mL)中における溶液に、無水酢酸(0.037mL,0.39mmol)およびトリエチルアミン(0.163mL,1.17mmol)を添加した。反応混合物を72時間撹拌し、濾過して若干の沈殿を分離した。濾液を濃縮し、残留物をシリカクロマトグラフィー(DCM−DCM/5% MeOH)により精製して、98mg(52%)の橙色固体を得た。
【0282】
【化51】

【0283】
実施例73 4−[(2−フルオロ−4−メチルフェニル)アミノ]−7−メトキシ−6−(モルホリン−4−イルメチル)シンノリン−3−カルボキサミド
カリウム4−トリフルオロボラトメチル−モルホリン(方法106,80mg,0.39mmol)、CS2CO3(362mg,1.11mmol)および6−ブロモ−4−(2−フルオロ−4−メチルフェニルアミノ)−7−メトキシシンノリン−3−カルボキサミド塩酸塩(実施例54,150mg,0.34mmol)のジオキサン(6mL)および水(1mL)中における混合物に、Pd(OAc)2(2.5mg,0.01mmol)および2−ジシクロヘキシルホスフィノ−2’,4’,6’−トリイソプロピルビフェニル(10.59mg,0.02mmol)を添加した。反応混合物をN2下に80℃で48時間撹拌した。混合物を水(50mL)に添加し、DCM(3×100mL)で抽出した。有機抽出液を合わせて乾燥させ(Na2SO4)、濾過し、濃縮し、残留物をシリカクロマトグラフィー(DCM中の0−20% MeOH)により精製して、33mg(21%)の黄色固体を得た。
【0284】
【化52】

【0285】
出発物質の製造
方法91 2−[(3−ブロモフェニル)ジアゼニル]−2−シアノアセトアミド
3−ブロモアニリン(6.33mL,58.1mmol)および濃HCl(14.5mL,174mmol)の懸濁液に、0℃で、亜硝酸ナトリウム(3.75mL,58.1mmol)の水(13mL)中における溶液を添加した。15分後、シアノアセトアミド(4.89g,58.1mmol)および酢酸ナトリウム(19.1g,232mmol)の水(85mL)およびエタノール(60mL)中における溶液を、反応混合物に滴加した。反応混合物を室温にまで高め、16時間撹拌した。沈殿を濾過し、水、エタノールおよびジエチルエーテルで洗浄し、次いで真空オーブン内で乾燥させて、4.52g(29%)の黄色固体を得た。m/z 269。
【0286】
方法92 4−アミノ−7−ブロモシンノリン−3−カルボキサミド
塩化アルミニウム(3.60ml,65.9mmol)を、2−[(3−ブロモフェニル)ジアゼニル]−2−シアノアセトアミド(方法91,4.4g,16.47mmol)のトルエン(41.2mL)中における懸濁液に添加し、反応混合物を110℃で16時間撹拌した。反応混合物を冷却し、40mLのHCl水溶液(2M)を滴加し、反応混合物を100℃で2時間撹拌した。反応混合物を冷却し、濾過し、残留物をエタノールおよび水で洗浄し、次いで真空オーブン内で乾燥させて、2.71g(62%)の褐色固体を得た。m/z 269。
【0287】
方法93 7−ブロモ−4−ヒドロキシシンノリン−3−カルボン酸
4−アミノ−7−ブロモシンノリン−3−カルボキサミド(方法92,2.4g,8.99mmol)のジオキサン(22.5mL)中における懸濁液に、水酸化カリウム(9.07g,161.7mmol)の水(36mL)中における溶液を添加した。反応混合物を110℃で16時間撹拌し、冷却し、酢酸を添加した。混合物を濾過し、残留物を水で洗浄し、次いで真空オーブン内で乾燥させて、2.10g(87%)の淡褐色固体を得た。m/z 271。
【0288】
方法94 7−ブロモ−4−クロロシンノリン−3−カルボキサミド
塩化チオニル(46.4mL,635mmol)中の7−ブロモ−4−ヒドロキシシンノリン−3−カルボン酸(方法93,1.90g,7.06mmol)を、80℃で16時間撹拌した。反応混合物を冷却し、減圧濃縮した。残留物をアセトン(20mL)に懸濁し、0℃に冷却し、水酸化アンモニウム(2.75mL,70.62mmol)を滴加した。0℃で30分間撹拌した後、混合物を室温にまで高め、濾過し、残留物を水で洗浄し、次いで真空オーブン内で乾燥させて、1.31g(65%)の褐色固体を得た。
【0289】
【化53】

【0290】
方法95 7−ブロモ−4−[(2−フルオロ−4−メチルフェニル)アミノ]シンノリン−3−カルボニトリル
オキシ塩化リン(0.97mL,10.39mmol)を、7−ブロモ−4−(2−フルオロ−4−メチルフェニルアミノ)シンノリン−3−カルボキサミド(実施例64,1.3g,3.46mmol)のDCM(35mL)中における懸濁液に添加し、反応混合物を45℃で1時間撹拌した。トリエチルアミン(4.8mL,34.6mmol)を反応混合物に滴加した。2時間撹拌した後、反応混合物を冷却し、DCMで希釈し、飽和NaHCO3で洗浄した。有機層を乾燥させ、減圧濃縮し、残留物をシリカクロマトグラフィー(DCM)により精製して、0.752g(61%)の褐色固体を得た。
【0291】
【化54】

【0292】
方法96〜104
下記の中間体は、実施例47〜83に用いたものと同様な処理により、適切な出発物質から製造された。
【0293】
【表19−1】

【0294】
【表19−2】

【0295】
方法105 4−[(2−フルオロ−4−メチルフェニル)アミノ]−7−[4−(2−ヒドロキシエチル)ピペラジン−1−イル]シンノリン−3−カルボニトリル
4−(2−フルオロ−4−メチルフェニルアミノ)−7−(ピペラジン−1−イル)シンノリン−3−カルボニトリル(方法98,0.53g,1.46mmol)、酢酸(0.067ml,1.17mmol)、(tert−ブチルジメチルシリルオキシ)アセトアルデヒド(0.334ml,1.75mmol)およびナトリウムシアノボロヒドリド(0.184g,2.92mmol)のメタノール(14.6mL)中における混合物を、16時間撹拌した。HCl(酢酸中1.0M,7.3ml,7.3mmol)を添加し、4時間撹拌した後、反応混合物を濃縮し、残留物をシリカクロマトグラフィー(DCM−DCM/MeOH/NH4OH(10/1/0.1))により精製して、370mg(62%)の黄色固体を得た。m/z 407。
【0296】
方法106 カリウム4−トリフルオロボラトメチル−モルホリン
アセトン(10.00mL)中の2−(ブロモメチル)−4,4,5,5−テトラメチル−1,3,2−ジオキサボロラン(1.9g,8.60mmol)を0℃に冷却し、フッ化水素カリウム(1.679g,21.50mmol)を添加し、続いて水(10mL)を滴加した。反応混合物を室温にまで高め、30分間撹拌し、溶媒を減圧下で除去した。残留物をアセトンに溶解し、ジエチルエーテルを添加し、沈殿を濾過して、1.60g(93%)のカリウムブロモメチルトリフルオロボレートを白色固体として得た。
【0297】
カリウムブロモメチルトリフルオロボレート(650mg,3.24mmol)およびモルホリン(2ml,22.96mmol)を80℃に30分間加熱した。混合物を室温にまで冷却し、濃縮し、残留物をアセトン(5mL)に溶解した。炭酸水素カリウム(324mg,3.24mmol)を添加し、得られた混合物を20分間撹拌した。混合物を濾過し、濃縮し、残留物をアセトンに溶解した。ジエチルエーテルを添加し、沈殿を濾過して、140mg(21%)の黄色ガムを得た。
【0298】
【化55】

【0299】
方法107 1−(2−{[tert−ブチル(ジメチル)シリル]オキシ}エチル)−1,4−ジアゼパン
4Åのモレキュラーシーブを、1−ホモピペラジンカルボン酸ベンジル(1.06mL,5.12mmol)、2−(tert−ブチルジメチルシリルオキシ)アセトアルデヒド(0.744mL,6.15mmol)、メタノール(5mL)、およびDCM(5mL)の混合物に添加した。20分間撹拌した後、混合物をナトリウムトリアセトキシボロヒドリド(2.71g,12.80mmol)のテトラヒドロフラン(10mL)中における溶液に添加し、1時間撹拌した。反応混合物を飽和NaHCO3溶液(100mL)に添加し、DCMで抽出した。有機抽出液を合わせてシリカ上へ減圧濃縮し、シリカクロマトグラフィー(EtOAcの0−20% MeOH)により精製して、1.02g(51%)の4−(2−(tert−ブチルジメチルシリルオキシ)エチル)−1,4−ジアゼパン−1−カルボン酸ベンジルを透明な油として得た。m/z 393。
【0300】
4−(2−(tert−ブチルジメチルシリルオキシ)エチル)−1,4−ジアゼパン−1−カルボン酸ベンジル(1.02g,2.60mmol)およびカーボン上パラジウム(0.083g,0.78mmol)のメタノール(10mL)中における混合物を、水素ガス下で20時間撹拌した。反応混合物を濾過し、減圧濃縮して、0.66g(98%)の無色の油を得た。
【0301】
【化56】

【0302】
方法108 (3R,5S)−3,5−ジメチルピペラジン−1−カルボン酸ベンジル
(2R,6S)−2,6−ジメチルピペラジン(8.0g,70.1mmol)のDCM(70mL)中における溶液に、トリエチルアミン(9.78mL,70.1mmol)を添加した。反応混合物を0℃に冷却し、クロロ炭酸ベンジル(9.86mL,70.1mmol)を添加した。0℃で1時間撹拌した後、反応物を室温にまで高めた。反応混合物をブラインで洗浄し、乾燥させ(Na2SO4)、濃縮し、残留物をシリカクロマトグラフィー(ヘキサン:EtOAc 1:1−EtOAc−EtOAc:MeOH 10:1)により精製して、13.48g(77%)の無色の油を得た。
【0303】
方法109 (3R,5S)−4−(2−(tert−ブチルジメチルシリルオキシ)エチル)−3,5−ジメチルピペラジン−1−カルボン酸ベンジル
(3R,5S)−3,5−ジメチルピペラジン−1−カルボン酸ベンジル(方法108,5.0g,20.1mmol)のDMA(25mL)中における溶液に、ヨウ化テトラブチルアンモニウム(7.44g,20.1mmol)、炭酸カリウム(5.57g,40.3mmol)および(2−ブロモエトキシ)(tert−ブチル)ジメチルシラン(8.67g,36.2mmol)を添加した。反応混合物を120℃で20時間撹拌し、次いで濃縮した。DCM(50mL)を添加し、有機層をH2Oで洗浄し、乾燥させ(Na2SO4)、濃縮し、シリカクロマトグラフィーにより精製して、7.2g(88%)の褐色の油を得た。
【0304】
方法110 (2R,6S)−1−(2−{[tert−ブチル(ジメチル)シリル]オキシ}エチル)−2,6−ジメチルピペラジン
(3R,5S)−4−(2−(tert−ブチルジメチルシリルオキシ)エチル)−3,5−ジメチルピペラジン−1−カルボン酸ベンジル(方法109,7.6g,18.7mmol)のメタノール(30mL)中における混合物、およびカーボン上パラジウム(l00mg)を、水素ガス下で16時間撹拌した。反応混合物をセライトにより濾過し、減圧濃縮し、残留物をシリカクロマトグラフィー(EtOAc、次いでEtOAc/MeOH/Et3N 10/1/0.1、次いでDCM/MeOH/Et3N 10/1/0.1)により精製して、4.0g(79%)の無色の油を得た。
【0305】
【化57】

【特許請求の範囲】
【請求項1】
下記の群から選択される化合物またはその医薬的に許容できる塩:
6−[(3R,5S)−4−アセチル−3,5−ジメチルピペラジン−1−イル]−4−[(2−フルオロ−4−メチルフェニル)アミノ]−7−メトキシシンノリン−3−カルボキサミド;
4−[(2−フルオロ−4−メチルフェニル)アミノ]−7−メトキシ−6−(4−メトキシピペリジン−1−イル)シンノリン−3−カルボキサミド;
4−[(2−フルオロ−4−メチルフェニル)アミノ]−7−メトキシ−6−[4−(2−メトキシエトキシ)ピペリジン−1−イル]シンノリン−3−カルボキサミド;
4−[(2−フルオロ−4−メチルフェニル)アミノ]−7−メトキシ−6−[4−(メチルスルホニル)ピペラジン−1−イル]シンノリン−3−カルボキサミド;
4−[(2−フルオロ−4−メチルフェニル)アミノ]−6−[(3R,5S)−4−(2−ヒドロキシエチル)−3,5−ジメチルピペラジン−1−イル]−7−メトキシシンノリン−3−カルボキサミド;
6−{4−[(2R)−2,3−ジヒドロキシプロピル]ピペラジン−1−イル}−4−[(2−フルオロ−4−メチルフェニル)アミノ]−7−メトキシシンノリン−3−カルボキサミド;
4−[(2−フルオロ−4−メチルフェニル)アミノ]−6−[4−(2−ヒドロキシエチル)−1,4−ジアゼパン−1−イル]−7−メトキシシンノリン−3−カルボキサミド;
6−{4−[(2S)−2,3−ジヒドロキシプロピル]ピペラジン−1−イル}−4−[(2−フルオロ−4−メチルフェニル)アミノ]−7−メトキシシンノリン−3−カルボキサミド;
4−[(2−フルオロ−4−メチルフェニル)アミノ]−6−[4−(2−ヒドロキシ−2−メチルプロパノイル)ピペラジン−1−イル]−7−メトキシシンノリン−3−カルボキサミド;
6−(l,1−ジオキシドチオモルホリン−4−イル)−4−[(2−フルオロ−4−メチルフェニル)アミノ]−7−メトキシシンノリン−3−カルボキサミド;
4−[(2−フルオロ−4−メチルフェニル)アミノ]−6−{4−[2−ヒドロキシ−1−(ヒドロキシメチル)エチル]ピペラジン−1−イル}−7−メトキシシンノリン−3−カルボキサミド;
7−ブロモ−4−[(2−フルオロ−4−メチルフェニル)アミノ]シンノリン−3−カルボキサミド;
4−[(2−フルオロ−4−メチルフェニル)アミノ]−6−{1−[(2S)−2−ヒドロキシプロパノイル]ピペリジン−4−イル}−7−メトキシシンノリン−3−カルボキサミド;
4−[(2−フルオロ−4−メチルフェニル)アミノ]−7−メトキシ−6−(モルホリン−4−イルメチル)シンノリン−3−カルボキサミド;
6−[1−(2,2−ジフルオロエチル)ピペリジン−4−イル]−4−[(2−フルオロ−4−メチルフェニル)アミノ]−7−メトキシシンノリン−3−カルボキサミド;
4−[(2−フルオロ−4−メチルフェニル)アミノ]−7−(4−メチルピペラジン−1−イル)シンノリン−3−カルボキサミド;
4−[(2−フルオロ−4−メチルフェニル)アミノ]−7−[4−(メチルスルホニル)ピペラジン−1−イル]シンノリン−3−カルボキサミド;
4−[(2−フルオロ−4−メチルフェニル)アミノ]−7−[4−(2−ヒドロキシエチル)ピペラジン−1−イル]シンノリン−3−カルボキサミド;および
4−[(2−フルオロ−4−メチルフェニル)アミノ]−7−メトキシ−6−{4−[2−(メチルスルホニル)エチル]ピペラジン−1−イル}シンノリン−3−カルボキサミド。
【請求項2】
式(IC)の化合物またはその医薬的に許容できる塩:
【化1】

[式中、
−−−は、単結合および二重結合から選択され;−−−が単結合である場合、XはCR24およびNから選択され;−−−が二重結合である場合、XはCであり;
Yは、OおよびSから選択され;
Aは、SO2、NR25およびCR28R29から選択され;
pは、0、1および2から選択され;
R23は、C1−6アルキルであり;
R24、R26、R27、R28は、それぞれ独立して水素およびC1−6アルキルから選択され;
R25は、C1−6アルキルスルホニルであり;
R29は、場合により1個以上のR30により置換されたC1−6アルコキシであり;
R30は、ハロ、ニトロ、シアノ、ヒドロキシ、トリフルオロメトキシ、トリフルオロメチル、アミノ、カルボキシ、カルバモイル、メルカプト、スルファモイル、C1−6アルキル、C2−6アルケニル、C2−6アルキニル、メトキシ、エトキシ、アセチル、アセトキシ、メチルアミノ、エチルアミノ、ジメチルアミノ、ジエチルアミノ、N−メチル−N−エチルアミノ、アセチルアミノ、N−メチルカルバモイル、N−エチルカルバモイル、N,N−ジメチルカルバモイル、N,N−ジエチルカルバモイル、N−メチル−N−エチルカルバモイル、フェニル、メチルチオ、エチルチオ、メチルスルフィニル、エチルスルフィニル、メシル、エチルスルホニル、メトキシカルボニル、エトキシカルボニル、N−メチルスルファモイル、N−エチルスルファモイル、N,N−ジメチルスルファモイル、N,N−ジエチルスルファモイル、およびN−メチル−N−エチルスルファモイルから選択され;
R31は、水素およびC1−4アルキルから選択され;
R32は、水素、ハロおよびC1−4アルキルから選択され;
R33は、水素およびハロから選択され;
R34は、ハロから選択される]。
【請求項3】
式(IF)の化合物またはその医薬的に許容できる塩:
【化2】

[式中、
−−−は、単結合および二重結合から選択され;−−−が単結合である場合、XはCR24およびNから選択され;−−−が二重結合である場合、XはCであり;
Aは、NR25およびCR28R29から選択され;
pは、0〜2であり;
R24、R26、R27、R28は、それぞれ独立して水素およびC1−6アルキルから選択され;
R25は、水素、C1−6アルキル、C1−6アルキルスルホニル、およびC1−6アルカノイルから選択され、その際、C1−6アルキルおよびC1−6アルカノイルは、場合により炭素において1個以上のR30により置換されており;
R29は、水素、アミノ、および場合により炭素において1個以上のR30により置換されたC1−6アルコキシから選択され;
R30は、ハロ、ニトロ、シアノ、ヒドロキシ、トリフルオロメトキシ、トリフルオロメチル、アミノ、カルボキシ、カルバモイル、メルカプト、スルファモイル、C1−6アルキル、C2−6アルケニル、C2−6アルキニル、メトキシ、エトキシ、アセチル、アセトキシ、メチルアミノ、エチルアミノ、ジメチルアミノ、ジエチルアミノ、N−メチル−N−エチルアミノ、アセチルアミノ、N−メチルカルバモイル、N−エチルカルバモイル、N,N−ジメチルカルバモイル、N,N−ジエチルカルバモイル、N−メチル−N−エチルカルバモイル、フェニル、メチルチオ、エチルチオ、メチルスルフィニル、エチルスルフィニル、メシル、エチルスルホニル、メトキシカルボニル、エトキシカルボニル、N−メチルスルファモイル、N−エチルスルファモイル、N,N−ジメチルスルファモイル、N,N−ジエチルスルファモイル、およびN−メチル−N−エチルスルファモイルから選択され;
R31は、水素およびC1−4アルキルから選択され;
R32は、水素、ハロおよびC1−4アルキルから選択され;
R33は、水素およびハロから選択され;
R34は、ハロから選択される]。
【請求項4】
請求項1〜3のいずれかに記載の化合物またはその医薬的に許容できる塩と、医薬的に許容できる希釈剤またはキャリヤーと、を含む医薬組成物。
【請求項5】
癌のリスクがある対象、癌を伴うと診断された対象、または癌の症状を示す対象を提供し、その対象に請求項1〜3のいずれかに記載の化合物を含む医薬組成物を投与することを含む、癌を処置する方法。
【請求項6】
CSF−1Rキナーゼおよび請求項1〜3のいずれかに記載の化合物またはその医薬的に許容できる塩を提供し、CSF−1Rキナーゼが阻害される条件下で混合することを含む、CSF−1Rキナーゼを阻害する方法。
【請求項7】
医薬として使用するための、請求項1〜3のいずれかに記載の化合物またはその医薬的に許容できる塩。
【請求項8】
温血動物においてCSF−1Rキナーゼ阻害作用を発生させる際に使用するための医薬の製造における、請求項1〜3のいずれか1項に記載の化合物またはその医薬的に許容できる塩の使用。
【請求項9】
請求項1〜3のいずれか1項に記載の化合物を製造する方法であって、式(IXa)または(IXb)の化合物:
【化3】

[式中、Lは置換可能な基である]を式(Xa)または(Xb)の化合物:
【化4】

と反応させ、その後、必要であれば、
i)式(I)の化合物を式(I)の他の化合物に変換し;
ii)いずれかの保護基を除去し;
iii)医薬的に許容できる塩を形成すること;
を含む上記方法。
【請求項10】
Lがクロロ、ブロモ、トシルおよびトリフルオロメチルスルホニルオキシから選択される、請求項9に記載の方法。
【請求項1】
下記の群から選択される化合物またはその医薬的に許容できる塩:
6−[(3R,5S)−4−アセチル−3,5−ジメチルピペラジン−1−イル]−4−[(2−フルオロ−4−メチルフェニル)アミノ]−7−メトキシシンノリン−3−カルボキサミド;
4−[(2−フルオロ−4−メチルフェニル)アミノ]−7−メトキシ−6−(4−メトキシピペリジン−1−イル)シンノリン−3−カルボキサミド;
4−[(2−フルオロ−4−メチルフェニル)アミノ]−7−メトキシ−6−[4−(2−メトキシエトキシ)ピペリジン−1−イル]シンノリン−3−カルボキサミド;
4−[(2−フルオロ−4−メチルフェニル)アミノ]−7−メトキシ−6−[4−(メチルスルホニル)ピペラジン−1−イル]シンノリン−3−カルボキサミド;
4−[(2−フルオロ−4−メチルフェニル)アミノ]−6−[(3R,5S)−4−(2−ヒドロキシエチル)−3,5−ジメチルピペラジン−1−イル]−7−メトキシシンノリン−3−カルボキサミド;
6−{4−[(2R)−2,3−ジヒドロキシプロピル]ピペラジン−1−イル}−4−[(2−フルオロ−4−メチルフェニル)アミノ]−7−メトキシシンノリン−3−カルボキサミド;
4−[(2−フルオロ−4−メチルフェニル)アミノ]−6−[4−(2−ヒドロキシエチル)−1,4−ジアゼパン−1−イル]−7−メトキシシンノリン−3−カルボキサミド;
6−{4−[(2S)−2,3−ジヒドロキシプロピル]ピペラジン−1−イル}−4−[(2−フルオロ−4−メチルフェニル)アミノ]−7−メトキシシンノリン−3−カルボキサミド;
4−[(2−フルオロ−4−メチルフェニル)アミノ]−6−[4−(2−ヒドロキシ−2−メチルプロパノイル)ピペラジン−1−イル]−7−メトキシシンノリン−3−カルボキサミド;
6−(l,1−ジオキシドチオモルホリン−4−イル)−4−[(2−フルオロ−4−メチルフェニル)アミノ]−7−メトキシシンノリン−3−カルボキサミド;
4−[(2−フルオロ−4−メチルフェニル)アミノ]−6−{4−[2−ヒドロキシ−1−(ヒドロキシメチル)エチル]ピペラジン−1−イル}−7−メトキシシンノリン−3−カルボキサミド;
7−ブロモ−4−[(2−フルオロ−4−メチルフェニル)アミノ]シンノリン−3−カルボキサミド;
4−[(2−フルオロ−4−メチルフェニル)アミノ]−6−{1−[(2S)−2−ヒドロキシプロパノイル]ピペリジン−4−イル}−7−メトキシシンノリン−3−カルボキサミド;
4−[(2−フルオロ−4−メチルフェニル)アミノ]−7−メトキシ−6−(モルホリン−4−イルメチル)シンノリン−3−カルボキサミド;
6−[1−(2,2−ジフルオロエチル)ピペリジン−4−イル]−4−[(2−フルオロ−4−メチルフェニル)アミノ]−7−メトキシシンノリン−3−カルボキサミド;
4−[(2−フルオロ−4−メチルフェニル)アミノ]−7−(4−メチルピペラジン−1−イル)シンノリン−3−カルボキサミド;
4−[(2−フルオロ−4−メチルフェニル)アミノ]−7−[4−(メチルスルホニル)ピペラジン−1−イル]シンノリン−3−カルボキサミド;
4−[(2−フルオロ−4−メチルフェニル)アミノ]−7−[4−(2−ヒドロキシエチル)ピペラジン−1−イル]シンノリン−3−カルボキサミド;および
4−[(2−フルオロ−4−メチルフェニル)アミノ]−7−メトキシ−6−{4−[2−(メチルスルホニル)エチル]ピペラジン−1−イル}シンノリン−3−カルボキサミド。
【請求項2】
式(IC)の化合物またはその医薬的に許容できる塩:
【化1】

[式中、
−−−は、単結合および二重結合から選択され;−−−が単結合である場合、XはCR24およびNから選択され;−−−が二重結合である場合、XはCであり;
Yは、OおよびSから選択され;
Aは、SO2、NR25およびCR28R29から選択され;
pは、0、1および2から選択され;
R23は、C1−6アルキルであり;
R24、R26、R27、R28は、それぞれ独立して水素およびC1−6アルキルから選択され;
R25は、C1−6アルキルスルホニルであり;
R29は、場合により1個以上のR30により置換されたC1−6アルコキシであり;
R30は、ハロ、ニトロ、シアノ、ヒドロキシ、トリフルオロメトキシ、トリフルオロメチル、アミノ、カルボキシ、カルバモイル、メルカプト、スルファモイル、C1−6アルキル、C2−6アルケニル、C2−6アルキニル、メトキシ、エトキシ、アセチル、アセトキシ、メチルアミノ、エチルアミノ、ジメチルアミノ、ジエチルアミノ、N−メチル−N−エチルアミノ、アセチルアミノ、N−メチルカルバモイル、N−エチルカルバモイル、N,N−ジメチルカルバモイル、N,N−ジエチルカルバモイル、N−メチル−N−エチルカルバモイル、フェニル、メチルチオ、エチルチオ、メチルスルフィニル、エチルスルフィニル、メシル、エチルスルホニル、メトキシカルボニル、エトキシカルボニル、N−メチルスルファモイル、N−エチルスルファモイル、N,N−ジメチルスルファモイル、N,N−ジエチルスルファモイル、およびN−メチル−N−エチルスルファモイルから選択され;
R31は、水素およびC1−4アルキルから選択され;
R32は、水素、ハロおよびC1−4アルキルから選択され;
R33は、水素およびハロから選択され;
R34は、ハロから選択される]。
【請求項3】
式(IF)の化合物またはその医薬的に許容できる塩:
【化2】

[式中、
−−−は、単結合および二重結合から選択され;−−−が単結合である場合、XはCR24およびNから選択され;−−−が二重結合である場合、XはCであり;
Aは、NR25およびCR28R29から選択され;
pは、0〜2であり;
R24、R26、R27、R28は、それぞれ独立して水素およびC1−6アルキルから選択され;
R25は、水素、C1−6アルキル、C1−6アルキルスルホニル、およびC1−6アルカノイルから選択され、その際、C1−6アルキルおよびC1−6アルカノイルは、場合により炭素において1個以上のR30により置換されており;
R29は、水素、アミノ、および場合により炭素において1個以上のR30により置換されたC1−6アルコキシから選択され;
R30は、ハロ、ニトロ、シアノ、ヒドロキシ、トリフルオロメトキシ、トリフルオロメチル、アミノ、カルボキシ、カルバモイル、メルカプト、スルファモイル、C1−6アルキル、C2−6アルケニル、C2−6アルキニル、メトキシ、エトキシ、アセチル、アセトキシ、メチルアミノ、エチルアミノ、ジメチルアミノ、ジエチルアミノ、N−メチル−N−エチルアミノ、アセチルアミノ、N−メチルカルバモイル、N−エチルカルバモイル、N,N−ジメチルカルバモイル、N,N−ジエチルカルバモイル、N−メチル−N−エチルカルバモイル、フェニル、メチルチオ、エチルチオ、メチルスルフィニル、エチルスルフィニル、メシル、エチルスルホニル、メトキシカルボニル、エトキシカルボニル、N−メチルスルファモイル、N−エチルスルファモイル、N,N−ジメチルスルファモイル、N,N−ジエチルスルファモイル、およびN−メチル−N−エチルスルファモイルから選択され;
R31は、水素およびC1−4アルキルから選択され;
R32は、水素、ハロおよびC1−4アルキルから選択され;
R33は、水素およびハロから選択され;
R34は、ハロから選択される]。
【請求項4】
請求項1〜3のいずれかに記載の化合物またはその医薬的に許容できる塩と、医薬的に許容できる希釈剤またはキャリヤーと、を含む医薬組成物。
【請求項5】
癌のリスクがある対象、癌を伴うと診断された対象、または癌の症状を示す対象を提供し、その対象に請求項1〜3のいずれかに記載の化合物を含む医薬組成物を投与することを含む、癌を処置する方法。
【請求項6】
CSF−1Rキナーゼおよび請求項1〜3のいずれかに記載の化合物またはその医薬的に許容できる塩を提供し、CSF−1Rキナーゼが阻害される条件下で混合することを含む、CSF−1Rキナーゼを阻害する方法。
【請求項7】
医薬として使用するための、請求項1〜3のいずれかに記載の化合物またはその医薬的に許容できる塩。
【請求項8】
温血動物においてCSF−1Rキナーゼ阻害作用を発生させる際に使用するための医薬の製造における、請求項1〜3のいずれか1項に記載の化合物またはその医薬的に許容できる塩の使用。
【請求項9】
請求項1〜3のいずれか1項に記載の化合物を製造する方法であって、式(IXa)または(IXb)の化合物:
【化3】

[式中、Lは置換可能な基である]を式(Xa)または(Xb)の化合物:
【化4】

と反応させ、その後、必要であれば、
i)式(I)の化合物を式(I)の他の化合物に変換し;
ii)いずれかの保護基を除去し;
iii)医薬的に許容できる塩を形成すること;
を含む上記方法。
【請求項10】
Lがクロロ、ブロモ、トシルおよびトリフルオロメチルスルホニルオキシから選択される、請求項9に記載の方法。
【公表番号】特表2011−520804(P2011−520804A)
【公表日】平成23年7月21日(2011.7.21)
【国際特許分類】
【出願番号】特願2011−507995(P2011−507995)
【出願日】平成21年5月6日(2009.5.6)
【国際出願番号】PCT/GB2009/050467
【国際公開番号】WO2009/136191
【国際公開日】平成21年11月12日(2009.11.12)
【出願人】(300022641)アストラゼネカ アクチボラグ (581)
【Fターム(参考)】
【公表日】平成23年7月21日(2011.7.21)
【国際特許分類】
【出願日】平成21年5月6日(2009.5.6)
【国際出願番号】PCT/GB2009/050467
【国際公開番号】WO2009/136191
【国際公開日】平成21年11月12日(2009.11.12)
【出願人】(300022641)アストラゼネカ アクチボラグ (581)
【Fターム(参考)】
[ Back to top ]

