化学修飾した細胞接着性ポリペプチド
【課題】低濃度においても細胞接着性が優れ、細胞増殖性に優れた細胞接着性ポリペプチドを提供する。
【解決手段】少なくとも細胞接着性最小アミノ酸配列(X)及び補助アミノ酸配列(Y)から構成され、反応性基含有アミノ酸残基を有するポリペプチド(P)と、カルボキシル基、スルホ基及びヒドロキシル基からなる群より選ばれる少なくとも1種の官能基(K)を有する化合物(A)とを化学反応させることにより、ポリペプチド(P)に含まれる反応性基含有アミノ酸残基を化学修飾した細胞接着性ポリペプチド。
【解決手段】少なくとも細胞接着性最小アミノ酸配列(X)及び補助アミノ酸配列(Y)から構成され、反応性基含有アミノ酸残基を有するポリペプチド(P)と、カルボキシル基、スルホ基及びヒドロキシル基からなる群より選ばれる少なくとも1種の官能基(K)を有する化合物(A)とを化学反応させることにより、ポリペプチド(P)に含まれる反応性基含有アミノ酸残基を化学修飾した細胞接着性ポリペプチド。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、化学修飾した細胞接着性ポリペプチドに関する。
【背景技術】
【0002】
人工の細胞接着性ポリペプチドとして、プロネクチンF{Arg Gly Asp配列と(Gly Ala Gly Ala Gly Ser)9配列(20)とを各々約13個有し、遺伝子組み換え大腸菌により製造される数平均分子量約11万のポリペプチド}及びプロネクチンL{Ile Lys Val Ala Val配列(7)と(Gly Ala Gly Ala Gly Ser)9配列(20)とを各々約13個有し、遺伝子組み換え大腸菌により製造される数平均分子量約11万のポリペプチド}(非特許文献1)が知られている。また、細胞接着性最小アミノ酸配列(X)と補助アミノ酸配列(Y)とが交互に化学結合してなる構造を有し、(Y)に含まれる全アミノ酸個数が1〜50個であり、かつ(Y)に含まれるグリシン(Gly)及びアラニン(Ala)の合計含有割合が(Y)の全アミノ酸個数に基づいて42〜100個数%である細胞接着性ポリペプチド(特許文献1)が知られている。さらに、化学修飾した人工の細胞接着性ポリペプチドとして、アミノ基及び/又はアンモニオ基を含有する化合物(塩酸N,N−ジメチルアミノエチルクロリド等)で修飾した水溶性の直鎖状ポリペプチド(特許文献2)が知られている。
【先行技術文献】
【非特許文献】
【0003】
【非特許文献1】ハンドブック オブ バイオデグラダブル ポリマーズ(アブラハム著,ハーウッド アカデミック パブリッシャーズ発行,アムステルダム1997(Abraham J. Dombら著, Handbook of Biodegradable Polymers, Harwood Academic Publishers発行, Amsterdam 1997年)
【特許文献】
【0004】
【特許文献1】特開2005−2106号公報
【特許文献2】特表平10−500701号公報
【発明の概要】
【発明が解決しようとする課題】
【0005】
しかし、無血清培地等の特殊な条件下において細胞培養する場合、従来の細胞接着性ポリペプチドは、細胞接着性が不十分であり、細胞増殖性が低いという問題点がある。一方、細胞接着性ポリペプチドを高濃度で用いることにより細胞接着性を補うこともできるが、経済的に問題がある。
本発明の目的は、低濃度においても細胞接着性が優れ、細胞増殖性に優れた細胞接着性ポリペプチドを提供することである。
【課題を解決するための手段】
【0006】
本発明者は、鋭意研究を重ねてきた結果、特定のポリペプチドに特定の官能基を化学修飾することにより上記目的を達成を達成することを見出し本発明に到達した。
【0007】
すなわち、本発明の細胞接着性ポリペプチドは、少なくとも細胞接着性最小アミノ酸配列(X)及び補助アミノ酸配列(Y)から構成され、反応性基含有アミノ酸残基を有するポリペプチド(P)と、
カルボキシル基、スルホ基及びヒドロキシル基からなる群より選ばれる少なくとも1種の官能基(K)を有する化合物(A)とを化学反応させることにより、
ポリペプチド(P)に含まれる反応性基含有アミノ酸残基を化学修飾した細胞接着性ポリペプチドである。
【0008】
また、本発明の細胞接着性ポリペプチド含有基材は、上記の細胞接着性ポリペプチド及び基材(B)を含むものである。
【0009】
また、本発明の細胞又は細胞集合体の生産方法は、上記の細胞接着性ポリペプチドを用いて細胞培養する工程を含むものである。
【発明の効果】
【0010】
本発明の細胞接着性ポリペプチドは、無血清培地等の特殊な条件下において細胞培養する場合、低濃度であっても、細胞接着性が優れている。したがって、基材等の細胞接着表面に対する細胞接着性ポリペプチドのコーティング量を減らしても、高い接着性を得られ、それにより高い細胞増殖性を得られる。また、細胞接着性ポリペプチドを高濃度で用いる必要がないため、経済的にも優れる。
【0011】
また、本発明の細胞接着性ポリペプチド含有基材は、上記の細胞接着性ポリペプチドを含むため、無血清培地等の特殊な条件下において細胞培養する場合、低濃度においても細胞接着性が優れ、優れた細胞増殖性を発揮する。
【0012】
また、本発明の細胞又は細胞集合体の生産方法は、上記の細胞接着性ポリペプチドを用いて細胞培養するため、効率よく細胞又は細胞集合体を生産することができる。
【図面の簡単な説明】
【0013】
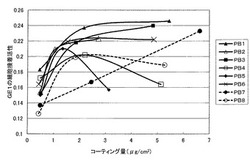
【図1】実施例1〜6、比較例1及び2で得た細胞接着性ポリペプチドについて、細胞接着性ポリペプチドのコーティング量に対するGE1細胞(マウス歯肉上皮由来細胞)の細胞接着活性の変化を表したグラフである。
【図2】実施例1〜6、比較例1及び2で得た細胞接着性ポリペプチドについて、細胞接着性ポリペプチドのコーティング量に対するC3H10T1/2細胞(マウス歯肉上皮細胞由来細胞)の細胞接着活性の変化を表したグラフである。
【図3】実施例1〜6、比較例1及び2で得た細胞接着性ポリペプチドについて、細胞接着性ポリペプチドのコーティング量に対するGE1細胞(マウス歯肉上皮由来細胞)の細胞増殖活性の変化を表したグラフである。
【図4】実施例1〜6、比較例1及び2で得た細胞接着性ポリペプチドについて、細胞接着性ポリペプチドのコーティング量に対するC3H10T1/2細胞(マウス歯肉上皮細胞由来細胞)の細胞増殖活性の変化を表したグラフである。
【発明を実施するための形態】
【0014】
「細胞接着性」とは、特定の最小アミノ酸配列が細胞のインテグリンレセプターに認識され、細胞が基材に接着しやすくなる性質を意味する(大阪府立母子医療センター雑誌、第8巻 第1号、58〜66頁、1992年)。
「細胞増殖性」とは細胞が基材に接着することにより細胞内シグナル伝達経路が活性化され、成長、分裂、生存する性質を意味する(Essential 細胞生物学、第2版、706頁、2005年)。
【0015】
細胞接着性最小アミノ酸配列(X)としては、例えば、「病態生理、第9巻 第7号、527〜535頁、1990年」や「大阪府立母子医療センター雑誌、第8巻 第1号、58〜66頁、1992年」に記載されているもの等が用いられる。
【0016】
これらの最小アミノ酸配列(X)の中で、Arg Gly Asp配列、Leu Asp Val配列、Leu Arg Glu配列、His Ala Val配列、Arg Glu Asp Val配列(1)、Tyr Ile Gly Ser Arg配列(2)、Pro Asp Ser Gly Arg配列(3)、Arg Tyr Val Val Leu Pro Arg配列(4)、Leu Gly Thr Ile Pro Gly配列(5)、Arg Asn Ile Ala Glu Ile Ile Lys Asp Ile配列(6)、Ile Lys Val Ala Val配列(7)、Asp Gly Glu Ala 配列(8)、Gly Val Lys Gly Asp Lys Gly Asn Pro Gly Trp Pro Gly Ala Pro配列(9)、Gly Glu Phe Tyr Phe Asp Leu Arg Leu Lys Gly Asp Lys配列(10)、Tyr Lys Leu Asn Val Asn Asp Ser配列(11)、Ala Lys Pro Ser Tyr Pro Pro Thr Tyr Lys配列(12)、Asn Arg Trp His Ser Ile Tyr Ile Thr Arg Phe Gly配列(13)、Thr Trp Tyr Lys Ile Ala Phe Gln Arg Asn Arg Lys配列(14)、Arg Lys Arg Leu Gln Val Gln Leu Ser Ile Arg Thr配列(15)、Tyr Thr Ile Thr Ile Arg Gly Val配列(95)、Pro His Ser Arg Asn配列(96)、Lys Arg Ser Arg配列(97)及びPhe His Arg Arg Ile Lys Ala配列(98)からなる群より選ばれる少なくとも1種が好ましく、細胞接着性及び細胞増殖性の観点等から、さらに好ましくはArg Gly Asp配列、Tyr Ile Gly Ser Arg配列(2)、Ile Lys Val Ala Val配列(7)及びArg Lys Arg Leu Gln Val Gln Leu Ser Ile Arg Thr(15)からなる群より選ばれる少なくとも1種、特に好ましくはArg Gly Asp配列である。
【0017】
これらの最小アミノ酸配列(X)の両端には、介在アミノ酸配列(Z)を含むことが好ましい。
介在アミノ酸配列(Z)としては、細胞接着性最小アミノ酸配列(X)及び補助アミノ酸配列(Y)以外のアミノ酸配列が含まれ、アラニン(Ala)、グリシン(Gly)、セリン(Ser)、トレオニン(Thr)、バリン(Val)、ロイシン(Leu)、イソロイシン(Ile)、システイン(Cys)、メチオニン(Met)、フェニルアラニン(Phe)、チロシン(Tyr)、プロリン(Pro)、トリプトファン(Trp)、アスパラギン(Asn)、グルタミン(Gln)、アスパラギン酸(Asp)、グルタミン酸(Glu)、アルギニン(Arg)、リジン(Lys)及び/又はヒスチジン(His)等から構成されるアミノ酸配列が含まれる。
【0018】
介在アミノ酸配列(Z)のうち、細胞接着性及び細胞増殖性の観点から、細胞接着性最小アミノ酸配列(X)のN末端に、Gly Ala Ala Val Thr Gly配列(62)、Gly Leu Pro Gly Pro Lys Gly Asp配列(63)、Gly Pro Ala Val Thr Gly配列(64)、Ala Gly Pro Lys Gly Ala Asp Gly Ser Pro Gly Pro Ala Val Thr Gly配列(65)、Gly Ala Ala Val Cys Glu Pro Gly配列(66)、Gly Ala Ala Leu Cys Val Ser Glu Pro Gly配列(67)、Ser Pro Ala Ser Ala Ala Leu Cys Val Ser Glu Pro Gly配列(68)、Ser Pro Ala Ser Ala Ala Val Cys Glu Pro Gly配列(69)、Ala Gly Pro Lys Gly Ala Asp Gly Ser Pro Gly Pro Ala Val Cys Glu Pro Gly配列(70)、Ala Gly Pro Lys Gly Ala Asp Gly Ser Pro Gly Pro Ala Leu Cys Val Ser Glu Pro Gly配列(71)、Gly Pro Ala Val Cys Glu Pro Gly配列(72)、Gly Pro Ala Leu Cys Val Ser Glu Pro Gly配列(73)及びGly Ala Ala Pro Gly Ala Ser配列(74)からなる群より選ばれる少なくとも1種を結合していることが好ましく、さらに好ましくはGly Ala Ala Val Thr Gly配列(62)、Gly Leu Pro Gly Pro Lys Gly Asp配列(63)、Gly Pro Ala Val Thr Gly配列(64)及びAla Gly Pro Lys Gly Ala Asp Gly Ser Pro Gly Pro Ala Val Thr Gly配列(65)からなる群より選ばれる少なくとも1種を結合していること、特に好ましくはGly Ala Ala Val Thr Gly配列(62)を結合していることである。
【0019】
介在アミノ酸配列(Z)のうち、細胞接着性及び細胞増殖性の観点から、細胞接着性最小アミノ酸配列(X)のC末端に、Ser Pro Ala Ser Ala Ala Gly Tyr配列(75)、Ser Pro Ala Ser Ala Ala Leu Cys Val Ser配列(76)、Ser Pro Ala Ser Ala Ala Val Cys配列(77)、Ala Gly Pro Lys Gly Ala Asp Gly Ser Pro Gly Pro配列(78)、Ala Gly Pro Lys Gly Ala Asp Gly Ser Pro Gly Pro Ala Val Cys配列(79)、Ala Gly Pro Lys Gly Ala Asp Gly Ser Pro Gly Pro Ala Leu Cys Val Ser配列(80)、Ala Gly Pro Lys Gly Ala Asp Gly Ser Pro配列(81)、Ser Pro Ala Ser Ala Ala Gly Pro Val Gly Ser Pro配列(82)、Cys Asp Ala Gly Tyr配列(83)、Cys Asp Ala Gly Pro Val Gly Ser Pro配列(84)及びSer Ala Gly Pro Ser Ala Gly Tyr配列(85)からなる群より選ばれる少なくとも1種を結合していることが好ましく、さらに好ましくはSer Pro Ala Ser Ala Ala Gly Tyr配列(75)、Ser Pro Ala Ser Ala Ala Leu Cys Val Ser配列(76)、Ser Pro Ala Ser Ala Ala Val Cys配列(77)、Ala Gly Pro Lys Gly Ala Asp Gly Ser Pro Gly Pro配列(78)、Ala Gly Pro Lys Gly Ala Asp Gly Ser Pro Gly Pro Ala Val Cys配列(79)、Ala Gly Pro Lys Gly Ala Asp Gly Ser Pro Gly Pro Ala Leu Cys Val Ser配列(80)、Ala Gly Pro Lys Gly Ala Asp Gly Ser Pro配列(81)及びSer Pro Ala Ser Ala Ala Gly Pro Val Gly Ser Pro配列(82)からなる群より選ばれる少なくとも1種を結合していること、特に好ましくはSer Pro Ala Ser Ala Ala Gly Tyr配列(75)を結合していることである。
【0020】
ポリペプチド(P)は、細胞接着性最小アミノ酸配列(X)を1分子中に少なくとも1個有すればよいが、細胞接着性の観点から、1分子中に2〜50個有するものが好ましく、さらに好ましくは3〜30個、特に好ましくは4〜20個、最も好ましくは5〜18個有するものである。
なお、2種以上の細胞接着性最小アミノ酸配列(X)が一分子中に含まれてもよい。
【0021】
補助アミノ酸配列(Y)は、最小アミノ酸配列(X)及び介在アミノ酸配列(Z)以外のアミノ酸配列であれば制限なく使用できるが、耐熱性、細胞接着性及び細胞増殖性の観点等から、Gly及び/又はAlaを有するものが好ましく、例えば(Gly Ala)a配列、(Gly Ala Gly Ala Gly Ser)b配列、(Gly Ala Gly Ala Gly Tyr)c配列、(Gly Ala Gly Val Gly Tyr)d配列、(Gly Ala Gly Tyr Gly Val)e配列、{Asp Gly Gly (Ala)f Gly Gly Ala}g配列、(Gly Val Pro Gly Val)h配列、(Gly)i、(Ala)j、(Gly Gly Ala)k配列、(Gly Val Gly Val Pro)m配列、(Gly Pro Pro)n配列、(Gly Ala Gln Gly Pro Ala Gly Pro Gly)o配列、(Gly Ala Pro Gly Ala Pro Gly Ser Gln Gly Ala Pro Gly Leu Gln)p配列及び/又は(Gly Ala Pro Gly Thr Pro Gly Pro Gln Gly Leu Pro Gly Ser Pro)q配列を有するものが好ましい。これらのうち、熱に対する安定性の観点から、(Gly Ala)a配列、(Gly Ala Gly Ala Gly Ser)b配列、(Gly Ala Gly Ala Gly Tyr)c配列、(Gly Ala Gly Val Gly Tyr)d配列、(Gly Ala Gly Tyr Gly Val)e配列、{Asp Gly Gly (Ala)f Gly Gly Ala}g配列、(Gly Val Pro Gly Val)h配列、(Gly Val Gly Val Pro)m配列及び/又は(Gly Pro Pro)n配列を有するものが好ましく、さらに好ましくは(Gly Ala Gly Ala Gly Ser)b配列、(Gly Val Pro Gly Val)h配列、(Gly Val Gly Val Pro)m配列及び/又は(Gly Pro Pro)n配列を有するものであり、特に好ましくは(Gly Ala Gly Ala Gly Ser)b配列を有するものである。
【0022】
なお、aは5〜100の整数、b、c、d及びeは2〜33の整数、fは1〜194の整数、gは1〜{200/(6+f)の小数点以下を切り捨てした数}の整数、hは2〜40の整数、i及びjは10〜200の整数、kは3〜66の整数、mは2〜40の整数、nは3〜66の整数、oは1〜22の整数、p及びqは1〜13の整数である。
【0023】
補助アミノ酸配列(Y)は、グリシン(Gly)及び/又はアラニン(Ala)を含むことが好ましい。グリシン(Gly)及び/又はアラニン(Ala)を含む場合、これらの合計含有割合(%)は、補助アミノ酸配列(Y)の全アミノ酸個数に基づいて、10〜100が好ましく、さらに好ましくは20〜95、特に好ましくは30〜90、最も好ましくは40〜85である。この範囲であると、耐熱性がさらに良好となる。
【0024】
補助アミノ酸配列(Y)にグリシン(Gly)及びアラニン(Ala)の両方を含む場合、これらの含有個数割合(Gly/Ala)は、0.03〜40が好ましく、さらに好ましくは0.08〜13、特に好ましくは0.2〜5である。この範囲であると、耐熱性がさらに良好となる。
【0025】
補助アミノ酸配列(Y)には、以上の例示の他に、他のアミノ酸{アラニン(Ala)、グリシン(Gly)、セリン(Ser)、トレオニン(Thr)、バリン(Val)、ロイシン(Leu)、イソロイシン(Ile)、システイン(Cys)、メチオニン(Met)、フェニルアラニン(Phe)、チロシン(Tyr)、プロリン(Pro)、トリプトファン(Trp)、アスパラギン(Asn)、グルタミン(Gln)、アスパラギン酸(Asp)、グルタミン酸(Glu)、アルギニン(Arg)、リジン(Lys)及びヒスチジン(His)等}を含んでいてもよい。
【0026】
(Gly Ala)a配列を有する補助アミノ酸配列としては、配列番号(16)〜(18)で表されるアミノ酸配列等が挙げられる。
(Gly Ala Gly Ala Gly Ser)b配列を有する補助アミノ酸配列としては、配列番号(19)〜(21)で表されるアミノ酸配列等が挙げられる。
(Gly Ala Gly Ala Gly Tyr)c配列を有する補助アミノ酸配列としては、配列番号(22)〜(24)で表されるアミノ酸配列等が挙げられる。
(Gly Ala Gly Val Gly Tyr)d配列を有する補助アミノ酸配列としては、配列番号(25)〜(27)で表されるアミノ酸配列等が挙げられる。
(Gly Ala Gly Tyr Gly Val)e配列を有する補助アミノ酸配列としては、配列番号(28)〜(30)で表されるアミノ酸配列等が挙げられる。
{Asp Gly Gly (Ala)f Gly Gly Ala}g配列を有する補助アミノ酸配列としては、配列番号(31)〜(33)で表されるアミノ酸配列等が挙げられる。
(Gly Val Pro Gly Val)h配列を有する補助アミノ酸配列としては、配列番号(34)〜(37)で表されるアミノ酸配列等が挙げられる。
(Gly)i配列を有する補助アミノ酸配列としては、配列番号(38)〜(40)で表されるアミノ酸配列等が挙げられる。
(Ala)j配列を有する補助アミノ酸配列としては、配列番号(41)〜(43)で表されるアミノ酸配列等が挙げられる。
(Gly Gly Ala)k配列を有する補助アミノ酸配列としては、配列番号(44)〜(46)で表されるアミノ酸配列等が挙げられる。
(Gly Val Gly Val Pro)m配列を有する補助アミノ酸配列としては、配列番号(47)〜(49)で表されるアミノ酸配列等が挙げられる。
(Gly Pro Pro)n配列を有する補助アミノ酸配列としては、配列番号(50)〜(52)で表されるアミノ酸配列等が挙げられる。
(Gly Ala Gln Gly Pro Ala Gly Pro Gly)o配列を有する補助アミノ酸配列としては、配列番号(53)〜(55)で表されるアミノ酸配列等が挙げられる。
(Gly Ala Pro Gly Ala Pro Gly Ser Gln Gly Ala Pro Gly Leu Gln)p配列を有する補助アミノ酸配列としては、配列番号(56)〜(58)で表されるアミノ酸配列等が挙げられる。
(Gly Ala Pro Gly Thr Pro Gly Pro Gln Gly Leu Pro Gly Ser Pro)q配列を有する補助アミノ酸配列としては、配列番号(59)〜(61)で表されるアミノ酸配列等が挙げられる。
【0027】
これらの補助アミノ酸配列のうち、熱に対する安定性の観点から、配列番号(16)、(17)、(19)、(20)、(21)、(22)、(23)、(25)、(26)、(28)、(29)、(31)、(32)、(33)、(34)、(35)、(37)、(38)、(39)、(41)、(42)、(44)、(45)、(47)、(48)、(50)、(51)、(53)、(54)、(56)、(57)、(59)又は(60)で表されるアミノ酸配列が好ましく、さらに好ましくは配列番号(17)、(19)、(20)、(21)、(23)、(26)、(29)、(33)、(34)、(35)、(36)、(37)、(39)、(42)、(45)、(48)、(51)、(54)、(57)又は(60)で表されるアミノ酸配列であり、特に好ましくは配列番号(19)、(20)又は(37)で表されるアミノ酸配列である。
【0028】
ポリペプチド(P)は、補助アミノ酸配列(Y)を1分子中に少なくとも1個有すればよいが、熱安定性、細胞接着性及び細胞増殖性の観点等から、1分子中に2〜50個有するものが好ましく、さらに好ましくは3〜30個、特に好ましくは4〜20個有するものである。また、2種以上の補助アミノ酸配列(Y)が1分子中に含まれてもよい。
【0029】
ポリペプチド(P)は、細胞接着性最小アミノ酸配列(X)と補助アミノ酸配列(Y)とが交互に化学結合してなる構造であることが好ましく、さらに好ましくは細胞接着性最小アミノ酸配列(X)の両端に介在アミノ酸配列(Z)を含むアミノ酸配列と補助アミノ酸配列(Y)とが交互に化学結合してなる構造である。この場合、細胞接着性最小アミノ酸配列(X)と補助アミノ酸配列(Y)との繰り返し単位(X−Y)の数(個)は、細胞接着性及び細胞増殖性の観点等から、2〜50が好ましく、さらに好ましくは3〜30、特に好ましくは4〜20、最も好ましくは5〜18である。
【0030】
ポリペプチド(P)は、直鎖構造を有するものである(分岐構造、環状構造及び架橋構造を持たない。)。なお、直鎖構造にはβ構造(直鎖状ペプチドが折れ曲がってこの部分同士が平行に並び、その間に水素結合が作られる二次構造)も含まれる。
【0031】
ポリペプチド(P)の数平均分子量(Mn)は、300〜3,000,000が好ましく、さらに好ましくは1,000〜1,000,000、特に好ましくは3,000〜300,000。なお、数平均分子量(Mn)は、公知の方法により測定でき、例えば、SDS−PAGE(SDSポリアクリルアミドゲル電気泳動)法により、測定サンプルを分離し、泳動距離を標準物質と比較することによって求められる(以下、同じ)。
【0032】
ポリペプチド(P)の好適な例を以下に示す。
(1)細胞接着性最小アミノ酸配列(X)がArg Gly Asp配列(x1)の場合
配列(x1)の13個と(Gly Ala Gly Ala Gly Ser)9配列(20)(y1)の12個とを有し、これらが交互に化学結合してなる構造を有するMn約11万のポリペプチド(86){「プロネクチンF」、プロネクチンは三洋化成工業(株)の登録商標(日本及び米国)である。三洋化成工業(株)製<以下同じ>};
配列(x1)の5個と(Gly Ala Gly Ala Gly Ser)3配列(19)(y2)の5個とを有しこれらが交互に化学結合してなる構造を有するMn約2万のポリペプチド(87)(「プロネクチンF2」);
配列(x1)の3個と(Gly Val Pro Gly Val)2 Gly Gly (Gly Ala Gly Ala Gly Ser)3配列(37)(y3)の3個とを有しこれらが交互に化学結合してなる構造を有するMn約1万のポリペプチド(88)(「プロネクチンF3」)等。
【0033】
(2)最小アミノ酸配列(X)がIle Lys Val Ala Val配列(7)(x2)の場合
プロネクチンF、プロネクチンF2又はプロネクチンF3のArg Gly Asp配列(x1)をIle Lys Val Ala Val配列(7)(x2)に変更したポリペプチド(89)「プロネクチンL」、ポリペプチド(90)「プロネクチンL2」、又はポリペプチド(91)「プロネクチンL3」等。
【0034】
(3)最小アミノ酸配列(X)がTyr Ile Gly Ser Arg配列(2)(x3)の場合
プロネクチンF、プロネクチンF2又はプロネクチンF3のArg Gly Asp配列(x1)をTyr Ile Gly Ser Arg配列(2)(x3)に変更したポリペプチド(92)「プロネクチンY」、ポリペプチド(93)「プロネクチンY2」、又はポリペプチド(94)「プロネクチンY3」等。
【0035】
ポリペプチド(P)は、人工的に製造でき、有機合成法(酵素法、固相合成法及び液相合成法等)、及び遺伝子組み換え法等によって容易に製造できる。有機合成法に関しては、生化学実験講座1、タンパク質の化学IV(1981年7月1日、日本生化学会編、株式会社東京化学同人発行)又は続生化学実験講座2、タンパク質の化学(下)(昭和62年5月20日、日本生化学会編、株式会社東京化学同人発行)に記載されている方法等が適用できる。遺伝子組み換え法に関しては、特許第3338441号公報に記載されている方法等が適用できる。有機合成法及び遺伝子組み換え法とも、ポリペプチド(P)を作製できるが、ポリペプチド(P)を安価に大量生産できるという観点等から、遺伝子組み換え法が好ましい。
【0036】
化合物(A)は、カルボキシル基、スルホ基及びヒドロキシル基からなる群より選ばれる少なくとも1種以上の官能基(K)を有する化合物であれば制限なく使用でき、カルボキシル基を有する化合物(A1)、スルホ基を有する化合物(A2)及びヒドロキシル基を有する化合物(A3)が含まれる。なお、上記の官能基(K)は、ポリペプチド(P)と、化合物(A)とを化学反応させることにより導入される官能基である。
【0037】
カルボキシル基を有する化合物(A1)としては、炭素数2〜30のカルボン酸のハロゲン化物{ハロゲン化アシル(酸ハロゲン化物)ではなく、ハロゲン置換カルボン酸}、炭素数2〜30のカルボキシル基を有するアルコール、炭素数2〜30のカルボキシル基を有するスルホン酸及び炭素数2〜30のカルボキシル基を有するアミン等が含まれる。
【0038】
炭素数2〜30のカルボン酸のハロゲン化物としては、フルオロ酢酸、クロロ酢酸、ブロモ酢酸、2−クロロプロピオン酸、3−クロロプロピオン酸、ω−クロロオクタデカン酸、ω−ブロモエイコサン酸及びω−クロロトリコサン酸等が挙げられる。
【0039】
炭素数2〜30のカルボキシル基を有するアルコールとしては、ヒドロキシ酢酸、ヒドロキシプロピオン酸、パントテン酸、グルクロン酸、サリチル酸、4−ヒドロキシ安息香酸、ヒドロキシ基含有アミノ酸(Ser及びThr)、ω−ヒドロキシオクタデカン酸、ω−ヒドロキシエイコサン酸及びω−ヒドロキシトリコサン酸等が挙げられる。
【0040】
炭素数2〜30のカルボキシル基を有するスルホン酸としては、スルホ酢酸、スルホコハク酸、o−スルホ安息香酸、m−スルホ安息香酸、p−スルホ安息香酸、2,4−ジスルホ安息香酸、3−スルホフタル酸、3,5−ジスルホフタル酸、4−スルホイソフタル酸、2−スルホテレフタル酸、2−メチル−4−スルホ安息香酸、2−メチル−3,5−ジスルホ安息香酸、4−プロピル−3−スルホ安息香酸、4−イソプロピル−3−スルホ安息香酸、2,4,6−トリメチル−3−スルホ安息香酸、2−メチル−5−スルホテレフタル酸、5−メチル−4−スルホイソフタル酸、5−スルホサリチル酸及び3−オキシ−4−スルホ安息香酸等が挙げられる。
【0041】
炭素数2〜30のカルボキシル基を有するアミンとしては、炭素数2〜20のアミノカルボン酸及び炭素数4〜30のペプチドが含まれ、2−アミノ酢酸、3−アミノプロピオン酸、ω−アミノオクタデカン酸、ω−アミノエイコサン酸、アミノ酸{アラニン(Ala)、アルギニン(Arg)、アスパラギン(Asn)、アスパラギン酸(Asp)、システイン(Cys)、グルタミン(Gln)、グルタミン酸(Glu)、グリシン(Gly)、ヒスチジン(His)、イソロイシン(Ile)、ロイシン(Leu)、リジン(Lys)、メチオニン(Met)、フェニルアラニン(Phe)、プロリン(Pro)、セリン(Ser)、トレオニン(Thr)、トリプトファン(Trp)、チロシン(Tyr)及びバリン(Val)等}及びアミノ酸が2〜15個結合したペプチド等が挙げられる。
【0042】
これらのカルボキシル基を含有する化合物(A1)のうち、細胞接着性及び細胞増殖性の観点から、カルボン酸のハロゲン化物が好ましく、さらに好ましくはクロロ酢酸である。
【0043】
スルホ基を有する化合物(A2)としては、炭素数2〜30のスルホン酸のハロゲン化物(ハロゲン置換スルホン酸)、炭素数2〜30のスルホ基を有するアルコール、炭素数2〜30のスルホ基を有するカルボン酸及び炭素数2〜30のスルホ基を有するアミン等が含まれる。
【0044】
炭素数2〜30のスルホン酸のハロゲン化物としては、クロロスルホン酸(ClSO3H)、クロロエタンスルホン酸、フルオロスルホン酸、p−クロロベンゼンスルホン酸、ω−クロロオクタデカンスルホン酸、ω−ブロモエイコサンスルホン酸及びω−クロロトリコサンスルホン酸及びこれらの塩(アルカリ金属塩)等が挙げられる。
【0045】
炭素数2〜30のスルホ基を有するアルコールとしては、2−ヒドロキシエタンスルホン酸、3−ヒドロキシプロパンスルホン酸、p−ヒドロキシベンゼンスルホン酸、ω−ヒドロキシオクタデカンスルホン酸、ω−ヒドロキシエイコサンスルホン酸、ω−ヒドロキシトリコサンスルホン酸、スルホエチレングリコール、2−スルホプロピレングリコール、1,2−ジスルホプロピレングリコール、2−スルホブタンジオール、2−スルホヘキサンジオール、3−スルホヘキサンジオール、1,5−ジスルホヘキサンジオール、2,5−ジスルホヘキサンジオール、1,3,5−トリスルホヘキサンジオール、1,2,4−トリスルホヘキサンジオール、2−スルホウンデカンジオール、4−スルホウンデカンジオール、6−スルホウンデカンジオール、2,4−ジスルホウンデカンジオール及び2,6,10−トリスルホウンデカンジオール等が挙げられる。
【0046】
炭素数2〜30のスルホ基を有するカルボン酸としては、上記のカルボキシル基を有するスルホン酸と同様である。
【0047】
炭素数2〜30のスルホ基を有するアミンとしては、スルファニル酸、2−アミノエタンスルホン酸、3−アミノプロパンスルホン酸、p−アミノベンゼンスルホン酸、ω−アミノオクタデカンスルホン酸、ω−アミノエイコサンスルホン酸及び、ω−アミノトリコサンスルホン酸等が挙げられる。
【0048】
これらのスルホ基を含有する化合物(A2)のうち、細胞接着性及び細胞増殖性の観点から、スルホン酸のハロゲン化物が好ましく、さらに好ましくはクロロエタンスルホン酸である。
【0049】
ヒドロキシル基を有する化合物(A3)としては、炭素数2〜30のアルコールのハロゲン化物(ハロゲン置換体アルコール)及び炭素数2〜30のヒドロキシル基を有するカルボン酸等が含まれる。
【0050】
炭素数2〜30のアルコールのハロゲン化物としては、2−フルオロエタノール、クロロエタノール、3−ブロモプロピルアルコール、p−クロロフェノール、ω−クロロオクタデシルアルコール、ω−ブロモエイコシルアルコール及び、ω−クロロトリコシルアルコール等が挙げられる。
【0051】
炭素数2〜30のヒドロキシル基を有するカルボン酸としては、カルボキシル基を有するアルコールと同様である。
【0052】
これらのヒドロキシル基を含有する化合物(A3)のうち、細胞接着性及び細胞増殖性の観点から、アルコールのハロゲン化物が好ましく、さらに好ましくはクロロエタノールである。
【0053】
これらの化合物(A)のうち、細胞接着性及び細胞増殖性の観点から、カルボキシル基を有する化合物(A1)及びスルホ基を有する化合物(A2)が好ましく、さらに好ましくはカルボン酸のハロゲン化物及びスルホン酸のハロゲン化物、特に好ましくはクロロ酢酸、クロロエタンスルホン酸、クロロスルホン酸及びこれらの塩(アルカリ金属塩)、最も好ましくはクロロ酢酸及び2−クロロエタンスルホン酸ナトリウムである。
【0054】
また、これらの化合物(A)のうち、ポリペプチド(P)と化合物(A)との反応性の観点から、カルボン酸のハロゲン化物、スルホン酸のハロゲン化物及びアルコールのハロゲン化物が好ましく、さらに好ましくはカルボン酸のフッ化物又は塩化物、スルホン酸のフッ化物又は塩化物及びアルコールのフッ化物又は塩化物、特に好ましくはクロロ酢酸、フルオロ酢酸、フルオロスルホン酸、フルオロスルホン酸の塩(アルカリ金属塩)、クロロエタンスルホン酸、クロロスルホン酸の塩(アルカリ金属塩)、2−フルオロエタノール及びクロロエタノールである。
【0055】
ポリペプチド(P)に含まれる反応性基含有アミノ酸残基とは、化合物(A)と反応する反応性基を有するアミノ酸の残基を意味し、好ましくはポリペプチド(P)のN末端及びC末端以外のアミノ酸残基である。
【0056】
反応性基としては、ヒドロキシル基、カルボキシル基、メルカプト基及び1級又は2級アミノ基等が挙げられる。反応性基のうち、結合形成の容易さの観点から、ヒドロキシル基、カルボキシル基及び1級アミノ基が好ましく、さらに好ましくはヒドロキシル基及びカルボキシル基、特に好ましくはヒドロキシル基である。
【0057】
反応性基含有アミノ酸残基としては、セリン残基、トレオニン残基、チロシン残基、アスパラギン酸残基、グルタミン酸残基、リシン残基、アルギニン残基、ヒスチジン残基及びトリプトファン残基等が挙げられる(バイオコンジュゲート テクニークス、Greg T.Hermanson著、Academic Press発行、1996)。これらの反応性基含有アミノ酸残基のうち、化合物(A)との反応性の観点から、セリン残基、トレオニン残基、チロシン残基、アスパラギン酸残基、グルタミン酸残基、リシン残基及びアルギニン残基が好ましく、さらに好ましくはセリン残基、トレオニン残基、アスパラギン酸残基及びグルタミン酸残基、特に好ましくはセリン残基及びトレオニン残基である。
【0058】
ポリペプチド(P)に含まれる反応性基含有アミノ酸残基を化学修飾するには、ポリペプチド(P)と化合物(A)との化学反応によって、化学結合{共有結合、イオン結合及び/又は水素結合等}を介して、化合物(A)を結合させることが好ましいが、化合物(A)とポリペプチド(P)との物理吸着(ファンデルワールス力による吸着)により化学修飾してもよい。
【0059】
化合物(A)と、ポリペプチド(P)とを化学結合させる方法としては、公知の方法が適用でき、特開2007−51127号公報等に記載の方法が挙げられる。化学結合のうち、結合の強さの観点等から、共有結合が好ましい。化学結合形成反応には反応溶媒を使用してもよく、反応溶媒としては公知のものが使用でき、例えば、水、臭化リチウム水溶液、過塩素酸リチウム水溶液、メタノール、エタノール、イソプロパノール、アセトン、ジスルフォキシド、ジメチルアセトアミド、テトラヒドロフラン、ジメチルスルホキシド及びこれらの少なくとも1種を含む混合溶媒等が挙げられる。
【0060】
化合物(A)とポリペプチド(P)とを共有結合させる方法としては、例えば、ポリペプチド(P)に含まれる反応性基含有アミノ酸残基の反応性基がヒドロキシル基の場合、化合物(A)のうち、カルボン酸のハロゲン化物、スルホン酸のハロゲン化物又はアルコールのハロゲン化物(以下、ハロゲン化物と略する)を使用してエーテル化反応(ウイリアムソン合成法)する方法、化合物(A)のうち、スルホ基を有するカルボン酸又はヒドロキシル基を有するカルボン酸(以下、カルボキシ化合物と略する)を使用してエステル化反応する方法が挙げられる。
【0061】
ポリペプチド(P)に含まれる反応性基含有アミノ酸残基の反応性基がカルボキシル基の場合、カルボキシル基を有するアミン又はスルホ基を有するアミンを使用してアミド化反応する方法、カルボキシル基を有するアルコール又はスルホ基を有するアルコールを使用して、エステル化反応する方法等が挙げられる。
【0062】
化合物(A)とポリペプチド(P)とをイオン結合させる方法としては、例えば、ポリペプチド(P)に含まれる反応性基含有アミノ酸残基の反応性基がアミノ基の場合、カルボキシル基を有するスルホン酸、スルホ基を有するカルボン酸又はヒドロキシル基を有するカルボン酸(以下、酸化合物と略する)を用いて中和反応する方法、アミノ基を塩酸等の酸を用いてアンモニウム塩にしてから、酸化合物を使用してイオン交換反応する方法が挙げられる。
【0063】
ポリペプチド(P)に含まれる反応性基含有アミノ酸残基を化学修飾する方法としては、以上のようなポリペプチド(P)と化合物(A)との直接的な化学結合を形成させる方法等の他に、縮合剤を用いて、間接的に化学結合を形成させてもよい。
【0064】
縮合剤としては、カルボジイミド、ジフェニルリン酸アジド、BOP試薬、DMT−MM及び向山試薬等が挙げられる。これらのうち、反応性の観点から、向山試薬が好ましい。なお、縮合剤を用いる方法は公知の縮合方法(エステル化反応、アミド化反応)等が適用できる。
【0065】
本発明の細胞接着性ポリペプチドにおいて、反応性基含有アミノ酸残基の化学修飾により導入された官能基(K)の平均個数(個)は、本発明の細胞接着性ポリペプチド1分子あたり、細胞接着性及び細胞増殖性の観点から、1〜156が好ましく、さらに好ましくは10〜120、特に好ましくは30〜115、最も好ましくは60〜90である。
【0066】
官能基(K)の平均個数は、ハロゲン化物を使用してエーテル化反応により化学修飾した場合、ポリペプチド(P)及び細胞接着性ポリペプチドを構成する各アミノ酸数をポストラベル法によるHPLC測定により求めた各アミノ酸のピーク面積から、下記式により求めることができる(ポリペプチドに塩酸等の酸を加え加熱することにより、ポリペプチドをアミノ酸に加水分解してから、オルトフタルアルデヒド又はニンヒドリンを用いてラベル化したアミノ酸をHPLCにより、アミノ酸のピーク面積を求める方法)。なお、化学修飾されないグリシンのピークを標準として用いる。
【0067】
官能基(K)の平均個数=Σ{γ−(βa/αa)/(β0/α0)×γ}
【0068】
α0:ポリペプチド(P)中のグリシンのHPLCのピーク面積
β0:ポリペプチド(P)中の各アミノ酸のHPLCのピーク面積
αa:細胞接着性ポリペプチド中のグリシンのHPLCのピーク面積
βa:細胞接着性ポリペプチド中の各アミノ酸のHPLCのピーク面積
γ: ポリペプチド(P)中の各アミノ酸の数
【0069】
ハロゲン化物以外の化合物(A)により化学修飾した場合、官能基(K)の平均個数は、ポリペプチド(P)及び細胞接着性ポリペプチドについて、MALDI−TOF MSを測定し、m/z値およびそのピーク強度を求め、下記式に当てはめることにより求めることができる。
【0070】
官能基の平均個数={[Σ(PMn×Nn)/100]−PM0}/L
【0071】
PM0:ポリペプチド(P)のm/z値
PMn:細胞接着性ポリペプチドのm/z値
Nn:細胞接着性ポリペプチドの全ピーク強度の和を100%とした場合のPMnのピーク強度の割合(%)
L:化合物(A)1分子がポリペプチド(P)1分子に結合した際に増加する分子量
Lは、例えば、化合物(A)がパントテン酸であり、パントテン酸のヒドロキシル基とポリペプチド(P)に含まれる反応性基含有アミノ酸残基のカルボキシル基(反応性基)とを脱水縮合反応させた場合、下記のように計算できる。
L=219(パントテン酸の分子量)−18(水の分子量)=201
したがって、この場合、Lは201である。
【0072】
細胞接着性ポリペプチドは、細胞表面タンパク質であるインテグリンとの結合により細胞と接着する。
本発明の細胞接着性ポリペプチドは、ポリペプチド(P)に含まれる反応性基含有アミノ酸残基をカルボキシル基、スルホ基及びヒドロキシル基からなる群より選ばれる少なくとも1種の官能基(K)を有する化合物(A)で化学修飾することにより、ポリペプチド(P)では接着できない種類のインテグリンと結合できるようになるため(多種のインテグリンと結合できるため)、細胞接着性ペプチドが低濃度であっても接着活性に優れると考えられる。
【0073】
本発明の細胞接着性ポリペプチドは、基材(B)とともに細胞接着性ポリペプチド含有基材とすることができる。
基材(B)の材質、形状、及び細胞接着性ポリペプチドの基材(B)への結合方法は、特開2005−2106号公報に記載されたものをそのまま適用できる。
【0074】
本発明のポリペプチド含有基材に含まれる細胞接着性ポリペプチドの含有量(以下、コーティング量と記載することがある。)は、細胞接着性及び細胞増殖性の観点等から、本発明のポリペプチド含有基材の単位面積あたり、0.1μg/cm2〜4μg/cm2が好ましく、さらに好ましくは0.1μg/cm2〜3μg/cm2、特に好ましくは0.4μ/cm2〜2μg/cm2である。
【0075】
なお、本発明において、単位面積は、基材(B)の表面のうち、培養される細胞が接着し得る表面の表面積を意味し、細胞が入り込まないような微小な凹凸(例えば、1μm以下)は平坦な表面として取扱うが、単位面積を高める目的でリブ(畝)等が設けてあるものについてはそのリブの表面積を単位面積に含まれる。
単位面積あたりの細胞接着性ポリペプチドの含有量の測定方法は特に限定されないが、例えば、免疫学的測定法が利用できる。具体的な方法としては、特開2005−2106号公報に記載されたものをそのまま適用できる。
【0076】
本発明の細胞接着性ポリペプチド含有基材は、必要に応じて滅菌処理を施してもよい。
滅菌方法としては、特に限定されないが、放射線滅菌、エチレンオキサイドガス滅菌、プラズマ滅菌、γ線滅菌、アルコール滅菌、オートクレーブ滅菌及び乾熱滅菌等が挙げられる。
【0077】
本発明の細胞接着性ポリペプチドを用いて細胞培養する工程を含む細胞又は細胞集合体の生産方法としては、公知の細胞接着性ポリペプチド又は培養基材の代わりに本発明の細胞接着性ポリペプチド又は細胞接着性ポリペプチド含有基材を使用する以外、公知の方法が適用できる。
【0078】
細胞培養工程としては、本発明の細胞接着性ポリペプチド、細胞接着性ポリペプチド含有基材又は、本発明の細胞接着性ポリペプチド及び本発明の細胞接着性ポリペプチド含有基材が入った適当な容器(シャーレ、プレート、フラスコ、ビーカー及びファーメンター等)に、細胞(CE)を縣濁させた培地を加えて適当な条件で培養する方法等が挙げられる。
【0079】
本発明の細胞接着性ポリペプチド含有基材に接着できる細胞(CE)としては特に制限がないが、生体組織や臓器の実質細胞、成熟細胞、肝細胞、ES細胞、iPS細胞、上皮細胞、内皮細胞及び表皮細胞等が挙げられる。主に医薬品等の有用物質生産や治療等に用いられる哺乳動物由来の正常細胞、哺乳動物由来の株化細胞及び昆虫細胞が適している。具体的には特開2005−2106号公報に記載された細胞等が挙げられる。
【0080】
本発明の細胞接着性ポリペプチド含有基材を用いる細胞培養方法に用いる培地としては、特に制限は無く、一般の細胞培養に用いられるものが利用できる。また、これら培地に必要に応じて、血清、細胞増殖因子及び/又は抗菌剤等を添加したものも利用できる。培地、血清及びその使用量、細胞増殖因子及びその使用量、並びに抗菌剤及びその使用量の具体例としては、特開2005−2106号公報に記載されたものがそのまま利用できる。
【0081】
細胞の播取量、培養条件、培養後の細胞回収方法についても、特開2005−2106号公報に記載されたものがそのまま利用できる。
【0082】
細胞接着性ポリペプチド含有基材を用いる細胞培養で得られる細胞(CE2)としては、細胞接着性ペプチド含有基材に接着できる細胞(CE)と同じものが挙げられる。なお、細胞(CE)が分化して、元の細胞(CE)とは異なる細胞(CE2)が得られる場合がある。例えば、元の細胞(CE)が骨髄未分化間葉系幹細胞であって、細胞(CE2)が骨芽細胞、軟骨細胞又は脂肪細胞等の場合である(ティッシュ・エンジニアリング、上田実 編、財団法人名古屋大学出版会、1999年10月10日)。
【実施例】
【0083】
以下、実施例により本発明をさらに詳しく説明するが、本発明はこれに限定されるものではない。
<実施例1>
(1)ポリペプチド(P1−0)の作製
特表平3−502935号公報中の実施例記載の方法に準じて、Ile Lys Val Ala Val配列(7)と(Gly Ala Gly Ala Gly Ser)9配列(20)とを各々約13個有し、数平均分子量約11万のペプチド(86)を遺伝子組換え大腸菌により製造し、カラムクロマトグラフィーにて精製してポリペプチド(P1−0)を得た。
【0084】
(2)化学修飾した細胞接着性ポリペプチド(P1−1)の作製
ポリペプチド(P1−0)50mgとクロロ酢酸230mgとを4.5M過塩素酸リチウム水溶液1.5mLに溶解した後、その溶液を攪拌しながら、水酸化ナトリウム100mgを溶解した4.5M過塩素酸リチウム水溶液1.325mLを一定速度で滴下した。室温(約25℃)で1時間攪拌したのち、反応液を透析、凍結乾燥して、水溶性の直鎖状ポリペプチド(化学修飾した細胞接着性ポリペプチド;P1−1)を得た。
【0085】
(3)細胞接着性ポリペプチド含有基材[PB1]の作製
化学修飾した細胞接着性ポリペプチド(P1−1)1mgを脱イオン水1mLに溶解し、さらに、99.5重量%塩化ナトリウムを0.85重量%含有する0.02Mリン酸緩衝液(pH7.2、PBS)で希釈して、細胞接着性ポリペプチド(P1−1)溶液(A1〜A3){細胞接着性ポリペプチド(P1−1)の濃度; A1:0.005、A2:5及びA3:50μg/mL}を作製した。この溶液(A1〜A3)を96穴(96ウェル)のポリスチレンプレート(日本ベクトン・ディッキンソン株式会社)中の8穴(8ウェル)ずつにそれぞれ50μL/ウェルで投入し、室温(約25℃)で2時間放置した。アスピレーターを用いて溶液を除去した後、生理食塩水100μL/ウェルで2回洗浄しさらに脱イオン水100μL/ウェルで洗浄して、本発明の細胞接着性ポリペプチド含有基材[PB1](コーティング量が異なるPB1−1〜PB1−3)を得た。
【0086】
<実施例2>
(1)化学修飾した細胞接着性ポリペプチド(P1−2)の作製
「クロロ酢酸230mg」を「2−クロロエタンスルホン酸ナトリウム405mg」に変更したこと以外、実施例1と同様にして、水溶性の直鎖状ポリペプチド(化学修飾した細胞接着性ポリペプチド;P1−2)を得た。
【0087】
(2)細胞接着性ポリペプチド含有基材[PB2]の作製
「化学修飾した細胞接着性ポリペプチド(P1−1)」を「化学修飾した細胞接着性ポリペプチド(P1−2)」に変更したこと以外、実施例1と同様にして、本発明の細胞接着性ポリペプチド含有基材[PB2](コーティング量が異なるPB2−1〜PB2−3)を得た。
【0088】
<実施例3>
(1)化学修飾した細胞接着性ポリペプチド(P1−3)の作製
「クロロ酢酸230mg」を「クロロエタノール94mg」に変更したこと以外、実施例1と同様にして、水溶性の直鎖状ポリペプチド(化学修飾した細胞接着性ポリペプチド;P1−3)を得た。
【0089】
(2)細胞接着性ポリペプチド含有基材[PB3]の作製
「化学修飾した細胞接着性ポリペプチド(P1−1)」を「化学修飾した細胞接着性ポリペプチド(P1−3)」に変更したこと以外、実施例1と同様にして、本発明の細胞接着性ポリペプチド含有基材[PB3](コーティング量が異なるPB3−1〜PB3−3)を得た。
【0090】
<実施例4>
(1)化学修飾した細胞接着性ポリペプチド(P1−4)の作製
「クロロ酢酸230mg」を「フルオロ酢酸191mg」に変更したこと以外、実施例1と同様にして、水溶性の直鎖状ポリペプチド(化学修飾した細胞接着性ポリペプチド;P1−4)を得た。
【0091】
(2)細胞接着性ポリペプチド含有基材[PB4]の作製
「化学修飾した細胞接着性ポリペプチド(P1−1)」を「化学修飾した細胞接着性ポリペプチド(P1−4)」に変更したこと以外、実施例1と同様にして、本発明の細胞接着性ポリペプチド含有基材[PB4](コーティング量が異なるPB4−1〜PB4−3)を得た。
【0092】
<実施例5>
(1)化学修飾した細胞接着性ポリペプチド(P1−5)の作製
「クロロ酢酸230mg」を「フルオロスルホン酸ナトリウム221mg」に変更したこと以外、実施例1と同様にして、水溶性の直鎖状ポリペプチド(化学修飾した細胞接着性ポリペプチド;P1−5)を得た。
【0093】
(2)細胞接着性ポリペプチド含有基材[PB5]の作製
「化学修飾した細胞接着性ポリペプチド(P1−1)」を「化学修飾した細胞接着性ポリペプチド(P1−5)」に変更したこと以外、実施例1と同様にして、本発明の細胞接着性ポリペプチド含有基材[PB5](コーティング量が異なるPB5−1〜PB5−3)を得た。
【0094】
<実施例6>
(1)化学修飾した細胞接着性ポリペプチド(P1−6)の作製
「クロロ酢酸230mg」を「2−フルオロエタノール75.4mg」に変更したこと以外、実施例1と同様にして、水溶性の直鎖状ポリペプチド(化学修飾した細胞接着性ポリペプチド;P1−6)を得た。
【0095】
(2)細胞接着性ポリペプチド含有基材[PB6]の作製
「化学修飾した細胞接着性ポリペプチド(P1−1)」を「化学修飾した細胞接着性ポリペプチド(P1−6)」に変更したこと以外、実施例1と同様にして、本発明の細胞接着性ポリペプチド含有基材[PB6](コーティング量が異なるPB6−1〜PB6−3)を得た。
【0096】
<比較例1>(特許文献1)
「化学修飾した細胞接着性ポリペプチド(P1−1)」を「直鎖状ポリペプチド(P1−0)」に変更したこと以外、実施例1と同様にして、比較用の細胞接着性ポリペプチド含有基材[PB7](コーティング量が異なるPB7−1〜PB7−3)を得た。
【0097】
<比較例2>(特許文献2)
(1)化学修飾した細胞接着性ポリペプチド(P1−7)の作製
「クロロ酢酸230mg」を「N,N−ジメチルアミノエチルクロリド150mg」に変更したこと以外、実施例1と同様にして、水溶性の直鎖状ポリペプチド(化学修飾した細胞接着性ポリペプチド;P1−7)を得た。
【0098】
(2)細胞接着性ポリペプチド含有基材[PB8]の作製
「化学修飾した細胞接着性ポリペプチド(P1−1)」を「化学修飾した細胞接着性ポリペプチド(P1−7)」に変更した以外、実施例1と同様にして、比較用の細胞接着性ポリペプチド含有基材[PB8](コーティング量が異なるPB8−1〜PB8−3)を得た。
【0099】
<コーティング量の測定>
Micro BCATM protein assay kit(THERMO Fisher Scientific社製)のReagent A溶液:Reagent B溶液:Reagent C溶液=25:24:1の混合液(C)を得た。細胞接着性ポリペプチド含有基材[PB1]〜[PB8](コーティング量の異なるPB1−1〜PB8−3)の各ウェルに混合液(C)を100μL加え、37℃で2時間静置した。
【0100】
2時間後に、ビシンコニン酸(BCA)とCu+とからなるキレートの生成量を、450nm(対照波長630nm)の吸光度でプレートリーダー(コロナ電気株式会社製MTP−32)を用いて測定し、あらかじめウシ血清アルブミンにより作成した検量線からコーティング量を得た。これらの結果を表1〜4に示す(これらの結果は各々8穴分(8ウェル分)の平均データである。)。
【0101】
<化学修飾により導入された官能基(K)の平均個数の測定>
化学修飾した細胞接着性ポリペプチド(P1−1)1mgを6N 塩酸200μLに加え脱気した。泡が発生しなるまで脱気した溶液を減圧密封下で110℃、22時間の加水分解を行った。次に、エバポレーターを用いて6N 塩酸を試料希釈液(アミノ酸自動分析用試料希釈液 Na型 pH2.20)に置換した後、2mlに試料希釈液でフィルアップ(full up)した。フィルアップした溶液を試料希釈液で10倍希釈し、0.2μmのフィルターを通し測定用試料とした。
【0102】
分析はポストラベル法によるHPLC測定を用いて行い、ラベル化試薬としてはオルトフタルアルデヒド、スタンダードとしてはアミノ酸混合標準液 H型を用いて、HPLCでの溶出時間からアミノ酸の種類を同定した。
上記において、(P1−1)にかえて(P1−0)を用いる以外は同様にして、HPLC測定を行った。
【0103】
カラム:Shim−pack Amino−Na
カラム温度:60℃
移動相:アミノ酸分析移動相セット(Na 型)(メーカー名:株式会社島津製作所)
流速:0.6ml/min
検出波長:励起波長350nm,測定波長450nm
(P1−0)及び(P1−1)のHPLCのピーク面積から、下記式により官能基(K)の平均個数を算出した。なお、化学修飾されないグリシンのピークを標準として用いた。
【0104】
官能基(K)の平均個数=Σ{γ−(βa/αa)/(β0/α0)×γ}
【0105】
α0:ポリペプチド(P1−0)中のグリシンのHPLCのピーク面積
β0:ポリペプチド(P1−0)中の各アミノ酸のHPLCのピーク面積
αa:細胞接着性ポリペプチド(P1−1)中のグリシンのHPLCのピーク面積
βa:細胞接着性ポリペプチド(P1−1)中の各アミノ酸のHPLCのピーク面積
γ:ポリペプチド(P1−0)中の各アミノ酸の数
【0106】
上記において、細胞接着性ポリペプチド(P1−1)に変えて細胞接着性ポリペプチド(P1−2)〜(P1−7)を用いたこと以外、上記と同様にして、化学修飾された細胞接着性ポリペプチド(P1−2)〜(P1−7)について、化学修飾により導入された官能基(K)の平均個数を求めた。これらの結果を表1〜4に示す。
【0107】
<評価:GE1細胞(マウス歯肉上皮由来細胞)の細胞接着活性>
PBSに牛血清アルブミンを0.2重量%含有する水溶液を[PB1]〜[PB8]の評価基材に50μL/ウェルで投入し、27±3℃で2時間放置した。アスピレーターを用いて溶液を除去した後、生理食塩水100μL/ウェルで2回洗浄し、さらに脱イオン水100μL/ウェルで洗浄した。次に、血清を含まないDMEM(ICN Biomedicals社製)を100μL/ウェルで添加し、30℃インキュベーター内に1時間保存した。1時間後、GE1細胞(大日本製薬株式会社製)を1万cells/ウェルで添加し、30℃、二酸化炭素濃度5容量%のインキュベーター中にて2時間放置して培養した。
【0108】
培養終了後、アスピレーターを用いて培地を除去し、生理食塩水を細胞に直接当たらないように注意しながら100μL/ウェルで添加し、アスピレーターを用いて生理食塩水を除去した。次にPBSを50μL/ウェルで添加し、さらにテトラカラーワン(生化学工業株式会社)を10μL/ウェルで添加して、37℃、二酸化炭素濃度5容量%のインキュベーター中に4時間放置した。
【0109】
4時間後に、ホルマザン生成量を、450nm(対照波長630nm)の吸光度でプレートリーダー(コロナ電気株式会社製MTP−32)を用いて測定し、この値を細胞接着活性とした。細胞接着活性は、当該吸光度の高さに比例する。これらの結果を表1に示す(これらの結果は各々8穴分(8ウェル分)の平均データである。)。また、得られた結果について、縦軸をGE1細胞の細胞接着活性、横軸をコーティング量としてプロットし、グラフを作成した(図1)。
【0110】
<評価:GE1細胞(マウス歯肉上皮細胞由来細胞)の細胞増殖活性>
[PB1]〜[PB8]の評価基材に血清を含まないDMEM(ICN Biomedicals社製)を100μL/ウェルで添加し、33℃インキュベーター内に1時間保存した。1時間後、GE1細胞(大日本製薬株式会社製)を1000cells/ウェルで添加し、33℃、二酸化炭素濃度5容量%のインキュベーター中にて2時間放置して培養した。
【0111】
培養終了後、アスピレーターを用いて培地を除去し、生理食塩水を細胞に直接当たらないように注意しながら100μL/ウェルで添加し、アスピレーターを用いて生理食塩水を除去した。次に10容量%の血清を含むDMEMを100μL/ウェルで添加し、33℃、二酸化炭素濃度5容量%のインキュベーター中に15日間培養した。また、5日間ごとに培地を交換した。
【0112】
15日後に、テトラカラーワン(生化学工業株式会社)を10μL/ウェルで添加して、37℃、二酸化炭素濃度5容量%のインキュベーター中に4時間放置した。4時間後に、ホルマザン生成量を、450nm(対照波長630nm)の吸光度でプレートリーダー(コロナ電気株式会社製MTP−32)を用いて測定し、この値を細胞増殖活性とした。細胞増殖活性は、当該吸光度の高さに比例する。これらの結果を表3に示す(これらの結果は各々8穴分(8ウェル分)の平均データである。)。また、得られた結果について、縦軸をGE1細胞の細胞増殖活性、横軸をコーティング量としてプロットし、グラフを作成した(図3)。
【0113】
<評価:C3H10T1/2細胞(マウス胎児由来線維芽細胞)の細胞接着活性>
PBSに牛血清アルブミンを0.2重量%含有する水溶液を[PB1]〜[PB8]の評価基材に50μL/ウェルで投入し、27±3℃で2時間放置した。アスピレーターを用いて溶液を除去した後、生理食塩水100μL/ウェルで2回洗浄し、さらに脱イオン水100μL/ウェルで洗浄した。次に、血清を含まないDMEM(ICN Biomedicals社製)を100μL/ウェルで添加し、37℃インキュベーター内に1時間保存した。1時間後、C3H10T1/2細胞(大日本製薬株式会社製)を1万cells/ウェルで添加し、37℃、二酸化炭素濃度5容量%のインキュベーター中にて2時間放置して培養した。
【0114】
培養終了後、アスピレーターを用いて培地を除去し、生理食塩水を細胞に直接当たらないように注意しながら100μL/ウェルで添加し、アスピレーターを用いて生理食塩水を除去した。次にPBSを50μL/ウェルで添加し、さらにテトラカラーワン(生化学工業株式会社)を10μL/ウェルで添加して、37℃、二酸化炭素濃度5容量%のインキュベーター中に4時間放置した。
【0115】
4時間後に、ホルマザン生成量を、450nm(対照波長630nm)の吸光度でプレートリーダー(コロナ電気株式会社製MTP−32)を用いて測定し、この値を細胞接着活性とした。細胞接着活性は、当該吸光度の高さに比例する。これらの結果を表2に示す(これらの結果は各々8穴分(8ウェル分)の平均データである。)。また、得られた結果について、縦軸をC3H10T1/2細胞の細胞接着活性、横軸をコーティング量としてプロットし、グラフを作成した(図2)。
【0116】
<評価:C3H10T1/2細胞(マウス歯肉上皮細胞由来細胞)の細胞増殖活性>
[PB1]〜[PB8]の評価基材に血清を含まないDMEM(ICN Biomedicals社製)を100μL/ウェルで添加し、37℃インキュベーター内に1時間保存した。1時間後、C3H10T1/2細胞(大日本製薬株式会社製)を1000cells/ウェルで添加し、37℃、二酸化炭素濃度5容量%のインキュベーター中にて2時間放置して培養した。
【0117】
培養終了後、アスピレーターを用いて培地を除去し、生理食塩水を細胞に直接当たらないように注意しながら100μL/ウェルで添加し、アスピレーターを用いて生理食塩水を除去した。次に10容量%の血清を含むDMEMを100μL/ウェルで添加し、37℃、二酸化炭素濃度5容量%のインキュベーター中に15日間培養した。また、5日間ごとに培地を交換した。
【0118】
15日後に、テトラカラーワン(生化学工業株式会社)を10μL/ウェルで添加して、37℃、二酸化炭素濃度5容量%のインキュベーター中に4時間放置した。4時間後に、ホルマザン生成量を、450nm(対照波長630nm)の吸光度でプレートリーダー(コロナ電気株式会社製MTP−32)を用いて測定し、この値を細胞増殖活性とした。細胞増殖活性は、当該吸光度の高さに比例する。これらの結果を表4に示す(これらの結果は各々8穴分(8ウェル分)の平均データである。)。また、得られた結果について、縦軸をC3H10T1/2細胞の細胞増殖活性、横軸をコーティング量としてプロットし、グラフを作成した(図4)。
【0119】
<評価:インテグリンの抗体添加による細胞接着阻害活性>
C3H10T1/2細胞(大日本製薬株式会社製)を血清を含まないDMEM(ICN Biomedicals社製)に400,000cells/mlで懸濁した。この細胞懸濁液に各インテグリン(α3、α4、αV、α6、β1及びβ4)の抗体(入手先;α3:Chemicon社、β4:Millipore社、αV:BioLegend社、α4,α6,β1:R&D systems社)のいずれかを10μg/mlの濃度で添加し、37℃、二酸化炭素濃度5容量%のインキュベーター中で30分間放置して、インテグリン抗体結合細胞を得た。これらのインテグリン抗体結合細胞と、基材[PB1−3、PB2−3、PB3−3、PB7−3及びPB8−3]とを用いて、上記と同様にして、細胞接着活性を測定し、この細胞接着活性の測定値(G1)と表2の細胞接着活性(G0)とから、細胞接着阻害(%)を下記式により求め、下記の基準で評価した。
【0120】
細胞接着阻害(%)={(G0)−(G1)}/(G0)×100
−:細胞接着阻害0%以上10%未満
+:細胞接着阻害10%以上20%未満
++:細胞接着阻害20%以上40%未満
+++:細胞接着阻害40%以上
【0121】
インテグリンの抗体を加えると、細胞表面のインテグリンがインテグリン抗体によりマスクされ、細胞接着が阻害されるため、細胞が細胞接着性ポリペプチドに接着できなくなる。したがって、それぞれのインテグリン抗体の添加による細胞接着阻害が大きいほど、細胞接着性ポリペプチドがそのインテグリンと結合していたことを意味する。これらの結果を表5に示す。
【0122】
【表1】

アスタリスクは比較例1との有意差を示す(*P<0.05、**P<0.01)。なお、t検定により有意差を判定した。
【0123】
表1において、本発明の細胞接着性ポリペプチド(P1−1)〜(P1−6)をコーティングした基材[PB1]〜[PB6](実施例1〜6)は、官能基を導入していないポリペプチドをコーティングした基材[PB7](比較例1)と比較して、コーティング量が0.5μg/cm2近辺である場合(PB1−1〜PB6−1)、すべての実施例の基材が比較例1(PB7−1)の基材よりも細胞接着活性が優れていた。特に、実施例1、2及び6の基材は、コーティング量が0.5μg/cm2近辺での細胞接着活性が、比較例1の基材の細胞接着活性よりも有意に高かった。さらに、コーティング量が2μg/cm2近辺である場合(実施例1〜6の基材(PB1−2〜PB6−2)と比較例1の基材(PB7−2)を比較した場合)も、本発明の実施例の基材が比較例の基材よりも細胞接着性が優れていた。このことは、図1からも明らかである。したがって、本発明の細胞接着性ポリペプチドは、コーティング量を減らしても細胞接着性が極めて優れていることがわかる。
【0124】
また、第3級アミノ基を導入した比較例2の基材は、化学修飾されたアミノ酸の平均個数が同程度である実施例2の基材と比較して、全てのコーティング量において実施例2の基材の方が細胞接着活性が高く、細胞接着性が優れていた。
【0125】
【表2】

アスタリスクは比較例1との有意差を示す(*P<0.05、**P<0.01)。なお、t検定により有意差を判定した。
【0126】
表2において、コーティング量が0.5μg/cm2近辺である場合(PB1−1〜PB7−1を比較した場合)、すべての実施例の基材が比較例1の基材よりも細胞接着活性が高く、細胞接着性が優れていた。特に、実施例1、2、4、5及び6の基材は、コーティング量が0.5μg/cm2近辺での細胞接着活性が、比較例1の基材の細胞接着活性よりも有意に高かった。このことは図2からも明らかである。したがって、本発明の細胞接着性ポリペプチドは、様々な細胞種で細胞接着性が優れていることがわかる。
【0127】
また、第3級アミノ基を導入した比較例2の基材は、化学修飾されたアミノ酸の平均個数が同程度である実施例2の基材と比較して、全てのコーティング量において実施例2の基材の方が細胞接着活性が高く、細胞接着性が優れていた。
【0128】
【表3】

アスタリスクは比較例1との有意差を示す(*P<0.05、**P<0.01)。なお、t検定により有意差を判定した。
【0129】
表3において、本発明の細胞接着性ポリペプチドをコーティングした基材[PB1]〜[PB6](実施例1〜6)は、官能基を導入していないポリペプチドをコーティングした基材[PB7](比較例1)及び第3級アミノ基を導入した基材[PB8](比較例2)と比較して、コーティング量が低濃度である0.5μg/cm2近辺(PB1−1〜PB8−1を比較した場合)での細胞増殖活性が高かった。特に、官能基の平均個数が60〜90である実施例1、2、及び6の基材において有意に高かった。このことは、図3からも明らかである。
【0130】
さらに、比較例2の基材は、化学修飾された官能基の平均個数が同程度である実施例2の基材と比較して、全てのコーティング量において実施例2の基材の方が細胞増殖活性が高く、細胞増殖性が優れていた。
【0131】
【表4】

アスタリスクは比較例1との有意差を示す(*P<0.05、**P<0.01)。なお、t検定により有意差を判定した。
【0132】
表4において、コーティング量が0.5μg/cm2近辺である場合(PB1−1〜PB8−1を比較した場合)、すべての実施例の基材が比較例1及び2の基材よりも細胞増殖活性が高く、細胞増殖性が優れていた。特に、実施例1、2及び6の基材は、コーティング量が0.5μg/cm2近辺での細胞増殖活性が、比較例1の基材の細胞増殖活性よりも有意に高かった。このことは図4からも明らかである。したがって、本発明の細胞接着性ポリペプチドは、様々な細胞種で細胞増殖性が優れていることが分かる。
【0133】
また、第3級アミノ基を導入した比較例2の基材に対して、実施例1〜6の基材は2μg/cm2近辺での細胞増殖活性が高く、細胞増殖性が優れていた。
【0134】
さらに、比較例2の基材は、化学修飾された官能基の平均個数が同程度である実施例2の基材と比較して、全てのコーティング量において実施例2の基材の方が細胞増殖活性が高く、細胞増殖性が優れていた。
【0135】
【表5】

【0136】
表5において、カルボキシル基又はスルホ基により化学修飾された本発明の細胞接着性ポリペプチド(実施例1及び2)及び第3級アミノ基を導入した細胞接着性ポリペプチド(比較例2)は、インテグリン(α3、α4、αV、α6、β1及びβ4)の抗体により細胞接着が阻害されており、比較例1の細胞接着性ポリペプチドと比べて、新たに、細胞表面のインテグリン(αV、α6及びβ4)と接着していることが分かった。また、カルボキシル基又はスルホ基により化学修飾された本発明の細胞接着性ポリペプチド(実施例1及び2)は、同様に、比較例2の細胞接着性ポリペプチドと比べて、新たに、細胞表面のインテグリン(αV)と接着していることが分かった。以上の通り、本発明の細胞接着性ポリペプチドは、比較例1、2の細胞接着性ポリペプチドと比較して、より多くの種類のインテグリンと結合するため、細胞接着性ポリペプチドが低濃度であっても細胞接着性が優れると考えられる。
【0137】
<実施例7〜12>
実施例1〜6で得た細胞接着性ポリペプチド(P1−1)〜(P1−6)を用いたマウス胎児由来線維芽細胞の細胞集合体の作製
1重量%ポリビニルアルコール(JP−18、日本塩ビ・ポバール株式会社製)水溶液をコーティングして細胞が接着しないようにした細胞非接着性スピンナーフラスコ(Double CelStir Spinner Flask、Wheaton社製)に、DMEM培地(ICN Biomedicals社製)8ml、C3H10T1/2細胞(マウス胎児由来線維芽細胞)懸濁液1ml(107cells/ml)、細胞接着性ポリペプチド(P1−1)1ml(1μg/ml)をそれぞれ加え、80rpm、37℃、二酸化炭素濃度5容量%のインキュベーター中にて旋回培養を行った。
また、細胞接着性ポリペプチド(P1−2)〜(P1−6)についても上記と同様にして、旋回培養を行った。
【0138】
培養6時間後、培養液300μLをそれぞれのフラスコから回収し、回収しなかった培養液については、7日間培養を継続した。
回収した各培養液を、U底96wellプレートに3カ所ずつ、それぞれ100μl/ウェルで添加した。その後、それぞれのウェルについて、細胞集合体の顕微鏡画像(倍率40倍、CKX41、OLYMPUS社製)を取得し、画像解析ソフト(image J、アメリカ国立衛生研究所)及びマイクロメーター(目盛10μm、目盛長1mm)を用いて解析することにより、得られた細胞集合体(1)〜(6)の粒子径と粒度分布を測定した。測定した結果は、3カ所のウェルの平均値及びばらつきで示した。結果を表6に示す。
なお、画像解析ソフトにより得られる数値の単位が「ピクセル」であるため、マイクロメーターにより画像を計測して、1ピクセルが何μmに相当するのかを算出し、実際の単位「μm」に換算した。
【0139】
<比較例3及び4>
比較例1〜2で使用した細胞接着性ポリペプチド(P1−0)又は(P1−7)を用いたマウス胎児由来線維芽細胞の細胞集合体の作製
細胞接着性ポリペプチド(P1−1)〜(P1−6)を細胞接着性ポリペプチド(P1−0)又は(P1−7)に変更したこと以外、実施例7〜12と同様にして、細胞集合体(7)〜(8)を作成し、細胞集合体の粒子径と粒度分布を測定した。結果を表6に示す。
【0140】
<比較例5>
U底96wellプレートに1重量%ポリビニルアルコール(JP−18、日本塩ビ・ポバール株式会社製)水溶液を50μl/ウェルで加え、37℃で15分間放置した。15分後、ポリビニルアルコール水溶液を除去し、PBS溶液を100μl/ウェルで加えて2回洗浄した。
洗浄したウェルに、C3H10T1/2細胞(マウス胎児由来線維芽細胞)懸濁液1ml(104cells /ml)を加え、37℃で7日間培養した。
【0141】
<細胞集合体の活性評価;ミトコンドリア活性>
培養して7日後の実施例7〜12、比較例3〜5の培養液を、それぞれU底96wellプレートに3カ所ずつ、それぞれ100μl/ウェルで添加し、さらにテトラカラーワン(生化学工業株式会社)を10μL/ウェルで添加して、37℃、二酸化炭素濃度5容量%のインキュベーター中に4時間放置した。
【0142】
4時間後に、ホルマザン生成量を、450nm(対照波長630nm)の吸光度でプレートリーダー(コロナ電気株式会社製MTP−32)を用いて測定した。生細胞数は細胞集合体に核放出溶液(0.2重量%クリスタルバイオレット、0.2Mクエン酸3ナトリウム、2重量%Tween20)を加え、1時間置くことで生細胞の核を細胞から放出させ、血球計数盤を用いて核数を測定した。ホルマザン生成量を生細胞数で標準化し、細胞集合体のミトコンドリア活性とした。測定した結果は、3カ所のウェルの平均値で評価した。また、実施例7〜12、比較例3及び4のミトコンドリア活性は、比較例5のミトコンドリア活性を100とした場合の相対値で表した。これらの結果を表6に示す。
【0143】
【表6】

【0144】
表6から、本発明の細胞接着性ポリペプチド(P1−1)〜(P1−6)を使用して得た細胞集合体(1)〜(6)(実施例7〜12;6時間培養後)の粒径は71〜107μmであり、比較の細胞接着性ポリペプチド(P1−0)又は(P1−7)を使用して得た細胞集合体(7)及び(8)(比較例3、4;6時間培養後)の粒径53μm及び64μmよりも有意に大きかった。
【0145】
また、本発明の細胞接着性ポリペプチドを使用して作製した細胞集合体(1)〜(6)の粒径のばらつきは±10μm〜±30μmであり、比較の細胞接着性ポリペプチドを使用して作製した細胞集合体(7)及び(8)の粒径のばらつき±31μm及び±32μmより小さかった。
したがって、本発明の細胞接着性ポリペプチドを用いれば、比較用の細胞集合体に比べて、粒径の大きな細胞集合体を得ることができた。また、本発明の細胞接着性ポリペプチドを用いれば、粒径のばらつきの小さな細胞集合体を得ることができた。
【0146】
また、表6の培養7日間後のミトコンドリア活性の測定結果から、本発明の細胞接着性ポリペプチド(P1−1)〜(P1−6)を使用した細胞培養(実施例7〜12)では89以上と、細胞接着性ポリペプチドを用いていない細胞培養(比較例5)と同等程度又はそれ以上であり、活性の高い細胞集合体を得られた。特に、実施例7〜10の細胞培養では105〜140と比較例5の細胞培養よりも高く、得られた細胞集合体の活性が非常に高かった。
【0147】
<実施例13〜18>
実施例1〜6で得た細胞接着性ポリペプチド(P1−1)〜(P1−6)を用いた肝臓由来細胞の細胞集合体の作製
1重量%ポリビニルアルコール(JP−18、日本塩ビ・ポバール株式会社製)水溶液でコーティングして細胞が接着しないようにした細胞非接着性スピンナーフラスコ(Double CelStir Spinner Flask、Wheaton社製)に、DMEM培地(ICN Biomedicals社製)8ml、HepG2細胞(肝臓由来細胞)懸濁液1ml(107cells/ml)、細胞接着性ポリペプチド(P1−1)1ml(1μg/ml)をそれぞれ加え、80rpm、37℃、二酸化炭素濃度5容量%のインキュベーター中にて旋回培養を行った。
また、細胞接着性ポリペプチド(P1−2)〜(P1−6)についても上記と同様にして、旋回培養を行った。
【0148】
培養6時間後、培養液300μLをそれぞてのフラスコから回収し、回収しなかった培養液については、7日間培養を継続した。
回収した各培養液を、U底96wellプレートに3カ所ずつ、それぞれ100μl/ウェルで添加した。その後、それぞれのウェルについて、細胞集合体の顕微鏡画像を取得し、得られた細胞集合体(9)〜(14)の粒子径と粒度分布を測定した。測定した結果は、3カ所のウェルの平均値及びばらつきで示した。結果を表7に示す。
【0149】
<比較例6及び7>
比較例1〜2で使用した細胞接着ポリペプチド(P1−0)又は(P1−7)を用いた肝臓由来細胞の細胞集合体の作製
細胞接着性ポリペプチド(P1−1)〜(P1−6)を細胞接着性ポリペプチド(P1−0)又は(P1−7)に変更したこと以外、実施例7〜12と同様にして、細胞集合体(15)〜(16)を作成し、細胞集合体の粒子径と粒度分布を測定した。結果を表7に示す。
【0150】
<比較例8>
U底96wellプレートに1重量%ポリビニルアルコール(JP−18、日本塩ビ・ポバール株式会社製)水溶液を50μl/ウェルで加え、37℃で15分間放置した。15分後、ポリビニルアルコール水溶液を除去し、PBS溶液を100μl/ウェルで加えて2回洗浄した。
洗浄したウェルに、HepG2細胞(肝臓由来細胞)懸濁液1ml(104cells/ml)を加え、37℃で7日間培養した。
【0151】
<細胞集合体の活性評価;チトクローム活性>
培養して7日後の実施例13〜18、比較例6〜8の培養液を、それぞれU底96wellプレートに3カ所ずつ、それぞれ100μl/ウェルで添加し、さらにP450−GLOTMCYP3A4 assay(プロメガ)を用いてチトクローム活性を測定した。生細胞数は細胞集合体に核放出溶液(0.2重量%クリスタルバイオレット、0.2Mクエン酸3ナトリウム、2重量%Tween20)を加え、1時間置くことで生細胞の核を細胞から放出させ、血球計数盤を用いて核数を測定した。チトクローム活性を生細胞数で標準化し、細胞集合体のチトクローム活性とした。測定した結果は、3カ所のウェルの平均値で評価した。また、実施例13〜18、比較例6及び7のチトクローム活性は、比較例8のチトクローム活性を100とした場合の相対値で表した。これらの結果を表7に示す。
【0152】
【表7】

【0153】
表7から、本発明の細胞接着性ポリペプチド(P1−1)〜(P1−6)を使用して得た細胞集合体(9)〜(14)(実施例13〜18;6時間培養後)の粒径は101〜150μmであり、比較の細胞接着性ポリペプチド(P1−0)又は(P1−7)を使用して得た細胞集合体(15)及び(16)(比較例6、7;6時間培養後)の粒径83μm及び94μmよりも有意に大きかった。
【0154】
また、本発明の細胞接着性ポリペプチドを使用して作製した細胞集合体の粒径のばらつきは±14μm〜±33μmであり、比較の細胞接着性ポリペプチドを使用して作製した細胞集合体の粒径のばらつき±36μm及び±39μmより小さかった。
したがって、本発明の細胞接着性ポリペプチドを用いれば、比較用の細胞集合体に比べて、粒径の大きな細胞集合体を得ることができた。また、本発明の細胞接着性ポリペプチドを用いれば、粒径のばらつきの小さな細胞集合体を得ることができた。
【0155】
また、表7の培養7日間後のチトクローム活性の測定結果から、本発明の細胞接着性ポリペプチド(P1−1)〜(P1−6)のチトクローム活性は101以上と、細胞接着性ポリペプチドを用いていない比較例8と同等程度又はそれ以上であり、活性の高い細胞集合体を得られた。特に、実施例13〜17のチトクローム活性は121〜150と比較例8のそれよりも極めて高く、得られた細胞集合体の活性が非常に高かった。
【産業上の利用可能性】
【0156】
本発明の細胞接着性ポリペプチドは、低濃度においても細胞接着性及び細胞増殖性が極めて高いため、従来は無血清培養条件下において接着が困難であった細胞(GE1細胞等)を基材上に効率良く接着させることができる。したがって、本発明の細胞接着性ポリペプチド、細胞接着性ポリペプチド含有基材及び細胞接着性ポリペプチド含有基材を用いて細胞培養する工程を含む製造方法は、細胞が関係する、研究開発、有用物質生産及び治療等に極めて有用である。
【0157】
研究開発用としては、動物実験(毒性試験、刺激性試験及び代謝機能試験等)の代替、遺伝子導入、目的物質(細胞、生理活性物質、遺伝子、有害化学物質及び薬効成分等)のスクリーニング及び細胞の精製や機能解析等に利用できる。
【0158】
有用物質生産用としては、サイトカイン、血栓溶解剤、血液凝固因子製剤、ワクチン、ホルモン、抗生物質、抗体及び増殖因子等の生産に利用できる。
【0159】
治療用としては、皮膚、頭蓋骨、筋肉、皮膚組織、骨、軟骨、血管、神経、腱、靭帯、毛胞組織、粘膜組織、歯周組織、象牙質、骨髄、網膜、漿膜、胃腸管及び脂肪等の組織、並びに肺、肝、膵及び腎等の臓器の治療に利用できる。
【技術分野】
【0001】
本発明は、化学修飾した細胞接着性ポリペプチドに関する。
【背景技術】
【0002】
人工の細胞接着性ポリペプチドとして、プロネクチンF{Arg Gly Asp配列と(Gly Ala Gly Ala Gly Ser)9配列(20)とを各々約13個有し、遺伝子組み換え大腸菌により製造される数平均分子量約11万のポリペプチド}及びプロネクチンL{Ile Lys Val Ala Val配列(7)と(Gly Ala Gly Ala Gly Ser)9配列(20)とを各々約13個有し、遺伝子組み換え大腸菌により製造される数平均分子量約11万のポリペプチド}(非特許文献1)が知られている。また、細胞接着性最小アミノ酸配列(X)と補助アミノ酸配列(Y)とが交互に化学結合してなる構造を有し、(Y)に含まれる全アミノ酸個数が1〜50個であり、かつ(Y)に含まれるグリシン(Gly)及びアラニン(Ala)の合計含有割合が(Y)の全アミノ酸個数に基づいて42〜100個数%である細胞接着性ポリペプチド(特許文献1)が知られている。さらに、化学修飾した人工の細胞接着性ポリペプチドとして、アミノ基及び/又はアンモニオ基を含有する化合物(塩酸N,N−ジメチルアミノエチルクロリド等)で修飾した水溶性の直鎖状ポリペプチド(特許文献2)が知られている。
【先行技術文献】
【非特許文献】
【0003】
【非特許文献1】ハンドブック オブ バイオデグラダブル ポリマーズ(アブラハム著,ハーウッド アカデミック パブリッシャーズ発行,アムステルダム1997(Abraham J. Dombら著, Handbook of Biodegradable Polymers, Harwood Academic Publishers発行, Amsterdam 1997年)
【特許文献】
【0004】
【特許文献1】特開2005−2106号公報
【特許文献2】特表平10−500701号公報
【発明の概要】
【発明が解決しようとする課題】
【0005】
しかし、無血清培地等の特殊な条件下において細胞培養する場合、従来の細胞接着性ポリペプチドは、細胞接着性が不十分であり、細胞増殖性が低いという問題点がある。一方、細胞接着性ポリペプチドを高濃度で用いることにより細胞接着性を補うこともできるが、経済的に問題がある。
本発明の目的は、低濃度においても細胞接着性が優れ、細胞増殖性に優れた細胞接着性ポリペプチドを提供することである。
【課題を解決するための手段】
【0006】
本発明者は、鋭意研究を重ねてきた結果、特定のポリペプチドに特定の官能基を化学修飾することにより上記目的を達成を達成することを見出し本発明に到達した。
【0007】
すなわち、本発明の細胞接着性ポリペプチドは、少なくとも細胞接着性最小アミノ酸配列(X)及び補助アミノ酸配列(Y)から構成され、反応性基含有アミノ酸残基を有するポリペプチド(P)と、
カルボキシル基、スルホ基及びヒドロキシル基からなる群より選ばれる少なくとも1種の官能基(K)を有する化合物(A)とを化学反応させることにより、
ポリペプチド(P)に含まれる反応性基含有アミノ酸残基を化学修飾した細胞接着性ポリペプチドである。
【0008】
また、本発明の細胞接着性ポリペプチド含有基材は、上記の細胞接着性ポリペプチド及び基材(B)を含むものである。
【0009】
また、本発明の細胞又は細胞集合体の生産方法は、上記の細胞接着性ポリペプチドを用いて細胞培養する工程を含むものである。
【発明の効果】
【0010】
本発明の細胞接着性ポリペプチドは、無血清培地等の特殊な条件下において細胞培養する場合、低濃度であっても、細胞接着性が優れている。したがって、基材等の細胞接着表面に対する細胞接着性ポリペプチドのコーティング量を減らしても、高い接着性を得られ、それにより高い細胞増殖性を得られる。また、細胞接着性ポリペプチドを高濃度で用いる必要がないため、経済的にも優れる。
【0011】
また、本発明の細胞接着性ポリペプチド含有基材は、上記の細胞接着性ポリペプチドを含むため、無血清培地等の特殊な条件下において細胞培養する場合、低濃度においても細胞接着性が優れ、優れた細胞増殖性を発揮する。
【0012】
また、本発明の細胞又は細胞集合体の生産方法は、上記の細胞接着性ポリペプチドを用いて細胞培養するため、効率よく細胞又は細胞集合体を生産することができる。
【図面の簡単な説明】
【0013】
【図1】実施例1〜6、比較例1及び2で得た細胞接着性ポリペプチドについて、細胞接着性ポリペプチドのコーティング量に対するGE1細胞(マウス歯肉上皮由来細胞)の細胞接着活性の変化を表したグラフである。
【図2】実施例1〜6、比較例1及び2で得た細胞接着性ポリペプチドについて、細胞接着性ポリペプチドのコーティング量に対するC3H10T1/2細胞(マウス歯肉上皮細胞由来細胞)の細胞接着活性の変化を表したグラフである。
【図3】実施例1〜6、比較例1及び2で得た細胞接着性ポリペプチドについて、細胞接着性ポリペプチドのコーティング量に対するGE1細胞(マウス歯肉上皮由来細胞)の細胞増殖活性の変化を表したグラフである。
【図4】実施例1〜6、比較例1及び2で得た細胞接着性ポリペプチドについて、細胞接着性ポリペプチドのコーティング量に対するC3H10T1/2細胞(マウス歯肉上皮細胞由来細胞)の細胞増殖活性の変化を表したグラフである。
【発明を実施するための形態】
【0014】
「細胞接着性」とは、特定の最小アミノ酸配列が細胞のインテグリンレセプターに認識され、細胞が基材に接着しやすくなる性質を意味する(大阪府立母子医療センター雑誌、第8巻 第1号、58〜66頁、1992年)。
「細胞増殖性」とは細胞が基材に接着することにより細胞内シグナル伝達経路が活性化され、成長、分裂、生存する性質を意味する(Essential 細胞生物学、第2版、706頁、2005年)。
【0015】
細胞接着性最小アミノ酸配列(X)としては、例えば、「病態生理、第9巻 第7号、527〜535頁、1990年」や「大阪府立母子医療センター雑誌、第8巻 第1号、58〜66頁、1992年」に記載されているもの等が用いられる。
【0016】
これらの最小アミノ酸配列(X)の中で、Arg Gly Asp配列、Leu Asp Val配列、Leu Arg Glu配列、His Ala Val配列、Arg Glu Asp Val配列(1)、Tyr Ile Gly Ser Arg配列(2)、Pro Asp Ser Gly Arg配列(3)、Arg Tyr Val Val Leu Pro Arg配列(4)、Leu Gly Thr Ile Pro Gly配列(5)、Arg Asn Ile Ala Glu Ile Ile Lys Asp Ile配列(6)、Ile Lys Val Ala Val配列(7)、Asp Gly Glu Ala 配列(8)、Gly Val Lys Gly Asp Lys Gly Asn Pro Gly Trp Pro Gly Ala Pro配列(9)、Gly Glu Phe Tyr Phe Asp Leu Arg Leu Lys Gly Asp Lys配列(10)、Tyr Lys Leu Asn Val Asn Asp Ser配列(11)、Ala Lys Pro Ser Tyr Pro Pro Thr Tyr Lys配列(12)、Asn Arg Trp His Ser Ile Tyr Ile Thr Arg Phe Gly配列(13)、Thr Trp Tyr Lys Ile Ala Phe Gln Arg Asn Arg Lys配列(14)、Arg Lys Arg Leu Gln Val Gln Leu Ser Ile Arg Thr配列(15)、Tyr Thr Ile Thr Ile Arg Gly Val配列(95)、Pro His Ser Arg Asn配列(96)、Lys Arg Ser Arg配列(97)及びPhe His Arg Arg Ile Lys Ala配列(98)からなる群より選ばれる少なくとも1種が好ましく、細胞接着性及び細胞増殖性の観点等から、さらに好ましくはArg Gly Asp配列、Tyr Ile Gly Ser Arg配列(2)、Ile Lys Val Ala Val配列(7)及びArg Lys Arg Leu Gln Val Gln Leu Ser Ile Arg Thr(15)からなる群より選ばれる少なくとも1種、特に好ましくはArg Gly Asp配列である。
【0017】
これらの最小アミノ酸配列(X)の両端には、介在アミノ酸配列(Z)を含むことが好ましい。
介在アミノ酸配列(Z)としては、細胞接着性最小アミノ酸配列(X)及び補助アミノ酸配列(Y)以外のアミノ酸配列が含まれ、アラニン(Ala)、グリシン(Gly)、セリン(Ser)、トレオニン(Thr)、バリン(Val)、ロイシン(Leu)、イソロイシン(Ile)、システイン(Cys)、メチオニン(Met)、フェニルアラニン(Phe)、チロシン(Tyr)、プロリン(Pro)、トリプトファン(Trp)、アスパラギン(Asn)、グルタミン(Gln)、アスパラギン酸(Asp)、グルタミン酸(Glu)、アルギニン(Arg)、リジン(Lys)及び/又はヒスチジン(His)等から構成されるアミノ酸配列が含まれる。
【0018】
介在アミノ酸配列(Z)のうち、細胞接着性及び細胞増殖性の観点から、細胞接着性最小アミノ酸配列(X)のN末端に、Gly Ala Ala Val Thr Gly配列(62)、Gly Leu Pro Gly Pro Lys Gly Asp配列(63)、Gly Pro Ala Val Thr Gly配列(64)、Ala Gly Pro Lys Gly Ala Asp Gly Ser Pro Gly Pro Ala Val Thr Gly配列(65)、Gly Ala Ala Val Cys Glu Pro Gly配列(66)、Gly Ala Ala Leu Cys Val Ser Glu Pro Gly配列(67)、Ser Pro Ala Ser Ala Ala Leu Cys Val Ser Glu Pro Gly配列(68)、Ser Pro Ala Ser Ala Ala Val Cys Glu Pro Gly配列(69)、Ala Gly Pro Lys Gly Ala Asp Gly Ser Pro Gly Pro Ala Val Cys Glu Pro Gly配列(70)、Ala Gly Pro Lys Gly Ala Asp Gly Ser Pro Gly Pro Ala Leu Cys Val Ser Glu Pro Gly配列(71)、Gly Pro Ala Val Cys Glu Pro Gly配列(72)、Gly Pro Ala Leu Cys Val Ser Glu Pro Gly配列(73)及びGly Ala Ala Pro Gly Ala Ser配列(74)からなる群より選ばれる少なくとも1種を結合していることが好ましく、さらに好ましくはGly Ala Ala Val Thr Gly配列(62)、Gly Leu Pro Gly Pro Lys Gly Asp配列(63)、Gly Pro Ala Val Thr Gly配列(64)及びAla Gly Pro Lys Gly Ala Asp Gly Ser Pro Gly Pro Ala Val Thr Gly配列(65)からなる群より選ばれる少なくとも1種を結合していること、特に好ましくはGly Ala Ala Val Thr Gly配列(62)を結合していることである。
【0019】
介在アミノ酸配列(Z)のうち、細胞接着性及び細胞増殖性の観点から、細胞接着性最小アミノ酸配列(X)のC末端に、Ser Pro Ala Ser Ala Ala Gly Tyr配列(75)、Ser Pro Ala Ser Ala Ala Leu Cys Val Ser配列(76)、Ser Pro Ala Ser Ala Ala Val Cys配列(77)、Ala Gly Pro Lys Gly Ala Asp Gly Ser Pro Gly Pro配列(78)、Ala Gly Pro Lys Gly Ala Asp Gly Ser Pro Gly Pro Ala Val Cys配列(79)、Ala Gly Pro Lys Gly Ala Asp Gly Ser Pro Gly Pro Ala Leu Cys Val Ser配列(80)、Ala Gly Pro Lys Gly Ala Asp Gly Ser Pro配列(81)、Ser Pro Ala Ser Ala Ala Gly Pro Val Gly Ser Pro配列(82)、Cys Asp Ala Gly Tyr配列(83)、Cys Asp Ala Gly Pro Val Gly Ser Pro配列(84)及びSer Ala Gly Pro Ser Ala Gly Tyr配列(85)からなる群より選ばれる少なくとも1種を結合していることが好ましく、さらに好ましくはSer Pro Ala Ser Ala Ala Gly Tyr配列(75)、Ser Pro Ala Ser Ala Ala Leu Cys Val Ser配列(76)、Ser Pro Ala Ser Ala Ala Val Cys配列(77)、Ala Gly Pro Lys Gly Ala Asp Gly Ser Pro Gly Pro配列(78)、Ala Gly Pro Lys Gly Ala Asp Gly Ser Pro Gly Pro Ala Val Cys配列(79)、Ala Gly Pro Lys Gly Ala Asp Gly Ser Pro Gly Pro Ala Leu Cys Val Ser配列(80)、Ala Gly Pro Lys Gly Ala Asp Gly Ser Pro配列(81)及びSer Pro Ala Ser Ala Ala Gly Pro Val Gly Ser Pro配列(82)からなる群より選ばれる少なくとも1種を結合していること、特に好ましくはSer Pro Ala Ser Ala Ala Gly Tyr配列(75)を結合していることである。
【0020】
ポリペプチド(P)は、細胞接着性最小アミノ酸配列(X)を1分子中に少なくとも1個有すればよいが、細胞接着性の観点から、1分子中に2〜50個有するものが好ましく、さらに好ましくは3〜30個、特に好ましくは4〜20個、最も好ましくは5〜18個有するものである。
なお、2種以上の細胞接着性最小アミノ酸配列(X)が一分子中に含まれてもよい。
【0021】
補助アミノ酸配列(Y)は、最小アミノ酸配列(X)及び介在アミノ酸配列(Z)以外のアミノ酸配列であれば制限なく使用できるが、耐熱性、細胞接着性及び細胞増殖性の観点等から、Gly及び/又はAlaを有するものが好ましく、例えば(Gly Ala)a配列、(Gly Ala Gly Ala Gly Ser)b配列、(Gly Ala Gly Ala Gly Tyr)c配列、(Gly Ala Gly Val Gly Tyr)d配列、(Gly Ala Gly Tyr Gly Val)e配列、{Asp Gly Gly (Ala)f Gly Gly Ala}g配列、(Gly Val Pro Gly Val)h配列、(Gly)i、(Ala)j、(Gly Gly Ala)k配列、(Gly Val Gly Val Pro)m配列、(Gly Pro Pro)n配列、(Gly Ala Gln Gly Pro Ala Gly Pro Gly)o配列、(Gly Ala Pro Gly Ala Pro Gly Ser Gln Gly Ala Pro Gly Leu Gln)p配列及び/又は(Gly Ala Pro Gly Thr Pro Gly Pro Gln Gly Leu Pro Gly Ser Pro)q配列を有するものが好ましい。これらのうち、熱に対する安定性の観点から、(Gly Ala)a配列、(Gly Ala Gly Ala Gly Ser)b配列、(Gly Ala Gly Ala Gly Tyr)c配列、(Gly Ala Gly Val Gly Tyr)d配列、(Gly Ala Gly Tyr Gly Val)e配列、{Asp Gly Gly (Ala)f Gly Gly Ala}g配列、(Gly Val Pro Gly Val)h配列、(Gly Val Gly Val Pro)m配列及び/又は(Gly Pro Pro)n配列を有するものが好ましく、さらに好ましくは(Gly Ala Gly Ala Gly Ser)b配列、(Gly Val Pro Gly Val)h配列、(Gly Val Gly Val Pro)m配列及び/又は(Gly Pro Pro)n配列を有するものであり、特に好ましくは(Gly Ala Gly Ala Gly Ser)b配列を有するものである。
【0022】
なお、aは5〜100の整数、b、c、d及びeは2〜33の整数、fは1〜194の整数、gは1〜{200/(6+f)の小数点以下を切り捨てした数}の整数、hは2〜40の整数、i及びjは10〜200の整数、kは3〜66の整数、mは2〜40の整数、nは3〜66の整数、oは1〜22の整数、p及びqは1〜13の整数である。
【0023】
補助アミノ酸配列(Y)は、グリシン(Gly)及び/又はアラニン(Ala)を含むことが好ましい。グリシン(Gly)及び/又はアラニン(Ala)を含む場合、これらの合計含有割合(%)は、補助アミノ酸配列(Y)の全アミノ酸個数に基づいて、10〜100が好ましく、さらに好ましくは20〜95、特に好ましくは30〜90、最も好ましくは40〜85である。この範囲であると、耐熱性がさらに良好となる。
【0024】
補助アミノ酸配列(Y)にグリシン(Gly)及びアラニン(Ala)の両方を含む場合、これらの含有個数割合(Gly/Ala)は、0.03〜40が好ましく、さらに好ましくは0.08〜13、特に好ましくは0.2〜5である。この範囲であると、耐熱性がさらに良好となる。
【0025】
補助アミノ酸配列(Y)には、以上の例示の他に、他のアミノ酸{アラニン(Ala)、グリシン(Gly)、セリン(Ser)、トレオニン(Thr)、バリン(Val)、ロイシン(Leu)、イソロイシン(Ile)、システイン(Cys)、メチオニン(Met)、フェニルアラニン(Phe)、チロシン(Tyr)、プロリン(Pro)、トリプトファン(Trp)、アスパラギン(Asn)、グルタミン(Gln)、アスパラギン酸(Asp)、グルタミン酸(Glu)、アルギニン(Arg)、リジン(Lys)及びヒスチジン(His)等}を含んでいてもよい。
【0026】
(Gly Ala)a配列を有する補助アミノ酸配列としては、配列番号(16)〜(18)で表されるアミノ酸配列等が挙げられる。
(Gly Ala Gly Ala Gly Ser)b配列を有する補助アミノ酸配列としては、配列番号(19)〜(21)で表されるアミノ酸配列等が挙げられる。
(Gly Ala Gly Ala Gly Tyr)c配列を有する補助アミノ酸配列としては、配列番号(22)〜(24)で表されるアミノ酸配列等が挙げられる。
(Gly Ala Gly Val Gly Tyr)d配列を有する補助アミノ酸配列としては、配列番号(25)〜(27)で表されるアミノ酸配列等が挙げられる。
(Gly Ala Gly Tyr Gly Val)e配列を有する補助アミノ酸配列としては、配列番号(28)〜(30)で表されるアミノ酸配列等が挙げられる。
{Asp Gly Gly (Ala)f Gly Gly Ala}g配列を有する補助アミノ酸配列としては、配列番号(31)〜(33)で表されるアミノ酸配列等が挙げられる。
(Gly Val Pro Gly Val)h配列を有する補助アミノ酸配列としては、配列番号(34)〜(37)で表されるアミノ酸配列等が挙げられる。
(Gly)i配列を有する補助アミノ酸配列としては、配列番号(38)〜(40)で表されるアミノ酸配列等が挙げられる。
(Ala)j配列を有する補助アミノ酸配列としては、配列番号(41)〜(43)で表されるアミノ酸配列等が挙げられる。
(Gly Gly Ala)k配列を有する補助アミノ酸配列としては、配列番号(44)〜(46)で表されるアミノ酸配列等が挙げられる。
(Gly Val Gly Val Pro)m配列を有する補助アミノ酸配列としては、配列番号(47)〜(49)で表されるアミノ酸配列等が挙げられる。
(Gly Pro Pro)n配列を有する補助アミノ酸配列としては、配列番号(50)〜(52)で表されるアミノ酸配列等が挙げられる。
(Gly Ala Gln Gly Pro Ala Gly Pro Gly)o配列を有する補助アミノ酸配列としては、配列番号(53)〜(55)で表されるアミノ酸配列等が挙げられる。
(Gly Ala Pro Gly Ala Pro Gly Ser Gln Gly Ala Pro Gly Leu Gln)p配列を有する補助アミノ酸配列としては、配列番号(56)〜(58)で表されるアミノ酸配列等が挙げられる。
(Gly Ala Pro Gly Thr Pro Gly Pro Gln Gly Leu Pro Gly Ser Pro)q配列を有する補助アミノ酸配列としては、配列番号(59)〜(61)で表されるアミノ酸配列等が挙げられる。
【0027】
これらの補助アミノ酸配列のうち、熱に対する安定性の観点から、配列番号(16)、(17)、(19)、(20)、(21)、(22)、(23)、(25)、(26)、(28)、(29)、(31)、(32)、(33)、(34)、(35)、(37)、(38)、(39)、(41)、(42)、(44)、(45)、(47)、(48)、(50)、(51)、(53)、(54)、(56)、(57)、(59)又は(60)で表されるアミノ酸配列が好ましく、さらに好ましくは配列番号(17)、(19)、(20)、(21)、(23)、(26)、(29)、(33)、(34)、(35)、(36)、(37)、(39)、(42)、(45)、(48)、(51)、(54)、(57)又は(60)で表されるアミノ酸配列であり、特に好ましくは配列番号(19)、(20)又は(37)で表されるアミノ酸配列である。
【0028】
ポリペプチド(P)は、補助アミノ酸配列(Y)を1分子中に少なくとも1個有すればよいが、熱安定性、細胞接着性及び細胞増殖性の観点等から、1分子中に2〜50個有するものが好ましく、さらに好ましくは3〜30個、特に好ましくは4〜20個有するものである。また、2種以上の補助アミノ酸配列(Y)が1分子中に含まれてもよい。
【0029】
ポリペプチド(P)は、細胞接着性最小アミノ酸配列(X)と補助アミノ酸配列(Y)とが交互に化学結合してなる構造であることが好ましく、さらに好ましくは細胞接着性最小アミノ酸配列(X)の両端に介在アミノ酸配列(Z)を含むアミノ酸配列と補助アミノ酸配列(Y)とが交互に化学結合してなる構造である。この場合、細胞接着性最小アミノ酸配列(X)と補助アミノ酸配列(Y)との繰り返し単位(X−Y)の数(個)は、細胞接着性及び細胞増殖性の観点等から、2〜50が好ましく、さらに好ましくは3〜30、特に好ましくは4〜20、最も好ましくは5〜18である。
【0030】
ポリペプチド(P)は、直鎖構造を有するものである(分岐構造、環状構造及び架橋構造を持たない。)。なお、直鎖構造にはβ構造(直鎖状ペプチドが折れ曲がってこの部分同士が平行に並び、その間に水素結合が作られる二次構造)も含まれる。
【0031】
ポリペプチド(P)の数平均分子量(Mn)は、300〜3,000,000が好ましく、さらに好ましくは1,000〜1,000,000、特に好ましくは3,000〜300,000。なお、数平均分子量(Mn)は、公知の方法により測定でき、例えば、SDS−PAGE(SDSポリアクリルアミドゲル電気泳動)法により、測定サンプルを分離し、泳動距離を標準物質と比較することによって求められる(以下、同じ)。
【0032】
ポリペプチド(P)の好適な例を以下に示す。
(1)細胞接着性最小アミノ酸配列(X)がArg Gly Asp配列(x1)の場合
配列(x1)の13個と(Gly Ala Gly Ala Gly Ser)9配列(20)(y1)の12個とを有し、これらが交互に化学結合してなる構造を有するMn約11万のポリペプチド(86){「プロネクチンF」、プロネクチンは三洋化成工業(株)の登録商標(日本及び米国)である。三洋化成工業(株)製<以下同じ>};
配列(x1)の5個と(Gly Ala Gly Ala Gly Ser)3配列(19)(y2)の5個とを有しこれらが交互に化学結合してなる構造を有するMn約2万のポリペプチド(87)(「プロネクチンF2」);
配列(x1)の3個と(Gly Val Pro Gly Val)2 Gly Gly (Gly Ala Gly Ala Gly Ser)3配列(37)(y3)の3個とを有しこれらが交互に化学結合してなる構造を有するMn約1万のポリペプチド(88)(「プロネクチンF3」)等。
【0033】
(2)最小アミノ酸配列(X)がIle Lys Val Ala Val配列(7)(x2)の場合
プロネクチンF、プロネクチンF2又はプロネクチンF3のArg Gly Asp配列(x1)をIle Lys Val Ala Val配列(7)(x2)に変更したポリペプチド(89)「プロネクチンL」、ポリペプチド(90)「プロネクチンL2」、又はポリペプチド(91)「プロネクチンL3」等。
【0034】
(3)最小アミノ酸配列(X)がTyr Ile Gly Ser Arg配列(2)(x3)の場合
プロネクチンF、プロネクチンF2又はプロネクチンF3のArg Gly Asp配列(x1)をTyr Ile Gly Ser Arg配列(2)(x3)に変更したポリペプチド(92)「プロネクチンY」、ポリペプチド(93)「プロネクチンY2」、又はポリペプチド(94)「プロネクチンY3」等。
【0035】
ポリペプチド(P)は、人工的に製造でき、有機合成法(酵素法、固相合成法及び液相合成法等)、及び遺伝子組み換え法等によって容易に製造できる。有機合成法に関しては、生化学実験講座1、タンパク質の化学IV(1981年7月1日、日本生化学会編、株式会社東京化学同人発行)又は続生化学実験講座2、タンパク質の化学(下)(昭和62年5月20日、日本生化学会編、株式会社東京化学同人発行)に記載されている方法等が適用できる。遺伝子組み換え法に関しては、特許第3338441号公報に記載されている方法等が適用できる。有機合成法及び遺伝子組み換え法とも、ポリペプチド(P)を作製できるが、ポリペプチド(P)を安価に大量生産できるという観点等から、遺伝子組み換え法が好ましい。
【0036】
化合物(A)は、カルボキシル基、スルホ基及びヒドロキシル基からなる群より選ばれる少なくとも1種以上の官能基(K)を有する化合物であれば制限なく使用でき、カルボキシル基を有する化合物(A1)、スルホ基を有する化合物(A2)及びヒドロキシル基を有する化合物(A3)が含まれる。なお、上記の官能基(K)は、ポリペプチド(P)と、化合物(A)とを化学反応させることにより導入される官能基である。
【0037】
カルボキシル基を有する化合物(A1)としては、炭素数2〜30のカルボン酸のハロゲン化物{ハロゲン化アシル(酸ハロゲン化物)ではなく、ハロゲン置換カルボン酸}、炭素数2〜30のカルボキシル基を有するアルコール、炭素数2〜30のカルボキシル基を有するスルホン酸及び炭素数2〜30のカルボキシル基を有するアミン等が含まれる。
【0038】
炭素数2〜30のカルボン酸のハロゲン化物としては、フルオロ酢酸、クロロ酢酸、ブロモ酢酸、2−クロロプロピオン酸、3−クロロプロピオン酸、ω−クロロオクタデカン酸、ω−ブロモエイコサン酸及びω−クロロトリコサン酸等が挙げられる。
【0039】
炭素数2〜30のカルボキシル基を有するアルコールとしては、ヒドロキシ酢酸、ヒドロキシプロピオン酸、パントテン酸、グルクロン酸、サリチル酸、4−ヒドロキシ安息香酸、ヒドロキシ基含有アミノ酸(Ser及びThr)、ω−ヒドロキシオクタデカン酸、ω−ヒドロキシエイコサン酸及びω−ヒドロキシトリコサン酸等が挙げられる。
【0040】
炭素数2〜30のカルボキシル基を有するスルホン酸としては、スルホ酢酸、スルホコハク酸、o−スルホ安息香酸、m−スルホ安息香酸、p−スルホ安息香酸、2,4−ジスルホ安息香酸、3−スルホフタル酸、3,5−ジスルホフタル酸、4−スルホイソフタル酸、2−スルホテレフタル酸、2−メチル−4−スルホ安息香酸、2−メチル−3,5−ジスルホ安息香酸、4−プロピル−3−スルホ安息香酸、4−イソプロピル−3−スルホ安息香酸、2,4,6−トリメチル−3−スルホ安息香酸、2−メチル−5−スルホテレフタル酸、5−メチル−4−スルホイソフタル酸、5−スルホサリチル酸及び3−オキシ−4−スルホ安息香酸等が挙げられる。
【0041】
炭素数2〜30のカルボキシル基を有するアミンとしては、炭素数2〜20のアミノカルボン酸及び炭素数4〜30のペプチドが含まれ、2−アミノ酢酸、3−アミノプロピオン酸、ω−アミノオクタデカン酸、ω−アミノエイコサン酸、アミノ酸{アラニン(Ala)、アルギニン(Arg)、アスパラギン(Asn)、アスパラギン酸(Asp)、システイン(Cys)、グルタミン(Gln)、グルタミン酸(Glu)、グリシン(Gly)、ヒスチジン(His)、イソロイシン(Ile)、ロイシン(Leu)、リジン(Lys)、メチオニン(Met)、フェニルアラニン(Phe)、プロリン(Pro)、セリン(Ser)、トレオニン(Thr)、トリプトファン(Trp)、チロシン(Tyr)及びバリン(Val)等}及びアミノ酸が2〜15個結合したペプチド等が挙げられる。
【0042】
これらのカルボキシル基を含有する化合物(A1)のうち、細胞接着性及び細胞増殖性の観点から、カルボン酸のハロゲン化物が好ましく、さらに好ましくはクロロ酢酸である。
【0043】
スルホ基を有する化合物(A2)としては、炭素数2〜30のスルホン酸のハロゲン化物(ハロゲン置換スルホン酸)、炭素数2〜30のスルホ基を有するアルコール、炭素数2〜30のスルホ基を有するカルボン酸及び炭素数2〜30のスルホ基を有するアミン等が含まれる。
【0044】
炭素数2〜30のスルホン酸のハロゲン化物としては、クロロスルホン酸(ClSO3H)、クロロエタンスルホン酸、フルオロスルホン酸、p−クロロベンゼンスルホン酸、ω−クロロオクタデカンスルホン酸、ω−ブロモエイコサンスルホン酸及びω−クロロトリコサンスルホン酸及びこれらの塩(アルカリ金属塩)等が挙げられる。
【0045】
炭素数2〜30のスルホ基を有するアルコールとしては、2−ヒドロキシエタンスルホン酸、3−ヒドロキシプロパンスルホン酸、p−ヒドロキシベンゼンスルホン酸、ω−ヒドロキシオクタデカンスルホン酸、ω−ヒドロキシエイコサンスルホン酸、ω−ヒドロキシトリコサンスルホン酸、スルホエチレングリコール、2−スルホプロピレングリコール、1,2−ジスルホプロピレングリコール、2−スルホブタンジオール、2−スルホヘキサンジオール、3−スルホヘキサンジオール、1,5−ジスルホヘキサンジオール、2,5−ジスルホヘキサンジオール、1,3,5−トリスルホヘキサンジオール、1,2,4−トリスルホヘキサンジオール、2−スルホウンデカンジオール、4−スルホウンデカンジオール、6−スルホウンデカンジオール、2,4−ジスルホウンデカンジオール及び2,6,10−トリスルホウンデカンジオール等が挙げられる。
【0046】
炭素数2〜30のスルホ基を有するカルボン酸としては、上記のカルボキシル基を有するスルホン酸と同様である。
【0047】
炭素数2〜30のスルホ基を有するアミンとしては、スルファニル酸、2−アミノエタンスルホン酸、3−アミノプロパンスルホン酸、p−アミノベンゼンスルホン酸、ω−アミノオクタデカンスルホン酸、ω−アミノエイコサンスルホン酸及び、ω−アミノトリコサンスルホン酸等が挙げられる。
【0048】
これらのスルホ基を含有する化合物(A2)のうち、細胞接着性及び細胞増殖性の観点から、スルホン酸のハロゲン化物が好ましく、さらに好ましくはクロロエタンスルホン酸である。
【0049】
ヒドロキシル基を有する化合物(A3)としては、炭素数2〜30のアルコールのハロゲン化物(ハロゲン置換体アルコール)及び炭素数2〜30のヒドロキシル基を有するカルボン酸等が含まれる。
【0050】
炭素数2〜30のアルコールのハロゲン化物としては、2−フルオロエタノール、クロロエタノール、3−ブロモプロピルアルコール、p−クロロフェノール、ω−クロロオクタデシルアルコール、ω−ブロモエイコシルアルコール及び、ω−クロロトリコシルアルコール等が挙げられる。
【0051】
炭素数2〜30のヒドロキシル基を有するカルボン酸としては、カルボキシル基を有するアルコールと同様である。
【0052】
これらのヒドロキシル基を含有する化合物(A3)のうち、細胞接着性及び細胞増殖性の観点から、アルコールのハロゲン化物が好ましく、さらに好ましくはクロロエタノールである。
【0053】
これらの化合物(A)のうち、細胞接着性及び細胞増殖性の観点から、カルボキシル基を有する化合物(A1)及びスルホ基を有する化合物(A2)が好ましく、さらに好ましくはカルボン酸のハロゲン化物及びスルホン酸のハロゲン化物、特に好ましくはクロロ酢酸、クロロエタンスルホン酸、クロロスルホン酸及びこれらの塩(アルカリ金属塩)、最も好ましくはクロロ酢酸及び2−クロロエタンスルホン酸ナトリウムである。
【0054】
また、これらの化合物(A)のうち、ポリペプチド(P)と化合物(A)との反応性の観点から、カルボン酸のハロゲン化物、スルホン酸のハロゲン化物及びアルコールのハロゲン化物が好ましく、さらに好ましくはカルボン酸のフッ化物又は塩化物、スルホン酸のフッ化物又は塩化物及びアルコールのフッ化物又は塩化物、特に好ましくはクロロ酢酸、フルオロ酢酸、フルオロスルホン酸、フルオロスルホン酸の塩(アルカリ金属塩)、クロロエタンスルホン酸、クロロスルホン酸の塩(アルカリ金属塩)、2−フルオロエタノール及びクロロエタノールである。
【0055】
ポリペプチド(P)に含まれる反応性基含有アミノ酸残基とは、化合物(A)と反応する反応性基を有するアミノ酸の残基を意味し、好ましくはポリペプチド(P)のN末端及びC末端以外のアミノ酸残基である。
【0056】
反応性基としては、ヒドロキシル基、カルボキシル基、メルカプト基及び1級又は2級アミノ基等が挙げられる。反応性基のうち、結合形成の容易さの観点から、ヒドロキシル基、カルボキシル基及び1級アミノ基が好ましく、さらに好ましくはヒドロキシル基及びカルボキシル基、特に好ましくはヒドロキシル基である。
【0057】
反応性基含有アミノ酸残基としては、セリン残基、トレオニン残基、チロシン残基、アスパラギン酸残基、グルタミン酸残基、リシン残基、アルギニン残基、ヒスチジン残基及びトリプトファン残基等が挙げられる(バイオコンジュゲート テクニークス、Greg T.Hermanson著、Academic Press発行、1996)。これらの反応性基含有アミノ酸残基のうち、化合物(A)との反応性の観点から、セリン残基、トレオニン残基、チロシン残基、アスパラギン酸残基、グルタミン酸残基、リシン残基及びアルギニン残基が好ましく、さらに好ましくはセリン残基、トレオニン残基、アスパラギン酸残基及びグルタミン酸残基、特に好ましくはセリン残基及びトレオニン残基である。
【0058】
ポリペプチド(P)に含まれる反応性基含有アミノ酸残基を化学修飾するには、ポリペプチド(P)と化合物(A)との化学反応によって、化学結合{共有結合、イオン結合及び/又は水素結合等}を介して、化合物(A)を結合させることが好ましいが、化合物(A)とポリペプチド(P)との物理吸着(ファンデルワールス力による吸着)により化学修飾してもよい。
【0059】
化合物(A)と、ポリペプチド(P)とを化学結合させる方法としては、公知の方法が適用でき、特開2007−51127号公報等に記載の方法が挙げられる。化学結合のうち、結合の強さの観点等から、共有結合が好ましい。化学結合形成反応には反応溶媒を使用してもよく、反応溶媒としては公知のものが使用でき、例えば、水、臭化リチウム水溶液、過塩素酸リチウム水溶液、メタノール、エタノール、イソプロパノール、アセトン、ジスルフォキシド、ジメチルアセトアミド、テトラヒドロフラン、ジメチルスルホキシド及びこれらの少なくとも1種を含む混合溶媒等が挙げられる。
【0060】
化合物(A)とポリペプチド(P)とを共有結合させる方法としては、例えば、ポリペプチド(P)に含まれる反応性基含有アミノ酸残基の反応性基がヒドロキシル基の場合、化合物(A)のうち、カルボン酸のハロゲン化物、スルホン酸のハロゲン化物又はアルコールのハロゲン化物(以下、ハロゲン化物と略する)を使用してエーテル化反応(ウイリアムソン合成法)する方法、化合物(A)のうち、スルホ基を有するカルボン酸又はヒドロキシル基を有するカルボン酸(以下、カルボキシ化合物と略する)を使用してエステル化反応する方法が挙げられる。
【0061】
ポリペプチド(P)に含まれる反応性基含有アミノ酸残基の反応性基がカルボキシル基の場合、カルボキシル基を有するアミン又はスルホ基を有するアミンを使用してアミド化反応する方法、カルボキシル基を有するアルコール又はスルホ基を有するアルコールを使用して、エステル化反応する方法等が挙げられる。
【0062】
化合物(A)とポリペプチド(P)とをイオン結合させる方法としては、例えば、ポリペプチド(P)に含まれる反応性基含有アミノ酸残基の反応性基がアミノ基の場合、カルボキシル基を有するスルホン酸、スルホ基を有するカルボン酸又はヒドロキシル基を有するカルボン酸(以下、酸化合物と略する)を用いて中和反応する方法、アミノ基を塩酸等の酸を用いてアンモニウム塩にしてから、酸化合物を使用してイオン交換反応する方法が挙げられる。
【0063】
ポリペプチド(P)に含まれる反応性基含有アミノ酸残基を化学修飾する方法としては、以上のようなポリペプチド(P)と化合物(A)との直接的な化学結合を形成させる方法等の他に、縮合剤を用いて、間接的に化学結合を形成させてもよい。
【0064】
縮合剤としては、カルボジイミド、ジフェニルリン酸アジド、BOP試薬、DMT−MM及び向山試薬等が挙げられる。これらのうち、反応性の観点から、向山試薬が好ましい。なお、縮合剤を用いる方法は公知の縮合方法(エステル化反応、アミド化反応)等が適用できる。
【0065】
本発明の細胞接着性ポリペプチドにおいて、反応性基含有アミノ酸残基の化学修飾により導入された官能基(K)の平均個数(個)は、本発明の細胞接着性ポリペプチド1分子あたり、細胞接着性及び細胞増殖性の観点から、1〜156が好ましく、さらに好ましくは10〜120、特に好ましくは30〜115、最も好ましくは60〜90である。
【0066】
官能基(K)の平均個数は、ハロゲン化物を使用してエーテル化反応により化学修飾した場合、ポリペプチド(P)及び細胞接着性ポリペプチドを構成する各アミノ酸数をポストラベル法によるHPLC測定により求めた各アミノ酸のピーク面積から、下記式により求めることができる(ポリペプチドに塩酸等の酸を加え加熱することにより、ポリペプチドをアミノ酸に加水分解してから、オルトフタルアルデヒド又はニンヒドリンを用いてラベル化したアミノ酸をHPLCにより、アミノ酸のピーク面積を求める方法)。なお、化学修飾されないグリシンのピークを標準として用いる。
【0067】
官能基(K)の平均個数=Σ{γ−(βa/αa)/(β0/α0)×γ}
【0068】
α0:ポリペプチド(P)中のグリシンのHPLCのピーク面積
β0:ポリペプチド(P)中の各アミノ酸のHPLCのピーク面積
αa:細胞接着性ポリペプチド中のグリシンのHPLCのピーク面積
βa:細胞接着性ポリペプチド中の各アミノ酸のHPLCのピーク面積
γ: ポリペプチド(P)中の各アミノ酸の数
【0069】
ハロゲン化物以外の化合物(A)により化学修飾した場合、官能基(K)の平均個数は、ポリペプチド(P)及び細胞接着性ポリペプチドについて、MALDI−TOF MSを測定し、m/z値およびそのピーク強度を求め、下記式に当てはめることにより求めることができる。
【0070】
官能基の平均個数={[Σ(PMn×Nn)/100]−PM0}/L
【0071】
PM0:ポリペプチド(P)のm/z値
PMn:細胞接着性ポリペプチドのm/z値
Nn:細胞接着性ポリペプチドの全ピーク強度の和を100%とした場合のPMnのピーク強度の割合(%)
L:化合物(A)1分子がポリペプチド(P)1分子に結合した際に増加する分子量
Lは、例えば、化合物(A)がパントテン酸であり、パントテン酸のヒドロキシル基とポリペプチド(P)に含まれる反応性基含有アミノ酸残基のカルボキシル基(反応性基)とを脱水縮合反応させた場合、下記のように計算できる。
L=219(パントテン酸の分子量)−18(水の分子量)=201
したがって、この場合、Lは201である。
【0072】
細胞接着性ポリペプチドは、細胞表面タンパク質であるインテグリンとの結合により細胞と接着する。
本発明の細胞接着性ポリペプチドは、ポリペプチド(P)に含まれる反応性基含有アミノ酸残基をカルボキシル基、スルホ基及びヒドロキシル基からなる群より選ばれる少なくとも1種の官能基(K)を有する化合物(A)で化学修飾することにより、ポリペプチド(P)では接着できない種類のインテグリンと結合できるようになるため(多種のインテグリンと結合できるため)、細胞接着性ペプチドが低濃度であっても接着活性に優れると考えられる。
【0073】
本発明の細胞接着性ポリペプチドは、基材(B)とともに細胞接着性ポリペプチド含有基材とすることができる。
基材(B)の材質、形状、及び細胞接着性ポリペプチドの基材(B)への結合方法は、特開2005−2106号公報に記載されたものをそのまま適用できる。
【0074】
本発明のポリペプチド含有基材に含まれる細胞接着性ポリペプチドの含有量(以下、コーティング量と記載することがある。)は、細胞接着性及び細胞増殖性の観点等から、本発明のポリペプチド含有基材の単位面積あたり、0.1μg/cm2〜4μg/cm2が好ましく、さらに好ましくは0.1μg/cm2〜3μg/cm2、特に好ましくは0.4μ/cm2〜2μg/cm2である。
【0075】
なお、本発明において、単位面積は、基材(B)の表面のうち、培養される細胞が接着し得る表面の表面積を意味し、細胞が入り込まないような微小な凹凸(例えば、1μm以下)は平坦な表面として取扱うが、単位面積を高める目的でリブ(畝)等が設けてあるものについてはそのリブの表面積を単位面積に含まれる。
単位面積あたりの細胞接着性ポリペプチドの含有量の測定方法は特に限定されないが、例えば、免疫学的測定法が利用できる。具体的な方法としては、特開2005−2106号公報に記載されたものをそのまま適用できる。
【0076】
本発明の細胞接着性ポリペプチド含有基材は、必要に応じて滅菌処理を施してもよい。
滅菌方法としては、特に限定されないが、放射線滅菌、エチレンオキサイドガス滅菌、プラズマ滅菌、γ線滅菌、アルコール滅菌、オートクレーブ滅菌及び乾熱滅菌等が挙げられる。
【0077】
本発明の細胞接着性ポリペプチドを用いて細胞培養する工程を含む細胞又は細胞集合体の生産方法としては、公知の細胞接着性ポリペプチド又は培養基材の代わりに本発明の細胞接着性ポリペプチド又は細胞接着性ポリペプチド含有基材を使用する以外、公知の方法が適用できる。
【0078】
細胞培養工程としては、本発明の細胞接着性ポリペプチド、細胞接着性ポリペプチド含有基材又は、本発明の細胞接着性ポリペプチド及び本発明の細胞接着性ポリペプチド含有基材が入った適当な容器(シャーレ、プレート、フラスコ、ビーカー及びファーメンター等)に、細胞(CE)を縣濁させた培地を加えて適当な条件で培養する方法等が挙げられる。
【0079】
本発明の細胞接着性ポリペプチド含有基材に接着できる細胞(CE)としては特に制限がないが、生体組織や臓器の実質細胞、成熟細胞、肝細胞、ES細胞、iPS細胞、上皮細胞、内皮細胞及び表皮細胞等が挙げられる。主に医薬品等の有用物質生産や治療等に用いられる哺乳動物由来の正常細胞、哺乳動物由来の株化細胞及び昆虫細胞が適している。具体的には特開2005−2106号公報に記載された細胞等が挙げられる。
【0080】
本発明の細胞接着性ポリペプチド含有基材を用いる細胞培養方法に用いる培地としては、特に制限は無く、一般の細胞培養に用いられるものが利用できる。また、これら培地に必要に応じて、血清、細胞増殖因子及び/又は抗菌剤等を添加したものも利用できる。培地、血清及びその使用量、細胞増殖因子及びその使用量、並びに抗菌剤及びその使用量の具体例としては、特開2005−2106号公報に記載されたものがそのまま利用できる。
【0081】
細胞の播取量、培養条件、培養後の細胞回収方法についても、特開2005−2106号公報に記載されたものがそのまま利用できる。
【0082】
細胞接着性ポリペプチド含有基材を用いる細胞培養で得られる細胞(CE2)としては、細胞接着性ペプチド含有基材に接着できる細胞(CE)と同じものが挙げられる。なお、細胞(CE)が分化して、元の細胞(CE)とは異なる細胞(CE2)が得られる場合がある。例えば、元の細胞(CE)が骨髄未分化間葉系幹細胞であって、細胞(CE2)が骨芽細胞、軟骨細胞又は脂肪細胞等の場合である(ティッシュ・エンジニアリング、上田実 編、財団法人名古屋大学出版会、1999年10月10日)。
【実施例】
【0083】
以下、実施例により本発明をさらに詳しく説明するが、本発明はこれに限定されるものではない。
<実施例1>
(1)ポリペプチド(P1−0)の作製
特表平3−502935号公報中の実施例記載の方法に準じて、Ile Lys Val Ala Val配列(7)と(Gly Ala Gly Ala Gly Ser)9配列(20)とを各々約13個有し、数平均分子量約11万のペプチド(86)を遺伝子組換え大腸菌により製造し、カラムクロマトグラフィーにて精製してポリペプチド(P1−0)を得た。
【0084】
(2)化学修飾した細胞接着性ポリペプチド(P1−1)の作製
ポリペプチド(P1−0)50mgとクロロ酢酸230mgとを4.5M過塩素酸リチウム水溶液1.5mLに溶解した後、その溶液を攪拌しながら、水酸化ナトリウム100mgを溶解した4.5M過塩素酸リチウム水溶液1.325mLを一定速度で滴下した。室温(約25℃)で1時間攪拌したのち、反応液を透析、凍結乾燥して、水溶性の直鎖状ポリペプチド(化学修飾した細胞接着性ポリペプチド;P1−1)を得た。
【0085】
(3)細胞接着性ポリペプチド含有基材[PB1]の作製
化学修飾した細胞接着性ポリペプチド(P1−1)1mgを脱イオン水1mLに溶解し、さらに、99.5重量%塩化ナトリウムを0.85重量%含有する0.02Mリン酸緩衝液(pH7.2、PBS)で希釈して、細胞接着性ポリペプチド(P1−1)溶液(A1〜A3){細胞接着性ポリペプチド(P1−1)の濃度; A1:0.005、A2:5及びA3:50μg/mL}を作製した。この溶液(A1〜A3)を96穴(96ウェル)のポリスチレンプレート(日本ベクトン・ディッキンソン株式会社)中の8穴(8ウェル)ずつにそれぞれ50μL/ウェルで投入し、室温(約25℃)で2時間放置した。アスピレーターを用いて溶液を除去した後、生理食塩水100μL/ウェルで2回洗浄しさらに脱イオン水100μL/ウェルで洗浄して、本発明の細胞接着性ポリペプチド含有基材[PB1](コーティング量が異なるPB1−1〜PB1−3)を得た。
【0086】
<実施例2>
(1)化学修飾した細胞接着性ポリペプチド(P1−2)の作製
「クロロ酢酸230mg」を「2−クロロエタンスルホン酸ナトリウム405mg」に変更したこと以外、実施例1と同様にして、水溶性の直鎖状ポリペプチド(化学修飾した細胞接着性ポリペプチド;P1−2)を得た。
【0087】
(2)細胞接着性ポリペプチド含有基材[PB2]の作製
「化学修飾した細胞接着性ポリペプチド(P1−1)」を「化学修飾した細胞接着性ポリペプチド(P1−2)」に変更したこと以外、実施例1と同様にして、本発明の細胞接着性ポリペプチド含有基材[PB2](コーティング量が異なるPB2−1〜PB2−3)を得た。
【0088】
<実施例3>
(1)化学修飾した細胞接着性ポリペプチド(P1−3)の作製
「クロロ酢酸230mg」を「クロロエタノール94mg」に変更したこと以外、実施例1と同様にして、水溶性の直鎖状ポリペプチド(化学修飾した細胞接着性ポリペプチド;P1−3)を得た。
【0089】
(2)細胞接着性ポリペプチド含有基材[PB3]の作製
「化学修飾した細胞接着性ポリペプチド(P1−1)」を「化学修飾した細胞接着性ポリペプチド(P1−3)」に変更したこと以外、実施例1と同様にして、本発明の細胞接着性ポリペプチド含有基材[PB3](コーティング量が異なるPB3−1〜PB3−3)を得た。
【0090】
<実施例4>
(1)化学修飾した細胞接着性ポリペプチド(P1−4)の作製
「クロロ酢酸230mg」を「フルオロ酢酸191mg」に変更したこと以外、実施例1と同様にして、水溶性の直鎖状ポリペプチド(化学修飾した細胞接着性ポリペプチド;P1−4)を得た。
【0091】
(2)細胞接着性ポリペプチド含有基材[PB4]の作製
「化学修飾した細胞接着性ポリペプチド(P1−1)」を「化学修飾した細胞接着性ポリペプチド(P1−4)」に変更したこと以外、実施例1と同様にして、本発明の細胞接着性ポリペプチド含有基材[PB4](コーティング量が異なるPB4−1〜PB4−3)を得た。
【0092】
<実施例5>
(1)化学修飾した細胞接着性ポリペプチド(P1−5)の作製
「クロロ酢酸230mg」を「フルオロスルホン酸ナトリウム221mg」に変更したこと以外、実施例1と同様にして、水溶性の直鎖状ポリペプチド(化学修飾した細胞接着性ポリペプチド;P1−5)を得た。
【0093】
(2)細胞接着性ポリペプチド含有基材[PB5]の作製
「化学修飾した細胞接着性ポリペプチド(P1−1)」を「化学修飾した細胞接着性ポリペプチド(P1−5)」に変更したこと以外、実施例1と同様にして、本発明の細胞接着性ポリペプチド含有基材[PB5](コーティング量が異なるPB5−1〜PB5−3)を得た。
【0094】
<実施例6>
(1)化学修飾した細胞接着性ポリペプチド(P1−6)の作製
「クロロ酢酸230mg」を「2−フルオロエタノール75.4mg」に変更したこと以外、実施例1と同様にして、水溶性の直鎖状ポリペプチド(化学修飾した細胞接着性ポリペプチド;P1−6)を得た。
【0095】
(2)細胞接着性ポリペプチド含有基材[PB6]の作製
「化学修飾した細胞接着性ポリペプチド(P1−1)」を「化学修飾した細胞接着性ポリペプチド(P1−6)」に変更したこと以外、実施例1と同様にして、本発明の細胞接着性ポリペプチド含有基材[PB6](コーティング量が異なるPB6−1〜PB6−3)を得た。
【0096】
<比較例1>(特許文献1)
「化学修飾した細胞接着性ポリペプチド(P1−1)」を「直鎖状ポリペプチド(P1−0)」に変更したこと以外、実施例1と同様にして、比較用の細胞接着性ポリペプチド含有基材[PB7](コーティング量が異なるPB7−1〜PB7−3)を得た。
【0097】
<比較例2>(特許文献2)
(1)化学修飾した細胞接着性ポリペプチド(P1−7)の作製
「クロロ酢酸230mg」を「N,N−ジメチルアミノエチルクロリド150mg」に変更したこと以外、実施例1と同様にして、水溶性の直鎖状ポリペプチド(化学修飾した細胞接着性ポリペプチド;P1−7)を得た。
【0098】
(2)細胞接着性ポリペプチド含有基材[PB8]の作製
「化学修飾した細胞接着性ポリペプチド(P1−1)」を「化学修飾した細胞接着性ポリペプチド(P1−7)」に変更した以外、実施例1と同様にして、比較用の細胞接着性ポリペプチド含有基材[PB8](コーティング量が異なるPB8−1〜PB8−3)を得た。
【0099】
<コーティング量の測定>
Micro BCATM protein assay kit(THERMO Fisher Scientific社製)のReagent A溶液:Reagent B溶液:Reagent C溶液=25:24:1の混合液(C)を得た。細胞接着性ポリペプチド含有基材[PB1]〜[PB8](コーティング量の異なるPB1−1〜PB8−3)の各ウェルに混合液(C)を100μL加え、37℃で2時間静置した。
【0100】
2時間後に、ビシンコニン酸(BCA)とCu+とからなるキレートの生成量を、450nm(対照波長630nm)の吸光度でプレートリーダー(コロナ電気株式会社製MTP−32)を用いて測定し、あらかじめウシ血清アルブミンにより作成した検量線からコーティング量を得た。これらの結果を表1〜4に示す(これらの結果は各々8穴分(8ウェル分)の平均データである。)。
【0101】
<化学修飾により導入された官能基(K)の平均個数の測定>
化学修飾した細胞接着性ポリペプチド(P1−1)1mgを6N 塩酸200μLに加え脱気した。泡が発生しなるまで脱気した溶液を減圧密封下で110℃、22時間の加水分解を行った。次に、エバポレーターを用いて6N 塩酸を試料希釈液(アミノ酸自動分析用試料希釈液 Na型 pH2.20)に置換した後、2mlに試料希釈液でフィルアップ(full up)した。フィルアップした溶液を試料希釈液で10倍希釈し、0.2μmのフィルターを通し測定用試料とした。
【0102】
分析はポストラベル法によるHPLC測定を用いて行い、ラベル化試薬としてはオルトフタルアルデヒド、スタンダードとしてはアミノ酸混合標準液 H型を用いて、HPLCでの溶出時間からアミノ酸の種類を同定した。
上記において、(P1−1)にかえて(P1−0)を用いる以外は同様にして、HPLC測定を行った。
【0103】
カラム:Shim−pack Amino−Na
カラム温度:60℃
移動相:アミノ酸分析移動相セット(Na 型)(メーカー名:株式会社島津製作所)
流速:0.6ml/min
検出波長:励起波長350nm,測定波長450nm
(P1−0)及び(P1−1)のHPLCのピーク面積から、下記式により官能基(K)の平均個数を算出した。なお、化学修飾されないグリシンのピークを標準として用いた。
【0104】
官能基(K)の平均個数=Σ{γ−(βa/αa)/(β0/α0)×γ}
【0105】
α0:ポリペプチド(P1−0)中のグリシンのHPLCのピーク面積
β0:ポリペプチド(P1−0)中の各アミノ酸のHPLCのピーク面積
αa:細胞接着性ポリペプチド(P1−1)中のグリシンのHPLCのピーク面積
βa:細胞接着性ポリペプチド(P1−1)中の各アミノ酸のHPLCのピーク面積
γ:ポリペプチド(P1−0)中の各アミノ酸の数
【0106】
上記において、細胞接着性ポリペプチド(P1−1)に変えて細胞接着性ポリペプチド(P1−2)〜(P1−7)を用いたこと以外、上記と同様にして、化学修飾された細胞接着性ポリペプチド(P1−2)〜(P1−7)について、化学修飾により導入された官能基(K)の平均個数を求めた。これらの結果を表1〜4に示す。
【0107】
<評価:GE1細胞(マウス歯肉上皮由来細胞)の細胞接着活性>
PBSに牛血清アルブミンを0.2重量%含有する水溶液を[PB1]〜[PB8]の評価基材に50μL/ウェルで投入し、27±3℃で2時間放置した。アスピレーターを用いて溶液を除去した後、生理食塩水100μL/ウェルで2回洗浄し、さらに脱イオン水100μL/ウェルで洗浄した。次に、血清を含まないDMEM(ICN Biomedicals社製)を100μL/ウェルで添加し、30℃インキュベーター内に1時間保存した。1時間後、GE1細胞(大日本製薬株式会社製)を1万cells/ウェルで添加し、30℃、二酸化炭素濃度5容量%のインキュベーター中にて2時間放置して培養した。
【0108】
培養終了後、アスピレーターを用いて培地を除去し、生理食塩水を細胞に直接当たらないように注意しながら100μL/ウェルで添加し、アスピレーターを用いて生理食塩水を除去した。次にPBSを50μL/ウェルで添加し、さらにテトラカラーワン(生化学工業株式会社)を10μL/ウェルで添加して、37℃、二酸化炭素濃度5容量%のインキュベーター中に4時間放置した。
【0109】
4時間後に、ホルマザン生成量を、450nm(対照波長630nm)の吸光度でプレートリーダー(コロナ電気株式会社製MTP−32)を用いて測定し、この値を細胞接着活性とした。細胞接着活性は、当該吸光度の高さに比例する。これらの結果を表1に示す(これらの結果は各々8穴分(8ウェル分)の平均データである。)。また、得られた結果について、縦軸をGE1細胞の細胞接着活性、横軸をコーティング量としてプロットし、グラフを作成した(図1)。
【0110】
<評価:GE1細胞(マウス歯肉上皮細胞由来細胞)の細胞増殖活性>
[PB1]〜[PB8]の評価基材に血清を含まないDMEM(ICN Biomedicals社製)を100μL/ウェルで添加し、33℃インキュベーター内に1時間保存した。1時間後、GE1細胞(大日本製薬株式会社製)を1000cells/ウェルで添加し、33℃、二酸化炭素濃度5容量%のインキュベーター中にて2時間放置して培養した。
【0111】
培養終了後、アスピレーターを用いて培地を除去し、生理食塩水を細胞に直接当たらないように注意しながら100μL/ウェルで添加し、アスピレーターを用いて生理食塩水を除去した。次に10容量%の血清を含むDMEMを100μL/ウェルで添加し、33℃、二酸化炭素濃度5容量%のインキュベーター中に15日間培養した。また、5日間ごとに培地を交換した。
【0112】
15日後に、テトラカラーワン(生化学工業株式会社)を10μL/ウェルで添加して、37℃、二酸化炭素濃度5容量%のインキュベーター中に4時間放置した。4時間後に、ホルマザン生成量を、450nm(対照波長630nm)の吸光度でプレートリーダー(コロナ電気株式会社製MTP−32)を用いて測定し、この値を細胞増殖活性とした。細胞増殖活性は、当該吸光度の高さに比例する。これらの結果を表3に示す(これらの結果は各々8穴分(8ウェル分)の平均データである。)。また、得られた結果について、縦軸をGE1細胞の細胞増殖活性、横軸をコーティング量としてプロットし、グラフを作成した(図3)。
【0113】
<評価:C3H10T1/2細胞(マウス胎児由来線維芽細胞)の細胞接着活性>
PBSに牛血清アルブミンを0.2重量%含有する水溶液を[PB1]〜[PB8]の評価基材に50μL/ウェルで投入し、27±3℃で2時間放置した。アスピレーターを用いて溶液を除去した後、生理食塩水100μL/ウェルで2回洗浄し、さらに脱イオン水100μL/ウェルで洗浄した。次に、血清を含まないDMEM(ICN Biomedicals社製)を100μL/ウェルで添加し、37℃インキュベーター内に1時間保存した。1時間後、C3H10T1/2細胞(大日本製薬株式会社製)を1万cells/ウェルで添加し、37℃、二酸化炭素濃度5容量%のインキュベーター中にて2時間放置して培養した。
【0114】
培養終了後、アスピレーターを用いて培地を除去し、生理食塩水を細胞に直接当たらないように注意しながら100μL/ウェルで添加し、アスピレーターを用いて生理食塩水を除去した。次にPBSを50μL/ウェルで添加し、さらにテトラカラーワン(生化学工業株式会社)を10μL/ウェルで添加して、37℃、二酸化炭素濃度5容量%のインキュベーター中に4時間放置した。
【0115】
4時間後に、ホルマザン生成量を、450nm(対照波長630nm)の吸光度でプレートリーダー(コロナ電気株式会社製MTP−32)を用いて測定し、この値を細胞接着活性とした。細胞接着活性は、当該吸光度の高さに比例する。これらの結果を表2に示す(これらの結果は各々8穴分(8ウェル分)の平均データである。)。また、得られた結果について、縦軸をC3H10T1/2細胞の細胞接着活性、横軸をコーティング量としてプロットし、グラフを作成した(図2)。
【0116】
<評価:C3H10T1/2細胞(マウス歯肉上皮細胞由来細胞)の細胞増殖活性>
[PB1]〜[PB8]の評価基材に血清を含まないDMEM(ICN Biomedicals社製)を100μL/ウェルで添加し、37℃インキュベーター内に1時間保存した。1時間後、C3H10T1/2細胞(大日本製薬株式会社製)を1000cells/ウェルで添加し、37℃、二酸化炭素濃度5容量%のインキュベーター中にて2時間放置して培養した。
【0117】
培養終了後、アスピレーターを用いて培地を除去し、生理食塩水を細胞に直接当たらないように注意しながら100μL/ウェルで添加し、アスピレーターを用いて生理食塩水を除去した。次に10容量%の血清を含むDMEMを100μL/ウェルで添加し、37℃、二酸化炭素濃度5容量%のインキュベーター中に15日間培養した。また、5日間ごとに培地を交換した。
【0118】
15日後に、テトラカラーワン(生化学工業株式会社)を10μL/ウェルで添加して、37℃、二酸化炭素濃度5容量%のインキュベーター中に4時間放置した。4時間後に、ホルマザン生成量を、450nm(対照波長630nm)の吸光度でプレートリーダー(コロナ電気株式会社製MTP−32)を用いて測定し、この値を細胞増殖活性とした。細胞増殖活性は、当該吸光度の高さに比例する。これらの結果を表4に示す(これらの結果は各々8穴分(8ウェル分)の平均データである。)。また、得られた結果について、縦軸をC3H10T1/2細胞の細胞増殖活性、横軸をコーティング量としてプロットし、グラフを作成した(図4)。
【0119】
<評価:インテグリンの抗体添加による細胞接着阻害活性>
C3H10T1/2細胞(大日本製薬株式会社製)を血清を含まないDMEM(ICN Biomedicals社製)に400,000cells/mlで懸濁した。この細胞懸濁液に各インテグリン(α3、α4、αV、α6、β1及びβ4)の抗体(入手先;α3:Chemicon社、β4:Millipore社、αV:BioLegend社、α4,α6,β1:R&D systems社)のいずれかを10μg/mlの濃度で添加し、37℃、二酸化炭素濃度5容量%のインキュベーター中で30分間放置して、インテグリン抗体結合細胞を得た。これらのインテグリン抗体結合細胞と、基材[PB1−3、PB2−3、PB3−3、PB7−3及びPB8−3]とを用いて、上記と同様にして、細胞接着活性を測定し、この細胞接着活性の測定値(G1)と表2の細胞接着活性(G0)とから、細胞接着阻害(%)を下記式により求め、下記の基準で評価した。
【0120】
細胞接着阻害(%)={(G0)−(G1)}/(G0)×100
−:細胞接着阻害0%以上10%未満
+:細胞接着阻害10%以上20%未満
++:細胞接着阻害20%以上40%未満
+++:細胞接着阻害40%以上
【0121】
インテグリンの抗体を加えると、細胞表面のインテグリンがインテグリン抗体によりマスクされ、細胞接着が阻害されるため、細胞が細胞接着性ポリペプチドに接着できなくなる。したがって、それぞれのインテグリン抗体の添加による細胞接着阻害が大きいほど、細胞接着性ポリペプチドがそのインテグリンと結合していたことを意味する。これらの結果を表5に示す。
【0122】
【表1】

アスタリスクは比較例1との有意差を示す(*P<0.05、**P<0.01)。なお、t検定により有意差を判定した。
【0123】
表1において、本発明の細胞接着性ポリペプチド(P1−1)〜(P1−6)をコーティングした基材[PB1]〜[PB6](実施例1〜6)は、官能基を導入していないポリペプチドをコーティングした基材[PB7](比較例1)と比較して、コーティング量が0.5μg/cm2近辺である場合(PB1−1〜PB6−1)、すべての実施例の基材が比較例1(PB7−1)の基材よりも細胞接着活性が優れていた。特に、実施例1、2及び6の基材は、コーティング量が0.5μg/cm2近辺での細胞接着活性が、比較例1の基材の細胞接着活性よりも有意に高かった。さらに、コーティング量が2μg/cm2近辺である場合(実施例1〜6の基材(PB1−2〜PB6−2)と比較例1の基材(PB7−2)を比較した場合)も、本発明の実施例の基材が比較例の基材よりも細胞接着性が優れていた。このことは、図1からも明らかである。したがって、本発明の細胞接着性ポリペプチドは、コーティング量を減らしても細胞接着性が極めて優れていることがわかる。
【0124】
また、第3級アミノ基を導入した比較例2の基材は、化学修飾されたアミノ酸の平均個数が同程度である実施例2の基材と比較して、全てのコーティング量において実施例2の基材の方が細胞接着活性が高く、細胞接着性が優れていた。
【0125】
【表2】

アスタリスクは比較例1との有意差を示す(*P<0.05、**P<0.01)。なお、t検定により有意差を判定した。
【0126】
表2において、コーティング量が0.5μg/cm2近辺である場合(PB1−1〜PB7−1を比較した場合)、すべての実施例の基材が比較例1の基材よりも細胞接着活性が高く、細胞接着性が優れていた。特に、実施例1、2、4、5及び6の基材は、コーティング量が0.5μg/cm2近辺での細胞接着活性が、比較例1の基材の細胞接着活性よりも有意に高かった。このことは図2からも明らかである。したがって、本発明の細胞接着性ポリペプチドは、様々な細胞種で細胞接着性が優れていることがわかる。
【0127】
また、第3級アミノ基を導入した比較例2の基材は、化学修飾されたアミノ酸の平均個数が同程度である実施例2の基材と比較して、全てのコーティング量において実施例2の基材の方が細胞接着活性が高く、細胞接着性が優れていた。
【0128】
【表3】

アスタリスクは比較例1との有意差を示す(*P<0.05、**P<0.01)。なお、t検定により有意差を判定した。
【0129】
表3において、本発明の細胞接着性ポリペプチドをコーティングした基材[PB1]〜[PB6](実施例1〜6)は、官能基を導入していないポリペプチドをコーティングした基材[PB7](比較例1)及び第3級アミノ基を導入した基材[PB8](比較例2)と比較して、コーティング量が低濃度である0.5μg/cm2近辺(PB1−1〜PB8−1を比較した場合)での細胞増殖活性が高かった。特に、官能基の平均個数が60〜90である実施例1、2、及び6の基材において有意に高かった。このことは、図3からも明らかである。
【0130】
さらに、比較例2の基材は、化学修飾された官能基の平均個数が同程度である実施例2の基材と比較して、全てのコーティング量において実施例2の基材の方が細胞増殖活性が高く、細胞増殖性が優れていた。
【0131】
【表4】

アスタリスクは比較例1との有意差を示す(*P<0.05、**P<0.01)。なお、t検定により有意差を判定した。
【0132】
表4において、コーティング量が0.5μg/cm2近辺である場合(PB1−1〜PB8−1を比較した場合)、すべての実施例の基材が比較例1及び2の基材よりも細胞増殖活性が高く、細胞増殖性が優れていた。特に、実施例1、2及び6の基材は、コーティング量が0.5μg/cm2近辺での細胞増殖活性が、比較例1の基材の細胞増殖活性よりも有意に高かった。このことは図4からも明らかである。したがって、本発明の細胞接着性ポリペプチドは、様々な細胞種で細胞増殖性が優れていることが分かる。
【0133】
また、第3級アミノ基を導入した比較例2の基材に対して、実施例1〜6の基材は2μg/cm2近辺での細胞増殖活性が高く、細胞増殖性が優れていた。
【0134】
さらに、比較例2の基材は、化学修飾された官能基の平均個数が同程度である実施例2の基材と比較して、全てのコーティング量において実施例2の基材の方が細胞増殖活性が高く、細胞増殖性が優れていた。
【0135】
【表5】

【0136】
表5において、カルボキシル基又はスルホ基により化学修飾された本発明の細胞接着性ポリペプチド(実施例1及び2)及び第3級アミノ基を導入した細胞接着性ポリペプチド(比較例2)は、インテグリン(α3、α4、αV、α6、β1及びβ4)の抗体により細胞接着が阻害されており、比較例1の細胞接着性ポリペプチドと比べて、新たに、細胞表面のインテグリン(αV、α6及びβ4)と接着していることが分かった。また、カルボキシル基又はスルホ基により化学修飾された本発明の細胞接着性ポリペプチド(実施例1及び2)は、同様に、比較例2の細胞接着性ポリペプチドと比べて、新たに、細胞表面のインテグリン(αV)と接着していることが分かった。以上の通り、本発明の細胞接着性ポリペプチドは、比較例1、2の細胞接着性ポリペプチドと比較して、より多くの種類のインテグリンと結合するため、細胞接着性ポリペプチドが低濃度であっても細胞接着性が優れると考えられる。
【0137】
<実施例7〜12>
実施例1〜6で得た細胞接着性ポリペプチド(P1−1)〜(P1−6)を用いたマウス胎児由来線維芽細胞の細胞集合体の作製
1重量%ポリビニルアルコール(JP−18、日本塩ビ・ポバール株式会社製)水溶液をコーティングして細胞が接着しないようにした細胞非接着性スピンナーフラスコ(Double CelStir Spinner Flask、Wheaton社製)に、DMEM培地(ICN Biomedicals社製)8ml、C3H10T1/2細胞(マウス胎児由来線維芽細胞)懸濁液1ml(107cells/ml)、細胞接着性ポリペプチド(P1−1)1ml(1μg/ml)をそれぞれ加え、80rpm、37℃、二酸化炭素濃度5容量%のインキュベーター中にて旋回培養を行った。
また、細胞接着性ポリペプチド(P1−2)〜(P1−6)についても上記と同様にして、旋回培養を行った。
【0138】
培養6時間後、培養液300μLをそれぞれのフラスコから回収し、回収しなかった培養液については、7日間培養を継続した。
回収した各培養液を、U底96wellプレートに3カ所ずつ、それぞれ100μl/ウェルで添加した。その後、それぞれのウェルについて、細胞集合体の顕微鏡画像(倍率40倍、CKX41、OLYMPUS社製)を取得し、画像解析ソフト(image J、アメリカ国立衛生研究所)及びマイクロメーター(目盛10μm、目盛長1mm)を用いて解析することにより、得られた細胞集合体(1)〜(6)の粒子径と粒度分布を測定した。測定した結果は、3カ所のウェルの平均値及びばらつきで示した。結果を表6に示す。
なお、画像解析ソフトにより得られる数値の単位が「ピクセル」であるため、マイクロメーターにより画像を計測して、1ピクセルが何μmに相当するのかを算出し、実際の単位「μm」に換算した。
【0139】
<比較例3及び4>
比較例1〜2で使用した細胞接着性ポリペプチド(P1−0)又は(P1−7)を用いたマウス胎児由来線維芽細胞の細胞集合体の作製
細胞接着性ポリペプチド(P1−1)〜(P1−6)を細胞接着性ポリペプチド(P1−0)又は(P1−7)に変更したこと以外、実施例7〜12と同様にして、細胞集合体(7)〜(8)を作成し、細胞集合体の粒子径と粒度分布を測定した。結果を表6に示す。
【0140】
<比較例5>
U底96wellプレートに1重量%ポリビニルアルコール(JP−18、日本塩ビ・ポバール株式会社製)水溶液を50μl/ウェルで加え、37℃で15分間放置した。15分後、ポリビニルアルコール水溶液を除去し、PBS溶液を100μl/ウェルで加えて2回洗浄した。
洗浄したウェルに、C3H10T1/2細胞(マウス胎児由来線維芽細胞)懸濁液1ml(104cells /ml)を加え、37℃で7日間培養した。
【0141】
<細胞集合体の活性評価;ミトコンドリア活性>
培養して7日後の実施例7〜12、比較例3〜5の培養液を、それぞれU底96wellプレートに3カ所ずつ、それぞれ100μl/ウェルで添加し、さらにテトラカラーワン(生化学工業株式会社)を10μL/ウェルで添加して、37℃、二酸化炭素濃度5容量%のインキュベーター中に4時間放置した。
【0142】
4時間後に、ホルマザン生成量を、450nm(対照波長630nm)の吸光度でプレートリーダー(コロナ電気株式会社製MTP−32)を用いて測定した。生細胞数は細胞集合体に核放出溶液(0.2重量%クリスタルバイオレット、0.2Mクエン酸3ナトリウム、2重量%Tween20)を加え、1時間置くことで生細胞の核を細胞から放出させ、血球計数盤を用いて核数を測定した。ホルマザン生成量を生細胞数で標準化し、細胞集合体のミトコンドリア活性とした。測定した結果は、3カ所のウェルの平均値で評価した。また、実施例7〜12、比較例3及び4のミトコンドリア活性は、比較例5のミトコンドリア活性を100とした場合の相対値で表した。これらの結果を表6に示す。
【0143】
【表6】

【0144】
表6から、本発明の細胞接着性ポリペプチド(P1−1)〜(P1−6)を使用して得た細胞集合体(1)〜(6)(実施例7〜12;6時間培養後)の粒径は71〜107μmであり、比較の細胞接着性ポリペプチド(P1−0)又は(P1−7)を使用して得た細胞集合体(7)及び(8)(比較例3、4;6時間培養後)の粒径53μm及び64μmよりも有意に大きかった。
【0145】
また、本発明の細胞接着性ポリペプチドを使用して作製した細胞集合体(1)〜(6)の粒径のばらつきは±10μm〜±30μmであり、比較の細胞接着性ポリペプチドを使用して作製した細胞集合体(7)及び(8)の粒径のばらつき±31μm及び±32μmより小さかった。
したがって、本発明の細胞接着性ポリペプチドを用いれば、比較用の細胞集合体に比べて、粒径の大きな細胞集合体を得ることができた。また、本発明の細胞接着性ポリペプチドを用いれば、粒径のばらつきの小さな細胞集合体を得ることができた。
【0146】
また、表6の培養7日間後のミトコンドリア活性の測定結果から、本発明の細胞接着性ポリペプチド(P1−1)〜(P1−6)を使用した細胞培養(実施例7〜12)では89以上と、細胞接着性ポリペプチドを用いていない細胞培養(比較例5)と同等程度又はそれ以上であり、活性の高い細胞集合体を得られた。特に、実施例7〜10の細胞培養では105〜140と比較例5の細胞培養よりも高く、得られた細胞集合体の活性が非常に高かった。
【0147】
<実施例13〜18>
実施例1〜6で得た細胞接着性ポリペプチド(P1−1)〜(P1−6)を用いた肝臓由来細胞の細胞集合体の作製
1重量%ポリビニルアルコール(JP−18、日本塩ビ・ポバール株式会社製)水溶液でコーティングして細胞が接着しないようにした細胞非接着性スピンナーフラスコ(Double CelStir Spinner Flask、Wheaton社製)に、DMEM培地(ICN Biomedicals社製)8ml、HepG2細胞(肝臓由来細胞)懸濁液1ml(107cells/ml)、細胞接着性ポリペプチド(P1−1)1ml(1μg/ml)をそれぞれ加え、80rpm、37℃、二酸化炭素濃度5容量%のインキュベーター中にて旋回培養を行った。
また、細胞接着性ポリペプチド(P1−2)〜(P1−6)についても上記と同様にして、旋回培養を行った。
【0148】
培養6時間後、培養液300μLをそれぞてのフラスコから回収し、回収しなかった培養液については、7日間培養を継続した。
回収した各培養液を、U底96wellプレートに3カ所ずつ、それぞれ100μl/ウェルで添加した。その後、それぞれのウェルについて、細胞集合体の顕微鏡画像を取得し、得られた細胞集合体(9)〜(14)の粒子径と粒度分布を測定した。測定した結果は、3カ所のウェルの平均値及びばらつきで示した。結果を表7に示す。
【0149】
<比較例6及び7>
比較例1〜2で使用した細胞接着ポリペプチド(P1−0)又は(P1−7)を用いた肝臓由来細胞の細胞集合体の作製
細胞接着性ポリペプチド(P1−1)〜(P1−6)を細胞接着性ポリペプチド(P1−0)又は(P1−7)に変更したこと以外、実施例7〜12と同様にして、細胞集合体(15)〜(16)を作成し、細胞集合体の粒子径と粒度分布を測定した。結果を表7に示す。
【0150】
<比較例8>
U底96wellプレートに1重量%ポリビニルアルコール(JP−18、日本塩ビ・ポバール株式会社製)水溶液を50μl/ウェルで加え、37℃で15分間放置した。15分後、ポリビニルアルコール水溶液を除去し、PBS溶液を100μl/ウェルで加えて2回洗浄した。
洗浄したウェルに、HepG2細胞(肝臓由来細胞)懸濁液1ml(104cells/ml)を加え、37℃で7日間培養した。
【0151】
<細胞集合体の活性評価;チトクローム活性>
培養して7日後の実施例13〜18、比較例6〜8の培養液を、それぞれU底96wellプレートに3カ所ずつ、それぞれ100μl/ウェルで添加し、さらにP450−GLOTMCYP3A4 assay(プロメガ)を用いてチトクローム活性を測定した。生細胞数は細胞集合体に核放出溶液(0.2重量%クリスタルバイオレット、0.2Mクエン酸3ナトリウム、2重量%Tween20)を加え、1時間置くことで生細胞の核を細胞から放出させ、血球計数盤を用いて核数を測定した。チトクローム活性を生細胞数で標準化し、細胞集合体のチトクローム活性とした。測定した結果は、3カ所のウェルの平均値で評価した。また、実施例13〜18、比較例6及び7のチトクローム活性は、比較例8のチトクローム活性を100とした場合の相対値で表した。これらの結果を表7に示す。
【0152】
【表7】

【0153】
表7から、本発明の細胞接着性ポリペプチド(P1−1)〜(P1−6)を使用して得た細胞集合体(9)〜(14)(実施例13〜18;6時間培養後)の粒径は101〜150μmであり、比較の細胞接着性ポリペプチド(P1−0)又は(P1−7)を使用して得た細胞集合体(15)及び(16)(比較例6、7;6時間培養後)の粒径83μm及び94μmよりも有意に大きかった。
【0154】
また、本発明の細胞接着性ポリペプチドを使用して作製した細胞集合体の粒径のばらつきは±14μm〜±33μmであり、比較の細胞接着性ポリペプチドを使用して作製した細胞集合体の粒径のばらつき±36μm及び±39μmより小さかった。
したがって、本発明の細胞接着性ポリペプチドを用いれば、比較用の細胞集合体に比べて、粒径の大きな細胞集合体を得ることができた。また、本発明の細胞接着性ポリペプチドを用いれば、粒径のばらつきの小さな細胞集合体を得ることができた。
【0155】
また、表7の培養7日間後のチトクローム活性の測定結果から、本発明の細胞接着性ポリペプチド(P1−1)〜(P1−6)のチトクローム活性は101以上と、細胞接着性ポリペプチドを用いていない比較例8と同等程度又はそれ以上であり、活性の高い細胞集合体を得られた。特に、実施例13〜17のチトクローム活性は121〜150と比較例8のそれよりも極めて高く、得られた細胞集合体の活性が非常に高かった。
【産業上の利用可能性】
【0156】
本発明の細胞接着性ポリペプチドは、低濃度においても細胞接着性及び細胞増殖性が極めて高いため、従来は無血清培養条件下において接着が困難であった細胞(GE1細胞等)を基材上に効率良く接着させることができる。したがって、本発明の細胞接着性ポリペプチド、細胞接着性ポリペプチド含有基材及び細胞接着性ポリペプチド含有基材を用いて細胞培養する工程を含む製造方法は、細胞が関係する、研究開発、有用物質生産及び治療等に極めて有用である。
【0157】
研究開発用としては、動物実験(毒性試験、刺激性試験及び代謝機能試験等)の代替、遺伝子導入、目的物質(細胞、生理活性物質、遺伝子、有害化学物質及び薬効成分等)のスクリーニング及び細胞の精製や機能解析等に利用できる。
【0158】
有用物質生産用としては、サイトカイン、血栓溶解剤、血液凝固因子製剤、ワクチン、ホルモン、抗生物質、抗体及び増殖因子等の生産に利用できる。
【0159】
治療用としては、皮膚、頭蓋骨、筋肉、皮膚組織、骨、軟骨、血管、神経、腱、靭帯、毛胞組織、粘膜組織、歯周組織、象牙質、骨髄、網膜、漿膜、胃腸管及び脂肪等の組織、並びに肺、肝、膵及び腎等の臓器の治療に利用できる。
【特許請求の範囲】
【請求項1】
少なくとも細胞接着性最小アミノ酸配列(X)及び補助アミノ酸配列(Y)から構成され、反応性基含有アミノ酸残基を有するポリペプチド(P)と、
カルボキシル基、スルホ基及びヒドロキシル基からなる群より選ばれる少なくとも1種の官能基(K)を有する化合物(A)とを化学反応させることにより、
ポリペプチド(P)に含まれる反応性基含有アミノ酸残基を化学修飾した細胞接着性ポリペプチド。
【請求項2】
化合物(A)がカルボキシル基又はスルホ基を有する化合物である請求項1に記載の細胞接着性ポリペプチド。
【請求項3】
化合物(A)がクロロ酢酸又は2−クロロエタンスルホン酸ナトリウムである請求項1又は2に記載の細胞接着性ポリペプチド。
【請求項4】
反応性基含有アミノ酸残基が、セリン残基、トレオニン残基、チロシン残基、アスパラギン酸残基、グルタミン酸残基、リシン残基、アルギニン残基、ヒスチジン残基及びトリプトファン残基からなる群より選ばれる少なくとも1種である請求項1〜3のいずれかに記載の細胞接着性ポリペプチド。
【請求項5】
細胞接着性最小アミノ酸配列(X)が、Arg Gly Asp配列、Leu Asp Val配列、Arg Glu Asp Val配列(1)、Tyr Ile Gly Ser Arg配列(2)、Pro Asp Ser Gly Arg配列(3)、Arg Tyr Val Val Leu Pro Arg配列(4)、Leu Gly Thr Ile Pro Gly配列(5)、Arg Asn Ile Ala Glu Ile Ile Lys Asp Ile配列(6)、Ile Lys Val Ala Val配列(7)、Leu Arg Glu配列、Asp Gly Glu Ala配列(8)、Gly Val Lys Gly Asp Lys Gly Asn Pro Gly Trp Pro Gly Ala Pro配列(9)、Gly Glu Phe Tyr Phe Asp Leu Arg Leu Lys Gly Asp Lys配列(10)、His Ala Val配列及びTyr Lys Leu Asn Val Asn Asp Ser配列(11)からなる群より選ばれる少なくとも1種である請求項1〜4のいずれかに記載の細胞接着性ポリペプチド。
【請求項6】
補助アミノ酸配列(Y)が、(Gly Ala)a配列 、(Gly Ala Gly Ala Gly Ser)b配列、(Gly Ala Gly Ala Gly Tyr)c配列、(Gly Ala Gly Val Gly Tyr)d配列、(Gly Ala Gly Tyr Gly Val)e配列、{Asp Gly Gly (Ala)f Gly Gly Ala}g配列、(Gly Val Pro Gly Val)h配列、(Gly Val Gly Val Pro)m配列及び(Gly Pro Pro)n配列からなる群より選ばれる少なくとも1種を有する請求項1〜5のいずれかに記載の細胞接着性ポリペプチド。
なお、aは5〜100の整数、b、c、d及びeは2〜33の整数、fは1〜194の整数、gは1〜{200/(6+f)の小数点以下を切り捨てした数}の整数、hは2〜40の整数、mは2〜40の整数、nは3〜66の整数である。
【請求項7】
ポリペプチド(P)が、さらに細胞接着性最少アミノ酸配列(X)の両端に介在アミノ酸配列(Z)を含み、
細胞接着性最少アミノ酸配列(X)の両端に介在アミノ酸配列(Z)を含むアミノ酸配列と補助アミノ酸配列(Y)とが交互に化学結合してなる構造である請求項1〜6のいずれかに記載の細胞接着性ポリペプチド。
【請求項8】
反応性基含有アミノ酸残基の化学修飾により導入された官能基(K)の平均個数が1〜156個である請求項1〜7のいずれかに記載の細胞接着性ポリペプチド。
【請求項9】
ポリペプチド(P)が、配列(86)、配列(87)、配列(88)、配列(89)、配列(90)、配列(91)、配列(92)、配列(93)又は配列(94)で表されるポリペプチドである請求項1〜8のいずれかに記載の細胞接着性ポリペプチド。
【請求項10】
請求項1〜9のいずれかに記載の細胞接着性ポリペプチド及び基材(B)を含む細胞接着性ポリペプチド含有基材。
【請求項11】
請求項1〜9のいずれかに記載の細胞接着性ポリペプチドを用いて細胞培養する工程を含む細胞又は細胞集合体の生産方法。
【請求項1】
少なくとも細胞接着性最小アミノ酸配列(X)及び補助アミノ酸配列(Y)から構成され、反応性基含有アミノ酸残基を有するポリペプチド(P)と、
カルボキシル基、スルホ基及びヒドロキシル基からなる群より選ばれる少なくとも1種の官能基(K)を有する化合物(A)とを化学反応させることにより、
ポリペプチド(P)に含まれる反応性基含有アミノ酸残基を化学修飾した細胞接着性ポリペプチド。
【請求項2】
化合物(A)がカルボキシル基又はスルホ基を有する化合物である請求項1に記載の細胞接着性ポリペプチド。
【請求項3】
化合物(A)がクロロ酢酸又は2−クロロエタンスルホン酸ナトリウムである請求項1又は2に記載の細胞接着性ポリペプチド。
【請求項4】
反応性基含有アミノ酸残基が、セリン残基、トレオニン残基、チロシン残基、アスパラギン酸残基、グルタミン酸残基、リシン残基、アルギニン残基、ヒスチジン残基及びトリプトファン残基からなる群より選ばれる少なくとも1種である請求項1〜3のいずれかに記載の細胞接着性ポリペプチド。
【請求項5】
細胞接着性最小アミノ酸配列(X)が、Arg Gly Asp配列、Leu Asp Val配列、Arg Glu Asp Val配列(1)、Tyr Ile Gly Ser Arg配列(2)、Pro Asp Ser Gly Arg配列(3)、Arg Tyr Val Val Leu Pro Arg配列(4)、Leu Gly Thr Ile Pro Gly配列(5)、Arg Asn Ile Ala Glu Ile Ile Lys Asp Ile配列(6)、Ile Lys Val Ala Val配列(7)、Leu Arg Glu配列、Asp Gly Glu Ala配列(8)、Gly Val Lys Gly Asp Lys Gly Asn Pro Gly Trp Pro Gly Ala Pro配列(9)、Gly Glu Phe Tyr Phe Asp Leu Arg Leu Lys Gly Asp Lys配列(10)、His Ala Val配列及びTyr Lys Leu Asn Val Asn Asp Ser配列(11)からなる群より選ばれる少なくとも1種である請求項1〜4のいずれかに記載の細胞接着性ポリペプチド。
【請求項6】
補助アミノ酸配列(Y)が、(Gly Ala)a配列 、(Gly Ala Gly Ala Gly Ser)b配列、(Gly Ala Gly Ala Gly Tyr)c配列、(Gly Ala Gly Val Gly Tyr)d配列、(Gly Ala Gly Tyr Gly Val)e配列、{Asp Gly Gly (Ala)f Gly Gly Ala}g配列、(Gly Val Pro Gly Val)h配列、(Gly Val Gly Val Pro)m配列及び(Gly Pro Pro)n配列からなる群より選ばれる少なくとも1種を有する請求項1〜5のいずれかに記載の細胞接着性ポリペプチド。
なお、aは5〜100の整数、b、c、d及びeは2〜33の整数、fは1〜194の整数、gは1〜{200/(6+f)の小数点以下を切り捨てした数}の整数、hは2〜40の整数、mは2〜40の整数、nは3〜66の整数である。
【請求項7】
ポリペプチド(P)が、さらに細胞接着性最少アミノ酸配列(X)の両端に介在アミノ酸配列(Z)を含み、
細胞接着性最少アミノ酸配列(X)の両端に介在アミノ酸配列(Z)を含むアミノ酸配列と補助アミノ酸配列(Y)とが交互に化学結合してなる構造である請求項1〜6のいずれかに記載の細胞接着性ポリペプチド。
【請求項8】
反応性基含有アミノ酸残基の化学修飾により導入された官能基(K)の平均個数が1〜156個である請求項1〜7のいずれかに記載の細胞接着性ポリペプチド。
【請求項9】
ポリペプチド(P)が、配列(86)、配列(87)、配列(88)、配列(89)、配列(90)、配列(91)、配列(92)、配列(93)又は配列(94)で表されるポリペプチドである請求項1〜8のいずれかに記載の細胞接着性ポリペプチド。
【請求項10】
請求項1〜9のいずれかに記載の細胞接着性ポリペプチド及び基材(B)を含む細胞接着性ポリペプチド含有基材。
【請求項11】
請求項1〜9のいずれかに記載の細胞接着性ポリペプチドを用いて細胞培養する工程を含む細胞又は細胞集合体の生産方法。
【図1】


【図2】


【図3】


【図4】




【図2】


【図3】


【図4】


【公開番号】特開2012−126707(P2012−126707A)
【公開日】平成24年7月5日(2012.7.5)
【国際特許分類】
【出願番号】特願2011−242004(P2011−242004)
【出願日】平成23年11月4日(2011.11.4)
【出願人】(000002288)三洋化成工業株式会社 (1,719)
【出願人】(599029420)
【Fターム(参考)】
【公開日】平成24年7月5日(2012.7.5)
【国際特許分類】
【出願日】平成23年11月4日(2011.11.4)
【出願人】(000002288)三洋化成工業株式会社 (1,719)
【出願人】(599029420)

【Fターム(参考)】
[ Back to top ]

