化学蓄熱材及びケミカルヒートポンプ
【課題】伝熱性に優れ、高い反応速度が得られる化学蓄熱材、及び、該化学蓄熱材を用いたケミカルヒートポンプを提供する。
【解決手段】Mg,Ca,Sr,Baの水酸化物、塩化物、または硫酸化物のいずれかを主成分とする粒子を表面に担持する膨張化グラファイトが、所定の形状に圧縮されて成形された成形体とされる化学蓄熱材6。及び、該化学蓄熱材6を収納する反応容器2と、水蒸気を液化または蒸発させる貯蔵容器3と、該反応容器2と該貯蔵容器3とを連結するガス流通路4と、該ガス流通路4に設けられる開閉弁5とを備えるケミカルヒートポンプ1。
【解決手段】Mg,Ca,Sr,Baの水酸化物、塩化物、または硫酸化物のいずれかを主成分とする粒子を表面に担持する膨張化グラファイトが、所定の形状に圧縮されて成形された成形体とされる化学蓄熱材6。及び、該化学蓄熱材6を収納する反応容器2と、水蒸気を液化または蒸発させる貯蔵容器3と、該反応容器2と該貯蔵容器3とを連結するガス流通路4と、該ガス流通路4に設けられる開閉弁5とを備えるケミカルヒートポンプ1。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、水和発熱反応と脱水吸熱反応との可逆反応を示す化学蓄熱材を利用したケミカルヒートポンプに関する。
【背景技術】
【0002】
ケミカルヒートポンプは、水和発熱反応と脱水吸熱反応との可逆反応を利用して、蓄熱及び放熱を行うものである。例えば、製鉄業などの高温プロセスや熱電併給システムからの排熱をケミカルヒートポンプで蓄熱し、必要に応じて放熱を行うことによって、効率的にエネルギーを利用することができる。
【0003】
ケミカルヒートポンプに適用される蓄熱材として、酸化マグネシウム/水酸化マグネシウム反応系、塩化カルシウム反応系などが知られている。酸化マグネシウム/水酸化マグネシウム系での水和反応及び脱水反応は、以下の反応式(1)で示される。
【化1】

反応式(1)の反応熱は、ΔHO=−81.0kJmol−1である。すなわち、酸化マグネシウムの水和反応は発熱反応であり、水酸化マグネシウムの脱水反応は吸熱反応である。
【0004】
特許文献1は、水酸化マグネシウムを450℃以下でか焼した酸化マグネシウムを反応容器内に充填させたケミカルヒートポンプを開示している。特許文献1のケミカルヒートポンプでは、先ず、夜間の余剰電力や排熱を利用して反応容器内の蒸気の水酸化マグネシウムを上記のか焼温度で加熱し、高圧力の水蒸気を放出させる。水蒸気は貯蔵容器に導かれ、冷却されて凝縮熱を放出する。昼間の電力需要が大きくなった時に、貯蔵容器内の水蒸気を反応容器に移動させて、水蒸気と酸化マグネシウムとを水和反応させる。水和反応により熱が放出されるとともに、貯蔵容器内の水蒸気が蒸発する際の蒸発潜熱によって熱が発生する。
【0005】
特許文献2は、プレートフィン型熱交換部を備える反応容器を有するケミカルヒートポンプを開示している。熱交換部の反応ガス流通路の表面は、塩化カルシウム、酸化マグネシウム、酸化カルシウムなどの反応材で覆われている。特許文献2は、ガス流通路において、ガス透過性材料として膨張黒鉛の表面及び反応器構造材の表面に反応材の析出相を形成することを開示している。
【先行技術文献】
【特許文献】
【0006】
【特許文献1】特許第2510120号公報(請求項1、段落〔0006〕、〔0012〕)
【特許文献2】特開2007−247928号公報(請求項8、段落〔0054〕〜〔0061〕)
【発明の概要】
【発明が解決しようとする課題】
【0007】
酸化マグネシウム及び水酸化マグネシウム自体は熱伝導性が悪く、ケミカルヒートポンプを構築した場合に、水和反応で発生した熱や脱水反応に必要な熱の供給が遅い。このため、水和反応及び脱水反応の速度が遅いことが問題であった。また、粉体であるため、上記反応に必要な水蒸気が出入りする際に飛散することが問題であった。
また、特許文献2に記載される方法で熱交換部の反応ガス流通路を反応材で被覆する場合は、反応に寄与する粉体量が少ないために、十分な量の熱エネルギーを放出及び貯蔵することができなかった。
【0008】
本発明は、伝熱性に優れ、高い反応速度が得られる化学蓄熱材、及び、該化学蓄熱材を用いたケミカルヒートポンプを提供することを目的とする。
【課題を解決するための手段】
【0009】
上記課題を解決するために、本発明は、Mg,Ca,Sr,Baの水酸化物、塩化物、及び硫酸化物のうち少なくとも1種類を主成分とする粒子を表面に担持する膨張化グラファイトが、所定の形状に圧縮されて成形された成形体とされる化学蓄熱材を提供する。
上記発明において、前記膨張化グラファイトと前記Mg,Ca,Sr,Baの水酸化物、塩化物、及び硫酸化物のうち少なくとも1種類を主成分とする粒子とのスラリーを乾燥させた生成物が、所定の形状に圧縮されて成形された成形体とされることが好ましい。この場合、前記生成物が、フレーク状または粉体状であることが好ましい。
【0010】
上記の水酸化物を主成分とする粒子を膨張化グラファイトに担持させることにより、高い伝熱性を有する化学蓄熱材とすることができる。化学蓄熱材が高伝熱性を有していると、脱水反応の反応熱を短時間で蓄熱することが可能であるとともに、水和反応の反応熱を迅速に系外に放出することができる。このため、反応効率が向上するとともに、蓄熱・放熱の効率が向上する。
本発明の化学蓄熱材は、膨張化グラファイトと水酸化物粒子のスラリーを乾燥させて得たフレーク状または粉体状の生成物を圧縮成形しており、成形性が良好であるとともに高密度の化学蓄熱材となっている。このため、圧縮成形されていない化学蓄熱材よりも単位体積当たりの蓄熱量及び発熱量を増大させることができる。また、成形体内部に適度な細孔が導入され、この細孔を通じて脱水反応で発生する水蒸気や水和反応に必要な水蒸気が移動できるため、高い反応速度を維持させることが可能である。
【0011】
従って、本発明の化学蓄熱材を有するケミカルヒートポンプは、高い蓄熱量及び発熱量が得られるとともに、高い反応速度を有する。また、脱水反応時及び水和反応時の水蒸気の出入りによって反応容器内の化学蓄熱材が飛散する恐れがなく、装置メンテナンスが容易であるとの効果も奏する。
【0012】
上記発明において、前記膨張化グラファイトと前記粒子との重量比が、1:8から1:16の範囲内とされることが好ましい。また、上記発明において、前記成形体の密度が0.504g/cm3以上とされることが好ましい。
上述の質量比及び密度とすることで、より高い蓄熱量及び発熱量を得ることが可能である。
【0013】
本発明は、上記の化学蓄熱材を収納する反応容器と、水蒸気を液化または蒸発させる貯蔵容器と、該反応容器と該貯蔵容器とを連結するガス流通路と、該ガス流通路に設けられる開閉弁とを備えるケミカルヒートポンプを提供する。
【0014】
本発明の化学蓄熱材を有するケミカルヒートポンプは、高い蓄熱量及び発熱量が得られるとともに、高い反応速度を有する。また、脱水反応時及び水和反応時の水蒸気の出入りによって反応容器内の化学蓄熱材が飛散する恐れがなく、装置メンテナンスが容易であるとの効果も奏する。
【0015】
上記発明において、前記化学蓄熱材が、前記反応容器の形状と略同一となるように成形されることが好ましい。こうすることで、反応容器内に収納される化学蓄熱材の密度を高めることができ、より高い蓄熱量及び発熱量を示すケミカルヒートポンプとすることができる。
【発明の効果】
【0016】
本発明の化学蓄熱材は、Mg,Ca,Sr,Baの水酸化物、塩化物、及び硫酸化物のいずれかを膨張化グラファイトに担持させているために、伝熱性を向上させて反応速度を向上させた物となる。また、上記膨張化グラファイトの粉体またはフレークを圧縮成形した化学蓄熱材であるために、高い蓄熱量及び発熱量が得られる。
【図面の簡単な説明】
【0017】
【図1】ケミカルヒートポンプの概略図である。
【図2】熱伝導率を示すグラフである。
【図3】脱水反応実験及び水和反応実験に用いたケミカルヒートポンプ装置の概略図である。
【図4】脱水反応実験におけるヒータ及び充填層中央部の温度変化を示すグラフである。
【図5】脱水反応時の反応転化率の変化を示すグラフである。
【図6】ペレット単位重量当たりの熱エネルギー貯蔵量を示すグラフである。
【図7】図6から取得した各経過時間でのペレット単位重量当たりのエネルギー貯蔵量を示すグラフである。
【図8】水和反応実験における充填層中央部の温度変化を示す。
【図9】水和反応時の反応転化率の変化を示すグラフである。
【図10】ペレット単位重量当たりの全発熱量を示すグラフである。
【図11】図10から取得した各経過時間でのペレット単位重量当たりの全発熱量を示すグラフである。
【図12】水蒸気温度及び水蒸気圧力を変えて水和反応を行ったときの反応開始5分後のペレット単位重量当たりの平均熱出力Wを示すグラフである。
【図13】各サイクルにおける脱水反応で90分後または120分後に到達する反応転化率を示すグラフである。
【図14】脱水反応実験における温度変化及び反応転化率を示すグラフである。
【図15】充填層単位体積当たりの熱エネルギー貯蔵量を示すグラフである。
【図16】水和反応実験における充填層中央部の温度変化及び反応転化率を示すグラフである。
【図17】充填層単位体積当たりの全発熱量を示すグラフである。
【図18】充填層単位体積当たりの平均熱出力の時間変化を示すグラフである。
【発明を実施するための形態】
【0018】
本発明に係る化学蓄熱材及びケミカルヒートポンプの一実施形態を、図面を参照して以下で説明する。
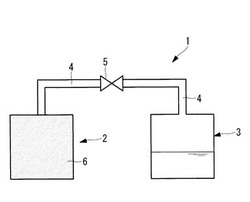
図1は、本実施形態のケミカルヒートポンプの概略図である。図1のケミカルヒートポンプ1は、反応容器2及び貯蔵容器3を備える。反応容器2及び貯蔵容器3は、ガス流通路4で連結され、ガス流通路4に開閉弁5が設けられる。
【0019】
貯蔵容器3内に、水和反応の原料であり、かつ、脱水反応の反応生成物である水蒸気及び水及びが貯蔵される。
【0020】
反応容器2内に、化学蓄熱材6が収納されている。本実施形態の化学蓄熱材6は、Mg,Ca,Sr,Baの水酸化物、塩化物、及び硫酸化物のいずれかを主成分とする粒子を表面に担持する膨張化グラファイトとされる。すなわち、本実施形態のケミカルヒートポンプは、酸化物の水和反応と水酸化物の脱水反応、及び、塩化物及び硫酸化物の水和・脱水反応を利用するものである。各反応式を以下に示す。反応式(2)〜(4)において、MはMg,Ca,Sr,Baのいずれかを表し、nはモル数を表す。
【化2】

【化3】

【化4】

本実施形態に適用される膨張化グラファイトは、エア・ウォーター株式会社製、品名:SS−3とされる。
【0021】
上記の水酸化物、塩化粒、硫酸化物の粒子を担持させた膨張化グラファイトは、平均粒径100μm〜2mm程度の 粉体状あるいはフレーク状とされる。粉体状あるいはフレーク状の膨張化グラファイトは、所定の形状に圧縮して成形されて化学蓄熱材6とされる。化学蓄熱材6は、膨張化グラファイトがペレットなどに圧縮成形され、これらが反応容器2内に密に充填されたものでも良い。あるいは、図1の反応容器2と略同一の形状に圧縮成形されたものでも良い。反応容器と略同一形状の化学蓄熱材を用いると、反応容器2内に充填される化学蓄熱材の密度が更に上昇するために、高い蓄熱量及び発熱量が得られるので好ましい。いずれの場合も、反応容器2内に充填された後の化学蓄熱材の密度が0.504g/cm3以上となるように、膨張化グラファイトが圧縮される。
【0022】
本実施形態の粒子は、Mg,Ca,Sr,Baの水酸化物、塩化物、硫酸化物のうち一種類あるいは複数種類が選択可能である。また、上記水酸化物に、Ni,Co,Alの水酸化物が添加されていても良い。Ni,Co,Alの水酸化物を添加することにより、脱水反応温度、すなわち蓄熱温度が下がり、より大量にある低温・低質の熱エネルギーの回収ができる。また、上記粒子は、表面がCaCl2やLiBrに被覆されることより表面修飾されていても良い。
【0023】
本実施形態において、膨張化グラファイトと粒子との重量比(膨張化グラファイト:水酸化物、塩化物、硫酸化物粒子)は、1:8から1:16の範囲内とされる。特に、1:8が最適値とされる。
【0024】
上記の粒子を担持する膨張化グラファイトは、以下の工程により製造される。
上記の水酸化物、塩化物、硫酸化物の粒子及び膨張化グラファイトを、上述した比率となるように秤量する。粒子及び膨張化グラファイトを水に添加して撹拌し、スラリーを作製する。
作製したスラリーをオーブンで乾燥する。乾燥中、スラリーを時々撹拌する。乾燥温度は、120℃程度とされる。
乾燥後、生成物を適切な大きさに粉砕し、粉体状またはフレーク状の膨張化グラファイトとする。
【0025】
(実施例)
以下の実施例により、本実施形態の化学蓄熱材の効果を説明する。
(1)試料調整
水酸化マグネシウム(Mg(OH)2)ペレット(宇部マテリアルズ株式会社製)を粉砕し、分級して、最大粒子径150μmの水酸化マグネシウム粒子を作製した。
【0026】
表1に示す配合比となるように秤量した水酸化マグネシウム粒子及び膨張化グラファイト(エア・ウォーター株式会社製、SS−3)を、純水30mlに添加した。これを撹拌し、スラリーを作製した。以下では、膨張化グラファイト:水酸化マグネシウム=1:1、1:2、1:4、1:8、1:16(重量比)で配合したものを、それぞれEM1P、EM2P、EM4P、EM8P、EM16Pと称する。
【表1】

【0027】
上記のスラリーを120℃のオーブン中で約半日乾燥させ、水分を蒸発させた。
乾燥後の膨張化グラファイトは凝集固化していたため、粉砕した。粉砕後の膨張化グラファイトをSEMを用いて観察し、表面に水酸化マグネシウム粒子が付着していることを確認した。
【0028】
粉砕後の膨張化グラファイトを、ペレット成形器を用いて、直径7.0mm、高さ3.5mmの平筒上のペレットに圧縮成形した。
表2に、各試料の密度を示す。ペレット及びペレットの密度は、30個の試料のサイズ及び重量を測定して得た結果の平均値とした。EM−wは、乾燥後のEM8Pを上記ペレットと同程度の大きさの不規則な塊に破砕したものである。EM−wの密度は、外観の寸法計測から算出した体積と、測定した試料の重量より求めた。
【表2】

【0029】
(2)熱伝導性の評価
EM1P、EM4P及びEM8Pの各ペレット、及び、水酸化マグネシウムペレットを、それぞれ直径40mmのガラス瓶に充填した。ガラス瓶に充填されたペレットの中心部に熱伝導率測定プローブを挿入し、非定常熱応答法で熱伝導率を測定した。
【0030】
図2に、各試料の熱伝導率を示す。同図において、縦軸は熱伝導率である。棒グラフは平均値を表している。水酸化マグネシウムペレットの場合、熱伝導率の平均値は1.5W/mK程度であったのに対し、膨張化グラファイトを用いたペレットはいずれも平均値が3.0W/mK程度であった。すなわち、膨張化グラファイトを用いることにより、従来の水酸化マグネシウムペレットに比べて熱伝導性を約2倍向上させることができた。
【0031】
(3)膨張化グラファイトに対する最適な水酸化物添加量の検討
脱水反応性及び水和反応性を評価して、膨張化グラファイトに対する水酸化物添加量の最適値を検討した。
図3に示す装置を用いて、脱水反応実験及び水和反応実験を実施した。図3のケミカルヒートポンプ装置10において、図1の装置と共通する構成に同じ符号が付されている。
図3のケミカルヒートポンプ装置10の反応部11は、チャンバ12を有する。チャンバの外側周囲にはヒータ13が設けられる。チャンバ12の底部には、脱水反応で発生する水蒸気、あるいは、水和反応に必要とされる水蒸気が出入り可能な通気口14が設けられている。チャンバ12は、天秤18上に配置される。天秤18はコンピュータ19に接続され、天秤18の測定値がコンピュータ19に送信されるようになっている。
【0032】
チャンバ12の内部に充填層(packed bed)15が収納される。充填層15は図1の装置における反応容器2に相当する。充填層15の内部に、膨張化グラファイトペレットまたは水酸化マグネシウムペレットが充填されている。実験では、充填層15は直径50mm、高さ48mmとした。
充填層15の外側周囲には、ヒータ16が設けられる。ヒータ16は、不図示の電源に接続される。
【0033】
貯蔵容器3には、冷却水熱交換器20とヒータ21が設置される。ヒータ21は不図示の電源に接続される。貯蔵容器3は排気流路22により真空ポンプ23と接続されている。排気流路22には開閉弁24が設けられる。
【0034】
ガス流通路4及び排気流路22には、流通するガスを所定温度に保持させるために、ベルトヒータが巻きつけられている。
【0035】
図3のケミカルヒートポンプ装置10では、充填層15、チャンバ12、貯蔵容器3内の水、貯蔵容器3上部の蒸気、ガス流通路4、及び、排気流路22の各温度が、温度調整部(不図示)で取得できるようになっている。温度調整部で取得された温度に基づいて、各ヒータ13,16,21に供給される電力が制御できるように構築されている。取得された温度は、コンピュータ19に送信される。
【0036】
充填層15については、少なくとも、充填層15高さの半分の位置で、充填層15の外側に熱電対17が設置される。これにより、充填層15中央部の温度が計測される。なお、充填層15に複数の熱電対17を設置して、充填層15の複数箇所の温度が計測されるようになっていても良い。
【0037】
(a)脱水反応性
図3のケミカルヒートポンプ装置を用いた脱水反応実験の手順を以下で説明する。開閉弁5及び開閉弁24が解放され、真空ポンプ23で系全体を減圧され、残留空気が除かれる。その後、開閉弁5及び開閉弁24を閉鎖した状態で、チャンバ12、充填層15、ガス流通路4及び排気流路22が120℃に加熱される。冷却水熱交換器20は20℃に冷却される。一定温度に到達した後、開閉弁5が開放される。これと同時に、ヒータ16により充填層15が400℃まで昇温速度30℃/分で加熱される。その後、ヒータ16は充填層15の温度を400℃で保持する。
【0038】
天秤18は、開閉弁5開放後の反応部11の重量を計測する。所定時間間隔で計測された値は、コンピュータ19に送信される。コンピュータ19は、反応部11の重量変化Δm、脱水反応の反応モル比xd、脱水反応の反応転化率Δxd、及びエネルギー貯蔵量Qを算出し、取得する。
【0039】
反応部11の重量変化Δm[g]は、計測時の試料の重量から反応開始前の試料の重量を引いた値である。重量変化Δmは、水酸化マグネシウムから放出された水蒸気が充填層15から貯蔵容器3に移動した重量に相当する。反応モル比xは、式(1)で表される。
【数1】

但し、mMg(OH)2[g]は充填層に入れた水酸化マグネシウムの初期重量、M[g・mol−1]はその物質の分子量である。
【0040】
脱水反応の反応転化率Δxdは、式(2)で表される。
Δxd=xd−xini−d …(2)
但し、xdは式(1)で求められる脱水反応の反応モル比、xini−dは、脱水反応開始時の反応モル比である。
【0041】
ペレット単位重量あたりのエネルギー貯蔵量Qmは、式(3)で求められる。
【数2】

但し、ΔH0は反応式(1)の反応熱(−81.0kJ/mol)、MはMg(OH)2の分子量(58.3g/mol)、mMg(OH)2[g]は充填層に入れた水酸化マグネシウムの初期重量、mpellet[g]は充填層に入れたペレットの初期重量である。
【0042】
以下では、EM4P,EM8P,EM16P及び水酸化マグネシウムペレットの比較を行った。
図4は、表1に示されるペレット及び水酸化マグネシウムペレットを充填層に入れた脱水反応実験におけるヒータ温度及び充填層中央部の温度変化を示す。同図において、横軸は脱水反応開始(昇温開始)からの経過時間、縦軸は温度である。
図4に示すように、水酸化マグネシウムペレットは熱伝導性が悪いために温度上昇が緩慢だった。これに対し、膨張化グラファイトを使用したペレットでは温度上昇が早かった。膨張かグラファイトの量が相対的に多いほど(例えばEM4P)、温度上昇が早い傾向が見られた。
【0043】
図5は、脱水反応時の反応転化率の変化を示す。同図において、横軸は経過時間、縦軸は反応転化率Δxdである。反応転化率Δxdが0の場合は全てが水酸化マグネシウム、Δxdが−1の場合は全てが酸化マグネシウムであることを意味している。
水酸化マグネシウムペレットの場合、脱水反応開始から90分でΔxd=−0.55に到達した。一方、膨張かグラファイトを用いた資料では15〜40分でΔxd=−0.55に到達した。すなわち、水酸化マグネシウム粒子を膨張化グラファイトに担持させることにより、短時間で蓄熱が可能である。
【0044】
図6は、ペレット単位重量当たりの熱エネルギー貯蔵量(蓄熱量)である。同図において、横軸は経過時間、縦軸はエネルギー貯蔵量である。
図7は、図6から取得した各経過時間でのペレット単位重量当たりのエネルギー貯蔵量を示す。同図において、縦軸はエネルギー貯蔵量である。
図6,7を参照すると、膨張化グラファイトを使用することにより、水酸化マグネシウムペレットよりも早くエネルギー貯蔵量が増大した。また、膨張化グラファイトに対する水酸化マグネシウム粒子の重量比が大きくなる程、エネルギー貯蔵量が増大した。すなわち、水酸化マグネシウム量が多いほど蓄熱密度を増大させることができた。
【0045】
脱水反応初期(例えば、反応開始5分〜10分程度)においては、水酸化マグネシウム量が少ないEM4P及びEM8Pの方が蓄熱密度(すなわちエネルギー貯蔵量)が大きくなる。これは、EM4P及びEM8Pでは膨張化グラファイト含有量が高く、伝熱速度が向上し、迅速に熱が水酸化マグネシウムに伝達されたためである。よって、短時間の蓄熱には、膨張化グラファイトに対する水酸化マグネシウム量が小さい方が適している。
一方、長時間(例えば60分)の脱水反応後では、図7に示すようにEM16Pでエネルギー貯蔵量が大きい。これは膨張化グラファイトに対する水酸化マグネシウム含有量が多いためである。これに対し、EM4Pでは、試料中の水酸化マグネシウム含有量が少ないために、水酸化マグネシウムペレットよりもエネルギー貯蔵量が小さくなった。
なお、EM2PやEM1Pは相対的に水酸化マグネシウム量が少ない。上記実験ではEM2P及びEM1Pの検討は行っていないが、図6,7の結果から、水酸化マグネシウム量がさらに少なくなると、より短時間で蓄熱されるが十分なエネルギーを貯蔵できないと考察することができる。
【0046】
(b)水和反応
図3のケミカルヒートポンプ装置を用いた水和反応実験の手順を以下で説明する。
上記脱水反応条件で充填層15内の各試料が十分に脱水され、脱水反応転化率Δxdが一定値になった後、開閉弁5が閉鎖される。チャンバ12及び充填層15は、所定の温度まで冷却される。脱水反応で貯蔵容器3に搬送され凝縮された水は、冷却水熱交換器20の操作が停止された後、貯蔵容器3底部のヒータ21で加熱される。貯蔵容器3内の水蒸気が所定の圧力及び温度で安定状態に到達したとき、開閉弁5が開放され、貯蔵容器3内の水蒸気がチャンバ12内に流入する。
【0047】
天秤18は、開閉弁5開放後の反応部11の重量を計測する。所定時間間隔で計測された値は、コンピュータ19に送信される。コンピュータ19は、反応部11の重量変化Δm、水和反応の反応モル比xh、水和反応の反応転化率Δxh、単位ペレットあたりの全発熱量q、平均熱出力Wを算出し、取得する。
【0048】
水和反応の反応モル比xhは、式(1)により算出される。
水和反応の反応転化率Δxhは、式(4)で表される。
Δxh=xh−xini−h …(4)
但し、xini−hは、水和反応開始時の反応モル比である。
【0049】
ペレット単位重量当たりの全発熱量qmは、式(5)で求められる。
【数3】

但し、ΔH0は反応式(1)の反応熱(−81.0kJ/mol)、MはMg(OH)2の分子量(58.3g/mol)、mMg(OH)2[g]は充填層に入れた水酸化マグネシウムの初期重量、mpellet[g]は充填層に入れたペレットの初期重量である。
【0050】
ペレット単位重量あたりの平均熱出力Wm[W/kg]は、式(6)で求められる。
Wm=qm/t …(6)
但し、t[s]は水和反応開始後の経過時間である。
【0051】
以下では、水蒸気温度:80℃、水蒸気圧力57.8kPa、反応開始温度:105℃の条件で水和反応実験を行った結果を示す。
図8は、水和反応実験における充填層中央部の温度変化を示す。同図において、横軸は、水和反応開始(開閉弁開放時)からの経過時間、縦軸は温度である。
図9は、水和反応時の反応転化率の変化を示す。同図において、横軸は経過時間、縦軸は反応転化率Δxhである。反応転化率Δxhが0の場合は全てが酸化マグネシウム、Δxhが1の場合は全てが水酸化マグネシウムであることを意味している。
【0052】
図8を参照すると、膨張化グラファイトを用いた試料は、水酸化マグネシウムペレットより初期の温度上昇が急激である。これは、発熱反応で発生した熱を迅速に放出していることを意味している。
図9に示すように、膨張化グラファイトを用いた試料では、反応開始から30分までの反応転化率が、水酸化マグネシウムペレットの場合よりも高く、約2倍となっている。つまり、膨張化グラファイトを用いると、発生した熱を迅速に系外に放出できるので、水和反応を高い反応速度で継続させることができる。
【0053】
図10は、ペレット単位重量当たりの全発熱量を示す。同図において、横軸は経過時間、縦軸は発熱量である。
図11は、図10から取得した各経過時間での単位ペレット重量当たりの平均熱出力を示す。同図において、縦軸は平均熱出力である。
【0054】
膨張化グラファイトを使用することにより反応転化率が向上したため、図10に示すように、膨張化グラファイトを使用した試料の発熱量は水酸化マグネシウムペレットの場合よりも高くなった。膨脹化グラファイトに対する水酸化マグネシウムの相対量が多いほど、発熱量が高い傾向があった。図11に示すように、反応開始5分以降では、水酸化マグネシウムペレットの全発熱量はほとんど増加しないのに対し、膨張化グラファイトを使用した試料の全発熱量は増加する傾向にあった。EM8P及びEM16Pで水酸化マグネシウムペレットより高い平均熱出力を得ることができた。
【0055】
EM4P,EM8P及びEM16Pを比較すると、水酸化マグネシウム量が多くなる程、反応転化率及び全発熱量が増加する傾向が見られた。
【0056】
以下では、供給される水蒸気温度及び水蒸気圧力を変えて水和反応実験を行った結果を示す。表3に、各実験条件での安定後の水蒸気圧力及び水蒸気温度を示す。
【表3】

【0057】
図12は、表3の実験条件について、水和反応開始5分後の単位ペレット重量当たりの平均熱出力Wを示す。同図において、縦軸は平均熱出力である。
反応圧力が低い条件1ではEM16Pの平均熱出力が高いが、反応圧力が高い条件(条件2〜4)ではEM8Pの平均熱出力が高くなった。EM8Pは、いずれの条件でも高い平均熱出力を示した。
なお、EM16Pの場合、短時間操作の結果である図12では条件3及び4で他より平均熱出力が低下しているが、例えば60分程度の長時間になると、反応量が他より大きくなり、発熱量は向上する。すなわち、要求される放熱時間によって水酸化マグネシウム含有量の最適値があると言える。
【0058】
EM2PやEM1Pに関しては、上述のように水酸化マグネシウム量が相対的に少なく蓄熱量が小さいことから、発熱量が小さくなると考察できる。
【0059】
(c)繰り返しサイクル耐久性
図3のケミカルヒートポンプ装置を用い、脱水反応と水和反応とを1サイクルとして反応を繰り返し、各ペレットの耐久性を評価した。温度条件は(a)及び(b)での実験と同じとした。脱水反応時間は120分とした。
図13に、各サイクルにおける脱水反応で120分後に到達する反応転化率を示す。同図において、横軸はサイクル数、縦軸は脱水反応時の反応転化率である。EM8P及びEM4Pでは23サイクル程度まで安定した反応性が確認された。水酸化マグネシウムペレットは10回以降15回まである程度安定した傾向が見られた。耐久性は水酸化マグネシウムペレットを使用した場合と同程度かまたは幾分向上していた。
【0060】
以上の結果から、水酸化マグネシウム粒子を膨脹化グラファイトに担持させることにより、熱伝導性が向上して脱水反応・水和反応の反応効率が上昇した。このため、エネルギー貯蔵量も増加した。膨脹化グラファイト:水酸化マグネシウムの重量比が1:8〜1:16の範囲で良好なケミカルヒートポンプ性能が得られると言える。特に、膨脹化グラファイト:水酸化マグネシウム=1:8(重量比)が最適値であった。
【0061】
水酸化カルシウム、水酸化ストロンチウム、水酸化バリウムは一般的に、水酸化マグネシウムより反応が高活性である。例えば、酸化マグネシウムは水と反応に時間要するのに対し、酸化カルシウムは水と混合すると瞬時に水和発熱反応を示す。よって、水酸化カルシウム、水酸化ストロンチウム、または、水酸化バリウムを膨張化グラファイトに担持させることにより、膨張化グラファイトによって伝熱性が促進されて反応熱の出入力が高速化し、結果として蓄熱性能が向上する。この場合も、上記の混合比にすることにより、効果的に蓄熱及び放熱が可能となる。
また、Ca,Sr,Baの塩化物や硫酸化物も同様に、水酸化マグネシウムより一般に反応性が高い。このため、膨張化グラファイトの混合による同様の蓄熱性能の促進が可能である。
【0062】
(4)圧縮成形による効果
以下では、圧縮成形による効果を、EM8P、EM−w、及び、水酸化マグネシウムペレットにより説明する。
(a)脱水反応
図14は、EM8P、EM−w及び水酸化マグネシウムペレットを充填層に入れた脱水反応実験における温度変化と反応転化率を示す。図14の横軸は脱水反応開始からの経過時間である。縦軸は、第1軸が温度、第2軸が反応転化率である。表4は、EM8Pペレット、EM−wの塊及び水酸化マグネシウムペレットを充填層に充填した場合の密度ρの計算結果である。充填粒子全重量と充填層体積から密度を算出した。
【表4】

【0063】
図15は、充填層単位体積当たりの熱エネルギー貯蔵量(体積当たりの蓄熱密度)である。表4の通り密度が大きく異なるため、単位重量あたりの性能比較は体積が大きくことなり、比較が困難である。そこで客観的な性能比較のために充填層単位体積あたりで検討した。同図において、横軸は経過時間、縦軸は単位体積あたりのエネルギー貯蔵量である。単位体積当たりの熱エネルギー貯蔵量Qvは、式(7)で求められる。
Qv=Qmρ …(7)
ここでρ[g/cm3]は充填層内のペレット充填密度である。
【0064】
図14に示すように、圧縮されていないEM−wは温度上昇及び反応転化率変化が大きい。これは、EM−Wは密度が低いために、反応可能な水酸化マグネシウム量が少なく、脱水反応が速く起こったため、及び、空隙率が大きく、発生した水蒸気の移動が容易であったため、と考えられる。しかし、図15に示すように、EM−wはエネルギー貯蔵量が非常に低い。この値は、化学蓄熱材として実用に適さない。
一方、EM8Pは、EM−wより温度上昇及び反応転化率変化は若干劣るものの、水酸化マグネシウムペレットに対して高い反応転化率が得られた。これは、圧縮成形されながらもペレット内に細孔を存在するために、水蒸気が円滑に移動可能であり、十分に反応を促進させることが可能であったためと考えられる。また、水酸化マグネシウムペレットと比較して熱伝導性が向上しているため、高速で蓄熱可能である。図15に示すように、EM8Pはエネルギー貯蔵量が大幅に上昇している。すなわち、EM8Pは圧縮成形されたことで、蓄熱密度が上昇した。
【0065】
(b)水和反応
図16は、EM8P、EM−w及び水酸化マグネシウムペレットを充填層に入れた水和反応実験における反応転化率を示す。図16の横軸は水和反応開始からの経過時間である。縦軸は、反応転化率である。
図17は、充填層単位体積当たりの全発熱量を示す。同図において、横軸は経過時間、縦軸は発熱量である。
図18は、充填層単位体積当たりの平均熱出力の時間変化である。同図において、横軸は経過時間、縦軸は平均熱出力である。
【0066】
充填層単位体積当たりの全熱発生量qv[MJ/m3]は、式(8)で求められる。
qv=qmρ …(8)
充填層単位体積当たりの平均熱出力Wv[kW/m3]は、式(9)で求められる。
Wv=Wmρ …(9)
【0067】
図16を参照すると、EM−wは密度が小さく、試料中への水蒸気の拡散が速いために短時間で反応転化率が増大したが、時間経過とともに減少している。図17に示すように、EM−wは単位体積当たりの全発熱量が小さく、反応開始5分以降は減少する傾向があった。また、図18に示すように、EM−wは出力速度も小さい。
【0068】
一方、EM8Pはペレット内に適度な細孔を存在させているために、ペレット内部にも水蒸気が入り込むことが可能である。また、高い伝熱性を有しているため、水和反応による反応熱が系外から迅速に除去される。このため、図16のように高い反応転化率を持続させることができた。また、EM8Pは圧縮成形されているため、発熱量及び平均熱出力が増大している。つまり、EM8Pでは、高い出力を得ることが可能である。
【0069】
以上のように、同じ材料であっても圧縮させていない場合は、実用的な発熱量を得ることができないが、圧縮成形された化学蓄熱材を用いることにより、ケミカルヒートポンプ性能を得ることが可能であると言える。すなわち、圧縮しない場合は蓄熱密度が低いため、同じ蓄熱量の装置を作った場合、圧縮試料利用の場合に比べ数倍の大きさになる。このため、容器、熱交換器の体積が大きくなり不経済である。圧縮試料によって装置がコンパクトになり、装置の経済性が格段に高くなる。
【0070】
ここでは水酸化マグネシウムを例に挙げて圧縮成形する効果を説明したが、Ca,Sr,Baの水酸化物も同様の効果が得られることが確認された。また、塩化物及び硫酸化物を適用した場合も、上記と同様の圧縮成形される効果が得られた。
【符号の説明】
【0071】
1 ケミカルヒートポンプ
2 反応容器
3 貯蔵容器
4 ガス流通路
5,24 開閉弁
6 化学蓄熱材
10 ケミカルヒートポンプ装置
11 反応部
12 チャンバ
13,16,21 ヒータ
14 通気口
15 充填層
17 熱電対
18 天秤
19 コンピュータ
20 冷却水熱交換器
22 排気流路
23 真空ポンプ
24 開閉弁
【技術分野】
【0001】
本発明は、水和発熱反応と脱水吸熱反応との可逆反応を示す化学蓄熱材を利用したケミカルヒートポンプに関する。
【背景技術】
【0002】
ケミカルヒートポンプは、水和発熱反応と脱水吸熱反応との可逆反応を利用して、蓄熱及び放熱を行うものである。例えば、製鉄業などの高温プロセスや熱電併給システムからの排熱をケミカルヒートポンプで蓄熱し、必要に応じて放熱を行うことによって、効率的にエネルギーを利用することができる。
【0003】
ケミカルヒートポンプに適用される蓄熱材として、酸化マグネシウム/水酸化マグネシウム反応系、塩化カルシウム反応系などが知られている。酸化マグネシウム/水酸化マグネシウム系での水和反応及び脱水反応は、以下の反応式(1)で示される。
【化1】

反応式(1)の反応熱は、ΔHO=−81.0kJmol−1である。すなわち、酸化マグネシウムの水和反応は発熱反応であり、水酸化マグネシウムの脱水反応は吸熱反応である。
【0004】
特許文献1は、水酸化マグネシウムを450℃以下でか焼した酸化マグネシウムを反応容器内に充填させたケミカルヒートポンプを開示している。特許文献1のケミカルヒートポンプでは、先ず、夜間の余剰電力や排熱を利用して反応容器内の蒸気の水酸化マグネシウムを上記のか焼温度で加熱し、高圧力の水蒸気を放出させる。水蒸気は貯蔵容器に導かれ、冷却されて凝縮熱を放出する。昼間の電力需要が大きくなった時に、貯蔵容器内の水蒸気を反応容器に移動させて、水蒸気と酸化マグネシウムとを水和反応させる。水和反応により熱が放出されるとともに、貯蔵容器内の水蒸気が蒸発する際の蒸発潜熱によって熱が発生する。
【0005】
特許文献2は、プレートフィン型熱交換部を備える反応容器を有するケミカルヒートポンプを開示している。熱交換部の反応ガス流通路の表面は、塩化カルシウム、酸化マグネシウム、酸化カルシウムなどの反応材で覆われている。特許文献2は、ガス流通路において、ガス透過性材料として膨張黒鉛の表面及び反応器構造材の表面に反応材の析出相を形成することを開示している。
【先行技術文献】
【特許文献】
【0006】
【特許文献1】特許第2510120号公報(請求項1、段落〔0006〕、〔0012〕)
【特許文献2】特開2007−247928号公報(請求項8、段落〔0054〕〜〔0061〕)
【発明の概要】
【発明が解決しようとする課題】
【0007】
酸化マグネシウム及び水酸化マグネシウム自体は熱伝導性が悪く、ケミカルヒートポンプを構築した場合に、水和反応で発生した熱や脱水反応に必要な熱の供給が遅い。このため、水和反応及び脱水反応の速度が遅いことが問題であった。また、粉体であるため、上記反応に必要な水蒸気が出入りする際に飛散することが問題であった。
また、特許文献2に記載される方法で熱交換部の反応ガス流通路を反応材で被覆する場合は、反応に寄与する粉体量が少ないために、十分な量の熱エネルギーを放出及び貯蔵することができなかった。
【0008】
本発明は、伝熱性に優れ、高い反応速度が得られる化学蓄熱材、及び、該化学蓄熱材を用いたケミカルヒートポンプを提供することを目的とする。
【課題を解決するための手段】
【0009】
上記課題を解決するために、本発明は、Mg,Ca,Sr,Baの水酸化物、塩化物、及び硫酸化物のうち少なくとも1種類を主成分とする粒子を表面に担持する膨張化グラファイトが、所定の形状に圧縮されて成形された成形体とされる化学蓄熱材を提供する。
上記発明において、前記膨張化グラファイトと前記Mg,Ca,Sr,Baの水酸化物、塩化物、及び硫酸化物のうち少なくとも1種類を主成分とする粒子とのスラリーを乾燥させた生成物が、所定の形状に圧縮されて成形された成形体とされることが好ましい。この場合、前記生成物が、フレーク状または粉体状であることが好ましい。
【0010】
上記の水酸化物を主成分とする粒子を膨張化グラファイトに担持させることにより、高い伝熱性を有する化学蓄熱材とすることができる。化学蓄熱材が高伝熱性を有していると、脱水反応の反応熱を短時間で蓄熱することが可能であるとともに、水和反応の反応熱を迅速に系外に放出することができる。このため、反応効率が向上するとともに、蓄熱・放熱の効率が向上する。
本発明の化学蓄熱材は、膨張化グラファイトと水酸化物粒子のスラリーを乾燥させて得たフレーク状または粉体状の生成物を圧縮成形しており、成形性が良好であるとともに高密度の化学蓄熱材となっている。このため、圧縮成形されていない化学蓄熱材よりも単位体積当たりの蓄熱量及び発熱量を増大させることができる。また、成形体内部に適度な細孔が導入され、この細孔を通じて脱水反応で発生する水蒸気や水和反応に必要な水蒸気が移動できるため、高い反応速度を維持させることが可能である。
【0011】
従って、本発明の化学蓄熱材を有するケミカルヒートポンプは、高い蓄熱量及び発熱量が得られるとともに、高い反応速度を有する。また、脱水反応時及び水和反応時の水蒸気の出入りによって反応容器内の化学蓄熱材が飛散する恐れがなく、装置メンテナンスが容易であるとの効果も奏する。
【0012】
上記発明において、前記膨張化グラファイトと前記粒子との重量比が、1:8から1:16の範囲内とされることが好ましい。また、上記発明において、前記成形体の密度が0.504g/cm3以上とされることが好ましい。
上述の質量比及び密度とすることで、より高い蓄熱量及び発熱量を得ることが可能である。
【0013】
本発明は、上記の化学蓄熱材を収納する反応容器と、水蒸気を液化または蒸発させる貯蔵容器と、該反応容器と該貯蔵容器とを連結するガス流通路と、該ガス流通路に設けられる開閉弁とを備えるケミカルヒートポンプを提供する。
【0014】
本発明の化学蓄熱材を有するケミカルヒートポンプは、高い蓄熱量及び発熱量が得られるとともに、高い反応速度を有する。また、脱水反応時及び水和反応時の水蒸気の出入りによって反応容器内の化学蓄熱材が飛散する恐れがなく、装置メンテナンスが容易であるとの効果も奏する。
【0015】
上記発明において、前記化学蓄熱材が、前記反応容器の形状と略同一となるように成形されることが好ましい。こうすることで、反応容器内に収納される化学蓄熱材の密度を高めることができ、より高い蓄熱量及び発熱量を示すケミカルヒートポンプとすることができる。
【発明の効果】
【0016】
本発明の化学蓄熱材は、Mg,Ca,Sr,Baの水酸化物、塩化物、及び硫酸化物のいずれかを膨張化グラファイトに担持させているために、伝熱性を向上させて反応速度を向上させた物となる。また、上記膨張化グラファイトの粉体またはフレークを圧縮成形した化学蓄熱材であるために、高い蓄熱量及び発熱量が得られる。
【図面の簡単な説明】
【0017】
【図1】ケミカルヒートポンプの概略図である。
【図2】熱伝導率を示すグラフである。
【図3】脱水反応実験及び水和反応実験に用いたケミカルヒートポンプ装置の概略図である。
【図4】脱水反応実験におけるヒータ及び充填層中央部の温度変化を示すグラフである。
【図5】脱水反応時の反応転化率の変化を示すグラフである。
【図6】ペレット単位重量当たりの熱エネルギー貯蔵量を示すグラフである。
【図7】図6から取得した各経過時間でのペレット単位重量当たりのエネルギー貯蔵量を示すグラフである。
【図8】水和反応実験における充填層中央部の温度変化を示す。
【図9】水和反応時の反応転化率の変化を示すグラフである。
【図10】ペレット単位重量当たりの全発熱量を示すグラフである。
【図11】図10から取得した各経過時間でのペレット単位重量当たりの全発熱量を示すグラフである。
【図12】水蒸気温度及び水蒸気圧力を変えて水和反応を行ったときの反応開始5分後のペレット単位重量当たりの平均熱出力Wを示すグラフである。
【図13】各サイクルにおける脱水反応で90分後または120分後に到達する反応転化率を示すグラフである。
【図14】脱水反応実験における温度変化及び反応転化率を示すグラフである。
【図15】充填層単位体積当たりの熱エネルギー貯蔵量を示すグラフである。
【図16】水和反応実験における充填層中央部の温度変化及び反応転化率を示すグラフである。
【図17】充填層単位体積当たりの全発熱量を示すグラフである。
【図18】充填層単位体積当たりの平均熱出力の時間変化を示すグラフである。
【発明を実施するための形態】
【0018】
本発明に係る化学蓄熱材及びケミカルヒートポンプの一実施形態を、図面を参照して以下で説明する。
図1は、本実施形態のケミカルヒートポンプの概略図である。図1のケミカルヒートポンプ1は、反応容器2及び貯蔵容器3を備える。反応容器2及び貯蔵容器3は、ガス流通路4で連結され、ガス流通路4に開閉弁5が設けられる。
【0019】
貯蔵容器3内に、水和反応の原料であり、かつ、脱水反応の反応生成物である水蒸気及び水及びが貯蔵される。
【0020】
反応容器2内に、化学蓄熱材6が収納されている。本実施形態の化学蓄熱材6は、Mg,Ca,Sr,Baの水酸化物、塩化物、及び硫酸化物のいずれかを主成分とする粒子を表面に担持する膨張化グラファイトとされる。すなわち、本実施形態のケミカルヒートポンプは、酸化物の水和反応と水酸化物の脱水反応、及び、塩化物及び硫酸化物の水和・脱水反応を利用するものである。各反応式を以下に示す。反応式(2)〜(4)において、MはMg,Ca,Sr,Baのいずれかを表し、nはモル数を表す。
【化2】

【化3】

【化4】

本実施形態に適用される膨張化グラファイトは、エア・ウォーター株式会社製、品名:SS−3とされる。
【0021】
上記の水酸化物、塩化粒、硫酸化物の粒子を担持させた膨張化グラファイトは、平均粒径100μm〜2mm程度の 粉体状あるいはフレーク状とされる。粉体状あるいはフレーク状の膨張化グラファイトは、所定の形状に圧縮して成形されて化学蓄熱材6とされる。化学蓄熱材6は、膨張化グラファイトがペレットなどに圧縮成形され、これらが反応容器2内に密に充填されたものでも良い。あるいは、図1の反応容器2と略同一の形状に圧縮成形されたものでも良い。反応容器と略同一形状の化学蓄熱材を用いると、反応容器2内に充填される化学蓄熱材の密度が更に上昇するために、高い蓄熱量及び発熱量が得られるので好ましい。いずれの場合も、反応容器2内に充填された後の化学蓄熱材の密度が0.504g/cm3以上となるように、膨張化グラファイトが圧縮される。
【0022】
本実施形態の粒子は、Mg,Ca,Sr,Baの水酸化物、塩化物、硫酸化物のうち一種類あるいは複数種類が選択可能である。また、上記水酸化物に、Ni,Co,Alの水酸化物が添加されていても良い。Ni,Co,Alの水酸化物を添加することにより、脱水反応温度、すなわち蓄熱温度が下がり、より大量にある低温・低質の熱エネルギーの回収ができる。また、上記粒子は、表面がCaCl2やLiBrに被覆されることより表面修飾されていても良い。
【0023】
本実施形態において、膨張化グラファイトと粒子との重量比(膨張化グラファイト:水酸化物、塩化物、硫酸化物粒子)は、1:8から1:16の範囲内とされる。特に、1:8が最適値とされる。
【0024】
上記の粒子を担持する膨張化グラファイトは、以下の工程により製造される。
上記の水酸化物、塩化物、硫酸化物の粒子及び膨張化グラファイトを、上述した比率となるように秤量する。粒子及び膨張化グラファイトを水に添加して撹拌し、スラリーを作製する。
作製したスラリーをオーブンで乾燥する。乾燥中、スラリーを時々撹拌する。乾燥温度は、120℃程度とされる。
乾燥後、生成物を適切な大きさに粉砕し、粉体状またはフレーク状の膨張化グラファイトとする。
【0025】
(実施例)
以下の実施例により、本実施形態の化学蓄熱材の効果を説明する。
(1)試料調整
水酸化マグネシウム(Mg(OH)2)ペレット(宇部マテリアルズ株式会社製)を粉砕し、分級して、最大粒子径150μmの水酸化マグネシウム粒子を作製した。
【0026】
表1に示す配合比となるように秤量した水酸化マグネシウム粒子及び膨張化グラファイト(エア・ウォーター株式会社製、SS−3)を、純水30mlに添加した。これを撹拌し、スラリーを作製した。以下では、膨張化グラファイト:水酸化マグネシウム=1:1、1:2、1:4、1:8、1:16(重量比)で配合したものを、それぞれEM1P、EM2P、EM4P、EM8P、EM16Pと称する。
【表1】

【0027】
上記のスラリーを120℃のオーブン中で約半日乾燥させ、水分を蒸発させた。
乾燥後の膨張化グラファイトは凝集固化していたため、粉砕した。粉砕後の膨張化グラファイトをSEMを用いて観察し、表面に水酸化マグネシウム粒子が付着していることを確認した。
【0028】
粉砕後の膨張化グラファイトを、ペレット成形器を用いて、直径7.0mm、高さ3.5mmの平筒上のペレットに圧縮成形した。
表2に、各試料の密度を示す。ペレット及びペレットの密度は、30個の試料のサイズ及び重量を測定して得た結果の平均値とした。EM−wは、乾燥後のEM8Pを上記ペレットと同程度の大きさの不規則な塊に破砕したものである。EM−wの密度は、外観の寸法計測から算出した体積と、測定した試料の重量より求めた。
【表2】

【0029】
(2)熱伝導性の評価
EM1P、EM4P及びEM8Pの各ペレット、及び、水酸化マグネシウムペレットを、それぞれ直径40mmのガラス瓶に充填した。ガラス瓶に充填されたペレットの中心部に熱伝導率測定プローブを挿入し、非定常熱応答法で熱伝導率を測定した。
【0030】
図2に、各試料の熱伝導率を示す。同図において、縦軸は熱伝導率である。棒グラフは平均値を表している。水酸化マグネシウムペレットの場合、熱伝導率の平均値は1.5W/mK程度であったのに対し、膨張化グラファイトを用いたペレットはいずれも平均値が3.0W/mK程度であった。すなわち、膨張化グラファイトを用いることにより、従来の水酸化マグネシウムペレットに比べて熱伝導性を約2倍向上させることができた。
【0031】
(3)膨張化グラファイトに対する最適な水酸化物添加量の検討
脱水反応性及び水和反応性を評価して、膨張化グラファイトに対する水酸化物添加量の最適値を検討した。
図3に示す装置を用いて、脱水反応実験及び水和反応実験を実施した。図3のケミカルヒートポンプ装置10において、図1の装置と共通する構成に同じ符号が付されている。
図3のケミカルヒートポンプ装置10の反応部11は、チャンバ12を有する。チャンバの外側周囲にはヒータ13が設けられる。チャンバ12の底部には、脱水反応で発生する水蒸気、あるいは、水和反応に必要とされる水蒸気が出入り可能な通気口14が設けられている。チャンバ12は、天秤18上に配置される。天秤18はコンピュータ19に接続され、天秤18の測定値がコンピュータ19に送信されるようになっている。
【0032】
チャンバ12の内部に充填層(packed bed)15が収納される。充填層15は図1の装置における反応容器2に相当する。充填層15の内部に、膨張化グラファイトペレットまたは水酸化マグネシウムペレットが充填されている。実験では、充填層15は直径50mm、高さ48mmとした。
充填層15の外側周囲には、ヒータ16が設けられる。ヒータ16は、不図示の電源に接続される。
【0033】
貯蔵容器3には、冷却水熱交換器20とヒータ21が設置される。ヒータ21は不図示の電源に接続される。貯蔵容器3は排気流路22により真空ポンプ23と接続されている。排気流路22には開閉弁24が設けられる。
【0034】
ガス流通路4及び排気流路22には、流通するガスを所定温度に保持させるために、ベルトヒータが巻きつけられている。
【0035】
図3のケミカルヒートポンプ装置10では、充填層15、チャンバ12、貯蔵容器3内の水、貯蔵容器3上部の蒸気、ガス流通路4、及び、排気流路22の各温度が、温度調整部(不図示)で取得できるようになっている。温度調整部で取得された温度に基づいて、各ヒータ13,16,21に供給される電力が制御できるように構築されている。取得された温度は、コンピュータ19に送信される。
【0036】
充填層15については、少なくとも、充填層15高さの半分の位置で、充填層15の外側に熱電対17が設置される。これにより、充填層15中央部の温度が計測される。なお、充填層15に複数の熱電対17を設置して、充填層15の複数箇所の温度が計測されるようになっていても良い。
【0037】
(a)脱水反応性
図3のケミカルヒートポンプ装置を用いた脱水反応実験の手順を以下で説明する。開閉弁5及び開閉弁24が解放され、真空ポンプ23で系全体を減圧され、残留空気が除かれる。その後、開閉弁5及び開閉弁24を閉鎖した状態で、チャンバ12、充填層15、ガス流通路4及び排気流路22が120℃に加熱される。冷却水熱交換器20は20℃に冷却される。一定温度に到達した後、開閉弁5が開放される。これと同時に、ヒータ16により充填層15が400℃まで昇温速度30℃/分で加熱される。その後、ヒータ16は充填層15の温度を400℃で保持する。
【0038】
天秤18は、開閉弁5開放後の反応部11の重量を計測する。所定時間間隔で計測された値は、コンピュータ19に送信される。コンピュータ19は、反応部11の重量変化Δm、脱水反応の反応モル比xd、脱水反応の反応転化率Δxd、及びエネルギー貯蔵量Qを算出し、取得する。
【0039】
反応部11の重量変化Δm[g]は、計測時の試料の重量から反応開始前の試料の重量を引いた値である。重量変化Δmは、水酸化マグネシウムから放出された水蒸気が充填層15から貯蔵容器3に移動した重量に相当する。反応モル比xは、式(1)で表される。
【数1】

但し、mMg(OH)2[g]は充填層に入れた水酸化マグネシウムの初期重量、M[g・mol−1]はその物質の分子量である。
【0040】
脱水反応の反応転化率Δxdは、式(2)で表される。
Δxd=xd−xini−d …(2)
但し、xdは式(1)で求められる脱水反応の反応モル比、xini−dは、脱水反応開始時の反応モル比である。
【0041】
ペレット単位重量あたりのエネルギー貯蔵量Qmは、式(3)で求められる。
【数2】

但し、ΔH0は反応式(1)の反応熱(−81.0kJ/mol)、MはMg(OH)2の分子量(58.3g/mol)、mMg(OH)2[g]は充填層に入れた水酸化マグネシウムの初期重量、mpellet[g]は充填層に入れたペレットの初期重量である。
【0042】
以下では、EM4P,EM8P,EM16P及び水酸化マグネシウムペレットの比較を行った。
図4は、表1に示されるペレット及び水酸化マグネシウムペレットを充填層に入れた脱水反応実験におけるヒータ温度及び充填層中央部の温度変化を示す。同図において、横軸は脱水反応開始(昇温開始)からの経過時間、縦軸は温度である。
図4に示すように、水酸化マグネシウムペレットは熱伝導性が悪いために温度上昇が緩慢だった。これに対し、膨張化グラファイトを使用したペレットでは温度上昇が早かった。膨張かグラファイトの量が相対的に多いほど(例えばEM4P)、温度上昇が早い傾向が見られた。
【0043】
図5は、脱水反応時の反応転化率の変化を示す。同図において、横軸は経過時間、縦軸は反応転化率Δxdである。反応転化率Δxdが0の場合は全てが水酸化マグネシウム、Δxdが−1の場合は全てが酸化マグネシウムであることを意味している。
水酸化マグネシウムペレットの場合、脱水反応開始から90分でΔxd=−0.55に到達した。一方、膨張かグラファイトを用いた資料では15〜40分でΔxd=−0.55に到達した。すなわち、水酸化マグネシウム粒子を膨張化グラファイトに担持させることにより、短時間で蓄熱が可能である。
【0044】
図6は、ペレット単位重量当たりの熱エネルギー貯蔵量(蓄熱量)である。同図において、横軸は経過時間、縦軸はエネルギー貯蔵量である。
図7は、図6から取得した各経過時間でのペレット単位重量当たりのエネルギー貯蔵量を示す。同図において、縦軸はエネルギー貯蔵量である。
図6,7を参照すると、膨張化グラファイトを使用することにより、水酸化マグネシウムペレットよりも早くエネルギー貯蔵量が増大した。また、膨張化グラファイトに対する水酸化マグネシウム粒子の重量比が大きくなる程、エネルギー貯蔵量が増大した。すなわち、水酸化マグネシウム量が多いほど蓄熱密度を増大させることができた。
【0045】
脱水反応初期(例えば、反応開始5分〜10分程度)においては、水酸化マグネシウム量が少ないEM4P及びEM8Pの方が蓄熱密度(すなわちエネルギー貯蔵量)が大きくなる。これは、EM4P及びEM8Pでは膨張化グラファイト含有量が高く、伝熱速度が向上し、迅速に熱が水酸化マグネシウムに伝達されたためである。よって、短時間の蓄熱には、膨張化グラファイトに対する水酸化マグネシウム量が小さい方が適している。
一方、長時間(例えば60分)の脱水反応後では、図7に示すようにEM16Pでエネルギー貯蔵量が大きい。これは膨張化グラファイトに対する水酸化マグネシウム含有量が多いためである。これに対し、EM4Pでは、試料中の水酸化マグネシウム含有量が少ないために、水酸化マグネシウムペレットよりもエネルギー貯蔵量が小さくなった。
なお、EM2PやEM1Pは相対的に水酸化マグネシウム量が少ない。上記実験ではEM2P及びEM1Pの検討は行っていないが、図6,7の結果から、水酸化マグネシウム量がさらに少なくなると、より短時間で蓄熱されるが十分なエネルギーを貯蔵できないと考察することができる。
【0046】
(b)水和反応
図3のケミカルヒートポンプ装置を用いた水和反応実験の手順を以下で説明する。
上記脱水反応条件で充填層15内の各試料が十分に脱水され、脱水反応転化率Δxdが一定値になった後、開閉弁5が閉鎖される。チャンバ12及び充填層15は、所定の温度まで冷却される。脱水反応で貯蔵容器3に搬送され凝縮された水は、冷却水熱交換器20の操作が停止された後、貯蔵容器3底部のヒータ21で加熱される。貯蔵容器3内の水蒸気が所定の圧力及び温度で安定状態に到達したとき、開閉弁5が開放され、貯蔵容器3内の水蒸気がチャンバ12内に流入する。
【0047】
天秤18は、開閉弁5開放後の反応部11の重量を計測する。所定時間間隔で計測された値は、コンピュータ19に送信される。コンピュータ19は、反応部11の重量変化Δm、水和反応の反応モル比xh、水和反応の反応転化率Δxh、単位ペレットあたりの全発熱量q、平均熱出力Wを算出し、取得する。
【0048】
水和反応の反応モル比xhは、式(1)により算出される。
水和反応の反応転化率Δxhは、式(4)で表される。
Δxh=xh−xini−h …(4)
但し、xini−hは、水和反応開始時の反応モル比である。
【0049】
ペレット単位重量当たりの全発熱量qmは、式(5)で求められる。
【数3】

但し、ΔH0は反応式(1)の反応熱(−81.0kJ/mol)、MはMg(OH)2の分子量(58.3g/mol)、mMg(OH)2[g]は充填層に入れた水酸化マグネシウムの初期重量、mpellet[g]は充填層に入れたペレットの初期重量である。
【0050】
ペレット単位重量あたりの平均熱出力Wm[W/kg]は、式(6)で求められる。
Wm=qm/t …(6)
但し、t[s]は水和反応開始後の経過時間である。
【0051】
以下では、水蒸気温度:80℃、水蒸気圧力57.8kPa、反応開始温度:105℃の条件で水和反応実験を行った結果を示す。
図8は、水和反応実験における充填層中央部の温度変化を示す。同図において、横軸は、水和反応開始(開閉弁開放時)からの経過時間、縦軸は温度である。
図9は、水和反応時の反応転化率の変化を示す。同図において、横軸は経過時間、縦軸は反応転化率Δxhである。反応転化率Δxhが0の場合は全てが酸化マグネシウム、Δxhが1の場合は全てが水酸化マグネシウムであることを意味している。
【0052】
図8を参照すると、膨張化グラファイトを用いた試料は、水酸化マグネシウムペレットより初期の温度上昇が急激である。これは、発熱反応で発生した熱を迅速に放出していることを意味している。
図9に示すように、膨張化グラファイトを用いた試料では、反応開始から30分までの反応転化率が、水酸化マグネシウムペレットの場合よりも高く、約2倍となっている。つまり、膨張化グラファイトを用いると、発生した熱を迅速に系外に放出できるので、水和反応を高い反応速度で継続させることができる。
【0053】
図10は、ペレット単位重量当たりの全発熱量を示す。同図において、横軸は経過時間、縦軸は発熱量である。
図11は、図10から取得した各経過時間での単位ペレット重量当たりの平均熱出力を示す。同図において、縦軸は平均熱出力である。
【0054】
膨張化グラファイトを使用することにより反応転化率が向上したため、図10に示すように、膨張化グラファイトを使用した試料の発熱量は水酸化マグネシウムペレットの場合よりも高くなった。膨脹化グラファイトに対する水酸化マグネシウムの相対量が多いほど、発熱量が高い傾向があった。図11に示すように、反応開始5分以降では、水酸化マグネシウムペレットの全発熱量はほとんど増加しないのに対し、膨張化グラファイトを使用した試料の全発熱量は増加する傾向にあった。EM8P及びEM16Pで水酸化マグネシウムペレットより高い平均熱出力を得ることができた。
【0055】
EM4P,EM8P及びEM16Pを比較すると、水酸化マグネシウム量が多くなる程、反応転化率及び全発熱量が増加する傾向が見られた。
【0056】
以下では、供給される水蒸気温度及び水蒸気圧力を変えて水和反応実験を行った結果を示す。表3に、各実験条件での安定後の水蒸気圧力及び水蒸気温度を示す。
【表3】

【0057】
図12は、表3の実験条件について、水和反応開始5分後の単位ペレット重量当たりの平均熱出力Wを示す。同図において、縦軸は平均熱出力である。
反応圧力が低い条件1ではEM16Pの平均熱出力が高いが、反応圧力が高い条件(条件2〜4)ではEM8Pの平均熱出力が高くなった。EM8Pは、いずれの条件でも高い平均熱出力を示した。
なお、EM16Pの場合、短時間操作の結果である図12では条件3及び4で他より平均熱出力が低下しているが、例えば60分程度の長時間になると、反応量が他より大きくなり、発熱量は向上する。すなわち、要求される放熱時間によって水酸化マグネシウム含有量の最適値があると言える。
【0058】
EM2PやEM1Pに関しては、上述のように水酸化マグネシウム量が相対的に少なく蓄熱量が小さいことから、発熱量が小さくなると考察できる。
【0059】
(c)繰り返しサイクル耐久性
図3のケミカルヒートポンプ装置を用い、脱水反応と水和反応とを1サイクルとして反応を繰り返し、各ペレットの耐久性を評価した。温度条件は(a)及び(b)での実験と同じとした。脱水反応時間は120分とした。
図13に、各サイクルにおける脱水反応で120分後に到達する反応転化率を示す。同図において、横軸はサイクル数、縦軸は脱水反応時の反応転化率である。EM8P及びEM4Pでは23サイクル程度まで安定した反応性が確認された。水酸化マグネシウムペレットは10回以降15回まである程度安定した傾向が見られた。耐久性は水酸化マグネシウムペレットを使用した場合と同程度かまたは幾分向上していた。
【0060】
以上の結果から、水酸化マグネシウム粒子を膨脹化グラファイトに担持させることにより、熱伝導性が向上して脱水反応・水和反応の反応効率が上昇した。このため、エネルギー貯蔵量も増加した。膨脹化グラファイト:水酸化マグネシウムの重量比が1:8〜1:16の範囲で良好なケミカルヒートポンプ性能が得られると言える。特に、膨脹化グラファイト:水酸化マグネシウム=1:8(重量比)が最適値であった。
【0061】
水酸化カルシウム、水酸化ストロンチウム、水酸化バリウムは一般的に、水酸化マグネシウムより反応が高活性である。例えば、酸化マグネシウムは水と反応に時間要するのに対し、酸化カルシウムは水と混合すると瞬時に水和発熱反応を示す。よって、水酸化カルシウム、水酸化ストロンチウム、または、水酸化バリウムを膨張化グラファイトに担持させることにより、膨張化グラファイトによって伝熱性が促進されて反応熱の出入力が高速化し、結果として蓄熱性能が向上する。この場合も、上記の混合比にすることにより、効果的に蓄熱及び放熱が可能となる。
また、Ca,Sr,Baの塩化物や硫酸化物も同様に、水酸化マグネシウムより一般に反応性が高い。このため、膨張化グラファイトの混合による同様の蓄熱性能の促進が可能である。
【0062】
(4)圧縮成形による効果
以下では、圧縮成形による効果を、EM8P、EM−w、及び、水酸化マグネシウムペレットにより説明する。
(a)脱水反応
図14は、EM8P、EM−w及び水酸化マグネシウムペレットを充填層に入れた脱水反応実験における温度変化と反応転化率を示す。図14の横軸は脱水反応開始からの経過時間である。縦軸は、第1軸が温度、第2軸が反応転化率である。表4は、EM8Pペレット、EM−wの塊及び水酸化マグネシウムペレットを充填層に充填した場合の密度ρの計算結果である。充填粒子全重量と充填層体積から密度を算出した。
【表4】

【0063】
図15は、充填層単位体積当たりの熱エネルギー貯蔵量(体積当たりの蓄熱密度)である。表4の通り密度が大きく異なるため、単位重量あたりの性能比較は体積が大きくことなり、比較が困難である。そこで客観的な性能比較のために充填層単位体積あたりで検討した。同図において、横軸は経過時間、縦軸は単位体積あたりのエネルギー貯蔵量である。単位体積当たりの熱エネルギー貯蔵量Qvは、式(7)で求められる。
Qv=Qmρ …(7)
ここでρ[g/cm3]は充填層内のペレット充填密度である。
【0064】
図14に示すように、圧縮されていないEM−wは温度上昇及び反応転化率変化が大きい。これは、EM−Wは密度が低いために、反応可能な水酸化マグネシウム量が少なく、脱水反応が速く起こったため、及び、空隙率が大きく、発生した水蒸気の移動が容易であったため、と考えられる。しかし、図15に示すように、EM−wはエネルギー貯蔵量が非常に低い。この値は、化学蓄熱材として実用に適さない。
一方、EM8Pは、EM−wより温度上昇及び反応転化率変化は若干劣るものの、水酸化マグネシウムペレットに対して高い反応転化率が得られた。これは、圧縮成形されながらもペレット内に細孔を存在するために、水蒸気が円滑に移動可能であり、十分に反応を促進させることが可能であったためと考えられる。また、水酸化マグネシウムペレットと比較して熱伝導性が向上しているため、高速で蓄熱可能である。図15に示すように、EM8Pはエネルギー貯蔵量が大幅に上昇している。すなわち、EM8Pは圧縮成形されたことで、蓄熱密度が上昇した。
【0065】
(b)水和反応
図16は、EM8P、EM−w及び水酸化マグネシウムペレットを充填層に入れた水和反応実験における反応転化率を示す。図16の横軸は水和反応開始からの経過時間である。縦軸は、反応転化率である。
図17は、充填層単位体積当たりの全発熱量を示す。同図において、横軸は経過時間、縦軸は発熱量である。
図18は、充填層単位体積当たりの平均熱出力の時間変化である。同図において、横軸は経過時間、縦軸は平均熱出力である。
【0066】
充填層単位体積当たりの全熱発生量qv[MJ/m3]は、式(8)で求められる。
qv=qmρ …(8)
充填層単位体積当たりの平均熱出力Wv[kW/m3]は、式(9)で求められる。
Wv=Wmρ …(9)
【0067】
図16を参照すると、EM−wは密度が小さく、試料中への水蒸気の拡散が速いために短時間で反応転化率が増大したが、時間経過とともに減少している。図17に示すように、EM−wは単位体積当たりの全発熱量が小さく、反応開始5分以降は減少する傾向があった。また、図18に示すように、EM−wは出力速度も小さい。
【0068】
一方、EM8Pはペレット内に適度な細孔を存在させているために、ペレット内部にも水蒸気が入り込むことが可能である。また、高い伝熱性を有しているため、水和反応による反応熱が系外から迅速に除去される。このため、図16のように高い反応転化率を持続させることができた。また、EM8Pは圧縮成形されているため、発熱量及び平均熱出力が増大している。つまり、EM8Pでは、高い出力を得ることが可能である。
【0069】
以上のように、同じ材料であっても圧縮させていない場合は、実用的な発熱量を得ることができないが、圧縮成形された化学蓄熱材を用いることにより、ケミカルヒートポンプ性能を得ることが可能であると言える。すなわち、圧縮しない場合は蓄熱密度が低いため、同じ蓄熱量の装置を作った場合、圧縮試料利用の場合に比べ数倍の大きさになる。このため、容器、熱交換器の体積が大きくなり不経済である。圧縮試料によって装置がコンパクトになり、装置の経済性が格段に高くなる。
【0070】
ここでは水酸化マグネシウムを例に挙げて圧縮成形する効果を説明したが、Ca,Sr,Baの水酸化物も同様の効果が得られることが確認された。また、塩化物及び硫酸化物を適用した場合も、上記と同様の圧縮成形される効果が得られた。
【符号の説明】
【0071】
1 ケミカルヒートポンプ
2 反応容器
3 貯蔵容器
4 ガス流通路
5,24 開閉弁
6 化学蓄熱材
10 ケミカルヒートポンプ装置
11 反応部
12 チャンバ
13,16,21 ヒータ
14 通気口
15 充填層
17 熱電対
18 天秤
19 コンピュータ
20 冷却水熱交換器
22 排気流路
23 真空ポンプ
24 開閉弁
【特許請求の範囲】
【請求項1】
Mg,Ca,Sr,Baの水酸化物、塩化物、及び硫酸化物のうち少なくとも1種類を主成分とする粒子を表面に担持する膨張化グラファイトが、所定の形状に圧縮されて成形された成形体とされる化学蓄熱材。
【請求項2】
前記膨張化グラファイトと前記Mg,Ca,Sr,Baの水酸化物、塩化物、及び硫酸化物のうち少なくとも1種類を主成分とする粒子とのスラリーを乾燥させた生成物が、所定の形状に圧縮されて成形された成形体とされる請求項1に記載の化学蓄熱材。
【請求項3】
前記生成物が、フレーク状または粉体状である請求項2に記載の化学蓄熱材。
【請求項4】
前記膨張化グラファイトと前記粒子との重量比が、1:8から1:16の範囲内とされる請求項1乃至請求項3のいずれか1項に記載の化学蓄熱材。
【請求項5】
前記成形体の密度が0.504g/cm3以上とされる請求項1に記載の化学蓄熱材。
【請求項6】
請求項1乃至請求項5のいずれか1項に記載の化学蓄熱材を収納する反応容器と、水蒸気を液化または蒸発させる貯蔵容器と、該反応容器と該貯蔵容器とを連結するガス流通路と、該ガス流通路に設けられる開閉弁とを備えるケミカルヒートポンプ。
【請求項7】
前記化学蓄熱材が、前記反応容器の形状と略同一となるように成形される請求項6に記載のケミカルヒートポンプ。
【請求項1】
Mg,Ca,Sr,Baの水酸化物、塩化物、及び硫酸化物のうち少なくとも1種類を主成分とする粒子を表面に担持する膨張化グラファイトが、所定の形状に圧縮されて成形された成形体とされる化学蓄熱材。
【請求項2】
前記膨張化グラファイトと前記Mg,Ca,Sr,Baの水酸化物、塩化物、及び硫酸化物のうち少なくとも1種類を主成分とする粒子とのスラリーを乾燥させた生成物が、所定の形状に圧縮されて成形された成形体とされる請求項1に記載の化学蓄熱材。
【請求項3】
前記生成物が、フレーク状または粉体状である請求項2に記載の化学蓄熱材。
【請求項4】
前記膨張化グラファイトと前記粒子との重量比が、1:8から1:16の範囲内とされる請求項1乃至請求項3のいずれか1項に記載の化学蓄熱材。
【請求項5】
前記成形体の密度が0.504g/cm3以上とされる請求項1に記載の化学蓄熱材。
【請求項6】
請求項1乃至請求項5のいずれか1項に記載の化学蓄熱材を収納する反応容器と、水蒸気を液化または蒸発させる貯蔵容器と、該反応容器と該貯蔵容器とを連結するガス流通路と、該ガス流通路に設けられる開閉弁とを備えるケミカルヒートポンプ。
【請求項7】
前記化学蓄熱材が、前記反応容器の形状と略同一となるように成形される請求項6に記載のケミカルヒートポンプ。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【図17】


【図18】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【図17】


【図18】


【公開番号】特開2013−112706(P2013−112706A)
【公開日】平成25年6月10日(2013.6.10)
【国際特許分類】
【出願番号】特願2011−257935(P2011−257935)
【出願日】平成23年11月25日(2011.11.25)
【新規性喪失の例外の表示】特許法第30条第1項適用申請有り 平成23年8月1日 国立大学法人東京工業大学主催の「平成23年度9月修了 東京工業大学大学院理工学研究科 原子核工学専攻修士論文発表会」において文書をもって発表
【新規性喪失の例外の表示】特許法第30条第1項適用申請有り 平成23年8月14日 公益社団法人化学工学会発行の「化学工学会第43回秋季大会 研究発表講演要旨集(CD−ROM)」に発表
【出願人】(304021417)国立大学法人東京工業大学 (1,821)
【Fターム(参考)】
【公開日】平成25年6月10日(2013.6.10)
【国際特許分類】
【出願日】平成23年11月25日(2011.11.25)
【新規性喪失の例外の表示】特許法第30条第1項適用申請有り 平成23年8月1日 国立大学法人東京工業大学主催の「平成23年度9月修了 東京工業大学大学院理工学研究科 原子核工学専攻修士論文発表会」において文書をもって発表
【新規性喪失の例外の表示】特許法第30条第1項適用申請有り 平成23年8月14日 公益社団法人化学工学会発行の「化学工学会第43回秋季大会 研究発表講演要旨集(CD−ROM)」に発表
【出願人】(304021417)国立大学法人東京工業大学 (1,821)
【Fターム(参考)】
[ Back to top ]

